Область техники, к которой относится изобретение Настоящее изобретение относится к области медицины, в частности к лабораторной диагностике, а именно к средствам для диагностики инфекций центральной нервной системы бактериальной и вирусной этиологии, как в медицинской практике, так и для научных исследований.
Уровень техники
По данным Российского референс-центра по мониторингу за бактериальными гнойными менингитами заболеваемость этими нозологическими формами в РФ в 2016 г. составила 1,5 на 100000. Среди детей до 14 лет этот показатель составил 4,76, а в группе 0-4 лет - 9,38 на 100000. Летальность при бактериальных менингитах в 2016 году составила 14%. В среднем в Российской Федерации этиология бактериальных менингитов выявляется только в 50% случаев, что отражает недостаточный уровень лабораторной диагностики. Ведущим возбудителем бактериальных менингитов в Российской Федерации являются Neisseria meningitidis (40.2% случаев), на долю Streptococcus pneumoniae приходится 28.4% случаев, на долю Haemophilus influenzae - 11.4%. Остальные бактерии являются причиной 20.1% случаев диагностированных менингитов. К редким возбудителям бактериальных менингитов в Российской Федерации, как и в других регионах мира относятся Streptococcus agalactiae, Escherichia coli и Listeria monocytogenes.
Сводные статистические данные о заболеваемости вирусными нейроинфекциями в Российской Федерации отсутствуют. Эпидемиологические данные по вирусным инфекциям ЦНС касаются преимущественно энтеровирусных (род Enterovirus) и арбовирусных инфекций. Согласно данным Государственного доклада «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2017 году» за последние 6 лет отмечались колебания показателя заболеваемости энтеровирусной инфекцией с тенденцией к росту. В 2017 году сезон энтеровирусных инфекций в Российской Федерации отмечен очередным подъемом заболеваемости, показатель составил 16,33 на 100000. В структуре клинических форм энтеровирусных инфекций в 2017 году, как и в предыдущие годы, преобладал энтеровирусный менингит - 21% от всех зарегистрированных случаев.
Сведения о заболеваемости в Российской Федерации наиболее тяжелыми формами энцефалитов, к которым относятся герпетические энцефалиты, отсутствуют. Во многом это связано с недостаточным уровнем диагностики. По данным Детского научно-клинического центра по инфекционным болезням расшифровка этиологии энцефалитов не превышает 40%. Среди расшифрованных случаев энцефалитов на герпес-вирусы приходится 48%-50%, на энтеровирусы - 7%-10%, на вирус клещевого энцефалита - 10%-11%.
Анализ имеющихся данных об этиологии инфекций ЦНС свидетельствует о необходимости создания диагностической тест-системы, позволяющей идентифицировать более одного патогена - возбудителя заболевания ЦНС - для осуществления правильных эпидемиологических мероприятий и выбора адекватной тактики лечения, такой как назначение специфической антибактериальной или антивирусной терапии.
На сегодняшний день к данному уровню техники можно отнести несколько существующих тест-систем.
В портфолио компании Biomerieux представлена система детекции одновременно 14 патогенов центральной нервной системы в цереброспинальной жидкости по анализу кривых плавления после проведения ПЦР. В число этих 14 патогенов входят: Е. coli K1, Н. influenzae, L. monocytogenes, N. meningitidis, S. agalactiae, S. pneumoniae, Cryptococcus neoformans/gattii, Cytomegalovirus, Enterovirus, Herpes simplex virus 1, 2, Herpes virus 6, Varicella zoster virus и Parechovirus. Проведение эксперимента происходит в картриджах, вставляемых в специальный прибор без предварительной пробоподготовки (https://www.biomerieux-diagnostics.com/filmarray-meningitis-encephalitis-me-panel). Этот прибор и эта панель разрешены к использованию в США и в Европейских странах. Данное изобретение позволяет проводить мультиплексные реакции для идентификации возбудителя инфекций ЦНС, однако метод отличается высокой стоимостью каждого тестирования, необходимостью использования специального оборудования и профессиональных навыков для проведения тестирования, что не препятствует массовизации метода для диагностики ЦНС.
Известны диагностические системы компании «Т2 Biosystems», которые предназначены для прямой детекции ряда бактериальных патогенов: Enterococcus faecium, Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa, Staphylococcus aureus, в различных биологических жидкостях, включая кровь, без предварительного выделения нуклеиновых кислот и их очистки. Реакции лизиса клеточных компонентов биологического материала и бактерий, этап амплификации и детекции ампликонов с помощью патентованной технологии Т2 магнитного резонанса проводятся автоматически в одном картридже в специальном аппарате (https://www.t2biosystems.com/t2direct-diagnostics-eu/t2bacteria-panel-eu/).
Еще одним изобретением для идентификации возбудителя инфекций является тест-система «АмплиСенс® N. meningitidis/H. influenzae/S. pneumoniae-FL», предназначенная для выявления ДНК N. meningitidis, H. influenzae и S. pneumoniae в клиническом материале методом полимеразной цепной реакции (ПНР) с гибридизационно-флуоресцентной детекцией (https://interlabservice.ru/catalog/reagents/?sid=1495&id=6505).
Главными недостатками всех известных систем является их сложность, высокая стоимость, низкая мобильность ввиду необходимость юстировки лазеров прибора при перемещении и длительность проведения анализа. Два последних изобретения, помимо того, что они также, как и панель Biomerieux, не могут быть использованы в местах предоставления медицинской помощи, нацелены на обнаружение ограниченного количества бактерий-возбудителей инфекционных заболеваний.
Таким образом, в результате поиска близких аналогов заявляемой тест-системы не обнаружено.
Технической задачей является создание способа этиологической идентификации основных возбудителей инфекций ЦНС в относительно короткий промежуток времени, применение которого не требует специального лабораторного оборудования и высоко квалифицированных профессиональных навыков.
Раскрытие изобретения
Настоящее техническое решение заключается в создании способа идентификации 16-ти основных возбудителей инфекций ЦНС как бактериальной, так и вирусной природы, на месте оказания медицинской помощи, непосредственно в приемном покое или в лечебно-диагностическом отделении, без проведения стадии пробоподготовки и без использования специального лабораторного оборудования.
Техническим результатом заявляемой тест-системы является массовое применение тестирования для определения этиологии следующих заболеваний: менингит, энцефалит, отит, внебольничная пневмония, герпес типов 1, 2 и 6, герпетическая ангина, цитомегаловирусную инфекцию, инфекционный мононуклеоз, ветрянку, кандидоз и туберкулез.
Технический результат достигается за счет того, что пары высоко специфичных и чувствительных бинарных зондов, представленных ДНКзимами, при обнаружении целевой нуклеиновой кислоты возбудителя инфекционного заболевания специфически связываются с ее участками и формируют гуаниновый квадруплекс (Г-4), обладающий ферментативной активностью пероксидазы, что позволяет выявлять патоген посредством колориметрической реакции. В отсутствие аналита Г-4 зонды находятся преимущественно в диссоциированной форме. При добавлении в раствор аналита зонды Г-4 собираются в комплексную структуру, которая и является ДНКзимом, способным катализировать восстановление пероксида водорода с одновременным окислением бесцветного субстрата до окрашенного продукта, что позволяет определить результат как визуально, так и спектрофотометрически.
Заявленная тест-система нацелена на обнаружение последовательностей нуклеиновых кислот патогенов SEQ ID №1 - SEQ ID №15, что позволяет идентифицировать следующие патогены: N. meningitidis, S. pneumoniae, H. influenzae, E. coli, L. monocytogenes, S. agalactiae, Candida albicans, Mycobacteria tuberculosis, S. aureus, Herpes simplex virus 1, Herpes simplex virus 2, Varicella zoster virus, Cytomegalovirus, Epstein Barr virus, Herpes virus 6, Enterovirus.
Г-4 зонды представлены олигонуклеотидами с последовательностями SEQ ID №16 - SEQ ID №45, содержащими участки, распознающие одноцепочечную ДНК или РНК возбудителя инфекционного заболевания ЦНС (аналит).
В качестве клинического материала может быть использована спинномозговая жидкость.
Новизна заявляемого технического решения заключается в том, что для получения информации о наличие нуклеиновой кислоты, ассоциированной с возбудителем, проба помещается в тест-систему и запускается программное обеспечение, полностью контролирующее процесс.
После завершения эксперимента пользователю предоставляется информация в виде паттерна светодиодов, соответствующих комбинации возбудителей в пробе. После завершения эксперимента, внутренняя часть картриджа полностью удаляется из системы и утилизируется согласно нормам. Такой порядок действий и такая репрезентация результата делает результат однозначным и позволяет использовать прибор без ужесточения мер биологической безопасности. Использование одной пробы для выявления 16 патогенов экономит время, затрачиваемое на получение результата.
Заявляемое техническое решение рекомендовано к использованию в медицинской клинической практике и эпидемиологии, а именно как устройство для диагностики энцефалита и менингита на месте оказания помощи, а также может быть применено в научные исследованиях, что соответствует критерию «промышленная применимость».
Предлагаемое изобретение поясняется чертежами, где схематично представлены последовательности участков РНК-аналитов, связываемых бинарными Г-4 зондами:
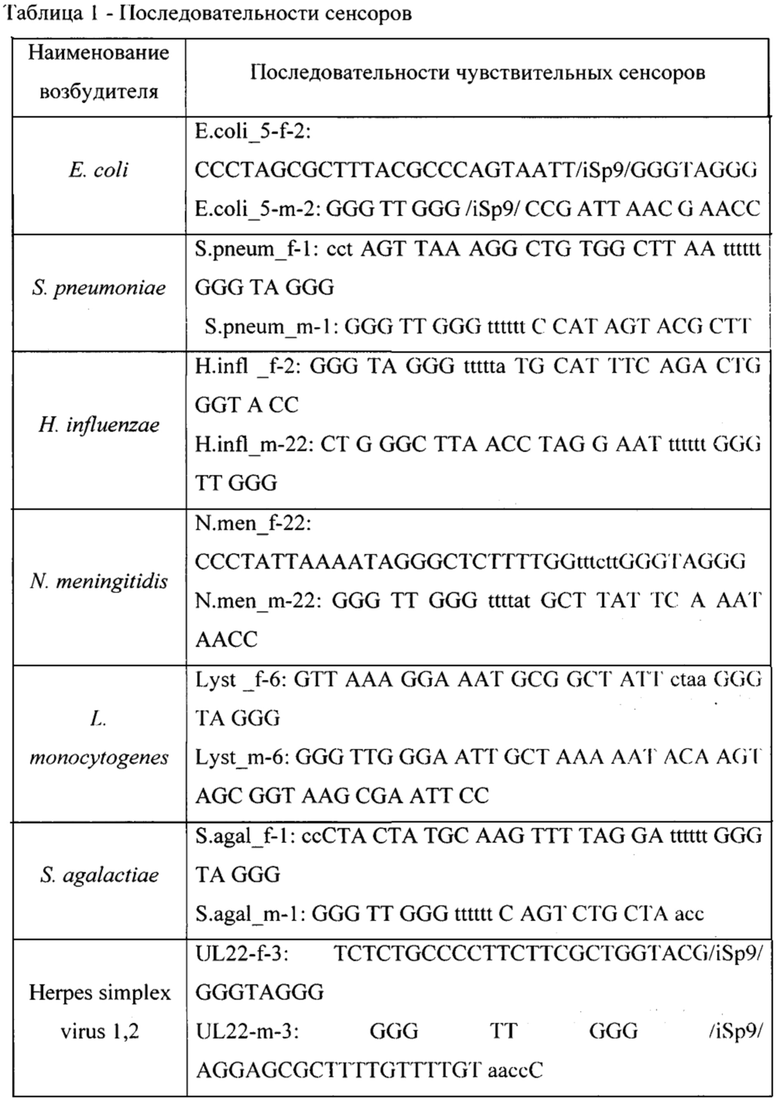
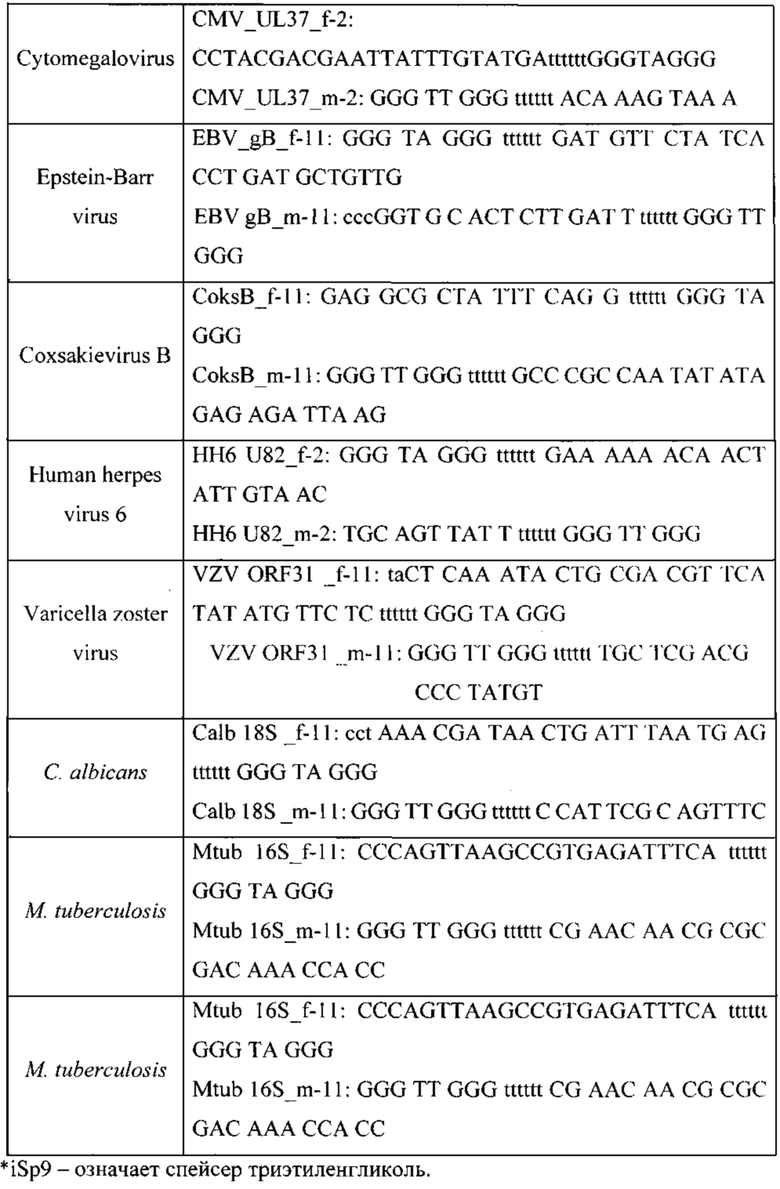
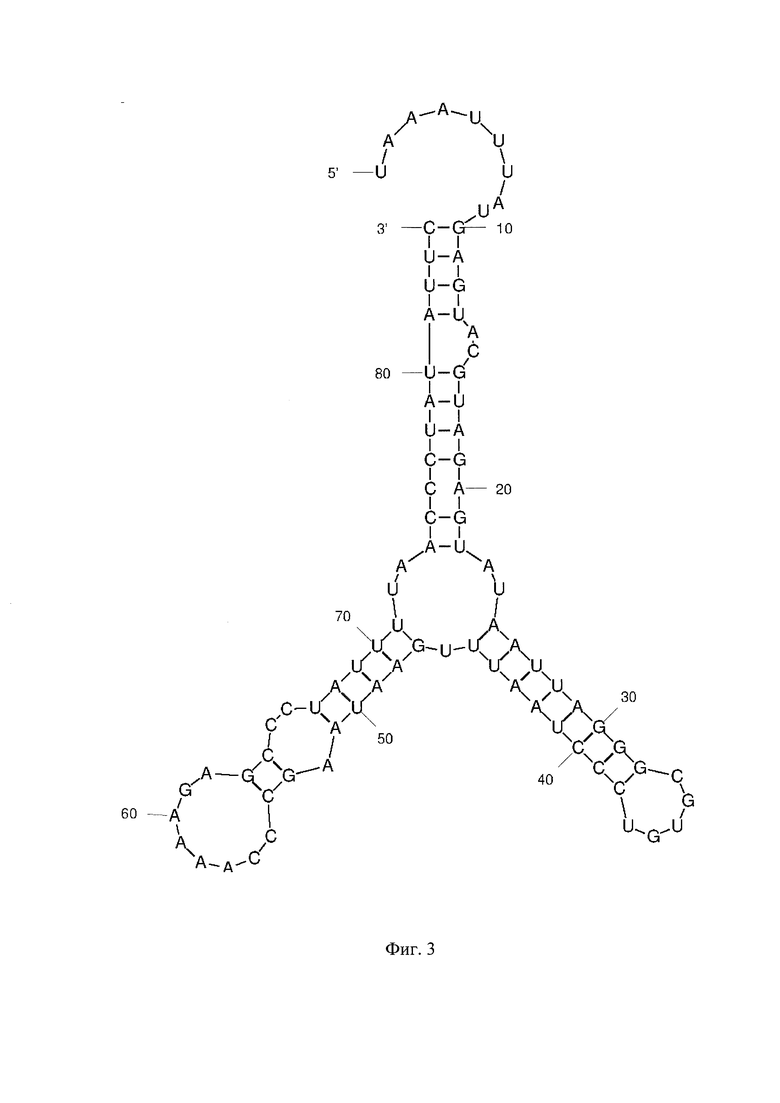
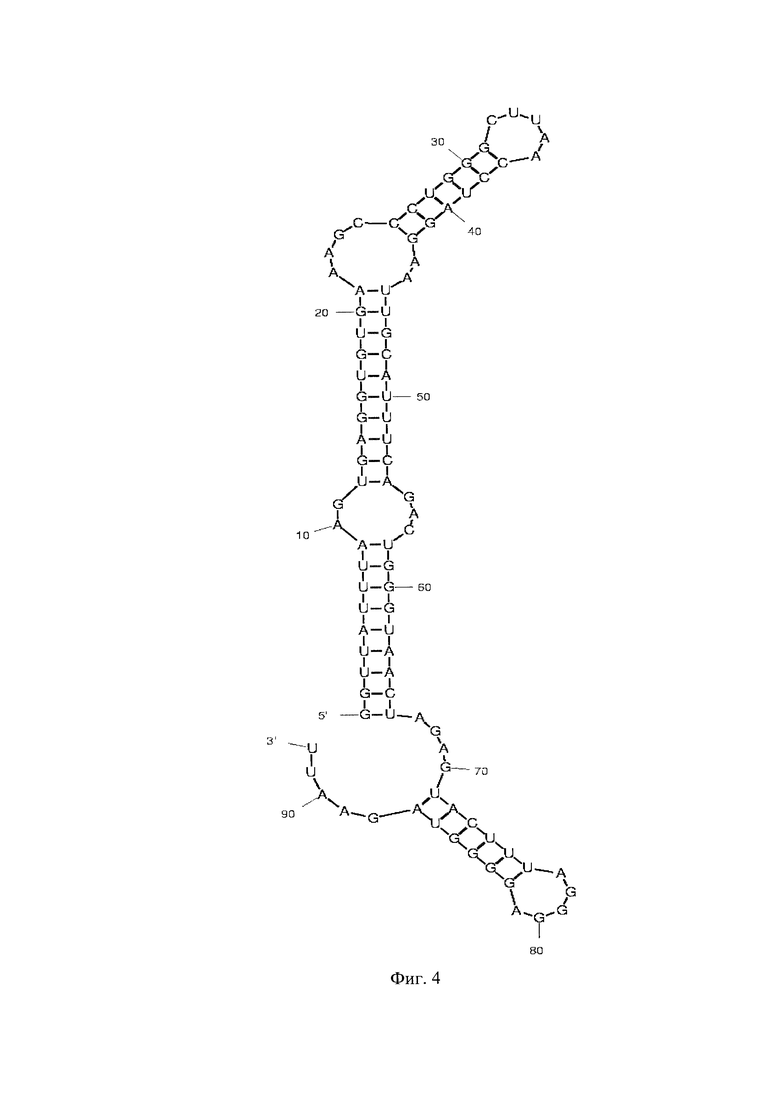
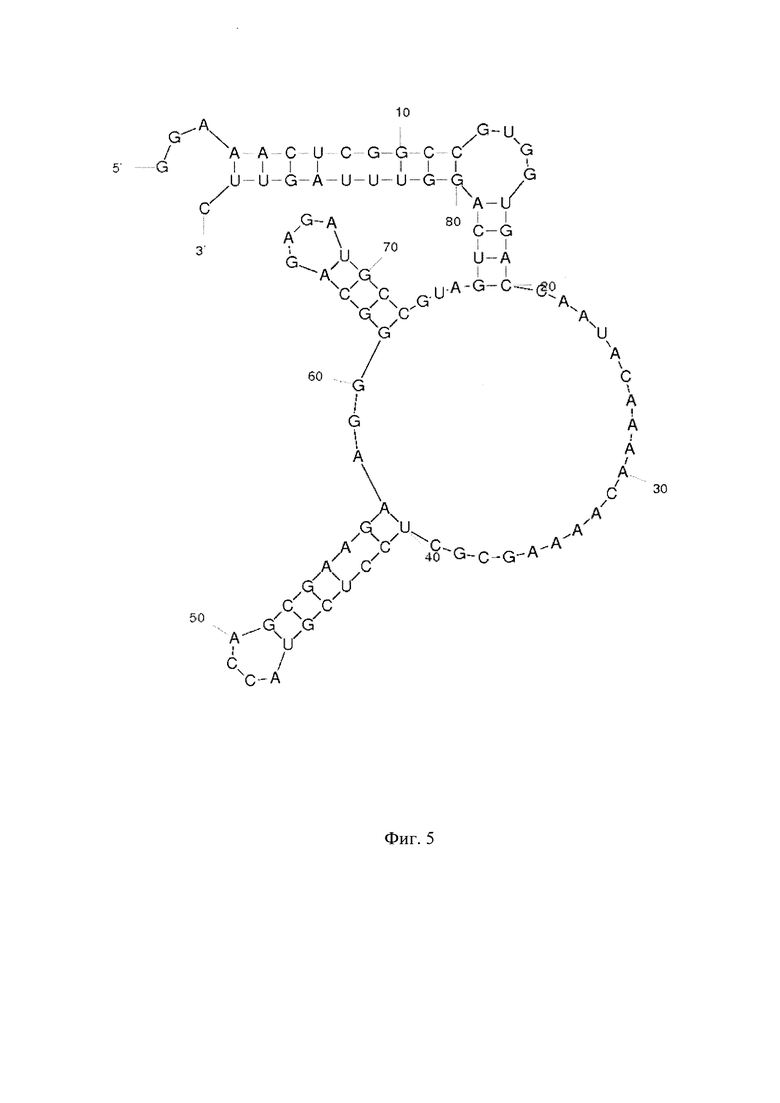
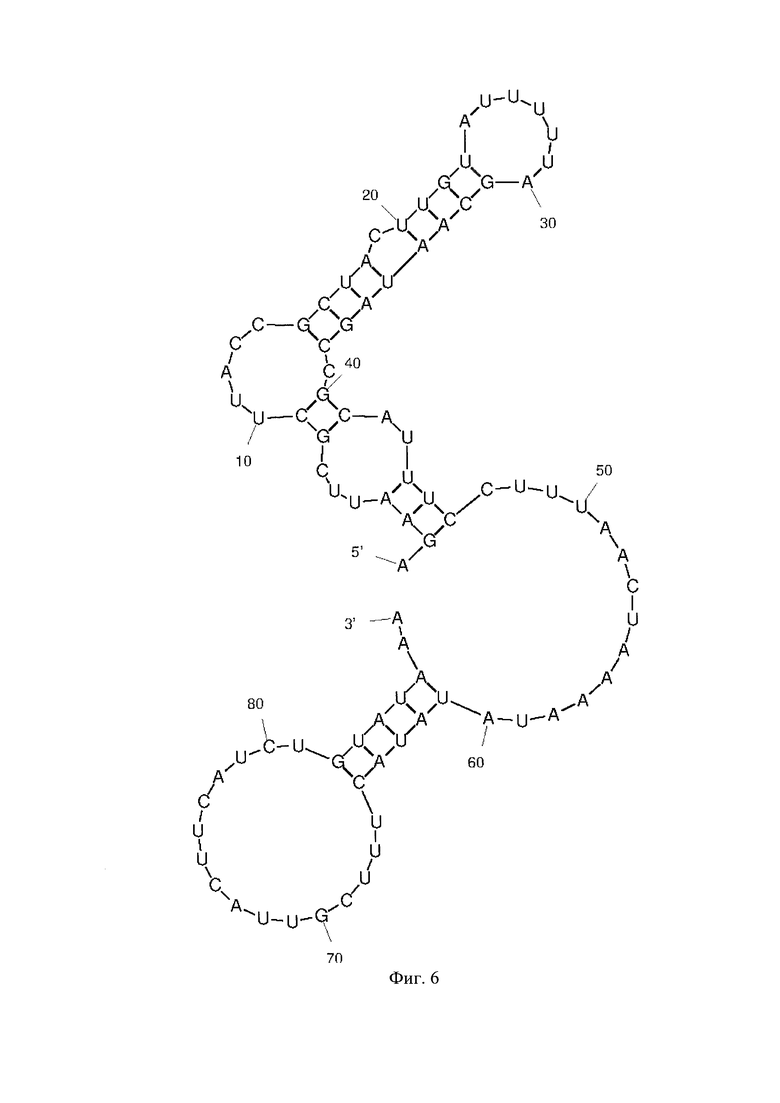
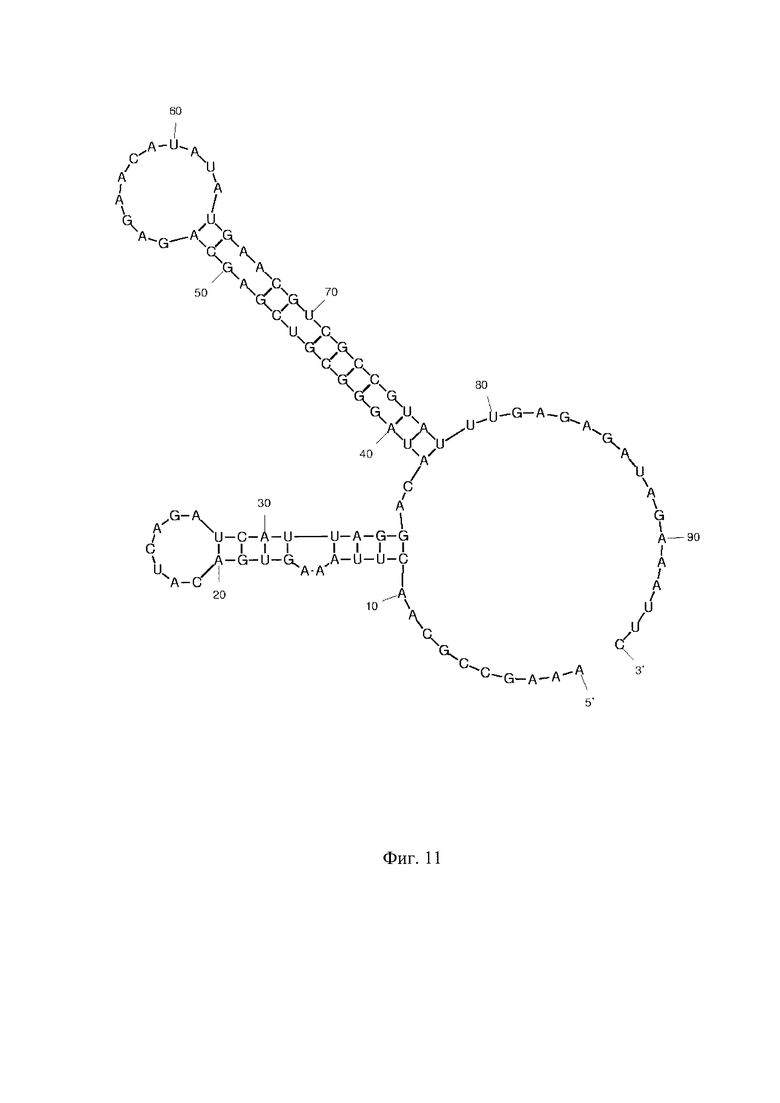
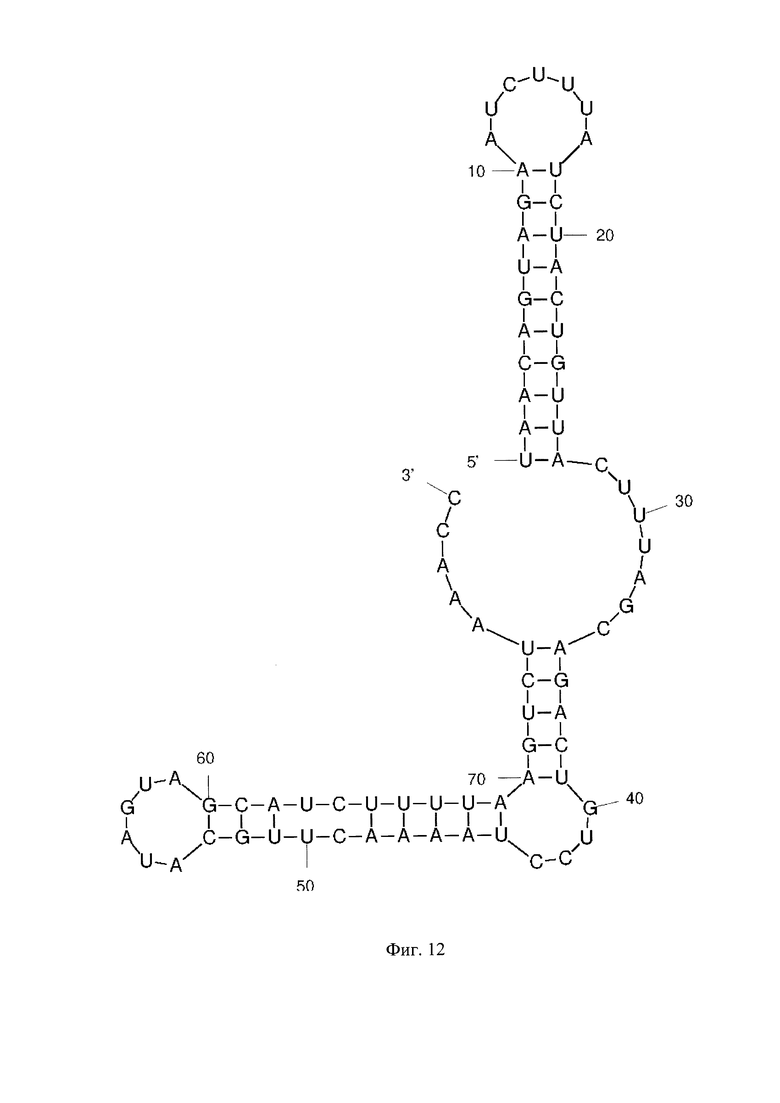
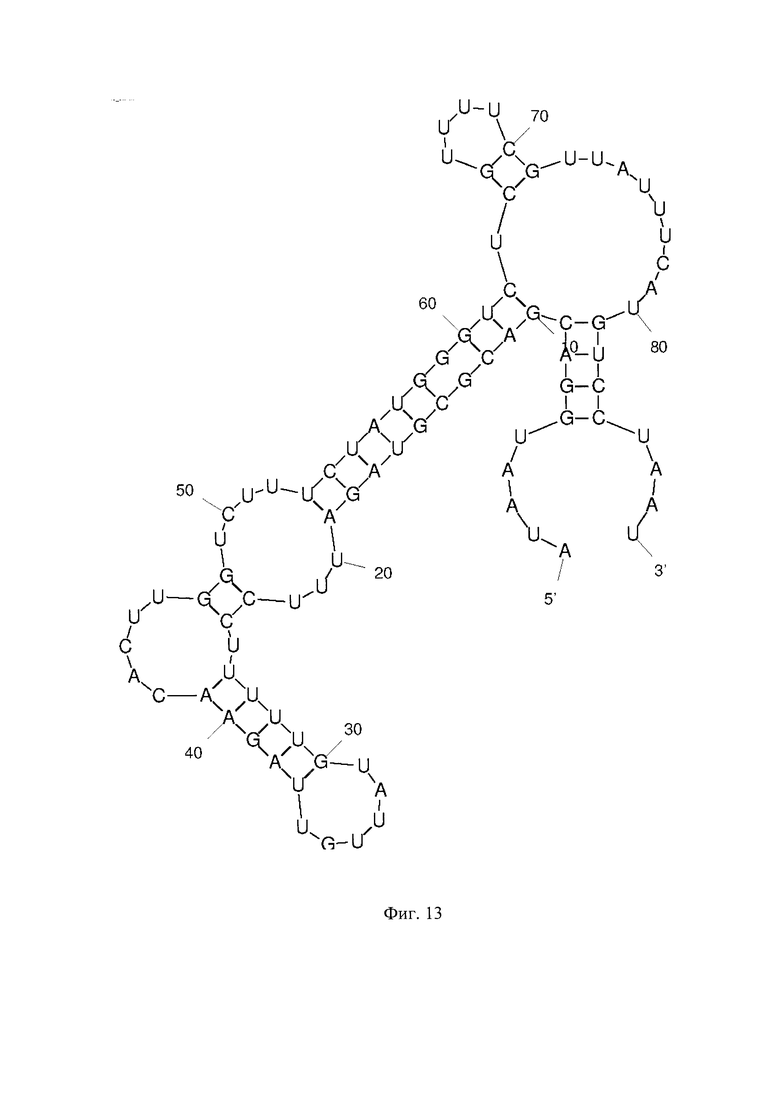
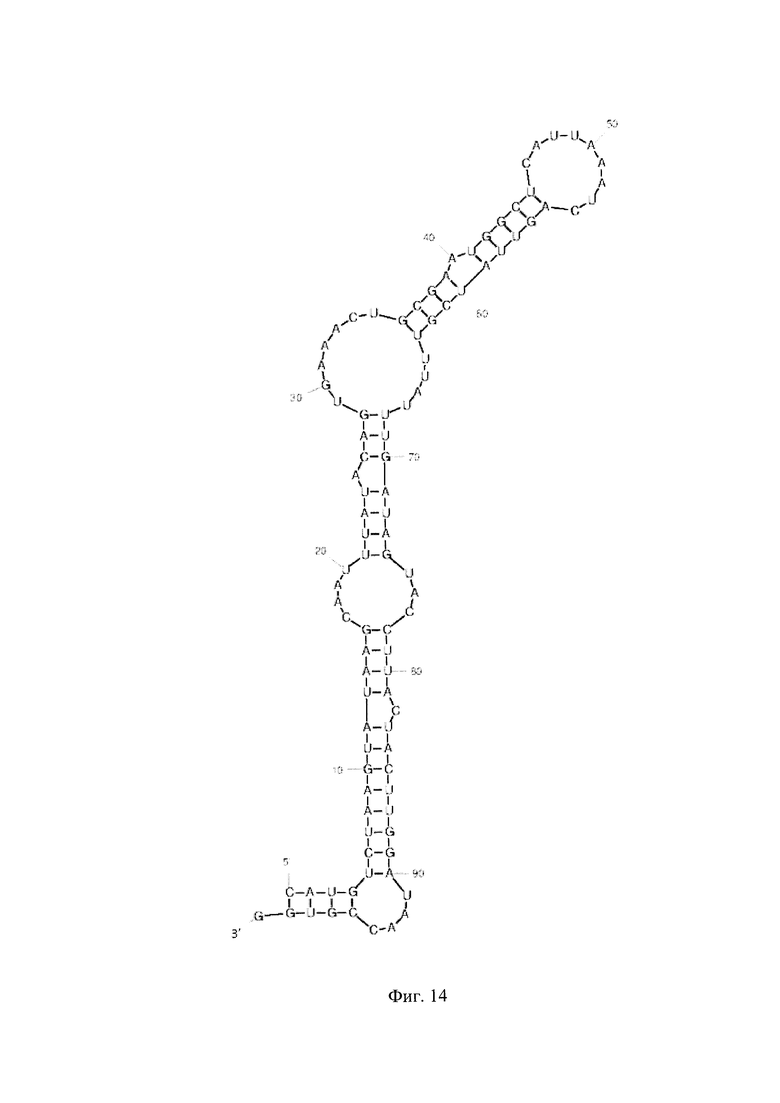
Фиг. 1 - РНК Е. coli, Фиг. 2 - РНК S. pneumoniae, Фиг. 3 - РНК N. meningitidis, Фиг. 4 - РНК Н. influenzae, Фиг. 5 - РНК вируса простого герпеса 1 и 2 типа, Фиг. 6 - РНК L. monocytogenes, Фиг. 7 - РНК вируса Коксаки В, Фиг. 8 - РНК М. tuberculosis, Фиг. 9 - РНК Cytomegalovirus, Фиг. 10 - РНК Human herpes virus 6, Фиг. 11 - РНК Varicella-zoster virus, Фиг. 12 - РНК S. agalactiae, Фиг. 13 - РНК Epstein-Barr virus, Фиг. 14 - РНК С. albicans, Фиг. 15 - РНК S. aureus. Предсказанная вторичная структура РНК-аналитов рассчитана в программе Mfold пакета EMBOSS.
Заявленное изобретение поясняется примерами. Приведенные примеры не являются ограничивающими, а раскрываются конкретные варианты реализации.
Пример 1. Создание тест-системы (вариант).
Синтетические олигонуклеотиды были произведены компаниями ДНК-Синтез, Россия и Евроген, Россия. Были сконструированы последовательности гибридизационных ДНК-зондов на основе Г-4 для детекции одноцепочечной ДНК и РНК N. meningitidis, Streptococcus pneumoniae, H. influenzae, E. coli, L. monocytogenes, S. agalactiae, C. albicans, M. tuberculosis, S. aureus, Вируса простого герпеса 1 типа, вируса простого герпеса 2 типа, вируса ветряной оспы, Cytomegalovirusa, вируса Эпштейна Барра, вируса герпеса 6 типа, энтеровируса Коксаки В.
Для фундаментальной разработки бинарных Г-4 (G-4) зондов была установлена вторичная структура РНК-аналитов N. meningitidis, S. pneumoniae, H. influenzae, E. coli, L. monocytogenes, S. agalactiae, C. albicans, M. tuberculosis, S. aureus, Вируса простого герпеса 1 типа, вируса простого герпеса 2 типа, вируса ветряной оспы, цитомегаловируса, вируса Эпштейна-Барра, вируса герпеса 6 типа, вируса Коксаки В при помощи сервера MFold (Фиг. 1-15). Для посадки бинарных Г-4 зондов были выбраны стабильные шпильки. В качестве спейсера использовали триэтиленгликоль или политимидин. Рабочая концентрация зондов составляет 1 мкМ. Последовательности зондов представлены в таблице 1.
Как видно из данных Таблицы 1, заявленная тест-система может одновременно включать несколько зондов, направленных на выявление одного конкретного возбудителя заболевания ЦНС.
Пример 2: Клинические примеры
Пациент №1.
Пациент с респираторной инфекцией, но с вестибулярными нарушениями: головокружением, рвотой, шумом и болью в ушах. Для диагностики использовали заявленную тест-систему.
Длительность анализа составила 90 мин.
Диагностическая специфичность зондов и чувствительность детекции аналитов составила 100%.
Диагноз: пневмококковая инфекция, вызванная S. pneumoniae
Диагноз пневмококковая инфекция подтвердился
микробиологическими методами.
Пациент №2.
Внезапная гипертермия с ознобом, вялость, головная боль, спутанность сознания и изменение поведения. Для диагностики использовали тест-систему согласно изобретению
Длительность анализа составила 90 минут.
Диагностическая специфичность зондов и чувствительность детекции аналитов составила 100%).
Диагноз: герпесвирусная инфекция
Диагноз герпесвирусная инфекция подтвердился методом ПЦР в реальном времени.
Пациент №3.
Бледность кожи, отказ от еды и питья, рвотой, болями в мышцах, суставах, животе, судорожные подергивания отдельных мышц, головная боль, тахикардия, неустойчивость артериального давления. Отмечена ригидность шеи. Присутствуют петехии. Для диагностики использовали тест-систему
Длительность анализа составила 90 минут.
Диагностическая специфичность зондов и чувствительность детекции аналитов составила 100%.
Диагноз: гнойный менингит, вызванный TV. meningitidis
Диагноз гнойный менингит подтвердился микробиологическими методами.
Исходя из вышесказанного, определение этиологии инфекций ЦНС при помощи ДНКзимных сенсоров показывает достоверные, подтверждаемые микробиологическими методами, результаты. Рабочими могут считаться следующие характеристики тест-системы:
1) Для визуализации реакции может быть использован любой субстрат, изменяющий свой цвет при окислении, в том числе диаминобензидин (ДАБ), 3,3',5,5'-тетраметилбензидин (ТМВ), 2,2-азино-бис (3-этилбензотиазолин-6-сульфокислота) (АБТС).
2) В качестве спейсера в ДНКзимных зондах может быть использован полиэтиленгликоль, триэтиленгликоль, гексаэтиленгликоль, политимидин.
3) Рабочая концентрация зондов может составлять 0,1-10 мкМ.
4) Для увеличения чувствительности тест-системы сенсоры совмещены в составе прибора с реакцией накопления аналита в виде изотермической ПЦР варианта NASBA (от англ. «Nucleic acid-based amplification»). Реакция накопления происходит в отдельных отсеках прибора в виде мультиплексных реакций, в которых происходит одновременного накопление нескольких аналитов. Реакция протекает при 41°С в присутствии ферментов, композиции солей и специфических олигонуклеотидов, подобранных для накопления целевого фрагмента в виде РНК.
5) Перед накоплением образец спинномозговой жидкости с содержащимися в нем патогенами лизируется буфером, состоящим из 0,25% SDS и 50 mM NaOH без или с добавлением зимолиазы и лизоцима в течение 20 минут. Нуклеиновые кислоты из полученного лизата впоследствии сорбируются на магнитных шариках и переосаждаются.
6) Заявляемая тест-система может быть помещена в поршневой картридж, микрофлюидный картридж, настольный микрокомпьютер. Такая форма позволяет обеспечить безопасность для ее оператора и автономность работы.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<160> SEQ ID NO 1
<211> 77
<213> Escherichia coli
<400> 1
TACGGAGGGT GCAAGCGTTA ATCGGAATTA CTGGGCGTAA AGCGCACGCA
GGCGGTTTGT TAAGTCAGAT GTGAAAT
<160> SEQ ID NO 2
<211> 84
<213> Neisseria meningitidis
<400> 2
TAAATTTATG AGTACGTAGA GTATAATTAG GGCGTGTCCC TAATTTGAAT AAGCCCAAAA
GAGCCCTATT TTAACCCTAT ATTC
<160> SEQ ID NO 3
<211> 83
<213> Streptococcus pneumoniae
<400> 3
ACTCTCCCCT CTTGCACTCA AGTTAAACAG TTTCCAAAGC GTACTATGGT
TAAGCCACAG CCTTTAACTTC AGACTTATCT AAC
<160> SEQ ID NO 4
<211> 92
<213> Haemophilus influenzae
<400> 4
AATTCTACCC CTCCCTAAAG TACTCTAGTT ACCCAGTCTG AAATGCAATT CCTAGGTTAA 60
GCCCAGGGCT TTCACACCTC ACTTAAATAA CC
<160> SEQ ID NO 5
<211> 79
<213> Streptococcus agalactiae
<400> 5
TAACAGTAGA ATCTTTATCT ACTGTTACTT TAGCAGACTG TCCTAAAACT TGCATAGTAG 60
CATCTTTTAA GTCTAAACC
<160> SEQ ID NO 6
<211> 116
<213> Listeria monocytogenes
<400> 88
AGAATTCGCT TACCGCTACT TGTATTTTTA GCAATAGCCG CATTTCCTTT AACTAAAATA 60
TATACTTTCG TTACTTCATC TGTATAAA
<160> SEQ ID NO 7
<211> 89
<213> Herpes simplex 1, 2
<400> 7
GGAAACTCGG CCGTGGTGAC CAATACAAAA CAAAAGCGCT CCTCGTACCA GCGAAGAAGG 60
GGCAGAGATG CCGTAGTCAG GTTTAGTTC
<160> SEQ ID NO 8
<211> 88
<213> Epstein Barr
<400> 8
ATAATGGACG ACGCGTAGAT TTCCTTTTTG TATTGTTAGA ACACTTGGTC TTTCTATGGG
TCTCGTTTTC GTTATTTCAT GTCCTAAT
<160> SEQ ID NO 9
<211> 95
<213> Varicella zoster virus
<400> 9
AAAGCCGCAA CTTAAAGTGA CATCAGATCA TTAGGACATA GGGCGTCGAG CAGAGAACAT
ATATGAACGT CGCCGTATTT GAGAGATAGA AATTC
<160> SEQ ID NO 10
<211> 87
<213> Cytomegalovirus
<400> 10
CGTGATCTTT CTTTTACTTT GTTCATACAA ATAATTCGTC GTACACCCCG ATTATCCCCC
CTATTGACTC CATATCGTTG ATACTTT
<160> SEQ ID NO 11
<211> 93
<213> Herpes virus 6
<400> 11
GACTTTACAA TTTGAGCTCT GGGCGTTACA ATAGTTGTTT TTTCAATAAC TGCATGCATT
AAAAAAGCCC GCTTATAAAA GATGTCAATA GAG
<160> SEQ ID NO 12
<211> 92
<213> Enterovirus
<400> 12
CTCTGGCGCA ATACTGATCT TAATCTCTCT ATATATTGGC GGGCCCTGAA ATAGCGCCTC
AAGGGTGGCC CCAACACTAT GTCTATGGTT AT
<160> SEQ ID NO 13
<211> 110
<213> Mycobacteria tuberculosis
<400> 13
GTAAAGAGCT CGTAGGTGGT TTGTCGCGTT GTTCGTGAAA TCTCACGGCT TAACTGTGAG
CGTGCGGGCG ATACGGGCAG ACTAGAGTAC TGCAGGGGAG ACTGGAATTC
<160> SEQ ID NO 14
<211> 99
<213> Candida albicans
<400> 14
CATGTCTAAG TATAAGCAAT TTATACAGTG AAACTGCGAA TGGCTCATTA AATCAGTTAT
CGTTTATTTG ATAGTACCTT ACTACTTGGA TAACCGTGG
<160> SEQ ID NO 15
<211> 118
<213> Staphylococcus aureus
<400> 15
TCAGTCAATT CATCTCTAAC TAACTGTAAT AACACTTCTT CATCAGCTAA GATTGCTTCT
AATTCACTAA TATAATTTAA TAACTCATTA TATTCAGCTT
CAATTTTGTC TCTCTCTA
<160> SEQ ID NO 16
<211> 33
<213> Искусственная последовательность
<400> 16
CCCTAGCGCT TTACGCCCAG TAATT /iSp9/ GGGTAGGG
<160> SEQ ID NO 17
<211> 22
<213> Искусственная последовательность
<400> 17
GGTTGGG /iSp9/ CCGATTAACG AACC
<160> SEQ ID NO 18
<211> 37
<213> Искусственная последовательность
<400> 18
CCTAGTTAAA GGCTGTGGCT TAATTTTTTG GGTAGGG
<160> SEQ ID NO 19
<211> 27
<213> Искусственная последовательность
<400> 19
GGGTTGGGTT TTTTCCATAG TACGCTT
<160> SEQ ID NO 20
<211> 34
<213> Искусственная последовательность
<400> 20
GGGTAGGGTT TTTATGCATT TCAGACTGGG TACC
<160> SEQ ID NO 21
<211> 28
<213> Искусственная последовательность
<400> 21
GGGCTTAACC TAGGTTTTTT GGGTTGGG
<160> SEQ ID NO 22
<211> 33
<213> Искусственная последовательность
<400> 22
TCTCTGCCCC TTCTTCGCTG GTACG /iSp9/ GGGTAGGG
<160> SEQ ID NO 23
<211> 32
<213> Искусственная последовательность
<400> 23
GGGTTGGG /iSp9/ AGGAGCGCTT TTGTTTTGTA ACCC
<160> SEQ ID NO 24
<211> 33
<213> Искусственная последовательность
<400> 24
GTTAAAGGAA ATGCGGCTAT TCTAAGGGTA GGG
<160> SEQ ID NO 25
<211> 44
<213> Искусственная последовательность
<400> 25
GGGTTGGGAA TTGCTAAAAA TACAAGTAGC GGTAAGCGAA TTCC
<160> SEQ ID NO 26
<211> 30
<213> Искусственная последовательность
<400> 26
GAGGCGCTAT TTCAGGTTTT TTGGGTAGGG
<160> SEQ ID NO 27
<211> 40
<213> Искусственная последовательность
<400> 27
GGGTTGGGTT TTTTGCCCGC CAATATATAG AGAGATTAAG
<160> SEQ ID NO 28
<211> 31
<213> Искусственная последовательность
<400> 28
CCCAGTTAAG CCGTGAGATT TCA /iSp9/ GGGTAGGG
<160> SEQ ID NO 29
<211> 31
<213> Искусственная последовательность
<400> 29
GGGTTGGG /iSp9/ CGAACAACGC GCGACAAACC ACC
<160> SEQ ID NO 30
<211> 37
<213> Искусственная последовательность
<400> 30
CCTACGACGA ATTATTTGTA TGATTTTTTG GGTAGGG
<160> SEQ ID NO 31
<211> 24
<213> Искусственная последовательность
<400> 31
GGGTTGGGTT TTTTACAAAG TAAA
<160> SEQ ID NO 32
<211> 34
<213> Искусственная последовательность
<400> 32
cct AT ACA AA GAC CAA GTG TTC TAA CAA TA CAA TTTTTT GGG TA GGG
<160> SEQ ID NO 33
<211> 24
<213> Искусственная последовательность
<400> 33
GGG TT GGG tttttt AAA GGA AATCTACGC
<160> SEQ ID NO 34
<211> 47
<213> Искусственная последовательность
<400> 34
TACTCAAATA CTGCGACGTT CATATATGTT CTCTTTTTTG GGTAGGG
<160> SEQ ID NO 35
<211> 31
<213> Искусственная последовательность
<400> 35
GGGTTGGGTT TTTTTGCTCG ACGCCCTATG T
<160> SEQ ID NO 36
<211> 37
<213> Искусственная последовательность
<400> 36
CCTAAACGAT AACTGATTTA ATGTTTTTTG GGTAGGG
<160> SEQ ID NO 37
<211> 24
<213> Искусственная последовательность
<400> 37
GGGTTGGGTT TTTTAGCCAT TCGC
<160> SEQ ID NO 38
<211> 47
<213> Искусственная последовательность
<400> 38
CCTATACAAA GACCAAGTGT TCTAACAATA CAATTTTTTG GGTAGGG
<160> SEQ ID NO 39
<211> 29
<213> Искусственная последовательность
<400> 39
GGGTTGGGTT TTTTAAAGGA AATCTACGC
<160> SEQ ID NO 40
<211> 45
<213> Искусственная последовательность
<400> 40
CCCTAAGCTG AATATAATGA GTTATTAAAT TTTTTTTGGG TAGGG
<160> SEQ ID NO 41
<211> 32
<213> Искусственная последовательность
<400> 41
GGGTTGGGTT TTTTATATTA GTGAATTAGC CC
<160> SEQ ID NO 42
<211> 39
<213> Искусственная последовательность
<400> 42
СCCTATTAAA ATAGGGCTCT TTTGGTTTCT TGGGTAGGG
<160> SEQ ID NO 43
<211> 30
<213> Искусственная последовательность
<400> 43
GGGTTGGGTT TTATGCTTAT TCAAATAACC
<160> SEQ ID NO 44
<211> 36
<213> Искусственная последовательность
<400> 44
CCCTACTATG CAAGTTTTAG GATTTTTTGG GTAGGG
<160> SEQ ID NO 45
<211> 27
<213> Искусственная последовательность
<400> 45
GGGTTGGGTT TTTTCAGTCT GCTAACC
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Тест-система и способ обнаружения специфических фрагментов нуклеиновых кислот 16 патогенов с использованием изотермической реакции амплификации | 2023 |
|
RU2810751C1 |
| Способ обратной транскрипции, совмещенный с мультиплексной ПЦР для видеоспецифической идентификации возбудителей бактериальной, и вирусной пневмонии человека с иммобилизованными праймерами и биологический микрочип для его осуществления | 2021 |
|
RU2784653C1 |
| Способ и набор праймеров для видоспецифической идентификации возбудителей бактериальной пневмонии человека | 2021 |
|
RU2781014C1 |
| СПОСОБ ТАРГЕТНОЙ АМПЛИФИКАЦИИ ГЕНОМОВ ВОЗБУДИТЕЛЕЙ ИНФЕКЦИЙ ОРГАНОВ РЕПРОДУКЦИИ ЧЕЛОВЕКА С ЦЕЛЬЮ ОДНОВРЕМЕННОЙ ИДЕНТИФИКАЦИИ ВОЗБУДИТЕЛЕЙ С НАБОРОМ ПРАЙМЕРОВ | 2015 |
|
RU2625006C1 |
| Набор синтетических олигонуклеотидных праймеров и зондов для выявления вируса респираторно-синцитиальной инфекции крупного рогатого скота и гена GAPDH крупного рогатого скота и способ выявления РНК вируса респираторно-синцитиальной инфекции крупного рогатого скота | 2020 |
|
RU2768753C2 |
| ОНКОЛИТИЧЕСКИЙ HSV-ВЕКТОР | 2014 |
|
RU2719190C2 |
| Набор для дифференциации пестивирусов крупного рогатого скота и способ дифференциации пестивирусов крупного рогатого скота | 2019 |
|
RU2731716C1 |
| Тест-система для количественной диагностики мРНК интерферонов I, II и III типов человека на основе ПЦР | 2020 |
|
RU2751791C1 |
| Использование композиции, состоящей из катионного пептида LTP и молекул РНК против респираторных вирусов | 2015 |
|
RU2609857C1 |
| Способ оценки репродуктивной активности вирусов гриппа в составе тривалентной и квадривалентной живой гриппозной вакцины | 2019 |
|
RU2735293C1 |
Изобретение относится к биотехнологии и медицине. Описана тест-система для выявления нуклеиновых кислот возбудителей инфекций ЦНС, содержащая пары высокоспецифичных и чувствительных бинарных зондов, представленных ДНКзимами. При обнаружении целевой нуклеиновой кислоты возбудителя инфекционного заболевания происходит специфическое связывание с ее участками и формируется гуаниновый квадруплекс, обладающий ферментативной активностью пероксидазы. Это позволяет выявлять патоген посредством колориметрической реакции. При этом зонды представлены олигонуклеотидами с последовательностями SEQ 16 – SEQ 45, содержащими участки, распознающими хотя бы одну из последовательностей нуклеиновых кислот патогенов в биообразце, а патогены включают последовательности, соответствующие представленным на SEQ ID 1 – SEQ ID 15. Тест-система позволяет идентифицировать следующие патогены: N. meningitidis, S. pneumoniae, H. influenzae, E. coli, L. monocytogenes, S. agalactiae, Candida albicans, Mycobacteria tuberculosis, S. aureus, Herpes simplex virus 1, Herpes simplex virus 2, Varicella zoster virus, Cytomegalovirus, Epstein Barr virus, Herpes virus 6, Enterovirus. Изобретение направлено на детекцию продукта, накопленного методами циклической или изотермической ПЦР. Изобретение адаптировано для работы в поршневом картридже, микрофлюидном картридже, биоманипуляторе с числовым программным управлением. Заявленная тест-система проста в эксплуатации, не требует специальных лабораторных условий и профессиональных навыков и обеспечивает получение быстрого и надежного результата. 2 з.п. ф-лы, 15 ил., 1 табл., 2 пр.
1. Тест-система для выявления нуклеиновых кислот возбудителей инфекций ЦНС, содержащая пары высокоспецифичных и чувствительных бинарных зондов, представленных ДНКзимами, при обнаружении целевой нуклеиновой кислоты возбудителя инфекционного заболевания специфически связываются с ее участками и формируют гуаниновый квадруплекс, обладающий ферментативной активностью пероксидазы, что позволяет выявлять патоген посредством колориметрической реакции, при этом зонды представлены олигонуклеотидами с последовательностями SEQ 16 – SEQ 45, содержащими участки, распознающими хотя бы одну из последовательностей нуклеиновых кислот патогенов в биообразце, при этом патогены включают последовательности, соответствующие представленным на SEQ ID 1 – SEQ ID 15, что позволяет идентифицировать следующие патогены: N. meningitidis, S. pneumoniae, H. influenzae, E. coli, L. monocytogenes, S. agalactiae, Candida albicans, Mycobacteria tuberculosis, S. aureus, Herpes simplex virus 1, Herpes simplex virus 2, Varicella zoster virus, Cytomegalovirus, Epstein Barr virus, Herpes virus 6, Enterovirus.
2. Тест-система по п. 1, в которой дезоксирибозимный бинарный зонд содержит спейсер, представленный полиэтиленгликолем, триэтиленгликолем, гексаэтиленгликолем или политимидином, но не ограничиваются ими.
3. Тест-система по п. 1, в которой для колориметрической реакции в качестве субстратов используют диаминобензидин (ДАБ), 3,3’, 5,5’-тетраметилбензин (ТМВ), 2,2-азино-бис (3-этилбензотиазолин-6-сульфокислота) (АБТС) или гомовалиновую кислоту (ГВК).
| Григорьева Е., Недорезова Д., Молекулярные машины: от создания искусственной модели к терапии рака, Биомолекула, 19.11.2019, найдено в интернет 20.12.2022 https://biomolecula.ru/articles/molekuliarnye-mashiny-ot-sozdaniia-iskusstvennoi-modeli-k-terapii-raka | |||
| ОДНОВРЕМЕННОЕ ОПРЕДЕЛЕНИЕ, ИДЕНТИФИКАЦИЯ И ДИФФЕРЕНЦИАЦИЯ ЭУБАКТЕРИАЛЬНЫХ ТАКСОНОВ С ПОМОЩЬЮ ГИБРИДИЗАЦИОННОГО АНАЛИЗА | 1995 |
|
RU2154106C2 |
| EP 3348645 A1, 18.07.2018 | |||
| Бодулев О.Л., Грибас А.В | |||
| и др., | |||
Авторы
Даты
2023-06-23—Публикация
2021-11-10—Подача