Изобретение относится к медицине, а именно аллергологии и иммунологии, дерматовенерологии и терапии и может быть использовано для количественного определения уровня адренокортикотропного гормона (АКТГ) на уровне шокового органа - в коже.
Кожа является самым большим органом человеческого тела. Это сложно организованный орган, состоящий из множества специализированных клеток, ограничивающих агрессивную внешнюю среду от внутренней среды организма. Наряду с покровной и защитной функциями кожа принимает участие в дыхании, терморегуляции, экскреции, рецепции, водно-солевом обмене, а также иммунной, метаболической и эндокринной функциях (Гормональное здоровье кожи / Бурчаков Д.И., Стенько А.Г., Талыбова A.M., Гилельс А.В. // Эффективная фармакотерапия. - 2016. - С. 26-30).
Кожа является мишенью для многих гормонов. Наибольшее влияние на ее нормальное функционирование и строение оказывают половые гормоны и гормоны щитовидной железы. Влияние щитовидной железы на состояние кожи обусловлено уровнем вырабатываемых ею гормонов (тороксина и трийодтиронина). При повышении их уровня кожа становится нежной и чувствительной к прикосновениям, а при снижении выработки гормонов - сухой и шероховатой. Действие половых гормонов (андрогенов и эстрогенов) на состояние кожи проявляется в антагонистических функциях. Эстрогены повышают антиоксидантные свойства кожи и активируют теломеразы, оказывая противовоспалительные свойства, а андрогены наоборот, обладают провоспалительными свойствами.
В поддержании кожного гомеостаза, включая реакцию на психологический и физический стресс, а также факторы воспаления, очень важную роль играет так называемая центральная гипоталамо-гипофизарно-надпочечниковая ось, ключевыми эффекторными молекулами которой являются глюкокортикоиды, и кортизол, в частности. Ключевой регулятор реакции на стресс - кортикотропин-рилизинг-гормон продуцируется в гипоталамусе и, связываясь с соответствующим рецептором в передней доле гипофиза, индуцирует секрецию пептидов, включая адренокортикотропный гормон (АКТГ), альфа-меланоцитстимулирующий гормон и бета-эндорфин. Адренокортикотропный гормон опосредует воспалительную реакцию, стимулируя выработку глюкокортикоидов надпочечниками (кортизола), которые действуют во многих клетках и тканях, проявляя обширное влияние на многие функции, включая противовоспалительное действие, тем самым регулируя гомеостаз, в том числе и кожный (Association between Stress and the HPA Axis in the Atopic Dermatitis / Lin T-K, Zhong L, Santiago JL// International Journal of Molecular Sciences - 2017, 18(10), P. 21-31).
Данные гормоны действуют на системном уровне, т.е. эндокринно, они достигают свои мишени в коже через системный кровоток.
Помимо того, что кожа является мишенью для гормонов, она является полноценным самостоятельным органом эндокринной системы. Многие гормональные вещества продуцируются или подвергаются трансформации именно здесь. В ней происходит конверсия тестостерона в дигидротестостерон, ароматизация андрогенов в эстрогены, превращение тироксина в трийодтиронин, продукция инсулиноподобного фактора роста, синтез катехоламинов, ретиноидов, эйкозаноидов, образование предшественника витамина D и множество других (Кожа как эндокринный орган. Часть 1. Стероидные гормоны, кортикостероида, катехоламины / Шарова А. // Косметика и медицина. - 2008. - №6. - С. 10-15.).
В ответ на продолжающееся воздействие факторов окружающей среды, для регулирования своего гемостаза в коже в процессе эволюции появилась местная периферическая гипоталамо-гипофизарно-надпочечниковая ось, аналогичная по иерархической структуре центральной оси. Периферическая ось действует на местном уровне, оказывая интракринный, аутокринный и паракринный эффект на клетки кожи, через соответствующие периферические маланокортиновые рецепторы MCR1-MCR5. Из всех гормонов периферической гипоталамо-гипофизарно-надпочечниковой оси только АКТГ может активировать все 5 типов MCR (Melanocortins, Melanocortin Receptors and Multiple Sclerosis / Robert P. Lisak and Joyce A. Benjamins // Brain Sciences. - 2017, 7(8), 104 https://doi.org/10.3390/brainsci7080104). Активация соответствующих меланокортиновых рецепторов приводит к синтезу меланина, влиянию на энергетический обмен, метаболизму липидов, обезболивающему, иммуномодулирующему и противовоспалительному эффекту, регенерации периферических нервов и росту аксонов и т.д. Противовоспалительный эффект АКТГ обусловлен глюкортикоид-зависимыми (выработка кортизола) и независимыми способами. К последним относятся ингибирование активации макрофагов, уменьшение фагоцитоза, снижение продукции провоспалительных цитокинов и усиление экспрессии противовоспалительных цитокинов и т.д. (Melanocortin Regulation of Inflammation / Wang W, Guo D-Y, Lin Y-J, Tao Y-X // Frontiers in Endocrinology, 09 October 2019. Sec. Neuroendocrine Science https://doi.org/10.3389/fendo.2019.00683).
Все исследования по изучению адренокортикотропного гормона проводятся на системном уровне (сыворотка и плазма крови), в биоптатах кожи или с использованием культуральных моделей клеток, содержащих эндогенно экспрессируемый АКТГ, а именно клеточной линии меланомы Cloudman S91, модели клеток человека - культуры меланоцитов, фибробластов, себоцитов, линии эпидермальных кератиноцитов человека НаСаТ, а также модели животных (волосяные фолликулы мышей линии C57BL-6 и норок). Для детекции самого адренокортикотропного гормона или его рецептора применяются такие методы как иммуногистохимия, RT-PCR, Нозерн-блоттинг, иммунофлуоресцентная микроскопия, проточная цитофлуориметрия, электрофоретический анализ, МТТ-анализ (микротитрационный колориметрический тест).
Перечисленные методы исследования являются трудоемкими, для их проведения требуется дорогостоящее оборудование и наличие высококвалифицированных специалистов, а также длительность проведения исследования. Определение АКТГ на системном уровне не отражает полной картины гормональной активности в коже, что определяет актуальность исследования топически секретируемого гормона на локальном уровне - в коже. Методов количественного определения уровня адренокортикотропного гормона, продуцируемого непосредственно в коже, обладающего короткодистантным механизмом действия на клетки-мишени, на настоящий момент нет.
Для количественного определения АКТГ на локальном уровне необходимо исследовать его концентрацию в коже методом «кожного окна».
Ранее, с помощью метода «кожного окна» появилась возможность определения количественного уровня биологически активных веществ (иммуноглобулины, цитокины) на уровне кожи.
Известен способ оценки активности атопического воспаления, который заключается в количественном определении иммуноглобулинов sIgA, IgA, IgM и IgG в экссудатах «кожного окна» у больных с атопическим дерматитом в период обострения (Цораева З.А. Нарушения местного и системного иммунитета при атопическом дерматите у детей и совершенствование тактики его лечения. / Цораева З.А. // Автореферат диссертации кандидата медицинских наук. - Москва. - 2007. - 27 с.). С целью изучения местного иммунитета кожи использовался метод «кожного окна» по Rebuck J и Crowley J в модификации Климова В.В. (Патент №1534395 от 07.01.1990 на изобретение: «Способ диагностики аллергического диатеза» / В.В. Климов, Т.В. Кошовкина, В.К. Раткин, А.А. Денисов), которая предполагает использование камер над зоной повреждения. Переднюю сторону предплечья дезинфицируют спиртом. Затем в средней трети ладонной поверхности предплечья с помощью стерильного скальпеля удаляют верхний слой эпидермиса на участке кожи площадью 1×1 см, получают поверхность с характерным блеском. На скарифицированный участок помещают камеру объемом 1 мл, предварительно заполненную стерильным физизиологическим раствором. Камеру фиксируют на 18 часов с помощью лейкопластыря. После снятия камеры в экссудате определяли количественный состав sIgA, IgA, IgM и IgG методом «радиальной иммунодиффузии» по Mancini et al., a IgE - иммуноферментным методом по стандартной методике. Показатели иммуноглобулинов характеризуют только гуморальное звено иммунитета и не отражают картины гормональной активности кожи. К недостаткам метода также относятся: длительность проведения процедуры, устаревший метод «радиальной иммунодиффузии».
Также известен способ оценки минимальной воспалительной активности кожи при атопическом дерматите в стадии ремиссии, который заключается в изучении цитокиновых профилей в экссудатах «кожного окна» при отсутствии каких-либо клинических проявлений у пациентов с атопическим дерматитом (Медицинская технология «Способ оценки минимальной воспалительной активности кожи при атопическом дерматите в стадии ремиссии» ФС №2010/217 от 10.06.2010 Климов В.В., Денисов А.А., Фирсова Е.К., Саликова Т.И., Загрешенко Д.С.). Забор экссудата по методике «кожного окна» по Rebuck J и Crowley J в модификации Климова В.В. проводился через 6 часов. В бесклеточной фракции экссудата «кожного окна» с помощью метода иммуноферментного анализа проводилось определение уровней IL-4, IFN-γ и IL-10. В соответствии с профилем цитокинов определяется наличие или отсутствие минимальной воспалительной активности кожи. Данный способ также не отражает картины гормональной активности кожи.
Назначение настоящего изобретения - количественное определение уровня адренокортикотропного гормона in vivo в экссудатах «кожного окна».
Назначение изобретения достигается способом определения адренокортикотропного гормона в экссудате «кожного окна», проводят постановку метода «кожного окна», а именно в средней трети ладонной поверхности предплечья с помощью стерильного скальпеля удаляют верхние слои эпидермиса до блестящего слоя, удалив роговой слой, на участке кожи площадью 1 на 1 см, получают поверхность с характерным блеском, на скарифицированный участок помещают пластиковую камеру объемом 1 мл, предварительно заполненную с помощью шприца стерильным раствором натрия хлорид 0,9%, камеру фиксируют на скарифицированном участке кожи с помощью лейкопластыря; через 6 часов камеру снимают, ее содержимое пипеточным дозатором собирают и переносят в пробирку типа эппендорф, центрифугируют экссудат «кожного окна», а полученную бесклеточную фракцию экссудата - супернатант сразу используют для определения концентрации адренокортикотропного гормона, эппендорф с экссудатом центрифугируют и с использованием набора реагентов АСТН Elecsys, Cobas е, производитель Roche Diagnostics проводят измерение уровня адренокортикотропного гормона на автоматическом электрохемилюминесцентном иммуноанализаторе Cobas е411 rack.
Если для проведения исследования необходимо набрать определенное количество материала, а определение уровня АКТГ планируется через некоторое время, тогда супернатант немедленно замораживают при температуре -20°С для хранения, а перед процедурой определения уровня АКТГ образцы размораживают при комнатной температуре в течение 20 минут, далее центрифугируют при 1500 об/мин в течение 2-х минут, при этом допустимо только однократное замораживание и размораживание образцов.
Новизна способа:
1. Количественное определение уровня АКТГ in vivo в экссудатах «кожного окна».
2. С применением данного способа появилась возможность быстрого определения уровня АКТГ непосредственно в коже.
3. Малая инвазивность, простота способа определения уровня АКТГ.
Технический результат, достигаемый предлагаемым способом, позволяет определить in vivo уровень адренокортикотропного гормона в экссудатах «кожного окна» доступным методом, малоинвазивным в сочетании с высокоточным современным методом иммуноанализа.
Способ осуществляется следующим образом.
Методика проведения «кожного окна» для получения кожного экссудата.
Перед началом процедуры исследователь надевает медицинские перчатки. Переднюю поверхность предплечья пациента дезинфицируют 70% этиловым спиртом. Затем в средней трети ладонной поверхности предплечья с помощью стерильного скальпеля удаляют верхние слои эпидермиса до блестящего слоя. Удалив роговой слой, на участке кожи площадью 1 на 1 см, получают поверхность с характерным блеском.
На скарифицированный участок помещают пластиковую камеру объемом 1 мл, предварительно заполненную с помощью шприца стерильным раствором натрия хлорид 0,9%. Камеру фиксируют на скарифицированном участке кожи с помощью лейкопластыря. Круговая обвязка предплечья лейкопластырем обеспечивает наиболее надежную фиксацию камеры.
Через 6 часов камеру снимают, ее содержимое пипеточным дозатором собирают и переносят в пробирку типа эппендорф. Далее, центрифугируют экссудат «кожного окна», а полученную бесклеточную фракцию экссудата (супернатант) сразу используют для определения концентрации адренокортикотропного гормона.
Если для проведения исследования необходимо набрать определенное количество материала, а определение уровня АКТГ планируется через некоторое время (например через 1-2 месяца), тогда супернатант требуется немедленно заморозить при температуре -20°С для хранения. Перед процедурой определения уровня АКТГ образцы размораживают при комнатной температуре в течение 20 минут, далее центрифугируют при 1500 об/мин в течение 2-х минут. Допустимо только однократное замораживание и размораживание образцов. Необходимо убедиться, что образцы доведены до комнатной температуры.
Метод количественного определения уровня АКТГ в экссудатах «кожного окна»
Для проведения анализа используют набор реагентов для определения адренокортикотропного гормона (АСТН Elecsys, Cobas е, производитель Roche Diagnostics GmbH, Германия). В соответствии с инструкцией производителя к набору реактива проводят подготовку к хранению реагентов, подготовку реагентов к анализу и проведение электрохемилюминесцентного иммуноанализа.
Для проведения анализа используют иммунохимический электрохемилюминесцентный автоматический анализатор Cobas е 411 rack (производитель Hitachi High-Technologies corporation, Япония).
Эппендорф с экссудатом устанавливают в штативы для образцов, которые помещают на борт иммунохимического анализатора Cobas е 411 rack. Анализатор автоматически обрабатывает образец и проводит вычисление концентрации АКТГ в образце.
Изобретение иллюстрируется фотографиями, представленными на Фиг. 1-5.
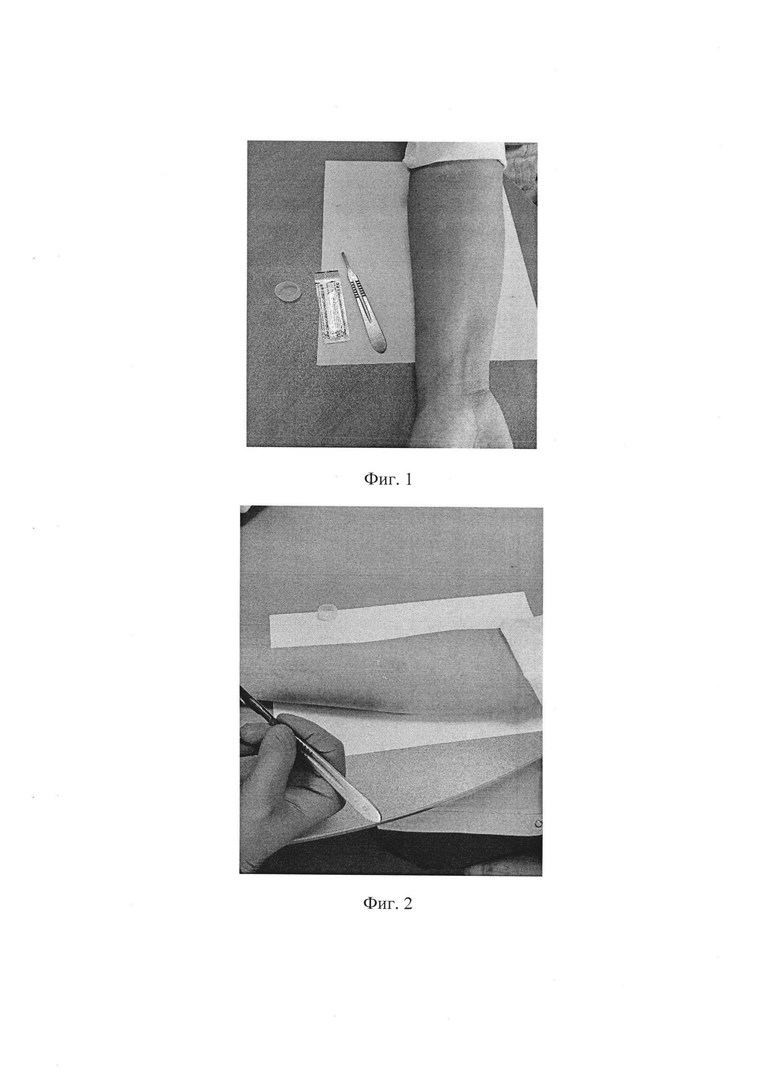
Фиг. 1. Подготовка пациента к процедуре. Пациент усаживается перед исследователем. Необходим свободный доступ к передней поверхности предплечья пациента, которую обрабатывают 70% этиловым спиртом. Далее необходимо убедиться в полном испарении спирта с поверхности кожи, она должна быть сухой.
Фиг. 2. В средней трети ладонной поверхности предплечья с помощью стерильного скальпеля удаляют верхние слои эпидермиса на участке кожи площадью 1 на 1 см, путем последовательного и многократного соскабливания кожи. В итоге, должна появиться блестящая поверхность, которую можно увидеть под определенным углом зрения. Остатки слущенного эпидермиса удаляют с передней поверхности предплечья с помощью ватки или салфетки.
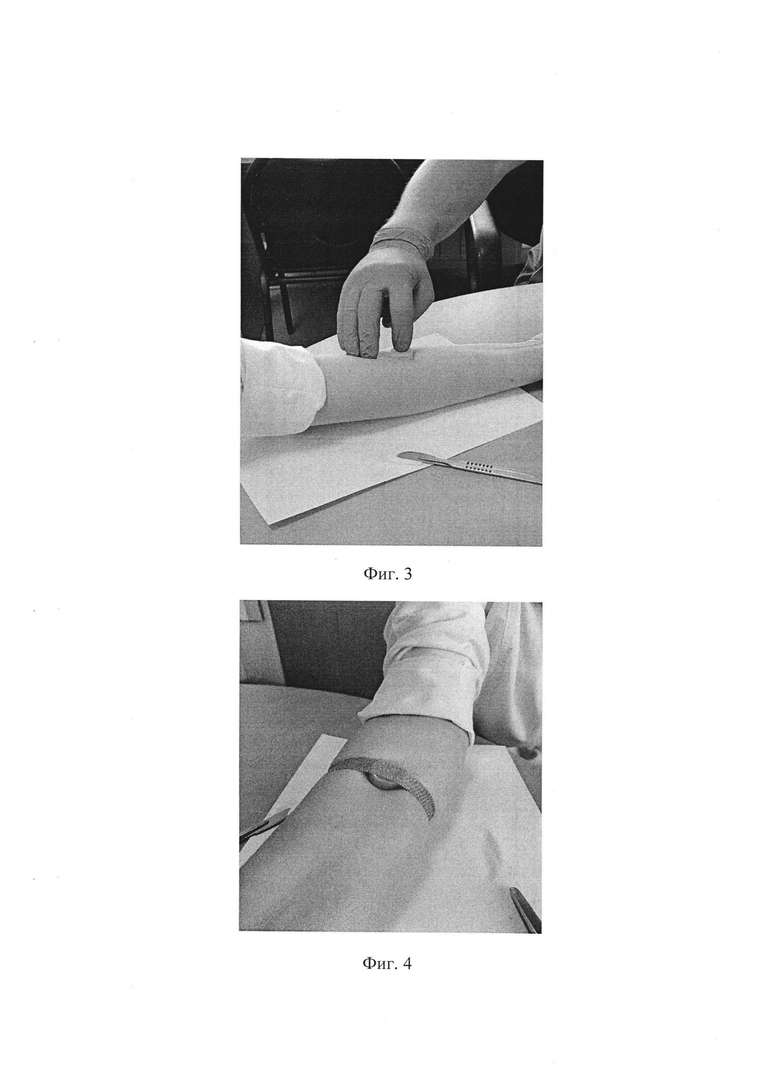
Фиг. 3. На скарифицированный участок кожи устанавливают пластиковую камеру объемом 1 мл, которую необходимо заполнить стерильным раствором натрия хлорида 0,9%.
Фиг. 4. Камеру фиксируют на скарифицированном участке кожи с помощью лейкопластыря. Круговая обвязка предплечья лейкопластырем должна обеспечивать надежную фиксацию камеры, но не нарушать приток и отток крови в конечности и не сдавливать ткани.
Фиг. 5. Через 6 часов камеру необходимо снять. Содержимое камеры собирают пипеточным дозатором и переносят в пробирку типа эппендорф, или создают серию аликвот в эппендорфах одного и того же образца.
При выполнении поставленной задачи было проведено 2 исследования.
Исследование №1 (Фиг. 1-5). Обследовано 25 образцов замороженных экссудатов «кожного окна», полученных из устанавливаемых на скарифицированный участок кожи камеры объемом 1 мл, предварительно заполненной стерильным 0,9% раствором натрия хлорида практически здоровым донорам-добровольцам. До проведения количественного определения уровня АКТГ в экссудатах, образцы хранились в течение 2-х месяцев при температуре - 20°С. Далее образцы выдерживались при комнатной температуре в течение 20 минут и центрифугировались при 1500 об/мин в течение 2-х минут. Полученный супернатант использовался для определения концентрации АКТГ на автоматическом электрохемилюминесцентном иммуноанализаторе Cobas е411 rack. Требуемое количество образца для проведения анализа составляет 50 мкл. Анализатор автоматически обрабатывает образец и проводит вычисление концентрации АКТГ в образце, количественный результат выдается в пг/мл.
Таким образом, метод «кожного окна» с применением камеры, заполненной стерильным физиологическим раствором, свидетельствует о его пригодности, в качестве способа количественного определения адренокортикотропного гормона топически продуцируемого на уровне кожи.
Исследование №2 (Фиг. 1-5). Экссудаты «кожного окна», полученные от пяти здоровых доноров добровольцев, после снятия камеры с участка скарификации через 6 часов, без предварительной заморозки, собирают в эппендорф и центрифугируют при 1500 об/мин в течение 2-х минут. Супернатант, полученный после центрифугирования экссудата, незамедлительно используется для определения концентрации АКТГ на анализаторе Cobas е411 rack. Время проведения анализа составляет 18 минут, после чего получают концентрацию АКТГ в экссудате в пг/мл. Полученные результаты незамороженных образцов не отличаются от результатов, подвергшихся заморозке и хранению образцов экссудатов «кожного окна».
ПРОТИВОПОКАЗАНИЯ К ИСПОЛЬЗОВАНИЮ
Абсолютные противопоказания:
1. Наличие рубцовых изменений и инфекционных воспалительных процессов на коже передней поверхности обеих рук.
2. Декомпенсированные системные заболевания.
3. Интеркуррентные заболевания в остром периоде.
Относительные противопоказания:
1. Заболевания, связанные с нарушением системы свертываемости крови.
2. Беременность и период лактации.
3. Возраст до 18 лет.
4. Склонность к гипертрофическим и келоидным рубцам.
5. Низкий порог болевой чувствительности.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ ЦИНКА В ЭКССУДАТЕ "КОЖНОГО ОКНА" | 2023 |
|
RU2811889C1 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ВИТИЛИГО | 2011 |
|
RU2484464C1 |
| Способ прогнозирования развития экзематозных реакций у больных экссудативным микозом стоп | 1988 |
|
SU1711077A1 |
| СПОСОБ СКРИНИНГОВОГО ОПРЕДЕЛЕНИЯ ВЫСОКОЙ ВЕРОЯТНОСТИ НАЛИЧИЯ АЛЛЕРГИЧЕСКОГО ХАРАКТЕРА ВОСПАЛЕНИЯ, АССОЦИИРОВАННОГО С ПОВЫШЕННЫМ УРОВНЕМ В КРОВИ ИНТЕРЛЕЙКИНА-8, ПРИ БРОНХОЛЕГОЧНЫХ ЗАБОЛЕВАНИЯХ У ДЕТЕЙ | 2018 |
|
RU2684406C1 |
| СПОСОБ СКРИНИНГОВОГО ОПРЕДЕЛЕНИЯ ВЫСОКОЙ ВЕРОЯТНОСТИ НАЛИЧИЯ ХРОНИЧЕСКОГО ХАРАКТЕРА ВОСПАЛЕНИЯ, АССОЦИИРОВАННОГО С БРОНХООБСТРУКТИВНЫМ СИНДРОМОМ, ПРИ БРОНХОЛЕГОЧНЫХ ЗАБОЛЕВАНИЯХ У ДЕТЕЙ | 2018 |
|
RU2690500C1 |
| Способ дифференциальной диагностики хронического гепатита у детей | 1985 |
|
SU1368702A1 |
| СПОСОБ ОЦЕНКИ АКТИВНОСТИ ВОСПАЛЕНИЯ ПРИ БРОНХИАЛЬНОЙ АСТМЕ | 2004 |
|
RU2277710C1 |
| СПОСОБ ДИАГНОСТИКИ ВНЕПЕЧЕНОЧНОЙ ПЕРСИСТЕНЦИИ ВИРУСНЫХ АНТИГЕНОВ В ТКАНЯХ У ДЕТЕЙ, БОЛЬНЫХ ХРОНИЧЕСКИМ ГЕПАТИТОМ В, ИЛИ ДЕЛЬТА, ИЛИ С | 1998 |
|
RU2146825C1 |
| СПОСОБ ДИАГНОСТИКИ ПАТОЛОГИИ КЛЕТОЧНОГО ИММУНИТЕТА ПРИ ХРОНИЧЕСКИХ ВИРУСНЫХ ИНФЕКЦИЯХ | 2000 |
|
RU2187813C2 |
| СПОСОБ ПРОГНОЗА ИНТЕРФЕРОН-РИБАВИРИНИНДУЦИРОВАННОЙ НЕЙТРОПЕНИИ У БОЛЬНЫХ ХРОНИЧЕСКИМ ГЕПАТИТОМ С, ПОЛУЧАЮЩИХ КОМБИНИРОВАННУЮ ПРОТИВОВИРУСНУЮ ТЕРАПИЮ | 2011 |
|
RU2444998C1 |

Изобретение относится к медицине, а именно аллергологии и иммунологии, дерматовенерологии и терапии и может быть использовано для количественного определения уровня адренокортикотропного гормона (АКТГ) на уровне шокового органа - в коже. Проводят постановку метода «кожного окна». В средней трети ладонной поверхности предплечья удаляют верхние слои эпидермиса, на участке кожи площадью 1 на 1 см, на скарифицированный участок помещают пластиковую камеру объемом 1 мл, заполненную стерильным раствором натрия хлорид 0,9%, камеру фиксируют на скарифицированном участке кожи с помощью лейкопластыря. Через 6 часов камеру снимают, ее содержимое собирают и переносят в пробирку типа эппендорф. Центрифугируют экссудат «кожного окна», а полученную бесклеточную фракцию экссудата - супернатант используют для определения концентрации адренокортикотропного гормона с использованием набора реагентов АСТН Elecsys, Cobas е, производитель Roche Diagnostics на автоматическом электрохемилюминесцентном иммуноанализаторе Cobas е411 rack. Способ обеспечивает количественное определение in vivo уровня АКТГ доступным малоинвазивным методом в сочетании с высокоточным современным методом иммуноанализа. 1 з.п. ф-лы, 5 ил., 2 пр.
1. Способ определения адренокортикотропного гормона в экссудате «кожного окна», характеризующийся тем, что проводят постановку метода «кожного окна», а именно в средней трети ладонной поверхности предплечья с помощью стерильного скальпеля удаляют верхние слои эпидермиса до блестящего слоя, удалив роговой слой, на участке кожи площадью 1 на 1 см, на скарифицированный участок помещают пластиковую камеру объемом 1 мл, предварительно заполненную с помощью шприца стерильным раствором натрия хлорид 0,9%, камеру фиксируют на скарифицированном участке кожи с помощью лейкопластыря; через 6 часов камеру снимают, ее содержимое пипеточным дозатором собирают и переносят в пробирку типа эппендорф, центрифугируют экссудат «кожного окна», а полученную бесклеточную фракцию экссудата - супернатант используют для определения концентрации адренокортикотропного гормона с использованием набора реагентов АСТН Elecsys, Cobas е, производитель Roche Diagnostics на автоматическом электрохемилюминесцентном иммуноанализаторе Cobas е411 rack.
2. Способ по п. 1, отличающийся тем, что если для проведения исследования необходимо набрать определенное количество материала, а определение уровня АКТГ планируется через некоторое время, тогда супернатант замораживают при температуре -20°С для хранения, а перед процедурой определения уровня АКТГ образцы размораживают при комнатной температуре в течение 20 минут, далее центрифугируют при 1500 об/мин в течение 2-х минут, при этом допустимо только однократное замораживание и размораживание образцов.
| ИНДУКТОР АПОПТОЗА | 1998 |
|
RU2144824C1 |
| СПОСОБ ПРОГНОЗА ХРОНИЧЕСКОГО РЕЦИДИВИРУЮЩЕГО ТЕЧЕНИЯ ЗАБОЛЕВАНИЯ У ЛИЦ, ПЕРЕНЕСШИХ ПЕРВИЧНУЮ РОЖУ | 1995 |
|
RU2101701C1 |
| CA 2388198 A1 28.10.1993 | |||
| УСТРОЙСТВО ДЛЯ ГАЗОВОЙ ЗАЩИТЫ СВАРОЧНОЙ ВАННЫ, СВАРОЧНОГО ШВА И ОКОЛОШОВНОЙ ЗОНЫ | 2015 |
|
RU2615103C1 |
| РОТОРНЫЙ ДВИГАТЕЛЬ ВНУТРЕННЕГО СГОРАНИЯ | 1998 |
|
RU2133845C1 |
| WEHNERT W | |||
| Cytologische Untersuchungen uber die Zusammensetzung des entzundlichen Exsudates bei Allergikern mit der Rebuckschen Hautfenstermethode [Cytologic studies of the composition of inflammatory exudates in allergic | |||
Авторы
Даты
2023-06-28—Публикация
2022-09-13—Подача