ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к области биомедицины, в частности, к классу нейропротекторных соединений, способам их получения и применения.
УРОВЕНЬ ТЕХНИКИ
Инсульт представляет собой острое цереброваскулярное заболевание, подразделяющее на ишемический и геморрагический инсульт. Доля ишемических инсультов составляет 60-70% от общего числа инсультов. Инсульт характеризуется высокой заболеваемостью, высокой смертностью и высокой степенью инвалидизации.
Молекулярный механизм нейропротекции и разработка нейропротекторных препаратов являются одной из актуальных областей исследований в лечении инсульта. В настоящее время широко используемые нейропротекторные средства включают скавенджеры свободных радикалов, антагонисты глутамата, антагонисты кальциевых каналов, стабилизаторы клеточных мембран и т.д. Однако ввиду сложности патогенеза инсульта в клинической практике не существует идеального нейропротекторного средства. В связи с высокой заболеваемостью и тяжелыми последствиями инсульта, разработка новых нейропротекторных средств имеет большое значение.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является представление соединения по формуле I, способа его получения и примененияс целью нейропротекции.
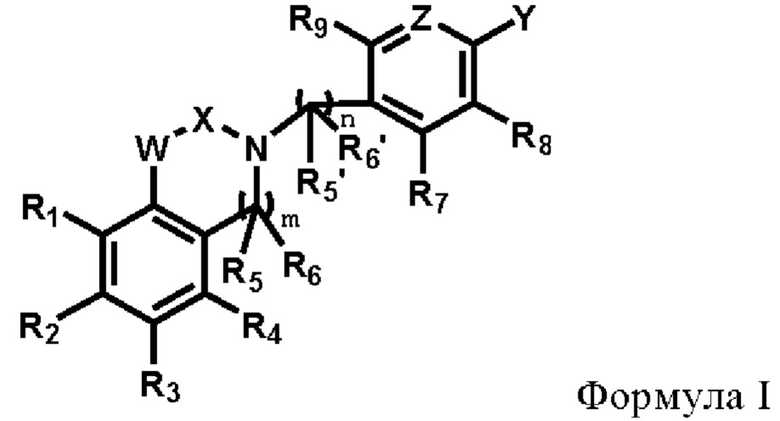
В первом аспекте настоящего изобретения предлагается соединение по формуле I или его стереоизомер, или его фармацевтически приемлемая соль:
где,
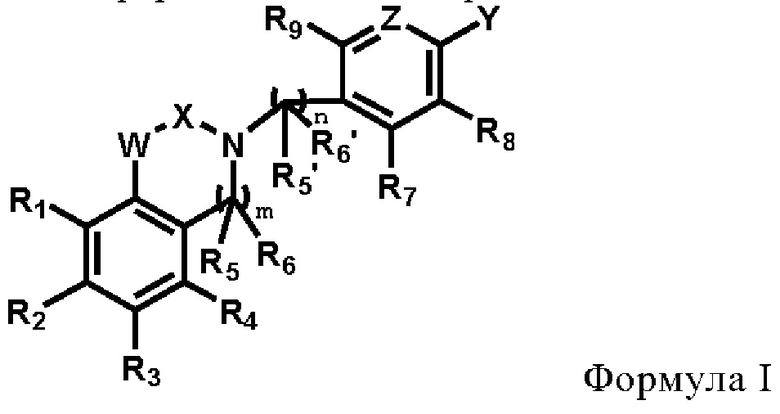
R1, R2, R3, R4, R5, R5', R6, R6', R7, R8 и R9 каждый независимо друг от друга выбирают из группысостоящей из водорода, галогена, амино, гидроксила, карбоксила, нитро, циано, С1-6 алкила, C1-6 алкокси, галогенированного C1-6 алкила, галогенированного С1-6 алкокси, С3-6 циклоалкила, галогенированного С3-6 циклоалкила и С1-6 алкиламино;
R5 и R6 или R5' и R6' могут циклизоваться с образованием замещенного или незамещенного 3-8-членного насыщенного или ненасыщенного циклоалкила или гетероциклоалкила, содержащего один или более (например, 2, 3 или 4) гетероатомов, выбранных из N, S или О, и замещенный означает замещенный одним или несколькими (например, 2, 3 или 4) заместителями, выбранными из группы состоящей из водорода, галогена и C1-6 алкила;
X выбирают из группы, состоящей из 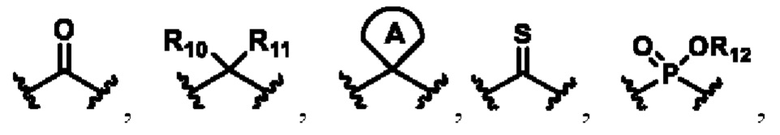
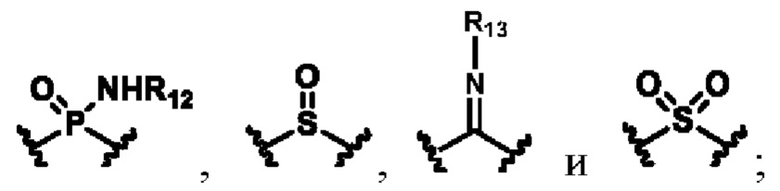
каждый из R10, R11, R12 и R13 независимо друг от друга выбирают из группы состоящей из водорода, галогена, С1-6 алкила, С3-6 циклоалкила, C1-6 алкокси, галогенированного С1-6 алкила, галогенированного С3-6 циклоалкила, галогенированного C1-6 алкокси, замещенного или незамещенного С6-10 арила, замещенного или незамещенного 5-6-членного гетероарила, содержащего один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, и 3-8-членный насыщенный или ненасыщенный гетероциклоалкил, содержащий один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, и замещенный означает замещенный одним или более (например, 2, 3 или 4) заместителями, выбираемыми из группы состоящей из водорода, галогена и C1-6 алкила;
кольцо А представляет собой замещенный или незамещенный 3-8-членный насыщенный или ненасыщенный циклоалкил или замещенный или незамещенный 3-8-членный гетероциклоалкил, содержащий один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, и замещенный означает замещенный одним или более (например, 2, 3 или 4) заместителями, выбираемыми из группы состоящей из водорода, галогена и С1-6 алкила;
W выбирают из группы состоящей из О, S и NR19;
R19 выбирают из группы состоящей из водорода, C1-6 алкила, С3-6 циклоалкила, галогенированного C1-6 алкила, галогенированного С3-6 циклоалкила, С6-10 арила, замещенного или незамещенного 3-8-членного насыщенного или ненасыщенного гетероциклоалкила или гетероарила, содержащий один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, и замещенныйозначает замещенный одним или несколькими (например, 2, 3 или 4) заместителями, выбираемыми из группы состоящей из водорода, галогена и C1-6 алкила;
m равно 0 или 1;
n равно 0 или 1;
Z представляет собой N или CR18;
R18 выбирают из группы состоящей из водорода, гидроксила, галогена, амино, циано, C1-6 алкила, С3-6 циклоалкила, C1-6 алкокси, галогенированного C1-6 алкила, галогенированного С3-6 циклоалкила, галогенированного C1-6 алкокси и C1-6 алкил амино;
Y выбирают из группы состоящей из COOR15, CONR16R17, С6-10 арила, 3-8-членного насыщенного или ненасыщенного гетероциклоалкила или гетероарила, содержащий один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, а гетероциклоалкил необязательно замещен одним или несколькими (например, 2, 3 или 4) заместителями, выбранными из группы состоящей из =O, водорода, галогена и С1-6 алкила;
каждый из R15, R16 и R17 независимо выбирают из группы состоящей из водорода, C1-6 алкила, С3-8 циклоалкила, С6-10 арила, 3-15-членного насыщенного или ненасыщенного гетероциклоалкила или гетероарила, содержащий один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, и -(C1-6 алкилен) (3-15-членный насыщенный или ненасыщенный гетероциклоалкил или гетероарил, включающий один или более (например, 2, 3, 4 или 5) гетероатомов, выбираемых из N, S или О); алкил, циклоалкил, арил, гетероарил и гетероциклоалкил необязательно замещены одним или несколькими (например, 2, 3 или 4) заместителями, выбранными из группы состоящей из водорода, галогена, гидроксила, C1-6 алкилен гидроксила, =O, -NR20R21, циано, С2-6 алкинила, С2-6 алкенила, С1-6 алкила, С3-8 циклоалкила, 3-8-членного гетероциклоалкила, содержащего один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, незамещенных или замещенных C1-6 алкилом, галогенированным C1-6 алкилом, C1-6 алкилом, замещенным амино и карбоксилом, C1-6 алкокси, 5-10-членным гетероарилом, содержащим один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, С6-12 арил и -COO(C1-6 алкил);
R20 и R21 независимо выбирают из группы состоящей из водорода, C1-6 алкила, С3-6 циклоалкила, галогенированного C1-6 алкила и галогенированного С3-6 циклоалкила;
или Y и R8 циклизуются с образованием 
В другом предпочтительном варианте осуществления m = 1, n = 0;
каждый из R1, R2, R3, R4, R5, R5', R6, R6', R7, R8 и R9 независимо выбирают из группысостоящей из водорода, галогена, C1-6 алкила, С3-6 циклоалкила, С1-6 алкокси, галогенированного C1-6 алкила, галогенированного С3-6 циклоалкила и галогенированного C1-6 алкокси;
X выбирают из группы состоящей из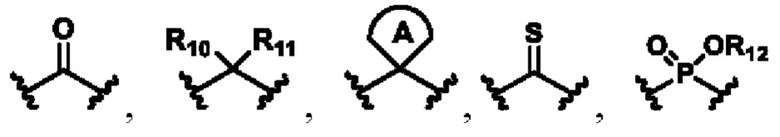 и
и 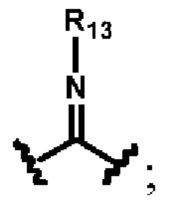
R10, R11, R12 и R13 независимо выбирают из группы состоящей из водорода, галогена, С1-6 алкила, С3-6 циклоалкила, галогенированного C1-6 алкила, галогенированного С3-6 циклоалкила, замещенного или незамещенного С6-10 арила и замещенного или незамещенного 5-6-членного гетероарила, содержащего один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, и замещенный означает замещенный одним или более (например, 2, 3 или 4) заместителями, выбираемыми из группы состоящей изводорода, галогена и C1-6 алкила;
кольцо А представляет собой замещенный или незамещенный 3-8-членный циклоалкил или замещенный или незамещенный 3-8-членный гетероциклоалкил, содержащий один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, и замещенныйи означает замещенный одним или более (например, 2, 3 или 4) заместителями, выбираемыми из группы состоящей из водорода, галогена и C1-6 алкила;
W представляет собой О;
Z представляет собой N или CR18;
R18 выбирают из группы состоящей из водорода, гидроксила, галогена, амино, циано, C1-6 алкила, С3-6 циклоалкила, C1-6 алкокси, галогенированного C1-6 алкила, галогенированного С3-6 циклоалкила, галогенированного C1-6 алкокси и C1-6 алкиламино;
Y выбирают из группы состоящей из COOR15 и замещенного или незамещенного 3-8-членного насыщенного или ненасыщенного гетероциклоалкила или гетероарила, содержащего один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, а гетероциклоалкил необязательно замещен одним или несколькими (например, 2, 3 или 4) заместителями, выбранными из группысостоящей из =O, водорода, галогена и С1-6 алкила;
R15 выбирают из группысостоящей из водорода, C1-6 алкила, С3-8 циклоалкила, С6-10 арила, 3-15-членного насыщенного или ненасыщенного гетероциклоалкила или гетероарила, содержащий один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, и -(C1-6 алкилен)(3-15-членный насыщенный или ненасыщенный гетероциклоалкил или гетероарил, включающий один или более (например, 2, 3, 4 или 5) гетероатомов, выбираемых из N, S или О); алкил, циклоалкил, арил, гетероарил и гетероциклоалкил необязательно замещены одним или несколькими (например, 2, 3 или 4) заместителями, выбранными из группы состоящей из водорода, галогена, гидроксила, C1-6 алкилен гидроксила, =O, -NR20R21, циано, С2-6 алкинила, С2-6 алкенила, C1-6 алкила, С3-10 циклоалкила, 3-8-членного гетероциклоалкила, содержащего один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, незамещенных или замещенных C1-6 алкилом, галогенированным C1-6 алкилом, C1-6 алкилом, замещенным амино и карбоксилом, С1-6 алкокси, 5-10-членным гетероарилом, содержащим один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, С6-12 арил, -COO(C1-6 алкил);
R20 и R21 независимо выбирают из группы состоящей из водорода, C1-6 алкила, С3-6 циклоалкила, галогенированного C1-6 алкила и галогенированного С3-6 циклоалкила;
или Y и R8 циклизуются с образованием 
В другом предпочтительном варианте осуществления m = 0, n = 1;
каждый из R1, R2, R3, R4, R5, R5', R6, R6', R7, R8 и R9 независимо выбирают из группы состоящей из водорода, галогена, C1-6 алкила, С3-6 циклоалкила, C1-6 алкокси, галогенированного C1-6 алкила, галогенированного С3-6 циклоалкила и галогенированного C1-6 алкокси;
X выбирают из группысостоящей из 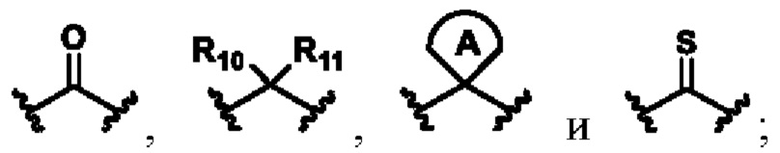
R10 и R11 независимо выбирают из группысостоящей из водорода, галогена, C1-6 алкила, С3-6 циклоалкила, галогенированного C1-6 алкила, галогенированного С3-6 циклоалкила, замещенного или незамещенного С6-10 арила и замещенного или незамещенного 5-6-членного гетероарила, содержащего один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, и замещенный означает замещенный одним или более (например, 2, 3 или 4) заместителями, выбираемыми из группы состоящей из водорода, галогена и C1-6 алкила;
кольцо А представляет собой замещенный или незамещенный 3-8-членный циклоалкил или замещенный или незамещенный 3-8-членный гетероциклоалкил, содержащий один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, и замещенный означает замещенный одним или более (например, 2, 3 или 4) заместителями, выбираемыми из группы состоящей из водорода, галогена и C1-6 алкила;
W представляет собой О;
Z представляет собой N или CR18;
R18 выбирают из группы состоящей из водорода, гидроксила, галогена, амино, циано, C1-6 алкила, С3-6 циклоалкила, C1-6 алкокси, галогенированного C1-6 алкила, галогенированного С3-6 циклоалкила, галогенированного C1-6 алкокси и C1-6 алкил амино;
Y представляет собой COOR15;
R15 выбирают из группы состоящей из водорода, C1-6 алкила, С3-8 циклоалкила, С6-10 арила и 3-15-члеиного насыщенного или ненасыщенного гетероциклоалкила или гетероарила, содержащего один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О; алкил, циклоалкил, арил, гетероарил и гетероциклоалкил необязательно замещены одним или несколькими (например, 2, 3 или 4) заместителями, выбранными из группысостоящей из водорода, галогена, гидроксила, =O, циано, С2-6 алкинила, С2-6 алкенила, C1-6 алкила, С3-8 циклоалкила, 3-8-членного гетероциклоалкила, содержащий один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, незамещенных или замещенных C1-6 алкилом, галогенированным C1-6 алкилом, C1-6 алкокси, 5-10-членным гетероарилом, содержащим один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, и С6-12 арил.
В другом предпочтительном варианте осуществления R1 и R3 представляют собой Cl.
В другом предпочтительном варианте осуществления R2, R4, R5, R5', R6, R6', R7, R8, R9 представляют собой водород.
В другом предпочтительном варианте осуществления X выбирают из группы состоящей из 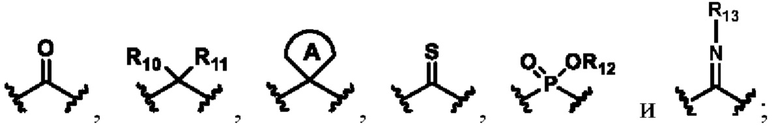
каждый из R10, R11, R12 и R13 независимо друг от друга выбирают из группы состоящей из водорода, галогена, C1-6 алкила, С3-6 циклоалкила, C1-6 алкокси, галогенированного С1-6 алкила, галогенированного С3-6 циклоалкила, галогенированного C1-6 алкокси, замещенного или незамещенного С6-10 арила, замещенного или незамещенного 5-6-членного гетероарила, содержащий один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, и 3-8-членный насыщенный или ненасыщенный гетероциклоалкил, содержащий один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, и замещенный означает замещенный одним или более (например, 2, 3 или 4) заместителями, выбираемыми из группы состоящей из водорода, галогена и C1-6 алкила;
кольцо А представляет собой замещенный или незамещенный 3-8-членный насыщенный или ненасыщенный циклоалкил или замещенный или незамещенный 3-8-членный гетероциклоалкил, содержащий один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, и замещенный означает замещенный одним или более (например, 2, 3 или 4) заместителями, выбираемыми из группы состоящей из водорода, галогена и C1-6 алкила.
В другом предпочтительном варианте осуществления W равен 0.
В другом предпочтительном варианте осуществления m = 1, а n = 0.
В другом предпочтительном варианте осуществления m = 0, a n = 1.
В другом предпочтительном варианте осуществления Z представляет собой N или CR18;
R18 выбирают из группы состоящей из водорода, гидроксила, галогена, амино, циано, C1-6 алкила, С3-6 циклоалкила, C1-6 алкокси, галогенированного C1-6 алкила, галогенированного С3-6 циклоалкила, галогенированного C1-6 алкокси и C1-6 алкил амино.
В другом предпочтительном варианте осуществления Y выбирают из группы состоящей из COOR15 и 3-8-членного насыщенного или ненасыщенного гетероциклоалкила или гетероарила, содержащего один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, и гетероциклоалкил необязательлно замещен одним или несколькими (например, 2, 3 или 4) заместителями, выбранными из группы состоящей из =O, водорода, галогена и C1-6 алкила;
R15 выбирают из группы состоящей из водорода, C1-6 алкила, С3-8 циклоалкила, С6-10 арила, 3-15-членного насыщенного или ненасыщенного гетероциклоалкила или гетероарила, содержащего один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, и -(C1-6 алкилен)(3-15-членный насыщенный или ненасыщенный гетероциклоалкил или гетероарил, включающий один или более (например, 2, 3, 4 или 5) гетероатомов, выбираемых из N, S или О); алкил, циклоалкил, арил, гетероарил и гетероциклоалкил необязательно замещены одним или несколькими (например, 2, 3 или 4) заместителями, выбранными из группы состоящей из водорода, галогена, гидроксила, С1-6 алкилен гидроксила, =O, -NR20R21, циано, С2-6 алкинила, С2-6 алкенила, С1-6 алкила, С3-10 циклоалкила, 3-8-членного гетероциклоалкила, содержащий один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, незамещенных или замещенных C1-6 алкилом, галогенированным C1-6 алкилом, C1-6 алкилом, замещенным амино и карбоксилом, C1-6 алкокси, 5-10-члеиным гетероарилом, содержащим один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, С6-12 арил и -COO(C1-6 алкил);
R20 и R21 независимо выбирают из группысостоящей из водорода, C1-6 алкила, С3-6 циклоалкила, галогенированного C1-6 алкила и галогенированного С3-6 циклоалкила.
В другом предпочтительном варианте осуществления Y и R8 циклизуются с образованием 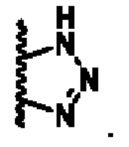
В другом предпочтительном варианте осуществления Y выбирают из группы состоящей из COOR15, 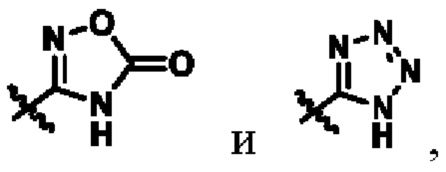 R15 соответствует определению, приведенному выше;
R15 соответствует определению, приведенному выше;
Z выбирают из группысостоящей из N и С(ОН).
В другом предпочтительном варианте осуществления Y представляет собой COOR15; R15 выбирают из группы состоящей из водорода, C1-6 алкила, С3-8 циклоалкила, С6-10 арила и 3-15-членного насыщенного или ненасыщенного гетероциклоалкила, содержащий один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О; алкил, циклоалкил, арил и гетероциклоалкил необязательно замещены одним или несколькими (например, 2, 3 или 4) заместителями, выбранными из группы, включающей водород, галоген, гидроксил, -NR20R21, циано, С2-6 алкинил, С2-6 алкенил и С1-6 алкил и С3-10 циклоалкил; R20 и R21 описаны выше;
Z представляет собой N.
В другом предпочтительном варианте осуществления Y представляет собой COOR15; R15 выбирают из группысостоящей из C1-6 алкила, С3-8 циклоалкила и 3-15-членного насыщенного или ненасыщенного гетероциклоалкила, содержащего один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, гетероциклоалкил необязательно замещен одним или несколькими (например, 2, 3 или 4) заместителями, выбранными из группы состоящей из водорода, галогена и C1-6 алкила и С3-10 циклоалкила;
Z представляет собой С(ОН).
В другом предпочтительном варианте осуществления каждый из R1, R2, R3, R4, R7, R8 и R9 независимо выбирают из группы состоящей из водорода и галогена;
каждый из R5, R5', R6 и R6' представляет собой водород;
W представляет собой О;
X представляет собой 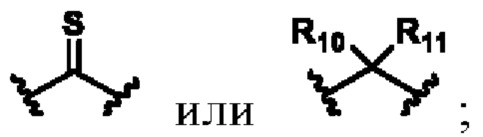
Z представляет собой N или С(ОН);
Y представляет собой COOR15;
R10 и R11 независимо выбирают из группы состоящей из водорода, галогена, C1-6 алкила, С3-6 циклоалкила, галогенированного C1-6 алкила и галогенированного С3-6 циклоалкила;
R15 выбирают из группысостоящей из водорода, C1-6 алкила, С3-8 циклоалкила, С6-10 арила, 3-15-членного насыщенного или ненасыщенного гетероциклоалкила или гетероариал, содержащего один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, и -(C1-6 алкилен)(3-15-членный насыщенный или ненасыщенный гетероциклоалкил или гетероарил, включающий один или более (например, 2, 3, 4 или 5) гетероатомов, выбираемых из N, S или О); алкил, циклоалкил, арил, гетероарил и гетероциклоалкил необязательно замещены одним или несколькими (например, 2, 3 или 4) заместителями, выбранными из группысостоящей из водорода, галогена, гидроксила, C1-6 алкилен гидроксила, =O, -NR20R21, циано, С2-6 алкинила, С2-6 алкенила, C1-6 алкила, С3-8 циклоалкила, 3-8-членного гетероциклоалкила, содержащего один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, незамещенных или замещенных C1-6 алкилом, галогенированным C1-6 алкилом, C1-6 алкилом, замещенным амино и карбоксилом, С1-6 алкокси, 5-10-члеиным гетероарилом, содержащим один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, С6-12 арил и -COO(C1-6 алкил);
R20 и R21 независимо выбирают из группы состоящей из водорода, C1-6 алкила, С3-6 циклоалкила, галогенированного C1-6 алкила и галогенированного С3-6 циклоалкила;
для m и n, m = 1 и n = 0, или m = 0 и n = 1.
В другом предпочтительном варианте осуществления каждый из R1, R2, R3, R4, R7, R8 и R9 независимо выбирают из группысостоящей из водорода и галогена;
каждый из R5, R5', R6 и R6' представляет собой водород;
W представляет собой О;
X представляет собой 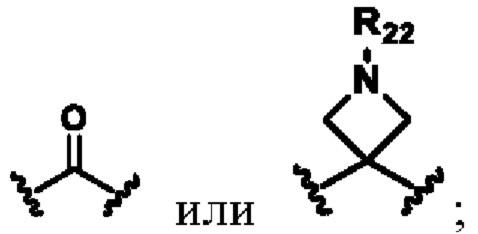
Z представляет собой N или С(ОН);
Y представляет собой COOR15;
R15 выбирают из группы состоящей из водорода, С1-6 алкила, С3-8 циклоалкила, С6-10 арила, 3-15-членного насыщенного или ненасыщенного гетероциклоалкила или гетероарила, содержащего один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, и -(C1-6 алкилен)(3-15-членный насыщенный или ненасыщенный гетероциклоалкил или гетероарил, включающий один или более (например, 2, 3, 4 или 5) гетероатомов, выбираемых из N, S или О); алкил, циклоалкил, арил, гетероарил и гетероциклоалкил необязатеьно замещены одним или несколькими (например, 2, 3 или 4) заместителями, выбранными из группы состоящей из водорода, галогена, гидроксила, C1-6 алкилен гидроксила, =O, -NR20R21, циано, С2-6 алкинила, С2-6 алкенила, C1-6 алкила, С3-8 циклоалкила, 3-8-членного гетероциклоалкила, содержащего один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, незамещенных или замещенных C1-6 алкилом, галогенированным C1-6 алкилом, C1-6 алкилом, замещенным амино и карбоксилом, C1-6 алкокси, 5-10-членным гетероарилом, содержащим один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, С6-12 арил и -COO(C1-6 алкил);
R20 и R21 независимо выбирают из группысостоящей из водорода, C1-6 алкила, С3-6 циклоалкила, галогенированного C1-6 алкила и галогенированного С3-6 циклоалкила;
R22 выбирают из группысостоящей из водорода и C1-6 алкила;
для m и n, m=1 и n=0, или m=0 и n=1.
В другом предпочтительном варианте осуществления каждый из R1, R2, R3, R4, R7, R8 и R9 независимо выбирают из группы состоящей из водорода и галогена;
каждый из R5, R5', R6 и R6' представляет собой водород;
W представляет собой О;
X представляет собой 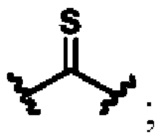
Z представляет собой N;
Y представляет собой COOR15;
R15 выбирают из группысостоящей из водорода, C1-6 алкила и С3-8 циклоалкила; алкила и циклоалкила необязательно замещены одним или несколькими (например, 2, 3 или 4) C1-6 алкокси;
для m и n, m = 1 и n = 0, или m = 0 и n=1.
В другом предпочтительном варианте осуществления каждый из R1, R2, R3, R4, R7, R8 и R9 независимо выбирают из группысостоящей из водорода и галогена;
каждый из R5, R5', R6 и R6' представляет собой водород;
W представляет собой О;
X представляет собой 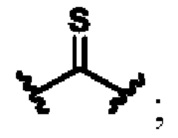
Z представляет собой N;
Y представляет собой COOR15;
R15 представляет собой С1-6 алкил, замещенный С1-6 алкокси;
m = 1 и n = 0.
В другом предпочтительном варианте осуществления в «C1-6 алкиле, замещенном C1-6 алкокси» С1-6 алкокси выбирают из группысостоящей из метокси, этокси, пропокси, изопропокси и бутокси;
C1-6 алкил выбирают из группы состоящей из метила, этила, пропила, изопропила, бутила, изобутила, трет-бутила, неопентила и трет-пентила.
В другом предпочтительном варианте осуществления соединение имеет структуру, описанную ниже.
Во втором аспекте настоящего изобретения представлен способ получения соединения или стереоизомера, или его фармацевтически приемлемой соли в соответствии с первым аспектом настоящего изобретения, включающий следующие этапы:
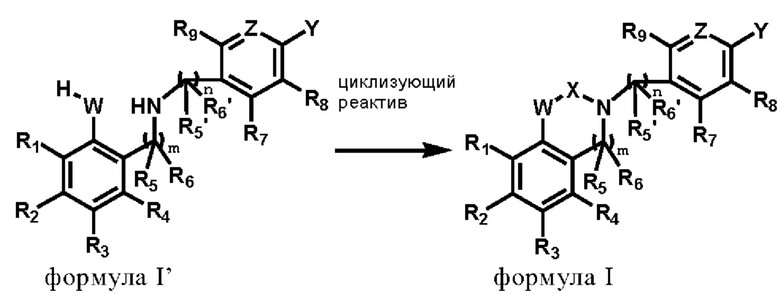
реакция соединения по формуле I' с циклизующим реактивом для получения соединения по формуле I;
где R1, R2, R3, R4, R5, R5', R6, R6', R7, R8, R9, W, X, Z, Y, m и n соответствует определению в первом аспекте настоящего изобретения.
В другом предпочтительном варианте осуществления циклизующий реактив выбирают из группысостоящей из фосген (карбонилхлорид), бис-(трихлорметил)-карбонат, N,N'-карбонилдиимидазол (CDI), тиофосген, N,N'-тиокарбонилдиимидазол (TCDI), жирные альдегиды, ароматические альдегиды, жирные кетоны, ароматические кетоны, фосфора оксихлорид, бромциан или их комбинацию.
В другом предпочтительном варианте осуществления жирный альдегид выбирают из группысостоящей из параформальдегида, н-бутиральдегида или их комбинации.
В другом предпочтительном варианте осуществления жирный кетон выбирают из группысостоящей из циклобутанона, 3-оксетанона или их комбинации.
В другом предпочтительном варианте осуществления ароматический альдегид представляет собой бензальдегид.
В третьем аспекте настоящего изобретения представлена фармацевтическая композиция, включающая фармацевтически приемлемый носитель и одно или несколько соединений, или стереоизомер, или фармацевтически приемлемую соль в соответствии с первым аспектом настоящего изобретения.
В четвертом аспекте настоящего изобретения представлено применение соединения, или стереоизомера, или фармацевтически приемлемой соли соединения в соответствии с первым аспектом настоящего изобретения для получения лекарственного препарата для профилактики и/или лечения заболеваний или нарушений, связанных с повреждением нейронов.
В другом предпочтительном варианте осуществления заболевания или нарушения, связанные с повреждением нейронов, выбирают из группы состоящей из нейропатическую боль, мигрень, воспалительную боль, хроническую боль, инсульт, черепно-мозговую травму, депрессию, болезнь Альцгеймера, эпилепсию, аффективные расстройства и нейродегенеративные заболевания.
В пятом аспекте настоящего изобретения представлено нейропротекторное средство, включающее одно или несколько соединений или стереоизомер, или их фармацевтически приемлемую соль в соответствии с первым аспектом изобретения.
В шестом аспекте настоящего изобретения представлен способ профилактики и/или лечения заболеваний или нарушений, связанных с повреждением нейронов, включающий этап введения нуждающемуся в этом пациенту профилактически и/или терапевтически эффективного количества фармацевтической композиции по третьему аспекту настоящего изобретения.
В седьмом аспекте настоящего изобретения представлен способ профилактики и/или лечения инфаркта головного мозга, включающий этап введения нуждающемуся в этом пациенту профилактически и/или терапевтически эффективного количества фармацевтической композиции по третьему аспекту настоящего изобретения.
Следует понимать, что в пределах объема настоящего изобретения вышеупомянутые технические признаки настоящего изобретения и технические признаки, конкретно описанные в последующем (например, в примерах) могут быть объединены друг с другом для получения новых или предпочтительных технических решений, которые не будут избыточно описаны один за другим в настоящем документе.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
После длительных и глубоких исследований авторы настоящего изобретения изобретатели неожиданно получили новое соединение, обладающее нейропротекторным эффектом. Соединение по настоящему изобретению может эффективно проходить через гематоэнцефалический барьер и обладает хорошим нейропротекторным эффектом, и может быть использовано для лечения таких заболеваний, как инсульт и боль. Исходя из этого, изобретатели сделали настоящее изобретение.
ТЕРМИНЫ
В настоящем изобретении, если не указано иное, используемые термины имеют общее значение, хорошо известное специалистам в данной области.
В настоящем изобретении термин «галоген» означает F, Cl, Br или I.
В настоящем изобретении термин «C1-6 алкил» означает алкил с прямой или разветвленной цепью, включающий от 1 до 6 атомов углерода, например, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, неопентил, трет-амил и т.п.
В настоящем изобретении термин «С2-6 алкенил» означает алкенил с прямой или разветвленной цепью, имеющий от 2 до 6 атомов углерода и содержащий одну двойную связь, и включает, помимо прочих, винил, пропенил, бутенил, изобутенил, пентенил, гексенил и т.п.
В настоящем изобретении термин «С2-6 алкинил» означает алкинил с прямой или разветвленной цепью, имеющий от 2 до 6 атомов углерода и содержащий одну тройную связь, и включает, помимо прочих, этинил, пропинил, бутинил, изобутинил, пентинил, гексинил и т п.
В настоящем изобретении термины «С3-8 циклоалкил» или «циклоалкил» означают циклический алкил (включая спиро-циклоалкил, мостиковый циклоалкил, такой как структура 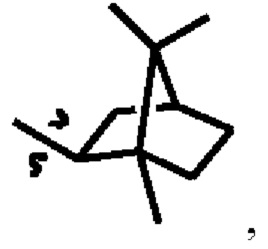 представленная в соединении 04033), имеющий от 3 до 8 атомов углерода на кольце, и включают, помимо прочих, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и т.п. Термин «С3-6 циклоалкил» имеет сходное значение.
представленная в соединении 04033), имеющий от 3 до 8 атомов углерода на кольце, и включают, помимо прочих, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и т.п. Термин «С3-6 циклоалкил» имеет сходное значение.
В настоящем изобретении термин «С1-6 алкокси» означает алкокси с прямой или разветвленной цепью, имеющий от 1 до 6 атомов углерода, и включает, помимо прочего, метокси, этокси, пропокси, изопропокси, бутокси и т.д. Предпочтительным является C1-4 алкокси.
В настоящем изобретении термин «C1-6 алкиламино» означает C1-6 алкил-NH-.
В настоящем изобретении термины «гетероциклоалкил» и «гетероциклил» означают 3-8-членный гетероциклил (включая гетероспироциклоалкил, гетероциклоалкил, гетероборный циклоалкил), содержащий 1, 2 или 3 гетероатома, выбираемых из N, О или S, и включают, помимо прочих, следующие группы: 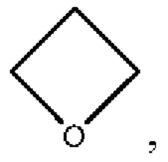
 Термин «ненасыщенный» обозначает наличие двойной связи в соответствующей структуре. Термин «насыщенный» обозначает отсутствие двойной связи в соответствующей структуре. Гетероциклоалкил может быть замещенным или незамещенным, и замещенный гетероциклоалкил имеет структуру
Термин «ненасыщенный» обозначает наличие двойной связи в соответствующей структуре. Термин «насыщенный» обозначает отсутствие двойной связи в соответствующей структуре. Гетероциклоалкил может быть замещенным или незамещенным, и замещенный гетероциклоалкил имеет структуру 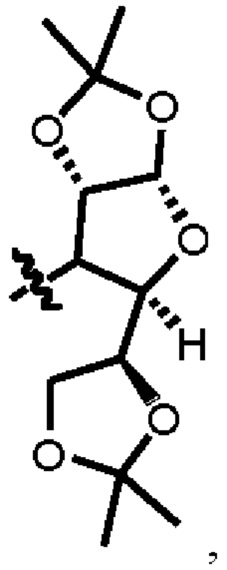 показанную в соединении 04132.
показанную в соединении 04132.
В настоящем изобретении термины «ароматическое кольцо» или «арил» имеют аналогичное значение, предпочтительным является «С6-10 арил». Термин «С6-10 арил» означает группу ароматического кольца, имеющую от 6 до 10 атомов углерода в кольце, не содержащей гетероатомов, такую как фенил, нафтил и т.п.
В настоящем изобретении термины «ароматический гетероцикл» или «гетероарил» имеют то же значение и относится к гетероароматической группе, содержащей от одного до нескольких гетероатомов. Например, «С3-10 гетероарил» означает ароматический гетероцикл, содержащий от 1 до 4 гетероатомов, выбираемых из кислорода, серы и азота, и от 3 до 10 атомов углерода. Неограничивающие примеры включают: фурил, тиенил, пиридил, пиразолил, пирролил, N-алкилпирролил, пиримидинил, пиразинил, имидазолил, тетразолил и тому подобное. Гетероарильное кольцо может быть соединено с арильным, гетероциклильным или циклоалкильным кольцом, при этом кольцо, соединенное с иходной структурой, является гетероарильным кольцом. Гетероарильные группы могут быть необязательно замещенными или незамещенными.
В настоящем изобретении термин «галогенированный» означает замещенный галогеном.
В настоящем изобретении термин «замещенный» означает, что один или несколько атомов водорода в определенной группе замещены определенным заместителем. Конкретные заместители представляют собой заместители, описанные соответствующим образом выше, или заместители, присутствующие в соответствующих вариантах осуществления изобретения. Если не указано иное, замещенная группа может иметь заместитель, выбираемый из определенной группы, в любом замещаемом положении группы, причем заместитель может быть одинаковым или различным в каждом положении. Специалисты в данной области поймут, что комбинации заместителей, предусмотренные настоящим изобретением, представляют собой комбинации, которые являются стабильными или химически достижимыми. Заместителями являются, например (но не ограничиваясь ими) галоген, гидроксил, карбоксил (-СООН), C1-С6 алкил, С2-С6 алкенил, С2-С6 алкинил, С3-C8 циклоалкил, 3-12-членный гетероциклил, арил, гетероарил, C1-C8 альдегидная группа, С2-С10 ацил, С2-С10 сложноэфирная группа, амино, C1-С6 алкокси, C1-С10 сульфонильная группа и т.п.
Соединение
Настоящее изобретение представляет соединение, описанное в формуле I, или его стереоизомер, или его фармацевтически приемлемую соль,
где каждая группа соответствует приведенным выше определениям.
В другом предпочтительном варианте осуществления в соединении один любой из R1, R2, R3, R4, R5, R5', R6, R6', R7, R8, R9, R10, R11, R12, R13, R15, R16, R17, R18, R19, кольца A, W, X, Y, Z, m и n является соответствующей группой в конкретном соединении по настоящему изобретению.
В другом предпочтительном варианте осуществления соединение предпочтительно представляет собой соединение, приведенное в примерах.
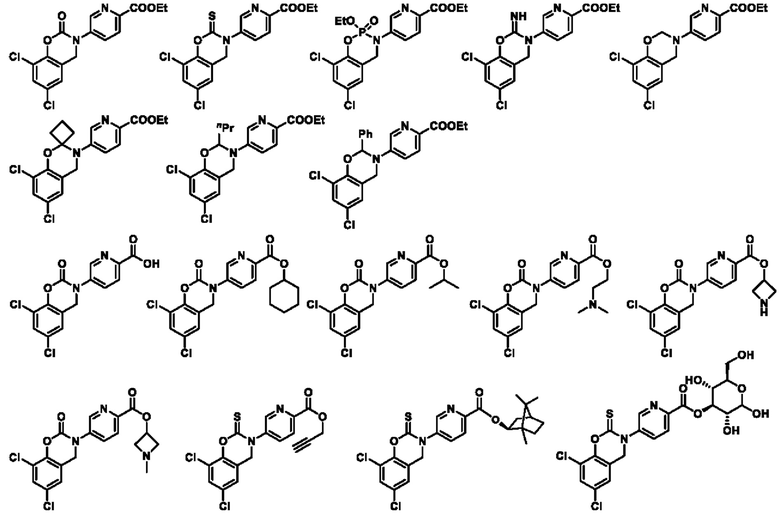
В другом предпочтительном варианте осуществления соединение выбирают из группы состоящей из:
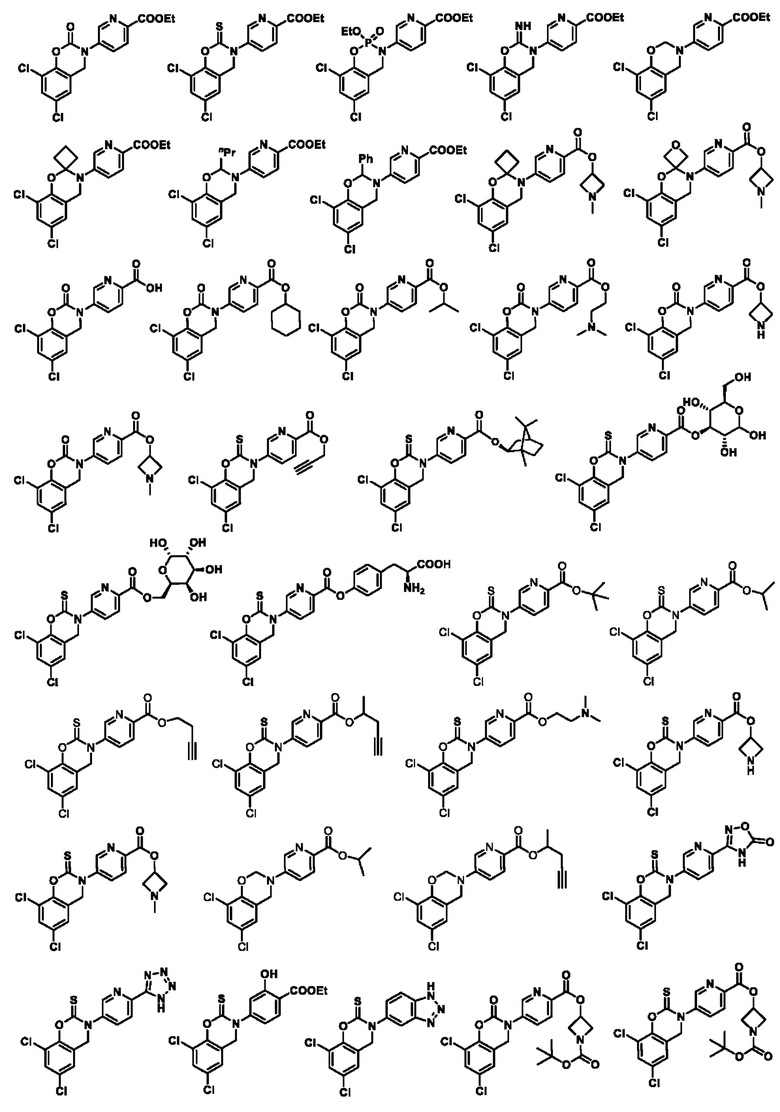
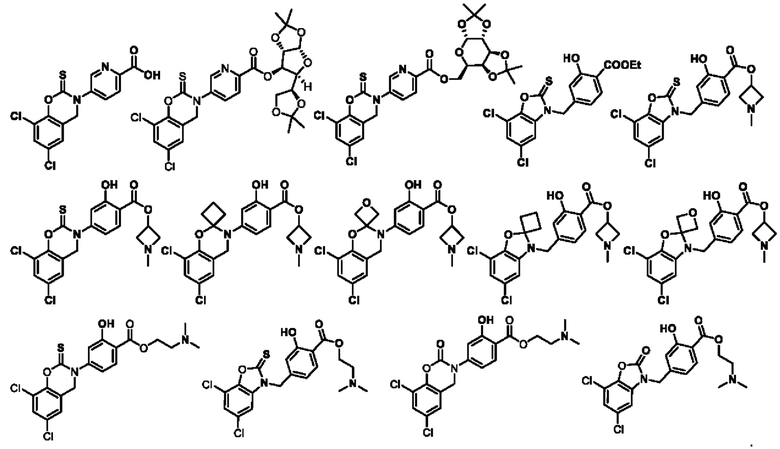
В другом предпочтительном варианте осуществления соединение выбирают из группы состоящей из:
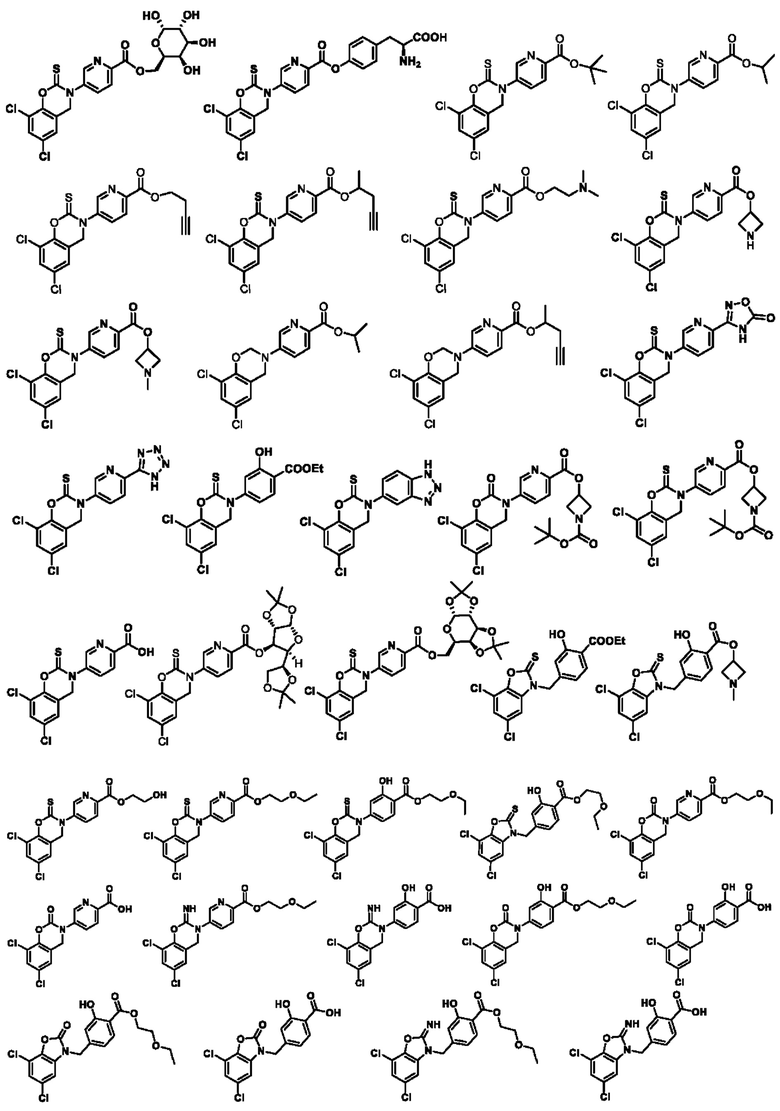
Используемый в настоящем документе термин «фармацевтически приемлемая соль» означает соль, образованную соединением настоящего изобретения с кислотой или основанием, пригодную для использования в качестве лекарственного препарата. Фармацевтически приемлемые соли включают неорганические соли и органические соли. Предпочтительным классом солей являются соли соединений по настоящему изобретению, образованные с кислотами. Кислоты, пригодные для образования соли, включают, помимо прочих, следующие: хлористоводородная кислота, бромная кислота, фтористоводородная кислота, трифторуксусная (ТФУК) кислота, серная кислота, азотная кислота, фосфорная кислота и другие неорганические кислоты; муравьиная кислота, уксусная кислота, трифторуксусная кислота, пропионовая кислота, янтарная кислота, нафталиндисульфоновая кислота (1,5), азиатиковая кислота, щавелевая кислота, валериановая кислота, диэтилуксусная кислота, малоновая кислота, янтарная кислота, фумаровая кислота, пимелиновая кислота, адипиновая кислота, малеиновая кислота, молочная кислота, яблочная кислота, винная кислота, лимонная кислота, пикриновая кислота, салициловая кислота, бензойная кислота, фенилпропионовая кислота, глюконовая кислота, аскорбиновая кислота, ниацин, изоникотиновая кислота, метансульфоновая кислота, этансульфоновая кислота, сульфаминовая кислота, п-толуолсульфоновая кислота, бензенсульфоновая кислота, нафталинсульфоновая кислота и другие органические кислоты а также пролин, фенилаланин, аспартовая кислота, глутаминовая кислота и другие аминокислоты.
Другим предпочтительным классом солей являются соли соединений по настоящему изобретению, образованные основаниями, такими как соли щелочных металлов (например, соли натрия или калия), соли щелочноземельных металлов (например, соли магния или кальция), соли аммония (например, соли алканол-аммония низшего порядка и другие фармацевтически приемлемые соли аминов), такие как соль метиламина, соль этиламина, соль пропиламина, соль диметиламина, соль триметиламина, соль диэтиламина, соль триэтиламина, соль триэтиламина, соль трет-бутиламина, соль этилендиамина, соль гидроксиэтиламина, соль дигидроксиэтиламина, соль тригидроксиэтиламина и соль амина, образованная из морфолина, пиперазина и лизина соответственно.
Термин «стереоизомер», или «оптический изомер», означает, что хиральный атом углерода, входящий в соединение по настоящему изобретению, может быть в конфигурации R или S или в их сочетании.
СПОСОБ ПОЛУЧЕНИЯ
Способ получения структурного соединения по формуле I в соответствии с настоящим изобретением более конкретно описан ниже, но эти конкретные способы не являются каким-либо ограничением. Соединения настоящего изобретения также можно надлежащим образом получить путем сочетания различных методов синтеза, описанных в спецификации или известных в данной области, и такие комбинации могут быть легко осуществлены специалистами в области, к которой относится настоящее изобретение.
Как правило, процесс получения соединений по настоящему изобретению осуществляется следующим образом, где исходные материалы и реактивы являются коммерчески доступными, если не указано иное.
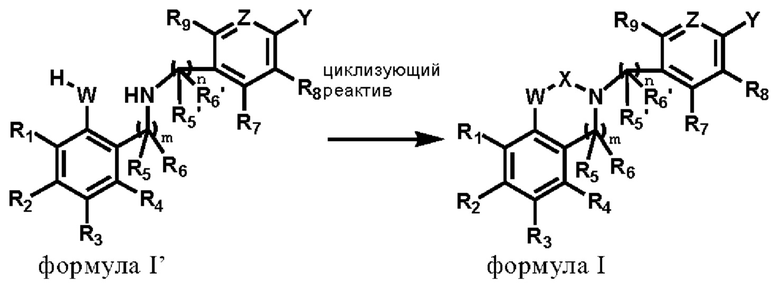
реакция соединения по формуле I' с циклизующим реактивом для получения соединения по формуле I;
где R1, R2, R3, R4, R5, R5', R6, R6', R7, R8, R9, W, X, Z, Y, m и n соответствует определению, приведенному выше.
Фармацевтическая композиция и способ применения
Изобретение также представляет фармацевтическую композицию, включающую фармацевтически приемлемый носитель и одно или более соединений или их стереоизомеров, или фармацевтически приемлемых солей.
Поскольку соединения по настоящему изобретению могут эффективно проходить через гематоэнцефалический барьер и обладают превосходным нейропротекторным действием, соединения по настоящему изобретению и фармацевтические композиции, содержащие соединения по настоящему изобретению в качестве основных действующих веществ, могут быть использованы для лечения, профилактики и облегчения заболеваний, связанных с повреждением нейронов. Согласно предшествующему уровню техники, соединения по настоящему изобретению могут быть использованы для лечения следующих заболеваний, помимо прочих: нейропатическая боль, мигрень, воспалительная боль, хроническая боль, инсульт, черепно-мозговая травма, депрессия, болезнь Альцгеймера, эпилепсия, аффективные расстройства, нейродегенеративные заболевания и др.
Фармацевтическая композиция настоящего изобретения включает безопасное и эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли, а также фармацевтически приемлемое вспомогательное вещество или носитель. «Безопасное и эффективное количество» означает такое количество соединения, которого достаточно для существенного улучшения состояния без появления серьезных побочных эффектов. Как правило, фармацевтическая композиция содержит 1-2000 мг соединения по настоящему изобретению/доза, более предпочтительно 1-200 мг соединения по настоящему изобретению/доза. Предпочтительно «одна доза» представляет собой капсулу, таблетку или инъекцию.
«Фармацевтически приемлемый носитель» означает один или несколько наполнителей в твердой или жидкой форме или желеобразные материалы, которые пригодны для использования для человека и должны иметь достаточную чистоту и достаточно низкую токсичность. «Совместимость» означает, что каждый компонент такой композиции может быть смешан с соединениями по настоящему изобретению, а также друг с другом без существенного снижения эффективности этих соединений. Некоторые примеры фармацевтически приемлемых веществ-носителей включают в себя целлюлозу и ее производные (такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза натрия, ацетат целлюлозы и т.д.), желатин, тальк, твердые смазки (такие как стеариновая кислота, магния стеарат), кальция сульфат, растительные масла (такие как соевое масло, кунжутное масло, арахисовое масло, оливковое масло и т.д.), полиолы (такие как пропиленгликоль, глицерин, маннит, сорбит и т.д.), эмульгаторы (такие как Tween®), смачивающий агент (такой как натрия додецилсульфат), красители, ароматизаторы, стабилизаторы, антиоксиданты, консерванты, апирогенную воду и пр.
Фармацевтическая композиция представляет собой инъекцию, капсулу, таблетку, пилюлю, порошок или гранулы.
Методы введения соединений или фармацевтических композиций настоящего изобретения не имеют конкретных ограничений, а типичные методы введения включают, помимо прочих, прием внутрь, ректальное, парентеральное (внутривенное, внутримышечное или подкожное) и местное введение.
Твердые лекарственные формы для приема внутрь включают капсулы, таблетки, пилюли, порошки и гранулы. В этих твердых лекарственных формах активное соединение смешивается по меньшей мере с одним обычным инертным вспомогательным веществом (или носителем), таким как натрия цитрат или дикальцийфосфат, или с любым из следующих компонентов: (а) наполнители или вещества для улучшения совместимости, например, крахмал, лактоза, сахароза, глюкоза, маннит и кремниевая кислота; (b) связующие вещества, например, гидроксиметилцеллюлоза, альгинат, желатин, поливинилпирролидон, сахароза и аравийская камедь; (с) увлажнители, такие как глицерин; (d) разрыхлители, такие как агар, карбонат кальция, картофельный крахмал или крахмал тапиоки, альгиновая кислота, некоторые сложные силикаты и натрия карбонат; (е) агенты, замедляющие растворение, такие как парафин; (f) ускорители абсорбции, например, четвертичные аммониевые соединения; (g) смачивающие агенты, такие как цетиловый спирт и глицерилмоностеарат; (h) адсорбенты, например, каолин; и (i) смазывающие вещества, такие как тальк, кальция стеарат, магния стеарат, твердый полиэтиленгликоль, натрия додецилсульфат или их смесь. В капсулах, таблетках и пилюлях лекарственные формы могут также содержать буферные агенты.
Твердые лекарственные формы, такие как таблетки, драже, капсулы, пилюли и гранулы, могут быть приготовлены с покрытиями и оболочками, такими как кишечнорастворимая оболочка и другие материалы, известные в этой области. Они могут содержать замутнители, а высвобождение активного соединения или соединения в таких композициях может происходить в части пищеварительного тракта с задержкой. Примерами компонентов для встраивания, которые могут быть использованы, являются полимерные и восковые материалы. При необходимости активное соединение может также находиться в микрокапсулированной форме с одним или несколькими вышеупомянутыми вспомогательными веществами.
Жидкие лекарственные формы для приема внутрь включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы или настойки. В дополнение к активному соединению жидкая лекарственная форма может содержать инертные разбавители, обычно используемые в этой области, такие как вода или другие растворители, сжижающие агенты и эмульгаторы, например, этанол, изопропанол, этилкарбонат, этилацетат, пропиленгликоль, 1,3-бутандиол, диметилформамид и масла, особенно хлопковое масло, арахисовое масло, масло зародышей кукурузы, оливковое масло, касторовое масло и кунжутное масло или смеси этих веществ.
Кроме этих инертных разбавителей, композиции могут содержать вспомогательные вещества, такие как смачиватели, эмульгаторы и суспендирующие вещества, подсластители, ароматизаторы и вкусовые добавки.
В дополнение к активному соединению, суспензия может содержать суспендирующий агент, такой как этоксилированный изооктадеканол, полиоксиэтилен сорбитол и дегидрированный эфир сорбитана, микрокристаллическая целлюлоза, алюминия метоксид и агар, или их смесь и т.д.
Композиции для парентерального введения могут включать физиологически приемлемые стерильные водные или безводные растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки, которые могут быть повторно растворены в стерильных растворах или суспензиях для инъекций. Подходящие водные и неводные носители, разбавители, растворители или наполнители включают в себя воду, этанол, многоатомные спирты и любые их подходящие смеси.
Дозированные формы соединений по настоящему изобретению для местного применения включают мази, порошки, пластыри, спреи и ингаляторы. Действующее вещество смешивается в стерильных условиях с физиологически приемлемым носителем и любыми консервантами, буферными веществами или пропеллентами, которые могут потребоваться в случае необходимости.
Соединения по настоящему изобретению можно применять самостоятельно или в сочетании с другими фармацевтически приемлемыми соединениями.
Способ лечения по настоящему изобретению может использоваться отдельно или в комбинации с другими средствами лечения или лекарственными препаратами.
При использовании фармацевтической композиции безопасное и эффективное количество соединения по настоящему изобретению вводят млекопитающему (например, человеку), нуждающемуся в лечении, при этом доза во время введения является фармацевтически эффективной дозой, для людей с массой тела 60 кг суточная доза обычно составляет 1-2000 мг, предпочтительно 1-500 мг. Конечно, при определении конкретных доз следует также учитывать такие факторы, как способ введения, состояние здоровья пациента и т.д., что находится в компетенции опытного врача.
По сравнению с предшествующим уровнем техники настоящее изобретение имеет следующие основные преимущества:
(1) Настоящее изобретение предлагает класс новых нейропротекторных соединений, которые могут эффективно проходить через гематоэнцефалический барьер.
(2) Соединение по настоящему изобретению обладает более высокой нейропротекторной активностью, более высокой эффективностью in vivo, лучшей безопасностью, лучшей фармакокинетикой и лучшими свойствами для получения лекарственного препарата на основе данных соединений.
(3) Предполагается, что соединения по настоящему изобретению будут использоваться для лечения и/или профилактики заболеваний или нарушений, связанных с повреждением нейронов.
Настоящее изобретение будет дополнительно проиллюстрировано ниже со ссылкой на конкретные примеры. Следует понимать, что эти примеры приведены только для иллюстрации изобретения, но не для ограничения объема изобретения. Экспериментальные методы без конкретных условий в следующих примерах обычно используют в соответствии со стандартными условиями, например, условиями, описанными в Sambrook et al., Molecular Cloning: Laboratory Manual (New York: Cold Spring Harbor Laboratory Press, 1989), или в соответствии с условиями, рекомендованными производителем. Если не указано иное, проценты и доли рассчитываются по массе.
Если не указано иное, вся профессиональная и научная терминология, используемая в тексте, имеет те же значения, которые известны специалистам в данной области. Кроме того, к методам изобретения могут быть применены любые методы и материалы со сходным или аналогичным описанием или составом. Описанный здесь предпочтительный вариант осуществления и материал предназначены только для демонстрационных целей.
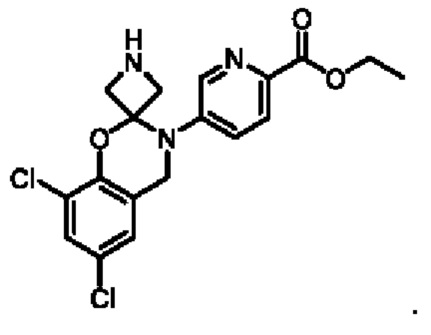
Пример 1: получение соединения 04013
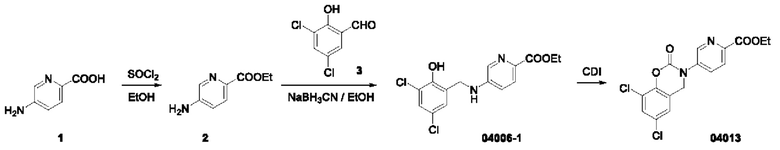
Этап 1. Соединение 2
При температуре 25°С медленно по каплям добавляли дихлорсульфоксид (20 мл) к раствору соединения 1 (2,0 г, 14,5 ммоль) в этаноле (20 мл). Реакционную систему нагревали до 60°С и перемешивали в течение ночи. Смесь концентрировали при пониженном давлении, остаток экстрагировали водой (50 мл) и этилацетатом (дважды по 50 мл). Объединенную органическую фазу высушивали над безводным натрия сульфатом и концентрировали при пониженном давлении с получением соединения 2 (0,90 г, выход: 37,5%) в виде твердого вещества белого цвета.
Этап 2. Соединение 04006-1
При температуре 25°С раствор соединения 2 (0,90 г, 5,4 ммоль) и соединения 3 (1,0 г, 5,0 ммоль) в метаноле перемешивали в течение 1 часа, добавляли натрия цианоборогидрид (0,38 г, 6,0 ммоль) и перемешивали в течение ночи. Реакцию гасили водным раствором натрия бикарбоната (100 мл), концентрировали при пониженном давлении для удаления метанола и экстрагировали этилацетатом (трижды по 100 мл). Объединенную органическую фазу высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении, остаток очищали на колонке с силикагелем с получением соединения 04006-1 (0,90 г, выход: 53%) в виде твердого вещества белого цвета.
МС (ИЭР): расчет для C15H14Cl2N2O3 340; факт, значение 341 [М+Н]+.
Этап 3. Соединение 04013
CDI (N,N'-карбонилдиимидазол)(200 мг, 0,62 ммоль) добавляли к раствору соединения 04006-1 (200 мг, 0,58 ммоль) в этилацетате (10 мл) при температуре 25°С и перемешивали в течение 16 часов. Реакционный раствор непосредственно фильтровали, фильтрационный осадок суспендировали в этилацетате, фильтровали и высушивали, получая соединение 04013 (65 мг, выход: 30%) в виде твердого вещества серо-белого цвета.
МС (ИЭР): расчет для C16H12Cl2N2O4 366; факт, значение 367 [М+Н]+.
1H-ЯМР (400 МГц, CD3OD): δ 8,83 (синглет, 1H), 8,24-8,22 (дублет, J=8,0 Гц, 1H), 7,97-7,95 (дублет, J=8,0 Гц, 1Н), 7,45 (синглет, 1H), 7,12 (синглет, 1H), 4,93 (синглет, 2Н), 4,53-4,48 (квадруплет, J=6,8 Гц, 2Н), 1,48-1,44 (триплет, J=6,8 Гц, 3Н).
Пример 2: получение соединения 04015

Этап 1. Соединение 04015
TCDI (тиокарбонилдиимидазол)(118 мг, 0,6 ммоль) добавляли к раствору соединения 04006-1 (0,2 г, 0,58 ммоль) в этилацетате (10 мл) при температуре 25°С и перемешивали в течение 16 часов. Реакционный раствор промывали водой, экстрагировали этилацетатом, органическую фазу высушивали над безводным натрия сульфатом и концентрировали при пониженном давлении. Остаток очищали на препаративной пластинке с получением соединения 04015 (22 мг, выход: 10%).
МС (ИЭР): расчет для C16H12Cl2N2O3S 382; факт, значение 383 [М+Н]+.
1Н-ЯМР (400 МГц, CD3OD): δ 8,83 (синглет, 1Н), 8,28 (дублет, J=8,0 Гц, 1Н), 7,91 (дублет, J=8,0 Гц, 1H), 7,48 (синглет, 1H), 7,07 (синглет, 1Н), 4,83 (синглет, 2Н), 4,52 (квадруплет, J=6,0 Гц, 2Н), 1,47 (триплет, J=6,0 Гц, 3Н).
Пример 3: получение соединения 04016
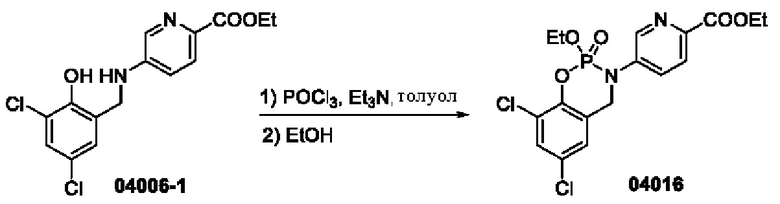
Этап 1. Соединение 04016
При температуре 25°С к раствору соединения 04006-1 (200 мг, 0,59 ммоль) и триэтиламина (178 мг, 1,76 ммоль) в толуоле (10 мл) добавляли фосфора оксихлорид (0,55 мл), нагревали реакционную систему до 70°С в защитной атмосфере азота и проводили реакцию в течение 16 часов. Смесь концентрировали при пониженном давлении, к остатку добавляли этанол (20 мл) и перемешивали в течение получаса. Смесь концентрировали при пониженном давлении и очищали остаток с помощью препаративной хроматографии для получения соединения 04016 (49,7 мг, выход: 19,6%).
МС (ИЭР): расчет для C17H17Cl2N2O5PS 430; факт, значение 431 [М+Н]+.
1Н-ЯМР (400 МГц, CDCl3): δ 8,70 (дублет, J=2,4 Гц, 1H), 8,13-8,10 (дублет, J=8,8 Гц, 1H), 7,87-7,80 (двойной дублет, дублет, J=8,8 Гц, 2,0 Гц, 1Н), 7,43 (синглет, 1H), 7,15 (дублет, J=2,4 Гц, 1H), 4,88-4,70 (мультиплет, 2Н), 4,47 (квадруплет, J=7,2 Гц, 2Н), 4,35-4,24 (мультиплет, 2Н), 1,47-1,42 (триплет, J=7,2 Гц, 3Н), 1,38-1,32 (триплет, J=7,2 Гц, 3Н).
Пример 4: получение соединения 04056
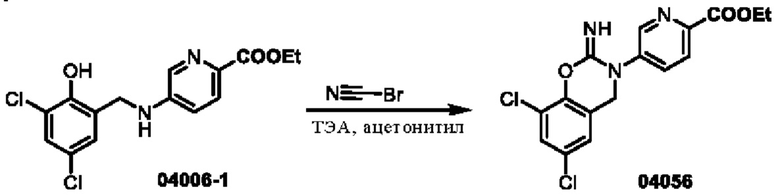
Этап 1. Соединение 04056
Соединение 04006-1 (200 мг, 0,59 ммоль) растворяли в ацетонитриле (5 мл), затем добавляли триэтиламин (178 мг, 1,77 ммоль), по каплям добавляли раствор цианогенбромида (79 мг, 0,76 ммоль) в ацетонитриле (5 мл) и перемешивали при температуре 25°С в течение 1 часа. Реакционный раствор разбавляли водой (20 мл) и затем экстрагировали этилацетатом (трижды по 50 мл). Объединенную органическую фазу высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении и очищали остаток с помощью хроматографии на колонке с нейтральным алюминия оксидом (элюент: дихлорметан/метанол = 100:1-100:8) с получением соединения 04056 (40,3 мг, выход: 19%) в виде твердого вещества желтого цвета.
ВЭЖХ-МС: [М+Н]+ = 366,0
1Н-ЯМР 1H-ЯМР (400 МГц, ДМСО-d6) δ 8,05 (синглет, 1Н), 7,79-7,63 (мультиплет, 2Н), 7,34 (дублет, J=13,0 Гц, 2Н), 6,88 (дублет, J=7,7 Гц, 1Н), 4,41 (дублет, J=3,9 Гц, 2Н), 4,23 (дублет, J=6,8 Гц, 2Н), 1,27 (триплет, J=6,7 Гц, 3Н).
Пример 5: получение соединения 04022
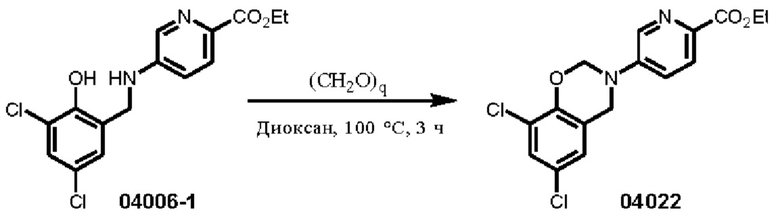
Этап 1. Соединение 04022
Соединение 04006-1 (300 мг, 0,88 ммоль) и параформальдегид (CAS: 30525-89-4) (79 мг, 2,64 ммоль) растворяли в 1,4-диоксане (10 мл), нагревали до 110°С и перемешивали в течение 16 часов. Реакционный раствор концентрировали и очищали с помощью хроматографии на колонке с силикагелем (элюент: дихлорметан) с получением соединения 04022 (твердое вещество белого цвета, 154 мг, выход: 50%).
ВЭЖХ-МС: [М+Н]+ = 353,1
1Н-ЯМР (400 МГц, CDCl3) δ 8,56 (синглет, 1Н), 8,07 (дублет, J=8,6 Гц, 1Н), 7,46 (дублет, J=8,5 Гц, 1H), 7,25 (дублет, J=1,9 Гц, 1Н), 6,97 (дублет, J=1,9 Гц, 1H), 5,50 (синглет, 2Н), 4,71 (синглет, 2Н), 4,45 (квадруплет, J=7,1 Гц, 2Н), 1,42 (триплет, J=7,1 Гц, 3Н).
Пример 6: получение соединения 04046
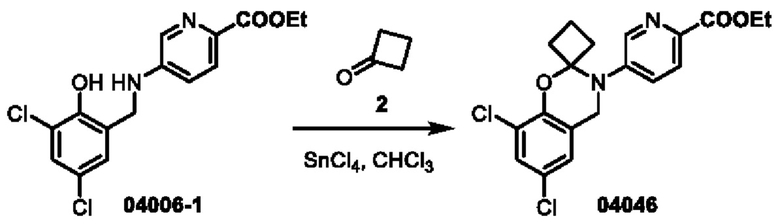
Этап 1. Соединение 04046
Соединение 04006-1 (50 мг, 0,15 ммоль) растворяли в хлороформе (5 мл), добавляли циклобутанон 2 (0,1 мл) и две капли олова тетрахлорида (2 М раствор в дихлорметане), реакционный раствор нагревали до 90°С и перемешивали в течение 16 часов. После охлаждения до 25°С реакционный раствор концентрировали и очищали с помощью хроматографии на колонке с нейтральным алюминия оксидом (элюент: дихлорметан) с получением соединения 04046 (твердое вещество желтого цвета, 6,0 мг, выход: 10,4%).
ВЭЖХ-МС: [М+Н]+ = 393,1
1Н-ЯМР (400 МГц, CDCl3) δ 8,48 (синглет, 1H), 7,93 (дублет, J=8,5 Гц, 1H), 7,39 (двойной дублет, J=8,5, 2,3 Гц, 1Н), 7,15 (дублет, J=2,0 Гц, 1Н), 6,75 (синглет, 1Н), 4,55 (синглет, 2Н), 4,40-4,33 (мультиплет, 2Н), 2,51-2,38 (мультиплет, 4Н), 2,11-2,01 (мультиплет, 1H), 1,86-1,77 (мультиплет, 1H), 1,34 (триплет, J=7,2 Гц, 3Н).
Пример 7: получение соединения 04044
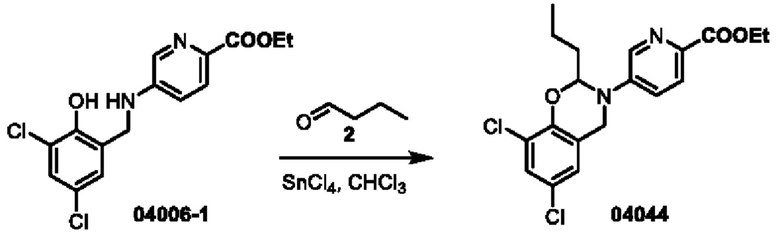
Этап 1. Соединение 04044
Соединение 04006-1 (50 мг, 0,15 ммоль), соединение 2 (0,1 млмл) и SnCl4 (2 капли, 2 М раствор в дихлорметане) растворяли в трихлорметане (8 мл), нагревали до 90°С и перемешивали в течение 16 часов.. После охлаждения до 25°С полученный раствор концентрировали, а остаток очищали с помощью препаративной хроматографии для получения соединения 04044 (твердое вещество светло-желтого цвета, 2,0 мг, выход: 3,4%).
ВЭЖХ-МС: [М+Н]+ = 395,0
1Н-ЯМР (400 МГц, CDCl3) δ 8,15 (синглет, 1H), 7,96 (дублет, J=8,6 Гц, 1Н), 7,29 (дублет, J=2,1 Гц, 1H), 7,15 (синглет, 1Н), 6,89 (дублет, J=8,1 Гц, 1Н), 4,79-4,72 (мультиплет, 1Н), 4,45-4,39 (мультиплет, 4Н), 1,69-1,62 (мультиплет, 2Н), 1,41 (триплет, J=7,1 Гц, 3Н), 1,32-1,25 (мультиплет, 2Н), 1,01-0,88 (мультиплет, 3Н).
Пример 8: получение соединения 04045
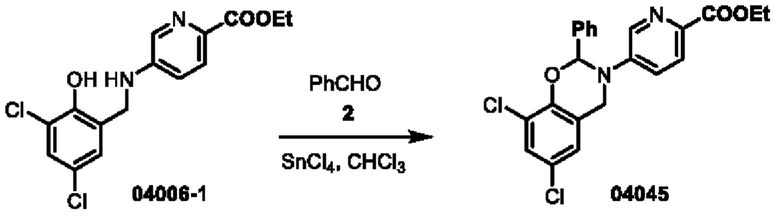
Этап 1. Соединение 04045
Соединение 04006-1 (50 мг, 0,15 ммоль), соединение 2 (0,1 млмл) и SnCl4 (2 капли, 2 М раствор в дихлорметане) растворяли в трихлорметане (8 мл), нагревали до 90°С и перемешивали в течение 16 часов.. После охлаждения до 25°С полученный раствор концентрировали, а остаток очищали с помощью препаративной хроматографии для получения соединения 04045 (12,3 мг, выход: 20%).
ВЭЖХ-МС: [М+Н]+ = 429,0
1Н-ЯМР (400 МГц, CDCl3) δ 8,64 (синглет, 1Н), 8,08 (дублет, J=8,4 Гц, 1Н), 7,54 (триплет, J=7,8 Гц, 1Н), 7,46-7,35 (мультиплет, 5Н), 7,27 (синглет, 1Н), 6,88 (синглет, 1H), 6,84 (синглет, 1Н), 4,48-4,40 (мультиплет, 4Н), 1,43 (триплет, J=7,1 Гц, 3Н).
Пример 9: получение соединения 04024
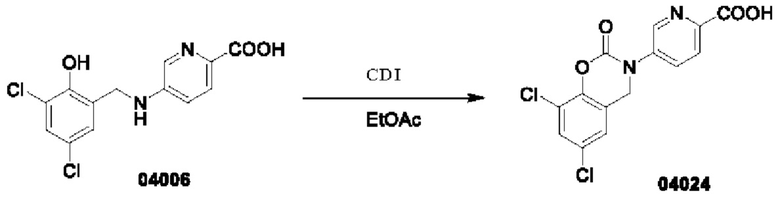
Этап 1. Соединение 04024
При температуре 25°С к раствору соединения 04006 (2 г, 6,4 ммоль) в диметилсульфоксиде (15 мл) добавляли CDI (2,1 г, 12,8 ммоль), и перемешивали в течение 0,5 ч. Реакционный раствор медленно добавляли к 10 мл ледяной воды, при этом образовывалось большое количество твердого вещества белого цвета в виде хлопьев. Смесь перемешивали в течение 0,5 ч, фильтровали, и фильтрационный осадок высушивали при пониженном давлении для получения соединения 04024 (1,5 г, выход: 69%).
МС (ИЭР): расчет для C14H8Cl2N2O4 338; факт, значение 339 [М+Н]+.
1Н-ЯМР (400 МГц, ДМСО-d6): δ 8,84 (синглет, 1H), 8,16 (дублет, J=8,4 Гц, 1H), 8,09 (дублет, J=8,4 Гц, 1Н), 7,75 (синглет, 1Н), 7,45(синглет, 1Н), 2,06(синглет, 2Н).
Пример 10: получение соединения 04019
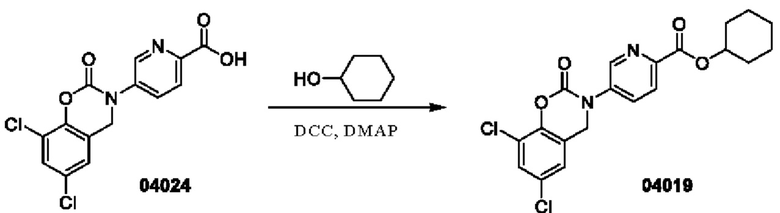
Этап 1. Соединение 04019
К раствору соединения 04024 (0,2 г, 0,59 ммоль) в дихлорметане (10 мл) последовательно добавляли DCC (243 мг, 1,18 ммоль), циклогексанол (295 мг, 2,95 ммоль) и DMAP (144 мг, 1,18 ммоль) при 25°С и перемешивали в течение 18 часов. Анализ методом ВЭЖХ-МС показал, что исходные материалы прореагировали полностью, и реакционный раствор фильтровали. Фильтрат концентрировали, остаток отделяли и очищали на колонке с силикагелем (элюент - петролейный эфир:этилацетат = от 10:1 до 2:1) с получением соединения 04019 (33,12 мг, выход: 13%).
МС (ИЭР): расчет для C20H18Cl2N2O4 420; Факт, значение 421 [М+Н]+.
1Н-ЯМР (400 МГц, ДМСО-d6): δ 8,86 (синглет, 1H), 8,16 (дублет, J=8,0 Гц, 1H), 8,09 (дублет, J=8,0 Гц, 1Н), 7,75 (синглет, 1Н), 7,46 (синглет, 1H), 5,06 (синглет, 2Н), 5,00-4,96 (мультиплет, 1H), 1,98-1,87 (мультиплет, 2Н), 1,80-1,70 (мультиплет, 2Н), 1,70-1,50 (мультиплет, 2Н), 1,50-1,20 (мультиплет, 4Н).
Пример 11: получение соединения 04020
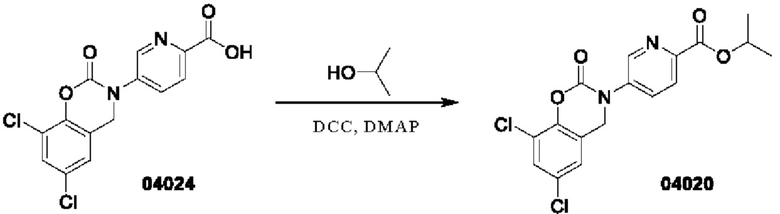
Этап 1. Соединение 04020
К раствору соединения 04024 (0,3 г, 0,89 ммоль) в дихлорметане (10 мл) последовательно добавляли DCC (550 мг, 2,67 ммоль), изопропанол (162 мг, 2,67 ммоль) и DM АР (218 мг, 1,78 ммоль), и перемешивали при 25°С в течение 18 часов. Анализ методом ВЭЖХ-МС показал, что исходные материалы прореагировали полностью, и реакционный раствор фильтровали. Фильтрат концентрировали при пониженном давлении, остаток очищали на колонке с силикагелем (элюент - петролейный эфир/этилацетат = 2/1) для получения соединения 04020 (23,71 мг, выход: 8%).
МС (ИЭР): расчет для C17H14Cl2N2O4 380; факт, значение 381 [М+Н]+.
1Н-ЯМР (400 МГц, CD3OD): δ 8,89 (синглет, 1H), 8,26 (дублет, J=8,0 Гц, 1Н), 8,16 (дублет, J=8,0 Гц, 1Н), 7,56 (синглет, 1Н), 7,38 (синглет, 1Н), 5,36-5,29 (мультиплет, 1H), 5,06 (синглет, 2Н), 1,44 (дублет, J=6,4 Гц, 6Н).
Пример 12: получение соединения 04071
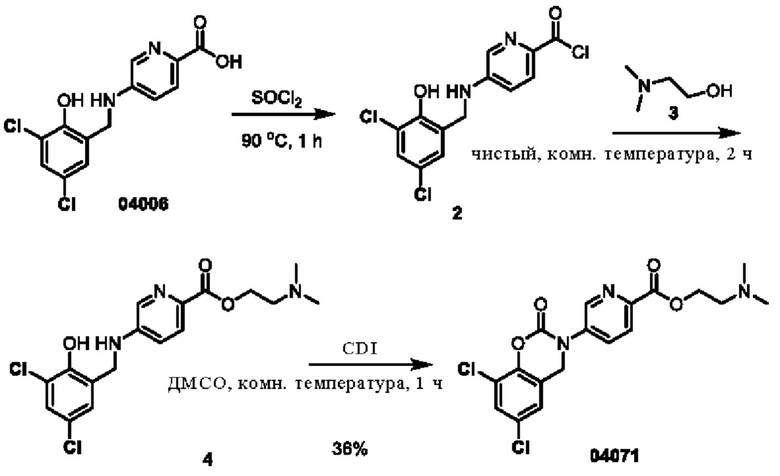
Этап 1. Соединение 2
Соединение 04006 (4,0 г, 12,8 ммоль) медленно добавляли к тионилхлориду (80 мл) при 0°С, реакционный раствор нагревали до 90°С и перемешивали в течение 1 часа, реакционная система превращалась в раствор коричнево-красного цвета. После удаления избытка тионилхлорида путем концентрирования при пониженном давлении получали твердое вещество коричнево-серого цвета. При 0°С твердое вещество коричнево-серого цвета медленно добавляли к соединению 3 (20 мл), затем температуру повышали до 25°С и перемешивали в течение 2 часов.. После концентрирования при пониженном давлении остаток отделяли и очищали с помощью хроматографии на колонке с силикагелем (элюент - дихлорметан/метанол = 10:1) с получением вещества в виде маслянистой жидкости. Маслянистую жидкость добавляли в воду (100 мл) и высушивали досуха для получения соединения 4 (2,0 г, выход: 40%).
ВЭЖХ-МС: [М+Н]+ = 384,1; 386,1.
Этап 2. Соединение 04071
Соединение 4 (800 мг, 1,04 ммоль) растворяли в диметилсульфоксиде (15 мл), затем медленно добавляли CDI (675 мг, 4,16 ммоль) и перемешивали при 25°С в течение 1 часа. Реакционный раствор концентрировали при пониженном давлении, а остаток очищали с помощью препаративной жидкостной хроматографии для получения соединения 04071 (308,5 мг, выход: 36%). ВЭЖХ-МС: [М+Н]+ = 410,0, 412,0
1H-ЯМР (400 МГц, ДМСО-d6) δ 8,87 (дублет, J=2,4 Гц, 1H), 8,17 (дублет, J=8,4 Гц, 1H), 8,10-8,07 (мультиплет, 1H), 7,73 (дублет, J=2,4 Гц, 1H), 7,45 (дублет, J=2,4 Гц, 1H), 5,06 (синглет, 2Н), 4,41 (триплет, J=5,6 Гц, 2Н), 2,63 (триплет, J=5,6 Гц, 2Н), 2,22 (синглет, 6Н).
Пример 13: получение соединения 04167 и соединения 04067
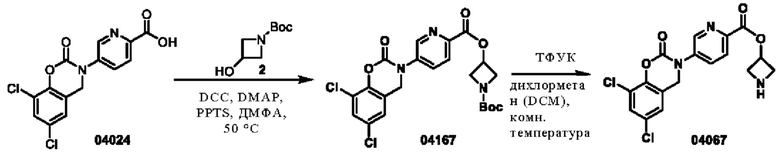
Этап 1. Соединение 04167
Соединение 04024 (1,1 г, 3,243 ммоль) растворяли в диметилформамиде (50 мл), затем последовательно добавляли соединение 2 (2,79 г, 16,107 ммоль), 4-диметиламинопиридин (DMAP) (1,19 г, 9,731 ммоль), пиридиния п-толуолсульфонат (PPTS) (2,44 г, 9,731 ммоль) и N,N'-дициклогексилкарбодиимид (DCC) (1,0 г, 4,865 ммоль). Реакционную систему нагревали до 50°С и перемешивали в течение 4 часов. Смесь охлаждали до 25°С, разбавляли этилацетатом (100 мл) и перемешивали в течение 0,5 ч. Реакционный раствор фильтровали, фильтрат промывали водой, промывали насыщенным раствором натрия хлорида, высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении и очищали остаток с помощью хроматографии на колонке с силикагелем (петролейный эфир/этилацетат = 1/1) для получения соединения 04167 (1,07 г, выход: 66%) в виде твердого вещества белого цвета.
ВЭЖХ-МС: [М+Н]+ = 494,1.
Этап 2. Соединение 04067
Соединение 04167 (1 г, 2,023 ммоль) растворяли в дихлорметане (10 мл), затем добавляли трифторуксусную кислоту (5 мл), и реакционный раствор перемешивали при 25°С в течение 1 часа. Смесь концентрировали при пониженном давлении, остаток очищали методом препаративной ВЭЖХ (0,1% муравьиная кислота/ацетонитрил/вода) с получением соединения 04067 (583 мг, выход: 67%).
ВЭЖХ-МС: [М+Н]+ = 394,0
1H-ЯМР (400 МГц, CD3OD) δ 8,88 (дублет, J=2,4 Гц, 1H), 8,28 (дублет, J=8,4 Гц, 1H), 8,15-8,13 (мультиплет, 1H), 7,54 (синглет, 1H), 7,33 (синглет, 1H), 5,57-5,53 (мультиплет, 1H), 5,06 (синглет, 2Н), 4,06-4,01 (мультиплет, 2Н), 3,91-3,87 (мультиплет, 2Н).
Пример 14: получение соединения 04068
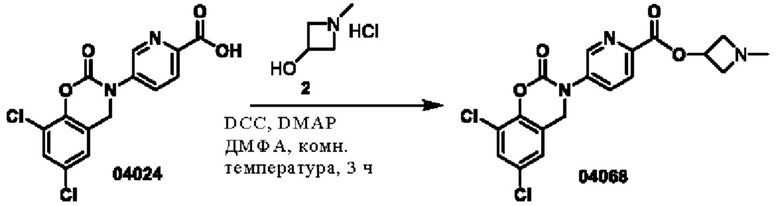
Этап 1. Соединение 04068
Соединение 04024 (3 г, 8,9 ммоль) растворяли в диметилформамиде (20 мл), затем добавляли DCC (2,7 г, 13,3 ммоль), DMAP (110 мг, 0,9 ммоль) и соединение 2 (1,6 г, 13,3 ммоль) и перемешивали в течение 3 часов при 25°С. После добавления этилацетата (100 мл) к реакционному раствору выпадал осадок твердого вещества. Раствор фильтровали. Фильтрат промывали водой. Органическую фазу отделяли и концентрировали при пониженном давлении, остаток очищали с помощью хроматографии на колонке с силикагелем (дихлорметан/метанол = от 100:1 до 100:5) с получением соединения 04068 (500 мг, выход: 14%) в виде твердого вещества желтого цвета.
ВЭЖХ-МС: [М+Н]+ = 408,1.
1Н-ЯМР (400 МГц, ДМСО-d6) δ 8,87 (дублет, J=2,0 Гц, 1Н), 8,19 (дублет, J=8,4 Гц, 1H), 8,11 (двойной дублет, J=8,4, 2,4 Гц, 1H), 7,74 (дублет, J=2,4 Гц, 1Н), 7,45 (дублет, J=2,4 ГцДН), 5,20-5,14 (мультиплет, 1H), 5,06 (синглет, 2Н), 3,71-3,68 (мультиплет, 2Н), 3,14-3,11 (мультиплет, 2Н), 2,30 (синглет, 3Н).
Пример 15: получение соединения 04115 и соединения 04034
Этап 1. Соединение 04115
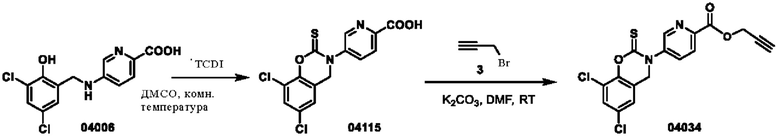
Соединение 04006 (1,2 г, 3,8 ммоль) растворяли в диметилсульфоксиде (10 мл), добавляли TCDI (1,37 г, 7,7 ммоль), и раствор перемешивали при 25°С в течение 2 часов в защитной атмосфере азота. Реакционный раствор разбавляли в 10 мл воды и корректировали рН раствора с помощью разбавленной хлористоводородной кислоты до значения менее 7, экстрагировали этилацетатом (трижды по 50 мл), высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении и очищали остаток с помощью хроматографии на колонке с силикагелем (элюент - DCM/MeOH = 100/1) для получения соединения 04115 (твердое вещество желтого цвета, 1,2 г, выход: 89%).
ВЭЖХ-МС: [М+Н]+ = 351,0.
Этап 2. Соединение 04034
Соединение 04115 (120 мг, 0,34 ммоль), соединение 3 (60 мг, 0,51 ммоль) и калия карбонат (94 мг, 0,68 ммоль) растворяли в диметилформамиде (2 мл), и реакционный раствор перемешивали при 25°С в течение 1 часа, разбавляли водой (10 мл) и экстрагировали этилацетатом (трижды по 50 мл). Полученную органическую фазу высушивали над безводным натрия сульфатом и концентрировали при пониженном давлении, остаток очищали с помощью хроматографии на колонке с силикагелем (элюент - петролейный эфир/этилацетат = 2/1) с получением соединения 04034 (твердое вещество белого цвета, 55,7 мг, выход: 42%).
ВЭЖХ-МС: [М+Н]+ = 393,1.
1Н-ЯМР (400 МГц, ДМСО-d6) δ 8,90 (дублет, J=2,0 Гц, 1H), 8,24-8,18 (мультиплет, 2Н), 7,78 (дублет, J=2,4 Гц, 1Н), 7,44 (дублет, J=2,0 Гц, 1H), 5,02-5,01 (мультиплет, 4Н), 3,67 (триплет, J=2,4 Гц, 1H).
Пример 16: получение соединения 04033
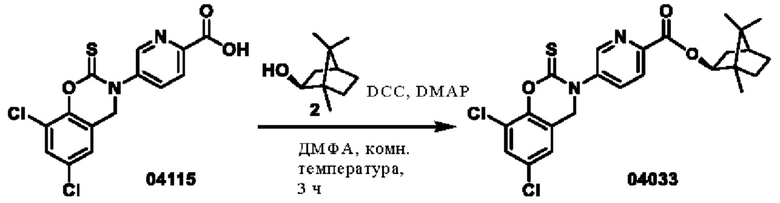
Этап 1. Соединение 04033
Соединение 04115 (150 мг, 0,42 ммоль), соединение 2 (85 мг, 0,55 ммоль), DCC (112 мг, 0,55 ммоль) и DMAP (15 мг, 0,04 ммоль) растворяли в диметилформамиде (2 мл) и перемешивали при 25°С в течение 3 часов. Реакционный раствор разбавляли водой (30 мл), затем экстрагировали этилацетатом (трижды по 50 мл), и органическую фазу высушивали над безводным натрия сульфатом. Остаток после концентрирования при пониженном давлении очищали с помощью хроматографии на колонке с силикагелем (элюент - петролейный эфир/этилацетат = 2/1) с получением соединения 04033 (твердое вещество белого цвета, 32,8 мг, выход 16%).
ВЭЖХ-МС: [М+Н]+ = 491,1.
1Н-ЯМР (400 МГц, ДМСО-d6) δ 8,89 (дублет, J=1,6 Гц, 1H), 8,20-8,16 (мультиплет, 2Н), 7,78 (синглет, 1Н), 7,44 (синглет, 1H), 5,10 (дублет, J=9,2 Гц, 1Н), 5,02 (синглет, 2Н), 2,42-2,39 (мультиплет, 1Н), 2,15-2,06 (мультиплет, 1H), 1,81-1,71 (мультиплет, 2Н), 1,42-1,27 (мультиплет, 2Н), 1,15-1,10 (мультиплет, 1H), 0,98-0,85 (мультиплет, 9Н).
Пример 17: получение соединения 04132 и соединения 04032
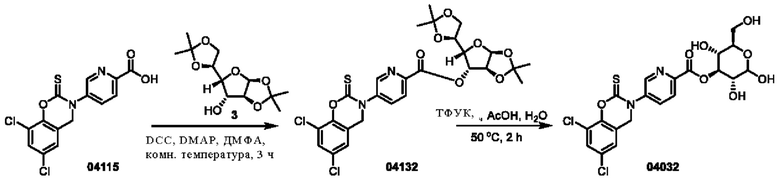
Этап 1. Соединение 04132
Соединение 04115 (1,06 г, 3,00 ммоль), соединение 3 (1,01 г, 3,90 ммоль), DCC (803 мг, 3,90 ммоль) и DMAP (36,6 мг, 0,30 ммоль) растворяли в диметилформамиде (10 мл) и перемешивали при 25°С в течение 3 часов. Реакционный раствор разбавляли водой (100 мл) и затем экстрагировали этилацетатом (трижды по 100 мл). Органическую фазу высушивали над безводным натрия сульфатом и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент - петролейный эфир/этилацетат = 5/1) с получением соединения 04132 (твердое вещество желтого цвета, 750 мг, выход 42%).
ВЭЖХ-МС: [М+Н]+ = 597,1.
Этап 2. Соединение 04032
Соединение 04132 (298 мг, 0,50 ммоль) растворяли в воде (3 мл), добавляли трифторуксусную кислоту (3 мл) и уксусную кислоту (3 мл), нагревали реакционную смесь до 50°С и перемешивали в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении и очищали остаток с помощью препаративной ВЭЖХ для получения соединения 04032 (твердое вещество белого цвета, 38,1 мг, выход 15%).
ВЭЖХ-МС: [М+Н]+ = 517,1.
1H-ЯМР (400 МГц, ДМСО-d6): δ 8,88 (синглет, 1H), 8,25-8,16 (мультиплет, 2Н), 7,78 (синглет, 1Н), 7,45 (синглет, 1H), 6,99-6,37 (мультиплет, 1Н), 5,36-4,96 (мультиплет, 5Н), 4,94-4,40 (мультиплет, 2Н), 3,80-3,58 (мультиплет, 1H), 3,59-3,40 (мультиплет, 2Н), 3,23-3,19 (мультиплет, 2Н).
Пример 18: получение соединения 04135 и соединения 04035
Этап 1. Соединение 04135
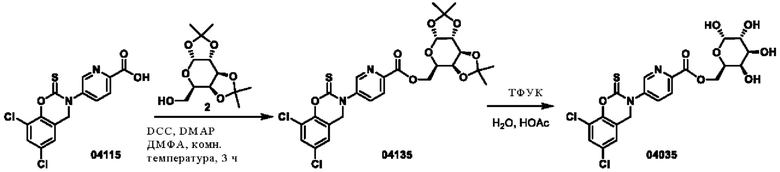
Соединение 04115 (400 мг, 1,1 ммоль), соединение 2 (381 мг, 1,4 ммоль), DCC (288 мг, 1,4 ммоль) и DMAP (12 мг, 0,1 ммоль) растворяли в диметилформамиде (3 мл) и перемешивали при 25°С в течение 3 часов. Реакционный раствор разбавляли водой (30 мл), экстрагировали этилацетатом (трижды по 50 мл), органическую фазу высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении и очищали остаток с помощью хроматографии на колонке с силикагелем (элюент - петролейный эфир/этилацетат = 2/1) с получением соединения 04135 (твердое вещество белого цвета, 150 мг, выход: 23%).
ВЭЖХ-МС: [М+Н]+ = 597,1.
Этап 2. Соединение 04035
Соединение 04135 (150 мг, 0,25 ммоль) растворяли в воде, добавляли трифторуксусную кислоту (2 мл) и уксусную кислоту (4 мл), и реакционный раствор перемешивали при 50°С в течение 2 часов. Смесь концентрировали при пониженном давлении и очищали остаток с помощью препаративной ВЭЖХ для получения соединения 04035 (твердое вещество белого цвета, 91,1 мг, выход 70%).
ВЭЖХ-МС: [М+Н]+ = 517,1, [М+Н+2]+ = 519,1
1Н-ЯМР (400 МГц, CD3OD) δ 8,81 (дублет, J=2,2 Гц, 1Н), 8,29 (дублет, J=8,4 Гц, 1H), 8,12 (двойной дублет, J=8,4, 2,4 Гц, 1H), 7,56 (дублет, J=2,2 Гц, 1Н), 7,29 (синглет, 1H), 4,98 (синглет,3Н), 4,62-4,47 (мультиплет, 5Н), 3,94 (двойной дублет, J=18,6, 7,5 Гц, 2Н), 3,83-3,74 (мультиплет, 1H), 3,50 (дублет, J=6,4 Гц, 1H).
Пример 19: получение соединения 04036
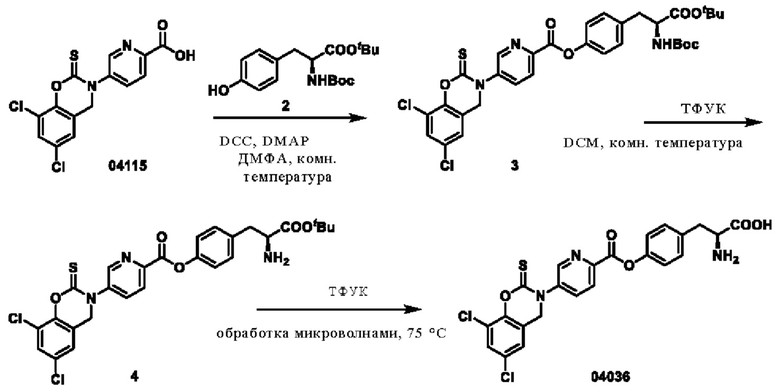
Этап 1. Соединение 3
Соединение 04115 (900 мг, 2,5 ммоль), соединение 2 (1,03 г, 3,1 ммоль), DCC (670 мг, 3,25 ммоль) и DMAP (30 мг, 0,25 ммоль) растворяли в диметилформамиде (10 мл) и перемешивали при 25°С в течение 3 часов. Реакционный раствор разбавляли водой (30 мл), а затем экстрагировали этилацетатом (трижды по 50 мл), органическую фазу высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении и очищали остаток с помощью хроматографии на колонке с силикагелем (элюент - петролейный эфир/этилацетат = 2/1) с получением соединения 3 (твердое вещество белого цвета, 300 мг, выход: 18%).
Этап 2. Соединение 4
Соединение 3 (150 мг, 0,22 ммоль) растворяли в дихлорметане (10 мл), добавляли трифторуксусную кислоту (5 мл) и перемешивали при 25°С в течение 18 часов. Реакционный раствор концентрировали при пониженном давлении и очищали остаток с помощью препаративной ВЭЖХ для получения соединения 4 (твердое вещество белого цвета, 80 мг, выход 63%).
ВЭЖХ-МС: [М+Н]+ = 574,1.
Этап 3. Соединение 04036
Соединение 4 (80 мг, 0,14 ммоль) растворяли в трифторуксусной кислоте (2 мл), реакционный раствор нагревали с помощью микроволнового излучения до 75°С и проводили реакцию в течение 10 минут.Реакционный раствор концентрировали при пониженном давлении и очищали остаток с помощью препаративной ВЭЖХ для получения соединения 04036 (твердое вещество белого цвета, 20,1 мг, выход 27%).
ВЭЖХ-МС: [М+Н]+ = 518,1.
1Н-ЯМР (400 МГц, ДМСО-d6) δ 8,94 (дублет, J=2,3 Гц, 1Н), 8,45-8,07 (мультиплет, 1Н), 7,76 (дублет, J=2,4 Гц, 0Н), 7,39 (двойной дублет, J=33,6, 5,4 Гц, 2Н), 7,21 (дублет, J=8,5 Гц, 2Н), 5,02 (синглет, 2Н), 3,41 (дублет, J=4,5 Гц, 1Н), 3,14 (синглет, 1H), 2,88 (дублет, J=6,3 Гц, 1H).
Пример 20: получение соединения 04048
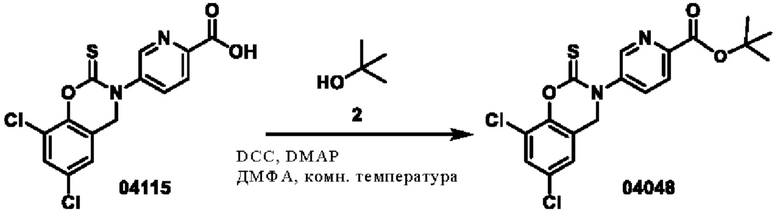
Этап 1. Соединение 04048
Соединение 04115 (1 г, 2,8 ммоль), трет-бутанол (980 мг, 14,1 ммоль), DCC (640 мг, 3,1 ммоль) и DMAP (68 мг, 0,56 ммоль) растворяли в диметилформамиде (15 мл) и перемешивали при 25°С в течение 3 часов. Реакционный раствор разбавляли водой (60 мл), а затем экстрагировали этилацетатом (трижды по 100 мл), органическую фазу высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении и очищали остаток с помощью хроматографии на колонке с силикагелем (элюент - петролейный эфир/этилацетат = 2/1) с получением соединения 04048 (твердое вещество белого цвета, 28,5 мг, выход: 2,5%).
ВЭЖХ-МС: [М+Н]+ = 411,1.
1H-ЯМР (400 МГц, ДМСО-d6) δ 8,85 (синглет, 1H), 8,15 (синглет, 2Н), 7,79 (дублет, J=2,1 Гц, 1H), 7,45 (дублет, J=1,9 Гц, 1Н), 5,01 (синглет, 2Н), 1,58 (синглет, 9Н).
Пример 21: получение соединения 04049
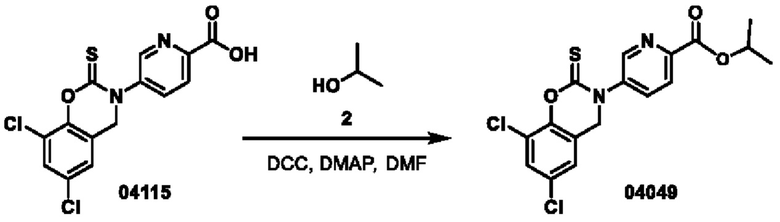
Этап 1. Соединение 04049
Соединение 04115 (350 мг, 1 ммоль), изопропанол (300 мг, 5 ммоль), DCC (250 мг, 1,2 ммоль) и DMAP (12 мг, 0,1 ммоль) растворяли в диметилформамиде (3 мл) и перемешивали при 25°С в течение 3 часов. Реакционный раствор разбавляли водой (30 мл), а затем экстрагировали этилацетатом (трижды по 50 мл), органическую фазу высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении и очищали остаток с помощью хроматографии на колонке с силикагелем (элюент - петролейный эфир/этилацетат = 2/1) с получением соединения 04049 (твердое вещество белого цвета, 10,7 мг, выход: 2,7%).
ВЭЖХ-МС: [М+Н]+ = 397,1, [М+Н+2]+ = 399,1
1Н-ЯМР (400 МГц, ДМСО-d6) δ 8,87 (дублет, J=1,8 Гц, 1H), 8,18 (двойной триплет, J=8,4, 5,3 Гц, 2Н), 7,78 (дублет, J=2,3 Гц, 1H), 7,45 (дублет, J=2,2 Гц, 1H), 5,25-5,15 (мультиплет, 1Н), 5,02 (синглет, 2Н), 1,36 (дублет, J=6,2 Гц, 6Н).
Пример 22: получение соединения 04050
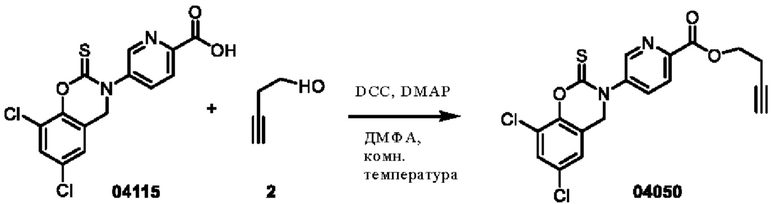
Этап 1. Соединение 04050
Соединение 04115 (350 мг, 1,0 ммоль), соединение 2 (170 мг, 2,0 ммоль), DCC (247 мг, 1,2 ммоль) и DMAP (12 мг, 0,1 ммоль) растворяли в диметилформамиде (3 мл) и перемешивали при 25°С в течение 3 часов. Реакционный раствор разбавляли водой (30 мл), а затем экстрагировали этилацетатом (трижды по 50 мл), органическую фазу высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении и очищали остаток с помощью хроматографии на колонке с силикагелем (элюент - дихлорметан/тетрагидрофуран = 100/1) с получением соединения 04050 (твердое вещество белого цвета, 72 мг, выход: 18%).
ВЭЖХ-МС: [М+Н]+ = 407,0, [М+Н+2]+ = 409,0
1Н-ЯМР (400 МГц, ДМСО-d6) δ 8,89 (дублет, J=2,0 Гц, 1H), 8,23-8,14 (мультиплет, 2Н), 7,78 (дублет, J=2,4 Гц, 1H), 7,73 (дублет, J=2,4 Гц, 1H), 5,02 (синглет, 2Н), 4,41 (триплет, J=6,4 Гц, 2Н), 2,91 (синглет, 1H), 2,68-2,66 (мультиплет, 2Н).
Пример 23: получение соединения 04052
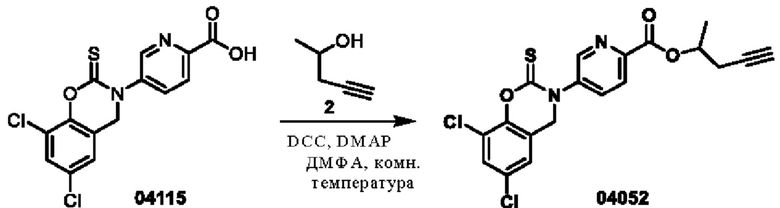
Этап 1. Соединение 04052
Соединение 04115 (200 мг, 0,56 ммоль), соединение 2 (57 мг, 0,67 ммоль), DCC (138 мг, 0,67 ммоль) и DMAP (7 мг, 0,067 ммоль) растворяли в диметилформамиде (3 мл) и перемешивали при 25°С в течение 3 часов. Реакционный раствор разбавляли водой (20 мл), а затем экстрагировали этилацетатом (трижды по 30 мл), органическую фазу высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении и очищали остаток с помощью хроматографии на колонке с силикагелем (элюент - дихлорметан/тетрагидрофуран=100/1) с получением соединения 04052 (твердое вещество белого цвета, 49 мг, выход: 21%).
ВЭЖХ-МС: [М+Н]+ = 421,0
1Н-ЯМР (400 МГц, ДМСО-d6) δ 8,88 (синглет, 1H), 8,22-8,16 (мультиплет, 2Н), 7,78 (дублет, J=2,0 Гц, 1H), 7,43 (дублет, J=1,6 Гц, 1H), 5,21-5,17 (мультиплет, 1H), 5,08 (синглет, 2Н), 2,95 (синглет, 1H), 2,65-2,63 (мультиплет, 2Н), 1,40 (дублет, J=6,0 Гц, 3Н).
Пример 24: получение соединения 04055
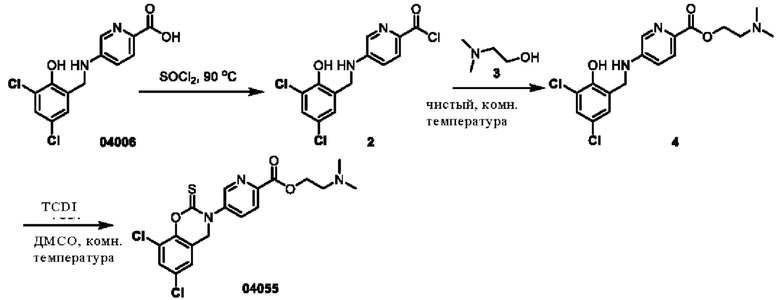
Этап 1. Соединение 4
Соединение 04006 (1,5 г, 4,8 ммоль) растворяли в тионилхлориде (15 мл), и после перемешивания при 90°С в течение 2 часов, тионилхлорид выпаривали под вакуумом для удаления с получением соединения 2 черного цвета (неочищенный продукт). Вышеуказанное соединение 2 добавляли к соединению 3 (10 мл) при 0°С и перемешивали реакционный раствор при 25°С в течение 3 часов. Смесь концентрировали при пониженном давлении и очищали остаток с помощью хроматографии на колонке с силикагелем (элюент: дихлорметан/метанол = 10/1) с получением соединения 4 (твердое вещество коричневого цвета, 2,1 г, выход: 100%).
ВЭЖХ-МС: [М+Н]+ = 384,2.
Этап 2. Соединение 04055
Соединение 4 (700 мг, 1,82 ммоль) растворяли в диметилсульфоксиде (20 мл), добавляли TCDI (649 мг, 3,64 ммоль) и перемешивали при 25°С в течение 3 часов в защитной атмосфере азота. Реакционный раствор разбавляли этилацетатом (200 мл) и промывали насыщенным раствором натрия хлорида (трижды по 50 мл), органическую фазу высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении, остаток очищали с помощью препаративной жидкостной хроматографии с получением соединения 04055 (67,1 мг, выход: 8,6%).
ВЭЖХ-МС: [М+Н]+ = 426,0, [М+Н+2]+ = 428,0
1H-ЯМР (400 МГц, ДМСО-d6) δ 8,88 (синглет, 1H), 8,27-8,07 (мультиплет, 2Н), 7,78 (дублет, J=2,4 Гц, 1H), 7,44 (синглет, 1Н), 5,02 (синглет, 2Н), 4,42 (триплет, J=5,6 Гц, 2Н), 2,66 (триплет, J=5,6 Гц, 2Н), 2,24 (синглет, 6Н).
Пример 25: получение соединения 04169 и соединения 04069
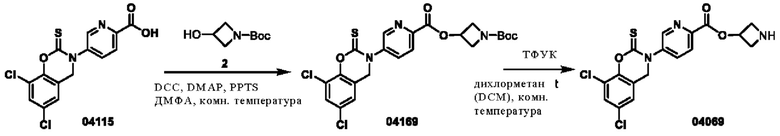
Этап 1. Соединение 04169
Соединение 04115 (2,09 г, 5,9 ммоль) растворяли в диметилформамиде (100 мл), затем добавляли DCC (1,8 г, 8,9 ммоль), DMAP (2,16 г, 17,7 ммоль), PPTS (4,4 г, 17,7 ммоль) и соединение 2 (5,0 г, 29,4 ммоль), и реакционный раствор перемешивали при 50°С в течение 4 часов. После добавления этилацетата (100 мл) к реакционному раствору выпадал осадок твердого вещества. Раствор фильтровали, а фильтрат промывали водой. Отделенную органическую фазу концентрировали при пониженном давлении и очищали остаток с помощью хроматографии на колонке с силикагелем (петролейный эфир/этилацетат = 100/1) с получением соединения 04169 (твердое вещество желтого цвета, 1,6 г, выход: 53%).
ВЭЖХ-МС: [М+Н]+ = 510,0.
Этап 2. Соединение 04069
Соединение 04169 (1,0 мг, 1,96 ммоль) растворяли в дихлорметане (6 мл), затем добавляли трифторуксусную кислоту (3 мл) и проводили реакцию при 25°С в течение 1 часа. Смесь концентрировали при пониженном давлении и очищали остаток с помощью препаративной жидкостной хроматографии для получения соединения 04069 (твердое вещество желтого цвета, 420,6 мг, выход 48%).
ВЭЖХ-МС: [М+Н]+ = 410,0
1H-ЯМР (400 МГц, CD3OD) δ 8,89 (дублет, J=2,4 Гц, 1H), 8,36 (дублет, J=8,4 Гц, 1H), 8,18 (двойной дублет, J=8,4, 2,4 Гц, 1H), 7,58 (дублет, J=2,4 Гц, 1Н), 7,30 (дублет, J=2,4 Гц, 1Н), 5,63-5,60 (мультиплет, 1Н), 5,00 (синглет, 2Н), 4,57-4,52 (мультиплет, 2Н), 4,37-4,32 (мультиплет, 2Н).
Пример 26: получение соединения 04007
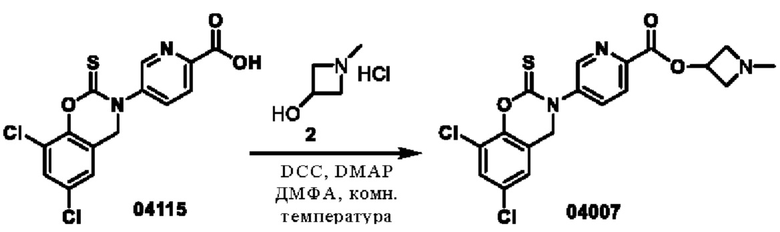
Этап 1. Соединение 04007
Соединение 04115 (2 г, 5,6 ммоль) растворяли в диметилформамиде (20 мл), затем добавляли DCC (1,7 г, 8,5 ммоль), DMAP (68 мг, 0,56 ммоль) и соединение 2 (1,0 г, 8,5 ммоль) и перемешивали в течение 3 часов при 25°С. После добавления этилацетата (100 мл) к реакционному раствору выпадал осадок твердого вещества. Раствор фильтровали, а фильтрат промывали водой. Органическую фазу концентрировали при пониженном давлении, остаток очищали с помощью хроматографии на колонке с силикагелем (дихлорметан/метанол = 100/1) с получением соединения 04007 (500 мг, выход: 21%) в виде твердого вещества желтого цвета.
ВЭЖХ-МС: [М+Н]+ = 424,0.
1Н-ЯМР (400 МГц, ДМСО-d6) δ 8,89 (дублет, J=1,6 Гц, 1Н), 8,25-8,19 (мультиплет, 2Н), 7,78 (дублет, J=2,4 Гц, 1H), 7,44 (дублет, J=2,4 Гц, 1H), 5,21-5,15 (мультиплет, 1H), 5,02 (синглет, 2Н), 3,72-3,68 (мультиплет, 2Н), 3,15-3,12 (мультиплет, 2Н), 2,30 (синглет, 3Н).
Пример 27: получение соединения 04047
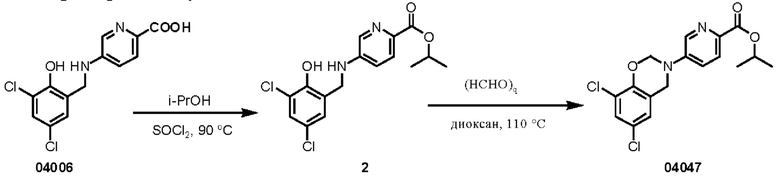
Этап 1. Соединение 2
Соединение 04006 (200 мг, 0,64 ммоль) растворяли в тионилхлориде (3 мл), нагревали до 90°С, перемешивали в течение 1 часа, охлаждали до 0°С, к реакционному раствору добавляли изопропанол (10 мл), нагревали до 25°С и перемешивали в течение 30 минут. После выпаривания досуха реакционного раствора при пониженном давлении добавляли дихлорметан (50 мл). Полученный раствор последовательно промывали насыщенным раствором натрия бикарбоната (трижды по 50 мл), водой (дважды по 50 мл) и насыщенным раствором натрия хлорида (дважды по 50 мл). Органическую фазу высушивали над безводным натрия сульфатом и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: дихлорметан/метанол = 10/1) с получением соединения 2 (твердое вещество коричневого цвета, 260 мг, выход: 100%).
ВЭЖХ-МС: [М+Н]+ = 355,1.
Этап 2. Соединение 04047
Соединение 2 (100 мг, 0,28 ммоль) растворяли в 1,4-диоксане (3 мл), добавляли параформальдегид (CAS: 30525-89-4, 25 мг, 0,845 ммоль), нагревали реакционный раствор 110°С и перемешивали в течение 16 часов. Смесь концентрировали при пониженном давлении и очищали остаток с помощью препаративной жидкостной хроматографии для получения соединения 04047 (твердое вещество желтого цвета, 51,1 мг, выход 50%).
ВЭЖХ-МС: [М+Н]+ = 367,1
1Н-ЯМР (400 МГц, CDCl3) δ 8,57 (дублет, J=2,5 Гц, 1Н), 8,04 (дублет, J=8,6 Гц, 1H), 7,44 (двойной дублет, J=8,7, 2,7 Гц, 1H), 7,24 (дублет, J=2,3 Гц, 1H), 6,96 (дублет, J=2,1 Гц, 1H), 5,49 (синглет, 2Н), 5,34-5,28 (мультиплет, 1H), 4,69 (синглет, 2Н), 1,40 (дублет, J=6,3 Гц, 6Н).
Пример 28: получение соединения 04051
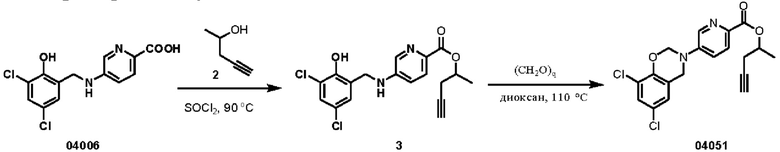
Этап 1. Соединение 3
Соединение 04006 (1,5 г, 4,8 ммоль) растворяли в тионилхлориде (15 мл), нагревали до 90°С и перемешивали в течение 2 часов. После концентрирования реакционного раствора при пониженном давлении добавляли соединение 2 (3 мл), и полученный раствор перемешивали при температуре 25°С в течение 5 часов. Смесь концентрировали при пониженном давлении и очищали остаток с помощью препаративной жидкостной хроматографии для получения соединения 3 (твердое вещество желтого цвета, 590 мг, выход 32%).
ВЭЖХ-МС: [М+Н]+ = 379,1
Этап 2. Соединение 04051
Соединение 3 (110 мг, 0,29 ммоль) растворяли в 1,4-диоксане (3 мл), добавляли параформальдегиде (CAS: 30525-89-4, 79 мг, 0,87 ммоль), нагревали реакционный раствор 110°С и перемешивали в течение 3 часов в защитной атмосфере азота. Смесь концентрировали при пониженном давлении и очищали остаток с помощью хроматографии на колонке с силикагелем (элюент - петролейный эфир/этилацетат = 1/1) с получением соединения 04051 (твердое вещество розового цвета, 27,3 мг, выход: 24%).
ВЭЖХ-МС: [М+Н]+ = 391,0
1Н-ЯМР (400 МГц, CDCl3) δ 8,57 (дублет, J=2,0 Гц, 1H), 8,05 (дублет, J=8,8 Гц, 1H), 7,44 (двойной дублет, J=8,8, 2,4 Гц, 1Н), 7,25 (синглет, 1H), 6,97 (синглет, 1Н), 5,50 (синглет, 2Н), 5,33-5,27 (мультиплет, 1H), 4,70 (синглет, 2Н), 2,69-2,55 (мультиплет, 2Н), 2,02 (синглет, 1H), 1,49 (дублет, J=6,0 Гц, 3Н).
Пример 29: получение соединения 04038
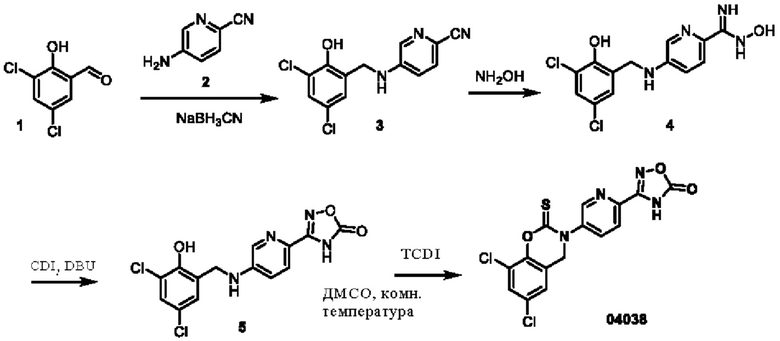
Этап 1. Соединение 3
К раствору соединения 2 (0,60 г, 5,1 ммоль) и соединения 1 (1,0 г, 5,2 ммоль) в метаноле (10 мл) добавляли уксусную кислоту ледяную (1 мл), перемешивали при 25°С в течение 2 часов, затем добавляли натрия цианоборогидрид (1,0 г, 15,7 ммоль) и продолжали перемешивать в течение 1 часа. Смесь концентрировали при пониженном давлении и очищали остаток с помощью хроматографии на колонке с силикагелем для получения соединения 3 (600 мг, выход: 39,5%).
МС (ИЭР): расчет для C13H9Cl2N3O 293; факт, значение 294 [М+Н]+.
Этап 2. Соединение 4
Гидроксиламина гидрохлорид (47 мг, 1,4 ммоль) и натрия бикарбонат (114 мг, 1,4 ммоль) добавляли к смешанному раствору соединения 3 (0,20 г, 0,68 ммоль) в этаноле (6 мл) и воде (3 мл), реакционную систему нагревали до 80°С и перемешивали в течение 2 часов. Реакционный раствор охлаждали до 25°С, концентрировали при пониженном давлении, добавляли воду (10 мл), перемешивали при 25°С в течение 30 минут, экстрагировали дихлорметаном, высушивали над безводным натрия сульфатом и концентрировали при пониженном давлении с получением соединения 4 (166 мг, выход: 74,9%) в виде твердого вещества белого цвета.
МС (ИЭР): расчет для C13H12Cl2N4O2 326; факт, значение 327 [М+Н]+.
Этап 3. Соединение 5
CDI (129 мг, 0,80 ммоль) и диазабициклоундецен (DBU, 122 мг, 0,80 ммоль) добавляли к раствору соединения 4 (0,13 г, 0,40 ммоль) в диметилсульфоксиде (6 мл). Реакционную систему перемешивали при 25°С в течение 60 минут, разбавляли водой (50 мл), корректировали рН до 3 с использованием 1 н. раствора HCl, экстрагировали этилацетатом, высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении, а остаток очищали с помощью препаративной хроматографии для получения соединения 5 (52 мг, выход: 36,9%) в виде вещества белого цвета.
МС (ИЭР): расчет для C14H10CI2N4O3 352; факт, значение 353 [М+Н]+.
1Н-ЯМР (400 МГц, ДМСО-dd): δ 12,70 (синглет, 1H), 9,86 (синглет, 1H), 8,12-8,07 (дублет, J=2,0 Гц, 1H), 7,73-7,66 (дублет, J=8,8 Гц, 1H), 7,46-7,42 (дублет, J=2,0 Гц, 1H), 7,24-7,16 (мультиплет, 2Н), 7,06-7,01 (двойной дублет, J=2,0 Гц, 8,8 Гц, 1H), 4,42-4,34 (дублет, J=5,6 Гц, 2Н).
Этап 4. Соединение 04038
Соединение 5 (584 мг, 1,66 ммоль) растворяли в диметилсульфоксиде (5 мл) и медленно добавляли TCDI (295 мг, 1,66 ммоль). Реакционную систему перемешивали при 25°С в течение 1 часа, экстрагировали этилацетатом, промывали насыщенным раствором натрия хлорида и сушили над безводным натрия сульфатом. Смесь концентрировали при пониженном давлении и очищали остаток с помощью препаративной жидкостной хроматографии для получения соединения 04038 (твердое вещество белого цвета, 299,3 мг, выход 45,8%).
ВЭЖХ-МС: [М+Н]+ = 394,97.
1Н-ЯМР (400 МГц, ДМСО-d6): δ 13,03 (синглет, 1H), 8,92 (дублет, J=1,2 Гц, 1Н), 8,13-8,22 (мультиплет, 2Н), 7,78 (дублет, J=2,4 Гц, 1Н), 7,44 (дублет, J=2,4 Гц, 1H), 5,04 (синглет, 2Н).
Пример 30: получение соединения 04039
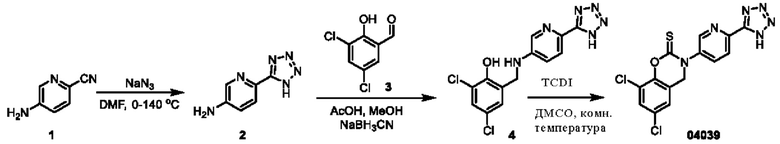
Этап 1. Соединение 2
На ледяной бане к раствору соединения 1 (1,0 г, 8,4 ммоль) в диметилформамиде (15 мл) порциями добавляли натрия азид (4,4 г, 67,7 ммоль), после чего реакционную систему нагревали до 140°С и проводили реакцию в течение 40 часов. Реакционную смесь охлаждали до 25°С, фильтровали, рН фильтрата регулировали приблизительно до 6 насыщенным водным раствором натрия бикарбоната, экстрагировали этилацетатом, высушивали над безводным натрия сульфатом, фильтровали и концентрировали при пониженном давлении с получением соединения 2 (0,30 г, выход: 22,0%) в виде твердого вещества желтого цвета.
МС (ИЭР): расчет для C6H6N6 162; факт, значение 163 [М+Н]+.
Этап 2. Соединение 4
К раствору соединения 2 (100 мг, 0,62 ммоль) и соединения 3 (120 мг, 0,63 ммоль) в метаноле (10 мл) добавляли уксусную кислоту ледяную (4 капли), перемешивали при 25°С в течение 2 часов в защитной атмосфере азота, затем добавляли натрия цианоборогидрид (101 мг, 1,57 ммоль), продолжали перемешивание реакционной смеси в течение 1 часа, а затем концентрировали при пониженном давлении. Остаток очищали с помощью препаративной хроматографии с получением соединения 4 (27,66 мг, выход: 13,3%) в виде вещества белого цвета.
МС (ИЭР): расчет для C13H10Cl2N6O 336; факт, значение 337 [М+Н]+.
1Н-ЯМР (400 МГц, CD3OD): δ 8,12 (синглет, 1H), 7,94-7,88 (дублет, J=8,4 Гц, 1H), 7,28-7,25 (дублет, J=2,0 Гц, 1H), 7,19-7,16 (дублет, J=2,0 Гц, 1H), 7,09-7,04 (двойной дублет, J=2,0 Гц, 8,4 Гц, 1Н), 4,45 (синглет, 2Н).
Этап 3. Соединение 04039
Соединение 4 (168 мг, 0,5 ммоль) растворяли в диметилсульфоксиде (2 мл), добавляли TCDI (178 мг, 1,0 ммоль) и перемешивали реакционный раствор при 25°С в течение 1 часа. Смесь концентрировали при пониженном давлении и очищали остаток с помощью препаративной жидкостной хроматографии для получения соединения 04039 (твердое вещество белого цвета, 1,2 мг, выход 0,6%). ВЭЖХ-МС: [М+Н]+ = 379,1
1Н-ЯМР (400 МГц, ДМСО-d6): δ 9,87 (синглет, 1Н), 8,74 (синглет, 1H), 8,25 (дублет, J=7,6 Гц, 1H), 8,05 (синглет, 1H), 7,42 (синглет, 1H), 7,18 (синглет, 1Н), 4,94 (синглет, 2Н).
Пример 31: получение соединения 04040
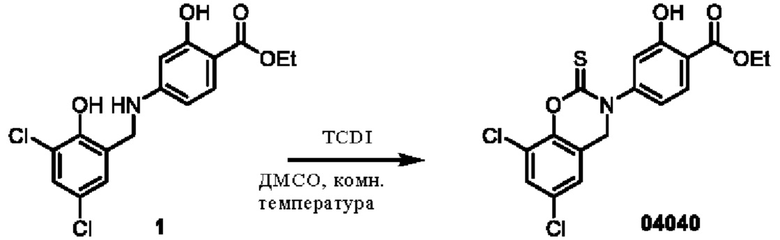
Этап 1. Соединение 04040
Соединение 1 (176 мг, 0,5 ммоль) растворяли в диметилсульфоксиде (2 мл), добавляли TCDI (106 мг, 0,59 ммоль) и перемешивали при 25°С в течение 3 часа. Реакционный раствор переливали в воду (50 мл), экстрагировали этилацетатом (трижды по 10 мл), органическую фазу высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении, остаток очищали с помощью препаративной жидкостной хроматографии с получением соединения 04040 (твердое вещество белого цвета, 76,9 мг, выход: 39,1%).
ВЭЖХ-МС: [М+Н]+ = 398,0
1Н-ЯМР (400 МГц, CDCl3) δ 11,05 (br, 1H), 7,98 (дублет, J=8,0 Гц, 1Н), 7,44 (синглет, 1H), 7,03 (синглет, 1H), 6,98 (синглет, 1H), 6,95 (дублет, J=12,0 Гц, 1H), 4,77 (синглет, 2Н), 4,44 (квадруплет, J=8,0 Гц, 2Н), 1,43 (триплет, J=4,0 Гц, 3Н).
Пример 32: получение соединения 04042
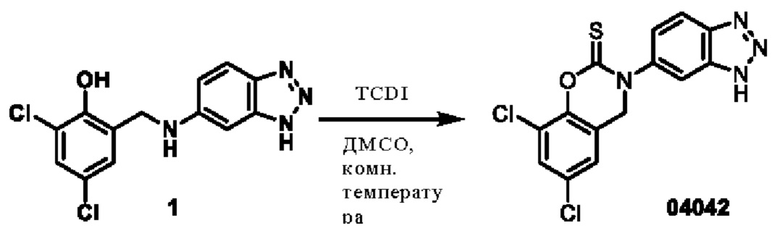
Этап 1. Соединение 04042
Соединение 1 (200 мг, 0,65 ммоль) растворяли в диметилсульфоксиде (2 мл), добавляли TCDI (139 мг, 0,78 ммоль) и перемешивали при 25°С в течение 1 часа. Реакционный раствор переливали в воду (100 мл), экстрагировали этилацетатом (трижды по 50 мл), органическую фазу высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении и очищали остаток с помощью хроматографии на колонке с силикагелем (элюент - этилацетат/петролейный эфир = 3/1) с получением соединения 04042 (твердое вещество белого цвета, 24,5 мг, выход: 12%).
ВЭЖХ-МС: [М+Н]+ = 351,0.
1H-ЯМР (400 МГц, CDCl3) δ 7,97 (дублет, J=8,4 Гц, 1H), 7,94 (синглет, 1H), 7,51 (дублет, J=8,8 Гц, 1H), 7,46 (дублет, J=2,0 Гц, 1H), 7,05 (синглет, 1H), 4,89 (синглет, 2Н).
Пример 33: получение соединения 04041
Этап 1. Соединение 2
Соединение 1 (7,6 г, 50 ммоль) растворяли в N,N-диметилформамиде (100 мл) и добавляли йодметан (21,3 г, 150 ммоль). После охлаждения реакционной системы до 0°С медленно порциями добавляли натрия гидрид (60%, 6 г, 150 ммоль), перемешивали в течение 1 часа и добавляли воду (20 мл) для гашения реакции. Полученный выше раствор экстрагировали этилацетатом (трижды по 200 мл), органическую фазу последовательно промывали водой (дважды по 200 мл) и насыщенным раствором натрия хлорида (200 мл), высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении и получали соединение 2 (маслянистая жидкость желтого цвета, 9,0 г, выход: 99%).
ВЭЖХ-МС: [М+Н]+ = 181,2
Этап 2. Соединение 3
Соединение 2 (9,0 г, 50 ммоль) растворяли в тетрахлорметане (100 мл), добавляли N-бромсукцинимид (NBS) (26,7 г, 150 ммоль) и азобисизобутиронитрил (AIBN) (1,64 г, 10 ммоль). Реакционную систему нагревали до 80°С и перемешивали в течение 16 часов, а реакционный раствор непосредственно использовали для следующей реакции.
ВЭЖХ-МС: [М+Н]+ = 339,0.
Этап 3. Соединение 4
AgNO3 (25,5 г, 150 ммоль) и воду (10 мл) добавляли к реакционному раствору, полученному на этапе 2, и перемешивали при 25°С в течение 1 часа. Реакционный раствор фильтровали, фильтрат разбавляли водой (300 мл), а затем экстрагировали этилацетатом (трижды по 200 мл). Органическую фазу последовательно промывали водой (дважды по 200 мл) и насыщенным раствором натрия хлорида (200 мл), затем высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении и очищали остаток с помощью хроматографии на колонке с силикагелем (элюент: петролейный эфир/дихлорметан = 1/100) с получением соединения 4 (маслянистая жидкость красного цвета, 6,0 г, выход: 62%).
ВЭЖХ-МС: [М+Н]+ = 195,1.
Этап 4. Соединение 6
Соединение 4 (5,82 г, 30 ммоль) растворяли в дихлорэтане (ДХЭ) (100 мл), добавляли соединение 5 (5,31 г, 30 ммоль), NaBH(OAc)3 (15,9 г, 75 ммоль), уксусную кислоту (10 мл) и перемешивали при 25°С в течение 3 часов. Реакционный раствор фильтровали и концентрировали для получения соединения 6 (твердое вещество серого цвета, 5,5 г, выход: 52%).
ВЭЖХ-МС: [М+Н]+ = 356,1.
Этап 5. Соединение 7
Соединение 6 (1,07 г, 3,0 ммоль) растворяли в дихлорметане (10 мл), добавляли ВВгз (3,76 г, 15,0 ммоль), и реакционный раствор перемешивали при 25°С в течение 2 часов. Реакционный раствор концентрировали и очищали с помощью хроматографии на колонке с силикагелем (элюент: дихлорметан/метанол = 4/1) с получением соединения 7 (твердое вещество коричневогоо цвета, 500 мг, выход: 51%).
ВЭЖХ-МС: [М+Н]+ = 328,0.
Этап 6. Соединение 8
Соединение 7 (164 мг, 0,5 ммоль) растворяли в этаноле (3 мл), добавляли тионилхлорид (590 мг, 5,0 ммоль), и перемешивали реакционный раствор при 70°С в течение 16 часов. Смесь концентрировали при пониженном давлении и очищали остаток с помощью хроматографии на колонке с силикагелем (элюент - петролейный эфир/этилацетат = 5/1) с получением соединения 8 (твердое вещество желтого цвета, 70 мг, выход: 40%).
ВЭЖХ-МС: [М+Н]+ = 356,1.
Этап 7. Соединение 04041
Соединение 8 (71,0 мг, 0,2 ммоль) растворяли в диметилсульфоксиде (2 мл), добавляли TCDI (71,2 мг, 0,4 ммоль) и перемешивали при 25°С в течение 1 часа. Реакционный раствор разбавляли водой (50 мл), затем экстрагировали этилацетатом (трижды по 50 мл), органическую фазу промывали насыщенным раствором натрия хлорида (100 мл), высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении, остаток очищали с помощью хроматографии на колонке с силикагелем (элюент: петролейный эфир/этилацетат = 5/1) с получением соединения 04041 (твердое вещество беловатого цвета, 10,2 мг, выход: 13%).
ВЭЖХ-МС: [М-Н]+ = 397,9.
1Н-ЯМР (400 МГц, ДМСО-d6): δ 10,57 (синглет, 1Н), 7,75 (дублет, J=8,1 Гц, 1Н), 7,64 (синглет, 2Н), 6,98 (синглет, 1H), 6,94 (дублет, J=8,2 Гц, 1H), 5,44 (синглет, 2Н), 4,34 (квадруплет, J=7,1 Гц, 2Н), 1,31 (триплет, J=7,1 Гц, 3Н).
Пример 34: получение соединения 04075
Этап 1. Соединение 6
Соединение 5 (6 г, 18,4 ммоль, 1,0 экв.) растворяли в диметилсульфоксиде (60 мл), затем добавляли TCDI (6,6 г, 36,8 ммоль, 2,0 экв.) и перемешивали при 25°С в течение 1 часа. Реакционный раствор разбавляли этилацетатом и последовательно промывали водой и насыщенным раствором натрия хлорида. Объединенную органическую фазу высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении и очищали остаток с помощью колоночной хроматографии (дихлорметан/метанол = 4/1) для получения соединения 6 (1,2 г, 17%) в виде твердого вещества коричневого цвета.
ВЭЖХ-МС: [М-Н]- = 368,0
Этап 2. Соединение 04075 Соединение 6 (300 мг, 0,81 ммоль, 1,0 экв.) растворяли в диметилформамиде (6 мл), затем добавляли соединение 7 (503 мг, 4,1 ммоль, 5,0 экв.), DCC (252 мг, 1,2 ммоль, 1,5 экв.), DMAP (300 мг, 2,4 ммоль, 3,0 экв.) и PPTS (600 мг, 2,4 ммоль, 3,0 экв.). Реакционный раствор перемешивали при 50°С в течение 4 часов, охлаждали до 25°С, затем разбавляли этилацетатом и перемешивали в течение 0,5 ч. Реакционный раствор фильтровали, фильтрат промывали водой, промывали насыщенным раствором натрия хлорида, высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении и очищали остаток с помощью колоночной хроматографии (дихлорметан/метанол = 5/1) для получения соединения 04075 (15 мг, 4%) в виде твердого вещества белого цвета.
ВЭЖХ-МС: [М-Н]- = 437,0
1Н-ЯМР (400 МГц, ДМСО-d6) δ 7,77 (дублет, J=8,0 Гц, 1Н), 7,62 (синглет, 2Н), 6,95-6,93 (мультиплет, 2Н), 5,43 (синглет, 2Н), 5,15-5,08 (мультиплет, 1H), 3,71-3,63 (мультиплет, 2Н), 3,17-3,10 (мультиплет, 2Н), 2,29 (синглет, 3Н).
Пример 35: получение соединения 04077
Этап 1. Соединение 04077
Соединение 04015 (120 мг, 0,337 ммоль, 1,0 экв.) растворяли в диметилформамиде (9 мл), затем добавляли соединение 2 (87 мг, 0,507 ммоль, 1,5 экв.) и цезия карбонат (220 мг, 0,675 ммоль, 2,0 экв.) и перемешивали при 60°С в течение 1 часа. После охлаждения до 25°С реакционный раствор разбавляли этилацетатом (30 мл), затем последовательно промывали водой и насыщенным раствором натрия хлорида, органическую фазу высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении, а остаток очищали с помощью препаративной ВЭЖХ (0,1% муравьиная кислота/ацетонитрил/вода) для получения соединения 04077 (30,5 мг, 22%) в виде твердого вещества белого цвета.
ВЭЖХ-МС: [М+Н]+ = 398,9
1Н-ЯМР (400 МГц, ДМСО-d6) δ 8,86-8,85 (мультиплет, 1Н), 8,22 (двойной дублет, J=8,4, 0,8 Гц, 1H), 8,15 (двойной дублет, J=8,4, 2,4 Гц, 1Н), 7,75 (дублет, J=2,4 Гц, 1H), 7,41 (дублет, J=2,4 Гц, 1H), 4,99 (синглет, 2Н), 4,93 (триплет, J=5,6 Гц, 1Н), 4,32 (триплет, J=4,8 Гц, 2Н), 3,71-3,69 (мультиплет, 2Н).
Пример 36: получение соединения 04089
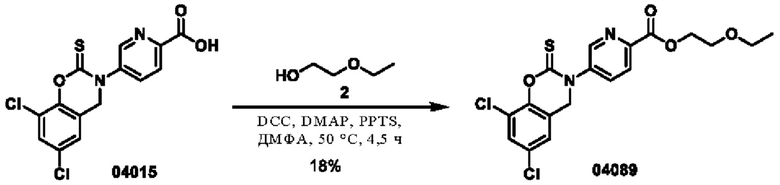
Этап 1. Соединение 04089
Соединение 04015 (1,5 г, 4,22 ммоль, 1,0 экв.) растворяли в диметилформамиде (диметилформамид, 90 мл), затем последовательно добавляли DCC (1,3 г, 6,33 ммоль, 1,5 экв.), DMAP (1,55 г, 12,67 ммоль, 3,0 экв.), PPTS (3,18 г, 12,67 ммоль, 3,0 экв.) и соединение 2 (1,91 г, 21,11 ммоль, 5,0 экв.), нагревали до 50°С и перемешивали в течение 4,5 часов. Реакционный раствор охлаждали до 25°С, добавляли этилацетат (60 мл) и перемешивали в течение 0,5 ч. Реакционный раствор фильтровали, фильтрат последовательно промывали водой и насыщенным раствором натрия хлорида, органическую фазу высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении, остаток очищали с помощью хроматографии на колонке с силикагелем (петролейный эфир/этилацетат = 2:1) с получением соединения 04078 (333 мг, 18%).
ВЭЖХ-МС: [М+Н]+ = 427,0
1H-ЯМР (400 МГц, ДМСО-d6) δ 8,88 (двойной дублет, J=2,4, 0,8 Гц, 1Н), 8,22-8,18 (мультиплет, 2Н), 7,77 (дублет, J=2,4 Гц, 1Н), 7,43 (дублет, J=2,4 Гц, 1Н), 5,01 (синглет, 2Н), 4,47-4,38 (мультиплет, 2Н), 3,74-3,67 (мультиплет, 2Н), 3,50 (квадруплет, J=6,8 Гц, 2Н), 1,11 (триплет, J=7,2 Гц, 3Н).
Пример 37: получение соединения 04081
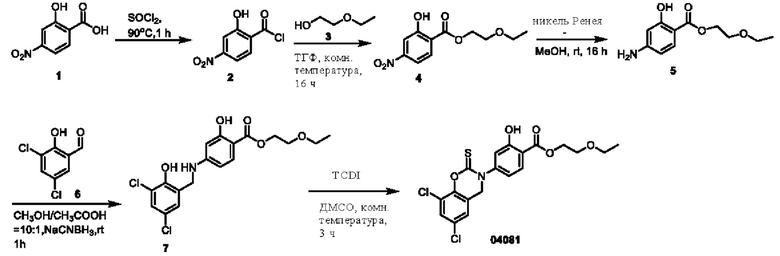
Этап 1. Соединение 2
Соединение 1 (8,0 г, 43,7 ммоль, 1,0 экв.) добавляли к тионилхлориду (30 мл), нагревали до 90°С и перемешивали в течение 1 часа. Реакционный раствор охлаждали до 25°С и концентрировали при пониженном давлении для получения соединения 2 (10 г, 100%), которое непосредственно использовали для следующей реакции без очистки.
Этап 2. Соединение 4
Соединение 2 (10 г, 43,7 ммоль, 1,0 экв.) растворяли в тетрагидрофуране (60 мл), добавляли соединение 3 (20 мл) и перемешивали при 25°С в течение 16 часов. Реакционный раствор концентрировали при пониженном давлении и очищали остаток с помощью хроматографии на колонке с силикагелем (петролейный эфир/этилацетат = 4/1) с получением соединения 4 (12,5 г, 100%).
ВЭЖХ-МС: [М-Н]- = 254,0
Этап 3. Соединение 5
Соединение 4 (12 г, 43,7 ммоль, 1,0 экв.) растворяли в метаноле (150 мл), добавляли никель Ренея (1,0 г) и перемешивали реакционную смесь при 25°С в течение 16 часов в атмосфере водорода под давлением 1 атм. Реакционный раствор фильтровали, фильтрат концентрировали при пониженном давлении и очищали остаток с помощью хроматографии на колонке с силикагелем (петролейный эфир/этилацетат = 2/1) с получением соединения 4 (8,0 г, 81%).
ВЭЖХ-МС: [М+Н]+ = 226,1
Этап 4. Соединение 7
Соединение 5 (7,5 г, 33,3 ммоль, 1,0 экв.) растворяли в смешанном растворителе метанол/уксусная кислота (10:1, 400 мл), добавляли соединение 6 (7,5 г, 39,3 ммоль, 1,18 экв.). Реакционный раствор перемешивали при 25°С в течение 30 минут, затем добавляли натрия цианоборогидрид (8,37 г, 133,2 ммоль, 4,0 экв.) и продолжали перемешивать в течение 0,5 ч. Реакционный раствор концентрировали, к остатку добавляли этилацетат (800 мл) и воду (100 мл), и корректировали рН до 7-8 с помощью насыщенного водного раствора натрия бикарбоната. Органическую фазу высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении и очищали остаток с помощью хроматографии на колонке из силикагеля (петролейный эфир/этилацетат = 1/1) для получения соединения 7 (12 г, 90%) в виде маслянистой жидкости коричневого цвета.
ВЭЖХ-МС: [М+Н]+ = 400,1
Этап 5. Соединение 04081
Соединение 7 (4 г, 10,0 ммоль, 1,0 экв.) растворяли в диметилсульфоксиде (40 мл), затем добавляли TCDI (1,87 г, 10,49 ммоль, 1,05 экв.) и перемешивали при 25°С в течение 2 часов. Реакционный раствор разбавляли этилацетатом (500 мл) и трижды промывали насыщенным раствором натрия хлорида. Органическую фазу высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении и очищали остаток с помощью хроматографии на колонке из силикагеля (петролейный эфир/этилацетат = 20/1) для получения соединения 04081 (815,6 мг, 18,4%).
ВЭЖХ-МС: [М+Н]+ = 441,9
1H-ЯМР (400 МГц, CDCl3) δ 10,90 (синглет, 1Н), 8,01 (дублет, J=8,8 Гц, 1Н), 7,44 (дублет, J=2,4 Гц, 1H), 7,04-7,01 (мультиплет, 1H), 6,98 (дублет, J=2,0 Гц, 1H), 6,96-6,93 (мультиплет, 1Н), 4,76 (синглет, 2Н), 4,53-4,51 (мультиплет, 2Н), 3,78-3,76 (мультиплет, 2Н), 3,58 (квадруплет, J=6,8 Гц, 2Н), 1,23 (триплет, J=6,8 Гц, 3Н).
Пример 38: получение соединения 04080
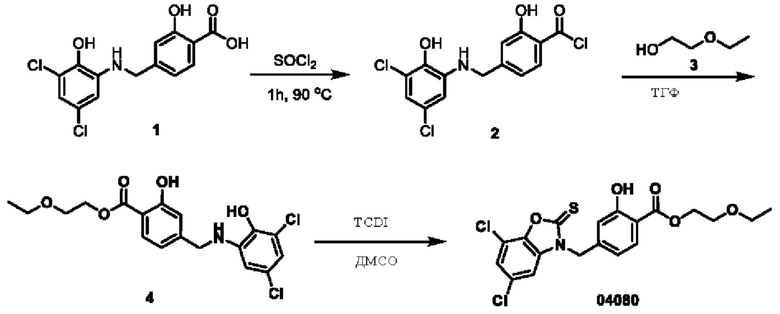
Этап 1. Соединение 2
Соединение 1 (8,5 г, 26,0 ммоль, 1,0 экв.) добавляли к тионилхлориду (20 мл), нагревали до 90°С и перемешивали в течение 1 ч при 90°С.Реакционный раствор охлаждали до 25°С и концентрировали при пониженном давлении для получения соединения 2 (10 г, 100%) в виде маслянистого вещества коричневого цвета, которое непосредственно использовали для следующей реакции без очистки.
Этап 2. Соединение 4
Соединение 2 (10 г, 26,0 ммоль, 1,0 экв.) растворяли в тетрагидрофуране (60 мл), добавляли соединение 3 (20 мл) и перемешивали при 25°С в течение 16 часов.
Реакционный раствор концентрировали, разбавляли этилацетатом (500 мл), затем корректировали значение рН до 7 8 с помощью водного раствора натрия карбоната и экстрагировали водную фазу этилацетатом. Объединенную органическую фазу высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении и очищали остаток с помощью хроматографии на колонке из силикагеля (петролейный эфир/этилацетат = 4/1) для получения соединения 4 (4 г, 38%) в виде маслянистой жидкости коричневого цвета.
ВЭЖХ-МС: [М+Н]+ = 400,0
Этап 3. Соединение 04080
Соединение 4 (4 г, 10,0 ммоль, 1,0 экв.) растворяли в диметилсульфоксиде (25 мл), затем добавляли TCDI (2,1 г, 12,0 ммоль, 1,2 экв.) и перемешивали при 25°С в течение 1 часа. Добавляли этилацетат (100 мл) и насыщенный водный раствор натрия карбоната (100 мл) и продолжали перемешивать смесь в течение 1 часа. Раствор разделяли, органическую фазу промывали три раза насыщенным раствором натрия хлорида, а затем высушивали над безводным натрия сульфатом. Смесь концентрировали при пониженном давлении и очищали остаток с помощью хроматографии на колонке с силикагелем (петролейный эфир/этилацетат = 20/1) с получением соединения 04080 (1,0734 г, 24%).
ВЭЖХ-МС: [М-Н]- = 440,0
1Н-ЯМР (400 МГц, ДМСО-d6) δ 10,48 (синглет, 1Н), 7,75 (дублет, J=8,0 Гц, 1Н), 7,66-7,61 (мультиплет, 2Н), 6,99 (синглет, 1H), 6,95 (дублет, J=8,0 Гц, 1Н), 5,44 (синглет, 2Н), 4,44-4,37 (мультиплет, 2Н), 3,69-3,67 (мультиплет, 2Н), 3,48 (квадруплет, J=6,8 Гц, 2Н), 1,10 (триплет, J=6,8 Гц, 3Н).
Пример 39: получение соединения 04096
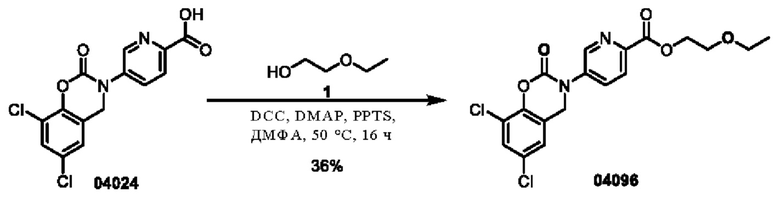
Этап 1. Соединение 04096
Соединение 04024 (1,1 г, 3,2 ммоль, 1,0 экв.) растворяют в диметилформамиде (20 мл), добавляют DMAP (1,19 г, 9,73 ммоль, 3,0 экв.), DCC (1,0 г, 4,87 ммоль, 1,5 экв.), PPTS (5,01 г, 9,73 ммоль, 3,0 экв.) и соединение 1 (1,46 г, 16,22 ммоль, 5,0 экв.), нагревают до 50°С и перемешивают в течение 4,5 часов. Реакционный раствор охлаждали до 25°С, добавляли этилацетат (80 мл), перемешивали в течение 0,5 ч, фильтровали, фильтрат промывали водой (трижды по 20 мл), промывали насыщенным раствором натрия хлорида (20 мл), органическую фазу высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении, остаток очищали с помощью хроматографии на колонке с силикагелем (петролейный эфир/этилацетат = 1/1) с получением соединения 04096 (485,8 мг, 36%) в виде твердого вещества белого цвета.
ВЭЖХ-МС: [М+Н]+ = 411,0
1Н-ЯМР (400 МГц, ДМСО-d6) δ 8,85 (дублет, J=2,0 Гц, 1H), 8,16-8,14 (мультиплет, 1H), 8,10-8,07 (мультиплет, 1Н), 7,72 (дублет, J=2,4 Гц, 1H), 7,43 (дублет, J=2,4 Гц, 1H), 5,04 (синглет, 2Н), 4,43-4,41 (мультиплет, 2Н), 3,71-3,68 (мультиплет, 2Н), 3,49 (квадруплет, J=6,8 Гц, 2Н), 1,10 (триплет, J=6,8 Гц, 3Н).
Пример 40: получение соединения 04097
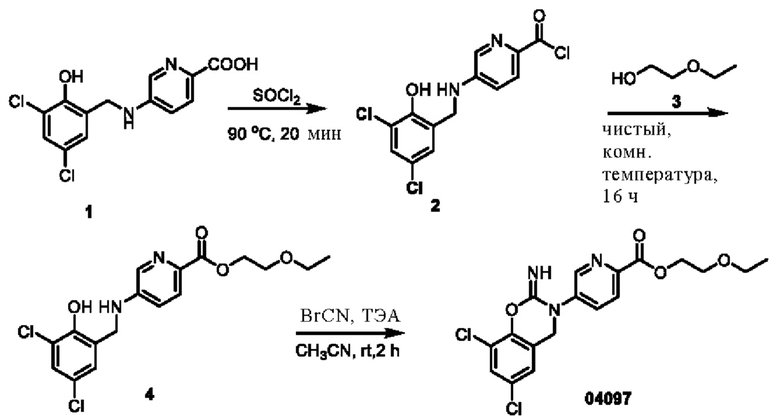
Этап 1. Соединение 2
Соединение 1 (6,0 г, 19,16 ммоль, 1,0 экв.) добавляли к тионилхлориду (20 мл), нагревали до 90°С и перемешивали в течение 20 минут, после чего реакционный раствор становился прозрачным раствором желтого цвета. Реакционный раствор охлаждали до 25°С, концентрировали при пониженном давлении, а полученное неочищенное соединение 2 (10 г) представляло собой маслянистую жидкость коричневого цвета, которое непосредственно использовали для следующей реакции без очистки.
Этап 2. Соединение 4
Неочищенное соединение 2 (10 г) растворяли в тетрагидрофуране (10 мл), добавляли соединение 3 (10 мл) и перемешивали при 25°С в течение 16 часов. Реакционный раствор концентрировали, остаток растворяли в этилацетате (500 мл), затем корректировали рН до 7 8 с помощью водного раствора натрия карбоната. Водную фазу, полученную после разделения жидкостей, экстрагировали этилацетатом, объединенную органическую фазу высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении и остаток очищали с помощью хроматографии на колонке с силикагелем (петролейный эфир/этилацетат = 4/1) с получением соединения 4 (1,6 г, выход на двух стадиях: 21%) в виде твердого вещества белого цвета.
ВЭЖХ-МС: [М+Н]+ = 385,0
Этап 3. Соединение 04097
Соединение 4 (1,6 г, 4,15 ммоль, 1,0 экв.) растворяли в ацетонитриле (40 мл), добавляли цианогенбромид (660 мг, 6,23 ммоль, 1,5 экв.) и триэтиламин (630 мг, 6,23 ммоль, 1,5 экв.) и перемешивали при 25°С в течение 2 часов. Реакционный раствор разбавляли этилацетатом (300 мл), промывали насыщенным раствором натрия хлорида, органическую фазу высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении, остаток очищали методом препаративной ВЭЖХ (0,1% муравьиная кислота/ацетонитрил/вода) с получением соединения 04097 (51 мг, 4%) в виде твердого вещества белого цвета.
ВЭЖХ-МС: [М+Н]+ = 410,0
1H-ЯМР (400 МГц, ДМСО-d6) δ 8,84 (синглет, 1H), 8,09-8,02 (мультиплет, 2Н), 7,70 (синглет, 1Н), 7,45-7,39 (мультиплет, 1Н), 7,18 (синглет, 1Н), 4,91 (синглет, 2Н), 4,44-4,38 (мультиплет, 2Н), 3,72-3,66 (мультиплет, 2Н), 3,52-3,47 (мультиплет, 2Н), 1,15 1,09 (мультиплет, 3Н).
Пример 41: получение соединения 04102
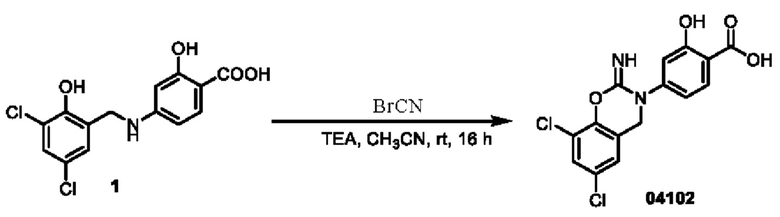
Этап 1. Соединение 04102
Соединение 1 (300 мг, 0,914 ммоль, 1,0 экв.) растворяют в ацетонитриле (35 мл), добавляли цианогенбромид (97 мг, 0,914 ммоль, 1,0 экв.), перемешивали при 25°С в течение 30 минут, затем по каплям добавляли триэтиламин (92 мг, 0,914 ммоль, 1,0 экв.) и перемешивали в течение ночи. Реакционный раствор концентрировали при пониженном давлении, остаток очищали методом препаративной ВЭЖХ (0,1% муравьиная кислота/ацетонитрил/вода) для получения соединения 04102 (10,8 мг, 3%) в виде твердого вещества белого цвета.
ВЭЖХ-МС: [М+Н]+ = 353,0
1Н-ЯМР (400 МГц, ДМСО-d6) δ 7,83-7,81 (мультиплет, 2Н), 7,47 (дублет, J=2,4 Гц, 1H), 6,85 (дублет, J=2,0 Гц, 1H), 6,75 (двойной дублет, J=8,1, 2,1 Гц, 1H), 4,86 (синглет, 2Н).
Пример 42: получение соединения 04099
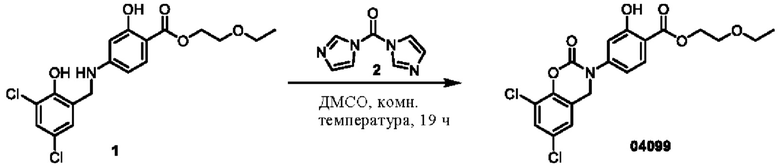
Этап 1. Соединение 04099
Соединение 1 (2,0 г, 5,0 ммоль, 1,0 экв.) растворяли в диметилсульфоксиде (10 мл), добавляли карбонилдиимидазол (1,22 г, 7,5 ммоль, 1,5 экв.) и перемешивали при 25°С в течение 16 часов в защитной атмосфере азота. Далее добавляли карбонилдиимидазол (406 мг, 2,5 ммоль, 0,5 экв.) и продолжали перемешивать в течение 3 часов. Реакционный раствор разбавляли водой (20 мл), а затем корректировали значение рН до 3 4 путем добавления по каплям разбавленного водного раствора хлористоводородной кислоты (2 М). Реакционный раствор экстрагировали этилацетатом (трижды по 20 мл), объединенную органическую фазу промывали насыщенным раствором натрия хлорида, высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении и очищали остаток колоночной хроматографией на силикагеле (петролейный эфир/этилацетат = 5/1) с получением соединения 04099 (1,31 г, 61%) в виде твердого вещества белого цвета.
ВЭЖХ-МС: [М+Н]+ = 426,0
1Н-ЯМР (400 МГц, CDCl3) δ 10,85 (синглет, 1Н), 7,94 (дублет, J=8, 4 Гц, 1Н), 7,42 (дублет, J=2,4 Гц, 1H), 7,08-7,07 (мультиплет, 1H), 7,01-6,98 (мультиплет, 1Н), 6,97-6,96 (мультиплет, 1Н), 4,83 (синглет, 2Н), 4,53-4,50 (мультиплет, 2Н), 3,79-3,76 (мультиплет, 2Н), 3,58 (квадруплет, J=7,2 Гц, 2Н), 1,23 (триплет, J=7,2 Гц, 3Н).
Пример 43: получение соединения 04100
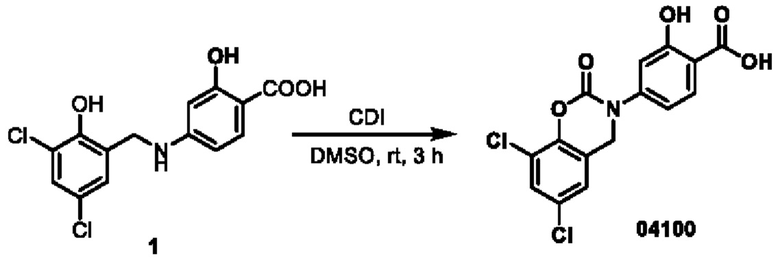
Этап 1. Соединение 04100
Соединение 1 (300 мг, 0,91 ммоль, 1,0 экв.) растворяли в диметилсульфоксиде (10 мл), затем добавляли CDI (220 мг, 1,36 ммоль, 1,5 экв.) и перемешивали при 25°С в течение 3 часов. К реакционному раствору добавляли воду (10 мл), значение рН корректировали до 3-4 с помощью разбавленной хлористоводородной кислоты, а затем экстрагировали этилацетатом (трижды по 10 мл). Объединенную органическую фазу высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении, остаток очищали методом препаративной ВЭЖХ (0,1% муравьиная кислота/ацетонитрил/вода) для получения соединения 04100 (50 мг, 16%) в виде твердого вещества белого цвета.
ВЭЖХ-МС: [М+Н]+ = 354,0
1Н-ЯМР (400 МГц, ДМСО-d6) δ 11,48 (синглет, 1H), 7,84 (дублет, J=8,5 Гц, 1H), 7,71 (дублет, J=2,4 Гц, 1H), 7,44 (дублет, J=2,4 Гц, 1H), 7,08-7,04 (мультиплет, 2Н), 4,97 (синглет, 2Н).
Пример 44: получение соединения 04103
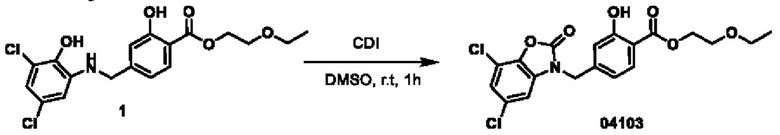
Этап 1. Соединение 04103
Соединение 1 (528 мг, 1,32 ммоль, 1,0 экв.) растворяли в диметилсульфоксиде (6 мл), затем добавляли CDI (257 мг, 1,58 ммоль, 1,2 экв.) и перемешивали при 25°С в течение 1 часа. Добавляли этилацетат (15 мл) и насыщенный водный раствор натрия карбоната (15 мл) и продолжали перемешивать реакционный раствор в течение 1 часа. После разделения жидкостей органическую фазу промывали насыщенным раствором натрия хлорида, высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении, и остаток очищали с помощью обращенно-фазовой колоночной хроматографии (0,1% муравьиная кислота/ацетонитрил/вода) для получения соединения 04103 (305,5 мг, 45%) в виде твердого вещества белого цвета.
ВЭЖХ-МС: [М+Н]+ = 426,0
1Н-ЯМР (400 МГц, ДМСО-d6) δ 10,49 (синглет, 1Н), 7,75 (дублет, J=8,0 Гц, 1H), 7,44-7,43 (мультиплет, 2Н), 7,02 (синглет, 1H), 6,97-6,95 (мультиплет, 1H), 5,07 (синглет, 2Н), 4,42-4,01 (мультиплет, 2Н), 3,70-3,69 (мультиплет, 2Н), 3,49 (квадруплет, J=6,8 Гц, 2Н), 1,10 (триплет, J=6,8 Гц, 3Н).
Пример 45: получение соединения 04104
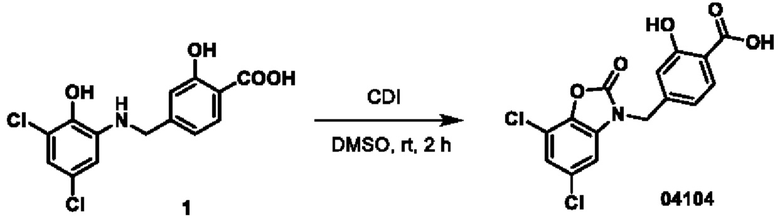
Этап 1. Соединение 04104
Соединение 1 (500 мг, 1,6 ммоль, 1,0 экв.) растворяли в диметилсульфоксиде (15 мл), затем добавляли CDI (377 мг, 2,4 ммоль, 1,5 экв.) и перемешивали при 25°С в течение 2 часов. К реакционному раствору добавляли воду (15 мл), значение рН корректировали до 3 4 с помощью разбавленной хлористоводородной кислоты, а затем экстрагировали этилацетатом (трижды по 20 мл). Объединенную органическую фазу высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении и очищали остаток с помощью обращенно-фазовой колоночной хроматографией (0,1% муравьиная кислота/ацетонитрил/вода) для получения соединения 04104 (53 мг, 6%) в виде твердого вещества белого цвета.
ВЭЖХ-МС: [М+Н]+ = 354,0
1H-ЯМР (400 МГц, ДМСО-d6) δ 7,74 (дублет, J=8,0 Гц, 1H), 7,44-7,42 (мультиплет, 2Н), 6,94 (синглет, 1H), 6,86 (дублет, J=8,0 Гц, 1H), 5,03 (синглет, 2Н).
Пример 46: получение соединения 04105
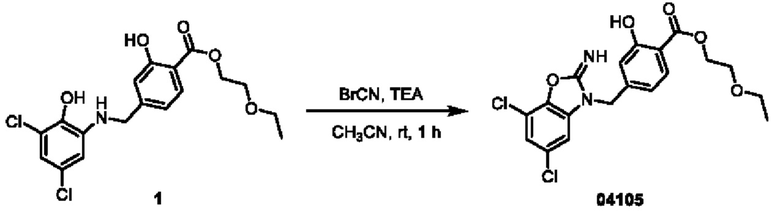
Этап 1. Соединение 04105
Соединение 1 (400 мг, 1,000 ммоль, 1,0 экв.) растворяли в ацетонитриле (6 мл), добавляли цианогенбромид (106 мг, 1,000 ммоль, 1,0 экв.) и перемешивали при 25°С в течение 0,5 ч. Добавляли триэтиламин (101 мг, 1,000 ммоль, 1,0 экв.) и продолжали перемешивать реакционный раствор в течение 1 часа. Реакционный раствор фильтровали, полученное твердое вещество суспендировали в ацетонитриле, фильтровали и высушивали с получением соединения 04105 (64,6 мг, 16%) в виде твердого вещества белого цвета.
ВЭЖХ-МС: [М+Н]+ = 425,0
1H-ЯМР (400 МГц, ДМСО-d6) δ 10,48 (синглет, 1H), 7,65 (дублет, J=8,1 Гц, 1H), 6,99 (синглет, 1Н), 6,92 (синглет, 1H), 6,88 (дублет, J=8,1 Гц, 1H), 6,79 (синглет, 1Н), 6,49 (синглет, 1Н), 4,42-4,39 (мультиплет, 4Н), 3,69-3,67 (мультиплет, 2Н), 3,48 (квадруплет, J=7,0 Гц, 2Н), 1,09 (триплет, J=7,0 Гц, 3Н).
Пример 47: получение соединения 04106
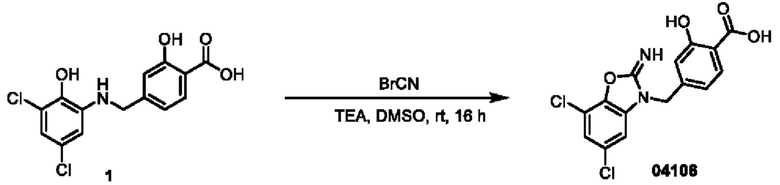
Этап 1. Соединение 04106
Соединение 1 (100 мг, 0,305 ммоль, 1,0 экв.) растворяли в диметилсульфоксиде (5 мл), добавляли цианогенбромид (32 мг, 0,305 ммоль, 1,0 экв.) и перемешивали при 25°С в течение 0,5 ч. Добавляли триэтиламин (31 мг, 0,305 ммоль, 1,0 экв.) и перемешивали в течение ночи. Реакционный раствор разбавляли этилацетатом (30 мл), затем последовательно промывали водой и насыщенным раствором натрия хлорида. Органическую фазу высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении, остаток очищали методом препаративной ВЭЖХ (0,1% муравьиная кислота/ацетонитрил/вода) для получения соединения 04106 (15,9 мг, 15%) в виде твердого вещества белого цвета.
ВЭЖХ-МС: [М+Н]+ = 352,9
1Н-ЯМР (400 МГц, ДМСО-d6) δ 12,00 (широкий синглет, 1Н), 7,74 (дублет, J=8,1 Гц, 1H), 7,20 (дублет, J=1,9 Гц, 2Н), 6,91 (синглет, 1H), 6,88-6,85 (мультиплет, 1H), 5,00 (синглет, 2Н).
Пример 48: получение соединения 04107
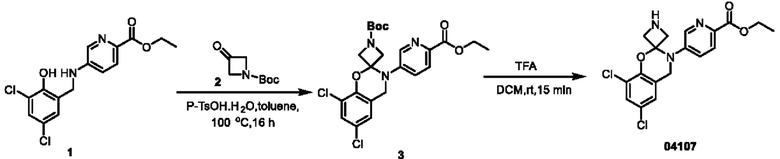
Этап 1. Соединение 3
Соединение 1 (30 мг, 0,0879 ммоль, 1,0 экв.) добавляли в толуол (3 мл), последовательно добавляли соединение 2 (30 мг, 0,1758 ммоль, 2,0 экв.) и п-толуолсульфоновой кислоты моногидрат (3 мг, 0,0176 ммоль, 0,2 экв.), повышали температуру до 100°С и перемешивали в течение 16 часов. Реакционный раствор охлаждали до 25°С и концентрировали при пониженном давлении для получения соединения 3 (43 мг, 99%) в виде желеобразного вещества коричневого цвета, которое непосредственно использовали для следующей реакции без очистки.
ВЭЖХ-МС: [М+Н]+ = 494,1
Этап 2. Соединение 04107
Соединение 3 (43 мг, 0,0869 ммоль, 1,0 экв.) растворяли в дихлорметане (1 мл), затем добавляли трифторуксусную кислоту (0,2 мл), и реакционный раствор перемешивали при 25°С в течение 15 минут. Значение рН раствора корректировали до 7 насыщенным водным раствором натрия бикарбоната, после разделения жидкостей проводили экстракцию дихлорметаном, объединенную органическую фазу высушивали над безводным натрия сульфатом, концентрировали при пониженном давлении и очищали остаток с помощью хроматографии на колонке с силикагелем с получением соединения 04107 (выход: 13%).
ВЭЖХ-МС: [М+Н]+ = 394,0
Исследование защитного эффекта соединений в отношении реперфузии при очаговой церебральной ишемии у крыс
1. Материалы и методы
1.1 Экспериментальные животные
Крысы Sprague Dawley (SD), самцы, класс SPF, масса тела 250-280 г.
1.2 Исследованные препараты
Соединения 04007, 04015, 04041, 04047, 04050 и 04089
Коммерчески доступный препарат эдаравона, раствор для инъекций, производства компании Nanjing Simcere dongyuan pharmaceutical Co., Ltd, концентрация 10 мг/мл
1.3 Экспериментальный способ
1.3.1 Подготовка модели фокальной церебральной ишемии-реперфузии Модель фокальной церебральной ишемии-реперфузии у крыс (окклюзия средней мозговой артерии, МСАО) была подготовлена путем ушивания внутренней сонной артерии. Крысам вводили внутрибрюшинно 7% раствор хлоралгидрата (6,0 мл/кг), глубина анестезии соответствовала сильной стимуляции у животных и сопровождалась незначительной реакцией. У крыс под общей анестезией связывали конечности резиновыми лентами (задние конечности фиксировали выше коленного сустава, а передние - выше лучезапястного сустава) и голову, после чего животных фиксировали на операционном столе в горизонтальном положении на спине и с помощью бритвы для животных сбривали шерсть от головного конца до груди, а кожу дезинфицировали спиртом. Шею разрезали в средней части и тупым способом отделяли подкожную клетчатку. Отделяли тонкий слой фасции на поверхности переднего шейного треугольника, нижнюю часть подъязычно-ключичной мышцы рассекали и получали доступ к проходящей продольно пульсирующей артерии, параллельной этой мышце. Оболочку артерии вскрывали, обнажали бифуркацию правой сонной артерии, выделяли правую общую сонную артерию, наружную сонную артерию, внутреннюю сонную артерия, аккуратно отслаивали блуждающий нерв, перевязывали и отсекали наружную сонную артерию. На проксимальный конец общей сонной артерии накладывали зажим, делали разрез от дистального конца лигатурной линии наружной сонной артерии, накладывали шов и вводили его во внутреннюю сонную артерию через бифуркацию общей сонной артерии, а затем медленно продвигали до появления небольшого сопротивления (около 20 мм от бифуркации). Все кровоснабжение через среднюю мозговую артерию блокировалось. Шов неплотно фиксировали шелком под разрезом наружной сонной артерии, лигатуру на конце общей сонной артерии вблизи сердца ослабляли, раневую поверхность накрывали марлей, смоченной дезинфицированным нормальным физиологическим раствором, и поддерживали температуру тела крысы путем помещения животного на теплосохраняющий коврик. После ишемии правого полушария головного мозга в течение 2,0 ч шов осторожно вытягивали, восстанавливали кровоснабжение для реперфузии, перевязывали наружную сонную артерию шелком, фиксирующим шов, ушивали кожу и дезинфицировали.
1.3.2 Разделение животных на группы и введение препарата
Экспериментальные животные были разделены на модельную группу, группу эдаравона (6 мг/кг) и группу исследуемого соединения (5 мг/кг). Приготовление исследуемого соединения: для приготовления раствора с концентрацией 1 мг/мл использовали 5% DMAC + 5% Solutol HS 15 + 90% физиологический раствор.
После подготовки модели ишемии животные были распределены в каждую группу вслепую с равной вероятностью. Животным вводили внутривенно однократно дозу исследуемого препарата сразу после реперфузии, а животным в модельной группе - такой же объем физиологического раствора. Животных умерщвляли через 24 часа после ишемии, ткани головного мозга отбирали, окрашивали и фотографировали для определения площади инфаркта головного мозга.
1.3.3 Измерение площади инфаркта головного мозга
Степень инфаркта головного мозга определяли с помощью окрашивания трифенилтетразолия хлоридом (ТТС). После завершения оценки симптомов неврологических дефектов у животных, их умерщвляли убивали с помощью СО2, забор головного мозга осуществляли путем декапитации, удаляли обонятельную луковицу, мозжечок и нижнюю часть ствола мозга, пятна крови на поверхности мозга промывали нормальным физиологическим раствором, остаточные пятна воды на поверхности аспирировали и помещали образец на 20 мин в морозильную камеру при -20°С. Сразу после забора выполняли корональный срез вертикально вниз в плоскости пересечения линии взгляда, и готовили срезы каждые 2 мм в обратном направлении, срезы головного мозга инкубировали в 1% растворе красителя ТТС (37°С в течение 20 мин). Нормальная ткань мозга окрашивалась в малиновый цвет, а ишемизированная ткань - была бледной. После промывания нормальным физиологическим раствором срезы мозга быстро располагались в ряд спереди назад, остатки воды на поверхности аспирировали досуха и делали фотографии.
Расчет площади инфаркта головного мозга: фотографии обрабатывались программой Image J, рассчитывалась соответствующая площадь левой половины головного мозга и площадь не пораженной инфарктом правой части головного мозга, и получался процент площади инфаркта.
2. Результаты экспериментов
2.1 Статистический анализ
Количественные данные выражены как среднее значение ± стандартные ошибки, для каждого показателя эффективности используется программное обеспечение GraphPad Prism (6.01) для одностороннего дисперсионного анализа, а критерий Фишера наименьшей значимой разницы используется для проверки разницы между группами после подтверждения значимости критерия дисперсионного анализа. Р<0,05 определяется как наличие существенной разницы.
2.2 Влияние исследуемых соединений на острую церебральную ишемию-реперфузию у крыс
Выраженность симптомов неврологического дефицита и площадь инфаркта головного мозга в каждой группе животных представлены в таблице 1.
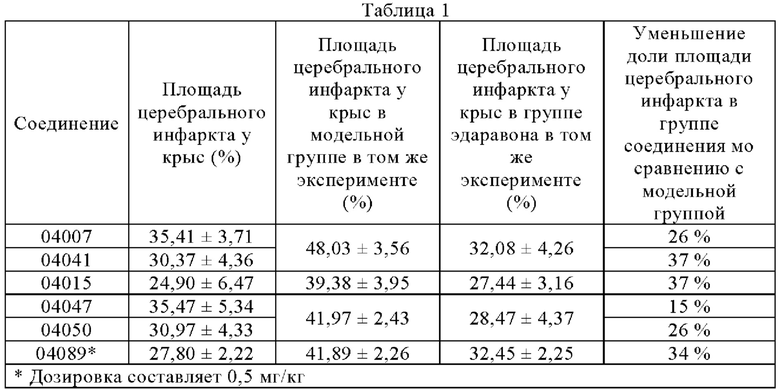
Видно, что по сравнению с модельной группой, соединения 04007, 04015, 04041, 04050 и 04089 могут в значительной степени уменьшить площадь инфаркта мозга у модельных крыс, за исключением соединения 04047, которое не оказывает значимого влияния на уменьшение площади инфаркта головного мозга у модельных крыс. Эти данные подтверждают хороший нейропротекторный эффект. По сравнению с группой положительного контроля эдаравона, доза 5 мг/кг для соединений 04007, 04015, 04041, 04050 и 0,5 мг/кг для соединения 04089 имеют эквивалентную или лучшую эффективность в сравнении с дозой эдаравона 6 мг/кг.
Все литературные источники, упомянутые в настоящем изобретении, включены в настоящий документ в виде ссылок, как если бы они были включены при помощи ссылки по отдельности. Кроме того, следует понимать, что после изучения вышеприведенного описания специалистами в данной области техники могут быть внесены многочисленные изменения и модификации, и такие эквиваленты также попадают в объем, определяемый прилагаемой формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ 2-АМИНОПИРИМИДИНА И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2795914C1 |
| ПРОИЗВОДНОЕ п-ФЕНИЛЕНДИАМИНА КАК РЕГУЛЯТОР КАЛИЕВЫХ КАНАЛОВ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И МЕДИЦИНСКОГО ПРИМЕНЕНИЯ | 2019 |
|
RU2762562C1 |
| СОЕДИНЕНИЕ ТЕТРАГИДРОИЗОХИНОЛИНА В КАЧЕСТВЕ МОДУЛЯТОРА КАЛИЕВЫХ КАНАЛОВ, ЕГО ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2021 |
|
RU2800873C1 |
| ГЕТЕРОЦИКЛИЧЕСКОЕ АМИДНОЕ СОЕДИНЕНИЕ, ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2020 |
|
RU2823875C1 |
| ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ, ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2800153C2 |
| СОЕДИНЕНИЕ, ИМЕЮЩЕЕ ИНГИБИРУЮЩУЮ АКТИВНОСТЬ В ОТНОШЕНИИ КИНАЗ | 2021 |
|
RU2831403C1 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛИДИНОНА В КАЧЕСТВЕ АГЕНТОВ МУСКАРИНОВЫХ РЕЦЕПТОРОВ | 2002 |
|
RU2288919C2 |
| ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ СОЕДИНЕНИЯ НА ОСНОВЕ КЕТОАМИДА | 2021 |
|
RU2819346C1 |
| НОВЫЙ АГОНИСТ β-РЕЦЕПТОРА ТИРЕОИДНЫХ ГОРМОНОВ | 2021 |
|
RU2839610C1 |
| ЗАМЕЩЕННЫЕ БЕНЗОЛЬНЫЕ СОЕДИНЕНИЯ | 2013 |
|
RU2658919C2 |
Изобретение относится к соединению формулы (I), где R1-R9, R5’, R6’, W, X, Y, Z, n, m определены в формуле изобретения, которое обладает нейропротекторным действием. Также раскрыты способ его получения, содержащая его фармацевтическая композиция и применение соединения для получения лекарственного препарата для профилактики и/или лечения заболеваний или нарушений, связанных с повреждением нейронов. 4 н. и 3 з.п. ф-лы, 1 табл., 48 пр.
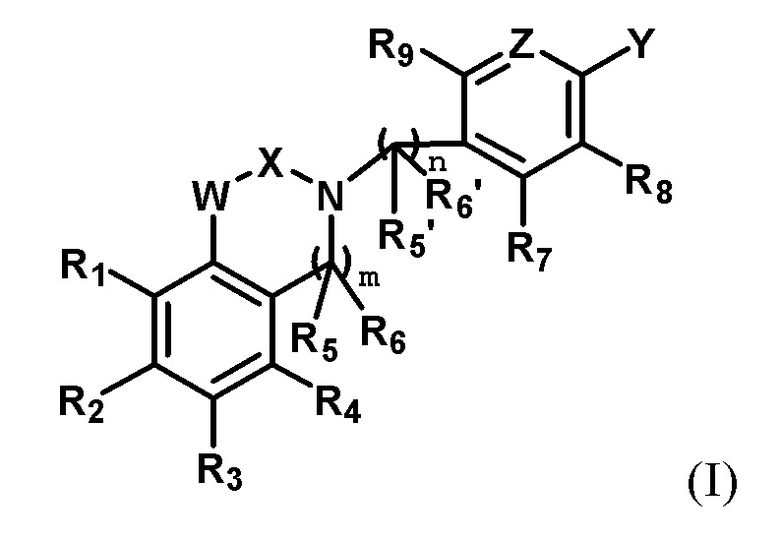
1. Соединение общей формулы I или его фармацевтически приемлемая соль:
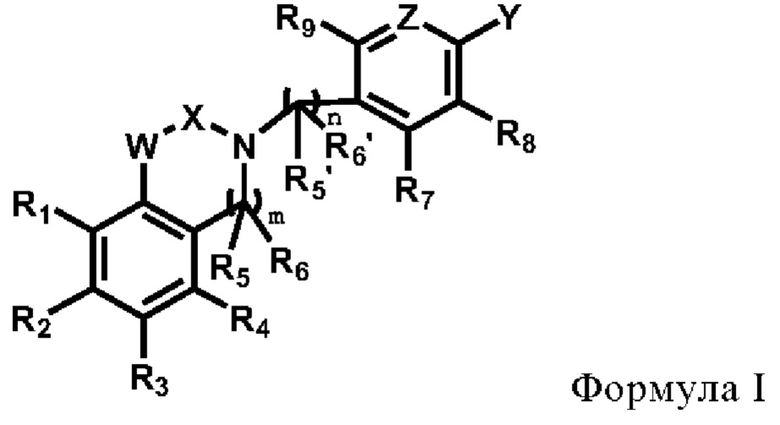
где R1 и R3 представляют собой хлор;
R2, R4, R5, R5', R6, R6', R7, R8 и R9 представляют собой водород;
X представляет собой 
W представляет собой О;
m равно 1;
n равно 0;
Z представляет собой N;
Y представляет собой COOR15;
R15 выбирают из группы, состоящей из водорода, C1-6 алкила, С3-8 циклоалкила, С6-10 арила, 3-15-членного насыщенного или ненасыщенного гетероциклоалкила, содержащего один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, и -(C1-6 алкилен) (3-15-членный насыщенный или ненасыщенный гетероциклоалкил или, включающий один или более (например, 2, 3, 4 или 5) гетероатомов, выбираемых из N, S или О); где алкил, циклоалкил, арил, и гетероциклоалкил необязательно замещены одним или несколькими (например, 2, 3 или 4) заместителями, выбранными из группы, состоящей из гидроксила, C1-6 алкилена гидроксила, -NR20R21, С2-6 алкинила, C1-6 алкила, 3-8-членного гетероциклоалкила, содержащего один или более (например, 2, 3 или 4) гетероатомов, выбираемых из N, S или О, незамещенных или замещенных С1-6 алкилом, C1-6 алкилом, замещенным амино и карбоксилом, C1-6 алкокси, и -COO(C1-6 алкил);
R20 и R21 независимо выбирают из группы, состоящей из водорода, C1-6 алкила.
2. Соединение по п. 1, где
R1 и R3 представляют собой хлор,
R2, R4, R7, R8 и R9 представляют собой водород;
каждый из R5, R5', R6 и R6' представляет собой водород;
W представляет собой О;
X представляет собой 
Z представляет собой N;
Y представляет собой COOR15;
R15 выбирают из группы состоящей из водорода, С1-6 алкила и С3-8 циклоалкила; алкила и циклоалкила необязательно замещены одним или несколькими (например, 2, 3 или 4) C1-6 алкокси;
m = 1 и n = 0.
3. Соединение по п. 1, где
R1 и R3 представляют собой хлор,
R2, R4, R7, R8 и R9 представляют собой водород;
каждый из R5, R5', R6 и R6' представляет собой водород;
W представляет собой О;
X представляет собой 
Z представляет собой N;
Y представляет собой COOR15;
R15 представляет собой C1-6 алкил, замещенный C1-6 алкокси;
m = 1 и n = 0.
4. Соединение по п. 1, где соединение выбирают из группы, состоящей из
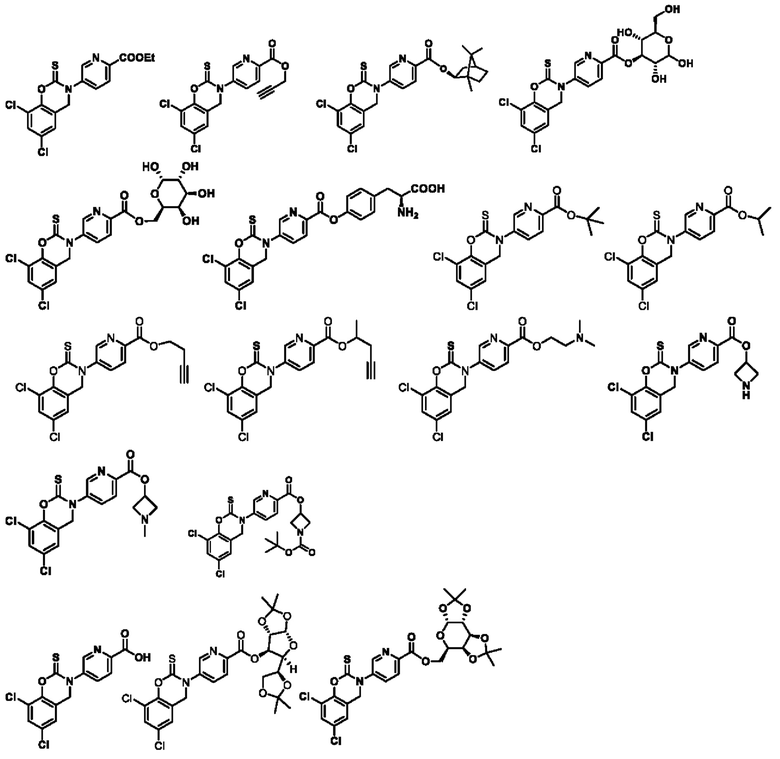
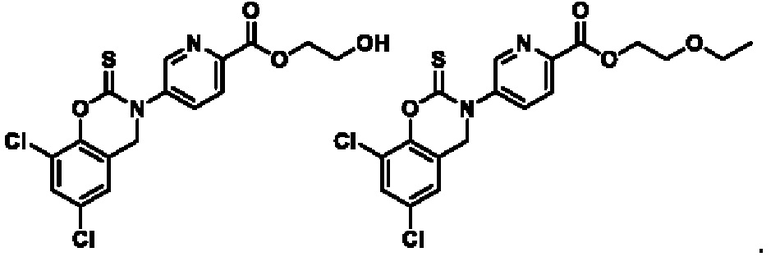
5. Способ получения соединения по п. 1, включающий следующие этапы:
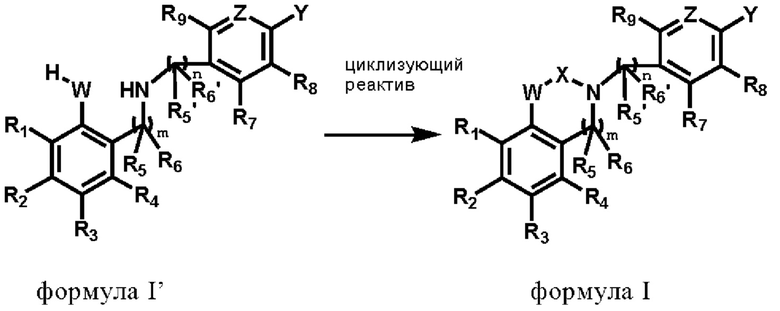
реакция соединения общей формулы I' с циклизующим реактивом для получения соединения общей формулы I;
где R1, R2, R3, R4, R5, R5', R6, R6', R7, R8, R9, W, X, Z, Y, m и n соответствуют определению в п. 1 формулы изобретения.
6. Фармацевтическая композиция для профилактики и/или лечения заболеваний или расстройств, связанных с повреждением нейронов, включающая фармацевтически приемлемый носитель и одно или несколько соединений по п. 1 в терапевтически эффективном количестве.
7. Применение соединения по п. 1 для получения лекарственного препарата для профилактики и/или лечения заболеваний или нарушений, связанных с повреждением нейронов.
| WO 2015155358 A1, 15.10.2015 | |||
| RU 2007141995 A, 20.05.2009 | |||
| Kumar G Naveen et al | |||
| "SYNTHESIS, CHARACTERIZATION, PHARMACOLOGICAL EVALUATION AND MOLECULAR DOCKING STUDIES OF NOVEL BENZOXAZINE DERIVATIVES FOR THE TREATMENT OF INFLAMMATION", International Journal of Pharmaceutical Sciences and Research, 2014, vol | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| STN Online RN | |||
Авторы
Даты
2023-08-29—Публикация
2020-12-10—Подача