УРОВЕНЬ ТЕХНИКИ
[001] Лошадиный хорионический гонадотропин (eCG) представляет собой гормон, продуцируемый эндометриальными чашами беременной кобылы (Christakos and Bahl, 1979). Ранее известный как сывороточный гонадотропин беременной кобылы (PMSG), гормон является общеупотребительным для индукции овуляции до искусственного осеменения при работе с домашним скотом. Он представляет собой высоко гликозилированный гликопротеин, состоящий из двух α- и β-гетеродимерных цепей. Альфа-субъединица является общей для всех гликопротеиновых гормонов (LH, FSH, TSH, CG), в то время как бета-субъединицы являются специфическими для каждого гормона и являются ответственными за специфичность связывания рецептора, хотя в случае GC, он связывается с тем же приемником, что и LH. У лошадиных (лошадей, ослов, зебр), плацентарный CG и гипофизарный LH экспрессируются с одного и того же гена и таким образом, имеют одинаковую белковую последовательность, которая отличается только их углеводными боковыми цепями, в частности, локализованными в бета-субъединице, так что по соглашению их также называют eLH/CG (Sherman et al., 1992).
[002] eLH и eCG кодированы одинаковыми генами, как описано выше, и имеют O-гликозилированное C-концевое удлинение и N-гликозилирование в своей бета-субъединице, в дополнение к двум N-гликозилированиям в своей альфа-субъединице (Murphy and Martinuk, 1991), но при экспрессии и секреции в различных тканях, они сильно различаются своими углеводными боковыми цепями N и О (Smith et al. 1993, Matsui et al. 1994, Bousfield and Butnev 2001), что придает им различные биологические активности in vivo из-за более длительного время полужизни eCG, по сравнению с eLH (Klett et al. 2003), так же как различную термостабильность (Galet et al. 2004).
[003] Получение eCG в настоящее время осуществляют посредством отбора крови у беременных кобыл, которые секретируют этот гормон между 40 и 130 сутками беременности (Allen and Moor, 1972). После очистки, формулирования и контроля, он поступает на рынок для использования, среди прочего, для искусственной индукции течки у самок коз, коров и свиней. eCG имеет две выдающихся характеристики для использования в промышленном животноводстве, в отличие от действия у лошадей, где он имеет только лютеинизирующую активность, у других видов он имеет активность как фолликулостимулирующего гормона (FSH), так и лютеинизирующего гормона (LH), и с другой стороны, из-за своей четвертичной структуры и своих множественных участков гликозилирования, увеличенное время полужизни в кровотоке (Stewart et al., 1976; Combarnous et al., 1981).
[004] Современный способ получения имеет все проблемы, связанные с продукцией и очисткой экстрагируемого гормона, особенно связанные со стоимостью содержания и охраны здоровья животных, так же как сложности в максимизации чистоты конечного состава. Таким образом, очень важной является возможность разработки альтернативного способа продукции.
[005] Известно, что различия в биологической активности eLH, секретируемого гипофизом, и eCG, секретируемого трофобластом, фундаментально можно отнести к различию в длине и сиалировании его гликанов. Кроме того, понятно также, что отсутствие адекватного гликозилирования в системах продукции рекомбинантного белка до настоящего времени препятствовало получению рекомбинантного eLH/CG с достаточным временем полужизни в плазме, чтобы иметь биологическую активность in vivo.
[006] В документе «Expression of a single BETA ALPHA chain protein of equine LH/CG in milk of transgenic rabbits and its biological activity». Galet et al, опубликованном в Molecular and Cellular Endocrinology 174 (2000) 31-40, описана конструкция слитого белка из бета/альфа-цепи, без добавления линкера. Указанную конструкцию экспрессируют в молоке трансгеннных кроликов. Несмотря на то, что полученный белок имеет сходную с нативным активность in vitro, он не имеет активности in vivo, и время полужизни полученного рекомбинантного гормона является очень низким.
[007] С другой стороны, в «Biological Activities of Tethered Equine Chorionic Gonadotropin (eCG) and Its Deglycosylated Mutants». MIN Kwan-Sik et al., опубликованном в Journal of Reproduction and Development, Vol. 50, No. 3, 2004, авторы подтвердили слитый белок из цепей бета и альфа в клетках CHO-K1, с мутациями и без мутаций, уменьшающих его гликозилирование, и не использовали никакого линкера для слияния цепей альфа и бета. Эти исследователи оценивали только активность in vitro (в культуре клеток) для активности как LH, так и FSH, и она ниже у мутантов, которые не являются гликозилированными. Хотя авторы получили активные гормоны, но только in vitro.
[008] Попытки получения рекомбинантных гормонов, опубликованные в «Biological activities of recombinant equine luteinizing hormone/chorionic gonadotropin (eLH/CG) expressed in Sf9 and Mimic insect cell line». Legardinier, et al., Journal of Molecular Endocrinology (2005) 34, 47-60, где показана экспрессия цепей бета и альфа отдельно в клетках насекомых SF9 и Mimic (SF9 с пятью добавленными гликозилтрансферазами), также не были успешными. Два eLH/CG, продуцированные в клетках Sf9 и Mimic, являлись активными в биоанализах in vitro LH и FSH, с активностью, сходной с eCG, но НЕ имели значительной биоактивности in vivo, ни в качестве фолликулостимулирующего гормона (FSH), или в специфическом анализе eCG. Несмотря на то, что рекомбинантный eLH/CG, продуцированный в клетках Mimic, является более гликозилированным, чем продуцированный в клетках Sf9, они НЕ имели отличий в активности in vivo, из-за недостаточного концевого сиалирования их углеводных цепей, приводящего к быстрому выведению из крови.
[009] Другая группа опубликовала в «Expression and bioactivity of a single chain recombinant equine luteinizing hormone (reLH)». Jablonka-Shariff et al. Theriogenology 67 (2007) 311-320, слияние цепей бета и альфа без использования какого-либо линкера. Экспрессию выполняли в клетках CHO-K1. Они описывают активность LH in vitro (продукция тестостерона клетками Лейдига) и in vivo, также по пику продукции тестостерона у лошадей. Однако, они не показали существования активности FSH. Исследователи, зная, что LH, продуцированный в гипофизе, является менее гликозилированным, чем GC, продуцированный в трофобласте, полученный ими рекомбинантный продукт (reLH) напоминает больше eLH, чем eCG и, таким образом, утверждают, что клетки CHO лишены активности соответствующей гликозилтрансферазы, необходимой для синтеза eCG.
[010] Наконец, Sogayaret al., в Патентной заявке WO 2017/112987 A1, опубликовали трансформацию клеток CHO dg44 (линии клеток CHO K1, известной геном dhfr, с использованием слитого белка, описанного в Jablonka-Shariff), подвергание их отбору и амплификации, и выбор клонов с высокой продукцией рекомбинантного гликозилированного eCG. Они оценивают, что полученные ими клетки CHO экспрессируют все ферменты, вовлеченные в гликозилирование, и что это является причиной, почему их eCG может являться активным in vitro и in vivo (у крыс и коров). Однако, предложенный способ требует отбора конкретных клонов, которые случайно гликозилированы с профилями, сходными с трофобластом, так что стабильность указанных клонов делает полезность указанного способа для масштабированной продукции относительной.
[011] Это является причиной, почему авторы настоящего изобретения решили модифицировать структуру eLH/CG, чтобы увеличивать шансы, что он может подвергаться пост-трансляционному гликозилированию более эффективно в рекомбинантной системе экспрессии без изменения его аффинности для его рецепторов, увеличения его гидродинамического объема и следовательно, его биологической активности in vivo.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[012] Настоящее изобретение относится к рекомбинантному одноцепочечному полипептиду хорионическому гонадотропину, отличающемуся тем, что полипептид имеет аминокислотную последовательность, кодирующую цепь бета и цепь альфа лошадиного хорионического гонадотропина, связанную с одной или более последовательностями, которые включают участки гликозилирования.
[013] В одном предпочтительном варианте осуществления, рекомбинантный одноцепочечный полипептид хорионический гонадотропин имеет аминокислотную последовательность выбранную из группы, состоящей из SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8 и SEQ ID NO: 10.
[014] Молекулы ДНК, кодирующие рекомбинантный полипептид, также являются важным вариантом осуществления настоящего изобретения. В частности, молекулы, имеющие последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5 и SEQ ID NO: 7.
[015] Экспрессирующий вектор, содержащий эти молекулы ДНК, также является объектом настоящего изобретения.
[016] В одном варианте осуществления, эти полипептиды являются частью фармацевтической композиции.
[017] Эти рекомбинантные белки и композиции могут быть использованы для получения лекарственных средств для лечения состояний, относящихся к репродукции или овуляции млекопитающих, таких как суперовуляция, неудачная овуляция, субфункция яичников, индукция послеродовой течки или гипоорхидия, у млекопитающих таких как бычьи, свиньи, овцы, собаки, кролики, оленьи, козы и лабораторные животные.
[018] Другой вариант осуществления относится к способу получения рекомбинантного одноцепочечного полипептида хорионического гонадотропина, посредством трансфекции вектором, экспрессирующим его, клетки CHO, и необязательно, его иммуноаффинной очистки.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
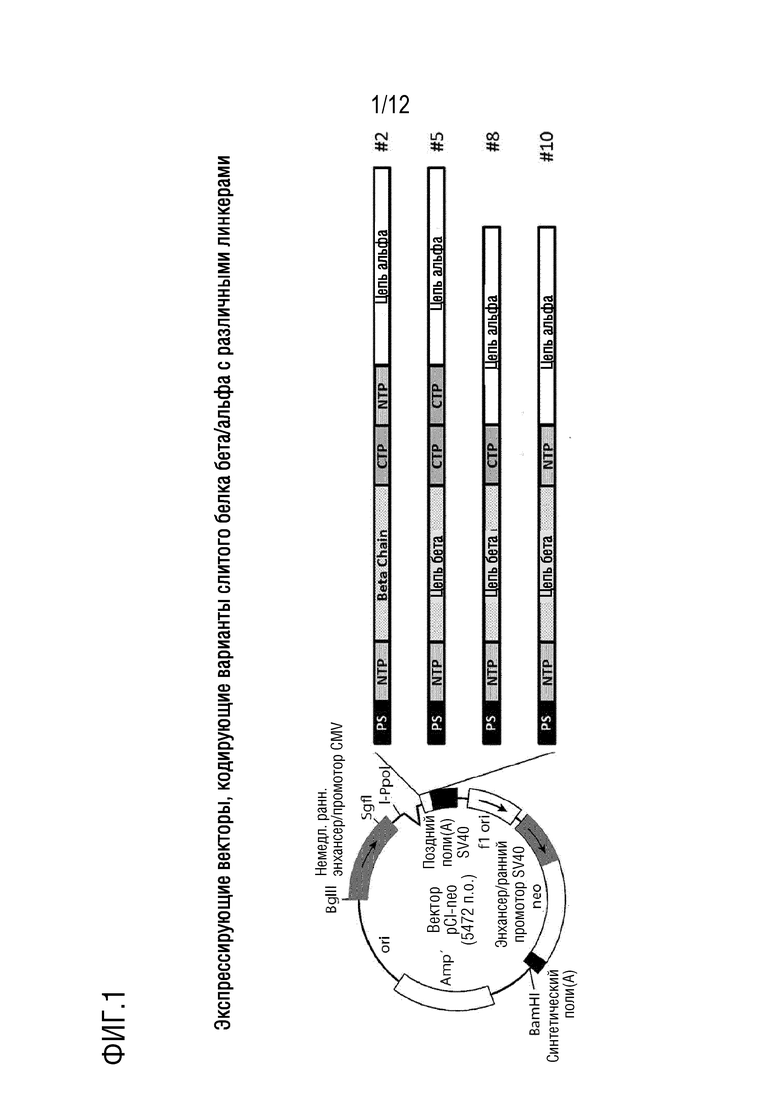
[019] На фигуре 1 показаны экспрессирующие векторы, позволяющие получение вариантов слитого белка бета/альфа, связанных посредством различных линкеров.
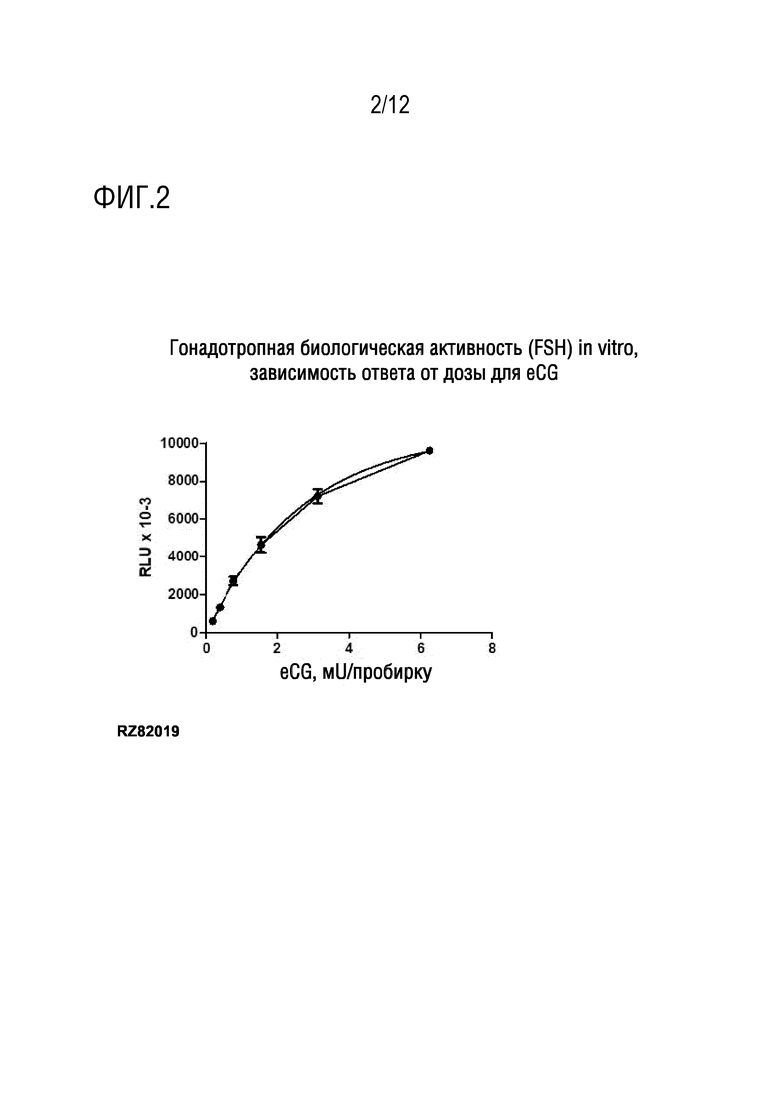
[020] На фигуре 2 показаны измерения гонадотропной биологической активности (FSH) in vitro, типичная кривая зависимости ответа от дозы для eCG.
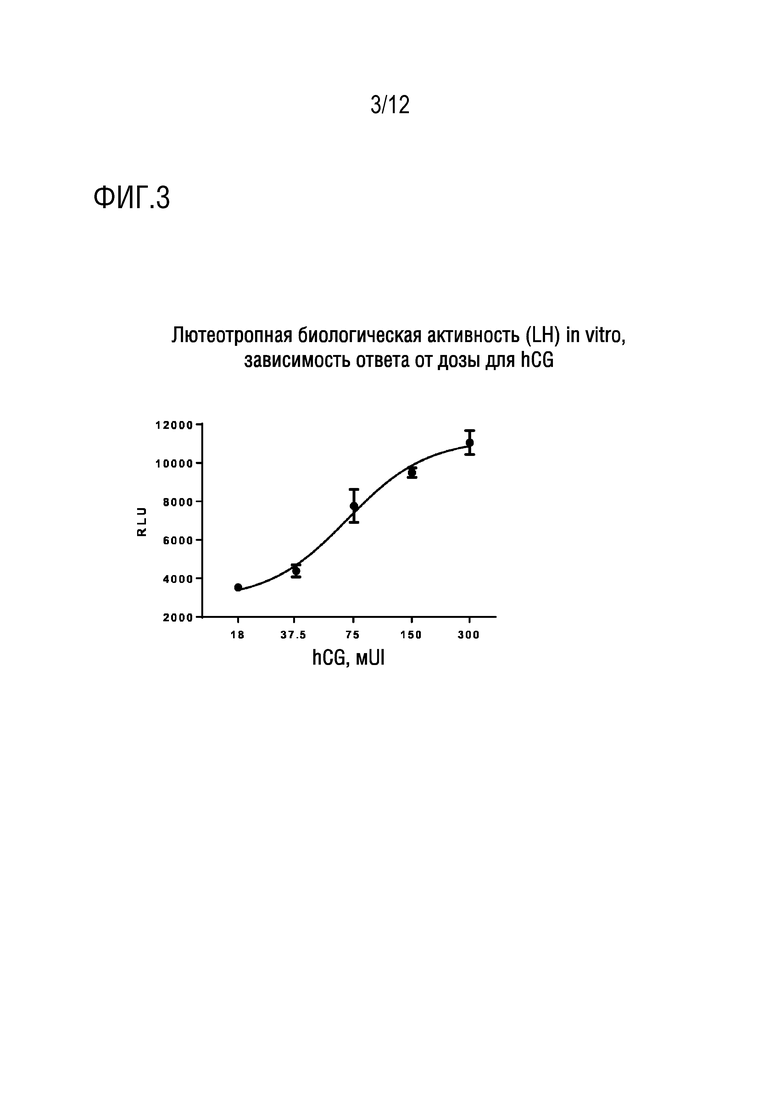
[021] На фигуре 3 показаны измерения лютеотропной биологической активности (LH) in vitro, кривая зависимости ответа от дозы для hCG.
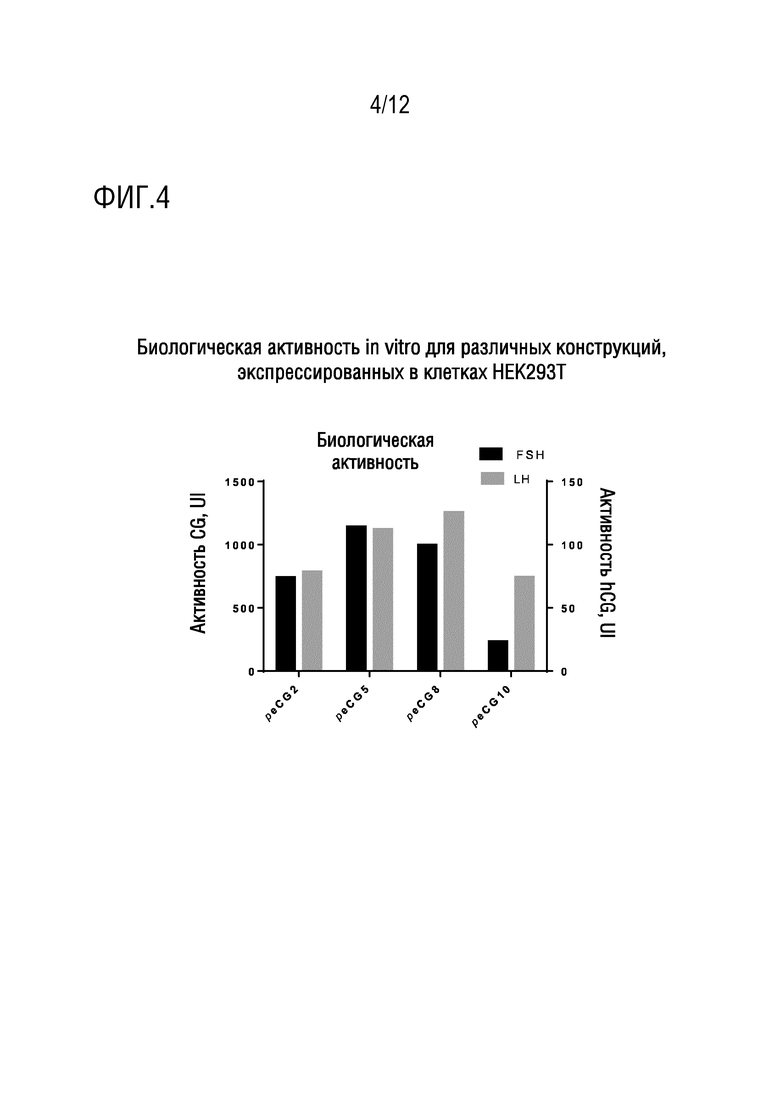
[022] На фигуре 4 показаны измерения биологической активности in vitro для конструкций, экспрессированных в клетках HEK293T.
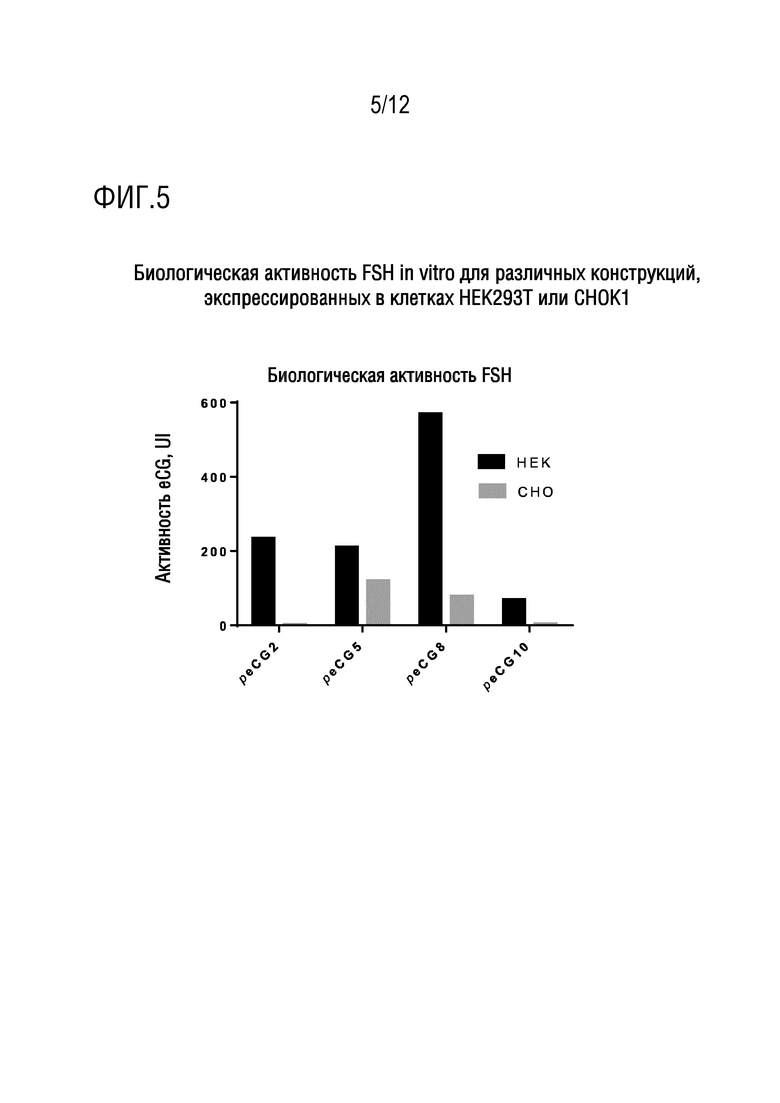
[023] На фигуре 5 показаны измерения биологической активности FSH in vitro для конструкций, экспрессированных в клетках HEK293T или CHOK1.
[024] На фигуре 6 показан анализ супернатантов продуктов экспрессии в клетках HEK293T или CHOK1. Показан 10% нативный акриламидный гель. В каждую дорожку загружали 17 мкг тотального белка. Серии H представляют собой серии, синтезированные клетками HEK, и С - клетками CHO K1. BSA 5 мкг и PMSG 0,25 IU. Единицы, соответствующие 17 мкг массы, составляли: 2H (pCG 2) 4 IU; 5H (pCG 5) 7,2 IU; 8H (pCG.8) 4,5 IU; 10H (pCG 10) 1,4 IU; 5C (pCG5) 0,55 IU; 8C (pCG 8) 0,22 IU.
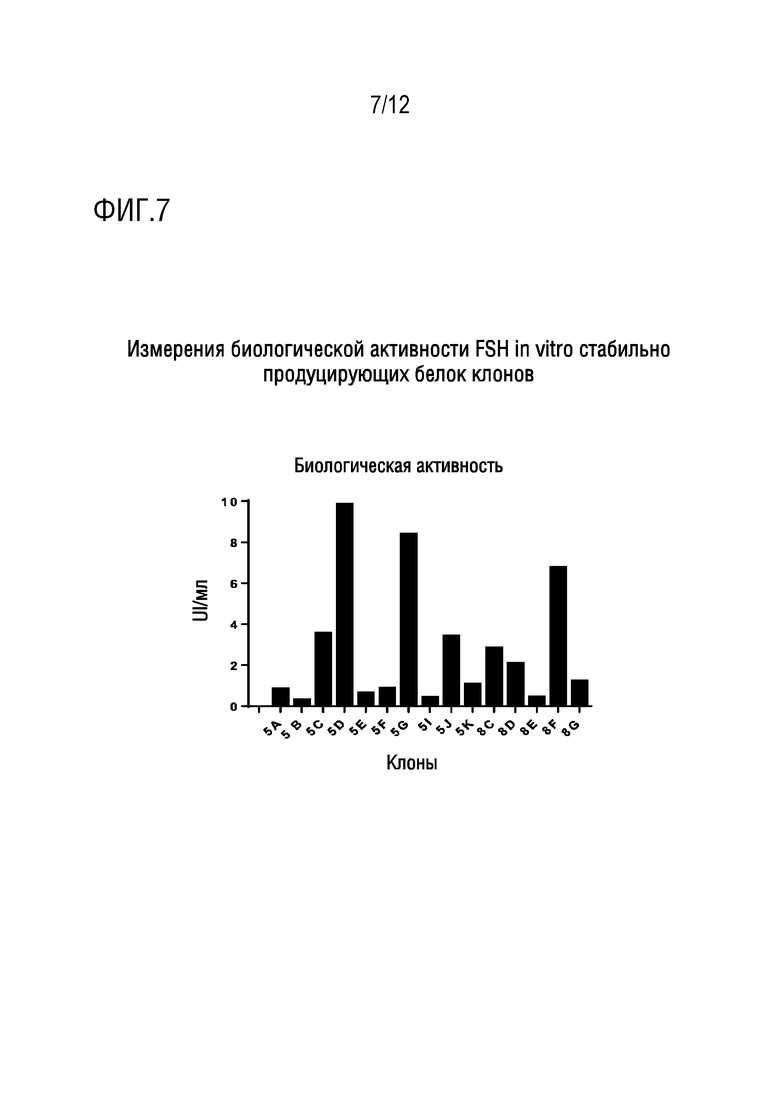
[025] На фигуре 7 показаны измерения биологической активности FSH in vitro стабильно продуцирующих белок клонов.
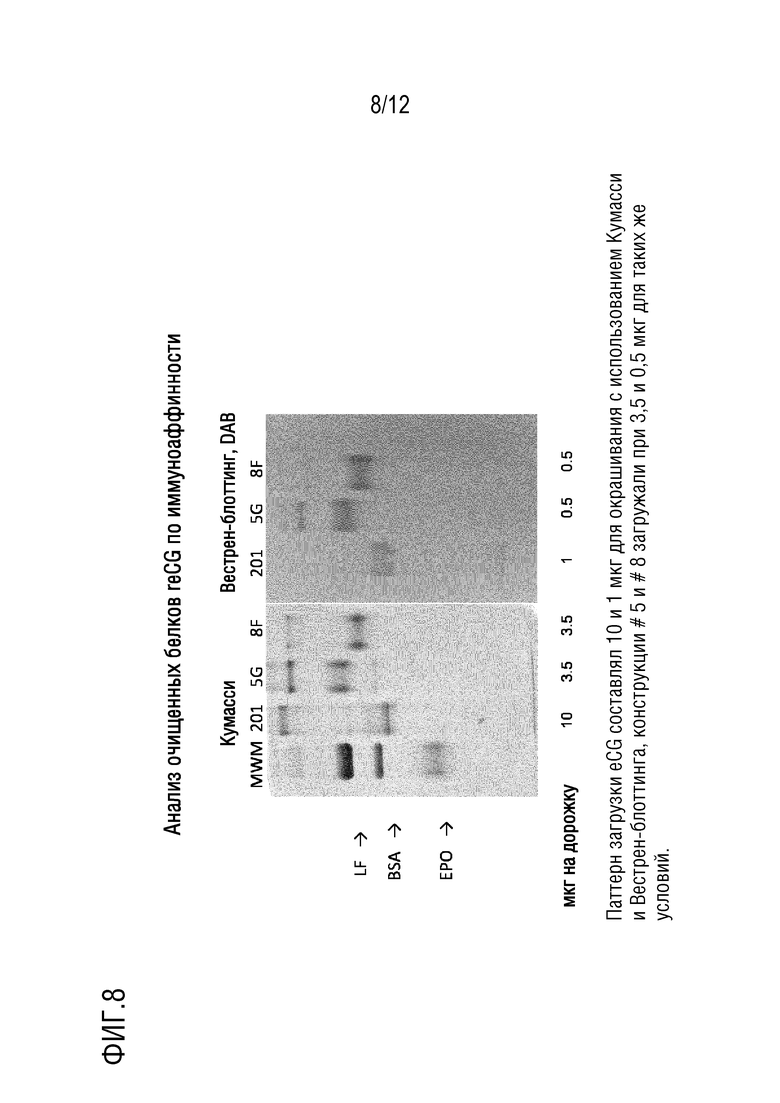
[026] На фигуре 8 показан анализ очищенных белков reCG по иммуноаффинности. Паттерн загрузки eCG составлял 10 и 1 мкг для окрашивания с использованием Кумасси и Вестрен-блоттинга, конструкции # 5 и # 8 загружали при 3,5 и 0,5 мкг для таких же условий.
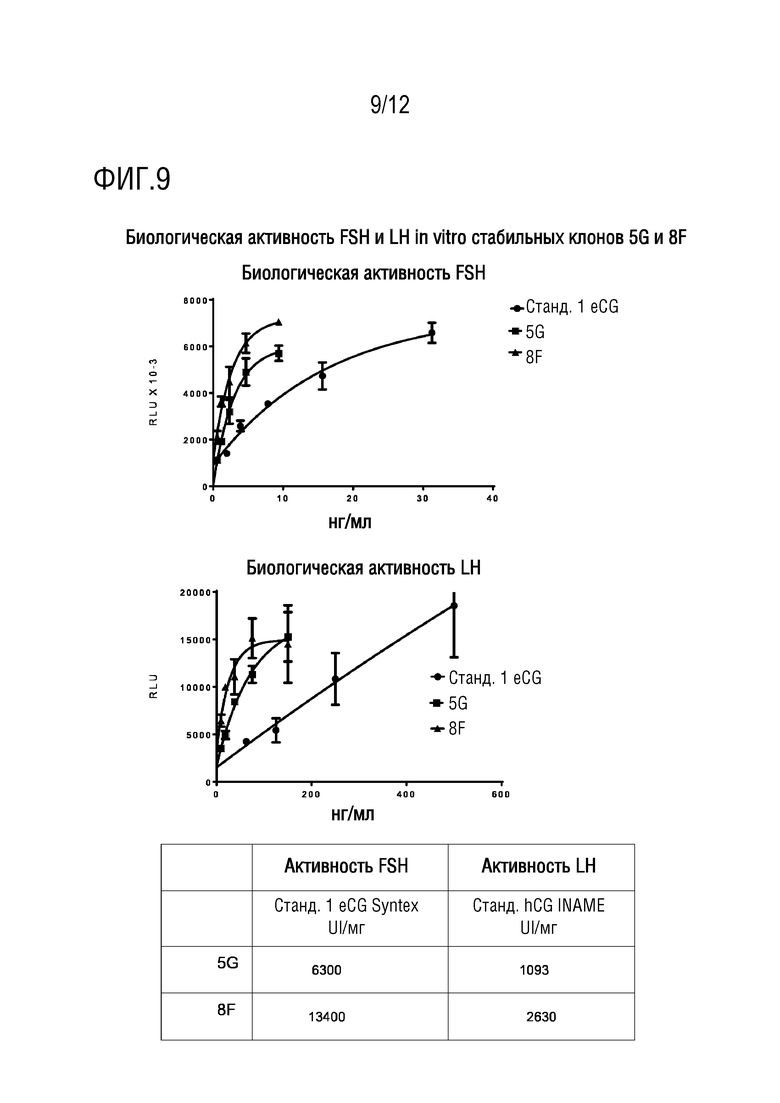
[027] На фигуре 9 показаны измерения биологической активности FSH и LH in vitro стабильных клонов 5G и 8F.
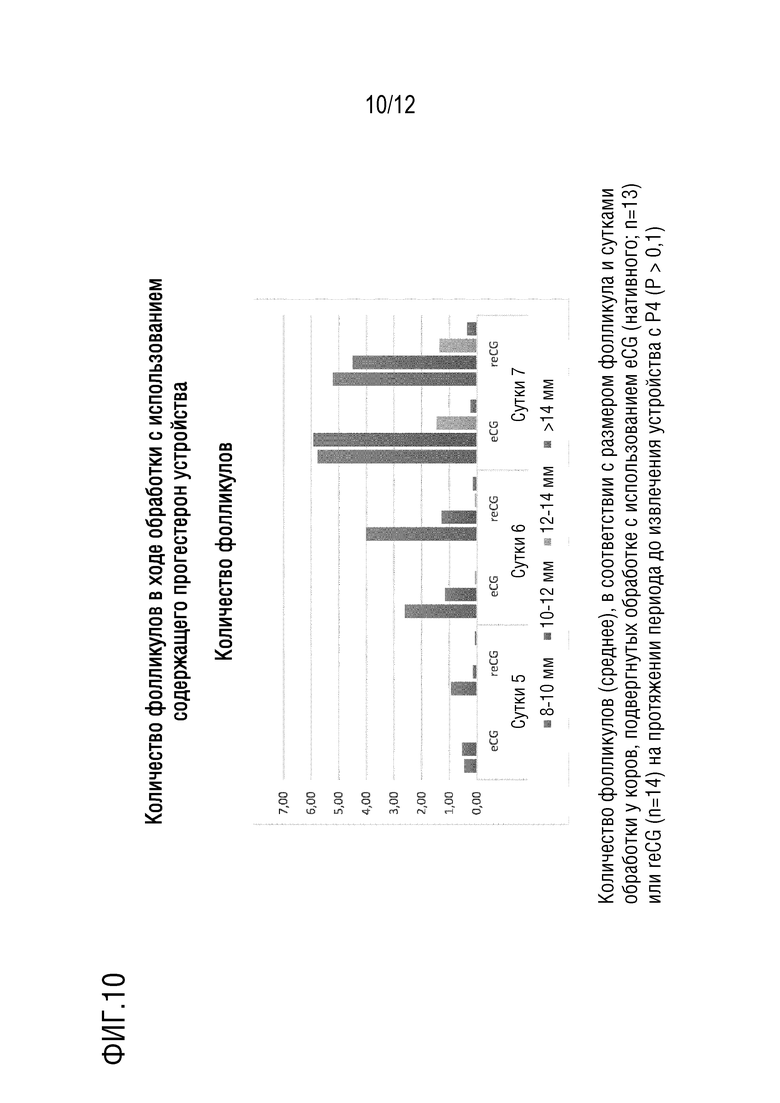
[028] На фигуре 10 показаны измерения количества фолликулов в ходе обработки с использованием устройства с прогестероном в полевых испытаниях у коров. Количество фолликулов (среднее), в соответствии с размером фолликула и сутками обработки у коров, подвергнутых обработке с использованием eCG (нативного; n=13) или reCG (n=14), на протяжении периода до извлечения устройства с P4 (P > 0,1).
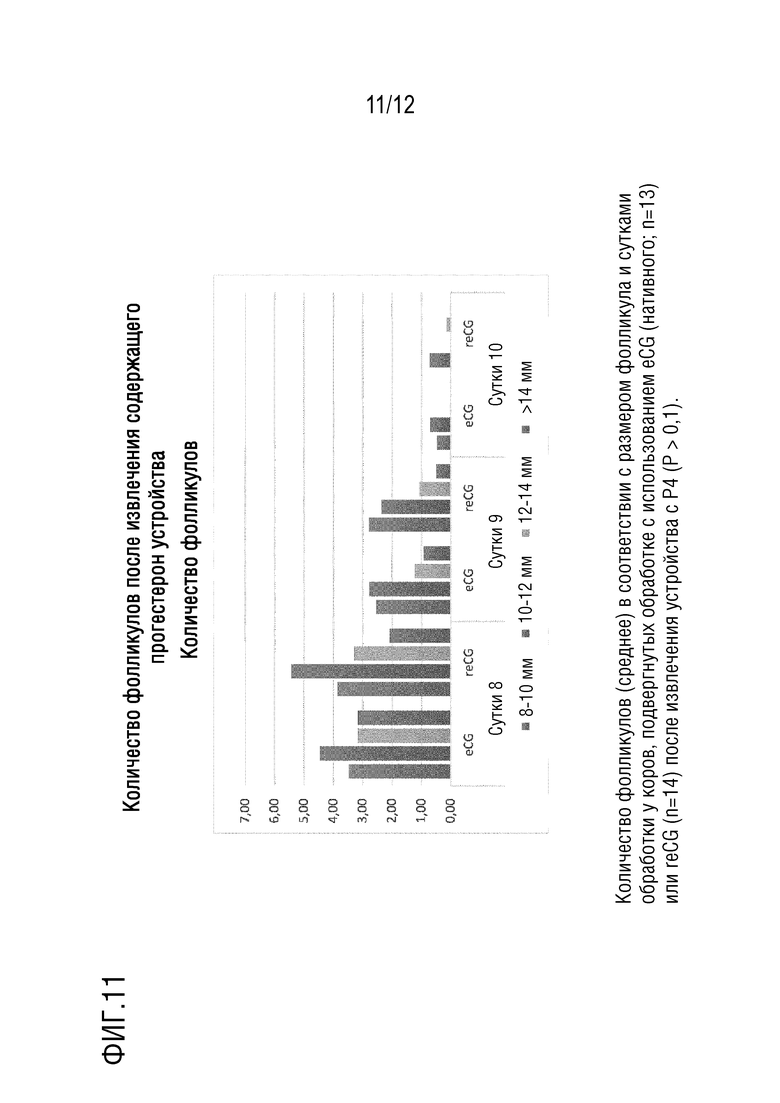
[029] На фигуре 11 показаны измерения количества фолликулов после извлечения устройства с прогестероном в полевых испытаниях у коров. Количество фолликулов (среднее) в соответствии с размером фолликула и сутками обработки у коров, подвергнутых обработке с использованием eCG (нативного; n=13) или reCG (n=14), после извлечения устройства с P4 (P > 0,1).
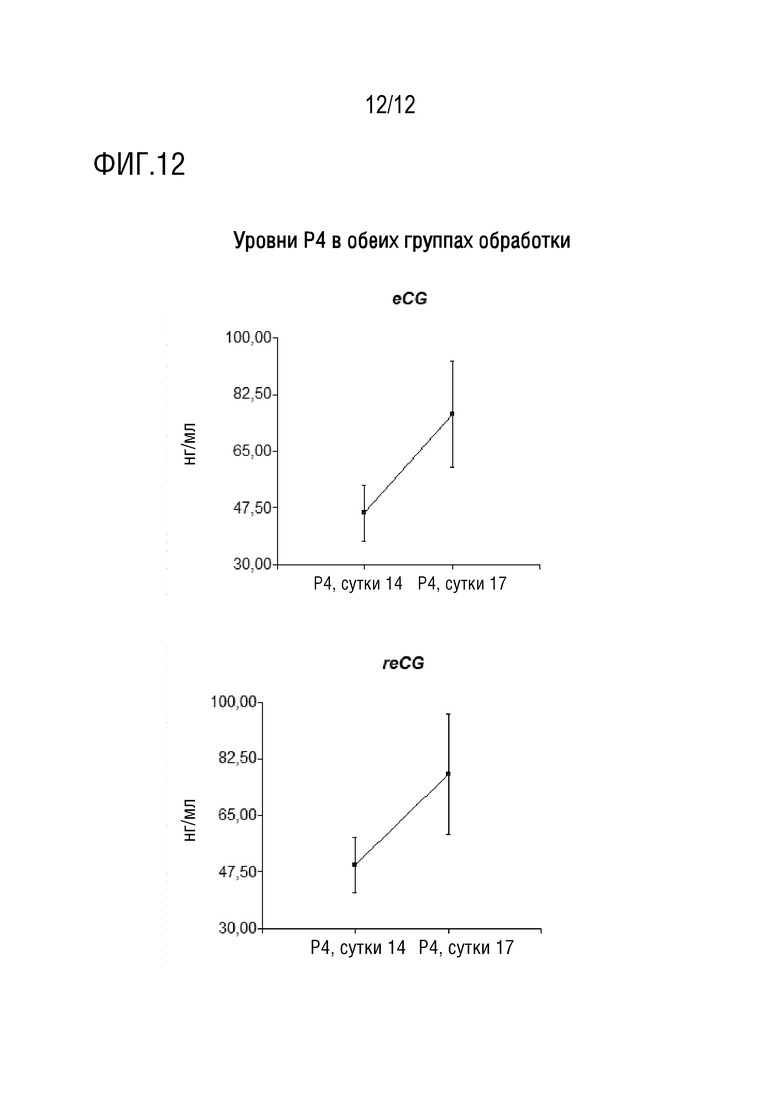
[030] На фигуре 12 показаны измерения количества фолликулов после извлечения устройства с уровнями P4 в обеих группах обработки.
ПОДРОБНОЕ ОПИСАНИЕ
Получение рекомбинантных вариантов слитого белка eCG альфа-бета
[031] В настоящем описании авторы настоящего изобретения описывают получение одиночной рекомбинантной альфа/бета цепи eCG (reCG) с добавлением участков гликозилирования для увеличения его времени полужизни в плазме. Конструкция одиночной цепи позволяет введение последовательности множества участков гликозилирования в качестве линкера и позволяет избежать проблемы ассоциации/диссоциации субъединиц.
[032] Для осуществления этого, авторы настоящего изобретения модифицировали последовательность гена посредством добавления двух последовательностей с множеством участков O-гликозилирования или N-гликозилирования. Последовательность O-гликозилирования является характерной для цепи бета и характеризуется тем, что находится в карбокси-концевом пептиде (CTP), последовательность для N-гликозилирования сконструирована из консенсусной последовательности N-гликозилирования у млекопитающих, и авторы настоящего изобретения называют ее NTP, в отличие от CTP, поскольку ее используют в амино (N)-концевом пептиде.
[033] Для оценки функциональности различных линкеров, получены экспрессирующие векторы, содержащие различные конструкции, как описано на фигуре 1. Нуклеотидные и аминокислотные последовательности каждого из этих вариантов представлены в прилагаемом списке последовательностей:
[034] SEQ ID NO: 1 соответствует полинуклеотидной последовательности конструкции, кодирующей NTP-БетаCTP-NTP-Альфа (КОНСТРУКЦИЯ # 2), и SEQ ID NO: 2 - ее аминокислотной последовательности. SEQ ID NO: 3 соответствует полинуклеотидной последовательности конструкции, кодирующей NTP-БетаCTP-CTP-Альфа (КОНСТРУКЦИЯ # 5), и SEQ ID NO: 4 - ее аминокислотной последовательности. SEQ ID NO: 5 соответствует полинуклеотидной последовательности конструкции, кодирующей NTP-БетаCTP-Альфа (КОНСТРУКЦИЯ # 8), и SEQ ID NO: 6 - ее аминокислотной последовательности. SEQ ID NO: 7 соответствует полинуклеотидной последовательности конструкции, кодирующей NTP-Бета-NTP-Альфа (КОНСТРУКЦИЯ # 10), и SEQ ID NO: 8 - ее аминокислотной последовательности. SEQ ID NO: 9 соответствует полинуклеотидной последовательности конструкции, кодирующей CTP-БетаCTP-CTP-Альфа (КОНСТРУКЦИЯ # 6), и SEQ ID NO: 10 - ее аминокислотной последовательности. SEQ ID NO: 11 соответствует полинуклеотидной последовательности конструкции, кодирующей БетаCTP-CTP-Альфа (КОНСТРУКЦИЯ # 4), и SEQ ID NO: 12 - ее аминокислотной последовательности.
Разработка способа определения eCG посредством конкурентного ELISA
[035] Связывающее антитело (Ab) представляет собой поликлональное антитело кролика против eCG, предоставленное Syntex. Специфические иммуноглобулины получены посредством очистки с использованием аффинной колонки с eCG, ковалентно связанным с агарозой CL. Индикатор получен посредством биотинилирования сиаловых остатков с использованием алкоксиамина-PEG12-биотина.
[036] Щелочную стрептавидин-фосфатазу (Strp-FA) использовали для количественной оценки не вытесненного Biot-eCG, присутствующего в образце или стандартной кривой.
[037] Тест проводят в 96-луночных планшетах для ELISA, стандартную кривую конструируют с использованием стандарта Станд. 1 eCG Syntex. Концентрацию щелочной фосфатазы определяют с использованием в качестве субстрата 4-нитрофенилфосфата в 100 мМ Трис pH9,2, 1 мМ MgCI2. Считывание при 405 нм. Динамический диапазон анализа составляет 20-0,16 нг/лунку.
Тест определения гонадотропной (FSH) биологической активности in vitro
[038] Клетки НЕК 293T трансфицировали с использованием плазмиды, несущей трансген бычьего рецептора гормона FSH и селективный антибиотик неомицин. После отбора по устойчивости к антибиотику и амплификации устойчивых клонов, экспрессию рецептора bFSH проверяли посредством связывания 125I-FSH в присутствии или в отсутствие 1 IU стандарта, предоставленного INAME, в качестве конкурента для подтверждения специфического связывания.
[039] Клоном, который экспрессировал рецептор FSH, связывал лиганд с высокой аффинностью, и для которого это связывание вызывало ответ синтеза вторичного мессенджера cAMP, проводили трансфекцию с конструкцией репортера люциферазы под контролем промотора CRE (pGL4 Promega). Клетки, которые имели эту конструкцию в присутствии cAMP, продуцировали люциферазу пропорционально количеству вторичного мессенджера. Фермент люцифераза трансформирует люциферин в присутствии ATP+O2 в метаболит и свет. Эта люминесценция, когда собрана вся система, является пропорциональной концентрации аналита, имеющего фолликулостимулирующую активность. Динамический диапазон теста составляет 12,5-0,4 мU/пробирку.
[040] Типичная кривая зависимости ответа от дозы для биологической активности in vitro показана на фигуре 2.
Тест определения лютеотропной биологической активности in vitro
[041] Линия клеток Лейдига мышей конститутивно экспрессирует рецептор LH и до гонадотропного стимула отвечает продукцией cAMP и секрецией прогестерона. Существующую линию переклонировали посредством частичной потери ответа на LH/hCG, и отобрали клон с наивысшим ответом на hCG, его трансфицировали с репортерным геном CRE-Luc, как для клеток HEK в анализе активности FSH.
[042] Тест проводят в планшетах P96, покрытых коллагеном, посредством рассева 25000 клеток на лунку и предварительной инкубации в течение 48 часов, затем стандартную кривую hGC или образец добавляют, продолжая инкубацию в течение 3 часов. После истечения времени стимуляции, культуральную среду отбирают, реагент добавляют для определения активности люциферазы, как в предшествующем тесте. Динамический диапазон теста составляет 50-0,8 мIU/лунку.
[043] Типичная кривая зависимости ответа от дозы для hCG показана на фигуре 3.
Тест определения биологической активности in vivo
[044] Образцы анализировали с использованием Европейской фармакопеи девятого издания (Eh. Ph.9), монографии Лошадиный хорионический гонадотропин для ветеринарного применения, в качестве аналитического стандарта.
[045] Присутствие лошадиного хорионического гонадотропина (eCG), либо природного, либо рекомбинантного, и его последующая биологическая активность (FSH), должна вызвать у неполовозрелых самок крыс, подвергнутых инъекции продукта, увеличение массы яичников. Это увеличение определяют посредством сравнения средней массы пары яичников, полученных после обработки, относительно массы пары яичников без обработки (исходной массы). Исходная масса пары яичников для линии, используемой в исследовании (Sprague Dawley (sd)) составляет ниже 25 мг.
[046] Способ: 0,2 мл образцов инъецировали подкожно выбранным крысам.
[047] Инъекции повторяли через 18, 21, 24, 42 и 48 часов после первой инъекции (сохраняя растворы в холодильнике). Животных умерщвляли не менее, чем через 40 часов и не более чем через 72 часа после последней инъекции. Затем яичники извлекали, отделяя жир, спайки и яйцевод, у каждого животного, и наконец, оба яичника каждой обработанной крысы взвешивали.
[048] Все манипуляции с животными, инъекцию, забой, извлечение, очистку и взвешивание яичников проводил персонал, обученный этим способам и манипуляциям с животными.
[049] Самок крыс линии Sprague Dawley (sd) в возрасте 21-28 суток (с промежутком друг от друга не более трех суток) и массой приблизительно 50-55 г (в диапазоне±10 г) использовали внутри выбранной группы.
Определение функциональности конструкций
A - Оценка в клетках HEK293T
[050] Для тестирования гонадотропной активности различных конструкций reCG, линия клеток HEK293T выбрана в качестве платформы для синтеза рекомбинантных белков. Эта линия клеток имеет характеристику наличия T-антигена, который вызывает умножение плазмид, если они имеют ген SV40, это означает, что при использовании временной трансфекции происходит экстраординарная экспрессия рекомбинантных белков, клонированных в подходящих плазмидах. Она имеет недостаток паттерна гликозилирования, который вынуждает рекомбинантные белки, синтезированные этой линией, иметь очень короткое время полужизни при присутствии в комплексных системах. Активность в системах без клиренса, в общем, не затронута, и таким образом, эти белки используют для тестирования активностей в системах in vitro.
[051] Виды биологической активности in vitro, определенные для каждой из конструкций 2, 5, 8 и 10, экспрессированных в клетках HEK293T, показаны на фигуре 4. Результаты для клеток HEK in vitro, из которых фиг. 4 является типичной, позволили авторам настоящего изобретения заключить, что сконструированные слитые белки имеют обе активности eGC in vitro.
[052] С другой стороны, исследовали биологическую активность in vivo тех же самых конструкций reCG (рекомбинантных), синтезированных в линии клеток HEK293T. Биологическую активность образцов оценивали при 500 IU/мл, в соответствии с результатами, полученными по тестам in vitro.
[053] Полученные результаты, во всех случаях, показали средние массы яичников ниже 25 мг, то есть, сходные с исходной массой для исследуемого штамма.
[054] Таким образом, заключили, что конструкции, синтезированные в клетках HEK, несмотря на то, что они имеют биологическую активность in vitro, лишены биологической активности in vivo.
В - Оценка в клетках CHOK1
[055] Благодаря результатам, полученным в клетках HEK293T, разработку reCG продолжали, с использованием в качестве платформы клеток CHOK1, продуцирующих гликопротеины, которые, как правило, имеют время полужизни в плазме больше, чем для HEK и SF9. Выбранные конструкции представляли собой #5 и #8, поскольку они экспрессировались в более высоких количествах в тестах in vitro.
[056] Сравнение биологической активности FSH in vitro белков, синтезированных посредством 10×106 клеток HEK или CHO, показано на фигуре 5.
[057] С другой стороны, белки, присутствующие в супернатантах, анализировали в 2 нативных полиакриламидных гелях, с использованием одного из них для детекции тотальных белков с использованием окрашивания Кумасси G250, и другого - для переноса на нитроцеллюлозную мембрану для анализа с использованием антитела, полученного у кроликов против нативного eCG. Полученные результаты показаны на фигуре 6.
[058] Кажущийся размер рекомбинантных белков, синтезированных в клетках HEK, является сходным с паттерном экстрагируемого eGC. Это показывает, что отсутствие наблюдаемой активности in vivo не обусловлено гидродинамическим объемом полипептидов, синтезированных в клетках HEK, или уровнем гликозилирования, но обусловлено его качеством.
[059] Таким образом, продолжили работу с рекомбинантными белками, продуцированными в клетках CHOK1, и с конструкциями #5 и #8, экспрессирующимися в более высоких количествах.
[060] Тест биологической активности in vivo показал увеличение массы яичников в пределах минимальных значений стимуляции из стандартной кривой. Для контрольной кондиционированной среды не получено значений, отличных от контроля.
[061] Принимая во внимание узнавание рекомбинантного гормона в Вестерн-блоттинге, проводимом с использованием антитела, полученного против нативного eCG, супернатант временно трансфицированных клеток CHO очищали с использованием аффинной колонки с использованием конструкции eCG #5. Всего получено 13 мкг белка с активностью FSH in vitro 61 IU. Активность in vivo определяли у 3 животных, для которых показаны массы яичников 203,9 мг, 119,8 мг и 172,9 мг, значения стимуляции, сходные с максимумом стандартной кривой.
Получение стабильно продуцирующих белок клонов
[062] Клетки CHO K1 трансфицировали с использованием конструкций eCG #5 и #8, и отбирали с использованием антибиотика G418 для получения клеток, стабильно несущих трансген. После достижения конфлюэнтности, экспрессию гормона определяли посредством ELISA, организованного для детекции активности 0,6 нг в 50 мкл аликвотах супернатанта.
[063] Критериями отбора клонов являлся хороший рост и продукция более чем 1,5 IU/мл, c 4 клонами из конструкций #5 и 3 - из #8, оставшимися в качестве кандидатов. Результаты показаны на фигуре 7.
[064] Клоны 5D, 5G, 5J и 8F размножали для определения биологической активности in vivo, и в соответствии с результатами, клоны 5G и 8F выбраны для продолжения выделения рекомбинантных белков посредством аффинной хроматографии двух конструкций для их дальнейшей характеризации.
Очистка reCG посредством иммуноаффинности
[065] Использовали иммунную сыворотку против eCG, полученную у овец в Syntex. Специфические IgG выделяли по аффинности с использованием колонки с eCG-сефарозой, получая 3 мг IgG против eCG на мл сыворотки. Аликвоты антисыворотки против eCG диализовали против буфера для связывания (бикарбонат-NaCl) с получением всего 90 мг IgG, которые связывали с 9 мл сефарозы-NHS.
[066] Кондиционированную среду, фильтрованную посредством 0,22 мкг, подвергали хроматографии при 1 мл/см2/минуту, промывали слой с использованием PBS до возврата к фоновым значениям и элюировали с использованием 3 мл глицина, pH3, собирая пик поглощения при 280 нм. Глициновый элюат, pH3, подвергали нейтрализации, диафильтрации против PBS и концентрировали.
[067] Получено 850 мкг конструкции #5 и 360 мкг - #8. Их анализировали посредством PAGE без восстановителя, выявляя полосы тотального белка посредством окрашивания Кумасси и специфические полосы - посредством Вестерн-блоттинга с использованием, в качестве первого антитела, антитела, полученного в Syntex с использованием нативного гормона у кроликов. Результаты представлены на фигуре 8.
[068] Следует отметить, что, в случае рекомбинантных гормонов, единственные полосы, выявленные с использованием антитела, являются такими же, как полосы, окрашенные с использованием Кумасси. Полосы очень высокой массы, возможно, представляют собой димеры слитых белков, в то время как полоса низкой массы, наблюдаемая в нативном белке, обусловлена частичной диссоциацией гетеродимера в условиях анализа с SDS, но без восстанавливающих средств.
[069] Определяли гонадотропную и лютеотропную активность in vitro обоих белков и стандарта 1 eCG Syntex. Результаты зависимой от дозы активности для массы и активности люциферазы, выраженной как относительные единицы люминесценции (RLU), представлены на фигуре 9. Различия в специфической активности между рекомбинантными и нативными гормонами являются заметными, являясь более заметными в случае лютеотропного гормона, где для нативного гормона не получено насыщения активности даже при более высоких дозах.
Исследование биологической активности стабильно полученных продуцирующих белок клонов
[070] Клетки CHOK1 трансфицировали с использованием конструкций #5 и #8 и отбирали для получения клеток, стабильно несущих трансген.
[071] Отбирали клоны с хорошим ростом и продукцией, размножали клоны 5D, 5G, 5J и 8F, и определяли их биологическую активность. Результаты показаны ниже:
Таблица 3. Биологическая активность in vivo стабильных клонов reCG.
[072] Благодаря результатам идентификации положительного eCG и высокой степени роста яичников подвергнутых обработке животных, по сравнению с исходными массами 25 мг, было решено сделать первое приближение оценки указанных образцов.
[073] Для этого, образцы различных клонов анализировали посредством аналитического способа на основе стандартной 3-точечной кривой eCG для различной концентрации, с использованием второго стандарта ecG Syntex, который был получен в Syntex и оценен по сравнению со стандартом: «Международный стандарт NIBSC, код 62/001 (NIBSC)».
[074] Благодаря высокому ответу в предшествующем тесте, образцы оценивают при теоретической активности 30 IU/мл, полученные результаты можно видеть в форме, используемой для обработки полученных необработанных данных:
Определение биологической активности в точке PMSG
Таблица масс яичников (мг), в зависимости от дозы
[075] Заключили, что анализированные клоны продуцируют рекомбинантный белок с положительной биологической активностью, с заметным увеличением массы яичников.
[076] Все подвергнутые обработке животные (8 животных для каждого анализированного образец) отвечали на обработку, без исключения.
[077] Кроме того, при сравнении ответов, известных авторам настоящего изобретения, и полученных у животных, подвергнутых обработке с использованием природного гормона, ответы, доказанные с использованием рекомбинантного гормона, являются идентичными, и странных сигналов или атипичного поведения не наблюдают у подвергнутых обработке животных.
[078] По полученным данным, активность клонов является следующей:
> 5D: 26 IU/мл
> 5G: 33 IU/мл
> 5J: 20 IU/мл
> 8F: 17IU/мл
Исследование процесса очистки:
[079] Целью являлось исследование того, приводит ли очистка к деградации молекулы или присутствовала ли ее потеря как последствие этого процесса.
[080] Образец конструкции 5G, подвергнутой процессу очистки, инъецировали 3 животным. Полученные ответы являлись следующими:
> 203,9 мг - 172,9 мг - 119,8 мг
[081] Поскольку значения роста являлись согласованными с значениями, полученными для указанного неочищенного клона, заключили, что eCG не подвергается потере или деградации в ходе очистки.
[082] В случае конструкции 8F, последующие попытки получения достаточной массы для определений биологической активности in vivo являлись отрицательными. Таким образом, пока не определен способ продукции, только для конструкции #5 продолжают развитие проекта.
Исследование лютеинизирующей активности (LH):
[083] Исследовали биологический ответ самцов крыс Sprague Dawley (sd) в возрасте 21-28 суток при подвергании обработке с использованием образца #5.
[084] Способ:
[085] Получали группу из самцов крыс Sprague Dawley (sd) в возрасте 21-28 суток (с промежутками возраста между ними не более трех суток) и массой приблизительно 60-65 грамм (с интервалом±10 грамм) из выбранной группы.
[086] Образец инъецировали подкожно в течение 4 последовательных суток, в объеме 0,5 мл каждые 24 часа.
[087] Крыс умерщвляли через 24 часа после последней инъекции, затем семенные пузырьки извлекали, очищали, высушивали с использованием фильтровальной бумаги и взвешивали.
[088] Задачи манипуляции с животными, инъекции, забоя, извлечения, очистки и взвешивания семенных пузырьков проводил обученный персонал вивария.
[089] Раствор образца получали посредством расчета, в соответствии с его активностью, массой или объемом, которые следует брать, и затем доведения до концентрации 5,264 IU/мл
[090] Результаты: 4 животных подвергали обработке, массы семенных пузырьков после обработки являлись следующими:
> 44,0 мг - 58,0 мг - 48,0 мг - 52,0 мг
[091] Зная, что для используемой линии крыс исходная масса пузырьков (без обработки) составляет ниже 12 мг, и что в пределах 50 мг ответ начинает насыщаться, авторы настоящего изобретения могут заключить, что присутствие лютеинизирующей активности доказано.
[092] Этот анализ подтверждает двойную активность рекомбинантного eCG: присутствует фолликулостимулирующая активность и лютеинизирующая активность.
Определение фолликулостимулирующей и лютеинизирующей активности конечного образца 5G
[093] Лютеинизирующую и фолликулостимулирующую активность анализировали в соответствии с Европейской фармакопеей издания 9.
[094] Анализировали группы из не менее, чем 8 животных, с использованием национального стандарта hCG INAME и второго стандарта eCG Syntex.
Результаты:
[095] На основании вышеуказанного, заключили, что рекомбинантный eCG, происходящий из конструкции #5, имеет две выдающихся активности, как фолликулостимулирующего (FSH), так и лютеинизирующего гормона (LH), подобно природному гормону.
Определение преимущества модификации амино-концевого пептида для активности in vivo
[096] Отсутствие биологической активности in vivo слитых белков с использованием в качестве линкера CTP из β-цепи eCG, для eCG, синтезированного в клетках как SF9, так и mimic (Legardinier, J Mol Endo (2005) 34), CHO K1 (Min, Endocrine Journal (1996), 43 585-593), или продуцированного в молочной железе трансгенных кроликов (Galet et al, Mol Cell Endocrinol 174 (2000) 31), показывает важность не только количества, но также качества гликозилирования. Таким образом авторы настоящего изобретения тестировали две альтернативные #5 конструкции, одну, названную #4, которая представляет собой слитый белок из слитых α- и β-цепей eCG, как конструкция #5, но без модификаций на амино-конце, и другую конструкцию #6, сходную с #5 в отношении наличия модифицированного амино-конца, но в этом случае, с использованием пептидной последовательности CTP. Эта модификация оценивает важность амино-концевой модификации для одинаковой линкерной последовательности.
[097] Клетки CHO K1 трансфицировали плазмидами, кодирующими конструкции #4 и #6, и отбирали по устойчивости к неомицину. Устойчивые клетки клонировали посредством разведения, выбирая те, которые экспрессируют белки в наивысшем количестве, как определено посредством ELISA (клоны 4C и 6A). Их культивировали в среде DMEN-F12 5% SFB, кондиционированную среду собирали, белки преципитировали с использованием сульфата аммония, суспендировали в PBS и диализовали против PBS 36-48 часов с тремя заменами буфера. Концентрацию рекомбинантных белков определяли посредством ELISA и биологической активности in vitro посредством стимуляции активности люциферазы.
конструкция eCG 4C 13341 IU/мг
конструкция eCG 5G 4013 IU/мг
конструкция eCG 6A 4768 IU/мг
[098] Наибольшая биологическая активность in vitro белка, синтезированного посредством конструкции 4C, является сходной с результатами, обнаруженными с использованием слитого белка из цепей бета-альфа (Min, Endocrine Journal (1996), 43 585-593). Ожидали также, что если для этого белка покажут активность в системах in vivo, она будет ниже, чем для других рекомбинантных белков (reCG-5G и reGC-6C).
[099] Когда эти белки тестировали в анализе in vivo, для белка, полученного с использованием конструкции 5G, который имеет пептид NTP на амино-конце, показана активность 5477 IU/мг, в то время как обе конструкция с пептидом CTP на амино-конце и конструкция без модификации в ней (6A и 4C, соответственно) не приводили к увеличениям массы яичников подвергнутых обработке животных.
[100] Эти данные явно показывают, что модификация амино-конца с использованием пептида NTP слитого белка из цепей альфа и бета лошадиного хорионического гонадотропина придает увеличение времени полужизни и таким образом, присутствие активности in vivo.
Сравнительные полевые испытания
[101] Для оценки действия рекомбинантных гормонов в полевых условиях, тестировали, вызывает ли внутримышечная инъекция оцененной дозы 2000 IU рекомбинантного белка eCG, происходящего из конструкции # 5 (reCG # 5), такой же суперстимулирующий и суперовуляторный ответ, который возникает в результате инъекции дозы 2000 IU нативного eCG (Novormon 5000, Syntex).
[102] Уровни прогестерона (P4) на сутки 3 и 7 после овуляции являются сходными у коров, подвергнутых обработке с использованием дозы 2000 IU нативного eCG или reCG # 5.
[103] Исследование проводили на зоотехнической станции Santa Julia из Catholic University of Cordoba (UCC) на протяжении мая, июня и июля 2019 г.
[104] Использовали 14 яловых коров Angus/Hereford в возрасте между 3 и 5 лет (тест проводили в двух повторах из 7 животных на группу в каждом повторе); у всех коров присутствовало желтое тело в начале обработки (цикличной). Физическое состояние (BCS) составляло в среднем 2,5 (шкала 1-5; изображение 1).
[105] Животных кормили по требованию рулонами люцерны хорошего качества и 15 кг ежесуточно на корову рубленного силоса из кукурузы в двух ежесуточных кормлениях, вводимых в кормушках и доставляемых посредством трактора с распределительной мешалкой.
Группы обработки:
[106] Всего 18 коров подвергали обработке на сутки -10 обработки с использованием дозы 500 мкг клопростенола (циклазы, Syntex), и детекцию течки проводили после введения PGF, 14 коров, для которых показана течка после PGF, отбирали для включения в исследование.
[107] Всех коров (14) подвергали обработке на сутки 0 обработки с использованием интравагинального устройства (DIB, 1 грамм P4, Syntex) плюс 2 мг бензоата эстрадиола (Gonadiol, Syntex), для синхронизации появления новой фолликулярной волны приблизительно на сутки 4 обработки (Bo et al, 1994).
[108] На сутки 4, коров разделяли на две группы для введения 2000 IU нативного eCG (группа eCG, n=7) или дозы 350 мкг продукта, полученного в Syntex, (группа reCG # 5, n=7), который оценивали как являющийся эквивалентным 2000 IU нативного eCG. Объем всех инъекций доводили до 10 мл, и инъекция являлась глубокой внутримышечной.
[109] На сутки 6,5 обработки, вводили дозу 500 мкг PGF (циклазы, Syntex), и вторую дозу вводили на сутки 7, в это время удаляли устройства с P4 (DIB 1 г, Syntex Argentina). Через сутки (сутки 8) вводили дозу 100 мкг GnRH (Gonasyn, Syntex).
[110] Через 20 (сутки -10 из повтора 2) суток после окончания повтора 1 (сутки 17), коров подвергали обработке с использованием такого же способа, но в этом случае коров из группы нативного eCG подвергали обработке с использованием reCG # 5, и наоборот. Таким образом всех коров пропускали через обе группы обработки.
Таблица 4. Повтор 1.
Таблица 5. Повтор 2.
* Доза на корову =10 мл - im
[111] Ультразвуковые сканирования яичников проводили на сутки, указанные в таблицах 4 и 5 выше. Структуры яичников очерчивали и регистрировали в электронной таблице, разработанной для этой цели.
[112] Животных исследовали посредством трансректального ультразвукового исследования (Chison 500; 7,5 МГц, Доплер). Все фолликулы диаметром более 3 мм идентифицировали, измеряли и наносили на диаграмму по отношении к их локализации в яичнике, для оценки изменений в каждом из них индивидуально. Используемый способ отслеживания представлял собой способ, описанный в работе (Knopf et al., 1989) и адаптированный в Bo (Bo et al., 1994). Данные, подлежащие оценке, представляют собой: диаметр доминантных фолликулов и основных подчиненных, количество фолликулов > 3 мм, присутствующих в яичниках. После инъекции eCG или reCG # 5, идентифицировали фолликулы диаметром более 8 мм. После введения GnRH, овуляцию определяли как исчезновение фолликулов более чем 8 мм, идентифицированных в предшествующем наблюдении. После овуляции, измеряли размер и количество желтого тела (CL), возникающего в результате овуляций (Adams et al., 1992).
[113] С другой стороны, как указано в таблицах 4 и 5, образцы крови отбирали на сутки 14 и 17 обработки для определения уровней прогестерона (P4), возникающего в результате овуляций.
[114] Образцы крови получали посредством пункции всех коров в яремную вену для определения уровней прогестерона в плазме. Одноразовую иглу (18 G) использовали для каждого животного, и кровь отбирали из стерильной 10 мл стеклянной пробирки с резиновой крышкой. Образцы всегда получали в пробирках с гепарином, немедленно после сбора их центрифугировали, и плазму замораживали при -20°C, в двух повторах (A или B), и надлежащим образом идентифицировали в соответствии с номером бирки коровы, датой и временем обработки, и либо A либо B.
[115] Образцы обрабатывали посредством способа иммунохемолюминесценсции (ECLIA, COBAS модуль e601, Roche).
[116] Среднее количество фолликулов по размеру (8-10 мм, 10-12 мм, 12-14 мм и > 14 мм) и по суткам обработки (сутки 5, сутки 6, сутки 7, сутки 8, сутки 9 и сутки 10) сравнивали посредством ANOVA.
[117] Среднее количество овуляций на сутки обработки сравнивали с использованием такой же статистики.
[118] Таким же способом, уровни P4 сравнивали на сутки 14 и 17 способа. Во всех случаях, учитывали эффект группы обработки, повтор и их взаимодействие. Использовали программное обеспечение Infostat (Di Rienzo et al., 2018).
[119] Результаты:
[120] Корову из группы eCG в повторе 2 исключили из исследования на сутки 6 обработки из-за респираторного заболевания. Корову подвергали обработке в соответствии с нормальными способами центра исследования под руководством ответственного ветеринара.
[121] Не обнаружено различий между количеством фолликулов (в соответствии с размером) на любые из суток обработки (P> 0,1). Не присутствовало эффекта повтора (P> 0,07) или взаимодействия повтор * группа (P> 0,4).
Таблица 6. Количество фолликулов (среднее±SEM) в соответствии с размером фолликулов и сутками обработки у коров, подвергнутых обработке с использованием eCG (нативного; n=13) или reCG #5(n=14)
Группа=P>0,10
Повтор=P>0,07
Группа * повтор=P>0,4
[122] Эти результаты показаны также на фигуре 10, на которой можно видеть информацию о количестве фолликулов (разделенную по размеру) в ходе обработки с использованием интравагинального устройства (сутки 5-7 способа). Графически можно наблюдать, что количество фолликулов, присутствующих в обеих группах, не отличается.
[123] Таким же образом, на фигуре 11 можно видеть количество фолликулов после удаления устройства с прогестероном.
[124] Все диагностированные овуляции (исчезновение фолликулов > 8 мм) происходили между сутками 9, 10 и 11 (только у одной коровы из группы eCG произошла овуляция на сутки 11) обработки. Не обнаружено различий количества овуляций между обеими группами обработки (P=0,83; Таблица 3). Также не присутствовало эффекта повтора (P=0,06) или взаимодействия повтор * группа (P=0,85).
[125] Не обнаружено различий (P> 0,7) средних уровней P4 между обеими группами обработки на сутки 14 и 17 обработки. Также не обнаружено эффекта повтора (P> 0,9). В следующей таблице показаны результаты.
Таблица 7. Уровни P4 у коров, подвергнутых обработке с использованием 2000 IU eCG или его эквивалента в дозах обработки с использованием eCG-подобного, на сутки 14 и 17 обработки.
P> 0,7
[126] На фигуре 12 показаны уровни P4 в обеих группах и на сутки отбора образцов.
[127] На основании полученных результатов, авторы настоящего изобретения могут заключить, что reCG # 5, инъецированный тестируемым животным, приводит к гонадотропной активности, сходной с активностью, образуемой нативным eCG (Novormon). Это потому, что суперстимулирующий ответ, обнаруженный в обеих группах коров, являлся сходным до и после удаления устройства с прогестероном, так же как количество овуляций, обнаруженное после удаления устройства.
[128] С другой стороны, авторы настоящего изобретения могут заключить, что время полужизни обоих продуктов является сходным, поскольку скорость роста фолликулов являлась сходной в обеих группах; однако, специфическое исследование для определения времени полужизни следует провести в будущем.
[129] Частоты овуляции, обнаруженные в этом исследовании, с использованием 2000 IU eCG, являлись сходными с частотами, опубликованными другими авторами с использованием такой же дозы у биотипически сходного крупного рогатого скота (Alfuraiji et al., 1993; Goulding et al., 1996).
[130] Не обнаружено различий в уровнях P4 на сутки 14 и 17 обработки, что показывает, что функциональность и количество желтых тел, присутствующих в каждой группе обработки, являются эквивалентными друг другу.
[131] Наконец, и на основании сходного полученного ответа, авторы настоящего изобретения считают, что reCG # 5, используемый в этом исследовании, можно использовать в более низких дозах (400 IU) для увеличения частот беременностей, полученных в программах FTAI у находящихся в отсутствие течки мясных коров и молочных коров. То есть, он может оказывать такой же эффект, как нативный eCG, при использовании для этой цели.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Syntex S.A.
Abentin, Alejandro D.
<120> РЕКОМБИНАНТНЫЙ ХОРИОНИЧЕСКИЙ ГОНАДОТРОПИН, СПОСОБ ЕГО
ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ПРИМЕНЕНИЯ
<130> MOM 234048
<160> 12
<170> PatentIn версии 3.5
<210> 1
<211> 1063
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность, кодирующая
NTP-БетаCTP-NTP-Альфа
<400> 1
atggagaccc tgcagggcct gctgctgtgg atgctgctga gcgtgggagg cgtgtgggct
60
ggcgatatcg gcctgaacat caccggcagc ggcctgaata tcacaggctc tggcctgaac
120
attaccggct ctggcctgaa tatcaccggc cctggctcta cagatatcag cagaggacca
180
ctgaggcctc tgtgccggcc tatcaacgcc accctggctg ctgagaagga ggcttgccca
240
atctgtatca cattcaccac aagcatctgc gccggctact gtccatccat ggtgcgcgtg
300
atgccagccg ctctgccagc tatccctcag ccagtgtgca cctatcggga gctgaggttc
360
gcttccatca ggctgccagg atgtccacct ggagtggacc ctatggtgtc ctttccagtg
420
gctctgtctt gccactgtgg cccctgccag atcaagacca cagactgtgg cgtgtttagg
480
gatcagccac tggcttgtgc tcctcaggct agctcctcta gcaaggatcc accctcccag
540
cccctgacca gcacatccac ccccacacct ggcgcttctc ggaggtcctc tcacccactg
600
cccatcaaga cctctggcag cggcctgaac atcacaggtt ctggcctgaa tattactggc
660
tctggcctga acatcaccgg ttccggcctg aatattaccg gcccaggctc cacatctttc
720
cccgacggcg agtttaccac acaggattgc cccgagtgta agctgaggga gaacaagtac
780
ttctttaagc tgggcgtgcc tatctatcag tgcaagggct gctgtttcag ccgggcctac
840
cctaccccag ctagaagccg caagacaatg ctggtgccta agaatatcac cagcgagtcc
900
acatgctgcg tggccaaggc ttttatccgg gtgaccgtga tgggcaacat caagctggag
960
aatcacaccc agtgctactg ttctacatgt tatcaccaca agatctgatt tcctgatgga
1020
gagtttacaa cgcaggattg cccagaaccc ccatcccaac ctc
1063
<210> 2
<211> 335
<212> белок
<213> Искусственная последовательность
<220>
<223> Рекомбинантный белок NTP-БетаCTP-NTP-Альфа
<400> 2
Met Glu Thr Leu Gln Gly Leu Leu Leu Trp Met Leu Leu Ser Val Gly
1 5 10 15
Gly Val Trp Ala Gly Asp Ile Gly Leu Asn Ile Thr Gly Ser Gly Leu
20 25 30
Asn Ile Thr Gly Ser Gly Leu Asn Ile Thr Gly Ser Gly Leu Asn Ile
35 40 45
Thr Gly Pro Gly Ser Thr Asp Ile Ser Arg Gly Pro Leu Arg Pro Leu
50 55 60
Cys Arg Pro Ile Asn Ala Thr Leu Ala Ala Glu Lys Glu Ala Cys Pro
65 70 75 80
Ile Cys Ile Thr Phe Thr Thr Ser Ile Cys Ala Gly Tyr Cys Pro Ser
85 90 95
Met Val Arg Val Met Pro Ala Ala Leu Pro Ala Ile Pro Gln Pro Val
100 105 110
Cys Thr Tyr Arg Glu Leu Arg Phe Ala Ser Ile Arg Leu Pro Gly Cys
115 120 125
Pro Pro Gly Val Asp Pro Met Val Ser Phe Pro Val Ala Leu Ser Cys
130 135 140
His Cys Gly Pro Cys Gln Ile Lys Thr Thr Asp Cys Gly Val Phe Arg
145 150 155 160
Asp Gln Pro Leu Ala Cys Ala Pro Gln Ala Ser Ser Ser Ser Lys Asp
165 170 175
Pro Pro Ser Gln Pro Leu Thr Ser Thr Ser Thr Pro Thr Pro Gly Ala
180 185 190
Ser Arg Arg Ser Ser His Pro Leu Pro Ile Lys Thr Ser Gly Ser Gly
195 200 205
Leu Asn Ile Thr Gly Ser Gly Leu Asn Ile Thr Gly Ser Gly Leu Asn
210 215 220
Ile Thr Gly Ser Gly Leu Asn Ile Thr Gly Pro Gly Ser Thr Ser Phe
225 230 235 240
Pro Asp Gly Glu Phe Thr Thr Gln Asp Cys Pro Glu Cys Lys Leu Arg
245 250 255
Glu Asn Lys Tyr Phe Phe Lys Leu Gly Val Pro Ile Tyr Gln Cys Lys
260 265 270
Gly Cys Cys Phe Ser Arg Ala Tyr Pro Thr Pro Ala Arg Ser Arg Lys
275 280 285
Thr Met Leu Val Pro Lys Asn Ile Thr Ser Glu Ser Thr Cys Cys Val
290 295 300
Ala Lys Ala Phe Ile Arg Val Thr Val Met Gly Asn Ile Lys Leu Glu
305 310 315 320
Asn His Thr Gln Cys Tyr Cys Ser Thr Cys Tyr His His Lys Ile
325 330 335
<210> 3
<211> 1023
<212> ДНК
<213> Нуклеотидная последовательность, кодирующая
NTP-БетаCTP-CTP-Альфа
<400> 3
atggagaccc tgcagggcct gctgctgtgg atgctgctgt ctgtgggagg cgtgtgggct
60
ggcgatatcg gcctgaacat caccggctcc ggcctgaata tcacaggctc tggcctgaac
120
atcaccggaa gcggcctgaa tatcaccgga ccaggcagca cagatatctc ccggggacca
180
ctgaggcctc tgtgcagacc tatcaacgcc acactggccg ctgagaagga ggcttgccca
240
atctgtatca ccttcaccac atccatctgc gccggctact gtccttctat ggtgagagtg
300
atgccagccg ctctgccagc tatcccacag cccgtgtgca cctatagaga gctgcgcttc
360
gctagcatca gactgccagg atgtccacct ggagtggacc ctatggtgtc ttttccagtg
420
gctctgagct gccactgtgg cccctgccag atcaagacca cagactgtgg cgtgtttcgc
480
gatcagccac tggcttgtgc tcctcaggct agctcctcta gcaaggaccc accaagccag
540
ccactgacca gcacatccac cccaacaccc ggcgcttctc ggaggtcctc tcaccctctg
600
ccaatcaaga caagcgcccc ccaggcctct tcctctagca aggatcctcc atcccagcct
660
ctgacctcta caagcacccc aacacctgga gcttccagac gctcctctca cccactgccc
720
atcaagacct ctttcccaga cggcgagttt accacacagg attgccccga gtgtaagctg
780
cgcgagaaca agtacttctt taagctgggc gtgcctatct atcagtgcaa gggctgctgt
840
ttcagccggg cctaccctac accagctcgg tccaggaaga ccatgctggt gccaaagaat
900
atcacctccg agtctacatg ctgcgtggcc aaggctttta tccgggtgac cgtgatgggc
960
aacatcaagc tggagaatca cacccagtgc tactgttcca catgttatca ccacaagatc
1020
tga
1023
<210> 4
<211> 340
<212> белок
<213> Искусственная последовательность
<220>
<223> Рекомбинантный белок NTP-БетаCTP-CTP-Альфа
<400> 4
Met Glu Thr Leu Gln Gly Leu Leu Leu Trp Met Leu Leu Ser Val Gly
1 5 10 15
Gly Val Trp Ala Gly Asp Ile Gly Leu Asn Ile Thr Gly Ser Gly Leu
20 25 30
Asn Ile Thr Gly Ser Gly Leu Asn Ile Thr Gly Ser Gly Leu Asn Ile
35 40 45
Thr Gly Pro Gly Ser Thr Asp Ile Ser Arg Gly Pro Leu Arg Pro Leu
50 55 60
Cys Arg Pro Ile Asn Ala Thr Leu Ala Ala Glu Lys Glu Ala Cys Pro
65 70 75 80
Ile Cys Ile Thr Phe Thr Thr Ser Ile Cys Ala Gly Tyr Cys Pro Ser
85 90 95
Met Val Arg Val Met Pro Ala Ala Leu Pro Ala Ile Pro Gln Pro Val
100 105 110
Cys Thr Tyr Arg Glu Leu Arg Phe Ala Ser Ile Arg Leu Pro Gly Cys
115 120 125
Pro Pro Gly Val Asp Pro Met Val Ser Phe Pro Val Ala Leu Ser Cys
130 135 140
His Cys Gly Pro Cys Gln Ile Lys Thr Thr Asp Cys Gly Val Phe Arg
145 150 155 160
Asp Gln Pro Leu Ala Cys Ala Pro Gln Ala Ser Ser Ser Ser Lys Asp
165 170 175
Pro Pro Ser Gln Pro Leu Thr Ser Thr Ser Thr Pro Thr Pro Gly Ala
180 185 190
Ser Arg Arg Ser Ser His Pro Leu Pro Ile Lys Thr Ser Ala Pro Gln
195 200 205
Ala Ser Ser Ser Ser Lys Asp Pro Pro Ser Gln Pro Leu Thr Ser Thr
210 215 220
Ser Thr Pro Thr Pro Gly Ala Ser Arg Arg Ser Ser His Pro Leu Pro
225 230 235 240
Ile Lys Thr Ser Phe Pro Asp Gly Glu Phe Thr Thr Gln Asp Cys Pro
245 250 255
Glu Cys Lys Leu Arg Glu Asn Lys Tyr Phe Phe Lys Leu Gly Val Pro
260 265 270
Ile Tyr Gln Cys Lys Gly Cys Cys Phe Ser Arg Ala Tyr Pro Thr Pro
275 280 285
Ala Arg Ser Arg Lys Thr Met Leu Val Pro Lys Asn Ile Thr Ser Glu
290 295 300
Ser Thr Cys Cys Val Ala Lys Ala Phe Ile Arg Val Thr Val Met Gly
305 310 315 320
Asn Ile Lys Leu Glu Asn His Thr Gln Cys Tyr Cys Ser Thr Cys Tyr
325 330 335
His His Lys Ile
340
<210> 5
<211> 906
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность, кодирующая NTP-БетаCTP-Альфа
<400> 5
atggagaccc tgcagggcct gctgctgtgg atgctgctgt ccgtgggagg cgtgtgggct
60
ggcgatatcg gcctgaacat caccggctct ggcctgaata tcacaggatc tggcctgaac
120
attaccggat ccggcctgaa tatcaccggc cctggctcca cagatatcag ccggggacca
180
ctgaggcctc tgtgccggcc tatcaacgcc acactggccg ctgagaagga ggcttgccca
240
atctgtatca ccttcaccac atctatctgc gccggctact gtccaagcat ggtgcgcgtg
300
atgccagccg ctctgccagc tatccctcag ccagtgtgca cctatcggga gctgaggttc
360
gcttctatca ggctgccagg atgtccacct ggagtggacc ctatggtgag ctttccagtg
420
gctctgtcct gccactgtgg cccttgccag atcaagacca cagactgtgg cgtgtttagg
480
gatcagccac tggcttgtgc tcctcaggct agctcctcta gcaaggatcc acccagccag
540
cccctgacca gcacatccac cccaacacct ggagctagcc ggaggtcctc tcacccactg
600
cccatcaaga catccttccc agacggcgag tttaccacac aggattgccc cgagtgtaag
660
ctgagggaga acaagtactt ctttaagctg ggcgtgccaa tctatcagtg caagggctgc
720
tgtttctcca gagcctaccc tacaccagct agatctcgca agaccatgct ggtgcccaag
780
aatatcacct ctgagagcac atgctgcgtg gccaaggctt ttatccgggt gaccgtgatg
840
ggcaacatca agctggagaa tcacacccag tgctactgtt ctacatgtta tcaccacaag
900
atctga
906
<210> 6
<211> 301
<212> белок
<213> Искусственная последовательность
<220>
<223> Рекомбинантный белок NTP-БетаCTP-Альфа
<400> 6
Met Glu Thr Leu Gln Gly Leu Leu Leu Trp Met Leu Leu Ser Val Gly
1 5 10 15
Gly Val Trp Ala Gly Asp Ile Gly Leu Asn Ile Thr Gly Ser Gly Leu
20 25 30
Asn Ile Thr Gly Ser Gly Leu Asn Ile Thr Gly Ser Gly Leu Asn Ile
35 40 45
Thr Gly Pro Gly Ser Thr Asp Ile Ser Arg Gly Pro Leu Arg Pro Leu
50 55 60
Cys Arg Pro Ile Asn Ala Thr Leu Ala Ala Glu Lys Glu Ala Cys Pro
65 70 75 80
Ile Cys Ile Thr Phe Thr Thr Ser Ile Cys Ala Gly Tyr Cys Pro Ser
85 90 95
Met Val Arg Val Met Pro Ala Ala Leu Pro Ala Ile Pro Gln Pro Val
100 105 110
Cys Thr Tyr Arg Glu Leu Arg Phe Ala Ser Ile Arg Leu Pro Gly Cys
115 120 125
Pro Pro Gly Val Asp Pro Met Val Ser Phe Pro Val Ala Leu Ser Cys
130 135 140
His Cys Gly Pro Cys Gln Ile Lys Thr Thr Asp Cys Gly Val Phe Arg
145 150 155 160
Asp Gln Pro Leu Ala Cys Ala Pro Gln Ala Ser Ser Ser Ser Lys Asp
165 170 175
Pro Pro Ser Gln Pro Leu Thr Ser Thr Ser Thr Pro Thr Pro Gly Ala
180 185 190
Ser Arg Arg Ser Ser His Pro Leu Pro Ile Lys Thr Ser Phe Pro Asp
195 200 205
Gly Glu Phe Thr Thr Gln Asp Cys Pro Glu Cys Lys Leu Arg Glu Asn
210 215 220
Lys Tyr Phe Phe Lys Leu Gly Val Pro Ile Tyr Gln Cys Lys Gly Cys
225 230 235 240
Cys Phe Ser Arg Ala Tyr Pro Thr Pro Ala Arg Ser Arg Lys Thr Met
245 250 255
Leu Val Pro Lys Asn Ile Thr Ser Glu Ser Thr Cys Cys Val Ala Lys
260 265 270
Ala Phe Ile Arg Val Thr Val Met Gly Asn Ile Lys Leu Glu Asn His
275 280 285
Thr Gln Cys Tyr Cys Ser Thr Cys Tyr His His Lys Ile
290 295 300
<210> 7
<211> 891
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность, кодирующая NTP-Бета-NTP-Альфа
<400> 7
atggagaccc tgcagggcct gctgctgtgg atgctgctgt ccgtgggagg cgtgtgggct
60
ggcgatatcg gcctgaacat caccggctct ggcctgaata tcacaggatc tggcctgaac
120
attaccggat ccggcctgaa tatcaccggc cctggctcca cagatatctc tcggggacca
180
ctgaggcctc tgtgcagacc aatcaacgcc accctggccg ctgagaagga ggcttgcccc
240
atctgtatca cattcaccac aagcatctgc gccggctact gtccatccat ggtgagagtg
300
atgccagccg ctctgccagc tatcccacag cccgtgtgca cctatagaga gctgcgcttc
360
gcttctatca gactgccagg atgtccacct ggagtggacc ctatggtgag ctttccagtg
420
gccctgtcct gccactgtgg cccttgccag atcaagacca cagactgtgg cgtgtttcgc
480
gatcagccac tggcttgtgg ctctggcctg aacatcacag gcagtggcct gaatattacc
540
ggctccggcc tgaacattac cggttccggc ctgaatatta ctggaccagg cagcacatcc
600
ttccctgacg gcgagtttac cacacaggat tgccccgagt gtaagctgcg cgagaacaag
660
tacttcttta agctgggcgt gcctatctat cagtgcaagg gctgctgttt ctctcgggct
720
taccctaccc cagctcggag caggaagaca atgctggtgc ccaagaatat cacctctgag
780
agcacatgct gcgtggccaa ggcttttatc cgggtgaccg tgatgggcaa catcaagctg
840
gagaatcaca cccagtgcta ctgttccaca tgttatcacc acaagatctg a
891
<210> 8
<211> 296
<212> белок
<213> Искусственная последовательность
<220>
<223> Рекомбинантный белок NTP-Бета-NTP-Альфа
<400> 8
Met Glu Thr Leu Gln Gly Leu Leu Leu Trp Met Leu Leu Ser Val Gly
1 5 10 15
Gly Val Trp Ala Gly Asp Ile Gly Leu Asn Ile Thr Gly Ser Gly Leu
20 25 30
Asn Ile Thr Gly Ser Gly Leu Asn Ile Thr Gly Ser Gly Leu Asn Ile
35 40 45
Thr Gly Pro Gly Ser Thr Asp Ile Ser Arg Gly Pro Leu Arg Pro Leu
50 55 60
Cys Arg Pro Ile Asn Ala Thr Leu Ala Ala Glu Lys Glu Ala Cys Pro
65 70 75 80
Ile Cys Ile Thr Phe Thr Thr Ser Ile Cys Ala Gly Tyr Cys Pro Ser
85 90 95
Met Val Arg Val Met Pro Ala Ala Leu Pro Ala Ile Pro Gln Pro Val
100 105 110
Cys Thr Tyr Arg Glu Leu Arg Phe Ala Ser Ile Arg Leu Pro Gly Cys
115 120 125
Pro Pro Gly Val Asp Pro Met Val Ser Phe Pro Val Ala Leu Ser Cys
130 135 140
His Cys Gly Pro Cys Gln Ile Lys Thr Thr Asp Cys Gly Val Phe Arg
145 150 155 160
Asp Gln Pro Leu Ala Cys Gly Ser Gly Leu Asn Ile Thr Gly Ser Gly
165 170 175
Leu Asn Ile Thr Gly Ser Gly Leu Asn Ile Thr Gly Ser Gly Leu Asn
180 185 190
Ile Thr Gly Pro Gly Ser Thr Ser Phe Pro Asp Gly Glu Phe Thr Thr
195 200 205
Gln Asp Cys Pro Glu Cys Lys Leu Arg Glu Asn Lys Tyr Phe Phe Lys
210 215 220
Leu Gly Val Pro Ile Tyr Gln Cys Lys Gly Cys Cys Phe Ser Arg Ala
225 230 235 240
Tyr Pro Thr Pro Ala Arg Ser Arg Lys Thr Met Leu Val Pro Lys Asn
245 250 255
Ile Thr Ser Glu Ser Thr Cys Cys Val Ala Lys Ala Phe Ile Arg Val
260 265 270
Thr Val Met Gly Asn Ile Lys Leu Glu Asn His Thr Gln Cys Tyr Cys
275 280 285
Ser Thr Cys Tyr His His Lys Ile
290 295
<210> 9
<211> 1062
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность, кодирующая
CTP-Бета-CTP-CTP-Альфа
<400> 9
atggagaccc tgcagggcct gctgctgtgg atgctgctgt ccgtgggagg cgtgtgggct
60
ggcgtgttcc gggaccagcc tctggcttgc gctccacagg cttccagctc ttccaaggat
120
cccccttctc agccactgac ctctacatcc accccaacac caggagcttc caggcggagc
180
tctcaccctc tgccaatcaa gacctccagc agaggaccac tgaggcctct gtgcaggccc
240
atcaacgcca ccctggctgc tgagaaggag gcttgcccta tctgtatcac attcaccaca
300
tccatctgcg ctggctactg tcctagcatg gtgcgcgtga tgccagccgc tctgccagct
360
atcccacagc ccgtgtgcac ctatagggag ctgcggttcg ctagcatcag gctgcctgga
420
tgtccaccag gagtggaccc aatggtgagc tttcctgtgg ccctgtcttg ccattgtggc
480
ccatgccaga tcaagaccac agactgtggc gtgtttagag atcagccact ggcctgtgct
540
ccacaggctt cttccagctc taaggaccct ccaagccagc ccctgaccag cacatctacc
600
cctaccccag gagctagcag acgctccagc catccactgc caatcaagac ctctgcccct
660
caggcctctt ccagctctaa agacccccct tctcagcccc tgacctccac aagcacccca
720
acacctggag cttccaggcg gtccagccat ccactgccca tcaagacaag cttccctgac
780
ggcgagttta ccacacagga ttgcccagag tgtaagctgc gggagaacaa gtacttcttt
840
aagctgggcg tgcccatcta tcagtgcaag ggctgctgtt tctccagggc ctaccctacc
900
ccagctagat cccgcaagac aatgctggtg cctaagaata tcacctctga gtccacatgc
960
tgcgtggcca aggcttttat ccgcgtgacc gtgatgggca acatcaagct ggagaatcac
1020
acccagtgct actgttctac atgttatcac cataagatct ga
1062
<210> 10
<211> 353
<212> белок
<213> Рекомбинантный белок CTP-Бета-CTP-CTP-Альфа
<400> 10
Met Glu Thr Leu Gln Gly Leu Leu Leu Trp Met Leu Leu Ser Val Gly
1 5 10 15
Gly Val Trp Ala Gly Val Phe Arg Asp Gln Pro Leu Ala Cys Ala Pro
20 25 30
Gln Ala Ser Ser Ser Ser Lys Asp Pro Pro Ser Gln Pro Leu Thr Ser
35 40 45
Thr Ser Thr Pro Thr Pro Gly Ala Ser Arg Arg Ser Ser His Pro Leu
50 55 60
Pro Ile Lys Thr Ser Ser Arg Gly Pro Leu Arg Pro Leu Cys Arg Pro
65 70 75 80
Ile Asn Ala Thr Leu Ala Ala Glu Lys Glu Ala Cys Pro Ile Cys Ile
85 90 95
Thr Phe Thr Thr Ser Ile Cys Ala Gly Tyr Cys Pro Ser Met Val Arg
100 105 110
Val Met Pro Ala Ala Leu Pro Ala Ile Pro Gln Pro Val Cys Thr Tyr
115 120 125
Arg Glu Leu Arg Phe Ala Ser Ile Arg Leu Pro Gly Cys Pro Pro Gly
130 135 140
Val Asp Pro Met Val Ser Phe Pro Val Ala Leu Ser Cys His Cys Gly
145 150 155 160
Pro Cys Gln Ile Lys Thr Thr Asp Cys Gly Val Phe Arg Asp Gln Pro
165 170 175
Leu Ala Cys Ala Pro Gln Ala Ser Ser Ser Ser Lys Asp Pro Pro Ser
180 185 190
Gln Pro Leu Thr Ser Thr Ser Thr Pro Thr Pro Gly Ala Ser Arg Arg
195 200 205
Ser Ser His Pro Leu Pro Ile Lys Thr Ser Ala Pro Gln Ala Ser Ser
210 215 220
Ser Ser Lys Asp Pro Pro Ser Gln Pro Leu Thr Ser Thr Ser Thr Pro
225 230 235 240
Thr Pro Gly Ala Ser Arg Arg Ser Ser His Pro Leu Pro Ile Lys Thr
245 250 255
Ser Phe Pro Asp Gly Glu Phe Thr Thr Gln Asp Cys Pro Glu Cys Lys
260 265 270
Leu Arg Glu Asn Lys Tyr Phe Phe Lys Leu Gly Val Pro Ile Tyr Gln
275 280 285
Cys Lys Gly Cys Cys Phe Ser Arg Ala Tyr Pro Thr Pro Ala Arg Ser
290 295 300
Arg Lys Thr Met Leu Val Pro Lys Asn Ile Thr Ser Glu Ser Thr Cys
305 310 315 320
Cys Val Ala Lys Ala Phe Ile Arg Val Thr Val Met Gly Asn Ile Lys
325 330 335
Leu Glu Asn His Thr Gln Cys Tyr Cys Ser Thr Cys Tyr His His Lys
340 345 350
Ile
<210> 11
<211> 915
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность, кодирующая Бета-CTP-CTP-Альфа
<400> 11
atggagaccc tgcagggcct gctgctgtgg atgctgctgt ctgtgggagg cgtgtgggct
60
tccaggggac cactgcggcc tctgtgcaga cctatcaacg ccaccctggc cgctgagaag
120
gaggcttgcc caatctgtat cacattcacc acaagcatct gcgctggcta ctgtccctct
180
atggtgagag tgatgccagc cgctctgcca gctatcccac agcccgtgtg cacctataga
240
gagctgcgct tcgcttctat cagactgcca ggatgtccac ctggagtgga ccctatggtg
300
tcctttccag tggccctgag ctgccactgt ggaccatgcc agatcaagac cacagactgt
360
ggcgtgtttc gcgatcagcc actggcttgt gctcctcagg cttccagctc ttccaaggac
420
ccaccctccc agcctctgac ctccacaagc accccaacac ccggcgcttc taggcggagc
480
tctcaccctc tgccaatcaa gacctccgcc ccccaggcct ctagctcttc caaggatcct
540
ccaagccagc ctctgacctc tacatccacc cccacacctg gcgctagcag acgcagctct
600
catccactgc ccatcaagac atctttccca gacggcgagt ttaccacaca ggattgcccc
660
gagtgtaagc tgcgcgagaa caagtacttc tttaagctgg gcgtgcctat ctatcagtgc
720
aagggctgct gtttctccag ggcctaccct accccagcta ggagccggaa gacaatgctg
780
gtgccaaaga atatcaccag cgagtctaca tgctgcgtgg ccaaggcttt tatccgggtg
840
accgtgatgg gcaacatcaa gctggagaat catacccagt gctactgttc cacatgttat
900
caccataaga tctga
915
<210> 12
<211> 304
<212> белок
<213> Искусственная последовательность
<220>
<223> Рекомбинантный белок Бета-CTP-CTP-Альфа
<400> 12
Met Glu Thr Leu Gln Gly Leu Leu Leu Trp Met Leu Leu Ser Val Gly
1 5 10 15
Gly Val Trp Ala Ser Arg Gly Pro Leu Arg Pro Leu Cys Arg Pro Ile
20 25 30
Asn Ala Thr Leu Ala Ala Glu Lys Glu Ala Cys Pro Ile Cys Ile Thr
35 40 45
Phe Thr Thr Ser Ile Cys Ala Gly Tyr Cys Pro Ser Met Val Arg Val
50 55 60
Met Pro Ala Ala Leu Pro Ala Ile Pro Gln Pro Val Cys Thr Tyr Arg
65 70 75 80
Glu Leu Arg Phe Ala Ser Ile Arg Leu Pro Gly Cys Pro Pro Gly Val
85 90 95
Asp Pro Met Val Ser Phe Pro Val Ala Leu Ser Cys His Cys Gly Pro
100 105 110
Cys Gln Ile Lys Thr Thr Asp Cys Gly Val Phe Arg Asp Gln Pro Leu
115 120 125
Ala Cys Ala Pro Gln Ala Ser Ser Ser Ser Lys Asp Pro Pro Ser Gln
130 135 140
Pro Leu Thr Ser Thr Ser Thr Pro Thr Pro Gly Ala Ser Arg Arg Ser
145 150 155 160
Ser His Pro Leu Pro Ile Lys Thr Ser Ala Pro Gln Ala Ser Ser Ser
165 170 175
Ser Lys Asp Pro Pro Ser Gln Pro Leu Thr Ser Thr Ser Thr Pro Thr
180 185 190
Pro Gly Ala Ser Arg Arg Ser Ser His Pro Leu Pro Ile Lys Thr Ser
195 200 205
Phe Pro Asp Gly Glu Phe Thr Thr Gln Asp Cys Pro Glu Cys Lys Leu
210 215 220
Arg Glu Asn Lys Tyr Phe Phe Lys Leu Gly Val Pro Ile Tyr Gln Cys
225 230 235 240
Lys Gly Cys Cys Phe Ser Arg Ala Tyr Pro Thr Pro Ala Arg Ser Arg
245 250 255
Lys Thr Met Leu Val Pro Lys Asn Ile Thr Ser Glu Ser Thr Cys Cys
260 265 270
Val Ala Lys Ala Phe Ile Arg Val Thr Val Met Gly Asn Ile Lys Leu
275 280 285
Glu Asn His Thr Gln Cys Tyr Cys Ser Thr Cys Tyr His His Lys Ile
290 295 300
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АДЕНОВИРУСЫ И СПОСОБЫ ПРИМЕНЕНИЯ АДЕНОВИРУСОВ | 2019 |
|
RU2782528C1 |
| Способы лечения кальцификации тканей | 2015 |
|
RU2770698C2 |
| ХИМЕРНЫЕ РЕЦЕПТОРЫ АНТИГЕНА, НАЦЕЛЕННЫЕ НА PSCA | 2016 |
|
RU2759879C2 |
| МУТАНТЫ РЕКОМБИНАЗ | 2015 |
|
RU2721920C2 |
| Антитело моноклональное мышиное 1Е10 и антитело рекомбинантное химерное (мышь-человек) xi1E10, нейтрализующие летальный токсин Bacillus anthracis, и штамм гибридных культивируемых клеток животных Mus musculus 1E10 | 2020 |
|
RU2745116C1 |
| Выделенная нуклеиновая кислота, которая кодирует слитый белок на основе FVIII-BDD и гетерологичного сигнального пептида, и ее применение | 2022 |
|
RU2818229C2 |
| Вакцины против Chlamydia sp. | 2014 |
|
RU2723046C2 |
| Вакцина на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2 | 2020 |
|
RU2783313C1 |
| Вакцина на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2 | 2021 |
|
RU2761879C1 |
| АНТИТЕЛО ПРОТИВ IL-17A И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2816204C2 |

Настоящее изобретение относится к области биотехнологии и может быть использовано в медицинской практике. Изобретение раскрывает рекомбинантный одноцепочечный полипептид хорионического гонадотропина, имеющего аминокислотную последовательность, кодирующую цепь бета и цепь альфа лошадиного хорионического гонадотропина, связанную с одной или более последовательностями, которые включают участки гликозилирования, что приводит в результате к превосходной активности in vitro и in vivo. Изобретение может быть использовано при получения лекарственного средства для лечения патологических состояний, относящихся к репродукции или овуляции млекопитающих. 7 н. и 4 з.п. ф-лы, 12 ил., 8 табл.
1. Рекомбинантный одноцепочечный полипептид хорионического гонадотропина с таким же периодом полужизни и биологической активностью, как у белка дикого типа, отличающийся тем, что полипептид имеет аминокислотную последовательность, кодирующую цепь бета и цепь альфа лошадиного хорионического гонадотропина, связанную с одной или более последовательностями, которые включают участки гликозилирования, причем указанные участки гликозилирования включают последовательность N-гликозилирования (NTP) в N-концевой области бета-цепи.
2. Рекомбинантный одноцепочечный полипептид хорионического гонадотропина по п. 1, отличающийся тем, что полипептид имеет аминокислотную последовательность выбранную из группы, состоящей из SEQ ID NO: 4 и SEQ ID NO: 6.
3. Молекула ДНК, отличающаяся тем, что она кодирует рекомбинантный полипептид по п. 1, причем она имеет последовательность, выбранную из группы, состоящей из SEQ ID NO: 3 и SEQ ID NO: 5.
4. Экспрессирующий вектор, отличающийся тем, что он содержит молекулу ДНК по п. 3.
5. Фармацевтическая композиция для лечения патологических состояний, относящихся к репродукции или овуляции млекопитающих, отличающаяся тем, что она содержит эффективное количество рекомбинантного одноцепочечного полипептида хорионического гонадотропина по любому из пп. 1, 2 и фармацевтически приемлемый носитель.
6. Применение рекомбинантного хорионического гонадотропина по любому из пп. 1, 2 или фармацевтической композиции по п. 5, отличающееся тем, что оно предназначено для получения лекарственного средства для лечения патологических состояний, относящихся к репродукции или овуляции млекопитающих.
7. Применение рекомбинантного хорионического гонадотропина по любому из пп. 1, 2 или фармацевтической композиции по п. 5, отличающееся тем, что он(она) используется при патологических состояниях, связанных с нарушениями репродукции или овуляции у млекопитающих, выбранных из: суперовуляции, неудачной овуляции, субфункции яичников, индукции послеродовой течки или гипоорхидии.
8. Применение по любому из пп. 6, 7, отличающееся тем, что указанное млекопитающее выбрано из бычьих, свиней, овец, собак, кроликов, оленьих, коз и лабораторных животных.
9. Способ получения рекомбинантного одноцепочечного полипептида хорионического гонадотропина, отличающийся тем, что он включает следующие стадии:
а) трансфекцию вектором по п. 4 клетки млекопитающего; и
b) культивирование трансфицированной клетки млекопитающего в условиях, подходящих для продуцирования целевого белка.
10. Способ по п. 9, отличающийся тем, клетка млекопитающего представляет собой клетку CHO.
11. Способ по п. 10, дополнительно включающий очистку рекомбинантного одноцепочечного хорионического гонадотропина посредством иммуноаффинности.
| LENKE E.P | |||
| et al.: "Single-chain human gonadotropin analogs induce follicle development in sheep", J | |||
| ENDOCRINOLOGY, 2008, v | |||
| Пылеочистительное устройство к трепальным машинам | 1923 |
|
SU196A1 |
| BEN-MENAHEM D.: "Single chain variants of the glycoprotein hormones and their receptors as tools to study receptor activation and for analogue design", J | |||
| NEUROENDOCRINOLOGY, 2004, v | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| WO | |||
Авторы
Даты
2023-09-05—Публикация
2019-08-30—Подача