ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к определенным мостиковым химическим соединениям, имеющим свойства модуляции MGL (моноацилглицеринлипазы), фармацевтическим композициям, содержащим данные химические соединения, химическим процессам получения этих химических соединений и их применению в лечении заболеваний, нарушений или состояний, связанных с активностью рецептора MGL у субъектов, в частности у людей.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Конопля посевная (Cannabis Sativa) и аналоги A9-тетрагидроканнабинола использовались в терапевтических целях со времен широкого распространения народной медицины. Эндоканнабиноидная система состоит из двух сопряженных с G-белком рецепторов: каннабиноидного рецептора типа 1 (CB1) (Matsuda et al., Nature, 1990, 346, 561-4) и каннабиноидного рецептора типа 2 (CB2) (Munro et al., Nature, 1993, 365, 61-5). Рецептор CB1 является одним из наиболее распространенных рецепторов, сопряженных с G-белком, экспрессируемых в головном мозге (Herkenam et al., Proc. Nat. Acad. Sci., 1990, 87 (5), 1932-1936). Рецептор CB1 также периферически экспрессируется в печени, желудочно-кишечном тракте, поджелудочной железе, жировой ткани и скелетных мышцах (Di Marzo et al., Curr Opin Lipidol, 2007, 18, 129-140). CB2 в основном экспрессируется в иммунных клетках, таких как моноциты (Pacher et al., Amer J Physiol, 2008, 294, H1133-H1134), при определенных условиях (при воспалении) в головном мозге ((Benito et al., Brit J Pharmacol, 2008, 153, 277-285), а также в скелетных (Cavuoto et al., Biochem Biophys Res Commun, 2007, 364, 105-110) и сердечных мышцах (Hajrasouliha et al., Eur J Pharmacol, 2008, 579, 246-252).
В 1992 году было обнаружено, что N-арахидоноилэтаноламин (AEA или анандамид) является эндогенным лигандом для каннабиноидных рецепторов (Devane et al., Science, 1992, 258, 1946-9). Впоследствии 2-арахидоноилглицерин (2-AG) также был идентифицирован как дополнительный эндогенный лиганд каннабиноидных рецепторов (Mechoulam et al., Biochem Pharmacol, 1995, 50, 83-90; Sugiura et al., Biochem Biophys Res Commun, 1995, 215, 89-97). По имеющимся данным, концентрации 2-AG были по меньшей мере в 100 раз выше, чем концентрации анандамида в головном мозге крыс (Buczynski and Parsons, Brit J Pharmacol, 2010, 160 (3), 423-42). Следовательно, 2-AG может играть в эндоканнабиноидной системе более важную физиологическую роль, чем анандамид (Sugiura et al. Prostaglandins Leukot Essent Fatty Acids., 2002, Feb-Mar, 66(2-3):173-92). Эндоканнабиноид 2-AG является полным агонистом рецепторов CB1 и CB2, в то время как анандамид является частичным агонистом обоих рецепторов (Suguira et al., Prog Lipid Res, 2006, 45(5):405-46). В отличие от многих классических нейротрансмиттеров, эндоканнабиноиды передают сигналы через ретроградный механизм. Они синтезируются по требованию в постсинаптических нейронах и затем быстро разлагаются после связывания с пресинаптическими каннабиноидными рецепторами (Ahn et al., Chem Rev. 2008, 108(5):1687-707). Моноацилглицеринлипаза (MGLL, также называемая MAG-липазой и MGL) представляет собой сериновую гидролазу, отвечающую за разложение 2-AG и превращение соединения в арахидоновую кислоту и глицерин в центральной нервной системе (Mechoulam et al., Biochem Pharmacol, 1995, 50, 83-90; Sugiura et al., Biochem Biophys Res Commun, 1995, 215, 89-97; Long et al., Nat Chem Biol. 2009 Jan;5(1):37-44;), Schlosburg et al, Nat Neurosci., 2010, Sep;13(9):1113-9) и периферических тканях (Long et al., Chem Biol., 2009 Jul 31;16(7):744-53). Гидролиз ананандамида выполняется с помощью гидролазы амидов жирных кислот (FAAH) (Piomelli, Nat Rev Neurosci, 2003 г., 4, 873-884). MGL существует как в растворимой, так и в мембраносвязанной форме (Dinh et al., Proc Natl Acad Sci U S A., 2002, Aug 6;99(16):10819-24). В головном мозге MGL находится в пресинаптических нейронах (Straiker et al., Mol Pharmacol., 2009, Dec;76(6):1220-7) и астроцитах (Walter et al., J Neurosci., 2004, Sep 15;24(37):8068-74) в областях, связанных с высокой плотностью рецепторов CB1. По сравнению с контрольными образцами дикого типа, генетическая абляция экспрессии MGL приводит к 10-кратному увеличению уровней 2-AG в головном мозге, не влияя на концентрацию ананандамида (Schlosburg et al., Nat Neurosci., 2010, Sep;13(9):1113-9).
Таким образом, модуляция MGL являет собой перспективную стратегию для увеличения потенциала каннабиноидной системы. Основное преимущество данного подхода заключается в том, что модуляции будут подвергнуты только те области головного мозга, в которых активно продуцируются эндоканнабиноиды, что потенциально минимизирует побочные эффекты, связанные с экзогенными агонистами CB1. Фармакологическая инактивация MGL ковалентными ингибиторами у животных повышает содержание 2-AG в головном мозге и периферических тканях и, как было обнаружено, вызывает антиноцицептивное, анксиолитическое и противовоспалительное действие, которое зависит от рецепторов CB1 и/или CB2 (Long et al., Nat Chem Biol., 2009, Jan, 5(1):37-44; Ghosh et al., Life Sci., 2013, Mar 19, 92(8-9):498-505; Bedse et al., Biol Psychiatry., 2017, Oct 1, 82(7):488-499; Bernal-Chico et al., Glia., 2015, Jan, 63(1):163-76; Patel et al. Neurosci Biobehav Rev., 2017, May, 76(Pt A):56-66; Betse et al., Transl Psychiatry., 2018, Apr 26, 8(1):92). Помимо роли MGL в способствовании прекращению передачи сигналов 2-AG, модуляция MGL, включая ингибирование MGL, также способствует влиянию рецепторов CB1/2 на нейровоспалительные процессы (Nomura et al., Science., 2011, Nov 11;334(6057):809-13. Модуляция MGL, в том числе ингибирование MGL, приводит к снижению передачи сигналов провоспалительных простаноидов у животных-моделей, использованных для моделирования травматического повреждения головного мозга (Katz et al., J Neurotrauma., 2015, Mar 1;32(5):297-306; Zhang et al., J Cereb Blood Flow Metab., 2015, Mar 31;35(4):706), нейродегенерации, включая болезнь Альцгеймера (Piro et al., Cell Rep., 2012, Jun 28, 1(6):617-23; Wenzel et al., Life Sci., 2018, Aug 15, 207:314-322; Chen et al., Cell Rep., 2012, Nov 29, 2(5):1329-39), болезнь Паркинсона (Nomura et al., Science, 2011, Nov 11, 334(6057), 809-13; Pasquarelli et al., Neurochem Int., 2017, Nov, 110:14-24), боковой амиотрофический склероз (Pasquarelli et al., Neuropharmacology, 2017, Sep 15, 124:157-169), рассеянный склероз (Hernadez-Torres et al., Angew Chem Int Ed Engl., 2014, Dec 8, 53(50):13765-70; Bernal-Chico et al., Glia., 2015, Jan, 63(1):163-76), болезнь Хантингтона (Covey et al., Neuropsychopharmacology, 2018, 43, 2056-2063), синдром Туретта и эпилептическое состояние (Terrone et al., Epilepsia., 2018, Jan, 59(1), 79-91; von Ruden et al., Neurobiol Dis., 2015, May;77:238-45).
Таким образом, путем усиления каннабиноидной системы и ослабления провоспалительных каскадов, модуляция MGL, включая ингибирование MGL, обеспечивает перспективный терапевтический подход к лечению обширного ряда сложных заболеваний. Важно отметить, что модуляция MGL, в том числе ингибирование MGL у животных, не вызывает полного спектра нейроповеденческих эффектов, наблюдаемых при использовании Δ9-тетрагидроканнабинола и других агонистов CB1 (Tuo et al., J Med Chem., 2017, Jan 12, 60(1), 4-46; Mulvihill et al., Life Sci., 2013, Mar 19, 92(8-9), 492-7).
Гипоактивность эндоканнабиноидов является фактором риска при лечении депрессии, тревожного расстройства и посттравматических стрессовых расстройств. Тысячелетия употребления человеком Cannabis Sativa и короткий период, в течение которого людей лечили римонабантом, веществом-антагонистом эндоканнабиноида, подтверждают данную гипотезу. Уровни 2-AG снижаются у субъектов с большим депрессивным расстройством (Hill et al., Pharmacopsychiatry., 2008, Mar; 41(2): 48-53; Hill et al., Psychoneuroendocrinology., 2009, Sep; 34(8): 1257-1262.). Низкие уровни циркулирующего 2-AG прогнозируют показатели депрессии (Hauer et al., Rev Neurosci., 2012, 23(5-6):681-90). У пациентов с посттравматическим стрессовым расстройством (ПТСР) было обнаружено снижение уровня циркулирующего 2-AG (Hill et al., Psychoneuroendocrinology, 2013, 38 (12), 2952-2961). Здоровые добровольцы, подвергнутые воздействию хронических стрессовых факторов, демонстрировали постепенное снижение уровней циркулирующего 2-AG, что соответствовало началу снижения показателей положительных эмоций (Yi et al., Progress in Neuro-Psychopharmacology and Biological Psychiatry, 2016, 67 (3), 92-97). Римонабант, обратный агонист/антагонист рецептора CB1, был снят с продажи из-за высокой частоты случаев возникновения тяжелой депрессии и идей самоубийства у пациентов (Christensen et al., The Lancet, 2007, 370, 1706-1713). Таким образом, модуляторы MGL являются потенциально полезными для лечения расстройств настроения, тревожного расстройства и ПТСР.
Агонисты каннабиноидных рецепторов клинически применяются для лечения болевого синдрома, спастики, рвоты и анорексии (Di Marzo, et al., Annu Rev Med., 2006, 57:553-74; Ligresti et al., Curr Opin Chem Biol., 2009, Jun;13(3):321-31). Таким образом, модуляторы MGL, в том числе ингибиторы MGL, также могут оказаться полезными относительно данных показаний. MGL оказывает CB1-зависимое антиноцицептивное воздействие на животных-моделей, использованных для моделирования химических, воспалительных, термических и нейропатических болевых синдромов (Guindon et al., Br J Pharmacol., 2011, Aug;163(7):1464-78; Kinsey et al., J Pharmacol Exp Ther., 2009, Sep;330(3):902-10; Long et al., Nat Chem Biol., 2009, Jan;5(1):37-44). Блокада MGL уменьшает холодовую аллодинию, вызванную механическим воздействием и воздействием ацетона, у мышей с хроническим сужением седалищного нерва (Kinsey et al., J Pharmacol Exp Ther., 2009, Sep;330(3):902-10). Ингибирование MGL приводит к сохранению опиатов с понижением переносимости, констипации и побочных эффектов применения каннабимиметиков (Wilkerson et al., J Pharmacol Exp Ther., 2016, Apr;357(1):145-56). Блокада MGL является защитной мерой при моделировании воспалительного заболевания кишечника (Alhouayek et al., FASEB J., 2011, Aug;25(8):2711-21). Ингибирование MGL также обращает ноцицептивное поведение, индуцированное паклитакселом, а также провоспалительные маркеры в мышиной модели нейропатии, вызванной химиотерапией (Curry et al., J Pharmacol Exp Ther., 2018, Jul;366(1):169-18). Ингибиторы MGL также могут быть потенциально полезными для лечения хронических воспалительных заболеваний мочевого пузыря, в том числе интерстициального цистита (Chinnadurai et al., Med Hypotheses 2019, Oct; 131: 109321).
Ингибирование гидролиза 2-AG оказывает антипролиферативное действие и снижает инвазивность клеток рака предстательной железы (Nithipatikom et al., Cancer Res., 2004, Dec 15, 64(24):8826-30; Nithipatikom et al., Biochem Biophys Res Commun., 2005, Jul 15,332(4):1028-33; Nithipatikom et al., Prostaglandins Other Lipid Mediat., 2011, Feb, 94(1-2):34-43). MGL положительно регулируется в агрессивных раковых клетках человека и первичных опухолях, где она играет уникальную роль в обеспечении липолитических источников свободных жирных кислот для синтеза онкогенных сигнальных липидов, стимулирующих агрессивное развитие ракового заболевания. Таким образом, помимо физиологических ролей MGL в опосредованной передаче сигналов с участием эндоканнабиноидов, при раковых заболеваниях MGL играет определенную роль в модуляции запасов предшественников жирных кислот для синтеза протуморогенных сигнальных липидов в злокачественных раковых клетках человеческого организма.
Блокада MGL демонстрирует противорвотный эффект в рамках моделирования рвоты у землероек с применением хлористого лития (Sticht et al., Br J Pharmacol., 2012, Apr, 165(8):2425-35).
Модуляторы MGL, в том числе ингибиторы MGL, могут оказаться полезными для модуляции лекарственной зависимости от опиатов. Блокада MGL снижает интенсивность симптомов отмены морфина, вызванных налоксоном, у мышей. Блокада MGL также ослабляла проявление спонтанных признаков синдрома отмены у морфинозависимых мышей (Ramesh et al., J Pharmacol Exp Ther., 2011, Oct, 339(1):173-85).
Модуляторы MGL также могут найти применение для лечения заболеваний глаз, включая, помимо прочего, глаукому и болезненные состояния, вызванные повышенным внутриглазным давлением (Miller et al., Pharmaceuticals, 2018, 11, 50).
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Варианты осуществления настоящего изобретения относятся к химическим структурным соединениям, содержащим их фармацевтическим составам, способам их получения и очистки и способам их применения для лечения заболеваний, расстройств и состояний, связанных с модуляцией MGL. Дополнительный вариант осуществления настоящего изобретения представляет собой способ лечения пациента, у которого диагностировано заболевание, расстройство или медицинское состояние, либо который страдает от заболевания, расстройства или медицинского состояния, связанного с модуляцией MGL, с помощью по меньшей мере одного химического соединения в рамках настоящего изобретения.
Дополнительные варианты осуществления, признаки и преимущества изобретения будут очевидны из следующего подробного описания и практического осуществления изобретения.
Вариантами данного изобретения являются соединения формулы (I),
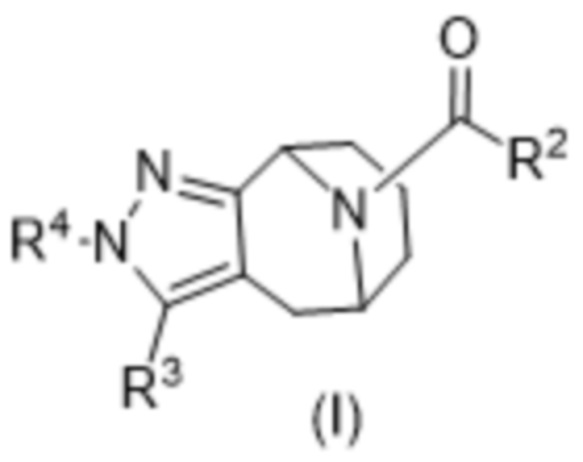
где
R2 выбирают из группы, состоящей из:
(a) 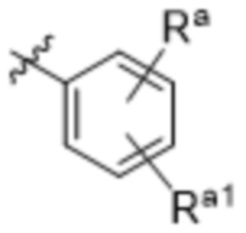 ;
;
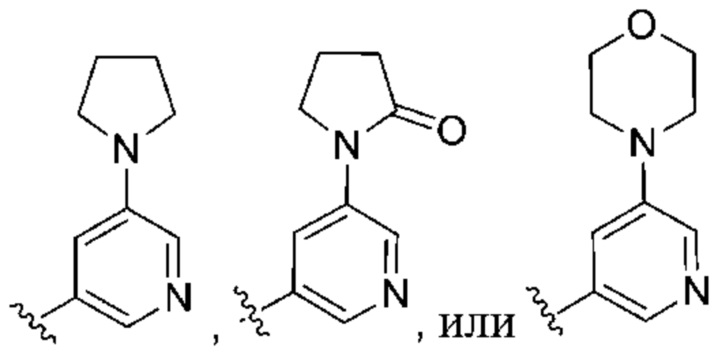
(b) 6-членного гетероарила, выбранного из группы, состоящей из: пиридазин-4-ила; пиразин-2-ила; пиримидинила; пиридинила, замещенного C1-4алкилом или ОC1-4алкилом; и пиридинила, где пиридинил замещен одним или двумя заместителями, каждый из которых независимо выбирают из группы, состоящей из галогена, C1-4алкила, OC1-4алкила, OC1-4галогеналкила, C3-6циклоалкила, NH2, CN, N(CH3)2,  ,
,  ,
, 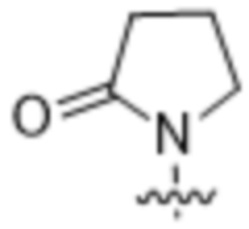 ,
, 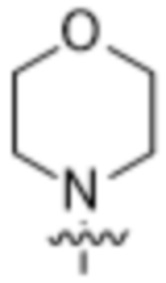 ,
, 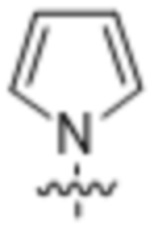 ,
, 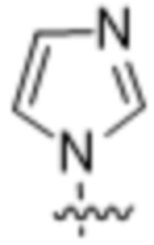 ,
, 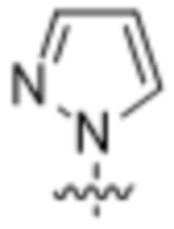 ,
, 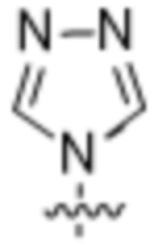 ,
,  и
и 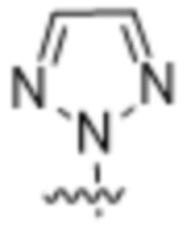 ;
;
(c) 5-членного гетероарила, выбранного из группы, состоящей из:
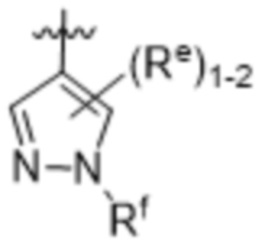 ,
, 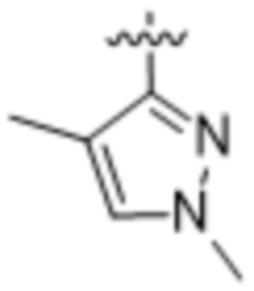 ,
, 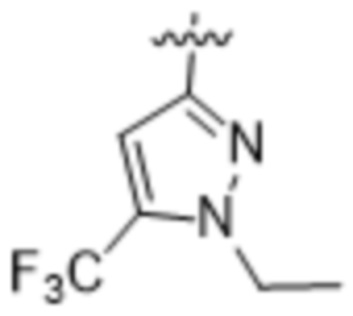 ,
, 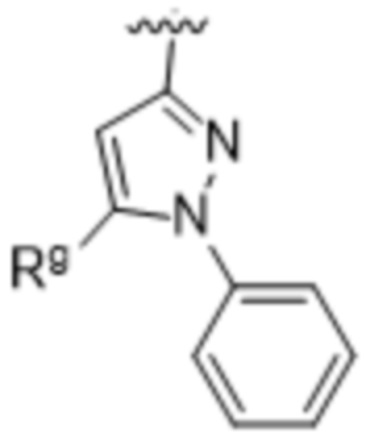 ,
, 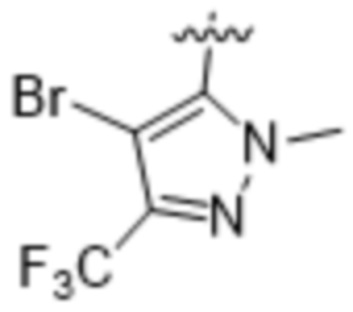 ,
, 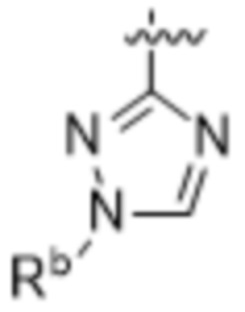 ,
,  ,
,  и
и  ;
;
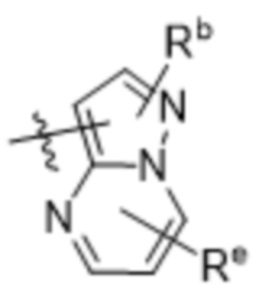
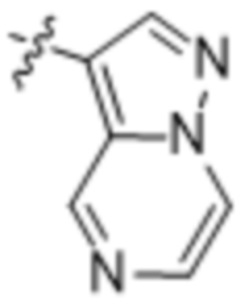
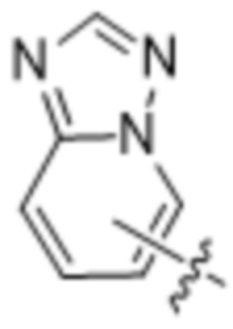
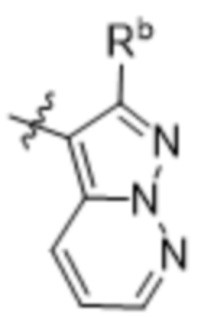
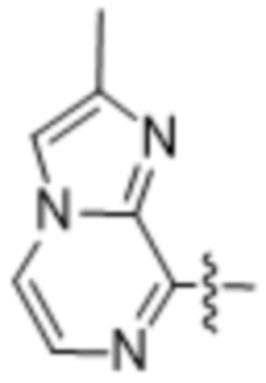
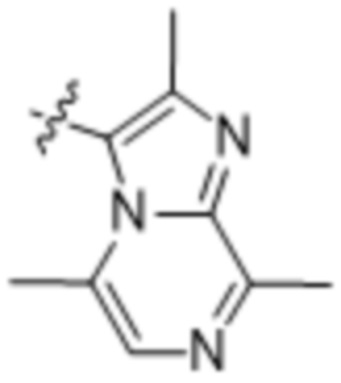
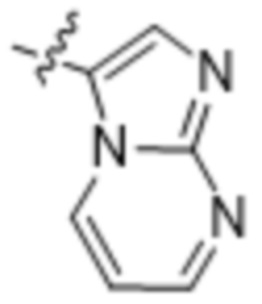
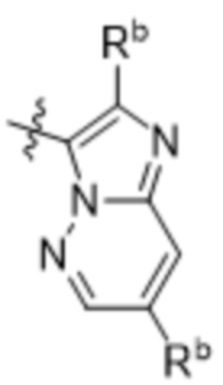
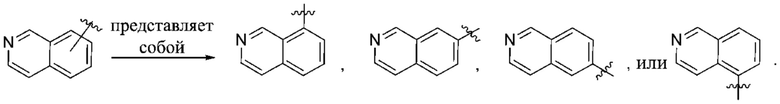
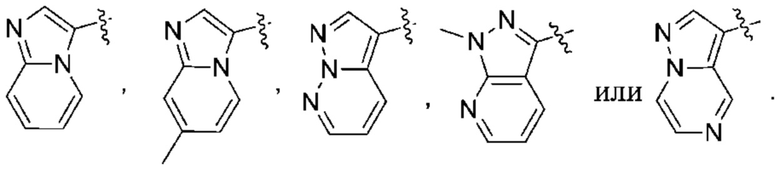
(d) 5,6-конденсированного бициклического гетероарила или 6,5-конденсированного бициклического гетероарила, выбранного из группы, состоящей из:
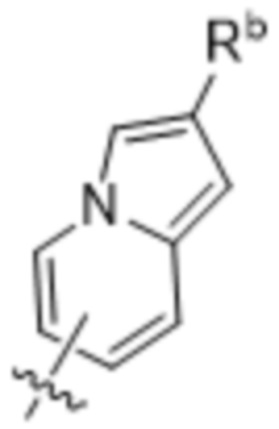 ,
, 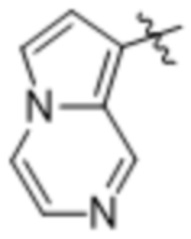 ,
, 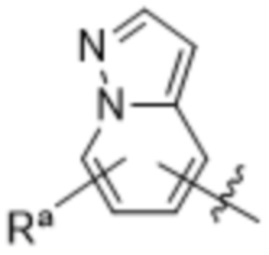 ,
, 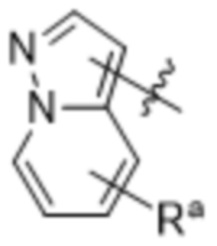 ,
, 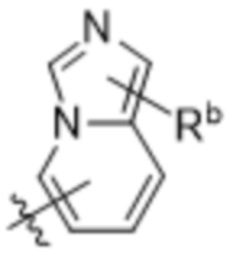 ,
, 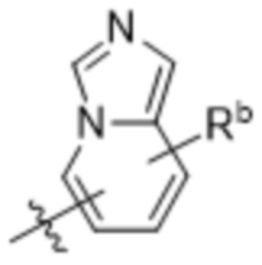 ,
, 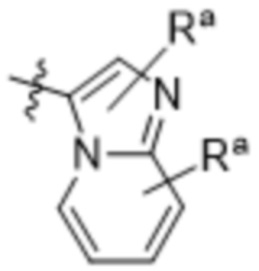 ,
, 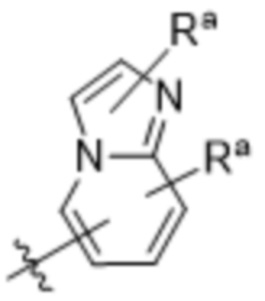 ,
, 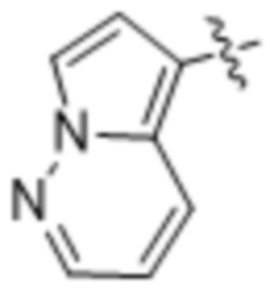 ,
, 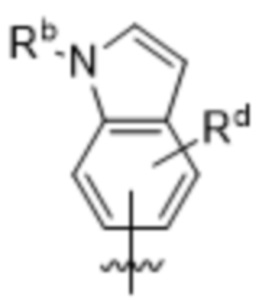 ,
, 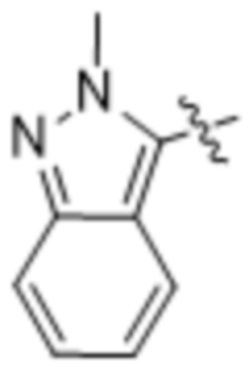 ,
, 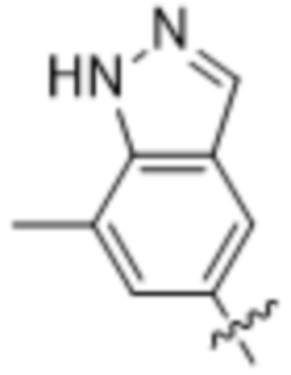 ,
, 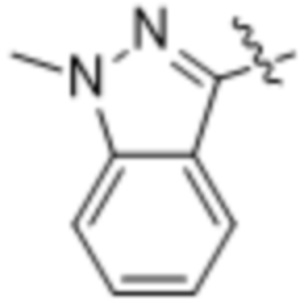 ,
, 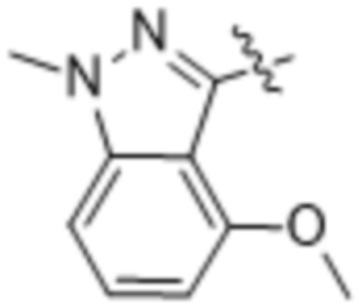 ,
, 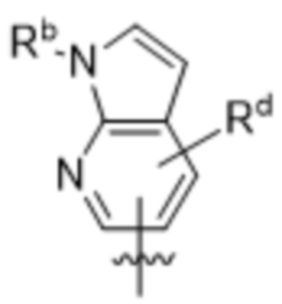 ,
, 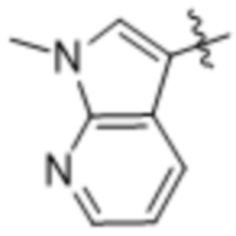 ,
,  ,
,  ,
,  ,
,  ,
, 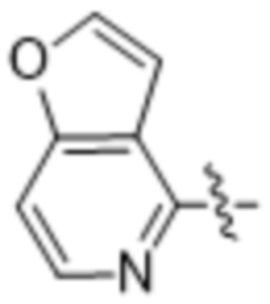 ,
, 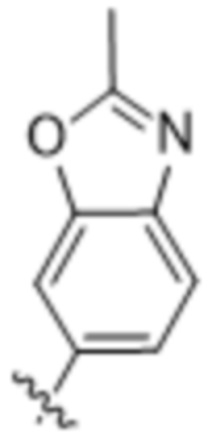 ,
, 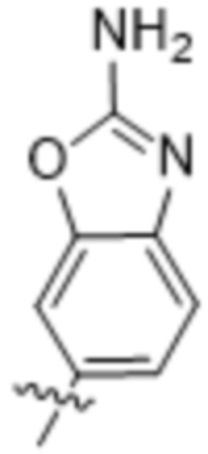 ,
, 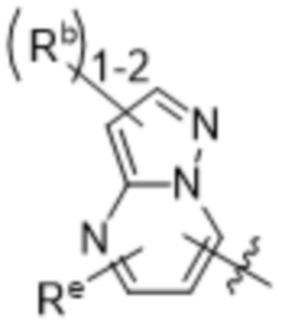 ,
,  ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,  ,
, 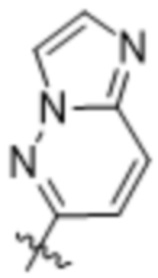 ,
, 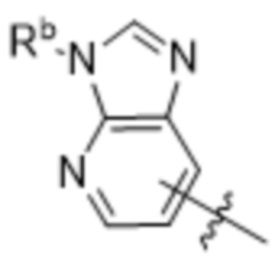 ,
, 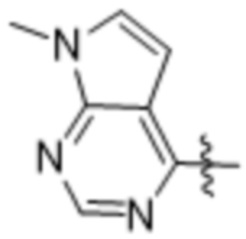 ,
, 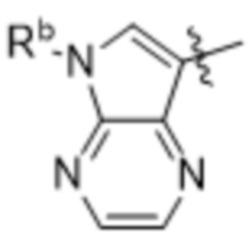 ,
, 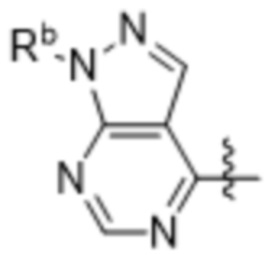 ,
, 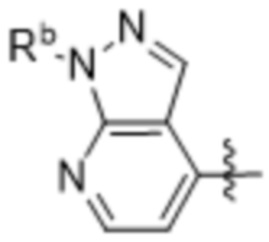 ,
, 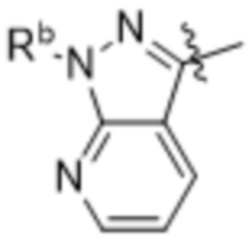 ,
, 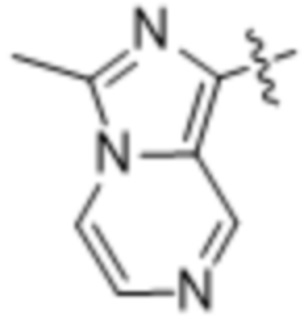 и
и 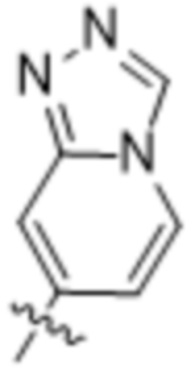 ;
;
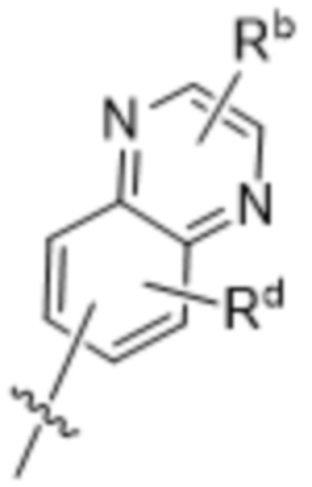
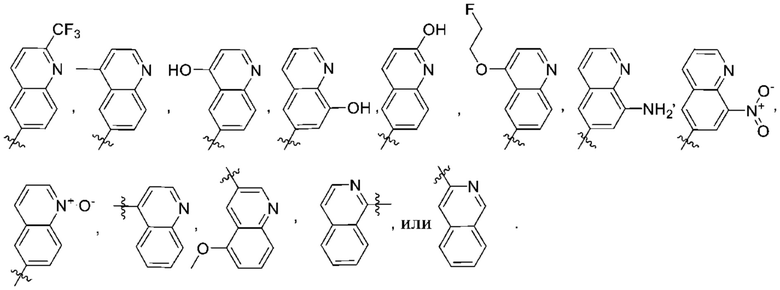
(e) 6,6-конденсированного бициклического гетероарила, выбранного из группы, состоящей из:
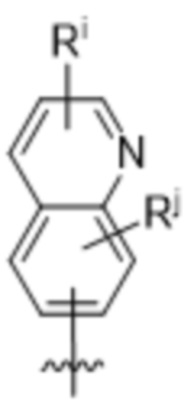 ,
, 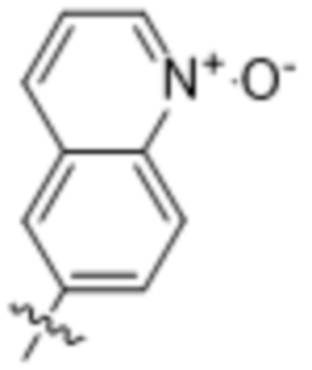 ,
,  ,
, 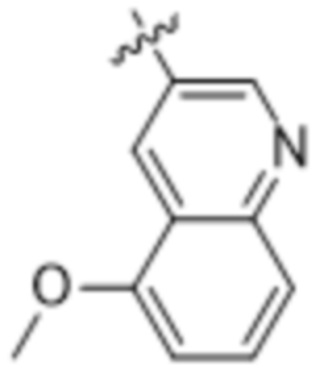 ,
, 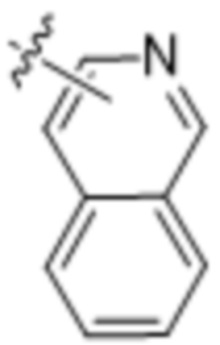 ,
, 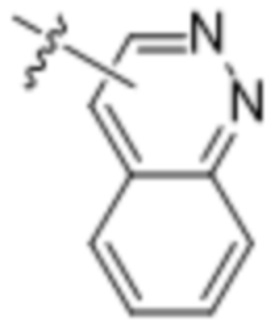 ,
, 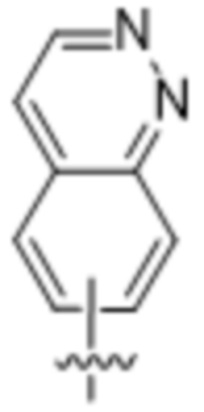 ,
, 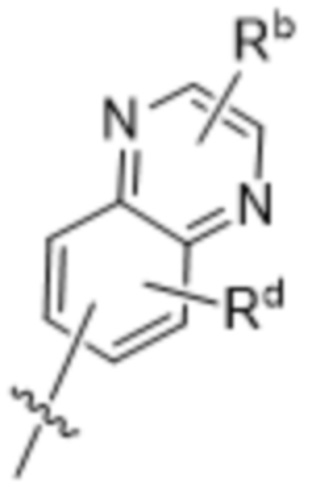 ,
, 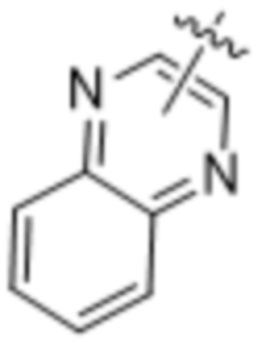 ,
, 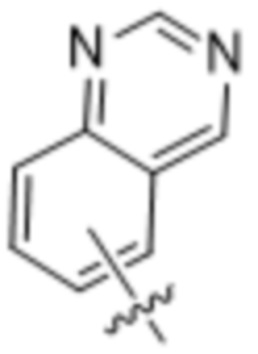 ,
, 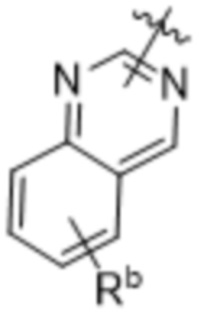 ,
,  ,
,  ,
, 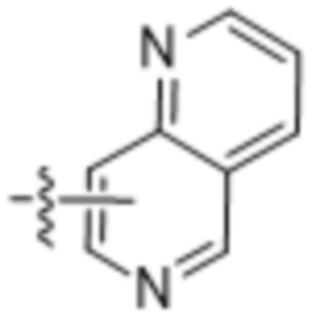 ,
, 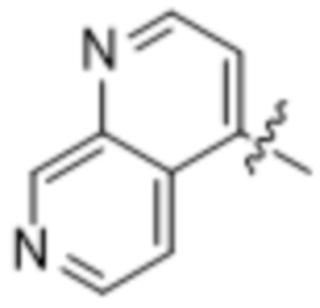 и
и 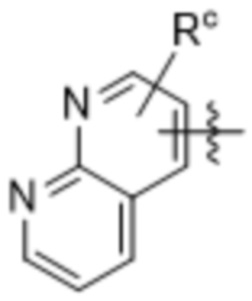 ; и
; и
(f)
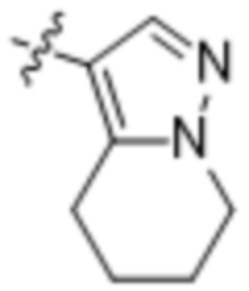 ,
, 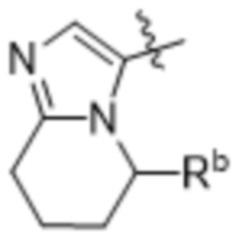 ,
, 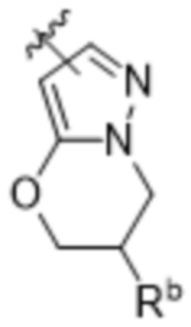 ,
, 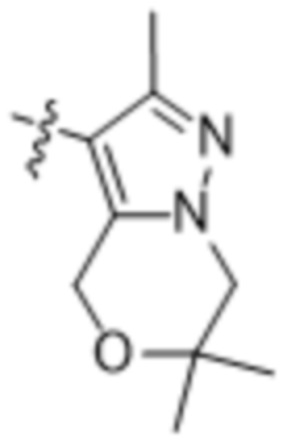 ,
, 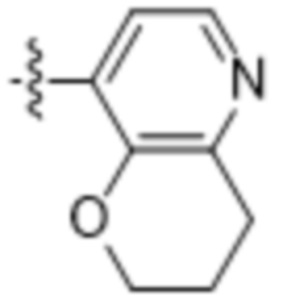 ,
, 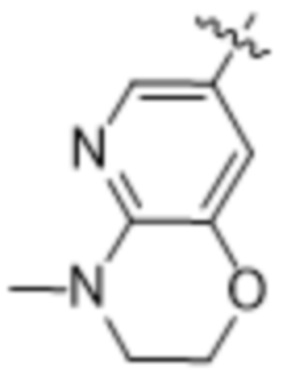 ,
, 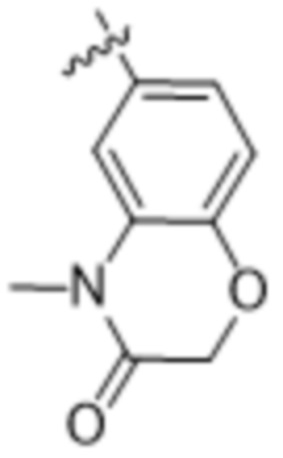 и
и 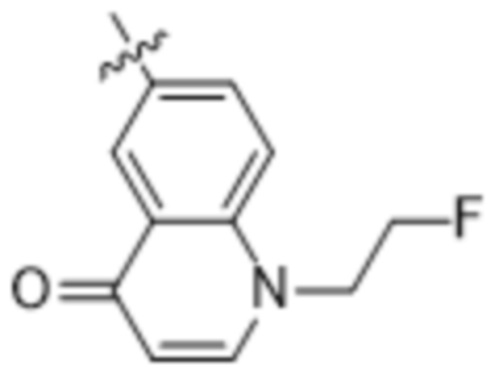 ;
;
где
Ra выбирают из группы, состоящей из: H, галогена, C1-4алкила, OC1-4алкила, C1-4галогеналкила и OC1-4галогеналкила;
Ra1 выбирают из группы, состоящей из: C1-4алкила; OC1-4алкила; OC1-4галогеналкила; N(C=O)CH3; оксазол-2-ила; пиримидин-2-ила; и 5-членного гетероарильного кольца, содержащего две, три или четыре члена, являющих собой атомы азота, где 5-членное гетероарильное кольцо необязательно замещено одним членом Ra;
Rb представляет собой H или C1-4алкил;
Rc представляет собой H или C1-4галогеналкил;
Rd представляет собой H или галоген.
Re выбирают из группы, состоящей из: H, галогена, C1-4алкила, C1-4галогеналкила, OC1-4алкила и C3-6циклоалкила;
Rf выбирают из группы, состоящей из: H, C1-4алкила, CH2CH2OH, C1-4галогеналкила, циклопропила, фенила и фенила, замещенного CF3;
Rg выбирают из группы, состоящей из: H, OC1-4алкила и C1-4галогеналкила;
Ri выбирают из группы, состоящей из: H, галогена, C1-4алкила, C1-4галогеналкила, OH, OC1-4алкила, OC1-4галогеналкила и C3-6циклоалкила;
Rj выбирают из группы, состоящей из: H, галогена, OCH3, OH, NH2 и NO2;
R3 выбирают из группы, состоящей из:
(g) фенила, где фенил независимо замещен одним, двумя или тремя заместителями, каждый из которых выбран из группы, состоящей из галогена, C1-4алкила, C1-4галогеналкила и OC1-4алкила;
(h) 5-(трифторметил)-2-тиенила или 1-метилиндол-2-ила; и
(i) циклопропила; и
R4 представляет собой C1-4алкил или C3-4циклоалкил;
и их фармацевтически приемлемых солей, изотопов, N-оксидов, сольватов и стереоизомеров.
Варианты осуществления настоящего изобретения также представляют собой соединения формулы (II),
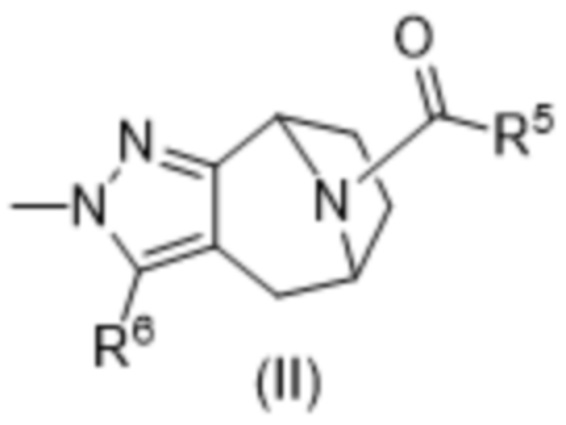
где
R5 выбирают из группы, состоящей из:
(a) фенила, необязательно независимо замещенного одним или двумя заместителями, выбранными из группы, состоящей из галогена, OC1-4алкила и 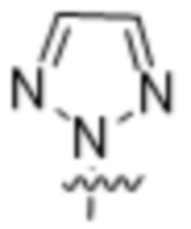 .
.
(b) 6-членного гетероарила, выбранного из группы, состоящей из: 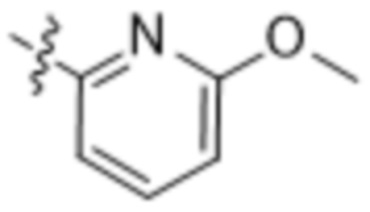 ,
, 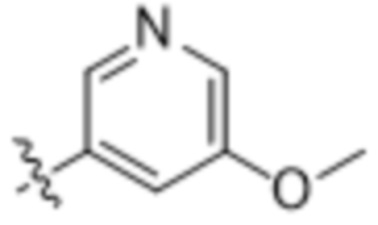 и
и 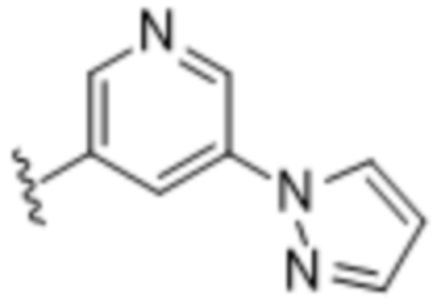 ;
;
(c) 5-членного гетероарила, выбранного из группы, состоящей из:
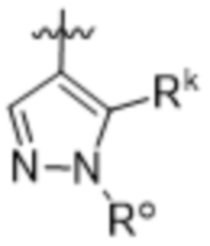 ,
, 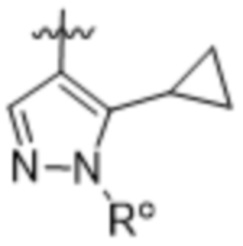 и
и 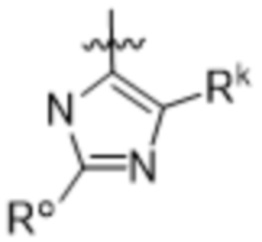 ;
;
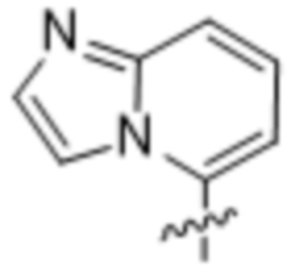
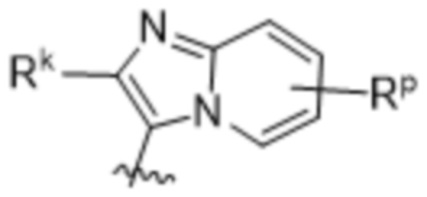
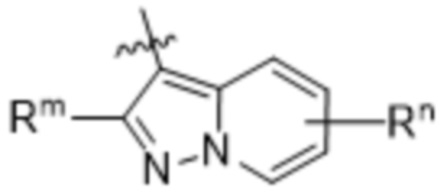
(d) 5,6-конденсированного бициклического гетероарила или 6,5-конденсированного бициклического гетероарила, выбранного из группы, состоящей из:
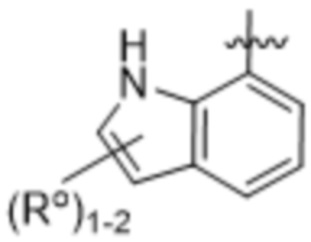 ,
, 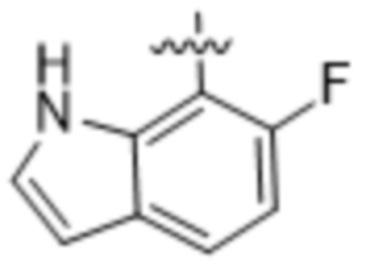 ,
, 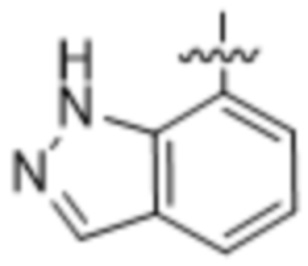 ,
, 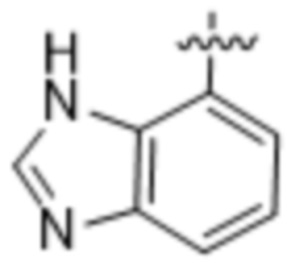 ,
,  ,
,
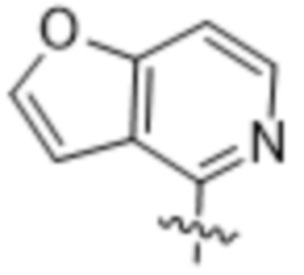 ,
, 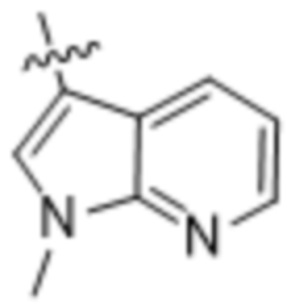 ,
,  ,
,  ,
,  ,
,
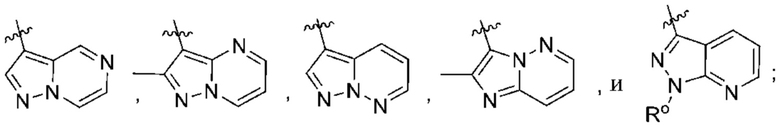
(e) 6,6-конденсированного бициклического гетероарила, выбранного из группы, состоящей из:
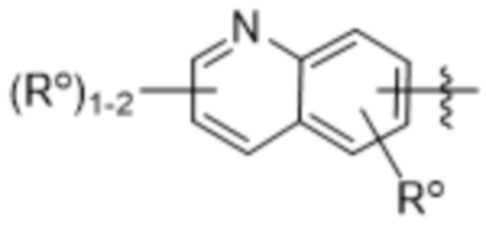 ,
, 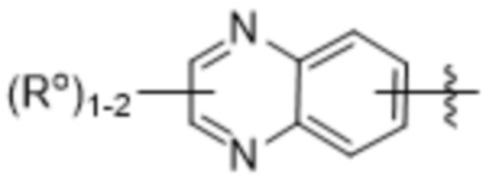 и
и 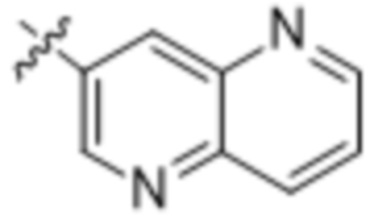 ;
;
(f)
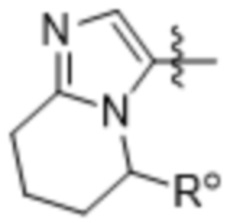 ,
, 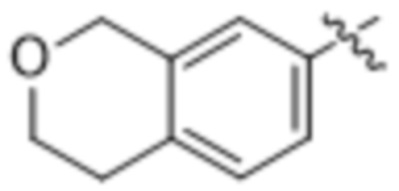 и
и 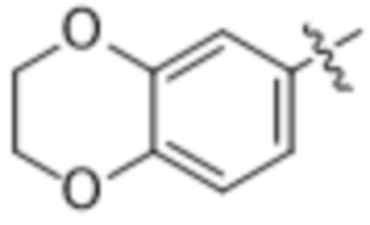 ;
;
где
Rk выбирают из группы, состоящей из: H, галогена, C1-4алкила и C1-4галогеналкила;
Rm выбирают из группы, состоящей из: H, C1-4алкила и C1-4галогеналкила;
Rn представляет собой H или OC1-4алкил;
Ro представляет собой H или C1-4алкил;
Rp выбирают из группы, состоящей из: H, галогена, C1-4алкила, C1-4галогеналкила и OC1-4алкила; и
R6 представляет собой фенил, независимо замещенный одним, двумя или тремя заместителями, выбранными из группы, состоящей из галогена, C1-4алкила, C1-4галогеналкила и OC1-4алкила;;
и их фармацевтически приемлемых солей, изотопов, N-оксидов, сольватов и стереоизомеров.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Термины «включающий», «содержащий», «состоящий из» используются в открытом, неограниченном значении.
Если не определено иное для особых случаев употребления, то термин «алкил» относится к алкильной группе с линейной или разветвленной цепью, содержащей от 1 до 8 атомов углерода. Примеры алкильных групп включают метил (Me), этил (Et), н-пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил (tBu), пентил, изопентил, трет-пентил, гексил, изогексил, а также группы, которые в свете общепринятых знаний, ожидаемых от специалиста в данной области, и описанных в настоящем документе концепций могут считаться эквивалентными любому одному из вышеприведенных примеров. Термин «C1-C4алкил» относится к алкильной группе с линейной или разветвленной цепью, содержащей от 1 до 4 атомов углерода.
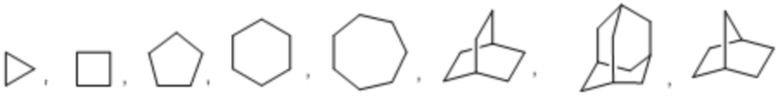
Термин «циклоалкил» означает насыщенный или частично насыщенный моноциклический, конденсированный полициклический или спирополициклический карбоцикл, содержащий от 3 до 12 кольцевых атомов на карбоцикл. Иллюстративные примеры циклоалкильных групп включают в себя следующие объекты в форме соответствующим образом связанных функциональных групп:
Термин «галоген» или «гало» означает хлор, фтор, бром или иод.
Термин «галогеналкил» относится к алкильной группе с прямой или разветвленной цепью, имеющей от 1 до 6 атомов углерода в цепочке, необязательно замещающих атомы водорода атомами галогенов. В настоящем документе термин «C1-C4 галогеналкил» относится к алкильной группе с линейной или разветвленной цепью, имеющей от 1 до 4 атомов углерода в цепочке, необязательно замещающих атомы водорода атомами галогенов. Примеры «галогеналкильных» групп включают в себя трифторметил (CF3), дифторметил (CF2H), монофторметил (CH2F), пентафторэтил (CF2CF3), тетрафторэтил (CHFCF3), монофторэтил (CH2CH2F), трифторэтил (CH2CF3), тетрафтортрифторметилэтил (CF(CF3)2) и группы, которые в свете общепринятых знаний, ожидаемых от специалиста в данной области, и приведенных в настоящем документе представлений, могут считаться эквивалентными одному из вышеприведенных примеров.
Термин «арил» относится к моноциклическому, ароматическому карбоциклу (кольцевой структуре, все кольцевые атомы которой являются атомами углерода), имеющему 6 атомов на каждое кольцо (Атомы углерода в арильных группах подвергаются гибридизации типа «sp2»).
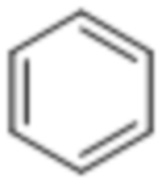
Термин «фенил» представляет собой следующую функциональную группу:
 .
.
Используемый в настоящем документе термин «гетероарил» относится к ароматической моноциклической или мультициклической кольцевой системе, содержащей от 5 до 14 кольцевых атомов, где от 1 до 4 кольцевых атомов независимо представляют собой O, N или S, а остальные кольцевые атомы представляют собой атомы углерода. В одном варианте осуществления гетероарильная группа имеет от 5 до 10 кольцевых атомов. В другом варианте осуществления гетероарильная группа является моноциклической и имеет 5 или 6 кольцевых атомов. В другом варианте осуществления гетероарильная группа является моноциклической и имеет 5 или 6 кольцевых атомов и по меньшей мере один кольцевой атом азота. Гетероарильная группа присоединяется через кольцевой атом углерода, а любой атом азота гетероарила может быть необязательно окислен до соответствующего N-оксида. Термин «гетероарил» также подразумевает гетероарильную группу, как определено выше, которая была конденсирована с бензольным кольцом.
Используемый в настоящем документе термин «5-членный гетероарил» относится к гетероарильной группе, как определено выше, которая имеет 5 кольцевых атомов. Не имеющие ограничительного характера примеры 5-членных гетероарилов иллюстративного характера включают: 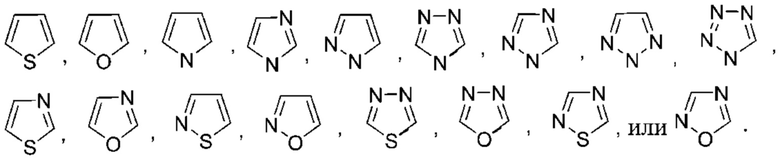
Используемый в настоящем документе термин «6-членный гетероарил» относится к гетероарильной группе, как определено выше, которая имеет 6 кольцевых атомов. Не имеющие ограничительного характера примеры 6-членных гетероарилов иллюстративного характера включают: 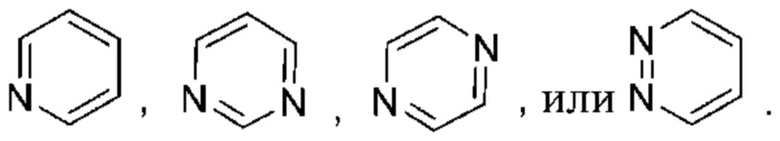
Используемый в настоящем документе термин «5,6-конденсированный бициклический гетероарил, или 6,5-конденсированный бициклический гетероарил» относится к гетероарильной группе, как определено выше, которая имеет 9 кольцевых атомов. Не имеющие ограничительного характера примеры 5,6-конденсированного бициклического гетероарила или 6,5-конденсированного бициклического гетероарила иллюстративного характера включают:
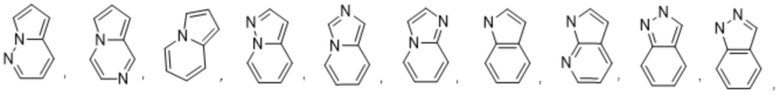
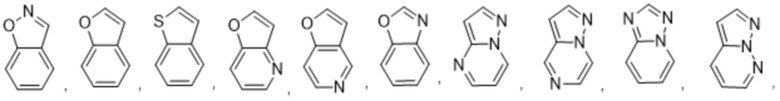
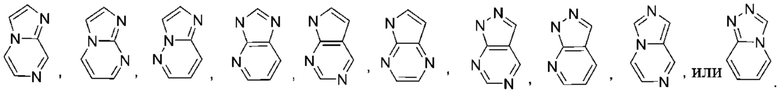
Используемый в настоящем документе термин «6,6-конденсированный бициклический гетероарил» относится к гетероарильной группе согласно приведенному выше определению, которая имеет 9 кольцевых атомов. Не имеющие ограничительного характера примеры 6,6-конденсированного бициклического гетероарила иллюстративного характера включают: 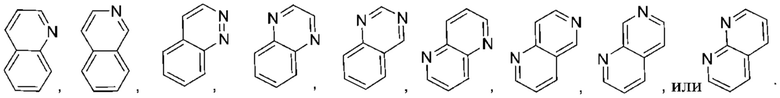
Специалисты в данной области определят, что перечисленные или проиллюстрированные выше гетероарильные, циклоалкильные и арильные группы не исчерпывают все возможности и в рамках этих определенных терминов можно также выбрать дополнительные типы.
Термин «замещенный» означает, что указанная группа или функциональная группа имеет один или более заместителей. Термин «незамещенный» означает, что указанная группа не имеет заместителей. Термин «необязательно замещенный» означает, что указанная группа не имеет заместителей или имеет один или более заместителей. Если термин «замещенный» применяется для описания структурной системы, это означает, что замещение происходит в любом положении системы, допускаемом валентностью.
Термин «переменная точка присоединения» означает, что группа может присоединяться в более чем одном альтернативном положении в структуре. Присоединяемое соединение или группа всегда замещает атом водорода у одного из кольцевых атомов. Иными словами, все перестановки в рамках соединения представлены одной схемой, как показано на иллюстрациях ниже.
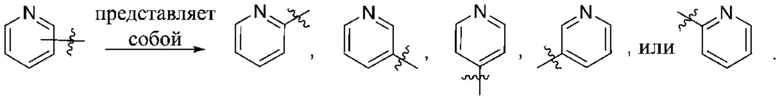
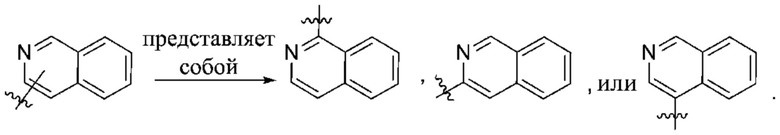
Специалистам в данной области будет ясно, что в случае, если в данном кольце присутствует более одного такого заместителя, то связывание каждого заместителя не зависит от всех остальных. Перечисленные или проиллюстрированные выше группы не являются исчерпывающими.
Термин «замещенный» означает, что указанная группа или функциональная группа имеет один или более заместителей. Термин «незамещенный» означает, что указанная группа не имеет заместителей. Термин «необязательно замещенный» означает, что указанная группа не имеет заместителей или имеет один или более заместителей. Если термин «замещенный» применяется для описания структурной системы, это означает, что замещение происходит в любом положении системы, допускаемом валентностью.
Любая из приведенных в настоящем документе формул предназначена для представления как соединений со структурами, показанными данной структурной формулой, так и некоторых вариаций или форм таких структур. В частности, соединения любой приведенной в настоящем документе формулы могут иметь асимметрические центры и, следовательно, существовать в различных энантиомерных формах. Все оптические изомеры и стереоизомеры соединений общей формулы, а также их смеси, рассматриваются в рамках объема формулы. Соединения данного изобретения могут иметь один или более асимметричных центров; таким образом, возможно получение таких соединений в качестве отдельных (R)- или (S)-изомеров или их смесей. Таким образом, любая приведенная в настоящем документе формула предназначена для обозначения рацемата, одной или более энантиомерных форм, одной или более диастереомерных форм и их смесей. Кроме того, предполагается, что любая приведенная в настоящем документе формула также относится к любому из гидратов, сольватов и полиморфов таких соединений, а также их смесям, даже если такие формы не указаны явным образом.
Термин «R» в стереоцентре обозначает, что стереоцентр имеет чистую R-конфигурацию, определенную в соответствии со стандартами, существующими в данной области; аналогично термин S обозначает, что стереоцентр имеет чистую S-конфигурацию. В настоящем документе термин RS обозначает стереоцентр, существующий в форме смеси R- и S-конфигураций.
Соединения, содержащие один стереоцентр без обозначения стереосвязи, представляют собой смесь 2 энантиомеров. Соединения, содержащие 2 стереоцентра без обозначения стереосвязи для обоих из них, представляют собой смесь 4 диастереомеров. Соединения с двумя стереоцентрами, каждый из которых обозначен как «RS» и имеет обозначения стереосвязи, представляют собой двухкомпонентную смесь, обладающую относительной стереохимической структурой, как показано в структурной формуле. Необозначенные стереоцентры, указанные в структурной формуле без обозначения стереосвязей, представляют собой смесь R- и S-конфигураций. Для необозначенных стереоцентров, структурная формула которых приведена с обозначениями стереосвязей, абсолютная стереохимическая структура соответствует показанной формуле.
Упоминание соединения в настоящем документе означает ссылку на любое из следующего: (a) буквально указанную форму такого соединения и (b) любую из форм такого соединения в той среде, где соединение находится на момент упоминания. Например, упоминание в настоящем документе такого соединения, как R-COOH, включает ссылку на любую из следующих форм, например R-COOH(тв.), R-COOH(раств.) и R-COO-(раств.). В этом примере R-COOH(тв.) относится к твердому соединению и может, например, содержаться в таблетке или какой-либо другой твердой фармацевтической композиции или препарате; R-COOH(раств.) относится к недиссоциированной форме соединения в растворителе; R-COO-(раств.) относится к диссоциированной форме соединения в растворителе, такой как диссоциированная форма соединения в водной среде, независимо от того, получена ли диссоциированная форма из R-COOH, его соли или любой другого вещества, которое дает R-COO- после диссоциации в рассматриваемой среде. В другом примере такое выражение, как «действие вещества на соединение формулы R-COOH», означает действие такого вещества на форму или формы соединения R-COOH, которая существует или которые существуют в той среде, где осуществляется такое воздействие. В еще одном примере такое выражение, как «реакция вещества с соединением формулы R-COOH», относится к реакции: (a) такого вещества в соответствующей химической форме или формах, которая существует или которые существуют в той среде, где осуществляется описываемая реакция; с (b) соответствующей химической формой или формами соединения R-COOH, которая существует или которые существуют в той среде, где осуществляется такая реакция. Таким образом, если такое вещество находится, например, в водной среде, подразумевается, что соединение R-COOH находится в той же среде и, следовательно, на такое вещество действуют такие формы, как R-COOH(водн.) и/или R-COO-(водн.), где нижний индекс «(водн.)» означает «водный» в соответствии с его общепринятым значением в химии и биохимии. В этих примерах номенклатуры выбрали функциональную группу карбоновой кислоты; однако этот выбор не является сознательным ограничением, а является всего лишь иллюстрацией. Подразумевается, что аналогичные примеры могут быть приведены и для иных функциональных групп, включая, без ограничений, такие группы, как гидроксильная группа, азотные основные группы, например, как в аминах, а также любые другие группы, которые известным образом взаимодействуют или перестраиваются в содержащей соединение среде. Такие взаимодействия и перестройки включают, без ограничений, диссоциацию, ассоциацию, таутомерию, сольволиз, включая гидролиз, сольватацию, включая гидратацию, протонирование и депротонирование. В настоящем документе не приводятся дальнейшие примеры в этой связи, поскольку эти взаимодействия и перестройки в каждой конкретной среде хорошо известны любому специалисту в данной области.
Любая из приведенных в настоящем документе формул также представляет как немеченые, так и меченные изотопами формы соединений. Меченные изотопами соединения имеют структуры, показанные представленными в настоящем документе формулами, при этом исключение заключается в замещении одного или более атомов атомом, имеющим выбранную атомную массу или массовое число в обогащенной форме. Примеры изотопов, которые могут быть включены в соединения по настоящему изобретению в форме, превышающей их естественное содержание, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора, хлора и йода, такие как 2H (или химический символ D), 3H (или химический символ T), 11C, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F, 36Cl и 125I соответственно. Такие меченные изотопами соединения используют при исследованиях метаболизма (предпочтительно с применением 14C), кинетики реакций (например, с применением 2H или 3H), для методик детекции или получения изображений (таких как позитронно-эмиссионная томография (ПЭТ) или однофотонная эмиссионная компьютерная томография (ОФЭКТ)), включая анализ распределения лекарственного средства или субстрата по тканям, или при радиотерапии пациентов. В частности, соединения, меченные 18F или 11C, могут оказаться особенно предпочтительными для исследований способами ПЭТ или ОФЭКТ. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий (т. е. 2H или D), может обеспечить некоторые лечебные преимущества вследствие большей метаболической стабильности соединений, например большего периода полужизни in vivo или сниженной необходимой дозировки. Соединения настоящего изобретения, меченные изотопами, можно по существу получать путем проведения процедур, описанных ниже в схемах или примерах и способах приготовления, которые описаны ниже, путем замещения легкодоступного реагента, не содержащего меченных изотопами атомов, реагентом с меченными изотопами атомами.
При описании любой приведенной в настоящем документе формулы выбор конкретной функциональной группы из списка возможных вариантов для указанной переменной не означает определение такого выбора варианта для такой переменной в других формулах. Иными словами, если какая-либо переменная присутствует в формуле более чем в одном месте, то выбор варианта из указанного списка в одном месте не зависит от выбора варианта для той же переменной в другом месте формулы, если не указано иное.
Термин «Cn-mалкил» означает линейную или разветвленную алифатическую цепь с общим количеством N атомов углерода в цепи, удовлетворяющим условию n ≤ N ≤ m, где m > n.
Если одно и то же множество заместителей назначается различным группам, подразумевается, что специфическое отдельное назначение заместителя каждой из таких групп выполняется независимо по отношению к конкретному отдельному назначению заместителей остальных группам. В качестве иллюстрации, но не в качестве ограничения, если каждая из групп Q и R может представлять собой H или F, выбор H или F для Q осуществляется независимо от выбора H или F для R, поэтому выбор назначения для Q не определяет выбор назначения для R, или наоборот, если явно не указано иное. Иллюстративное перечисление пунктов формулы изобретения в этом отношении будет толковаться как «каждое соединение из Q и R независимо представляет собой H или F», или «каждое соединение из Q и R независимо выбирают из группы, состоящей из H и F».
Если не указано иное, описание или название конкретного соединения в описании и формуле изобретения включает в себя как отдельные энантиомеры, так и их смеси (рацемические или другие). Способы определения стереохимии и разделения стереоизомеров хорошо известны в данной области.
В другом примере цвиттерионное соединение в настоящем документе было бы включено путем ссылки на соединение, которое может образовывать цвиттерион, даже если оно явно не упоминается в своей цвиттерионной форме. Такие термины, как «цвиттерион», «цвиттерионы», а также их синонимы «цвиттерионное (-ые) соединение (-я)», являются стандартными рекомендованными ИЮПАК терминами, которые хорошо известны и входят в стандартные наборы определенных научных названий. В этой связи термину «цвиттерион» присвоен уникальный идентификатор CHEBI:27369 в Словаре химических объектов биологического интереса (ChEBI). Как по существу хорошо известно, цвиттерион или цвиттерионное соединение представляет собой нейтральное соединение, имеющее формальные единичные заряды противоположных знаков. Иногда для этих соединений также применяется термин «внутренние соли». В других источниках эти соединения называются «диполярными ионами», хотя в некоторых источниках последний термин считается неправильным. В качестве конкретного примера аминоэтановая кислота (аминокислота глицин) имеет формулу H2NCH2COOH и в некоторых средах (в данном случае в нейтральной среде) существует в форме цвиттериона +H3NCH2COO-. Цвиттерионы, цвиттерионные соединения, внутренние соли и диполярные ионы в известных и хорошо обоснованных значениях перечисленных терминов относятся к объему данного изобретения, как без труда определит специалист в данной области. Поскольку нет необходимости называть каждый отдельный вариант осуществления, который может представить себе специалист в данной области, в настоящем документе не приводятся явно структуры цвиттерионных соединений, родственных соединениям настоящего изобретения. Однако все такие структуры являются частью вариантов осуществления настоящего изобретения. В настоящем документе отсутствуют дополнительные примеры в этой связи, поскольку возможные взаимодействия и перестройки в каждой конкретной среде, приводящие к различным формам каждого конкретного соединения, хорошо известны специалисту в данной области.
При описании любой приведенной в настоящем документе формулы выбор конкретной функциональной группы из списка возможных вариантов для указанной переменной не означает определение такого выбора варианта для переменной в других формулах. Иными словами, если какая-либо переменная присутствует в формуле более чем в одном месте, то выбор варианта из указанного списка в одном месте не зависит от выбора варианта для той же переменной в другом месте формулы, если не указано иное.
В качестве первого примера терминологии заместителей, если заместитель S1пример представляет собой один из S1 и S2, а заместитель S2пример представляет собой один из S3 и S4, эти обозначения относятся к вариантам осуществления данного изобретения, приведенным в соответствии с вариантами, где S1пример представляет собой S1, а S2пример представляет собой S3; S1пример представляет собой S1, а S2пример представляет собой S4; S1пример представляет собой S2, а S2пример представляет собой S3; S1пример представляет собой S2, а S2пример представляет собой S4; а также эквивалентам каждого из таких вариантов. Более краткую терминологию «S1пример представляет собой один из S1 и S2, а S2пример представляет собой один из S3 и S4» соответственно применяют в настоящем документе для краткости, а не для ограничения. Приведенный выше первый пример по используемой для обозначения заместителей терминологии, данный в общих терминах, предназначен для иллюстрации различных вариантов обозначений заместителей, описанных в настоящем документе.
Более того, если для любого элемента химической структуры или заместителя приводится более одного обозначения, варианты осуществления настоящего изобретения содержат различные, принимаемые независимо, сочетания вариантов из перечисленных обозначений, а также их эквиваленты. В качестве второго примера терминологии заместителей, если в данном документе описано, что если заместитель Sпример представляет собой один из S1, S2 и S3, то этот перечень относится к вариантам осуществления данного изобретения, для которых Sпример представляет собой S1; Sпример представляет собой S2; Sпример представляет собой S3; Sпример представляет собой один из S1 и S2; Sпример представляет собой один из S1 и S3; Sпример представляет собой один из S2 и S3; Sпример представляет собой один из S1, S2 и S3; и Sпример представляет собой любой эквивалент каждого из этих вариантов. Для краткости изложения, но не с целью ограничения, в настоящем документе соответственно применяется сокращенная терминология: «Sпример представляет собой один из S1, S2 и S3». Приведенный выше второй пример по используемой для обозначения заместителей терминологии, данный в общих терминах, предназначен для иллюстрации различных вариантов обозначения заместителей, описанных в настоящем документе.
Предполагается, что номенклатура «Ci-C», где j > i, используемая в настоящем документе для обозначения класса заместителей, предназначена для указания вариантов осуществления настоящего изобретения, для которых индивидуально реализовано каждое и все возможные количества атомов углерода от i до j, включая i и j. В качестве примера термин «C1-C3» относится независимо к вариантам осуществления, в которых имеется один атом углерода (C1), вариантам осуществления, в которых имеются два атома углерода (C2), и вариантам осуществления, в которых имеются три атома углерода (C3).
Термин «фармацевтически приемлемая соль» означает соль кислоты или основания соединения, представленного формулой (I) (а также соединений формулы (II)), которое является нетоксичным, биологически переносимым или иным образом биологически приемлемым для введения субъекту. См. по существу S.M. Berge, et al., “Pharmaceutical Salts”, J. Pharm. Sci., 1977, 66:1-19, и Handbook of Pharmaceutical Salts, Properties, Selection, and Use, Stahl and Wermuth, Eds., Wiley-VCH и VHCA, Zurich, 2002. Предпочтительными фармацевтически приемлемыми солями являются соли, которые имеют фармакологический эффект и приемлемы для контакта с тканями пациентов без ненадлежащей раздражающей, токсической или аллергической реакции.
Соединение формулы (I) (а также соединения формулы (II)) может иметь в достаточной степени кислую группу, в достаточной степени основную группу или оба типа функциональных групп, и, соответственно, вступать в реакцию с рядом неорганических или органических оснований, а также неорганических и органических кислот с образованием фармацевтически приемлемой соли.
Примеры фармацевтически приемлемых солей включают в себя сульфаты, пиросульфаты, бисульфаты, сульфиты, бисульфиты, фосфаты, моногидрогенфосфаты, дигидрогенфосфаты, метафосфаты, пирофосфаты, хлориды, бромиды, иодиды, ацетаты, пропионаты, деканоаты, каприлаты, акрилаты, формиаты, изобутираты, капроаты, гептаноаты, пропиолаты, оксалаты, малонаты, сукцинаты, субераты, себацинаты, фумараты, малеаты, бутин-1,4-диоаты, гексин-1,6-диоаты, бензоаты, хлорбензоаты, метилбензоаты, динитробензоаты, гидроксибензоаты, метоксибензоаты, фталаты, сульфонаты, ксилолсульфонаты, фенилацетаты, фенилпропионаты, фенилбутираты, цитраты, лактаты, γ-гидроксибутираты, гликоляты, тартраты, метансульфонаты, пропансульфонаты, нафталин-1-сульфонаты, нафталин-2-сульфонаты и манделаты.
Соединения формулы (I) (а также соединения формулы (II)) могут содержать по крайней мере один основный атом азота, поэтому желательные фармацевтически приемлемые соли могут быть получены по любой соответствующей методике, известной специалистам, например, путем обработки свободного основания неорганической кислотой, такой как хлористоводородная кислота, бромисто-водородная кислота, серная кислота, сульфаминовая кислота, азотная кислота, борная кислота, фосфорная кислота и т. п., или органической кислотой, такой как уксусная кислота, фенилуксусная кислота, пропионовая кислота, стеариновая кислота, молочная кислота, аскорбиновая кислота, малеиновая кислота, гидроксималеиновая кислота, изэтионовая кислота, янтарная кислота, валериановая кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота, олеиновая кислота, пальмитиновая кислота, лауриновая кислота, пиранозидиловой кислотой, такой как глюкуроновая кислота или галактуроновая кислота, альфа-гидроксикислотой, такой как миндальная кислота, лимонная кислота или винная кислота, аминокислотой, такой как аспарагиновая кислота или глутаминовая кислота, ароматической кислотой, такой как бензойная кислота, 2-ацетоксибензойная кислота, нафтойная кислота или коричная кислота, сульфоновой кислотой, такой как лаурилсульфоновая кислота, п-толуолсульфоновая кислота, метансульфоновая кислота, этансульфоновая кислота, любой совместимой смесью кислот, таких как приведенные в примерах настоящего документа, и любой иной кислотой или смесью кислот, которые рассматриваются как эквивалентные.
Соединения формулы (I) (а также соединения формулы (II) могут содержать функциональную группу карбоновой кислоты, требуемая фармацевтически приемлемая соль может быть получена любым соответствующим способом, например, путем обработки свободной кислоты неорганическим или органическим основанием, таким как амин (первичный, вторичный или третичный), гидроксид щелочного металла, гидроксид щелочноземельного металла, любая совместимая смесь оснований, таких как приведенные в настоящей заявке в примерах, и любого другого основания и их смеси, которые рассматриваются как эквивалентные или приемлемые заменители в свете обычного уровня знаний в данной технологии. Иллюстративные примеры подходящих солей включают органические соли, полученные из аминокислот, таких как глицин и аргинин, аммиак, карбонаты, бикарбонаты, первичные, вторичные и третичные амины, а также циклические амины, такие как бензиламины, пирролидины, пиперидин, морфолин, пиперазин, N-метилглюкамин и трометамин и неорганические соли, полученные из натрия, кальция, калия, магния, марганца, железа, меди, цинка, алюминия и лития.
Соединения изобретения, включая их фармацевтически приемлемые соли, отдельно или в комбинации (совокупно называемые «активным агентом» или «активными агентами»), настоящего изобретения можно использовать в качестве модуляторов MGL в способах изобретения. Такие способы модуляции MGL включают использование терапевтически эффективного количества по крайней мере одного химического соединения настоящего изобретения.
В некоторых вариантах осуществления модулятор MGL используется в качестве ингибитора для лечения пациентов, у которых диагностировано заболевание, расстройство или медицинское состояние, либо которые страдают от заболевания, расстройства или медицинского состояния, опосредованного активностью рецептора MGL, и, в том числе, описанного в настоящем документе. Симптомы или состояния заболевания подразумеваются включенными в объем понятия «заболевания, расстройства или состояния».
Соответственно, настоящее изобретение относится к способам применения описанных в настоящем документе активных агентов для лечения пациентов, у которых диагностировано заболевание, расстройство или медицинское состояние, либо которые страдают от заболевания, расстройства или медицинского состояния, связанного с активностью рецепторов MGL. В настоящем документе термин «лечить» или «лечение» относится к назначению активного агента или композиции изобретения субъекту с целью терапевтического или профилактического благоприятного влияния посредством модуляции активности рецептора MGL. Лечение включает обращение течения, облегчение, ослабление, замедление прогрессирования, уменьшение тяжести или профилактику заболевания, расстройства или состояния, или одного или более симптомов такого заболевания, расстройства или состояния, связанного с модуляцией MGL. Термин «пациент» относится к млекопитающему пациенту, требующему такого лечения, такому как человек.
Термин «композиция» обозначает продукт, включающий установленные ингредиенты в терапевтически эффективных количествах, а также любой продукт, полученный непосредственно или опосредованно из комбинаций установленных ингредиентов в установленных количествах.
Термин «ингибитор MGL» охватывает соединение, которое взаимодействует с MGL по существу для снижения или устранения его каталитической активности, тем самым повышая концентрации его субстрата (-ов). Термин «MGL-модулируемый» используется для обозначения состояния зависимости от модуляции фермента MGL, включая состояние зависимости от ингибирования фермента MGL. Данное изобретение относится к методам лечения, облегчения симптомов и/или профилактики заболеваний, состояний или расстройств, связанных с болевым синдромом (в том числе воспалительным болевым синдромом), а также психических расстройств, неврологических расстройств, раковых заболеваний и заболеваний глаз путем введения терапевтически эффективных доз модуляторов MGL пациентам, нуждающимся в таком вмешательстве.
Термин «модуляторы» включает в себя как ингибиторы, так и активаторы, причем термин «ингибиторы» относится к соединениям, которые снижают, предотвращают, деактивируют, десенсибилизируют или понижают экспрессию или активность MGL, а «активаторы» представляют собой соединения, которые увеличивают, активируют, облегчают, сенсибилизируют или повышают экспрессию или активность MGL.
Если не указано иное, используемый в настоящем документе термин «влиять» или «подверженный влиянию» (когда речь идет о заболевании, состоянии или расстройстве, зависимом от ингибирования MGL) включает снижение частоты и/или тяжести одного или более симптомов или проявлений указанного заболевания, состояния или расстройства; и/или включает предотвращение развития одного или более симптомов или проявлений указанного заболевания, состояния или расстройства или развития заболевания, состояния или расстройства.
В способах лечения в соответствии с изобретением терапевтически эффективное количество по меньшей мере одного активного агента в соответствии с изобретением назначается пациенту, у которого диагностировано заболевание, расстройство или состояние, либо который страдает от заболевания, расстройства или состояния. Термин «терапевтически эффективное количество» обозначает количество или дозу, достаточные для достижения по существу требуемого терапевтического или профилактического эффекта у пациентов, требующих такого лечения при указанном заболевании, расстройстве или состоянии. Эффективные количества или дозировки активных веществ настоящего изобретения могут быть определены стандартными способами, например моделированием, исследованиями с повышением дозы или клиническими испытаниями с учетом стандартных факторов, таких как способ или путь введения или доставки лекарственного средства, фармакокинетика вещества, степень тяжести и характер течения заболевания, расстройства или состояния, предшествующий или текущий курс лечения объекта, состояние здоровья и реакция объекта на лекарственные средства, а также мнение лечащего врача. Для человека весом 70 кг иллюстративной приемлемой дозировкой является количество от приблизительно 1 до 1000 мг/день, принимаемое за один или множество раз (например, BID, TID, QID или иное, в зависимости от способа).
После улучшения состояния пациента, облегчения симптомов заболевания или расстройства можно корректировать дозу для профилактического или поддерживающего лечения. Например, дозировка, или частота введения, или и то и другое могут быть снижены в зависимости от симптомов до уровня, при котором поддерживается требуемый терапевтический или профилактический эффект. Разумеется, если проявления симптомов ослаблены до приемлемого уровня, лечение можно прекратить. Однако при рецидиве симптомов пациенту может потребоваться долговременное периодическое лечение.
Кроме того, соединения настоящего изобретения предназначены для применения отдельно, в комбинации с одним или более из других соединений настоящего изобретения или в комбинации с дополнительными активными ингредиентами для лечения описанных ниже состояний. Дополнительные активные ингредиенты можно вводить в виде отдельной лекарственной формы вместе с по меньшей мере одним соединением настоящего изобретения, с активными агентами изобретения или включать их в фармацевтическую композицию в соответствии с настоящим изобретением. В иллюстративном варианте осуществления дополнительные активные ингредиенты представляют собой компоненты с известной или доказанной эффективностью при лечении состояний, расстройств или заболеваний, связанных с модуляцией MGL, такие как другой ингибитор MGL или соединение, активное в отношении другой мишени, связанной с конкретным состоянием, расстройством или заболеванием. Упомянутая комбинация компонентов может служить для повышения эффективности (например, путем включения в состав данной комбинации соединения, повышающего эффективность или активность агента в соответствии с настоящим изобретением), ослабления одного или более побочных эффектов или снижения требуемой дозировки активного агента в соответствии с настоящим изобретением.
Применительно к ингибированию мишени «эффективное количество» означает количество, достаточное для воздействия на процесс модуляции MGL.
Активные агенты настоящего изобретения предусмотрены для самостоятельного использования или в комбинации с одним или более дополнительными активными компонентами для приготовления фармацевтических композиций изобретения. В состав соответствующей целям изобретения фармацевтической композиции входит терапевтически эффективное количество по меньшей мере одного активного агента в соответствии с изобретением.
Фармацевтически приемлемые наполнители, обычно используемые в фармацевтических композициях, представляют собой вещества, которые являются нетоксичными, биологически переносимыми и иным образом биологически подходящими для введения пациенту, такие как инертное вещество, добавленное в фармакологическую композицию или иным образом использованное в качестве несущей среды, носителя или разбавителя для облегчения введения агента, а также совместимое с этим агентом. Примеры таких эксципиентов включают в себя карбонат кальция, фосфат кальция, различные сахара и типы крахмала, производные целлюлозы, желатин, растительные масла и полиэтиленгликоли.
Формы доставки фармацевтических композиций, содержащих одну или более единиц дозирования активных агентов, можно получать с применением фармацевтически приемлемых эксципиентов и методик приготовления, известных в настоящее время или доступных специалистам в данной области в будущем. Композиции можно вводить с применением способов, обладающих признаками изобретения, приемлемым путем доставки, например, перорально, парентерально, ректально, местно, через глаза или путем ингаляции.
Препарат может быть представлен в форме таблеток, капсул, саше, драже, порошков, гранул, пастилок, порошков для восстановления, жидких препаратов или суппозиториев. Композиции могут быть получены для любого одного из множества способов введения, таких как внутривенная инфузия, местное нанесение или пероральное введение. Предпочтительно композиции могут быть получены для перорального введения.
Для перорального введения активные агенты изобретения могут быть обеспечены в форме таблеток, капсул или гранул или в виде раствора, эмульсии или суспензии. Для получения композиций для перорального применения активные агенты могут быть смешаны с получением дозы, например, для человека массой 70 кг, от приблизительно 1 до приблизительно 1000 мг/день, предназначенной для приема за один или множество раз, в качестве иллюстративного диапазона.
Таблетки для перорального введения могут включать в себя активный (-ые) компонент (-ы), смешанный (-ые) с совместимыми фармацевтически приемлемыми эксципиентами, такими как разбавители, вещества для улучшения распадаемости таблеток, связывающие вещества, смазывающие вещества, подсластители, вкусовые добавки, красители и консерванты. Приемлемые инертные наполнители включают в себя карбонат натрия и кальция, фосфат натрия и кальция, лактозу, крахмал, сахар, глюкозу, метилцеллюлозу, стеарат магния, маннит, сорбит и т. п. Примеры жидких эксципиентов для перорального применения включают в себя этанол, глицерин, воду и т. п. Примеры веществ для улучшения распадаемости таблеток представляют собой крахмал, поливинилпирролидон (ПВП), натрия крахмал гликолят, микрокристаллическую целлюлозу и альгиновую кислоту. Связывающие агенты могут включать в себя крахмал и желатин. Смазывающий агент, при его наличии, может представлять собой стеарат магния, стеариновую кислоту или тальк. При необходимости таблетки могут быть покрыты таким материалом, как глицерилмоностеарат или глицерилдистеарат, для отсрочки всасывания в желудочно-кишечном тракте, или они могут иметь кишечнорастворимое покрытие.
Капсулы для перорального введения включают в себя твердые и мягкие желатиновые капсулы или капсулы из (гидроксипропил)метилцеллюлозы. Для приготовления твердых желатиновых капсул активные компоненты могут быть смешаны с твердым, полутвердым или жидким разбавителем. Жидкости для перорального введения могут быть представлены в форме суспензий, растворов, эмульсий или сиропов, или они могут быть лиофилизованы или представлены в сухом виде для восстановления водой или другой приемлемой несущей средой перед применением. Такие жидкие композиции могут необязательно содержать фармацевтически приемлемые эксципиенты, такие как суспендирующие агенты (например, сорбит, метилцеллюлозу, альгинат натрия, желатин, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу, гель алюминия стеарата и т. п.); неводные несущие среды, например масло (например, миндальное масло или фракционированное кокосовое масло), пропиленгликоль, этиловый спирт или воду; консерванты (например, метил- или пропил-п-гидроксибензоат или сорбиновую кислоту); смачивающие агенты, такие как лецитин; и, при необходимости, ароматизирующие или красящие агенты.
Активные агенты данного изобретения также можно вводить непероральным образом. Например, композиции могут быть приготовлены для ректального введения в виде суппозитория, клизмы или пены. В случае композиций для парентерального введения, включая внутривенное, внутримышечное, внутрибрюшинное или подкожное введение, агенты изобретения могут быть приготовлены в виде стерильных водных растворов или суспензий с добавлением соответствующих буферных растворов до получения требуемых значений pH и изотоничности, либо в виде парентерально приемлемого масла. Приемлемые водные несущие среды включают в себя раствор Рингера и изотонический раствор хлорида натрия. Подобные лекарственные формы могут быть приготовлены в виде однодозовой формы, такой как ампулы или одноразовые приспособления для инъекций, в виде многодозовой формы, такой как флаконы, из которых может быть отобрано требуемое количество препарата, или в твердой форме или форме первичного концентрата, который может быть использован для приготовления композиций для инъекций. Типичные дозы для инфузии находятся в диапазоне от около 1 до 1000 мкг/кг/мин вещества в виде смеси с фармацевтическим носителем в течение промежутка времени от нескольких минут до нескольких дней.
Для местного применения агенты могут быть смешаны с фармацевтическим носителем в концентрации от около 0,01% до около 20% лекарственного средства в несущей среде, предпочтительно 0,1-10%. В другом способе введения агенты изобретения могут применяться в виде пластыря с составом для трансдермальной доставки.
Альтернативно в способах изобретения активные вещества могут быть введены путем ингаляции, через нос или рот, например, в виде спрея, содержащего также соответствующий носитель.
В дополнительном варианте осуществления изобретение относится к способу лечения пациента, у которого диагностировано заболевание, расстройство или состояние, либо который страдает от заболевания, расстройства или состояния, связанного с модуляцией MGL, включающему введение нуждающемуся в таком лечении пациенту терапевтически эффективного количества активного агента.
Соединения формулы (I) (а также соединения формулы (II)) подходят для способов лечения, облегчения и (или) профилактики заболевания, состояния или расстройства, зависящего от ингибирования MGL. Такие способы включают введение пациенту, включая животное, млекопитающее и человека, требующему такого лечения, облегчения и/или профилактики, терапевтически эффективного количества соединения формулы (I), (а также соединений формулы (II)) или их энантиомера, диастереомера, сольвата или фармацевтически приемлемой соли.
В частности, соединения формулы (I) (а также соединения формулы (II)) или их фармацевтически приемлемые соли, изотопы, N-оксиды, сольваты и стереоизомеры используют для лечения, облегчения и/или профилактики заболеваний, состояний или расстройств, вызывающих болевой синдром, психические расстройства, неврологические расстройства, раковые заболевания и патологические состояния глаз. Более конкретно, соединения формулы (I) (а также соединения формулы (II)) или их фармацевтически приемлемые соли, изотопы, N-оксиды, сольваты и стереоизомеры используют для лечения, облегчения и/или профилактики воспалительной боли, большого депрессивного расстройства, терапевтически резистентной депрессии, тревожной депрессии или биполярного расстройства путем введения нуждающемуся в этом субъекту терапевтически эффективного количества соединения формулы (I) (а также соединений формулы (II)) или их фармацевтически приемлемой соли, изотопа, N-оксида, сольвата или стереоизомера, как определено в настоящем документе.
(1) Болевой синдром
Примеры воспалительной боли включают, помимо прочего, боль, вызванную заболеванием, состоянием, расстройством или болезненным состоянием, включая воспалительное заболевание кишечника, висцеральную боль, мигрень, послеоперационную боль, остеоартрит, ревматоидный артрит, боль в спине, боль в пояснице, боль в суставах, боль в животе, боль в груди, родовые схватки, заболевания опорно-двигательного аппарата, кожные заболевания, зубную боль, изжогу, ожог, солнечный ожог, укус змеи, укус ядовитой змеи, укус паука, укус насекомых, нейрогенный мочевой пузырь, интерстициальный цистит, инфекцию мочевыводящих путей, ринит, контактный дерматит/гиперчувствительность, зуд, экзему, фарингит, мукозит, энтерит, синдром раздраженного кишечника, холецистит, панкреатит, постмастэктомический болевой синдром, менструальную боль, эндометриоз, боль вследствие физической травмы, головную боль, синусовую головную боль, тензионную головную боль или арахноидит.
Одним из типов воспалительной боли является воспалительная гипералгезия/гиперчувствительность. Примеры воспалительной гипералгезии включают заболевание, состояние, расстройство или болезненное состояние, включая воспаление, остеоартрит, ревматоидный артрит, боль в спине, боль в суставах, боль в животе, мышечные заболевания, кожные заболевания, послеоперационную боль, головные боли, зубную боль, ожог, солнечный ожог, укус насекомых, нейрогенный мочевой пузырь, недержание мочи, интерстициальный цистит, инфекцию мочевыводящих путей, кашель, астму, хроническое обструктивное заболевание легких, ринит, контактный дерматит/гиперчувствительность и/или кожную аллергию, зуд, экзему, фарингит, энтерит, синдром раздраженного кишечника, воспалительные заболевания кишечника, включая болезнь Крона, язвенный колит, доброкачественную гипертрофию предстательной железы и гиперчувствительность слизистой носа.
В одном варианте осуществления настоящее изобретение относится к способу лечения, облегчения симптомов и (или) профилактики воспалительной висцеральной гипералгезии, которой сопутствует повышенная висцеральная раздражительность, включающему, в основном включающему, либо состоящему из стадии введения нуждающемуся в таком лечении субъекту терапевтически эффективного количества соединения формулы (I) (а также соединений формулы (II)) или их фармацевтически приемлемой соли, изотопа, N-оксида, сольвата или стереоизомера. В еще одном варианте осуществления настоящее изобретение относится к способу лечения воспалительной соматической гипералгезии, которая характеризуется повышенной чувствительностью к тепловым, механическим и (или) химическим воздействиям, включающему введение нуждающемуся в таком лечении субъекту терапевтически эффективного количества соединения формулы (I) (а также соединений формулы (II)) или их фармацевтически приемлемой соли, изотопа, N-оксида, сольвата или стереоизомера.
Дополнительный вариант осуществления настоящего изобретения относится к способу лечения, облегчения симптомов и/или предотвращения проявления нейропатической боли. Примеры проявления нейропатической боли включают болевой синдром, вызванный заболеванием, состоянием, расстройством или болезненным состоянием, включая раковые заболевания, неврологические расстройства, операции на позвоночнике и периферическом нерве, опухоль головного мозга, травматическое повреждение мозга (ТПМ), травму спинного мозга, хронический болевой синдром, фибромиалгию, синдром хронической усталости, волчанку, саркоидоз, периферическую нейропатию, двустороннюю периферическую нейропатию, диабетическую нейропатию, центральную боль, виды нейропатии, связанные с повреждением спинного мозга, инсульт, боковой амиотрофический склероз (БАС), болезнь Паркинсона, рассеянный склероз, неврит седалищного нерва, невралгию нижнечелюстного сустава, периферический неврит, полиневрит, боль культи, фантомные боли в ампутированных конечностях, переломы костей, пероральную нейропатическую боль, боль Шарко, комплексный регионарный болевой синдром I и II (КРБС I/II), радикулопатию, синдром Гийена-Барре, парестетическую мералгию, парестезию полости рта, неврит зрительного нерва, постфебрильный неврит, мигрирующий неврит, сегментарный неврит, неврит Гомбо, нейронит, цервикобрахиальную невралгию, краниальную невралгию, синдром коленчатого узла, глоссофарингеальную невралгию, мигренозную невралгию, идиопатическая невралгию, межреберную невралгию, невралгию молочной железы, невралгию Мортона, синдром носоресничного нерва, затылочную невралгию, постгерпетическую невралгию, каузалгию, болезнь Митчелла, невралгию Слудера, основно-небную невралгию, невралгию надглазничного нерва, невралгию тройничного нерва, вульводинию, видиановую невралгию или нейропатию, вызванную химиотерапией.
Одним из видов нейропатической боли является нейропатическая холодовая аллодиния, которая характеризуется наличием связанного с нейропатией аллодинического состояния с повышенной чувствительностью к холодовым раздражителям. Примеры нейропатической холодовой аллодинии включают аллодинию, вызванную заболеванием, состоянием, расстройством или болезненным состоянием, включая нейропатическую боль (невралгию), боль, вызванную хирургической операцией на позвоночнике и периферическом нерве или травмой, травматическое повреждение головного мозга (ТПГМ). невралгию тройничного нерва, постгерпетическую невралгию, каузалгия, периферическую нейропатию, диабетическую нейропатию, центральную боль, инсульт, периферический неврит, полиневрит, комплексный регионарный болевой синдром I и II (КРБС I/II) и радикулопатию.
В другом варианте осуществления настоящее изобретение относится к способу лечения, облегчения симптомов и (или) профилактики нейропатической холодовой аллодинии с повышенной чувствительностью к холодовым раздражителям, включающему введение нуждающемуся в таком лечении субъекту терапевтически эффективного количества соединения формулы (I) (а также соединений формулы (II)) или их фармацевтически приемлемой соли, изотопа, N-оксида, сольвата или стереоизомера.
2) Психические расстройства
Примеры психических расстройств включают, без ограничений, тревожные расстройства, такие как социальное беспокойство, посттравматическое стрессовое расстройство, фобии, социофобию, особые фобии, паническое расстройство, обсессивно-компульсивное расстройство, острое стрессовое расстройство, тревожное расстройство, вызванное разлукой, и генерализованное тревожное расстройство, а также депрессию, в том числе такие ее проявления, как большое депрессивное расстройство, биполярное расстройство, сезонное аффективное расстройство, послеродовая депрессия, маниакальная депрессия и биполярная депрессия, расстройства настроения и аффективные расстройства настроения, которые можно лечить в соответствии с настоящим изобретением, включают, без ограничений, биполярное расстройство I типа депрессивной, гипоманиакальной, маниакальной и смешанной форм; биполярное расстройство II типа; депрессивные расстройства, такие как одиночный депрессивный эпизод или рецидивирующее большое депрессивное расстройство, малое депрессивное расстройство, терапевтически резистентная депрессия, тревожная депрессия, биполярное расстройство, послеродовое депрессивное расстройство, депрессивные расстройства с психотическими симптомами; устойчивые расстройства настроения, такие как циклотимия, дистимия, эутимия; и предменструальное дисфорическое расстройство;психозы.
3) Неврологические расстройства
Примеры неврологических расстройств включают, без ограничений, треморы, дискинезии, дистонии, спастичность, синдром Туретта; нейромиелит зрительного нерва, болезнь Паркинсона; болезнь Альцгеймера; сенильную деменцию; болезнь Хантингтона; Эпилепсию/припадочные расстройства и расстройства сна.
4) Раковые заболевания:
Примеры раковых заболеваний включают, без ограничений, доброкачественные опухоли кожи, опухоли предстательной железы, опухоли яичников и церебральные опухоли (глиобластомы, медуллоэпителиомы, медуллобластомы, нейробластомы, опухоли эмбрионального происхождения, астроцитомы, астробластомы, эпендимомы, олигодендрогелиомы, нейроэпителиомы, эпифизарные опухоли, эпендимобластомы, злокачественные менингиомы, саркоматоз, злокачественные меланомы, невриномы).
5) Заболевания глаз
Примеры заболеваний глаз включают, без ограничений, глазную гипертензию, глаукому, дегенерацию и апоптоз ганглиозных клеток сетчатки и нейроретинальных клеток.
В других вариантах осуществления настоящего изобретения предлагается способ модуляции активности рецептора MGL, в том числе, когда такой рецептор имеется у субъекта, включающий воздействие на рецептор MGL терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений изобретения.
Вариантами данного изобретения являются соединения формулы (I),

где
R2 выбирают из группы, состоящей из:
(a)  ;
;
(b) 6-членного гетероарила, выбранного из группы, состоящей из: пиридазин-4-ила; пиразин-2-ила; пиримидинила; пиридинила, замещенного C1-4алкилом или ОC1-4алкилом; и пиридинила, где пиридинил замещен одним или двумя заместителями, каждый из которых независимо выбирают из группы, состоящей из галогена, C1-4алкила, OC1-4алкила, OC1-4галогеналкила, C3-6циклоалкила, NH2, CN, N(CH3)2,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  ;
;
(c) 5-членного гетероарила, выбранного из группы, состоящей из:
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  ;
;
(d) 5,6-конденсированного бициклического гетероарила или 6,5-конденсированного бициклического гетероарила, выбранного из группы, состоящей из:
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  ;
;
(e) 6,6-конденсированного бициклического гетероарила, выбранного из группы, состоящей из:
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  ; и
; и
(f)
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  ;
;
где
Ra выбирают из группы, состоящей из: H, галогена, C1-4алкила, OC1-4алкила, C1-4галогеналкила и OC1-4галогеналкила;
Ra1 выбирают из группы, состоящей из: C1-4алкила; OC1-4алкила; OC1-4галогеналкила; N(C=O)CH3; оксазол-2-ила; пиримидин-2-ила; и 5-членного гетероарильного кольца, содержащего две, три или четыре члена, являющих собой атомы азота, где 5-членное гетероарильное кольцо необязательно замещено одним членом Ra;
Rb представляет собой H или C1-4алкил;
Rc представляет собой H или C1-4галогеналкил;
Rd представляет собой H или галоген.
Re выбирают из группы, состоящей из: H, галогена, C1-4алкила, C1-4галогеналкила, OC1-4алкила и C3-6циклоалкила;
Rf выбирают из группы, состоящей из: H, C1-4алкила, CH2CH2OH, C1-4галогеналкила, циклопропила, фенила и фенила, замещенного CF3;
Rg выбирают из группы, состоящей из: H, OC1-4алкила и C1-4галогеналкила;
Ri выбирают из группы, состоящей из: H, галогена, C1-4алкила, C1-4галогеналкила, OH, OC1-4алкила, OC1-4галогеналкила и C3-6циклоалкила;
Rj выбирают из группы, состоящей из: H, галогена, OCH3, OH, NH2 и NO2;
R3 выбирают из группы, состоящей из:
(g) фенила, где фенил независимо замещен одним, двумя или тремя заместителями, выбранными из группы, состоящей: из галогена, C1-4алкила, C1-4галогеналкила и OC1-4алкила;
(h) 5-(трифторметил)-2-тиенила или 1-метилиндол-2-ила; и
(i) циклопропила; и
R4 представляет собой C1-4алкил или C3-4циклоалкил;
и их фармацевтически приемлемые соли, изотопы, N-оксиды, сольваты и стереоизомеры.
Дополнительный вариант осуществления изобретения представляет собой соединение Формулы (I), где R2 представляет собой  , где Ra представляет собой H, галоген, C1-4алкил или OC1-4алкил; и Ra1 представляет собой C1-4алкил, OC1-4алкил, OC1-4галогеналкил или (C=O)NHCH3.
, где Ra представляет собой H, галоген, C1-4алкил или OC1-4алкил; и Ra1 представляет собой C1-4алкил, OC1-4алкил, OC1-4галогеналкил или (C=O)NHCH3.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой
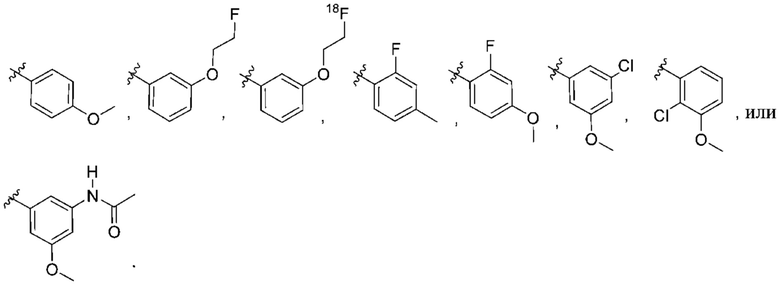
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой  , где Ra представляет собой H, галоген, C1-4алкил, OC1-4алкил или C1-4галогеналкил; и Ra1 представляет собой
, где Ra представляет собой H, галоген, C1-4алкил, OC1-4алкил или C1-4галогеналкил; и Ra1 представляет собой 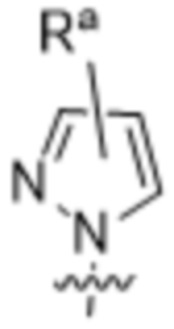 ,
, 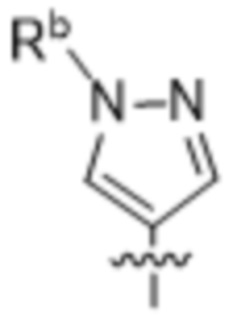 ,
,  ,
, 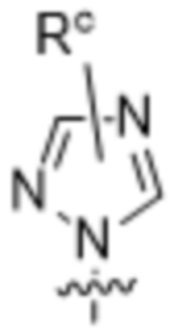 ,
, 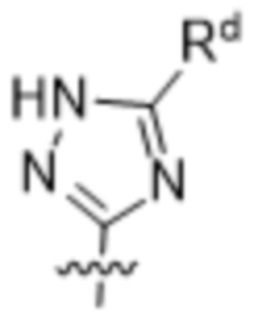 ,
, 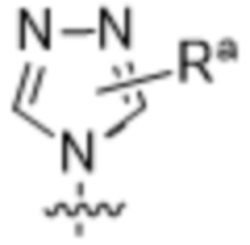 ,
, 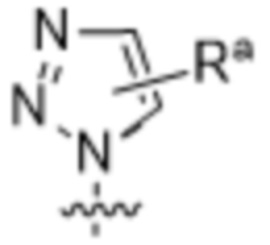 ,
, 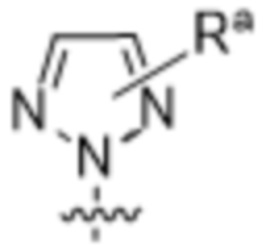 ,
, 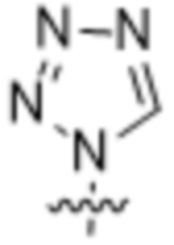 ,
, 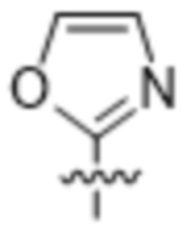 или
или 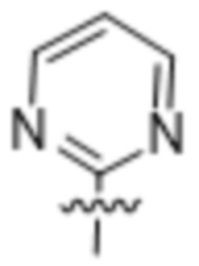 .
.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где Ra1 представляет собой
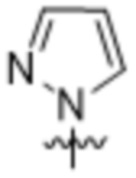 ,
, 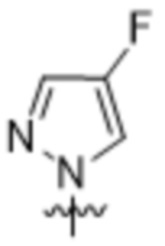 ,
, 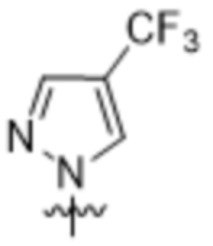 ,
, 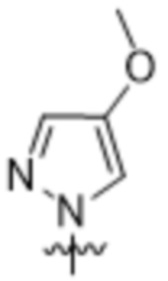 ,
, 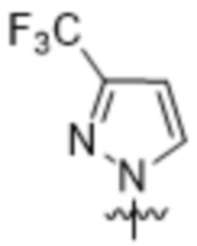 ,
, 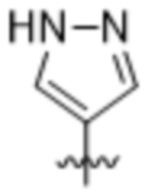 ,
, 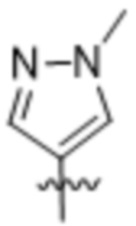 ,
, 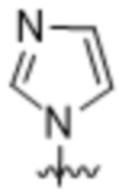 ,
, 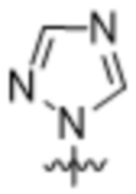 ,
, 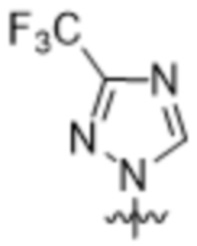 ,
, 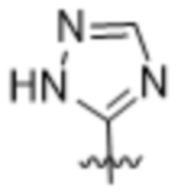 ,
, 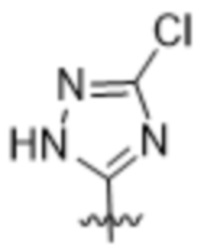 ,
, 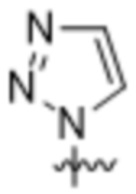 ,
, 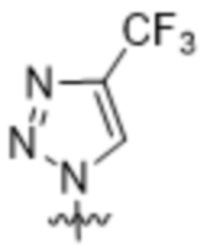 ,
, 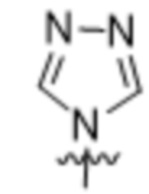 ,
, 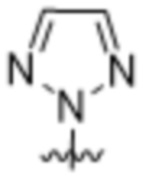 ,
, 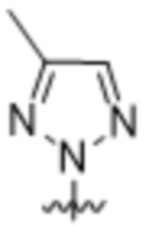 ,
, 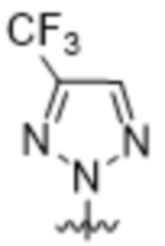 ,
, 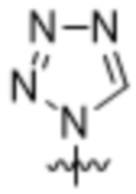 ,
, 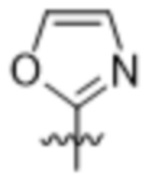 или
или 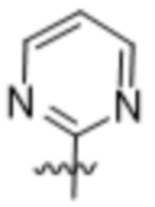 .
.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где Ra представляет собой H, Cl, F, CH3, CF3 или OCH3.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где Rb представляет собой H или CH3;
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где Rc представляет собой H или CH3;
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где Rd представляет собой H, Cl или F.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой 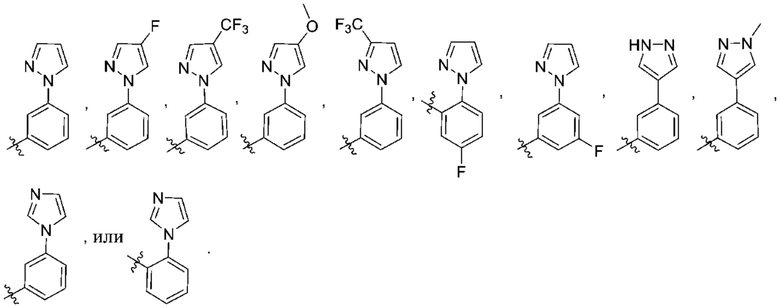
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой 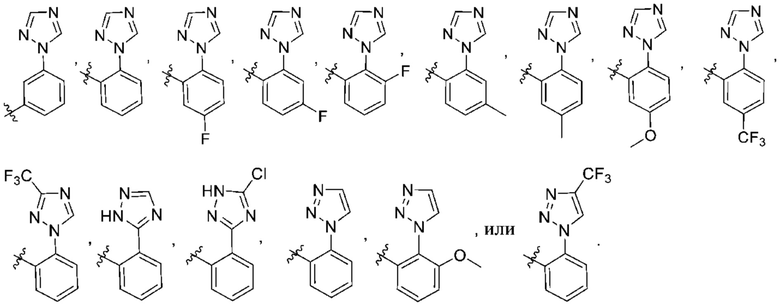
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой 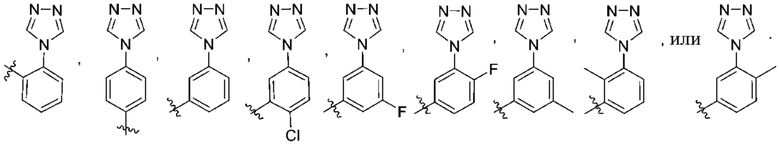
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой 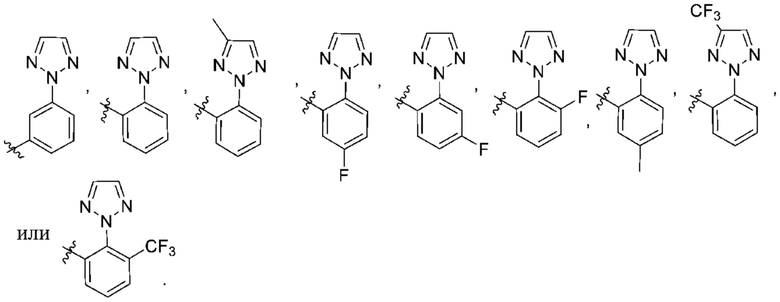
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой 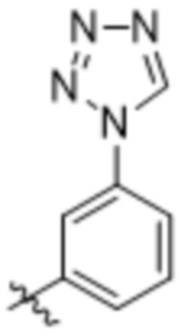 ,
, 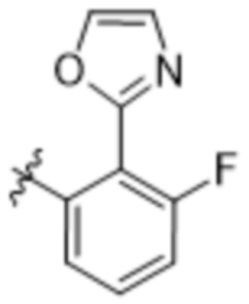 или
или 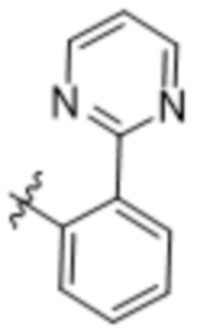 .
.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой  , где Ra представляет собой H, Cl, Br, F или OCH3, и Ra1 представляет собой OCH3 или
, где Ra представляет собой H, Cl, Br, F или OCH3, и Ra1 представляет собой OCH3 или  .
.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой 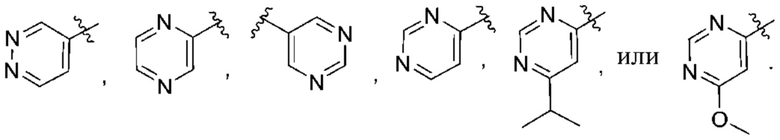
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой 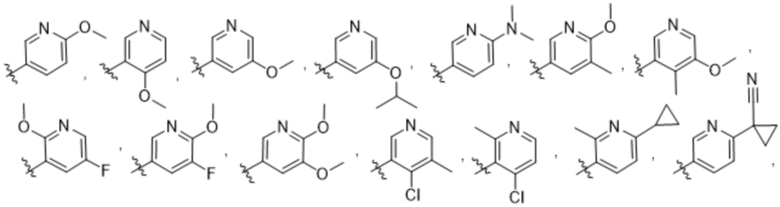
 .
.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой 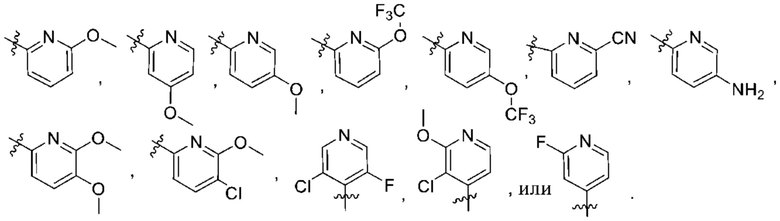
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I) где R2 представляет собой 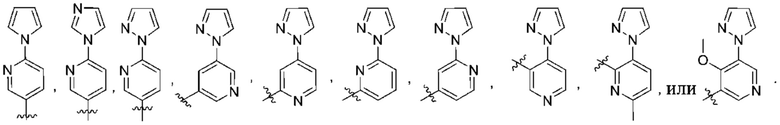
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой 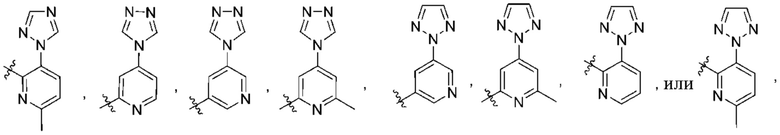
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой 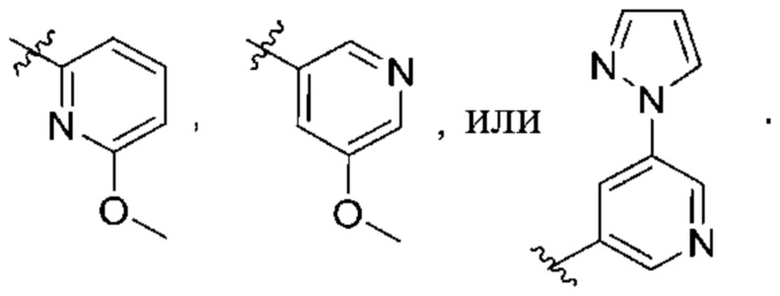
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой  или
или  .
.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой:  , и Re независимо выбран из группы, состоящей из: H, галогена, C1-4алкила, C1-4галогеналкила, OC1-4алкила, и циклопропила.
, и Re независимо выбран из группы, состоящей из: H, галогена, C1-4алкила, C1-4галогеналкила, OC1-4алкила, и циклопропила.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I) где R2 представляет собой:  , и Rf выбирают из группы, состоящей из: H, C1-4алкила, CH2CH2OH, CH2CF3, циклопропила, фенила и фенила, замещенного CF3.
, и Rf выбирают из группы, состоящей из: H, C1-4алкила, CH2CH2OH, CH2CF3, циклопропила, фенила и фенила, замещенного CF3.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой  , и Rg представляет собой H, OCH3 или CF3.
, и Rg представляет собой H, OCH3 или CF3.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой 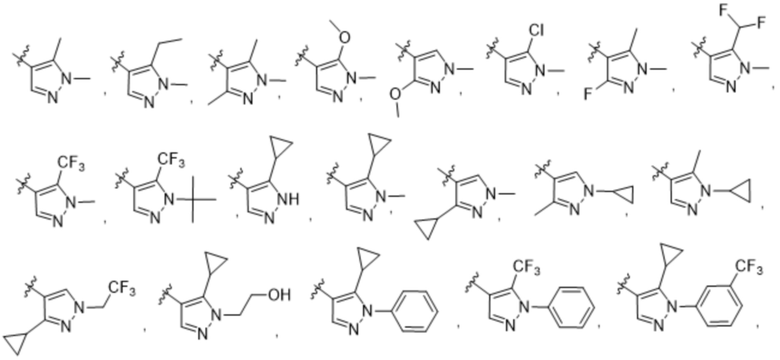
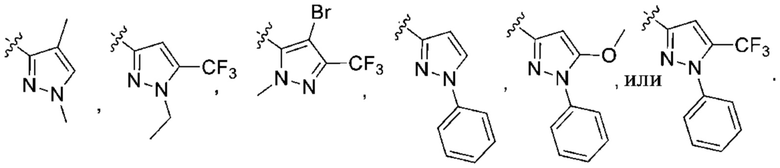
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой  или
или  .
.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой  или
или  , и Ra независимо выбран из группы, состоящей из: H, Cl, F, C1-4алкила, ОC1-4алкила и C1-4галогеналкила; и Rb представляет собой CH3 или CH(CH3)2.
, и Ra независимо выбран из группы, состоящей из: H, Cl, F, C1-4алкила, ОC1-4алкила и C1-4галогеналкила; и Rb представляет собой CH3 или CH(CH3)2.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой 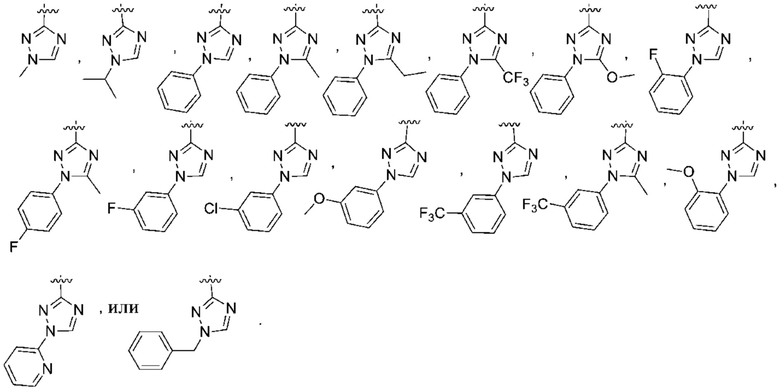
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой 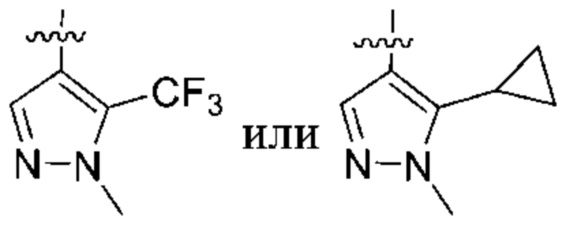 .
.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой 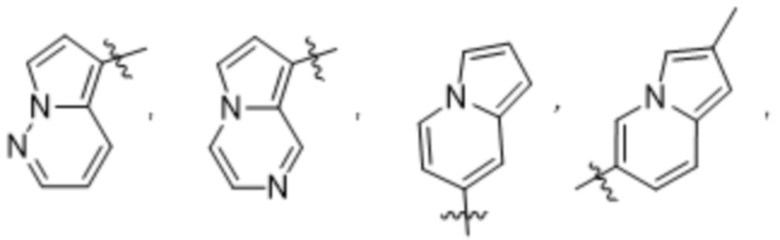
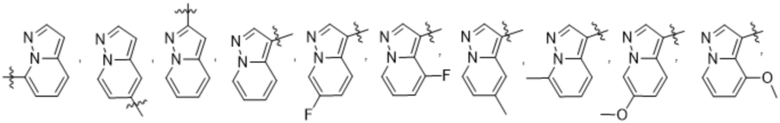
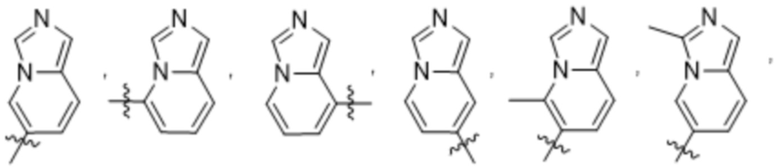
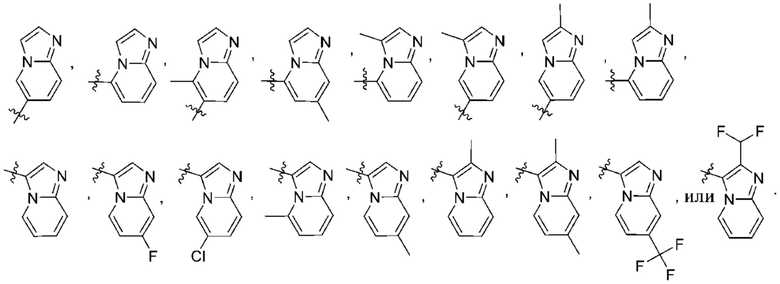
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой 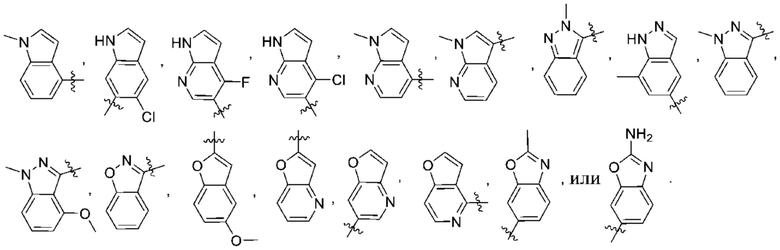
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой 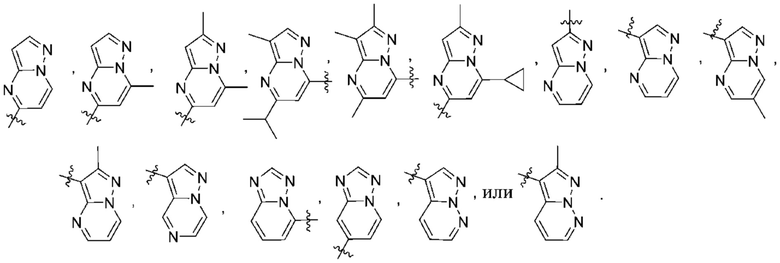
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой 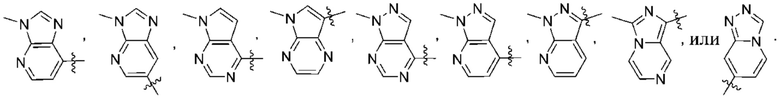 Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой 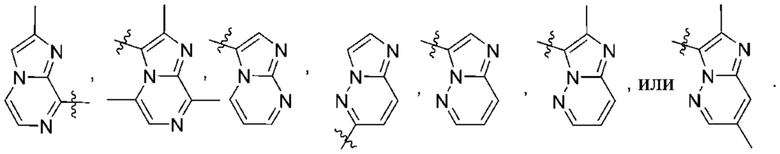
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой 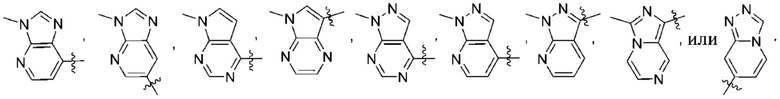
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой 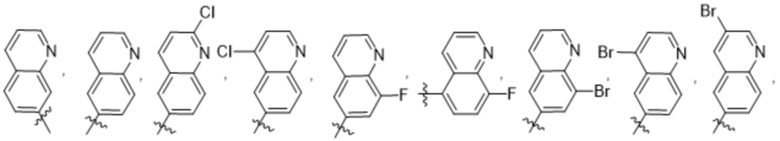
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I) где R2 представляет собой 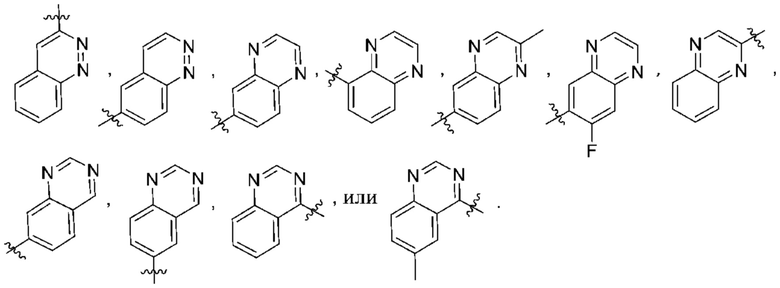
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I) где R2 представляет собой 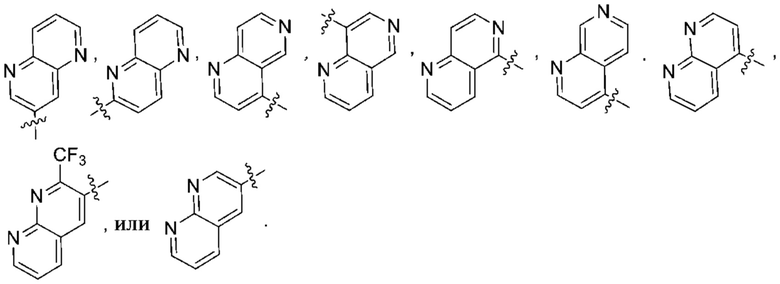
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I) где R2 представляет собой 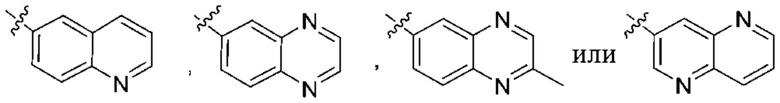
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I) где R2 представляет собой 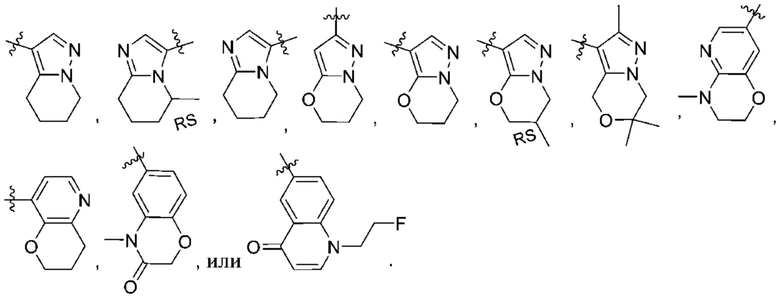
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I) где R3 представляет собой 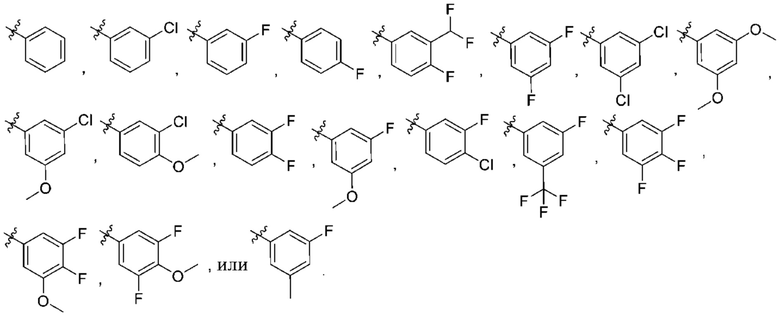
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R3 представляет собой циклопропил и R4 представляет собой CH3.
В дополнительном варианте осуществления данного изобретения предложено соединение формулы (I), где R3 представляет собой 5-(трифторметил)-2-тиенил или 1-метилиндол-2-ил; и R4 представляет собой CH3.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R3 представляет собой 3-хлорфенил, 3-фторфенил, 4-фторфенил, 3,5-дифторфенил, 3,5-дихлорфенил, 3,4-дифторфенил, и 4-хлор-3-фторфенил.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R4 представляет собой CH3.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R4 представляет собой циклопропил.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), где R2 представляет собой  , где Ra представляет собой F, Cl или OCH3, Ra1 представляет собой OCH3, CH3 или 2H-1,2,3-триазол-2-ил, и R4 представляет собой CH3.
, где Ra представляет собой F, Cl или OCH3, Ra1 представляет собой OCH3, CH3 или 2H-1,2,3-триазол-2-ил, и R4 представляет собой CH3.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), имеющее формулу (IA):
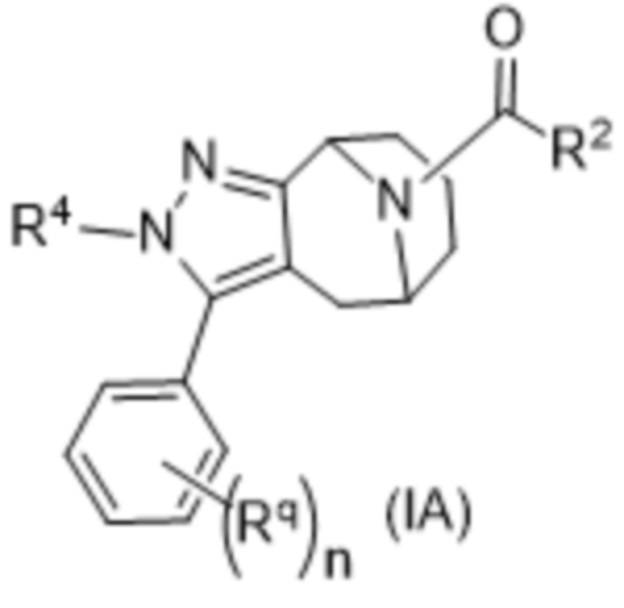
где
R2 выбирают из группы, состоящей из:
(a)
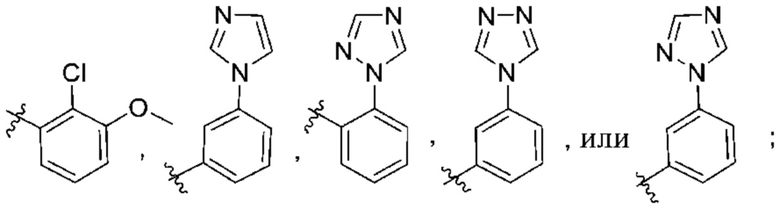
(b)
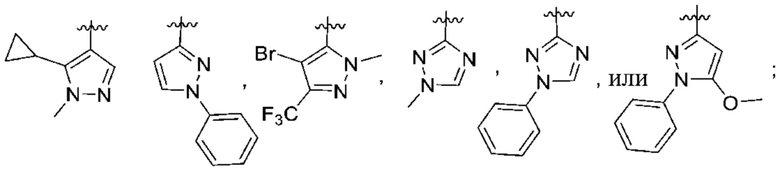
(c)
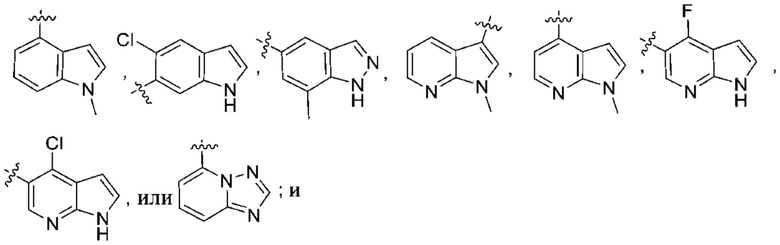
(d)
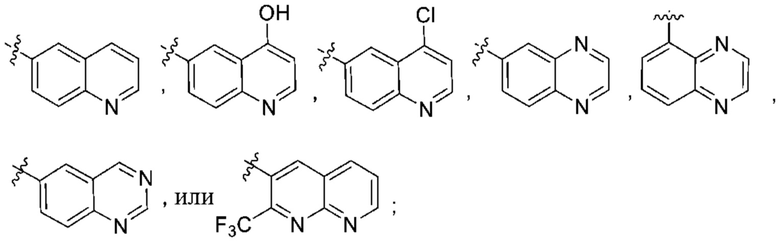
R4 представляет собой CH3 или циклопропил;
Rq представляет собой галоген или CHF2; и
n равно 0, 1 или 2;
и их фармацевтически приемлемых солей, изотопов, N-оксидов, сольватов и стереоизомеров.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), имеющее формулу (IB):
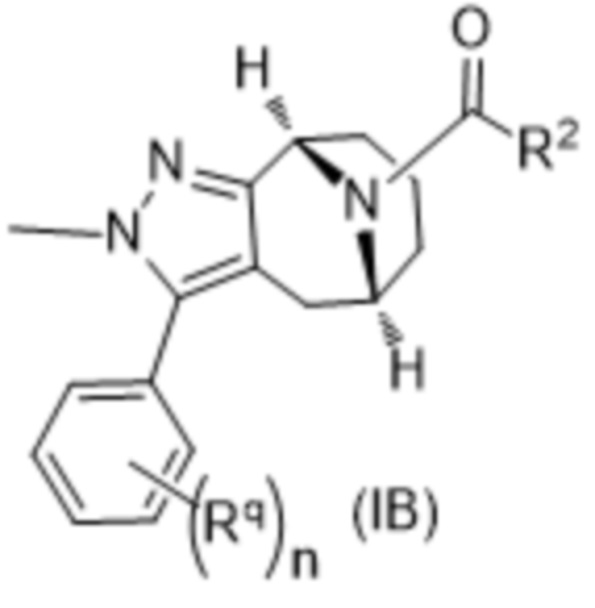
где
R2 представляет собой фенил, необязательно независимо замещенный одним или двумя заместителями, выбранными из группы, состоящей из: галогена, C1-4алкила, C1-4галогеналкила, OC1-4алкила, OC1-4галогеналкила, NH(C=O)(CH3),
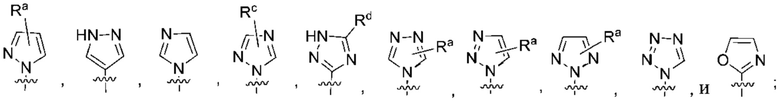
где
Ra выбирают из группы, состоящей из: H, галогена, C1-4алкила, OC1-4алкила и C1-4галогеналкила;
Rb представляет собой C1-4алкил;
Rc представляет собой H или CF3;
Rd представляет собой H или галоген.
каждый Rq независимо выбирают из группы, состоящей из: Cl, F, CF3 и OCH3; и
n равно 0, 1, 2 или 3;
и их фармацевтически приемлемых солей, изотопов, N-оксидов, сольватов и стереоизомеров.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), имеющее формулу (IC):
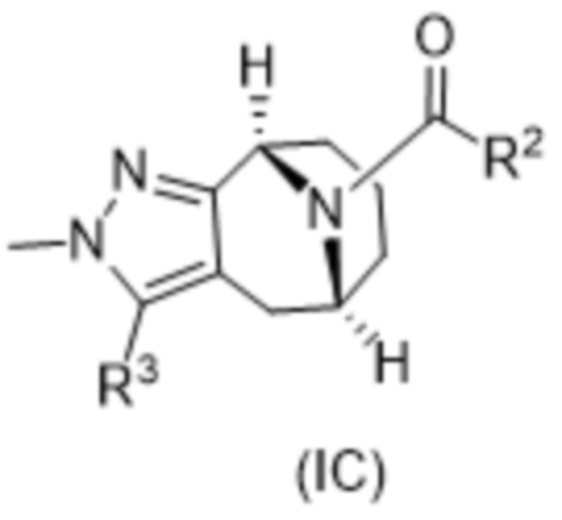
где
R2 выбирают из группы, состоящей из:
(a) 5-членного гетероарила, выбранного из группы, состоящей из:
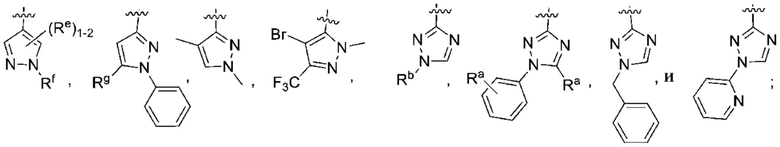 и
и
(b) 6-членного гетероарила, выбранного из группы, состоящей из: пиридазин-4-ила; пиразин-2-ила; пиримидинила; пиридинила, замещенного C1-4алкилом или ОC1-4алкилом; и пиридинила, причем пиридинил замещен одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, C1-4алкила, OC1-4алкила, OC1-4галогеналкила, циклопропила, NH2, CN, N(CH3)2,  ,
,  ,
,  ,
,  ,
,  ,
, 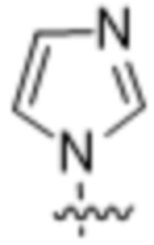 ,
,  ,
, 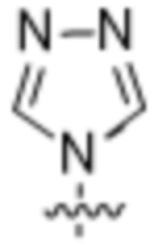 ,
,  и
и  ;
;
где
Ra выбирают из группы, состоящей из: H, галогена, ОC1-4алкила и C1-4галогеналкила;
Rb представляет собой C1-4алкил;
Re выбирают из группы, состоящей из: F, C1-4алкила, CF2H, CF3, OCH3 и циклопропила;
Rf выбирают из группы, состоящей из: H, C1-4алкила, циклопропила и фенила;
Rg представляет собой H или CF3; и
R3 представляет собой фенил, замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из: Cl и F;
и их фармацевтически приемлемых солей, изотопов, N-оксидов, сольватов и стереоизомеров.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), включающее формулу (IC), где R2 представляет собой: 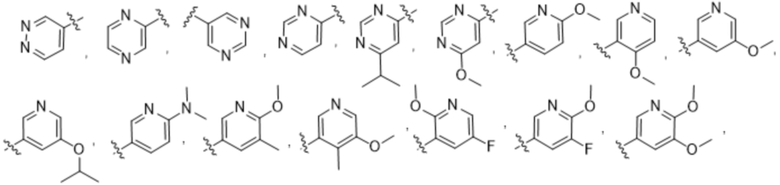
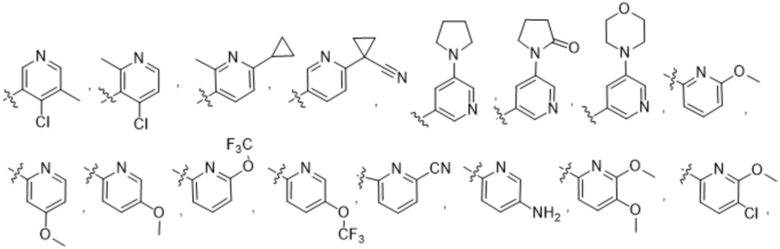
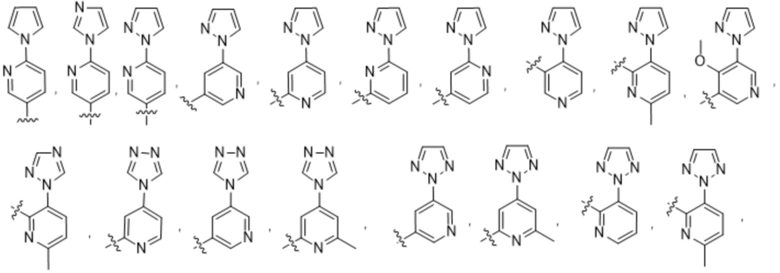
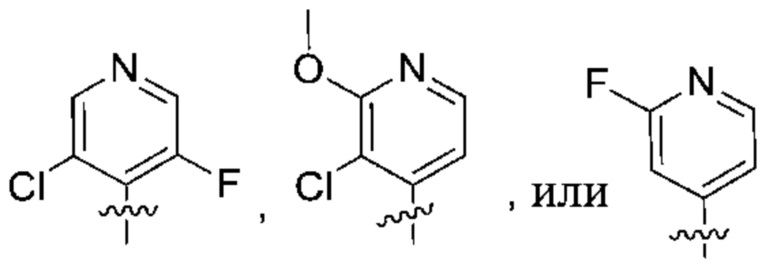 .
.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), включающее формулу (IC), где R2 представляет собой: 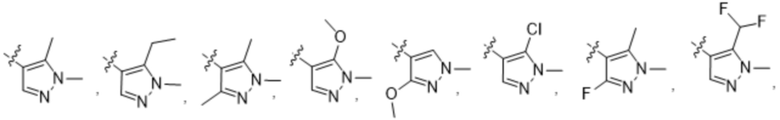
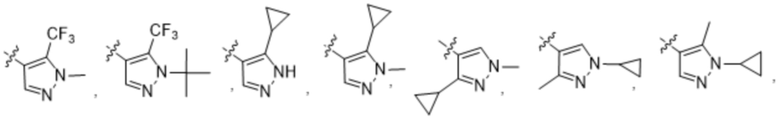
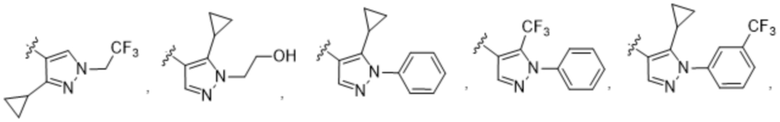
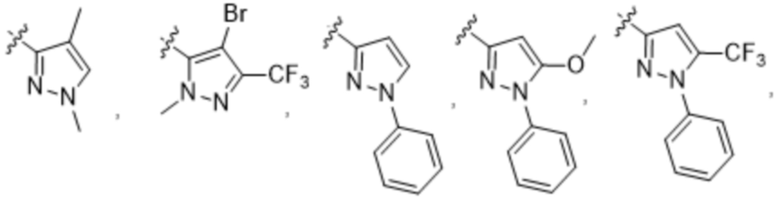
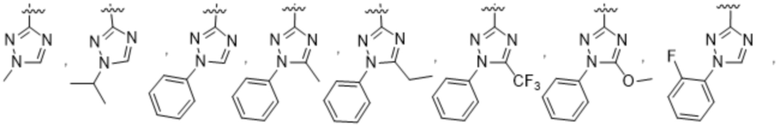
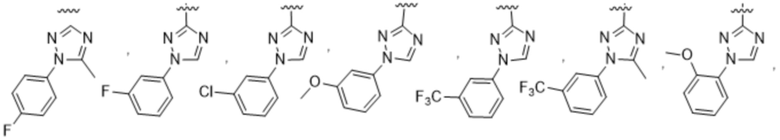
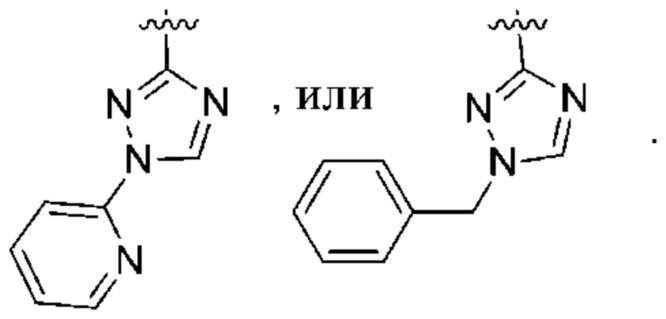
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), имеющее формулу (ID):
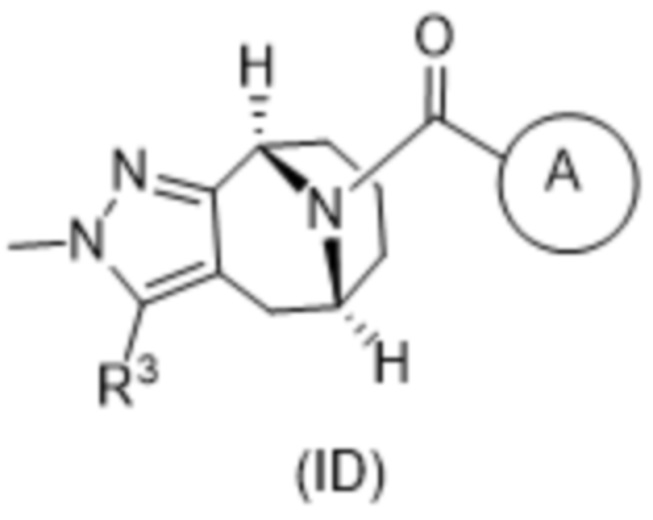
где
Кольцо A выбирают из группы, состоящей из:
(a) 6,6-конденсированного бициклического гетероарила, выбранного из группы, состоящей из:
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  ; и
; и
(b) 5,6-конденсированного бициклического гетероарила или 6,5-конденсированного бициклического гетероарила, выбранного из группы, состоящей из:
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  ;
;
где
Ra выбирают из группы, состоящей из: H, Cl, F, CH3, OCH3, CF3 и CF2H;
Rb представляет собой H или CH3;
Rc представляет собой H или CF3;
Rd выбирают из группы, состоящей из: H, Cl и F;
Re выбирают из группы, состоящей из: H, C1-4алкила и циклопропила;
Ri выбирают из группы, состоящей из: H, Cl, Br, CH3, CF3, OH и OCH2CH2F;
Rj выбирают из группы, состоящей из: H, галогена, OCH3, OH, NH2 и NO2; и
R3 представляет собой циклопропил, 1-метил-1H-индол-2-ил или фенил, замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из: Cl, F, CH3, OCH3 и CF3;
и их фармацевтически приемлемых солей, изотопов, N-оксидов, сольватов и стереоизомеров.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), включающее формулу (ID), где R3 представляет собой:
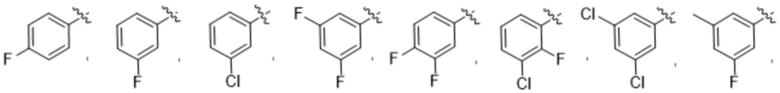
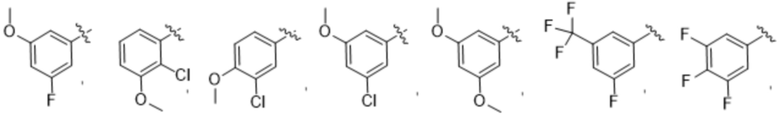
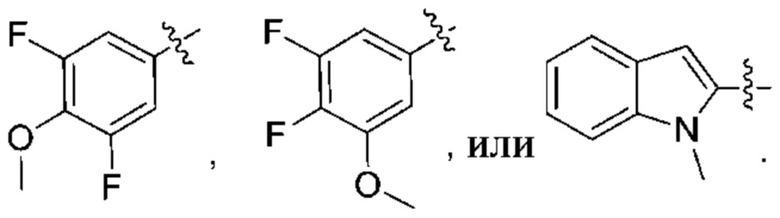
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), включающее формулу (ID), где кольцо A представляет собой: 
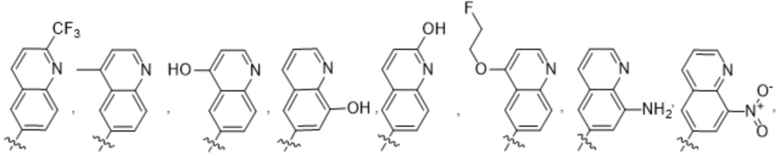
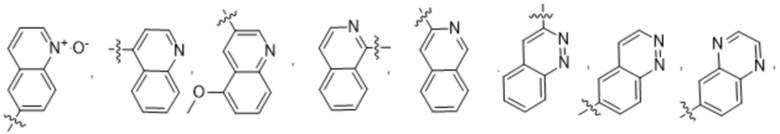
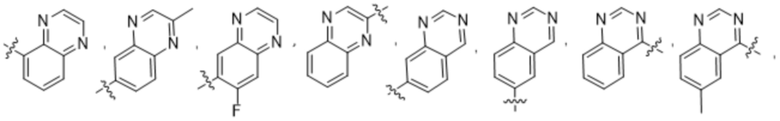
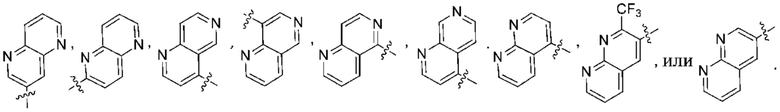
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (I), включающее формулу (ID), где кольцо A представляет собой: 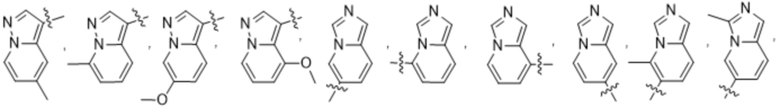
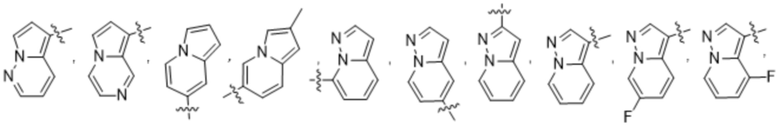
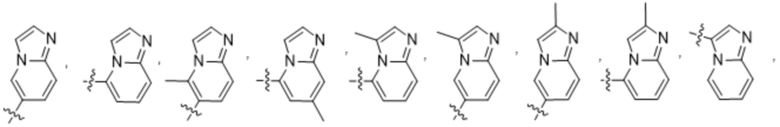
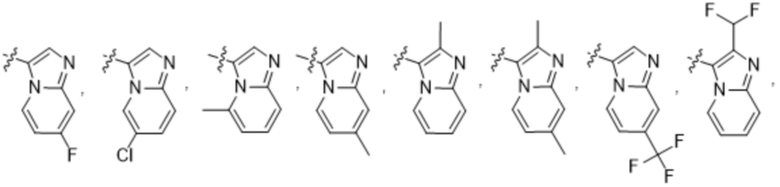
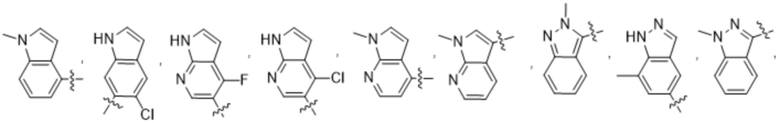
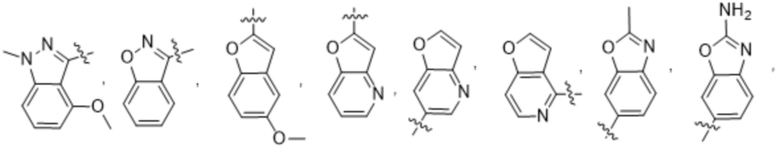
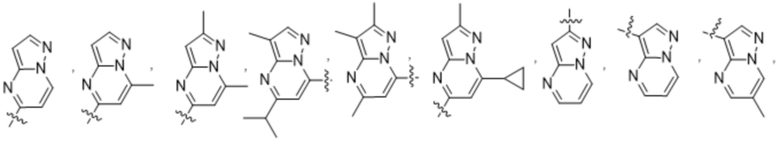
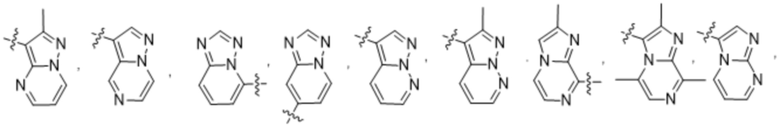
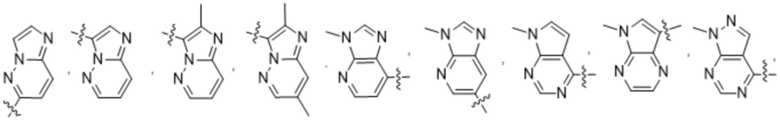
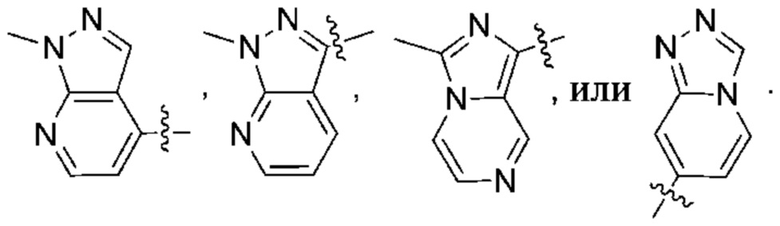
Дополнительным вариантом осуществления изобретения является соединение, выбранное из группы, состоящей из соединений формулы (I), формулы (IA), формулы (IB), формулы (IC), формулы (ID) или их комбинации.
Дополнительный вариант осуществления настоящего изобретения представляет собой соединение, как показано ниже в таблице 1.
Таблица 1.
и их фармацевтически приемлемые соли, изотопы, N-оксиды, сольваты и стереоизомеры.
Таблица 2.
и их фармацевтически приемлемые соли, изотопы, N-оксиды, сольваты и стереоизомеры.
Дополнительным вариантом осуществления настоящего изобретения является соединение, выбранное из группы, состоящей из следующих соединений:
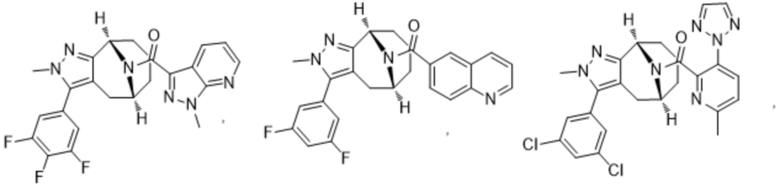
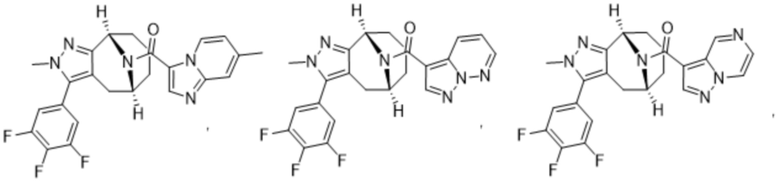

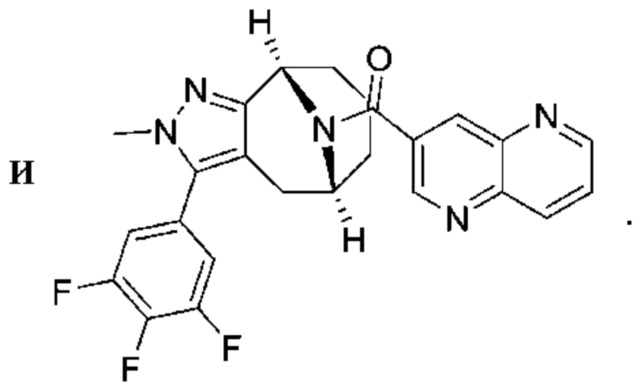
и их фармацевтически приемлемых солей, изотопов, N-оксидов, сольватов и стереоизомеров.
Дополнительный вариант осуществления изобретения представляет собой фармацевтическую композицию, содержащую:
(A) терапевтически эффективное количество по меньшей мере одного соединения, выбранного из соединений формулы (I):

где
R2 выбирают из группы, состоящей из:
(a)  ;
;
(b) 6-членного гетероарила, выбранного из группы, состоящей из: пиридазин-4-ила; пиразин-2-ила; пиримидинила; пиридинила, замещенного C1-4алкилом или ОC1-4алкилом; и пиридинила, где пиридинил замещен одним или двумя заместителями, каждый из которых независимо выбирают из группы, состоящей из галогена, C1-4алкила, OC1-4алкила, OC1-4галогеналкила, C3-6циклоалкила, NH2, CN, N(CH3)2,  ,
,  ,
,  ,
,  ,
,  ,
, 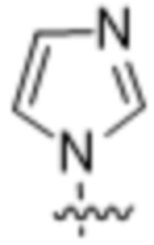 ,
,  ,
, 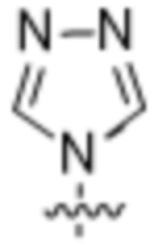 ,
,  и
и  ;
;
(c) 5-членного гетероарила, выбранного из группы, состоящей из:
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  ;
;
(d) 5,6-конденсированного бициклического гетероарила или 6,5-конденсированного бициклического гетероарила, выбранного из группы, состоящей из:
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  ;
;
(e) 6,6-конденсированного бициклического гетероарила, выбранного из группы, состоящей из:
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  ; и
; и
(f)
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  ;
;
Ra выбирают из группы, состоящей из: H, галогена, C1-4алкила, OC1-4алкила, C1-4галогеналкила и OC1-4галогеналкила;
Ra1 выбирают из группы, состоящей из: C1-4алкила; OC1-4алкила; OC1-4галогеналкила; N(C=O)CH3; оксазол-2-ила; пиримидин-2-ила; и 5-членного гетероарильного кольца, содержащего две, три или четыре члена, являющих собой атомы азота, где 5-членное гетероарильное кольцо необязательно замещено одним членом Ra;
Rb представляет собой H или C1-4алкил;
Rc представляет собой H или C1-4галогеналкил;
Rd представляет собой H или галоген.
Re выбирают из группы, состоящей из: H, галогена, C1-4алкила, C1-4галогеналкила, OC1-4алкила и C3-6циклоалкила;
Rf выбирают из группы, состоящей из: H, C1-4алкила, CH2CH2OH, C1-4галогеналкила, циклопропила, фенила и фенила, замещенного CF3;
Rg выбирают из группы, состоящей из: H, OC1-4алкила и C1-4галогеналкила;
Ri выбирают из группы, состоящей из: H, галогена, C1-4алкила, C1-4галогеналкила, OH, OC1-4алкила, OC1-4галогеналкила и C3-6циклоалкила;
Rj выбирают из группы, состоящей из: H, галогена, OCH3, OH, NH2 и NO2;
R3 выбирают из группы, состоящей из:
(g) фенила, где фенил независимо замещен одним, двумя или тремя заместителями, каждый из которых выбран из группы, состоящей из галогена, C1-4алкила, C1-4галогеналкила и OC1-4алкила;
(h) 5-(трифторметил)-2-тиенила или 1-метилиндол-2-ила; и
(i) циклопропила; и
R4 представляет собой C1-4алкил или C3-4 циклоалкил;
и фармацевтически приемлемых солей, изотопов, N-оксидов, сольватов и стереоизомеров
соединений формулы (I),
и (B) по меньшей мере один фармацевтически приемлемый эксципиент.
Дополнительный вариант осуществления изобретения представляет собой фармацевтическую композицию, содержащую эффективное количество по меньшей мере одного соединения формулы (IA), а также фармацевтически приемлемых солей, N-оксидов или сольватов соединений формулы (IA), фармацевтически приемлемых пролекарственных препаратов соединений формулы (IA) и фармацевтически активных метаболитов формулы (IA); и по меньшей мере один фармацевтически приемлемый эксципиент.
Дополнительный вариант осуществления изобретения представляет собой фармацевтическую композицию, содержащую эффективное количество по меньшей мере одного соединения формулы (IB), а также фармацевтически приемлемых солей, N-оксидов или сольватов соединений формулы (IB), фармацевтически приемлемых пролекарственных препаратов соединений формулы (IB) и фармацевтически активных метаболитов формулы (IB); и по меньшей мере один фармацевтически приемлемый эксципиент.
Дополнительный вариант осуществления изобретения представляет собой фармацевтическую композицию, содержащую эффективное количество по меньшей мере одного соединения формулы (IC), а также фармацевтически приемлемых солей, N-оксидов или сольватов соединений формулы (IC), фармацевтически приемлемых пролекарственных препаратов соединений формулы (IC) и фармацевтически активных метаболитов формулы (IC); и по меньшей мере один фармацевтически приемлемый эксципиент.
Дополнительный вариант осуществления изобретения представляет собой фармацевтическую композицию, содержащую эффективное количество по меньшей мере одного соединения формулы (ID), а также фармацевтически приемлемые соли, N-оксиды или сольваты соединений формулы (ID), фармацевтически приемлемые пролекарственные препараты соединений формулы (ID) и фармацевтически активные метаболиты формулы (ID); и по меньшей мере один фармацевтически приемлемый эксципиент.
Дополнительный вариант осуществления изобретения представляет собой фармацевтическую композицию, содержащую эффективное количество по меньшей мере одного соединения, указанного в таблице 1 (а также в таблице 2), а также фармацевтически приемлемых солей, N-оксидов или сольватов соединений, указанных в таблице 1 (а также в таблице 2), фармацевтически приемлемых пролекарственных препаратов соединений, указанных в таблице 1, и фармацевтически активных метаболитов, указанных в таблице 1 (а также в таблице 2); и по меньшей мере один фармацевтически приемлемый эксципиент.
Также в объем изобретения входят энантиомеры и диастереомеры соединений формулы (I) (а также формул (IA), (IB), (IC) и (ID)). Кроме того, в объем изобретения входят фармацевтически приемлемые соли, N-оксиды или сольваты соединений формулы (I) (а также формул (IA), (IB), (IC) и (ID)). Кроме того, в объем изобретения входят фармацевтически приемлемые пролекарственные препараты из соединений формулы (I) (а также формул (IA), (IB), (IC) и (ID)) и фармацевтически активные метаболиты соединений формулы (I) (а также формул (IA), (IB), (IC) и (ID)).
Кроме того, в объем изобретения входят изотопные варианты соединений формулы (I) (а также формул (IA), (IB), (IC) и (ID)), такие как, например, дейтерированные соединения формулы (I). Кроме того, в объем изобретения входят фармацевтически приемлемые соли, N-оксиды или сольваты изотопных вариантов соединений формулы (I) (а также формул (IA), (IB), (IC) и (ID)). Кроме того, в объем изобретения входят фармацевтически приемлемые пролекарственные препараты из изотопных вариантов соединений формулы (I) (а также формул (IA), (IB), (IC) и (ID)) и фармацевтически активные метаболиты изотопных вариантов соединений формулы (I) (а также формул (IA), (IB), (IC) и (ID)).
В дополнительном варианте осуществления изобретения представлен способ лечения субъекта, у которого диагностировано заболевание, расстройство или состояние, либо который страдает от заболевания, расстройства или состояния, опосредованного активностью MGL-рецептора, включающий введение требующему такого лечения субъекту терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы (I):

где
R2 выбирают из группы, состоящей из:
(a)  ;
;
(b) 6-членного гетероарила, выбранного из группы, состоящей из: пиридазин-4-ила; пиразин-2-ила; пиримидинила; пиридинила, замещенного C1-4алкилом или ОC1-4алкилом; и пиридинила, где пиридинил замещен одним или двумя заместителями, каждый из которых независимо выбирают из группы, состоящей из галогена, C1-4алкила, OC1-4алкила, OC1-4галогеналкила, C3-6циклоалкила, NH2, CN, N(CH3)2,  ,
,  ,
,  ,
,  ,
,  ,
, 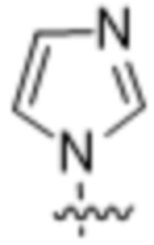 ,
,  ,
, 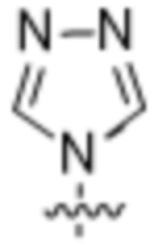 ,
,  и
и  ;
;
(c) 5-членного гетероарила, выбранного из группы, состоящей из:
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  ;
;
(d) 5,6-конденсированного бициклического гетероарила или 6,5-конденсированного бициклического гетероарила, выбранного из группы, состоящей из:
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
, 
 ,
,  ,
,  ,
,  , и
, и  ;
;
(e) 6,6-конденсированного бициклического гетероарила, выбранного из группы, состоящей из:
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  ; и
; и
(f)
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  ;
;
Ra выбирают из группы, состоящей из: H, галогена, C1-4алкила, OC1-4алкила, C1-4галогеналкила и OC1-4галогеналкила;
Ra1 выбирают из группы, состоящей из: C1-4алкила; OC1-4алкила; OC1-4галогеналкила; N(C=O)CH3; оксазол-2-ила; пиримидин-2-ила; и 5-членного гетероарильного кольца, содержащего две, три или четыре члена, являющих собой атомы азота, где 5-членное гетероарильное кольцо необязательно замещено одним членом Ra;
Rb представляет собой H или C1-4алкил;
Rc представляет собой H или C1-4галогеналкил;
Rd представляет собой H или галоген.
Re выбирают из группы, состоящей из: H, галогена, C1-4алкила, C1-4галогеналкила, OC1-4алкила и C3-6циклоалкила;
Rf выбирают из группы, состоящей из: H, C1-4алкила, CH2CH2OH, C1-4галогеналкила, циклопропила, фенила и фенила, замещенного CF3;
Rg выбирают из группы, состоящей из: H, OC1-4алкила и C1-4галогеналкила;
Ri выбирают из группы, состоящей из: H, галогена, C1-4алкила, C1-4галогеналкила, OH, OC1-4алкила, OC1-4галогеналкила и C3-6циклоалкила;
Rj выбирают из группы, состоящей из: H, галогена, OCH3, OH, NH2 и NO2;
R3 выбирают из группы, состоящей из:
(g) фенила, где фенил независимо замещен одним, двумя или тремя заместителями, каждый из которых выбран из группы, состоящей из галогена, C1-4алкила, C1-4галогеналкила и OC1-4алкила;
(h) 5-(трифторметил)-2-тиенила или 1-метилиндол-2-ила; и
(i) циклопропила; и
R4 представляет собой C1-4алкил или C3-4циклоалкил;
и их фармацевтически приемлемых солей, изотопов, N-оксидов, сольватов и стереоизомеров, требующему этого субъекту.
Дополнительный вариант осуществления изобретения представляет собой способ лечения субъекта, у которого диагностировано заболевание, расстройство или состояние, либо который страдает от заболевания, расстройства или состояния, опосредованного активностью MGL-рецептора, включающий введение требующему такого лечения субъекту терапевтически эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы (I) (а также формул (IA), (IB), (IC) и (ID)), энантиомеров и диастереомеров соединений формулы (I), изотопных вариантов соединений формулы (I) и фармацевтически приемлемых солей всех вышеперечисленных соединений.
Вариантами данного изобретения являются соединения формулы (II),

где
R5 выбирают из группы, состоящей из:
(a) фенила, необязательно независимо замещенного одним или двумя заместителями, выбранными из группы, состоящей из галогена, OC1-4алкила и  .
.
(b) 6-членного гетероарила, выбранного из группы, состоящей из:  ,
,  и
и  ;
;
(c) 5-членного гетероарила, выбранного из группы, состоящей из:
 ,
,  и
и  ;
;
(d) 5,6-конденсированного бициклического гетероарила или 6,5-конденсированного бициклического гетероарила, выбранного из группы, состоящей из:
 ,
,  ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,  ,
,  ,
,
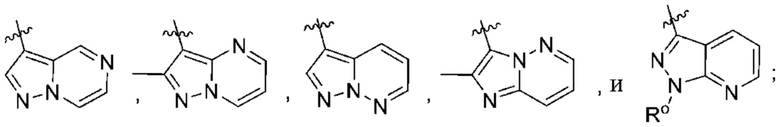
(e) 6,6-конденсированного бициклического гетероарила, выбранного из группы, состоящей из:
 ,
,  и
и  ;
;
(f)
 ,
,  и
и  ;
;
где
Rk выбирают из группы, состоящей из: H, галогена, C1-4алкила и C1-4галогеналкила;
Rm выбирают из группы, состоящей из: H, C1-4алкила и C1-4галогеналкила;
Rn представляет собой H или OC1-4алкил;
Ro представляет собой H или C1-4алкил;
Rp выбирают из группы, состоящей из: H, галогена, C1-4алкила, C1-4галогеналкила и OC1-4алкила; и
R6 представляет собой фенил, независимо замещенный одним, двумя или тремя заместителями, выбранными из группы, состоящей из галогена, C1-4алкила, C1-4галогеналкила и OC1-4алкила;
и их фармацевтически приемлемых солей, изотопов, N-оксидов, сольватов и стереоизомеров.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (II), где R5 представляет собой
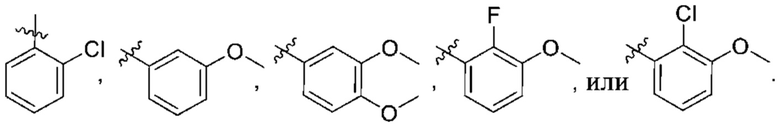
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (II), где R5 представляет собой 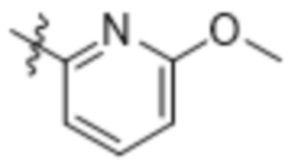 .
.
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (II), где R5 представляет собой 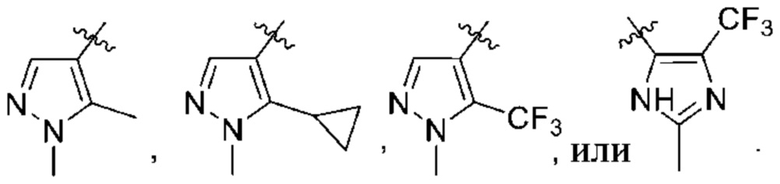
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (II), где R5 представляет собой 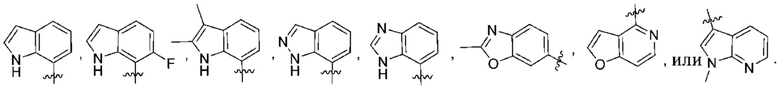
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (II), где R5 представляет собой 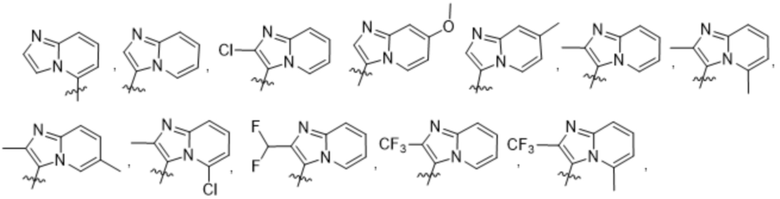
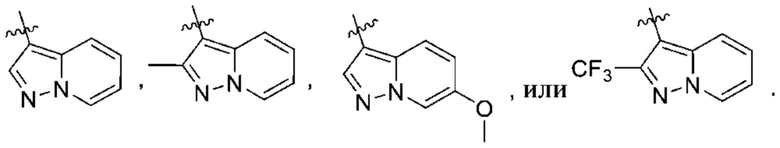
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (II), где R5 представляет собой 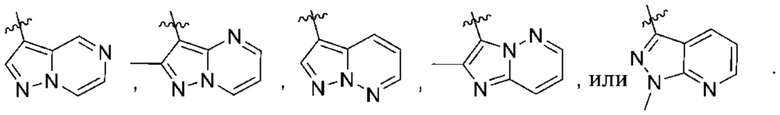
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (II), где R5 представляет собой 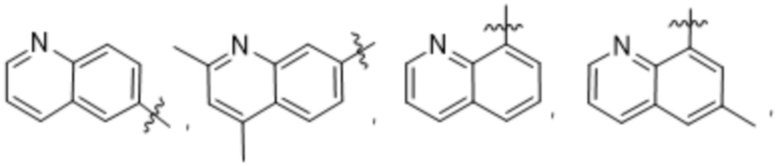
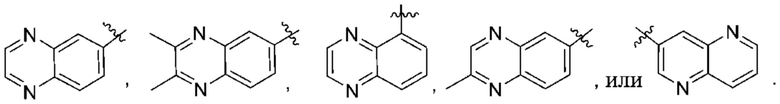
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (II), где R5 представляет собой 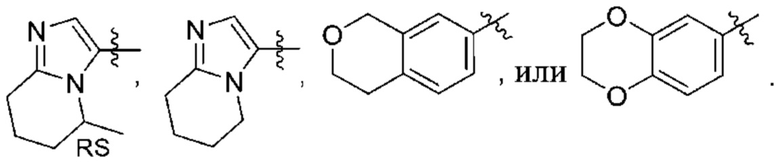
Дополнительный вариант осуществления изобретения представляет собой соединение формулы (II), где R6 представляет собой 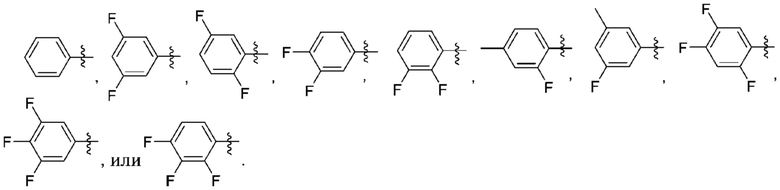
Дополнительный вариант осуществления настоящего изобретения представляет собой соединение, как показано ниже в таблице 3.
Таблица 3.
и их фармацевтически приемлемых солей, изотопов, N-оксидов, сольватов и стереоизомеров.
Дополнительный вариант осуществления изобретения представляет собой фармацевтическую композицию, содержащую:
(A) терапевтически эффективное количество по меньшей мере одного соединения, выбранного из соединений формулы (II),

где
R5 выбирают из группы, состоящей из:
(a) фенила, необязательно независимо замещенного одним или двумя заместителями, выбранными из группы, состоящей из галогена, OC1-4алкила и  .
.
(b) 6-членного гетероарила, выбранного из группы, состоящей из:  ,
,  и
и  ;
;
(c) 5-членного гетероарила, выбранного из группы, состоящей из:
 ,
,  и
и  ;
;
(d) 5,6-конденсированного бициклического гетероарила или 6,5-конденсированного бициклического гетероарила, выбранного из группы, состоящей из:
 ,
,  ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,  ,
,  ,
,

(e) 6,6-конденсированного бициклического гетероарила, выбранного из группы, состоящей из:
 ,
,  и
и  ;
;
(f)
 ,
,  и
и  ;
;
где
Rk выбирают из группы, состоящей из: H, галогена, C1-4алкила и C1-4галогеналкила;
Rm выбирают из группы, состоящей из: H, C1-4алкила и C1-4галогеналкила;
Rn представляет собой H или OC1-4алкил;
Ro представляет собой H или C1-4алкил;
Rp выбирают из группы, состоящей из: H, галогена, C1-4алкила, C1-4галогеналкила и OC1-4алкила; и
R6 представляет собой фенил, независимо замещенный одним, двумя или тремя заместителями, выбранными из группы, состоящей из галогена, C1-4алкила, C1-4галогеналкила и OC1-4алкила;
и фармацевтически приемлемых солей, изотопов, N-оксидов, сольватов и стереоизомеров
соединений формулы (II);
и (B) по меньшей мере один фармацевтически приемлемый эксципиент.
Дополнительный вариант осуществления изобретения представляет собой фармацевтическую композицию, содержащую эффективное количество по меньшей мере одного соединения, указанного в таблице 3, а также фармацевтически приемлемых солей, N-оксидов или сольватов соединений, указанных в таблице 3, фармацевтически приемлемых пролекарственных препаратов соединений, указанных в таблице 3 и фармацевтически активных метаболитов, указанных в таблице 3; и по меньшей мере один фармацевтически приемлемый эксципиент.
В дополнительном варианте осуществления изобретения представлен способ лечения субъекта, у которого диагностировано заболевание, расстройство или состояние, либо который страдает от заболевания, расстройства или состояния, опосредованного активностью MGL-рецептора, включающий введение требующему такого лечения субъекту эффективного количества по меньшей мере одного соединения, выбранного из соединений формулы (II):

где
R5 выбирают из группы, состоящей из:
(a) фенила, необязательно независимо замещенного одним или двумя заместителями, выбранными из группы, состоящей из галогена, OC1-4алкила и  .
.
(b) 6-членного гетероарила, выбранного из группы, состоящей из:  ,
,  и
и  ;
;
(c) 5-членного гетероарила, выбранного из группы, состоящей из:
 ,
,  и
и  ;
;
(d) 5,6-конденсированного бициклического гетероарила или 6,5-конденсированного бициклического гетероарила, выбранного из группы, состоящей из:
 ,
,  ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,  ,
,  ,
,

(e) 6,6-конденсированного бициклического гетероарила, выбранного из группы, состоящей из:
 ,
,  и
и  ;
;
(f)
 ,
,  и
и  ;
;
где
Rk выбирают из группы, состоящей из: H, галогена, C1-4алкила и C1-4галогеналкила;
Rm выбирают из группы, состоящей из: H, C1-4алкила и C1-4галогеналкила;
Rn представляет собой H или OC1-4алкил;
Ro представляет собой H или C1-4алкил;
Rp выбирают из группы, состоящей из: H, галогена, C1-4алкила, C1-4галогеналкила и OC1-4алкила; и
R6 представляет собой фенил, независимо замещенный одним, двумя или тремя заместителями, выбранными из группы, состоящей из галогена, C1-4алкила, C1-4галогеналкила и OC1-4алкила;
и их фармацевтически приемлемых солей, изотопов, N-оксидов, сольватов и стереоизомеров, требующему этого субъекту.
Ниже описаны примеры соединений, используемые в способах изобретения, путем ссылки на приведенные ниже иллюстративные схемы синтеза для их общего получения и последующие конкретные примеры. Как будет очевидно специалистам в данной области, для получения различных соединений, описанных в настоящем документе, исходные материалы можно выбирать приемлемым образом так, чтобы требуемые заместители можно было проводить через схему реакции с защитой или без нее, в зависимости от ситуации, и получать требуемый продукт. Альтернативно может быть необходимо или желательно вместо желаемого заместителя вводить приемлемую группу, которую можно проводить через схему реакции, а затем при необходимости заменять на требуемый заместитель. Если не указано иное, все химические переменные определены, как указано выше со ссылкой на формулу (I). Реакции могут проводиться в промежутке между температурой плавления и температурой кипения растворителя с обратным холодильником и предпочтительно между 0 °C и температурой кипения растворителя с обратным холодильником. Реакционные смеси можно нагревать традиционным способом или в микроволновой печи. Реакции можно также проводить в герметичных сосудах под давлением при температуре, которая выше обычной температуры кипения с обратным холодильником растворителя.
В настоящем документе используются представленные ниже аббревиатуры и сокращения.
Таблица:
ПРИМЕРЫ ПОЛУЧЕНИЯ
Ниже описаны примеры соединений, используемых в способах изобретения, путем ссылки на иллюстративные схемы синтеза для их общего получения, а также последующие конкретные примеры.
СХЕМА 1
В соответствии со СХЕМОЙ 1, опосредованное медью Ульмана замещение необязательно замещенного арилгалогенидного соединения формулы (III), где Ra независимо выбирают из группы, состоящей из галогена, C1-4алкила, C1-4галогеналкила и OC1-4алкила; с азотсодержащим нуклеофильным реагентом, таким как 5-членный гетероарил, содержащий 2 или 3 члена, являющих собой атомы азота формулы (IV), где Ra независимо выбирают из группы, состоящей из галогена, C1-4алкила, C1-4галогеналкила и OC1-4алкила; в присутствии медного катализатора, такого как медный порошок, иодид меди (I) и т. п.; неорганического основания, такого как карбонат цезия, карбонат калия, K3PO4 и т. п.; вспомогательного бидентатного аминового лиганда, такого как транс-N, N′-диметилциклогексан-1,2-диамин; в инертном высококипящем растворителе, таком как нитробензол, толуол, ксилол, N-метилпирролидон (NMP), N, N-диметилформамид (DMF) и т. п., при температурах в диапазоне от 100-200 °C; с использованием традиционного или микроволнового нагрева; позволяет получать соединение формулы (XVIII), где X представляет собой CH. Например, 3-йодбензойная кислота взаимодействует с 3-(трифторметил)пиразолом, основанием, таким как карбонат цезия, медным катализатором, таким как CuI, лигандом, таким как транс-N, N′-диметилциклогексан-1,2-диамин, в подходящем растворителе, таком как DMF, при температурах в диапазоне от 100 до 140 °C, при микроволновом облучении с образованием 3-[3-(трифторметил)пиразол-1-ил]бензойной кислоты.
СХЕМА 2
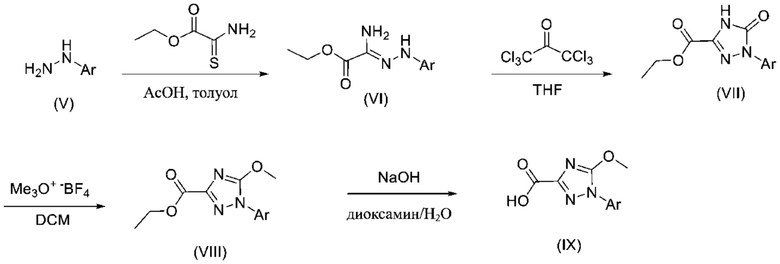
В соответствии со СХЕМОЙ 2 конденсация арилгидразина формулы (V), где Ar представляет собой и необязательно замещенный фенил; с этил 2-амино-2-тиоксоацетатом; в смеси уксусной кислоты и толуола; позволяет получать промежуточное аминное соединение формулы (VI). Промежуточное амино соединение формулы (VI) далее подвергают циклизации трифосгеном с получением этил 5-оксо-1-арил-1H-1,2,4-триазол3-карбоксилата формулы (VII). Ариловый эфир формулы (VIII) синтезируют путем обработки 1,2,4-триазолона формулы (VII) солями алкилоксония, такими как тетрафторборат триметилоксония или тетрафторборат триэтилоксония; в приемлемом растворителе, таком как дихлорметан (DCM) и т. п., при температурах в диапазоне от 0°C до комнатной температуры. Сапонификация сложного эфирного соединения формулы (VIII) основанием, таким как водный раствор лития или гидроксид натрия, в полярном растворителе, таком как тетрагидрофуран (THF), диоксан, метанол (MeOH), этанол (EtOH) или их смесь, позволяет получать кислотное соединение формулы (IX).
СХЕМА 3

В соответствии со СХЕМОЙ 3 триазолы формулы (Xa) и (Xb) получают в реакции циклоприсоединения [3+2] между азидометилбензолом и сложным эфиром 4,4,4-трифтор-2-бутиновой кислоты; в подходящем растворителе, таком как толуол и т. п.; при температуре приблизительно 115 °C; в течение периода от 16 до 24 ч; с получением смеси изомерных соединений триазола. Гидролиз сложноэфирной функциональной группы в соединениях формулы (Xa) и (Xb) выполняется в описанных выше условиях. Декарбоксилирование выполняется при помощи карбоната серебра; в подходящем растворителе, таком как диметилсульфоксид (ДМСО) и т. п.; в присутствии уксусной кислоты: при температуре в 120 °C; в течение периода в 18 ч; с получением соединений формулы (XIa) и (XIb), где PG представляет собой бензил. Отщепление бензильной защитной группы соединений формулы (XIa) и (XIb) выполняется в соответствии с процедурами, известными специалистам в данной области, с применением стандартных методик, в том числе описанных в публикации T. W. Greene and P. G. M. Wuts, “Protective Groups in Organic Synthesis,” 3 ed., John Wiley & Sons, 1999, с. 579-580; 620-621. Например, если PG представляет собой бензил, удаление защитных групп выполняется с использованием 10% палладия на углероде Selcat-Q-6, Pd/C и т. п.; в атмосфере H2 при давлении в 1 атм.; в приемлемом растворителе, таком как 1,4-диоксан, этанол, MeOH, этилацетат (EtOAc) или их смесь, предпочтительно 1,4-диоксан; в присутствии или в отсутствии HCl в течение периода от 24 до 78 ч с получением 4-(трифторметил)-1H-1,2,3-триазола и 5-(трифторметил)-1H-1,2,3-триазола.
СХЕМА 4
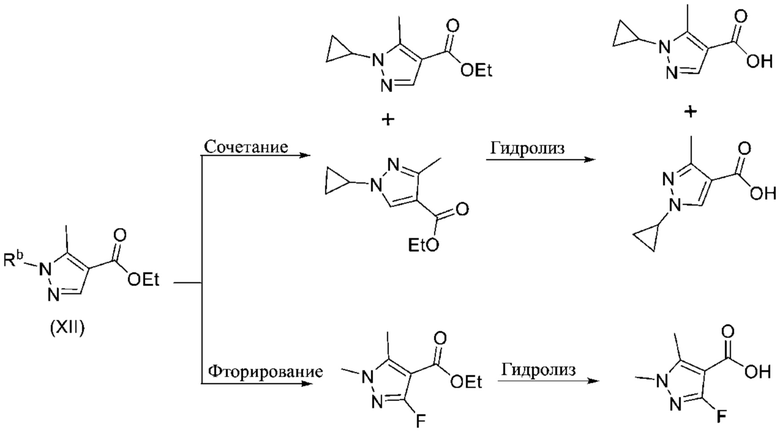
В соответствии со СХЕМОЙ 4 соединение формулы (XII), где Rb представляет собой H, вводят в опосредованную металлом реакцию перекрестного сочетания; с циклоалкильной бороновой кислотой, замещенной приемлемым образом, сложным эфиром бороновой кислоты и т. п.; медным катализатором, таким как Cu(OAc)2, лигандом, таким как 2,2'-бипиридин и т. п.; основанием, таким как K2CO3, Cs2CO3, бис(триметилсилил)амидом лития (LHMDS), трет-бутоксидом натрия (NaOtBu), K3PO4 и т. п.; в приемлемом растворителе, таком как толуол, THF, DMF, диоксан, 1,2-дихлорэтан или их смесь; получение смеси изомерных соединений этил 1-циклопропил-5-метил-1H-пиразол-4-карбоксилата и этил 1-циклопропил-3-метил-1H-пиразол-4-карбоксилата. Гидролиз этил 1-циклопропил-5-метил-1H-пиразол-4-карбоксилата и этил 1-циклопропил-3-метил-1H-пиразол-4-карбоксилата с использованием ранее описанных способов позволяет получать 1-циклопропил-5-метил-1H-пиразол-4-карбоновую кислоту и 1-циклопропил-3-метил-1H-пиразол-4-карбоновую кислоту.
Соединение формулы (XII), где Rb представляет собой CH3, фторируют с использованием источника электрофильного фтора, такого как N-фторбензолсульфонимид (NFSI), и основания, такого как диизопропиламид лития (LDA); в подходящем растворителе, таком как THF и т. п.; при температурах в диапазоне от -78°C до комн. темп.; в течение периода в 18-24 ч; с образованием этил 3-фтор-1,5-диметил-1H-пиразол-4-карбоксилата. Последующий кислотный гидролиз этил 3-фтор-1,5-диметил-1H-пиразол-4-карбоксилата с HCl при температуре приблизительно 110°C в течение 3 ч позволяет получать 3-фтор-1,5-диметил-1H-пиразол-4-карбоновую кислоту.
СХЕМА 5
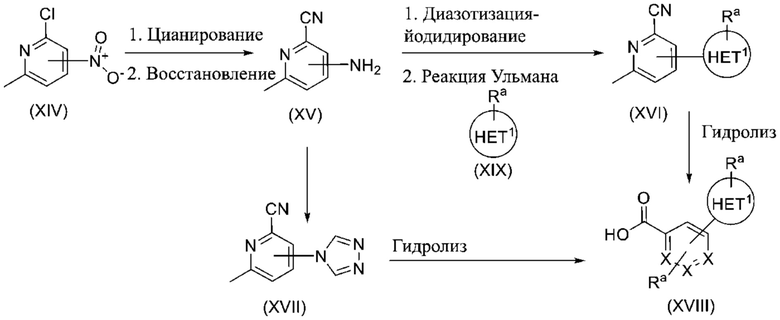
В соответствии со СХЕМОЙ 5, соединение формулы (XIV) подвергается катализируемому палладием цианированию с использованием условий, известных специалистам в данной области. Например, соединение формулы (XIV) взаимодействует с палладиевым катализатором, таким как тетракис(трифенилфосфин)палладий(0) и т. п.; цианидом цинка в качестве нуклеофильного реагента; в подходящем растворителе, таком как N, N-диметилформамид (DMF) и т. п.; при температуре приблизительно 80 °C; в течение периода в 18-24 ч; с образованием цианосоединения. Восстановление нитрогруппы выполняется с помощью железа в уксусной кислоте с получением соединения формулы (XV). Ариламиновое соединение формулы (XV) подвергается двухэтапной реакции диазотирования-иодирования в условиях, известных специалистам в данной области. Например, диазотизацию ариламина проводят с использованием соляной или серной кислоты в присутствии нитрита натрия; последующая реакция иодирования с KI позволяет получить йодное соединение. Реакция йодного промежуточного соединения в реакции замещения, опосредованной медью Ульмана, с доступным в продаже или получаемым синтетическим путем 5-членным гетероарильным кольцом, содержащим 2 или 3 члена, являющих собой атомы азота формулы (XIX), с получением соединения формулы (XVI). Нитрильное соединение формулы (XVI) гидролизуют основанием, таким как гидроксид натрия, гидроксид калия и т. п.; в подходящем растворителе, таком как 1,4-диоксан и вода; с образованием соединения формулы (XVIII), где X представляет собой CH или N (где только одно значение X может представлять собой N); HET1 представляет собой 5-членный гетероарил, содержащий 2 или 3 члена, являющих собой атомы азота, и Ra представляет собой H, галоген, C1-4алкил, C1-4галогеналкил и OC1-4алкил.
В альтернативном способе, соединение формулы (XVIII), где X представляет собой CH или N (где только одно значение X может представлять собой N); получают в две стадии из соединения формулы (XV). Соединение формулы (XV) взаимодействует с диформилгидразином; в присутствии триметилсилилхлорида в виде кислоты Льюиса; основания, такого как триэтиламин; в подходящем растворителе, таком как пиридин; при температуре приблизительно 100 °C; в течение периода, составляющего приблизительно 16 ч; позволяет получать 1,2,4-триазол-4-ильное промежуточное соединение. Щелочной гидролиз нитрильного соединения формулы (XVII) выполняется с помощью гидроксидного основания, такого как NaOH или KOH, в приемлемом растворителе, таком как 1,4-диоксан и вода, с получением соединения формулы (XVIII), где X представляет собой CH или N (где только одно значение X может представлять собой N), а HET1 представляет собой 1,2,4-триазол-4-ил.
СХЕМА 6
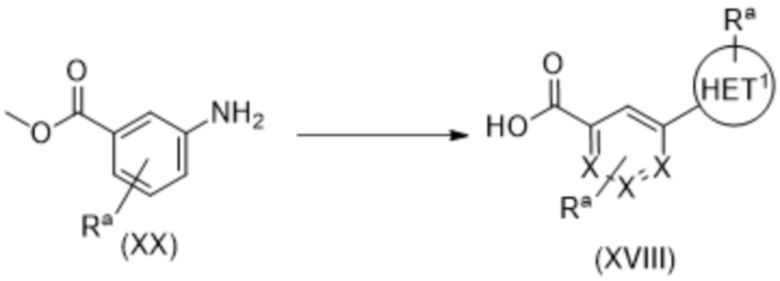
В соответствии со СХЕМОЙ 6 соединение формулы (XVIII), где X представляет собой CH, HET1 представляет собой 1,2,4-триазол-4-ил, получают в две стадии из соединения формулы (XX), где Ra представляет собой галоген или C1-4алкил. На первой стадии соединение формулы (XX), где Ra представляет собой галоген или C1-4алкил, вводят в реакцию с диформилгидразином, в присутствии триметилсилилхлорида в виде кислоты Льюиса, триэтиламина, в приемлемом растворителе, таком как пиридин, при температуре приблизительно 100 °C, в течение периода приблизительно 16 ч с получением 1,2,4-триазол-4-ильного промежуточного соединения; на второй стадии сапонификацию проводят в соответствии с условиями, известными специалистам в данной области, или условиями, описанными выше.
Аналогичным образом вместо соединения формулы (XX) можно использовать метил 4-аминопиридин-2-карбоксилат и метил 5-аминоникотинат с получением соединений формулы (XVIII), где только одно значение X представляет собой NG.
СХЕМА 7
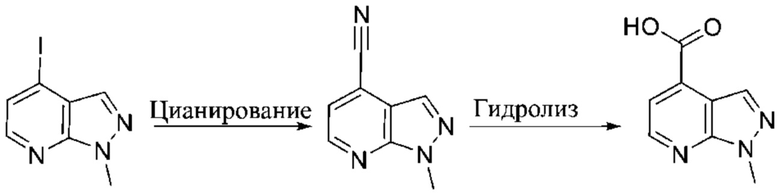
В соответствии со СХЕМОЙ 7 доступный в продаже или получаемый синтетическим путем 4-йод-1-метил-1H-пиразоло[3,4-b]пиридин взаимодействует с катализируемым медью цианированием с использованием CuCN, которое может функционировать как в качестве медного катализатора, так и в качестве цианирующего реагента; с добавлением или без добавления CuI; в подходящем растворителе, таком как ДМСО и т. п.; при температуре около 120 °C; в течение периода от 20 до 48 ч; с получением 1-метил-1H-пиразоло[3,4-b]пиридин-4-карбонитрила. Гидролиз нитрила до образования соответствующей кислоты выполняется в соответствии с ранее описанными процедурами. Аналогичным образом 5-бром-7-метилимидазо[1,2-a]пиридин превращается в (7-метилимидазо[1,2-a]пиридин-5-ил)(λ1-оксиданил)метанон.
СХЕМА 8
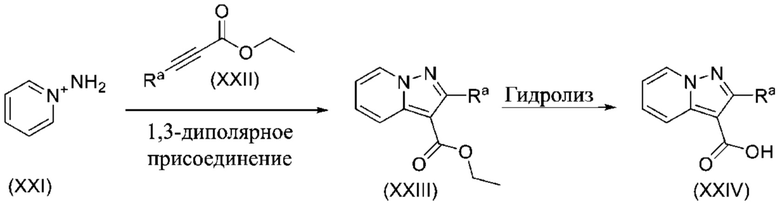
В соответствии со СХЕМОЙ 8, 1-аминопиридин-1-ий реагирует в реакции 1,3-диполярного присоединения с соединением формулы (XXII), где Ra представляет собой H, C1-4алкил или C1-4галогеналкил; в присутствии основания, такого как TEA, и т. п.; 2,3-дихлор-5,6-дициано-п-бензохинона (DDQ); в подходящем растворителе, таком как DMF и т. п.; при температурах в диапазоне от 0 ºC до комн. темп. в течение периода в 16-24 ч; с получением соединения формулы (XXIII). Гидролиз сложного эфира до образования соответствующей кислоты выполняется в соответствии с ранее описанными процедурами.
СХЕМА 9
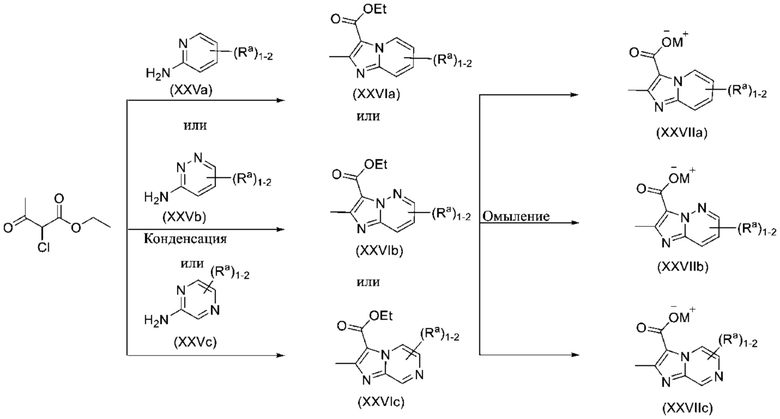
В соответствии со СХЕМОЙ 9, соединения формул (XXVIa, XXVIb и XXVIc) получают в условиях, известных специалистам в данной области, путем конденсации доступных в продаже или получаемых синтетическим путем замещенного пиридина. пиридазина и аминов пиразина формул (XXVa, XXVb и XXVc), где Ra соответствует определению, приведенному в п. 1, с применением этил-2-хлор-3-оксобутаноата в приемлемом растворителе, таком как 1,2-диметоксиэтан (DME) и т. п.; при температуре в 90 ºC в течение периода приблизительно в 2-16 часов. Сапонификация сложных эфиров (XXVIa, XXVIb и XXVIc) до образования соответствующей кислоты выполняется в условиях, известных специалистам в данной области. Например, используя подходящее основание, такое как триметилсиланилат калия (TMSOK), NaOH, LiOH и т. п., в подходящем растворителе, таком как вода/THF/MeOH, при температуре приблизительно в 60°C в течение периода приблизительно в 24 ч, с получением соединений формул (XXVIIa, XXVIIb и XXVIIc), где M представляет собой калий, Na или Li, предпочтительно калий.
СХЕМА 10
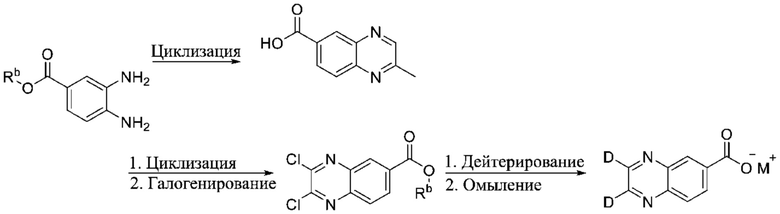 b
b
В соответствии со СХЕМОЙ 10, 2-метилхиноксалин-6-карбоновую кислоту (где Rb представляет собой H) получают конденсацией доступной в продаже или получаемой синтетическим путем 2-амино-4-аминобензойной кислоты с 1,2-диоксоалканами, такими как 2-оксопропаналь и т. п.; в подходящем растворителе, таком как EtOH и т. п., при температуре в 80 ºC в течение периода примерно в 16-24 часов с получением 2-метилхиноксалин-6-карбоновой кислоты.
Аналогичным образом, метил-3,4-диаминобензоат (где Rb представляет собой CH3) конденсируется с диэтилоксалатом в подходящем растворителе, таком как этанол и т. п.; при температуре приблизительно 140 ºC; в течение периода приблизительно 16-24 часов; позволяет получать метил-2,3-дигидроксихиноксалин-6-карбоксилат. Последующее хлорирование хлорирующим реагентом, таким как тионилхлорид и т. п.; в чистом виде или в подходящем растворителе, таком как толуол и т. п.; с последующим добавлением каталитического количества DMF; при температуре флегмы; позволяет получать метил-2,3-дихлорхиноксалин-6-карбоксилат. Катализируемое палладием восстановительное дейтерирование метилового эфира 2,3-дихлорхиноксалин-6-карбоксилата с использованием доступного в продаже дейтерированного реагента, такого как бородейтерид натрия; в присутствии палладиевого катализатора, такого как 1,1′-бис(дифенилфосфино)ферроцендихлорпалладий(II) (PdCl2(dppf)) и т. п.; основания, такого как N1, N1, N2, N2-тетраметилэтан-1,2-диамин (TMEDA) и т. п.; в подходящем растворителе, таком как THF и т. п.; при комнатной температуре; в течение периода в 1-3 часа; позволяет получать метилхиноксалин-6-карбоксилат-2,3-d2. Сапонификация сложного эфира до образования соответствующей кислоты выполняется с использованием условий, известных специалистам в данной области, например, с использованием приемлемого основания, такого как NaOH, LiOH, KOH и т. п., предпочтительно Li; в подходящем растворителе, таком как вода/THF/MeOH, при комнатной температуре в течение периода приблизительно в 1 ч получали хиноксалин-6-карбоновую кислоту-2,3-d2 (где M представляет собой Li). Соли калия, натрия и лития выделяют в зависимости от основания, используемого в процессе сапонификации.
СХЕМА 11
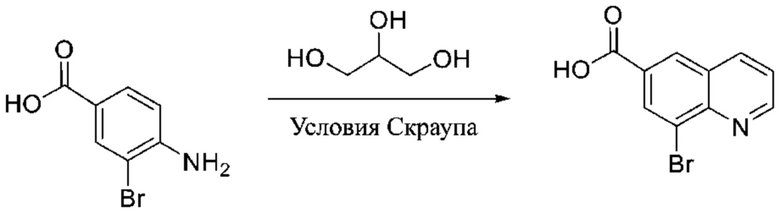
В соответствии со СХЕМОЙ 11 обработка 4-амино-3-бромбензойной кислоты избытком глицерина в условиях по Скраупу, известных специалистам в данной области (R.H.F. Manske and M.Kulka, "The Skraup Synthesis of Quinolines"; Org. Reaction, vol. 7, с. 59-98, 1953), позволяет получать 6-карбокси-8-бромхинолин. Например, реакционную смесь 4-амино-3-бромбензойной кислоты нагревают при 140 ºC с добавлением серной кислоты, глицерина, окислителя, такого как нитробензол, в присутствии сульфата железа, с получением 6-карбокси-8-бромхинолина.
СХЕМА 12
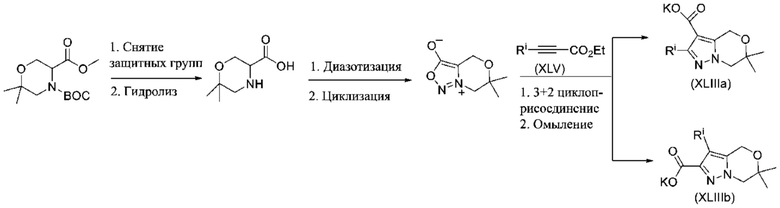
В соответствии со СХЕМОЙ 12 6,6-диметилморфолин-3-карбоновую кислоту получают в две стадии из 4-(трет-бутил) 3-метил 6,6-диметилморфолин-3,4-дикарбоксилата. На первой стадии удаление защитных групп группы BOC выполняется в соответствии с процедурами, известными специалистам в данной области, с применением стандартных методик, в том числе описанных в публикации T. W. Greene and P. G. M. Wuts, “Protective Groups in Organic Synthesis,” 3 ed., John Wiley & Sons, 1999, с. 518-525. Например, удаление защитных групп в кислотной среде, в том числе в присутствии трифторуксусной кислоты (TFA)/CH2Cl2, HCl/диоксана и т. п., при комнатной температуре в течение 2 часов. Последующий гидролиз непосредственно в реакционной смеси с применением подходящего основания, такого как NaOH и т. п., в растворителе, таком как MeOH/вода, позволяет получать 6,6-диметилморфолин-3-карбоновую кислоту. Диазотизация 6,6-диметилморфолин-3-карбоновой кислоты выполняется с использованием нитрита натрия; в воде; в кислотной среде, в том числе в присутствии конц. HCl; при температурах в диапазоне от 0°C до комнатной температуры; в течение 16 ч. полученную нитрозокислоту обрабатывают трифторуксусным ангидридом (TFAA) в подходящем растворителе, таком как ацетонитрил (ACN) и т. п.; при комнатной температуре; в течение периода в 2 ч; с получением 6,6-диметил-6,7-дигидро-4H-[1,2,3]оксадиазоло[4,3-c][1,4]оксазин-8-ий-3-олата (Ссылка: Nikitenko, A.A., et al., Org. Process Res. Dev., 2006, 10 (4), pp 712-716)
6,6-Диметил-6,7-дигидро-4H-[1,2,3]оксадиазоло[4,3-c][1,4]оксазин-8-ий-3-олат подвергается реакции [3+2] циклоприсоединения с алкиноатом формулы (XLV), где Ri представляет собой C1-4алкил; в подходящем растворителе, таком как ксилол и т. п. при температуре приблизительно 140 ºC; в течение 2 часов. Последующая сапонификация двух полученных региоизомерных сложных эфиров до образования соответствующих кислот выполняется в описанных выше условиях. Например, используя приемлемое основание, такое как NaOH, LiOH, KOH и т. п.; в подходящем растворителе, таком как вода, THF, МеОН или их смесь; при температуре около 60 °C; в течение периода, составляющего приблизительно 24 ч; с получением соединений формул (XLIIIa) и (XLIIIb), где M представляет собой K, Na или Li.
СХЕМА 13
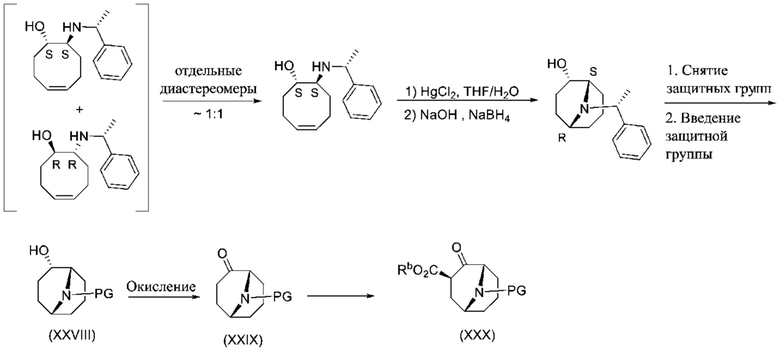
В соответствии со СХЕМОЙ 13 (1S,8S)-(+)-транс-8-[(R)-фенилэтиламино)циклоокт-4-енол и (1R,8R)-(-)-транс-8-[(R)-фенилэтиламино]циклоокт-4-енол получают в соответствии со способами, описанными в публикации Carroll, F.I., et al., “Synthesis and Pharmacological Characterization of Nicotinic Acetylcholine Receptor Properties of (+)- and (-)-Pyrido-[3,4-b]homotropanes “, Journal of Medicinal Chemistry, 49(11), 3244-3250; 2006.
(1S,8S, Z)-8-(((R)-1-фенилэтил)амино)циклоокт-4-ен-1-ол превращают в (1S,2S,5R)-9-((R)-1-фенилэтил)-9-азабицикло[3.3.1]нонан-2-ол в рамках двух стадий. На первой стадии реакция (1S,8S, Z)-8-(((R)-1-фенилэтил)амино)циклоокт-4-ен-1-ола с хлоридом ртути(II) в приемлемом растворителе, таком как диэтиловый эфир, тетрагидрофуран, диоксан, вода или их смесь, при комнатной температуре в течение периода 12-24 ч позволяет получить комплекс хлорида ртути в алкенильной функциональной группе. На второй стадии восстановление вышеупомянутого комплекса хлорида ртути осуществляют путем реакции с 3 M гидроксидом натрия и восстанавливающим агентом, таким как боргидрид натрия, при температуре приблизительно 0°C с получением циклизованного продукта, представляющего собой (1S,2S,5R)-9-((R)-1-фенилэтил)-9-азабицикло[3.3.1]нонан-2-ол.
Удаление защитных групп хирального (R)-метилбензила выполняется с использованием условий гидрогенизации, известных специалистам в данной области, и с применением стандартных методик, в том числе описанных в публикации T. W. Greene and P. G. M. Wuts, “Protective Groups in Organic Synthesis,” 3 ed., John Wiley & Sons, 1999; с. 579-580; 620-621. Например, с использованием Н2 в присутствии катализатора, такого как Pd/C и т. п., в подходящем растворителе, таком как MeOH и т. п., с получением (1S,2S,5 R)-9-азабицикло[3.3.1]нонан-2-ола.
Функциональная аминогруппа (1S,2S,5R)-9-азабицикло[3.3.1]нонан-2-ола защищена защитной группой карбамата, такой как трет-бутилоксикарбонил (BOC). Например, реакция (1S,2S,5R)-9-азабицикло[3.3.1]нонан-2-ола с BOC-ангидридом при комнатной температуре в течение периода, составляющего приблизительно 4-7 ч, позволяет получить соединение формулы (XXVIII), где PG представляет собой BOC.
Соединение формулы (XXVIII) превращают в соединение формулы (XXIX) в условиях окисления, таких как окисление Сверна (Моффотта-Сверна). Например, соединение формулы (XXVIII) обрабатывают ДМСО, оксалилхлоридом, триэтиламином в приемлемом растворителе, таком как DCM и т. п., с образованием соединения формулы (XXIX). В соответствии с предпочтительным методом, на начальной стадии реакцию проводят при температуре -78 °C, а далее реагенты нагревают до комнатной температуры и перемешивают на протяжении ночи.
Соединение формулы (XXIX) превращают в соединение (XXX) путем обработки сильным основанием, таким как бис(триметилсилил)амид лития (LiHMDS/LHMDS) и т. п., в приемлемом растворителе, таком как THF и т. п., при температуре приблизительно -78°C в течение периода приблизительно 30 минут. Полученный енолат лития захватывают метилом или этилцианоформиатом при температуре приблизительно -78°C в течение 1-3 ч с получением сложного β-кетоэфирного соединения формулы (XXX), где PG представляет собой BOC, а Rb представляет собой C1-4алкил.
СХЕМА 14
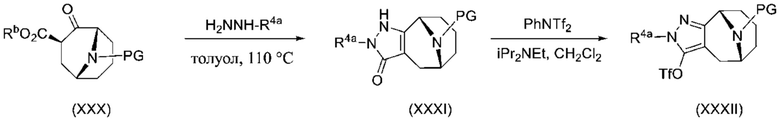
В соответствии со СХЕМОЙ 14 сложное кетоэфирное соединение формулы (XXX) вводят в реакцию с доступным в продаже или получаемым синтетическим путем гидразином формулы R4aNHNH2 в инертном растворителе, таком как толуол и т. п., при температуре приблизительно 100°C с получением пиразолонового соединения формулы (XXXI), где R4а представляет собой C1-4алкил или C3-6циклоалкил.
Получение пиразолонового соединения формулы (XXXI) с замещаемой группой на основе сульфоната, такой как трифторметансульфонил (трифлат), выполняется путем реакции с трифлатирующим агентом, таким как трифторметансульфоновый ангидрид (Tf2O), основанием, таким как триэтиламин (TEA), пиридин и т. п., в подходящем растворителе, таком как DCM и т. п. Более мягкие трифлатирующие агенты, такие как N-фенилбис(трифторметансульфонимид) (Tf2NPh), основание, такое как TEA, DIEA и т. п., в подходящем растворителе, таком как DCM и т. п.; используются для улучшения селективности, с получением соединения формулы (XXXII).
рацемический(5R,8S)-2-метил-3-фенил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол получают в соответствии со способами, аналогичными описанным выше.
СХЕМА 15
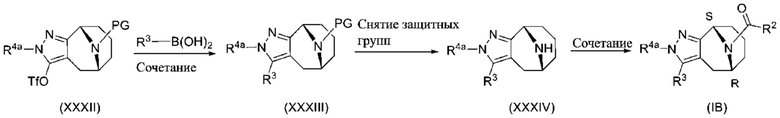
В соответствии со СХЕМОЙ 15, соединение формулы (XXXII) реагирует в опосредованной металлом реакции перекрестного сочетания с получением соединения формулы (XXXIII), где R4a представляет собой H или C1-4алкил, PG представляет собой BOC, и R3 представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, независимо выбранными из группы, состоящей из галогена или C1-4галогеналкила; или пиридинила, замещенного CF3. Например, соединение формулы (XXXII), где R4a представляет H или C1-4алкил и PG; вступает в реакцию с соответствующим образом замещенным доступным в продаже или получаемым синтетическим путем алкилом, циклоалкилом, арилом или гетероарилом бороновой кислоты, сложным боронатным эфиром и т. п., в присутствии палладиевого катализатора, такого как [1,1′ -бис(ди-трет-бутилфосфино)ферроцен]дихлорпалладий(II) (PdCl2(dtbpf)), тетракис(трифенилфосфин)палладий(0) (Pd(PPh3)4), [1,1′ -бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (PdCl2(dppf)), палладий(II)бис(трифенилфосфин) дихлорид (Pd(PPh3)2Cl2) и т. п., основания, такого как K3PO4, водн. раствора Na2CO3, Na2CO3, Cs2CO3 и т. п., в подходящем растворителе, таком как 1,2-диметоксиэтан, 1,4-диоксан, DMF, вода или их смесь, при температурах в диапазоне от 60 до 180 °C, используя традиционный или микроволновой нагрев, в течение периода от приблизительно 30 мин до 16 ч, с получением соединения формулы (XXXIII).
В альтернативном способе трет-бутил (5R,9S)-2-метил-3-(((трифторметил)сульфонил)окси)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбоксилат приводят в опосредованную металлом реакцию сочетания с доступной в продаже или получаемой синтетическим путем арильной или гетероарильной бороновой кислотой, сложным боронатным эфиром формулы R3-B(OH)2, где R3 представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, независимо выбранными из группы, состоящей из галогена, C1-4галогеналкила, OC1-4алкила; или 1-метил-1H-индол-2-ила; с использованием катализатора, такого как хлор(2-дициклогексилфосфино-2′,4′,6′-триизопропил-1,1′-бифенил)[2-(2′-амино-1,1′-бифенил)]палладий(II) (XPhos Pd G2) и т. п.; основания, такого как K3PO4, водн. раствора Na2CO3, Na2CO3, Cs2CO3 и т. п., в подходящем растворителе, таком как 1,2-диметоксиэтан, 1,4-диоксан, DMF, вода или их смесь, при температурах в диапазоне от 60 до 180 °C, используя традиционный или микроволновой нагрев, в течение периода от приблизительно 30 мин до 16 ч, с получением соединения формулы (XIII).
Отщепление защитной группы BOC соединения формулы (XXXIII) выполняется в соответствии с процедурами, известными специалистам в данной области, с применением стандартных методик, в том числе описанных в публикации T. W. Greene and P. G. M. Wuts, “Protective Groups in Organic Synthesis,” 3 ed., John Wiley & Sons, 1999, с. 518-525. Например, в кислотной среде, в том числе в присутствии TFA/CH2Cl2, HCl/диоксана и т. п., позволяет получать соединение формулы (XXXIV).
Соединение формулы (IB) получают традиционными методами формирования амидной связи, такими как реакции сочетания, хорошо известными специалистам в данной области (примеры: HATU (1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиния 3-оксид гексафторфосфат), BOP (бензотриазол-1-илокси-трис(диметиламино)фосфония гексафторфосфат) или путем превращения кислоты в хлорангидрид кислоты). Например, реакция соединения формулы (XXXIV), где R4a представляет собой H или C1-4алкил, а R3 соответствует описанию в п. 1; с помощью доступной в продаже или получаемой синтетическим путем кислоты, где кислоту активируют соответствующим активирующим реагентом, например карбодиимидом, таким как N, N'-дициклогексилкарбодиимид (DCC) или 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC, EDAC или EDCI), необязательно в присутствии гидроксибензотриазола (HOBt) и/или катализатора, такого как 4-диметиламинопиридин (DMAP); галогентрисаминофосфониевой соли, такой как (бензотриазол-1-илокси)трис(диметиламино)фосфония гексафторфосфат (BOP) или бромтрипирролидинофосфония гексафторфосфат (PyBroP®); приемлемой соли пиридиния, такой как 2-хлор-1-метилпиридиния хлорид; или другого приемлемого соединительного агента, такого как N, N,N′,N′ -тетраметил-O-(1H-бензотриазол-1-ил)урония гексафторфосфат (HBTU), 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиния 3-оксид гексафторфосфат (HATU), 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфоринан-2,4,6-триоксид (T3P®) и т. п. Реакции сочетания выполняют в приемлемом растворителе, таком как DCM, THF, DMF и т. п., необязательно в присутствии третичного амина, такого как N-метилморфолин, N-этилдиизопропиламин (DIEA, DIPEA) или триэтиламин (TEA), при температуре в диапазоне от 0 °C до комн. темп. с получением соединения формулы (IA) или формулы (IB).
Соединение формулы (IB) (а также соединение формулы (I)), где R2 представляет собой гетероарил, замещенный реакционноспособной функциональной группой, такой как гидроксильная группа, алкилируют подходящим алкилгалогенидом, таким как 1-йодэтан, фтор-2-йодэтан и т. п. Например, соединение формулы (IB) (а также соединение формулы (I)), где R2 представляет собой 4-гидроксихинолин, взаимодействует с фтор-2-йодэтаном; подходящим основанием, таким как Cs2CO3, K2CO3 и т. п.: в подходящем растворителе, таком как N, N-диметилформамид, с получением соединения формулы (IA) (а также соединения формулы (I)), где R2представляет собой 4-(2-фторэтокси)хинолин.
Соединение формулы (IB) (а также соединение формулы (I)), где R2 представляет собой хинолин, окисляют до N-оксидного соединения формулы (IB) (а также соединения формулы (I)) с применением м-хлорпероксибензойной кислоты (m-CPBA) в подходящем растворителе, таком как DCM, хлороформ и т. п., при температурах в диапазоне от 0 ºC до комнатной температуры в течение периода от 30 минут до 1 ч.
Соединение формулы (IB) (а также соединение формулы (I)), где R2 представляет собой бромзамещенный хинолин, подвергают тритированию при условиях, известных специалистам в данной области. Например, (4-бромхинолин-6-ил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон реагирует с Pd/C в приемлемом растворителе (MeOH и пр.), в присутствии газообразного трития под давлением в 1 атм. с получением ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хинолин-6-ил-4-t)метанона.
Соединение формулы (IB) (а также соединение формулы (I)), где R2 представляет собой гетероарил, замещенный реакционноспособной функциональной группой, такой как Br, вводят в реакцию в условиях каталитической реакции галогенирования и дегалогенирования, таких как Pd/C и газообразный водород, в условиях, известных специалистам в данной области.
СХЕМА 15
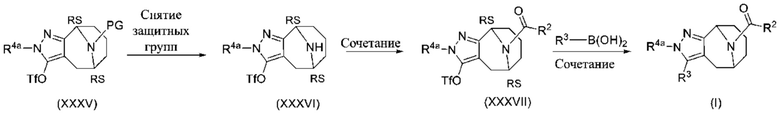
В соответствии со СХЕМОЙ 15, соединение формулы (I) получают из соединения формулы (XXXV) в рамках трех стадий. На первой стадии удаление защитной группы BOC, как описано ранее, с последующим сочетанием амидной связи и последующим сочетанием по Сузуки, как описано ранее, позволяет получить соединение формулы (I).
СХЕМА 16
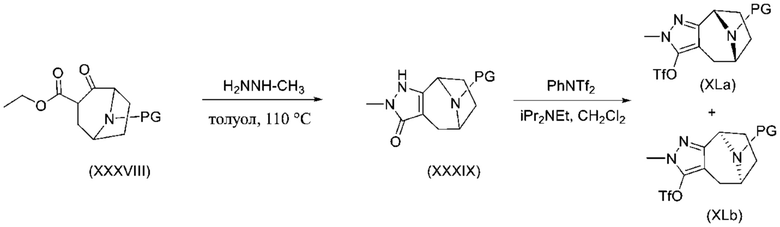
В соответствии со СХЕМОЙ 16, соединение формулы (XXXVIII) получают способом, описанным в JOC 2002, 67, 3479-3486, где PG представляет собой BOC. Сложное кетоэфирное соединение формулы (XXXVIII) вводят в реакцию с доступным в продаже или получаемым синтетическим путем метилгидразином в инертном растворителе, таком как толуол и т. п., при температуре приблизительно 100°C с получением соединения формулы (XXXIX), где PG представляет собой BOC.
Получение соединения формулы (XXIX) с замещаемой группой на основе сульфоната, такой как трифторметансульфонил (трифлат), выполняется путем реакции с трифлатирующим агентом, таким как трифторметансульфоновый ангидрид (Tf2O), основанием, таким как триэтиламин (TEA), пиридин и т. п., в подходящем растворителе, таком как DCM и т. п. Более мягкие трифлатирующие агенты, такие как N-фенилбис(трифторметансульфонимид) (Tf2NPh), основание, такое как TEA, DIEA и т. п., в подходящем растворителе, таком как DCM и т. п.; используются для улучшения селективности, с получением соединения формулы (XLa) и (XLb), где PG представляет собой BOC. Одиночные энантиомеры выделяли путем очистки (XLa) и (XLb) с помощью хиральной СФХ.
СХЕМА 17
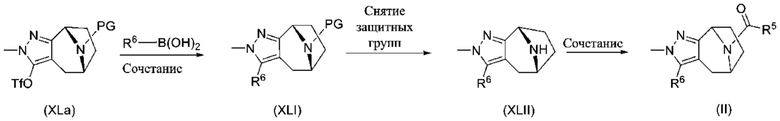
В соответствии со СХЕМОЙ 17, одиночное энантиомерное соединение формулы (XLa) (а также XLb или рацемическую смесь) вводят в реакцию сочетания с подходящим образом замещенным доступным в продаже или получаемым синтетическим путем алкилом. циклоалкилом, арилом или гетероарилом борной кислотой, сложным боронатным эфиром и т. п., в присутствии катализатора на основе палладия в условиях сочетания по Сузуки, описанных ранее, с образованием соединения формулы (XLI). Удаление защитных групп выполняется в соответствии с ранее описанными способами. Последующее амидное сочетание соединения формулы (XLII) с подходящим образом замещенной доступной в продаже или получаемой синтетическим путем кислотой позволяет получать соединение формулы (II).
Соединения формулы (I) (а также формул (IA), (IB), (IC), (ID) или (II)) могут быть преобразованы в соответствующие соли с применением способов, известных специалистам в данной области. Например, обработка амина формулы (I) трифторуксусной кислотой, HCl или лимонной кислотой в таком растворителе, как Et2O, CH2Cl2, THF, MeOH, хлороформ или изопропанол, позволяет получать соответствующую солевую форму. В альтернативном варианте осуществления соли трифторуксусной или муравьиной кислоты получают в результате очистки соединений в условиях обращенно-фазовой ВЭЖХ. Кристаллические формы фармацевтически приемлемых солей соединений формулы (I) (а также формул (IA), (IB), (IC), (ID) или (II)) можно получать в кристаллической форме путем перекристаллизации из полярных растворителей (включая смеси полярных растворителей и водные смеси полярных растворителей) или из неполярных растворителей (включая смеси неполярных растворителей).
Если соединения в соответствии с настоящим изобретением имеют по меньшей мере один хиральный центр, они могут соответственно существовать в виде энантиомеров. Если соединения имеют два или более хиральных центров, они могут дополнительно существовать в виде диастереомеров. Следует понимать, что все такие изомеры и их смеси входят в объем настоящего изобретения.
Соединения, полученные в соответствии с описанными выше схемами, можно получать в виде отдельных форм, например отдельных энантиомеров, путем формоспецифического синтеза или путем разделения. Соединения, полученные в соответствии с описанными выше схемами, в альтернативном варианте осуществления можно получать в виде смесей разных форм, таких как рацемические (1 : 1) или нерацемические (не 1 : 1) смеси. При получении рацемических и нерацемических смесей энантиомеров отдельные энантиомеры могут быть выделены с помощью традиционных способов разделения, известных специалистам в данной области, таких как хиральная хроматография, перекристаллизация, образование диастереомерной соли, превращение в диастереомерные аддукты, биотрансформация или ферментная трансформация. При получении региоизомерных или диастереомерных смесей в случае необходимости отдельные изомеры можно получать традиционными способами, такими как хроматография или кристаллизация.
Приведенные ниже конкретные примеры дополнительно иллюстрируют настоящее изобретение и различные предпочтительные варианты осуществления.
ПРИМЕРЫ
Если не указано иное, для получения описанных в приведенных ниже примерах соединений и соответствующих аналитических данных использовали следующие экспериментальные и аналитические протоколы.
Если не оговорено иное, реакционные смеси перемешивали на магнитной мешалке при комнатной температуре (комн. темп.) в атмосфере азота. Если растворы были «осушены», для этого по существу использовали осушающий агент, такой как Na2SO4 или MgSO4. Если смеси, растворы и экстракты были «сконцентрированы», то их, как правило, концентрировали на роторном испарителе под пониженным давлением. Реакции в условиях микроволнового излучения проводили в инициаторе Biotage или приборе CEM (микроволновый реактор) Discover.
Нормально-фазовую хроматографию на силикагеле (КФХ) выполняли на силикагеле (SiO2) с использованием предварительно заправленных картриджей.
Препаративную обращенно-фазовую высокоэффективную жидкостную хроматографию (ОФ-ВЭЖХ) выполняли с одним вариантом из:
СПОСОБА A - системы для ВЭЖХ Agilent с колонкой Xterra Prep RP18 (5 мкМ, 30×100 или 50×150 мм) или колонки XBridge C18 OBD (5 мкМ, 30×100 или 50×150 мм); подвижная фаза 5% ACN в 20 мМ NH4OH, выдерживание в течение 2 мин с последующим градиентом 5-99% ACN в течение 15 мин, впоследствии выдерживание при 99% ACN в течение 5 мин; скорость потока 40 или 80 мл/мин;
или
СПОСОБА B - системы ВЭЖХ Shimadzu серии LC-8A с колонкой Inertsil ODS-3 (3 мкм, 30×100 мм, T=45 °C), подвижная фаза 5% ACN в H2O (оба с 0,05% TFA), выдерживание в течение 1 мин с последующим градиентом 5-99% ACN в течение 6 мин, впоследствии выдерживание при 99% ACN в течение 3 мин; скорость потока 80 мл/мин;
или
СПОСОБА C системы ВЭЖХ Shimadzu серии LC-8A с колонкой XBridge C18 OBD (5 мкм, 50×100 мм), подвижную фазу 5% ACN в H2O (обе с 0,05% ТФУ) выдерживали в течение 1 мин с последующим градиентом 5-99% АЦН в течение 14 мин, впоследствии выдерживали при 99% ACN в течение 10 мин со скоростью потока 80 мл/мин.;
или
СПОСОБА D - системы ВЭЖХ Gilson с колонкой XBridge C18 (5 мкм, 100×50 мм), подвижная фаза 5-99% ACN в 20 мМ NH4OH в течение 10 мин, впоследствии выдерживание при 99% ACN в течение 2 мин, скорость потока 80 мл/мин.
СПОСОБ E: Система ВЭЖХ Agilent с колонкой Gemini-NX C18 (5 мкМ, 30×100 мм) и подвижной фазой 0-90% ACN в 10 мМ (NH4)HCO3 в течение 16 мин со скоростью потока 30 мл/мин Препаративная сверхкритическая флюидная высокоэффективная жидкостная хроматография (СФХ) выполнялась либо на системе Jasco препаративной СФХ, либо на системе APS 1010 от Berger instruments, либо на системе SFC-PICLAB-PREP 200 (PIC SOLUTION, г. Авиньон, Франция). Разделение проводили при 100-150 бар со скоростью потока в диапазоне 40-60 мл/мин. Колонку нагревали до температуры от 35 до 40 °C.
Если не указано иное, масс-спектры (МС) получали на анализаторе Agilent серии 1100 MSD с использованием ионизации электрораспылением (ИЭР) в позитивном режиме. Рассчитанная (рассч.) масса соответствует точной массе.
Спектры ядерного магнитного резонанса (ЯМР) были получены на спектрометрах Bruker модели DRX. Для мультиплетности используют следующие обозначения: с=синглет, д=дублет, т=триплет, к=квартет, м=мультиплет, уш. = уширенный. Следует понимать, что для соединений, содержащих способный к обмену протон, указанный протон может быть виден или не виден на спектре ЯМР в зависимости от выбора растворителя, используемого для построения ЯМР-спектра, и концентрации соединения в растворе.
Названия химических элементов были созданы с помощью программного обеспечения ChemDraw Ultra 17.1 (CambridgeSoft Corp., г. Кембридж, штат Массачусетс, США) или OEMetaChem V1.4.0.4 (Open Eye).
.
Соединения, обозначенные R* или S*, представляют собой энантиомерно чистые соединения, для которых абсолютная конфигурация не определялась.
Промежуточное соединение 1: рацемический(5R,9S)-2-Метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
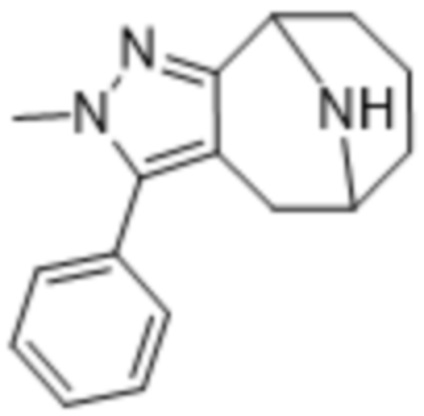
Стадия А: рацемический трет-Бутил (5R,9S)-2-метил-3-оксо-2,3,4,5,6,7,8,9-октагидро-1H-5,9-эпиминциклоокта[c]пиразол-10-карбоксилат. К раствору рацемического-9-(трет-бутил) 3-этил (1S,5R)-2-оксо-9-азабицикло [3.3.1] нонан-3,9-дикарбоксилата (2.5 г, 8.4 ммоль) в толуоле (30,0 мл) добавляли метилгидразин (0,66 мл, 12.6 ммоль) и полученную смесь нагревали при температуре 110 ºC в течение 3 ч. После охлаждения до комн. темп., растворитель концентрировали в вакууме и неочищенный остаток очищали (FCC, SiO2; 0-10% MeOH/DCM) с получением титульного соединения в виде масла (2.3 г, выход 91%). МС (ИЭР): масса, рассчитанная для C15H23N3O3, 293,1; полученное m/z, 294,1 [M+H]+.
Стадия B: рацемич еский трет-Бутил (5R,9S)-2-метил-3-(((трифторметил)сульфонил) окси)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбоксилат. К раствору рацемического трет-бутил (5R,9S)-2-метил-3-оксо-2,3,4,5,6,7,8,9-октагидро-1H-5,9-эпиминциклоокта[c]пиразол-10-карбоксилата (2.0 г, 6.8 ммоль) в дихлорметане (DCM) (30.0 мл) добавляли N, N-диизопропилэтиламин (DIEA/DIPEA/основание Хунига) (1.3 мл, 7.5 ммоль) с последующим добавлением 1,1,1-трифтор-N-фенил-N-((трифторметил)сульфонил)метансульфонамида (2,7 г, 7.5 ммоль). Реакционную смесь перемешивали при комн. темп. в течение 5 ч, растворитель концентрировали в вакууме и неочищенный остаток очищали (FCC, SiO2; 0-20 EtOAc/гексаны при длине волны в 220 нм) с получением титульного соединения в виде масла (2,5 г, выход 86%). МС (ИЭР): масса, рассчитанная для C16H22F3N3O5S, 425,1; полученное m/z, 369.9 [M+2H-трет-бутил] +.
Стадия C: рацемический трет-Бутил (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбоксилат. Раствор рацемического трет-бутил (5R,9S)-2-метил-3-(((трифторметил)сульфонил)окси)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбоксилата (750 мг, 1.8 ммоль), фенилбороновой кислоты (645 мг, 5,3 ммоль), фосфата калия (1,1 г, 5,3 ммоль) и 1,1′-ферроцендил-бис(дифенилфосфина) (dppf) (60 мг, 0,1 ммоль) в диоксане (6.0 мл) дегазировали азотом в течение 10 минут. Одновременно добавляли [1,1′-Бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (PdCl2(dppf)) (195 мг, 0,3 ммоль) и полученную смесь дегазировали азотом в течение дополнительного периода в 10 минут. Реакционную смесь нагревали в микроволновом реакторе при 140 ºC в течение 30 минут. После охлаждения до к. т. неочищенную смесь разбавляли солевым раствором и экстрагировали с использованием DCM (x3). Объединенные органические экстракты высушивали над Na2SO4, концентрировали в вакууме и очищали (FCC, SiO2; 0-50% EtOAc/гексаны) с получением продукта в виде белого твердого вещества (605 мг, выход 97%). МС (ИЭР): масса, рассчитанная для C21H27N3O2, 353.2; полученное m/z, 354,1 [M+H]+.
Стадия D. рацемический (5R,9S)-2-Метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол. К раствору рацемического трет-бутил (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-карбоксилата в дихлорметане (DCM) (2,0 мл) добавляли трифторуксусную кислоту (2,0 мл) и смесь перемешивали при комнатной температуре в течение 1 ч. Растворитель концентрировали в вакууме с получением титульного соединения в виде твердого вещества белого цвета (475 г, 95% выход). МС (ИЭР): масса, рассчитанная для C13H15N3, 253,1; полученное m/z, 254,1 [M+H]+.
Промежуточное соединение 2: трет-Бутил (5R,9S)-2-метил-3-(((трифторметил)сульфонил) окси)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбоксилат.
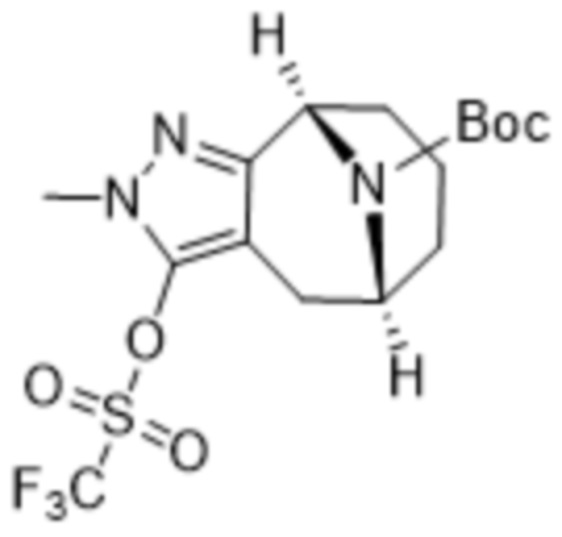
Способ A.
Стадия А: (4Z)-9-Оксабицикло[6.1.0]нон-4-ен. К раствору 1,5-циклооктадиена (125 г, 116 ммоль) в тетрагидрофуране (175 мл) по каплям добавляли раствор 3-хлорпероксибензойной кислоты (m-CPBA) (55%, 300 г, 956 ммоль) в хлороформе (1,75 л) и реакционную смесь перемешивали при комнатной температуре в течение 42 ч. Реакционную смесь промывали 20% бисульфитом натрия (4×1 л), насыщенным раствором бикарбоната натрия (4×1 л) и солевым раствором (2×1 л). Органический слой сушили над сульфатом натрия, фильтровали и выпаривали. Смесь дистиллировали в условиях вакуума (п. о. = 40 ºC при давлении в 2 мм рт. ст.) с получением титульного соединения (74,2 г, выход 51%) в виде бесцветной жидкости. МС (ИЭР): масса, рассчитанная для C8H12O, - 124,1; полученное m/z, 123,0 [M−H]−.
Стадия B: (1S,8S, Z)-8-(((R)-1-Фенилэтил)амино)циклоокт-4-ен-1-ол. К раствору трифторметансульфоната гидрата иттербия(III) (12.5 г, 20.2 ммоль) в дистиллированном тетрагидрофуране (200 мл) добавляли (R)-(+)-α-метилбензиламин (77 мл, 604 ммоль, 0.95 г/мл) и 1,2-эпокси-5-циклооктен (50 г, 403 ммоль) в дистиллированном тетрагидрофуране (300 мл). Реакционную смесь перемешивали в герметичной пробирке при 100°C в течение 48 ч, выливали в воду (500 мл) и выпаривали летучие вещества. Водный слой экстрагировали с помощью дихлорметана (3×500 мл), объединенные органические слои высушивали над сульфатом натрия, фильтровали и выпаривали с получением титульного соединения (120 г, неочищ.) в виде желтого масла. Реакцию повторяли с количеством в 99 г (798 ммоль). Неочищенные продукты из обеих реакций объединяли и превращали в хлористоводородную соль в рамках 2 партий. К 20 г неочищенного продукта добавляли хлороводород (3,88 M в диэтиловом эфире, 82 мл, 318 ммоль). Выделившуюся фазу собирали и выделяли первую партию (3,34 г, 11.8 ммоль, 14%) в виде белого кристаллического твердого вещества. К оставшемуся количеству неочищенного продукта (280 г, 114 ммоль) в этилацетате (560 мл) добавляли хлороводород (3,88 M в диэтиловом эфире, 560 мл, 2173 ммоль). Суспензию перемешивали при комнатной температуре в течение 30 мин и собирали выделившуюся фазу. Твердое вещество суспендировали в этилацетате, насыщенном водой (5.6 л), и перемешивали при 50°C в течение 30 мин. После охлаждения до комнатной температуры собирали выделившуюся фазу и выделяли вторую партию (78 г, 277 ммоль, выход 24%) в виде белого кристаллического твердого вещества. МС (ИЭР): масса, рассчитанная для C16H23NO, - 245,2; полученное m/z, m/z=246,2 [M+H]+. 1H ЯМР (400МГц, CDCl3) δ 7,46-7,18 (м, 6H), 4,33-4,09 (м, 2H), 3,88 (уш. с, 4H), 3,42 (с, 1H), 3,02-2,82 (м, 1H), 2,05-1,85 (м, 2H), 1,79-1,60 (м, 2H), 1,50 (д, J=6,8 Гц, 2H), 1,38- 1,27 (м, 2H)
Стадия C: (1S,2S,5R)-9-((R)-1-фенилэтил)-9-азабицикло[3.3.1]нонан-2-ол. К раствору хлорида ртути(II) (104 г, 383 ммоль) в тетрагидрофуране (750 мл) и воде (320 мл) добавляли раствор (1S,8S, Z)-8-[[(1R)-1-фенилэтил]амино]циклоокт-4-ен-1-ола (98.0 г, 348 ммоль) в тетрагидрофуране (350 мл) и гидроксиде натрия (3 M, 116 мл, 348 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 суток. К реакционной смеси добавляли гидроксид натрия (3 M, 280 мл, 840 ммоль) и раствор боргидрида натрия (13,0 г, 344 ммоль) в гидроксиде натрия (3 M, 70 мл, 210 ммоль) при 0 °C, затем реакционную смесь перемешивали при комнатной температуре в течение 1 суток с получением титульного соединения (98 г), которое применяли на следующей стадии без дополнительной очистки. ЖХМС: 58%, tR=2,019 мин, m/z=246,1 [M+H]+.
Стадия D: трет-Бутил (1S,2S,5R)-2-гидрокси-9-азабицикло[3.3.1]нонан-9-карбоксилат. Смесь (1R,2S,5R)-9-[(1R)-1-фенилэтил]-9-азабицикло[3.3.1]нонан-4-ола (98.0 г, неочищ.) и 10% палладия на углероде (42.5 г) в метаноле (2.5 л) перемешивали при комнатной температуре в течение 2 ч в водородной атмосфере. К реакционной смеси добавляли ди-трет-бутилдикарбонат (175 г, 802 ммоль) и триэтиламин (56 мл, 402 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь фильтровали с помощью подушки Celite®; и подушку Celite® промывали метанолом (2×500 мл). Объединенные фильтраты концентрировали при пониженном давлении и остаток очищали с помощью колоночной хроматографии на силикагеле с элюированием этилацетатом. Остаток очищали с помощью градиентной колоночной хроматографии на силикагеле с элюированием смесью гептана и этилацетата (100:0 → 3:1) с получением первой партии титульного соединения (43,4 г, 180 ммоль, выход 44%) в виде желтого масла. 1H ЯМР (500 МГц, ДМСО-d6) δ 4,94-4,87 (м, 1H), 4,08-3,87 (м, 2H), 3,66-3,53 (м, 1H), 1,96-1,31 (м, 10H), 1,39 (с, 9H).
Стадия E: трет-Бутил (1R,5R)-2-оксо-9-азабицикло[3.3.1]нонан-9-карбоксилат. К раствору оксалилхлорида (12,9 мл, 152 ммоль) в дихлорметане (560 мл) добавляли диметилсульфоксид по каплям (21,5 мл, 303 ммоль) при -78 °C. К реакционной смеси добавляли раствор трет-бутил (1R,2S,5R)-2-гидрокси-9-азабицикло[3.3.1]нонан-9-карбоксилата (24,5 г, 102 ммоль) в дихлорметане (140 мл) и реакционную смесь перемешивали при -78°C в течение 30 мин. Добавляли триэтиламин (TEA) (85 мл, 61 ммоль), реакционной смеси позволяли нагреться до комнатной температуры и перемешивали в течение 2 ч. Реакционную смесь промывали водой (3×300 мл), высушивали над сульфатом натрия, фильтровали и выпаривали. Остаток очищали колоночной хроматографией на силикагеле с элюированием смесью гептана и этилацетата (4:1), с получением титульного соединения (19.5 г, 82 ммоль, выход 80%) в виде белого кристаллического твердого вещества. 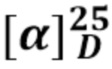 +116.0° (c 0,110, MeOH). МС (ИЭР): масса, рассчитанная для C13H21NO3, 239.2; полученное m/z, 262,1 [M+Na]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 4,49-4,35 (м, 1H), 4,34-4,23 (м, 1H), 2,43-2,24 (м, 3H), 1,83-1,74 (м, 1H), 1,71-1,56 (м, 2H), 1,57-1,33 (м, 4H), 1,43, 1,39 (с, 9H).
+116.0° (c 0,110, MeOH). МС (ИЭР): масса, рассчитанная для C13H21NO3, 239.2; полученное m/z, 262,1 [M+Na]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 4,49-4,35 (м, 1H), 4,34-4,23 (м, 1H), 2,43-2,24 (м, 3H), 1,83-1,74 (м, 1H), 1,71-1,56 (м, 2H), 1,57-1,33 (м, 4H), 1,43, 1,39 (с, 9H).
Стадия F: 9-(трет-Бутил) 3-этил (1S,5R)-2-оксо-9-азабицикло[3.3.1]нонан-3,9-дикарбоксилат. К раствору трет-бутил (1R,5R)-2-оксо-9-азабицикло[3.3.1]нонан-9-карбоксилата (8,2 г, 34,3 ммоль) в дистиллированном тетрагидрофуране (180 мл) добавляли бис(триметилсилил)амид лития (LiHMDS) (1 M в тетрагидрофуране, 41,2 мл, 41,2 ммоль) при -78°C и реакционную смесь перемешивали при -78°C в течение 30 мин. К реакционной смеси добавляли раствор этилцианоформиата (4,4 мл, 44,5 ммоль) в дистиллированном тетрагидрофуране (20 мл), и реакционную смесь перемешивали при -78°C в течение 1 ч. Реакцию гасили насыщенным хлоридом аммония (200 мл). Водный слой экстрагировали дихлорметаном (2×200 мл). Объединенные органические слои промывали водой (2×150 мл), сушили над сульфатом натрия, фильтровали и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле с элюированием смесью гептана и этилацетата (4:1), с получением титульного соединения (5.5 г, 18 ммоль, выход 51%) в виде бледно-желтого масла. 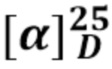 −45,0° (c 0,185, MeOH). МС (ИЭР): масса, рассчитанная для C16H25NO5, 311.2; полученное m/z, 256,1 [M+2H−трет-Бутил]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 11,83 (с, 1H), 4,52-4,37 (м, 1H), 4,36-4,25 (м, 1H), 4,20 (кв, J=7,1 Гц, 2H), 2,66-2,49 (м, 1H), 2.09 (д, J=16,5 Гц, 1H), 1,76-1,45 (м, 6H), 1,39 (с, 9H), 1,24 (т, J=7,1 Гц, 3H).
−45,0° (c 0,185, MeOH). МС (ИЭР): масса, рассчитанная для C16H25NO5, 311.2; полученное m/z, 256,1 [M+2H−трет-Бутил]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 11,83 (с, 1H), 4,52-4,37 (м, 1H), 4,36-4,25 (м, 1H), 4,20 (кв, J=7,1 Гц, 2H), 2,66-2,49 (м, 1H), 2.09 (д, J=16,5 Гц, 1H), 1,76-1,45 (м, 6H), 1,39 (с, 9H), 1,24 (т, J=7,1 Гц, 3H).
Стадия G: трет-Бутил (5R,9S)-2-метил-3-оксо-2,3,4,5,6,7,8,9-октагидро-1H-5,9-эпиминциклоокта[c]пиразол-10-карбоксилат. К смеси 9-(трет-бутил) 3-этил (1S,5R)-2-оксо-9-азабицикло[3.3.1]нонан-3,9-дикарбоксилата (20,4 г, 65,5 ммоль) в уксусной кислоте (AcOH) (260 мл) добавляли метилгидразин (5,2 мл, 99.3 ммоль, 0.88 г/мл) и реакционную смесь перемешивали при 80°C в течение 8 ч. Реакционную смесь выпаривали и остаток очищали с помощью колоночной хроматографии на силикагеле с элюированием смесью этилацетата и метанола (10:1) с получением титульного соединения (15.4 г, 52.5 ммоль, выход 80%). МС (ИЭР): масса, рассчитанная для C15H23N3O3, 293,2; полученное m/z, 294,2 [M+H]+.
Стадия H: трет-Бутил (5R,9S)-2-метил-3-(((трифторметил)сульфонил)окси)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбоксилат. К раствору трет-бутил (5R,9S)-2-метил-3-оксо-2,3,4,5,6,7,8,9-октагидро-1H-5,9-эпиминциклоокта[c]пиразол-10-карбоксилата (20,0 г, 68,2 ммоль) в дихлорметане (300 мл) добавляли N, N-диизопропилэтиламин (13 мл, 75,1 ммоль) и N-фенил-бис(трифторметансульфонимид) (26,8 г, 75,0 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь промывали насыщенным бикарбонатом натрия (2×200 мл), 10% бисульфатом калия (2×200 мл) и солевым раствором (1×200 мл), сушили сульфатом натрия, фильтровали и выпаривали. Остаток очищали с помощью градиентной колоночной хроматографии на силикагеле с элюированием смесью гептана и этилацетата (6:1 → 4:1). Остаток растворяли в этилацетате (100 мл) и выпаривали. Менее чистые фракции объединяли и выпаривали. Остаток растворяли в дихлорметане (100 мл), промывали насыщенным бикарбонатом натрия (3×150 мл), сушили сульфатом натрия, фильтровали и выпаривали. Продукты объединяли с получением титульного соединения (16,4 г, 39 ммоль, выход 56%) в виде бесцветного масла. МС (ИЭР): масса, рассчитанная для C16H22F3N3O5S, - 425,1; полученное m/z, 370,1 [M+2H-трет-бутил] +. 1H ЯМР (500 МГц, ДМСО-d6) δ 5,06 (д, J=18,9 Гц, 1H), 4,48 (д, J=31,6 Гц, 1H), 3,73 (с, 3H), 2,84 (дд, J=16,3, 7,4 Гц, 1H), 2,44 (д, J=16,3 Гц, 1H), 1,78-1,61 (м, 3H), 1,59-1,41 (м, 2H), 1,38 (с, 9H), 1,27-1,16 (м, 1H). Оптическое вращение: 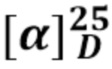 +10,0° (c 0,15, MeOH).
+10,0° (c 0,15, MeOH).
Способ B
Титульное соединение получали посредством очистки рацемического трет-бутил (5R,9S)-2-метил-3-(((трифторметил)сульфонил) окси)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбоксилата с помощью хиральной СФХ (стадия B, промежуточное соединение 1) с использованием неподвижной фазы: Lux Cellulose-2 5 мкм 250*30 мм, подвижная фаза: 85% CO2, 15% iPrOH (одиночный энантиомер; время удерживания 0,93 мин). МС (ИЭР): масса, рассчитанная для C16H22F3N3O5S, - 425,1; полученное m/z, 370,0 [M+2H-трет-бутил] +. 1H ЯМР (500 МГц, ДМСО-d6) δ 5,06 (д, J=18,9 Гц, 1H), 4,48 (д, J=31,6 Гц, 1H), 3,73 (с, 3H), 2,84 (дд, J=16,3, 7,4 Гц, 1H), 2,44 (д, J=16,3 Гц, 1H), 1,78-1,61 (м, 3H), 1,59-1,41 (м, 2H), 1,38 (с, 9H), 1,27-1,16 (м, 1H).
Промежуточное соединение 3: трет-Бутил (5S,9R)-2-метил-3-(((трифторметил)сульфонил) окси)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбоксилат.
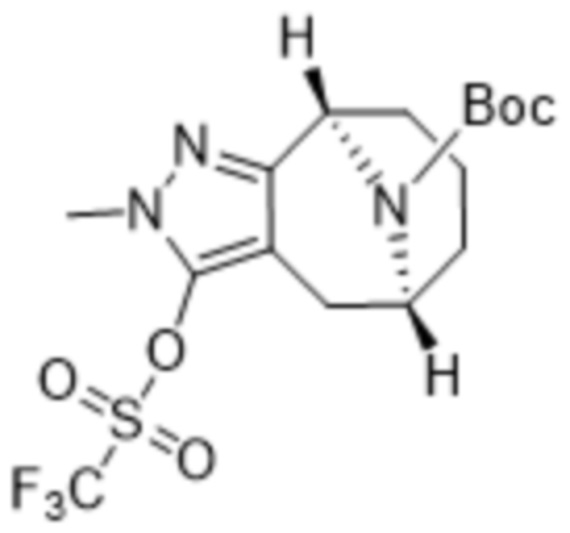
Титульное соединение получали путем ранее указанной очистки промежуточного соединения 2 (способ В) с помощью хиральной СФХ, при этом данное промежуточное соединение которое использовалось с получением титульного соединения (одиночный энантиомер; время удерживания 0,48 мин). МС (ИЭР): масса, рассчитанная для C16H22F3N3O5S, 425,1; полученное m/z, 370,0 [M+2H-трет-бутил] +.
Промежуточное соединение 4: рацемический (5R,9S)-3-(3-Фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
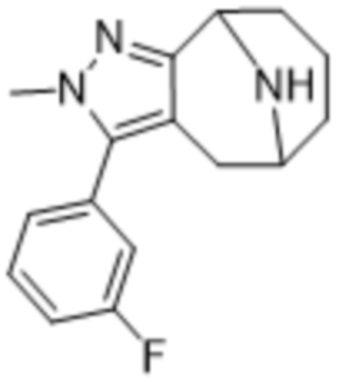
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 1, используя (3-фторфенил) бороновую кислоту вместо фенилбороновой кислоты на стадии C. МС (ИЭР): масса, рассчитанная для C16H18FN3, 271,1; полученное m/z, 272,1 [M+H]+.
Промежуточное соединение 5: рацемический (5R,9S)-3-(4-Фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.

Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 1, используя (4-фторфенил) бороновую кислоту вместо фенилбороновой кислоты на стадии C. МС (ИЭР): масса, рассчитанная для C16H18FN3, 271,1; полученное m/z, 272,1 [M+H]+.
Промежуточное соединение 6: рацемический (5R,9S)-3-(3-Хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
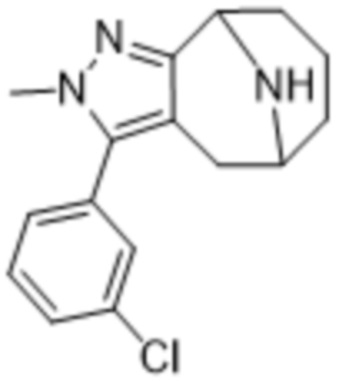
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 1, используя (3-хлорфенил) бороновую кислоту вместо фенилбороновой кислоты на стадии C. МС (ИЭР): масса, рассчитанная для C16H18ClN3, 287,1; полученное m/z, 288,1 [M+H]+.
Промежуточное соединение 7: рацемический-(5R,9S)-3-(3,5-Дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
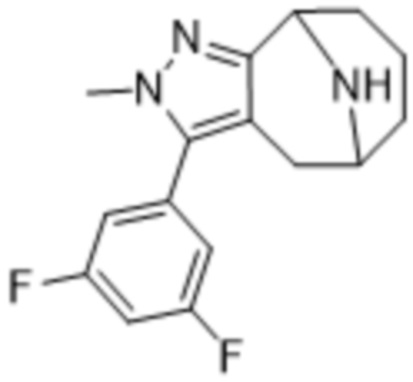
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 1, используя (3,5-дифторфенил) бороновую кислоту вместо фенилбороновой кислоты на стадии C. МС (ИЭР): масса, рассчитанная для C16H18ClN3, - 289,1; полученное m/z, 290,1 [M+H]+.
Промежуточное соединение 8: рацемический-(5R,9S)-3-(3,4-Дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
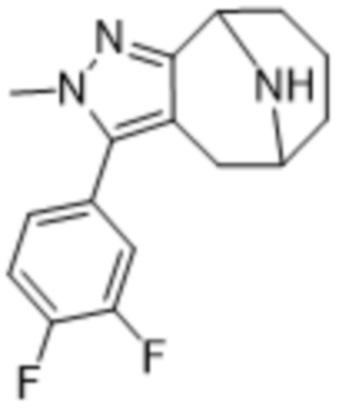
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 1, используя (3,4-дифторфенил) бороновую кислоту вместо фенилбороновой кислоты на стадии C. МС (ИЭР): масса, рассчитанная для C16H18ClN3, - 289,1; полученное m/z, 290,1 [M+H]+.
Промежуточное соединение 9: рацемический(5R,9S)-2-Метил-3-(5-(трифторметил) тиофен-2-ил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
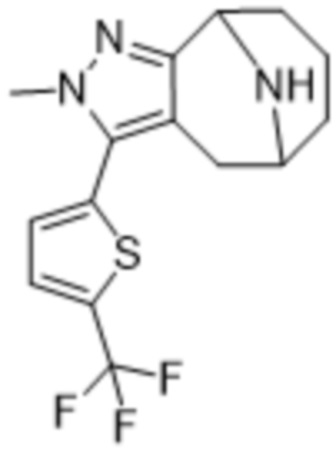
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 1, используя (5-(трифторметил) тиофен-2-ил) бороновую кислоту вместо фенилбороновой кислоты на стадии C. МС (ИЭР): масса, рассчитанная для C16H18ClN3, - 327,1; полученное m/z, 328,1 [M+H]+.
Промежуточное соединение 10: рацемический-(5R,9S)-3-(3-(Дифторметил)-4-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
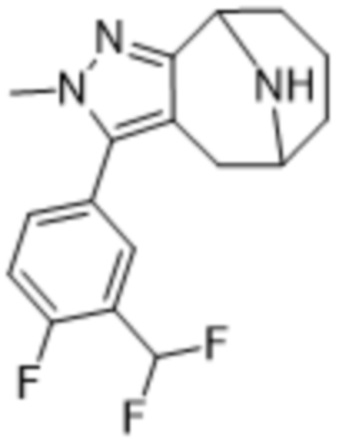
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 1, используя (3-(дифторметил)-4-фторфенил) бороновую кислоту вместо фенилбороновой кислоты на стадии C. МС (ИЭР): масса, рассчитанная для C16H18ClN3, - 327,1; полученное m/z, 328,1 [M+H]+.
Промежуточное соединение 11: рацемический(5R,9S)-2-Циклопропил-3-(3-фторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
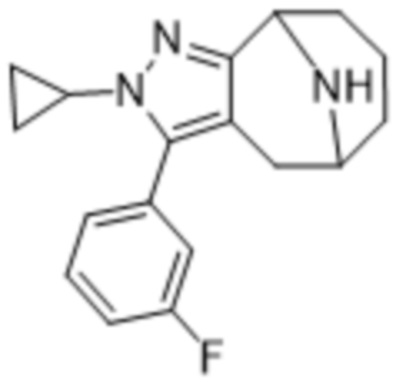
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 1, используя гидрохлорид циклопропилгидразина вместо метилгидразина на стадии A и (3-фторфенил) бороновую кислоту вместо фенилбороновой кислоты на стадии C. МС (ИЭР): масса, рассчитанная для C18H20FN3, 297,1; полученное m/z, 298,1 [M+H]+.
Промежуточное соединение 12: (5R,9S)-3-(3,5-Дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
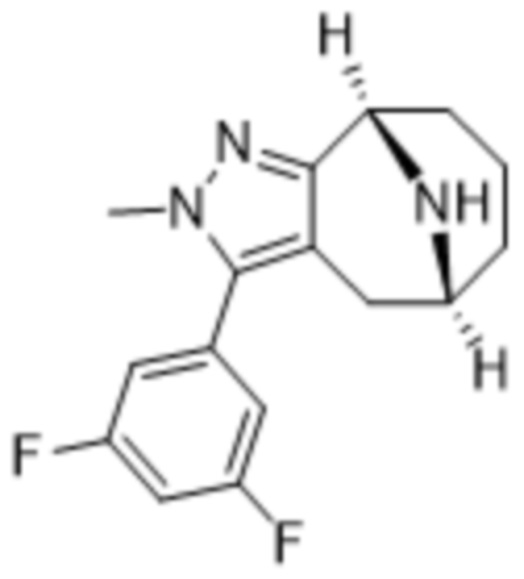
Стадия A: трет-Бутил (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбоксилат. Во флакон для микроволновой обработки помещали раствор трет-бутил (5R,9S)-2-метил-3-(((трифторметил)сульфонил)окси)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбоксилата (промежуточное соединение 2) (500 мг, 1,2 ммоль), (3,5-дифторфенил)бороновую кислоту (223 мг, 1,4 ммоль), хлор(2-дициклогексилфосфино-2′,4′,6′-триизопропил-1,1′-бифенил)[2-(2′-амино-1,1′-бифенил)]палладий(II) (XPhos Pd G2) (93 мг, 0,12 ммоль) и насыщ. водн. раствор Na2CO3 (8,0 мл) в диоксане (2,0 мл). Флакон вакуумировали и дегазировали N2 (x3), после чего закрывали крышкой и герметизировали. Смесь нагревали в микроволновом реакторе при температуре 110°C в течение 30 минут. После охлаждения до к. т. неочищенную смесь разбавляли солевым раствором и экстрагировали с использованием DCM (x3). Объединенные органические экстракты высушивали над Na2SO4, концентрировали в вакууме и очищали (FCC, SiO2; 0-100% EtOAc/гексаны) с получением продукта в виде белого твердого вещества (356 мг, выход 78%). МС (ИЭР): масса, рассчитанная для C21H25F2N3O2, 389,1; полученное m/z, 334.0 [M+2H-трет-бутил] +.
Стадия B: (5R,9S)-3-(3,5-Дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол. К раствору трет-бутил (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбоксилата в DCM (2,0 мл) добавляли трифторуксусную кислоту (2,0 мл) и смесь перемешивали при комнатной температуре в течение 1 ч. Растворитель концентрировали в вакууме и очищали обращенно-фазовой ВЭЖХ на колонке XBridge C18 (5 мкм, 100×4,6 мм), подвижная фаза 10-100% ACN в 20 мМ NH4OH с получением титульного соединения в виде белого твердого вещества (225 мг, выход 86%). МС (ИЭР): масса, рассчитанная для C16H17F2N3, 289,1; полученное m/z, 290,1[M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,36-7,28 (м, 1H), 7,28-7,20 (м, 2H), 3,95 (т, J=3,3 Гц, 1H), 3,78 (с, 3H), 2,86 (дд, J=16,1, 7,3 Гц, 1H), 2,34 (д, J=16,1 Гц, 2H), 1,86-1,64 (м, 2H), 1,62-1,44 (м, 2H), 1,40-1,21 (м, 2H).
Промежуточное соединение 13: (5R,9S)-3-(3-Фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
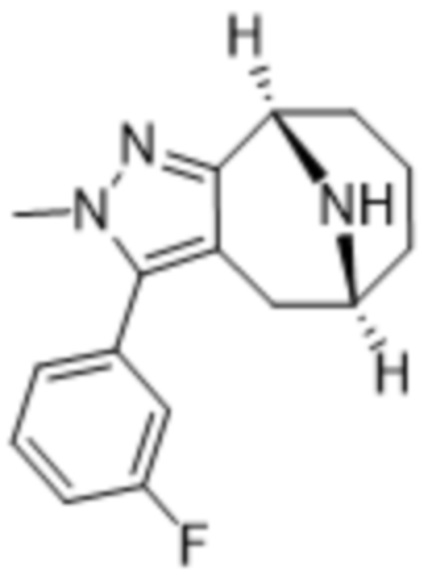
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 12, используя (3-фторфенил) бороновую кислоту вместо (3,5-дифторфенил) бороновой кислоты. МС (ИЭР): масса, рассчитанная для C16H18FN3, - 271,1; полученное m/z, 272,1 [M+H]+.
Промежуточное соединение 14: (5R,9S)-3-(3-Хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
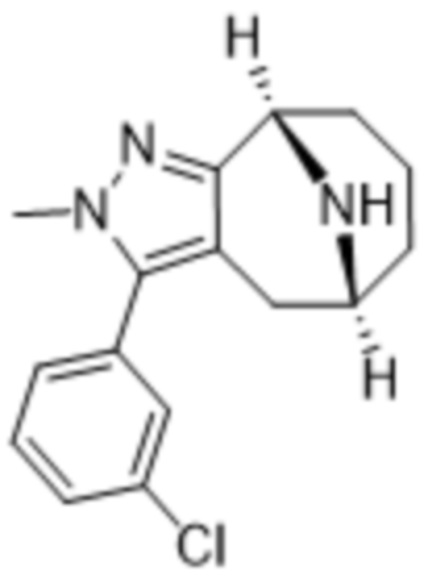
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 12, используя (3-хлорфенил) бороновую кислоту вместо (3,5-дифторфенил) бороновой кислоты. МС (ИЭР): масса, рассчитанная для C16H18ClFN3, - 287,1; полученное m/z, 288,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,59-7,57 (м, 1H), 7,57-7,54 (м, 1H), 7,54-7,51 (м, 1H), 7,48-7,44 (м, 1H), 4,43-4,36 (м, 1H), 3,79 (с, 3H), 3,68-3,61 (м, 1H), 2,97 (дд, J=16,4, 7,4 Гц, 1H), 2,55 (д, J=16,4 Гц, 1H), 1,97-1,81 (м, 2H), 1,74-1,65 (м, 1H), 1,65-1,56 (м, 1H), 1,47-1,39 (м, 1H), 1,37-1,25 (м, 1H).
Промежуточное соединение 15: (5R,9S)-3-(3-Фтор-5-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
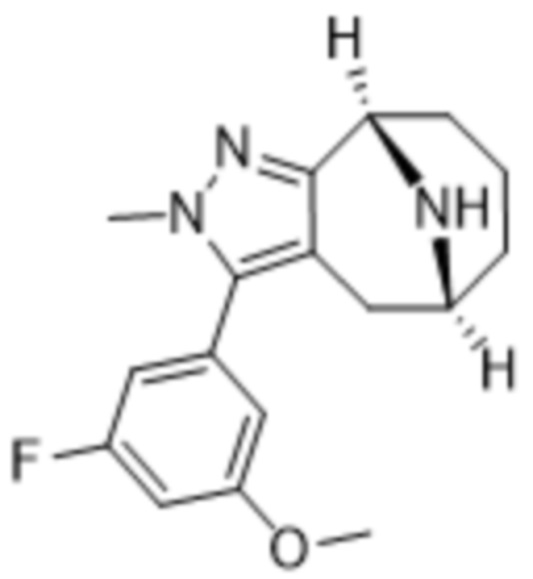
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 12, используя (3-фтор-5-метоксифенил) бороновую кислоту вместо (3,5-дифторфенил) бороновой кислоты. МС (ИЭР): масса, рассчитанная для C17H20FN3O, - 301,1; полученное m/z, 302,1 [M+H]+.
Промежуточное соединение 16: (5R,9S)-3-(3-Фтор-5-(трифторметил) фенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
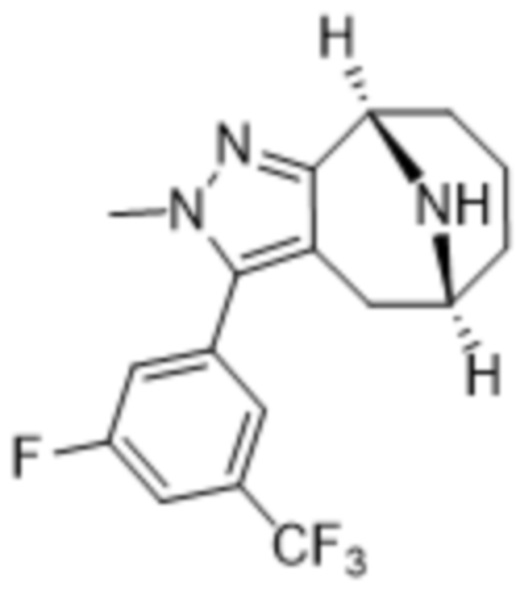
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 12, используя (3-фтор-5-(трифторметил) фенил) бороновую кислоту вместо (3,5-дифторфенил) бороновой кислоты. МС (ИЭР): масса, рассчитанная для C17H17F4N3, - 339,1; полученное m/z, 340,1 [M+H]+.
Промежуточное соединение 17: (5R,9S)-3-(3-Хлор-5-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
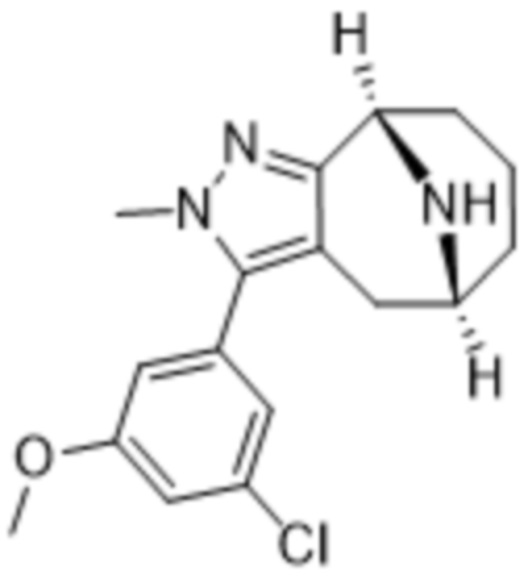
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 12, используя (3-хлор-5-метоксифенил) бороновую кислоту вместо (3,5-дифторфенил) бороновой кислоты. МС (ИЭР): масса, рассчитанная для C17H20ClN3O, - 317,1; полученное m/z, 318,1 [M+H]+.
Промежуточное соединение 18: (5R,9S)-3-(3-Хлор-4-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
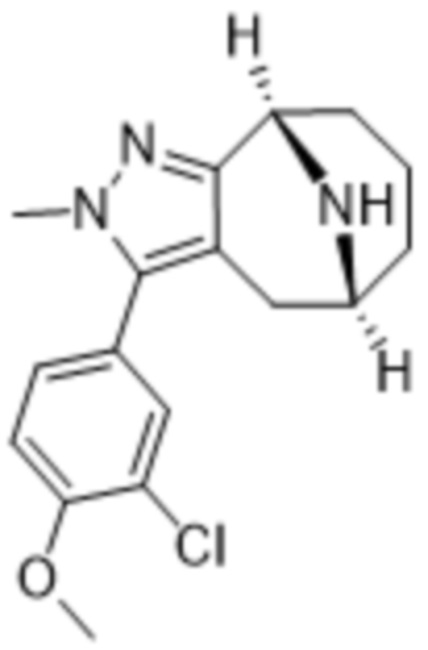
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 12, используя (3-хлор-4-метоксифенил) бороновую кислоту вместо (3,5-дифторфенил) бороновой кислоты. МС (ИЭР): масса, рассчитанная для C17H20ClN3O, 317,1; полученное m/z, - 318,1 [M+H]+.
Промежуточное соединение 19: (5R,9S)-3-(3,5-Дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
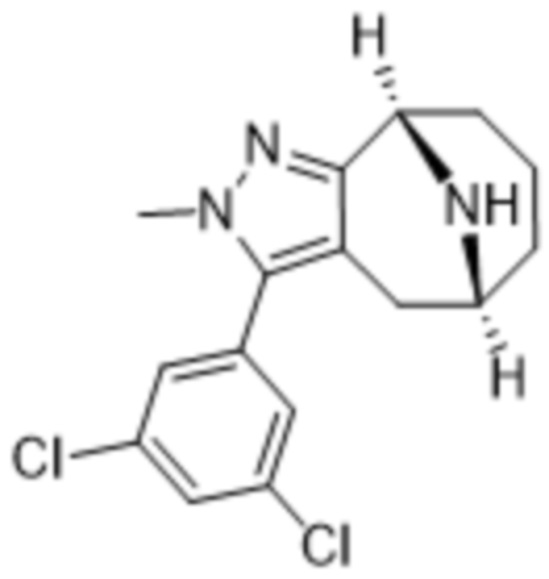
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 12, используя (3,5-дихлорфенил) бороновую кислоту вместо (3,5-дифторфенил) бороновой кислоты. МС (ИЭР): масса, рассчитанная для C16H17Cl2N3, - 321,1; полученное m/z, 322,1 [M+H]+.
Промежуточное соединение 20: (5R,9S)-3-(4-Хлор-3-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
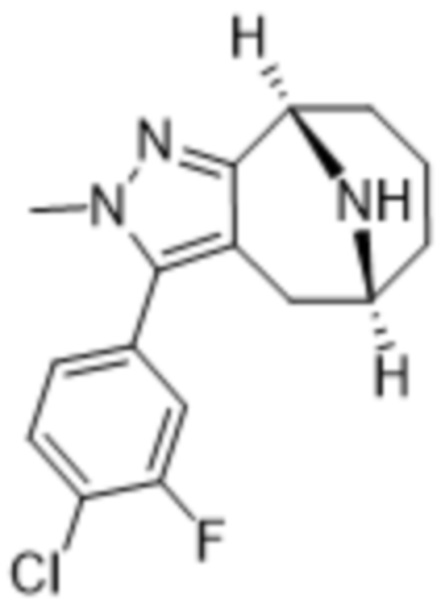
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 12, используя (4-хлор-3-фторфенил) бороновую кислоту вместо (3,5-дифторфенил) бороновой кислоты. МС (ИЭР): масса, рассчитанная для C16H17ClFN3, 305,1; полученное m/z, 306,1 [M+H]+.
Промежуточное соединение 21: (5R,9S)-3-(3,4-Дифтор-5-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 12, используя (3,4-дифтор-5-метоксифенил) бороновую кислоту вместо (3,5-дифторфенил) бороновой кислоты. МС (ИЭР): масса, рассчитанная для C17H19F2N3O, - 319,1; полученное m/z, 320,1 [M+H]+.
Промежуточное соединение 22: (5R,9S)-3-(3,5-Дифтор-4-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 12, используя (3,5-дифтор-4-метоксифенил) бороновую кислоту вместо (3,5-дифторфенил) бороновой кислоты. МС (ИЭР): масса, рассчитанная для C17H19F2N3O, - 319,1; полученное m/z, 320,1 [M+H]+.
Промежуточное соединение 23: (5R,9S)-3-(3,5-Диметоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
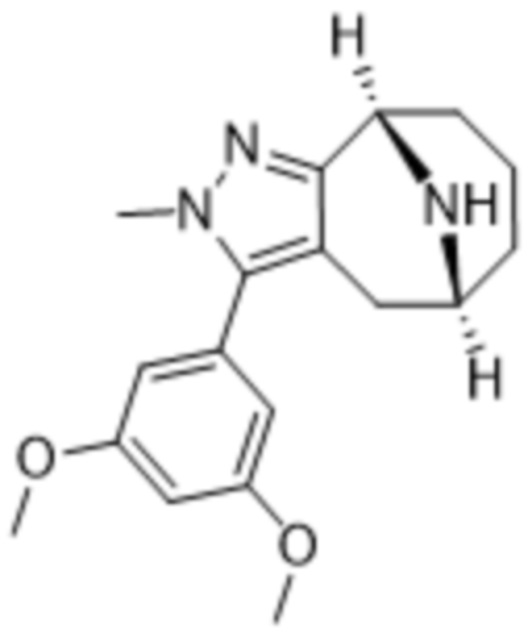
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 12, используя (3,5-диметоксифенил) бороновую кислоту вместо (3,5-дифторфенил) бороновой кислоты. МС (ИЭР): масса, рассчитанная для C18H23N3O2, - 313,1; полученное m/z, 314,1 [M+H]+.
Промежуточное соединение 24: (5R,9S)-3-(3,4-Дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
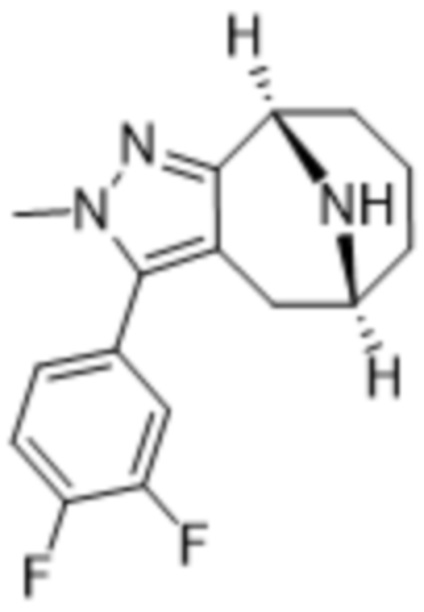
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 12, используя (3,4-дифторфенил) бороновую кислоту вместо (3,5-дифторфенил) бороновой кислоты. МС (ИЭР): масса, рассчитанная для C16H17F2N3, - - 289,1; полученное m/z, 290,1 [M+H]+.
Промежуточное соединение 25: (5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
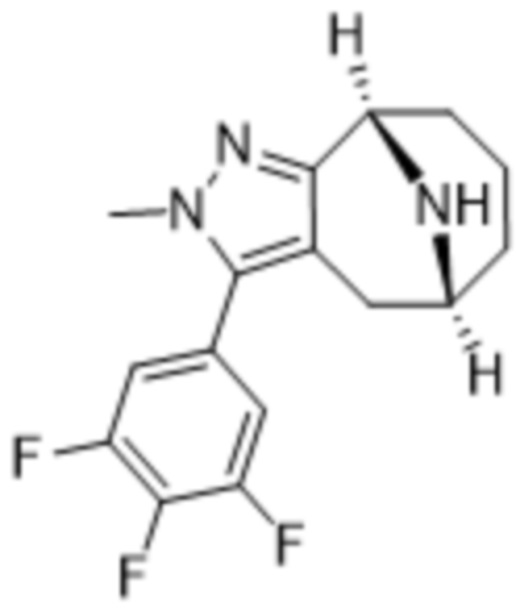
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 12, используя (3,4,5-трифторфенил) бороновую кислоту вместо (3,5-дифторфенил) бороновой кислоты на стадии A, используя традиционный либо микроволновый нагрев. МС (ИЭР): масса, рассчитанная для C16H16F3N3, - 307,1; полученное m/z, 308,1 [M+H]+.
Промежуточное соединение 26: (5S,9R)-2-Метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
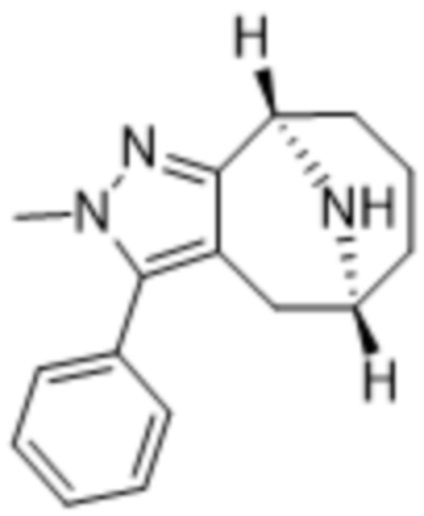
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 1, с использованием трет-бутил (5S,9R)-2-метил-3-(((трифторметил)сульфонил)окси)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбоксилата (промежуточное соединение 3) вместо рацемического(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (стадия C, промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C16H19N3, - 253,1; полученное m/z, 254,1 [M+H]+.
Промежуточное соединение 27: (5R,9S)-2-Метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
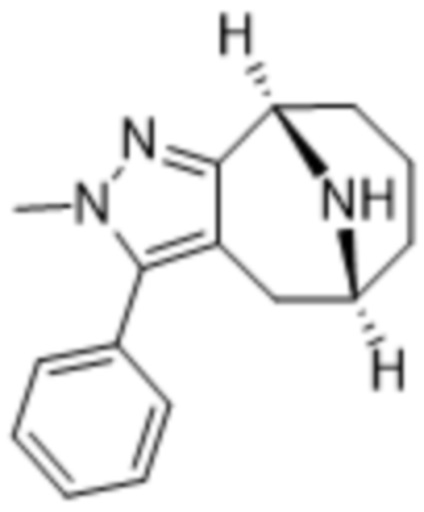
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 1, с использованием трет-бутил (5R,9S)-2-метил-3-(((трифторметил)сульфонил) окси)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбоксилата (промежуточное соединение 2) вместо рацемического(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (стадия C, промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C16H19N3, - 253,1; полученное m/z, 254,1 [M+H]+.
Промежуточное соединение 28: (5S,9R)-3-(3-Фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
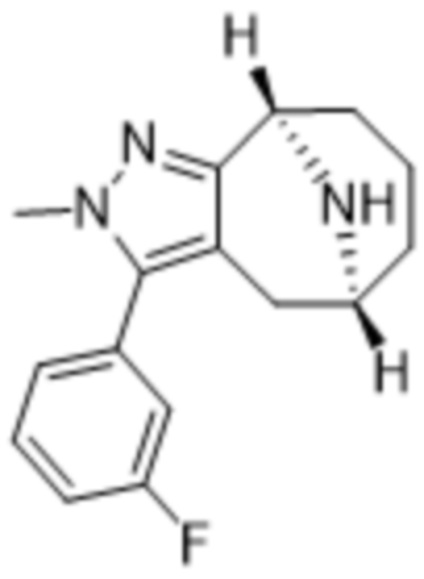
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 1, используя (3-фторфенил) бороновую кислоту вместо фенилбороновой кислоты на стадии C и трет-бутил (5S,9R)-2-метил-3-(((трифторметил)сульфонил)окси)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбоксилат (промежуточное соединение 3) вместо рацемического(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (стадия C, промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C16H18FN3, - 271,1; полученное m/z, 272,1 [M+H]+.
Промежуточное соединение 29: (5S,9R)-3-(3,5-Дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
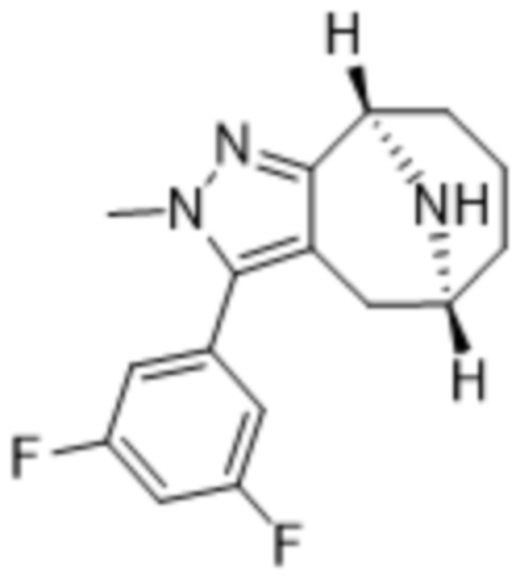
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 1, используя (3,5-дифторфенил)бороновую кислоту вместо фенилбороновой кислоты на стадии С и трет-бутил (5S,9R)-2-метил-3-(((трифторметил)сульфонил)окси)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбоксилат (промежуточное соединение 3) вместо рацемического(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (стадия C, промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C16H17F2N3, - 289,1; полученное m/z, 290,1 [M+H]+.
Промежуточное соединение 30: (5R,9S)-3-(4-Фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
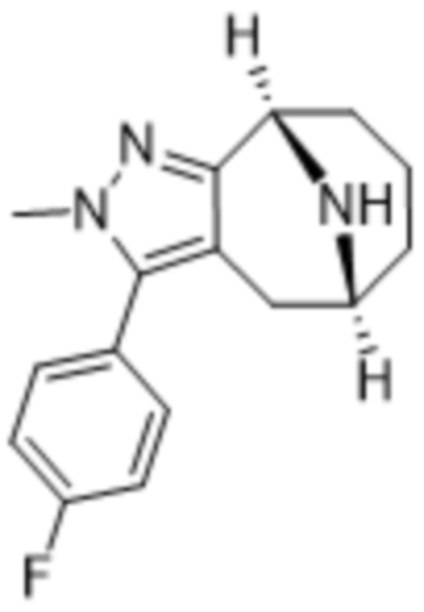
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 12, используя (4-фторфенил) бороновую кислоту вместо (3,5-дифторфенил) бороновой кислоты. МС (ИЭР): масса, рассчитанная для C16H18FN3, 271,1; полученное m/z, - 272,1 [M+H]+.
Промежуточное соединение 31: (5R,9S)-3-Циклопропил-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
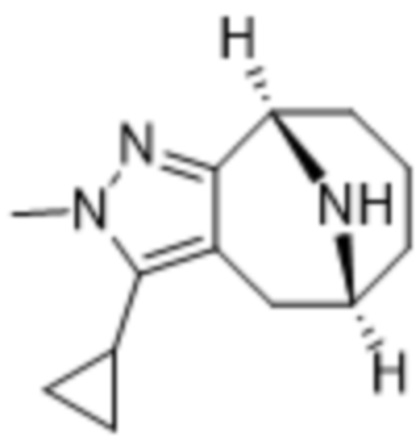
Титульное соединение получали способом, аналогичным описанному относительно промежуточного соединения 12, используя циклопропилбороновую кислоту вместо (3,5-дифторфенил) бороновой кислоты. МС (ИЭР): масса, рассчитанная для C13H19N3, - 217,1; полученное m/z, 218,1 [M+H]+.
Промежуточное соединение 32: (5R,9S)-2-метил-3-(1-метил-1H-индол-2-ил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
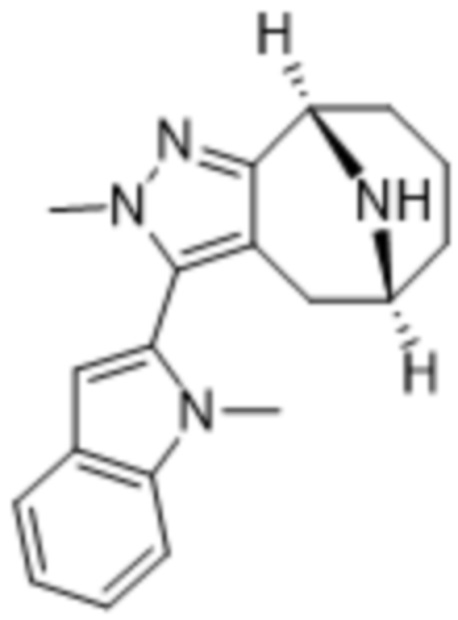
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 12, используя метил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индол вместо (3,5-дифторфенил)-бороновой кислоты. МС (ИЭР): масса, рассчитанная для C19H22N4, - 306,1; полученное m/z, 307,1 [M+H]+.
Промежуточное соединение 33:2-метилхиноксалин-6-карбоновая кислота.
К раствору 3,4-диаминобензойной кислоты (500 мг, 3,3 ммоль) в этаноле (4,0 мл) добавляли 2-оксопропаналь (0,45 мл, 6,6 ммоль) и смесь нагревали с обратным холодильником при 80 ºC в течение 16 часов. Реакционную смесь охладили до комнатной температуры и сконцентрировали под пониженным давлением. Полученную неочищенную смесь использовали без очистки. МС (ИЭР): масса, рассчитанная для C10H8 N 2O2, - 188,0, полученное m/z, 189,0 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,38 (с, 1H), 8,96 (с, 1H), 8,62-8,49 (м, 1H), 8,31-8,19 (м, 1H), 8,17-7,95 (м, 1H), 2,75 (д, J=1,6 Гц, 3H).
Промежуточное соединение 34: рацемический (5R,8S)-2-метил-3-фенил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол.
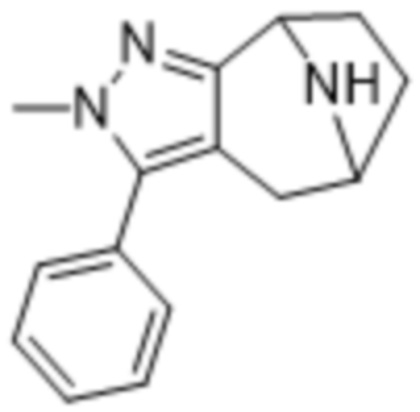
Стадия А: рацемический трет-бутил (5R,8S)-2-метил-3-(((трифторметил)сульфонил)окси)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-карбоксилат. Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 1, стадии A-B, используя 8-(трет-бутил) 3-этил 2-оксо-8-азабицикло[3.2.1]октан-3,8-дикарбоксилат (промежуточное соединение 35, продукт стадии E) вместо рацемического-9-(трет-бутил) 3-этил (1S,5R)-2-оксо-9-азабицикло [3.3.1] нонан-3,9-дикарбоксилата на стадии A. МС(ИЭР): масса рассчитана для C15H20F3N3O5S, - 411,1; полученное m/z, 356,0 [M+2H-трет-бутил] +.
Стадия B: рацемический (5R,8S)-2-метил-3-фенил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол. Титульное соединение получали способом, аналогичным способу получения промежуточного соединения 12, стадии A-B, используя рацемический трет-бутил(5R,8S)-2-метил-3-(((трифторметил)сульфонил)окси)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-карбоксилат вместо трет-бутил (5R,9S)-2-метил-3-(((трифторметил)сульфонил)окси)-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-карбоксилата (промежуточное соединение 2) и фенилбороновой кислоты вместо (3,5-дифторфенил) бороновой кислоты на стадии A. МС (ИЭР): масса, рассчитанная для C15H17N3, - 239,1; полученное m/z, 240,1 [M+H]+.
Промежуточное соединение 35: трет-бутил (5R,8S)-2-метил-3-(((трифторметил)сульфонил)окси)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-карбоксилат.
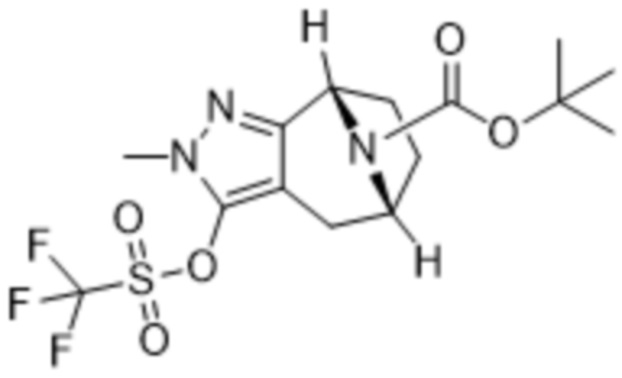
Стадия А: этил 5-формил-1H-пиррол-2-карбоксилат. В охлажденный (0 ºC) раствор дихлорэтана (ДХЭ) (250 мл) и POCl3 (18,7 мл, 201 ммоль) медленно добавляли N, N-диметилформамид (ДМФ) (17,7 мл, 230 ммоль), эту суспензию перемешивали при 0 ºC в течение 15 минут. Затем в реакционную смесь добавляли раствор этил 1H-пиррол-2-карбоксилата (20 г, 144 ммоль), растворенного в дихлорэтане (ДХЭ) (50 мл), и перемешивали при 0 ºC в течение 30 мин, нагревая до комнатной температуры в течение ночи. Завершенную реакцию охлаждали до 0 ºC и добавляли 50 мл раствора тригидрата ацетата натрия (~ 43 г). Полученную смесь нагревали до 75 ºC в течение 30 мин, а затем охлаждали до комнатной температуры. Водный слой экстрагировали метил-трет-бутиловым эфиром (МТБЭ), промывали водным раствором NaHCO3, солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали. Очистка (FCC, элюирование 0-10% EtOAc в гексанах) позволяла получить Титульное соединение (18,1 г, 75%). МС (ИЭР): масса, рассчитанная для C8H9NO3, - 167,1; полученное m/z, 168,1 [M+H]+. 1 H ЯМР (500 МГц, CDCl3) δ 10,04-9,67 (с, 1H), 9,74-9,59 (с, 1H), 7,02-6,86 (д, J=2,5 Гц, 2H), 4,49-4,30 (м, 2H), 1,45-1,31 (м, 2H).
Стадия B: этил- (E)-5-(3-этокси-3-оксопроп-1-ен-1-ил)-1H-пиррол-2-карбоксилат. В охлажденный (0 ºC) раствор NaH (8,7 г, 217 ммоль) в ТГФ (200 мл) добавляли триэтилфосфонат ацетат (61,7 г, 234 ммоль). Реакционную смесь перемешивали при 0 ºC в течение 3 часов, затем добавляли этил 5-формил-1H-пиррол-2-карбоксилат (27,9 г, 167 ммоль). Реакционную смесь перемешивали при комн. темп. в течение ночи. Реакционную смесь гасили водным раствором NH4Cl (200 мл) и экстрагировали в Et2O (x 3), промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный материал перекристаллизовывали из 10% EtOAc в гексанах) с получением указанного в заголовке соединения (39,5 г, 99,8%). МС (ИЭР): масса, рассчитанная для C12H15NO4, - 237,1; полученное m/z, 238,1 [M+H]+. 1H ЯМР (500 МГц, CDCl3) δ 9,93 (с, 1H), 7,56 (д, J=16,0 Гц, 1H), 6,98-6,81 (м, 1H), 6,63-6,43 (м, 1H), 6,32 (д, J=16,0 Гц, 1H), 4,39 (к, J=7,1 Гц, 2H), 4,25 (к, J=7,1 Гц, 2H), 1,39 (т, J=7,1 Гц, 3H), 1,32 (т, J=7,2 Гц, 3H).
Стадия C: этил 5-(3-этокси-3-оксопропил)пирролидин-2-карбоксилат. В колбу добавляли этил- (E)-5-(3-этокси-3-оксопроп-1-ен-1-ил)-1H-пиррол-2-карбоксилат (39,5 г, 167 ммоль), родий на колонке Aclunia (27,4 г, 13,3 ммоль), суспендировали в уксусной кислоте (80 мл), вакуумировали и снова заполняли N2. Затем на колбу устанавливали эластичный баллон с Н2, откачивали воздух и дважды заполняли Н2. Реакционную смесь перемешивали при комнатной температуре в течение 48 часов. Неочищенную реакционную смесь пропустили через Celite®, промыли ДХМ, затем сконцентрировали при пониженном давлении. К реакционной смеси добавляли воду (400 мл) и экстрагировали реакционную смесь в ДХМ (x3). Органические слои объединяли, промывали водным раствором NaHCO3, солевым раствором, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке продукта в виде окрашенного масла (38,6 г, 95%). МС (ИЭР): масса, рассчитанная для C12H21NO4, - 243,1; полученное m/z, 244,1 [M+H]+.
Стадия D: 1-(трет-бутил) 2-этил 5-(3-этокси-3-оксопропил)пирролидин-1,2-дикарбоксилат. В раствор этил-5-(3-этокси-3-оксопропил)пирролидин-2-карбоксилата (38,6 г, 158 ммоль) и Boc-ангидрида (ди-трет-бутилдекарбоната) (38 г, 175 ммоль) в ДХМ (317 мл) медленно добавляли ТЭА (44,1 мл, 317 ммоль). Полученную реакционную смесь перемешивали при компнатной температуре в течение ночи. Реакционную смесь разбавляли с помощью ДХМ (200 мл), промывали водой, солевым раствором, сушили над Na2SO4, фильтровали и концентрировали с получением указанного в заголовке продукта (54,8 г, 100,6%). МС (ИЭР): масса, рассчитанная для C17H29NO6, - 343,2; полученное m/z - 244,1 [M+2H-CO2tBu]+.
Стадия E: 8-(трет-бутил)-3-этил-2-оксо-8-азабицикло[3.2.1]октан-3,8-дикарбоксилат. Раствор 1-(трет-бутил) 2-этил 5-(3-этокси-3-оксопропил)пирролидин-1,2-дикарбоксилата (54,8 г, 160 ммоль) в ТГФ (1,3 л) и трет-бутоксиде калия (KOtBu) (21,5 г, 191 ммоль) нагревали при 60 ºC в течение 3 ч. Реакционную смесь охлаждали и концентрировали при пониженном давлении. Неочищенный продукт повторно суспендировали в ДХМ (800 мл) и промывали насыщенным раствором NH4Cl. Водный слой экстрагировали с помощью EtOAc (x2). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, отфильтровали и концентрировали при пониженном давлении. Очистка (FCC, SiO2, элюирование 0-10% EtOAc в гексанах) позволяла получить Титульное соединение (37,8 г, 79,7%). МС (ИЭР): масса, рассчитанная для C15H23NO5, - 297,2; полученное m/z - 242,1 [M+2H-tBu]+.
Стадия F: рацемический трет-бутил 2-метил-3-оксо-1,2,3,4,5,6,7,8-октагидро-5,8-эпиминциклогепта[c]пиразол-9-карбоксилат. К раствору 8-(трет-бутил) 3-этил 2-оксо-8-азабицикло[3.2.1]октан-3,8-дикарбоксилата (1,76 г, 5,9 ммоль) в толуоле (33 мл) добавляли метилгидразин (467 мл). Полученную смесь нагревали при 110 ºC в течение 2 часов. Охлажденную реакционную смесь концентрировали при пониженном давлении. Очистка (FCC, SiO2, элюирование с помощью 0-10% MeOH в ДХМ) позволяла получить Титульное соединение в виде прозрачного масла. МС (ИЭР): масса, рассчитанная для C14H21N3O3, - 279,2; полученное m/z - 280,2 [M+1]+.
Стадия G: трет-бутил (5R,8S)-2-метил-3-(((трифторметил)сульфонил)окси)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-карбоксилат и трет-бутил (5S,8R)-2-метил-3-(((трифторметил)сульфонил)окси)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-карбоксилат. К раствору рацемического трет-бутил-2-метил-3-оксо-1,2,3,4,5,6,7,8-октагидро-5,8-эпиминциклогепта[c]пиразол-9-карбоксилата (9,48 г, 34 ммоль) в ДХМ (152 мл) добавили N-фенил-бис(трифторметансульфонимид) (13,5 г, 37 ммоль), а затем DIEA (6,4 мл, 37 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 18 ч. Завершенную реакционную смесь концентрировали при пониженном давлении. Очистка (FCC, SiO2, элюирование 0-20% EtOAc в гексанах) позволяла получить указанную в заголовке рацемическую смесь соединений (11,2 г, 80%). МС (ИЭР): масса, рассчитанная для C15H20F3N3O5S, - 411,1; полученное m/z, 356,0 [M+2H-трет-бутил] +.
Были выделены одиночные энантиомеры путем очистки методом хиральной СФХ рацемического трет-бутил-2-метил-3-(((трифторметил)сульфонил)окси)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-карбоксилата с использованием неподвижной фазы: Chiralpak IC 5 мкм, 250*30 мм, подвижная фаза: 93% CO2, 7% iPrOH с получением трет-бутил- (5R,8S)-2-метил-3-(((трифторметил)сульфонил)окси)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-карбоксилата (один энантиомер; время удерживания 1,05 мин) МС (ИЭР): масса, рассчитанная для C15H20F3N3O5S, - 411,1; полученное m/z, 356,0 [M+2H-трет-бутил] + и
промежуточное соединение 104: трет-бутил (5S,8R)-2-метил-3-(((трифторметил)сульфонил)окси)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-карбоксилат (один энантиомер; время удерживания 1,13 мин) МС (ИЭР): масса, рассчитанная для C15H20F3N3O5S, - 411,1; полученное m/z, 356,0 [M+2H-трет-бутил] +.
Промежуточное соединение 36: 8-бромхинолин-6-карбоновая кислота.
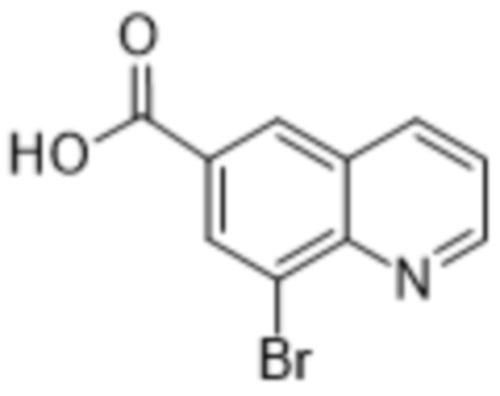
К смеси 4-амино-3-бромбензойной кислоты (500 мг, 2,31 ммоль) в концентрированной серной кислоте (650 мкл) добавляли глицерин (1,75 г, 19,0 ммоль), 4-нитробензойную кислоту (391 мг, 234 ммоль), борную кислоту (215 мг, 3,48 ммоль) и гептагидрата сульфата железа(II) (234 мг, 0,842 ммоль), и реакционную смесь перемешивали при 140°C в течение 42 ч. Реакционную смесь охлаждали до комнатной температуры и доводили pH до 10 с помощью 10% гидроксида натрия. Водный слой экстрагировали этилацетатом (2×100 мл) и объединенные органические слои высушивали над сульфатом натрия, фильтровали и выпаривали с получением указанного в заголовке соединения (150 мг, выход 25%) в виде желтого порошка. МС (ИЭР): масса, рассчитанная для C10H6BrNO2, - 251,0; полученное m/z, 252,0 [M+H]+.
Промежуточное соединение 37: 1-(3-хлорфенил)-1,2,4-триазол-3-карбоновая кислота.
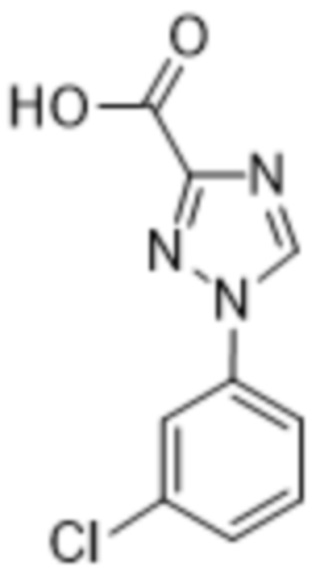
Стадия А: метил 1-(3-хлорфенил)-1,2,4-триазол-3-карбоксилат. К смеси метил-1 H-1,2,4-триазол-5-карбоксилата (300 мг, 2,36 ммоль), (3-хлорфенил)бороновой кислоты (370 мг, 2,37 ммоль) и ацетата меди(II) (429 мг, 2,36 ммоль) в дихлорметане (5 мл) добавляли пиридин (570 мкл, 7,08 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 3 суток. Реакционную смесь фильтровали через пластину из Celite® и фильтрат промывали 10% бисульфатом калия (1×5 мл), насыщенным бикарбонатом натрия (1×5 мл) и солевым раствором (3×5 мл). Органический слой сушили над сульфатом магния, отфильтровали и выпарили. Полученный остаток растирали с простым диэтиловым эфиром (5 мл) с получением указанного в заголовке соединения (120 мг, выход 21%) в виде белого порошка. МС (ИЭР): масса, рассчитанная для C10H8ClN3O2, - 237,0; полученное m/z, 238,1 [M+H]+.
Стадия B: 1-(3-хлорфенил)-1,2,4-триазол-3-карбоновая кислота. К раствору метил 1-(3-хлорфенил)-1,2,4-триазол-3-карбоксилата (120 мг, 0,505 ммоль) в 1,4-диоксане (1 мл) добавляли водный раствор гидроксида натрия (500 мкл, 1,00 ммоль, 2 M) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь подкисляли до pH 5 6M соляной кислотой и собирали осадок с получением указанного в заголовке соединения (99 мг, выход 87%) в виде белого порошка. МС (ИЭР): масса, рассчитанная для C9H6ClN3O2, - 223,0; полученное m/z, 224,1 [M+H]+.
Промежуточное соединение 38: 1-(3-(трифторметил)фенил)-1H-1,2,4-триазол-3-карбоновая кислота.
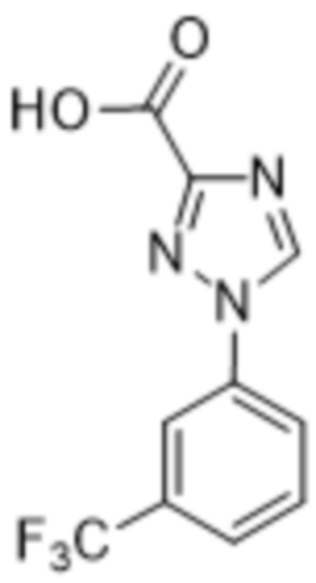
Титульное соединение получали аналогично промежуточному соединению 37, используя (3-(трифторметил)фенил)бороновую кислоту вместо (3-хлорфенил)бороновой кислоты. МС (ИЭР): масса, рассчитанная для C10H6F3N3O2, - 257,0; полученное m/z, 258,1 [M+H]+.
Промежуточное соединение 39: 1-(2-фторфенил)-1H-1,2,4-триазол-3-карбоновая кислота.
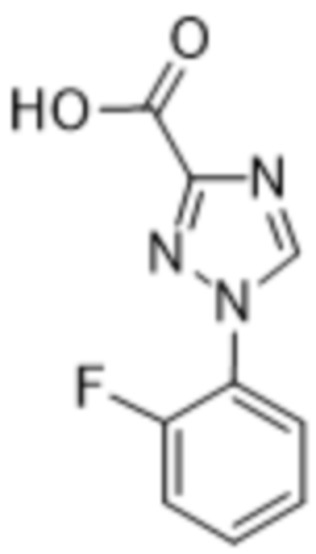
Титульное соединение получали аналогично промежуточному соединению 37, используя (2-фторфенил)бороновую кислоту вместо (3-хлорфенил)бороновой кислоты. МС (ИЭР): масса, рассчитанная для C9H6FN3O2, - 207,0; полученное m/z, 208,1 [M+H]+.
Промежуточное соединение 40: 5-метил -1-(3-(трифторметил)фенил)-1H-1,2,4-триазол-3-карбоновая кислота.
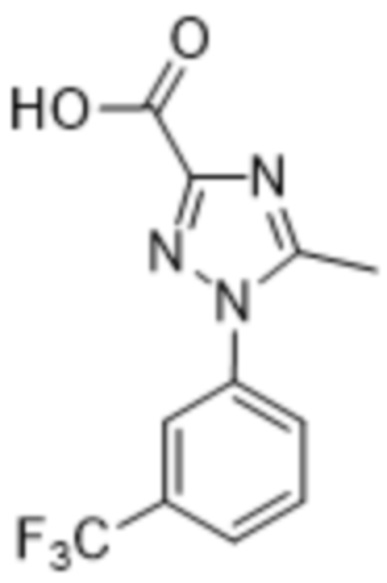
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 37, используя (3-(трифторметил)фенил)бороновую кислоту вместо (3-хлорфенил)бороновой кислоты и метил 5-метил-1 H-1,2,4-триазол-3-карбоксилат вместо метил-1 H-1,2,4-триазол-5-карбоксилата. МС (ИЭР): масса, рассчитанная для C11H8 N 3F3N3O2, - 271,1; полученное m/z, 272,1 [M+H]+.
Промежуточное соединение 41: 1-(3-метоксифенил)-1,2,4-триазол-3-карбоновая кислота.
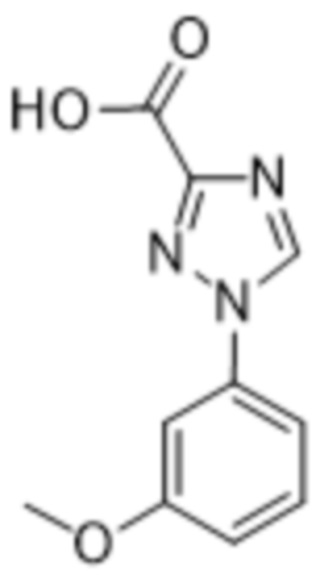
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 37, используя (3-метоксифенил)бороновую кислоту вместо (3-хлорфенил)бороновой кислоты. МС (ИЭР): масса, рассчитанная для C10H9N3O3-219,1; полученное m/z, 220,1 [M+H]+.
Промежуточное соединение 42: 1-(2-метоксифенил)-1,2,4-триазол-3-карбоновая кислота.
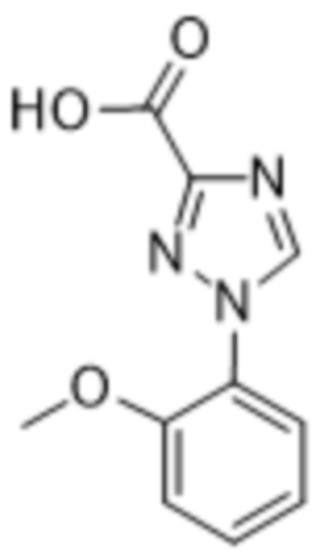
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 37, используя (2-метоксифенил)бороновую кислоту вместо (3-хлорфенил)бороновой кислоты. МС (ИЭР): масса, рассчитанная для C10H9N3O3, - 219,1; полученное m/z, 220,1 [M+H]+.
Промежуточное соединение 43: 2-(1H-имидазол-1-ил)бензойная кислота.
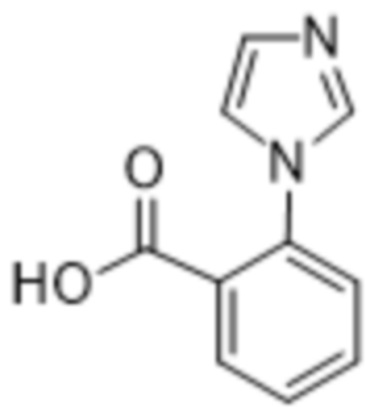
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 37, используя (2-(метоксикарбонил)фенил)бороновую кислоту вместо (3-хлорфенил)бороновой кислоты и имидазол вместо метил-1 H-1,2,4-триазол-5-карбоксилата. МС (ИЭР): масса, рассчитанная для C10H8N2O2, - 188,1; полученное m/z, 189,1 [M+H]+.
Промежуточное соединение 44: 3-[3-(трифторметил)пиразол-1-ил] бензойная кислота.
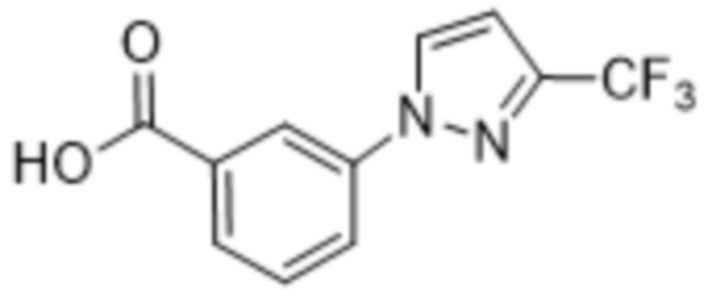
Смесь 3-йодбензойной кислоты (300 мг, 1,21 ммоль), 3-(трифторметил)пиразола (247 мг, 1,82 ммоль), карбоната цезия (670 мг, 2,06 ммоль), транс-N, N ′-диметилциклогексан-1,2-диамина (32 мкл, 0,203 ммоль) и йодида меди(I) (25 мг, 0,131 ммоль) в N, N-диметилформамиде (1,25 мл) перемешивали при 100°C в течение 30 мин, затем при 140°C в течение 70 мин при микроволновом облучении. Реакционную смесь помещали в воду (5 мл), подкисляли до pH 3 с помощью 1 M соляной кислоты и экстрагировали этилацетатом (3×5 мл). Комбинированные органические слои сушили над сульфатом натрия, фильтровали и выпаривали. Неочищенный продукт очищали препаративной ВЭЖХ (способ E) с получением указанного в заголовке соединения (140 мг, выход 45%) в виде желтовато-коричневого порошка. МС (ИЭР): масса, рассчитанная для C11H7F3N2O2, - 256,0; полученное m/z, 257,1 [M+H]+.
Промежуточное соединение 45: 2-(2H-1,2,3-триазол-2-ил)-5-(трифторметил)бензойная кислота.
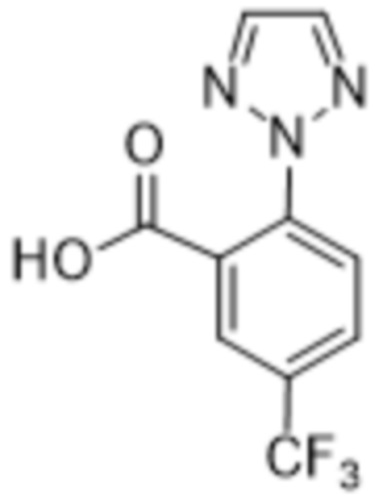
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 44, используя 2-йод-5-(трифторметил)бензойную кислоту вместо 3-йодбензойной кислоты и 1,2,3-триазол вместо 3-(трифторметил)пиразола. МС (ИЭР): масса, рассчитанная для C10H6F3N3O2, - 257,0; полученное m/z, 258,1 [M+H]+.
Промежуточное соединение 46: 5-метокси-2-(2H-1,2,3-триазол-2-ил)бензойная кислота.
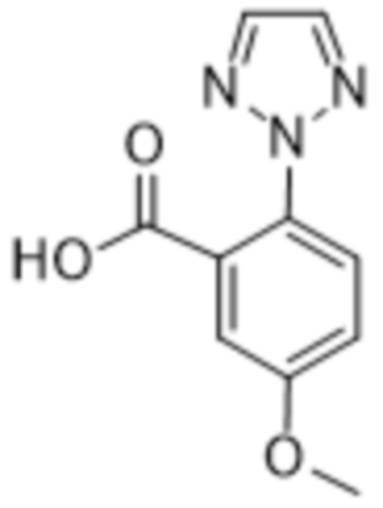
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 44, используя 2-йод-5-метоксибензойную кислоту вместо 3-йодбензойной кислоты и 1,2,3-триазол вместо 3-(трифторметил)пиразола. МС (ИЭР): масса, рассчитанная для C10H9N3O3, - 219,1; полученное m/z, 220,1 [M+H]+.
Промежуточное соединение 47: 3-метокси-2-(2H-1,2,3-триазол-2-ил)бензойная кислота.
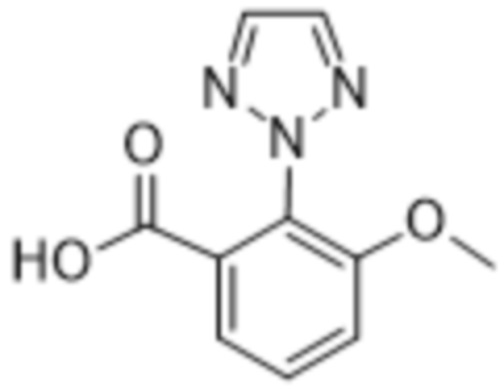
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 44, используя 2-йод-3-метоксибензойную кислоту вместо 3-йодбензойной кислоты и 1,2,3-триазол вместо 3-(трифторметил)пиразола. МС (ИЭР): масса, рассчитанная для C10H9N3O3, - 219,1; полученное m/z, 220,1 [M+H]+.
Промежуточное соединение 48: 3-метокси-2-(1H-1,2,3-триазол-1-ил)бензойная кислота.
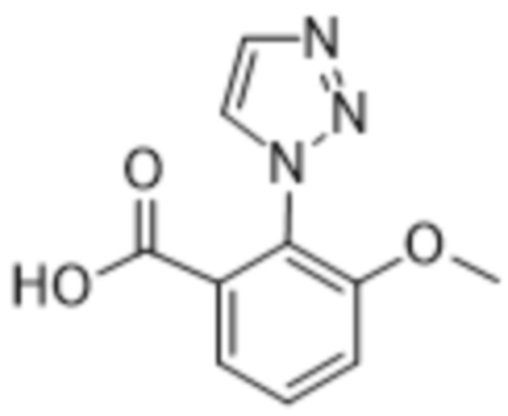
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 44, используя 2-йод-3-метоксибензойную кислоту вместо 3-йодбензойной кислоты и 1,2,3-триазол вместо 3-(трифторметил)пиразола. МС (ИЭР): масса, рассчитанная для C10H9N3O3, - 219,1; полученное m/z, 220,1 [M+H]+.
Промежуточное соединение 49: 2-(2H-1,2,3-триазол-2-ил)бензойная кислота.
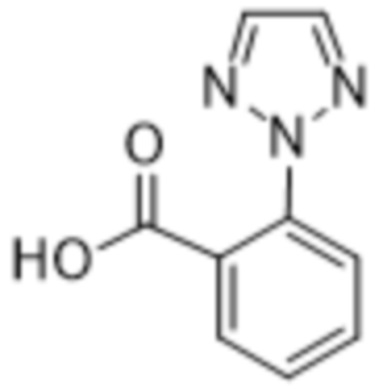
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 44, используя 2-йодбензойную кислоту вместо 3-йодбензойной кислоты и 1,2,3-триазол вместо 3-(трифторметил)пиразола. МС (ИЭР): масса, рассчитанная для C9H7N3O2, - 189,1; полученное m/z, 190,1 [M+H]+.
Промежуточное соединение 50: 2-(1H-1,2,3-триазол-1-ил)бензойная кислота.
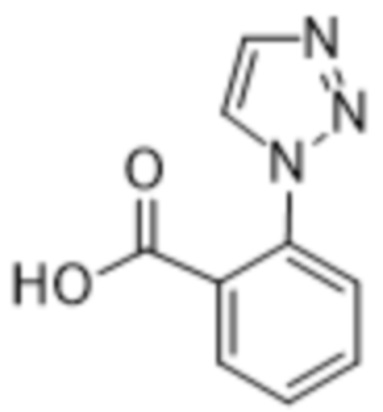
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 44, используя 2-йодбензойную кислоту вместо 3-йодбензойной кислоты и 1,2,3-триазол вместо 3-(трифторметил)пиразола. МС (ИЭР): масса, рассчитанная для C9H7N3O2, - 189,1; полученное m/z, 190,1 [M+H]+.
Промежуточное соединение 51: 3-(2H-1,2,3-триазол-2-ил)бензойная кислота.
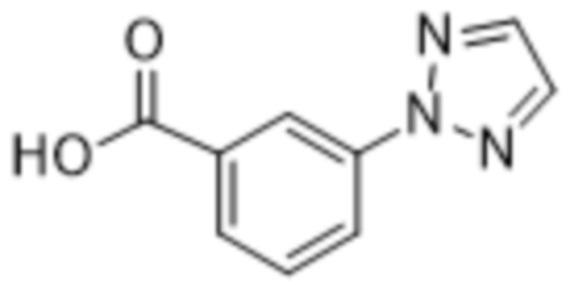
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 44, используя 1,2,3-триазол вместо 3-(трифторметил)пиразола. МС (ИЭР): масса, рассчитанная для C9H7N3O2, - 189,1; полученное m/z, 190,1 [M+H]+.
Промежуточное соединение 52: 2-(1H-1,2,4-триазол-1-ил)-5-(трифторметил)бензойная кислота.
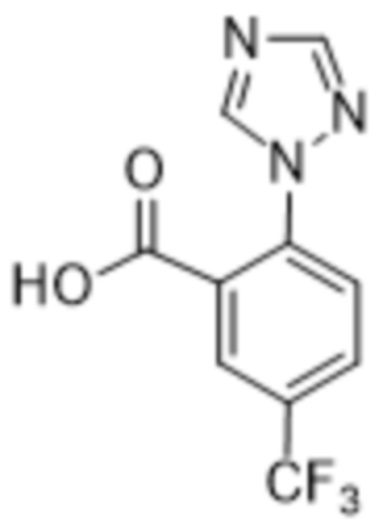
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 44, используя 2-йод-5-(трифторметил)бензойную кислоту вместо 3-йодбензойной кислоты и 1,2,4-триазол вместо 3-(трифторметил)пиразола. МС (ИЭР): масса, рассчитанная для C10H6F3N3O2, - 257,0; полученное m/z, 258,0 [M+H]+.
Промежуточное соединение 53: 2-(3-(трифторметил)- 1H-1,2,4-триазол-1-ил)бензойная кислота.
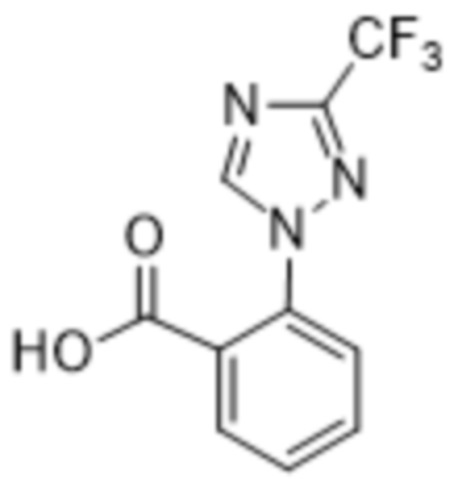
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 44, используя 2-йодбензойную кислоту вместо 3-йодбензойной кислоты и 3-трифторметил)-1H-1,2,4-триазол вместо 3-(трифторметил)пиразола. МС (ИЭР): масса, рассчитанная для C10H6F3N3O2, - 257,0; полученное m/z, 258,1 [M+H]+.
Промежуточное соединение 54: 3-фтор-2-(1H-1,2,4-триазол-1-ил)бензойная кислота.
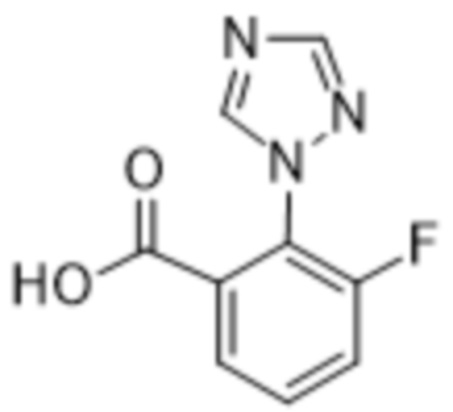
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 44, используя 3-фтор -2-йодбензойную кислоту вместо 3-йодбензойной кислоты и 1,2,4-триазол вместо 3-(трифторметил)пиразола. МС (ИЭР): масса, рассчитанная для C9H6FN3O2, - 207,0; полученное m/z, 208,1 [M+H]+.
Промежуточное соединение 55: 4-фтор-2-(1H-1,2,4-триазол-1-ил)бензойная кислота.
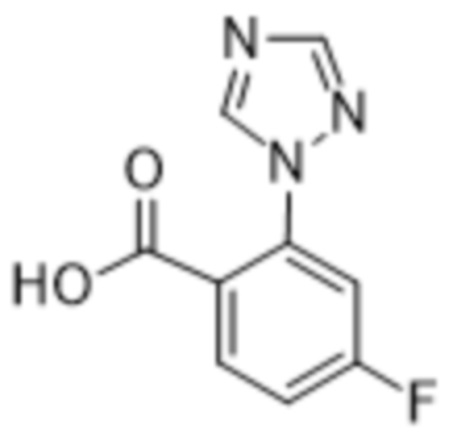
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 44, используя 4-фтор -2-йодбензойную кислоту вместо 3-йодбензойной кислоты и 1,2,4-триазол вместо 3-(трифторметил)пиразола. МС (ИЭР): масса, рассчитанная для C9H6FN3O2, - 207,0; полученное m/z, 208,1 [M+H]+.
Промежуточное соединение 56: 5-фтор-2-(1H-1,2,4-триазол-1-ил)бензойная кислота.
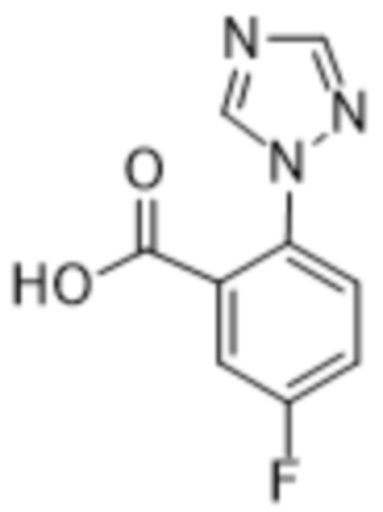
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 44, используя 5-фтор -2-йодбензойную кислоту вместо 3-йодбензойной кислоты и 1,2,4-триазол вместо 3-(трифторметил)пиразола. МС (ИЭР): масса, рассчитанная для C9H6FN3O2, - 207,0; полученное m/z, 208,1 [M+H]+.
Промежуточное соединение 57: 4-метил-2-(1H-1,2,4-триазол-1-ил)бензойная кислота.
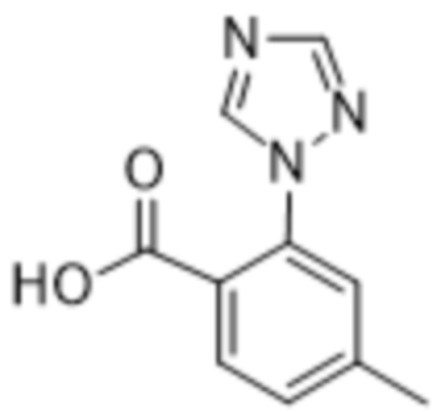
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 44, используя 2-йод-4-метилбензойную кислоту вместо 3-йодбензойной кислоты и 1,2,4-триазол вместо 3-(трифторметил)пиразола. МС (ИЭР): масса, рассчитанная для C10H9N3O2, - 203,1; полученное m/z, 202,1 [M+H]-.
Промежуточное соединение 58: 5-метил-2-(1H-1,2,4-триазол-1-ил)бензойная кислота.
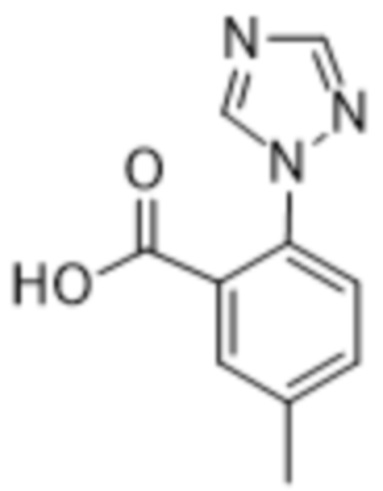
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 44, используя 2-йод-5-метилбензойную кислоту вместо 3-йодбензойной кислоты и 1,2,4-триазол вместо 3-(трифторметил)пиразола. МС (ИЭР): масса, рассчитанная для C10H9N3O2, - 203,1; полученное m/z, 204,1 [M+H]+.
Промежуточное соединение 59: 3-[4-(трифторметил)пиразол-1-ил] бензойная кислота.
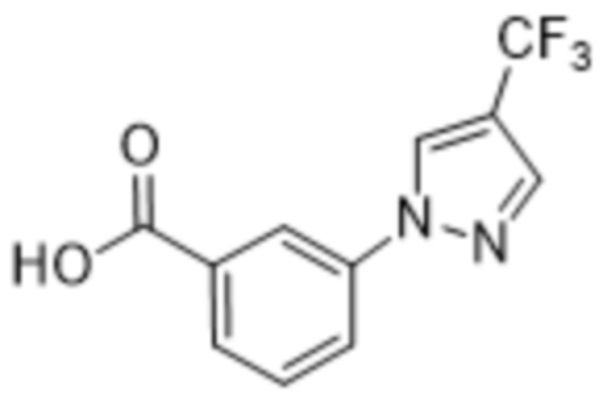
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 44, используя 4-(трифторметил)пиразол вместо 3-(трифторметил)пиразола. МС (ИЭР): масса, рассчитанная для C11H7F3N2O2, - 256,0; полученное m/z, 257,1 [M+H]+.
Промежуточное соединение 60: 3-(4-фтор-1H-пиразол-1-ил)бензойная кислота.
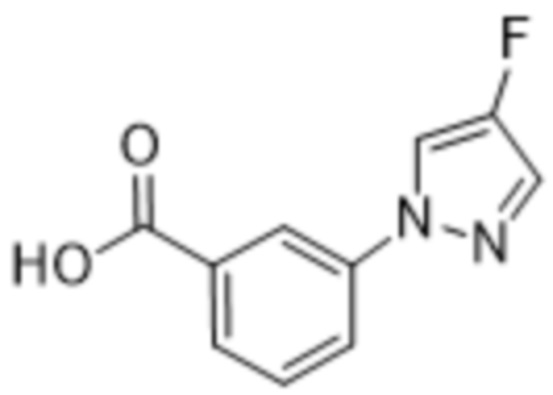
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 44, используя 4-фторпиразол вместо 3-(трифторметил)пиразола. МС (ИЭР): масса, рассчитанная для C10H7F1N2O2, - 206,0; полученное m/z, 207,1 [M+H]+.
Промежуточное соединение 61: 3-(4-метокси-1H-пиразол-1-ил)бензойная кислота.
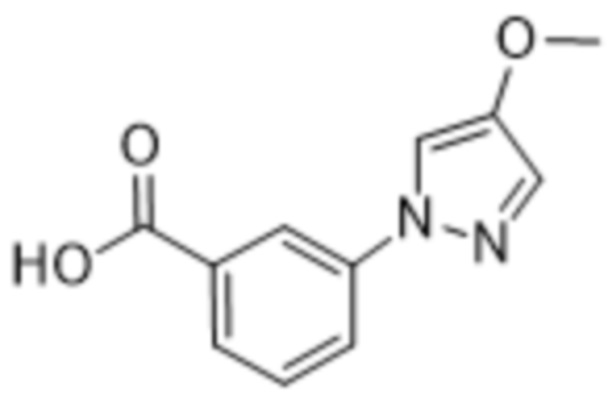
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 44, используя 4-метоксипиразол вместо 3-(трифторметил)пиразола. МС (ИЭР): масса, рассчитанная для C11H10N2O3, - 218,1; полученное m/z, 219,1 [M+H]+.
Промежуточное соединение 62: 5-метокси-1-фенил-1,2,4-триазол-3-карбоновая кислота.
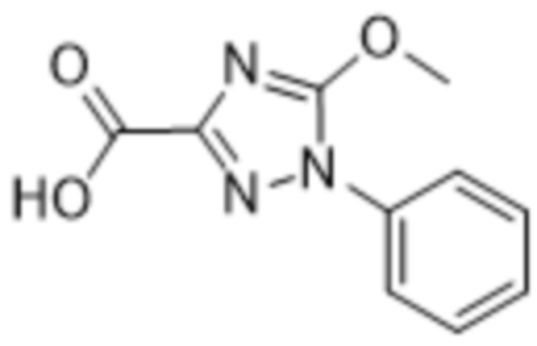
Стадия А: этил (2 Z)-2-амино-2-(фенилгидразоно)ацетат. К раствору этил-2-амино-2-тиоксоацетата (615 мг, 4,62 ммоль) в смеси толуола (10 мл) и уксусной кислоты (1 мл) добавляли фенилгидразин (455 мкл, 4,62 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь выливали в 1 M карбонат натрия (20 мл) и экстрагировали этилацетатом (3×10 мл). Объединенные органические слои промывали 1 M карбонатом натрия (2×10 мл) и солевым раствором (1×10 мл), сушили сульфатом натрия, фильтровали и выпаривали с получением указанного в заголовке соединения (652 мг) в виде желтого масла, которое использовали непосредственно на следующей стадии. МС (ИЭР): масса, рассчитанная для C10H13N3O2, - 207,1; полученное m/z, 208,1 [M+H]+.
Стадия B: этил 5-оксо-1-фенил-4 H-1,2,4-триазол-3-карбоксилат. К раствору этил-(2Z)-2-амино-2-(фенилгидразоно)ацетата (600 мг, в неочищенном виде) в дистиллированном тетрагидрофуране (20 мл) добавляли трифосген (860 мг, 2,90 ммоль) при 0 °C. Реакционную смесь перемешивали при 0°C в течение 2 ч, затем при комнатной температуре 18 ч. Реакционную смесь разводили водой (20 мл) и экстрагировали этилацетатом (2×20 мл). Объединенные органические слои промывали солевым раствором (2×10 мл), сушили над сульфатом натрия, фильтровали и выпарили. Очистка (FCC, SiO2, н-гептан:этилацетат (100:0 → 50:50) позволила получить Титульное соединение (295 мг, выход 43%) в виде белого порошка. МС (ИЭР): масса, рассчитанная для C11H11N3O3, - 233,1; полученное m/z, 234,1 [M+H]+.
Стадия C: этил 5-метокси-1-фенил-1,2,4-триазол-3-карбоксилат. К раствору этил-5-оксо-1-фенил-4H-1,2,4-триазол-3-карбоксилата (260 мг, 1,11 ммоль) в дихлорметане (10 мл) добавляли тетрафторборат триметилоксония (34 мг, 0,232 ммоль) при 0 °C. Реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь гасили 1 M карбонат натрия (10 мл) и экстрагировали дихлорметаном (2×10 мл). Объединенные органические слои промывали солевым раствором (2×10 мл), сушили над сульфатом натрия, фильтровали и выпарили. Очистка (FCC, SiO2, н-гептан:этилацетат (100:0 → 50:50) позволила получить Титульное соединение (155 мг, выход 56%) в виде бледно-желтого порошка. МС (ИЭР): масса, рассчитанная для C12H13N3O3, - 247,1; полученное m/z, 248,1 [M+H]+.
Стадия D: 5-метокси-1-фенил-1,2,4-триазол-3-карбоновая кислота. К раствору этил-5-метокси-1-фенил-1,2,4-триазол-3-карбоксилата (150 мг, 0,607 ммоль) в 1,4-диоксане (1 мл) добавляли гидроксид натрия (1 M, 1 мл, 1,00 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь разбавляли этилацетатом (3 мл) и водный слой подкисляли до pH 5 с помощью 2 M соляной кислоты и экстрагировали этилацетатом (2×2 мл). Комбинированные органические слои сушили над сульфатом натрия, фильтровали и выпаривали с получением указанного в заголовке соединения (113 мг, выход 84%) в виде белого порошка. МС (ИЭР): масса, рассчитанная для C10H9N3O3, - 219,1; полученное m/z, 220,1 [M+H]+.
Промежуточное соединение 63: ((5R,9S)-3-(3-фтор-5-метилфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол.
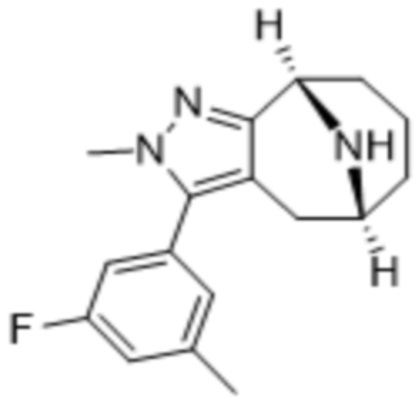
Титульное соединение получали способом, аналогичным способу получения промежуточного соединения 12, используя (3-фтор-5-метилфенил)бороновую кислоту вместо (3,5-дифторфенил)бороновой кислоты на стадии А. МС (ИЭР): масса, рассчитанная для C17H20FN3, - 285,2; полученное m/z, 286,1 [M+H]+.
Промежуточное соединение 64: 3-фтор-5-пиразол-1-ил-бензойная кислота.
Смесь метил 3-бром-5-фторбензоата (300 мг, 1,29 ммоль), пиразола (132 мг, 1,94 ммоль), карбоната цезия (713 мг, 2,19 ммоль), транс-N, N'-диметилциклогексан-1,2-диамина (35 мкл, 0,222 ммоль, 0,902 г/мл) и иодида меди(I) (25 мг, 0,131 ммоль) в N, N-диметилформамиде (1 мл) перемешивали при 140°C в течение 120 мин при микроволновом облучении. Реакционную смесь разводили этилацетатом (5 мл) и водой (5 мл). Водный слой подкислили до pH 3 1М соляной кислоты. Осадок собирали и промывали водой (2 × 5 мл) с получением указанного в заголовке соединения (245 мг, 1,19 ммоль, 92%) в виде желтовато-коричневого порошка.
МС (ИЭР): масса, рассчитанная для C10H7FN2O2, - 206,1; полученное m/z, 207,2 [M+H]+. 1H ЯМР (500 MГц, ДМСО-d6) δ 13,56 (уш. с., 1H), 8,67 (д, J=2,6 Гц, 1H), 8,28-8,25 (м, 1H), 8,03 (дт, J=10,1, 2,3 Гц, 1H), 7,81 (д, J=1,7 Гц, 1H), 7,61-7,56 (м, 1H), 6,62-6,59 (м, 1H).
Промежуточное соединение 65: 5-метокси-2-(1H-1,2,4-триазол-1-ил)бензойная кислота.
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 44, используя 2-йод-5-метоксибензойную кислоту вместо 3-йодбензойной кислоты и 1,2,4-триазол вместо 3-(трифторметил)пиразола. МС (ИЭР): масса, рассчитанная для C10H9N3O3, - 219,1; полученное m/z, 220,2 [M+H]+.
Промежуточное соединение 66: 2-[4-(трифторметил)триазол-2-ил]бензойная кислота.
Стадия А: этил 3-бензил-5-(трифторметил)триазол-4-карбоксилат и этил 1-бензил-5-(трифторметил)триазол-4-карбоксилат. К раствору азидометилбензола (1,2 г, 9,01 ммоль) в толуоле (40 мл) добавляли этил-4,4,4-трифтор-2-бутиноат (3,0 г, 18,1 ммоль). Реакционную смесь перемешивали при 115°C в течение 16 ч и выпаривали с получением смеси указанных в заголовке соединений (2,65 г, 8,86 ммоль, 98%) в виде желтого масла. МС (ИЭР): масса, рассчитанная для C13H12F3N3O2, - 299,1; полученное m/z, 300,1 [M+H]+.
Стадия B: 3-бензил-5-(трифторметил)триазол-4-карбоновая кислота и 1-бензил-5-(трифторметил)триазол-4-карбоновая кислота. К смеси этил 3-бензил-5-(трифторметил)триазол-4-карбоксилата и этил-1-бензил-5-(трифторметил)триазол-4-карбоксилата (2,65 г, 8,86 ммоль) в 1,4-диоксане (14 мл) и воде (14 мл) добавляли гидроксид натрия (720 мг, 18 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь гасили с помощью 6 M соляной кислоты (3 мл) и выпаривали. Остаток перенесли в воду (10 мл) и экстрагировали с помощью дихлорметана (3×20 мл). Комбинированные органические слои сушили над сульфатом натрия, фильтровали и выпаривали. Остаток растирали с диизопропиловым эфиром с получением первой порции смеси указанных в заголовке соединений (680 мг, 2,51 ммоль, 28%) в виде белого порошка.
Растворитель для растирания выпаривали с получением второй порции смеси указанных в заголовке соединений (670 мг, 2,47 ммоль, 28%) в виде белого порошка. МС (ИЭР): масса, рассчитанная для C11H8F3N3O2, - 271,1; полученное m/z, 272,1 [M+H]+.
Стадия C: 1-бензил-4-(трифторметил)триазол и 1-бензил-5-(трифторметил)триазол. К смеси 3-бензил-5-(трифторметил)триазол-4-карбоновой кислоты и 1-бензил-5-(трифторметил)триазол-4-карбоновой кислоты (1 г, 3,69 ммоль) в диметилсульфоксиде (50 мл) добавляли карбонат серебра (305 мг, 1,11 ммоль) и уксусную кислоту (36 мкл, 0,629 ммоль, 1,049 г/мл). Реакционную смесь перемешивали при 120°C в течение 18 ч и подкисляли до pH 3 с помощью 1 M водного раствора соляной кислоты. Смесь разбавляли в воде (50 мл) и экстрагировали этилацетатом (2 х 50 мл). Объединенные органические слои промывали водой (3×25 мл), сушили над сульфатом магния, фильтровали и выпаривали с получением смеси указанных в заголовке соединений (300 мг, 1,32 ммоль, 36%) в виде желтого порошка. МС (ИЭР): масса, рассчитанная для C10H8F3N3O3, - 227,1; полученное m/z, 228,1 [M+H]+.
Стадия D: 4-(трифторметил)-1 H -триазол. К раствору смеси 1-бензил-4-(трифторметил)триазола и 1-бензил-5-(трифторметил)триазола (750 мг, 3,3 ммоль) в 1,4-диоксане (20 мл) добавляли Selcat-Q-6 10% палладия на углероде (351 мг, 0,33 ммоль) и хлорид водорода (4,2 M в 1,4-диоксане, 2,36 мл, 9,91 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 78 ч в атмосфере водорода (1 бар) с получением указанного в заголовке соединения (35 мл, 0,094 M маточный раствор) в виде бледно-желтой жидкости.
Стадия E: 2-[4-(трифторметил)триазол-2-ил]бензойная кислота. Смесь 2-йодбензойной кислоты (200 мг, 0,806 ммоль), 4-(трифторметил)-1H-триазола (0,094 M маточный раствор в 1,4-диоксане, 11 мл, 1,034 ммоль), карбоната цезия (445 мг, 1,366 ммоль), транс-N, N'-диметилциклогексан-1,2-диамина (22 мкл, 0,140 ммоль) и иодида меди(I) (15 мг, 0,079 ммоль) в N, N-диметилформамиде (5 мл) перемешивали при 140°C в течение 30 мин при микроволновом облучении. Реакционную смесь охлаждали до комнатной температуры. Реакционную смесь охлаждали до комнатной температуры, фильтровали и промывали 1,4-диоксаном (5 мл). Объединенные фильтраты выпаривали. Реакцию повторяли дважды в масштабе 50 и 72 мг. Неочищенные продукты объединяли и очищали с помощью препаративной ВЭЖХ (способ E) с получением указанного в заголовке соединения (44 мг, 0,171 ммоль, 13%) в виде бледно-желтого масла и 2-[4-(трифторметил)триазол-1-ил]бензойной кислоты (промежуточное соединение 67) (27 мг, 0,105 ммоль, 8%) в виде бледно-желтого масла. МС (ИЭР): масса, рассчитанная для C10H6F3N3O2, - 257,0; полученное m/z, 258,1 [M+H]+. 1 H ЯМР (300 МГц, ДМСО-d6) δ 13,40 (уш. с, 1 H), 8,72 (с, 1 H), 7,91 (д, J=7,3 Гц, 1 H), 7,85-7,78 (м, 2 H), 7,78-7,64 (м, 1 H).
Промежуточное соединение 67: 2-[4-(трифторметил)триазол-1-ил] бензойная кислота.
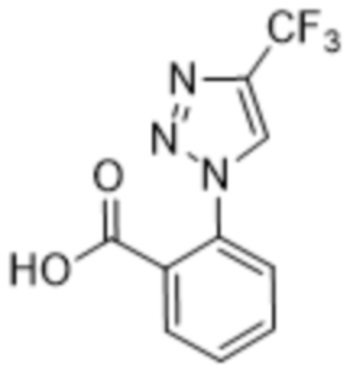
Титульное соединение выделяли из промежуточного соединения 66, стадия E.
МС (ИЭР): масса, рассчитанная для C10H6F3N3O2, - 257,0; полученное m/z, 258,1 [M+H]+. 1 H ЯМР (300 МГц, ДМСО-d6) δ 13,33 (уш. с, 1 H), 9,36 (с, 1 H), 8,04 (д, J=7,4 Гц, 1 H), 7,90-7,64 (м, 3 H).
Промежуточное соединение 68: 3-фтор-5-(4H-1,2,4-триазол-4-ил)бензойная кислота.
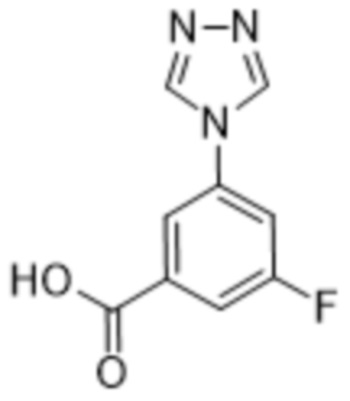
Стадия А: метил-3-фтор-5-(1,2,4-триазол-4-ил)бензоат. К раствору метил 3-амино-5-фторбензоата (250 мг, 1,48 ммоль) в пиридине (8 мл) добавляли 1,2-диформилгидразин (325 мг, 3,69 ммоль) и триэтиламин (1 мл, 7,16 ммоль). К смеси по каплям добавляли хлортриметилсилан (375 мкл, 2,96 ммоль). Реакционную смесь перемешивали при 100°C в течение 16 ч и выпаривали. Остаток разбавляли дихлорметаном (8 мл) и водой (10 мл). Водный слой экстрагировали дихлорметаном (2×10 мл). Объединенные органические слои промывали 10% бисульфатом калия (1×15 мл) и 1 M гидроксидом натрия (1×15 мл), сушили сульфатом натрия, фильтровали и выпаривали с получением указанного в заголовке соединения (131 мг, 0,592 ммоль, 40%) в виде белого порошка. МС (ИЭР): масса, рассчитанная для C10H8FN3O2, - 221,1; полученное m/z, 222,1 [M+H]+.
Стадия B: 3-фтор-5-(1,2,4-триазол-4-ил)бензойная кислота. К раствору метил-3-фтор-5-(1,2,4-триазол-4-ил)бензоата (130 мг, 0,588 ммоль) в 1,4-диоксане (1 мл) и воде (1 мл) добавляли гидроксид натрия (48 мг, 1,20 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Реакцию гасили 6 M соляной кислоты (0,20 мл). Осадок собирали и промывали водой (1 × 1 мл) с получением указанного в заголовке соединения (80 мг, 0,386 ммоль, 65%) в виде белого порошка. МС (ИЭР): масса, рассчитанная для C9H6FN3O2, - 207,0; полученное m/z, 208,1 [M+H]+.
Промежуточное соединение 69: 4-фтор-3-(4H-1,2,4-триазол-4-ил)бензойная кислота.
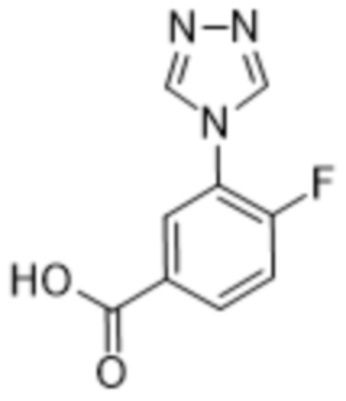
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 68 с применением метил-3-амино-4-фторбензоата вместо метил-3-амино-5-фторбензоата на стадии A. МС (ИЭР): масса, рассчитанная для C9H6FN3O2S, - 207,0; найденное m/z, 206,0 [M-H]-.
Промежуточное соединение 70: 3-метил-5-(4H-1,2,4-триазол-4-ил)бензойная кислота.
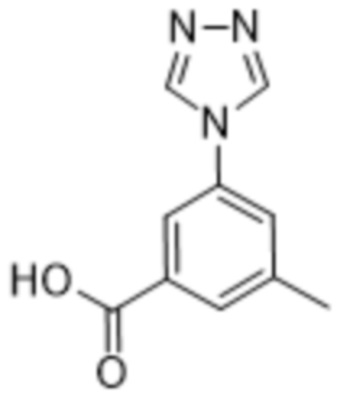
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 68, используя метил-3-амино-5-метилбензоат вместо метил-3-амино-5-фторбензоата на стадии A. МС (ИЭР): масса, рассчитанная для C10H9 N 3O2S, - 203,1; полученное m/z, 204,1 [M+H]+.
Промежуточное соединение 71: 2-метил-3-(4H-1,2,4-триазол-4-ил)бензойная кислота.
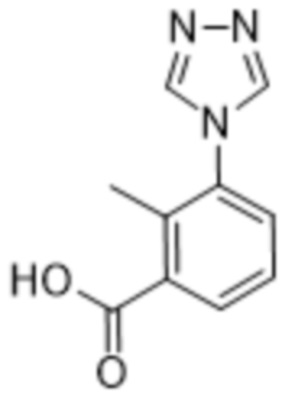
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 68, используя метил-3-амино-2-метилбензоат вместо метил-3-амино-5-фторбензоата на стадии A. МС (ИЭР): масса, рассчитанная для C10H9 N 3O2S, - 203,1; полученное m/z, 204,1 [M+H]+.
Промежуточное соединение 72: 4-метил-3-(4H-1,2,4-триазол-4-ил)бензойная кислота.
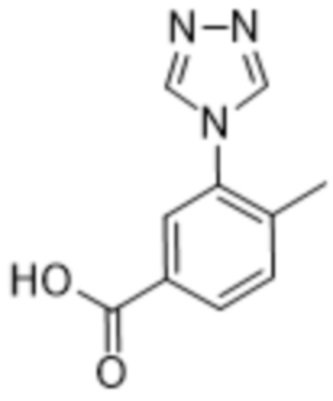
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 68, используя метил-3-амино-4-метилбензоат вместо метил-3-амино-5-фторбензоата на стадии A. МС (ИЭР): масса, рассчитанная для C10H9 N 3O2S, - 203,1; полученное m/z, 204,1 [M+H]+.
Промежуточное соединение 73: 2-(4-метил-2H-1,2,3-триазол-2-ил)бензойная кислота.
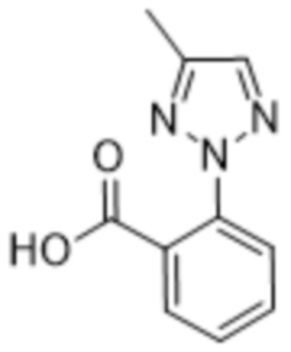
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 44, используя 2-йодбензойную кислоту вместо 3-йодбензойной кислоты и 4-метил-2H-1,2,3-триазол вместо 3-(трифторметил)пиразола. МС (ИЭР): масса, рассчитанная для C10H9N3O2, - 203,1; полученное m/z, 204,1 [M+H]+.
Промежуточное соединение 74: 4-фтор-2-(2H-1,2,3-триазол-2-ил)бензойная кислота.
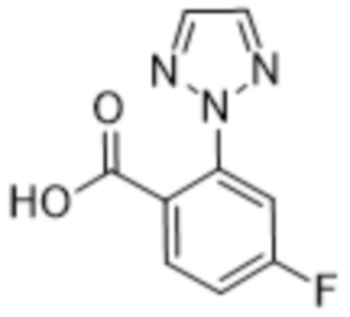
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 44, используя 4-фтор -2-йодбензойную кислоту вместо 3-йодбензойной кислоты и 1,2,3-триазол вместо 3-(трифторметил)пиразола. МС (ИЭР): масса, рассчитанная для C9H6FN3O2, - 207,0; полученное m/z, 208,1 [M+H]+.
Промежуточное соединение 75: 3-фтор-2-(2H-1,2,3-триазол-2-ил)бензойная кислота.
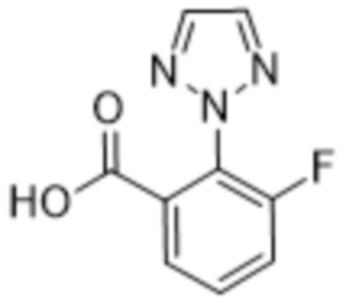
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 44, используя 3-фтор -2-йодбензойную кислоту вместо 3-йодбензойной кислоты и 1,2,3-триазол вместо 3-(трифторметил)пиразола. МС (ИЭР): масса, рассчитанная для C9H6FN3O2, - 207,0; полученное m/z, 208,1 [M+H]+.
Промежуточное соединение 76: 5-метил-2-(2H-1,2,3-триазол-2-ил)бензойная кислота.
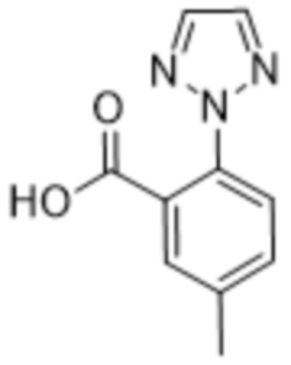
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 44, используя 2-йод-5-метилбензойную кислоту вместо 3-йодбензойной кислоты и 1,2,3-триазол вместо 3-(трифторметил)пиразола. МС (ИЭР): масса, рассчитанная для C10H9N3O2, - 203,1; полученное m/z, 204,2 [M+H]+.
Промежуточное соединение 77: 2-(2H-1,2,3-триазол-2-ил)-3-(трифторметил)бензойная кислота.
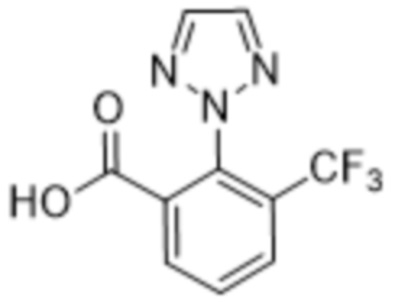
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 44, используя 2-йод-3-(трифторметил)бензойную кислоту вместо 3-йодбензойной кислоты и 1,2,3-триазол вместо 3-(трифторметил)пиразола. МС (ИЭР): масса, рассчитанная для C10H6F3N3O2, - 257,0; полученное m/z, 258,1 [M+H]+.
Промежуточное соединение 78: 4-(1H-пиразол-1-ил)пиколиновая кислота.
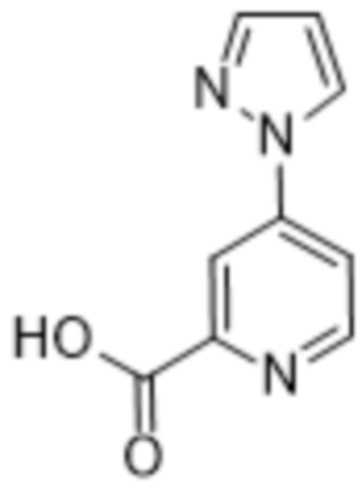
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 64, используя метил-4-йодпиколинат вместо метил-3-бром-5-фторбензоата. МС (ИЭР): масса, рассчитанная для C9H7N3O2, - 189,1; полученное m/z, 190,1 [M+H]+.
Промежуточное соединение 79: индолизин-7-карбоновая кислота.
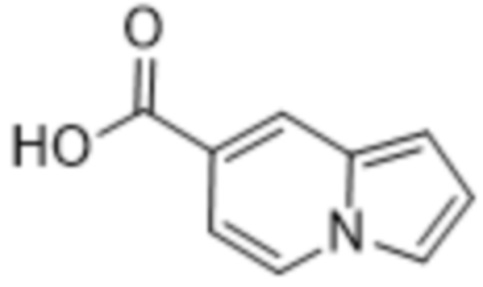
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 66, стадия B, используя метил-индолизин-7-карбоксилат вместо этил-3-бензил-5-(трифторметил)триазол-4-карбоксилата. МС (ИЭР): масса, рассчитанная для C9H7NO2, - 161,1; полученное m/z, 162,1 [M+H]+. 1 H ЯМР (300 МГц, ДМСО-d6) δ 12,73 (уш. с, 1 H), 8,29 (д, J=7,2 Гц, 1 H), 8,16-8,09 (м, 1 H), 7,78-7,69 (м, 1 H), 6,94 (дд, J=7,3, 1,8 Гц, 1 H), 6,88 (дд, J=4,0, 2,6 Гц, 1 H), 6,78-6,71 (м, 1 H).
Промежуточное соединение 80: 2-(1H-пиразол-1-ил)изоникотиновая кислота.
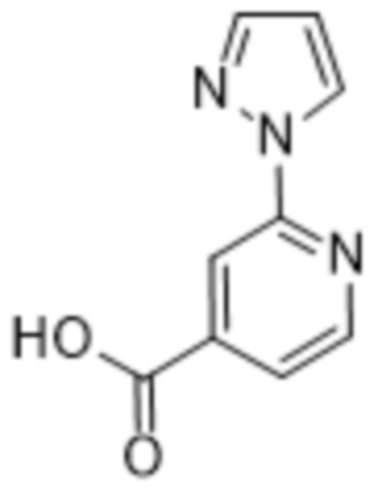
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 64, используя метил-2-йодизоникотинат вместо метил-3-бром-5-фторбензоата. МС (ИЭР): масса, рассчитанная для C9H7N3O2, - 189,1; полученное m/z, 190,1 [M+H]+.
Промежуточное соединение 81: 4-метокси-5-(1H-пиразол-1-ил)никотиновая кислота.
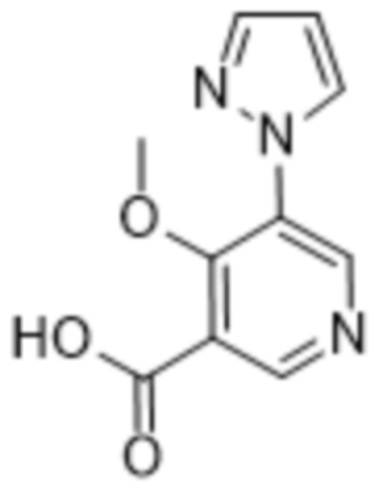
Стадия А: метил 4-гидроксипиридин-3-карбоксилат. К смеси 4-гидроксиникотиновой кислоты (2,09 г, 15 ммоль) в метаноле (41 мл, 101 ммоль, 0,792 г/мл) добавляли серную кислоту (80 мкл, 1,5 ммоль, 1,84 г/мл). Реакционную смесь перемешивали при 65°C в течение 16 ч. Реакционную смесь нейтрализовали насыщенным карбонатом натрия (3 мл) и собирали осадок с получением указанного в заголовке соединения (1,98 г, 12,9 ммоль, 86%) в виде порошка грязно-белого цвета. МС (ИЭР): масса, рассчитанная для C7H7NO3, - 153,0; полученное m/z, 154,1 [M+H]+.
Стадия B: метил 4-гидрокси-5-йодпиридин-3-карбоксилат. К суспензии метил 4-гидроксипиридин-3-карбоксилата (1,11 г, 7,25 ммоль) в ацетонитриле (5 мл) и уксусной кислоте (3 мл) добавляли N-йодсукцинимид (1,63 г, 7,24 ммоль) и реакционную смесь перемешивали при 60°C в течение 16 ч. Реакционную смесь выпаривали. Остаток разбавляли ацетоном (10 мл) и осадок собирали с получением указанного в заголовке соединения (828 мг, 2,97 ммоль, 41%) в виде порошка грязно-белого цвета. МС (ИЭР): масса, рассчитанная для C7H6INO3, - 278,9; полученное m/z, 280,0 [M+H]+.
Стадия C: метил 5-йод-4-метоксипиридин-3-карбоксилат. К суспензии метил-4-гидрокси-5-йодпиридин-3-карбоксилата (811 мг, 2,91 ммоль) в дихлорметане (15 мл) добавляли тетрафторборат триметилоксония (1075 мг, 7,25 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 20 ч. В реакционную смесь добавляли тетрафторборат триметилоксония (1075 мг, 7,25 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь разбавляли водой (40 мл). Водный слой экстрагировали дихлорметаном (3×50 мл). Объединенные органические слои промывали водой (2 х 20 мл). Органический слой сушили над сульфатом магния, фильтровали и выпаривали с получением указанного в заголовке соединения (260 мг, 0,887 ммоль, 30%) в виде порошка грязно-белого цвета. МС (ИЭР): масса, рассчитанная для C8H8INO3, - 293,0; полученное m/z, 294,0 [M+H]+.
Стадия D: 4-метокси-5-пиразол-1-ил-пиридин-3-карбоновая кислота. К раствору метил-5-йод-4-метоксипиридин-3-карбоксилата (100 мг, 0,341 ммоль) в диметилсульфоксиде (1 мл) добавляли пиразол (116 мг, 1,70 ммоль), оксид меди(I) (5,0 мг, 0,0349 ммоль) и карбонат цезия (222 мг, 0,681 ммоль). Реакционную смесь перемешивали при 110°C в течение 40 ч в атмосфере аргона. Реакционную смесь очищали препаративной ВЭЖХ (способ E) с получением указанного в заголовке соединения (15 мг, 0,068 ммоль, 20%) в виде порошка грязно-белого цвета. МС (ИЭР): масса, рассчитанная для C10H9N3O3, - 219,1; полученное m/z, 220,2 [M+H]+.
Промежуточное соединение 82: 4-(1H-пиразол-1-ил)никотиновая кислота.
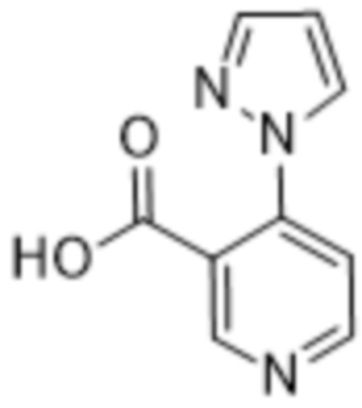
Стадия А: метил-4-пиразол-1-илпиридин-3-карбоксилат. Смесь гидробромида сложного метилового эфира 4-бром-никотиновой кислоты (220 мг, 0,741 ммоль), пиразола (76 мг, 1,12 ммоль), карбоната цезия (725 мг, 2,23 ммоль), транс-N, N'-диметилцикло-нгексан-1,2-диамина (20 мкл, 0,127 ммоль, 0,902 мкг/мл) и иодида меди(I) (14 мг, 0,0735 ммоль) в N, N-диметилформамиде (2 мл) перемешивали при 140°C в течение 20 мин при микроволновом облучении. Реакционную смесь разбавляли водой (10 мл) и экстрагировали этилацетатом (3 × 10 мл). Комбинированные органические слои сушили над сульфатом магния, фильтровали и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле, выполняя элюирование с использованием этилацетата, с получением указанного в заголовке соединения (60 мг, 0,295 ммоль, 39%) в виде желтого масла. МС (ИЭР): масса, рассчитанная для C10H9N3O2, - 203,1; полученное m/z, 204,2 [M+H]+.
Стадия B: 4-пиразол-1-илпиридин-3-карбоновая кислота. К смеси метил 4-пиразол-1-илпиридин-3-карбоксилата (60 мг, 0,295 ммоль) в воде (800 мкл) и 1,4-диоксана (800 мкл) добавляли гидроксид натрия (30 мг, 0,75 ммоль). Реакционную смесь перемешивали при 80°C при 2 ч. Реакционную смесь гасили 6 M соляной кислоты (0,15 мл) и выпаривали с получением указанного в заголовке соединения (80 мг) в виде неочищенного белого порошка. Титульное соединение использовали в неочищенном виде без дополнительной очистки.
Промежуточное соединение 83: 6-метил-3-(1H-1,2,4-триазол-1-ил)пиколиновая кислота.
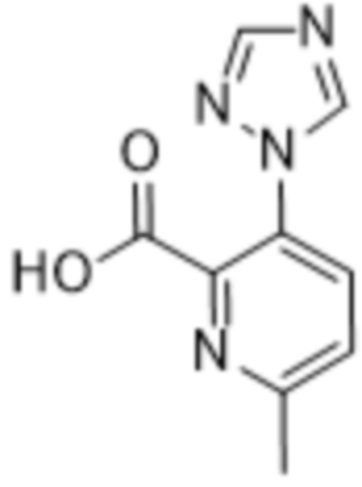
Стадия А: 6-метил-3-нитро-пиридин-2-карбонитрил. К суспензии 2-хлор-6-метил-3-нитропиридина (1,0 г, 5,795 ммоль) в N, N-диметилформамиде (10 мл) добавляли цианид цинка (749 мг, 6,378 ммоль) и тетракис(трифенилфосфин)палладий(0) (1004 мг, 0,869 ммоль). Реакционную смесь перемешивали при 80°C в течение 22 ч в атмосфере аргона и выпаривали при пониженном давлении. Реакцию повторяли в том же масштабе. Неочищенные продукты объединяли и очищали с помощью градиентной колоночной хроматографии на силикагеле, выполняя элюирование с использованием н-гептана:этилацетата (100:00 → 70:30) с получением указанного в заголовке соединения (700 мг, 4,29 ммоль, 37%) в виде желтого масла.
МС (ИЭР): масса, рассчитанная для C7H5N3O2, - 163,0; полученное m/z, 164,1 [M+H]+.
Стадия B: 3-амино-6-метилпиридин-2-карбонитрил. К раствору 6-метил-3-нитропиридин-2-карбонитрила (640 мг, 3,92 ммоль) в уксусной кислоте (10 мл) добавляли железо (548 мг, 9,81 ммоль) при 0 °C. Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 2 часов. Реакционную смесь разбавляли дихлорметаном (20 мл) и фильтровали через слой Celite®. Celite® промывали дихлорметаном (3 х 10 мл). Объединенные фильтраты выпаривали и остаток поглощали водой (15 мл), доводили pH до 9 насыщенным карбонатом натрия (5 мл) и экстрагировали дихлорметаном (3×50 мл). Комбинированные органические слои сушили над сульфатом магния, фильтровали и выпаривали с получением указанного в заголовке соединения (451 мг, 3,39 ммоль, 86%) в виде оранжевого порошка. МС (ИЭР): масса, рассчитанная для C7H7N3, - 133,1; полученное m/z - 134,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,20 (д, J=8,6 Гц, 1H), 7,14 (д, J=8,7 Гц, 1H), 6,03 (уш. с., 2H), 2,29 (с, 3H).
Стадия C: 3-йод-6-метилпиридин-2-карбонитрил. К суспензии 3-амино-6-метилпиридин-2-карбонитрила (750 мг, 5,63 ммоль) в воде (10 мл) добавляли соляную кислоту (6 M, 5,6 мл, 33,6 ммоль) и смесь охлаждали до 0 °C. Добавляли по каплям водный раствор нитрита натрия (2 M, 4,2 мл, 8,4 ммоль) в течение 5 мин при 0°C и реакционную смесь перемешивали при 0°C в течение 30 мин. Добавляли по каплям водный раствор йодида калия (2 M, 6,2 мл, 12,4 ммоль) в течение 10 мин, поддерживая температуру в диапазоне 0 -5 °C. Реакционную смесь перемешивали при 0°C в течение 30 мин. Реакционную смесь разводили насыщенным водным раствором карбоната натрия (5 мл) и экстрагировали этилацетатом (3×10 мл). Комбинированные органические слои сушили над сульфатом магния, фильтровали и выпаривали. Остаток очищали с помощью градиентной колоночной хроматографии на силикагеле, выполняя элюирование с использованием н-гептан-этилацетата (9:1 → 4:1) с получением указанного в заголовке соединения (925 мг, 3,79 ммоль, 67%) в виде грязно-белого порошка. МС (ИЭР): масса, рассчитанная для C7H5IN2, - 244,0; полученное m/z, 245,0 [M+H]+.
Стадия D: 6-метил-3-(1,2,4-триазол-1-ил)пиридин-2-карбонитрил. К раствору 3-йод-6-метилпиридин-2-карбонитрила (250 мг, 1,02 ммоль) и 1,2,4-триазола (106 мг, 1,53 ммоль) в N, N-диметилформамиде (1,5 мл) добавляли карбонат цезия (567 мг, 1,74 ммоль), транс-N, N ′-диметилциклогексан-1,2-диамин (28 мкл, 0,178 ммоль, 0,902 г/мл) и иодид меди(I) (20 мг, 0,105 ммоль). Реакционную смесь перемешивали при 140°C в течение 40 мин при микроволновом облучении и вливали в воду (8 мл). Смесь экстрагировали этилацетатом (3×10 мл) и объединенные органические слои сушили над сульфатом магния, фильтровали и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле с элюированием этилацетатом с получением указанного в заголовке соединения (50 мг, 0,270 ммоль, 26%) в виде бледно-желтого порошка.
МС (ИЭР): масса, рассчитанная для C9H7N5, - 185,1; полученное m/z, 186,2 [M+H]+.
Стадия E: 6-Метил-3-(1,2,4-триазол-1-ил)пиридин-2-карбоновая кислота. К смеси 6-метил-3-(1,2,4-триазол-1-ил)пиридин-2-карбонитрила (50 мг, 0,27 ммоль) в воде (675 мкл) и 1,4-диоксана (675 мкл) добавляли гидроксид натрия (27 мг, 0,675 ммоль). Реакционную смесь перемешивали при 60°C в течение 1 ч, затем при 80°C в течение 23 ч. Реакционную смесь гасили 6 M соляной кислотой (0,115 мл) и выпаривали с получением указанного в заголовке соединения (88 мг, в неочищенном виде) в виде бледно-желтого порошка, содержащего прибл. 35 мас.% хлорида натрия. МС (ИЭР): масса, рассчитанная для C9H8N4O2, - 204,1; полученное m/z, 161,1 [M+2H−CO2]+. 1H ЯМР (300 MГц, ДМСО-d6) δ 8,92 (с, 1H), 8,16 (с, 1H), 7,84 (д, J=8,2 Гц, 1H), 7,49-7,34 (м, 1H), 7,30 (д, J=8,2 Гц, 1H), 2,50-2,47 (м, 3H).
Промежуточное соединение 84: 6-метил-3-(1H-пиразол-1-ил)пиколиновая кислота.
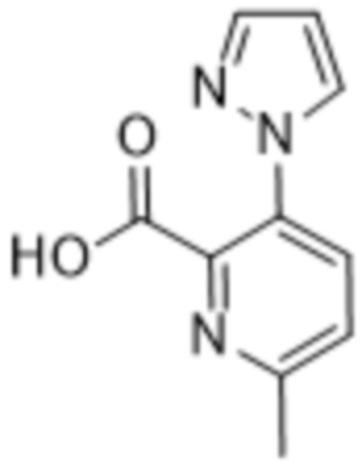
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 83, используя пиразол вместо 1,2,4-триазола на стадии D. МС (ИЭР): масса, рассчитанная для C10H9FN3O2, - 203,1; полученное m/z, 202,1 [M+H]-.
Промежуточное соединение 85: 3-2H-1,2,3-триазол-2-ил)пиколиновая кислота.
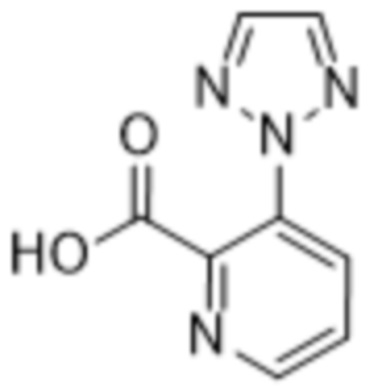
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 83, стадии D-E, используя 3-бромпиколинонитрил вместо 3-йод-6-метилпиридин-2-карбонитрила, используя 1 H-1,2,3-триазол вместо 1,2,4-триазола; и используя традиционное нагревание вместо микроволнового. МС (ИЭР): масса, рассчитанная для C8H6N4O2, - 190,1; полученное m/z, 191,1 [M+H]+.
Промежуточное соединение 86: 6-метил-4-(2H-1,2,3-триазол-2-ил)пиколиновая кислота.
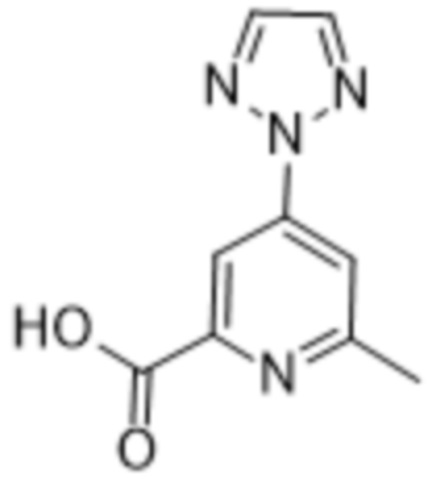
Стадия А: 4-амино-6-метилпиридин-2-карбонитрил. К раствору 6-метил-4-нитропиридин-2-карбонитрила (1,0 г, 6,13 ммоль) в уксусной кислоте (20 мл) добавляли железо (856 мг, 15,3 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь фильтровали через слой Celite® и Celite® промывали этилацетатом (3×50 мл). Объединенные фильтраты промывали насыщенным раствором карбоната натрия (3×30 мл) и солевым раствором (1×30 мл). Органический слой сушили над сульфатом магния, фильтровали и выпаривали с получением указанного в заголовке соединения (760 мг, 5,71 ммоль, 93%) в виде желтовато-коричневого порошка. МС (ИЭР): масса, рассчитанная для C7H7N3, - 133,1;полученное m/z, 134,2 [M+H]+.
Стадия B: 4-йод-6-метилпиридин-2-карбонитрил. К суспензии 4-амино-6-метилпиридин-2-карбонитрила (650 мг, 4,88 ммоль) в воде (7 мл) добавляли соляную кислоту (6 M, 4,89 мл, 29,3 ммоль) и смесь охлаждали до 0 °C. К смеси по каплям добавляли нитрит натрия (2 M, 3,66 мл, 7,32 ммоль) в течение 1 мин при 0°C и реакционную смесь перемешивали при 0°C в течение 30 мин. К реакционной смеси добавляли 2 M водный раствор йодида калия (5,37 мл, 10,7 ммоль) по каплям в течение 1 мин при 0 °C. Реакционную смесь перемешивали при 0°C в течение 30 мин. Реакционную смесь гасили насыщенным раствором карбоната натрия (50 мл) и экстрагировали этилацетатом (3×50 мл). Комбинированные органические слои сушили над сульфатом магния, фильтровали и выпаривали. Остаток очищали посредством колоночной хроматографии на силикагеле с элюированием смесью н-гексан: этилацетат (4:1) с получением указанного в заголовке соединения (320 мг, 1,31 ммоль, 27%) в виде желтого порошка. МС (ИЭР): масса, рассчитанная для C7H5IN2, - 244,0;полученное m/z, 245,0 [M+H]+.
Стадия C: 6-метил-4-(2H-1,2,3-триазол-2-ил)пиколиновая кислота. Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 83, используя 4-йод-6-метилпиридин-2-карбонитрил вместо 3-йод-6-метилпиридин-2-карбонитрила на стадии D, используя традиционное нагревание вместо микроволнового. МС (ИЭР): масса, рассчитанная для C9H8N4O2, - 204,1;полученное m/z, 205,1 [M+H]+.
Промежуточное соединение 87: 4-(4H-1,2,4-триазол-4-ил)пиколиновая кислота.
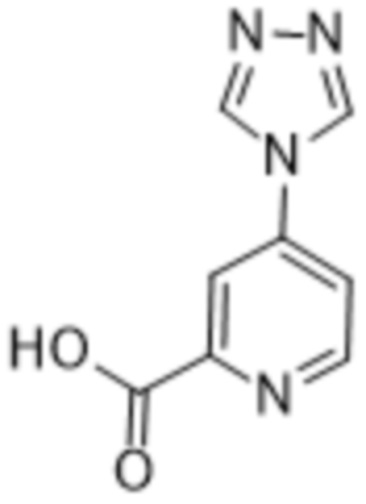
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 68, используя метил-4-аминопиридин-2-карбоксилат вместо метил-3-амино-5-фторбензоата на стадии A. МС (ИЭР): масса, рассчитанная для C8H6 N 4O2, - 190,1; полученное m/z, 191,1 [M+H]+.
Промежуточное соединение 88: 5-(4H-1,2,4-триазол-4-ил)никотиновая кислота.
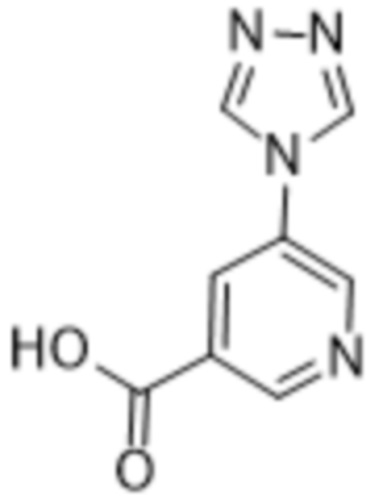
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 68, используя метил-5-аминоникотинат вместо метил-3-амино-5-фторбензоата на стадии A. МС (ИЭР): масса, рассчитанная для C8H6 N 4O2, - 190,1; полученное m/z, 191,1 [M+H]+.
Промежуточное соединение 89: 6-метил-4-(4H-1,2,4-триазол-4-ил)пиколиновая кислота.
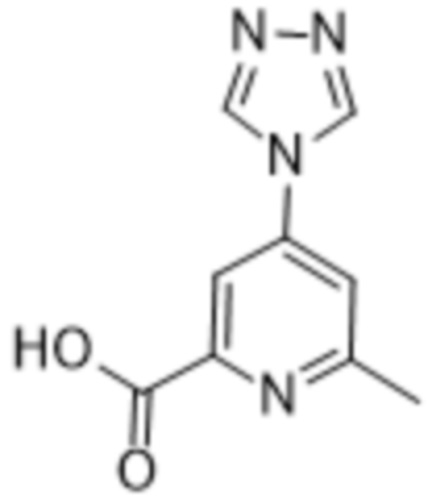
Стадия А: 4-амино-6-метилпиридин-2-карбонитрил. К раствору 6-метил-4-нитропиридин-2-карбонитрила (1,0 г, 6,13 ммоль) в уксусной кислоте (20 мл) добавляли порошок железа (3,08 г, 55,2 ммоль) при 50°C и реакционную смесь перемешивали при 50°C в течение 30 мин, фильтровали и выпаривали. Остаток очищали методом колоночной хроматографии на силикагеле с элюированием смесью н-гептан:этилацетат (1:1) с получением указанного в заголовке соединения (160 мг, 1,20 ммоль, 19%) в виде белого порошка.
Стадия B: 6-метил-4-(1,2,4-триазол-4-ил)пиридин-2-карбонитрил. К раствору 4-амино-6-метилпиридин-2-карбонитрила (150 мг, 1,13 ммоль) в пиридине (5 мл) добавляли 1,2-диформилгидразин (248 мг, 2,82 ммоль) и триэтиламин (786 мкл, 5,63 ммоль). К смеси по каплям добавляли хлортриметилсилан (1,43 мл, 11,3 ммоль) и реакционную смесь перемешивали при 100°C в течение 16 ч. Реакционную смесь фильтровали и выпаривали, а остаток очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью хлороформ: метанол (10:1), с получением указанного в заголовке соединения (65 мг, 0,351 ммоль, 31%) в виде белого порошка. МС (ИЭР): масса, рассчитанная для C9H7N5, - 185,1; полученное m/z, 186,1 [M+H]+.
Стадия C: гидрохлорид 6-метил-4-(1,2,4-триазол-4-ил)пиридин-2-карбоновой кислоты. К смеси 6-метил-4-(1,2,4-триазол-4-ил)пиридин-2-карбонитрила (50 мг, 0,270 ммоль) в воде (600 мкл) и 1,4-диоксане (600 мкл) добавляли гидроксид натрия (50 мг, 1,25 ммоль). Реакционную смесь перемешивали при 80°C в течение 1 ч. Реакцию гасили 6 M соляной кислотой (0,3 мл) и смесь выпаривали. Остаток растирали с водой (1 мл) с получением указанного в заголовке соединения (21 мг, 0,087 ммоль, 32%) в виде белого порошка. МС (ИЭР): масса, рассчитанная для C9H8N4O2, - 204,1; полученное m/z, 205,1 [M+H]+.
Промежуточное соединение 90: 5-(триазол-2-ил)пиридин-3-карбоновая кислота.
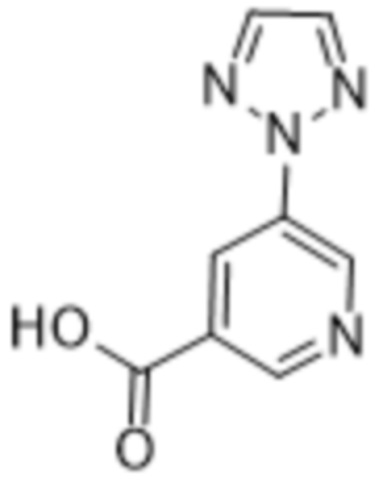
Стадия А: 5-(триазол-2-ил)пиридин-3-карбоновая кислота и 5-(триазол-1-ил)пиридин-3-карбоновая кислота. Смесь метил 5-йодпиридин-3-карбоксилата (200 мг, 0,76 ммоль), 1 H-1,2,3-триазола (80 мг, 1,16 ммоль), карбоната цезия (420 мг, 1,29 ммоль), транс-N, N'-диметилциклогексан-1,2-диамина (20 мкл, 0,127 ммоль, 0,902 г/мл) и иодида меди(I) (20 мг, 0,105 ммоль) в N, N-диметилформамиде (2 мл) перемешивали при 140°C в течение 3 ч. Реакционную смесь фильтровали и фильтрат выпаривали с получением смеси указанных в заголовке соединений (320 мг, неочищ.) в виде коричневого порошка. МС (ИЭР): масса, рассчитанная для C8H6N4O2, - 190,1;полученное m/z, 189,2 [M+H]-.
Стадия B: метил 5-(триазол-2-ил)пиридин-3-карбоксилат и метил 5-(триазол-1-ил)пиридин-3-карбоксилат. К суспензии неочищенной кислотной смеси (320 мг, 1,68 ммоль) в сухом тетрагидрофуране (5 мл) добавляли 1,0 М эфирный раствор диазометана (5 мл, 5 ммоль, 1 М). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь разводили водой (5 мл) и экстрагировали этилацетатом (3×5 мл). Объединенные органические слои промывали водой (1×5 мл), сушили над сульфатом натрия, фильтровали и выпарили. Неочищенный продукт очищали препаративной ВЭЖХ с получением метил-5-(триазол-2-ил)пиридин-3-карбоксилата (11 мг, 0,054 ммоль, 3%) в виде белого порошка. МС: m/z 205,1 [M+H]+.
Фракции из той же препаративной ВЭЖХ (способ E) собирали с получением метил 5-(триазол-1-ил)пиридин-3-карбоксилата (8 мг, 0,039 ммоль, 2%) в виде белого порошка. МС (ИЭР): масса, рассчитанная для C9H8N4O2, - 204,1;полученное m/z, 205,1 [M+H]+.
Стадия C: 5-(триазол-2-ил)пиридин-3-карбоновая кислота. К раствору метил-5-(триазол-2-ил)пиридин-3-карбоксилата (11 мг, 0,0539 ммоль) в 1,4-диоксане (500 мкл) добавляли раствор гидроксида натрия (6 мг, 0,15 ммоль) в воде (130 мкл). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь подкислили до pH 4 с помощью 1 М соляной кислоты (100 мкл). Смесь выпаривали с получением указанного в заголовке соединения (18 мг, 0,095 ммоль, неочищ.) в виде светло-коричневого порошка. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,82 (уш. с, 1H), 9,45 (д, J=2,5 Гц, 1H), 9,10 (д, J=1,7 Гц, 1H), 8,76-8,71 (м, 1H), 8,27 (с, 2H).
Промежуточное соединение 91: 3-фтор-1,5-диметил-1H-пиразол-4-карбоновая кислота.
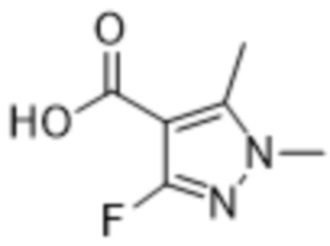
Стадия А: этил 3-фтор-1,5-диметил-1H-пиразол-4-карбоксилат. К раствору этил-1,5-диметил-1H-пиразол-4-карбоксилата (50 мг, 0,30 ммоль) в ТГФ (2,5 мл) при -78°C добавляли диизопропиламид лития (LDA) (2,0 M в ТГФ/гептан/этилбензол) (0,30 мл, 0,60 ммоль) и смесь перемешивали при -78°C в течение 30 мин, после чего добавляли раствор N-фтордибензолсульфонимида (NFSI) (187 мг, 0,60 ммоль) в ТГФ (0,5 мл). Реакционную смесь выдерживали при -78°C в течение дополнительных 30 минут, холодную баню удаляли и смесь перемешивали при комнатной температуре в течение ночи. Реакцию гасили с использованием насыщенного водного раствора NH4Cl и затем разбавляли EtOAc и H2O. Слои разделяли и водный слой экстрагировали с помощью EtOAc (× 3). Затем объединенные органические слои промывали солевым раствором, сушили над Na2SO4, отфильтровывали и концентрировали в вакууме. Неочищенный остаток очищали посредством хроматографии на силикагеле (0-10% MeOH в ДХМ) с получением желтого твердого вещества (33,5 мг, выход 61%). МС (ИЭР): масса, рассчитанная для C8H11FN2O2, - 186,1; полученное m/z, 187,1 [M+H]+. 1 H ЯМР (400 МГц, хлороформ-d) δ 4,29 (к, J=7,1 Гц, 2 H), 3,67 (с, 3 H), 2,38 (с, 3 H), 1,34 (т, J=7,1 Гц, 3 H).
Стадия B: 3-фтор-1,5-диметил-1H-пиразол-4-карбоновая кислота. Раствор этил-3-фтор-1,5-диметил-1H-пиразол-4-карбоксилата (9,7 мг, 52,1 мкмоль) в 37% -м водном растворе HCl (1,62 мл) нагревали до 110°C в течение 3 ч, после чего охлаждали до комнатной температуры и разбавляли H2O. Смесь осторожно нейтрализовали 10 Н водного раствора NaH и затем экстрагировали этилацетатом (× 3). Затем объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением желтого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. МС (ИЭР): масса, рассчитанная для C6H7FN2O2, - 158,0; полученное m/z, 159,1 [M+H]+. 1 H ЯМР (400 МГц, метанол-d4) δ 3,68 (д, J=1,5 Гц, 3 H), 2,34 (с, 3 H).
Промежуточное соединение 92: 1-циклопропил-5-метил-пиразол-4-карбоновая кислота.
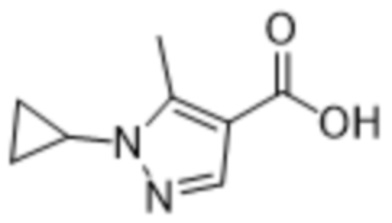
Стадия А: этил 1-циклопропил-5-метил-пиразол-4-карбоксилат и этил 2-циклопропил-5-метил-пиразол-4-карбоксилат. К раствору этил 3-метил-1H-пиразол-4-карбоксилата (1,55 г, 10,1 ммоль) в 1,2-дихлорэтане (60 мл) добавляли циклопропилбороновую кислоту (1,73 г, 20,1 ммоль), ацетат меди(II) (3,65 г, 20,1 ммоль), карбонат калия (278 г, 20,1 ммоль) и 2,2'-бипиридин (3,14 г, 20,1 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 суток. Реакционную смесь разводили водой (100 мл) и экстрагировали хлороформом (2×60 мл). Объединенные органические слои промывали солевым раствором (1×10 мл), сушили над сульфатом магния, фильтровали и выпарили. Остаток очищали с помощью градиентной колоночной хроматографии на силикагеле, выполняя элюирование с использованием н-гептан-этилацетата (20:1 → 1:1), с получением смеси 60:40 указанных в заголовке соединений (290 мг, 1,493 ммоль, 15%) в виде бесцветной жидкости.
Этил-1-циклопропил-5-метил-пиразол-4-карбоксилат. МС (ИЭР): масса, рассчитанная для C10H14N2O2, - 194,1;полученное m/z, 195,2 [M+H]+. 1 H ЯМР (300 МГц, ДМСО-d6) δ 7,69 (с, 1 H), 4,20 (к, J=6,8 Гц, 2 H), 3,64-3,48 (м, 1 H), 2,57 (с, 3 H), 1,26 (т, J=7,1 Гц, 3 H), 1,13-1,03 (м, 4 H).
Фракции из той же колонки собирали и очищали посредством колоночной хроматографии на силикагеле, выполняя элюирование с использованием н-гептан-этилацетата (100:1 → 1:1), с получением чистого этил-2-циклопропил-5-метил-пиразол-4-карбоксилата (90 мг, 0,463 ммоль, 5%) в виде бесцветной жидкости.
МС (ИЭР): масса, рассчитанная для C10H14N2O2, - 194,1; полученное m/z, 195,2 [M+H]+.
1H ЯМР (500 МГц, ДМСО-d6) δ 8,21 (с, 1H), 4,18 (к, J=7,1 Гц, 2H), 3,74-3,66 (м, 1H), 2,30 (с, 3H), 1,25 (т, J=7,1 Гц, 3H), 1,09-1,01 (м, 2H), 0,96-0,90 (м, 2H).
Стадия B: 1-циклопропил-5-метил-пиразол-4-карбоновая кислота. К смеси этил-1-циклопропил-5-метил-пиразол-4-карбоксилата и этил 2-циклопропил-5-метил-пиразол-4-карбоксилата (260 мг, 1,34 ммоль) в воде (1,5 мл) и 1,4-диоксане (1,5 мл) добавляли гидроксид натрия (120 мг, 3 ммоль). Реакционную смесь перемешивали при 80°C в течение 18 ч. Реакционную смесь выпаривали. Остаток растворили в воде (2 мл) и подкислили до pH 4 с помощью 1 M раствора соляной кислоты. Осадок собирали с получением указанного в заголовке соединения (35 мг, 0,211 ммоль, 16%) в виде белого порошка. МС (ИЭР): масса, рассчитанная для C8H10N2O2, - 166,1; полученное m/z, 167,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 12,19 (уш. с, 1H), 7,65 (с, 1H), 3,59-3,50 (м, 1H), 2,55 (с, 3H), 1,08-0,98 (м, 4H). Структура подтверждена спектроскопией ядерного эффекта Оверхаузера.
Промежуточное соединение 93: 1-циклопропил-3-метил-пиразол-4-карбоновая кислота.
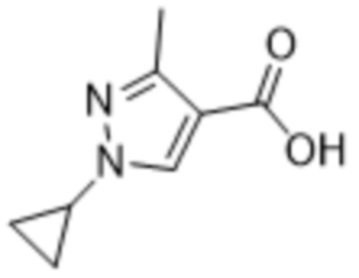
К смеси этил-2-циклопропил-5-метил-пиразол-4-карбоксилата (промежуточное соединение 92, стадия A) (70 мг, 0,36 ммоль) в воде (1 мл) и 1,4-диоксане (1 мл) добавляли гидроксид натрия (32 мг, 0,80 ммоль). Реакционную смесь перемешивали при 80°C в течение 2 ч. Реакционную смесь выпаривали и растворяли остаток в воде (2 мл). Смесь подкислили до pH 4 с помощью 1 М соляной кислоты. Осадок собирали с получением указанного в заголовке соединения (25 мг, 0,150 ммоль, 42%) в виде белого порошка. МС (ИЭР): масса, рассчитанная для C8H10N2O2, - 166,1;полученное m/z, 167,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 12,11 (уш. с, 1H), 8,14 (с, 1H), 3,78-3,58 (м, 1H), 2,28 (с, 3H), 1,14-0,80 (м, 4H). Структура подтверждена спектроскопией ядерного эффекта Оверхаузера.
Промежуточное соединение 94: 1-Метил-1H-пиразоло[3,4-b]пиридин-4-карбоновая кислота.
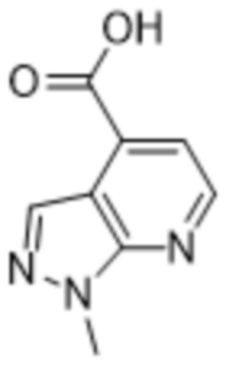
Стадия А: 4-йод-1-метилпиразоло[3,4- b ]пиридин. К раствору 4-йод-1H-пиразоло[3,4-b]пиридина (405 мг, 1,65 ммоль) в N, N-диметилформамиде (4 мл) добавляли гидрид натрия (60% в минеральном масле, 80 мг, 2,0 ммоль) при 0°C и реакционную смесь перемешивали при 0°C в течение 15 мин. К реакционной смеси добавили йодметан (115 мкл, 1,85 ммоль, 2,28 г/мл) и реакционную смесь перемешивали при 0°C в течение 45 мин. Реакционную смесь вливали в воду (20 мл) и экстрагировали этилацетатом (3×15 мл). Комбинированные органические слои сушили над сульфатом магния, фильтровали и выпаривали. Остаток очищали методом колоночной хроматографии на силикагеле с элюированием смесью н-гептан:этилацетат (9:1) с получением указанного в заголовке соединения (200 мг, 0,772 ммоль, 47%) в виде белого порошка. МС (ИЭР): масса, рассчитанная для C7H6IN3, - 259,0; полученное m/z, 260,0 [M+H]+.
Стадия B: 1-метилпиразоло[3,4- b ]пиридин-4-карбонитрил.
К раствору 4-йод-1-метилпиразоло[3,4-b]пиридина (150 мг, 0,579 ммоль) в диметилсульфоксиде (1,5 мл) добавляли цианид меди(I) (62 мг, 0,692 ммоль). Реакционную смесь перемешивали при 120°C в течение 20 ч в атмосфере аргона и вливали в воду (15 мл). Осадок собирали с получением неочищенного указанного в заголовке соединения (165 мг) в виде оранжевого порошка. МС (ИЭР): масса, рассчитанная для C8H6N4, - 158,1; полученное m/z, 157,1 [M+H]-.
Стадия C: 1-метилпиразоло[3,4- b ]пиридин-4-карбоновая кислота. К смеси 1-метилпиразоло[3,4-b]пиридин-4-карбонитрила (150 мг, 0,948 ммоль) в воде (1 мл) и 1,4-диоксане (1 мл) добавляли гидроксид натрия (1 M, 960 мкл, 0,96 ммоль). Реакционную смесь перемешивали при 80°C в течение 20 ч и фильтровали. Фильтрат разбавляли в воде (5 мл) и экстрагировали этилацетатом (2 х 5 мл). Водный слой подкислили до pH 4 1М соляной кислоты. Осадок собирали с получением указанного в заголовке соединения (35 мг, 0,198 ммоль, 21%) в виде желтовато-коричневого порошка. МС (ИЭР): масса, рассчитанная для C8H7N3O2, - 177,1; полученное m/z, 178,1 [M+H]+.
Промежуточное соединение 95: 7-метилимидазо[1,2-a]пиридин-5-карбоксиловая кислота.
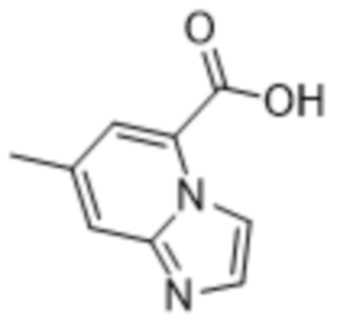
Стадия А: 7-метилимидазо[1,2- a ]пиридин-5-карбонитрил. К раствору 5-бром-7-метилимидазо[1,2-a]пиридина (300 мг, 1,42 ммоль) в диметилсульфоксиде (3 мл) добавляли цианид меди(I) (152 мг, 1,70 ммоль). Реакционную смесь перемешивали при 120°C в течение 20 часов. К реакционной смеси добавляли йодид меди(I) (54 мг, 0,284 ммоль). Реакционную смесь перемешивали при 120°C в течение 20 ч. Реакционную смесь вливали в воду (20 мл). Осадок собирали и растирали с теплым хлороформом (3 х 20 мл). Фильтрат выпаривали с получением указанного в заголовке соединения (103 мг, 0,655 ммоль, 46%) в виде желтовато-коричневого порошка. МС (ИЭР): масса, рассчитанная для C9H7N3, - 157,1; полученное m/z, 158,1 [M+H]+.
Стадия B: 7-метилимидазо[1,2- a ]пиридин-5-карбоксиловая кислота. К смеси 7-метилимидазо[1,2-a]пиридин-5-карбонитрила (93 мг, 0,592 ммоль) в воде (1,5 мл) и 1,4-диоксане (1,5 мл) добавляли гидроксид натрия (59 мг, 1,48 ммоль). Реакционную смесь перемешивали при 50°C в течение 1 ч. Смесь подкисляли до pH 4 с помощью 1 M соляной кислоты. Смесь выпаривали. Остаток растирали с метанолом (2×3 мл) и фильтрат выпаривали с получением указанного в заголовке соединения (120 мг, неочищ.) в виде бледно-желтого порошка. МС (ИЭР): масса, рассчитанная для C9H8N2O2, - 176,1; полученное m/z, 177,1 [M+H]+. 1H ЯМР (500 MГц, ДМСО-d6) δ 8,86 (д, J=2,0 Гц, 1H), 8,16-8,09 (м, 1H), 8,00-7,96 (м, 1H), 7,96-7,93 (м, 1H), 3,72-3,17 (м, 1H), 2,54 (с, 3H).
Промежуточное соединение 96: калий 7-фторимидазо[1,2-a]пиридин-3-карбоксилат.
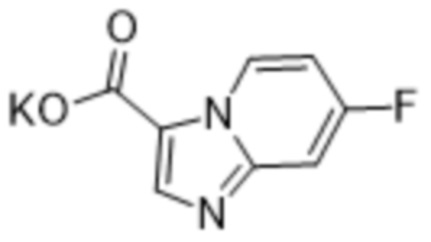
К раствору этил 7-фторимидазо[1,2-a] пиридин-3-карбоксилата (100 мг, 0,5 ммоль) в ТГФ (4,0 мл) добавляли триметилсиланилат калия (92,4 мг, 0,72 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 16 ч. Затем реакционную смесь фильтровали и промывали ТГФ с получением указанного в заголовке соединения в виде белого твердого вещества, которое применяли на следующей стадии без очистки. МС (ИЭР): масса, рассчитанная для C8H4FKN2O2, - 218,0; полученное m/z, 181,1 [M-K+2H]+.
Промежуточное соединение 97: 2,7-диметилимидазо[1,2-b]пиридазин-3-карбоксилат калия.
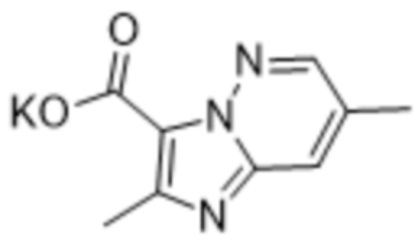
Стадия А: этил 2,7-диметилимидазо[1,2-b] пиридазин-3-карбоксилат. К раствору 5-метилпиридазин-3-амина (250 мг, 2,3 ммоль) в 1,2-диметоксиэтане (2,2 мл, 20, 8 ммоль) добавляли этил-2-хлор-3-оксобутаноат (2,3 мл, 2,7 ммоль) и смесь нагревали до 90°C в течение 1 ч. Реакционную смесь концентрировали при пониженном давлении, разбавляли этилацетатом, промывали органический слой водой(x2). Объединенные органические экстракты сушили над безводным Na2SO4 и концентрировали под вакуумом. Очистка с помощью флэш-хроматографии (SiO2; 0-100% EtOAc/смесь гексанов) позволила получить Титульное соединение в виде белого твердого вещества (86,4 мг, выход 20%). МС (ИЭР): масса, рассчитанная для C11H13 N 3O2, - 219,1, полученное m/z - 220,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,57 (д, J=2,1 Гц, 1H), 7,98-7,90 (м, 1H), 4,35 (к, J=7,1 Гц, 2H), 2,60 (с, 3H), 2,41 (д, J=1,2 Гц, 3H), 1,34 (т, J=7,1 Гц, 3H).
Стадия B: 2,7-диметилимидазо[1,2-b]пиридазин-3-карбоксилат калия. Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 96, используя этил-2,7-диметилимидазо[1,2-b] пиридазин-3-карбоксилат (стадия A) вместо этил-7-фторимидазо[1,2-a]-пиридин-3-карбоксилата и перемешивая реакционную смесь при 60°C вместо комнатной температуры. МС (ИЭР): масса, рассчитанная для C9H8KN3O2, - 229,0; полученное m/z, 192,0 [M-K+2H] +.
Промежуточное соединение 98: 2,5,8-триметилимидазо[1,2-a]пиразин-3-карбоксилат калия.
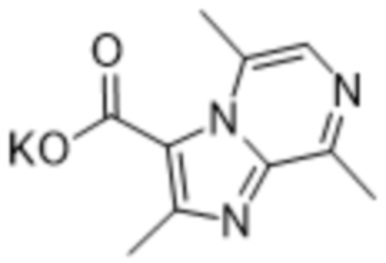
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 97, используя 3,6-диметилпиразин-2-амин вместо 5-метилпиридазин-3-амина на стадии A. МС (ИЭР): масса, рассчитанная для C10H10KN3O2, - 243,0; полученное m/z, 206,1 [M-K+2H] +.
Промежуточное соединение 99: 3-метилимидазо[1,5-a]пиразин-1-карбоксилат натрия.
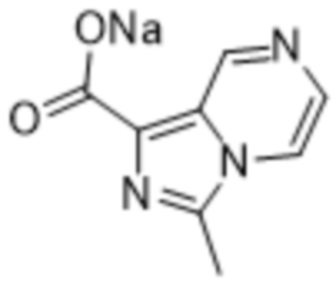
К раствору метил-3-метилимидазо[1,5-a] пиразин-1-карбоксилата (53 мг, 0,28 ммоль) в этаноле (3,0 мл) добавляли раствор гидроксида натрия (33 мг, 0,83 ммоль) в воде (1,0 мл). Полученную смесь перемешивали при 80°C в течение 16 ч. Затем реакционную смесь фильтровали и промывали этилацетатом с получением указанного в заголовке соединения в виде белого твердого вещества, которое использовали на следующей стадии без очистки. МС (ИЭР): масса, рассчитанная для C8H6 N 3 NaO 2, - 199,0, полученное m/z - 178,1 [M-Na+2H]+.
Промежуточное соединение 100: 2-(трифторметил)пиразоло[1,5-a]пиридин-3-карбоновая кислота.
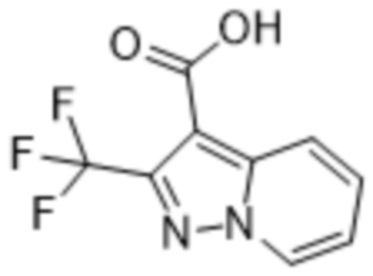
Стадия А: этил-2-(трифторметил)пиразоло[1,5-а]пиридин-3-карбоксилат. Раствор 1-аминопиридин-1-ия (1 г, 10,5 ммоль) в ДМФ (10 мл) охлаждали до 0 ºC на ледяной бане и добавляли этил-4,4,4-трифторбут-2-иноат (1,5 мл, 10,5 ммоль) с последующим добавлением ТЭА (1,5 мл, 10,5 ммоль) и 2,3-дихлор-5,6-дициано-п-бензохинона (DDQ) (2,39 г, 10,5 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь охлаждали до 0 ºC на ледяной бане и добавляли 2,3-дихлор-5,6-дициано-п-бензохинон (2,39 г, 10,5 ммоль), который перемешивали в течение ночи при нагревании до комнатной температуры. Реакционную смесь вливали в воду и экстрагировали ДХМ (2x). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, отфильтровали, концентрировали при пониженном давлении и очищали (FCC, SiO2; 0-30% EtOAc/смесь гексанов) с получением указанного в заголовке соединения (220 мг, 8%). МС (ИЭР): масса, рассчитанная для C11H9F3N2O2, - 258,0; полученное m/z, 259,0 [M+H]+.
Стадия B: 2-(трифторметил)пиразоло[1,5-a]пиридин-3-карбоновая кислота.
К раствору этил-2-(трифторметил)пиразоло[1,5-а]пиридин-3-карбоксилата (220 мг, 0,852 ммоль) в ТГФ/этанол/H2O (1:1:1, 3 мл) добавляли LiOH (82 мг, 3,4 ммоль). Полученный раствор перемешивали при к.т. в течение ночи. Завершенную реакцию концентрировали и ресуспендировали в воде. Реакционную смесь подкисляли с помощью 1 Н HCl и экстрагировали EtOAc (3x). Органический слой сушили над Na2SO4, фильтровали и концентрировали с получением указанного в заголовке соединения, которое затем переносили без дополнительной очистки (216 мг, 100%). МС (ИЭР): масса, рассчитанная для C9H5F3N2O2, - 230,0; полученное m/z, 231,0 [M+H]+.
Промежуточное соединение 101: литий-хиноксалин-6-карбоновая-2,3-d2 кислота.
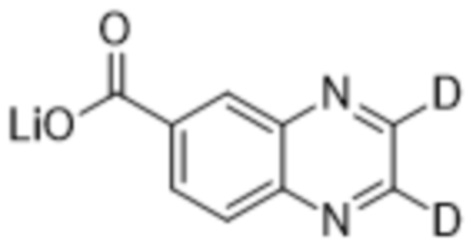
Стадия А: метил 2,3-дигидроксихиноксалин-6-карбоксилат. Раствор метил-3,4-диаминобензоата (1,0 г, 6,0 ммоль) в диэтилоксалате (20,0 мл) нагревали до 140°C на масляной бане в течение 16 ч. Полученную смесь охлаждали до комнатной температуры и твердые вещества собирали фильтрацией, затем сушили под вакуумом с получением указанного в заголовке соединения в виде желтого твердого вещества (780 мг, выход 60%). МС (ИЭР): масса, рассчитанная для C10H8 N 2O4, - 220,1, полученное m/z, 221,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 12,10 (д, J=74,3 Гц, 2H), 7,78-7,62 (м, 2H), 7,20 (д, J=8,4 Гц, 1H), 3,84 (с, 3H).
Стадия B: метил 2,3-дихлорхиноксалин-6-карбоксилат. К раствору метил 2,3-дигидроксихиноксалин-6-карбоксилата (590 мг, 2,7 ммоль) в толуоле (16,0 мл) добавляли тионилхлорид (3,8 мл, 53,6 ммоль), а затем N, N-диметилформамид (0,25 мл, 3,2 ммоль). Полученный раствор нагревали до температуры кипения с обратным холодильником в течение 3 ч. После охлаждения смеси концентрировали растворитель под вакуумом и растирали с этилацетатом. Полученное коричневое твердое вещество фильтровали и сушили в вакууме с получением указанного в заголовке соединения (308 мг, 45% выход). МС (ИЭР): масса, рассчитанная для C10H6 Cl 2N2O2, - 257,1; получено m/z, 257,9 [M+H]+.
Стадия C: метилхиноксалин-6-карбоксилат-2,3- d 2 . К раствору метил 2,3-дихлорхиноксалин-6-карбоксилата (208 мг, 0,81 ммоль) в ТГФ (16,0 мл) добавляли PdCl2(dppf) (30 мг, 0,04 ммоль), N1, N1, N2, N2-тетраметилэтан-1,2-диамин (0,21 мл, 1,37 ммоль) и бородейтерид натрия (68 мг, 1,62 ммоль). Смесь дегазировали азотом и затем перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь разводили водой и экстрагировали этилацетатом (x2). Объединенные органические экстракты сушили над Na2SO4 и концентрировали. Очистка с помощью флэш-хроматографии (SiO2; 0-100% EtOAc/смесь гексанов) позволила получить Титульное соединение в виде белого твердого вещества (72,5 мг, выход 47%). МС (ИЭР): масса, рассчитанная для C10H6 D 2N2O2, - 190,2; получено m/z, 191,0 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,65 (дд, J=1,9, 0,6 Гц, 1H), 8,33 (дд, J=8,7, 1,9 Гц, 1H), 8,23 (дд, J=8,7, 0,6 Гц, 1H), 3,97 (c, 3H).
Стадия D: хиноксалин-6-карбоксилат лития-2,3- d2 к раствору метилхиноксалин-6-карбоксилат-2,3-d2 (68 мг, 0,36 ммоль) в ТГФ (2,4 мл) добавили раствор гидроксида лития (17,0 мг, 0,72 ммоль) в воде (1,0 мл). Смесь перемешивали при комнатной температуре в течение 1 ч, затем концентрировали с получением указанного в заголовке соединения в виде белого твердого вещества, которое дополнительно использовали на следующей стадии без очистки (количественный выход). МС (ИЭР): масса, рассчитанная для C9H3 D 2 LiN 2O2, - 182,1; получено m/z, 177,1 [M+H]+.
Промежуточное соединение 102: литий-хиноксалин-6-карбоновая-2-d кислота.
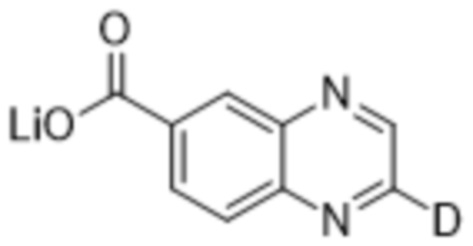
Титульное соединение получали аналогично промежуточному соединению 101, используя этил-2-оксоацетат и этанол вместо диэтилоксалата, и перемешивали реакционную смесь при комнатной температуре вместо нагревания на стадии A. МС (ИЭР): масса, рассчитанная для C9H4DLiN2O2, - 181,1, получено m/z, 175,9[M-Li+2 H] +.
Промежуточное соединение 103: 2,6,6-триметил-6,7-дигидро-4H-пиразол[5,1-c][1,4]оксазин-3-карбоксилата калия.
Стадия А: 6,6-диметилморфолин-3-карбоновая кислота. К раствору 4-(трет-бутил)3-метил-6,6-диметилморфолин-3,4-дикарбоксилата (5 г, 18,3 ммоль) в ДХМ (18,3 мл) добавляли трифторуксусную кислоту (6,0 мл) и перемешивали реакционную смесь при комнатной температуре в течение 2 ч. Концентрировали растворитель, растворяли неочищенный остаток в метаноле (MeOH) (9,2 мл) с последующим добавлением гидроксида натрия (3,0 г, 73,2 ммоль) в воде. Концентрировали растворитель, используя роторный испаритель, и неочищенный продукт использовали на следующей стадии без очистки. МС (ИЭР): масса, рассчитанная для C7H13NO3, - 159,1, полученное m/z, 160,2 [M+H]+.
Стадия B: 6,6-диметил-6,7-дигидро-4H- [1,2,3] оксадиазоло[4,3-c][1,4]оксазин-8-ий-3-олат. К раствору 6,6-диметилморфолин-3-карбоновой кислоты (2,9 г, 18,3 ммоль) в воде (1,8 мл, 95,2 ммоль) добавляли нитрит натрия (1,9 г, 27,4 ммоль) и соляную кислоту (37% водный раствор) (1,24 мл, 14,8 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 16 часов, затем разбавили водой и экстрагировали 3 раза смесью 20% изопропилового спирта и хлороформа. Объединенные органические экстракты сушили над безводным Na2SO4 и концентрировали под вакуумом. Неочищенный остаток затем растворяли в ацетонитриле (7,5 мл) с последующим добавлением 2,2,2-трифторуксусного ангидрида (1,5 мл, 11,1 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь гасили карбонатом калия (2,0 г, 14,8 ммоль), добавляли воду и фильтровали с получением указанного в заголовке соединения в виде кристаллического осадка, экстрагированного 3 раза с помощью 20% iPrOH/хлороформа. Твердое вещество использовали на следующей стадии без дополнительной очистки. МС (ИЭР): масса, рассчитанная для C7H12N2O4, - 170,2; полученное m/z, 171,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ ч/млн 4,6 (с, 2H) 4,3 (с, 2H) 1,3 (с, 6H).
Стадия C: этил-2,6,6-триметил-6,7-дигидро-4H-пиразол[5,1-c] [1,4] оксазин-3-карбоксилата:
К раствору 6,6-диметил-6,7-дигидро-4H- [1,2,3] оксадиазоло[4,3-c] [1,4]оксазин-8-ий-3-олата (200 мг, 1,2 ммоль) в ксилоле (4,0 мл) добавили этилбут-2-иноат (0,28 мл, 2,4 ммоль) и перемешивали смесь при 145°C в течение 16 ч. Концентрировали растворитель и очищали с помощью флэш-хроматографии (SiO2; 0-100% EtOAc/гексаны) с получением указанного в заголовке соединения в качестве основного региоизомера (91 мг, выход 33%). МС (ИЭР): масса, рассчитанная для C12H18N2O3, - 238,3; полученное m/z, 239,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 4,88 (с, 2H), 4,17 (к, J=7,1 Гц, 2H), 3,89 (с, 2H), 2,32 (с, 3H), 1,28 (с, 1H), 1,27-1,24 (м, 8H).
Стадия D: 2,6,6-триметил-6,7-дигидро-4H-пиразол[5,1-c][1,4]оксазин-3-карбоксилат калия: Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 96, используя этил-2,6,6-триметил-6,7-дигидро-4H-пиразол[5,1-c] [1,4] оксазин-3-карбоксилат (стадия C) вместо этил-7-фторимидазо[1,2-a] пиридин-3-карбоксилата и перемешивали реакционную смесь при 60°C в течение 24 ч, а не при комнатной температуре. МС (ИЭР): масса, рассчитанная для C10H13KN2O3, - 248,1; полученное m/z, 211,1 [M-K+2H] +.
Промежуточное соединение 104: трет-бутил (5S,8R)-2-метил-3-(((трифторметил)сульфонил)окси)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-карбоксилат.
Титульное соединение получали из той же хиральной очистки СФХ рацемического трет-бутил (5R,8S)-2-метил-3-(((трифторметил)сульфонил)окси)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-карбоксилата (промежуточное соединение 35), применяемого для получения указанного в заголовке соединения (одного энантиомера; время удержания 1,13 мин). МС (ИЭР): масса, рассчитанная для C15H20F3N3O5S, - 411,1; полученное m/z, 356,0 [M+2H-трет-бутил] +.
Промежуточное соединение 105: (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат.
Стадия А: трет -бутил (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-карбоксилат. Флакон для микроволновой обработки с трет-бутил (5R,8S)-2-метил-3-(((трифторметил)сульфонил)окси)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-карбоксилатом (промежуточное соединение 35) (500 мг, 1,22 ммоль), (3,4,5-трифторфенил)бороновой кислотой (257 мг, 1,46 ммоль), карбонатом натрия (386 мг, 3,65 ммоль) и XPhos Pd G2 (96 мг, 0,12 ммоль) в 1,4-диоксане (17 мл) и воде (2 мл) продували N2 в течение 5 мин. Полученную смесь нагревали в микроволновом реакторе в течение 30 минут при температуре 110 ºC. Завершенную реакционную разбавляли водой и экстрагировали в ДХМ (3x). Объединенные органические компоненты сушили над Na2SO4, отфильтровали, концентрировали при пониженном давлении и очищали (FCC, SiO2; 0-30% EtOAc/смесь гексанов) с получением указанного в заголовке соединения (465 мг, 97%). МС (ИЭР): масса, рассчитанная для C20H22F3N3O2, - 393,2; полученное m/z, 338,0 [M+2H-трет-бутил] +.
Стадия B: (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат. К раствору трет-бутил (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-карбоксилата (950 мг, 2,42 ммоль) в ДХМ (10 мл) добавляли трифторуксусную кислоту (ТФУ) (3,5 мл, 45,8 ммоль) и перемешивали при комнатной температуре в течение 30 мин. Завершенную реакцию концентрировали и использовали далее без дополнительной очистки (983 мг, 100%). МС (ИЭР): масса, рассчитанная для C15H14F3N3, - 293,3; полученное m/z, 294,0 [M+H]+.
Промежуточное соединение 106: (5R,8S)-2-метил-3-фенил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат.
Титульное соединение получали способом, аналогичным способу получения промежуточного соединения 105, используя фенилбороновую кислоту вместо (3,4,5-трифторфенил)бороновой кислоты на стадии А. МС (ИЭР): масса, рассчитанная для C15H17N3, - 239,1; полученное m/z, 240,1 [M+H]+.
Промежуточное соединение 107: (5R,8S)-2-метил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-3-ил трифторметансульфонат 2,2,2-трифторацетат.
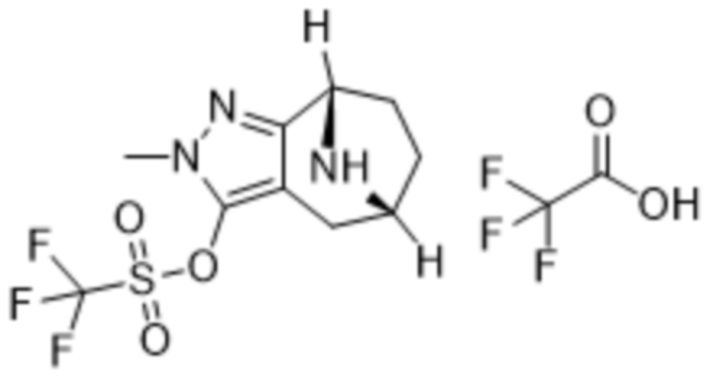
К раствору трет-бутил (5R,8S)-2-метил-3-(((трифторметил)сульфонил)окси)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-карбоксилата (промежуточное соединение 104) (235 мг, 0,571 ммоль) в ДХМ (5 мл) добавляли ТФУ (0,85 мл, 11,07 ммоль) и перемешивали при комнатной температуре в течение 30 мин. Завершенную реакцию концентрировали и использовали далее без дополнительной очистки (177 мг, 100%). МС (ИЭР): масса, рассчитанная для C10H12F3N3O3S, - 311,1; полученное m/z, 312,0 [M+H]+.
Промежуточное соединение 108: (5R,8S)-9-(3-метоксибензоил)-2-метил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-3-илтрифторметансульфонат.
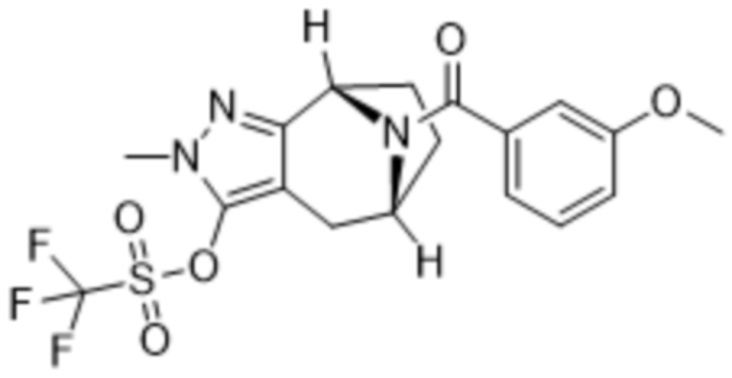
В раствор (5R,8S)-2-метил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-3-ил трифторметансульфоната 2,2,2-трифторацетата (промежуточное соединение 107) (90 мг, 0,289 ммоль), 3-метоксибензойной кислоты (58 мг, 0,379 ммоль) и HATU (330 мг, 0,867 ммоль) в ДМФ (11 мл) добавляли DIEA (200 μл, 1,16 ммоль). Полученный раствор перемешивали при к.т. в течение ночи. Завершенную реакцию разбавляли водой и экстрагировали в ДХМ (x2), объединенные органические компоненты сушили над Na2SO4, фильтровали, концентрировали при пониженном давлении и очищали (FCC, SiO2; 0-10% MeOH/ДХМ) с получением указанного в заголовке соединения (62 мг, 48%). МС (ИЭР): масса, рассчитанная для C18H18F3N3O5S, - 445,1; полученное m/z, 446,0 [M+H]+.
Промежуточное соединение 109: (5R,8S)-9-(5-циклопропил-1-метил-1H-пиразол-4-карбонил)-2-метил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-3-ил трифторметансульфонат.
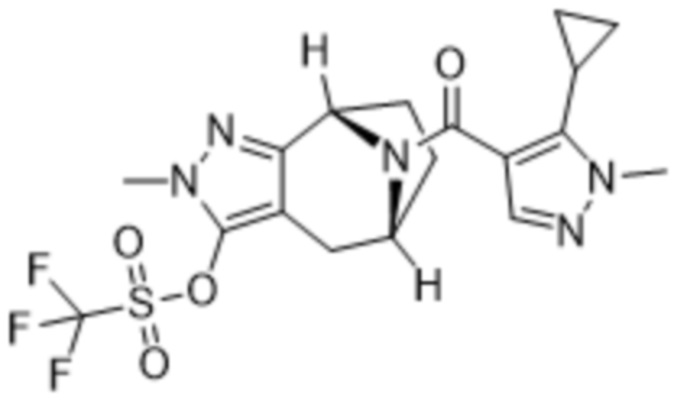
Титульное соединение получали способом, аналогичным для промежуточного соединения 108, используя 5-циклопропил-1-метил-1H-пиразол-4-карбоновую кислоту вместо 3-метоксибензойной кислоты. МС (ИЭР): масса, рассчитанная для C18H20F3N5O4S, - 459,1; полученное m/z, 460,0 [M+H]+.
Промежуточное соединение 110: (5R,8S)-2-метил-9-(хинолин-6-карбонил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-3-ил трифторметансульфонат.
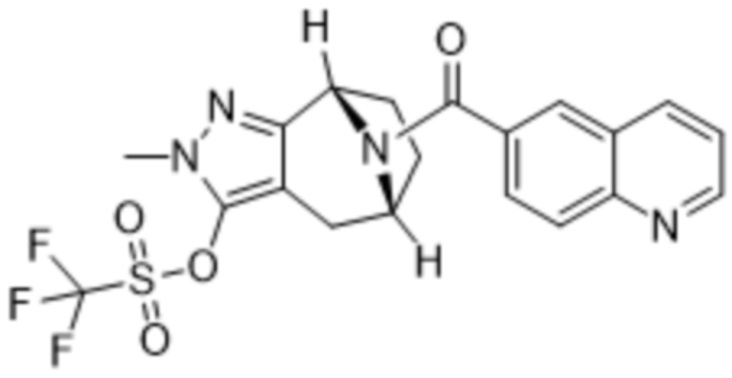
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 108, используя хинолин-6-карбоновую кислоту вместо 3-метоксибензойной кислоты. МС (ИЭР): масса, рассчитанная для C18H17F3N4O4S, - 466,1; полученное m/z, 467,0 [M+H]+.
Промежуточное соединение 111: (5S,8R)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат.
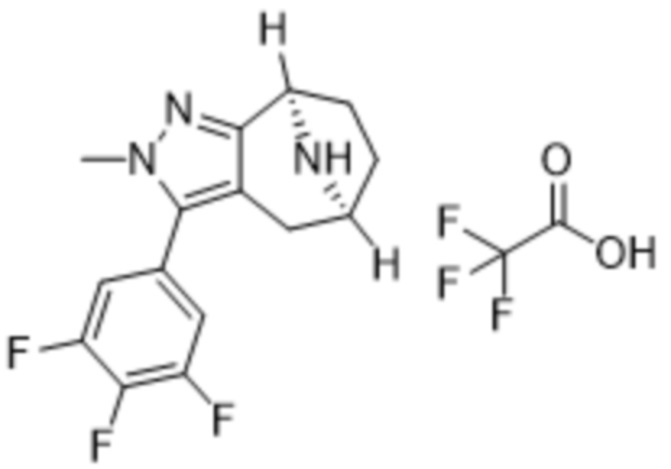
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 105, используя трет-бутил (5S,8R)-2-метил-3-(((трифторметил)сульфонил)окси)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-карбоксилат вместо (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетата на стадии A. МС (ИЭР): масса, рассчитанная для C15H14F3N3, - 293,3; полученное m/zЮ 294,1 [M+H]+.
Промежуточное соединение 112: 5-фтор-2-(2H-1,2,3-триазол-2-ил)бензойная кислота.
Титульное соединение получали способом, аналогичным описанному для промежуточного соединения 44, используя 5-фтор -2-йодбензойную кислоту вместо 3-йодбензойной кислоты и 1,2,3-триазол вместо 3-(трифторметил)пиразола. МС (ИЭР): масса, рассчитанная для C9H6FN3O2, - 207,0; полученное m/z, 208,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,34 (уш. с, 1H), 8,05 (с, 2H), 7,78 (дд, J=8,8, 4,9 Гц, 1H), 7,59 (дд, J=8,6, 2,9 Гц, 1H), 7,55 (тд, J=8,4, 3,0 Гц, 1H).
Пример 1. Рацемический ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил)метанон.
К раствору рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) (25 мг, 0,01 ммоль) в ДХМ (2,0 мл) добавляли 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиния 3-оксид гексафторфосфат (HATU) (45 мг, 0,12 ммоль), а затем N, N-диизопропилэтиламин (DIPEA или DIEA) (0,05 мл, 0,3 ммоль) и хинолин-6-карбоновой кислоты (18,8 мг, 0,11 ммоль) и смесь перемешивали в течение 1 ч при комнатной температуре. Затем реакционную смесь разбавляли водой и экстрагировали с помощью ДХМ (х2). Объединенные органические фазы промывали солевым раствором, сушили над Na2SO4, отфильтровывали и концентрировали в вакууме. Неочищенный продукт очищали обращенно-фазовой ВЭЖХ на колонке XBridge C18 (5 мкм, 100×4,6 мм), подвижная фаза 10-100% ACN в 20 мМ NH4OH с получением указанного в заголовке соединения в виде белого твердого вещества (16,2 мг, выход 40%). МС (ИЭР): масса, рассчитанная для C26H24N4O, - 408,2; полученное m/z - 409,2 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6): δ 9,07-8,89 (м, 1H), 8,48 (д, J=8,4 Гц, 1H), 8,20-8,02 (м, 2H), 7,88-7,73 (м, 1H), 7,68-7,39 (м, 6H), 5,17-4,81 (м, 1H), 4,11 (с, 1H), 3,76 (д, J=40,8 Гц, 3H), 3,23-2,93 (м, 1H), 2,49-2,31 (м, 1H), 2,14-1,38 (м, 6H).
Пример 2. ((5R,9S)-3-циклопропил-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил)метанон.
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-циклопропил-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 31) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C23H24N4O, - 372,2; полученное m/z - 373,0 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6): δ 9,07-8,81 (м, 1H), 8,56-8,40 (м, 1H), 8,16-7,93 (м, 2H), 7,83-7,50 (м, 2H), 5,69-5,56 (м, 1H), 4,78-4,57 (м, 1H), 3,81-3,69 (м, 3H), 3,40-3,38 (м, 2H), 1,92-1,22 (м, 7H), 0,97-0,85 (м, 2H), 0,80-0,60 (м, 2H).
Пример 3. Рацемический(2-хлор-3-метоксифенил) ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.

Титульное соединение получали способом, аналогичным описанному в примере 1, используя 2-хлор-3-метоксибензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H24ClN3O2, - 421,1; полученное m/z, 422,1 [M+H]+.
Пример 4. (2-хлор-3-метоксифенил) ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) метанон.
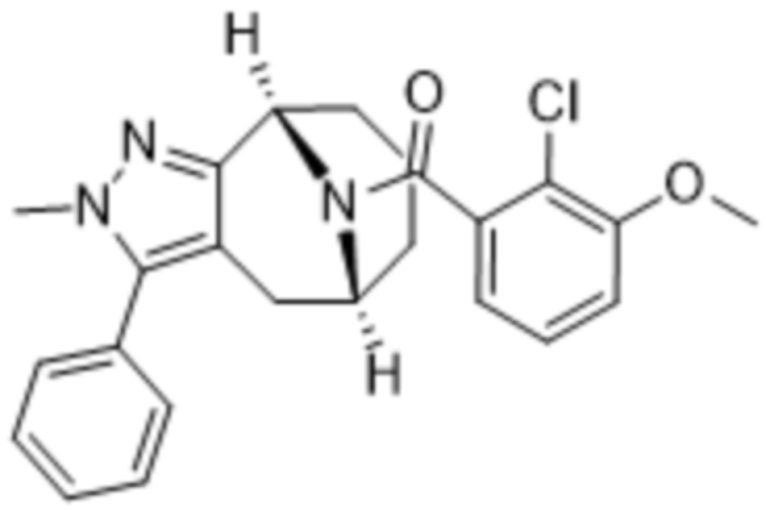
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 27) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-хлор-3-метоксибензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H24ClN3O2, - 421,1; полученное m/z, 422,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,56-7,30 (м, 6H), 7,24-7,16 (м, 1H), 7,10-6,62 (м, 1H), 5,82-5,67 (м, 1H), 3,92-3,86 (м, 3H), 3,85-3,66 (м, 4H), 3,14-2,67 (м, 1H), 2,38 (дд, J=19,2, 16,0 Гц, 1H), 1,95-1,34 (м, 6H).
Пример 5. (2-хлор-3-метоксифенил) ((5S,9R)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) метанон.
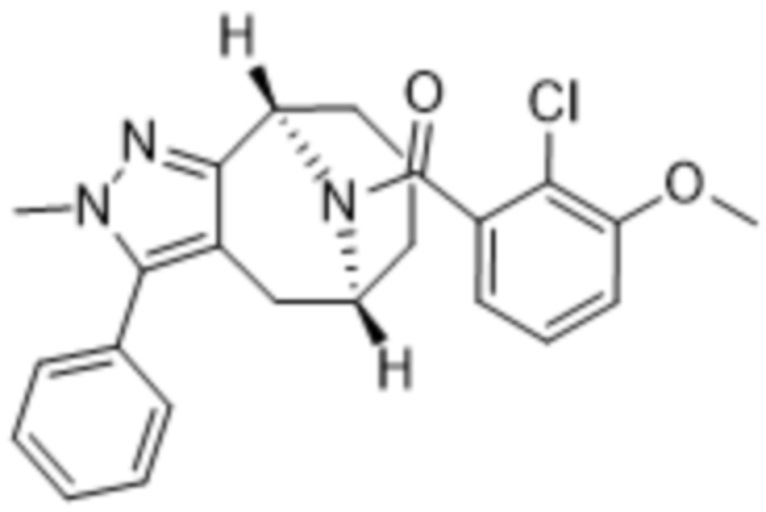
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5S,9R)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 26) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-хлор-3-метоксибензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H24ClN3O2, - 421,1; полученное m/z, 422,1 [M+H]+.
Пример 6. Рацемический (2-(1H-1,2,4-Триазол-1-ил) фенил)((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
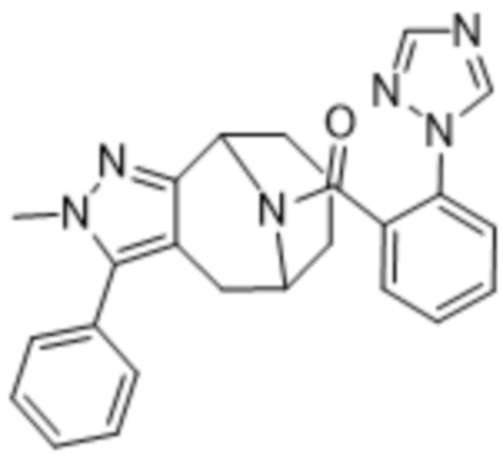
Титульное соединение получали способом, аналогичным описанному в примере 1, используя 2-(1 H-1,2,4-триазол-1-ил) бензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H24N6O, - 424,2; полученное m/z - 425,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,02-8,64 (м, 1H), 8,49-8,23 (м, 1H), 7,75-7,39 (м, 9H), 5,64 (с, 1H), 3,86-3,58 (м, 4H), 3,08-2,77 (м, 1H), 2,35 (дд, J=16,2, 8,4 Гц, 1H), 1,80-1,28 (м, 6H).
Пример 7. Рацемический (3-(4H-1,2,4-Триазол-4-ил) фенил)((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
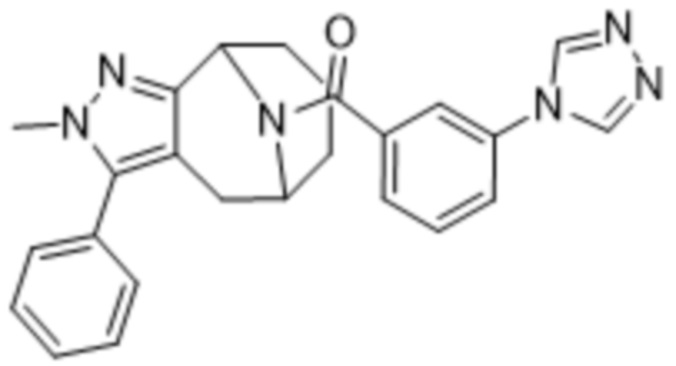
Титульное соединение получали способом, аналогичным описанному в примере 1, используя 3-(4H-1,2,4-триазол-4-ил) бензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H24N6O, - 424,2; полученное m/z - 425,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,21 (д, J=1,1 Гц, 2H), 7,93-7,76 (м, 2H), 7,71-7,59 (м, 1H), 7,58-7,35 (м, 6H), 5,79-5,68 (м, 1H), 4,03 (тд, J=7,0, 6,6, 4,6 Гц, 1H), 3,76 (д, J=40,0 Гц, 3H), 3,11-2,92 (м, 1H), 2,47-2,33 (м, 1H), 1,96-1,33 (м, 6H).
Пример 8. Рацемический (4-(1H-1,2,4-триазол-1-ил) фенил)((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
Титульное соединение получали способом, аналогичным описанному в примере 1, используя 4-(1 H-1,2,4-триазол-1-ил) бензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H24N6O, - 424,2; полученное m/z, 425,2 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,39 (с, 1H), 8,26 (д, J=2,7 Гц, 1H), 8,08-7,88 (м, 2H), 7,77-7,60 (м, 1H), 7,58-7,32 (м, 6H), 5,74 (с, 1H), 4,06 (с, 1H), 3,86-3,68 (м, 3H), 3,24-2,88 (м, 1H), 2,42 (д, J=16,2 Гц, 1H), 2,02-1,40 (м, 6H).
Пример 9. Рацемический (3-(1H-имидазол-1-ил) фенил) ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) метанон.
Титульное соединение получали способом, аналогичным описанному в примере 1, используя 3-(1H-имидазол-1-ил) бензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H25N5O, - 423,2; полученное m/z, 424,2 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,35 (дд, J=3,0, 1,8 Гц, 1H), 7,90-7,31 (м, 10H), 7,11 (дд, J=3,1, 1,9 Гц, 1H), 5,74 (с, 1H), 4,04 (с, 1H), 3,83-3,67 (м, 3H), 3,19-2,90 (м, 1H), 2,40 (д, J=16,1 Гц, 1H), 2,03-1,36 (м, 6H).
Пример 10. Рацемический (1-метил-1H-1,2,4-триазол-3-ил)((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
Титульное соединение получали способом, аналогичным описанному в примере 1, используя 1-метил-1H-1,2,4-триазол-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C20H22N6O, - 362,2; полученное m/z, 363,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,58 (дд, J=21,7, 0,7 Гц, 1H), 7,61-7,35 (м, 5H), 5,55 (д, J=172,8 Гц, 1H), 5,07-4,44 (м, 1H), 3,95-3,87 (м, 3H), 3,81-3,70 (м, 3H), 3,17-2,89 (м, 1H), 2,47-2,28 (м, 1H), 1,93-1,36 (м, 6H).
Пример 11. Рацемический (5-хлор-1-метил-1H-пиразол-4-ил)((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
Титульное соединение получали способом, аналогичным описанному в примере 1, используя 5-хлор-1-метил-1H-пиразол-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C21H22ClN5O, - 395,2; полученное m/z, 396,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 7,74 (с, 1H), 7,57-7,37 (м, 5H), 5,73-5,56 (м, 1H), 4,33-4,18 (м, 1H), 3,82 (с, 3H), 3,78 (с, 3H), 3,14-2,93 (м, 1H), 2,65-2,31 (м, 1H), 2,07-1,55 (м, 4H), 1,56-1,30 (м, 2H).
Пример 12. Рацемический (5-метокси-1-метил-1H-пиразол-4-ил)((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
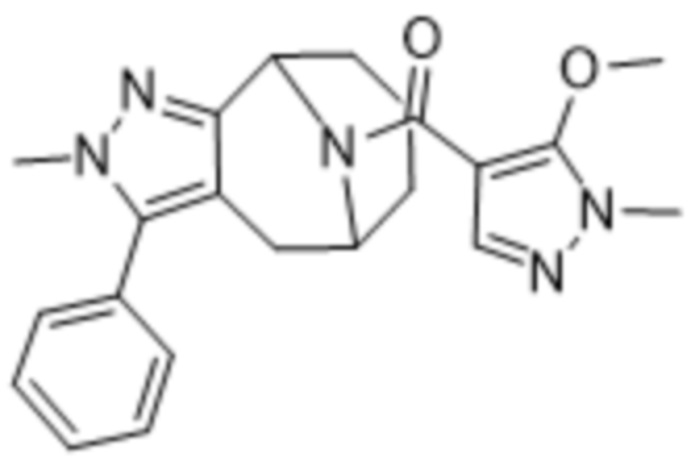
Титульное соединение получали способом, аналогичным описанному в примере 1, используя 5-метокси-1-метил-1H-пиразол-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C22H25N5O2, - 391,2; полученное m/z, 392,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,56-7,46 (м, 4H), 7,46-7,40 (м, 2H), 5,69-5,58 (м, 1H), 4,47-4,35 (м, 1H), 3,92 (с, 3H), 3,77 (с, 3H), 3,59 (с, 3H), 3,14-3,04 (м, 1H), 2,50-2,41 (м, 1H), 1,85-1,57 (м, 4H), 1,54-1,34 (м, 2H).
Пример 13. Рацемический (4-бром-1-метил-3-(трифторметил)-1H-пиразол-5-ил) ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
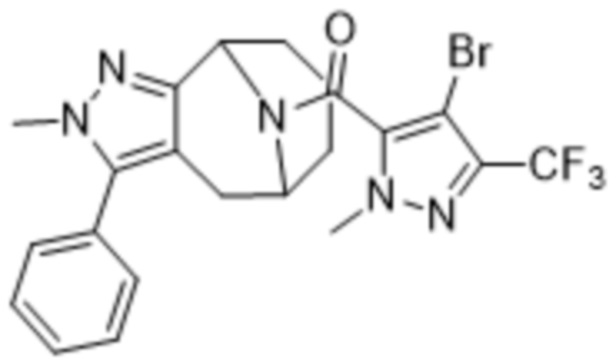
Титульное соединение получали способом, аналогичным описанному в примере 1, используя 4-бром-1-метил-3-(трифторметил)-1H-пиразол-5-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C22H21BrF3N5O, - 507,1; полученное m/z, 508,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,60-7,38 (м, 5H), 5,75 (д, J=18,7 Гц, 1H), 4,04-3,71 (м, 6H), 3,31-2,85 (м, 2H), 2,64-2,52 (м, 1H), 2,05-1,32 (м, 6H).
Пример 14. Рацемический (5-циклопропил-1-метил-1H-пиразол-4-ил)((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
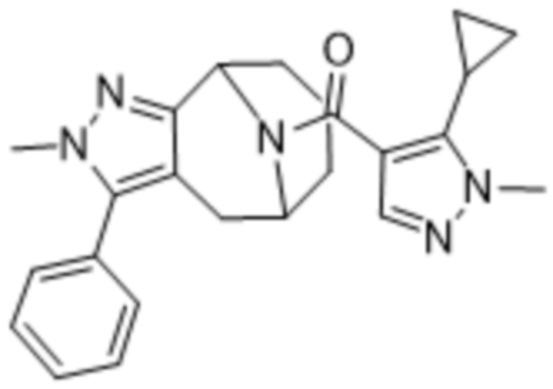
Титульное соединение получали способом, аналогичным описанному в примере 1, используя 4-хлорхинолин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H27N5O, - 401,2; полученное m/z, 402,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6): δ 7,55-7,30 (м, 6H), 5,72 (д, J=26,3 Гц, 1H), 4,94 (д, J=32,7 Гц, 1H), 3,88-3,79 (м, 3H), 3,81-3,68 (м, 3H), 3,11-2,88 (м, 1H), 2,46-2,28 (м, 1H), 1,88-1,36 (м, 7H), 0,96-0,78 (м, 2H), 0,65-0,33 (м, 2H).
Пример 15. Рацемический ((5R,9S)-2-Метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (1-фенил-1H-1,2,4-триазол-3-ил)метанон.
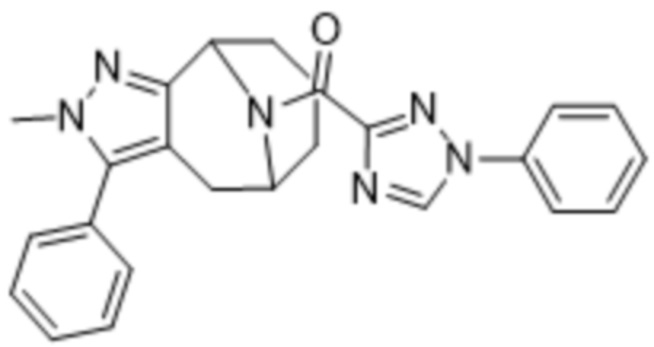
Титульное соединение получали способом, аналогичным описанному в примере 1, используя 1-фенил-1H-1,2,4-триазол-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H24N6O, - 424,2; полученное m/z, 425,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,41 (д, J=18,5 Гц, 1H), 7,96-7,79 (м, 2H), 7,64-7,56 (м, 2H), 7,55-7,40 (м, 6H), 5,57 (д, J=203,7 Гц, 1H), 5,10-4,52 (м, 1H), 3,76 (д, J=29,6 Гц, 3H), 3,18-2,96 (м, 1H), 2,56 (д, J=16,2 Гц, 1H), 2,06-1,39 (м, 6H).
Пример 16. Рацемический ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (1-фенил-1H-пиразол-3-ил)метанон.
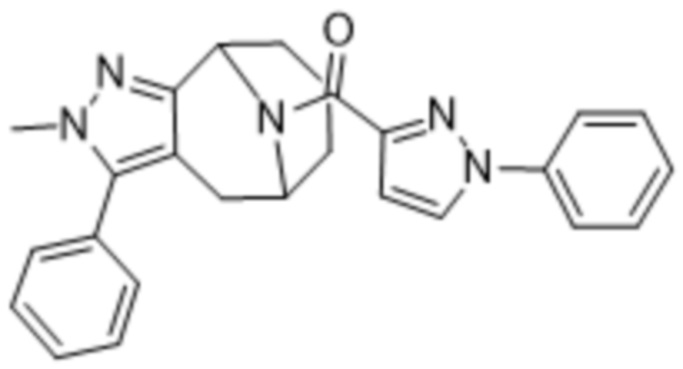
Титульное соединение получали способом, аналогичным описанному в примере 1, используя 1-фенил-1H-пиразол-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H25N5O, - 423,2; полученное m/z, 424,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,60 (дд, J=13,8, 2,5 Гц, 1H), 7,95-7,79 (м, 2H), 7,62-7,30 (м, 8H), 6,84 (дд, J=2,5, 1,4 Гц, 1H), 6,03-5,68 (м, 1H), 5,19-5,01 (м, 1H), 3,85-3,62 (м, 3H), 3,15-3,01 (м, 1H), 2,57-2,53 (м, 1H), 1,91-1,38 (м, 6H).
Пример 17. Рацемический (5-метокси-1-фенил-1H-пиразол-3-ил) ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) метанон.
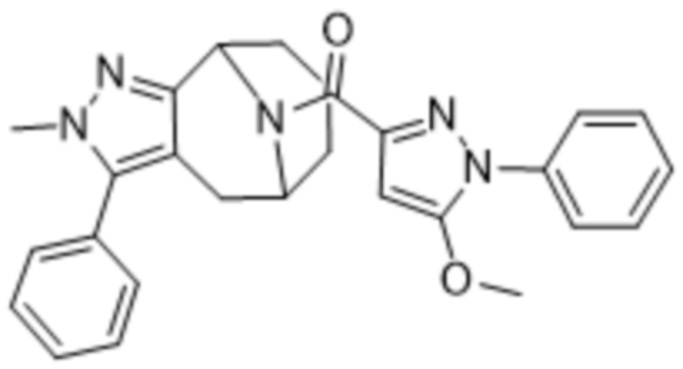
Титульное соединение получали способом, аналогичным описанному в примере 1, используя 5-метокси-1-фенил-1H-пиразол-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C27H27N5O2, - 453,2; полученное m/z, 454,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 7,74-7,57 (м, 2H), 7,58-7,30 (м, 8H), 6,22 (с, 1H), 6,10-5,71 (м, 1H), 5,12 (д, J=72,4 Гц, 1H), 4,00-3,92 (м, 3H), 3,81-3,65 (м, 3H), 3,14-2,96 (м, 1H), 2,07-1,38 (м, 7H).
Пример 18. Рацемический (1-метил-1H-индол-4-ил) ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
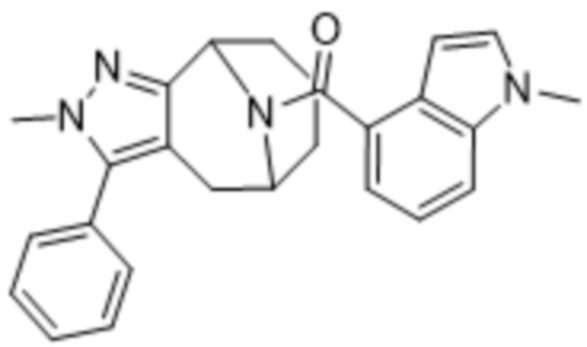
Титульное соединение получали способом, аналогичным описанному в примере 1, используя 1-метил-1H-индол-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H26N4O, - 410,2; полученное m/z - 411,1 [M+H]+. 1 H ЯМР (400 МГц, ДМСО-d6) δ 7,57-7,38 (м, 6 H), 7,27-7,14 (м, 1 H), 6,98 (д, J=7,0 Гц, 1 H), 6,32 (д, J=23,4 Гц, 1 H), 5,78 (д, J=21,0 Гц, 1 H), 4,14-3,76 (м, 6 H), 3,69 (с, 1 H), 3,22-2,78 (м, 2 H), 2,31 (д, J=16,1 Гц, 1 H), 2,02-1,33 (м, 6 H).
Пример 19. Рацемический (5-хлор-1H-индол-6-ил) ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) метанон.
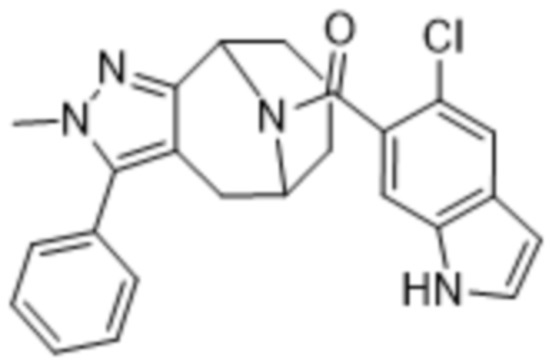
Титульное соединение получали способом, аналогичным описанному в примере 1, используя 5-хлор-1H-индол-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H23ClN4O, - 430,1; полученное m/z - 431,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 11,48-11,13 (м, 1H), 7,82-7,61 (м, 1H), 7,57-7,37 (м, 5H), 7,18 (д, J=63,8 Гц, 1H), 6,60-6,42 (м, 1H), 5,92-5,67 (м, 1H), 5,21-4,45 (м, 1H), 3,85-3,68 (м, 3H), 3,24-2,73 (м, 2H), 2,45-2,32 (м, 1H), 2,04-1,27 (м, 6H).
Пример 20. Рацемический (7-метил-1H-индазол-5-ил) ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) метанон.
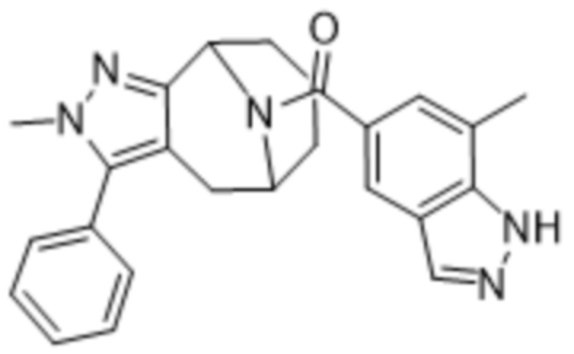
Титульное соединение получали способом, аналогичным описанному в примере 1, используя 7-метил-1H-индазол-5-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H25N5O, - 411,2; полученное m/z, 412,1 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 13,32 (с, 1H), 8,14 (д, J=10,6 Гц, 1H), 7,70-7,39 (м, 6H), 7,18 (с, 1H), 5,70 (с, 1H), 4,96 (д, J=20,3 Гц, 1H), 4,19 (с, 1H), 3,75 (д, J=36,8 Гц, 3H), 3,23-2,92 (м, 2H), 2,41 (д, J=16,3 Гц, 1H), 2,07-1,31 (м, 7H).
Пример 21. Рацемический (1-метил-1H-пирроло[2,3-b] пиридин-4-ил)((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
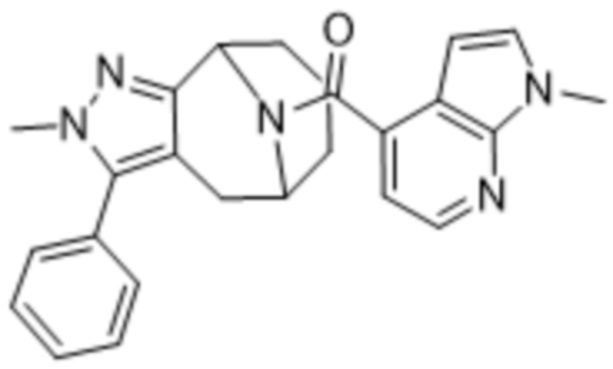
Титульное соединение получали способом, аналогичным описанному в примере 1, используя 1-метил-1H-пирроло[2,3-b] пиридин-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H25N5O, - 411,2; полученное m/z, 412,1 [M+H]+. 1 H ЯМР (400 МГц, ДМСО-d6) δ 8,33 (дд, J=11,6, 4,8 Гц, 1 H), 7,63-7,34 (м, 5 H), 7,03 (дд, J=18,7, 4,8 Гц, 1 H), 6,35 (дд, J=36,5, 3,5 Гц, 1 H), 5,81 (с, 1 H), 5,19-4,53 (м, 1 H), 3,97-3,65 (м, 6 H), 3,22-2,78 (м, 2 H), 2,34 (д, J=16,1 Гц, 1 H), 2,04-1,34 (м, 6 H).
Пример 22. Рацемический (4-хлор-1H-пирроло[2,3-b] пиридин-5-ил) ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
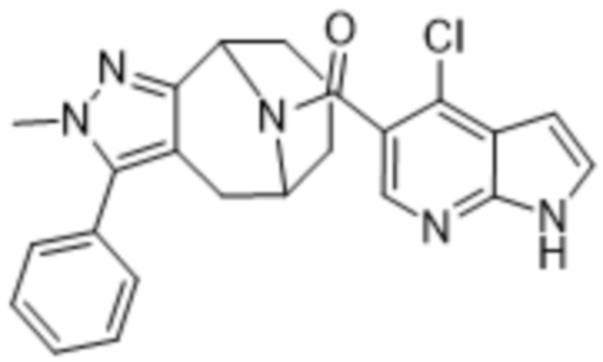
Титульное соединение получали способом, аналогичным описанному в примере 1, используя 4-хлор-1H-пирроло[2,3-b] пиридин-5-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H22ClN5O, - 431,1; полученное m/z - 432,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,37-7,86 (м, 1H), 7,76-7,62 (м, 1H), 7,59-7,32 (м, 5H), 6,68-6,43 (м, 1H), 5,80 (д, J=41,6 Гц, 1H), 4,15-3,83 (м, 1H), 3,82-3,69 (м, 3H), 3,20-2,85 (м, 2H), 2,48-2,16 (м, 1H), 2,00-1,32 (м, 6H).
Пример 23. Рацемический (4-фтор-1H-пирроло[2,3-b] пиридин-5-ил) ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
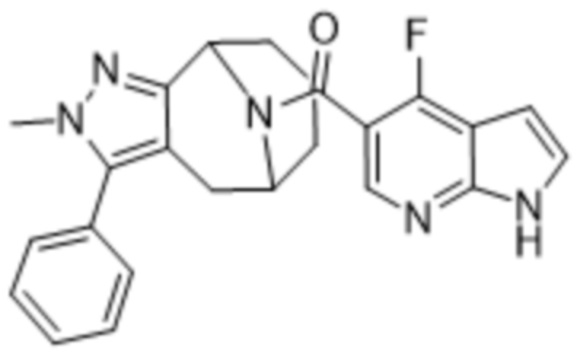
Титульное соединение получали способом, аналогичным описанному в примере 1, используя 4-фтор-1H-пирроло[2,3-b] пиридин-5-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H22FN5O, - 415,1; полученное m/z, 416,1 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 12,23 (с, 1H), 8,21 (с, 1H), 7,69-7,36 (м, 6H), 6,71-6,42 (м, 1H), 4,89 (д, J=172,2 Гц, 1H), 4,00 (с, 1H), 3,76 (д, J=29,1 Гц, 3H), 3,16-2,82 (м, 1H), 2,41 (д, J=16,3 Гц, 1H), 2,00-1,32 (м, 6H).
Пример 24. Рацемический (1-метил-1H-пирроло[2,3-b] пиридин-3-ил)((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
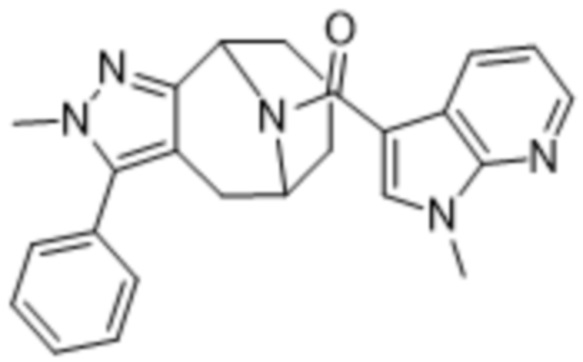
Титульное соединение получали способом, аналогичным описанному в примере 1, используя 1-метил-1H-пирроло[2,3-b] пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H25N5O, - 411,2; полученное m/z, 412,1 [M+H]+. 1 H ЯМР (500 МГц, ДМСО-d6) δ 8,34 (дд, J=4,6, 1,6 Гц, 1 H), 8,16-7,91 (м, 2 H), 7,48 (дд, J=38,4, 4,5 Гц, 5 H), 7,21 (дд, J=7,9, 4,6 Гц, 1 H), 4,78 (с, 1 H), 3,87 (с, 3 H), 3,76 (с, 3 H), 3,27-3,07 (м, 2 H), 2,49-2,39 (м, 1 H), 2,05-1,36 (м, 6 H).
Пример 25. Рацемический [1,2,4] триазолo[1,5-a] пиридин-5-ил((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
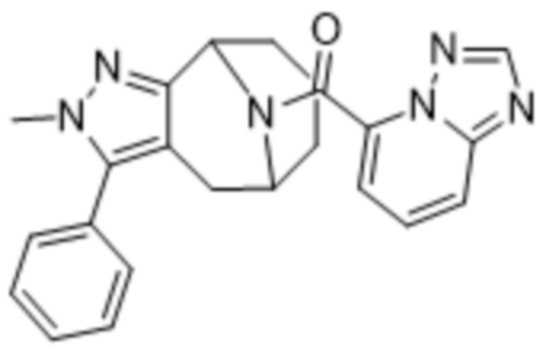
Титульное соединение получали способом, аналогичным описанному в примере 1, используя [1,2,4] триазоло[1,5-a] пиридин-5-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H22N6O, - 398,1; полученное m/z, 399,1 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 8,66-8,42 (м, 1H), 8,00-7,63 (м, 2H), 7,58-7,06 (м, 6H), 5,85-5,09 (м, 1H), 3,76 (д, J=37,5 Гц, 4H), 3,06-2,79 (м, 1H), 2,36 (д, J=16,1 Гц, 1H), 2,08-1,33 (м, 6H).
Пример 26: Рацемический ((5R,8S)-2-Метил-3-фенил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил) (хинолин-6-ил) метанон.
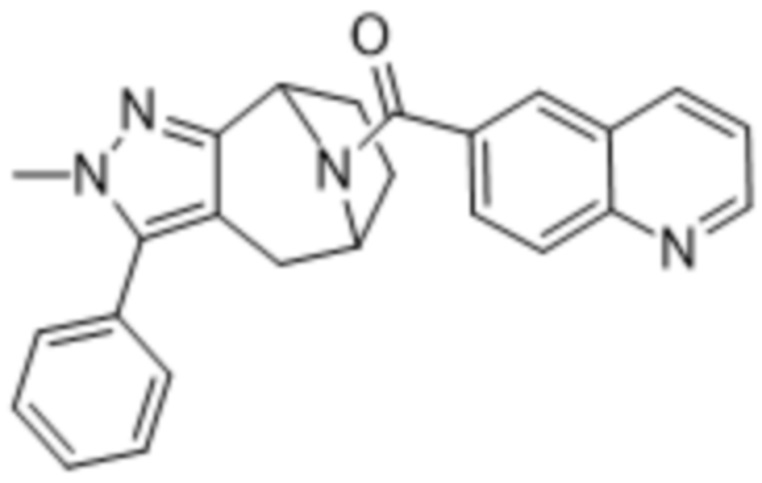
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,8S)-2-метил-3-фенил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол (промежуточное соединение 34) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C25H22N4O, - 394,1; полученное m/z, 395,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,98 (с, 1H), 8,57-8,40 (м, 1H), 8,28-8,02 (м, 2H), 7,94-7,37 (м, 7H), 5,56-5,40 (м, 1H), 4,50-4,32 (м, 1H), 3,85-3,65 (м, 3H), 3,14-2,84 (м, 1H), 2,43-1,56 (м, 5H).
Пример 27. Рацемический (4-хлорхинолин-6-ил) ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) метанон.
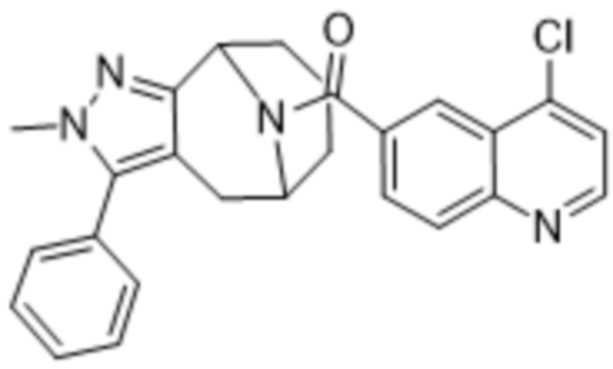
Титульное соединение получали способом, аналогичным описанному в примере 1, используя 4-хлорхинолин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H23ClN4O, - 442,1; полученное m/z, 443,1 [M+H]+. 1 H ЯМР (400 МГц, ДМСО-d6) δ 8,93 (дд, J=9,4, 4,7 Гц, 1 H), 8,27-8,15 (м, 2 H), 7,99-7,81 (м, 2 H), 7,55-7,40 (м, 5 H), 5,77 (д, J=8,5 Гц, 1 H), 4,96 (д, J=96,1 Гц, 1 H), 3,86-3,67 (м, 3 H), 3,23-2,85 (м, 1 H), 2,43 (д, J=16,2 Гц, 1 H), 1,90-1,41 (м, 6 H).
Пример 28. Рацемический (4-гидроксихинолин-6-ил) ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил) метанон.
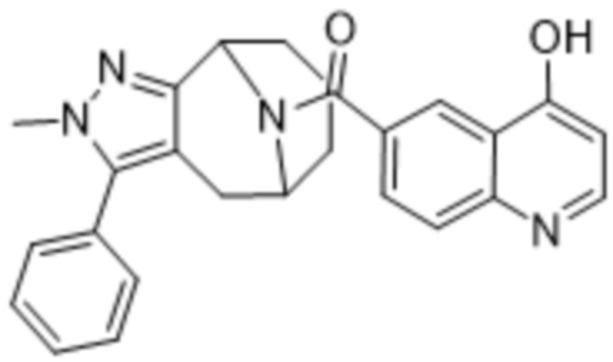
Титульное соединение получали способом, аналогичным описанному в примере 1, используя 4-гидроксихинолин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H24N4O2, - 424,2; полученное m/z, 425,2 [M+H]+. 1H-ЯМР (500 МГц, ДМСО-d6) δ 11,94 (с, 1H), 8,14-7,89 (м, 2H), 7,74-7,42 (м, 6H), 6,16-6,02 (м, 1H), 4,93 (д, J=74,9 Гц, 1H), 4,12 (с, 1H), 3,81-3,67 (м, 3H), 3,30-2,83 (м, 2H), 2,47-2,33 (м, 1H), 2,00-1,36 (м, 6H).
Пример 29. Рацемический ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиноксалин-5-ил)метанон.
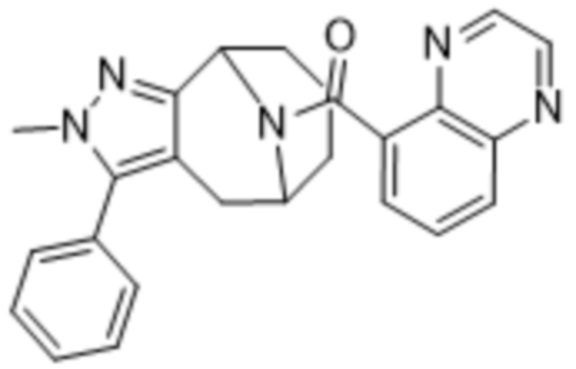
Титульное соединение получали способом, аналогичным описанному в примере 1, используя хиноксалин-5-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H23N5O, - 409,1; полученное m/z, 410,1 [M+H]+. 1 H ЯМР (500 МГц, ДМСО-d6) δ 9,10-8,86 (м, 2 H), 8,24-8,04 (м, 1 H), 8,04-7,67 (м, 2 H), 7,61-7,36 (м, 5 H), 5,98-5,73 (м, 1 H), 3,81 (д, J=3,8 Гц, 2 H), 3,71-3,49 (м, 2 H), 3,22-2,62 (м, 1 H), 2,25 (дд, J=33,8, 15,9 Гц, 1 H), 2,03-1,33 (м, 6 H).
Пример 30. Рацемический ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиноксалин-6-ил)метанон.
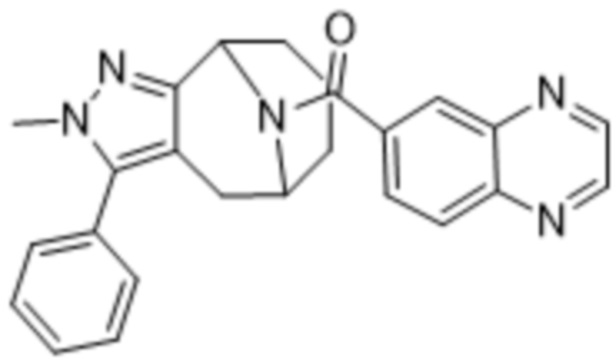
Титульное соединение получали способом, аналогичным описанному в примере 1, используя хиноксалин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H23N5O, - 409,2; полученное m/z, 410,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,11-8,97 (м, 2H), 8,28-8,04 (м, 2H), 7,97-7,83 (м, 1H), 7,61-7,36 (м, 5H), 5,77 (д, J=13,7 Гц, 1H), 3,76 (д, J=44,7 Гц, 3H), 3,25-2,95 (м, 2H), 2,40 (д, J=16,2 Гц, 1H), 2,03-1,40 (м, 6H).
Пример 31. Рацемический ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинозалин-6-ил)метанон.
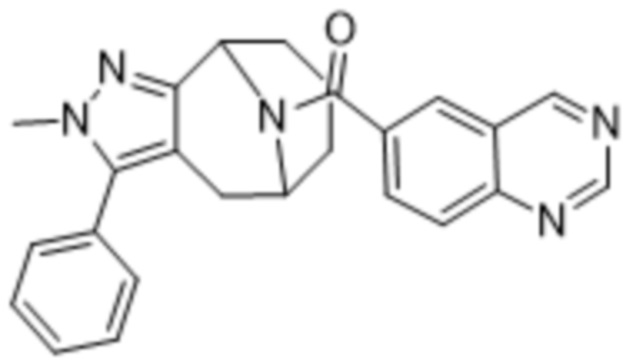
Титульное соединение получали способом, аналогичным описанному в примере 1, используя хинозалин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H23N5O, - 409,2; полученное m/z, 410,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,71 (д, J=9,5 Гц, 1H), 9,37 (д, J=12,6 Гц, 1H), 8,31-8,22 (м, 1H), 8,19-7,95 (м, 2H), 7,57-7,41 (м, 5H), 5,77 (д, J=5,6 Гц, 1H), 3,76 (д, J=50,8 Гц, 3H), 3,20-3,01 (м, 2H), 2,47-2,34 (м, 1H), 2,04-1,41 (м, 6H).
Пример 32. Рацемический ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-(трифторметил)-1,8-нафтиридин-3-ил)метанон.
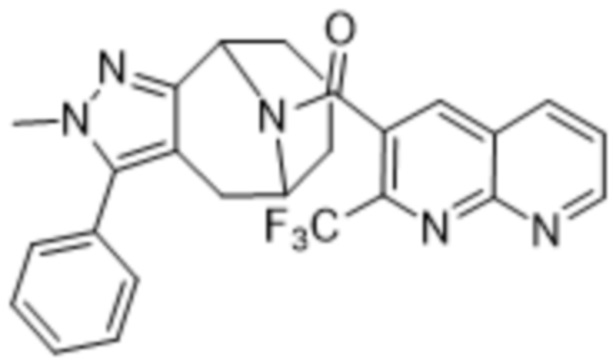
Титульное соединение получали способом, аналогичным описанному в примере 1, используя 2-(трифторметил)-1,8-нафтиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H22F3N5O, - 477,2; полученное m/z, 478,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,40-8,60 (м, 3H), 794-7,81 (м, 1H), 7,65-7,38 (м, 5H), 5,83 (с, 1H), 4,10-3,92 (м, 1H), 3,92-3,68 (м, 3H), 3,30-3,04 (м, 1H), 2,45-2,26 (м, 1H), 2,07-1,34 (м, 6H).
Пример 33. Рацемический(2-хлор-3-метоксифенил) ((5R,9S) -3-(4-фторфенил-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
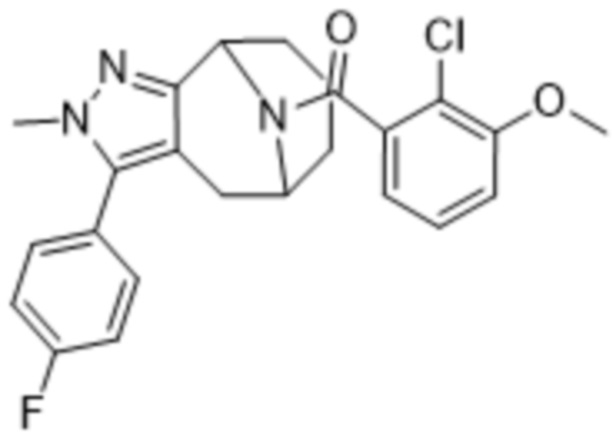
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,9S)-3-(4-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 5) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-хлор-3-метоксибензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H23ClFN3O2, - 439,1; полученное m/z, 440,1 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 7,69-7,30 (м, 5H), 7,26-6,59 (м, 2H), 5,90-5,55 (м, 1H), 5,17-4,37 (м, 1H), 3,96-3,86 (м, 3H), 3,81-3,65 (м, 3H), 3,15-2,73 (м, 1H), 2,36 (т, J=16,9 Гц, 1H), 1,98-1,26 (м, 6H).
Пример 34. (2-(2H-1,2,3-Триазол-2-ил)фенил)((5R,9S)-3-(4-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.

Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(4-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 30) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-(2H-1,2,3-триазол-2-ил)бензойную кислоту (промежуточное соединение 30) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H23FN6O, - 442,1; полученное m/z - 443,1 [M+H]+. 1H ЯМР (600 MГц, ДМСО-d6) δ 8,16 (д, J=12,8 Гц, 1H), 8,03-7,74 (м, 2H), 7,72-7,11 (м, 7H), 5,71-4,94 (м, 1H), 4,57-4,25 (м, 1H), 3,86-3,52 (м, 3H), 3,14-2,78 (м, 1H), 2,43-2,13 (м, 1H), 1,91-1,12 (м, 6H).
Пример 35. Рацемический (1,4-диметил-1H-пиразол-3-ил)((5R,9S)-3-(4-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
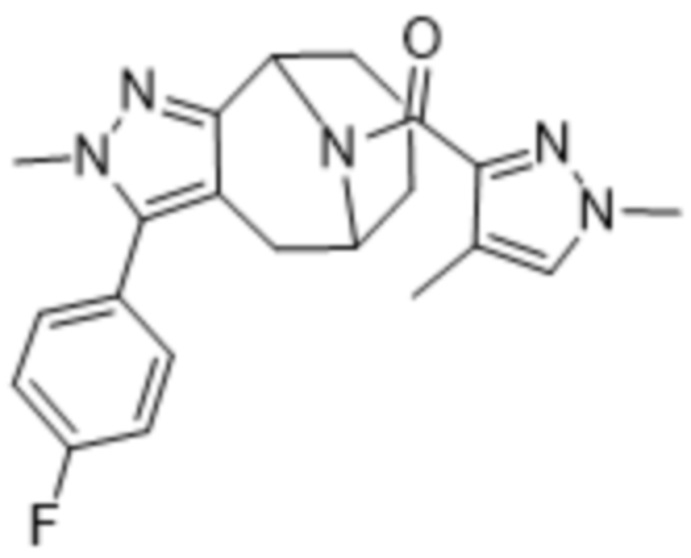
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,9S)-3-(4-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 5) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1,3-диметил-1H-пиразол-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C22H24FN5O, - 393,2; полученное m/z - 394,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 7,64-7,44 (м, 3H), 7,41-7,28 (м, 2H), 5,78-5,67 (м, 1H), 4,80-4,68 (м, 1H), 3,78 (с, 3H), 3,75 (с, 3H), 3,06-2,88 (м, 1H), 2,51-2,37 (м, 1H), 2,03 (с, 3H), 1,94-1,54 (м, 4H), 1,55-1,31 (м, 2H).
Пример 36. ((5R,9S)-3-(4-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-метил-1H-пиразолo[3,4-b]пиридин-3-ил)метанон.
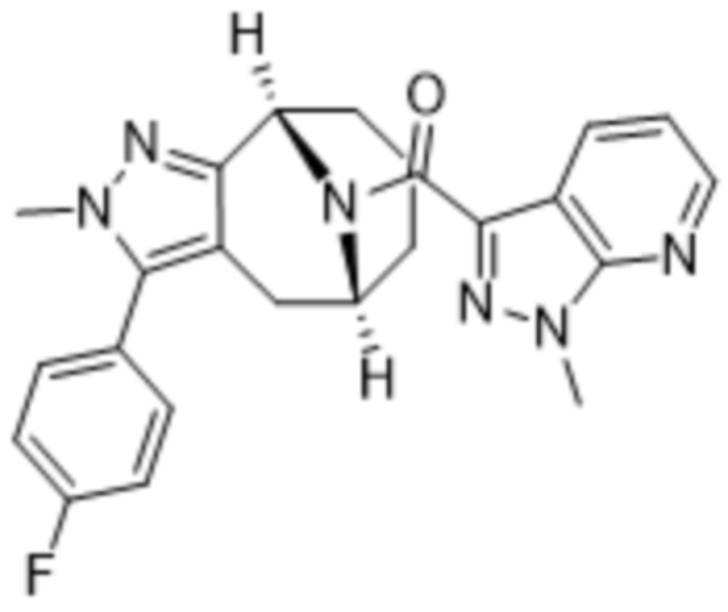
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(4-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 30) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-метил-1H-пиразол[3,4-b]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H23FN6O, - 430,1; полученное m/z - 431,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 8,67-8,37 (м, 1H), 7,63-7,49 (м, 2H), 7,43-7,26 (м, 4H), 6,36-6,21 (м, 1H), 5,26-5,07 (м, 1H), 4,24-4,09 (м, 3H), 3,84-3,64 (м, 3H), 3,17-2,99 (м, 1H), 2,64-2,54 (м, 1H), 2,11-1,42 (м, 6H).
Пример 37. Рацемический ((5R,9S)-3-(4-Фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил) метанон.
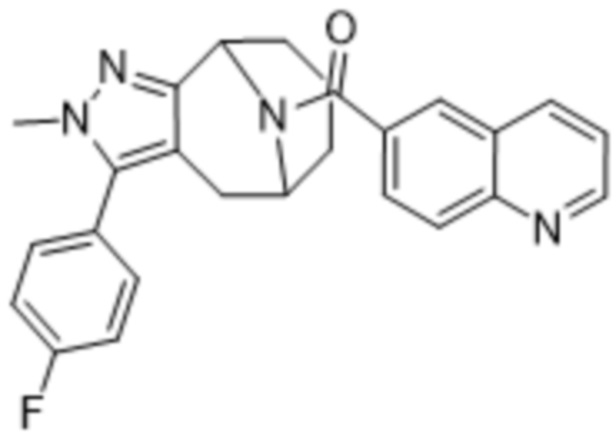
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,9S)-3-(4-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 5) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C26H23FN4O, - 426,2; полученное m/z, 427,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,08-8,86 (м, 1H), 8,58-8,43 (м, 1H), 8,20-8,02 (м, 2H), 7,87-7,71 (м, 1H), 7,69-7,51 (м, 3H), 7,44-7,27 (м, 2H), 5,82-5,03 (м, 1H), 4,86-4,06 (м, 1H), 3,86-3,62 (м, 3H), 3,21-2,96 (м, 1H), 2,40 (д, J=16,2 Гц, 1H), 2,12-1,37 (м, 6H).
Пример 38. ((5R,9S)-3-(4-Фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил) метанон.
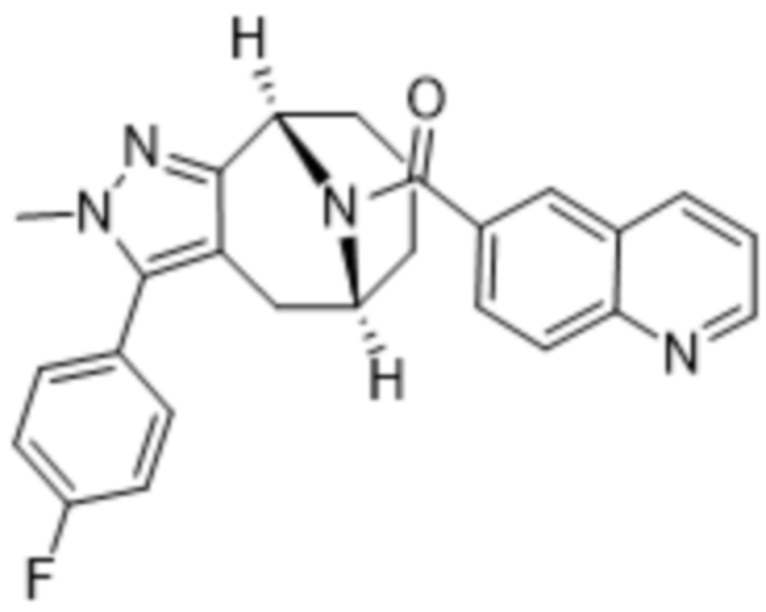
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(4-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 30) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C26H23FN4O, - 426,1; полученное m/z, 427,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,01-8,92 (м, 1H), 8,54-8,42 (м, 1H), 8,21-8,03 (м, 2H), 7,81-7,54 (м, 4H), 7,47-7,21 (м, 2H), 5,82-5,65 (м, 1H), 4,14-4,05 (м, 1H), 3,78-3,67 (м, 3H), 3,19-2,94 (м, 1H), 2,40 (д, J=16,2 Гц, 1H), 2,10-1,26 (м, 6H).
Пример 39. Рацемический(2-хлор-3-метоксифенил) ((5R,9S) -3-(3-фторфенил-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
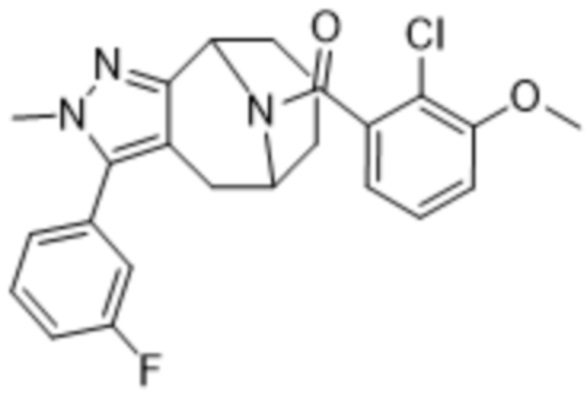
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,9S)-3-(3-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 4) вместо рацемического(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-хлор-3-метоксибензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H23ClFN3O2, - 439,1; полученное m/z, 440,1 [M+H]+. 1 H ЯМР (400 МГц, ДМСО-d6) δ 7,63-7,50 (м, 1H), 7,47-7,12 (м, 5H), 7,11-6,55 (м, 1H), 5,77 (д, J=8,5 Гц, 1H), 3,95-3,85 (м, 3H), 3,82-3,65 (м, 4H), 3,16-2,76 (м, 1H), 2,40 (дд, J=23,1, 16,1 Гц, 1H), 2,00-1,32 (м, 6H).
Пример 40. Рацемический ((5R,9S)-3-(3-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил) (1-фенил-1 H-1,2,4-триазол-3-ил) метанон.
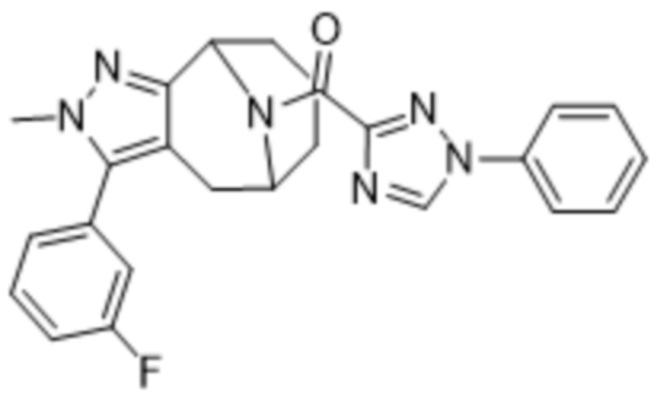
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,9S)-3-(3-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 4) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-фенил-1H-1,2,4-триазол-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H23FN6O, - 442,1; полученное m/z, 443,1 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 9,41 (д, J=12,7 Гц, 1H), 7,95-7,83 (м, 2H), 7,66-7,24 (м, 7H), 5,57 (д, J=160,3 Гц, 1H), 5,12-4,55 (м, 1H), 3,78 (д, J=23,3 Гц, 3H), 3,20-2,97 (м, 1H), 2,61-2,55 (м, 1H), 2,15-1,38 (м, 6H).
Пример 41. ((5R,9S)-3-(3-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил) (фуро[3,2-b] пиридин-6-ил) метанон.
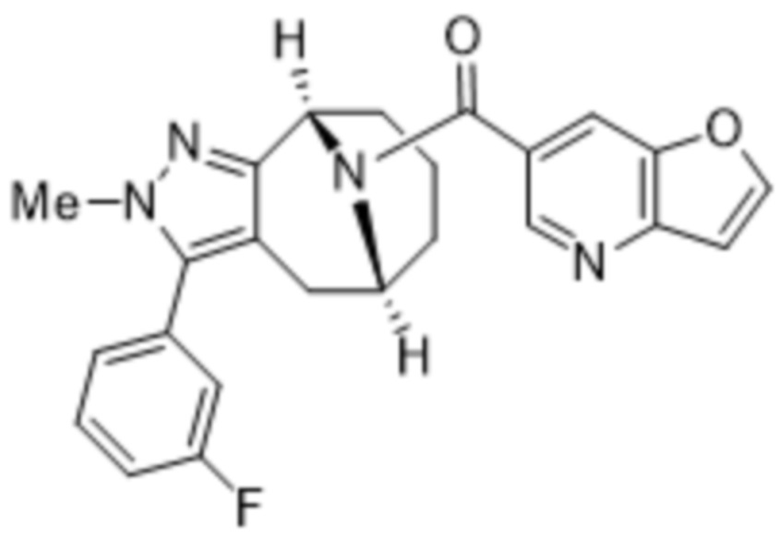
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 13) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и фурол[3,2-b]пиридин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H21FN4O2, - 416,1; полученное m/z, 417,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,63-8,41 (м, 2H), 8,23-8,06 (м, 1H), 7,62-7,18 (м, 5H), 5,80-5,02 (м, 1H), 4,88-4,00 (м, 1H), 3,78 (д, J=39,0 Гц, 3H), 3,15-3,03 (м, 1H), 2,40 (д, J=16,2 Гц, 1H), 2,05-1,38 (м, 6H).
Пример 42. Рацемический ((5R,9S)-3-(3-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил) метанон.
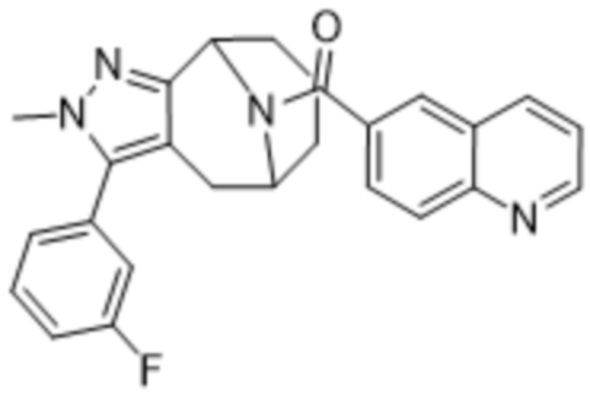
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,9S)-3-(3-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 4) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C26H23FN4O, - 426,1; полученное m/z - 427,1 [M+H]+. 1 H ЯМР (400 МГц, ДМСО-d6) δ 9,06-8,93 (м, 1 H), 8,48 (д, J=8,3 Гц, 1 H), 8,08 (дд, J=7,2, 3,8 Гц, 2 H), 7,85-7,70 (м, 1 H), 7,67-7,51 (м, 2 H), 7,51-7,20 (м, 3 H), 5,76 (д, J=5,9 Гц, 1 H), 4,24-4,05 (м, 1 H), 3,78 (д, J=40,8 Гц, 3 H), 3,22-3,02 (м, 1 H), 2,44 (д, J=16,1 Гц, 1 H), 2,11-1,37 (м, 6 H).
Пример 43. ((5S,9R)-3-(3-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил) метанон.
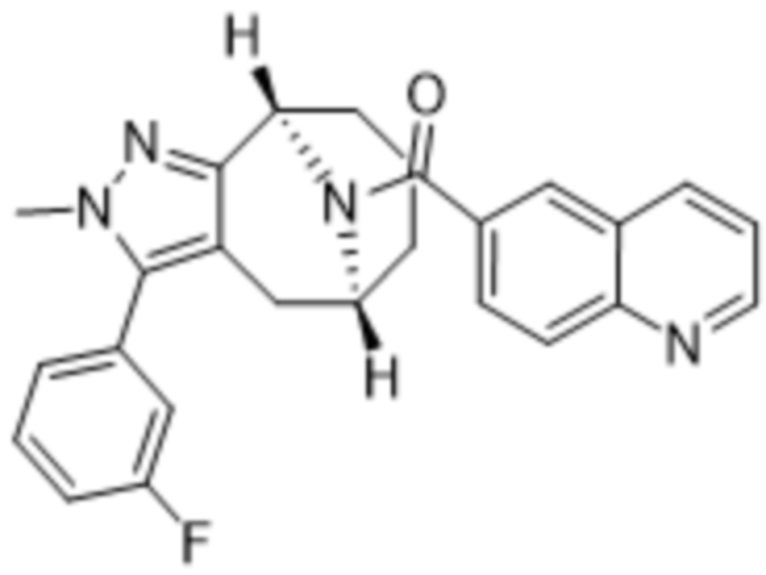
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5S,9R)-3-(3-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c] пиразол (промежуточное соединение 28) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C26H23FN4O, - 426,2; полученное m/z - 427,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,09 -8,91 (м, 1H), 8,56 -8,43 (м, 1H), 8,18 -7,99 (м, 2H), 7,84 -7,66 (м, 1H), 7,66 -7,50 (м, 2H), 7,50 -7,24 (м, 3H), 5,77 (с, 1H), 4,12 (д, J=6,5 Гц, 1H), 3,78 (д, J=51,1 Гц, 3H), 3,25 -2,88 (м, 1H), 2,47 -2,32 (м, 1H), 2,11 -1,38 (м, 6H).
Пример 44. ((5R,9S)-3-(3-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил) метанон.
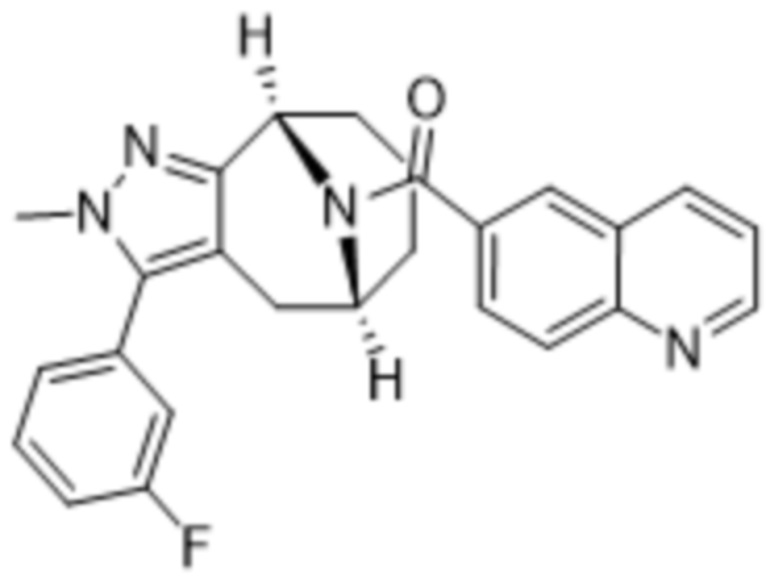
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 13) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C26H23FN4O, - 426,2; полученное m/z - 427,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,04-8,90 (м, 1H), 8,57-8,37 (м, 1H), 8,19-8,05 (м, 2H), 7,88-7,70 (м, 1H), 7,68-7,52 (м, 2H), 7,50-7,23 (м, 3H), 5,77 (с, 1H), 4,12 (с, 1H), 3,88-3,68 (м, 3H), 3,17-2,99 (м, 1H), 2,48-2,38 (м, 1H), 2,06-1,39 (м, 6H).
Пример 45. Рацемический ((5R,9S)-2-циклопропил-3-(3-фторфенил)-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил)метанон.
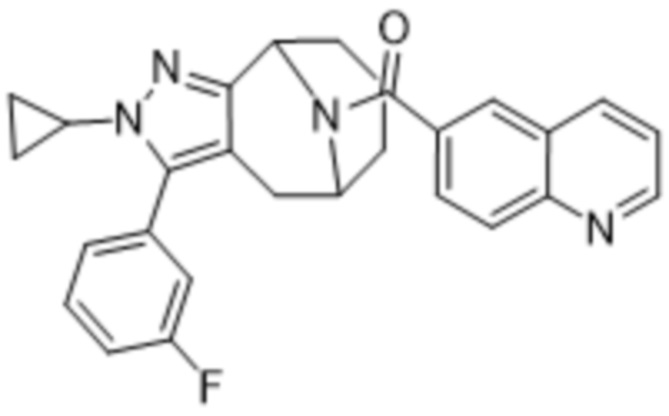
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,9S)-2-циклопропил-3-(3-фторфенил)-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 11) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C28H25FN4O, - 452,2; полученное m/z - 453,2 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,05-8,82 (м, 1H), 8,48 (д, J=8,5 Гц, 1H), 8,17-7,98 (м, 2H), 7,85-7,69 (м, 1H), 7,69-7,40 (м, 4H), 7,39-7,18 (м, 1H), 5,76-5,73 (м, 1H), 3,83-3,58 (м, 1H), 3,22-2,93 (м, 2H), 2,42 (д, J=16,4 Гц, 1H), 2,10-1,36 (м, 6H), 1,10-0,74 (м, 4H).
Пример 46. (3-(1 H-1,2,4-триазол-1-ил)фенил)((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
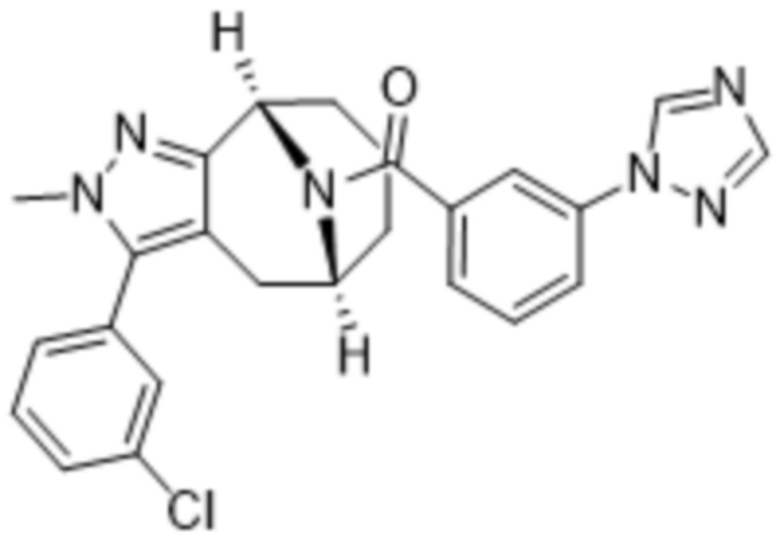
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 14) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-(1H-1,2,4-триазол-1-ил)бензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H23ClN6O, - 458,2; полученное m/z - 459,2 [M+H]+. 1 H ЯМР (500 МГц, ДМСО-d6) δ 9,38 (с, 1 H), 8,26 (с, 1 H), 7,99-7,94 (м, 1 H), 7,94-7,91 (м, 1 H), 7,71-7,59 (м, 2 H), 7,59-7,38 (м, 4 H), 5,77-5,70 (м, 1 H), 4,11-4,02 (м, 1 H), 3,80 (с, 3 H), 3,01 (дд, J=16,2, 7,4 Гц, 1 H), 2,43 (д, J=16,2 Гц, 1 H), 2,03-1,36 (м, 6 H).
Пример 47. (3-(1H-Пиразол-4-ил)фенил)((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
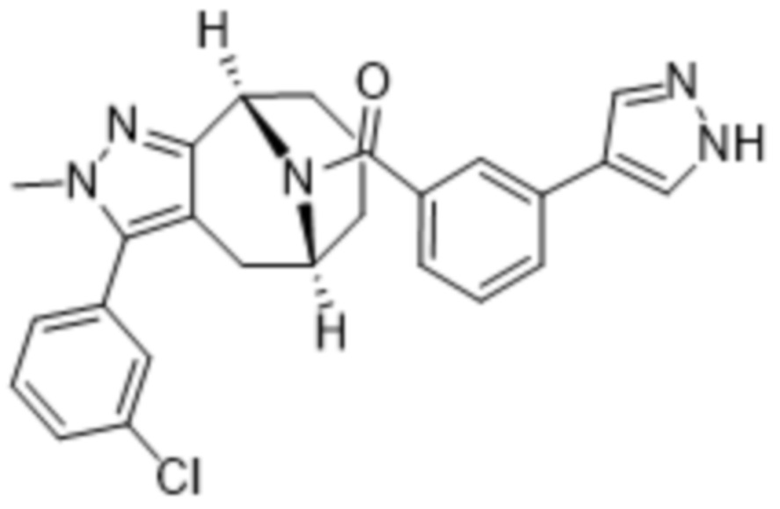
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 14) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-(1H-пиразол-4-ил)бензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H24ClN5O, - 457,2; полученное m/z - 458,2 [M+H]+. 1 H ЯМР (500 МГц, метанол-d4) δ 8,15-7,84 (м, 2 H), 7,76-7,69 (м, 1 H), 7,67-7,58 (м, 1 H), 7,57-7,45 (м, 4 H), 7,45-7,39 (м, 1 H), 7,30-7,24 (м, 1 H), 5,94-5,88, 5,05-5,00 (м, 1 H), 5,22-5,15, 4,30-4,22 (м, 1 H), 3,84, 3,77 (с, 3 H), 3,19, 3,01 (дд, J=16,4, 7,4 Гц, 1 H), 2,60, 2,50 (д, J=16,3 Гц, 1 H), 2,18-1,49 (м, 6 H).
Пример 48. (3-(1H-пиразол-1-ил)фенил)((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
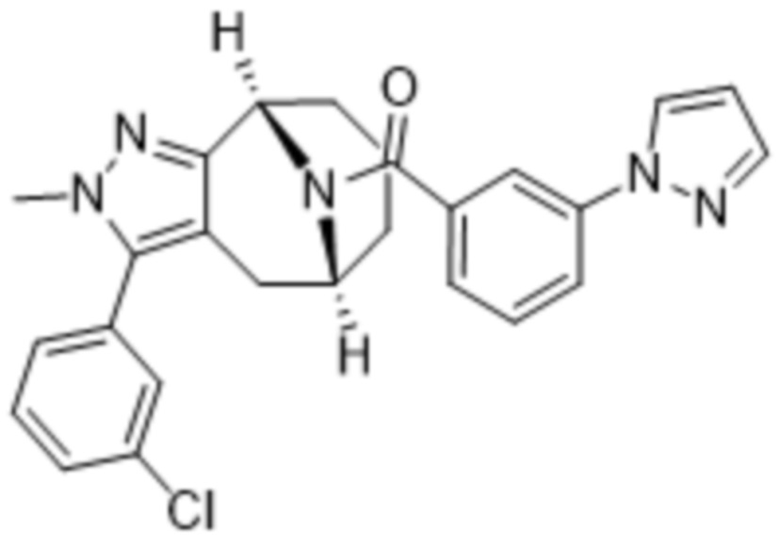
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 14) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-(1H-пиразол-1-ил)бензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H24ClN5O, - 457,2; полученное m/z - 458,2 [M+H]+. 1 H ЯМР (300 МГц, ДМСО-d6) δ 8,69-8,52 (м, 1 H), 8,03-7,92 (м, 1 H), 7,91-7,82 (м, 1 H), 7,81-7,74 (м, 1 H), 7,68-7,44 (м, 5 H), 7,39 -7,24 (м, 1 H), 6,63-6,50 (м, 1 H), 5,81 -5,66 (м, 1 H), 4,15-4,00 (м, 1 H), 3,80 (с, 3 H), 2,99 (дд, J=16,2, 7,3 Гц, 1 H), 2,43 (д, J=17,3 Гц, 1 H), 2,08-1,35 (м, 6 H).
Пример 49. (3-(1H-тетразол-1-ил)фенил)((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
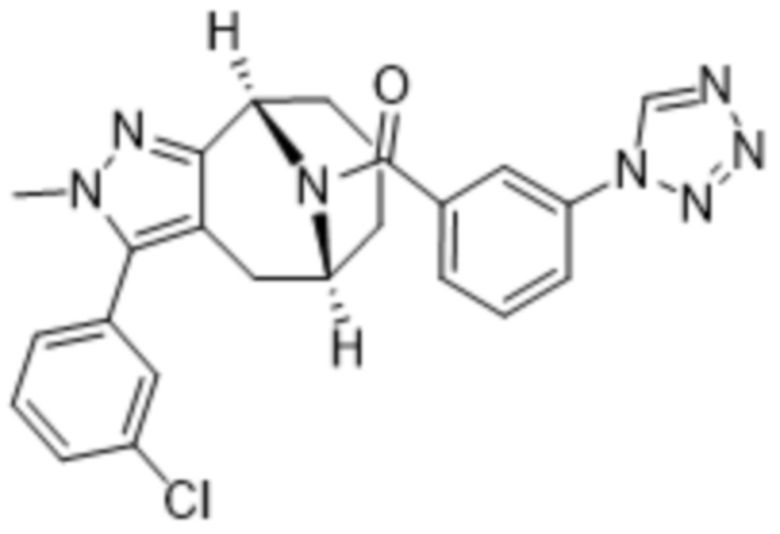
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 14) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-(1H-тетразол-1-ил)бензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H22ClN7O, - 459,2; полученное m/z - 460,2 [M+H]+. 1 H ЯМР (500 МГц, ДМСО-d6) δ 10,15 (с, 1 H), 8,05-8,00 (м, 1 H), 7,99-7,94 (м, 1 H), 7,73 (т, J=7,9 Гц, 1 H), 7,64-7,59 (м, 2 H), 7,59-7,47 (м, 3 H), 5,78-5,69 (м, 1 H), 4,11-4,02 (м, 1 H), 3,81 (с, 3 H), 3,03 (дд, J=16,2, 7,4 Гц, 1 H), 2,43 (д, J=16,2 Гц, 1 H), 2,08-1,37 (м, 6 H).
Пример 50. (2-хлор-5-(4H-1,2,4-триазол-4-ил)фенил)((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
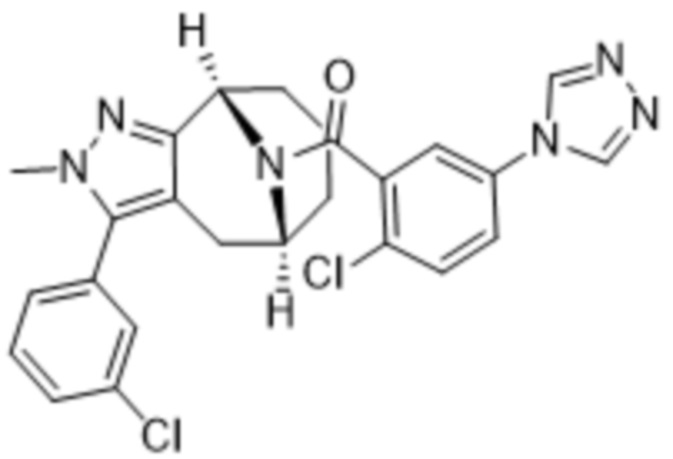
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 14) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-хлор 5-[1,2,4]триазол-4-ил-бензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22Cl2N6O, - 492,1; полученное m/z - 493,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,19 (с, 2H), 7,90-7,69 (м, 3H), 7,64-7,45 (м, 4H), 5,84-5,80 (м, 1H), 3,87 -3,78 (м, 1H), 3,81 (с, 3H), 3,13 -2,89 (м, 1H), 2,51 -2,37 (м, 1H), 2,00 -1,36 (м, 6H).
Пример 51. (4-(4 H-1,2,4-триазол-4-ил)фенил)((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
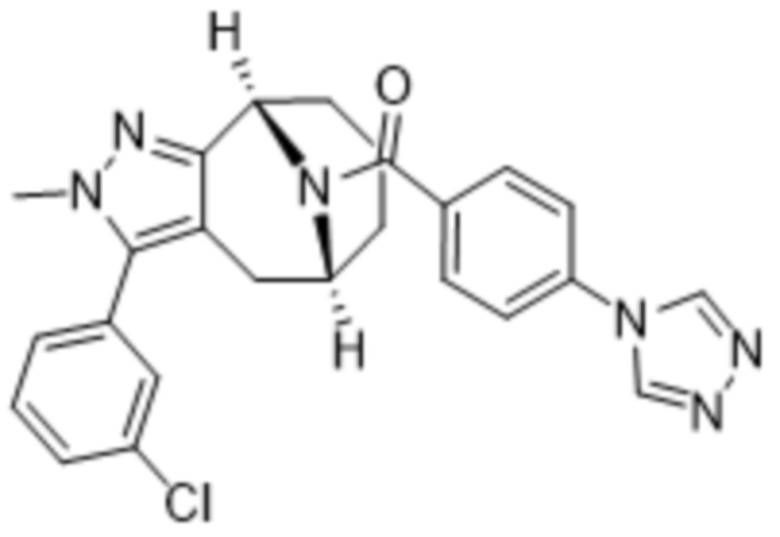
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 14) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 4-(4H-1,2,4-триазол-4-ил)бензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H23ClN6O, - 458,2; полученное m/z - 459,2 [M+H]+. 1 H ЯМР (500 МГц, ДМСО-d6) δ 9,20-9,15 (м, 2 H), 7,80-7,75 (м, 2 H), 7,66-7,60 (м, 2 H), 7,60-7,47 (м, 4 H), 5,76-5,67 (м, 1 H), 4,08-3,99 (м, 1 H), 3,80 (с, 3 H), 3,04 (дд, J=16,0, 7,0 Гц, 1 H), 2,42 (д, J=16,1 Гц, 1 H), 2,07-1,31 (м, 6 H).
Пример 52. ((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-изопропил-1 H-1,2,4-триазол-3-ил)метанон.
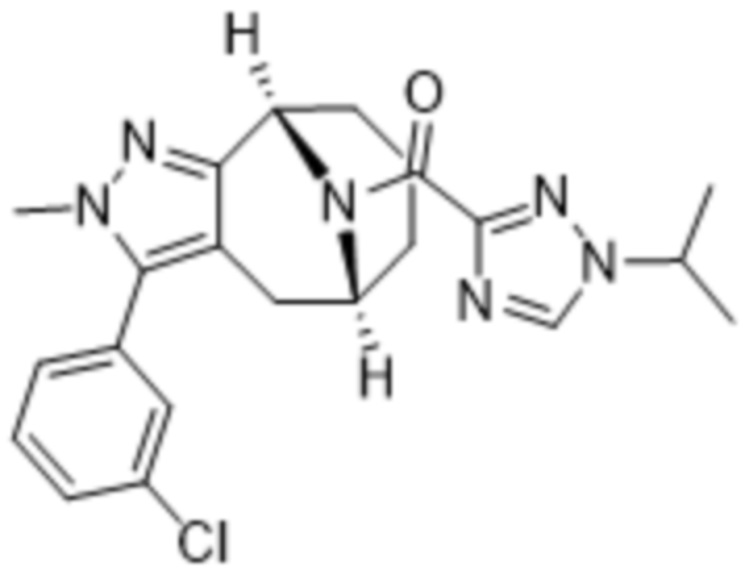
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 14) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-изопропил-1H-1,2,4-триазол-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C22H25ClN6O, - 424,2; полученное m/z - 425,2 [M+H]+. 1 H ЯМР (500 МГц, ДМСО-d6) δ 8,64 (с, 1 H), 7,63-7,57 (м, 1 H), 7,57-7,43 (м, 3 H), 5,76-5,69 (м, 1 H), 4,71-4,60 (м, 1 H), 4,54-4,48 (м, 1 H), 3,78 (с, 3 H), 2,99 (дд, J=15,8, 7,4 Гц, 1 H), 2,57-2,46 (м, 1 H), 2,07-1,54 (м, 4 H), 1,54 -1,38 (м, 2 H), 1,45 (д, J=6,7 Гц, 6 H).
Пример 53. ((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-(2-фторфенил)-1 H-1,2,4-триазол-3-ил)метанон.
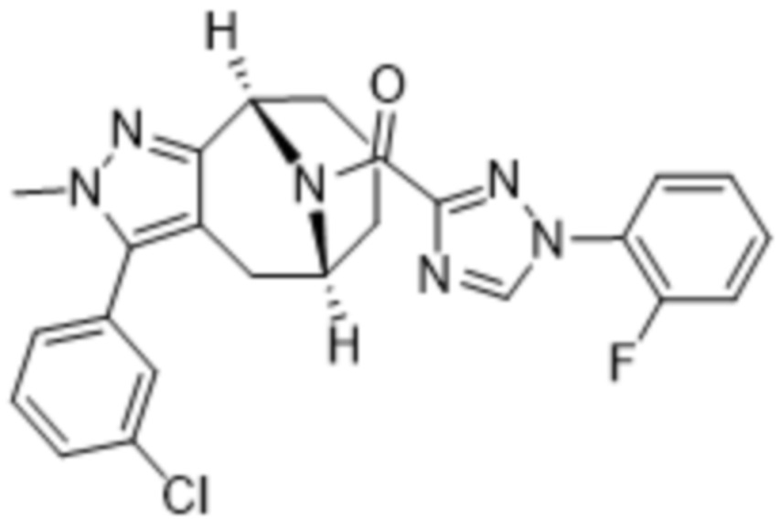
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 14) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-(2-фторфенил-1H-1,2,4-триазол-3-карбоновую кислоту (промежуточное соединение 39) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22ClFN6O, - 476,2; полученное m/z - 477,2 [M+H]+. 1 H ЯМР (500 МГц, ДМСО-d6) δ 9,13 (д, J=2,2 Гц, 1 H), 7,89-7,80 (м, 1 H), 7,64-7,40 (м, 7 H), 5,80-5,75 (м, 1 H), 4,59-4,49 (м, 1 H), 3,79 (с, 3 H), 3,07-2,97 (м, 1 H), 2,53 (д, J=16,4 Гц, 1 H), 2,04-1,38 (м, 6 H).
Пример 54. ((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-(пиридин-2-ил)-1 H-1,2,4-триазол-3-ил)метанон.
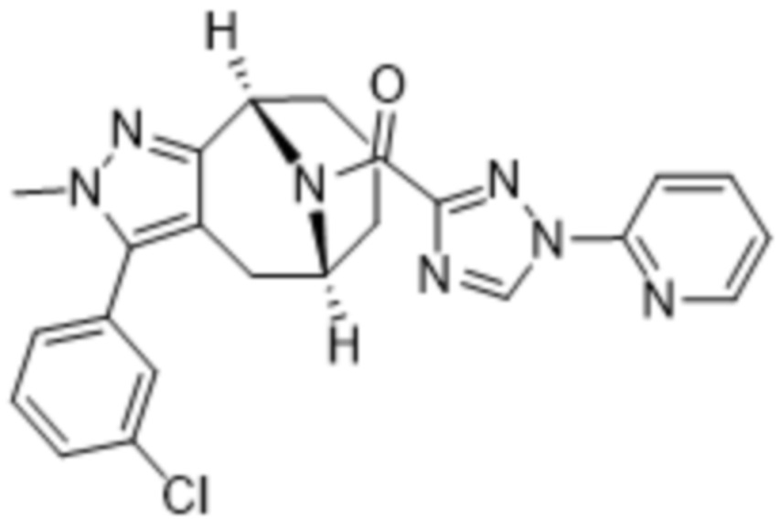
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 14) вместо рацемической (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-(пиридин-2-ил)-1 H-1,2,4-триазол-3-карбоновой кислоты вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H22ClN7O, - 459,2; полученное m/z - 460,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,47 (с, 1H), 8,64-8,53 (м, 1H), 8,15-8,06 (м, 1H), 7,92-7,85 (м, 1H), 7,64-7,59 (м, 1H), 7,58-7,45 (м, 4H), 5,81-5,75 (м, 1H), 4,60-4,53 (м, 1H), 3,80 (с, 3H), 3,13-3,00 (м, 1H), 2,55-2,49 (м, 1H), 2,06-1,40 (м, 6H).
Пример 55. ((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-(3-фторфенил)-1 H-1,2,4-триазол-3-ил)метанон.
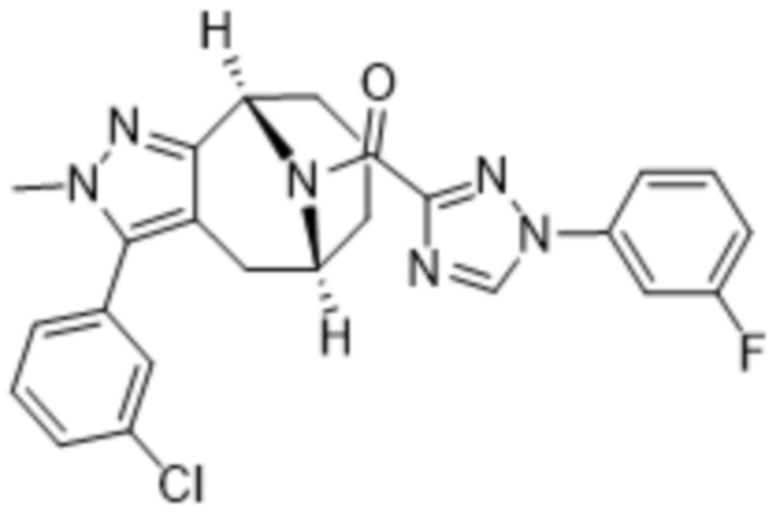
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 14) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-(3-фторфенил-1H-1,2,4-триазол-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22ClFN6O, - 476,2; полученное m/z - 477,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,43 (с, 1H), 7,86-7,79 (м, 1H), 7,79-7,72 (м, 1H), 7,69-7,58 (м, 2H), 7,58-7,46 (м, 3H), 7,36-7,28 (м, 1H), 5,80-5,73 (м, 1H), 4,58-4,48 (м, 1H), 3,79 (с, 3H), 3,12-2,97 (м, 1H), 2,56-2,48 (м, 1H), 1,93-1,39 (м, 6H).
Пример 56. (1-(3-хлорфенил)-1 H-1,2,4-триазол-3-ил)((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
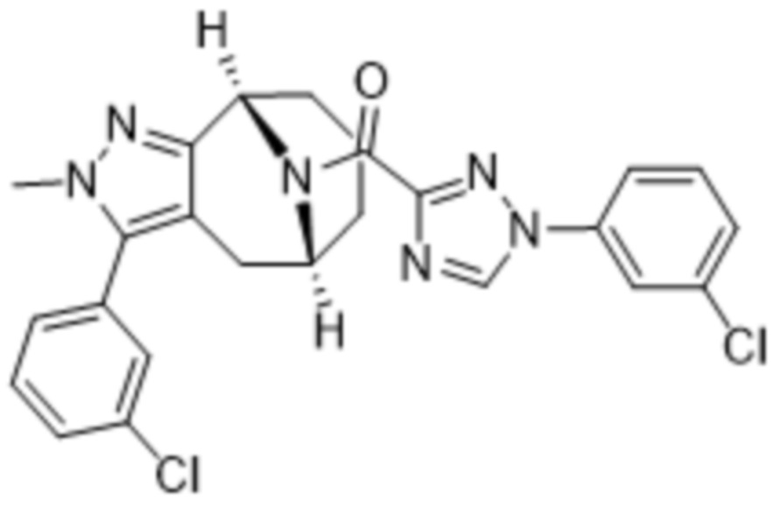
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 14) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-(3-хлорфенил)-1,2,4-триазол-3-карбоновую кислоту (промежуточное соединение 37) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22Cl2N6O, - 492,1; полученное m/z - 493,2 [M+H]+. 1 H ЯМР (500 МГц, ДМСО-d6) δ 9,44 (с, 1 H), 8,08-8,00 (м, 1 H), 7,91-7,83 (м, 1 H), 7,63 (т, J=8,2 Гц, 1 H), 7,63-7,59 (м, 1 H), 7,58-7,46 (м, 4 H), 5,80-5,74 (м, 1 H), 4,58-4,50 (м, 1 H), 3,79 (с, 3 H), 3,11-2,99 (м, 1H), 2,55-2,50 (м, 1 H), 2,07-1,35 (м, 6 H).
Пример 57. ((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-фенил-5-(трифторметил)-1H-пиразол-4-ил)метанон.
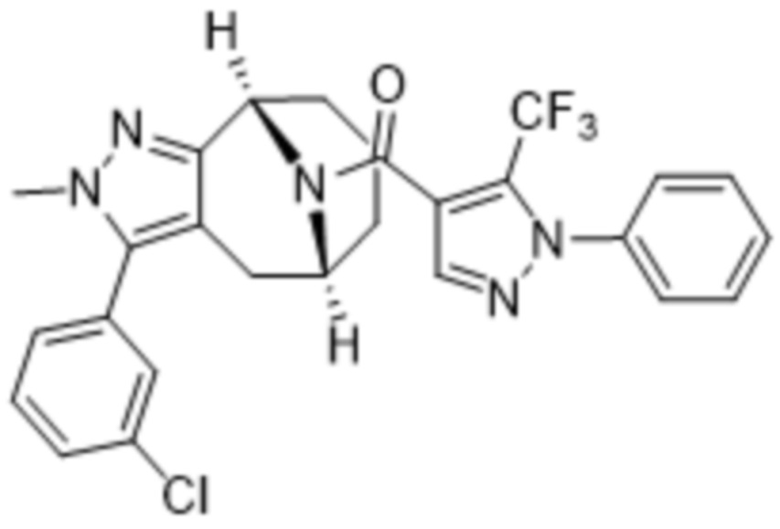
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 14) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-фенил-5-(трифторметил)-1H-пиразол-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C27H23ClF3N5O, - 525,2; полученное m/z - 526,1 [M+H]+. 1 H ЯМР (500 МГц, ДМСО-d6) δ 8,12 (с, 1H), 7,66-7,44 (м, 9H), 5,78-5,71 (м, 1H), 4,21-4,11 (м, 1H), 3,80 (с, 3H), 3,04 (дд, J=16,2, 7,4 Гц, 1H), 2,51-2,44 (м, 1H), 1,94-1,37 (м, 6H).
Пример 58. ((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метил-1-(3-(трифторметил)фенил)-1H-1,2,4-триазол-3-ил)метанон.
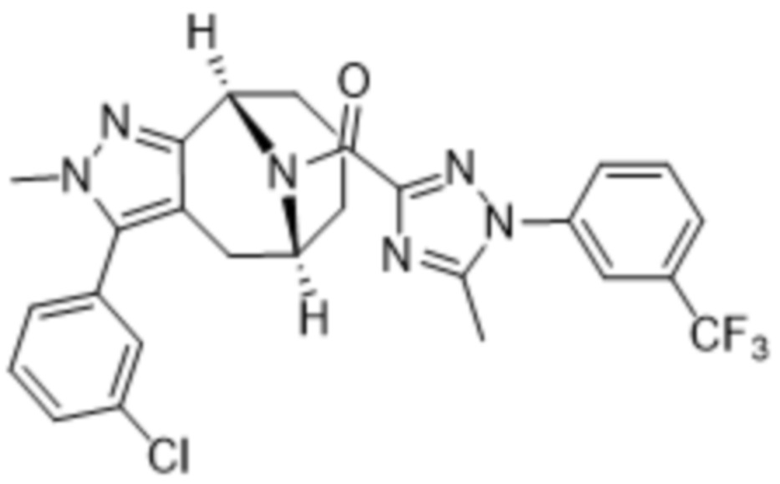
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 14) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-метил-1-(3-(трифторметил)фенил)-1H-1,2,4-триазол-3-карбоновую кислоту (промежуточное соединение 40) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C27H24ClF3N6O, - 540,2; полученное m/z - 541,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,05-8,02 (м, 1H), 8,00-7,96 (м, 1H), 7,95-7,90 (м, 1H), 7,88-7,84 (м, 1H), 7,61-7,58 (м, 1H), 7,57-7,45 (м, 3H), 5,78-5,72 (м, 1H), 4,67-4,59 (м, 1H), 3,79 (с, 3H), 3,09-2,97 (м, 1H), 2,60-2,42 (м, 1H), 2,53 (с, 3H), 1,98-1,59 (м, 4H), 1,58-1,41 (м, 2H).
Пример 59. ((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-(3-(трифторметил)фенил)-1 H-1,2,4-триазол-3-ил)метанон.
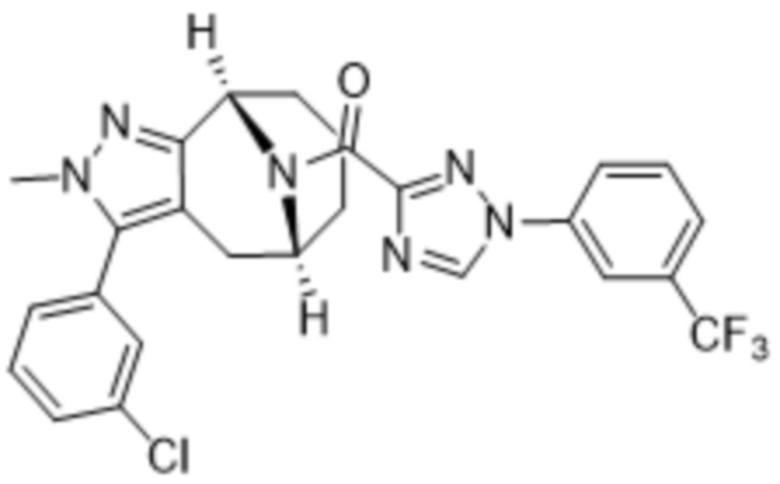
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 14) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-(3-(трифторметил)фенил)-1H-1,2,4-триазол-3-карбоновую кислоту (промежуточное соединение 38) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H22ClF3N6O, - 526,2; полученное m/z - 527,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,53 (с, 1H), 8,29-8,24 (м, 1H), 8,24-8,18 (м, 1H), 7,89-7,79 (м, 2H), 7,63-7,59 (м, 1H), 7,57-7,45 (м, 3H), 5,81-5,74 (м, 1H), 4,57-4,50 (м, 1H), 3,80 (с, 3H), 3,13-2,98 (м, 1H), 2,57-2,47 (м, 1H), 2,07-1,40 (м, 6H).
Пример 60. (1-бензил-1 H-1,2,4-триазол-3-ил)((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
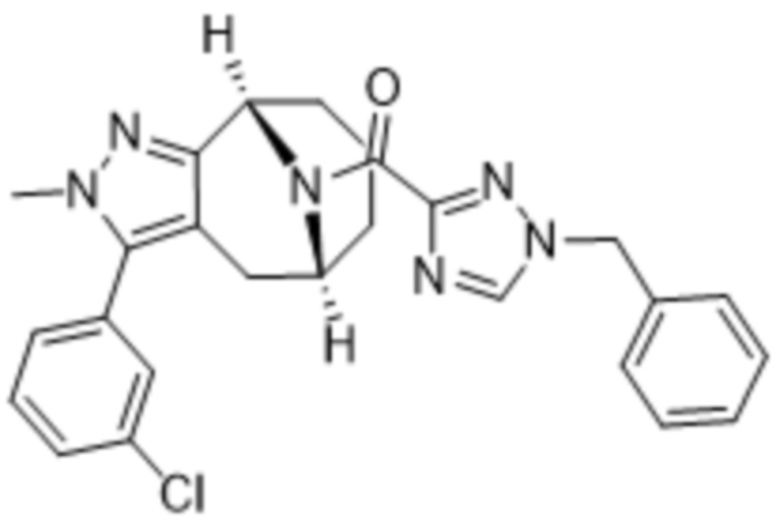
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 14) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-бензил-1H-1,2,4-триазол-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H25ClN6O, - 472,2; полученное m/z - 473,2 [M+H]+. 1 H ЯМР (500 МГц, ДМСО-d6) δ 8,75 (с, 1H), 7,61-7,56 (м, 1H), 7,56-7,49 (м, 2H), 7,49-7,43 (м, 1H), 7,43-7,27 (м, 5H), 5,73-5,68 (м, 1H), 5,45 (с, 2H), 4,48-4,42 (м, 1H), 3,77 (с, 3 H), 2,94 (дд, J=16,0, 7,4 Гц, 1H), 2,46 (д, J=16,2 Гц, 1H), 1,96-1,37 (м, 6H).
Пример 61. Бензо[d]изоксазол-3-ил((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
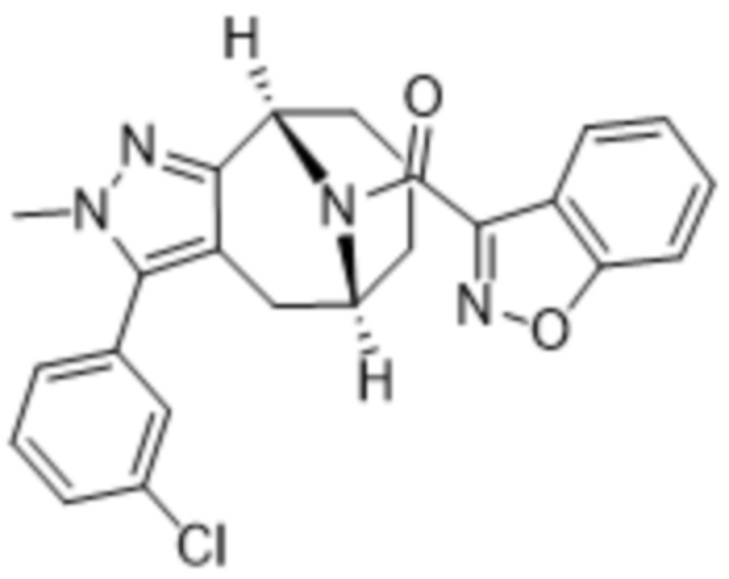
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 14) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и бензо[d]изоксазол-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H21ClN4O2, - 432,1; полученное m/z, 433,1 [M+H]+. 1 H ЯМР (500 МГц, ДМСО-d6) δ 7,93-7,90 (м, 1 H), 7,88-7,85 (м, 1 H), 7,78-7,72 (м, 1 H), 7,62-7,59 (м, 1 H), 7,58-7,45 (м, 4 H), 5,93-5,80 (м, 1 H), 4,65-4,51 (м, 1 H), 3,80 (с, 3 H), 3,01 (дд, J=16,2, 7,3 Гц, 1 H), 2,54 (д, J=16,1 Гц, 1 H), 2,02-1,68 (м, 4 H), 1,59-1,41 (м, 2 H).
Пример 62. ((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-метил-1H-индазол-3-ил)метанон.
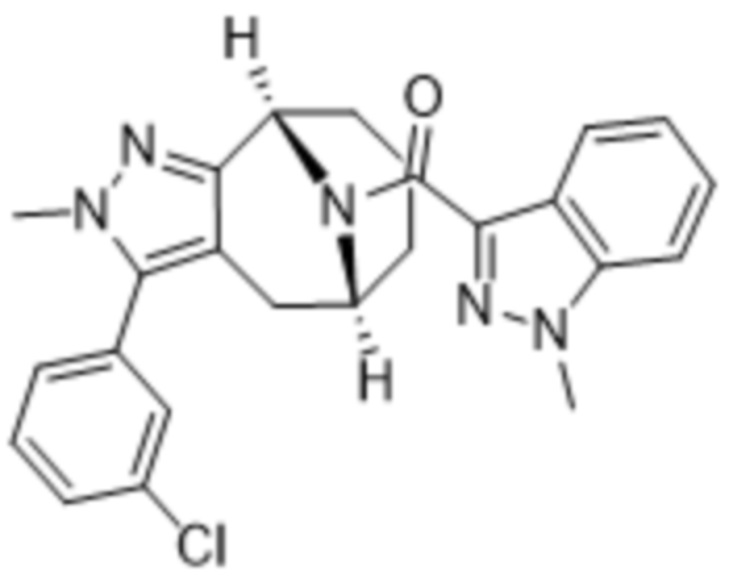
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 14) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-метил-1H-индазол-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H24ClN5O, - 445,2; полученное m/z - 446,1 [M+H]+. 1 H ЯМР (500 МГц, ДМСО-d6) δ 8,00-7,94 (м, 1 H), 7,72 (дд, J=12,9, 8,5 Гц, 1 H), 7,63-7,57 (м, 1 H), 7,57-7,42 (м, 4 H), 7,27-7,21 (м, 1 H), 5,88-5,80 (м, 1 H), 5,39-5,31 (м, 1 H), 4,10 (с, 3 H), 3,79 (с, 3 H), 3,14-3,03 (м, 1 H), 2,56 (дд, J=16,2, 11,7 Гц, 1 H), 2,10-1,62 (м, 4 H), 1,57-1,42 (м, 2 H).
Пример 63. Рацемический ((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил) метанон.
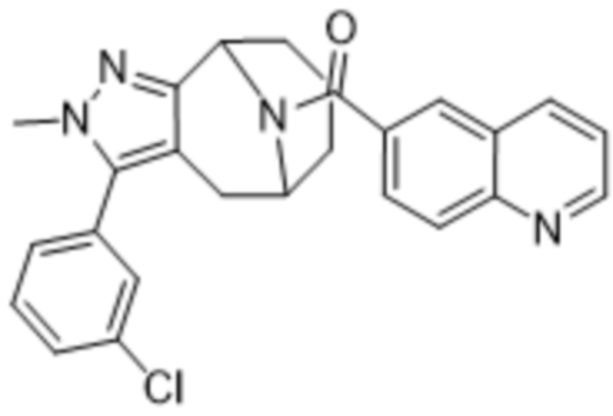
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 6) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C26H23ClN4O, - 442,1; полученное m/z - 443,1 [M+H]+. 1 H ЯМР (400 МГц, ДМСО-d6) δ 9,04-8,89 (м, 1 H), 8,48 (д, J=8,3 Гц, 1 H), 8,18-7,99 (м, 2 H), 7,85-7,46 (м, 6 H), 5,77 (с, 1 H), 3,77 (с, 3 H), 3,21-2,95 (м, 2 H), 2,44 (д, J=16,2 Гц, 1 H), 2,07-1,38 (м, 6 H).
Пример 64. ((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиноксалин-6-ил) метанон.
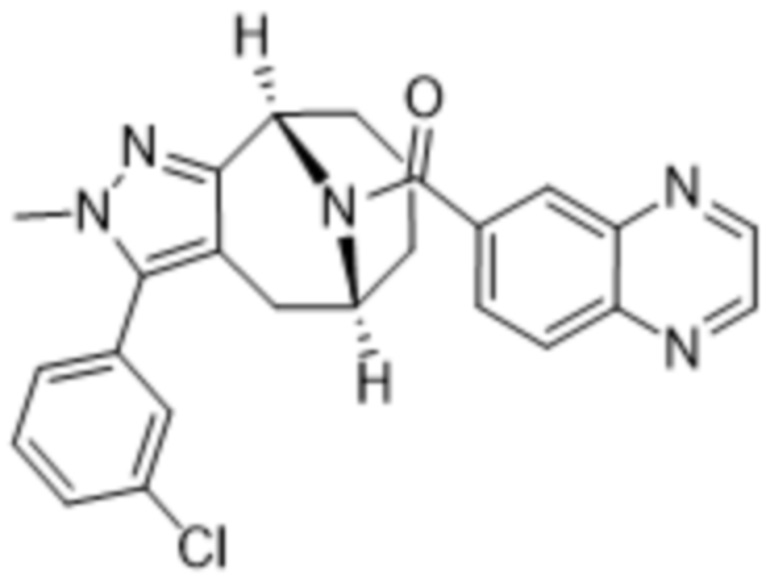
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 14) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и хиноксалин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22ClN5O, - 443,1; полученное m/z - 444,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,09-8,95 (м, 2H), 8,25-8,01 (м, 2H), 7,93-7,78 (м, 1H), 7,68-7,43 (м, 4H), 5,77 (д, J=14,8 Гц, 1H), 4,08 (д, J=5,7 Гц, 1H), 3,84-3,66 (м, 3H), 3,16-2,98 (м, 1H), 2,41 (д, J=16,2 Гц, 1H), 2,04-1,39 (м, 6H).
Пример 65. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(4-(2-фторэтокси)хинолин-6-ил)метанон.
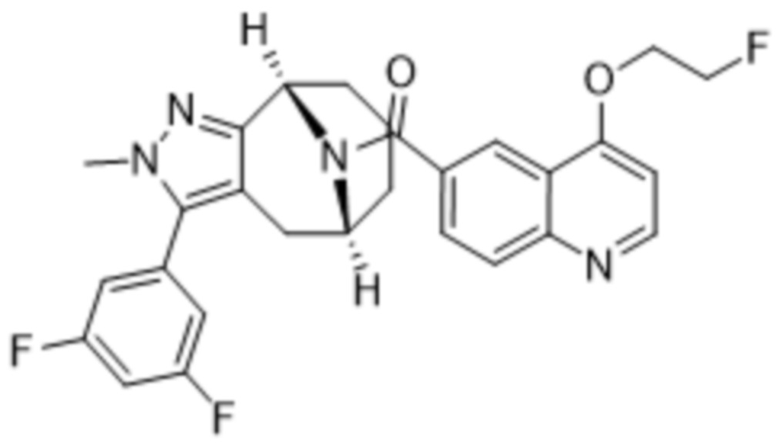
Стадия А: ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(4-гидроксихинолин-6-ил)метанон. К раствору 4-гидроксихинолин-6-карбоновой кислоты (70 мг, 0,37 ммоль); (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 12), трифторуксусной кислоты (100 мг, 0.25 ммоль) и HATU (141 мг, 0,37 ммоль) в ДХМ (1,6 мл) добавляли триэтиламин (0,10 мл, 0,74 ммоль). Смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь концентрировали и загружали непосредственно на колонку с силикагелем (12 г) и элюировали градиентом от 0 до 20% MeOH/ДХМ с получением желтого масла (80 мг, выход 70%). МС (ИЭР): масса, рассчитанная для C26H22F2N4O2, - 460,2; полученное m/z, 461,1 [M+H]+.
Стадия B: ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(4-(2-фторэтокси)хинолин-6-ил)метанон. Раствор ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(4-гидроксихинолин-6-ил)метанона (80 мг, 0,17 ммоль) в диметилформамиде (ДМФ) (0,7 мл) обрабатывали 1-фтор-2-йодэтаном (45 мг, 0,26 ммоль) и карбонатом цезия (113 мг, 0,35 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч и затем разбавили водой. Твердые осадки фильтровали и очищали на колонке с силикагелем (4 г) с метанолом (MeOH) в дихлорметане (DCM) (градиент от 1 до 5%) с получением указанного в заголовке соединения в виде белого твердого вещества (21 мг, выход 24%). МС (ИЭР): масса, рассчитанная для C28H25F3N4O2, - 506,2; полученное m/z, 507,2 [M+H]+. 1 H ЯМР (CDCl3) δ 8,81 (д, J=5,3, 1,1 Гц, 1 H), 8,41 (дд, J=9,2, 1,9 Гц, 1 H), 8,08 (дд, J=8,6, 4,2 Гц, 1 H), 7,77 (тд, J=8,9, 2,0 Гц, 1 H), 6,98-6,84 (м, 3 H), 6,78 (дд, J=5,2, 1,4 Гц, 1 H), 6,06 и 5,12 (с, 1 H), 5,30 и 4,28 (м, 1 H), 4,95-4,86 (м, 2 H), 4,49-4,41 (м, 2 H), 3,89 и 3,80 (с, 3 H), 3,31-3,28 и 3,10-3,04 (м, 1 H), 2,54 и 2,44 (д, J=16,2 Гц, 1 H), 2,13-1,99 (м, 1 H), 1,94-1,73 (м, 3 H), 1,68-1,51 (м, 2 H).
Пример 66. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-(2-фторэтокси)фенил)метанон.
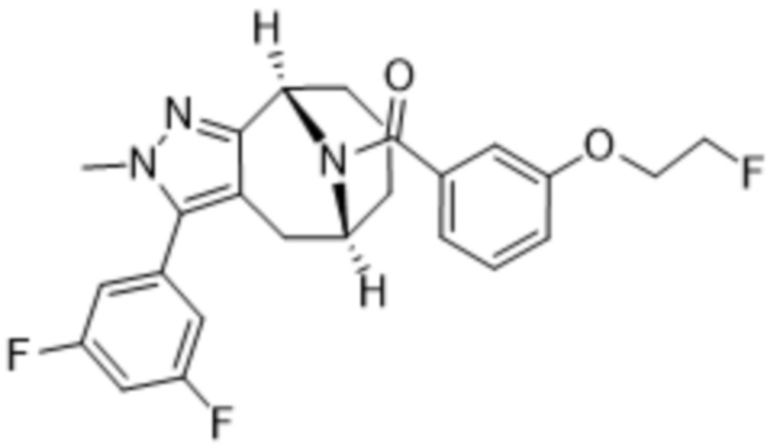
Титульное соединение получали способом, аналогичным описанному в примере 65, используя 3-гидроксибензойную кислоту вместо 4-гидроксихинолин-6-карбоновой кислоты на стадии A. МС (ИЭР): масса, рассчитанная для C25H24F3N3O2, - 455,2; полученное m/z, 456,2 [M+H]+. 1H ЯМР (CDCl3): δ 7,34-7,30 (м, 1H), 7,02- 6,96 (м, 3H), 6,91- 6,82 (м, 3H), 5,98 и 5,05 (м, 1H), 5,21 и 4,22 (м, 1H), 4,80-4,69 (м, 2H), 4,25-4,19 (м, 2H) 3,85 и 3,79 (с, 3H), 3,23-3,19 и 2,97-2,91 (м, 1H), 2,44 (дд, J=36,7, 16,3 Гц, 1H), 2,01-1,68 (м, 3H), 1,63-1,47 (3H).
Пример 67. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-(2-(фтор-18 F)этокси)фенил)метанон.
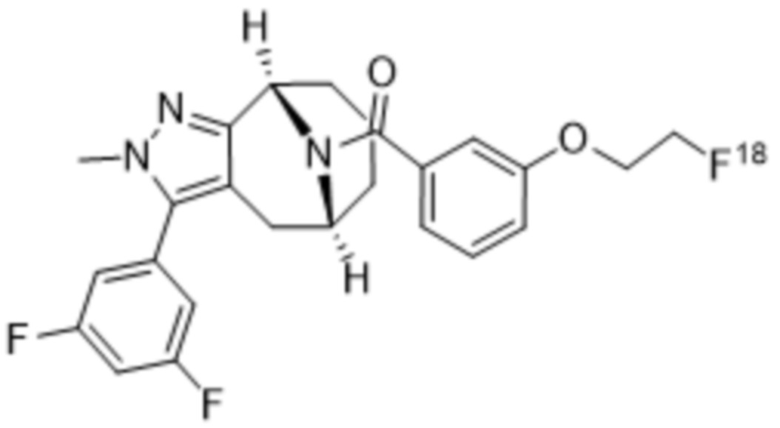
Стадия А: 2-(3-((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбонил)фенокси)этил 4-метилбензолсульфонат. Титульное соединение получали способом, аналогичным описанному в примере 65, стадия B, используя этилендитозилат вместо 1-фтор-2-йодэтана. МС (ИЭР): масса, рассчитанная для C32H31F2N3SO5, - 607,2, полученное m/z - 608,2 [M+H]+.
Стадия B: ((5 R ,9 S )-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-(2-(фтор-18 F)этокси)фенил)метанон. [18 F]фторид в транспортировочном флаконе производства компании PETNET Solutions Inc. (г. Сан-Диего, штат Калифорния, США) переносили и захватывали на ионообменном картридже. Затем его элюировали в реакционный сосуд (RV1) модуля Synthra RNPlus ® с использованием раствора карбоната калия (0,75 мг) и Kryptofix 222 (7,2 мг) в 0,8 мл смеси ацетонитрил/вода (6/2, об./об.). После выпаривания растворителя под вакуумом в потоке азота при 85°C добавляли безводный CH3CN (0,5 мл). Этот процесс повторяли и повышали температуру до 110°C в течение 3,5 мин. Затем реакционный флакон охлаждали до 70 °C, после чего в реакционный сосуд добавляли раствор 3,0 мг 2-(3-((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-карбонил)фенокси)этил 4-метилбензолсульфоната в 0,7 мл безводного ацетонитрила (MeCN/ACN). Реакционную смесь нагревали при 110°C в течение 10 мин. Реактор охлаждали до температуры 40 °C, разбавляли водой (4,3 мл) и содержимое переносили в контур инжектора ВЭЖХ для очистки. Очистку выполняли посредством ВЭЖХ с применением полупрепаративной колонки Eclipse XDB-C18 (5 мкм, 9,4 мм x 250 мм) со смесью 10 мМ NH4OAc и MeCN (45:55 об./об.) при скорости потока 4 мл/мин с УФ-детектированием при 254 нм. Очищенный раствор с радиоактивной меткой разбавили 30 мл воды и пропустили через картридж SepPak Light C-18. Картридж C-18 дополнительно промывали 10 мл воды, после чего использовали 0,5 мл этанола для элюирования маркера. Раствор с меткой дополнительно разбавляли 4,5 мл солевого раствора. Готовый состав содержит 10% этанола, подходящего для внутривенной инъекции (в/в).
Пример 68. Рацемический (2-(2H-1,2,3-Триазол-2-ил) фенил) ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) метанон.
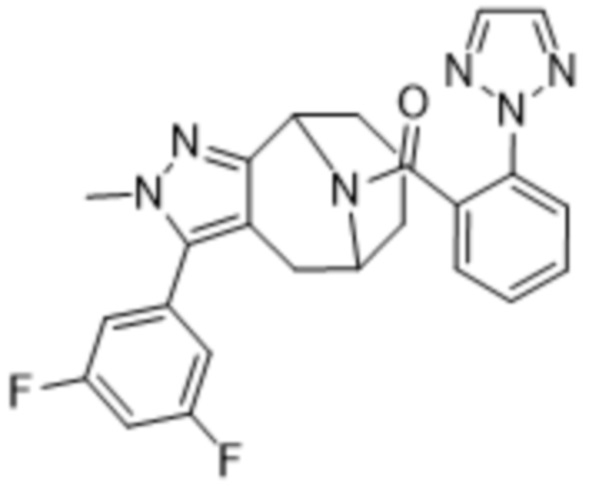
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 7) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-(2H-1,2,3-триазол-2-ил)бензойную кислоту (промежуточное соединение 49) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F2N6O, - 460,1; полученное m/z, 461,1 [M+H]+. 1H ЯМР (500 MГц, ДМСО-d6) δ 8,16 (д, J=11,4 Гц, 1H), 8,00-7,74 (м, 1H), 7,70-7,49 (м, 3H), 7,46-7,13 (м, 4H), 5,69 (д, J=3,2 Гц, 1H), 3,97-3,62 (м, 4H), 3,22-2,87 (м, 1H), 2,43-2,21 (м, 1H), 1,90-1,27 (м, 6H).
Пример 69. (2-(1H-1,2,4-триазол-5-ил) фенил) ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) метанон.
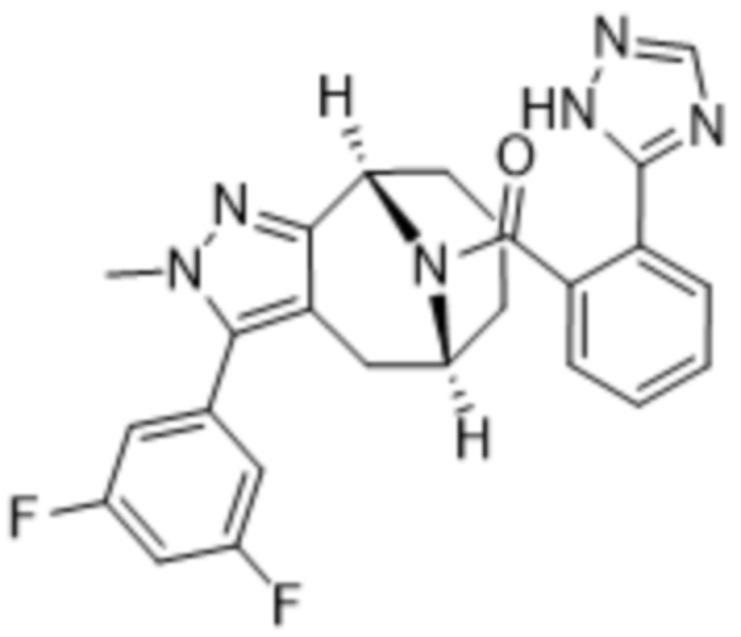
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-(1H-1,2,4-триазол-5-ил)бензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F2N6O, - 460,1; полученное m/z, 461,1 [M+H]+. 1 H ЯМР (500 МГц, ДМСО-d6) δ 8,60-7,82 (м, 2 H), 7,72- 6,80 (м, 6 H), 5,75 (д, J=3,3 Гц, 1 H), 4,35 (д, J=82,0 Гц, 1 H), 3,89-3,55 (м, 4 H), 3,11-2,78 (м, 1 H), 2,38 (дд, J=44,8, 15,9 Гц, 1 H), 2,17-1,27 (м, 6 H).
Пример 70. (2-(5-хлор-1 H-1,2,4-триазол-3-ил)фенил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
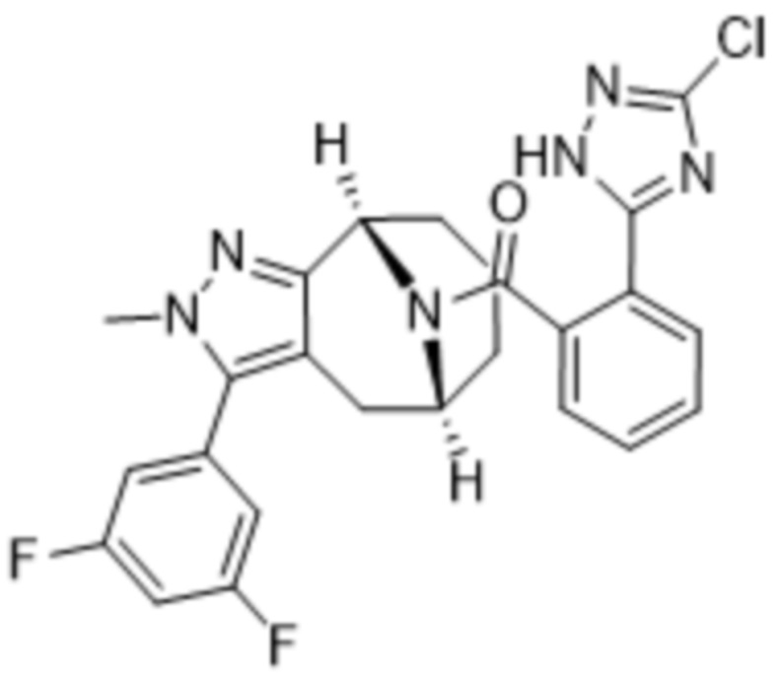
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-(3-хлор-1H-1,2,4-триазол-5-ил)бензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21ClF2N6O, - 494,1; полученное m/z - 495,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 15,00-14,33 (м, 1H), 7,90-7,00 (м, 7H), 5,76-5,63 (м, 1H), 3,79 (с, 3H), 3,79-3,68 (м, 1H), 3,00-2,86 (м, 1H), 2,58-2,42 (м, 1H), 2,25-1,16 (м, 6H).
Пример 71. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-(1-метил-1H-пиразол-4-ил)фенил)метанон.
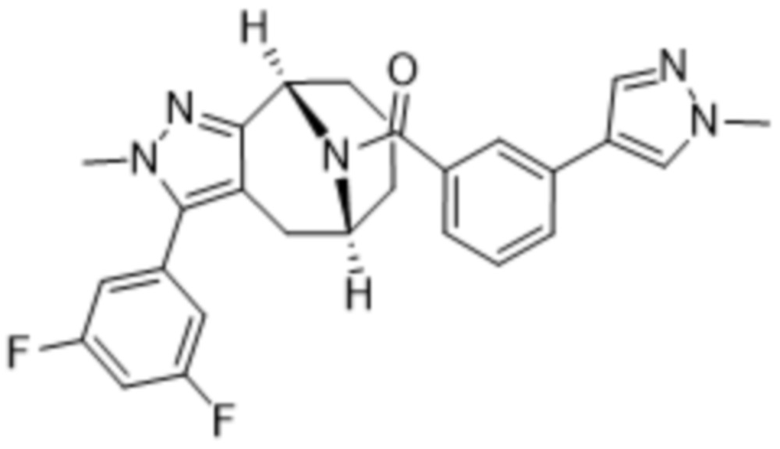
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-(1-метил-1H-пиразол-4-ил)бензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C27H25F2N5O, - 473,2; полученное m/z - 474,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,23 (с, 1H), 7,93-(с, 1H), 7,72-7,61 (м, 1H), 7,61-7,56 (м, 1H), 7,49-7,27 (м, 4H), 7,26-7,17 (м, 1H), 5,81-5,64 (м, 1H), 4,16-3,99 (м, 1H), 3,86 (с, 3H), 3,83 (с, 3H), 3,06-2,94 (м, 1H), 2,51-2,36 (м, 1H), 2,06-1,30 (м, 6H).
Пример 72. (3-(4H-1,2,4-триазол-4-ил) фенил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
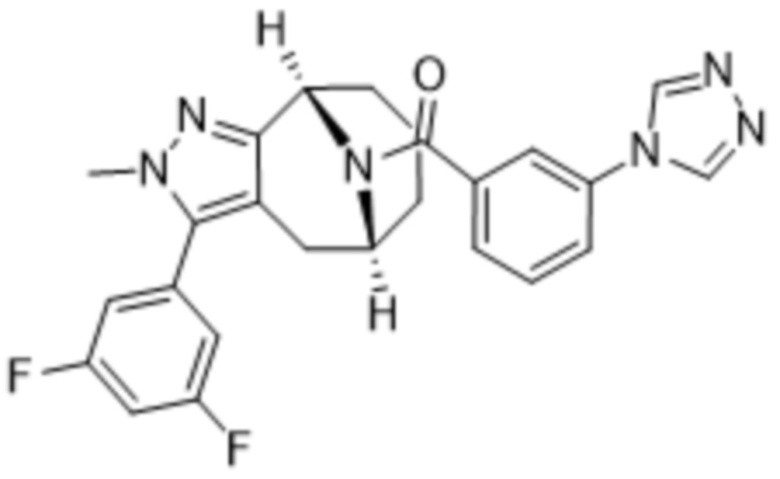
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-(4H-1,2,4-триазол-4-ил)бензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F2N6O, - 460,1; полученное m/z, 461,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,20 (д, J=4,4 Гц, 2H), 7,91-7,74 (м, 2H), 7,73-7,58 (м, 1H), 7,51-7,28 (м, 4H), 5,73 (д, J=3,5 Гц, 1H), 4,05 (т, J=6,2 Гц, 1H), 3,85-3,69 (м, 3H), 3,15-2,98 (м, 1H), 2,44 (д, J=16,2 Гц, 1H), 2,08-1,37 (м, 6H).
Пример 73. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метил-2-(2 H-1,2,3-триазол-2-ил)фенил)метанон.
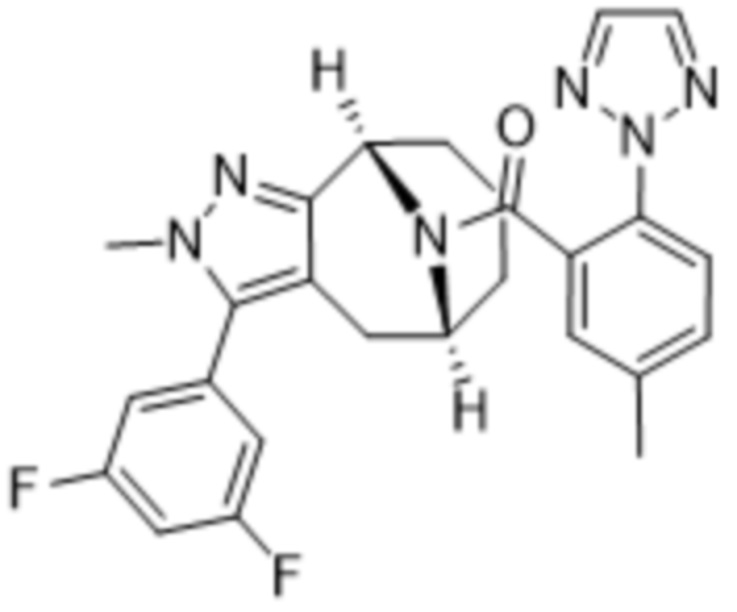
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-метил-2-(2H-1,2,3-триазол-2-ил)бензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H24F2N6O, - 474,2; полученное m/z - 475,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6): 8,11 (с, 1H), 7,86-6,95 (м, 7H), 5,74-5,61 (м, 1H), 3,94-3,77 (м, 1H), 3,82 (с, 3H), 3,03-2,85 (м, 1H), 2,49-2,31 (м, 4H), 1,95-1,13 (м, 6H).
Пример 74. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (3-фтор-2-(2H-1,2,3-триазол-2-ил) фенил) метанон.
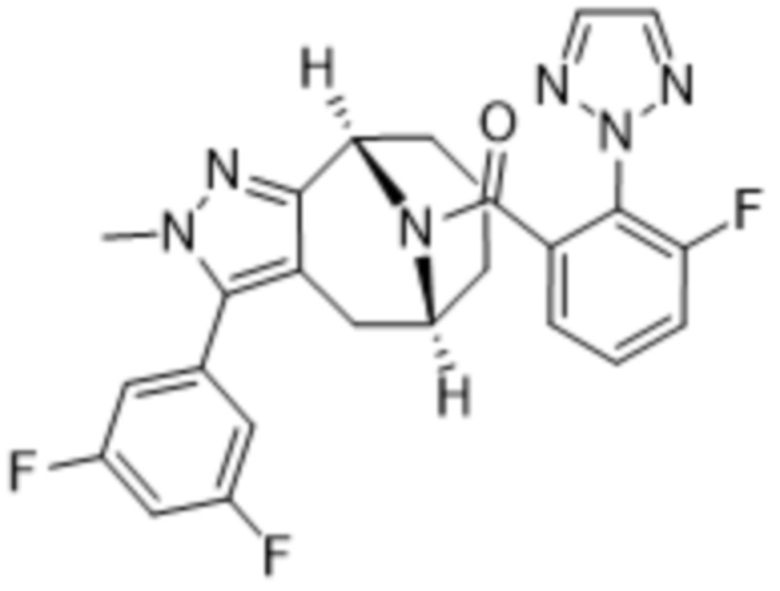
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-фтор-2-(2H-1,2,3-триазол-2-ил)бензойную кислоту [WO2016040789] вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21F3N6O, - 478,1; полученное m/z - 479,1 [M+H]+. 1 H ЯМР (500 МГц, ДМСО-d6) δ 8,18 (д, J=8,2 Гц, 1 H), 7,86-7,43 (м, 3 H), 7,35 (т, J=9,0 Гц, 4 H), 5,51 (с, 1 H), 3,95 (с, 1 H), 3,81 (с, 3 H), 3,06 (дд, J=16,3, 7,5 Гц, 1 H), 2,47-2,33 (м, 1 H), 1,86-1,26 (м, 6 H).
Пример 75. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-фтор-2-(оксазол-2-ил)фенил)метанон.
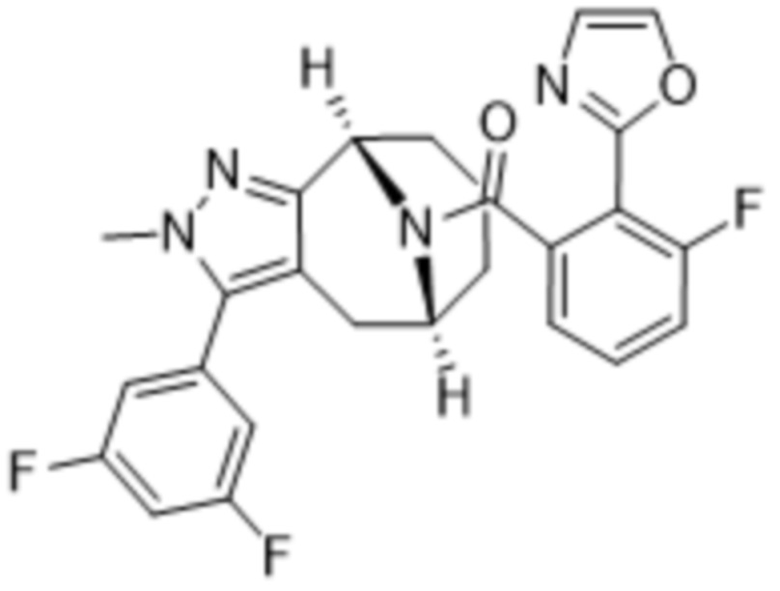
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-фтор-2-(оксазол-2-ил)бензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H21F3N4O2, - 471,2; полученное m/z, 472,2 [M+H]+. 1 H ЯМР (300 МГц, ДМСО-d6) δ 8,51-8,16 (м, 1H), 7,75-7,57 (м, 1H), 7,60-7,13 (м, 6H), 5,72-5,58 (м, 1H), 3,82 (с, 3H), 3,92-3,63 (м, 1H), 3,19-2,77 (м, 1H), 2,52-2,31 (м, 1H), 1,97-1,22 (м, 6H).
Пример 76. Рацемический ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-(пиримидин-2-ил)фенил)метанон.
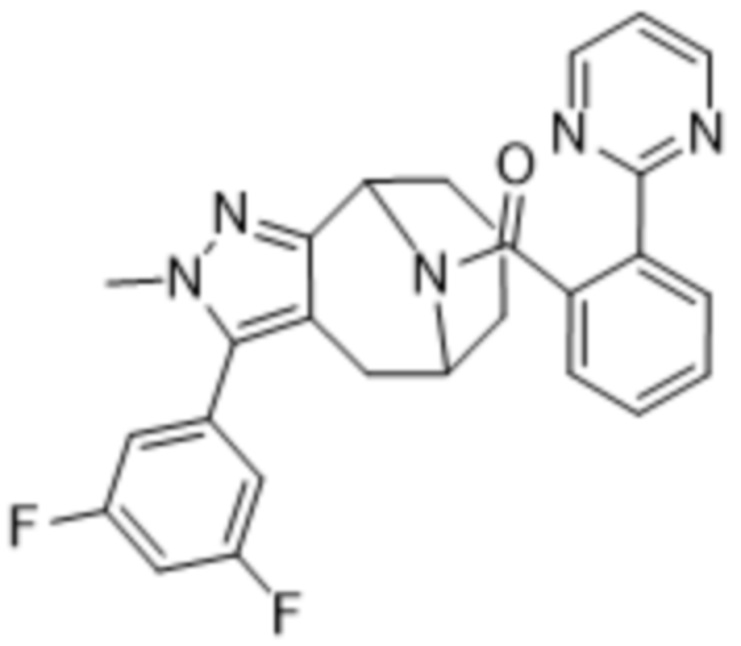
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 7) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-(пиримидин-2-ил)бензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H21F3N4O2, - 478,2; полученное m/z, 479,2 [M+H]+. 1 H ЯМР (300 МГц, ДМСО-d6) δ 8,51-8,16 (м, 1H), 7,75-7,57 (м, 1H), 7,60-7,13 (м, 6H), 5,72-5,58 (м, 1H), 3,82 (с, 3H), 3,92-3,63 (м, 1H), 3,19-2,77 (м, 1H), 2,52-2,31 (м, 1H), 1,97-1,22 (м, 6H).
Пример 77. Рацемический ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метокси-1-метил-1H-пиразол-4-ил)метанон.
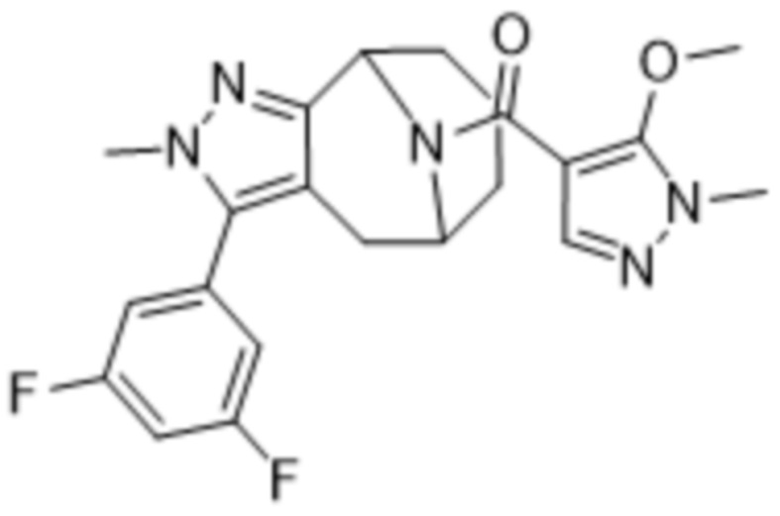
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 7) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-метокси-1-метил-1H-пиразол-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C22H23F2N5O2, - 427,2; полученное m/z, 428,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 7,47 (с, 1H), 7,41-7,18 (м, 3H), 5,73-5,53 (м, 1H), 4,51-4,31 (м, 1H), 3,93 (с, 3H), 3,81 (с, 3H), 3,59 (с, 3H), 3,26-3,10 (м, 1H), 2,51-2,35 (м, 1H), 2,05-1,23 (м, 6H).
Пример 78. Рацемический ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-этил-5-(трифторметил)-1H-пиразол-3-ил)метанон.
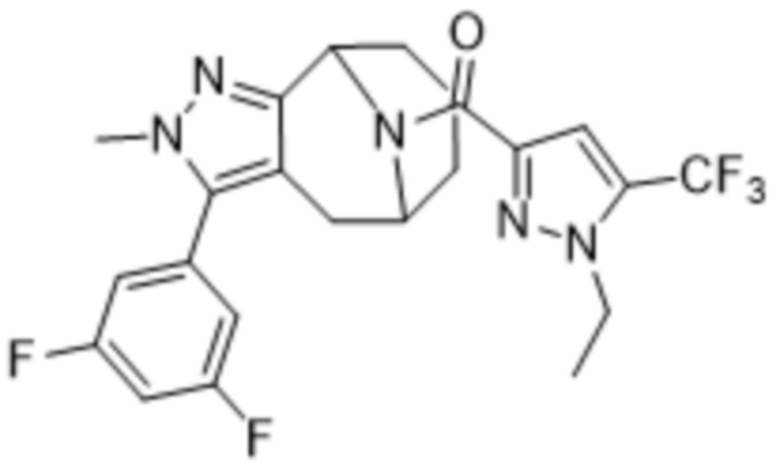
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 7) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-этил-5-(трифторметил)-1H-пиразол-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H22F5N5O, - 479,2; полученное m/z - 480,2 [M+H]+. 1 H ЯМР (500 МГц, ДМСО-d6) δ 7,37-7,27 (м, 3 H), 7,17-7,13 (м, 1 H), 5,75-5,70 (м, 1 H), 4,92-4,85 (м, 1 H), 4,29 (к, J=7,2 Гц, 2 H), 3,81 (с, 3 H), 3,13-3,00 (м, 1 H), 2,61-2,52 (м, 1 H), 1,88-1,61 (м, 4 H), 1,55-1,43 (м, 2 H), 1,41 (т, J=7,2 Гц, 3 H).
Пример 79. Рацемический (5-циклопропил-1H-пиразол-4-ил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
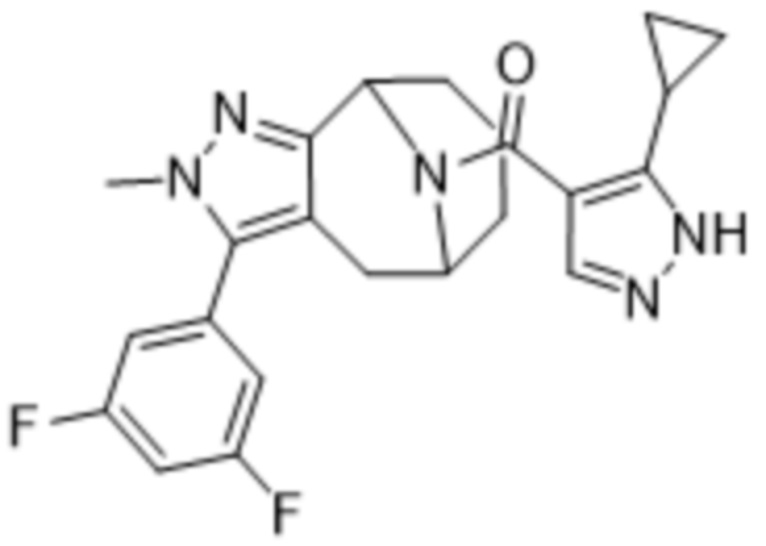
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 7) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-циклопропил-1H-пиразол-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H23F2N5O, - 423,2; полученное m/z - 424,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 12,68- 12,55 (м, 1H), 7,60-7,39 (м, 1H), 7,39-7,24 (м, 3H), 5,77-5,55 (м, 1H), 4,44-4,24 (м, 1H), 3,89-3,69 (м, 3H), 3,14-2,99 (м, 1H), 2,17-1,54 (м, 5H), 1,54-1,34 (м, 2H), 1,01-0,67 (м, 4H).
Пример 80. Рацемический (5-циклопропил-1-(2-гидроксиэтил)-1H-пиразол-4-ил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
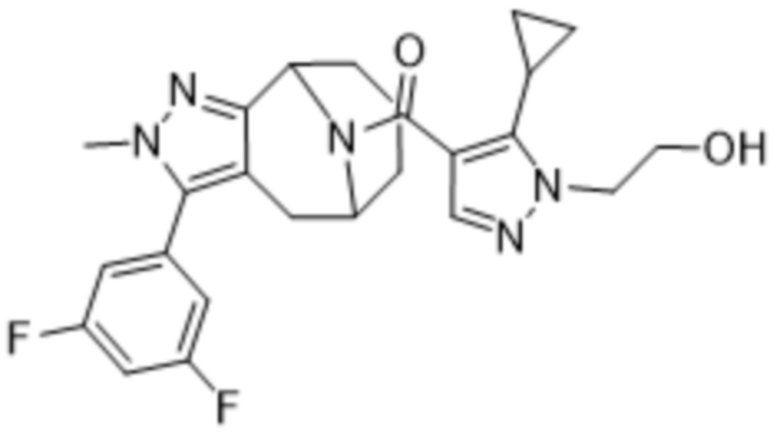
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 7) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-циклопропил--1-(2-гидроксиэтил)-1H-пиразол-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H27F2N5O2, - 467,2; полученное m/z, 468,3 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,45 (с, 1H), 7,37-7,25 (м, 3H), 5,72-5,66 (м, 1H), 4,91-4,85 (м, 1H), 4,25-4,14 (м, 3H), 3,85-3,73 (м, 5H), 3,08-2,96 (м, 1H), 2,47-2,40 (м, 1H), 1,96-1,30 (м, 7H), 0,96-0,81 (м, 2H), 0,71-0,57 (м, 2H).
Пример 81. Рацемический (3-циклопропил-1-(2,2,2-трифторэтил)-1H-пиразол-4-ил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
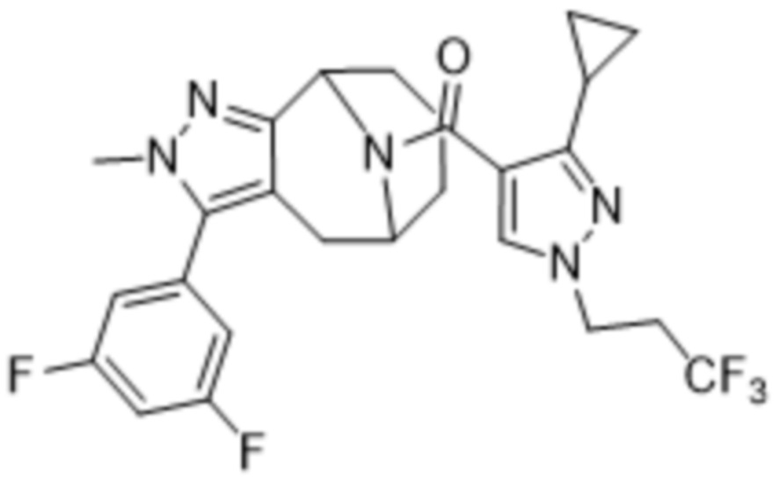
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 7) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-циклопропил-1-(3,3,3-трифторпропил)-1H-пиразол-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H24F5N5O, - 505,2; полученное m/z - 506,2 [M+H]+. 1 H ЯМР (500 МГц, ДМСО-d6) δ 7,62 (с, 1 H), 7,37-7,25 (м, 3 H), 5,75-5,66 (м, 1 H), 5,14 (к, J=9,0 Гц, 2 H), 4,11-4,02 (м, 1 H), 3,82 (с, 3 H), 3,08-2,98 (м, 1 H), 2,49-2,42 (м, 1 H), 1,95-1,33 (м, 7 H), 1,03-0,85 (м, 2 H), 0,76-0,63 (м, 2 H).
Пример 82. Рацемический (5-циклопропил-1-фенил-1H-пиразол-4-ил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.

Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 7) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-циклопропил-1-фенил-1H-пиразол-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C29H27F2N5O, - 499,2; полученное m/z - 500,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 7,74 (с, 1H), 7,71-7,60 (м, 2H), 7,59-7,50 (м, 2H), 7,49-7,41 (м, 1H), 7,41-7,24 (м, 3H), 5,82-5,65 (м, 1H), 4,40-4,18 (м, 1H), 3,83 (с, 3H), 3,22-2,99 (м, 1H), 2,51-2,35 (м, 1H), 2,11-1,27 (м, 7H), 0,92-0,67 (м, 2H), 0,65-0,42 (м, 2H).
Пример 83. Рацемический (5-циклопропил-1-(3-(трифторметил)фенил)-1H-пиразол-4-ил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
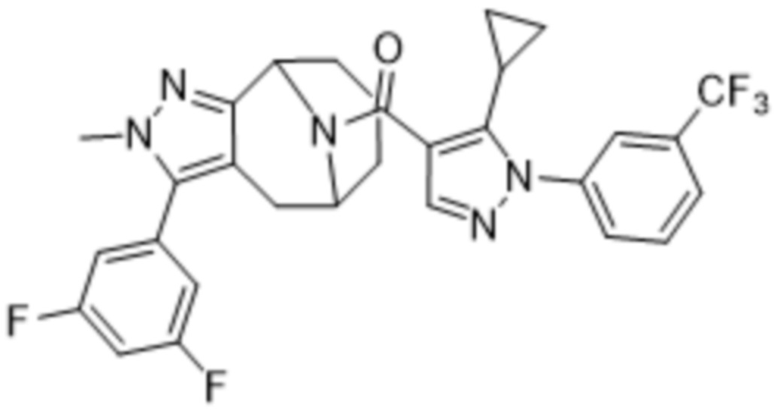
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 7) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-циклопропил-1-(3-(трифторметил)фенил)-1H-пиразол-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C30H26F5N5O, - 567,2; полученное m/z, 568,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,09-7,99 (м, 2H), 7,86-7,75 (м, 3H), 7,41-7,24 (м, 3H), 5,78-5,71 (м, 1H), 4,38-4,29 (м, 1H), 3,83 (с, 3H), 3,15-3,03 (м, 1H), 2,51-2,43 (м, 1H), 2,15-2,03 (м, 1H), 1,88-1,57 (м, 4H), 1,55-1,37 (м, 2H), 0,90-0,74 (м, 2H), 0,62-0,45 (м, 2H).
Пример 84. Рацемический ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метил-1-фенил-1 H-1,2,4-триазол-3-ил)метанон.
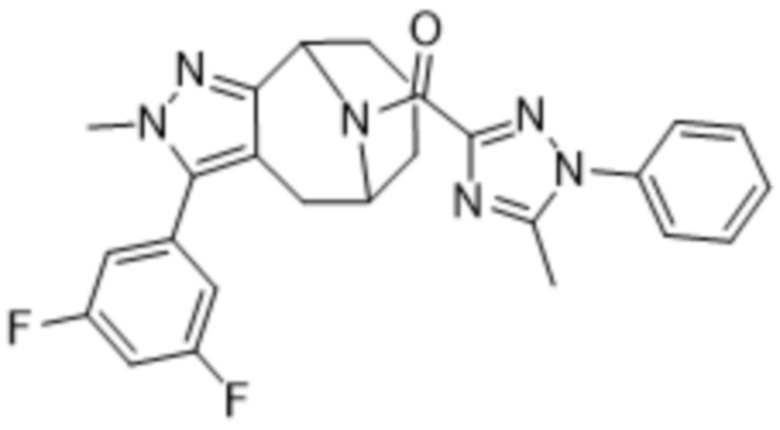
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 7) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-метил-1-фенил-1H-1,2,4-триазол-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H24F2N6O, - 474,2; полученное m/z, 475,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,69-7,49 (м, 5H), 7,37-7,27 (м, 3H), 5,77-5,73 (м, 1H), 4,71-4,64 (м, 1H), 3,81 (с, 3H), 3,10-2,98 (м, 1H), 2,62-2,54 (м, 1H), 2,52 (с, 3H), 1,89-1,67 (м, 4H), 1,57-1,40 (м, 2H).
Пример 85. Рацемический ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-(4-фторфенил)-5-метил-1 H-1,2,4-триазол-3-ил)метанон.
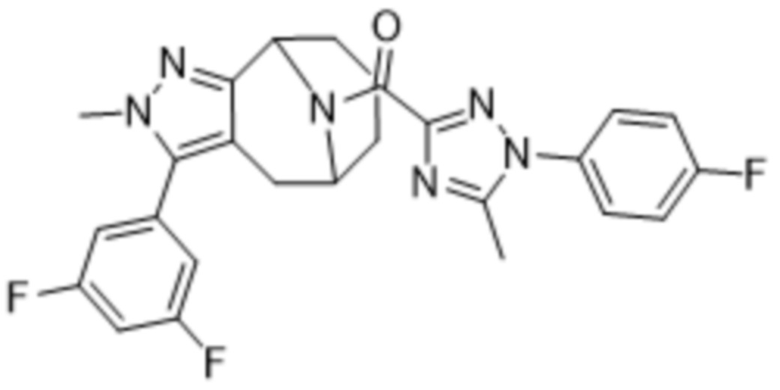
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 7) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-(4-фторфенил)-5-метил-1H-1,2,4-триазол-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H23F3N6O, - 492,2; полученное m/z, 493,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,75-7,65 (м, 2H), 7,49-7,39 (м, 2H), 7,37-7,26 (м, 3H), 5,77-5,72 (м, 1H), 4,69-4,63 (м, 1H), 3,81 (с, 3H), 3,12-2,97 (м, 1H), 2,62-2,53 (м, 1H), 2,47 (с, 3H), 1,88-1,66 (м, 4H), 1,56-1,38 (м, 2H).
Пример 86. Рацемический ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-этил-1-фенил-1 H-1,2,4-триазол-3-ил)метанон.
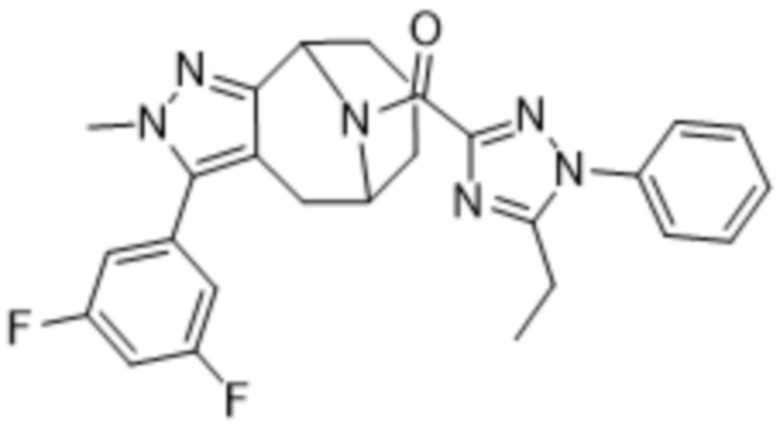
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 7) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-этил-1-фенил-1H-1,2,4-триазол-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C27H26F2N6O, - 488,2; полученное m/z, 489,2 [M+H]+. 1 H ЯМР (500 МГц, ДМСО-d6) δ 7,66-7,50 (м, 5H), 7,38-7,27 (м, 3H), 5,79-5,71 (м, 1H), 4,70-4,61 (м, 1H), 3,81 (с, 3H), 3,11-2,98 (м, 1H), 2,88-2,77 (м, 2H), 2,62-2,55 (м, 1H), 2,02-1,39 (м, 6H), 1,22 (т, J=7,6 Гц, 3H).
Пример 87. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-фторпиридин-4-ил)метанон.
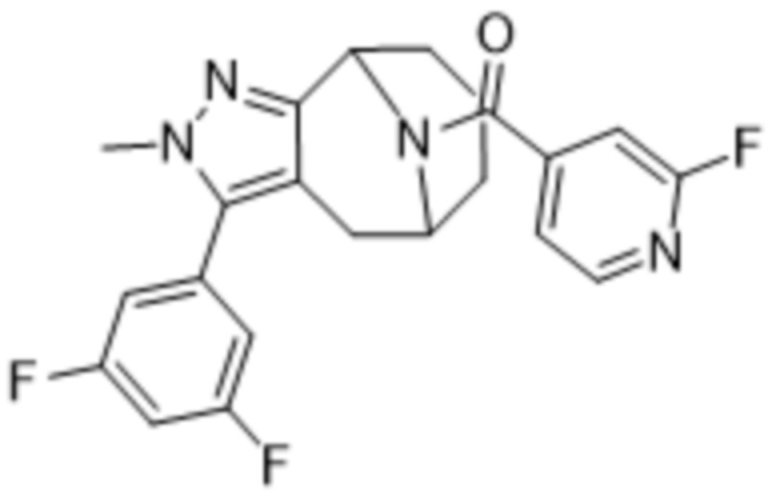
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 7) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-фторизоникотиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C22H19F3N4O, - 412,2; полученное m/z, 413,2 [M+H]+. 1 H ЯМР (CDCl3) δ 8,30 (д, J=5,0 Гц, 1H), 7,19 (м, 1H), 6,94 (м, 1H), 6,91- 6,84 (м, 3H), 5,97 и 4,85 (м, 1H), 5,21 и 4,03 (м, 1H), 3,85 и 3,81 (с, 3H), 3,23-3,18 и 2,95-2,90 (м, 1H), 2,46 (дд, J=23,1, 16,3 Гц, 1H), 2,01-1,93 (м, 1H), 1,91-1,82 (м, 1H), 1,80-1,73 (м, 1H), 1,63 -1,50 (3H).
Пример 88. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метоксипиридин-3-ил)метанон.
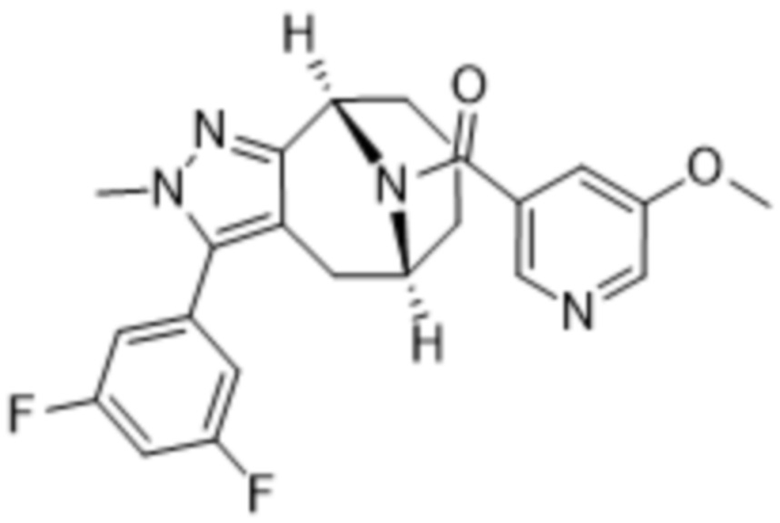
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-метоксиникотиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H22F2N4O2, - 424,2; полученное m/z, 425,2 [M+H]+. 1 H ЯМР (300 МГц, DMSO-d6) δ 8,38 (д, J=2,9 Гц, 1H), 8,22 (д, J=1,6 Гц, 1H), 7,46-7,40 (м, 1H), 7,39-7,25 (м, 3H), 5,78-5,64 (м, 1H), 4,08-3,95 (м, 1H), 3,87 (с, 3H), 3,83 (с, 3H), 3,17-3,00 (м, 1H), 2,40 (д, J=16,4 Гц, 1H), 2,08-1,30 (м, 6H).
Пример 89. (5-аминопиридин-2-ил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
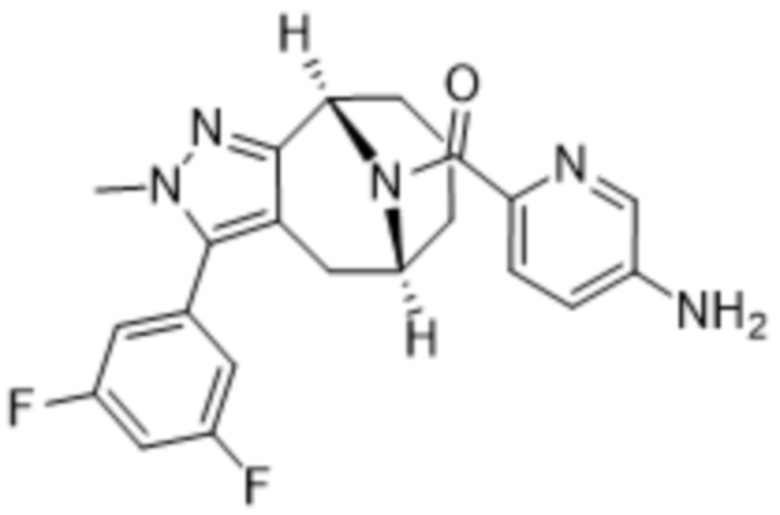
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемического (4 R,9 S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-аминопиколиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C22H21F2N5O, - 409,2; полученное m/z, 410,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,86-7,78 (м, 1H), 7,39-7,21 (м, 4H), 6,94- 6,88 (м, 1H), 5,72 (с, 2H), 5,67-5,60 (м, 1H), 4,76-4,67 (м, 1H), 3,78 (с, 3H), 3,10-2,89 (м, 1H), 2,67-2,31 (м, 1H), 2,14-1,31 (м, 6H).
Пример 90. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метоксибензофуран-2-ил)метанон.
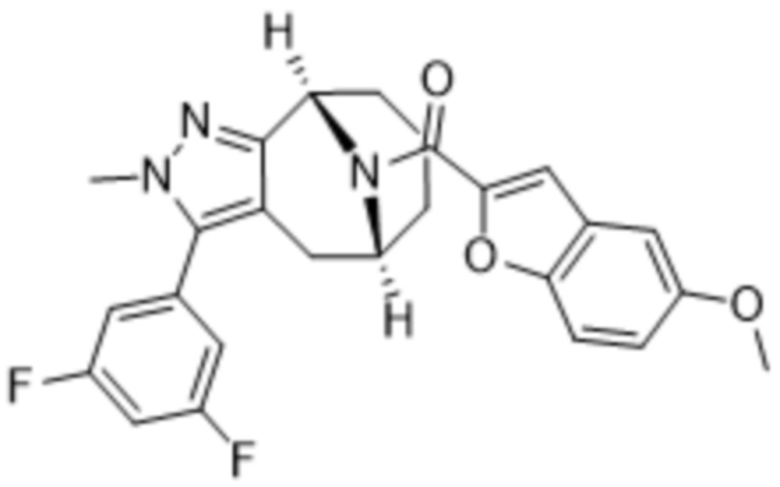
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-метоксибензофуран-2-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H23F2N3O3, - 463,2; полученное m/z - 464,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 7,59-7,53 (м, 1H), 7,43-7,28 (м, 4H), 7,24-7,17 (м, 1H), 7,09-7,02 (м, 1H), 5,76-5,60 (м, 1H), 4,88-4,69 (м, 1H), 3,89-3,68 (м, 6H), 3,32-3,02 (м, 1H), 2,60 (д, J=16,3 Гц, 1H), 1,95-1,61 (м, 4H), 1,61-1,35 (м, 2H).
Пример 91. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил) (2-метилбензо[d]оксазол-6-ил) метанон.
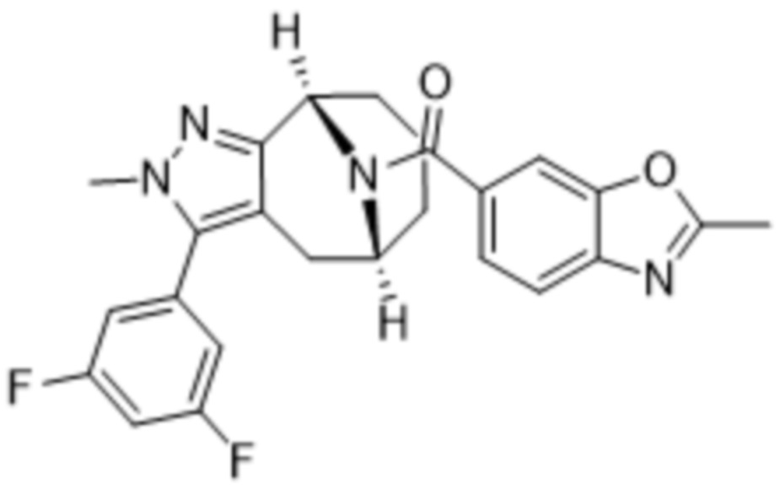
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-метилбензо[d]оксазол-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F2N4O2, - 448,1; полученное m/z, 449,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,81-7,69 (м, 2H), 7,45-7,29 (м, 4H), 5,72 (д, J=3,1 Гц, 1H), 4,16-4,01 (м, 1H), 3,87-3,73 (м, 3H), 3,17-3,02 (м, 1H), 2,66-2,57 (м, 3H), 2,48-2,37 (м, 1H), 1,99-1,38 (м, 6H).
Пример 92. (2-аминобензо[d]оксазол-6-ил) ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил) метанон.
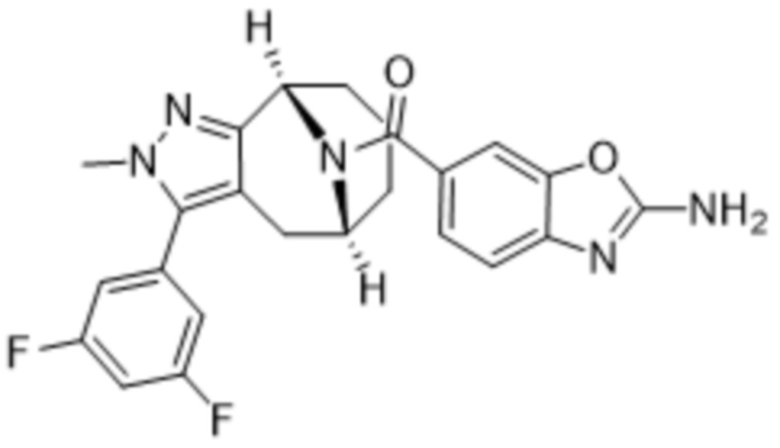
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-аминобензо[d]оксазол-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H21F2N5O2, - 449,1; полученное m/z, 450,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,28-9,08 (м, 1H), 8,75 (дд, J=16,4, 5,9 Гц, 1H), 8,40-8,24 (м, 1H), 8,08-7,90 (м, 1H), 7,81-7,63 (м, 1H), 7,41-7,24 (м, 3H), 5,97-5,09 (м, 1H), 3,95-3,66 (м, 4H), 2,99-2,63 (м, 1H), 2,45 (д, J=16,2 Гц, 1H), 2,08-1,40 (м, 6H).
Пример 93. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил) (фуро[3,2-b] пиридин-2-ил) метанон.
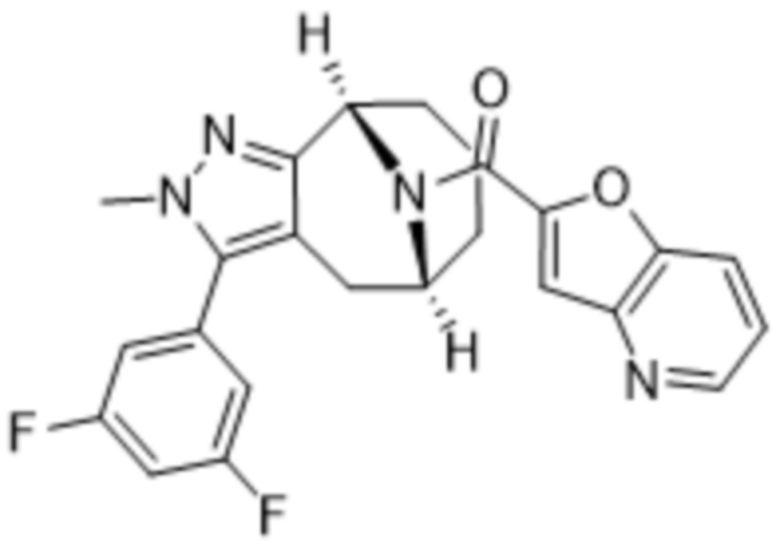
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и фурол[3,2-b]пиридин-2-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H20F2N4O2, - 434,1; полученное m/z, 435,1 [M+H]+. 1H ЯМР (500 MГц, ДМСО-d6) δ 8,67-8.53 (м, 1H), 8,16 (т, J=8,7 Гц, 1H), 7,64-7,27 (м, 5H), 5,76-5,37 (м, 1H), 5,03-4,62 (м, 1H), 3,89-3,74 (м, 3H), 3,19-3,03 (м, 1H), 2,65-2,54 (м, 1H), 2,12-1,45 (м, 6H).
Пример 94. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(фуро[3,2-c]пиридин-4-ил)метанон.
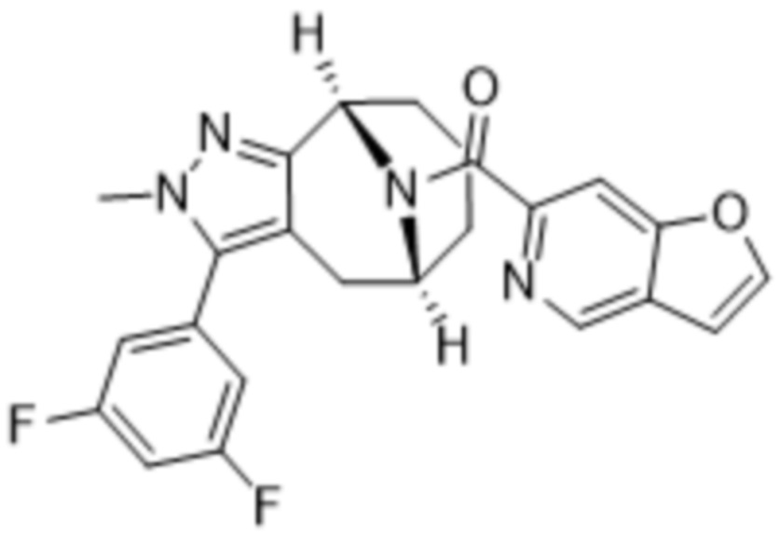
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и фурол[3,2-c]пиридин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H20F2N4O2, - 434,2; полученное m/z - 435,2 [M+H]+. 1 H ЯМР (300 МГц, ДМСО-d6) δ 8,47 (д, J=5,7 Гц, 1H), 8,24-8,12 (м, 1H), 7,82-7,76 (м, 1H), 7,41-7,23 (м, 3H), 7,10-7,03 (м, 1H), 5,89-5,76 (м, 1H), 4,36-4,21 (м, 1H), 3,83 (с, 3H), 2,99 (дд, J=16,1, 7,4 Гц, 1H), 2,59-2,36 (м, 1H), 2,03-1,35 (м, 6H).
Пример 95. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (1-метил-1H-пиразолo[3,4-b] пиридин-3-ил) метанон.
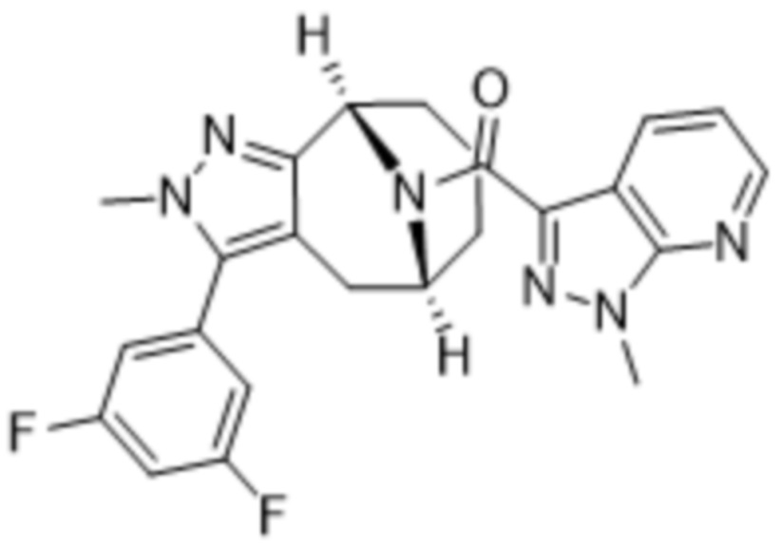
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-метил-1H-пиразол[3,4-b]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H22F2N6O, - 448,1; полученное m/z - 449,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,68-8,59 (м, 1H), 8,48-8,35 (м, 1H), 7,40-7,27 (м, 4H), 6,09 (д, J=247,3 Гц, 1H), 5,55-5,09 (м, 1H), 4,21-4,08 (м, 3H), 3,89-3,74 (м, 3H), 3,21-3,05 (м, 1H), 2,61 (дд, J=16,2, 7,8 Гц, 1H), 2,06-1,48 (м, 6H).
Пример 96. Рацемический ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил) метанон.
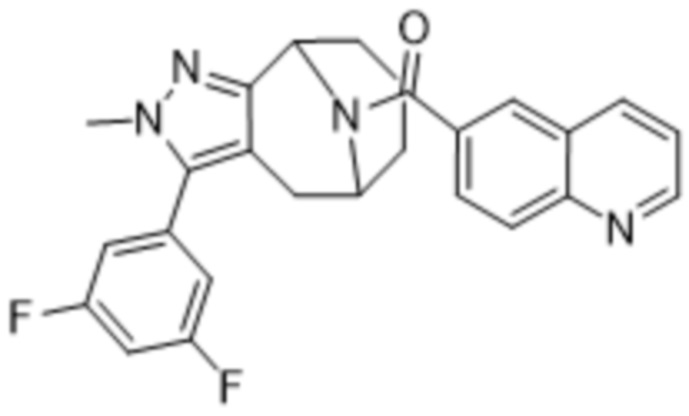
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 7) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C26H22F2N4O, - 444,2; полученное m/z - 445,1 [M+H]+. 1 H ЯМР (400 МГц, ДМСО-d6) δ 9,08-8,78 (м, 1H), 8,48 (д, J=8,4 Гц, 1H), 8,18-8,00 (м, 2H), 7,88-7,55 (м, 2H), 7,45-7,25 (м, 3H), 5,76 (с, 1H), 3,87-3,66 (м, 3H), 3,29-2,87 (м, 2H), 2,46 (д, J=16,1 Гц, 1H), 2,12-1,34 (м, 6H).
Пример 97. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хинолин-6-ил)метанон.
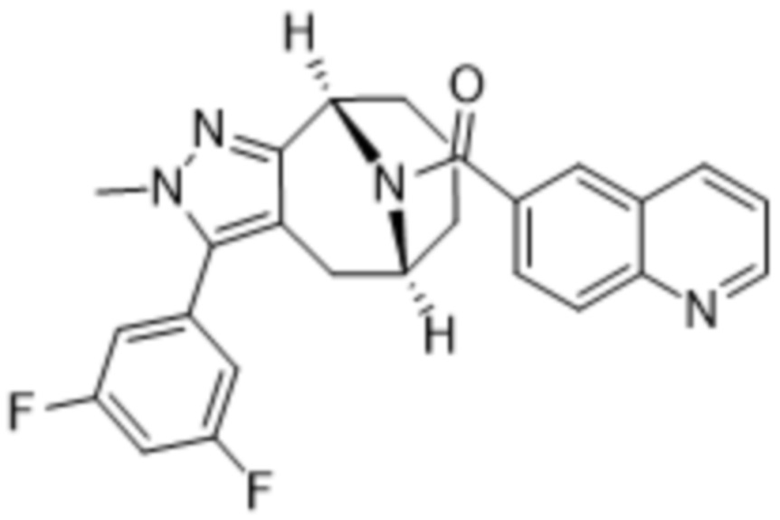
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C26H22F2N4O, - 444,2; полученное m/z - 445,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,04-8,92 (м, 1H), 8,55-8,42 (м, 1H), 8,17-8,04 (м, 2H), 7,87-7,55 (м, 2H), 7,45-7,24 (м, 3H), 5,83-5,70 (м, 1H), 4,18-4,05 (м, 1H), 3,89-3,69 (м, 3H), 3,21-3,06 (м, 1H), 2,47 (д, J=16,3 Гц, 1H), 2,09-1,41 (м, 6H).
Пример 98. ((5S,9R)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил) метанон.
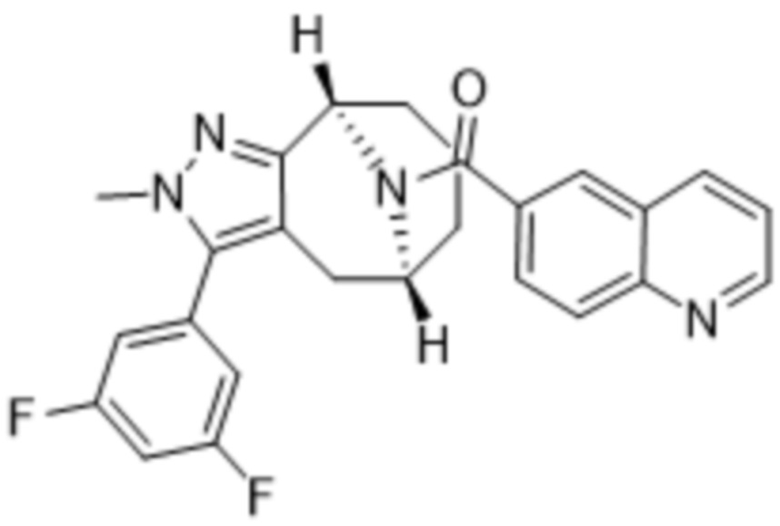
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5S,9R)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 29) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C26H22F2N4O, - 444,2; полученное m/z - 445,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,04-8,92 (м, 1H), 8,55-8,42 (м, 1H), 8,17-8,04 (м, 2H), 7,87-7,55 (м, 2H), 7,45-7,24 (м, 3H), 5,83-5,70 (м, 1H), 4,18-4,05 (м, 1H), 3,89-3,69 (м, 3H), 3,21-3,06 (м, 1H), 2,47 (д, J=16,3 Гц, 1H), 2,09-1,41 (м, 6H).
Пример 99. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (изохинолин-3-ил) метанон.
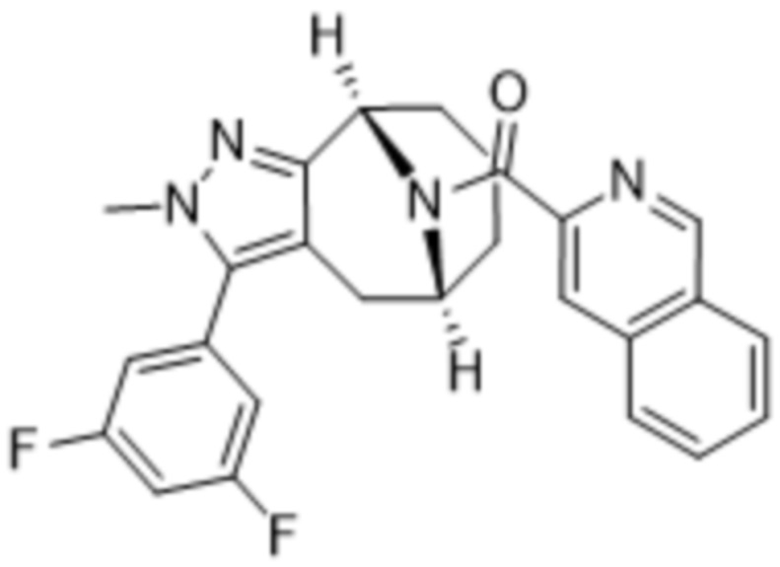
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и изохинолин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H22F2N4O, - 444,2; полученное m/z - 445,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,44-9,28 (м, 1H), 8,27-8,05 (м, 3H), 7,92-7,71 (м, 2H), 7,40-7,27 (м, 3H), 5,80 (с, 1H), 4,36-4,04 (м, 1H), 3,88-3,72 (м, 3H), 3,15-2,97 (м, 1H), 2,49-2,31 (м, 1H), 2,08-1,43 (м, 6H).
Пример 100. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хинолин-7-ил)метанон.
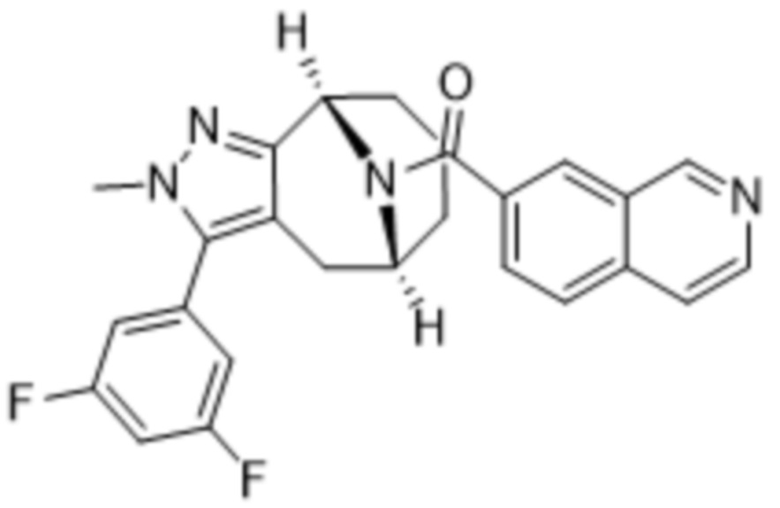
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и изохинолин-7-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H22F2N4O, - 444,2; полученное m/z - 445,2 [M+H]+. 1 H ЯМР (500 МГц, ДМСО-d6) δ 9,02-8,93 (м, 1H), 8,49-8,41 (м, 1H), 8,08 (д, J=8,4 Гц, 1H), 8,04-8,00 (м, 1H), 7,67-7,54 (м, 2H), 7,40-7,26 (м, 3H), 5,82-5,73 (м, 1H), 4,15-4,03 (м, 1H), 3,84 (с, 3H), 3,06 (дд, J=16,2, 7,3 Гц, 1H), 2,44 (д, J=16,2 Гц, 1H), 2,07-1,36 (м, 6H).
Пример 101. (4-бромхинолин-6-ил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
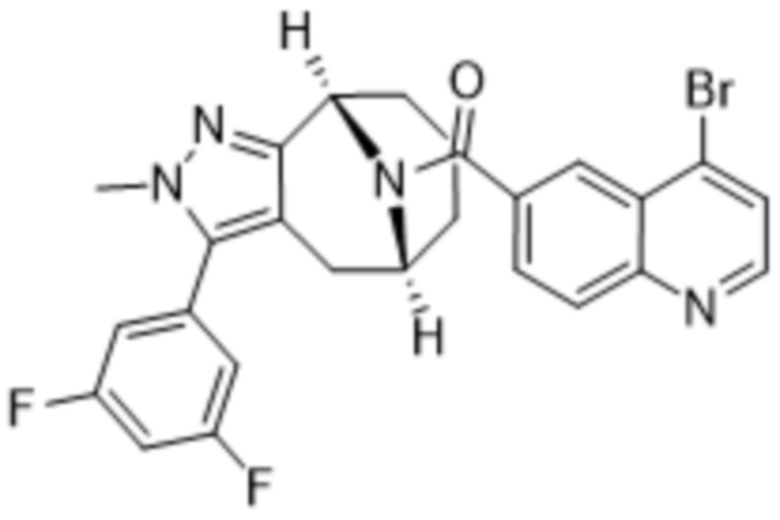
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемической (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 4-бромхинолин-6-карбоновой кислоты вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H21BrF2N4O, - 522,1; полученное m/z - 523,1 [M+H]+. 1 H ЯМР (500 МГц, ДМСО-d6) δ 8,81 (дд, J=9,0, 4,6 Гц, 1H), 8,21-7,98 (м, 3H), 7,95-7,80 (м, 1H), 7,43-7,23 (м, 3H), 5,77 (с, 1H), 4,10 (с, 1H), 3,92-3,71 (м, 3H), 3,22-2,98 (м, 1H), 2,46 (с, 1H), 2,03-1,43 (м, 6H).
Пример 102. (3-бромхинолин-6-ил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
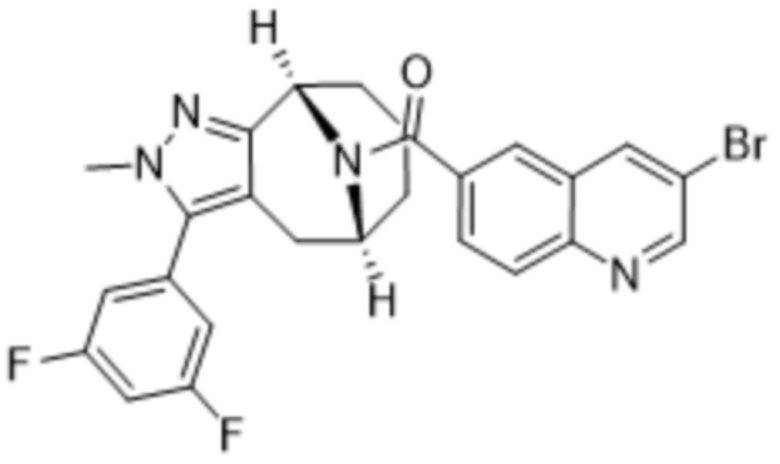
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемической (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-бромхинолин-6-карбоновой кислоты вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H21BrF2N4O, - 522,1; полученное m/z - 523,1 [M+H]+. 1 H ЯМР (500 МГц, DMSO-d6) δ 9,01 (д, J=2,4 Гц, 1H), 8,84-8,82 (м, 1H), 8,10 (д, J=8,7 Гц, 1H), 8,07-8,04 (м, 1H), 7,84 (дд, J=8,6, 1,9 Гц, 1H), 7,40-7,28 (м, 3H), 5,81-5,69 (м, 1H), 4,13-4,05 (м, 1H), 3,84 (с, 3H), 3,09 (дд, J=16,3, 7,4 Гц, 1H), 2,50-2,43 (м, 1H), 2,12-1,33 (м, 6H).
Пример 103. (8-бромхинолин-6-ил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
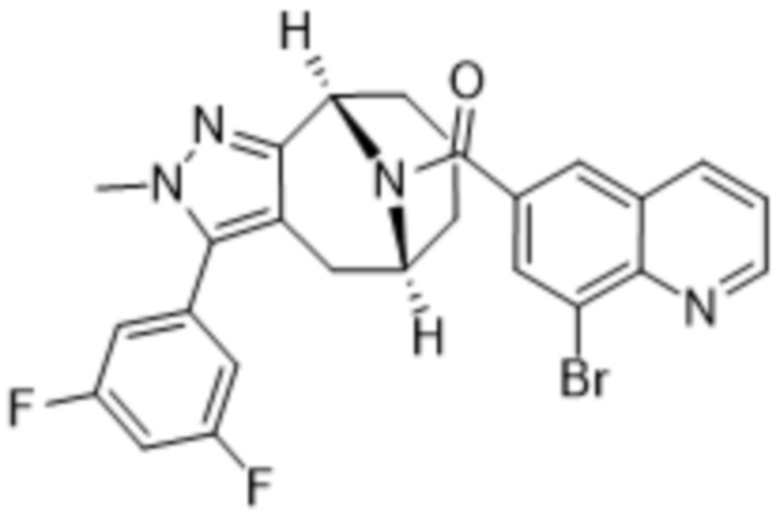
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемической (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 8-бромхинолин-6-карбоновой кислоты (промежуточное соединение 1) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H21BrF2N4O, - 522,1; полученное m/z - 523,1 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 9,16-8,99 (м, 1H), 8,60-8,48 (м, 1H), 8,21-8,03 (м, 2H), 7,81-7,62 (м, 1H), 7,44-7,23 (м, 3H), 5,83-5,68 (м, 1H), 4,25-4,07 (м, 1H), 3,85 (с, 3H), 3,22-2,97 (м, 1H), 2,66-2,37 (м, 1H), 2,13-1,30 (м, 6H).
Пример 104. (2-хлорхинолин-6-ил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
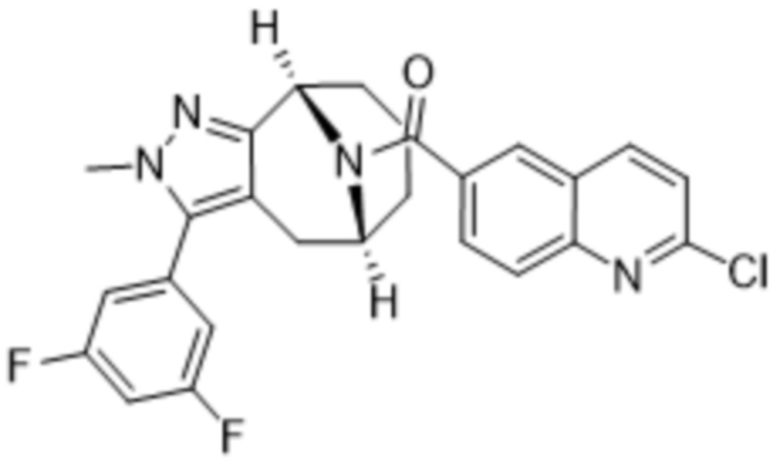
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемической (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-хлорхинолин-6-карбоновой кислоты вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H21ClF2N4O, - 478,1; полученное m/z, 479,1 [M+H]+. 1 H ЯМР (500 МГц, DMSO-d6) δ 8,55 (д, J=8,7 Гц, 1H), 8,16 (д, J=1,9 Гц, 1H), 8,02 (д, J=8,7 Гц, 1H), 7,86 (дд, J=8,6, 1,9 Гц, 1H), 7,67 (д, J=8,6 Гц, 1H), 7,40-7,27 (м, 3H), 5,81-5,71 (м, 1H), 4,13-4,04 (м, 1H), 3,84 (с, 3H), 3,10 (дд, J=16,6, 7,4 Гц, 1H), 2,46 (д, J=16,0 Гц, 1H), 2,08-1,35 (м, 6H).
Пример 105. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(8-фторхинолин-5-ил)метанон.
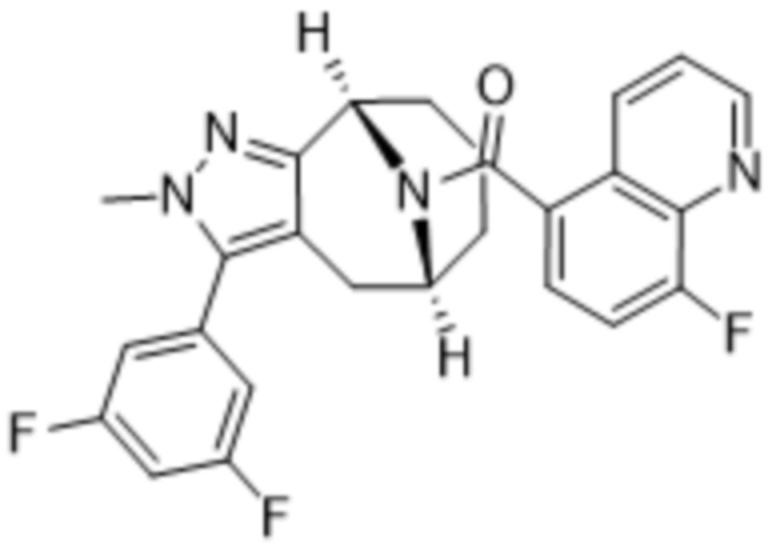
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемической (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 8-фторхинолин-5-карбоновой кислоты вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H21F3N4O, - 462,2; полученное m/z, 463,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,12-8,98 (м, 1H), 8,46-8,36 (м, 1H), 7,83-7,47 (м, 3H), 7,42-7,26 (м, 3H), 5,96-5,84 (м, 1H), 3,84 (с, 3H), 3,80-3,63 (м, 1H), 3,10-2,95 (м, 1H), 2,66-2,35 (м, 1H), 2,13-1,66 (м, 2H), 1,64-1,30 (м, 4H).
Пример 106. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(8-фторхинолин-6-ил)метанон.
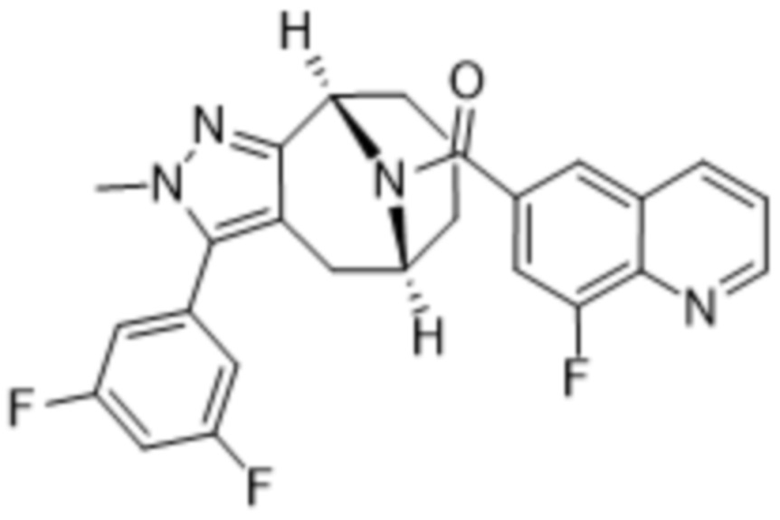
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемической (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 8-фторхинолин-6-карбоновой кислоты вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H21F3N4O, - 462,2; полученное m/z, 463,1 [M+H]+. 1 H ЯМР (500 МГц, DMSO-d6) δ 9,02 (дд, J=4,2, 1,6 Гц, 1H), 8,57-8,52 (м, 1H), 7,95-7,92 (м, 1H), 7,70 (дд, J=8,3, 4,2 Гц, 1H), 7,67 (дд, J=10,9, 1,7 Гц, 1H), 7,39-7,30 (м, 3H), 5,79-5,70 (м, 1H), 4,18-4,09 (м, 1H), 3,84 (с, 3H), 3,10 (дд, J=16,1, 7,4 Гц, 1H), 2,45 (д, J=16,2 Гц, 1H), 1,98-1,67 (м, 3H), 1,64-1,37 (м, 3H).
Пример 107. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-(трифторметил)хинолин-6-ил)метанон.
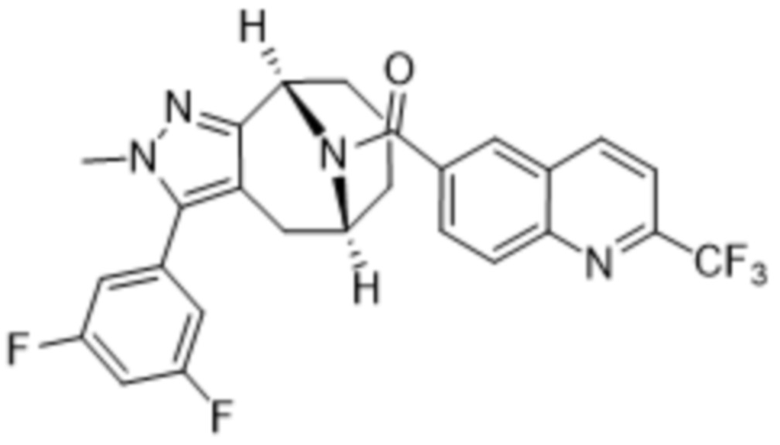
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемической (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-(трифторметил)хинолин-6-карбоновой кислоты вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C27H21F5N4O, - 512,2; полученное m/z, 513,1 [M+H]+. 1 H ЯМР (500 МГц, ДМСО-d6) δ 8,87-8,79 (м, 1H), 8,29-8,24 (м, 1H), 8,24 (д, J=8,7 Гц, 1H), 8,06 (д, J=8,6 Гц, 1H), 7,95 (дд, J=8,7, 1,9 Гц, 1H), 7,41-7,29 (м, 3H), 5,84-5,72 (м, 1H), 4,14-4,03 (м, 1H), 3,85 (с, 3H), 3,10 (дд, J=16,4, 7,6 Гц, 1H), 2,50-2,42 (м, 1H), 2,09 -1,34 (м, 6H).
Пример 108. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(8-гидроксихинолин-6-ил)метанон.
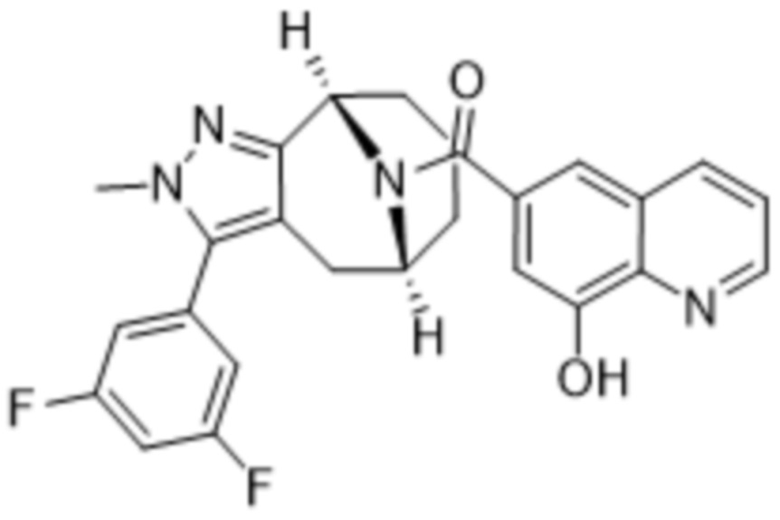
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемической (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 8-гидроксихинолин-6-карбоновой кислоты вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H22F2N4O2, - 460,2; полученное m/z, 461,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 10,37-10,05 (м, 1H), 9,01-8,81 (м, 1H), 8,47-8,34 (м, 1H), 7,69-7,55 (м, 1H), 7,50-7,41 (м, 1H), 7,39-7,27 (м, 3H), 7,12-7,01 (м, 1H), 5,84-5,65 (м, 1H), 4,24-4,00 (м, 1H), 3,84 (с, 3H), 3,23-2,94 (м, 1H), 2,56-2,39 (м, 1H), 2,09-1,26 (м, 6H).
Пример 109. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метоксихинолин-3-ил)метанон.
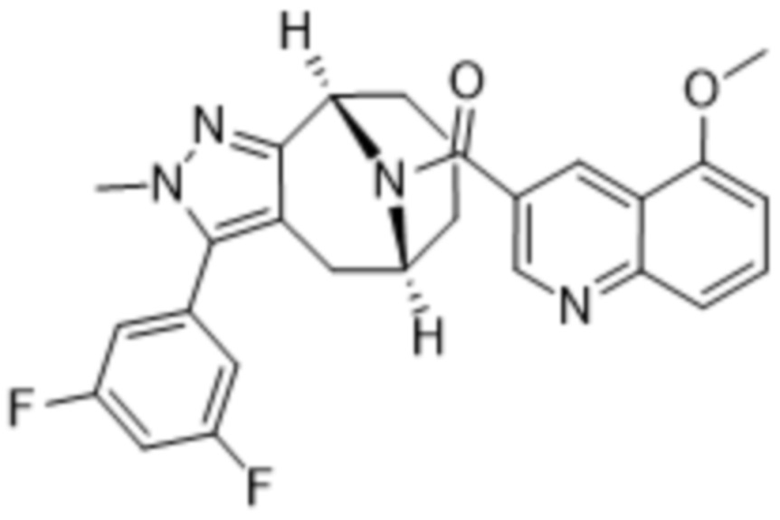
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-метоксихинолин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C27H24F2N4O2, - 474,2; полученное m/z, 475,2 [M+H]+. 1 H ЯМР (500 МГц, DMSO-d6) δ 8,94 (д, J=2,2 Гц, 1H), 8,53 (д, J=2,2 Гц, 1H), 7,79-7,74 (м, 1H), 7,69-7,61 (м, 1H), 7,40-7,29 (м, 3H), 7,19-7,11 (м, 1H), 5,82-5,71 (м, 1H), 4,18-4,09 (м, 1H), 4,01 (с, 3H), 3,84 (с, 3H), 3,07 (дд, J=16,2, 7,4 Гц, 1H), 2,44 (д, J=16,4 Гц, 1H), 2,07-1,38 (м, 6H).
Пример 110. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(8-нитрохинолин-6-ил)метанон.
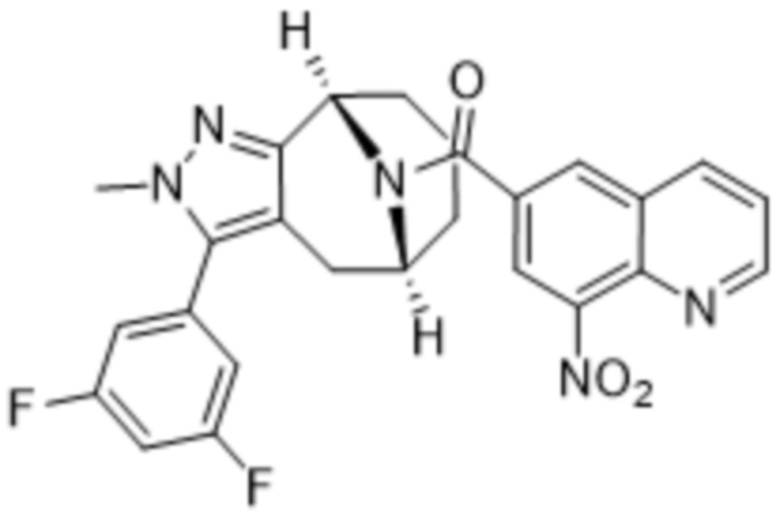
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемической (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 8-нитрохинолин-6-карбоновой кислоты вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H21F2N5O3, - 489,2; полученное m/z, 490,2 [M+H]+. 1 H ЯМР (300 МГц, ДМСО-d6) δ 9,18-9,03 (м, 1H), 8,75-8,59 (м, 1H), 8,45-8,28 (м, 2H), 7,81 (дд, J=8,4, 4,3 Гц, 1H), 7,44-7,22 (м, 3H), 5,82-5,68 (м, 1H), 4,23-4,07 (м, 1H), 3,85 (с, 3H), 3,13 (дд, J=16,3, 7,3 Гц, 1H), 2,58-2,37 (м, 1H), 2,20-1,31 (м, 6H).
Пример 111. (8-аминохинолин-6-ил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
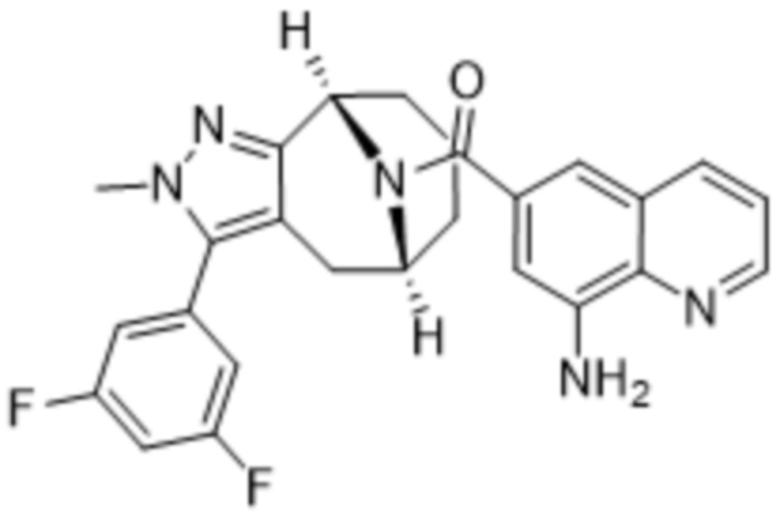
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемической (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 8-аминохинолин-6-карбоновой кислоты вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H23F2N5O, - 459,2; полученное m/z, 460,1 [M+H]+. 1 H ЯМР (500 МГц, DMSO-d6) δ 8,77 (дд, J=4,2, 1,7 Гц, 1H), 8,30-8,23 (м, 1H), 7,51 (дд, J=8,3, 4,1 Гц, 1H), 7,39-7,29 (м, 3H), 7,11 (д, J=1,7 Гц, 1H), 6,82 (д, J=1,7 Гц, 1H), 6,10 (с, 2H), 5,76-5,68 (м, 1H), 4,24-4,15 (м, 1H), 3,84 (с, 3H), 3,02 (дд, J=16,2, 7,4 Гц, 1H), 2,55-2,44 (м, 1H), 2,02-1,31 (м, 6H).
Пример 112. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиназолин-7-ил) метанон.
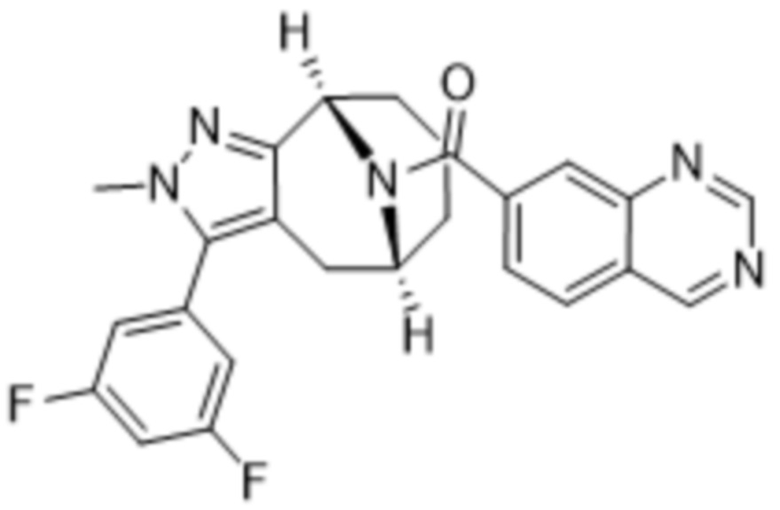
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и хиназолин-7-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21F2N5O, - 445,2; полученное m/z, 446,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,70 (дд, J=6,2, 0,9 Гц, 1H), 9,37 (д, J=6,4 Гц, 1H), 8,36-8,22 (м, 1H), 8,10-7,67 (м, 2H), 7,43-7,27 (м, 3H), 5,78 (д, J=3,5 Гц, 1H), 4,13-3,92 (м, 1H), 3,88-3,73 (м, 3H), 3,16-3,01 (м, 1H), 2,42 (д, J=16,2 Гц, 1H), 2,06-1,38 (м, 6H).
Пример 113. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиноксалин-6-ил)метанон.
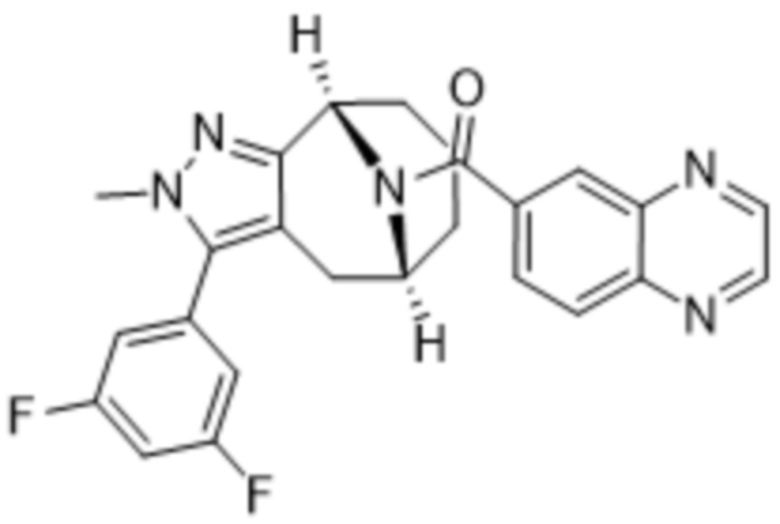
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и хиноксалин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21F2N5O, - 445,2; полученное m/z, 446,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,03 (д, J=7,5 Гц, 2H), 8,24-8,05 (м, 2H), 7,95-7,77 (м, 1H), 7,46-7,30 (м, 3H), 5,80 (д, J=3,2 Гц, 1H), 4,09 (т, J=5,8 Гц, 1H), 3,90-3,71 (м, 3H), 3,22-3,00 (м, 1H), 2,44 (д, J=16,2 Гц, 1H), 2,00-1,35 (м, 6H).
Пример 114. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хиназолин-6-ил)метанон.
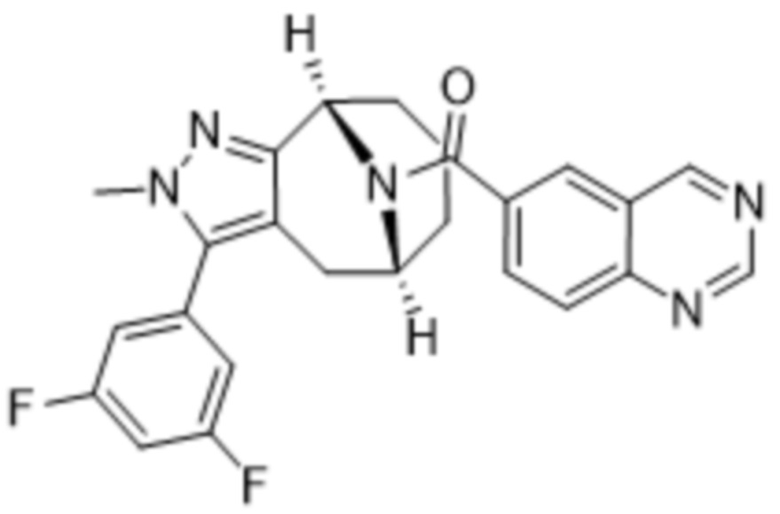
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и хиназолин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21F2N5O, - 445,2; полученное m/z, 446,1 [M+H]+. 1 H ЯМР (500 МГц, ДМСО-d6) δ 9,70 (с, 1H), 9,36 (с, 1H), 8,28-8,22 (м, 1H), 8,14-8,04 (м, 2H), 7,41-7,28 (м, 3H), 5,82-5,72 (м, 1H), 4,14-4,06 (м, 1H), 3,85 (с, 3H), 3,10 (дд, J=16,5, 7,6 Гц, 1H), 2,50-2,43 (м, 1H), 2,11-1,35 (м, 6H).
Пример 115. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилхиноксалин-6-ил)метанон.
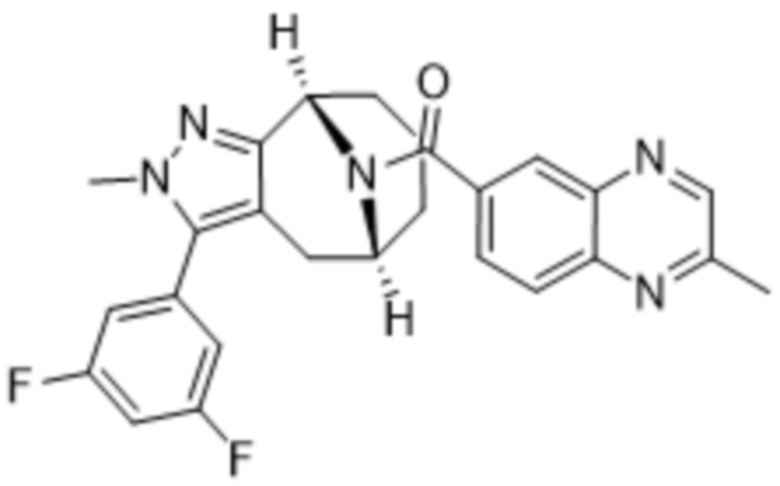
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемической (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-метилхиноксалин-6-карбоновой кислоты (промежуточное соединение 33) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H23F2N5O, - 459,2; полученное m/z, 460,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,92 (с, 1H), 8,20-7,90 (м, 2H), 7,88-7,70 (м, 1H), 7,46-7,23 (м, 3H), 5,86-5,66 (м, 1H), 4,16-3,96 (м, 1H), 3,84 (с, 3H), 3,25-2,99 (м, 1H), 2,73 (с, 3H), 2,53-2,34 (м, 1H), 2,06-1,31 (м, 6H).
Пример 116. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил) (7-фторхиноксалин-6-ил) метанон.
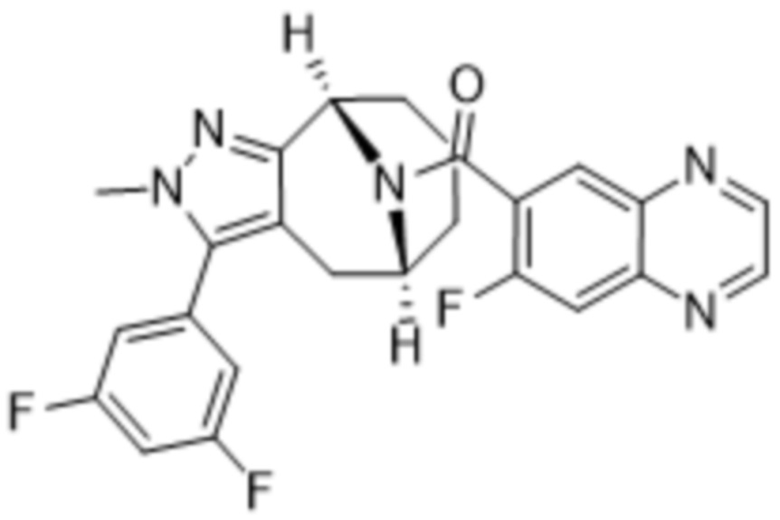
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 7-фторхиноксалин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H20F3N5O, - 463,1; полученное m/z, 464,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,10-8,88 (м, 2H), 8,41-7,85 (м, 2H), 7,43-7,24 (м, 3H), 5,83 (с, 1H), 3,97 (с, 1H), 3,88-3,72 (м, 3H), 3,16-2,84 (м, 1H), 2,47-2,32 (м, 1H), 1,99-1,34 (м, 6H).
Пример 117. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил) (1,6-нафтиридин-5-ил) метанон.
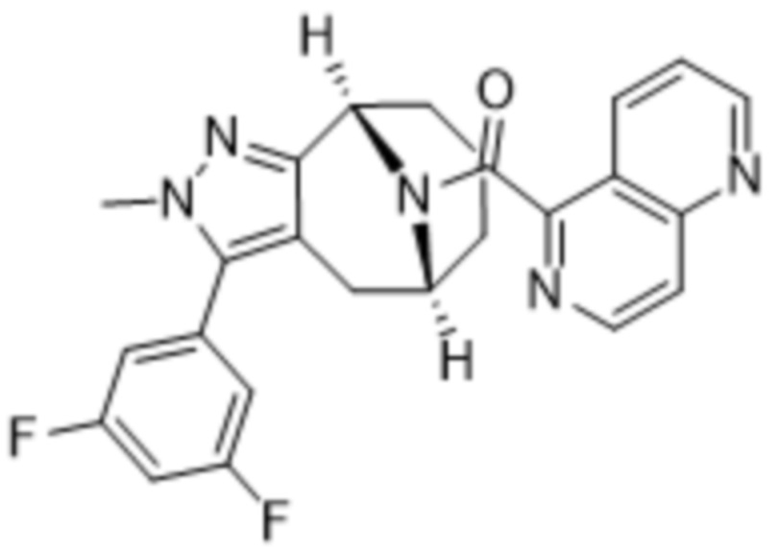
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемической (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1,6-нафтиридин-5-карбоновой кислоты вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21F2N5O, - 445,2; полученное m/z, 446,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,24-9,09 (м, 1H), 8,75 (дд, J=16,4, 5,9 Гц, 1H), 8,42-8,23 (м, 1H), 8,07-7,93 (м, 1H), 7,79-7,66 (м, 1H), 7,41-7,22 (м, 3H), 5,98-5,21 (м, 1H), 3,91-3,62 (м, 4H), 2,95-2,63 (м, 1H), 2,48-2,35 (м, 1H), 2,07-1,40 (м, 6H).
Пример 118. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1,8-нафтиридин-3-ил)метанон.

Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемической (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1,8-нафтиридин-3-карбоновой кислоты вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21F2N5O, - 445,2; полученное m/z, 446,1 [M+H]+. 1 H ЯМР (500 МГц, ДМСО-d6) δ 9,16 (дд, J=4,2, 2,0 Гц, 1H), 9,13 (д, J=2,4 Гц, 1H), 8,60 (д, J=2,4 Гц, 1H), 8,59-8,57 (м, 1H), 7,72 (дд, J=8,1, 4,2 Гц, 1H), 7,41-7,27 (м, 3H), 5,83-5,75 (м, 1H), 4,21-4,12 (м, 1H), 3,85 (с, 3H), 3,16 (дд, J=16,3, 7,4 Гц, 1H), 2,52-2,42 (м, 1H), 2,12-1,37 (м, 6H).
Пример 119. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1,8-нафтиридин-4-ил)метанон.
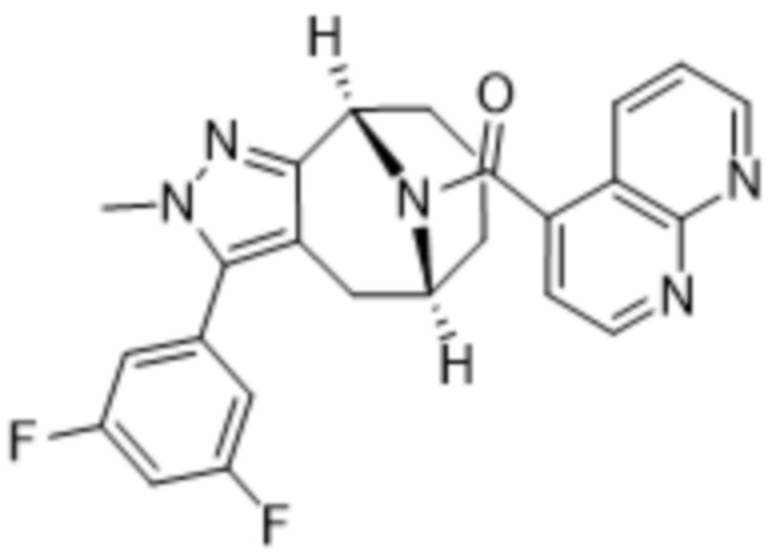
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемической (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1,8-нафтиридин-4-карбоновой кислоты вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21F2N5O, - 445,2; полученное m/z, 446,2 [M+H]+. 1 H ЯМР (300 МГц, ДМСО-d6) δ 9,30-9,01 (м, 2H), 8,51-8,33 (м, 1H), 7,85-7,54 (м, 2H), 7,45-7,18 (м, 3H), 5,97-5,83 (м, 1H), 3,85 (с, 3H), 3,81-3,61 (м, 1H), 3,15-2,95 (м, 1H), 2,38 (д, J=16,3 Гц, 1H), 2,20-1,31 (м, 6H).
Пример 120. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1,7-нафтиридин-4-ил)метанон.
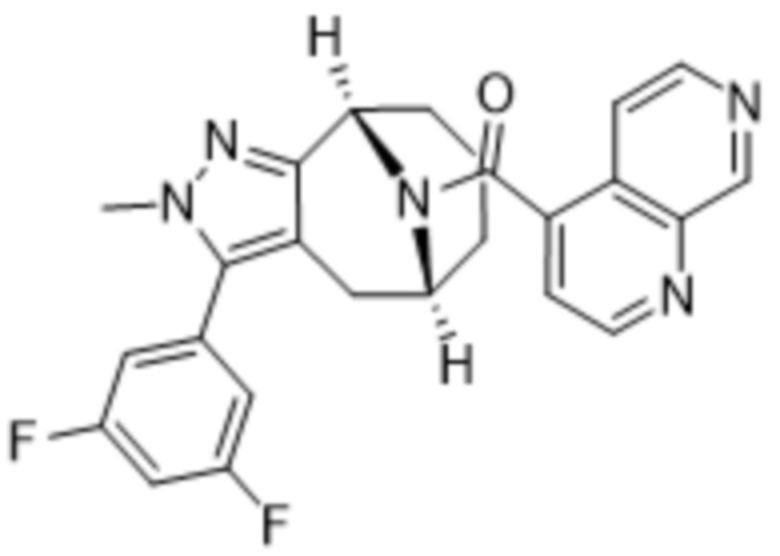
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемической (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1,7-нафтиридин-4-карбоновой кислоты вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21F2N5O, - 445,2; полученное m/z - 446,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,56-9,41 (м, 1H), 9,16-9,05 (м, 1H), 8,79-8,61 (м, 1H), 8,02-7,71 (м, 1H), 7,48-7,17 (м, 4H), 5,96-5,84 (м, 1H), 3,85 (с, 3H), 3,84-3,60 (м, 1H), 3,25-2,94 (м, 1H), 2,44-2,29 (м, 1H), 2,18-1,35 (м, 6H).
Пример 121. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1,6-нафтиридин-4-ил)метанон.
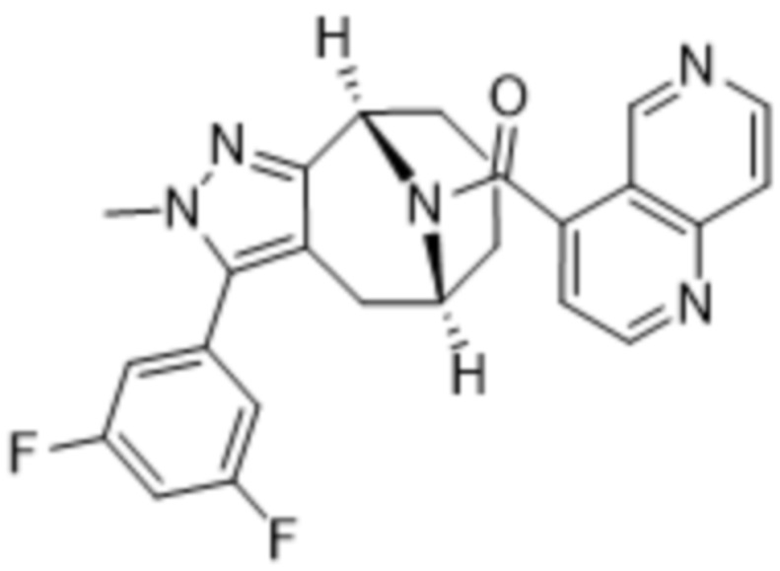
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемической (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1,6-нафтиридин-4-карбоновой кислоты вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21F2N5O, - 445,2; полученное m/z - 446,2 [M+H]+. 1 H ЯМР (500 МГц, ДМСО-d6) δ 9,45-8,70 (м, 3H), 8,10-7,94 (м, 1H), 7,73-7,60 (м, 1H), 7,42-7,29 (м, 3H), 5,99-5,84 (м, 1H), 3,85 (с, 3H), 3,83-3,61 (м, 1H), 3,27-3,01 (м, 1H), 2,41 (д, J=16,2 Гц, 1H), 2,17-1,34 (м, 6H).
Пример 122. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил) (1,5-нафтиридин-2-ил) метанон
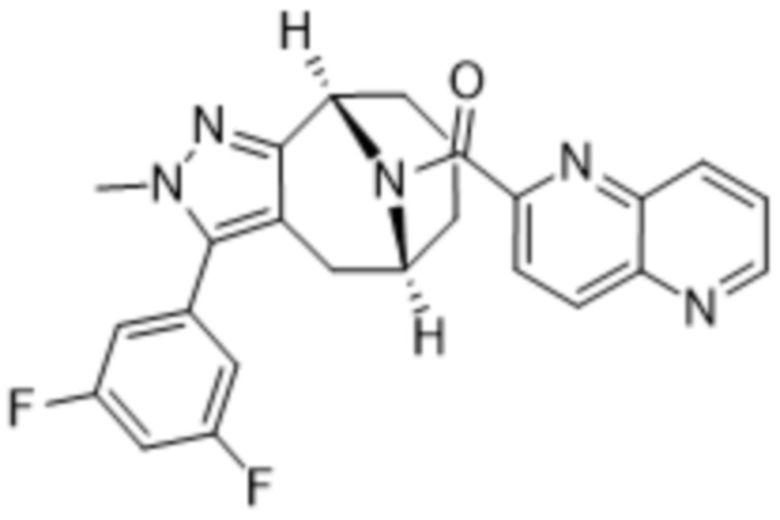
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемической (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1,5-нафтиридин-2-карбоновой кислоты вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21F2N5O, - 445,2; полученное m/z - 446,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,18-9,02 (м, 1H), 8,61-8,45 (м, 2H), 7,99-7,78 (м, 2H), 7,42-7,28 (м, 3H), 5,81 (с, 1H), 4,34-4,10 (м, 1H), 3,90-3,70 (м, 3H), 3,16-3,07 (м, 1H), 2,47 (д, J=5,7 Гц, 1H), 2,14-1,43 (м, 6H).
Пример 123. 6-((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-карбонил)-1-(2-фторэтил)хинолин-4(1 H)-он.
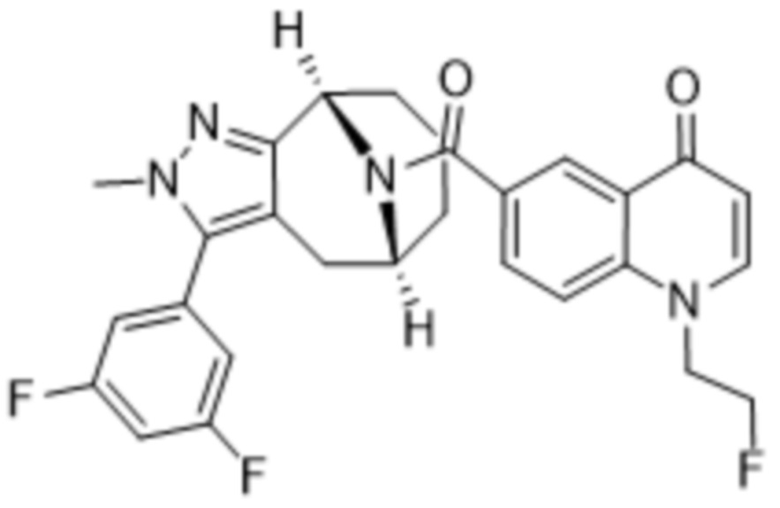
Титульное соединение получали как побочный продукт, полученный во время очистки в примере 65, стадия B. МС (ИЭР): масса, рассчитанная для C28H25F3N4O2, - 506,2; полученное m/z, 507,2 [M+H]+. 1H ЯМР (CDCl3): δ 8,50 (дд, J=18,7, 2,1 Гц, 1H), 7,73 (ддд, J=30,2, 8,8, 2,1 Гц, 1H), 7,54 (дд, J=7,8, 0,7 Гц, 1H), 7,37 (дд, J=11,7, 8,8 Гц, 1H), 6,91-6,82 (м, 3H), 6,27 (д, J=7,8 Гц, 1H), 5,99 и 5,01 (с, 1H), 5,20 и 4,27 (м, 1H), 4,82-4,72 (м, 2H), 4,45-4,40 (м, 2H), 3,86 и 3,76 (с, 3H), 3,27-3,19 и 3,05-3,00 (м, 1H), 2,46 (дд, J=33,9, 16,3 Гц, 1H), 2,12-1,94 (м, 1H), 1,94-1,67 (м, 3H), 1,64-1,51 (м, 2H).
Пример 124. 6-((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-карбонил)-4-метил-2H-бензо[b][1,4]оксазин-3(4 H)-он.
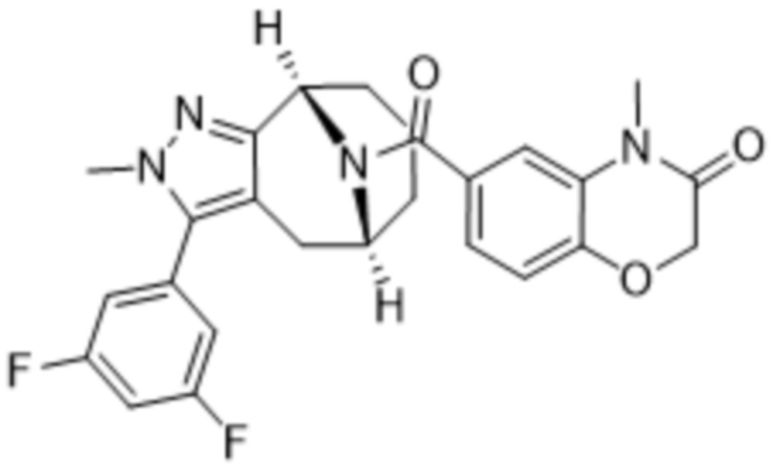
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемической (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 4-метил-3-оксо-3,4-дигидро-2H-бензо[b][1,4]оксазин-6-карбоновой кислоты вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H24F2N4O3, - 478,2; полученное m/z - 479,3 [M+H]+. 1 H ЯМР (500 МГц, ДМСО-d6) δ 7,40-7,27 (м, 3H), 7,22-7,15 (м, 1H), 7,11- 6,99 (м, 2H), 5,73-5,60 (м, 1H), 4,70 (с, 2H), 4,21-4,08 (м, 1H), 3,82 (с, 3H), 3,30-3,25 (м, 3H), 3,03 (дд, J=16,0, 7,2 Гц, 1H), 2,45 (д, J=16,6 Гц, 1H), 2,08-1,31 (м, 6H).
Пример 125. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(4-метил-3,4-дигидро-2H-пиридо[3,2-b][1,4]оксазин-7-ил)метанон.
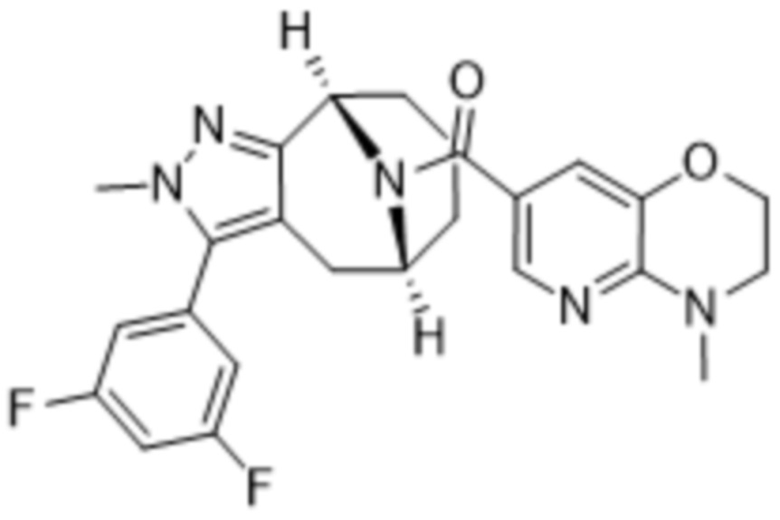
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемической (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 4-метил-3,4-дигидро-2H-пиридо[3,2-b][1,4]оксазин-7-карбоновой кислоты вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H25F2N5O2, - 465,2; полученное m/z - 466,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,85-7,71 (м, 1H), 7,41-7,26 (м, 3H), 7,01- 6,89 (м, 1H), 5,67-5,50 (м, 1H), 4,34-4,22 (м, 1H), 4,24-4,19 (м, 2H), 3,88-3,71 (м, 3H), 3,54-3,44 (м, 2H), 3,18-2,99 (м, 1H), 3,07 (с, 3H), 2,55-2,38 (м, 1H), 2,01-1,32 (м, 6H).
Пример 126. (2-(2 H-1,2,3-триазол-2-ил)фенил)((5R,9S)-3-(3,4-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
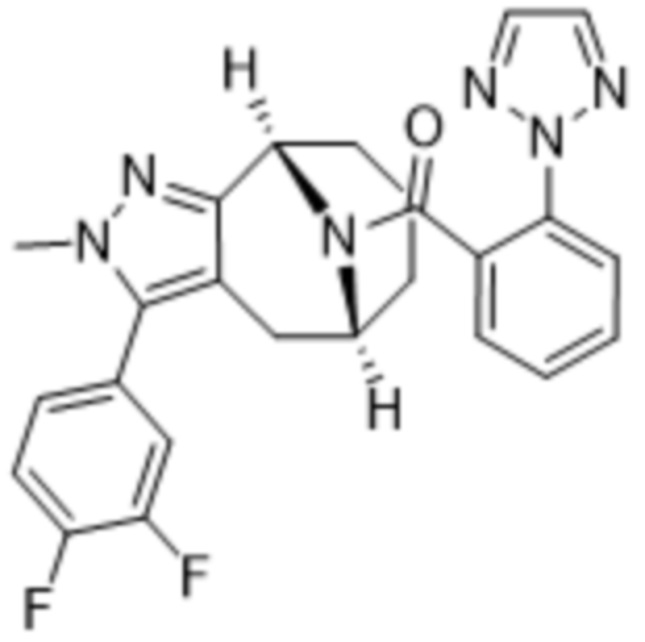
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,4-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 24) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-(2H-1,2,3-триазол-2-ил)бензойную кислоту (промежуточное соединение 49) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F2N6O, - 460,1; полученное m/z, 461,1 [M+H]+. 1H ЯМР (600 MГц, Хлороформ-d) δ 12,91 (д, J=13,3 Гц, 1H), 12,75-12,58 (м, 1H), 12,58-11,63 (м, 7H), 10,60-10,28 (м, 1H), 9,36-8,96 (м, 1H), 8,65-8,35 (м, 3H), 7,87-7,61 (м, 1H), 7,19- 6,84 (м, 1H), 6,68-5,89 (м, 6H).
Пример 127. Рацемический ((5R,9S)-3-(3,4-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил) метанон.
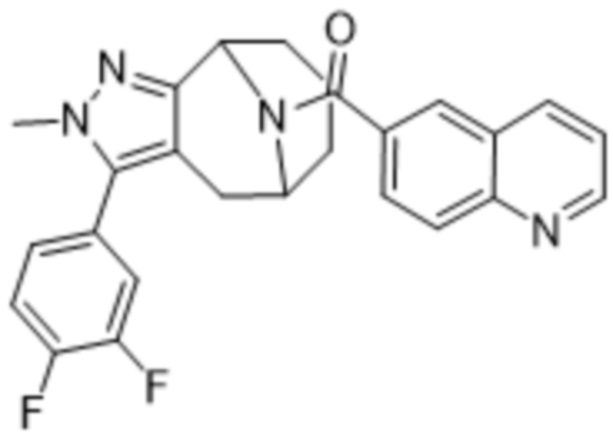
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,9S)-3-(3,4-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 8) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C26H22F2N4O, - 444,1; полученное m/z - 445,1 [M+H]+. 1 H ЯМР (500 МГц, ДМСО-d6) δ 9,03-8,91 (м, 1H), 8,56-8,40 (м, 1H), 8,19-8,00 (м, 2H), 7,86-7,56 (м, 4H), 7,42 (д, J=9,2 Гц, 1H), 5,76 (д, J=3,6 Гц, 1H), 4,11 (с, 1H), 3,87-3,66 (м, 3H), 3,09 (ддд, J=32,8, 16,2, 7,4 Гц, 1H), 2,48-2,34 (м, 1H), 2,10-1,40 (м, 6H).
Пример 128. ((5R,9S)-3-(3,4-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хинолин-6-ил)метанон.
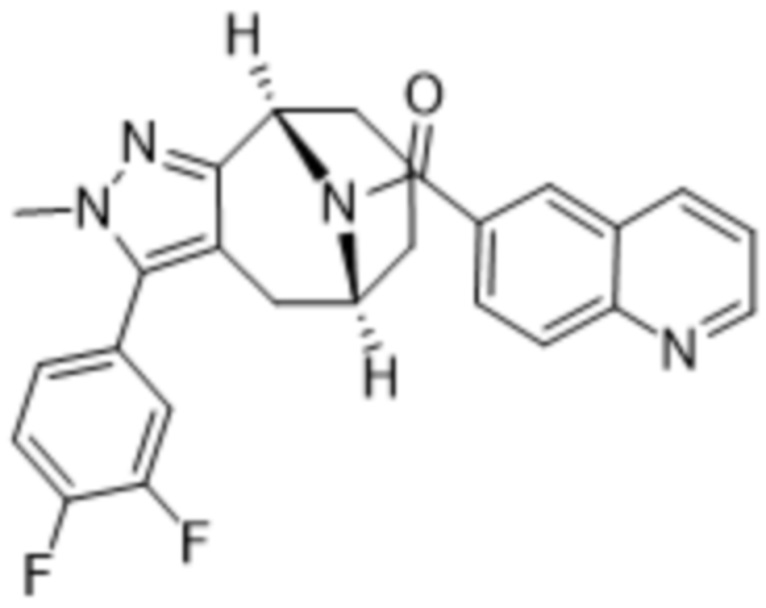
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,4-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 24) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C26H22F2N4O, - 444,1; полученное m/z - 445,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,05-8,91 (м, 1H), 8,55-8,39 (м, 1H), 8,16-7,98 (м, 2H), 7,82-7,56 (м, 4H), 7,41 (с, 1H), 5,86-5,68 (м, 1H), 4,19-4,02 (м, 1H), 3,87-3,68 (м, 3H), 3,16-2,98 (м, 1H), 2,48-2,32 (м, 1H), 2,05-1,41 (м, 6H).
Пример 129. Рацемический ((5R,9S)-3-(3,4-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиноксалин-6-ил) метанон.
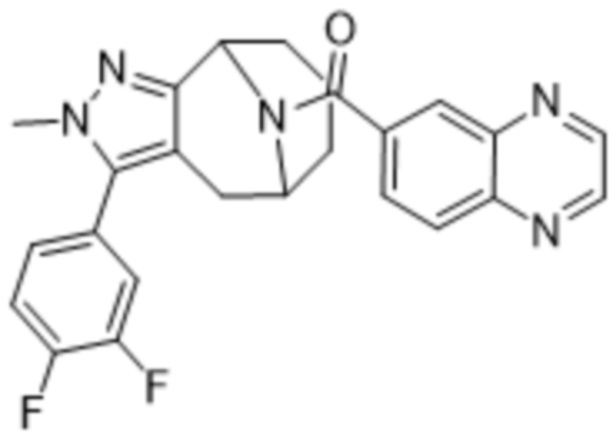
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,9S)-3-(3,4-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 8) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и хиноксалин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21F2N5O, - 445,1; полученное m/z - 446,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,12-8,94 (м, 2H), 8,27-8,02 (м, 2H), 7,95-7,67 (м, 2H), 7,66-7,38 (м, 2H), 5,78 (с, 1H), 4,08 (с, 1H), 3,87-3,65 (м, 3H), 3,21-3,01 (м, 1H), 2,47-2,27 (м, 1H), 2,07-1,34 (м, 6H).
Пример 130. ((5R,9S)-3-(3-фтор-5-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиноксалин-6-ил) метанон.
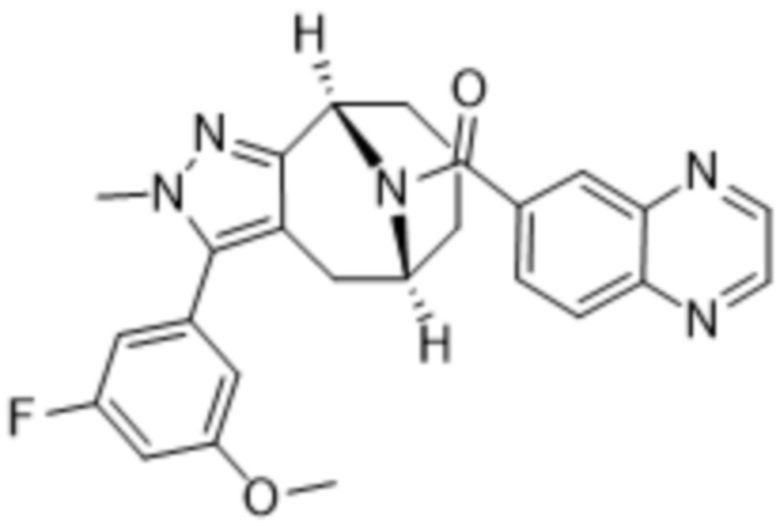
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-фтор 5-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 15) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и хиноксалин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H24FN5O2, - 457,1; полученное m/z, 458,1 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 9,03 (д, J=7,1 Гц, 2H), 8,28-7,80 (м, 3H), 7,08- 6,80 (м, 3H), 5,88-5,71 (м, 1H), 4,16-3,97 (м, 1H), 3,93-3,64 (м, 6H), 3,19-3,00 (м, 1H), 2,47-2,33 (м, 1H), 2,05-1,36 (м, 6H).
Пример 131. ((5R,9S)-3-(4-хлор-3-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиноксалин-6-ил) метанон.
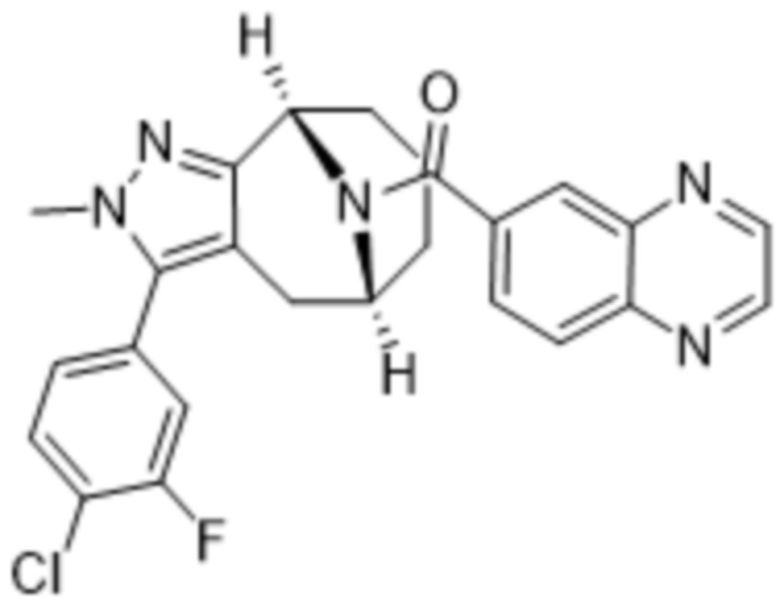
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(4-хлор-3-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 20) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и хиноксалин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21ClFN5O, - 461,1; полученное m/z - 462,1 [M+H]+. 1H ЯМР (500 MГц, ДМСО-d6) δ 9,02 (д, J=12,1 Гц, 2H), 8,26-8,04 (м, 2H), 7,93-7,66 (м, 2H), 7,60-7,31 (м, 2H), 5,85-5,75 (м, 1H), 4,10-3,97 (м, 1H), 3,74-3,64 (м, 3H), 3,07-2,83 (м, 1H), 2,39-2,27 (м, 1H), 2,05-1,37 (м, 6H).
Пример 132. ((5R,9S)-3-(3-хлор-4-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиноксалин-6-ил) метанон.
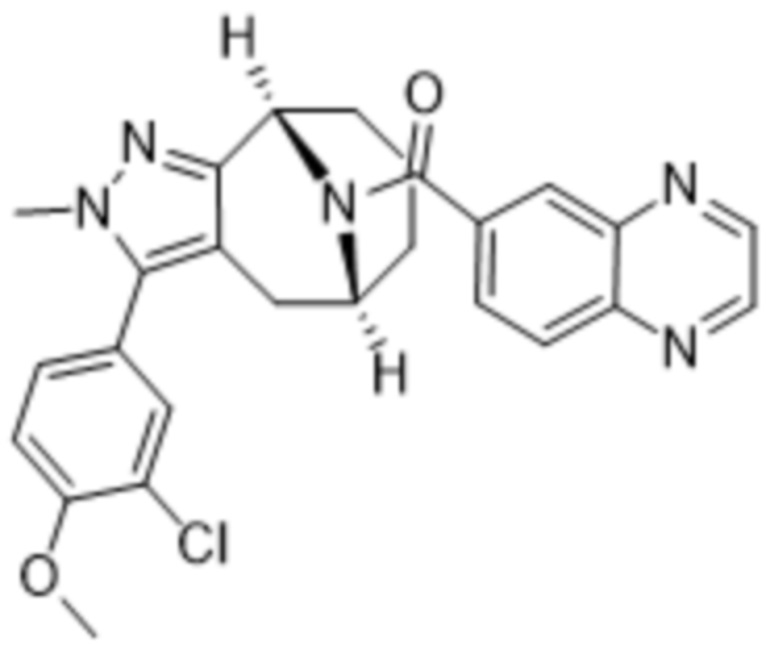
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-хлор 4-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 18) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и хиноксалин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H24ClN5O2, - 473,1; полученное m/z, 474,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,11-8,95 (м, 2H), 8,26-7,97 (м, 2H), 7,95-7,78 (м, 1H), 7,50-7,21 (м, 2H), 7,16-7,01 (м, 1H), 5,79 (с, 1H), 4,21-3,97 (м, 1H), 3,96-3,86 (м, 3H), 3,65-3,54 (м, 3H), 2,98-2,71 (м, 1H), 2,40-2,17 (м, 1H), 2,06-1,40 (м, 6H).
Пример 133. (2-(2 H-1,2,3-триазол-2-ил)фенил)((5R,9S)-3-(3-хлор-4-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
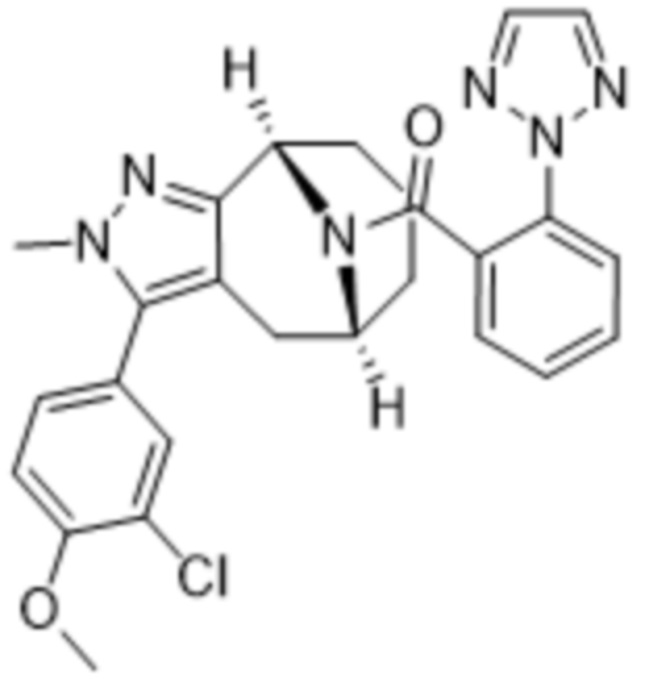
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-хлор-4-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 18) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-(2H-1,2,3-триазол-2-ил)бензойную кислоту (промежуточное соединение 49) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H25ClN6O2, - 488,1; полученное m/z, 489,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 8,36-7,69 (м, 3H), 7,71-6,77 (м, 6H), 5,77-5,52 (м, 1H), 4,60-4,26 (м, 1H), 3,96 -3,84 (м, 3H), 3,79-3,58 (м, 3H), 3,07-2,85 (м, 1H), 2,43-2,30 (м, 1H), 1,94-1,11 (м, 6H).
Пример 134. ((5R,9S)-3-(3-хлор-4-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил) (1-метил-1H-пиразоло[3,4-b]пиридин-3-ил)метанон.
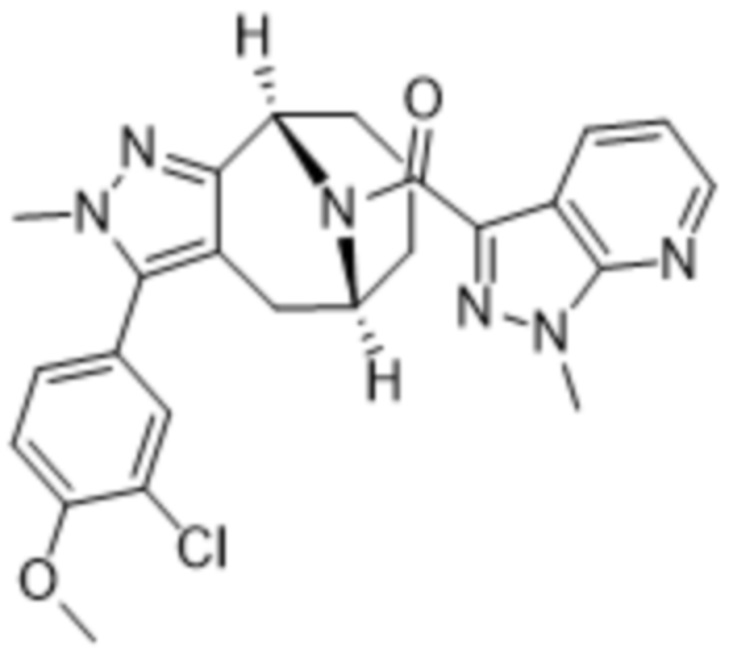
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-хлор-4-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 18) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-метил-1H-пиразол[3,4-b]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H25ClN6O2, - 476,1; полученное m/z, 477,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 8,71-8,59 (м, 1H), 8,50-8,26 (м, 1H), 7,62-7,48 (м, 1H), 7,46-7,37 (м, 1H), 7,38-7,31 (м, 1H), 7,26 (дд, J=8,6, 6,4 Гц, 1H), 6,36-5,77 (м, 1H), 5,49 -5,02 (м, 1H), 4,21-4,07 (м, 3H), 3,96-3,88 (м, 3H), 3,79-3,69 (м, 3H), 3,15-2,99 (м, 1H), 2,57-2,52 (м, 1H), 2,05-1,46 (м, 6H).
Пример 135. ((5R,9S)-3-(3-хлор-4-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хинолин-6-ил)метанон.
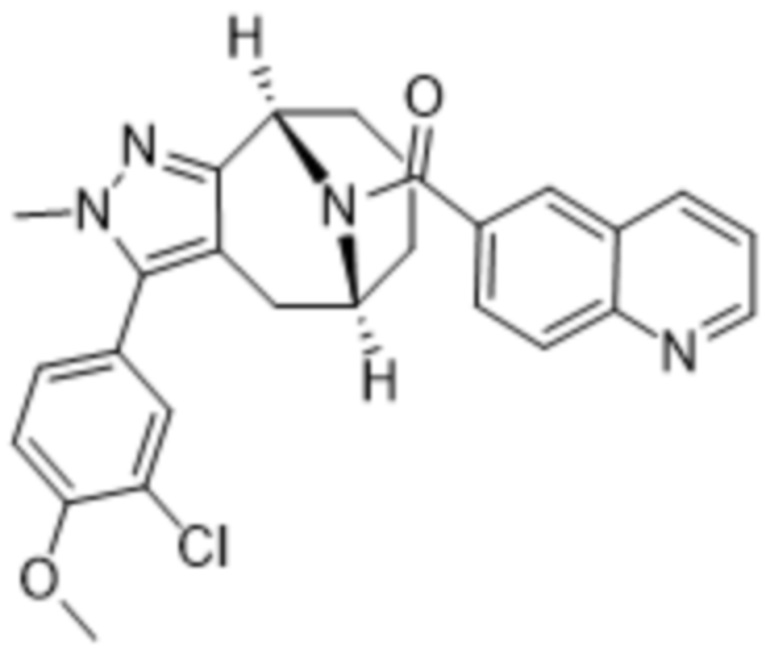
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-хлор-4-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c] пиразол (промежуточное соединение 18) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C27H25ClN4O2, - 472,1; полученное m/z, 473,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 9,01-8,91 (м, 1H), 8,47 (д, J=8,3 Гц, 1H), 8,15-8,01 (м, 2H), 7,82-7,71 (м, 1H), 7,66-7,54 (м, 2H), 7,53-7,41 (м, 1H), 7,27 (т, J=9,6 Гц, 1H), 4,14-4,05 (м, 1H), 3,94-3,89 (м, 4H), 3,82 -3,62 (м, 3H), 3,14-2,95 (м, 1H), 2,40 (д, J=15,9 Гц, 1H), 2,04-1,40 (м, 6H).
Пример 136. ((5R,9S)-3-(3-Хлор-5-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилбензо[d]оксазол-6-ил)метанон.
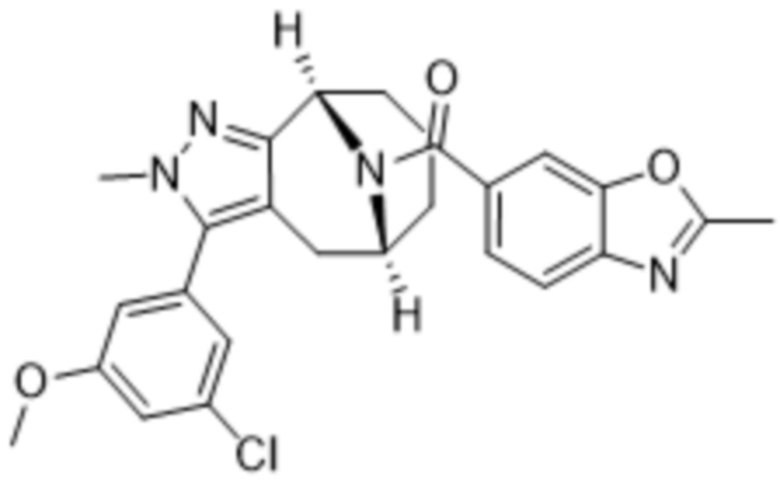
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-хлор-5-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол
(промежуточное соединение 17) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-метилбензо[d]оксазол-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H25ClN4O3, - 476,1; полученное m/z, 477,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 7,86-7,66 (м, 2H), 7,46-7,27 (м, 1H), 7,22 -6,96 (м, 3H), 5,79-5,61 (м, 1H), 4,15-3,95 (м, 1H), 3,92-3,60 (м, 6H), 3,15-2,94 (м, 1H), 2,64 (д, J=6,7 Гц, 3H), 2,38 (д, J=16,0 Гц, 1H), 2,00-1,33 (м, 6H).
Пример 137. ((5R,9S)-3-(3-Хлор-5-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хинолин-6-ил)метанон.
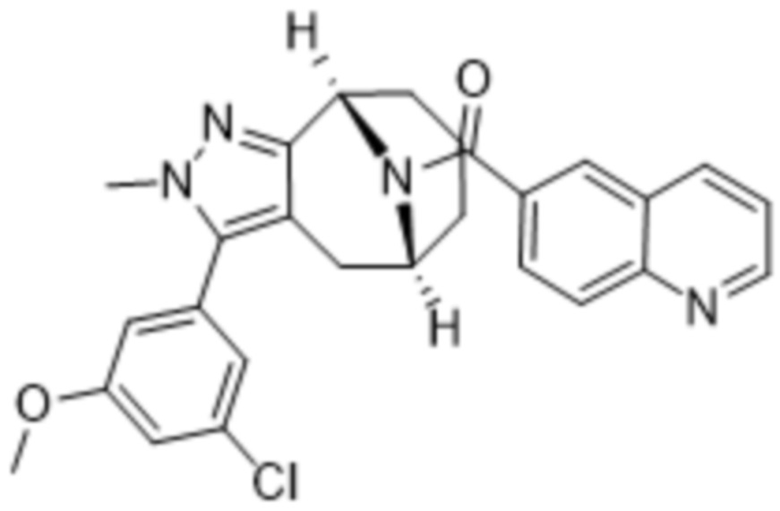
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-хлор-5-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 17) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C27H25ClN4O2, - 472,1; полученное m/z, 473,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,04-8,87 (м, 1H), 8,48 (д, J=8,4 Гц, 1H), 8,15-8,03 (м, 2H), 7,85-7,51 (м, 2H), 7,23-6,93 (м, 3H), 5,81-5,63 (м, 1H), 4,19-4,06 (м, 1H), 3,89-3,70 (м, 6H), 3,11-2,96 (м, 1H), 2,43 (д, J=16,2 Гц, 1H), 2,06-1,40 (м, 6H).
Пример 138. ((5R,9S)-3-(3-Хлор-5-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хиноксалин-6-ил)метанон.
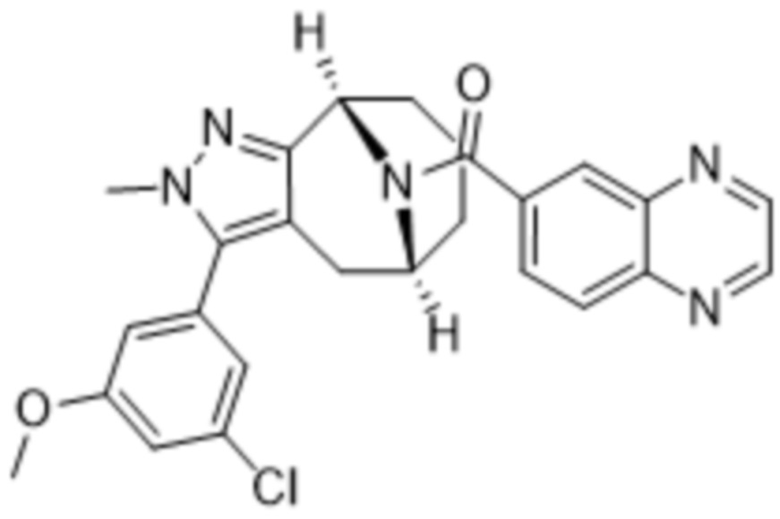
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-хлор-5-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол
(промежуточное соединение 17) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и хиноксалин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H24ClN5O2, - 473,1; полученное m/z, 474,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 9,09-8,99 (м, 2H), 8,26-8,01 (м, 2H), 7,97-7,77 (м, 1H), 7,24-6,96 (м, 3H), 5,86-5,70 (м, 1H), 4,16-3,95 (м, 1H), 3,91-3,64 (м, 6H), 3,20-2,94 (м, 1H), 2,41 (д, J=16,0 Гц, 1H), 2,04-1,37 (м, 6H).
Пример 139. ((5R,9S)-3-(3,5-Диметоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилбензо[d]оксазол-6-ил)метанон.
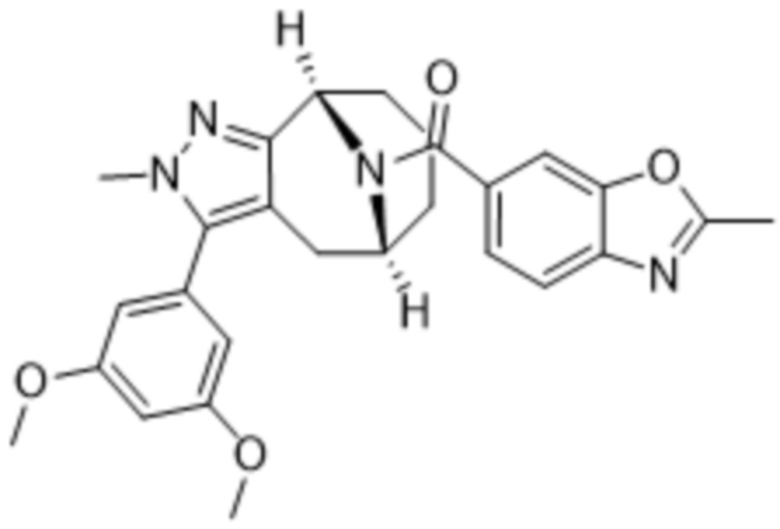
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-диметоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол
(промежуточное соединение 23) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-метилбензо[d]оксазол-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C27H28N4O4, - 472,2; полученное m/z, 473,2 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 7,81-7,65 (м, 2H), 7,45-7,27 (м, 1H), 6,70-6,52 (м, 3H), 5,82-5,52 (м, 1H), 4,09-3,98 (м, 1H), 3,90-3,66 (м, 9H), 3,15-2,93 (м, 1H), 2,64 (д, J=8,4 Гц, 3H), 2,37 (д, J=16,0 Гц, 1H), 1,98-1,37 (м, 6H).
Пример 140. ((5R,9S)-3-(3,5-Диметоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хиноксалин-6-ил)метанон.
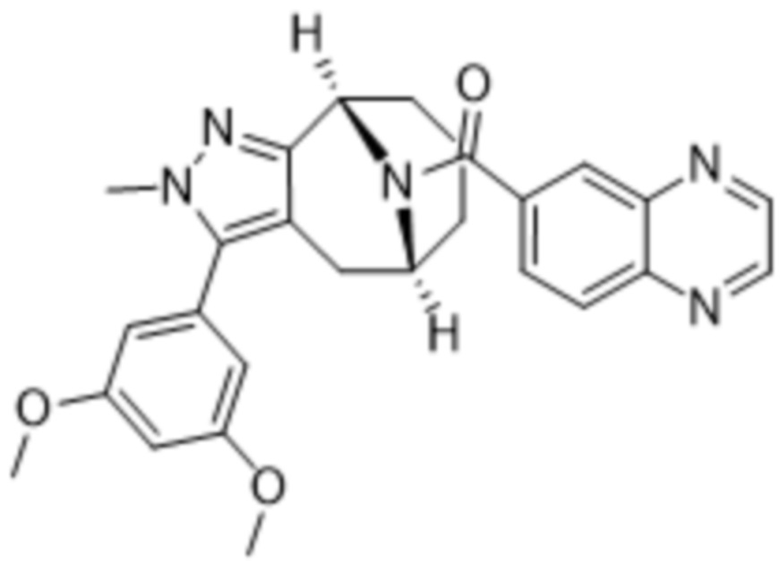
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-диметоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол
(промежуточное соединение 23) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и хиноксалин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C27H27N5O3, - 469,2; полученное m/z, 470,2 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 9,12-8,95 (м, 2H), 8,27-8,02 (м, 2H), 7,96-7,73 (м, 1H), 6,72-6,43 (м, 3H), 5,83-5,63 (м, 1H), 4,14-4,00 (м, 1H), 3,84-3,69 (м, 9H), 3,22-2,92 (м, 1H), 2,40 (д, J=15,9 Гц, 1H), 2,04-1,37 (м, 6H).
Пример 141. (3-(4H-1,2,4Tриазол-4-ил)фенил)((5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
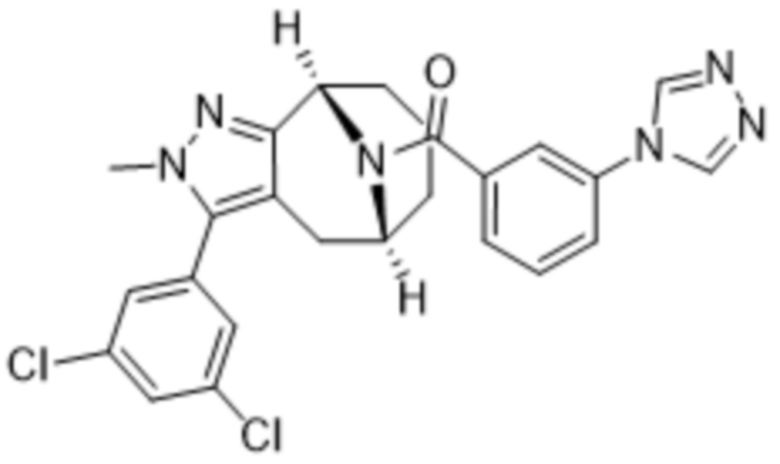
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол
(промежуточное соединение 19) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-(4H-1,2,4-триазол-4-ил) бензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22Cl2N6O, - 492,1; полученное m/z, 493,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 9,20 (д, J=6,2 Гц, 2H), 7,90-7,33 (м, 7H), 5,83-5,62 (м, 1H), 4,14-3,98 (м, 1H), 3,85-3,70 (м, 3H), 3,11-2,95 (м, 1H), 2,44 (д, J=16,1 Гц, 1H), 2,06-1,40 (м, 6H).
Пример 142. ((5R,9S)-3-(3,5-Дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(4-метил-3,4-дигидро-2H-пиридо[3,2-b][1,4]оксазин-7-ил)метанон.
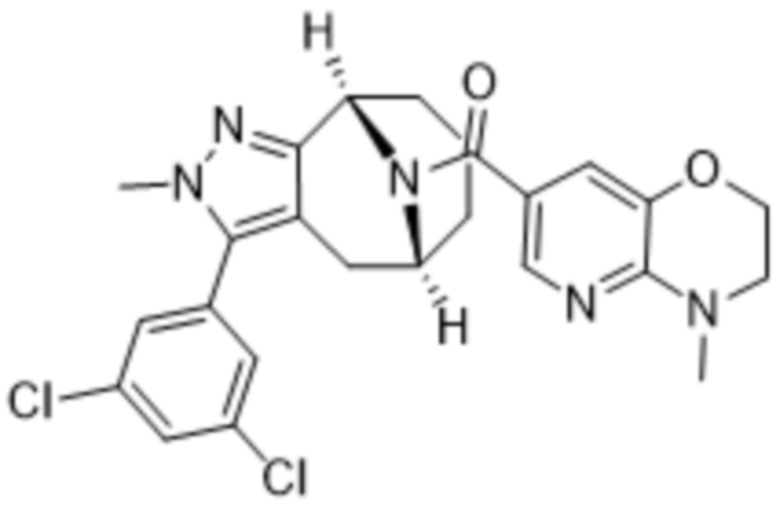
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол
(промежуточное соединение 19) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 4-метил-3,4-дигидро-2H-пиридо[3,2-b] [1,4] оксазин-7-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H25Cl2N5O2, - 497,1; полученное m/z, 498,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 7,87-7,55 (м, 4H), 6,94 (д, J=51,0 Гц, 1H), 5,72-5,49 (м, 1H), 4,27 (с, 1H), 4,22 (т, J=4,4 Гц, 2H), 3,85-3,69 (м, 3H), 3,49 (т, J=4,4 Гц, 2H), 3,18-2,95 (м, 4H), 2,41 (д, J=16,1 Гц, 1H), 2,02-1,34 (м, 6H).
Пример 143. ((5R,9S)-3-(3,5-Дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метокси-1-метил-1H-пиразол-4-ил)метанон.
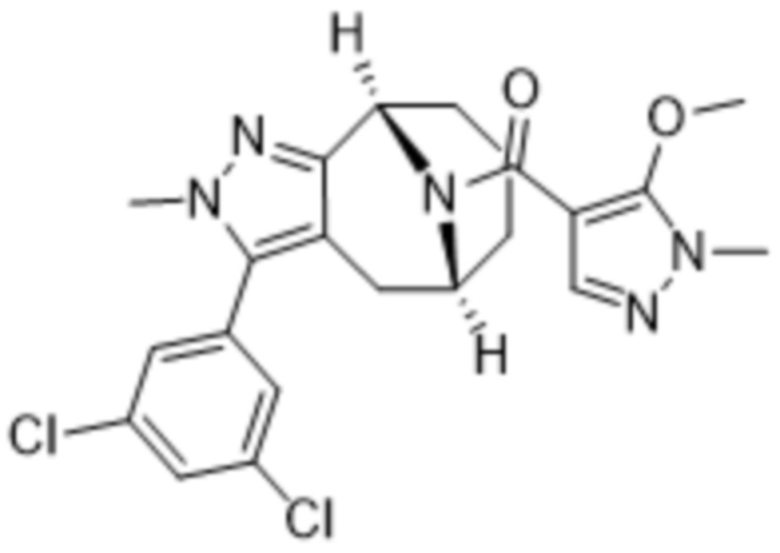
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол
(промежуточное соединение 19) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-метокси-1-метил-1H-пиразол-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C22H23Cl2N5O2, - 492,1; полученное m/z, 493,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 7,76-7,59 (м, 3H), 7,42 (д, J=75,0 Гц, 1H), 5,70-5,56 (м, 1H), 4,54-4,31 (м, 1H), 4,00-3,71 (м, 6H), 3,64-3,57 (м, 3H), 3,20-2,96 (м, 1H), 2,50-2,35 (м, 1H), 1,96-1,36 (м, 6H).
Пример 144. (5-Циклопропил-1-метил-1H-пиразол-4-ил)((5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
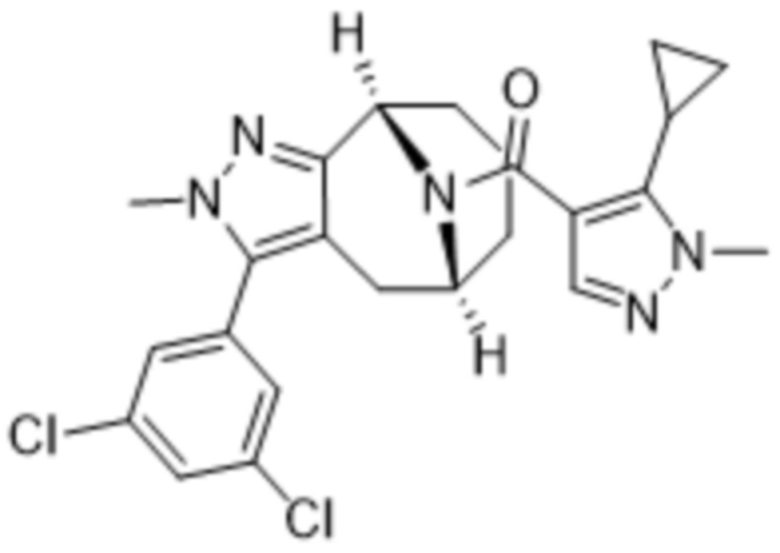
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол
(промежуточное соединение 19) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-циклопропил-1-метил-1H-пиразол-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H25Cl2N5O, - 469,1; полученное m/z, 470,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 7,80-7,56 (м, 3H), 7,37 (д, J=75,0 Гц, 1H), 5,73-5,58 (м, 1H), 4,28-4,04 (м, 1H), 3,88-3,73 (м, 6H), 3,06-2,94 (м, 1H), 2,42 (д, J=16,1 Гц, 1H), 1,92-1,37 (м, 7H), 0,95-0,42 (м, 4H).
Пример 145. ((5R,9S)-3-(3,5-Дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-фенил-1H-1,2,4-триазол-3-ил)метанон.
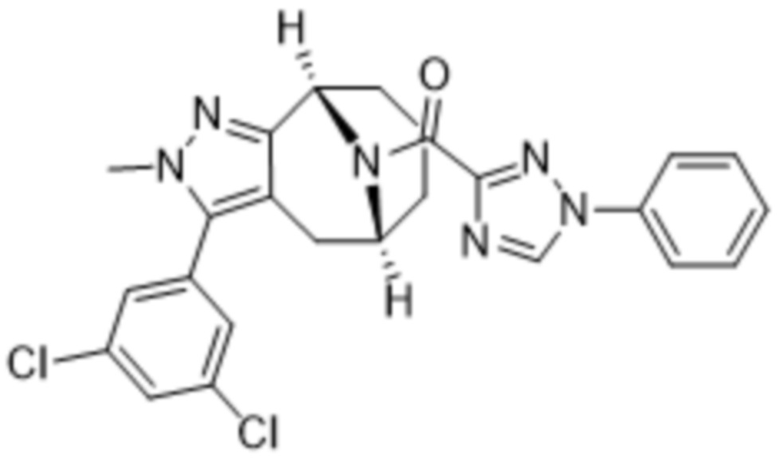
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол
(промежуточное соединение 19) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-фенил-1H-1,2,4-триазол-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22Cl2N6O, - 492,1; полученное m/z, 493,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 9,42 (д, J=15,2 Гц, 1H), 7,97-7,80 (м, 2H), 7,78-7,39 (м, 6H), 5,92-5,69 (м, 1H), 4,77-4,31 (м, 1H), 3,86-3,66 (м, 3H), 3,13-2,98 (м, 1H), 2,58 (дд, J=31,4, 16,1 Гц, 1H), 2,02-1,43 (м, 6H).
Пример 146. ((5R,9S)-3-(3,5-Дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метоксипиридин-3-ил)метанон.
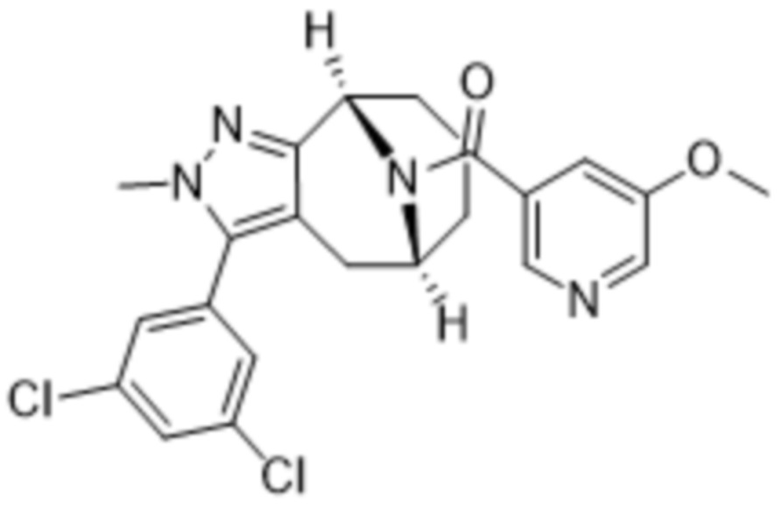
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол
(промежуточное соединение 19) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-метоксиникотиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H22Cl2N4O2, - 456,1; полученное m/z, 457,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 8,46-8,32 (м, 1H), 8,27-8,10 (м, 1H), 7,77-7,58 (м, 3H), 7,47-7,30 (м, 1H), 5,80-5,62 (м, 1H), 4,04-3,98 (м, 1H), 3,88-3,69 (м, 6H), 3,13-2,96 (м, 1H), 2,42 (д, J=16,1 Гц, 1H), 2,01-1,36 (м, 6H).
Пример 147. ((5R,9S)-3-(3,5-Дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(6-метил-3-(2H-1,2,3-триазол-2-ил)пиридин-2-ил)метанон.
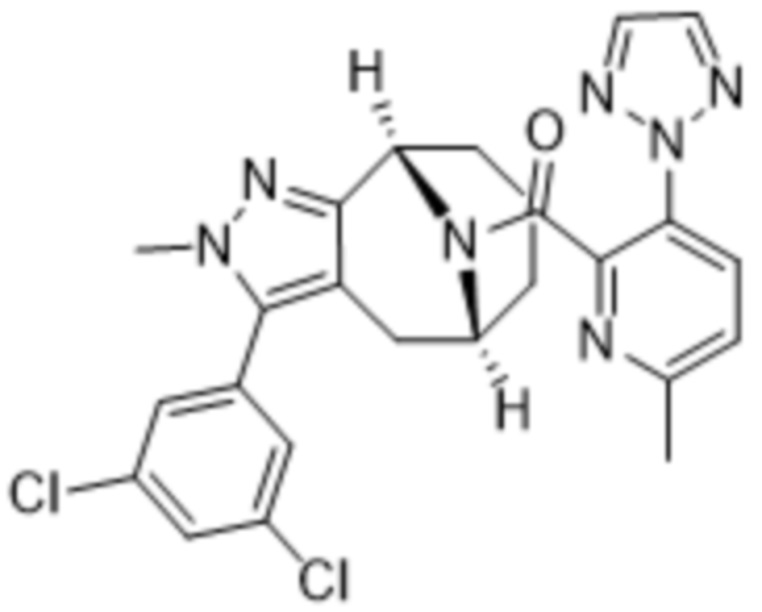
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол
(промежуточное соединение 19) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-метил-3-(2H-1,2,3-триазол-2-ил) пиколиновую кислоту [WO2016040789] вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H23Cl2N7O, - 507,1; полученное m/z, 508,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,23 (дд, J=9,6, 8,4 Гц, 1H), 8,04 (д, J=41,6 Гц, 2H), 7,72-7,47 (м, 4H), 5,73-5,52 (м, 1H), 3,91-3,84 (м, 1H), 3,83-3,66 (м, 3H), 2,90-2,67 (м, 1H), 2,59-2,52 (м, 3H), 2,46-2,35 (м, 1H), 1,94-1,30 (м, 6H).
Пример 148. ((5R,9S)-3-(3,5-Дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилбензо[d]оксазол-6-ил)метанон.
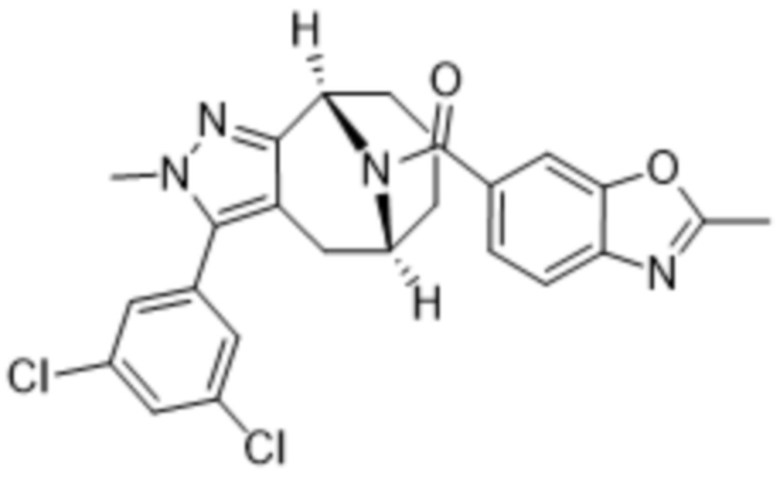
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол
(промежуточное соединение 19) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-метилбензо[d]оксазол-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22Cl2N4O2, - 480,1; полученное m/z, 481,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 7,83-7,60 (м, 5H), 7,45-7,27 (м, 1H), 5,75-5,57 (м, 1H), 4,11-3,96 (м, 1H), 3,84-3,67 (м, 3H), 3,15-2,99 (м, 1H), 2,64 (д, 3H), 2,40 (д, J=16,0 Гц, 1H), 2,03-1,39 (м, 6H).
Пример 149. ((5R,9S)-3-(3,5-Дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(фуро[3,2-b]пиридин-2-ил)метанон.
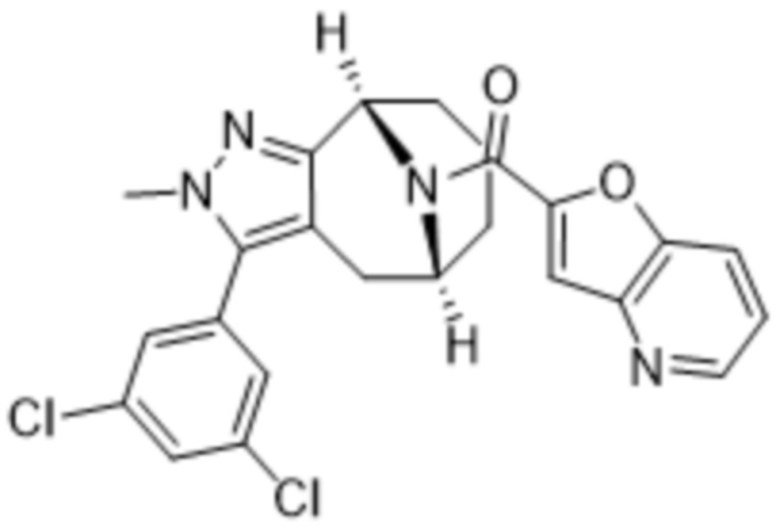
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол
(промежуточное соединение 19) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и фуро[3,2-b] пиридин-2-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H20Cl2N4O2, - 466,1; полученное m/z, 467,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 8,63 (дд, J=13,0, 4,6 Гц, 1H), 8,23-8,10 (м, 1H), 7,79-7,39 (м, 5H), 5,78-5,35 (м, 1H), 5,06-4,66 (м, 1H), 3,87-3,70 (м, 3H), 3,30-3,03 (м, 1H), 2,65-2,56 (м, 1H), 2,12-1,45 (м, 6H).
Пример 150. ((5R,9S)-3-(3,5-Дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(имидазо[1,5-a]пиридин-8-ил)метанон.
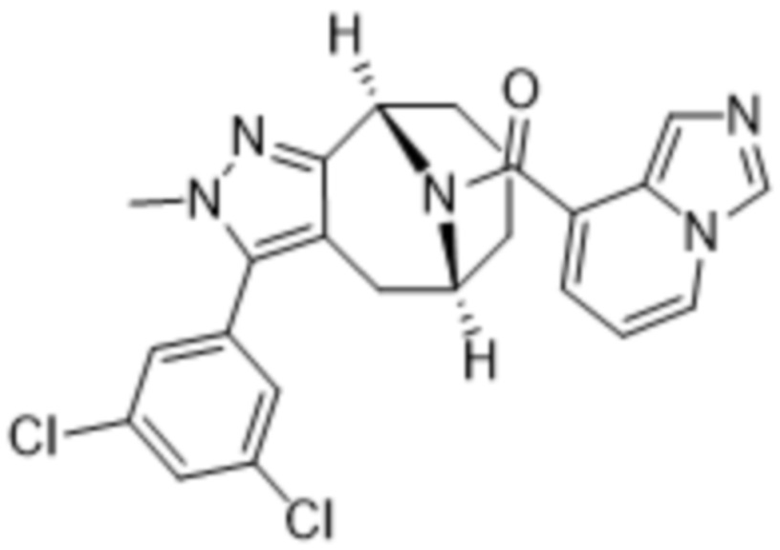
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол
(промежуточное соединение 19) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и имидазо[1,5-a] пиридин-8-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H21Cl2N5O, - 465,1; полученное m/z, 466,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,53-8,29 (м, 2H), 7,74-7,55 (м, 3H), 7,24 (д, J=54,5 Гц, 1H), 6,83-6,64 (м, 2H), 5,82-5,61 (м, 1H), 4,11-3,93 (м, 1H), 3,85-3,67 (м, 3H), 3,19-2,90 (м, 1H), 2,45-2,33 (м, 1H), 2,01-1,36 (м, 6H).
Пример 151. ((5R,9S)-3-(3,5-Дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(имидазо[1,2-a]пиридин-3-ил)метанон.
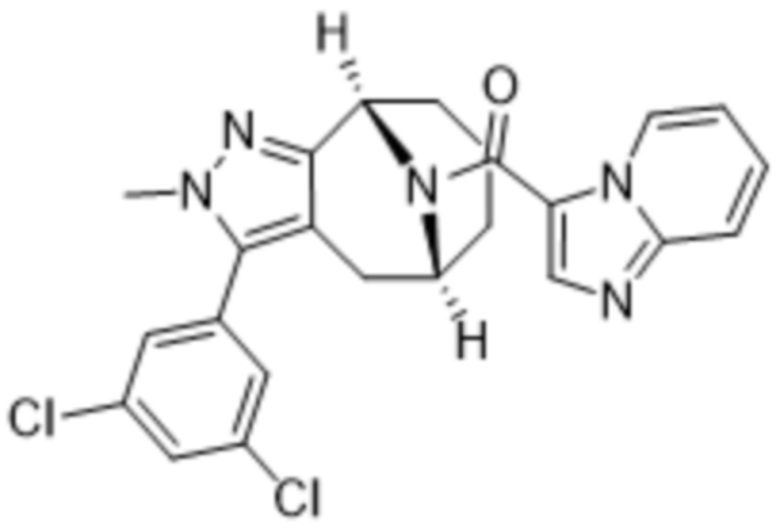
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол
(промежуточное соединение 19) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и имидазо[1,2-a] пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H21Cl2N5O, - 465,1; полученное m/z, 466,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,00-8,81 (м, 1H), 8,06 (с, 1H), 7,77-7,59 (м, 4H), 7,49-7,40 (м, 1H), 7,17-6,98 (м, 1H), 5,68 (с, 1H), 4,92 (с, 1H), 3,80 (с, 3H), 3,28-3,05 (м, 1H), 2,55 (д, J=16,2 Гц, 1H), 2,07-1,44 (м, 6H).
Пример 152:((5R,9S)-3-(3,5-Дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хинолин-6-ил)метанон.
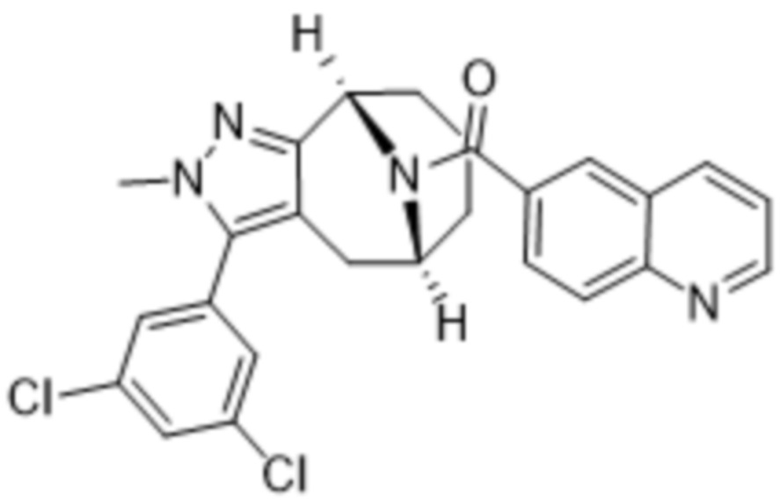
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 19) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C26H22Cl2N4O, - 476,1; полученное m/z, 477,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 9,04-8,86 (м, 1H), 8,52-8,34 (м, 1H), 8,13-7,99 (м, 2H), 7,83-7,48 (м, 5H), 5,83-5,59 (м, 1H), 4,18-3,98 (м, 1H), 3,84-3,71 (м, 3H), 3,12-2,97 (м, 1H), 2,45 (д, J=16,1 Гц, 1H), 2,04-1,40 (м, 6H).
Пример 153. ((5R,9S)-3-(3,5-Дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хиноксалин-6-ил)метанон.
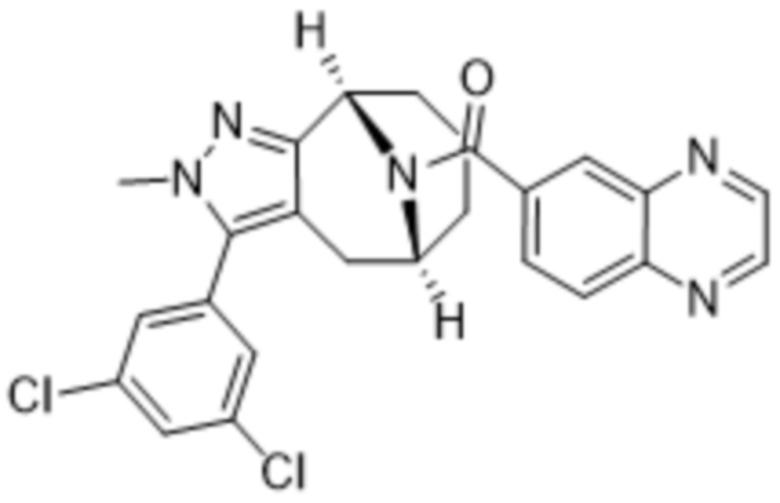
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол
(промежуточное соединение 19) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и хиноксалин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21Cl2N5O, - 477,1; полученное m/z, 478,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 9,13-8,90 (м, 2H), 8,28-8,00 (м, 2H), 7,97-7,44 (м, 4H), 5,86-5,68 (м, 1H), 4,14-3,99 (м, 1H), 3,88-3,68 (м, 3H), 3,17-3,01 (м, 1H), 2,47-2,31 (м, 1H), 2,04-1,40 (м, 6H).
Пример 154. рацемический-((5R,9S)-3-(3-(Дифторметил)-4-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил) метанон.
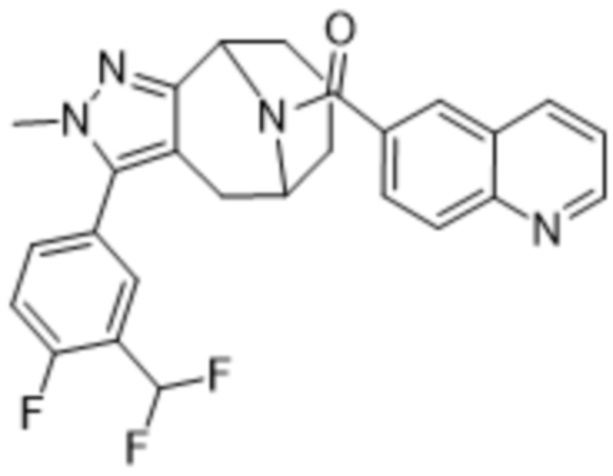
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический-(5R,9S)-3-(3-(дифторметил)-4-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 10) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C27H23F3N4O, 476,1; полученное m/z, 477,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,08-8,88 (м, 1H), 8,48 (т, J=7,9 Гц, 1H), 8,18-8,02 (м, 2H), 7,87-7,71 (м, 3H), 7,66-7,48 (м, 2H), 7,43-7,05 (м, 1H), 5,77 (с, 1H), 4,13 (с, 1H), 3,88-3,65 (м, 3H), 3,17-2,97 (м, 1H), 2,43 (д, J=16,1 Гц, 1H), 2,07-1,42 (м, 6H).
Пример 155. рацемический-((5R,9S)-3-(3-(Дифторметил)-4-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиноксалин-6-ил) метанон.
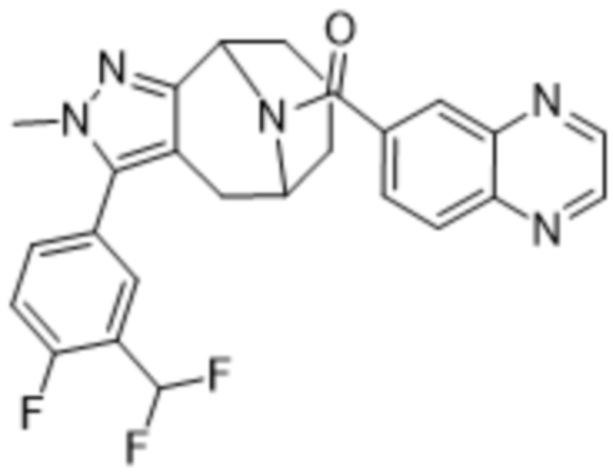
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический-(5R,9S)-3-(3-(дифторметил)-4-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 10) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и хиноксалин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H22F3N5O, - 477,1; полученное m/z, 478,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,11-8,90 (м, 2H), 8,27-8,01 (м, 2H), 7,97-7,72 (м, 3H), 7,64-7,46 (м, 1H), 7,39-7,07 (м, 1H), 5,79 (с, 1H), 4,09 (т, J=5,7 Гц, 1H), 3,83-3,63 (м, 3H), 3,22-2,89 (м, 1H), 2,40 (д, J=16,1 Гц, 1H), 2,06-1,34 (м, 6H).
Пример 156. ((5R,9S)-3-(3-Фтор-5-(трифторметил) фенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиноксалин-6-ил) метанон.
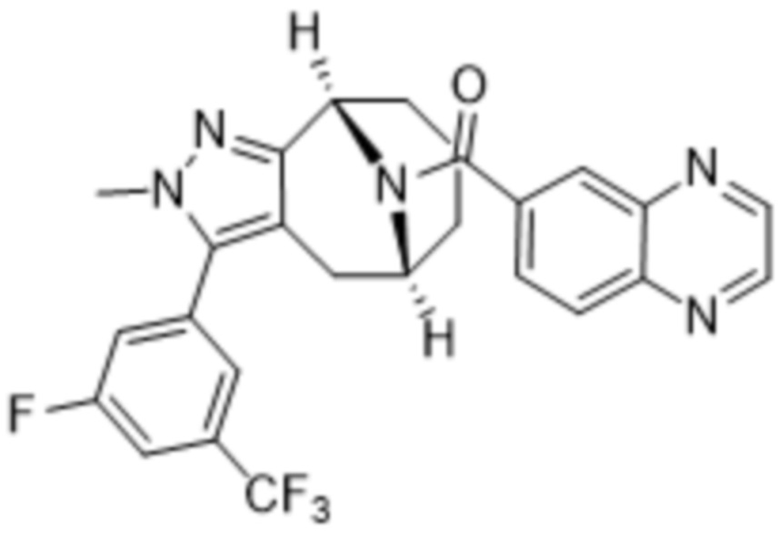
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-фтор-5-(трифторметил)фенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 16) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и хиноксалин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H21F4N5O, 495,2; полученное m/z, 496,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,11-8,88 (м, 2H), 8,26-8,00 (м, 2H), 7,94-7,67 (м, 4H), 5,79 (с, 1H), 4,09 (с, 1H), 3,89-3,71 (м, 3H), 3,14-3,03 (м, 1H), 2,49-2,37 (м, 1H), 2,02-1,31 (м, 6H).
Пример 157. (3-Хлор-5-метоксифенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
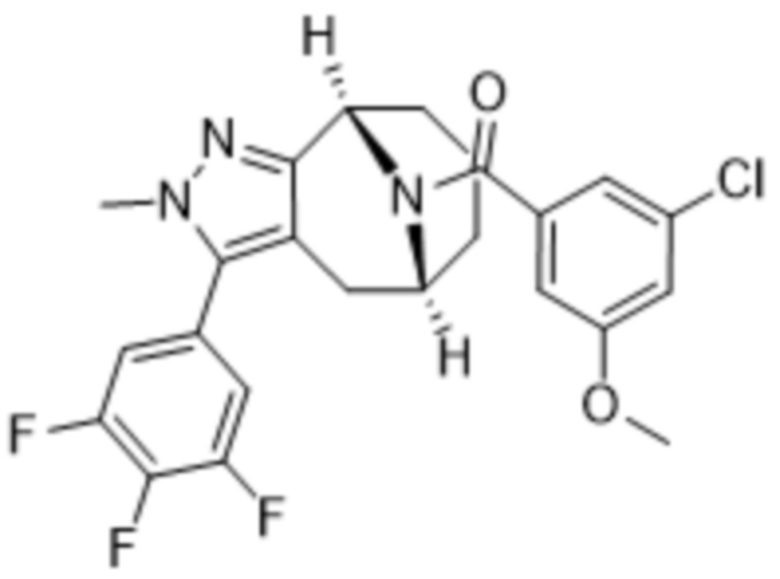
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-хлор-5-метоксибензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H21ClF3N3O2, - 475,1; полученное m/z, 476,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 7,58 (т, J=7,8 Гц, 2H), 7,19-6,78 (м, 3H), 5,67 (с, 1H), 4,00 (с, 1H), 3,86-3,66 (м, 6H), 3,05-2,91 (м, 1H), 2,45-2,39 (м, 1H), 1,96-1,32 (м, 6H).
Пример 158. N-(3-Метокси-5-((5 R,9 S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбонил) фенил)ацетамид,
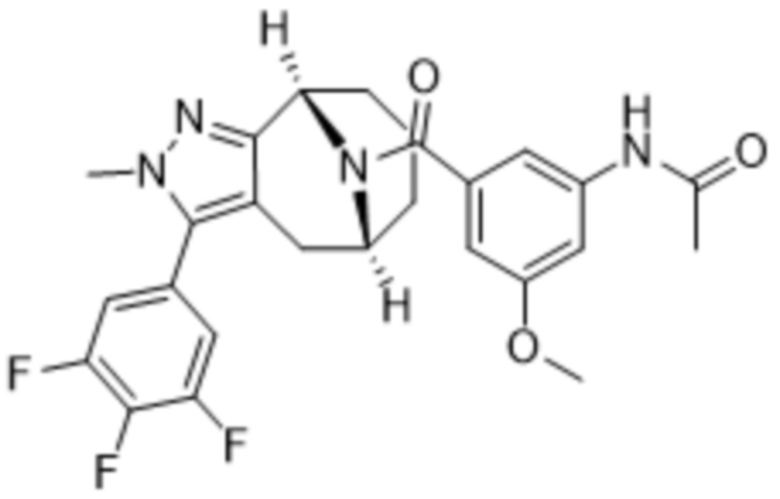
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-ацетамидо-5-метоксибензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H25F3N4O3, - 498,1; полученное m/z, 499,0 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 10,12-9,96 (м, 1H), 7,66-7,43 (м, 2H), 7,39-7,14 (м, 2H), 6,64-6,47 (м, 1H), 5,83-5,55 (м, 1H), 4,15-3,96 (м, 1H), 3,86-3,64 (м, 6H), 3,12-2,90 (м, 1H), 2,48-2,30 (м, 1H), 2,04 (д, J=2,2 Гц, 3H), 1,96-1,35 (м, 6H).
Пример 159. (3-(4H-1,2,4-Триазол-4-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
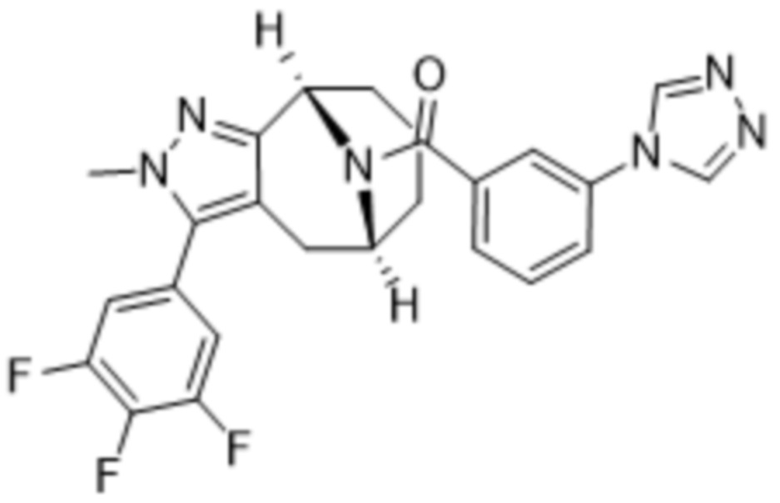
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-(4H-1,2,4-триазол-4-ил)бензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21F3N6O, - 478,1; полученное m/z, 479,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 9,20 (д, J=5,7 Гц, 2H), 7,93-7,74 (м, 2H), 7,74-7,58 (м, 3H), 7,54-7,35 (м, 1H), 5,79-5,64 (м, 1H), 4,08-3,94 (м, 1H), 3,87-3,70 (м, 3H), 3,11-2,97 (м, 1H), 2,47-2,34 (м, 1H), 2,05-1,35 (м, 6H).
Пример 160. (2-(4H-1,2,4-Триазол-4-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
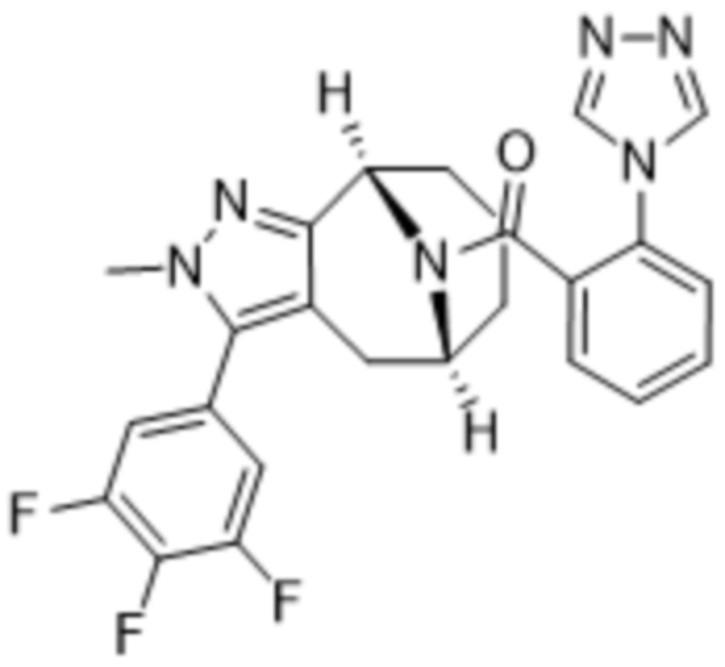
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-(4H-1,2,4-триазол-4-ил)бензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21F3N6O, - 478,1; полученное m/z, 479,1 [M+H]+. 1H ЯМР (500 МГц, DMF-d7) δ 9,33-8,96 (м, 1H), 8,56 (с, 2H), 8,17-7,78 (м, 5H), 6,15-5,99 (м, 1H), 4,88-4,63 (м, 1H), 4,20-4,06 (м, 3H), 3,51-3,21 (м, 1H), 2,81-2,62 (м, 1H), 2,27-1,63 (м, 6H).
Пример 161. (3-Фтор-2-(1H-1,2,4-триазол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
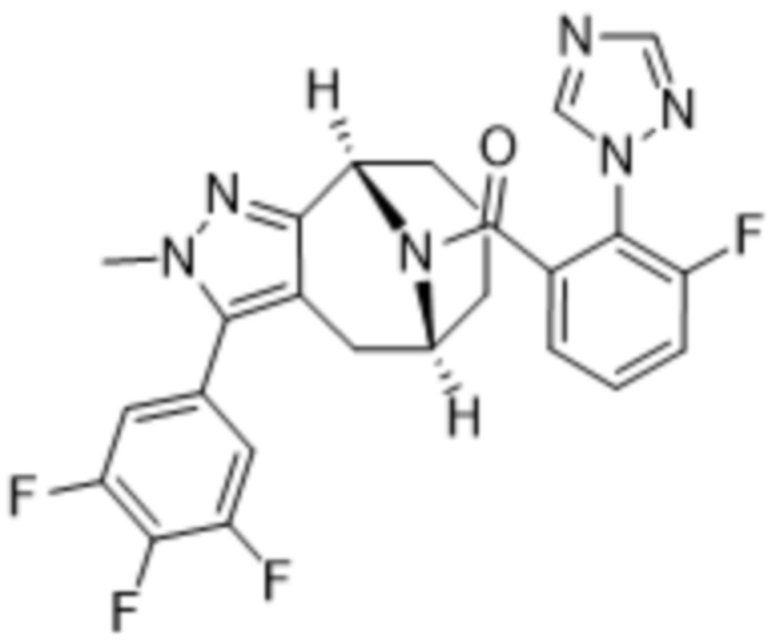
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-фтор-2-(1H-1,2,4-триазол-1-ил)бензойную кислоту (промежуточное соединение 54) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H20F4N6O, - 496,2; полученное m/z, 497,1 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 9,01-8,90 (м, 1H), 8,38-8,25 (м, 1H), 7,77-7,29 (м, 5H), 5,58-5,49 (м, 1H), 3,95-3,84 (м, 1H), 3,79 (с, 3H), 3,13-2,95 (м, 1H), 2,40-2,24 (м, 1H), 1,96-1,18 (м, 6H).
Пример 162. (4-Фтор-2-(1H-1,2,4-триазол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
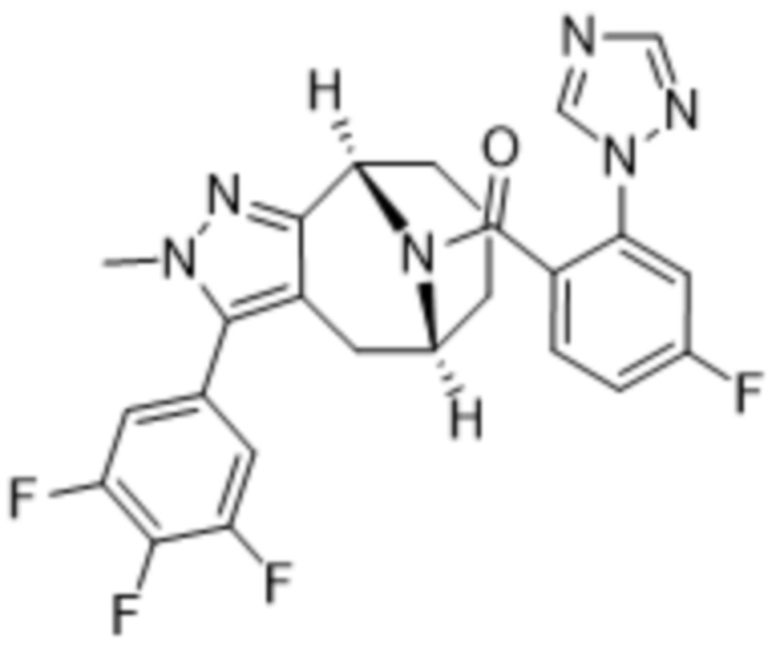
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 4-фтор-2-(1H-1,2,4-триазол-1-ил)бензойную кислоту (промежуточное соединение 55) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H20F4N6O, - 496,2; полученное m/z, 497,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 9,02-8,94 (м, 1H), 8,32-8,24 (м, 1H), 7,89-7,33 (м, 5H), 5,68-5,57 (м, 1H), 3,87-3,65 (м, 1H), 3,80 (с, 3H), 2,97 (дд, J=16,3, 7,2 Гц, 1H), 2,42-2,33 (м, 1H), 1,80-1,16 (м, 6H).
Пример 163. (5-Фтор-2-(1H-1,2,4-триазол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
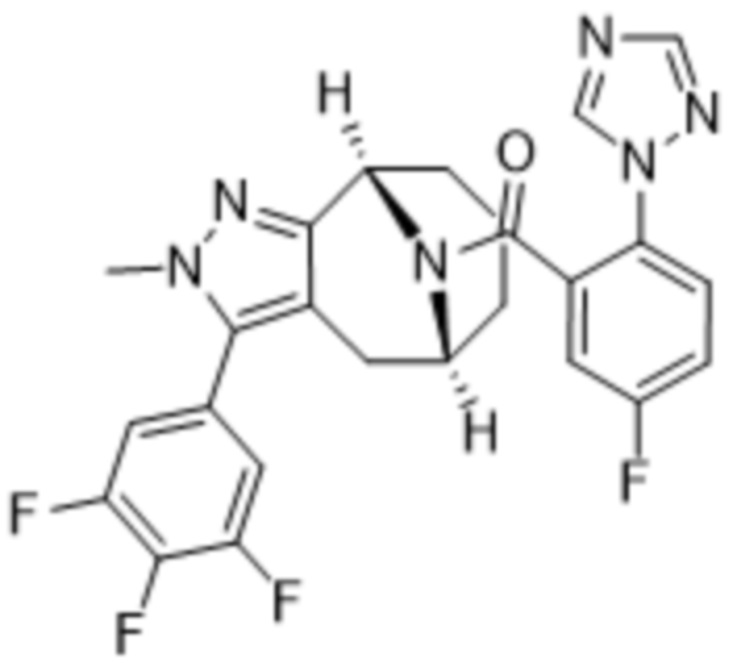
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-фтор-2-(1H-1,2,4-триазол-1-ил)бензойную кислоту (промежуточное соединение 56) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H20F4N6O, - 496,2; полученное m/z, 497,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,91-8,85 (м, 1H), 8,30-8,22 (м, 1H), 7,81-7,75 (м, 1H), 7,65-7,39 (м, 4H), 5,63-5,56 (м, 1H), 3,86-3,76 (м, 1H), 3,80 (с, 3H), 3,04 (дд, J=16,0, 7,4 Гц, 1H), 2,42-2,25 (м, 1H), 1,83-1,18 (м, 6H).
Пример 164. (4-Метил-2-(1H-1,2,4-триазол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
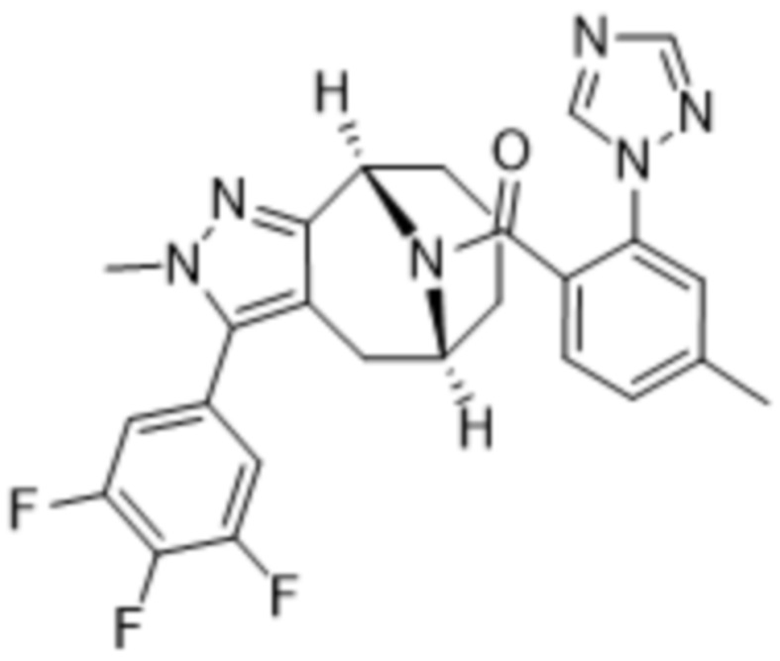
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 4-метил-2-(1H-1,2,4-триазол-1-ил)бензойную кислоту (промежуточное соединение 57) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H23F3N6O, - 492,2; полученное m/z, 493,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,96-8,83 (м, 1H), 8,29-8,20 (м, 1H), 7,68-7,29 (м, 5H), 5,67-5,57 (м, 1H), 3,86-3,77 (м, 1H), 3,79 (с, 3H), 2,95 (дд, J=16,0, 7,0 Гц, 1H), 2,42 (с, 3H), 2,45-2,24 (м, 1H), 1,77-0,97 (м, 6H).
Пример 165. (5-Метил-2-(1H-1,2,4-триазол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
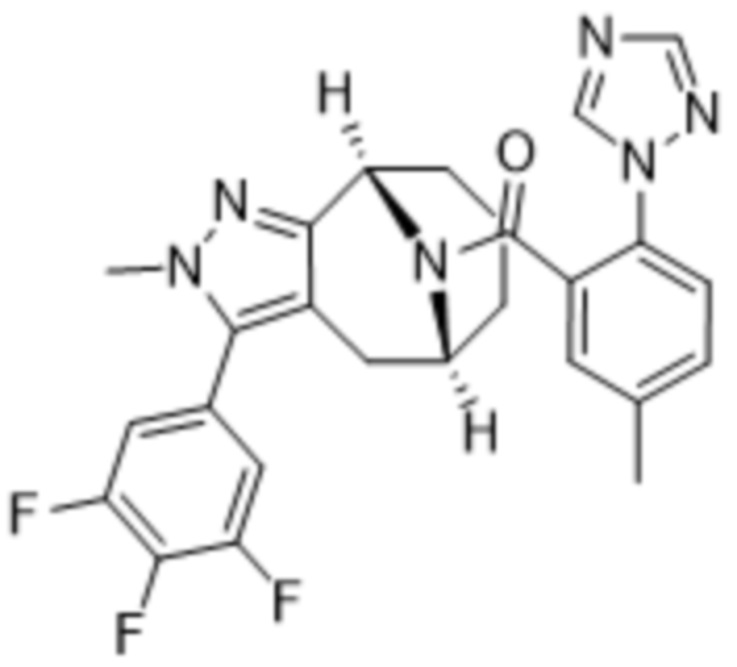
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-метил-2-(1H-1,2,4-триазол-1-ил)бензойную кислоту (промежуточное соединение 58) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H23F3N6O, 492,2; полученное m/z, 493,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,85 (с, 1H), 8,23 (с, 1H), 7,68-7,52 (м, 3H), 7,48-7,36 (м, 2H), 5,66-5,59 (м, 1H), 3,80 (с, 3H), 3,70-3,63 (м, 1H), 2,99-2,86 (м, 1H), 2,39 (с, 3H), 2,46-2,22 (м, 1H), 1,92-1,17 (м, 6H).
Пример 166. (2-(1H-1,2,4-Триазол-1-ил)-5-(трифторметил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
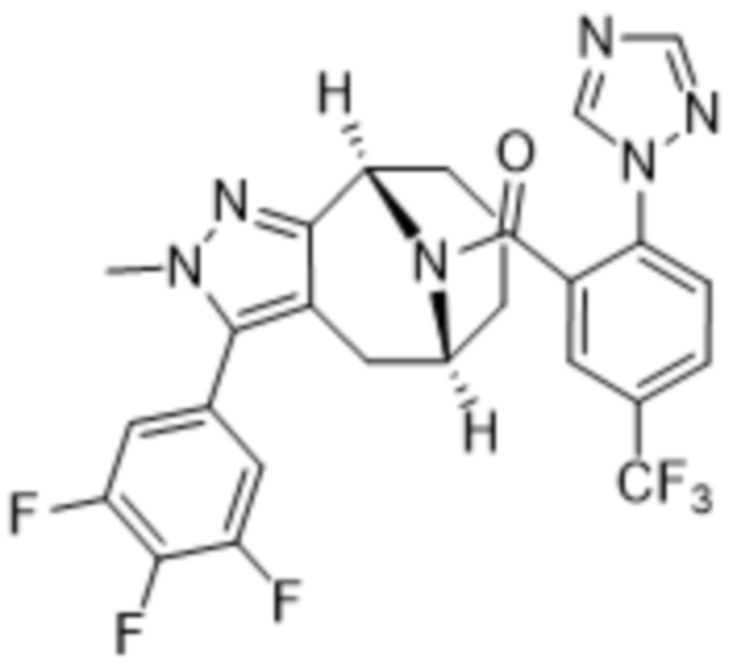
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-(1H-1,2,4-триазол-1-ил)-5-(трифторметил)бензойную кислоту (промежуточное соединение 52) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H20F6N6O, - 546,2; полученное m/z, 547,1 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 9,09-9,04 (м, 1H), 8,39-8,30 (м, 1H), 8,12-7,81 (м, 3H), 7,66-7,52 (м, 1H), 7,54-7,36 (м, 1H), 5,71-5,62 (м, 1H), 3,80 (с, 3H), 3,84-3,70 (м, 1H), 2,97-2,79 (м, 1H), 2,45-2,21 (м, 1H), 1,88-1,19 (м, 6H).
Пример 167. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-(3-(трифторметил)-1H-1,2,4-триазол-1-ил)фенил)метанон.
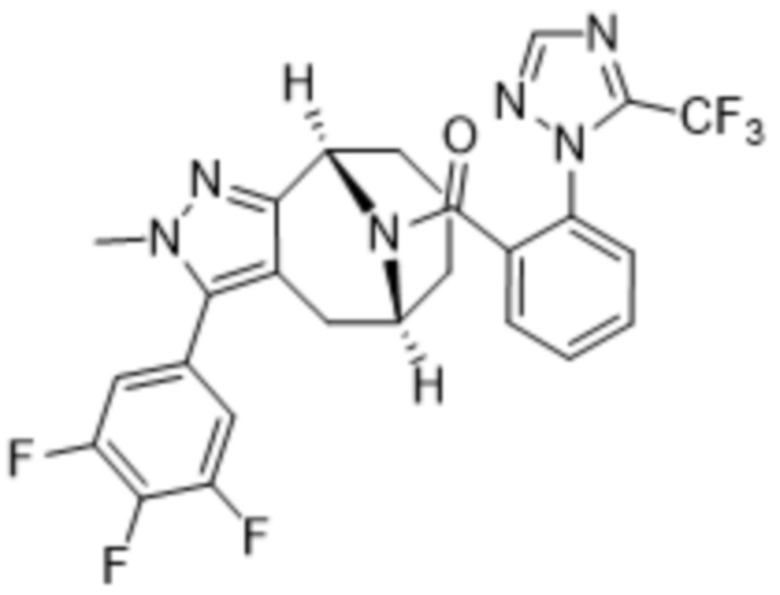
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-(3-(трифторметил)-1H-1,2,4-триазол-1-ил)бензойную кислоту (промежуточное соединение 53) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H20F6N6O, 546,2; полученное m/z, 547,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,34-9,30 (м, 1H), 7,87-7,82 (м, 1H), 7,77-7,57 (м, 3H), 7,56-7,51 (м, 1H), 7,41-7,31 (м, 1H), 5,60-5,55 (м, 1H), 4,01-3,92 (м, 1H), 3,80 (с, 3H), 3,11 (дд, J=16,3, 7,5 Гц, 1H), 2,46-2,40 (м, 1H), 1,95-1,29 (м, 6H).
Пример 168. (2-(1H-Имидазол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
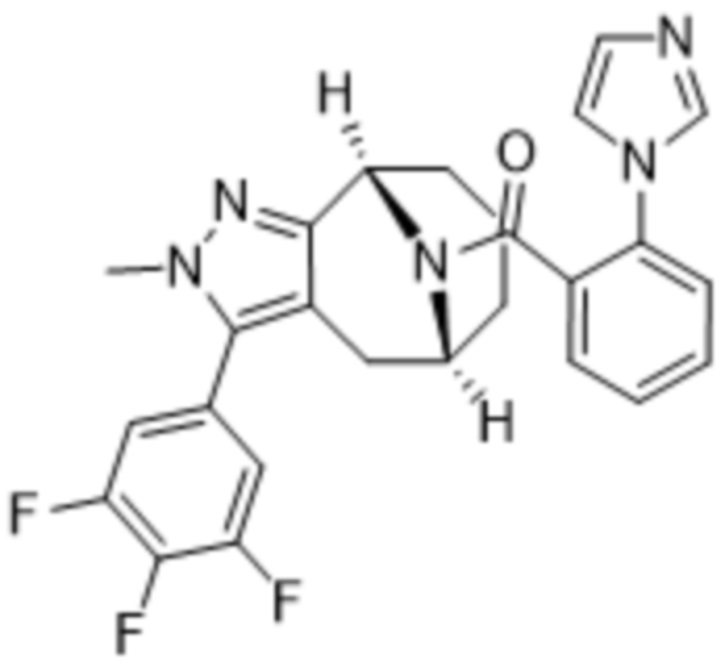
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-(1H-имидазол-1-ил)бензойную кислоту (промежуточное соединение 43) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H22F3N5O, - 477,2; полученное m/z, 478,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,15-6,58 (м, 9H), 5,75-5,63 (м, 1H), 3,78 (с, 3H), 3,66-3,53 (м, 1H), 2,86-2,69 (м, 1H), 2,39-2,23 (м, 1H), 1,93-1,03 (м, 6H).
Пример 169. (5-Фтор-2-(1H-пиразол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
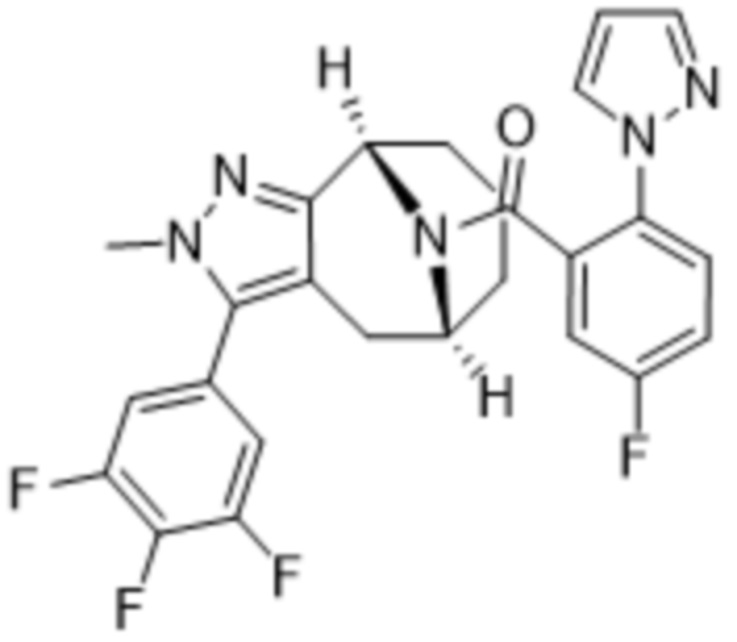
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-фтор-2-(1H-пиразол-1-ил)бензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H21F4N5O, - 495,1; полученное m/z, 496,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 8,18-7,82 (м, 1H), 7,73-7,28 (м, 6H), 6,65-6,48 (м, 1H), 5,74-5,55 (м, 1H), 3,86-3,72 (м, 4H), 3,01-2,82 (м, 1H), 2,38-2,22 (м, 1H), 1,70-1,15 (м, 6H).
Пример 170. (3-(1-Метил-1H-пиразол-4-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
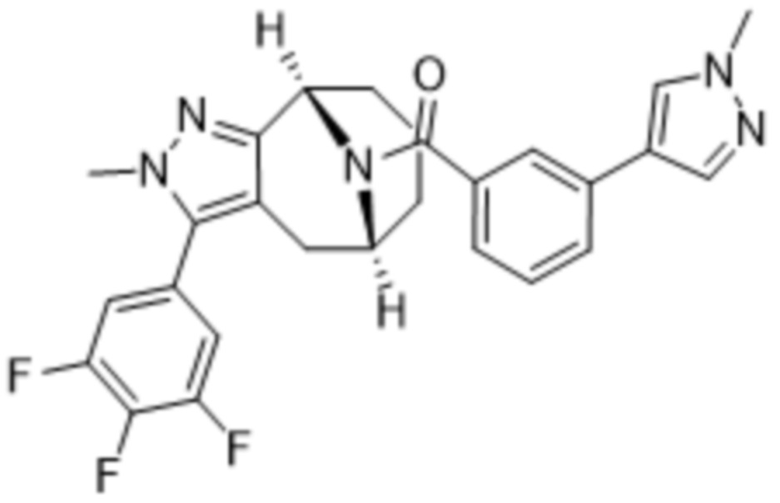
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-(1-метил-1H-пиразол-4-ил)бензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C27H24F3N5O, - 491,1; полученное m/z, 492,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 8,23 (д, J=7,4 Гц, 1H), 7,93 (дд, J=12,6, 0,8 Гц, 1H), 7,74-7,53 (м, 4H), 7,49-7,38 (м, 1H), 7,22-7,09 (м, 1H), 5,80-5,65 (м, 1H), 4,12-4,00 (м, 1H), 3,88-3,71 (м, 6H), 3,13-2,95 (м, 1H), 2,47-2,36 (м, 1H), 2,01-1,39 (м, 6H).
Пример 171. (3-(4-Фтор-1H-пиразол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
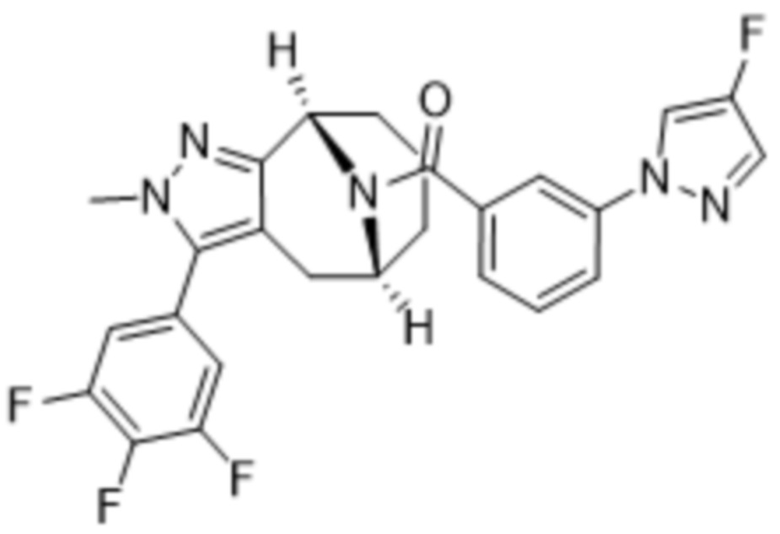
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-(4-фтор-1H-пиразол-1-ил)бензойную кислоту (промежуточное соединение 60) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H21F4N5O, 495,2; полученное m/z, 496,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,79 (д, J=4,4 Гц, 1H), 7,95-7,89 (м, 1H), 7,89-7,84 (м, 1H), 7,83-7,77 (м, 1H), 7,64-7,53 (м, 3H), 7,38-7,32 (м, 1H), 5,76-5,70 (м, 1H), 4,10-4,03 (м, 1H), 3,81 (с, 3H), 2,99 (дд, J=16,2, 7,3 Гц, 1H), 2,44 (д, J=16,3 Гц, 1H), 2,00-1,65 (м, 3H), 1,60 (д, J=13,2 Гц, 1H), 1,56-1,38 (м, 2H).
Пример 172. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-(4-(трифторметил)-1H-пиразол-1-ил)фенил)метанон.
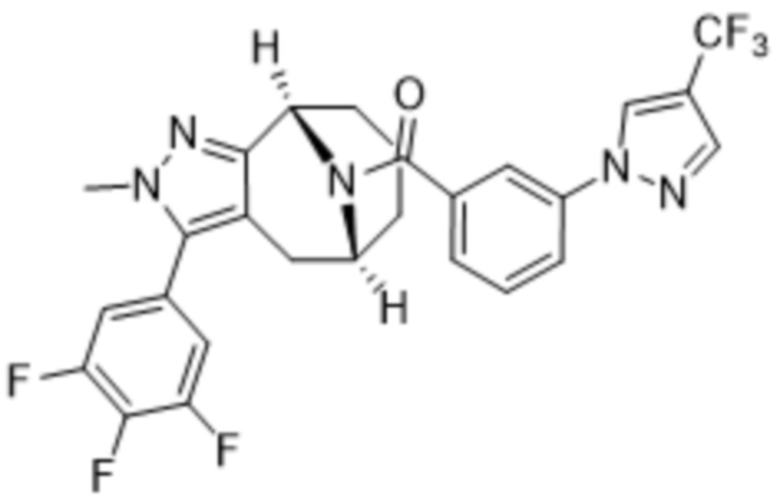
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-[4-(трифторметил)пиразол-1-ил]бензойную кислоту (промежуточное соединение 59) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C27H21F6N5O, - 545,2; полученное m/z, 546,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,31-9,26 (м, 1H), 8,26-8,22 (м, 1H), 8,04-8,00 (м, 1H), 7,96-7,94 (м, 1H), 7,68-7,54 (м, 3H), 7,46-7,41 (м, 1H), 5,76-5,71 (м, 1H), 4,09-4,02 (м, 1H), 3,82 (с, 3H), 3,01 (дд, J=16,2, 7,4 Гц, 1H), 2,46-2,40 (м, 1H), 2,03-1,38 (м, 6H).
Пример 173. (3-(4-Метокси-1H-пиразол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
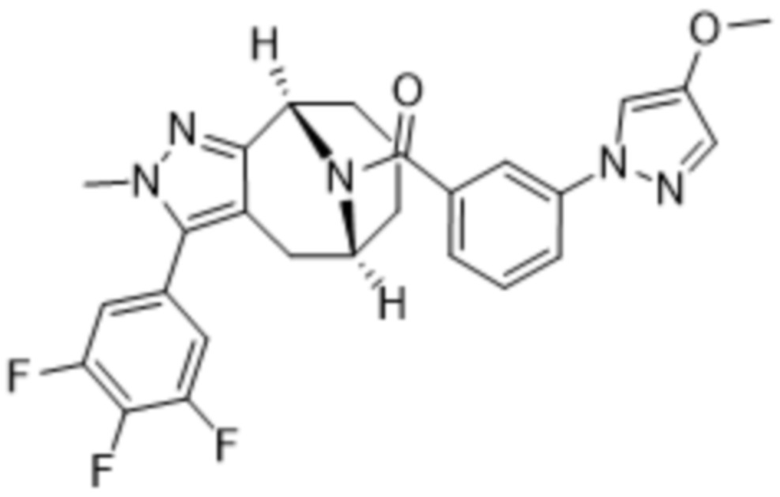
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-(4-метокси-1H-пиразол-1-ил)бензойную кислоту (промежуточное соединение 61) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C27H24F3N5O2, - 507,2; полученное m/z, 508,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,40 (с, 1H), 7,92-7,86 (м, 1H), 7,82-7,78 (м, 1H), 7,64-7,51 (м, 3H), 7,57 (с, 1H), 7,31-7,25 (м, 1H), 5,76-5,70 (м, 1H), 4,09-4,04 (м, 1H), 3,82 (с, 3H), 3,77 (с, 3H), 3,01 (дд, J=16,2, 7,3 Гц, 1H), 2,44 (д, J=16,2 Гц, 1H), 1,99-1,37 (м, 6H).
Пример 174. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-(3-(трифторметил)-1H-пиразол-1-ил)фенил)метанон.
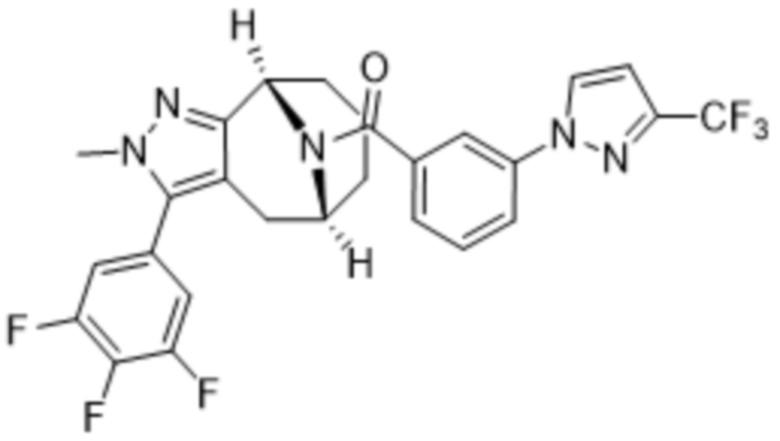
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-[3-(трифторметил)пиразол-1-ил]бензойную кислоту (промежуточное соединение 44) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C27H21F6N5O, - 545,2; полученное m/z, 546,1 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,88-8,78 (м, 1H), 8,07-7,97 (м, 1H), 7,95-7,83 (м, 1H), 7,72-7,53 (м, 3H), 7,50-7,42 (м, 1H), 7,12-7,03 (м, 1H), 5,78-5,68 (м, 1H), 4,15-4,01 (м, 1H), 3,82 (с, 3H), 3,03 (дд, J=16,1, 7,3 Гц, 1H), 2,59-2,36 (м, 1H), 2,05-1,38 (м, 6H).
Пример 175. (3-(2H-1,2,3-Триазол-2-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
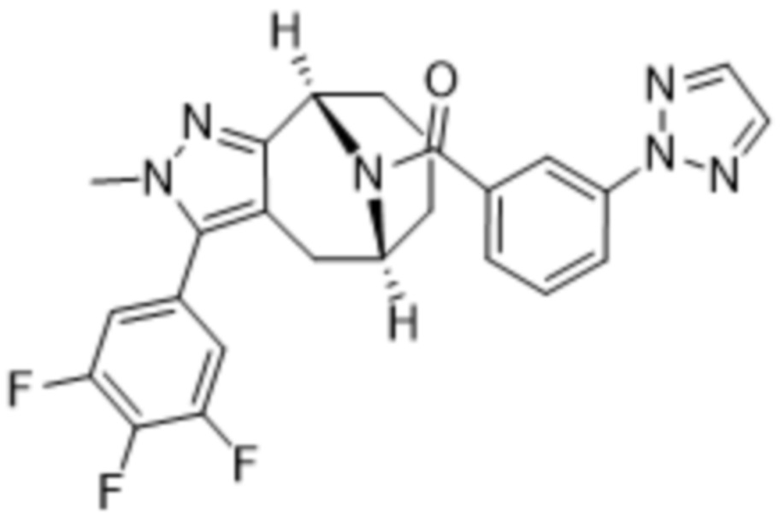
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-(2H-1,2,3-триазол-2-ил)бензойную кислоту (промежуточное соединение 51) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21F3N6O, - 478,2; полученное m/z, 479,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,15 (с, 2H), 8,13-8,09 (м, 1H), 8,02-7,98 (м, 1H), 7,70-7,55 (м, 3H), 7,49-7,44 (м, 1H), 5,73-5,69 (м, 1H), 4,12-4,06 (м, 1H), 3,80 (с, 3H), 2,99 (дд, J=16,3, 7,4 Гц, 1H), 2,44 (д, J=16,3 Гц, 1H), 1,98-1,35 (м, 6H).
Пример 176. (5-Фтор-2-(2H-1,2,3-триазол-2-ил) фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
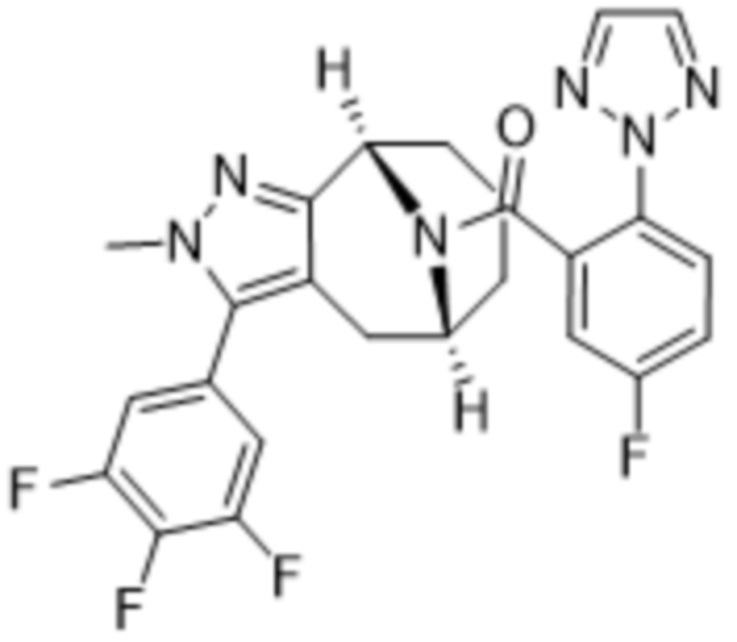
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-фтор-2-(2H-1,2,3-триазол-2-ил)бензойную кислоту [получено в соответствии с процедурой, описанной в Договоре о патентной кооперации, Патентная публикация WO2016040789] вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H20F4N6O, - 496,1; полученное m/z, 497,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 8,17 (д, J=15,0 Гц, 1H), 8,03-7,86 (м, 1H), 7,79-6,98 (м, 5H), 5,65 (с, 1H), 4,41 (д, J=132,8 Гц, 1H), 3,93-3,60 (м, 3H), 3,11-2,94 (м, 1H), 2,43-2,29 (м, 1H), 1,94-1,23 (м, 6H).
Пример 177. (3-Метил-2-(2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
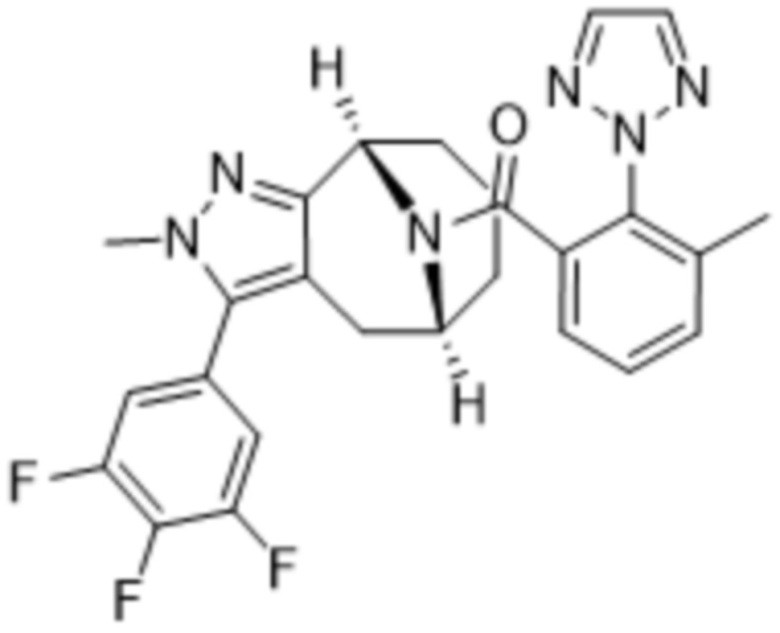
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-метил-2-(2H-1,2,3-триазол-2-ил)бензойную кислоту [WO2016040789] вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H23F3N6O, - 492,1; полученное m/z, 493,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 8,11 (д, J=7,4 Гц, 1H), 7,79-7,36 (м, 5H), 7,35-6,89 (м, 1H), 5,53-5,43 (м, 1H), 3,98-3,86 (м, 1H), 3,82-3,69 (м, 3H), 3,08-2,97 (м, 1H), 2,39 (д, J=16,0 Гц, 1H), 2,19-2,05 (м, 3H), 1,96-1,26 (м, 6H).
Пример 178. (3-Метокси-2-(2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
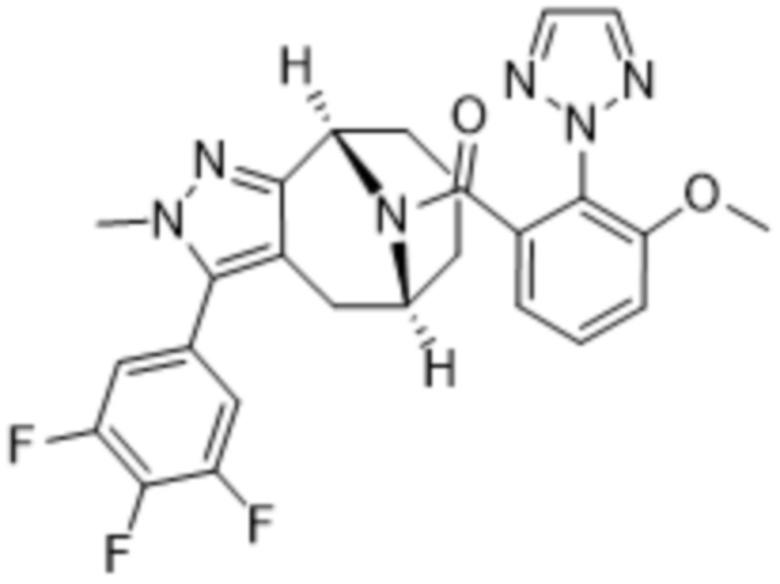
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-метокси-2-(2H-1,2,3-триазол-2-ил)бензойную кислоту (промежуточное соединение 47) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H23F3N6O2, - 508,2; полученное m/z, 509,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,01 (с, 2H), 7,65-7,53 (м, 3H), 7,38-7,28 (м, 1H), 7,03-6,96 (м, 1H), 5,42 (с, 1H), 3,95-3,88 (м, 1H), 3,78 (с, 3H), 3,76 (с, 3H), 2,99 (дд, J=16,1, 7,3 Гц, 1H), 2,38 (д, J=16,0 Гц, 1H), 1,97-1,21 (м, 6H).
Пример 179. (4-Метокси-2-(2H-1,2,3-триазол-2-ил) фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
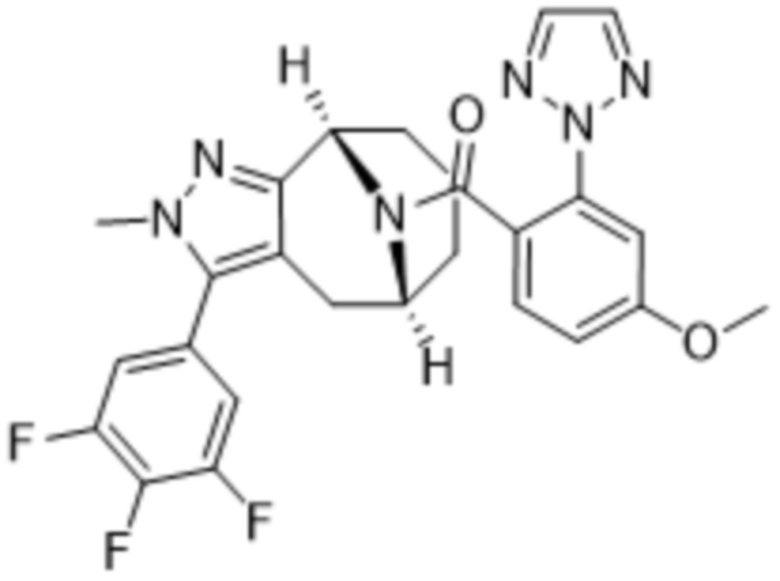
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 4-метокси-2-(2H-1,2,3-триазол-2-ил)бензойную кислоту [WO2016040789] вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H23F3N6O2, - 508,2; полученное m/z, 509,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 8,16 (д, J=14,0 Гц, 1H), 7,89-6,79 (м, 6H), 5,65 (с, 1H), 4,57-4,24 (м, 1H), 3,94-3,51 (м, 6H), 3,13-2,91 (м, 1H), 2,43-2,25 (м, 1H), 1,91-1,17 (м, 6H).
Пример 180. (5-Метокси-2-(2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
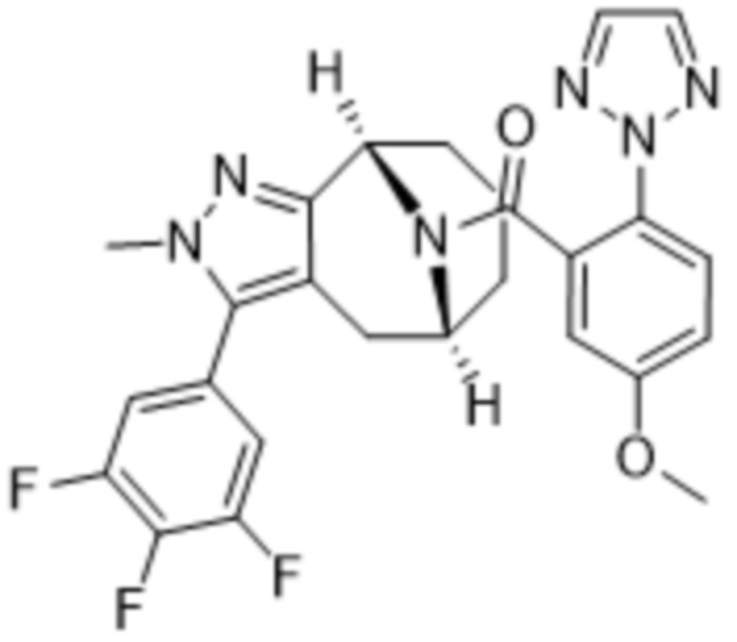
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-метокси-2-(2H-1,2,3-триазол-2-ил)бензойную кислоту (промежуточное соединение 46) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H23F3N6O2, - 508,2; полученное m/z, 509,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,10 (д, J=5,0 Гц, 1H), 7,88-7,72 (м, 1H), 7,71-7,37 (м, 3H), 7,25-7,13 (м, 1H), 6,91 (д, J=2,8 Гц, 1H), 5,70-5,60 (м, 1H), 3,89 (с, 1H), 3,83 (с, 3H), 3,80 (с, 3H), 3,02-2,90 (м, 1H), 2,40-2,22 (м, 1H), 1,98-1,20 (м, 6H).
Пример 181:(2-(2H-1,2,3-Триазол-2-ил)-3-(трифторметил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
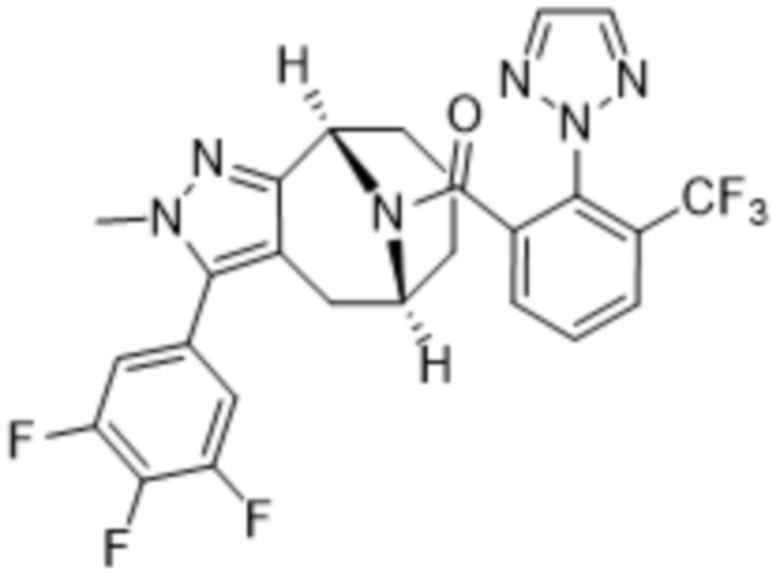
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-(2H-1,2,3-триазол-2-ил)-3-(трифторметил)бензойную кислоту (промежуточное соединение 77) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H20F6N6O, - 546,2; полученное m/z, 547,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,29-8,15 (м, 1H), 8,24-8,23 (м, 1H), 7,97-7,79 (м, 1H), 7,86-7,84 (м, 1H), 7,69-7,53 (м, 3H), 5,73-5,67 (м, 1H), 3,91-3,71 (м, 1H), 3,81 (с, 3H), 3,05-2,93 (м, 1H), 2,42-2,34 (м, 1H), 1,98-1,60 (м, 2H), 1,59-1,17 (м, 4H).
Пример 182. (2-(2H-1,2,3-Триазол-2-ил)-5-(трифторметил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
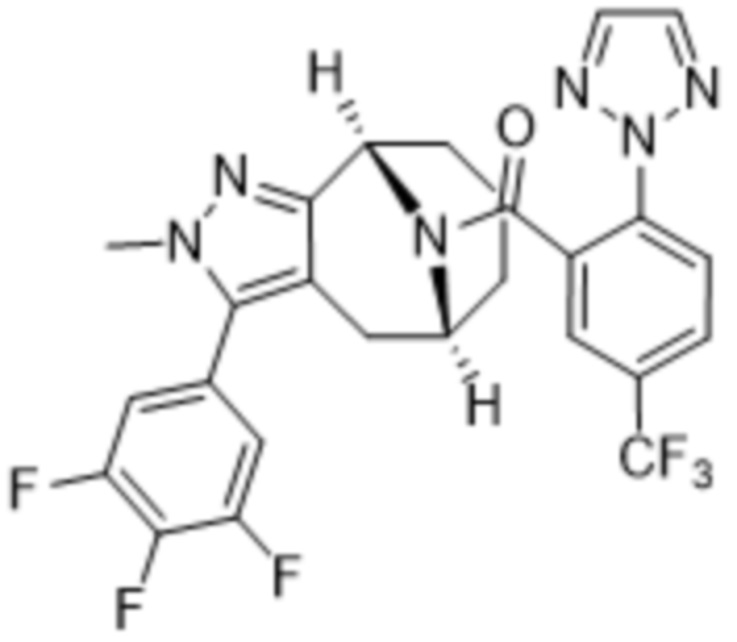
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-(2H-1,2,3-триазол-2-ил)-5-(трифторметил)бензойную кислоту (промежуточное соединение 45) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H20F6N6O, - 546,2; полученное m/z, 547,1 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,27-8,25 (м, 1H), 8,23-8,10 (м, 1H), 8,08-7,96 (м, 1H), 7,89-7,85 (м, 1H), 7,79-7,74 (м, 1H), 7,65-7,51 (м, 2H), 5,76-5,65 (м, 1H), 3,86-3,72 (м, 1H), 3,81 (с, 3H), 2,96-2,83 (м, 1H), 2,46-2,29 (м, 1H), 2,11-1,20 (м, 6H).
Пример 183. (2-(1H-1,2,3-Триазол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
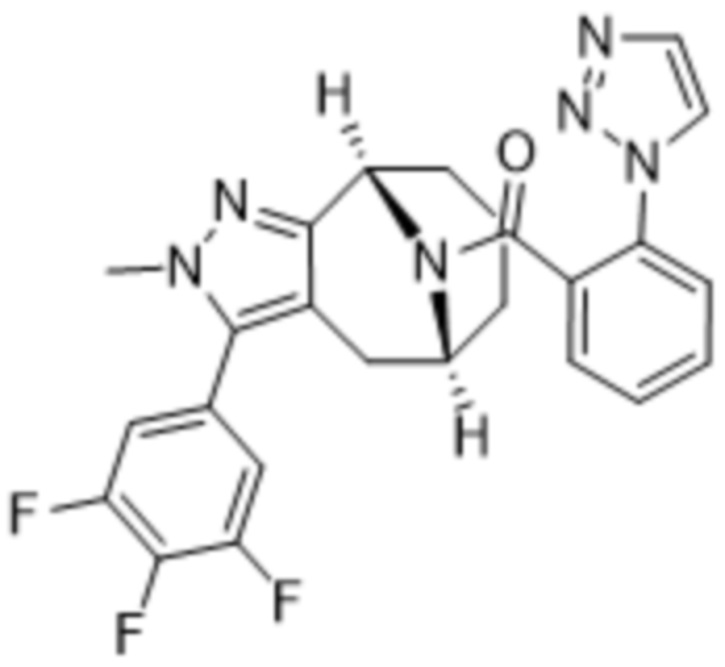
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-(1H-1,2,3-триазол-1-ил)бензойную кислоту (промежуточное соединение 50) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21F3N6O, - 478,2; полученное m/z, 479,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,51-8,46 (м, 1H), 7,99-7,94 (м, 1H), 7,74-7,55 (м, 5H), 7,54-7,42 (м, 1H), 5,63-5,58 (м, 1H), 3,87-3,73 (м, 1H), 3,79 (с, 3H), 2,97 (дд, J=16,1, 7,3 Гц, 1H), 2,42-2,31 (м, 1H), 1,81-1,20 (м, 6H).
Пример 184. (3-Метокси-2-(1H-1,2,3-триазол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
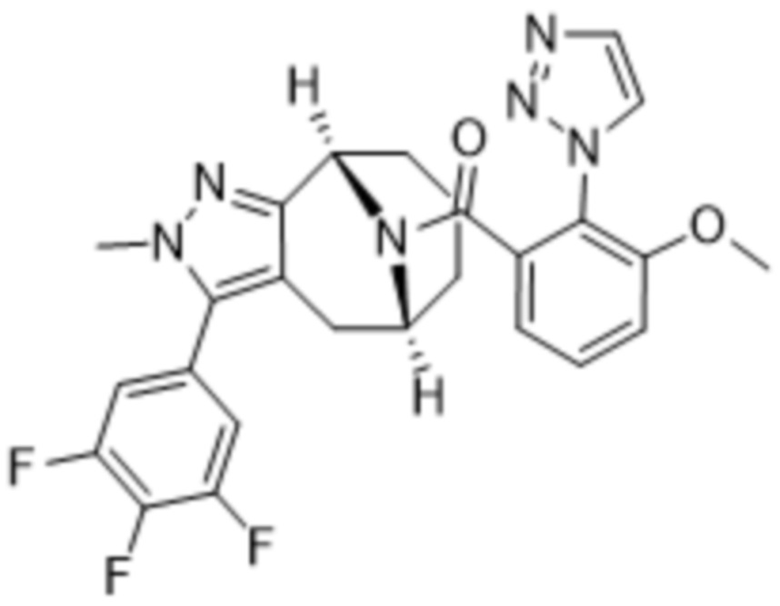
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-метокси-2-(1H-1,2,3-триазол-1-ил)бензойную кислоту (промежуточное соединение 48) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H23F3N6O2, - 508,2; полученное m/z, 509,2 [M+H]+.1H ЯМР (500 МГц, ДМСО-d6) δ 8,32-8,27 (м, 1H), 7,90-7,85 (м, 1H), 7,65-7,44 (м, 3H), 7,40-7,31 (м, 1H), 7,07-7,01 (м, 1H), 5,47-5,40 (м, 1H), 3,99-3,93 (м, 1H), 3,81 (с, 3H), 3,77 (с, 3H), 3,02 (дд, J=16,2, 7,3 Гц, 1H), 2,39 (д, J=16,0 Гц, 1H), 1,92-1,19 (м, 6H).
Пример 185. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(4,5,6,7-тетрагидропиразолo[1,5-a]пиридин-3-ил)метанон.
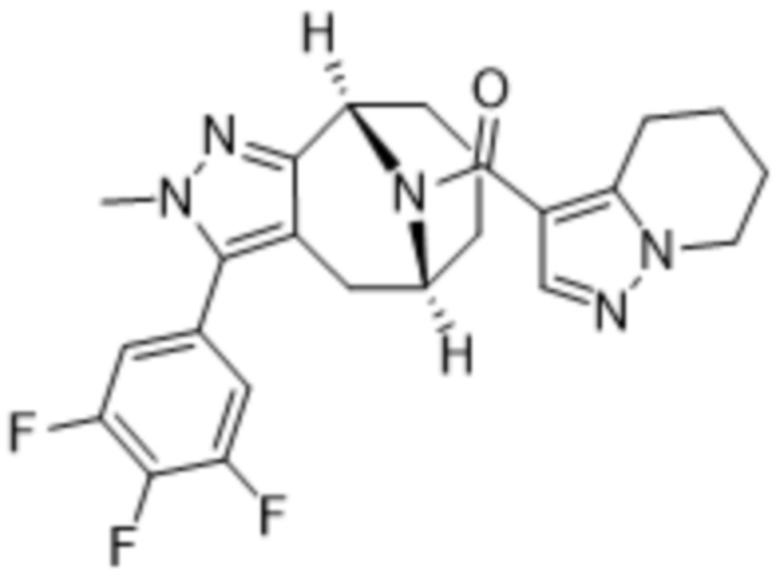
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 4,5,6,7-тетрагидропиразоло[1,5-a]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H24F3N5O, - 455,2; полученное m/z, 456,0 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,73-7,39 (м, 3H), 5,69-5,10 (м, 1H), 4,99-4,36 (м, 1H), 4,17-3,95 (м, 2H), 3,79 (с, 3H), 3,22-3,04 (м, 1H), 2,92 -2,69 (м, 2H), 2,46-2,36 (м, 1H), 2,03-1,90 (м, 2H), 1,83-1,33 (м, 8H).
Пример 186. (3,4-Дигидро-2H-пирано[3,2-b]пиридин-7-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
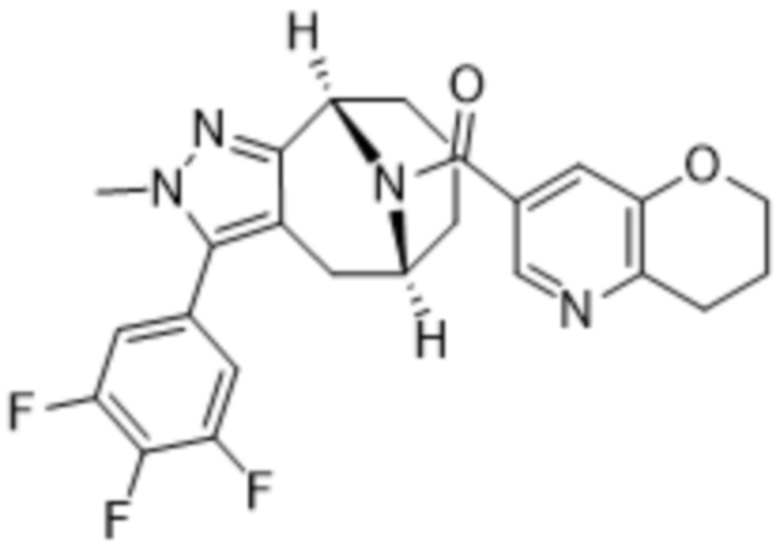
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3,4-дигидро-2H-пирано[3,2-b]пиридин-7-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H23F3N4O2, - 468,1; полученное m/z, 469,0 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,18-7,97 (м, 1H), 7,65-7,41 (м, 2H), 7,24-6,72 (м, 1H), 5,81-5,63 (м, 1H), 4,33-3,99 (м, 2H), 3,88-3,67 (м, 4H), 3,09-2,95 (м, 1H), 2,93-2,81 (м, 2H), 2,43-2,27 (м, 1H), 2,12-1,90 (м, 2H), 1,85-1,27 (м, 6H).
Пример 187. (6,7-Дигидро-5H-пиразолo[5,1-b][1,3]оксазин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
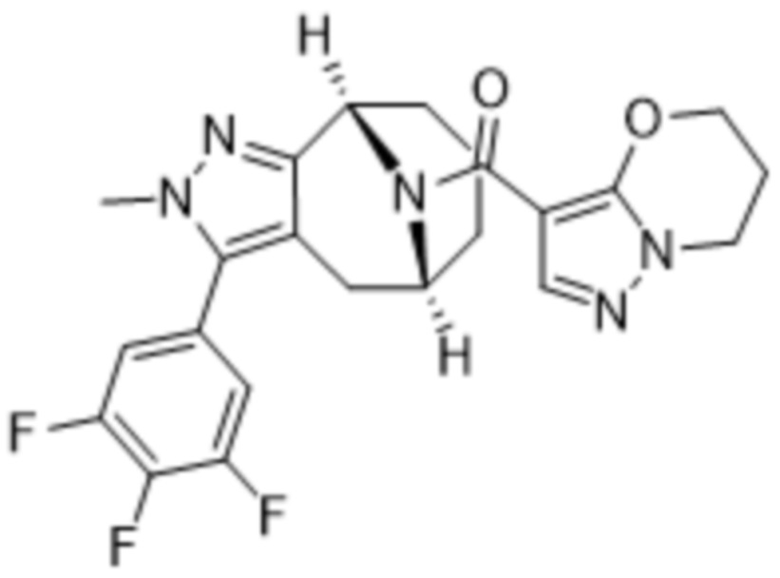
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и (6,7-дигидро-5H-пиразоло[5,1-b][1,3]оксазин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H22F3N5O2, - 457,1; полученное m/z, 458,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 7,61-7,35 (м, 3H), 5,54 (с, 1H), 5,15-4,73 (м, 1H), 4,38 (с, 2H), 4,09 (с, 2H), 3,85-3,65 (м, 3H), 3,02 (с, 1H), 2,48-2,35 (м, 1H), 2,19 (с, 2H), 2,00-1,36 (м, 6H).
Пример 188. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(6-метил-6,7-дигидро-5H-пиразолo[5,1-b][1,3]оксазин-3-ил)метанон.
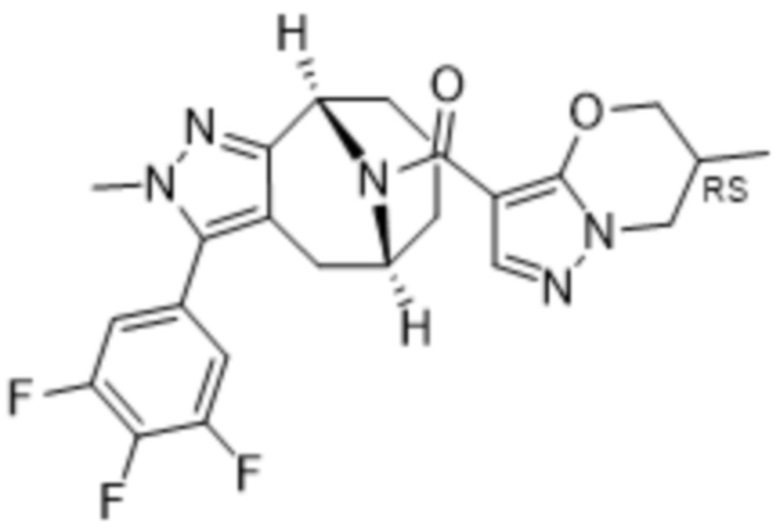
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и (R/S)6-метил-6,7-дигидро-5H-пиразоло[5,1-b][1,3]оксазин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H24F3N5O2, - 471,1; полученное m/z, 472,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,63-7,40 (м, 3H), 5,53 (с, 1H), 5,13-4,73 (м, 1H), 4,46-3,94 (м, 4H), 3,86-3,65 (м, 4H), 3,15-2,91 (м, 1H), 2,44-2,30 (м, 1H), 2,03-1,37 (м, 6H), 1,02 (с, 3H).
Пример 189. (6,7-Дигидро-5H-пиразолo[5,1-b][1,3]оксазин-2-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
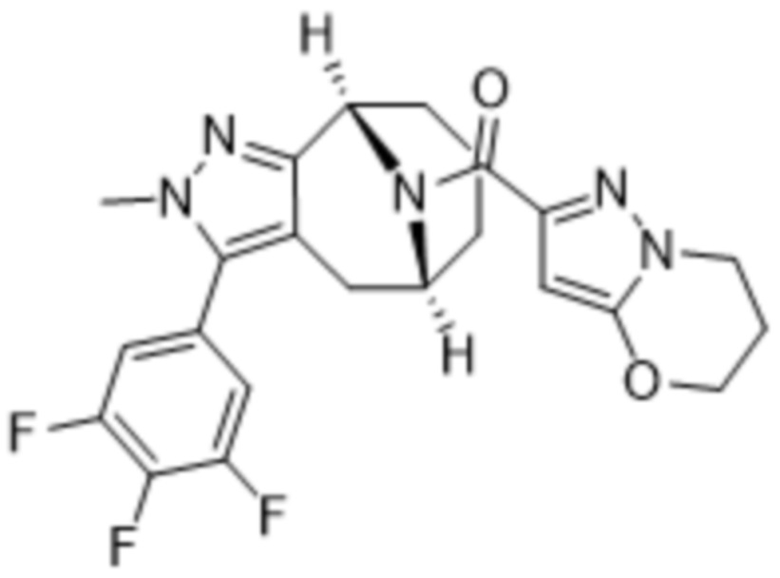
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6,7-дигидро-5H-пиразоло[5,1-b][1,3]оксазин-2-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H22F3N5O2, - 457,1; полученное m/z, 458,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,64-7,45 (м, 2H), 5,75 (д, J=9,3 Гц, 1H), 5,71-5,57 (м, 1H), 5,07-4,91 (м, 1H), 4,37-4,25 (м, 2H), 4,19-4,03 (м, 2H), 3,82-3,71 (м, 3H), 3,08-2,91 (м, 1H), 2,63-2,52 (м, 1H), 2,26-2,13 (м, 2H), 1,93-1,39 (м, 6H).
Пример 190. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-метил-5-(трифторметил)-1H-пиразол-4-ил)метанон.
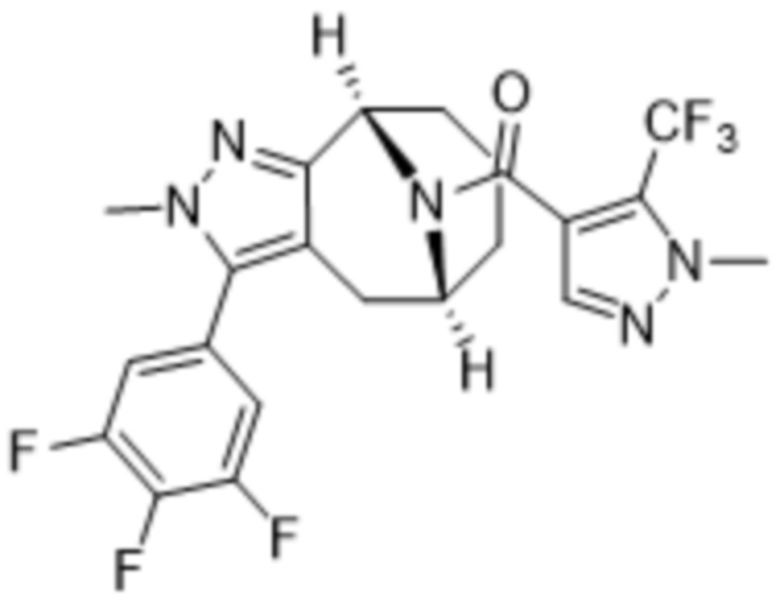
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-метил-5-(трифторметил)-1H-пиразол-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C22H19F6N5O, - 483,1; полученное m/z, 484,1 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 7,80 (с, 1H), 7,65-7,51 (м, 2H), 5,76-5,66 (м, 1H), 4,09-3,94 (м, 1H), 4,00 (с, 3H), 3,80 (с, 3H), 2,97 (дд, J=15,8, 7,3 Гц, 1H), 2,61-2,33 (м, 1H), 1,85-1,31 (м, 6H).
Пример 191. (1-(трет-Бутил)-5-(трифторметил)-1H-пиразол-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
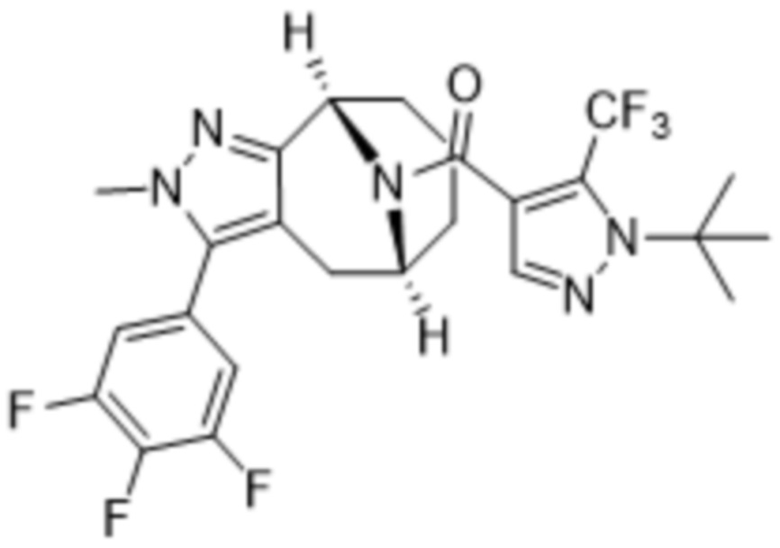
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-(трет-бутил)-5-(трифторметил)-1H-пиразол-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H25F6N5O, - 525,2; полученное m/z, 526,0 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 7,78 (с, 1H), 7,63-7,54 (м, 2H), 5,81-5,55 (м, 1H), 4,01-3,87 (м, 1H), 3,81-3,76 (м, 3H), 3,07-2,89 (м, 1H), 2,46-2,40 (м, 1H), 1,79-1,67 (м, 3H), 1,63 (с, 9H), 1,45 (т, J=19,0 Гц, 3H).
Пример 192. (5-Этил-1-фенил-1H-1,2,4-триазол-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
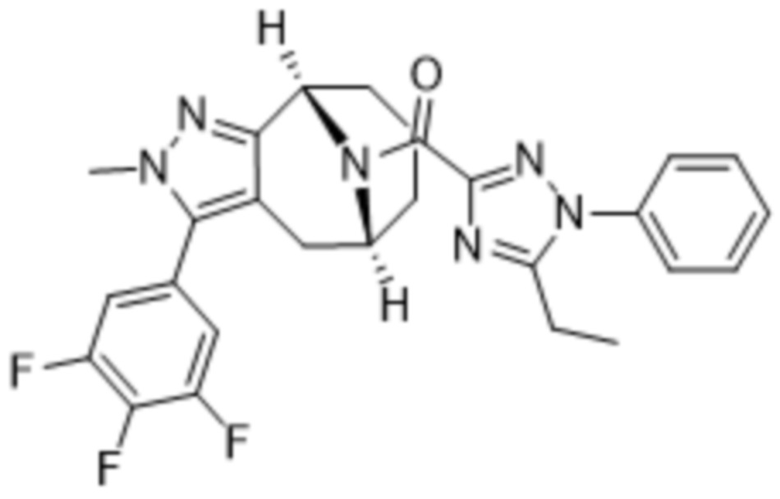
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-фенил-1H-1,2,4-триазол-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C27H25F3N6O, - 506,2; полученное m/z, 507,2 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 7,66-7,50 (м, 7H), 5,80-5,40 (м, 1H), 5,10-4,62 (м, 1H), 3,83-3,70 (м, 3H), 3,12-2,94 (м, 1H), 2,90-2,75 (м, 2H), 2,62-2,53 (м, 1H), 1,99-1,42 (м, 6H), 1,29-1,14 (м, 3H).
Пример 193. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-фенил-5-(трифторметил)-1H-пиразол-3-ил)метанон.
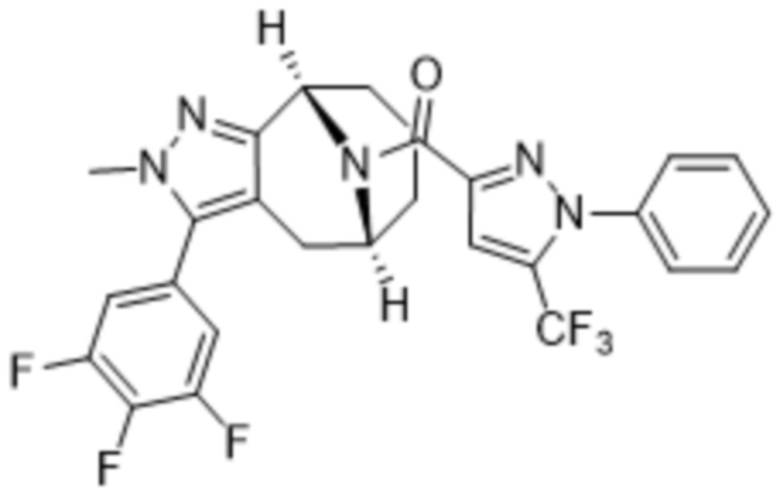
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-фенил-5-(трифторметил)-1H-пиразол-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C27H21F6N5O, - 545,2; полученное m/z, 546,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,66-7,52 (м, 7H), 7,42 (с, 1H), 5,78-5,73 (м, 1H), 5,01-4,94 (м, 1H), 3,79 (с, 3H), 3,09-2,99 (м, 1H), 2,61-2,53 (м, 1H), 1,99-1,39 (м, 6H).
Пример 194. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-фенил-5-(трифторметил)-1H-1,2,4-триазол-3-ил)метанон.
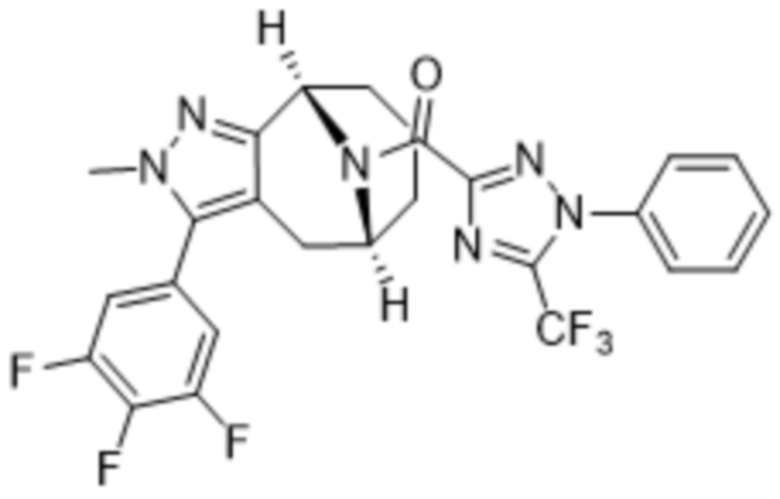
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-фенил-5-(трифторметил)-1H-1,2,4-триазол-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H20F6N6O, - 546,2; полученное m/z, 547,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,70-7,62 (м, 7H), 5,77-5,73 (м, 1H), 4,69-4,63 (м, 1H), 3,80 (с, 3H), 2,99 (дд, J=16,1, 7,4 Гц, 1H), 2,60 (д, J=16,1 Гц, 1H), 1,89-1,69 (м, 4H), 1,56-1,39 (м, 2H).
Пример 195. (5-Метокси-1-фенил-1H-1,2,4-триазол-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
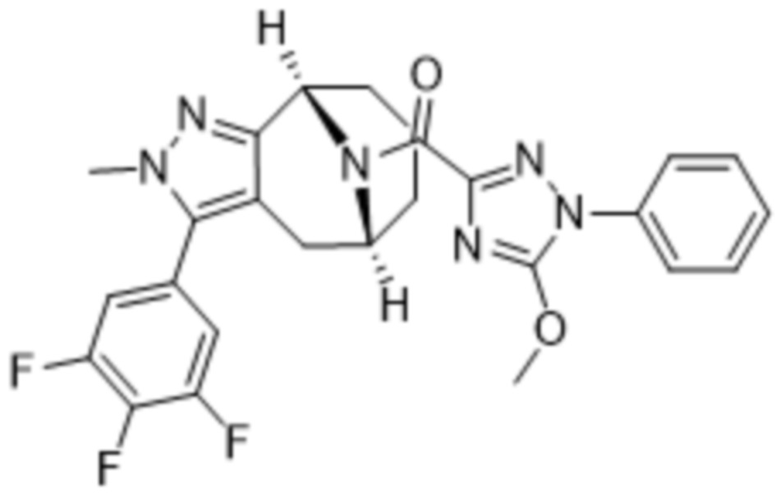
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-метокси-1-фенил-1,2,4-триазол-3-карбоновую кислоту (промежуточное соединение 1) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H23F3N6O2, - 508,2; полученное m/z, 509,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,72-7,65 (м, 2H), 7,63-7,49 (м, 4H), 7,44-7,37 (м, 1H), 5,72-5,69 (м, 1H), 4,75-4,69 (м, 1H), 4,13 (с, 3H), 3,78 (с, 3H), 3,05-2,99 (м, 1H), 2,56 (д, J=16,2 Гц, 1H), 1,86-1,38 (м, 6H).
Пример 196. (1-(3-Фторфенил)-1H-1,2,4-триазол-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
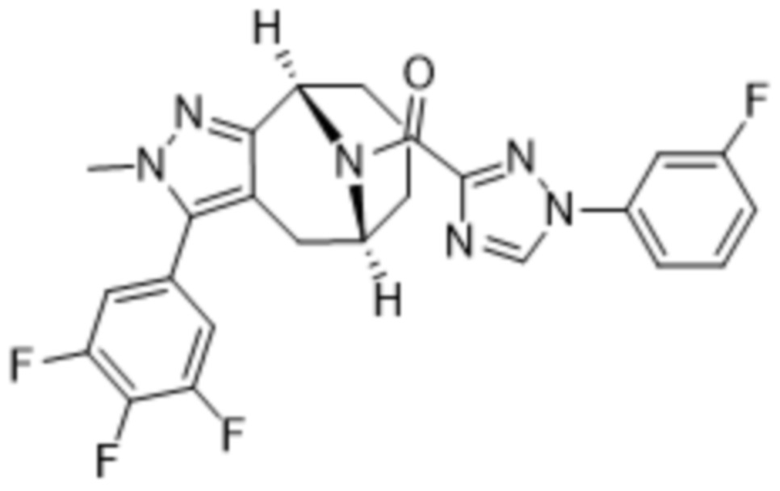
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-(3-фторфенил)-1H-1,2,4-триазол-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H20F4N6O, - 496,2; полученное m/z, 497,1 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 9,45 (с, 1H), 7,83-7,72 (м, 2H), 7,71-7,51 (м, 3H), 7,39-7,26 (м, 1H), 5,80-5,72 (м, 1H), 4,61-4,50 (м, 1H), 3,81 (с, 3H), 3,09-2,98 (м, 1H), 2,60-2,43 (м, 1H), 2,04-1,58 (м, 4H), 1,56-1,38 (м, 2H).
Пример 197. (1-(4-Фторфенил)-5-метил-1H-1,2,4-триазол-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
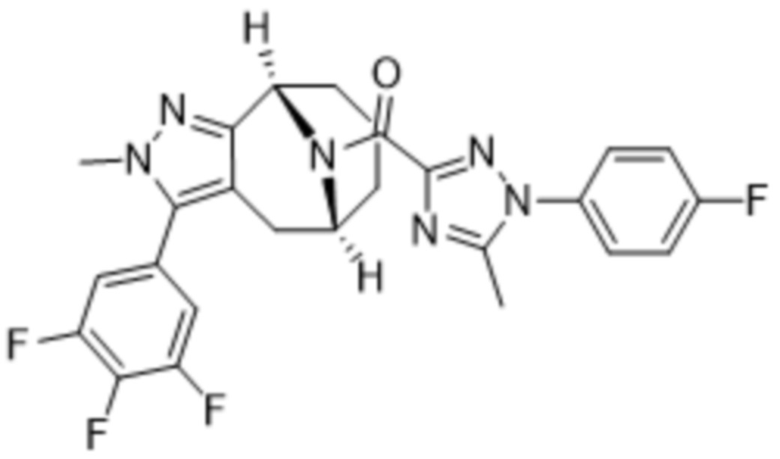
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-(4-фторфенил)-5-метил-1H-1,2,4-триазол-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H22F4N6O, - 510,1; полученное m/z, 511,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 7,75-7,67 (м, 2H), 7,64-7,55 (м, 2H), 7,52-7,37 (м, 2H), 5,79-5,39 (м, 1H), 5,11-4,57 (м, 1H), 3,84-3,73 (м, 3H), 3,09-2,97 (м, 1H), 2,65-2,53 (м, 1H), 2,50-2,46 (м, 3H), 1,98-1,37 (м, 6H).
Пример 198. (1-(2-Метоксифенил)-1H-1,2,4-триазол-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
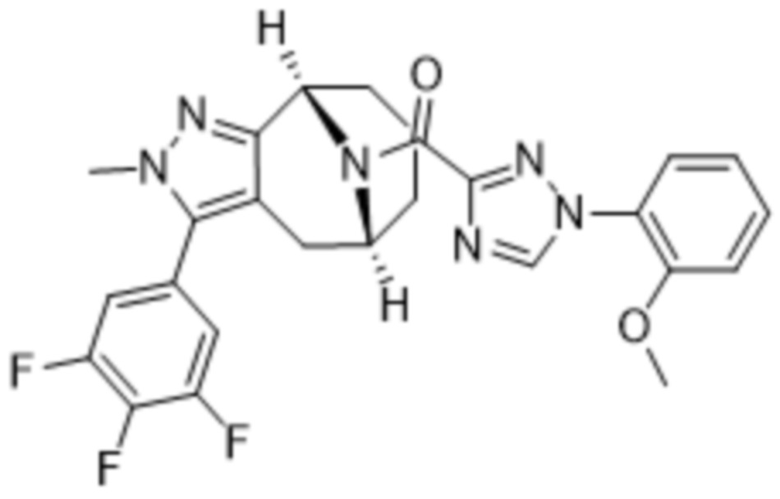
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-(2-метоксифенил)-1,2,4-триазол-3-карбоновую кислоту (промежуточное соединение 1) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H23F3N6O2, - 508,2; полученное m/z, 509,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 9,04 (с, 1H), 7,66 (дд, J=7,9, 1,6 Гц, 1H), 7,63-7,55 (м, 2H), 7,54-7,44 (м, 1H), 7,38-7,31 (м, 1H), 7,20-7,09 (м, 1H), 5,80-5,72 (м, 1H), 4,64-4,52 (м, 1H), 3,89 (с, 3H), 3,80 (с, 3H), 3,08-2,96 (м, 1H), 2,64-2,42 (м, 1H), 2,02-1,57 (м, 4H), 1,57-1,38 (м, 2H).
Пример 199. (1-(3-Метоксифенил)-1H-1,2,4-триазол-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
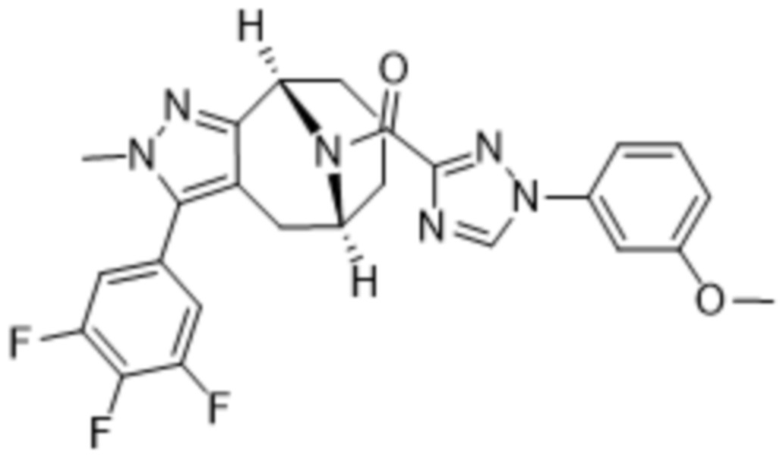
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-(3-метоксифенил)-1,2,4-триазол-3-карбоновую кислоту (промежуточное соединение 41) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H23F3N6O2, - 508,2; полученное m/z, 509,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 9,41 (с, 1H), 7,68-7,55 (м, 2H), 7,54-7,41 (м, 3H), 7,08-6,99 (м, 1H), 5,80-5,72 (м, 1H), 4,61-4,51 (м, 1H), 3,85 (с, 3H), 3,80 (с, 3H), 3,10-2,98 (м, 1H), 2,60-2,43 (м, 1H), 2,08-1,37 (м, 6H).
Пример 200. (4-Метоксипиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
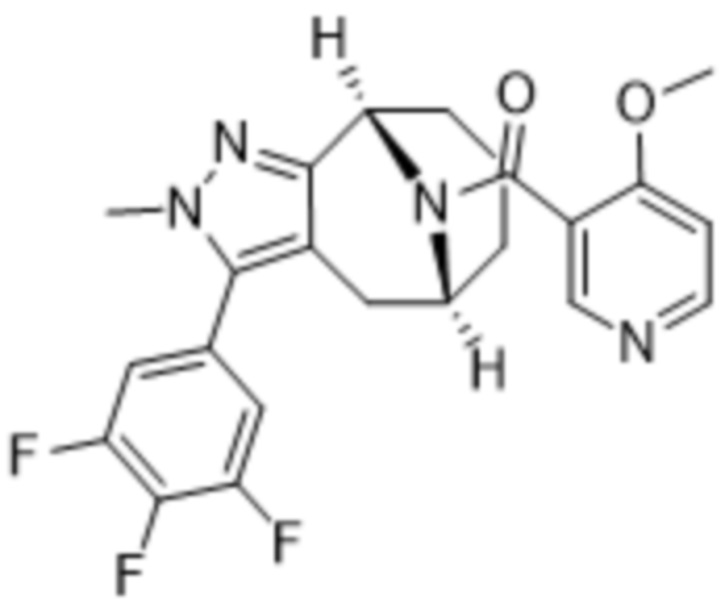
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 4-метоксиникотиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H21F3N4O2, - 442,2; полученное m/z, 443,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,58-8,46 (м, 1H), 8,25-8,17 (м, 1H), 7,65-7,50 (м, 2H), 7,27-7,08 (м, 1H), 5,80-5,71 (м, 1H), 4,01-3,92 (м, 1H), 3,92 (с, 3H), 3,80 (с, 3H), 2,93-2,79 (м, 1H), 2,42-2,30 (м, 1H), 1,96-1,31 (м, 6H).
Пример 201. (6-Метоксипиридин-2-ил) ((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
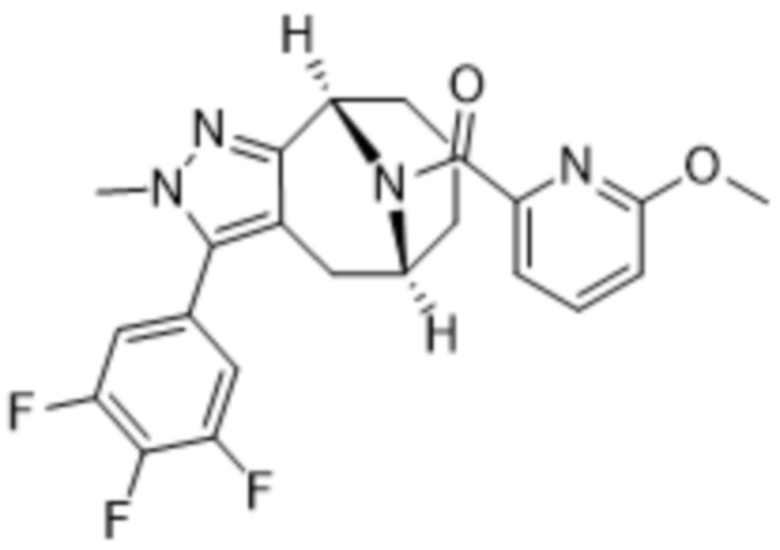
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-метоксипиколиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H21F3N4O2, - 442,2; полученное m/z, 443,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 7,88-7,70 (м, 1H), 7,63-7,46 (м, 2H), 7,16 (д, J=7,2 Гц, 1H), 7,00-6,85 (м, 1H), 5,81-5,58 (м, 1H), 4,35-4,20 (м, 1H), 3,91-3,70 (м, 6H), 3,12-2,91 (м, 1H), 2,65-2,51 (м, 1H), 2,10-1,38 (м, 6H).
Пример 202. (4-Метоксипиридин-2-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
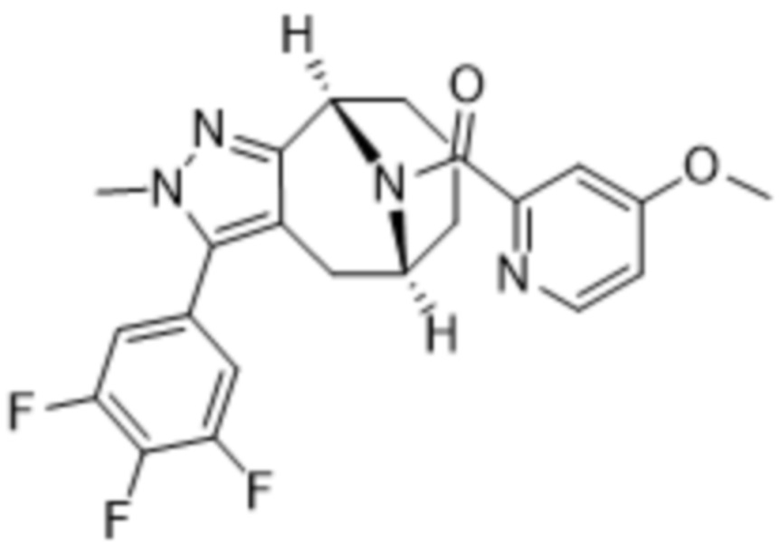
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 4-метоксипиколиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H21F3N4O2, - 442,2; полученное m/z, 443,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,38 (д, J=5,7 Гц, 1H), 7,62-7,52 (м, 2H), 7,12-7,09 (м, 1H), 7,04 (дд, J=5,8, 2,6 Гц, 1H), 5,74-5,70 (м, 1H), 4,20-4,15 (м, 1H), 3,86 (с, 3H), 3,80 (с, 3H), 2,98 (дд, J=16,0, 7,3 Гц, 1H), 2,45 (д, J=16,0 Гц, 1H), 1,90-1,37 (м, 6H).
Пример 203. (5-Метоксипиридин-2-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
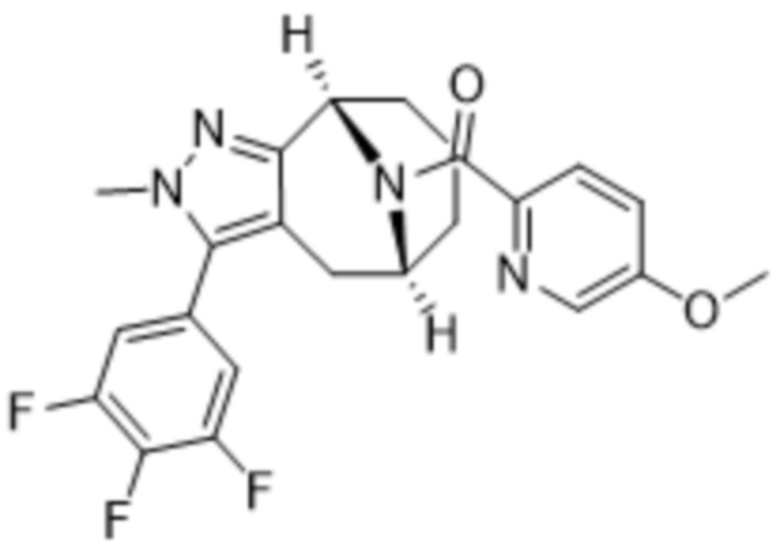
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-метоксипиколиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H21F3N4O2, - 442,2; полученное m/z, 443,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,26 (д, J=2,7 Гц, 1H), 7,62-7,52 (м, 3H), 7,50-7,44 (м, 1H), 5,73-5,67 (м, 1H), 4,43-4,38 (м, 1H), 3,85 (с, 3H), 3,78 (с, 3H), 3,08-2,96 (м, 1H), 2,57-2,41 (м, 1H), 2,03-1,35 (м, 6H).
Пример 204. (6-Метоксипиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
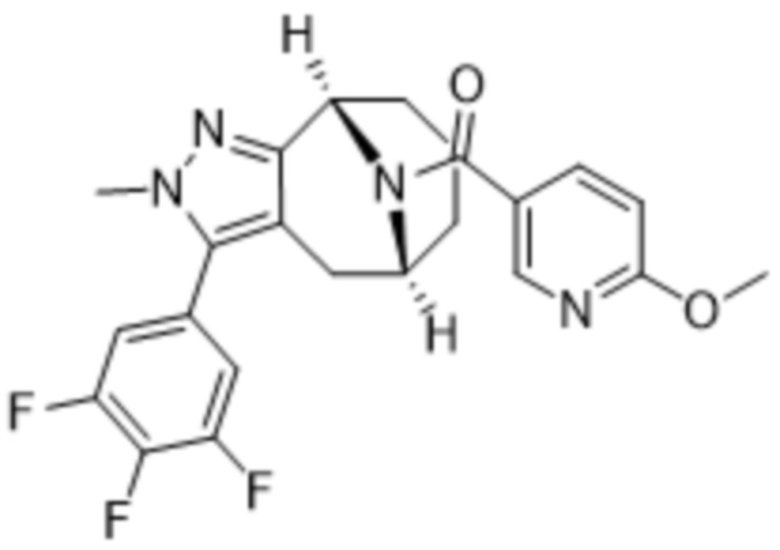
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-метоксиникотиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H21F3N4O2, - 442,2; полученное m/z, 443,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,28 (с, 1H), 7,81-7,74 (м, 1H), 7,65-7,52 (м, 2H), 6,92-6,83 (м, 1H), 5,70-5,60 (м, 1H), 4,15-4,08 (м, 1H), 3,88 (с, 3H), 3,79 (с, 3H), 3,10 (дд, J=16,4, 7,4 Гц, 1H), 2,40 (д, J=16,2 Гц, 1H), 2,00-1,35 (м, 6H).
Пример 205. (5-Изопропоксипиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
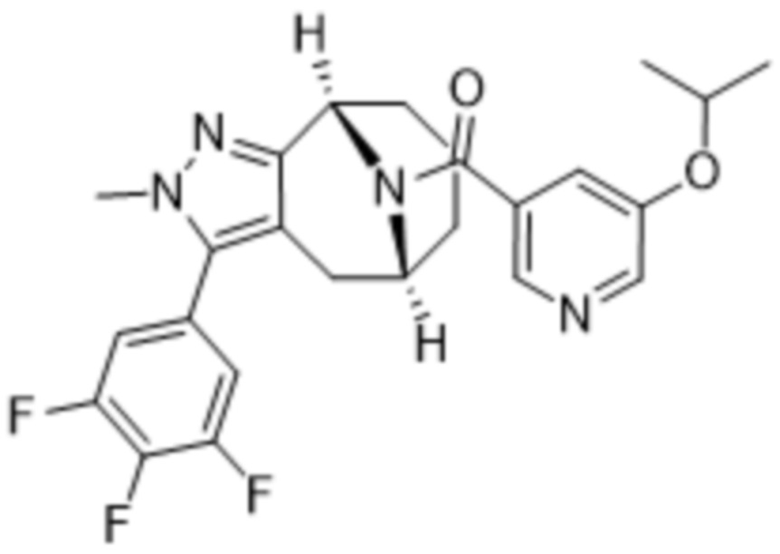
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-изопропоксиникотиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H25F3N4O2, 470,1; полученное m/z, 471,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 8,34 (дд, J=13,5, 2,8 Гц, 1H), 8,13 (дд, J=50,4, 1,7 Гц, 1H), 7,69-7,58 (м, 2H), 7,48-7,28 (м, 1H), 5,81-5,60 (м, 1H), 4,83-4,68 (м, 1H), 4,04-3,95 (м, 1H), 3,85-3,72 (м, 3H), 3,14-2,93 (м, 1H), 2,47-2,35 (м, 1H), 2,00-1,40 (м, 6H), 1,29 (дд, J=5,9, 1,3 Гц, 6H).
Пример 206. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(6-(трифторметокси)пиридин-2-ил)метанон.
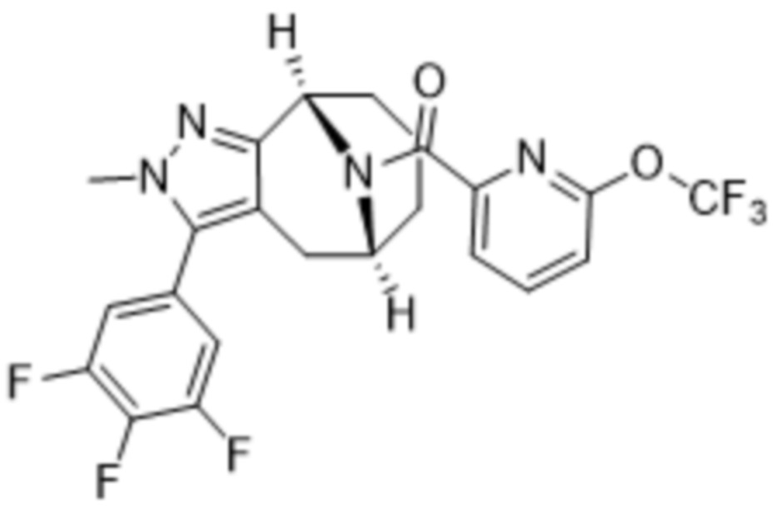
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-(трифторметокси)пиколиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H18F6N4O2, - 496,1; полученное m/z, 497,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,25-8,10 (м, 1H), 7,71-7,37 (м, 4H), 5,75-5,60 (м, 1H), 4,26-4,09 (м, 1H), 3,83-3,67 (м, 3H), 3,15-2,88 (м, 1H), 2,68-2,52 (м, 1H), 2,09-1,38 (м, 6H).
Пример 207. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-(трифторметокси)пиридин-2-ил)метанон.
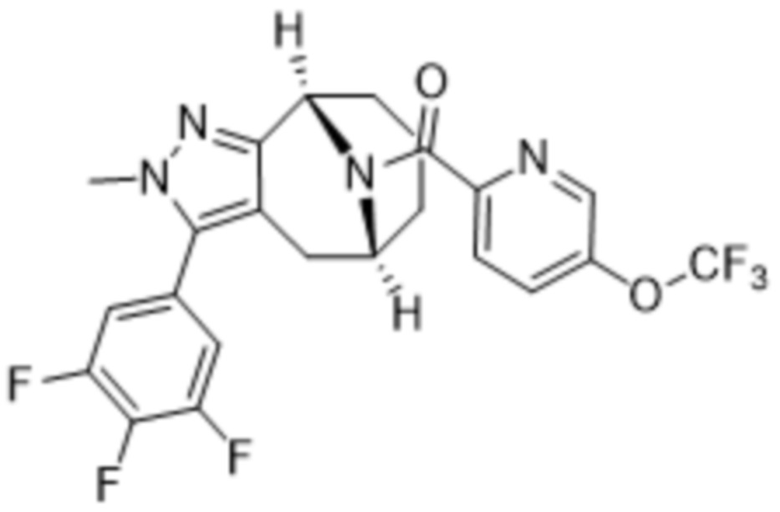
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-(трифторметокси)пиколиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H18F6N4O2, - 496,1; полученное m/z, 497,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,80-8,51 (м, 1H), 8,10-7,99 (м, 1H), 7,86-7,69 (м, 1H), 7,66-7,47 (м, 2H), 5,88-5,59 (м, 1H), 4,27-4,04 (м, 1H), 3,85-3,66 (м, 3H), 3,12-2,95 (м, 1H), 2,68-2,52 (м, 1H), 2,08-1,34 (м, 6H).
Пример 208. 6-((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбонил) пиколинонитрил,
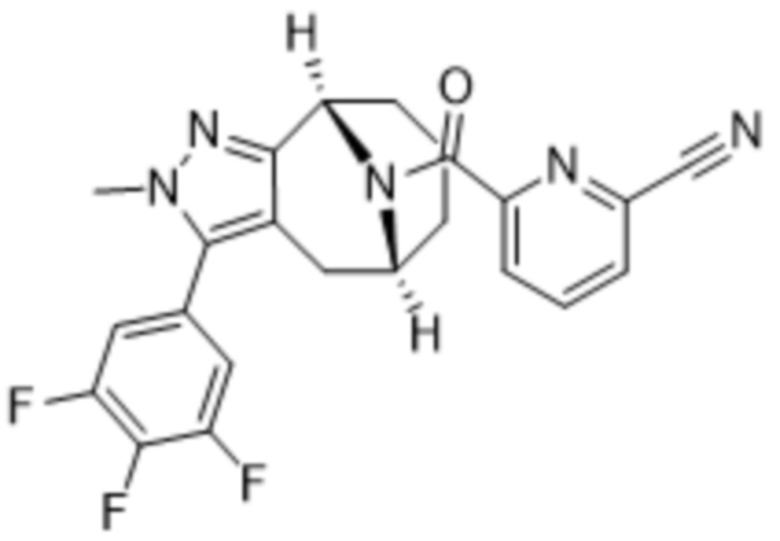
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-цианопиколиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H18F3N5O, - 437,1; полученное m/z, 438,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 9,13-8,86 (м, 1H), 8,54-8,23 (м, 1H), 7,86-7,70 (м, 1H), 7,69-7,50 (м, 2H), 5,89-5,50 (м, 1H), 4,15-3,96 (м, 1H), 3,89-3,69 (м, 3H), 3,13-2,91 (м, 1H), 2,48-2,37 (м, 1H), 1,95-1,42 (м, 6H).
Пример 209. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пиразин-2-ил)метанон.
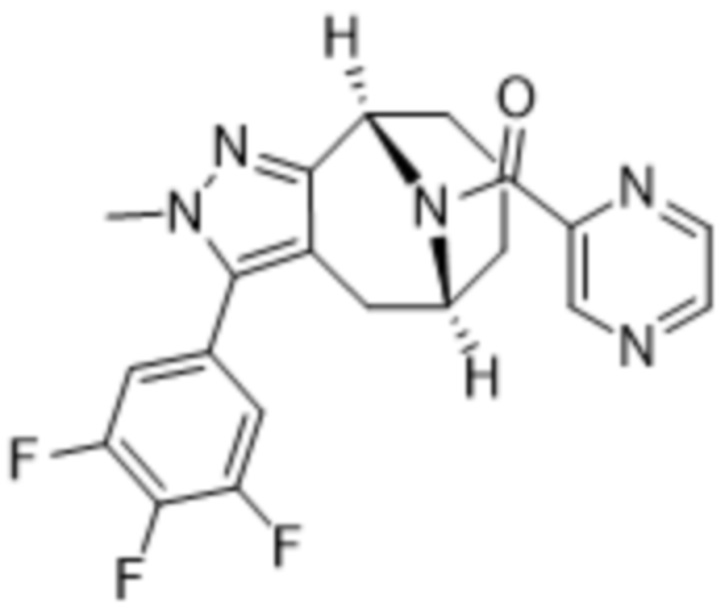
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и пиразин-2-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C21H18F3N5O, - 413,1; полученное m/z, 414,1 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,86 (д, J=1,5 Гц, 1H), 8,77 (дд, J=7,5, 2,6 Гц, 1H), 8,73-8,65 (м, 1H), 7,67-7,52 (м, 2H), 5,80-5,70 (м, 1H), 4,27-4,16 (м, 1H), 3,81 (с, 3H), 3,04 (дд, J=15,9, 7,3 Гц, 1H), 2,60-2,38 (м, 1H), 2,09-1,31 (м, 6H).
Пример 210. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пиримидин-4-ил)метанон.
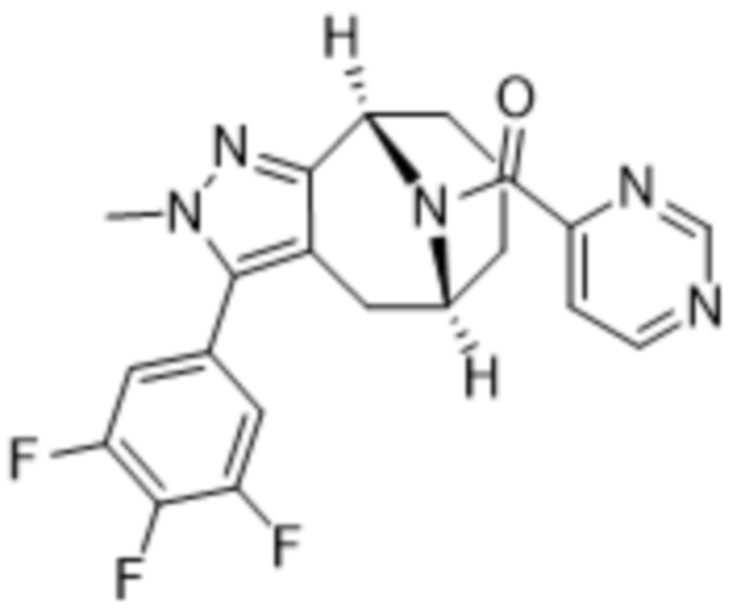
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и пиримидин-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C21H18F3N5O, - 413,1; полученное m/z, 414,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,24 (д, J=1,4 Гц, 1H), 8,97 (д, J=5,1 Гц, 1H), 7,69 (дд, J=5,1, 1,5 Гц, 1H), 7,62-7,55 (м, 2H), 5,74-5,69 (м, 1H), 4,11-4,05 (м, 1H), 3,80 (с, 3H), 2,99 (дд, J=16,1, 7,4 Гц, 1H), 2,56-2,38 (м, 1H), 1,91-1,42 (м, 6H).
Пример 211. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пиридазин-4-ил)метанон.
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и пиридазин-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C21H18F3N5O, - 413,1; полученное m/z, 414,1 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 9,41-9,31 (м, 1H), 9,34-9,31 (м, 1H), 7,77 (дд, J=5,2, 2,3 Гц, 1H), 7,66-7,53 (м, 2H), 5,77-5,67 (м, 1H), 3,97-3,88 (м, 1H), 3,81 (с, 3H), 3,10 (дд, J=16,4, 7,4 Гц, 1H), 2,42 (д, J=16,5 Гц, 1H), 2,07-1,31 (м, 6H).
Пример 212. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пиримидин-5-ил)метанон.
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и пиримидин-5-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C21H18F3N5O, 413,1; полученное m/z, 414,1 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 9,30 (с, 1H), 8,93 (с, 2H), 7,68-7,51 (м, 2H), 5,77-5,66 (м, 1H), 4,04 (д, J=6,5 Гц, 1H), 3,82 (с, 3H), 3,16 (дд, J=16,3, 7,3 Гц, 1H), 2,42 (д, J=16,5 Гц, 1H), 2,09-1,34 (м, 6H).
Пример 213. (5-(1H-Пиразол-1-ил)пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-(1H-пиразол-1-ил)никотиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21F3N6O, - 478,2; полученное m/z, 479,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 9,23 (д, J=2,8 Гц, 1H), 8,70 (д, J=2,5 Гц, 1H), 8,61-8,54 (м, 1H), 8,32-8,26 (м, 1H), 7,90-7,80 (м, 1H), 7,68-7,51 (м, 2H), 6,68-6,55 (м, 1H), 5,81-5,68 (м, 1H), 4,14-4,03 (м, 1H), 3,82 (с, 3H), 3,17-3,00 (м, 1H), 2,49-2,37 (м, 1H), 2,07-1,38 (м, 6H).
Пример 214. (6-(1H-Пиразол-1-ил)пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-(1H-пиразол-1-ил)никотиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21F3N6O, - 478,2; полученное m/z, 479,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,79-8,32 (м, 2H), 8,19-7,83 (м, 4H), 7,78-7,28 (м, 2H), 6,67-6,49 (м, 1H), 4,25-4,11 (м, 1H), 3,83-3,73 (м, 3H), 3,19-3,03 (м, 1H), 2,44 (д, J=16,3 Гц, 1H), 2,11-1,28 (м, 6H).
Пример 215. (6-(1H-Пиррол-1-ил) пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
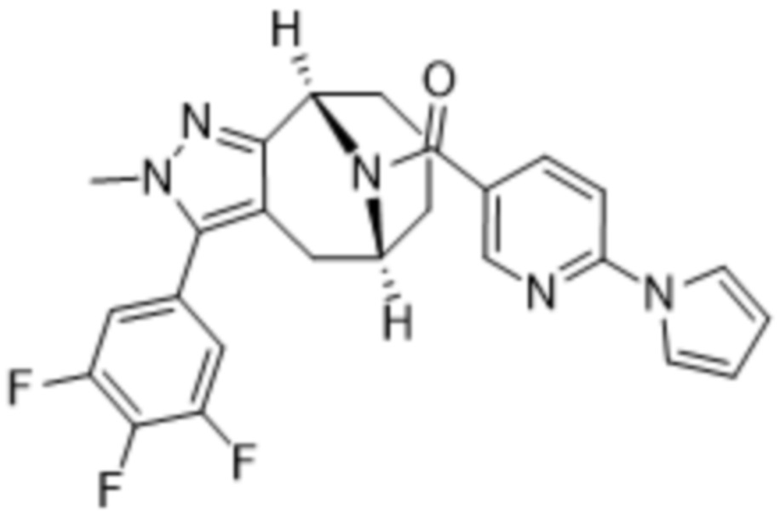
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-(1H-пиррол-1-ил)никотиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H22F3N5O, - 477,1; полученное m/z, 478,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,71-8,42 (м, 2H), 8,24-7,76 (м, 3H), 7,72-7,42 (м, 2H), 7,16 (д, J=1,3 Гц, 1H), 5,80-5,61 (м, 1H), 4,19-4,01 (м, 1H), 3,86-3,71 (м, 4H), 3,20-3,04 (м, 1H), 2,42 (д, J=16,2 Гц, 1H), 2,06-1,36 (м, 6H).
Пример 216. (6-(1H-Имидазол-1-ил) пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
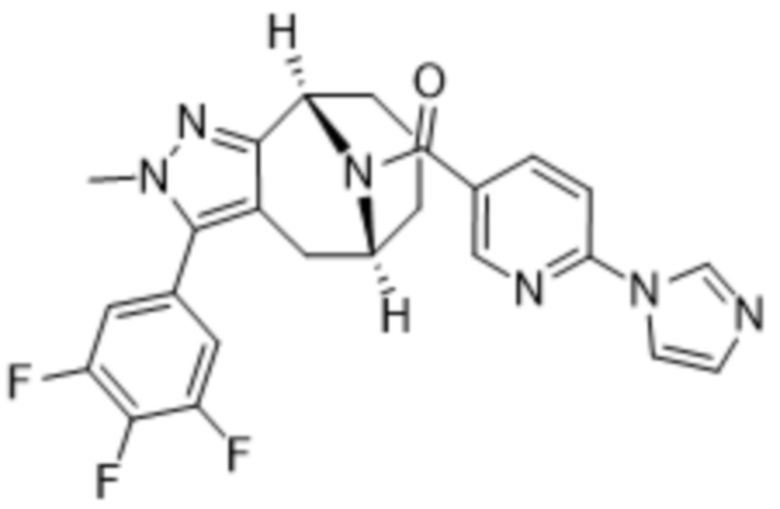
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-(1H-имидазол-1-ил)никотиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21F3N6O, - 478,1; полученное m/z, 479,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,63-8,46 (м, 2H), 8,12-7,87 (м, 3H), 7,61 (дт, J=10,4, 9,6, 6,5 Гц, 2H), 7,16 (д, J=1,2 Гц, 1H), 5,85-5,63 (м, 1H), 4,17-3,99 (м, 1H), 3,88-3,53 (м, 3H), 3,17-3,06 (м, 1H), 2,43 (д, J=16,2 Гц, 1H), 2,07-1,37 (м, 6H).
Пример 217. (6-Метил-3-(2H-1,2,3-триазол-2-ил)пиридин-2-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
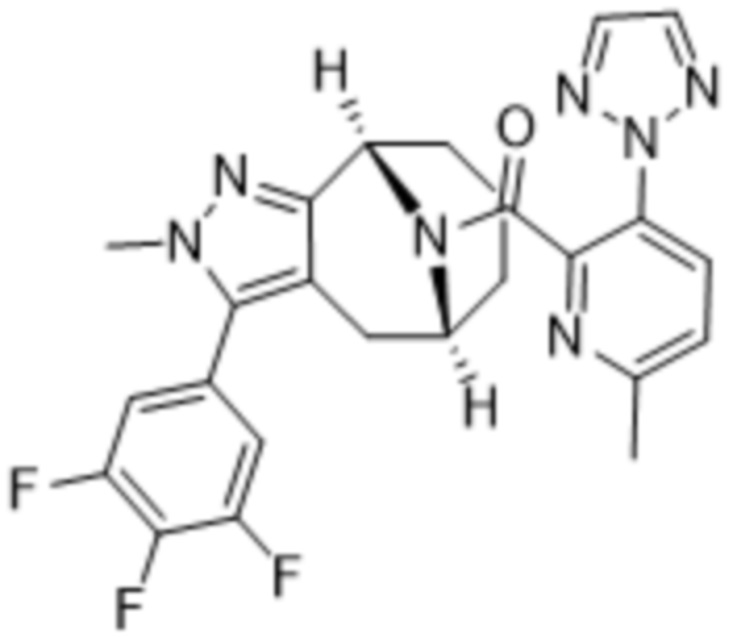
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-метил-3-(2H-1,2,3-триазол-2-ил)пиколиновую кислоту [WO2016040789] вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N7O, - 493,1; полученное m/z, 494,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,23 (дд, J=9,3, 8,4 Гц, 1H), 8,12-7,93 (м, 2H), 7,65-7,47 (м, 3H), 5,75-5,58 (м, 1H), 3,89-3,84 (м, 1H), 3,82-3,69 (м, 3H), 3,11-2,75 (м, 1H), 2,57-2,53 (м, 3H), 2,47-2,42 (м, 1H), 2,02-1,34 (м, 6H).
Пример 218. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-(пирролидин-1-ил)пиридин-3-ил)метанон.
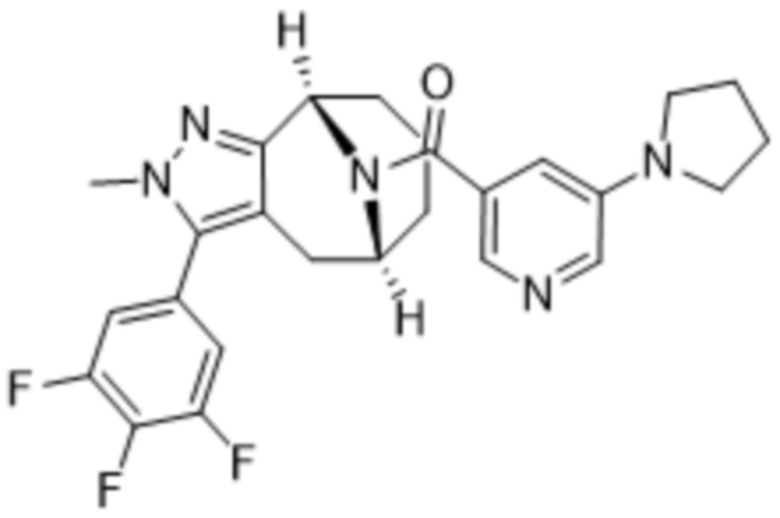
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-(пирролидин-1-ил)никотиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H26F3N5O, - 481,2; полученное m/z, 482,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 8,01 (дд, J=11,6, 2,8 Гц, 1H), 7,89-7,71 (м, 1H), 7,68-7,52 (м, 2H), 6,89-6,74 (м, 1H), 5,73-5,60 (м, 1H), 4,10-4,00 (м, 1H), 3,85-3,69 (м, 3H), 3,31-3,22 (м, 4H), 3,11-2,94 (м, 1H), 2,46-2,34 (м, 1H), 1,99-1,90 (м, 4H), 1,92-1,35 (м, 6H).
Пример 219. 1-(5-((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбонил) пиридин-3-ил) пирролидин-2-он,
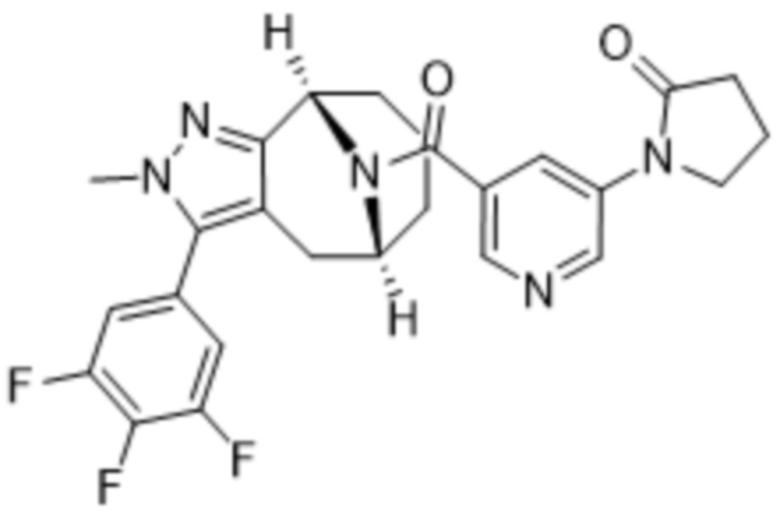
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-(2-оксопирролидин-1-ил)никотиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H24F3N5O2, - 495,1; полученное m/z, 496,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,95 -8,80 (м, 1H), 8,44 -8,15 (м, 2H), 7,64 -7,44 (м, 2H), 5,72 (с, 1H), 4,05 (с, 1H), 3,91 (т, J=7,0 Гц, 2H), 3,85-3,72 (м, 3H), 3,27-3,00 (м, 2H), 2,57 (д, J=20,3 Гц, 1H), 2,49 -2,40 (м, 1H), 2,16 -2,03 (м, 2H), 1,99 -1,35 (м, 6H).
Пример 220. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-морфолинопиридин-3-ил)метанон.
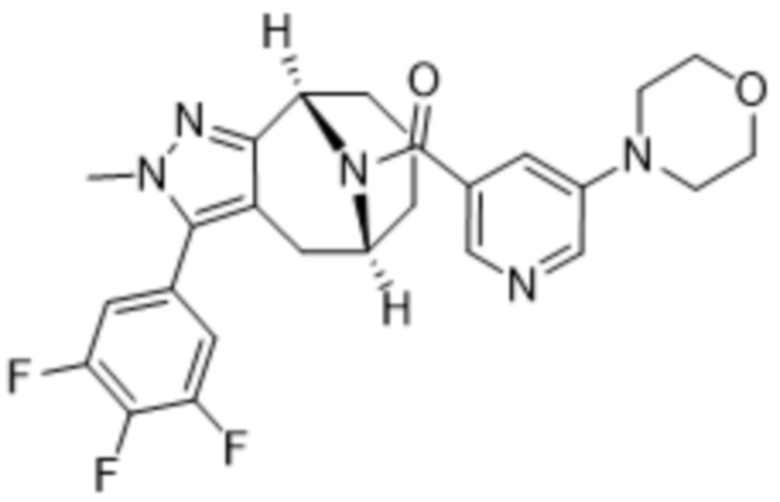
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-морфолиноникотиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H26F3N5O2, - 497,2; полученное m/z, 498,2 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,46-8,34 (м, 1H), 8,07-7,90 (м, 1H), 7,69-7,55 (м, 2H), 7,41-7,16 (м, 1H), 5,76-5,61 (м, 1H), 4,12-3,96 (м, 1H), 3,83-3,71 (м, 6H), 3,27-3,15 (м, 5H), 3,14-2,89 (м, 1H), 2,47-2,32 (м, 1H), 2,02 -1,38 (м, 6H).
Пример 221. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилиндолизин-6-ил)метанон.
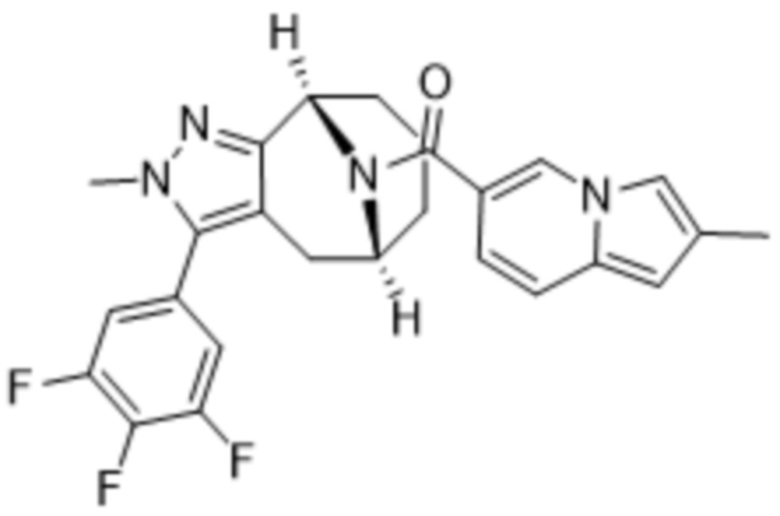
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-метилиндолизин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H23F3N4O, - 464,1; полученное m/z, 465,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,45-8,12 (м, 1H), 7,67-7,27 (м, 4H), 6,65 (с, 1H), 6,29 (с, 1H), 5,73-5,53 (м, 1H), 4,43-4,13 (м, 1H), 3,87-3,70 (м, 3H), 3,15-2,98 (м, 1H), 2,26 (с, 3H), 2,64-2,53 (м, 1H), 2,11-1,36 (м, 6H).
Пример 222. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (2-метилбензо[d]оксазол-6-ил) метанон.
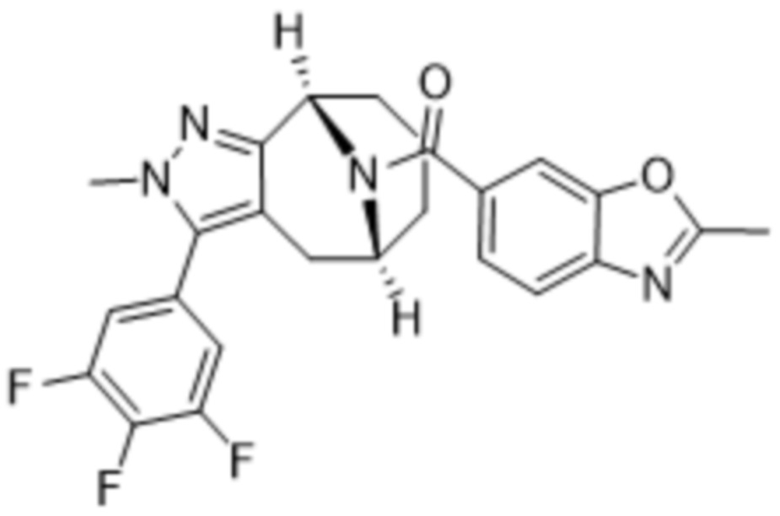
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-метилбензо[d]оксазол-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21F3N4O2, - 466,1; полученное m/z, 467,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,79-7,68 (м, 2H), 7,61 (т, J=7,8 Гц, 2H), 7,47-7,29 (м, 1H), 5,78-5,57 (м, 1H), 4,19-4,00 (м, 1H), 3,84-3,70 (м, 3H), 3,14-2,99 (м, 1H), 2,64 (д, J=3,0 Гц, 3H), 2,39 (д, J=16,2 Гц, 1H), 2,02-1,36 (м, 6H).
Пример 223. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пиразолo[1,5-a]пиридин-3-ил)метанон.
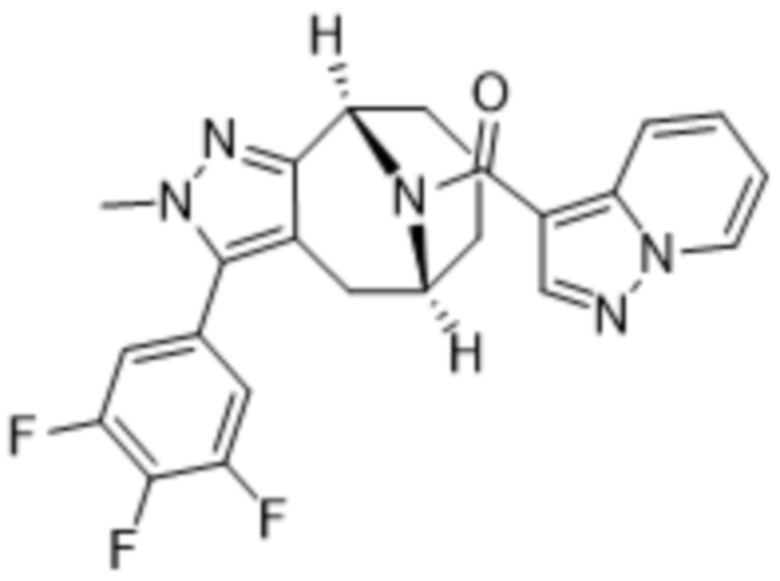
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и пиразоло[1,5-a]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H20F3N5O, - 451,1; полученное m/z, 452,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,90-8,71 (м, 1H), 8,29 (с, 1H), 7,88 (с, 1H), 7,61 (т, J=7,5 Гц, 2H), 7,50-7,39 (м, 1H), 7,12-6,92 (м, 1H), 5,75-5,33 (м, 1H), 5,04-4,62 (м, 1H), 3,89-3,68 (м, 3H), 3,25-3,01 (м, 1H), 2,67-2,52 (м, 1H), 2,07 -1,39 (м, 6H).
Пример 224. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метилпиразолo[1,5-a]пиридин-3-ил)метанон.
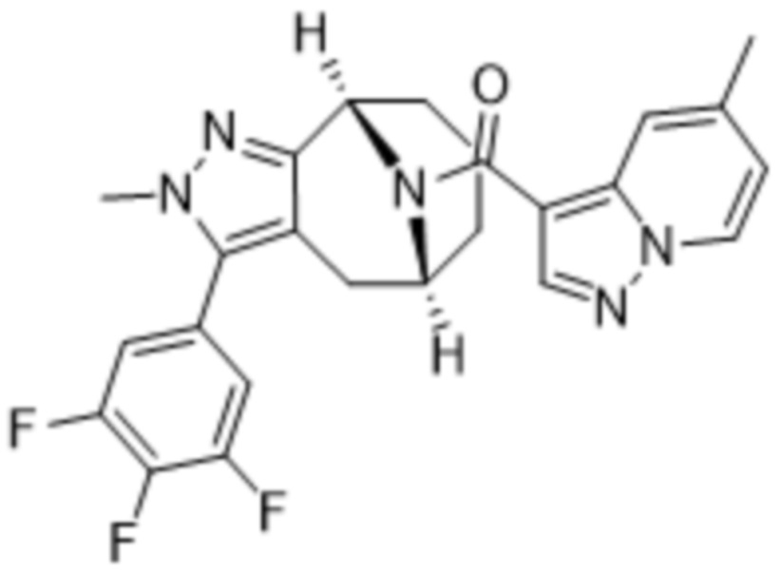
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-метилпиразоло[1,5-a]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N5O, - 465,1; полученное m/z, 466,0 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 8,66 (д, J=7,0 Гц, 1H), 8,21 (с, 1H), 7,72-7,54 (м, 3H), 6,89 (дд, J=7,1, 1,9 Гц, 1H), 5,75-5,30 (м, 1H), 5,06-4,62 (м, 1H), 3,89-3,69 (м, 3H), 3,25-3,10 (м, 1H), 2,59-2,52 (м, 1H), 2,45-2,31 (м, 3H), 2,01-1,38 (м, 6H).
Пример 225. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пиразолo[1,5-a]пиридин-5-ил)метанон.
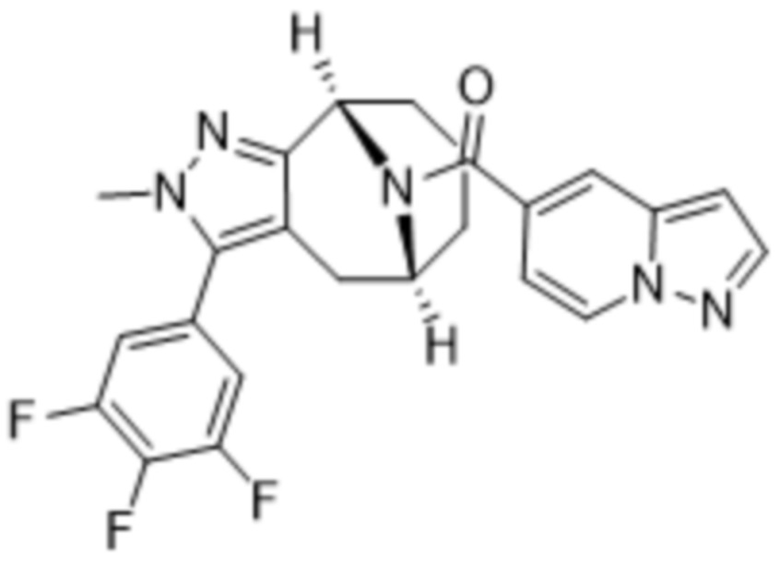
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и пиразоло[1,5-a]пиридин-5-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H20F3N5O, - 451,2; полученное m/z, 452,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,74 (дд, J=14,5, 7,2 Гц, 1H), 8,12-7,99 (м, 1H), 7,78 (д, J=16,6 Гц, 1H), 7,67-7,56 (м, 2H), 6,94-6,62 (м, 2H), 5,76-5,55 (м, 1H), 4,25-4,08 (м, 1H), 3,85-3,71 (м, 3H), 3,13-3,01 (м, 1H), 2,49-2,40 (м, 1H), 2,03-1,38 (м, 6H).
Пример 226. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пиразолo[1,5-a]пиридин-6-ил)метанон.
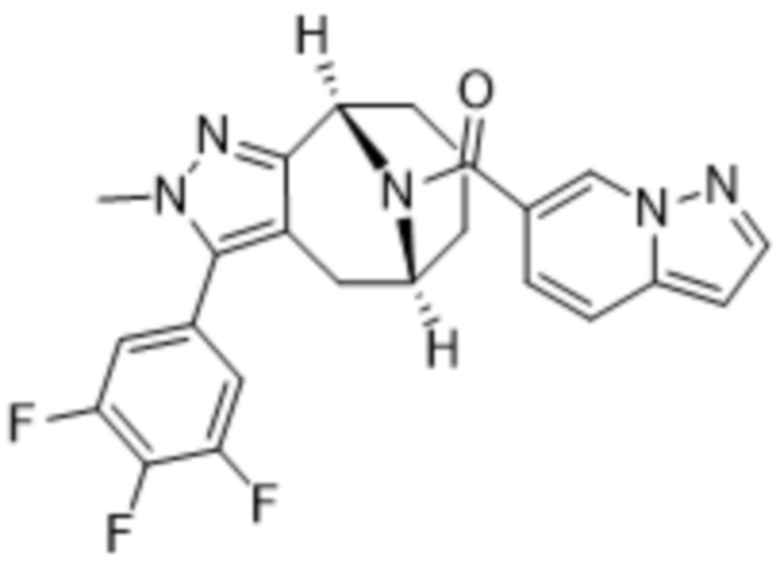
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и пиразоло[1,5-a]пиридин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H20F3N5O, - 451,2; полученное m/z, 452,0 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,20-7,90 (м, 1H), 7,85-7,72 (м, 1H), 7,65-7,44 (м, 2H), 7,37-6,64 (м, 3H), 5,85-5,75 (м, 1H), 3,86-3,55 (м, 4H), 3,16 -2,74 (м, 1H), 2,47-2,29 (м, 1H), 2,03-1,27 (м, 6H).
Пример 227. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пиразолo[1,5-a]пиридин-2-ил)метанон.
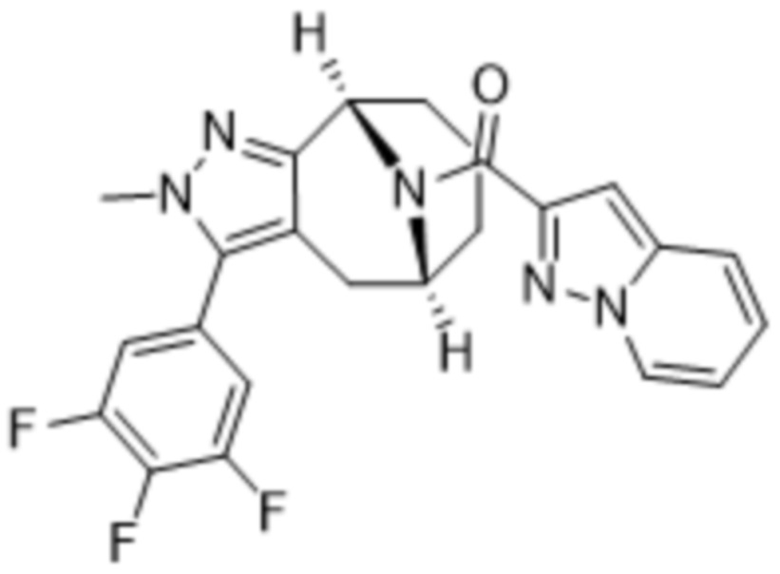
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и пиразоло[1,5-a]пиридин-2-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H20F3N5O, - 451,2; полученное m/z, 452,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 8,79-8,62 (м, 1H), 7,81-7,64 (м, 1H), 7,58 (дд, J=8,7, 6,6 Гц, 2H), 7,34-7,24 (м, 1H), 7,04-6,93 (м, 1H), 6,86 (дд, J=5,2, 0,9 Гц, 1H), 5,84-5,66 (м, 1H), 5,12-4,86 (м, 1H), 3,83-3,68 (м, 3H), 3,13-3,01 (м, 1H), 2,64-2,53 (м, 1H), 1,99-1,42 (м, 6H).
Пример 228. Имидазо[1,2-a]пиридин-5-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
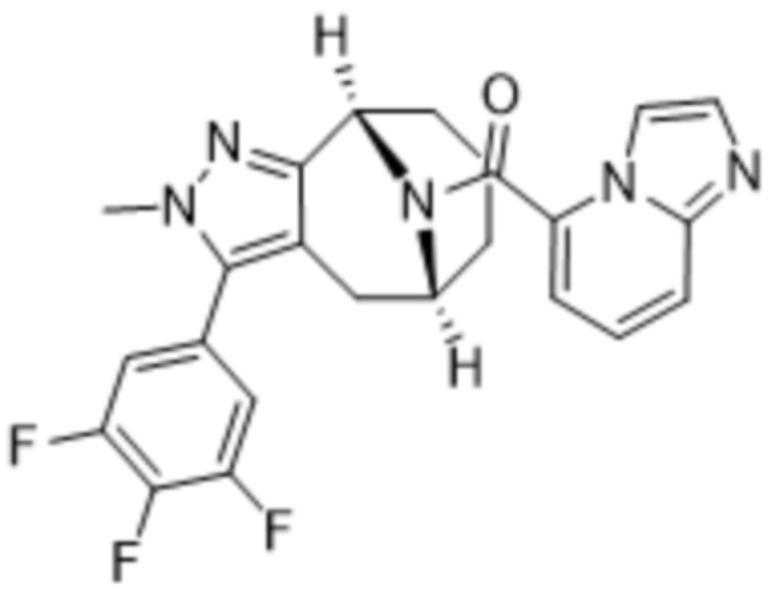
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и имидазо[1,2-a]пиридин-5-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H20F3N5O, - 451,2; полученное m/z, 452,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,93-7,45 (м, 5H), 7,39-7,16 (м, 1H), 7,09-6,88 (м, 1H), 5,87-5,64 (м, 1H), 4,12-3,98 (м, 1H), 3,86-3,68 (м, 3H), 3,17-2,98 (м, 1H), 2,47-2,37 (м, 1H), 2,13-1,34 (м, 6H).
Пример 229. Имидазо[1,5-a]пиридин-5-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
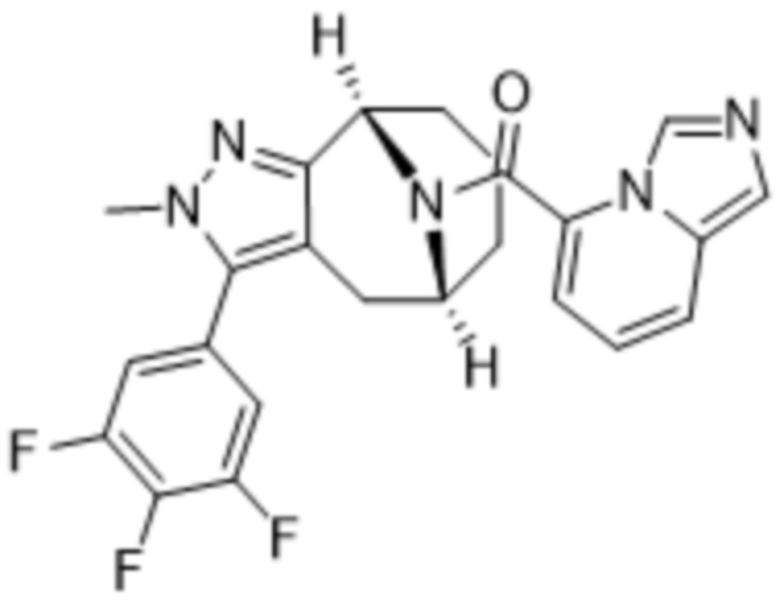
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и имидазо[1,5-a]пиридин-5-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H20F3N5O, - 451,2; полученное m/z, 452,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,35-8,05 (м, 1H), 7,74-7,43 (м, 4H), 6,91-6,62 (м, 2H), 5,88-5,63 (м, 1H), 4,30-4,06 (м, 1H), 3,87-3,65 (м, 3H), 3,18-2,98 (м, 1H), 2,76-2,52 (м, 1H), 2,15-1,34 (м, 6H).
Пример 230: Имидазо[1,5-a]пиридин-6-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
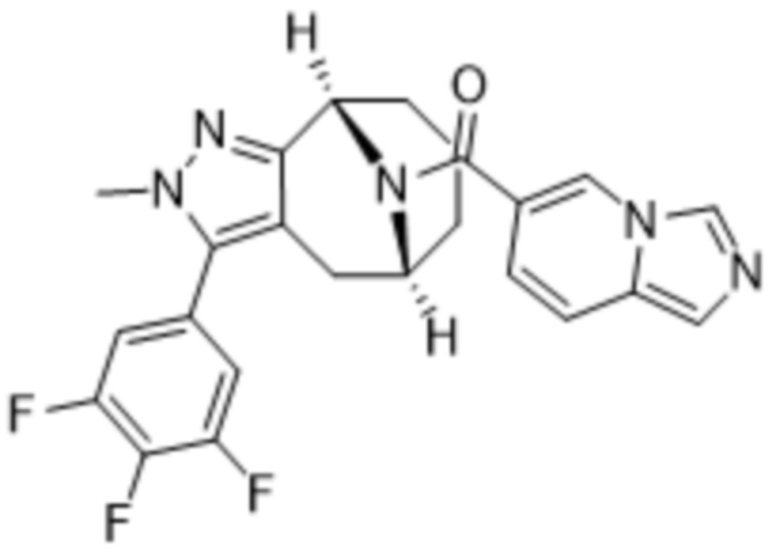
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и имидазо[1,5-a]пиридин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H20F3N5O, - 451,2; полученное m/z, 452,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,59-8,48 (м, 1H), 8,46-8,36 (м, 1H), 7,67-7,52 (м, 3H), 7,45 -7,36 (м, 1H), 6,83-6,74 (м, 1H), 5,70-5,57 (м, 1H), 4,34-4,20 (м, 1H), 3,80 (с, 3H), 3,12-3,02 (м, 1H), 2,60-2,40 (м, 1H), 1,92-1,32 (м, 6H).
Пример 231. Имидазо[1,2-a]пиридин-6-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
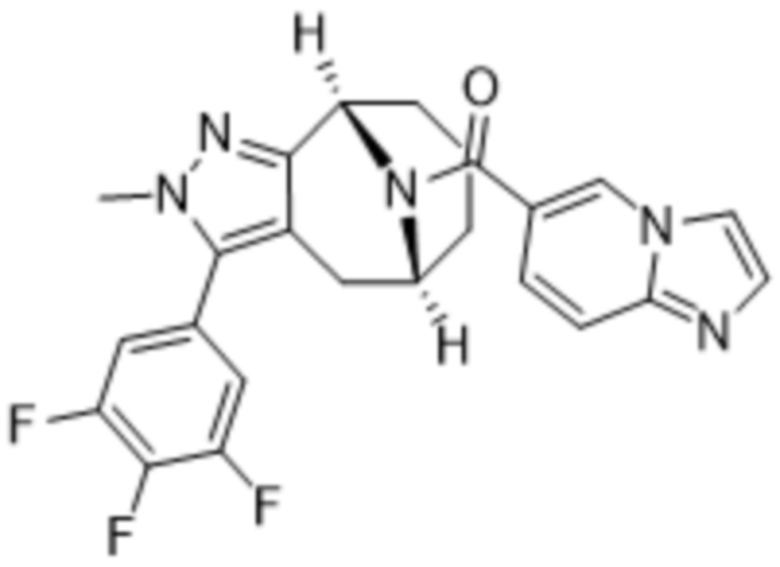
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и имидазо[1,2-a]пиридин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H20F3N5O, - 451,2; полученное m/z, 452,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,85-8,71 (м, 1H), 8,06-7,90 (м, 1H), 7,72-7,53 (м, 4H), 7,35-7,12 (м, 1H), 5,74-5,57 (м, 1H), 4,38-4,17 (м, 1H), 3,82 (с, 3H), 3,10 (дд, J=16,3, 7,4 Гц, 1H), 2,65-2,36 (м, 1H), 2,13-1,32 (м, 6H).
Пример 232: ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(7-метилимидазо[1,2-a]пиридин-3-ил)метанон.
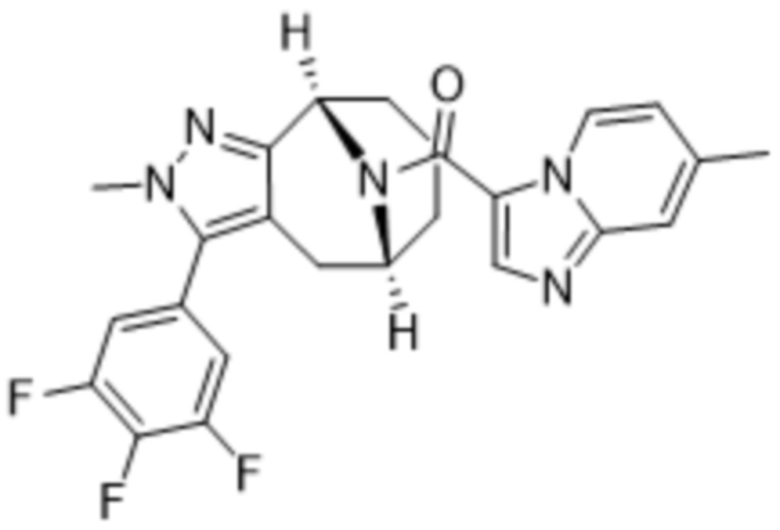
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 7-метилимидазо[1,2-a]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N5O, - 465,1; полученное m/z, 466,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,79 (дд, J=7,0, 0,9 Гц, 1H), 7,97 (с, 1H), 7,62 (дд, J=8,8, 6,7 Гц, 2H), 7,50-7,42 (м, 1H), 6,93 (дд, J=7,2, 1,7 Гц, 1H), 5,66 (с, 1H), 4,92 (с, 1H), 3,80 (с, 3H), 3,17 (с, 1H), 2,60-2,53 (м, 1H), 2,44-2,31 (м, 3H), 2,03-1,42 (м, 6H).
Пример 233. (1-Метил-1H-пирроло[2,3-b]пиридин-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
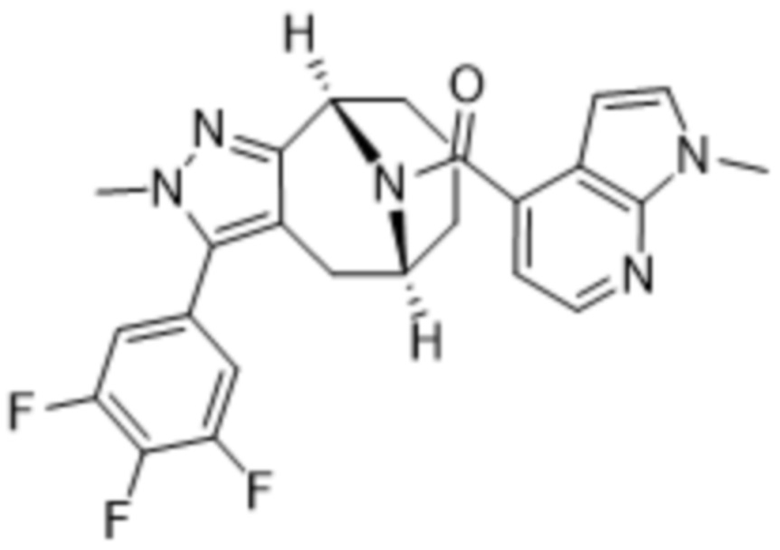
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-метил-1H-пирроло[2,3-b]пиридин-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N5O, - 465,1; полученное m/z, 466,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 8,33 (дд, J=13,1, 4,7 Гц, 1H), 7,68-7,49 (м, 3H), 7,09-6,92 (м, 1H), 6,47-6,29 (м, 1H), 5,88-5,77 (м, 1H), 4,61-4,49 (м, 1H), 3,88-3,76 (м, 6H), 3,22-2,80 (м, 1H), 2,37 (д, J=16,1 Гц, 1H), 2,03-1,34 (м, 6H).
Пример 234: (1-Метил-1H-пирроло[2,3-b]пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
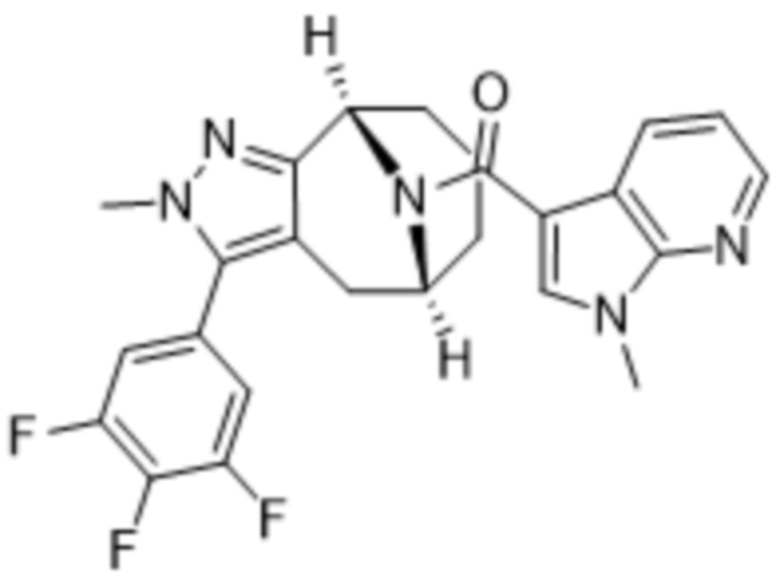
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-метил-1H-пирроло[2,3-b]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N5O, - 465,1; полученное m/z, 466,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 8,34 (дд, J=4,6, 1,6 Гц, 1H), 7,95 (с, 2H), 7,61 (т, J=7,6 Гц, 2H), 7,20 (дд, J=7,9, 4,6 Гц, 1H), 5,79-5,43 (м, 1H), 4,95-4,64 (м, 1H), 3,90-3,71 (м, 6H), 3,21-3,06 (м, 1H), 2,58-2,51 (м, 1H), 2,03-1,37 (м, 6H).
Пример 235. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пирроло[1,2-b]пиридазин-5-ил)метанон.
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и (пирроло[1,2-b]пиридазин-5-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H20F3N5O, - 451,2; полученное m/z, 452,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,39-8,26 (м, 1H), 8,15 (д, J=9,2 Гц, 1H), 7,89 (д, J=2,9 Гц, 1H), 7,68-7,49 (м, 2H), 7,08 (с, 1H), 6,97-6,81 (м, 1H), 5,71-5,34 (м, 1H), 4,91-4,62 (м, 1H), 3,84-3,68 (м, 3H), 3,26-3,03 (м, 1H), 2,67 (с, 1H), 2,07-1,39 (м, 6H).
Пример 236: ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пирроло[1,2-a]пиразин-8-ил)метанон.
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и пирроло[1,2-a]пиразин-8-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H20F3N5O, 466,1; полученное m/z, 467,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,01 (с, 1H), 8,37 (дд, J=4,8, 1,5 Гц, 1H), 7,79 (д, J=2,7 Гц, 1H), 7,71-7,57 (м, 3H), 7,11 (с, 1H), 5,79-5,22 (м, 1H), 5,09-4,42 (м, 1H), 3,79 (с, 3H), 3,25-3,09 (м, 1H), 2,64-2,51 (м, 1H), 2,06-1,35 (м, 6H).
Пример 237. (4-Метокси-1-метил-1H-индазол-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 4-метокси-1-метил-1H-индазол-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H24F3N5O2, 495,2; полученное m/z, 496,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,67-7,51 (м, 2H), 7,42-7,29 (м, 1H), 7,20 (дд, J=11,3, 8,4 Гц, 1H), 6,57 (дд, J=12,5, 7,7 Гц, 1H), 5,87-5,68 (м, 1H), 4,61-4,42 (м, 1H), 4,06-3,93 (м, 3H), 3,83-3,59 (м, 6H), 3,13-2,68 (м, 1H), 2,47-2,37 (м, 1H), 1,99-1,28 (м, 6H).
Пример 238: (1-Метил-1H-пиразолo[3,4-b]пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-метил-1H-пиразоло[3,4-b]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H21F3N6O, 466,1; полученное m/z, 467,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,74-8,61 (м, 1H), 8,49-8,33 (м, 1H), 7,66-7,52 (м, 2H), 7,35 (дд, J=8,1, 4,5 Гц, 1H), 6,41-5,78 (м, 1H), 5,54-5,08 (м, 1H), 4,14 (д, J=17,8 Гц, 3H), 3,78 (д, J=20,9 Гц, 3H), 3,21-3,04 (м, 1H), 2,64-2,55 (м, 1H), 2,03-1,45 (м, 6H).
Пример 239. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пиразолo[1,5-b]пиридазин-3-ил)метанон.
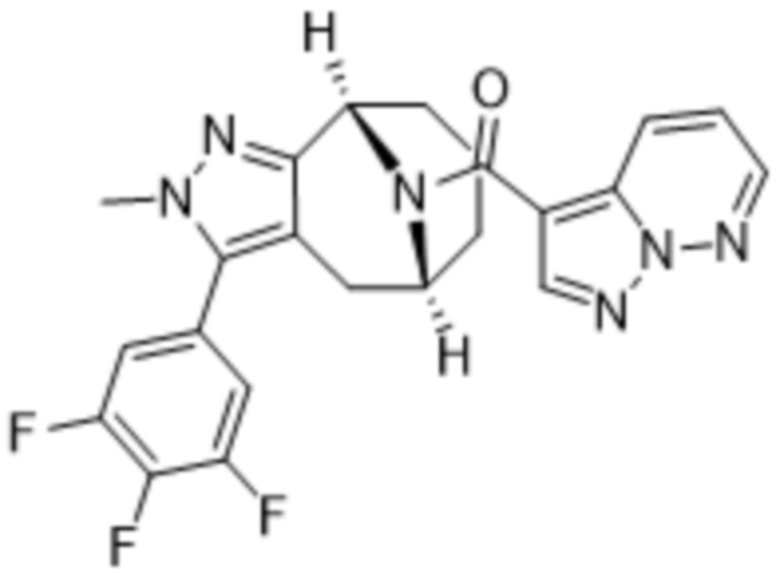
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и пиразоло[1,5-b]пиридазин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H19F3N6O, 452,1; полученное m/z, 453,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 8,67-8,26 (м, 3H), 7,63 (с, 2H), 7,39 (дд, J=9,1, 4,4 Гц, 1H), 5,78-5,29 (м, 1H), 5,04-4,55 (м, 1H), 3,90-3,62 (м, 3H), 3,30-3,03 (м, 1H), 2,66-2,52 (м, 1H), 2,14-1,37 (м, 6H).
Пример 240: ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (пиразолo[1,5-a]пиримидин-2-ил)метанон.
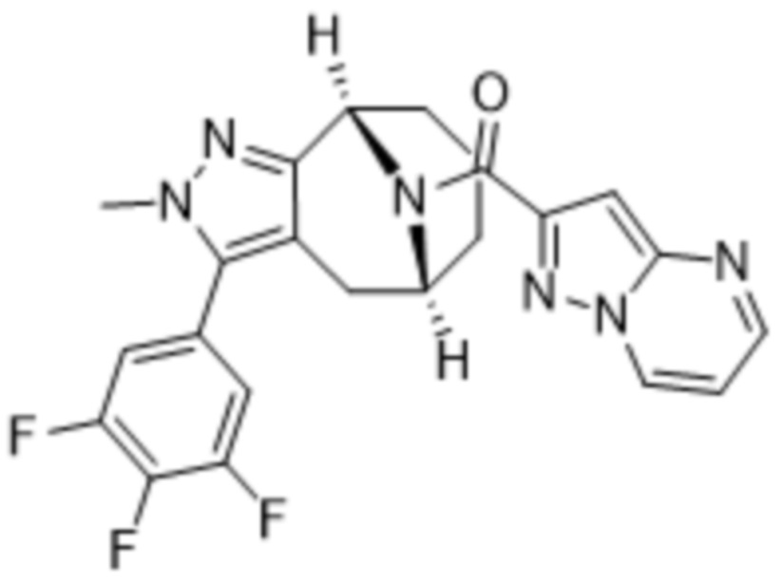
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и пиразоло[1,5-a]пиримидин-2-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H19F3N6O, 452,1; полученное m/z, 453,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,25-9,07 (м, 1H), 8,70-8,53 (м, 1H), 7,67-7,54 (м, 2H), 7,20-7,10 (м, 1H), 7,02-6,85 (м, 1H), 5,83-5,58 (м, 1H), 5,12-4,66 (м, 1H), 3,85-3,70 (м, 3H), 3,14-3,02 (м, 1H), 2,60 (д, J=16,3 Гц, 1H), 2,03-1,31 (м, 6H).
Пример 241. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пиразолo[1,5-a]пиримидин-3-ил)метанон.
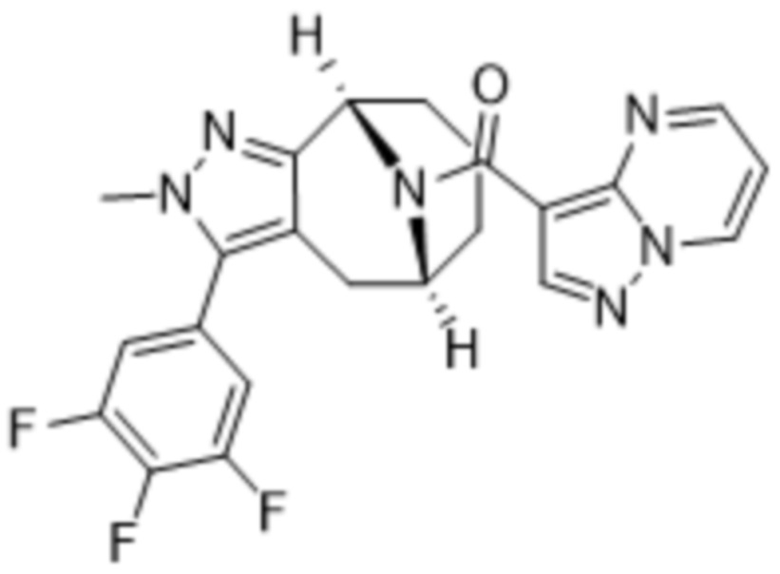
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и пиразоло[1,5-a]пиримидин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H19F3N6O, - 452,1; полученное m/z, 453,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 9,30-9,03 (м, 1H), 8,82-8,62 (м, 1H), 8,41 (д, J=16,9 Гц, 1H), 7,57 (дд, J=8,6, 6,6 Гц, 2H), 7,27-6,96 (м, 1H), 5,82-5,57 (м, 1H), 4,52-4,00 (м, 1H), 3,88-3,64 (м, 3H), 3,16-3,02 (м, 1H), 2,42-2,25 (м, 1H), 1,97-1,41 (м, 6H).
Пример 242: ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(6-метилпиразолo[1,5-a]пиримидин-3-ил)метанон.
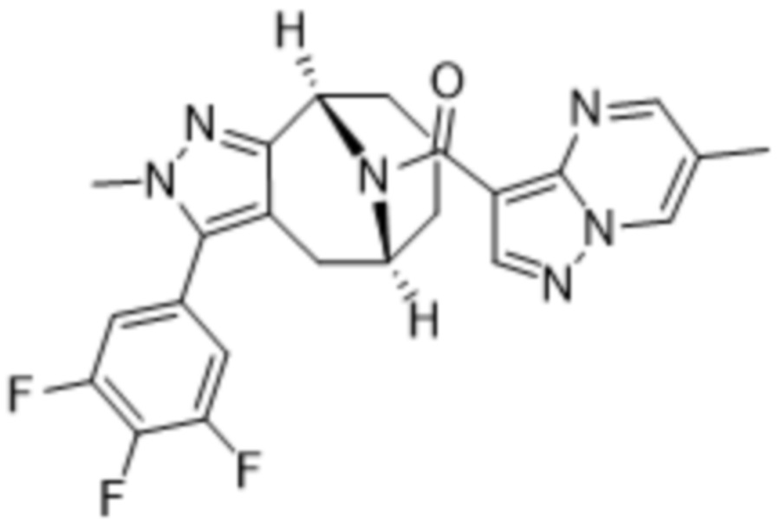
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H21F3N6O, 466,1; полученное m/z, 467,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 9,06 (д, J=20,2 Гц, 1H), 8,69 -8,56 (м, 1H), 8,32 (д, J=17,3 Гц, 1H), 7,57 (дд, J=8,7, 6,6 Гц, 2H), 5,78 -5,61 (м, 1H), 4,53 -4,29 (м, 1H), 3,86 -3,63 (м, 3H), 3,20 -3,03 (м, 1H), 2,47 -2,40 (м, 1H), 2,38 -2,27 (м, 3H), 1,93 -1,39 (м, 6H).
Пример 243. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пиразолo[1,5-a]пиримидин-5-ил)метанон.
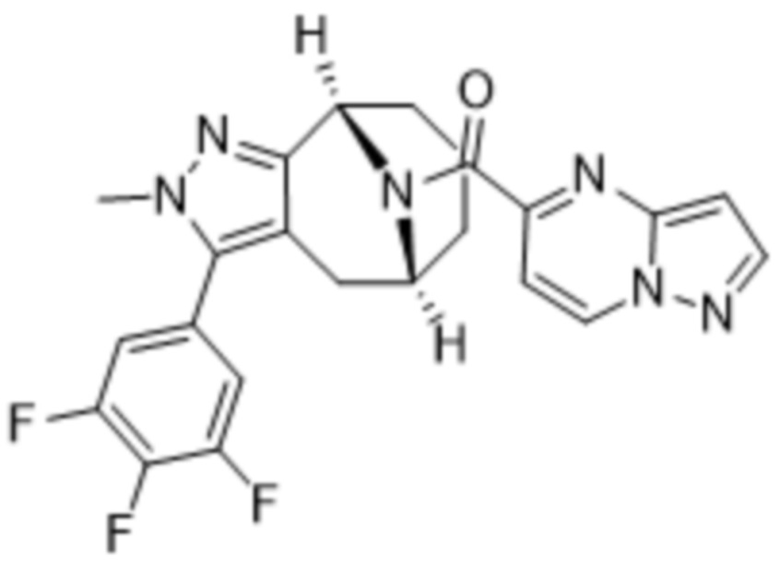
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и пиразоло[1,5-a]пиримидин-5-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H19F3N6O, 452,1; полученное m/z, 453,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 9,32-9,09 (м, 1H), 8,32 (дд, J=19,6, 2,3 Гц, 1H), 7,66-7,44 (м, 2H), 7,15 (дд, J=13,8, 7,1 Гц, 1H), 6,89-6,73 (м, 1H), 5,98-5,60 (м, 1H), 4,44-3,96 (м, 1H), 3,87-3,71 (м, 3H), 3,16-2,98 (м, 1H), 2,66-2,52 (м, 1H), 2,04-1,43 (м, 6H).
Пример 244: ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пиразолo[1,5-a]пиразин-3-ил)метанон.
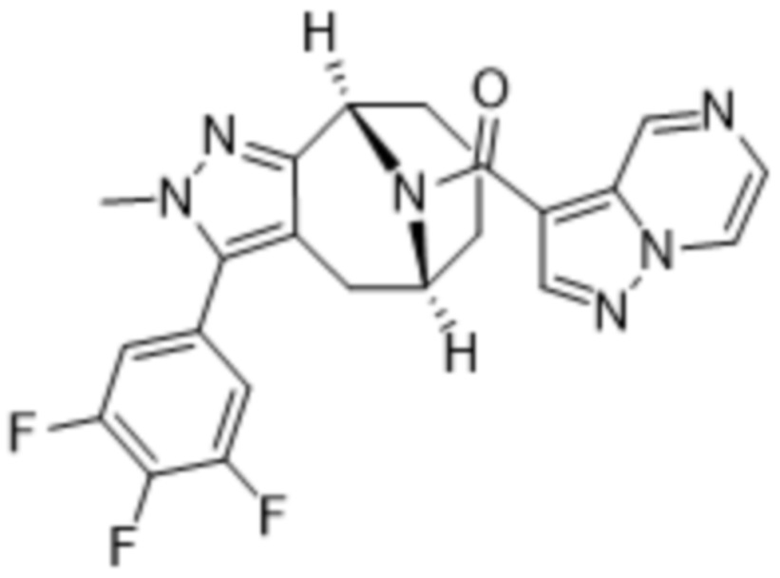
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и пиразоло[1,5-a]пиразин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H19F3N6O, 452,1; полученное m/z, 453,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,40-9,17 (м, 1H), 8,90 (дд, J=4,8, 1,5 Гц, 1H), 8,47 (с, 1H), 8,14-8,00 (м, 1H), 7,62 (с, 2H), 5,79-5,29 (м, 1H), 5,12-4,59 (м, 1H), 3,92-3,71 (м, 3H), 3,21-2,94 (м, 1H), 2,70-2,51 (м, 1H), 2,04-1,39 (м, 6H).
Пример 245. Имидазо[1,2-b]пиридазин-6-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
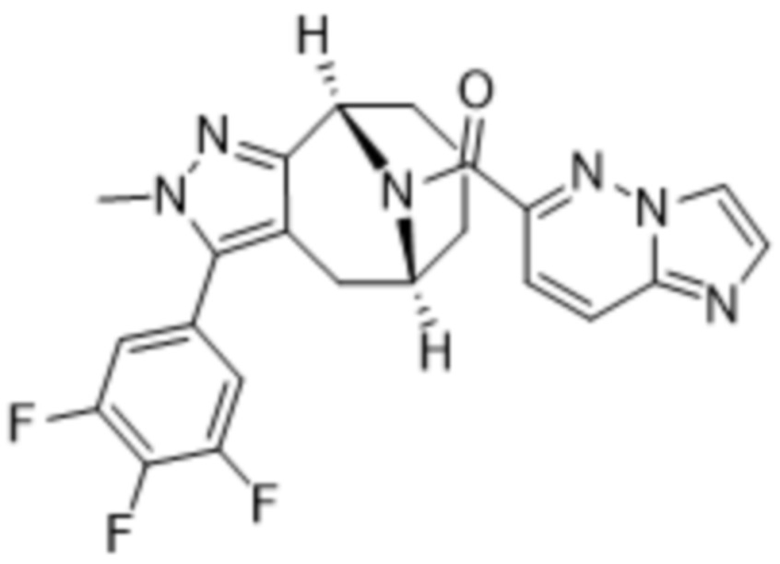
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и имидазо[1,2-b]пиридазин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H19F3N6O, 452,1; полученное m/z, 453,0 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,44-8,33 (м, 1H), 8,30-8,18 (м, 1H), 7,90 (дд, J=12,9, 1,3 Гц, 1H), 7,68-7,55 (м, 2H), 7,34 (дд, J=15,1, 9,4 Гц, 1H), 5,82-5,63 (м, 1H), 4,43-4,20 (м, 1H), 3,86-3,70 (м, 3H), 3,14-3,02 (м, 1H), 2,77-2,54 (м, 1H), 2,04-1,42 (м, 6H).
Пример 246: Имидазо[1,2-b]пиридазин-3-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
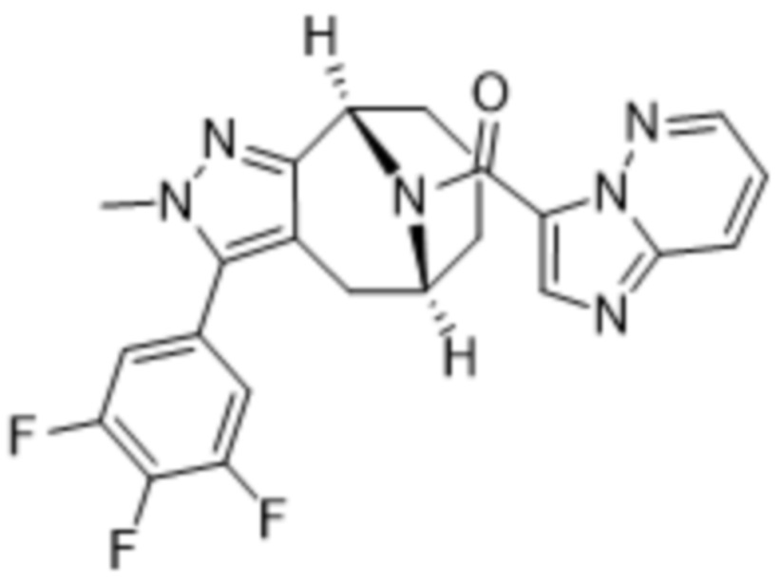
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и имидазо[1,2-b]пиридазин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H19F3N6O, 452,1; полученное m/z, 453,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 8,62 (дд, J=4,4, 1,6 Гц, 1H), 8,22 (д, J=9,4 Гц, 1H), 8,00 (д, J=36,2 Гц, 1H), 7,64-7,51 (м, 2H), 7,41-7,22 (м, 1H), 5,90-5,62 (м, 1H), 4,24-4,02 (м, 1H), 3,89-3,58 (м, 3H), 3,16-3,03 (м, 1H), 2,49-2,37 (м, 1H), 1,96-1,37 (м, 6H).
Пример 247. [1,2,4]Триазолo[1,5-a]пиридин-7-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
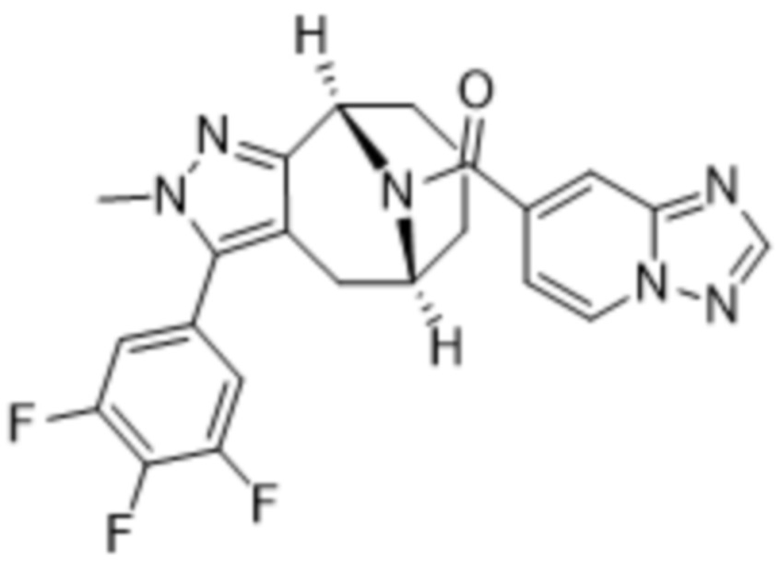
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и [1,2,4]триазолo[1,5-a]пиридин-7-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H19F3N6O, 452,2; полученное m/z, 453,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,05-8,99 (м, 1H), 8,59-8,56 (м, 1H), 7,94-7,88 (м, 1H), 7,65-7,55 (м, 2H), 7,28-7,17 (м, 1H), 5,74-5,66 (м, 1H), 4,11-4,03 (м, 1H), 3,80 (с, 3H), 3,14-3,02 (м, 1H), 2,39 (д, J=16,3 Гц, 1H), 2,04-1,32 (м, 6H).
Пример 248: ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метил-5H-пирроло[2,3-b]пиразин-7-ил)метанон.
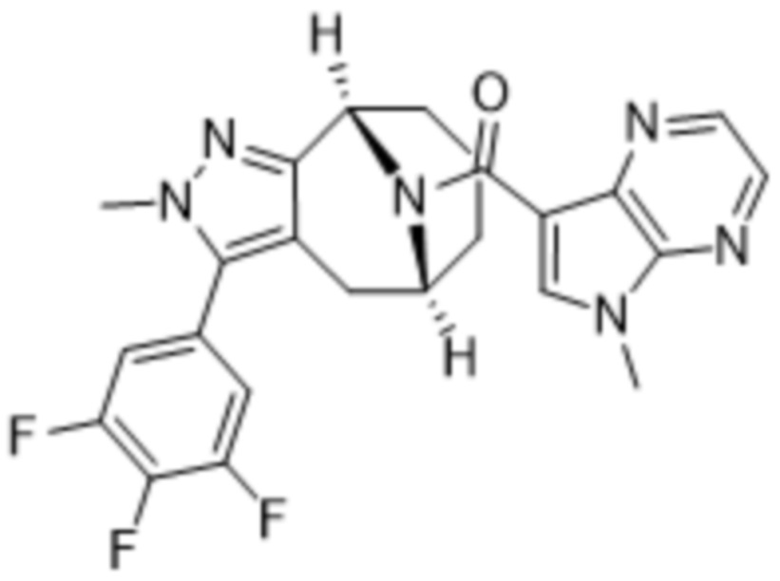
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-метил-5H-пирроло[2,3-b]пиразин-7-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H21F3N6O, 466,1; полученное m/z, 467,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 8,62-8,18 (м, 3H), 7,61-7,39 (м, 2H), 5,86-5,54 (м, 1H), 4,72-4,35 (м, 1H), 3,96-3,65 (м, 6H), 3,14-3,03 (м, 1H), 2,48-2,27 (м, 1H), 1,95-1,36 (м, 6H).
Пример 249. Имидазо[1,2-a]пиримидин-3-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
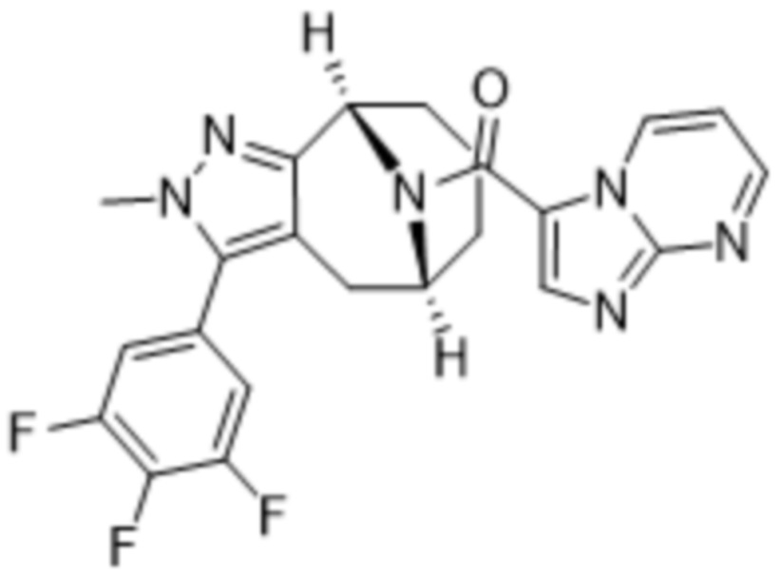
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и имидазо[1,2-a]пиримидин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H19F3N6O, 452,1; полученное m/z, 453,0 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,26 (дд, J=6,9, 2,0 Гц, 1H), 8,70 (дд, J=4,1, 2,0 Гц, 1H), 8,32-8,03 (м, 1H), 7,76-7,53 (м, 2H), 7,23 (дд, J=6,9, 4,1 Гц, 1H), 5,80-5,58 (м, 1H), 5,04-4,82 (м, 1H), 3,86-3,70 (м, 3H), 3,21-3,08 (м, 1H), 2,70-2,54 (м, 1H), 1,90-1,18 (м, 6H).
Пример 250: ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хинолин-4-ил)метанон.
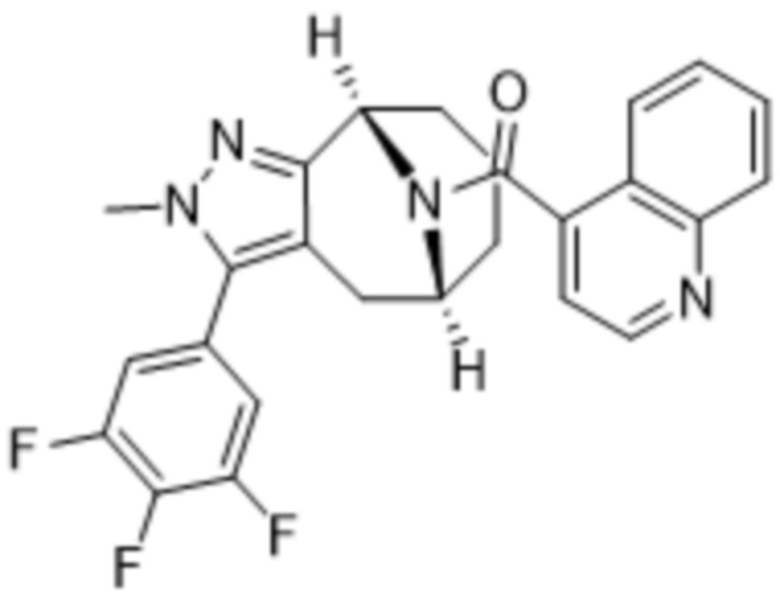
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и хинолин-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H21F3N4O, 462,1; полученное m/z, 463,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,06-8,83 (м, 1H), 8,17-7,05 (м, 7H), 6,02-5,78 (м, 1H), 4,45-4,02 (м, 1H), 3,85-3,68 (м, 3H), 3,08-2,60 (м, 1H), 2,37 (д, J=16,1 Гц, 1H), 2,10-1,32 (м, 6H).
Пример 251. Изохинолин-1-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
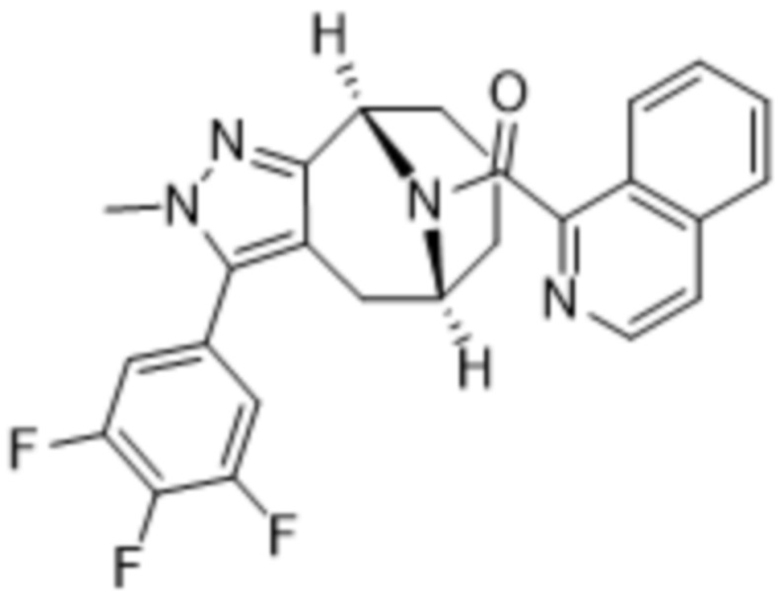
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и изохинолин-1-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H21F3N4O, 462,1; полученное m/z, 463,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,51 (дд, J=15,5, 5,6 Гц, 1H), 8,17-8,02 (м, 1H), 7,99-7,49 (м, 6H), 5,99-5,73 (м, 1H), 3,87-3,70 (м, 3H), 3,69-3,56 (м, 1H), 2,86-2,75 (м, 1H), 2,47-2,37 (м, 1H), 2,09-1,37 (м, 6H).
Пример 252: ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил) метанон.
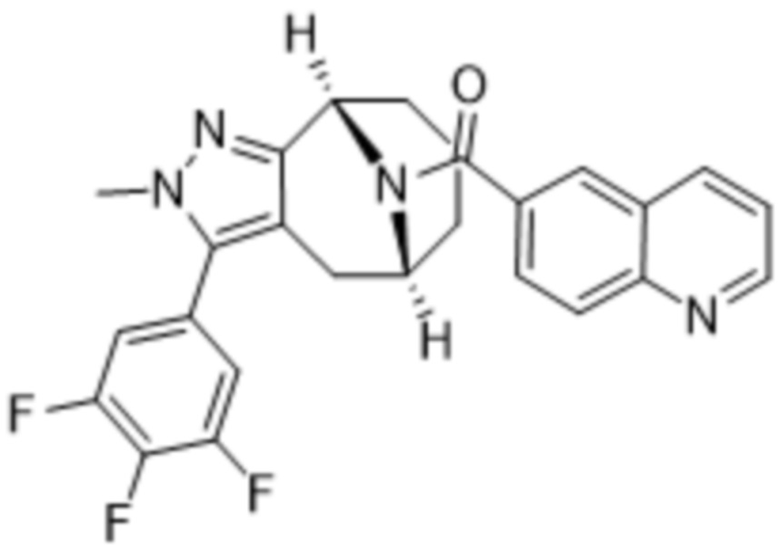
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C26H21F3N4O, 462,1; полученное m/z, 463,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,97 (дд, J=4,2, 1,7 Гц, 1H), 8,48 (д, J=8,4 Гц, 1H), 8,14-8,00 (м, 2H), 7,82-7,51 (м, 4H), 5,87-5,69 (м, 1H), 4,22-4,04 (м, 1H), 3,87-3,70 (м, 3H), 3,15-3,03 (м, 1H), 2,47-2,40 (м, 1H), 2,00-1,37 (м, 6H).
Пример 253. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хинолин-7-ил)метанон.
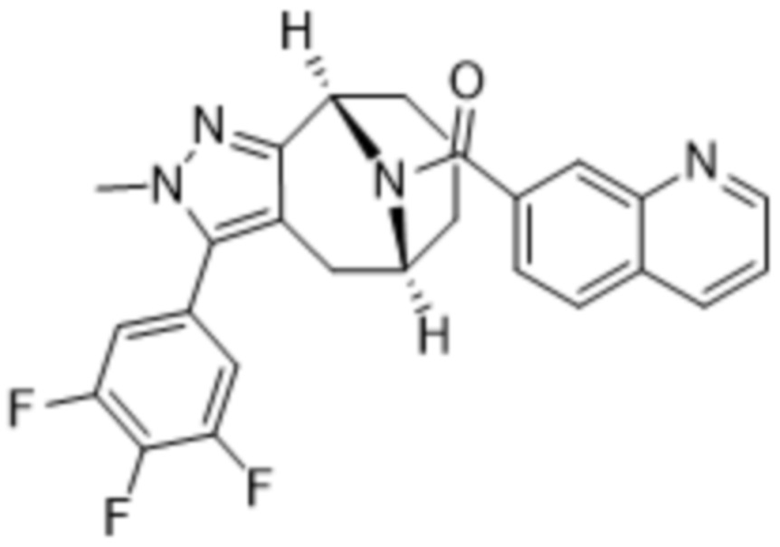
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и хинолин-7-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H21F3N4O, 462,1; полученное m/z, 463,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,05-8,86 (м, 1H), 8,53-8,40 (м, 1H), 8,16-7,88 (м, 2H), 7,74-7,52 (м, 4H), 5,83-5,66 (м, 1H), 4,18-4,01 (м, 1H), 3,86-3,69 (м, 3H), 3,14-2,96 (м, 1H), 2,46-2,30 (м, 1H), 2,03-1,38 (м, 6H).
Пример 254: ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хиназолин-4-ил)метанон.
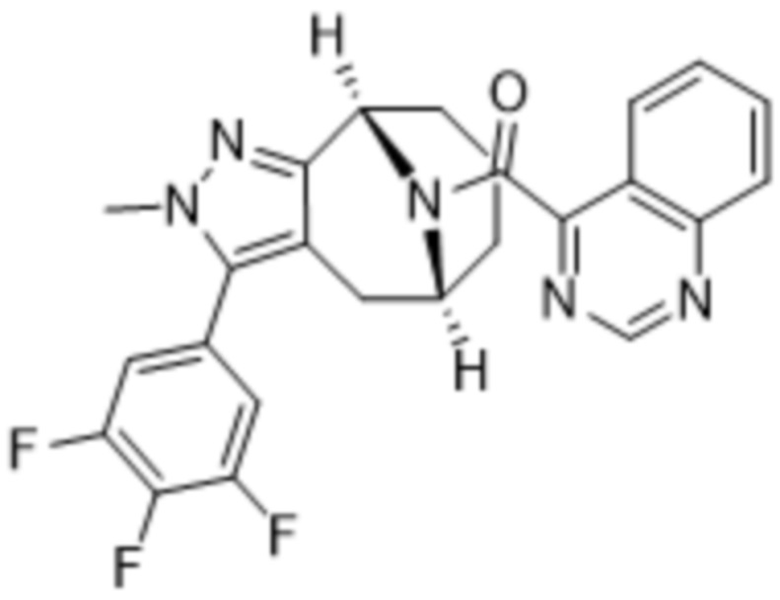
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и хиназолин-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H20F3N5O, 463,1; полученное m/z, 464,0 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,33 (д, J=18,1 Гц, 1H), 8,33-7,38 (м, 6H), 5,99-5,78 (м, 1H), 4,19-4,02 (м, 1H), 3,86-3,65 (м, 3H), 2,93-2,79 (м, 1H), 2,45-2,37 (м, 1H), 2,05-1,46 (м, 6H).
Пример 255. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиноксалин-6-ил) метанон.
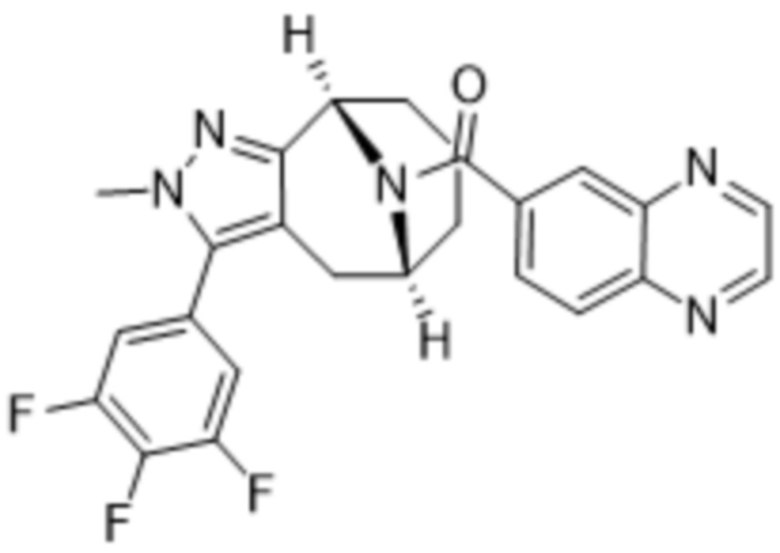
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и хиноксалин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H20F3N5O, 463,1; полученное m/z, 464,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,07-8,96 (м, 2H), 8,25-7,99 (м, 2H), 7,93-7,79 (м, 1H), 7,64-7,52 (м, 2H), 5,81-5,74 (м, 1H), 4,08 (с, 1H), 3,86-3,70 (м, 3H), 3,19-2,99 (м, 1H), 2,41 (д, J=16,1 Гц, 1H), 2,05-1,38 (м, 6H).
Пример 256: ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилхиноксалин-6-ил)метанон.
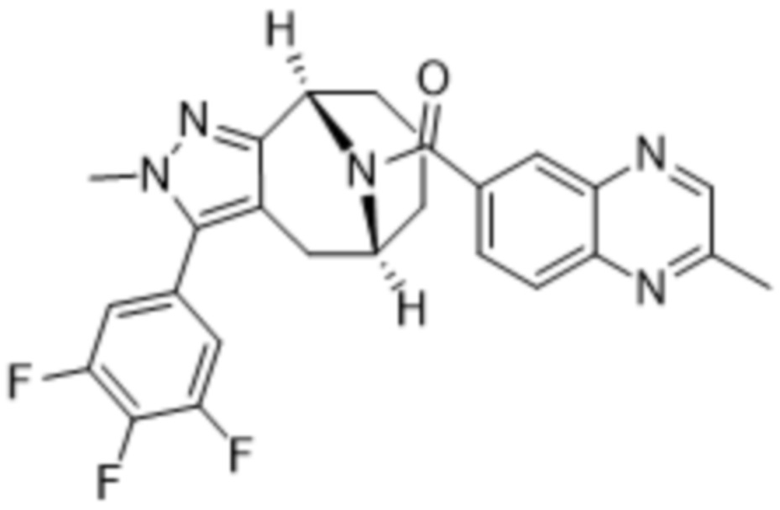
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-метилхиноксалин-6-карбоновую кислоту (промежуточное соединение 33) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H22F3N5O, 477,1; полученное m/z, 478,0 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 8,98-8,87 (м, 1H), 8,14-7,59 (м, 5H), 5,83-5,69 (м, 1H), 4,17-4,02 (м, 1H), 3,84-3,68 (м, 3H), 3,16-3,02 (м, 1H), 2,81-2,69 (м, 3H), 2,47-2,38 (м, 1H), 1,99-1,42 (м, 6H).
Пример 257. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хиноксалин-2-ил)метанон.
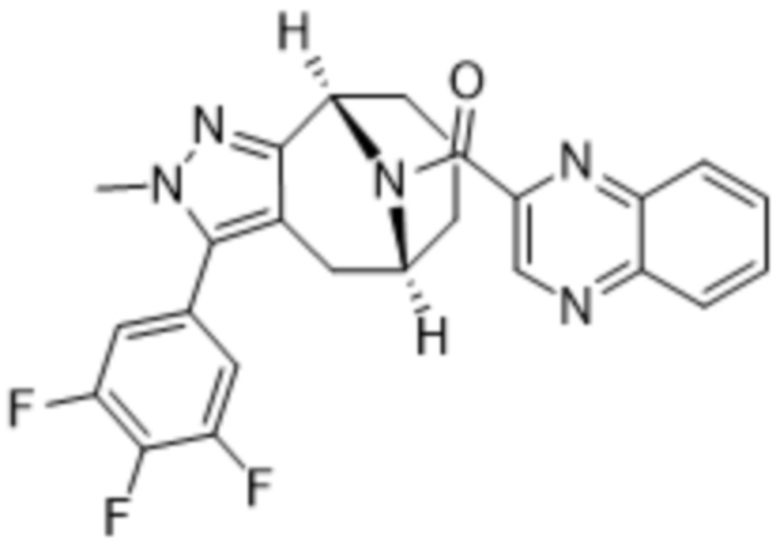
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и хиноксалин-2-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H20F3N5O, 463,1; полученное m/z, 464,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,12 (д, J=4,4 Гц, 1H), 8,22-8,04 (м, 2H), 8,04-7,88 (м, 2H), 7,69-7,43 (м, 2H), 5,89-5,57 (м, 1H), 4,52-4,30 (м, 1H), 3,89-3,65 (м, 3H), 3,24-3,04 (м, 1H), 2,65 (д, J=16,3 Гц, 1H), 2,17-1,46 (м, 6H).
Пример 258: Циннолин-3-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
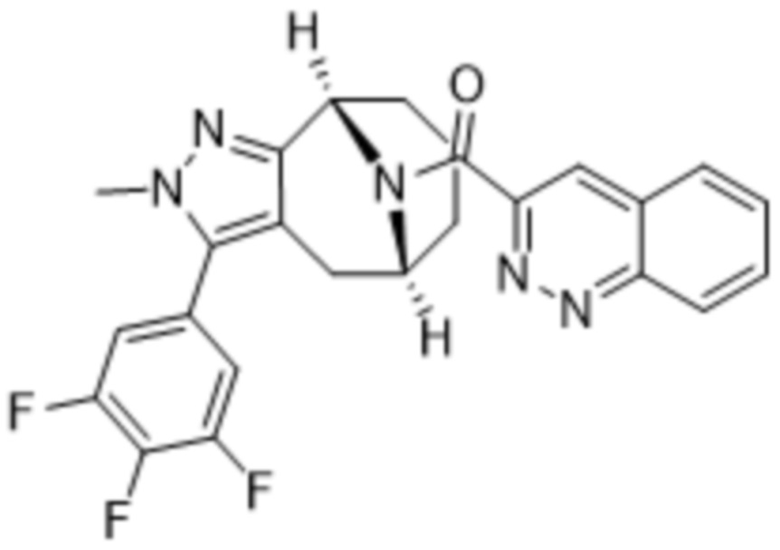
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и циннолин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H20F3N5O, 463,1; полученное m/z, 464,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 8,61-8,42 (м, 2H), 8,24-8,11 (м, 1H), 8,10-7,90 (м, 2H), 7,68-7,45 (м, 2H), 5,91-5,78 (м, 1H), 4,32-4,11 (м, 1H), 3,85-3,70 (м, 3H), 3,19-3,02 (м, 1H), 2,49-2,39 (м, 1H), 2,09-1,44 (м, 6H).
Пример 259. Циннолин-6-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) метанон.
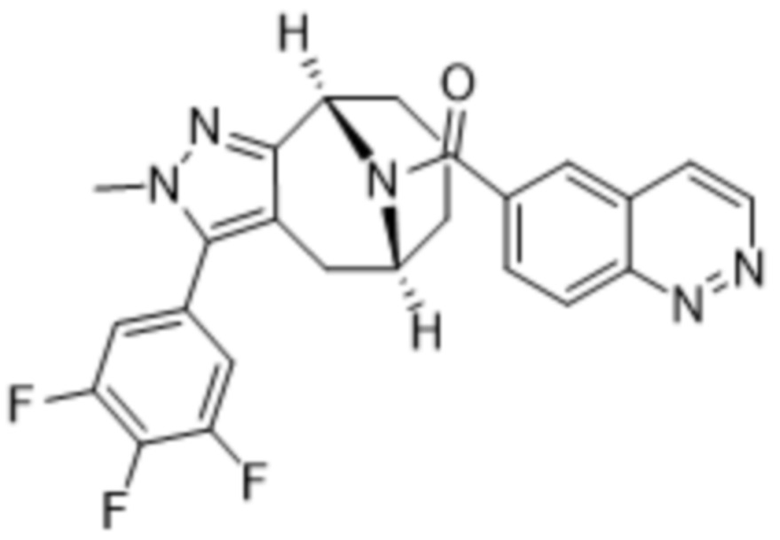
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и циннолин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H20F3N5O, 463,1; полученное m/z, 464,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 9,46 (дд, J=8,8, 5,8 Гц, 1H), 8,60-8,48 (м, 1H), 8,38-8,27 (м, 1H), 8,21-8,08 (м, 1H), 8,00-7,85 (м, 1H), 7,65-7,54 (м, 2H), 5,82-5,64 (м, 1H), 4,14 -3,96 (м, 1H), 3,86-3,69 (м, 3H), 3,16-2,99 (м, 1H), 2,46-2,40 (м, 1H), 2,05-1,43 (м, 6H).
Пример 260: ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1,5-нафтиридин-2-ил)метанон.
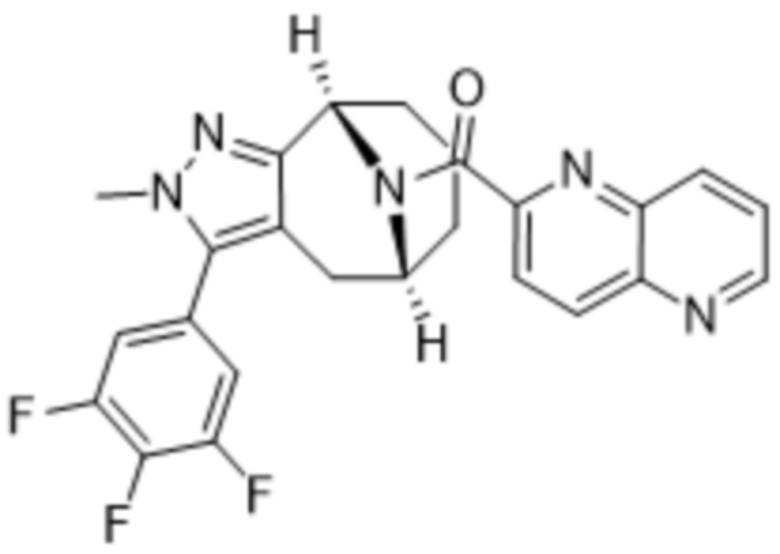
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1,5-нафтиридин-2-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H20F3N5O, 463,1; полученное m/z, 464,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 9,16-9,04 (м, 1H), 8,61-8,43 (м, 2H), 8,02-7,80 (м, 2H), 7,70-7,52 (м, 2H), 5,85-5,76 (м, 1H), 4,32-4,13 (м, 1H), 3,86-3,70 (м, 3H), 3,16-3,07 (м, 1H), 2,75-2,56 (м, 1H), 2,16-1,42 (м, 6H).
Пример 261. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1,5-нафтиридин-3-ил)метанон.
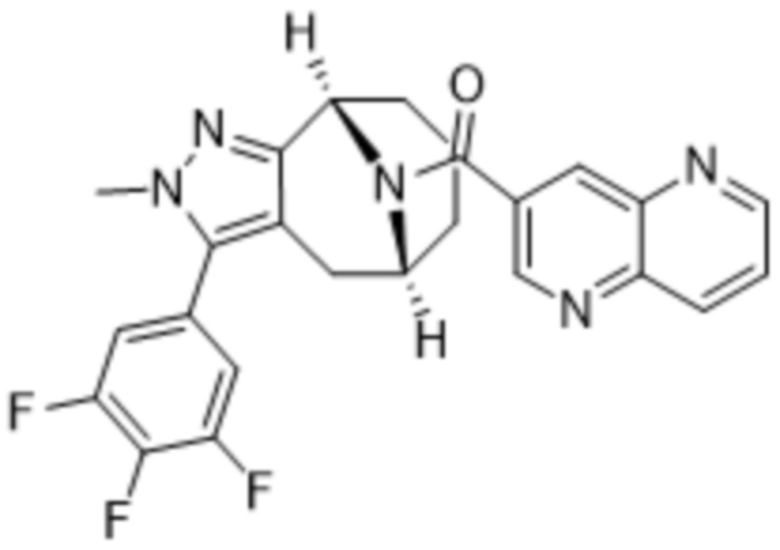
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1,5-нафтиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H20F3N5O, 463,1; полученное m/z, 464,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 9,16-8,94 (м, 2H), 8,54 -8,28 (м, 2H), 7,96-7,79 (м, 1H), 7,71-7,50 (м, 2H), 5,84 -5,73 (м, 1H), 4,23-4,08 (м, 1H), 3,88-3,73 (м, 3H), 3,20-3,06 (м, 1H), 2,46-2,31 (м, 1H), 2,06-1,37 (м, 6H).
Пример 262: ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1,6-нафтиридин-8-ил)метанон.
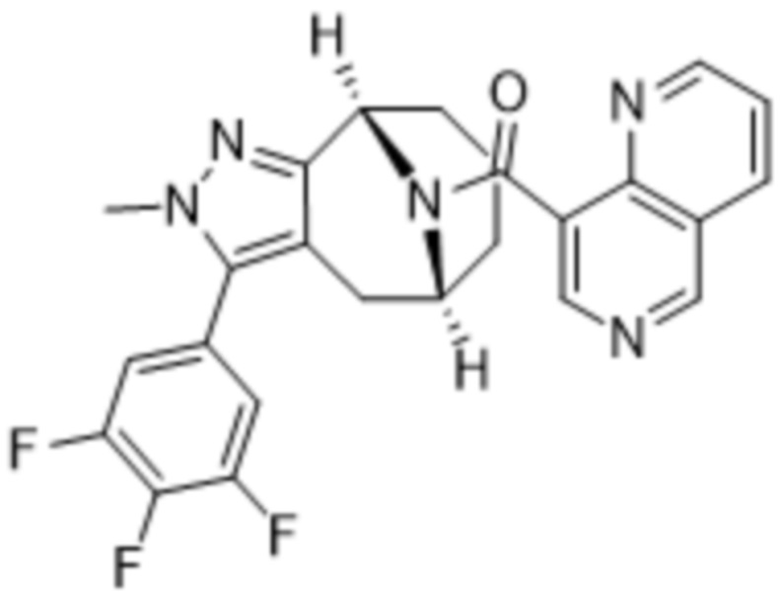
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1,6-нафтиридин-8-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H20F3N5O, 463,1; полученное m/z, 464,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,54-9,39 (м, 1H), 9,27-8,37 (м, 3H), 7,88-7,44 (м, 3H), 6,02-5,77 (м, 1H), 4,38-3,98 (м, 1H), 3,88-3,69 (м, 3H), 3,18-2,89 (м, 1H), 2,45-2,22 (м, 1H), 2,06-1,32 (м, 6H).
Пример 263. (2-(2H-1,2,3-Триазол-2-ил)фенил)((5R,9S)-3-(3,5-дифтор-4-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
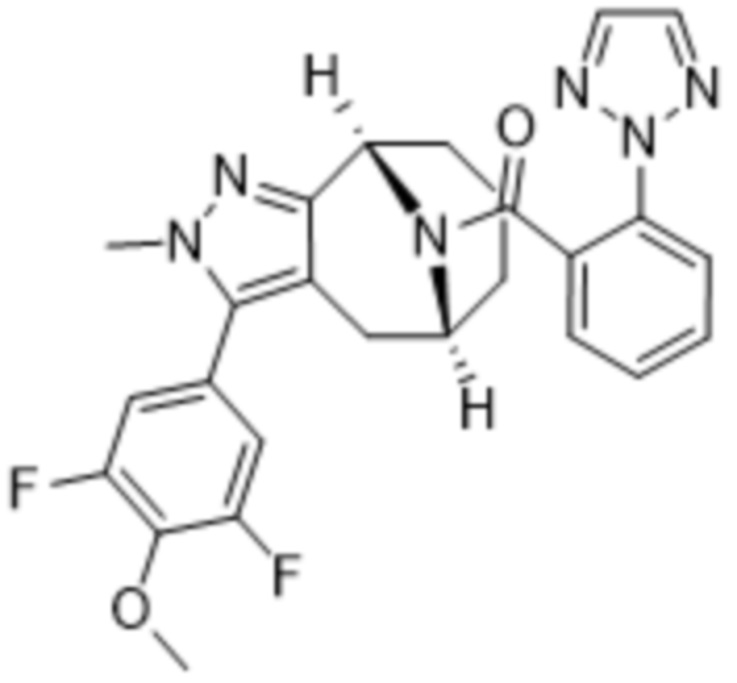
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифтор-4-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9- эпиминциклоокта[c]пиразол (промежуточное соединение 22) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-(2H-1,2,3-триазол-2-ил)бензойную кислоту (промежуточное соединение 49) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H24F2N6O2, 490,1; полученное m/z, 491,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 8,16 (д, J=13,2 Гц, 1H), 8,03-7,72 (м, 2H), 7,70-7,39 (м, 3H), 7,31-6,89 (м, 2H), 5,74-5,61 (м, 1H), 4,56-4,26 (м, 1H), 4,00-3,85 (м, 3H), 3,85-3,60 (м, 3H), 3,15-2,88 (м, 1H), 2,46-2,35 (м, 1H), 1,90-1,19 (м, 6H).
Пример 264: ((5R,9S)-3-(3,5-Дифтор-4-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-метил-1H-пиразолo[3,4-b]пиридин-3-ил)метанон.
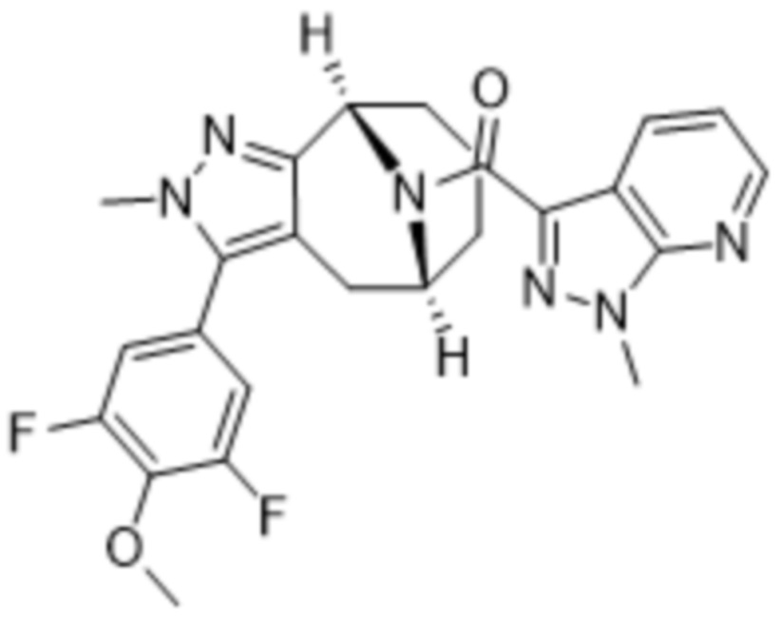
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифтор-4-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9- эпиминциклоокта[c]пиразол (промежуточное соединение 22) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-метил-1H-пиразоло[3,4-b]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H24F2N6O2, 478,1; полученное m/z, 479,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 8,69-8,54 (м, 1H), 8,47-8,32 (м, 1H), 7,42-7,29 (м, 3H), 6,36-6,25 (м, 1H), 5,17-5,08 (м, 1H), 4,19-4,10 (м, 3H), 4,01-3,96 (м, 3H), 3,82-3,73 (м, 3H), 3,15-3,08 (м, 1H), 2,63 -2,55 (м, 1H), 2,02-1,41 (м, 6H).
Пример 265. ((5R,9S)-3-(3,5-Дифтор-4-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хинолин-6-ил)метанон.
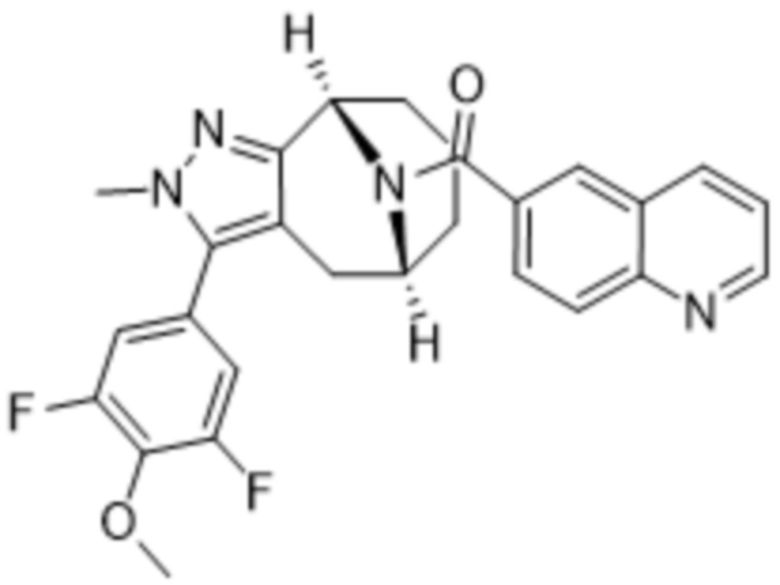
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифтор-4-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9- эпиминциклоокта[c]пиразол (промежуточное соединение 22) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C27H24F2N4O2, 474,2; полученное m/z, 475,0 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,96 (д, J=4,5 Гц, 1H), 8,48 (д, J=8,3 Гц, 1H), 8,19-8,04 (м, 2H), 7,85-7,56 (м, 2H), 7,39 (т, J=8,6 Гц, 2H), 5,87-5,69 (м, 1H), 4,16-4,09 (м, 1H), 4,01-3,96 (м, 3H), 3,84-3,79 (м, 3H), 2,49-2,40 (м, 1H), 1,94-1,40 (м, 7H).
Пример 266: (2-(2H-1,2,3-Триазол-2-ил)фенил)((5R,9S)-3-(3,4-дифтор-5-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
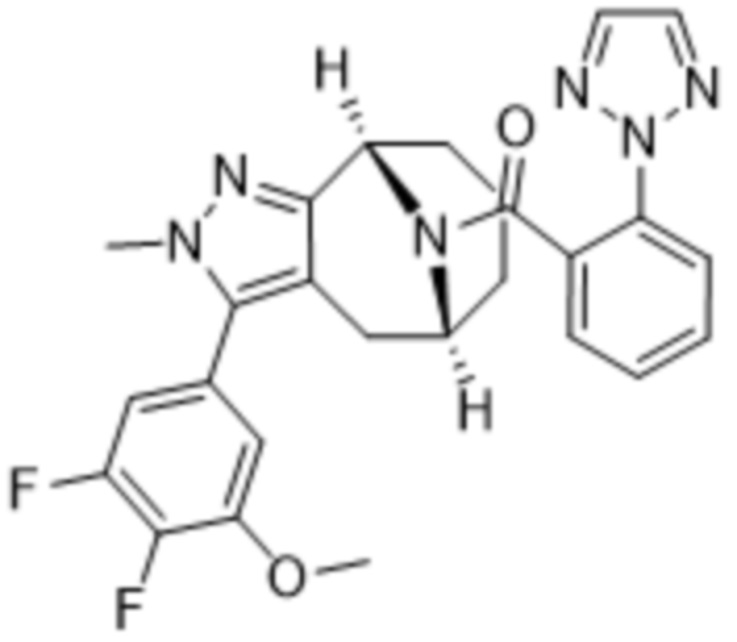
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,4-дифтор-5-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 21) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-(2H-1,2,3-триазол-2-ил)бензойную кислоту (промежуточное соединение 49) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H24F2N6O2, - 490,1; полученное m/z, 491,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 8,16 (д, J=13,2 Гц, 1H), 8,03-7,72 (м, 2H), 7,70-7,39 (м, 3H), 7,31-6,89 (м, 2H), 5,74-5,61 (м, 1H), 4,56-4,26 (м, 1H), 4,00-3,85 (м, 3H), 3,85-3,60 (м, 3H), 3,15-2,88 (м, 1H), 2,46-2,35 (м, 1H), 1,90-1,19 (м, 6H).
Пример 267. ((5R,9S)-3-(3,4-Дифтор-5-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (1-метил-1H-пиразолo[3,4-b] пиридин-3-ил) метанон.
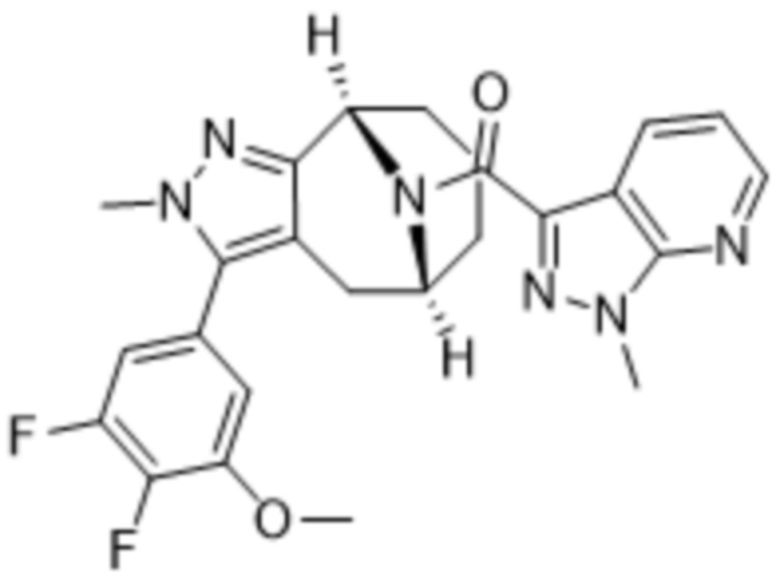
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,4-дифтор-5-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 21) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-метил-1H-пиразоло[3,4-b]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H24F2N6O2, - 478,1; полученное m/z, 479,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,69-8,58 (м, 1H), 8,47-8,37 (м, 1H), 7,39-7,32 (м, 1H), 7,25-7,07 (м, 2H), 6,37-6,23 (м, 1H), 5,26-5,06 (м, 1H), 4,20-4,10 (м, 3H), 3,96-3,90 (м, 3H), 3,83-3,74 (м, 3H), 3,18-3,07 (м, 1H), 2,65-2,55 (м, 1H), 2,08-1,35 (м, 6H).
Пример 268: ((5R,9S)-3-(3,4-Дифтор-5-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хинолин-6-ил)метанон.
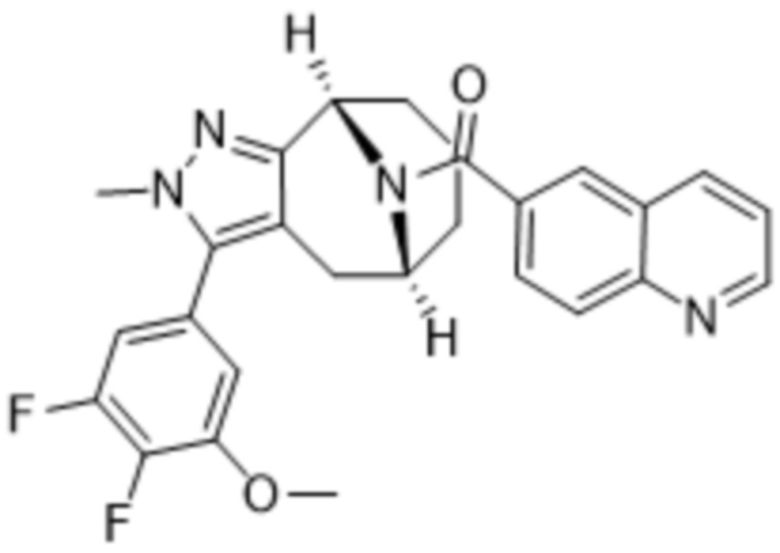
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,4-дифтор-5-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 21) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C27H24F2N4O2, -474,1; полученное m/z, 475,1 [M+H]+. 1H ЯМР (600 МГц, ДМСО-d6) δ 9,05-8,93 (м, 1H), 8,47 (т, J=7,8 Гц, 1H), 8,15-8,01 (м, 2H), 7,86-7,56 (м, 2H), 7,32-7,07 (м, 2H), 5,76 (с, 1H), 4,12 (с, 1H), 3,97-3,93 (м, 3H), 3,84-3,73 (м, 3H), 3,22-3,02 (м, 1H), 2,43 (д, J=16,1 Гц, 1H), 2,05-1,42 (м, 6H).
Пример 269. ((5R,9S)-2-Метил-3-(1-метил-1H-индол-2-ил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил) метанон.
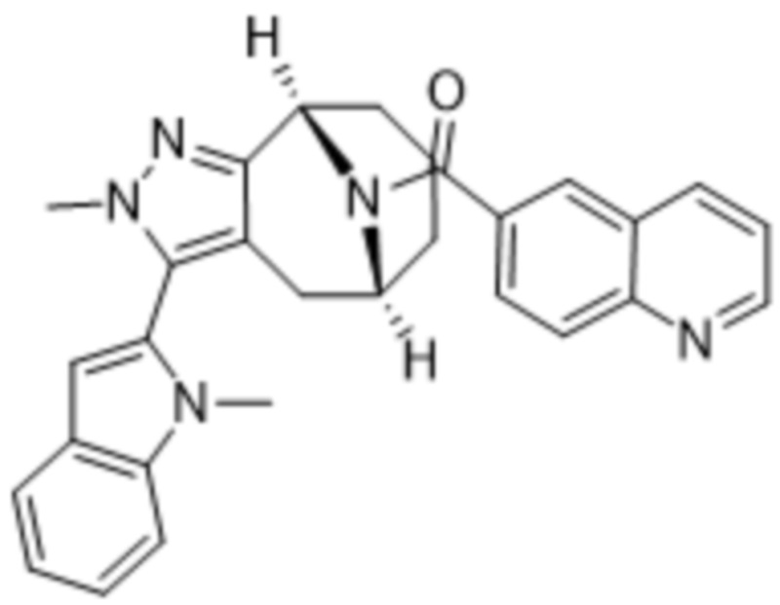
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(1-метил-1H-индол-2-ил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 32) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C29H27N5O, 461,2; полученное m/z, 462,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,06-8,89 (м, 1H), 8,48 (дд, J=17,5, 8,2 Гц, 1H), 8,16-8,03 (м, 2H), 7,82-7,71 (м, 1H), 7,68-7,47 (м, 3H), 7,29-7,05 (м, 2H), 6,70 (с, 1H), 5,88-5,68 (м, 1H), 4,16-4,06 (м, 1H), 3,81-3,56 (м, 6H), 2,98-2,82 (м, 1H), 2,40-2,30 (м, 1H), 2,00-1,46 (м, 6H).
Пример 270: рацемический-((5R,9S)-2-Метил-3-(5-(трифторметил)тиофен-2-ил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хинолин-6-ил)метанон.
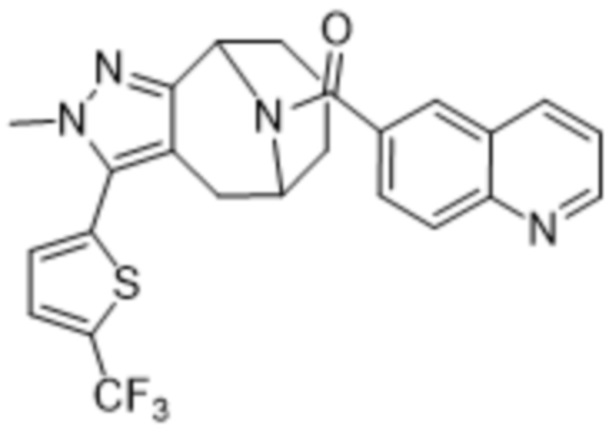
Титульное соединение получали способом, аналогичным описанному в примере 1, используя рацемический (5R,9S)-2-метил-3-(5-(трифторметил) тиофен -2- ил)-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 9) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C25H21F3N4OS, - 482,1; полученное m/z, 483,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,03-8,91 (м, 1H), 8,55-8,37 (м, 1H), 8,15-8,02 (м, 2H), 7,90-7,45 (м, 4H), 5,77 (с, 1H), 4,17 (с, 1H), 3,99-3,80 (м, 3H), 3,26-2,98 (м, 1H), 2,65 (дд, J=69,0, 16,4 Гц, 1H), 2,11-1,33 (м, 6H).
Пример 271. (4-Метоксифенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
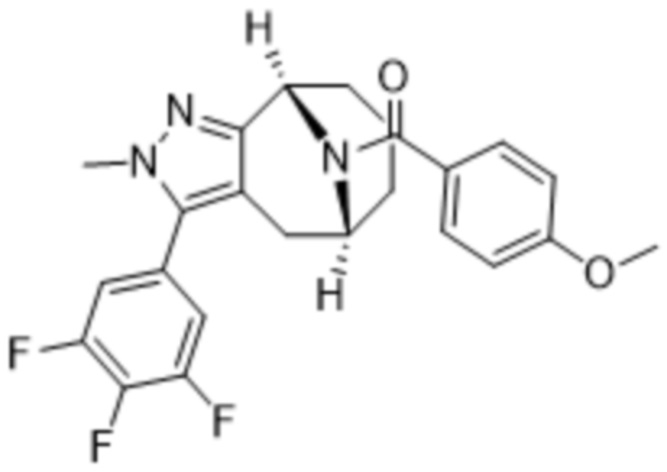
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 4-метоксибензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H22F3N3O2, - 441,2; полученное m/z, 442,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 7,65 -7,54 (м, 2H), 7,43 -7,37 (м, 2H), 7,04 -6,94 (м, 2H), 5,71 -5,59 (м, 1H), 4,22 -4,06 (м, 1H), 3,80 (с, 3H), 3,79 (с, 3H), 3,12 -2,96 (м, 1H), 2,42 (д, J=16,2 Гц, 1H), 1,99 -1,32 (м, 6H).
Пример 272. (2-Фтор-4-метилфенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
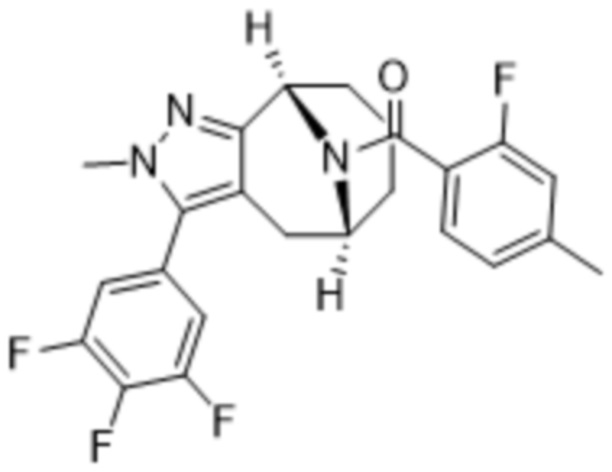
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-фтор-4-метилбензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H21F4N3O, - 443,2; полученное m/z, 444,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 7,62 -7,50 (м, 2H), 7,37 -7,09 (м, 1H), 7,14 -7,08 (м, 1H), 7,08 -7,04 (м, 1H), 5,78 -5,64 (м, 1H), 3,92 -3,81 (м, 1H), 3,77 (с, 3H), 2,83 (дд, J=16,1, 7,4 Гц, 1H), 2,51 -2,43 (м, 1H), 2,32 (с, 3H), 1,90 -1,29 (м, 6H).
Пример 273: (2-Фтор-4-метоксифенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
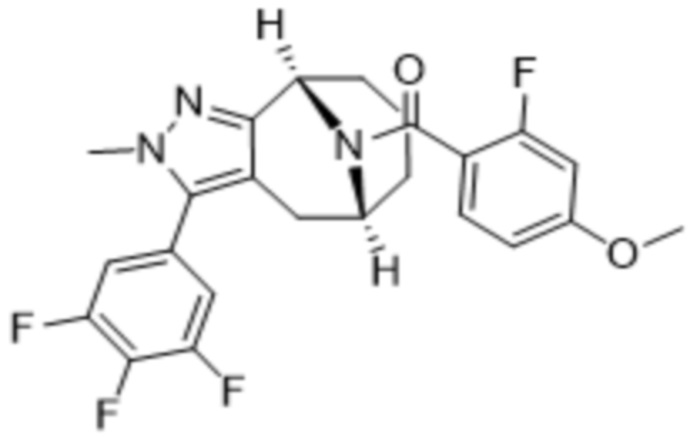
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-фтор-4-метоксибензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H21F4N3O2, 459,2; полученное m/z, 460,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 7,67-7,48 (м, 2H), 7,31 (с, 1H), 7,02-6,74 (м, 2H), 5,83 -5,59 (м, 1H), 5,08-4,57 (м, 1H), 3,85-3,70 (м, 6H), 3,22 -2,80 (м, 1H), 2,49 -2,42 (м, 1H), 1,88 -1,31 (м, 6H).
Пример 274. (3-Фтор-5-(1H-пиразол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
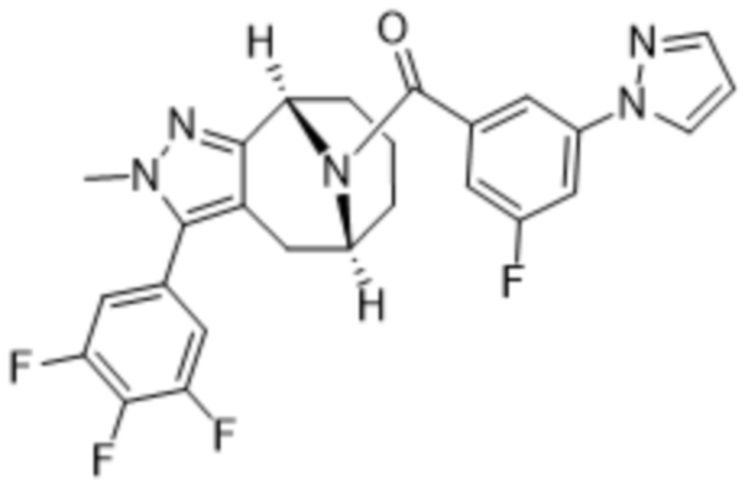
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-фтор-5-пиразол-1-ил-бензойную кислоту (промежуточное соединение 64) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H21F4N5O, 495,2; полученное m/z, 496,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,64 (д, J=2,6 Гц, 1H), 7,84 -7,80 (м, 1H), 7,77 (д, J=1,7 Гц, 1H), 7,74 -7,71 (м, 1H), 7,61 -7,53 (м, 2H), 7,21 -7,16 (м, 1H), 6,59 -6,55 (м, 1H), 5,70 -5,67 (м, 1H), 4,06 -4,00 (м, 1H), 3,79 (с, 3H), 2,99 (дд, J=16,2, 7,4 Гц, 1H), 2,41 (д, J=16,1 Гц, 1H), 1,98 -1,35 (м, 6H).
Пример 275. (3-Фтор-5-(4H-1,2,4-триазол-4-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
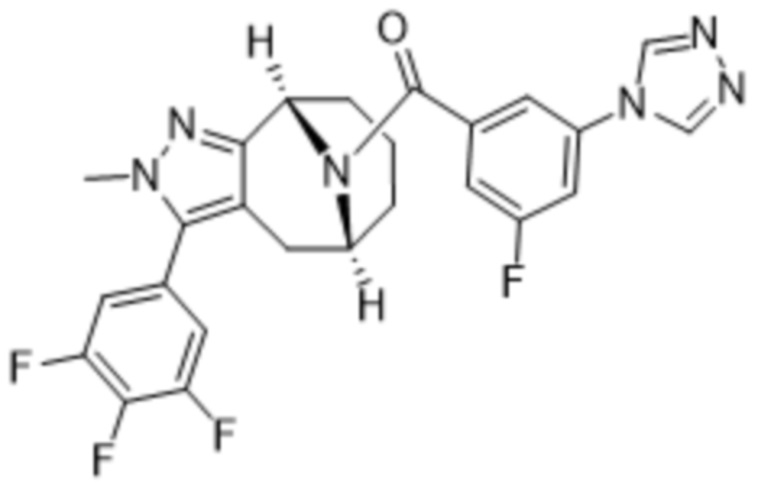
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-фтор-5-(4H-1,2,4-триазол-4-ил)бензойную кислоту (промежуточное соединение 68) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H20F4N6O, - 496,2; полученное m/z, 497,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) : 9,25 (с, 2H), 7,91-7,82 (м, 1H), 7,72-7,65 (м, 1H), 7,63-7,53 (м, 2H), 7,42-7,33 (м, 1H), 5,74-5,67 (м, 1H), 4,06 -3,97 (м, 1H), 3,82 (с, 3H), 3,05 (дд, J=16,4, 7,2 Гц, 1H), 2,42 (д, J=16,5 Гц, 1H), 2,09-1,35 (м, 6H).
Пример 276. (4-Фтор-3-(4H-1,2,4-триазол-4-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.

Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 4-фтор-3-(4H-1,2,4-триазол-4-ил)бензойную кислоту (промежуточное соединение 69) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H20F4N6O, - 496,2; полученное m/z, 497,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) : 8,98 (с, 2H), 7,89 -7,72 (м, 1H), 7,69 -7,45 (м, 4H), 5,70 (с, 1H), 4,10 (д, J=6,7 Гц, 1H), 3,81 (с, 3H), 3,12 -2,97 (м, 1H), 2,59-2,37 (м, 1H), 2,07-1,35 (м, 6H).
Пример 277. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(4-метил-3-(4H-1,2,4-триазол-4-ил)фенил)метанон.
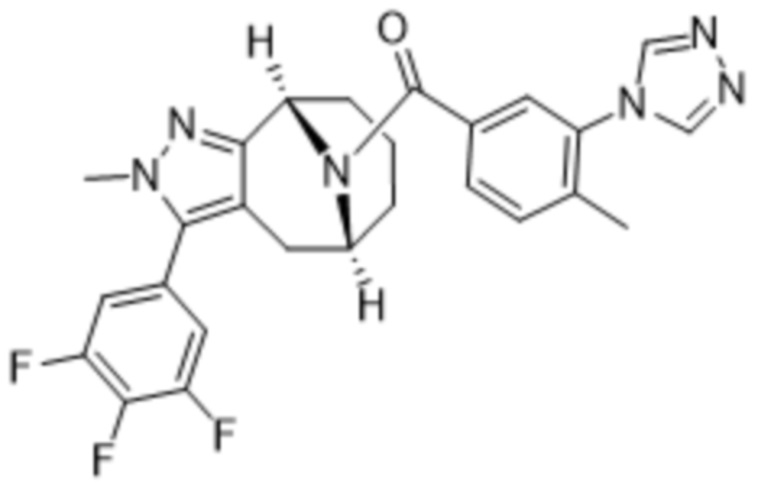
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 4-метил-3-(4H-1,2,4-триазол-4-ил)бензойную кислоту (промежуточное соединение 72) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H23F3N6O, 492,2; полученное m/z, 493,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,84 (с, 2H), 7,63 -7,38 (м, 5H), 5,73 -5,64 (м, 1H), 4,15 -4,08 (м, 1H), 3,80 (с, 3H), 3,03 (дд, J=16,5, 7,4 Гц, 1H), 2,44 (д, J=16,3 Гц, 1H), 2,18 (с, 3H), 1,91 -1,38 (м, 6H).
Пример 278. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-метил-5-(4H-1,2,4-триазол-4-ил)фенил)метанон.
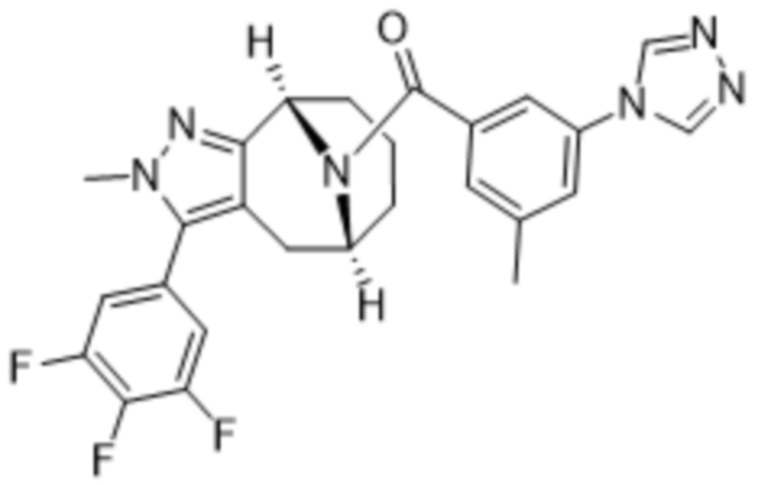
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-метил-5-(4H-1,2,4-триазол-4-ил)бензойную кислоту (промежуточное соединение 70) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H23F3N6O, 492,2; полученное m/z, 493,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) : 9,17 (с, 2H), 7,73 -7,65 (м, 1H), 7,64 -7,49 (м, 3H), 7,32 -7,25 (м, 1H), 5,77 -5,64 (м, 1H), 4,11 -3,99 (м, 1H), 3,82 (с, 3H), 3,01 (дд, J=15,5, 7,1 Гц, 1H), 2,66 -2,36 (м, 1H), 2,43 (с, 3H), 2,07 -1,33 (м, 6H).
Пример 279. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метил-3-(4H-1,2,4-триазол-4-ил)фенил)метанон.
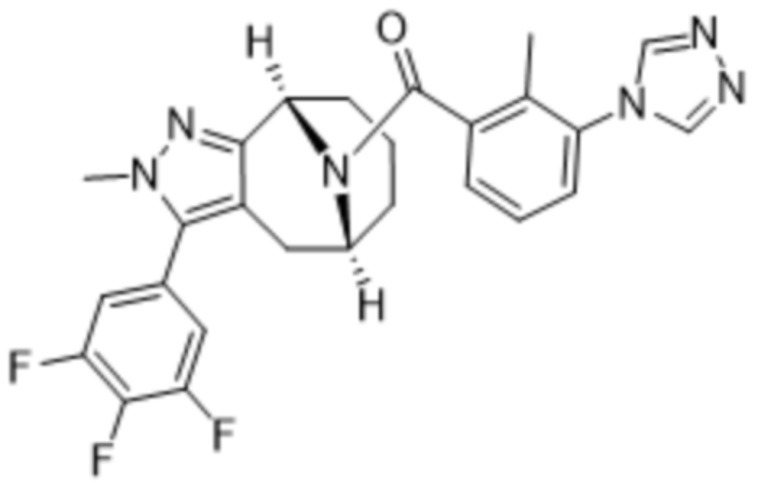
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-метил-3-(4H-1,2,4-триазол-4-ил)бензойную кислоту (промежуточное соединение 71) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H23F3N6O, 492,2; полученное m/z, 493,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) : 8,83 (с, 2H), 7,68 -7,30 (м, 5H), 5,85 -5,75 (м, 1H), 3,81 (с, 3H), 3,78 -3,70 (м, 1H), 3,43 -3,22 (м, 1H), 3,03 -2,81 (м, 1H), 2,10 (с, 3H), 1,95 -1,31 (м, 6H).
Пример 280. (2-(2H-1,2,3-Триазол-2-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
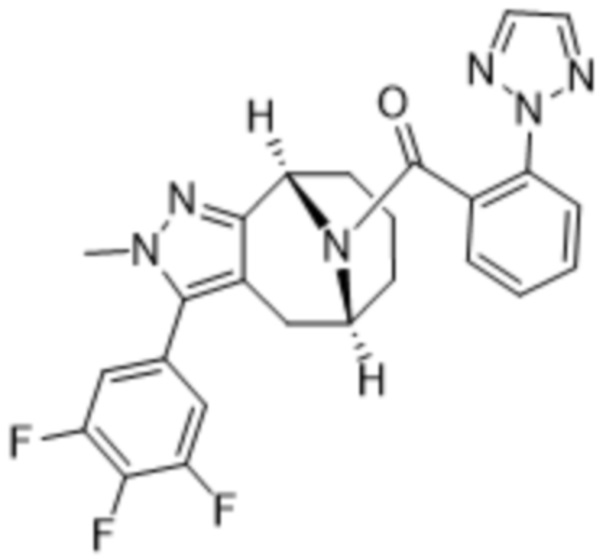
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-(2H-1,2,3-триазол-2-ил)бензойную кислоту (промежуточное соединение 49) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21F3N6O, 478,2; полученное m/z, 479,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,12 (с, 2H), 7,90 -7,86 (м, 1H), 7,66 -7,36 (м, 5H), 5,67 -5,63 (м, 1H), 3,88 -3,81 (м, 1H), 3,78 (с, 3H), 2,95 (дд, J=16,3, 7,6 Гц, 1H), 2,35 (д, J=16,1 Гц, 1H), 1,88 -1,19 (м, 6H).
Пример 281. (4-Фтор-2-(2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
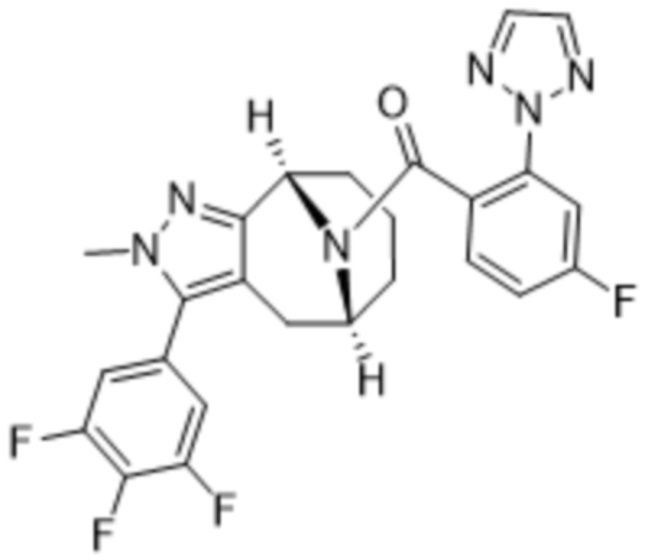
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 4-фтор-2-(2H-1,2,3-триазол-2-ил)бензойную кислоту (промежуточное соединение 74) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H20F4N6O, - 496,2; полученное m/z, 497,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) : 8,25 -8,14 (м, 1H), 7,89 -7,28 (м, 6H), 5,73 -5,62 (м, 1H), 3,92 -3,76 (м, 1H), 3,81 (с, 3H), 3,03 -2,91 (м, 1H), 2,42 -2,34 (м, 1H), 1,94 -1,17 (м, 6H).
Пример 282. (3-Фтор-2-(2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
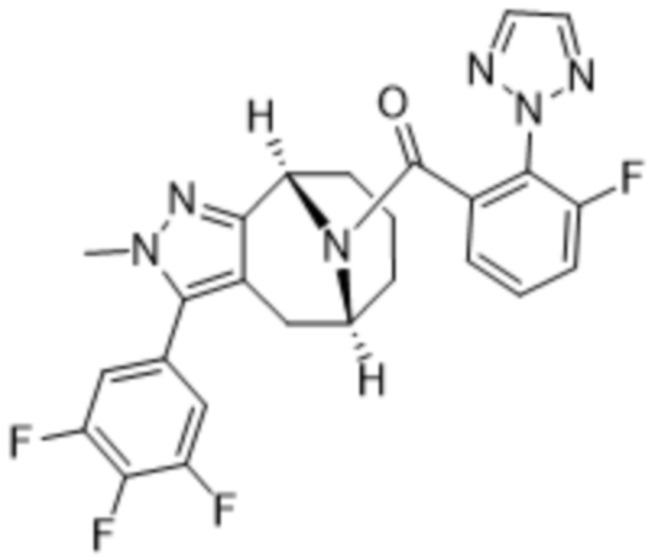
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-фтор-2-(2H-1,2,3-триазол-2-ил)бензойную кислоту (промежуточное соединение 75) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H20F4N6O, - 496,2; полученное m/z, 497,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,17 (с, 1H), 7,75 -7,31 (м, 6H), 5,55 -5,47 (м, 1H), 3,98 -3,91 (м, 1H), 3,79 (с, 3H), 3,04 (дд, J=16,2, 7,2 Гц, 1H), 2,41 (д, J=16,2 Гц, 1H), 1,89 -1,27 (м, 6H).
Пример 283. (5-Фтор-2-(2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
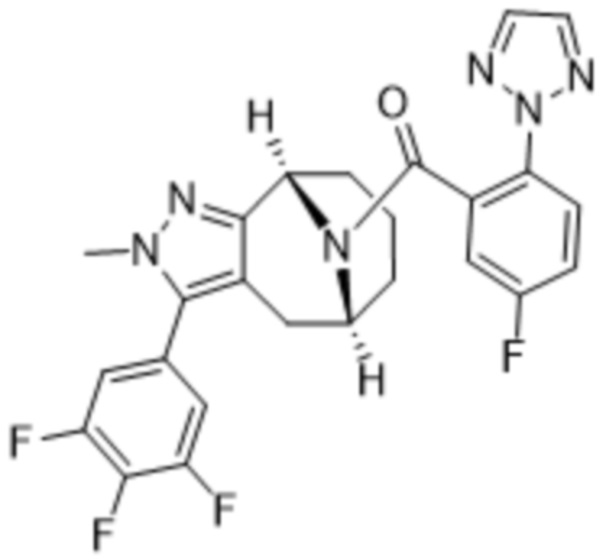
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-фтор-2-(2H-1,2,3-триазол-2-ил)бензойную кислоту (промежуточное соединение 112) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H20F4N6O, - 496,2; полученное m/z, 497,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,12 (с, 2H), 7,91 (дд, J=9,0, 4,9 Гц, 1H), 7,61 -7,55 (м, 1H), 7,55 -7,30 (м, 3H), 5,65 -5,60 (м, 1H), 3,88 -3,83 (м, 1H), 3,78 (с, 3H), 3,02 (дд, J=16,1, 7,2 Гц, 1H), 2,33 (д, J=16,0 Гц, 1H), 1,82 -1,19 (м, 6H).
Пример 284. (5-Метил-2-(2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
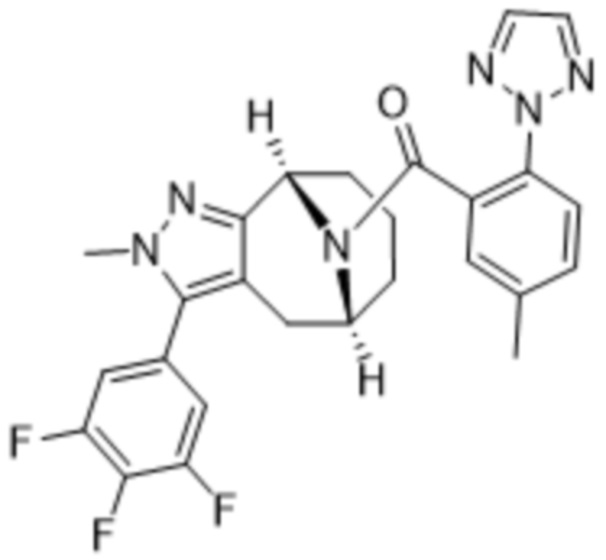
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-метил-2-(2H-1,2,3-триазол-2-ил)бензойную кислоту (промежуточное соединение 76) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H23F3N6O, 492,2; полученное m/z, 493,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) : 8,11 (с, 2H), 7,84 -7,31 (м, 5H), 5,73 -5,58 (м, 1H), 3,92 -3,81 (м, 1H), 3,81 (с, 3H), 2,99 -2,87 (м, 1H), 2,39 (с, 3H), 2,45 -2,22 (м, 1H), 1,91 -1,10 (м, 6H).
Пример 285. (2-(2H-1,2,3-Триазол-2-ил)-3-(трифторметил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
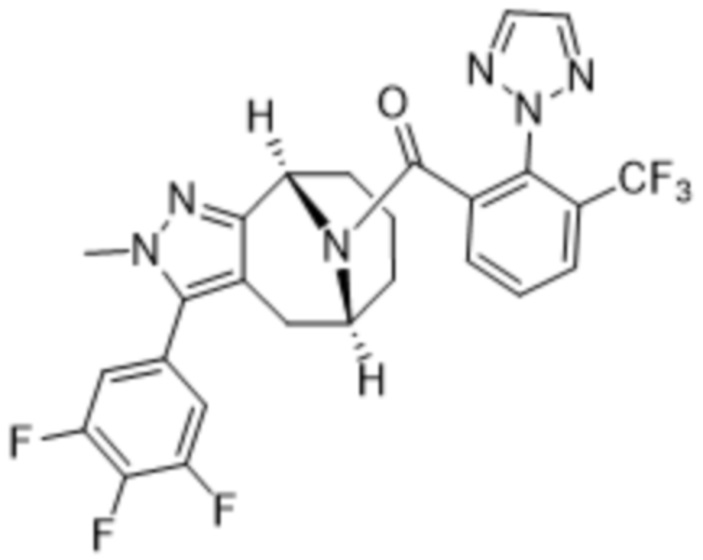
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-(2H-1,2,3-триазол-2-ил)-3-(трифторметил)бензойную кислоту (промежуточное соединение 77) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H20F6N6O, 546,2; полученное m/z, 547,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) : 8,17 (с, 2H), 8,12 -7,39 (м, 5H), 5,51 -5,38 (м, 1H), 3,95 -3,84 (м, 1H), 3,79 (с, 3H), 3,14 -2,98 (м, 1H), 2,63 -2,33 (м, 1H), 2,05 -1,20 (м, 6H).
Пример 286. (2-(4-Метил-2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
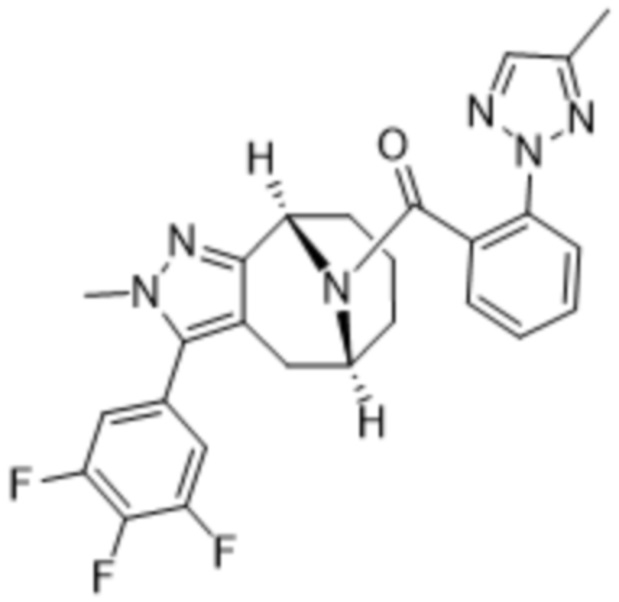
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-(4-метил-2H-1,2,3-триазол-2-ил)бензойную кислоту (промежуточное соединение 73) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H23F3N6O, 492,2; полученное m/z, 493,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 7,88 (с, 1H), 7,90 -7,77 (м, 1H), 7,62 -7,55 (м, 2H), 7,46 -7,41 (м, 1H), 7,62 -7,32 (м, 2H), 5,70 -5,64 (м, 1H), 3,90 -3,84 (м, 1H), 3,78 (с, 3H), 3,00 -2,93 (м, 1H), 2,50 -2,42 (м, 1H), 2,33 (с, 3H), 1,91 -1,18 (м, 6H).
Пример 287. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-(4-(трифторметил)-2H-1,2,3-триазол-2-ил)фенил)метанон.
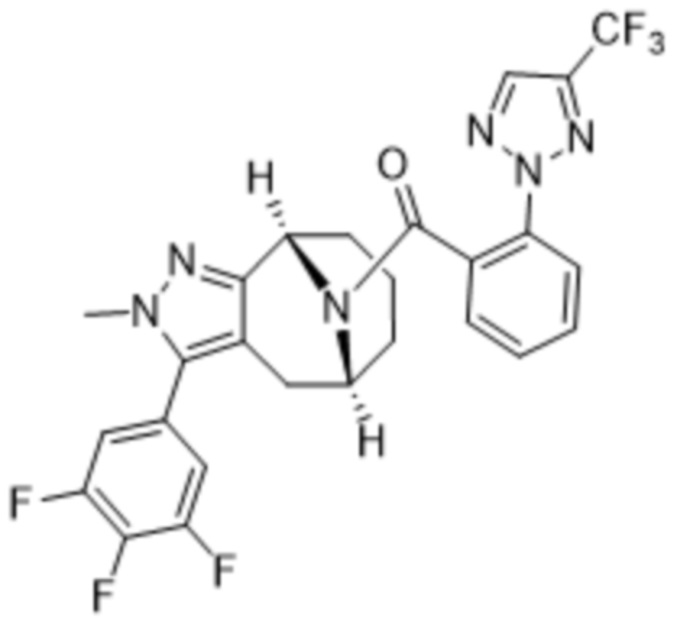
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-[4-(трифторметил)триазол-2-ил]бензойную кислоту (промежуточное соединение 66) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H20F6N6O, 546,2; полученное m/z, 547,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,79 (с, 1H), 7,95 -7,91 (м, 1H), 7,73 -7,65 (м, 2H), 7,64 -7,56 (м, 2H), 7,51 -7,46 (м, 1H), 5,62 -5,57 (м, 1H), 4,02 -3,94 (м, 1H), 3,78 (с, 3H), 3,14 -3,01 (м, 1H), 2,42 (д, J=16,3 Гц, 1H), 1,90 -1,30 (м, 6H).
Пример 288. (5-Метокси-2-(1H-1,2,4-триазол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
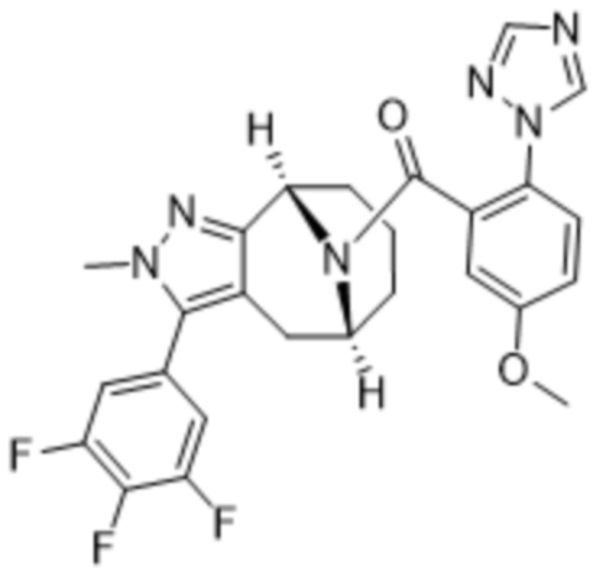
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-метокси-2-(1H-1,2,4-триазол-1-ил)бензойную кислоту (промежуточное соединение 65) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H23F3N6O2, 508,2; полученное m/z, 509,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,75 (с, 1H), 8,18 (с, 1H), 7,59 (д, J=8,7 Гц, 1H), 7,59 -7,53 (м, 2H), 7,15 (дд, J=8,9, 2,8 Гц, 1H), 6,95 (д, J=2,8 Гц, 1H), 5,60 -5,55 (м, 1H), 3,81 (с, 3H), 3,76 (с, 3H), 3,81 -3,74 (м, 1H), 2,94 (дд, J=16,1, 7,2 Гц, 1H), 2,34 (д, J=16,1 Гц, 1H), 1,77 -1,19 (м, 6H).
Пример 289. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-(4-(трифторметил)-1H-1,2,3-триазол-1-ил)фенил)метанон.
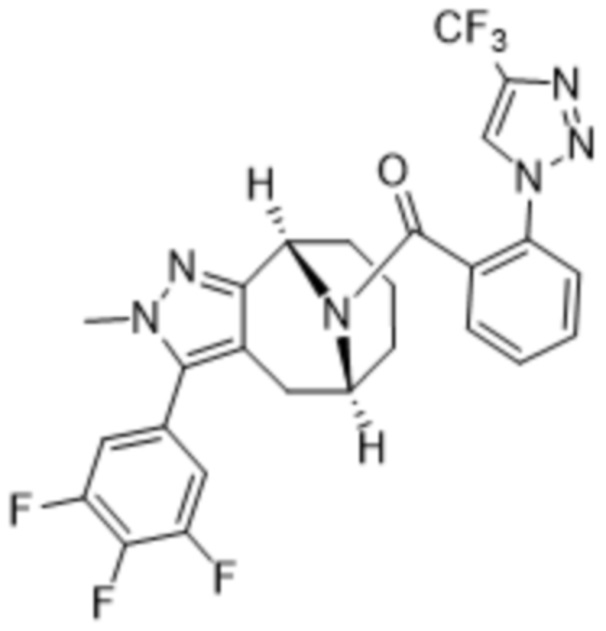
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-[4-(трифторметил)триазол-1-ил]бензойную кислоту (промежуточное соединение 67) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H20F6N6O, 546,2; полученное m/z, 547,3 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 9,35 (с, 1H), 7,83 -7,77 (м, 1H), 7,75 -7,68 (м, 2H), 7,63 -7,54 (м, 2H), 7,45 -7,28 (м, 1H), 5,62 -5,46 (м, 1H), 3,77 (с, 3H), 3,75 -3,68 (м, 1H), 3,12 -2,97 (м, 1H), 2,40 (д, J=16,3 Гц, 1H), 1,90 -1,21 (м, 6H).
Пример 290. (6-Изопропилпиримидин-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
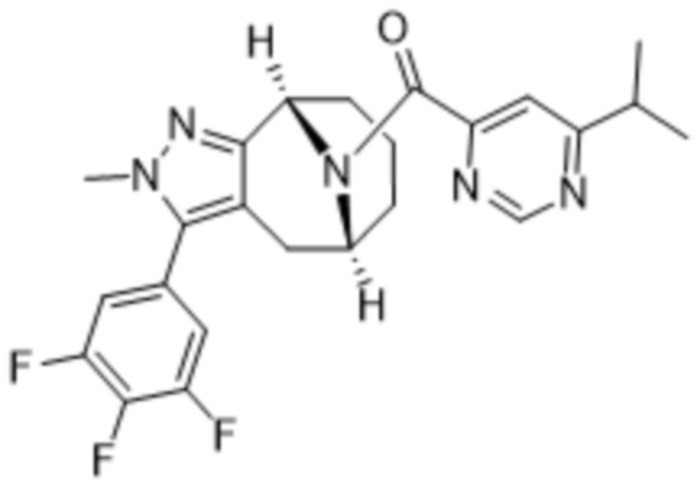
Стадия А: 6-Изопропилпиримидин-4-карбоновая кислота, К раствору метил 6-(пропан-2-ил)пиримидин-4-карбоксилата (135 мг, 0,749 ммоль) в 1,4-диоксане (500 мкл) и воде (500 мкл) добавляли гидроксид натрия (60 мг, 1,50 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч, Реакционную смесь подкисляли до тех пор, пока значение pH не становилось равным 3, с помощью 6 M хлористо-водородной кислоты (0,25 мл), разбавляли этилацетатом (1 мл) и водой (1 мл) и разделяли слои, Водный слой экстрагировали этилацетатом (3×2 мл). Комбинированные органические слои сушили над сульфатом натрия, фильтровали и выпаривали с получением титульного соединения (82 мг, 0,493 ммоль, 65%) в виде белого порошка, МС (ИЭР): масса, рассчитанная для C8H10N2O2, 166,1; полученное m/z, 167,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,84 (уш.с, 1H), 9,24 (с, 1H), 7,90 (с, 1H), 3,20 -3,04 (м, 1H), 1,26 (д, J=6,8 Гц, 6H).
Стадия B: (6-Изопропилпиримидин-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон. Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-изопропилпиримидин-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H24F3N5O, 455,2; полученное m/z, 456,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 9,09 (д, J=1,3 Гц, 1H), 7,59 -7,53 (м, 2H), 7,56 (с, 1H), 5,74 -5,62 (м, 1H), 4,09 -3,99 (м, 1H), 3,78 (с, 3H), 3,08 -3,00 (м, 1H), 2,95 (дд, J=16,1, 7,3 Гц, 1H), 2,51 -2,41 (м, 1H), 1,87 -1,36 (м, 6H), 1,23 (д, J=6,9 Гц, 6H).
Пример 291. (6-Метоксипиримидин-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
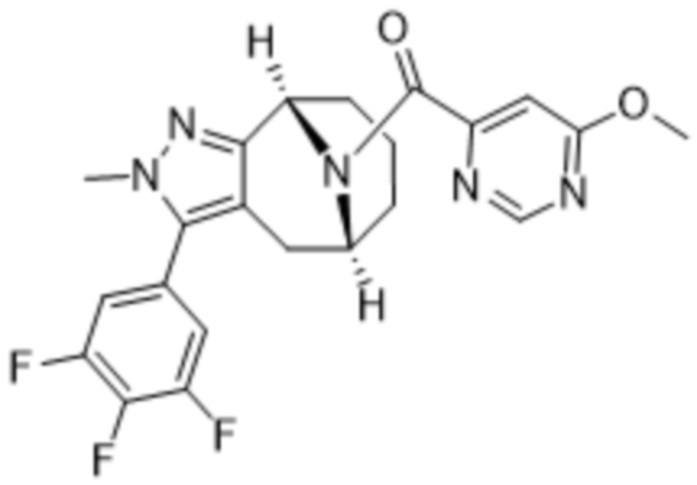
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-метоксипиримидин-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C22H20F3N5O2, 443,2; полученное m/z, 444,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) : 8,84 -8,79 (м, 1H), 7,70 -7,47 (м, 2H), 7,14 -7,07 (м, 1H), 5,76 -5,63 (м, 1H), 4,11 -4,02 (м, 1H), 3,97 (с, 3H), 3,80 (с, 3H), 3,15 -2,89 (м, 1H), 2,65 -2,34 (м, 1H), 2,01 -1,33 (м, 6H).
Пример 292. (6-(Диметиламино)пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
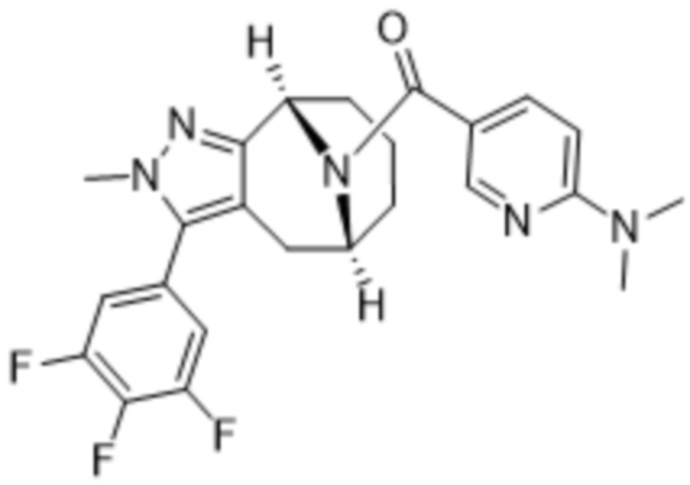
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-(диметиламино)никотиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H24F3N5O, 455,2; полученное m/z, 456,3 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,22 -8,16 (м, 1H), 7,65 -7,45 (м, 3H), 6,62 (д, J=8,8 Гц, 1H), 5,67 -5,46 (м, 1H), 4,32 -4,14 (м, 1H), 3,77 (с, 3H), 3,15 -2,98 (м, 1H), 3,04 (с, 6H), 2,40 (д, J=16,3 Гц, 1H), 1,99 -1,29 (м, 6H).
Пример 293. (5-Метокси-4-метилпиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
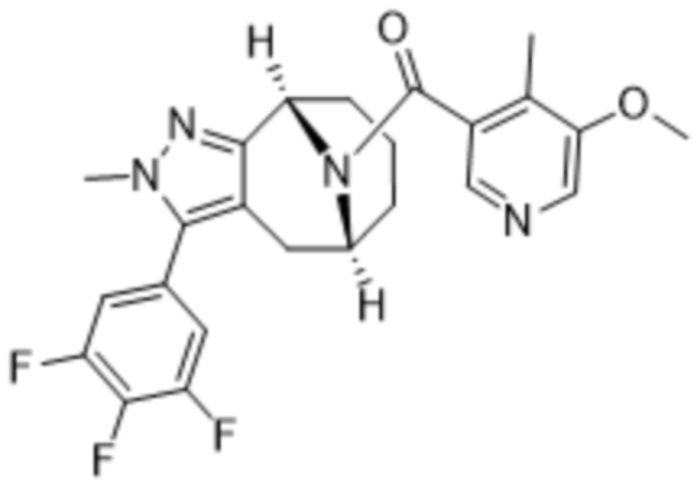
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-метокси-4-метилникотиновой кислоты гидрохлорид вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H23F3N4O2, 456,2; полученное m/z, 457,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) : 8,40 -8,26 (м, 2H), 7,71 -7,48 (м, 2H), 5,89 -5,69 (м, 1H), 3,94 (с, 3H), 3,81 (с, 3H), 3,85 -3,63 (м, 1H), 3,18 -2,94 (м, 1H), 2,41 -2,32 (м, 1H), 2,18 (с, 3H), 2,02 -1,29 (м, 6H).
Пример 294. (6-Метокси-5-метилпиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
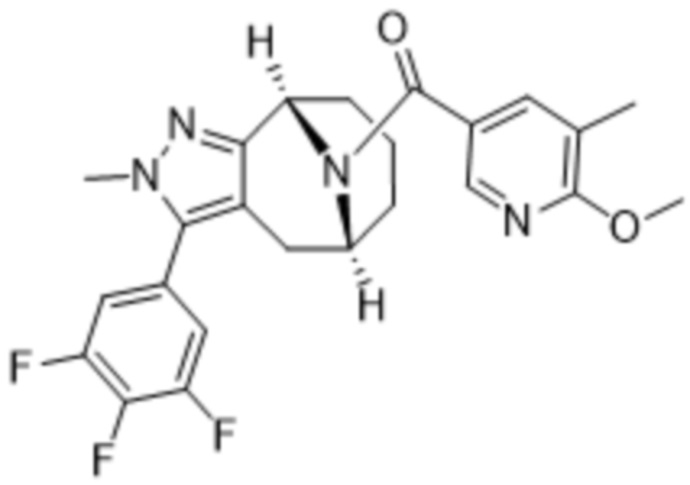
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-метокси-5-метилникотиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H23F3N4O2, 456,2; полученное m/z, 457,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,11 -8,07 (м, 1H), 7,64 -7,52 (м, 3H), 5,66 -5,60 (м, 1H), 4,16 -4,09 (м, 1H), 3,89 (с, 3H), 3,78 (с, 3H), 3,08 (дд, J=16,1, 7,3 Гц, 1H), 2,39 (д, J=16,3 Гц, 1H), 2,15 (с, 3H), 1,87 -1,32 (м, 6H).
Пример 295. (5-Фтор-6-метоксипиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
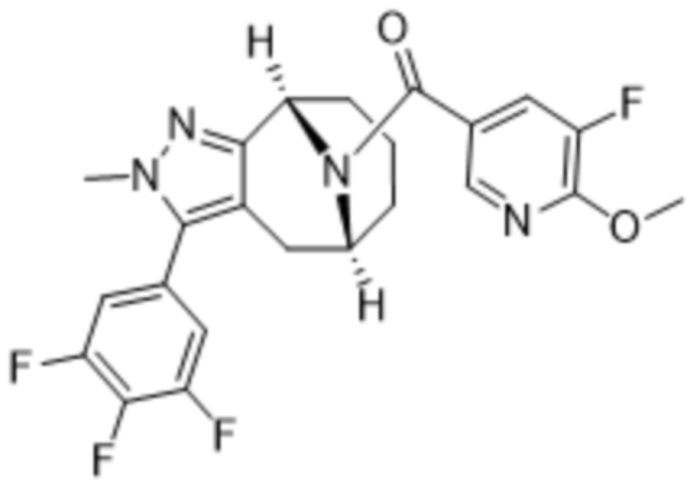
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-фтор-6-метоксиникотиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H20F4N4O2, 460,2; полученное m/z, 461,3 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,08 (д, J=1,9 Гц, 1H), 7,77 (дд, J=10,7, 1,9 Гц, 1H), 7,63 -7,52 (м, 2H), 5,66 -5,59 (м, 1H), 4,15 -4,06 (м, 1H), 3,96 (с, 3H), 3,78 (с, 3H), 3,10 (дд, J=16,3, 7,4 Гц, 1H), 2,38 (д, J=16,3 Гц, 1H), 1,88 -1,30 (м, 6H).
Пример 296. (5-Фтор-2-метоксипиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
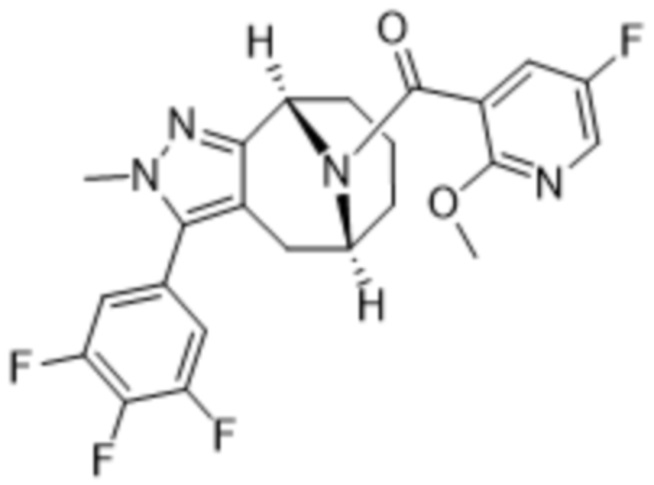
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-фтор-2-метоксиникотиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H20F4N4O2, 460,2; полученное m/z, 461,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,28 -8,17 (м, 2H), 7,61 -7,46 (м, 2H), 5,75 -5,64 (м, 1H), 3,77 (с, 3H), 3,80 -3,69 (м, 4H), 2,91 -2,79 (м, 1H), 2,51 -2,42 (м, 1H), 1,95 -1,29 (м, 6H).
Пример 297. (5,6-Диметоксипиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.

Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5,6-диметоксиникотиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H23F3N4O3, 472,2; полученное m/z, 473,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 7,80 -7,76 (м, 1H), 7,62 -7,53 (м, 2H), 7,30 -7,26 (м, 1H), 5,67 -5,61 (м, 1H), 4,19 -4,12 (м, 1H), 3,88 (с, 3H), 3,79 (с, 3H), 3,78 (с, 3H), 3,06 (дд, J=16,0, 7,4 Гц, 1H), 2,39 (д, J=16,2 Гц, 1H), 2,00 -1,34 (м, 6H).
Пример 298. (5,6-Диметоксипиридин-2-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
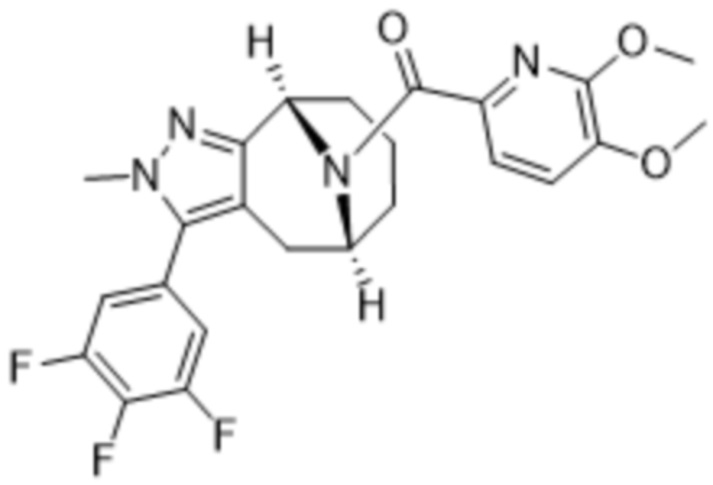
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5,6-диметоксипиколиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H23F3N4O3, 472,2; полученное m/z, 473,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 7,61 -7,48 (м, 2H), 7,34 (д, J=8,0 Гц, 1H), 7,21 (д, J=7,9 Гц, 1H), 5,69 -5,63 (м, 1H), 4,63 -4,55 (м, 1H), 3,84 (с, 3H), 3,80 (с, 3H), 3,76 (с, 3H), 3,03 -2,94 (м, 1H), 2,58 -2,44 (м, 1H), 1,86 -1,70 (м, 2H), 1,68 -1,52 (м, 2H), 1,52 -1,35 (м, 2H).
Пример 299. (3-Хлор-2-метоксипиридин-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
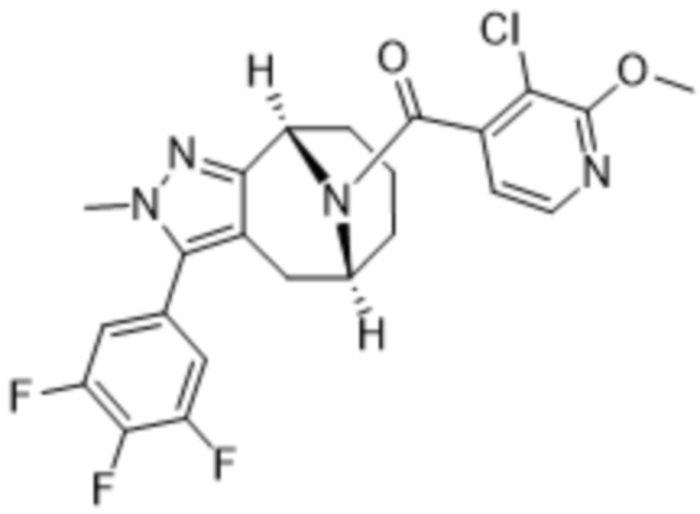
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-хлор-2-метоксиизоникотиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H20ClF3N4O2, 476,1; полученное m/z, 477,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) : 8,17 (д, J=5,1 Гц, 1H), 7,72 -7,43 (м, 2H), 6,99 (д, J=5,0 Гц, 1H), 5,81 -5,65 (м, 1H), 3,98 (с, 3H), 3,81 (с, 3H), 3,85 -3,69 (м, 1H), 2,99 -2,81 (м, 1H), 2,63 -2,33 (м, 1H), 1,98 -1,31 (м, 6H).
Пример 300. (5-Хлор-6-метоксипиридин-2-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
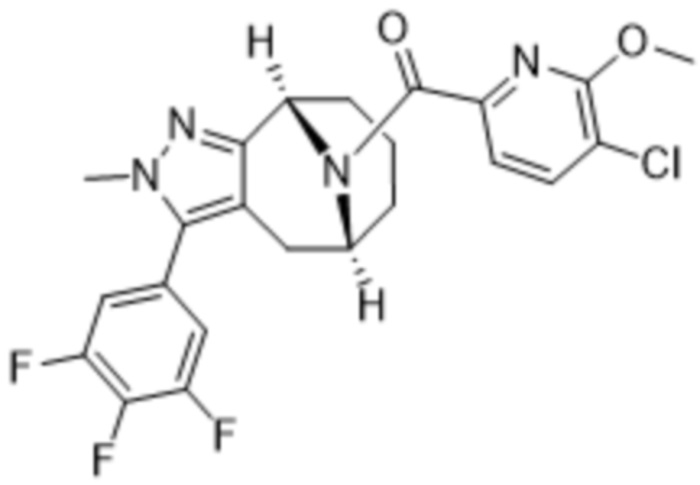
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-хлор-6-метоксипиколиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H20ClF3N4O2, - 476,1; полученное m/z, 477,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) : 8,05 -7,95 (м, 1H), 7,67 -7,46 (м, 2H), 7,22 (д, J=7,8 Гц, 1H), 5,77 -5,61 (м, 1H), 4,45 -4,26 (м, 1H), 3,94 (с, 3H), 3,80 (с, 3H), 3,13 -2,92 (м, 1H), 2,65 -2,35 (м, 1H), 1,95-1,27 (м, 6H).
Пример 301. (4-Хлор-2-метилпиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
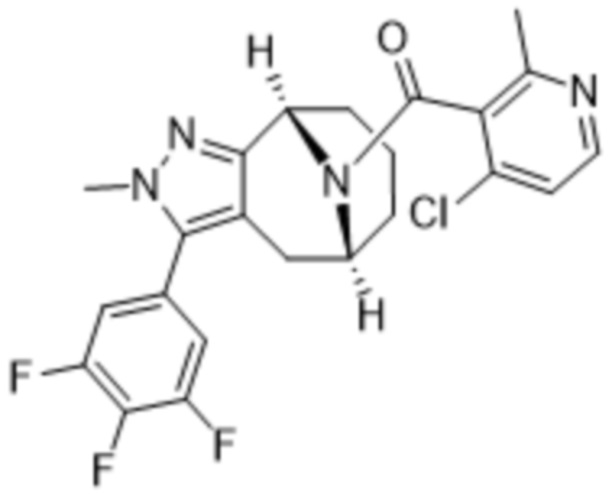
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 4-хлор-2-метилникотиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H20ClF3N4O, - 460,1; полученное m/z, 461,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,48-8,44 (м, 1H), 7,63-7,42 (м, 3H), 5,85-5,82 (м, 1H), 3,80 (с, 3H), 3,82-3,75 (м, 1H), 2,95 (дд, J=16,2, 7,5 Гц, 1H), 2,56-2,46 (м, 1H), 2,26 (с, 3H), 1,92-1,35 (м, 6H).
Пример 302. (4-Хлор-5-метилпиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
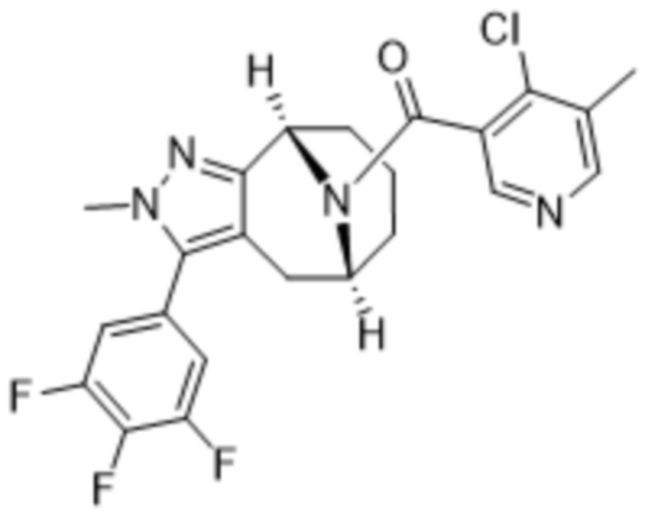
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 4-хлор-5-метилникотиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H20ClF3N4O, - 460,1; полученное m/z, 461,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,57-8,55 (м, 1H), 8,34-8,29 (м, 1H), 7,63-7,55 (м, 2H), 5,79-5,75 (м, 1H), 3,78 (с, 3H), 3,75-3,69 (м, 1H), 3,00-2,93 (м, 1H), 2,36 (с, 3H), 2,40-2,29 (м, 1H), 1,96-1,27 (м, 6H).
Пример 303. (3-Хлор-5-фторпиридин-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
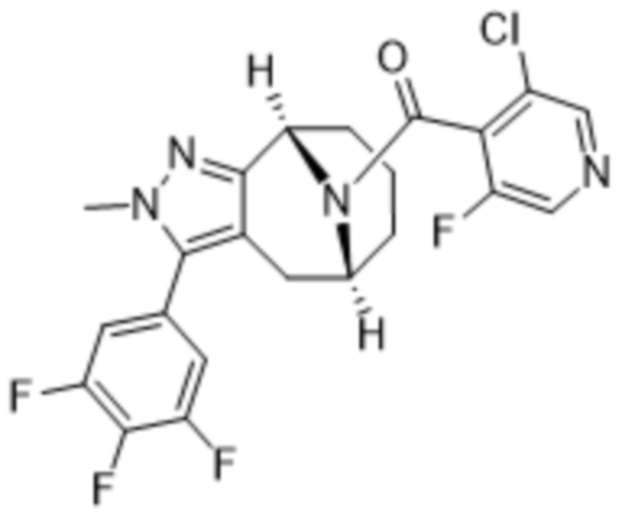
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-хлор-5-фторизоникотиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C22H17ClF4N4O, - 464,1; полученное m/z, 465,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,70 -8,69 (м, 1H), 8,69 -8,68 (м, 1H), 7,63 -7,52 (м, 2H), 5,80 -5,75 (м, 1H), 3,94 -3,86 (м, 1H), 3,80 (с, 3H), 2,79 (дд, J=16,3, 7,3 Гц, 1H), 2,58 -2,45 (м, 1H), 1,89-1,61 (м, 4H), 1,56-1,36 (м, 2H).
Пример 304. (6-Циклопропил-2-метилпиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
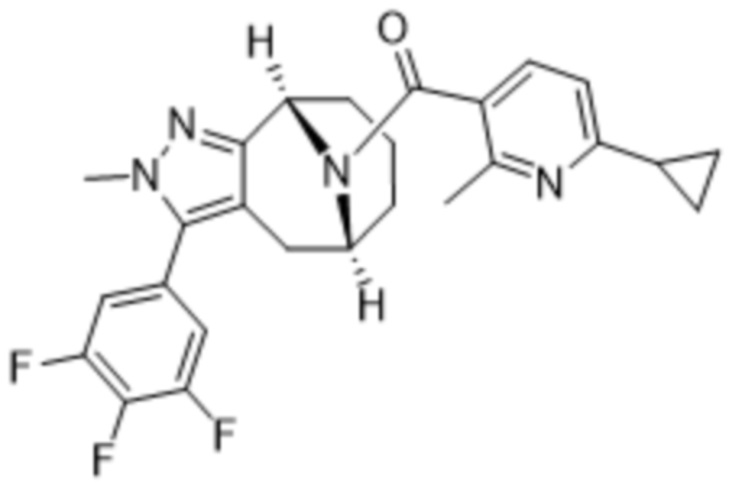
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-циклопропил-2-метилникотиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H25F3N4O, - 466,2; полученное m/z, 467,3 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 7,64-7,49 (м, 3H), 7,14-7,01 (м, 1H), 5,77-5,71 (м, 1H), 3,78 (с, 3H), 3,81-3,70 (м, 1H), 2,96-2,75 (м, 1H), 2,53 (д, J=16,3 Гц, 1H), 2,41-2,36 (м, 3H), 2,10-2,03 (м, 1H), 1,86-1,28 (м, 6H), 0,98-0,82 (м, 4H).
Пример 305. 1-(5-((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбонил)пиридин-2-ил)циклопропан-1-карбонитрил,
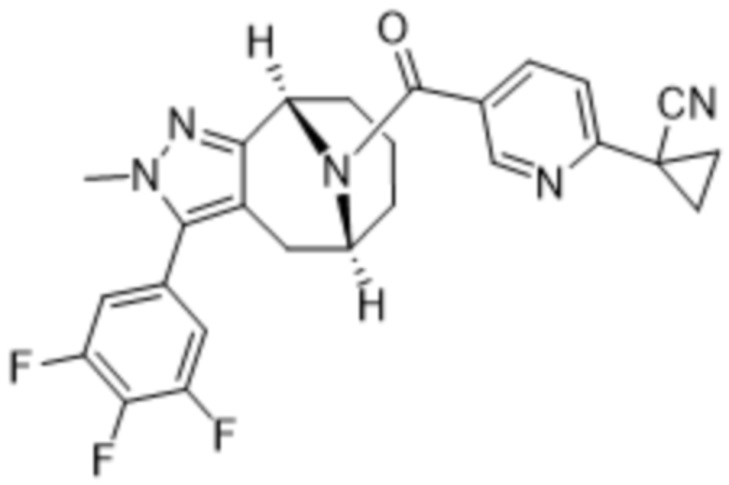
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-(1-цианоциклопропил)никотиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H22F3N5O, 477,2; полученное m/z, - 478,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,56 (д, J=2,1 Гц, 1H), 7,89 (дд, J=8,1, 2,3 Гц, 1H), 7,65-7,53 (м, 3H), 5,72-5,61 (м, 1H), 4,03-3,95 (м, 1H), 3,78 (с, 3H), 3,11-3,01 (м, 1H), 2,38 (д, J=16,3 Гц, 1H), 1,89-1,78 (м, 4H), 1,77-1,32 (м, 6H).
Пример 306. (2-(1H-Пиразол-1-ил)пиридин-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
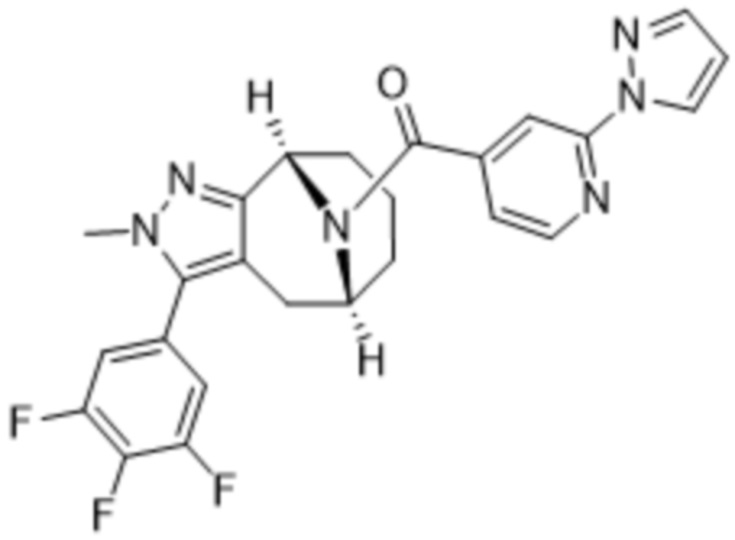
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-(1H-пиразол-1-ил)изоникотиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21F3N6O, 478,2; полученное m/z, - 479,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,63-8,61 (м, 1H), 8,53 (д, J=5,0 Гц, 1H), 7,85-7,81 (м, 2H), 7,63-7,54 (м, 2H), 7,36 (дд, J=5,1, 1,4 Гц, 1H), 6,60-6,57 (м, 1H), 5,73-5,68 (м, 1H), 4,01-3,96 (м, 1H), 3,79 (с, 3H), 2,97 (дд, J=16,3, 7,4 Гц, 1H), 2,43 (д, J=16,3 Гц, 1H), 1,95-1,33 (м, 6H).
Пример 307. (4-(1H-Пиразол-1-ил)пиридин-2-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
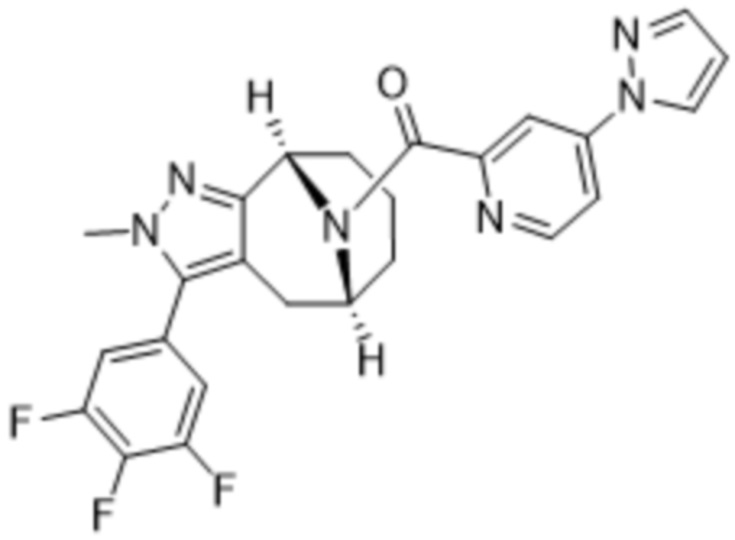
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 4-(1H-пиразол-1-ил)пиколиновую кислоту (промежуточное соединение 78) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21F3N6O, - 478,2; полученное m/z, 479,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) : 8,88-8,74 (м, 1H), 8,64 (д, J=5,6 Гц, 1H), 8,07-8,02 (м, 1H), 8,02-7,94 (м, 1H), 7,93-7,83 (м, 1H), 7,68-7,45 (м, 2H), 6,74-6,57 (м, 1H), 5,82-5,69 (м, 1H), 4,30-4,16 (м, 1H), 3,81 (с, 3H), 3,14-2,91 (м, 1H), 2,67-2,36 (м, 1H), 2,06-1,30 (м, 6H).
Пример 308. (4-(1H-Пиразол-1-ил)пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
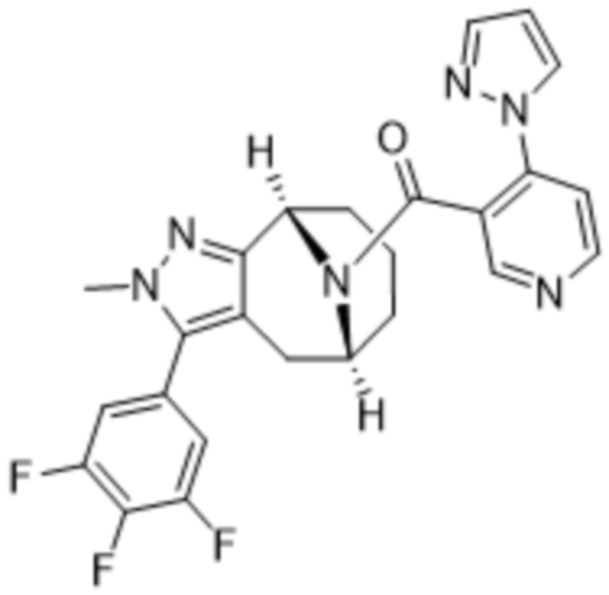
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 4-(1H-пиразол-1-ил)никотиновую кислоту (промежуточное соединение 82) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21F3N6O, - 478,2; полученное m/z, 479,3 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,70 (д, J=5,6 Гц, 1H), 8,50-8,46 (м, 1H), 8,42 (д, J=2,6 Гц, 1H), 7,86 (д, J=1,6 Гц, 1H), 7,79 (д, J=5,5 Гц, 1H), 7,63-7,54 (м, 2H), 6,65-6,62 (м, 1H), 5,76-5,70 (м, 1H), 3,78 (с, 3H), 3,75-3,67 (м, 1H), 2,97 (дд, J=16,3, 7,4 Гц, 1H), 2,29 (д, J=16,1 Гц, 1H), 1,93-1,17 (м, 6H).
Пример 309. (6-(1H-Пиразол-1-ил)пиридин-2-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
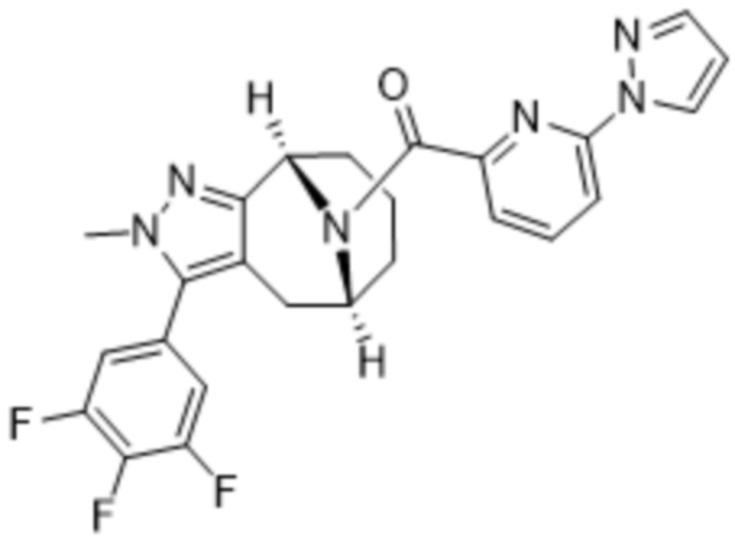
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-(1H-пиразол-1-ил)пиколиновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21F3N6O, 478,2; полученное m/z, - 479,1 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) : 8,59-8,56 (м, 1H), 8,17-8,07 (м, 1H), 8,06-7,97 (м, 1H), 7,87-7,83 (м, 1H), 7,68-7,46 (м, 3H), 6,61-6,54 (м, 1H), 5,80-5,71 (м, 1H), 4,32-4,21 (м, 1H), 3,81 (с, 3H), 3,09-2,97 (м, 1H), 2,56-2,38 (м, 1H), 1,96-1,37 (м, 6H).
Пример 310. (6-Метил-3-(1H-пиразол-1-ил)пиридин-2-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
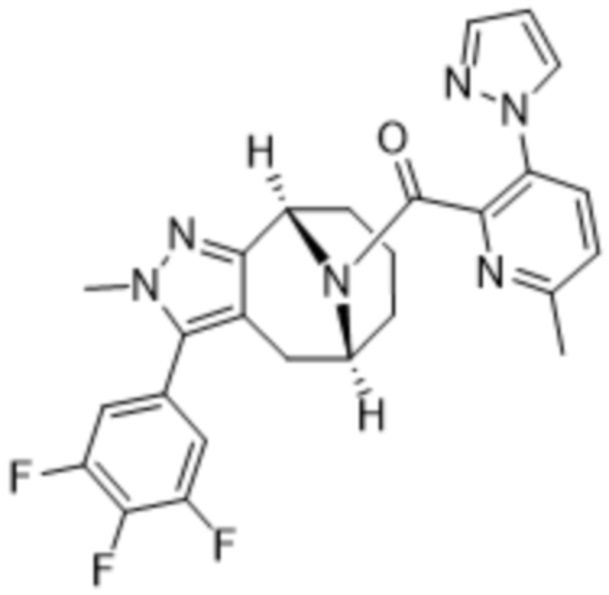
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-метил-3-(1H-пиразол-1-ил)пиколиновую кислоту (промежуточное соединение 84) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H23F3N6O, - 492,2; полученное m/z, 493,3 [M+H]+. 1H ЯМР (500 МГц, Хлороформ-d) : 7,98 (д, J=2,5 Гц, 1H), 7,93-7,88 (м, 1H), 7,72-7,67 (м, 1H), 7,34-7,32 (м, 1H), 7,00-6,90 (м, 2H), 6,39-6,35 (м, 1H), 6,02-5,97 (м, 1H), 3,81 (с, 3H), 3,87-3,65 (м, 1H), 2,63 (с, 3H), 2,65-2,57 (м, 1H), 2,17 (д, J=16,1 Гц, 1H), 2,00-1,31 (м, 6H).
Пример 311. (4-Метокси-5-(1H-пиразол-1-ил)пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
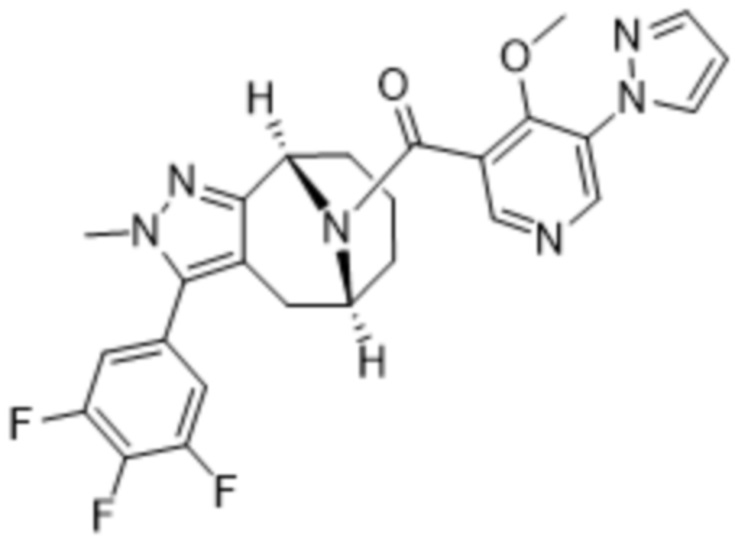
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 4-метокси-5-(1H-пиразол-1-ил)никотиновую кислоту (промежуточное соединение 81) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H23F3N6O2, - 508,2; полученное m/z, 509,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,73 (д, J=2,3 Гц, 1H), 8,41 (д, J=2,3 Гц, 1H), 7,91-7,87 (м, 1H), 7,69-7,66 (м, 1H), 7,59-7,51 (м, 2H), 6,46-6,43 (м, 1H), 5,74-5,70 (м, 1H), 4,07-4,01 (м, 1H), 3,80 (с, 6H), 2,98 (дд, J=16,2, 7,4 Гц, 1H), 2,48-2,43 (м, 1H), 1,85-1,57 (м, 3H), 1,51-1,32 (м, 3H).
Пример 312. (6-Метил-3-(1H-1,2,4-триазол-1-ил)пиридин-2-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
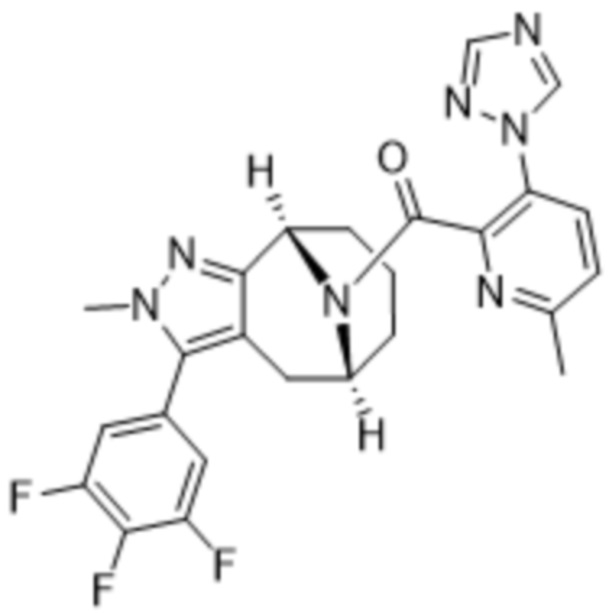
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-метил-3-(1H-1,2,4-триазол-1-ил)пиколиновую кислоту (промежуточное соединение 83) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N7O, - 493,2; полученное m/z, 494,2 [M+H]+. 1H ЯМР (500 МГц, Хлороформ-d) : 8,61 (с, 1H), 8,07 (с, 1H), 7,89 (д, J=8,3 Гц, 1H), 7,38 (д, J=8,3 Гц, 1H), 7,00-6,91 (м, 2H), 6,00-5,95 (м, 1H), 3,82 (с, 3H), 3,80-3,73 (м, 1H), 2,71 (дд, J=16,3, 7,2 Гц, 1H), 2,66 (с, 3H), 2,25 (д, J=16,0 Гц, 1H), 2,01-1,35 (м, 6H).
Пример 313. (5-(4H-1,2,4-Триазол-4-ил)пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
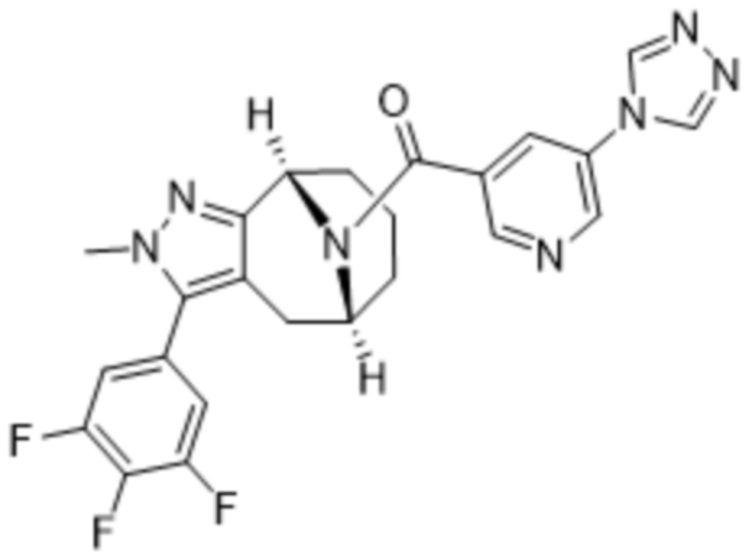
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-(4H-1,2,4-триазол-4-ил)никотиновую кислоту (промежуточное соединение 88) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H20F3N7O, - 479,2; полученное m/z, 480,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 9,25 (с, 2H), 9,10 (д, J=2,6 Гц, 1H), 8,69 (д, J=1,7 Гц, 1H), 8,27 (с, 1H), 7,65-7,54 (м, 2H), 5,77-5,72 (м, 1H), 4,11-4,00 (м, 1H), 3,82 (с, 3H), 3,15-3,04 (м, 1H), 2,44 (д, J=16,3 Гц, 1H), 2,11-1,37 (м, 6H).
Пример 314. (4-(4H-1,2,4-Триазол-4-ил)пиридин-2-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
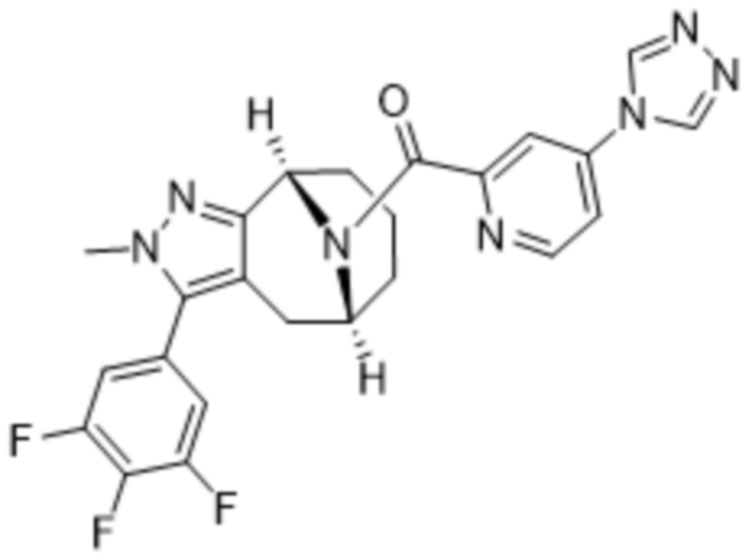
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 4-(4H-1,2,4-триазол-4-ил)пиколиновую кислоту (промежуточное соединение 87) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H20F3N7O, - 479,2; полученное m/z, 480,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 9,41 (с, 2H), 8,74 (д, J=5,5 Гц, 1H), 8,06 (д, J=2,2 Гц, 1H), 7,93 (дд, J=5,5, 2,3 Гц, 1H), 7,62-7,53 (м, 2H), 5,81-5,73 (м, 1H), 4,19-4,10 (м, 1H), 3,81 (с, 3H), 3,01 (дд, J=15,8, 7,2 Гц, 1H), 2,53-2,44 (м, 1H), 1,94-1,40 (м, 6H).
Пример 315. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(6-метил-4-(4H-1,2,4-триазол-4-ил)пиридин-2-ил)метанон.
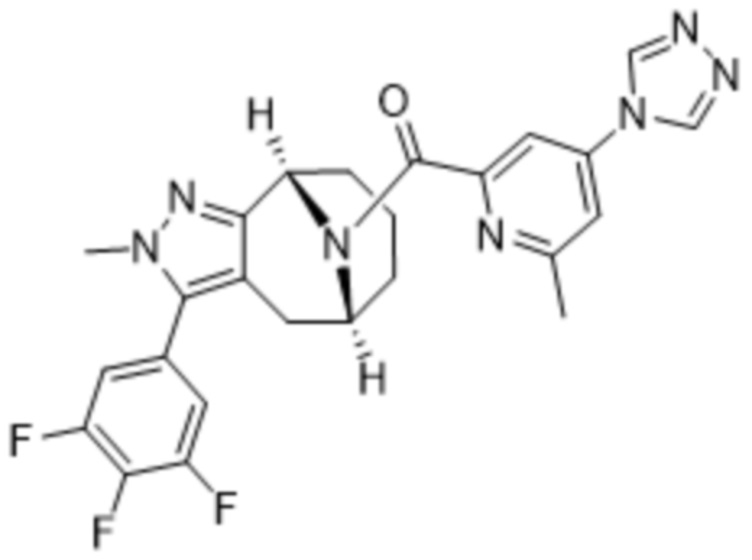
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-метил-4-(4H-1,2,4-триазол-4-ил)пиколиновую кислоту (промежуточное соединение 89) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N7O, - 493,2; полученное m/z, 494,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) : 9,38 (с, 2H), 7,95-7,77 (м, 2H), 7,66-7,48 (м, 2H), 5,80-5,68 (м, 1H), 4,20-4,08 (м, 1H), 3,81 (с, 3H), 3,11-2,95 (м, 1H), 2,72-2,58 (м, 1H), 2,56 (с, 3H), 2,12-1,33 (м, 6H).
Пример 316. (5-(2H-1,2,3-Триазол-2-ил)пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
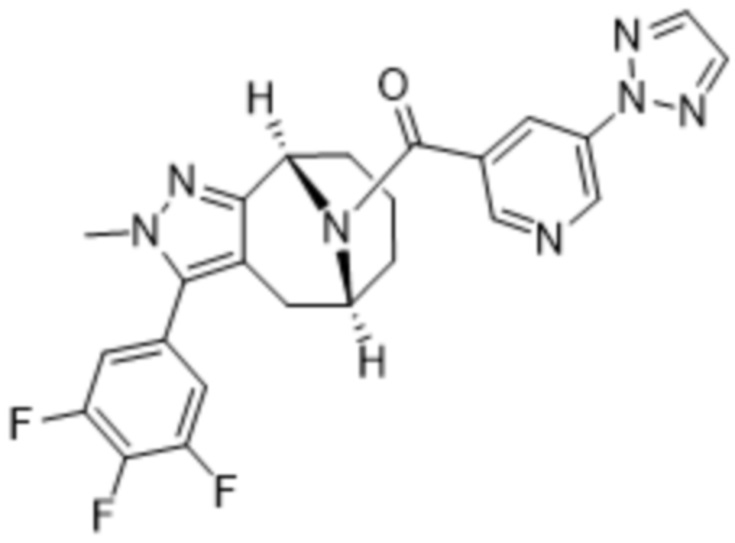
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-(триазол-2-ил)пиридин-3-карбоновую кислоту (промежуточное соединение 90) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H20F3N7O, - 479,2; полученное m/z, 480,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 9,30 (д, J=2,5 Гц, 1H), 8,68 (д, J=1,9 Гц, 1H), 8,38-8,33 (м, 1H), 8,23 (с, 2H), 7,63-7,54 (м, 2H), 5,75-5,69 (м, 1H), 4,12-4,04 (м, 1H), 3,79 (с, 3H), 3,06 (дд, J=16,3, 7,5 Гц, 1H), 2,41 (д, J=16,2 Гц, 1H), 2,01-1,32 (м, 6H).
Пример 317. (3-(2H-1,2,3-Триазол-2-ил)пиридин-2-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
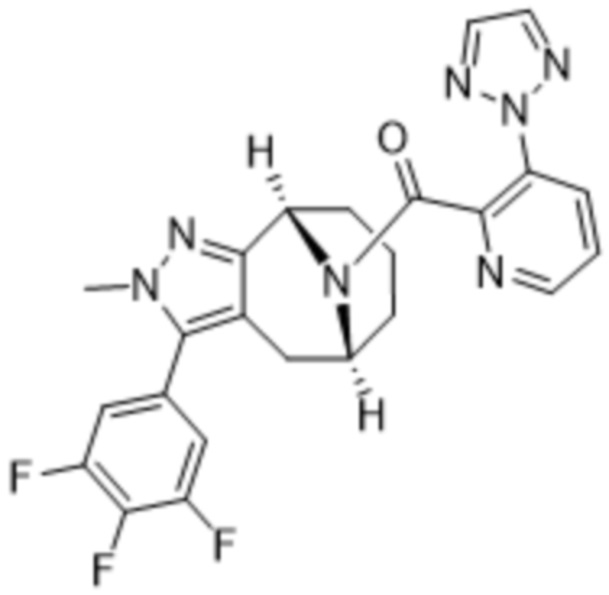
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-(2H-1,2,3-триазол-2-ил)пиколиновую кислоту (промежуточное соединение 85) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H20F3N7O, - 479,2; полученное m/z, 480,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,65 (дд, J=4,7, 1,4 Гц, 1H), 8,36 (дд, J=8,3, 1,5 Гц, 1H), 8,12 (с, 2H), 7,69 (дд, J=8,3, 4,7 Гц, 1H), 7,56-7,52 (м, 2H), 5,69-5,65 (м, 1H), 3,89-3,84 (м, 1H), 3,81 (с, 3H), 2,80 (дд, J=15,9, 7,2 Гц, 1H), 2,44 (д, J=15,9 Гц, 1H), 1,96-1,34 (м, 6H).
Пример 318. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(6-метил-4-(2H-1,2,3-триазол-2-ил)пиридин-2-ил)метанон.
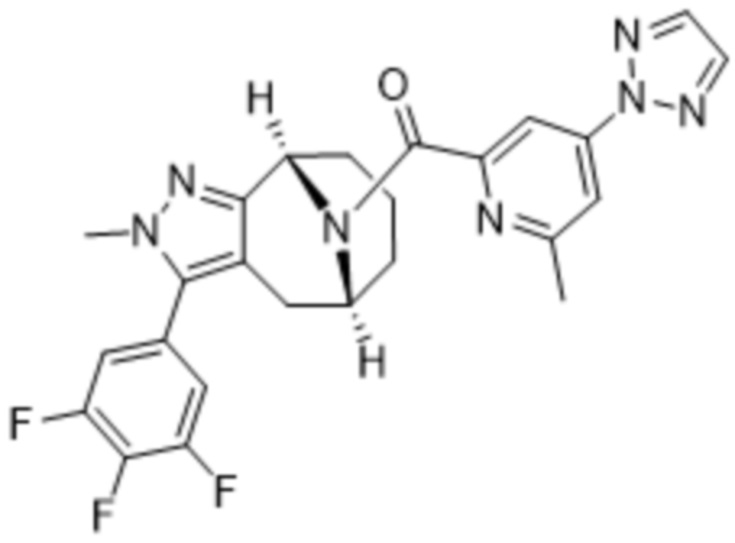
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-метил-4-(2H-1,2,3-триазол-2-ил)пиколиновую кислоту (промежуточное соединение 86) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N7O, - 493,2; полученное m/z, 494,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,25 (с, 2H), 7,94 (д, J=1,9 Гц, 1H), 7,88 (д, J=1,9 Гц, 1H), 7,63-7,50 (м, 2H), 5,75-5,67 (м, 1H), 4,31-4,22 (м, 1H), 3,78 (с, 3H), 3,00 (дд, J=16,0, 7,3 Гц, 1H), 2,57 (с, 3H), 2,49-2,41 (м, 1H), 1,92-1,36 (м, 6H).
Пример 319. (1,5-Диметил-1H-пиразол-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
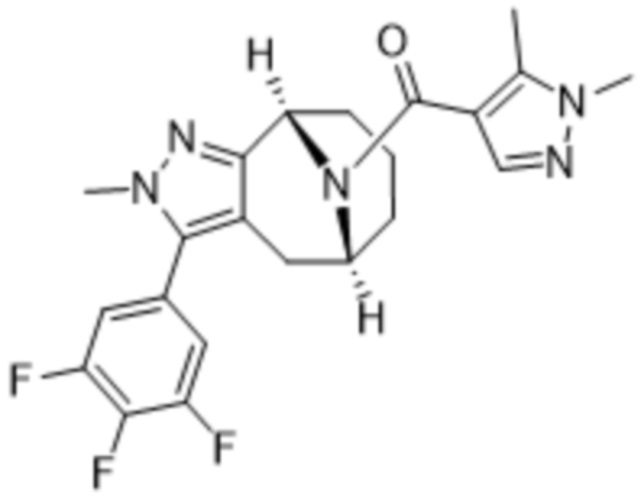
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1,5-диметил-1H-пиразол-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C22H22F3N5O, - 429,2; полученное m/z, 430,1 [M+H]+. 1H ЯМР (500 МГц, Хлороформ-d) δ 7,55-7,39 (м, 1H), 7,03-6,96 (м, 2H), 5,91 (уш.с, 0,33H), 5,34 (уш.с, 0,55H), 5,15 (уш.с, 0,57H), 4,58 (уш.с, 0,36H), 3,85-3,74 (м, 6H), 3,23-2,91 (м, 1H), 2,51-2,31 (м, 4H), 2,06-1,44 (м, 6H).
Пример 320. (5-Этил-1-метил-1H-пиразол-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
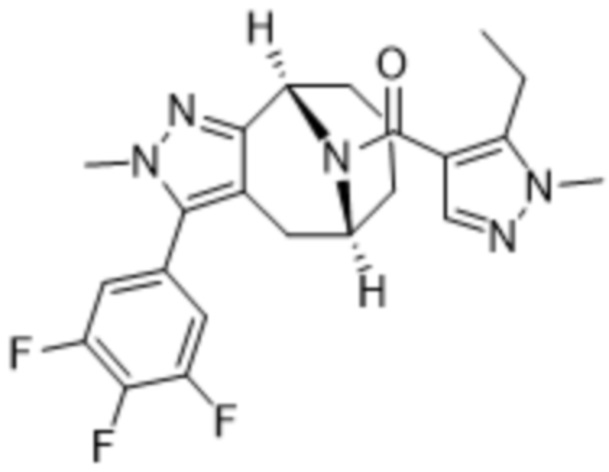
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-этил-1-метил-1H-пиразол-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H24F3N5O, - 443,2; полученное m/z, 444,3 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 7,78 (с, 1H), 7,63-7,47 (м, 2H), 5,70-5,52 (м, 1H), 4,44-4,26 (м, 1H), 3,76 (с, 3H), 3,75-3,70 (м, 3H), 3,10-2,93 (м, 1H), 2,64-2,38 (м, 3H), 1,89-1,51 (м, 4H), 1,47-1,29 (м, 2H), 1,14-0,98 (м, 3H).
Пример 321. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1,3,5-триметил-1H-пиразол-4-ил)метанон.
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1,3,5-триметил-1H-пиразол-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H24F3N5O, - 443,2; полученное m/z, 444,1 [M+H]+. 1H ЯМР (500 МГц, Хлороформ-d) δ 6,99 (уш.с, 2H), 5,93 (уш.с, 0,31H), 5,20 (уш.с, 0,60H), 4,97 (уш.с, 0,57H), 4,22 (уш.с, 0,33H), 3,80 (с, 3H), 3,70 (с, 3H), 3,22-3,10 (м, 0,58H), 2,86 (уш.с, 0,36H), 2,49-2,35 (м, 1,34H), 2,31-2,09 (м, 5,45H), 2,02-1,39 (м, 6,35H).
Пример 322. (5-Метокси-1-метил-1H-пиразол-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-метокси-1-метил-1H-пиразол-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C22H22F3N5O2, - 445,2; полученное m/z, 446,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 7,63-7,56 (м, 2H), 7,44 (с, 1H), 5,65-5,56 (м, 1H), 4,43-4,36 (м, 1H), 3,90 (с, 3H), 3,77 (с, 3H), 3,56 (с, 3H), 3,14 (дд, J=16,3, 7,5 Гц, 1H), 2,42 (д, J=16,4 Гц, 1H), 1,80-1,33 (м, 6H).
Пример 323. (3-Метокси-1-метил-1H-пиразол-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-метокси-1-метил-1H-пиразол-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C22H22F3N5O2, - 445,2; полученное m/z, 446,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 7,76 (с, 1H), 7,60-7,46 (м, 2H), 5,60-5,46 (м, 1H), 4,34-4,21 (м, 1H), 3,79 (с, 3H), 3,75 (с, 3H), 3,67 (с, 3H), 3,02-2,87 (м, 1H), 2,54-2,41 (м, 1H), 1,79-1,52 (м, 4H), 1,50-1,29 (м, 2H).
Пример 324. (3-Фтор-1,5-диметил-1H-пиразол-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-фтор-1,5-диметил-1H-пиразол-4-карбоновую кислоту (промежуточное соединение 91) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C22H21F4N5O, - 447,2; полученное m/z, 448,1 [M+H]+. 1H ЯМР (500 МГц, Хлороформ-d) δ 7,03-6,96 (м, 2H), 5,91 (уш.с, 0,32H), 5,18-5,01 (м, 1,20H), 4,30 (уш.с, 0,32H), 3,81 (уш.с, 3H), 3,68 (с, 3H), 3,24-2,92 (м, 1H), 2,49-2,37 (м, 1H), 2,33-2,20 (м, 3H), 2,01-1,76 (м, 3,20H), 1,76-1,41 (м, 3H).
Пример 325. (5-(Дифторметил)-1-метил-1H-пиразол-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
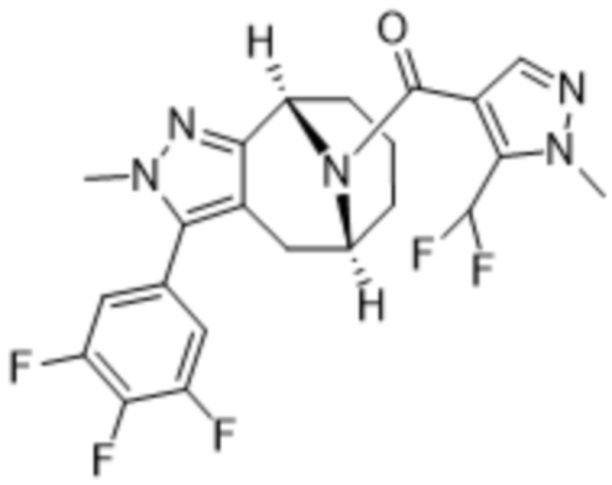
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-(дифторметил)-1-метил-1H-пиразол-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C22H20F5N5O, - 465,2; полученное m/z, 466,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) : 7,76 (с, 1H), 7,69-7,51 (м, 2H), 7,27 (т, J=52,6 Гц, 1H), 5,76-5,57 (м, 1H), 4,36-4,20 (м, 1H), 3,98 (с, 3H), 3,80 (с, 3H), 3,14 (дд, J=16,3, 7,2 Гц, 1H), 2,69-2,32 (м, 1H), 2,01-1,30 (м, 6H).
Пример 326. (1-Циклопропил-5-метил-1H-пиразол-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
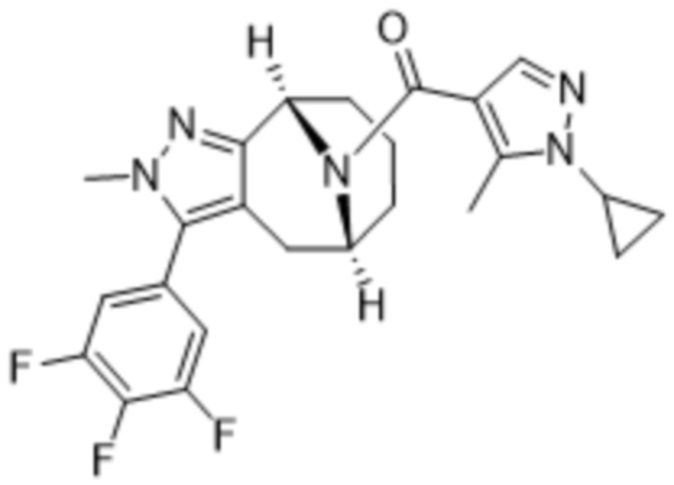
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-циклопропил-5-метил-пиразол-4-карбоновую кислоту (промежуточное соединение 92) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H24F3N5O, - 455,2; полученное m/z, 456,4 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 7,63-7,52 (м, 2H), 7,46 (с, 1H), 5,66-5,51 (м, 1H), 4,46-4,27 (м, 1H), 3,77 (с, 3H), 3,55-3,46 (м, 1H), 3,14-2,96 (м, 1H), 2,45-2,27 (м, 1H), 2,36 (с, 3H), 1,94-1,52 (м, 4H), 1,50-1,30 (м, 2H), 1,09-0,94 (м, 4H).
Пример 327. (1-Циклопропил-3-метил-1H-пиразол-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.

Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-циклопропил-3-метил-пиразол-4-карбоновую кислоту (промежуточное соединение 93) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H24F3N5O, - 455,2; полученное m/z, 456,3 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 7,86 (с, 1H), 7,61-7,48 (м, 2H), 5,68-5,53 (м, 1H), 4,42-4,22 (м, 1H), 3,77 (с, 3H), 3,70-3,58 (м, 1H), 3,11-2,94 (м, 1H), 2,57-2,38 (м, 1H), 2,13 (с, 3H), 1,93-1,53 (м, 4H), 1,49-1,30 (м, 2H), 1,07-0,97 (м, 2H), 0,94-0,85 (м, 2H).
Пример 328. (3-Циклопропил-1-метил-1H-пиразол-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
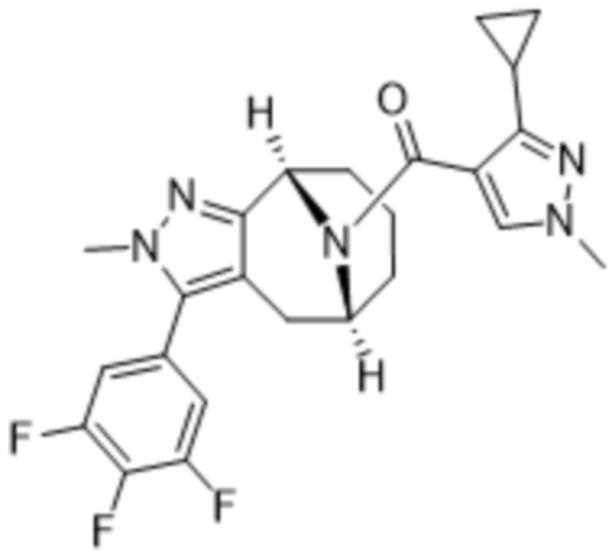
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-циклопропил-1-метил-1H-пиразол-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H24F3N5O, - 455,2; полученное m/z, 456,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 7,75 (с, 1H), 7,61-7,47 (м, 2H), 5,70-5,56 (м, 1H), 4,44-4,26 (м, 1H), 3,76 (с, 3H), 3,70 (с, 3H), 3,07-2,93 (м, 1H), 2,65-2,30 (м, 1H), 2,00-1,54 (м, 5H), 1,50-1,29 (м, 2H), 0,84-0,64 (м, 4H).
Пример 329. Индолизин-7-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
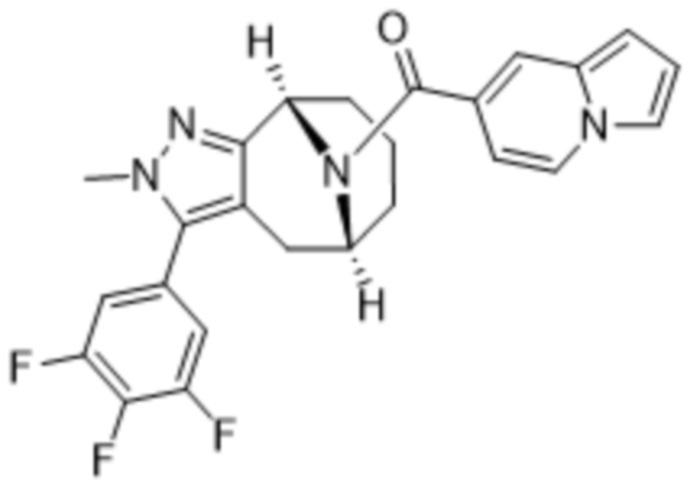
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и индолизин-7-карбоновую кислоту (промежуточное соединение 79) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H21F3N4O, - 450,2; полученное m/z, 451,1 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) : 8,29 (д, J=7,1 Гц, 1H), 7,73-7,45 (м, 4H), 6,90-6,74 (м, 1H), 6,66-6,42 (м, 2H), 5,74-5,51 (м, 1H), 4,46-4,20 (м, 1H), 3,80 (с, 3H), 3,10 (дд, J=16,6, 7,4 Гц, 1H), 2,63-2,33 (м, 1H), 2,06-1,33 (м, 6H).
Пример 330. (4-Фторпиразолo[1,5-a]пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
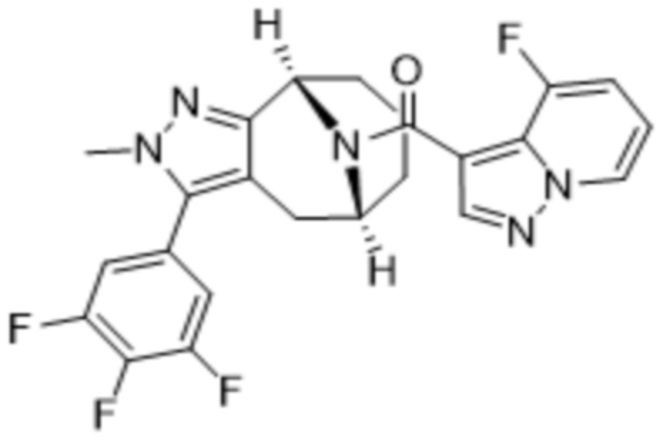
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 4-фторпиразоло[1,5-a] пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H19F4N5O, - 469,2; полученное m/z, 470,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,68 (д, J=7,0 Гц, 1H), 8,20 (д, J=47,2 Гц, 1H), 7,60 (т, J=7,8 Гц, 2H), 7,26 (дд, J=10,6, 7,7 Гц, 1H), 7,01 (д, J=6,3 Гц, 1H), 5,81-5,65 (м, 1H), 5,15-4,16 (м, 1H), 3,84-3,65 (м, 3H), 3,13-3,01 (м, 1H), 2,46-2,22 (м, 1H), 1,99-1,36 (м, 6H).
Пример 331. (6-Фторпиразолo[1,5-a]пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
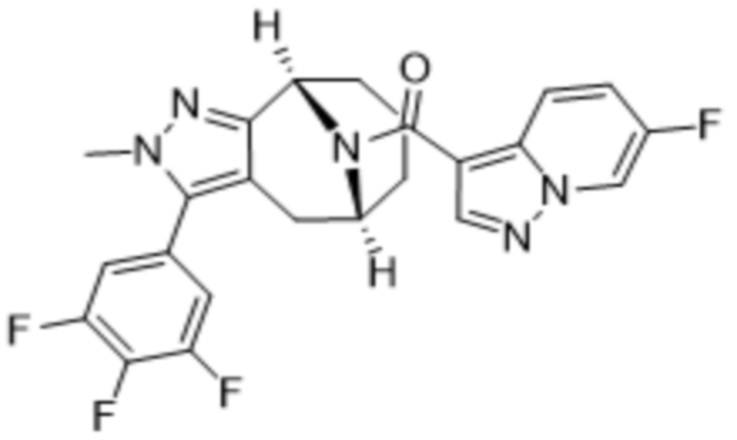
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-фторпиразоло[1,5-a] пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H19F4N5O, - 469,1; полученное m/z, 470,0 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,18-9,08 (м, 1H), 8,32 (с, 1H), 7,92 (с, 1H), 7,67-7,47 (м, 3H), 5,75-5,34 (м, 1H), 5,04-4,62 (м, 1H), 3,79 (с, 3H), 3,23-3,02 (м, 1H), 2,61-2,52 (м, 1H), 2,01-1,37 (м, 6H).
Пример 332. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(7-метилпиразолo[1,5-a]пиридин-3-ил)метанон.
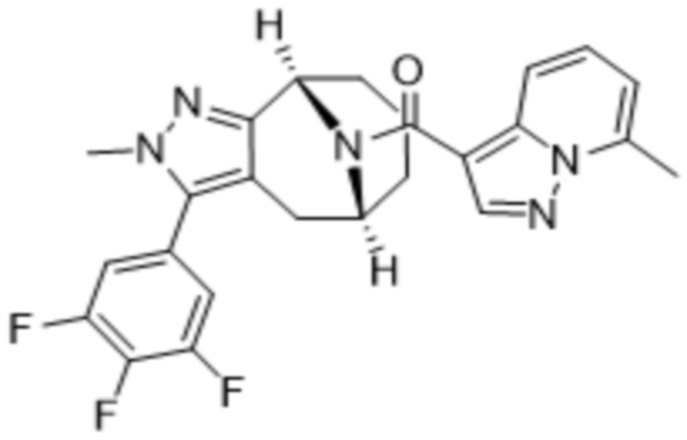
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 7-метилпиразоло[1,5-a] пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N5O, - 465,2; полученное m/z, 466,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,30 (с, 1H), 7,77 (с, 1H), 7,60 (т, J=7,7 Гц, 2H), 7,38 (дд, J=8,9, 6,9 Гц, 1H), 7,04-6,93 (м, 1H), 5,77-5,33 (м, 1H), 5,04-4,51 (м, 1H), 3,79 (с, 3H), 3,25-3,12 (м, 1H), 2,72 (с, 3H), 2,59-2,51 (м, 1H), 2,05-1,36 (м, 6H).
Пример 333. (4-Метоксипиразолo[1,5-a]пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
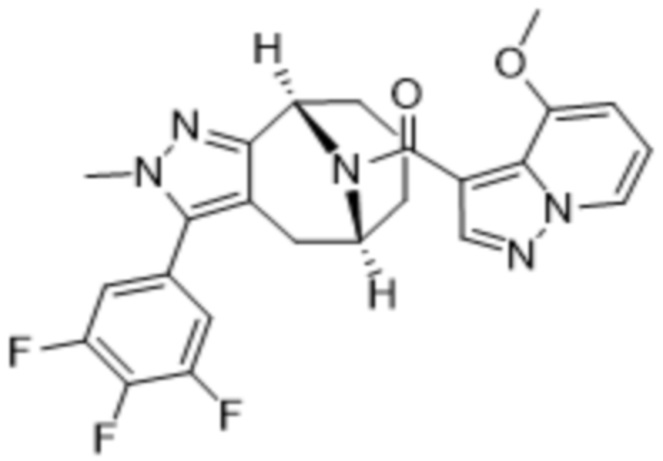
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 4-метоксипиразоло[1,5-a] пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N5O2, - 481,2; полученное m/z, 482,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,34 (дд, J=9,4, 6,8 Гц, 1H), 7,98 (с, 1H), 7,65-7,51 (м, 2H), 6,93-6,84 (м, 1H), 6,67 (дд, J=26,1, 7,7 Гц, 1H), 5,80-5,10 (м, 1H), 4,64-3,91 (м, 1H), 3,83-3,42 (м, 6H), 3,14-2,72 (м, 1H), 2,37 (д, J=16,0 Гц, 1H), 1,91-1,34 (м, 6H).
Пример 334. (6-Метоксипиразолo[1,5-a] пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
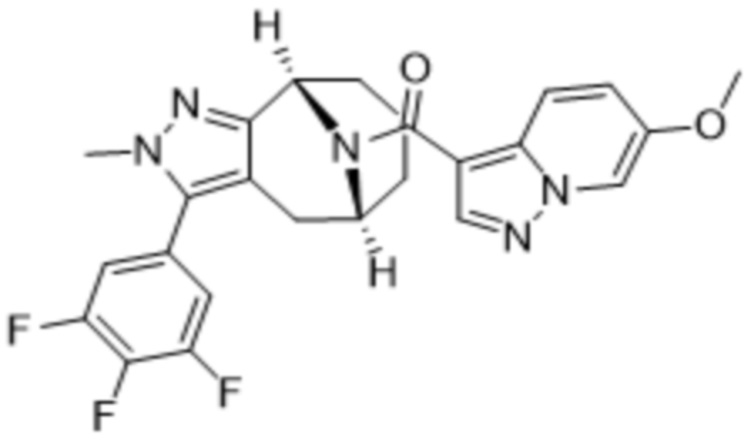
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-метоксипиразоло[1,5-a] пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N5O2, - 481,1; полученное m/z, 482,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,51 (дд, J=2,3, 0,8 Гц, 1H), 8,19 (с, 1H), 7,79 (д, J=9,8 Гц, 1H), 7,61 (т, J=7,9 Гц, 2H), 7,23 (дд, J=9,6, 2,2 Гц, 1H), 5,77-5,35 (м, 1H), 5,04-4,59 (м, 1H), 3,85 (с, 3H), 3,81-3,73 (м, 3H), 3,28-3,12 (м, 2H), 2,00-1,38 (м, 6H).
Пример 335. Имидазо[1,5-a]пиридин-7-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
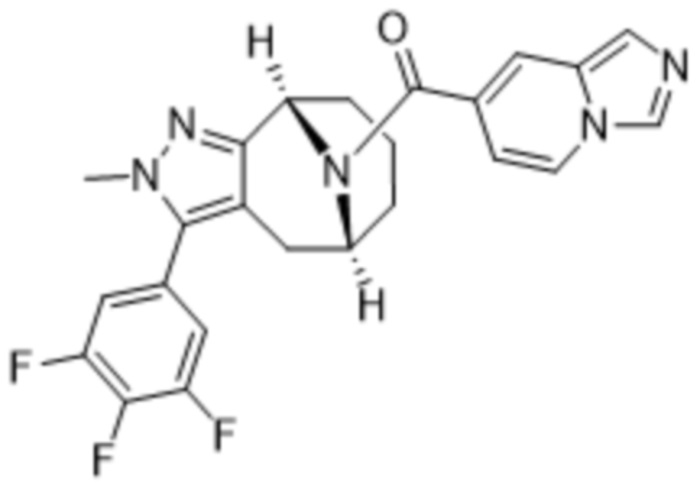
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и имидазо[1,5-a]пиридин-7-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H20F3N5O, - 451,2; полученное m/z, 452,1 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) : 8,51-8,43 (м, 1H), 8,42-8,31 (м, 1H), 7,72-7,54 (м, 3H), 7,53-7,42 (м, 1H), 6,74-6,55 (м, 1H), 5,73-5,55 (м, 1H), 4,43-4,13 (м, 1H), 3,81 (с, 3H), 3,16-3,02 (м, 1H), 2,64-2,33 (м, 1H), 2,05-1,34 (м, 6H).
Пример 336. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метилимидазо[1,5-a]пиридин-6-ил)метанон.
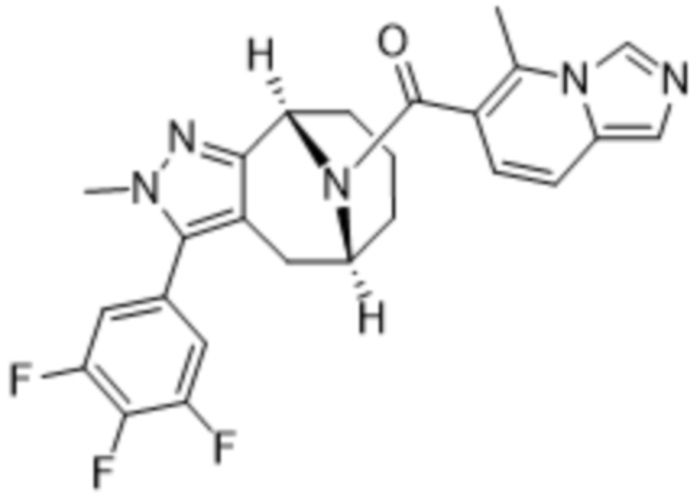
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-метилимидазо[1,5-a]пиридин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N5O, - 465,2; полученное m/z, 466,4 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,38 (с, 1H), 7,63-7,53 (м, 2H), 7,51 (д, J=9,1 Гц, 1H), 7,47 (с, 1H), 6,62 (д, J=9,2 Гц, 1H), 5,77-5,72 (м, 1H), 3,98-3,93 (м, 1H), 3,79 (с, 3H), 2,95 (дд, J=16,1, 7,3 Гц, 1H), 2,59 (с, 3H), 2,54 (дд, J=16,3, 6,9 Гц, 1H), 1,90-1,32 (м, 6H).
Пример 337. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-метилимидазо[1,5-a]пиридин-6-ил)метанон.
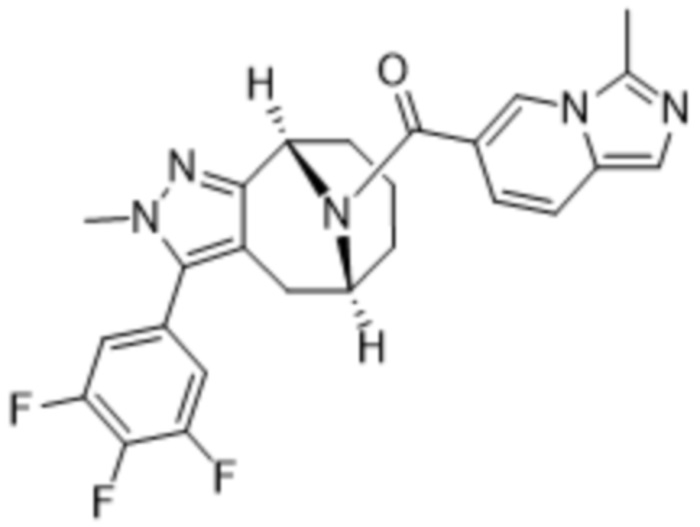
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-метилимидазо[1,5-a]пиридин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N5O, - 465,2; полученное m/z, 466,4 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,46-8,37 (м, 1H), 7,78-7,55 (м, 4H), 7,00-6,93 (м, 1H), 5,72-5,66 (м, 1H), 4,25-4,17 (м, 1H), 3,82 (с, 3H), 3,11-3,04 (м, 1H), 2,74 (с, 3H), 2,57-2,40 (м, 1H), 1,93-1,37 (м, 6H).
Пример 338. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метилимидазо[1,2-a]пиридин-6-ил)метанон.
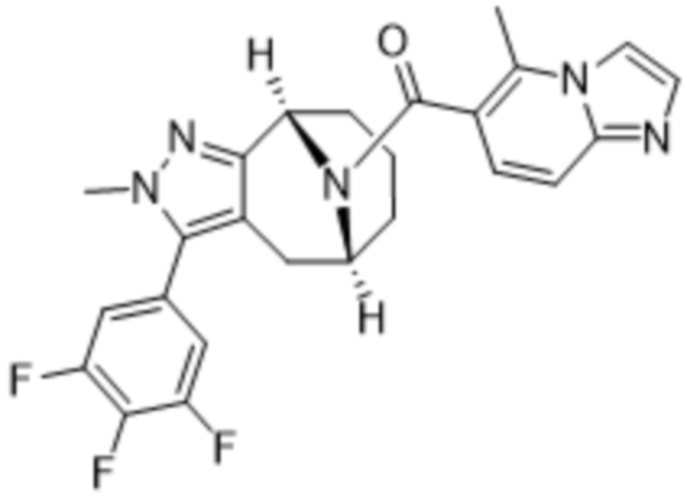
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-метилимидазо[1,2-a]пиридин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N5O, - 465,2; полученное m/z, 466,4 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 7,93-7,91 (м, 1H), 7,69-7,67 (м, 1H), 7,63-7,57 (м, 2H), 7,57-7,45 (м, 1H), 7,07 (д, J=9,1 Гц, 1H), 5,80-5,72 (м, 1H), 3,96-3,88 (м, 1H), 3,79 (с, 3H), 2,96 (дд, J=16,2, 7,3 Гц, 1H), 2,61 (с, 3H), 2,44-2,35 (м, 1H), 1,94-1,52 (м, 4H), 1,51-1,33 (м, 2H).
Пример 339. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(7-метилимидазо[1,2-a]пиридин-5-ил)метанон.
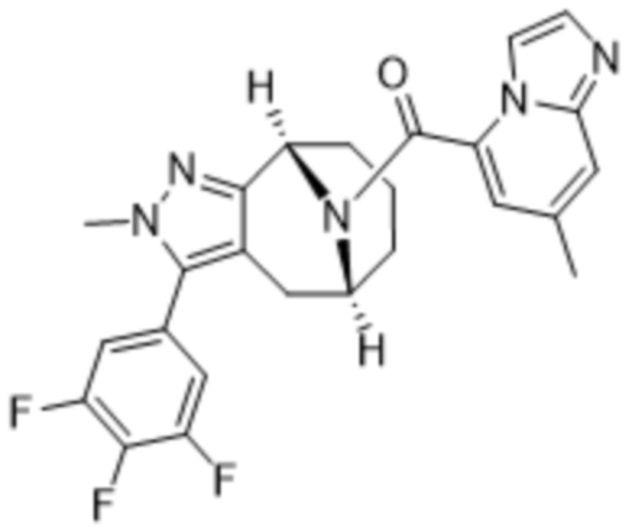
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 7-метилимидазо[1,2-a]пиридин-5-карбоновую кислоту (промежуточное соединение 95) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N5O, - 465,2; полученное m/z, 466,3 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 7,70-7,50 (м, 3H), 7,58-7,53 (м, 1H), 7,47-7,44 (м, 1H), 6,89-6,86 (м, 1H), 5,83-5,74 (м, 1H), 4,09-3,99 (м, 1H), 3,83 (с, 3H), 3,07-2,93 (м, 1H), 2,61-2,44 (м, 1H), 2,38 (с, 3H), 2,10-1,34 (м, 6H).
Пример 340. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-метилимидазо[1,2-a]пиридин-5-ил)метанон.
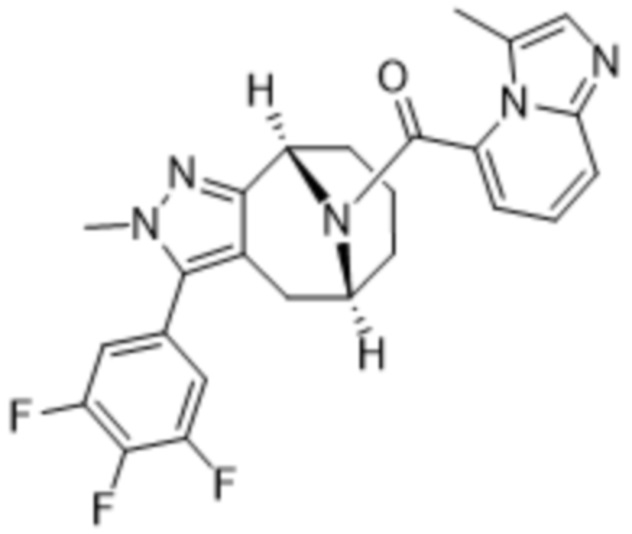
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-метилимидазо[1,2-a]пиридин-5-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N5O, - 465,2; полученное m/z, 466,4 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 7,71-7,61 (м, 2H), 7,61-7,52 (м, 1H), 7,47 (с, 1H), 7,20 (дд, J=9,0, 6,8 Гц, 1H), 6,95 (дд, J=6,9, 1,2 Гц, 1H), 5,90-5,78 (м, 1H), 4,27-4,11 (м, 1H), 3,83 (с, 3H), 3,21 (дд, J=16,1, 7,4 Гц, 1H), 2,55-2,39 (м, 1H), 2,13-1,37 (м, 6H), 1,92 (с, 3H).
Пример 341. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-метилимидазо[1,2-a]пиридин-6-ил)метанон.
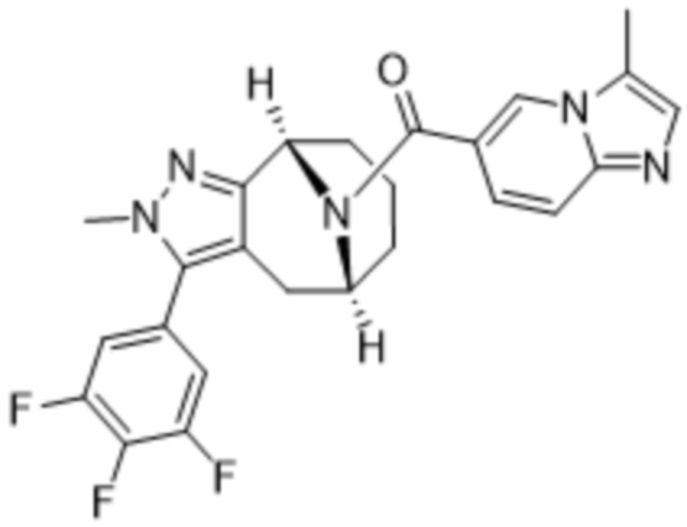
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-метилимидазо[1,2-a]пиридин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N5O, - 465,2; полученное m/z, 466,4 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6) : 8,45-8,36 (м, 1H), 7,70-7,53 (м, 3H), 7,49-7,43 (м, 1H), 7,30-7,10 (м, 1H), 5,78-5,65 и 5,09-4,92 (м, 1H), 4,31 -4,19 и 3,86-3,73 (м, 1H), 3,84 (с, 3H), 3,18-3,03 (м, 1H), 2,62-2,35 (м, 4H), 2,15-1,31 (м, 6H).
Пример 342. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилимидазо[1,2-a]пиридин-6-ил)метанон.
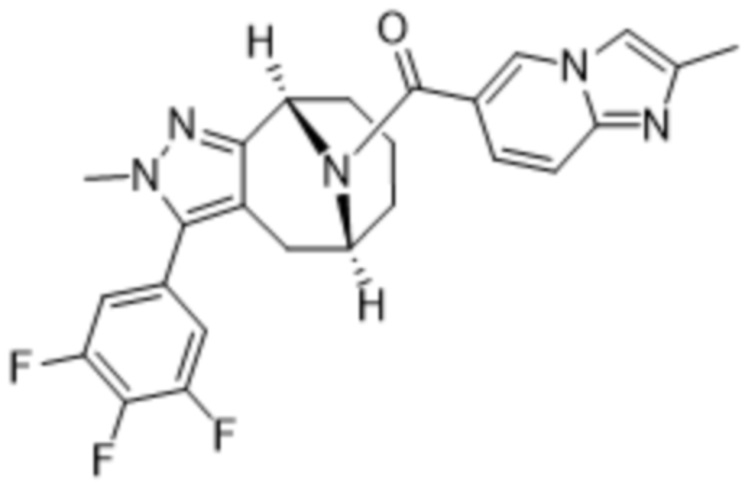
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-метилимидазо[1,2-a]пиридин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N5O, - 465,2; полученное m/z, 466,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,66 (с, 1H), 7,78-7,69 (м, 1H), 7,64-7,56 (м, 3H), 7,52-7,42 (м, 1H), 5,71-5,61 (м, 1H), 4,30-4,19 (м, 1H), 3,81 (с, 3H), 3,09 (дд, J=16,3, 7,4 Гц, 1H), 2,54-2,42 (м, 1H), 2,34 (с, 3H), 1,93-1,37 (м, 6H).
Пример 343. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилимидазо[1,2-a]пиридин-5-ил)метанон.
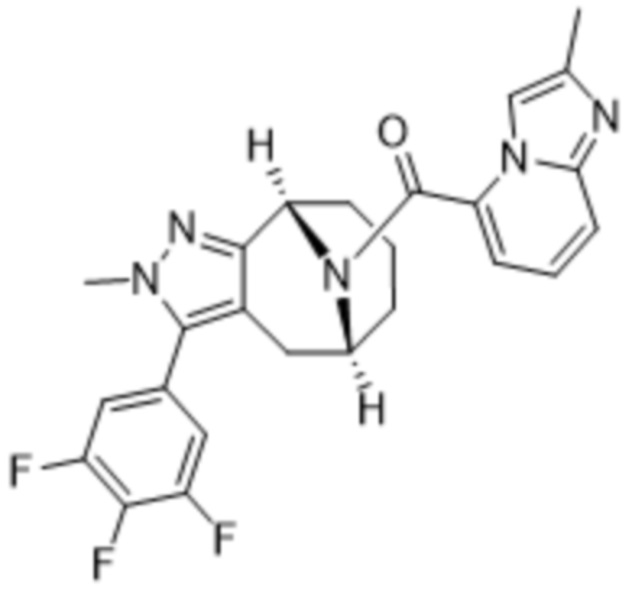
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-метилимидазо[1,2-a]пиридин-5-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N5O, - 465,2; полученное m/z, 466,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 7,64-7,49 (м, 4H), 7,22-7,17 (м, 1H), 6,96-6,91 (м, 1H), 5,79-5,72 (м, 1H), 4,07-4,00 (м, 1H), 3,80 (с, 3H), 3,07-2,93 (м, 1H), 2,46-2,39 (м, 1H), 2,32 (с, 3H), 2,05-1,34 (м, 6H).
Пример 344. Имидазо[1,2-a]пиридин-3-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
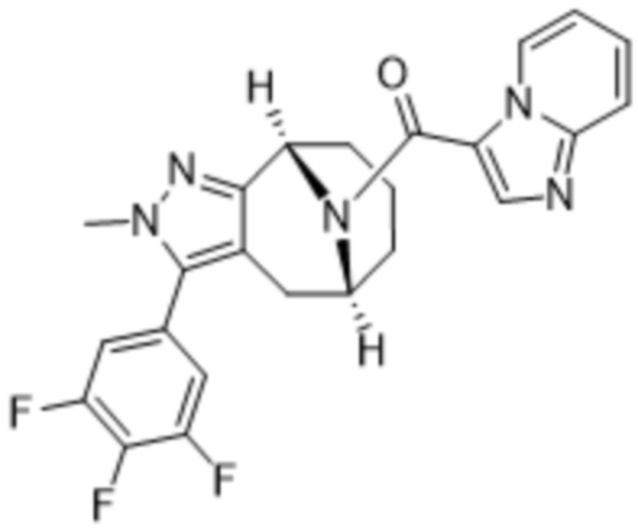
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и имидазо[1,2-a] пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H20F3N5O, - 451,2; полученное m/z, 452,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,92-8,85 (м, 1H), 8,05 (с, 1H), 7,77-7,69 (м, 1H), 7,62 (дд, J=8,8, 6,7 Гц, 2H), 7,50-7,37 (м, 1H), 7,12-7,05 (м, 1H), 5,74-5,60 (м, 1H), 5,03-4,80 (м, 1H), 3,80 (с, 3H), 3,30-3,14 (м, 1H), 2,59-2,52 (м, 1H), 2,05-1,43 (м, 6H).
Пример 345. (7-Фторимидазо[1,2-a]пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
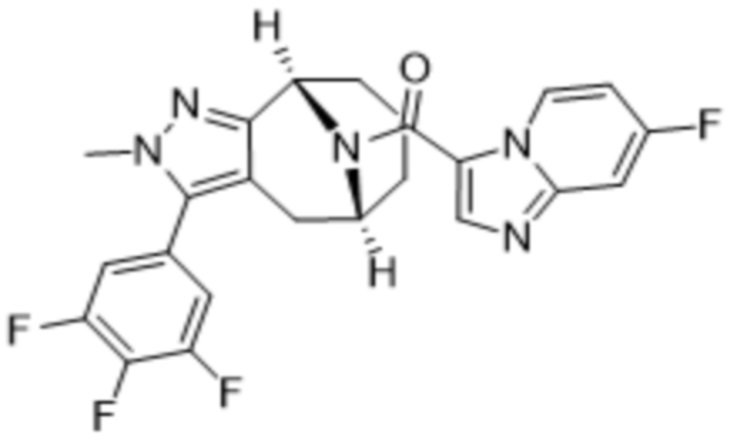
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и калия 7-фторимидазо[1,2-a]пиридин-3-карбоксилат (промежуточное соединение 96) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H19F4N5O, - 469,2; полученное m/z, 470,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,93 (дд, J=7,7, 5,9 Гц, 1H), 8,05 (с, 1H), 7,70-7,53 (м, 3H), 7,21-6,99 (м, 1H), 5,81-5,48 (м, 1H), 5,07-4,81 (м, 1H), 3,80 (с, 3H), 2,65-2,51 (м, 2H), 2,06-1,41 (м, 6H).
Пример 346. (7-Хлоримидазо[1,2-a]пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
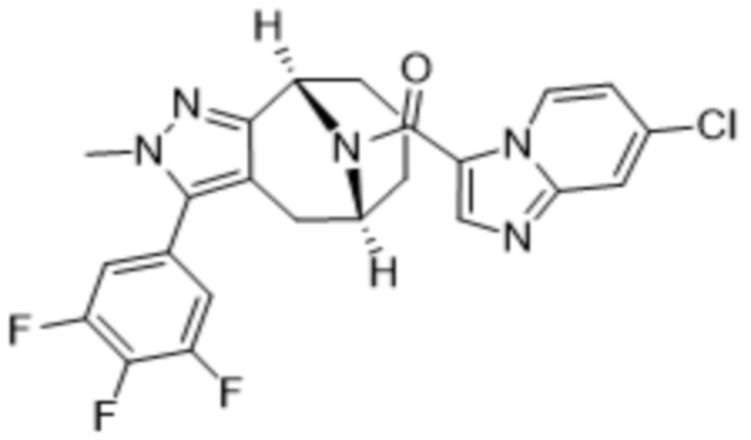
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 7-хлоримидазо[1,2-a] пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H19ClF3N5O, - 485,1; полученное m/z, 486,0 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,65-8,54 (м, 1H), 8,35 (дд, J=3,1, 0,8 Гц, 1H), 7,91-7,77 (м, 1H), 7,63-7,50 (м, 2H), 7,15-7,01 (м, 1H), 5,81-5,57 (м, 1H), 3,82-3,70 (м, 3H), 3,25-2,95 (м, 2H), 2,60-2,52 (м, 1H), 2,03-1,40 (м, 6H).
Пример 347. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилимидазо[1,2-a] пиридин-3-ил) метанон.
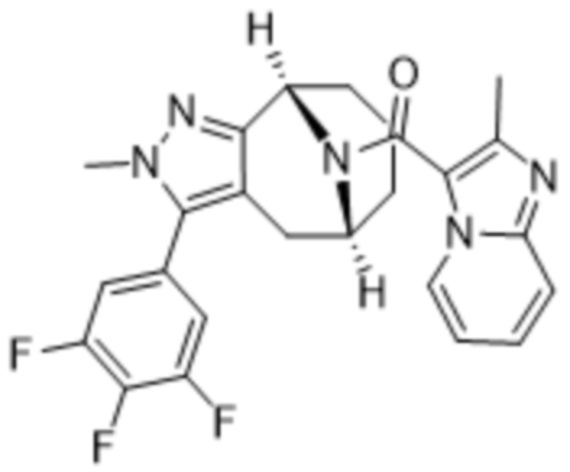
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-метилимидазо[1,2-a]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N5O, - 465,5; полученное m/z, 467,0 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,39 (с, 1H), 7,67-7,51 (м, 3H), 7,41-7,27 (м, 1H), 6,96 (т, J=6,9 Гц, 1H), 5,62-5,12 (м, 1H), 3,80 (с, 3H), 3,22-2,99 (м, 2H), 2,37 (с, 3H), 2,01-1,35 (м, 7H).
Пример 348. (2,7-Диметилимидазо[1,2-a]пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
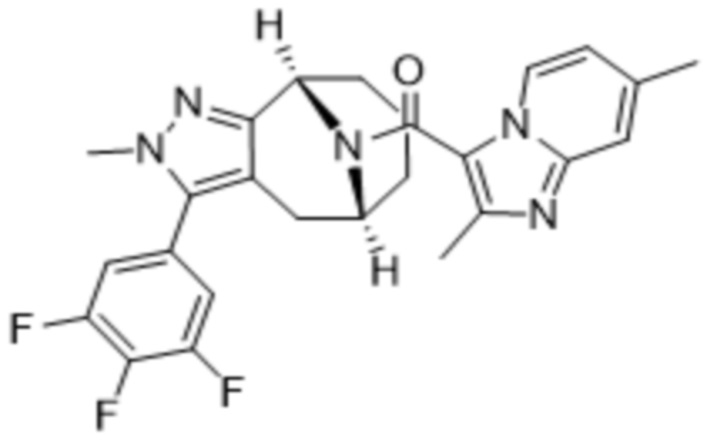
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2,7-диметилимидазо[1,2-a] пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H24F3N5O, - 479,2; полученное m/z, 480,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,28 (с, 1H), 7,59 (дд, J=8,7, 6,6 Гц, 2H), 7,40-7,27 (м, 1H), 6,86-6,73 (м, 1H), 5,52-5,06 (м, 1H), 4,77-4,32 (м, 1H), 3,79 (с, 3H), 3,18-3,01 (м, 1H), 2,55 (с, 1H), 2,40-2,29 (м, 6H), 1,99-1,37 (м, 6H).
Пример 349. ((5R,9S)-3-(3-Фтор-5-метилфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилимидазо[1,2-a]пиридин-3-ил)метанон.
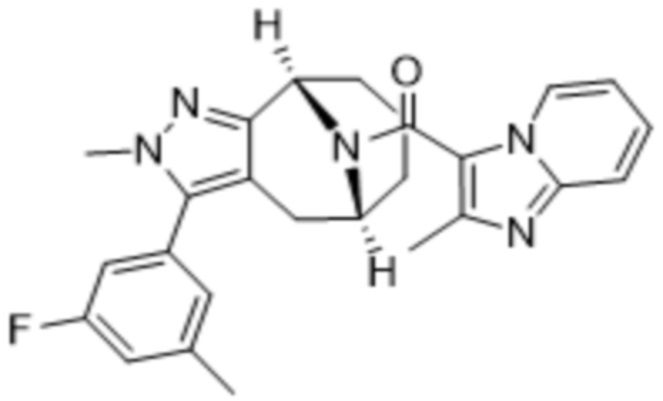
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-фтор-5-метилфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 63) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-метилимидазо[1,2-a]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H26FN5O, - 443,2; полученное m/z, 444,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,39 (с, 1H), 7,61-7,51 (м, 1H), 7,40-7,30 (м, 1H), 7,18 (д, J=10,3 Гц, 2H), 7,11 (д, J=9,8 Гц, 1H), 6,96 (т, J=6,8 Гц, 1H), 5,49-4,80 (м, 1H) 3,78 (с, 3H), 3,22-2,91 (м, 2H), 2,63-2,52 (м, 1H), 2,41-2,30 (м, 6H), 1,95-1,37 (м, 6H).
Пример 350. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метилимидазо[1,2-a]пиридин-3-ил)метанон.
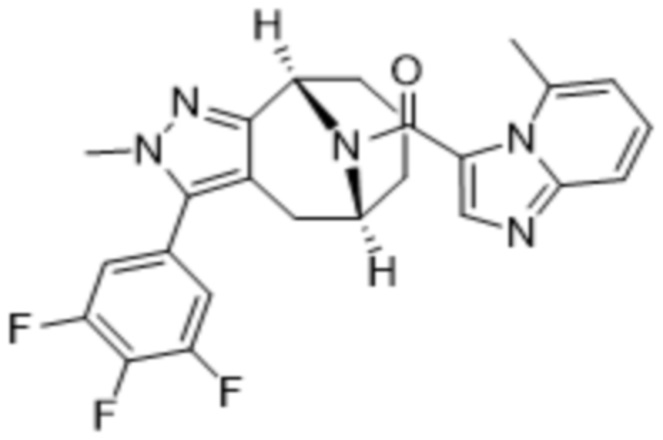
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и лития 5-метилимидазо[1,2-a] пиридин-3-карбоксилат вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N5O, - 465,2; полученное m/z, 466,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 7,95 (с, 1H), 7,72-7,53 (м, 3H), 7,37 (дд, J=9,0, 6,8 Гц, 1H), 6,90 (д, J=6,9 Гц, 1H), 5,83-5,69 (м, 1H), 5,13-4,52 (м, 1H), 3,88-3,69 (м, 3H), 3,23-3,01 (м, 1H), 2,65-2,56 (м, 1H), 2,53-2,48 (м, 3H),1,93-1,37 (м, 6H).
Пример 351. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(7-(трифторметил)имидазо[1,2-a]пиридин-3-ил)метанон.
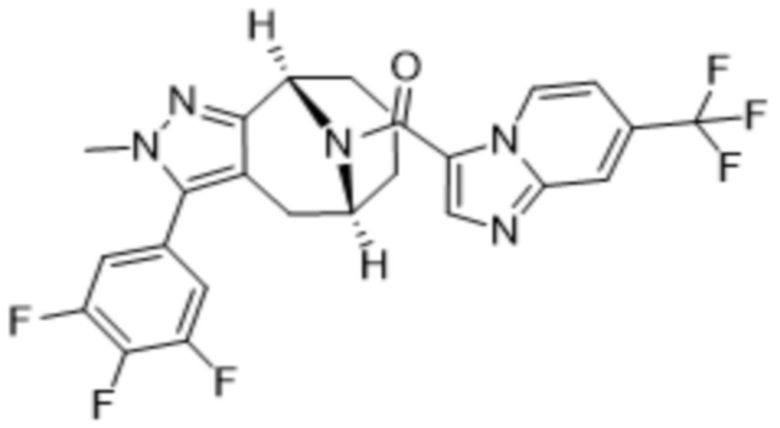
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 7-(трифторметил) имидазо[1,2-a] пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H19F6N5O, - 519,5; полученное m/z, 520,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,03 (д, J=7,3 Гц, 1H), 8,29-8,16 (м, 2H), 7,63 (т, J=7,7 Гц, 2H), 7,35 (дд, J=7,4, 2,0 Гц, 1H), 5,81-5,48 (м, 1H), 5,07-4,72 (м, 1H), 3,81 (с, 3H), 2,63-2,54 (м, 1H), 2,07-1,92 (м, 1H), 1,91-1,41 (м, 6H).
Пример 352. (2-(Дифторметил)имидазо[1,2-a]пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
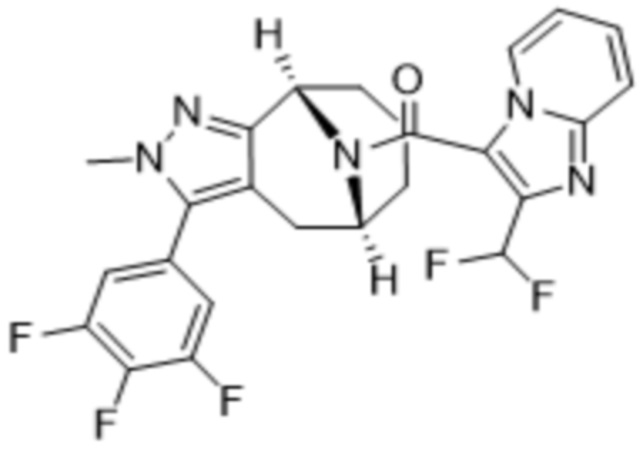
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-(дифторметил)имидазо[1,2-a]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H20F5N5O, - 501,2; полученное m/z, 502,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,28 (д, J=174,0 Гц, 1H), 7,81-7,68 (м, 1H), 7,62-7,42 (м, 3H), 7,36-6,89 (м, 2H), 5,75 (с, 1H), 5,35-4,45 (м, 1H), 3,79 (с, 3H), 3,27-2,75 (м, 2H), 2,11 -1,31 (м, 6H).
Пример 353. (2-Метил-2H-индазол-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
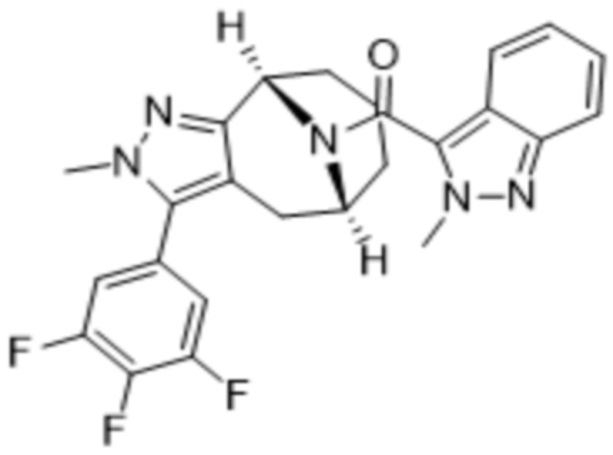
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-метил-2H-индазол-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N5O, - 465,2; полученное m/z, 466,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 7,73-7,55 (м, 3H), 7,35-7,13 (м, 2H), 5,78 (с, 1H), 5,23-4,71 (м, 1H), 4,22-4,00 (м, 3H), 3,87-3,72 (м, 3H), 3,24-2,57 (м, 2H), 2,33-2,02 (м, 1H), 2,11-1,33 (м, 6H).
Пример 354. (2,7-Диметилпиразолo[1,5-a]пиримидин-5-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
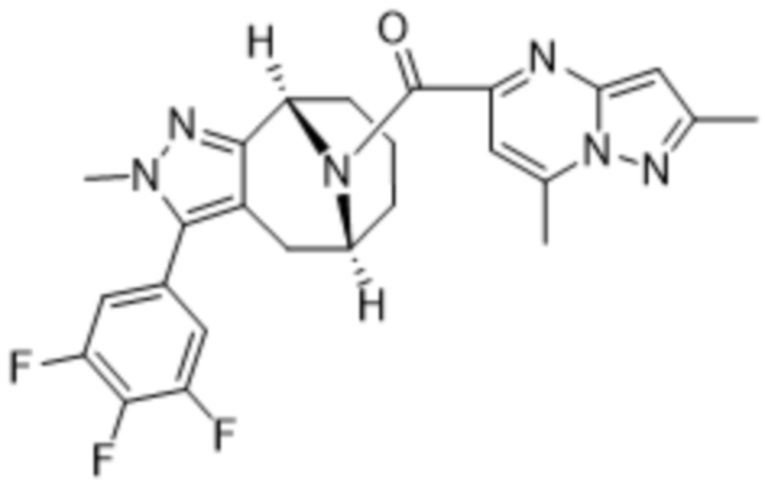
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2,7-диметилпиразоло[1,5-a]пиримидин-5-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H23F3N6O, - 480,2; полученное m/z, 481,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 7,61-7,53 (м, 2H), 7,03-7,01 (м, 1H), 6,56 (с, 1H), 5,71-5,67 (м, 1H), 4,31-4,25 (м, 1H), 3,78 (с, 3H), 2,98 (дд, J=16,1, 7,3 Гц, 1H), 2,70 (с, 3H), 2,51-2,45 (м, 1H), 2,43 (с, 3H), 1,90-1,33 (м, 6H).
Пример 355. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(7-метилпиразолo[1,5-a]пиримидин-6-ил)метанон.
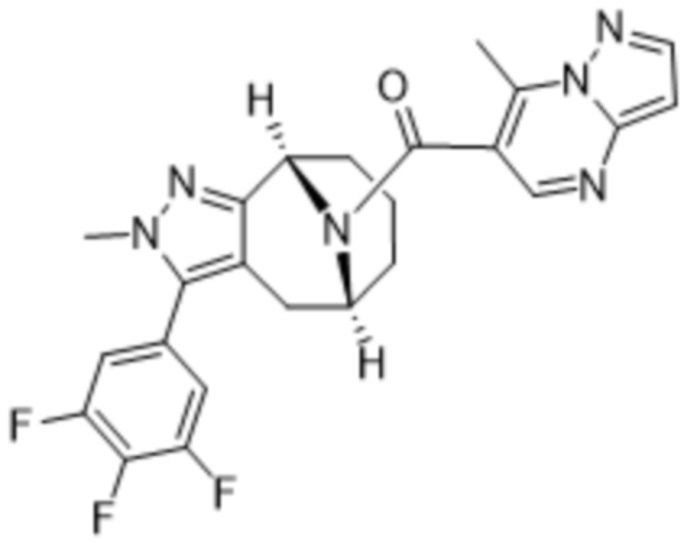
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 7-метилпиразоло[1,5-a]пиримидин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H21F3N6O, - 466,2; полученное m/z, 467,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,43-8,34 (м, 1H), 8,30 (д, J=2,2 Гц, 1H), 7,67-7,52 (м, 2H), 6,80 (д, J=2,3 Гц, 1H), 5,79-5,74 (м, 1H), 4,10-4,04 (м, 1H), 3,80 (с, 3H), 3,21-3,02 (м, 1H), 2,82-2,71 (м, 3H), 2,57 (д, J=16,3 Гц, 1H), 2,01-1,30 (м, 6H).
Пример 356. (5-Изопропил-3-метилпиразолo[1,5-a]пиримидин-7-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
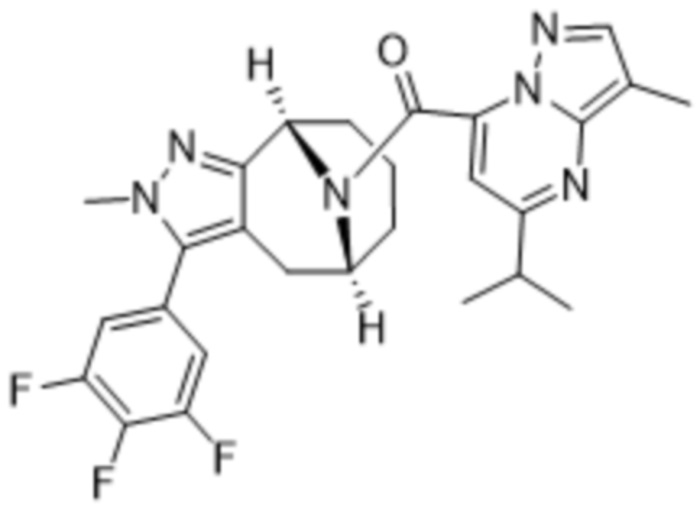
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-изопропил-3-метилпиразоло[1,5-a]пиримидин-7-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C27H27F3N6O, - 508,2; полученное m/z, 509,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,15 (с, 1H), 7,61-7,50 (м, 2H), 6,98 (с, 1H), 5,75-5,70 (м, 1H), 4,42-4,36 (м, 1H), 3,78 (с, 3H), 3,76-3,67 (м, 1H), 3,12-3,01 (м, 1H), 2,52-2,42 (м, 1H), 2,26 (с, 3H), 1,93-1,41 (м, 6H), 1,36 (д, J=7,1 Гц, 6H).
Пример 357. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2,3,5-триметилпиразолo[1,5-a]пиримидин-7-ил)метанон.
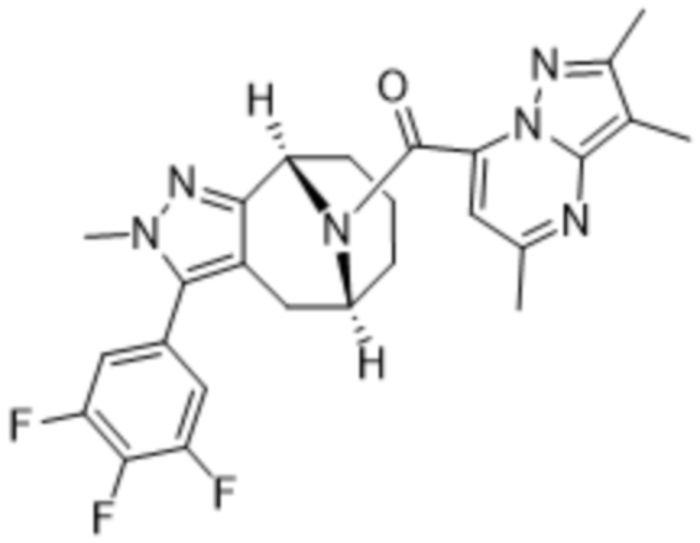
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2,3,5-триметилпиразоло[1,5-a]пиримидин-7-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H25F3N6O, - 494,2; полученное m/z, 495,3 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 7,63-7,54 (м, 2H), 6,73 (с, 1H), 5,77-5,69 (м, 1H), 3,79 (с, 3H), 3,68-3,62 (м, 1H), 2,90 (дд, J=16,3, 7,3 Гц, 1H), 2,55-2,45 (м, 3H), 2,40 (д, J=16,2 Гц, 1H), 2,33 (с, 3H), 2,16 (с, 3H), 1,97-1,67 (м, 3H), 1,59-1,30 (м, 3H).
Пример 358. (7-Циклопропил-2-метилпиразолo[1,5-a]пиримидин-5-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
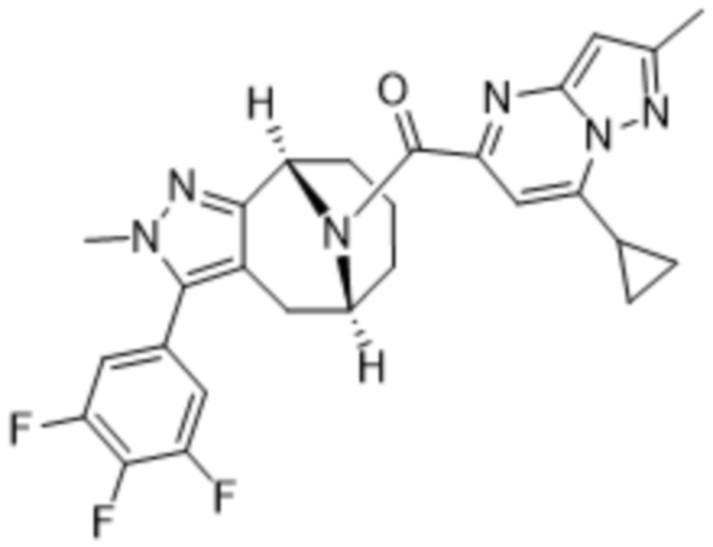
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 7-циклопропил-2-метилпиразоло[1,5-a]пиримидин-5-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C27H25F3N6O, - 506,2; полученное m/z, 507,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 7,62-7,52 (м, 2H), 6,89 (с, 1H), 6,34 (с, 1H), 5,77-5,72 (м, 1H), 3,79 (с, 3H), 3,78-3,65 (м, 1H), 2,92 (дд, J=16,7, 7,4 Гц, 1H), 2,46-2,35 (м, 1H), 2,36 (с, 3H), 2,21-2,01 (м, 1H), 1,96-1,33 (м, 6H), 1,09-0,97 (м, 4H).
Пример 359. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилпиразолo[1,5-a]пиримидин-3-ил)метанон.
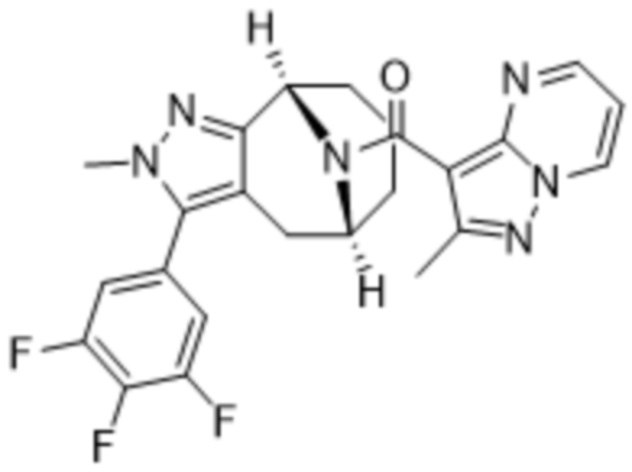
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-метилпиразоло[1,5-a] пиримидин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H21F3N6O, - 466,2; полученное m/z, 467,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,18-9,00 (м, 1H), 8,66-8,50 (м, 1H), 7,68-7,49 (м, 2H), 7,19-6,91 (м, 1H), 5,88-5,00 (м, 1H), 4,94-4,13 (м, 1H), 3,91-3,67 (м, 3H), 3,15-2,94 (м, 1H), 2,47-2,30 (м, 4H), 1,92-1,34 (м, 6H).
Пример 360. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилпиразолo[1,5-b]пиридазин-3-ил)метанон.
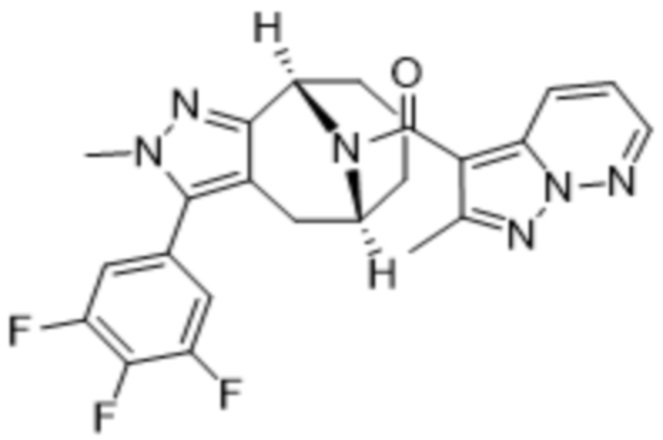
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-метилпиразоло[1,5-b] пиридазин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H21F3N6O, - 466,2; полученное m/z, 467,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,46 (дд, J=4,5, 1,9 Гц, 1H), 8,06 (с, 1H), 7,59 (дд, J=8,7, 6,6 Гц, 2H), 7,29 (дд, J=9,0, 4,5 Гц, 1H), 5,79-4,85 (м, 1H), 4,28-3,94 (м, 1H), 3,80 (с, 3H), 3,21-2,66 (м, 2H), 2,42 (с, 3H), 2,00-1,35 (м, 6H).
Пример 361. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилимидазо[1,2-a]пиразин-8-ил)метанон.
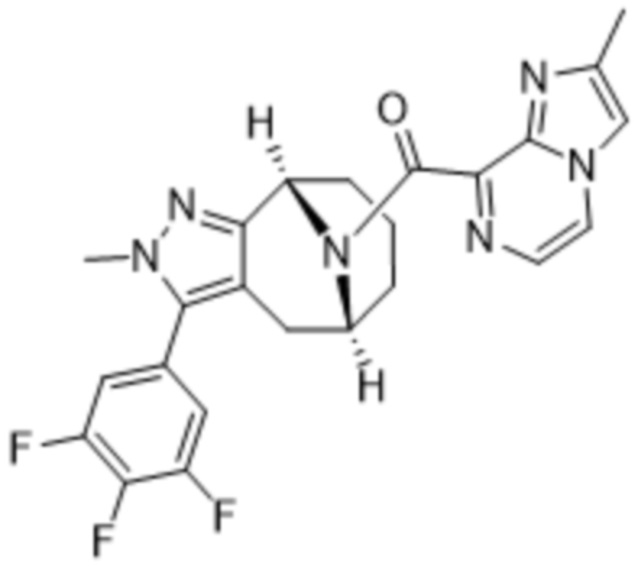
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-метилимидазо[1,2-a]пиразин-8-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H21F3N6O, - 466,2; полученное m/z, 467,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,53 (д, J=4,5 Гц, 1H), 7,96-7,92 (м, 1H), 7,79 (д, J=4,5 Гц, 1H), 7,55-7,46 (м, 2H), 5,80-5,72 (м, 1H), 3,79 (с, 3H), 3,81-3,75 (м, 1H), 2,85 (дд, J=16,0, 7,4 Гц, 1H), 2,41-2,38 (м, 1H), 2,37 (с, 3H), 1,92-1,68 (м, 3H), 1,56-1,35 (м, 3H).
Пример 362. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2,5,8-триметилимидазо[1,2-a]пиразин-3-ил)метанон.
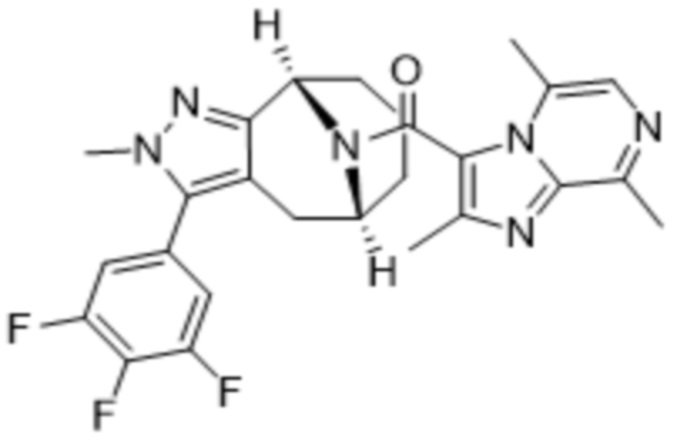
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и калия 2,5,8-триметилимидазо[1,2-a]пиразин-3-карбоксилат (промежуточное соединение 98) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H25F3N6O, - 494,2; полученное m/z, 495,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 7,71-7,48 (м, 3H), 5,89-5,74 (м, 0,5H), 5,25-4,65 (м, 1H), 4,26-4,09 (м, 0,5H), 3,88-3,64 (м, 3H), 3,27-2,78 (м, 2H), 2,73-2,54 (м, 5H), 2,48-2,38 (м, 1H), 2,36-2,20 (м, 1H), 2,14-2,05 (м, 1H), 2,03-1,97 (м, 1H), 1,92-1,40 (м, 6H).
Пример 363. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилимидазо[1,2-b]пиридазин-3-ил)метанон.
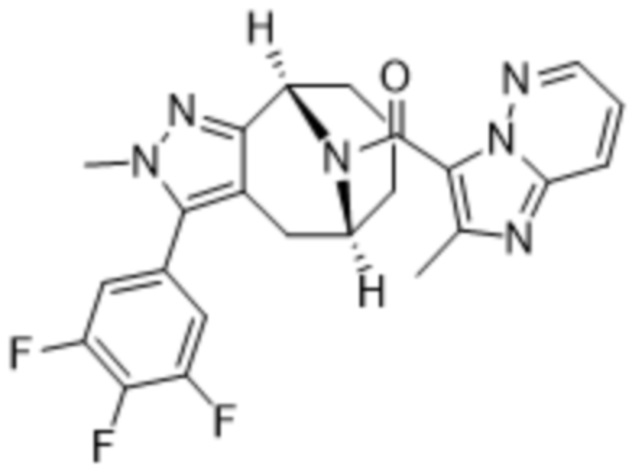
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-метилимидазо[1,2-b] пиридазин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H21F3N6O, - 466,2; полученное m/z, 467,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,52 (д, J=4,4 Гц, 1H), 8,14-8,03 (м, 1H), 7,66-7,52 (м, 2H), 7,33-7,20 (м, 1H), 5,82-5,07 (м, 1H), 4,60-3,99 (м, 1H), 3,85-3,70 (м, 3H), 2,97-2,84 (м, 1H), 2,48-2,22 (м, 4H), 1,96-1,39 (м, 6H).
Пример 364. (2,7-Диметилимидазо[1,2-b]пиридазин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
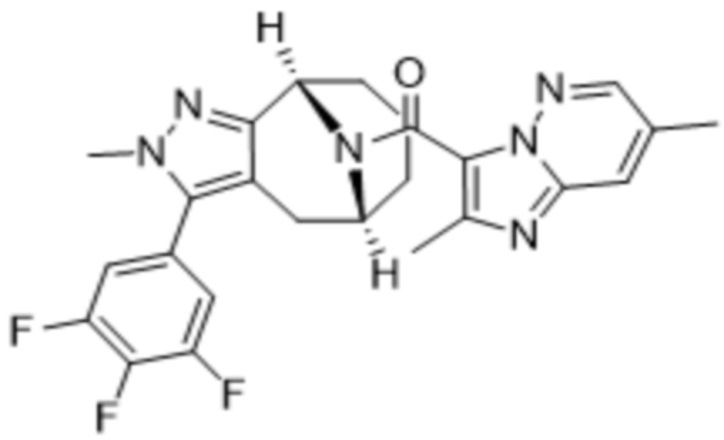
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и калия 2,7-диметилимидазо[1,2-b]пиридазин-3-карбоксилат (промежуточное соединение 97) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H23F3N6O, - 480,2; полученное m/z, 481,2 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,41 (д, J=2,0 Гц, 1H), 7,87 (д, J=10,7 Гц, 1H), 7,65-7,50 (м, 2H), 5,85-5,70 (м, 1H), 5,16-4,49 (м, 1H), 3,82 (с, 3H), 3,74 (с, 1H), 3,20-3,13 (м, 1H), 2,42-2,33 (м, 5H), 2,31-2,21 (м, 1H), 1,95-1,39 (м, 6H).
Пример 365. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-метил-3H-имидазо[4,5-b]пиридин-7-ил)метанон.
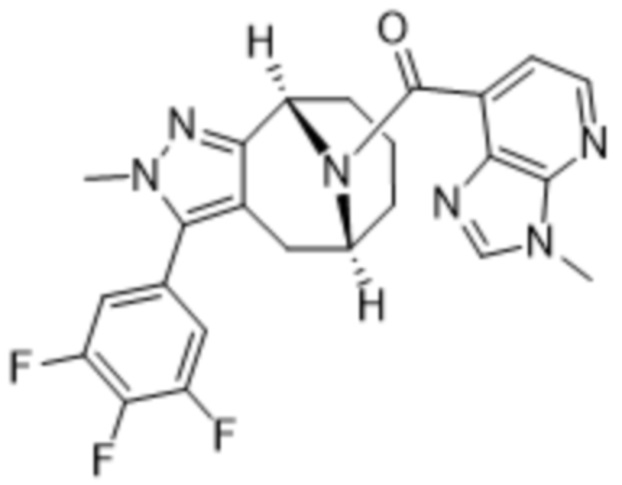
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического-(5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-метил-3H-имидазо[4,5-b]пиридин-7-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H21F3N6O, - 466,2; полученное m/z, 467,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) : 8,45 (с, 1H), 8,43-8,37 (м, 1H), 7,55-7,49 (м, 2H), 7,21 (д, J=4,8 Гц, 1H), 5,84-5,76 (м, 1H), 3,84 (с, 3H), 3,79 (с, 3H), 3,77-3,72 (м, 1H), 2,88 (дд, J=16,1, 7,3 Гц, 1H), 2,34 (д, J=15,9 Гц, 1H), 1,95-1,65 (м, 3H), 1,55-1,29 (м, 3H).
Пример 366. ((5R,9S)-2-Метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-метил-3H-имидазо[4,5-b]пиридин-6-ил)метанон.
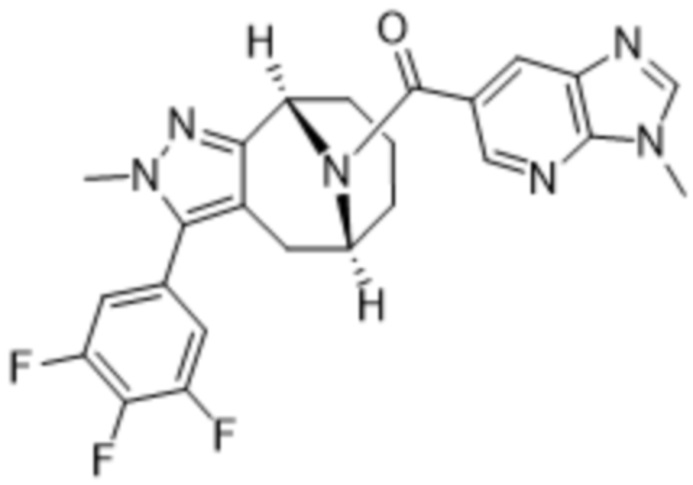
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-метил-3H-имидазо[4,5-b]пиридин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H21F3N6O, - 466,2; полученное m/z, 467,2 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6): 8,51 (с, 1H), 8,44 (д, J=1,9 Гц, 1H), 8,13 (д, J=1,9 Гц, 1H), 7,65-7,54 (м, 2H), 5,74-5,67 (м, 1H), 4,11-4,03 (м, 1H), 3,85 (с, 3H), 3,79 (с, 3H), 3,09 (дд, J=16,2, 7,4 Гц, 1H), 2,39-2,32 (м, 1H), 2,01-1,32 (м, 6H).
Пример 367. ((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)метанон.
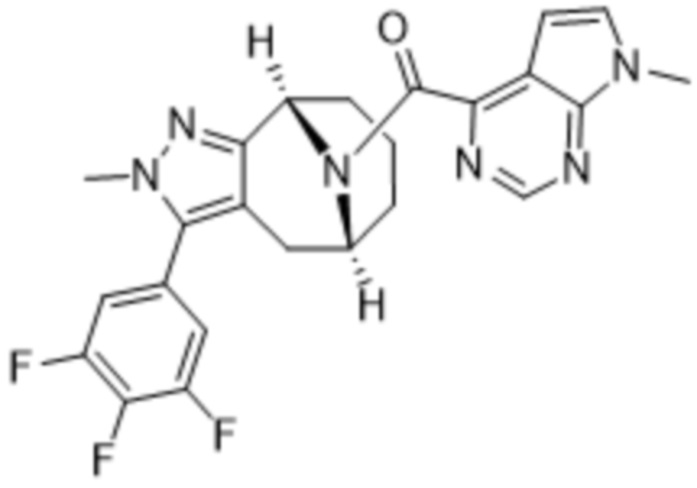
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 7-метил-7H-пирроло[2,3-d]пиримидин-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H21F3N6O, - 466,2; полученное m/z, 467,3 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6): 8,79 (с, 1H), 7,67 (д, J=3,5 Гц, 1H), 7,56-7,52 (м, 2H), 6,54 (д, J=3,5 Гц, 1H), 5,80-5,76 (м, 1H), 4,06-4,00 (м, 1H), 3,82 (с, 3H), 3,79 (с, 3H), 2,87 (дд, J=16,1, 7,3 Гц, 1H), 2,43 (д, J=16,1 Гц, 1H), 1,95-1,35 (м, 6H).
Пример 368. (1-метил-1H-пиразоло[3,4-b]пиридин-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
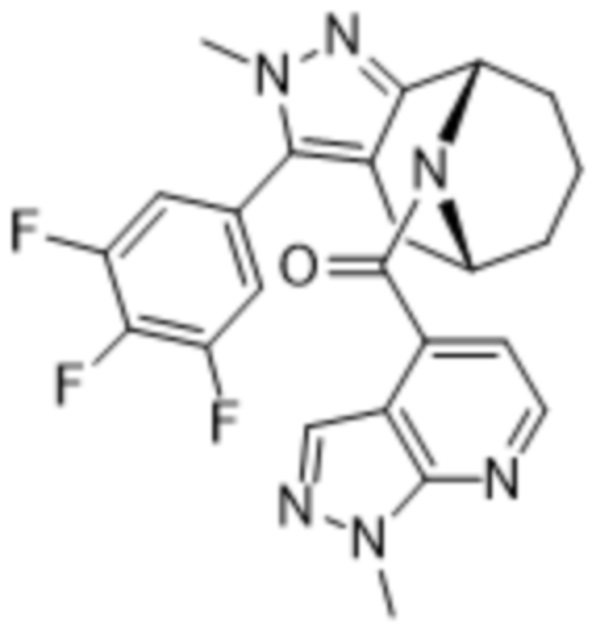
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-метил-1H-пиразоло[3,4-b]пиридин-4-карбоновую кислоту (промежуточное соединение 94) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H21F3N6O, - 466,2; полученное m/z, 467,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6): 8,64 (д, J=4,8 Гц, 1H), 8,16 (с, 1H), 7,71-7,50 (м, 2H), 7,23 (д, J=4,6 Гц, 1H), 5,86-5,75 (м, 1H), 4,10 (с, 3H), 3,89-3,77 (м, 1H), 3,82 (с, 3H), 2,92 (дд, J=16,3, 7,3 Гц, 1H), 2,39 (д, J=17,0 Гц, 1H), 2,09-1,28 (м, 6H).
Пример 369. (1-метил-1H-пиразоло[3,4-d]пиримидин-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
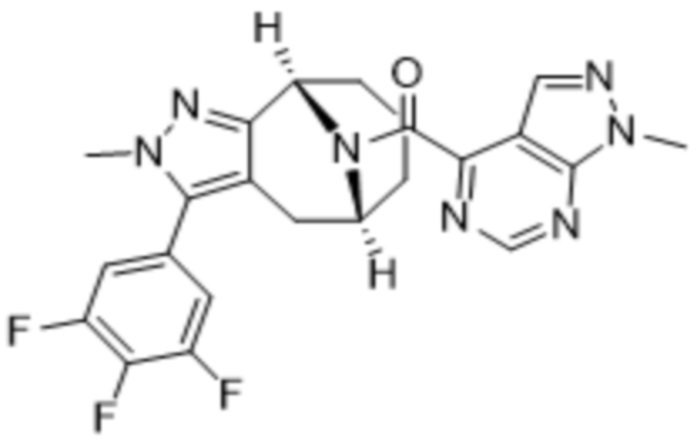
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-метил-1H-пиразоло[3,4-d]пиримидин-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H20F3N7O, - 467,2; полученное m/z, 468,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,08 (д, J=16,1 Гц, 1H), 8,35 (д, J=32,4 Гц, 1H), 7,69-7,49 (м, 2H), 5,81 (с, 1H), 5,22-4,96 (м, 1H), 4,14-4,05 (м, 3H), 3,77 (д, J=33,1 Гц, 3H), 3,23-3,09 (м, 1H), 3,03-2,89 (м, 1H), 2,00-1,41 (м, 6H).
Пример 370. [1,2,4]Триазоло[4,3-a]пиридин-7-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон.
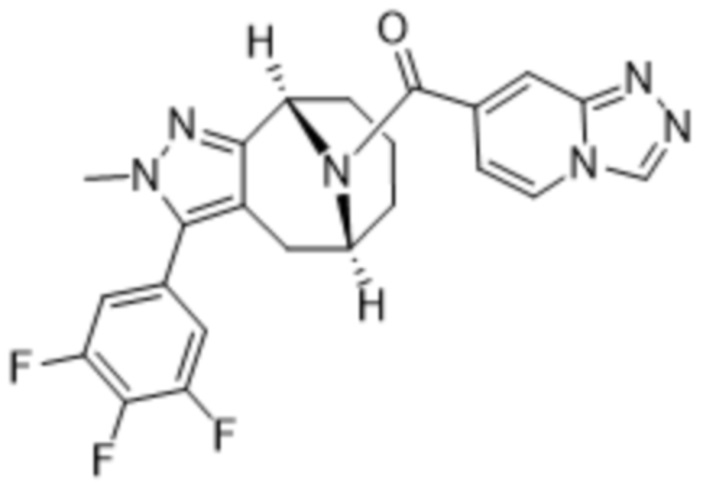
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и [1,2,4]триазоло[4,3-a]пиридин-7-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H19F3N6O, - 452,2; полученное m/z, 453,1 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6): 9,32 (с, 1H), 8,68-8,59 (м, 1H), 7,89-7,81 (м, 1H), 7,68-7,54 (м, 2H), 7,04-6,96 (м, 1H), 5,75-5,65 (м, 1H), 4,19-4,07 (м, 1H), 3,82 (с, 3H), 3,11 (дд, J=16,2, 7,4 Гц, 1H), 2,42 (д, J=16,9 Гц, 1H), 2,06-1,36 (м, 6H).
Пример 371. ((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-метилимидазо[1,5-a]пиразин-1-ил)метанон.
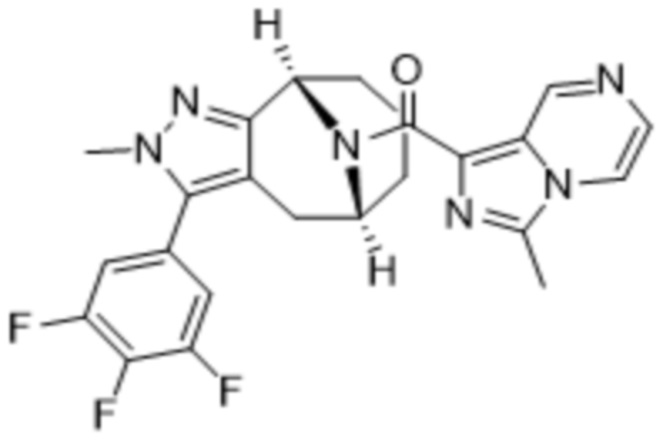
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и натрия 3-метилимидазо[1,5-a]пиразин-1-карбоксилат (промежуточное соединение 99) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H21F3N6O, - 466,2; полученное m/z, 467,1 [M+H]+. 1H ЯМР (400 МГц, метанол-d4) δ 9,38 (с, 1H), 8,14 (с, 1H), 7,70 (д, J=5,1 Гц, 1H), 7,33 (т, J=7,3 Гц, 2H), 5,94 (с, 1H), 3,89-3,76 (м, 3H), 2,74 (д, J=12,1 Гц, 3H), 2,61 (т, J=15,8 Гц, 1H), 2,30-1,51 (м, 8H).
Пример 372. ((5R,9S)-3-(3-фтор-5-метилфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хинолин-6-ил)метанон.
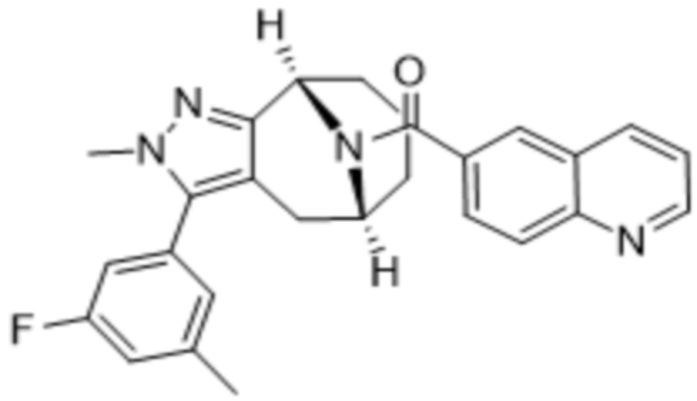
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3-фтор-5-метилфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 63) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и хинолин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C27H25FN4O, - 440,2; полученное m/z, 441,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,02-8,93 (м, 1H), 8,48 (д, J=8,3 Гц, 1H), 8,15-8,04 (м, 2H), 7,83-7,68 (м, 1H), 7,65-7,52 (м, 1H), 7,25-7,04 (м, 3H), 5,82-5,01 (м, 1H), 4,91-3,99 (м, 1H), 3,86-3,66 (м, 3H), 3,14-3,00 (м, 1H), 2,48-2,31 (м, 4H), 2,07-1,36 (м, 6H).
Пример 373. ((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(4-метилхинолин-6-ил)метанон.
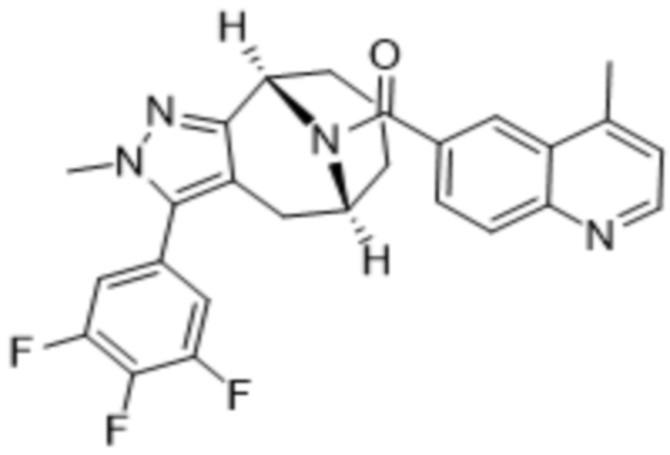
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 4-метилхинолин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C27H23F3N4O, - 476,2; полученное m/z, 477,0 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 8,82 (дд, J=8,0, 4,4 Гц, 1H), 8,16-8,02 (м, 2H), 7,82-7,66 (м, 1H), 7,66-7,39 (м, 3H), 5,83-4,82 (м, 1H), 4,17-4,01 (м, 1H), 3,88-3,63 (м, 3H), 3,15-2,98 (м, 1H), 2,76-2,65 (м, 3H), 2,47-2,37 (м, 1H), 2,06-1,42 (м, 6H).
Пример 374. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-гидроксихинолин-6-ил)метанон.
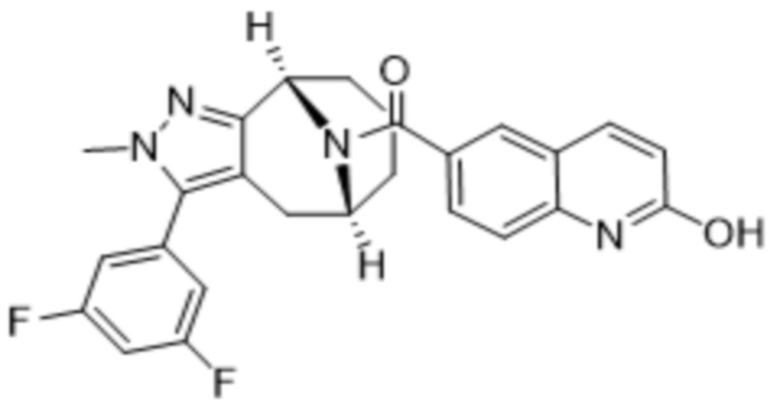
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 12) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-гидроксихинолин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H22F2N4O2, - 460,5; полученное m/z, 461,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 11,99-11,80 (м, 1H), 8,01-7,93 (м, 1H), 7,77 (д, J=10,0 Гц, 1H), 7,54 (дд, J=25,0, 8,5 Гц, 1H), 7,39-7,27 (м, 4H), 6,55 (д, J=9,5 Гц, 1H), 5,75-5,61 (м, 1H), 5,05-4,78 (м, 1H), 3,89-3,70 (м, 3H), 3,19-3,04 (м, 1H), 2,49-2,43 (м, 1H), 2,04-1,40 (м, 6H).
Пример 375. 6-((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбонил) хинолин 1-оксид.

К ледяному раствору ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хинолин-6-ил)метанона (пример 97, 150 мг, 0,34 ммоль) в ДХМ (6.0 мл) порциями добавляли мета-хлорпероксибензойную кислоту (м-ХПБК или мХПБК) (87,4 мг, 0,51 ммоль) при 0 ºC в течение 10 минут и смесь медленно нагревали до комнатной температуры. После перемешивания в течение 1 ч реакционную смесь гасили насыщенным водным раствором NaHCO3 и экстрагировали ДХМ (2x). Объединенные органические фазы промывали солевым раствором, сушили над Na2SO4, отфильтровывали и концентрировали в вакууме. Неочищенный продукт очищали обращенно-фазовой ВЭЖХ на колонке XBridge C18 (5 мкм, 100×4,6 мм), подвижная фаза 10-100% ACN в 20 мМ NH4OH с получением указанного в заголовке соединения в виде белого твердого вещества (111 мг, выход 71%). МС (ИЭР): масса, рассчитанная для C26H22F2N4O2, - 460,5; полученное m/z, 461,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,68-8,52 (м, 2H), 8,18 (дд, J=11,0, 1,7 Гц, 1H), 8,03 (дд, J=8,6, 4,5 Гц, 1H), 7,89-7,71 (м, 1H), 7,59 -7,49 (м, 1H), 7,41-7,25 (м, 3H), 5,84-4,72 (м, 2H), 3,80 (д, J=48,8 Гц, 3H), 3,20-3,03 (м, 1H), 2,46 (д, J=16,2 Гц, 1H), 2,06-1,37 (м, 6H).
Пример 376. ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хинолин-6-ил-4-t)метанон.
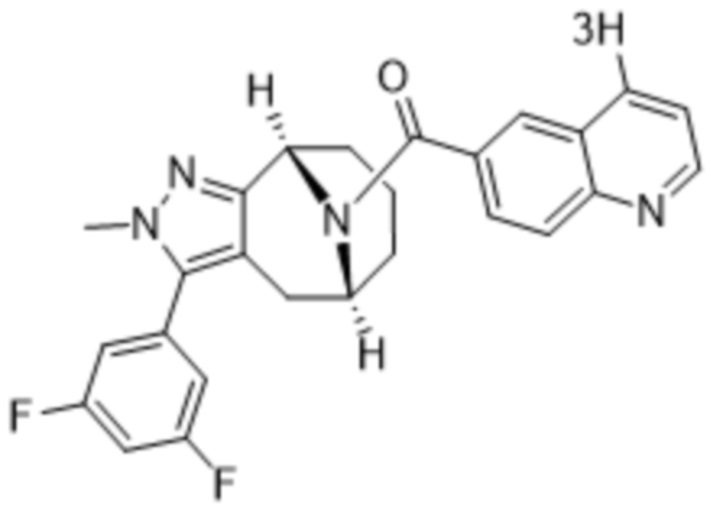
В круглодонную колбу объемом 5 мл помещали (4-бромхинолин-6-ил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон (пример 101, 10 мг, 0,02 ммоль), метанол (1,5 мл) и Pd/C (8 мг, 0,008 ммоль). Смесь перемешивали при комнатной температуре в течение 2 ч в атмосфере газообразного трития 1 атм. Растворитель удалили в вакууме, остаток растворили в этаноле и профильтровали. Неустойчивый тритий удаляли с помощью роторного испарителя (3x) и неочищенный материал очищали на колонке для ВЭЖХ-C-18 с использованием (градиент A=вода, а B=ACN: A->100% B за 60 мин, УФ=254 нМ, поток=6 мл/мин). Продукт анализировали как имеющий удельную активность=10,8 Ки/ммоль и расфасовывали в этанол (1 мКи/мл). МС (ИЭР): масса, рассчитанная для C26H21TF2N4O, - 446,2; полученное m/z, 446,9 [M+H]+.
Пример 377. ((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(6-метилхиназолин-4-ил)метанон.
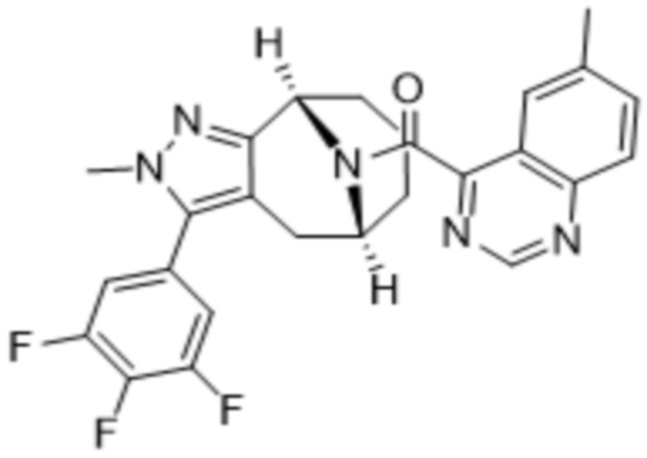
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-метилхиназолин-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H22F3N5O, - 477,2; полученное m/z, 478,2 [M+H]+. 1H ЯМР (500 MГц, ДМСО-d6) δ 9,26 (д, J=18,2 Гц, 1H), 8,04-7,90 (м, 2H), 7,70-7,54 (м, 3H), 5,97-4,30 (м, 3H), 3,77 (м, 2H), 2,87-2,60 (м, 1H), 2,52 (д, J=1,0 Гц, 2H), 2,48-2,44 (м, 2H), 2,09-1,40 (м, 6H).
Пример 378. ((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хиноксалин-6-ил-2-d)метанон.
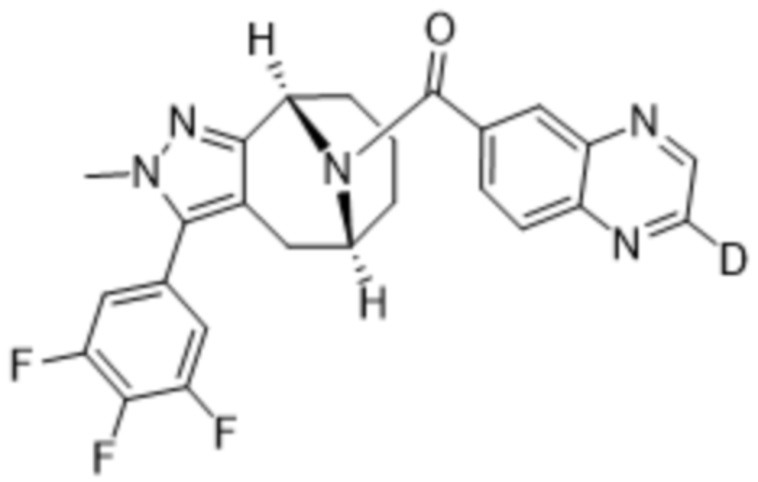
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и лития хиноксалин-6-карбоновую кислоту-2-d кислоту (промежуточное соединение 102) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H19DF3N5O, - 464,2; полученное m/z, 465,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 9,09-8,99 (м, 1H), 8,20 (дд, J=14,5, 8,5 Гц, 1H), 8,09 (дд, J=42,7, 1,9 Гц, 1H), 7,94 -7,74 (м, 1H), 7,66 -7,55 (м, 2H), 5,83-4,74 (м, 1H), 4,16-4,03 (м, 1H), 3,86-3,66 (м, 3H), 3,18-3,04 (м, 1H), 2,45-2,36 (м, 1H), 2,01-1,35 (м, 6H).
Пример 379. ((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хиноксалин-6-ил-2,3-d2)метанон.
.

Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и лития хиноксалин-6-карбоновую кислоту-2,3-d2 кислоту (промежуточное соединение 101) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H18D2F3N5O, - 465,2; полученное m/z, 466,0 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,20 (дд, J=14,4, 8,5 Гц, 1H), 8,09 (дд, J=42,7, 1,9 Гц, 1H), 7,95-7,77 (м, 1H), 7,67-7,55 (м, 2H), 5,81-5,75 и 5,16-4,79 (м, 1H), 4,14-4,04 (м, 1H), 3,85-3,72 (м, 3H), 3,15-3,00 (м, 1H), 2,48-2,33 (м, 1H), 2,06-1,36 (м, 6H).
Пример 380. ((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метил-5,6,7,8-тетрагидроимидазо[1,2-a]пиридин-3-ил)метанон.
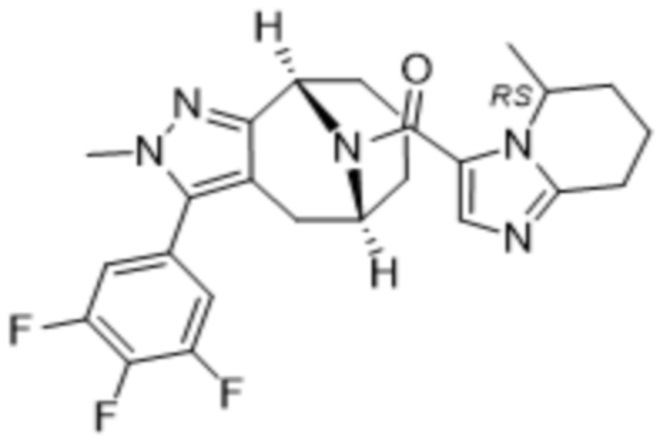
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-метил-5,6,7,8-тетрагидроимидазо[1,2-a]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H26F3N5O, - 469,2; полученное m/z, 470,1 [M+H]+. 1H ЯМР (500 MГц, ДМСО-d6) δ 7,61 (д, J=54,4 Гц, 2H), 7,22 (с, 1H), 5,71-5,34 (м, 1H), 4,89-4,52 (м, 2H), 3,80 (с, 3H), 2,87-2,52 (м, 3H), 2,18-1,55 (м, 8H), 1,54-0,76 (м, 6H).
Пример 381. ((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5,6,7,8-тетрагидроимидазо[1,2-a]пиридин-3-ил)метанон.
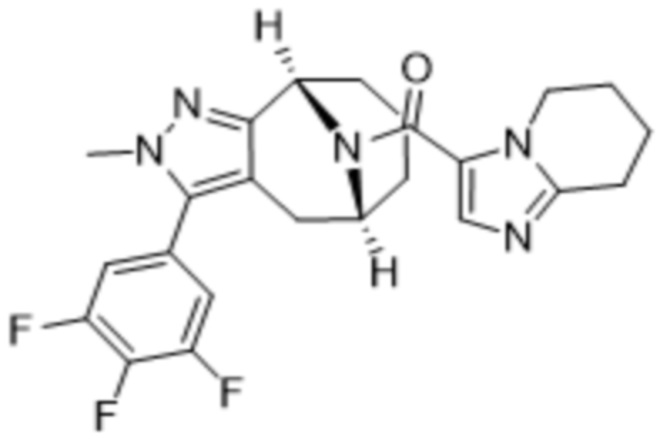
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5,6,7,8-тетрагидроимидазо[1,2-a]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H24F3N5O, - 455,2; полученное m/z, 456,1 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 7,70-7,53 (м, 2H), 7,20 (с, 1H), 5,72-5,36 (м, 1H), 4,98-4,48 (м, 1H), 4,06 (дд, J=13,1, 6,9 Гц, 1H), 3,93 (с, 1H), 3,79 (с, 3H), 3,29-2,93 (м, 2H), 2,84-2,71 (м, 2H), 1,94-1,69 (м, 6H), 1,69-1,59 (м, 2H), 1,54-1,37 (м, 2H).
Пример 382. ((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2,6,6-триметил-6,7-дигидро-4H-пиразол[5,1-c][1,4]оксазин-3-ил)метанон.
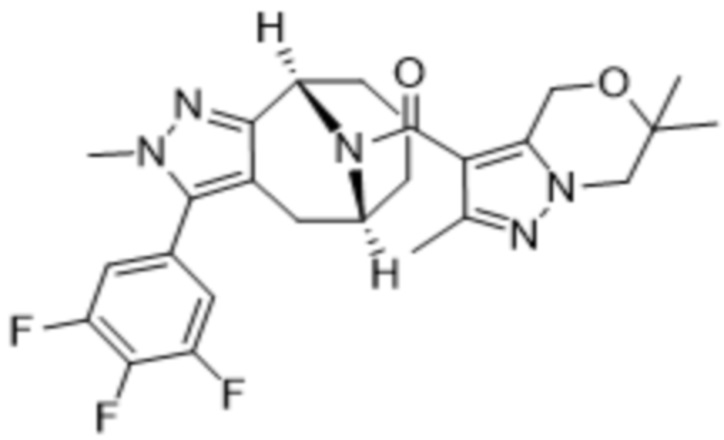
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол (промежуточное соединение 25) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и калия 2,6,6-триметил-6,7-дигидро-4H-пиразол[5,1-c][1,4]оксазин-3-карбоксилат (промежуточное соединение 103) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H28F3N5O2, - 499,2; полученное m/z, 500,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 7,64-7,48 (м, 2H), 5,78-5,16 (м, 1H), 4,67 (т, J=15,9 Гц, 2H), 3,88 (с, 2H), 3,79 (с, 3H), 3,26-2,62 (м, 2H), 2,47 (с, 1H), 2,12 (с, 3H), 1,74 (д, J=33,5 Гц, 3H), 1,63-1,31 (м, 3H), 1,26 (д, J=2,6 Гц, 6H).
Пример 383. (3-хлорфенил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
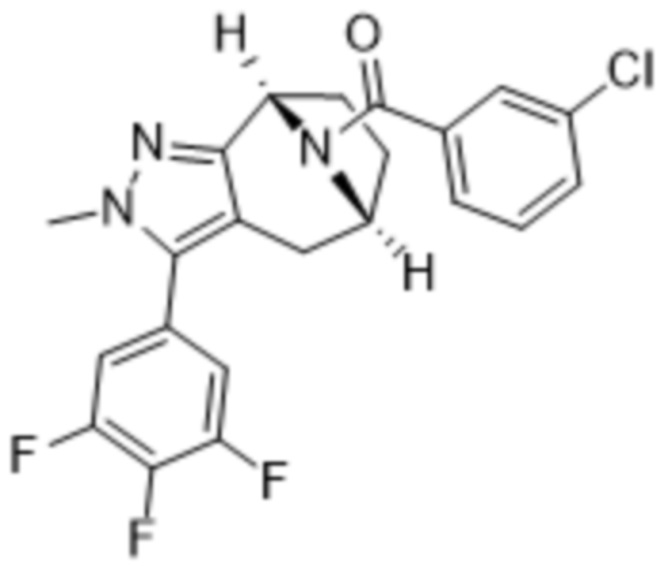
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-хлорбензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C22H17ClF3N3O, - 431,1; полученное m/z, 432,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,49-7,27 (м, 4H), 7,02-6,88 (м, 2H), 5,84-3,96 (м, 2H), 3,78 (д, J=21,8 Гц, 3H), 3,39-3,23 (м, 1H), 2,44-2,14 (м, 3H), 2,14-1,91 (м, 1H), 1,76-1,59 (м, 1H).
Пример 384. (3-метоксифенил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
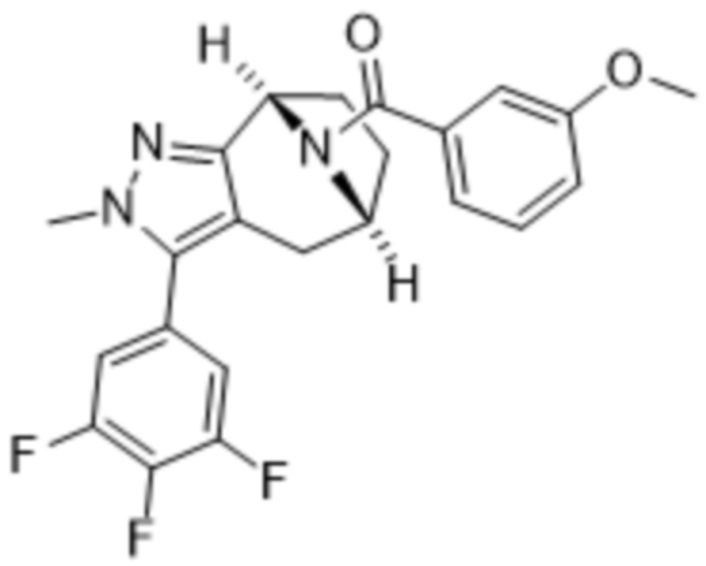
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3-метоксибензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H20F3N3O2, - 427,2; полученное m/z, 428,1 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,39-7,27 (м, 1H), 7,15-6,91 (м, 5H), 5,80-5,13 (м, 1H), 5,13-4,35 (м, 1H), 3,88-3,74 (м, 6H), 3,36-2,84 (м, 1H), 2,45-2,11 (м, 3H), 2,11-1,93 (м, 1H), 1,74-1,59 (м, 1H).
Пример 385. ((5R,8S)-3-(2,5-дифторфенил)-2-метил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)(3-метоксифенил)метанон.
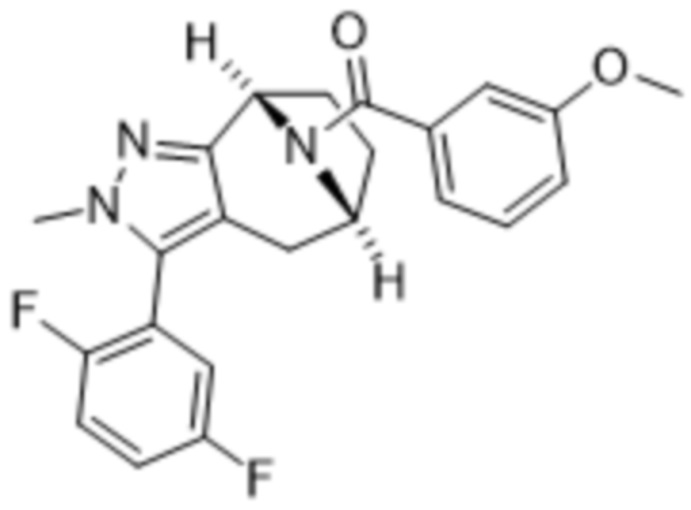
Флакон для микроволновой обработки с (5R,8S)-9-(3-метоксибензоил)-2-метил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-3-илтрифторметансульфонатом (промежуточное соединение 108) (20 мг, 0,045 ммоль), 2,5-дифторфенилбороновой кислотой (9 мг, 0,054 ммоль), карбонатом натрия (14 мг, 0,135 ммоль) и XPhos Pd G2 (4 мг, 0,005 ммоль) в 1,4-диоксане (2 мл) и воде (0,5 мл) продували N2 в течение 5 мин. Полученную смесь нагревали в микроволновом реакторе в течение 30 минут при температуре 110 ºC. Завершенную реакционную разбавляли водой и экстрагировали в ДХМ (x3). Объединенные органические компоненты сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Очистка (обращенно-фазовая ВЭЖХ на колонке XBridge C18 (5 мм, 100×4,6 мм), подвижная фаза 10-100% ACN в 20 мМ NH4OH) позволила получить титульное соединение (4,3 мг, 23%). МС (ИЭР): масса, рассчитанная для C23H21F2N3O2, - 409,2; полученное m/z, 410,0 [M+H]+. 1H ЯМР (500 МГц, CDCl3) δ 7,36-7,28 (м, 1H), 7,23-6,90 (м, 6H), 5,87-5,11 (м, 1H), 5,10-4,30 (м, 1H), 3,81 (с, 3H), 3,79-3,67 (m, 3H), 3,31-2,83 (м, 1H), 2,45-2,11 (м, 2H), 2,11-1,96 (м, 1H), 1,78-1,64 (м, 1H), 1,36-1,25 (м, 1H).
Пример 386. (3-метоксифенил)((5R,8S)-2-метил-3-(2,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
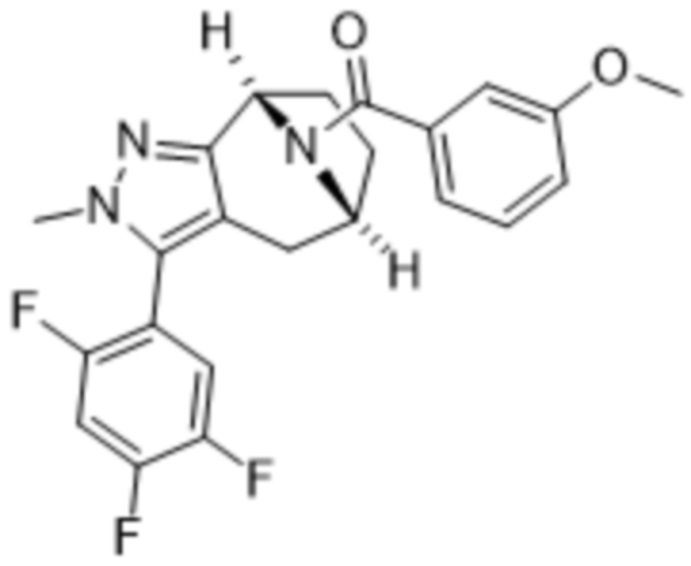
Титульное соединение получали способом, аналогичным описанному в примере 385, используя 2,4,5-трифторфенилбороновую кислоту вместо 2,5-дифторфенилбороновой кислоты. МС (ИЭР): масса, рассчитанная для C23H20F3N3O2, - 427,2; полученное m/z, 428,1 [M+H]+. 1H ЯМР (500 МГц, CDCl3) δ 7,34-7,27 (м, 2H), 7,20-7,04 (м, 2H), 7,04-6,93 (м, 2H), 5,77-5,11 (м, 1H), 5,09-4,34 (м, 1H), 3,81 (с, 3H), 3,77-3,67 (м, 4H), 3,26-2,83 (м, 1H), 2,38-1,96 (м, 2H), 1,77-1,60 (м, 1H), 1,36-1,21 (м, 1H).
Пример 387. ((5R,8S)-3-(2,3-дифторфенил)-2-метил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)(3-метоксифенил)метанон.
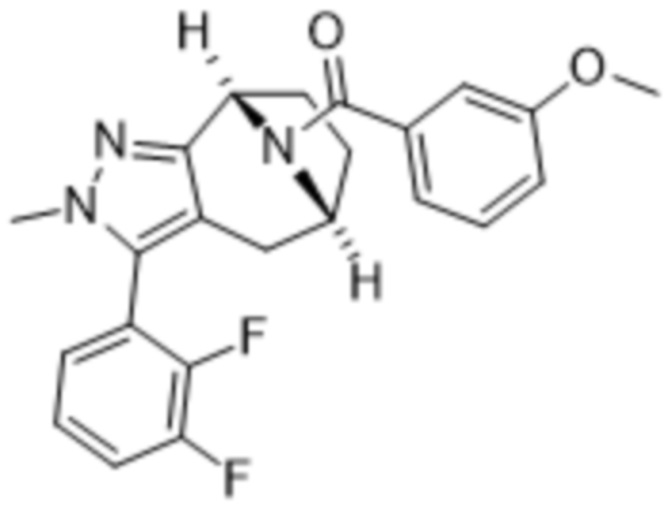
Титульное соединение получали способом, аналогичным описанному в примере 385, используя 2,3-дифторфенилбороновую кислоту вместо 2,5-дифторфенилбороновой кислоты. МС (ИЭР): масса, рассчитанная для C23H21F2N3O2, - 409,2; полученное m/z, 410,1 [M+H]+. 1H ЯМР (500 МГц, CDCl3) δ 7,33-7,27 (м, 2H), 7,23-7,14 (м, 1H), 7,12-6,99 (м, 3H), 6,99-6,94 (м, 1H), 5,79-5,12 (м, 1H), 5,10-4,32 (м, 1H), 3,81 (с, 3H), 3,79-3,69 (м, 3H), 3,26-2,86 (м, 1H), 2,39-2,12 (м, 3H), 2,11-1,80 (м, 1H), 1,77-1,66 (м, 1H).
Пример 388. (2,3-диметоксифенил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
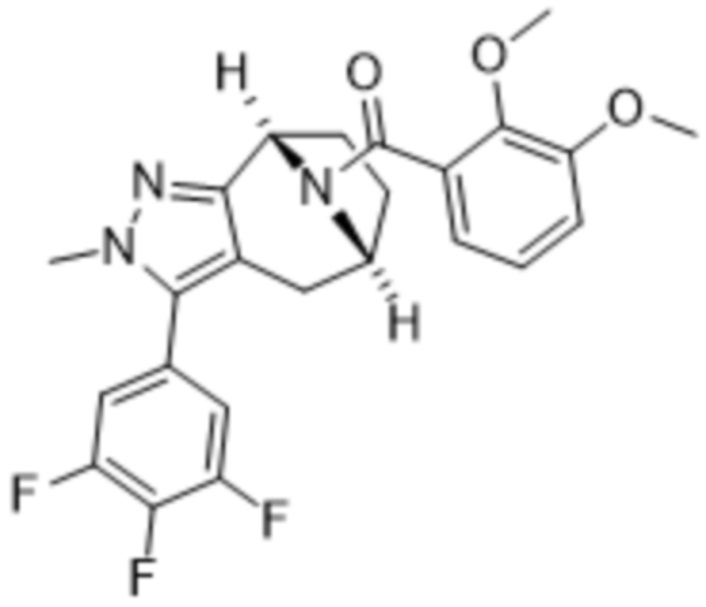
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2,3-диметоксибензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H22F3N3O3, - 457,2; полученное m/z, 458,1 [M+H]+. 1H ЯМР (600 МГц, CDCl3) δ 7,11-7,01 (м, 1H), 6,99-6,85 (м, 3H), 6,77 (с, 1H), 5,80-5,13 (м, 1H), 4,73-4,09 (м, 1H), 3,94-3,82 (м, 6H), 3,82-3,71 (м, 3H), 3,33-3,23 (м, 1H), 2,39-2,13 (м, 3H), 2,09-1,89 (м, 1H), 1,70-1,60 (м, 1H).
Пример 389. (2-фтор-3-метоксифенил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
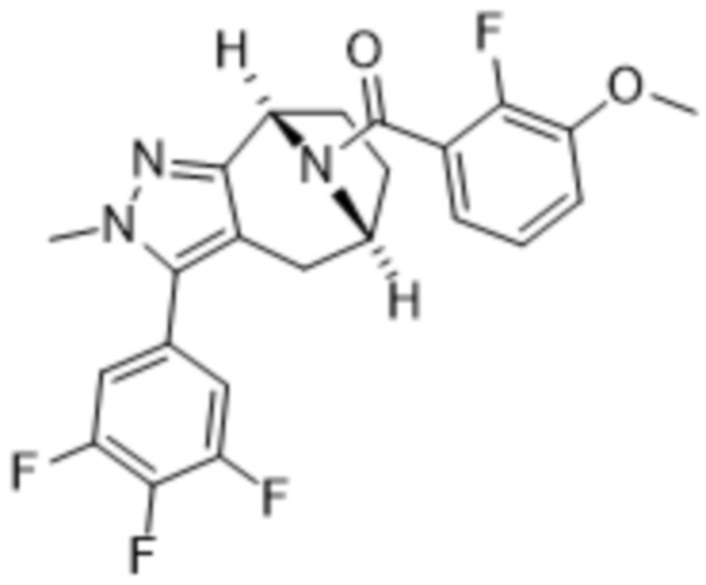
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-фтор-3-метоксибензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H19F4N3O2, - 445,1; полученное m/z, 446,0 [M+H]+. 1H ЯМР (600 МГц, CDCl3) δ 7,15-7,06 (м, 1H), 7,04-6,86 (м, 4H), 5,80-5,07 (м, 1H), 4,82-4,17 (м, 1H), 3,95-3,87 (м, 3H), 3,83-3,70 (м, 3H), 3,34-2,80 (м, 1H), 2,40-2,21 (м, 3H), 2,08-1,95 (м, 1H), 1,69-1,60 (м, 1H).
Пример 390. (2-хлор-3-метоксифенил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
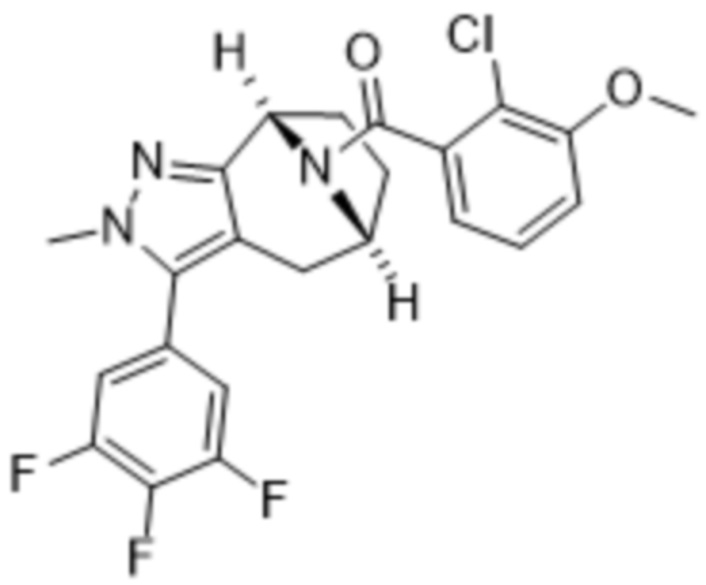
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-хлор-3-метоксибензойную кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H19ClF3N3O2, - 461,1; полученное m/z, 462,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,37- 6,67 (м, 5H), 5,85-5,06 (м, 1H), 4,67-3,84 (м, 4H), 3,77 (д, J=23,6 Гц, 3H), 3,43-2,60 (м, 1H), 2,45-2,12 (м, 1H), 2,12-1,90 (м, 1H), 1,60 (с, 3H).
Пример 391. (6-метоксипиридин-2-ил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
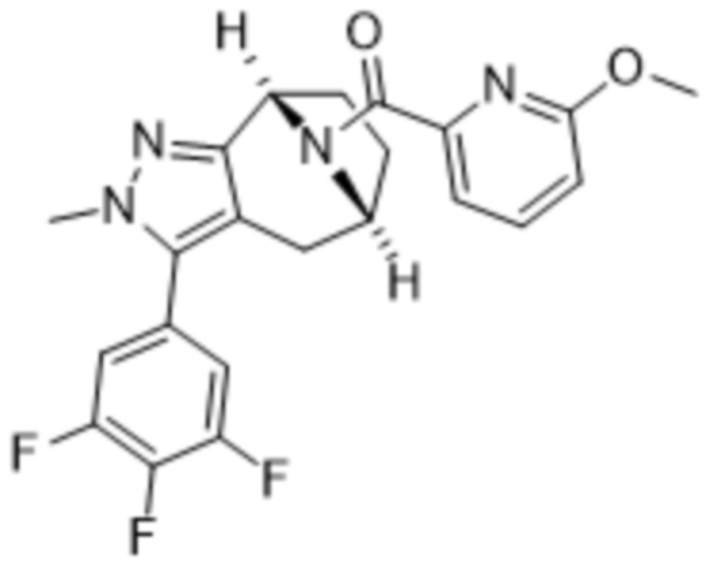
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-метоксипиридин-2-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C22H19F3N4O2, - 428,1; полученное m/z, 429,1 [M+H]+. 1H ЯМР (600 МГц, CDCl3) δ 7,70-7,63 (м, 1H), 7,56 -7,45 (м, 1H), 7,00-6,91 (м, 2H), 6,86- 6,80 (м, 1H), 6,16-5,73 (м, 1H), 5,42-5,14 (м, 1H), 4,03-3,92 (м, 3H), 3,83-3,71 (м, 3H), 3,36-3,22 (м, 1H), 2,44-2,28 (м, 3H), 2,28-1,96 (м, 1H), 1,79-1,61 (м, 1H).
Пример 392. (1,5-диметил-1H-пиразол-4-ил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
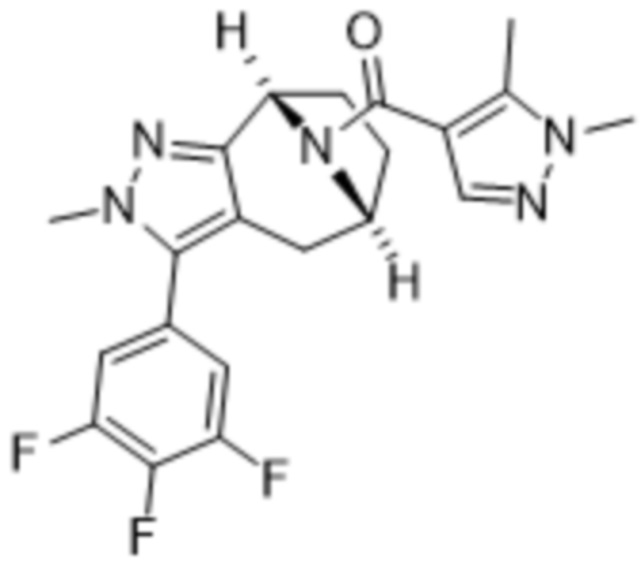
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1,5-диметил-1H-пиразол-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C21H20F3N5O, - 415,2; полученное m/z, 416,1 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,54 (с, 1H), 6,97 (дд, J=7,7, 6,3 Гц, 2H), 5,18 (д, J=55,1 Гц, 2H), 3,79 (с, 3H), 3,78 (с, 3H), 3,17 (с, 1H), 2,42 (с, 3H), 2,38-2,12 (м, 3H), 2,03 (т, J=10,6 Гц, 1H), 1,67 (д, J=13,4 Гц, 1H).
Пример 393. (5-циклопропил-1-метил-1H-пиразол-4-ил)((5R,8S)-3-(3-фтор-5-метилфенил)-2-метил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
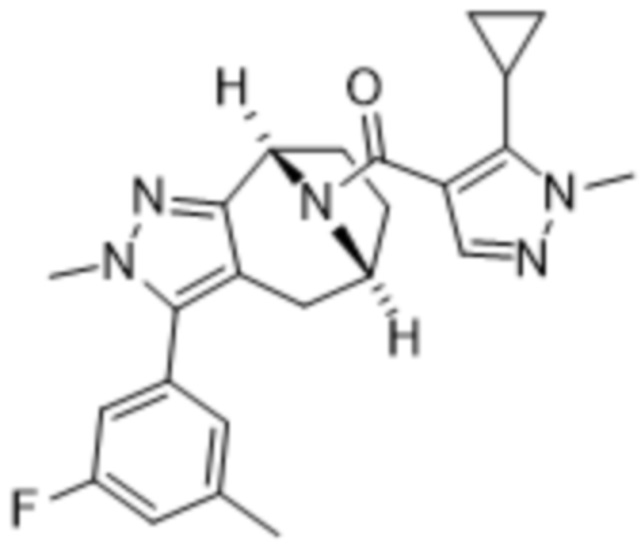
Титульное соединение получали способом, аналогичным описанному в примере 385, используя (5R,8S)-9-(5-циклопропил-1-метил-1H-пиразол-4-карбонил)-2-метил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-3-ил трифторметансульфонат (промежуточное соединение 109) вместо (5R,8S)-9-(3-метоксибензоил)-2-метил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-3-ил трифторметансульфонат (промежуточное соединение 108) и (3-фтор-5-метилфенил)бороновую кислоту вместо 2,5-дифторфенилбороновой кислоты. МС (ИЭР): масса, рассчитанная для C24H26FN5O, - 419,2; полученное m/z, 420,1 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,45 (с, 1H), 6,97-6,87 (м, 2H), 6,83 (д, J=9,2 Гц, 1H), 5,75-5,04 (м, 1H), 5,04-4,34 (м, 1H), 3,88 (с, 3H), 3,76 (с, 3H), 3,31 (д, J=15,7 Гц, 1H), 2,41 (с, 3H), 2,38-1,93 (м, 4H), 1,83-1,60 (м, 2H), 0,94 (д, J=38,0 Гц, 1H), 0,69 (с, 1H), 0,52 (с, 2H).
Пример 394. (5-циклопропил-1-метил-1H-пиразол-4-ил)((5R,8S)-2-метил-3-фенил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
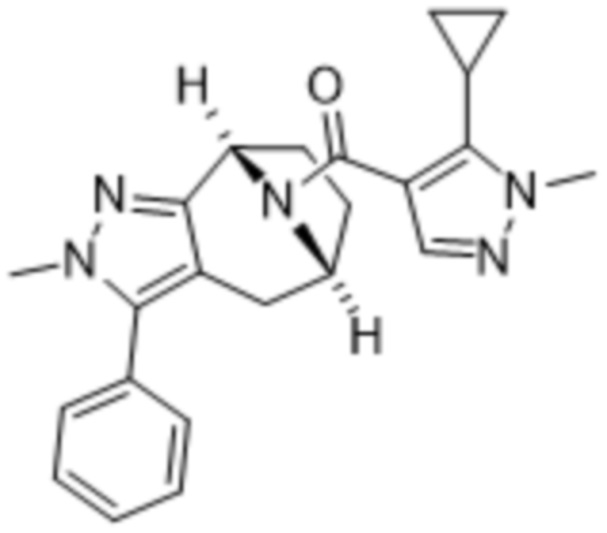
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-финил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 106) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-циклопропил-1-метил-1H-пиразол-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H25N5O, - 387,2; полученное m/z, 388,2 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,57-7,38 (м, 4H), 7,32 (д, J=7,1 Гц, 2H), 5,08 (с, 1H), 5,03-4,36 (м, 1H), 3,98-3,82 (м, 3H), 3,77 (д, J=5,3 Гц, 3H), 3,45-2,83 (м, 1H), 2,47-1,93 (м, 3H), 1,50-1,14 (м, 3H), 1,05-0,43 (м, 4H).
Пример 395. (5-циклопропил-1-метил-1H-пиразол-4-ил)((5R,8S)-3-(3,4-дифторфенил)-2-метил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
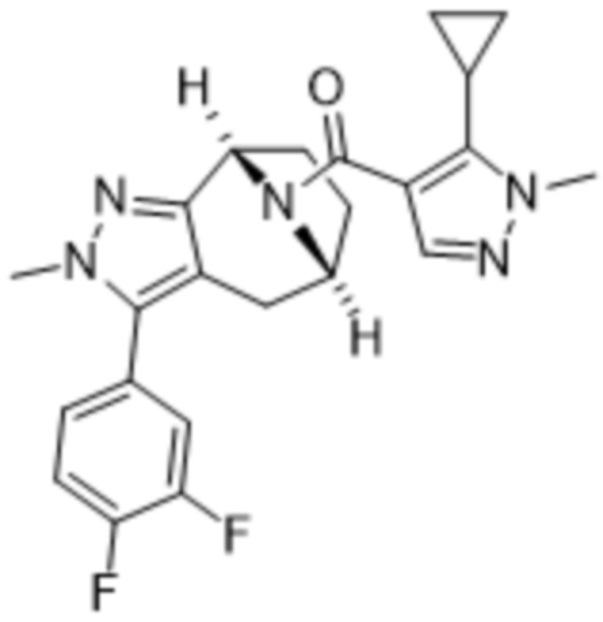
Титульное соединение получали способом, аналогичным описанному в примере 385, используя (5R,8S)-9-(5-циклопропил-1-метил-1H-пиразол-4-карбонил)-2-метил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-3-ил трифторметансульфонат (промежуточное соединение 109) вместо (5R,8S)-9-(3-метоксибензоил)-2-метил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-3-ил трифторметансульфонат (промежуточное соединение 108) и 3,4-дифторфенилбороновую кислоту вместо 2,5-дифторфенилбороновой кислоты. МС (ИЭР): масса, рассчитанная для C23H23F2N5O, - 423,2; полученное m/z, 424,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,45 (с, 1H), 7,32-7,21 (м, 1H), 7,13 (д, J=9,5 Гц, 1H), 7,06 (с, 1H), 5,08 (с, 1H), 4,71 (д, J=222,4 Гц, 1H), 3,88 (с, 3H), 3,76 (д, J=10,9 Гц, 3H), 3,42-2,79 (м, 1H), 2,43-1,91 (м, 5H), 1,87-1,62 (м, 1H), 0,90 (с, 1H), 0,71 (с, 1H), 0,52 (с, 2H).
Пример 396. (5-циклопропил-1-метил-1H-пиразол-4-ил)((5R,8S)-3-(2,4-дифторфенил)-2-метил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
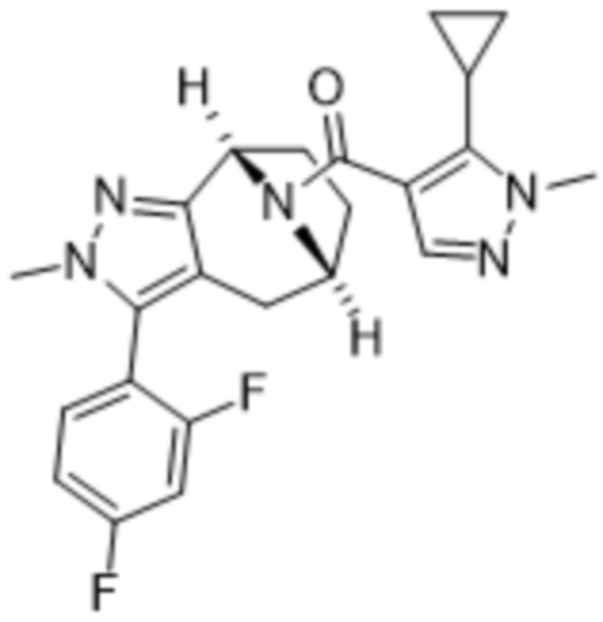
Титульное соединение получали способом, аналогичным описанному в примере 385, используя (5R,8S)-9-(5-циклопропил-1-метил-1H-пиразол-4-карбонил)-2-метил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-3-ил трифторметансульфонат (промежуточное соединение 109) вместо (5R,8S)-9-(3-метоксибензоил)-2-метил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-3-ил трифторметансульфонат (промежуточное соединение 108) и 2,4-дифторфенилбороновую кислоту вместо 2,5-дифторфенилбороновой кислоты. МС (ИЭР): масса, рассчитанная для C23H23F2N5O, - 423,2; полученное m/z, 424,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,45 (с, 1H), 7,26-7,20 (м, 1H), 6,98 (к, J=10,9, 9,9 Гц, 2H), 5,07 (с, 1H), 4,98 (с, 1H), 3,87 (с, 3H), 3,67 (с, 3H), 3,32-1,93 (м, 5H), 1,80-1,63 (м, 2H), 1,08-0,36 (м, 4H).
Пример 397. (5-циклопропил-1-метил-1H-пиразол-4-ил)((5R,8S)-3-(3,5-дифторфенил)-2-метил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
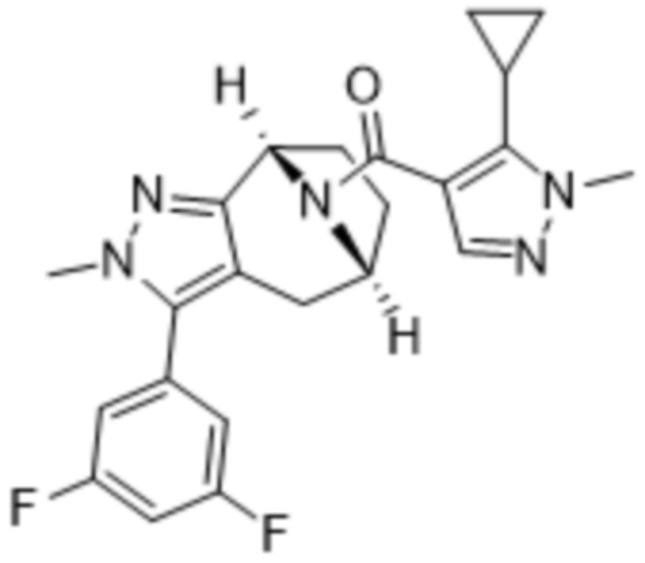
Титульное соединение получали способом, аналогичным описанному в примере 385, используя (5R,8S)-9-(5-циклопропил-1-метил-1H-пиразол-4-карбонил)-2-метил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-3-ил трифторметансульфонат (промежуточное соединение 109) вместо (5R,8S)-9-(3-метоксибензоил)-2-метил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-3-ил трифторметансульфонат (промежуточное соединение 108) и 3,5-дифторфенилбороновую кислоту вместо 2,5-дифторфенилбороновой кислоты. МС (ИЭР): масса, рассчитанная для C23H23F2N5O, - 423,2; полученное m/z, 424,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,45 (с, 1H), 6,85 (д, J=7,7 Гц, 3H), 5,04 (д, J=35,4 Гц, 1H), 3,88 (с, 3H), 3,78 (с, 3H), 3,31 (д, J=16,1 Гц, 1H), 2,42-2,11 (м, 2H), 2,04 (д, J=23,5 Гц, 1H), 1,81-1,60 (м, 2H), 1,54 (с, 2H), 0,88 (д, J=18,0 Гц, 1H), 0,70 (с, 1H), 0,52 (с, 2H).
Пример 398. (5-циклопропил-1-метил-1H-пиразол-4-ил)((5R,8S)-2-метил-3-(2,3,4-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
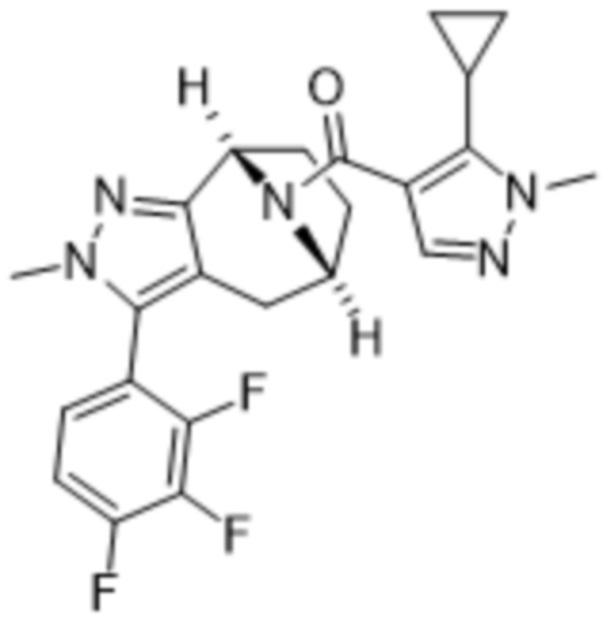
Титульное соединение получали способом, аналогичным описанному в примере 385, используя (5R,8S)-9-(5-циклопропил-1-метил-1H-пиразол-4-карбонил)-2-метил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-3-ил трифторметансульфонат (промежуточное соединение 109) вместо (5R,8S)-9-(3-метоксибензоил)-2-метил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-3-ил трифторметансульфонат (промежуточное соединение 108) и 2,3,4-трифторфенилбороновую кислоту вместо 2,5-дифторфенилбороновой кислоты. МС (ИЭР): масса, рассчитанная для C23H22F3N5O, - 441,2; полученное m/z, 442,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,45 (с, 1H), 7,08 (т, J=8,1 Гц, 1H), 7,05-6,96 (м, 1H), 5,38 (д, J=243,7 Гц, 1H), 5,05-4,35 (м, 1H), 3,88 (с, 3H), 3,69 (с, 3H), 3,21 (д, J=15,8 Гц, 1H), 2,41-2,11 (м, 3H), 2,04 (д, J=11,4 Гц, 1H), 1,80-1,61 (м, 2H), 0,93 (д, J=37,3 Гц, 1H), 0,65 (с, 1H), 0,49 (д, J=20,4 Гц, 2H).
Пример 399. (5-циклопропил-1-метил-1H-пиразол-4-ил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
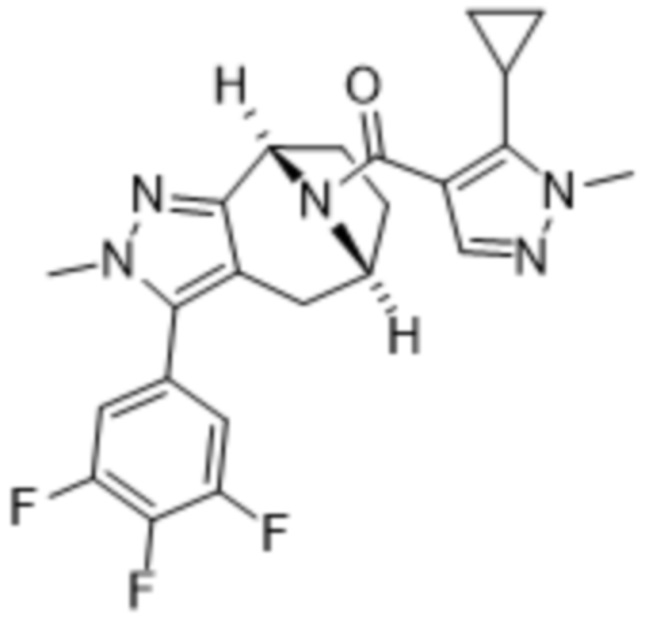
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-циклопропил-1-метил-1H-пиразол-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H22F3N5O, - 441,2; полученное m/z, 442,2 [M+H]+. 1H ЯМР (600 МГц, CDCl3) δ 7,74-7,50 (м, 1H), 7,49-7,41 (м, 2H), 7,00-6,90 (м, 3H), 5,04 (д, J=50,6 Гц, 1H), 4,28-4,13 (м, 1H), 3,88 (с, 3H), 3,76 (с, 3H), 3,28 (д, J=15,3 Гц, 1H), 2,32 (д, J=16,9 Гц, 2H), 2,24-2,13 (м, 1H), 2,01 (д, J=11,9 Гц, 1H), 1,80-1,63 (м, 3H).
Пример 400. ((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)(2-метил-4-(трифторметил)-1H-имидазол-5-ил)метанон.
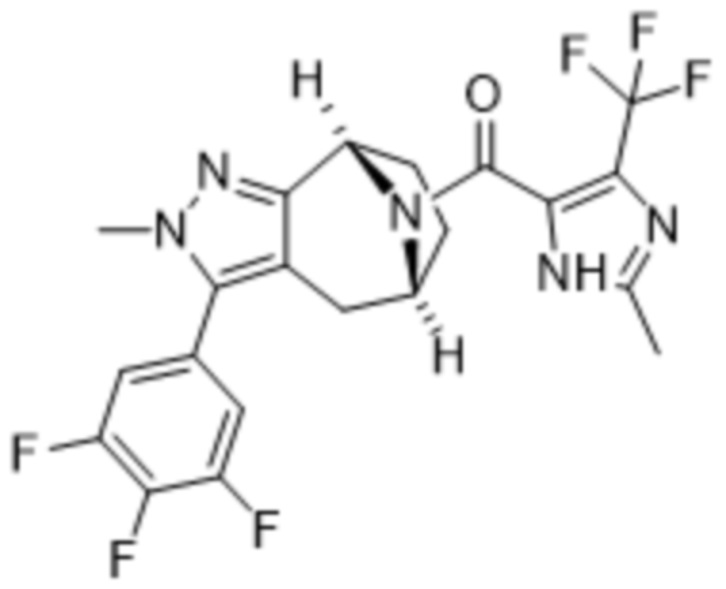
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-метил-4-(трифторметил)-1H-имидазол-5-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C21H17F6N5O, - 469,1; полученное m/z, 470,0 [M+H]+. 1H ЯМР (500 МГц, CDCl3) δ 6,99-6,87 (м, 2H), 5,76-5,03 (м, 1H), 4,70-4,09 (м, 1H), 3,88-3,68 (м, 3H), 3,54-3,25 (м, 1H), 2,47-1,93 (м, 7H), 1,76-1,62 (м, 1H).
Пример 401. (1 H -индол-7-ил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
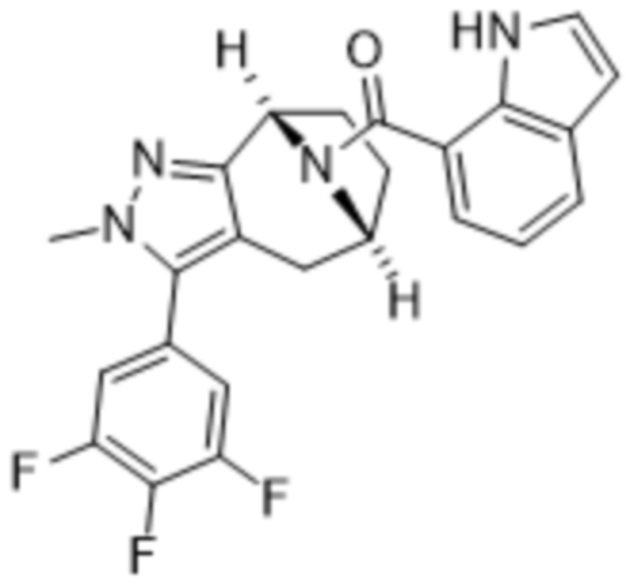
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и индол-7-корбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H19F3N4O, - 436,2; полученное m/z, 437,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 9,43 (с, 1H), 7,74 (д, J=7,9 Гц, 1H), 7,35 (д, J=7,3 Гц, 1H), 7,11 (т, J=7,7 Гц, 1H), 7,07-6,94 (м, 2H), 6,62-6,53 (м, 1H), 5,60 (с, 1H), 3,81 (с, 3H), 3,21 (с, 1H), 2,48-2,38 (м, 1H), 2,38-2,13 (м, 2H), 2,05 (т, J=10,1 Гц, 1H), 1,76-1,62 (м, 1H), 1,54 (с, 1H).
Пример 402. (6-фтор-1H-индол-7-ил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
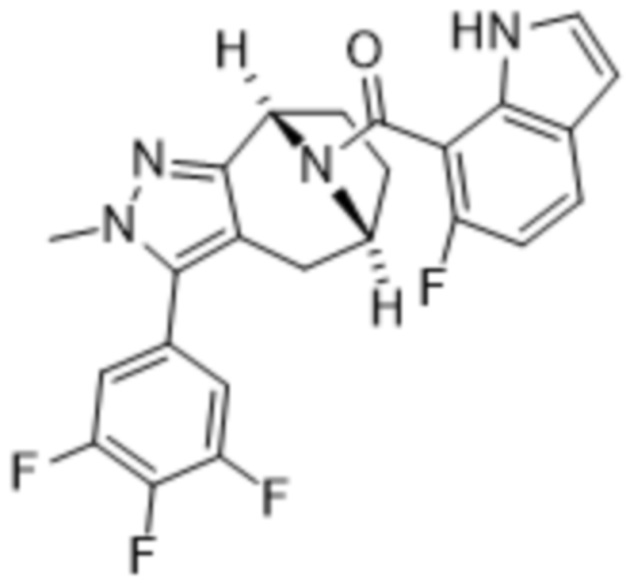
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-фтор-1H-индол-7-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H18F4N4O, - 454,1; полученное m/z, 455,0 [M+H]+. 1H ЯМР (600 МГц, CDCl3) δ 8,46-8,30 (м, 1H), 7,49-7,39 (м, 1H), 7,35-7,28 (м, 2H), 7,03-6,90 (м, 2H), 6,56-6,49 (м, 1H), 5,82-5,12 (м, 1H), 4,93-4,23 (м, 1H), 3,86-3,68 (м, 3H), 3,36-2,80 (м, 1H), 2,43-2,18 (м, 3H), 2,11-1,92 (м, 1H), 1,72-1,60 (м, 1H).
Пример 403. (2,3-диметил-1H-индол-7-ил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
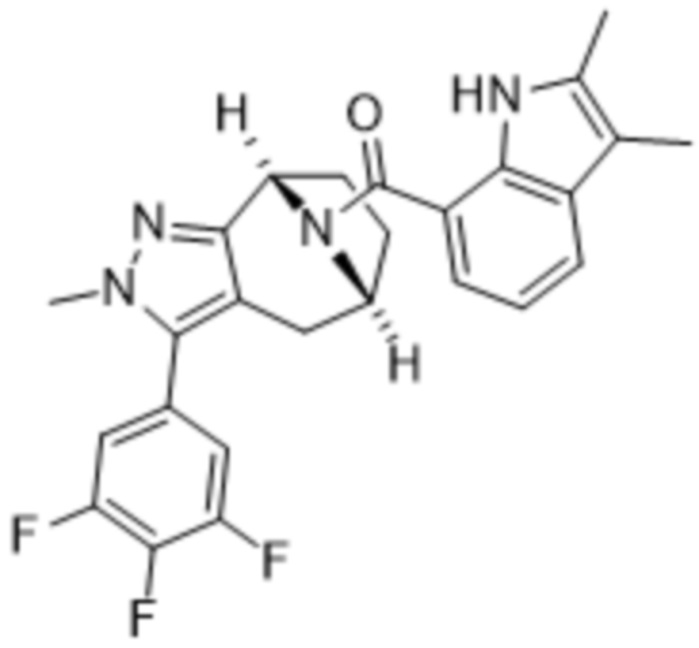
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2,3-диметил-1H-индол-7-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H23F3N4O, - 464,2; полученное m/z, 465,1 [M+H]+. 1H ЯМР (600 МГц, CDCl3) δ 8,96 (с, 1H), 7,56 (д, J=7,8 Гц, 1H), 7,26 (с, 2H), 7,10-7,02 (м, 1H), 6,99 (т, J=6,9 Гц, 2H), 5,88-5,43 (м, 1H), 3,87-3,73 (м, 3H), 3,34-3,03 (м, 1H), 2,40 (д, J=15,3 Гц, 1H), 2,35 (с, 3H), 2,33-2,25 (м, 1H), 2,25-2,21 (м, 3H), 2,18 (с, 1H), 2,03 (т, J=10,4 Гц, 1H), 1,74-1,60 (м, 1H).
Пример 404. (1H-индазол-7-ил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
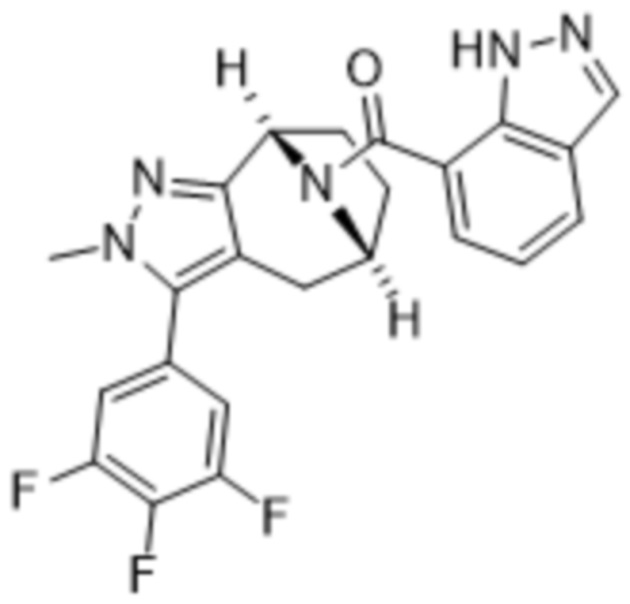
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1H-индазол-7-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H18F3N5O, - 437,1; полученное m/z, 438,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 11,03 (с, 1H), 8,11 (с, 1H), 7,94-7,82 (м, 1H), 7,62-7,49 (м, 1H), 7,23-7,14 (м, 1H), 7,07-6,89 (м, 2H), 5,53 (с, 1H), 5,38-4,96 (м, 1H), 3,81 (с, 3H), 3,32-3,12 (м, 1H), 2,50-2,39 (м, 1H), 2,39-2,16 (м, 2H), 2,14-2,02 (м, 1H), 1,80-1,66 (м, 1H).
Пример 405. (1H-бензо[d]имидазол-7-ил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
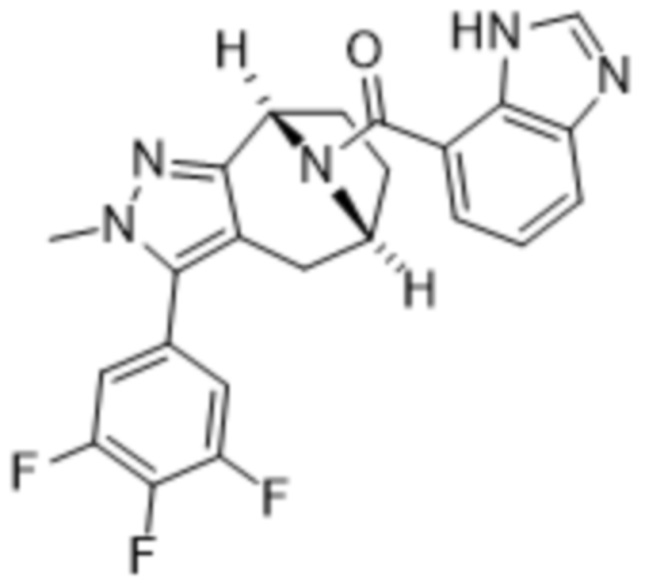
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1H-бензимидазол-7-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H18F3N5O, - 437,1; полученное m/z, 438,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 10,29 (с, 1H), 8,09 (с, 1H), 7,94 (д, J=8,0 Гц, 1H), 7,50 (д, J=15,8 Гц, 1H), 7,30 (т, J=7,8 Гц, 1H), 7,07-6,92 (м, 2H), 5,74-5,48 (м, 1H), 5,39-5,08 (м, 1H), 3,82 (с, 3H), 3,32-3,12 (м, 1H), 2,50-2,40 (м, 1H), 2,40-2,15 (м, 2H), 2,15-2,01 (м, 1H), 1,81-1,64 (м, 1H).
Пример 406. ((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)(2-метилбензо[d]оксазол-6-ил)метанон.
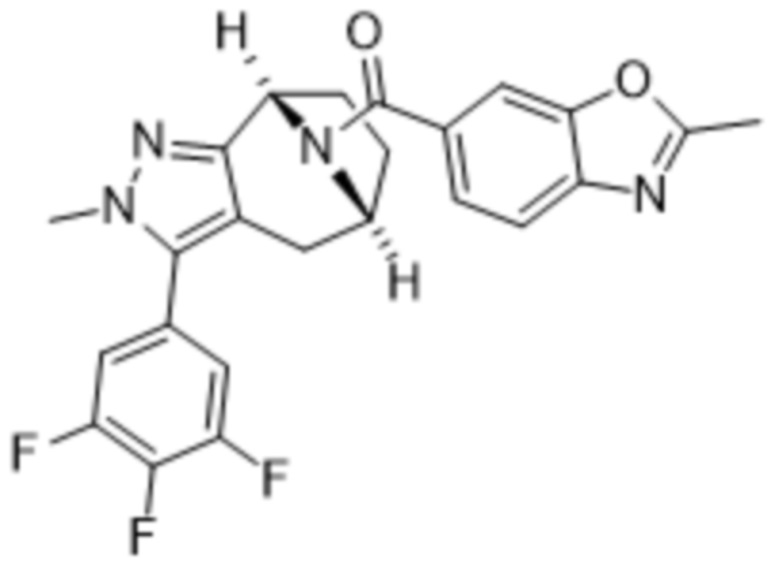
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-метил-1,3-бензоксазол-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H19F3N4O2, - 452,1; полученное m/z, 453,0 [M+H]+. 1H ЯМР (600 МГц, CDCl3) δ 7,72-7,59 (м, 2H), 7,43 (с, 1H), 6,99 (с, 2H), 5,19 (с, 1H), 5,10-4,37 (м, 1H), 3,79 (с, 3H), 3,54-3,19 (м, 1H), 2,67 (с, 3H), 2,46-1,92 (м, 4H), 1,75-1,63 (м, 1H).
Пример 407. Фуро[3,2-c]пиридин-4-ил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
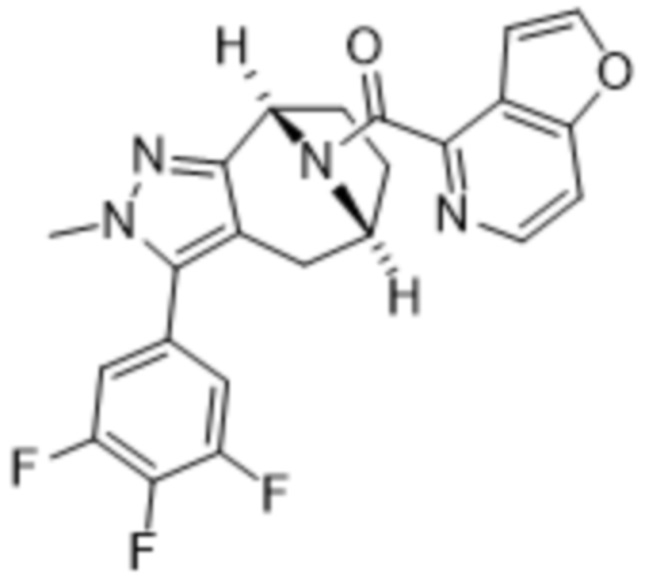
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и фуро[3,2-c]пиридин-4-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H17F3N4O2, - 438,1; полученное m/z, 439,2 [M+H]+. 1H ЯМР (600 МГц, CDCl3) δ 8,53-8,47 (м, 1H), 7,72-7,67 (м, 1H), 7,55-7,48 (м, 1H), 7,32-7,30 (м, 1H), 7,01-6,92 (м, 2H), 6,20-5,81 (м, 1H), 5,38-5,22 (м, 1H), 3,85-3,71 (м, 3H), 3,40-3,27 (м, 1H), 2,46-2,19 (м, 3H), 2,12-1,99 (м, 1H), 1,78-1,64 (м, 1H).
Пример 408. (1-метил-1H-пирроло[2,3-b]пиридин-3-ил)((5R,8S)-2-метил-3-фенил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
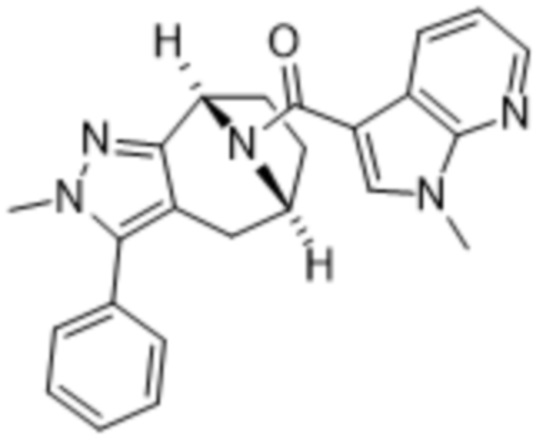
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-фенил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 106) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-метил-1H-пироло[2,3-b]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H23N5O, - 397,2; полученное m/z, 398,1 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 8,40-8,36 (м, 1H), 8,29-8,23 (м, 1H), 7,58 (с, 1H), 7,50-7,44 (м, 2H), 7,44-7,37 (м, 1H), 7,36 (д, J=1,7 Гц, 1H), 7,35-7,32 (м, 1H), 7,20-7,14 (м, 1H), 5,48 (с, 1H), 5,15 (с, 1H), 3,91 (с, 3H), 3,82 (с, 3H), 3,25 (с, 1H), 2,45-2,36 (м, 1H), 2,36-2,17 (м, 2H), 2,14-2,03 (м, 1H), 1,77-1,64 (м, 1H).
Пример 409. (1-метил-1H-пирроло[2,3-b]пиридин-3-ил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
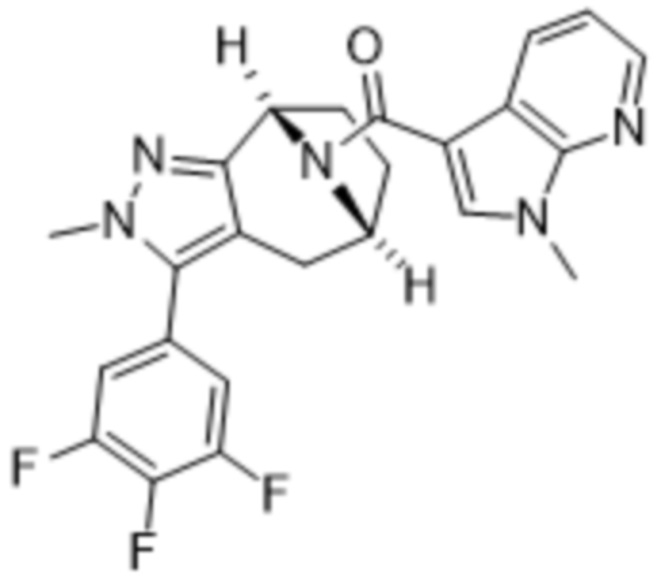
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-метил-1H-пирроло[2,3-b]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H20F3N5O, - 451,2; полученное m/z, 452,0 [M+H]+. 1H ЯМР (600 МГц, CDCl3) δ 8,40-8,37 (м, 1H), 8,25-8,21 (м, 1H), 7,56 (с, 1H), 7,20-7,15 (м, 1H), 7,02-6,93 (м, 2H), 5,46 (с, 1H), 5,13 (с, 1H), 3,92 (с, 3H), 3,80 (с, 3H), 3,22 (с, 1H), 2,42-2,22 (м, 3H), 2,12-2,03 (м, 1H), 1,74-1,63 (м, 1H).
Пример 410. Имидазо[1,2-a]пиридин-5-ил((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
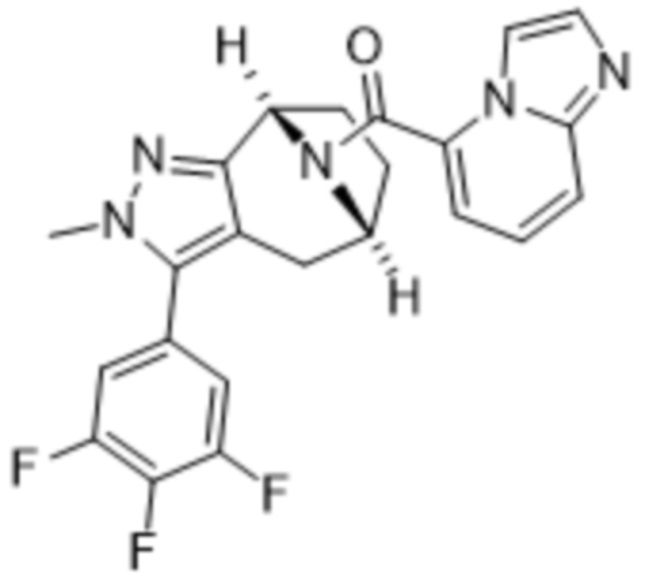
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и имидазол[1,2-a]пиридин-5-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H18F3N5O, - 437,1; полученное m/z, 438,0 [M+H]+. 1H ЯМР (600 МГц, CDCl3) δ 8,43 (с, 1H), 7,70 (д, J=1,3 Гц, 1H), 7,66-7,60 (м, 2H), 7,29 (д, J=6,9 Гц, 1H), 6,99 (т, J=6,9 Гц, 2H), 5,15 (с, 2H), 3,80 (с, 3H), 3,55-3,16 (м, 1H), 2,44-2,30 (м, 2H), 2,30-2,17 (м, 1H), 2,13-2,02 (м, 1H), 1,78-1,66 (м, 1H).
Пример 411. Имидазо[1,2-a]пиридин-3-ил((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
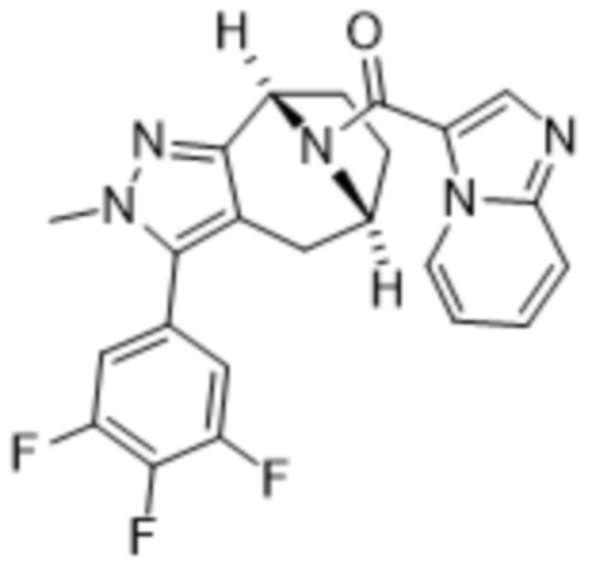
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и имидазол[1,2-a]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H18F3N5O, - 437,1; полученное m/z, 438,1 [M+H]+. 1H ЯМР (600 МГц, CDCl3) δ 9,19 (д, J=7,0 Гц, 1H), 8,02 (с, 1H), 7,72-7,64 (м, 1H), 7,38-7,30 (м, 1H), 7,02-6,90 (м, 3H), 5,65 (с, 1H), 5,18 (с, 1H), 3,81 (с, 3H), 3,28-3,17 (м, 1H), 2,43 (д, J=15,3 Гц, 1H), 2,39-2,30 (м, 1H), 2,31-2,19 (м, 1H), 2,16-2,05 (м, 1H), 1,79-1,68 (м, 1H).
Пример 412. (2-хлоримидазо[1,2-a]пиридин-3-ил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
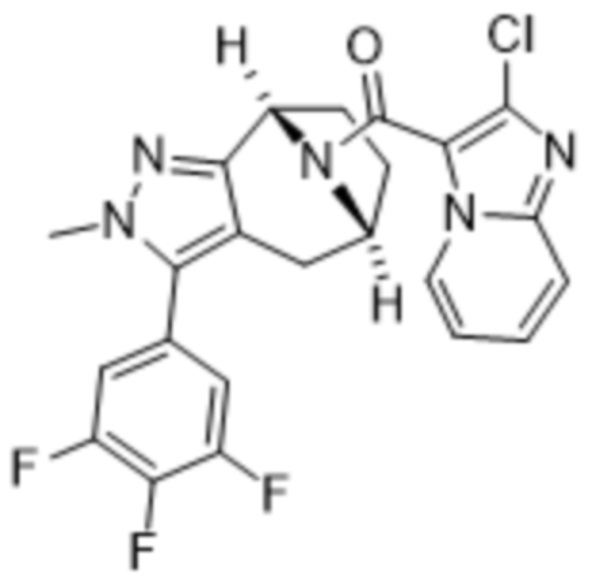
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-хлоримидазо[1,2-a]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H17ClF3N5O, - 471,1; полученное m/z, 472,0 [M+H]+. 1 H ЯМР (400 МГц, CDCl3) δ 8,63-8,57 (м, 1H), 7,60-7,54 (м, 1H), 7,38-7,30 (м, 1H), 7,02-6,93 (м, 2H), 6,93-6,86 (м, 1H), 5,37 (с, 1H), 4,96 (с, 1H), 3,76 (с, 3H), 2,53-2,34 (м, 3H), 2,09 (т, J=9,4 Гц, 1H), 1,73 (т, J=7,6 Гц, 1H), 1,62-1,42 (м, 1H).
Пример 413. (7-метоксиимидазо[1,2-a]пиридин-3-ил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
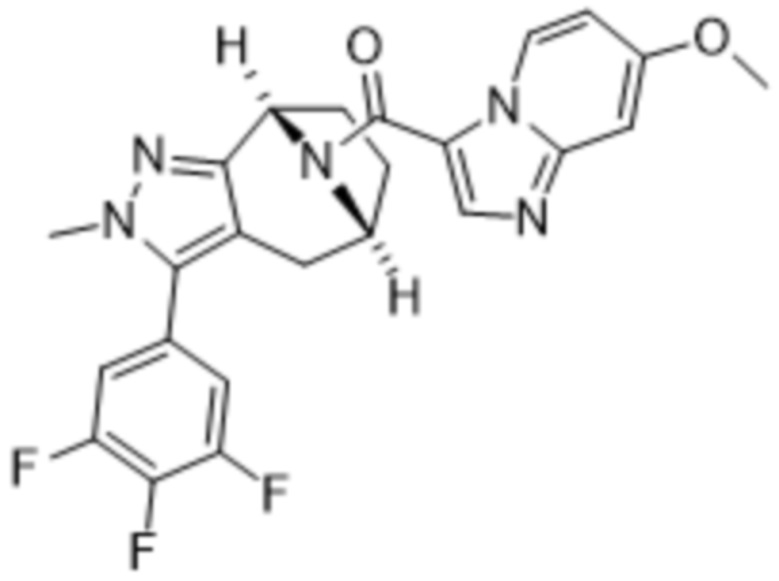
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 7-метиоксиимидазо[1,2-A]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H20F3N5O2, - 467,2; полученное m/z, 468,0 [M+H]+. 1H ЯМР (600 МГц, CDCl3) δ 9,04 (д, J=7,7 Гц, 1H), 7,91 (с, 1H), 7,00-6,95 (м, 2H), 6,93 (д, J=2,5 Гц, 1H), 6,66-6,61 (м, 1H), 5,63 (с, 1H), 5,16 (с, 1H), 3,88 (с, 3H), 3,81 (с, 3H), 3,49 (д, J=5,5 Гц, 1H), 3,26-3,16 (м, 1H), 2,48-2,04 (м, 3H), 1,77-1,66 (м, 1H).
Пример 414. ((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)(2-метилимидазо[1,2-a]пиридин-3-ил)метанон.
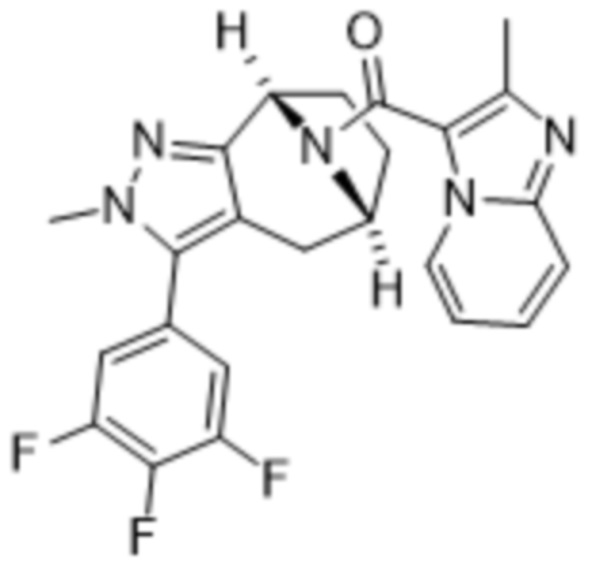
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-метилимидазо[1,2-a]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H20F3N5O, - 451,2; полученное m/z, 452,1 [M+H]+. 1H ЯМР (500 МГц, CDCl3) δ 8,58-8,52 (м, 1H), 7,58-7,51 (м, 1H), 7,30-7,21 (м, 1H), 7,01-6,91 (м, 2H), 6,84-6,77 (м, 1H), 5,19 (с, 1H), 4,95 (с, 1H), 3,78 (с, 3H), 3,36-3,11 (м, 1H), 2,52 (с, 3H), 2,45-2,32 (м, 2H), 2,32-2,18 (м, 1H), 2,12-2,05 (м, 1H), 1,84-1,61 (м, 1H).
Пример 415. (2,5-диметилимидазо[1,2-a]пиридин-3-ил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
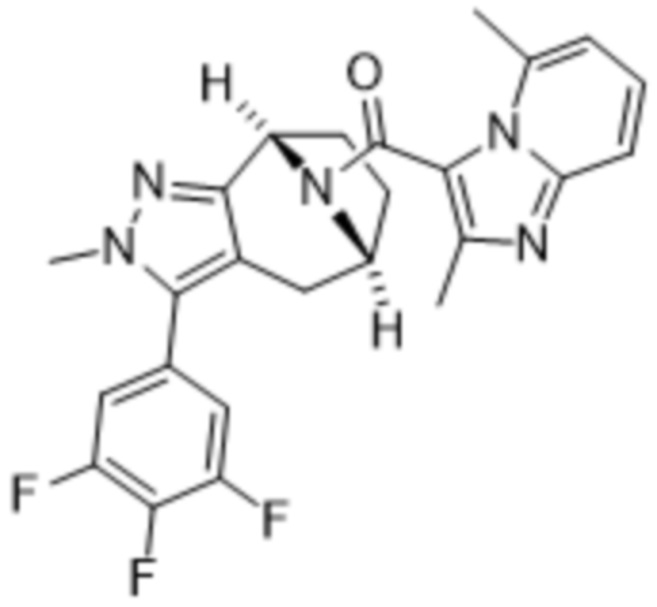
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2,5-диметилимидазо[1,2-a]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N5O, - 465,2; полученное m/z, 466,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 8,39 (д, J=6,9 Гц, 1H), 7,08-7,03 (м, 1H), 7,02-6,91 (м, 2H), 6,72 (т, J=6,9 Гц, 1H), 5,19 (с, 1H), 4,92 (с, 1H), 3,77 (с, 3H), 3,19 (с, 1H), 2,65-2,58 (м, 3H), 2,54 (с, 3H), 2,46-2,18 (м, 3H), 2,13-1,99 (м, 1H), 1,79-1,65 (м, 1H).
Пример 416. (2,6-диметилимидазо[1,2-a]пиридин-3-ил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
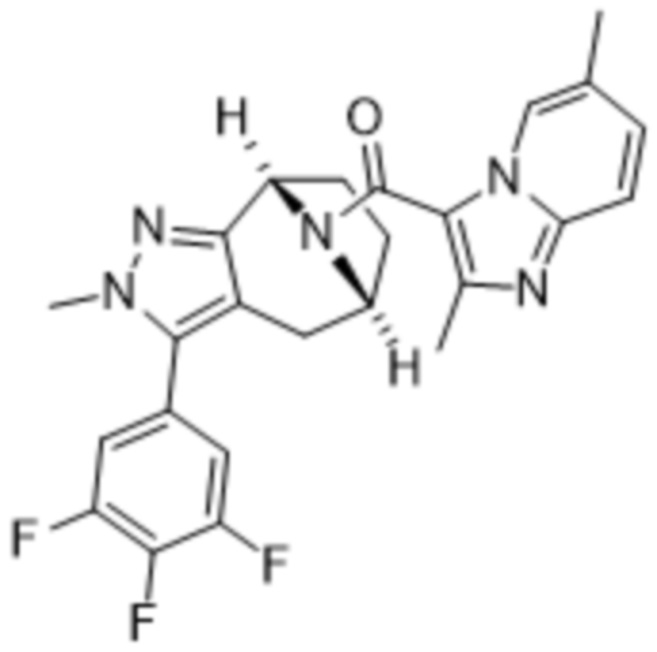
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2 H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2,6-диметилимидазо[1,2-a]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N5O, - 465,2; полученное m/z, 466,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 8,38-8,32 (м, 1H), 7,49-7,40 (м, 1H), 7,14-7,07 (м, 1H), 7,03-6,90 (м, 2H), 5,20 (с, 1H), 4,95 (с, 1H), 3,79 (с, 3H), 3,30-3,10 (м, 1H), 2,50 (с, 3H), 2,44-2,18 (м, 5H), 2,15-2,01 (м, 1H), 1,79-1,63 (м, 1H), 1,55-1,38 (м, 1H).
Пример 417. ((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)(2-метилимидазо[1,2-a]пиридин-3-ил)метанон.
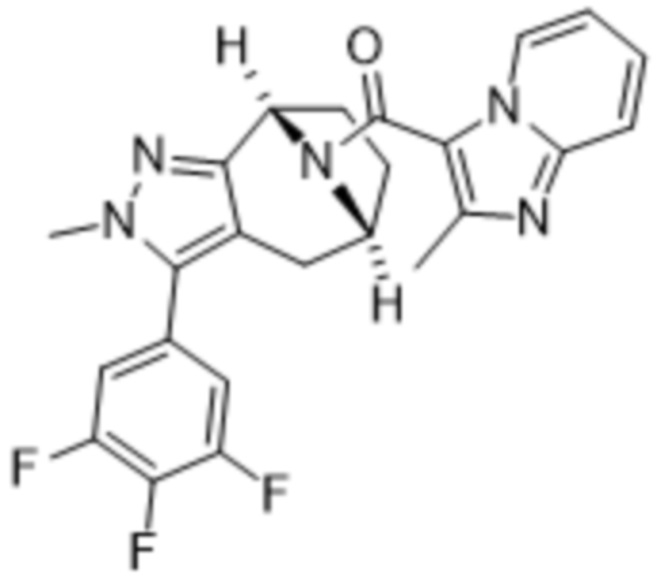
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-метилимидазо[1,2-a]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N5O, - 465,2; полученное m/z, 466,2 [M+H]+. 1H ЯМР (500 МГц, CDCl3) δ 8,48-8,41 (м, 1H), 7,32-7,28 (м, 1H), 7,01-6,90 (м, 2H), 6,68-6,61 (м, 1H), 5,19 (с, 1H), 4,93 (с, 1H), 3,78 (с, 3H), 3,16 (д, J=27,4 Гц, 1H), 2,49 (с, 3H), 2,44-2,32 (м, 5H), 2,32-2,18 (м, 1H), 2,14-2,01 (м, 1H), 1,70 (д, J=13,3 Гц, 1H).
Пример 418. (5-хлор-2-метилимидазо[1,2-a]пиридин-3-ил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
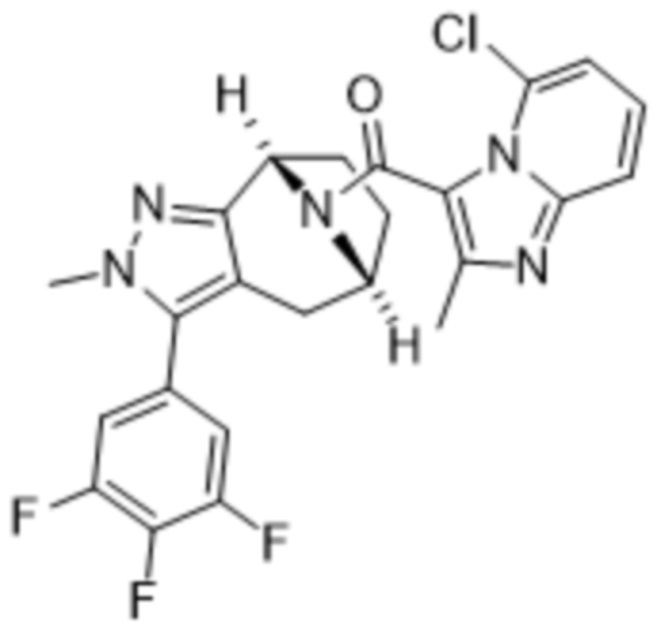
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-хлор-2-метил-имидазо[1,2-a]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H19ClF3N5O, - 485,1; полученное m/z, 486,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 8,63-8,57 (м, 1H), 7,52-7,45 (м, 1H), 7,25-7,19 (м, 1H), 7,04-6,92 (м, 2H), 5,15 (с, 1H), 4,96 (с, 1H), 3,79 (с, 3H), 3,23 (с, 1H), 2,51 (с, 3H), 2,49-2,33 (м, 2H), 2,33-2,19 (м, 1H), 2,15-2,03 (м, 1H), 1,81-1,65 (м, 1H).
Пример 419. (2-(дифторметил)имидазо[1,2-a]пиридин-3-ил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
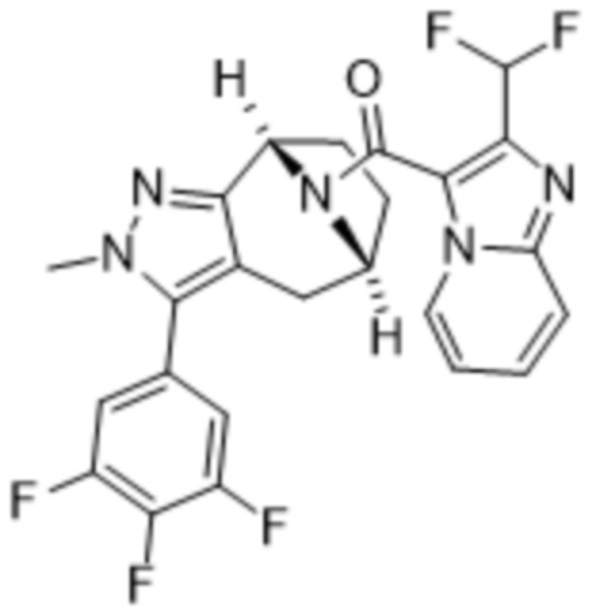
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-(дифторметил)имидазол[1,2-a]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H18F5N5O, - 487,1; полученное m/z, 488,0 [M+H]+. 1 H ЯМР (400 МГц, CDCl3) δ 8,29 (д, J=7,0 Гц, 1H), 7,73-7,67 (м, 1H), 7,39-7,31 (м, 1H), 7,05-6,73 (м, 4H), 5,29 (д, J=7,7 Гц, 1H), 4,88 (с, 1H), 3,77 (с, 3H), 3,08 (д, J=48,6 Гц, 1H), 2,49-2,25 (м, 3H), 2,17-2,04 (м, 1H), 1,79-1,67 (м, 1H).
Пример 420. ((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)(2-(трифторметил)имидазо[1,2-a]пиридин-3-ил)метанон.
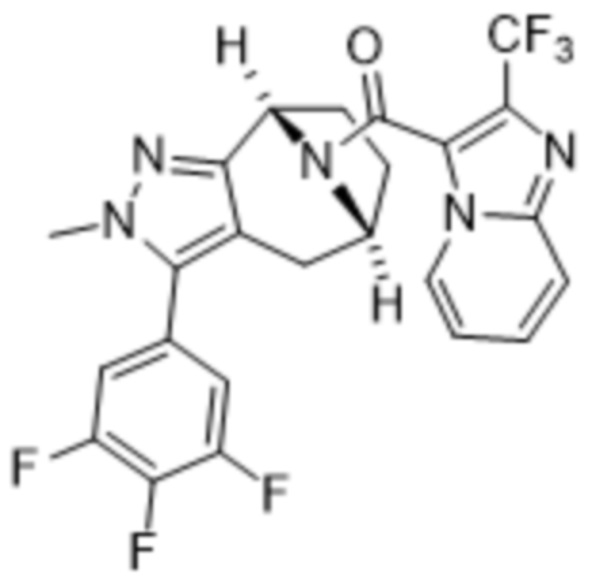
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-(трифторметил)имидазол[1,2-a]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H17F6N5O, - 505,1; полученное m/z, 506,0 [M+H]+. 1 H ЯМР (400 МГц, CDCl3) δ 8,14 (с, 1H), 7,72 (д, J=9,2 Гц, 1H), 7,37 (т, J=8,0 Гц, 1H), 6,94 (с, 3H), 5,03 (с, 1H), 3,76 (с, 3H), 3,41 (с, 0H), 2,39 (с, 3H), 2,06 (д, J=14,3 Гц, 1H), 1,72 (с, 1H), 1,57 (с, 2H).
Пример 421. (5-метил-2-(трифторметил)имидазо[1,2-a]пиридин-3-ил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
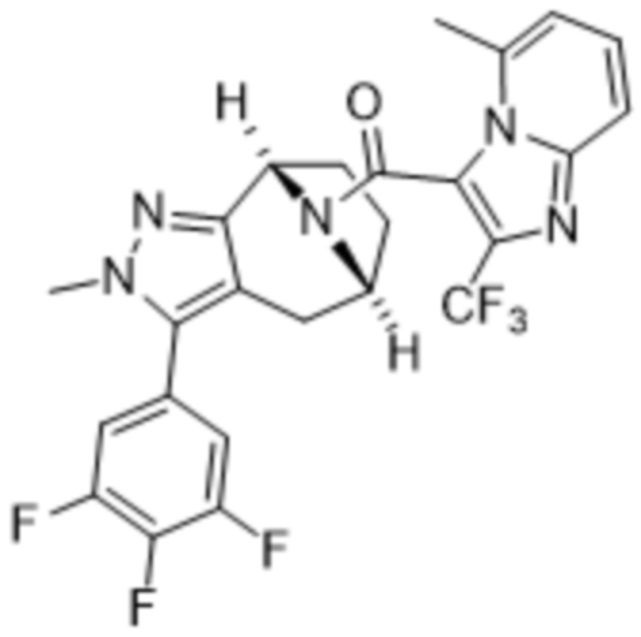
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 5-метил-2-(трифторметил)имидазол[1,2-a]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H19F6N5O, - 519,1; полученное m/z, 520,0 [M+H]+. 1H ЯМР (600 МГц, CDCl3) δ 7,99 (с, 1H), 7,14 (с, 1H), 7,02-6,83 (м, 3H), 5,68-4,69 (м, 1H), 3,78 (д, J=2,6 Гц, 3H), 3,22-3,00 (м, 1H), 2,65 (с, 3H), 2,52-1,98 (м, 4H), 1,84-1,66 (м, 1H), 1,42 (дд, J=30,7, 7,0 Гц, 1H).
Пример 422. ((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)(пиразоло[1,5-a]пиридин-3-ил)метанон.

Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и пиразоло[1,5-a]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H18F3N5O, - 437,1; полученное m/z, 438,1 [M+H]+. 1 H ЯМР (600 МГц, CDCl3) δ 8,51-8,47 (м, 1H), 8,18 (с, 1H), 8,11 (д, J=8,9 Гц, 1H), 7,35-7,30 (м, 1H), 7,02-6,94 (м, 2H), 6,94-6,88 (м, 1H), 5,52 (с, 1H), 5,16 (с, 1H), 3,80 (с, 3H), 3,22 (с, 1H), 2,45-2,29 (м, 2H), 2,30-2,19 (м, 1H), 2,16-2,04 (м, 1H), 1,77-1,65 (м, 1H).
Пример 423. ((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)(2-метилпиразоло[1,5-a]пиридин-3-ил)метанон.
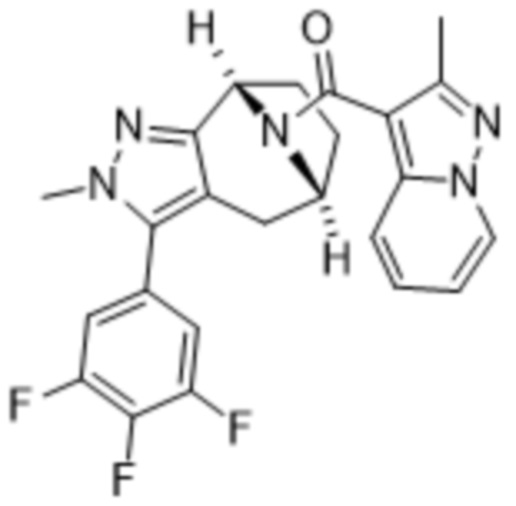
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-метилпиразоло[1,5-a]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H20F3N5O, - 451,2; полученное m/z, 452,0 [M+H]+. 1 H ЯМР (400 МГц, CDCl3) δ 8,39 (дт, J=6,9, 1,1 Гц, 1H), 7,47 (д, J=8,8 Гц, 1H), 7,21 (ддд, J=8,9, 6,8, 1,1 Гц, 1H), 7,04-6,90 (м, 2H), 6,79 (тд, J=6,9, 1,4 Гц, 1H), 3,78 (с, 3H), 3,76-3,67 (м, 1H), 3,23-3,14 (м, 2H), 2,80 (с, 1H), 2,50 (с, 3H), 2,45-2,16 (м, 2H), 2,13-1,97 (м, 1H), 1,77-1,62 (м, 1H).
Пример 424. (6-метоксипиразол[1,5-a]пиридин-3-ил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
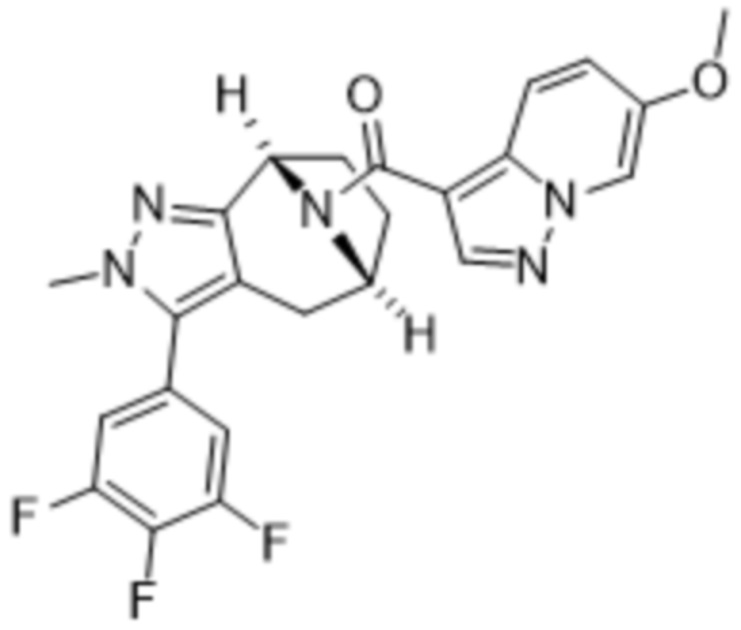
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-метокси-пиразоло[1,5-a]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H20F3N5O2, - 467,2; полученное m/z, 468,0 [M+H]+. 1H ЯМР (600 МГц, CDCl3) δ 8,09 (с, 1H), 8,08-8,05 (м, 1H), 8,02 (д, J=9,6 Гц, 1H), 7,14-7,09 (м, 1H), 7,01-6,93 (м, 2H), 5,53 (с, 1H), 5,15 (с, 1H), 3,85 (с, 3H), 3,80 (с, 3H), 3,21 (д, J=15,3 Гц, 1H), 2,45-2,29 (м, 2H), 2,29-2,19 (м, 1H), 2,08 (т, J=10,6 Гц, 1H), 1,78-1,62 (м, 1H).
Пример 425. ((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)(2-(трифторметил)пиразоло[1,5-a]пиридин-3-ил)метанон.
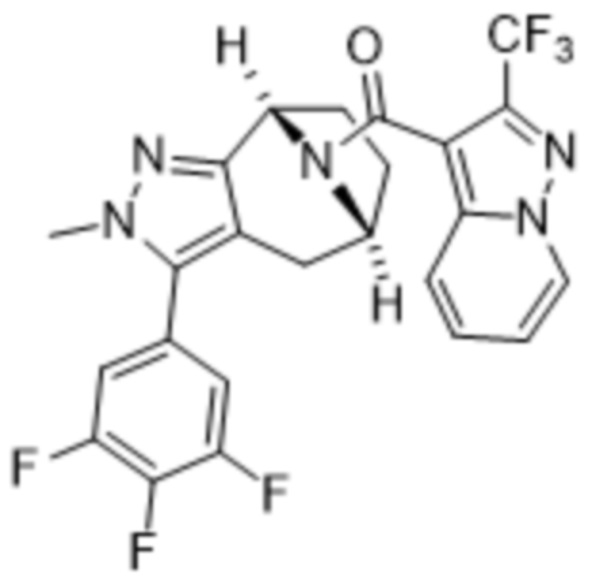
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-(трифторметил)пиразоло[1,5-a]пиридин-3-карбоновую кислоту (промежуточное соединение 100) вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H17F6N5O, - 505,1; полученное m/z, 506,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 8,51 (д, J=7,1 Гц, 1H), 7,34 (с, 2H), 7,08-6,86 (м, 3H), 6,23-4,60 (м, 2H), 3,90-3,61 (м, 2H), 3,29-3,12 (м, 2H), 2,81 (с, 3H), 2,33 (д, J=36,2 Гц, 1H), 2,15-1,63 (м, 1H).
Пример 426. ((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)(пиразоло[1,5-a]пиразин-3-ил)метанон.
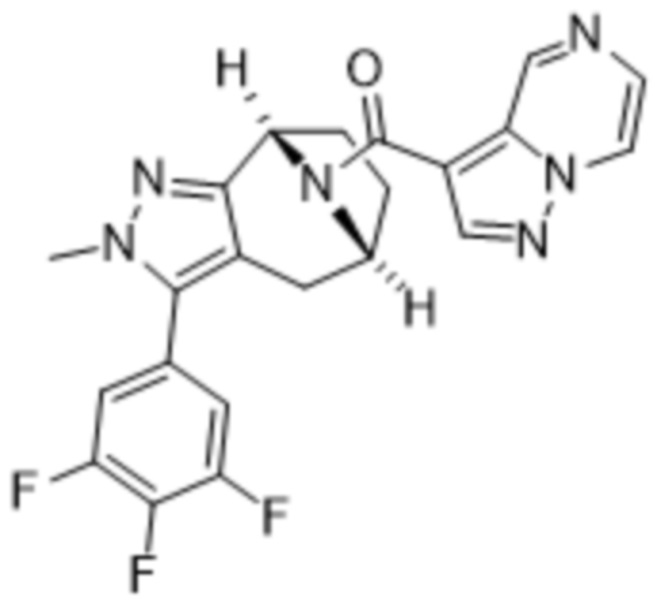
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и пиразоло[1,5-a]пиразин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C22H17F3N6O, - 438,1; полученное m/z, 439,0 [M+H]+. 1 H ЯМР (500 МГц, CDCl3) δ 9,54 (с, 1H), 8,40 (дд, J=4,7, 1,5 Гц, 1H), 8,24 (с, 1H), 8,03 (д, J=4,7 Гц, 1H), 6,98 (дд, J=7,7, 6,2 Гц, 2H), 5,57-5,10 (м, 2H), 3,81 (с, 3H), 3,55-3,14 (м, 1H), 2,49-2,21 (м, 3H), 2,12 (т, J=10,5 Гц, 1H), 1,81-1,67 (м, 1H).
Пример 427. ((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)(пиразоло[1,5-a]пиримидин-3-ил)метанон.
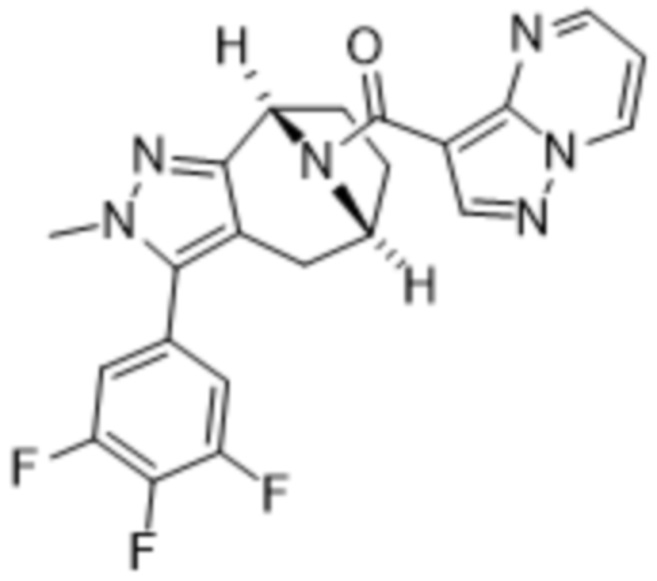
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и пиразоло[1,5-a]пиримидин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C22H17F3N6O, - 438,1; полученное m/z, 439,0 [M+H]+. 1 H ЯМР (400 МГц, CDCl3) δ 8,72 (д, J=6,9 Гц, 1H), 8,65 (дд, J=4,1, 1,8 Гц, 1H), 8,42 (с, 1H), 7,05-6,91 (м, 3H), 5,44 (с, 1H), 5,10 (с, 1H), 3,75 (д, J=17,4 Гц, 3H), 3,56-3,31 (м, 1H), 2,62-2,23 (м, 3H), 2,05 (т, J=9,7 Гц, 1H), 1,71 (дд, J=13,4, 7,6 Гц, 1H).
Пример 428. ((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)(2-метилимидазо[1,2-b]пиридазин-3-ил)метанон.
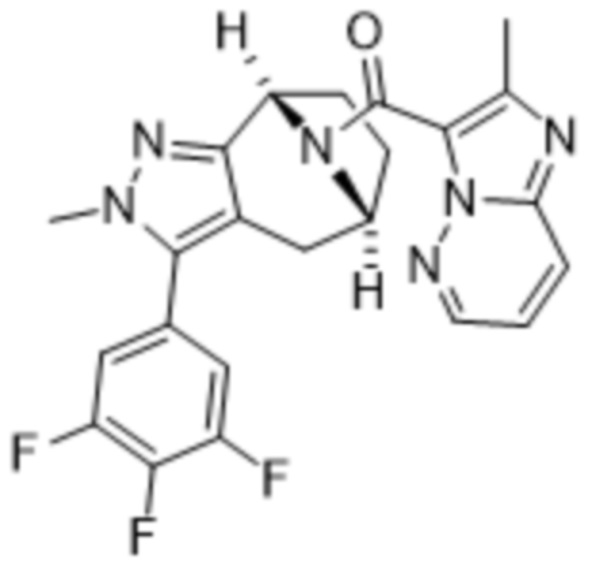
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и гидрохлорид 2-метилимидазо[1,2-b]пиридазин-3-карбоновой кислоты вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H19F3N6O, - 452,2; полученное m/z, 453,0 [M+H]+. 1H ЯМР (500 МГц, CDCl3) δ 8,37-8,31 (м, 1H), 7,92-7,88 (м, 1H), 7,12-7,06 (м, 1H), 6,98 (с, 2H), 5,26-4,70 (м, 1H), 3,86-3,67 (м, 3H), 3,53-3,36 (м, 3H), 2,64-2,44 (м, 2H), 2,44-2,31 (м, 3H), 2,15-1,62 (м, 2H).
Пример 429. ((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)(2-метилпиразоло[1,5-a]пиримидин-3-ил)метанон.
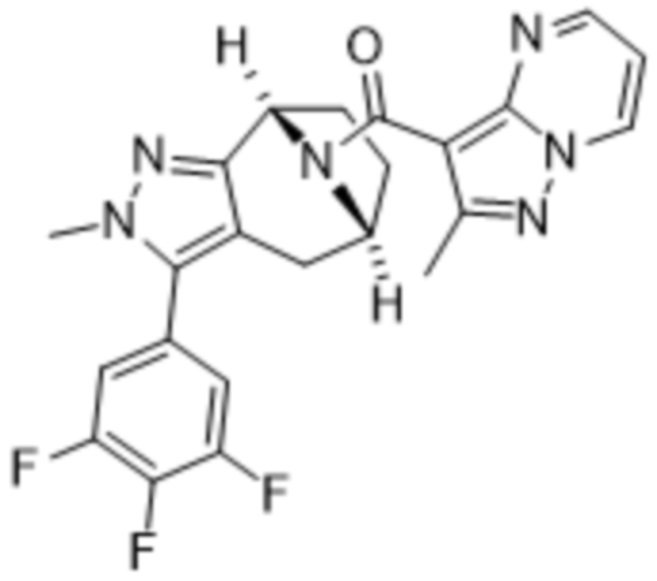
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2-метилпиразоло[1,5-a]пиримидин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H19F3N6O, - 452,2; полученное m/z, 453,0 [M+H]+. 1 H ЯМР (400 МГц, CDCl3) δ 8,59 (д, J=7,0 Гц, 1H), 8,57-8,51 (м, 1H), 6,99 (д, J=6,4 Гц, 2H), 6,89-6,81 (м, 1H), 5,12 (с, 2H), 3,89-3,31 (м, 6H), 2,54 (с, 3H), 2,35 (д, J=15,4 Гц, 1H), 2,02 (с, 1H), 1,68 (с, 1H).
Пример 430. (1-метил-1H-пиразоло[3,4-b]пиридин-3-ил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
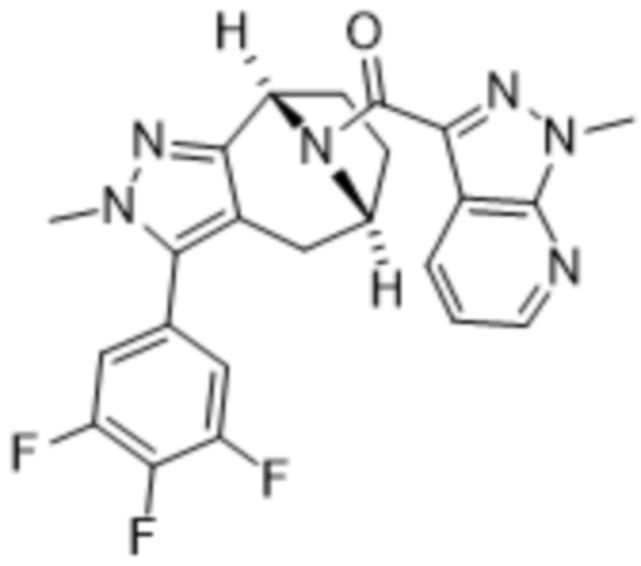
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1-метил-1H-пиразоло[3,4-b]пиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H19F3N6O, - 452,2; полученное m/z, 453,1 [M+H]+. 1 H ЯМР (600 МГц, CDCl3) δ 8,71-8,59 (м, 1H), 8,60-8,52 (м, 1H), 7,24-7,19 (м, 1H), 7,00-6,89 (м, 2H), 6,72 (д, J=5,3 Гц, 1H), 5,88 (с, 1H), 4,26-4,17 (м, 3H), 3,82-3,71 (м, 3H), 3,38-3,20 (м, 1H), 2,49-1,99 (м, 4H), 1,85-1,63 (м, 1H).
Пример 431. ((5R,8S)-2-метил-3-фенил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)(хинолин-6-ил)метанон.
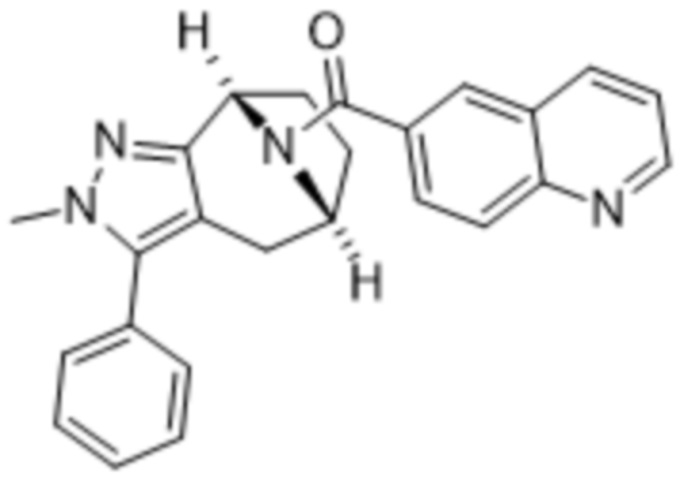
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,8S)-2-метил-3-фенил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 106) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C25H22N4O, - 394,2; полученное m/z, 395,1 [M+H]+. 1 H ЯМР (400 МГц, CDCl3) δ 9,01-8,94 (м, 1H), 8,20 (д, J=8,3 Гц, 1H), 8,14 (д, J=8,7 Гц, 1H), 8,00 (с, 1H), 7,82 (д, J=8,8 Гц, 1H), 7,54-7,29 (м, 6H), 5,23 (с, 1H), 5,16-4,33 (м, 1H), 3,81 (с, 3H), 3,44-2,92 (м, 1H), 2,53-2,14 (м, 3H), 2,16-1,95 (м, 1H), 1,74 (д, J=10,4 Гц, 1H).
Пример 432. ((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)(хинолин-8-ил)метанон.
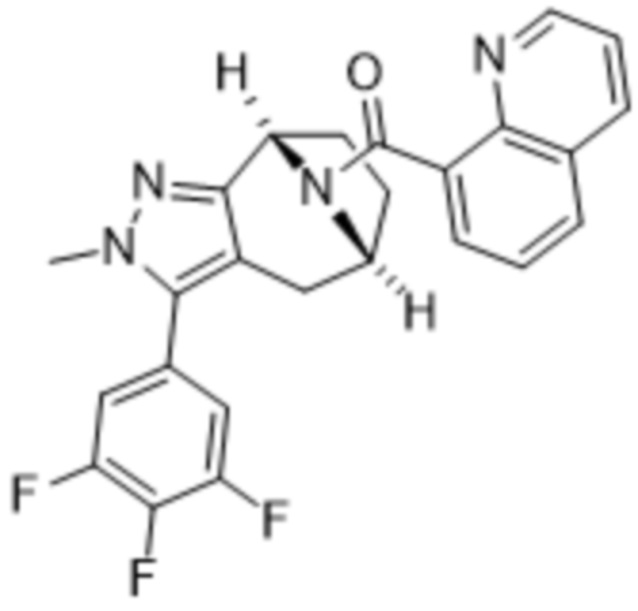
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 8-хинолинкарбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H19F3N4O, - 448,2; полученное m/z, 449,1 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 8,95 (д, J=17,9 Гц, 1H), 8,22-8,11 (м, 1H), 7,91-7,81 (м, 1H), 7,73-7,37 (м, 2H), 7,06-6,88 (м, 2H), 5,68 (д, J=237,4 Гц, 1H), 4,42 (д, J=5,6 Гц, 1H), 3,82 (с, 1H), 3,71 (с, 3H), 3,47-2,71 (м, 1H), 2,60-1,96 (м, 3H), 1,86 (т, J=10,4 Гц, 1H), 1,77-1,64 (м, 1H).
Пример 433. ((5S,8R)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)(хинолин-6-ил)метанон.
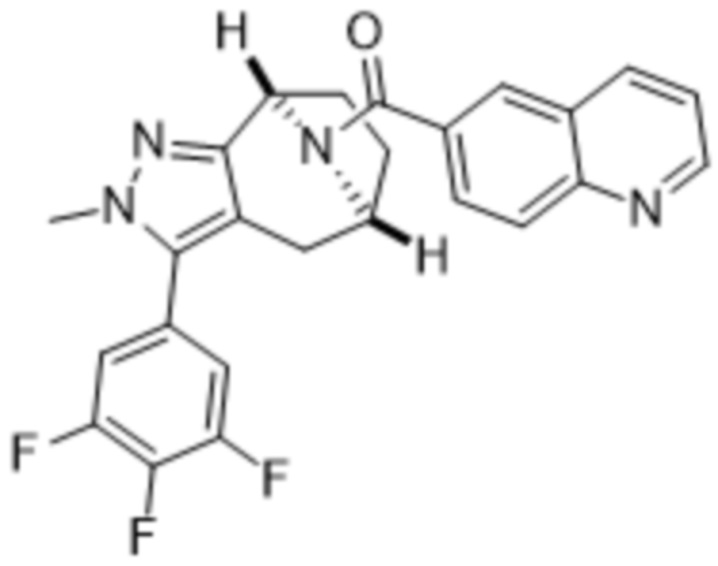
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5S,8R)-2-метил-3-(3,4,5-трифторфенил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 111) вместо (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C25H19F3N4O, - 448,2; полученное m/z, 449,1 [M+H]+. 1 H ЯМР (500 МГц, CDCl3) δ 9,04-8,92 (м, 1H), 8,19 (д, J=8,3 Гц, 1H), 8,14 (д, J=8,5 Гц, 1H), 7,98 (с, 1H), 7,88-7,74 (м, 1H), 7,50-7,41 (м, 1H), 7,08-6,90 (м, 2H), 5,86-5,14 (м, 1H), 5,17-4,38 (м, 1H), 3,80 (с, 3H), 3,41-2,84 (м, 1H), 2,51-2,14 (м, 3H), 2,15-1,97 (м, 1H), 1,71 (д, J=11,2 Гц, 1H).
Пример 434. ((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)(хинолин-6-ил)метанон.
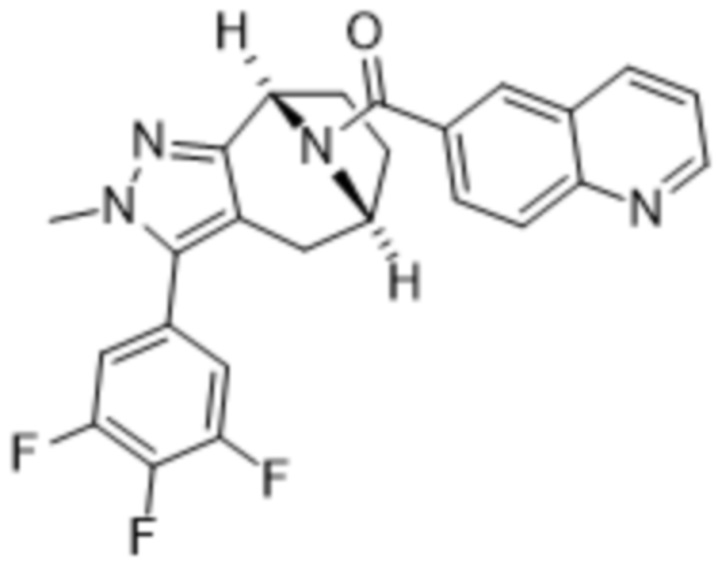
Титульное соединение получали способом, аналогичным описанному в примере 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1). МС (ИЭР): масса, рассчитанная для C25H19F3N4O, - 448,2; полученное m/z, 449,1 [M+H]+. 1 H ЯМР (500 МГц, CDCl3) δ 9,02-8,94 (м, 1H), 8,19 (д, J=8,4 Гц, 1H), 8,14 (д, J=8,5 Гц, 1H), 7,98 (с, 1H), 7,79 (д, J=8,7 Гц, 1H), 7,51-7,42 (м, 1H), 7,08-6,93 (м, 2H), 5,23 (с, 1H), 5,09 (д, J=5,2 Гц, 1H), 3,80 (с, 3H), 3,41-2,86 (м, 1H), 2,47-2,15 (м, 3H), 2,04 (т, J=10,3 Гц, 1H), 1,71 (д, J=11,3 Гц, 1H).
Пример 435. (2,4-диметилхинолин-7-ил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
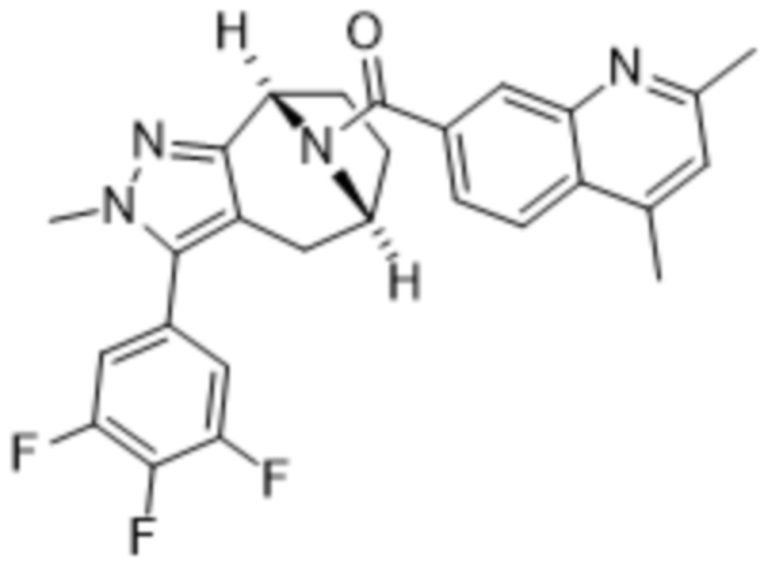
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2,4-диметилхинолин-7-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C27H23F3N4O, - 476,2; полученное m/z, 477,1 [M+H]+. 1H ЯМР (600 МГц, CDCl3) δ 8,16-7,52 (м, 3H), 7,19 (с, 1H), 7,02-6,94 (м, 2H), 5,86-5,16 (м, 1H), 5,12-4,47 (м, 1H), 3,90-3,70 (м, 3H), 3,43-2,91 (м, 1H), 2,70 с, 3H), 2,68 (с, 3H), 2,42-2,20 (м, 3H), 2,11-1,95 (м, 1H), 1,75-1,62 (м, 1H).
Пример 436. ((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)(6-метилхинолин-8-ил)метанон.
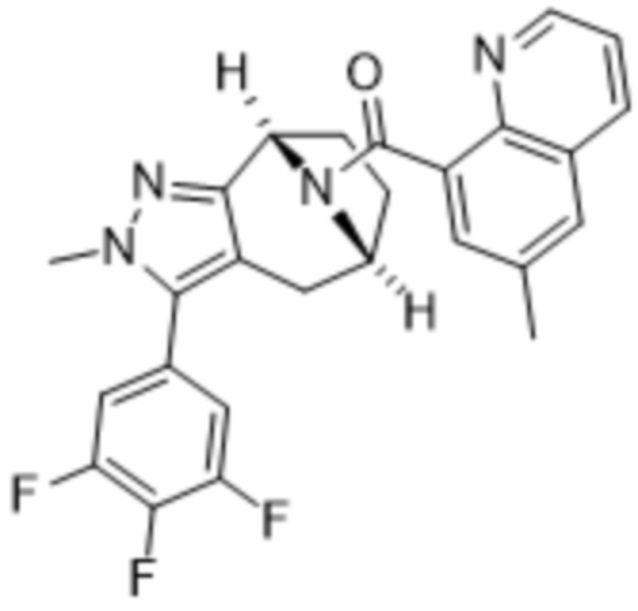
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 6-метилхинолин-8-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H21F3N4O, - 462,2; полученное m/z, 463,2 [M+H]+. 1H ЯМР (500 МГц, CDCl3) δ 8,86 (д, J=21,3 Гц, 1H), 8,15-7,97 (м, 1H), 7,66-7,33 (м, 3H), 7,07-6,88 (м, 2H), 6,04-5,28 (м, 1H), 4,48-4,36 (м, 1H), 3,87-3,61 (м, 3H), 3,46-3,26 (м, 1H), 2,62-2,34 (м, 5H), 2,28-2,01 (м, 1H), 1,94-1,79 (м, 1H), 1,78-1,62 (м, 1H).
Пример 437. ((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)(хиноксалин-6-ил)метанон.
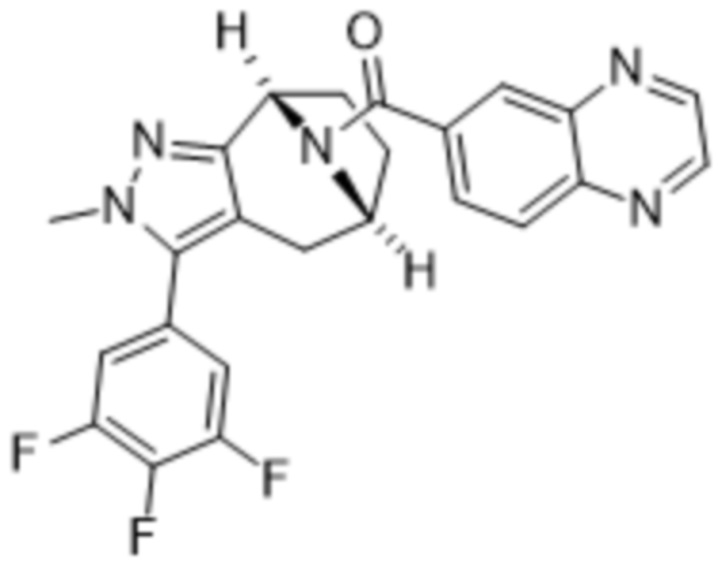
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и хиноксалин-6-корбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H18F3N5O, - 449,1; полученное m/z, 450,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 8,91 (с, 2H), 8,17 (д, J=12,7 Гц, 2H), 7,99-7,81 (м, 1H), 7,08-6,92 (м, 2H), 5,51 (д, J=230,9 Гц, 1H), 4,75 (д, J=231,1 Гц, 1H), 3,93-3,25 (м, 3H), 2,49-2,20 (м, 3H), 2,20-1,98 (м, 1H), 1,72 (с, 1H), 1,55 (с, 1H).
Пример 438. (2,3-диметилхиноксалин-6-ил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
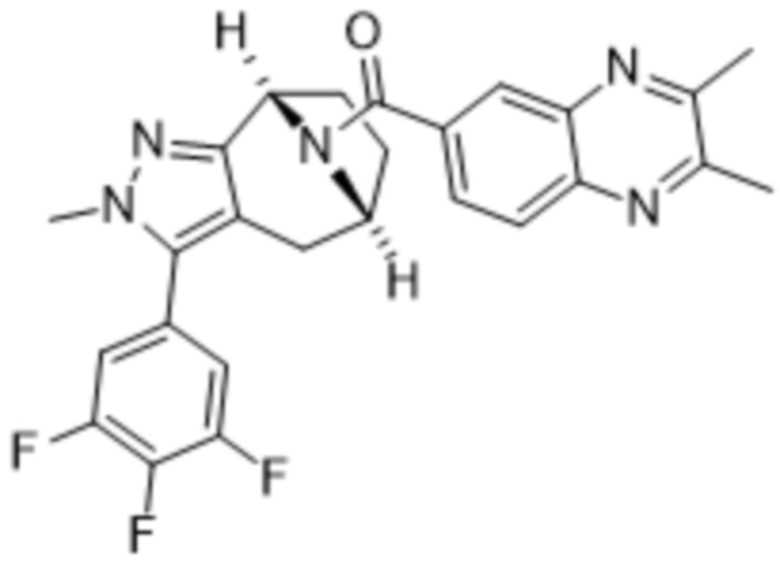
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2,3-диметилхиноксалин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C26H22F3N5O, - 477,2; полученное m/z, 478,1 [M+H]+. 1H ЯМР (600 МГц, CDCl3) δ 8,13-7,98 (м, 2H), 7,85-7,71 (м, 1H), 7,03-6,94 (м, 2H), 5,49 (д, J=341,1 Гц, 1H), 5,12-4,39 (м, 1H), 3,89-3,68 (м, 3H), 3,34 (д, J=15,3 Гц, 1H), 2,85-2,68 (м, 6H), 2,48-2,21 (м, 3H), 2,15-1,96 (м, 1H), 1,79-1,65 (м, 1H).
Пример 439. ((5R,8S)-2-метил-3-фенил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)(хиноксалин-5-ил)метанон.
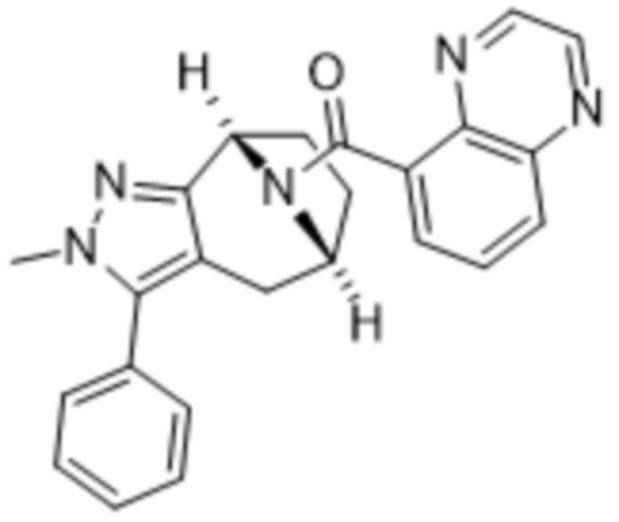
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-фенил-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 106) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и хиноксалин-5-корбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H21N5O, - 395,2; полученное m/z, 396,1 [M+H]+. 1 H ЯМР (400 МГц, CDCl3) δ 8,95-8,81 (м, 2H), 8,20-8,10 (м, 1H), 7,93-7,61 (м, 2H), 7,54-7,28 (м, 5H), 6,03-5,25 (м, 2H), 4,43 (д, J=5,6 Гц, 1H), 3,83 (с, 3H), 3,52-2,70 (м, 1H), 2,52-2,31 (м, 1H), 2,33-2,07 (м, 1H), 2,01-1,86 (м, 1H), 1,80-1,66 (м, 1H).
Пример 440. ((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)(1,5-нафтиридин-3-ил)метанон.
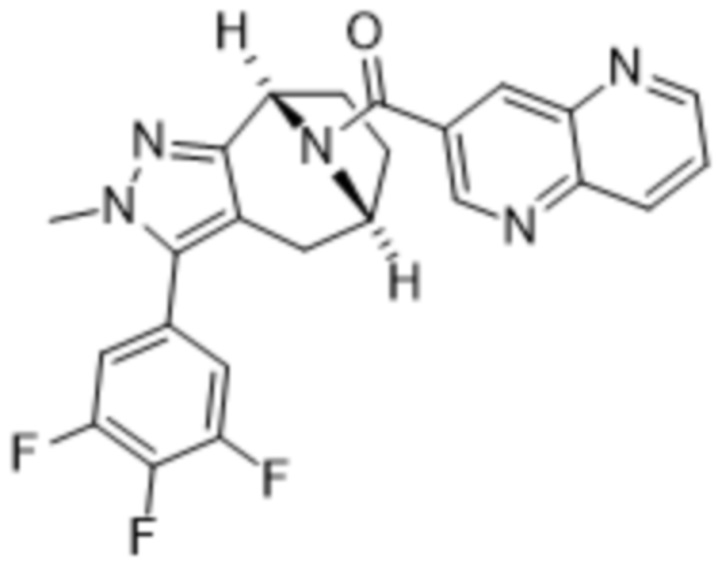
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 1,5-нафтиридин-3-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H18F3N5O, - 449,1; полученное m/z, 450,1 [M+H]+. 1H ЯМР (600 МГц, CDCl3) δ 9,11-9,02 (м, 2H), 8,44 (с, 2H), 7,72 (с, 1H), 7,00 (с, 2H), 5,22 (с, 1H), 5,04 (с, 1H), 3,77 (с, 4H), 3,35 (с, 1H), 2,50-2,24 (м, 2H), 2,16-2,02 (м, 1H), 1,74 (с, 1H).
Пример 441. ((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)(5-метил-5,6,7,8-тетрагидроимидазо[1,2-a]пиридин-3-ил)метанон.
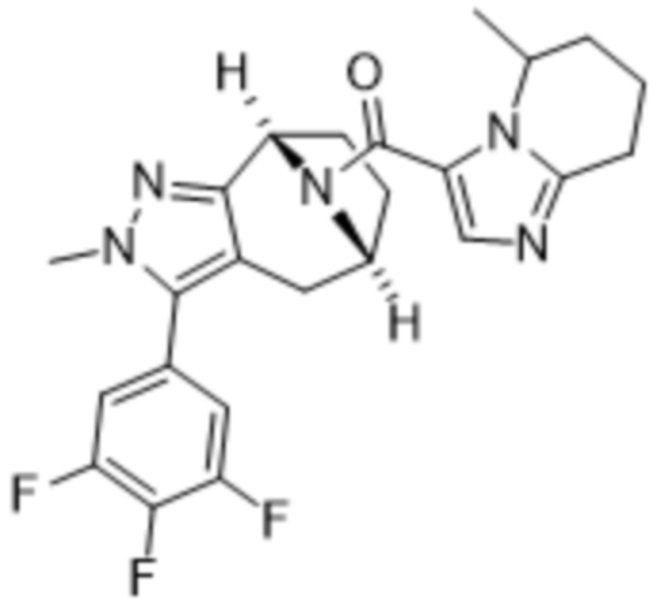
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и гидрохлорид 5-метил-5H,6H,7H,8H-имидазо[1,2-a]пиридин-3-карбоновой кислоты вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H24F3N5O, - 455,2; полученное m/z, 456,0 [M+H]+. 1H ЯМР (500 МГц, CDCl3) δ 7,24 (с, 1H), 7,00-6,90 (м, 2H), 5,70-4,59 (м, 2H), 3,85-3,70 (м, 3H), 3,41-3,00 (м, 1H), 3,00-2,86 (м, 1H), 2,86-2,72 (м, 1H), 2,53-2,20 (м, 1H), 2,19-1,61 (м, 5H), 1,56 (с, 3H), 1,41-0,96 (м, 4H).
Пример 442. ((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)(5,6,7,8-тетрагидроимидазо[1,2-a]пиридин-3-ил)метанон.
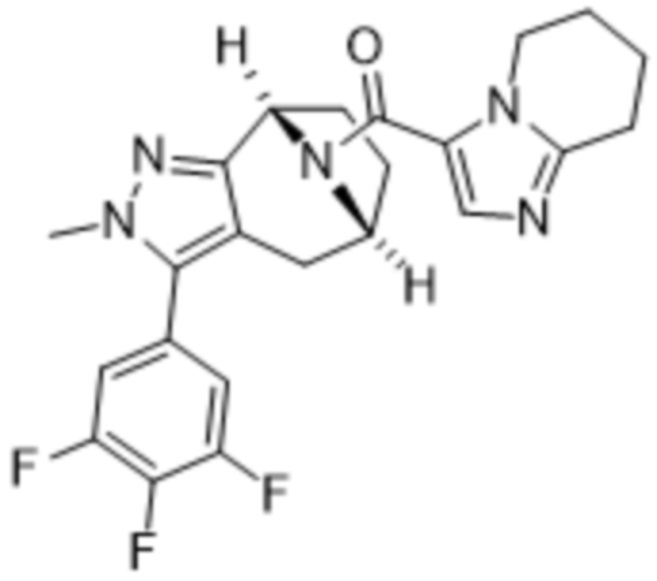
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и гидрохлорид 5H,6H,7H,8H-имидазо[1,2-a]пиридин-3-карбоновой кислоты вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C23H22F3N5O, - 441,2; полученное m/z, 442,1 [M+H]+. 1H ЯМР (600 МГц, CDCl3) δ 7,29 (с, 1H), 6,99-6,93 (м, 2H), 5,64-5,38 (м, 1H), 5,20-4,90 (м, 1H), 4,43-4,02 (м, 2H), 3,80 (с, 3H), 3,15 (д, J=15,3 Гц, 1H), 2,90 (т, J=6,4 Гц, 2H), 2,43-2,33 (м, 1H), 2,29 (к, J=11,0 Гц, 1H), 2,20 (с, 1H), 2,11-2,02 (м, 1H), 2,04-1,83 (м, 4H), 1,70-1,62 (м, 1H).
Пример 443. Изохроман-7-ил((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
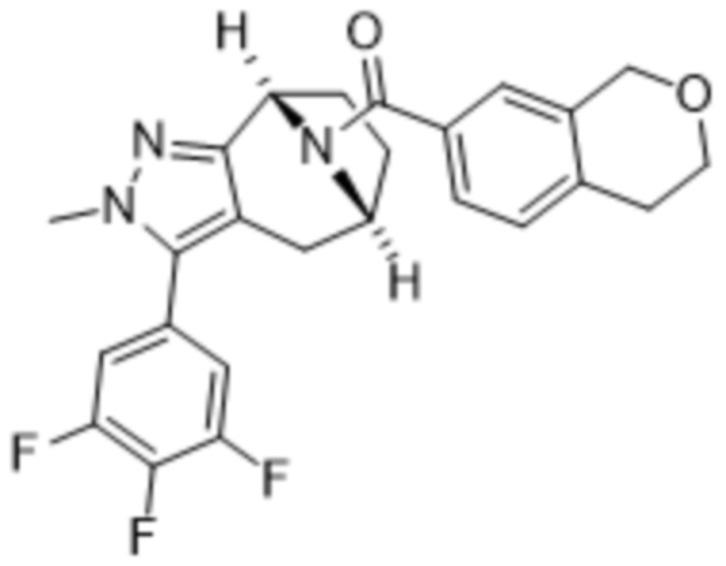
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 3,4-дигидро-1H-2-бензопиран-7-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C25H22F3N3O2, - 453,2; полученное m/z, 454,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,26-7,20 (м, 1H), 7,19-7,08 (м, 2H), 7,04-6,91 (м, 2H), 5,22-5,10 (м, 1H), 5,08-4,98 (м, 1H), 4,77 (с, 2H), 3,98 (т, J=5,7 Гц, 2H), 3,79 (с, 3H), 3,34-3,18 (м, 1H), 2,88 (т, J=5,7 Гц, 2H), 2,43-2,07 (м, 3H), 2,06-1,94 (м, 1H), 1,74-1,61 (м, 1H).
Пример 444. (2,3-дигидробензо[b][1,4]диоксин-6-ил)((5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол-9-ил)метанон.
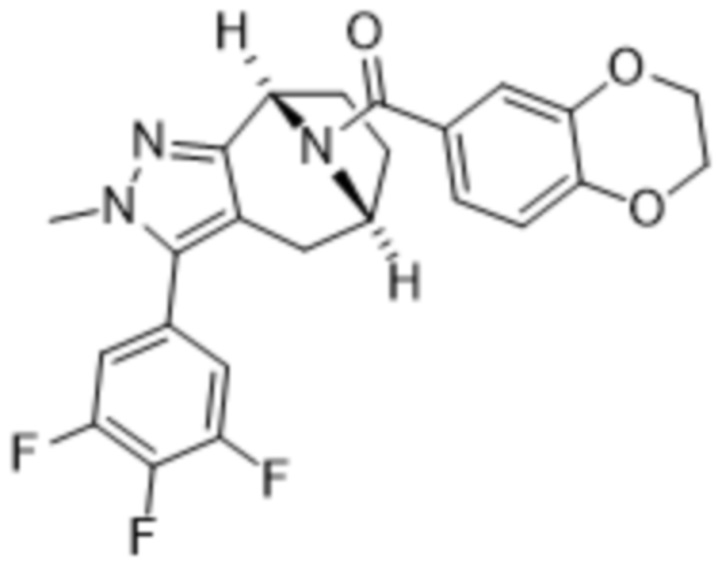
Титульное соединение получали аналогично примеру 1, используя (5R,8S)-2-метил-3-(3,4,5-трифторфенил)-2,4,5,6,7,8-гексагидро-5,8-эпиминциклогепта[c]пиразол 2,2,2-трифторацетат (промежуточное соединение 105) вместо рацемического (5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразола (промежуточное соединение 1) и 2,3-дигидробензо[b][1,4]диоксин-6-карбоновую кислоту вместо хинолин-6-карбоновой кислоты. МС (ИЭР): масса, рассчитанная для C24H20F3N3O3, - 455,1; полученное m/z, 456,0 [M+H]+. 1H ЯМР (400 МГц, CDCl3) δ 7,10-6,68 (м, 5H), 5,81-4,66 (м, 2H), 4,33-4,02 (м, 5H), 3,85-3,72 (м, 3H), 3,56-2,73 (м, 1H), 2,37-2,12 (м, 2H), 2,12-1,88 (м, 1H), 1,73-1,59 (м, 1H).
БИОЛОГИЧЕСКИЕ ДАННЫЕ
Анализ, используемый для измерения активности MGL in vitro, основан на анализе, используемом для другой сериновой гидролазы (FAAH), описанном в публикации Wilson et al., 2003 г., (высокопроизводительный анализ, совместимый с анализом для определения активности гидролазы амидов жирных кислот. Wilson SJ, Lovenberg TW, Barbier AJ. Anal Biochem. 2003 Jul 15;318(2):270-5.). Анализ заключается в комбинировании эндогенно экспрессируемого MGL из клеток HeLa с тестируемыми соединениями, добавлении [глицерин-1,3-3H]-олеоилглицерина, инкубации в течение одного часа и последующем измерении количества расщепленного [1,3-3H]-глицерина, проходящего через фильтр с активированным углем. Количество расщепленного тритированного глицерина, проходящего через угольный фильтр, пропорционально активности фермента MGL в конкретной лунке/условиях испытания.
Стандартные условия данного анализа позволяют объединить 300 нМ [глицерин-1,3-3H]-олеоилглицерина с человеческим MGL из клеток HeLa и тестируемых соединений в течение одного часа, после чего реакционную смесь фильтруют через активированный уголь и измеряют тритий в потоке. Концентрация исследуемого соединения в режиме скрининга составляет 10 мкМ, тогда как наибольшую концентрацию соединения в анализах IC50 определяют эмпирически. MGL - это преобладающая гидролаза в клетках HeLa/клеточных гомогенатах.
Н/и - не исследовали.
Таблица 4.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНДЕНСИРОВАННЫЕ С ГЕТЕРОАРИЛКЕТОНАМИ АЗАДЕКАЛИНЫ - МОДУЛЯТОРЫ ГЛЮКОКОРТИКОИДНЫХ РЕЦЕПТОРОВ | 2013 |
|
RU2639867C2 |
| ПРОИЗВОДНЫЕ ИЗОКСАЗОЛИНА В КАЧЕСТВЕ ПРОТИВОПАРАЗИТАРНЫХ АГЕНТОВ | 2011 |
|
RU2551354C2 |
| Макрогетероциклические нуклеозидные производные и их аналоги, получение и применение | 2017 |
|
RU2731385C1 |
| ПРОИЗВОДНЫЕ ПИРИМИДИН-4(3H)-ОНА В КАЧЕСТВЕ АНТАГОНИСТОВ TRPV4 | 2021 |
|
RU2840769C1 |
| БИЦИКЛИЧЕСКИЕ КЕТОНЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2797922C2 |
| ПРОИЗВОДНЫЕ КСАНТЕНДИОНА ДЛЯ ЛЕЧЕНИЯ ПИГМЕНТАЦИИ И СТАРЕНИЯ КОЖИ | 2011 |
|
RU2598374C2 |
| ПРОИЗВОДНЫЕ МАННОЗЫ ДЛЯ ЛЕЧЕНИЯ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ | 2014 |
|
RU2678327C2 |
| ЗАМЕЩЕННЫЕ 1,2-ДИГИДРО-3Н-ПИРАЗОЛО[3,4-D]ПИРИМИДИН-3-ОНЫ | 2019 |
|
RU2812726C2 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2716136C2 |
| СОЕДИНЕНИЯ, КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ МОДУЛЯЦИИ CFTR | 2016 |
|
RU2752567C2 |
Изобретение относится к области органической химии, а именно к мостиковым соединениям формулы (I), при этом R2, R3, R4, R5 и R6 определены в п.1 формулы изобретения. Также изобретение относится к конкретным мостиковым соединениям. Технический результат: модулирование MGL (моноацилглицеринлипазы), полезное при лечении расстройств и состояний, связанных с модуляцией MGL, такие как связанные с болью, психическими расстройствами, неврологическими расстройствами (включая, без ограничений, большое депрессивное расстройство, терапевтически резистентную депрессию, тревожную депрессию, биполярное расстройство), раковые заболевания и заболевания глаз. 2 н. и 56 з.п. ф-лы, 4 табл., 444 пр.
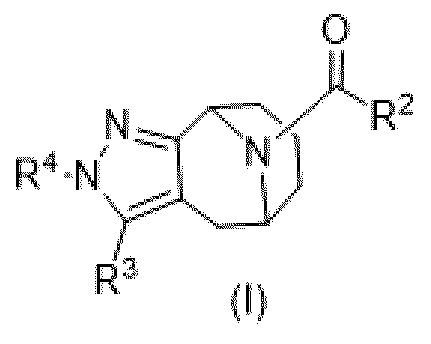
1. Соединение, имеющее структуру формулы (I)
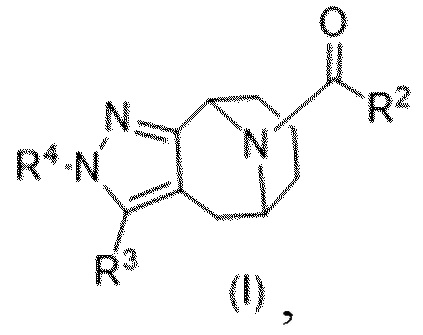
где R2 выбирают из группы, состоящей из:
(a) 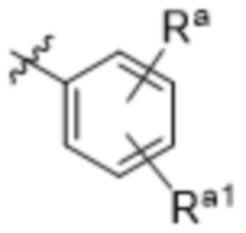 ;
;
(b) 6-членного гетероарила, выбранного из группы, состоящей из: пиридазин-4-ила; пиразин-2-ила; пиримидинила; пиримидинила, замещенного C1-4алкилом или OC1-4алкилом; и пиридинила, причем пиридинил замещен одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, C1-4алкила, OC1-4алкила, OC1-4галогеналкила, C3-6циклоалкила, NH2, CN, N(CH3)2,  ,
, 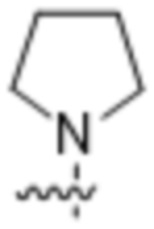 ,
, 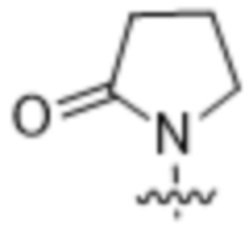 ,
, 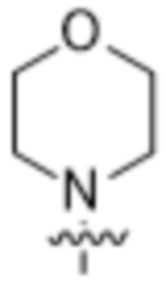 ,
, 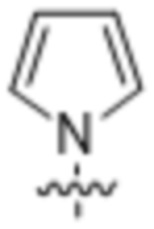 ,
, 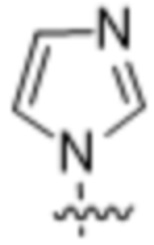 ,
, 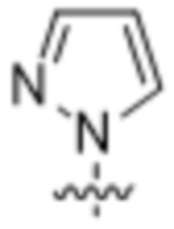 ,
, 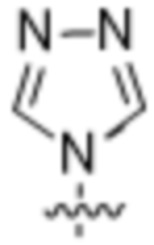 ,
, 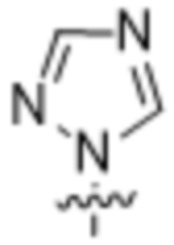 и
и  ;
;
(c) 5-членного гетероарила, выбранного из группы, состоящей из:
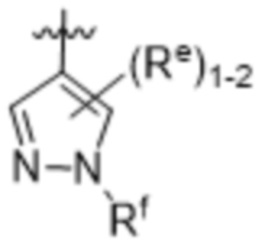 ,
, 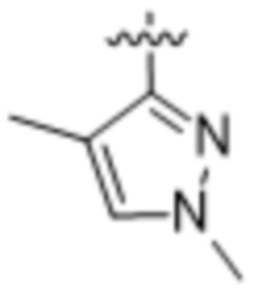 ,
, 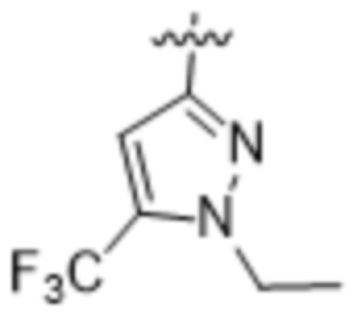 ,
, 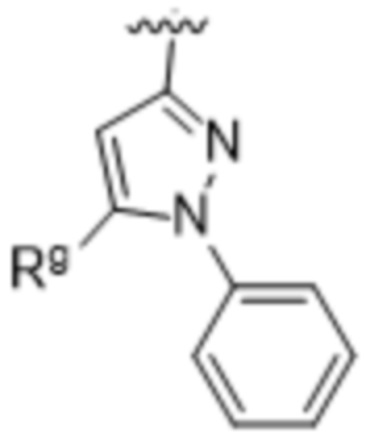 ,
, 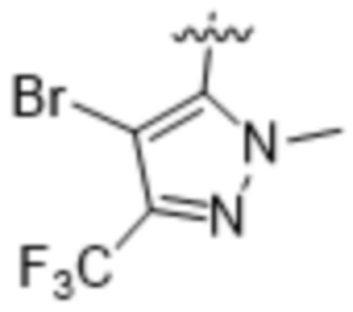 ,
, 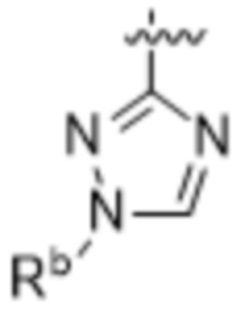 ,
, 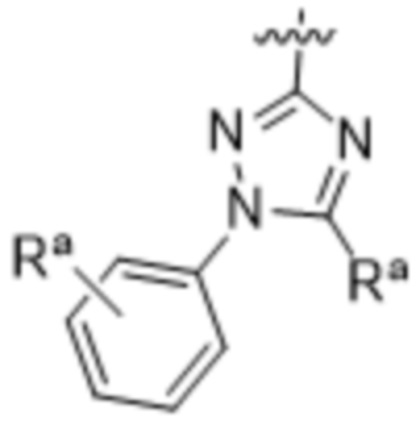 ,
, 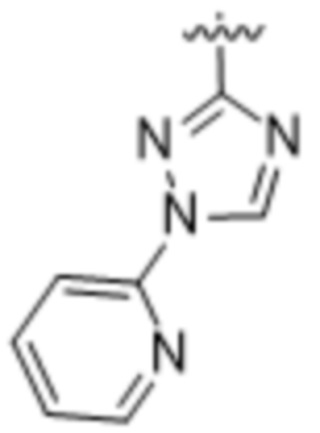 и
и 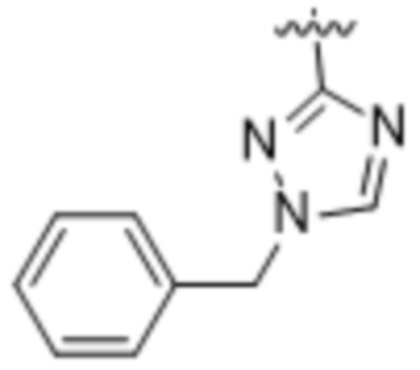 ;
;
(d) 5,6-конденсированного бициклического гетероарила или 6,5-конденсированного бициклического гетероарила, выбранного из группы, состоящей из:
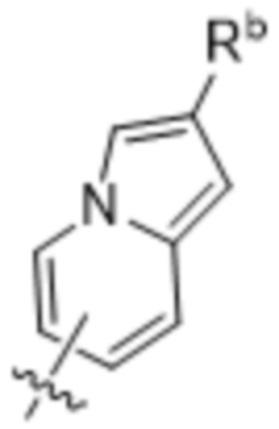 ,
, 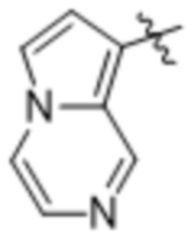 ,
, 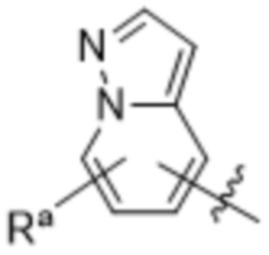 ,
, 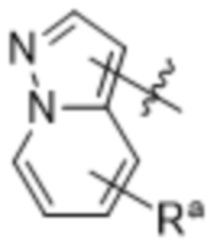 ,
, 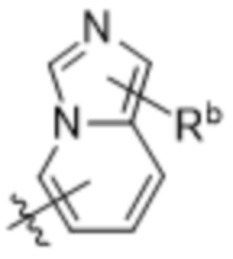 ,
, 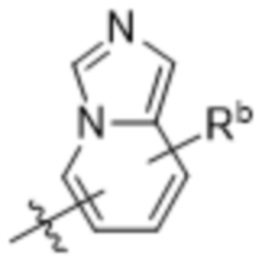 ,
, 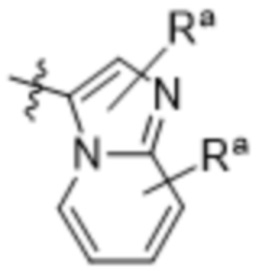 ,
, 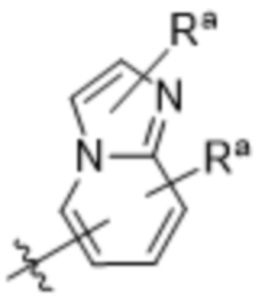 ,
, 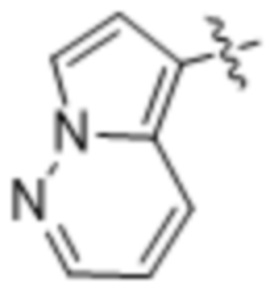 ,
, 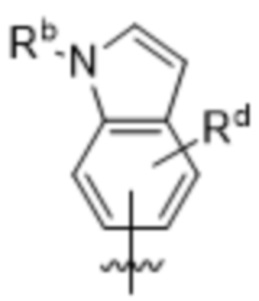 ,
, 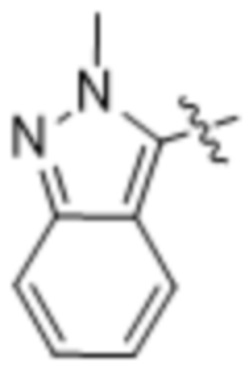 ,
, 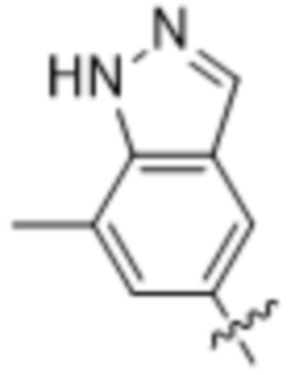 ,
, 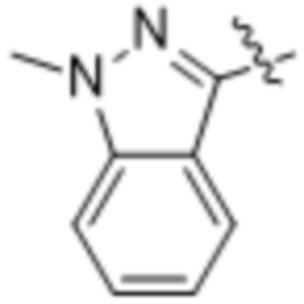 ,
, 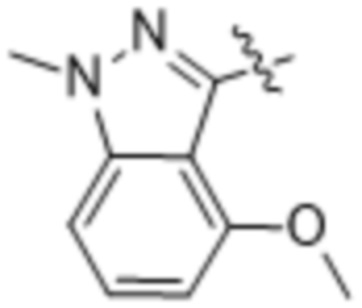 ,
, 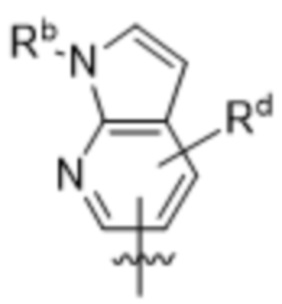 ,
, 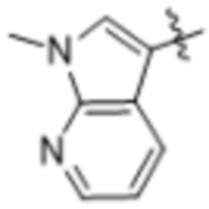 ,
, 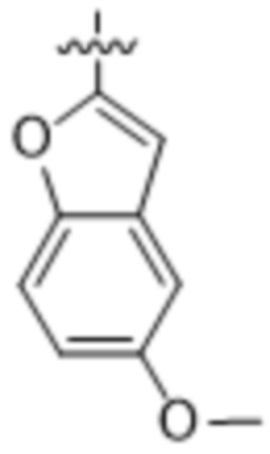 ,
, 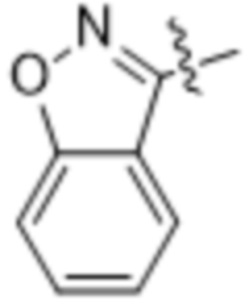 ,
, 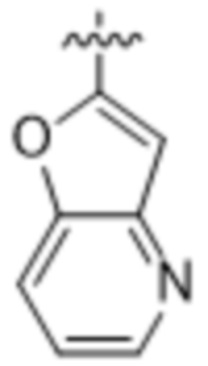 ,
, 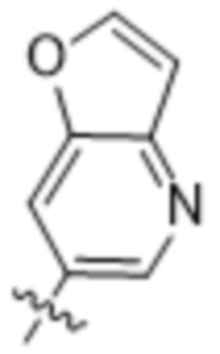 ,
, 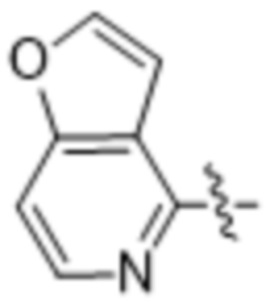 ,
, 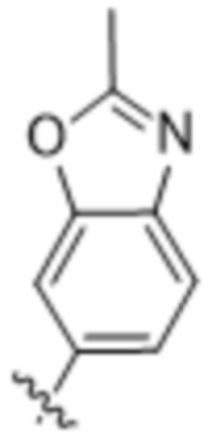 ,
, 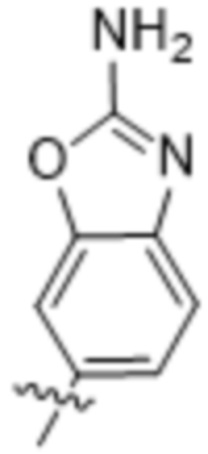 ,
,
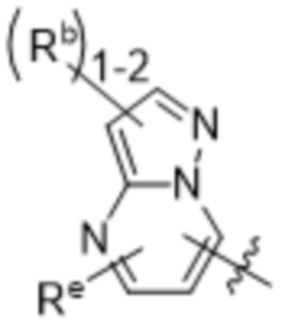 ,
, 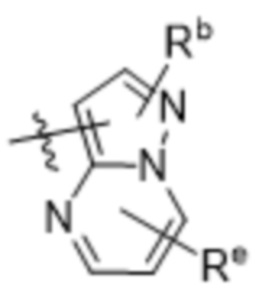 ,
, 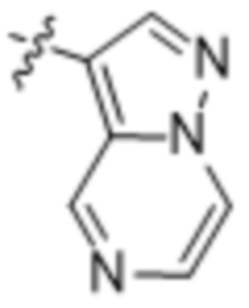 ,
, 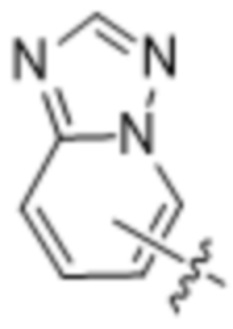 ,
, 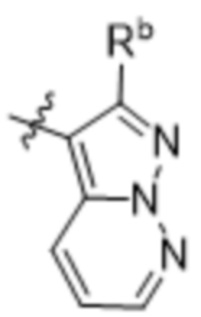 ,
,
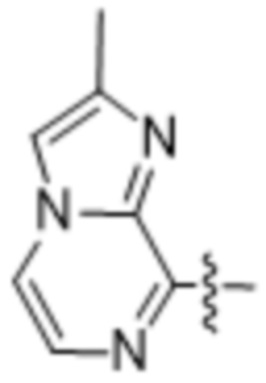 ,
, 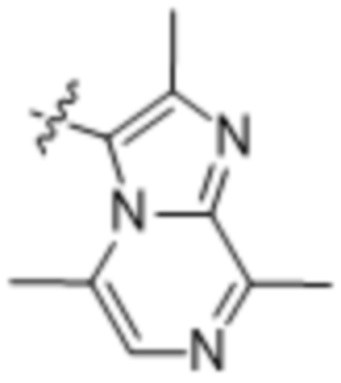 ,
, 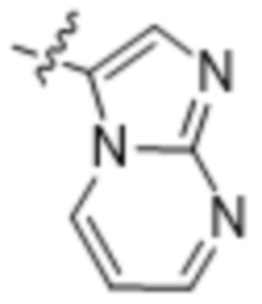 ,
, 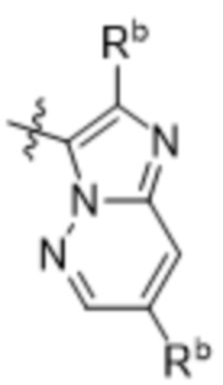 ,
, 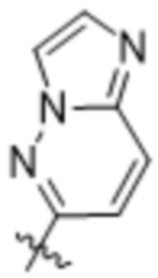 ,
, 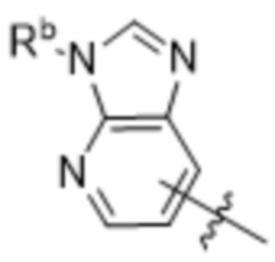 ,
, 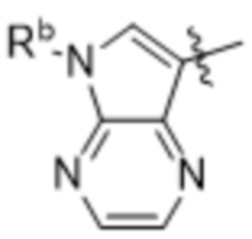 ,
, 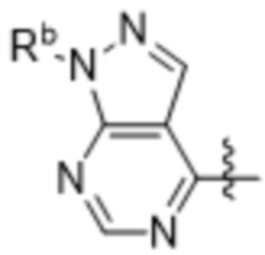 ,
, 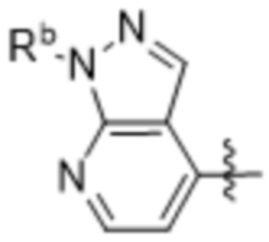 ,
, 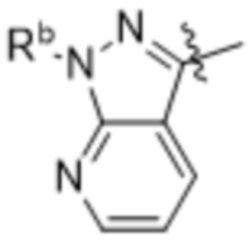 ,
, 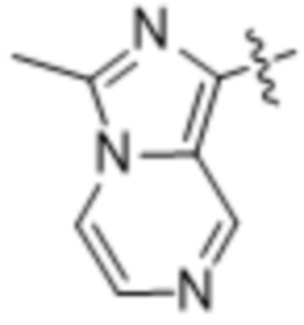 и
и 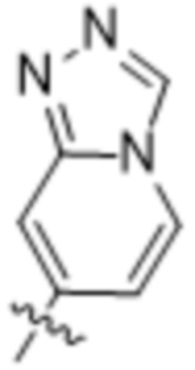 ;
;
(e) 6,6-конденсированного бициклического гетероарила, выбранного из группы, состоящей из:
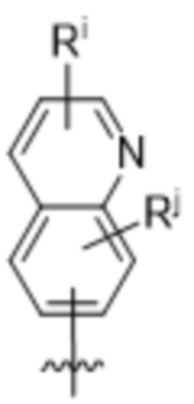 ,
, 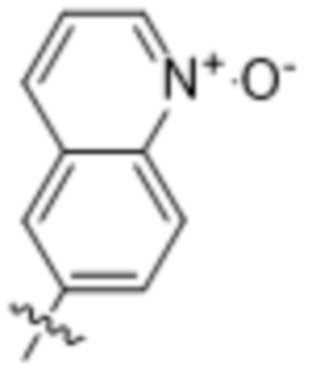 ,
, 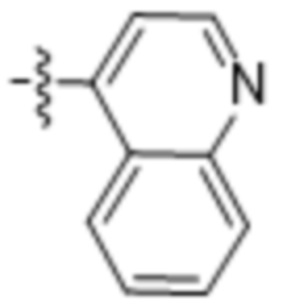 ,
, 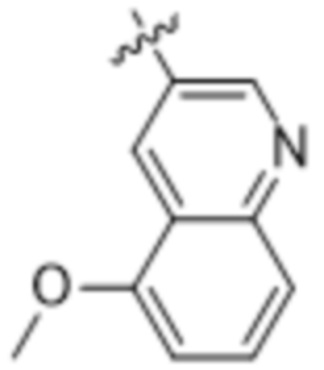 ,
, 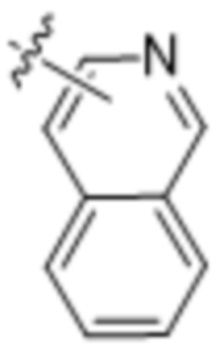 ,
, 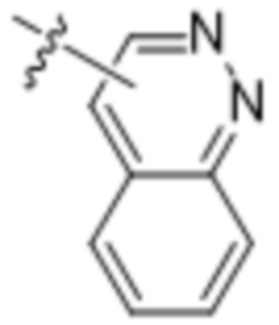 ,
, 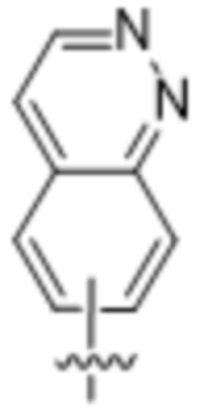 ,
,  ,
,  ,
,  ,
,  ,
, 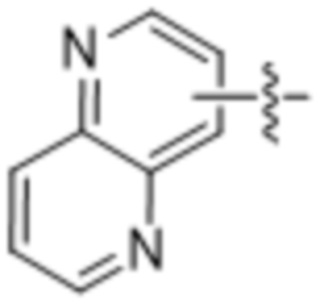 ,
, 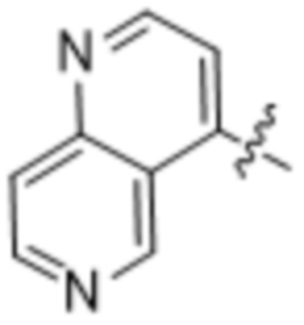 ,
, 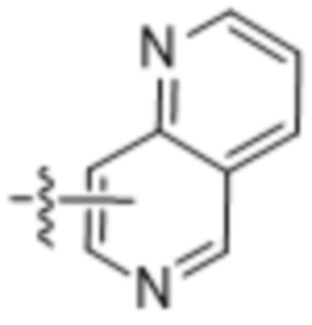 ,
, 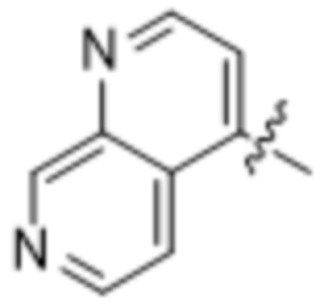 и
и 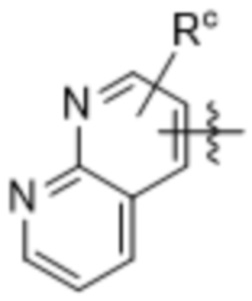 ; и
; и
(f)
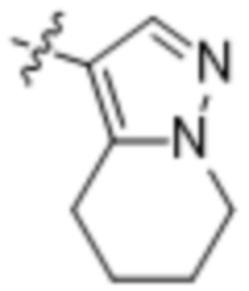 ,
, 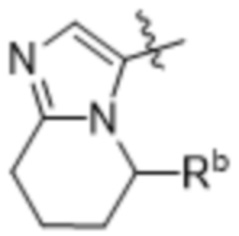 ,
, 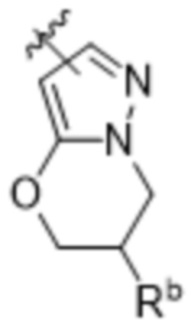 ,
, 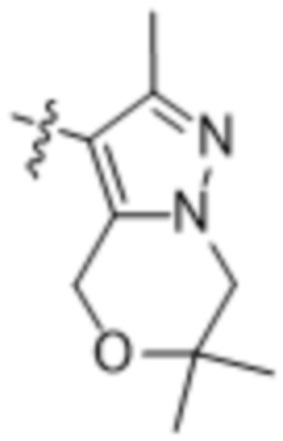 ,
, 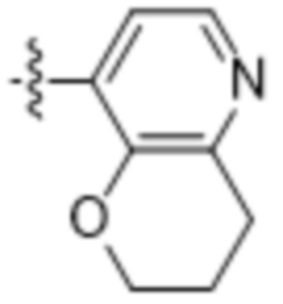 ,
, 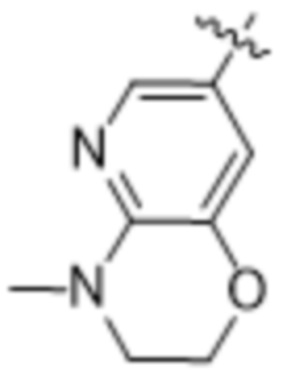 ,
, 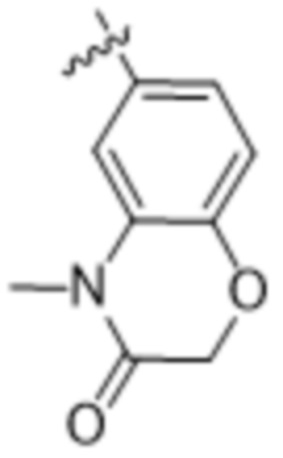 и
и 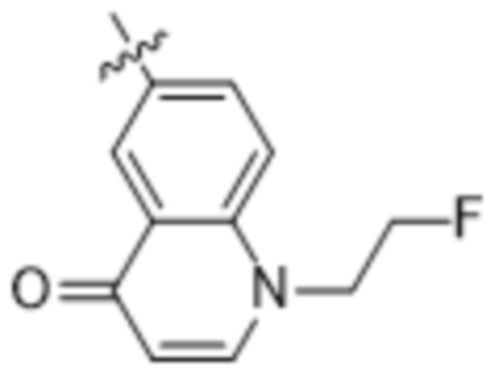 ;
;
где Ra выбирают из группы, состоящей из H, галогена, C1-4алкила, OC1-4алкила, C1-4галогеналкила и OC1-4галогеналкила;
Ra1 выбирают из группы, состоящей из C1-4алкила, OC1-4алкила, OC1-4галогеналкила, N(C=O)CH3, оксазол-2-ила, пиримидин-2-ила и 5-членного гетероарильного кольца, содержащего два, три или четыре члена, представляющих собой атом азота, причем 5-членное гетероарильное кольцо необязательно замещено одним членом Ra;
Rb представляет собой H или C1-4алкил;
Rc представляет собой H или C1-4галогеналкил;
Rd представляет собой H или галоген;
Re выбирают из группы, состоящей из H, галогена, C1-4алкила, C1-4галогеналкила, OC1-4алкила и C3-6циклоалкила;
Rf выбирают из группы, состоящей из H, C1-4алкила, CH2CH2OH, C1-4галогеналкила, циклопропила, фенила и фенила, замещенного CF3;
Rg выбирают из группы, состоящей из H, OC1-4алкила и C1-4галогеналкила;
Ri представляет собой H, галоген, C1-4алкил, C1-4галогеналкил, OH, OC1-4алкил, OC1-4галогеналкил, C3-6циклоалкил;
Rj выбирают из группы, состоящей из H, галогена, OCH3, OH, NH2 и NO2;
R3 выбирают из группы, состоящей из:
(g) фенила, где фенил независимо замещен одним, двумя или тремя заместителями, выбранными из группы, состоящей из галогена, C1-4алкила, C1-4галогеналкила и OC1-4алкила;
(h) 5-(трифторметил)-2-тиенила или 1-метилиндол-2-ила; и
(i) циклопропила; и
R4 представляет собой C1-4алкил или C3-4циклоалкил;
и его фармацевтически приемлемые соли, изотопы, N-оксиды, сольваты и стереоизомеры.
2. Соединение по п. 1, в котором R2 представляет собой  , где Ra представляет собой H, галоген, C1-4алкил или OC1-4алкил; и Ra1 представляет собой C1-4алкил, OC1-4алкил, OC1-4галогеналкил или (C=O)NHCH3.
, где Ra представляет собой H, галоген, C1-4алкил или OC1-4алкил; и Ra1 представляет собой C1-4алкил, OC1-4алкил, OC1-4галогеналкил или (C=O)NHCH3.
3. Соединение по п. 1, в котором R2 представляет собой:
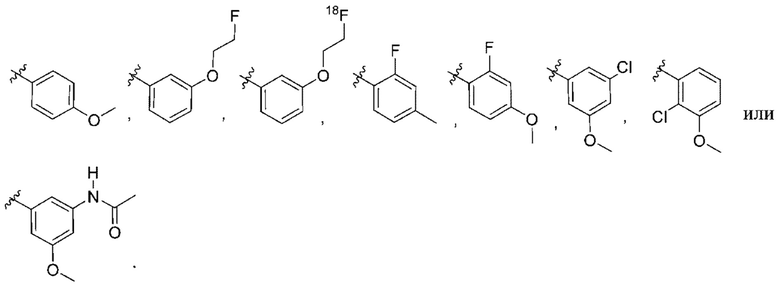
4. Соединение по п. 1, в котором R2 представляет собой: 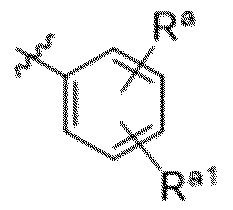 , где Ra представляет собой H, галоген, C1-4алкил, OC1-4алкил или C1-4галогеналкил; и Ra1 представляет собой:
, где Ra представляет собой H, галоген, C1-4алкил, OC1-4алкил или C1-4галогеналкил; и Ra1 представляет собой:

5. Соединение по п. 4, где Ra1 представляет собой:  ,
, 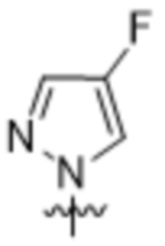 ,
, 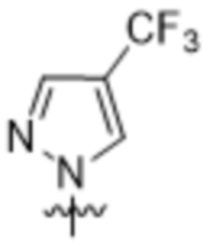 ,
, 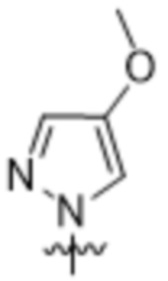 ,
, 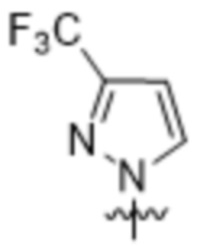 ,
, 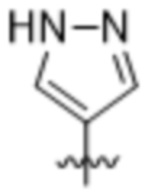 ,
, 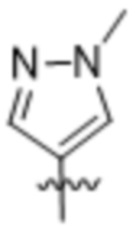 ,
, 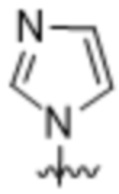 ,
, 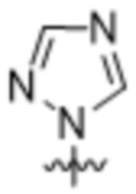 ,
, 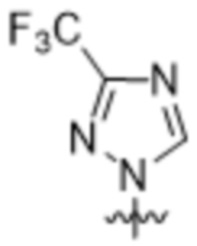 ,
, 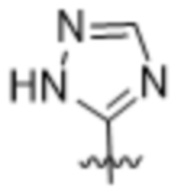 ,
, 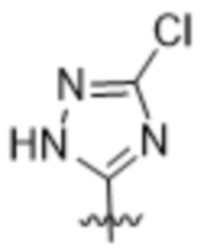 ,
, 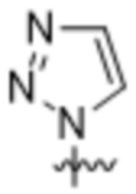 ,
, 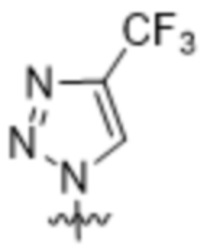 ,
, 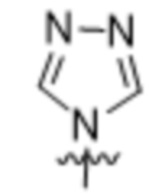 ,
, 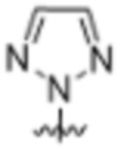 ,
, 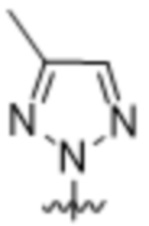 ,
, 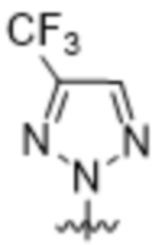 ,
, 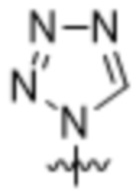 ,
, 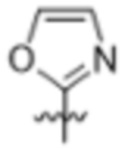 или
или 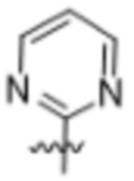 .
.
6. Соединение по п. 4, в котором Ra представляет собой H, Cl, F, CH3, CF3 или OCH3.
7. Соединение по п. 4, в котором Rb представляет собой H или CH3.
8. Соединение по п. 4, в котором Rc представляет собой H или CF3.
9. Соединение по п. 4, в котором R d представляет собой H, Cl или F.
10. Соединение по п. 1, в котором R2 представляет собой:
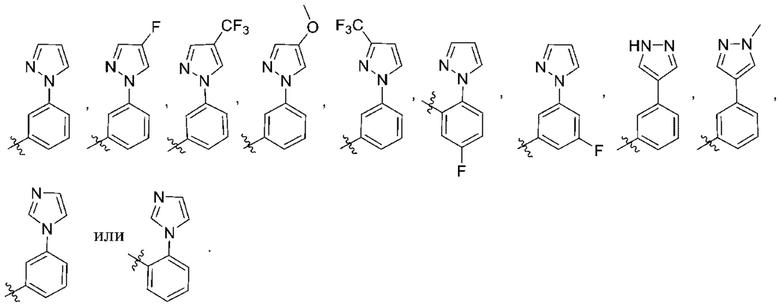
11. Соединение по п. 1, в котором R2 представляет собой:
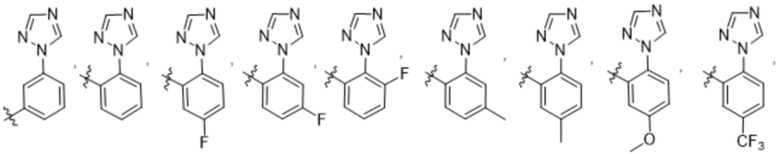
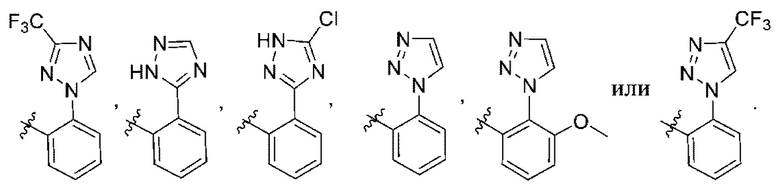
12. Соединение по п. 1, в котором R2 представляет собой:
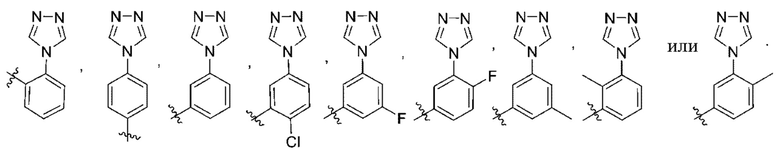
13. Соединение по п. 1, в котором R2 представляет собой: 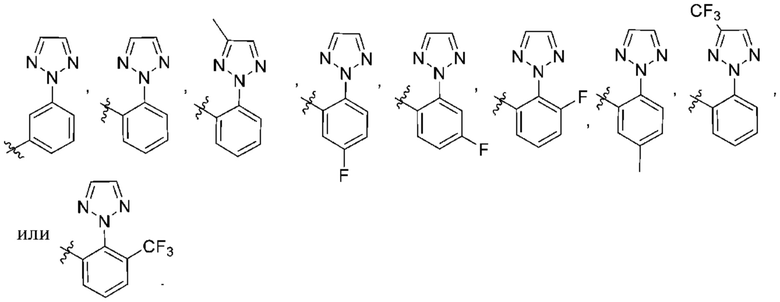
14. Соединение по п. 1, в котором R2 представляет собой: 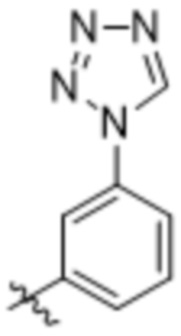 ,
,  или
или  .
.
15. Соединение по п. 1, в котором R2 представляет собой 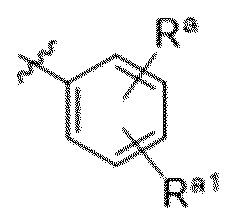 , где Ra представляет собой H, Cl, Br, F или OCH3 и Ra1 представляет собой OCH3 или
, где Ra представляет собой H, Cl, Br, F или OCH3 и Ra1 представляет собой OCH3 или 
16. Соединение по п. 1, в котором R2 представляет собой: 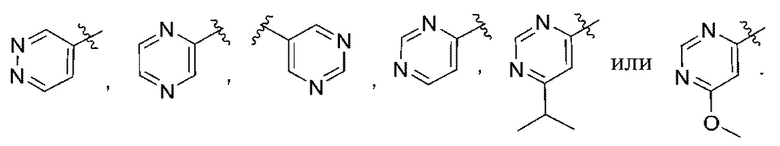
17. Соединение по п. 1, в котором R2 представляет собой: 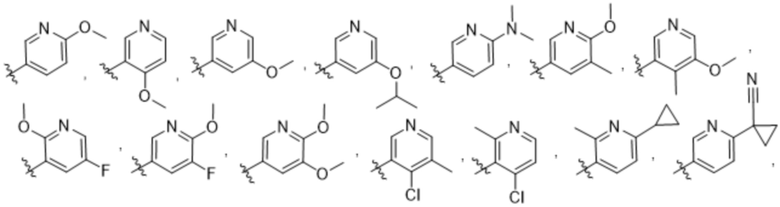
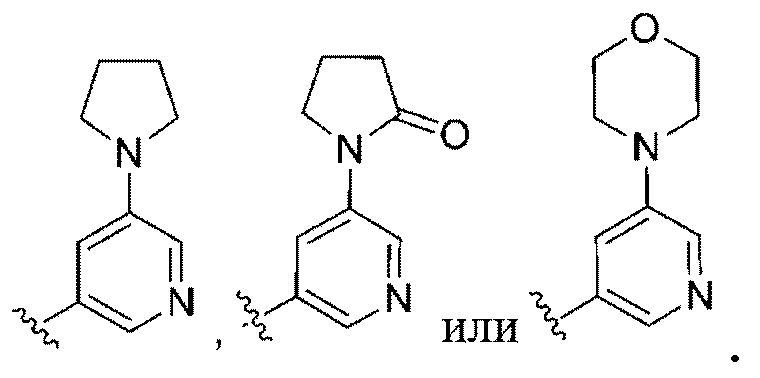
18. Соединение по п. 1, в котором R2 представляет собой: 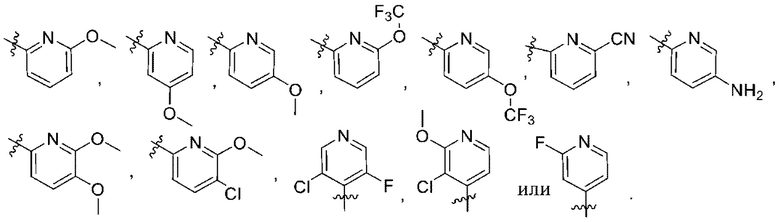
19. Соединение по п. 1, в котором R2 представляет собой: 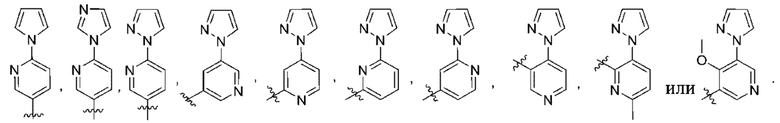
20. Соединение по п. 1, в котором R2 представляет собой: 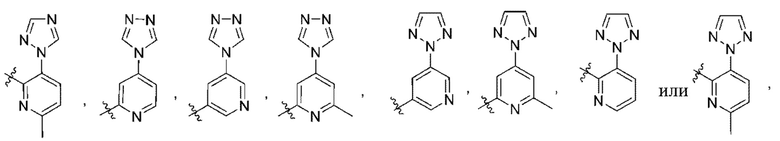
21. Соединение по п. 1, в котором R2 представляет собой: 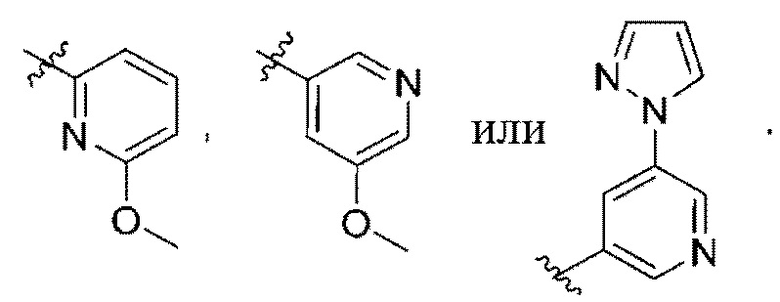
22. Соединение по п. 1, в котором R2 представляет собой  или
или 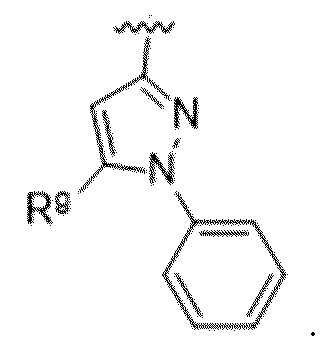
23. Соединение по п. 22, в котором Re независимо выбирают из группы, состоящей из H, галогена, C1-4алкила, C1-4галогеналкила, OC1-4алкила и циклопропила.
24. Соединение по п. 22, в котором Rf выбирают из группы, состоящей из H, C1-4алкила, CH2CH2OH, CH2CF3, циклопропила, фенила и фенила, замещенного CF3.
25. Соединение по п. 22, в котором Rg представляет собой H, OCH3 или CF3.
26. Соединение по п. 1, в котором R2 представляет собой: 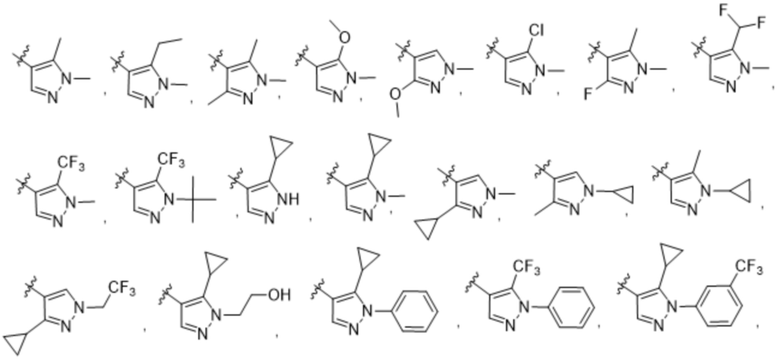
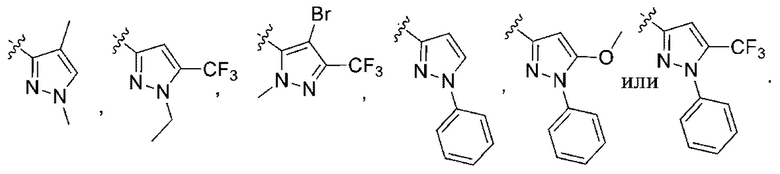
27. Соединение по п. 1, в котором R2 представляет собой
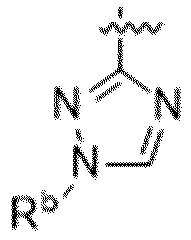 или
или 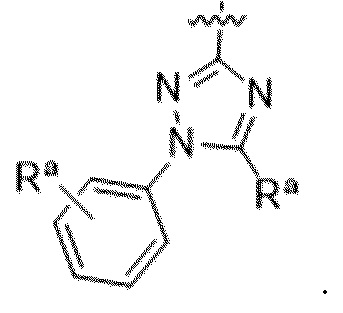
28. Соединение по п. 27, в котором Ra независимо выбирают из группы, состоящей из H, Cl, F, C1-4алкила, OC1-4алкила и C1-4галогеналкила; и Rb представляет собой CH3 или CH(CH3)2.
29. Соединение по п. 1, в котором R2 представляет собой:
30. Соединение по п. 1, в котором R2 представляет собой  .
.
31. Соединение по п. 1, в котором R2 представляет собой:
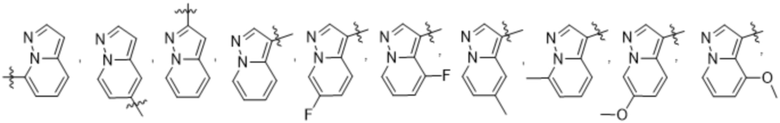
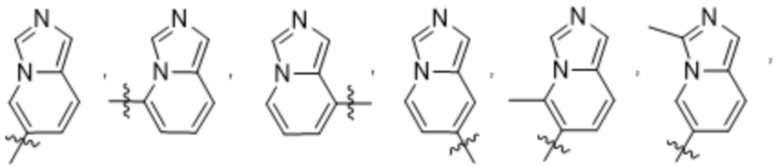
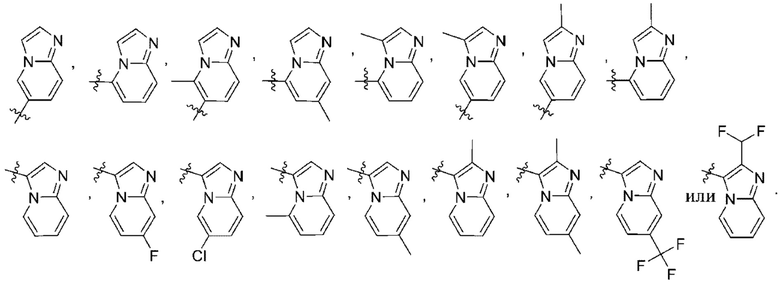
32. Соединение по п. 1, в котором R2 представляет собой: 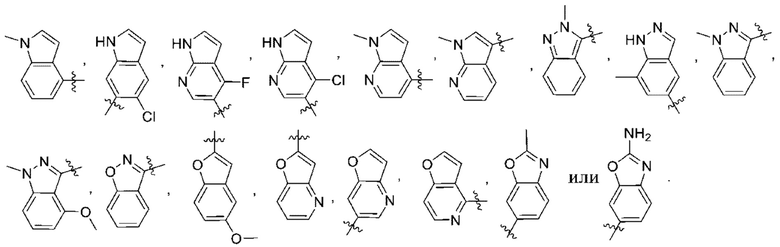
33. Соединение по п. 1, в котором R2 представляет собой: 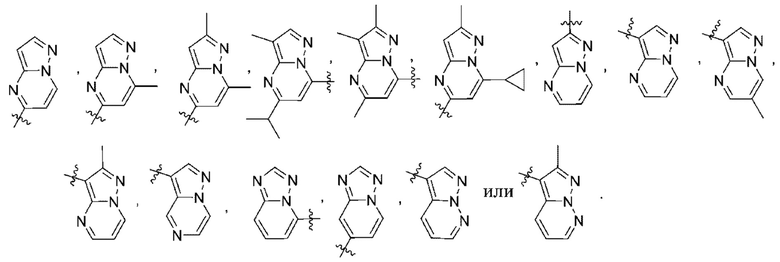
34. Соединение по п. 1, в котором R2 представляет собой: 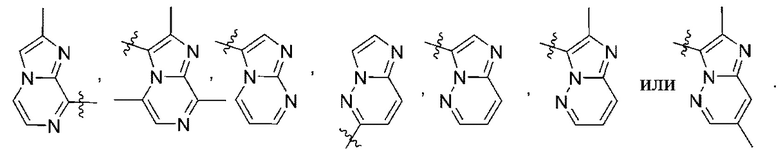
35. Соединение по п. 1, в котором R2 представляет собой: 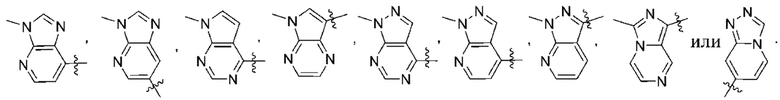
36. Соединение по п. 1, в котором R2 представляет собой: 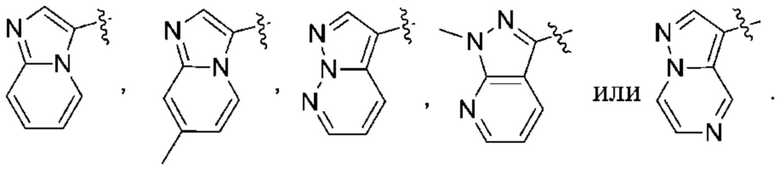
37. Соединение по п. 1, в котором R2 представляет собой: 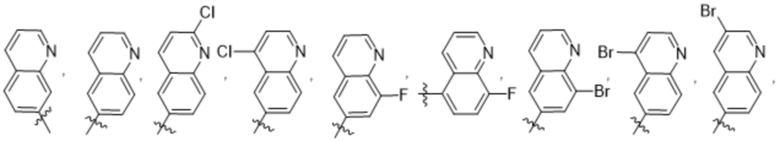
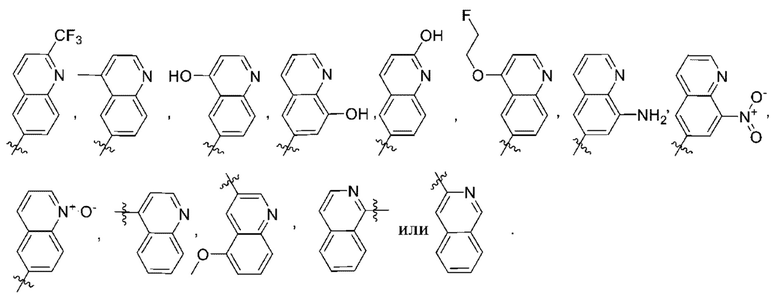
38. Соединение по п. 1, в котором R2 представляет собой: 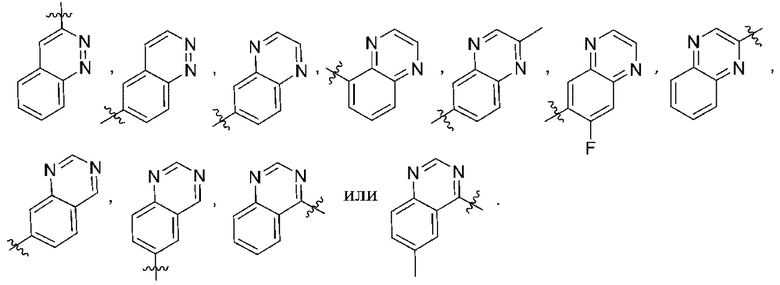
39. Соединение по п. 1, в котором R2 представляет собой: 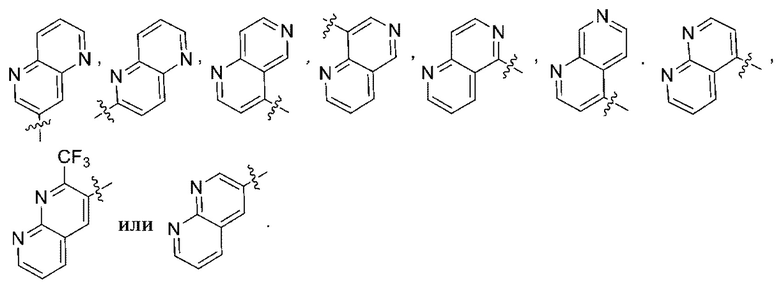
40. Соединение по п. 1, котором R2 представляет собой:  .
.
41. Соединение по п. 1, в котором R2 представляет собой:
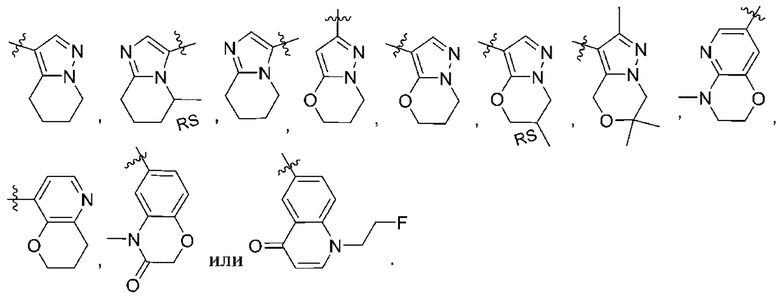
42. Соединение по п. 1, где R3 представляет собой:
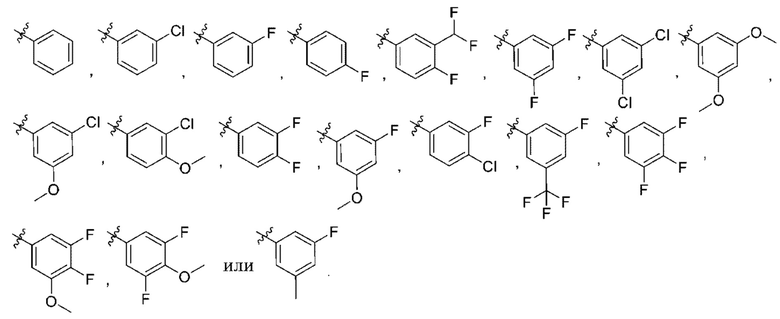
43. Соединение по п. 1, в котором R3 представляет собой циклопропил и R4 представляет собой CH3.
44. Соединение по п. 1, в котором R3 представляет собой 5-(трифторметил)-2-тиенил или 1-метилиндол-2-ил; а R4 представляет собой CH3.
45. Соединение по п. 1, где R3 представляет собой 3-хлорфенил, 3-фторфенил, 4-фторфенил, 3,5-дифторфенил, 3,5-дихлорфенил, 3,4-дифторфенил и 4-хлор-3-фторфенил.
46. Соединение по п. 1, где R4 представляет собой CH3.
47. Соединение по п. 1, где R4 представляет собой циклопропил.
48. Соединение по п. 1, где R2 представляет собой  , где Ra представляет собой F, Cl или OCH3, Ra1 представляет собой OCH3, CH3 или 2H-1,2,3-триазол-2-ил и R4 представляет собой CH3.
, где Ra представляет собой F, Cl или OCH3, Ra1 представляет собой OCH3, CH3 или 2H-1,2,3-триазол-2-ил и R4 представляет собой CH3.
49. Соединение по п. 1, имеющее структуру формулы (1A)
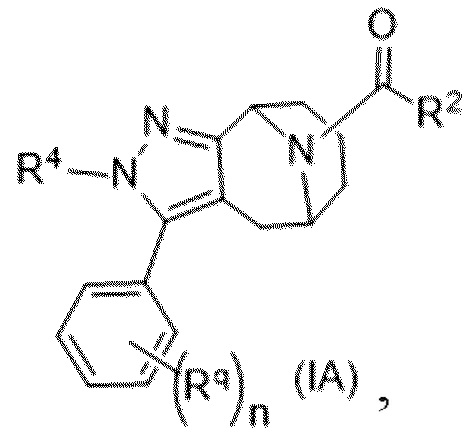
где R2 выбирают из группы, состоящей из:
(a)
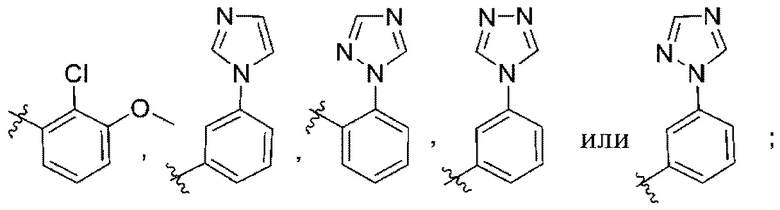
(b)
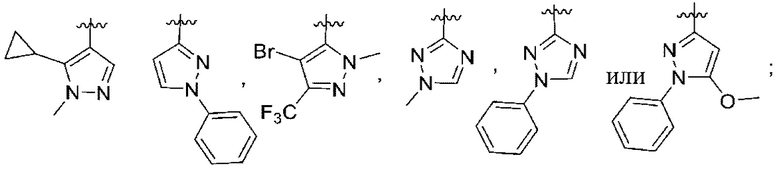
(c)
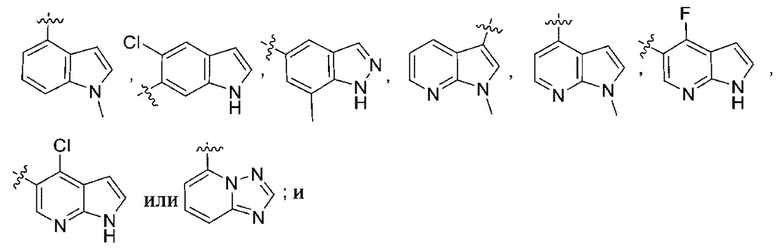
(d)
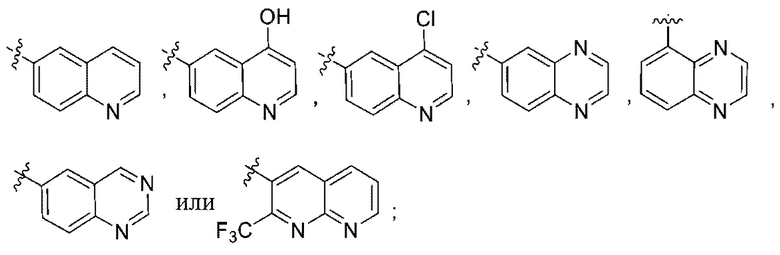
R4 представляет собой CH3 или циклопропил;
Rq представляет собой галоген или CHF2; и
n равно 0, 1 или 2;
и его фармацевтически приемлемые соли, изотопы, N-оксиды, сольваты и стереоизомеры.
50. Соединение по п. 1, имеющее структуру формулы (1B)
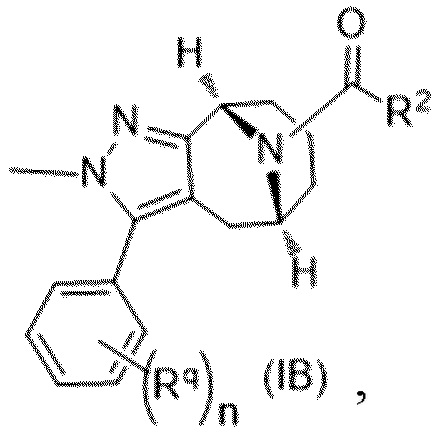
где R2 представляет собой фенил, необязательно независимо замещенный одним или двумя заместителями, выбранными из группы, состоящей из галогена, C1-4алкила, C1-4галогеналкила, OC1-4алкила, OC1-4галогеналкила, NH(C=O)(CH3),
где Ra выбирают из группы, состоящей из H, галогена, C1-4алкила, OC1-4алкила и C1-4галогеналкила;
Rb представляет собой C1-4 алкил;
Rc представляет собой H или CF3;
Rd представляет собой H или галоген;
каждый Rq независимо выбирают из группы, состоящей из Cl, F, CF3 и OCH3; и
n равно 0, 1, 2 или 3;
и его фармацевтически приемлемые соли, изотопы, N-оксиды, сольваты и стереоизомеры.
51. Соединение по п. 1, имеющее структуру формулы (1C)
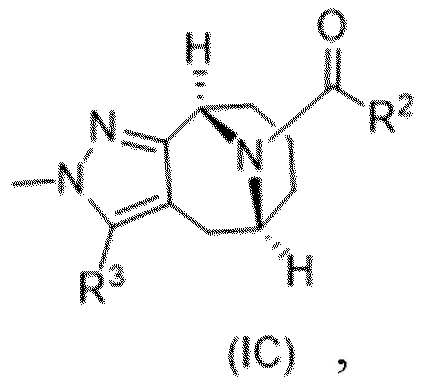
где R2 выбирают из группы, состоящей из:
(a) 5-членного гетероарила, выбранного из группы, состоящей из:
 и
и
(b) 6-членного гетероарила, выбранного из группы, состоящей из: пиридазин-4-ила; пиразин-2-ила; пиримидинила; пиримидинила, замещенного C1-4алкилом или C1-4алкилом; и пиридинила, причем пиридинил замещен одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, C1-4алкила, OC1-4алкила, OC1-4галогеналкила, циклопропила, NH2, CN, N(CH3)2,  ,
,  ,
,  ,
,  ,
,  ,
, 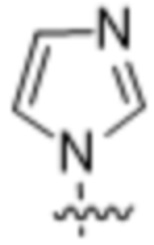 ,
,  ,
, 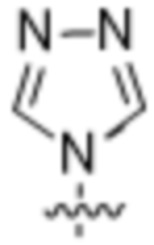 ,
,  и
и  ;
;
где Ra выбирают из группы, состоящей из H, галогена, OC1-4алкила и C1-4галогеналкила;
Rb представляет собой C1-4алкил;
Re выбирают из группы, состоящей из F, C1-4алкила, CF2H, CF3, OCH3 и циклопропила;
Rf выбирают из группы, состоящей из H, C1-4алкила, циклопропила и фенила;
Rg представляет собой H или CF3; и
R3 представляет собой фенил, замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из Cl и F;
и его фармацевтически приемлемые соли, изотопы, N-оксиды, сольваты и стереоизомеры.
52. Соединение по п. 51, в котором R2 представляет собой:
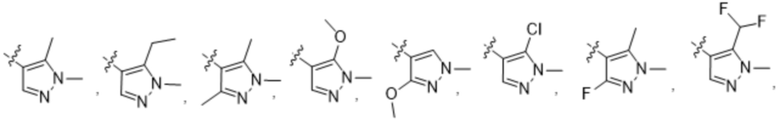
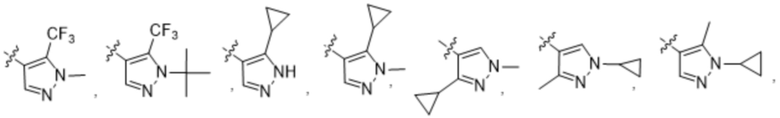
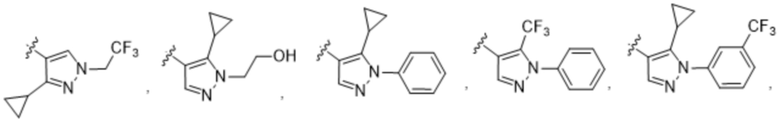
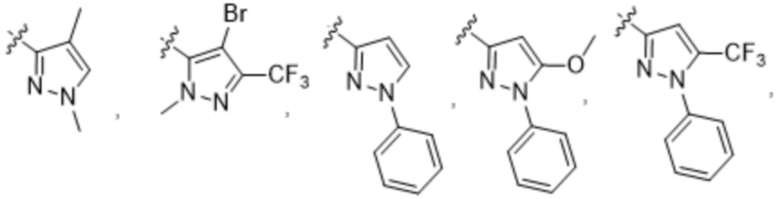
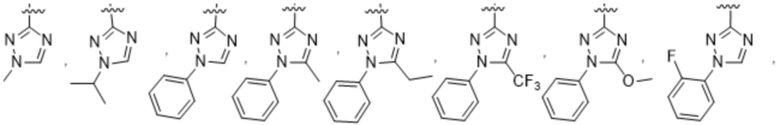
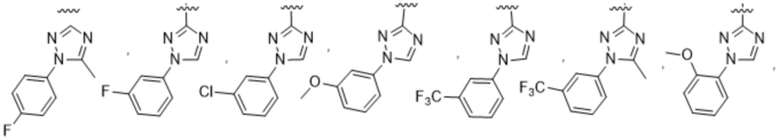
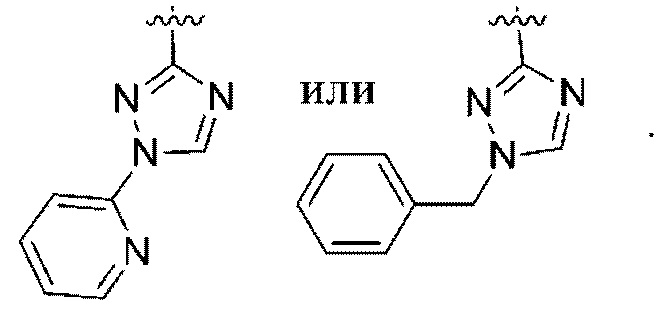
53. Соединение по п. 51, в котором R2 представляет собой: 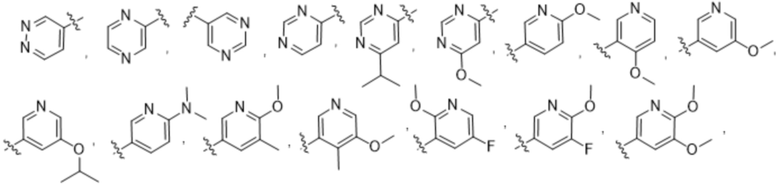
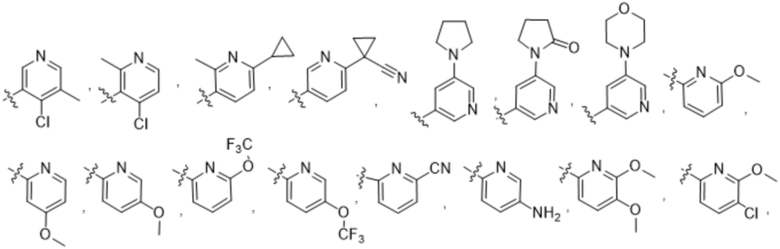
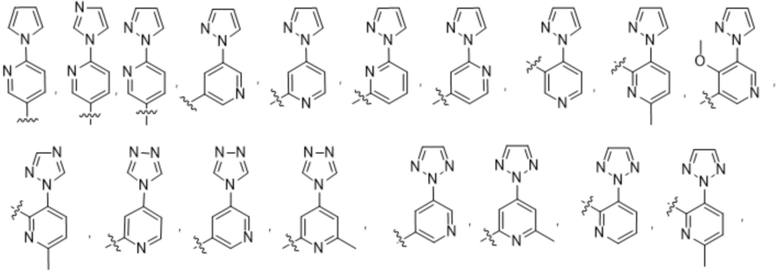
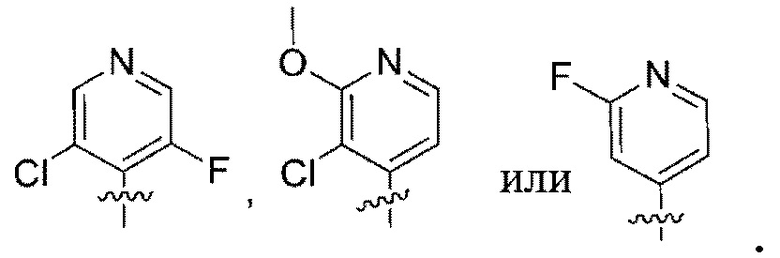
54. Соединение по п. 1, имеющее структуру формулы (1D)
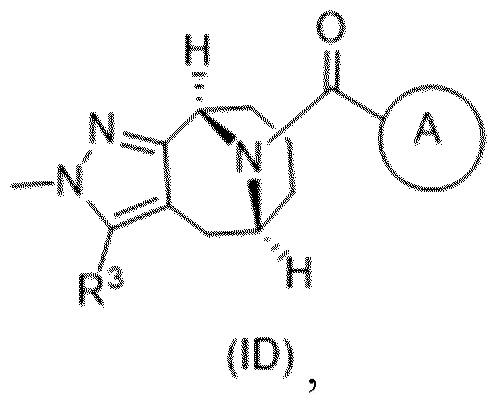
где Кольцо A выбирают из группы, состоящей из:
(c) 6,6-конденсированного бициклического гетероарила, выбранного из группы, состоящей из:
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  ; и
; и
(d) 5,6-конденсированного бициклического гетероарила или 6,5-конденсированного бициклического гетероарила, выбранного из группы, состоящей из:
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  и
и  ;
;
где Ra выбирают из группы, состоящей из H, Cl, F, CH3, OCH3, CF3 и CF2H;
Rb представляет собой H или CH3;
Rc представляет собой H или CF3;
Rd выбирают из группы, состоящей из H, Cl и F;
Re выбирают из группы, состоящей из H, C1-4алкила и циклопропила;
Ri выбирают из группы, состоящей из H, Cl, Br, CH3, CF3, OH и OCH2CH2F;
Rj выбирают из группы, состоящей из H, галогена, OCH3, OH, NH2 и NO2; и
R3 представляет собой циклопропил, 1-метил-1H-индол-2-ил или фенил, замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из Cl, F, CH3, OCH3 и CF3;
и его фармацевтически приемлемые соли, изотопы, N-оксиды, сольваты и стереоизомеры.
55. Соединение по п. 54, в котором R3 представляет собой:
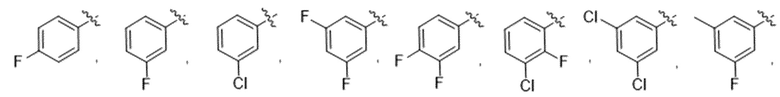
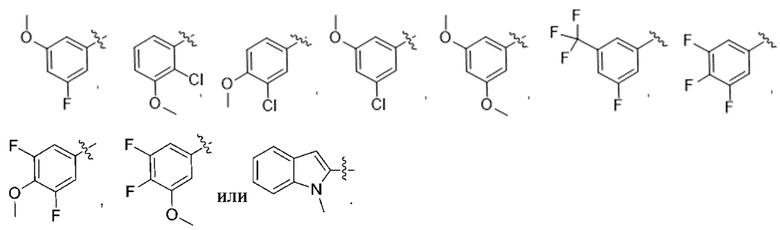
56. Соединение по п. 54, в котором кольцо A представляет собой: 
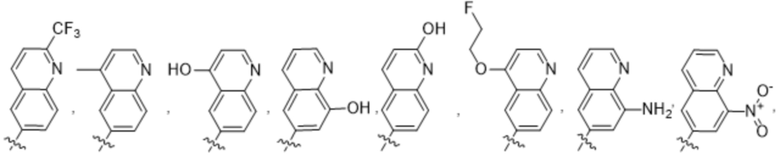
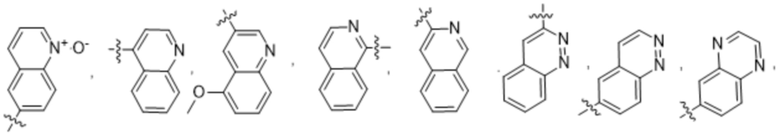
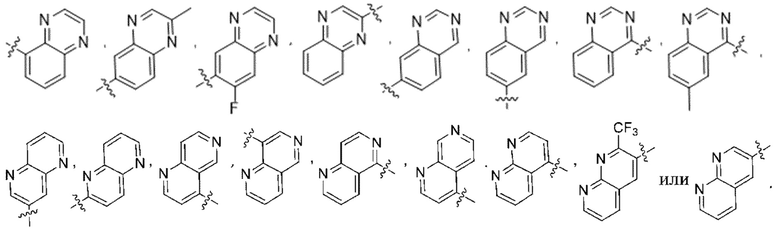
57. Соединение по п. 54, в котором кольцо A представляет собой: 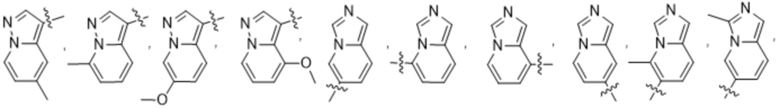
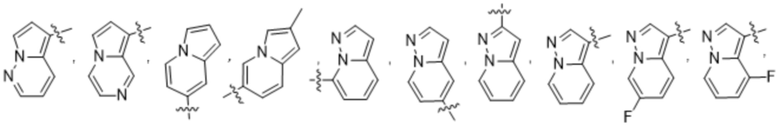
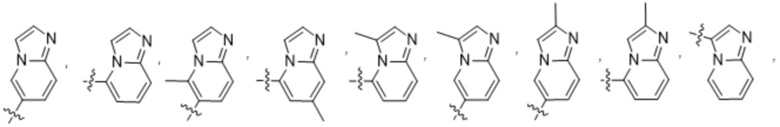
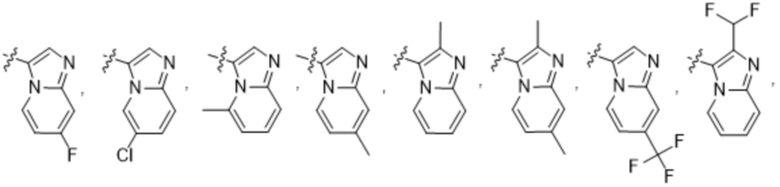
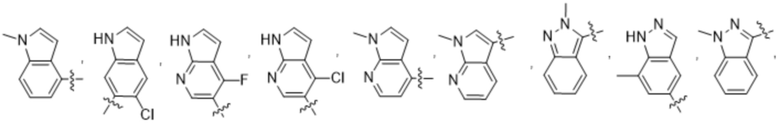
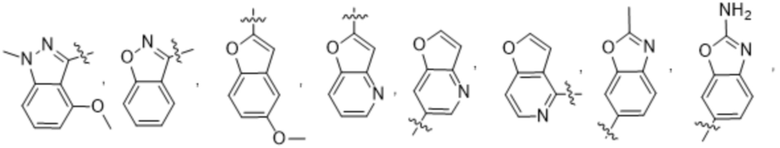
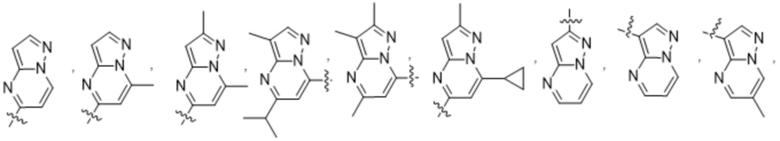
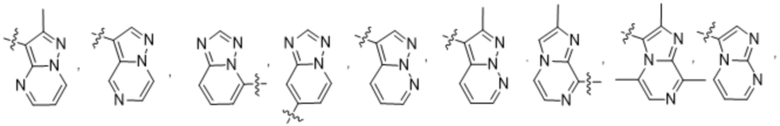
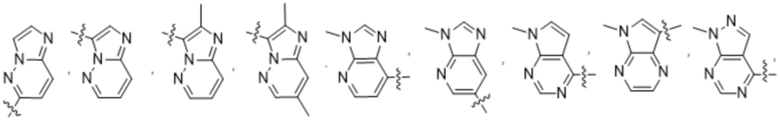
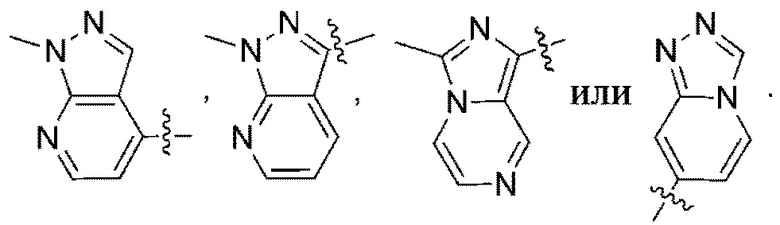
58. Соединение, выбранное из группы, состоящей из следующих:
рацемический ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил)метанон;
((5R,9S)-3-циклопропил-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил)метанон;
рацемический (2-хлор-3-метоксифенил) ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(2-хлор-3-метоксифенил) ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) метанон;
(2-хлор-3-метоксифенил) ((5S,9R)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) метанон;
рацемический (2-(1H-1,2,4-триазол-1-ил) фенил)((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
рацемический (3-(4H-1,2,4-триазол-4-ил) фенил)((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
рацемический (4-(1H-1,2,4-триазол-1-ил) фенил)((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
рацемический (3-(1H-имидазол-1-ил) фенил) ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) метанон;
рацемический (1-метил-1H-1,2,4-триазол-3-ил)((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
рацемический (5-хлор-1-метил-1H-пиразол-4-ил)((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
рацемический (5-метокси-1-метил-1H-пиразол-4-ил)((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
рацемический (4-бром-1-метил-3-(трифторметил)-1H-пиразол-5-ил) ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
рацемический (5-циклопропил-1-метил-1H-пиразол-4-ил) ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
рацемический ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (1-фенил-1H-1,2,4-триазол-3-ил)метанон;
рацемический ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (1-фенил-1H-пиразол-3-ил)метанон;
рацемический (5-метокси-1-фенил-1H-пиразол-3-ил) ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) метанон;
рацемический (1-метил-1H-индол-4-ил) ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
рацемический (5-хлор-1H-индол-6-ил) ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) метанон;
рацемический (7-метил-1H-индазол-5-ил) ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) метанон;
рацемический (1-метил-1H-пирроло[2,3-b] пиридин-4-ил)((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
рацемический (4-хлор-1H-пирроло[2,3-b] пиридин-5-ил) ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
рацемический (4-фтор-1H-пирроло[2,3-b] пиридин-5-ил) ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
рацемический (1-метил-1H-пирроло[2,3-b] пиридин-3-ил)((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
рацемический [1,2,4] триазол[1,5-a] пиридин-5-ил((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
рацемический (4-хлорхинолин-6-ил) ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) метанон;
рацемический (4-гидроксихинолин-6-ил) ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) метанон;
рацемический ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиноксалин-5-ил)метанон;
рацемический ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиноксалин-6-ил)метанон;
рацемический ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиназолин-6-ил)метанон;
рацемический ((5R,9S)-2-метил-3-фенил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-(трифторметил)-1,8-нафтиридин-3-ил)метанон;
рацемический (2-хлор-3-метоксифенил) ((5R,9S)-3-(4-фторфенил-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(2-(2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-3-(4-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
рацемический (1,4-диметил-1H-пиразол-3-ил)((5R,9S)-3-(4-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-3-(4-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-метил-1H-пиразолo[3,4-b]пиридин-3-ил)метанон;
рацемический ((5R,9S)-3-(4-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил)метанон;
((5R,9S)-3-(4-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил)метанон;
рацемический (2-хлор-3-метоксифенил) ((5R,9S)-3-(3-фторфенил-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
рацемический-((5R,9S)-3-(3-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (1-фенил-1H-1,2,4-триазол-3-ил) метанон;
((5R,9S)-3-(3-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (фуро[3,2-b] пиридин-6-ил) метанон;
рацемический ((5R,9S)-3-(3-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил)метанон;
((5S,9R)-3-(3-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил)метанон;
((5R,9S)-3-(3-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил)метанон;
рацемический ((5R,9S)-2-циклопропил-3-(3-фторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил)метанон;
(3-(1H-1,2,4-триазол-1-ил)фенил)((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(3-(1H-пиразол-4-ил)фенил)((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(3-(1H-пиразол-1-ил)фенил)((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(3-(1H-тетразол-1-ил)фенил)((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(2-хлор-5-(4H-1,2,4-триазол-4-ил)фенил)((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(4-(4H-1,2,4-триазол-4-ил)фенил)((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-изопропил-1H-1,2,4-триазол-3-ил)метанон;
((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-(2-фторфенил)-1H-1,2,4-триазол-3-ил)метанон;
((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-(пиридин-2-ил)-1H-1,2,4-триазол-3-ил)метанон;
((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-(3-фторфенил)-1H-1,2,4-триазол-3-ил)метанон;
(1-(3-хлорфенил)-1H-1,2,4-триазол-3-ил)((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-фенил-5-(трифторметил)-1H-пиразол-4-ил)метанон;
((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метил-1-(3-(трифторметил)фенил)-1H-1,2,4-триазол-3-ил)метанон;
((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-(3-(трифторметил)фенил)-1H-1,2,4-триазол-3-ил)метанон;
(1-бензил-1H-1,2,4-триазол-3-ил)((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
бензо[d]изоксазол-3-ил((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-метил-1H-индазол-3-ил)метанон;
рацемический ((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил) метанон;
((5R,9S)-3-(3-хлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиноксалин-6-ил) метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(4-(2-фторэтокси)хинолин-6-ил)метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-(2-фторэтокси)фенил)метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-(2-(фтор-18F)этокси)фенил)метанон;
рацемический (2-(2H-1,2,3-триазол-2-ил) фенил) ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(2-(1H-1,2,4-триазол-5-ил) фенил) ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) метанон;
(2-(5-хлор-1H-1,2,4-триазол-3-ил)фенил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-(1-метил-1H-пиразол-4-ил)фенил)метанон;
(3-(4H-1,2,4-триазол-4-ил) фенил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метил-2-(2H-1,2,3-триазол-2-ил)фенил)метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (3-фтор-2-(2H-1,2,3-триазол-2-ил) фенил) метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-фтор-2-(оксазол-2-ил)фенил)метанон;
рацемический ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-(пиримидин-2-ил)фенил)метанон;
рацемический ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метокси-1-метил-1H-пиразол-4-ил)метанон;
рацемический ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-этил-5-(трифторметил)-1H-пиразол-3-ил)метанон;
рацемический (5-циклопропил-1H-пиразол-4-ил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
рацемический (5-циклопропил-1-(2-гидроксиэтил)-1H-пиразол-4-ил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
рацемический (3-циклопропил-1-(2,2,2-трифторэтил)-1H-пиразол-4-ил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
рацемический (5-циклопропил-1-фенил-1H-пиразол-4-ил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
рацемический (5-циклопропил-1-(3-(трифторметил)фенил)-1H-пиразол-4-ил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
рацемический ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метил-1-фенил-1H-1,2,4-триазол-3-ил)метанон;
рацемический ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-(4-фторфенил)-5-метил-1H-1,2,4-триазол-3-ил)метанон;
рацемический ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-этил-1-фенил-1H-1,2,4-триазол-3-ил)метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-фторпиридин-4-ил)метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метоксипиридин-3-ил)метанон;
(5-аминопиридин-2-ил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метоксибензофуран-2-ил)метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (2-метилбензо[d]оксазол-6-ил) метанон;
(2-аминобензо[d]оксазол-6-ил) ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (фуро[3,2-b] пиридин-2-ил) метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(фуро[3,2-c]пиридин-4-ил)метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (1-метил-1H-пиразоло[3,4-b] пиридин-3-ил) метанон;
рацемический ((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил) метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хинолин-6-ил)метанон;
((5S,9 R)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил) метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (изохинолин-3-ил) метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хинолин-7-ил)метанон;
(4-бромхинолин-6-ил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(3-бромхинолин-6-ил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(8-бромхинолин-6-ил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(2-хлорхинолин-6-ил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(8-фторхинолин-5-ил)метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(8-фторхинолин-6-ил)метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-(трифторметил)хинолин-6-ил)метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(8-гидроксихинолин-6-ил)метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метоксихинолин-3-ил)метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(8-нитрохинолин-6-ил)метанон;
(8-аминохинолин-6-ил)((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиназолин-7-ил) метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиноксалин-6-ил)метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиназолин-6-ил) метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилхиноксалин-6-ил)метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (7-фторхиноксалин-6-ил) метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (1,6-нафтиридин-5-ил) метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1,8-нафтиридин-3-ил)метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1,8-нафтиридин-4-ил)метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1,7-нафтиридин-4-ил)метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1,6-нафтиридин-4-ил)метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (1,5-нафтиридин-2-ил) метанон;
6-((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбонил)-1-(2-фторэтил)хинолин-4(1H)-он;
6-((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбонил)-4-метил-2H-бензо[b][1,4]оксазин-3(4H)-он;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(4-метил-3,4-дигидро-2H-пиридо[3,2-b][1,4]оксазин-7-ил)метанон;
(2-(2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-3-(3,4-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
рацемический ((5R,9S)-3-(3,4-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил) метанон;
((5R,9S)-3-(3,4-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хинолин-6-ил)метанон;
рацемический ((5R,9S)-3-(3,4-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиноксалин-6-ил) метанон;
((5R,9S)-3-(3-фтор-5-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиноксалин-6-ил)метанон;
((5R,9S)-3-(4-хлор-3-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиноксалин-6-ил)метанон;
((5R,9S)-3-(3-хлор-4-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиноксалин-6-ил)метанон;
(2-(2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-3-(3-хлор-4-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-3-(3-хлор-4-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (1-метил-1H-пиразоло[3,4-b]пиридин-3-ил)метанон;
((5R,9S)-3-(3-хлор-4-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил)метанон;
((5R,9S)-3-(3-хлор-5-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилбензо[d]оксазол-6-ил)метанон;
((5R,9S)-3-(3-хлор-5-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил)метанон;
((5R,9S)-3-(3-хлор-5-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиноксалин-6-ил)метанон;
((5R,9S)-3-(3,5-диметоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилбензо[d]оксазол-6-ил)метанон;
((5R,9S)-3-(3,5-диметоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хиноксалин-6-ил)метанон;
(3-(4H-1,2,4-триазол-4-ил)фенил)((5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(4-метил-3,4-дигидро-2H-пиридо[3,2-b][1,4]оксазин-7-ил)метанон;
((5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метокси-1-метил-1H-пиразол-4-ил)метанон;
(5-циклопропил-1-метил-1H-пиразол-4-ил)((5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-фенил-1H-1,2,4-триазол-3-ил)метанон;
((5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метоксипиридин-3-ил)метанон;
((5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(6-метил-3-(2H-1,2,3-триазол-2-ил)пиридин-2-ил)метанон;
((5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилбензо[d]оксазол-6-ил)метанон;
((5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(фуро[3,2-b]пиридин-2-ил)метанон;
((5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(имидазо[1,5-a]пиридин-8-ил)метанон;
((5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(имидазо[1,2-a]пиридин-3-ил)метанон;
(4-метокси-2-(2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-3-(3,5-дихлорфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хиноксалин-6-ил)метанон;
рацемический ((5R,9S)-3-(3-(дифторметил)-4-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил) метанон;
рацемический ((5R,9S)-3-(3-(дифторметил)-4-фторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиноксалин-6-ил) метанон;
((5R,9S)-3-(3-фтор-5-(трифторметил) фенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиноксалин-6-ил) метанон;
(3-хлор-5-метоксифенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
N-(3-метокси-5-((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбонил) фенил)ацетамид;
(3-(4H-1,2,4-триазол-4-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(2-(4H-1,2,4-триазол-4-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(3-фтор-2-(1H-1,2,4-триазол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(4-фтор-2-(1H-1,2,4-триазол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(5-фтор-2-(1H-1,2,4-триазол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(4-метил-2-(1H-1,2,4-триазол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(5-метил-2-(1H-1,2,4-триазол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(2-(1H-1,2,4-триазол-1-ил)-5-(трифторметил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-(3-(трифторметил)-1H-1,2,4-триазол-1-ил)фенил)метанон;
(2-(1H-имидазол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(5-фтор-2-(1H-пиразол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(3-(1-метил-1H-пиразол-4-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(3-(4-фтор-1H-пиразол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-(4-(трифторметил)-1H-пиразол-1-ил)фенил)метанон;
(3-(4-метокси-1H-пиразол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-(3-(трифторметил)-1H-пиразол-1-ил)фенил)метанон;
(3-(2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(5-фтор-2-(2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(3-метил-2-(2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(3-метокси-2-(2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(4-метокси-2-(2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(5-метокси-2-(2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(2-(2H-1,2,3-триазол-2-ил)-4-(трифторметил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(2-(2H-1,2,3-триазол-2-ил)-5-(трифторметил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(2-(1H-1,2,3-триазол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(3-метокси-2-(1H-1,2,3-триазол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(4,5,6,7-тетрагидропиразол[1,5-a]пиридин-3-ил)метанон;
(3,4-дигидро-2H-пирано[3,2-b]пиридин-7-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(6,7-дигидро-5H-пиразоло[5,1-b][1,3]оксазин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(6-метил-6,7-дигидро-5H-пиразоло[5,1-b][1,3]оксазин-3-ил)метанон;
(6,7-дигидро-5H-пиразоло[5,1-b][1,3]оксазин-2-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-метил-5-(трифторметил)-1H-пиразол-4-ил)метанон;
(1-(трет-бутил)-5-(трифторметил)-1H-пиразол-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(5-этил-1-фенил-1H-1,2,4-триазол-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-фенил-5-(трифторметил)-1H-пиразол-3-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-фенил-5-(трифторметил)-1H-1,2,4-триазол-3-ил)метанон;
(5-метокси-1-фенил-1H-1,2,4-триазол-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(1-(3-фторфенил)-1H-1,2,4-триазол-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(1-(4-фторфенил)-5-метил-1H-1,2,4-триазол-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(1-(2-метоксифенил)-1H-1,2,4-триазол-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(1-(3-метоксифенил)-1H-1,2,4-триазол-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(4-метоксипиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(6-метоксипиридин-2-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(4-метоксипиридин-2-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(5-метоксипиридин-2-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(6-метоксипиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(5-изопропоксипиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(6-(трифторметокси)пиридин-2-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-(трифторметокси)пиридин-2-ил)метанон;
6-((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбонил) пиколинонитрила;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пиразин-2-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пиримидин-4-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пиридазин-4-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пиримидин-5-ил)метанон;
(5-(1H-пиразол-1-ил)пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(6-(1H-пиразол-1-ил)пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(6-(1H-пиррол-1-ил) пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(6-(1H-имидазол-1-ил) пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(6-метил-3-(2H-1,2,3-триазол-2-ил)пиридин-2-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-(пирролидин-1-ил)пиридин-3-ил)метанон;
1-(5-((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбонил) пиридин-3-ил) пирролидин-2-она;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-морфолинопиридин-3-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилиндолизин-6-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (2-метилбензо[d]оксазол-6-ил) метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пиразоло[1,5-a]пиридин-3-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метилпиразоло[1,5-a]пиридин-3-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пиразоло[1,5-a]пиридин-5-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пиразоло[1,5-a]пиридин-6-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пиразоло[1,5-a]пиридин-2-ил)метанон;
имидазо[1,2-a]пиридин-5-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
имидазо[1,5-a]пиридин-5-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
имидазо[1,5-a]пиридин-6-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
имидазо[1,2-a]пиридин-6-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(7-метилимидазо[1,2-a]пиридин-3-ил)метанон;
(1-метил-1H-пирроло[2,3-b]пиридин-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(1-метил-1H-пирроло[2,3-b]пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пирроло[1,2-b]пиридазин-5-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пирроло[1,2-a]пиразин-8-ил)метанон;
(4-метокси-1-метил-1H-индазол-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(1-метил-1H-пиразоло[3,4-b]пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пиразоло[1,5-b]пиридазин-3-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (пиразоло[1,5-a]пиримидин-2-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пиразоло[1,5-a]пиримидин-3-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(6-метилпиразоло[1,5-a]пиримидин-3-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пиразоло[1,5-a]пиримидин-5-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(пиразоло[1,5-a]пиразин-3-ил)метанон;
имидазо[1,2-b]пиридазин-6-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
имидазо[1,2-b]пиридазин-3-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
[1,2,4]триазол[1,5-a]пиридин-7-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метил-5H-пирроло[2,3-b]пиразин-7-ил)метанон;
имидазо[1,2-a]пиримидин-3-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хинолин-4-ил)метанон;
изохинолин-1-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил) метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хинолин-7-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хиназолин-4-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хиноксалин-6-ил) метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилхиноксалин-6-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хиноксалин-2-ил)метанон;
циннолин-3-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
циннолин-6-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1,5-нафтиридин-2-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1,5-нафтиридин-3-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1,6-нафтиридин-8-ил)метанон;
(2-(2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-3-(3,5-дифтор-4-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-3-(3,5-дифтор-4-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1-метил-1H-пиразоло[3,4-b]пиридин-3-ил)метанон;
((5R,9S)-3-(3,5-дифтор-4-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хинолин-6-ил)метанон;
(2-(2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-3-(3,5-дифтор-4-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-3-(3,4-дифтор-5-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (1-метил-1H-пиразоло[3,4-b] пиридин-3-ил)метанон;
((5R,9S)-3-(3,4-дифтор-5-метоксифенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хинолин-6-ил)метанон;
((5R,9S)-2-метил-3-(1-метил-1H-индол-2-ил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил) (хинолин-6-ил)метанон;
рацемический-((5R,9S)-2-метил-3-(5-(трифторметил)тиофен-2-ил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хинолин-6-ил)метанон;
(4-метоксифенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(2-фтор-4-метоксифенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(2-фтор-4-метоксифенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(3-фтор-5-(1H-пиразол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(3-фтор-5-(4H-1,2,4-триазол-4-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(4-фтор-3-(4H-1,2,4-триазол-4-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(4-метил-3-(4H-1,2,4-триазол-4-ил)фенил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-метил-5-(4H-1,2,4-триазол-4-ил)фенил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метил-3-(4H-1,2,4-триазол-4-ил)фенил)метанон;
(2-(2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(4-фтор-2-(2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(3-фтор-2-(2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(5-фтор-2-(2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(5-метил-2-(2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(2-(2H-1,2,3-триазол-2-ил)-3-(трифторметил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(2-(4-метил-2H-1,2,3-триазол-2-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-(4-(трифторметил)-2H-1,2,3-триазол-2-ил)фенил)метанон;
(5-метокси-2-(1H-1,2,4-триазол-1-ил)фенил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-(4-(трифторметил)-1H-1,2,3-триазол-1-ил)фенил)метанон;
(6-изопропилпиримидин-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(6-метоксипиримидин-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(6-(диметиламино)пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(5-метокси-4-метилпиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(6-метокси-5-метилпиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(5-фтор-6-метоксипиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(5-фтор-2-метоксипиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(5,6-диметоксипиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(5,6-диметоксипиридин-2-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(3-хлор-2-метоксипиридин-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(5-хлор-6-метоксипиридин-2-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(4-хлор-2-метилпиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(4-хлор-5-метилпиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(3-хлор-5-фторпиридин-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(6-циклопропил-2-метилпиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
1-(5-((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбонил)пиридин-2-ил)циклопропан-1-карбонитрил;
(2-(1H-пиразол-1-ил)пиридин-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(4-(1H-пиразол-1-ил)пиридин-2-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(4-(1H-пиразол-1-ил)пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(6-(1H-пиразол-1-ил)пиридин-2-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(6-метил-3-(1H-пиразол-1-ил)пиридин-2-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(4-метокси-5-(1H-пиразол-1-ил)пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(6-метил-3-(1H-1,2,4-триазол-1-ил)пиридин-2-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(5-(4H-1,2,4-триазол-4-ил)пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(4-(4H-1,2,4-триазол-4-ил)пиридин-2-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(6-метил-4-(4H-1,2,4-триазол-4-ил)пиридин-2-ил)метанон;
(5-(2H-1,2,3-триазол-2-ил)пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(3-(2H-1,2,3-триазол-2-ил)пиридин-2-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(6-метил-4-(2H-1,2,3-триазол-2-ил)пиридин-2-ил)метанон;
(1,5-диметил-1H-пиразол-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(5-этил-1-метил-1H-пиразол-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(1,3,5-триметил-1H-пиразол-4-ил)метанон;
(5-метокси-1-метил-1H-пиразол-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(3-метокси-1-метил-1H-пиразол-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(3-фтор-1,5-диметил-1H-пиразол-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(5-(дифторметил)-1-метил-1H-пиразол-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(1-циклопропил-5-метил-1H-пиразол-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(1-циклопропил-3-метил-1H-пиразол-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(3-циклопропил-1-метил-1H-пиразол-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
индолизин-7-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(4-фторпиразоло[1,5-a]пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(6-фторпиразоло[1,5-a]пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(7-метилпиразоло[1,5-a]пиридин-3-ил)метанон;
(4-метоксипиразол[1,5-a]пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(6-метоксипиразол[1,5-a] пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
имидазо[1,5-a]пиридин-7-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метилимидазо[1,5-a]пиридин-6-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-метилимидазо[1,5-a]пиридин-6-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метилимидазо[1,2-a]пиридин-6-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(7-метилимидазо[1,2-a]пиридин-5-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-метилимидазо[1,2-a]пиридин-5-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-метилимидазо[1,2-a]пиридин-6-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилимидазо[1,2-a]пиридин-6-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилимидазо[1,2-a]пиридин-5-ил)метанон;
имидазо[1,2-a]пиридин-3-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(7-фторимидазо[1,2-a]пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(7-хлоримидазо[1,2-a]пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилимидазо[1,2-a] пиридин-3-ил) метанон;
(2,7-диметилимидазо[1,2-a]пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-3-(3-фтор-5-метилфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилимидазо[1,2-a]пиридин-3-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метилимидазо[1,2-a]пиридин-3-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(7-(трифторметил)имидазо[1,2-a]пиридин-3-ил)метанон;
(2-(дифторметил)имидазо[1,2-a]пиридин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(2-метил-2H-индазол-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(2,7-диметилпиразоло[1,5-a]пиримидин-5-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(7-метилпиразоло[1,5-a]пиримидин-6-ил)метанон;
(5-изопропил-3-метилпиразоло[1,5-a]пиримидин-7-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2,3,5-триметилпиразоло[1,5-a]пиримидин-7-ил)метанон;
(7-циклопропил-2-метилпиразоло[1,5-a]пиримидин-5-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилпиразоло[1,5-a]пиримидин-3-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилпиразоло[1,5-b]пиридазин-3-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилимидазо[1,2-a]пиразин-8-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2,5,8-триметилимидазо[1,2-a]пиразин-3-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-метилимидазо[1,2-b]пиридазин-3-ил)метанон;
(2,7-диметилимидазо[1,2-b]пиридазин-3-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-метил-3H-имидазо[4,5-b]пиридин-7-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-метил-3H-имидазо[4,5-b]пиридин-6-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(7-метил-7H-пирроло[2,3-d]пиримидин-4-ил)метанон;
(1-метил-1H-пиразоло[3,4-b]пиридин-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
(1-метил-1H-пиразоло[3,4-d]пиримидин-4-ил)((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
[1,2,4]триазол[4,3-a]пиридин-7-ил((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(3-метилимидазо[1,5-a]пиразин-1-ил)метанон;
((5R,9S)-3-(3-фтор-5-метилфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хинолин-6-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(4-метилхинолин-6-ил)метанон;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2-гидроксихинолин-6-ил)метанон;
6-((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-карбонил) хинолин 1-оксида;
((5R,9S)-3-(3,5-дифторфенил)-2-метил-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хинолин-6-ил-4-t)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(6-метилхиназолин-4-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хиноксалин-6-ил-2-d)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(хиноксалин-6-ил-2,3-d2)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5-метил-5,6,7,8-тетрагидроимидазо[1,2-a]пиридин-3-ил)метанон;
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(5,6,7,8-тетрагидроимидазо[1,2-a]пиридин-3-ил)метанон; и
((5R,9S)-2-метил-3-(3,4,5-трифторфенил)-4,5,6,7,8,9-гексагидро-2H-5,9-эпиминциклоокта[c]пиразол-10-ил)(2,6,6-триметил-6,7-дигидро-4H-пиразол[5,1-c][1,4]оксазин-3-ил)метанон;
и его фармацевтически приемлемые соли, изотопы, N-оксиды, сольваты и стереоизомеры.
| RU 2009142430 A, 27.05.2011 | |||
| WO 2014152604 A1, 25.09.2014. |
Авторы
Даты
2023-06-02—Публикация
2019-09-27—Подача