Область техники, к которой относится изобретение
Моделирование участия органов дыхания в терморегуляторных процессах является фундаментальным направлением современной пульмонологии и биологии [1]. Интенсивно разрабатываются способы и модели для исследования механизма участия респираторного отдела легких в терморегуляторных процессах у млекопитающих [2].
Для исследования участия внешнего дыхания в терморегуляции организма известны способы моделирования экспериментальной лихорадки, которые осуществляют при введении бактериального липополисахарида (ЛПС) животным, после чего у них измеряют ректальную температуру [3, 4]. Также разработаны способы моделирования для оценки роли центральной нервной системы в формировании лихорадки [3]. Указанные способы основаны на измерении ректальной температуры после в условиях введения бактериального пирогена и общей анестезии экспериментальных животных. Недостаток этих способов моделирования экспериментальной лихорадки заключается в их осуществлении без учета острого повреждения головного мозга. Тогда как, часто у одного пациента отмечают одновременное наличие двух или более заболеваний, синдромов или психических расстройств, связанных между собой общими факторами риска или единым патогенетическим механизмом [5, 6]. Так, указывается на коморбидность острого повреждения при ишемии головного мозга на фоне хронической обструктивной болезни легких и системного воспаления [7]. Наличие коморбидности не всегда может быть объясненным явлением как, например, в результате случайного временного сочетания заболеваний, поэтому исследование этого состояния с помощью моделей экспериментальных болезней [8].
Наиболее близким к заявляемому способу является модель воспроизведения системного воспаления при коморбидности острого повреждения головного мозга при ишемии и хронической обструктивной болезни легких [10]. Существо данной экспериментальной модели заключается в хирургической окклюзии сонных артерий, затем для индукции эндотоксинемии введения ЛПС и протеолитических ферментов животным, что приводит к развитию хронической обструктивной болезни легких. К недостатку такой модели изучения коморбидности относится отсутствие оценки температуры тела для выявления лихорадки. Также к недостатку известных способов исследования состояния центральной нервной системы и участия внешнего дыхания в температурных реакциях при гипертермии относится отсутствие экспериментальной закрытой внутричерепной травмы головного мозга при обязательной общей анестезии на момент первого дня экспериментального воздействия на организм [11].
Показано, что бактериальные пирогены (ЛПС) стимулируют выработку в клетках биологически активных продуктов [12]. В этом процессе, участвуют также гранулоциты лейкоцитарного происхождения, в том, числе тучные клетки (мастоциты) [12]. Недостатком известных способов моделирования коморбидности повреждения головного мозга и нарушения функции легких является отсутствие гистохимических данных учета количества тучных клеток и лейкоцитов в тканях дыхательной системы, периваскулярном пространстве легочных артерий при введении бактериального липополисахарида крысам.
Для воспроизведения экспериментальной эндотосинемии используют широкий диапазон дозы ЛПС:
1) более 1 мг/кг [10];
2) от 100 мкг до 500 мкг/кг веса [13, 14];
3) 5 минимальных пирогеных доз (МПД) ЛПС (для кролика минимальная пирогенная доза ЛПС 0,0075±0,0025 мкг в мл на кг веса) [15].
Рекомендации государственной фармакопеи России указывают на недостаток известных способов экспериментального воспроизведения эндотосинемии, которые заключаются во введении в организм животных больших доз (>1 мг/кг) бактериального ЛПС. При этом известно, что введение пирогенала (фармакопейная форма бактериального ЛПС) в дозе 100 мкг/кг вызывает сложные адаптивные реакции у крыс [16]. На однократное введение ЛПС в дозе более 100 мкг/кг внутривенно у экспериментальных животных отмечают гипотермию (низкая температура тела) [14].
Установлено, что катионы кальция участвуют в качестве нейротрансмитеров в процессах терморегуляции организма и в термозависимых реакциях органов дыхания [17,1]. Ализарин красный С (АКС) является одним реагентов, который выявляет катионы кальция в тканях легких. Наличие ализарин-позитивных клеток в респираторном отделе легких позволяет оценить степень участия легких в терморегуляторных процессах при общем охлаждении организма и во время черепно-мозговой травмы (ЧМТ) [18; 19; 20]. Недостатком этого способа является отсутствие оценки влияния бактериального ЛПС на содержание ализарин-позитивных клеток в легких при эксперименте.
Также известно, что общая анестезия при введении пирогенов снижает температуру тела у экспериментальных животных, поэтому недостатком известных способов осуществления экспериментальной ЧМТ является обязательное условие проведения общей анестезии, что затрудняет исследование температуры тела во время эксперимента. Учитывая, что общая анестезия организма и высокие дозы ЛПС более 100 мкг/кг способствуют развитию гипотермии [14], важным условием осуществления заявленного способа является трехкратное введение ЛПС в дозе 33,33 мг/кг крысам, при условии обязательной общей анестезии на первый день эксперимента.
Уровень техники заявляемого способа заключается в экспериментальном моделировании коморбидности закрытой внутричерепной травмы с нарушением функции легких, индуцируемом бактериальным пирогеналом, при обязательной общей анестезии на момент нанесения черепно-мозговой травмы в первый день эксперимента, с последующим внутримышечным троекратным введением крысам бактериального пирогенала ЛПС в дозе 33,33 мкг/кг веса на 1, 3, 4 сутки эксперимента, учетом количества ализарин-позитивных клеток в тканях легких и измерением ректальной температуры животных на 3, 4 сутки после экспериментальной черепно-мозговой травмы.
Задача заявленного способа состоит в экспериментальном воспроизведении коморбидности закрытой внутричерепной травмы головного мозга и нарушении функции легких, путем индукции эндотоксинемии при введении ЛПС с оценкой частоты дыхания и ректальной температуры для изучения процессов терморегуляции у крыс и привлечением гистохимического исследования тканей легких.
Основным техническим результатом способа является гистохимическая окраска ализариновым красным С и толуидиновым синим тканей легких с помощью, которой можно количественно оценить нарушение функции этого органа и процессов терморегуляции при коморбидности черепно-мозговой травмы и эндотоксиномии при обязательной общей анестезии на момент первого дня экспериментального воздействия на организм.
Техническим результатом заявленного способа является измерение ректальной температуры, частоты дыхания, исследование количества клеток, содержащихся в периваскулярном пространстве легочных артерий, окрашенных спиртовым раствором ализаринового красного С и докрашенных гематоксилином Эрлиха, которые являются показателями коморбидности закрытой внутричерепной травмы, нарушения функции легких и процессов терморегуляции организма при обязательной общей анестезии на момент первого дня экспериментального воздействия на организм.
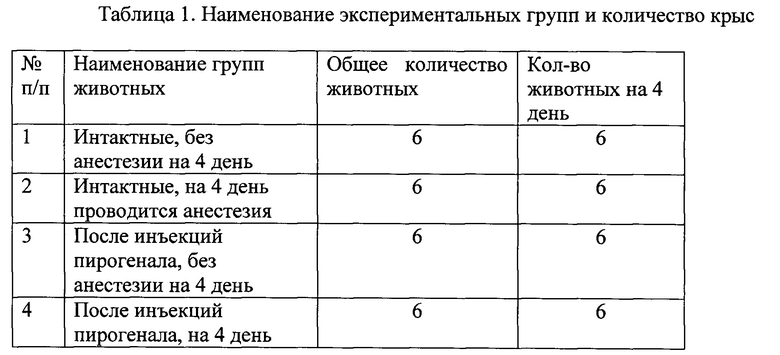
Признаки, используемые для осуществления условий необходимых для оценки коморбидного состояния организма: измерение ректальной температуры, частоты дыхания и гистохимическая характеристика тканей легких. В известных способах используют оценку ректальной температуры у трех групп экспериментальных животных: 1) без введения пирогенала, 2) при введении пирогенала, 3) при введении пирогенала и общей анестезии. В заявленном способе термометрию проводят на 3 и 4 день исследования у 8 групп экспериментальных животных. Изучают следующие основные группы экспериментальных животных (табл.1):
1) интактные, без ЧМТ и введения пирогенала без общей анестезии на 1 и 4 день;
2) интактные, без ЧМТ и введения пирогенала при общей анестезии на 1 и 4 день;
3) при троекратном внутримышечном введении бактериального пирогенала в дозе 33,33 мкг/кг на 1, 3, 4 сутки эксперимента без общей анестезии на 4 день;
4) при троекратном внутримышечном введении бактериального пирогенала в дозе 33,33 мкг/кг на 1, 3, 4 сутки эксперимента при общей анестезии на 1 и 4 день;
5) при закрытой внутричерепной травме, без общей анестезии на 4 день;
6) при закрытой внутричерепной травме при общей анестезии на 1 и 4 день;
7) при закрытой внутричерепной травме и троекратном введении пирогенала в дозе 33,33 мкг/кг на 1, 3, 4 сутки эксперимента без общей анестезии на 4 день.
8) при закрытой внутричерепной травме и троекратном внутримышечном введении бактериального пирогенала в дозе 33,33 мкг/кг на 1, 3, 4 сутки эксперимента, при общей анестезии на 1 и 4 день;
Для вивисекции экспериментальных животных, под общей анестезией на 6 день эксперимента, проводят вскрытие грудной клетки с извлечением легких для гистохимического исследования. С помощью световой и флуоресцентной микроскопии изучают окрашенные ализариновым красным С (АКС) и толуидиновым синим гистологические срезы тканей легких. В 100 полях зрения при 1000-кратном увеличении микроскопа подсчитывается количество ализарин-позитивных клеток, лейкоцитов и мастоцитов.
Способ применили для исследования белых крыс Wistar, самцов весом 250 грамм. Для оценки частоты дыхания, термометрии и гистохимических характеристик тканей легких, согласно условиям осуществления заявленного способа на первый день эксперимента производили общую анестезию, после чего распределяли экспериментальных животных на 8 групп (табл. 1).
Для воспроизведения лихорадки животным вводили фармакопейную форму бактериального ЛПС, раствор пирогенала (р-р для в/м введ. амп., 100 мкг, 1 мл, "МЕДГАМАЛ" ФГБУ "НИЦЭМ им. Н.Ф. Гамалеи" Минздрава России).

Общую анестезию проводили с помощью внутримышечного введения золетила 100 в дозе 20 мг/кг («Virbac» Франция). Экспериментальную ЧМТ осуществляли с помощью модели падающего груза весом 200 грамм, адаптированного для крыс [11], в отличие от прототипа, удар грузом весом 200 грамм наносили 3 раза подряд в теменную область головы крыс.
В день моделирования ЧМТ была проведена общая анестезия животных контрольных и экспериментальных групп, которым на 3 и 4 дни исследования замерялась ректальная температура и проводилась оценка частоты дыхания. Частоту дыхания у наркотизированных животных измеряли с помощью аппарата для исследования системы дыхания у грызунов MouseOx Pulse Oximeter for Mice&Rats (Ugo Basile). Ректальную температуру замеряли с помощью медицинского электронного градусника. Термометрию у крыс проводили в летний период времени, в термостатируемом помещении. Поддержка температуры окружающей среды в помещении осуществлялась с помощью кондиционера COMFEE MS AF A-07HRN1-QC2 до 30°С. Наркотизируемых крыс клали на термостатируемый гистологический столик, нагретый до 30°С и накрывали тканью, после чего проводили термометрию в течение 1 часа - ранняя фаза лихорадки.
На 4 и 6 сутки после начала эксперимента животным проводился общий наркоз, и осуществлялась вивисекция с забором легких для гистохимического исследования. С этой целью левое легкое извлекали из грудной клетки и помещали в 5% раствор АКС на основе 96° этилового спирта для фиксации и окрашивания на 48 ч, после чего обезвоживали кусочек ткани размером 10×10×10 мм3 в хлороформе и заливали в парафин. На микротоме изготавливали срезы толщиной 5 мкм, помещали на предметные стекла с адгезивным покрытием, депарафинировали. Контрольные препараты обесцвечивали в солянокислом спирте и окрашивали гематоксилином Эрлиха и эозином. Часть правого легкого фиксировали в формалине, заливали в парафин, после чего изготавливали гистологические срезы, которые окрашивали толуидиновым синим для выявления тучных клеток (BiOVitrum, Россия). Также проводили окраску 5% раствором АКС в 96° этаноле (ЛенРеактив, Россия). С помощью световой и флуоресцентной микроскопии изучали гистологические срезы, окрашенные АКС и толуидиновым синим. При общем увеличении микроскопа х 1000, в 100 полях зрения подсчитывается количество ализарин-позитивных клеток и мастоцитов, сегментоядерных лейкоцитов и др. в одном поле зрения.
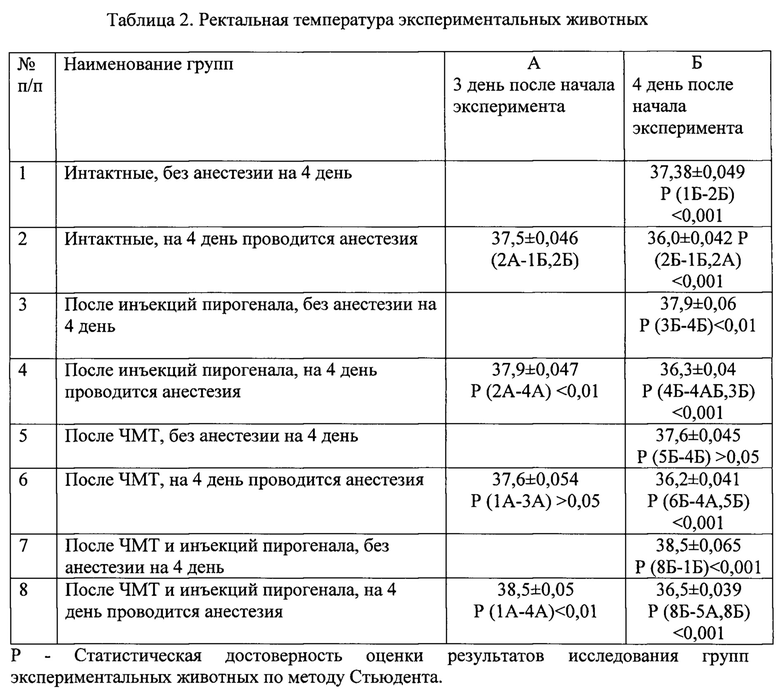
Установлено, что в/м введение пирогенала вызывает субфебрильную гипертермию организма крыс на 3 и 4 день эксперимента табл. 2, 3. Проведение общего наркоза приводит к понижению температуры крыс при лихорадке. При нанесении ЧМТ на 3, 4 день ректальная температура животных не изменялась. При исследовании ректальной температуры экспериментальных животных после ЧМТ и введения пирогенала на 3 и 4 день у крыс обнаружена фибрилляция температуры табл.2. Проведение общего наркоза приводит к понижению температуры у экспериментальных животных при лихорадке и ЧМТ, что отражает роль центральной системы в развитии лихорадочного состояния табл. 2.
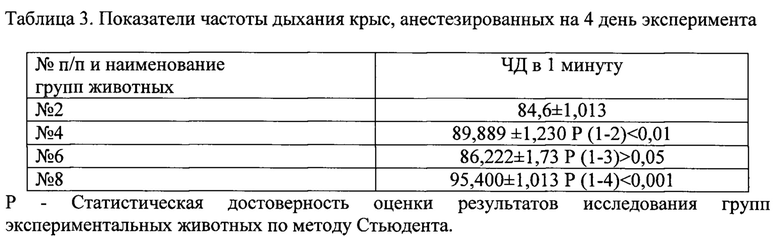
На 4 день эксперимента обнаружено, что в/м введение пирогенала и нанесение ЧМТ не вызывает достоверного изменения частоты дыхания ЧД (табл. 3). Тогда как, достоверное повышение этого показателя обнаруживается у крыс при введении пирогенала после нанесения ЧМТ.
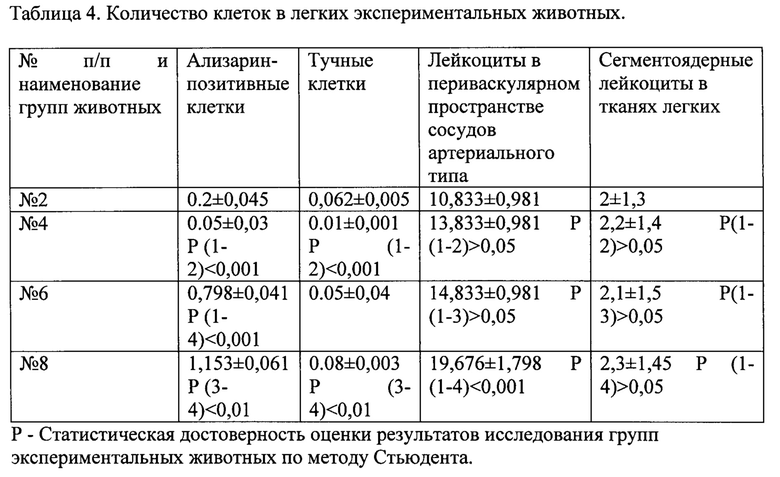
При суправитальном окрашивании спиртовым раствором АКС, в тканях легких выявляются два типа клеток слабо и интенсивно окрашенные клетки (ализарин-позитивные). Последние, обнаруживались в стенках альвеол или в переваскулярном пространстве кровеносных сосудов. Для этих клеток характерны округлое ядро, интенсивно окрашенные АКС ядрышки и цитоплазма. Учитывая особенности красителя АКС, мы использовали комбинированный микроскопический анализ окрашенных срезов. При увеличении ×1000 изучали паренхиму легких включая респираторный отдел и, в 100 полях зрения подсчитывали содержание ализарин-позитивных клеток. В легких контрольных животных этот показатель составил 0,2±0,045 клеток в одном поле зрения, что достоверно отличалось при исследовании количества этих клеток при ЧМТ (0,8±0,09, р<0,001). При коморбидности ЧМТ и инъекций пирогенала, количество клеток достоверно увеличивалось по сравнению с животными при ЧМТ (табл. 4), тогда как введение ЛПС вызывало их снижение. У экспериментальных животных не было обнаружено морфофизиологических признаков отека тканей и лейкоцитарной инфильтрации альвеол ацинуса легких. Просвет альвеол был свободен от экссудата. При этом в случае коморбидности ЧМТ и введения пирогенала отмечалось достоверное повышение содержания лейкоцитов (сегментоядерных лейкоцитов, макрофагов, лимфоцитов) в периваскулярном пространстве легочных кровеносных сосудов артериального типа. Достоверное повышение количества тучных клеток в легких по сравнению со здоровыми животными отмечено при коморбидности ЧМТ и инъекций пирогенала (р<0,01), при этом обнаружена их активная дегрануляция. Таким образом, введение после ЧМТ пирогенала в дозе 33,33 мг/кг крысам оказывает существенное воздействие на содержание клеточных маркеров нарушения дыхательной функции респираторного отдела легких, что подтверждает техническую результативность заявляемого способа.
Источники информации
1. Perelman J.M., Pirogov А.В., Prikhodko A.G., Zinovev S.V., Kolosov V.P. American Journal of Respiratory and Critical Care Medicine. 2018. Vol. 197(S): A3804.
2. White MD. J Appl Physiol. 2006, 101(2):655-63, Bun Tsuji, Keiji Hayashi, Narihiko Kondo,d and Takeshi Nishiyasua. Temperature (Austin). 2016. Vol. 3(1): 146-160.
3. Практикум по экспериментальной и клинической патологии под ред. Л.П. Чурилова. Санкт Петербург. СпецЛит, 2018: 599 с.
4. Shike Hou, Hui Ding, Qi Lv, Xiaofeng Yin, Jianqi Song, Ning Xu  Haojun Fan. PLoS ONE 2014. Vol. 9(1): e87826.
Haojun Fan. PLoS ONE 2014. Vol. 9(1): e87826.
5. Feinstein A.R. Journal Chronic Disease. 1970. Vol. 23(7):455-468.
6. Белялов Ф.И. Лечение болезней в условиях коморбидности. Изд. 12-е. Москва: ГЭОТАР-Медиа: 2022: 560 с.
7. Плехова Н.Г., Гельцер Б.И., Зиновьев С.В., Заяц Ю.В. Архив патологии. 2019. Т. 81; №3: С. 19-26.
8. Melanie Haffher-Luntzer, Kurt D. Hankenson and Anita Ignatius et al. Journal of Orthopaedic Research. 2019. Vol. 37 (12): 2491-2498.
9. Sunghee Cho, and Jiwon Yang. 2018. Vol. 49 (2): 501-507.
10. Гельцер Б.И., Котельников B.H., Заяц Ю.В. Журнал неврологии и психиатрии им. С.С. Корсакова. 2019. Т. 119. №7. С. 54-59.
11. Радьков И.В., Плехова Н.Г., Дюйзен И.В., Зиновьев С.В., Барышев А.Н. 2020. Patent Ru 2725287 C1.
12. El-Radhi AS. Pathogenesis of Fever. Clinical Manual of Fever in Children. 2018. Springer, Cham.. doi:10.1007/978-3-319-92336-9_3.
13. Alekseeva I.V., Abramova A.Yu., Kozlov A.Yu., Koplik E.V., Pertsov A.S., Lyadov D.A., Nikenina E.V., Pertsov S.S. Bull.Exp.Biol. Med. 2019. Vol.167, №5 - P. 624-627.
14 Romanovsky AA, Almeida MC, Aronoff DM, Ivanov AI, Konsman JP, Steiner AA, Turek VF. Front Biosci. 2005. Vol. 10:2193-2216.
15. Государственная фармакопея 13 издание (ГФ XIII). T1. Москва, 2015.
16. Alekseeva I.V., Abramova A.Yu., Kozlov A.Yu., Koplik E.V., Pertsov A.S., Lyadov D.A., Nikenina E.V., Pertsov S.S. Bull.Exp.Biol. Med. 2019. Vol.167, №5-P. 624-627.
17. Yarlagadda A, Clayton AH. Psychiatry (Edgmont). 2008; 5(12):51-54.
18 Зиновьев С.В. Бюллетень физиологии и патологии дыхания. 2012. №45. С. 57-61.
19. Зиновьев С.В., Плехова Н.Г., Радьков И.В. Медико-фармацевтический журнал Пульс. 2021. Т. 23. №5. С. 162-167.
20. Зиновьев С.В., Плехова Н.Г., Радьков И.В. Лабораторные животные для научных исследований. 2021. №4. С.10-16.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения окислительного потенциала клеток с применением бихроматометрии | 2022 |
|
RU2798290C1 |
| СРЕДСТВО, ОКАЗЫВАЮЩЕЕ АНТИИШЕМИЧЕСКОЕ, АНТИГИПОКСИЧЕСКОЕ И АНТИАМНЕСТИЧЕСКОЕ ДЕЙСТВИЕ В ОСТРОМ ПЕРИОДЕ ЧЕРЕПНО-МОЗГОВОЙ ТРАВМЫ | 2009 |
|
RU2424802C2 |
| Применение энисамия йодида для профилактики и/или лечения острого респираторного дистресс-синдрома (ОРДС) | 2022 |
|
RU2799328C1 |
| ФАРМАКОЛОГИЧЕСКИ АКТИВНАЯ СУБСТАНЦИЯ ЗАЩИТНОГО СОЕДИНЕНИЯ ОРГАНИЗМА 3СО, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 1990 |
|
RU2104704C1 |
| Способ профилактики или терапии острого респираторного дистресс-синдрома на модели индуцированного ОРДС у лабораторных животных | 2021 |
|
RU2772735C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО, ОКАЗЫВАЮЩЕЕ АНТИИШЕМИЧЕСКОЕ, АНТИГИПОКСИЧЕСКОЕ И ПРОТИВОСУДОРОЖНОЕ ДЕЙСТВИЕ ПРИ ЧЕРЕПНО-МОЗГОВОЙ ТРАВМЕ | 2005 |
|
RU2309745C2 |
| СРЕДСТВО, ОКАЗЫВАЮЩЕЕ НЕЙРОПРОТЕКТОРНОЕ ДЕЙСТВИЕ В ОСТРОМ ПЕРИОДЕ ЧЕРЕПНО-МОЗГОВОЙ ТРАВМЫ | 2009 |
|
RU2414901C2 |
| Способ нейропротекции головного мозга при моделировании открытой черепно-мозговой травмы | 2023 |
|
RU2827849C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО, ОКАЗЫВАЮЩЕЕ МНОГОФАКТОРНОЕ НЕЙРОПРОТЕКТОРНОЕ И НООТРОПНОЕ ДЕЙСТВИЕ ПРИ ЧЕРЕПНО-МОЗГОВОЙ ТРАВМЕ | 2005 |
|
RU2318501C2 |
| Способ регенерации клеток головного мозга с восстановлением его функций | 2023 |
|
RU2816789C1 |
Изобретение относится к медицине, а именно к способу моделирования коморбидности закрытой внутричерепной травмы и дисфункции дыхательной и терморегуляторной систем у животных. Для этого проводят общую анестезию в первый и четвертый день экспериментального воздействия на организм, наносят крысам черепно-мозговую травму. Далее внутримышечно вводят на 1, 3, 4 сутки пирогенал в дозе 33,33 мкг/кг, измеряют ректальную температуру, частоту дыхания на 3, 4 сутки после начала эксперимента, количественно изучают клетки в тканях легких, окрашенных ализариновым красным С и толуидиновым синим. При увеличении ректальной температуры на 3-й день после начала эксперимента; понижении ректальной температуры, увеличении частоты дыхания, увеличении количества ализарин-позитивных клеток в легких, тучных клеток в легких, лейкоцитов в периваскулярном пространстве сосудов артериального типа, сегментоядерных лейкоцитов в тканях легких на 4-й день после начала эксперимента по сравнению со здоровыми животными судят о смоделированном коморбидном состоянии. Изобретение обеспечивает экспериментальное воспроизведение коморбидности закрытой внутричерепной травмы головного мозга и нарушения функции легких. 4 табл.
Способ моделирования коморбидности закрытой внутричерепной травмы и дисфункции дыхательной и терморегуляторной систем у животных, включающий общую анестезию в первый и четвертый день экспериментального воздействия на организм, нанесение крысам черепно-мозговой травмы и последующее внутримышечное введение на 1, 3, 4 сутки пирогенала в дозе 33,33 мкг/кг, измерение ректальной температуры, частоты дыхания на 3, 4 сутки после начала эксперимента, количественное изучение клеток в тканях легких, окрашенных ализариновым красным С и толуидиновым синим, и при увеличении ректальной температуры на 3-й день после начала эксперимента; понижении ректальной температуры, увеличении частоты дыхания, увеличении количества ализарин-позитивных клеток в легких, тучных клеток в легких, лейкоцитов в периваскулярном пространстве сосудов артериального типа, сегментоядерных лейкоцитов в тканях легких на 4-й день после начала эксперимента по сравнению со здоровыми животными судят о смоделированном коморбидном состоянии.
| Способ моделирования тяжелой черепно-мозговой травмы | 2016 |
|
RU2641569C1 |
| БЕЛОШИЦКИЙ В.В | |||
| Принципы моделирования черепно-мозговой травмы в эксперименте / Украiнський нейрохiрургiчний журнал, 2008, N4, стр | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| РОМАНОВА Г.А | |||
| и др | |||
| Моделирование черепно-мозговой травмы / Патологическая физиология и экспериментальная терапия, 2015, т | |||
| Устройство для охлаждения водою паров жидкостей, кипящих выше воды, в применении к разделению смесей жидкостей при перегонке с дефлегматором | 1915 |
|
SU59A1 |
| Прялка для изготовления крученой нити | 1920 |
|
SU112A1 |
| ПАРФЕНОВ А.Л | |||
| и др | |||
| Формирование | |||
Авторы
Даты
2023-10-03—Публикация
2022-07-05—Подача