Область техники
Изобретение относится к генной инженерии, биотехнологиям, иммунологии и медицине (в частности, к онкогинекологии), а именно к иммуногенной композиции на основе смеси рекомбинантных белков E6-CBD и E7-CBD для лечения злокачественных новообразований, ассоциированных с вирусом папилломы человека 16 типа (ВПЧ 16). Иммуногенная композиция индуцирует гуморальный и Т-клеточный ответ, направленный на распознавание и эффективную элиминацию из организма ВПЧ-инфицированных и малигнизированных клеток, что обеспечивает выраженный противоопухолевый эффект in vivo.
Уровень техники
Вирусы папилломы человека (ВПЧ) - большое семейство малых безоболочечных двухцепочечных ДНК-содержащих вирусов, которые обладают тропизмом к поверхностям слизистых оболочек или эпидермальному плоскому эпителию и вызывают развитие как доброкачественных, так и злокачественных новообразований, таких как рак шейки матки, рак аногенитальной области, носоглотки, головы и шеи. Описано более 200 типов ВПЧ, на долю высокоонкогенных типов ВПЧ - 16 и 18 - приходится более 80% всех цервикальных раков [Human papillomaviruses // IARC Monogr. Eval. Carcinog. Risks Hum. 2007. V. 90. P. 1-636; Bruni L., Albero G., Serrano B. et al. Human papillomavirus and related diseases in the world. Summary report 17 June 2019 // ICO/IARC Information Centre on HPV and Cancer (HPV Information Centre), 2019. 315 pp.]. По данным Всемирной организации здравоохранения, рак шейки матки занимает четвертое место в мире по распространенности среди онкологических заболеваний у женщин, в последние годы сохраняется тенденция к росту заболеваемости в развивающихся странах и в Российской Федерации [Global strategy to accelerate the elimination of cervical cancer as a public health problem // World Health Organization, 2020; Эпидемиологическое обоснование вакцинопрофилактики папилломавирусной инфекции // СПб.: ФБУН НИИЭМ имени Пастера, 2018].
ВПЧ-инфекция передается преимущественно половым путем, но возможны также вертикальный (от инфицированной матери плоду) [Smith Е.М., Parker М. A., Rubenstein L.M. et al. Evidence for vertical transmission of HPV from mothers to infants // Infect. Dis. Obstet. Gynecol. 2010. V. 210. P. 326389] и горизонтальные пути передачи вируса, в том числе контактно-бытовой [Liu Z., Tasnuva R., Nyitray A. Penises not required: a systematic review of the potential for human papillomavirus horizontal transmission that is non-sexual or does not include penile penetration // Sex. Health. 2015. V. 13. P. 10-21]. ВПЧ-инфекции зачастую протекают бессимптомно, неспецифические клинические признаки появляются лишь на поздних стадиях, что затрудняет выявление и проведение своевременного лечения ВПЧ-ассоциированных заболеваний.
При ВПЧ-инфекции основную роль в иммортализации, злокачественной трансформации клеток и поддержании их трансформированного фенотипа играют онкобелки Е6 и Е7 ВПЧ [Hancock G., Hellner K., Dorrell L. Therapeutic HPV vaccines // Best Pract. Res. Clin. Obstet. Gynaecol. 2018. V. 47. P. 59-72], которые инактивируют онкосупрессорные белки р53 и pRb, индуцируют генетическую нестабильность и стимулируют неконтролируемую клеточную пролиферацию [Вонский М.С., Шабаева М.Г., Рунов А.Л. и др. Канцерогенез, ассоциированный с инфекцией вирусами папилломы человека, его механизмы и возможности иммунотерапии // Биохимия. 2019. Т. 84. №7. С.995-1015]. Белки Е6 и Е7 ВПЧ характеризуются высокой консервативностью; конститутивно экспрессируются в опухолевых и предраковых клетках; не вызывают развитие аутоиммунных реакций, поскольку являются чужеродными белками для человека. Благодаря перечисленным свойствам белки Е6 и Е7 ВПЧ являются наиболее перспективными мишенями для создания терапевтических вакцин против ВПЧ-индуцированных онкологических заболеваний [Chabeda A., Yanez R., Lamprecht R. et al. Therapeutic vaccines for high risk HPV associated diseases // Papillomavirus Res. 2017. V. 5. P. 46-58].
В патентной документации представлены варианты иммуногенных композиций на основе рекомбинантных онкобелков Е6 и Е7 (патенты RU 2377305 C1, US 9974849 В2, СА 2691091 А1; заявки на патенты WO 2011/068934 А2, WO 2006/065166 А1, US 2013/0209402 A1), проходящих доклинические и клинические испытания, но в настоящее время ни одна из терапевтических вакцин против ВПЧ-ассоциированных заболеваний не одобрена к использованию в клинической практике. Рекомендованы к применению профилактические вакцины: квадривалентная и нонавалентная вакцины Gardasil® (Merck Sharp&Dohme Corp., США) и бивалентная вакцина Cervarix® (GlaxoSmithKline Biologicals, Бельгия), направленные на формирование ВПЧ-нейтрализующих антител. Всемирной организацией здравоохранения принята глобальная стратегия по ликвидации рака шейки матки, включающая проведение профилактической вакцинации против ВПЧ в сочетании со скринингом и лечением предраковых состояний [Global strategy to accelerate the elimination of cervical cancer as a public health problem // World Health Organization, 2020]. В России вакцинация против папилломавирусной инфекции не включена в Национальный календарь профилактических прививок, таким образом, существенная доля населения не защищена от ВПЧ-инфекций.
Следует учесть, что успешность профилактической вакцинации определяется ВПЧ-наивностью (отсутствием ВПЧ-инфекции). У индивидов, которые были инфицированы ВПЧ до проведения вакцинации, профилактические вакцины не способны предотвратить персистенцию вируса, развитие неопластических изменений и рака, а также вертикальную и горизонтальную передачу вируса от инфицированных родителей детям и не оказывают терапевтического эффекта в отношении уже существующих в организме опухолевых новообразований [Arbyn М., Xu L., Simoens С, Martin-Hirsch P.P.L. Prophylactic vaccination against human papillomaviruses to prevent cervical cancer and its precursors // Cochrane Database Syst. Rev. 2018. V. 5. P. CD009069].
Таким образом, с учетом отсутствия обязательной профилактической вакцинации против папилломавирусной инфекции в Российской Федерации, высокой распространенности урогенитальных ВПЧ-инфекций и ежегодного роста заболеваемости крайне актуальна разработка новых эффективных терапевтических иммуногенных композиций с выраженным противоопухолевым эффектом для лечения ВПЧ-ассоциированных злокачественных новообразований.
Описание иллюстраций:
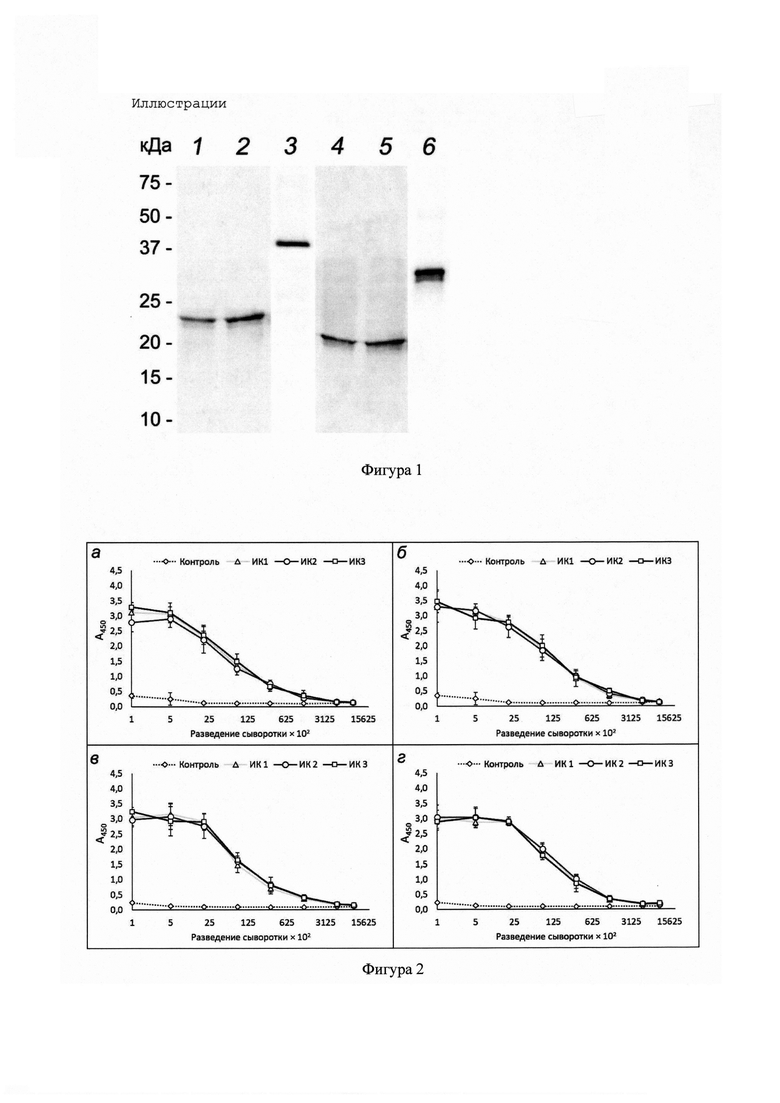
Фигура 1 - Результаты иммуноблоттинга, полученные с использованием коммерческих антител к антигенам Е6 (1-3) и Е7 (4-6) ВПЧ 16, ВПЧ 16-положительных клеточных линий карциномы шейки матки SiHa (1,4) и CaSki (2,5), а также рекомбинантных белков E6-CBD (3) и E7-CBD (б).
Фигура 2 - Титр антител к рекомбинантным белкам E6-CBD (а, б) и E7-CBD (в, г), наблюдаемый через 14 (а, в) и 42 (б, г) суток после трехкратного введения иммуногенной композиции на основе смеси рекомбинантных белков E6-CBD и E7-CBD с добавлением различных адъювантов (ИК1-ИКЗ) мышам линии BALB/c. К - контроль.
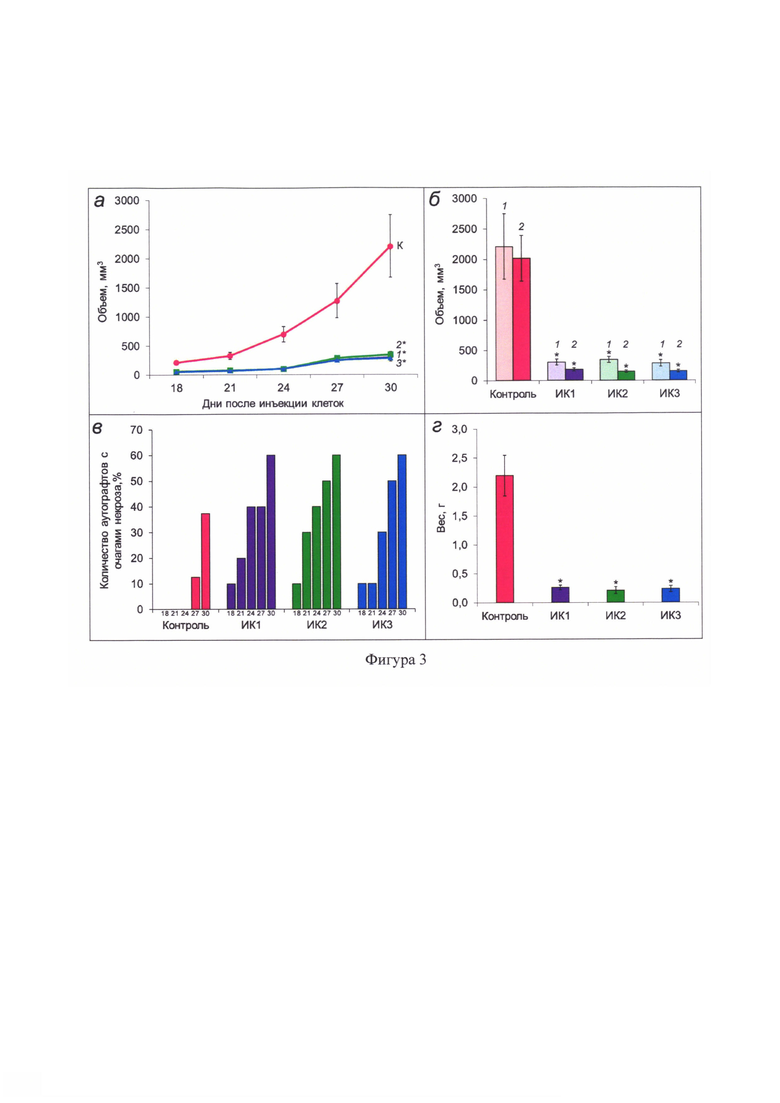
Фигура 3 - Оценка эффективности иммуногенной композиции на основе смеси рекомбинантных белков E6-CBD и E7-CBD с добавлением различных адъювантов (ИК1-ИК3) in vivo на экспериментальной модели мышей линии BALB/c с ВПЧ 16-ассоциированными опухолями: а - динамика роста аутографтов после трехкратного введения иммуногенной композиции (указаны сутки после инъекции туморогенных клеток 4Т1 Е6/Е7); К - контроль, 1 - ИК1, 2 - ИК2, 3 - ИК3; 6 - объем терминальных аутографтов: 1 - объем, рассчитанный с использованием двух линейных параметров по формуле (1); 2 - объем, рассчитанный с использованием трех линейных параметров по формуле (2); в - динамика появления очагов некроза у аутографтов мышей контрольной и опытных групп (цифры под столбцами - сутки после инъекции туморогенных клеток 4Т1 Е6/Е7); г - вес терминальных аутографтов. *р<0.05 (статистически значимая разница между контрольной и опытными группами).
Раскрытие изобретения
Требуемый технический результат заключается в разработке новой эффективной иммуногенной композиции, содержащей смесь рекомбинантных белков E6-CBD и E7-CBD, для лечения ВПЧ-ассоциированных злокачественных новообразований. Механизм действия иммуногенной композиции основан на индукции цитотоксического Т-клеточного иммунного ответа, направленного на распознавание и эффективную элиминацию из организма человека ВПЧ-инфицированных и малигнизированных клеток, что обеспечивает выраженный противоопухолевый эффект in vivo.
Для реализации изобретения были поставлены следующие задачи:
1) создание слитных рекомбинантных белков E6-CBD (SEQ ID NO 1) и E7-CBD (SEQ ID NO 2), разработка эффективного способа получения в клетках Escherichia coli рекомбинантных белков E6-CBD и E7-CBD, легко поддающихся очистке и обладающих достаточной иммуногенностью;
2) создание иммуногенной композиции, содержащей смесь иммунологически активных рекомбинантных белков E6-CBD и E7-CBD с добавлением приемлемых для инъекционного использования жидких адъювантов, для эффективной терапии ВПЧ 16-ассоциированных злокачественных новообразований.
Решение первой поставленной задачи обеспечивается получением смеси рекомбинантных белков E6-CBD (41,2 кДа) и E7-CBD (33,1 кДа), включающих последовательности онкобелков Е6 и Е7 ВПЧ 16 соответственно, глицин-серинового спейсера и целлюлозосвязывающего домена (CBD) из Caldicellulosiruptor danielii для обеспечения простой и эффективной одностадийной технологии выделения и очистки целевых белков.
Способ получения смеси рекомбинантных белков E6-CBD (SEQ ID NO 1) и E7-CBD (SEQ ID NO 2) включает следующие стадии:
1) выращивание клеток Е. coli, экспрессирующих ген, кодирующий рекомбинантный белок E6-CBD, с нуклеотидной последовательностью SEQ ID NO 3;
2) выращивание клеток Е. coli, экспрессирующих ген, кодирующий рекомбинантный белок E7-CBD, с нуклеотидной последовательностью SEQ ID NO 4;
3) связывание рекомбинантных белков E6-CBD и E7-CBD в составе клеточных экстрактов Е. coli с целлюлозосвязывающим сорбентом за счет аффинного взаимодействия при процедуре инкубации;
4) последующая отмывка от несвязавшихся бактериальных белков и выделение целевых рекомбинантных белков;
5) получение смеси очищенных рекомбинантных белков E6-CBD и E7-CBD. Рекомбинантные белки E6-CBD и E7-CBD включают в себя целлюлозосвязывающий домен из С.danielii, определяющий способность данных белков связываться с целлюлозосодержащим сорбентом, что позволяет проводить в одну стадию иммобилизацию и очистку белкового продукта. Поскольку в клетках Е. coli отсутствуют белки, специфически связывающиеся с целлюлозой, то синтезируемые рекомбинантные белки E6-CBD и E7-CBD являются единственными белками клеток штамма-продуцента, прочно связывающимися с целлюлозосодержащим сорбентом. Это обеспечивает возможность одностадийного получения высокоочищенных препаратов рекомбинантных белков E6-CBD и E7-CBD, иммобилизованных на целлюлозосодержащем сорбенте.
Решение второй поставленной задачи обеспечивается созданием иммуногенной композиции для лечения ВПЧ 16-ассоциированных злокачественных новообразований. Полученная иммуногенная композиция содержит смесь рекомбинантных белков E6-CBD и E7-CBD, охарактеризованных выше, с добавлением различных адъювантов, пригодных для инъекционного использования, для индукции цитотоксического Т-клеточного иммунного ответа на опухолевые антигены.
Таким образом, получена смесь иммунологически активных рекомбинантных белков E6-CBD и E7-CBD, которые в составе инъекционной иммуногенной композиции индуцируют гуморальный и клеточный иммунный ответ против ВПЧ 16, в следствие чего наблюдается эффективная элиминация из организма ВПЧ-инфицированных и малигнизированных клеток, обеспечивающая выраженную противоопухолевую активность заявленной иммуногенной композиции in vivo.
Осуществление изобретения
Первым этапом работы стал дизайн рекомбинантных белков E6-CBD и E7-CBD. Были спланированы нуклеотидные последовательности синтетических генов, кодирующих онкогенные белки Е6 и Е7 ВПЧ 16. Для эффективной экспрессии в Е. coli последовательности генов оптимизировали по кодонному составу (за счет вырожденных позиций нуклеотидных остатков, таким образом, чтобы в них по возможности присутствовали кодоны, наиболее часто встречающиеся в Е. coli) и вторичной структуре мРНК (с целью предупреждения образования шпилек и сложных элементов вторичной структуры, которые могут снижать эффективность трансляции). Синтез генов, кодирующих онкобелки Е6 и Е7 ВПЧ 16, проведен фирмой «Евроген» (Россия).
Последовательности полученных синтетических генов встраивали по сайтам NcoI и Kpn2I на 5'- и 3'-концах соответственно в плазмиды pR1504 на основе вектора pQE-6 (Qiagen, США) под промотором фага Т7. Полученными плазмидами трансформировали штамм Е. coli M15 методом электропорации. Правильность нуклеотидных последовательностей клонированных генов, кодирующих онкобелки Е6 и Е7 ВПЧ 16, подтверждали секвенированием.
Далее клонированные гены, кодирующие онкобелки Е6 и Е7, встраивали по сайтам рестрикции BamHI, BglI и BglII в экспрессионные векторы рТТ10 (на основе плазмиды pQE-6) и pL650 (на основе плазмиды pR1504) соответственно, содержащие нуклеотидные последовательности, кодирующие глицин-сериновый спейсер и целлюлозосвязывающий домен (CBD) из С.danielii. Полученными векторами трансформировали штаммы Е. coli BL21 [pRep4] и M15 [pRep4]. Индукция экспрессии обоих рекомбинантных белков с помощью ИПТГ приводила к накоплению соответствующих продуктов ожидаемой молекулярной массы, содержание рекомбинантных белков E6-CBD и E7-CBD составляло 15%.
Процедура выделения и очистки полученных рекомбинантных белков E6-CBD и Е7-CBD основана на способности специфически взаимодействовать с целлюлозосодержащим сорбентом Perloza МТ500 за счет целлюлозосвязывающего домена из С. danielii, что позволяет проводить в одну стадию процедуру иммобилизации на целлюлозосодержащем сорбенте и очистки целевых белков.
Разработанная методика выделения и очистки рекомбинантных белков E6-CBD и E7-CBD из индуцированных клеток штаммов-продуцентов включает следующие стадии: осаждение клеток из культуральной среды центрифугированием, лизис и разрушение клеток посредством обработки лизоцимом и ультразвуком, разделение методом центрифугирования белков легкорастворимой фракции и нерастворимых белков, очистка рекомбинантных белков с помощью аффинной хроматографии на целлюлозосодержащем сорбенте, стерилизующая фильтрация.
Целевые рекомбинантные белки E6-CBD и E7-CBD находились как во фракции легкорастворимых белков, так и во фракции нерастворимых белков. Для дальнейшей очистки рекомбинантных белков E6-CBD и E7-CBD использовали супернатант.Очищенные белки представляли собой гомогенные препараты, молекулярные массы полученных белков соответствовали ожидаемым - 41,2 кДа (E6-CBD) и 33,1 кДа (E7-CBD).
Выход белков после очистки по разработанной методике из 1 г биомассы клеток-продуцентов составил 4,5 мг для каждого белка, степень очистки (по данным электрофореза по Лэммли) - не менее 95%. Важный технический результат - получение целевых белков в растворимой форме, характеризующихся стабильностью при хранении при значениях рН, близких к нейтральным, и не содержащих примесей других бактериальных белков, ДНК штамма-продуцента, липополисахаридов и эндотоксинов.
Таким образом, по разработанной простой и эффективной технологии были получены слитые рекомбинантные белки E6-CBD и E7-CBD. Наличие антигенных свойств у обоих рекомбинантных белков подтверждено методом вестерн-блоттинга с использованием коммерческих антител к антигенам Е6 и Е7 ВПЧ 16 (пример №1, фигура 1).
Следующим этапом исследования стала разработка иммуногенной композиции для лечения ВПЧ 16-ассоциированных злокачественных новообразований.
На основе смеси рекомбинантных белков E6-CBD и E7-CBD была разработана иммуногенная композиция (пример №2, таблица 1), в состав которой в качестве основного активного компонента входит смесь полученных на первом этапе работы рекомбинантных белков E6-CBD и E7-CBD, а также пригодный для инъекционного использования адъювант - дополнительный иммуномодулирующий компонент для направленной индукции цитотоксического Т-клеточного иммунного ответа на опухолевые антигены. В качестве адъювантов использовали соединения, выбранные из группы: 3-О-дезацил-4'-монофосфорил липид А с гидроксидом алюминия; CpG ODN (CpG ODN 1585 и 1826) с гидроксидом алюминия; CpG-олигонуклеотиды, иммобилизованные на ДЭАЭ-декстране. Объем одной инъекционной дозы иммуногенной композиции по изобретению составляет 0,5 мл.
Иммуногенность разработанной композиции на основе смеси рекомбинантных белков E6-CBD и E7-CBD (таблица 1) была исследована in vivo на самках мышей линии BALB/c, которым вводили иммуногенную композицию по изобретению (пример №2, таблица 1) трехкратно с интервалом 5 суток. Показано, что специфический компонент иммуногенной композиции - смесь рекомбинантных белков E6-CBD и E7-CBD ВПЧ 16 -является высокоиммуногенным и вызывает повышение гуморального иммунного ответа на экспериментальной модели животных in vivo (пример №3, фигура 2).
Противоопухолевый эффект разработанной иммуногенной композиции на основе смеси рекомбинантных белков E6-CBD и E7-CBD изучали in vivo с использованием созданной в данной работе экспериментальной модели мышей линии BALB/c с ВПЧ-ассоциированными опухолями. После формирования аутографтов мышам вводили иммуногенную композицию (пример №2, таблица 1) трехкратно с интервалом 5 суток. Данные, полученные в ходе мониторинга экспериментальных животных, анализ кривых роста, терминального объема и веса аутографтов свидетельствуют о наличии выраженного противоопухолевого эффекта у иммуногенной композиции на основе смеси рекомбинантных белков E6-CBD и E7-CBD с тремя используемыми адъювантами (пример №4, фигура 3).
Таким образом, заявленное изобретение, а именно новая иммуногенная композиция на основе смеси рекомбинантных белков E6-CBD и E7-CBD, обладает научной новизной, не имеет полных аналогов и обладает конкурентным преимуществом для достижения технического результата - эффективной терапии ВПЧ 16-ассоциированных злокачественных новообразований вследствие специфической индукции гуморального и Т-клеточного иммунного ответа против ВПЧ 16 и выраженной противоопухолевой активности иммуногенной композиции.
Реализацию изобретения рассмотрим на характерных примерах, которые приведены исключительно с целью иллюстрации и не предназначены для ограничения каким-либо способом рамок данного изобретения.
Пример 1. Проверка антигенности рекомбинантных белков E6-CBD и E7-CBD методом вестерн-блоттинга
Для проверки сохранности иммунореактивных эпитопов у полученных рекомбинантных белков E6-CBD и E7-CBD после процедур выделения и очистки был проведен вестерн-блоттинг с использованием ВПЧ 16-положительных клеточных линий карциномы шейки матки SiHa (АТСС НТВ-35™) и CaSki (АТСС CRL-1550™). Клетки культивировали в среде DMEM с L-глутамином, содержавшей 10% фетальной бычьей сыворотки, антибиотики пенициллин (50 ед./мл) и стрептомицин (50 мкг/мл). Культивирование осуществляли в СО2-инкубаторе при 37°С и 5% СО2.
Для приготовления клеточных лизатов использовали RIPA-буфер (50 мМ Tris-HCl, рН 8.0, 150 мМ NaCl, 1% Nonidet Р-40, 0.5% дезоксихолата натрия, 0.1% SDS, 1 мМ ортованадат натрия, 1 мМ NaF) с ингибитором протеаз cOmplete™, EDTA-free Protease Inhibitor Cocktail ("Roche", Германия). Концентрацию белков измеряли с использованием ВСА-метода Pierce™ ВСА Protein Assay Kit, ("Thermo Scientific", США). Для разделения белков в 7% ПААГ в присутствии SDS использовали 40 мкг белка клеточных линий SiHa и CaSki и 0.5 мкг рекомбинантных белков E6-CBD и E7-CBD. Белки смешивали с буфером для нанесения проб по Лэммли (4% SDS, 10% Р-меркаптоэтанола, 20% глицерина, 0.004% бромфенолового синего, 0.125 М Tris-HCl, рН 6.8) и инкубировали 5 мин при 95°С. Перенос белков на нитроцеллюлозную мембрану Hybond-ECL 0.45 мкм ("GE Healthcare/Life Sciences", США) осуществляли методом полусухого переноса с использованием катодного (6 мМ Tris, 4 мМ N-циклогексил-3-аминопропансульфокислота (CAPS), 40% этиловый спирт) и анодного буферов (6 мМ Tris, 4 мМ CAPS, 10% SDS). Перенос проводили с использованием прибора Trans-Blot Turbo Transfer System ("Bio-Rad", США) в течение 20 мин при постоянном напряжении 25 В и переменном токе до 1 А. Мембрану блокировали в 5% обезжиренном молоке на TBST-буфере (20 мМ Tris, рН 7.5, 150 мМ NaCl, 0.1% Tween-20) в течение 1 ч при комнатной температуре. Инкубацию с первичными антителами мыши проводили при 4°С в течение ночи: в титре 1:200 к белку Е6 ВПЧ 16 (sc-460, "Santa Cruz Biotechnology", США), в титре 1:500 к белку Е7 ВПЧ 16 (sc-65711, "Santa Cruz Biotechnology", США). Инкубацию со вторичными антителами козы к иммуноглобулинам мыши, конъюгированными с пероксидазой хрена, в титре 1:5000 ("Bio-Rad", США) проводили в течение 1 ч при комнатной температуре. Проявляли с использованием субстрата Clarity™ Western ECL Substrate ("Bio-Rad", США) в соответствии с инструкцией производителя.
Результаты вестерн-блоттинга (фигура 1) показали, что коммерческие антитела к белкам Е6 и Е7 ВПЧ 16 эффективно распознают рекомбинантные белки E6-CBD и E7-CBD, полученные и очищенные предлагаемым в данной заявке способом: выявлены белковые полосы размером ~41 и ~33 кДа, что соответствует теоретическим молекулярным массам рекомбинантных белков E6-CBD и E7-CBD.
Таким образом, методом вестерн-блоттинга было подтверждено наличие антигенных свойств у обоих рекомбинантных белков E6-CBD и E7-CBD.
Пример 2. Получение иммуногенной композиции на основе смеси рекомбинантных белков E6-CBD и E7-CBD
На основе смеси рекомбинантных белков E6-CBD и E7-CBD разработана иммуногенная композиция с добавлением различных адъювантов. Состав иммуногенной композиции представлен в таблице 1.


Эффективность применения иммуногенной композиции на основе смеси рекомбинантных белков E6-CBD и E7-CBD для лечения злокачественных новообразований, ассоциированных с вирусом папилломы человека 16 типа, иллюстрируется следующими примерами.
Пример 3. Оценка гуморального иммунного ответа
В работе использовали самок мышей сингенной инбредной линии BALB/c в возрасте 7-8 недель весом 18-20 г (ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России). Мышам трех опытных групп (n=10; обозначение групп ИК1, ИК2 и ИК3) вводили иммуногенную композицию, содержащую смесь рекомбинантных белков E6-CBD (42 мкг) и E7-CBD (35 мкг) с добавлением различных адъювантов (пример №2, таблица 1), трехкратно с интервалом в 5 суток. Инъекции иммуногенной композиции объемом 150 мкл проводили одноразовым стерильным инсулиновым шприцом подкожно в холку животного. Животным контрольной группы (n=10) по описанной схеме вводили физиологический раствор. Для потенциальной активации гуморального иммунного ответа мышей содержали в течение 14 и 42 суток после последней инъекции иммуногенной композиции. В течение всего эксперимента проводили постоянный мониторинг физиологического состояния экспериментальных животных.
По истечении 14 и 42 суток с момента последней инъекции лабораторных животных опытных и контрольной групп вводили в ингаляционный наркоз и проводили сбор образцов крови из сердечной полости для определения титра антител в сыворотке крови. После сбора всех индивидуальных образцов крови в вакуумные пробирки их оставляли при комнатной температуре на 20 мин, затем центрифугировали в течение 30 мин при 1500 g без охлаждения. Надосадочную жидкость переносили в 1.5-мл стерильные пробирки и замораживали при -80°С.
Для определения титра антител к специфическим компонентам иммуногенной композиции (смеси рекомбинантных белков E6-CBD и E7-CBD) в сыворотке мышей использовали метод непрямого иммуноферментного анализа (ИФА). Для этого белки Е6-CBD и E7-CBD, разведенные в 0.05 М карбонатно-бикарбонатного буфера до концентрации 1 мкг/мл, сорбировали в 96-луночном планшете (Costar® Assay Plate, Corning Incorporated, США) в количестве 100 нг белка на лунку в течение 2 ч при комнатной температуре. Далее проводили блокировку с использованием Blocker™ Casein in PBS ("Thermo Scientific", США) в течение 1 ч при 37°С. Затем добавляли 100 мкл сыворотки, разведенной в соотношении 1: 100 - 1: 1024000 в промывочном буфере PBST (фосфатно-солевой буфер ("ПанЭко", Россия) с 0.05% Tween-20, инкубировали 1 ч при 37°С. Для обнаружения антител, связавшихся с сорбированными антигенами, добавляли вторичные антитела к иммуноглобулинам мыши, конъюгированными с пероксидазой хрена (ИМТЕК, Россия), разведенные в PBST в соотношении 1: 10000, инкубировали 1 ч при 37°С. Далее добавляли 100 мкл ТМБ-субстрата для пероксидазы хрена (ИМТЕК, Россия), инкубировали при комнатной температуре 5-7 мин, затем останавливали реакцию добавлением 50 мкл 2 М серной кислоты. С помощью микропланшетного ридера Spectramax М5е (Molecular Devices, США) измеряли поглощение при длине волны 450 нм. Количественно титр определяли как предельное разведение сыворотки, при котором еще наблюдается регистрируемый данным методом положительный эффект взаимодействия антисыворотки с антигеном.
Результаты исследования иммуногенности иммуногенной композиции на основе смеси рекомбинантных белков E6-CBD и E7-CBD с добавлением различных адъювантов (ИК1-ИК3) представлены на фигуре 2. Во всех опытных группах титр специфичных к Е6-CBD и E7-CBD антител достигал значений ~ 1: 128000 и сохранялся на высоком уровне в течение 14 и 42 суток после последней инъекции иммуногенной композиции по изобретению. При этом различия в полученном результате в случае использования различных адъювантов (ИК1-ИК3) отсутствовали.
Таким образом, исследование гуморального иммунного ответа на трехкратное введение иммуногенной композиции показало, что специфические компоненты композиции - рекомбинантные белки E6-CBD и E7-CBD ВПЧ 16 - являются высокоиммуногенными и вызывают повышение гуморального иммунного ответа на экспериментальной модели животных in vivo.
Пример 4. Противоопухолевый эффект иммуногенной композиции на основе смеси рекомбинантных белков E6-CBD и E7-CBD
Противоопухолевый эффект иммуногенной композиции на основе смеси рекомбинантных белков E6-CBD и E7-CBD с добавлением различных адъювантов изучали in vivo с использованием созданной в данной работе экспериментальной модели мышей линии BALB/c с ВПЧ-ассоциированными опухолями, развитие которых было индуцировано подкожным введением модифицированных клеток рака молочной железы мыши 4Т1 (АТСС CRL-2539™) со стабильной экспрессией полноразмерных онкобелков Е6 и Е7 ВПЧ 16 (далее - клетки 4Т1 Е6/Е7), которую получали путем трансфекции вектором, содержащим полноразмерные рамки считывания онкогенов Е6 и Е7 ВПЧ 16, под контролем промотора цитомегаловируса (pCMV-Neo-Bam).
Мышам линии BALB/c (n=40) в правый бок подкожно одноразовыми инсулиновыми шприцами вводили суспензию 0.25 × 106 туморогенных клеток 4Т1 Е6/Е7 в физиологическом растворе объемом 100 мкл. Начиная с третьих суток после инъекции пальпацией ежедневно проверяли наличие сформированного опухолевого узелка. Измерения линейных параметров аутографтов ("длины" и "ширины") проводили с помощью электронного штангенциркуля через равные временные промежутки.
После формирования опухолевых узелков (на 5-й день после введения клеток 4Т1 Е6/Е7) мышам трех опытных групп (n=10, обозначение групп ИК1, ИК2 и ИК3) была сделана первая инъекция иммуногенной композиции и далее - еще две инъекции иммуногенной композиции с интервалом в 5 суток (трехэтапная иммунизация). Состав иммуногенной композиции на основе смеси рекомбинантных белков E6-CBD и E7-CBD с добавлением различных адъювантов (ИК1-ИК3) представлен в таблице 1. Инъекции проводили одноразовым стерильным инсулиновым шприцом подкожно в холку животного, объем раствора для введения составлял 150 мкл. Животным контрольной группы (n=10) по описанной схеме вводили физиологический раствор.
Для оценки противоопухолевого эффекта иммуногенной композиции проводили визуальный осмотр аутографтов, анализировали кривые роста, терминальный объем и вес аутографтов. Визуальный осмотр аутографтов осуществляли при каждом измерении их параметров на предмет наличия очагов некроза.
Анализ кривых роста аутографтов. По полученным в ходе эксперимента измерениям линейных параметров ("ширина" и "длина") рассчитывали объем каждого аутографта по следующей формуле:
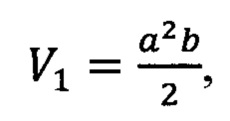
где а - "ширина", и - "длина", а≤<b. Далее строили график зависимости объема аутографтов от количества дней после инъекции клеток 4Т1 Е6/Е7 с учетом стандартных отклонений.
Анализ терминального объема и веса аутографтов. По окончании исследования мышей терминировали парами эфира. После извлечения аутографтов измеряли их третий линейный параметр - "высоту" (с). Для расчета терминального объема аутографтов использовали аппроксимированную формулу объема эллипсоида, поскольку данная пространственная фигура наиболее близка к форме подкожных аутографтов:
где а,b,с- полуоси эллипсоида. 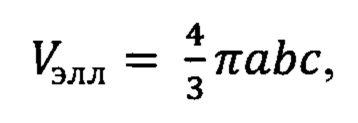
Аппроксимация: 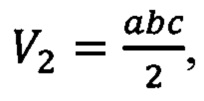 где а,b,с - "ширина", "длина" и "высота" соответственно.
где а,b,с - "ширина", "длина" и "высота" соответственно.
Аутографты взвешивали на электронных весах и строили гистограмму среднего веса терминальных аутографтов с учетом стандартных отклонений.
Противоопухолевый эффект иммуногенной композиции считали потенциально положительным при отсутствии пересечения пределов погрешностей кривых/столбцов, соответствующих опытным и контрольной группам. Статистическую оценку полученных данных проводили с помощью одностороннего дисперсионного анализа (one-way ANOVA) с апостериорным анализом по Тьюки.
На 21-24-й день после инъекции туморогенных клеток 4Т1 Е6/Е7 мыши контрольной группы стали иметь нездоровый внешний вид, начали проявляться признаки истощения и потери массы тела, снижение активности, потускнение и пожелтение волосяного покрова, незначительное увеличение регионарных (относительно произведенной инъекции клеток) лимфоузлов. На 27-й день после инъекции клеток 4Т1 Е6/Е7 в контрольной группе мышей были зафиксированы случаи летального исхода, наиболее вероятной причиной которых послужило активное разрастание аутографтов с инвазией в брюшную полость и последующим поражением внутренних органов.
На 18-й день после инъекции клеток была детектирована статистически значимая разница между аутографтами контрольной и опытных групп. На основании дальнейших произведенных измерений линейных параметров аутографтов были построены графики зависимости объема аутографтов от количества дней после инъекции клеток 4Т1 Е6/Е7 (фигура 3а). На 30-й день после инъекции клеток 4Т1 Е6/Е7 объем аутографтов мышей опытных групп ИК1-ИК3 был в среднем в 7 раз меньше, чем объем аутографтов контрольной группы.
По окончании исследований (на 30-й день после инъекции клеток 4Т1 Е6/Е7) сформированные аутографты извлекали и измеряли третий линейный параметр, с использованием которого рассчитывали их терминальный объем по аппроксимированной формуле объема эллипсоида (фигура 3б). Терминальный объем аутографтов мышей опытных групп ИК1-ИК3 был в среднем в 12 раз меньше, чем у животных контрольной группы.
Для комплексной оценки противоопухолевого эффекта иммуногенной композиции также следует учитывать внешний вид аутографтов как в процессе мониторинга in vivo, так и после их извлечения по окончании эксперимента. К 18-му дню после инъекции клеток 4Т1 Е6/Е7 по результатам визуального осмотра было детектировано наличие очагов некроза в зоне формирования аутографтов у животных опытных групп в 30-40% случаев, в то время как у аутографтов контрольной группы очаги некроза полностью отсутствовали. На момент завершения эксперимента у аутографтов опытных групп явно детектировался центральный некроз в 60-90% случаев. У аутографтов контрольной группы очаги некроза появились только к 27-му дню после инъекции клеток 4Т1 Е6/Е7, число случаев появления которых возросло до 40% к моменту терминирования (фигура 3в).
По результатам взвешивания терминальных аутографтов было установлено, что аутографты опытных групп ИК1-ИК3 были в среднем в 10 раз легче аутографтов контрольной группы (фигура 3 г).
Таким образом, полученные в ходе мониторинга экспериментальных животных данные и проведенный анализ кривых роста, терминального объема и веса аутографтов свидетельствуют о наличии противоопухолевого эффекта иммуногенной композиции на основе смеси рекомбинантных белков E6-CBD и E7-CBD с добавлением различных адъювантов. Различия в полученном эффекте в случае использования в составе иммуногенной композиции различных адъювантов (ИК1-ИК3) отсутствовали.
Оценивая эффективность применения заявленной иммуногенной композиции для лечения ВПЧ-ассоциированных злокачественных новообразований, можно сделать вывод о том, что иммуногенная композиция на основе смеси рекомбинантных белков E6-CBD и E7-CBD индуцирует гуморальный и клеточный иммунный ответ против ВПЧ 16, как следствие, наблюдается эффективная элиминация из организма ВПЧ-инфицированных и малигнизированных клеток, что обеспечивает выраженную противоопухолевую активность иммуногенной композиции на основе смеси рекомбинантных белков E6-CBD и E7-CBD in vivo.
Приведенные примеры осуществления изобретения не являются исчерпывающими. Возможные иные примеры осуществления, соответствующие объему патентных притязаний.
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing dtdVersion="V1_3" fileName="Иммуногенная
композиция на основе рекомбинантных белков E6-CBD И E7-CBD для
лечения злокачественных новообразований, ассоциированных с вирусом
папилломы человека 16 типа .xml" softwareName="WIPO Sequence"
softwareVersion="2.2.0" productionDate="2023-02-28">
<ApplicantFileReference>1</ApplicantFileReference>
<ApplicantName languageCode="ru">Федеральное государственное
бюджетное учреждение "Центр стратегического планировния и
управления медико-биологическими рисками здоровью" Федерального
медико-биологического агентства</ApplicantName>
<ApplicantNameLatin>Federal State Budgetary Institution "Center
for Strategic Planning and Management of Biomedical Health
Risks" of the Federal Medical Biological
Agency</ApplicantNameLatin>
<InventionTitle languageCode="ru">Иммуногенная композиция на основе
рекомбинантных белков E6-CBD И E7-CBD для лечения злокачественных
новообразований, ассоциированных с вирусом папилломы человека 16
типа</InventionTitle>
<SequenceTotalQuantity>4</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>360</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..360</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>MGHQKRTAMFQDPQERPRKLPQLCTELQTTIHDIILECVYCKQQLLRRE
VYDFAFRDLCIVYRDGNPYAVCDKCLKFYSKISEYRHYCYSVYGTTLEQQYNKPLCDLLIRCINCQKPLC
PEEKQRHLDKKQRFHNIRGRWTGRCMSCCRSSRTRRETQLGSPGSGSGSGSGSGARSSAPLGEKVLPSTF
EDGTRQGWDWDGPSGVKGPITIESVNGSKVLSFEVEYPEKKPQDGWATAARLILKEISTKREDNKYLAFD
FYIKPERASKGMIQIFLAFSPPSLGYWAQVQDSFNIDLSKLSSAKKIEEGLYKFSVFFDLDKIQDGKVLR
PDTILRDIIIVIADGNSDFKGRMFIDNVRST</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>300</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..300</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q4">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>MGHGDTPTLHEYMLDLQPETTDLYCYEQLNDSSEEEDEIDGPAGQAEPD
RAHYNIVTFCCKCDSTLRLCVQSTHVDIRTLEDLLMGTLGIVCPICSQKPGSPGSGSGSGSGSGARSSAP
LGEKVLPSTFEDGTRQGWDWDGPSGVKGPITIESVNGSKVLSFEVEYPEKKPQDGWATAARLILKEISTK
REDNKYLAFDFYIKPERASKGMIQIFLAFSPPSLGYWAQVQDSFNIDLSKLSSAKKIEEGLYKFSVFFDL
DKIQDGKVLRPDTILRDIIIVIADGNSDFKGRMFIDNVRST</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="3">
<INSDSeq>
<INSDSeq_length>1083</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..1083</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q10">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atgggtcaccaaaagagaactgcaatgtttcaggacccacaggagcgac
ccagaaagttaccacagttatgcacagagctgcaaacaactatacatgatataatattagaatgtgtgta
ctgcaagcaacagttactgcgacgtgaggtatatgactttgcttttcgggatttatgcatagtatataga
gatgggaatccatatgctgtatgtgataaatgtttaaagttttattctaaaattagtgagtatagacatt
attgttatagtgtgtatggaacaacattagaacagcaatacaacaaaccgttgtgtgatttgttaattag
gtgtattaactgtcaaaagccactgtgtcctgaagaaaagcaaagacatctggacaaaaagcaaagattc
cataatataaggggtcggtggaccggtcgatgtatgtcttgttgcagatcatcaagaacacgtagagaaa
cccagctgggatccccgggttctggctccggctctggttccggttctggcgccagatccagcgcgccgct
gggcgaaaaagtgctgccgagcacctttgaagatggcacccgccagggctgggattgggatggcccgagc
ggcgtgaaaggcccgattaccattgaaagcgtgaacggcagcaaagtgctgagctttgaagtggaatacc
cggaaaaaaaaccgcaggatggctgggcgaccgcggcgcgcctgattctgaaagaaattagcaccaaacg
cgaagataacaaatacctggcgtttgatttttacattaaaccggaacgcgcgagcaaaggcatgattcag
atttttctggcgtttagcccgccgagcctgggctactgggcgcaggtgcaggatagctttaacattgatc
tgagcaaactgagcagcgcgaaaaaaattgaagaaggcctgtacaaatttagcgtgttttttgatctgga
taaaattcaggatggcaaagtgctgcgcccggataccattctgcgcgatattattattgtgattgcggat
ggcaacagcgattttaaaggccgcatgtttattgataacgtgagatctacctaa</INSDSeq_sequen
ce>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="4">
<INSDSeq>
<INSDSeq_length>903</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..903</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q8">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atgggtcatggagatacacctacattgcatgaatatatgttagatttgc
aaccagagacaactgatctctactgttatgagcaattaaatgacagctcagaggaggaggatgaaataga
tggtccagctggacaagcagaaccggacagagcccattacaatattgtaaccttttgttgcaagtgtgac
tctacgcttcggttgtgcgtacaaagcacacacgtagacattcgtactttggaagacctgttaatgggca
cactaggaattgtgtgccccatctgttctcagaaaccaggatccccgggttctggctccggctctggttc
cggttctggcgccagatccagcgcgccgctgggcgaaaaagtgctgccgagcacctttgaagatggcacc
cgccagggctgggattgggatggcccgagcggcgtgaaaggcccgattaccattgaaagcgtgaacggca
gcaaagtgctgagctttgaagtggaatacccggaaaaaaaaccgcaggatggctgggcgaccgcggcgcg
cctgattctgaaagaaattagcaccaaacgcgaagataacaaatacctggcgtttgatttttacattaaa
ccggaacgcgcgagcaaaggcatgattcagatttttctggcgtttagcccgccgagcctgggctactggg
cgcaggtgcaggatagctttaacattgatctgagcaaactgagcagcgcgaaaaaaattgaagaaggcct
gtacaaatttagcgtgttttttgatctggataaaattcaggatggcaaagtgctgcgcccggataccatt
ctgcgcgatattattattgtgattgcggatggcaacagcgattttaaaggccgcatgtttattgataacg
tgagatctacctaa</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
Изобретение относится к генной инженерии, биотехнологиям, иммунологии и медицине, в частности к онкогинекологии. Описана смесь рекомбинантных белков E6-CBD и E7-CBD, включающих антигены Е6 и Е7, а также целлюлозосвязывающий домен (CBD) из Caldicellulosiruptor danielii для обеспечения одностадийной технологии выделения и очистки. Разработан простой и эффективный способ получения рекомбинантных белков E6-CBD и E7-CBD, включающий связывание с целлюлозосодержащим сорбентом за счет аффинного взаимодействия, последующую отмывку от несвязавшихся бактериальных белков и выделение целевых продуктов. На основе смеси рекомбинантных белков E6-CBD и E7-CBD с добавлением различных адъювантов получена иммуногенная композиция, индуцирующая формирование гуморального и клеточного иммунного ответа против ВПЧ 16 и обеспечивающая выраженный противоопухолевый эффект in vivo. Раскрыто применение иммуногенной композиции для лечения злокачественных новообразований, ассоциированных с вирусом папилломы человека 16 типа (ВПЧ 16). Изобретение расширяет арсенал средств для лечения злокачественных новообразований, ассоциированных с вирусом папилломы человека 16 типа. 4 н.п. ф-лы, 3 ил., 1 табл., 4 пр.
1. Смесь рекомбинантных белков E6-CBD с аминокислотной последовательностью SEQ ID NO 1 и молекулярной массой 41,2 кДа и E7-CBD с аминокислотной последовательностью SEQ ID NO 2 и молекулярной массой 33,1 кДа, обладающих иммуногенностью в отношении вируса папилломы человека 16 типа.
2. Способ получения смеси рекомбинантных белков E6-CBD и E7-CBD по п. 1, включающий следующие этапы:
- получение рекомбинантных белков E6-CBD и E7-CBD в составе клеточных экстрактов Е. coli, трансформированных экспрессионными плазмидами, которые содержат химерные гены SEQ ID NO 3 и SEQ ID NO 4, кодирующие рекомбинантные белки E6-CBD и E7-CBD соответственно;
- связывание рекомбинантных белков E6-CBD и E7-CBD с целлюлозосодержащим сорбентом за счет аффинного взаимодействия при процедуре инкубации;
- отмывка от несвязавшихся бактериальных белков и выделение целевых рекомбинантных белков E6-CBD и E7-CBD;
- получение смеси очищенных рекомбинантных белков E6-CBD и E7-CBD.
3. Иммуногенная композиция для лечения злокачественных новообразований, ассоциированных с вирусом папилломы человека 16 типа, включающая смесь рекомбинантных белков E6-CBD и E7-CBD, представленных в п. 1, с добавлением различных адъювантов, выбранных из группы: 3-O-дезацил-4'-монофосфорил липид А с гидроксидом алюминия; CpG ODN с гидроксидом алюминия; CpG-олигонуклеотиды, иммобилизованные на ДЭАЭ-декстране.
4. Применение иммуногенной композиции по п. 3 для лечения злокачественных новообразований, ассоциированных с вирусом папилломы человека 16 типа.
| МУКОЗАЛЬНАЯ ВАКЦИНА ДЛЯ ИММУНОТЕРАПИИ ЗАБОЛЕВАНИЙ, ОБУСЛОВЛЕННЫХ ВИРУСАМИ ПАПИЛЛОМЫ ЧЕЛОВЕКА, И СПОСОБ ЛЕЧЕНИЯ С ЕЕ ИСПОЛЬЗОВАНИЕМ (ВАРИАНТЫ) | 2008 |
|
RU2377305C1 |
| WO 2011068934 A2, 09.06.2011 | |||
| Arbyn М., Xu L., Simoens С, Martin-Hirsch P.P.L | |||
| Prophylactic vaccination against human papillomaviruses to prevent cervical cancer and its precursors // Cochrane Database Syst | |||
| Rev | |||
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| V | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| P | |||
| Транспортер для бетона или т.п. строительных материалов | 1927 |
|
SU9069A1 |
Авторы
Даты
2023-10-17—Публикация
2023-03-03—Подача