Область техники, к которой относится изобретение
[0001]
Настоящее изобретение относится к антителам против человеческого Toll-подобного рецептора (TLR) 7 для лечения расстройств и заболеваний.
Предпосылки создания изобретения
[0002]
Известно, что у человека присутствуют 10 типов TLR, которые представляют собой паттерн-распознающие молекулы и которые образуют одно семейство. Из них TLR7 (вариант 1) представляет собой отдельный трансмембранный белок, состоящий из 1049 аминокислот, и были предположения о его возможной важной роли в патогенезе различных воспалительных заболеваний и аутоиммунных заболеваний на основании детекции одноцепочечных РНК и роли в биологической защитной реакции путем продукции типа I интерферонов и цитокинов и т.п. (Непатентная литература 1). Кроме того, также известно, что TLR7 (вариант 2), который представляет собой отдельный трансмембранный белок, состоящий из 1049 аминокислот, обладает такой же функцией, что и TLR7 (вариант 1), указанный выше (Непатентная литература 2). В частности, есть много сообщений, в которых предполагается, что TLR7 вовлечен в заболевания, такие как псориаз и системная красная волчанка, и предполагается, что такие заболевания можно лечить путем ингибирования функций TLR7 (Непатентная литература 3).
[0003]
Хотя дефицит TLR7 уменьшает симптомы в моделях заболевания, лекарственные средства, способные, в частности, ингибировать TLR7, считаются перспективными для лечения воспалительных заболеваний или т.п., на основании сообщений, предполагающих, что дефицит TLR9 вовлечен в прогрессирование заболевания (Непатентная литература 4).
[0004]
До настоящего времени предпринимались попытки, связанные с исследованиями и разработкой нуклеиновых кислот, низкомолекулярных соединений и т.п. для ингибирования человеческого TLR7, но ингибировать человеческий TLR7 трудно, в частности, с использованием нуклеиновых кислот или низкомолекулярных соединений. Кроме того, мышиное антитело против TLR7 мыши известно как антитело к TLR7 (Патентная литература 1), но необходимы исследования и разработки новых человеческий TLR7-специфических ингибиторов.
Перечень цитируемых документов
Патентная литература
[0005]
Патентная литература 1: Международная публикация WO 2014/174704
Непатентная литература
[0006]
Непатентная литература 1: Takeuchi O, Akira S. Cell. 2010 Mar 19; 140 (6): 805-2
Непатентная литература 2: Chuang TH, Ulevitch RJ, Eur Cytokine Netw. 2000 Sep; 11 (3): 372-8
Непатентная литература 3: Lyn-Cook BD, Xie C, Oates J, Treadwell E, Word B, Hammons G, Wiley K. Mol Immunol. 2014 Sep; 61 (1): 38-43.
Непатентная литература 4: Christensen SR, Shupe J, Nickerson K, Kashgarian M, Flavell RA, Shlomchik MJ Immunity. 2006 Sep; 25 (3): 417-28.
Сущность изобретения
Техническая задача
[0007]
Целью настоящего изобретения является обеспечение средства для лечения и/или профилактики связанных с иммунным воспалением заболеваний, аллергических заболеваний, инфекций и рака.
Решение задачи
[0008]
Для решения указанных выше задач авторами настоящего изобретения были предприняты поиски вещества, обладающего эффектом лечения и/или профилактики связанных с иммунным воспалением заболеваний, аллергических заболеваний, инфекций и рака, и было обнаружено мышиное антитело к человеческому TLR7. Настоящее изобретение было создано путем гуманизации полученного мышиного антитела к человеческому TLR7 и дальнейшей модификации CDR, каркасных областей и вариабельных областей гуманизированного антитела.
[0009]
Таким образом, настоящее изобретение включает следующие аспекты.
(1) Антитело или антигенсвязывающий фрагмент антитела, которое обладает следующими свойствами:
(a) специфически связывается с TLR7 человека или TLR7 обезьяны и не связывается я с TLR7 мыши или TLR7 крысы; и
(b) ингибирует функцию TLR7 человека или TLR7 обезьяны.
(2) Антитело или антигенсвязывающий фрагмент антитела в соответствии с пунктом (1), представленным выше, где TLR7 человека представляет собой молекулу, состоящую из аминокислотной последовательности SEQ ID NO:2 или SEQ ID NO:4, TLR7 обезьяны представляет собой молекулу, состоящую из аминокислотной последовательности SEQ ID NO:85, TLR7 мыши представляет собой молекулу, состоящую из аминокислотной последовательности SEQ ID NO:83, или TLR7 крысы представляет собой молекулу, состоящую из аминокислотной последовательности SEQ ID NO:84.
(3) Антитело или антигенсвязывающий фрагмент антитела в соответствии с пунктом (1) или (2), представленным выше, которое обладает конкурентной ингибирующей активностью в отношении связывания с человеческим TLR7 с:
антителом, содержащим тяжелую цепь с вариабельной областью тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO:5, и легкую цепь с вариабельной областью легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO:11;
антителом, содержащим тяжелую цепь с вариабельной областью тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO:7, и легкую цепь с вариабельной областью легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO:13; или
антителом, содержащим тяжелую цепь с вариабельной областью тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO:9, и легкую цепь с вариабельной областью легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO:15.
(4) Антитело или антигенсвязывающий фрагмент антитела в соответствии с любым из пунктов (1)-(3), представленным выше, которое включает:
(a) CDRH1, состоящую из аминокислотной последовательности SEQ ID NO:17, CDRH2, состоящую из аминокислотной последовательности SEQ ID NO:18, и CDRH3, состоящую из аминокислотной последовательности SEQ ID NO:19, в качестве определяющих комплементарность областей в тяжелой цепи, и CDRL1, состоящую из аминокислотной последовательности SEQ ID NO:20, CDRL2, состоящую из аминокислотной последовательности SEQ ID NO:21, и CDRL3, состоящую из аминокислотной последовательности SEQ ID NO:22, в качестве определяющих комплементарность областей в легкой цепи;
(b) CDRH1, состоящую из аминокислотной последовательности SEQ ID NO:23, CDRH2, состоящую из аминокислотной последовательности SEQ ID NO:24, и CDRH3, состоящую из аминокислотной последовательности SEQ ID NO:25, в качестве определяющих комплементарность областей в тяжелой цепи, и CDRL1, состоящую из аминокислотной последовательности SEQ ID NO:26, CDRL2, состоящую из аминокислотной последовательности SEQ ID NO:27, и CDRL3, состоящую из аминокислотной последовательности SEQ ID NO:28, в качестве определяющих комплементарность областей в легкой цепи; или
(c) CDRH1, состоящую из аминокислотной последовательности SEQ ID NO:29, CDRH2, состоящую из аминокислотной последовательности SEQ ID NO:30, и CDRH3, состоящую из аминокислотной последовательности SEQ ID NO:31, в качестве определяющих комплементарность областей в тяжелой цепи, и CDRL1, состоящую из аминокислотной последовательности SEQ ID NO:32, CDRL2, состоящую из аминокислотной последовательности SEQ ID NO:33, и CDRL3, состоящую из аминокислотной последовательности SEQ ID NO:34, в качестве определяющих комплементарность областей в легкой цепи.
(5) Антитело или антигенсвязывающий фрагмент антитела в соответствии с пунктом (4), представленным выше, которое включает:
CDRH1, состоящую из аминокислотной последовательности SEQ ID NO:17, CDRH2, состоящую из аминокислотной последовательности SEQ ID NO:18, и CDRH3, состоящую из аминокислотной последовательности SEQ ID NO:19, в качестве определяющих комплементарность областей в тяжелой цепи, и
CDRL1, состоящую из аминокислотной последовательности SEQ ID NO:20, CDRL2, состоящую из аминокислотной последовательности SEQ ID NO:21, и CDRL3, состоящую из аминокислотной последовательности SEQ ID NO:22, в качестве определяющих комплементарность областей в легкой цепи.
(6) Антитело или антигенсвязывающий фрагмент антитела в соответствии с любым из пунктов (1)-(5), представленным выше, которое включает:
(a) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:5, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:11;
(b) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:7, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:13; или
(c) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:9, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:15.
(7) Антитело или антигенсвязывающий фрагмент антитела в соответствии с любым из пунктов (1)-(6), представленным выше, где константная область представляет собой происходящую от человека константную область.
(8) Антитело или антигенсвязывающий фрагмент антитела в соответствии с пунктом (7), представленным выше, которое включает:
(a) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-465 в аминокислотной последовательности SEQ ID NO:35, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:36;
(b) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-471 в аминокислотной последовательности SEQ ID NO:37, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:38, или
(c) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-470 в аминокислотной последовательности SEQ ID NO:39, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-234 в аминокислотной последовательности SEQ ID NO:40.
(9) Антитело или антигенсвязывающий фрагмент антитела в соответствии с любым из пунктов (1)-(8), представленным выше, которое является гуманизированным.
(10) Антитело или антигенсвязывающий фрагмент антитела в соответствии с пунктом (9), представленным выше, которое включает:
(I) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, выбранной из группы, состоящей из:
(a) аминокислотной последовательности SEQ ID NO:41;
(b) аминокислотной последовательности SEQ ID NO:42;
(c) аминокислотной последовательности, имеющей гомологию по меньшей мере 95% или больше с последовательностью (a) или (b); и
(d) аминокислотной последовательности, полученной из последовательности (a) или (b) путем делеции, замены или добавления 1-10 аминокислот; и
вариабельную область легкой цепи, состоящую из аминокислотной последовательности, выбранной из группы, состоящей из:
(e) аминокислотной последовательности SEQ ID NO:43;
(f) аминокислотной последовательности SEQ ID NO:44;
(g) аминокислотной последовательности, имеющей гомологию по меньшей мере 95% или больше с последовательностью (e) или (f); и
(h) аминокислотной последовательности, полученной из последовательности (e) или (f) путем делеции, замены или добавления 1-10 аминокислот; или
(II) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, выбранной из группы, состоящей из:
(a) аминокислотной последовательности SEQ ID NO:50;
(b) аминокислотной последовательности, имеющей гомологию по меньшей мере 95% или больше с последовательностью (a); и
(c) аминокислотной последовательности, полученной из последовательности (a) путем делеции, замены или добавления 1-10 аминокислот; и
вариабельную область легкой цепи, состоящую из аминокислотной последовательности, выбранной из группы, состоящей из:
(d) аминокислотной последовательности SEQ ID NO:51;
(e) аминокислотной последовательности, имеющей гомологию по меньшей мере 95% или больше с последовательностью (d); и
(f) аминокислотной последовательности, полученной из последовательности (d) путем делеции, замены или добавления 1-10 аминокислот.
(11) Антитело или антигенсвязывающий фрагмент антитела в соответствии с пунктом (10), представленным выше, которое включает:
(a) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:41, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:43;
(b) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:41, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:44;
(c) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:42, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:43;
(d) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:42, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:44; или
(e) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:50, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:51.
(12) Антитело или антигенсвязывающий фрагмент антитела в соответствии с пунктом (11), представленным выше, которое включает вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:42, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:44.
(13) Антитело или антигенсвязывающий фрагмент антитела в соответствии с пунктом (11), представленным выше, которое включает:
(a) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-465 в аминокислотной последовательности SEQ ID NO:45, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:48;
(b) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-465 в аминокислотной последовательности SEQ ID NO:45, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:49;
(c) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-465 в аминокислотной последовательности SEQ ID NO:46, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:48;
(d) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-465 в аминокислотной последовательности SEQ ID NO:46, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:49;
(e) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-462 в аминокислотной последовательности SEQ ID NO:47, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:48;
(f) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-462 в аминокислотной последовательности SEQ ID NO:47, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:49;
(g) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-471 в аминокислотной последовательности SEQ ID NO:52, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:53; или
(h) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-468 в аминокислотной последовательности SEQ ID NO:54, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:53.
(14) Антитело или антигенсвязывающий фрагмент антитела в соответствии с пунктом (13), представленным выше, которое содержит тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-465 в аминокислотной последовательности SEQ ID NO:46, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:49.
(15) Антитело или антигенсвязывающий фрагмент антитела, которое обладает следующими свойствами:
(a) специфически связывается с TLR7 человека,
(b) ингибирует функцию TLR7 человека, и
(c) включает:
(1) CDRH1, состоящую из аминокислотной последовательности SEQ ID NO:17, CDRH2, состоящую из аминокислотной последовательности SEQ ID NO:18, и CDRH3, состоящую из аминокислотной последовательности SEQ ID NO:19, в качестве определяющих комплементарность областей в тяжелой цепи, и CDRL1, состоящую из аминокислотной последовательности SEQ ID NO:20, CDRL2, состоящую из аминокислотной последовательности SEQ ID NO:21, и CDRL3, состоящую из аминокислотной последовательности SEQ ID NO:22, в качестве определяющих комплементарность областей в легкой цепи;
(2) CDRH1, состоящую из аминокислотной последовательности SEQ ID NO:23, CDRH2, состоящую из аминокислотной последовательности SEQ ID NO:24, и CDRH3, состоящую из аминокислотной последовательности SEQ ID NO:25, в качестве определяющих комплементарность областей в тяжелой цепи, и CDRL1, состоящую из аминокислотной последовательности SEQ ID NO:26, CDRL2, состоящую из аминокислотной последовательности SEQ ID NO:27, и CDRL3, состоящую из аминокислотной последовательности SEQ ID NO:28, в качестве определяющих комплементарность областей в легкой цепи; или
(3) CDRH1, состоящую из аминокислотной последовательности SEQ ID NO:29, CDRH2, состоящую из аминокислотной последовательности SEQ ID NO:30, и CDRH3, состоящую из аминокислотной последовательности SEQ ID NO:31, в качестве определяющих комплементарность областей в тяжелой цепи, и CDRL1, состоящую из аминокислотной последовательности SEQ ID NO:32, CDRL2, состоящую из аминокислотной последовательности SEQ ID NO:33, и CDRL3, состоящую из аминокислотной последовательности SEQ ID NO:34, в качестве определяющих комплементарность областей в легкой цепи.
(16) Антитело или антигенсвязывающий фрагмент антитела в соответствии с пунктом (15), представленным выше, которое включает:
CDRH1, состоящую из аминокислотной последовательности SEQ ID NO:17, CDRH2, состоящую из аминокислотной последовательности SEQ ID NO:18, и CDRH3, состоящую из аминокислотной последовательности SEQ ID NO:19, в качестве определяющих комплементарность областей в тяжелой цепи, и
CDRL1, состоящую из аминокислотной последовательности SEQ ID NO:20, CDRL2, состоящую из аминокислотной последовательности SEQ ID NO:21, и CDRL3, состоящую из аминокислотной последовательности SEQ ID NO:22, в качестве определяющих комплементарность областей в легкой цепи.
(17) Антитело или антигенсвязывающий фрагмент антитела в соответствии с пунктом (15) или (16), представленным выше, которое включает:
(a) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:5, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:11;
(b) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:7, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:13; или
(c) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:9, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:15.
(18) Антитело или антигенсвязывающий фрагмент антитела в соответствии с любым из пунктов (15)-(17), представленным выше, где константная область представляет собой происходящую от человека константную область.
(19) Антитело или антигенсвязывающий фрагмент антитела в соответствии с пунктом (18), представленным выше, которое включает:
(a) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-465 в аминокислотной последовательности SEQ ID NO:35, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:36;
(b) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-471 в аминокислотной последовательности SEQ ID NO:37, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:38, или
(c) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-470 в аминокислотной последовательности SEQ ID NO:39, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-234 в аминокислотной последовательности SEQ ID NO:40.
(20) Антитело или антигенсвязывающий фрагмент антитела в соответствии с любым из пунктов (15)-(19), представленным выше, которое является гуманизированным.
(21) Антитело или антигенсвязывающий фрагмент антитела в соответствии с пунктом (20), представленным выше, которое включает:
(I) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, выбранной из группы, состоящей из:
(a) аминокислотной последовательности SEQ ID NO:41;
(b) аминокислотной последовательности SEQ ID NO:42;
(c) аминокислотной последовательности, имеющей гомологию по меньшей мере 95% или больше с последовательностью (a) или (b); и
(d) аминокислотной последовательности, полученной из последовательности (a) или (b) путем делеции, замены или добавления 1-10 аминокислот; и
вариабельную область легкой цепи, состоящую из аминокислотной последовательности, выбранной из группы, состоящей из:
(e) аминокислотной последовательности SEQ ID NO:43;
(f) аминокислотной последовательности SEQ ID NO:44;
(g) аминокислотной последовательности, имеющей гомологию по меньшей мере 95% или больше с последовательностью (e) или (f); и
(h) аминокислотной последовательности, полученной из последовательности (e) или (f) путем делеции, замены или добавления 1-10 аминокислот; или
(II) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, выбранной из группы, состоящей из:
(a) аминокислотной последовательности SEQ ID NO:50;
(b) аминокислотной последовательности, имеющей гомологию по меньшей мере 95% или больше с последовательностью (a); и
(c) аминокислотной последовательности, полученной из последовательности (a) путем делеции, замены или добавления 1-10 аминокислот; и
вариабельную область легкой цепи, состоящую из аминокислотной последовательности, выбранной из группы, состоящей из:
(d) аминокислотной последовательности SEQ ID NO:51;
(e) аминокислотной последовательности, имеющей гомологию по меньшей мере 95% или больше с последовательностью (d); и
(f) аминокислотной последовательности, полученной из последовательности (d) путем делеции, замены или добавления 1-10 аминокислот.
(22) Антитело или антигенсвязывающий фрагмент антитела в соответствии с пунктом (21), представленным выше, которое включает:
(a) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:41, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:43;
(b) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:41, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:44;
(c) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:42, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:43;
(d) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:42, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:44; или
(e) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:50, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:51.
(23) Антитело или антигенсвязывающий фрагмент антитела в соответствии с пунктом (22), представленным выше, которое включает вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:42, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:44.
(24) Антитело или антигенсвязывающий фрагмент антитела в соответствии с пунктом (22), представленным выше, которое включает:
(a) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-465 в аминокислотной последовательности SEQ ID NO:45, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:48;
(b) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-465 в аминокислотной последовательности SEQ ID NO:45, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:49;
(c) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-465 в аминокислотной последовательности SEQ ID NO:46, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:48;
(d) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-465 в аминокислотной последовательности SEQ ID NO:46, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:49;
(e) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-462 в аминокислотной последовательности SEQ ID NO:47, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:48;
(f) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-462 в аминокислотной последовательности SEQ ID NO:47, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:49;
(g) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-471 в аминокислотной последовательности SEQ ID NO:52, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:53; или
(h) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-468 в аминокислотной последовательности SEQ ID NO:54, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:53.
(25) Антитело или антигенсвязывающий фрагмент антитела в соответствии с пунктом (24), представленным выше, которое содержит тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-465 в аминокислотной последовательности SEQ ID NO:46, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:49.
(26) Антитело или антигенсвязывающий фрагмент антитела, которое содержит тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-465 в аминокислотной последовательности SEQ ID NO:45, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:48.
(27) Антитело или антигенсвязывающий фрагмент антитела, которое содержит тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-465 в аминокислотной последовательности SEQ ID NO:46, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:48.
(28) Антитело или антигенсвязывающий фрагмент антитела, которое содержит тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-465 в аминокислотной последовательности SEQ ID NO:46, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:49.
(29) Антитело или антигенсвязывающий фрагмент антитела, которое содержит тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-462 в аминокислотной последовательности SEQ ID NO:47, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:49.
(30) Антитело или антигенсвязывающий фрагмент антитела, которое содержит тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-471 в аминокислотной последовательности SEQ ID NO:52, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:53.
(31) Антитело или антигенсвязывающий фрагмент антитела, которое содержит тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-468 в аминокислотной последовательности SEQ ID NO:54, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:53.
(32) Антитело или антигенсвязывающий фрагмент антитела в соответствии с любым из пунктов (26)-(31), представленным выше, которое обладает следующими свойствами:
(a) специфически связывается с TLR7 человека; и
(b) ингибирует функцию TLR7 человека.
(33) Антигенсвязывающий фрагмент антитела в соответствии с любым из пунктов (1)-(32), представленным выше, где антигенсвязывающий фрагмент выбран из группы, состоящей из Fab, F(ab)2, Fab' и Fv.
(34) Полинуклеотид, включающий полинуклеотидную последовательность, кодирующую антитело или антигенсвязывающий фрагмент антитела в соответствии с любым из пунктов (1)-(33) выше.
(35) Полинуклеотид в соответствии с пунктом (34), представленным выше, включающий:
(1) полинуклеотидную последовательность, кодирующую CDRH1, состоящую из аминокислотной последовательности SEQ ID NO:17, полинуклеотидную последовательность, кодирующую CDRH2, состоящую из аминокислотной последовательности SEQ ID NO:18, и полинуклеотидную последовательность, кодирующую CDRH3, состоящую из аминокислотной последовательности SEQ ID NO:19, и полинуклеотидную последовательность, кодирующую CDRL1, состоящую из аминокислотной последовательности SEQ ID NO:20, полинуклеотидную последовательность, кодирующую CDRL2, состоящую из аминокислотной последовательности SEQ ID NO:21, и полинуклеотидную последовательность, кодирующую CDRL3, состоящую из аминокислотной последовательности SEQ ID NO:22;
(2) полинуклеотидную последовательность, кодирующую CDRH1, состоящую из аминокислотной последовательности SEQ ID NO:23, полинуклеотидную последовательность, кодирующую CDRH2, состоящую из аминокислотной последовательности SEQ ID NO:24, и полинуклеотидную последовательность, кодирующую CDRH3, состоящую из аминокислотной последовательности SEQ ID NO:25, и полинуклеотидную последовательность, кодирующую CDRL1, состоящую из аминокислотной последовательности SEQ ID NO:26, полинуклеотидную последовательность, кодирующую CDRL2, состоящую из аминокислотной последовательности SEQ ID NO:27, и полинуклеотидную последовательность, кодирующую CDRL3, состоящую из аминокислотной последовательности SEQ ID NO:28; или
(3) полинуклеотидную последовательность, кодирующую CDRH1, состоящую из аминокислотной последовательности SEQ ID NO:29, полинуклеотидную последовательность, кодирующую CDRH2, состоящую из аминокислотной последовательности SEQ ID NO:30, и полинуклеотидную последовательность, кодирующую CDRH3, состоящую из аминокислотной последовательности SEQ ID NO:31, и полинуклеотидную последовательность, кодирующую CDRL1, состоящую из аминокислотной последовательности SEQ ID NO:32, полинуклеотидную последовательность, кодирующую CDRL2, состоящую из аминокислотной последовательности SEQ ID NO:33, и полинуклеотидную последовательность, кодирующую CDRL3, состоящую из аминокислотной последовательности SEQ ID NO:34.
(36) Полинуклеотид в соответствии с пунктом (35), представленным выше, включающий:
(I) полинуклеотидную последовательность, выбранную из группы, состоящей из:
(a) полинуклеотидной последовательности, кодирующей вариабельную область тяжелой цепи, представленной в SEQ ID NO:77;
(b) полинуклеотидной последовательности, кодирующей вариабельную область тяжелой цепи, представленной в SEQ ID NO:78; и
(c) полинуклеотидной последовательности полинуклеотида, который гибридизуется с полинуклеотидом, состоящим из полинуклеотидной последовательности, комплементарной полинуклеотидной последовательности (a) или (b), в жестких условиях; и
полинуклеотидную последовательность, выбранную из группы, состоящей из:
(d) полинуклеотидной последовательности, кодирующей вариабельную область легкой цепи, представленной в SEQ ID NO:79;
(e) полинуклеотидной последовательности, кодирующей вариабельную область легкой цепи, представленной в SEQ ID NO:80; и
(f) полинуклеотидной последовательности полинуклеотида, который гибридизуется с полинуклеотидом, состоящим из полинуклеотидной последовательности, комплементарной полинуклеотидной последовательности (d) или (e), в жестких условиях; или
(II) полинуклеотидную последовательность, выбранную из группы, состоящей из:
(a) полинуклеотидной последовательности, кодирующей вариабельную область тяжелой цепи, представленной в SEQ ID NO:81; и
(b) полинуклеотидной последовательности полинуклеотида, который гибридизуется с полинуклеотидом, состоящим из полинуклеотидной последовательности, комплементарной полинуклеотидной последовательности (a), в жестких условиях; и
полинуклеотидную последовательность, выбранную из группы, состоящей из:
(c) полинуклеотидной последовательности, кодирующей вариабельную область легкой цепи, представленной в SEQ ID NO:82; и
(d) полинуклеотидной последовательности полинуклеотида, который гибридизуется с полинуклеотидом, состоящим из полинуклеотидной последовательности, комплементарной полинуклеотидной последовательности (c), в жестких условиях.
(37) Полинуклеотид в соответствии с пунктом (36), представленным выше, включающий:
(a) полинуклеотидную последовательность, кодирующую вариабельную область тяжелой цепи, представленную в SEQ ID NO:77, и полинуклеотидную последовательность, кодирующую вариабельную область легкой цепи, представленную в SEQ ID NO:79;
(b) полинуклеотидную последовательность, кодирующую вариабельную область тяжелой цепи, представленную в SEQ ID NO:77, и полинуклеотидную последовательность, кодирующую вариабельную область легкой цепи, представленную в SEQ ID NO:80;
(c) полинуклеотидную последовательность, кодирующую вариабельную область тяжелой цепи, представленную в SEQ ID NO:78, и полинуклеотидную последовательность, кодирующую вариабельную область легкой цепи, представленную в SEQ ID NO:79;
(d) полинуклеотидную последовательность, кодирующую вариабельную область тяжелой цепи, представленную в SEQ ID NO:78, и полинуклеотидную последовательность, кодирующую вариабельную область легкой цепи, представленную в SEQ ID NO:80; или
(e) полинуклеотидную последовательность, кодирующую вариабельную область тяжелой цепи, представленную в SEQ ID NO:81, и полинуклеотидную последовательность, кодирующую вариабельную область легкой цепи, представленную в SEQ ID NO:82.
(38) Вектор экспрессии, включающий полинуклеотид в соответствии с любым из пунктов (34)-(37) выше.
(39) Клетка-хозяин, трансформированная вектором экспрессии в соответствии с пунктом (38), представленным выше.
(40) Клетка-хозяин в соответствии с пунктом (39), представленным выше, где клетка-хозяин представляет собой эукариотическую клетку.
(41) Способ для получения антитела или антигенсвязывающего фрагмента антитела, включающий следующие стадии:
культивирование клетки-хозяина в соответствии с пунктом (39) или (40), представленным выше; и
сбор антитела или фрагмента, представляющего интерес, из культуры, полученной на стадии, описанной выше.
(42) Антитело или антигенсвязывающий фрагмент антитела, полученные способом получения в соответствии с пунктом (41).
(43) Антитело в соответствии с любым из пунктов (1)-(32), представленным выше, включающее одну или несколько модификаций, выбранных из группы, состоящей из гликозилирования до N-связи, гликозилирования до O-связи, N-концевого процессинга, C-концевого процессинга, дезамидирования, изомеризации аспарагиновой кислоты, окисления метионина, добавления метионинового остатка к N-концу, амидирования пролинового остатка и делеции одной или двух аминокислот на карбоксиконце тяжелой цепи.
(44) Антитело в соответствии с пунктом (43), представленным выше, включающее: две тяжелые цепи, состоящие из одного вида или комбинации любых двух видов тяжелых цепей, выбранных из группы, состоящей из полноразмерных и делеционных вариантов с одной или двумя аминокислотами, делетированными на карбоксиконце.
(45) Антитело в соответствии с пунктом (44), представленным выше, где одна аминокислота делетирована на карбоксиконце в каждой из двух тяжелых цепей.
(46) Антитело в соответствии с любым из пунктов (43)-(45), представленным выше, где пролиновый остаток на карбоксиконце тяжелой цепи дополнительно амидирован.
(47) Фармацевтическая композиция для лечения и/или профилактики заболевания, включающая: по меньшей мере одно из антител или антигенсвязывающих фрагментов антител в соответствии с пунктом (1)-(33) и (42)-(46), представленным выше, или вектор экспрессии в соответствии с пунктом (38) в качестве активного ингредиента.
(48) Фармацевтическая композиция в соответствии с пунктом (47), представленным выше, для лечения заболевания, вызванного функцией человеческого TLR7.
(49) Фармацевтическая композиция в соответствии с пунктом (48), представленным выше, где заболевание, вызванное функцией человеческого TLR7, представляет собой связанное с иммунным воспалением заболевание, аллергическое заболевание, инфекцию или рак.
(50) Фармацевтическая композиция в соответствии с пунктом (49), представленным выше, где связанное с иммунным воспалением заболевание представляет собой системную красную волчанку, ревматоидный артрит, ювенильный идиопатический артрит, болезнь Стилла, развившуюся у взрослых, анкилозирующий спондилит, системную склеродерму, полимиозит, дерматомиозит, псориатический артрит, остеоартрит, смешанное заболевание соединительной ткани или мышечную дистрофию.
(51) Фармацевтическая композиция в соответствии с пунктом (49) или (50), представленным выше, где связанное с иммунным воспалением заболевание представляет собой системную красную волчанку.
(52) Фармацевтическая композиция в соответствии с любым из пунктов (47)-(51), представленным выше, для использования в комбинации с иммуносупрессантом, противовоспалительным лекарственным средством, противоаллергическим средством, противоинфекционным средством или противораковым средством.
(53) Способ для лечения заболевания, вызванного функцией человеческого TLR7, включающий: введение субъекту по меньшей мере одного из антител или антигенсвязывающих фрагментов антител в соответствии с пунктом (1)-(33) и (42)-(46), представленным выше.
(54) Способ для лечения заболевания, вызванного функцией человеческого TLR7, включающий введение субъекту по меньшей мере одного из антител или антигенсвязывающих фрагментов антител в соответствии с пунктом (1)-(33) и (42)-(46), представленным выше, вместе с иммуносупрессантом, противовоспалительным лекарственным средством, противоаллергическим средством, противоинфекционным средством или противораковым средством, одновременно, раздельно или последовательно.
(55) Способ лечения в соответствии с пунктом (53) или (54), представленным выше, где заболевание, вызванное функцией человеческого TLR7, представляет собой связанное с иммунным воспалением заболевание, аллергическое заболевание, инфекцию или рак.
(56) Способ лечения в соответствии с пунктом (55), представленным выше, где связанное с иммунным воспалением заболевание представляет собой системную красную волчанку, ревматоидный артрит, ювенильный идиопатический артрит, болезнь Стилла, развившуюся у взрослых, анкилозирующий спондилит, системную склеродерму, полимиозит, дерматомиозит, псориатический артрит, остеоартрит, смешанное заболевание соединительной ткани или мышечную дистрофию.
(57) Способ лечения в соответствии с пунктом (55) или (56), представленным выше, где связанное с иммунным воспалением заболевание представляет собой системную красную волчанку.
(58) Антитело или антигенсвязывающий фрагмент антитела в соответствии с любым из пунктов (1)-(33) и (42)-(46), представленным выше, или вектор экспрессии в соответствии с пунктом (38), представленным выше, для применения для лечения или профилактики заболевания, вызванного функцией человеческого TLR7.
(59) Антитело, антигенсвязывающий фрагмент антитела или вектор экспрессии в соответствии с пунктом (58), представленным выше, где заболевание, вызванное функцией человеческого TLR7, представляет собой связанное с иммунным воспалением заболевание, аллергическое заболевание, инфекцию или рак.
(60) Антитело, антигенсвязывающий фрагмент антитела или вектор экспрессии в соответствии с пунктом (59), представленным выше, где связанное с иммунным воспалением заболевание представляет собой системную красную волчанку, ревматоидный артрит, ювенильный идиопатический артрит, болезнь Стилла, развившуюся у взрослых, анкилозирующий спондилит, системную склеродерму, полимиозит, дерматомиозит, псориатический артрит, остеоартрит, смешанное заболевание соединительной ткани или мышечную дистрофию.
(61) Антитело, антигенсвязывающий фрагмент антитела или вектор экспрессии в соответствии с пунктом (59) или (60), представленным выше, где связанное с иммунным воспалением заболевание представляет собой системную красную волчанку.
(62) Антитело, антигенсвязывающий фрагмент антитела или вектор экспрессии в соответствии с любым из пунктов (58)-(61), представленным выше, для использования в комбинации с иммуносупрессантом, противовоспалительным лекарственным средством, противоаллергическим средством, противоинфекционным средством или противораковым средством.
(63) Применение антитела или антигенсвязывающего фрагмента антитела в соответствии с любым из пунктов (1)-(33) и (42)-(46), представленным выше, или вектора экспрессии в соответствии с пунктом (38), представленным выше, для получения терапевтического средства или профилактического средства от заболевания, вызываемого функцией человеческого TLR7.
(64) Применение в соответствии с пунктом (63), представленным выше, где заболевание, вызываемое функцией человеческого TLR7, представляет собой связанное с иммунным воспалением заболевание, аллергическое заболевание, инфекцию или рак.
(65) Применение в соответствии с пунктом (64), представленным выше, где связанное с иммунным воспалением заболевание представляет собой системную красную волчанку, ревматоидный артрит, ювенильный идиопатический артрит, болезнь Стилла, развившуюся у взрослых, анкилозирующий спондилит, системную склеродерму, полимиозит, дерматомиозит, псориатический артрит, остеоартрит, смешанное заболевание соединительной ткани или мышечную дистрофию.
(66) Применение в соответствии с пунктом (64) или (65), представленным выше, где связанное с иммунным воспалением заболевание представляет собой системную красную волчанку.
(67) Применение в соответствии с любым из пунктов (63)-(66), представленным выше, где терапевтическое средство или профилактическое средство используют в комбинации с иммуносупрессантом, противовоспалительным лекарственным средством, противоаллергическим средством, противоинфекционным средством или противораковым средством.
Полезные эффекты изобретения
[0010]
В соответствии с настоящим изобретением, может быть получено средство, имеющее механизм действия, направленный на ингибирование функции TLR7, для лечения и/или профилактики связанных с иммунным воспалением заболеваний, аллергических заболеваний, инфекций и рака.
Краткое описание чертежей
[0011]
[Фиг. 1] Фиг. 1 показывает аминокислотную последовательность (SEQ ID NO:2) TLR7 человека (вариант 1).
[Фиг. 2] Фиг. 2 показывает аминокислотную последовательность (SEQ ID NO:4) TLR7 человека (вариант 2).
[Фиг. 3] Фиг. 3 показывает аминокислотную последовательность (SEQ ID NO:83) TLR7 мыши.
[Фиг. 4] Фиг. 4 показывает аминокислотную последовательность (SEQ ID NO:84) TLR7 крысы.
[Фиг. 5] Фиг. 5 показывает аминокислотную последовательность (SEQ ID NO:85) TLR7 обезьяны.
[Фиг. 6] Фиг. 6 представляет график, показывающий, что антитело AT01, антитело NB7 и антитело FAN2 подавляют продукцию IL-6 из мононуклеарных клеток периферической крови человека (которые далее указаны как PBMC), обработанных CL-264, зависимым от концентрации образом.
[Фиг. 7] Фиг. 7 показывает аминокислотную последовательность (SEQ ID NO:35) тяжелой цепи антитела cAT01, которая включает ее сигнальную последовательность, и аминокислотную последовательность (SEQ ID NO:36) легкой цепи антитела cAT01, которая включает ее сигнальную последовательность. В аминокислотной последовательности тяжелой цепи аминокислотная последовательность в положениях 1-19 представляет собой сигнальную последовательность, аминокислотная последовательность в положениях 20-135 представляет собой вариабельную область тяжелой цепи, и аминокислотная последовательность в положениях 136-465 представляет собой константную область тяжелой цепи. В аминокислотной последовательности легкой цепи аминокислотная последовательность в положениях 1-20 представляет собой сигнальную последовательность, аминокислотная последовательность в положениях 21-126 представляет собой вариабельную область легкой цепи, и аминокислотная последовательность в положениях 127-233 представляет собой константную область легкой цепи.
[Фиг. 8] Фиг. 8 показывает аминокислотную последовательность (SEQ ID NO:37) тяжелой цепи антитела cNB7, которая включает ее сигнальную последовательность, и аминокислотную последовательность (SEQ ID NO:38) легкой цепи антитела cNB7, которая включает ее сигнальную последовательность. В аминокислотной последовательности тяжелой цепи аминокислотная последовательность в положениях 1-19 представляет собой сигнальную последовательность, аминокислотная последовательность в положениях 20-141 представляет собой вариабельную область тяжелой цепи, и аминокислотная последовательность в положениях 142-471 представляет собой константную область тяжелой цепи. В аминокислотной последовательности легкой цепи аминокислотная последовательность в положениях 1-20 представляет собой сигнальную последовательность, аминокислотная последовательность в положениях 21-126 представляет собой вариабельную область легкой цепи, и аминокислотная последовательность в положениях 127-233 представляет собой константную область легкой цепи.
[Фиг. 9] Фиг. 9 показывает аминокислотную последовательность (SEQ ID NO:39) тяжелой цепи антитела cFAN2, которая включает ее сигнальную последовательность, и аминокислотную последовательность (SEQ ID NO:40) легкой цепи антитела cFAN2, которая включает ее сигнальную последовательность. В аминокислотной последовательности тяжелой цепи аминокислотная последовательность в положениях 1-19 представляет собой сигнальную последовательность, аминокислотная последовательность в положениях 20-140 представляет собой вариабельную область тяжелой цепи, и аминокислотная последовательность в положениях 141-470 представляет собой константную область тяжелой цепи. В аминокислотной последовательности легкой цепи аминокислотная последовательность в положениях 1-20 представляет собой сигнальную последовательность, аминокислотная последовательность в положениях 21-127 представляет собой вариабельную область легкой цепи, и аминокислотная последовательность в положениях 128-234 представляет собой константную область легкой цепи.
[Фиг. 10] Фиг. 10 представляет график, показывающий, что cAT01, cNB7 и cFAN2, которые являются химерными антителами против TLR7 человека, подавляют продукцию IL-6 из человеческих PBMC, обработанных CL-264, зависимым от концентрации образом.
[Фиг. 11] Фиг. 11 показывает аминокислотную последовательность (SEQ ID NO:45) тяжелой цепи huAT01_H1_IgG1LALA, которая включает ее сигнальную последовательность и которая представляет собой гуманизированную тяжелую цепь. В этой последовательности аминокислотная последовательность в положениях 1-19 представляет собой сигнальную последовательность, аминокислотная последовательность в положениях 20-135 представляет собой вариабельную область, и аминокислотная последовательность в положениях 136-465 представляет собой константную область. Кроме того, аминокислотная последовательность в положениях 45-54 представляет собой CDRH1, аминокислотная последовательность в положениях 69-78 представляет собой CDRH2, и аминокислотная последовательность в положениях 118-124 представляет собой CDRH3.
[Фиг. 12] Фиг. 12 показывает аминокислотную последовательность (SEQ ID NO:46) тяжелой цепи huAT01_H3_IgG1LALA, которая включает ее сигнальную последовательность и которая представляет собой гуманизированную тяжелую цепь. В этой последовательности аминокислотная последовательность в положениях 1-19 представляет собой сигнальную последовательность, аминокислотная последовательность в положениях 20-135 представляет собой вариабельную область, и аминокислотная последовательность в положениях 136-465 представляет собой константную область. Кроме того, аминокислотная последовательность в положениях 45-54 представляет собой CDRH1, аминокислотная последовательность в положениях 69-78 представляет собой CDRH2, и аминокислотная последовательность в положениях 118-124 представляет собой CDRH3.
[Фиг. 13] Фиг. 13 показывает аминокислотную последовательность (SEQ ID NO:47) тяжелой цепи huAT01_H3_IgG4Pro, которая включает ее сигнальную последовательность и которая представляет собой гуманизированную тяжелую цепь. В этой последовательности аминокислотная последовательность в положениях 1-19 представляет собой сигнальную последовательность, аминокислотная последовательность в положениях 20-135 представляет собой вариабельную область, и аминокислотная последовательность в положениях 136-462 представляет собой константную область. Кроме того, аминокислотная последовательность в положениях 45-54 представляет собой CDRH1, аминокислотная последовательность в положениях 69-78 представляет собой CDRH2, и аминокислотная последовательность в положениях 118-124 представляет собой CDRH3.
[Фиг. 14] Фиг. 14 показывает сравнение аминокислотной последовательности (SEQ ID NO:5) вариабельной области cAT01_H, которая представляет собой тяжелую цепь химерного антитела cAT01 (которая далее указана как cAT01_H), аминокислотной последовательности (SEQ ID NO:41) вариабельной области тяжелой цепи гуманизированного антитела huAT01_H1_IgG1LALA (которая далее указана как huAT01_H1) и аминокислотной последовательности (SEQ ID NO:42) вариабельной области тяжелой цепи гуманизированного антитела huAT01_H3_IgG1LALA (которая далее указана как huAT01_H3). В последовательностях huAT01_H1 и huAT01_H3 символ "∙" представляет собой такой же аминокислотный остаток, как в cAT01_H, и замененный аминокислотный остаток показан в том месте, где описан этот аминокислотный остаток.
[Фиг. 15] Фиг. 15 показывает аминокислотную последовательность (SEQ ID NO:48) легкой цепи huAT01_L1, которая включает ее сигнальную последовательность и которая представляет собой гуманизированную легкую цепь. В этой последовательности аминокислотная последовательность в положениях 1-20 представляет собой сигнальную последовательность, аминокислотная последовательность в положениях 21-126 представляет собой вариабельную область, и аминокислотная последовательность в положениях 127-233 представляет собой константную область. Кроме того, аминокислотная последовательность в положениях 44-54 представляет собой CDRL1, аминокислотная последовательность в положениях 70-76 представляет собой CDRL2, и аминокислотная последовательность в положениях 109-116 представляет собой CDRL3.
[Фиг. 16] Фиг. 16 показывает аминокислотную последовательность (SEQ ID NO:49) легкой цепи huAT01_L2, которая включает ее сигнальную последовательность и которая представляет собой гуманизированную легкую цепь. В этой последовательности аминокислотная последовательность в положениях 1-20 представляет собой сигнальную последовательность, аминокислотная последовательность в положениях 21-126 представляет собой вариабельную область, и аминокислотная последовательность в положениях 127-233 представляет собой константную область. Кроме того, аминокислотная последовательность в положениях 44-54 представляет собой CDRL1, аминокислотная последовательность в положениях 70-76 представляет собой CDRL2, и аминокислотная последовательность в положениях 109-116 представляет собой CDRL3.
[Фиг. 17] Фиг. 17 показывает сравнение аминокислотной последовательности (SEQ ID NO:11) вариабельной области cAT01_L, которая представляет собой легкую цепь химерного антитела cAT01 (которая далее указана как cAT01_L), аминокислотной последовательности (SEQ ID NO:43) вариабельной области легкой цепи гуманизированного антитела huAT01_L1 (которая далее указана как huAT01_L1) и аминокислотной последовательности (SEQ ID NO:44) вариабельной области легкой цепи гуманизированного антитела huAT01_L2 (которая далее указана как huAT01_L2). В последовательностях huAT01_L1 и huAT01_L2, символ "∙" представляет собой такой же аминокислотный остаток, как в cAT01_L, и замененный аминокислотный остаток показан в том месте, где описан этот аминокислотный остаток.
[Фиг. 18] Фиг. 18 показывает аминокислотную последовательность (SEQ ID NO:52) тяжелой цепи huNB7_H3_IgG1LALA, которая включает ее сигнальную последовательность и которая представляет собой гуманизированную тяжелую цепь. В этой последовательности аминокислотная последовательность в положениях 1-19 представляет собой сигнальную последовательность, аминокислотная последовательность в положениях 20-141 представляет собой вариабельную область, и аминокислотная последовательность в положениях 142-471 представляет собой константную область. Кроме того, аминокислотная последовательность в положениях 45-55 представляет собой CDRH1, аминокислотная последовательность в положениях 70-78 представляет собой CDRH2, и аминокислотная последовательность в положениях 118-130 представляет собой CDRH3.
[Фиг. 19] Фиг. 19 показывает аминокислотную последовательность (SEQ ID NO:54) тяжелой цепи huNB7_H3_IgG4Pro, которая включает ее сигнальную последовательность и которая представляет собой гуманизированную тяжелую цепь. В этой последовательности аминокислотная последовательность в положениях 1-19 представляет собой сигнальную последовательность, аминокислотная последовательность в положениях 20-141 представляет собой вариабельную область, и аминокислотная последовательность в положениях 142-468 представляет собой константную область. Кроме того, аминокислотная последовательность в положениях 45-55 представляет собой CDRH1, аминокислотная последовательность в положениях 70-78 представляет собой CDRH2, и аминокислотная последовательность в положениях 118-130 представляет собой CDRH3.
[Фиг. 20] Фиг. 20 показывает сравнение аминокислотной последовательности (SEQ ID NO:7) вариабельной области cNB7_H, которая представляет собой тяжелую цепь химерного антитела cNB7 (которая далее указана как cNB7_H), и аминокислотной последовательности (SEQ ID NO:50) вариабельной области тяжелой цепи гуманизированного антитела huNB7_H3_IgG1LALA (которая далее указана как huNB7_H3). В huNB7_H3 символ "∙" представляет собой такой же аминокислотный остаток, как в cNB7_H, и замененный аминокислотный остаток показан в том месте, где описан этот аминокислотный остаток.
[Фиг. 21] Фиг. 21 показывает аминокислотную последовательность (SEQ ID NO:53) легкой цепи huNB7_L3, которая включает ее сигнальную последовательность и которая представляет собой гуманизированную легкую цепь. В этой последовательности аминокислотная последовательность в положениях 1-20 представляет собой сигнальную последовательность, аминокислотная последовательность в положениях 21-126 представляет собой вариабельную область, и аминокислотная последовательность в положениях 127-233 представляет собой константную область. Кроме того, аминокислотная последовательность в положениях 44-54 представляет собой CDRL1, аминокислотная последовательность в положениях 70-76 представляет собой CDRL2, и аминокислотная последовательность в положениях 109-116 представляет собой CDRL3.
[Фиг. 22] Фиг. 22 показывает сравнение аминокислотной последовательности (SEQ ID NO:13) вариабельной области cNB7_L, которая представляет собой легкую цепь химерного антитела cNB7 (которая далее указана как cNB7_L), и аминокислотной последовательности (SEQ ID NO:51) вариабельной области легкой цепи гуманизированного антитела huNB7_L3 (которая далее указана как huNB7_L3). В huNB7_L3 символ "∙" представляет собой такой же аминокислотный остаток, как в cNB7_L, и замененный аминокислотный остаток показан в том месте, где описан этот аминокислотный остаток.
[Фиг. 23] Фиг. 23 представляет график, показывающий, что гуманизированные антитела против TLR7 человека (huAT01_H1L1_IgG1LALA, huAT01_H3L1_IgG1LALA, huAT01_H3L2_IgG1LALA, huAT01_H3L2_IgG4Pro, huNB7_H3L3_IgG1LALA и huNB7_H3L3_IgG4Pro) подавляют продукцию IL-6 из человеческих PBMC, обработанных CL-264, зависимым от концентрации образом.
[Фиг. 24] Фиг. 24-1 показывает аминокислотную последовательность (SEQ ID NO:17) CDRH1 антитела AT01, аминокислотную последовательность (SEQ ID NO:18) его CDRH2, аминокислотную последовательность (SEQ ID NO:19) его CDRH3, аминокислотную последовательность (SEQ ID NO:20) его CDRL1, аминокислотную последовательность (SEQ ID NO:21) его CDRL2 и аминокислотную последовательность (SEQ ID NO:22) его CDRL3. Фиг. 24-2 показывает аминокислотную последовательность (SEQ ID NO:23) CDRH1 антитела NB7, аминокислотную последовательность (SEQ ID NO:24) его CDRH2, аминокислотную последовательность (SEQ ID NO:25) его CDRH3, аминокислотную последовательность (SEQ ID NO:26) его CDRL1, аминокислотную последовательность (SEQ ID NO:27) его CDRL2 и аминокислотную последовательность (SEQ ID NO:28) его CDRL3. Фиг. 24-3 показывает аминокислотную последовательность (SEQ ID NO:29) CDRH1 антитела FAN2, аминокислотную последовательность (SEQ ID NO:30) его CDRH2, аминокислотную последовательность (SEQ ID NO:31) его CDRH3, аминокислотную последовательность (SEQ ID NO:32) его CDRL1, аминокислотную последовательность (SEQ ID NO:33) его CDRL2 и аминокислотную последовательность (SEQ ID NO:34) его CDRL3.
[Фиг. 25] Фиг. 25 показывает результаты анализа, который осуществляли методом проточной цитометрии, связывания гуманизированного антитела против человеческого TLR7 (huAT01_H3L2_IgG1LALA) с антигеном (TLR7 человека: вариант 1), и представляет график, показывающий специфическое связывание с антигеном.
[Фиг. 26] Фиг. 26 показывает результаты анализа, который осуществляли методом проточной цитометрии, связывания гуманизированного антитела против человеческого TLR7 (huAT01_H3L2_IgG1LALA) с антигеном (TLR7 человека: вариант 2), и представляет график, показывающий специфическое связывание с антигеном.
[Фиг. 27] Фиг. 27 показывает результаты анализа, который осуществляли методом проточной цитометрии, связывания гуманизированного антитела против человеческого TLR7 (huAT01_H3L2_IgG1LALA) с антигеном (TLR7 обезьяны), и представляет график, показывающий специфическое связывание с антигеном.
[Фиг. 28] Фиг. 28 показывает результаты анализа, который осуществляли методом проточной цитометрии, связывания гуманизированного антитела против человеческого TLR7 (huAT01_H3L2_IgG1LALA) с антигеном (TLR7 мыши), и представляет график, показывающий отсутствие связывания с антигеном.
[Фиг. 29] Фиг. 29 показывает результаты анализа, который осуществляли методом проточной цитометрии, связывания гуманизированного антитела против человеческого TLR7 (huAT01_H3L2_IgG1LALA) с антигеном (TLR7 крысы), и представляет график, показывающий отсутствие связывания с антигеном.
Описание вариантов осуществления
[0012]
В настоящем описании термин "ген" включает не только ДНК, но также мРНК, кДНК и кРНК.
[0013]
В настоящем описании термин "полинуклеотид" используется в таком же значении, что и “нуклеиновая кислота”, и также включает ДНК, РНК, зонды, олигонуклеотиды и праймеры.
[0014]
В настоящем описании термины "полипептид" и "белок" используются без различия.
[0015]
В настоящем описании термин "РНК фракция" означает фракцию, содержащую РНК.
[0016]
В настоящем описании термин "клетки" включает клетки в организме животных и культивированные клетки.
[0017]
В настоящем описании термин "TLR7" используют в том же значении, что и TLR7 белок.
[0018]
В настоящем описании термин "антигенсвязывающий фрагмент антитела" означает частичный фрагмент антитела, обладающий активностью связывания с антигеном, и включает Fab, F(ab')2, Fv, scFv, диатела, линейные антитела, мультиспецифические антитела, образованные из фрагментов антител, и т.п. Кроме того, антигенсвязывающий фрагмент антитела также включает Fab', который представляет собой одновалентный фрагмент в вариабельной области антитела, полученный обработкой F(ab')2 в восстанавливающих условиях. Однако нет никаких ограничений, что касается этих молекул, при условии, что фрагмент обладает способностью связываться с антигеном. Кроме того, антигенсвязывающий фрагмент включает не только те, которые получены обработкой полноразмерной молекулы белка антитела подходящим ферментом, но также белок, продуцируемый в подходящей клетке-хозяине, с использованием генетически сконстрированного гена антитела.
[0019]
Известно, что определяющие комплементарность области (CDR: определяющие комплементарность области) присутствуют в трех точках в каждой из тяжелых и легких цепей молекулы антитела. Определяющие комплементарность области, которые также называют гипервариабельными областями, присутствуют в вариабельных областях тяжелых и легких цепей антитела на участках, где вариабельность первичной структуры особенно высока. В первичной структуре полипептидной цепи в каждой из тяжелых и легких цепей определяющие комплементарность области отдельно присутствуют в трех точках. Что касается определяющих комплементарность областей антитела, в настоящем описании определяющие комплементарность области тяжелой цепи представлены как CDRH1, CDRH2 и CDRH3 от амино-конца аминокислотной последовательности тяжелой цепи, а определяющие комплементарность области легкой цепи представлены как CDRL1, CDRL2 и CDRL3 от амино-конца аминокислотной последовательности легкой цепи. Эти сайты являются смежными друг с другом в трехмерной структуре и определяют специфичность в отношении антигена, подлежащего связыванию. Кроме того, последовательность аминоцепи каждой CDR описана в соответствии с AbM определением (Martin, A. C. R., Cheetham, J. C. and Rees, A. R. (1989) Proc. Natl Acad. Sci. USA, 86, 9268-9272).
[0020]
В настоящем изобретении фраза "гибридизующийся в жестких условиях" означает гибридизующийся при 68°C в коммерчески доступном растворе для гибридизации, ExpressHyb Hybridization Solution (Clontech Laboratories, Inc.), или гибридизующийся в условиях, которые обеспечивают возможность гибридизации при 68°C в присутствии 0,7-1,0-M NaCl с использованием фильтра, на котором иммобилизуется ДНК, и последующей идентификации путем промывки при 68°C с использованием SSC раствора 0,1-2-кратной концентрации (SSC 1-кратной концентрации состоит из 150-мМ NaCl и 15-мМ цитрата натрия), или в эквивалентных условиях.
[0021]
1. TLR7
TLR7 человека, используемый в настоящем изобретении, можно непосредственно очистить из человеческих B-клеток или дендритных клеток или можно получить приспособив для использования клеточные мембранные фракции указанных выше клеток. Кроме того, TLR7 человека можно получить путем синтеза in-vitro или продуцирования в клетках-хозяевах генноинженерными методами. В генной инженерии TLR7 человека экспрессируют, в частности, путем его интегрирования в вектор, способный экспрессировать кДНК TLR7 человека, с последующим синтезом в растворе, содержащем ферменты, субстраты и энергетические вещества, которые необходимы для транскрипции и трансляции, или TLR7 человека экспрессируют путем трансформации клеток-хозяев других прокариот или эукариот, чтобы можно было получить такой белок.
[0022]
Подобным образом, TLR7 обезьяны, TLR7 мыши и TLR7 крысы можно непосредственно очистить из TLR7-экспрессирующих клеток обезьян, мышей и крыс, соответственно, и использовать, или можно получить приспособив для использования клеточные мембранные фракции указанных выше клеток. Кроме того, TLR7 обезьяны, TLR7 мыши и TLR7 крысы можно получить путем синтеза in-vitro или продуцирования в клетках-хозяевах генноинженерными методами.
[0023]
Полинуклеотидные последовательности, кодирующие аминокислотные последовательности TLR7 человека (вариант 1) и TLR7 человека (вариант 2), представлены в SEQ ID NO:1 и SEQ ID NO:3, соответственно, в Перечне последовательностей, а аминокислотные последовательности TLR7 человека (вариант 1) и TLR7 человека (вариант 2) представлены в SEQ ID NO:2 и SEQ ID NO:4, соответственно, в Перечне последовательностей.
[0024]
кДНК TLR7 человека можно получить, например, так называемым методом ПЦР, где полимеразную цепную реакцию (которая далее указана как "ПЦР") (Saiki, R. K., et al., Science, (1988) 239, 487-49) осуществляют с использованием библиотеки кДНК из органа, экспрессирующего мРНК человеческого TLR7, в качестве матрицы и праймера, который специфически амплифицирует кДНК человеческого TLR7.
[0025]
кДНК человеческого TLR7 также включает полинуклеотид, который гибридизуется с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей человеческий TLR7, в жестких условиях и кодирует белок, имеющий биологическую активность, эквивалентную TLR7 человека. Кроме того, кДНК человеческого TLR7 также включает вариант сплайсинга, транскрибированный из генного локуса TLR7 человека, или полинуклеотид, который гибридизуется с вариантом сплайсинга в жестких условиях и кодирует белок, имеющий биологическую активность, эквивалентную TLR7 человека.
[0026]
Кроме того, человеческий TLR7 также включает белок, который состоит из аминокислотной последовательности человеческого TLR7 или аминокислотной последовательности, исключая сигнальную последовательность, с заменой, делецией или добавкой одной, двух, трех, четырех или пяти аминокислот, и обладает биологической активностью, эквивалентной TLR7 человека. Кроме того, человеческий TLR7 также включает белок, который состоит из аминокислотной последовательности, кодируемой вариантом сплайсинга, транскрибированным из генного локуса TLR7 человека, или аминокислотной последовательности с заменой, делецией или добавкой одной, двух, трех, четырех или пяти аминокислот, и обладает биологической активностью, эквивалентной TLR7 человека.
[0027]
Полинуклеотидная последовательность, кодирующая аминокислотную последовательность TLR7 обезьяны, представлена в SEQ ID NO:58 в Перечне последовательностей, а аминокислотная последовательность TLR7 обезьяны представлена в SEQ ID NO:85 в Перечне последовательностей.
[0028]
кДНК TLR7 обезьяны можно получить, например, методом ПЦР с использованием библиотеки кДНК из органа, экспрессирующего мРНК TLR7, в качестве матрицы и праймера, который специфически амплифицирует кДНК TLR7 обезьяны.
[0029]
кДНК TLR7 обезьяны также включает полинуклеотид, который гибридизуется с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей TLR7 обезьяны, в жестких условиях и кодирует белок, имеющий биологическую активность, эквивалентную TLR7 обезьяны. Кроме того, кДНК TLR7 обезьяны также включает вариант сплайсинга, транскрибированный из генного локуса TLR7 обезьяны, или полинуклеотид, который гибридизуется с вариантом сплайсинга в жестких условиях и кодирует белок, имеющий биологическую активность, эквивалентную TLR7 обезьяны.
[0030]
Кроме того, TLR7 обезьяны также включает белок, который состоит из аминокислотной последовательности TLR7 обезьяны или аминокислотной последовательности, исключая сигнальную последовательность, с заменой, делецией или добавкой одной, двух, трех, четырех или пяти аминокислот, и обладает биологической активностью, эквивалентной TLR7 обезьяны. Кроме того, TLR7 обезьяны также включает белок, который состоит из аминокислотной последовательности, кодируемой вариантом сплайсинга, транскрибированным из генного локуса TLR7 обезьяны, или аминокислотной последовательности с заменой, делецией или добавкой одной, двух, трех, четырех или пяти аминокислот, и обладает биологической активностью, эквивалентной TLR7 обезьяны.
[0031]
Полинуклеотидная последовательность, кодирующая аминокислотную последовательность TLR7 обезьяны, представлена в SEQ ID NO:58 в Перечне последовательностей, а аминокислотная последовательность TLR7 обезьяны представлена в SEQ ID NO:85 в Перечне последовательностей.
[0032]
кДНК TLR7 обезьяны можно получить, например, методом ПЦР с использованием библиотеки кДНК из органа, экспрессирующего мРНК TLR7 обезьяны, в качестве матрицы и праймера, который специфически амплифицирует кДНК TLR7 обезьяны.
[0033]
Полинуклеотидная последовательность, кодирующая аминокислотную последовательность TLR7 мыши, представлена в SEQ ID NO:56 в Перечне последовательностей, а аминокислотная последовательность TLR7 мыши представлена в SEQ ID NO:83 в Перечне последовательностей.
[0034]
кДНК TLR7 мыши можно получить, например, методом с использованием библиотеки кДНК из органа, экспрессирующего мРНК TLR7 мыши, в качестве матрицы и праймера, который специфически амплифицирует кДНК TLR7 мыши.
[0035]
Полинуклеотидная последовательность, кодирующая аминокислотную последовательность TLR7 крысы, представлена в SEQ ID NO:57 в Перечне последовательностей, а аминокислотная последовательность TLR7 крысы представлена в SEQ ID NO:84 в Перечне последовательностей.
[0036]
кДНК TLR7 крысы можно получить, например, методом ПЦР с использованием библиотеки кДНК из органа, экспрессирующего мРНК TLR7 крысы, в качестве матрицы и праймера, который специфически амплифицирует кДНК TLR7 крысы.
[0037]
2. Анти-TLR7 антитело и его получение
Настоящее изобретение обеспечивает антитело или антигенсвязывающий фрагмент антитела, которое обладает следующими свойствами:
(a) специфически связывается с TLR7 человека или TLR7 обезьяны и не связывается я с TLR7 мыши или TLR7 крысы; и
(b) ингибирует функцию TLR7 человека или TLR7 обезьяны.
[0038]
Антитело или антигенсвязывающий фрагмент антитела по настоящему изобретению связывается специфически с TLR7 человека или TLR7 обезьяны и ингибирует их функции.
[0039]
Активность связывания антитела или антигенсвязывающего фрагмента антитела с TLR7 оценивают методом проточной цитометрии в соответствии с традиционным способом.
[0040]
В настоящем описании ингибирование функции TLR7 означает подавление продукции IL-6 и/или интерферона I типа TLR7-экспрессирующими клетками. Активность ингибирования функции TLR7 оценивают путем инкубации TLR7-экспрессирующих клеток (например, PBMC) in vitro в присутствии антитела или антигенсвязывающего фрагмента антитела и измерения концентрации IL-6 или интерферона I типа в культуральном супернатанте.
[0041]
В одном варианте осуществления настоящего изобретения TLR7 человека представляет собой молекулу, состоящую из аминокислотной последовательности SEQ ID NO:2 или SEQ ID NO:4, TLR7 обезьяны представляет собой молекулу, состоящую из аминокислотной последовательности SEQ ID NO:85, TLR7 мыши представляет собой молекулу, состоящую из аминокислотной последовательности SEQ ID NO:83, или TLR7 крысы представляет собой молекулу, состоящую из аминокислотной последовательности SEQ ID NO:84. Например, в настоящем изобретении TLR7 человека может представлять собой молекулу, состоящую из аминокислотной последовательности SEQ ID NO:2 или SEQ ID NO:4, TLR7 обезьяны может представлять собой молекулу, состоящую из аминокислотной последовательности SEQ ID NO:85, TLR7 мыши может представлять собой молекулу, состоящую из аминокислотной последовательности SEQ ID NO:83, и TLR7 крысы может представлять собой молекулу, состоящую из аминокислотной последовательности SEQ ID NO:84.
[0042]
Например, антитело или антигенсвязывающий фрагмент антитела по настоящему изобретению может представлять собой антитело против человеческого TLR7 или антигенсвязывающий фрагмент антитела, которое обладает следующими свойствами:
(a) специфически связывается с TLR7 человека и не связывается с TLR7 мыши и/или TLR7 крысы; и
(b) ингибирует функцию человеческого TLR7, где человеческий TLR7 представляет собой молекулу, состоящую из аминокислотной последовательности SEQ ID NO:2 или SEQ ID NO:4, TLR7 мыши представляет собой молекулу, состоящую из аминокислотной последовательности SEQ ID NO:83, и TLR7 крысы представляет собой молекулу, состоящую из аминокислотной последовательности SEQ ID NO:84.
[0043]
Например, антитело или антигенсвязывающий фрагмент антитела по настоящему изобретению может представлять собой антитело к TLR7 обезьяны или антигенсвязывающий фрагмент антитела, которое обладает следующими свойствами:
(a) специфически связывается с TLR7 обезьяны и не связывается с TLR7 мыши и/или TLR7 крысы; и
(b) ингибирует функцию TLR7 обезьяны, где TLR7 обезьяны представляет собой молекулу, состоящую из аминокислотной последовательности SEQ ID NO:85, TLR7 мыши представляет собой молекулу, состоящую из аминокислотной последовательности SEQ ID NO:83, и TLR7 крысы представляет собой молекулу, состоящую из аминокислотной последовательности SEQ ID NO:84.
[0044]
Далее анти-TLR7 антитело по настоящему изобретению и способ его получения описаны со ссылкой на антитело против человеческого TLR7 в качестве примера. Антитело против TLR7 обезьяны также можно получить таким же способом, как способ получения антитела против человеческого TLR7.
[0045]
Антитело к человеческому TLR7 по настоящему изобретению можно получить путем иммунизации животного человеческим TLR7 или любым полипептидом, выбранным из аминокислотной последовательности человеческого TLR7, и сбора и очистки антитела, продуцируемого in vivo, с использованием традиционных способов.
[0046]
Человеческий TLR7, служащий в качестве антигена, можно получить путем обеспечения экспрессии гена TLR7 человека в клетке-хозяине генноинженерными методами. В частности, можно получить вектор, способный экспрессировать TLR7 ген, и ввести в клетку-хозяин для экспрессии гена, и экспрессированный TLR7 можно очистить.
[0047]
Антитело к человеческому TLR7 по настоящему изобретению можно получить также путем ДНК иммунизации. ДНК иммунизация представляет собой метод для индукции иммунитета к антигену путем трансфицирования субъекта-животного, такого как мышь или крыса, с использованием антиген-экспрессирующей плазмиды, обеспечивая, таким образом, возможность экспрессии антигена указанным субъектом.
[0048]
Примеры методов трансфекции включают метод непосредственного введения плазмиды в мышцу путем инъекции, метод инъекции конъюгата плазмиды с липосомой, полиэтиленимином или т.п. в вену, метод с использованием вирусных векторов, метод инъекции частиц золота с присоединенной плазмидой с использованием генной пушки и гидродинамический метод быстрой инъекции большого количества раствора плазмиды в вену.
[0049]
Для повышения уровня экспрессии при трансфекции путем внутримышечной инъекции экспрессирующей плазмиды метод, включающий внутримышечную инъекцию плазмиды и затем применение электропорации на этом же месте (Aihara H, Miyazaki J. Nat Biotechnol. 1998 Sep; 16(9): 867-70, или Mir LM, Bureau MF, Gehl J, Rangara R, Rouy D, Caillaud JM, Delaere P, Branellec D, Schwartz B, Scherman D. Proc Natl Acad Sci U S A. 1999 Apr 13; 96(8): 4262-7), известен как электропорация in-vivo. В этом методе уровень экспрессии еще больше повышают путем обработки мышцы гиалуронидазой перед внутримышечной инъекцией плазмиды (McMahon JM, Signori E, Wells KE, Fazio VM, Wells DJ. Gene Ther. 2001 Aug; 8(16): 1264-70).
[0050]
Кроме того, моноклональное антитело также можно получить в соответствии с известным способом (например, Kohler and Milstein, Nature (1975) 256, p. 495-497, Kennet, R. ed., Monoclonal Antibodies, p. 365-367, Plenum Press, N.Y. (1980)), путем слияния антитело-продуцирующей клетки, которая продуцирует антитело к TLR7, с миеломной клеткой для установления гибридомы. Конкретные примеры такого способа включают способы, описанные в Международной публикации WO 09/48072 (опубликованной 16 апреля 2009 года) и Международной публикации WO 10/117011 (опубликованной 14 октября 2010 года).
[0051]
Примеры мышиного антитела к человеческому TLR7, созданного как описано выше, могут включать антитело AT01, антитело NB7 и антитело FAN2.
[0052]
Аминокислотная последовательность вариабельной области тяжелой цепи антитела AT01 представлена в SEQ ID NO:5 в Перечне последовательностей, а полинуклеотидная последовательность, кодирующая аминокислотную последовательность, представлена в SEQ ID NO:6 в Перечне последовательностей. Аминокислотная последовательность вариабельной области тяжелой цепи антитела NB7 представлена в SEQ ID NO:7 в Перечне последовательностей, а полинуклеотидная последовательность, кодирующая аминокислотную последовательность, представлена в SEQ ID NO:8 в Перечне последовательностей. Аминокислотная последовательность вариабельной области тяжелой цепи антитела FAN2 представлена в SEQ ID NO:9 в Перечне последовательностей, а полинуклеотидная последовательность, кодирующая аминокислотную последовательность, представлена в SEQ ID NO:10 в Перечне последовательностей.
[0053]
Кроме того, аминокислотная последовательность вариабельной области легкой цепи антитела AT01 представлена в SEQ ID NO:11 в Перечне последовательностей, а полинуклеотидная последовательность, кодирующая аминокислотную последовательность, представлена в SEQ ID NO:12 в Перечне последовательностей. Аминокислотная последовательность вариабельной области легкой цепи антитела NB7 представлена в SEQ ID NO:13 в Перечне последовательностей, а полинуклеотидная последовательность, кодирующая аминокислотную последовательность, представлена в SEQ ID NO:14 в Перечне последовательностей. Аминокислотная последовательность вариабельной области легкой цепи антитела FAN2 представлена в SEQ ID NO:15 в Перечне последовательностей, а полинуклеотидная последовательность, кодирующая аминокислотную последовательность, представлена в SEQ ID NO:16 в Перечне последовательностей.
[0054]
Вариабельная область тяжелой цепи антитела AT01 включает CDRH1, состоящую из аминокислотной последовательности SEQ ID NO:17 (GYTFTNNWLH), CDRH2, состоящую из аминокислотной последовательности SEQ ID NO:18 (DIYPSNGRTN), и CDRH3, состоящую из аминокислотной последовательности SEQ ID NO:19 (ERGYFDY). Кроме того, вариабельная область легкой цепи антитела включает CDRL1, состоящую из аминокислотной последовательности SEQ ID NO:20 (KASQDINKYIA), CDRL2, состоящую из аминокислотной последовательности SEQ ID NO:21 (YTSTLQP), и CDRL3, состоящую из аминокислотной последовательности SEQ ID NO:22 (LQYDYLLT). Аминокислотные последовательности указанных выше CDR показаны также на Фиг. 24-1.
[0055]
Вариабельная область тяжелой цепи антитела NB7 включает CDRH1, состоящую из аминокислотной последовательности SEQ ID NO:23 (GYSITSDYAWN), CDRH2, состоящую из аминокислотной последовательности SEQ ID NO:24 (HISYRGNTN), и CDRH3, состоящую из аминокислотной последовательности SEQ ID NO:25 (WNYYGYVDYAMDY). Кроме того, вариабельная область легкой цепи антитела включает CDRL1, состоящую из аминокислотной последовательности SEQ ID NO:26 (RASQDISNYLN), CDRL2, состоящую из аминокислотной последовательности SEQ ID NO:27 (YTSRLHS), и CDRL3, состоящую из аминокислотной последовательности SEQ ID NO:28 (QQGDTFPT). Аминокислотные последовательности указанных выше CDR показаны также на Фиг. 24-2.
[0056]
Вариабельная область тяжелой цепи антитела FAN2 включает CDRH1, состоящую из аминокислотной последовательности SEQ ID NO:29 (GFSLTGYGVN), CDRH2, состоящую из аминокислотной последовательности SEQ ID NO:30 (MIWGDGSTD), и CDRH3, состоящую из аминокислотной последовательности SEQ ID NO:31 (DKGYDGYYYAMDY). Кроме того, вариабельная область легкой цепи антитела включает CDRL1, состоящую из аминокислотной последовательности SEQ ID NO:32 (RASENIYSYLA), CDRL2, состоящую из аминокислотной последовательности SEQ ID NO:33 (DAKTLAE), и CDRL3, состоящую из аминокислотной последовательности SEQ ID NO:34 (QHHYGIPYT). Аминокислотные последовательности указанных выше CDR показаны также на Фиг. 24-3.
[0057]
В одном варианте осуществления антитело или антигенсвязывающий фрагмент антитела по настоящему изобретению может обладать конкурентной ингибиторной активностью за связывание с человеческим TLR7 с антителом, содержащим аминокислотные последовательности вариабельной области тяжелой цепи и вариабельной области легкой цепи антитела AT01, антитела NB7 или антитела FAN2.
[0058]
В другом варианте осуществления антитело или антигенсвязывающий фрагмент антитела по настоящему изобретению может представлять собой антитело или антигенсвязывающий фрагмент антитела, которое включает CDRH1-CDRH3 антитела AT01 в качестве определяющих комплементарность областей в тяжелой цепи и CDRL1-CDRL3 антитела AT01 в качестве определяющих комплементарность областей в легкой цепи, антитело или антигенсвязывающий фрагмент антитела, которое включает CDRH1-CDRH3 антитела NB7 в качестве определяющих комплементарность областей в тяжелой цепи и CDRL1-CDRL3 антитела NB7 в качестве определяющих комплементарность областей в легкой цепи, или антитело или антигенсвязывающий фрагмент антитела, которое включает CDRH1-CDRH3 антитела FAN2 в качестве определяющих комплементарность областей в тяжелой цепи и CDRL1-CDRL3 антитела FAN2 в качестве определяющих комплементарность областей в легкой цепи. В предпочтительном аспекте антитело или антигенсвязывающий фрагмент антитела по настоящему изобретению может представлять собой антитело или антигенсвязывающий фрагмент антитела, которое включает CDRH1-CDRH3 антитела AT01 в качестве определяющих комплементарность областей в тяжелой цепи и CDRL1-CDRL3 антитела AT01 в качестве определяющих комплементарность областей в легкой цепи.
[0059]
Еще в одном варианте осуществления антитело или антигенсвязывающий фрагмент антитела по настоящему изобретению может представлять собой антитело, включающее последовательности вариабельной области тяжелой цепи и вариабельной области легкой цепи антитела AT01, антитела NB7 или антитела FAN2.
[0060]
Антитело по настоящему изобретению включает рекомбинантные антитела, искусственно модифицированные для снижения гетероантигенности для людей и т.п., такие как химерные антитела, гуманизированные антитела и человеческие антитела, в дополнение к указанным выше моноклональным антителам к человеческому TLR7. Эти антитела можно получить с использованием известных способов.
[0061]
Примеры химерных антител могут включать антитело, в котором вариабельная область и константная область антитела гетерогенны друг другу, такое как химерное антитело с вариабельной областью, происходящей из мышиного или крысиного антитела, объединенной с константной областью человеческого происхождения (см. Proc. Natl. Acad. Sci. U. S. A., 81, 6851-6855, (1984)). Примеры химерного антитела, полученного из мышиного антитела к человеческому TLR7 (антитела AT01), могут включать антитело, состоящее из тяжелой цепи, включающей вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:5, и легкой цепи, включающей вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:11. Примеры AT01 антитело-происходящего химерного антитела могут включать антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности в положениях 20-465 в SEQ ID NO:35, и легкой цепи, состоящей из аминокислотной последовательности в положениях 21-233 в SEQ ID NO:36. В настоящем описании такое антитело указано как "cAT01" или "антитело cAT01".
[0062]
Кроме того, примеры химерного антитела, полученного из мышиного антитела к человеческому TLR7 (антитела NB7), могут включать антитело, состоящее из тяжелой цепи, включающей вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:7, и легкой цепи, включающей вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:13. Примеры NB7 антитело-происходящего химерного антитела могут включать антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности в положениях 20-471 в SEQ ID NO:37, и легкой цепи, состоящей из аминокислотной последовательности в положениях 21-233 в SEQ ID NO:38. В настоящем описании такое антитело указано как "cNB7" или "антитело cNB7".
[0063]
Кроме того, примеры химерного антитела, полученного из мышиного антитела к человеческому TLR7 (антитела FAN2), могут включать антитело, состоящее из тяжелой цепи, включающей вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:9, и легкой цепи, включающей вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:15. Примеры FAN2 антитело-происходящего химерного антитела могут включать антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности в положениях 20-470 в SEQ ID NO:39, и легкой цепи, состоящей из аминокислотной последовательности в положениях 21-234 в SEQ ID NO:40. В настоящем описании такое антитело указано как "cFAN2" или "антитело cFAN2".
[0064]
Гуманизированные антитела, которые являются рекомбинантными антителами, можно получить путем искусственной модификации последовательностей указанных выше химерных антител к человеческому TLR7 для снижения гетероантигенности для человека и т.п. Кроме того, антитело по настоящему изобретению включает антитела с модифицированными CDR гуманизированных антител. Эти антитела можно получить с использованием известных способов.
[0065]
Примеры гуманизированных антител могут включать антитело только с CDR, встроенными в полученное от человека антитело (см. Nature (1986) 321, p. 522-525), и антитело не только с последовательностями CDR, но также с аминокислотными остатками из некоторых частей каркасной области, привитых в человеческое антитело (Международная публикация WO 90/07861).
[0066]
Например, гуманизированные антитела, происходящие из антитела cAT01 и антитела cNB7, сохраняют все из 6 CDR последовательностей, происходящих из cAT01 или cNB7, и обладают активностью ингибирования функции человеческого TLR7.
[0067]
Подходящие случаи указанных выше гуманизированных антител могут включать cAT01 антитело-происходящие гуманизированные антитела (антитела huAT01), такие как: антитело, состоящее из тяжелой цепи, включающей вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:41, и легкой цепи, включающей вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:43; антитело, состоящее из тяжелой цепи, включающей вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:41, и легкой цепи, включающей вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:44; антитело, состоящее из тяжелой цепи, включающей вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:42, и легкой цепи, включающей вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:43; и антитело, состоящее из тяжелой цепи, включающей вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:42, и легкой цепи, включающей вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:44.
[0068]
Кроме того, антитело, обладающее активностью, эквивалентной указанному выше антителу huAT01, может быть выбрано путем сочетания последовательностей, демонстрирующих высокую гомологию с аминокислотной последовательностью вариабельной области тяжелой цепи и аминокислотной последовательностью вариабельной области легкой цепи указанного выше антитела huAT01, соответственно. Гомология как правило, представляет собой гомологию 80% или больше, предпочтительно гомологию 90% или больше, более предпочтительно гомологию 95% или больше, наиболее предпочтительно гомологию 99% или больше (однако, CDR являются такими же, как в указанных выше антителах). Кроме того, антитело, обладающее активностью, эквивалентной указанным выше антителам, также может быть выбрано путем сочетания аминокислотной последовательности с заменой, делецией или добавлением одного-нескольких (например, 2, 3, 4, 5, 6, 7, 8, 9 или 10) аминокислотных остатков в аминокислотной последовательности вариабельной области тяжелой цепи или вариабельной области легкой цепи (однако, за исключением сайтов CDR).
[0069]
Другие подходящие случаи могут включать: антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности в положениях 20-465 в аминокислотной последовательности SEQ ID NO:45, и легкой цепи, состоящей из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:48; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности в положениях 20-465 в аминокислотной последовательности SEQ ID NO:45, и легкой цепи, состоящей из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:49; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности в положениях 20-465 в аминокислотной последовательности SEQ ID NO:46, и легкой цепи, состоящей из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:48; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности в положениях 20-465 в аминокислотной последовательности SEQ ID NO:46, и легкой цепи, состоящей из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:49; антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности в положениях 20-462 в аминокислотной последовательности SEQ ID NO:47, и легкой цепи, состоящей из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:48; или антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности в положениях 20-462 в аминокислотной последовательности SEQ ID NO:47, и легкой цепи, состоящей из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:49.
[0070]
Кроме того, примеры cNB7 антитело-происходящего гуманизированного антитела (антитела huNB7) могут включать антитело, состоящее из тяжелой цепи, включающей вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO:50, и легкой цепи, включающей вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO:51.
[0071]
Кроме того, антитело, обладающее активностью, эквивалентной указанному выше антителу huNB7, может быть выбрано путем сочетания последовательностей, демонстрирующих высокую гомологию с аминокислотной последовательностью вариабельной области тяжелой цепи и аминокислотной последовательностью вариабельной области легкой цепи указанного выше антитела huNB7. Гомология, как правило, представляет собой гомологию 80% или больше, предпочтительно гомологию 90% или больше, более предпочтительно гомологию 95% или больше, наиболее предпочтительно гомологию 99% или больше (однако, CDR являются такими же, как в указанных выше антителах). Кроме того, антитело, обладающее активностью, эквивалентной указанному выше антителу, также может быть выбрано путем сочетания аминокислотной последовательности с заменой, делецией или добавлением одного-нескольких (например, 2, 3, 4, 5, 6, 7, 8, 9 или 10) аминокислотных остатков в аминокислотной последовательности вариабельной области тяжелой цепи или вариабельной области легкой цепи (однако, за исключением сайтов CDR).
[0072]
Другие подходящие случаи могут включать: антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности в положениях 20-471 в аминокислотной последовательности SEQ ID NO:52, и легкой цепи, состоящей из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:53; или антитело, состоящее из тяжелой цепи, состоящей из аминокислотной последовательности в положениях 20-468 в аминокислотной последовательности SEQ ID NO:54, и легкой цепи, состоящей из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO:53.
[0073]
Антитело по настоящему изобретению можно получить путем введения дополнительной мутации в указанные выше гуманизированные антитела для изменения связывающей способности в отношении TLR7 человека. Такой метод называется созреванием аффинности, и конкретные примеры могут включать метод рибосомного дисплея. Рибосомный дисплей представляет собой метод выделения генной последовательности белка, который связывается с молекулой-мишенью, с использованием трехкомпонентного комплекса, в котором белок и мРНК, несущая генетическую информацию белка, связаны вместе через рибосомы (Stafford RL. et. al. Protein Eng. Des. Sel. 2014 (4): 97-109).
[0074]
Чтобы избежать повреждения нормальных экспрессирующих человеческий TLR7 клеток, желательно, чтобы антитело имело низкую эффекторную активность. Известно, что эффекторная активность различается в зависимости от подкласса антитела. Например, характерной особенностью IgG4 является то, что он имеет низкие ADCC и CDC активности, а характерной особенностью IgG2 является то, что он обладает CDC активностью, имея при этом низкую ADCC активность. На основании таких характерных особенностей антитело с пониженными ADCC и CDC активностями можно получить путем замены константной области IgG1 константной областью IgG2 или IgG4. Кроме того, IgG1 антитело с пониженными ADCC и CDC активностями можно получить путем частичной замены последовательности константной области IgG1 со ссылкой на IgG2 или IgG4. В качестве примера, Marjan Hezareh et. al. Journal of Virology, 75 (24): 12161-12168 (2001) показывает, что ADCC и CDC активности снижаются путем замены лейциновых остатков 234 и 235 (нумерация представлена в соответствии с EU-индексом Kabat et. al.) IgG1, соответственно, аланиновыми остатками.
[0075]
Настоящее изобретение включает модифицированные формы антитела или антигенсвязывающего фрагмента антитела. Модифицированные формы означают формы, образованные путем модификации химическим или биологическим путем антитела или антигенсвязывающего фрагмента антитела по настоящему изобретению. Химически модифицированные формы включают химически модифицированные формы углеводной цепи путем присоединения химической группы к аминокислотному каркасу, N-связи или O-связи. Биологически модифицированные формы включают формы, модифицированные после трансляции (например, путем гликозилирования до N-связи или O-связи, N-концевого или C-концевого процессинга, дезамидирования, изомеризации аспарагиновой кислоты и окисления метионина), и формы с метиониновым остатком, добавленным на N-конце путем экспрессии с использованием прокариотических клеток-хозяев. Кроме того, модифицированные продукты также означают продукты, меченные для обеспечения возможности детекции или выделения антитела по настоящему изобретению или антигена, такие как фермент-меченные продукты, флуоресцентно-меченные продукты и аффинно-меченные продукты. Такие модифицированные продукты антитела или антигенсвязывающего фрагмента антитела по настоящему изобретению полезны для улучшения стабильности и удержания в кровотоке исходного антитела по настоящему изобретению, уменьшения антигенности и детекции или выделения антитела или антигена.
[0076]
Известно, что лизиновый остаток на карбоксиконце тяжелой цепи антител, продуцируемых в культивированных клетках млекопитающих, делетирован (Journal of Chromatography A, 705: 129-134 (1995)). Кроме того, также известно, что два аминокислотных остатка, глицин и лизин, на карбоксиконце одной и той же тяжелой цепи делетированы, а новый появившийся на карбоксиконце пролиновый остаток амидирован (Analytical Biochemistry, 360: 75-83 (2007)).
[0077]
Однако такие делеции и модификации последовательности тяжелой цепи не оказывают никакого влияния на антигенсвязывающую способность и эффекторные функции (такие как активация комплемента и антитело-зависимая клеточная цитотоксичность) антитела.
[0078]
Соответственно, примеры модифицированных форм антитела и антигенсвязывающего фрагмента антитела по настоящему изобретению могут включать: делеционные варианты с одной или двумя аминокислотами, делетированными на карбоксиконце тяжелой цепи; и амидированные делеционные варианты (такие как тяжелая цепь с амидированным пролиновым остатком в карбоксиконцевой части). Однако делеционные варианты на карбоксиконце тяжелой цепи антитела в соответствии с настоящим изобретением не ограничиваются указанными выше типами, при условии, что сохраняются антигенсвязывающая способность и эффекторные функции.
[0079]
Две тяжелые цепи, составляющие антитело в соответствии с настоящим изобретением, могут представлять собой комбинацию любого одного или двух типов тяжелых цепей, выбранных из группы, состоящей из полноразмерных и указанных выше делеционных вариантов. На количественное соотношение делеционных вариантов может влиять тип культивируемых клеток млекопитающего и условия культивирования для получения антитела в соответствии с настоящим изобретением, но примеры основного компонента антитела в соответствии с настоящим изобретением могут включать компонент с одним аминокислотным остатком, делетированным на карбоксиконце в каждой из двух тяжелых цепей. Таким образом, тяжелые цепи, состоящие из аминокислотных последовательностей с делецией одной или двух аминокислот на карбоксиконце последовательности каждой тяжелой цепи, представленной аминокислотной последовательностью в положениях 20-465 в SEQ ID NO:35, аминокислотной последовательностью в положениях 20-471 в SEQ ID NO:37, аминокислотной последовательностью в положениях 20-470 в SEQ ID NO:39, аминокислотной последовательностью в положениях 20-465 в SEQ ID NO:45, аминокислотной последовательностью в положениях 20-465 в SEQ ID NO:46, аминокислотной последовательностью в положениях 20-462 в SEQ ID NO:47, аминокислотной последовательностью в положениях 20-471 в SEQ ID NO:52 и аминокислотной последовательностью в положениях 20-468 в SEQ ID NO:54 в Перечне последовательностей, также можно использовать для антитела по настоящему изобретению.
[0080]
Антитела, полученные указанными выше способами, оценивают на их связывающие свойства в отношении антигена, чтобы из них можно было выбрать подходящее антитело. Другим показателем для сравнения свойств антител может быть, например, стабильность антител. Дифференциальная сканирующая калориметрия (DSC) представляет собой метод, который позволяет быстро и точно измерить среднюю точку термической денатурации (Tm), которая является хорошим индикатором относительной структурной стабильности белков. Различия в термостабильности можно сравнить, измерив значения Tm с использованием DSC и сравнив эти значения. Известно, что стабильность антител при хранении показывает некоторую корреляцию с термостабильностью антител (Lori Burton, et. Al., Pharmaceutical Development and Technology (2007) 12, p. 265-273), и подходящее антитело может быть выбрано, используя в качестве показателя термостабильность. Примеры других показателей для выбора антитела могут включать высокий выход в подходящей клетке-хозяине и низкую способность к агрегации в водном растворе. Так как антитело, например, с наивысшим выходом, необязательно демонстрирует наивысшую термостабильность, необходимо осуществить всестороннее определение на основе вышеуказанных показателей, чтобы выбрать антитело, которое наиболее подходит для введения людям.
[0081]
Кроме того, также известен способ получения одноцепочечного иммуноглобулина путем связывания полноразмерных последовательностей тяжелой и легкой цепей антитела с использованием подходящего линкера (Lee, H-S, et. al., Molecular Immunology (1999) 36, p. 61-71; Shirrmann, T. et al., mAbs (2010), 2, (1) p. 73-76). Такой одноцепочечный иммуноглобулин димеризован и, таким образом, может сохранять структуру и активность, аналогичные структуре и активности антитела, которое изначально было тетрамером. Кроме того, антитело по настоящему изобретению может представлять собой антитело, включающее одну вариабельную область тяжелой цепи и никаких последовательностей легкой цепи. Такое антитело называется однодоменным антителом (sdAb) или нанотелом и, как сообщается, действительно наблюдается у верблюдов или лам и поддерживает антигенсвязывающую способность (Muyldermans S. et. Al., Protein Eng. (1994) 7 (9), 1129-35, Hamers-Casterman C. et. Al., Nature (1993) 363 (6428) 446-8). Указанное выше антитело также можно представить представить как своего рода антигенсвязывающий фрагментантитела по настоящему изобретению.
[0082]
Кроме того, антитело-зависимую клеточную цитотоксичность можно повысить путем регулирования гликозилирования, связанного с антителом по настоящему изобретению. Международная публикация WO 99/54342, Международная публикация WO 00/61739, Международная публикация WO 02/31140, Международная публикация WO 2007/133855, Международная публикация WO 2013/120066 и т.п. известны как способы регулирования гликозилирования антител, но нет никаких ограничений, что касается таких способов.
[0083]
В случае получения антитела путем сначала выделения гена антитела и затем его введения в подходящую клетку-хозяин можно использовать комбинацию такой подходящей клетки-хозяина и вектора экспрессии.
[0084]
Конкретные примеры гена антитела могут включать комбинацию гена, кодирующего последовательность тяжелой цепи, и гена, кодирующего последовательность легкой цепи антител в настоящем описании. Более конкретно, примеры гена антитела могут включать комбинацию полинуклеотида, включающего полинуклеотидную последовательность, кодирующую антитело или антигенсвязывающий фрагмент антитела по настоящему изобретению, полинуклеотида, включающего полинуклеотидную последовательность, кодирующую аминокислотную последовательность вариабельной области тяжелой цепи антитела или антигенсвязывающего фрагмента антитела по настоящему изобретению, и полинуклеотида, включающего полинуклеотидную последовательность, кодирующую аминокислотную последовательность вариабельной области легкой цепи антитела или антигенсвязывающего фрагмента антитела по настоящему изобретению. Ген последовательности тяжелой цепи, составляющий ген антитела, также включает полинуклеотид, включающий полинуклеотидную последовательность полинуклеотида, который гибридизуется с полинуклеотидом, состоящим из полинуклеотидной последовательности, комплементарной указанной выше полинуклеотидной последовательности, кодирующей вариабельную область тяжелой цепи, в жестких условиях. Кроме того, ген последовательности легкой цепи, составляющий ген антитела, также включает полинуклеотид, включающий полинуклеотидную последовательность полинуклеотида, который гибридизуется с полинуклеотидом, состоящим из полинуклеотидной последовательности, комплементарной указанной выше полинуклеотидной последовательности, кодирующей вариабельную область легкой цепи, в жестких условиях.
[0085]
При трансформировании клетки-хозяина ген последовательности тяжелой цепи и ген последовательности легкой цепи могут быть встроены в один и тот же вектор экспрессии или в разные векторы экспрессии. В случае использования эукариотической клетки в качестве клетки-хозяина, можно использовать клетки животных, клетки растений и эукариотические микроорганизмы. Примеры клеток животных могут включать (1) клетки млекопитающих, такие как COS клетки (Gluzman, Y. Cell (1981) 23, p. 175-182, ATCC CRL-1650), которые являются клетками обезьяны, и дигидрофолатредуктаза-дефицитные штаммы (Urlaub, G. и Chasin, L. A. Proc. Natl. Acad. Sci. U. S. A. (1980) 77, p. 4126-4220) мышиных фибробластов NIH3T3 (ATCC No. CRL-1658) и клетки яичника китайского хомячка (CHO клетки, ATCC CCL-61). Кроме того, в случае использования прокариотических клеток примеры могут включать Escherichia coli и Bacillus subtilis. Антитело получают путем введения гена целевого антитела в такую клетку путем трансформации и культивирования трансформированной клетки in vitro. Поскольку выход может различаться в зависимости от последовательности антитела в указанном выше способе культивирования, в качестве фармацевтических продуктов можно выбрать легко получаемые антитела из антител, обладающих одинаковой активностью связывания, с использованием выхода в качестве показателя.
[0086]
Нет никакого ограничения, что касается изотипа антитела по настоящему изобретению, и примеры могут включать IgG (IgG1, IgG2, IgG3 и IgG4), IgM, IgA (IgA1 и IgA2), IgD или IgE, предпочтительно IgG или IgM, более предпочтительно IgG1 или IgG4.
[0087]
Кроме того, антитело по настоящему изобретению может представлять собой антигенсвязывающий фрагмент антитела, включающий антигенсвязывающий сайт антитела или его модифицированного продукта. Фрагмент антитела можно получить обработкой антитела протеазой, такой как папаин и пепсин, или модификацией гена антитела генноинженерным методом для обеспечения возможности экспрессии в подходящей культивированной клетке. Из таких фрагментов антитела фрагменты, сохраняющие все или часть функций полноразмерных молекул антитела, могут называться антигенсвязывающими фрагментами антитела.
[0088]
Примеры функций антител в основном могут включать антигенсвязывающую активность, активность нейтрализации антигенной активности, активность усиления антигенной активности, антитело-зависимую цитотоксичность, комплемент-зависимую цитотоксичность и комплемент-зависимую клеточную цитотоксичность. Функция антигенсвязывающего фрагмента антитела в настоящем изобретении представляет собой активность связывания с TLR7 человека, предпочтительно активность ингибирования функции человеческого TLR7, более предпочтительно активность подавления продукции IL-6 и/или интерферона I типа TLR7-экспрессирующими клетками.
[0089]
Примеры фрагмента антитела могут включать Fab, F(ab')2, Fv или одноцепочечные Fv (scFv), полученные путем связывания Fv тяжелой и легкой цепей подходящим линкером, диатела, линейные антитела и мультиспецифические антитела, образованные из фрагментов антител. Кроме того, фрагмент антитела также включает одновалентный Fab' фрагмент в вариабельной области антитела, полученный обработкой F(ab')2 в восстанавливающих условиях.
[0090]
Кроме того, антитело по настоящему изобретению может представлять собой мультиспецифическое антитело, обладающее специфичностью в отношении по меньшей мере двух типов различных антигенов. Как правило, такая молекула связывается с двумя типами антигенов (т.е. биспецифическое антитело), но "мультиспецифическое антитело" в настоящем изобретении включает антитела, обладающие специфичностью в отношении большего числа (например, трех типов) антигенов.
[0091]
Мультиспецифическое антитело по настоящему изобретению может представлять собой антитело, состоящее из полноразмерного антитела или фрагмента такого антитела (например, F(ab')2 биспецифическое антитело). Биспецифическое антитело можно получить также путем связывания тяжелой и легкой цепей (HL пары) двух типов антител друг с другом или путем получения биспецифическое антитело-продуцирующей слитой клетки методом слияния гибридом, которые продуцируют разные моноклональные антитела (Millstein et al., Nature (1983) 305, p. 537-539).
[0092]
Антитело по настоящему изобретению также может представлять собой одноцепочечное антитело (которое также может быть указано как scFv). Одноцепочечное антитело можно получить путем связывания вариабельной области тяжелой цепи и вариабельной области легкой цепи антитела при помощи полипептидного линкера (Pluckthun, The Pharmacology of Monoclonal Antibodies, 113 (edited by Rosenberg and Moore), Springer Verlag, New York, p. 269-315 (1994), Nature Biotechnology (2005), 23, p. 1126-1136). Кроме того, BiscFv фрагмент, полученный путем связывания двух scFv полипептидным линкером, также можно использовать в качестве биспецифического антитела.
[0093]
Способы для получения одноцепочечных антител известны в данной области техники (например, см. патент США № 4946778, патент США № 5260203, патент США № 5091513 и патент США № 5455030). В таком scFv вариабельная область тяжелой цепи и вариабельная область легкой цепи связаны через линкер, который не образует конъюгаты, предпочтительно полипептидный линкер (Huston, J. S. et al., Proc. Natl. Acad. Sci. U. S. A. (1988), 85, p. 5879-5883). Вариабельная область тяжелой цепи и вариабельная область легкой цепи в scFv могут происходить из одного и того же антитела или из разных антител. Любой одноцепочечный пептид, состоящий из 12-19 остатков, например, используют в качестве полипептидного линкера, который связывает вариабельные области.
[0094]
ДНК, кодирующую scFv, получают путем ПЦР амплификации с использованием элемента ДНК, кодирующего всю или желаемую часть аминокислотной последовательности, ДНК, кодирующей тяжелую цепь или вариабельную область тяжелой цепи антитела, и ДНК, кодирующей его легкую цепь или вариабельную область легкой цепи, в качестве матрицы и пары праймеров, ограничивающих последовательность с двух сторон, и дальнейшей амплификации путем объединения ДНК, кодирующей участок полипептидного линкера, и пары праймеров, ограничивающих последовательность с двух сторон, для возможности связывания, соответственно, с тяжелой цепью и легкой цепью.
[0095]
Кроме того, после получения ДНК, кодирующей scFv, можно получить вектор экспрессии, содержащий ДНК, и клетку-хозяин, трансформированную вектором экспрессии, в соответствии с традиционными способами. Кроме того, scFv можно получить с использованием клетки-хозяина в соответствии с традиционным способом. Такой фрагмент антитела можно получить путем получения и экспрессии его гена в клетке-хозяине, как описано выше.
[0096]
Антитело по настоящему изобретению может представлять собой антитело, мультимеризованное для повышения аффинности к антигену. Антитело, которое должно быть мультимеризовано, может представлять собой одно антитело или несколько антител, которые распознают несколько эпитопов одного и того же антигена. Примеры способа мультимеризации антитела могут включать связывание IgG CH3 домена с двумя scFv, связывание с стрептавидином и введение мотива спираль-петля-спираль.
[0097]
Антитело по настоящему изобретению может представлять собой поликлональное антитело, которое представляет собой смесь нескольких типов антител против TLR7 человека, включающих разные аминокислотные последовательности. В качестве примера поликлонального антитела можно указать смесь нескольких типов антител, включающих разные CDR. В качестве такого поликлонального антитела можно использовать антитело, очищенное из культуры, полученной культивированием смеси клеток, которые продуцируют разные антитела (см. международную публикацию WO 2004/061104).
[0098]
В качестве модифицированного продука антитела можно использовать антитело, связанное с различными молекулами, такими как полиэтиленгликоль (ПЭГ).
[0099]
Антитело по настоящему изобретению также может представлять собой иммуноконъюгат, образованный таким антителом и другим лекарственным средством. Примеры антитела могут включать антитело, связанное с радиоактивным веществом или соединением, обладающим фармакологическим действием (Nature Biotechnology (2005) 23, p. 1137-1146).
[0100]
Полученное антитело можно очистить до гомогенности. Для разделения и очистки антитела можно использовать обычные методы разделения и очистки, используемые для белков. Например, антитело можно разделить и очистить путем соответствующего выбора и комбинирования колоночной хроматографии, фильтрации на фильтре, ультрафильтрации, высаливания, диализа, препаративного электрофореза в полиакриламидном геле, изоэлектрического фокусирования и т.п. (Strategies для Protein Purification and Characterization: A Laboratory Course Manual, Daniel R. Marshak et al. eds., Cold Spring Harbor Laboratory Press (1996); Antibodies: A Laboratory Manual. Ed Harlow and David Lane, Cold Spring Harbor Laboratory (1988)), но нет никаких ограничений, что касается выбора методов.
[0101]
Примеры хроматографии могут включать аффинную хроматографию, ионообменную хроматографию, гидрофобную хроматографию, гель-фильтрационную хроматографию, обращенно-фазовую хроматографию и адсорбционную хроматографию. Такую хроматографию можно осуществить с использованием жидкостной хроматографии, такой как ВЭЖХ и FPLC. Примеры колонки, используемой для аффинной хроматографии, могут включать колонку с протеином А и колонку с протеином G. Примеры колонки, которая представляет собой колонку с протеином А, могут включать Hyper D, POROS, Sepharose F. F. (Pharmacia). Кроме того, антитело также можно очистить с использованием носителя с иммобилизованным антигеном, используя свойство связывания с антигеном.
[0102]
3. Лекарственное средство, содержащее антитело против человеческого TLR7
Антитела, которые ингибируют функцию человеческого TLR7, можно получить из антител к TLR7 человека, полученных способами, раскрытыми в описанном выше разделе "2. Анти-TLR7 антитело и его получение". Эти антитела, которые ингибируют функцию человеческого TLR7, могут ингибировать биологическую активность человеческого TLR7 in vivo, т.е. активацию экспрессирующих человеческий TLR7 клеток, что типично для клеток крови, лигандами человеческого TLR7, и поэтому могут использоваться в качестве лекарственных средств, таких как средства для лечения и/или профилактики заболеваний, вызываемых функцией человеческого TLR7.
[0103]
Заболевания и состояния, вызываемые функцией человеческого TLR7, могут включать связанные с иммунным воспалением заболевания, аллергические заболевания, инфекции или рак.
[0104]
Примеры связанных с иммунным воспалением заболеваний могут включать заболевания соединительной ткани и скелетно-мышечной системы (такие как системная красная волчанка, ревматоидный артрит, ювенильный идиопатический артрит, болезнь Стилла, развившаяся у взрослых, анкилозирующий спондилит, системная склеродерма, полимиозит, дерматомиозит, псориатический артрит, остеоартрит, смешанное заболевание соединительной ткани и мышечная дистрофия), системы крови (такие как аутоиммунная гемолитическая анемия, апластическая анемия и идиопатическая тромбоцитопеническая пурпура), системы пищеварительного тракта (такие как болезнь Крона, язвенный колит и илеит), гепатобилиарной системы и поджелудочной железы и эндокринной системы (такие как аутоиммунный гепатит, вирусный гепатит, алкогольный гепатит, неалкогольный стеатогепатит, первичный склерозирующий холангит, первичный билиарный цирроз, синдром Шегрена, диабет 1 типа, аутоиммунный тиреоидит, болезнь Грейвса и тиреоидит Хашимото), дыхательной системы (такие как хроническая обструктивная болезнь легких, кистозный фиброз и интерстициальная пневмония), черепно-мозгового отдела нервной системы (такие как рассеянный склероз, тяжелая миастения, менингит, энцефаломиелит и аутоиммунный энцефалит), зрительной системы (такие как увеит, трахома и эндофтальмит), сердечно-сосудистой системы (такие как синдром васкулита, гранулематозный полиангиит, гранулематоз Вегенера, миокардит, ишемическая болезнь сердца и атеросклероз), системы кожного эпидермиса (такие как псориаз, пузырчатка, витилиго, контактный дерматит и экзема), почечной системы (такие как гломерулонефрит, диабетическая нефропатия, IgA нефропатия, связанный с пурпурой нефрит, нефроз и интерстициальный цистит) и эндокринной системы (такие как диабет 1 типа, аутоиммунный тиреоидит, болезнь Грейвса и тиреоидит Хашимото) и системное воспаление (например, болезнь Бехчета, синдром антифосфолипидных антител, связанные с IgG4 заболевания, сепсис, кровотечение, гиперчувствительность, отторжение трансплантата и симптомы шока, вызванные, например, химиотерапией рака).
[0105]
Примеры аллергических заболеваний могут включать атопический дерматит, астму, анафилаксию, анафилактоидные реакции, пищевую аллергию, ринит, средний отит, реакции на лекарственные средства, реакции на укусы насекомых, реакции на растения, аллергию на латекс, конъюнктивит и крапивницу.
[0106]
Примеры инфекций могут включать заболевания, вызываемые вирусами (такими как вирус с одноцепочечной РНК, вирус с двухцепочечной РНК, вирус с одноцепочечной ДНК и вирус с двухцепочечной ДНК), бактериями (такими как грамотрицательные бактерии, грамположительные бактерии, кислотоустойчивые бактерии, актиномицеты, спирохеты, спиральные бактерии, Rickettsia, Chlamydia и Mycoplasma), грибками (такими как Trichophyton, Candida, Cryptococcus, Aspergillus, Pneumocystis и Malassezia) и паразитами (такими как филярии, трематоды, цестоды, Distoma, Echinococcus, Entamoeba histolytica, блохи, вши, клещи, Ascaridida и Oxyuridae)
[0107]
Примеры лечения рака могут включать лечения лимфомы, лейкоза, рака молочной железы, рака легкого и рака кожи.
[0108]
Примеры антител против человеческого TLR7 в качестве лекарственных средств могут включать химерные антитела и гуманизированные антитела, которые получены из антитела AT01 и/или антитела NB7, и их CDR модифицированные формы.
[0109]
Ингибиторную активность против функции человеческого TLR7, проявляемую антителами против TLR7 человека in vitro, можно измерить, например, на основании активности подавления активации клеток крови, экспрессирующих TLR7 человека. Например, активность подавления высвобождения IL-6 из PBMC человека путем стимуляции CL264 можно измерить путем добавления каждого антителя против человеческого TLR7 к человеческим PBMC при различных концентрациях.
[0110]
Было экспериментально доказано и широко признано, что при различных связанных с иммунным воспалением заболеваниях, включая системную красную волчанку, повышена концентрация лиганда человеческого TLR7, повышена экспрессия человеческого TLR7 или вызывается стимуляция человеческого TLR7. Воспалительные ответы из-за воспалительных цитокинов, таких как интерлейкин 6 (IL-6), продуцируемых в результате действия лигандов человеческого TLR7 на экспрессирующие человеческий TLR7 клетки, и высвобождение интерферонов I типа из-за повышения и активации продукции антитела вызывают системные иммунные воспалительные ответы и вызывают развитие, или ухудшение, аутоиммунного заболевания, такого как системная красная волчанка. Соответственно, подавление продукции цитокинов, которая зависит от стимуляции человеческого TLR7, приводит к предотвращению и лечению системной красной волчанки и т.п., и применимость антитела к TLR7 человека в качестве лекарственного средства можно определить, используя подавление активности в качестве показателя.
[0111]
Примеры подходящего антитела в настоящем изобретении могут включать антитело или антигенсвязывающий фрагмент антитела, которое связывается специфически с TLR7 человека, включающим аминокислотную последовательность, представленную в SEQ ID NO:2 или 4, и уменьшает количество IL-6, высвобождаемого CL264-обработанными человеческими PBMC, зависимым от концентрации образом.
[0112]
Кроме того, лечебное или профилактическое действие антитела против человеческого TLR7 в отношении различных заболеваний можно проверить на основании системы оценки in-vivo или системы оценки ex-vivo путем введения антитела против человеческого TLR7 обезьянам, перекрестно реагирующим с антителом, или также на основании следующей системы оценки in-vivo путем введения антитела против человеческого TLR7 трансгенным мышам с человеческим TLR7 и мышам с TLR7-нокаутом.
[0113]
Эффекты на продукцию воспалительных цитокинов оценивают путем сравнения способности продуцировать цитокины в периферической крови между группой введения анти-TLR7 антитела и группой, которой не вводили антитело, у мышей с воспалением, индуцированным интраперитонеальным или внутривенным введением лигандов TLR7.
[0114]
Эффекты на атопический дерматит оценивают путем количественной оценки поведения, вызванного атопическим дерматитом, спонтанно развившимся или индуцированным таким методом, как многократное нанесение крема, содержащего антиген клещей, на ушную раковину или спину от 3 до 6 раз каждые 3 дня - 2 недели, нанесение гаптенов на ушную раковину, брюшную полость или спину раз в день - раз в неделю, введение вещества, вызывающего зуд, внутрикожно в ушную раковину, подкожно в спину или интратекально, или использование NC/Nga мышей, которые являются спонтанно атопическими мышами, путем измерения частоты кожного зуда с использованием магнитов, установленных как на тыльной части обеих стоп мышей, так и на устройстве для измерения кожного зуда, или путем наблюдения патологических изменений кожи, периферической крови, ткани спинного мозга и т.п. и сравнения результатов между группой, которой вводили антитело против человеческого TLR7, и группой, которой не осуществляли введение.
[0115]
Эффекты на псориаз оценивают путем количественной оценки псориазиформного дерматита, индуцированного таким методом, как нанесение имиквимода или R848 на ушную раковину и спину после бритья, введение цитокинов, таких как IL-23, мышам внутрикожно в ушную раковину, например, путем измерения массы и толщины воспаленного участка или миелопероксидазной активности нейтрофилов, инфильтрирующих этот участок, путем анализа инфильтрированных клеток методом проточной цитометрии, анализа генов или измерения концентрации цитокинов и сравнения результатов между группой, которой вводили анти-TLR7 антитело, и группой, которой не осуществляли введение.
[0116]
Эффекты на артрит оценивают путем индукции артрита таким методом, как введение эмульсии, полученной путем смешивания раствора бычьего коллагена II типа и полного адъюванта Фрейнда внутрикожно в основание хвоста мышей, а затем введение эмульсии, полученной путем смешивания раствора бычьего коллагена типа II и неполного адъюванта Фрейнда через 2-3 недели или введение антитела к бычьему коллагену II типа и лигандов TLR и сравнение оценки последующего отека сустава, измерение толщины подушки стопы, концентраций антител, цитокинов или биомаркеров крови в крови или тканях, или пролиферативной активности, способности продуцировать цитокины или поверхностные антигены клеток, полученных из периферической крови, селезенки, лимфатических узлов, костного мозга, суставных участков и т.п., между группой, которой вводили антитело против человеческого TLR7, и группой, которой не осуществляли введение.
[0117]
Эффекты на колит оценивают путем индукции колита таким методом, как введение тринитробензолсульфоновой кислоты в кишечник мышей, голодающих в течение 24 часов, с предоставлением неограниченного доступа к 1-10% водному раствору декстрансульфата натрия из бутыли в течение 4 дней - 2 недель, или перенос CD4+CD25-CD45RBhi Т-клеток, собранных из лимфатических узлов и селезенки трансгенных мышей с человеческим TLR7 после очистки интраперитонеально мышам с дефицитом Rag2, и сравнение массы тела в течение периода наблюдения, степени утолщения, количества и размера полипов, а также гистопатологических изменений в кишечнике при вскрытии после завершения теста, концентрации антител, цитокинов или биомаркеров крови в крови или тканях, пролиферативной активности, способности продуцировать цитокины или поверхностные антигены клеток, полученных из кишечника, периферической крови, тимуса, селезенки, лимфатических узлов, костного мозга, или пейеровых бляшек, или т.п. между группой, которой вводили антитело против человеческого TLR7, и группой, которой не осуществляли введение.
[0118]
Эффекты на системную красную волчанку оценивают путем сравнения между группой, которой вводили антитело против человеческого TLR7, и группой, которой не осуществляли введение: концентрации антител, цитокинов или биомаркеров крови в крови или тканях, собранных у мышей NZB/WF1, мышей MRL/lpr и мышей BXSB, которые являются спонтанными моделями, с течением времени, титра антител или концентрации биомаркеров в их моче или симптома, вызванного переносом клеток, полученных из такого органа, как селезенка и лимфатические узлы, собранных после завершения вышеуказанного теста, необработанным мышам, или т.п.
[0119]
Эффекты на на гепатит оценивается путем индукции гепатита таким методом, как введение D-галактозамина отдельно или в комбинации с липополисахаридом интраперитонеально мышам и введение только конканавалина А в хвостовую вену и сравнение концентраций AST и ALT в крови, собранной через 1 час - 1 неделю после введения воспалительного вещества, концентрации цитокинов и гистопатологического состояния поражений печени между группой, которой вводили антитело против человеческого TLR7, и группой, которой не осуществляли введение.
[0120]
Полученное таким образом антитело, которое ингибирует биологическую активность человеческого TLR7, полезно в качестве лекарственного средства, в частности, в качестве антитела для профилактики или лечения связанных с иммунным воспалением заболеваний, включая системную красную волчанку, аллергические заболевания, инфекции или рак.
[0121]
В качестве одного примера, антитело против человеческого TLR7 можно вводить отдельно или в комбинации с по меньшей мере одним другим терапевтическим средством для лечения или профилактики связанных с иммунным воспалением заболеваний, аллергических заболеваний, инфекций или рака. Примеры другого терапевтического средства, которое можно вводить в комбинации с антителом против человеческого TLR7, могут включать кортикостероиды, нестероидные противовоспалительные лекарственные средства, антиметаболиты нуклеиновых кислот, ингибиторы синтеза нуклеиновых кислот, антифолаты, ингибиторы кальциневрина, антималярийные лекарственные средства, антитимоцитарные глобулины, биологические препараты, таргетирующие антигены клеточной поверхности, или биологические препараты, таргетирующие цитокины интерфероны или рецепторы цитокинов интерферонов, но нет никаких ограничений этих примеров.
[0122]
Конкретные примеры терапевтического средства могут включать метилпреднизолон в качестве кортикостероида, локсопрофен натрия гидрат, диклофенак натрия, индометацин и ацетилсалициловую кислоту в качестве нестероидных противовоспалительных лекарственных средств, микофенолят мофетил в качестве антиметаболита нуклеиновой кислоты, циклофосфамид в качестве ингибитора синтеза нуклеиновых кислот, циклоспорин и таклоримс в качестве ингибиторов кальциневрина, гидроксихлорохин в качестве противомалярийного препарата, метотрексат в качестве антифолата, зетбулин, лимфоглобулин и тимоглобулин в качестве антитимоцитарных глобулинов, алемтузумаб, ритуксимаб и абатацепт в качестве биологических препаратов, таргетирующих антигены клеточной поверхности, и инфликсимаб этанерцепт, адалимумаб, тоцилизумаб, белимумаб и анифролумаб в качестве биологических препаратов, таргетирующих цитокины интерфероны или рецепторы цитокинов интерферонов.
[0123]
В зависимости от состояния связанных с иммунным воспалением заболеваний, аллергических заболеваний, инфекций или рака и степени целенаправленного лечения и/или профилактики, также можно вводить два, три или более типов других терапевтических средств, и другие терапевтические средства могут быть инкапсулированы в виде одного препарата, чтобы их можно было вводить одновременно. Другие терапевтические средства и антитело против человеческого TLR7 также могут быть инкапсулированы в виде одного препарата, чтобы их можно было вводить одновременно. Кроме того, антитело против человеческого TLR7 и другие терапевтические средства также могут быть инкапсулированы в виде отдельных препаратов, и их можно вводить одновременно. Кроме того, другие терапевтические средства и антитело против человеческого TLR7 также можно вводить отдельно друг за другом. Например, терапевтическое средство, содержащее антитело против человеческого TLR7 или антигенсвязывающий фрагмент антитела в качестве активного ингредиента, можно вводить после введения других терапевтических средств, или другие терапевтические средства можно вводить после введения терапевтического средства, содержащего антитело против человеческого TLR7 или антигенсвязывающий фрагмент антитела в качестве активного ингредиента. В случае введения в виде генной терапии, ген белкового терапевтического средства и ген антитела против человеческого TLR7 могут быть встроены ниже одной и той же или разных промоторных областей и могут быть встроены в один и тот же или разные векторы.
[0124]
Прицельно действующие конъюгаты лекарственных средств, раскрытые в M. C. Garnet "Targeted drug conjugates: principles and progress", Advanced Drug Delivery Reviews, (2001) 53, 171-216, могут быть получены путем связывания терапевтических средств с антителом против человеческого TLR7 или его фрагментом. Для этой цели может применяться любой фрагмент антитела, помимо молекул антител, при условии, что у него не полностью потеряно Т-клеточное распознавание. Их примеры могут включать такие фрагменты, как Fab, F (ab')2 и Fv, и антитело и такие фрагменты можно использовать таким же образом, как в настоящем изобретении. Связывание антитела против человеческого TLR7 или фрагмента антитела с терапевтическими средствами может быть в различных формах, раскрытых в M. C. Garnet "Targeted drug conjugates: principles and progress", Advanced Drug Delivery Reviews, (2001) 53, 171-216, G. T. Hermanson "Bioconjugate Techniques" Academic Press, California (1996), Putnam and J. Kopecek "Polymer Conjugates with Anticancer Activity" Advances in Polymer Science (1995) 122, 55-123, и т.д. Их примеры могут включать способ, в котором антитело против человеческого TLR7 химически связывают с терапевтическими средствами непосредственно или через спейсер, такой как олигопептид, или связывают через подходящий носитель лекарственного средства. Примеры носителя лекарственного средства могут включать липосомы и водорастворимые полимеры. Более конкретно, примеры способа связывания через такой носитель лекарственного средства могут включать способ, в котором антитело и терапевтические средства включают в липосому, и липосому связывают с антителом, и способ, в котором терапевтические средства химически связывают с водорастворимым полимером (соединение с молекулярной массой около 1000-100000) непосредственно или через спейсер, такой как олигопептид, и антитело связывают с водорастворимым полимером. Антитело (или фрагмент) можно связать с терапевтическими средствами или носителями лекарственных средств, такими как липосомы и водорастворимые полимеры, способом, известным специалистам в данной области, таким как способ в соответствии с G. T. Hermanson "Bioconjugate Techniques" Academic Press, California (1996), Putnam and J. Kopecek "Polymer Conjugates with Anticancer Activity" Advances in Polymer Science (1995) 122, 55-123. Терапевтические средства можно включить в липосому способом, известным специалистам в данной области, таким как способ в соответствии с D. D. Lasic "Liposomes: From Physics to Applications", Elsevier Science Publishers B. V., Amsterdam (1993). Терапевтические средства можно связать с водорастворимым полимером способом, известным специалистам в данной области, таким как способ в соответствии с D. Putnam and J Kopecek "Polymer Conjugates with Anticancer Activity" Advances in Polymer Science (1995) 122, 55-123. Конъюгаты антитела (или фрагмента) и белкового терапевтического средства (или фрагмента) могут быть получены генноинженерным методом, известным специалистам в данной области, помимо описанного выше метода.
[0125]
Настоящее изобретение также обеспечивает фармацевтическую композицию, включающую вектор экспрессии, который включает полинуклеотид, включающий полинуклеотидную последовательность, кодирующую по меньшей мере одно антитело против человеческого TLR7 или антигенсвязывающий фрагмент антитела, в качестве активного ингредиента в количестве, эффективном для лечения и/или профилактики заболевания, и разбавитель, носитель, солюбилизатор, эмульгатор, консервант и/или добавку, которые являются фармацевтически приемлемыми.
[0126]
Настоящее изобретение также обеспечивает фармацевтическую композицию, включающую вектор экспрессии, который включает полинуклеотид, включающий полинуклеотидную последовательность, кодирующую по меньшей мере одно антитело против человеческого TLR7 или антигенсвязывающий фрагмент антитела, в количестве, эффективном для лечения и/или профилактики заболевания, по меньшей мере одно терапевтическое средство в количестве, эффективном для лечения и/или профилактики заболевания, и разбавитель, носитель, солюбилизатор, эмульгатор, консервант, и/или добавку, которые являются фармацевтически приемлемыми.
[0127]
Примеры терапевтического средства могут включать антифолаты, ингибиторы кальциневрина, кортикостероиды, антитимоцитарные глобулины, антиметаболиты нуклеиновых кислот, ингибиторы синтеза нуклеиновых кислот, биологические препараты, таргетирующие антигены клеточной поверхности, или биологические препараты, таргетирующие цитокины или цитокиновые рецепторы, описанные выше, но нет никаких ограничений, что касается этих примеров.
[0128]
Вещества, используемые для препаратов, которые являются приемлемыми в фармацевтической композиции по настоящему изобретению, предпочтительно нетоксичны, предпочтительно при вводимой дозе и вводимой концентрации, для субъекта, которому вводят фармацевтическую композицию.
[0129]
Фармацевтическая композиция по настоящему изобретению может содержать вещества, используемые для препаратов для изменения или поддержания pH, осмотического давления, вязкости, прозрачности, цвета, изотоничности, стерильности, стабильности, скорости растворения, скорости замедленного высвобождения, скорости абсорбции и скорости проникновения. Примеры веществ, используемых для препаратов, могут включать, но не ограничиваются этим: аминокислоты, такие как глицин, аланин, глутамин, аспарагин, аргинин или лизин, антибактериальные агенты, антиоксиданты, такие как аскорбиновая кислота, сульфат натрия или бисульфит натрия, буферы, такие как фосфорная кислота, лимонная кислота, буферный раствор борной кислоты, бикарбонат натрия или раствор трис-хлористоводородной кислоты (Tris-Hcl), наполнители, такие как маннит или глицин, хелатирующие агенты, такие как этилендиаминтетрауксусная кислота (ЭДТА), комплексообразователи, такие как кофеин, поливинилпирролидин, β-циклодекстрин или гидроксипропил-β-циклодекстрин, объемообразующие агенты, такие как глюкоза, манноза или декстрин, другие углеводы, такие как моносахариды или дисахариды, красители, ароматизаторы, разбавители, эмульгаторы, гидрофильные полимеры, такие как поливинилпирролидин, консерванты, такие как низкомолекулярные полипептиды, солеобразующие противоионы, бензалконийхлорид, бензойная кислота, салициловая кислота, тимеросал, фенетиловый спирт, метилпарабен, пропилпарабен, хлоргексидин, сорбиновая кислота или пероксид водорода, растворители, такие как глицерин, пропиленгликоль или полиэтиленгликоль, сахарные спирты, такие как маннит или сорбит, суспендирующие агенты, полисорбаты, такие как сложный эфир сорбитана, полисорбат 20 или полисорбат 80, поверхностно-активные вещества, такие как тритон, трометамин, лецитин или холестерин, агенты, повышающие стабильность, такие как сахароза или сорбит, агенты, повышающие эластичность, такие как хлорид натрия, хлорид калия, маннит или сорбит, транспортирующие агенты, эксципиенты и/или фармацевтические вспомогательные вещества. Добавляемое количество веществ, используемых для препаратов, должно быть предпочтительно 0,01-100-кратным, в частности 0,1-10-кратным, по отношению к массе антитела против человеческого TLR7. Подходящий состав фармацевтической композиции в препаратах может быть надлежащим образом определен специалистами в данной области, в соответствии с заболеванием, для которого он будет применяться, используемого пути введения или т.п.
[0130]
Эксципиенты или носители в фармацевтической композиции могут быть жидкими или твердыми. Подходящие эксципиенты или носители могут представлять собой воду для инъекций, физиологический раствор, искусственную спинномозговую жидкость или другие вещества, обычно используемые для парентерального введения. В качестве носителей также можно использовать нейтральный физиологический раствор или физиологический раствор, содержащий сывороточный альбумин. Фармацевтическая композиция может содержать Трис-буфер с pH от 7,0 до 8,5, ацетатный буфер с pH от 4,0 до 5,5 или буферный раствор лимонной кислоты с pH от 3,0 до 6,2. Кроме того, эти буферы также могут содержать сорбит или другие соединения. Примеры фармацевтической композиции по настоящему изобретению могут включать фармацевтическую композицию, включающую антитело против человеческого TLR7, и фармацевтическую композицию, включающую антитело против человеческого TLR7 и по меньшей мере одно терапевтическое средство, и фармацевтическую композицию по настоящему изобретению получают в виде лекарственного средства, имеющего выбранный состав и необходимую чистоту, в форме лиофилизированного продукта или жидкости. Фармацевтическая композиция, включающая антитело против человеческого TLR7, и фармацевтическая композиция, включающая антитело против человеческого TLR7 и по меньшей мере одно лекарственное средство от нарушения костного метаболизма, может быть получена в виде лиофилизированного продукта с использованием подходящего наполнителя, такого как сахароза.
[0131]
Может быть получена фармацевтическая композиция по настоящему изобретению для парентерального введения или может быть получена фармацевтическая композиция по настоящему изобретению для перорального введения с абсобрцией в желудочно-кишечном тракте. Композицию и концентрацию препарата можно определить в зависимости от способа введения. Альтернативно, аффинность, которая представляет собой более высокую аффинность к человеческому TLR7 (более низкое значение Kd), выраженную как константа диссоциации (значение Kd), антител против человеческого TLR7, содержащихся в фармацевтической композиции по настоящему изобретению, обеспечивает возможность проявления эффективности лекарственного средства у человека при уменьшенной дозе, и поэтому дозировку фармацевтической композиции по настоящему изобретению для человека также можно определить на основании этой аффинности. Дозировка в настоящем изобретении может составлять около 0,1-100 мг/кг один раз каждые 1-180 дней, когда антитело против человеческого TLR7 вводят человеку.
[0132]
Примеры вариантов осуществления фармацевтической композиции по настоящему изобретению могут включать инъекции, включая внутривенные капельницы, суппозитории, назальные препараты, сублингвальные препараты и трансдермальные препараты.
[0133]
Хотя большинство одобренных препаратов антител вводят внутривенно, во многих медицинских учреждениях предпочтительным является подкожное введение. В таком случае объем ограничивается до 1,0-1,5 мл, и, следовательно, требуется раствор антитела с высокой концентрацией в зависимости от дозировки. Однако, когда концентрация увеличивается, вязкость раствора лекарственного средства увеличивается, и поэтому инъекция может быть невозможной из-за высокой вязкости при толщине обычно используемых инъекционных игл. То есть, в случае выбора инъекции свойство низкой вязкости имеет важное значение, которое должно быть приоритетным как вариант осуществления фармацевтической композиции, и подходящее антитело может быть выбрано с использованием вязкости в качестве показателя.
Примеры
[0134]
Далее настоящее изобретение будет конкретно описано при помощи примеров, но настоящее изобретение не ограничивается этими примерами. В следующих примерах каждую процедуру, связанную с генной инженерией, осуществляли в соответствии со способом, раскрытым в "Molecular Cloning" (Sambrook, J., Fritsch, E. F. and Maniatis, T., Cold Spring Harbor Laboratory Press, 1989), или осуществляли с использованием коммерчески доступного реагента или набора в соответствии с инструкциями, прилагаемыми к коммерчески доступному продукту, если не указано иное.
[0135]
[Пример 1]
Получение мышиного антитела к человеческому TLR7
1)-1 Иммунизация
1)-1-1 Получение Ba/F3 клеточной линии, экспрессирующей человеческий TLR7-Flag-His×6/человеческий Unc93B1-HA×2
Ген TLR7 (вариант 2) человека (SEQ ID NO:3) встраивали в ретровирусные векторы, pMXs (Cell Biolabs, Inc.), которые метили при помощи Flag-His×6, добавленной к C-концу гена с использованием фермента In Fusion (зарегистрированная торговая марка) (Takara Bio Inc). Ретровирусные векторы тринсфицировали в пакующую клеточную линию на основе HEK293 клеточной линии, Plat-E (Cell Biolabs, Inc), с использованием реагента для трансфекции Fugene (зарегистрированная торговая марка) 6 (Roche). Культуральный супернатант собирали через 24 часа и использовали в качестве вирусной суспензии. Вирусную суспензию смешивали с реагентом для трансфекции DOTAP (Roche), смесь добавляли к Ba/F3 клеточной линии (RIKEN, BRC) и осуществляли высокоскоростное центрифугирование при 2000 об/мин в течение 1 часа с получением Ba/F3 клеточной линии, экспрессирующей человеческий TLR7-Flag-His×6.
[0136]
Человеческий TLR7, кодируемый геном TLR7 человека (вариант 2) (SEQ ID NO:3), включает аминокислотную последовательность SEQ ID NO:4. Последовательность показана на Фиг. 2.
[0137]
Ген Unc93B1 человека (SEQ ID NO:55) встраивали в ретровирусные векторы, pMXs (Cell Biolabs, Inc.), которые метили при помощи HA×2, добавленной к C-концу гена с использованием фермента In Fusion (зарегистрированная торговая марка) (Takara Bio Inc). Ретровирусные векторы трансфицировали в пакующую клеточную линию на основе HEK293 клеточной линии, Plat-E (Cell Biolabs, Inc), с использованием реагента для трансфекции Fugene (зарегистрированная торговая марка) 6 (Roche). Культуральный супернатант собирали через 24 часа и использовали в качестве вирусной суспензии. Вирусную суспензию смешивали с реагентом для трансфекции DOTAP (Roche), смесь добавляли к Ba/F3 клеточной линии, экспрессирующей человеческий TLR7-Flag-His×6, полученной как описано выше, и осуществляли высокоскоростное центрифугирование при 2000 об/мин в течение 1 часа с получением Ba/F3 клеточной линии, экспрессирующей человеческий TLR7-Flag-His×6/человеческий Unc93B1-HA×2.
[0138]
1)-1-2 Иммунизация мыши
Ba/F3 клеточную линию, экспрессирующую человеческий TLR7-Flag-His×6/человеческий Unc93B1-HA×2, полученную как описано выше в 1)-1-1, смешивали с адъювантом TiterMAX (зарегистрированная торговая марка) Gold (TiterMax USA, Inc.) и смесь вводили в качестве антигена в подошву, основание хвоста и брюшную полость TLR9-дефицитным мышам, происходящим от BALB/c, полученным от Institute of Medical Science of the University of Tokyo, в общей сложности 3 раза в неделю.
[0139]
На 4-й раз осуществляли интраперитонеальное введение Ba/F3 клеточной линии, экспрессирующей человеческий TLR7-Flag-His×6/человеческий Unc93B1-HA×2, суспендированной в 1×PBS.
[0140]
Селезенку удаляли через 5 дней после последней иммунизации и использовали для получения гибридом.
[0141]
1)-2 Получение гибридом
Клетки селезенки после иммунизации смешивали с Sp2/o клеточной линией (ATCC) и осуществляли слияние клеток с использованием набора HVJ-E для слияния клеток (ISHIHARA SANGYO KAISHA, LTD). Для отбора гибридом клетки культивировали, начиная с дня после процедуры слияния клеток, в RPMI1640 (Life Technologies), содержащей HAT (Thermo Fisher Scientific)-содержащий культуральный раствор (10% FBS), 50 мкМ 2-Меркаптоэтанола (Life Technologies), 50 Ед./мл Пенициллина и 50 мкг/мл Стрептомицина (Life Technologies), и образовавшиеся колонии гибридом собирали для получения моноклональных гибридом.
[0142]
1)-3 Скрининг антитела, связывающегося с человеческим TLR7, методом проточной цитометрии
Культуральный супернатант собирали из гибридом, образующих колонии, под микроскопом и использовали для скрининга. Ba/F3 клеточную линию, экспрессирующую hTLR7-Flag-His×6/hUnc93B1-HA×2, обрабатывали 0,1% раствором Сапонина (Sigma-Aldrich Co. LLC) для пермеабилизации мембран, а Ba/F3 клетки, которые ничего не экспрессировали, каждую окрашивали культуральным супернатантом и анализировали методом проточной цитометрии (LSRFortessaTMX-20, Becton, Dickinson и Company), для отбора гибридом, продуцирующих анти-hTLR7 антитело.
[0143]
1)-4 Скрининг человеческого TLR7 антитела на ингибирование функции человеческого TLR7 методом проточной цитометрии
Человеческий TLR7 (вариант 2) ген (SEQ ID NO:3) и человеческий Unc93B1 D34A мутант-HA×2 ген (SEQ ID NO:86) вводили в Ba/F3 клеточную линию (RIKEN, BRC) с использованием ретровируса. Кроме того, содержащую NF-κB-зеленый флуоресцентный белок (GFP) репортерную плазмиду (STRATAGENE) трансфицировали в клетки методом электропорации, таким образом получали Ba/F3 клеточную линию, экспрессирующую hTLR7/hUnc93B1 D34A мутант-HA×2 и способную анализировать NF-κB активацию, и гибридомный культуральный супернатант добавляли к клеточной линии. Клетки стимулировали через 4 часа при помощи 25 нг/мл лиганда TLR7, R848 (InvivoGen). В результате анализа эффектов ингибирования ответа человеческого TLR7 путем измерения интенсивности флуоресценции GFP с использованием проточной цитометрии, который осуществляли через 24 часа, были отобраны три гибридомы, продуцирующие мышиное антитело к человеческому TLR7, и они были названы AT01, NB7 и FAN2, соответственно.
[0144]
В настоящем описании антитела, продуцируемые гибридомами AT01, NB7 и FAN2, указаны как антитело AT01, антитело NB7 и антитело FAN2 , соответственно.
[0145]
1)-5 Определение изотипа антитела
Изотипы антител, продуцируемых гибридомами, продуцирующими мышиное антитело к человеческому TLR7 (AT01, NB7 и FAN2), полученными в 1)-4, каждый определяли с использованием набора для изотипирования мышиных моноклональных антител IsoStrip (Merck KGaA). В результае, каждый из изотипов антитела AT01, антитела NB7 и антитела FAN2 был определен как представляющий собой IgG1/κ цепь.
[0146]
1)-6 Получение мышиного антитела к человеческому TLR7
Мышиное моноклональное антитело к человеческому TLR7 очищали из асцитов, собранных примерно через 10 дней после интраперитонеального введения каждой гибридомы ICR-CD1-Foxn1 бестимусным мышам (ICR-nu, CHARLES RIVER LABORATORIES JAPAN, INC.), предварительно обработанным пристаном (Sigma-Aldrich Co. LLC., currently, Merck KGaA).
[0147]
Сначала пристан интраперитонеально вводили мышам ICR-nu и мышей выдерживали в течение 7 дней или больше. Затем AT01, NB7 или FAN2-продуцирующую гибридому культивировали в RPMI1640 (Life Technologies), содержащей 10% FBS, 50 мкМ 2-Меркаптоэтанола (Life Technologies), 50 Ед./мл Пенициллина и 50 мкг/мл Стрептомицина (Life Technologies), с последующей пролиферацией до достаточного объема. Затем гибридому суспендировали в 1×PBS и интраперитонеально вводили мышам ICR-nu.
[0148]
Асциты собирали через 10 дней и клетки крови осаждали высокоскоростным центрифугированием для сбора супернатанта. После 10-кратного разведения при помощи 1×PBS асциты пропускали через 0,45-мкм фильтр (Millipore).
[0149]
Антитело очищали из указанных выше асцитов на колонке с белком G (GE Healthcare Japan Corporation) с использованием AKTAprime plus (GE Healthcare Japan Corporation).
[0150]
Затем осуществляли процедуру замены буфера физиологическим раствором вместе с обогащением с использованием PD-10 (GE Healthcare Japan Corporation) для получения антитела при концентрации 1,0 мг/мл или больше.
[0151]
В завершение, осуществляли старилизацию с использованием Millex-GV 0,22 мкм (Millipore) с получением очищенного образца.
[0152]
[Пример 2]
Оценка мышиного антитела к человеческому TLR7 in vitro
2)-1 Оценка селективности связывания мышиного антитела к человеческому TLR7
2)-1-1 Получение Ba/F3 клеточной линии, экспрессирующей мышиный TLR7-Flag-His×6
Ген TLR7 мыши (SEQ ID NO:56) встраивали в ретровирусные векторы, pMXs (Cell Biolabs, Inc.), которые метили при помощи Flag-His×6, добавленной к C-концу гена с использованием фермента In Fusion (зарегистрированная торговая марка) (Takara Bio Inc). Ретровирусные векторы трансфицировали в пакующую клеточную линию на основе HEK293 клеточной линии, Plat-E (Cell Biolabs, Inc), с использованием реагента для трансфекции Fugene (зарегистрированная торговая марка) 6 (Roche). Культуральный супернатант собирали через 24 часа и использовали в качестве вирусной суспензии. Вирусную суспензию смешивали с реагентом для трансфекции DOTAP (Roche), смесь добавляли к Ba/F3 клеточной линии (RIKEN, BRC) и осуществляли высокоскоростное центрифугирование при 2000 об/мин в течение 1 часа с получением Ba/F3 клеточной линии, экспрессирующей мышиный TLR7-Flag-His×6.
[0153]
Мышиный TLR7, кодируемый геном TLR7 мыши (SEQ ID NO:56), включает аминокислотную последовательность SEQ ID NO:83. Последовательность показана на Фиг. 3.
[0154]
2)-1-2 Получение Ba/F3 клеточной линии, экспрессирующей крысиный TLR7-Flag-His×6
Ген TLR7 крысы (SEQ ID NO:57) встраивали в ретровирусные векторы, pMXs (Cell Biolabs, Inc.), которые метили при помощи Flag-His×6, добавленной к C-концу гена с использованием фермента In Fusion (зарегистрированная торговая марка) (Takara Bio Inc). Ретровирусные векторы трансфицировали в пакующую клеточную линию на основе HEK293 клеточной линии, Plat-E (Cell Biolabs, Inc), с использованием реагента для трансфекции Fugene (зарегистрированная торговая марка) 6 (Roche). Культуральный супернатант собирали через 24 часа и использовали в качестве вирусной суспензии. Вирусную суспензию смешивали с реагентом для трансфекции DOTAP (Roche), смесь добавляли к Ba/F3 клеточной линии (RIKEN, BRC) и осуществляли высокоскоростное центрифугирование при 2000 об/мин в течение 1 часа с получением Ba/F3 клеточной линии, экспрессирующей крысиный TLR7-Flag-His×6.
[0155]
Крысиный TLR7, кодируемый геном TLR7 крысы (SEQ ID NO:57), включает аминокислотную последовательность SEQ ID NO:84. Последовательность показана на Фиг. 4.
[0156]
2)-1-3 Получение Ba/F3 клеточной линии, экспрессирующей обезьяний TLR7-Flag-His×6
Ген TLR7 обезьяны (SEQ ID NO:58) встраивали в ретровирусные векторы, pMXs (Cell Biolabs, Inc.), которые метили при помощи Flag-His×6, добавленной к C-концу гена с использованием фермента In Fusion (зарегистрированная торговая марка) (Takara Bio Inc). Ретровирусные векторы трансфицировали в пакующую клеточную линию на основе HEK293 клеточной линии, Plat-E (Cell Biolabs, Inc), с использованием реагента для трансфекции Fugene (зарегистрированная торговая марка) 6 (Roche). Культуральный супернатант собирали через 24 часа и использовали в качестве вирусной суспензии. Вирусную суспензию смешивали с реагентом для трансфекции DOTAP (Roche), смесь добавляли к Ba/F3 клеточной линии (RIKEN, BRC) и осуществляли высокоскоростное центрифугирование при 2000 об/мин в течение 1 часа для конструирования Ba/F3 клеточной линии, экспрессирующей обезьяний TLR7-Flag-His×6.
[0157]
Обезьяний TLR7, кодируемый геном TLR7 обезьяны (SEQ ID NO:58), включает аминокислотную последовательность SEQ ID NO:85. Последовательность показана на Фиг. 5.
[0158]
2)-1-4 Оценка селективности связывания мышиного антитела к человеческому TLR7 методом проточной цитометрии
Ba/F3 клеточную линию, экспрессирующую человеческий TLR7-Flag-His×6/человеческий Unc93B1-HA×2, полученную как описано выше в 1)-1-1, Ba/F3 клеточную линию, экспрессирующую мышиный TLR7-Flag-His×6, полученную как описано выше в 2)-1-1, Ba/F3 клеточную линию, экспрессирующую крысиный TLR7-Flag-His×6×2, полученную как описано выше в 2)-1-2, и Ba/F3 клеточную линию, экспрессирующую обезьяний TLR7-Flag--His×6, полученную как описано выше в 2)-1-3, подвергали обработке 0,1% раствором Сапонина для пермеабилизации мембран и окрашивали с использованием антитела AT01, антитела NB7 и антитела FAN2 и вторичного антитела, козлиного анти-мышиного IgG (H+L)-PE (eBioscience). Селективность связывания каждого антитела оценивали путем сравнения средней интенсивности флуоресценции (MFI) на основании данных анализа проточной цитометрии.
[0159]
Результаты показывают, что антитело AT01, антитело NB7 и антитело FAN2 специфически связывались с TLR7 человека или TLR7 обезьяны и не связывались с TLR7 мыши или TLR7 крысы.
[0160]
2)-2 Оценка связывающей способности мышиного антитела к человеческому TLR7
Ba/F3 клеточную линию, экспрессирующую человеческий TLR7-Flag-His×6/человеческий Unc93B1-HA×2, полученную как описано выше в 1)-1-1, подвергали обработке 0,1% раствором Сапонина для пермеабилизации мембран и окрашивали с использованием серии разведений антитела AT01, антитела NB7 и антитела FAN2 и вторичного антитела, козлиного анти-мышиного IgG (H+L)-PE (eBioscience). Активность связывания каждого антитела оценивали путем сравнения средней интенсивности флуоресценции (MFI) на основании данных анализа проточной цитометрии.
[0161]
Результаты показывают наивысшую связывающую активность у антител в следующем порядке: антитело AT01, антитело NB7 и антитело FAN2.
[0162]
2)-3 Ингибирующая активность мышиного антитела к человеческому TLR7 в отношении продукции цитокинов
Человеческие PBMC закупали у Cellular Technology Limited в виде замороженного продукта и размораживали в соответствии с инструкциями по применению.
[0163]
PBMCs, суспендированные при концентрации 2,5×106 клеток/мл в RPMI1640 (Life Technologies Corp.), содержащей 10% FBS, 1 мМ пирувата натрия (Life Technologies Corp.), 0,1 мМ MEM заменимых аминокислот (Life Technologies Corp.), 50 мкМ 2-меркаптоэтанола (Life Technologies Corp.), 50 Ед./мл пенициллина и 50 мкг/мл стрептомицина (Life Technologies Corp.), высевали в 96-луночный планшет для культуры клеток при 100 мкл и в планшет добавляли мышиное антитело к человеческому TLR7, антитело AT01, антитело NB7 или антитело FAN2, или мышиное IgG контрольное антитело (BioLegend, Inc.) при 80 мкл/лунка, с последующей предварительной обработкой в инкубаторе при 37°C в течение 4 часов.
[0164]
Затем добавляли 1 мг/мл CL-264 (InvivoGen) при 20 мкл/лунка и смесь тщательно перемешивали, с последующим культивированием при 37°C в течение примерно 20 часов в атмосфере 5% CO2. Планшет тщательно перемешивали и затем центрифугировали при 1500 об/мин в течение 5 минут и концентрацию интерлейкина-6 (IL-6), содержащегося в супернатанте, измеряли методом FRET (Cisbio Bioassay. Inc).
[0165]
Фиг. 6 показывает результаты. Мышиное антитело к человеческому TLR7 подавляло продукцию IL-6 из человеческих PBMC, обработанных CL-264, зависимым от концентрации образом. Антитело AT01, антитело NB7 и антитело FAN2 ингибировали продукцию IL-6 из человеческих PBMC зависимым от концентрации образом. Полумаксимальные ингибирующие концентрации (IC50) антитела AT01, антитела NB7 и антитела FAN2 составляли 192 нг/мл, 771 нг/мл и 8389 нг/мл, соответственно, которые были рассчитаны на основании концентраций двух значений, которые находятся по обе стороны от 50% ингибирующей активности, и ингибирующей активности, когда добавляли каждую из этих двух концентраций.
[0166]
При этом, ингибирование не наблюдалось при использовании мышиного IgG контрольного антитела, даже при концентрации 10 мг/мл.
[0167]
[Пример 3]
Определение нуклеотидной последовательности и аминокислотной последовательности кДНК, кодирующей вариабельную область мышиного антитела к человеческому TLR7
3)-1 Синтез кДНК
Тотальную РНК собирали из гибридом AT01, NB7 и FAN2 с использованием реагента TRIzol (Ambion). Затем синтезировали кДНК с использованием набора для синтеза одноцепочечной кДНК PrimeScript (TAKARA).
[0168]
3)-2 Амплификация и секвенирование фрагментов гена вариабельной области тяжелой и легкой цепи иммуноглобулина мыши
Нуклеотидные последовательности, кодирующие вариабельные области антитела, содержащиеся в синтезированной кДНК, были определены GenScript Corporation.
[0169]
3)-2-1 Мышиное антитело к человеческому TLR7 (AT01)
Аминокислотная последовательность, кодируемая нуклеотидной последовательностью кДНК, кодирующей вариабельную область тяжелой цепи антитела AT01, определенного выше, представлена в SEQ ID NO:5 в Перечне последовательностей.
[0170]
Аминокислотная последовательность, кодируемая нуклеотидной последовательностью кДНК, кодирующей вариабельную область легкой цепи антитела AT01, определенного выше, представлена в SEQ ID NO:11 в Перечне последовательностей.
[0171]
3)-2-2 Мышиное антитело к человеческому TLR7 (NB7)
Аминокислотная последовательность, кодируемая нуклеотидной последовательностью кДНК, кодирующей вариабельную область тяжелой цепи антитела NB7, определенного выше, представлена в SEQ ID NO:7 в Перечне последовательностей.
[0172]
Аминокислотная последовательность, кодируемая нуклеотидной последовательностью кДНК, кодирующей вариабельную область легкой цепи антитела NB7, определенного выше, представлена в SEQ ID NO:13 в Перечне последовательностей.
[0173]
3)-2-3 Мышиное антитело к человеческому TLR7 (FAN2)
Аминокислотная последовательность, кодируемая нуклеотидной последовательностью кДНК, кодирующей вариабельную область тяжелой цепи антитела FAN2, определенного выше, представлена в SEQ ID NO:9 в Перечне последовательностей.
[0174]
Аминокислотная последовательность, кодируемая нуклеотидной последовательностью кДНК, кодирующей вариабельную область легкой цепи антитела FAN2, определенного выше, представлена в SEQ ID NO:15 в Перечне последовательностей.
[0175]
[Пример 4]
Продукция химерного антитела против человеческого TLR7
4)-1 Конструирование вектора экспрессии химерного анти-TLR7 антитела
4)-1-1 Конструирование вектора экспрессии химерной легкой цепи, pCMA-LK
Фрагмент ДНК (SEQ ID NO:59), содержащий приблизительно 5,4 т.п.н. фрагмент, полученный путем расщепления плазмиды pкДНК3.3-TOPO/LacZ (Invitrogen Corp.) рестрикционными ферментами XbaI и PmeI, и последовательность ДНК, кодирующую сигнальную последовательность легкой цепи человека и константную область каппа-цепи человека, связывали вместе с использованием набора для ПЦР клонирования In-Fusion HD (Clontech Laboratories, Inc) для получения pcDNA3.3/LK. pCMA-LK конструировали путем удаления единицы экспрессии неомицина из pcDNA3.3/LK.
[0176]
4)-1-2 Конструирование вектора экспрессии тяжелой цепи химерного IgG1, pCMA-G1
Фрагмент ДНК (SEQ ID NO:60), содержащий фрагмент ДНК, полученный путем расщепления pCMA-LK при помощи XbaI и PmeI, и удаления сигнальной последовательности легкой цепи и константной области каппа-цепи человека, связывали с последовательностью ДНК, кодирующей сигнальную последовательность тяжелой цепи человека и константную область IgG1 человека, с использованием набора для ПЦР клонирования In-Fusion HD (Clontech Laboratories, Inc.) для конструирования pCMA-G1.
[0177]
4)-1-3 Конструирование вектора экспрессии AT01 химерного антитела против человеческого TLR7
Синтезировали фрагмент ДНК, включающий нуклеотидную последовательность, кодирующую вариабельную область тяжелой цепи антитела cAT01, представленную нуклеотидами 36-422 в нуклеотидной последовательности SEQ ID NO:61 (Geneart AG). Синтезированный фрагмент ДНК встраивали в сайт, где pCMA-G1 был вырезан рестрикционным ферментом, BlpI, с использованием набора для ПЦР клонирования In-Fusion HD (Clontech Laboratories, Inc.), конструируя таким образом вектор экспрессии тяжелой цепи антитела cAT01. Тяжелая цепь антитела cAT01 включает аминокислотную последовательность SEQ ID NO:35, включая сигнальную последовательность. Последовательность показана на Фиг. 7.
[0178]
Синтезировали фрагмент ДНК (SEQ ID NO:62), включающий последовательность ДНК, кодирующую легкую цепь антитела cAT01 (Geneart AG). С использованием pCMA-LK, полученного в Примере 4)-1-1, вектор экспрессии легкой цепи антитела cAT01 конструировали таким же способом, как описано выше. Легкая цепь антитела cAT01 включает аминокислотную последовательность SEQ ID NO:36, включая сигнальную последовательность. Последовательность показана на Фиг. 7.
4)-1-4 Конструирование вектора экспрессии NB7 химерного антитела против человеческого TLR7
Синтезировали фрагмент ДНК, включающий нуклеотидную последовательность, кодирующую вариабельную область тяжелой цепи антитела cNB7, представленную нуклеотидами 36-440 в нуклеотидной последовательности SEQ ID NO:63 (Geneart AG). Вектор экспрессии тяжелой цепи cNB7 конструировали таким же способом, как в Примере 4)-1-3. Тяжелая цепь антитела cNB7 включает аминокислотную последовательность SEQ ID NO:37, включая сигнальную последовательность. Последовательность показана на Фиг. 8.
[0179]
Синтезировали фрагмент ДНК (SEQ ID NO:64), включающий последовательность ДНК, кодирующую легкую цепь cNB7 (Geneart AG). С использованием pCMA-LK, полученного в Примере 4)-1-1, вектор экспрессии легкой цепи cNB7 конструировали таким же способом, как в Примере 4)-1-3. Легкая цепь антитела cNB7 включает аминокислотную последовательность SEQ ID NO:38, включая сигнальную последовательность. Последовательность показана на Фиг. 8.
[0180]
4)-1-5 Конструирование вектора экспрессии FAN2 химерного антитела против человеческого TLR7
Синтезировали фрагмент ДНК, включающий нуклеотидную последовательность, кодирующую вариабельную область тяжелой цепи антитела cFAN2, представленную нуклеотидами 36-437 в нуклеотидной последовательности SEQ ID NO:65 (Geneart AG). Вектор экспрессии тяжелой цепи cFAN2 конструировали таким же способом, как в Примере 4)-1-3. Тяжелая цепь антитела cFAN2 включает аминокислотную последовательность SEQ ID NO:39, включая сигнальную последовательность. Последовательность показана на Фиг. 9.
[0181]
Синтезировали фрагмент ДНК (SEQ ID NO:66), включающий последовательность ДНК, кодирующую легкую цепь cFAN2 (Geneart AG). С использованием pCMA-LK, полученного в Примере 4)-1-1, вектор экспрессии легкой цепи cFAN2 конструировали таким же способом, как в Примере 4)-1-3. Легкая цепь антитела cFAN2 включает аминокислотную последовательность SEQ ID NO:40, включая сигнальную последовательность. Последовательность показана на Фиг. 9.
[0182]
4)-2 Получение химерного антитела против человеческого TLR7
4)-2-1 Получение химерного антитела AT01
Осуществляли пересев и культивирование клеток FreeStyle 293F (Invitrogen Corp.) в соответствии с инструкциями. 1,2×109 клеток FreeStyle 293F (Invitrogen Corp.) в логарифмической фазе роста высевали в 3-л колбу Фернбаха-Эрленмейера (Corning Incorporated) и разбавляли средой для экспрессии FreeStyle293 (Invitrogen Corp.) при концентрации до 2,0×106 клеток/мл. 0,24 мг вектора экспрессии тяжелой цепи, сконструированного как описано выше в 4)-1-3, 0,36 мг вектора экспрессии легкой цепи, сконструированного как описано выше в 4)-1-3, и 1,8 мг Полиэтиленимина (Polyscience #24765) добавляли к 40 мл Opti-Pro SFM среды (Invitrogen Corp.), с последующим осторожным перемешиванием и последующим выстаиванием в течение 5 минут. Затем смесь добавляли к FreeStyle 293F клеткам. После встряхивания культуры в инкубаторе при 37°C в атмосфере 8% CO2 в течение 4 часов при 90 об/мин добавляли 600 мл EX-CELL VPRO среды (SAFC Biosciences), 18 мл GlutaMAX I (Gibco) и 30 мл Yeastolate Ultrafiltrate (Gibco), с последующим встряхиванием культуры в инкубаторе при 37°C в атмосфере 8% CO2 при 90 об/мин в течение 7 дней и полученный культуральный супернатант фильтровали с использованием одноразового капсульного фильтра (Advantec #CCS-045-E1H) с получением химерного антитела AT01.
[0183]
4)-2-2 Получение химерного антитела NB7
С использованием вектора экспрессии тяжелой цепи и вектора экспрессии легкой цепи, сконструированного как описано в 4)-1-4 выше, химерное антитело NB7 получали способом 4)-2-1.
[0184]
4)-2-3 Получение химерного антитела FAN2
С использованием вектора экспрессии тяжелой цепи и вектора экспрессии легкой цепи, сконструированного как описано в 4)-1-5 выше, химерное антитело FAN2 получали способом 4)-2-1.
[0185]
4)-3 Очистка химерного антитела против человеческого TLR7
Антитело, представляющее интерес, очищали из каждого культурального супернатанта, полученного в Примере 4)-2, одностадийным способом аффинной хроматографии с Белком A. Культуральный супернатант вносили в колонку (GE Healthcare Bioscience), заполненную MabSelectSuRe, уравновешенную при помощи PBS, и затем колонку промывали PBS в объеме, превышающем объем колонки в два раза или больше. Затем осуществляли элюирование с использованием 2M раствора гидрохлорида аргинина (pH 4,0) для сбора фракции, содержащей антитело. Фракцию подвергали процедуре замены буфера на PBS(-) путем диализа (Slide-A-Lyzer Dialysis Cassette, Thermo Scientific). Антитело концентрировали с использованием центрифужного УФ фильтровального устройства VIVASPIN20 (молекулярная масса фракций UF10K, Sartorius AG) для получения IgG при концентрации 10 мг/мл или больше. В завершение, осуществляли фильтрование с использованием фильтра Minisart-Plus (Sartorius AG) с получением очищенного образца.
[0186]
[Пример 5]
Активность химерного антитела против человеческого TLR7 in vitro
5)-1 Определение антигенсвязывающей активности химерного антитела против человеческого TLR7 методом проточной цитометрии
Ba/F3 клеточную линию, экспрессирующую человеческий TLR7-Flag-His×6/hUnc93B1-HA×2, подвергали обработке 0,1% раствором Сапонина для пермеабилизации мембран и окрашивали с использованием серии разведений химерного антитела AT01, антитела NB7 и антитела FAN2 при концентрациях антител, полученных в Примере 4, и вторичного антитела, козлиного античеловеческого IgG Fc-PE (eBioscience). Активность связывания каждого антитела оценивали путем сравнения MFI на основании данных анализа проточной цитометрии. Результаты показывают наивысшую связывающую активность у антител в следующем порядке: химерное антитело AT01 (cAT01), химерное антитело NB7 (cNB7) и химерное антитело FAN2 (cFAN2).
[0187]
5)-2 Ингибирующая активность химерного антитела против человеческого TLR7 в отношении продукции цитокинов
Человеческие PBMC закупали у Cellular Technology Limited в виде замороженного продукта и размораживали в соответствии с инструкциями по применению. PBMCs, суспендированные при концентрации 2,5×106 клеток/мл в RPMI1640 (Life Technologies Corp.), содержащей 10% FBS, 1 мМ пирувата натрия (Life Technologies Corp.), 0,1 мМ MEM заменимых аминокислот (Life Technologies Corp.), 50 мкМ 2-меркаптоэтанола (Life Technologies Corp.), 50 Ед./мл пенициллина и 50 мг/мл стрептомицина (Life Technologies Corp.), высевали в 96-луночный планшет для культуры клеток при 100 мл и добавляли химерное антитело против человеческого TLR7, cAT01, cNB7 или cFAN2, или человеческое IgG контрольное антитело (Eureka Therapeutics) при 80 мкл/лунка, с последующей предварительной обработкой в инкубаторе при 37°C в течение 4 часов. Затем добавляли 1 мг/мл CL-264 (InvivoGen) при 20 мкл/лунка и смесь тщательно перемешивали, с последующим культивированием при 37°C в течение примерно 20 часов в атмосфере 5% CO2. Планшет тщательно перемешивали и затем центрифугировали при 1500 об/мин в течение 5 минут и измеряли концентрацию IL-6, содержащегося в супернатанте, методом FRET (Cisbio Bioassay. Inc).
[0188]
Фиг. 10 показывает, что химерное антитело против человеческого TLR7 подавляет продуцирование IL-6 из человеческих PBMC, обработанных CL-264, зависимым от концентрации образом. Антитела cAT01, cNB7 и cFAN2 ингибировали продуцирование IL-6 из человеческих PBMC в зависимости от добавляемой концентрации. Полумаксимальные ингибирующие концентрации (IC50) антител cAT01, cNB7 и cFAN2 составляли 35 нг/мл, 196 нг/мл, 10000 нг/мл или больше, соответственно, которые были рассчитаны на основании концентраций двух значений, которые находятся по обе стороны от 50% ингибирующей активности, и ингибирующей активности, когда добавляли каждую из этих двух концентраций.
[0189]
При этом, ингибирование не наблюдалось при использовании человеческого IgG контрольного антитела, даже при концентрации 10 мг/мл.
[0190]
[Пример 6]
Получение гуманизированного антитела против человеческого TLR7
6)-1 Гуманизированная конструкция антитела против человеческого TLR7
6)-1-1 Молекулярное моделирование вариабельных областей антитела
Молекулярное моделирование вариабельных областей осуществляли способом, известным как гомологическое моделирование (Methods in Enzymology, 203, 121-153, (1991)), с использованием коммерчески доступной программы анализа белковой трехмерной структуры, BioLuminate (Schrodinger K.K). Используемая матрица представляла собой структуру, зарегистрированную в Protein Data Bank (Nuc. Acid Res. 35, D301-D303 (2007)), имеющую высокую идентичность последовательностей с вариабельными областями тяжелых и легких цепей.
[0191]
6)-1-2 Конструирование гуманизированной аминокислотной последовательности
Метод, известный как прививка CDR (Proc. Natl. Acad. Sci. USA 86, 10029-10033(1989)), использовали для гуманизации. Акцепторы, имеющие высокую идентичность, выбирали из консенсусных последовательностей, определенных в Kabat et al. (Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service National Institutes of Health, Bethesda, MD. (1991)), и последовательностей зародышевой линии человека, зарегистрированных в IMGT (THE INTERNATIONAL IMMUNOGENETICS INFORMATION SYSTEM (зарегистрированная торговая марка), http://www.imgt.org), а донорные остатки для переноса на акцепторы выбирали путем анализа трехмерных моделей со ссылкой на стандарты, представленные в Queen et al. (Proc. Natl. Acad. Sci. USA 86, 10029-10033 (1989)).
[0192]
6)-1-3 Конструирование гуманизированной аминокислотной последовательности антитела AT01
Консенсусные последовательности человеческой гамма-цепи подгруппы 1 и каппа-цепи подгруппы 1, имеющие высокую идентичность с каркасными областями cAT01, были выбраны в качестве акцепторов cAT01. При молекулярном моделировании вариабельных областей известную структуру (PDB ID:1E4W) использовали в качестве матрицы.
[0193]
6)-1-3-1 Гуманизация тяжелой цепи антитела AT01
(1) Тяжелая цепь, которая была сконструирована, была названа huAT01_H1_IgG1LALA. huAT01_H1_IgG1LALA включает аминокислотную последовательность, представленную в SEQ ID NO:45, включая сигнальную последовательность, в качестве полноразмерной аминокислотной последовательности тяжелой цепи. Последовательность показана на Фиг. 11. В этой последовательности аминокислотная последовательность в положениях 1-19 представляет собой сигнальную последовательность, аминокислотная последовательность в положениях 20-135 представляет собой вариабельную область, и аминокислотная последовательность в положениях 136-465 представляет собой константную область. Кроме того, аминокислотная последовательность в положениях 45-54 представляет собой CDRH1, аминокислотная последовательность в положениях 69-78 представляет собой CDRH2, и аминокислотная последовательность в положениях 118-124 представляет собой CDRH3.
[0194]
Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO:45, включает последовательность, представленную в SEQ ID NO:67. Кроме того, нуклеотидная последовательность, кодирующая вариабельную область тяжелой цепи, включает последовательность, представленную в SEQ ID NO:77.
[0195]
(2) Тяжелая цепь, которая была сконструирована, была названа huAT01_H3_IgG1LALA. huAT01_H3_IgG1LALA, включая сигнальную последовательность, в качестве полноразмерной аминокислотной последовательности тяжелой цепи включает аминокислотную последовательность, представленную в SEQ ID NO:46. Последовательность показана на Фиг. 12. В этой последовательности аминокислотная последовательность в положениях 1-19 представляет собой сигнальную последовательность, аминокислотная последовательность в положениях 20-135 представляет собой вариабельную область, и аминокислотная последовательность в положениях 136-465 представляет собой константную область. Кроме того, аминокислотная последовательность в положениях 45-54 представляет собой CDRH1, аминокислотная последовательность в положениях 69-78 представляет собой CDRH2, и аминокислотная последовательность в положениях 118-124 представляет собой CDRH3.
[0196]
Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO:46, включает последовательность, представленную в SEQ ID NO:68. Кроме того, нуклеотидная последовательность, кодирующая вариабельную область тяжелой цепи, включает последовательность, представленную в SEQ ID NO:78.
[0197]
(3) Тяжелая цепь, которая была сконструирована, была названа huAT01_H3_IgG4Pro. huAT01_H3_IgG4Pro, включая сигнальную последовательность, в качестве полноразмерной аминокислотной последовательности тяжелой цепи включает аминокислотную последовательность, представленную в SEQ ID NO:47. Последовательность показана на Фиг. 13. В этой последовательности аминокислотная последовательность в положениях 1-19 представляет собой сигнальную последовательность, аминокислотная последовательность в положениях 20-135 представляет собой вариабельную область, и аминокислотная последовательность в положениях 136-462 представляет собой константную область. Кроме того, аминокислотная последовательность в положениях 45-54 представляет собой CDRH1, аминокислотная последовательность в положениях 69-78 представляет собой CDRH2, и аминокислотная последовательность в положениях 118-124 представляет собой CDRH3.
[0198]
Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO:47, включает последовательность, представленную в SEQ ID NO:69. Кроме того, нуклеотидная последовательность, кодирующая вариабельную область тяжелой цепи, включает последовательность, представленную в SEQ ID NO:78.
[0199]
Фиг. 14 показывает сравнение аминокислотной последовательности (SEQ ID NO:5) вариабельной области cAT01_H, которая представляет собой тяжелую цепь химерного антитела cAT01 (которая далее указана как cAT01_H), аминокислотной последовательности (SEQ ID NO:41) вариабельной области тяжелой цепи гуманизированного антитела, huAT01_H1_IgG1LALA (которая далее указана как huAT01_H1), и аминокислотной последовательности (SEQ ID NO:42) вариабельной области huAT01_H3_IgG1LALA (которая далее указана как huAT01_H3). В последовательностях huAT01_H1 и huAT01_H3, символ "∙" представляет собой такой же аминокислотный остаток, как в cAT01_H, и замененный аминокислотный остаток показан в том месте, где описан этот аминокислотный остаток.
[0200]
6)-1-3-2 Гуманизация легкой цепи антитела AT01
Легкая цепь, которая была сконструирована, была названа huAT01_L1. huAT01_L1 включает аминокислотную последовательность, представленную в SEQ ID NO:48, включая сигнальную последовательность, в качестве полноразмерной аминокислотной последовательности легкой цепи. Последовательность показана на Фиг. 15. В этой последовательности аминокислотная последовательность в положениях 1-20 представляет собой сигнальную последовательность, аминокислотная последовательность в положениях 21-126 представляет собой вариабельную область, и аминокислотная последовательность в положениях 127-233 представляет собой константную область. Кроме того, аминокислотная последовательность в положениях 44-54 представляет собой CDRL1, аминокислотная последовательность в положениях 70-76 представляет собой CDRL2, и аминокислотная последовательность в положениях 109-116 представляет собой CDRL3.
[0201]
Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO:48, включает последовательность, представленную в SEQ ID NO:70. Кроме того, нуклеотидная последовательность, кодирующая вариабельную область легкой цепи включает последовательность, представленную в SEQ ID NO:79.
[0202]
Легкая цепь, которая была сконструирована, была названа huAT01_L2. huAT01_L2 включает аминокислотную последовательность, представленную в SEQ ID NO:49, включая сигнальную последовательность, в качестве полноразмерной аминокислотной последовательности легкой цепи. Последовательность показана на Фиг. 16. В этой последовательности аминокислотная последовательность в положениях 1-20 представляет собой сигнальную последовательность, аминокислотная последовательность в положениях 21-126 представляет собой вариабельную область, и аминокислотная последовательность в положениях 127-233 представляет собой константную область. Кроме того, аминокислотная последовательность в положениях 44-54 представляет собой CDRL1, аминокислотная последовательность в положениях 70-76 представляет собой CDRL2, и аминокислотная последовательность в положениях 109-116 представляет собой CDRL3.
[0203]
Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO:49, представлена в SEQ ID NO:71. Кроме того, нуклеотидная последовательность, кодирующая вариабельную область легкой цепи, включает последовательность, представленную в SEQ ID NO:80.
[0204]
Фиг. 17 показывает сравнение аминокислотной последовательности (SEQ ID NO:11) вариабельной области cAT01_L, которая представляет собой легкую цепь химерного антитела cAT01 (которая далее указана как cAT01_L), аминокислотной последовательности (SEQ ID NO:43) вариабельной области легкой цепи гуманизированного антитела huAT01_L1 (которая далее указана как huAT01_L1) и аминокислотной последовательности (SEQ ID NO:44) вариабельной области huAT01_L2 (которая далее указана как huAT01_L2). В последовательностях huAT01_L1 и huAT01_L2 символ "∙" представляет собой такой же аминокислотный остаток, как в cAT01_L, и замененный аминокислотный остаток показан в том месте, где описан этот аминокислотный остаток.
[0205]
6)-1-4 Конструирование гуманизированной аминокислотной последовательности NB7
Последовательности зародышевой линии человека IGHV4-30-4*02 и IGHJ6*01, имеющие высокую идентичность с каркасными областями cNB7, были выбраны в качестве акцепторов cNB7. При молекулярном моделировании вариабельных областей известную структуру (PDB ID:3CDF) использовали в качестве матрицы.
[0206]
6)-1-4-1 Гуманизация тяжелой цепи антитела NB7
(1) Тяжелая цепь, которая была сконструирована, была названа huNB7_H3_IgG1LALA. huNB7_H3_IgG1LALA включает аминокислотную последовательность, представленную в SEQ ID NO:52, включая сигнальную последовательность, в качестве полноразмерной аминокислотной последовательности тяжелой цепи. Последовательность показана на Фиг. 18. В этой последовательности аминокислотная последовательность в положениях 1-19 представляет собой сигнальную последовательность, аминокислотная последовательность в положениях 20-141 представляет собой вариабельную область, и аминокислотная последовательность в положениях 142-471 представляет собой константную область. Кроме того, аминокислотная последовательность в положениях 45-55 представляет собой CDRH1, аминокислотная последовательность в положениях 70-78 представляет собой CDRH2, аминокислотная последовательность в положениях 118-130 представляет собой CDRH3.
[0207]
Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO:52, представлена в SEQ ID NO:72. Кроме того, нуклеотидная последовательность, кодирующая вариабельную область тяжелой цепи, включает последовательность, представленную в SEQ ID NO:81.
[0208]
(2) Тяжелая цепь, которая была сконструирована, была названа huNB7_H3_IgG4Pro. huNB7_H3_IgG4Pro включает аминокислотную последовательность, представленную в SEQ ID NO:54, включая сигнальную последовательность, в качестве полноразмерной аминокислотной последовательности тяжелой цепи. Последовательность показана на Фиг. 19. В этой последовательности аминокислотная последовательность в положениях 1-19 представляет собой сигнальную последовательность, аминокислотная последовательность в положениях 20-141 представляет собой вариабельную область, и аминокислотная последовательность в положениях 142-468 представляет собой константную область. Кроме того, аминокислотная последовательность в положениях 45-55 представляет собой CDRH1, аминокислотная последовательность в положениях 70-78 представляет собой CDRH2, аминокислотная последовательность в положениях 118-130 представляет собой CDRH3.
[0209]
Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO:54, представлена в SEQ ID NO:73. Кроме того, нуклеотидная последовательность, кодирующая вариабельную область тяжелой цепи, включает последовательность, представленную в SEQ ID NO:81.
[0210]
Фиг. 20 показывает сравнение аминокислотной последовательности (SEQ ID NO:7) вариабельной области cNB7_H, которая представляет собой тяжелую цепь химерного антитела cNB7 (которая далее указана как cNB7_H) и аминокислотной последовательности (SEQ ID NO:50) вариабельной области тяжелой цепи гуманизированного антитела huNB7_H3_IgG1LALA (которая далее указана как huNB7_H3). В huNB7_H3, символ "∙" представляет собой такой же аминокислотный остаток, как в cNB7_H, и замененный аминокислотный остаток показан в том месте, где описан этот аминокислотный остаток.
[0211]
6)-1-4-2 Гуманизация легкой цепи антитела NB7
Легкая цепь, которая была сконструирована, была названа huNB7_L3. huNB7_L3 включает аминокислотную последовательность, представленную в SEQ ID NO:53, включая сигнальную последовательность, в качестве полноразмерной аминокислотной последовательности легкой цепи. Последовательность показана на Фиг. 21. В этой последовательности аминокислотная последовательность в положениях 1-20 представляет собой сигнальную последовательность, аминокислотная последовательность в положениях 21-126 представляет собой вариабельную область, и аминокислотная последовательность в положениях 127-233 представляет собой константную область. Кроме того, аминокислотная последовательность в положениях 44-54 представляет собой CDRL1, аминокислотная последовательность в положениях 70-76 представляет собой CDRL2, и аминокислотная последовательность в положениях 109-116 представляет собой CDRL3.
[0212]
Нуклеотидная последовательность, кодирующая аминокислотную последовательность SEQ ID NO:53, представлена в SEQ ID NO:74. Кроме того, нуклеотидная последовательность, кодирующая вариабельную область легкой цепи включает последовательность, представленную в SEQ ID NO:82.
[0213]
Фиг. 22 показывает сравнение аминокислотной последовательности (SEQ ID NO:13) вариабельной области cNB7_L, которая представляет собой легкую цепь химерного антитела cNB7 (которая далее указана как cNB7_L), и аминокислотной последовательности (SEQ ID NO:51) вариабельной области легкой цепи гуманизированного антитела huNB7_L3 (которая далее указана как huNB7_L3). В huNB7_L3, символ "∙" представляет собой такой же аминокислотный остаток, как в cNB7_L, и замененный аминокислотный остаток показан в том месте, где описан этот аминокислотный остаток.
[0214]
6)-2 Конструкция гуманизированного антитела путем сочетания тяжелой и легкой цепей
6)-2-1 Конструкция гуманизированного анти-TLR7 антитела AT01
(1) Антитело, включающее huAT01_H1_IgG1LALA, состоящую из аминокислотной последовательности в положениях 20-465 в SEQ ID NO:45, в качестве тяжелой цепи и huAT01_L1, состоящую из аминокислотной последовательности в положениях 21-233 в SEQ ID NO:48, в качестве легкой цепи, было названо "huAT01_H1L1_IgG1LALA антитело" или "huAT01_H1L1_IgG1LALA".
[0215]
(2) Антитело, включающее huAT01_H3_IgG1LALA, состоящую из аминокислотной последовательности в положениях 20-465 в SEQ ID NO:46, в качестве тяжелой цепи и huAT01_L1, состоящую из аминокислотной последовательности в положениях 21-233 в SEQ ID NO:48, в качестве легкой цепи, было названо "huAT01_H3L1_IgG1LALA антитело" или "huAT01_H3L1_IgG1LALA".
[0216]
(3) Антитело, включающее huAT01_H3_IgG1LALA, состоящую из аминокислотной последовательности в положениях 20-465 в SEQ ID NO:46, в качестве тяжелой цепи и huAT01_L2, состоящую из аминокислотной последовательности в положениях 21-233 в SEQ ID NO:49, в качестве легкой цепи, было названо "huAT01_H3L2_IgG1LALA антитело" или "huAT01_H3L2_IgG1LALA".
[0217]
(4) Антитело, включающее huAT01_H3_IgG4Pro, состоящую из аминокислотной последовательности в положениях 20-462 в SEQ ID NO:47, в качестве тяжелой цепи и huAT01_L2, состоящую из аминокислотной последовательности в положениях 21-233 в SEQ ID NO:49, в качестве легкой цепи, было названо "huAT01_H3L2_IgG4Pro антитело" или "huAT01_H3L2_IgG4Pro".
[0218]
6)-2-2 Конструкция гуманизированного анти-TLR7 антитела NB7
(1) Антитело, состоящее из huNB7_H3_IgG1LALA, состоящей из аминокислотной последовательности в положениях 20-471 в SEQ ID NO:52, в качестве тяжелой цепи и huNB7_L3, состоящей из аминокислотной последовательности в положениях 21-233 в SEQ ID NO:53, в качестве легкой цепи, было названо "huNB7_H3L3_IgG1LALA антитело" или "huNB7_H3L3_IgG1LALA".
[0219]
(2) Антитело, состоящее из huNB7_H3_IgG4Pro, состоящей из аминокислотной последовательности в положениях 20-468 в SEQ ID NO:54, в качестве тяжелой цепи и huNB7_L3, состоящей из аминокислотной последовательности в положениях 21-233 в SEQ ID NO:53, в качестве легкой цепи, было названо "huNB7_H3L3_IgG4Pro антитело" или "huNB7_H3L3_IgG4Pro".
[0220]
6)-3 Получение гуманизированного антитела против человеческого TLR7
6)-3-1 Конструирование вектора экспрессии тяжелой цепи гуманизированного IgG1LALA типа, pCMA-G1LALA
pCMA-G1LALA конструировали таким же способом, как в Примере 4)-1-2, с использованием фрагментов ДНК, включающих нуклеотидные последовательности, кодирующие аминокислотные последовательности сигнальной последовательности тяжелой цепи человека и константной области IgG1LALA человека (SEQ ID NO:75).
[0221]
6)-3-2 Конструирование вектора экспрессии тяжелой цепи гуманизированного IgG4Pro типа, pCMA-G4Pro
pCMA-G4Pro конструировали таким же способом, как в Примере 4)-1-2, с использованием фрагментов ДНК, включающих нуклеотидные последовательности, кодирующие аминокислотные последовательности сигнальной последовательности тяжелой цепи человека и константной области IgG4Pro человека (SEQ ID NO:76).
[0222]
6)-3-3 Конструирование вектора экспрессии гуманизированной тяжелой цепи AT01
6)-3-3-1 Конструирование вектора экспрессии huAT01_H1_IgG1LALA
Синтезировали фрагмент ДНК, представленный нуклеотидами 36-422 в нуклеотидной последовательности huAT01_H1_IgG1LALA, представленной в SEQ ID NO:46, (Geneart AG). Синтезированный фрагмент ДНК встраивали в сайт, где pCMA-G1LALA был вырезан рестрикционным ферментом, BlpI, с использованием набора для ПЦР клонирования In-Fusion HD (Clontech Laboratories, Inc.), конструируя таким образом вектор экспрессии huAT01_H1_IgG1LALA.
[0223]
6)-3-3-2 Конструирование вектора экспрессии huAT01_H3_IgG1LALA
Синтезировали фрагмент ДНК, представленный нуклеотидами 36-422 в нуклеотидной последовательности huAT01_H3_IgG1LALA, представленной в SEQ ID NO:68, (Geneart AG). Вектор экспрессии huAT01_H3_IgG1LALA конструировали таким же способом, как в Примере 6)-3-3-1.
[0224]
6)-3-3-3 Конструирование вектора экспрессии huAT01_H3_IgG4Pro
Синтезировали фрагмент ДНК, представленный нуклеотидами 36-422 в нуклеотидной последовательности huAT01_H3_IgG4Pro, представленной в SEQ ID NO:69, (Geneart AG). Синтезированный фрагмент ДНК встраивали в сайт, где pCMA-G4Pro был вырезан рестрикционным ферментом, BlpI, с использованием набора для ПЦР клонирования In-Fusion HD (Clontech Laboratories, Inc.), конструируя таким образом вектор экспрессии huAT01_H3_IgG4Pro.
[0225]
6)-3-4 Конструирование вектора экспрессии гуманизированной легкой цепи AT01
6)-3-4-1 Конструирование вектора экспрессии huAT01_L1
Синтезировали фрагмент ДНК, представленный нуклеотидами 37-399 в нуклеотидной последовательности huAT01_L1, представленной в SEQ ID NO:70, (Geneart AG). Синтезированный фрагмент ДНК встраивали в сайт, где pCMA-LK был вырезан рестрикционным ферментом, BsiWI, с использованием набора для ПЦР клонирования In-Fusion HD (Clontech Laboratories, Inc.), конструируя таким образом вектор экспрессии huAT01_L1.
[0226]
6)-3-4-2 Конструирование вектора экспрессии huAT01_L2
Синтезировали фрагмент ДНК, представленный нуклеотидами 37-399 в нуклеотидной последовательности huAT01_L2, представленной в SEQ ID NO:71, (Geneart AG). Вектор экспрессии huAT01_L1 конструировали таким же способом, как в Примере 6)-3-4-1, с использованием набора для ПЦР клонирования In-Fusion HD (Clontech Laboratories, Inc).
[0227]
6)-3-5 Конструирование вектора экспрессии гуманизированной тяжелой цепи NB7
6)-3-5-1 Конструирование вектора экспрессии huNB7_H3_IgG1LALA
Синтезировали фрагмент ДНК, представленный нуклеотидами 36-440 в нуклеотидной последовательности huNB7_H3_IgG1LALA, представленной в SEQ ID NO:72, (Geneart AG). Вектор экспрессии huNB7_H3_IgG1LALA конструировали таким же способом, как в Примере 6)-3-3-1.
[0228]
6)-3-5-2 Конструирование вектора экспрессии huNB7_H3_IgG4Pro
Синтезировали фрагмент ДНК, представленный нуклеотидами 36-440 в нуклеотидной последовательности huNB7_H3_IgG4Pro, представленной в SEQ ID NO:73, (Geneart AG). Вектор экспрессии huNB7_H3_IgG4Pro конструировали таким же способом, как в Примере 6)-3-3-3.
[0229]
6)-3-6 Конструирование вектора экспрессии гуманизированной легкой цепи NB7
6)-3-6-1 Конструирование вектора экспрессии huNB7_L3
Синтезировали фрагмент ДНК, представленный нуклеотидами 37-399 в нуклеотидной последовательности huNB7_L3, представленной в SEQ ID NO:74, (Geneart AG). Вектор экспрессии huNB7_L3 конструировали таким же способом, как в Примере 6)-3-4-1, с использованием набора для ПЦР клонирования In-Fusion HD (Clontech Laboratories, Inc).
[0230]
6)-3-7 Получение гуманизированных антител
6)-3-7-1 Продукция гуманизированных антител
Получение гуманизированных антител huAT01_H1L1_IgG1LALA, huAT01_H3L1_IgG1LALA, huAT01_H3L2_IgG1LALA, huAT01_H3L2_IgG4Pro, huNB7_H3L3_IgG1LALA и huNB7_H3L3_IgG4Pro осуществляли путем комбинирования тяжелой и легкой цепей, сконструированных в Примере 6)-2, с использованием векторов экспрессии, сконструированных в Примерах 6)-3-1 по 6)-3-6, таким же способом, как в Примере 4)-2.
[0231]
6)-3-7-2 Очистка гуманизированных антител
Культуральный супернатант, полученный в Примере 6)-3-7-1, очищали двухстадийным способом с использованием аффинной хроматографии с белком A и керамического гидроксиапатита.
[0232]
Культуральный супернатант вносили в колонку (GE Healthcare Bioscience), заполненную MabSelectSuRe, уравновешенную при помощи PBS, и затем колонку промывали PBS в объеме, превышающем объем колонки в два раза или больше. Затем каждое антитело элюировали с использованием 2M раствора гидрохлорида аргинина (pH 4,0).
[0233]
Фракцию, содержащую антитело, подвергали процедуре замены буфера на PBS путем диализа (Slide-A-Lyzer Dialysis Cassette, Thermo Scientific), разбавляли 5-кратно буфером 5 мМ фосфата натрия/50 мМ MES/pH 7,0 и вносили в колонку с керамическим гидроксиапатитом (Japan Bio-Rad Laboratories, Inc., колонка Bio-Scale с CHT гидроксиапатитом 1 типа), уравновешенную буфером 5 мМ NaPi/50 мМ MES/30 мМ NaCl/pH 7,0.
[0234]
Осуществляли элюирование с линейным градиентом концентрации с использованием хлорида натрия и собирали фракцию, содержащую антитело. Фракцию подвергали процедуре замены буфера на HBSor (25 мМ гистидина/5% сорбита, pH 6,0) путем диализа (Slide-A-Lyzer Dialysis Cassette, Thermo Scientific). Антитело концентрировали с использованием центрифужного УФ фильтровального устройства VIVASPIN20 (молекулярная масса фракций UF10K, Sartorius AG) для получения IgG при концентрации 50 мг/мл. В завершение, осуществляли фильтрование с использованием Minisart-Plus фильтра (Sartorius AG) с получением очищенного образца.
[0235]
[Пример 7]
Активность гуманизированного антитела против человеческого TLR7 in vitro
7)-1 Ингибирующая активность гуманизированного антитела против человеческого TLR7 в отношении продукции цитокинов
Человеческие PBMC закупали у Cellular Technology Limited в виде замороженного продукта и размораживали в соответствии с инструкциями по применению.
[0236]
PBMC, суспендированные при концентрации 2,5×106 клеток/мл в RPMI1640 (Life Technologies Corp.), содержащей 10% FBS, 1 мМ пирувата натрия (Life Technologies Corp.), 0,1 мМ MEM заменимых аминокислот (Life Technologies Corp.), 50 мМ 2-меркаптоэтанола (Life Technologies Corp.), 50 Ед./мл пенициллина и 50 мкг/мл стрептомицина (Life Technologies Corp.), высевали в 96-луночный планшет для культуры клеток при 100 мл и добавляли гуманизированное антитело против человеческого TLR7, huAT01_H1L1_IgG1LALA, huAT01_H3L1_IgG1LALA, huAT01_H3L2_IgG1LALA, huAT01_H3L2_IgG4Pro, huNB7_H3L3_IgG1LALA или huNB7_H3L3_IgG4Pro, или человеческое IgG контрольное антитело (Eureka Therapeutics) при 80 мкл/лунка, с последующей предварительной обработкой в инкубаторе при 37°C в течение 4 часов.
[0237]
Затем добавляли 1 мг/мл CL-264 (InvivoGen) при 20 мкл/лунка и смесь тщательно перемешивали, с последующим культивированием при 37°C в течение примерно 20 часов в атмосфере 5% CO2.
[0238]
Планшет тщательно перемешивали и затем центрифугировали при 1500 об/мин в течение 5 минут и измеряли концентрацию IL-6, содержащегося в супернатанте, методом FRET (Cisbio Bioassay. Inc).
[0239]
Фиг. 23 показывает, что гуманизированное антитело против человеческого TLR7 подавляет продуцирование IL-6 из человеческих PBMC, обработанных CL-264, зависимым от концентрации образом.
[0240]
Антитела huAT01_H1L1_IgG1LALA, huAT01_H3L1_IgG1LALA, huAT01_H3L2_IgG1LALA, huAT01_H3L2_IgG4Pro, huNB7_H3L3_IgG1LALA и huNB7_H3L3_IgG4Pro ингибировали продуцирование IL-6 из человеческих PBMC зависимым от концентрации образом.
[0241]
Полумаксимальные ингибирующие концентрации (IC50) антител huAT01_H1L1_IgG1LALA, huAT01_H3L1_IgG1LALA, huAT01_H3L2_IgG1LALA, huAT01_H3L2_IgG4Pro, huNB7_H3L3_IgG1LALA и huNB7_H3L3_IgG4Pro составляли 74 нг/мл, 138 нг/мл, 38 нг/мл, 24 нг/мл, 307 нг/мл и 31 нг/мл, соответственно, которые были рассчитаны на основании концентраций двух значений, которые находятся по обе стороны от 50% ингибирующей активности, и ингибирующей активности, когда добавляли каждую из этих двух концентраций.
[0242]
[Пример 8]
Подтверждение связывания антигена с гуманизированным антителом против человеческого TLR7
8)-1 Получение HEK293 клеток, экспрессирующих TLR7 человека (вариант 1)-Flag
Lenti-X (зарегистрированная торговая марка) HEK293 T клетки (Clontech Laboratories, Inc.) при концентрации 4,5×106 клеток/колба высевали в 75-см2 колбу (Sumitomo Bakelite Co., Ltd.) и культивировали в течение ночи в DMEM среде (FUJIFILM Wako Pure Chemical Corporation), содержащей 10% FBS, 50 Ед./мл пенициллина и 50 мг/мл стрептомицина (Life Technologies Corp.), в условиях 37°C и 5% CO2.
[0243]
На следующий день плазмиды, экспрессирующие pcDNA3.1-TLR7 человека (вариант 1)-Flag, от компании GenScript Corporation трансфицировали в Lenti-X (зарегистрированная торговая марка) HEK293 T клетки (Clontech Laboratories, Inc.) с использованием реагента для трансфекции Липофектамина (зарегистрированная торговая марка) 2000 (Life Technologies Corp.) и клетки затем культивировали в течение ночи в условиях 37°C и 5% CO2.
[0244]
На следующий день введенные посредством экспрессионной плазмиды клетки обрабатывали при помощи TrypLE Express (Life Technologies Corporation) и клетки после обработки промывали окрашивающим буфером для проточной цитометрии (Life Technologies Corporation) и затем суспендировали в окрашивающем буфере для проточной цитометрии (Life Technologies Corporation). Полученную клеточную суспензию использовали в анализе методом проточной цитометрии.
[0245]
Было подтверждено, что человеческий TLR7 экспрессировался в клетках, трансфицированных плазмидами, экспрессирующими pcDNA3.1-человеческий TLR7 (вариант 1)-Flag, при помощи проточной цитометрии (Miltenyi Biotec K.K.) с использованием анти-Flag-PE антитела (BioLegend, Inc.) или изотипического контрольного антитела (BioLegend, Inc.) в качестве отрицательного контроля.
[0246]
Аминокислотная последовательность человеческого TLR7 (вариант 1) и полинуклеотидная последовательность, кодирующая аминокислотную последовательность, представлены в SEQ ID NO:2 и 1 в Перечне последовательностей, соответственно.
[0247]
8)-2 Получение HEK293 клеток, принудительно экспрессирующих человеческий TLR7 (вариант 2)-Flag
Lenti-X (зарегистрированная торговая марка) HEK293 T клетки (Clontech Laboratories, Inc.) при концентрации 4,5×106 клеток/колба высевали в 75-см2 колбу (Sumitomo Bakelite Co., Ltd.) и культивированн в течение ночи в DMEM среде (FUJIFILM Wako Pure Chemical Corporation), содержащей 10% FBS, 50 Ед./мл пенициллина и 50 мкг/мл стрептомицина (Life Technologies Corp.), в условиях 37°C и 5% CO2.
[0248]
На следующий день плазмиды, экспрессирующие pcDNA3.1-человеческий TLR7 (вариант 2)-Flag, от компании GenScript Biotech Corporation, трансфицировали в Lenti-X (зарегистрированная торговая марка) HEK293 T клетки (Clontech Laboratories, Inc.) с использованием реагента для трансфекции Липофектамина (зарегистрированная торговая марка) 2000 (Life Technologies Corp.) и клетки затем культивировали в течение ночи в условиях 37°C и 5% CO2.
[0249]
На следующий день трансфицированые экспрессирующим вектором клетки обрабатывали при помощи TrypLE Express (Life Technologies Corporation) и клетки после обработки промывали окрашивающим буфером для проточной цитометрии (Life Technologies Corporation) и затем суспендировали в окрашивающем буфере для проточной цитометрии (Life Technologies Corporation). Полученную клеточную суспензию использовали в анализе методом проточной цитометрии.
[0250]
Было подтверждено, что человеческий TLR7 экспрессировался в клетках, трансфицированных плазмидами, экспрессирующими pcDNA3.1-человеческий TLR7 (вариант 2)-Flag, при помощи проточной цитометрии (Miltenyi Biotec K.K.) с использованием анти-Flag-PE антитела (BioLegend, Inc.) или изотипического контрольного антитела (BioLegend, Inc.) в качестве отрицательного контроля.
[0251]
8)-3 Получение HEK293 клеток, экспрессирующих обезьяний TLR7-Flag
Lenti-X (зарегистрированная торговая марка) HEK293 T клетки (Clontech Laboratories, Inc.) при концентрации 4,5×106 клеток/колба высевали в 75-см2 колбу (Sumitomo Bakelite Co., Ltd.) и культивировали в течение ночи в DMEM среде (FUJIFILM Wako Pure Chemical Corporation), содержащей 10% FBS, 50 Ед./мл пенициллина и 50 мкг/мл стрептомицина (Life Technologies Corp.), в условиях 37°C и 5% CO2.
[0252]
На следующий день плазмиды, экспрессирующие pcDNA3.1-обезьяний TLR7-Flag, от компании GenScript Corporation, трансфицировали в Lenti-X (зарегистрированная торговая марка) HEK293 T клетки (Clontech Laboratories, Inc.) с использованием реагента для трансфекции Липофектамина (зарегистрированная торговая марка) 2000 (Life Technologies Corp.) и клетки затем культивировали в течение ночи в условиях 37°C и 5% CO2.
[0253]
На следующий день трансфицированые экспрессирующим вектором клетки обрабатывали при помощи TrypLE Express (Life Technologies Corporation) и клетки после обработки промывали окрашивающим буфером для проточной цитометрии (Life Technologies Corporation) и затем суспендировали в окрашивающем буфере для проточной цитометрии (Life Technologies Corporation). Полученную клеточную суспензию использовали в анализе методом проточной цитометрии.
[0254]
Было подтверждено, что обезьяний TLR7 экспрессировался в клетках, трансфицированных плазмидами, экспрессирующими pcDNA3.1-обезьяний TLR7-Flag, при помощи проточной цитометрии (Miltenyi Biotec K.K.), с использованием анти-Flag-PE антитела (BioLegend, Inc.) или изотипического контрольного антитела (BioLegend, Inc.) в качестве отрицательного контроля.
[0255]
8)-4 Получение HEK293 клеток, экспрессирующих мышиный TLR7-Flag
Lenti-X (зарегистрированная торговая марка) HEK293 T клетки (Clontech Laboratories, Inc.) при концентрации 4,5×106 клеток/колба высевали в 75-см2 колбу (Sumitomo Bakelite Co., Ltd.) и культивированн в течение ночи в DMEM среде (FUJIFILM Wako Pure Chemical Corporation), содержащей 10%FBS, 50 Ед./мл пенициллина и 50 мкг/мл стрептомицина (Life Technologies Corp.), в условиях 37°C и 5% CO2.
[0256]
На следующий день плазмиды, экспрессирующие pcDNA3.1-мышиный TLR7-Flag, от компании GenScript Corporation, трансфицировали в Lenti-X (зарегистрированная торговая марка) HEK293 T клетки (Clontech Laboratories, Inc.) с использованием реагента для трансфекции Липофектамина (зарегистрированная торговая марка) 2000 (Life Technologies Corp.) и клетки затем культивировали в течение ночи в условиях 37°C и 5% CO2.
[0257]
На следующий день трансфицированые экспрессирующим вектором клетки обрабатывали при помощи TrypLE Express (Life Technologies Corporation) и клетки после обработки промывали окрашивающим буфером для проточной цитометрии (Life Technologies Corporation) и затем суспендировали в окрашивающем буфере для проточной цитометрии (Life Technologies Corporation). Полученную клеточную суспензию использовали в анализе методом проточной цитометрии.
[0258]
Было подтверждено, что мышиный TLR7 экспрессировался в клетках, трансфицированных плазмидами, экспрессирующими pcDNA3.1-мышиный TLR7-Flag, при помощи проточной цитометрии (Miltenyi Biotec K.K.) с использованием анти-Flag-PE антитела (BioLegend, Inc.) или изотипического контрольного антитела (BioLegend, Inc.) в качестве отрицательного контроля.
[0259]
8)-5 Получение HEK293 клеток, экспрессирующирующих крысиный TLR7-Flag
Lenti-X (зарегистрированная торговая марка) HEK293 T клетки (Clontech Laboratories, Inc.) при концентрации 4,5×106 клеток/колба высевали в 75-см2 колбу (Sumitomo Bakelite Co., Ltd.) и культивировали в течение ночи в DMEM среде (FUJIFILM Wako Pure Chemical Corporation), содержащей 10% FBS, 50 Ед./мл пенициллина и 50 мкг/мл стрептомицина (Life Technologies Corp.), в условиях 37°C и 5% CO2.
[0260]
На следующий день плазмиды, экспрессирующие pcDNA3.1-крысиный TLR7-Flag, от компании GenScript Corporation, трансфицировали в Lenti-X (зарегистрированная торговая марка) HEK293 T клетки (Clontech Laboratories, Inc.) с использованием реагента для трансфекции Липофектамина (зарегистрированная торговая марка) 2000 (Life Technologies Corp.) и клетки затем культивировали в течение ночи в условиях 37°C и 5% CO2.
[0261]
На следующий день трансфицированые экспрессирующим вектором клетки обрабатывали при помощи TrypLE Express (Life Technologies Corporation) и клетки после обработки промывали окрашивающим буфером для проточной цитометрии (Life Technologies Corporation) и затем суспендировали в окрашивающем буфере для проточной цитометрии (Life Technologies Corporation). Полученную клеточную суспензию использовали в анализе методом проточной цитометрии.
[0262]
Было подтверждено, что крысиный TLR7 экспрессировался в клетках, трансфицированных плазмидами, экспрессирующими pcDNA3.1-крысиный TLR7-Flag, при помощи проточной цитометрии (Miltenyi Biotec K.K.) с использованием анти-Flag-PE антитела (BioLegend, Inc.) или изотипического контрольного антитела (BioLegend, Inc.) в качестве отрицательного контроля.
[0263]
8)-6 Оценка селективности связывания гуманизированного антитела против человеческого TLR7 методом проточной цитометрии
HEK293 клетки, экспрессирующие человеческий TLR7 (вариант 1)-Flag, полученные в 8)-1, HEK293 клетки, экспрессирующие человеческий TLR7 (вариант 2)-Flag, полученные в 8)-2, HEK293 клетки, экспрессирующие обезьяний TLR7-Flag, полученные в 8)-3, HEK293 клетки, экспрессирующие мышиный TLR7-Flag, полученные в 8)-4, и HEK293 клетки, экспрессирующие крысиный TLR7-Flag, полученные в 8)-5, иммобилизовывали/подвергали пермеабилизации мембран с использованием раствора для фиксации и пермеабилизации (Becton, Dickinson and Company) и затем окрашивали с использованием huAT01_H3L2_IgG1LALA, которое представляет собой одно из гуманизированных антител против человеческого TLR7, и Alexa Fluor (зарегистрированная торговая марка) 647 AffiniPure козлиного античеловеческого IgG+IgM (H+L) (Jackson ImmunoResearch Inc.), которое представляет собой вторичное антитело.
[0264]
Связывание гуманизированного антитела против человеческого TLR7 с человеческим TLR7 определяли на основании данных проточной цитометрии (Miltenyi Biotec K.K.) и данные анализировали с использованием программы (Flowjo), которая анализирует данные проточной цитометрии.
[0265]
Результаты показывают, что huAT01_H3L2_IgG1LALA, которое представляет собой одно из гуманизированных антител против TLR7 человека, специфически связывалось с TLR7 человека (вариант 1), TLR7 человека (вариант 2) или TLR7 обезьяны и не связывалось с TLR7 мыши или TLR7 крысы. Фиг. 25-29 показывают результаты.
Промышленная применимость
[0266]
Гуманизированное анти-TLR7 антитело по настоящему изобретению обладает ингибирующей активностью-подавляющим действием в отношении функции человеческого TLR7 и, таким образом, может представлять собой средство для лечения или профилактики связанных с иммунным воспалением заболеваний и т.п.
Перечень последовательностей
[0267]
SEQ ID NO:1: Нуклеотидная последовательность, кодирующая человеческий TLR7 (вариант 1)
SEQ ID NO:2: Аминокислотная последовательность человеческого TLR7 (вариант 1)
SEQ ID NO:3: Нуклеотидная последовательность, кодирующая человеческий TLR7 (вариант 2)
SEQ ID NO:4: Аминокислотная последовательность человеческого TLR7 (вариант 2)
SEQ ID NO:5: Аминокислотная последовательность вариабельной области тяжелой цепи антитела AT01
SEQ ID NO:6: Нуклеотидная последовательность, кодирующая вариабельную область тяжелой цепи антитела cAT01
SEQ ID NO:7: Аминокислотная последовательность вариабельной области тяжелой цепи антитела NB7
SEQ ID NO:8: Нуклеотидная последовательность, кодирующая вариабельную область тяжелой цепи антитела cNB7
SEQ ID NO:9: Аминокислотная последовательность вариабельной области тяжелой цепи антитела FAN2
SEQ ID NO:10: Нуклеотидная последовательность, кодирующая вариабельную область тяжелой цепи антитело cFAN2
SEQ ID NO:11: Аминокислотная последовательность вариабельной области легкой цепи антитела AT01
SEQ ID NO:12: Нуклеотидная последовательность, кодирующая вариабельную область легкой цепи антитела cAT01
SEQ ID NO:13: Аминокислотная последовательность вариабельной области легкой цепи антитела NB7
SEQ ID NO:14: Нуклеотидная последовательность, кодирующая вариабельную область легкой цепи антитела cNB7
SEQ ID NO:15: Аминокислотная последовательность вариабельной области легкой цепи антитела FAN2
SEQ ID NO:16: Нуклеотидная последовательность, кодирующая вариабельную область легкой цепи антитела cFAN2
SEQ ID NO:17: Аминокислотная последовательность CDRH1 антитела AT01
SEQ ID NO:18: Аминокислотная последовательность CDRH2 антитела AT01
SEQ ID NO:19: Аминокислотная последовательность CDRH3 антитела AT01
SEQ ID NO:20: Аминокислотная последовательность CDRL1 антитела AT01
SEQ ID NO:21: Аминокислотная последовательность CDRL2 антитела AT01
SEQ ID NO:22: Аминокислотная последовательность CDRL3 антитела AT01
SEQ ID NO:23: Аминокислотная последовательность CDRH1 антитела NB7
SEQ ID NO:24: Аминокислотная последовательность CDRH2 антитела NB7
SEQ ID NO:25: Аминокислотная последовательность CDRH3 антитела NB7
SEQ ID NO:26: Аминокислотная последовательность CDRL1 антитела NB7
SEQ ID NO:27: Аминокислотная последовательность CDRL2 антитела NB7
SEQ ID NO:28: Аминокислотная последовательность CDRL3 антитела NB7
SEQ ID NO:29: Аминокислотная последовательность CDRH1 антитела FAN2
SEQ ID NO:30: Аминокислотная последовательность CDRH2 антитела FAN2
SEQ ID NO:31: Аминокислотная последовательность CDRH3 антитела FAN2
SEQ ID NO:32: Аминокислотная последовательность CDRL1 антитела FAN2
SEQ ID NO:33: Аминокислотная последовательность CDRL2 антитела FAN2
SEQ ID NO:34: Аминокислотная последовательность CDRL3 антитела FAN2
SEQ ID NO:35: Аминокислотная последовательность тяжелой цепи AT01, химерного антитела против человеческого TLR7 (cAT01)
SEQ ID NO:36: Аминокислотная последовательность легкой цепи AT01, химерного антитела против человеческого TLR7 (cAT01)
SEQ ID NO:37: Аминокислотная последовательность тяжелой цепи NB7, химерного антитела против человеческого TLR7 (cNB7)
SEQ ID NO:38: Аминокислотная последовательность легкой цепи NB7, химерного антитела против человеческого TLR7 (cNB7)
SEQ ID NO:39: Аминокислотная последовательность тяжелой цепи FAN2, химерного антитела против человеческого TLR7 (cFAN2)
SEQ ID NO:40: Аминокислотная последовательность легкой цепи FAN2, химерного антитела против человеческого TLR7 (cFAN2)
SEQ ID NO:41: Аминокислотная последовательность вариабельной области тяжелой цепи huAT01_H1_IgG1LALA
SEQ ID NO:42: Аминокислотная последовательность вариабельной области тяжелой цепи huAT01_H3_IgG1LALA
SEQ ID NO:43: Аминокислотная последовательность вариабельной области легкой цепи huAT01_L1
SEQ ID NO:44: Аминокислотная последовательность вариабельной области легкой цепи huAT01_L2
SEQ ID NO:45: Аминокислотная последовательность huAT01_H1_IgG1LALA
SEQ ID NO:46: Аминокислотная последовательность huAT01_H3_IgG1LALA
SEQ ID NO:47: Аминокислотная последовательность huAT01_H3_IgG4Pro
SEQ ID NO:48: Аминокислотная последовательность huAT01_L1
SEQ ID NO:49: Аминокислотная последовательность huAT01_L2
SEQ ID NO:50: Аминокислотная последовательность вариабельной области тяжелой цепи huNB7_H3_IgG1LALA
SEQ ID NO:51: Аминокислотная последовательность вариабельной области легкой цепи huNB7_L3
SEQ ID NO:52: Аминокислотная последовательность huNB7_H3_IgG1LALA
SEQ ID NO:53: Аминокислотная последовательность huNB7_L3
SEQ ID NO:54: Аминокислотная последовательность huNB7_H3_IgG4Pro
SEQ ID NO:55: Нуклеотидная последовательность гена Unc93B1 человека
SEQ ID NO:56: Нуклеотидная последовательность гена TLR7 мыши
SEQ ID NO:57: Нуклеотидная последовательность гена TLR7 крысы
SEQ ID NO:58: Нуклеотидная последовательность гена TLR7 обезьяны
SEQ ID NO:59: Нуклеотидные последовательности фрагментов ДНК, включающих нуклеотидные последовательности, кодирующие сигнальную последовательность легкой цепи человека и константную область каппа-цепи человека
SEQ ID NO:60: Нуклеотидные последовательности фрагментов ДНК, включающих нуклеотидные последовательности, кодирующие сигнальную последовательность тяжелой цепи человека и константную область IgG1 человека
SEQ ID NO:61: Нуклеотидная последовательность, кодирующая тяжелую цепь антитела cAT01
SEQ ID NO:62: Нуклеотидная последовательность фрагмента ДНК, включающего нуклеотидную последовательность, кодирующую легкую цепь антитела cAT01
SEQ ID NO:63: Нуклеотидная последовательность, кодирующая тяжелую цепь антитела cNB7
SEQ ID NO:64: Нуклеотидная последовательность фрагмента ДНК, включающего нуклеотидную последовательность, кодирующую легкую цепь антитела cNB7
SEQ ID NO:65: Нуклеотидная последовательность, кодирующая тяжелую цепь антитела cFAN2
SEQ ID NO:66: Нуклеотидная последовательность фрагмента ДНК, включающего нуклеотидную последовательность, кодирующую легкую цепь антитела cFAN2
SEQ ID NO:67: Нуклеотидная последовательность, кодирующая huAT01_H1_IgG1LALA
SEQ ID NO:68: Нуклеотидная последовательность, кодирующая huAT01_H3_IgG1LALA
SEQ ID NO:69: Нуклеотидная последовательность, кодирующая huAT01_H3_IgG4Pro
SEQ ID NO:70: Нуклеотидная последовательность, кодирующая huAT01_L1
SEQ ID NO:71: Нуклеотидная последовательность, кодирующая huAT01_L2
SEQ ID NO:72: Нуклеотидная последовательность, кодирующая huNB7_H3_IgG1LALA
SEQ ID NO:73: Нуклеотидная последовательность, кодирующая huNB7_H3_IgG4Pro
SEQ ID NO:74: Нуклеотидная последовательность, кодирующая huNB7_L3
SEQ ID NO:75: Нуклеотидные последовательности фрагментов ДНК, включающих нуклеотидные последовательности, кодирующие сигнальную последовательность тяжелой цепи человека и константную область IgG1LALA человек
SEQ ID NO:76: Нуклеотидные последовательности фрагментов ДНК, включающих нуклеотидные последовательности, кодирующие сигнальную последовательность тяжелой цепи человека и константную область IgG4Pro человека
SEQ ID NO:77: Нуклеотидная последовательность, кодирующая вариабельную область тяжелой цепи huAT01_H1
SEQ ID NO:78: Нуклеотидная последовательность, кодирующая вариабельную область тяжелой цепи huAT01_H3
SEQ ID NO:79: Нуклеотидная последовательность, кодирующая вариабельную область легкой цепи huAT01_L1
SEQ ID NO:80: Нуклеотидная последовательность, кодирующая вариабельную область легкой цепи huAT01_L2
SEQ ID NO:81: Нуклеотидная последовательность, кодирующая вариабельную область тяжелой цепи huNB7_H3
SEQ ID NO:82: Нуклеотидная последовательность, кодирующая вариабельную область легкой цепи huNB7_L3
SEQ ID NO:83: Аминокислотная последовательность TLR7 мыши
SEQ ID NO:84: Аминокислотная последовательность TLR7 крысы
SEQ ID NO:85: Аминокислотная последовательность TLR7 обезьяны
SEQ ID NO:86: Нуклеотидная последовательность человеческого Unc93B1 D34A мутант-HA×2 гена
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ДАЙИТИ САНКИО КОМПАНИ, ЛИМИТЕД
ДЗЕ ЮНИВЕРСИТИ ОФ ТОКИО
<120> АНТИТЕЛО ПРОТИВ TLR7 ЧЕЛОВЕКА
<130> FA1511-19113
<150> JP 2018-104676
<151> 2018-05-31
<160> 86
<170> PatentIn version 3.5
<210> 1
<211> 3150
<212> ДНК
<213> Homo sapiens
<400> 1
atggtgtttc caatgtggac actgaagaga caaattctta tcctttttaa cataatccta
60
atttccaaac tccttggggc tagatggttt cctaaaactc tgccctgtga tgtcactctg
120
gatgttccaa agaaccatgt gatcgtggac tgcacagaca agcatttgac agaaattcct
180
ggaggtattc ccacgaacac cacgaacctc accctcacca ttaaccacat accagacatc
240
tccccagcgt cctttcacag actggaccat ctggtagaga tcgatttcag atgcaactgt
300
gtacctattc cactggggtc aaaaaacaac atgtgcatca agaggctgca gattaaaccc
360
agaagcttta gtggactcac ttatttaaaa tccctttacc tggatggaaa ccagctacta
420
gagataccgc agggcctccc gcctagctta cagcttctca gccttgaggc caacaacatc
480
ttttccatca gaaaagagaa tctaacagaa ctggccaaca tagaaatact ctacctgggc
540
caaaactgtt attatcgaaa tccttgttat gtttcatatt caatagagaa agatgccttc
600
ctaaacttga caaagttaaa agtgctctcc ctgaaagata acaatgtcac agccgtccct
660
actgttttgc catctacttt aacagaacta tatctctaca acaacatgat tgcaaaaatc
720
caagaagatg attttaataa cctcaaccaa ttacaaattc ttgacctaag tggaaattgc
780
cctcgttgtt ataatgcccc atttccttgt gcgccgtgta aaaataattc tcccctacag
840
atccctgtaa atgcttttga tgcgctgaca gaattaaaag ttttacgtct acacagtaac
900
tctcttcagc atgtgccccc aagatggttt aagaacatca acaaactcca ggaactggat
960
ctgtcccaaa acttcttggc caaagaaatt ggggatgcta aatttctgca ttttctcccc
1020
agcctcatcc aattggatct gtctttcaat tttgaacttc aggtctatcg tgcatctatg
1080
aatctatcac aagcattttc ttcactgaaa agcctgaaaa ttctgcggat cagaggatat
1140
gtctttaaag agttgaaaag ctttaacctc tcgccattac ataatcttca aaatcttgaa
1200
gttcttgatc ttggcactaa ctttataaaa attgctaacc tcagcatgtt taaacaattt
1260
aaaagactga aagtcataga tctttcagtg aataaaatat caccttcagg agattcaagt
1320
gaagttggct tctgctcaaa tgccagaact tctgtagaaa gttatgaacc ccaggtcctg
1380
gaacaattac attatttcag atatgataag tatgcaagga gttgcagatt caaaaacaaa
1440
gaggcttctt tcatgtctgt taatgaaagc tgctacaagt atgggcagac cttggatcta
1500
agtaaaaata gtatattttt tgtcaagtcc tctgattttc agcatctttc tttcctcaaa
1560
tgcctgaatc tgtcaggaaa tctcattagc caaactctta atggcagtga attccaacct
1620
ttagcagagc tgagatattt ggacttctcc aacaaccggc ttgatttact ccattcaaca
1680
gcatttgaag agcttcacaa actggaagtt ctggatataa gcagtaatag ccattatttt
1740
caatcagaag gaattactca tatgctaaac tttaccaaga acctaaaggt tctgcagaaa
1800
ctgatgatga acgacaatga catctcttcc tccaccagca ggaccatgga gagtgagtct
1860
cttagaactc tggaattcag aggaaatcac ttagatgttt tatggagaga aggtgataac
1920
agatacttac aattattcaa gaatctgcta aaattagagg aattagacat ctctaaaaat
1980
tccctaagtt tcttgccttc tggagttttt gatggtatgc ctccaaatct aaagaatctc
2040
tctttggcca aaaatgggct caaatctttc agttggaaga aactccagtg tctaaagaac
2100
ctggaaactt tggacctcag ccacaaccaa ctgaccactg tccctgagag attatccaac
2160
tgttccagaa gcctcaagaa tctgattctt aagaataatc aaatcaggag tctgacgaag
2220
tattttctac aagatgcctt ccagttgcga tatctggatc tcagctcaaa taaaatccag
2280
atgatccaaa agaccagctt cccagaaaat gtcctcaaca atctgaagat gttgcttttg
2340
catcataatc ggtttctgtg cacctgtgat gctgtgtggt ttgtctggtg ggttaaccat
2400
acggaggtga ctattcctta cctggccaca gatgtgactt gtgtggggcc aggagcacac
2460
aagggccaaa gtgtgatctc cctggatctg tacacctgtg agttagatct gactaacctg
2520
attctgttct cactttccat atctgtatct ctctttctca tggtgatgat gacagcaagt
2580
cacctctatt tctgggatgt gtggtatatt taccatttct gtaaggccaa gataaagggg
2640
tatcagcgtc taatatcacc agactgttgc tatgatgctt ttattgtgta tgacactaaa
2700
gacccagctg tgaccgagtg ggttttggct gagctggtgg ccaaactgga agacccaaga
2760
gagaaacatt ttaatttatg tctcgaggaa agggactggt taccagggca gccagttctg
2820
gaaaaccttt cccagagcat acagcttagc aaaaagacag tgtttgtgat gacagacaag
2880
tatgcaaaga ctgaaaattt taagatagca ttttacttgt cccatcagag gctcatggat
2940
gaaaaagttg atgtgattat cttgatattt cttgagaagc cctttcagaa gtccaagttc
3000
ctccagctcc ggaaaaggct ctgtgggagt tctgtccttg agtggccaac aaacccgcaa
3060
gctcacccat acttctggca gtgtctaaag aacgccctgg ccacagacaa tcatgtggcc
3120
tatagtcagg tgttcaagga aacggtctag
3150
<210> 2
<211> 1049
<212> Белок
<213> Homo sapiens
<400> 2
Met Val Phe Pro Met Trp Thr Leu Lys Arg Gln Ile Leu Ile Leu Phe
1 5 10 15
Asn Ile Ile Leu Ile Ser Lys Leu Leu Gly Ala Arg Trp Phe Pro Lys
20 25 30
Thr Leu Pro Cys Asp Val Thr Leu Asp Val Pro Lys Asn His Val Ile
35 40 45
Val Asp Cys Thr Asp Lys His Leu Thr Glu Ile Pro Gly Gly Ile Pro
50 55 60
Thr Asn Thr Thr Asn Leu Thr Leu Thr Ile Asn His Ile Pro Asp Ile
65 70 75 80
Ser Pro Ala Ser Phe His Arg Leu Asp His Leu Val Glu Ile Asp Phe
85 90 95
Arg Cys Asn Cys Val Pro Ile Pro Leu Gly Ser Lys Asn Asn Met Cys
100 105 110
Ile Lys Arg Leu Gln Ile Lys Pro Arg Ser Phe Ser Gly Leu Thr Tyr
115 120 125
Leu Lys Ser Leu Tyr Leu Asp Gly Asn Gln Leu Leu Glu Ile Pro Gln
130 135 140
Gly Leu Pro Pro Ser Leu Gln Leu Leu Ser Leu Glu Ala Asn Asn Ile
145 150 155 160
Phe Ser Ile Arg Lys Glu Asn Leu Thr Glu Leu Ala Asn Ile Glu Ile
165 170 175
Leu Tyr Leu Gly Gln Asn Cys Tyr Tyr Arg Asn Pro Cys Tyr Val Ser
180 185 190
Tyr Ser Ile Glu Lys Asp Ala Phe Leu Asn Leu Thr Lys Leu Lys Val
195 200 205
Leu Ser Leu Lys Asp Asn Asn Val Thr Ala Val Pro Thr Val Leu Pro
210 215 220
Ser Thr Leu Thr Glu Leu Tyr Leu Tyr Asn Asn Met Ile Ala Lys Ile
225 230 235 240
Gln Glu Asp Asp Phe Asn Asn Leu Asn Gln Leu Gln Ile Leu Asp Leu
245 250 255
Ser Gly Asn Cys Pro Arg Cys Tyr Asn Ala Pro Phe Pro Cys Ala Pro
260 265 270
Cys Lys Asn Asn Ser Pro Leu Gln Ile Pro Val Asn Ala Phe Asp Ala
275 280 285
Leu Thr Glu Leu Lys Val Leu Arg Leu His Ser Asn Ser Leu Gln His
290 295 300
Val Pro Pro Arg Trp Phe Lys Asn Ile Asn Lys Leu Gln Glu Leu Asp
305 310 315 320
Leu Ser Gln Asn Phe Leu Ala Lys Glu Ile Gly Asp Ala Lys Phe Leu
325 330 335
His Phe Leu Pro Ser Leu Ile Gln Leu Asp Leu Ser Phe Asn Phe Glu
340 345 350
Leu Gln Val Tyr Arg Ala Ser Met Asn Leu Ser Gln Ala Phe Ser Ser
355 360 365
Leu Lys Ser Leu Lys Ile Leu Arg Ile Arg Gly Tyr Val Phe Lys Glu
370 375 380
Leu Lys Ser Phe Asn Leu Ser Pro Leu His Asn Leu Gln Asn Leu Glu
385 390 395 400
Val Leu Asp Leu Gly Thr Asn Phe Ile Lys Ile Ala Asn Leu Ser Met
405 410 415
Phe Lys Gln Phe Lys Arg Leu Lys Val Ile Asp Leu Ser Val Asn Lys
420 425 430
Ile Ser Pro Ser Gly Asp Ser Ser Glu Val Gly Phe Cys Ser Asn Ala
435 440 445
Arg Thr Ser Val Glu Ser Tyr Glu Pro Gln Val Leu Glu Gln Leu His
450 455 460
Tyr Phe Arg Tyr Asp Lys Tyr Ala Arg Ser Cys Arg Phe Lys Asn Lys
465 470 475 480
Glu Ala Ser Phe Met Ser Val Asn Glu Ser Cys Tyr Lys Tyr Gly Gln
485 490 495
Thr Leu Asp Leu Ser Lys Asn Ser Ile Phe Phe Val Lys Ser Ser Asp
500 505 510
Phe Gln His Leu Ser Phe Leu Lys Cys Leu Asn Leu Ser Gly Asn Leu
515 520 525
Ile Ser Gln Thr Leu Asn Gly Ser Glu Phe Gln Pro Leu Ala Glu Leu
530 535 540
Arg Tyr Leu Asp Phe Ser Asn Asn Arg Leu Asp Leu Leu His Ser Thr
545 550 555 560
Ala Phe Glu Glu Leu His Lys Leu Glu Val Leu Asp Ile Ser Ser Asn
565 570 575
Ser His Tyr Phe Gln Ser Glu Gly Ile Thr His Met Leu Asn Phe Thr
580 585 590
Lys Asn Leu Lys Val Leu Gln Lys Leu Met Met Asn Asp Asn Asp Ile
595 600 605
Ser Ser Ser Thr Ser Arg Thr Met Glu Ser Glu Ser Leu Arg Thr Leu
610 615 620
Glu Phe Arg Gly Asn His Leu Asp Val Leu Trp Arg Glu Gly Asp Asn
625 630 635 640
Arg Tyr Leu Gln Leu Phe Lys Asn Leu Leu Lys Leu Glu Glu Leu Asp
645 650 655
Ile Ser Lys Asn Ser Leu Ser Phe Leu Pro Ser Gly Val Phe Asp Gly
660 665 670
Met Pro Pro Asn Leu Lys Asn Leu Ser Leu Ala Lys Asn Gly Leu Lys
675 680 685
Ser Phe Ser Trp Lys Lys Leu Gln Cys Leu Lys Asn Leu Glu Thr Leu
690 695 700
Asp Leu Ser His Asn Gln Leu Thr Thr Val Pro Glu Arg Leu Ser Asn
705 710 715 720
Cys Ser Arg Ser Leu Lys Asn Leu Ile Leu Lys Asn Asn Gln Ile Arg
725 730 735
Ser Leu Thr Lys Tyr Phe Leu Gln Asp Ala Phe Gln Leu Arg Tyr Leu
740 745 750
Asp Leu Ser Ser Asn Lys Ile Gln Met Ile Gln Lys Thr Ser Phe Pro
755 760 765
Glu Asn Val Leu Asn Asn Leu Lys Met Leu Leu Leu His His Asn Arg
770 775 780
Phe Leu Cys Thr Cys Asp Ala Val Trp Phe Val Trp Trp Val Asn His
785 790 795 800
Thr Glu Val Thr Ile Pro Tyr Leu Ala Thr Asp Val Thr Cys Val Gly
805 810 815
Pro Gly Ala His Lys Gly Gln Ser Val Ile Ser Leu Asp Leu Tyr Thr
820 825 830
Cys Glu Leu Asp Leu Thr Asn Leu Ile Leu Phe Ser Leu Ser Ile Ser
835 840 845
Val Ser Leu Phe Leu Met Val Met Met Thr Ala Ser His Leu Tyr Phe
850 855 860
Trp Asp Val Trp Tyr Ile Tyr His Phe Cys Lys Ala Lys Ile Lys Gly
865 870 875 880
Tyr Gln Arg Leu Ile Ser Pro Asp Cys Cys Tyr Asp Ala Phe Ile Val
885 890 895
Tyr Asp Thr Lys Asp Pro Ala Val Thr Glu Trp Val Leu Ala Glu Leu
900 905 910
Val Ala Lys Leu Glu Asp Pro Arg Glu Lys His Phe Asn Leu Cys Leu
915 920 925
Glu Glu Arg Asp Trp Leu Pro Gly Gln Pro Val Leu Glu Asn Leu Ser
930 935 940
Gln Ser Ile Gln Leu Ser Lys Lys Thr Val Phe Val Met Thr Asp Lys
945 950 955 960
Tyr Ala Lys Thr Glu Asn Phe Lys Ile Ala Phe Tyr Leu Ser His Gln
965 970 975
Arg Leu Met Asp Glu Lys Val Asp Val Ile Ile Leu Ile Phe Leu Glu
980 985 990
Lys Pro Phe Gln Lys Ser Lys Phe Leu Gln Leu Arg Lys Arg Leu Cys
995 1000 1005
Gly Ser Ser Val Leu Glu Trp Pro Thr Asn Pro Gln Ala His Pro
1010 1015 1020
Tyr Phe Trp Gln Cys Leu Lys Asn Ala Leu Ala Thr Asp Asn His
1025 1030 1035
Val Ala Tyr Ser Gln Val Phe Lys Glu Thr Val
1040 1045
<210> 3
<211> 3150
<212> ДНК
<213> Homo sapiens
<400> 3
atggtgtttc caatgtggac actgaagaga caaattctta tcctttttaa cataatccta
60
atttccaaac tccttggggc tagatggttt cctaaaactc tgccctgtga tgtcactctg
120
gatgttccaa agaaccatgt gatcgtggac tgcacagaca agcatttgac agaaattcct
180
ggaggtattc ccacgaacac cacgaacctc accctcacca ttaaccacat accagacatc
240
tccccagcgt cctttcacag actggaccat ctggtagaga tcgatttcag atgcaactgt
300
gtacctattc cactggggtc aaaaaacaac atgtgcatca agaggctgca gattaaaccc
360
agaagcttta gtggactcac ttatttaaaa tccctttacc tggatggaaa ccagctacta
420
gagataccgc agggcctccc gcctagctta cagcttctca gccttgaggc caacaacatc
480
ttttccatca gaaaagagaa tctaacagaa ctggccaaca tagaaatact ctacctgggc
540
caaaactgtt attatcgaaa tccttgttat gtttcatatt caatagagaa agatgccttc
600
ctaaacttga caaagttaaa agtgctctcc ctgaaagata acaatgtcac agccgtccct
660
actgttttgc catctacttt aacagaacta tatctctaca acaacatgat tgcaaaaatc
720
caagaagatg attttaataa cctcaaccaa ttacaaattc ttgacctaag tggaaattgc
780
cctcgttgtt ataatgcccc atttccttgt gcgccgtgta aaaataattc tcccctacag
840
atccctgtaa atgcttttga tgcgctgaca gaattaaaag ttttacgtct acacagtaac
900
tctcttcagc atgtgccccc aagatggttt aagaacatca acaaactcca ggaactggat
960
ctgtcccaaa acttcttggc caaagaaatt ggggatgcta aatttctgca ttttctcccc
1020
agcctcatcc aattggatct gtctttcaat tttgaacttc aggtctatcg tgcatctatg
1080
aatctatcac aagcattttc ttcactgaaa agcctgaaaa ttctgcggat cagaggatat
1140
gtctttaaag agttgaaaag ctttaacctc tcgccattac ataatcttca aaatcttgaa
1200
gttcttgatc ttggcactaa ctttataaaa attgctaacc tcagcatgtt taaacaattt
1260
aaaagactga aagtcataga tctttcagtg aataaaatat caccttcagg agattcaagt
1320
gaagttggct tctgctcaaa tgccagaact tctgtagaaa gttatgaacc ccaggtcctg
1380
gaacaattac attatttcag atatgataag tatgcaagga gttgcagatt caaaaacaaa
1440
gaggcttctt tcatgtctgt taatgaaagc tgctacaagt atgggcagac cttggatcta
1500
agtaaaaata gtatattttt tgtcaagtcc tctgattttc agcatctttc tttcctcaaa
1560
tgcctgaatc tgtcaggaaa tctcattagc caaactctta atggcagtga attccaacct
1620
ttagcagagt tgagatattt ggacttctcc aacaaccggc ttgatttact ccattcaaca
1680
gcatttgaag agcttcacaa actggaagtt ctggatataa gcagtaatag ccattatttt
1740
caatcagaag gaattactca tatgctaaac tttaccaaga acctaaaggt tctgcagaaa
1800
ctgatgatga acgacaatga catctcttcc tccaccagca ggaccatgga gagtgagtct
1860
cttagaactc tggaattcag aggaaatcac ttagatgttt tatggagaga aggtgataac
1920
agatacttac aattattcaa gaatctgcta aaattagagg aattagacat ctctaaaaat
1980
tccctaagtt tcttgccttc tggagttttt gatggtatgc ctccaaatct aaagaatctc
2040
tctttggcca aaaatgggct caaatctttc agttggaaga aactccagtg tctaaagaac
2100
ctggaaactt tggacctcag ccacaaccaa ctgaccactg tccctgagag attatccaac
2160
tgttccagaa gccacaagaa tctgattctt aagaataatc aaatcaggag tccgacgaag
2220
tattttctac aagatgcctt ccagttgcga tatctggatc tcagctcaaa taaaatccag
2280
atgatccaaa agaccagctt cccagaaaat gtcctcaaca atctgaagat gttgcttttg
2340
catcataatc ggtttctgtg cacctgtgat gctgtgtggt ttgtctggtg ggttaaccat
2400
acggaggtga ctattcctta cctggccaca gatgtgactt gtgtggggcc aggagcacac
2460
aagggccaaa gtgtgatctc cctggatctg tacacctgtg agttagatct gactaacctg
2520
attctgttct cactttccat atctgtatct ctctttctca tggtgatgat gacagcaagt
2580
cacctctatt tctgggatgt gtggtatatt taccatttct gtaaggccaa gataaagggg
2640
tatcagcgtc taatatcacc agactgttgc tatgatgctt ttattgtgta tgacactaaa
2700
gacccagctg tgaccgagtg ggttttggct gagctggtgg ccaaactgga agacccaaga
2760
gagaaacatt ttaatttatg tctcgaggaa agggactggt taccagggca gccagttctg
2820
gaaaaccttt cccagagcat acagcttagc aaaaagacag tgtttgtgat gacagacaag
2880
tatgcaaaga ctgaaaattt taagatagca ttttacttgt cccatcagag gctcatggat
2940
gaaaaagttg atgtgattat cttgatattt cttgagaagc cctttcagaa gtccaagttc
3000
ctccagctcc ggaaaaggct ctgtgggagt tctgtccttg agtggccaac aaacccgcaa
3060
gctcacccat acttctggca gtgtctaaag aacgccctgg ccacagacaa tcatgtggcc
3120
tatagtcagg tgttcaagga aacggtctag
3150
<210> 4
<211> 1049
<212> Белок
<213> Homo sapiens
<400> 4
Met Val Phe Pro Met Trp Thr Leu Lys Arg Gln Ile Leu Ile Leu Phe
1 5 10 15
Asn Ile Ile Leu Ile Ser Lys Leu Leu Gly Ala Arg Trp Phe Pro Lys
20 25 30
Thr Leu Pro Cys Asp Val Thr Leu Asp Val Pro Lys Asn His Val Ile
35 40 45
Val Asp Cys Thr Asp Lys His Leu Thr Glu Ile Pro Gly Gly Ile Pro
50 55 60
Thr Asn Thr Thr Asn Leu Thr Leu Thr Ile Asn His Ile Pro Asp Ile
65 70 75 80
Ser Pro Ala Ser Phe His Arg Leu Asp His Leu Val Glu Ile Asp Phe
85 90 95
Arg Cys Asn Cys Val Pro Ile Pro Leu Gly Ser Lys Asn Asn Met Cys
100 105 110
Ile Lys Arg Leu Gln Ile Lys Pro Arg Ser Phe Ser Gly Leu Thr Tyr
115 120 125
Leu Lys Ser Leu Tyr Leu Asp Gly Asn Gln Leu Leu Glu Ile Pro Gln
130 135 140
Gly Leu Pro Pro Ser Leu Gln Leu Leu Ser Leu Glu Ala Asn Asn Ile
145 150 155 160
Phe Ser Ile Arg Lys Glu Asn Leu Thr Glu Leu Ala Asn Ile Glu Ile
165 170 175
Leu Tyr Leu Gly Gln Asn Cys Tyr Tyr Arg Asn Pro Cys Tyr Val Ser
180 185 190
Tyr Ser Ile Glu Lys Asp Ala Phe Leu Asn Leu Thr Lys Leu Lys Val
195 200 205
Leu Ser Leu Lys Asp Asn Asn Val Thr Ala Val Pro Thr Val Leu Pro
210 215 220
Ser Thr Leu Thr Glu Leu Tyr Leu Tyr Asn Asn Met Ile Ala Lys Ile
225 230 235 240
Gln Glu Asp Asp Phe Asn Asn Leu Asn Gln Leu Gln Ile Leu Asp Leu
245 250 255
Ser Gly Asn Cys Pro Arg Cys Tyr Asn Ala Pro Phe Pro Cys Ala Pro
260 265 270
Cys Lys Asn Asn Ser Pro Leu Gln Ile Pro Val Asn Ala Phe Asp Ala
275 280 285
Leu Thr Glu Leu Lys Val Leu Arg Leu His Ser Asn Ser Leu Gln His
290 295 300
Val Pro Pro Arg Trp Phe Lys Asn Ile Asn Lys Leu Gln Glu Leu Asp
305 310 315 320
Leu Ser Gln Asn Phe Leu Ala Lys Glu Ile Gly Asp Ala Lys Phe Leu
325 330 335
His Phe Leu Pro Ser Leu Ile Gln Leu Asp Leu Ser Phe Asn Phe Glu
340 345 350
Leu Gln Val Tyr Arg Ala Ser Met Asn Leu Ser Gln Ala Phe Ser Ser
355 360 365
Leu Lys Ser Leu Lys Ile Leu Arg Ile Arg Gly Tyr Val Phe Lys Glu
370 375 380
Leu Lys Ser Phe Asn Leu Ser Pro Leu His Asn Leu Gln Asn Leu Glu
385 390 395 400
Val Leu Asp Leu Gly Thr Asn Phe Ile Lys Ile Ala Asn Leu Ser Met
405 410 415
Phe Lys Gln Phe Lys Arg Leu Lys Val Ile Asp Leu Ser Val Asn Lys
420 425 430
Ile Ser Pro Ser Gly Asp Ser Ser Glu Val Gly Phe Cys Ser Asn Ala
435 440 445
Arg Thr Ser Val Glu Ser Tyr Glu Pro Gln Val Leu Glu Gln Leu His
450 455 460
Tyr Phe Arg Tyr Asp Lys Tyr Ala Arg Ser Cys Arg Phe Lys Asn Lys
465 470 475 480
Glu Ala Ser Phe Met Ser Val Asn Glu Ser Cys Tyr Lys Tyr Gly Gln
485 490 495
Thr Leu Asp Leu Ser Lys Asn Ser Ile Phe Phe Val Lys Ser Ser Asp
500 505 510
Phe Gln His Leu Ser Phe Leu Lys Cys Leu Asn Leu Ser Gly Asn Leu
515 520 525
Ile Ser Gln Thr Leu Asn Gly Ser Glu Phe Gln Pro Leu Ala Glu Leu
530 535 540
Arg Tyr Leu Asp Phe Ser Asn Asn Arg Leu Asp Leu Leu His Ser Thr
545 550 555 560
Ala Phe Glu Glu Leu His Lys Leu Glu Val Leu Asp Ile Ser Ser Asn
565 570 575
Ser His Tyr Phe Gln Ser Glu Gly Ile Thr His Met Leu Asn Phe Thr
580 585 590
Lys Asn Leu Lys Val Leu Gln Lys Leu Met Met Asn Asp Asn Asp Ile
595 600 605
Ser Ser Ser Thr Ser Arg Thr Met Glu Ser Glu Ser Leu Arg Thr Leu
610 615 620
Glu Phe Arg Gly Asn His Leu Asp Val Leu Trp Arg Glu Gly Asp Asn
625 630 635 640
Arg Tyr Leu Gln Leu Phe Lys Asn Leu Leu Lys Leu Glu Glu Leu Asp
645 650 655
Ile Ser Lys Asn Ser Leu Ser Phe Leu Pro Ser Gly Val Phe Asp Gly
660 665 670
Met Pro Pro Asn Leu Lys Asn Leu Ser Leu Ala Lys Asn Gly Leu Lys
675 680 685
Ser Phe Ser Trp Lys Lys Leu Gln Cys Leu Lys Asn Leu Glu Thr Leu
690 695 700
Asp Leu Ser His Asn Gln Leu Thr Thr Val Pro Glu Arg Leu Ser Asn
705 710 715 720
Cys Ser Arg Ser His Lys Asn Leu Ile Leu Lys Asn Asn Gln Ile Arg
725 730 735
Ser Pro Thr Lys Tyr Phe Leu Gln Asp Ala Phe Gln Leu Arg Tyr Leu
740 745 750
Asp Leu Ser Ser Asn Lys Ile Gln Met Ile Gln Lys Thr Ser Phe Pro
755 760 765
Glu Asn Val Leu Asn Asn Leu Lys Met Leu Leu Leu His His Asn Arg
770 775 780
Phe Leu Cys Thr Cys Asp Ala Val Trp Phe Val Trp Trp Val Asn His
785 790 795 800
Thr Glu Val Thr Ile Pro Tyr Leu Ala Thr Asp Val Thr Cys Val Gly
805 810 815
Pro Gly Ala His Lys Gly Gln Ser Val Ile Ser Leu Asp Leu Tyr Thr
820 825 830
Cys Glu Leu Asp Leu Thr Asn Leu Ile Leu Phe Ser Leu Ser Ile Ser
835 840 845
Val Ser Leu Phe Leu Met Val Met Met Thr Ala Ser His Leu Tyr Phe
850 855 860
Trp Asp Val Trp Tyr Ile Tyr His Phe Cys Lys Ala Lys Ile Lys Gly
865 870 875 880
Tyr Gln Arg Leu Ile Ser Pro Asp Cys Cys Tyr Asp Ala Phe Ile Val
885 890 895
Tyr Asp Thr Lys Asp Pro Ala Val Thr Glu Trp Val Leu Ala Glu Leu
900 905 910
Val Ala Lys Leu Glu Asp Pro Arg Glu Lys His Phe Asn Leu Cys Leu
915 920 925
Glu Glu Arg Asp Trp Leu Pro Gly Gln Pro Val Leu Glu Asn Leu Ser
930 935 940
Gln Ser Ile Gln Leu Ser Lys Lys Thr Val Phe Val Met Thr Asp Lys
945 950 955 960
Tyr Ala Lys Thr Glu Asn Phe Lys Ile Ala Phe Tyr Leu Ser His Gln
965 970 975
Arg Leu Met Asp Glu Lys Val Asp Val Ile Ile Leu Ile Phe Leu Glu
980 985 990
Lys Pro Phe Gln Lys Ser Lys Phe Leu Gln Leu Arg Lys Arg Leu Cys
995 1000 1005
Gly Ser Ser Val Leu Glu Trp Pro Thr Asn Pro Gln Ala His Pro
1010 1015 1020
Tyr Phe Trp Gln Cys Leu Lys Asn Ala Leu Ala Thr Asp Asn His
1025 1030 1035
Val Ala Tyr Ser Gln Val Phe Lys Glu Thr Val
1040 1045
<210> 5
<211> 116
<212> Белок
<213> Mus musculus
<400> 5
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Asn Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Asn
20 25 30
Trp Leu His Trp Val Lys Gln Arg Pro Gly Arg Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Ser Asn Gly Arg Thr Asn Tyr Asn Glu Gln Phe
50 55 60
Lys Thr Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Arg Gly Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Ala Leu
100 105 110
Thr Val Ser Ser
115
<210> 6
<211> 348
<212> ДНК
<213> Mus musculus
<400> 6
caggtgcagc tgcagcagcc tggcgccgaa ctcgtgaaac ctggcgcctc cgtgaacctg
60
agctgcaagg ccagcggcta caccttcacc aacaactggc tgcactgggt caagcagagg
120
cccggcagag gcctggaatg gatcggcgac atctacccca gcaacggccg gaccaactac
180
aacgagcagt tcaagaccaa ggccaccctg accgtggaca agagcagcag caccgcctac
240
atgcagctgt ccagcctgac cagcgaggac agcgccgtgt acttctgcgc cagagagcgg
300
ggctacttcg actattgggg ccagggaacc gctctgaccg tcagctca
348
<210> 7
<211> 122
<212> Белок
<213> Mus musculus
<400> 7
Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile Thr Ser Asp
20 25 30
Tyr Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Met Gly His Ile Ser Tyr Arg Gly Asn Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Phe
65 70 75 80
Leu Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Ser Trp Asn Tyr Tyr Gly Tyr Val Asp Tyr Ala Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 8
<211> 366
<212> ДНК
<213> Mus musculus
<400> 8
gacgtgcagc tgcaggaatc tggccctggc ctcgtgaagc ctagccagag cctgagcctg
60
acatgcaccg tgaccggcta cagcatcacc agcgactacg cctggaactg gatccggcag
120
ttccccggca acaagctgga atggatgggc cacatcagct accggggcaa caccaactac
180
aaccccagcc tgaagtcccg gatctccatc acccgggaca ccagcaagaa ccagttcttt
240
ctgcagctga acagcgtgac caccgaggac accgccacct actactgcgc cagctggaac
300
tactacggct acgtggacta tgccatggac tactggggcc agggcacctc cgtgaccgtc
360
agctca
366
<210> 9
<211> 121
<212> Белок
<213> Mus musculus
<400> 9
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Gly Tyr
20 25 30
Gly Val Asn Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Met Ile Trp Gly Asp Gly Ser Thr Asp Tyr Asn Ser Ala Leu Lys
50 55 60
Ser Arg Leu Ser Ile Arg Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Arg Tyr Tyr Cys Ala
85 90 95
Arg Asp Lys Gly Tyr Asp Gly Tyr Tyr Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 10
<211> 363
<212> ДНК
<213> Mus musculus
<400> 10
caggtgcagc tgaaagagtc tggccctgga ctggtggccc ctagccagag cctgagcatc
60
acctgtaccg tgtccggctt cagcctgacc ggctacggcg tgaactgggt gcgccagcct
120
cctggcaaag gcctggaatg gctgggcatg atctggggcg acggcagcac cgactacaac
180
agcgccctga agtcccggct gagcatccgg aaggacaaca gcaagtccca ggtgttcctg
240
aagatgaaca gcctgcagac cgacgacacc gcccggtact actgcgccag agacaagggc
300
tacgacggct actactacgc catggactac tggggccagg gcacctctgt gaccgtcagc
360
tca
363
<210> 11
<211> 106
<212> Белок
<213> Mus musculus
<400> 11
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Thr Ser Leu Gly
1 5 10 15
Gly Lys Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Ile Asn Lys Tyr
20 25 30
Ile Ala Trp Tyr Gln His Lys Pro Gly Lys Gly Pro Arg Leu Leu Ile
35 40 45
His Tyr Thr Ser Thr Leu Gln Pro Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Arg Asp Tyr Ser Phe Ser Ile Ser Asn Leu Glu Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Tyr Leu Leu Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 12
<211> 318
<212> ДНК
<213> Mus musculus
<400> 12
gacatccaga tgacccagag ccctagcagc ctgagcacaa gcctgggcgg caaagtgacc
60
atcacatgca aggccagcca ggacatcaac aagtatatcg cctggtatca gcacaaaccc
120
ggcaagggcc ccagactgct gattcactac accagcaccc tgcagcccgg catccccagc
180
agattttctg gcagcggctc cggcagagac tacagcttca gcatcagcaa cctggaaccc
240
gaggatatcg ccacctacta ctgcctgcag tacgactacc tgctgacctt cggagccggc
300
accaagctgg aactgaag
318
<210> 13
<211> 106
<212> Белок
<213> Mus musculus
<400> 13
Asp Ile Gln Met Thr Gln Thr Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Asn Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asp Thr Phe Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 14
<211> 318
<212> ДНК
<213> Mus musculus
<400> 14
gacatccaga tgacccagac acccagcagc ctgagcgcca gcctgggcga tagagtgacc
60
atcagctgca gagccagcca ggacatcagc aactacctga actggtatca gcagaaaccc
120
gacggcaccg tgaagctgct gatctactac accagcagac tgcacagcgg cgtgcccagc
180
agattttctg gcagcggctc cggcaccgac tacagcctga ccatcaacaa cctggaacag
240
gaagatatcg ctacctactt ctgtcagcaa ggcgacacct tccccacctt cggcggaggc
300
accaagctgg aaatcaag
318
<210> 15
<211> 107
<212> Белок
<213> Mus musculus
<400> 15
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Glu Thr Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Asp Ala Lys Thr Leu Ala Glu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gln Phe Ser Leu Lys Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Gly Ser Tyr Tyr Cys Gln His His Tyr Gly Ile Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 16
<211> 321
<212> ДНК
<213> Mus musculus
<400> 16
gacatccaga tgacacagtc tcccgccagc ctgagcgcct ctgtgggaga gacagtgacc
60
atcacctgtc gggccagcga gaacatctac agctacctgg cctggtatca gcagaagcag
120
ggcaagagcc cccagctgct ggtgtacgat gccaagacac tggccgaggg cgtgcccagc
180
agattttctg gcagcggctc cggcacccag ttcagcctga agatcaacag cctgcagccc
240
gaggacttcg gcagctacta ctgccagcac cactacggca tcccttacac cttcggcgga
300
ggcaccaagc tggaaatcaa g
321
<210> 17
<211> 10
<212> Белок
<213> Mus musculus
<400> 17
Gly Tyr Thr Phe Thr Asn Asn Trp Leu His
1 5 10
<210> 18
<211> 10
<212> Белок
<213> Mus musculus
<400> 18
Asp Ile Tyr Pro Ser Asn Gly Arg Thr Asn
1 5 10
<210> 19
<211> 7
<212> Белок
<213> Mus musculus
<400> 19
Glu Arg Gly Tyr Phe Asp Tyr
1 5
<210> 20
<211> 11
<212> Белок
<213> Mus musculus
<400> 20
Lys Ala Ser Gln Asp Ile Asn Lys Tyr Ile Ala
1 5 10
<210> 21
<211> 7
<212> Белок
<213> Mus musculus
<400> 21
Tyr Thr Ser Thr Leu Gln Pro
1 5
<210> 22
<211> 8
<212> Белок
<213> Mus musculus
<400> 22
Leu Gln Tyr Asp Tyr Leu Leu Thr
1 5
<210> 23
<211> 11
<212> Белок
<213> Mus musculus
<400> 23
Gly Tyr Ser Ile Thr Ser Asp Tyr Ala Trp Asn
1 5 10
<210> 24
<211> 9
<212> Белок
<213> Mus musculus
<400> 24
His Ile Ser Tyr Arg Gly Asn Thr Asn
1 5
<210> 25
<211> 13
<212> Белок
<213> Mus musculus
<400> 25
Trp Asn Tyr Tyr Gly Tyr Val Asp Tyr Ala Met Asp Tyr
1 5 10
<210> 26
<211> 11
<212> Белок
<213> Mus musculus
<400> 26
Arg Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn
1 5 10
<210> 27
<211> 7
<212> Белок
<213> Mus musculus
<400> 27
Tyr Thr Ser Arg Leu His Ser
1 5
<210> 28
<211> 8
<212> Белок
<213> Mus musculus
<400> 28
Gln Gln Gly Asp Thr Phe Pro Thr
1 5
<210> 29
<211> 10
<212> Белок
<213> Mus musculus
<400> 29
Gly Phe Ser Leu Thr Gly Tyr Gly Val Asn
1 5 10
<210> 30
<211> 9
<212> Белок
<213> Mus musculus
<400> 30
Met Ile Trp Gly Asp Gly Ser Thr Asp
1 5
<210> 31
<211> 13
<212> Белок
<213> Mus musculus
<400> 31
Asp Lys Gly Tyr Asp Gly Tyr Tyr Tyr Ala Met Asp Tyr
1 5 10
<210> 32
<211> 11
<212> Белок
<213> Mus musculus
<400> 32
Arg Ala Ser Glu Asn Ile Tyr Ser Tyr Leu Ala
1 5 10
<210> 33
<211> 7
<212> Белок
<213> Mus musculus
<400> 33
Asp Ala Lys Thr Leu Ala Glu
1 5
<210> 34
<211> 9
<212> Белок
<213> Mus musculus
<400> 34
Gln His His Tyr Gly Ile Pro Tyr Thr
1 5
<210> 35
<211> 465
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность тяжелой цепи химерного
антитела против TLR7 человека AT01 (cAT01)
<400> 35
Met Lys His Leu Trp Phe Phe Leu Leu Leu Val Ala Ala Pro Arg Trp
1 5 10 15
Val Leu Ser Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys
20 25 30
Pro Gly Ala Ser Val Asn Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Asn Asn Trp Leu His Trp Val Lys Gln Arg Pro Gly Arg Gly Leu
50 55 60
Glu Trp Ile Gly Asp Ile Tyr Pro Ser Asn Gly Arg Thr Asn Tyr Asn
65 70 75 80
Glu Gln Phe Lys Thr Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser
85 90 95
Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val
100 105 110
Tyr Phe Cys Ala Arg Glu Arg Gly Tyr Phe Asp Tyr Trp Gly Gln Gly
115 120 125
Thr Ala Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
130 135 140
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
145 150 155 160
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
165 170 175
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
180 185 190
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
195 200 205
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
210 215 220
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys
225 230 235 240
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
245 250 255
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
260 265 270
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
275 280 285
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
290 295 300
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
305 310 315 320
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
325 330 335
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
340 345 350
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
355 360 365
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
370 375 380
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
385 390 395 400
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
405 410 415
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
420 425 430
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
435 440 445
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
450 455 460
Lys
465
<210> 36
<211> 233
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность легкой цепи химерного
антитела против TLR7 человека AT01 (cAT01)
<400> 36
Met Val Leu Gln Thr Gln Val Phe Ile Ser Leu Leu Leu Trp Ile Ser
1 5 10 15
Gly Ala Tyr Gly Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser
20 25 30
Thr Ser Leu Gly Gly Lys Val Thr Ile Thr Cys Lys Ala Ser Gln Asp
35 40 45
Ile Asn Lys Tyr Ile Ala Trp Tyr Gln His Lys Pro Gly Lys Gly Pro
50 55 60
Arg Leu Leu Ile His Tyr Thr Ser Thr Leu Gln Pro Gly Ile Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Arg Asp Tyr Ser Phe Ser Ile Ser
85 90 95
Asn Leu Glu Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp
100 105 110
Tyr Leu Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Ala
115 120 125
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
130 135 140
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
145 150 155 160
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
165 170 175
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
180 185 190
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
195 200 205
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
210 215 220
Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 37
<211> 471
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность тяжелой цепи химерного
антитела против TLR7 человека NB7 (cNB7)
<400> 37
Met Lys His Leu Trp Phe Phe Leu Leu Leu Val Ala Ala Pro Arg Trp
1 5 10 15
Val Leu Ser Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys
20 25 30
Pro Ser Gln Ser Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile
35 40 45
Thr Ser Asp Tyr Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys
50 55 60
Leu Glu Trp Met Gly His Ile Ser Tyr Arg Gly Asn Thr Asn Tyr Asn
65 70 75 80
Pro Ser Leu Lys Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn
85 90 95
Gln Phe Phe Leu Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr
100 105 110
Tyr Tyr Cys Ala Ser Trp Asn Tyr Tyr Gly Tyr Val Asp Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr
130 135 140
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
145 150 155 160
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
165 170 175
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
180 185 190
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
195 200 205
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
210 215 220
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu
225 230 235 240
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
245 250 255
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
260 265 270
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
275 280 285
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
290 295 300
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
305 310 315 320
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
325 330 335
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
340 345 350
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
355 360 365
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys
370 375 380
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
385 390 395 400
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
405 410 415
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
420 425 430
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
435 440 445
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
450 455 460
Leu Ser Leu Ser Pro Gly Lys
465 470
<210> 38
<211> 233
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность легкой цепи химерного
антитела против TLR7 человека NB7 (cNB7)
<400> 38
Met Val Leu Gln Thr Gln Val Phe Ile Ser Leu Leu Leu Trp Ile Ser
1 5 10 15
Gly Ala Tyr Gly Asp Ile Gln Met Thr Gln Thr Pro Ser Ser Leu Ser
20 25 30
Ala Ser Leu Gly Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp
35 40 45
Ile Ser Asn Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val
50 55 60
Lys Leu Leu Ile Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Asn
85 90 95
Asn Leu Glu Gln Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asp
100 105 110
Thr Phe Pro Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Ala
115 120 125
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
130 135 140
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
145 150 155 160
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
165 170 175
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
180 185 190
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
195 200 205
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
210 215 220
Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 39
<211> 470
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность тяжелой цепи химерного
антитела против TLR7 человека FAN2 (cFAN2)
<400> 39
Met Lys His Leu Trp Phe Phe Leu Leu Leu Val Ala Ala Pro Arg Trp
1 5 10 15
Val Leu Ser Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala
20 25 30
Pro Ser Gln Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu
35 40 45
Thr Gly Tyr Gly Val Asn Trp Val Arg Gln Pro Pro Gly Lys Gly Leu
50 55 60
Glu Trp Leu Gly Met Ile Trp Gly Asp Gly Ser Thr Asp Tyr Asn Ser
65 70 75 80
Ala Leu Lys Ser Arg Leu Ser Ile Arg Lys Asp Asn Ser Lys Ser Gln
85 90 95
Val Phe Leu Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Arg Tyr
100 105 110
Tyr Cys Ala Arg Asp Lys Gly Tyr Asp Gly Tyr Tyr Tyr Ala Met Asp
115 120 125
Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys
130 135 140
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
145 150 155 160
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
165 170 175
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
180 185 190
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
195 200 205
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
210 215 220
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro
225 230 235 240
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
245 250 255
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
260 265 270
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
275 280 285
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
290 295 300
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
305 310 315 320
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
325 330 335
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
340 345 350
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
355 360 365
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
370 375 380
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
385 390 395 400
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
405 410 415
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
420 425 430
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
435 440 445
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
450 455 460
Ser Leu Ser Pro Gly Lys
465 470
<210> 40
<211> 234
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность легкой цепи химерного
антитела против TLR7 человека FAN2 (cFAN2)
<400> 40
Met Val Leu Gln Thr Gln Val Phe Ile Ser Leu Leu Leu Trp Ile Ser
1 5 10 15
Gly Ala Tyr Gly Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser
20 25 30
Ala Ser Val Gly Glu Thr Val Thr Ile Thr Cys Arg Ala Ser Glu Asn
35 40 45
Ile Tyr Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro
50 55 60
Gln Leu Leu Val Tyr Asp Ala Lys Thr Leu Ala Glu Gly Val Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Gln Phe Ser Leu Lys Ile Asn
85 90 95
Ser Leu Gln Pro Glu Asp Phe Gly Ser Tyr Tyr Cys Gln His His Tyr
100 105 110
Gly Ile Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
115 120 125
Ala Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
130 135 140
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
145 150 155 160
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
165 170 175
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
180 185 190
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
195 200 205
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
210 215 220
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 41
<211> 116
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность вариабельной области тяжелой
цепи huAT01_H1_IgG1LALA
<400> 41
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Asn
20 25 30
Trp Leu His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Tyr Pro Ser Asn Gly Arg Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Arg Gly Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 42
<211> 116
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность вариабельной области тяжелой
цепи huAT01_H3_IgG1LALA
<400> 42
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Asn
20 25 30
Trp Leu His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Tyr Pro Ser Asn Gly Arg Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Arg Gly Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 43
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность вариабельной области легкой
цепи huAT01_L1
<400> 43
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Ile Asn Lys Tyr
20 25 30
Ile Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
His Tyr Thr Ser Thr Leu Gln Pro Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Arg Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Tyr Leu Leu Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 44
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность вариабельной области легкой
цепи huAT01_L2
<400> 44
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Ile Asn Lys Tyr
20 25 30
Ile Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
His Tyr Thr Ser Thr Leu Gln Pro Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Arg Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Tyr Leu Leu Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 45
<211> 465
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность huAT01_H1_IgG1LALA
<400> 45
Met Lys His Leu Trp Phe Phe Leu Leu Leu Val Ala Ala Pro Arg Trp
1 5 10 15
Val Leu Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Asn Asn Trp Leu His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Met Gly Asp Ile Tyr Pro Ser Asn Gly Arg Thr Asn Tyr Ala
65 70 75 80
Gln Lys Phe Gln Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Glu Arg Gly Tyr Phe Asp Tyr Trp Gly Gln Gly
115 120 125
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
130 135 140
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
145 150 155 160
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
165 170 175
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
180 185 190
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
195 200 205
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
210 215 220
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys
225 230 235 240
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
245 250 255
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
260 265 270
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
275 280 285
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
290 295 300
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
305 310 315 320
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
325 330 335
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
340 345 350
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
355 360 365
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
370 375 380
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
385 390 395 400
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
405 410 415
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
420 425 430
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
435 440 445
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
450 455 460
Lys
465
<210> 46
<211> 465
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность huAT01_H3_IgG1LALA
<400> 46
Met Lys His Leu Trp Phe Phe Leu Leu Leu Val Ala Ala Pro Arg Trp
1 5 10 15
Val Leu Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Asn Asn Trp Leu His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Met Gly Asp Ile Tyr Pro Ser Asn Gly Arg Thr Asn Tyr Ala
65 70 75 80
Gln Lys Phe Gln Gly Arg Val Thr Leu Thr Val Asp Lys Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val
100 105 110
Tyr Phe Cys Ala Arg Glu Arg Gly Tyr Phe Asp Tyr Trp Gly Gln Gly
115 120 125
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
130 135 140
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
145 150 155 160
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
165 170 175
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
180 185 190
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
195 200 205
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
210 215 220
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys
225 230 235 240
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro
245 250 255
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
260 265 270
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
275 280 285
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
290 295 300
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
305 310 315 320
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
325 330 335
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
340 345 350
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
355 360 365
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
370 375 380
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
385 390 395 400
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
405 410 415
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
420 425 430
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
435 440 445
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
450 455 460
Lys
465
<210> 47
<211> 462
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность huAT01_H3_IgG4Pro
<400> 47
Met Lys His Leu Trp Phe Phe Leu Leu Leu Val Ala Ala Pro Arg Trp
1 5 10 15
Val Leu Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Asn Asn Trp Leu His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Met Gly Asp Ile Tyr Pro Ser Asn Gly Arg Thr Asn Tyr Ala
65 70 75 80
Gln Lys Phe Gln Gly Arg Val Thr Leu Thr Val Asp Lys Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val
100 105 110
Tyr Phe Cys Ala Arg Glu Arg Gly Tyr Phe Asp Tyr Trp Gly Gln Gly
115 120 125
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
130 135 140
Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu
145 150 155 160
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
165 170 175
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
180 185 190
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
195 200 205
Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro
210 215 220
Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro
225 230 235 240
Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe
245 250 255
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
260 265 270
Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val
275 280 285
Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
290 295 300
Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val
305 310 315 320
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
325 330 335
Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser
340 345 350
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
355 360 365
Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
370 375 380
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
385 390 395 400
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
405 410 415
Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp
420 425 430
Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
435 440 445
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
450 455 460
<210> 48
<211> 233
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность huAT01_L1
<400> 48
Met Val Leu Gln Thr Gln Val Phe Ile Ser Leu Leu Leu Trp Ile Ser
1 5 10 15
Gly Ala Tyr Gly Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser
20 25 30
Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp
35 40 45
Ile Asn Lys Tyr Ile Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
50 55 60
Lys Leu Leu Ile His Tyr Thr Ser Thr Leu Gln Pro Gly Val Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Arg Asp Phe Thr Leu Thr Ile Ser
85 90 95
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp
100 105 110
Tyr Leu Leu Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr
115 120 125
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
130 135 140
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
145 150 155 160
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
165 170 175
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
180 185 190
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
195 200 205
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
210 215 220
Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 49
<211> 233
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность huAT01_L2
<400> 49
Met Val Leu Gln Thr Gln Val Phe Ile Ser Leu Leu Leu Trp Ile Ser
1 5 10 15
Gly Ala Tyr Gly Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser
20 25 30
Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp
35 40 45
Ile Asn Lys Tyr Ile Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
50 55 60
Lys Leu Leu Ile His Tyr Thr Ser Thr Leu Gln Pro Gly Ile Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Arg Asp Tyr Thr Leu Thr Ile Ser
85 90 95
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp
100 105 110
Tyr Leu Leu Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr
115 120 125
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
130 135 140
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
145 150 155 160
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
165 170 175
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
180 185 190
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
195 200 205
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
210 215 220
Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 50
<211> 122
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность вариабельной области тяжелой
цепи huNB7_H3_IgG1LALA
<400> 50
Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Asp
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile Thr Ser Asp
20 25 30
Tyr Ala Trp Asn Trp Ile Arg Gln Pro Pro Gly Asn Lys Leu Glu Trp
35 40 45
Ile Gly His Ile Ser Tyr Arg Gly Asn Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Trp Asn Tyr Tyr Gly Tyr Val Asp Tyr Ala Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 51
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность вариабельной области легкой
цепи huNB7_L3
<400> 51
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Phe Cys Gln Gln Gly Asp Thr Phe Pro Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 52
<211> 471
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность huNB7_H3_IgG1LALA
<400> 52
Met Lys His Leu Trp Phe Phe Leu Leu Leu Val Ala Ala Pro Arg Trp
1 5 10 15
Val Leu Ser Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys
20 25 30
Pro Ser Asp Thr Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile
35 40 45
Thr Ser Asp Tyr Ala Trp Asn Trp Ile Arg Gln Pro Pro Gly Asn Lys
50 55 60
Leu Glu Trp Ile Gly His Ile Ser Tyr Arg Gly Asn Thr Asn Tyr Asn
65 70 75 80
Pro Ser Leu Lys Ser Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn
85 90 95
Gln Phe Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Ser Trp Asn Tyr Tyr Gly Tyr Val Asp Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr
130 135 140
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
145 150 155 160
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
165 170 175
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
180 185 190
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
195 200 205
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
210 215 220
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu
225 230 235 240
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
245 250 255
Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
260 265 270
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
275 280 285
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
290 295 300
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
305 310 315 320
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
325 330 335
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
340 345 350
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
355 360 365
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys
370 375 380
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
385 390 395 400
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
405 410 415
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
420 425 430
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
435 440 445
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
450 455 460
Leu Ser Leu Ser Pro Gly Lys
465 470
<210> 53
<211> 233
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность huNB7_L3
<400> 53
Met Val Leu Gln Thr Gln Val Phe Ile Ser Leu Leu Leu Trp Ile Ser
1 5 10 15
Gly Ala Tyr Gly Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser
20 25 30
Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp
35 40 45
Ile Ser Asn Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Val
50 55 60
Lys Leu Leu Ile Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser
85 90 95
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Phe Cys Gln Gln Gly Asp
100 105 110
Thr Phe Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr
115 120 125
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
130 135 140
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
145 150 155 160
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
165 170 175
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
180 185 190
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
195 200 205
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
210 215 220
Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 54
<211> 468
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность huNB7_H3_IgG4Pro
<400> 54
Met Lys His Leu Trp Phe Phe Leu Leu Leu Val Ala Ala Pro Arg Trp
1 5 10 15
Val Leu Ser Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys
20 25 30
Pro Ser Asp Thr Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile
35 40 45
Thr Ser Asp Tyr Ala Trp Asn Trp Ile Arg Gln Pro Pro Gly Asn Lys
50 55 60
Leu Glu Trp Ile Gly His Ile Ser Tyr Arg Gly Asn Thr Asn Tyr Asn
65 70 75 80
Pro Ser Leu Lys Ser Arg Val Thr Ile Ser Arg Asp Thr Ser Lys Asn
85 90 95
Gln Phe Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Ser Trp Asn Tyr Tyr Gly Tyr Val Asp Tyr Ala Met
115 120 125
Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr
130 135 140
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser
145 150 155 160
Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
165 170 175
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
180 185 190
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
195 200 205
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys
210 215 220
Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu
225 230 235 240
Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu
245 250 255
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
260 265 270
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
275 280 285
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
290 295 300
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
305 310 315 320
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
325 330 335
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser
340 345 350
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
355 360 365
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
370 375 380
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
385 390 395 400
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
405 410 415
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
420 425 430
Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
435 440 445
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
450 455 460
Ser Leu Gly Lys
465
<210> 55
<211> 1794
<212> ДНК
<213> Homo sapiens
<400> 55
atggaggcgg agccgccgct ctacccgatg gcgggggctg cggggccgca gggcgacgag
60
gacctgctcg gggtcccgga cgggcccgag gccccgctgg acgagctggt gggcgcgtac
120
cccaactaca acgaggagga ggaggagcgc cgctactacc gccgcaagcg cctgggcgtg
180
ctcaagaacg tgctggctgc cagcgccggg ggcatgctca cctacggcgt ctacctgggc
240
ctcctgcaga tgcagctgat cctgcactac gacgagacct accgcgaggt gaagtatggc
300
aacatggggc tgcccgacat cgacagcaaa atgctgatgg gcatcaacgt gactcccatc
360
gccgccctgc tctacacacc tgtgctcatc aggttttttg gaacgaagtg gatgatgttc
420
ctcgctgtgg gcatctacgc cctctttgtc tccaccaact actgggagcg ctactacacg
480
cttgtgccct cggctgtggc cctgggcatg gccatcgtgc ctctttgggc ttccatgggc
540
aactacatca ccaggatggc gcagaagtac catgagtact cccactacaa ggagcaggat
600
gggcagggga tgaagcagcg gcctccgcgg ggctcccacg cgccctatct cctggtcttc
660
caagccatct tctacagctt cttccatctg agcttcgcct gcgcccagct gcccatgatt
720
tatttcctga accactacct gtatgacctg aaccacacgc tgtacaatgt gcagagctgc
780
ggcaccaaca gccacgggat cctcagcggc ttcaacaaga cggttctgcg gacgctcccg
840
cggagcggaa acctcattgt ggtggagagc gtgctcatgg cagtggcctt cctggccatg
900
ctgctggtgc tgggtttgtg cggagccgct taccggccca cggaggagat cgatctgcgc
960
agcgtgggct ggggcaacat cttccagctg cccttcaagc acgtgcgtga ctaccgcctg
1020
cgccacctcg tgcctttctt tatctacagc ggcttcgagg tgctctttgc ctgcactggt
1080
atcgccttgg gctatggcgt gtgctcggtg gggctggagc ggctggctta cctcctcgtg
1140
gcttacagcc tgggcgcctc agccgcctca ctcctgggcc tgctgggcct gtggctgcca
1200
cgcccggtgc ccctggtggc cggagcaggg gtgcacctgc tgctcacctt catcctcttt
1260
ttctgggccc ctgtgcctcg ggtcctgcaa cacagctgga tcctctatgt ggcagctgcc
1320
ctttggggtg tgggcagtgc cctgaacaag actggactca gcacactcct gggaatcttg
1380
tacgaagaca aggagagaca ggacttcatc ttcaccatct accactggtg gcaggctgtg
1440
gccatcttca ccgtgtacct gggctcgagc ctgcacatga aggctaagct ggcggtgctg
1500
ctggtgacgc tggtggcggc cgcggtctcc tacctgcgga tggagcagaa gctgcgccgg
1560
ggcgtggccc cgcgccagcc ccgcatcccg cggccccagc acaaggtgcg cggttaccgc
1620
tacttggagg aggacaactc ggacgagagc gacgcggagg gcgagcatgg ggacggcgcg
1680
gaggaggagg cgccgcccgc agggcccagg cctggccccg agcccgctgg actcggccgc
1740
cggccctgcc cgtacgaaca ggcgcagggg ggagacgggc cggaggagca gtga
1794
<210> 56
<211> 3153
<212> ДНК
<213> Mus musculus
<400> 56
atggtgtttt cgatgtggac acggaagaga caaattttga tctttttaaa tatgctctta
60
gtttctagag tctttgggtt tcgatggttt cctaaaactc taccttgtga agttaaagta
120
aatatcccag aggcccatgt gatcgtggac tgcacagaca agcatttgac agaaatccct
180
gagggcattc ccactaacac caccaatctt acccttacca tcaaccacat accaagcatc
240
tctccagatt ccttccgtag gctgaaccat ctggaagaaa tcgatttaag atgcaattgt
300
gtacctgttc tactggggtc caaagccaat gtgtgtacca agaggctgca gattagacct
360
ggaagcttta gtggactctc tgacttaaaa gccctttacc tggatggaaa ccaacttctg
420
gagataccac aggatctgcc atccagctta catcttctga gccttgaggc taacaacatc
480
ttctccatca cgaaggagaa tctaacagaa ctggtcaaca ttgaaacact ctacctgggt
540
caaaactgtt attatcgaaa tccttgcaat gtttcctatt ctattgaaaa agatgctttc
600
ctagttatga gaaatttgaa ggttctctca ctaaaagata acaatgtcac agctgtcccc
660
accactttgc cacctaattt actagagctc tatctttata acaatatcat taagaaaatc
720
caagaaaatg attttaataa cctcaatgag ttgcaagttc ttgacctaag tggaaattgc
780
cctcgatgtt ataatgtccc atatccgtgt acaccgtgtg aaaataattc ccccttacag
840
atccatgaca atgctttcaa ttcattgaca gaattaaaag ttttacgttt acacagtaat
900
tctcttcagc atgtgccccc aacatggttt aaaaacatga gaaacctcca ggaactagac
960
ctctcccaaa actacttggc cagagaaatt gaggaggcca aatttttgca ttttcttccc
1020
aaccttgttg agttggattt ttctttcaat tatgagctgc aggtctacca tgcatctata
1080
actttaccac attcactctc ttcattggaa aacttgaaaa ttctgcgtgt caaggggtat
1140
gtctttaaag agctgaaaaa ctccagtctt tctgtattgc acaagcttcc caggctggaa
1200
gttcttgacc ttggcactaa cttcataaaa attgctgacc tcaacatatt caaacatttt
1260
gaaaacctca aactcataga cctttcagtg aataagatat ctccttcaga agagtcaaga
1320
gaagttggct tttgtcctaa tgctcaaact tctgtagacc gtcatgggcc ccaggtcctt
1380
gaggccttac actatttccg atacgatgaa tatgcacgga gctgcaggtt caaaaacaaa
1440
gagccacctt ctttcttgcc tttgaatgca gactgccaca tatatgggca gaccttagac
1500
ttaagtagaa ataacatatt ttttattaaa ccttctgatt ttcagcatct ttcattcctc
1560
aaatgcctca acttatcagg aaacaccatt ggccaaactc ttaatggcag tgaactctgg
1620
ccgttgagag agttgcggta cttagacttc tccaacaacc ggcttgattt actctactca
1680
acagcctttg aagagctcca gagtcttgaa gttctggatc taagtagtaa cagccactat
1740
tttcaagcag aaggaattac tcacatgcta aactttacca agaaattacg gcttctggac
1800
aaactcatga tgaatgataa tgacatctct acttcggcca gcaggaccat ggaaagtgac
1860
tctcttcgaa ttctggagtt cagaggcaac catttagatg ttctatggag agccggtgat
1920
aacagatact tggacttctt caagaatttg ttcaatttag aggtattaga tatctccaga
1980
aattccctga attccttgcc tcctgaggtt tttgagggta tgccgccaaa tctaaagaat
2040
ctctccttgg ccaaaaatgg gctcaaatct ttcttttggg acagactcca gttactgaag
2100
catttggaaa ttttggacct cagccataac cagctgacaa aagtacctga gagattggcc
2160
aactgttcca aaagtctcac aacactgatt cttaagcata atcaaatcag gcaattgaca
2220
aaatattttc tagaagatgc tttgcaattg cgctatctag acatcagttc aaataaaatc
2280
caggtcattc agaagactag cttcccagaa aatgtcctca acaatctgga gatgttggtt
2340
ttacatcaca atcgctttct ttgcaactgt gatgctgtgt ggtttgtctg gtgggttaac
2400
catacagatg ttactattcc atacctggcc actgatgtga cttgtgtagg tccaggagca
2460
cacaaaggtc aaagtgtcat atcccttgat ctgtatacgt gtgagttaga tctcacaaac
2520
ctgattctgt tctcagtttc catatcatca gtcctctttc ttatggtagt tatgacaaca
2580
agtcacctct ttttctggga tatgtggtac atttattatt tttggaaagc aaagataaag
2640
gggtatcagc atctgcaatc catggagtct tgttatgatg cttttattgt gtatgacact
2700
aaaaactcag ctgtgacaga atgggttttg caggagctgg tggcaaaatt ggaagatcca
2760
agagaaaaac acttcaattt gtgtctagaa gaaagagact ggctaccagg acagccagtt
2820
ctagaaaacc tttcccagag catacagctc agcaaaaaga cagtgtttgt gatgacacag
2880
aaatatgcta agactgagag ttttaagatg gcattttatt tgtctcatca gaggctcctg
2940
gatgaaaaag tggatgtgat tatcttgata ttcttggaaa agcctcttca gaagtctaag
3000
tttcttcagc tcaggaagag actctgcagg agctctgtcc ttgagtggcc tgcaaatcca
3060
caggctcacc catacttctg gcagtgcctg aaaaatgccc tgaccacaga caatcatgtg
3120
gcttatagtc aaatgttcaa ggaaacagtc tag
3153
<210> 57
<211> 3153
<212> ДНК
<213> Rattus norvegicus
<400> 57
atggtatttc caatgtggac attgaagaga caaagtttta tctttttaaa tatgatctta
60
gtttctagag tccttgggtt tcgatggtat cctaaaactc taccttgtga tgtctctctc
120
gatagcacaa acacccatgt gattgtggat tgcacagaca agcatttgac agaaatacct
180
gagggtattc ccactaatac caccaacctt acccttacca tcaaccacat accaagcatc
240
tctccagact ccttccatag gctgaagcat ctggaggagc ttgatttaag atgcaactgt
300
gtacctattc tactggggtc caaagccaat gtgtgcacca agaggctaca gattagacct
360
ggaagcttta gtggactctc tgacttaaaa tccctttacc tggatggaaa tcaacttcta
420
gagataccac aggatcttcc atcaagctta cagcttctga gccttgaggc taacaatatc
480
ttctccatca caaaggagaa tctatcagaa ctagtcaaca ttgaatcact ctacctgggc
540
caaaactgtt attatcgaaa tccttgcaat gtttcctatt ctattgaaaa agatgctttc
600
ctagttatga aaaatttaaa ggttctctca ctaaaagata acaatgtcac agctgtcccc
660
accattttgc cacctaattt gctagaactc tatctttata acaacatcat taagagaatc
720
caagaacatg attttaataa gctcagccag ttgcaagttc ttgacctaag tggaaactgc
780
cctcgatgtt ataatgtccc atatccatgt acaccatgtg aaaataattc tcccttacag
840
atccatgaca atgcttttga ttcattaaca gaattaaaag ttttacgtct acacagtaac
900
tctcttcagc atgtgcctgc agaatggttt aaaaacatga gcaacctcca ggaactagac
960
ctctcccaaa actacttagc cagagaaatt gaagaagcca aatttttgaa ttctctcccc
1020
aaccttgtcc agttggatct gtctttcaat tatgagctgc aggtctacca tgcatctatt
1080
actttaccac actcactctc ttcattgaca aagttgaaaa atctgtatat caagggatat
1140
gtctttaaag agctgaaaga ctccagcctt tctgtattgc acaacctttc caatctagaa
1200
gttcttgacc ttggcactaa cttcataaaa attgctgacc tcaacatatt ccaacagttt
1260
gaaaacctca aattcataga cctttcagtg aataagatat ccccctcaga agagtcaaga
1320
gaagttggtt tatgtcctaa tgcccaaact tctgtagact ggcacggacc ccaggtcctt
1380
gaggccttac actatttccg atatgatgaa tatgcacgga gctgcaggtt caaaaacaaa
1440
gagccgccta cttttttgcc tttgaatgca gactgccaca catatgggaa gaccttagac
1500
ctaagtagaa ataacatatt ttttattaaa ccctctgatt ttaagcatct ttcattcctg
1560
aaatgcctca atttgtcagg aaacgccatt ggccaaactc ttaatggcag tgaactccag
1620
cccttgagag agctgcggta cttagacttc tccaacaacc ggcttgattt actctactca
1680
acagcctttg aagagctcca gaatctggaa attctggatc taagtagtaa cagccactat
1740
tttcaagcag aaggaattac tcacatgcta aactttacca agaaattacg gcatctagag
1800
aaactcatga tgaatgacaa tgacatctct acttcagcca gcaggaccat ggaaagtgaa
1860
tctcttcgtg ttctggaatt cagaggcaac catttagatg ttctatggag agatggtgat
1920
aacagatact tggacttctt caagaatctg ctcaacttag aggaattaga tatctccaga
1980
aattccctga attccgtgcc tcctggagtt tttgagggta tgccaccgaa tctaacgact
2040
ctctccttag ccaaaaatgg actcagatct ttctcttggg gtagacttca gttactaaag
2100
catttgaaaa atttggacct cagccacaac cagctgacaa ctgtccctgc gagattggcc
2160
aactgttcca aaagtctcac aaaactgatt cttaatcata atcaaatcag gcagttgaca
2220
aaatattttc tagaagatgc tttgcaattg cgctatctag acatcagttc aaataagatc
2280
caggtcattc agaagactag cttcccagaa aacgtcctca acaatctgaa catgttgctt
2340
ttacatcaca atcgctttct ttgcaactgt gatgctgtgt ggtttgtctg gtgggttaat
2400
catacagatg ttactattcc atacctggcc actgatgtga cttgtgcagg tccaggcgca
2460
cacaaaggtc aaagtgtcat atctctggat ctatatacat gtgaattaga tctcacaaac
2520
ctgattctgt tctcagtttc catatcatca gtcctctttc ttatgatagt tatgacaaca
2580
agtcacctct ttttctggga tatgtggtac atttattatt tctggaaagc caagataaag
2640
ggttatcaac atctgcaatc aatggagtct tgttatgatg cttttattgt gtatgacact
2700
aaaaactcag ctgtgacaga atgggttttg caggagctgg tggttaaatt ggaagaccca
2760
agagaaaaac actttaattt gtgtctagaa gaaagagact ggctaccagg gcagccagtt
2820
ctagaaaacc tttcccagag catacagctc agcagaaaga cagtgtttgt gatgacacag
2880
aaatatgcga agactgagag ttttaagatg gcgttttatt tgtcccatca gaggcttatg
2940
gatgaaaagg tggatgtgat tatcttgata ttcttggaaa agcctcttca gaagtctaag
3000
tttcttcagc tccggaagag gctctgcagc agttctgtcc ttgagtggcc tacaaatcca
3060
caagctcacc catatttctg gcagtgcctg aaaaatgccc tgactacaga caatcatgtg
3120
gcttatagtc aaatgttcaa ggaaacagtc tag
3153
<210> 58
<211> 3150
<212> ДНК
<213> Macaca mulatta
<400> 58
atgatgttcc ctgtgtggac cctgaagcgg cagatcctga ttctgttcaa tattatcctg
60
atttctaaac tgctgggggc aaggtggttc cccaagactc tgccttgcga cgtgaccctg
120
gatgtcagca agaaccacgt gatcgtcgac tgtacagata aacatctgac tgagattcca
180
ggcggcatcc ccaccaacac cacaaatctg accctgacaa tcaatcacat tcctgacatc
240
tctccagcca gttttcaccg gctggtgcat ctggtcgaga ttgatttccg atgcaactgt
300
gtgcctatcc ggctgggaag caagtccaat atgtgccctc ggagactgca gatcaagcca
360
agatctttta gtggcctgac ctacctgaag agcctgtatc tggacggaaa ccagctgctg
420
gagatcccac agggactgcc accttccctg cagctgctgt ctctggaagc caacaatatt
480
ttctccatca ggaaggagaa cctgacagaa ctggctaata tcgagattct gtacctgggc
540
cagaactgct actatcgcaa tccctgttac gtgtcatata gcatcgaaaa agacgccttt
600
ctgaacctga ctaagctgaa agtcctgtct ctgaaggata acaatgtgac taccgtcccc
660
accgtgctgc ctagtactct gaccgagctg tacctgtata acaatatgat tgcagagatc
720
caggaagacg atttcaacaa tctgaaccag ctgcagattc tggacctgag tggaaactgc
780
cccaggtgtt acaatgctcc ctttccttgc acaccttgta agaacaattc tccactgcag
840
atccccgtca atgcattcga tgccctgact gagctgaaag tgctgcggct gcactccaac
900
tctctgcagc atgtcccacc cagatggttt aagaatatca acaatctgca ggagctggac
960
ctgagccaga acttcctggc caaggaaatt ggcgatgcta aattcctgca ctttctgcca
1020
aacctgatcc agctggacct gagcttcaat tttgagctgc aggtgtaccg ggcatctatg
1080
aacctgagtc aggcctttag ctccctgaaa agcctgaaga ttctgcggat cagaggctat
1140
gtgtttaaag agctgaagtc attcaatctg agccccctgc ataacctgca gaatctggaa
1200
gtgctggatc tgggaaccaa cttcatcaaa attgccaatc tgagcatgtt caaacagttt
1260
aagagactga aagtgattga cctgtccgtc aacaagatca gtccctcagg cgattctagt
1320
gaagtggggt tttgcagcaa tgctcgaaca tcagtcgaga gctacgaacc tcaggtgctg
1380
gaacagctgt actatttcag atacgacaaa tatgccagat catgcaggtt taagaacaaa
1440
gaggcttcct tcacatctgt gaatgaaagc tgttacaagt atgggcagac tctggacctg
1500
agtaagaact caattttctt tatcaaatca agcgatttcc agcacctgtc ctttctgaag
1560
tgtctgaacc tgagtgggaa tctgatctca cagactctga atggatctga gtttcagcct
1620
ctggctgaac tgagatacct ggacttctca aacaataggc tggatctgct gcatagcacc
1680
gcattcgagg aactgaggaa actggaggtg ctggacattt cctctaacag ccactatttt
1740
cagtccgaag gaatcacaca tatgctgaac ttcactaaga atctgaaagt gctgcagaag
1800
ctgatgatga acgacaatga catcagcagc agcacatccc gcactatgga gagcgaatcc
1860
ctgcgcaccc tggagtttcg aggcaaccac ctggatgtgc tgtggcggga cggggataac
1920
agatacctgc agctgttcaa gaatctgctg aaactggagg aactggacat ttccaaaaac
1980
tctctgagtt ttctgccctc tggggtgttc gatggaatgc ctccaaacct gaagaatctg
2040
tctctggcca agaatggcct gaaaagtttt atctgggaga agctgaggta tctgaaaaac
2100
ctggaaacac tggacctgag tcacaatcag ctgacaactg tgcctgagag gctgtcaaac
2160
tgctcacgca gcctgaagaa tctgattctg aaaaacaatc agatcaggtc tctgactaaa
2220
tacttcctgc aggacgcctt tcagctgcgc tatctggatc tgtcctctaa taagattcag
2280
atgatccaga aaaccagctt ccctgagaac gtgctgaaca atctgaagat gctgctgctg
2340
caccataatc gctttctgtg cacatgtgac gccgtctggt tcgtgtggtg ggtcaaccac
2400
accgaggtga caattccata cctggcaact gatgtgacct gcgtcggacc aggagcacat
2460
aagggacaga gcgtgatctc cctggacctg tatacctgtg aactggatct gacaaatctg
2520
attctgtttt ccctgtctat cagtgtctca ctgttcctga tggtcatgat gaccgcaagc
2580
cacctgtact tttgggatgt gtggtacatc taccatttct gcaaggccaa aattaagggc
2640
tatcagcggc tgatctcccc tgactgctgt tacgatgctt ttatcgtgta tgacactaag
2700
gaccccgcag tgaccgagtg ggtcctggct gaactggtcg caaagctgga ggacccacgc
2760
gaaaaacact tcaacctgtg tctggaggaa cgagattggc tgccagggca gcccgtgctg
2820
gagaatctga gccagtccat ccagctgtcc aagaaaaccg tgttcgtcat gacagacaag
2880
tacgctaaga ccgaaaactt caagatcgca ttctatctgt ctcatcagag actgatggac
2940
gagaaagtgg atgtcatcat tctgatcttc ctggaaaagc catttcagaa aagcaagttc
3000
ctgcagctgc gaaagcggct gtgcggcagt tcagtgctgg agtggcctac aaacccacag
3060
gcccacccct acttttggca gtgtctgaaa aacgccctgg ctaccgataa tcatgtggct
3120
tatagccagg tcttcaagga aacagtgtag
3150
<210> 59
<211> 449
<212> ДНК
<213> Homo sapiens
<400> 59
gcctccggac tctagagcca ccatggtgct gcagacccag gtgttcatct ccctgctgct
60
gtggatctcc ggcgcgtacg gcgatatcgt gatgattaaa cgtacggtgg ccgccccctc
120
cgtgttcatc ttccccccct ccgacgagca gctgaagtcc ggcaccgcct ccgtggtgtg
180
cctgctgaat aacttctacc ccagagaggc caaggtgcag tggaaggtgg acaacgccct
240
gcagtccggg aactcccagg agagcgtgac cgagcaggac agcaaggaca gcacctacag
300
cctgagcagc accctgaccc tgagcaaagc cgactacgag aagcacaagg tgtacgcctg
360
cgaggtgacc caccagggcc tgagctcccc cgtcaccaag agcttcaaca ggggggagtg
420
ttaggggccc gtttaaacgg gggaggcta
449
<210> 60
<211> 1132
<212> ДНК
<213> Homo sapiens
<400> 60
gcctccggac tctagagcca ccatgaaaca cctgtggttc ttcctcctgc tggtggcagc
60
tcccagatgg gtgctgagcc aggtgcaatt gtgcaggcgg ttagctcagc ctccaccaag
120
ggcccaagcg tcttccccct ggcaccctcc tccaagagca cctctggcgg cacagccgcc
180
ctgggctgcc tggtcaagga ctacttcccc gaacccgtga ccgtgagctg gaactcaggc
240
gccctgacca gcggcgtgca caccttcccc gctgtcctgc agtcctcagg actctactcc
300
ctcagcagcg tggtgaccgt gccctccagc agcttgggca cccagaccta catctgcaac
360
gtgaatcaca agcccagcaa caccaaggtg gacaagagag ttgagcccaa atcttgtgac
420
aaaactcaca catgcccacc ctgcccagca cctgaactcc tggggggacc ctcagtcttc
480
ctcttccccc caaaacccaa ggacaccctc atgatctccc ggacccctga ggtcacatgc
540
gtggtggtgg acgtgagcca cgaagaccct gaggtcaagt tcaactggta cgtggacggc
600
gtggaggtgc ataatgccaa gacaaagccc cgggaggagc agtacaacag cacgtaccgg
660
gtggtcagcg tcctcaccgt cctgcaccag gactggctga atggcaagga gtacaagtgc
720
aaggtctcca acaaagccct cccagccccc atcgagaaaa ccatctccaa agccaaaggc
780
cagccccggg aaccacaggt gtacaccctg cccccatccc gggaggagat gaccaagaac
840
caggtcagcc tgacctgcct ggtcaaaggc ttctatccca gcgacatcgc cgtggagtgg
900
gagagcaatg gccagcccga gaacaactac aagaccaccc ctcccgtgct ggactccgac
960
ggctccttct tcctctacag caagctcacc gtggacaaga gcaggtggca gcagggcaac
1020
gtcttctcat gctccgtgat gcatgaggct ctgcacaacc actacaccca gaagagcctc
1080
tccctgtctc ccggcaaatg agatatcggg cccgtttaaa cgggggaggc ta
1132
<210> 61
<211> 1395
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность, кодирующая тяжелую цепь
антитела cAT01
<400> 61
atgaaacacc tgtggttctt cctcctgctg gtggcagctc ccagatgggt gctgagccag
60
gtgcagctgc agcagcctgg cgccgaactc gtgaaacctg gcgcctccgt gaacctgagc
120
tgcaaggcca gcggctacac cttcaccaac aactggctgc actgggtcaa gcagaggccc
180
ggcagaggcc tggaatggat cggcgacatc taccccagca acggccggac caactacaac
240
gagcagttca agaccaaggc caccctgacc gtggacaaga gcagcagcac cgcctacatg
300
cagctgtcca gcctgaccag cgaggacagc gccgtgtact tctgcgccag agagcggggc
360
tacttcgact attggggcca gggaaccgct ctgaccgtca gctcagcctc caccaagggc
420
ccaagcgtct tccccctggc accctcctcc aagagcacct ctggcggcac agccgccctg
480
ggctgcctgg tcaaggacta cttccccgaa cccgtgaccg tgagctggaa ctcaggcgcc
540
ctgaccagcg gcgtgcacac cttccccgct gtcctgcagt cctcaggact ctactccctc
600
agcagcgtgg tgaccgtgcc ctccagcagc ttgggcaccc agacctacat ctgcaacgtg
660
aatcacaagc ccagcaacac caaggtggac aagagagttg agcccaaatc ttgtgacaaa
720
actcacacat gcccaccctg cccagcacct gaactcctgg ggggaccctc agtcttcctc
780
ttccccccaa aacccaagga caccctcatg atctcccgga cccctgaggt cacatgcgtg
840
gtggtggacg tgagccacga agaccctgag gtcaagttca actggtacgt ggacggcgtg
900
gaggtgcata atgccaagac aaagccccgg gaggagcagt acaacagcac gtaccgggtg
960
gtcagcgtcc tcaccgtcct gcaccaggac tggctgaatg gcaaggagta caagtgcaag
1020
gtctccaaca aagccctccc agcccccatc gagaaaacca tctccaaagc caaaggccag
1080
ccccgggaac cacaggtgta caccctgccc ccatcccggg aggagatgac caagaaccag
1140
gtcagcctga cctgcctggt caaaggcttc tatcccagcg acatcgccgt ggagtgggag
1200
agcaatggcc agcccgagaa caactacaag accacccctc ccgtgctgga ctccgacggc
1260
tccttcttcc tctacagcaa gctcaccgtg gacaagagca ggtggcagca gggcaacgtc
1320
ttctcatgct ccgtgatgca tgaggctctg cacaaccact acacccagaa gagcctctcc
1380
ctgtctcccg gcaaa
1395
<210> 62
<211> 749
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность фрагмента ДНК, содержащего
нуклеотидную последовательность, кодирующую легкую цепь антитела
cAT01
<400> 62
ccagcctccg gactctagag ccaccatggt gctgcagacc caggtgttca tcagcctgct
60
gctgtggatc agcggcgcct acggcgacat ccagatgacc cagagcccta gcagcctgag
120
cacaagcctg ggcggcaaag tgaccatcac atgcaaggcc agccaggaca tcaacaagta
180
tatcgcctgg tatcagcaca aacccggcaa gggccccaga ctgctgattc actacaccag
240
caccctgcag cccggcatcc ccagcagatt ttctggcagc ggctccggca gagactacag
300
cttcagcatc agcaacctgg aacccgagga tatcgccacc tactactgcc tgcagtacga
360
ctacctgctg accttcggag ccggcaccaa gctggaactg aagagagccg tggccgctcc
420
ctccgtgttc atcttcccac ctagcgacga gcagctgaag tccggcacag cctctgtcgt
480
gtgcctgctg aacaacttct acccccgcga ggccaaggtg cagtggaagg tggacaatgc
540
cctgcagagc ggcaacagcc aggaaagcgt gaccgagcag gacagcaagg actccaccta
600
cagcctgtcc tccaccctga ccctgagcaa ggccgactac gagaagcaca aggtgtacgc
660
ctgcgaagtg acccaccagg gcctgagcag ccctgtgacc aagagcttca accggggcga
720
gtgctgagtt taaacggggg aggctaact
749
<210> 63
<211> 1413
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность, кодирующая тяжелую цепь
антитела cNB7
<400> 63
atgaaacacc tgtggttctt cctcctgctg gtggcagctc ccagatgggt gctgagcgac
60
gtgcagctgc aggaatctgg ccctggcctc gtgaagccta gccagagcct gagcctgaca
120
tgcaccgtga ccggctacag catcaccagc gactacgcct ggaactggat ccggcagttc
180
cccggcaaca agctggaatg gatgggccac atcagctacc ggggcaacac caactacaac
240
cccagcctga agtcccggat ctccatcacc cgggacacca gcaagaacca gttctttctg
300
cagctgaaca gcgtgaccac cgaggacacc gccacctact actgcgccag ctggaactac
360
tacggctacg tggactatgc catggactac tggggccagg gcacctccgt gaccgtcagc
420
tcagcctcca ccaagggccc aagcgtcttc cccctggcac cctcctccaa gagcacctct
480
ggcggcacag ccgccctggg ctgcctggtc aaggactact tccccgaacc cgtgaccgtg
540
agctggaact caggcgccct gaccagcggc gtgcacacct tccccgctgt cctgcagtcc
600
tcaggactct actccctcag cagcgtggtg accgtgccct ccagcagctt gggcacccag
660
acctacatct gcaacgtgaa tcacaagccc agcaacacca aggtggacaa gagagttgag
720
cccaaatctt gtgacaaaac tcacacatgc ccaccctgcc cagcacctga actcctgggg
780
ggaccctcag tcttcctctt ccccccaaaa cccaaggaca ccctcatgat ctcccggacc
840
cctgaggtca catgcgtggt ggtggacgtg agccacgaag accctgaggt caagttcaac
900
tggtacgtgg acggcgtgga ggtgcataat gccaagacaa agccccggga ggagcagtac
960
aacagcacgt accgggtggt cagcgtcctc accgtcctgc accaggactg gctgaatggc
1020
aaggagtaca agtgcaaggt ctccaacaaa gccctcccag cccccatcga gaaaaccatc
1080
tccaaagcca aaggccagcc ccgggaacca caggtgtaca ccctgccccc atcccgggag
1140
gagatgacca agaaccaggt cagcctgacc tgcctggtca aaggcttcta tcccagcgac
1200
atcgccgtgg agtgggagag caatggccag cccgagaaca actacaagac cacccctccc
1260
gtgctggact ccgacggctc cttcttcctc tacagcaagc tcaccgtgga caagagcagg
1320
tggcagcagg gcaacgtctt ctcatgctcc gtgatgcatg aggctctgca caaccactac
1380
acccagaaga gcctctccct gtctcccggc aaa
1413
<210> 64
<211> 749
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность фрагмента ДНК, содержащего
нуклеотидную последовательность, кодирующую легкую цепь антитела
cNB7
<400> 64
ccagcctccg gactctagag ccaccatggt gctgcagacc caggtgttca tcagcctgct
60
gctgtggatc agcggcgcct acggcgacat ccagatgacc cagacaccca gcagcctgag
120
cgccagcctg ggcgatagag tgaccatcag ctgcagagcc agccaggaca tcagcaacta
180
cctgaactgg tatcagcaga aacccgacgg caccgtgaag ctgctgatct actacaccag
240
cagactgcac agcggcgtgc ccagcagatt ttctggcagc ggctccggca ccgactacag
300
cctgaccatc aacaacctgg aacaggaaga tatcgctacc tacttctgtc agcaaggcga
360
caccttcccc accttcggcg gaggcaccaa gctggaaatc aagagagccg tggccgctcc
420
ctccgtgttc atcttcccac ctagcgacga gcagctgaag tctggcacag ccagcgtcgt
480
gtgcctgctg aacaacttct acccccgcga ggccaaggtg cagtggaagg tggacaatgc
540
cctgcagagc ggcaacagcc aggaaagcgt gaccgagcag gacagcaagg actccaccta
600
ctccctgagc agcaccctga ccctgagcaa ggccgactac gagaagcaca aggtgtacgc
660
ctgcgaagtg acccaccagg gcctgtctag ccccgtgacc aagagcttca accggggcga
720
gtgttgagtt taaacggggg aggctaact
749
<210> 65
<211> 1410
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность, кодирующая тяжелую цепь
антитела cFAN2
<400> 65
atgaaacacc tgtggttctt cctcctgctg gtggcagctc ccagatgggt gctgagccag
60
gtgcagctga aagagtctgg ccctggactg gtggccccta gccagagcct gagcatcacc
120
tgtaccgtgt ccggcttcag cctgaccggc tacggcgtga actgggtgcg ccagcctcct
180
ggcaaaggcc tggaatggct gggcatgatc tggggcgacg gcagcaccga ctacaacagc
240
gccctgaagt cccggctgag catccggaag gacaacagca agtcccaggt gttcctgaag
300
atgaacagcc tgcagaccga cgacaccgcc cggtactact gcgccagaga caagggctac
360
gacggctact actacgccat ggactactgg ggccagggca cctctgtgac cgtcagctca
420
gcctccacca agggcccaag cgtcttcccc ctggcaccct cctccaagag cacctctggc
480
ggcacagccg ccctgggctg cctggtcaag gactacttcc ccgaacccgt gaccgtgagc
540
tggaactcag gcgccctgac cagcggcgtg cacaccttcc ccgctgtcct gcagtcctca
600
ggactctact ccctcagcag cgtggtgacc gtgccctcca gcagcttggg cacccagacc
660
tacatctgca acgtgaatca caagcccagc aacaccaagg tggacaagag agttgagccc
720
aaatcttgtg acaaaactca cacatgccca ccctgcccag cacctgaact cctgggggga
780
ccctcagtct tcctcttccc cccaaaaccc aaggacaccc tcatgatctc ccggacccct
840
gaggtcacat gcgtggtggt ggacgtgagc cacgaagacc ctgaggtcaa gttcaactgg
900
tacgtggacg gcgtggaggt gcataatgcc aagacaaagc cccgggagga gcagtacaac
960
agcacgtacc gggtggtcag cgtcctcacc gtcctgcacc aggactggct gaatggcaag
1020
gagtacaagt gcaaggtctc caacaaagcc ctcccagccc ccatcgagaa aaccatctcc
1080
aaagccaaag gccagccccg ggaaccacag gtgtacaccc tgcccccatc ccgggaggag
1140
atgaccaaga accaggtcag cctgacctgc ctggtcaaag gcttctatcc cagcgacatc
1200
gccgtggagt gggagagcaa tggccagccc gagaacaact acaagaccac ccctcccgtg
1260
ctggactccg acggctcctt cttcctctac agcaagctca ccgtggacaa gagcaggtgg
1320
cagcagggca acgtcttctc atgctccgtg atgcatgagg ctctgcacaa ccactacacc
1380
cagaagagcc tctccctgtc tcccggcaaa
1410
<210> 66
<211> 752
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность фрагмента ДНК, содержащего
нуклеотидную последовательность, кодирующую легкую цепь антитела
cFAN2
<400> 66
ccagcctccg gactctagag ccaccatggt gctgcagacc caggtgttca tcagcctgct
60
gctgtggatc agcggcgcct acggcgacat ccagatgaca cagtctcccg ccagcctgag
120
cgcctctgtg ggagagacag tgaccatcac ctgtcgggcc agcgagaaca tctacagcta
180
cctggcctgg tatcagcaga agcagggcaa gagcccccag ctgctggtgt acgatgccaa
240
gacactggcc gagggcgtgc ccagcagatt ttctggcagc ggctccggca cccagttcag
300
cctgaagatc aacagcctgc agcccgagga cttcggcagc tactactgcc agcaccacta
360
cggcatccct tacaccttcg gcggaggcac caagctggaa atcaagagag ccgtggccgc
420
tccctccgtg ttcatcttcc cacctagcga cgagcagctg aagtccggca cagctagcgt
480
cgtgtgcctg ctgaacaact tctacccccg cgaggccaag gtgcagtgga aggtggacaa
540
tgccctgcag agcggcaaca gccaggaaag cgtgaccgag caggacagca aggactccac
600
ctacagcctg tccagcaccc tgaccctgag caaggccgac tacgagaagc acaaggtgta
660
cgcctgcgaa gtgacccacc agggcctgag cagcccagtg accaagagct tcaaccgggg
720
cgagtgctga gtttaaacgg gggaggctaa ct
752
<210> 67
<211> 1395
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность, кодирующая huAT01_H1_IgG1LALA
<400> 67
atgaaacacc tgtggttctt cctcctgctg gtggcagctc ccagatgggt gctgagccag
60
gtgcagctgg tgcagtctgg cgccgaagtg aagaaaccag gcgccagcgt gaaggtgtcc
120
tgcaaggcca gcggctacac ctttaccaac aactggctgc actgggtgcg ccaggctcca
180
ggacagggac tggaatggat gggcgacatc taccccagca acggccggac caactacgcc
240
cagaaattcc agggcagagt gaccatcacc gccgacaaga gcaccagcac cgcctacatg
300
gaactgagca gcctgcggag cgaggacacc gccgtgtact actgcgccag agagcggggc
360
tacttcgact attggggcca gggcacactc gtgaccgtca gctcagcctc caccaagggc
420
ccaagcgtct tccccctggc accctcctcc aagagcacct ctggcggcac agccgccctg
480
ggctgcctgg tcaaggacta cttccccgaa cccgtgaccg tgagctggaa ctcaggcgcc
540
ctgaccagcg gcgtgcacac cttccccgct gtcctgcagt cctcaggact ctactccctc
600
agcagcgtgg tgaccgtgcc ctccagcagc ttgggcaccc agacctacat ctgcaacgtg
660
aatcacaagc ccagcaacac caaggtggac aagagagttg agcccaaatc ttgtgacaaa
720
actcacacat gcccaccctg cccagcacct gaagccgcgg ggggaccctc agtcttcctc
780
ttccccccaa aacccaagga caccctcatg atctcccgga cccctgaggt cacatgcgtg
840
gtggtggacg tgagccacga agaccctgag gtcaagttca actggtacgt ggacggcgtg
900
gaggtgcata atgccaagac aaagccccgg gaggagcagt acaacagcac gtaccgggtg
960
gtcagcgtcc tcaccgtcct gcaccaggac tggctgaatg gcaaggagta caagtgcaag
1020
gtctccaaca aagccctccc agcccccatc gagaaaacca tctccaaagc caaaggccag
1080
ccccgggaac cacaggtgta caccctgccc ccatcccggg aggagatgac caagaaccag
1140
gtcagcctga cctgcctggt caaaggcttc tatcccagcg acatcgccgt ggagtgggag
1200
agcaatggcc agcccgagaa caactacaag accacccctc ccgtgctgga ctccgacggc
1260
tccttcttcc tctacagcaa gctcaccgtg gacaagagca ggtggcagca gggcaacgtc
1320
ttctcatgct ccgtgatgca tgaggctctg cacaaccact acacccagaa gagcctctcc
1380
ctgtctcccg gcaaa
1395
<210> 68
<211> 1395
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность, кодирующая huAT01_H3_IgG1LALA
<400> 68
atgaaacacc tgtggttctt cctcctgctg gtggcagctc ccagatgggt gctgagccag
60
gtgcagctgg tgcagtctgg cgccgaagtg aagaaaccag gcgccagcgt gaaggtgtcc
120
tgcaaggcca gcggctacac ctttaccaac aactggctgc actgggtgcg ccaggctcca
180
ggacagggac tggaatggat gggcgacatc taccccagca acggccggac caactacgcc
240
cagaaattcc agggcagagt gaccctgacc gtggacaaga gcaccagcac cgcctacatg
300
gaactgagca gcctgcggag cgaggatacc gccgtgtact tctgtgccag agagcggggc
360
tacttcgact actggggcca gggaacactc gtgaccgtca gctcagcctc caccaagggc
420
ccaagcgtct tccccctggc accctcctcc aagagcacct ctggcggcac agccgccctg
480
ggctgcctgg tcaaggacta cttccccgaa cccgtgaccg tgagctggaa ctcaggcgcc
540
ctgaccagcg gcgtgcacac cttccccgct gtcctgcagt cctcaggact ctactccctc
600
agcagcgtgg tgaccgtgcc ctccagcagc ttgggcaccc agacctacat ctgcaacgtg
660
aatcacaagc ccagcaacac caaggtggac aagagagttg agcccaaatc ttgtgacaaa
720
actcacacat gcccaccctg cccagcacct gaagccgcgg ggggaccctc agtcttcctc
780
ttccccccaa aacccaagga caccctcatg atctcccgga cccctgaggt cacatgcgtg
840
gtggtggacg tgagccacga agaccctgag gtcaagttca actggtacgt ggacggcgtg
900
gaggtgcata atgccaagac aaagccccgg gaggagcagt acaacagcac gtaccgggtg
960
gtcagcgtcc tcaccgtcct gcaccaggac tggctgaatg gcaaggagta caagtgcaag
1020
gtctccaaca aagccctccc agcccccatc gagaaaacca tctccaaagc caaaggccag
1080
ccccgggaac cacaggtgta caccctgccc ccatcccggg aggagatgac caagaaccag
1140
gtcagcctga cctgcctggt caaaggcttc tatcccagcg acatcgccgt ggagtgggag
1200
agcaatggcc agcccgagaa caactacaag accacccctc ccgtgctgga ctccgacggc
1260
tccttcttcc tctacagcaa gctcaccgtg gacaagagca ggtggcagca gggcaacgtc
1320
ttctcatgct ccgtgatgca tgaggctctg cacaaccact acacccagaa gagcctctcc
1380
ctgtctcccg gcaaa
1395
<210> 69
<211> 1386
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность, кодирующая huAT01_H3_IgG4Pro
<400> 69
atgaaacacc tgtggttctt cctcctgctg gtggcagctc ccagatgggt gctgagccag
60
gtgcagctgg tgcagtctgg cgccgaagtg aagaaaccag gcgccagcgt gaaggtgtcc
120
tgcaaggcca gcggctacac ctttaccaac aactggctgc actgggtgcg ccaggctcca
180
ggacagggac tggaatggat gggcgacatc taccccagca acggccggac caactacgcc
240
cagaaattcc agggcagagt gaccctgacc gtggacaaga gcaccagcac cgcctacatg
300
gaactgagca gcctgcggag cgaggatacc gccgtgtact tctgtgccag agagcggggc
360
tacttcgact actggggcca gggaacactc gtgaccgtca gctcagcctc caccaagggc
420
cctagcgtgt tccctctggc cccttgtagc agaagcacca gcgagtctac agccgccctg
480
ggctgcctcg tgaaggacta ctttcccgag cccgtgaccg tgtcctggaa ctctggcgct
540
ctgacaagcg gcgtgcacac ctttccagcc gtgctgcaga gcagcggcct gtactctctg
600
tccagcgtcg tgactgtgcc cagcagctct ctgggcacca agacctacac ctgtaacgtg
660
gaccacaagc ccagcaacac caaggtggac aagcgggtgg aatctaagta cggccctccc
720
tgccctcctt gcccagcccc tgaatttctg ggcggaccct ccgtgttcct gttcccccca
780
aagcccaagg acaccctgat gatcagccgg acccccgaag tgacctgcgt ggtggtggat
840
gtgtcccagg aagatcccga ggtgcagttc aattggtacg tggacggcgt ggaagtgcac
900
aacgccaaga ccaagcctag agaggaacag ttcaacagca cctaccgggt ggtgtccgtg
960
ctgacagtgc tgcaccagga ctggctgaac ggcaaagagt acaagtgcaa ggtgtccaac
1020
aagggcctgc ccagctccat cgagaaaacc atcagcaagg ccaagggcca gccccgcgaa
1080
ccccaggtgt acacactgcc tccaagccag gaagagatga ccaagaatca ggtgtccctg
1140
acctgtctcg tgaaaggctt ctacccctcc gatatcgccg tggaatggga gagcaacggc
1200
cagcccgaga acaactacaa gaccaccccc cctgtgctgg actccgatgg ctcattcttc
1260
ctgtacagca gactgaccgt ggacaagagc cggtggcagg aaggcaacgt gttcagctgc
1320
tccgtgatgc acgaggccct gcacaaccac tacacccaga agtccctgtc tctgagcctg
1380
ggcaaa
1386
<210> 70
<211> 699
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность, кодирующая huAT01_L1
<400> 70
atggtgctgc agacccaggt gttcatctcc ctgctgctgt ggatctccgg cgcgtacggc
60
gacatccaga tgacccagag ccctagcagc ctgagcgcca gcgtgggcga cagagtgacc
120
atcacatgca aggccagcca ggacatcaac aagtatatcg cctggtatca gcagaagccc
180
ggcaaggccc ccaagctgct gatccactac accagcacac tgcagcctgg cgtgcccagc
240
agattttccg gctctggcag cggcagagac ttcaccctga ccatcagcag cctgcagccc
300
gaggacttcg ccacctacta ctgcctgcag tacgactacc tgctgacctt cggccagggc
360
accaaggtgg aaatcaagcg tacggtggcc gccccctccg tgttcatctt ccccccctcc
420
gacgagcagc tgaagtccgg caccgcctcc gtggtgtgcc tgctgaataa cttctacccc
480
agagaggcca aggtgcagtg gaaggtggac aacgccctgc agtccgggaa ctcccaggag
540
agcgtgaccg agcaggacag caaggacagc acctacagcc tgagcagcac cctgaccctg
600
agcaaagccg actacgagaa gcacaaggtg tacgcctgcg aggtgaccca ccagggcctg
660
agctcccccg tcaccaagag cttcaacagg ggggagtgt
699
<210> 71
<211> 699
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность, кодирующая huAT01_L2
<400> 71
atggtgctgc agacccaggt gttcatctcc ctgctgctgt ggatctccgg cgcgtacggc
60
gacatccaga tgacccagag ccctagcagc ctgagcgcca gcgtgggcga cagagtgacc
120
atcacatgca aggccagcca ggacatcaac aagtatatcg cctggtatca gcagaagccc
180
ggcaaggccc ccaagctgct gatccactac accagcacac tgcagcccgg catccccagc
240
agattttccg gctctggcag cggcagagac tacaccctga ccatcagcag cctgcagcca
300
gaggacttcg ccacctacta ctgcctgcag tacgactacc tgctgacctt cggccagggc
360
accaaggtgg aaatcaagcg tacggtggcc gccccctccg tgttcatctt ccccccctcc
420
gacgagcagc tgaagtccgg caccgcctcc gtggtgtgcc tgctgaataa cttctacccc
480
agagaggcca aggtgcagtg gaaggtggac aacgccctgc agtccgggaa ctcccaggag
540
agcgtgaccg agcaggacag caaggacagc acctacagcc tgagcagcac cctgaccctg
600
agcaaagccg actacgagaa gcacaaggtg tacgcctgcg aggtgaccca ccagggcctg
660
agctcccccg tcaccaagag cttcaacagg ggggagtgt
699
<210> 72
<211> 1413
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность, кодирующая huNB7_H3_IgG1LALA
<400> 72
atgaaacacc tgtggttctt cctcctgctg gtggcagctc ccagatgggt gctgagcgac
60
gtgcagctgc aggaatctgg ccctggcctc gtgaagccca gcgataccct gagcctgacc
120
tgtaccgtga ccggctacag catcaccagc gactacgcct ggaactggat cagacagccc
180
cctggcaaca agctggaatg gatcggccac atcagctacc ggggcaacac caactacaac
240
cccagcctga agtccagagt gaccatcagc cgggacacca gcaagaacca gttctccctg
300
aagctgagca gcgtgacagc cgccgatacc gccgtgtact actgcgccag ctggaactac
360
tacggctacg tggactatgc catggactac tggggccagg gcaccacagt gaccgtcagc
420
tcagcctcca ccaagggccc aagcgtcttc cccctggcac cctcctccaa gagcacctct
480
ggcggcacag ccgccctggg ctgcctggtc aaggactact tccccgaacc cgtgaccgtg
540
agctggaact caggcgccct gaccagcggc gtgcacacct tccccgctgt cctgcagtcc
600
tcaggactct actccctcag cagcgtggtg accgtgccct ccagcagctt gggcacccag
660
acctacatct gcaacgtgaa tcacaagccc agcaacacca aggtggacaa gagagttgag
720
cccaaatctt gtgacaaaac tcacacatgc ccaccctgcc cagcacctga agccgcgggg
780
ggaccctcag tcttcctctt ccccccaaaa cccaaggaca ccctcatgat ctcccggacc
840
cctgaggtca catgcgtggt ggtggacgtg agccacgaag accctgaggt caagttcaac
900
tggtacgtgg acggcgtgga ggtgcataat gccaagacaa agccccggga ggagcagtac
960
aacagcacgt accgggtggt cagcgtcctc accgtcctgc accaggactg gctgaatggc
1020
aaggagtaca agtgcaaggt ctccaacaaa gccctcccag cccccatcga gaaaaccatc
1080
tccaaagcca aaggccagcc ccgggaacca caggtgtaca ccctgccccc atcccgggag
1140
gagatgacca agaaccaggt cagcctgacc tgcctggtca aaggcttcta tcccagcgac
1200
atcgccgtgg agtgggagag caatggccag cccgagaaca actacaagac cacccctccc
1260
gtgctggact ccgacggctc cttcttcctc tacagcaagc tcaccgtgga caagagcagg
1320
tggcagcagg gcaacgtctt ctcatgctcc gtgatgcatg aggctctgca caaccactac
1380
acccagaaga gcctctccct gtctcccggc aaa
1413
<210> 73
<211> 1404
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность, кодирующая huNB7_H3_IgG4Pro
<400> 73
atgaaacacc tgtggttctt cctcctgctg gtggcagctc ccagatgggt gctgagcgac
60
gtgcagctgc aggaatctgg ccctggcctc gtgaagccca gcgataccct gagcctgacc
120
tgtaccgtga ccggctacag catcaccagc gactacgcct ggaactggat cagacagccc
180
cctggcaaca agctggaatg gatcggccac atcagctacc ggggcaacac caactacaac
240
cccagcctga agtccagagt gaccatcagc cgggacacca gcaagaacca gttctccctg
300
aagctgagca gcgtgacagc cgccgatacc gccgtgtact actgcgccag ctggaactac
360
tacggctacg tggactatgc catggactac tggggccagg gcaccacagt gaccgtcagc
420
tcagcctcca ccaagggccc tagcgtgttc cctctggccc cttgtagcag aagcaccagc
480
gagtctacag ccgccctggg ctgcctcgtg aaggactact ttcccgagcc cgtgaccgtg
540
tcctggaact ctggcgctct gacaagcggc gtgcacacct ttccagccgt gctgcagagc
600
agcggcctgt actctctgtc cagcgtcgtg actgtgccca gcagctctct gggcaccaag
660
acctacacct gtaacgtgga ccacaagccc agcaacacca aggtggacaa gcgggtggaa
720
tctaagtacg gccctccctg ccctccttgc ccagcccctg aatttctggg cggaccctcc
780
gtgttcctgt tccccccaaa gcccaaggac accctgatga tcagccggac ccccgaagtg
840
acctgcgtgg tggtggatgt gtcccaggaa gatcccgagg tgcagttcaa ttggtacgtg
900
gacggcgtgg aagtgcacaa cgccaagacc aagcctagag aggaacagtt caacagcacc
960
taccgggtgg tgtccgtgct gacagtgctg caccaggact ggctgaacgg caaagagtac
1020
aagtgcaagg tgtccaacaa gggcctgccc agctccatcg agaaaaccat cagcaaggcc
1080
aagggccagc cccgcgaacc ccaggtgtac acactgcctc caagccagga agagatgacc
1140
aagaatcagg tgtccctgac ctgtctcgtg aaaggcttct acccctccga tatcgccgtg
1200
gaatgggaga gcaacggcca gcccgagaac aactacaaga ccaccccccc tgtgctggac
1260
tccgatggct cattcttcct gtacagcaga ctgaccgtgg acaagagccg gtggcaggaa
1320
ggcaacgtgt tcagctgctc cgtgatgcac gaggccctgc acaaccacta cacccagaag
1380
tccctgtctc tgagcctggg caaa
1404
<210> 74
<211> 699
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность, кодирующая huNB7_L3
<400> 74
atggtgctgc agacccaggt gttcatctcc ctgctgctgt ggatctccgg cgcgtacggc
60
gacatccaga tgacccagag ccctagcagc ctgagcgcca gcgtgggcga cagagtgacc
120
atcacctgta gagccagcca ggacatcagc aactacctga actggtatca gcagaaaccc
180
ggcaaggccg tgaagctgct gatctactac accagcagac tgcacagcgg cgtgcccagc
240
agattttctg gcagcggctc cggcaccgac tacaccctga caatcagcag cctgcagccc
300
gaggacttcg ctacctactt ctgtcagcaa ggcgacacct tccccacctt cggccagggc
360
accaaggtgg aaatcaagcg tacggtggcc gccccctccg tgttcatctt ccccccctcc
420
gacgagcagc tgaagtccgg caccgcctcc gtggtgtgcc tgctgaataa cttctacccc
480
agagaggcca aggtgcagtg gaaggtggac aacgccctgc agtccgggaa ctcccaggag
540
agcgtgaccg agcaggacag caaggacagc acctacagcc tgagcagcac cctgaccctg
600
agcaaagccg actacgagaa gcacaaggtg tacgcctgcg aggtgaccca ccagggcctg
660
agctcccccg tcaccaagag cttcaacagg ggggagtgt
699
<210> 75
<211> 1137
<212> ДНК
<213> Homo sapiens
<400> 75
ccagcctccg gactctagag ccaccatgaa acacctgtgg ttcttcctcc tgctggtggc
60
agctcccaga tgggtgctga gccaggtgca attgtgcagg cggttagctc agcctccacc
120
aagggcccaa gcgtcttccc cctggcaccc tcctccaaga gcacctctgg cggcacagcc
180
gccctgggct gcctggtcaa ggactacttc cccgaacccg tgaccgtgag ctggaactca
240
ggcgccctga ccagcggcgt gcacaccttc cccgctgtcc tgcagtcctc aggactctac
300
tccctcagca gcgtggtgac cgtgccctcc agcagcttgg gcacccagac ctacatctgc
360
aacgtgaatc acaagcccag caacaccaag gtggacaaga gagttgagcc caaatcttgt
420
gacaaaactc acacatgccc accctgccca gcacctgaag ccgcgggggg accctcagtc
480
ttcctcttcc ccccaaaacc caaggacacc ctcatgatct cccggacccc tgaggtcaca
540
tgcgtggtgg tggacgtgag ccacgaagac cctgaggtca agttcaactg gtacgtggac
600
ggcgtggagg tgcataatgc caagacaaag ccccgggagg agcagtacaa cagcacgtac
660
cgggtggtca gcgtcctcac cgtcctgcac caggactggc tgaatggcaa ggagtacaag
720
tgcaaggtct ccaacaaagc cctcccagcc cccatcgaga aaaccatctc caaagccaaa
780
ggccagcccc gggaaccaca ggtgtacacc ctgcccccat cccgggagga gatgaccaag
840
aaccaggtca gcctgacctg cctggtcaaa ggcttctatc ccagcgacat cgccgtggag
900
tgggagagca atggccagcc cgagaacaac tacaagacca cccctcccgt gctggactcc
960
gacggctcct tcttcctcta cagcaagctc accgtggaca agagcaggtg gcagcagggc
1020
aacgtcttct catgctccgt gatgcatgag gctctgcaca accactacac ccagaagagc
1080
ctctccctgt ctcccggcaa atgagatatc gggcccgttt aaacggggga ggctaac
1137
<210> 76
<211> 1117
<212> ДНК
<213> Homo sapiens
<400> 76
ccagcctccg gactctagag ccaccatgaa acacctgtgg ttcttcctcc tgctggtggc
60
agctcccaga tgggtgctga gccaggtgca attgtgcagg cggttagctc agcctccacc
120
aagggcccta gcgtgttccc tctggcccct tgtagcagaa gcaccagcga gtctacagcc
180
gccctgggct gcctcgtgaa ggactacttt cccgagcccg tgaccgtgtc ctggaactct
240
ggcgctctga caagcggcgt gcacaccttt ccagccgtgc tgcagagcag cggcctgtac
300
tctctgtcca gcgtcgtgac tgtgcccagc agctctctgg gcaccaagac ctacacctgt
360
aacgtggacc acaagcccag caacaccaag gtggacaagc gggtggaatc taagtacggc
420
cctccctgcc ctccttgccc agcccctgaa tttctgggcg gaccctccgt gttcctgttc
480
cccccaaagc ccaaggacac cctgatgatc agccggaccc ccgaagtgac ctgcgtggtg
540
gtggatgtgt cccaggaaga tcccgaggtg cagttcaatt ggtacgtgga cggcgtggaa
600
gtgcacaacg ccaagaccaa gcctagagag gaacagttca acagcaccta ccgggtggtg
660
tccgtgctga cagtgctgca ccaggactgg ctgaacggca aagagtacaa gtgcaaggtg
720
tccaacaagg gcctgcccag ctccatcgag aaaaccatca gcaaggccaa gggccagccc
780
cgcgaacccc aggtgtacac actgcctcca agccaggaag agatgaccaa gaatcaggtg
840
tccctgacct gtctcgtgaa aggcttctac ccctccgata tcgccgtgga atgggagagc
900
aacggccagc ccgagaacaa ctacaagacc accccccctg tgctggactc cgatggctca
960
ttcttcctgt acagcagact gaccgtggac aagagccggt ggcaggaagg caacgtgttc
1020
agctgctccg tgatgcacga ggccctgcac aaccactaca cccagaagtc cctgtctctg
1080
agcctgggca aatgagttta aacgggggag gctaact
1117
<210> 77
<211> 348
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность, кодирующая вариабельную
область тяжелой цепи huAT01_H1
<400> 77
caggtgcagc tggtgcagtc tggcgccgaa gtgaagaaac caggcgccag cgtgaaggtg
60
tcctgcaagg ccagcggcta cacctttacc aacaactggc tgcactgggt gcgccaggct
120
ccaggacagg gactggaatg gatgggcgac atctacccca gcaacggccg gaccaactac
180
gcccagaaat tccagggcag agtgaccatc accgccgaca agagcaccag caccgcctac
240
atggaactga gcagcctgcg gagcgaggac accgccgtgt actactgcgc cagagagcgg
300
ggctacttcg actattgggg ccagggcaca ctcgtgaccg tcagctca
348
<210> 78
<211> 348
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность, кодирующая вариабельную
область тяжелой цепи huAT01_H3
<400> 78
caggtgcagc tggtgcagtc tggcgccgaa gtgaagaaac caggcgccag cgtgaaggtg
60
tcctgcaagg ccagcggcta cacctttacc aacaactggc tgcactgggt gcgccaggct
120
ccaggacagg gactggaatg gatgggcgac atctacccca gcaacggccg gaccaactac
180
gcccagaaat tccagggcag agtgaccctg accgtggaca agagcaccag caccgcctac
240
atggaactga gcagcctgcg gagcgaggat accgccgtgt acttctgtgc cagagagcgg
300
ggctacttcg actactgggg ccagggaaca ctcgtgaccg tcagctca
348
<210> 79
<211> 318
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность, кодирующая вариабельную
область легкой цепи huAT01_L1
<400> 79
gacatccaga tgacccagag ccctagcagc ctgagcgcca gcgtgggcga cagagtgacc
60
atcacatgca aggccagcca ggacatcaac aagtatatcg cctggtatca gcagaagccc
120
ggcaaggccc ccaagctgct gatccactac accagcacac tgcagcctgg cgtgcccagc
180
agattttccg gctctggcag cggcagagac ttcaccctga ccatcagcag cctgcagccc
240
gaggacttcg ccacctacta ctgcctgcag tacgactacc tgctgacctt cggccagggc
300
accaaggtgg aaatcaag
318
<210> 80
<211> 318
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность, кодирующая вариабельную
область легкой цепи huAT01_L2
<400> 80
gacatccaga tgacccagag ccctagcagc ctgagcgcca gcgtgggcga cagagtgacc
60
atcacatgca aggccagcca ggacatcaac aagtatatcg cctggtatca gcagaagccc
120
ggcaaggccc ccaagctgct gatccactac accagcacac tgcagcccgg catccccagc
180
agattttccg gctctggcag cggcagagac tacaccctga ccatcagcag cctgcagcca
240
gaggacttcg ccacctacta ctgcctgcag tacgactacc tgctgacctt cggccagggc
300
accaaggtgg aaatcaag
318
<210> 81
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность, кодирующая вариабельную
область тяжелой цепи huNB7_H3
<400> 81
gacgtgcagc tgcaggaatc tggccctggc ctcgtgaagc ccagcgatac cctgagcctg
60
acctgtaccg tgaccggcta cagcatcacc agcgactacg cctggaactg gatcagacag
120
ccccctggca acaagctgga atggatcggc cacatcagct accggggcaa caccaactac
180
aaccccagcc tgaagtccag agtgaccatc agccgggaca ccagcaagaa ccagttctcc
240
ctgaagctga gcagcgtgac agccgccgat accgccgtgt actactgcgc cagctggaac
300
tactacggct acgtggacta tgccatggac tactggggcc agggcaccac agtgaccgtc
360
agctca
366
<210> 82
<211> 318
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность, кодирующая вариабельную
область легкой цепи huNB7_L3
<400> 82
gacatccaga tgacccagag ccctagcagc ctgagcgcca gcgtgggcga cagagtgacc
60
atcacctgta gagccagcca ggacatcagc aactacctga actggtatca gcagaaaccc
120
ggcaaggccg tgaagctgct gatctactac accagcagac tgcacagcgg cgtgcccagc
180
agattttctg gcagcggctc cggcaccgac tacaccctga caatcagcag cctgcagccc
240
gaggacttcg ctacctactt ctgtcagcaa ggcgacacct tccccacctt cggccagggc
300
accaaggtgg aaatcaag
318
<210> 83
<211> 1050
<212> Белок
<213> Mus musculus
<400> 83
Met Val Phe Ser Met Trp Thr Arg Lys Arg Gln Ile Leu Ile Phe Leu
1 5 10 15
Asn Met Leu Leu Val Ser Arg Val Phe Gly Phe Arg Trp Phe Pro Lys
20 25 30
Thr Leu Pro Cys Glu Val Lys Val Asn Ile Pro Glu Ala His Val Ile
35 40 45
Val Asp Cys Thr Asp Lys His Leu Thr Glu Ile Pro Glu Gly Ile Pro
50 55 60
Thr Asn Thr Thr Asn Leu Thr Leu Thr Ile Asn His Ile Pro Ser Ile
65 70 75 80
Ser Pro Asp Ser Phe Arg Arg Leu Asn His Leu Glu Glu Ile Asp Leu
85 90 95
Arg Cys Asn Cys Val Pro Val Leu Leu Gly Ser Lys Ala Asn Val Cys
100 105 110
Thr Lys Arg Leu Gln Ile Arg Pro Gly Ser Phe Ser Gly Leu Ser Asp
115 120 125
Leu Lys Ala Leu Tyr Leu Asp Gly Asn Gln Leu Leu Glu Ile Pro Gln
130 135 140
Asp Leu Pro Ser Ser Leu His Leu Leu Ser Leu Glu Ala Asn Asn Ile
145 150 155 160
Phe Ser Ile Thr Lys Glu Asn Leu Thr Glu Leu Val Asn Ile Glu Thr
165 170 175
Leu Tyr Leu Gly Gln Asn Cys Tyr Tyr Arg Asn Pro Cys Asn Val Ser
180 185 190
Tyr Ser Ile Glu Lys Asp Ala Phe Leu Val Met Arg Asn Leu Lys Val
195 200 205
Leu Ser Leu Lys Asp Asn Asn Val Thr Ala Val Pro Thr Thr Leu Pro
210 215 220
Pro Asn Leu Leu Glu Leu Tyr Leu Tyr Asn Asn Ile Ile Lys Lys Ile
225 230 235 240
Gln Glu Asn Asp Phe Asn Asn Leu Asn Glu Leu Gln Val Leu Asp Leu
245 250 255
Ser Gly Asn Cys Pro Arg Cys Tyr Asn Val Pro Tyr Pro Cys Thr Pro
260 265 270
Cys Glu Asn Asn Ser Pro Leu Gln Ile His Asp Asn Ala Phe Asn Ser
275 280 285
Leu Thr Glu Leu Lys Val Leu Arg Leu His Ser Asn Ser Leu Gln His
290 295 300
Val Pro Pro Thr Trp Phe Lys Asn Met Arg Asn Leu Gln Glu Leu Asp
305 310 315 320
Leu Ser Gln Asn Tyr Leu Ala Arg Glu Ile Glu Glu Ala Lys Phe Leu
325 330 335
His Phe Leu Pro Asn Leu Val Glu Leu Asp Phe Ser Phe Asn Tyr Glu
340 345 350
Leu Gln Val Tyr His Ala Ser Ile Thr Leu Pro His Ser Leu Ser Ser
355 360 365
Leu Glu Asn Leu Lys Ile Leu Arg Val Lys Gly Tyr Val Phe Lys Glu
370 375 380
Leu Lys Asn Ser Ser Leu Ser Val Leu His Lys Leu Pro Arg Leu Glu
385 390 395 400
Val Leu Asp Leu Gly Thr Asn Phe Ile Lys Ile Ala Asp Leu Asn Ile
405 410 415
Phe Lys His Phe Glu Asn Leu Lys Leu Ile Asp Leu Ser Val Asn Lys
420 425 430
Ile Ser Pro Ser Glu Glu Ser Arg Glu Val Gly Phe Cys Pro Asn Ala
435 440 445
Gln Thr Ser Val Asp Arg His Gly Pro Gln Val Leu Glu Ala Leu His
450 455 460
Tyr Phe Arg Tyr Asp Glu Tyr Ala Arg Ser Cys Arg Phe Lys Asn Lys
465 470 475 480
Glu Pro Pro Ser Phe Leu Pro Leu Asn Ala Asp Cys His Ile Tyr Gly
485 490 495
Gln Thr Leu Asp Leu Ser Arg Asn Asn Ile Phe Phe Ile Lys Pro Ser
500 505 510
Asp Phe Gln His Leu Ser Phe Leu Lys Cys Leu Asn Leu Ser Gly Asn
515 520 525
Thr Ile Gly Gln Thr Leu Asn Gly Ser Glu Leu Trp Pro Leu Arg Glu
530 535 540
Leu Arg Tyr Leu Asp Phe Ser Asn Asn Arg Leu Asp Leu Leu Tyr Ser
545 550 555 560
Thr Ala Phe Glu Glu Leu Gln Ser Leu Glu Val Leu Asp Leu Ser Ser
565 570 575
Asn Ser His Tyr Phe Gln Ala Glu Gly Ile Thr His Met Leu Asn Phe
580 585 590
Thr Lys Lys Leu Arg Leu Leu Asp Lys Leu Met Met Asn Asp Asn Asp
595 600 605
Ile Ser Thr Ser Ala Ser Arg Thr Met Glu Ser Asp Ser Leu Arg Ile
610 615 620
Leu Glu Phe Arg Gly Asn His Leu Asp Val Leu Trp Arg Ala Gly Asp
625 630 635 640
Asn Arg Tyr Leu Asp Phe Phe Lys Asn Leu Phe Asn Leu Glu Val Leu
645 650 655
Asp Ile Ser Arg Asn Ser Leu Asn Ser Leu Pro Pro Glu Val Phe Glu
660 665 670
Gly Met Pro Pro Asn Leu Lys Asn Leu Ser Leu Ala Lys Asn Gly Leu
675 680 685
Lys Ser Phe Phe Trp Asp Arg Leu Gln Leu Leu Lys His Leu Glu Ile
690 695 700
Leu Asp Leu Ser His Asn Gln Leu Thr Lys Val Pro Glu Arg Leu Ala
705 710 715 720
Asn Cys Ser Lys Ser Leu Thr Thr Leu Ile Leu Lys His Asn Gln Ile
725 730 735
Arg Gln Leu Thr Lys Tyr Phe Leu Glu Asp Ala Leu Gln Leu Arg Tyr
740 745 750
Leu Asp Ile Ser Ser Asn Lys Ile Gln Val Ile Gln Lys Thr Ser Phe
755 760 765
Pro Glu Asn Val Leu Asn Asn Leu Glu Met Leu Val Leu His His Asn
770 775 780
Arg Phe Leu Cys Asn Cys Asp Ala Val Trp Phe Val Trp Trp Val Asn
785 790 795 800
His Thr Asp Val Thr Ile Pro Tyr Leu Ala Thr Asp Val Thr Cys Val
805 810 815
Gly Pro Gly Ala His Lys Gly Gln Ser Val Ile Ser Leu Asp Leu Tyr
820 825 830
Thr Cys Glu Leu Asp Leu Thr Asn Leu Ile Leu Phe Ser Val Ser Ile
835 840 845
Ser Ser Val Leu Phe Leu Met Val Val Met Thr Thr Ser His Leu Phe
850 855 860
Phe Trp Asp Met Trp Tyr Ile Tyr Tyr Phe Trp Lys Ala Lys Ile Lys
865 870 875 880
Gly Tyr Gln His Leu Gln Ser Met Glu Ser Cys Tyr Asp Ala Phe Ile
885 890 895
Val Tyr Asp Thr Lys Asn Ser Ala Val Thr Glu Trp Val Leu Gln Glu
900 905 910
Leu Val Ala Lys Leu Glu Asp Pro Arg Glu Lys His Phe Asn Leu Cys
915 920 925
Leu Glu Glu Arg Asp Trp Leu Pro Gly Gln Pro Val Leu Glu Asn Leu
930 935 940
Ser Gln Ser Ile Gln Leu Ser Lys Lys Thr Val Phe Val Met Thr Gln
945 950 955 960
Lys Tyr Ala Lys Thr Glu Ser Phe Lys Met Ala Phe Tyr Leu Ser His
965 970 975
Gln Arg Leu Leu Asp Glu Lys Val Asp Val Ile Ile Leu Ile Phe Leu
980 985 990
Glu Lys Pro Leu Gln Lys Ser Lys Phe Leu Gln Leu Arg Lys Arg Leu
995 1000 1005
Cys Arg Ser Ser Val Leu Glu Trp Pro Ala Asn Pro Gln Ala His
1010 1015 1020
Pro Tyr Phe Trp Gln Cys Leu Lys Asn Ala Leu Thr Thr Asp Asn
1025 1030 1035
His Val Ala Tyr Ser Gln Met Phe Lys Glu Thr Val
1040 1045 1050
<210> 84
<211> 1050
<212> Белок
<213> Rattus norvegicus
<400> 84
Met Val Phe Pro Met Trp Thr Leu Lys Arg Gln Ser Phe Ile Phe Leu
1 5 10 15
Asn Met Ile Leu Val Ser Arg Val Leu Gly Phe Arg Trp Tyr Pro Lys
20 25 30
Thr Leu Pro Cys Asp Val Ser Leu Asp Ser Thr Asn Thr His Val Ile
35 40 45
Val Asp Cys Thr Asp Lys His Leu Thr Glu Ile Pro Glu Gly Ile Pro
50 55 60
Thr Asn Thr Thr Asn Leu Thr Leu Thr Ile Asn His Ile Pro Ser Ile
65 70 75 80
Ser Pro Asp Ser Phe His Arg Leu Lys His Leu Glu Glu Leu Asp Leu
85 90 95
Arg Cys Asn Cys Val Pro Ile Leu Leu Gly Ser Lys Ala Asn Val Cys
100 105 110
Thr Lys Arg Leu Gln Ile Arg Pro Gly Ser Phe Ser Gly Leu Ser Asp
115 120 125
Leu Lys Ser Leu Tyr Leu Asp Gly Asn Gln Leu Leu Glu Ile Pro Gln
130 135 140
Asp Leu Pro Ser Ser Leu Gln Leu Leu Ser Leu Glu Ala Asn Asn Ile
145 150 155 160
Phe Ser Ile Thr Lys Glu Asn Leu Ser Glu Leu Val Asn Ile Glu Ser
165 170 175
Leu Tyr Leu Gly Gln Asn Cys Tyr Tyr Arg Asn Pro Cys Asn Val Ser
180 185 190
Tyr Ser Ile Glu Lys Asp Ala Phe Leu Val Met Lys Asn Leu Lys Val
195 200 205
Leu Ser Leu Lys Asp Asn Asn Val Thr Ala Val Pro Thr Ile Leu Pro
210 215 220
Pro Asn Leu Leu Glu Leu Tyr Leu Tyr Asn Asn Ile Ile Lys Arg Ile
225 230 235 240
Gln Glu His Asp Phe Asn Lys Leu Ser Gln Leu Gln Val Leu Asp Leu
245 250 255
Ser Gly Asn Cys Pro Arg Cys Tyr Asn Val Pro Tyr Pro Cys Thr Pro
260 265 270
Cys Glu Asn Asn Ser Pro Leu Gln Ile His Asp Asn Ala Phe Asp Ser
275 280 285
Leu Thr Glu Leu Lys Val Leu Arg Leu His Ser Asn Ser Leu Gln His
290 295 300
Val Pro Ala Glu Trp Phe Lys Asn Met Ser Asn Leu Gln Glu Leu Asp
305 310 315 320
Leu Ser Gln Asn Tyr Leu Ala Arg Glu Ile Glu Glu Ala Lys Phe Leu
325 330 335
Asn Ser Leu Pro Asn Leu Val Gln Leu Asp Leu Ser Phe Asn Tyr Glu
340 345 350
Leu Gln Val Tyr His Ala Ser Ile Thr Leu Pro His Ser Leu Ser Ser
355 360 365
Leu Thr Lys Leu Lys Asn Leu Tyr Ile Lys Gly Tyr Val Phe Lys Glu
370 375 380
Leu Lys Asp Ser Ser Leu Ser Val Leu His Asn Leu Ser Asn Leu Glu
385 390 395 400
Val Leu Asp Leu Gly Thr Asn Phe Ile Lys Ile Ala Asp Leu Asn Ile
405 410 415
Phe Gln Gln Phe Glu Asn Leu Lys Phe Ile Asp Leu Ser Val Asn Lys
420 425 430
Ile Ser Pro Ser Glu Glu Ser Arg Glu Val Gly Leu Cys Pro Asn Ala
435 440 445
Gln Thr Ser Val Asp Trp His Gly Pro Gln Val Leu Glu Ala Leu His
450 455 460
Tyr Phe Arg Tyr Asp Glu Tyr Ala Arg Ser Cys Arg Phe Lys Asn Lys
465 470 475 480
Glu Pro Pro Thr Phe Leu Pro Leu Asn Ala Asp Cys His Thr Tyr Gly
485 490 495
Lys Thr Leu Asp Leu Ser Arg Asn Asn Ile Phe Phe Ile Lys Pro Ser
500 505 510
Asp Phe Lys His Leu Ser Phe Leu Lys Cys Leu Asn Leu Ser Gly Asn
515 520 525
Ala Ile Gly Gln Thr Leu Asn Gly Ser Glu Leu Gln Pro Leu Arg Glu
530 535 540
Leu Arg Tyr Leu Asp Phe Ser Asn Asn Arg Leu Asp Leu Leu Tyr Ser
545 550 555 560
Thr Ala Phe Glu Glu Leu Gln Asn Leu Glu Ile Leu Asp Leu Ser Ser
565 570 575
Asn Ser His Tyr Phe Gln Ala Glu Gly Ile Thr His Met Leu Asn Phe
580 585 590
Thr Lys Lys Leu Arg His Leu Glu Lys Leu Met Met Asn Asp Asn Asp
595 600 605
Ile Ser Thr Ser Ala Ser Arg Thr Met Glu Ser Glu Ser Leu Arg Val
610 615 620
Leu Glu Phe Arg Gly Asn His Leu Asp Val Leu Trp Arg Asp Gly Asp
625 630 635 640
Asn Arg Tyr Leu Asp Phe Phe Lys Asn Leu Leu Asn Leu Glu Glu Leu
645 650 655
Asp Ile Ser Arg Asn Ser Leu Asn Ser Val Pro Pro Gly Val Phe Glu
660 665 670
Gly Met Pro Pro Asn Leu Thr Thr Leu Ser Leu Ala Lys Asn Gly Leu
675 680 685
Arg Ser Phe Ser Trp Gly Arg Leu Gln Leu Leu Lys His Leu Lys Asn
690 695 700
Leu Asp Leu Ser His Asn Gln Leu Thr Thr Val Pro Ala Arg Leu Ala
705 710 715 720
Asn Cys Ser Lys Ser Leu Thr Lys Leu Ile Leu Asn His Asn Gln Ile
725 730 735
Arg Gln Leu Thr Lys Tyr Phe Leu Glu Asp Ala Leu Gln Leu Arg Tyr
740 745 750
Leu Asp Ile Ser Ser Asn Lys Ile Gln Val Ile Gln Lys Thr Ser Phe
755 760 765
Pro Glu Asn Val Leu Asn Asn Leu Asn Met Leu Leu Leu His His Asn
770 775 780
Arg Phe Leu Cys Asn Cys Asp Ala Val Trp Phe Val Trp Trp Val Asn
785 790 795 800
His Thr Asp Val Thr Ile Pro Tyr Leu Ala Thr Asp Val Thr Cys Ala
805 810 815
Gly Pro Gly Ala His Lys Gly Gln Ser Val Ile Ser Leu Asp Leu Tyr
820 825 830
Thr Cys Glu Leu Asp Leu Thr Asn Leu Ile Leu Phe Ser Val Ser Ile
835 840 845
Ser Ser Val Leu Phe Leu Met Ile Val Met Thr Thr Ser His Leu Phe
850 855 860
Phe Trp Asp Met Trp Tyr Ile Tyr Tyr Phe Trp Lys Ala Lys Ile Lys
865 870 875 880
Gly Tyr Gln His Leu Gln Ser Met Glu Ser Cys Tyr Asp Ala Phe Ile
885 890 895
Val Tyr Asp Thr Lys Asn Ser Ala Val Thr Glu Trp Val Leu Gln Glu
900 905 910
Leu Val Val Lys Leu Glu Asp Pro Arg Glu Lys His Phe Asn Leu Cys
915 920 925
Leu Glu Glu Arg Asp Trp Leu Pro Gly Gln Pro Val Leu Glu Asn Leu
930 935 940
Ser Gln Ser Ile Gln Leu Ser Arg Lys Thr Val Phe Val Met Thr Gln
945 950 955 960
Lys Tyr Ala Lys Thr Glu Ser Phe Lys Met Ala Phe Tyr Leu Ser His
965 970 975
Gln Arg Leu Met Asp Glu Lys Val Asp Val Ile Ile Leu Ile Phe Leu
980 985 990
Glu Lys Pro Leu Gln Lys Ser Lys Phe Leu Gln Leu Arg Lys Arg Leu
995 1000 1005
Cys Ser Ser Ser Val Leu Glu Trp Pro Thr Asn Pro Gln Ala His
1010 1015 1020
Pro Tyr Phe Trp Gln Cys Leu Lys Asn Ala Leu Thr Thr Asp Asn
1025 1030 1035
His Val Ala Tyr Ser Gln Met Phe Lys Glu Thr Val
1040 1045 1050
<210> 85
<211> 1049
<212> Белок
<213> Macaca mulatta
<400> 85
Met Met Phe Pro Val Trp Thr Leu Lys Arg Gln Ile Leu Ile Leu Phe
1 5 10 15
Asn Ile Ile Leu Ile Ser Lys Leu Leu Gly Ala Arg Trp Phe Pro Lys
20 25 30
Thr Leu Pro Cys Asp Val Thr Leu Asp Val Ser Lys Asn His Val Ile
35 40 45
Val Asp Cys Thr Asp Lys His Leu Thr Glu Ile Pro Gly Gly Ile Pro
50 55 60
Thr Asn Thr Thr Asn Leu Thr Leu Thr Ile Asn His Ile Pro Asp Ile
65 70 75 80
Ser Pro Ala Ser Phe His Arg Leu Val His Leu Val Glu Ile Asp Phe
85 90 95
Arg Cys Asn Cys Val Pro Ile Arg Leu Gly Ser Lys Ser Asn Met Cys
100 105 110
Pro Arg Arg Leu Gln Ile Lys Pro Arg Ser Phe Ser Gly Leu Thr Tyr
115 120 125
Leu Lys Ser Leu Tyr Leu Asp Gly Asn Gln Leu Leu Glu Ile Pro Gln
130 135 140
Gly Leu Pro Pro Ser Leu Gln Leu Leu Ser Leu Glu Ala Asn Asn Ile
145 150 155 160
Phe Ser Ile Arg Lys Glu Asn Leu Thr Glu Leu Ala Asn Ile Glu Ile
165 170 175
Leu Tyr Leu Gly Gln Asn Cys Tyr Tyr Arg Asn Pro Cys Tyr Val Ser
180 185 190
Tyr Ser Ile Glu Lys Asp Ala Phe Leu Asn Leu Thr Lys Leu Lys Val
195 200 205
Leu Ser Leu Lys Asp Asn Asn Val Thr Thr Val Pro Thr Val Leu Pro
210 215 220
Ser Thr Leu Thr Glu Leu Tyr Leu Tyr Asn Asn Met Ile Ala Glu Ile
225 230 235 240
Gln Glu Asp Asp Phe Asn Asn Leu Asn Gln Leu Gln Ile Leu Asp Leu
245 250 255
Ser Gly Asn Cys Pro Arg Cys Tyr Asn Ala Pro Phe Pro Cys Thr Pro
260 265 270
Cys Lys Asn Asn Ser Pro Leu Gln Ile Pro Val Asn Ala Phe Asp Ala
275 280 285
Leu Thr Glu Leu Lys Val Leu Arg Leu His Ser Asn Ser Leu Gln His
290 295 300
Val Pro Pro Arg Trp Phe Lys Asn Ile Asn Asn Leu Gln Glu Leu Asp
305 310 315 320
Leu Ser Gln Asn Phe Leu Ala Lys Glu Ile Gly Asp Ala Lys Phe Leu
325 330 335
His Phe Leu Pro Asn Leu Ile Gln Leu Asp Leu Ser Phe Asn Phe Glu
340 345 350
Leu Gln Val Tyr Arg Ala Ser Met Asn Leu Ser Gln Ala Phe Ser Ser
355 360 365
Leu Lys Ser Leu Lys Ile Leu Arg Ile Arg Gly Tyr Val Phe Lys Glu
370 375 380
Leu Lys Ser Phe Asn Leu Ser Pro Leu His Asn Leu Gln Asn Leu Glu
385 390 395 400
Val Leu Asp Leu Gly Thr Asn Phe Ile Lys Ile Ala Asn Leu Ser Met
405 410 415
Phe Lys Gln Phe Lys Arg Leu Lys Val Ile Asp Leu Ser Val Asn Lys
420 425 430
Ile Ser Pro Ser Gly Asp Ser Ser Glu Val Gly Phe Cys Ser Asn Ala
435 440 445
Arg Thr Ser Val Glu Ser Tyr Glu Pro Gln Val Leu Glu Gln Leu Tyr
450 455 460
Tyr Phe Arg Tyr Asp Lys Tyr Ala Arg Ser Cys Arg Phe Lys Asn Lys
465 470 475 480
Glu Ala Ser Phe Thr Ser Val Asn Glu Ser Cys Tyr Lys Tyr Gly Gln
485 490 495
Thr Leu Asp Leu Ser Lys Asn Ser Ile Phe Phe Ile Lys Ser Ser Asp
500 505 510
Phe Gln His Leu Ser Phe Leu Lys Cys Leu Asn Leu Ser Gly Asn Leu
515 520 525
Ile Ser Gln Thr Leu Asn Gly Ser Glu Phe Gln Pro Leu Ala Glu Leu
530 535 540
Arg Tyr Leu Asp Phe Ser Asn Asn Arg Leu Asp Leu Leu His Ser Thr
545 550 555 560
Ala Phe Glu Glu Leu Arg Lys Leu Glu Val Leu Asp Ile Ser Ser Asn
565 570 575
Ser His Tyr Phe Gln Ser Glu Gly Ile Thr His Met Leu Asn Phe Thr
580 585 590
Lys Asn Leu Lys Val Leu Gln Lys Leu Met Met Asn Asp Asn Asp Ile
595 600 605
Ser Ser Ser Thr Ser Arg Thr Met Glu Ser Glu Ser Leu Arg Thr Leu
610 615 620
Glu Phe Arg Gly Asn His Leu Asp Val Leu Trp Arg Asp Gly Asp Asn
625 630 635 640
Arg Tyr Leu Gln Leu Phe Lys Asn Leu Leu Lys Leu Glu Glu Leu Asp
645 650 655
Ile Ser Lys Asn Ser Leu Ser Phe Leu Pro Ser Gly Val Phe Asp Gly
660 665 670
Met Pro Pro Asn Leu Lys Asn Leu Ser Leu Ala Lys Asn Gly Leu Lys
675 680 685
Ser Phe Ile Trp Glu Lys Leu Arg Tyr Leu Lys Asn Leu Glu Thr Leu
690 695 700
Asp Leu Ser His Asn Gln Leu Thr Thr Val Pro Glu Arg Leu Ser Asn
705 710 715 720
Cys Ser Arg Ser Leu Lys Asn Leu Ile Leu Lys Asn Asn Gln Ile Arg
725 730 735
Ser Leu Thr Lys Tyr Phe Leu Gln Asp Ala Phe Gln Leu Arg Tyr Leu
740 745 750
Asp Leu Ser Ser Asn Lys Ile Gln Met Ile Gln Lys Thr Ser Phe Pro
755 760 765
Glu Asn Val Leu Asn Asn Leu Lys Met Leu Leu Leu His His Asn Arg
770 775 780
Phe Leu Cys Thr Cys Asp Ala Val Trp Phe Val Trp Trp Val Asn His
785 790 795 800
Thr Glu Val Thr Ile Pro Tyr Leu Ala Thr Asp Val Thr Cys Val Gly
805 810 815
Pro Gly Ala His Lys Gly Gln Ser Val Ile Ser Leu Asp Leu Tyr Thr
820 825 830
Cys Glu Leu Asp Leu Thr Asn Leu Ile Leu Phe Ser Leu Ser Ile Ser
835 840 845
Val Ser Leu Phe Leu Met Val Met Met Thr Ala Ser His Leu Tyr Phe
850 855 860
Trp Asp Val Trp Tyr Ile Tyr His Phe Cys Lys Ala Lys Ile Lys Gly
865 870 875 880
Tyr Gln Arg Leu Ile Ser Pro Asp Cys Cys Tyr Asp Ala Phe Ile Val
885 890 895
Tyr Asp Thr Lys Asp Pro Ala Val Thr Glu Trp Val Leu Ala Glu Leu
900 905 910
Val Ala Lys Leu Glu Asp Pro Arg Glu Lys His Phe Asn Leu Cys Leu
915 920 925
Glu Glu Arg Asp Trp Leu Pro Gly Gln Pro Val Leu Glu Asn Leu Ser
930 935 940
Gln Ser Ile Gln Leu Ser Lys Lys Thr Val Phe Val Met Thr Asp Lys
945 950 955 960
Tyr Ala Lys Thr Glu Asn Phe Lys Ile Ala Phe Tyr Leu Ser His Gln
965 970 975
Arg Leu Met Asp Glu Lys Val Asp Val Ile Ile Leu Ile Phe Leu Glu
980 985 990
Lys Pro Phe Gln Lys Ser Lys Phe Leu Gln Leu Arg Lys Arg Leu Cys
995 1000 1005
Gly Ser Ser Val Leu Glu Trp Pro Thr Asn Pro Gln Ala His Pro
1010 1015 1020
Tyr Phe Trp Gln Cys Leu Lys Asn Ala Leu Ala Thr Asp Asn His
1025 1030 1035
Val Ala Tyr Ser Gln Val Phe Lys Glu Thr Val
1040 1045
<210> 86
<211> 1797
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность человеческого Unc93B1 D34A
мутант-HAx2 гена
<400> 86
atggaggtgg agcctccgct ctaccctgtg gccggggccg cgggtcctca aggggatgaa
60
gaccggcacg gagttcctga tgggccagag gctcccttgg ccgaactcgt gggtgcgtac
120
cccaactaca atgaggagga ggaagagcgc cgctactacc gccgcaagcg cctcggagtg
180
gtcaagaacg tgctggcggc cagcacgggt gtcaccctta cttacggcgt ctacctgggc
240
ctcctgcaga tgcaactgat cctgcactat gatgagacct acagagaggt gaagtatggc
300
aacatggggc tgccggacat cgatagcaag atgctgatgg gtatcaacgt gacgcctatc
360
gctgccctgc tctacacacc tgtgctcatc aggttttttg gtaccaagtg gatgatgttc
420
ttggctgtgg gcatctatgc cctctttgtc tctaccaact actgggaacg ctactacacg
480
ctggtgccct ctgctgtggc tctgggcatg gccattgtgc ctctgtgggc ctccatgggc
540
aactatatca ccaggatgtc ccagaagtac tatgaatact cccactacaa ggagcaagat
600
gagcagggac ctcagcagcg cccaccacga ggttcccacg caccctatct cctggttttc
660
caggccatct tctatagctt cttccacttg agcttcgcgt gtgcccagct gcccatgatt
720
tacttcctca acaactacct gtatgacctg aaccacacac tgatcaacgt gcagagctgc
780
ggtactaaga gccaaggcat tctgaatggc ttcaacaaga cggtccttcg gacgctgccg
840
cgcagcaaaa accttattgt tgtagagagc gtgctcatgg cggtggcctt cttggccatg
900
ctgatggtgc tgggcctgtg tggagccgct taccggccca cggaagagat cgacctgcgc
960
agcgtgggct ggggcaacat cttccagctg cccttcaaac acgtgcgtga ctttcgctta
1020
cgccatctgg tgcccttctt tatctacagt ggctttgagg tgctctttgc ctgcactggt
1080
tttgccctgg gctacggcgt gtgctccatg gggctggagc gactggcata cctgctcata
1140
gcttacagcc tgggtgcctc agcctcctcg gttctggggc tgctgggact gtggctgcct
1200
cgctctgtcc cgctcgtggc tggggcagga ctgcacctac tgctcaccct tagcctcttt
1260
ttctgggctc ctgctcctcg ggtcctccag cacagttgga tcttttactt cgtggctgcc
1320
ctctggggtg tgggcagcgc cctcaacaag accggactta gcacactcct gggcatccta
1380
tatgaagaca aagagaggca ggacttcatc ttcaccatct atcactggtg gcaggccgtg
1440
gccatctttg ttgtgtacct gggctccagc ttgcccatga aggccaagct ggcagtgttg
1500
ctggtgaccc tggtagcagc agcagcctca tacctgtgga tggagcagaa gttgcagcaa
1560
ggattggtcc cgcggcagcc gcgcattccg aagccacagc acaaagtccg cggctaccgc
1620
tacctggagg aggacaactc ggatgagagt gacatggagg gcgagcaggg tcagggggac
1680
tgcgcagagg acgaagcacc acaggcaggg cccctgggtg cagagccagc tggcccctgc
1740
cgcaagccct gtccctatga acaggctctg ggtggcgatg ggcctgagga gcagtga
1797
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛО ПРОТИВ SIRPα | 2019 |
|
RU2791002C2 |
| АНТИ-CDH6-АНТИТЕЛО И КОНЪЮГАТ АНТИ-CDH6-АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2018 |
|
RU2798285C2 |
| АНТИТЕЛО ДЛЯ ЛЕЧЕНИЯ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ | 2017 |
|
RU2781148C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО | 2021 |
|
RU2840407C1 |
| АНТИТЕЛО ПРОТИВ GPR20 И КОНЪЮГАТЫ АНТИТЕЛО ПРОТИВ GPR20-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2018 |
|
RU2772804C2 |
| АНТИ-ORAI1 АНТИТЕЛО | 2015 |
|
RU2724742C2 |
| АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА, СПОСОБНАЯ К МНОГОКРАТНОМУ СВЯЗЫВАНИЮ ДВУХ ИЛИ БОЛЕЕ МОЛЕКУЛ АНТИГЕНА | 2021 |
|
RU2841525C2 |
| СЛИТАЯ С Fc α-ЦЕПЬ ВЫСОКОАФФИННОГО РЕЦЕПТОРА IgE | 2016 |
|
RU2715606C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРЕДУПРЕЖДЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2017 |
|
RU2766586C2 |
| АНТИ-C5 АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2774716C2 |





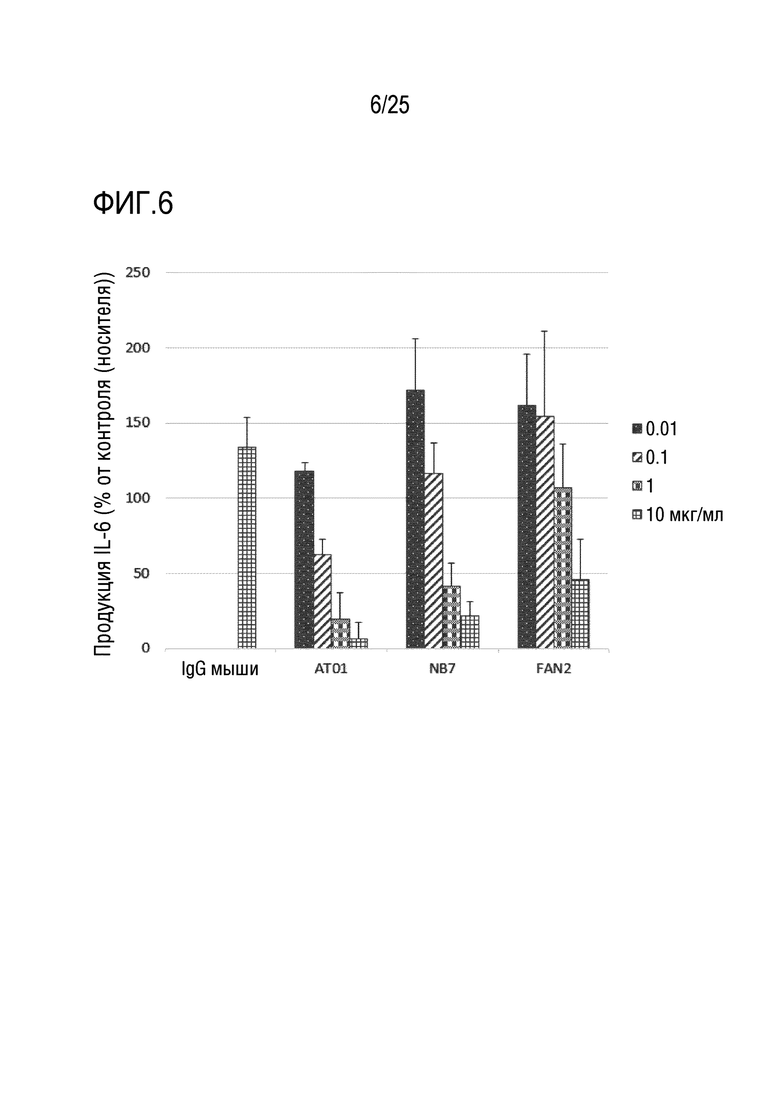



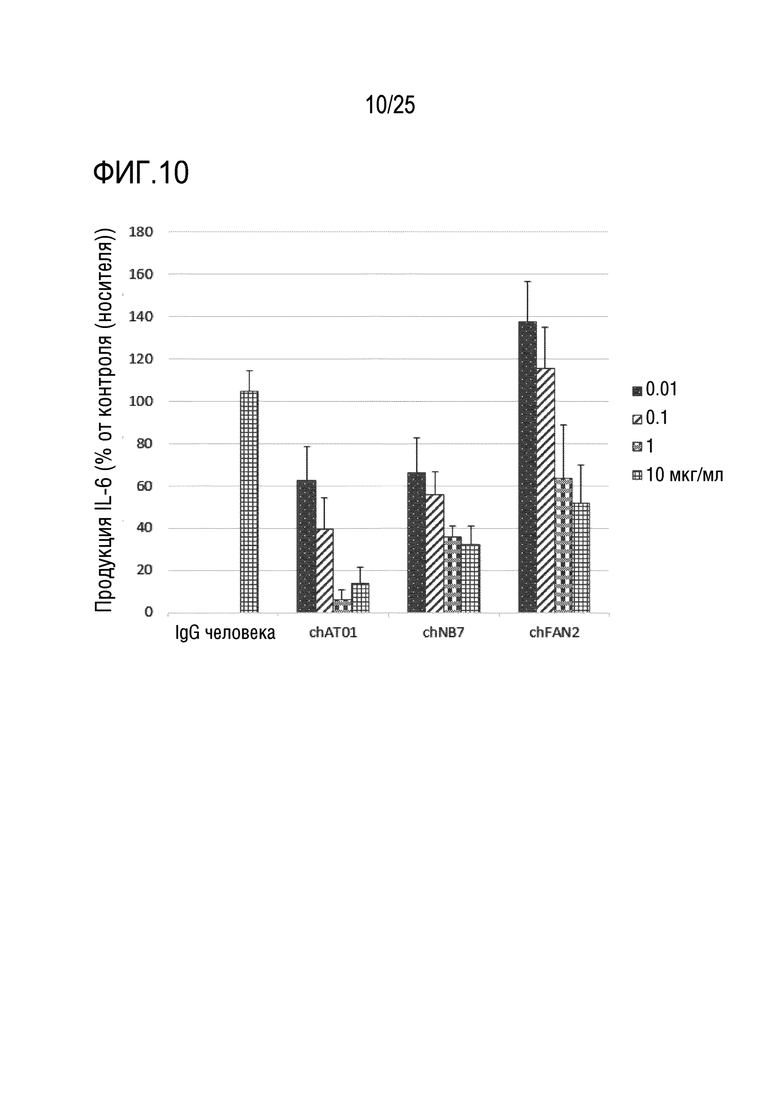




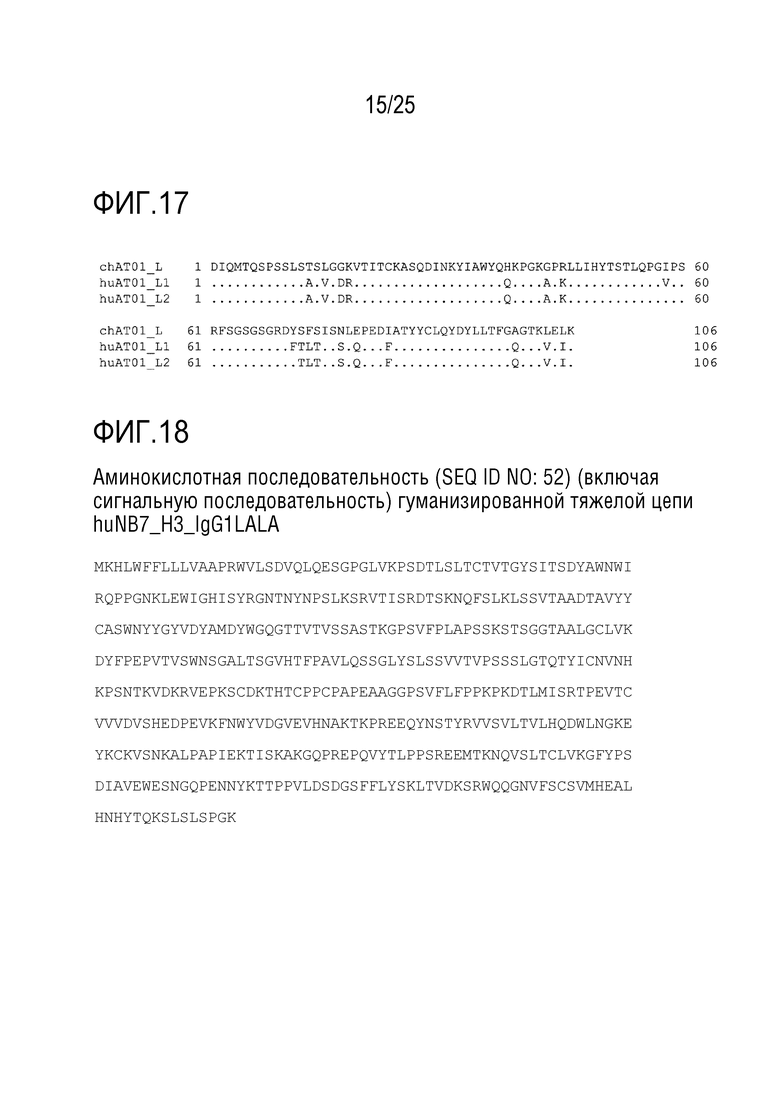


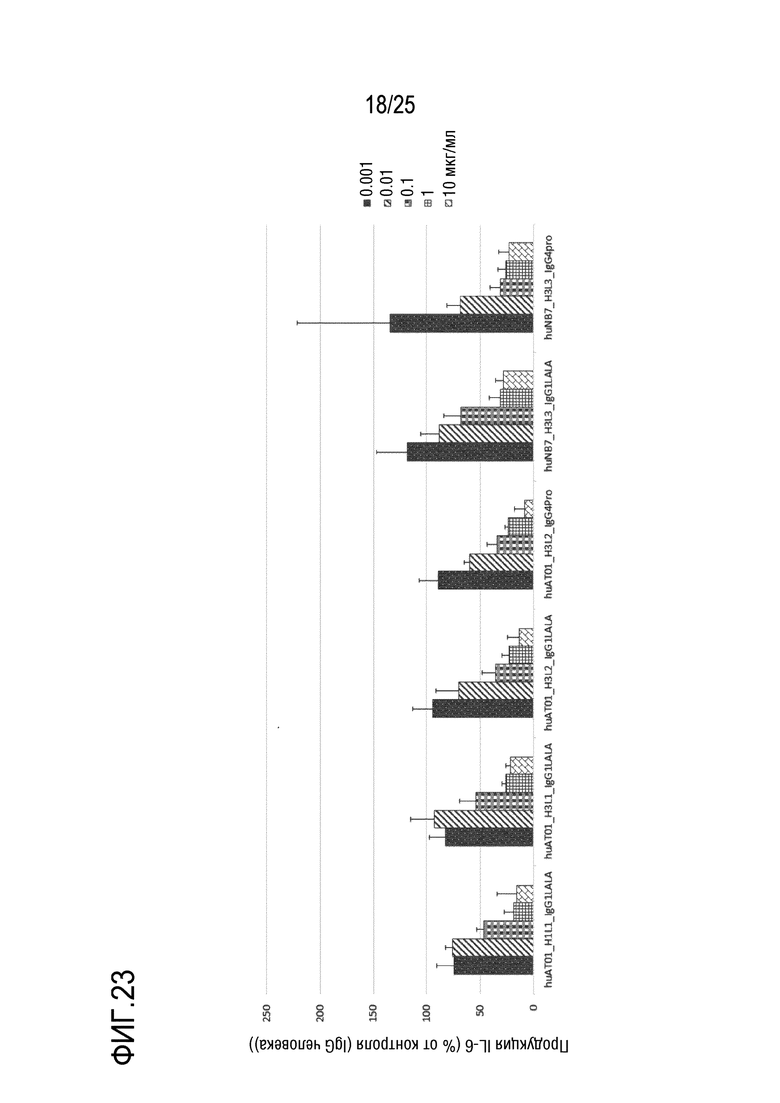


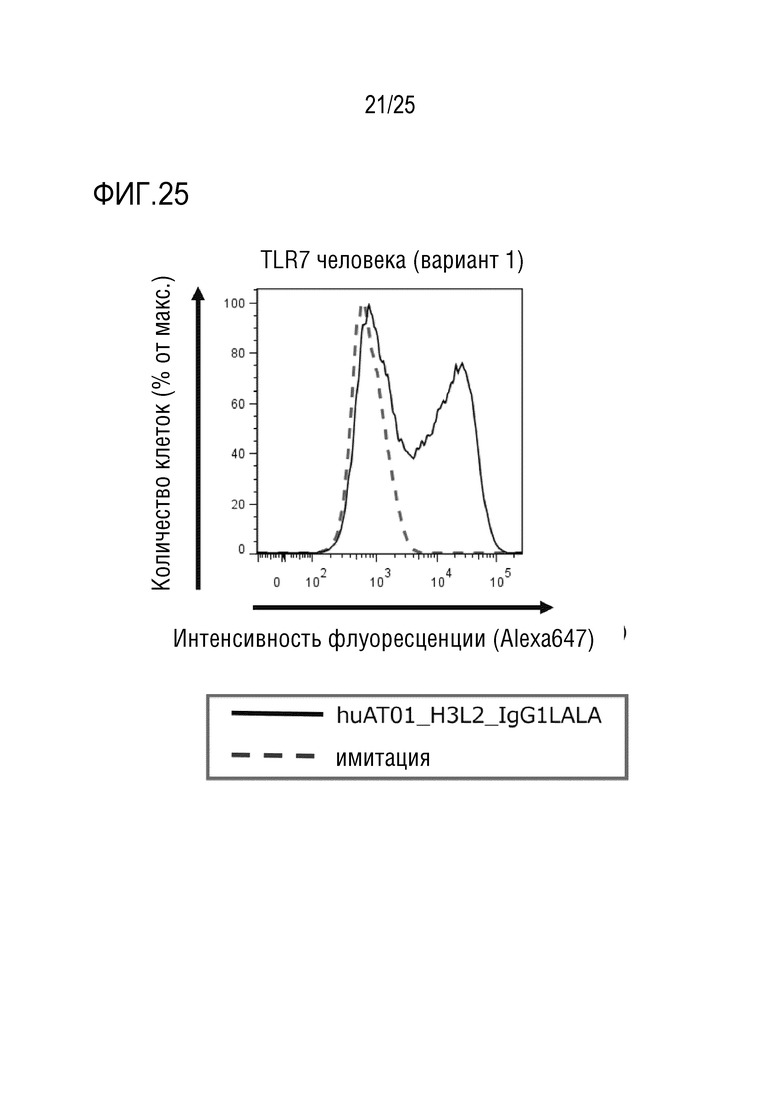
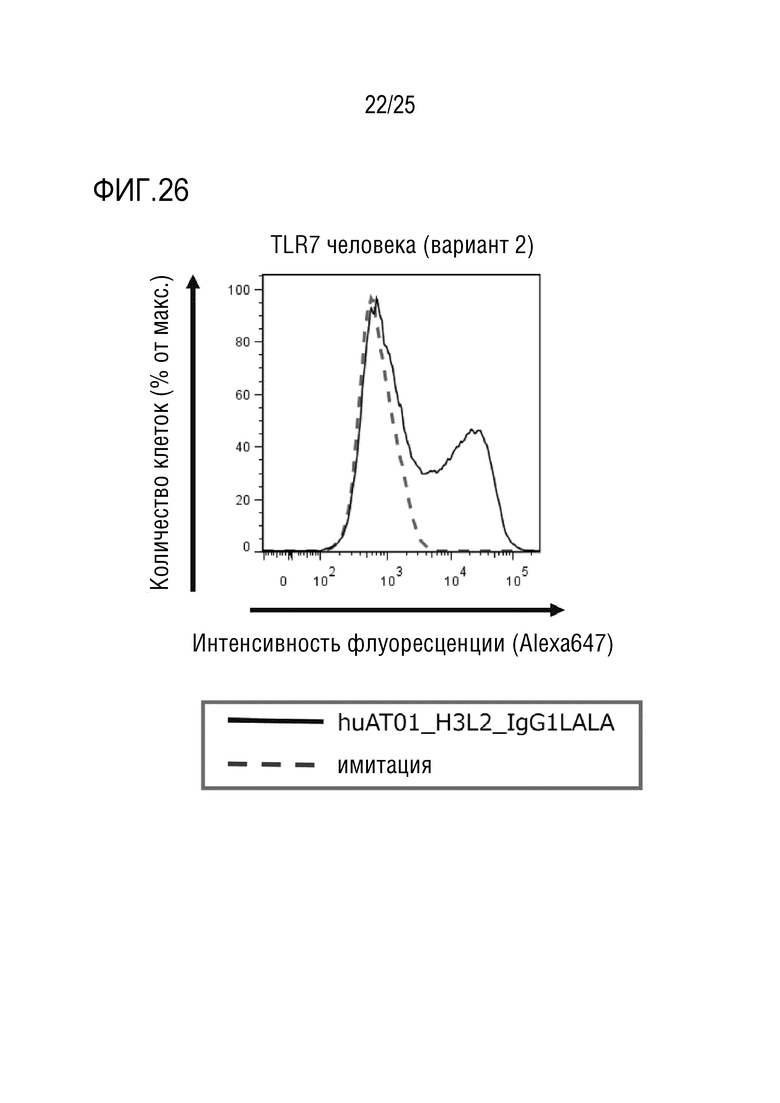
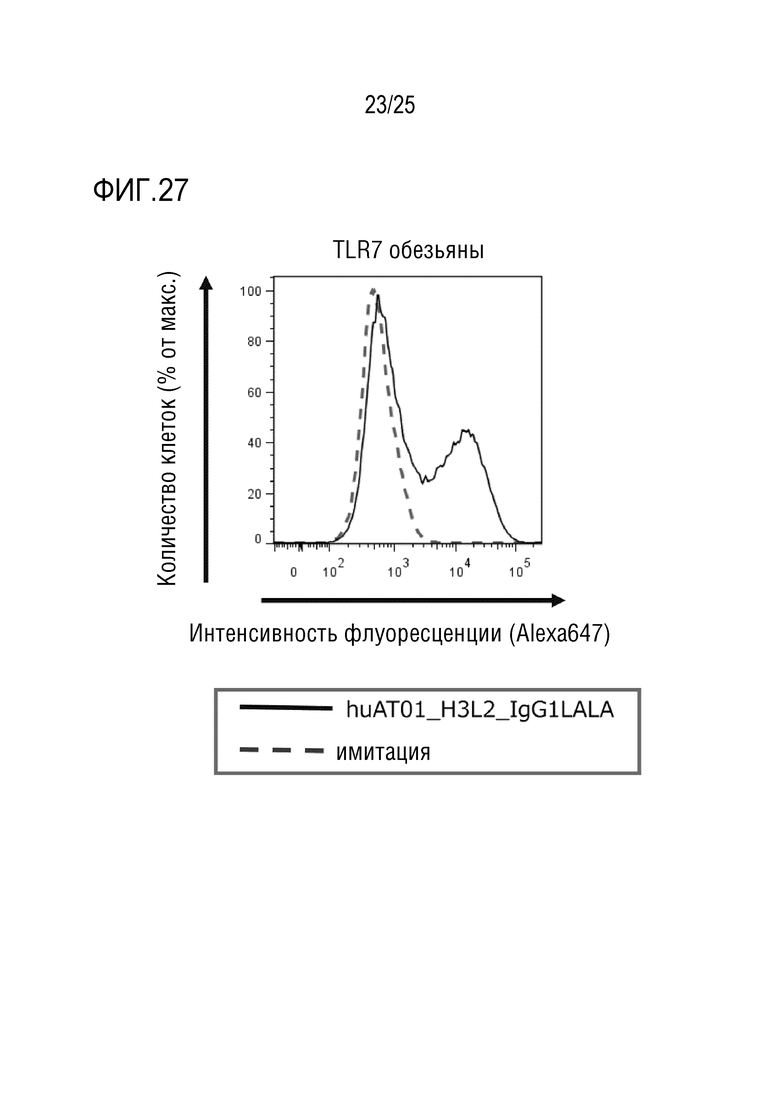
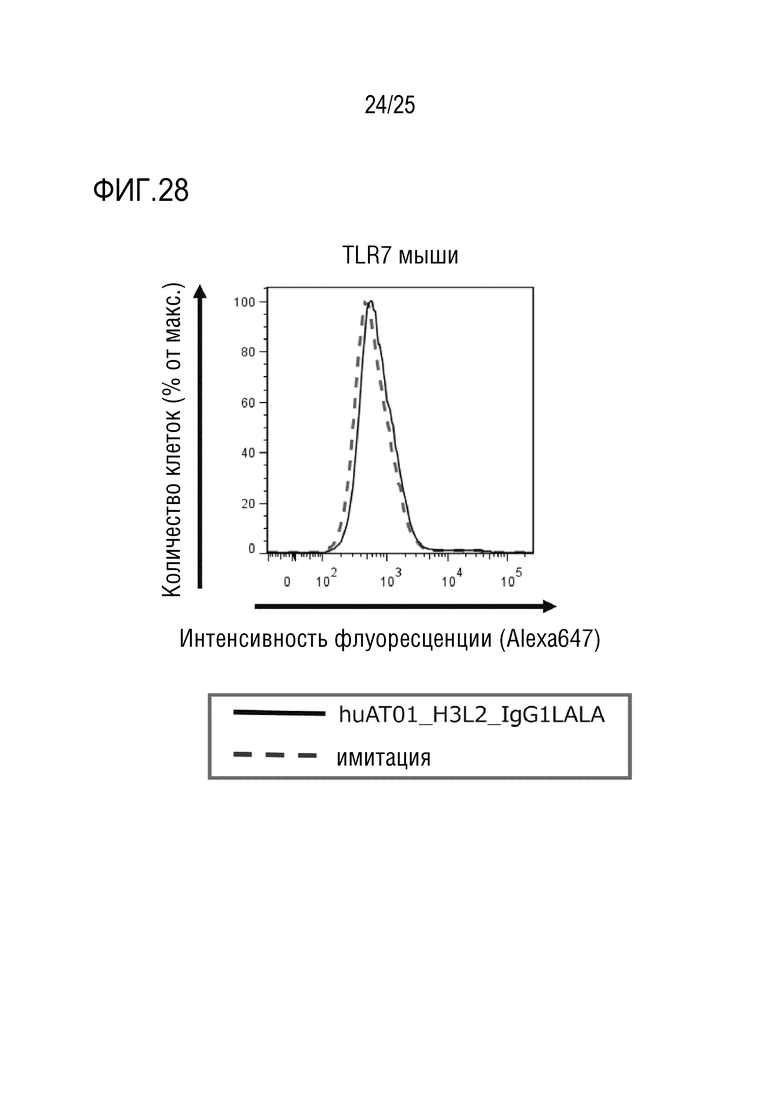
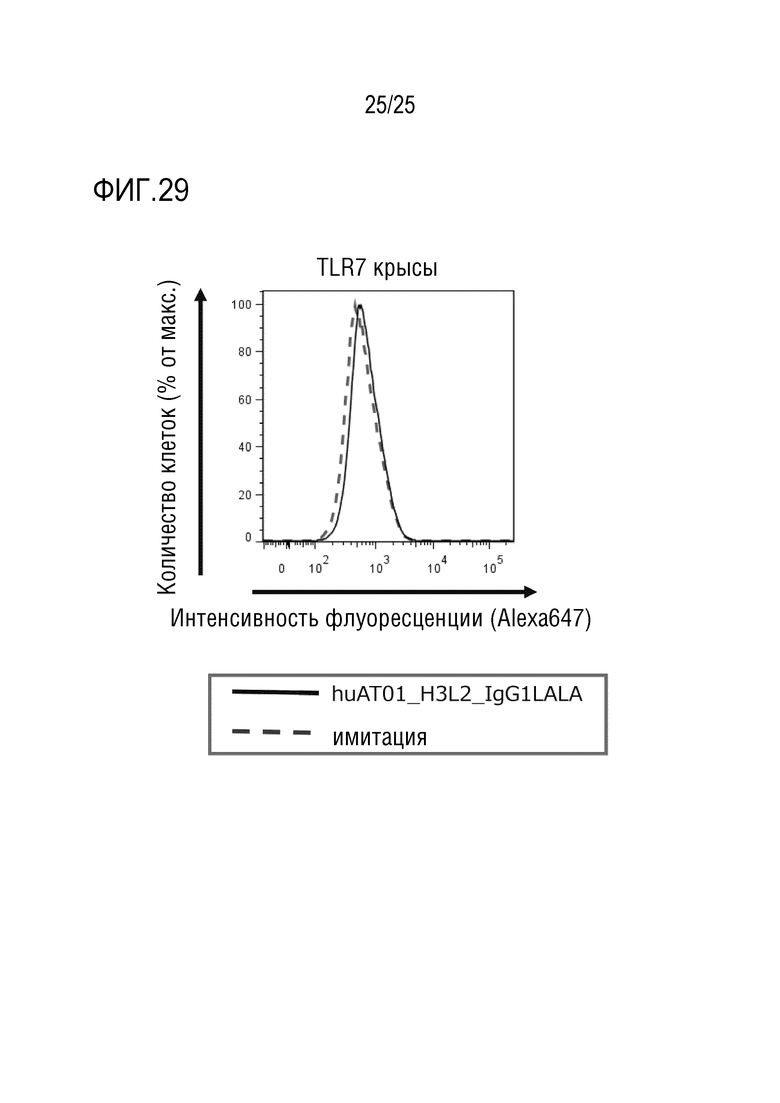
Изобретение относится к области биотехнологии. Предложены антитела или их антигенсвязывающие фрагменты, которое специфически связываются с TLR7 человека или TLR7 обезьяны и не связываются с TLR7 мыши или TLR7 крысы. Антитела ингибируют функцию TLR7 человека или TLR7 обезьяны. Также изобретение относится к полинуклеотидам, кодирующим антитела или их антигенсвязывающие фрагменты, векторам экспрессии и клеткам-хозяевам, включающим указанные полинуклеотиды, способу получения антител и их антигенсвязывающих фрагментов. Настоящее изобретение может найти дальнейшее применение в терапии связанных с иммунным воспалением заболеваний. 6 н. и 21 з.п. ф-лы, 31 ил., 8 пр.
1. Антитело или антигенсвязывающий фрагмент антитела, которое обладает следующими свойствами:
(a) специфически связывается с TLR7 человека или TLR7 обезьяны и не связывается с TLR7 мыши или TLR7 крысы;
(b) ингибирует функцию TLR7 человека или TLR7 обезьяны; и
(с) содержит:
(i) CDRH1, состоящую из аминокислотной последовательности SEQ ID NO: 17, CDRH2, состоящую из аминокислотной последовательности SEQ ID NO: 18, и CDRH3, состоящую из аминокислотной последовательности SEQ ID NO: 19, в качестве определяющих комплементарность областей в тяжелой цепи и
CDRL1, состоящую из аминокислотной последовательности SEQ ID NO: 20, CDRL2, состоящую из аминокислотной последовательности SEQ ID NO: 21, и CDRL3, состоящую из аминокислотной последовательности SEQ ID NO: 22, в качестве определяющих комплементарность областей в легкой цепи;
(ii) CDRH1, состоящую из аминокислотной последовательности SEQ ID NO: 23, CDRH2, состоящую из аминокислотной последовательности SEQ ID NO: 24, и CDRH3, состоящую из аминокислотной последовательности SEQ ID NO: 25, в качестве определяющих комплементарность областей в тяжелой цепи и
CDRL1, состоящую из аминокислотной последовательности SEQ ID NO: 26, CDRL2, состоящую из аминокислотной последовательности SEQ ID NO: 27, и CDRL3, состоящую из аминокислотной последовательности SEQ ID NO: 28, в качестве определяющих комплементарность областей в легкой цепи; или
(iii) CDRH1, состоящую из аминокислотной последовательности SEQ ID NO: 29, CDRH2, состоящую из аминокислотной последовательности SEQ ID NO: 30, и CDRH3, состоящую из аминокислотной последовательности SEQ ID NO: 31, в качестве определяющих комплементарность областей в тяжелой цепи и
CDRL1, состоящую из аминокислотной последовательности SEQ ID NO: 32, CDRL2, состоящую из аминокислотной последовательности SEQ ID NO: 33, и CDRL3, состоящую из аминокислотной последовательности SEQ ID NO: 34, в качестве определяющих комплементарность областей в легкой цепи.
2. Антитело или антигенсвязывающий фрагмент антитела по п.1, где
TLR7 человека представляет собой молекулу, состоящую из аминокислотной последовательности SEQ ID NO: 2 или SEQ ID NO: 4,
TLR7 обезьяны представляет собой молекулу, состоящую из аминокислотной последовательности SEQ ID NO: 85,
TLR7 мыши представляет собой молекулу, состоящую из аминокислотной последовательности SEQ ID NO: 83, или
TLR7 крысы представляет собой молекулу, состоящую из аминокислотной последовательности SEQ ID NO: 84.
3. Антитело или антигенсвязывающий фрагмент антитела по п.1 или 2, которое обладает конкурентной ингибирующей активностью в отношении связывания с человеческим TLR7 с:
антителом, содержащим тяжелую цепь с вариабельной областью тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 5, и легкую цепь с вариабельной областью легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 11;
антителом, содержащим тяжелую цепь с вариабельной областью тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 7, и легкую цепь с вариабельной областью легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 13; или
антителом, содержащим тяжелую цепь с вариабельной областью тяжелой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 9, и легкую цепь с вариабельной областью легкой цепи, состоящей из аминокислотной последовательности SEQ ID NO: 15.
4. Антитело или антигенсвязывающий фрагмент антитела по любому из пп.1-3, которое содержит:
CDRH1, состоящую из аминокислотной последовательности SEQ ID NO: 17, CDRH2, состоящую из аминокислотной последовательности SEQ ID NO: 18, и CDRH3, состоящую из аминокислотной последовательности SEQ ID NO: 19, в качестве определяющих комплементарность областей в тяжелой цепи и
CDRL1, состоящую из аминокислотной последовательности SEQ ID NO: 20, CDRL2, состоящую из аминокислотной последовательности SEQ ID NO: 21, и CDRL3, состоящую из аминокислотной последовательности SEQ ID NO: 22, в качестве определяющих комплементарность областей в легкой цепи.
5. Антитело или антигенсвязывающий фрагмент антитела по любому из пп.1-4, которое содержит:
(a) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 5, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 11;
(b) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 7, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 13; или
(c) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 9, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 15.
6. Антитело или антигенсвязывающий фрагмент антитела по любому из пп.1-5, где константная область представляет собой константную область человеческого происхождения.
7. Антитело или антигенсвязывающий фрагмент антитела по п.6, которое содержит:
(a) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-465 в аминокислотной последовательности SEQ ID NO: 35, и
легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO: 36;
(b) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-471 в аминокислотной последовательности SEQ ID NO: 37, и
легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO: 38; или
(c) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-470 в аминокислотной последовательности SEQ ID NO: 39, и
легкую цепь, состоящую из аминокислотной последовательности в положениях 21-234 в аминокислотной последовательности SEQ ID NO: 40.
8. Антитело или антигенсвязывающий фрагмент антитела по любому из пп.1-7, которое является гуманизированным.
9. Антитело или антигенсвязывающий фрагмент антитела по п.8, которое содержит:
(I) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, выбранной из группы, состоящей из:
(a) аминокислотной последовательности SEQ ID NO: 41;
(b) аминокислотной последовательности SEQ ID NO: 42;
(c) аминокислотной последовательности, имеющей гомологию по меньшей мере 95% или больше с последовательностью (a) или (b); и
(d) аминокислотной последовательности, полученной из последовательности (a) или (b) путем делеции, замены или добавления 1-10 аминокислот; и
вариабельную область легкой цепи, состоящую из аминокислотной последовательности, выбранной из группы, состоящей из:
(e) аминокислотной последовательности SEQ ID NO: 43;
(f) аминокислотной последовательности SEQ ID NO: 44;
(g) аминокислотной последовательности, имеющей гомологию по меньшей мере 95% или больше с последовательностью (e) или (f); и
(h) аминокислотной последовательности, полученной из последовательности (e) или (f) путем делеции, замены или добавления 1-10 аминокислот; или
(II) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, выбранной из группы, состоящей из:
(a) аминокислотной последовательности SEQ ID NO: 50;
(b) аминокислотной последовательности, имеющей гомологию по меньшей мере 95% или больше с последовательностью (a); и
(c) аминокислотной последовательности, полученной из последовательности (a) путем делеции, замены или добавления 1-10 аминокислот; и
вариабельную область легкой цепи, состоящую из аминокислотной последовательности, выбранной из группы, состоящей из:
(d) аминокислотной последовательности SEQ ID NO: 51;
(e) аминокислотной последовательности, имеющей гомологию по меньшей мере 95% или больше с последовательностью (d); и
(f) аминокислотной последовательности, полученной из последовательности (d) путем делеции, замены или добавления 1-10 аминокислот.
10. Антитело или антигенсвязывающий фрагмент антитела по п.9, которое содержит:
(a) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 41, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 43;
(b) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 41, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 44;
(c) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 42, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 43;
(d) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 42, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 44; или
(e) вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 50, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 51.
11. Антитело или антигенсвязывающий фрагмент антитела по п.10, которое содержит вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 42, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 44.
12. Антитело или антигенсвязывающий фрагмент антитела по п.10, которое содержит:
(a) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-465 в аминокислотной последовательности SEQ ID NO: 45, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO: 48;
(b) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-465 в аминокислотной последовательности SEQ ID NO: 45, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO: 49;
(c) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-465 в аминокислотной последовательности SEQ ID NO: 46, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO: 48;
(d) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-465 в аминокислотной последовательности SEQ ID NO: 46, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO: 49;
(e) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-462 в аминокислотной последовательности SEQ ID NO: 47, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO: 48;
(f) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-462 в аминокислотной последовательности SEQ ID NO: 47, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO: 49;
(g) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-471 в аминокислотной последовательности SEQ ID NO: 52, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO: 53; или
(h) тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-468 в аминокислотной последовательности SEQ ID NO: 54, и легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO: 53.
13. Антитело или антигенсвязывающий фрагмент антитела по п.12, которое содержит
тяжелую цепь, состоящую из аминокислотной последовательности в положениях 20-465 в аминокислотной последовательности SEQ ID NO: 46, и
легкую цепь, состоящую из аминокислотной последовательности в положениях 21-233 в аминокислотной последовательности SEQ ID NO: 49.
14. Антитело или антигенсвязывающий фрагмент антитела по любому из пп.1-13, где антигенсвязывающий фрагмент антитела выбран из группы, состоящей из Fab, F(ab)2, Fab' и Fv.
15. Полинуклеотид, включающий полинуклеотидную последовательность, кодирующую антитело или антигенсвязывающий фрагмент антитела по любому из пп.1-14.
16. Полинуклеотид по п.15, содержащий:
(1) полинуклеотидную последовательность, кодирующую CDRH1, состоящую из аминокислотной последовательности SEQ ID NO: 17,
полинуклеотидную последовательность, кодирующую CDRH2, состоящую из аминокислотной последовательности SEQ ID NO: 18, и
полинуклеотидную последовательность, кодирующую CDRH3, состоящую из аминокислотной последовательности SEQ ID NO: 19, и
полинуклеотидную последовательность, кодирующую CDRL1, состоящую из аминокислотной последовательности SEQ ID NO: 20,
полинуклеотидную последовательность, кодирующую CDRL2, состоящую из аминокислотной последовательности SEQ ID NO: 21, и
полинуклеотидную последовательность, кодирующую CDRL3, состоящую из аминокислотной последовательности SEQ ID NO: 22;
(2) полинуклеотидную последовательность, кодирующую CDRH1, состоящую из аминокислотной последовательности SEQ ID NO: 23,
полинуклеотидную последовательность, кодирующую CDRH2, состоящую из аминокислотной последовательности SEQ ID NO: 24, и
полинуклеотидную последовательность, кодирующую CDRH3, состоящую из аминокислотной последовательности SEQ ID NO: 25, и
полинуклеотидную последовательность, кодирующую CDRL1, состоящую из аминокислотной последовательности SEQ ID NO: 26,
полинуклеотидную последовательность, кодирующую CDRL2, состоящую из аминокислотной последовательности SEQ ID NO: 27, и
полинуклеотидную последовательность, кодирующую CDRL3, состоящую из аминокислотной последовательности SEQ ID NO: 28; или
(3) полинуклеотидную последовательность, кодирующую CDRH1, состоящую из аминокислотной последовательности SEQ ID NO: 29,
полинуклеотидную последовательность, кодирующую CDRH2, состоящую из аминокислотной последовательности SEQ ID NO: 30, и
полинуклеотидную последовательность, кодирующую CDRH3, состоящую из аминокислотной последовательности SEQ ID NO: 31, и
полинуклеотидную последовательность, кодирующую CDRL1, состоящую из аминокислотной последовательности SEQ ID NO: 32,
полинуклеотидную последовательность, кодирующую CDRL2, состоящую из аминокислотной последовательности SEQ ID NO: 33, и
полинуклеотидную последовательность, кодирующую CDRL3, состоящую из аминокислотной последовательности SEQ ID NO: 34.
17. Полинуклеотид по п.16, содержащий:
(I) полинуклеотидную последовательность, выбранную из группы, состоящей из:
(a) полинуклеотидной последовательности, кодирующей вариабельную область тяжелой цепи, представленной в SEQ ID NO: 77;
(b) полинуклеотидной последовательности, кодирующей вариабельную область тяжелой цепи, представленной в SEQ ID NO: 78; и
(c) полинуклеотидной последовательности полинуклеотида, который гибридизуется с полинуклеотидом, состоящим из полинуклеотидной последовательности, комплементарной полинуклеотидной последовательности (a) или (b), в жестких условиях; и
полинуклеотидную последовательность, выбранную из группы, состоящей из:
(d) полинуклеотидной последовательности, кодирующей вариабельную область легкой цепи, представленной в SEQ ID NO: 79;
(e) полинуклеотидной последовательности, кодирующей вариабельную область легкой цепи, представленной в SEQ ID NO: 80; и
(f) полинуклеотидной последовательности полинуклеотида, который гибридизуется с полинуклеотидом, состоящим из полинуклеотидной последовательности, комплементарной полинуклеотидной последовательности (d) или (e), в жестких условиях; или
(II) полинуклеотидную последовательность, выбранную из группы, состоящей из:
(a) полинуклеотидной последовательности, кодирующей вариабельную область тяжелой цепи, представленной в SEQ ID NO: 81; и
(b) полинуклеотидной последовательности полинуклеотида, который гибридизуется с полинуклеотидом, состоящим из полинуклеотидной последовательности, комплементарной полинуклеотидной последовательности (a), в жестких условиях; и
полинуклеотидную последовательность, выбранную из группы, состоящей из:
(c) полинуклеотидной последовательности, кодирующей вариабельную область легкой цепи, представленной в SEQ ID NO: 82; и
(d) полинуклеотидной последовательности полинуклеотида, который гибридизуется с полинуклеотидом, состоящим из полинуклеотидной последовательности, комплементарной полинуклеотидной последовательности (c), в жестких условиях.
18. Полинуклеотид по п.17, содержащий:
(a) полинуклеотидную последовательность, кодирующую вариабельную область тяжелой цепи, представленную в SEQ ID NO: 77, и полинуклеотидную последовательность, кодирующую вариабельную область легкой цепи, представленную в SEQ ID NO: 79;
(b) полинуклеотидную последовательность, кодирующую вариабельную область тяжелой цепи, представленную в SEQ ID NO: 77, и полинуклеотидную последовательность, кодирующую вариабельную область легкой цепи, представленную в SEQ ID NO: 80;
(c) полинуклеотидную последовательность, кодирующую вариабельную область тяжелой цепи, представленную в SEQ ID NO: 78, и полинуклеотидную последовательность, кодирующую вариабельную область легкой цепи, представленную в SEQ ID NO: 79;
(d) полинуклеотидную последовательность, кодирующую вариабельную область тяжелой цепи, представленную в SEQ ID NO: 78, и полинуклеотидную последовательность, кодирующую вариабельную область легкой цепи, представленную в SEQ ID NO: 80; или
(e) полинуклеотидную последовательность, кодирующую вариабельную область тяжелой цепи, представленную в SEQ ID NO: 81, и полинуклеотидную последовательность, кодирующую вариабельную область легкой цепи, представленную в SEQ ID NO: 82.
19. Вектор экспрессии, включающий полинуклеотид по любому из пп.15-18.
20. Клетка-хозяин для получения антитела или антигенсвязывающий фрагмент антитела по любому из пп.1-14, где клетка трансформирована вектором экспрессии по п.19.
21. Клетка-хозяин по п.20, где клетка-хозяин представляет собой эукариотическую клетку.
22. Способ для получения антитела или антигенсвязывающего фрагмента антитела по любому из пп.1-14, включающий следующие стадии:
культивирование клетки-хозяина по п.20 или 21; и
сбор антитела или фрагмента, представляющего интерес, из культуры, полученной на стадии, описанной выше.
23. Антитело или антигенсвязывающий фрагмент антитела, полученные способом получения по п.22, где антитело или антигенсвязывающий фрагмент антитела обладает следующими свойствами:
(a) специфически связывается с TLR7 человека или TLR7 обезьяны и не связывается с TLR7 мыши или TLR7 крысы;
(b) ингибирует функцию TLR7 человека или TLR7 обезьяны.
24. Антитело по любому из пп.1-13, содержащее одну или несколько модификаций, выбранных из группы, состоящей из гликозилирования до N-связи, гликозилирования до O-связи, N-концевого процессинга, C-концевого процессинга, дезамидирования, изомеризации аспарагиновой кислоты, окисления метионина, добавления метионинового остатка к N-концу, амидирования пролинового остатка и делеции одной или двух аминокислот на карбоксиконце тяжелой цепи.
25. Антитело по п.24, содержащее две тяжелые цепи, состоящие из одного вида или комбинации любых двух видов тяжелых цепей, выбранных из группы, состоящей из полноразмерных и делеционных вариантов с делецией одной или двух аминокислот на карбоксиконце.
26. Антитело по п.25, где одна аминокислота делетирована на карбоксиконце в каждой из двух тяжелых цепей.
27. Антитело по любому из пп.24-26, где пролиновый остаток на карбоксиконце тяжелой цепи дополнительно амидирован.
| WO 2014174704 A1, 30.10.2014 | |||
| WO 2016201300 A1, 15.12.2016 | |||
| YAN-WEI WU et al., Toll-like receptors: potential targets for lupus treatment, ACTA PHARMACOLOGICA SINICA, 2015, vol | |||
| Коридорная многокамерная вагонеточная углевыжигательная печь | 1921 |
|
SU36A1 |
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| HONGCHENG LIU et al., In vitro and in vivo modifications of recombinant and human IgG antibodies, mAbs, 2014, Volume 6, Issue 5, pp.1145-1154 | |||
Авторы
Даты
2023-11-23—Публикация
2019-05-30—Подача