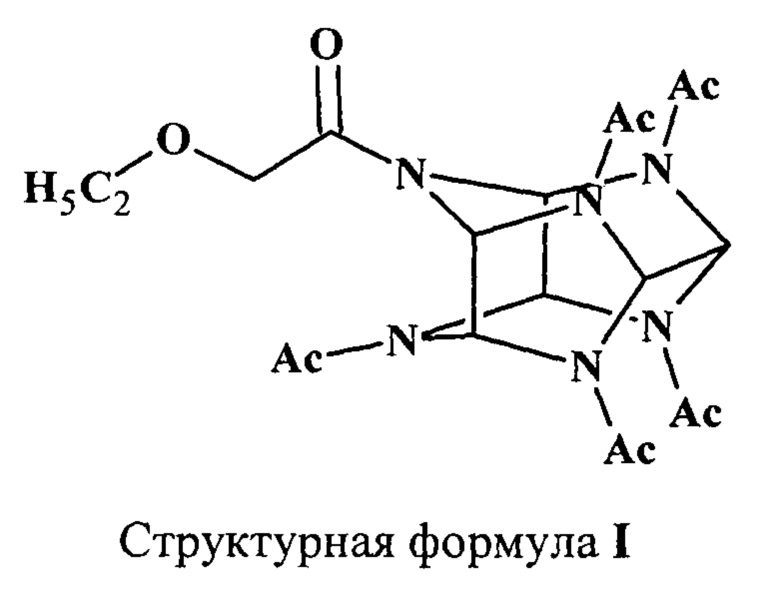
Изобретение относится к фармацевтической химии и фармакологии, а именно к новому химическому веществу - 4-(2-этоксиацетил)-2,6,8,10,12-пентаацетил-2,4,6,8,10,12-гексаазатетрацикло[5,5,0,03,11,05,9] додекану (I), обладающему анальгетической активностью:
Болевые синдромы занимают ведущее место среди самых частых проблем, с которыми сталкивается практически каждый человек. Независимо от типа, локализации боли, острая она или хроническая, для каждого наиболее простым и доступным, а, соответственно, и самым распространенным способом борьбы с нею является использование анальгетиков. Существующие в настоящее время анальгетики делят на две основные группы - наркотические (опиоидные) и ненаркотические [Табеева Г.Р. Непростые простые анальгетики, или о чем надо помнить при выборе анальгетика // Русский Медицинский Журнал. 2013, 21 (10): 470-475; Kristensen D.M. et al., 2016; Hider-Mlynarz К. et al., 2018]. По данным научной литературы более чем за 140 лет в мире синтезированы сотни субстанций ненаркотических анальгетиков и нестероидных противовоспалительных средств (НПВС). Существуют препараты с высокой селективностью ингибирования ЦОГ-2 для длительного приема у больных с хроническим болевым синдромом [Каратеев А.Е. Целекоксиб, эторикоксиб, мелоксикам и нимесулид: сравнение достоинств и недостатков // Современная ревматология. 2011. №2. С. 9-19; Колоколов О.В., Ситкали И.В., Колоколова A.M. Ноцицептивная боль в практике невролога: алгоритмы диагностики, адекватность и безопасность терапии // Русский Медицинский Журнал. 2015. Т. 23. №12. С. 664-667]. Известны и применяются в настоящее время НПВС с выраженным анальгезирующим действием - лорноксикам и кеторолак [Максимов М.Л. Лорноксикам: современный анальгетик в лечении хронического болевого синдрома // Русский Медицинский Журнал. 2015. Т. 23., №7., С. 399-403]. Анальгезирующим эффектом обладает ряд препаратов, относящихся к таким фармакологическим группам, как кортикостероиды и спазмолитические средства. Часть из них в связи с тяжелыми побочными эффектами (гастродуоденопатия, нефротоксичность, кардиоваскулярные эффекты, гепатотоксичность, тератогенность, гематотоксичность) и недостаточной эффективностью во многих странах запрещено производить и применять Несмотря на прогресс медицины и фармакологии, до сих пор не найдено адекватной замены опиоидным анальгетикам, которые на протяжении длительного времени продолжают оставаться основой фармакотерапии сильных болевых синдромов [Симурзина О.Н. Обезболивающие средства: помощь или вред // Russian Agricultural Science Review. 2015. Т. 7. №7. С.91-103; Кауе A.D., Cornett Е. М., Patil S. S., Gennuso S. A. et al. New opioid receptor modulators and agonists // Best Practice & Research Clinical Anaesthesiology, 2018. V. 32(2). P. 125-136; Shiels M.S., Chernyavskiy P., Anderson W.F. et al. Trends in premature mortality in the USA by sex, race, and ethnicity from 1999 to 2014: an analysis of death certificate data // The Lancet. 2017. V. 389. № 10073. P. 1043-1054; Smith H. Opioid metabolism // Mayo Clinic Proceedings. 2009. V. 84. №7. P. 613-624; Черняков A.B. Проблема боли и обезболивания в амбулаторной хирургии // Русский Медицинский Журнал. 2016, 2 (14); 927-931; Cawich S.O., Deonarine U., Harding H.E., Dan D., Naraynsingh V., Cannabis and Postoperative Analgesia. Handbook of Cannabis and Related Pathologies. Biology, Pharmacology, Diagnosis, and Treatment. 2017, 450-458]. Однако выраженный эйфорический эффект, присущий опиатам, стал причиной злоупотребления ими и жесткого контроля за оборотом и производством со стороны правоохранительных органов [Палехов А.В., Введенская Е.С.Тактика выбора и применения опиоидных анальгетиков для купирования хронической боли // Паллиативная медицина и реабилитация. 2018, (3): 18-24]. Недостатками НПВС по-прежнему остаются побочные нежелательные эффекты и их фармакологическая активность на уровне периферии нервной системы [Машковский М.Д. Лекарственные средства: 15-е изд. М.: ОО «Издательство Новая Волна». 2008, 1206; Михайлова А.С. Анальгетический арсенал клинициста. Фарматека. 2018, (3): 50-56]. Актуальной задачей в процессе выбора наиболее перспективных соединений для разработки в РФ препаратов-анальгетиков наибольший практический интерес представляют сильнодействующие ненаркотические анальгетики, влияющие на центральную и периферическую системы передачи нервного импульса у человека [А.И. Головко, А.Г. Софронов, Г.А. Софронов «Новые» запрещенные каннабиноиды. Нейрохимия и нейробиология / А.И. Головко, А.Г. Софронов, Г.А. Софронов // Наркология. 2010. Т. 9. №7 (103). С. 68-83.;Соснов А.В., Садовников С.В., Семченко Ф.М., Руфанов К.А., Тохмахчи В.Н., Соснова А.А., Тюрин И.А. Сильнодействующие ненаркотические анальгетики как направление развития фармацевтики. Разработка и регистрация лекарственных средств. 2016, 14 (1): 196-206; Колесников Ю.А., Беспалов А.Ю., Драволина О.А., Звартау Э.Э. Фармакология мю-опиоидов: пути развития: СПб: РИД ПСПбГМУ, 2021, 208 с.].
Одним из наиболее часто используемых и наиболее близким по техническому результату к предлагаемому соединению I является трамадол - анальгетик смешанного механизма действия, включающего в себя опиоидный и неопиоидный компоненты аналгезии, который выбран в качестве препарата сравнения [Машковский М.Д. Лекарственные средства: 15-е изд. М.: ОО «Издательство Новая Волна». 2008, 1206; Михайлова А.С. Анальгетический арсенал клинициста. Фарматека. 2018, (3): 50-56].
Нами впервые выявлена выраженная анальгетическая активность I, относящегося к нетоксичным средствам.
Задачей изобретения является расширение арсенала безопасных анальгетических средств.
Поставленная задача достигается применением впервые синтезированного соединения I в качестве анальгетического средства. Техническим результатом предлагаемого изобретения является вещество, способ его получения и выявление анальгетического действия нового нетоксичного вещества.
Предлагаемое в качестве изобретения анальгетическое средство 4-(3,4-дибромтиофенилкарбонил)-2,6,8,10,12-пентаацетил-2,4,6,8,10,12гексаазаизовюрцитан впервые синтезировано в Институте проблем химико-энергетических технологий (г. Бийск).
В НИИ фармакологии и регенеративной медицины имени Е.Д. Гольдберга Томского НИМЦ (г. Томск) в результате экспериментальных исследований выявлена выраженная анальгетическая активность данного вещества.
Выявленное свойство, предлагаемого в качестве изобретения соединения I, явным образом не вытекает из уровня техники в данной области и неочевидно для специалиста.
Предлагаемое изобретение может быть использовано в медицине. Идентичной совокупности признаков не обнаружено при исследовании уровня техники по патентной и научно-медицинской литературе [Толстикова Т.Г., Морозова Е.А., Сысолятин С.В., Калашников А.И., Жукова Ю.И., Сурмачев В.Н. Синтез и биологическая активность производных 2,4,6,8,10,12-гексаазатетрацикло[5,5,0,03,11,05,9]додекана. Химия в интересах устойчивого развития. 2010, 18: 511-516; Sergey V. Sysolyatin, Alexander I. Kalashnikov, Valeriy V. Malykhin, Irina A. Surmacheva, Gennady V. Sakovich. Reductive Debenzelation of 2,4,6,8,10,12 - Hexaazaisowurtzitane/ International Journal of Energetic Materials and Chemical Propulsion.2010, 9 (4): 365; Крылова С.Г., Лопатина K.A., Нестерова Ю.В., Поветьева Т.Н., Кульпин П.В., Афанасьева О.Г., Кулагина Д.А., Сафонова Е.А., Зуева Е.П., Суслов Н.И., Сысолятин С.В. Некоторые аспекты исследования центрального механизма антиноцицептивного действия нового анальгетика из класса гексаазаизовюрцитанов // Бюллетень экспериментальной биологии и медицины. 2020 (12): 739-746; Kulagina, D.A., Sysolyatin, S.V., Kalashnikov, A.I. et al. Synthesis and Analgesic Activity of 4,10-Bis((±)-5-Benzoyl-2,3-Dihydro-1hpyrrolo[1,2-a]Pyrrole-l-Carbonyl)-2,6,8,12-Tetraacetyl-2,4,6,8,10,12-Hexaazatetracyclo[5,5,03,11,05,9]Dodecane. Pharm. Chem. J. 54, 1140-1144 (2021); Tomilova, E., Kurgachev, D., Kulagina, D.. Sergey Sysolyatin, S., Krylova, S., Novikov, D. Development of HPLC-Method for Simultaneous Determination of API and Related Components in Thiowurtzine: A New Non-Narcotic Analgesic. Chromatographia 84, 147-154 (2021)].
Возможность осуществления заявляемого изобретения подтверждается примером конкретного выполнения способа получения заявленного средства.
Пример 1
Получение 4-(2-этоксиацетил)-2,6,8,10,12-пентаацетил-2,4,6,8,10,12-гексаазатет-рацикло[5,5,0,03,11,05,9]додекана (I) 26,03 г (0,068 моль) 2,6,8,10,12-пентаацетил-2,4,6,8,10,12-гексаазатетрацикло[5,5,0,03,11,05,9]додекана растворяют в 300 мл сухого ацетонитрила. При перемешивании добавляют 12,49 г (0,102 моль) хлорангидрида этоксиуксусной кислоты. Раствор кипятят при перемешивании в течение 5 часов, фильтруют и охлаждают.
Ацетонитрил отогняют под вакуумом, осадок растворяют в 63,9 мл метанола при перемешивании и нагревании. Масса технического продукта 25,95 г (81,2% от теоретического). Полученный продукт перекристаллизовывают из смеси 156 мл метанола и 104 мл гексана. Масса очищенного вещества 19,1 г (73,6% от теоретического) в виде бесцветных кристаллов с содержанием основного вещества (ВЭЖХ) 99,01% и температурой плавления 148,0-150,0°С.
C22H32N6O8 Найдено (%): С 51,72; Н 6,31; N 18,09. Вычислено (%): С 51,79; Н 6,11; N 18,13; О 24,11.
ИК-спектр, ν/см-1: 3501, 3040, 2982, 2934, 1677, 1412, 1362, 1287, 1169, 1041, 979, 952, 790, 718.
Спектр ЯМР 1Н (ДМСО-d6, δ, м.д.): 1.13-1.15 (т, 3Н, СН3), 1.94-2.06 (м, 12Н, СН3СО), 2.31-2.50 (с, 3Н, СН3СО), 3.45-3.47 (кв, 2Н, СН2), 4.23-4.27 (кв, 2Н, СН2), 4.23-4.60 (м, 2Н, СН), 6.57-6.91 (м, 4Н, СН).
Спектр ЯМР 13С (ДМСО-d6, δ, м.д.): 15.39 (С, СН3, EtO), 21.20, 22.47 (С, СН3, СН3СО); 62.43, 64.07, 65.83, 67.12, 69.62, 73.89 (С, СН), 66.50, 68.42 (С, СН2), 167.65, 167.70, 167.72, 167.76, 167.81, 167.87 (С, СО, СН3СО).
Возможность осуществления заявляемого изобретения подтверждается примером конкретного выполнения исследования анальгетической активности I, в сравнении с референс-препаратом трамадолом, доказывающего, что выявленные признаки решают поставленную задачу.
Пример 2
Эксперименты были выполнены на 254 аутбредных мышах CD1 обоих полов, (7-8 недель, масса 22-27 г) первой категории конвенциональных, полученных из отдела экспериментального биомоделирования НИИФиРМ им. Е.Д. Гольдберга Томского НИМЦ (сертификат здоровья животных). Содержание животных и дизайн экспериментов были одобрены комиссией по биоэтике НИИФиРМ им. Е.Д. Гольдберга (протокол JACUC №192112021) и соответствовали директиве 2010/63/EU Европейского парламента и Совета Европейского союза по охране животных, используемых в научных целях; ГОСТ 33044-2014 «Принципы надлежащей лабораторной практики», 01.08.2015. Эвтаназию животных осуществляли в СО2-камере.
Каждому животному внутри группы присваивали индивидуальный номер от 1 до 12, помечаемый с помощью меток фукорцином. Мышей распределяли на группы рандомизированно, используя в качестве критерия массу тела, так, чтобы индивидуальное значение массы не отклонялось от среднего значения в пределах одного пола более чем на ±10%. Данные (вес и номер) отобранных животных ранжировали в порядке убывания веса, используя для этого компьютерную программу Excel, имеющую команду SORT.
Статистическая обработка полученных результатов проведена с использованием программного обеспечения Statistica 10.0. Для всех данных рассчитаны: среднее значение (X) и стандартное отклонение (m), которые вместе со значением количества вариант (n) представлены в итоговых таблицах. Используя выборочные коэффициенты асимметрии и эксцесса, оценивали степень приближения закона распределения исследуемого признака к нормальному. При отклонениях распределений признака от нормального вида для независимых выборок использовали непараметрический критерий Краскела - Уоллиса и Вилкоксона - Манна - Уитни, для сравнения частот использовали критерий углового преобразования Фишера. Различие сравниваемых величин считали достоверным в том случае, если вероятность их тождества была меньше 5% (Р<0,05) [Руководство по проведению доклинических исследований лекарственных средств. Под ред. Миронова А.Н., Бунатян Н.Д. и др. М., ЗАО «Гриф и К». 2012].
Определение острой токсичности 4-(2-этоксиацетил)-2,6,8,10,12-пентаацетил-2,4,6,8,10,12-гексаазатетрацикло [5,5,0,03,11,05,9]додекана
Эксперименты выполнены на аутбредных мышах CD1 обоих полов (n=12). Выживаемость животных после однократного внутрижелудочного введения через атравматичный зонд соединения I в дозе 5000 мг/кг в объеме 0,5 мл воды очищенной / 20 г мышь представлена в таблице 1. При оценке характера экскреции, состояния шерсти, состояния кожных покровов, слизистых оболочек, аппетита, дыхания, подвижности, походки и других показателей при осмотре экспериментальных животных не было выявлено признаков отклонения от здоровья в течение 14 суток наблюдения.

Масса тела экспериментальных животных является одним из важных показателей ветеринарного мониторинга в длительно продолжающемся эксперименте, поскольку может свидетельствовать об общем неблагоприятном воздействии тестируемого вещества на метаболизм, а в сочетании с данными токсикологического исследования - о проявлении побочных и нежелательных эффектов. Анализ показателей массы тела животных свидетельствует об отсутствии негативного влияния исследуемого вещества на метаболизм подопытных животных после 14-суточного наблюдения (таблица 2).
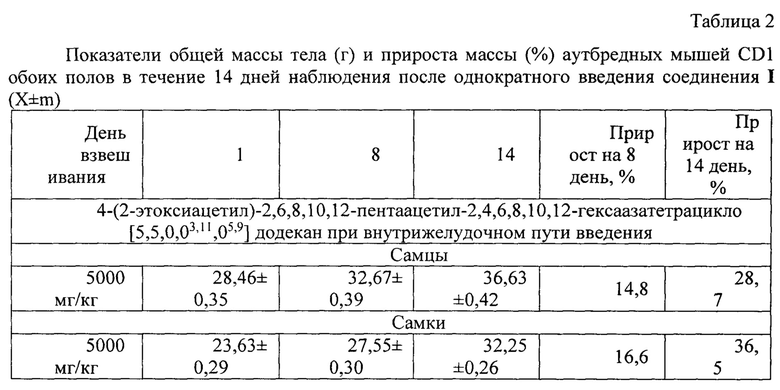
Поскольку ЛД50 находилась за пределами максимальной введенной дозы вещества, то произвести ее расчет не представилось возможным ввиду отсутствия летальности у животных. Согласно результатам исследования острой токсичности, проведенного на мышах обоих полов, соединение I можно отнести к нетоксичным веществам (ЛД50>5000 мг/кг), ГОСТ 12.1.007-76.
Влияние 4-(2-этоксиацетил)-2,6,8,10,12-пентаацетил-2,4,6,8,10,12-гексаазатетрацикло[5,5,0,03,11,05,9]додекана на развитие висцеральной боли - тест «уксусные корчи»
Тест «уксусные корчи» (Abdominal constriction test) позволяет воспроизводить у лабораторных животных острую висцеральную и соматически глубокую боль, характеризующуюся ноющими, разлитыми и схваткообразными ощущениями, соответствующими клинической ситуации перитонита [Руководство по проведению доклинических исследований лекарственных средств. Под ред. Миронова А.Н., Бунатян Н.Д. и др. М., ЗАО «Гриф и К». 2012; Barrot М. Tests and models of nociception and pain in rodents. Neuroscience. 2012, 211: 39-50]. Специфическую болевую реакцию - «корчи» (характерные движения животных, включающие сокращения брюшных мышц, чередующиеся с их расслаблением, вытягиванием задних конечностей и прогибанием спины) - вызывали внутрибрюшинным введением 0,75% раствора уксусной кислоты (ГОСТ 61-75) мышам в дозе 0,1 мл/10 г массы тела. Анальгезирующий эффект оценивали по способности потенциального лекарственного средства (в течение 15 мин после инъекции) уменьшать (в %) количество «корчей» по сравнению с контрольной группой животных (критерий эффективности - снижение болевой реакции не менее чем на 50%) и латентному времени наступления болевой реакции. Для исследования анальгетического действия соединения I на модели химического раздражения брюшины использовали 60 аутбредных мышей-самцов CD1.
Количество уксусных «корчей» (22,5±2,8) и латентное время их наступления (218±9 сек) указывают на развитие острой висцеральной боли у мышей группы контроля после введения химического раздражителя (таблица 3). Судя по снижению количества «корчей» в 2,0 раза (Р<0,01) и повышению латентного времени развития болевой реакции в 1,4 раза (Р<0,01), трамадол после 3 сут применения оказывал выраженное анальгетическое действие, угнетение болевой реакции при этом составило 50,7%.
Анализ результатов, полученных при использовании исследуемого вещества в диапазоне доз 25-200 мг/кг, показал, что соединение I проявляет «куполообразный» дозозависимый эффект с максимальным значением в дозе 50 мг/кг (74,7%).
У животных, получавших минимальную дозу 25 мг/кг, отмечалось статистически значимое снижение количества «корчей» в 1,7 раза относительно соответствующего значения контроля, что обеспечивало угнетение болевой реакции на 40,9% (таблица 3). Введение соединения I в дозе 50 мг/кг приводило к повышению латентного времени в 1,8 раза (Р<0,01) и снижению количества «корчей» в 3,9 раза (Р<0,01) в сравнении с соответствующими значениями контроля (таблица 3). Следует отметить, что соединение I в этой дозе статистически значимо превышало эффект трамадола, снижая количество «корчей» в 1,9 раза. Дальнейшее увеличение дозы соединения I до 100 мг/кг приводило к незначительному снижению выраженности эффекта: угнетение болевой реакции составило 64%, при этом количество «корчей» уменьшилось в 2,8 раза (Р<0,01), а латентное время развития болевого ответа повысилось в 1,8 раза (Р<0,01) относительно соответствующих показателей в группе нелеченых мышей. Применение I в дозе 200 мг/кг оказывало статистически значимый анальгетический эффект (60%) за счет уменьшения количества «корчей» в 2,5 раза (Р<0,01) и удлинения времени развития болевой реакции в 2,4 раза (Р<0,01).
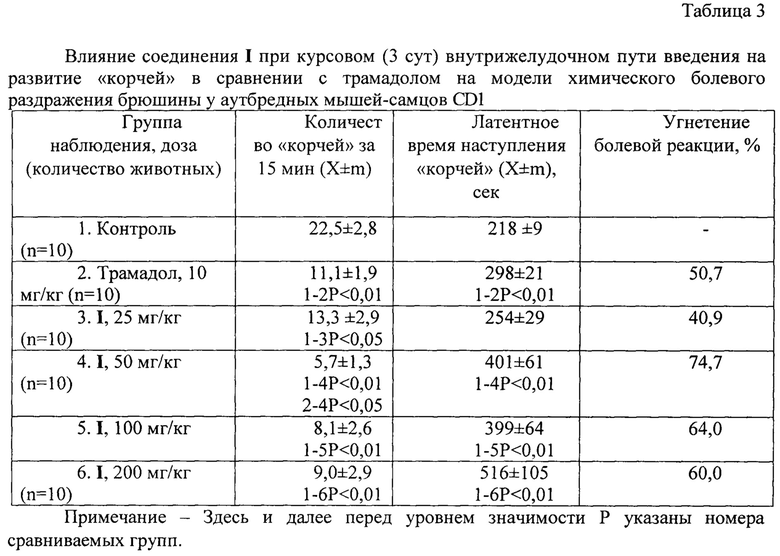
Таким образом, показано, что впервые синтезированное вещество 4-(2-этоксиацетил)-2,6,8,10,12-пентаацетил-2,4,6,8,10,12-гексаазатетрацикло[5,5,0,03,11,05,9]додекан при курсовом внутрижелудочном введении в тесте «уксусные корчи» оказывает выраженное дозозависимое анальгетическое действие, превышающее в дозе 50 мг/кг эффект трамадола, в пользу чего свидетельствует значение угнетения болевой реакции (74,7,6% против 50,7% анальгетика).
Влияние 4-(2-этоксиацетил)-2,6,8,10,12-пентаацетил-2,4,6,8,10,12-гексаазатетрацикло [5,5,0,03,11,05,9]додекана на термическую соматическую боль в тесте «горячая пластина» (hot plate)
Дальнейшее доказательство анальгетической активности соединения I проводили при его однократном введении на модели термической соматической боли «горячая пластина», отличающейся по характеру воздействия и типу ответной реакции. Поведенческие реакции, регистрируемые в тесте «горячая пластина», характеризуются самой сложной организацией рефлекса с вовлечением корковых и подкорковых структур головного мозга. Данная экспериментальная модель позволяет не только оценить обезболивающее действие вещества, но и определить уровень вмешательства в нейромедиаторные процессы центральной нервной системы. В исследованиях для быстрой и эффективной проверки уровня обезболивания на мелких лабораторных животных использовали HOTPLATE ANALGESIA METER (Columbus Instruments, USA). Мышей помещали на пластину, нагретую до 54,00±0,5°С. Эта температура создает ощущение дискомфорта, не вызывая серьезных повреждений. К конечным точкам данного эксперимента относятся: облизывание задних лап (голова обращена в сторону задней лапы, и вентральная поверхность под углом направлена вверх). При этом остальные поведенческие реакции игнорируют. Если животное не проявляет активности в течение 30-секундного интервала, то его убирают с горячей поверхности, а за латентное время подпрыгивания принимали 30 сек. При обработке полученных результатов рассчитывали величину максимально возможного эффекта (МВЭ). % МВЭ=ЛП0 - ЛПК/(30 - ЛПк)×100, где ЛП0 - латентный период ноцицептивной реакции в опытной группе; ЛПк - латентный период ноцицептивной реакции в контрольной группе; 30 с - максимальное время экспозиции для мышей. Одним из критериев, характеризующих анальгетическую активность исследуемого вещества, является количество животных с максимальным проявлением обезболивающего эффекта - экспозицией в течение 30 сек на горячей пластине прибора.
Исследование антиноцицептивного действия соединения I и трамадола проводили на 60 аутбредных мышах-самцах CD1 через 1 и 2 ч после однократного внутрижелудочного введения.
Референс-препарат трамадол проявлял низкую эффективность через 1 ч после введения: время развития болевой реакции и количество мышей с 30-секундной экспозицией не отличались от таковых в контрольной группе животных, при этом расчетная величина МВЭ составила 32,6% (таблица 4). Анальгетическое действие опиоидного анальгетика реализовалось через 2 ч после его введения: отмечалось увеличение латентного времени.
Через 1 ч после внутрижелудочного введения I обезболивающий эффект выявлен лишь при использовании исследуемого вещества в дозе 25 мг/кг, судя по статистически значимому повышению латентного времени развития болевой реакции и увеличению количества мышей с отсутствием боли до 50% (Р<0,01) в сравнении с соответствующими значениями контроля. Значение МВЭ в этой группе было максимальным и составило 58,1%. В этот срок наблюдения следует отметить увеличений числа мышей с 30-секундной экспозицией до 40% в группе животных, получавших I в дозе 200 мг/кг, против 10% в контроле (таблица 4).
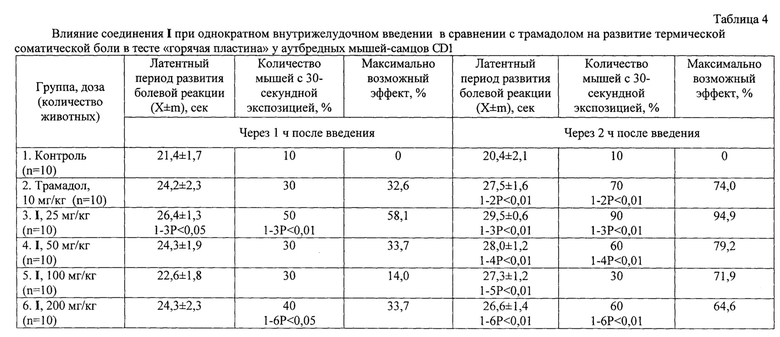
Через 2 ч наблюдения I продемонстрировало выраженное антиноцицептивное действие во всех дозах, сравнимое с активностью трамадола, причем максимальная активность вещества выявлена при введении в дозе 25 мг/кг: латентное время развития болевого ответа превысило таковое значение в контроле в 1,4 раза (Р<0,01), а количество мышей с 30-секундной экспозицией выросло до 90% (Р<0,01) против 10% в группе нелеченых животных (таблица 4).
После применения вещества в дозах 50, 100 и 200 мг/кг отмечалась дозозависимое линейное снижение обезболивающего эффекта I: латентное время развития болевой реакции превышало в 1,4 (Р<0,01), в 1,3 (Р<0,01) и в 1,3 раза (Р<0,01) соответственно значение контроля. Следует отметить статистически значимое повышение количества мышей с 30-секундной экспозицией в группах с введением I в дозах 50 (60%) и 200 мг/кг (60%), сравнимое с соответствующим значением трамадола (70%). Значение МВЭ уменьшались от 94,9% (25 мг/кг) до 79,2% (50 мг/кг), 71,9% (100 мг/кг) и 64,6% (200 мг/кг).
Таким образом, высокая эффективность 4-(2-этоксиацетил)-2,6,8,10,12-пентаацетил-2,4,6,8,10,12 гексаазатетрацикло[5,5,0,03,11,05,9]додекана, выявленная при курсовом внутрижелудочном введении на модели «уксусные корчи», подтверждена при однократном введении в тесте «горячая пластина» с другим механизмом ноцицепции. Анальгетическая активность I превосходила эффект трамадола по всем исследуемым показателям через 1 ч после введения, при этом была сопоставима с его действием через 2 ч наблюдения.
Влияние 4-(2-этоксиацетил)-2,6,8,10,12-пентаацетил-2,4,6,8,10,12 гексаазатет-рацикло [5,5,0,03,11,05,9]додекана при внутрижелудочном пути введения однократно и курсом на развитие соматической боли при механической компрессии здоровой лапы в тесте по Рэндалл-Селитто
Тест «Механической компрессии лапы» по Рэндалл-Селитто позволяет выявить антиноцицептивное действие потенциального анальгетика на супраспинальном и периферическом уровне организации болевой чувствительности. Для осуществления теста использовали анальгезиметр («Ugo Basile», Италия), который разработан для выполнения точного тестирования анальгетиков на нормальной и воспаленной лапе крыс и мышей по методу Рэндалл-Селитто [Руководство по проведению доклинических исследований лекарственных средств. Под ред. Миронова А.Н., Бунатян Н.Д. и др. М., ЗАО «Гриф и К». 2012; Barrot М. Tests and models of nociception and pain in rodents. Neuroscience. 2012, 211: 39-50]. При увеличении давления на конечность последовательно наблюдали: спинальный рефлекс отдергивания конечности, комплекс супраспинальных двигательных реакций животного, направленных на освобождение конечности, и вокализацию. Регистрировали порог возникновения вокализации (вес в граммах), латентное время болевой реакции, число животных без болевой реакции. Критерием анальгетического эффекта считали достоверное уменьшение интенсивности болевых реакций, оцененной в граммах по силе воздействия на здоровую лапу, латентному времени болевой реакции, числу животных без болевой реакции в течение 15 сек после однократного и 3-суточного внутрижелудочного введения.
Исследование антипоцицептивной активности I в тесте по Рэндалл-Селитто проводили на 62 аутбредных мышах-самцах CD1.
На модели механической гиперальгезии по Рэндалл-Селитто величина болевого порога у животных группы контроля через 1 ч после однократного введения растворителя составляла 263,5±44,2 г, после его 3-суточного применения через 1 ч после последнего введения - 264,3±59,8 г (таблица 5). Трамадол проявлял выраженную анальгетическую активность через 1 ч после однократного и курсового 3-суточного введения, обусловленную повышением порога болевой чувствительности в 1,8 (Р<0,05) и 1,7 раза (Р<0,05), а также увеличением латентного времени развития болевой реакции в 1,9 (Р<0,05) и 1,8 раза (Р<0,05) соответственно. Следует отметить повышение количества мышей без проявления боли до 27% (Р<0,01) в оба срока наблюдения (таблица 5). Изменения основных параметров анальгетического эффекта носили характер тенденции при однократном введении I в дозах 25 и 50 мг/кг (таблица 5). Вместе с тем, выявлено увеличение количества мышей без болевой реакции после введения вещества в дозах 25 мг/кг (27%, Р<0,01) и 50 мг/кг (20%, Р<0,01).
Курсовое введение увеличило эффективность I в этих дозах, что выражалось в повышении порога в 1,9 раза (25 мг/кг, Р<0,05), латентного времени в 2 раза (25 мг/кг, Р<0,05) и 1,9 раза (50 мг/кг, Р<0,05), увеличении количества животных без проявления боли до 18% (25 мг/кг, Р<0,05) и 30% (50 мг/кг, Р<0,01) (таблица 6).
Исследуемое вещество I эффективно повышало болевую чувствительность мышей к компрессионной боли при введении в дозах 100 и 200 мг/кг через 1 ч после однократного введения за счет увеличения порога болевой чувствительности в 2,0 раза (Р<0,05) и 1,8 раза (Р<0,05), времени болевого ответа - в 2,1 (Р<0,01) и 1,9 раза (Р<0,05) соответственно, количества мышей без болевой реакции - до 40% (Р<0,01) в обоих случаях.
Аналогичная направленность эффекта отмечалась после курсового применения I в дозе 100 мг/кг, обусловленная повышением порога болевой чувствительности в 2 раза (Р<0,01), увеличением латентного периода развития боли в 2,2 раза (Р<0,05) и количества мышей с 15-секундной экспозицией до 50% (Р<0,01) относительно соответствующих значений контроля (таблица 6) В группе животных, получавших I в дозе 200 мг/кг, отмечалась тенденция к повышению основных показателей анальгетической активности, при этом количество мышей с максимальным проявлением обезболивающего действия составило 50% (Р<0,01).
Таким образом, результаты исследования I при однократном и 3-дневном применении в диапазоне доз 25-200 мг/кг per os в тесте «механическая компрессия лапы» у аутбредных мышей-самцов CD1 свидетельствуют в пользу выраженной антиноцицептивной активности I, сопоставимой с эффектом трамадола во все сроки наблюдения.


Влияние 4-(2-этоксиацетил)-2,6,8,10,12-пентаацетил-2,4,6,8,10,12 гексаазатетрацикло [5,5,0,03,11,05,9]додекана при курсовом внутрижелудочном пути введения на развитие соматической боли при механической компрессии здоровой и лапы с каррагениновым воспалением
Одним из недостатков модели механической компрессии является слабая чувствительность метода, что требует использования воздействия высокой интенсивности. Для повышения чувствительности метода используют методику механического раздражения воспаленной конечности, например, каррагенин-индуцированную гиперальгезию. Острую воспалительную реакцию (отек) вызывали субплантарным введением 0,1 мл 1% (в 0,9% NaCl) раствора каррагенина (сульфатированный полисахарид из ирландского морского мха) под апоневротическую пластинку задней лапы крысы. В другую заднюю лапу вводили 0,1 мл 0,9% NaCl. При этом кардинальные признаки воспаления - отек, гипералгезия, эритема - развиваются сразу после субплантарной инъекции без повреждения тканей воспаленной лапы.
Исследование анальгетического действия вещества I проводили на 60 аутбредных мышах-самцах CD1 в тесте Rendal Selitto.
На модели механической гиперальгезии по Рэндалл-Селитто величина болевого порога у животных группы контроля при компрессии здоровой лапы составляла 229,2±29,8 г, латентное время развития болевой реакции - 4,7±0,6 сек (таблица 7). Воспаление, индуцированное в лапе мышей инъекцией каррагенина, изменяло болевую чувствительность животных до 136,7±23,8 г, а латентное время развития болевой реакции - до 3,0±0,6 секунд (таблица 7).
Значение болевого порога у животных после 3-суточного курсового применения трамадола составило 339,5±54,4 г, латентное время развития болевого ответа - 7,2±1,2 сек при механическом раздражении здоровой лапы (таблица 7). Каррагениновое воспаление лапы снижало чувствительность животных в этой группе, что приводило к повышению болевого порога до 437,6±59,2 г (Р<0,01), увеличению значения времени болевой реакции - до 9,6±1,4 секунд (Р<0,01) в сравнении с соответствующими значениями контроля, повышению количества животных с 15-секундной экспозицией до 30% (Р<0,01) против 0% контроля (Р<0,01) и 10% - здоровой лапы.
Вещество I в дозе 25 мг/кг оказывало выраженное анальгетическое действие при компрессии здоровой лапы за счет повышения болевого порога в 2,3 раза (Р<0,01) и увеличения латентного времени развития болевой реакции в 2,3 раза (Р<0,01), превышающих соответствующие значения контроля (таблица 7).

В пользу выраженного анальгетического эффекта вещества I в дозе 25 мг/кг свидетельствовал показатель количества мышей без проявления боли, который составлял 50% (Р<0,01) против 0% контроля и 10% в группе получавших трамадол. Однако значения обезболивающего действия I в дозах 50, 100 и 200 мг/кг при компрессии здоровой лапы носили характер тенденции. Кроме того, в дозе 100 мг/кг, выявлено статистически значимое повышение количества животных без проявления боли до 30%/
Выраженное обезболивающее действие вещества I проявлялось при каррагенин-индуцированной гиперальгезии во всех дозах (таблица 7). Доза 25 мг/кг оказалась эффективной по всем изученным параметрам: отмечалось повышение порога болевой чувствительности в 2,8 раза (Р<0,01), латентного времени - в 2,8 раза (Р<0,01), количества мышей без проявления болевой реакции в течение 15 секунд - до 40% (Р<0,05) относительно соответствующих значений контроля. Похожая закономерность наблюдалась в отношении остальных доз: повышение болевого порога - в 3,4 раза (50 мг/кг, Р<0,01), в 2,3 раза (100 кг/кг, Р<0,05), в 3,2 раза (200 мг/кг, Р<0,05); увеличение латентного времени - в 3,4 раза (50 мг/кг, Р<0,01), в 2,3 раза (100 мг/кг), в 3,1 раза (200 мг/кг, Р<0,01) в сравнении с соответствующими значениями контроля. Следует отметить увеличение количества животных без проявления болевой реакции в исследуемых группах: в дозе 50 мг/кг - 50% (Р<0,0), в дозе 100 мг/кг - 30% (Р<0,01), в дозе 200 мг/кг - 30% (Р<0,01) против 0% в группе контроля.
Таким образом, 4-(2-этоксиацетил)-2,6,8,10,12-пентаацетил2,4,6,8,10,12-гексаазатетрацикло[5,5,0,03,11,05,9]додекан I после 3-суточного внутрижелудочного введения эффективно снижал чувствительность мышей к боли при механической компрессии здоровой и лапы с каррагениновым воспалением в тесте Rendal Selitto. Эффект I был сравним с активностью трамадола.
Совокупность полученных данных позволяет сделать вывод о том, что впервые синтезированный 4-(2-этоксиацетил)-2,6,8,10,12-пентаацетил2,4,6,8,10,12-гексаазатет-рацикло[5,5,0,03,11,05,9]додекан оказывает выраженный анальгетический эффект, сравнимый и/или превышающий действие трамадола. Выявленная активность I может реализоваться за счет ингибирующего влияния на периферические и центральные механизмы развития болевого синдрома на супраспинальном, спинальном и периферическом уровне организации болевой чувствительности.
| название | год | авторы | номер документа |
|---|---|---|---|
| 4-(3,4-ДИБРОМТИОФЕНКАРБОНИЛ)-10-(2-ЭТОКСИАЦЕТИЛ)-2,6,8,12-ТЕТРААЦЕТИЛ-2,4,6,8,10,12-ГЕКСААЗАТЕТРАЦИКЛО[5,5,0,0 , 0 ]ДОДЕКАН В КАЧЕСТВЕ АНАЛЬГЕТИЧЕСКОГО СРЕДСТВА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2021 |
|
RU2786231C1 |
| 4,10-ди(этоксиацетил)-2,6,8,12-тетраацетил-2,4,6,8,10,12-гексаазатетрацикло [5,5,0,0 ,0] додекан в качестве анальгетического средства и способ его получения | 2020 |
|
RU2736936C1 |
| 4-(2-ЭТОКСИАЦЕТИЛ)-2,6,8,10,12-ПЕНТААЦЕТИЛ-2,4,6,8,10,12-ГЕКСААЗАТЕТРАЦИКЛО[5,5,0, 0,0]ДОДЕКАН В КАЧЕСТВЕ РАНОЗАЖИВЛЯЮЩЕГО СРЕДСТВА ПРИ ПЛОСКОСТНОЙ КОЖНОЙ РАНЕ | 2024 |
|
RU2837202C1 |
| 4-(3,4-ДИБРОМТИОФЕНИЛКАРБОНИЛ)-2,6,8,10,12-ПЕНТААЦЕТИЛ-2,4,6,8,10,12 ГЕКСААЗАИЗОВЮРЦИТАН В КАЧЕСТВЕ АНАЛЬГЕТИЧЕСКОГО СРЕДСТВА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2021 |
|
RU2769523C1 |
| 4,10-ДИ(ЭТОКСИАЦЕТИЛ)-2,6,8,12-ТЕТРААЦЕТИЛ-2,4,6,8,10,12-ГЕКСААЗАТЕТРАЦИКЛО [5,5,0,0,0]ДОДЕКАН В КАЧЕСТВЕ ПРОТИВОВОСПАЛИТЕЛЬНОГО СРЕДСТВА | 2022 |
|
RU2798994C1 |
| 4-(3,4-ДИБРОМТИОФЕНКАРБОНИЛ)-2,6,8,12-ТЕТРААЦЕТИЛ-2,4,6,8,10,12-ГЕКСААЗАТЕТРАЦИКЛО[5,5,0,0,0]ДОДЕКАН В КАЧЕСТВЕ АНАЛЬГЕТИЧЕСКОГО СРЕДСТВА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2014 |
|
RU2565766C1 |
| 4,10-БИС((±)-5-БЕНЗОИЛ-2,3-ДИГИДРО-1Н-ПИРРОЛО[1,2-А]ПИРРОЛ-1-КАРБОНИЛ)-2,6,8,12-ТЕТРААЦЕТИЛ-2,4,6,8,10,12-ГЕКСААЗАТЕТРАЦИКЛО[5,5,0,0,0]ДОДЕКАН В КАЧЕСТВЕ АНАЛЬГЕТИЧЕСКОГО СРЕДСТВА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2014 |
|
RU2558148C1 |
| 4-(3,4-Дибромтиофенкарбонил)-2,6,8,12-тетраацетил-2,4,6,8,10,12-гексаазатетрацикло[5,5,0,0,0]додекан в качестве противосудорожного средства | 2018 |
|
RU2684107C1 |
| 4-(3,4-ДИБРОМТИОФЕНКАРБОНИЛ)-10-ИЗОНИКОТИНИЛ-2,6,8,12-ТЕТРААЦЕТИЛ-2,4,6,8,10,12-ГЕКСААЗАТЕТРАЦИКЛО[5,5,0,0,0]ДОДЕКАН В КАЧЕСТВЕ АНАЛЬГЕТИЧЕСКОГО СРЕДСТВА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2022 |
|
RU2799639C1 |
| Средство, обладающее противовоспалительным и анальгетическим действием | 2016 |
|
RU2629607C1 |
Изобретение относится к фармацевтической химии и фармакологии, а именно к новому химическому соединению 4-(2-этоксиацетил)-2,6,8,10,12-пентаацетил-2,4,6,8,10,12-гексаазатетрацикло[5,5,0,03,11,05,9]додекану формулы (I). Также изобретение относится к способу его получения, заключающемуся в ацилировании 2,6,8,10,12-пентаацетил-2,4,6,8,10,12-гексаазатетрацикло[5,5,0,03,11,05,9]додекана хлорангидридом 2-этоксиуксусной кислоты. Технический результат изобретения заключается в выявлении анальгетической активности 4-(2-этоксиацетил)-2,6,8,10,12-пентаацетил-2,4,6,8,10,12-гексаазатетрацикло[5,5,0,03,11,05,9]додекана, а также осуществлении способа его получения. 2 н.п. ф-лы, 7 табл., 2 пр.

1. 4-(2-Этоксиацетил)-2,6,8,10,12-пентаацетил-2,4,6,8,10,12-гексаазатет-рацикло[5,5,0,03,11,05,9]додекан (I), обладающий анальгетической активностью.

2. Способ получения 4-(2-этоксиацетил)-2,6,8,10,12-пентаацетил-2,4,6,8,10,12-гексаазатетрацикло[5,5,0,03,11,,05,9]додекана, заключающийся в ацилировании 2,6,8,10,12-пентаацетил-2,4,6,8,10,12-гексаазатетрацикло[5,5,0,03,11,05,9]додекана хлорангидридом 2-этоксиуксусной кислоты.
| МАШКОВСКИЙ М.Д., Лекарственные средства, 15-е изд | |||
| М.: ООО "Издательство Новая Волна", 2005, 164 стр., стр | |||
| Канатное устройство для подъема и перемещения сыпучих и раздробленных тел | 1923 |
|
SU155A1 |
| 4,10-ди(этоксиацетил)-2,6,8,12-тетраацетил-2,4,6,8,10,12-гексаазатетрацикло [5,5,0,0 ,0] додекан в качестве анальгетического средства и способ его получения | 2020 |
|
RU2736936C1 |
| 4-(3,4-ДИБРОМТИОФЕНИЛКАРБОНИЛ)-2,6,8,10,12-ПЕНТААЦЕТИЛ-2,4,6,8,10,12 ГЕКСААЗАИЗОВЮРЦИТАН В КАЧЕСТВЕ АНАЛЬГЕТИЧЕСКОГО СРЕДСТВА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2021 |
|
RU2769523C1 |
| AGUERO S | |||
| et al, Discovery of a Novel Non-Narcotic Analgesic Derived from the CL-20 Explosive: Synthesis, Pharmacology, and Target Identification of Thiowurtzine, a Potent Inhibitor | |||
Авторы
Даты
2023-12-05—Публикация
2023-04-17—Подача