Изобретение относится к иммунологии и нанобиотехнологии, а именно, к способу повышения иммуногенности вакцинного антигена путем использования в качестве адъюванта наноматериала - оксида графена.
Большинство новых биотехнологических вакцин, таких как вакцины на основе нуклеиновых кислот, пептидные вакцины и др., обладают низкой иммуногенностью и не могут стимулировать клеточный иммунный эффект, опосредуемый CD8+ цитотоксическими Т-клетками, что стало узким местом в разработке биотехнологических вакцин [Li L, Petrovsky N. Molecular mechanisms for enhanced DNA vaccine immunogenicity. Expert Rev Vaccines [Internet]. 2016 Mar 3; 15 (3): 313-29. Available from: http://class.classmatandread.net/Branding/-branding.pdf; Backlund CM, Holden RL, Moynihan KD, Garafola D, Farquhar C, Mehta NK, et al. Cell-penetrating peptides enhance peptide vaccine accumulation and persistence in lymph nodes to drive immunogenicity. Proc Natl Acad Sci [Internet], 2022 Aug 9; 119 (32). Available from: https://pnas.org/doi/full/10.1073/pnas.2204078119]. Адъюванты играют важную роль в усилении антиген-специфических иммунных ответов и ремоделировании типа иммунного ответа. Адъюванты, используемые в настоящее время в клинической практике (например, алюминиевый адъювант, эмульсия MF59), могут индуцировать сильные гуморальные иммунные ответы, но мало влияют на клеточные иммунные ответы [Morefield GL, Sokolovska A, Jiang D, Hogenesch H, Robinson JP, Hem SL. Role of aluminum-containing adjuvants in antigen internalization by dendritic cells in vitro. Vaccine. 2005; 23 (13): 1588-95]. Очевидно, что использование только алюминиевого адъюванта недостаточно для разработки действительно эффективных современных вакцин.
С развитием нанотехнологий появляются новые идеи, связанные с использованием наноматериалов в качестве адъювантов при разработке вакцин. Многие наноматериалы обладают хорошей биосовместимостью и уникальными физико-химическими свойствами. В настоящее время идет активный поиск безопасных наноматериалов, пригодных к использованию в качестве адъювантов, способных повысить иммуногенность вакцинных антигенов, в частности, активизировать формирование клеточного иммунного ответа, опосредуемого CD8+ цитотоксическими Т-клетками.
Одним из претендентов на роль адъюванта - активатора клеточного иммунитета - является оксид графена [Cao W, Не L, Cao W, Huang X, Jia K, Dai J. Recent progress of graphene oxide as a potential vaccine carrier and adjuvant. Acta Biomater [Internet]. 2020 Aug; 112: 14-28. Available from: https://doi.org/10.1016/j.actbio.2020.06.009]. Благодаря своим уникальным физико-химическим свойствам, оксид графена широко используется в медицине для целей фототермического лечения рака, доставки лекарств, антибактериальной терапии и медицинской визуализации. Оксид графена также проявляет значительную адъювантную активность.
Повлиять на формирование клеточного иммунитета можно путем регуляции функции антиген-презентации, первым этапом которой является интернализация вакцинного антигена антиген-презентующими клетками [Uribe-Querol Е, Rosales С. Phagocytosis: Our Current Understanding of a Universal Biological Process. Front Immunol [Internet]. 2020 Jun 2; 11 (June): 1-13. Available from: https://www.frontiersin.org/article/10.3389/fimmu.2020.01066/full]. Одним из способов интернализации антигена антиген-презентующими клетками является фагоцитоз.
Макрофаги являются ключевыми клетками врожденного и адаптивного иммунитета и известны своей замечательной фенотипической гетерогенностью и функциональным разнообразием [Murray PJ, Allen JE, Biswas SK, Fisher EA, Gilroy DW, Goerdt S, et al. Macrophage Activation and Polarization: Nomenclature and Experimental Guidelines [Internet]. Vol. 41, Immunity. 2014. p. 14-20. Available from: http://www.ncbi.nlm.nih.gov/pubmed/25035950]. Важно отметить, что макрофаги являются профессиональными антиген-презентующими клетками и главными фагоцитами в организме. Макрофаги также являются самыми многочисленными иммунными клетками, присутствующими в опухоли, и могут составлять до 50% клеточной массы солидных опухолей, поэтому противоопухолевая терапия, основанная на использовании макрофагов, в настоящий момент считается одной из самых перспективных [Zhu S, Luo Z, Li X, Han X, Shi S, Zhang T. Tumor-associated macrophages: role in tumorigenesis and immunotherapy implications. J Cancer [Internet]. 2021; 12 (1): 54-64. Available from: https://www.jcancer.org/v12p0054.htm].
Главным содержанием настоящего патента является преодоление недостатков предшествующего уровня техники и разработка способа активации клеточного иммунитета путем акселерации фагоцитарной функции макрофагов наночастицами оксида графена. В литературе широко представлены работы, исследующие эффекты оксида графена/оксида графена функционализированного на жизнеспособность, дифференцировку и функциональную, включая фагоцитарную, активность основных субпопуляций клеток иммунной системы. Важно отметить, что в подавляющем большинстве исследований с фокусом на влиянии оксида графена на фагоцитарную активность иммунных клеток в качестве объектов фагоцитоза рассматриваются сами наночастицы оксида графена [https://www.researchgate.net/project/A-study-of-the-graphene-oxide-biocompatibility-with-cells-of-the-immune-system-in-the-context-of-its-use-in-biomedicine]. Очевидно, результаты этих исследований ничего не говорят нам о влиянии оксида графена на фагоцитоз объектов биологического происхождения, например, патогенных бактерий, клетками иммунной системы и - в более широком контексте - на функцию антиген-презентации и клеточный иммунитет. Наиболее близкими к заявляемому являются способы повышения иммуногенности клеточных вакцин, описанные в патентах CN 108836980 A [AXIAOHUIW, QIANQIAN Z, LINSHENG Z, CHULIN НЕ. Application of graphene oxide in preparing dendritic cell function accelerant [Internet]. Available from: https://lens.org/155-168-425-134-6621, CN 113069541 A [QIANQIAN Z, SUJING SUN, XIAOHUIW, LINSHENG Z. Application of graphene oxide sheet in preparation of DC vaccine immunologic adjuvant, DC vaccine and preparation method of DC vaccine [Internet]. Available from: https://lens.org/191-419- 479-381-14X] и CN 109010810 A [GUILEI MA, XIAOLI W, FENGQIANG CAO, MENGMENG YAN. Tumor vaccine based on nano-graphene oxide-Al(OH)3/antigen composite and preparation method thereof [Internet]. Available from: https://lens.org/135-902-702-252-412]. Во всех трех патентах описывается использование оксида графена в качестве активатора клеточного иммунитета. В частности, в патенте CN 108836980 А описан способ использование оксида графена в качестве акселератора двух ключевых свойств дендритных клеток, предназначенных для адоптивного переноса, - зрелости и способности к миграции in vivo. В патенте CN 113069541 А описан способ использования оксида графена для акселерации процесса формирования иммунологического синапса между дендритными клетками и Т-лимфоцитами, что приводит к 20-кратному повышению количества антиген-специфических CD8+ цитотоксических Т-клеток. В патенте CN 109010810 А описан способ приготовления вакцины с использованием оксида графена в составе комплекса оксид графена/гидроксид алюминия Al(ОН)3/антиген, который обеспечивает эффективную доставку вакцинного антигена в цитозоль дендритных клеток с последующей кросс-презентацией антигена и активацией клеточного иммунитета. Главным отличием нашей разработки от вышеперечисленных является использование оксида графена в качестве акселератора фагоцитарной функции макрофагов. В настоящий момент основным способом воздействия на фагоцитарную функцию макрофагов является активация/ингибирование CD47/SIRPa взаимодействия при помощи соответствующих антител. Наиболее близким к заявляемому является способ, описанный в патенте ЕР 3 656 443 В1 [IRVING, W., MINGYE, F. & JENS-PETER, V. USE OF TRL AGONIST AND ANTI-CD47 AGENT TO ENHANCE PHAGOCYTOSIS OF CANCER CELLS [Internet]. Available from: https://www.lens.org/lens/patent/032-554-629-965-615/frontpage?l=en]. Этот патент описывает способ акселерации фагоцитарной функции клеток-фагоцитов, например, макрофагов, путем воздействия на эти клетки эффективной дозой агента, блокирующего CD47-SIRPa взаимодействие, и этим агентом являются моноклональные анти-CD47 (in vitro и in vivo) или анти-SIRPa (in vivo) антитела. Основным недостатком этого способа является экспрессия CD47 практически на каждой клетке организма, что приводит к неизбирательному связыванию антител, нацеленных на CD47, и, следовательно, неизбежной off-target токсичности, одним из проявлений которой является анемия и тромбоцитопения. Ориентация на SIRPa рецептор может оказаться более безопасной, так как его экспрессия более ограничена, но и она распространяется за пределы миелоидных линий, например, на эпителиальные клетки. Решение этой проблемы безопасности включает разработку принципиально новых способов воздействия на фагоцитарную функцию клеток-фагоцитов, одним из которых является способ акселерации фагоцитарной функции макрофагов при помощи наночастиц оксида графена, описанный в настоящем патенте.
Задачей изобретения является повышение эффективности биотехнологических вакцин на основе макрофагов путем активации фагоцитарный функции макрофагов при помощи оксида графена.
Технический результат изобретения заключается в опосредуемом оксидом графена увеличении показателя фагоцитоза макрофагов, измеренного путем подсчета количества макрофагов, поглотивших флуоресцентные частицы pHrodo™ BioParticles®. Среди профагоцитировавших клеток выделяли 3 группы: мало-, средне- и активно-фагоцитирующие макрофаги. К мало-фагоцитирующим относили макрофаги, поглотившие от 1 до 4 бактерий, к средне-фагоцитирующим - от 5 до 10, и к активно-фагоцитирующим - 11 и более бактерий. После этого рассчитывали показатель фагоцитоза, присваивая макрофагам с малой фагоцитирующей способностью - 1 балл, со средне-фагоцитирующей способностью - 2 балла и с активно-фагоцитирующей способностью - 3 балла. Показатель фагоцитоза макрофагов определяли в условных единицах и рассчитывали по формуле:
[количество мало-фагоцитирующих макрофагов]х1+[количество средне-фагоцитирующих макрофагов]х2+[к-во активно-фагоцитирующих макрофагов]х3.
Настоящее изобретение включает метод использования оксида графена для активации фагоцитарной функции макрофагов.
Метод предполагает идентификацию пациента. Этим пациентом является человек или животное с показаниями к применению адоптивного переноса макрофагов с терапевтическим фенотипом, одной из характеристик которого является повышенная фагоцитарная активность.
Метод включает различные способы получения аутологичных макрофагов: (1) путем дифференцировки из аутологичных моноцитов ex vivo и (2) путем выделения готовых макрофагов из жидкостей и тканей пациента.
Метод включает различные способы выделения аутологичных моноцитов: (1) венозный забор крови с последующим выделением моноцитов из венозной крови, (2) адсорбционный аферезис, (3) выделение предшественников моноцитов из костного мозга, (4) выделение моноцитов из замороженной пуповинной крови пациента, (5) получение моноцитов из индуцированных плюрипотентных стволовых клеток пациента и другие способы, дающие возможность получить достаточное количество моноцитов.
Метод включает способ дифференцировки макрофагов из аутологичных моноцитов ex vivo любым из стандартных способов.
Метод включает способ репрограммирования аутологичных макрофагов ex vivo на терапевтический фенотип с использованием соответствующего метода.
Метод включает получение оксида графена методом электрохимического расслоения рабочих электродов из высокоориентированного пиролитического графита. Оксид графена, синтезированный этим методом, представляет собой прямоугольные двухслойные 2Д нанопластинки толщиной 1.2±0.3 нм и площадью 0.1-3 мкм2. Одну аликвоту буфера для электрофореза, содержащего эксфолиированный оксид графена, разбавляют в соотношении 1:10 000 фосфатно-солевым буфером для получения концентрации оксида графена 1 мг/мл.
Полученную суспензию добавляют к клеточному монослою. Чтобы свести к минимуму цитотоксичность, индуцированную оксидом графена, используется минимальная конечная концентрация 2 мкг/мл среды оксида графена, которая позволяет увеличить коэффициент фагоцитоза макрофагов, но не вызывает некроз клеток. Клетки культивируются в присутствии оксида графена в течение 2 часов, после чего отмываются. Коэффициент фагоцитоза макрофагов определяется по стандартной методике с использованием флуоресцентных частиц pHrodo™ BioParticles®.
1. Пример 1.
Эксперименты проводили на самцах мышей линии C57/BL6J весом 21±2 г, полученных из вивария МГМСУ им. А.И. Евдокимова.
Для культивирования и активации макрофагов использовали среду DMEM/F12 (Панэко), сыворотку (Thermo Hyclone, UK), пенициллин-стрептомицин (Gibco), IFN-γ (Invitogen, США), LPS (Sigma-Aldrich, США), ингибитор Stat3 (S3I204, Axon Med, США), ингибитор Stat6 (As1517499, Axon Med, США), ингибитор SMAD3 (SIS3, Calbiochem, США), флуоресцентные частицы Hrodo® Red Staphylococcus aureus Bioparticles (A10010, Invitrogen).
Макрофаги выделяли из перитонеального смыва мышей и помещали в культуральные планшеты со средой с 10% FBS, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина при 37°С и 5% CO2 для прикрепления. Через час старую среду с неприкрепившимися клетками отбирали и добавляли свежую, после чего проводили активацию макрофагов в различные фенотипы.
Для получения М2 фенотипа, в среду добавляли сыворотку до 40% и культивировали 12 часов, после чего стимулировали 500 нг/мл ЛПС в течение 24 часов. Для получения М3 фенотипа, в среду без сыворотки добавляли 20 нг/мл IFN-γ, 5 мкг/мл ингибитора STAT3, 10 мкг/мл ингибитора STAT6 и 2 нмоль/мл ингибитора SMAD3 и культивировали 12 часов, после чего макрофаги стимулировали 500 нг/мл ЛПС в течение 24 часов. Контрольные МО макрофаги культивировали 36 часов в среде, содержащей 10% сыворотки.
Оксид графена получали методом электрохимического расслоения рабочих электродов из высокоориентированного пиролитического графита. Одну аликвоту буфера для электрофореза, содержащего эксфолиированный оксид графена, разбавляли в соотношении 1:10 000 фосфатно-солевым буфером для получения концентрации оксида графена 1 мг/мл. Полученную суспензию добавляли к клеточному монослою. Чтобы свести к минимуму цитотоксичность, индуцированную оксидом графена, использовали минимальную конечную концентрацию 2 мкг/мл среды оксида графена, которая позволяла увеличить коэффициент фагоцитоза макрофагов, но не вызывала некроза клеток. Макрофаги культивировали в присутствии оксида графена в течение 2 часов, после чего отмывали и определяли коэффициент фагоцитоза по стандартной методике с использованием флуоресцентных частиц pHrodo™BioParticles®.
Фагоцитарную активность макрофагов и эффект оксида графена оценивали в нормальной и опухолевой среде. Оценку проводили с использованием набора окрашенных бактерий pHrodo® Red Staphylococcus aureus Bioparticles (Invitrogen) путем подсчета фагоцитирующих макрофагов на фотографиях, полученных с помощью системы визуализации клеток Zoe (Bio-Rad, США). Флуоресцентные частицы pHrodoTM BioParticles® были разморожены и приготовлены в концентрации 10 мкг/мл согласно протоколу производителя. Культуральную среду в лунках заменяли на 100 мкл суспензии флуоресцентных частиц pHrodo™ BioParticles® и переносили в СО2 инкубатор на 1 час при 37°С. Затем лунки фотографировали из расчета 5 полей на лунку, 3 лунки на эксперимент и данные усредняли. Подсчитывали клетки, поглотившие флуоресцентные частицы. Среди фагоцитирующих макрофагов выделяли 3 группы: мало-, средне- и активно-фагоцитирующие клетки. К мало-фагоцитирующим относили макрофаги, поглотившие от 1 до 4 бактерий, к средне-фагоцитирующим - от 5 до 10, и к активно-фагоцитирующим - 11 и более бактерий. После этого рассчитывали показатель фагоцитоза, присваивая макрофагам с малой фагоцитирующей способностью - 1 балл, со средне-фагоцитирующей способностью - 2 балла и с активно-фагоцитирующей способностью - 3 балла. Показатель активности фагоцитоза макрофагов определяли в условных единицах и рассчитывали по формуле:
[количество мало-фагоцитирующих макрофагов]х1+[количество средне-фагоцитирующих макрофагов]х2+[к-во активно-фагоцитирующих макрофагов]х3.
Для оценки влияния опухолевой среды на фагоцитарную активность макрофагов к среде культивирования макрофагов на этапе стимуляции с ЛПС добавляли 10% кондиционированной среды, полученной при культивировании клеток опухоли Эр лиха в течение 24 часов.
Данные представляли как среднее ± стандартная ошибка измерения и анализировали с помощью Two Factor ANOVA и post-hoc критерия Тьюки. При р<0.05 различия считали статистически значимыми.
Результаты экспериментов по оценке влияния наночастиц оксида графена на фагоцитарную активность макрофагов различных фенотипов в нормальной и опухолевой среде представлены в таблице 1.
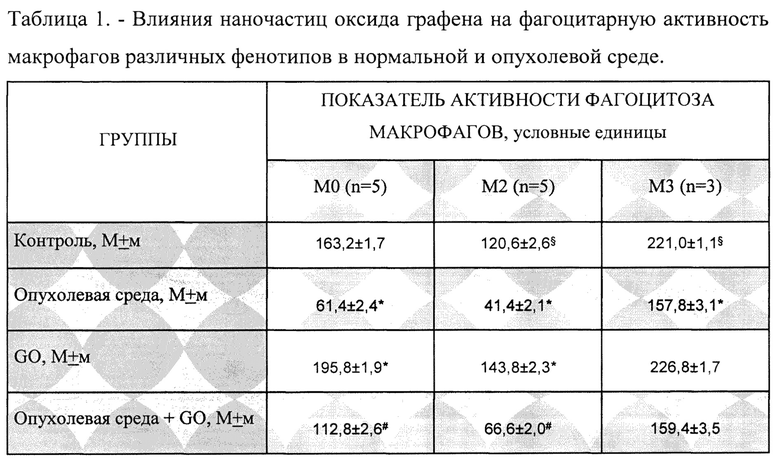

Результаты, представленные в таблице 1, позволяют обнаружить несколько важных закономерностей.
Во-первых, видно, что фенотип макрофагов влияет на их способность к фагоцитозу: изменение МО фенотипа в сторону М2 снижает фагоцитарную активность макрофагов, а в сторону М3, напротив, увеличивает.
Во-вторых, опухолевая среда существенно снижает фагоцитарную способность макрофагов. Наиболее сильно это проявляется в отношении М0 и М2 фенотипов, коэффициент фагоцитоза которых снижался в 2,9 и 2,6 раз, соответственно. Фагоцитарная активность М3 макрофагов в опухолевой среде снижалась существенно меньше, всего на 29%.
В-третьих, добавление оксида графена приводило к повышению фагоцитарной способности макрофагов с фенотипами М0 и М2 на 20% и 19%, соответственно, по сравнению с контролем, тогда как коэффициент фагоцитоза макрофагов с фенотипом М3 практически не изменялся.
И, наконец, в-четвертых, наночастицы оксида графена снижали депрессивный эффект опухолевой среды на фагоцитарную активность макрофагов. Однако опять, этот эффект существенно зависел от фенотипа макрофагов. Для М0 макрофагов происходило почти двукратное повышение активности (Таблица 1), для М2 фенотипа фагоцитарная активности в опухолевой среде при добавлении GO увеличивалась более, чем на 50% (Таблица 1), а для М3 фенотипа, добавление GO практически не влияло на уже достаточно высокую активность в опухолевой среде (Таблица 1).
Таким образом, результаты свидетельствуют о том, что наночастицы оксида графена способны повышать исходную и восстанавливали ослабленную в опухолевой среде способность макрофагов к фагоцитозу. Особенность эффекта была в том, что оксид графена существенно повышал фагоцитарную активность макрофагов с фенотипами М0 и М2, которые имели исходно низкую активностью, и практически не влиял на М3 фенотип с исходно высокой активностью. Фенотип-зависимый характер влияния наночастиц оксида графена имеет большую практическую значимость, поскольку в зоне опухоли существенно преобладают М0 и М2 макрофаги [Zhu S, Luo Z, Li X, Han X, Shi S, Zhang T. Tumor-associated macrophages: role in tumorigenesis and immunotherapy implications. J Cancer [Internet], 2021; 12 (1): 54-64. Available from: https://www.jcancer.orv/v12p0054.htm].
| название | год | авторы | номер документа |
|---|---|---|---|
| МОДИФИЦИРОВАННЫЕ МОНОЦИТЫ/МАКРОФАГИ, ЭКСПРЕССИРУЮЩИЕ ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ, И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2766690C2 |
| ИСПОЛЬЗОВАНИЕ ПРОСТАГЛАНДИНА Е1 (АЛПРОСТАДИЛА) ДЛЯ АКТИВАЦИИ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТИ МАКРОФАГОВ | 2024 |
|
RU2832882C1 |
| СПОСОБ ОЦЕНКИ ФАГОЦИТАРНОЙ АКТИВНОСТИ НЕЙТРОФИЛОВ | 2023 |
|
RU2824345C1 |
| Способ анализа эффективности фагоцитоза | 2023 |
|
RU2831297C1 |
| Способ сортировки фагоцитирующих клеток | 2024 |
|
RU2835814C1 |
| NK-клеточная линия, экспрессирующая PSMA-специфический химерный антигенный рецептор и секретирующая блокатор взаимодействия CD47/SIRPa | 2020 |
|
RU2757353C1 |
| СПОСОБ ТОРМОЖЕНИЯ РОСТА ПОДКОЖНОГО ТРАНСПЛАНТАТА ЭКСПЕРИМЕНТАЛЬНОЙ ГЛИОБЛАСТОМЫ ЧЕЛОВЕКА U-87, ПЕРЕВИТОГО ИММУНОДЕФИЦИТНЫМ МЫШАМ NU/J | 2019 |
|
RU2717218C1 |
| СРЕДСТВО ГУМИНОВОЙ ПРИРОДЫ, УСИЛИВАЮЩЕЕ ФАГОЦИТИРУЮЩУЮ АКТИВНОСТЬ КЛЕТОК | 2023 |
|
RU2834961C1 |
| Способ подбора лекарственных средств для реализации фармакологической индукции митохондриальной дисфункции в макрофагах для противоопухолевой терапии | 2023 |
|
RU2810558C1 |
| СПОСОБ ПОДАВЛЕНИЯ РОСТА ОПУХОЛИ ОСНОВЕ IN VITRO РЕПРОГРАММИРОВАНИЯ МАКРОФАГОВ НА М1 ФЕНОТИП С ПОВЫШЕННОЙ СПОСОБНОСТЬЮ К ПРОДУКЦИИ ОКСИДА АЗОТА В ЭКСПЕРИМЕНТЕ | 2015 |
|
RU2599545C1 |
Изобретение относится к биотехнологии, а именно к способу повышения фагоцитарной активности макрофагов. Способ предусматривает воздействие на макрофаги наночастиц оксида графена, полученных методом электрохимического расслоения рабочих электродов из высокоориентированного пиролитического графита и разбавленных фосфатно-солевым буфером для получения концентрации оксида графена 1 мг/мл, при этом полученную суспензию добавляют к клеточному монослою из макрофагов в конечной концентрации 2 мкг/мл среды для предотвращения некроза клеток, клетки культивируются в присутствии оксида графена в течение 2 часов, после чего отмываются. Изобретение эффективно для повышения эффективности биотехнологических вакцин на основе макрофагов. 1 пр., 1 табл.
Способ повышения фагоцитарной активности макрофагов путем воздействия наночастиц оксида графена, полученных методом электрохимического расслоения рабочих электродов из высокоориентированного пиролитического графита и разбавленных фосфатно-солевым буфером для получения концентрации оксида графена 1 мг/мл, при этом полученную суспензию добавляют к клеточному монослою из макрофагов в конечной концентрации 2 мкг/мл среды для предотвращения некроза клеток, клетки культивируются в присутствии оксида графена в течение 2 часов, после чего отмываются.
| ПОЛУЧЕНИЕ ОКСИДА ГРАФЕНА | 2014 |
|
RU2691365C1 |
| ALI M.R | |||
| et al | |||
| N-Hydroxysuccinimide crosslinked graphene oxide-gold nanoflower modified SPE electrode for sensitive detection of chloramphenicol antibiotic, RSC Advances, 2021, No.26 | |||
| ХРАМЦОВ П | |||
| и др | |||
| Взаимодействие наночастиц оксида графена с клетками иммунной системы, Гены и клетки, 2020, том 15, No.3 | |||
| КОМПЛЕКС ДЛЯ УСИЛЕНИЯ ИММУННОГО ОТВЕТА | 2019 |
|
RU2779622C2 |
Авторы
Даты
2023-12-11—Публикация
2022-12-08—Подача