Изобретение относится к области нанохимии, а именно к химическим методам синтеза наночастиц металлов. Техническим результатом изобретения является получение наночастиц аморфного гидроксида железа (III) с узким распределением по размерам методом химического осаждения, проводимого при комнатной температуре без термостатирования и применения щелочей. Наночастицы аморфного гидроксида железа (III) могут выступать реагентами в спектрофотометрических методах анализа, процессах синтеза сорбентов и материалов электронной техники.
Аморфные металлы, в отличие от металлов с кристаллической структурой, более химически активные, коррозионностойкие и прочные. Аморфные железосодержащие сплавы имеют высокую магнитную проницаемость [1].
Для получения частиц аморфных металлов необходимо очень быстро охлаждать их расплавы [2] или осаждать атомы металлов на подложку из потока плазмы [3], что с технической точки зрения проблематично.
Альтернативным, хотя и неэкологичным является метод химической конденсации, в основе которого лежит реакция Элмора В.С.
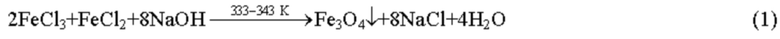
Изменение условий осаждения: температуры, природы реагентов и концентрации их растворов - позволяет синтезировать гидратированные оксиды двух- и трехвалентного железа с различными физико-химическими характеристиками.
Известен двухстадийный способ получения частиц Fe3O4 размером от 42 до 81 нм [4]. На первой стадии, осадительной, при 283-295 K смешивают растворы NaOH и FeSO4, из которых предварительно удален кислород путем барботирования азотом. На второй стадии, окислительной, при 310-313 K добавляют NaNO3. Осадок Fe3O4 отделяют от жидкой фазы постоянным магнитом, многократно промывают водой и сушат при комнатной температуре. Данный способ получения Fe3O4 требует нагревания и занимает до 24 часов, что является недостатком.
Синтез частиц Fe3O4 можно проводить при комнатной температуре в одну стадию продолжительность 1-2 часа, если к раствору FeSO4 добавить расчетный объем водно-аммиачного раствора AgNO3 в качестве окислителя [5]. Несмотря на простоту осуществления, этот способ дорогостоящий, т.к. серебро - драгоценный металл.
Процессы образования и роста твердой фазы в ходе гомогенных реакций осаждения плохо поддаются регулированию, поэтому для ограничения роста частиц осаждение проводят в нанореакторах, служить которыми могут капли микроэмульсий. Элипсоидные частицы аморфного гидроксида железа (III) размером 30-40 нм получают [6] путем интенсивного смешения двух микроэмульсий при величине pH = 9, устанавливаемой концентрированным раствором аммиака. Органической фазой в обеих микроэмульсиях является гептан, а неорганической: в одной микроэмульсии - вода, в другой - раствор Fe(NO3)3. Мицеллобразующим агентом выступает цетилтриметиламмоний бромид. Частицы осадка кристаллизуются при температуре отжига выше 473 K в течение 20 мин. Недостаток способа - в необходимости многократно промывать осадок водой и этанолом, а также использовать пожаро- и взрывоопасные реагенты: аммиак и гептан.
Прототипом данного изобретения является способ синтеза частиц Fe3O4 размером от 50 до 165 нм при комнатной температуре и атмосферном давлении [7]. Готовят два водных раствора, один из которых содержит соли двух- и трехвалентного железа, а второй - щелочь и поверхностно-активное вещество. Растворы смешивают в ультразвуковом поле не более 30 мин. В полученный золь, не прекращая ультразвуковое воздействие, добавляют смесь катионитов и анионитов для извлечения непрореагировавших исходных веществ и побочных продуктов реакций. Ионный обмен проводят до нейтрализации дисперсионной среды. У этого способа несколько недостатков. Во-первых, одновременно образуются частицы дисперсной фазы нано- и микрометрового размера. Во-вторых, для синтеза необходим ультразвуковой диспергатор, применение которого, в-третьих, вызывает кавитационный износ оборудования.
Задачей данного изобретения является расширение технологических возможностей химического метода синтеза наночастиц гидроксида железа (III) путем замены ионным обменом и стерической стабилизацией стадии осаждения железа (III) щелочами, при проведении которой необходимо термостатирование или ультразвуковое воздействие и высока вероятность получения систем, не являющихся нанодисперсными. Поставленная задача решается введением в свежеприготовленный раствор H2O-FeCl3 катионита в солевой форме для установления и поддержания необходимой величины pH и природного высокомолекулярного соединения, желатина, для стабилизации образующейся дисперсной фазы.
Сущность изобретения заключается в том, что применение ионного обмена позволяет плавно изменить и поддерживать примерно на одном уровне величину pH. В результате чего увеличивается равновесная степень превращения железа (III) в гидроксоформы, и устанавливается оптимальное для получения наночастиц соотношение скоростей образования и роста зародышей гидроксидной фазы. Тогда как при добавлении щелочей, предлагаемом в прототипе, в течение некоторого времени часть объема имеет pH выше требуемого значения. В пересыщенном растворе зародыши гидроксидной фазы быстро образуются и растут, что приводит к получению полидисперсных систем с широким распределением частиц по размерам - от нескольких нанометров до десятых долей микрона. Посредством медленного введения щелочей, увеличения скорости перемешивания и интенсификации ультразвуком можно минимизировать, но не исключить негативное влияние локального перепада концентраций в растворе.
Желатинизация, в свою очередь, увеличивает время жизни дисперсной системы и, в отличие от прототипа, не требует дополнительных материальных и энергозатрат, которые неизбежны при ультразвуковой кавитации.
Первым этапом предлагаемого способа синтеза наночастиц является приготовление водного раствора хлорида железа (III) с концентрацией 0,1-1,0 моль/м3. Соль FeCl3 полностью растворяется в воде с образованием анионов и катионов:

Катион Fe3+ может координировать вокруг себя от одного до четырех хлор-ионов, но образование хлоридных комплексов FeCl2+, FeCl2+, FeCl3, FeCl4- подавлено гидролизом. Гидролиз ионов железа (III) протекает ступенчато с образованием четырех одноядерных FeOH2+, Fe(OH)2+, Fe(OH)3, Fe(OH)4- и одного двухъядерного Fe2(OH)24+ гидроксокомплекса.
Математическое моделирование комплексообразования и потенциометрические исследования показывают [8], что в водных растворах FeCl3 с концентрацией железа (III) 0,1-1,0 моль/м3 доминирует FeOH2+. Суммарная доля остальных гидроксокомплексов не превышает 10 %, а содержание ионов гидроксония близко к значению, соответствующему выпадению осадка. Для достижения состояния насыщения необходимо повысить pH указанных растворов на 0,1-0,3. Сделать это можно двумя способами: увеличить концентрацию гидроксильных ионов в растворе либо снизить концентрацию ионов гидроксония. Оба способа можно реализовать с помощью ионного обмена, но второй вариант предпочтительнее, т.к. позволяет сместить равновесие реакций гидролиза вправо.
В связи с этим, второй этап синтеза наночастиц - это помещение катионита в солевой форме в свежеприготовленный водный раствор хлорида железа (III).
Выделяющиеся при гидролизе ионы гидроксония

катионит извлекает из раствора:
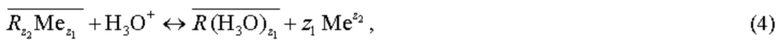
где z1 - заряд функциональной группы R матрицы катионита, z2 - заряд противоиона, Me - противоион, обычно Na+ или Ca2+.
Незначительное количество положительно заряженных ионных форм железа (III) тоже взаимодействует с катионитом.
Кинетические особенности ионного обмена характеризуют внешнедиффузионный коэффициент и коэффициент внутренней диффузии, которые, в свою очередь, зависят от режима процесса, структуры и свойств катионита. Следовательно, частицы гидроксида железа (III) требуемой дисперсности могут быть получены за заданный промежуток времени путем подбора катионита с определенными функциональными свойствами и условий проведения реакций ионного обмена и гидролиза.
В результате ионного обмена при температуре 295±3 K и объемном соотношении катионита к раствору 1:(100-150) через 10-30 мин химическое равновесие реакций гидролиза смещается в сторону продуктов реакции. Раствор становится насыщенным, зарождается новая фаза.
Образование частиц гидроксида железа (III) вызывает переход окраски. Жидкость превращается из бесцветной в бледно-желтую. Свежеосажденный из разбавленных растворов и не подвергавшийся тепловой обработке гидроксид железа (III) является аморфным [9].
Методами динамического и электрофоретического рассеяния света установлено, что частицы имеют размер, лежащий в нанометровом диапазоне, и электрокинетический потенциал, варьирующийся, в зависимости от условий синтеза, от +0,025 до +0,045 В.
Дзета-потенциал, близкий к 0,03 В, является критическим [10], поэтому третий этап работ - стабилизация частиц дисперсной фазы. Для этого после отделения гранул катионита методом декантации в дисперсную систему медленно вводят раствор желатина с массовой долей 10 % при температуре 310-315 K и постоянном перемешивании до достижения массовой доли в дисперсионной среде 1-5 %.
Стабилизированную дисперсную систему следует хранить в герметичной емкости, в темном месте при температуре 280-283 K не более 5-7 дней.
В лабораторных условиях были получены описанным способом и изучены наночастицы гидроксида железа (III). Для синтеза использовались:
а) хлорид железа (III) FeCl3∙6H2O (ч., ГОСТ 4147-74),
б) дистиллированная вода (ГОСТ 6709-72),
в) универсальный катионит КУ-2-8 в Na+-форме (ГОСТ 20298-74),
г) желатин Т-9 (ГОСТ 11293-89).
Эксперименты выполнялись трижды, полученные данные усреднялись. Результаты исследований свидетельствуют о достижении заявленного технического результата изобретения.
Пример 1.
В дистиллированную воду на 120-180 мин помещают 1,0⋅10-3 кг воздушно-сухого катионита КУ-2-8. После декантации набухший катионит КУ-2-8 заливают 3,0⋅10-4 м3 свежеприготовленного раствора FeCl3 с концентрацией 0,5 моль/м3. Реакции гидролиза и ионного обмена проводят при температуре 294±2 K и постоянном перемешивании верхнеприводной или вибрационной мешалкой. Магнитную мешалку использовать нежелательно, т.к. она может разрушить гранулы катионита КУ-2-8.
Через 25 мин жидкость приобретает бледно-желтый цвет, и катионит КУ-2-8 отделяют декантацией. В полученную дисперсную систему для стабилизации добавляют медленно, при постоянном перемешивании 7,0⋅10-5 м3 предварительно приготовленного и подогретого до 314±2 K раствора желатина с массовой долей 10 %.
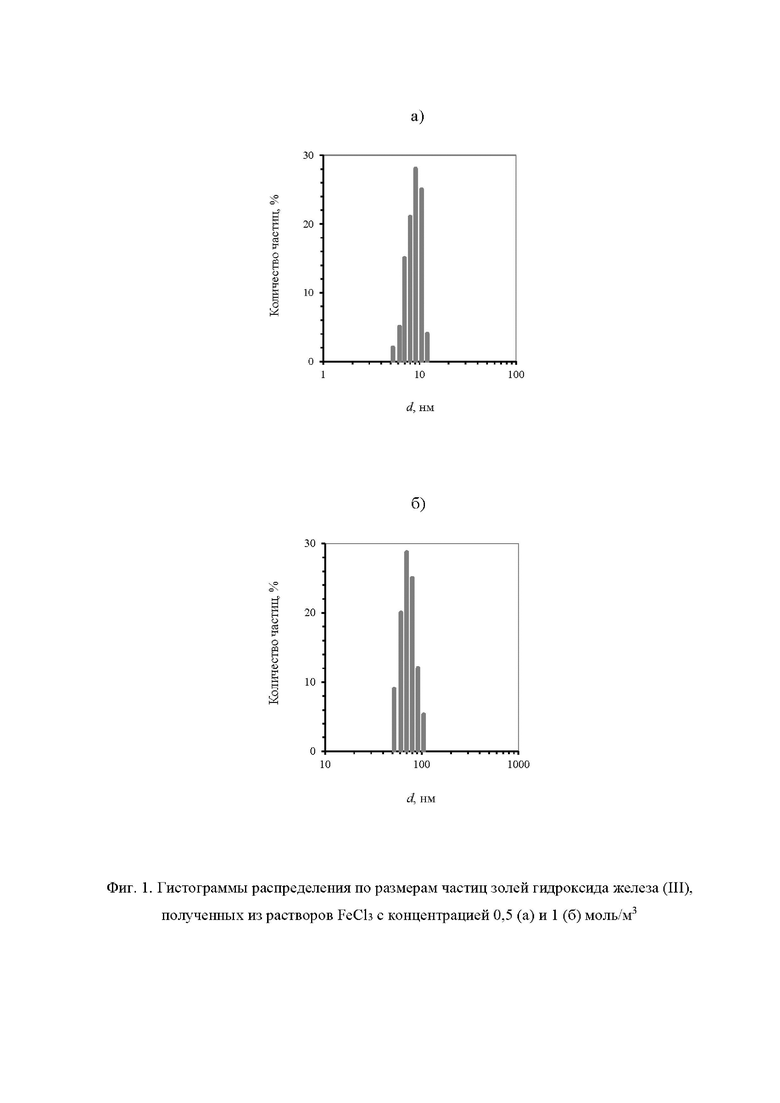
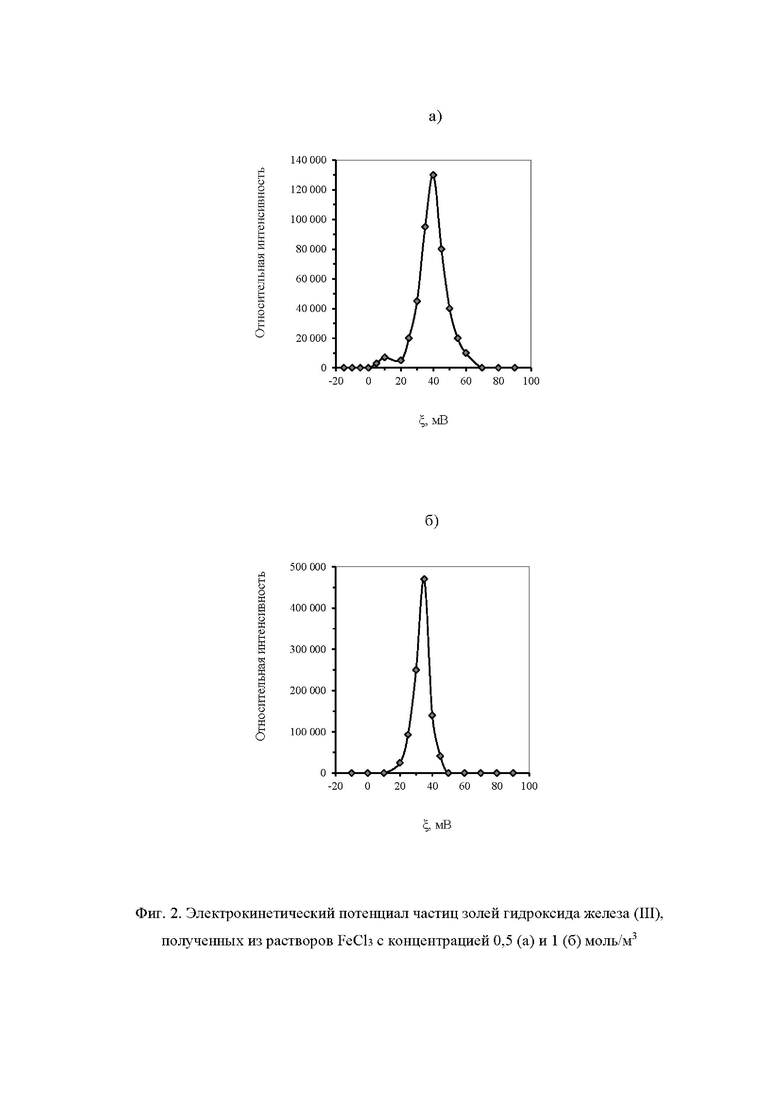
С помощью системы Malvern Zetasizer Nano ZS установлено, что частицы золя гидроксида железа (III), полученного описанным способом, имеют гидродинамический диаметр d = (9±2)⋅10-9 м и электрокинетический потенциал ξ=0,038±0,007 В (фиг. 1а и 2а).
Пример 2.
Эксперименты выполняются так же, как в примере 1, но для синтеза используется раствор FeCl3 с концентрацией 1,0 моль/м3.
Частицы гидроксида железа (III) размером d = (70±8)⋅10-9 м с электрокинетическим потенциалом ξ=0,031±0,004 В образуются через 20 мин после начала реакций гидролиза и ионного обмена (фиг. 1б и 2б).
Библиографический список
1. Судзуки К., Фудзимори Х., Хасимото К. Аморфные металлы. / Под ред. Масумото Ц. Пер. с япон. - М.: Металлургия, 1987. - 328 с.
2. Евтеев А.В., Косилов А.Т., Миленин А.В. Фазовые и структурные превращения в молекулярно-динамической модели железа при сверхбыстром нагреве и охлаждении // Физика твердого тела. - 2001. - Т. 43. Вып. 12. - С. 2187-2192.
3. Пат. 2476620 РФ, МПК C23C 14/38, B82B 3/00, H01F 1/01. Устройство и способ получения наночастиц / Лапшин Р.В., Азанов П.В. - № 2011137468; заявл. 12.09.2011; опубл. 27.02.2013. Бюл. № 6. - 28 с.
4. Пат. 2620432 РФ, МПК C01G 49/08, B82B 3/00, B82Y 30/00. Способ получения магнетита / Юртов Е.В., Мурадова А.Г., Зайцева М.П. - № 2016126952; заявл. 05.07.2016; опубл. 25.05.2017. Бюл. № 15. - 5 с.
5. Пат. 2572418 РФ, МПК C01G 49/08, H01F 1/00. Способ получения магнитоактивного соединения / Хабаров Ю.Г., Бабкин И.М., Вешняков В.А. - № 2014141830; заявл. 16.10.2014; опубл. 10.01.2016. Бюл. № 1. - 8 с.
6. Петрова О.С., Чеканова А.Е., Гудилин Е.А. и др. Синтез и характеризация мезопористых наночастиц γ-Fe2O3 // Альтернативная энергетика и экология. - 2007. - № 1 (45). - С. 70-73.
7. Пат 2655391 РФ, МПК B01J 23/745, B01J 37/04, B01J 37/30, B01J 37/34, C01G 49/08. Способ получения наноразмерного катализатора на основе смешанного оксида железа для интенсификации добычи тяжелого углеводородного сырья и катализатор, полученный этим способом / Ситнов С.А., Мухаматдинов И.И., Вахин А.В. и др. - № 2018108569; заявл. 12.03.2018; опубл. 28.05.2018. Бюл. № 16. - 16 с.
8. Иканина Е.В. Физико-химические закономерности синтеза, микроструктура и функциональные свойства композиционного сорбента катионит КУ-2-8 - гидроксид железа (III): дис. …канд. хим. наук. - Екатеринбург, 2013. - 176 с.
9. Чалый В.П. Гидроокиси металлов (закономерности образования, состав, структура и свойства). - Киев: Наукова думка, 1972. - 157 с.
10. Киреев В.А. Краткий курс физической химии. - М.: Химия, 1978. - 624 с.
Изобретение относится к химической промышленности и может быть использовано в аналитической химии, промышленной экологии и электронике. Сначала в дистиллированную воду помещают катионит в солевой форме. Затем набухший катионит заливают свежеприготовленным водным раствором хлорида железа (III) с концентрацией 0,1-1,0 моль/м3 при их объемном соотношении 1:(100-150). Реакции гидролиза и ионного обмена, в ходе которых происходит насыщение раствора, проводят при температуре 292-298 K и постоянном перемешивании в течение 10-30 мин, в результате чего химическое равновесие реакций гидролиза смещается в сторону образования продуктов реакции. По окончании реакций катионит отделяют от осаждённых частиц, к которым добавляют желатин в качестве стабилизатора. Полученные наночастицы аморфного гидроксида железа (III) имеют гидродинамический диаметр 10-70 нм и электрокинетический потенциал от +0,025 до +0,045 В. Изобретение позволяет исключить использование щелочей при осаждении, а также обеспечить узкое распределение наночастиц аморфного гидроксида железа (III) по размерам. 2 ил., 2 пр.
Способ получения наночастиц аморфного гидроксида железа (III), включающий насыщение раствора в ходе гидролиза и ионного обмена, осаждение частиц и добавление желатина в качестве стабилизатора, отличающийся тем, что химическое равновесие реакций гидролиза смещается в сторону образования продуктов реакции в присутствии катионита в солевой форме в свежеприготовленном водном растворе хлорида железа (III) с концентрацией 0,1-1,0 моль/м3 при объемном соотношении 1:(100-150) и температуре 292-298 K в течение 10-30 мин.
| Способ получения наноразмерного катализатора на основе смешанного оксида железа для интенсификации добычи тяжелого углеводородного сырья и катализатор, полученный этим способом | 2018 |
|
RU2655391C1 |
| УСТРОЙСТВО И СПОСОБ ПОЛУЧЕНИЯ НАНОЧАСТИЦ | 2011 |
|
RU2476620C1 |
| СПОСОБ ПОЛУЧЕНИЯ МАГНИТОАКТИВНОГО СОЕДИНЕНИЯ | 2014 |
|
RU2572418C1 |
| СПОСОБ ПОЛУЧЕНИЯ МАГНЕТИТА | 2016 |
|
RU2620432C1 |
| Пуговица | 0 |
|
SU83A1 |
Авторы
Даты
2023-12-19—Публикация
2022-12-18—Подача