ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Данное изобретение относится к сконструированным мультиспецифическим антителам и другим мультимерным белкам с асимметричными мутациями в области CH2-CH3 и к способам их получения и применения.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Данная заявка содержит перечень последовательностей, представленных через EFS-Web, все содержание которого полностью включено в данный документ посредством ссылки. Текстовый файл ASCII, созданный 29 мая 2018 г., назван JBI5124WOPCT_ST25.txt и имеет размер 164 килобайт.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Программы терапевтических биопрепаратов все чаще преобразуются к биспецифическим антителам для двойного нацеливания, усилиям по перенаправлению клеток и модуляции иммунных контрольных точек; в настоящее время многие биспецифические терапевтические средства находятся в клинических исследованиях (Jachimowicz et al. BioDrugs. 2014 (4):331-43). Разработка биспецифических антител была ограничена сложностью как процессов синтеза, так и процессов выделения и очистки, способных генерировать высокие титры и чистый продукт воспроизводимым и масштабируемым образом, а также отделять биспецифические молекулы от избытка исходных или промежуточных молекул. Разработаны способы специфического объединения в пары тяжелых цепей IgG или полумолекул, включающие выступ-во-впадину, контролируемый обмен Fab-фрагментами, CrossMAb и общие легкие цепи и ортогональную поверхность взаимодействия Fab. Получение молекул на основе Fv (т.е. BiTE, диател) и каркасов, не содержащих IgG, (т.е. DARPin, аднектинов, финомеров и центиринов) повысило интерес к разработке этих молекул в качестве терапевтических средств.
Недостатком Fv в отдельности или альтернативных каркасных молекул является их, как правило, более короткое время жизни в результате экскреции с мочой или лизосомальной деградации из-за их неспособности рециркулировать посредством FcRn. Таким образом, мультиспецифичные молекулы на основе IgG, содержащие интактный домен Fc, являются привлекательными благодаря их более длительному периоду полужизни в сыворотке, способности облегчать эффекторные функции и индуцировать апоптотические пути.
Очистка биспецифических антител может быть сложной из-за множества стадий, необходимых для удаления остаточных исходных и других промежуточных мкАт и молекул фрагментов Ат. Такие молекулы могут иметь биофизические характеристики, которые аналогичны полученным биспецифическим антителам и, таким образом, не могут быть легко отделены хроматографическими методами. Эта трудность при очистке может приводить к снижению выхода или чистоты биспецифической молекулы.
Следовательно, остается потребность в альтернативных биспецифических и мультиспецифических форматах и способе очистки биспецифических и мультиспецифических молекул, таких как антитела.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В изобретении предложено выделенное мультиспецифическое антитело, содержащее первую область CH2-CH3, содержащую мутацию Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R, и вторую область CH2-CH3, содержащую аминокислотный остаток дикого типа в положениях 307, 309 и 311, причем нумерация остатков соответствует индексу EU.
В изобретении также предложено выделенное мультиспецифическое антитело, содержащее первую область СН2-СН3, содержащую мутацию Q311R, и вторую область СН2-СН3, содержащую аминокислотный остаток дикого типа в положении 311, причем нумерация остатков соответствует индексу EU.
В изобретении также предложено выделенное мультиспецифическое антитело, содержащее первую область СН2-СН3, содержащую мутацию Q311K, и вторую область СН2-СН3, содержащую аминокислотный остаток дикого типа в положении 311, причем нумерация остатков соответствует индексу EU.
В изобретении также предложено выделенное мультиспецифическое антитело, содержащее первую область CH2-CH3, содержащую мутацию T307P/L309Q, и вторую область CH2-CH3, содержащую аминокислотный остаток дикого типа в положениях 307 и 309, причем нумерация остатков соответствует индексу EU.
В изобретении также предложено выделенное мультиспецифическое антитело, содержащее первую область CH2-CH3, содержащую мутацию T307P/V309Q, и вторую область CH2-CH3, содержащую аминокислотный остаток дикого типа в положениях 307 и 309, причем нумерация остатков соответствует индексу EU.
В изобретении также предложено выделенное мультиспецифическое антитело, содержащее первую область CH2-CH3, содержащую мутацию T307P/L309Q/Q311R, и вторую область CH2-CH3, содержащую аминокислотный остаток дикого типа в положениях 307, 309 и 311, причем нумерация остатков соответствует индексу EU.
В изобретении также предложено выделенное мультиспецифическое антитело, содержащее первую область CH2-CH3, содержащую мутацию T307P/V309Q/Q311R, и вторую область CH2-CH3, содержащую аминокислотный остаток дикого типа в положениях 307, 309 и 311, причем нумерация остатков соответствует индексу EU.
В изобретении также предложен выделенный полинуклеотид,
содержащий полинуклеотид, кодирующий первую область CH2-CH3, содержащую мутацию Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R;
содержащий полинуклеотид, кодирующий первую область CH2-CH3, содержащую мутацию Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R, и вторую область CH2-CH3, содержащую аминокислотный остаток дикого типа в положениях 307, 309 и 311; или
содержащий полинуклеотидную последовательность SEQ ID NO: 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 87, 88 или 91.
В изобретении также предложен вектор, содержащий
выделенный полинуклеотид, кодирующий первую область CH2-CH3, содержащую мутацию Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R;
выделенный полинуклеотид, содержащий полинуклеотидную последовательность SEQ ID NO: 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 87, 88 или 91;
выделенный полинуклеотид, содержащий полинуклеотид, кодирующий первую область CH2-CH3, содержащую мутацию Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R, и вторую область CH2-CH3, содержащую аминокислотный остаток дикого типа в положениях 307, 309 и 311; или
выделенный полинуклеотид содержит
SEQ ID NO: 27 и 47, соответственно;
SEQ ID NO: 28 и 47, соответственно;
SEQ ID NO: 29 и 47, соответственно;
SEQ ID NO: 30 и 47, соответственно;
SEQ ID NO: 31 и 48, соответственно;
SEQ ID NO: 32 и 48, соответственно;
SEQ ID NO: 33 и 48, соответственно;
SEQ ID NO: 34 и 48, соответственно;
SEQ ID NO: 35 и 49, соответственно;
SEQ ID NO: 36 и 49, соответственно;
SEQ ID NO: 37 и 49, соответственно;
SEQ ID NO: 38 и 49, соответственно;
SEQ ID NO: 39 и 50, соответственно;
SEQ ID NO: 40 и 50, соответственно;
SEQ ID NO: 41 и 50, соответственно;
SEQ ID NO: 42 и 50, соответственно;
SEQ ID NO: 43 и 51, соответственно;
SEQ ID NO: 44 и 51, соответственно;
SEQ ID NO: 45 и 51, соответственно;
SEQ ID NO: 46 и 51, соответственно;
SEQ ID NO: 87 и 89, соответственно;
SEQ ID NO: 87 и 90, соответственно;
SEQ ID NO: 88 и 89, соответственно;
SEQ ID NO: 88 и 90, соответственно;
SEQ ID NO: 92 и 89, соответственно; или
SEQ ID NO: 92 и 90, соответственно.
В изобретении также предлагается клетка-хозяин, содержащая вектор изобретения.
В изобретении также предложен способ получения выделенного мультиспецифического антитела согласно изобретению, включающий:
культивирование клетки-хозяина согласно изобретению в условиях, в которых экспрессируется мультиспецифическое антитело; и
очистку мультиспецифического антитела с использованием аффинной хроматографии лиганда белка A.
В изобретении также предложен способ получения выделенного мультиспецифического антитела, содержащего первую тяжелую цепь, содержащую мутацию Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R, и вторую тяжелую цепь, содержащую аминокислотный остаток дикого типа в положениях 307, 309 и 311, включающий
обеспечение первого исходного антитела, содержащего первую тяжелую цепь, содержащую мутацию Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R, и первую легкую цепь;
обеспечение второго исходного антитела, содержащего вторую тяжелую цепь, содержащую аминокислотный остаток дикого типа в положениях 307, 309 и 311, и вторую легкую цепь;
приведение в контакт первого исходного антитела и второго исходного антитела в образце;
инкубацию образца; и
очистку мультиспецифического антитела с использованием аффинной хроматографии лиганда белка A.
В изобретении также предложено выделенное антитело, содержащее две тяжелые цепи или их фрагменты, имеющие идентичные аминокислотные последовательности, и две легкие цепи или их фрагменты, причем две тяжелые цепи содержат мутацию Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R, причем нумерация остатков соответствует индексу EU.
В изобретении предложен полинуклеотид,
кодирующий тяжелую цепь антитела, содержащую область CH2-CH3 с SEQ ID NO: 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 52, 53 или 56; или
содержащий полинуклеотидную последовательность SEQ ID NO: 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 87, 88 или 91.
В изобретении также предложен мультимерный белок, содержащий первый полипептид и второй полипептид, причем первый полипептид содержит первую область CH2-CH3, содержащую мутацию Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R, и второй полипептид содержит вторую область CH2-CH3, содержащую аминокислотный остаток дикого типа в положениях 307, 309 и 311, причем нумерация остатков соответствует индексу EU.
В изобретении также предложена фармацевтическая композиция, содержащая мультимерный белок согласно изобретению.
В изобретении также предложен способ получения выделенного мультимерного белка, содержащего первую область CH2-CH3, содержащую мутацию Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R, и вторую область CH2-CH3, содержащую аминокислотный остаток дикого типа в положениях 307, 309 и 311, включающий
обеспечение первого исходного белка, содержащего первую область CH2-CH3, содержащую мутацию Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R;
обеспечение второго исходного белка, содержащего вторую область CH2-CH3, содержащую аминокислотный остаток дикого типа в положениях 307, 309 и 311;
приведение в контакт первого исходного белка и второго исходного белка в образце;
инкубацию образца; и
очистку мультиспецифического белка с использованием аффинной хроматографии лиганда белка A.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1A показано выравнивание доменов CH2 человеческого IgG1 и мышиного IgG2a по аминокислотным остаткам от 305 до 315; нумерация остатков соответствует индексу EU.
На Фиг. 1B показаны взаимодействия остатков CH2 IgG1 T307, L309 и Q311 (подчеркнутые остатки на фигуре) с FcRn или Z-доменом (пептидом Z34C). Каждый остаток обеспечивал взаимодействие боковых цепей с остатками в FcRn и с Z-доменом. T307 взаимодействовал с I1 на β2-микроглобулиновом домене FcRn. L309 и Q311R отвечали за взаимодействия как с FcRn, так и с Z-доменом (пунктирные и сплошные линии для L309 и Q311, соответственно). IQRT: SEQ ID NO: 102 (часть цепи β2 FcRn); LNGEEFMDFDLKQGTWGGDWPEA: SEQ ID NO: 103 (часть α-цепи FcRn); VLTVLHQDWLN: SEQ ID NO: 104 (часть домена CH2 IgG1); FNMQCQRRFYEALHDPNLNEEQRNAKIKSIRDDC: SEQ ID NO: 99.
На Фиг. 2A показана кривая зависимости доза - эффект для конкурентного связывания указанных моноспецифических антител и мкАт RSV-L в отношении FcRn с использованием анализа AlphaScreen. На графике показан % наблюдаемого максимального сигнала в зависимости от концентрации конкурента.
На Фиг. 2B показана кривая зависимости доза - эффект для конкурентного связывания указанных моноспецифических или биспецифических антител и мкАт RSV-L в отношении FcRn с использованием анализа AlphaScreen. На графике показан % наблюдаемого максимального сигнала в зависимости от концентрации конкурента.
На Фиг. 3A показана кривая зависимости доза - эффект для конкурентного связывания указанных моноспецифических или биспецифических антител и мкАт RSV-L в отношении FcγRI с использованием анализа AlphaScreen. На графике показан % наблюдаемого максимального сигнала в зависимости от концентрации конкурента.
На Фиг. 3B показана кривая зависимости доза-эффект для конкурентного связывания указанных моноспецифических или биспецифических антител и мкАт RSV-L в отношении FcγRIIa с использованием анализа AlphaScreen. На графике показан % наблюдаемого максимального сигнала в зависимости от концентрации конкурента.
На Фиг. 3C показана кривая зависимости доза - эффект для конкурентного связывания указанных моноспецифических или биспецифических антител и мкАт RSV-L в отношении Fc FcγRIIb с использованием анализа AlphaScreen. На графике показан % наблюдаемого максимального сигнала в зависимости от концентрации конкурента.
На Фиг. 3D показана кривая зависимости доза - эффект для конкурентного связывания указанных моноспецифических или биспецифических антител и мкАт RSV-L для FcγRIIIa с использованием анализа AlphaScreen. На графике показан % наблюдаемого максимального сигнала в зависимости от концентрации конкурента.
На Фиг. 4A показана хроматограмма хроматографии гидрофобного взаимодействия (HIC), демонстрирующая, что биспецифическое антитело может быть отделено от исходных моноспецифических мкАт в подобранных условиях.
На Фиг. 4B показана HIC-хроматограмма образца из смеси эквимолярного количества антител RSV-L[TLQ], и gp120-R, и bsRSV-L[TLQ], полученных с помощью обмена Fab-фрагментами.
На Фиг. 4C представлен профиль элюирования образца из смеси антител RSV-L[TLQ], gp120-R and bsRSV-L[TLQ], полученных с помощью обмена Fab-фрагментов из смолы белка A.
На Фиг. 4D показана HIC-хроматограмма пиков элюирования белка A.
На Фиг. 5A представлен профиль элюирования образца bsRSV-L[TLQ] с обменом Fab-фрагментами в супернатанте.
На Фиг. 5B показаны HIC-анализы элюатов аффинной колонки с белком A при pH 4,7 образца bsRSV-L[TLQ], образованного обменом Fab-фрагментами в супернатанте.
На Фиг. 5C показаны HIC-анализы элюатов аффинной колонки с белком A при pH 4,2 образца bsRSV-L[TLQ], образованного обменом Fab-фрагментами в супернатанте.
На Фиг. 5D показаны HIC-анализы элюатов аффинной колонки с белком A при pH 3,4 образца bsRSV-L[TLQ], образованного обменом Fab-фрагментами в супернатанте.
На Фиг. 6А показана хроматограмма белка А для образца bsRSV-L[Q311R], образованного обменом Fab-фрагментами в супернатанте, демонстрирующая три различных пика, элюирующихся при рН 4,6, 4,2 и 3,4.
На Фиг. 6B показаны HIC-анализы элюатов аффинной колонки с белком A при pH 4,6 образца bsRSV-L[Q311R], образованного обменом Fab-фрагментами в супернатанте.
На Фиг. 6С показаны HIC-анализы элюатов аффинной колонки с белком A при pH 4,2 образца bsRSV-L[Q311R], образованного обменом Fab-фрагментами в супернатанте.
На Фиг. 6D показаны HIC-анализы элюатов аффинной колонки с белком A при pH 3,4 образца bsRSV-L[Q311R], образованного обменом Fab-фрагментами в супернатанте.
На Фиг. 7A показана хроматограмма белка А образца bsTNF-[TLQ], полученного с использованием технологии общей легкой цепи.
На Фиг. 7B показаны HIC-анализы элюатов аффинной колонки c белком A при pH 4,7 образца bsTNF-[TLQ], полученного с использованием технологии общей легкой цепи.
На Фиг. 7C показаны HIC-анализы элюатов аффинной колонки c белком A при pH 4,2 образца bsTNF-[TLQ], полученного с использованием технологии общей легкой цепи.
На Фиг. 7D показаны HIC-анализы элюатов аффинной колонки c белком A при pH 3,4 образца bsTNF-[TLQ], полученного с использованием технологии общей легкой цепи.
На Фиг. 8 показан фармакокинетический анализ указанных антител у гемизиготных мышей Tg32. На графике показана концентрация каждого мкАт, нормированная к начальной временной точке на графике линейной фазы в зависимости от времени. Каждая точка отражает среднее значение+стандартную ошибку для четырех животных на группу.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Все публикации, включая, без ограничений, патенты и заявки на патенты, цитируемые в данном описании, включены в настоящий документ путем ссылки, как если бы они были полностью изложены в настоящем документе.
Следует понимать, что применяемые в настоящем документе термины предназначены только для цели описания конкретных вариантов осуществления и не имеют ограничительного характера. Все применяемые в настоящем документе технические и научные термины, если не указано иное, имеют общепринятое значение, понятное обычному специалисту в области, к которой относится изобретение.
В настоящем документе описаны примеры материалов и способов, хотя при практическом осуществлении для проверки настоящего изобретения могут применяться любые способы и материалы, аналогичные или эквивалентные тем, которые описаны в настоящем документе. При описании и изложении формулы настоящего изобретения будут применяться следующие термины.
Определения
При использовании в этом описании и в прилагаемой формуле изобретения формы единственного числа включают и множественное число, если содержание текста ясно не указывает на иное. Так, например, ссылка на «клетку» включает в себя комбинацию двух или более клеток и т. п.
Термин «мультимерный белок» относится к белку, состоящему из двух или более отдельных полипептидных цепей, которые объединяются с образованием одного белка. Полипептидные цепи могут быть связаны нековалентно или ковалентно, например, посредством дисульфидных связей.
Термин «связывание» относится к специфическому связыванию двух белков, такому как связывание антитела с антигеном или связывание мультиспецифического белка с его лигандом. Термин «специфическое связывание» относится к предпочтительному связыванию двух белков, как правило, с равновесной константой диссоциации (KD) около 1×10-8 M или менее, например, около 1×10-9 M или менее, около 1×10-10 M или менее, около 1×10-11 M или менее или около 1×10-12 M или менее, как правило, с KD, которая по меньшей мере в сто раз ниже его KD связывания с неспецифическим антигеном (например, БСА, казеином).
Термин «сниженное связывание» относится к измеримому снижению связывания антител или мультиспецифических белков согласно изобретению, имеющих по меньшей мере одну мутацию в области CH2-CH3 с лигандом белка A по сравнению с связыванием исходной молекулы без мутации.
Термин «модулирует связывание» относится к измеримой разнице в связывании антител или мультиспецифических белков согласно изобретению, имеющих по меньшей мере одну мутацию в области CH2-CH3 с FcγR или FcRn.
Термин «антиген» относится к молекуле, такой как белок, или к фрагменту белка, который способен к вызову иммунного ответа у субъекта.
Термин «асимметричные стабилизирующие мутации» относится к мутациям в первой области CH2-CH3 и во второй области CH2-CH3, которые находятся в различных положениях в первой и второй областях CH2-CH3 и способствуют (например, стабилизируют) образованию гетеродимера между первой областью CH2-CH3 и второй областью CH2-CH3 по сравнению с образованием гомодимера между первой областью CH2-CH3 или второй областью CH2-CH3.
Термин «гетерологичный белок» относится к полипептиду или белку, который естественным образом не является частью полипептида, содержащего область CH2-CH3 в эндогенной клетке.
Термин «домен фибронектина типа III (FN3)» («домен FN3») относится к домену, часто встречающемуся в белках, включая фибронектины, тенасцин, белки внутриклеточного цитоскелета, цитокиновые рецепторы и прокариотические ферменты (Bork and Doolittle, Proc Nat Acad Sci USA 89:8990-8994, 1992; Meinke et al., J Bacteriol 175:1910-1918, 1993; Watanabe et al., J Biol Chem 265:15659-15665, 1990). Примеры доменов FN3 представляют собой 15 разных доменов FN3, присутствующих в тенасцине С человека, 15 разных доменов FN3, присутствующих в фибронектине (FN) человека, и синтетические домены FN3 неприродного происхождения, описанные, например, в патенте США № 8,278,419. Отдельные домены FN3 обозначают по номеру домена и названию белка, например 3-й домен FN3 тенасцина (TN3) или 10-й домен FN3 фибронектина (FN10). Домены FN3 могут быть сконструированы таким образом, чтобы связывать антиген с высокой специфичностью и аффинностью.
Термин «финомер» относится к антигенсвязывающему белку, полученному из домена SH3 Fyn человека, который может быть сконструирован таким образом, чтобы связывать антиген с высокой специфичностью и аффинностью.
Термин «антитела» понимается в широком значении и включает молекулы иммуноглобулинов, в том числе моноклональные антитела, включая мышиные, кроличьи, человеческие, гуманизированные и химерные моноклональные антитела, антигенсвязывающие фрагменты, моноспецифические, биспецифические или мультиспецифические антитела, димерные, тетрамерные или мультимерные антитела, одноцепочечные антитела, доменные антитела и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит антигенсвязывающий сайт требуемой специфичности. «Полноразмерные антитела» состоят из двух тяжелых цепей (HC) и двух легких цепей (LC), соединенных между собой дисульфидными связями, а также из их мультимеров (например, IgM). Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (VH) и константной области тяжелой цепи (состоящей из доменов CH1, шарнирной области CH2 и CH3). Каждая легкая цепь состоит из вариабельной области легкой цепи (VL) и константной области легкой цепи (CL). VH и VL можно дополнительно подразделить на области гипервариабельности, называемые определяющими комплементарность областями (CDR), между которыми расположены каркасные области (FR). Каждая область VH и VL состоит из трех CDR и четырех сегментов FR, размещенных в направлении от N-конца к C-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, и FR4.
«Определяющие комплементарность области (CDR)» представляют собой области антитела, которые связываются с антигеном. Существует три CDR, в VH (HCDR1, HCDR2, HCDR3) и три CDR в VL (LCDR1, LCDR2, LCDR3). CDR можно определить с помощью различных систем разграничения, таких как Кабат (Wu and Kabat, J Exp Med 132: 211-250, 1970; Kabat et al Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md., 1991), Chothia (Chothia and Lesk, J Mol Biol 196: 901-917, 1987) и IMGT (Lefranc et al., Dev Comp Immunol 27:55-77, 2003). Описано соответствие между различными разграничениями и нумерацией вариабельных областей (см., например, Lefranc et al., Dev Comp Immunol 27: 55-77, 2003; Honegger and Pluckthun, J Mol Biol 309:657-70, 2001; Международная база данных ImMunoGeneTics (IMGT); Веб-ресурсы, http://www_imgt_org). Для разграничения CDR можно использовать доступные программы, такие как abYsis, компании UCL Business PLC. Термины «CDR», «HCDR1», «HCDR2», «HCDR3», «LCDR1», «LCDR2» и «LCDR3» в настоящем документе включают в себя CDR, определенные любым из способов, описанных выше, по Kabat, Chothia или IMGT, если в описании явным образом не указано иное.
В зависимости от аминокислотной последовательности константной области тяжелой цепи иммуноглобулины могут относиться к пяти основным классам - IgA, IgD, IgE, IgG и IgM. IgA и IgG далее подразделяются на изотипы IgA1, IgA2, IgG1, IgG2, IgG3 и IgG4. Легкие цепи антител любых видов позвоночных в зависимости от аминокислотных последовательностей их константных областей можно отнести к одному из двух четко отличающихся типов, а именно каппа (κ) и лямбда (λ).
Термин «антигенсвязывающий фрагмент» относится к части молекулы иммуноглобулина, которая сохраняет антигенсвязывающие свойства родительского полноразмерного антитела. Иллюстративными антигенсвязывающими фрагментами являются определяющие комплементарность области тяжелой цепи (HCDR) 1, 2 и/или 3, определяющие комплементарность области легкой цепи (LCDR) 1, 2 и/или 3, VH, VL, VH и VL, фрагменты Fab, F(ab')2, Fd и Fv, а также доменные антитела (dAb), состоящие или из одного домена VH, или из одного домена VL. Домены VH и VL могут быть связаны вместе посредством синтетического линкера с образованием различных типов конфигураций одноцепочечных антител, в которых домены VH/VL соединяются в пару внутримолекулярно или межмолекулярно в тех случаях, когда домены VH и VL экспрессируются в виде отдельных цепей с образованием одновалентного антигенсвязывающего сайта, например одноцепочечного Fv (scFv) или диатела; они описаны, например, в международной патентной публикации № WO1998/44001, международной патентной публикации № WO1988/01649; международной патентной публикации № WO1994/13804; международной патентной публикации № WO1992/01047.
Термин «область CH2-CH3» относится к части константного домена человеческого антитела и включает аминокислотные остатки 231-446 (нумерация остатков соответствует индексу EU). В области CH2-CH3 может быть удален C-концевой лизин в положении 447.
Термин «моноклональное антитело» относится к популяции антител с одинаковым аминокислотным составом в каждой тяжелой и каждой легкой цепи за исключением возможных известных изменений, таких как удаление C-концевого лизина из тяжелой цепи антитела. Моноклональные антитела, как правило, специфически связываются с одним антигенным эпитопом, за исключением биспецифических или мультиспецифических моноклональных антител, которые связываются с двумя или более отличными антигенными эпитопами. В пределах популяции антител моноклональные антитела могут иметь гетерогенное гликозилирование. Моноклональное антитело может быть моноспецифическим или мультиспецифическим, или моновалентным, бивалентным или мультивалентным. Биспецифическое антитело включено в термин «моноклональное антитело».
Термин «выделенный» относится к однородной популяции молекул (таких как синтетические полинуклеотиды или белок, такой как антитело), которые были по существу отделены и/или очищены от других компонентов той системы, в которой данные молекулы формировались, такой как рекомбинантная клетка, а также к белку, который был подвергнут по меньшей мере одной стадии очистки или выделения. Термин «выделенное антитело» относится к антителу, которое по существу не содержит иных клеточного материала и/или реагентов, и охватывает антитела, которые выделены до относительно высокой чистоты, такой как 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% чистоты.
Термин «гуманизированное антитело» относится к антителу, в котором последовательности CDR получены из видов, отличных от человека, а каркасные области получены из последовательностей иммуноглобулинов человека. Гуманизированное антитело может содержать замены в каркасных областях, в результате чего каркасная область может не являться точной копией экспрессируемого человеческого иммуноглобулина или генных последовательностей иммуноглобулина зародышевой линии человека.
Термин «человеческое антитело» относится к антителу, которое оптимизировано для обеспечения минимального иммунного ответа при введении субъекту - человеку. Вариабельные области человеческого антитела получены из последовательностей иммуноглобулинов зародышевой линии человека. Если антитело содержит константную область или часть константной области, то константная область также получена из последовательностей иммуноглобулинов зародышевой линии человека.
Человеческое антитело содержит вариабельные области тяжелой или легкой цепи, которые «получены из» последовательностей иммуноглобулинов зародышевой линии человека, если вариабельные области антитела получены из системы, в которой используются гены иммуноглобулина зародышевой линии человека. Такими примерами систем являются библиотеки генов человеческих иммуноглобулинов, отображаемые на фаге, или клетки млекопитающих и трансгенные животные, отличные от человека, такие как мыши или крысы, несущие локусы человеческих иммуноглобулинов. «Человеческое антитело», как правило, содержит аминокислотные отличия по сравнению с иммуноглобулинами, экспрессируемыми у людей, обусловленные, например, введением соматических мутаций, намеренным введением замен в каркасную область или CDR, и изменениями аминокислот, введенными во время клонирования и рекомбинации VJD у животных, отличных от человека. «Человеческое антитело» является по меньшей мере на около 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичным аминокислотной последовательности, кодируемой последовательностями иммуноглобулинов зародышевой линии человека. В некоторых случаях «человеческое антитело» может содержать консенсусные каркасные последовательности, полученные из анализов человеческой каркасной последовательности, например, как описано в Knappik et al., J Mol Biol 296: 57-86, 2000, или синтетический HCDR3, включенный в библиотеки генов человеческих иммуноглобулинов, отображаемые на фаге, например, как описано в Shi et al., J Mol Biol 397: 385-396, 2010 и в международной патентной публикации № WO2009/085462. Антитела, в которых CDR получены от видов, отличных от человека, не подходят под определение антитела человека.
Термин «рекомбинантный» относится к антителам и другим белкам, которые приготовлены, экспрессированы, созданы или выделены рекомбинантными средствами.
Термин «мультиспецифический» относится к белку, такому как антитело, которое специфически связывает два или более различных антигенов или два или более различных эпитопов в пределах одного антигена. Мультиспецифический белок может иметь перекрестную реактивность с другими родственными антигенами, например, таким же антигеном от других видов (гомологов), таких как человек или обезьяна, например, Macaca fascicularis (яванский макак, крабоед), Pan troglodytes (шимпанзе), Callithrix jacchus (игрунка обыкновенная, мармозет), или может связывать эпитоп, который имеется в двух или более разных антигенах.
Термин «биспецифический» относится к белку, такому как антитело, которое специфически связывает два разных антигена или два разных эпитопа в пределах одного антигена. Биспецифический белок может иметь перекрестную реактивность с другими родственными антигенами, например, таким же антигеном от других видов (гомологов), таких как человек или обезьяна, например, Macaca fascicularis (яванский макак, крабоед), Pan troglodytes (шимпанзе), Callithrix jacchus (игрунка обыкновенная, мармозет), или может связывать эпитоп, который имеется в двух или более разных антигенах.
Термин «моноспецифический» относится к белку, такому как антитело, которое специфически связывает один отдельный антиген или отдельный эпитоп. Моноспецифический белок может иметь перекрестную реактивность с другими родственными антигенами, например, таким же антигеном от других видов (гомологов), таких как человек или обезьяна, например, Macaca fascicularis (яванский макак, крабоед), Pan troglodytes (шимпанзе), Callithrix jacchus (игрунка обыкновенная, мармозет), или может связывать эпитоп, который имеется в двух или более разных антигенах.
Термин «вектор» относится к полинуклеотиду, который способен к удвоению внутри биологической системы, или может быть перемещен между такими системами. Полинуклеотиды-векторы обычно содержат некоторые функциональные элементы, такие как точки начала репликации, сигналы полиаденилирования или селективные маркеры, способствующие дупликации или сохранению данных полинуклеотидов в биологической системе, такой как клетка, вирус, животное, растение, а также в реконструированных биологических системах.
«Аффинная хроматография лиганда белка A» относится к способу аффинной хроматографии, в котором используется аффинность IgG-связывающих доменов лиганда белка A к области Fc молекулы иммуноглобулина. Данная область Fc содержит человеческие или животные константные домены иммуноглобулина CH2 и CH3 или домены иммуноглобулина, по существу подобные этим. Лиганд белка A охватывает нативный белок A из клеточной стенки Staphylococcus aureus, белок A, полученный рекомбинантными или синтетическими способами, и варианты, которые сохраняют способность связываться с областью Fc. На практике хроматография лиганда белка А включает использование лиганда белка A, иммобилизованного на твердой неподвижной фазе. См. Gagnon, Protein A Affinity Chromatography, Purification Tools for Monoclonal Antibodies, pp. 155-198, Validated Biosystems, 1996. Твердая неподвижная фаза представляет собой неводную матрицу, к которой прикрепляется лиганд белка A. К таким широко известным неподвижным фазам относятся агароза, сефароза, стекло, кремнезем, полистирол, нитроцеллюлоза, древесный уголь, песок, целлюлоза и любой другой подходящий материал. Для прикрепления второго белка к твердой неподвижной фазе можно использовать любой подходящий хорошо известный способ. Такие твердые неподвижные фазы с лигандом иммобилизованного белка A и без него можно легко приобрести из многих коммерческих источников, включая, например, Vector Laboratory (Burlingame, штат Калифорния), Santa Cruz Biotechnology (Санта Круз, штат Калифорния), BioRad (Геркулес, штат Калифорния), Amersham Biosciences (часть GE Healthcare, Упсала, Швеция), Pall (Порт Вашингтон, штат Нью-Йорк) и EMD Millipore (Биллерика, штат Массачусетс). Лиганд белка A, иммобилизованный на пористой стеклянной матрице, доступен в продаже под названием PROSEP®-A (Millipore). Твердая фаза также может представлять собой матрицу на основе агарозы. Лиганд белка A, иммобилизованный на агарозной матрице, доступен в продаже под названием MABSELECT™ (Amersham Biosciences).
Термин «экспрессионный вектор» относится к вектору, который можно использовать в биологической системе или реконструированной биологической системе для управления трансляцией полипептида, кодируемого полинуклеотидной последовательностью, присутствующей в экспрессионном векторе.
Термин «полинуклеотид» относится к синтетической молекуле, содержащей цепь нуклеотидов, ковалентно связанных через сахарофосфатную основную цепь или другую эквивалентную ковалентную химическую структуру. кДНК является иллюстративным примером синтетического полинуклеотида.
Термин «полипептид» или «белок» относится к молекуле, которая содержит по меньшей мере два аминокислотных остатка, связанных пептидной связью с образованием полипептида. Малые полипептиды, содержащие менее 50 аминокислот, могут называться «пептидами».
Термин «вариант» относится к полипептиду или полинуклеотиду, который отличается от эталонного полипептида или эталонного полинуклеотида одной или более модификациями, например одной или более заменами, вставками или делециями.
Термин «валентный» относится к наличию в молекуле установленного числа сайтов связывания, специфичных для антигена. Таким образом, термины «моновалентный», «двухвалентный», «четырехвалентный» и «шестивалентный» относятся к наличию в молекуле одного, двух, четырех и шести сайтов связывания соответственно, специфичных для антигена.
Термин «лиганд белка A» относится к природному или модифицированному стафилококковому белку A и включает домены сконструированного белка A. Сконструированный белок A может представлять собой, например, Z-домен, варианты Z-домена, Y-домен или сконструированный белок A, в котором отсутствуют D- и E-домены. Домены сконструированного белка A могут быть неспособными связываться (или связываться с очень низкой аффинностью, если она вообще присутствует) с доменом VH3 иммуноглобулина, но могут по-прежнему связываться с областью CH2-CH3 IgG1, IgG2 и IgG4.
«Z-домен» представляет собой синтетический сконструированный вариант B-домена белка A Staphylococcus aureus с мутациями A1V и G29A по сравнению с B-доменом дикого типа белка A. Z-домен, который содержит аминокислотную последовательность SEQ ID NO: 1. Дополнительные варианты Z-домена представляют собой варианты, имеющие аминокислотные последовательности SEQ ID NO: 99, 100 и 101 и те, что описаны в US2006/0194950.
SEQ ID NO: 1
VDNKFNKEQQNAFYEILHLPNLNEEQRNAFIQSLKDDPSQSANLLAEAKKLNDAQAPK
SEQ ID NO: 99
FNMQCQRRFYEALHDPNLNEEQRNAKIKSIRDDC
SEQ ID NO: 100
VDNKFNKEQQNAFYEILHLPNLNEEQRNAFIQSLKDDPSQSANLLAEAKKLNDAQAPK
SEQ ID NO: 101
FNMQQQRRFYEALHDPNLNEEQRNAKIKSIRDD
Нумерация аминокислотных остатков в константной области антитела в тексте описания приведена в соответствии с индексом EU, как описано в публикации Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991), если явно не указано иное. Соответствие между различными системами нумерации константных доменов доступно в международной базе данных ImMunoGeneTics (IMGT); Веб-ресурсы, http://www_imgt_org).
В настоящем документе применяются традиционные одно- и трехбуквенные коды обозначения аминокислот, как показано в таблице 1.
Таблица 1.
Химические соединения: мультиспецифические антитела
В данном изобретении предложены мультиспецифические антитела и другие мультимерные белки, содержащие область CH2-CH3, имеющие асимметричные мутации в области CH2-CH3, которые облегчают их очистку при помощи хроматографии лиганда белка A, кодирующих их полинуклеотидов, векторов и клеток-хозяев, а также способов их получения и применения.
Получение и очистка полноразмерных биспецифических антител требует эффективного разделения биспецифических антител от избытка исходных и/или промежуточных молекул. В данном документе были определены мутации Fc, которые снижают связывание мутированной тяжелой цепи с лигандом белка A. Таким образом, биспецифические антитела, имеющие эти мутации Fc, расположенные асимметрично (например, только в одной тяжелой цепи), могут быть очищены от исходных антител на основании их профиля дифференциального элюирования из аффинных колонок с лигандом белка A.
Были разработаны различные способы специфического объединения в пары тяжелых цепей или полумолекул IgG, и они включают выступ-во-впадину (см., например, патент США № 7695936) CrossMAb (Schaefer et al., Proc Natl Acad Sci USA 108: 11187-11192, 2011), контролируемый обмен Fab-фрагментов (Labrijn et al., Proc Natl Acad Sci USA 110: 5145-5150, 2013), общие легкие цепи (см., например, патент США № 7951917) и ортогональную поверхность взаимодействия Fab (Lewis et al., Nat Biotechnol 32:191-198, 2014). Композиции и способы, описанные в данном документе, обеспечивают дополнительно улучшенные способы создания и очистки биспецифических антител.
FcRn отвечает за перенос материнского IgG плоду и за защиту сывороточного IgG от лизосомальной деградации. Оба этих процесса зависят от способности FcRn связываться с KD около 600 нМ с IgG при кислотном pH (<6,5) в рециркулирующей эндосоме и диссоциировать при нейтральном pH, высвобождая IgG обратно в сыворотку (Roopenian and Akilesh, Nat Rev Immunol 7: 715-725, 2007). IgG связывается с FcRn на поверхности раздела CH2-CH3, так что один Fc содержит два идентичных сайта связывания FcRn. Структурные и биохимические исследования показали, что один Fc связывает два гетеродимера FcRn, хотя эндоцитарный перенос может включать мультимеризацию самого FcRn на поверхности мембраны. Несколько исследований показали, что модулирование взаимодействия между Fc и FcRn сильно влияет на время жизни в сыворотке (Dall ' Acqua et al., J Immunol 169: 5171-5180, 2002; Hinton et al., J Biol Chem 279(8): 6213-6216, 2004; Hinton et al., J Immunol 176: 346-356, 2006; Vaccaro et al., Nat Biotechnol 23: 1283-1288, 2005; Yeung et al., J Immunol 182: 7663-7671, 2009; Stapleton et al., Nat Commun 2: 599, 2011), что приводит к выводу, что FcRn в основном отвечает за определение время жизни IgG в сыворотке у взрослых.
Попытки модулировать характеристики связывания лиганда белка A для Ат часто связаны со значительно уменьшенным периодом полужизни в сыворотке, поскольку и белок A, и неонатальный Fc-рецептор (FcRn) имеют сайт связывания на Fc. Мутации, введенные в данном месте, не снижают связывание Fc с FcRn и, следовательно, не уменьшают период полужизни сконструированных антител в сыворотке. Одна из введенных мутаций Q311R привела к некоторому усилению связывания с FcRn и увеличению периода полужизни антитела в сыворотке.
В то время как примеры описывают успешное конструирование и очистку мультиспецифических полноразмерных антител из исходных антител, технология, описанная в данном документе, применима к любому мультимерному белку, который содержит две области CH2-CH3.
В изобретении предложено выделенное мультиспецифическое антитело, содержащее первую область CH2-CH3, содержащую мутацию Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R, и вторую область CH2-CH3, содержащую аминокислотный остаток дикого типа в положениях 307, 309 и 311, причем нумерация остатков соответствует индексу EU.
Выделенное мультиспецифическое антитело с асимметричными мутациями Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R можно эффективно очищать от исходных антител с использованием аффинной хроматографии лиганда белка A. Введенные мутации Q311K, T307P/L309Q и T307P/L309Q/Q311R не снижают связывание сконструированных антител с FcRn или FcγR и, следовательно, не предполагают изменения периода полужизни антитела или эффекторных функций. Введенная мутация Q311R повышала связывание с FcRn и период полужизни антитела в сыворотке.
В изобретении также предложено выделенное мультиспецифическое антитело, содержащее первую область СН2-СН3, содержащую мутацию Q311R, и вторую область СН2-СН3, содержащую аминокислотный остаток дикого типа в положении 311, причем нумерация остатков соответствует индексу EU.
В изобретении также предложено выделенное мультиспецифическое антитело, содержащее первую область СН2-СН3, содержащую мутацию Q311K, и вторую область СН2-СН3, содержащую аминокислотный остаток дикого типа в положении 311, причем нумерация остатков соответствует индексу EU.
В изобретении также предложено выделенное мультиспецифическое антитело, содержащее первую область CH2-CH3, содержащую мутацию T307P/L309Q, и вторую область CH2-CH3, содержащую аминокислотный остаток дикого типа в положениях 307 и 309, причем нумерация остатков соответствует индексу EU.
В изобретении также предложено выделенное мультиспецифическое антитело, содержащее первую область CH2-CH3, содержащую мутацию T307P/V309Q, и вторую область CH2-CH3, содержащую аминокислотный остаток дикого типа в положениях 307 и 309, причем нумерация остатков соответствует индексу EU.
В изобретении также предложено выделенное мультиспецифическое антитело, содержащее первую область CH2-CH3, содержащую мутацию T307P/L309Q/Q311R, и вторую область CH2-CH3, содержащую аминокислотный остаток дикого типа в положениях 307, 309 и 311, причем нумерация остатков соответствует индексу EU.
В изобретении также предложено выделенное мультиспецифическое антитело, содержащее первую область CH2-CH3, содержащую мутацию T307P/V309Q/Q311R, и вторую область CH2-CH3, содержащую аминокислотный остаток дикого типа в положениях 307, 309 и 311, причем нумерация остатков соответствует индексу EU.
В некоторых вариантах осуществления первая область CH2-CH3 имеет сниженное связывание с лигандом белка A по сравнению со второй областью CH2-CH3.
Связывание с лигандом белка А может быть определено экспериментально с использованием любого подходящего способа. В таких способах могут использоваться аппараты ProteOn XPR36, Biacore 3000 или KinExA. Измеренное значение аффинности может изменяться при измерении в различных условиях (например, осмолярности, pH). Таким образом, измерения аффинности и других параметров связывания (например, KD, Kon, Koff), как правило, проводятся в стандартизированных условиях и с использованием стандартизированного буфера, такого как буфер, описанный в данном документе. Альтернативно связывание с лигандом белка А может быть оценено непосредственно с использованием хроматографии лиганда белка А с использованием градиента рН. Молекулы со сниженным связыванием с лигандом белка A при более высоком значении pH. В качестве примера хроматографии лиганда белка A можно использовать колонку mAbSelect Sure (GE Healthcare), а образцы элюируют в 3 стадии, используя буферы, содержащие 50 мМ цитрата, при pH около 4,7, 4,2 или 3,4.
В некоторых вариантах осуществления изобретения лиганд белка A содержит стафилококковый белок A.
В некоторых вариантах осуществления лиганд белка A содержит Z-домен.
В некоторых вариантах осуществления Z-домен содержит аминокислотную последовательность SEQ ID NO: 1.
В некоторых вариантах осуществления лиганд белка A содержит Y-домен.
В некоторых вариантах осуществления лиганд белка А содержит аминокислотную последовательность SEQ ID NO: 99.
В некоторых вариантах осуществления лиганд белка А содержит аминокислотную последовательность SEQ ID NO: 100.
В некоторых вариантах осуществления лиганд белка А содержит аминокислотную последовательность SEQ ID NO: 101.
Стафилококковый белок A (spA) содержит 5 гомологичных спиральных IgG-связывающих доменов, обозначаемых E, D, A, B и C (Uhlen, Guss et al. 1984). Каждый из этих доменов достаточен для связывания с областью Fc, однако spA также связывается с областью VH членов семейства VH3 человека (Romagnani et al., J Immunol 129:596-602, 1982; Sasso et al., J Immunol 147: 1877-1883, 1991). Повышающие стабильность мутации, введенные в домен B или домен C spA, привели к образованию синтетического Z-домена и Y-домена, соответственно, которые устойчивы к обработке в условиях высокого pH и связывают только Fc. Тандемные или тетрамерные Z-домены, тетрамерные Y-домены или нативный spA были включены в коммерческие аффинные смолы, такие как MabSelect SuRe (GE), TOYOPEARL AF-rProtein A HC-650F и MabSelect Xtra.
В некоторых вариантах осуществления мультиспецифическое антитело представляет собой изотип IgG1.
В некоторых вариантах осуществления мультиспецифическое антитело представляет собой изотип IgG2.
В некоторых вариантах осуществления мультиспецифическое антитело представляет собой изотип IgG4.
Хотя в этих примерах представлены экспериментальные данные об успешной генерации и очистке мультиспецифических антител IgG1, ожидается, что идентифицированные мутации будут также функционировать на изотипах IgG2 и IgG4, поскольку остатки 307 и 311 являются консервативными во всех трех изотипах, а положение 309 является консервативным между IgG1 и IgG4 с консервативной заменой Leu на Val в IgG2.
В некоторых вариантах осуществления связывание мультиспецифического антитела с FcγR сопоставимо с таковым у исходного антитела без мутации.
В некоторых вариантах осуществления FcγR представляет собой FcγRI, FcγRIIa, FcγRIIb и/или FcγRIIIa.
В некоторых вариантах осуществления FcγR представляет собой FcγRI.
В некоторых вариантах осуществления FcγR представляет собой FcγRIIa.
В некоторых вариантах осуществления FcγR представляет собой FcγRIIb.
В некоторых вариантах осуществления FcγR представляет собой FcγRIIIa.
Иллюстративные мультиспецифические антитела с сопоставимым связыванием с FcγR представляют собой мультиспецифические антитела с мутациями Q311R или T307P/L309Q/Q311R.
В некоторых вариантах осуществления связывание мультиспецифического антитела с FcRn сопоставимо с таковым исходным антителом без мутации.
Иллюстративные мультиспецифические антитела с сопоставимым связыванием с FcRn представляют собой мультиспецифические антитела с мутациями Q311K или T307P/L309Q/Q311R.
В некоторых вариантах осуществления связывание мультиспецифического антитела с FcRn усиливается по сравнению со связыванием исходного антитела без мутации с FcRn.
Иллюстративные мультиспецифические антитела с усиленным связыванием с FcRn представляют собой антитела с мутацией Q311R.
В изобретении также предложено выделенное мультиспецифическое антитело, содержащее первую область CH2-CH3, содержащую мутацию Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R, и вторую область CH2-CH3, содержащую аминокислотный остаток дикого типа в положениях 307, 309 и 311, причем нумерация остатков соответствует индексу EU, при этом мультиспецифическое антитело дополнительно содержит асимметричные стабилизирующие мутации в первой области CH2-CH3 и во второй области CH2-CH3.
В некоторых вариантах осуществления асимметричные стабилизирующие мутации в первой области CH2-CH3 и во второй области CH2-CH3 или во второй области CH2-CH3 и в первой области CH2-CH3 представляют собой
F405L и K409R, соответственно;
дикого типа и F405L/R409K, соответственно;
T366W и T366S/L368A/Y407V, соответственно;
T366Y/F405A и T394W/Y407T, соответственно;
T366W/F405W и T394S/Y407A, соответственно;
F405W/Y407A и T366W/T394S, соответственно;
L351Y/F405A/Y407V и T394W, соответственно;
T366I/K392M/T394W и F405A/Y407V, соответственно;
T366L/K392M/T394W и F405A/Y407V, соответственно;
L351Y/Y407A и T366A/K409F, соответственно;
L351Y/Y407A и T366V/K409F, соответственно;
Y407A и T366A/K409F, соответственно;
D399K/E356K и K409D/K392D, соответственно; или
D399K/E356K/E357K и K409D/K392D/K370, соответственно.
В некоторых вариантах осуществления асимметричные стабилизирующие мутации в первой области CH2-CH3 и во второй области CH2-CH3 или во второй области CH2-CH3 и в первой области CH2-CH3 представляют собой F405L и K409R, соответственно.
В некоторых вариантах осуществления асимметричные стабилизирующие мутации в первой области CH2-CH3 и во второй области CH2-CH3 или во второй области CH2-CH3 и в первой области CH2-CH3 представляют собой дикий тип и F405L/R409K соответственно.
В некоторых вариантах осуществления асимметричные стабилизирующие мутации в первой области CH2-CH3 и во второй области CH2-CH3 или во второй области CH2-CH3 и в первой области CH2-CH3 представляют собой T366W и T366S/L368A/Y407V, соответственно.
В некоторых вариантах осуществления асимметричные стабилизирующие мутации в первой области CH2-CH3 и во второй области CH2-CH3 или во второй области CH2-CH3 и в первой области CH2-CH3 представляют собой T366Y/F405A и T394W/Y407T, соответственно.
В некоторых вариантах осуществления асимметричные стабилизирующие мутации в первой области CH2-CH3 и во второй области CH2-CH3 или во второй области CH2-CH3 и в первой области CH2-CH3 представляют собой T366W/F405W и T394S/Y407A, соответственно.
В некоторых вариантах осуществления асимметричные стабилизирующие мутации в первой области CH2-CH3 и во второй области CH2-CH3 или во второй области CH2-CH3 и в первой области CH2-CH3 представляют собой F405W/Y407A и T366W/T394S, соответственно.
В некоторых вариантах осуществления асимметричные стабилизирующие мутации в первой области CH2-CH3 и во второй области CH2-CH3 или во второй области CH2-CH3 и в первой области CH2-CH3 представляют собой L351Y/F405A/Y407V и T394W, соответственно.
В некоторых вариантах осуществления асимметричные стабилизирующие мутации в первой области CH2-CH3 и во второй области CH2-CH3 или во второй области CH2-CH3 и в первой области CH2-CH3 представляют собой T366I/K392M/T394W и F405A/Y407V, соответственно.
В некоторых вариантах осуществления асимметричные стабилизирующие мутации в первой области CH2-CH3 и во второй области CH2-CH3 или во второй области CH2-CH3 и в первой области CH2-CH3 представляют собой T366L/K392M/T394W и F405A/Y407V, соответственно.
В некоторых вариантах осуществления асимметричные стабилизирующие мутации в первой области CH2-CH3 и во второй области CH2-CH3 или во второй области CH2-CH3 и в первой области CH2-CH3 представляют собой L351Y/Y407A и T366A/K409F, соответственно.
В некоторых вариантах осуществления асимметричные стабилизирующие мутации в первой области CH2-CH3 и во второй области CH2-CH3 или во второй области CH2-CH3 и в первой области CH2-CH3 представляют собой L351Y/Y407A и T366V/K409F, соответственно.
В некоторых вариантах осуществления асимметричные стабилизирующие мутации в первой области CH2-CH3 и во второй области CH2-CH3 или во второй области CH2-CH3 и в первой области CH2-CH3 представляют собой Y407A и T366A/K409F, соответственно.
В некоторых вариантах осуществления асимметричные стабилизирующие мутации в первой области CH2-CH3 и во второй области CH2-CH3 или во второй области CH2-CH3 и в первой области CH2-CH3 представляют собой D399K/E356K и K409D/K392D, соответственно.
В некоторых вариантах осуществления асимметричные стабилизирующие мутации в первой области CH2-CH3 и во второй области CH2-CH3 или во второй области CH2-CH3 и в первой области CH2-CH3 представляют собой D399K/E356K/E357K и K409D/K392D/K370, соответственно.
Асимметричные стабилизирующие мутации могут быть введены в биспецифические или мультиспецифические антитела для облегчения процессов последующего отделения их от избытка исходных или промежуточных молекул.
Иллюстративные асимметричные стабилизирующие мутации представляют собой мутации, которые способствуют обмену Fab-фрагментами (например, полумолекулярный обмен, обменивающий на пару тяжелая цепь - легкая цепь) между двумя исходными антителами. В данной технологии мутации, которые способствуют образованию гетеродимера из двух полумолекул исходного антитела, или in vitro в бесклеточной среде, или с использованием совместной экспрессии, вводятся в поверхность раздела CH3 тяжелой цепи в каждом исходном антителе. Например, мутации F405L в первом исходном антителе и K409R во втором исходном антителе может быть использована для стимуляции обмена Fab-фрагментами IgG1. Для антител IgG4 можно использовать первое исходное антитело дикого типа и мутацию F405L/R409K во втором исходном антителе.
Дополнительные асимметричные стабилизирующие мутации представляют собой мутации типа «выступ-во-впадину» (Genentech) или мутации, которые вводят электростатически соответствующие остатки (Chugai, Amgen, NovoNordisk, Oncomed). Иллюстративные мутации типа «выступ-во-впадину» (экспрессированных в виде мутированного положения в первом исходном антителе/мутированного положения во втором исходном антителе) представляют собой T366Y/F405A, T366W/F405W, F405W/Y407A, T394W/Y407T, T394S/Y407A, T366W/T394S, F405W/T394S и T366W/T366S_L368A_Y407V. Иллюстративные мутации, которые вводят электростатически соответствующие остатки, представляют собой те, которые описаны в публикации патента США № US2010/0015133; патентной публикации США № US2009/0182127; патентной публикации США № US2010/028637 или патентной публикации США № US2011/0123532. Дополнительные асимметричные стабилизирующие мутации представляют собой L351Y_F405A_Y407V/T394W, T366I_K392M_T394W/F405A_Y407V, T366L_K392M_T394W/F405A_Y407V, L351Y_Y407A/T366A_K409F, L351Y_Y407A/T366V_K409F, Y407A/T366A_K409F, или T350V_L351Y_F405A_Y407V/T350V_T366L_K392L_T394W как описано в публикации патента США. № US2012/0149876 или патентной публикации США № US2013/0195849.
Как правило, мутации получают на уровне ДНК в молекуле, такой как константный домен антитела, с помощью стандартных способов.
В некоторых вариантах осуществления мультиспецифическое антитело содержит мутацию Q311R/F405L в первой области CH2-CH3 и мутацию K409R во второй области CH2-CH3.
В некоторых вариантах осуществления мультиспецифическое антитело содержит мутацию Q311K/F405L в первой области CH2-CH3 и мутацию K409R во второй области CH2-CH3.
В некоторых вариантах осуществления мультиспецифическое антитело содержит мутацию T307P/L309Q/F405L в первой области CH2-CH3 и мутацию K409R во второй области CH2-CH3.
В некоторых вариантах осуществления мультиспецифическое антитело содержит мутацию T307P/L309Q/Q311R/F405L в первой области CH2-CH3 и мутацию K409R во второй области CH2-CH3.
В некоторых вариантах осуществления мультиспецифическое антитело содержит мутацию Q311R/K409R в первой области CH2-CH3 и мутацию F405L во второй области CH2-CH3.
В некоторых вариантах осуществления мультиспецифическое антитело содержит мутацию Q311K/K409R в первой области CH2-CH3 и мутацию F405L во второй области CH2-CH3.
В некоторых вариантах осуществления мультиспецифическое антитело содержит мутацию T307P/L309Q/K409R в первой области CH2-CH3 и мутацию F405L во второй области CH2-CH3.
В некоторых вариантах осуществления мультиспецифическое антитело содержит мутацию T307P/L309Q/Q311R/K409R в первой области CH2-CH3 и мутацию F405L во второй области CH2-CH3.
В некоторых вариантах осуществления мультиспецифическое антитело содержит мутацию Q311R в первой области CH2-CH3 и мутацию F405L/R409K во второй области CH2-CH3.
В некоторых вариантах осуществления мультиспецифическое антитело содержит мутацию Q311K в первой области CH2-CH3 и мутацию F405L/R409K во второй области CH2-CH3.
В некоторых вариантах осуществления мультиспецифическое антитело содержит мутацию T307P/V309Q в первой области CH2-CH3 и мутацию F405L/R409K во второй области CH2-CH3.
В некоторых вариантах осуществления мультиспецифическое антитело содержит мутацию T307P/V309Q/Q311R в первой области CH2-CH3 и мутацию F405L/R409K во второй области CH2-CH3.
В некоторых вариантах осуществления мультиспецифическое антитело содержит мутацию Q311R/T366W в первой области CH2-CH3 и мутацию T366S/L368A/Y407V во второй области CH2-CH3.
В некоторых вариантах осуществления мультиспецифическое антитело содержит мутацию Q311K/T366W в первой области CH2-CH3 и мутацию T366S/L368A/Y407V во второй области CH2-CH3.
В некоторых вариантах осуществления мультиспецифическое антитело содержит мутацию T307P/L309Q/T366W в первой области CH2-CH3 и мутацию T366S/L368A/Y407V во второй области CH2-CH3.
В некоторых вариантах осуществления мультиспецифическое антитело содержит мутацию T307P/L309Q/Q311R/T366W в первой области CH2-CH3 и мутацию T366S/L368A/Y407V во второй области CH2-CH3.
В некоторых вариантах осуществления мультиспецифическое антитело содержит мутацию Q311R/T366S/L368A/Y407V в первой области CH2-CH3 и мутацию T366W во второй области CH2-CH3.
В некоторых вариантах осуществления мультиспецифическое антитело содержит мутацию Q311K/T366S/L368A/Y407V в первой области CH2-CH3 и мутацию T366W во второй области CH2-CH3.
В некоторых вариантах осуществления мультиспецифическое антитело содержит мутацию T307P/L309Q/T366S/L368A/Y407V в первой области CH2-CH3 и мутацию T366W во второй области CH2-CH3.
В некоторых вариантах осуществления мультиспецифическое антитело содержит мутацию T307P/L309Q/Q311R/T366S/L368A/Y407V в первой области CH2-CH3 и мутацию T366W во второй области CH2-CH3.
Аминокислотные последовательности иллюстративных областей CH2-CH3 в мультиспецифических антителах согласно изобретению приведены в таблице 2 и таблице 3.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO : 2 и 22, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO: 3 и 22, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO: 4 и 22, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO: 5 и 22, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO: 6 и 23, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO: 7 и 23, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO: 8 и 23, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO: 9 и 23, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO: 10 и 24, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO: 11 и 24, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO: 12 и 24, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO: 13 и 24, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO: 14 и 25, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO: 15 и 25, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO: 16 и 25, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO: 17 и 25, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO: 18 и 26, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO: 19 и 26, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO: 20 и 26, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO: 21 и 26, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO: 52 и 54, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO: 52 и 55, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO: 53 и 54, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO: 53 и 55, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO: 56 и 54, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность SEQ ID NO: 56 и 55, соответственно.
Мультиспецифические антитела согласно изобретению могут дополнительно содержать общую легкую цепь для дополнительного облегчения процессов последующего отделения их от избытка исходных или промежуточных молекул.
В некоторых вариантах осуществления мультиспецифическое антитело содержит первую легкую цепь и вторую легкую цепь.
В некоторых вариантах осуществления первая легкая цепь и вторая легкая цепь имеют идентичные аминокислотные последовательности.
В некоторых вариантах осуществления антитело представляет собой биспецифическое антитело.
Таблица 2.
Таблица 3.
Мутации могут быть перенесены в изотипы IgG2 и IgG4, поскольку положения 307, 309 и 311 сохраняются по всем изотипам, за исключением того, что IgG2 имеет валин в положении 309. Положения 366, 368 и 407 также сохраняются по всем изотипам антител. F405L сохраняется, однако IgG4 имеет R в положении 409. Для стимуляции обмена Fab-фрагментами антитела IgG4 человека, одно исходное антитело будет сконструировано так, чтобы иметь мутацию F405L/R409K, а другое исходное антитело представляет собой антитело дикого типа.
В некоторых вариантах осуществления мультиспецифическое антитело связывается по меньшей мере с двумя антигенами.
В некоторых вариантах осуществления антиген представляет собой ABCF1, ACVR1, ACVR1B, ACVR2, ACVR2B, ACVRL1, ADORA2A, аггрекан, AGR2, AICDA, AIF1, AIG1, AKAP1, AKAP2, альбумин, AMH, AMHR2, ANGPT1, ANGPT2, ANGPTL3, ANGPTL4, ANPEP, APC, APOC1, APOE, AR, AZGP1 (цинк-альфа-гликопротеин), B7.1, B7.2, BAD, BAFF, BAG1, BAI1, BCL2, BCL6, BDNF, BLNK, BLR1 (MDR15), BlyS, BMP1, BMP2, BMP3B (GDF10), BMP4, BMP6, BMP8, BMPR1A, BMPR1B, BMPR2, BPAG1 (плектин), BRCA1, BTLA, C19orf10 (IL27w), C3, C4A, C5, C5R1, CANT1, CASP1, CASP4, CAV1, CCBP2 (D6/JAB61), CCL1 (1-309), CCL11 (эотаксин), CCL13 (MCP-4), CCL15 (MIP-1d), CCL16 (HCC-4), CCL17 (TARC), CCL18 (PARC), CCL19 (MIP-3b), CCL2 (MCP-1), MCAF, CCL20 (MIP-3a), CCL21 (MIP-2), SLC, эксодус-2, CCL22 (MDC/STC-1), CCL23 (MPIF-1), CCL24 (MPIF-2/эотаксин-2), CCL25 (TECK), CCL26 (эотаксин-3), CCL27 (CTACK/ILC), CCL28, CCL3 (MIP-1a), CCL4 (MIP-1b), CCL5 (RANTES), CCL7 (MCP-3), CCL8 (mcp-2), CCNA1, CCNA2, CCND1, CCNE1, CCNE2, CCR1 (CKR1/HM145), CCR2 (mcp-1RB/RA), CCR3 (CKR3/CMKBR3), CCR4, CCR5 (CMKBR5/ChemR13), CCR6 (CMKBR6/CKR-L3/STRL22/DRY6), CCR7 (CKR7/EBI1), CCR8 (CMKBR8/TER1/CKR-L1), CCR9 (GPR-9-6), CCRL1 (VSHK1), CCRL2 (L-CCR), CD123, CD137, CD164, CD16a, CD16b, CD19, CD1C, CD20, CD200, CD-22, CD24, CD28, CD3, CD30, CD32a, CD32b, CD37, CD38, CD39, CD3E, CD3G, CD3Z, CD4, CD40, CD40L, CD44, CD45RB, CD47, CD52, CD69, CD72, CD73, CD74, CD79A, CD79B, CD8, CD80, CD81, CD83, CD86, CD89, CD96, CDH1 (E-кадгерин), CDH10, CDH12, CDH13, CDH18, CDH19, CDH20, CDH5, CDH7, CDH8, CDH9, CDK2, CDK3, CDK4, CDK5, CDK6, CDK7, CDK9, CDKN1A (p21Wap1/Cip1), CDKN1B (p27Kip1), CDKN1C, CDKN2A (p16INK4a), CDKN2B, CDKN2C, CDKN3, CEBPB, CER1, CHGA, CHGB, хитиназа, CHST10, CKLFSF2, CKLFSF3, CKLFSF4, CKLFSF5, CKLFSF6, CKLFSF7, CKLFSF8, CLDN3, CLDN7 (клаудин-7), CLN3, CLU (кластерин), CMKLR1, CMKOR1 (RDC1), CNR1, COL18A1, COL1A1, COL4A3, COL6A1, CR2, CRP, CSF1 (M-CSF), CSF2 (GM-CSF), CSF3 (GCSF), CTLA4, CTNNB1 (b-катенин), CTSB (катепсин B), CX3CL1 (SCYD1), CX3CR1 (V28), CXCL1 (GRO1), CXCL10(IP-10), CXCL11 (I-TAC/IP-9), CXCL12 (SDF1), CXCL13, CXCL14, CXCL16, CXCL2 (GRO2), CXCL3 (GRO3), CXCL5 (ENA-78/LIX), CXCL6 (GCP-2), CXCL9 (MIG), CXCR3 (GPR9/CKR-L2), CXCR4, CXCR6 (TYMSTR/STRL33/Bonzo), CYB5, CYC1, CYSLTR1, DAB2IP, DES, DKFZp451J0118, DNAM-1, DNCL1, DPP4, E2F1, ECGF1, EDG1, EFNA1, EFNA3, EFNB2, EGF, EGFR, ELAC2, ENG, ENO1, ENO2, ENO3, EPHB4, EPO, ERBB2 (Her-2), EREG, ERK8, ESR1, ESR2, F3 (TF), FADD, FasL, FASN, FCER1A, FCER2, FCGR3A, FGF, FGF1 (aFGF), FGF10, FGF11, FGF12, FGF12B, FGF13, FGF14, FGF16, FGF17, FGF18, FGF19, FGF2 (bFGF), FGF20, FGF21, FGF22, FGF23, FGF3 (int-2), FGF4 (HST), FGF5, FGF6 (HST-2), FGF7 (KGF), FGF8, FGF9, FGFR, FGFR3, FIGF (VEGFD), FIL1 (эпсилон), FIL1 (дзета), FLJ12584, FLJ25530, FLRT1 (фибронектин), FLT1, FOS, FOSL1 (FRA-1), FY (DARC), GABRP (GABAa), GAGEB1, GAGEC1, GALNAC4S-6ST, GATA3, GDF5, GFI1, GGT1, GITR, GITRL, GM-CSF, GNAS1, GNRH1, GPR2 (CCR10), GPR31, GPR44, GPR81 (FKSG80), GRCC10 (C10), GRP, GSN (гелсолин), GSTP1, HAVCR2, HDAC4, HDAC5, HDAC7A, HDAC9, HGF, HIF1A, HIP1, гистамин и гистаминовые рецепторы, HLA, HLA-A, HLA-DRA, HM74, HMOX1, HUMCYT2A, HVEM, ICEBERG, ICOS, ICOSL, IDO, ID2, ИФН-альфа, ИФН альфа-1, ИФН альфа-2, ИФН альфа-4, ИФН альфа-5, ИФН альфа-6, ИФН альфа-7, ИФН бета-1, ИФН-гамма, ИФН омега-1, IGBP1, IGF1, IGF1R, IGF2, IGFBP2, IGFBP3, IGFBP6, ИЛ-1, ИЛ-10, ИЛ-10RA, ИЛ-10RB, ИЛ-11, ИЛ-11RA, ИЛ-12, ИЛ-12A, ИЛ-12B, ИЛ-12RB1, ИЛ-12RB2, ИЛ-13, ИЛ-13RA1, ИЛ-13RA2, ИЛ-14, ИЛ-15, ИЛ-15RA, ИЛ-16, ИЛ-17, ИЛ-17B, ИЛ-17C, ИЛ-17R, ИЛ-18, ИЛ-18BP, ИЛ-18R1, ИЛ-18RAP, ИЛ-19, ИЛ-1A, ИЛ-1B, ИЛ-1F10, ИЛ-1F5, ИЛ-1F6, ИЛ-1F7, ИЛ-1F8, ИЛ-1F9, ИЛ-1HY1, ИЛ-1R1, ИЛ-1R2, ИЛ-1RAP, ИЛ-1RAPL1, ИЛ-1RAPL2, ИЛ-1RL1, ИЛ-1RL2, ИЛ-1RN, ИЛ-2, ИЛ-20, ИЛ-20RA, ИЛ-21R, ИЛ-22, ИЛ-22R, ИЛ-22RA2, ИЛ-23, ИЛ-24, ИЛ-25, ИЛ-26, ИЛ-27, ИЛ-28A, ИЛ-28B, ИЛ-29, ИЛ-2RA, ИЛ-2RB, ИЛ-2RG, ИЛ-3, ИЛ-30, ИЛ-3RA, ИЛ-4, ИЛ-4R, ИЛ-5, ИЛ-5RA, ИЛ-6, ИЛ-6R, ИЛ-6ST (гликопротеин 130), ИЛ-7, ИЛ-7R, ИЛ-8, ИЛ-8RA, ИЛ-8RB, ИЛ-8RB, ИЛ-9, ИЛ-9R, ILK, INHA, INHBA, INSL3, INSL4, инсулин, рецептора инсулина, IRAK1, IRAK2, ITGA1, ITGA2, ITGA3, ITGA6 (интегрин альфа-6), ITGAV, ITGB3, ITGB4 (интегрин бета-4), JAG1, JAK1, JAK3, JUN, K6HF, KAI1, KDR, KITLG, KIR, KLF5 (GC-бокс-связывающий белок), KLF6, KLK10, KLK12, KLK13, KLK14, KLK15, KLK3, KLK4, KLK5, KLK6, KLK9, KRT1, KRT19 (кератин-19), KRT2A, KRTHB6 (специфический для волос кератин типа II), LAG-3, LAMA5, LDL, LEP (лептин), LFA, Lingo-p75, Lingo-Troy, LPS, LTA (ФНО-бета), LTB, LTB4R (GPR16), LTB4R2, LTBR, MACMARCKS, MAG или Omgp, MAP2K7 (c-Jun), MDK, мезотелин, MIB1, мидкин, MIF, MIP-2, MKI67 (Ki-67), MMP2, MMP9, MS4A1, MSMB, MT3 (металлотионектин-III), MTSS1, MUC1 (муцин), MYC, MYD88, NCK2, нейрокан, NFKB1, NFKB2, NGFB (NGF), NGFR, NgR-Lingo, NgR-Nogo66 (Nogo), NgR-p75, NgR-Troy, NKG2D, NKp46, NME1 (NM23A), NOX5, NPPB, NR0B1, NR0B2, NR1D1, NR1D2, NR1H2, NR1H3, NR1H4, NRII2, NRII3, NR2C1, NR2C2, NR2E1, NR2E3, NR2F1, NR2F2, NR2F6, NR3C1, NR3C2, NR4A1, NR4A2, NR4A3, NR5A1, NR5A2, NR6A1, NRP1, NRP2, NT5E, NTN4, ODZ1, OPRD1, OX-40, OX-40L, P2RX7, PAP, PART1, PATE, PAWR, PCA3, PCNA, PD-1, PDGFA, PDGFB, PECAM1, PF4 (CXCL4), PGF, PGR, фосфокан, PIAS2, PIK3CG, PLAU (uPA), PLG, PLXDC1, PPBP (CXCL7), PPID, PR1, PRKCQ, PRKD1, PRL, PROC, PROK2, PSAP, PSCA, PTAFR, PTEN, PTGS2 (COX-2), PTN, RAC2 (p21Rac2), RARB, RGS1, RGS13, RGS3, RNF110 (ZNF144), ROBO2, ROR1, SI00A2, SCGB1D2 (липофилин B), SCGB2A1 (маммаглобин 2), SCGB2A2 (маммаглобин 1), SCYE1 (эндотелиальный моноциты-активирующий цитокин), SDF2, SERPINA1, SERPINA3, SERPINB5 (маспин), SERPINE1 (PAI-1), SERPINF1, SHBG, SLA2, SLC2A2, SLC33A1, SLC43A1, SLIT2, SPP1, SPRR1B (Spr1), ST6GAL1, STAB1, STAT6, STEAP, STEAP2, TB4R2, TBX21, TCP10, TDGF1, TEK, TF (рецептор трансферрина), TGFA, TGFB1, TGFB111, TGFB2, TGFB3, TGFBI, TGFBR1, TGFBR2, TGFBR3, TH1L, THBS1 (тромбоспондин-1), THBS2, THBS4, THPO, TIE (Tie-1), TIGIT, TIM-3, TIMP3, тканевый фактор, TLR10, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, ФНО, ФНО-a, TNFAIP2 (B94), TNFAIP3, TNFRSF11A, TNFRSF1A, TNFRSF1B, TNFRSF21, TNFRSF5, TNFRSF6 (Fas), TNFRSF7, TNFRSF8, TNFRSF9, TNFSF10 (TRAIL), TNFSF11 (ФНО-связанный индуцирующий активацию цитокин), TNFSF12 (APO3L), TNFSF13 (лиганд, индуцирующий пролиферацию), TNFSF13B, TNFSF14 (HVEM-L), TNFSF15 (VEGI), TNFSF18, TNFSF4 (лиганд OX40), TNFSF5 (лиганд CD40), TNFSF6 (FasL), TNFSF7 (лиганд CD27), TNFSF8 (лиганд CD30), TNFSF9 (лиганд 4-1BB), TOLLIP, Toll-подобные рецепторы, TOP2A (топоизомераза IIa), TP53, TPM1, TPM2, TRADD, TRAF1, TRAF2, TRAF3, TRAF4, TRAF5, TRAF6, TREM1, TREM2, TRPC6, TSLP, TWEAK, VEGF, VEGFB, VEGFC, версикан, VHL C5, VISTA, VLA-4, XCL1 (лимфотактин), XCL2 (SCM-1b), XCR1 (GPR5/CCXCR1), YY1, и ZFPM2.
В некоторых вариантах осуществления мультиспецифическое антитело связывает CD3.
В некоторых вариантах осуществления мультиспецифическое антитело связывает CD3 и опухолевый антиген.
В некоторых вариантах осуществления мультиспецифическое антитело связывает два антигена, причем два антигена представляют собой любые два из PD1, CD27, CD28, NKP46, ICOS, GITR, OX40, CTLA4, LAG3, TIM3, KIRa, CD73, CD39, IDO, BTLA, VISTA, TIGIT, CD96, CD30, HVEM, DNAM-1, LFA, опухолевого антигена, EGFR, cMet, FGFR, ROR1, CD123, ИЛ-1RAP, FGFR, мезотелина, CD3, T-клеточного рецептора, CD32b, CD32a, CD16a, CD16b, NKG2D, NKP46, CD28, CD47, DLL, CD8, CD89, HLA, B-клеточного рецептора или CD137.
Конструирование мультиспецифических антител согласно изобретению
Дополнительные мутации Fc могут быть внесены в мультиспецифические антитела согласно изобретению для модуляции эффекторных функций и фармакокинетических свойств. В традиционной иммунной функции взаимодействие комплексов антитело-антиген с клетками иммунной системы приводит к широкому ряду ответов в диапазоне от эффекторных функций, таких как антителозависимая цитотоксичность и фагоцитоз, до иммуномодулирующих сигналов, таких как регулирование пролиферации лимфоцитов и секреция антител. Все из этих взаимодействий инициируются посредством связывания области Fc антител или иммунных комплексов со специализированными рецепторами клеточной поверхности. Разнообразие клеточных ответов, запускаемых антителами и иммунными комплексами, обусловлено структурной гетерогенностью Fc-рецепторов: FcγRI (CD64), FcγRIIA (CD32A) и FcγRIII (CD16) представляют собой активирующие Fcγ-рецепторы (то есть, усиливают иммунную систему), и FcγRIIB (CD32B) представляет собой ингибирующий Fcγ-рецептор (то есть подавляют иммунную систему). Связывание с рецептором FcRn модулирует период полужизни антитела.
В некоторых вариантах осуществления мультиспецифическое антитело согласно изобретению дополнительно содержит по меньшей мере одну мутацию, которая модулирует связывание антитела с FcγR.
В некоторых вариантах осуществления мультиспецифическое антитело согласно изобретению дополнительно содержит по меньшей мере одну мутацию, которая модулирует связывание антитела с FcRn.
Иллюстративные мутации, которые увеличивают период полужизни мультиспецифических антител, представляют собой мутации M428L/N434S, M252Y/S254T/T256E, T250Q/M428L, N434A и T307A/E380A/N434A. Иллюстративные мутации, которые уменьшают период полужизни мультиспецифических антител, представляют собой мутации H435A, P257I/N434H, D376V/N434H, M252Y/S254T/T256E/H433K/N434F, T308P/N434A и H435R.
В некоторых вариантах осуществления мультиспецифическое антитело согласно изобретению содержит по меньшей мере одну мутацию, которая уменьшает связывание антитела с активирующим Fcγ - рецептором (FcγR) и/или уменьшает эффекторные функции Fc, такие как связывание C1q, комплемент-зависимую цитотоксичность (CDC), антителозависимую клеточно-опосредованную цитотоксичность (ADCC) или фагоцитоз (ADCP).
Иллюстративные мутации, которые уменьшают связывание мультиспецифического антитела согласно изобретению с активацией FcγR и/или минимизируют эффекторные функции антитела, представляют собой L234A/L235A в IgG1, V234A/G237A/P238S/H268A/V309L/A330S/P331S в IgG2, F234A/L235A в IgG4, S228P/F234A/L235A в IgG4, N297A во всех изотипах Ig, V234A/G237A в IgG2, K214T/E233P/L234V/L235A/G236-делеция/A327G/P331A/D365E/L358M в IgG1, H268Q/V309L/A330S/P331S в IgG2, S267E/L328F в IgG1, L234F/L235E/D265A в IgG1, L234A/L235A/G237A/P238S/H268A/A330S/P331S в IgG1, S228P/F234A/L235A/G237A/P238S в IgG4 и S228P/F234A/L235A/G236-делеция/G237A/P238S в IgG4.
Иллюстративные мутации, которые увеличивают связывание мультиспецифического антитела согласно изобретению с активирующим Fcγ и/или усиливают эффекторные функции антитела, представляют собой S239D/I332E, S298A/E333A/K334A, F243L/R292P/Y300L, F243L/R292P/Y300L/P396L, F243L/R292P/Y300L/V305I/P396L и G236A/S239D/I332E, K326A/E333A, K326W/E333A, H268F/S324T, S267E/H268F, S267E/S324T и S267E/H268F/S324T.
Для повышения стабильности IgG4 известная замена S228P может быть сделана в антителах IgG4.
Термины «антителозависимая клеточная цитотоксичность», «антителозависимая клеточно-опосредованная цитотоксичность» или «ADCC» представляют собой механизм индукции гибели клеток, который зависит от взаимодействия покрытых антителами клеток-мишеней с эффекторными клетками, обладающими литической активностью, например, клетками-естественными киллерами, моноцитами, макрофагами и нейтрофилами, посредством гамма-рецепторов Fc (FcγR), экспрессирующихся на эффекторных клетках. Например, NK-клетки экспрессируют FcγRIIIa, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIIIa. Гибель покрытых антителами клеток-мишеней происходит в результате активности эффекторных клеток через секрецию мембранных порообразующих белков и протеаз. Для оценки активности ADCC антител согласно изобретению данные антитела можно добавлять к клеткам, экспрессирующим необходимый антиген, в комбинации с эффекторными клетками иммунной системы, которые могут быть активированы комплексами антиген-антитело, что приводит к цитолизу клетки-мишени. Цитолиз можно обнаруживать по высвобождению метки (например, радиоактивных субстратов, флуоресцентных красителей или природных внутриклеточных белков) из лизированных клеток. Примеры эффекторных клеток для таких анализов включают в себя мононуклеарные клетки периферической крови (PBMC) и NK-клетки. Иллюстративные клетки-мишени включают клетки, экспрессирующие необходимый антиген или эндогенно, или рекомбинантно. В примере анализа клетки-мишени применяли в соотношении 1 клетка-мишень на 50 эффекторных клеток. Клетки-мишени предварительно метили BATDA (Perkin-Elmer) в течение 20 минут при 37°C, дважды промывали и ресуспендировали в среде DMEM с 10% термоинактивированной эмбриональной телячьей сыворотки (FBS), 2 мМ L-глутамина (все получены от компании Invitrogen). Клетки-мишени (1×104 клеток) и эффекторные клетки (0,5×106 клеток) объединяли и добавляли по 100 мкл клеток в лунки 96-луночных планшетов с U-образным дном. Дополнительно добавляли 100 мкл с исследуемыми антителами или без них. Планшеты центрифугировали при 200 g в течение 3 минут, инкубировали при 37°C в течение 2 часов, а затем повторно центрифугировали при 200 g в течение 3 минут. Отбирали в совокупности 20 мкл супернатанта на лунку и лизис клеток измеряли посредством добавления 200 мкл реагента DELPHIA на основе европия (PerkinElmer). Данные нормализовали по максимальной цитотоксичности с 0,67% Triton X-100 (Sigma Aldrich) и минимальному контролю, который определяли по высвобождению BATDA из клеток-мишеней в отсутствие любого антитела.
«Антителозависимый клеточный фагоцитоз» (ADCP) относится к механизму уничтожения покрытых антителами клеток-мишеней посредством интернализации фагоцитарными клетками, такими как макрофаги или дендритные клетки. ADCP можно оценивать с помощью моноцитарных макрофагов в качестве эффекторных клеток и клеток Дауди (ATCC® CCL-213™) или клеток В-клеточного лейкоза, или лимфомы, или опухолевых клеток, экспрессирующих необходимый антиген, в качестве клеток-мишеней, сконструированных с целью экспрессии зеленого флуоресцентного белка (GFP) или другой меченой молекулы. Соотношение эффекторных клеток и клеток-мишеней может составлять, например, 4 : 1. Эффекторные клетки можно инкубировать с клетками-мишенями в течение 4 часов с антителом по изобретению или без него. После инкубации клетки можно отделять с помощью аккутазы. Идентификацию макрофагов можно проводить с помощью антител к CD11b и к CD14, связанных с флуоресцентной меткой, а процентное значение фагоцитоза можно определять на основании % флуоресцентного GFP в макрофагах CD11+CD14+ с помощью стандартных способов.
«Комплемент-зависимая цитотоксичность» (CDC), относится к механизму индукции гибели клеток, в рамках которого эффекторный домен Fc связанного с мишенью антитела связывает и активирует компонент комплемента C1q, который, в свою очередь, активирует каскад комплемента, приводящий к гибели клетки-мишени. Активация комплемента может также приводить к осаждению компонентов комплемента на поверхности клетки-мишени, что упрощает ADCC посредством связывания на лейкоцитах рецепторов комплемента (например, CR3). CDC может измеряться, например, посредством высевания клеток Дауди при 1×105 клеток/лунка (50 мкл/лунка) в RPMI-B (RPMI с добавлением 1% BSA), добавления 50 мкл исследуемых антител в лунки до конечной концентрации в диапазоне 0-100 мкг/мл, инкубации реакционной смеси в течение 15 мин при комнатной температуре, добавления 11 мкл объединенной человеческой сыворотки в лунки и инкубации реакционной смеси в течение 45 мин при 37°C. Процентное значение (%) лизированных клеток может определяться как % окрашенных пропидий йодидом клеток в анализе FACS с помощью стандартных способов.
Кроме того, в мультиспецифичные антитела согласно изобретению могут быть внесены дополнительные мутации, которые усиливают связывание антитела с FcyRIIb. Примерами таких мутаций являются мутации S267E, S267D, S267E/I332E, S267E/L328F, G236D/S267E и E233D/G237D/H268D/P271G/A330R/P238D.
В целом, мутации, усиливающие связывание с активирующим FcγR и снижающие связывание с ингибирующим FcγRIIb, могут быть введены в антитела, которые используются для усиления иммунных ответов у субъекта, например, для лечения онкологических заболеваний и инфекций. Мутации, снижающие связывание с активирующим FcγR или усиливающие связывание с ингибирующим FcγRIIb, могут быть введены в антитела, которые используются для ослабления иммунных ответов у субъекта, например, для лечения воспалительного или аутоиммунного заболевания. Мутации, усиливающие связывание с ингибирующим FcγRIIb, также могут быть введены в агонистические антитела, которые связывают членов суперсемейства TNFR, для усиления их агонистической активности.
Способность мультиспецифических антител согласно изобретению индуцировать ADCC можно усилить путем конструирования их олигосахаридного компонента. Человеческий IgG1 является N-гликозилированным в Asn297 с большинством гликанов в хорошо известных биантеннарных формах G0, G0F, G1, G1F, G2 или G2F. Антитела, продуцируемые несконструированными клетками CHO, как правило, имеют содержание фукозы в гликанах по меньшей мере около 85%. Удаление центральной фукозы из олигосахаридов типа 2-антенарного комплекса, присоединенных к областям Fc, усиливает ADCC антител посредством улучшенного связывания FcγRIIIa без изменения связывания с антигеном или активности CDC. Такие мкАт могут быть достигнуты с использованием различных способов, о которых сообщалось, что они приводят к успешной экспрессии относительно высоко дефукозилированных антител, несущих комплексы биантеннарного типа олигосахариды-Fc, такие как контроль осмоляльности культуры, применение варианта линии СНО Lec13 в качестве линии клеток-хозяев, применение варианта линии СНО EB66 в качестве линии клеток-хозяев, применения линии клеток гибридомы крысы YB2/0 в качестве линии клеток-хозяев, введения малой интерферирующей РНК, специфической в отношении гена α 1,6-фукозилтрасферазы (FUT8), или совместной экспрессии β-1,4-N-ацетилглюкозаминилтрансфераза III и альфа-маннозидаза II Гольджи или мощный ингибитор альфа-маннозидазы I, кифунензин.
В некоторых вариантах осуществления мультиспецифические антитела согласно изобретению имеют биантеннарную структуру гликана с содержанием фукозы от около 0% до около 15%, например, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или 0%.
В некоторых вариантах осуществления мультиспецифические антитела согласно изобретению имеют биантеннарную структуру гликана с содержанием фукозы около 50%, 40%, 45%, 40%, 35%, 30%, 25%, 20%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или 0%.
Термин «содержание фукозы» означает количество моносахарида фукозы в пределах сахаридной цепи в положении Asn297. Относительное количество фукозы представляет собой процентное содержание фукозосодержащих структур, относящихся ко всем гликоструктурам. Они могут быть охарактеризованы и количественно определены множеством способов, например: 1) при помощи MALDI-TOF (времяпролетной ионизации лазерной десорбцией с использованием матрицы) образца, обработанного N-гликозидазой F (например, комплексные, гибридные, олигоманнозные и высокоманнозные структуры); 2) посредством ферментативного высвобождения гликанов Asn297 с последующей дериватизацией и обнаружением/количественным определением с помощью ВЭЖХ (СВЭЖХ) с флуоресцентным обнаружением и/или ВЭЖХ-МС (СВЭЖХ-МС); 3) анализа интактного белка нативного или восстановленного mAb с обработкой или без обработки гликанов Asn297 ферментом Endo S или другим ферментом, который расщепляет связь между первым и вторым моносахаридами GlcNAc, сохраняя фукозу присоединенной к первому GlcNAc; 4) расщепления mAb на составляющие пептиды посредством ферментативного расщепления (например, трипсином или эндопептидазой Lys-C) и последующим разделением, обнаружением и количественным определением посредством ВЭЖХ-МС (СВЭЖХ-МС); или 5) отделения олигосахаридов mAb от белка mAb на Asn 297 посредством специфического ферментативного дегликозилирования с помощью PNGase F. Высвобожденные олигосахариды можно метить флуорофором, разделять и идентифицировать различными вспомогательными методиками, которые позволяют точно охарактеризовать структуры гликанов посредством масс-спектрометрии с матрично-активированной лазерной десорбцией/ионизацией (MALDI) посредством сравнения экспериментальных масс с теоретическими массами, определить степень сиалилирования с помощью ионообменной ВЭЖХ (GlycoSep C), разделить и количественно оценить формы олигосахаридов по критерию гидрофильности с помощью ВЭЖХ с обычной фазой (GlycoSep N), а также разделить и количественно оценить формы олигосахаридов с помощью высокоэффективного капиллярного электрофореза с лазер-индуцированной флуоресценцией (HPCE-LIF).
Термины «низкофукозный» или «с низким содержанием фукозы» относятся к антителам с содержанием фукозы около 0-15%.
Выражения «нормофукозный» или «с нормальным содержанием фукозы» относятся к антителам с содержанием фукозы более около 50%, как правило, более около 60%, 70%, 80% или более 85%.
Мультиспецифические антитела согласно изобретению могут быть модифицированы посттрансляционно в рамках процессов, таких как гликозилирование, изомеризация, дегликозилирование или ковалентная модификация неприродного происхождения, такая как присоединение фрагментов полиэтиленгликоля (пегилирование) или липидизация. Такие модификации могут выполняться in vivo или in vitro. Например, антитела по изобретению, описанные в настоящем документе, можно конъюгировать с полиэтиленгликолем (пегилировать) для усовершенствования их фармакокинетических профилей. Конъюгация может быть выполнена методиками, известными специалистам в данной области. Было показано, что конъюгация терапевтических антител с PEG усиливает их фармакодинамику и при этом не изменяет функцию.
Мультиспецифические антитела согласно изобретению могут быть модифицированы с целью улучшения стабильности, селективности, перекрестной реактивности, аффинности, иммуногенности или достижения других желательных биологических или биофизических свойств, что также находится в рамках объема изобретения. На стабильность антитела влияет ряд факторов, включая (1) внутреннюю укладку отдельных доменов, влияющую на их собственную стабильность; (2) поверхностные взаимодействия белок/белок, влияющие на объединение в пары HC и LC; (3) глубину расположения полярных и заряженных остатков; (4) сеть H-мостиков между полярными и заряженными остатками; и (5) поверхностный заряд и распределение полярных аминокислотных остатков наряду с другими внутри- и межмолекулярными взаимодействиями (Worn and Pluckthun 2001). Остатки, способные дестабилизировать структуру, можно выявить на основании кристаллической структуры антитела или в определенных случаях путем молекулярного моделирования, а влияние остатков на стабильность антитела можно исследовать путем создания и оценки вариантов, содержащих мутации в выявленных остатках. Один из способов повышения стабильности антитела заключается в увеличении средней температуры перехода (Tm), измеряемой с помощью дифференциальной сканирующей калориметрии (DSC). Как правило, Tm белка имеет положительную корреляцию с его стабильностью и отрицательную корреляцию с подверженностью к нарушениям третичной структуры и денатурации в растворах, а также деградации, которая зависит от склонности белка к нарушению третичной структуры. Результаты исследований состава позволяют предположить, что Tm Fab влияет на долговременную физическую стабильность соответствующего моноклонального антитела (mAb).
C-концевой лизин (CTL) из введенных антител может быть удален из циркулирующих эндогенных карбоксипептидаз. Удаление CTL во время изготовления можно контролировать на уровне менее максимального посредством контроля концентрации внеклеточного Zn2+, ЭДТА или ЭДТА-Fe3+, как описано в патентной публикации США № US20140273092. Содержание CTL в антителах можно измерять с помощью известных способов.
В некоторых вариантах осуществления мультиспецифические антитела согласно изобретению имеют содержание С-концевого лизина от около 10% до около 90%, от около 20% до около 80%, от около 40% до около 70%, от около 55% до около 70% или около 60%.
В некоторых вариантах осуществления мультиспецифические антитела согласно изобретению имеют содержание С-концевого лизина около 0%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100%.
В изобретении также предложено выделенное антитело, содержащего две тяжелые цепи, имеющие идентичные аминокислотные последовательности, и две легкие цепи, причем две идентичные тяжелые цепи содержат мутацию Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R, при этом нумерация остатков соответствует индексу EU.
В изобретении также предложено выделенное антитело, содержащее две тяжелые цепи, имеющие идентичные аминокислотные последовательности, и две легкие цепи, причем две идентичные тяжелые цепи содержат мутацию Q311R, при этом нумерация остатков соответствует индексу EU.
В изобретении также предложено выделенное антитело, содержащее две тяжелые цепи, имеющие идентичные аминокислотные последовательности, и две легкие цепи, причем две идентичные тяжелые цепи содержат мутацию Q311K, при этом нумерация остатков соответствует индексу EU.
В изобретении также предложено выделенное антитело, содержащее две тяжелые цепи, имеющие идентичные аминокислотные последовательности, и две легкие цепи, причем две идентичные тяжелые цепи содержат мутацию T307P/L309Q, при этом нумерация остатков соответствует индексу EU.
В изобретении также предложено выделенное антитело, содержащее две тяжелые цепи, имеющие идентичные аминокислотные последовательности, и две легкие цепи, причем две идентичные тяжелые цепи содержат мутацию T307P/V309Q, при этом нумерация остатков соответствует индексу EU.
В изобретении также предложено выделенное антитело, содержащее две тяжелые цепи, имеющие идентичные аминокислотные последовательности, и две легкие цепи, причем две идентичные тяжелые цепи содержат мутацию T307P/L309Q/Q311R, при этом нумерация остатков соответствует индексу EU.
В изобретении также предложено выделенное антитело, содержащее две тяжелые цепи, имеющие идентичные аминокислотные последовательности, и две легкие цепи, причем две идентичные тяжелые цепи содержат мутацию T307P/V309Q/Q311R, при этом нумерация остатков соответствует индексу EU.
Выделенное антитело можно использовать в качестве исходного антитела для получения мультиспецифических антител согласно изобретению.
В некоторых вариантах осуществления выделенное антитело дополнительно содержит мутацию F405L, K409R, F405L/R409K, T366W или T366S/L368A/Y407V.
В некоторых вариантах осуществления выделенное антитело представляет собой изотип IgG1, IgG2 или IgG4.
Способы создания сконструированных мультиспецифических антител согласно изобретению
Сконструированные мультиспецифические антитела согласно изобретению, которые имеют измененные аминокислотные последовательности по сравнению с исходными мультиспецифическими антителами, можно создать с помощью стандартных технологий клонирования и экспрессии. Например, можно выполнять направленный точечный мутагенез или ПЦР-опосредованный мутагенез с целью встраивания мутации (-й), а влияние на связывание антитела или на другое целевое функциональное свойство можно оценивать известными способами и способами, описанными в примерах в настоящем документе.
Аллотипы антител
Иммуногенность терапевтических антител связана с повышенным риском реакций на инфузию и сниженной длительностью терапевтического ответа (Baert et al., (2003) N Engl J Med 348:602-08). Степень, с которой терапевтические антитела индуцируют иммунный ответ в организме-хозяине, отчасти может определяться аллотипом антитела (Stickler et al., (2011) Genes and Immunity 12:213-21). Аллотип антитела связан с вариациями аминокислотной последовательности в конкретных положениях в последовательностях константных областей антитела.
В таблице 4 показаны выбранные аллотипы IgG1, IgG2 и IgG4.
В некоторых вариантах осуществления мультиспецифические антитела согласно изобретению относятся к аллотипу G2m(n), G2m(n-), G2m(n)/(n-), nG4m(a), G1m(17) или G1m(17,1).
Таблица 4.
Создание и выделение мультиспецифических антител согласно изобретению
Мультиспецифические антитела согласно изобретению могут быть получены с использованием стандартных методов молекулярной биологии и стимуляции обмена Fab-фрагментами исходных антител. Мультиспецифические антитела согласно изобретению можно очищать с использованием аффинной хроматографии лиганда белка A.
В изобретении также предложен способ получения выделенного мультиспецифического антитела, содержащего первую тяжелую цепь или ее фрагмент, содержащую мутацию Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R, и вторую тяжелую цепь или ее фрагмент, содержащую аминокислотный остаток дикого типа в положениях 307, 309 и 311, включающий
обеспечение первого исходного антитела, содержащего первую тяжелую цепь или ее фрагмент, содержащую мутацию Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R, и первую легкую цепь;
обеспечение второго исходного антитела, содержащего вторую тяжелую цепь или ее фрагмент, содержащую аминокислотный остаток дикого типа в положениях 307, 309 и 311, и вторую легкую цепь;
приведение в контакт первого исходного антитела и второго исходного антитела в образце;
инкубацию образца; и
очистку мультиспецифического антитела с использованием аффинной хроматографии лиганда белка A.
В изобретении также предложен способ получения выделенного мультиспецифического антитела, содержащего первую тяжелую цепь или ее фрагмент, содержащую мутацию T307P/L309Q, и вторую тяжелую цепь или ее фрагмент, содержащую аминокислотный остаток дикого типа в положениях 307 и 309, включающий:
обеспечение первого исходного антитела, содержащего первую тяжелую цепь или ее фрагмент, содержащую мутацию T307P/L309Q, и первую легкую цепь;
обеспечение второго исходного антитела, содержащего вторую тяжелую цепь или ее фрагмент, содержащую аминокислотный остаток дикого типа в положениях 307 и 309, и вторую легкую цепь;
приведение в контакт первого исходного антитела и второго исходного антитела в образце;
инкубацию образца; и
очистку мультиспецифического антитела с использованием аффинной хроматографии лиганда белка A.
В изобретении также предложен способ получения выделенного мультиспецифического антитела, содержащего первую тяжелую цепь или ее фрагмент, содержащую мутацию T307P/V309Q, и вторую тяжелую цепь или ее фрагмент, содержащую аминокислотный остаток дикого типа в положениях 307 и 309, включающий:
обеспечение первого исходного антитела, содержащего первую тяжелую цепь или ее фрагмент, содержащую мутацию T307P/V309Q, и первую легкую цепь;
обеспечение второго исходного антитела, содержащего вторую тяжелую цепь или ее фрагмент, содержащую аминокислотный остаток дикого типа в положениях 307 и 309, и вторую легкую цепь;
приведение в контакт первого исходного антитела и второго исходного антитела в образце;
инкубацию образца; и
очистку мультиспецифического антитела с использованием аффинной хроматографии лиганда белка A.
В изобретении также предложен способ получения выделенного мультиспецифического антитела, содержащего первую тяжелую цепь или ее фрагмент, содержащую мутацию T307P/L309Q/Q311R, и вторую тяжелую цепь или ее фрагмент, содержащую аминокислотный остаток дикого типа в положениях 307, 309 и 311, включающий:
обеспечение первого исходного антитела, содержащего первую тяжелую цепь или ее фрагмент, содержащую мутацию T307P/L309Q/Q311R, и первую легкую цепь;
обеспечение второго исходного антитела, содержащего вторую тяжелую цепь или ее фрагмент, содержащую аминокислотный остаток дикого типа в положениях 307, 309 и 311, и вторую легкую цепь;
приведение в контакт первого исходного антитела и второго исходного антитела в образце;
инкубацию образца; и
очистку мультиспецифического антитела с использованием аффинной хроматографии лиганда белка A.
В изобретении также предложен способ получения выделенного мультиспецифического антитела, содержащего первую тяжелую цепь или ее фрагмент, содержащую мутацию T307P/V309Q/Q311R, и вторую тяжелую цепь или ее фрагмент, содержащую аминокислотный остаток дикого типа в положениях 307, 309 и 311, включающий:
обеспечение первого исходного антитела, содержащего первую тяжелую цепь или ее фрагмент, содержащую мутацию T307P/V309Q/Q311R, и первую легкую цепь;
обеспечение второго исходного антитела, содержащего вторую тяжелую цепь или ее фрагмент, содержащую аминокислотный остаток дикого типа в положениях 307, 309 и 311, и вторую легкую цепь;
приведение в контакт первого исходного антитела и второго исходного антитела в образце;
инкубацию образца; и
очистку мультиспецифического антитела с использованием аффинной хроматографии лиганда белка A.
Области VH и VL мультиспецифических антител могут быть получены из существующих областей VH/VL антител, специфических к необходимому антигену, или из доменов VH/VL исходных антител, генерируемых de novo.
Исходные антитела могут быть получены de novo с использованием различных технологий. Например, для их генерации можно применять способ гибридом по Kohler and Milstein, Nature 256:495, 1975. В методе гибридом мышь или другое животное-хозяина, например хомяка, крысу или обезьяну, иммунизируют антигеном, с последующим слиянием спленоцитов от иммунизированных животных с клетками миеломы с использованием стандартных способов с получением клеток гибридомы (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). Колонии, возникающие из одиночных клеток иммортализованной гибридомы, подвергают скринингу на основании продукции антител с желательными свойствами, такими как специфичность связывания, перекрестная реактивность или ее отсутствие и аффинность к антигену.
Для создания исходных антител к необходимому антигену можно использовать трансгенных мышей, несущих в своем геноме локусы человеческих иммуноглобулинов (Ig), которые описаны, например, в международной патентной публикации № WO90/04036; патенте США № 6,150,584; международной патентной публикации № WO99/45962, международной патентной публикации № WO02/066630, международной патентной публикации № WO02/43478, Lonberg et al. (1994) Nature 368:856-9; Green et al., Nature Genet 7:13-21, 1994; Green & Jakobovits, Exp. Med. 188:483-95, 1998; Lonberg and Huszar, Int Rev Immunol 13:65-93, 1995; Bruggemann et al., Eur J Immunol 21:1323- 1326, 1991; Fishwild et al., Nat Biotechnol 14:845-851, 1996; Mendez et al., Nat Genet 15:146-156, 1997; Green, J Immunol Methods 231:11-23, 1999; Yang et al., Cancer Res 59:1236-1243, 1999; Brüggemann and Taussig, Curr Opin Biotechnol. 8:455-458, 1997; международной патентной публикации №. WO02/043478). Эндогенные локусы иммуноглобулинов у таких мышей могут быть прерваны или делетированы, а в мышиный геном может быть встроен по меньшей мере один полный или частичный локус человеческого иммуноглобулина с использованием гомологичной или негомологичной рекомбинации, с использованием трансхромосом или с использованием минигенов. Для получения человеческих антител, направленных против выбранного антигена, с применением описанной выше технологии можно задействовать такие компании, как Regeneron (http://_www_regeneron_com), Harbour Antibodies (http://_www_harbourantibodies_com), Open Monoclonal Technology, Inc. (OMT) (http://_www_omtinc_net), KyMab (http://_www_kymab_com), Trianni (http://_www.trianni_com) и Ablexis (http://_www_ablexis_com).
Исходные антитела можно выбирать из библиотеки фагового дисплея, где фаг конструируют с возможностью экспрессии человеческих иммуноглобулинов или их частей, таких как Fab, одноцепочечные антитела (scFv), либо неспаренные или спаренные вариабельные области антител. Исходные антитела могут быть выделены, например, из библиотеки фагового дисплея, экспрессирующей вариабельные области тяжелой и легкой цепей антитела в виде слитых белков с белком оболочки бактериофага pIX, как описано в публикации Shi et al., J Mol Biol 397:385-96, 2010 и в международной патентной публикации № WO09/085462). В библиотеках можно проводить скрининг на связывание фагов с необходимым антигеном, и полученные положительные клоны могут быть дополнительно охарактеризованы, из лизатов клонов могут быть выделены Fab и экспрессированы в виде полноразмерных IgG. Такие способы использования фагового дисплея для выделения человеческих антител описаны, например, в патентах США № 5,223,409; 5403484, 5571698, 5427908, 5580717, 5969108, 6172197, 5885793; 6521404, 6544731, 6555313, 6582915 и 6593081.
Выделенные области VH/VL могут быть клонированы как любой изотип Ig или часть константного домена антитела, такого как область CH2-CH3, с использованием стандартных способов клонирования. Мутации Fc можно вводить в исходные антитела с использованием стандартных способов.
В некоторых вариантах осуществления первое исходное антитело и второе исходное антитело получают в виде очищенных антител.
В некоторых вариантах осуществления первое исходное антитело и второе исходное антитело предложены в среде для культивирования клеток, полученные из клеток, экспрессирующих первое исходное антитело и второе исходное антитело.
В некоторых вариантах осуществления первое исходное антитело и второе исходное антитело совместно экспрессируются в клетке.
В настоящем документе было показано, что генерация мультиспецифических антител согласно изобретению происходит тогда, когда исходные антитела представлены в неочищенных экстрактах в виде неочищенных антител. Способность очищать мультиспецифические антитела из неочищенных экстрактов снижает стоимость процесса выделения и очистки, так как необходима только одна стадия очистки.
Как только исходные антитела приводят в контакт друг с другом, выполняют стадию инкубации.
В некоторых вариантах осуществления инкубацию выполняют при температуре от около 20°C до около 37°C.
В некоторых вариантах осуществления инкубацию выполняют при температуре от около 25°C до около 37°C.
В некоторых вариантах осуществления инкубацию выполняют при температуре от около 25°C до около 37°C в течение от около девяноста минут до около шести часов.
В некоторых вариантах осуществления восстанавливающий агент добавляют во время стадии инкубации.
В некоторых вариантах осуществления восстанавливающий агент представляет собой 2-меркаптоэтиламин (2-MEA).
В некоторых вариантах осуществления восстанавливающий агент представляет собой дитиотреитол (DTT).
В некоторых вариантах осуществления восстанавливающий агент представляет собой дитиоэритритол (DTE).
В некоторых вариантах осуществления восстанавливающий агент представляет собой глутатион.
В некоторых вариантах осуществления восстанавливающий агент представляет собой трис(2-карбоксиэтил)фосфин (ТСЕР).
В некоторых вариантах осуществления восстанавливающий агент представляет собой L-цистеин.
В некоторых вариантах осуществления восстанавливающий агент представляет собой бета-меркаптоэтанол.
В некоторых вариантах осуществления восстанавливающий агент присутствует в концентрации от около 10 мМ до около 100 мМ.
В некоторых вариантах осуществления 2-MEA присутствует в концентрации от около 10 мМ до около 100 мМ.
В некоторых вариантах осуществления 2-MEA присутствует в концентрации от около 25 мМ до около 75 мМ.
Например, можно применять инкубацию в течение по меньшей мере 90 мин при температуре по меньшей мере 20°C в присутствии по меньшей мере 25 мМ 2-MEA или в присутствии по меньшей мере 0,5 мМ дитиотреитола при pH от 5 до 8, например, при pH 7,0 или при pH 7,4.
В некоторых вариантах осуществления для хроматографии лиганда белка A используют градиент pH.
В некоторых вариантах осуществления градиент pH составляет от около pH 7,0 до около pH 3,0.
В некоторых вариантах осуществления градиент рН составляет от около рН 4,6 до около рН 3,4.
В некоторых вариантах осуществления мультимерное антитело элюируют в диапазоне от около pH 4,4 до около pH 4,1.
В некоторых вариантах осуществления градиент рН представляет собой ступенчатый градиент рН 4,6, рН 4,1 и рН 3,4.
В некоторых вариантах осуществления для хроматографии лиганда белка А используется цитратный буфер.
В некоторых вариантах осуществления для хроматографии лиганда белка А используется 50 мМ цитратный буфер.
В некоторых вариантах осуществления для хроматографии лиганда белка A используются ацетатный буфер.
В некоторых вариантах осуществления для хроматографии лиганда белка A используется 40 мМ ацетатный буфер.
Хроматография HIC белка А может быть выполнена с использованием колонки MabSelect Sure (GE Healthcare) или в периодическом режиме. Супернатанты культуры загружают в колонку непосредственно без дополнительной обработки в соответствии с инструкциями производителя. Антитела элюируют с использованием ступенчатого градиента рН, используя буферы, содержащие 50 мМ цитрата, при рН 4,7, рН 4,2 или рН 3,4. Фракции элюирования собирали и концентрировали до > 1 мг/мл перед анализом. Чистоту выделенного мультимерного антитела можно оценить с помощью хроматографии гидрофобного взаимодействия (HIC).
Химические соединения: мультимерные белки согласно изобретению
Указанные в данном документе мутации можно использовать для выделения любого мультимерного белка из его исходных белков при условии, что мультимерный белок имеет по меньшей мере две полипептидные цепи, каждая из которых имеет область CH2-CH3 с асимметричными мутациями Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R.
В изобретении также предложен мультимерный белок, содержащий первый полипептид и второй полипептид, причем первый полипептид содержит первую область CH2-CH3, содержащую мутацию Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R, и второй полипептид содержит вторую область CH2-CH3, содержащую аминокислотный остаток дикого типа в положениях 307, 309 и 311, причем нумерация остатков соответствует индексу EU.
В изобретении также предложен мультимерный белок, содержащий первый полипептид и второй полипептид, причем первый полипептид содержит первую область CH2-CH3, содержащую мутацию Q311R, и второй полипептид содержит вторую область CH2-CH3, содержащую аминокислотный остаток дикого типа в положении 311, при этом нумерация остатков соответствует индексу EU.
В изобретении также предложен мультимерный белок, содержащий первый полипептид и второй полипептид, причем первый полипептид содержит первую область CH2-CH3, содержащую мутацию Q311K, и второй полипептид содержит вторую область CH2-CH3, содержащую аминокислотный остаток дикого типа в положении 311, при этом нумерация остатков соответствует индексу EU.
В изобретении также предложен мультимерный белок, содержащий первый полипептид и второй полипептид, причем первый полипептид содержит первую область CH2-CH3, содержащую мутацию T307P/L309Q, и второй полипептид содержит вторую область CH2-CH3, содержащую аминокислотный остаток дикого типа в положениях 307 и 309, при этом нумерация остатков соответствует индексу EU.
В изобретении также предложен мультимерный белок, содержащий первый полипептид и второй полипептид, причем первый полипептид содержит первую область CH2-CH3, содержащую мутацию T307P/V309Q, и второй полипептид содержит вторую область CH2-CH3, содержащую аминокислотный остаток дикого типа в положениях 307 и 309, причем нумерация остатков соответствует индексу EU.
В изобретении также предложен мультимерный белок, содержащий первый полипептид и второй полипептид, причем первый полипептид содержит первую область CH2-CH3, содержащую мутацию T307P/L309Q/Q311R, и второй полипептид содержит вторую область CH2-CH3, содержащую аминокислотный остаток дикого типа в положениях 307, 309 и 311, при этом нумерация остатков соответствует индексу EU.
В изобретении также предложен мультимерный белок, содержащий первый полипептид и второй полипептид, причем первый полипептид содержит первую область CH2-CH3, содержащую мутацию T307P/V309Q/Q311R, и второй полипептид содержит вторую область CH2-CH3, содержащую аминокислотный остаток дикого типа в положениях 307, 309 и 311, при этом нумерация остатков соответствует индексу EU.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 относятся к изотипу IgG1.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 относятся к изотипу IgG2.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 относятся к изотипу IgG4.
В некоторых вариантах осуществления первая область CH2-CH3 имеет сниженное связывание с лигандом белка A по сравнению со второй областью CH2-CH3.
В некоторых вариантах осуществления изобретения лиганд белка A содержит стафилококковый белок A.
В некоторых вариантах осуществления лиганд белка A содержит Z-домен.
В некоторых вариантах осуществления лиганд белка A содержит Y-домен.
В некоторых вариантах осуществления Z-домен содержит аминокислотную последовательность SEQ ID NO: 1.
В некоторых вариантах осуществления лиганд белка А содержит аминокислотную последовательность SEQ ID NO: 99, 100 или 101.
В некоторых вариантах осуществления мультимерный белок дополнительно содержит асимметричные стабилизирующие мутации в первой области CH2-CH3 и во второй области CH2-CH3.
В некоторых вариантах осуществления асимметричные стабилизирующие мутации в первой области CH2-CH3 и во второй области CH2-CH3 или во второй области CH2-CH3 и в первой области CH2-CH3 представляют собой
F405L и K409R, соответственно;
дикого типа и F405L/R409K, соответственно;
T366W и T366S/L368A/Y407V, соответственно;
T366Y/F405A и T394W/Y407T, соответственно;
T366W/F405W и T394S/Y407A, соответственно;
F405W/Y407A и T366W/T394S, соответственно;
L351Y/F405A/Y407V и T394W, соответственно;
T366I/K392M/T394W и F405A/Y407V, соответственно;
T366L/K392M/T394W и F405A/Y407V, соответственно;
L351Y/Y407A и T366A/K409F, соответственно;
L351Y/Y407A и T366V/K409F, соответственно;
Y407A и T366A/K409F, соответственно;
D399K/E356K и K409D/K392D, соответственно; или
D399K/E356K/E357K и K409D/K392D/K370, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и вторая область CH2-CH3 содержат аминокислотную последовательность
SEQ ID NO: 2 и 22, соответственно;
SEQ ID NO: 3 и 22, соответственно;
SEQ ID NO: 4 и 22, соответственно;
SEQ ID NO: 5 и 22, соответственно;
SEQ ID NO: 6 и 23, соответственно;
SEQ ID NO: 7 и 23, соответственно;
SEQ ID NO: 8 и 23, соответственно;
SEQ ID NO: 9 и 23, соответственно;
SEQ ID NO: 10 и 24, соответственно;
SEQ ID NO: 11 и 24, соответственно;
SEQ ID NO: 12 и 24, соответственно;
SEQ ID NO: 13 и 24, соответственно;
SEQ ID NO: 14 и 25, соответственно;
SEQ ID NO: 15 и 25, соответственно;
SEQ ID NO: 16 и 25, соответственно;
SEQ ID NO: 17 и 25, соответственно;
SEQ ID NO: 18 и 26, соответственно;
SEQ ID NO: 19 и 26, соответственно;
SEQ ID NO: 20 и 26, соответственно;
SEQ ID NO: 21 и 26, соответственно;
SEQ ID NO: 52 и 54, соответственно;
SEQ ID NO: 52 и 55, соответственно;
SEQ ID NO: 53 и 54, соответственно;
SEQ ID NO: 53 и 55, соответственно;
SEQ ID NO: 56 и 54, соответственно; или
SEQ ID NO: 56 и 55, соответственно.
В некоторых вариантах осуществления первая область CH2-CH3 и/или вторая область CH2-CH3 связана с гетерологичным белком.
В некоторых вариантах осуществления гетерологичный белок представляет собой пептид.
В некоторых вариантах осуществления гетерологичный белок представляет собой внеклеточный домен рецептора.
В некоторых вариантах осуществления гетерологичный белок представляет собой внеклеточный домен лиганда.
В некоторых вариантах осуществления гетерологичный белок представляет собой секретируемый белок.
В некоторых вариантах осуществления гетерологичный белок представляет собой ScFv.
В некоторых вариантах осуществления гетерологичный белок представляет собой вариабельную область тяжелой цепи (VH).
В некоторых вариантах осуществления гетерологичный белок представляет собой вариабельную область легкой цепи (VL).
В некоторых вариантах осуществления гетерологичный белок представляет собой домен фибронектина типа III.
В некоторых вариантах осуществления гетерологичный белок представляет собой финомер.
В некоторых вариантах осуществления гетерологичный белок связан с N-концом первой области CH2-CH3 и/или второй области CH2-CH3 необязательно посредством линкера.
В некоторых вариантах осуществления гетерологичный белок связан с C-концом первой области CH2-CH3 и/или второй областью CH2-CH3 необязательно посредством линкера.
В некоторых вариантах осуществления линкер содержит аминокислотную последовательность SEQ ID NO: 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 92, 93, 94, 95, 96, 97 или 98.
В некоторых вариантах осуществления мультимерный белок представляет собой антитело.
В некоторых вариантах осуществления антитело является мультиспецифическим.
В некоторых вариантах осуществления антитело является биспецифическим.
В некоторых вариантах осуществления антителом является моноспецифическим.
В некоторых вариантах осуществления мультимерный белок содержит две полипептидные цепи.
В некоторых вариантах осуществления мультимерный белок содержит три полипептидные цепи.
В некоторых вариантах осуществления мультимерный белок содержит четыре полипептидные цепи.
Иллюстративные форматы мультимерного белка, которые входят в объем изобретения, показаны в таблице 5. В таких форматах пептид (P) может представлять собой внеклеточный домен рецептора, внеклеточный домен лиганда, секретируемый белок, scFv, Fab, вариабельную область тяжелой цепи (VH), вариабельную область легкой цепи (VL), домен фибронектина типа III или финомер. В таких форматах линкер (L) может необязательно отсутствовать. Примеры линкеров приведены в таблице 6. Звездочка (*) в таблице указывает на то, что два домена CH2-CH3 имеют асимметричные мутации, как было описано в данном документе.
Мультимерные белки согласно изобретению могут быть дополнительно модифицированы, как описано в данном документе для мультиспецифических антител, с использованием стандартных способов. Мультимерные белки согласно изобретению могут быть получены с использованием стандартных способов клонирования.
Таблица 5.
(P-L)n-CH2-CH3*
CH2-CH3*-(L-P)n
(P-L)n-CH2-CH3*-(L-P)n
VH2-CH1-шарнир-CH2-CH3*
VL1
VL2
VH1-L-VH2-L-CH2-CH3*
VL1
VL2
VH2-CH1-шарнир-CH2-CH3*
VL1
VH1-L-VH2-L-CH2-CH3*
VL1
VL1-L-VH2-L-CH2-CH3*
VL1-L-VH2
L-CH2-CH3*
(P-L)n -VH2-CH1-шарнир-CH2-CH3*-(L-P)n
VL1
VL2
Таблица 6.
Полинуклеотиды, векторы и клетки-хозяева
В настоящем изобретении также предложен выделенный полинуклеотид, кодирующий любую из областей CH2-CH3, тяжелых цепей антител, легких цепей антител или полипептидов мультимерных белков согласно изобретению.
В изобретении также предложен выделенный полинуклеотид,
содержащий полинуклеотид, кодирующий первую область CH2-CH3, содержащую мутацию Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R;
содержащий полинуклеотид, кодирующий первую область CH2-CH3, содержащую мутацию Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R, и вторую область CH2-CH3, содержащую аминокислотный остаток дикого типа в положениях 307, 309 и 311; или
содержащий полинуклеотидную последовательность SEQ ID NO: 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 87, 88 или 91.
Полинуклеотидные последовательности согласно изобретения могут быть функционально связаны с одним или более регуляторными элементами, такими как промотор или энхансер, которые позволяют экспрессировать нуклеотидную последовательность в предполагаемой клетке-хозяине. Полинуклеотид может представлять собой кДНК.
В изобретении также предложен вектор, содержащий полинуклеотид изобретения. Такие векторы могут представлять собой плазмидные векторы, вирусные векторы, векторы для экспрессии бакуловирусов, векторы на основе транспозонов или любые другие векторы, приемлемые для введения синтетического полинуклеотида настоящего изобретения в данный организм или в данное генетическое окружение любым способом. Полинуклеотиды согласно изобретению могут быть функционально связаны с регуляторными последовательностями в векторе(ах) экспрессии, который обеспечивают экспрессию областей СН2-СН3, кодируемых полинуклеотидами. К таким управляющим последовательностям относятся сигнальные последовательности, промоторы (например, естественно ассоциированные или гетерологичные промоторы), энхансерные элементы и последовательности терминации транскрипции, и их выбирают так, чтобы они были совместимы с клеткой-хозяином, выбранной для экспрессии антитела. После введения вектора в соответствующего хозяина проводят инкубацию хозяина в условиях, приемлемых для высокоуровневой экспрессии белков, кодируемых введенными полинуклеотидами.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 27 и 47.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 28 и 47.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 29 и 47.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 30 и 47.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 31 и 48.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 32 и 48.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 33 и 48.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 34 и 48.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 35 и 49.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 36 и 49.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 37 и 49.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 38 и 49.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 39 и 50.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 40 и 50.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 41 и 50.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 42 и 50.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 43 и 51.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 44 и 51.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 45 и 51.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 46 и 51.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 87 и 89.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 87 и 90.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 88 и 89.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 88 и 90.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 92 и 89.
В некоторых вариантах осуществления вектор содержит полинуклеотиды SEQ ID NO: 92 и 90.
В таблице 7 показаны последовательности кДНК иллюстративных областей СН2-СН3.
Таблица 7.
Как правило, приемлемые экспрессионные векторы могут реплицироваться в организмах-хозяевах либо в виде эписом, либо в виде неотъемлемой части хромосомной ДНК хозяина. Обычно экспрессионные векторы содержат маркеры селекции, например, вызывающие резистентность к ампициллину, резистентность к гигромицину, резистентность к тетрациклину, резистентность к канамицину или резистентность к неомицину, чтобы обеспечивать обнаружение таких клеток, трансформированных желаемыми последовательностями ДНК.
Приемлемые промоторные и энхансерные элементы известны в данной области. Примеры промоторов для экспрессии в эукариотических клетках включают промотор гена легкой и/или тяжелой цепи иммуноглобулина и элементы энхансера, немедленно-ранний промотор цитомегаловируса, промотор тимидинкиназы вируса простого герпеса, ранние и поздние промоторы SV40, промотор, присутствующий в длинных концевых повторах ретровируса; промотор мышиного металлотионеина-I, а также различные известные в данной области техники тканеспецифические промоторы. Выбор соответствующего вектора и промотора вполне соответствует уровню обычного специалиста в данной области.
Известно большое количество приемлемых векторов и промоторов; многие из них коммерчески доступны для создания рекомбинантных конструктов. Иллюстративные векторы представляют собой векторы для экспрессии в бактериях pBs, phagescript, PsiX174, pBluescript SK, pBs KS, pNH8a, pNH16a, pNH18a, pNH46a (Stratagene, Ла-Холья, г. Сан-Диего, штат Калифорния, США); pTrc99A, pKK223-3, pKK233-3, pDR540 и pRIT5 (Pharmacia, г. Упсала, Швеция) и эукариотические векторы, такие как pWLneo, pSV2cat, pOG44, PXR1, pSG (Stratagene) pSVK3, pBPV, pMSG и pSVL (Pharmacia).
В изобретении также предложена клетка-хозяин, содержащая один или более векторов изобретения. Термин «клетка-хозяин» относится к клетке, в которую был встроен вектор. Следует понимать, что термин «клетка-хозяин» служит для обозначения не только конкретной заявленной клетки, но и потомства такой клетки, а также стабильной клеточной линии, полученной из конкретной заявленной клетки. Так как в последующих поколениях могут возникать некоторые модификации вследствие либо мутации, либо воздействий среды, такое потомство может быть неидентичным исходной клетке, но оно также может быть охвачено термином «клетка-хозяин», используемым в настоящем документе. Такими клетками-хозяевами могут быть эукариотические, прокариотические, растительные клетки или клетки архей. Кишечная палочка (Escherichia coli), бациллы, такие как сенная палочка (Bacillus subtilis), и другие энтеробактерии, такие как сальмонеллы (Salmonella), серратия (Serratia) и различные виды псевдомонад (Pseudomonas), являются примерами прокариотических клеток-хозяев. Для экспрессии также могут использоваться другие микроорганизмы, такие как дрожжи. Сахаромицеты (например, S. cerevisiae) и пихии являются примерами приемлемых дрожжевых клеток-хозяев. Примерами эукариотических клеток могут быть клетки млекопитающих, насекомых, птиц или другие клетки животного происхождения. Эукариотические клетки млекопитающих включают иммортализованные клеточные линии, такие как гибридомы или клеточные линии миеломы, например мышиные клеточные линии SP2/0 (Американская коллекция типовых культур (ATCC), г. Манассас, штат Вирджиния, США, CRL-1581), NS0 (Европейская коллекция клеточных культур (ECACC), г. Солсбери, Уилтшир, Великобритания, ECACC № 85110503), FO (ATCC CRL-1646) и Ag653 (ATCC CRL-1580). Примером человеческой клеточной линии миеломы является U266 (ATTC CRL-TIB-196) Другие используемые клеточные линии включают линии, полученные из клеток яичника китайского хомячка (CHO), например CHO-K1SV (Lonza Biologics, г. Уолкерсвилл, штат Мэриленд, США), CHO-K1 (ATCC CRL-61) или DG44.
В изобретении также предложен способ получения выделенного мультиспецифического антитела согласно изобретению, включающий культивирование клетки-хозяина согласно изобретению в условиях, в которых экспрессируется мультиспецифическое антитело, и очистку мультиспецифического антитела с использованием аффинной хроматографии белка A.
Фармацевтические композиции, введение и способы лечения
В изобретении также предложены фармацевтические композиции, содержащие мультиспецифические антитела или мультимерные белки согласно изобретению и фармацевтически приемлемый носитель. Для терапевтического применения мультиспецифические антитела или мультимерные белки согласно изобретению могут быть получены в виде фармацевтических композиций, содержащих эффективное количество мультиспецифических антител или мультимерных белков согласно изобретению в качестве активного ингредиента в фармацевтически приемлемом носителе. Термин «носитель» относится к разбавителю, адъюванту, вспомогательному веществу или носителю, вместе с которыми вводят активное соединение. Такие несущие среды могут представлять собой жидкости, такие как вода и масла, включая масла минерального, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т. п. Например, можно использовать 0,4% физиологический раствор и 0,3% глицин. Эти растворы являются стерильными и, как правило, не содержат твердых частиц. Их можно стерилизовать с применением хорошо известных стандартных методик стерилизации (например, фильтрации). Композиции могут содержать фармацевтически приемлемые вспомогательные вещества, необходимые для приближения к физиологическим условиям, такие как агенты, регулирующие pH, и буферные агенты, стабилизаторы, загустители, смазывающие агенты, красители и т. д. Концентрация мультиспецифических антител или мультимерных белков согласно изобретению в таком фармацевтическом составе может значительно варьироваться, т. е. от менее чем около 0,5%, обычно по меньшей мере до около 1% и до 15 или 20% масс., и будет преимущественно выбираться на основании необходимой дозы, объемов текучей среды, значений вязкости и т. д. в соответствии с конкретным выбранным способом введения. Приемлемые несущие среды и составы, включающие другие человеческие белки, например сывороточный альбумин человека, описаны, например, в Remington: The Science and Practice of Pharmacy, 21st Edition, Troy, D.B. ed., Lipincott Williams and Wilkins, Philadelphia, PA 2006, Part 5, Pharmaceutical Manufacturing pp 691-1092, см., в особенности pp. 958-989.
Способ введения для терапевтического применения мультиспецифических антител или мультимерных белков согласно изобретению может представлять собой любой приемлемый путь, обеспечивающий доставку агента хозяину, такой как парентеральное введение, например, внутрикожное, внутримышечное, интраперитонеальное, внутривенное или подкожное, ингаляционное; чресслизистое (пероральное, интраназальное, интравагинальное, ректальное) с применением состава в виде таблетки, капсулы, раствора, порошка, геля, корпускулы; и введение варианта, содержащегося в шприце, имплантированном устройстве, осмотическом насосе, картридже, микронасосе или же с помощью других средств, которые хорошо известны в данной области и очевидны для квалифицированного специалиста. Локализованное специфическое введение можно обеспечить, например, путем доставки в сустав, бронхи, брюшную полость, внутри капсулы, в хрящ, полости тела, клетку, мозжечок, желудочек мозга, толстую кишку, шейку матки, желудок, печень, полость сердца, кость, таз, перикард, полость живота, плевру, предстательную железу, легкие, прямую кишку, почку, сетчатку, позвоночник, синовиальную сумку, грудную клетку, матку, сосуд, мочевой пузырь, поврежденную ткань, вагинально, ректально, буккально, сублингвально, интраназально или наружно.
Фармацевтические композиции могут поставляться в виде набора, содержащего контейнер, который содержит фармацевтическую композицию, описанную в данном документе. Фармацевтическая композиция может быть предложена, например, в форме раствора для инъекций на одну или более доз или в виде стерильного порошка, который разводят перед инъекцией. В альтернативном варианте осуществления такой набор может включать диспенсер сухого порошка, генератор жидкого аэрозоля или небулайзер для введения фармацевтической композиции. Такой набор может дополнительно содержать письменную информацию о показаниях и применении фармацевтической композиции.
Мультиспецифические антитела и другие мультимерные белки можно применять для лечения любого патологического состояния у субъекта-человека в зависимости от их специфичности.
Хотя изобретение описано в общих чертах, варианты осуществления изобретения будут дополнительно описаны в следующих примерах, которые не следует толковать как ограничивающие объем формулы изобретения.
Пример 1. Конструирование мутаций Fc, потенциально снижающих связывание Fc с белком А
FcRn и Z-домен белка A связываются с Fc на поверхности раздела между доменами CH2 и CH3, связываясь со многими из тех же самых остатков в Fc Поскольку мышиный IgG2a/b связывается с Z-доменом слабее, чем человеческий IgG1, в то время как все связываются с FcRn, были идентифицированы положения на поверхности связывания Z-домена из домена CH2 IgG1 человека, которые не были сохранены в домене СН2 IgG2a мыши. На Фиг. 1A показано выравнивание доменов CH2 IgG1 человека и IgG2a мыши между остатками 305 и 315. Поскольку остатки в положениях 305, 307, 309, 314 и 315 отличаются между человеческими и мышиными последовательностями, предполагалось, что введение обратных мутаций T307P и/или L309Q в IgG1 человека может привести к образованию сконструированных вариантов IgG1 со сниженным связыванием с белком А, не влияя при этом на взаимодействие с FcRn. Валин 305 в IgG1 человека расположен в β-цепи в домене CH2 и не взаимодействует с белком А или FcRn. В то время как лейцин 314 и аспарагин 315 отличаются в человеческом и мышином IgG, их различия являются консервативными (например, L314 в человеческом IgG заменяется на другой гидрофобный остаток: L/M314 в мышином IgG и N315 заменяют на другой полярный остаток: S315 в мышином IgG). Таким образом, было высказано предположение о том, что изменения в положениях 307 и 309 окажут наибольшее влияние на взаимодействие человеческого IgG1 с белком А и FcRn.
Анализ кристаллических структур комплексов Z-домена (пептид Z34C, дисульфид-связывающий двухспиральный пучок, полученный из Z-домена, PDB ID 1L6X) и Fc продемонстрировал, что остаток Q311 Fc IgG1 взаимодействовал с F9, L13, R23, N24 и I27 на Z-домене (нумерация остатков соответствует SEQ ID NO: 99) главным образом за счет гидрофобных взаимодействий (Фиг. 1B). И наоборот, остаток Q311 Fc IgG1 взаимодействовал с преимущественно кислотной поверхностью FcRn, содержащей E115 и E116 (соответствующие остаткам E4 и E5 в SEQ ID NO: 103) из α субъединицы FcRn (PDB ID 4N0U). Предполагалось, что мутирующий остаток Q311 Fc может дифференциально влиять на связывание полученного варианта(ов) с Z-доменом и FcRn. На Фиг. 1B показаны остатки Fc в контакте с FcRn или Z-доменом при длине отсечки 5 Å.
Пример 2. Создание моноспецифических и биспецифических антител, используемых в исследованиях
Мутации T307A, Q311A, Q311K, Q311E, T307P/L309Q или T307P/L309Q/Q311R были введены в обе тяжелые цепи различных моноспецифических антител с использованием стандартных методов молекулярной биологии.
Биспецифические мкАт создавали с использованием технологии общей легкой цепи или путем стимуляции обмена Fab-фрагментами с использованием технологии Duobody® и технологии выступ-во-впадину. В технологии общей легкой цепи использовали анти-TNFα и анти-αVβ5 антитела, которые, как известно, имеют общую легкую цепь. В технологии выступ-во-впадину в исходные моноспецифические антитела вводили или выступ (мутация T366W), или впадину (мутации T366S, L368A, Y407V). В технологии Duobody® в исходные моноспецифические антитела были введены мутации F405L или K409R.
Полученные биспецифические антитела содержат мутации (мутацию), которые потенциально нарушают или уменьшают связывание белка А (T307A, Q311A, Q311K, Q311E, T307P/L309Q и T307P/L309Q/Q311R) только в одной тяжелой цепи (например, асимметричные мутации).
Ат экспрессировали в клетках Expi293F (Invitrogen) в соответствии с протоколом производителя, используя молярное соотношение плазмид, кодирующих легкую цепь и тяжелую цепь, 3:1. Котрансфекции проводили с использованием молярного соотношения 3:0.5:0.5 для плазмид, кодирующих легкую цепь, тяжелую цепь 1 и тяжелую цепь 2, Культуральные супернатанты собирали при помощи фильтрации после 5-суточных периодов экспрессии. Титры оценивали с использованием поверхностной бислойной интерферометрии против стандартов изотипического контроля известной концентрации. Исходные Ат очищали с помощью аффинной хроматографии белка А с использованием смолы MabSelect SuRe (GE Healthcare) в соответствии с протоколом производителя. Варианты с измененным связыванием белка A очищали при помощи аффинной хроматографии на основе белка G (GE Healthcare) в соответствии с протоколом производителя.
В таблице 8 показаны полученные моноспецифические антитела.
В таблице 9 показаны полученные биспецифические (bs) антитела.
Таблица 8.
Таблица 9.
Аминокислотные последовательности тяжелой и легкой цепей созданных антител.
SEQ ID NO: 68 HC gp120-R
QVQLVQSGAEVKKPGASVKVSCQASGYRFSNFVIHWVRQAPGQRFEWMGWINPYNGNKEFSAKFQDRVTFTADTSANTAYMELRSLRSADTAVYYCARVGPYSWDDSPQDNYYMDVWGKGTTVIVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 69 LC gp120-R EIVLTQSPGTLSLSPGERATFSCRSSHSIRSRRVAWYQHKPGQAPRLVIHGVSNRASGISDRFSGSGSGTDFTLTITRVEPEDFALYYCQVYGASSYTFGQGTKLERKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 70 HC RSV-L
QITLKESGPTLVKPTQTLTLTCTFSGFSLSTSGMGVSWIRQPPGKALEWLAHIYWDDDKRYNPSLKSRLTITKDTSKNQVVLTMTNMDPVDTATYYCARLYGFTYGFAYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFLLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 71 LC RSV
DIVMTQSPDSLAVSLGERATINCRASQSVDYNGISYMHWYQQKPGQPPKLLIYAASNPESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQQIIEDPWTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 72 HC RSV-L[Q311A]
QITLKESGPTLVKPTQTLTLTCTFSGFSLSTSGMGVSWIRQPPGKALEWLAHIYWDDDKRYNPSLKSRLTITKDTSKNQVVLTMTNMDPVDTATYYCARLYGFTYGFAYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHADWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFLLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 73 HC RSV-L[Q311K]
QITLKESGPTLVKPTQTLTLTCTFSGFSLSTSGMGVSWIRQPPGKALEWLAHIYWDDDKRYNPSLKSRLTITKDTSKNQVVLTMTNMDPVDTATYYCARLYGFTYGFAYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHKDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFLLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 74 HC RSV-L[Q311R] (Q311R/ F405L)
QITLKESGPTLVKPTQTLTLTCTFSGFSLSTSGMGVSWIRQPPGKALEWLAHIYWDDDKRYNPSLKSRLTITKDTSKNQVVLTMTNMDPVDTATYYCARLYGFTYGFAYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHRDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFLLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 75 HC RSV-L[Q311H] (Q311H/ F405L)
QITLKESGPTLVKPTQTLTLTCTFSGFSLSTSGMGVSWIRQPPGKALEWLAHIYWDDDKRYNPSLKSRLTITKDTSKNQVVLTMTNMDPVDTATYYCARLYGFTYGFAYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHHDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFLLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 76 HC RSV-L[TL] (T307P/L309Q/ F405L)
QITLKESGPTLVKPTQTLTLTCTFSGFSLSTSGMGVSWIRQPPGKALEWLAHIYWDDDKRYNPSLKSRLTITKDTSKNQVVLTMTNMDPVDTATYYCARLYGFTYGFAYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLPVQHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFLLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 77 HC RSV-L[TLQ] (T307P/L309Q/Q311R/F405L)
QITLKESGPTLVKPTQTLTLTCTFSGFSLSTSGMGVSWIRQPPGKALEWLAHIYWDDDKRYNPSLKSRLTITKDTSKNQVVLTMTNMDPVDTATYYCARLYGFTYGFAYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLPVQHRDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFLLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 78 HC RSV-L[I253D] (I253D/F405L)
QITLKESGPTLVKPTQTLTLTCTFSGFSLSTSGMGVSWIRQPPGKALEWLAHIYWDDDKRYNPSLKSRLTITKDTSKNQVVLTMTNMDPVDTATYYCARLYGFTYGFAYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMDSRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFLLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 79 HC aVb5
QVQLVESGGGVVQPGRSRRLSCAASGFTFSRYTMHWVRQAPGKGLEWVAVISFDGSNKYYVGSVKGRFTISRDNSENTLYLQVNILRAEDTAVYYCAREARGSYAFDIWGQGTMVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 80 LC анти-ФНО и анти-aVb5
EIVLTQSPATLSLSPGERATLSCRASQSVSSYLAWYQQKPGQAPRLLIYDASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSNWPPFTFGPGTKVDIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
SEQ ID NO: 81 HC анти-ФНО
EVQLVESGGGVVQPGGSLSLSCAASGFIFSSYAMHWVRQAPGNGLEWVAFMSYDGSNKKYADSVKGRFTISRDNSENTLYLQMNSLRAEDTAVYYCARDRGIAAGGNYYYYGMDVWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 82 HC TNF-[Q311R]
EVQLVESGGGVVQPGGSLSLSCAASGFIFSSYAMHWVRQAPGNGLEWVAFMSYDGSNKKYADSVKGRFTISRDNSENTLYLQMNSLRAEDTAVYYCARDRGIAAGGNYYYYGMDVWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHRDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 83 HC TNF-[TLQ] (T307P/L309Q/Q311R):
EVQLVESGGGVVQPGGSLSLSCAASGFIFSSYAMHWVRQAPGNGLEWVAFMSYDGSNKKYADSVKGRFTISRDNSENTLYLQMNSLRAEDTAVYYCARDRGIAAGGNYYYYGMDVWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLPVQHRDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 84 HC TNF-knob[Q311R] (Q311R/T366W)
EVQLVESGGGVVQPGGSLSLSCAASGFIFSSYAMHWVRQAPGNGLEWVAFMSYDGSNKKYADSVKGRFTISRDNSENTLYLQMNSLRAEDTAVYYCARDRGIAAGGNYYYYGMDVWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHRDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLWCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 85 HC TNF-knob[TLQ] (T307P/L309Q/Q311R/T366W)
EVQLVESGGGVVQPGGSLSLSCAASGFIFSSYAMHWVRQAPGNGLEWVAFMSYDGSNKKYADSVKGRFTISRDNSENTLYLQMNSLRAEDTAVYYCARDRGIAAGGNYYYYGMDVWGQGTTVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLPVQHRDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLWCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO: 86 HC aVb5-hole (T366S/L368A/Y407V)
QVQLVESGGGVVQPGRSRRLSCAASGFTFSRYTMHWVRQAPGKGLEWVAVISFDGSNKYYVGSVKGRFTISRDNSENTLYLQVNILRAEDTAVYYCAREARGSYAFDIWGQGTMVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLSCAVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLVSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
Пример 3. Влияние мутаций T307, L309 и/или Q311 на связывание с Z-доменом и FcRn Связывание моноспецифических вариантов IgG1 с Z-доменом
Моноспецифические анти-RSV антитела, содержащие мутации Fc, как показано в таблице 8, использовали в исследовании.
RSV-L элюировали из смолы для белка A при pH 4,09. Тогда как мутация T307A не влияла на связывание белка A (данные не показаны), мутация T307P/L309Q (мкАт RSV-L[TL]) приводила к умеренному снижению связывания с белком A, вызывая элюирование этого мкАт при pH 4,48. Дополнительное ослабление влияния на связывание белка А может быть достигнуто за счет симметричных мутаций Q311K или Q311R, но не из-за мутации Q311A. Введение тройной мутации T307P/L309Q/Q311R (мкАт RSV-L[TLQ]) дополнительно нарушало взаимодействие с белком А, о чем свидетельствует повышенное элюирование при рН 4,70. В таблице 10 показаны показатели рН элюирования созданных вариантов IgG1.
Эти результаты показали, что каждая из симметричных мутаций Q311K, Q311R, T307P/L309Q и T307P/L309Q/Q311R снижала связывание варианта IgG1 с белком А, потенциально позволяя очищать и разделять биспецифические антитела, имеющие асимметричные мутации, образуемые из исходного варианта IgG1c, на основе дифференциального элюирования белка A.
Таблица 10. Значения pH элюирования для созданных вариантов IgG1
Связывание вариантов IgG1 с FcRn
Ни одна из введенных одиночных мутаций в положении 311 - (Q311R, Q311A, Q311K и Q311H) не нарушала взаимодействия моноспецифических антител с FcRn. Мутация Q311R привела к умеренно улучшенной способности связывания FcRn, что позволяет предположить, что эта мутация может обеспечить увеличенный период полужизни в сыворотке. RSV-L [TLQ] связывал FcRn с аналогичной аффинностью по сравнению с RSV-L. Биспецифические антитела IgG1 с асимметричными мутациями F405L Q311R (bsRSV-L[Q311R]) или F405L/T307P/L309Q/Q311R (bsRSV-L[TLQ]) также связывали FcRn с идентичной аффинностью по сравнению с IgG1 дикого типа. На Фиг. 2A показана кривая зависимости доза - эффект для конкурентного связывания вариантов IgG1 с мутациями Q311R, Q311A, Q311K или Q311H с FcRn. На Фиг. 2В показана кривая доза-ответ для конкурентного связывания вариантов IgG1 с симметричным (например, моноспецифических мкАт RSV-L, RSV-L[Q311R], RSV-L[TLQ]) или асимметричным (например, биспецифических мкАт bsRSV-L[Q311R], bsRSV-L[TLQ]) мутациями Q311R или T307P/L309Q/Q311R с FcRn. Известно, что мутация I253D нарушает взаимодействие с FcRn и используется в качестве отрицательного контроля.
Мутации в Q311R, Q311A, Q311K или Q311H не влияли на взаимодействие с FcRn. Мутация Q311R усилила взаимодействие с FcRn. Включение мутаций T307P/L309Q/Q311R в одну или обе тяжелые цепи не нарушало взаимодействие с FcRn. Эти результаты позволяют предположить, что биспецифические антитела, имеющие асимметричные мутации Q311R или T307P/L309Q/Q311R, могут быть выделены и очищены от их исходных моноспецифических антител путем дифференциальной очистки белка А. Кроме того, эти антитела могут иметь более длительный период полужизни в сыворотке по сравнению с IgG1 дикого типа.
Способы
Мутации T307A, Q311A, Q311K, Q311R, Q311H, T307P/L309Q и T307P/L309Q/Q311R были введены в моноспецифические исходные анти-RSV или анти-gp120 антитела. Исходные антитела дополнительно конструировали так, чтобы они имели мутацию F405L (анти-RSV антитело) или мутацию K409R (анти-gp120 антитело) для создания биспецифических анти-RSV/gp120 антител с использованием обмена Fab-фрагментами. Была оценена степень, в которой мутации могут модулировать связывание с Z-доменом и FcRn.
Z-домен, используемый в экспериментах, имеет аминокислотную последовательность SEQ ID NO: 1.
Связывание белка A
Для каждого исходного мкАт, содержащего мутации на обоих фрагментах, 1 мг загружали в колонки mAbSelect sure объемом 1 мл (GE Healthcare) и элюировали со скоростью 1 мл/мин с использованием 30 мл градиента от 1 X PBS при pH 7,2 до 50 мМ цитрата при pH 3,5. Контролировали оптическую плотность при 280 нм и рН. Показатель рН в максимуме пика использовали для определения рН элюирования в препаративных экспериментах.
Связывание FcRn
Связывание FcRn оценивали in vitro с использованием анализа AlphaScreen. В этих анализах биотинилированный IgG связывали с покрытой стрептавидином донорной гранулой, а His-меченный FcRn связывали с покрытой никелем акцепторной гранулой. Связывание между двумя белками привело к сигналу люминесценции. Для конкуренции в связывании использовали немеченый или мутантный IgG дикого типа, что приводило к дозозависимому снижению сигнала. мкАт были биотинилированы с использованием набора SureLINK Chromophoric Biotin Labeling kit (KPL Inc.) в соответствии с протоколом производителя. His-меченный FcRn был приобретен у компании Sino Biological. Анализы проводили в 1 X PBS, доведенном до pH 6,0, с добавлением 0,05% (масс./об.) бычьего сывороточного альбумина (BSA) и 0,01% (масс./об.) Твин-20. Биотинилированный IgG1 дикого типа в концентрации 1 мкг/мл связывали с донорными гранулами, конъюгированными со стрептавидином, и His-меченный FcRn в концентрации 0,2 мкг/мл связывали акцепторной гранулой, конъюгированной с никелем. Конкурентные Ат готовили в концентрации 0,4 мг/мл и серийно разводили в 3 раза для каждой точки. Люминесценцию между 520-620 нм регистрировали с использованием планшет-ридера EnVision (Perkin Elmer). Данные анализировали с использованием программного обеспечения Prism 6.01 (GraphPad Software, Inc.) и аппроксимировали с использованием модели конкуренции с 4 параметрами, как описано ранее (Vafa et al., Methods 65:114-126, 2014).
Пример 4. Мутации T307P, L309Q и Q311R не оказывают влияния на связывание с рецептором Fcγ (FcγR) или стабильность антитела
Сообщалось, что мутации на поверхности раздела CH2-CH3 изменяют структуру Fc, что приводит к увеличению динамики Fc, снижению термостабильности и изменению взаимодействия с Fcγ-рецепторами (Majumdar et al., MAbs 7:84-95, 2015). Для определения того, оказывают ли мутации Q311R или T307P/L309Q/Q311R аналогичное воздействие на структуру Fc, антитела, имеющие эти мутации, оценивали на их способность связываться с Fcγ-рецепторами и на их термостабильность.
Ни симметричные, ни асимметричные мутации Q311R или T307P/L309Q/Q311R в моноспецифических или биспецифических антителах, соответственно, не влияли на способность варианта IgG1 взаимодействовать с Fcγ-рецепторами in vitro. Этот результат был в некоторой степени ожидаемым, поскольку Fcγ-рецепторы связываются с поверхностью раздела CH2-шарнир вместо поверхности раздела CH2-CH3. Результаты также показали, что введенные мутации не нарушали общую структуру Fc. На Фиг. 3А, Фиг.3В, Фиг. 3С и Фиг. 3D показана кривая доза-эффект для конкурентного связывания выбранных антител с FcγRI, FcγRIIa, FcγRIIb, и FcγRIIIa, соответственно. На графиках показан % видимого максимального сигнала в зависимости от концентрации конкурента.
Сравнение значений Tm сконструированных IgG продемонстрировало, что мутации Q311R или T307P/L309Q/Q311R не нарушают термостабильность мкАт. В таблице 11 показаны параметры для дифференциальной сканирующей калориметрии (значения Tm и энтальпии) для протестированных антител. Вместе эти результаты указывают на то, что эффект мутаций Q311R и T307P/L309Q/Q311R ограничен взаимодействием белка A и FcRn.
Таблица 11.
Способы
Для оценки связывания вариантов IgG1 с FcγR использовали анализ AlphaScreen с использованием протокола, описанного в Примере 2, с небольшими модификациями. Растворимые внеклеточные домены FcγR, которые содержали C-концевую метку, были приобретены у R&D systems. Анализы проводили в 1 X PBS при pH 7,2, с добавлением 0,05% (масс./об.) бычьего сывороточного альбумина (BSA) и 0,01% (масс./об.) Твин-20. Биотинилированный IgG1 дикого типа в концентрации 1 μмкг/мл связывали с донорными гранулами, конъюгированными со стрептавидином, и His-меченные FcγR связывали акцепторной гранулой, конъюгированной с никелем. Для FcγRI для увеличения окна сигнала использовали биотинилированный мутант IgG1-L234A/L235A, который связывал рецептор слабее, чем IgG1 дикого типа. Концентрации используемых FcγR составляли 200 нг/мл (FcγRI и FcγRIIIa), 10 нг/мл (FcγRIIa) или 14 нг/мл (FcγRIIb). Конкурентные Ат готовили в концентрации 0,4 мг/мл и серийно разводили в 3 раза для каждой точки.
Для определения Tm и энтальпии нарушения третичной структуры антител использовали дифференциальную сканирующую калориметрию (DSC). Образцы разводили до 1 мг /мл в 1X PBS, pH 7,2. Образцы уравновешивали до 25°C в течение 15 мин., после чего нагревали до температуры 25-95°C со скоростью 1°C/мин. Данные анализировали с помощью программного обеспечения Origin.
Пример 5. Разделение биспецифических антител от исходных моноспецифических мкАт после обмена Fab-фрагментами in vitro очищенных антител путем элюирования из смолы белка А
Введение асимметричных мутаций Q311R или T307P/L309Q/Q311R в биспецифические антитела облегчало их очистку от исходных моноспецифических мкАт.
Полученные после обмена Fab-фрагментами in vitro исходные антитела RSV-L[TLQ] и gp120-R и биспецифические bsRSV-L[TLQ] в соотношении 1:1:1, очищали с помощью дифференциальной аффинной хроматографии белка А, а пики элюирования объединяли и анализировали с помощью HIC.
На Фиг. 4A показано, что как исходное, так и биспецифическое мкАт можно разделить с помощью хроматографии гидрофобного взаимодействия с использованием подобранных условий. На Фиг. 4B показана HIC-хроматограмма экимолярной смеси антител, введенных в колонку с белком A. На Фиг. 4C представлен профиль элюирования смеси антител из смолы белка A, что привело к образованию трех отдельных пиков элюирования при рН 4,7, рН 4,2 и рН 3,4, что соответствует присутствию двух исходных антител и биспецифического антитела На Фиг. 4D показаны HIC-анализы пиков элюирования белка A. Анализ пиков элюирования с помощью HIC продемонстрировал, что при элюировании с высоким pH (pH 4,8) в основном удерживается исходное мкАт RSV-L[TLQ], в то время как при элюировании с pH 3.4 удерживается в основном исходное мкАт gp120-R. При элюировании со средним рН (рН 4,2) удерживается около 94% чистого биспецифического мкАт bsRSV-L[TLQ]. В таблице 12 показана чистота элюирования bsRSV-L[TLQ] при дифференциальной очистке белка А.
Таблица 12.
RSV-L[TLQ]
bsRSV-L[TLQ]
gp120-R
Способы
В исследовании использовали исходные антитела RSV-L[TLQ] и gp120-R, и биспецифическое мкАт bsRSV-L[TLQ].
RSV-L[TLQ] очищали с использованием аффинной хроматографии белка G и диализовали в 1X PBS. gp120-R очищали при помощи аффинной хроматографии белка А и диализовали в 1X PBS. Затем два исходных мкАт подвергали обмену Fab-фрагментами в концентрации 1 мг/мл. Вкратце, 5 мг каждого исходного антитела смешивали в буфере, содержащем 1 X PBS, 75 мМ 2-меркаптоэтиламина, и инкубировали при 31°C в течение 5 ч с последующим экстенсивным диализом против 1 X PBS. Полученный материал, который содержал > 95% бсАт (биспецифического антитела), затем смешивали в молярном соотношении 1:1:1 с двумя очищенными исходными мкАт и смесь использовали в экспериментах по дифференциальной очистке белка A.
Дифференциальную очистку белка A проводили с помощью колонки mAbSelect Sure объемом 1 мл (GE Healthcare). Смесь элюировали в 3 стадии с использованием буферов, содержащих 50 мМ цитрата с pH 4,7, pH 4,2 или pH 3,4. Фракции элюирования собирали и концентрировали до > 1 мг/мл перед анализом.
Анализ пиков элюирования из дифференциальной очистки белка A анализировали с помощью хроматографии гидрофобного взаимодействия (HIC) с использованием колонки Butyl-NPR (Tosoh Biosciences). Около 30 мкг каждого образца вводили в колонку и элюировали с использованием 0-100% градиента буферов, содержащего 100 мМ фосфата натрия, pH 6,0, 1,5 M (NH4)2SO4, или 100 мМ фосфата натрия, pH 6,0.
Пример 6. Разделение биспецифических антител от исходных моноспецифических мкАт после обмена Fab-фрагментами in vitro в неочищенных супернатантах путем элюирования из смолы белка А
Введение асимметричных Q311R или T307P/L309Q/Q311R в биспецифические антитела, полученные из смешанного материала супернатанта, облегчало очистку созданных биспецифических антител от исходных антител.
Для создания биспецифических антител при помощи технологии DuoBody® необходима предварительная очистка мкАт перед обменом Fab-фрагментами. Однако реакции cFAE часто имеют остаточные количества двухвалентного исходного мкАт, что может привести к необходимости дополнительных стадий выделения и доочистки. Таким образом, использование дифференциальной хроматографии на белке А с использованием градиентов рН может упростить очистку биспецифических антител. Другим способом уменьшения количества стадий очистки является выполнение протоколов обмена Fab-фрагментами с использованием супернатантов культуры. В данном способе титры исходных мкАт точно определяются таким образом, что исходные мкАт смешиваются в молярном соотношении 1:1. Путем проведения контролируемого обмена Fab-фрагментами с супернатантами культуры затраты на получение биспецифических антител могут быть снижены, поскольку на одну стадию очистки белка A становится меньше и экономится время из-за отсутствия необходимости проведения очистки и определения характеристик двух исходных антител.
bsRSV-L[TLQ] и bsFSV-L[Q311R] были получены с использованием обмена Fab-фрагментами в супернатантах клеточных культур, содержащих эквивалентные количества исходных антител RSV-L[TLQ] и gp120-R, и полученные образцы наносились на аффинную колонку с белком А.
На Фиг. 5A показана хроматограмма белка А образца bsRSV-L[TLQ], образованного обменом Fab-фрагментами с заменой Fab-фрагментов в супернатанте, на которой показаны три отдельных пика, элюирующихся при рН 4,7, 4,2 и 3,4.
На Фиг. 5B показаны HIC-анализы элюатов аффинной колонки с белком A при pH 4,7 образца bsRSV-L[TLQ], образованного обменом Fab-фрагментами в супернатанте.
На Фиг. 5C показаны HIC-анализы элюатов аффинной колонки с белком A при pH 4,2 образца bsRSV-L[TLQ], образованного обменом Fab-фрагментами в супернатанте.
На Фиг. 5D показаны HIC-анализы элюатов аффинной колонки с белком A при pH 3,4 образца bsRSV-L[TLQ], образованного обменом Fab-фрагментами в супернатанте.
На Фиг. 6A показана хроматограмма белка А образца bsRSV-L[Q311R], образованного обменом Fab-фрагментами в супернатанте, на которой показаны три отдельных пика, элюирующихся при рН 4,7, 4,2 и 3,4.
На Фиг. 6B показаны HIC-анализы элюатов аффинной колонки с белком A при pH 4,7 образца bsRSV-L[Q311R], образованного обменом Fab-фрагментами в супернатанте.
На Фиг. 6С показаны HIC-анализы элюатов аффинной колонки с белком A при pH 4,2 образца bsRSV-L[Q311R], образованного обменом Fab-фрагментами в супернатанте.
На Фиг. 6D показаны HIC-анализы элюатов аффинной колонки с белком A при pH 3,4 образца bsRSV-L[Q311R], образованного обменом Fab-фрагментами в супернатанте.
Для обмена Fab-фрагментами в супернатанте, продуцирующего bsRSV-L[TLQ], оставшееся исходное RSV-L[TLQ] удаляли элюированием при pH 4,7 (Фиг. 5B), а оставшееся исходное gp120-R удаляли элюированием при pH 3,4 (Фиг. 5D) Часть bsRSV-L[TLQ] элюировали только при pH 4,2 (Фиг. 5C). Часть bsRSV-L[TLQ] элюировали при pH 3,4 (Фиг. 5D) и при pH 4,7 (Фиг. 5B), что приводило к снижению конечного выхода очищенного bsRSV-L[TLQ]. В таблице 13 показана чистота элюатов из дифференциальной очистки белка A bsRSV-L[TLQ], образованного обменом Fab-фрагментами супернатанте. bsRSV-L[TLQ] выделяли с чистотой более 95%.
Таблица 13.
Для обмена Fab-фрагментами в супернатанте, продуцирующего bsRSV-L[Q311R], оставшееся исходное RSV-L[Q311R] удаляли элюированием при pH 4,6 (Фиг. 6B), а оставшееся исходное gp120-R удаляли элюированием при pH 3,4 (Фиг. 6D). Эффективное элюирование исходного RSV-L[Q311R] требовало немного более кислого pH из-за того, что белок A, связывающий одну мутацию, сильнее, чем тройной мутант T307P/L309Q/Q311R. Часть бсАт элюировали только при pH 4,2 (Фиг. 6C). Часть bsRSV-L[Q311R] элюировали при pH 3,4 (Фиг. 6D) и при pH 4,6 (Фиг. 6B), что приводило к снижению конечного выхода очищенного бсАт.
В таблице 14 показана чистота элюатов из дифференциальной очистки белка A bsRSV-L[Q311R], образованного обменом Fab-фрагментами в супернатанте. bsRSV-L[Q311R] выделяли с чистотой более 95%.
Таблица 14.
В заключение следует отметить, что этот эксперимент продемонстрировал полезность мутаций Q311R и T307P/L309Q/Q311R для эффективного разделения биспецифичных антител, образующихся при помощи обмена Fab-фрагментами в супернатанте.
Способы
Исходные мкАт RSV-L[Q311R] или RSV-L[TLQ] и gp120-R экспрессировали в клетках Expi293 и определяли титры антител (Octet, ForteBio). Для получения биспецифических антител bsRSV-L[Q311R] и bsRSV-L[TLQ], культуральные супернатанты, содержащие эквивалентные миллиграммовые количества RSV-L[Q311R] и gp120-R или RSV-L[TLQ] и gp120-R, объединяли и проводили реакции обмена Fab-фрагментами при конечной концентрации 0,2 мг/мл белка путем добавления 2-меркаптоэтиламина до конечной концентрации 75 мМ с последующей инкубацией при 31°C в течение 5 часов и экстенсивным диализом в 1X DPBS, pH 7,4 (Labrijn Aran F, Meesters Joyce I et al. 2014). После диализа белки наносили на колонку mAbSelect Sure объемом 1 мл (GE) и элюировали, используя ступенчатый градиент pH.
Перед очисткой контрольные смеси, содержащие эквивалентные 1 мг количества очищенных исходных мкАт и биспецифических антител, разделяли на колонке mAbSelect Sure объемом 1 мл (GE) для определения оптимальных условий элюирования. Очищенная белковая смесь, содержащая RSV-L[Q311R], gp120-R и bsRSV-L[Q311R], продемонстрировала оптимальное отделение исходных мкАт от бсАт путем элюирования с 50 мМ цитрата, рН 4,6 в течение 30 объемов колонок (CV), с последующим добавлением 50 мМ цитрата, рН 4,2 в течение 30 CV, а затем 50 мМ цитрата, рН 3,4 в течение 20 CV. Очищенная белковая смесь, содержащая RSV-L[TLQ], gp120-R и bsRSV-L[TLQ], продемонстрировала оптимальное отделение исходных мкАт от биспецифического мкАт путем элюирования с 50 мМ цитрата, рН 4,7 для 30 CV, с последующим добавлением 50 мМ цитрата, рН 4,2 в течение 30 CV, а затем 50 мМ цитрата, pH 3,4, в течение 20 CV.
Следовательно, bsRSV-L[Q311R], полученный из скрещенных в супернатанте исходных мкАт, элюировали с 50 мМ цитрата, рН 4,6 в течение 30 CV, с последующим добавлением 50 мМ цитрата, рН 4,2 в течение 30 CV, а затем 50 мМ цитрата, рН 3,4 в течение 20 CV в последующих экспериментах. bsRSV-L[TLQ], полученный из смешанных в супернатанте исходных мкАт, элюировали с 50 мМ цитрата pH 4,7 в течение 30 CV, с последующим добавлением 50 мМ цитрата pH 4,2 в течение 30 CV, а затем 50 мМ цитрата pH 3,4 в течение 20 CV в последующих экспериментах. В последующих экспериментах для каждой пары биспецифических антител использовали оптимальные условия элюирования.
Эффективность разделения оценивали с помощью хроматографии гидрофобного взаимодействия. Фракции элюирования с каждой стадии рН объединяли, нейтрализовали Трис при рН 7,5 и концентрировали для анализа. Образцы готовили при эквивалентных концентрациях белка, разводили 1: 2 в буфере для связывания (0,1 M NaHPO4 pH 6,5, 1,5 M (NH4)2SO4), наносили на колонку TSKgel Butyl-NPR размером 4,6 мм х 10 см (Tosoh Bioscience, LLC), уравновешенную в 0,1 М NaHPO4 pH 6,5, 1,5 M (NH4)2SO4 и элюировали со скоростью 0,5 мл/мин, используя градиент до 0,1 М NaHPO4, рН 6,5, в течение 25 минут.
Пример 7. Разделение биспецифических антител от исходных моноспецифических мкАт после обмена Fab-фрагментами in vitro, начиная с совместно трансфицированного материала
Оценивали применимость мутаций Q311R или T307P/L309Q/Q311R для очистки биспецифических антител, полученных с использованием технологии общей легкой цепи, вместо обмена Fab-фрагментами.
Полученные биспецифические антитела bsTNF-[TLQ] и bsTNF-[Q311R] были выделены до чистоты более 95% с использованием методов ступенчатого элюирования при 3 pH, описанных в предыдущих примерах. bsTNF-[TLQ] и bsTNF- [Q311R] элюировали при рН 4,2. Кроме того, исходные TNF-[TLQ] и TNF-[Q311R] эффективно элюируются при pH 4,7, при этом мкАт не обнаруживается в других элюатах. Чистота bsTNF-[TLQ] и bsTNF-[Q311R], выделенных при элюировании при pH 4,2, была высокой, однако выход биспецифических антител был несколько ниже по сравнению с биспецифическими антителами, полученными с использованием обмена Fab-фрагментами, из-за значительно отличающихся уровней экспрессии двух исходных мкАт при совместной трансфекции (~ 300 мг/л для исходного TNF-[TLQ] по сравнению с ~ 35 мг/л для aVb5). Несмотря на ~ 10-кратное различие в уровнях экспрессии исходных мкАт, введение мутаций T307P/L309Q/Q311R способствовало выделению более 95% чистого bsTNF-[TLQ], на долю которого приходится лишь ~ 10% от общей количества антитела в исходном образце). В таблице 15 показана чистота элюатов из дифференциальной очистки белка A bsTNF-[TLQ], полученных с использованием технологии общей легкой цепи. В таблице 16 показана чистота элюатов из дифференциальной очистки белка A bsTNF-[Q311R], полученных с использованием технологии общей легкой цепи.
На Фиг. 7A показана хроматограмма белка А образца bsTNF-[TLQ], полученных с использованием технологии общей легкой цепи, на которой показаны три отдельных пика, элюирующихся при рН 4,7, 4,2 и 3,4.
На Фиг. 7B показаны HIC-анализы элюатов аффинной колонки c белком A при pH 4,7 образца bsTNF-[TLQ], полученного с использованием технологии общей легкой цепи.
На Фиг. 7C показаны HIC-анализы элюатов аффинной колонки c белком A при pH 4,2 образца bsTNF-[TLQ], полученного с использованием технологии общей легкой цепи.
На Фиг. 7D показаны HIC-анализы элюатов аффинной колонки c белком A при pH 3,4 образца bsTNF-[TLQ], полученного с использованием технологии общей легкой цепи.
Аналогичные хроматограммы были получены для образцов bsTNF-[Q311R], полученных с использованием технологии общей легкой цепи.
Таблица 15.
Таблица 16.
Способы
В экспериментах использовали исходные антитела TNF-[Q311R], TNF-[TLQ] и aVb5 (см. таблицу 8) Исходные анти-ФНО и анти-αVβV антитела имеют общую легкую цепь, и, следовательно, мкАт использовали в экспериментах для сведения к минимуму видов мкАт, которые могли бы образовываться при ошибочном объединении легких цепей.
Совместную трансфекцию TNF-[Q311R] и aVb5 или TNF-[TLQ] и aVb5 проводили в клетках Expi293 в соответствии с протоколом производителя с использованием молярного соотношения 0,5: 0,5 : 3,0 плазмиды для тяжелая цепь TNF-[Q311R] или TNF-[TLQ] : тяжелая цепь aVb5: легкая цепь. Для определения приблизительных уровней относительной экспрессии также проводили отдельные трансфекции исходных мкАи с использованием молярного соотношения тяжелая цепь: легкая цепь 1,0: 3,0, а титры определяли с использованием Octet. Около 50 мл каждого супернатанта наносили на колонку mAbSelect Sure объемом 1 мл и элюировали с использованием ступенчатого градиента рН с 3 ступенями: 50 мМ цитрата pH 4,7 (или 4,6), 4,2, и 3,4. Фракций, концентрировали и буферный раствор заменяли на 1 X PBS перед HIC-анализом.
Пример 8. Мутации Q311R или T307P/L309Q/Q311R не оказывают влияния на период полужизни антитела в сыворотке
Для исследования ФК (фармакокинетических) свойств выбранных антител использовали гемизиготных мышей Tg32. В этих экспериментах RSV-L имел период полужизни ~ 7 суток. Оба гомодимерных исходных Ат, имеющих мутации Q311R или T307P/L309Q/Q311R (антитела RSV-L[Q311R] и RSV-L[TLQ]), имели период полужизни по крайней мере такой же, как у мкАт дикого типа (~ 7 и 9 суток, соответственно). Мутации также не оказывали значительного влияния на период полужизни в сыворотке при асимметричном введении в биспецифические антитела. bsRSV-L[Q311R] и bsRSV-L[TLQ] имели период полужизни в сыворотке, равный 11/1+3,6 и 4,8+2,0 суткам, соответственно. Период полужизни RSV-L в сыворотке составил 7,0+3,9 суток, период полужизни RSV-L[TLQ] составил 9,0+4,0 суток, а период полужизни RSV-L[Q311R] в сыворотке составил 6,7+3,4 суток. Мутантное антитело I253D не связывает FcRn и был использован в качестве контроля в эксперименте.
На Фиг. 8 показаны результаты фармакокинетического анализа выбранных вариантов. Эти результаты согласуются с анализом связывания FcRn in vitro (Пример 3). Экспериментальные результаты демонстрируют, что асимметрично введенные мутации Q311R или T307P/L309Q/Q311R в биспецифические антитела, полученные с использованием спектра технологий, приводят к получению антител, которые сохраняют нормальный период полужизни в сыворотке и позволяют проводить дифференциальную аффинную очистку биспецифических антител с использованием белка A от контаминирующих исходных моноспецифических антител.
Способы
Гемизиготных мышей Tg32 (Jackson Laboratories кат. № 014565) использовали для фармакокинетических (ФК) исследований антител. Эти мыши являются трансгенными по отношению к субъединице человеческого α-микроглобулина FcRn и, таким образом, помогают прогнозировать период полужизни в сыворотке у человека. (Petkova et al., Int Immunol 18:1759-1769, 2006). Мышам вводили исследуемые Ат внутривенно в хвостовую вену в дозе 2 мг/кг 4 животным на группу. 1 ч, 1 сут, 3 сут, 7 сут, 14 сут и 21 сут были выбраны как временные точки. Серийные образцы крови путем ретроорбитальной пункции были получены от мышей, анестезированных CO2, в указанные моменты времени, а образцы крови умерщвленных животных были взяты путем пункции сердца. Через 30 минут при комнатной температуре образцы крови центрифугировали при 3000 x g в течение 15 мин и отбирали сыворотку для анализа.
Для обнаружения исследуемых антител в сыворотке мыши проводили электрохемилюминесцентный иммунологический анализ. 96-луночные планшеты со стрептавидином Gold (Meso Scale Discovery) покрывали в течение ночи 50 мкл/лунка 3 мкг/мл фрагмента биотин-F(ab')2 специфичного к Fc-фрагменту IgG человека (Jackson Immunoresearch кат № 109-066-008) в StartingBlock (блокирующий буфер) (Thermo); а затем промывали в Трис-солевом буферном растворе с Твин-20 (TBST). Образцы сывороток разводили в 5% сыворотке мышей линии CD-1 в Starting Block (1:20, с последующими серийными 2-кратными разведениями), инкубировали на планшетах в течение 2 ч и промывали. Меченный Ru++ F(ab')2, к IgG человека (полученный от Jackson, 109-006-097) в 1% и инкубировали на планшетах в течение 1,5 ч и промывали BSA-TBST. Добавляли двести микролитров/лунку буфера для считывания с поверхностно-активным веществом и планшеты считывали с использованием планшет-ридера MSD Sector Imager 6000. Сывороточные концентрации Ат IgG2b определяли по стандартной кривой с использованием 4-х параметрической нелинейной регрессии в программном обеспечении Prism 6.01.
Расчеты конечного периода полужизни (t1/2) фазы элиминации (фаза β) в ФК-исследованиях проводили с использованием 1-фазной модели экспоненциального спада, с аппроксимацией нелинейной регрессией зависимости натурального логарифма концентрации от времени с использованием программного обеспечения Prism версии 6.01. Модель нелинейного спада, полученная методом наименьших квадратов, взвешивалась по обратной величине аппроксимированной концентрации. Период полужизни для фазы элиминации (фаза β) определялся по формуле t1/2=ln2/β, где β представляет собой наклон линии, аппроксимированной в регрессионном анализе методом наименьших квадратов, начиная после первой дозы. Конечный период полужизни Ат определяли, взяв среднее от значений t1/2, вычисленных для каждого животного в экспериментальной группе.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Chiu, Mark
Zwolak, Adam
<120> Сконструированные мультиспецифические антитела и другие мультимерные
белки с асимметричными мутациями в области CH2-CH3
<130> JBI5124WOPCT
<140> Переуступка прав
<141> 2018-06-04
<150> 62/515316
<151> 2017-06-05
<160> 105
<170> PatentIn, версия 3.5
<210> 1
<211> 58
<212> PRT
<213> Искусственная последовательность
<220>
<223> Z-домен
<400> 1
Val Asp Asn Lys Phe Asn Lys Glu Gln Gln Asn Ala Phe Tyr Glu Ile
1 5 10 15
Leu His Leu Pro Asn Leu Asn Glu Glu Gln Arg Asn Ala Phe Ile Gln
20 25 30
Ser Leu Lys Asp Asp Pro Ser Gln Ser Ala Asn Leu Leu Ala Glu Ala
35 40 45
Lys Lys Leu Asn Asp Ala Gln Ala Pro Lys
50 55
<210> 2
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG1 HC2-HC3 Q311K
<400> 2
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Lys
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 3
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG1 HC2-HC3 Q311R
<400> 3
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Arg
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 4
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<223> IIgG1 HC2-HC3 T307P/L309Q
<400> 4
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Pro Val Gln His Gln
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 5
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG1 HC2-HC3 T307P/L309Q/Q311R
<400> 5
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Pro Val Gln His Arg
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 6
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG1 HC2-HC3 Q311K/F405L
<400> 6
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Lys
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Leu Leu Tyr
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 7
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG1 HC2-HC3 Q311R/F405L
<400> 7
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Arg
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Leu Leu Tyr
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 8
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG1 HC2-HC3 T307P/L309Q/F405L
<400> 8
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Pro Val Gln His Gln
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Leu Leu Tyr
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 9
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG1 HC2-HC3 T307P/L309Q/Q311R/F405L
<400> 9
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Pro Val Gln His Arg
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Leu Leu Tyr
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 10
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG1 HC2-HC3 Q311K/K409R
<400> 10
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Lys
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 11
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG1 HC2-HC3 Q311R/K409R
<400> 11
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Arg
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 12
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG1 HC2-HC3 T307P/L309Q/K409R
<400> 12
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Pro Val Gln His Gln
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 13
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG1 HC2-HC3 T307P/L309Q/Q311R/K409R
<400> 13
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Pro Val Gln His Arg
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 14
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG1 HC2-HC3 Q311K/ T366W
<400> 14
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Lys
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 15
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG1 HC2-HC3 Q311R/T366W
<400> 15
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Arg
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 16
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG1 HC2-HC3 T307P/L309Q/ T366W
<400> 16
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Pro Val Gln His Gln
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 17
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG1 HC2-HC3 T307P/L309Q/Q311R/ T366W
<400> 17
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Pro Val Gln His Arg
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 18
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG1 HC2-HC3 Q311K/T366S/L368A/Y407V
<400> 18
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Lys
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 19
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG1 HC2-HC3 Q311R/T366S/L368A/Y407V
<400> 19
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Arg
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 20
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG1 HC2-HC3 T307P/L309Q/ T366S/L368A/Y407V
<400> 20
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Pro Val Gln His Gln
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 21
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG1 HC2-HC3 T307P/L309Q/Q311R/ T366S/L368A/Y407V
<400> 21
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Pro Val Gln His Arg
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 22
<211> 216
<212> PRT
<213> Homo sapiens
<400> 22
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 23
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 K409R
<400> 23
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 24
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 F405L
<400> 24
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Leu Leu Tyr
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 25
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 T366S/L368A/Y407V
<400> 25
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 26
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 T366W
<400> 26
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
85 90 95
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 27
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 Q311K
<400> 27
cctgaactgc tggggggacc gtcagtcttc ctcttccccc caaaacccaa ggacaccctc 60
atgatctccc ggacccctga ggtcacatgc gtggtggtgg acgtgagcca cgaagaccct 120
gaggtcaagt tcaactggta cgtggacggc gtggaggtgc ataatgccaa gacaaagccg 180
cgggaggagc agtacaacag cacgtaccgt gtggtcagcg tcctcaccgt cctgcacaag 240
gactggctga atggcaagga gtacaagtgc aaggtctcca acaaagccct cccagccccc 300
atcgagaaaa ccatctccaa agccaaaggg cagccccgag aaccacaggt gtacaccctg 360
cccccatccc gggatgagct gaccaagaac caggtcagcc tgacctgcct ggtcaaaggc 420
ttctatccca gcgacatcgc cgtggagtgg gagagcaatg ggcagccgga gaacaactac 480
aagaccacgc ctcccgtgct ggactccgac ggctccttct tcctctacag caagctcacc 540
gtggacaaga gcaggtggca gcaggggaac gtcttctcat gctccgtgat gcatgaggct 600
ctgcacaacc actacacgca gaagagcctc tccctgtctc cgggtaaa 648
<210> 28
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 Q311R
<400> 28
cctgaactgc tggggggacc gtcagtcttc ctcttccccc caaaacccaa ggacaccctc 60
atgatctccc ggacccctga ggtcacatgc gtggtggtgg acgtgagcca cgaagaccct 120
gaggtcaagt tcaactggta cgtggacggc gtggaggtgc ataatgccaa gacaaagccg 180
cgggaggagc agtacaacag cacgtaccgt gtggtcagcg tcctcaccgt cctgcaccgg 240
gactggctga atggcaagga gtacaagtgc aaggtctcca acaaagccct cccagccccc 300
atcgagaaaa ccatctccaa agccaaaggg cagccccgag aaccacaggt gtacaccctg 360
cccccatccc gggatgagct gaccaagaac caggtcagcc tgacctgcct ggtcaaaggc 420
ttctatccca gcgacatcgc cgtggagtgg gagagcaatg ggcagccgga gaacaactac 480
aagaccacgc ctcccgtgct ggactccgac ggctccttct tcctctacag caagctcacc 540
gtggacaaga gcaggtggca gcaggggaac gtcttctcat gctccgtgat gcatgaggct 600
ctgcacaacc actacacgca gaagagcctc tccctgtctc cgggtaaa 648
<210> 29
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 T307P/L309Q
<400> 29
cctgaactgc tggggggacc gtcagtcttc ctcttccccc caaaacccaa ggacaccctc 60
atgatctccc ggacccctga ggtcacatgc gtggtggtgg acgtgagcca cgaagaccct 120
gaggtcaagt tcaactggta cgtggacggc gtggaggtgc ataatgccaa gacaaagccg 180
cgggaggagc agtacaacag cacgtaccgt gtggtcagcg tcctccccgt ccagcaccag 240
gactggctga atggcaagga gtacaagtgc aaggtctcca acaaagccct cccagccccc 300
atcgagaaaa ccatctccaa agccaaaggg cagccccgag aaccacaggt gtacaccctg 360
cccccatccc gggatgagct gaccaagaac caggtcagcc tgacctgcct ggtcaaaggc 420
ttctatccca gcgacatcgc cgtggagtgg gagagcaatg ggcagccgga gaacaactac 480
aagaccacgc ctcccgtgct ggactccgac ggctccttct tcctctacag caagctcacc 540
gtggacaaga gcaggtggca gcaggggaac gtcttctcat gctccgtgat gcatgaggct 600
ctgcacaacc actacacgca gaagagcctc tccctgtctc cgggtaaa 648
<210> 30
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 T307P/L309Q/Q311R
<400> 30
cctgaactgc tggggggacc gtcagtcttc ctcttccccc caaaacccaa ggacaccctc 60
atgatctccc ggacccctga ggtcacatgc gtggtggtgg acgtgagcca cgaagaccct 120
gaggtcaagt tcaactggta cgtggacggc gtggaggtgc ataatgccaa gacaaagccg 180
cgggaggagc agtacaacag cacgtaccgt gtggtcagcg tcctccccgt ccagcaccgg 240
gactggctga atggcaagga gtacaagtgc aaggtctcca acaaagccct cccagccccc 300
atcgagaaaa ccatctccaa agccaaaggg cagccccgag aaccacaggt gtacaccctg 360
cccccatccc gggatgagct gaccaagaac caggtcagcc tgacctgcct ggtcaaaggc 420
ttctatccca gcgacatcgc cgtggagtgg gagagcaatg ggcagccgga gaacaactac 480
aagaccacgc ctcccgtgct ggactccgac ggctccttct tcctctacag caagctcacc 540
gtggacaaga gcaggtggca gcaggggaac gtcttctcat gctccgtgat gcatgaggct 600
ctgcacaacc actacacgca gaagagcctc tccctgtctc cgggtaaa 648
<210> 31
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 Q311K/F405L
<400> 31
cctgaactgc tggggggacc gtcagtcttc ctcttccccc caaaacccaa ggacaccctc 60
atgatctccc ggacccctga ggtcacatgc gtggtggtgg acgtgagcca cgaagaccct 120
gaggtcaagt tcaactggta cgtggacggc gtggaggtgc ataatgccaa gacaaagccg 180
cgggaggagc agtacaacag cacgtaccgt gtggtcagcg tcctcaccgt cctgcacaag 240
gactggctga atggcaagga gtacaagtgc aaggtctcca acaaagccct cccagccccc 300
atcgagaaaa ccatctccaa agccaaaggg cagccccgag aaccacaggt gtacaccctg 360
cccccatccc gggatgagct gaccaagaac caggtcagcc tgacctgcct ggtcaaaggc 420
ttctatccca gcgacatcgc cgtggagtgg gagagcaatg ggcagccgga gaacaactac 480
aagaccacgc ctcccgtgct ggactccgac ggctccttcc tgctctacag caagctcacc 540
gtggacaaga gcaggtggca gcaggggaac gtcttctcat gctccgtgat gcatgaggct 600
ctgcacaacc actacacgca gaagagcctc tccctgtctc cgggtaaa 648
<210> 32
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 Q311R/F405L
<400> 32
cctgaactgc tggggggacc gtcagtcttc ctcttccccc caaaacccaa ggacaccctc 60
atgatctccc ggacccctga ggtcacatgc gtggtggtgg acgtgagcca cgaagaccct 120
gaggtcaagt tcaactggta cgtggacggc gtggaggtgc ataatgccaa gacaaagccg 180
cgggaggagc agtacaacag cacgtaccgt gtggtcagcg tcctcaccgt cctgcaccgg 240
gactggctga atggcaagga gtacaagtgc aaggtctcca acaaagccct cccagccccc 300
atcgagaaaa ccatctccaa agccaaaggg cagccccgag aaccacaggt gtacaccctg 360
cccccatccc gggatgagct gaccaagaac caggtcagcc tgacctgcct ggtcaaaggc 420
ttctatccca gcgacatcgc cgtggagtgg gagagcaatg ggcagccgga gaacaactac 480
aagaccacgc ctcccgtgct ggactccgac ggctccttcc tgctctacag caagctcacc 540
gtggacaaga gcaggtggca gcaggggaac gtcttctcat gctccgtgat gcatgaggct 600
ctgcacaacc actacacgca gaagagcctc tccctgtctc cgggtaaa 648
<210> 33
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 T307P/L309Q/F405L
<400> 33
cctgaactgc tggggggacc gtcagtcttc ctcttccccc caaaacccaa ggacaccctc 60
atgatctccc ggacccctga ggtcacatgc gtggtggtgg acgtgagcca cgaagaccct 120
gaggtcaagt tcaactggta cgtggacggc gtggaggtgc ataatgccaa gacaaagccg 180
cgggaggagc agtacaacag cacgtaccgt gtggtcagcg tcctccccgt ccagcaccag 240
gactggctga atggcaagga gtacaagtgc aaggtctcca acaaagccct cccagccccc 300
atcgagaaaa ccatctccaa agccaaaggg cagccccgag aaccacaggt gtacaccctg 360
cccccatccc gggatgagct gaccaagaac caggtcagcc tgacctgcct ggtcaaaggc 420
ttctatccca gcgacatcgc cgtggagtgg gagagcaatg ggcagccgga gaacaactac 480
aagaccacgc ctcccgtgct ggactccgac ggctccttcc tgctctacag caagctcacc 540
gtggacaaga gcaggtggca gcaggggaac gtcttctcat gctccgtgat gcatgaggct 600
ctgcacaacc actacacgca gaagagcctc tccctgtctc cgggtaaa 648
<210> 34
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 T307P/L309Q/Q311R/F405L
<400> 34
cctgaactgc tggggggacc gtcagtcttc ctcttccccc caaaacccaa ggacaccctc 60
atgatctccc ggacccctga ggtcacatgc gtggtggtgg acgtgagcca cgaagaccct 120
gaggtcaagt tcaactggta cgtggacggc gtggaggtgc ataatgccaa gacaaagccg 180
cgggaggagc agtacaacag cacgtaccgt gtggtcagcg tcctccccgt ccagcaccgg 240
gactggctga atggcaagga gtacaagtgc aaggtctcca acaaagccct cccagccccc 300
atcgagaaaa ccatctccaa agccaaaggg cagccccgag aaccacaggt gtacaccctg 360
cccccatccc gggatgagct gaccaagaac caggtcagcc tgacctgcct ggtcaaaggc 420
ttctatccca gcgacatcgc cgtggagtgg gagagcaatg ggcagccgga gaacaactac 480
aagaccacgc ctcccgtgct ggactccgac ggctccttcc tgctctacag caagctcacc 540
gtggacaaga gcaggtggca gcaggggaac gtcttctcat gctccgtgat gcatgaggct 600
ctgcacaacc actacacgca gaagagcctc tccctgtctc cgggtaaa 648
<210> 35
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 Q311K/K409R
<400> 35
cctgaactgc tggggggacc gtcagtcttc ctcttccccc caaaacccaa ggacaccctc 60
atgatctccc ggacccctga ggtcacatgc gtggtggtgg acgtgagcca cgaagaccct 120
gaggtcaagt tcaactggta cgtggacggc gtggaggtgc ataatgccaa gacaaagccg 180
cgggaggagc agtacaacag cacgtaccgt gtggtcagcg tcctcaccgt cctgcacaag 240
gactggctga atggcaagga gtacaagtgc aaggtctcca acaaagccct cccagccccc 300
atcgagaaaa ccatctccaa agccaaaggg cagccccgag aaccacaggt gtacaccctg 360
cccccatccc gggatgagct gaccaagaac caggtcagcc tgacctgcct ggtcaaaggc 420
ttctatccca gcgacatcgc cgtggagtgg gagagcaatg ggcagccgga gaacaactac 480
aagaccacgc ctcccgtgct ggactccgac ggctccttct tcctctacag ccggctcacc 540
gtggacaaga gcaggtggca gcaggggaac gtcttctcat gctccgtgat gcatgaggct 600
ctgcacaacc actacacgca gaagagcctc tccctgtctc cgggtaaa 648
<210> 36
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 Q311R/K409R
<400> 36
cctgaactgc tggggggacc gtcagtcttc ctcttccccc caaaacccaa ggacaccctc 60
atgatctccc ggacccctga ggtcacatgc gtggtggtgg acgtgagcca cgaagaccct 120
gaggtcaagt tcaactggta cgtggacggc gtggaggtgc ataatgccaa gacaaagccg 180
cgggaggagc agtacaacag cacgtaccgt gtggtcagcg tcctcaccgt cctgcaccgg 240
gactggctga atggcaagga gtacaagtgc aaggtctcca acaaagccct cccagccccc 300
atcgagaaaa ccatctccaa agccaaaggg cagccccgag aaccacaggt gtacaccctg 360
cccccatccc gggatgagct gaccaagaac caggtcagcc tgacctgcct ggtcaaaggc 420
ttctatccca gcgacatcgc cgtggagtgg gagagcaatg ggcagccgga gaacaactac 480
aagaccacgc ctcccgtgct ggactccgac ggctccttct tcctctacag ccggctcacc 540
gtggacaaga gcaggtggca gcaggggaac gtcttctcat gctccgtgat gcatgaggct 600
ctgcacaacc actacacgca gaagagcctc tccctgtctc cgggtaaa 648
<210> 37
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 T307P/L309Q/K409R
<400> 37
cctgaactgc tggggggacc gtcagtcttc ctcttccccc caaaacccaa ggacaccctc 60
atgatctccc ggacccctga ggtcacatgc gtggtggtgg acgtgagcca cgaagaccct 120
gaggtcaagt tcaactggta cgtggacggc gtggaggtgc ataatgccaa gacaaagccg 180
cgggaggagc agtacaacag cacgtaccgt gtggtcagcg tcctccccgt ccagcaccag 240
gactggctga atggcaagga gtacaagtgc aaggtctcca acaaagccct cccagccccc 300
atcgagaaaa ccatctccaa agccaaaggg cagccccgag aaccacaggt gtacaccctg 360
cccccatccc gggatgagct gaccaagaac caggtcagcc tgacctgcct ggtcaaaggc 420
ttctatccca gcgacatcgc cgtggagtgg gagagcaatg ggcagccgga gaacaactac 480
aagaccacgc ctcccgtgct ggactccgac ggctccttct tcctctacag ccggctcacc 540
gtggacaaga gcaggtggca gcaggggaac gtcttctcat gctccgtgat gcatgaggct 600
ctgcacaacc actacacgca gaagagcctc tccctgtctc cgggtaaa 648
<210> 38
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 T307P/L309Q/Q311R/K409R
<400> 38
cctgaactgc tggggggacc gtcagtcttc ctcttccccc caaaacccaa ggacaccctc 60
atgatctccc ggacccctga ggtcacatgc gtggtggtgg acgtgagcca cgaagaccct 120
gaggtcaagt tcaactggta cgtggacggc gtggaggtgc ataatgccaa gacaaagccg 180
cgggaggagc agtacaacag cacgtaccgt gtggtcagcg tcctccccgt ccagcaccgg 240
gactggctga atggcaagga gtacaagtgc aaggtctcca acaaagccct cccagccccc 300
atcgagaaaa ccatctccaa agccaaaggg cagccccgag aaccacaggt gtacaccctg 360
cccccatccc gggatgagct gaccaagaac caggtcagcc tgacctgcct ggtcaaaggc 420
ttctatccca gcgacatcgc cgtggagtgg gagagcaatg ggcagccgga gaacaactac 480
aagaccacgc ctcccgtgct ggactccgac ggctccttct tcctctacag ccggctcacc 540
gtggacaaga gcaggtggca gcaggggaac gtcttctcat gctccgtgat gcatgaggct 600
ctgcacaacc actacacgca gaagagcctc tccctgtctc cgggtaaa 648
<210> 39
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 Q311K/ T366W
<400> 39
cctgaactgc tggggggacc gtcagtcttc ctcttccccc caaaacccaa ggacaccctc 60
atgatctccc ggacccctga ggtcacatgc gtggtggtgg acgtgagcca cgaagaccct 120
gaggtcaagt tcaactggta cgtggacggc gtggaggtgc ataatgccaa gacaaagccg 180
cgggaggagc agtacaacag cacgtaccgt gtggtcagcg tcctcaccgt cctgcacaag 240
gactggctga atggcaagga gtacaagtgc aaggtctcca acaaagccct cccagccccc 300
atcgagaaaa ccatctccaa agccaaaggg cagccccgag aaccacaggt gtacaccctg 360
cccccatccc gggatgagct gaccaagaac caggtcagcc tgtggtgcct ggtcaaaggc 420
ttctatccca gcgacatcgc cgtggagtgg gagagcaatg ggcagccgga gaacaactac 480
aagaccacgc ctcccgtgct ggactccgac ggctccttct tcctctacag caagctcacc 540
gtggacaaga gcaggtggca gcaggggaac gtcttctcat gctccgtgat gcatgaggct 600
ctgcacaacc actacacgca gaagagcctc tccctgtctc cgggtaaa 648
<210> 40
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 Q311R/T366W
<400> 40
cctgaactgc tggggggacc gtcagtcttc ctcttccccc caaaacccaa ggacaccctc 60
atgatctccc ggacccctga ggtcacatgc gtggtggtgg acgtgagcca cgaagaccct 120
gaggtcaagt tcaactggta cgtggacggc gtggaggtgc ataatgccaa gacaaagccg 180
cgggaggagc agtacaacag cacgtaccgt gtggtcagcg tcctcaccgt cctgcaccgg 240
gactggctga atggcaagga gtacaagtgc aaggtctcca acaaagccct cccagccccc 300
atcgagaaaa ccatctccaa agccaaaggg cagccccgag aaccacaggt gtacaccctg 360
cccccatccc gggatgagct gaccaagaac caggtcagcc tgtggtgcct ggtcaaaggc 420
ttctatccca gcgacatcgc cgtggagtgg gagagcaatg ggcagccgga gaacaactac 480
aagaccacgc ctcccgtgct ggactccgac ggctccttct tcctctacag caagctcacc 540
gtggacaaga gcaggtggca gcaggggaac gtcttctcat gctccgtgat gcatgaggct 600
ctgcacaacc actacacgca gaagagcctc tccctgtctc cgggtaaa 648
<210> 41
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 T307P/L309Q/ T366W
<400> 41
cctgaactgc tggggggacc gtcagtcttc ctcttccccc caaaacccaa ggacaccctc 60
atgatctccc ggacccctga ggtcacatgc gtggtggtgg acgtgagcca cgaagaccct 120
gaggtcaagt tcaactggta cgtggacggc gtggaggtgc ataatgccaa gacaaagccg 180
cgggaggagc agtacaacag cacgtaccgt gtggtcagcg tcctccccgt ccagcaccag 240
gactggctga atggcaagga gtacaagtgc aaggtctcca acaaagccct cccagccccc 300
atcgagaaaa ccatctccaa agccaaaggg cagccccgag aaccacaggt gtacaccctg 360
cccccatccc gggatgagct gaccaagaac caggtcagcc tgtggtgcct ggtcaaaggc 420
ttctatccca gcgacatcgc cgtggagtgg gagagcaatg ggcagccgga gaacaactac 480
aagaccacgc ctcccgtgct ggactccgac ggctccttct tcctctacag caagctcacc 540
gtggacaaga gcaggtggca gcaggggaac gtcttctcat gctccgtgat gcatgaggct 600
ctgcacaacc actacacgca gaagagcctc tccctgtctc cgggtaaa 648
<210> 42
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 T307P/L309Q/Q311R/ T366W
<400> 42
cctgaactgc tggggggacc gtcagtcttc ctcttccccc caaaacccaa ggacaccctc 60
atgatctccc ggacccctga ggtcacatgc gtggtggtgg acgtgagcca cgaagaccct 120
gaggtcaagt tcaactggta cgtggacggc gtggaggtgc ataatgccaa gacaaagccg 180
cgggaggagc agtacaacag cacgtaccgt gtggtcagcg tcctccccgt ccagcaccgg 240
gactggctga atggcaagga gtacaagtgc aaggtctcca acaaagccct cccagccccc 300
atcgagaaaa ccatctccaa agccaaaggg cagccccgag aaccacaggt gtacaccctg 360
cccccatccc gggatgagct gaccaagaac caggtcagcc tgtggtgcct ggtcaaaggc 420
ttctatccca gcgacatcgc cgtggagtgg gagagcaatg ggcagccgga gaacaactac 480
aagaccacgc ctcccgtgct ggactccgac ggctccttct tcctctacag caagctcacc 540
gtggacaaga gcaggtggca gcaggggaac gtcttctcat gctccgtgat gcatgaggct 600
ctgcacaacc actacacgca gaagagcctc tccctgtctc cgggtaaa 648
<210> 43
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 Q311K/T366S/L368A/Y407V
<400> 43
cctgaactgc tggggggacc gtcagtcttc ctcttccccc caaaacccaa ggacaccctc 60
atgatctccc ggacccctga ggtcacatgc gtggtggtgg acgtgagcca cgaagaccct 120
gaggtcaagt tcaactggta cgtggacggc gtggaggtgc ataatgccaa gacaaagccg 180
cgggaggagc agtacaacag cacgtaccgt gtggtcagcg tcctcaccgt cctgcacaag 240
gactggctga atggcaagga gtacaagtgc aaggtctcca acaaagccct cccagccccc 300
atcgagaaaa ccatctccaa agccaaaggg cagccccgag aaccacaggt gtacaccctg 360
cccccatccc gggatgagct gaccaagaac caggtcagcc tgagctgcgc cgtcaaaggc 420
ttctatccca gcgacatcgc cgtggagtgg gagagcaatg ggcagccgga gaacaactac 480
aagaccacgc ctcccgtgct ggactccgac ggctccttct tcctcgtgag caagctcacc 540
gtggacaaga gcaggtggca gcaggggaac gtcttctcat gctccgtgat gcatgaggct 600
ctgcacaacc actacacgca gaagagcctc tccctgtctc cgggtaaa 648
<210> 44
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 Q311R/T366S/L368A/Y407V
<400> 44
cctgaactgc tggggggacc gtcagtcttc ctcttccccc caaaacccaa ggacaccctc 60
atgatctccc ggacccctga ggtcacatgc gtggtggtgg acgtgagcca cgaagaccct 120
gaggtcaagt tcaactggta cgtggacggc gtggaggtgc ataatgccaa gacaaagccg 180
cgggaggagc agtacaacag cacgtaccgt gtggtcagcg tcctcaccgt cctgcaccgg 240
gactggctga atggcaagga gtacaagtgc aaggtctcca acaaagccct cccagccccc 300
atcgagaaaa ccatctccaa agccaaaggg cagccccgag aaccacaggt gtacaccctg 360
cccccatccc gggatgagct gaccaagaac caggtcagcc tgagctgcgc cgtcaaaggc 420
ttctatccca gcgacatcgc cgtggagtgg gagagcaatg ggcagccgga gaacaactac 480
aagaccacgc ctcccgtgct ggactccgac ggctccttct tcctcgtgag caagctcacc 540
gtggacaaga gcaggtggca gcaggggaac gtcttctcat gctccgtgat gcatgaggct 600
ctgcacaacc actacacgca gaagagcctc tccctgtctc cgggtaaa 648
<210> 45
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 T307P/L309Q/ T366S/L368A/Y407V
<400> 45
cctgaactgc tggggggacc gtcagtcttc ctcttccccc caaaacccaa ggacaccctc 60
atgatctccc ggacccctga ggtcacatgc gtggtggtgg acgtgagcca cgaagaccct 120
gaggtcaagt tcaactggta cgtggacggc gtggaggtgc ataatgccaa gacaaagccg 180
cgggaggagc agtacaacag cacgtaccgt gtggtcagcg tcctccccgt ccagcaccag 240
gactggctga atggcaagga gtacaagtgc aaggtctcca acaaagccct cccagccccc 300
atcgagaaaa ccatctccaa agccaaaggg cagccccgag aaccacaggt gtacaccctg 360
cccccatccc gggatgagct gaccaagaac caggtcagcc tgagctgcgc cgtcaaaggc 420
ttctatccca gcgacatcgc cgtggagtgg gagagcaatg ggcagccgga gaacaactac 480
aagaccacgc ctcccgtgct ggactccgac ggctccttct tcctcgtgag caagctcacc 540
gtggacaaga gcaggtggca gcaggggaac gtcttctcat gctccgtgat gcatgaggct 600
ctgcacaacc actacacgca gaagagcctc tccctgtctc cgggtaaa 648
<210> 46
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 T307P/L309Q/Q311R/ T366S/L368A/Y407V
<400> 46
cctgaactgc tggggggacc gtcagtcttc ctcttccccc caaaacccaa ggacaccctc 60
atgatctccc ggacccctga ggtcacatgc gtggtggtgg acgtgagcca cgaagaccct 120
gaggtcaagt tcaactggta cgtggacggc gtggaggtgc ataatgccaa gacaaagccg 180
cgggaggagc agtacaacag cacgtaccgt gtggtcagcg tcctccccgt ccagcaccgg 240
gactggctga atggcaagga gtacaagtgc aaggtctcca acaaagccct cccagccccc 300
atcgagaaaa ccatctccaa agccaaaggg cagccccgag aaccacaggt gtacaccctg 360
cccccatccc gggatgagct gaccaagaac caggtcagcc tgagctgcgc cgtcaaaggc 420
ttctatccca gcgacatcgc cgtggagtgg gagagcaatg ggcagccgga gaacaactac 480
aagaccacgc ctcccgtgct ggactccgac ggctccttct tcctcgtgag caagctcacc 540
gtggacaaga gcaggtggca gcaggggaac gtcttctcat gctccgtgat gcatgaggct 600
ctgcacaacc actacacgca gaagagcctc tccctgtctc cgggtaaa 648
<210> 47
<211> 648
<212> ДНК
<213> Homo sapiens
<400> 47
cctgaactgc tggggggacc gtcagtcttc ctcttccccc caaaacccaa ggacaccctc 60
atgatctccc ggacccctga ggtcacatgc gtggtggtgg acgtgagcca cgaagaccct 120
gaggtcaagt tcaactggta cgtggacggc gtggaggtgc ataatgccaa gacaaagccg 180
cgggaggagc agtacaacag cacgtaccgt gtggtcagcg tcctcaccgt cctgcaccag 240
gactggctga atggcaagga gtacaagtgc aaggtctcca acaaagccct cccagccccc 300
atcgagaaaa ccatctccaa agccaaaggg cagccccgag aaccacaggt gtacaccctg 360
cccccatccc gggatgagct gaccaagaac caggtcagcc tgacctgcct ggtcaaaggc 420
ttctatccca gcgacatcgc cgtggagtgg gagagcaatg ggcagccgga gaacaactac 480
aagaccacgc ctcccgtgct ggactccgac ggctccttct tcctctacag caagctcacc 540
gtggacaaga gcaggtggca gcaggggaac gtcttctcat gctccgtgat gcatgaggct 600
ctgcacaacc actacacgca gaagagcctc tccctgtctc cgggtaaa 648
<210> 48
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 K409R
<400> 48
cctgaactgc tggggggacc gtcagtcttc ctcttccccc caaaacccaa ggacaccctc 60
atgatctccc ggacccctga ggtcacatgc gtggtggtgg acgtgagcca cgaagaccct 120
gaggtcaagt tcaactggta cgtggacggc gtggaggtgc ataatgccaa gacaaagccg 180
cgggaggagc agtacaacag cacgtaccgt gtggtcagcg tcctcaccgt cctgcaccag 240
gactggctga atggcaagga gtacaagtgc aaggtctcca acaaagccct cccagccccc 300
atcgagaaaa ccatctccaa agccaaaggg cagccccgag aaccacaggt gtacaccctg 360
cccccatccc gggatgagct gaccaagaac caggtcagcc tgacctgcct ggtcaaaggc 420
ttctatccca gcgacatcgc cgtggagtgg gagagcaatg ggcagccgga gaacaactac 480
aagaccacgc ctcccgtgct ggactccgac ggctccttct tcctctacag ccggctcacc 540
gtggacaaga gcaggtggca gcaggggaac gtcttctcat gctccgtgat gcatgaggct 600
ctgcacaacc actacacgca gaagagcctc tccctgtctc cgggtaaa 648
<210> 49
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 F405L
<400> 49
cctgaactgc tggggggacc gtcagtcttc ctcttccccc caaaacccaa ggacaccctc 60
atgatctccc ggacccctga ggtcacatgc gtggtggtgg acgtgagcca cgaagaccct 120
gaggtcaagt tcaactggta cgtggacggc gtggaggtgc ataatgccaa gacaaagccg 180
cgggaggagc agtacaacag cacgtaccgt gtggtcagcg tcctcaccgt cctgcaccag 240
gactggctga atggcaagga gtacaagtgc aaggtctcca acaaagccct cccagccccc 300
atcgagaaaa ccatctccaa agccaaaggg cagccccgag aaccacaggt gtacaccctg 360
cccccatccc gggatgagct gaccaagaac caggtcagcc tgacctgcct ggtcaaaggc 420
ttctatccca gcgacatcgc cgtggagtgg gagagcaatg ggcagccgga gaacaactac 480
aagaccacgc ctcccgtgct ggactccgac ggctccttcc tgctctacag caagctcacc 540
gtggacaaga gcaggtggca gcaggggaac gtcttctcat gctccgtgat gcatgaggct 600
ctgcacaacc actacacgca gaagagcctc tccctgtctc cgggtaaa 648
<210> 50
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 T366S/L368A/Y407V
<400> 50
cctgaactgc tggggggacc gtcagtcttc ctcttccccc caaaacccaa ggacaccctc 60
atgatctccc ggacccctga ggtcacatgc gtggtggtgg acgtgagcca cgaagaccct 120
gaggtcaagt tcaactggta cgtggacggc gtggaggtgc ataatgccaa gacaaagccg 180
cgggaggagc agtacaacag cacgtaccgt gtggtcagcg tcctcaccgt cctgcaccag 240
gactggctga atggcaagga gtacaagtgc aaggtctcca acaaagccct cccagccccc 300
atcgagaaaa ccatctccaa agccaaaggg cagccccgag aaccacaggt gtacaccctg 360
cccccatccc gggatgagct gaccaagaac caggtcagcc tgagctgcgc cgtcaaaggc 420
ttctatccca gcgacatcgc cgtggagtgg gagagcaatg ggcagccgga gaacaactac 480
aagaccacgc ctcccgtgct ggactccgac ggctccttct tcctcgtgag caagctcacc 540
gtggacaaga gcaggtggca gcaggggaac gtcttctcat gctccgtgat gcatgaggct 600
ctgcacaacc actacacgca gaagagcctc tccctgtctc cgggtaaa 648
<210> 51
<211> 648
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG1 CH2-CH3 T366W
<400> 51
cctgaactgc tggggggacc gtcagtcttc ctcttccccc caaaacccaa ggacaccctc 60
atgatctccc ggacccctga ggtcacatgc gtggtggtgg acgtgagcca cgaagaccct 120
gaggtcaagt tcaactggta cgtggacggc gtggaggtgc ataatgccaa gacaaagccg 180
cgggaggagc agtacaacag cacgtaccgt gtggtcagcg tcctcaccgt cctgcaccag 240
gactggctga atggcaagga gtacaagtgc aaggtctcca acaaagccct cccagccccc 300
atcgagaaaa ccatctccaa agccaaaggg cagccccgag aaccacaggt gtacaccctg 360
cccccatccc gggatgagct gaccaagaac caggtcagcc tgtggtgcct ggtcaaaggc 420
ttctatccca gcgacatcgc cgtggagtgg gagagcaatg ggcagccgga gaacaactac 480
aagaccacgc ctcccgtgct ggactccgac ggctccttct tcctctacag caagctcacc 540
gtggacaaga gcaggtggca gcaggggaac gtcttctcat gctccgtgat gcatgaggct 600
ctgcacaacc actacacgca gaagagcctc tccctgtctc cgggtaaa 648
<210> 52
<211> 215
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG2 CH2-CH3 Q311R
<400> 52
Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
1 5 10 15
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
20 25 30
Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
35 40 45
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
50 55 60
Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His Arg Asp
65 70 75 80
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
85 90 95
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg
100 105 110
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys
115 120 125
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
130 135 140
Ile Ser Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
145 150 155 160
Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
165 170 175
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
180 185 190
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
195 200 205
Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 53
<211> 215
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG2 CH2-CH3 T307P/V309Q/Q311R
<400> 53
Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
1 5 10 15
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
20 25 30
Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
35 40 45
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
50 55 60
Asn Ser Thr Phe Arg Val Val Ser Val Leu Pro Val Gln His Arg Asp
65 70 75 80
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
85 90 95
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg
100 105 110
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys
115 120 125
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
130 135 140
Ile Ser Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
145 150 155 160
Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
165 170 175
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
180 185 190
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
195 200 205
Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 54
<211> 215
<212> PRT
<213> Homo sapiens
<400> 54
Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
1 5 10 15
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
20 25 30
Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
35 40 45
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
50 55 60
Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His Gln Asp
65 70 75 80
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
85 90 95
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg
100 105 110
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys
115 120 125
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
130 135 140
Ile Ser Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
145 150 155 160
Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
165 170 175
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
180 185 190
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
195 200 205
Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 55
<211> 215
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG2 F405L/K409R
<400> 55
Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
1 5 10 15
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
20 25 30
Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
35 40 45
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
50 55 60
Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His Gln Asp
65 70 75 80
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
85 90 95
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg
100 105 110
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys
115 120 125
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
130 135 140
Ile Ser Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
145 150 155 160
Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Leu Leu Tyr Ser
165 170 175
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
180 185 190
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
195 200 205
Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 56
<211> 216
<212> PRT
<213> Искусственная последовательность
<220>
<223> IgG4 CH2-CH3 T307P/V309Q
<400> 56
Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
1 5 10 15
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
20 25 30
Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
35 40 45
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
50 55 60
Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
65 70 75 80
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
85 90 95
Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
100 105 110
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr
115 120 125
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
130 135 140
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
145 150 155 160
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
165 170 175
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe
180 185 190
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
195 200 205
Ser Leu Ser Leu Ser Leu Gly Lys
210 215
<210> 57
<211> 38
<212> PRT
<213> Искусственная последовательность
<220>
<223> Линкер 1FU1
<400> 57
Ala Ser Leu Asp Thr Thr Ala Glu Asn Gln Ala Lys Asn Glu His Leu
1 5 10 15
Gln Lys Glu Asn Glu Arg Leu Leu Arg Asp Trp Asn Asp Val Gln Gly
20 25 30
Arg Phe Glu Lys Gly Ser
35
<210> 58
<211> 30
<212> PRT
<213> Искусственная последовательность
<220>
<223> Линкер 1DC1 (13AA)2
<400> 58
Ala Ser Glu Lys Asn Lys Arg Ser Thr Pro Tyr Ile Glu Arg Ala Glu
1 5 10 15
Lys Asn Lys Arg Ser Thr Pro Tyr Ile Glu Arg Ala Gly Ser
20 25 30
<210> 59
<211> 43
<212> PRT
<213> Искусственная последовательность
<220>
<223> Линкер 1DC1 (13AA)3
<400> 59
Ala Ser Glu Lys Asn Lys Arg Ser Thr Pro Tyr Ile Glu Arg Ala Glu
1 5 10 15
Lys Asn Lys Arg Ser Thr Pro Tyr Ile Glu Arg Ala Glu Lys Asn Lys
20 25 30
Arg Ser Thr Pro Tyr Ile Glu Arg Ala Gly Ser
35 40
<210> 60
<211> 24
<212> PRT
<213> Искусственная последовательность
<220>
<223> Линкер AS(AP) 10GS
<400> 60
Ala Ser Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro
1 5 10 15
Ala Pro Ala Pro Ala Pro Gly Ser
20
<210> 61
<211> 44
<212> PRT
<213> Искусственная последовательность
<220>
<223> Линкер AS(AP) 20GS
<400> 61
Ala Ser Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro
1 5 10 15
Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro
20 25 30
Ala Pro Ala Pro Ala Pro Ala Pro Ala Pro Gly Ser
35 40
<210> 62
<211> 26
<212> PRT
<213> Искусственная последовательность
<220>
<223> Линкер (EAAAK)4
<400> 62
Ala Ser Ala Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala
1 5 10 15
Ala Lys Glu Ala Ala Ala Lys Ala Gly Ser
20 25
<210> 63
<211> 46
<212> PRT
<213> Искусственная последовательность
<220>
<223> Линкер (EAAAK)8
<400> 63
Ala Ser Ala Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala
1 5 10 15
Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala
20 25 30
Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Ala Gly Ser
35 40 45
<210> 64
<211> 22
<212> PRT
<213> Искусственная последовательность
<220>
<223> Линкер GS(G4S)4
<400> 64
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
1 5 10 15
Ser Gly Gly Gly Gly Ser
20
<210> 65
<211> 42
<212> PRT
<213> Искусственная последовательность
<220>
<223> Линкер GS(G4S)8
<400> 65
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
1 5 10 15
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25 30
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
35 40
<210> 66
<211> 62
<212> PRT
<213> Искусственная последовательность
<220>
<223> Линкер GS12X(G4S)
<400> 66
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
1 5 10 15
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25 30
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
35 40 45
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
50 55 60
<210> 67
<211> 82
<212> PRT
<213> Искусственная последовательность
<220>
<223> Линкер GS16X(G4S)
<400> 67
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
1 5 10 15
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25 30
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
35 40 45
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
50 55 60
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
65 70 75 80
Gly Ser
<210> 68
<211> 457
<212> PRT
<213> Искусственная последовательность
<220>
<223> HC gp120-R (K409R)
<400> 68
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Gln Ala Ser Gly Tyr Arg Phe Ser Asn Phe
20 25 30
Val Ile His Trp Val Arg Gln Ala Pro Gly Gln Arg Phe Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Tyr Asn Gly Asn Lys Glu Phe Ser Ala Lys Phe
50 55 60
Gln Asp Arg Val Thr Phe Thr Ala Asp Thr Ser Ala Asn Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Val Gly Pro Tyr Ser Trp Asp Asp Ser Pro Gln Asp Asn Tyr
100 105 110
Tyr Met Asp Val Trp Gly Lys Gly Thr Thr Val Ile Val Ser Ser Ala
115 120 125
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser
130 135 140
Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
145 150 155 160
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
165 170 175
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
180 185 190
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr
195 200 205
Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg
210 215 220
Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
225 230 235 240
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
245 250 255
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
260 265 270
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
275 280 285
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
290 295 300
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
305 310 315 320
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
325 330 335
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
340 345 350
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
355 360 365
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
370 375 380
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
385 390 395 400
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
405 410 415
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
420 425 430
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
435 440 445
Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455
<210> 69
<211> 215
<212> PRT
<213> Искусственная последовательность
<220>
<223> LC gp120-R
<400> 69
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Phe Ser Cys Arg Ser Ser His Ser Ile Arg Ser Arg
20 25 30
Arg Val Ala Trp Tyr Gln His Lys Pro Gly Gln Ala Pro Arg Leu Val
35 40 45
Ile His Gly Val Ser Asn Arg Ala Ser Gly Ile Ser Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Thr Arg Val Glu
65 70 75 80
Pro Glu Asp Phe Ala Leu Tyr Tyr Cys Gln Val Tyr Gly Ala Ser Ser
85 90 95
Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Arg Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 70
<211> 450
<212> PRT
<213> Искусственная последовательность
<220>
<223> HC анти-RSV-L (F405L)
<400> 70
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Tyr Trp Asp Asp Asp Lys Arg Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Leu Tyr Gly Phe Thr Tyr Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Leu Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 71
<211> 218
<212> PRT
<213> Искусственная последовательность
<220>
<223> LC анти-RSV
<400> 71
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Gln Ser Val Asp Tyr Asn
20 25 30
Gly Ile Ser Tyr Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Pro Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ile Ile
85 90 95
Glu Asp Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 72
<211> 450
<212> PRT
<213> Искусственная последовательность
<220>
<223> HC RSV-L[Q311A] (Q311A/ F405L)
<400> 72
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Tyr Trp Asp Asp Asp Lys Arg Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Leu Tyr Gly Phe Thr Tyr Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Ala Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Leu Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 73
<211> 450
<212> PRT
<213> Искусственная последовательность
<220>
<223> HC RSV-L[Q311K] (Q311K/ F405L)
<400> 73
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Tyr Trp Asp Asp Asp Lys Arg Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Leu Tyr Gly Phe Thr Tyr Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Lys Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Leu Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 74
<211> 450
<212> PRT
<213> Искусственная последовательность
<220>
<223> HC RSV-L[Q311K] (Q311R/ F405L)
<400> 74
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Tyr Trp Asp Asp Asp Lys Arg Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Leu Tyr Gly Phe Thr Tyr Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Arg Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Leu Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 75
<211> 450
<212> PRT
<213> Искусственная последовательность
<220>
<223> HC RSV-L[Q311K] (Q311H/ F405L)
<400> 75
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Tyr Trp Asp Asp Asp Lys Arg Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Leu Tyr Gly Phe Thr Tyr Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His His Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Leu Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 76
<211> 450
<212> PRT
<213> Искусственная последовательность
<220>
<223> HC RSV-L[TL] (T307P/L309Q/ F405L)
<400> 76
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Tyr Trp Asp Asp Asp Lys Arg Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Leu Tyr Gly Phe Thr Tyr Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Pro Val Gln His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Leu Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 77
<211> 450
<212> PRT
<213> Искусственная последовательность
<220>
<223> HC RSV-L[TLQ] (T307P/L309Q/Q311R/F405L)
<400> 77
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Tyr Trp Asp Asp Asp Lys Arg Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Leu Tyr Gly Phe Thr Tyr Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Pro Val Gln His Arg Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Leu Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 78
<211> 450
<212> PRT
<213> Искусственная последовательность
<220>
<223> HC RSV-L[I253D] (I253D/F405L)
<400> 78
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Tyr Trp Asp Asp Asp Lys Arg Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Leu Tyr Gly Phe Thr Tyr Gly Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Asp
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Leu Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 79
<211> 449
<212> PRT
<213> Искусственная последовательность
<220>
<223> HC aVb5
<400> 79
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Arg Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Arg Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Phe Asp Gly Ser Asn Lys Tyr Tyr Val Gly Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Glu Asn Thr Leu Tyr
65 70 75 80
Leu Gln Val Asn Ile Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Ala Arg Gly Ser Tyr Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 80
<211> 215
<212> PRT
<213> Искусственная последовательность
<220>
<223> LC анти-TNF и анти-aVb5
<400> 80
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Pro
85 90 95
Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 81
<211> 456
<212> PRT
<213> Искусственная последовательность
<220>
<223> HC к TNF
<400> 81
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Ser Leu Ser Cys Ala Ala Ser Gly Phe Ile Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Asn Gly Leu Glu Trp Val
35 40 45
Ala Phe Met Ser Tyr Asp Gly Ser Asn Lys Lys Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Glu Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Gly Ile Ala Ala Gly Gly Asn Tyr Tyr Tyr Tyr Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser
115 120 125
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
130 135 140
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
145 150 155 160
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
165 170 175
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
180 185 190
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
195 200 205
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
210 215 220
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
225 230 235 240
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
245 250 255
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
260 265 270
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
275 280 285
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
290 295 300
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
305 310 315 320
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
325 330 335
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
340 345 350
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
355 360 365
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
370 375 380
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
385 390 395 400
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
405 410 415
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
420 425 430
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
435 440 445
Ser Leu Ser Leu Ser Pro Gly Lys
450 455
<210> 82
<211> 456
<212> PRT
<213> Искусственная последовательность
<220>
<223> HC TNF-[Q311R]
<400> 82
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Ser Leu Ser Cys Ala Ala Ser Gly Phe Ile Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Asn Gly Leu Glu Trp Val
35 40 45
Ala Phe Met Ser Tyr Asp Gly Ser Asn Lys Lys Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Glu Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Gly Ile Ala Ala Gly Gly Asn Tyr Tyr Tyr Tyr Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser
115 120 125
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
130 135 140
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
145 150 155 160
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
165 170 175
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
180 185 190
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
195 200 205
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
210 215 220
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
225 230 235 240
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
245 250 255
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
260 265 270
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
275 280 285
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
290 295 300
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Arg
305 310 315 320
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
325 330 335
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
340 345 350
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
355 360 365
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
370 375 380
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
385 390 395 400
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
405 410 415
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
420 425 430
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
435 440 445
Ser Leu Ser Leu Ser Pro Gly Lys
450 455
<210> 83
<211> 456
<212> PRT
<213> Искусственная последовательность
<220>
<223> HC TNF-[TLQ] (T307P/L309Q/Q311R)
<400> 83
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Ser Leu Ser Cys Ala Ala Ser Gly Phe Ile Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Asn Gly Leu Glu Trp Val
35 40 45
Ala Phe Met Ser Tyr Asp Gly Ser Asn Lys Lys Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Glu Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Gly Ile Ala Ala Gly Gly Asn Tyr Tyr Tyr Tyr Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser
115 120 125
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
130 135 140
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
145 150 155 160
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
165 170 175
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
180 185 190
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
195 200 205
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
210 215 220
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
225 230 235 240
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
245 250 255
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
260 265 270
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
275 280 285
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
290 295 300
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Pro Val Gln His Arg
305 310 315 320
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
325 330 335
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
340 345 350
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
355 360 365
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
370 375 380
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
385 390 395 400
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
405 410 415
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
420 425 430
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
435 440 445
Ser Leu Ser Leu Ser Pro Gly Lys
450 455
<210> 84
<211> 456
<212> PRT
<213> Искусственная последовательность
<220>
<223> HC TNF-knob[Q311R] (Q311R/T366W)
<400> 84
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Ser Leu Ser Cys Ala Ala Ser Gly Phe Ile Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Asn Gly Leu Glu Trp Val
35 40 45
Ala Phe Met Ser Tyr Asp Gly Ser Asn Lys Lys Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Glu Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Gly Ile Ala Ala Gly Gly Asn Tyr Tyr Tyr Tyr Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser
115 120 125
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
130 135 140
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
145 150 155 160
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
165 170 175
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
180 185 190
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
195 200 205
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
210 215 220
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
225 230 235 240
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
245 250 255
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
260 265 270
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
275 280 285
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
290 295 300
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Arg
305 310 315 320
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
325 330 335
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
340 345 350
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
355 360 365
Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser
370 375 380
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
385 390 395 400
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
405 410 415
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
420 425 430
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
435 440 445
Ser Leu Ser Leu Ser Pro Gly Lys
450 455
<210> 85
<211> 456
<212> PRT
<213> Искусственная последовательность
<220>
<223> HC TNF-knob[TLQ] (T307P/L309Q/Q311R/T366W)
<400> 85
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Ser Leu Ser Cys Ala Ala Ser Gly Phe Ile Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Asn Gly Leu Glu Trp Val
35 40 45
Ala Phe Met Ser Tyr Asp Gly Ser Asn Lys Lys Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Glu Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Gly Ile Ala Ala Gly Gly Asn Tyr Tyr Tyr Tyr Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser
115 120 125
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
130 135 140
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
145 150 155 160
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
165 170 175
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
180 185 190
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
195 200 205
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
210 215 220
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
225 230 235 240
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
245 250 255
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
260 265 270
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
275 280 285
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
290 295 300
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Pro Val Gln His Arg
305 310 315 320
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
325 330 335
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
340 345 350
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr
355 360 365
Lys Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser
370 375 380
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
385 390 395 400
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
405 410 415
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
420 425 430
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
435 440 445
Ser Leu Ser Leu Ser Pro Gly Lys
450 455
<210> 86
<211> 449
<212> PRT
<213> Искусственная последовательность
<220>
<223> HC aVb5-hole (T366S/L368A/Y407V)
<400> 86
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Arg Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Arg Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Phe Asp Gly Ser Asn Lys Tyr Tyr Val Gly Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Glu Asn Thr Leu Tyr
65 70 75 80
Leu Gln Val Asn Ile Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Ala Arg Gly Ser Tyr Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Ser
355 360 365
Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 87
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG2 CH2-CH3 Q311R
<400> 87
ccacctgtgg caggaccgtc agtcttcctc ttccccccaa aacccaagga caccctcatg 60
atctcccgga cccctgaggt cacgtgcgtg gtggtggacg tgagccacga agaccccgag 120
gtccagttca actggtacgt ggacggcgtg gaggtgcata atgccaagac aaagccacgg 180
gaggagcagt tcaacagcac gttccgtgtg gtcagcgtcc tcaccgttgt gcaccgggac 240
tggctgaacg gcaaggagta caagtgcaag gtctccaaca aaggcctccc agcccccatc 300
gagaaaacca tctccaaaac caaagggcag ccccgagaac cacaggtgta caccctgccc 360
ccatcccggg aggagatgac caagaaccag gtcagcctga cctgcctggt caaaggcttc 420
taccccagcg acatcgccgt ggagtgggag agcaatgggc agccggagaa caactacaag 480
accacacctc ccatgctgga ctccgacggc tccttcttcc tctacagcaa gctcaccgtg 540
gacaagagca ggtggcagca ggggaacgtc ttctcatgct ccgtgatgca tgaggctctg 600
cacaaccact acacgcagaa gagcctctcc ctgtctccgg gtaaa 645
<210> 88
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG2 CH2-CH3 T307P/V309Q/Q311R
<400> 88
ccacctgtgg caggaccgtc agtcttcctc ttccccccaa aacccaagga caccctcatg 60
atctcccgga cccctgaggt cacgtgcgtg gtggtggacg tgagccacga agaccccgag 120
gtccagttca actggtacgt ggacggcgtg gaggtgcata atgccaagac aaagccacgg 180
gaggagcagt tcaacagcac gttccgtgtg gtcagcgtcc tccccgttca gcaccgggac 240
tggctgaacg gcaaggagta caagtgcaag gtctccaaca aaggcctccc agcccccatc 300
gagaaaacca tctccaaaac caaagggcag ccccgagaac cacaggtgta caccctgccc 360
ccatcccggg aggagatgac caagaaccag gtcagcctga cctgcctggt caaaggcttc 420
taccccagcg acatcgccgt ggagtgggag agcaatgggc agccggagaa caactacaag 480
accacacctc ccatgctgga ctccgacggc tccttcttcc tctacagcaa gctcaccgtg 540
gacaagagca ggtggcagca ggggaacgtc ttctcatgct ccgtgatgca tgaggctctg 600
cacaaccact acacgcagaa gagcctctcc ctgtctccgg gtaaa 645
<210> 89
<211> 645
<212> ДНК
<213> Homo sapiens
<400> 89
ccacctgtgg caggaccgtc agtcttcctc ttccccccaa aacccaagga caccctcatg 60
atctcccgga cccctgaggt cacgtgcgtg gtggtggacg tgagccacga agaccccgag 120
gtccagttca actggtacgt ggacggcgtg gaggtgcata atgccaagac aaagccacgg 180
gaggagcagt tcaacagcac gttccgtgtg gtcagcgtcc tcaccgttgt gcaccaggac 240
tggctgaacg gcaaggagta caagtgcaag gtctccaaca aaggcctccc agcccccatc 300
gagaaaacca tctccaaaac caaagggcag ccccgagaac cacaggtgta caccctgccc 360
ccatcccggg aggagatgac caagaaccag gtcagcctga cctgcctggt caaaggcttc 420
taccccagcg acatcgccgt ggagtgggag agcaatgggc agccggagaa caactacaag 480
accacacctc ccatgctgga ctccgacggc tccttcttcc tctacagcaa gctcaccgtg 540
gacaagagca ggtggcagca ggggaacgtc ttctcatgct ccgtgatgca tgaggctctg 600
cacaaccact acacgcagaa gagcctctcc ctgtctccgg gtaaa 645
<210> 90
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG2 F405L/K409R
<400> 90
ccacctgtgg caggaccgtc agtcttcctc ttccccccaa aacccaagga caccctcatg 60
atctcccgga cccctgaggt cacgtgcgtg gtggtggacg tgagccacga agaccccgag 120
gtccagttca actggtacgt ggacggcgtg gaggtgcata atgccaagac aaagccacgg 180
gaggagcagt tcaacagcac gttccgtgtg gtcagcgtcc tcaccgttgt gcaccaggac 240
tggctgaacg gcaaggagta caagtgcaag gtctccaaca aaggcctccc agcccccatc 300
gagaaaacca tctccaaaac caaagggcag ccccgagaac cacaggtgta caccctgccc 360
ccatcccggg aggagatgac caagaaccag gtcagcctga cctgcctggt caaaggcttc 420
taccccagcg acatcgccgt ggagtgggag agcaatgggc agccggagaa caactacaag 480
accacacctc ccatgctgga ctccgacggc tccttcctgc tctacagccg gctcaccgtg 540
gacaagagca ggtggcagca ggggaacgtc ttctcatgct ccgtgatgca tgaggctctg 600
cacaaccact acacgcagaa gagcctctcc ctgtctccgg gtaaa 645
<210> 91
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<223> IgG4 CH2-CH3 T307P/V309Q
<400> 91
ccacctgtgg caggaccgtc agtcttcctc ttccccccaa aacccaagga caccctcatg 60
atctcccgga cccctgaggt cacgtgcgtg gtggtggacg tgagccacga agaccccgag 120
gtccagttca actggtacgt ggacggcgtg gaggtgcata atgccaagac aaagccacgg 180
gaggagcagt tcaacagcac gttccgtgtg gtcagcgtcc tccccgttca gcaccaggac 240
tggctgaacg gcaaggagta caagtgcaag gtctccaaca aaggcctccc agcccccatc 300
gagaaaacca tctccaaaac caaagggcag ccccgagaac cacaggtgta caccctgccc 360
ccatcccggg aggagatgac caagaaccag gtcagcctga cctgcctggt caaaggcttc 420
taccccagcg acatcgccgt ggagtgggag agcaatgggc agccggagaa caactacaag 480
accacacctc ccatgctgga ctccgacggc tccttcttcc tctacagcaa gctcaccgtg 540
gacaagagca ggtggcagca ggggaacgtc ttctcatgct ccgtgatgca tgaggctctg 600
cacaaccact acacgcagaa gagcctctcc ctgtctccgg gtaaa 645
<210> 92
<211> 10
<212> PRT
<213> Homo sapiens
<400> 92
Glu Pro Lys Ser Cys Asp Lys Thr His Thr
1 5 10
<210> 93
<211> 7
<212> PRT
<213> Homo sapiens
<400> 93
Glu Arg Lys Cys Cys Val Glu
1 5
<210> 94
<211> 12
<212> PRT
<213> Homo sapiens
<400> 94
Glu Leu Lys Thr Pro Leu Gly Asp Thr Thr His Thr
1 5 10
<210> 95
<211> 5
<212> PRT
<213> Homo sapiens
<400> 95
Glu Ser Lys Tyr Gly
1 5
<210> 96
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> сконструированный шарнир IgG1
<400> 96
Glu Pro Lys Ser Ser Asp Lys Thr His Thr
1 5 10
<210> 97
<211> 18
<212> PRT
<213> Homo sapiens
<400> 97
Pro Ser Thr Pro Pro Thr Pro Ser Pro Ser Thr Pro Pro Thr Pro Ser
1 5 10 15
Pro Ser
<210> 98
<211> 22
<212> PRT
<213> Homo sapiens
<400> 98
Gly Gly Glu Glu Lys Lys Lys Glu Lys Glu Lys Glu Glu Gln Glu Glu
1 5 10 15
Arg Glu Thr Lys Thr Pro
20
<210> 99
<211> 34
<212> PRT
<213> Искусственная последовательность
<220>
<223> сконструированный Z-домен
<400> 99
Phe Asn Met Gln Cys Gln Arg Arg Phe Tyr Glu Ala Leu His Asp Pro
1 5 10 15
Asn Leu Asn Glu Glu Gln Arg Asn Ala Lys Ile Lys Ser Ile Arg Asp
20 25 30
Asp Cys
<210> 100
<211> 58
<212> PRT
<213> Искусственная последовательность
<220>
<223> сконструированный Z-домен
<400> 100
Val Asp Asn Lys Phe Asn Lys Glu Gln Gln Asn Ala Phe Tyr Glu Ile
1 5 10 15
Leu His Leu Pro Asn Leu Asn Glu Glu Gln Arg Asn Ala Phe Ile Gln
20 25 30
Ser Leu Lys Asp Asp Pro Ser Gln Ser Ala Asn Leu Leu Ala Glu Ala
35 40 45
Lys Lys Leu Asn Asp Ala Gln Ala Pro Lys
50 55
<210> 101
<211> 33
<212> PRT
<213> Искусственная последовательность
<220>
<223> сконструированный Z-домен
<400> 101
Phe Asn Met Gln Gln Gln Arg Arg Phe Tyr Glu Ala Leu His Asp Pro
1 5 10 15
Asn Leu Asn Glu Glu Gln Arg Asn Ala Lys Ile Lys Ser Ile Arg Asp
20 25 30
Asp
<210> 102
<211> 4
<212> PRT
<213> Homo sapiens
<400> 102
Ile Gln Arg Thr
1
<210> 103
<211> 23
<212> PRT
<213> Homo sapiens
<400> 103
Leu Asn Gly Glu Glu Phe Met Asp Phe Asp Leu Lys Gln Gly Thr Trp
1 5 10 15
Gly Gly Asp Trp Pro Glu Ala
20
<210> 104
<211> 11
<212> PRT
<213> Homo sapiens
<400> 104
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
1 5 10
<210> 105
<211> 11
<212> PRT
<213> Mus musculus
<400> 105
Ala Leu Pro Ile Gln His Gln Asp Trp Met Ser
1 5 10
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, СВЯЗЫВАЮЩИЕ PD-L1 и LAG-3 | 2017 |
|
RU2784388C2 |
| ЧЕТЫРЕХВАЛЕНТНЫЕ СИММЕТРИЧНЫЕ БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА | 2019 |
|
RU2807346C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2839153C2 |
| ПОЛИПЕПТИДНЫЙ ЛИНКЕР ДЛЯ ПОЛУЧЕНИЯ МУЛЬТИСПЕЦИФИЧЕСКИХ АНТИТЕЛ | 2018 |
|
RU2776302C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА К CCL2 | 2020 |
|
RU2819613C1 |
| БИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ И ПУТИ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2766199C2 |
| ТРИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ, ОТНОСЯЩИЕСЯ К НИМ СПОСОБЫ И ВАРИАНТЫ ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2822200C2 |
| МОЛЕКУЛЫ, СВЯЗЫВАЮЩИЕ ADAM9, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2783619C2 |
| АНТИ-CD137 АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2829536C2 |
| ТРИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ, СВЯЗЫВАЮЩИЕ CD38, CD28 И CD3, А ТАКЖЕ СПОСОБЫ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ВИРУСНОЙ ИНФЕКЦИИ | 2019 |
|
RU2820351C2 |

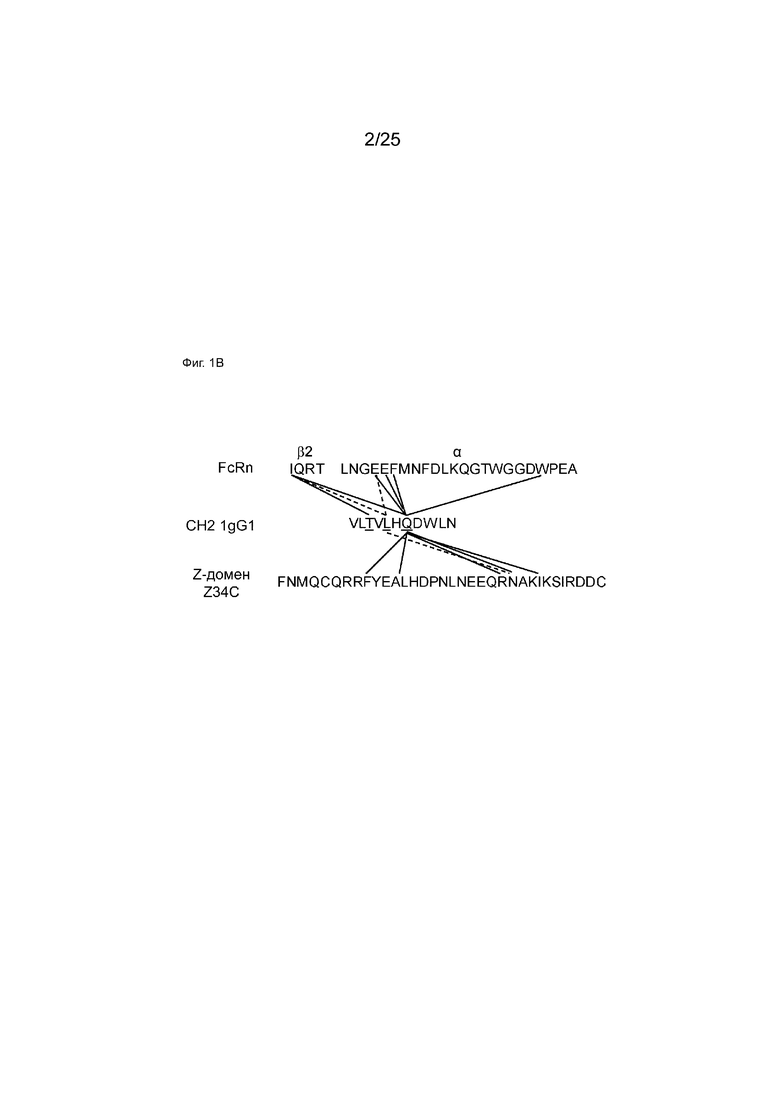
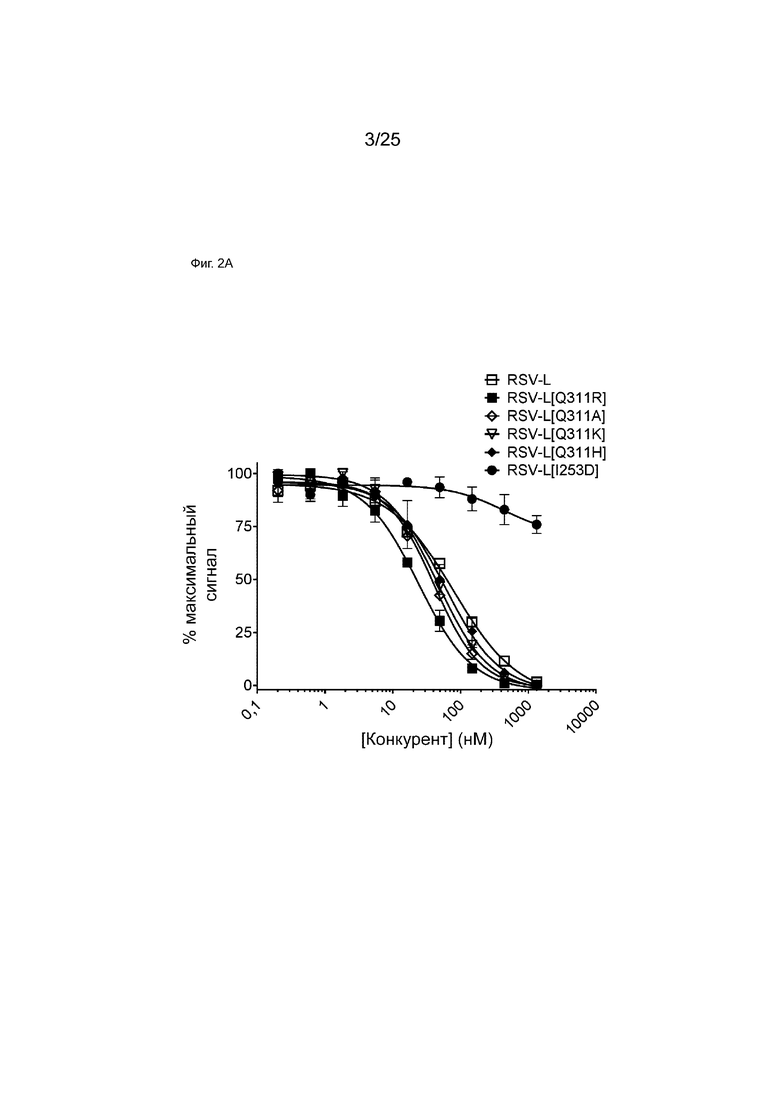
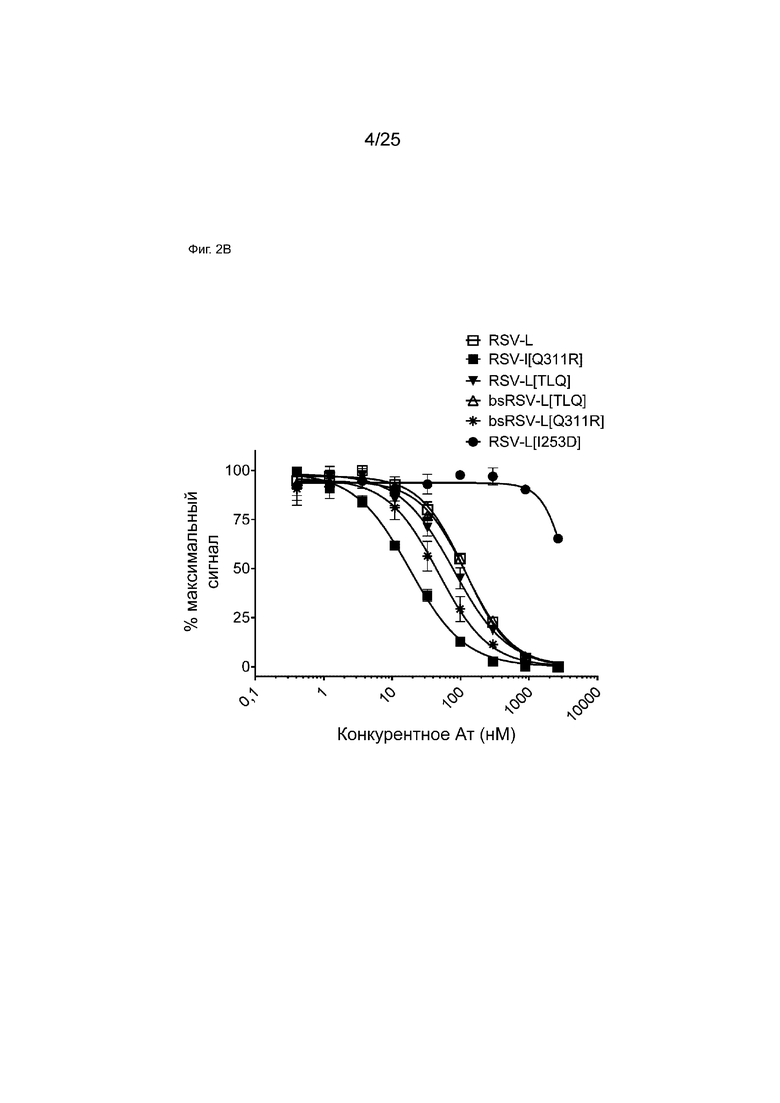
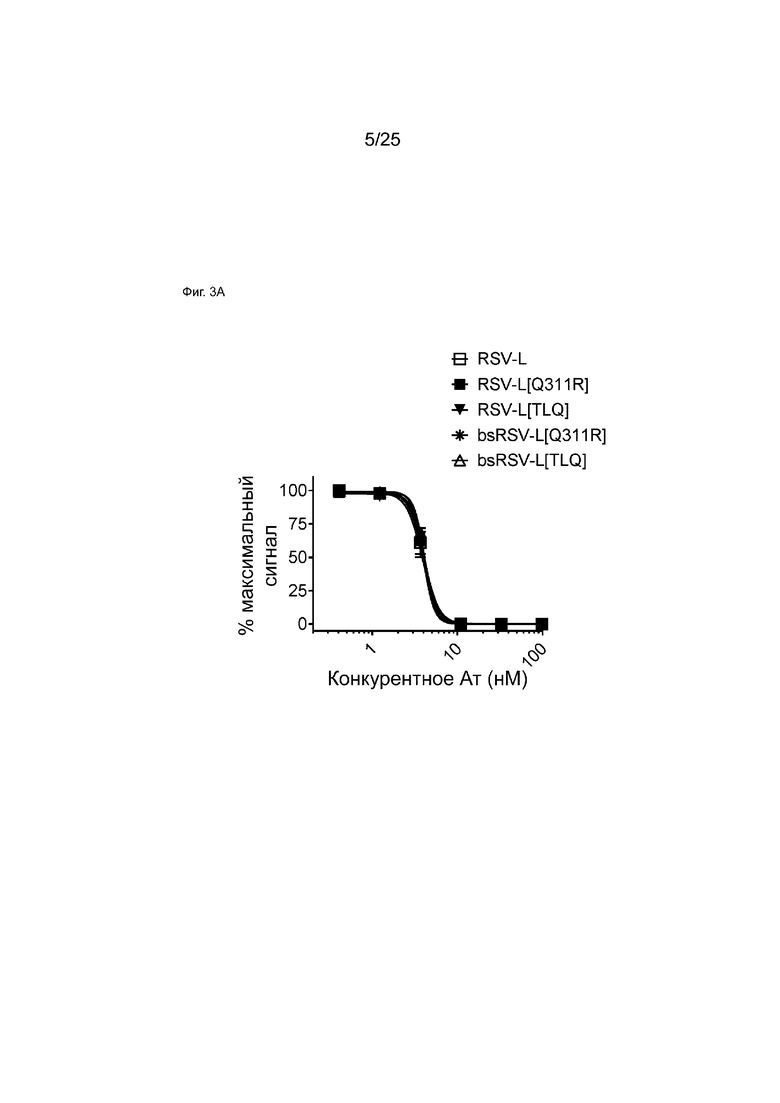
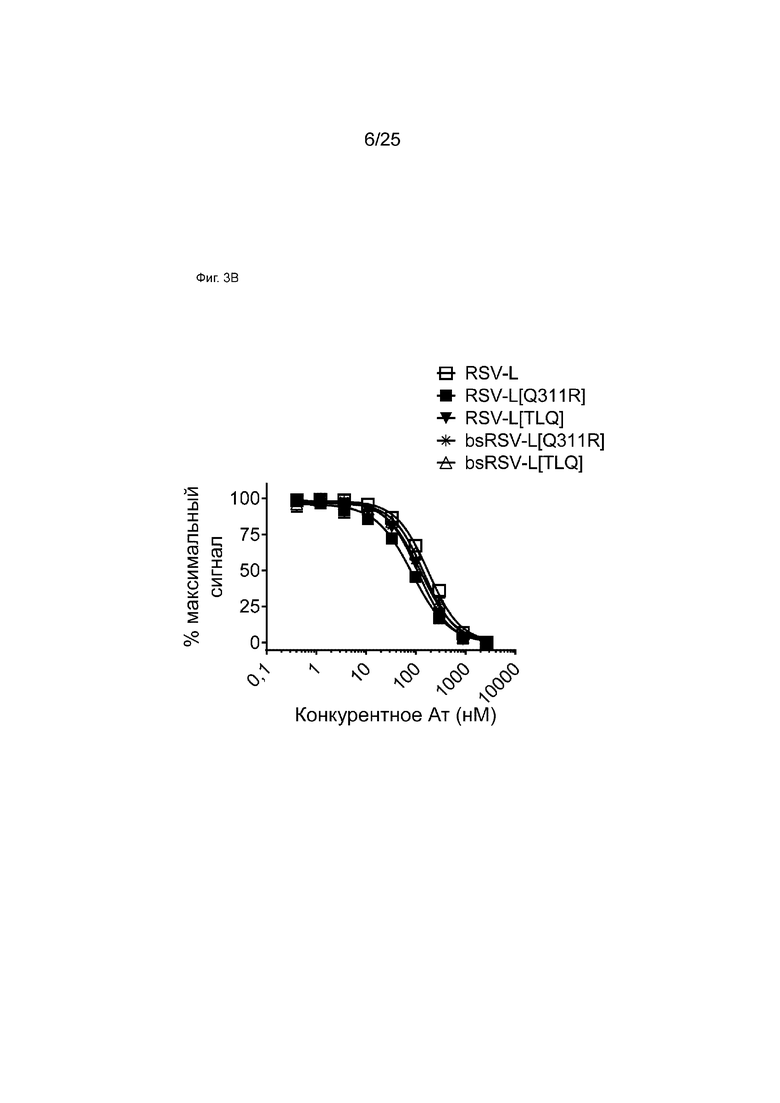
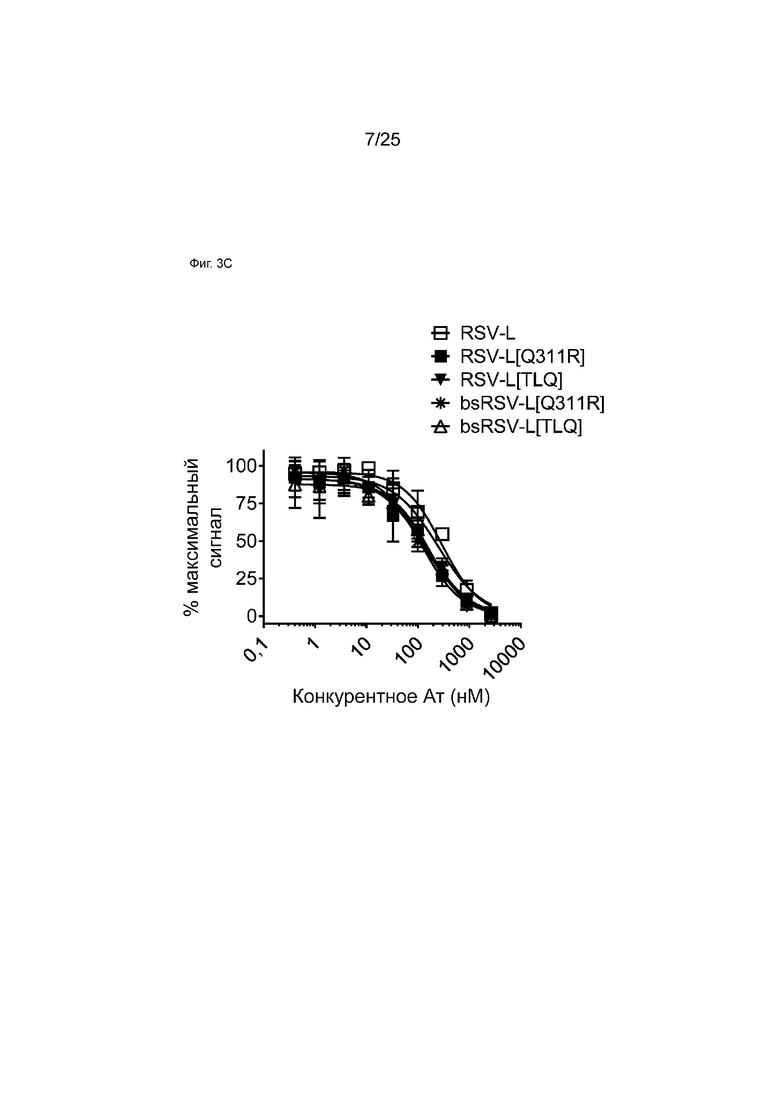
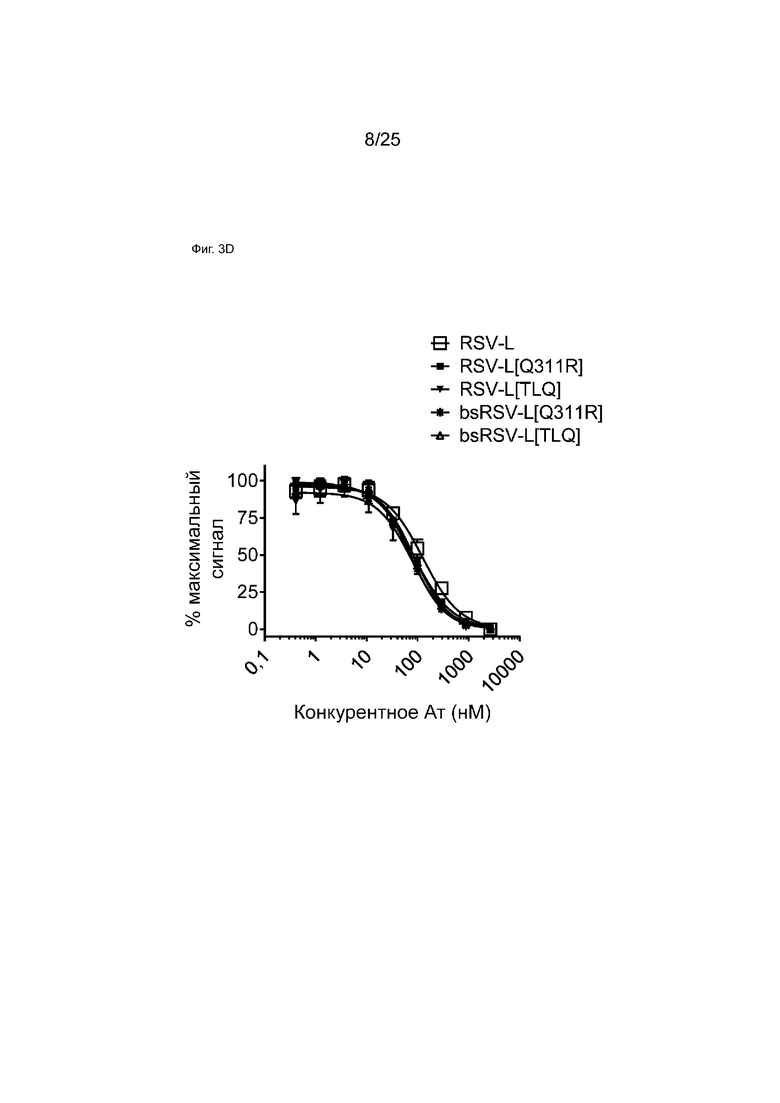
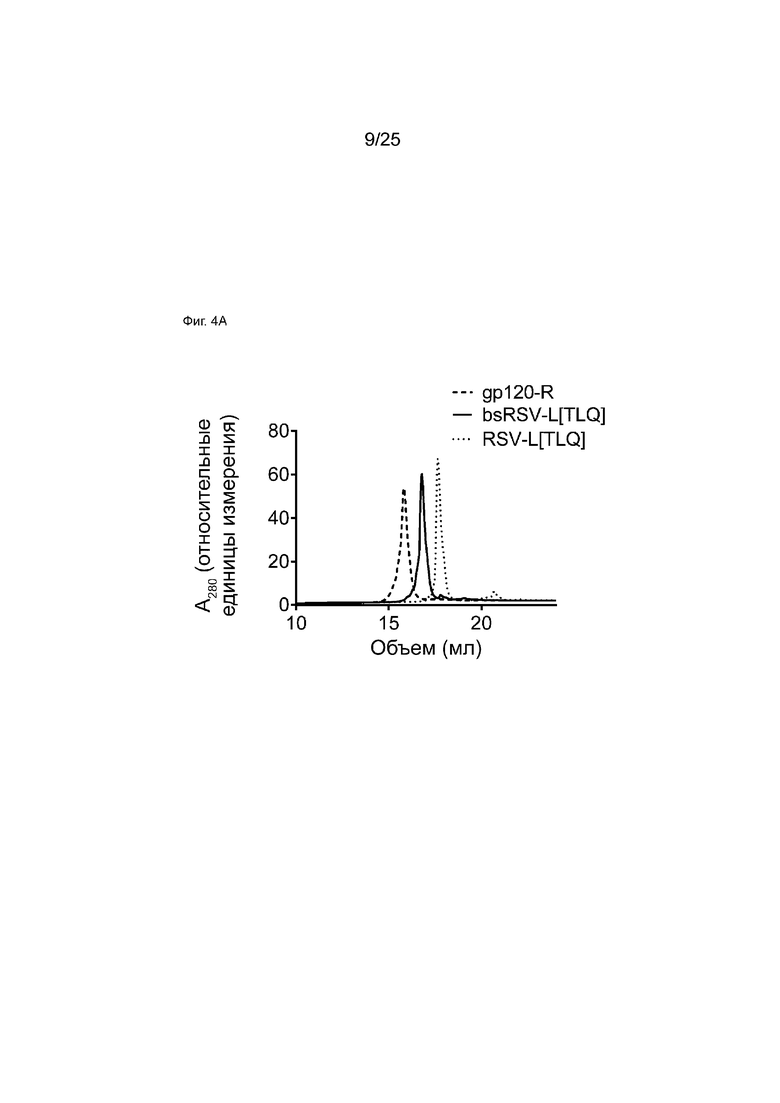
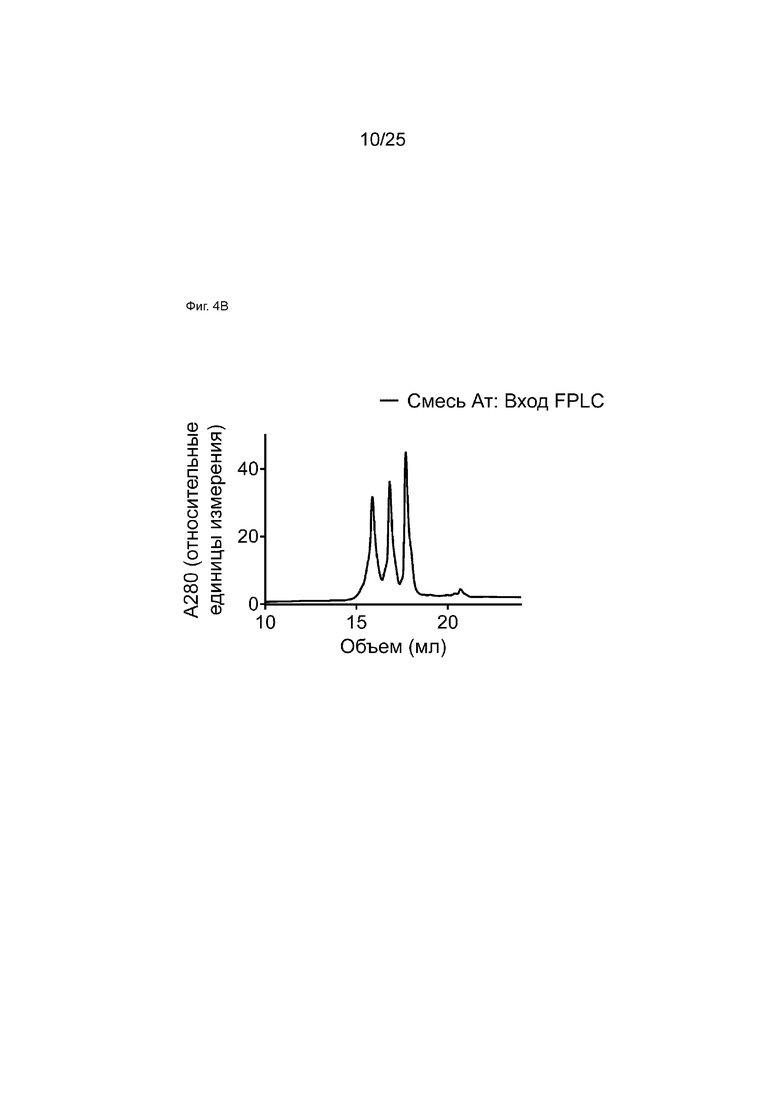
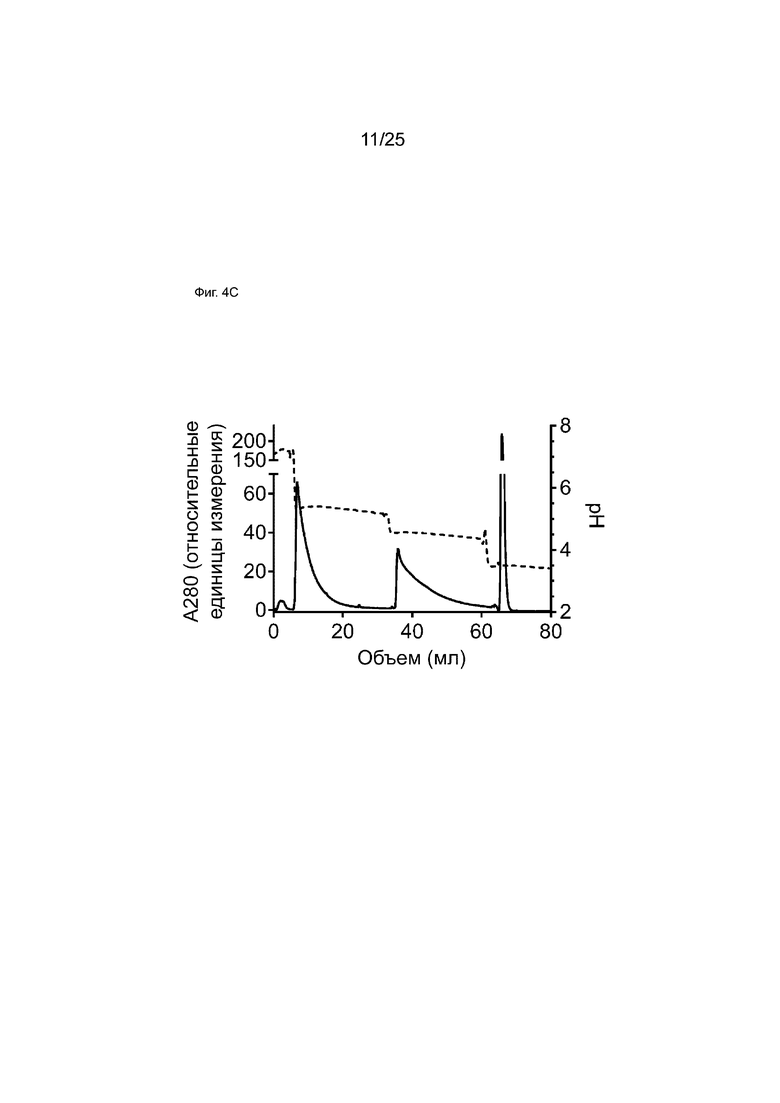
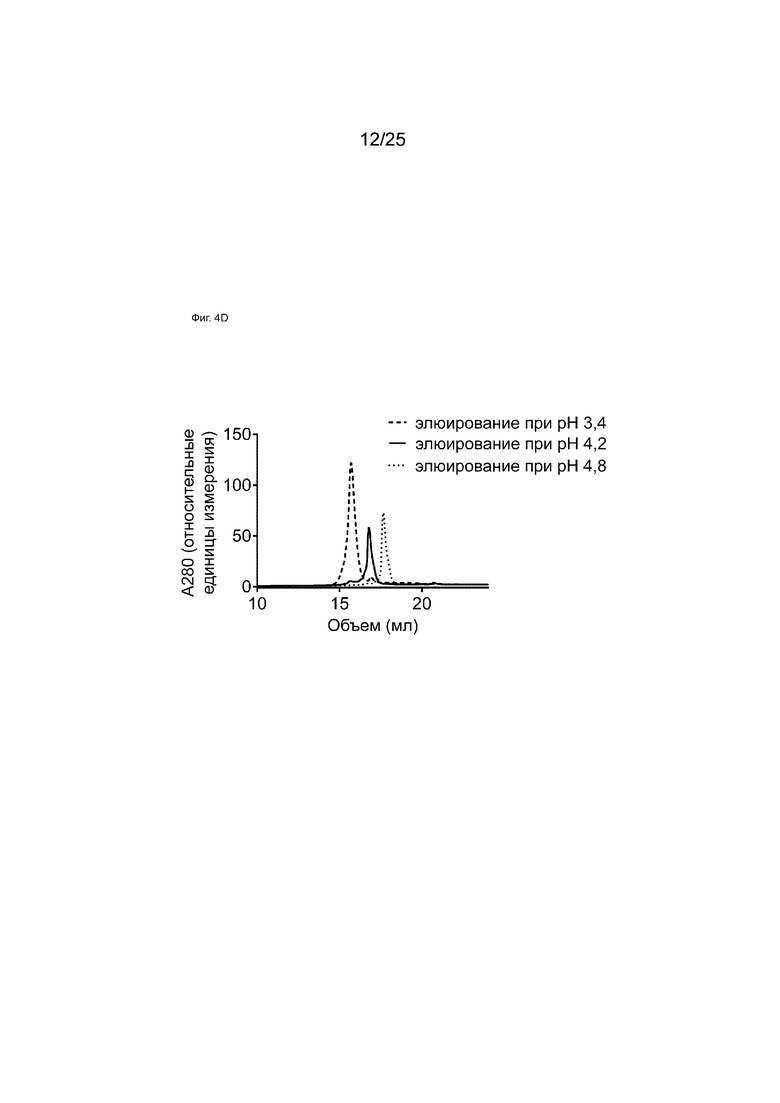
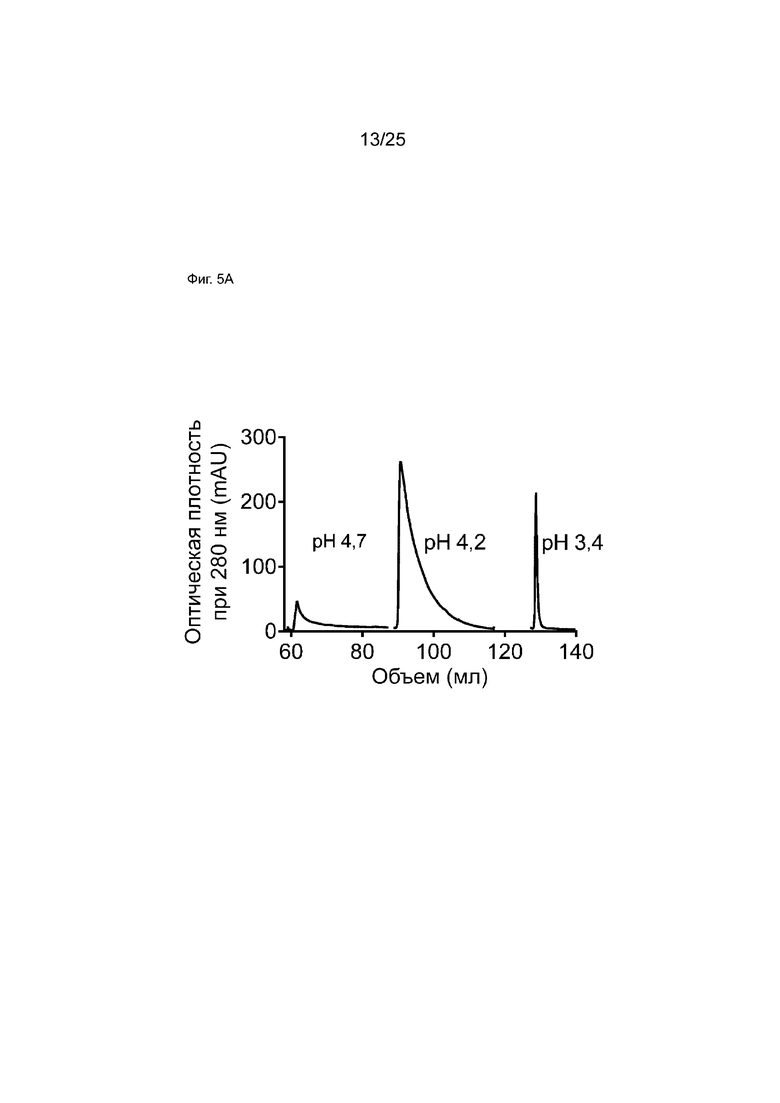
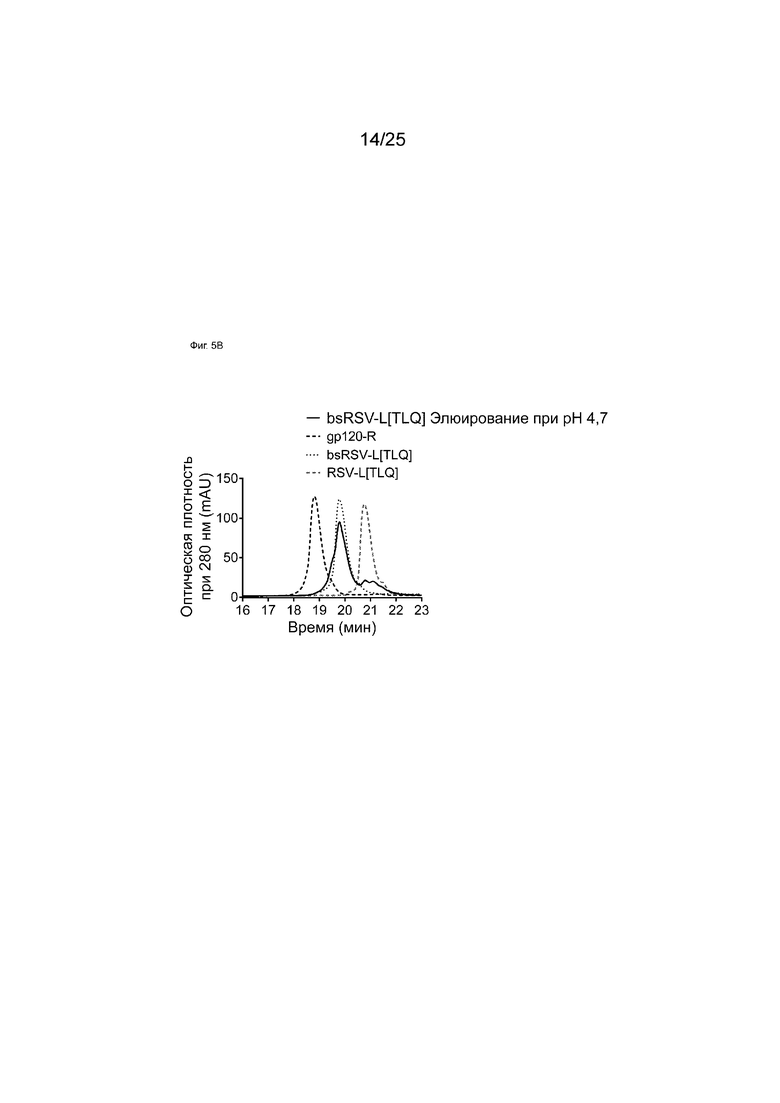
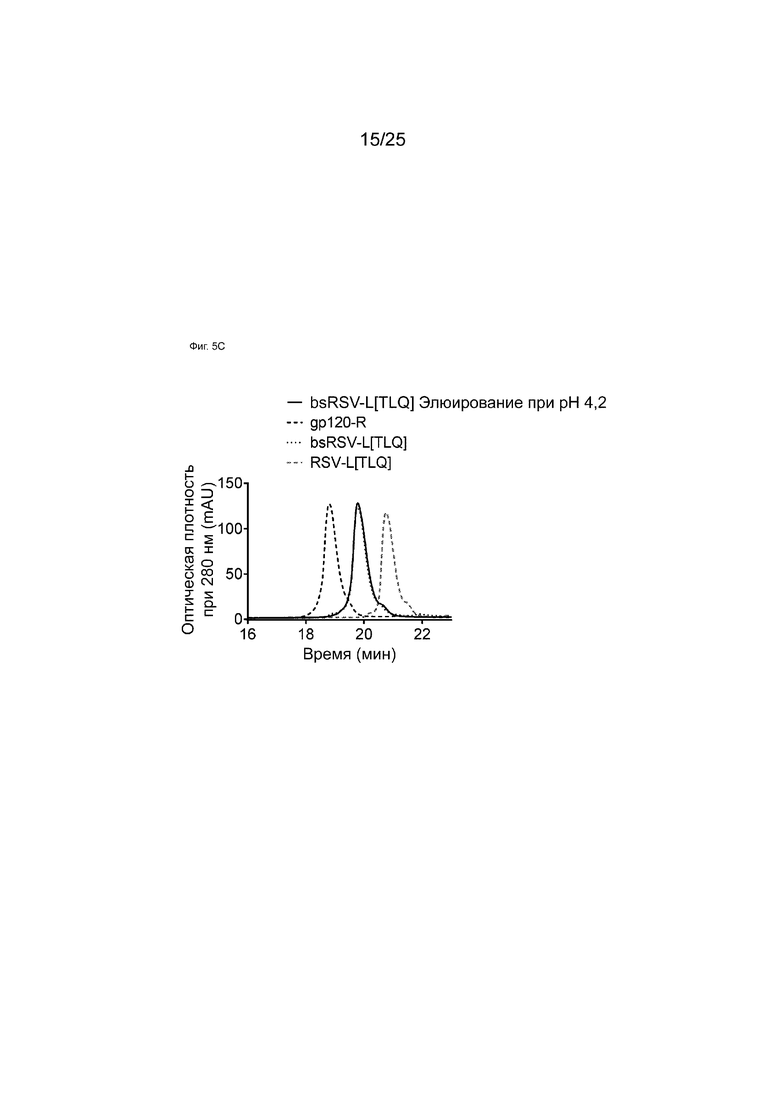
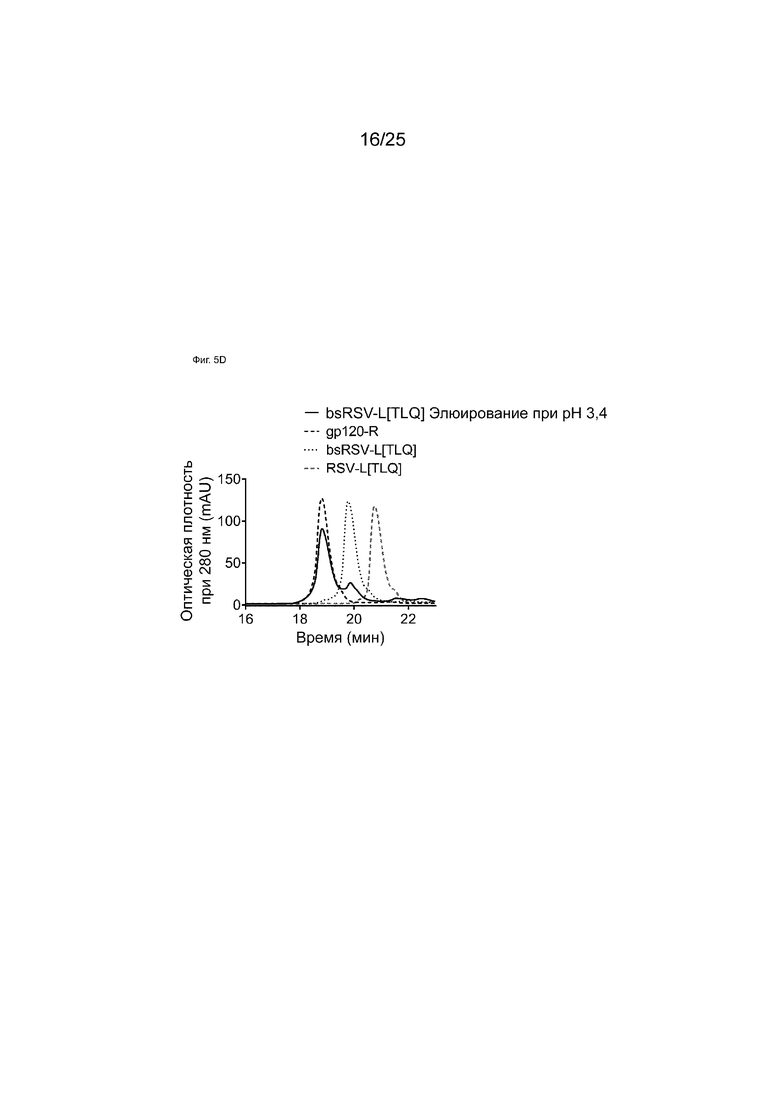
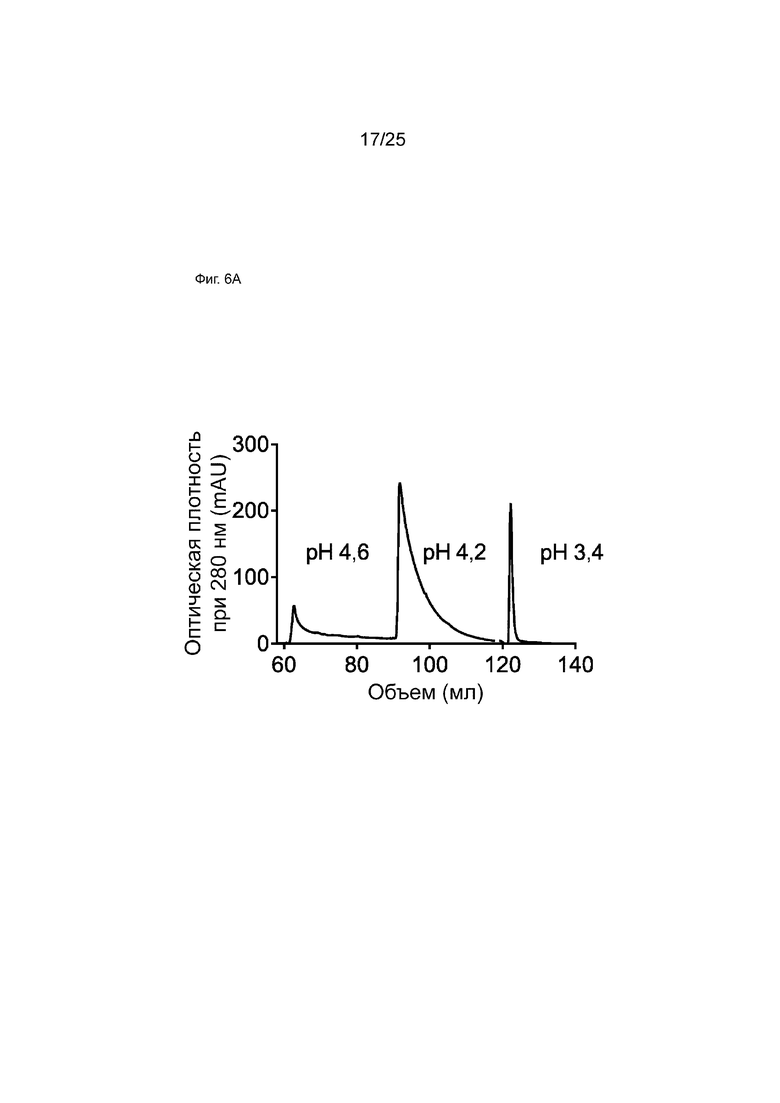
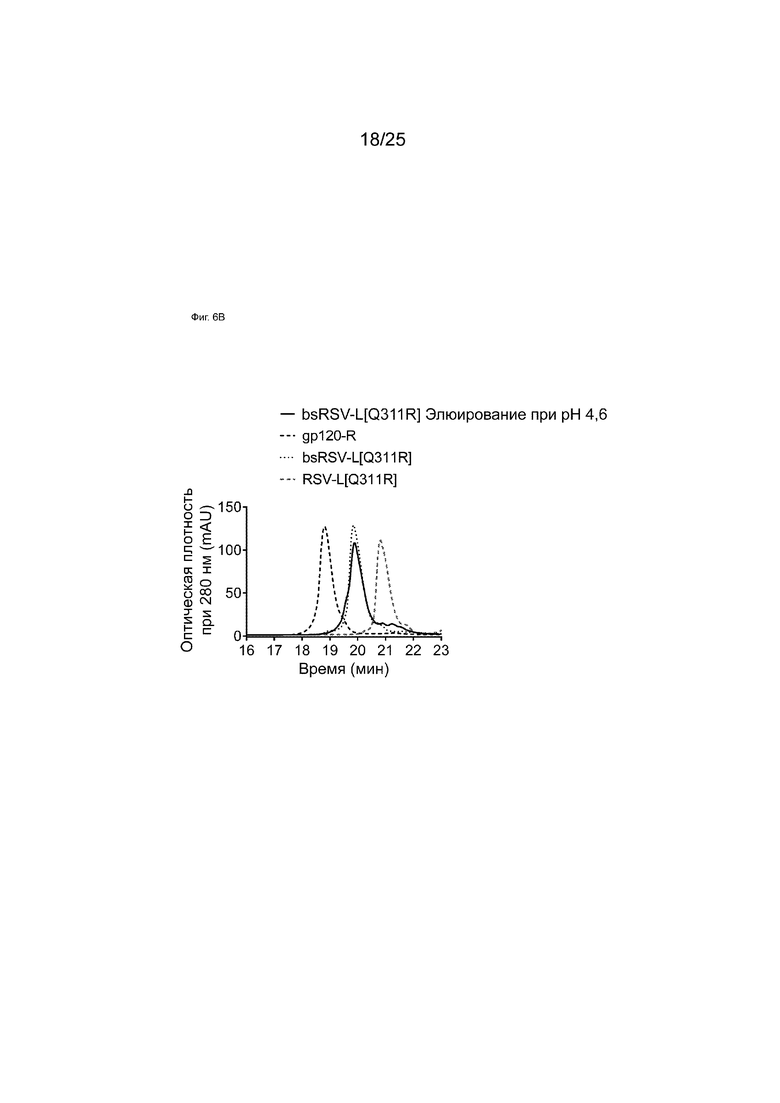
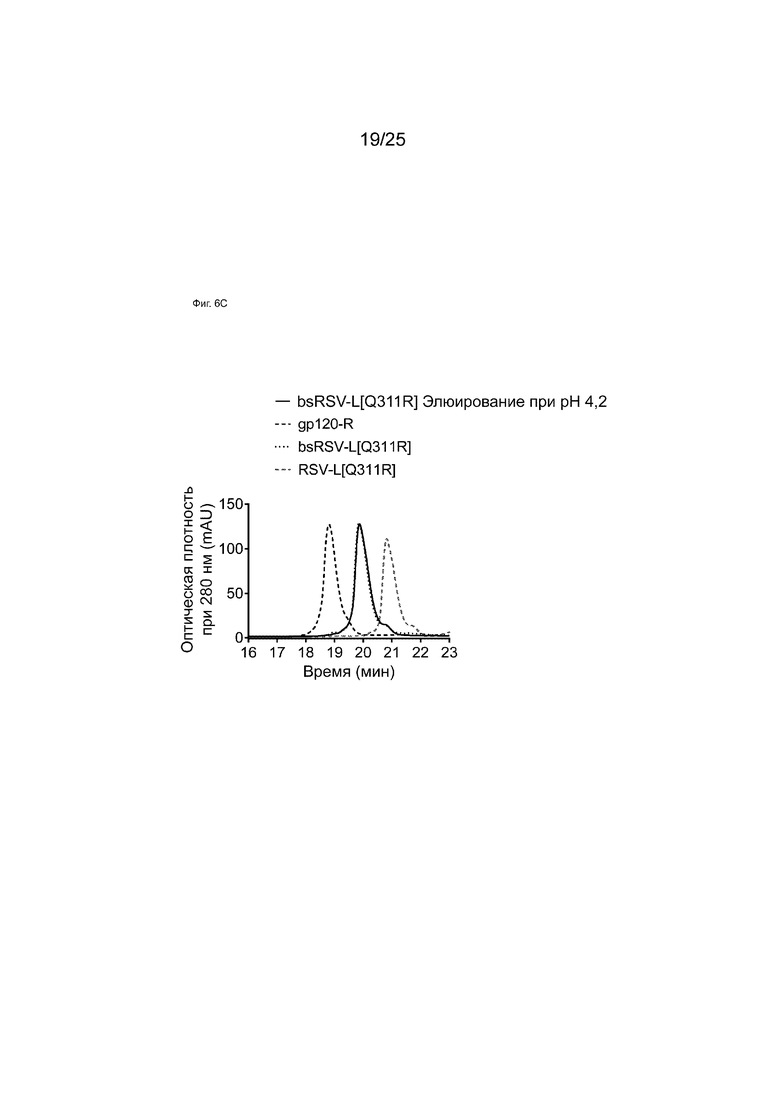
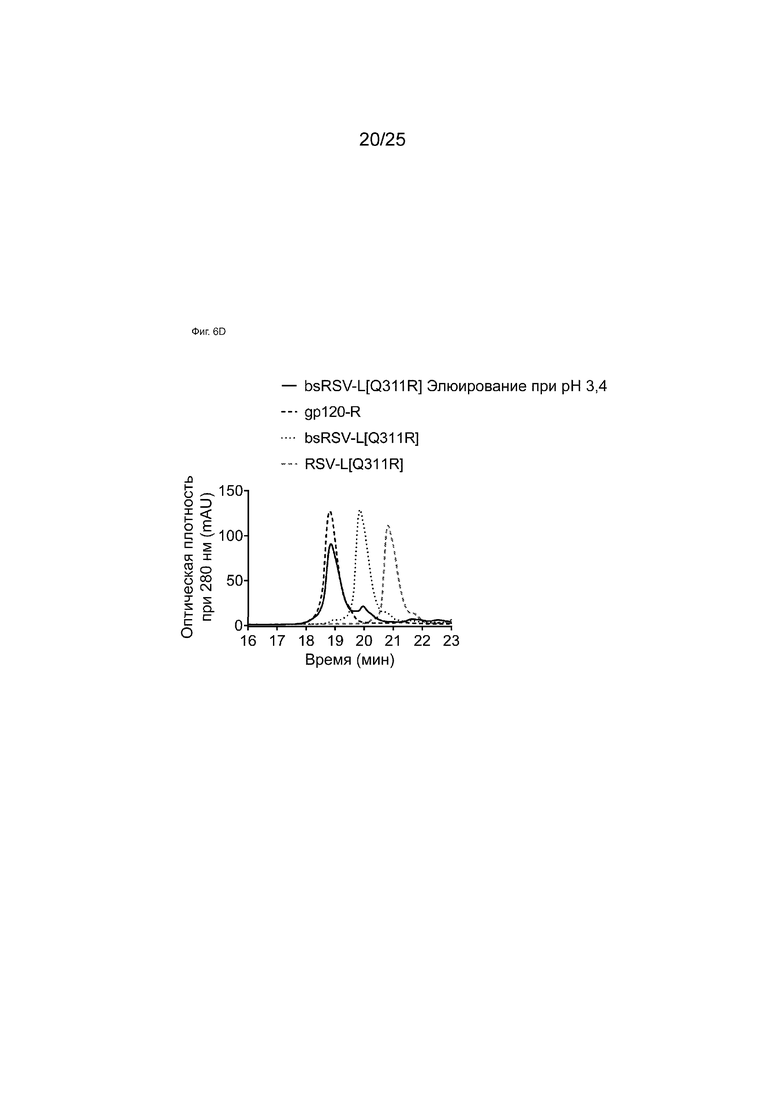
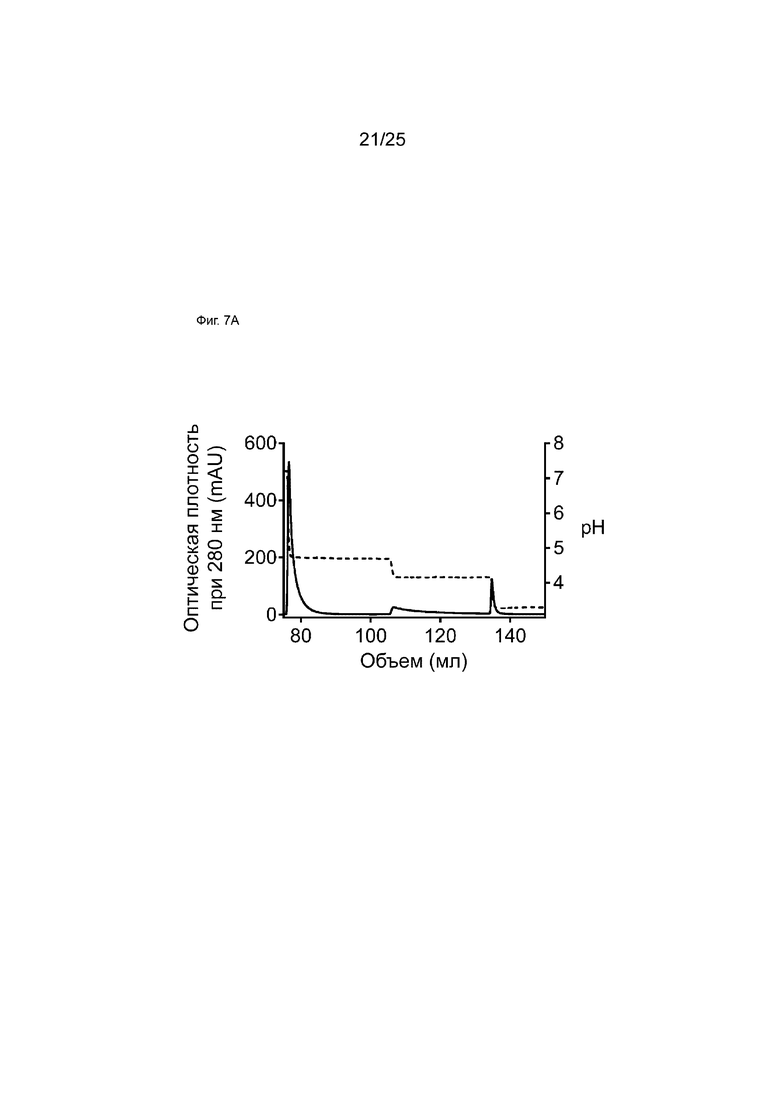
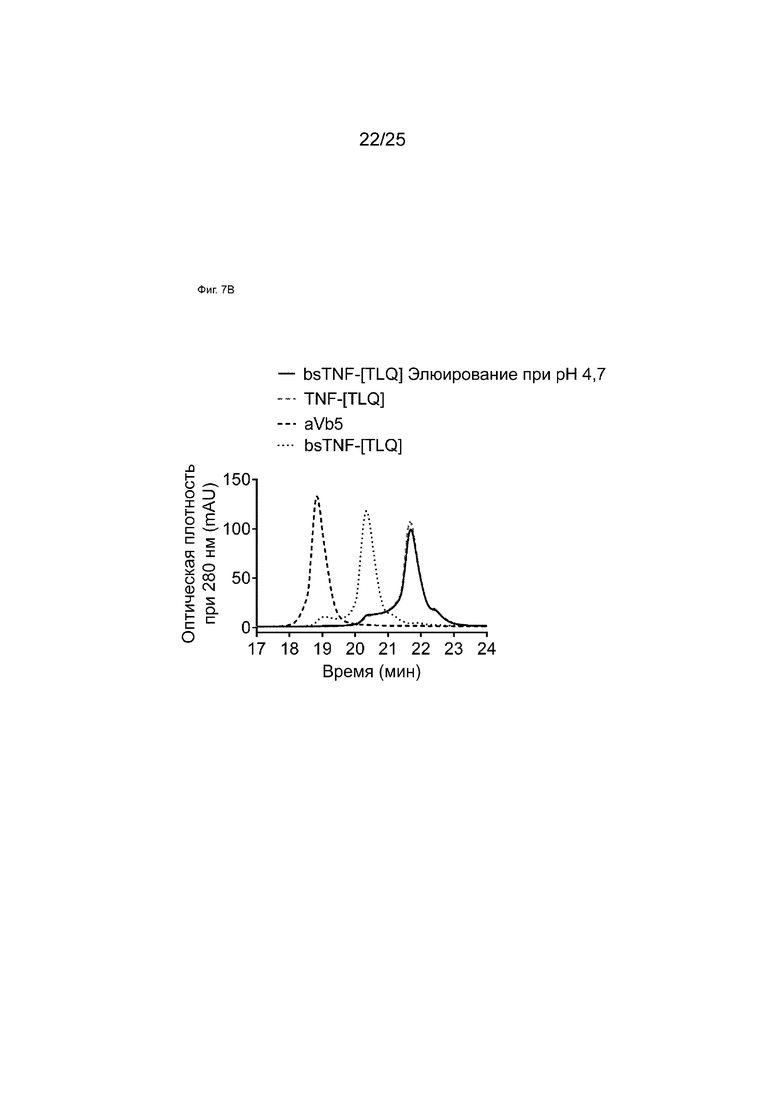
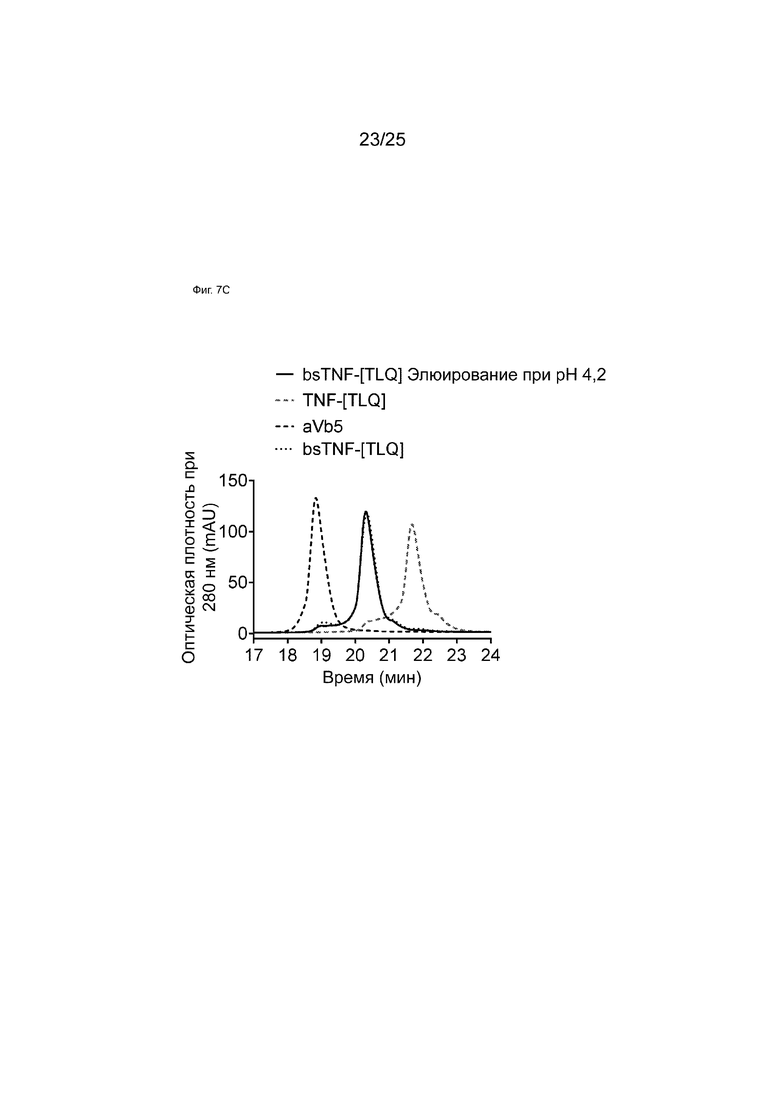
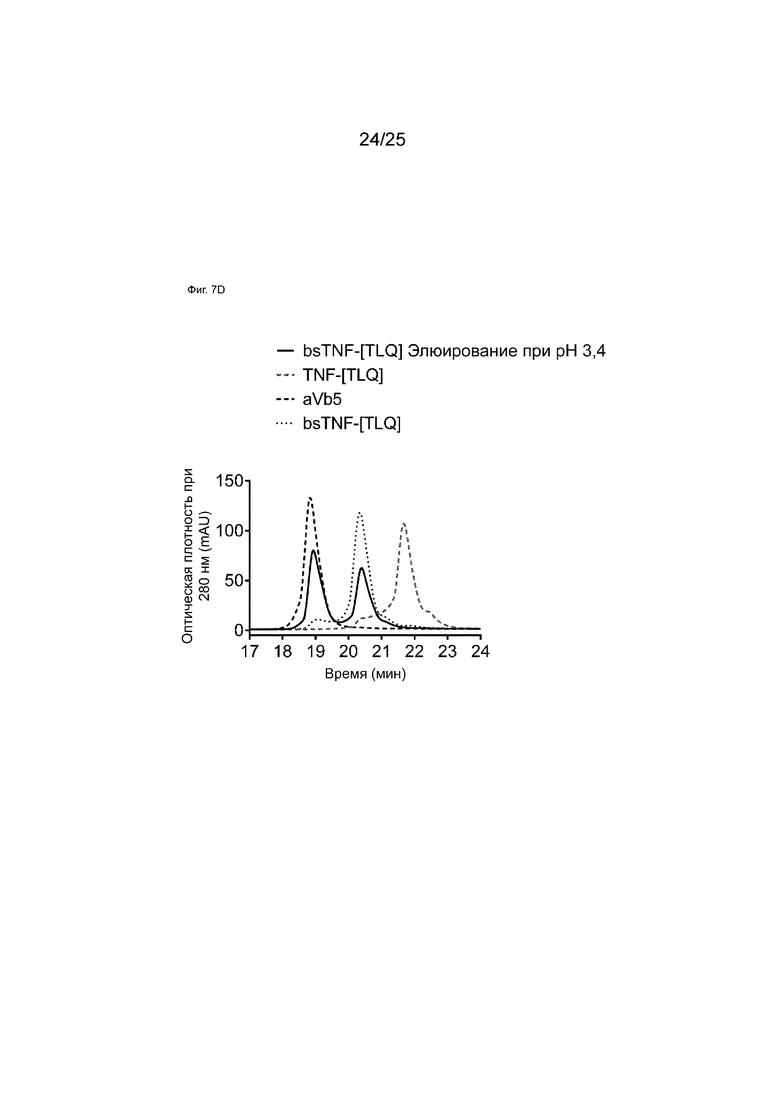
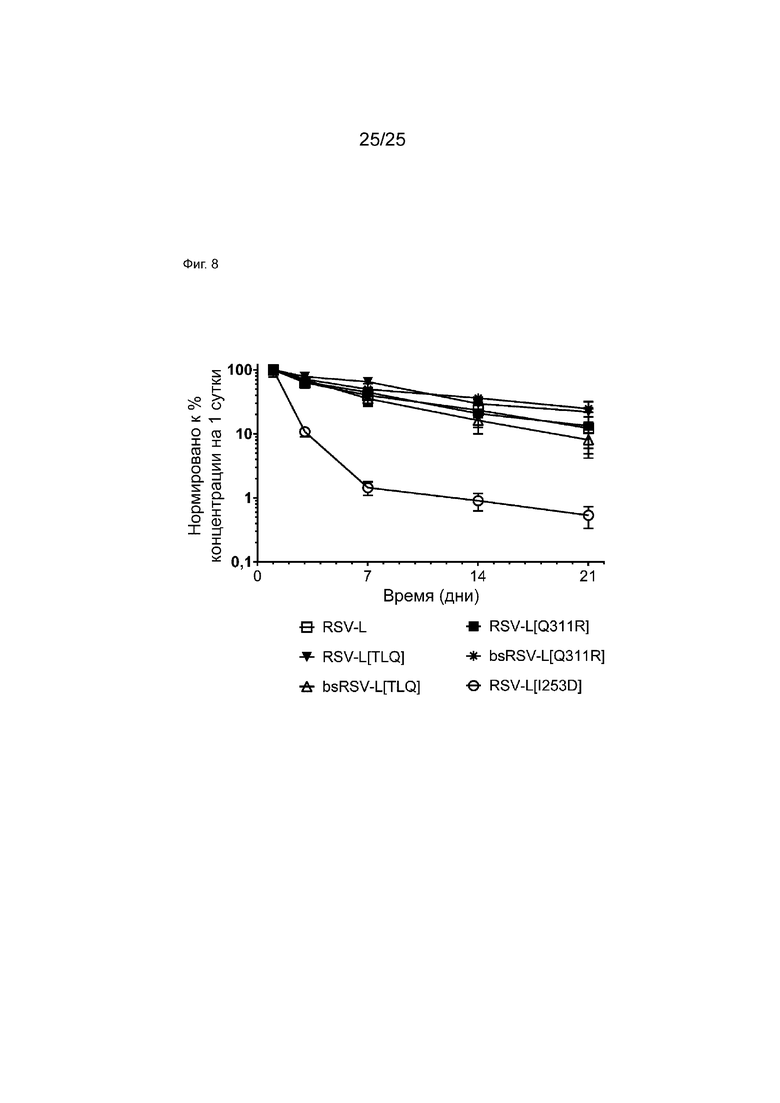
Группа изобретений относится к биотехнологии. Представлены: сконструированные мультиспецифическое антитело и выделенное антитело, мультимерный белок с асимметричными мутациями в области CH2–CH3 и способы их получения. А также предложены фармацевтические композиции для лечения онкологических заболеваний, выделенный полинуклеотид, кодирующий мультиспецифическое антитело, вектор экспрессии и клетка-хозяин, продуцент мультиспецифического антитела. Группа изобретний позволяет получить антитела со сниженной способностью связывать белок А и применять их для лечения онкологических заболеваний. 12 н. и 44 з.п. ф-лы, 25 ил., 16 табл., 7 пр.
1. Выделенное мультиспецифическое антитело со сниженной способностью связывать белок А, содержащее первую область CH2–CH3 с мутацией Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R, и вторую область CH2–CH3 c аминокислотным остатком дикого типа в положениях 307, 309 и 311, при этом нумерация остатков соответствует индексу EU, в котором первая область СН2–СН3 и вторая область СН2–СН3 содержат аминокислотную последовательность:
a) SEQ ID NO: 2 и 22, соответственно;
b) SEQ ID NO: 3 и 22, соответственно;
c) SEQ ID NO: 4 и 22, соответственно;
d) SEQ ID NO: 5 и 22, соответственно;
e) SEQ ID NO: 6 и 23, соответственно;
f) SEQ ID NO: 7 и 23, соответственно;
g) SEQ ID NO: 8 и 23, соответственно;
h) SEQ ID NO: 9 и 23, соответственно;
i) SEQ ID NO: 10 и 24, соответственно;
j) SEQ ID NO: 11 и 24, соответственно;
k) SEQ ID NO: 12 и 24, соответственно;
l) SEQ ID NO: 13 и 24, соответственно;
m) SEQ ID NO: 14 и 25, соответственно;
n) SEQ ID NO: 15 и 25, соответственно;
o) SEQ ID NO: 16 и 25, соответственно;
p) SEQ ID NO: 17 и 25, соответственно;
q) SEQ ID NO: 18 и 26, соответственно
r) SEQ ID NO: 19 и 26, соответственно;
s) SEQ ID NO: 20 и 26, соответственно;
t) SEQ ID NO: 21 и 26, соответственно;
u) SEQ ID NO: 52 и 54, соответственно;
v) SEQ ID NO: 52 и 55, соответственно;
w) SEQ ID NO: 53 и 54, соответственно;
x) SEQ ID NO: 53 и 55, соответственно;
y) SEQ ID NO: 56 и 54, соответственно; или
z) SEQ ID NO: 56 и 55, соответственно.
2. Выделенное мультиспецифическое антитело по п.1, в котором антитело представляет собой изотип IgG1, IgG2 или IgG4.
3. Выделенное мультиспецифическое антитело по п.1 или 2, в котором первая область СН2–СН3 имеет сниженное связывание с лигандом белка А по сравнению со второй областью СН2–СН3.
4. Выделенное мультиспецифическое антитело по п. 3, в котором лиганд белка А содержит стафилококковый белок А, Z-домен или Y-домен.
5. Выделенное мультиспецифическое антитело по п. 4, в котором Z–домен содержит аминокислотную последовательность SEQ ID NO 1.
6. Выделенное мультиспецифическое антитело по любому из пп.1-5, содержащее асимметричные стабилизирующие мутации в первой области СН2–СН3 и во второй области СН2–СН3.
7. Выделенное мультиспецифическое антитело по п. 6, в котором асимметричные стабилизирующие мутации в первой области CH2–CH3 и во второй области CH2– CH3 или во второй области CH2–CH3 и в первой области CH2–CH3 представляют собой
a) F405L и K409R, соответственно;
b) дикого типа и F405L/R409K, соответственно;
c) T366W и T366S/L368A/Y407V, соответственно;
d) T366Y/F405A и T394W/Y407T, соответственно;
e) T366W/F405W и T394S/Y407A, соответственно;
f) F405W/Y407A и T366W/T394S, соответственно;
g) L351Y/F405A/Y407V и T394W, соответственно;
h) T366I/K392M/T394W и F405A/Y407V, соответственно;
i) T366L/K392M/T394W и F405A/Y407V, соответственно;
j) L351Y/Y407A и T366A/K409F, соответственно;
k) L351Y/Y407A и T366V/K409F, соответственно;
l) Y407A и T366A/K409F, соответственно;
m) D399K/E356K и K409D/K392D, соответственно; или
n) D399K/E356K/E357K и K409D/K392D/K370, соответственно.
8. Выделенное мультиспецифическое антитело по любому из пп.1-7, в котором выделенное мультиспецифическое антитело содержит по меньшей мере одну мутацию, которая модулирует связывание антитела с FcγR или FcRn.
9. Выделенное мультиспецифическое антитело по п. 8, в котором по меньшей мере одна мутация, которая модулирует связывание антитела с FcγR или FcRn, представляет собой L234A, F234A, V234A, L235A, G237A, P238S, H268A, V309L, A330A, P331S, L234A/L235A, F234A/L235A, V234A/L235A, V234A/G237A/P238S/H268A/V309L/A330S/P331S, L234A/L235A/G237A/P238S/H268A/A330S/P331S, S239D/I332E, S298A/E333A/K334A, F243L/R292P/Y300L, F243L/R292P/Y300L/P396L, F243L/R292P/Y300L/V305I/P396L, G236A/S239D/I332E, S267E, S267E/L328F, S267E/I332E или M252Y/S254T/T256E.
10. Выделенное мультиспецифическое антитело по любому из пп. 1-9, содержащее первую легкую цепь и вторую легкую цепь.
11. Выделенное мультиспецифическое антитело по п. 10, в котором первая легкая цепь и вторая легкая цепь имеют идентичные аминокислотные последовательности.
12. Выделенное мультиспецифическое антитело по любому из пп. 1-11, отличающееся тем, что выделенное мультиспецифическое антитело связывает два или более антигена.
13. Выделенное мультиспецифическое антитело по п. 12, в котором два антигена представляют собой любые два, выбранные из PD1, CD27, CD28, NKP46, ICOS, GITR, OX40, CTLA4, LAG3, TIM3, KIRa, CD73, CD39, IDO, BTLA, VISTA, TIGIT, CD96, CD30, HVEM, DNAM–1, LFA, опухолевого антигена, EGFR, cMet, FGFR, ROR1, CD123, IL1RAP, FGFR, мезотелина, CD3, T-клеточного рецептора, CD32b, CD32a, CD16a, CD16b, NKG2D, NKP46, CD28, CD47, DLL, CD8, CD89, HLA, В-клеточного рецептора или CD137.
14. Bыделенное мультиспецифическое антитело по любому из пп. 1-13, которое представляет собой биспецифическое антитело.
15. Фармацевтическая композиция для лечения онкологических заболеваний, содержащая эффективное количество выделенного мультиспецифического антитела по любому из пп. 1-14 и фармацевтически приемлемый носитель.
16. Выделенный полинуклеотид, кодирующий мультиспецифическое антитело по любому из пп. 1-14 или его область:
a) cодержащий полинуклеотид, кодирующий первую область CH2–CH3 с мутацией Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R;
b) содержащий полинуклеотид, кодирующий первую область CH2–СН3 с мутацией Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R , и вторую область CH2–CH3 с аминокислотным остатком дикого типа в положениях 307, 309 и 311;
с) содержащий полинуклеотидную последовательность SEQ ID NO: 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 87, 88 или 91.
17. Вектор экспрессии, содержащий
a) выделенный полинуклеотид, кодирующий первую область CH2–CH3 с мутацией Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R;
b) выделенный полинуклеотид, содержащий полинуклеотидную последовательность SEQ ID NO: 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 87, 88 или 91;
c) выделенный полинуклеотид, содержащий полинуклеотид, кодирующий первую область CH2–CH3 с мутацией Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или Т307P/V309Q/Q311R, и вторую область CH2–CH3 с аминокислотным остатком дикого типа в положениях 307, 309 и 311;
d) выделенный полинуклеотид, содержащий
i) SEQ ID NO: 27 и 47, соответственно;
ii) SEQ ID NO: 28 и 47, соответственно;
iii) SEQ ID NO: 29 и 47, соответственно;
iv) SEQ ID NO: 30 и 47, соответственно;
v) SEQ ID NO: 31 и 48, соответственно;
vi) SEQ ID NO: 32 и 48, соответственно;
vii) SEQ ID NO: 33 и 48, соответственно;
viii) SEQ ID NO: 34 и 48, соответственно;
ix) SEQ ID NO: 35 и 49, соответственно;
x) SEQ ID NO: 36 и 49, соответственно;
xi) SEQ ID NO: 37 и 49, соответственно;
xii) SEQ ID NO: 38 и 49, соответственно;
xiii) SEQ ID NO: 39 и 50, соответственно;
xiv) SEQ ID NO: 40 и 50, соответственно;
xv) SEQ ID NO: 41 и 50, соответственно;
xvi) SEQ ID NO: 42 и 50, соответственно;
xvii) SEQ ID NO: 43 и 51, соответственно;
xviii) SEQ ID NO: 44 и 51, соответственно;
xix) SEQ ID NO: 45 и 51, соответственно;
xx) SEQ ID NO: 46 и 51, соответственно;
xxi) SEQ ID NO: 87 и 89, соответственно;
xxii) SEQ ID NO: 87 и 90, соответственно;
xxiii) SEQ ID NO: 88 и 89, соответственно;
xxiv) SEQ ID NO: 88 и 90, соответственно;
xxv) SEQ ID NO: 92 и 89, соответственно; или
xxvi) SEQ ID NO: 92 и 90, соответственно.
18. Клетка-хозяин продуцент мультиспецифического антитела по любому из пп. 1-14 или его области, содержащая вектор по п. 17.
19. Клетка-хозяин по п. 18, отличающаяся тем, что клетка-хозяин представляет собой клетки гибридомы, миеломы, SP2/0, NS0, U266, CHO, CHO–K1SV, CHO–K1, DG44 или Hek293.
20. Способ получения выделенного мультиспецифического антитела по любому из пп. 1-14, включающий
a) культивирование клетки-хозяина по п. 18 в условиях, при которых экспрессируется мультиспецифическое антитело; и
b) очистку мультиспецифического антитела с использованием аффинной хроматографии лиганда белка A.
21. Способ получения выделенного мультиспецифического антитела по любому из пп. 1-14, включающий
a) обеспечение первого исходного антитела, содержащего первую тяжелую цепь или ее фрагмент с мутацией Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R, и первую легкую цепь;
b) обеспечение второго исходного антитела, содержащего вторую тяжелую цепь или ее фрагмент с аминокислотным остатком дикого типа в положениях 307, 309 и 311, и вторую легкую цепь;
c) приведение в контакт первого исходного антитела и второго исходного антитела в образце;
d) инкубацию образца; и
е) очистку мультиспецифического антитела с использованием аффинной хроматографии лиганда белка A.
22. Выделенное антитело со сниженной способностью связывать белок А, содержащее две тяжелые цепи или их фрагменты, имеющие идентичные аминокислотные последовательности, и две легкие цепи или их фрагменты, причем две тяжелые цепи содержат мутацию Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R, при этом нумерация остатков соответствует индексу EU.
23. Выделенное антитело по п. 22, в котором две тяжелые цепи или их фрагменты дополнительно содержат мутацию F405L, K409R, F405L/R409K, T366W или T366S/L368A/Y407V.
24. Выделенное антитело по п. 22 или 23, в котором антитело представляет собой изотип IgG1, IgG2 или IgG4.
25. Выделенное антитело по любому из пп. 22-24, содержащее область СН2–СН3 тяжелой цепи SEQ ID NO: 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 52, 53 или 56.
26. Способ получения выделенного антитела по любому из пп. 22-25, включающий культирование клетки-хозяина в условиях, в которых антитело экспрессируется, и очистку антитела.
27. Мультимерный белок со сниженной способностью связывать белок А, содержащий первый полипептид и второй полипептид, причем первый полипептид содержит первую область CH2–CH3 с мутацией Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R, и второй полипептид содержит вторую область CH2–CH3 с аминокислотным остатком дикого типа в положениях 307, 309 и 311, при этом нумерация остатков соответствует индексу EU, в котором первая область CH2–CH3 и вторая область CH2–CH3 содержат аминокислотную последовательность
a) SEQ ID NO: 2 и 22, соответственно;
b) SEQ ID NO: 3 и 22, соответственно;
c) SEQ ID NO: 4 и 22, соответственно;
d) SEQ ID NO: 5 и 22, соответственно;
e) SEQ ID NO: 6 и 23, соответственно;
f) SEQ ID NO: 7 и 23, соответственно;
g) SEQ ID NO: 8 и 23, соответственно;
h) SEQ ID NO: 9 и 23, соответственно;
i) SEQ ID NO: 10 и 24, соответственно;
j) SEQ ID NO: 11 и 24, соответственно;
k) SEQ ID NO: 12 и 24, соответственно;
l) SEQ ID NO: 13 и 24, соответственно;
m) SEQ ID NO: 14 и 25, соответственно;
n) SEQ ID NO: 15 и 25, соответственно;
o) SEQ ID NO: 16 и 25, соответственно;
p) SEQ ID NO: 17 и 25, соответственно;
q) SEQ ID NO: 18 и 26, соответственно;
r) SEQ ID NO: 19 и 26, соответственно;
s) SEQ ID NO: 20 и 26, соответственно;
t) SEQ ID NO: 21 и 26, соответственно;
u) SEQ ID NO: 52 и 54, соответственно;
v) SEQ ID NO: 52 и 55, соответственно;
w) SEQ ID NO: 53 и 54, соответственно;
x) SEQ ID NO: 53 и 55, соответственно;
y) SEQ ID NO: 56 и 54, соответственно; или
z) SEQ ID NO: 56 и 55, соответственно.
28. Мультимерный белок по п. 27, в котором первая область СН2–СН3 и вторая область СН2–СН3 относятся к изотипу IgG1, IgG2 или IgG4.
29. Мультимерный белок по п. 27 или 28, в котором первая область СН2 –СН3 имеет сниженное связывание с лигандом белка А по сравнению со второй областью СН2–СН3.
30. Мультимерный белок по п. 29, в котором лиганд белка А содержит стафилококковый белок А, Z-домен или Y-домен.
31. Мультимерный белок по п. 30, в котором Z–домен содержит аминокислотную последовательность SEQ ID NO: 1.
32. Мультимерный белок по любому из пп. 27-31, содержащий асимметричные стабилизирующие мутации в первой области CH2–CH3 и во второй области CH2–CH3.
33. Мультимерный белок по п. 32, в котором асимметричные стабилизирующие мутации в первой области CH2–CH3 и во второй области CH2–CH3 или во второй области CH2–CH3 и в первой области CH2–CH3 представляют собой
a) F405L и K409R, соответственно;
b) дикого типа и F405L/R409K, соответственно;
c) T366W и T366S/L368A/Y407V, соответственно;
d) T366Y/F405A и T394W/Y407T, соответственно;
e) T366W/F405W и T394S/Y407A, соответственно;
f) F405W/Y407A и T366W/T394S, соответственно;
g) L351Y/F405A/Y407V и T394W, соответственно;
h) T366I/K392M/T394W и F405A/Y407V, соответственно;
i) T366L/K392M/T394W и F405A/Y407V, соответственно;
j) L351Y/Y407A и T366A/K409F, соответственно;
k) L351Y/Y407A и T366V/K409F, соответственно;
l) Y407A и T366A/K409F, соответственно;
m) D399K/E356K и K409D/K392D, соответственно; или
n) D399K/E356K/E357K и K409D/K392D/K370.
34. Мультимерный белок по любому из пп. 27-33, в котором первая область СН2–СН3 и/или вторая область СН2–СН3 связана с гетерологичным белком.
35. Мультимерный белок по п. 34, в котором гетерологичный белок представляет собой пептид, внеклеточный домен рецептора, внеклеточный домен лиганда, секретируемый белок, scFv, Fab, вариабельную область тяжелой цепи (VH), вариабельную область легкой цепи (VL), домен фибронектина типа III и/или финомер.
36. Мультимерный белок по п. 35, в котором гетерологичный белок связан с N-концом или с C-концом первой области CH2–CH3 и/или второй области CH2–CH3, необязательно посредством линкера.
37. Мультимерный белок по п. 36, линкер содержит аминокислотную последовательность SEQ ID NO: 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 92, 93, 94, 95, 96, 97 или 98.
38. Мультимерный белок по п. 27, в котором мультимерный белок представляет собой антитело.
39. Мультимерный белок по п. 38, в котором антитело является мультиспецифическим, биспецифическим или моноспецифическим.
40. Мультимерный белок по любому из пп. 27-39, содержащий две, три или четыре полипептидные цепи.
41. Фармацевтическая композиция для лечения онкологических заболеваний, содержащая эффективное количество мультимерного белка по любому из пп. 27–40 и фармацевтически приемлемый носитель.
42. Способ получения выделенного мультимерного белка по любому из пп. 27-40, включающий:
а) обеспечение первого исходного белка, содержащего первую область CH2–CH3 с мутацией Q311R, Q311K, T307P/L309Q, T307P/V309Q, T307P/L309Q/Q311R или T307P/V309Q/Q311R;
b) обеспечение второго исходного белка, содержащего вторую область CH2 –CH3 с аминокислотным остатком дикого типа в положениях 307, 309 и 311;
c) приведение в контакт первого исходного белка и второго исходного белка в образце;
d) инкубацию образца; и
е) очистку мультиспецифического белка с использованием аффинной хроматографии лиганда белка A.
43. Способ по п. 42, в котором выделенный мультимерный белок содержит асимметричные стабилизирующие мутации в первой области CH2–CH3 и во второй области CH2–CH3.
44. Способ по п. 43, в котором асимметричные стабилизирующие мутации в первой области CH2–CH3 и во второй области CH2–CH3 или во второй области CH2–CH3 и в первой области CH2–CH3 представляют собой
a) F405L и K409R, соответственно;
b) дикого типа и F405L/R409K, соответственно;
c) T366W и T366S/L368A/Y407V, соответственно;
d) T366Y/F405A и T394W/Y407T, соответственно;
e) T366W/F405W и T394S/Y407A, соответственно;
f) F405W/Y407A и T366W/T394S, соответственно;
g) L351Y/F405A/Y407V и T394W, соответственно;
h) T366I/K392M/T394W и F405A/Y407V, соответственно;
i) T366L/K392M/T394W и F405A/Y407V, соответственно;
j) L351Y/Y407A и T366A/K409F, соответственно;
k) L351Y/Y407A и T366V/K409F, соответственно;
l) Y407A и T366A/K409F, соответственно;
m) D399K/E356K и K409D/K392D, соответственно; или
n) D399K/E356K/E357K и K409D/K392D/K370, соответственно.
45. Способ по любому из пп. 42-44, в котором первая область CH2–CH3 и вторая область CH2–CH3 относятся к изотипу IgG1, IgG2 или IgG4.
46. Способ по любому из пп. 42-45, в котором первая область CH2–CH3 и/или вторая область CH2–CH3 связана с гетерологичным белком.
47. Способ по п. 46, в котором гетерологичный белок представляет собой пептид, внеклеточный домен рецептора, внеклеточный домен лиганда, секретируемый белок, scFv, Fab, вариабельную область тяжелой цепи (VH), вариабельную область легкой цепи (VL), домен фибронектина типа III и/или финомер.
48. Способ по п. 46 или 47, в котором гетерологичный белок связан с N-концом или с C-концом первой области CH2–CH3 и/или второй области CH2–CH3, посредством линкера.
49. Способ по п. 48, в котором линкер содержит аминокислотную последовательность SEQ ID NO: 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 92, 93, 94, 95, 96, 97 или 98.
50. Способ по любому из пп. 42-49, в котором первый исходный белок и второй исходный белок представлены в виде очищенных белков.
51. Способ по любому из пп. 42-49, в котором первый исходный белок и второй исходный белок представлены в среде для культивирования клеток, полученной из клеток, экспрессирующих первый исходный белок и второй исходный белок.
52. Способ по п. 42, в котором восстанавливающий агент добавляют на стадии d).
53. Способ по п.52, в котором восстанавливающий агент представляет собой 2-меркаптоэтиламин (2-МЕА), дитиотреитол(ДТТ), дитиоэритритол (DTE), глутатион, трис(2-карбоксиэтил)фосфин (ТСЕР), L-цистеин или бета-меркаптоэтанол.
54. Способ по п. 53, в котором 2-MEA присутствует в концентрации от около 10 мМ до около 100 мМ.
55. Способ по п. 53, в котором 2-MEA присутствует в концентрации от около 25 мМ до около 75 мМ.
56. Способ по п. 42, в котором стадию d) выполняют при температуре от около 25°C до около 37°C в течение от около девяноста минут до около шести часов.
| WO 2015158867 A1, 22.10.2015 | |||
| WO 2017034770 A1, 02.03.2017 | |||
| WO 2017011342 A9, 19.01.2017 | |||
| AXL-АНТИТЕЛА | 2008 |
|
RU2506276C2 |
Авторы
Даты
2023-09-26—Публикация
2018-06-04—Подача