ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области иммунологии и, более конкретно, к антителам против клаудина 18.2 (CLDN18A2, CLDN18.2) или их антигенсвязывающим фрагментам, производным, содержащим антитела или их антигенсвязывающие фрагменты, фармацевтическим композициям и их родственным вариантам применения в лечении рака.
УРОВЕНЬ ТЕХНИКИ
Клаудины являются интегральными мембранными белками, включающими основные структурные белки плотных контактов, такие как апикальные межклеточные адгезивные контакты у поляризованных типов клеток, наблюдаемых в слоях эпителиальных или эндотелиальных клеток. Плотные контакты состоят из полицепочечных ретикулярных белков, которые образуют непрерывное уплотнение вокруг клетки, обеспечивая физический барьер для транспорта растворенных веществ и воды в параклеточное пространство, но при этом данный перенос является регулируемым. Семейство клаудинов у людей содержит по меньшей мере 23 представителя, размер которых варьируется от 22 до 34 кДа. Хотя клаудины важны для функционирования и стабильности нормальных тканей, опухолевые клетки часто проявляют аберрантное функционирование плотных контактов. Это может быть связано с нарушением регуляции экспрессии и/или локализации клаудинов по причине дедиферренцировки опухолевых клеток или необходимости эффективного поглощения питательных веществ опухолевыми массами с аномальным ангиогенезом и быстрорастущими раковыми тканями (Morin, 2005, PMID: 16266975). Отдельные представители семейства клаудинов могут подвергаться положительной регуляции при определенных типах рака, но отрицательной регуляции при других типах рака.
Клаудин 18 (CLDN18) является интегральным мембранным белком, расположенным в плотных контактах эпителия и эндотелия, с молекулярной массой, составляющей приблизительно 27,9 кДа. CLDN18 образует межклеточные плотные контакты с другими белками плотных контактов, регулируя способность к проникновению тканевых молекул и ионов в межклеточное пространство и поддерживая стабильность тканевой среды. Известно, что существует 2 подтипа клаудина 18: сплайс-вариант 1 (CLDN18A1, CLDN18.1): №№ доступа в GenBank NP_057453 и NM016369, и сплайс-вариант 2 (CLDN18A2, CLDN18.2): №№ доступа в GenBank NM_001002026 и NP_001002026. В нормальных клетках CLDN18A1 селективно экспрессируется в эпителиальных клетках легких, тогда как CLDN18A2 специфически экспрессируется в нормальных эпителиальных дифференцированных клетках желудка и не экспрессируется в активно делящихся эпителиальных стволовых клетках желудка. Тем не менее, CLDN18A2 сверхэкспрессируется в опухолевых клетках при многих типах рака, например, высокая экспрессия CLDN18A2 обнаружена у 75% пациентов с раком желудка, 50% пациентов с раком поджелудочной железы и 30% пациентов с раком пищевода, а также при раке легкого и других типах рака. Поэтому для лечения и выявления рака большое значение имеет обнаружение антител, которые специфически связываются с CLDN18A2, но не с CLDN18A1.
Существующее антитело IMAB362 к CLDN18A2 вошло в стадию клинических исследований, клинические результаты продемонстрировали, что у пациентов с раком желудка с высокой экспрессией CLDN18.2 (70% или больше опухолевых клеток с экспрессией CLDN18.2, составляющей 2+ или больше) по сравнению с химиотерапией отдельно выживаемость без прогрессирования в случае химиотерапии + IMAB362 повышалась с 6,1 до 9,1 месяцев, HR = 0,46; общее время выживания повышалось с 9,3 до 16,6 месяцев, HR = 0,44. Помимо антитела IMAB362, в клинические исследования вошли также CAR-T, полученные против мишеней CLDN18.2. Тем не менее, данные антитела (или антигенсвязывающие фрагменты в CAR-T), которые вошли в стадию клинических исследований, обладают меньшей аффинностью к клаудину 18.2. Следовательно, остается потребность в продолжении скрининга и получении антител к CLDN18.2 с более высокой аффинностью для достижения большей эффективности при той же дозе.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение предусматривает антитело к CLDN18.2 или его антигенсвязывающий фрагмент, которые специфически связываются с CLDN18.2 и в значительной степени не связываются с CLDN18.1.
В некоторых вариантах осуществления CLDN18.2 представляет собой пептид, имеющий № доступа в GenBank NP_001002026 (мРНК: NM_001002026). CLDN18.1 представляет собой пептид, имеющий № доступа в GenBank NP_057453 (мРНК: NM_016369).
В некоторых вариантах осуществления между антителом или его антигенсвязывающим фрагментом по настоящему изобретению и CLDN18.1 отсутствует значительное связывание. В некоторых примерах антитело или его антигенсвязывающий фрагмент связываются с CLDN18.1 при уровне, составляющем не более 20% от уровня связывания с CLDN18.2. Например, уровень связывания может составлять 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или менее 1% от уровня связывания антитела или его антигенсвязывающего фрагмента с CLDN18.2. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент по настоящему изобретению связываются с CLDN18.2 при уровне, который в 1 раз, 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз или более чем в 10 раз превышает уровень связывания с CLDN18.1.
Настоящее изобретение предусматривает антитело к CLDN18.2 или его антигенсвязывающий фрагмент, при этом антитело или его антигенсвязывающий фрагмент способны специфически связываться с CLDN18.2 и содержат вариабельную область тяжелой цепи, при этом вариабельная область тяжелой цепи содержит три HCDR, выбранные из группы, состоящей из SEQ ID NO: 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, и/или вариабельную область легкой цепи, при этом вариабельная область легкой цепи содержит три LCDR, выбранные из группы, состоящей из SEQ ID NO: 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113.
В некоторых вариантах осуществления настоящее изобретение предусматривает антитело к CLDN18.2 или его антигенсвязывающий фрагмент, содержащие вариабельную область тяжелой цепи и/или вариабельную область легкой цепи, при этом вариабельная область тяжелой цепи содержит HCDR1, выбранную из группы, состоящей из SEQ ID NO: 37, 40, 43, 45, 49, 53, 56, 59, 62, 65, 68, 71, 74, 77, 80, 83, и HCDR2, выбранную из группы, состоящей из SEQ ID NO: 38, 41, 46, 48, 50, 52, 54, 57, 60, 63, 66, 69, 72, 75, 78, 81, 84, и HCDR3, выбранную из группы, состоящей из SEQ ID NO: 39, 42, 44, 47, 51, 55, 58, 61, 64, 67, 70, 73, 76, 79, 82, 85, и/или вариабельная область легкой цепи содержит LCDR1, выбранную из группы, состоящей из SEQ ID NO: 86, 87, 88, 89, 90, 91, 92, 111, 112, 113, и LCDR2, выбранную из группы, состоящей из SEQ ID NO: 93, 94, 95, 96, и LCDR3, выбранную из группы, состоящей из SEQ ID NO: 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110.
В предпочтительном варианте осуществления настоящее изобретение предусматривает антитело к CLDN18.2 или его антигенсвязывающий фрагмент, содержащие вариабельную область тяжелой цепи и/или вариабельную область легкой цепи, при этом вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, выбранные из группы, состоящей из:
SEQ ID NO: 37, SEQ ID NO: 38 и SEQ ID NO: 39, или
SEQ ID NO: 40, SEQ ID NO: 41 и SEQ ID NO: 42, или
SEQ ID NO: 43, SEQ ID NO: 41 и SEQ ID NO: 44, или
SEQ ID NO: 45, SEQ ID NO: 46 и SEQ ID NO: 47, или
SEQ ID NO: 37, SEQ ID NO: 48 и SEQ ID NO: 39, или
SEQ ID NO: 49, SEQ ID NO: 50 и SEQ ID NO: 51, или
SEQ ID NO: 49, SEQ ID NO: 52 и SEQ ID NO: 51, или
SEQ ID NO: 53, SEQ ID NO: 54 и SEQ ID NO: 55, или
SEQ ID NO: 56, SEQ ID NO: 57 и SEQ ID NO: 58, или
SEQ ID NO: 59, SEQ ID NO: 60 и SEQ ID NO: 61, или
SEQ ID NO: 62, SEQ ID NO: 63 и SEQ ID NO: 64, или
SEQ ID NO: 65, SEQ ID NO: 66 и SEQ ID NO: 67, или
SEQ ID NO: 68, SEQ ID NO: 69 и SEQ ID NO: 70, или
SEQ ID NO: 71, SEQ ID NO: 72 и SEQ ID NO: 73, или
SEQ ID NO: 74, SEQ ID NO: 75 и SEQ ID NO: 76, или
SEQ ID NO: 77, SEQ ID NO: 78 и SEQ ID NO: 79, или
SEQ ID NO: 80, SEQ ID NO: 81 и SEQ ID NO: 82, или
SEQ ID NO: 83, SEQ ID NO: 84 и SEQ ID NO: 85,
и/или вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, выбранные из группы, состоящей из:
SEQ ID NO: 86, SEQ ID NO: 93 и SEQ ID NO: 97, или
SEQ ID NO: 87, SEQ ID NO: 94 и SEQ ID NO: 98, или
SEQ ID NO: 88, SEQ ID NO: 93 и SEQ ID NO: 99, или
SEQ ID NO: 87, SEQ ID NO: 95 и SEQ ID NO: 100, или
SEQ ID NO: 88, SEQ ID NO: 93 и SEQ ID NO: 97, или
SEQ ID NO: 88, SEQ ID NO: 93 и SEQ ID NO: 101, или
SEQ ID NO: 89, SEQ ID NO: 93 и SEQ ID NO: 102, или
SEQ ID NO: 88, SEQ ID NO: 93 и SEQ ID NO: 100, или
SEQ ID NO: 90, SEQ ID NO: 93 и SEQ ID NO: 103, или
SEQ ID NO: 91, SEQ ID NO: 96 и SEQ ID NO: 104, или
SEQ ID NO: 88, SEQ ID NO: 93 и SEQ ID NO: 98, или
SEQ ID NO: 92, SEQ ID NO: 93 и SEQ ID NO: 105, или
SEQ ID NO: 88, SEQ ID NO: 93 и SEQ ID NO: 106, или
SEQ ID NO: 88, SEQ ID NO: 93 и SEQ ID NO: 107, или
SEQ ID NO: 87, SEQ ID NO: 93 и SEQ ID NO: 108, или
SEQ ID NO: 88, SEQ ID NO: 93 и SEQ ID NO: 109, или
SEQ ID NO: 88, SEQ ID NO: 93 и SEQ ID NO: 110, или
SEQ ID NO: 111, SEQ ID NO: 93 и SEQ ID NO: 107, или
SEQ ID NO: 112, SEQ ID NO: 93 и SEQ ID NO: 107, или
SEQ ID NO: 113, SEQ ID NO: 93 и SEQ ID NO: 107, или
SEQ ID NO: 111, SEQ ID NO: 93 и SEQ ID NO: 110, или
SEQ ID NO: 112, SEQ ID NO: 93 и SEQ ID NO: 110, или
SEQ ID NO: 113, SEQ ID NO: 93 и SEQ ID NO: 110.
Согласно одному аспекту настоящего изобретения антитело к CLDN18.2 или его антигенсвязывающий фрагмент содержат вариабельную область тяжелой цепи и вариабельную область легкой цепи, при этом вариабельная область содержит 6 CDR из любой из следующих групп, при этом 6 CDR из каждой группы расположены в следующем порядке: HCDR1, HCDR2, HCDR3, LCDR1, LCDR2, LCDR3:
(1) SEQ ID NO: 37, 38, 39, 86, 93, 97;
(2) SEQ ID NO: 40, 41, 42, 87, 94, 98;
(3) SEQ ID NO: 43, 41, 44, 88, 93, 99;
(4) SEQ ID NO: 45, 46, 47, 87, 95, 100;
(5) SEQ ID NO: 37, 48, 39, 88, 93, 97;
(6) SEQ ID NO: 49, 50, 51, 88, 93, 101;
(7) SEQ ID NO: 49, 52, 51, 89, 93, 102;
(8) SEQ ID NO: 53, 54, 55, 88, 93, 100;
(9) SEQ ID NO: 56, 57, 58, 90, 93, 103;
(10) SEQ ID NO: 59, 60, 61, 91, 96, 104;
(11) SEQ ID NO: 62, 63, 64, 88, 93, 98;
(12) SEQ ID NO: 65, 66, 67, 92, 93, 105;
(13) SEQ ID NO: 68, 69, 70, 88, 93, 106;
(14) SEQ ID NO: 71, 72, 73, 88, 93, 107;
(15) SEQ ID NO: 74, 75, 76, 88, 93, 106;
(16) SEQ ID NO: 77, 78, 79, 87, 93, 108;
(17) SEQ ID NO: 80, 81, 82, 88, 93, 109;
(18) SEQ ID NO: 83, 84, 85, 88, 93, 110;
(19) SEQ ID NO: 71, 72, 73, 111, 93, 107;
(20) SEQ ID NO: 71, 72, 73, 112, 93, 107;
(21) SEQ ID NO: 71, 72, 73, 113, 93, 107;
(22) SEQ ID NO: 83, 84, 85, 111, 93, 110;
(23) SEQ ID NO: 83, 84, 85, 112, 93, 110;
(24) SEQ ID NO: 83, 84, 85, 113, 93, 110.
В некоторых вариантах осуществления настоящее изобретение предусматривает антитело к CLDN18.2 или его антигенсвязывающий фрагмент, содержащие вариабельную область тяжелой цепи и/или вариабельную область легкой цепи, при этом вариабельная область тяжелой цепи характеризуется по меньшей мере 80%, 85%, 90%, 95% или 100% идентичностью последовательности с SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, и/или вариабельная область легкой цепи характеризуется по меньшей мере 80%, 85%, 90%, 95% или 100% идентичностью последовательности с SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 114, 115, 116, 117, 118, 119.
Согласно одному аспекту настоящего изобретения антитело к CLDN18.2 или его антигенсвязывающий фрагмент характеризуются от по меньшей мере 80% до 100% идентичности последовательности с вариабельной областью тяжелой цепи и вариабельной областью легкой цепи из любой из групп, состоящих из:
(1) SEQ ID NO: 1 и 2;
(2) SEQ ID NO: 3 и 4;
(3) SEQ ID NO: 5 и 6;
(4) SEQ ID NO: 7 и 8;
(5) SEQ ID NO: 9 и 10;
(6) SEQ ID NO: 11 и 12;
(7) SEQ ID NO: 13 и 14;
(8) SEQ ID NO: 15 и 16;
(9) SEQ ID NO: 17 и 18;
(10) SEQ ID NO: 19 и 20;
(11) SEQ ID NO: 21 и 22;
(12) SEQ ID NO: 23 и 24;
(13) SEQ ID NO: 25 и 26;
(14) SEQ ID NO: 27 и 28;
(15) SEQ ID NO: 29 и 30;
(16) SEQ ID NO: 31 и 32;
(17) SEQ ID NO: 33 и 34;
(18) SEQ ID NO: 35 и 36;
(19) SEQ ID NO: 27 и 114;
(20) SEQ ID NO: 27 и 115;
(21) SEQ ID NO: 27 и 116;
(22) SEQ ID NO: 35 и 117;
(23) SEQ ID NO: 35 и 118;
(24) SEQ ID NO: 35 и 119.
В некоторых предпочтительных вариантах осуществления антитело к CLDN18.2 или его антигенсвязывающий фрагмент, описанные в данном документе, представляют собой мышиное антитело, химерное антитело или гуманизированное антитело.
В некоторых вариантах осуществления настоящее изобретение предусматривает антитело к CLDN18.2 или его антигенсвязывающий фрагмент, содержащие вариабельную область тяжелой цепи и вариабельную область легкой цепи, при этом вариабельная область тяжелой цепи характеризуется по меньшей мере 80%, 85%, 90%, 95% или 100% идентичностью последовательности с SEQ ID NO: 120, 122, 125, 128, и/или вариабельная область легкой цепи характеризуется по меньшей мере 80%, 85%, 90%, 95% или 100% идентичностью последовательности с SEQ ID NO: 121, 123, 124, 126, 127.
Согласно одному аспекту настоящего изобретения антитело к CLDN18.2 или его антигенсвязывающий фрагмент характеризуются по меньшей мере 80%, 85%, 90%, 95% или 100% идентичностью последовательности с вариабельной областью тяжелой цепи и вариабельной областью легкой цепи из любой из групп, состоящих из:
(1) SEQ ID NO: 120 и 121;
(2) SEQ ID NO: 120 и 123;
(3) SEQ ID NO: 120 и 124;
(4) SEQ ID NO: 122 и 121;
(5) SEQ ID NO: 125 и 126;
(6) SEQ ID NO: 125 и 127;
(7) SEQ ID NO: 128 и 126.
В некоторых предпочтительных вариантах осуществления антитело к CLDN18.2 представляет собой моноклональное антитело.
В некоторых предпочтительных вариантах осуществления антитело к CLDN18.2 или его антигенсвязывающий фрагмент дополнительно содержат константную область тяжелой цепи и/или константную область легкой цепи, предпочтительно константная область тяжелой цепи содержит Fc или вариант Fc, и Fc происходит от мыши или человека.
В некоторых предпочтительных вариантах осуществления антитело к CLDN18.2 представляет собой полноразмерное антитело.
В некоторых предпочтительных вариантах осуществления антитело к CLDN18.2 или его антигенсвязывающий фрагмент по настоящему изобретению имеет форму IgG1, IgG2, IgG3 или IgG4.
В некоторых предпочтительных вариантах осуществления к антигенсвязывающим фрагментам по настоящему изобретению относятся Fab, Fv, scFv, F(ab')2, линейные антитела и однодоменные антитела.
В некоторых вариантах осуществления настоящее изобретение предусматривает конъюгат, образованный посредством связывания вышеупомянутого антитела или его антигенсвязывающего фрагмента с меткой для захвата или меткой для выявления. К таким меткам для выявления относятся без ограничения радионуклиды, люминесцентные вещества (например флуоресцеин), окрашенные вещества или ферменты.
В некоторых вариантах осуществления настоящее изобретение предусматривает биспецифическое или полиспецифическое антитело, при этом один антигенсвязывающий домен биспецифического или полиспецифического антитела предусматривает антитело к CLDN18.2 или его антигенсвязывающий фрагмент по настоящему изобретению.
В некоторых вариантах осуществления настоящее изобретение предусматривает конъюгат антитело-лекарственное средство, содержащий описанные ранее антитело или его антигенсвязывающий фрагмент. Структура таких конъюгатов антитело-лекарственное средство хорошо известна из уровня техники и образована посредством взаимодействия антитело-линкер-лекарственное средство (токсин).
В некоторых вариантах осуществления настоящее изобретение предусматривает химерный антигенный рецептор, в котором внеклеточная распознающая структурная единица предусматривает описанные ранее антитело или его антигенсвязывающий фрагмент.
В некоторых вариантах осуществления настоящее изобретение предусматривает нуклеиновую кислоту, кодирующую любые из вышеупомянутых антител или их антигенсвязывающих фрагментов. Согласно другому аспекту настоящего изобретения предусмотрен рекомбинантный вектор, содержащий нуклеиновую кислоту.
В некоторых вариантах осуществления настоящее изобретение предусматривает клетку-хозяина, содержащую вектор экспрессии по настоящему изобретению, или клетку-хозяина, в геном которой встроена нуклеиновая кислота, кодирующая антитело или его антигенсвязывающий фрагмент. В некоторых предпочтительных вариантах осуществления клетка-хозяин может представлять собой прокариотическую клетку, такую как E. coli; также может представлять собой эукариотические клетки, такие как клетки дрожжей или млекопитающих, например клетки CHO или клетки HEK293.
В некоторых вариантах осуществления настоящее изобретение предусматривает способ получения антитела или его антигенсвязывающего фрагмента, включающий культивирование клеток-хозяев по настоящему изобретению в подходящих условиях и очистку продуктов экспрессии из клеток.
В некоторых вариантах осуществления настоящее изобретение предусматривает применение антитела или его антигенсвязывающего фрагмента для получения лекарственного средства, специфически нацеливающегося на опухолевые клетки, экспрессирующие CLDN18.2, такого как лекарственное средство на основе моноклонального антитела, конъюгат антитело-лекарственное средство, биспецифическое антитело или полиспецифическое антитело, или для получения иммунной клетки, модифицированной химерным антигенным рецептором, или для получения реагента для диагностики опухоли, экспрессирующей CLDN18.2; в некоторых вариантах осуществления к опухоли, экспрессирующей CLDN18.2, относятся рак желудка, рак поджелудочной железы, рак пищевода, рак легкого, рак яичника, рак толстой кишки, рак печени, рак головы и шеи, рак желчного пузыря и их метастазы, метастазы рака желудка, такие как опухоль Крукенберга.
В некоторых вариантах осуществления настоящее изобретение предусматривает способ выявления экспрессии CLDN18.2 в образце, включающий приведение образца в контакт с вышеупомянутыми антителом к CLDN18.2 или его антигенсвязывающим фрагментом; выявление образования комплекса антитела к CLDN18.2 или его антигенсвязывающего фрагмента с CLDN18.2; необязательно антитело к CLDN18.2 или его антигенсвязывающий фрагмент являются меченными для выявления.
В некоторых вариантах осуществления настоящее изобретение предусматривает фармацевтическую композицию, содержащую эффективное количество антитела или его антигенсвязывающего фрагмента по настоящему изобретению, или содержащую эффективное количество нуклеиновой кислоты, кодирующей антитело или его антигенсвязывающий фрагмент, или содержащую эффективное количество рекомбинантного вектора, содержащего кодирующую нуклеиновую кислоту, или содержащую эффективное количество клетки-хозяина, содержащей кодирующую нуклеиновую кислоту, или содержащую эффективное количество конъюгата антитело-лекарственное средство по настоящему изобретению, или содержащую эффективное количество химерного антигенного рецептора по настоящему изобретению, или содержащую эффективное количество биспецифического или полиспецифического антитела по настоящему изобретению. В некоторых вариантах осуществления фармацевтическая композиция дополнительно содержит фармацевтически приемлемый носитель.
В некоторых предпочтительных вариантах осуществления фармацевтическая композиция дополнительно содержит одно или более дополнительных терапевтических средств. К таким дополнительным терапевтическим средствам относятся цитотоксические средства, цитостатические средства, антиангиогенные средства, антинеопластические средства, химиотерапевтические средства, радиотерапевтические средства, противораковые средства таргетной терапии, модификаторы биологического ответа, противораковые вакцины, цитокины, гормоны, антиметастатические средства и иммунотерапевтические средства.
В некоторых вариантах осуществления настоящее изобретение предусматривает упаковку для лекарственного средства или набор, содержащие контейнер и фармацевтическую композицию по настоящему изобретению в контейнере.
В некоторых вариантах осуществления настоящее изобретение предусматривает способ индуцирования гибели клеток, экспрессирующих CLDN18.2, включающий приведение клеток в контакт с фармацевтической композицией по настоящему изобретению. В некоторых вариантах осуществления клетки приводятся в контакт с фармацевтической композицией in vitro. В некоторых вариантах осуществления клетки приводятся в контакт с фармацевтической композицией in vivo. В некоторых вариантах осуществления клетка представляет собой опухолевую клетку. В некоторых вариантах осуществления клетка представляет собой клетку солидной опухоли. В некоторых вариантах осуществления клетка выбрана из группы, состоящей из клеток рака желудка, клеток рака пищевода, клеток рака кишечника, клеток рака поджелудочной железы, клеток нефробластомы, клеток рака легкого, клеток рака яичника, клеток рака толстой кишки, клеток рака прямой кишки, клеток рака печени, клеток рака головы и шеи, клеток хронического миелогенного лейкоза и клеток рака желчного пузыря.
В некоторых вариантах осуществления настоящее изобретение предусматривает способ лечения заболевания, ассоциированного с экспрессией CLDN18.2, у субъекта, включающий введение нуждающемуся в этом субъекту фармацевтической композиции по настоящему изобретению. В некоторых вариантах осуществления заболевание представляет собой опухоль. В некоторых вариантах осуществления опухоль предпочтительно представляет собой рак желудка, рак пищевода, рак кишечника, рак поджелудочной железы, нефробластому, рак легкого, рак яичника, рак толстой кишки, рак прямой кишки, рак печени, рак головы и шеи, хронический миелогенный лейкоз или рак желчного пузыря. В некоторых вариантах осуществления способ дополнительно включает введение субъекту дополнительного терапевтического средства.
Антитела по настоящему изобретению можно вводить в комбинации с другим дополнительным терапевтическим средством, в том числе без ограничения химиотерапевтическими средствами, цитотоксическими средствами, радиотерапевтическими средствами, противораковыми вакцинами, антинеопластическими средствами, противораковыми средствами таргетной терапии, антиангиогенными средствами, модификаторами биологического ответа, цитокинами, гормонами, антиметастатическими средствами и иммунотерапевтическими средствами.
В некоторых предпочтительных вариантах осуществления к химиотерапевтическим средствам, которые можно использовать в комбинации с антителом или его антигенсвязывающим фрагментом по настоящему изобретению, относятся без ограничения ингибиторы митоза, в том числе винкристин, винбластин, виндезин и навельбин; ингибиторы топоизомеразы I, такие как соединения на основе камптотецина, в том числе иринотекан, топотекан и другие соединения, полученные из камптотецина и его аналогов; производные подофиллотоксина, такие как этопозид, тенипозид и мидоксизоз; алкилирующие средства, такие как цисплатин, карбоплатин, циклофосфамид, азотистый иприт, триметилентиофосфорамид, кармустин, бусульфан, хлорамбуцил, брихинолизин, урациловый иприт, клопрофен и дакарбазин; антиметаболиты, в том числе цитарабин, 5-фторурацил, метотрексат, меркаптопурин, азатиоприн и прокарбазин; антибиотики, в том числе без ограничения доксорубицин, блеомицин, дактиномицин, даунорубицин, митомицин, саркомицин C, актиномицин D, рокситромицин, адриамицин, рапамицин и их производные, а также дауномицин, и другие химиотерапевтические средства, в том числе без ограничения паклитаксел, доцетаксел, дакарбазин, азацитидин, амсакон, мелфалан, ифосфамид и митоксантрон. В некоторых предпочтительных вариантах осуществления дополнительное терапевтическое средство выбрано из одного или более из эпирубицина, оксалиплатина и 5-фторурацила.
В некоторых вариантах осуществления к противораковым средствам таргетной терапии относятся без ограничения макромолекулярные лекарственные средства таргетной терапии, низкомолекулярные лекарственные средства таргетной терапии и т. д.
В некоторых предпочтительных вариантах осуществления к макромолекулярным средствам таргетной терапии относятся без ограничения средства таргетной терапии, нацеливающиеся на эпидермальный фактор роста, в том числе цетуксимаб, панитумумаб, нимотузумаб и т. д.; ингибиторы сигнального пути HER-2 или HER-3, в том числе трастузумаб, пертузумаб, T-DM1 и т. д.; лекарственные средства против фактора роста эндотелия сосудов, в том числе VEGF-TRAP, бевацизумаб, рамуцирумаб и т. д.; также средства, нацеливающиеся на другие мишени, могут нацеливаться без ограничения на такие мишени, как PI3K, PARP, PI3Kα, PKB/AKT и STAT3.
В некоторых вариантах осуществления к низкомолекулярным средствам таргетной терапии относятся без ограничения средства, нацеливающиеся на эпидермальный фактор роста, в том числе эрлотиниб или гефитиниб и т. д.; ингибиторы сигнального пути HER-2 или HER-3, в том числе лапатиниб или афатиниб и т. д.; ингибиторы тирозинкиназ, в том числе иматиниб или сунитиниб и т. д.; лекарственные средства против фактора роста эндотелия сосудов, в том числе сорафениб, регорафениб, пазопаниб, рекомбинантный человеческий эндостатин, апатиниб и т. д.; лекарственные средства, нацеливающиеся на c-Met/ROS1, в том числе кризотиниб и т. д., и другие нацеливающиеся средства, в том числе без ограничения вориностат и маримастат и т. д.; лекарственные средства, нацеливающиеся на mTOR, в том числе эверолимус и т. д., и средства, нацеливающиеся на другие мишени, в том числе без ограничения PI3Kα, PKB/AKT и STAT3.
В некоторых вариантах осуществления к иммунотерапевтическим средствам относятся без ограничения иммуносупрессивные средства и агонисты, где к мишеням относятся PD-1/PD-L1, PD-L2, CTLA-4, LAG-3, IDO, TIM3, TIGIT, CD47, SIRPα, 4-1BB, CSF-1/CSF1R, GITR, OX40, CD40, CD27, CD28, B7H4, B7H3, TGFβ, BTLA, VISTA, ICOS, CD39, CD73, A2AR, KIR и NKG2A и т. д.; а также средство клеточной терапии, ассоциированной с иммунотерапией.
В некоторых вариантах осуществления к ингибиторам контрольных точек иммунного ответа, которые нацеливаются на PD-1/PD-L1, относятся без ограничения макромолекулярные лекарственные средства, такие как пембролизумаб, ниволумаб, атезолизумаб, авелумаб, синтилимаб, цемиплимаб и дурвалумаб и т. д., а также низкомолекулярные лекарственные средства.
В некоторых вариантах осуществления к ингибиторам контрольных точек иммунного ответа, которые нацеливаются на CTLA-4, относятся без ограничения ипилимумаб и т. д.; к цитокинам относятся без ограничения IL-10, IL-15, IL4 и IL13 и т. д.; к ингибиторам, которые нацеливаются на BRAF, относятся без ограничения биниметиниб и т. д.
В некоторых вариантах осуществления другое терапевтическое средство выбрано из онколитических вирусов, таких как парвовирус, аденовирус, вирус герпеса, поксвирус, полиовирус, реовирус, альфавирус, вирус Мараба, ретровирус и вирус Коксаки и т. д.; в качестве альтернативы, другое терапевтическое средство выбрано из противораковых вакцин или ингибиторов протеаз, таких как бортезомиб и т. д.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Графические материалы дополнительно иллюстрируют новые признаки, раскрытые в данном описании. Раскрытые в данном описании признаки и преимущества станут более понятны при обращении к графическим материалам, но следует понимать, что данные графические материалы являются лишь иллюстрацией конкретных вариантов осуществления идей, раскрытых в данном документе, и не подразумеваются как ограничивающие объем прилагаемой формулы изобретения.
На фиг. 1-5 показано связывание образцов надосадочной жидкости от 18 линий клеток гибридом по настоящему изобретению с клетками HEK293, стабильно трансформированными с помощью hCLDN18.2, согласно результатам измерения посредством проточной цитометрии.
На фиг. 6-11 показано связывание 18 химерных антител по настоящему изобретению со стабильно трансфицированными клетками HEK293, экспрессирующими hCLDN18.2.
На фиг. 12-17 показано связывание 18 химерных антител по настоящему изобретению с клетками, полученными из опухолевой ткани рака желудка, которые в естественных условиях экспрессируют hCLDN18.2.
На фиг. 18-23 показаны результаты оценки ADCC 18 химерных антител по настоящему изобретению в отношении стабильно трансфицированных клеток CHO-K1, экспрессирующих hCLDN18.2.
На фиг. 24-29 показаны результаты оценки CDC 18 химерных антител по настоящему изобретению в отношении стабильно трансфицированных клеток CHO-K1, экспрессирующих hCLDN18.2.
На фиг. 30 показано связывание гуманизированного антитела hu299B2-S32A по настоящему изобретению со стабильно трансфицированными клетками HEK293, экспрессирующими hCLDN18.2.
На фиг. 31 показано связывание гуманизированного антитела hu253C4-N31Q по настоящему изобретению со стабильно трансфицированными клетками HEK293, экспрессирующими hCLDN18.2.
На фиг. 32 показано связывание гуманизированного антитела hu299B2-S32A по настоящему изобретению с клетками, полученными из опухолевой ткани рака желудка, которые в естественных условиях экспрессируют hCLDN18.2.
На фиг. 33 показано связывание гуманизированного антитела hu253C4-N31Q по настоящему изобретению с клетками, полученными из опухолевой ткани рака желудка, которые в естественных условиях экспрессируют hCLDN18.2.
На фиг. 34 показаны результаты оценки ADCC гуманизированного антитела hu299B2-S32A по настоящему изобретению в отношении стабильно трансфицированных клеток CHO-K1, экспрессирующих hCLDN18.2.
На фиг. 35 показаны результаты оценки ADCC гуманизированного антитела hu253C4-N31Q по настоящему изобретению в отношении стабильно трансфицированных клеток CHO-K1, экспрессирующих hCLDN18.2.
На фиг. 36 показаны результаты оценки CDC гуманизированного антитела hu299B2-S32A по настоящему изобретению в отношении стабильно трансфицированных клеток CHO-K1, экспрессирующих hCLDN18.2.
На фиг. 37 показаны результаты оценки CDC гуманизированного антитела hu253C4-N31Q по настоящему изобретению в отношении стабильно трансфицированных клеток CHO-K1, экспрессирующих hCLDN18.2.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Термины
Все публикации, патенты и патентные заявки, упомянутые в данном описании, включены в данный документ посредством ссылки в той же степени, как если бы каждая публикация, патент или патентная заявка были специально и отдельно указаны как включенные посредством ссылки.
Прежде чем настоящее изобретение будет подробно описано ниже, следует понимать, что настоящее изобретение не ограничено конкретной методологией, протоколами и реагентами, описанными в данном документе, поскольку они могут варьироваться. Также следует понимать, что используемые в данном документе термины предназначены только для описания конкретных вариантов осуществления и не подразумеваются как ограничивающие объем настоящего изобретения. Если не указано иное, все используемые в данном документе технические и научные термины имеют те же значения, что и термины, которые обычно понимаются специалистом в области техники, к которой принадлежит настоящее изобретение.
Определенные варианты осуществления, раскрытые в данном документе, охватывают числовые диапазоны, и определенные аспекты настоящего изобретения могут быть описаны в терминах диапазонов. Если не указано иное, следует понимать, что числовые диапазоны или описания диапазонов приведены лишь для краткости и удобства и не должны истолковываться как строго ограничивающие объем настоящего изобретения. Соответственно, описание в формате диапазонов следует понимать как конкретно раскрывающее все возможные поддиапазоны и все возможные конкретные числовые точки в пределах данного диапазона, в связи с этим в данном документе явным образом описаны поддиапазоны и числовые точки. Например, описание диапазона от 1 до 6 следует рассматривать как конкретно раскрывающее поддиапазоны от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и т. д., а также конкретные числовые точки в пределах данных диапазонов, например, 1, 2, 3, 4, 5, 6. Вышеупомянутые идеи в равной степени применимы независимо от широты числовых значений. При применении описания в форме диапазона диапазон включает конечные точки диапазона.
Термин «приблизительно» применительно к измеряемой величине, такой как количество и временная продолжительность, относится к изменению, которое включает ± 20%, или в некоторых случаях ± 10%, или в некоторых случаях ± 5%, или в некоторых случаях ± 1%, или в некоторых случаях ± 0,1% от указанного значения.
Используемые в данном документе трехбуквенные коды и однобуквенные коды аминокислот являются такими, как описано в J. Biol. Chem, 243, p3558(1968).
Используемые в данном документе термины «антитело к клаудину 18.2», «антитело к CLDN18.2» или «антитело против CLDN18.2» относятся к такому антителу, которое способно связываться с белком CLDN18.2 или его фрагментом с достаточной аффинностью, таким образом, что антитело можно использовать в качестве диагностического и/или терапевтического средства, которое нацеливается на CLDN18.2. Полученный от человека белок CLDN18.2 обозначен как hCLDN18.2, таким образом, «антитело к человеческому клаудину 18.2», «антитело к клаудину 18.2 человека», «антитело к hCLDN18.2», «антитело против hCLDN18.2»,«антитело, направленное против hCLDN18.2», в частности, относится к такому антителу, которое способно связываться с человеческим белком CLDN18.2 или его фрагментом с достаточной аффинностью, таким образом, что антитело можно использовать в качестве диагностического и/или терапевтического средства, которое нацеливается на человеческий CLDN18.2.
Используемый в данном документе термин «антитело», как правило, относится к тетрамерному белку Y-типа, содержащему две тяжелые (H) полипептидные цепи и две легкие (L) полипептидные цепи, удерживаемые вместе ковалентными дисульфидными связями и нековалентными взаимодействиями. Данную структуру имеют нативные антитела IgG. Каждая легкая цепь состоит из одного вариабельного домена (VL) и одного константного домена (CL). Каждая тяжелая цепь содержит один вариабельный домен (VH) и константную область.
Как известно из уровня техники, константные домены тяжелой цепи можно классифицировать на α, δ, ε, γ и μ, которые определяют такие изотипы антитела, как IgA, IgD, IgE, IgG и IgM соответственно, и IgG и IgA можно дополнительно классифицировать на разные подклассы, где IgG можно подразделить, например, на IgG1, IgG2, IgG3 и IgG4, и IgA можно подразделить на IgA1 и IgA2. Легкие цепи антител любого вида позвоночных можно отнести к одному из двух различных типов, называемых κ и λ, на основании аминокислотных последовательностей их константного домена.
У IgG, IgA и IgD константная область содержит три домена, называемых CH1, CH2, CH3 (IgM и IgE содержат четвертый домен, называемый CH4). У IgG, IgA и IgD домены CH1 и CH2 разделены гибкой шарнирной областью, которая представляет собой богатый пролином и богатый цистеином сегмент с переменной длиной. Каждый тип антитела дополнительно содержит межцепочечные и внутрицепочечные дисульфидные связи, образованные парными остатками цистеина.
Термин «вариабельная область» или «вариабельный домен» демонстрирует значительное изменение аминокислотного состава среди антител, и данная структура преимущественно отвечает за распознавание и связывание антигена. Вариабельная область каждой пары легкой/тяжелой цепей образует связывающий сайт антитела, таким образом, что интактное антитело IgG содержит два связывающих сайта (т. е. оно является бивалентным). Каждая из вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL) содержит три области с чрезвычайной вариабельностью, которые называются гипервариабельными областями (HVR), или, в более общем смысле, определяющими комплементарность областями (CDR), каждая VH и VL содержит четыре каркасные области (FR), которые представлены как FR1, FR2, FR3 и FR4 соответственно. Так, последовательности CDR и FR, как правило, встречаются в следующих последовательностях вариабельной области тяжелой цепи (VH) (или вариабельной области легкой цепи (VL)): FR1-HCDR1(LCDR1)-FR2-HCDR2(LCDR2)-FR3-HCDR3 (LCDR3)-FR4.
Термин «Fc» используется в данном документе для определения С-концевой области тяжелой цепи иммуноглобулина, содержащей по меньшей мере часть константной области. Данный термин включает Fc-области с нативной последовательностью и варианты Fc-областей. Если не указано иное, нумерация аминокислотных остатков в Fc-области или константной области соответствует системе нумерации EU, которая также называется EU-индексом, как описано в Kabat et al., Sequences of Proteins of Immunological Interest, 5thEd.Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
Как используется в данном документе, типы «антител» в широком смысле могут включать, например, поликлональные антитела, моноклональные антитела, химерные антитела, гуманизированные и приматизированные антитела, антитела с привитыми CDR, человеческие антитела (в том числе человеческие антитела, полученные рекомбинантным путем), антитела, полученные рекомбинантным путем, внутриклеточные антитела, полиспецифические антитела, биспецифические антитела, моновалентные антитела, поливалентные антитела, антиидиотипические антитела, синтетические антитела (в том числе мутеины и их варианты) и т. д.
Термины «полноразмерное антитело» и «интактное антитело» используются в данном документе взаимозаменяемо для обозначения антитела, характеризующегося структурой, в значительной степени сходной со структурой нативного антитела, или содержащего Fc-область.
Термин «моноклональное антитело» (или «mAb») относится к практически гомогенному антителу, продуцируемому клоном одной клетки, которое направлено против только определенного антигенного эпитопа. Моноклональные антитела можно получить с применением ряда методик, известных из уровня техники, в том числе методик получения гибридом, рекомбинантных методик, методик с применением фагового дисплея, трансгенных животных, синтетических методик или их комбинаций.
Термин «химерное антитело» обозначает конструкцию, в которой часть тяжелой и/или легкой цепи идентична или гомологична соответствующей последовательности в антителе, которое получено от конкретного вида или принадлежит к конкретному классу или подклассу антител, а остальная часть цепи(цепей) идентична или гомологична соответствующей последовательности в антителе, которое получено от другого вида или принадлежит к другому классу или подклассу антител, и соответствующие последовательности во фрагментах таких антител. В узком смысле химерное антитело содержит все или большую часть выбранных вариабельных областей мышиных тяжелой и легкой цепей, функционально связанных с константными областями человеческих легкой и тяжелой цепей. Последовательности константной области или их варианты или производные могут быть функционально связаны с раскрытыми вариабельными областями тяжелой и легкой цепей с применением стандартных методик молекулярной биологии с получением полноразмерных антител к CLDN18.2, которые можно использовать сами по себе или можно включить в настоящее изобретение.
Термин «гуманизированное антитело» означает гибридный иммуноглобулин, цепь иммуноглобулина или ее фрагмент, которые содержат наименьшую последовательность, полученную из иммуноглобулина, отличного от человеческого. В большинстве случаев гуманизированное антитело представляет собой человеческий иммуноглобулин (реципиентное антитело), в котором остатки из CDR реципиента заменены остатками из CDR от вида, отличного от человека (донорное антитело), характеризующегося требуемой специфичностью, аффинностью и свойствами, такого как мыши, крысы, кролики или приматы. В некоторых случаях каркасные остатки человеческого иммуноглобулина заменены на соответствующие остатки, отличные от человеческих. В некоторых случаях в гуманизированные антитела, в которых остатки в одной или нескольких FR из вариабельной области реципиентного человеческого антитела заменены на соответствующие остатки из донорного антитела от вида, отличного от человека, можно ввести «обратные мутации». Такие обратные мутации могут помочь поддерживать надлежащую трехмерную конфигурацию одной или нескольких привитых CDR с улучшением таким образом аффинности и стабильности антител. Можно использовать антитела от ряда донорных видов, в том числе без ограничения мышей, крыс, кроликов или приматов, отличных от человека. Кроме того, гуманизированные антитела могут содержать новые остатки, не встречающиеся в реципиентном антителе или донорном антителе, для дополнительного улучшения характеристик антитела.
Следует отметить, что разделение CDR и FR в вариабельных областях моноклональных антител по настоящему изобретению определяется согласно определению Kabat. Тем не менее, специалистам в данной области техники также известны и другие системы наименований и нумерации, такие как согласно Chothia, IMGT или AHo. Таким образом, в объеме настоящего изобретения явно содержатся гуманизированные антитела, содержащие одну или несколько CDR, полученных согласно любой системе номенклатуры, основанной на последовательностях моноклональных антител по настоящему изобретению.
Термин «идентичность последовательностей», «сходство последовательностей» или «гомология последовательностей» относится к проценту аминокислотных остатков в кандидатной последовательности, которые идентичны тем же аминокислотным остаткам в эталонной полипептидной последовательности после того, как последовательности выровнены (и при необходимости введены гэпы) для достижения максимального процента идентичности последовательностей, а какие-либо консервативные замены не считаются частью идентичности последовательностей. Выравнивание последовательностей можно осуществлять с применением различных подходов в данной области техники для определения процента идентичности аминокислотных последовательностей, например, с применением общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN или MEGALIGN (DNASTAR). Специалисты в данной области техники смогут определить подходящие параметры для аналитического выравнивания, в том числе любой алгоритм, необходимый для достижения максимального выравнивания по всей длине сравниваемой последовательности.
Термин «фрагмент антитела» охватывает по меньшей мере часть интактного антитела. Используемый в данном документе термин «фрагмент» молекулы антитела включает «антигенсвязывающий фрагмент» антитела, а термин «антигенсвязывающий фрагмент» относится к полипептидному фрагменту иммуноглобулина или антитела, который специфически связывается или взаимодействует с выбранным антигеном или его антигенным эпитопом, или к продукту в виде слитого белка, дополнительно полученному из фрагмента, например, одноцепочечному антителу, внеклеточной связывающей области в химерном антигенном рецепторе и т. д. К иллюстративным фрагментам антител или их антигенсвязывающим фрагментам относятся без ограничения вариабельные фрагменты легкой цепи (VL), вариабельные фрагменты тяжелой цепи (VH), Fab-фрагменты, F(ab')2-фрагменты, Fd-фрагменты, Fv-фрагменты, однодоменные антитела, линейные антитела, одноцепочечные антитела (scFv) и биспецифические антитела или полиспецифические антитела, образованные из фрагментов антител, и т. п.
Термин «Fab-фрагмент» включает вариабельную область каждой из тяжелой и легкой цепей, а также включает константную область легкой цепи и первую константную область СН1 тяжелой цепи, которая представляет собой фрагмент моновалентного антитела. Термин «F(ab')2-фрагмент» охватывает два Fab-фрагмента, а также шарнирные области, что в совокупности представляет собой бивалентный фрагмент антитела.
Термин «Fd-фрагмент» обычно охватывает вариабельную область тяжелой цепи и константную область CH1; термин «Fv-фрагмент» относится к наименьшему фрагменту антитела, содержащему вариабельные области тяжелой цепи и легкой цепи, но не содержащему константную область и несущему все антигенсвязывающие сайты.
Термин «scFv» относится к слитому белку, содержащему по меньшей мере один фрагмент антитела, содержащий вариабельную область легкой цепи, и по меньшей мере один фрагмент антитела, содержащий вариабельную область тяжелой цепи, где вариабельные области легкой и тяжелой цепей соединены (например, посредством синтетического линкера, такого как короткий гибкий полипептидный линкер) и способны экспрессироваться в виде одноцепочечного полипептида, и где scFv сохраняет специфичность интактного антитела, из которого он получен. Если не указано иное, scFv может содержать описанные вариабельные области VL и VH в любом порядке (например, относительно N-конца и C-конца полипептида), и scFv может содержать VL-линкер-VH или может содержать VH-линкер-VL.
Термин «полиспецифическое антитело» относится к новой конструкции антитела, связывающейся с более чем двумя разными сайтами и/или мишенями, которая образована посредством функционального связывания (например, химического слияния, слияния генов, нековалентного связывания или других способов) антитела с одной или несколькими другими связывающими молекулами. Более распространенным полиспецифическим антителом является «биспецифическое антитело», которое, в частности, относится к конструкции антитела со специфичностью к двум различным антигенам. Как правило, биспецифическое или полиспецифическое антитело содержит по меньшей мере два антигенсвязывающих домена.
Термин «антиген» относится к веществу, распознаваемому и специфически связываемому антителом или антигенсвязывающим фрагментом, и в широком смысле антиген может включать любой иммуногенный фрагмент или иммуногенную детерминанту выбранной мишени, в том числе одиночный эпитоп, полиэпитоп, одиночный домен, несколько доменов или весь внеклеточный домен (ECD) или белок. Антигены могут составлять пептиды, белки, гликопротеины, полисахариды и липиды, их части и их комбинации. Неограничивающие иллюстративные антигены включают опухолевые антигены или антигены патогенов и т. п. «Антиген» может также относиться к молекуле, которая запускает иммунный ответ. Для получения антител, специфических в отношении антигенной детерминанты, можно использовать любую форму антигенов, или клеток, или препаратов, содержащих антигены. Антиген может представлять собой выделенный полноразмерный белок, белок клеточной поверхности (например, при иммунизации клеткой, экспрессирующей по меньшей мере часть антигена на своей поверхности), или растворимый белок (например, при иммунизации только ECD-частью белка), или белковую конструкцию (например Fc-антиген). Антиген может продуцироваться в генетически модифицированных клетках. Любой из вышеупомянутых антигенов можно использовать отдельно или в комбинации с одним или более усиливающими иммуногенность адъювантами, известными из уровня техники. ДНК, кодирующая антиген, может быть геномной или негеномной (например кДНК) и может кодировать по меньшей мере часть ECD, достаточную для запуска иммуногенного ответа. Для трансформации клеток, в которых экспрессируется антиген, можно использовать любой вектор, в том числе без ограничения аденовирусные векторы, лентивирусные векторы, плазмиды и невирусные векторы, такие как катионные липиды.
Термин «эпитоп» относится к сайту на антигене, который специфически связывается с иммуноглобулином или антителом. Эпитопы могут быть образованы из смежных аминокислот или несмежных аминокислот, сблизившихся при сворачивании третичной структуры белка. Эпитопы, образованные из смежных аминокислот, как правило, сохраняются при воздействии денатурирующих растворителей, тогда как эпитопы, образованные при сворачивании третичной структуры, как правило, утрачиваются при обработке денатурирующими растворителями. Эпитопы, как правило, содержат по меньшей мере 3-15 аминокислот в уникальной пространственной конформации. Способы определения эпитопа, с которым связывается данное антитело, хорошо известны из уровня техники, в том числе иммуноблоттинг и анализы с выявлением иммунопреципитации. Способы определения пространственной конформации эпитопа включают методики, известные из уровня техники и описанные в данном документе, такие как рентгеновская кристаллография, двумерный ядерный магнитный резонанс и т. д.
Термины «полипептид», «пептид» и «белок» в данном документе используются взаимозаменяемо для обозначения полимеров, состоящих из аминокислот и имеющих любую длину. Полимер может быть линейным, циклическим или разветвленным и может содержать модифицированные аминокислоты, в частности консервативно модифицированные аминокислоты, и он может прерываться неаминокислотными фрагментами. Термин также охватывает модифицированные аминокислотные полимеры, такие как аминокислотные полимеры, которые были модифицированы посредством сульфатирования, гликозилирования, липидирования, ацетилирования, фосфорилирования, йодирования, метилирования, окисления, протеолитического процессинга, пренилирования, рацемизации, селеноилирования, добавления аминогруппы, которое опосредовано транспортной РНК (тРНК), такого как аргинилирование, убиквитинирование, или любой другой операции, такой как конъюгация с метящим компонентом. Используемый в данном документе термин «аминокислота» относится к природным и/или неприродным или синтетическим аминокислотам, в том числе глицину и оптическим D- или L-изомерам, а также аналогам аминокислот и пептидомиметикам. Полипептид или аминокислотная последовательность, «полученные из» данного белка, относятся к источнику полипептида. Термин также включает полипептиды, экспрессируемые с указанных последовательностей нуклеиновой кислоты.
Термин «аминокислотная модификация» (или «модифицированная аминокислота») включает аминокислотные замены, вставки и/или делеции в полипептидной последовательности. Используемый в данном документе термин «аминокислотная замена» или «замена» относится к замене аминокислоты в конкретном положении в исходной полипептидной последовательности на другую аминокислоту. Например, замена S32A означает, что серин в положении 32 заменен на аланин.
Идентичность или гомологию последовательности вариабельной области гуманизированного антитела с вариабельной областью человеческого рецептора можно определить так, как рассмотрено в данном документе, и при измерении таким образом эти две последовательности предпочтительно будут характеризоваться по меньшей мере 60% или 65% идентичностью последовательностей, более предпочтительно по меньшей мере 70%. %, 75%, 80%, 85% или 90% идентичностью последовательностей, еще более предпочтительно по меньшей мере 93%, 95%, 98% или 99% идентичностью последовательностей. Предпочтительно, неидентичные положения остатков различаются по консервативным аминокислотным заменам. «Консервативная замена» представляет собой аминокислотную замену, при которой один аминокислотный остаток заменяется на другой аминокислотный остаток, содержащий боковую цепь (R-группу) со схожими химическими свойствами (например зарядом или гидрофобностью). В целом, консервативные аминокислотные замены практически не изменяют функциональные свойства белка. В данной области техники были определены семейства аминокислотных остатков со сходными боковыми цепями. Данные семейства включают аминокислоты, содержащие основные боковые цепи (например, лизин, аргинин, гистидин), кислотные боковые цепи (например, аспарагиновая кислота, глутаминовая кислота), незаряженные полярные боковые цепи (например, глицин, аспарагин, серин, треонин, тирозин, цистеин, триптофан), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), β-разветвленные боковые цепи (например, треонин, валин, изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, один или более аминокислотных остатков в CDR-областях или каркасных областях антител по настоящему изобретению можно заменить аминокислотными остатками с другими сходными боковыми цепями. В случае, если две или более аминокислотных последовательностей отличаются друг от друга консервативными заменами, процент идентичности последовательностей или степень сходства можно увеличить для корректировки консервативной природы замены.
При продуцировании моноклональных антител различные варианты посттрансляционных модификаций (PTM), такие как гликозилирование, окисление, осахаривание, дезамидирование, изомеризация и циклизация концевых групп, легко получить с помощью различных физических и химических факторов. Данные PTM могут вызывать изменения физических и химических свойств антитела, изменить взаимодействие с Fc-рецептором антитела и влиять на активность связывания с антигеном-мишенью; появление некоторых PTM может даже снизить стабильность антител, вызвать иммуногенность и т. д. (JARASCH et al., JOURNAL OF PHARMACEUTICAL SCIENCES, 2015). Посредством таких аминокислотных модификаций в сайте PTM, как консервативные замены, можно устранять отрицательные эффекты. В объеме настоящего изобретения также явно содержатся аминокислотные замены в CDR антитела для модификации посредством PTM.
Термин «антителозависимая клеточноопосредованная цитотоксичность» (ADCC) относится к связыванию антитела с эпитопом инфицированной вирусом клетки или опухолевой клетки, где Fc-фрагмент связывается с Fc-рецепторами (FcR), присутствующими на клетках-киллерах (NK-клетках, макрофагах и т. п.), опосредуя непосредственное уничтожение клеток-мишеней клетками-киллерами.
Термин «комплементзависимая цитотоксичность» (CDC) относится к цитотоксическому эффекту в присутствии комплемента, т. е. к лизису клеток-мишеней атакующим мембрану комплексом, образованным посредством активации комплемента по классическому пути, который инициируется комплексом, образованным посредством связывания специфических антител с соответствующими мембранными поверхностными антигенами.
Антитела по настоящему изобретению также могут содержать замены или модификации константных областей (например Fc), в том числе без ограничения замены, мутации и/или модификации аминокислотных остатков, которые приводят к образованию соединений, обладающих в том числе и без ограничения следующими предпочтительными характеристиками: измененная фармакокинетика, увеличенный период полужизни в сыворотке крови, повышенная аффинность связывания, сниженная иммуногенность, увеличенный выход, измененное связывание Fc-лиганда с Fc-рецепторами (FcR), повышенная или сниженная ADCC или CDC, измененное гликозилирование и/или образование дисульфидных связей и модифицированная специфичность связывания.
Термин «аффинность» или «аффинность связывания» относится к силе суммы всех нековалентных взаимодействий между одним сайтом связывания молекулы (например антитела) и ее партнером по связыванию (например антигеном). Термин «KD» относится к константе диссоциации конкретного взаимодействия антитело-антиген. Значения аффинности связывания можно определить с применением различных методик, известных из уровня техники, таких как поверхностный плазмонный резонанс, биослойная интерферометрия, двухполяризационная интерферометрия, статическое светорассеяние, динамическое светорассеяние, изотермическая титрационная калориметрия, ELISA, аналитическое ультрацентрифугирование и проточная цитометрия и т. п.
Термин «конкурентное связывание» или «конкурентное антитело» обычно относится к антителу, которое связывается с тем же эпитопом, что и антитело по настоящему изобретению, при этом такое связывание приводит к связыванию антитела по настоящему изобретению с эпитопом, подлежащим подавлению или блокированию, и степень конкурентного ингибирования можно рассчитать в конкурентном анализе.
Термин «фармацевтическая композиция» относится к составу, который представлен в форме, которая обеспечивает эффективную биологическую активность содержащихся в нем активных ингредиентов, и который не содержит дополнительных ингредиентов, характеризующихся неприемлемой токсичностью в отношении субъекта, которому вводится состав.
Термин «фармацевтический носитель» или «фармацевтически приемлемый носитель» относится к разбавителю, адъюванту (например адъюванту Фрейнда (полному и неполному)), вспомогательному веществу или среде-носителю, с которым вводится терапевтическое средство.
Термин «эффективное количество» относится к дозе фармацевтического состава на основе антитела или фрагмента по настоящему изобретению, которая при введении пациенту в однократной дозе или многократных дозах приводит к достижению требуемого эффекта у подвергаемого лечению пациента. Эффективное количество легко может быть определено лечащим врачом, таким как специалист в данной области техники, посредством рассмотрения следующих факторов: например, особенностей человеческого вида; веса тела, возраста и здоровья; конкретных задействованных заболеваний; тяжести заболевания; ответа отдельного пациента; конкретного вводимого антитела; режимов введения; характеристик биодоступности вводимого состава; выбранного режима введения доз и применения какой-либо сопутствующей терапии.
Термины «клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» используются взаимозаменяемо и относятся к клетке, в которую вводится экзогенная нуклеиновая кислота, в том числе к потомству такой клетки. К клеткам-хозяевам относятся «трансформанты» и «трансформированные клетки», к которым относятся в первую очередь трансформированные клетки и полученное от них потомство, независимо от количества пассажей. Потомство может не быть точно таким же по содержанию нуклеиновых кислот, как и исходная клетка, а может содержать мутации. В данный документ включено мутантное потомство, характеризующееся такой же функциональной или биологической активностью, что и клетки, отобранные посредством скрининга или выбранные из потомства первоначально трансформированной клетки.
Используемый в данном документе термин «трансфекция» относится к введению экзогенной нуклеиновой кислоты в эукариотическую клетку. Трансфекцию можно осуществлять посредством различных способов, известных из уровня техники, в том числе посредством совместного осаждения ДНК с фосфатом кальция, трансфекции, опосредованной DEAE-декстраном, трансфекции, опосредованной полибреном, электропорации, микроинъекции, слияния липосом, липидной трансфекции, слияния протопластов, ретровирусной инфекции и биобаллистики.
Термин «стабильная трансфекция» или «ST» относится к введению и встраиванию экзогенной нуклеиновой кислоты, ДНК или РНК, в геном трансфицированной клетки. Термин «стабильный трансфектант» относится к клетке, у которой чужеродная ДНК стабильно встроена в геномную ДНК.
Термины «кодирование молекулой нуклеиновой кислоты», «кодирующая последовательность ДНК» и «кодирующая ДНК» относятся к порядку дезоксирибонуклеотидов в цепи дезоксирибонуклеиновой кислоты. Порядок этих дезоксирибонуклеотидов определяет порядок аминокислот в полипептидной (белковой) цепи. Таким образом, последовательность нуклеиновой кислоты кодирует аминокислотную последовательность.
Способы получения и очистки антител и антигенсвязывающих фрагментов хорошо известны из уровня техники и могут быть найдены, например, в главах 5-8 и 15 в Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory. Антитела или их антигенсвязывающие фрагменты по настоящему изобретению генетически сконструированы с добавлением одной или более человеческих FR-областей к CDR-областям, полученным не от человека. Человеческие последовательности FR зародышевого типа можно получить на веб-сайте http://imgt.cines.fr от ImMunoGeneTics (IMGT) или в J. Immunoglobulin, (2001) ISBN: 012441351.
Сконструированные антитела или их антигенсвязывающие фрагменты по настоящему изобретению можно получать и очищать посредством традиционных способов. Например, последовательности кДНК, кодирующие тяжелые и легкие цепи, можно клонировать в векторы экспрессии или подвергнуть рекомбинации с ними. Рекомбинантный вектор экспрессии иммуноглобулина способен стабильно трансфицировать клетки СНО. Как более рекомендуемые в предшествующем уровне техники, системы экспрессии млекопитающих могут приводить к гликозилированию антител, особенно на высококонсервативном N-конце Fc-области. Стабильные клоны получают посредством экспрессии антител, которые специфически связываются с человеческими антигенами. Положительные клоны выращиваются посредством культивирования в среде без сыворотки крови в биореакторе для получения антител. Среду, в которую секретируются антитела, можно очистить и собрать с применением традиционных методик. Антитело можно концентрировать посредством фильтрации с применением традиционных способов. Растворимые смеси и полимеры также можно удалить посредством таких традиционных способов, как молекулярные сита, ионообмен и т. п.
Используемый в данном документе термин «индивидуум» или «субъект» относится к любому животному, такому как млекопитающее или сумчатое животное. К индивидуумам по настоящему изобретению относятся без ограничения люди, отличные от человека приматы (например, яванские макаки, или макаки-резусы, или другие типы макак), мыши, свиньи, лошади, ослы, крупный рогатый скот, овцы, крысы и любые виды домашней птицы.
Термин «конъюгат антитело-лекарственное средство» (ADC) относится к антителу, с которым ковалентно связано терапевтически активное вещество или активный ингредиент лекарственного средства (API), таким образом, что терапевтически активное вещество или активный ингредиент лекарственного средства (API) могут быть нацелены на мишень связывания антитела для проявления его фармакологической функции. Терапевтически активное вещество или активный фармацевтический ингредиент могут представлять собой цитотоксин, способный уничтожать клетки-мишени для ADC, предпочтительно злокачественную или раковую клетку. Ковалентное присоединение терапевтически активного вещества, активного фармацевтического ингредиента или цитотоксина можно осуществить способом, отличным от сайт-специфического, с применением стандартных химических линкеров, которые связывают полезную нагрузку с остатками лизина или цистеина, или, предпочтительно, конъюгацию осуществляют сайт-специфическим способом, который позволяет полностью контролировать сайт конъюгации и соотношение лекарственного средства и антитела в получаемых ADC.
Термин «химерный антигенный рецептор» (CAR) представляет собой сконструированный рецептор, который переносит любую специфичность на иммунные эффекторные клетки. Как правило, такие реципиенты используются для переноса специфичности моноклональных антител на Т-клетки; перенос их кодирующих последовательностей облегчается ретровирусными или лентивирусными векторами или транспозонами. Т-клетки со сконструированным CAR (также сокращенно называемые CAR-T-клетками) представляют собой генетически сконструированные Т-клетки, несущие химерный рецептор, внеклеточная распознающая структурная единица которых содержит полученный из антитела распознающий домен, и внутриклеточная область которых получена из фрагмента, стимулирующего лимфоциты. Структура прототипа CAR является модульной и разработана для размещения различных функциональных доменов, что позволяет выбирать специфичность и контролировать активацию Т-клеток. Предпочтительной распознающей единицей, полученной из антитела, является одноцепочечный вариабельный фрагмент (scFv), который сочетает в себе специфичность и связывающие остатки вариабельных областей тяжелой и легкой цепей моноклонального антитела. К наиболее распространенным фрагментам, активирующим лимфоциты, относится домен, костимулирующий Т-клетки (например CD28), в тандеме с триггерным для Т-клеток фрагментом (например CD3ζ). При снабжении эффекторных лимфоцитов (например Т-клеток или естественных клеток-киллеров) такими химерными рецепторами сконструированная клетка перенаправляется с заранее определенной специфичностью к требуемому антигену-мишени не рестриктированным посредством HLA образом. CAR-конструкции вводятся ex vivo в Т-клетки из периферических лимфоцитов данного пациента с применением ретровирусных или лентивирусных векторов или транспозонов. После инфузии полученных Т-клеток со сконструированным CAR обратно пациенту они перемещаются, достигают своего сайта-мишени, и при взаимодействии со своими клетками-мишенями или тканями-мишенями они подвергаются активации и выполняют свою предварительно определенную эффекторную функцию. К терапевтическим мишеням в случае подхода с применением CAR относятся раковые и ВИЧ-инфицированные клетки или аутоиммунные эффекторные клетки.
Используемый в данном документе термин «опухоль» относится к заболеванию, характеризующемуся патологической пролиферацией клеток или тканей и последующей миграцией или инвазией в другие ткани или органы. Рост опухоли обычно является неконтролируемым и прогрессирующим и не индуцирует или подавляет пролиферацию нормальных клеток. Опухоли могут поражать различные клетки, ткани или органы, в том числе без ограничения мочевой пузырь, кость, головной мозг, молочную железу, хрящ, глиальные клетки, пищевод, фаллопиеву трубу, желчный пузырь, сердце, кишечник, почку, печень, легкое, лимфатические узлы, нервную ткань, яичник, поджелудочную железу, предстательную железу, скелетную мышцу, кожу, спинной мозг, селезенку, желудок, яичко, тимус, щитовидную железу, трахею, уретру, мочеточник, уретру, матку, влагалище, или ткань или соответствующую клетку. К опухолям относятся различные виды рака, такие как саркомы, карциномы или плазмоцитомы (злокачественные опухоли из плазматических клеток). К опухоли согласно настоящему изобретению могут относиться без ограничения лейкоз (например, острый лейкоз, острый лимфоцитарный лейкоз, острый миелоидный лейкоз, острый промиелоцитарный лейкоз, острый миеломоноцитарный лейкоз, острый моноцитарный лейкоз, хронический лейкоз, хронический миелогенный лейкоз, хронический лимфоцитарный лейкоз, истинная полицитемия), лимфома (болезнь Ходжкина, неходжкинская болезнь), первичная макроглобулинемия, болезнь тяжелых цепей, солидные опухоли, такие как саркомы и виды рака (например, фибросаркома, миксосаркома, липосаркома, хондросаркома, остеосаркома, хордома, эндотелиальная саркома, лимфангиосаркома, ангиосаркома, лимфангиоэндотелиома, мезотелиома, опухоль Юинга, лейомиосаркома, рабдомиосаркома, рак толстой кишки, рак поджелудочной железы, рак молочной железы, рак яичника, рак предстательной железы, плоскоклеточная карцинома, базальноклеточная карцинома, аденокарцинома, аденокарцинома потовой железы, аденокарцинома сольной железы, папиллярная карцинома, папиллярная аденокарцинома, бронхиальная карцинома, миелоидный рак, почечноклеточная карцинома, рак печени, карцинома желчного протока, хориокарцинома, семинома, эмбриональный рак, нефробластома, рак шейки матки, рак матки, рак яичка, рак легкого, мелкоклеточный рак легкого, рак мочевого пузыря, эпителиальный рак, глиома, астроцитома, медуллобластома, краниофарингиома, эпендимома, пинеалома, гемангиобластома, невриномы слухового нерва, олигодендроглиома, шваннома, менингиома, меланома, нейробластома, ретинобластома), рак пищевода, рак желчного пузыря, рак почки, множественная миелома. Предпочтительно, термин «опухоль» включает без ограничения рак поджелудочной железы, рак печени, рак легкого, рак желудка, рак пищевода, плоскоклеточную карциному головы и шеи, рак предстательной железы, рак толстой кишки, рак молочной железы, лимфому, рак желчного пузыря, рак почки, лейкоз, множественную миелому, рак яичника, рак шейки матки и глиому.
Используемый в данном документе термин «заболевание», или «состояние», или «нарушение», и т. п. относится к любому изменению или нарушению, которое нарушает нормальное функционирование клетки, ткани или органа или препятствует ему. Например, термин «заболевание» включает без ограничения опухоли, инфекции патогенами, аутоиммунные заболевания, дисфункции Т-клеток или виды недостаточности иммунной толерантности (например отторжение трансплантата).
Используемый в данном документе термин «лечение» относится к клиническому вмешательству в попытке изменить заболевание, вызванное отдельными или подвергаемыми лечению клетками, либо с профилактической целью, либо в клинико-патологическом аспекте. К терапевтическим эффектам относятся без ограничения предупреждение возникновения или рецидива заболевания, облегчение симптомов, снижение прямых или непрямых патологических последствий какого-либо заболевания, предупреждение метастазирования, замедление скорости прогрессирования заболевания, ослабление или ремиссия состояния, ремиссия или улучшение прогноза и т. п.
Термин «упаковка с лекарственным средством» или «набор» включает эффективное количество одной или более стандартных лекарственных форм фармацевтической композиции по настоящему изобретению. В некоторых вариантах осуществления упаковка с лекарственным средством может включать стерильный контейнер; такие контейнеры могут иметь форму упаковок, ампул, бутылок, флаконов, пробирок, пакетов, блистерных упаковок или других подходящих контейнеров, известных из уровня техники. Такие контейнеры могут быть получены из пластика, стекла, ламинированной бумаги, металлической фольги или других материалов, подходящих для хранения лекарственных препаратов. Кроме того, упаковка с лекарственным средством также содержит инструкции по введению индивидууму фармацевтической композиции по настоящему изобретению. Инструкции обычно включают способы применения фармацевтических композиций по настоящему изобретению для лечения заболеваний.
Пример
Настоящее изобретение будет подробно описано ниже в связи с конкретными примерами. Следует понимать, что данные примеры использованы только для описания настоящего изобретения и не подразумеваются как ограничивающие объем настоящего изобретения. Экспериментальные способы в представленных далее примерах, в которых не указаны конкретные условия, обычно проводятся в соответствии с общепринятыми условиями, Molecular Cloning: A Laboratory Manual(Third Edition) by J. Sambrook et al., Science Press, 2002, или в соответствии с условиями, рекомендованными производителем.
Пример 1. Иммунизация животных
Для получения антител к CLDN18.2 процедуру анализа выполняли с применением стандартных биологических протоколов. В общей сложности 15 мышей разных линий иммунизировали стабильно трансфицированными клетками CHO-K1 (CHO-K1/hCLDN18.2), экспрессирующими hCLDN18.2, и ДНК-вектором, кодирующим hCLDN18.2, в качестве иммуногенов.
На более поздней стадии иммунизации собирали кровь из угловой вены с получением образцов плазмы крови и выявляли титр иммунной сыворотки крови посредством ELISA и FACS с определением иммунного ответа животных. После 4 процедур иммунизации отбирали 6 мышей для умерщвления для получения клеток гибридомы.
Пример 2. Получение клетки гибридомы для моноклональных антител к CLDN18.2
Для получения клеток гибридомы для моноклонального антитела к CLDN18.2 6 мышей умерщвляли диоксидом углерода, отдельно собирали питающие клетки с помощью шприца и суспензию питающих клеток помещали в подготовленный 96-луночный планшет. Определенное количество клеток миеломы и клеток селезенки пропорционально смешивали для слияния клеток. К слитым клеткам добавляли среду HAT (1 мл 100 × добавки HT + 1 мл аминоптерина + 10 мл FBS + 88 мл DMEM) и тщательно перемешивали с получением суспензии клеток. Затем суспензию клеток выливали в культуральную чашку, тщательно перемешивали и с применением многоканальной пипетки высевали суспензию клеток в 96-луночный планшет для питающих клеток. Планшеты со слитыми питательными клетками помещали в инкубатор и инкубировали при постоянной температуре 37°C, 5,5% CO2 в течение 7-10 дней. Клоны, положительные в отношении антител к CLDN18.2, затем подвергали скринингу посредством ELISA и FACS. Отобранные посредством скрининга положительные клоны субклонировали посредством анализа с ограничивающим разбавлением с получением стабильных одиночных клеток гибридомы. Образцы надосадочной жидкости субклонированных клеток подвергали скринингу посредством FACS с применением стабильно трансфицированных клеток HEK293, экспрессирующих hCLDN18.2 (HEK293-hCLDN18.2). Как видно на фиг. 1-5 из описания, в конечном итоге были получены 18 штаммов клеток гибридом для продуцирования антител, которые специфически связываются с hCLDN18.2.
Полученный посредством скрининга штамм клеток гибридомы, секретирующих моноклональное антитело, культивировали и общую РНК экстрагировали из клетки посредством традиционного биологического способа. кДНК синтезировали на матрице общей РНК посредством обратной транскрипции с применением набора для синтеза 1-ой цепи кДНК PrimeScript™ (TAKARA). Затем кДНК служила матрицей при амплификации с применением праймеров к последовательностям, кодирующим константные области антитела. После разделения ПЦР-продуктов посредством электрофореза в агарозном геле очищали и выделяли фрагменты ДНК и получали аминокислотные последовательности вариабельных областей 18 моноклональных антител по настоящему изобретению посредством секвенирования, и результаты показаны в таблице 1.
Таблица 1. Аминокислотные последовательности вариабельных областей 18 моноклональных антител


На основании представленных выше аминокислотных последовательностей разделяли CDR и FR вариабельных областей антител с использованием правил нумерации согласно Kabat, и состав 6 последовательностей CDR каждого антитела показан в представленной ниже таблице 2, где числа в скобках в таблице 2 указывают на номера последовательностей, например (37) обозначает SEQ ID NO: 37.
Таблица 2. CDR 18 моноклональных антител


Пример 3. Конструирование химерного антитела к CLDN18.2 и его экспрессия после временной трансфекции в эукариотических клетках
Фрагмент гена-мишени, полученный после сплайсинга секвенированной вариабельной области моноклонального антитела по настоящему изобретению и константной области человеческого IgG1, клонировали в вектор экспрессии pcDNA3.4 с получением плазмиды экспрессии для трансфекции. Клетки Expi293F™ (Thermo Fisher Scientific) культивировали в среде без сыворотки крови, высевали во встряхиваемые колбы (Corning Inc.) и культивировали на встряхиваемом столе в среде при 37°C, 8% CO2. Корректировали плотность клеток, рекомбинантный вектор экспрессии, содержащий фрагмент гена-мишени, и реагент для трансфекции ExpiFectamine™ 293 смешивали в соответствии с подходящим соотношением и добавляли во встряхиваемую колбу для культивирования клеток, после трансфекции в течение 16-18 ч добавляли усилитель трансфекции 1 ExpiFectamine™ 293 и усилитель трансфекции 2 ExpiFectamine™ 293, через 6 дней культивирования клеток собирали и очищали надосадочную жидкость и, наконец, очищенное химерное антитело подвергали SDS-PAGE-анализу в отношении чистоты и определению концентрации при A280. Химерным антителам присваивали названия таким образом, чтобы приставка ch- была добавлена к названию исходного клона гибридомы.
Пример 4. Анализ связывания химерного антитела к CLDN18.2
А. Связывание химерных антител к CLDN18.2 с клетками, экспрессирующими hCLDN18.2
FACS использовали для выявления связывания химерных антител к CLDN18.2 со стабильно трансфицированными клетками HEK293, экспрессирующими hCLDN18.2 (HEK293-hCLDN18.2), и клетками, полученными из опухолевой ткани рака желудка, которые в естественных условиях экспрессируют hCLDN18.2 (PDX-hCLDN18.2).
Клетки HEK293-hCLDN18.2 или PDX-hCLDN18.2 собирали и ресуспендировали в PBS для корректировки концентрации клеток и добавляли антитело, разбавленное с градиентом, при этом нерелевантный человеческий IgG представлял собой отрицательный контроль, а химерное антитело ch-175D10 из патента CN103509110B представляло собой положительный контроль (эталонное антитело). После инкубации при 4 C на встряхиваемом столе в течение от 50 мин до 1 ч смесь два раза промывали раствором фосфатного буфера с центрифугированием, добавляли флуоресцентно меченное вторичное антитело к человеческому IgG, 100 мкл на лунку; после инкубации при 4 C на встряхиваемом столе в течение от 40 мин до 1 ч смесь два раза промывали фосфатным буферным раствором с центрифугированием и затем подготовленный образец выявляли на проточном цитометре; среднюю интенсивность флуоресценции (далее в данном документе называемую MFI) для каждой концентрации рассчитывали с помощью программного обеспечения и затем с помощью программного обеспечения GraphPad рассчитывали концентрацию при половинном связывании (далее в данном документе называемую EC50) и среднюю максимальную интенсивность флуоресценции (самое высокое значение MFI), и результаты показаны в таблице 3.
Таблица 3. Связывание химерных антител к CLDN18.2 с hCLDN18.2


 В таблице 3 и на фиг. 6-17 показаны результаты определения аффинности химерного антитела по настоящему изобретению и эталонного антитела ch-175D10 в отношении клеток HEK293-hCLDN18.2 и клеток PDX-hCLDN18.2 соответственно. Экспериментальные результаты демонстрировали, что связывание химерного антитела по настоящему изобретению с клетками HEK293-hCLDN18.2 характеризовалось средней максимальной интенсивностью флуоресценции, составляющей 5586-12203, тогда как связывание эталонного антитела ch-175D10 с HEK293-hCLDN18.2 в тех же условиях взаимодействия характеризовалось средней максимальной интенсивностью флуоресценции, составляющей только 5451. Связывание химерного антитела с PDX-hCLDN18.2 характеризовалось средней максимальной интенсивностью флуоресценции, составляющей 7616-19876, концентрацией при половинном связывании (EC50), составляющей 4,554-96,23 нМ, тогда как связывание эталонного антитела ch-175D10 с PDX- hCLDN18.2 в тех же условиях взаимодействия характеризовалось средней максимальной интенсивностью флуоресценции, составляющей только 7160, и концентрацией при половинном связывании (EC50), составляющей только 63,85 нМ. Таким образом, связывание большинства химерных антител по настоящему изобретению с антигеном hCLDN18.2 было более сильным, чем связывание ch-175D10.
В таблице 3 и на фиг. 6-17 показаны результаты определения аффинности химерного антитела по настоящему изобретению и эталонного антитела ch-175D10 в отношении клеток HEK293-hCLDN18.2 и клеток PDX-hCLDN18.2 соответственно. Экспериментальные результаты демонстрировали, что связывание химерного антитела по настоящему изобретению с клетками HEK293-hCLDN18.2 характеризовалось средней максимальной интенсивностью флуоресценции, составляющей 5586-12203, тогда как связывание эталонного антитела ch-175D10 с HEK293-hCLDN18.2 в тех же условиях взаимодействия характеризовалось средней максимальной интенсивностью флуоресценции, составляющей только 5451. Связывание химерного антитела с PDX-hCLDN18.2 характеризовалось средней максимальной интенсивностью флуоресценции, составляющей 7616-19876, концентрацией при половинном связывании (EC50), составляющей 4,554-96,23 нМ, тогда как связывание эталонного антитела ch-175D10 с PDX- hCLDN18.2 в тех же условиях взаимодействия характеризовалось средней максимальной интенсивностью флуоресценции, составляющей только 7160, и концентрацией при половинном связывании (EC50), составляющей только 63,85 нМ. Таким образом, связывание большинства химерных антител по настоящему изобретению с антигеном hCLDN18.2 было более сильным, чем связывание ch-175D10.
B. Селективность связывания химерных антител к CLDN18.2
FACS использовали для выявления связывания химерных антител по настоящему изобретению со стабильно трансфицированными клетками HEK293, экспрессирующими мышиный CLDN18.2 (HEK293-mCLDN18.2), и стабильно трансфицированными клетками HEK293, экспрессирующими человеческий CLDN18.1 (HEK293-hCLDN18.1).
Раздельно собирали клетки HEK293-mCLDN18.2 и HEK293-hCLDN18.1 и ресуспендировали в PBS для корректировки концентрации клеток, а затем добавляли химерное антитело, разбавленное с градиентом, где нерелевантный человеческий IgG использовали в качестве отрицательного контроля, а ch-175D10 все еще представлял собой положительный контроль (эталонное антитело). После инкубации при 4°C на встряхиваемом столе в течение 50 мин смесь два раза промывали раствором фосфатного буфера с центрифугированием, добавляли флуоресцентно меченное вторичное антитело к человеческому IgG, 100 мкл на лунку; после инкубации при 4 C на встряхиваемом столе в течение 40 мин смесь два раза промывали фосфатным буферным раствором с центрифугированием и затем подготовленный образец выявляли на проточном цитометре; с помощью программного обеспечения GraphPad рассчитывали концентрацию при половинном связывании (EC50) и среднюю максимальную интенсивность флуоресценции (самое высокое значение MFI), и результаты показаны в таблице 4.
Таблица 4. Связывание химерных антител к CLDN18.2 с mCLDN18.2 и hCLDN18.1 соответственно
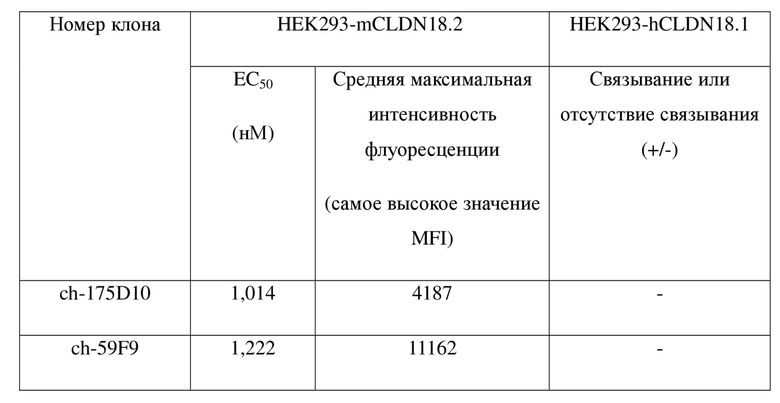

В таблице 4 показаны результаты определения аффинности химерного антитела по настоящему изобретению и эталонного антитела ch-175D10 в отношении клеток HEK293-mCLDN18.2 и клеток HEK293-hCLDN18.1 соответственно. Экспериментальные результаты демонстрировали, что химерное антитело по настоящему изобретению было таким же, как и эталонное антитело ch-175D10, причем оба из них связывались с антигеном mCLDN18.2, где связывание химерного антитела с HEK293-mCLDN18.2 характеризовалось средней максимальной интенсивностью флуоресценции, составляющей 6093-14768, и концентрацией при половинном связывании (EC50), составляющей 0,573-1,763 нМ, связывание эталонного антитела ch-175D10 с HEK293-mCLDN18.2 в тех же условиях взаимодействия характеризовалось средней максимальной интенсивностью флуоресценции, составляющей 4187, и концентрацией при половинном связывании (EC50), составляющей 1,014 нМ, что указывает на то, что химерное антитело характеризовалось EC50 связывания, сопоставимой с EC50 связывания эталонного антитела, и максимальная степень связывания была выше, чем у эталонного антитела. Более того, химерное антитело было таким же, как и эталонное антитело ch-175D10, но при этом не связывалось с антигеном hCLDN18.1.
Пример 5. Функциональный анализ химерных антител к CLDN18.2 in vitro
A. Антителозависимая клеточноопосредованная цитотоксичность (ADCC)
Клетки CHO-K1/hCLDN18.2 использовали в качестве клеток-мишеней, NK-клетки, трансфицированные геном FcγRIIIa типа 158V/V (NK92/FcRγ3a.158V/V), использовали в качестве эффекторных клеток, и высвобождение лактатдегидрогеназы (LDH) в клетке выявляли с помощью набора для анализа цитотоксичности (Roche) и использовали в качестве индикатора эффекта уничтожения клеток.
Клетки CHO-K1/hCLDN18.2 собирали посредством центрифугирования, надосадочную жидкость удаляли и клетки ресуспендировали в буфере для анализа ADCC для корректировки плотности клеток и переносили в 96-луночный аналитический планшет. Химерные антитела, рабочие растворы контрольных образцов или буфер для анализа ADCC при различных градиентах концентрации переносили в 96-луночный планшет, инкубировали в течение приблизительно 30 мин в инкубаторе для клеток (37°C/5% CO2), эффекторные клетки, буфер для анализа ADCC или клеточные лизаты переносили в 96-луночный аналитический планшет и дополнительно инкубировали в течение приблизительно 6 ч в инкубаторе для клеток (37°C/5%CO2). После инкубации 96-луночный аналитический планшет вынимали и центрифугировали при низкой скорости вращения, надосадочную жидкость осторожно пипетировали и переносили в новый 96-луночный аналитический планшет, добавляли рабочий раствор для выявления LDH, планшет инкубировали при комнатной температуре в течение приблизительно 10-30 мин, значение OD определяли на микропланшет-ридере, где длина волны при выявлении составляла 492 нм, и эталонная длина волны составляла 650 нм.
Процент лизиса клеток, вызванного эффектом ADCC, рассчитывали с применением следующей формулы:
% лизиса клеток = 100% × (высвобождение образца - смешанное высвобождение из клеток-мишеней/эффекторных клеток)/(максимальное высвобождение - высвобождение из клеток-мишеней), где максимальное высвобождение представляло собой значение поглощения, полученное в лунках с клетками-мишенями, обработанными с помощью Triton X-100, смешанное высвобождение из клеток-мишеней/эффекторных клеток представляло собой значение поглощения, полученное в лунках со смесью клеток-мишеней и эффекторных клеток, и высвобождение из клеток-мишеней представляло собой значение поглощения, полученное в лунках, содержащих только клетки-мишени, высвобождение образца представляло собой значения поглощения, полученные в лунках со смесью химерного антитела, клеток-мишеней и эффекторных клеток, и EC50 и максимальный лизис рассчитывали с помощью программного обеспечения GraphPad, и результаты показаны в таблице 5.
Таблица 5. Активность ADCC химерных антител к CLDN18.2


В таблице 5 и на фиг. 18-23 показаны результаты определения ADCC химерного антитела по настоящему изобретению и эталонного антитела ch-175D10 на клетках CHO-K1/hCLDN18.2. Экспериментальные результаты демонстрировали, что максимальный эффект ADCC химерного антитела по настоящему изобретению на клетках CHO-K1/hCLDN18.2 составлял 29,06-48,46%, а эффект ADCC эталонного антитела ch-175D10 составлял 31,81% в тех же условиях взаимодействия. Концентрация химерного антитела по настоящему изобретению, при которой эффект ADCC достигал 50% (EC50), составляла 0,010-0,064 мкг/мл, а концентрация ch-175D10, при которой эффект ADCC составлял 50% (EC50) в тех же условиях взаимодействия, составляла 0,021 мкг/мл. Представленные выше результаты демонстрировали, что по активности ADCC химерные антитела по настоящему изобретению были сопоставимы с эталонным антителом ch-175D10.
B. Комплементзависимая цитотоксичность (CDC)
Жизнеспособность клеток измеряли с помощью набора для хемилюминесцентного анализа жизнеспособности клеток CellTiter-Glo® (Promega) с применением CHO-K1/hCLDN18.2 в качестве клеток-мишеней и объединенной нормальной сыворотки крови человека (PNHS) в качестве источника комплемента.
Клетки CHO-K1/hCLDN18.2 собирали, ресуспендировали в буфере для анализа CDC для корректировки плотности клеток, высевали в 384-луночный планшет для клеток, 20 мкл на лунку, с получением 4-кратной концентрации раствора образца, который (буфер для анализа CDC в качестве контроля) переносили в соответствующие лунки 384-луночного планшета для клеток, 10 мкл на лунку, планшет инкубировали при комнатной температуре в течение приблизительно 30 мин и объединенную нормальную сыворотку крови человека (PNHS) разбавляли до 4-кратной рабочей концентрации с применением буфера для анализа CDC. Разбавленную PNHS переносили в соответствующие лунки 384-луночного планшета для инкубации, 10 мкл на лунку, планшет инкубировали в инкубаторе для клеток (37 C/5% CO2) в течение приблизительно 4 ч, 384-луночный планшет вынимали и анализировали с помощью набора для хемилюминесцентного анализа жизнеспособности клеток CellTiter-Glo® (Promega) и результаты считывали с применением программного обеспечения PHERAstar Plus.
Степень лизиса клеток, вызванного химерным антителом, в анализе CDC рассчитывали с применением следующей формулы:
% лизиса клеток = 100% × (1-(тестируемые лунки - контрольные лунки с сывороткой крови) / (лунки с клетками + сыворотка крови - контрольные лунки с сывороткой крови))
Экспериментальные контроли представляют собой контрольные лунки с сывороткой крови: только сыворотка крови (т. е. 30 мкл буфера + 10 мкл разбавленной сыворотки крови). Лунки с клетками + сыворотка крови: сыворотку крови добавляли в лунки с суспензией клеток CHO-K1/hCLDN18.2 (т. е. 20 мкл суспензии клеток + 10 мкл буфера + 10 мкл разбавленной сыворотки крови). Тестируемые лунки: сыворотку крови и химерное антитело добавляли в лунки с суспензией клеток CHO-K1/hCLDN18.2 (т. е. 20 мкл суспензии клеток + 10 мкл антитела + 10 мкл разбавленной сыворотки крови).
EC50 и максимальный лизис рассчитывали с применением программного обеспечения GraphPad и результаты показаны в таблице 6.
Таблица 6. Активность CDC химерных антител к CLDN18.2


В таблице 6 и на фиг. 24-29 показаны результаты определения CDC химерного антитела по настоящему изобретению и эталонного антитела ch-175D10 на клетках CHO-K1/hCLDN18.2. Экспериментальные результаты демонстрировали, что максимальный эффект CDC химерного антитела по настоящему изобретению на клетках CHO-K1/hCLDN18.2 составлял 89,08-97,11%, а максимальный эффект CDC эталонного антитела ch-175D10 составлял 87,41% в тех же условиях взаимодействия. Концентрация химерного антитела по настоящему изобретению, при которой эффект CDC достигал 50% (EC50), составляла 0,038-0,380 мкг/мл, а концентрация ch-175D10, при которой эффект CDC составлял 50% (EC50) в тех же условиях взаимодействия, была выше 1 мкг/мл. Можно видеть, что активность CDC большинства антител была сильнее, чем активность CDC эталонного антитела.
Пример 6. Получение вариантов химерных антител к CLDN18.2
Посредством анализа посттрансляционных модификаций (PTM) моноклонального антитела, раскрытого в настоящем изобретении, было обнаружено, что 1 сайт дезамидирования присутствовал в обеих вариабельных областях 299B2 и 253C4; проводили одну процедуру сайт-направленного мутагенеза в отношении 31-й, 32-й или 33-й аминокислоты в вариабельной области легкой цепи 299B2 с получением трех мутантных вариантов 299B2: 299B2-N31Q, 299B2-S32A и 299B2-G33A соответственно.
И проводили одну процедуру сайт-направленного мутагенеза в отношении 31-й, 32-й или 33-й аминокислоты в вариабельной области легкой цепи 253C4 с получением трех мутантных вариантов 253C4: 253C4-N31Q, 253C4-S32A и 253C4-G33A соответственно.
Аминокислотные последовательности вариабельной области тяжелой цепи 299B2-N31Q, 299B2-S32A и 299B2-G33A были такими же, как и у 299B2, аминокислотные последовательности вариабельной области тяжелой цепи 253C4-N31Q, 253C4-S32A и 253C4-G33A были такими же, как и у 253C4. Последовательности CDR вариабельной области и последовательности вариабельных областей тяжелой и легкой цепей 6 описанных выше вариантов показаны в таблицах 7 и 8 соответственно.
Таблица 7. Последовательности CDR антител 299B2 и 253C4 и их вариантов 

Таблица 8. Последовательности вариабельной области антител 299B2 и 253C4 и их вариантов

Как описано в примере 3, химерное антитело конструировали посредством субклонирования фрагмента гена-мишени, полученного посредством сплайсинга 6 описанных выше вариантов вариабельных областей с константной областью человеческого IgG1, в вектор экспрессии, и химерному антителу данного варианта присваивали название таким образом, чтобы была добавлена приставка ch- к названию по схеме «клон гибридомы-сайт мутации», например химерное антитело 299B2-N31Q обозначали как ch-299B2-N31Q. После временной экспрессии в линиях клеток млекопитающих проводили анализы аффинности с применением клеток HEK293-hCLDN18.2 и образцы надосадочной жидкости моноклональных клеток подвергали скринингу посредством FACS. Результаты определения аффинности вариантов антител ch-299B2 и ch-253C4 показаны в таблице 9.
Таблица 9. Аффинность вариантов антител ch-299B2 и ch-253C4
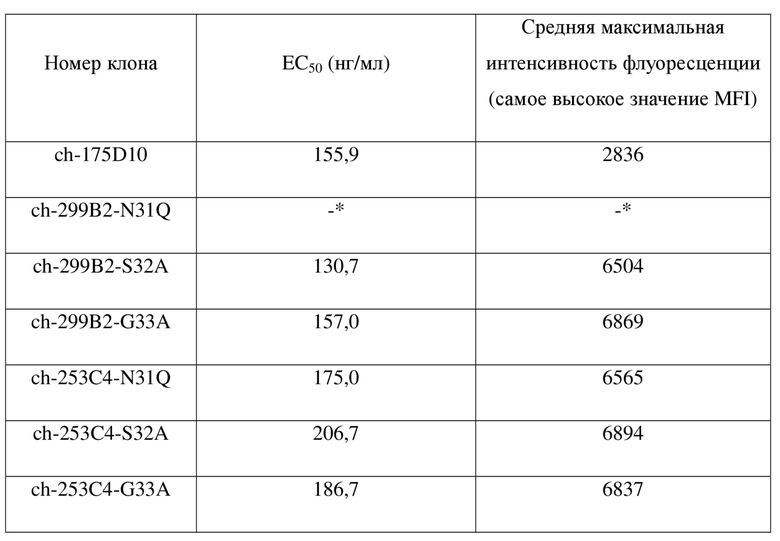
* При максимальной концентрации не достигалось максимального связывания и осуществить подгонку кривой было невозможно.
Пример 7. Получение гуманизированных антител
A. Конструирование гуманизированных антител и экспрессия антитела 299B2-S32A
Посредством сравнения сходства последовательностей в качестве матрицы антитела было выбрано антитело зародышевого типа с наивысшим сходством с 299B2. В данном примере в качестве матрицы антитела для тяжелой цепи 299B2-S32A было выбрано антитело IGHV1-46*01 из базы данных IMGT, в качестве матрицы антитела для легкой цепи 299B2-S32A было выбрано антитело IGKV4-1*01, CDR-области матрицы антитела заменяли на CDR-области легкой цепи и тяжелой цепи из 299B2-S32A.
Проводили гомологичное моделирование последовательностей вариабельной области мышиного антитела. Проводили поиск наилучшей матрицы для моделирования в базе данных антител PDB по последовательности вариабельной области мышиного антитела и в качестве матрицы было выбрано антитело 2GKI с 74% гомологией. Исходя из пространственной структуры 2GKI аминокислотные остатки в каркасной области последовательности с привитой CDR подвергали обратной мутации в соответствии со следующими критериями: 1. Выбирали классические остатки в каркасной области для обратной мутации; 2. Выбирали остатки гидрофобной центральной области в каркасной области для обратной мутации; 3. Выбирали остатки в участке взаимодействия тяжелой цепи/легкой цепи для обратной мутации; 4. Выбирали сходные остатки для обратных мутаций с низким приоритетом.
299B2-S32A подвергали гуманизации с получением 4 гуманизированных антител: hu299B2-S32A-1, hu299B2-S32A-2, hu299B2-S32A-3 и hu299B2-S32A-4, последовательности всех упомянутых выше гуманизированных антител 299B2-S32A показаны в таблице 10.
Фрагмент гена-мишени, который был получен посредством сплайсинга вариабельной области гуманизированного антитела hu299B2-S32A и константной области человеческого IgG1, субклонировали в вектор экспрессии pcDNA3.4 посредством стандартных способов, известных специалистам в данной области техники, клетки Expi293F™ в логарифмической фазе роста подвергали временной трансфекции с помощью реагента для трансфекции ExpiFectamine™ 293, собирали надосадочную жидкость культуры и подвергали аффинной очистке, конечное очищенное антитело подвергали SDS-PAGE-анализу в отношении чистоты и определению концентрации при A280.
B. Конструирование гуманизированных антител и экспрессия антитела 253C4-N31Q
Посредством сравнения сходства последовательностей в качестве матрицы антитела было выбрано антитело зародышевого типа с наивысшим сходством с 253C4. В данном примере в качестве матрицы антитела для тяжелой цепи 253C4-N31Q было выбрано антитело IGKV4-1*01 из базы данных IMGT, в качестве матрицы антитела для легкой цепи 253C4-N31Q было выбрано антитело IGHV1-2*06, CDR-области матрицы антитела заменяли на CDR-области легкой цепи и тяжелой цепи из 253C4-N31Q.
Проводили гомологичное моделирование последовательностей вариабельной области мышиного антитела. Проводили поиск наилучшей матрицы для моделирования в базе данных антител PDB по последовательности вариабельной области мышиного антитела и в качестве матрицы было выбрано антитело 2GKI с 74% гомологией. Исходя из пространственной структуры 2GKI аминокислотные остатки в каркасной области последовательности с привитой CDR подвергали обратной мутации в соответствии со следующими критериями: 1. Выбирали классические остатки в каркасной области для обратной мутации; 2. Выбирали остатки гидрофобной центральной области в каркасной области для обратной мутации; 3. Выбирали остатки в участке взаимодействия тяжелой цепи/легкой цепи для обратной мутации; 4. Выбирали сходные остатки для обратных мутаций с низким приоритетом.
253C4-N31Q подвергали гуманизации с получением 3 гуманизированных антител: hu253C4-N31Q-1, hu253C4-N31Q-2 и hu253C4-N31Q-3, последовательности всех гуманизированных антител 253C4-N31Q показаны в таблице 10.
Фрагмент гена-мишени, который был получен посредством сплайсинга вариабельной области гуманизированного антитела hu253C4-N31Q и константной области человеческого IgG1, субклонировали в вектор экспрессии pcDNA3.4 посредством стандартных способов, известных специалистам в данной области техники, клетки Expi293F™ в логарифмической фазе роста подвергали временной трансфекции с помощью реагента для трансфекции ExpiFectamine™ 293, собирали надосадочную жидкость культуры и подвергали аффинной очистке, конечное очищенное антитело подвергали SDS-PAGE-анализу в отношении чистоты и определению концентрации при A280.
Таблица 10. Последовательности вариабельной области гуманизированных антител hu299B2-S32A и hu253C4-N31Q

Пример 8. Активность связывания гуманизированных антител hu299B2 и hu253C4
А. Связывание гуманизированных антител с клетками, экспрессирующими hCLDN18.2
Анализы активности связывания проводили с применением клеток HEK293-hCLDN18.2 и PDX-hCLDN18.2 со ссылкой на пример 4A, при этом нерелевантный человеческий IgG представлял собой отрицательный контроль, а химерное антитело ch-175D10 из патента CN103509110B представляло собой положительный контроль (эталонное антитело). С применением результатов измерения посредством проточной цитометрии с помощью программного обеспечения рассчитывали среднюю интенсивность флуоресценции (далее называемую MFI) для каждой концентрации и затем с помощью программного обеспечения GraphPad рассчитывали концентрацию при половинном связывании (EC50) и среднюю максимальную интенсивность флуоресценции (самое высокое значение MFI), и результаты показаны в таблице 11.
Таблица 11. Связывание гуманизированного антитела к CLDN18.2 с hCLDN18.2


В таблице 11 и на фиг. 30-33 показаны результаты определения аффинности гуманизированного антитела по настоящему изобретению и эталонного антитела ch-175D10 в отношении клеток HEK293-hCLDN18.2 и клеток PDX-hCLDN18.2 соответственно. Экспериментальные результаты демонстрировали, что связывание гуманизированного антитела hu299B2-S32A по настоящему изобретению с клетками HEK293-hCLDN18.2 характеризовалось средней максимальной интенсивностью флуоресценции, составляющей 29529-39986, тогда как связывание эталонного антитела ch-175D10 с HEK293-hCLDN18.2 в тех же условиях взаимодействия характеризовалось средней максимальной интенсивностью флуоресценции, составляющей только 26921, что указывает на то, что аффинность гуманизированного антитела hu299B2-S32A в отношении HEK293-hCLDN18.2 превосходила аффинность эталонного антитела ch-175D10. Связывание hu253C4-N31Q с HEK293-hCLDN18.2 характеризовалось средней максимальной интенсивностью флуоресценции, сопоставимой с таковой эталонного антитела ch-175D10, и EC50 превосходила таковую эталонного антитела ch-175D10.
Связывание hu299B2-S32A и hu253C4-N31Q по настоящему изобретению с PDX-hCLDN18.2 характеризовалось средней максимальной интенсивностью флуоресценции, составляющей 15585-25189, концентрацией при половинном связывании (EC50), составляющей 11,42-29,68 нМ, тогда как связывание эталонного антитела ch-175D10 с PDX- hCLDN18.2 в тех же условиях взаимодействия характеризовалось средней максимальной интенсивностью флуоресценции, составляющей только 5703, и концентрацией при половинном связывании (EC50), составляющей 24,89 нМ. Можно видеть, что максимальное связывание гуманизированного антитела по настоящему изобретению с нативным антигеном hCLDN18.2 было сильнее, чем связывание ch-175D10, и EC50 была сопоставимой с EC50 ch-175D10.
B. Селективность связывания гуманизированных антител
Связывание гуманизированного антитела по настоящему изобретению с клетками HEK293-mCLDN18.2 и клетками HEK293-hCLDN18.1 исследовали с применением FACS в соответствии со способом, описанным в примере 4B.
Раздельно собирали клетки HEK293-mCLDN18.2 и HEK293-hCLDN18.1 и ресуспендировали в PBS для корректировки концентрации клеток, а затем добавляли гуманизированное антитело, разбавленное с градиентом, где нерелевантный человеческий IgG использовали в качестве отрицательного контроля, а ch-175D10 все еще представлял собой положительный контроль (эталонное антитело). После инкубации при 4°C на встряхиваемом столе в течение 50 мин смесь два раза промывали раствором фосфатного буфера с центрифугированием, добавляли флуоресцентно меченное вторичное антитело к человеческому IgG, 100 мкл на лунку; после инкубации при 4°C на встряхиваемом столе в течение 40 мин смесь два раза промывали фосфатным буферным раствором с центрифугированием и затем подготовленный образец выявляли на проточном цитометре; с помощью программного обеспечения GraphPad рассчитывали концентрацию при половинном связывании (EC50) и среднюю максимальную интенсивность флуоресценции (самое высокое значение MFI), и результаты показаны в таблице 12.
Таблица 12. Связывание гуманизированных антител к CLDN18.2 с mCLDN18.2 и hCLDN18.1 соответственно


В таблице 12 показаны результаты определения аффинности гуманизированного антитела по настоящему изобретению и эталонного антитела ch-175D10 в отношении клеток HEK293-mCLDN18.2 и клеток HEK293-hCLDN18.1 соответственно. Экспериментальные результаты демонстрировали, что гуманизированное антитело по настоящему изобретению было таким же, как и эталонное антитело ch-175D10, причем оба из них связывались с антигеном mCLDN18.2, где связывание гуманизированного антитела с HEK293-mCLDN18.2 характеризовалось средней максимальной интенсивностью флуоресценции, составляющей 36841-102785, и концентрацией при половинном связывании (EC50), составляющей 0,026-0,342 мкг/мл, связывание эталонного антитела ch-175D10 с HEK293-mCLDN18.2 в тех же условиях взаимодействия характеризовалось средней максимальной интенсивностью флуоресценции, составляющей 86407, и концентрацией при половинном связывании (EC50), составляющей 0,136 мкг/мл, что указывает на то, что связывание гуманизированного антитела с mCLDN18.2 сопоставимо со связыванием эталонного антитела. Более того, гуманизированное антитело было таким же, как и эталонное антитело ch-175D10, но при этом не связывалось с антигеном hCLDN18.1.
Пример 9. Функциональный анализ гуманизированных антител in vitro
A. Антителозависимая клеточноопосредованная цитотоксичность (ADCC)
Согласно способу, описанному в примере 5A, клетки CHO-K1/hCLDN18.2 использовали в качестве клеток-мишеней, NK-клетки, трансфицированные геном FcγRIIIa типа 158V/V (NK92/FcRγ3a.158V/V), использовали в качестве эффекторных клеток, и высвобождение лактатдегидрогеназы (LDH) в клетке выявляли с помощью набора для анализа цитотоксичности (Roche) и использовали в качестве индикатора эффекта уничтожения клеток.
Процент лизиса клеток, вызванного эффектом ADCC, рассчитывали с применением следующей формулы:
% лизиса клеток = 100% × (высвобождение образца - смешанное высвобождение из клеток-мишеней/эффекторных клеток)/(максимальное высвобождение - высвобождение из клеток-мишеней), где максимальное высвобождение представляло собой значение поглощения, полученное в лунках с клетками-мишенями, обработанными с помощью Triton X-100, смешанное высвобождение из клеток-мишеней/эффекторных клеток представляло собой значение поглощения, полученное в лунках со смесью клеток-мишеней и эффекторных клеток, и высвобождение из клеток-мишеней представляло собой значение поглощения, полученное в лунках, содержащих только клетки-мишени, высвобождение образца представляло собой значения поглощения, полученные в лунках со смесью гуманизированного антитела, клеток-мишеней и эффекторных клеток, и EC50 и максимальный лизис рассчитывали с помощью программного обеспечения GraphPad, и результаты показаны в таблице 13.
Таблица 13. Активность ADCC гуманизированных антител к CLDN18.2


В таблице 13 и на фиг. 34-35 показаны результаты определения ADCC гуманизированного антитела по настоящему изобретению и эталонного антитела ch-175D10 на клетках CHO-K1/hCLDN18.2. Экспериментальные результаты демонстрировали, что максимальный эффект ADCC гуманизированного антитела по настоящему изобретению на клетках CHO-K1/hCLDN18.2 составлял 54,85-70,26%, а эффект ADCC эталонного антитела ch-175D10 составлял приблизительно 50% в тех же условиях взаимодействия. Концентрация гуманизированного антитела по настоящему изобретению, при которой эффект ADCC достигал 50% (EC50), составляла 0,022-0,038 мкг/мл, а концентрация ch-175D10, при которой эффект ADCC составлял 50% (EC50) в тех же условиях взаимодействия, составляла 0,040 мкг/мл. Представленные выше результаты демонстрировали, что по активности ADCC гуманизированные антитела по настоящему изобретению были сопоставимы с эталонным антителом ch-175D10.
B. Комплементзависимая цитотоксичность (CDC)
Согласно способу, описанному в примере 5B, жизнеспособность клеток измеряли с помощью набора для хемилюминесцентного анализа жизнеспособности клеток CellTiter-Glo® (Promega) с применением CHO-K1/hCLDN18.2 в качестве клеток-мишеней и объединенной нормальной сыворотки крови человека (PNHS) в качестве источника комплемента и результаты считывали с применением программного обеспечения PHERAstar Plus.
Степень лизиса клеток, вызванного гуманизированным антителом, в анализе CDC рассчитывали с применением следующей формулы:
% лизиса клеток = 100% × (1-(тестируемые лунки - контрольные лунки с сывороткой крови)/(лунки с клетками + сыворотка крови - контрольные лунки с сывороткой крови))
Экспериментальные контроли представляют собой контрольные лунки с сывороткой крови: только сыворотка крови (т. е. 30 мкл буфера + 10 мкл разбавленной сыворотки крови). Лунки с клетками + сыворотка крови: сыворотку крови добавляли в лунки с суспензией клеток CHO-K1/hCLDN18.2 (т. е. 20 мкл суспензии клеток + 10 мкл буфера + 10 мкл разбавленной сыворотки крови). Тестируемые лунки: сыворотку крови и химерное антитело добавляли в лунки с суспензией клеток CHO-K1/hCLDN18.2 (т. е. 20 мкл суспензии клеток + 10 мкл антитела + 10 мкл разбавленной сыворотки крови).
EC50 и максимальный лизис рассчитывали с применением программного обеспечения GraphPad и результаты показаны в таблице 14.
Таблица 14. Активность CDC гуманизированных антител к CLDN18.2


В таблице 14 и на фиг. 36-37 показаны результаты определения CDC гуманизированного антитела по настоящему изобретению и эталонного антитела ch-175D10 на клетках CHO-K1/hCLDN18.2. Экспериментальные результаты демонстрировали, что максимальный эффект CDC гуманизированного антитела по настоящему изобретению на клетках CHO-K1/hCLDN18.2 составлял 96,11-99,87%, а максимальный эффект CDC эталонного антитела ch-175D10 составлял 87,76% в тех же условиях взаимодействия. Концентрация химерного антитела по настоящему изобретению, при которой эффект CDC достигал 50% (EC50), составляла 0,092-0,175 мкг/мл, а концентрация ch-175D10, при которой эффект CDC составлял 50% (EC50) в тех же условиях взаимодействия, была выше 1 мкг/мл. Можно видеть, что активность CDC всех гуманизированных антител была сильнее, чем активность CDC эталонного антитела.
Подразумевается, что описанные выше варианты осуществления настоящего изобретения являются только иллюстративными, и специалист в данной области техники сможет распознать или определить эквиваленты многочисленных конкретных соединений, материалов и действий без проведения дополнительных экспериментов. Подразумевается, что все такие эквиваленты входят в объем настоящего изобретения и охватываются формулой изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> QILU PHARMACEUTICAL CO., LTD.
<120> АНТИТЕЛО ПРОТИВ КЛАУДИНА 18A2 И ЕГО ПРИМЕНЕНИЕ
<130> MTPIRU20024
<140> PCT/CN2020/090427
<141> 2020-05-15
<150> CN201910406762.4
<151> 2019-05-16
<160> 128
<170> SIPOSequenceListing 1.0
<210> 1
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 1
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Met Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Pro Cys Lys Ala Ser Gly Tyr Thr Leu Thr Gly Tyr
20 25 30
Trp Ile Glu Trp Leu Lys Gln Arg Pro Arg His Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Leu Leu Gly Ser Gly Ser Ile Lys Tyr Asn Val Lys Phe
50 55 60
Lys Asp Lys Ala Thr Phe Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Leu Thr Thr Glu Asp Ser Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Lys Gly Leu Arg Gly Asn Ser Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 2
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 2
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Ser Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Arg Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Tyr Tyr Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 3
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 3
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Thr
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Asn Tyr
20 25 30
Trp Thr His Trp Met Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile His Pro Asn Ser Gly Ser Ser Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Arg Ser Ser Ser Thr Val Tyr
65 70 75 80
Met Gln Leu Arg Arg Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Ile His Tyr Gly Asn Ser Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser
115
<210> 4
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 4
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Phe Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Trp Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Ala Tyr Ser Tyr Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 5
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 5
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Thr
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Thr His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile His Pro Asn Ser Gly Ser Ser Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Arg Arg Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Ile His Tyr Gly Asn Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser
115
<210> 6
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 6
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Ile Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Phe Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 7
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 7
Gln Val Gln Leu Gln Gln Pro Gly Thr Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile His Pro Asn Ser Tyr Ser Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Arg Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Ile Tyr Tyr Gly Asn Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser
115
<210> 8
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 8
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Arg Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Phe Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr His Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Phe Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Arg Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 9
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 9
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Met Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Trp Ile Glu Trp Ile Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Leu Pro Gly Ser Gly Ser Ile Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Lys Ala Thr Phe Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Thr Glu Asp Ser Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Lys Gly Leu Arg Gly Asn Ser Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 10
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 10
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Arg Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Tyr Tyr Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 11
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 11
Glu Val His Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
His Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Tyr Asn Gly Gly Ile Arg Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Ile Tyr Tyr Gly Asn Ser Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ala
115
<210> 12
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 12
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asn Tyr Ile Tyr Pro Phe Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Arg
<210> 13
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 13
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Asp Tyr
20 25 30
His Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Val
35 40 45
Gly Leu Ile Asn Pro Tyr Asn Gly Gly Ile Arg Phe Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Ile Tyr Tyr Gly Asn Ser Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ala
115
<210> 14
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 14
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Leu Thr Cys Lys Ser Gly Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Gly Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Phe Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 15
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 15
Gln Val Gln Leu Gln Gln Ser Gly Ala Gly Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Ser Tyr
20 25 30
Trp Met Ile Trp Val Lys Gln Arg Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Gln Ile Tyr Pro Gly Asp Gly Asp Thr Asn Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Phe
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Thr Arg Ile Tyr Tyr Gly Asn Ala Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ala
115
<210> 16
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 16
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 17
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 17
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Gln Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Phe Ile Asn Pro Tyr Asn Gly Gly Ile Arg Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Ile Tyr Phe Gly Asn Ser Phe Ala Asn Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ala
115
<210> 18
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 18
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Pro Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Arg Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ile Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Asn Leu Glu Ile
100 105 110
Lys
<210> 19
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 19
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Glu Phe Ser Leu Thr Thr Tyr
20 25 30
Gly Val Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Gly Asp Gly Ser Thr Asn Tyr His Ser Ala Leu Ile
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Thr Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Leu Asn Ser Leu Gln Thr Asp Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Lys Pro Gly Leu Arg Asn Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser
115
<210> 20
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 20
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Ser Val Ser Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Gly Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Leu Ile Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu
100 105 110
Lys
<210> 21
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 21
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Arg Pro Gly Val
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Gly Ser Ser Tyr Thr Phe Thr Asp Tyr
20 25 30
Thr Met His Trp Val Lys Gln Ser His Ala Lys Ser Leu Glu Trp Ile
35 40 45
Gly Phe Ile Gly Val Tyr Tyr Gly Asn Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Met Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ala Arg Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ile Gly Arg Gly Asn Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser
115
<210> 22
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 22
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Asn Cys Gln Asn
85 90 95
Ala Tyr Ser Tyr Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 23
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 23
Asp Val Gln Leu Gln Glu Ser Gly Pro Asp Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Ile Cys Thr Val Thr Gly Tyr Ser Ile Thr Ser Gly
20 25 30
Tyr Ser Trp His Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Met Gly Tyr Ile His Tyr Ser Gly Gly Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Ile Ser Phe Thr Arg Asp Thr Ser Lys Asn Gln Phe Phe
65 70 75 80
Leu Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Leu Glu Arg Gly Asn Ser Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ala
115
<210> 24
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 24
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Thr Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Phe Tyr Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 25
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 25
Glu Ile Gln Leu Val Glu Ser Gly Gly Gly Leu Val Arg Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Lys Asn Tyr
20 25 30
Val Met Ser Trp Val Arg Gln Ser Pro Glu Arg Arg Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Thr Gly Gly Asp Tyr Thr Tyr Tyr Val Asp Thr Val
50 55 60
Thr Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Glu Met Thr Ser Leu Arg Ser Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Val Gly Tyr Gly Asn Ser Leu Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser
115
<210> 26
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 26
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Ser Cys Gln Asn
85 90 95
Asn Tyr Phe Tyr Pro Leu Thr Phe Gly Ala Gly Thr Glu Leu Glu Leu
100 105 110
Lys
<210> 27
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 27
Gln Val Gln Leu Lys Gln Ser Gly Pro Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Thr Ser Gly Tyr Ile Phe Thr Asn Tyr
20 25 30
Trp Ile His Trp Val Lys Gln Arg Ser Gly Gln Gly Leu Glu Trp Val
35 40 45
Val Arg Ile Tyr Pro Gly Thr Gly Asn Thr Tyr Tyr Asn Glu Lys Phe
50 55 60
Thr Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Lys Tyr Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ser Arg Glu Gly Tyr Gly Lys Gly Asn Ser Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 28
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 28
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Asn Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Phe Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr His Cys Gln Asn
85 90 95
Ala Tyr Tyr Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Met
100 105 110
Lys
<210> 29
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 29
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Glu Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Ala Tyr
20 25 30
Asn Met Asn Trp Val Arg Gln Arg Asn Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asp Pro Tyr Tyr Gly Gly Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Lys Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Thr Val Tyr Tyr Gly Asn Ser Leu Ile Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ala
115
<210> 30
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 30
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Thr Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asn Tyr Phe Tyr Pro Leu Thr Phe Gly Ala Gly Thr Gln Leu Glu Leu
100 105 110
Lys
<210> 31
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 31
Gln Val Gln Leu Lys Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Thr Ser Gly Tyr Thr Phe Thr Thr Phe
20 25 30
Trp Ile His Trp Ile Lys Gln Arg Ser Gly Gln Gly Leu Glu Trp Ile
35 40 45
Ala Lys Ile Tyr Pro Gly Thr Gly Tyr Thr Tyr Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Ala Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Lys Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Gly Tyr Gly Lys Gly Asn Ala Val Asp Phe Trp Gly Gln
100 105 110
Gly Ser Ser Val Thr Val Ser Ser
115 120
<210> 32
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 32
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Phe Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Asp Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Thr Tyr Pro Ser Thr Phe Gly Gly Gly Thr Asn Leu Glu Ile
100 105 110
Lys
<210> 33
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 33
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Arg Pro Gly Glu
1 5 10 15
Thr Val Arg Ile Ser Cys Lys Ala Ser Gly Phe Thr Phe Thr Thr Ala
20 25 30
Gly Met His Trp Val Gln Lys Met Ala Gly Lys Gly Leu Lys Trp Leu
35 40 45
Gly Trp Thr Asn Thr His Ser Gly Glu Pro Lys Tyr Ala Glu Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Asp Thr Ser Gly Ser Asp Ala Tyr
65 70 75 80
Leu Gln Ile Gly Asn Leu Lys Tyr Glu Asp Ala Ala Thr Tyr Phe Cys
85 90 95
Ala Lys Trp Gly Arg Gly Asn Ala Leu Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser
115
<210> 34
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 34
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Asn Thr Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Thr Tyr Ser Tyr Pro Leu Thr Phe Gly Gly Gly Thr Lys Leu Glu Leu
100 105 110
Arg
<210> 35
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 35
Gln Val Gln Leu Lys Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Ser Leu Ser Cys Lys Thr Ser Gly Tyr Ile Phe Thr Ser Tyr
20 25 30
Trp Ile His Trp Val Lys Gln Arg Ser Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Phe Tyr Pro Gly Thr Gly Thr Ala Tyr Tyr Asn Glu Asn Phe
50 55 60
Glu Gly Lys Ala Thr Leu Thr Ala Asp Arg Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Lys Ser Asp Asp Ser Ala Val Tyr Phe Cys
85 90 95
Thr Arg Glu Gly Tyr Gly Lys Gly Asn Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 36
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 36
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Thr Gly
1 5 10 15
Glu Lys Val Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Ser Gly Gln
35 40 45
Pro Pro Glu Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Val Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Tyr Phe Pro Phe Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 37
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 37
Gly Tyr Trp Ile Glu
1 5
<210> 38
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 38
Glu Ile Leu Leu Gly Ser Gly Ser Ile Lys Tyr Asn Val Lys Phe Lys
1 5 10 15
Asp
<210> 39
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 39
Lys Gly Leu Arg Gly Asn Ser Phe Asp Tyr
1 5 10
<210> 40
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 40
Asn Tyr Trp Thr His
1 5
<210> 41
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 41
Met Ile His Pro Asn Ser Gly Ser Ser Asn Tyr Asn Glu Lys Phe Lys
1 5 10 15
Ser
<210> 42
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 42
Ile His Tyr Gly Asn Ser Met Asp Tyr
1 5
<210> 43
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 43
Ser Tyr Trp Thr His
1 5
<210> 44
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 44
Ile His Tyr Gly Asn Ala Met Asp Tyr
1 5
<210> 45
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 45
Asn Tyr Trp Met His
1 5
<210> 46
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 46
Met Ile His Pro Asn Ser Tyr Ser Thr Asn Tyr Asn Glu Lys Phe Arg
1 5 10 15
Ser
<210> 47
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 47
Ile Tyr Tyr Gly Asn Ala Met Asp Tyr
1 5
<210> 48
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 48
Glu Ile Leu Pro Gly Ser Gly Ser Ile Lys Tyr Asn Glu Lys Phe Lys
1 5 10 15
Asp
<210> 49
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 49
Asp Tyr His Met Asn
1 5
<210> 50
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 50
Val Ile Asn Pro Tyr Asn Gly Gly Ile Arg Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 51
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 51
Ile Tyr Tyr Gly Asn Ser Phe Ala Tyr
1 5
<210> 52
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 52
Leu Ile Asn Pro Tyr Asn Gly Gly Ile Arg Phe Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 53
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 53
Ser Tyr Trp Met Ile
1 5
<210> 54
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 54
Gln Ile Tyr Pro Gly Asp Gly Asp Thr Asn Tyr Asn Gly Lys Phe Lys
1 5 10 15
Gly
<210> 55
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 55
Ile Tyr Tyr Gly Asn Ala Phe Ala Tyr
1 5
<210> 56
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 56
Asp Tyr Gln Met Asn
1 5
<210> 57
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 57
Phe Ile Asn Pro Tyr Asn Gly Gly Ile Arg Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 58
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 58
Ile Tyr Phe Gly Asn Ser Phe Ala Asn
1 5
<210> 59
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 59
Thr Tyr Gly Val Ser
1 5
<210> 60
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 60
Val Ile Trp Gly Asp Gly Ser Thr Asn Tyr His Ser Ala Leu Ile Ser
1 5 10 15
<210> 61
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 61
Pro Gly Leu Arg Asn Ala Met Asp Tyr
1 5
<210> 62
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 62
Asp Tyr Thr Met His
1 5
<210> 63
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 63
Phe Ile Gly Val Tyr Tyr Gly Asn Thr Asn Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 64
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 64
Ile Gly Arg Gly Asn Ala Met Asp Tyr
1 5
<210> 65
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 65
Ser Gly Tyr Ser Trp His
1 5
<210> 66
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 66
Tyr Ile His Tyr Ser Gly Gly Thr Asn Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 67
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 67
Leu Glu Arg Gly Asn Ser Phe Ala Tyr
1 5
<210> 68
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 68
Asn Tyr Val Met Ser
1 5
<210> 69
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 69
Glu Ile Arg Thr Gly Gly Asp Tyr Thr Tyr Tyr Val Asp Thr Val Thr
1 5 10 15
Gly
<210> 70
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 70
Val Gly Tyr Gly Asn Ser Leu Asp Tyr
1 5
<210> 71
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 71
Asn Tyr Trp Ile His
1 5
<210> 72
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 72
Arg Ile Tyr Pro Gly Thr Gly Asn Thr Tyr Tyr Asn Glu Lys Phe Thr
1 5 10 15
Gly
<210> 73
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 73
Glu Gly Tyr Gly Lys Gly Asn Ser Met Asp Tyr
1 5 10
<210> 74
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 74
Ala Tyr Asn Met Asn
1 5
<210> 75
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 75
Asn Ile Asp Pro Tyr Tyr Gly Gly Thr Asn Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 76
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 76
Val Tyr Tyr Gly Asn Ser Leu Ile Tyr
1 5
<210> 77
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 77
Thr Phe Trp Ile His
1 5
<210> 78
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 78
Lys Ile Tyr Pro Gly Thr Gly Tyr Thr Tyr Tyr Asn Glu Lys Phe Lys
1 5 10 15
Gly
<210> 79
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 79
Glu Gly Tyr Gly Lys Gly Asn Ala Val Asp Phe
1 5 10
<210> 80
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 80
Thr Ala Gly Met His
1 5
<210> 81
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 81
Trp Thr Asn Thr His Ser Gly Glu Pro Lys Tyr Ala Glu Asp Phe Lys
1 5 10 15
Gly
<210> 82
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 82
Trp Gly Arg Gly Asn Ala Leu Asp Tyr
1 5
<210> 83
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 83
Ser Tyr Trp Ile His
1 5
<210> 84
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 84
Arg Phe Tyr Pro Gly Thr Gly Thr Ala Tyr Tyr Asn Glu Asn Phe Glu
1 5 10 15
Gly
<210> 85
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 85
Glu Gly Tyr Gly Lys Gly Asn Ala Met Asp Tyr
1 5 10
<210> 86
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 86
Lys Ser Ser Gln Ser Leu Leu Asn Ser Gly Asn Gln Lys Ser Tyr Leu
1 5 10 15
Thr
<210> 87
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 87
Lys Ser Ser Gln Ser Leu Phe Asn Ser Gly Asn Gln Lys Asn Tyr Leu
1 5 10 15
Thr
<210> 88
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 88
Lys Ser Ser Gln Ser Leu Leu Asn Ser Gly Asn Gln Lys Asn Tyr Leu
1 5 10 15
Thr
<210> 89
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 89
Lys Ser Gly Gln Ser Leu Leu Asn Ser Gly Asn Gln Lys Asn Tyr Leu
1 5 10 15
Thr
<210> 90
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 90
Lys Pro Ser Gln Ser Leu Leu Asn Ser Gly Asn Gln Lys Asn Tyr Leu
1 5 10 15
Thr
<210> 91
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 91
Lys Ser Ser Gln Ser Leu Leu Asn Ser Gly Asn Gln Lys Asn Tyr Leu
1 5 10 15
Ala
<210> 92
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 92
Lys Ser Thr Gln Ser Leu Leu Asn Ser Gly Asn Gln Lys Asn Tyr Leu
1 5 10 15
Thr
<210> 93
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 93
Trp Ala Ser Thr Arg Glu Ser
1 5
<210> 94
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 94
Trp Ala Ser Thr Trp Glu Ser
1 5
<210> 95
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 95
Trp Ala Phe Thr Arg Glu Ser
1 5
<210> 96
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 96
Gly Ala Ser Thr Arg Glu Ser
1 5
<210> 97
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 97
Gln Asn Asp Tyr Tyr Tyr Pro Phe Thr
1 5
<210> 98
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 98
Gln Asn Ala Tyr Ser Tyr Pro Phe Thr
1 5
<210> 99
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 99
Gln Asn Asp Tyr Ser Phe Pro Phe Thr
1 5
<210> 100
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 100
Gln Asn Asp Tyr Ser Tyr Pro Phe Thr
1 5
<210> 101
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 101
Gln Asn Asn Tyr Ile Tyr Pro Phe Thr
1 5
<210> 102
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 102
Gln Asn Asp Tyr Phe Tyr Pro Tyr Thr
1 5
<210> 103
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 103
Gln Asn Asp Tyr Ile Tyr Pro Tyr Thr
1 5
<210> 104
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 104
Gln Asn Asp Leu Ile Tyr Pro Leu Thr
1 5
<210> 105
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 105
Gln Asn Asp Tyr Phe Tyr Pro Phe Thr
1 5
<210> 106
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 106
Gln Asn Asn Tyr Phe Tyr Pro Leu Thr
1 5
<210> 107
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 107
Gln Asn Ala Tyr Tyr Tyr Pro Tyr Thr
1 5
<210> 108
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 108
Gln Asn Asp Tyr Thr Tyr Pro Ser Thr
1 5
<210> 109
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 109
Gln Asn Thr Tyr Ser Tyr Pro Leu Thr
1 5
<210> 110
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 110
Gln Asn Asp Tyr Tyr Phe Pro Phe Thr
1 5
<210> 111
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 111
Lys Ser Ser Gln Ser Leu Leu Gln Ser Gly Asn Gln Lys Asn Tyr Leu
1 5 10 15
Thr
<210> 112
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 112
Lys Ser Ser Gln Ser Leu Leu Asn Ala Gly Asn Gln Lys Asn Tyr Leu
1 5 10 15
Thr
<210> 113
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 113
Lys Ser Ser Gln Ser Leu Leu Asn Ser Ala Asn Gln Lys Asn Tyr Leu
1 5 10 15
Thr
<210> 114
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 114
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Asn Cys Lys Ser Ser Gln Ser Leu Leu Gln Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Phe Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr His Cys Gln Asn
85 90 95
Ala Tyr Tyr Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Met
100 105 110
Lys
<210> 115
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 115
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Asn Cys Lys Ser Ser Gln Ser Leu Leu Asn Ala
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Phe Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr His Cys Gln Asn
85 90 95
Ala Tyr Tyr Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Met
100 105 110
Lys
<210> 116
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 116
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Asn Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Ala Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Phe Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr His Cys Gln Asn
85 90 95
Ala Tyr Tyr Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Met
100 105 110
Lys
<210> 117
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 117
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Thr Gly
1 5 10 15
Glu Lys Val Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Gln Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Ser Gly Gln
35 40 45
Pro Pro Glu Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Val Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Tyr Phe Pro Phe Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 118
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 118
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Thr Gly
1 5 10 15
Glu Lys Val Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ala
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Ser Gly Gln
35 40 45
Pro Pro Glu Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Val Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Tyr Phe Pro Phe Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 119
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 119
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Thr Gly
1 5 10 15
Glu Lys Val Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Ala Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Ser Gly Gln
35 40 45
Pro Pro Glu Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Val Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Tyr Phe Pro Phe Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 120
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 120
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Asn Tyr
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Tyr Pro Gly Thr Gly Asn Thr Tyr Tyr Asn Glu Lys Phe
50 55 60
Thr Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Tyr Gly Lys Gly Asn Ser Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 121
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 121
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Leu Leu Asn Ala
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Ala Tyr Tyr Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 122
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 122
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Thr Ser Gly Tyr Ile Phe Thr Asn Tyr
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Tyr Pro Gly Thr Gly Asn Thr Tyr Tyr Asn Glu Lys Phe
50 55 60
Thr Gly Arg Val Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Glu Gly Tyr Gly Lys Gly Asn Ser Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 123
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 123
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Met Asn Cys Lys Ser Ser Gln Ser Leu Leu Asn Ala
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Phe Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr His Cys Gln Asn
85 90 95
Ala Tyr Tyr Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 124
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 124
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Met Asn Cys Lys Ser Ser Gln Ser Leu Leu Asn Ala
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Phe Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Val Ala Val Tyr His Cys Gln Asn
85 90 95
Ala Tyr Tyr Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 125
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 125
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Ser Tyr
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Phe Tyr Pro Gly Thr Gly Thr Ala Tyr Tyr Asn Glu Asn Phe
50 55 60
Glu Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Tyr Gly Lys Gly Asn Ser Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 126
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 126
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Leu Leu Gln Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Tyr Phe Pro Phe Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 127
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 127
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Leu Asn Cys Lys Ser Ser Gln Ser Leu Leu Gln Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Val Ser Ser Val Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Tyr Phe Pro Phe Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 128
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически полученный полипептид
<400> 128
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Thr Ser Gly Tyr Ile Phe Thr Ser Tyr
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Phe Tyr Pro Gly Thr Gly Thr Ala Tyr Tyr Asn Glu Asn Phe
50 55 60
Glu Gly Arg Val Thr Leu Thr Ala Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Glu Gly Tyr Gly Lys Gly Asn Ser Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА, СОДЕРЖАЩИЕ ПОЛИПЕПТИД, ВСТРОЕННЫЙ В УЧАСТОК КАРКАСНОЙ ОБЛАСТИ 3 | 2019 |
|
RU2796254C2 |
| АНТИТЕЛО ПРОТИВ СТОЛБНЯЧНОГО ТОКСИНА И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2815280C1 |
| АНТИТЕЛА, НАПРАВЛЕННЫЕ ПРОТИВ FC-РЕЦЕПТОР-ПОДОБНОГО БЕЛКА 5, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2774158C2 |
| АНТИ-CLDN АНТИТЕЛО, ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЕГО ОБНАРУЖЕНИЯ | 2020 |
|
RU2801315C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ, НАЦЕЛЕННЫЕ НА ПОДОБНЫЙ FC-РЕЦЕПТОРУ БЕЛОК 5, И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2779747C2 |
| АНТИТЕЛЬНЫЕ АГЕНТЫ, СПЕЦИФИЧНЫЕ К CD19 ЧЕЛОВЕКА, И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2773317C2 |
| АНТИТЕЛА, КОТОРЫЕ СВЯЗЫВАЮТ ОПУХОЛЕВУЮ ТКАНЬ, ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ | 2020 |
|
RU2806915C2 |
| АНТИТЕЛА ПРОТИВ КЛАУДИНА И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2815926C2 |
| C3-СВЯЗЫВАЮЩИЕ АГЕНТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2802307C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ МОДУЛЯЦИИ ПЕРЕДАЧИ СИГНАЛА LAIR | 2017 |
|
RU2757394C2 |


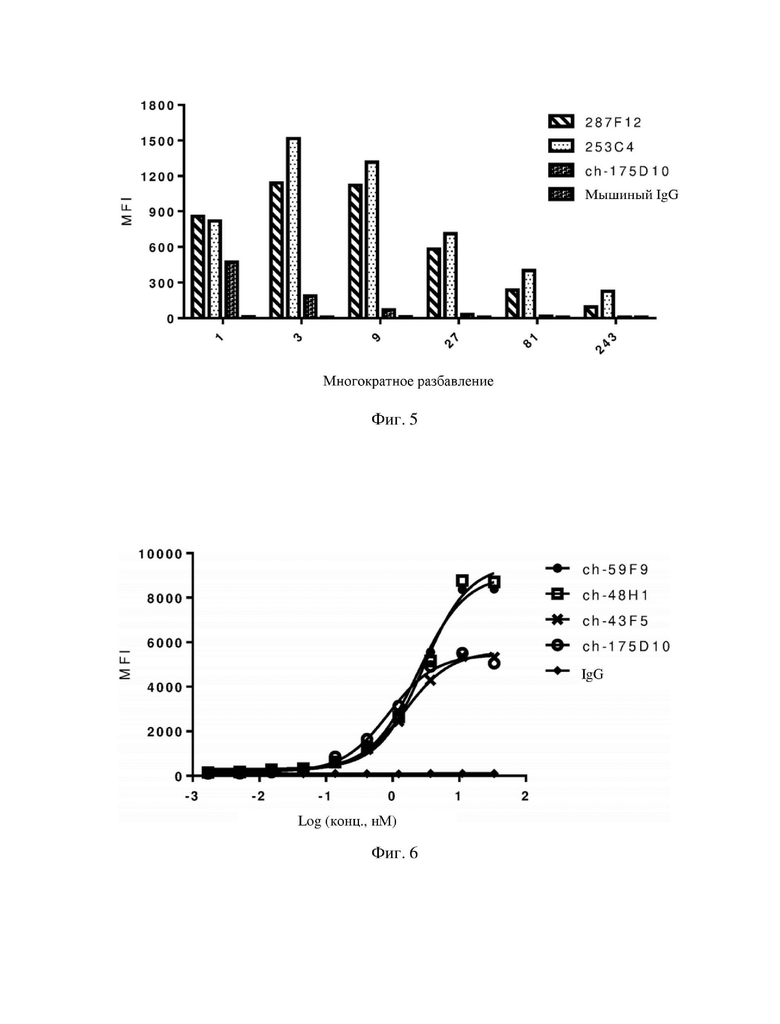




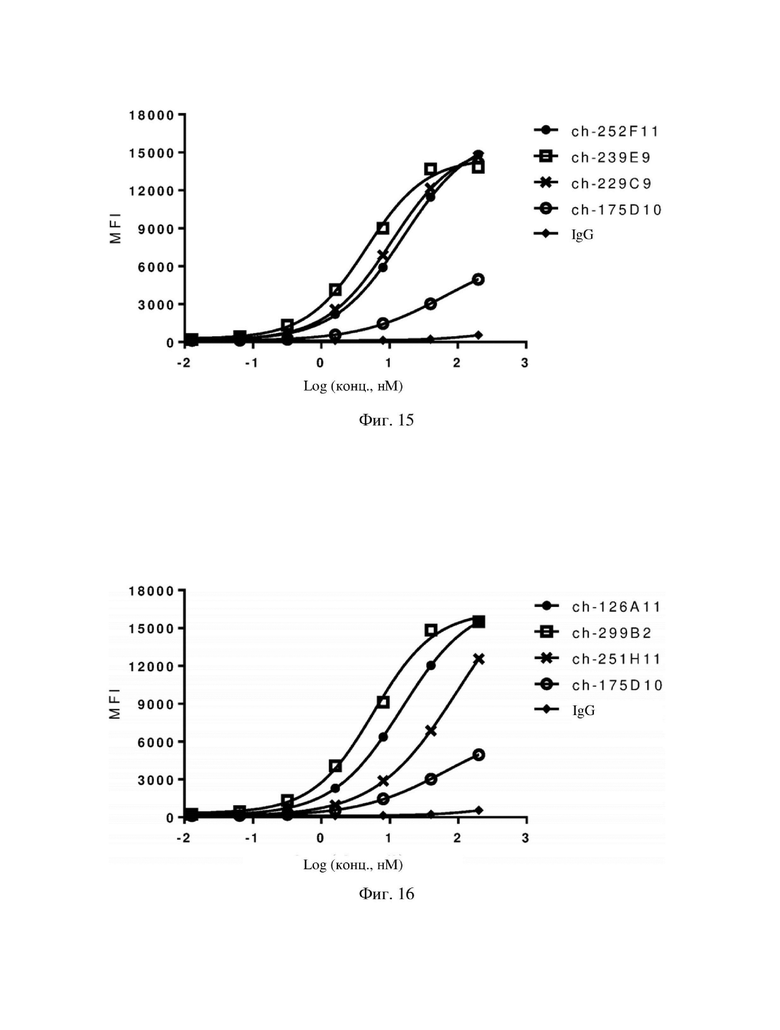





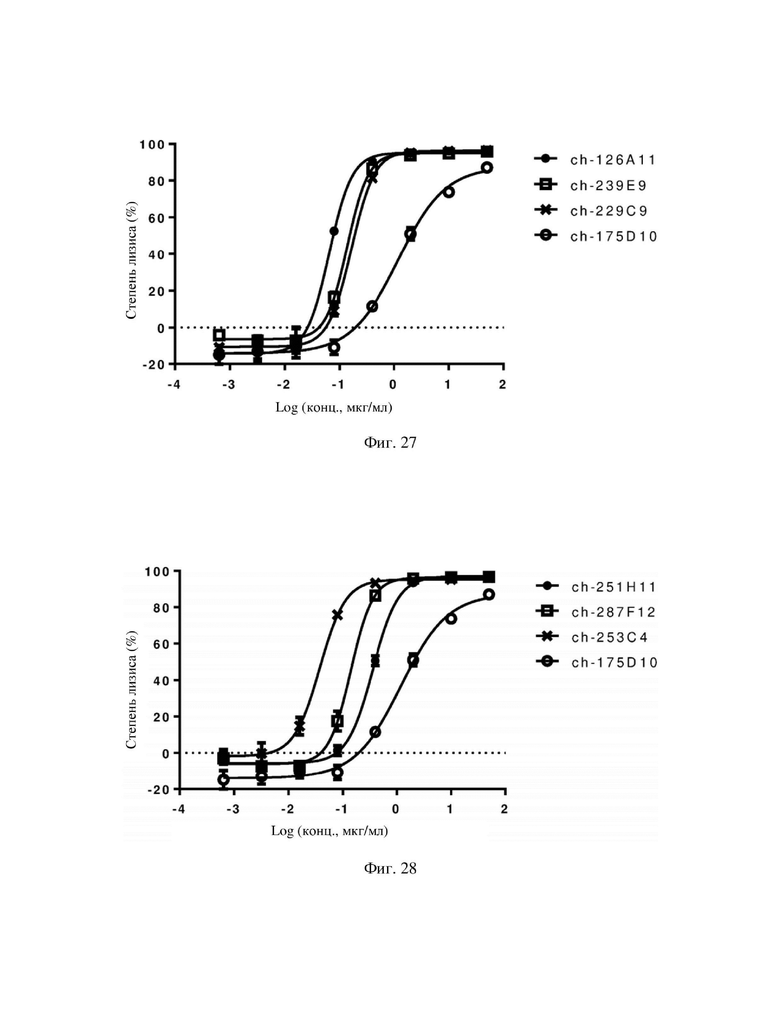


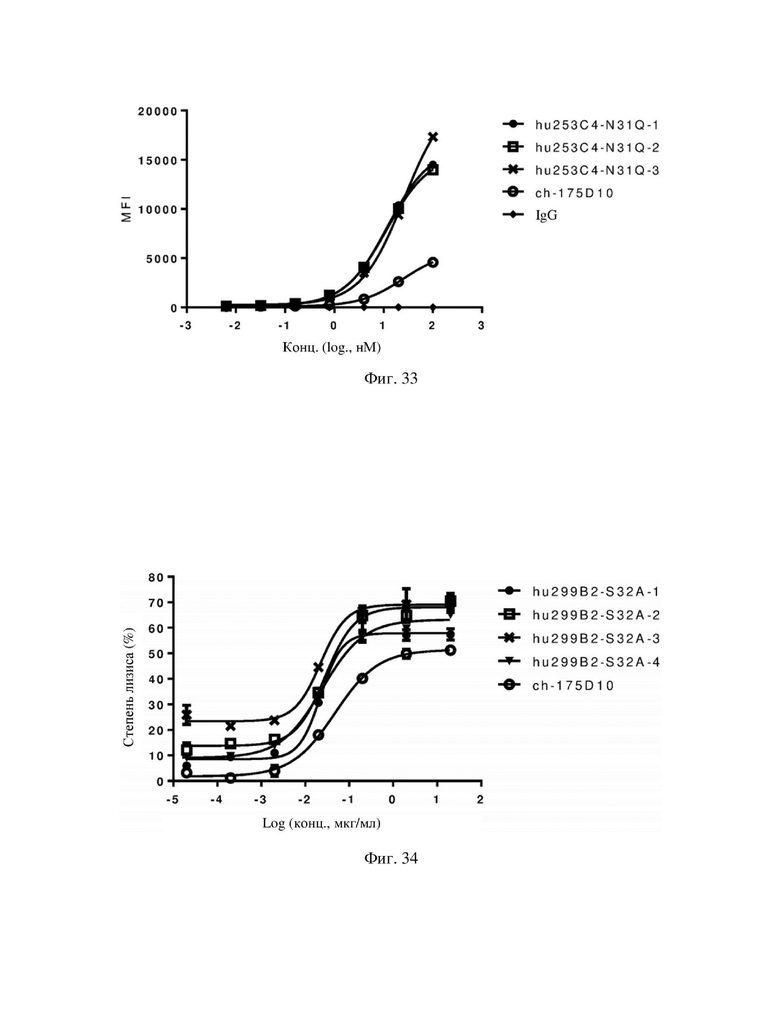


Изобретение относится к области биотехнологии. Описана группа изобретений, включающая антитело к CLDN18.2 или его антигенсвязывающий фрагмент, нуклеиновую кислоту, кодирующую вышеуказанное антитело, способ получения антитела к CLDN18.2 или его антигенсвязывающего фрагмента, применение антитела к CLDN18.2 или его антигенсвязывающего фрагмента в изготовлении лекарственного средства для специфического нацеливания на опухолевые клетки, экспрессирующие CLDN18.2, или диагностического реагента для выявления опухолей, экспрессирующих CLDN18.2 и способ выявления экспрессии CLDN18.2 в образце. Изобретение расширяет арсенал средств, связывающихся с к CLDN18.2. 5 н. и 5 з.п. ф-лы, 37 ил., 14 табл., 9 пр.
1. Антитело к CLDN18.2 или его антигенсвязывающий фрагмент, содержащие вариабельную область тяжелой цепи и вариабельную область легкой цепи, при этом вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, выбранные из группы, состоящей из:
SEQ ID NO: 71, SEQ ID NO: 72 и SEQ ID NO: 73;
и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, выбранные из группы, состоящей из:
SEQ ID NO: 88, SEQ ID NO: 93 и SEQ ID NO: 107, или
SEQ ID NO: 111, SEQ ID NO: 93 и SEQ ID NO: 107, или
SEQ ID NO: 112, SEQ ID NO: 93 и SEQ ID NO: 107, или
SEQ ID NO: 113, SEQ ID NO: 93 и SEQ ID NO: 107.
2. Антитело к CLDN18.2 или его антигенсвязывающий фрагмент по п. 1, содержащие вариабельную область тяжелой цепи и вариабельную область легкой цепи, где
(1) вариабельная область тяжелой цепи характеризуется от по меньшей мере 80% до 100% идентичности последовательности с SEQ ID NO: 27, 120, 122, и
(2) вариабельная область легкой цепи характеризуется от по меньшей мере 80% до 100% идентичности последовательности с SEQ ID NO: 28, 114, 115, 116, 121, 123, 124.
3. Антитело к CLDN18.2 или его антигенсвязывающий фрагмент по п. 1 или п. 2, характеризующиеся от по меньшей мере 80% до 100% идентичности последовательности с вариабельной областью тяжелой цепи и вариабельной областью легкой цепи из любой из групп, состоящих из:
(1) SEQ ID NO: 27 и 28;
(2) SEQ ID NO: 27 и 114;
(3) SEQ ID NO: 27 и 115;
(4) SEQ ID NO: 27 и 116;
(5) SEQ ID NO: 120 и 121;
(6) SEQ ID NO: 120 и 123;
(7) SEQ ID NO: 120 и 124;
(8) SEQ ID NO: 122 и 121.
4. Антитело к CLDN18.2 или его антигенсвязывающий фрагмент по любому из пп. 1-3, которые представляют собой мышиное антитело, химерное антитело или гуманизированное антитело.
5. Антитело к CLDN18.2 или его антигенсвязывающий фрагмент по любому из пп. 1-4, которые представляют собой моноклональное антитело; или
дополнительно содержат константную область тяжелой цепи и константную область легкой цепи, или содержат константную область тяжелой цепи, содержащую Fc или вариант Fc, при этом Fc получен из Fc мыши или человека; или
антитело к CLDN18.2 представляет собой полноразмерное антитело; или
антитело к CLDN18.2 или его антигенсвязывающий фрагмент представлены в форме IgG1, IgG2, IgG3 или IgG4; или
антитело к CLDN18.2 или его антигенсвязывающий фрагмент представляют собой Fab, Fv, scFv, F(ab')2, линейное антитело, однодоменное антитело.
6. Нуклеиновая кислота, кодирующая антитело к CLDN18.2 или его антигенсвязывающий фрагмент по любому из пп. 1-5.
7. Способ получения антитела к CLDN18.2 или его антигенсвязывающего фрагмента по любому из пп. 1-5, включающий культивирование клетки-хозяина, содержащей рекомбинантный вектор, в подходящих условиях и очистку продуктов экспрессии из клеток, где указанный рекомбинантный вектор содержит нуклеиновую кислоту по п. 6.
8. Применение антитела к CLDN18.2 или его антигенсвязывающего фрагмента по любому из пп. 1-5 в изготовлении лекарственного средства для специфического нацеливания на опухолевые клетки, экспрессирующие CLDN18.2, или диагностического реагента для выявления опухолей, экспрессирующих CLDN18.2.
9. Применение по п. 8, отличающееся тем, что опухоли включают рак желудка, рак поджелудочной железы, рак пищевода, рак легкого, рак яичника, рак толстой кишки, рак печени, рак головы и шеи и рак желчного пузыря и их метастазы, метастазы рака желудка, представляющие собой опухоль Крукенберга.
10. Способ выявления экспрессии CLDN18.2 в образце, включающий:
(1) приведение образца в контакт с антителом к CLDN18.2 или его антигенсвязывающим фрагментом по любому из пп. 1-5;
(2) выявление образования комплекса антитела к CLDN18.2 или его антигенсвязывающего фрагмента с CLDN18.2; необязательно антитело к CLDN18.2 или его антигенсвязывающий фрагмент являются меченными для выявления.
| WO 2018006882 A1, 11.01.2018 | |||
| WO 2016073649 A1, 12.05.2016 | |||
| АНТИТЕЛА ПРОТИВ КЛАУДИНА 18.2 ДЛЯ ДИАГНОСТИКИ РАКА | 2013 |
|
RU2661772C2 |
| WO 2013174509 A1, 28.11.2013 | |||
| EP3099706 B1, 31.10.2018 | |||
| Micke P | |||
| et al | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Амперметр с подвижным железом | 1925 |
|
SU2206A1 |
Авторы
Даты
2024-01-11—Публикация
2020-05-15—Подача