ПЕРЕКРЕСТНАЯ ССЫЛКА
[1] Данная заявка испрашивает приоритет по отношению к заявке № PCT/CN2018/119797 согласно Договору о патентной кооперации, поданной 7 декабря 2018 г., указанная заявка включена в данный документ посредством ссылки в полном объеме для всех целей.
УРОВЕНЬ ТЕХНИКИ
[2] Рак пищевода и поджелудочной железы относится к числу злокачественных новообразований, характеризующихся наиболее неудовлетворенными медицинскими потребностями. Рак желудка (РЖ) занимает третье место по распространенности среди причин смерти от рака, и наибольшая доля больных раком желудка приходится на Восточную Азию, в частности, на Корею, Монголию, Японию и Китай. Рак поджелудочной железы характеризуется наиболее высоким уровнем смертности среди всех видов рака в развитых странах, и ожидается его рост как в Соединенных Штатах Америки, так и в Китае.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[3] В определенных вариантах реализации данного изобретения, в данном документе раскрыты антитела против клаудина 18.2 и фармацевтические композиции, содержащие их. В определенных вариантах реализации данного изобретения, в данном документе также описаны способы лечения субъекта, имеющего рак, с помощью антитела против клаудина 18.2 и способы индукции эффекта уничтожения клеток с помощью антитела против клаудина 18.2.
[4] В определенных вариантах реализации данного изобретения, в данном документе раскрыто антитело против клаудина 18.2 (антитело против CLDN18.2), характеризующееся полумаксимальной эффективной концентрацией (EC50), которая ниже, чем EC50 референсного антитела 175D10, при этом указанное референсное антитело 175D10 содержит последовательность тяжелой цепи (HC), указанную в SEQ ID NO: 98, и последовательность легкой цепи (LC), указанную в SEQ ID NO: 99.
[5] В определенных вариантах реализации данного изобретения, в данном документе раскрыто антитело против клаудина 18.2 (антитело против CLDN18.2), содержащее по меньшей мере одну мутацию в сайте посттрансляционной модификации.
[6] В определенных вариантах реализации данного изобретения, в данном документе раскрыто антитело против клаудина 18.2 (антитело против CLDN18.2), содержащее по меньшей мере одну мутацию в области Fc, которая придает усиленную антителозависимую клеточно-опосредованную цитотоксичность (АЗКЦ, англ. «ADCC»), при этом усиленная АЗКЦ сравнивается с референсным антителом 175D10, содержащим последовательность тяжелой цепи (HC), указанную в SEQ ID NO: 98, и последовательность легкой цепи (LC), указанную в SEQ ID NO: 99 В некоторых вариантах реализации данного изобретения ЕС50 указанного антитела против CLDN18.2 составляет около 5 нМ или меньше. В некоторых вариантах реализации данного изобретения ЕС50 антитела против CLDN18.2 составляет около 5 нМ, около 4 нМ, около 3 нМ, около 2 нМ, около 1 нМ, около 0,5 нМ или меньше.
[7] В определенных вариантах реализации данного изобретения, в данном документе раскрыто антитело против клаудина 18.2 (антитело против CLDN18.2), обладающее более высокой аффинностью связывания с CLDN18.2 по сравнению с аффинностью связывания референсного антитела 175D10, при этом указанное референсное антитело 175D10 содержит последовательность тяжелой цепи (HC), указанную в SEQ ID NO: 98, и последовательность легкой цепи (LC), указанную в SEQ ID NO: 99.
[8] В некоторых вариантах реализации данного изобретения антитело против CLDN18.2 содержит вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL), при этом указанная область VH содержит: последовательность CDR1 GFSLTSYX1VX2; где X1 выбран из N или G; и X2 выбран из Y или H; последовательность CDR2 VIWX3X4GX5TX6YX7X8X9LX10S; где X3 выбран из N или P; X4 выбран из T или G; X5 выбран из A или N; X6 выбран из R или N; X7 выбран из N, Q или E; X8 выбран из S или I; X9 выбран из Т или А; и X10 выбран из K или M; и последовательность CDR3 DX11X12X13X14X15X16X17X18X19X20; где X11 выбран из S или R; X12 выбран из A или R; X13 выбран из M или L; X14 выбран из P или A; X15 выбран из A или M; X16 выбран из I или D; X17 выбран из P или Y; X18 присутствует или отсутствует, если присутствует, то представляет собой F; X19 присутствует или отсутствует, если присутствует, то представляет собой A; и X20 присутствует или отсутствует, если присутствует, то представляет собой Y. В некоторых вариантах реализации данного изобретения указанная область VH содержит последовательность CDR1 X21X22X23X24X25SFGMH; где X21 присутствует или отсутствует, если присутствует, то представляет собой G; X22 присутствует или отсутствует, если присутствует, то представляет собой F; X23 присутствует или отсутствует, если присутствует, то представляет собой T; X24 присутствует или отсутствует, если присутствует, то представляет собой F; и X25 присутствует или отсутствует, если присутствует, то представляет собой S; последовательность CDR2 YISSGSX26X27IYYX28DX29X30KG; где X26 выбран из S или G; X27 выбран из P или S; X28 выбран из V или A; X29 выбран из K или T; и X30 выбран из L или V; и последовательность CDR3 AX31X32X33X34X35X36X37X38X39X40X41; где X31 выбран из G или T; X32 выбран из Y или S; X33 выбран из A или Y; X34 выбран из V или Y; X35 выбран из R или Y; X36 выбран из N или G; X37 выбран из A или N; X38 выбран из L или A; X39 выбран из D или L; X40 выбран из Y или E; и X41 присутствует или отсутствует, если присутствует, то представляет собой Y. В некоторых вариантах реализации данного изобретения указанная область VH содержит последовательность CDR1, состоящую из SEQ ID NO: 1, последовательность CDR2 VIWNTGATRYX7SX9LKS и последовательность CDR3, состоящую из SEQ ID NO: 3, где X7 выбран из N, Q или E; и X9 выбран из T или A. В некоторых вариантах реализации данного изобретения указанная область VH содержит последовательность CDR1, состоящую из SEQ ID NO: 13, последовательность CDR2 VIWPGGNTNYX7X8ALMS и последовательность CDR3, состоящую из SEQ ID NO: 15, где X7 выбран из N или E; и X8 выбран из S или I. В некоторых вариантах реализации данного изобретения указанная область VH содержит последовательность CDR1, выбранную из SEQ ID NO: 1, 7, 10 или 13; последовательность CDR2, выбранную из SEQ ID NO: 2, 4, 5, 6, 8, 11, 14, 16 или 17; и последовательность CDR3, выбранную из SEQ ID NO: 3, 9, 12 или 15. В некоторых вариантах реализации данного изобретения указанная область VH содержит последовательность CDR1, состоящую из SEQ ID NO: 1; последовательность CDR2, выбранную из SEQ ID NO: 2, 4, 5 или 6; и последовательность CDR3, состоящую из SEQ ID NO: 3. В некоторых вариантах реализации данного изобретения указанная область VH содержит последовательность CDR1, состоящую из SEQ ID NO: 13; последовательность CDR2, выбранную из SEQ ID NO: 14, 16 или 17; и последовательность CDR3, состоящую из SEQ ID NO: 15. В некоторых вариантах реализации данного изобретения указанная область VH содержит последовательность CDR1, состоящую из SEQ ID NO: 7, последовательность CDR2, состоящую из SEQ ID NO: 8, и последовательность CDR3, состоящую из SEQ ID NO: 9. В некоторых вариантах реализации данного изобретения указанная область VH содержит последовательность CDR1, состоящую из SEQ ID NO: 10, последовательность CDR2, состоящую из SEQ ID NO: 11, и последовательность CDR3, состоящую из SEQ ID NO: 12. В некоторых вариантах реализации данного изобретения указанная область VL содержит последовательность CDR1, выбранную из SEQ ID NO: 18, 21, 24-28, 31-35, 38 или 39; последовательность CDR2, выбранную из SEQ ID NO: 19, 22, 29 или 36; и последовательность CDR3, выбранную из SEQ ID NO: 20, 23, 30 или 37. В некоторых вариантах реализации данного изобретения указанная область VL содержит последовательность CDR1, выбранную из SEQ ID NO: 21 или 24-27; последовательность CDR2, состоящую из SEQ ID NO: 22; и последовательность CDR3, состоящую из SEQ ID NO: 23. В некоторых вариантах реализации данного изобретения указанная область VL содержит последовательность CDR1, выбранную из SEQ ID NO: 28 или 31-34; последовательность CDR2, состоящую из SEQ ID NO: 29; и последовательность CDR3, состоящую из SEQ ID NO: 30. В некоторых вариантах реализации данного изобретения указанная область VL содержит последовательность CDR1, выбранную из SEQ ID NO: 35, 38 или 39; последовательность CDR2, состоящую из SEQ ID NO: 36; и последовательность CDR3, состоящую из SEQ ID NO: 37. В некоторых вариантах реализации данного изобретения указанная область VL содержит последовательность CDR1, состоящую из SEQ ID NO: 18, последовательность CDR2, состоящую из SEQ ID NO: 19, и последовательность CDR3, состоящую из SEQ ID NO: 20.
[9] В некоторых вариантах реализации данного изобретения антитело против CLDN18.2 представляет собой полноразмерное антитело. В некоторых вариантах реализации данного изобретения антитело против CLDN18.2 представляет собой связывающий фрагмент. В некоторых вариантах реализации данного изобретения антитело против CLDN18.2 содержит моновалентный Fab', бивалентный Fab2, одноцепочечный вариабельный фрагмент (оцFv), диатело, миниантитело, наноантитело, однодоменное антитело (одАт) или антитело верблюдовых, или их связывающий фрагмент. В некоторых вариантах реализации данного изобретения антитело против CLDN18.2 содержит гуманизированное антитело или его связывающий фрагмент, химерное антитело или его связывающий фрагмент, моноклональное антитело или его связывающий фрагмент, или биспецифическое антитело или его связывающий фрагмент.
[10] В некоторых вариантах реализации данного изобретения антитело против CLDN18.2 содержит мутацию в сайте посттрансляционной модификации. В некоторых вариантах реализации данного изобретения указанная мутация находится в аминокислотном положении 60, 61 или 62 области VH, и при этом аминокислотные положения соответствуют положению 60, 61 или 62 из SEQ ID NO: 40. В некоторых вариантах реализации данного изобретения указанная мутация находится в аминокислотном положении 60 или 62 из SEQ ID NO: 40. В некоторых вариантах реализации данного изобретения указанная мутация находится в аминокислотном положении 60 или 61 из SEQ ID NO: 57. В некоторых вариантах реализации данного изобретения указанная мутация в аминокислотном остатке N60 представляет собой мутацию на глутамин или глутаминовую кислоту. В некоторых вариантах реализации данного изобретения указанная мутация в аминокислотном остатке S61 представляет собой мутацию на изолейцин. В некоторых вариантах реализации данного изобретения указанная мутация в аминокислотном остатке T62 представляет собой мутацию на аланин. В некоторых вариантах реализации данного изобретения указанная мутация находится в аминокислотном положении 31 или 32 области VL, и при этом аминокислотные положения соответствуют положению 31 или 32 из SEQ ID NO: 46, 52 или 60. В некоторых вариантах реализации данного изобретения указанная мутация находится в аминокислотном положении 31 или 32 из SEQ ID NO: 46, 52 или 60. В некоторых вариантах реализации данного изобретения указанная мутация в аминокислотном остатке N31 представляет собой мутацию на аспарагиновую кислоту или на глутаминовую кислоту. В некоторых вариантах реализации данного изобретения указанная мутация в аминокислотном остатке S32 представляет собой мутацию на лейцин, валин или изолейцин. В некоторых вариантах реализации данного изобретения указанная мутация повышает аффинность связывания модифицированного антитела против CLDN18.2 по сравнению с референсным антителом 175D10.
[11] В некоторых вариантах реализации данного изобретения антитело против CLDN18.2 содержит химерное антитело или его связывающий фрагмент. В некоторых вариантах реализации данного изобретения указанное химерное антитело или его связывающий фрагмент содержит область VH, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 40-43, и область VL, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательности с SEQ ID NO: 44. В некоторых вариантах реализации данного изобретения указанное химерное антитело или его связывающий фрагмент содержит область VH, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательности с SEQ ID NO: 45, и область VL, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 46-50. В некоторых вариантах реализации данного изобретения указанное химерное антитело или его связывающий фрагмент содержит область VH, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательности с SEQ ID NO: 51, и область VL, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 52-56. В некоторых вариантах реализации данного изобретения указанное химерное антитело или его связывающий фрагмент содержит область VH, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 57-59, и область VL, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 60-62. В некоторых вариантах реализации данного изобретения указанное химерное антитело или его связывающий фрагмент содержит область CH, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательности с SEQ ID NO: 63, и область CL, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательности с SEQ ID NO: 64.
[12] В некоторых вариантах реализации данного изобретения антитело против CLDN18.2 содержит гуманизированное антитело или его связывающий фрагмент. В некоторых вариантах реализации данного изобретения указанное гуманизированное антитело или его связывающий фрагмент содержит область VH, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 65-68, и область VL, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 69-73. В некоторых вариантах реализации данного изобретения указанное гуманизированное антитело или его связывающий фрагмент содержит область VH, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 74-76, и область VL, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 77-80. В некоторых вариантах реализации данного изобретения указанное гуманизированное антитело или его связывающий фрагмент содержит область VH, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 81-84, и область VL, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 85-88. В некоторых вариантах реализации данного изобретения указанное гуманизированное антитело или его связывающий фрагмент содержит область VH, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 89-92, и область VL, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 93-97.
[13] В некоторых вариантах реализации данного изобретения антитело против CLDN18.2 содержит каркас IgM.
[14] В некоторых вариантах реализации данного изобретения антитело против CLDN18.2 содержит каркас IgG2.
[15] В некоторых вариантах реализации данного изобретения антитело против CLDN18.2 содержит каркас IgG1.
[16] В некоторых вариантах реализации данного изобретения антитело против CLDN18.2 содержит одну или большее число мутаций в области FC. В некоторых вариантах реализации данного изобретения одна или большее число мутаций включают в себя мутацию в аминокислотном положении S239, в аминокислотном положении I332, в аминокислотном положении F243, в аминокислотном положении R292, в аминокислотном положении Y300, в аминокислотном положении V305, в аминокислотном положении P396 или их комбинацию. В некоторых вариантах реализации данного изобретения одна или большее число мутаций в области FC придают усиленную АЗКЦ референсному антителу 175D10. В некоторых вариантах реализации данного изобретения антитело против CLDN18.2 обладает комплементзависимой цитотоксической (КЗЦ, англ. «CDC») активностью по сравнению с референсным антителом 175D10.
[17] В некоторых вариантах реализации данного изобретения антитело против CLDN18.2 дополнительно конъюгировано с полезной нагрузкой. В некоторых вариантах реализации данного изобретения указанная полезная нагрузка представляет собой ауристатин или его производное. В некоторых вариантах реализации данного изобретения указанное производное ауристатина представляет собой монометилауристатин E (MMAE). В некоторых вариантах реализации данного изобретения указанное производное ауристатина представляет собой монометилауристатин F (MMAF).
[18] В некоторых вариантах реализации данного изобретения соотношение лекарственное средство/антитело (СЛСАТ, англ. «DAR») составляет около 2, около 3 или около 4.
[19] В некоторых вариантах реализации данного изобретения антитело против CLDN18.2 имеет общий связывающий эпитоп с референсным антителом 175D10.
[20] В некоторых вариантах реализации данного изобретения антитело против CLDN18.2 обладает активностью перекрестного связывания с белком CLDN18.2 мыши и яванской макаки.
[21] В определенных вариантах реализации данного изобретения, в данном документе раскрыто антитело против клаудина 18.2 (антитело против CLDN18.2), которое специфически связывается с изоформой CLDN18.2. В некоторых вариантах реализации данного изобретения изоформа CLDN18.2 представляет собой изоформу, экспрессируемую в линии клеток SNU620.
[22] В определенных вариантах реализации данного изобретения, в данном документе раскрыт полимер нуклеиновой кислоты, кодирующий антитело против CLDN18.2, описанное в данном документе.
[23] В определенных вариантах реализации данного изобретения, в данном документе раскрыт вектор, содержащий полимер нуклеиновой кислоты, кодирующий антитело против CLDN18.2, описанное в данном документе.
[24] В определенных вариантах реализации данного изобретения, в данном документе раскрыта фармацевтическая композиция, содержащая: описанное в данном документе антитело против CLDN18.2; и фармацевтически приемлемый эксципиент. В некоторых вариантах реализации данного изобретения указанную фармацевтическую композицию формулируют для системного введения. В некоторых вариантах реализации данного изобретения указанную фармацевтическую композицию формулируют для местного введения.
[25] В определенных вариантах реализации данного изобретения, в данном документе раскрыт способ лечения субъекта, имеющего рак, который характеризуется сверхэкспрессией белка CLDN18.2, включающий в себя: введение указанному субъекту антитела против CLDN18.2, описанного в данном документе, или фармацевтической композиции, описанной в данном документе, тем самым производя лечение рака у субъекта. В некоторых вариантах реализации данного изобретения рак представляет собой рак желудочно-кишечного тракта. В некоторых вариантах реализации данного изобретения указанный рак желудочно-кишечного тракта представляет собой рак желудка. В некоторых вариантах реализации данного изобретения указанный рак желудочно-кишечного тракта представляет собой рак поджелудочной железы. В некоторых вариантах реализации данного изобретения указанный рак желудочно-кишечного тракта представляет собой рак пищевода или холангиокарциному. В некоторых вариантах реализации данного изобретения рак представляет собой рак легкого или рак яичника. В некоторых вариантах реализации данного изобретения указанный способ дополнительно включает в себя введение субъекту дополнительного терапевтического агента. В некоторых вариантах реализации данного изобретения указанный дополнительный терапевтический агент включает в себя химиотерапевтический агент, иммунотерапевтический агент, нацеленный терапевтический агент, терапевтический агент на основе гормонов, терапевтический агент на основе стволовых клеток или радиационную терапию. В некоторых вариантах реализации данного изобретения указанный дополнительный терапевтический агент и указанное антитело против CLDN18.2 вводят одновременно. В некоторых вариантах реализации данного изобретения указанный дополнительный терапевтический агент и указанное антитело против CLDN18.2 вводят последовательно. В некоторых вариантах реализации данного изобретения указанный дополнительный терапевтический агент вводят до введения указанного антитела против CLDN18.2. В некоторых вариантах реализации данного изобретения указанный дополнительный терапевтический агент вводят после введения указанного антитела против CLDN18.2. В некоторых вариантах реализации данного изобретения указанный дополнительный терапевтический агент и указанное антитело против CLDN18.2 формулируют в виде раздельных доз. В некоторых вариантах реализации данного изобретения субъект представляет собой человека.
[26] В некоторых вариантах реализации данного изобретения, в данном документе раскрыт способ индукции эффекта уничтожения клеток, включающий в себя: приведение в контакт множества клеток с антителом против CLDN18.2, содержащим полезную нагрузку, в течение периода времени, достаточного для интернализации указанного антитела против CLDN18.2 и, таким образом, для индукции эффекта уничтожения клеток. В некоторых вариантах реализации данного изобретения антитело против CLDN18.2 включает в себя антитело против CLDN18.2, описанное в данном документе. В некоторых вариантах реализации данного изобретения полезная нагрузка включает в себя майтансиноид, ауристатин, таксоид, калихеамицины, дуокармицин, аматоксин или их производное. В некоторых вариантах реализации данного изобретения полезная нагрузка включает в себя ауристатин или его производное. В некоторых вариантах реализации данного изобретения полезная нагрузка представляет собой монометилауристатин E (MMAE). В некоторых вариантах реализации данного изобретения полезная нагрузка представляет собой монометилауристатин F (MMAF). В некоторых вариантах реализации данного изобретения клетка представляет собой раковую клетку. В некоторых вариантах реализации данного изобретения клетка представляет собой клетку из рака желудочно-кишечного тракта. В некоторых вариантах реализации данного изобретения рак желудочно-кишечного тракта представляет собой рак желудка. В некоторых вариантах реализации данного изобретения рак желудочно-кишечного тракта представляет собой рак поджелудочной железы. В некоторых вариантах реализации данного изобретения рак желудочно-кишечного тракта представляет собой рак пищевода или холангиокарциному. В некоторых вариантах реализации данного изобретения клетка представляет собой клетку из рака легкого или рака яичника. В некоторых вариантах реализации данного изобретения указанный способ представляет собой способ in vitro. В некоторых вариантах реализации данного изобретения указанный способ представляет собой способ in vivo. В некоторых вариантах реализации данного изобретения субъект представляет собой человека.
[27] В определенных вариантах реализации данного изобретения, в данном документе раскрыт набор, содержащий описанное в данном документе антитело против CLDN18.2, описанный в данном документе вектор или фармацевтическую композицию, содержащую описанное в данном документе антитело против CLDN18.2.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[28] Различные аспекты данного изобретения конкретно изложены в прилагаемой формуле изобретения. Лучшее понимание особенностей и преимуществ данного изобретения будет получено при обращении к следующему подробному описанию, которое излагает иллюстративные варианты реализации данного изобретения, в которых используются принципы данного изобретения, и прилагаемые графические материалы.
[29] На Фиг. 1 проиллюстрирована сконструированная экспрессия CLDN18.2 на клетках HEK293.
[30] На Фиг. 2 проиллюстрирована последовательность ДНК CLDN18.2 человека.
[31] На Фиг. 3 проиллюстрирована ДНК CLDN18.2 ECL1.
[32] На Фиг. 4A - Фиг. 4C проиллюстрированы дозозависимые кривые связывания очищенных антител против CLDN18.2, полученных из организма мыши, на клетках CHO-CLDN18.2. Антитела показали наивысшее (Фиг. 4A), более высокое (Фиг. 4B) и подобное или более слабое (Фиг. 4C) максимальное связывание по сравнению с таковым для антитела 175D10.
[33] На Фиг. 5A - Фиг. 5B проиллюстрировано связывание антител с клеточной линией рака желудка SNU601 (Фиг. 5A) и SNU620 (Фиг. 5B). Нумерация «1», «2», «3» и «4» обозначает, соответственно, 282A12, 175D10, 101C6 и изотипические контроли.
[34] На Фиг. 6A - Фиг. 6D проиллюстрированы химерные антитела 364D1A7 и 413H9F8, специфически связывающиеся с линией клеток CHO-CLDN18.2. На Фиг. 6A и Фиг. 6B проиллюстрированы кривые связывания химерного антитела 364D1A7 на клеточных линиях CHO-CLDN18.1 и CHO-CLDN18.2. На Фиг. 6C и Фиг. 6D проиллюстрированы кривые связывания химерного антитела 413H9F8 на клеточных линиях CHO-CLDN18.1 и CHO-CLDN18.2. Клеточная линия CHO-CLDN18.1 была использована для экспериментов, представленных на Фиг. 6A и Фиг. 6C, а клеточная линия CHO-CLDN18.2 была использована для экспериментов, представленных на Фиг. 6B и Фиг. 6D. Химерное антитело 175D10 и родительские антитела служат в качестве контролей.
[35] На Фиг. 7A - Фиг. 7D проиллюстрировано дозозависимое связывание химерных вариантов 282A12F3 с линией клеток CHO-CLDN18.2. На Фиг. 7A и Фиг. 7C показаны кривые связывания химерного антитела (xi282A12F3) и химерных антител с мутантными сайтами ПТМ (282A12F3-VH-N60Q и 282A12F3-VH-N60E) на линии клеток CHO-CLDN18.1. На Фиг. 7B и Фиг. 7D показаны кривые связывания химерного антитела (xi282A12F3) и химерных антител с мутантными сайтами ПТМ (282A12F3-VH-N60Q и 282A12F3-VH-N60E) на линии клеток CHO-CLDN18.2.
[36] На Фиг. 8A - Фиг. 8D проиллюстрировано дозозависимое связывание химерных вариантов 413H9F8 с линией клеток CHO-CLDN18.2. На Фиг. 8A и Фиг. 8C показана кривая связывания мышиного антитела (413H9F8), химерного антитела (xi413H9F8) и химерных антител с мутантными сайтами ПТМ (413H9F8-VL-N31E, 413H9F8-VL-S32L и 413H9F8-VL-S32V) на линии клеток CHO-CLDN18.1. На Фиг. 8B и Фиг. 8D показана кривая связывания мышиного антитела (413H9F8), химерного антитела (xi413H9F8) и химерных антител с мутантными сайтами ПТМ (413H9F8-VL-N31E, 413H9F8-VL-S32L и 413H9F8-VL-S32V) на линии клеток CHO-CLDN18.2.
[37] На Фиг. 9A - Фиг. 9D проиллюстрировано дозозависимое связывание химерных вариантов 364D1A7 с линией клеток CHO-CLDN18.2. На Фиг. 9A и Фиг. 9C показаны кривые связывания мышиного антитела (364D1A7), химерных антител (xi364D1A7) и химерных антител с мутантными сайтами ПТМ (364D1A7-VL-N31E, 364D1A7-VL-S32L и 364D1A7-VL-S32V) на линии клеток CHO-CLDN18.1. На Фиг. 9B и Фиг. 9D показаны кривые связывания мышиного антитела (364D1A7), химерных антител (xi364D1A7) и химерных антител с мутантными сайтами ПТМ (364D1A7-VL-N31E, 364D1A7-VL-S32L и 364D1A7-VL-S32V) на линии клеток CHO-CLDN18.2.
[38] На Фиг. 10A - Фиг. 10B проиллюстрировано дозозависимое связывание химерных вариантов 357B8F8 с линией клеток CHO-CLDN18.2. На Фиг. 10А показаны кривые связывания химерных антител 357B8F8 с мутантными сайтами ПТМ на линии клеток CHO-CLDN18.1. На Фиг. 10B показаны кривые связывания химерных антител 357B8F8 с мутантными сайтами ПТМ на линии клеток CHO-CLDN18.2.
[39] На Фиг. 11A - Фиг. 11C представлено связывание иллюстративных вариантов химерного антитела с линией раковых клеток SNU620. Кривые связывания химерных антител с мутантными сайтами ПТМ на линии клеток рака желудка SNU620 представлены на следующих фигурах: Фиг. 11A, 413H9F8; Фиг. 11В, 264D1A7; и Фиг. 11C, 357B8F8.
[40] На Фиг. 12A - Фиг. 12D проиллюстрировано конкурентное связывание химерных антител с линией клеток CHO-CLDN18.2. Проведен мониторинг связывания xi175D10 (Фиг. 12A), 282A12F3 (T62A) (Фиг. 12B), 413H9F8-VL-S32V (Фиг. 12C) и 364D1A7-VL-S32V (Фиг. 12D) на клетках CHO-CLDN18.2 после инкубации с иллюстративными концентрациями xi175D10, 282A12F3 (T62A), 413H9F8-VL-S32V, 364D1A7-VL-S32V или чIgG1.
[41] На Фиг. 13A - Фиг. 13E представлена межвидовая связывающая активность в отношении различных видов CLDN18.2 с помощью иллюстративных антител. Аффинности связывания hz282 (Фиг. 13A), xi175D10 (Фиг. 13B), 413H9F8-VL-S32V (Фиг. 13C), 364D1A7-VL-S32V (Фиг. 13D) и 357B8F8-VH-S61I-VL-S32I (Фиг. 13E) определяли на клетках СНО, экспрессирующих CLDN18.2 человека (закрашенный квадрат), мыши (закрашенный кружок) или яванской макаки (закрашенный треугольник). чIgG1 был установлен в качестве отрицательного контроля.
[42] На Фиг. 14A - Фиг. 14B проиллюстрирована специфическая для CLDN18.2 активность АЗКЦ, индуцированная антителами против CLDN18.2 и клетками FcR-TANK (CD16A-15V). Активность АЗКЦ вариантов антител против CLDN18.2 определяли в клеточных линиях CHO-CLDN18.1 (Фиг. 14A) и CHO-CLDN18.2 (Фиг. 14B).
[43] На Фиг. 15 проиллюстрирована активность АЗКЦ вариантов химерного антитела на линии клеток NCI-N87. Активность АЗКЦ анализировали при соотношении эффектор (FcR-TANK (CD16A-15V)) : клетка-мишень как 2 : 1 и времени инкубации в 16 часов. Представлены данные из дублированных лунок.
[44] На Фиг. 16 проиллюстрирована активность АЗКЦ вариантов химерного антитела на линии клеток NUGC4-18.2. Активность АЗКЦ анализировали при соотношении эффектор (МКПК) : клетка-мишень как 40 : 1 и времени инкубации в 5 часов. Представлены данные от одного донора в условии дублированных лунок.
[45] На Фиг. 17 проиллюстрирована активность КЗЦ вариантов химерного антитела на линии клеток CHO-18.2.
[46] На Фиг. 18A - Фиг. 18B проиллюстрировано связывание гуманизированных антител 282A12F3 (T62A) с клетками CHO-CLDN18.2. На Фиг.18А показаны кривые связывания гуманизированных антител 282A12F3 (T62A) на клетках CHO-CLDN18.2. На Фиг.18В показаны кривые связывания гуманизированных антител 282A12F3 (T62A) на клетках CHO-CLDN18.1.
[47] На Фиг. 19A - Фиг. 19B проиллюстрировано связывание гуманизированных антител 282A12F3 (T62A) с клетками рака желудка SNU620. На Фиг. 19A показаны кривые связывания гуманизированных антител 282A12F3 (T62A) hz282-1~hz282-10 с клетками рака желудка SNU620. На Фиг. 19B показаны кривые связывания гуманизированных антител 282A12F3 (T62A) hz282-11~hz282-20 с клетками рака желудка SNU620.
[48] На Фиг. 20A - Фиг. 20D проиллюстрированы аффинности связывания гуманизированных антител 413H9F8-VL-S32V (стратегия 1) с клетками CHO-CLDN18.2. Полные кривые связывания гуманизированных антител 413H9F8-VL-S32V проиллюстрированы следующим образом: 413H9F8-cp1, 413H9F8-cp2 и 413H9F8-cp3 - на Фиг. 20A; 413H9F8-cp4, 413H9F8-cp5 и 413H9F8-cp 6 - на Фиг. 20B; 413H9F8-cp7, 413H9F8-cp8 и 413H9F8-cp9 - на Фиг. 20C; и 413H9F8-cp10, 413H9F8-cp811, и 413H9F8-cp12 - на Фиг. 20D. Данные эксперименты проводились на клетках CHO-CLDN18.2.
[49] На Фиг. 21A - Фиг. 21D проиллюстрированы аффинности связывания гуманизированных антител 413H9F8-VL-S32V по стратегии 2 с клетками CHO-CLDN18.2. Полные кривые связывания гуманизированных антител 413H9F8-VL-S32V проиллюстрированы следующим образом: 413H9F8-H1L1, 413H9F8-H2L1, 413H9F8-H3L1 и 413H9F8-H4L1 - на Фиг. 21A; 413H9F8-H1L2, 413H9F8-H2L2, 413H9F8-H3L2 и 413H9F8-H4L2 - на Фиг. 21B; 413H9F8-H1L3, 413H9F8-H2L3, 413H9F8-H3L3 и 413H9F8-H4L3 - на Фиг. 21C; 413H9F8-H1L4, 413H9F8-H2L4, 413H9F8-H3L4 и 413H9F8-H4L4 - на Фиг. 21D. Данные эксперименты проводились на клетках CHO-CLDN18.2.
[50] На Фиг. 22A - Фиг. 22E проиллюстрированы аффинности связывания гуманизированных антител 364D1A7-VL-S32V на клетках CHO-CLDN18.2. Полные кривые связывания гуманизированных антител 364D1A7-VL-S32V проиллюстрированы следующим образом: 364D1A7-H1L1, 364D1A7-H2L1, 364D1A7-H3L1 и 364D1A7-H4L1 - на Фиг. 22A; 364D1A7-H1L2, 364D1A7-H2L2, 364D1A7-H3L2 и 364D1A7-H4L2 - на Фиг. 22B; 364D1A7-H1L3, 364D1A7-H2L3, 364D1A7-H3L3 и 364D1A7-H4L3 - на Фиг. 22C; 364D1A7-H1L4, 364D1A7-H2L4, 364D1A7-H3L4 и 364D1A7-H4L4 - на Фиг. 22D; 364D1A7-H1L5, 364D1A7-H2L5, 364D1A7-H3L5 и 364D1A7-H4L5 - на Фиг. 22E. Данные эксперименты проводились на клетках CHO-CLDN18.2.
[51] На Фиг. 23A - Фиг. 23C проиллюстрированы аффинности связывания гуманизированных антител 413H9F8-VL-32V и 364D1A7-VL-S32V на клетках CHO-CLDN18.2. На Фиг. 23A и Фиг. 23B показаны полные кривые связывания гуманизированных антител 413H9F8-VL-S32V на клетках CHO-CLDN18.2. На Фиг. 23C показана полная кривая связывания гуманизированных антител 364D1A7-VL-S32V на клетках CHO-CLDN18.2.
[52] На Фиг. 24A - Фиг. 24C проиллюстрирована активность АЗКЦ вариантов гуманизированных антител с клетками cR-TANK (CD16A-15V) против линии клеток рака желудка NCI-N87-CLDN18.2. Гуманизированные антитела 413H9F8 (Фиг. 24A и Фиг. 24B) и 364D1A7 (Фиг. 24C) анализировали на их способность индуцировать АЗКЦ с клетками FcR-TANK (CD16A-15V) против клеток NCI-N87-CLDN18.2 при соотношении эффектор:клетка-мишень как 8:1. Смешанные клетки культивировали в течение 4 часов.
[53] На Фиг. 25A - Фиг. 25C проиллюстрирована активность АЗКЦ вариантов гуманизированных антител с МКПК человека против линии клеток рака желудка NUGC4-CLDN18.2. Гуманизированные антитела 413H9F8 (Фиг. 25A и Фиг. 25B) и 364D1A7 (Фиг. 25C) анализировали на их способность индуцировать АЗКЦ с МКПК человека против клеток NUGC4-CLDN18.2 при соотношении эффектор:клетка-мишень как 40 : 1, клетки культивировали в течение 5 часов. Представлены данные от одного донора в условии дублированных лунок.
[54] На Фиг. 26A - Фиг. 26B проиллюстрирована активность КЗЦ вариантов гуманизированных антител на линии клеток CHO-18.2. Активность КЗЦ гуманизированных антител 413H9F8-VL-S32V (Фиг. 26A) и 364D1A7-VL-S32V (Фиг. 26B) определяли с сывороткой крови человека против клеток CHO-CLDN18.2.
[55] На Фиг. 27 представлена иллюстративная конструкция мАт-мк-вц-PAB-MMAE, использованная в данном исследовании.
[56] На Фиг. 28A - Фиг. 28B проиллюстрированы CLDN18.2-специфические конъюгаты антитело - лекарственное средство (КАТЛС, англ. «ADC»), ингибирующие жизнеспособность клеток HEK293-CLDN18.2. Жизнеспособность клеток HEK293-CLDN18.2 (Фиг. 28A) и HK293 (Фиг. 28B) определяли после обработки с помощью КАТЛС xi175D10-вцMMAE (СЛСАТ=4,02), 282A12F3 (T62A)-вцMMAE (СЛСАТ=3,94) и чIgG1-вцMMAE (СЛСАТ=3,91) и неконъюгированными антителами xi175D10, 282A12F3 (T62A) и чIgG1 в течение 5 суток. Жизнеспособность определяли в клеточной линии HEK293, экспрессирующей CLDN18.2.
[57] На Фиг. 29A - Фиг. 29B проиллюстрированы CLDN18.2-специфические КАТЛС, ингибирующие жизнеспособность клеток NCI-N87-CLDN18.2 и NUGC4-CLDN18.2. Жизнеспособность клеток NCI-N87-CLDN18.2 (Фиг. 29A) и NUGC4-CLDN18.2 (Фиг. 29B) определяли после обработки с помощью КАТЛС xi175D10-вцMMAE (СЛСАТ=4,02), 282A12F3 (T62A)-вцMMAE (СЛСАТ=3,94) и чIgG1-вцMMAE (СЛСАТ=3,91) в течение 5 суток.
[58] На Фиг. 30A - Фиг. 30B проиллюстрированы CLDN18.2-специфические КАТЛС, ингибирующие жизнеспособность клеток PANC-1-CLDN18.2. На Фиг. 30A показана эффективность АЗКЦ для 282A12F3 (T62A) в отношении клеток PANC-1-CLDN18.2. На Фиг. 30B показана жизнеспособность клеток PANC-1-CLDN18.2 после обработки CLDN18.2-специфическими КАТЛС xi175D10-вцMMAE (СЛСАТ=4,02), 282A12F3 (T62A)-вцMMAE (СЛСАТ=3,94) и чIgG1-вцMMAE (СЛСАТ=3,91) в течение 5 суток.
[59] На Фиг. 31 проиллюстрирована активность АЗКЦ вариантов 413H9F8-cp2 с клетками FcR-TANK (CD16A-15V) против линии клеток CHO-CLDN18.2.
[60] На Фиг. 32 проиллюстрирована активность АЗКЦ вариантов 413H9F8-cp2 и 413H9F8-H2L2 с МКПК человека против линии клеток рака желудка NUGC4-CLDN18.2.
[61] На Фиг. 33A - Фиг. 33B проиллюстрирована интернализация антител против CLDN18.2 клетками NUGC4-CLDN18.2 (Фиг. 33A) и клетками NCI-N87-CLDN18.2 (Фиг. 33B).
[62] На Фиг. 34 проиллюстрированы эффективности антител против CLDN18.2 в модели ксенотрансплантата, полученного от пациента (КПП, англ. «PDX») с раком желудка человека GA0006, у «голых» (без тимуса) мышей.
[63] На Фиг. 35A - Фиг. 35E проиллюстрированы эффективности антител против CLDN18.2 на мышиных ксенотрансплантатных моделях рака поджелудочной железы у мышей Nu/Nu.
[64] На Фиг. 36 проиллюстрированы комбинаторные эффективности антител против CLD1N8.2 и химиотерапии в модели ксенотрансплантата, полученного от пациента (КПП) с раком желудка человека GA0006.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[65] Клаудины (CLDN) представляют собой центральные белки плотных контактов, которые регулируют барьерную функцию и полярность эпителиальных клеток, тем самым создавая границу между апикальными и базолатеральными доменами плазматической мембраны. На сегодняшний день описано 27 членов семейства CLDN с различными органоспецифическими паттернами экспрессии. Было показано, что уровни экспрессии клаудинов часто аномальны при неоплазиях человека. Один из членов семейства CLDN - изоформа 2 CLDN-18 (CLDN18.2) - является селективным антигеном желудочного происхождения, и его экспрессия в нормальных тканях ограничена дифференцированными эпителиальными клетками слизистой оболочки желудка.
[66] Белок CLDN18.2 является высококонсервативным у мышей, крыс, кроликов, собак, обезьян и человека, и включает в себя четыре трансмембранных домена и два внеклеточных домена. Около 8 из 51 аминокислотного остатка в первом внеклеточном домене отличаются от изоформы 1 CLDN-18, специфичной для ткани легких (CLDN18.1), и могут служить эпитопом для связывания моноклональных антител.
[67] Было показано, что в условиях рака белок CLDN18.2 участвует в развитии и прогрессировании опухоли. Действительно, было показано, что CLDN18.2 представлен на поверхности клеток рака желудка человека и его метастазов (Sahin, et al, “Claudin-18 splice variant 2 is a pan-cancer target suitable for therapeutic antibody development,” Clin Cancer Res 2008; 14: 7624-34), и его эктопическая активация наблюдалась при раке поджелудочной железы (Woll, et al., “Claudin 18.2 is a target for IMAB362 antibody in pancreatic neoplasms,” Int J Cancer 2014; 134: 731-739; а также Tanaka, et al., “Claudin-18 is an early-stage marker of pancreatic carcinogenesis,” J Histochem Cytochem 2011; 59: 942-952). Аберрантная активация CLDN18.2 также наблюдалась при раковых заболеваниях желчных протоков, пищевода, яичника и легкого, и была связана с плохой общей выживаемостью и метастазированием в лимфатические узлы (Shinozaki, et al., “Claudin-18 in biliary neoplasms. Its significance in the classification of intrahepatic cholangiocarcinoma,” Virchows Arch 2011; 459: 73-80; а также Micke, et al., “Aberrantly activated claudin 6 and 18.2 as potential therapy targets in non-small-cell lung cancer,” Int J CNCER 2014; 135: 2206-2214).
[68] В некоторых вариантах реализации данного изобретения, в данном документе раскрыты антитела против CLDN18.2 и их применение. В некоторых случаях антитела против CLDN18.2 представляют собой химерные антитела. В других случаях антитела против CLDN18.2 представляют собой гуманизированные антитела. В дополнительных случаях, в данном документе раскрыты способы лечения и способы индукции эффекта уничтожения клеток, в которых используется антитело против CLDN18.2.
Антитела против клаудина 18.2
[69] В определенных вариантах реализации данного изобретения, в данном документе раскрыты антитела против клаудина 18.2 (антитела против CLDN18.2). В некоторых случаях антитело против CLDN18.2 связывается с внеклеточным доменом CLDN18.2. В некоторых случаях антитело против CLDN18.2 связывается с первым внеклеточным доменом CLDN18.2. В некоторых случаях антитело против CLDN18.2 связывается с областью из восьми остатков в первом внеклеточном домене CLDN18.2, например, с остатками 32-41 CLDN18.2 человека (идентификатор UniProtKB P56856-2). В некоторых вариантах реализации данного изобретения, в данном документе также описаны антитела против CLDN18.2, которые содержат одну или большее число мутаций в сайтах посттрансляционной модификации, с функциональными свойствами, отличающимися от таковых для референсного антитела против CLDN18.2, и (или) с селективностью в отношении изоформы CLDN18.2.
[70] В некоторых вариантах реализации данного изобретения описанное в данном документе антитело против CLDN18.2 характеризуется полумаксимальной эффективной концентрацией (EC50), которая ниже, чем ЕС50 для референсного антитела против CLDN18.2. В некоторых случаях референсное антитело представляет собой 175D10, которое содержит последовательность тяжелой цепи (НС) и последовательность легкой цепи (LC), указанные в SEQ ID NO: 98 и SEQ ID NO: 99, соответственно. В некоторых случаях ЕС50 антитела против CLDN18.2 составляет около 5 нМ или меньше. В некоторых случаях ЕС50 антитела против CLDN18.2 составляет около 4 нМ, около 3 нМ, около 2 нМ, около 1 нМ, около 0,5 нМ или меньше.
[71] В некоторых вариантах реализации данного изобретения описанное в данном документе антитело против CLDN18.2 обладает более высокой аффинностью связывания с CLDN18.2 по сравнению с аффинностью связывания референсного антитела против CLDN18.2. В некоторых случаях референсное антитело представляет собой 175D10, которое содержит последовательность тяжелой цепи и последовательность легкой цепи, указанные в SEQ ID NO: 98 и SEQ ID NO: 99, соответственно.
[72] В некоторых вариантах реализации данного изобретения описанное в данном документе антитело против CLDN18.2 обладает более высокой антителозависимой клеточно-опосредованной цитотоксичностью (АЗКЦ) по сравнению с референсным антителом против CLDN18.2. В некоторых случаях референсное антитело представляет собой 175D10, которое содержит последовательность тяжелой цепи и последовательность легкой цепи, указанные в SEQ ID NO: 98 и SEQ ID NO: 99, соответственно. В некоторых случаях антитело против CLDN18.2 дополнительно содержит мутацию в области Fc, которая придает усиленную АЗКЦ.
[73] В некоторых вариантах реализации данного изобретения описанное в данном документе антитело против CLDN18.2 содержит по меньшей мере одну мутацию в сайте посттрансляционной модификации.
[74] В некоторых вариантах реализации данного изобретения описанное в данном документе антитело против CLDN18.2 специфически связывается с изоформой CLDN18.2. В некоторых случаях указанная изоформа CLDN18.2 представляет собой изоформу, экспрессируемую в линии клеток SNU620.
[75] В некоторых вариантах реализации данного изобретения антитело против CLDN18.2 содержит вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL), при этом область VH содержит последовательность CDR1 GFSLTSYX1VX2; последовательность CDR2 VIWX3X4GX5TX6YX7X8X9LX10S; и последовательность CDR3 DX11X12X13X14X15X16X17X18X19X20; где X1 выбран из N или G; X2 выбран из Y или H; X3 выбран из N или P; X4 выбран из T или G; X5 выбран из A или N; X6 выбран из R или N; X7 выбран из N, Q или E; X8 выбран из S или I; X9 выбран из Т или А; X10 выбран из K или M; X11 выбран из S или R; X12 выбран из A или R; X13 выбран из M или L; X14 выбран из P или A; X15 выбран из A или M; X16 выбран из I или D; X17 выбран из P или Y; X18 присутствует или отсутствует, если присутствует, то представляет собой F; X19 присутствует или отсутствует, если присутствует, то представляет собой A; и X20 присутствует или отсутствует, если присутствует, то представляет собой Y.
[76] В некоторых случаях область VH содержит последовательность CDR1 X21X22X23X24X25SFGMH; последовательность CDR2 YISSGSX26X27IYYX28DX29X30KG; и последовательность CDR3 AX31X32X33X34X35X36X37X38X39X40X41; где X21 присутствует или отсутствует, если присутствует, то представляет собой G; X22 присутствует или отсутствует, если присутствует, то представляет собой F; X23 присутствует или отсутствует, если присутствует, то представляет собой T; X24 присутствует или отсутствует, если присутствует, то представляет собой F; X25 присутствует или отсутствует, если присутствует, то представляет собой S; X26 выбран из S или G; X27 выбран из P или S; X28 выбран из V или A; X29 выбран из K или T; и X30 выбран из L или V; X31 выбран из G или T; X32 выбран из Y или S; X33 выбран из A или Y; X34 выбран из V или Y; X35 выбран из R или Y; X36 выбран из N или G; X37 выбран из A или N; X38 выбран из L или A; X39 выбран из D или L; X40 выбран из Y или E; и X41 присутствует или отсутствует, если присутствует, то представляет собой Y.
[77] В некоторых вариантах реализации данного изобретения область VH содержит последовательности CDR1, CDR2 и CDR3, выбранные из Таблицы 1.
(Родитель)
(T62A)
(Родитель)
(Родитель)
(Родитель)
[78] В некоторых случаях область VH содержит последовательность CDR1, состоящую из SEQ ID NO: 1, последовательность CDR2 VIWNTGATRYX7SX9LKS и последовательность CDR3, состоящую из SEQ ID NO: 3, где X7 выбран из N, Q или E; и X9 выбран из T или A.
[79] В некоторых случаях область VH содержит последовательность CDR1, состоящую из SEQ ID NO: 13, последовательность CDR2 VIWPGGNTNYX7X8ALMS и последовательность CDR3, состоящую из SEQ ID NO: 15, где X7 выбран из N или E; и X8 выбран из S или I.
[80] В некоторых случаях область VH содержит последовательность CDR1, состоящую из SEQ ID NO: 1, 7, 10 или 13; последовательность CDR2, выбранную из SEQ ID NO: 2, 4, 5, 6, 8, 11, 14, 16 или 17; и последовательность CDR3, выбранную из SEQ ID NO: 3, 9, 12, или 15.
[81] В некоторых случаях область VH содержит последовательность CDR1, состоящую из SEQ ID NO: 1; последовательность CDR2, состоящую из SEQ ID NO: 2, 4, 5 или 6; и последовательность CDR3, состоящую из SEQ ID NO: 3.
[82] В некоторых случаях область VH содержит последовательность CDR1, состоящую из SEQ ID NO: 13; последовательность CDR2, состоящую из SEQ ID NO: 14, 16 или 17; и последовательность CDR3, состоящую из SEQ ID NO: 15.
[83] В некоторых случаях область VH содержит последовательность CDR1, состоящую из SEQ ID NO: 7, последовательность CDR2, состоящую из SEQ ID NO: 8, и последовательность CDR3, состоящую из SEQ ID NO: 9.
[84] В некоторых случаях область VH содержит последовательность CDR1, состоящую из SEQ ID NO: 10, последовательность CDR2, состоящую из SEQ ID NO: 11, и последовательность CDR3, состоящую из SEQ ID NO: 12.
[85] В некоторых случаях область VL содержит последовательности CDR1, CDR2 и CDR3, выбранные из Таблицы 2.
(Родитель)
(Родитель)
(Родитель)
[86] В некоторых случаях область VL содержит последовательность CDR1, выбранную из SEQ ID NO: 18, 21, 24-28, 31-35, 38 или 39; последовательность CDR2, выбранную из SEQ ID NO: 19, 22, 29 или 36; и последовательность CDR3, выбранную из SEQ ID NO: 20, 23, 30 или 37.
[87] В некоторых случаях область VL содержит последовательность CDR1, выбранную из SEQ ID NO: 21 или 24-27; последовательность CDR2, состоящую из SEQ ID NO: 22; и последовательность CDR3, состоящую из SEQ ID NO: 23.
[88] В некоторых случаях область VL содержит последовательность CDR1, выбранную из SEQ ID NO: 28 или 31-34; последовательность CDR2, состоящую из SEQ ID NO: 29; и последовательность CDR3, состоящую из SEQ ID NO: 30.
[89] В некоторых случаях область VL содержит последовательность CDR1, выбранную из SEQ ID NO: 35, 38 или 39; последовательность CDR2, состоящую из SEQ ID NO: 36; и последовательность CDR3, состоящую из SEQ ID NO: 37.
[90] В некоторых случаях область VL содержит последовательность CDR1, выбранную из SEQ ID NO: 18, последовательность CDR2, состоящую из SEQ ID NO: 19, и последовательность CDR3, состоящую из SEQ ID NO: 20.
[91] В некоторых вариантах реализации данного изобретения антитело против CLDN18.2 содержит область VH, содержащую последовательность CDR1 GFSLTSYX1VX2; последовательность CDR2 VIWX3X4GX5TX6YX7X8X9LX10S; и последовательность CDR3 DX11X12X13X14X15X16X17X18X19X20; где X1 выбран из N или G; X2 выбран из Y или H; X3 выбран из N или P; X4 выбран из T или G; X5 выбран из A или N; X6 выбран из R или N; X7 выбран из N, Q, или E; X8 выбран из S или I; X9 выбран из T или A; X10 выбран из K или M; X11 выбран из S или R; X12 выбран из A или R; X13 выбран из M или L; X14 выбран из P или A; X15 выбран из A или M; X16 выбран из I или D; X17 выбран из P или Y; X18 присутствует или отсутствует, если присутствует, то представляет собой F; X19 присутствует или отсутствует, если присутствует, то представляет собой A; и X20 присутствует или отсутствует, если присутствует, то представляет собой Y; и область VL, содержащую последовательность CDR1, выбранную из SEQ ID NO: 18, 35, 38 или 39; последовательность CDR2, выбранную из SEQ ID NO: 19 или 36; и последовательность CDR3, выбранную из SEQ ID NO: 20 или 37.
[92] В некоторых вариантах реализации данного изобретения антитело против CLDN18.2 содержит область VH, содержащую последовательность CDR1 X21X22X23X24X25SFGMH; последовательность CDR2 YISSGSX26X27IYYX28DX29X30KG; и последовательность CDR3 AX31X32X33X34X35X36X37X38X39X40X41; где X21 присутствует или отсутствует, если присутствует, то представляет собой G; X22 присутствует или отсутствует, если присутствует, то представляет собой F; X23 присутствует или отсутствует, если присутствует, то представляет собой T; X24 присутствует или отсутствует, если присутствует, то представляет собой F; X25 присутствует или отсутствует, если присутствует, то представляет собой S; X26 выбран из S или G; X27 выбран из P или S; X28 выбран из V или A; X29 выбран из K или T; и X30 выбран из L или V; X31 выбран из G или T; X32 выбран из Y или S; X33 выбран из A или Y; X34 выбран из V или Y; X35 выбран из R или Y; X36 выбран из N или G; X37 выбран из A или N; X38 выбран из L или A; X39 выбран из D или L; X40 выбран из Y или E; and X41 присутствует или отсутствует, если присутствует, то представляет собой Y; и область VL, содержащую последовательность CDR1, выбранную из SEQ ID NO: 21, 24-28 или 31-34; последовательность CDR2, выбранную из SEQ ID NO: 22 или 29; и последовательность CDR3, выбранную из SEQ ID NO: 23 или 30.
[93] В некоторых вариантах реализации данного изобретения антитело против CLDN18.2 содержит область VH, содержащую последовательность CDR1, состоящую из SEQ ID NO: 1, последовательность CDR2 VIWNTGATRYX7SX9LKS и последовательность CDR3, состоящую из SEQ ID NO: 3, где X7 выбран из N, Q или E; и X9 выбран из T или A; и область VL, содержащую последовательность CDR1, состоящую из SEQ ID NO: 18, последовательность CDR2, состоящую из SEQ ID NO: 19, и последовательность CDR3, состоящую из SEQ ID NO: 20.
[94] В некоторых случаях антитело против CLDN18.2 содержит область VH, содержащую последовательность CDR1, состоящую из SEQ ID NO: 13, последовательность CDR2 VIWPGGNTNYX7X8ALMS и последовательность CDR3, состоящую из SEQ ID NO: 15, где X7 выбран из N или E; и X8 выбран из S или I; и область VL, содержащую последовательность CDR1, состоящую из SEQ ID NO: 35, 38 или 39; последовательность CDR2, состоящую из SEQ ID NO: 36; и последовательность CDR3, состоящую из SEQ ID NO: 37.
[95] В некоторых случаях антитело против CLDN18.2 содержит область VH, содержащую последовательность CDR1, выбранную из SEQ ID NO: 1, 7, 10 или 13; последовательность CDR2, выбранную из SEQ ID NO: 2, 4, 5, 6, 8, 11, 14, 16 или 17; и последовательность CDR3, выбранную из SEQ ID NO: 3, 9, 12 или 15; и область VL, содержащую последовательность CDR1, выбранную из SEQ ID NO: 18, 21, 24-28, 31-35, 38 или 39; последовательность CDR2, выбранную из SEQ ID NO: 19, 22, 29 или 36; и последовательность CDR3, выбранную из SEQ ID NO: 20, 23, 30 или 37.
[96] В некоторых случаях антитело против CLDN18.2 содержит область VH, содержащую последовательность CDR1, состоящую из SEQ ID NO: 1; последовательность CDR2, состоящую из SEQ ID NO: 2, 4, 5 или 6; и последовательность CDR3, состоящую из SEQ ID NO: 3; и область VL, содержащую последовательность CDR1, состоящую из SEQ ID NO: 18, последовательность CDR2, состоящую из SEQ ID NO: 19, и последовательность CDR3, состоящую из SEQ ID NO: 20.
[97] В некоторых случаях антитело против CLDN18.2 содержит область VH, содержащую последовательность CDR1, состоящую из SEQ ID NO: 13; последовательность CDR2, состоящую из SEQ ID NO: 14, 16 или 17; и последовательность CDR3, состоящую из SEQ ID NO: 15; и область VL, содержащую последовательность CDR1, выбранную из SEQ ID NO: 35, 38 или 39; последовательность CDR2, состоящую из SEQ ID NO: 36; и последовательность CDR3, состоящую из SEQ ID NO: 37.
[98] В некоторых случаях антитело против CLDN18.2 содержит область VH, содержащую последовательность CDR1, состоящую из SEQ ID NO: 7, последовательность CDR2, состоящую из SEQ ID NO: 8, и последовательность CDR3, состоящую из SEQ ID NO: 9; и область VL, содержащую последовательность CDR1, выбранную из SEQ ID NO: 21 или 24-27; последовательность CDR2, состоящую из SEQ ID NO: 22; и последовательность CDR3, состоящую из SEQ ID NO: 23.
[99] В некоторых случаях антитело против CLDN18.2 содержит область VH, содержащую последовательность CDR1, состоящую из SEQ ID NO: 10, последовательность CDR2, состоящую из SEQ ID NO: 11, и последовательность CDR3, состоящую из SEQ ID NO: 12; и область VL, содержащую последовательность CDR1, выбранную из SEQ ID NO: 28 или 31-34; последовательность CDR2, состоящую из SEQ ID NO: 29; и последовательность CDR3, состоящую из SEQ ID NO: 30.
[100] В некоторых вариантах реализации данного изобретения описанное в данном документе антитело против CLDN18.2 представляет собой полноразмерное антитело или его связывающий фрагмент. В некоторых случаях антитело против CLDN18.2 представляет собой химерное антитело или его связывающий фрагмент. В некоторых случаях антитело против CLDN18.2 представляет собой гуманизированное антитело или его связывающий фрагмент. В дополнительных случаях антитело против CLDN18.2 представляет собой моноклональное антитело или его связывающий фрагмент.
[101] В некоторых случаях антитело против CLDN18.2 содержит моновалентный Fab', бивалентный Fab2, одноцепочечный вариабельный фрагмент (оцFv), диатело, миниантитело, наноантитело, однодоменное антитело (одАт) или антитело верблюдовых, или их связывающий фрагмент.
[102] В некоторых случаях антитело против CLDN18.2 представляет собой биспецифическое антитело или его связывающий фрагмент. Примеры форматов биспецифических антител включают в себя следующие, но не ограничиваются ими: «выступы и впадины» (KiH), иммуноглобулин по технологии асимметричной реинженерии (ART-Ig), квадрому Triomab, биспецифическое моноклональное антитело (BiMAb, BsmAb, BsAb, bsMab, BS-Mab или Bi-MAb), азиметрик, биспецифическое взаимодействие с антителами на основе рецептора Т-клеток (BEAT), биспецифическое взаимодействие с Т-клетками (BiTE), биклоникс, Fab-оцFv-Fc, два-в-одном/ Fab двойного действия (DAF), финомаб, слитый белок оцFv-Fc-(Fab), докинг-локинг (DNL), адаптир (ранее - SCORPION), тандемное диатело (TandAb), перенацеливание с двойной аффинностью (DART), наноантитело, тройное антитело, тандемы оцFv (taFv), тройные головки, тандемное dAb/VHH, тройное dAb/VHH или четырехвалентное dAb/VHH. В некоторых случаях антитело против CLDN18.2 представляет собой биспецифическое антитело или его связывающий фрагмент, содержащий формат биспецифического антитела, показанный на Фиг. 2 из работы Brinkmann and Kontermann, “The making of bispecific antibodies,” MABS 9(2): 182-212 (2017).
[103] В некоторых вариантах реализации данного изобретения описанное в данном документе антитело против CLDN18.2 содержит мутацию в сайте посттрансляционной модификации. В некоторых случаях указанная мутация находится в области VH. В других случаях указанная мутация находится в области VL. В дополнительных случаях две или более мутации находятся в области VH, области VL или их комбинации.
[104] В некоторых случаях указанная мутация находится в аминокислотном положении 60, 61 или 62 области VH антитела против CLDN18.2, и при этом аминокислотное положение соответствует положению 60, 61 или 62 из SEQ ID NO: 40. В некоторых случаях указанная мутация находится в аминокислотном положении 60 или 61, что соответствует положению 60 или 61 из SEQ ID NO: 40. В некоторых случаях указанная мутация находится в аминокислотном положении 60 или 62, что соответствует положению 60 или 62 из SEQ ID NO: 40. В некоторых случаях указанная мутация находится в аминокислотном положении 60 (N60) или 61 (S61) из SEQ ID NO: 40. В некоторых случаях указанная мутация находится в аминокислотном положении 60 (N60) или 62 (T62) из SEQ ID NO: 40. В некоторых случаях указанная мутация повышает аффинность связывания антитела против CLDN18.2 по сравнению с референсным антителом 175D10.
[105] В некоторых случаях указанная мутация находится в аминокислотном положении 60, 61 или 62 области VH антитела против CLDN18.2, и при этом аминокислотное положение соответствует положению 60, 61 или 62 из SEQ ID NO: 57. В некоторых случаях указанная мутация находится в аминокислотном положении 60 или 61, что соответствует положению 60 или 61 из SEQ ID NO: 57. В некоторых случаях указанная мутация находится в аминокислотном положении 60 или 62, что соответствует положению 60 или 62 из SEQ ID NO: 57. В некоторых случаях указанная мутация находится в аминокислотном положении 60 (N60) или 61 (S61) из SEQ ID NO: 57. В некоторых случаях указанная мутация находится в аминокислотном положении 60 (N60) или 62 (T62) из SEQ ID NO: 57. В некоторых случаях указанная мутация повышает аффинность связывания антитела против CLDN18.2 по сравнению с референсным антителом 175D10.
[106] В некоторых случаях аминокислотный остаток N60 мутирован в полярную аминокислоту или кислую аминокислоту. В некоторых случаях аминокислотный остаток N60 мутирован в полярную аминокислоту, выбранную из серина, треонина, аспарагина или глутамина. В некоторых случаях аминокислотный остаток N60 мутирован в кислую аминокислоту, выбранную из аспарагиновой кислоты или глутаминовой кислоты. В некоторых случаях аминокислотный остаток N60 мутирован в глутамин. В некоторых случаях аминокислотный остаток N60 мутирован в глутаминовую кислоту.
[107] В некоторых случаях аминокислотный остаток S61 мутирован в неполярный остаток, необязательно выбранный из аланина, цистеина, глицина, изолейцина, лейцина, метионина, фенилаланина, пролина, триптофана, тирозина и валина. В некоторых случаях аминокислотный остаток S61 мутирован в изолейцин.
[108] В некоторых случаях аминокислотный остаток T62 мутирован в неполярный остаток, необязательно выбранный из аланина, цистеина, глицина, изолейцина, лейцина, метионина, фенилаланина, пролина, триптофана, тирозина и валина. В некоторых случаях аминокислотный остаток T62 мутирован в аланин.
[109] В некоторых случаях указанная мутация находится в аминокислотном положении 31 или 32 области VL антитела против CLDN18.2, в котором аминокислотные положения соответствуют положению 31 или 32 из SEQ ID NO: 46. В некоторых случаях указанная мутация находится в аминокислотном положении 31 (N31) или 32 (S32) из SEQ ID NO: 46. В некоторых случаях указанная мутация повышает аффинность связывания антитела против CLDN18.2 по сравнению с референсным антителом 175D10.
[110] В некоторых случаях указанная мутация находится в аминокислотном положении 31 или 32 области VL антитела против CLDN18.2, и при этом аминокислотные положения соответствуют положению 31 или 32 из SEQ ID NO: 52. В некоторых случаях указанная мутация находится в аминокислотном положении 31 (N31) или 32 (S32) из SEQ ID NO: 52. В некоторых случаях указанная мутация повышает аффинность связывания антитела против CLDN18.2 по сравнению с референсным антителом 175D10.
[111] В некоторых случаях указанная мутация находится в аминокислотном положении 31 или 32 области VL антитела против CLDN18.2, в котором аминокислотные положения соответствуют положению 31 или 32 из SEQ ID NO: 60. В некоторых случаях указанная мутация находится в аминокислотном положении 31 (N31) или 32 (S32) из SEQ ID NO: 60. В некоторых случаях указанная мутация повышает аффинность связывания антитела против CLDN18.2 по сравнению с референсным антителом 175D10.
[112] В некоторых случаях аминокислотный остаток N31 мутирован в кислую аминокислоту. В некоторых случаях аминокислотный остаток N31 мутирован в аспарагиновую кислоту или в глутаминовую кислоту. В некоторых случаях аминокислотный остаток N31 мутирован в аспарагиновую кислоту. В некоторых случаях аминокислотный остаток N31 мутирован в глутаминовую кислоту.
[113] В некоторых случаях аминокислотный остаток S32 мутирован в неполярный остаток, необязательно выбранный из аланина, цистеина, глицина, изолейцина, лейцина, метионина, фенилаланина, пролина, триптофана, тирозина и валина. В некоторых случаях аминокислотный остаток S32 мутирован в лейцин, валин или изолейцин. В некоторых случаях аминокислотный остаток S32 мутирован в лейцин. В некоторых случаях аминокислотный остаток S32 мутирован в валин. В некоторых случаях аминокислотный остаток S32 мутирован в изолейцин.
[114] В некоторых вариантах реализации данного изобретения описанное в данном документе антитело против CLDN18.2 содержит мутацию в аминокислотном положении 60, 61 или 62 области VH антитела против CLDN18.2, в котором аминокислотное положение соответствует положению 60 , 61 или 62 из SEQ ID NO: 57; и мутацию в аминокислотном положении 31 или 32 области VL антитела против CLDN18.2, в котором аминокислотное положение соответствуют положению 31 или 32 из SEQ ID NO: 60. В некоторых случаях указанная мутация находится в аминокислотном положении 60 или 61, что соответствует положению 60 или 61 из SEQ ID NO: 57. В некоторых случаях указанная мутация находится в аминокислотном положении 60 или 62, что соответствует положению 60 или 62 из SEQ ID NO: 57. В некоторых случаях указанная мутация находится в аминокислотном положении 60 (N60) или 61 (S61) из SEQ ID NO: 57. В некоторых случаях указанная мутация находится в аминокислотном положении 60 (N60) или 62 (T62) из SEQ ID NO: 57. В некоторых случаях указанная мутация находится в аминокислотном положении 31 (N31) или 32 (S32) из SEQ ID NO: 60. В некоторых случаях указанные мутации повышают аффинность связывания антитела против CLDN18.2 по сравнению с референсным антителом 175D10.
[115] В некоторых вариантах реализации данного изобретения описанное в данном документе антитело против CLDN18.2 представляет собой химерное антитело или его связывающий фрагмент. В некоторых случаях указанное химерное антитело или его связывающий фрагмент содержит область VH, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 40-43, и область VL, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательности с SEQ ID NO: 44. В некоторых случаях указанное химерное антитело или его связывающий фрагмент содержит область VH, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательности с SEQ ID NO: 45, и область VL, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 46-50. В некоторых случаях указанное химерное антитело или его связывающий фрагмент содержит область VH, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательности с SEQ ID NO: 51, и область VL, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 52-56. В некоторых случаях указанное химерное антитело или его связывающий фрагмент содержит область VH, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 57-59, и область VL, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 60-62.
[116] В некоторых вариантах реализации данного изобретения область VH и область VL химерного антитела против CLDN18.2 проиллюстрированы в Таблице 3. Подчеркнутые области обозначают соответствующую последовательность CDR1, CDR2 или CDR3.
(Родитель)
(T62A)
(Родитель)
(Родитель)
(Родитель)
(Родитель)
(Родитель)
(Родитель)
[117] В некоторых случаях указанное химерное антитело или его связывающий фрагмент содержит область CH, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательности с SEQ ID NO: 63, и область CL, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательности с SEQ ID NO: 64. В некоторых случаях указанное химерное антитело или его связывающий фрагмент содержит область CH и область CL, как указано в Таблице 4.
[118] В некоторых вариантах реализации данного изобретения описанное в данном документе антитело против CLDN18.2 представляет собой гуманизированное антитело или его связывающий фрагмент. В некоторых случаях указанное гуманизированное антитело или его связывающий фрагмент содержит область VH, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 65-68, и область VL, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 69-73. В некоторых случаях указанное гуманизированное антитело или его связывающий фрагмент содержит область VH, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 74-76, и область VL, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 77-80. В некоторых случаях указанное гуманизированное антитело или его связывающий фрагмент содержит область VH, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 81-84, и область VL, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 85-88. В некоторых случаях указанное гуманизированное антитело или его связывающий фрагмент содержит область VH, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 89-92, и область VL, которая по меньшей мере на 80%, на 85%, на 90%, на 95% или на 100% идентична последовательностям с SEQ ID NO: 93-97.
[119] В некоторых вариантах реализации данного изобретения область VH и область VL гуманизированного антитела против CLDN18.2 проиллюстрированы в Таблице 5. Подчеркнутые области обозначают соответствующую последовательность CDR1, CDR2 или CDR3.
[120] В некоторых вариантах реализации данного изобретения описанное в данном документе антитело против CLDN18.2 содержит область VH и область VL, как показано в Таблице 6.
(SEQ ID NO: 65)
(SEQ ID NO: 66)
(SEQ ID NO: 67)
(SEQ ID NO: 68)
(SEQ ID NO: 69)
(SEQ ID NO: 65+SEQ ID NO: 69)
(SEQ ID NO: 66+SEQ ID NO: 69)
(SEQ ID NO: 67+SEQ ID NO: 69)
(SEQ ID NO: 68+SEQ ID NO: 69)
(SEQ ID NO: 70)
(SEQ ID NO: 65+SEQ ID NO: 70)
(SEQ ID NO: 66+SEQ ID NO: 70)
(SEQ ID NO: 67+SEQ ID NO: 70)
(SEQ ID NO: 68+SEQ ID NO: 70)
(SEQ ID NO: 71)
(SEQ ID NO: 65+SEQ ID NO: 71)
(SEQ ID NO: 66+SEQ ID NO: 71)
(SEQ ID NO: 67+SEQ ID NO: 71)
(SEQ ID NO: 68+SEQ ID NO: 71)
(SEQ ID NO: 72)
(SEQ ID NO: 65+SEQ ID NO: 72)
(SEQ ID NO: 66+SEQ ID NO: 72)
(SEQ ID NO: 67+SEQ ID NO: 72)
(SEQ ID NO: 68+SEQ ID NO: 72)
(SEQ ID NO: 73)
(SEQ ID NO: 65+SEQ ID NO: 73)
(SEQ ID NO: 66+SEQ ID NO: 73)
(SEQ ID NO: 67+SEQ ID NO: 73)
(SEQ ID NO: 68+SEQ ID NO: 73)
[121] В некоторых вариантах реализации данного изобретения описанное в данном документе антитело против CLDN18.2 содержит область VH и область VL, как показано в Таблице 7.
(SEQ ID NO: 74)
(SEQ ID NO: 75)
(SEQ ID NO: 76)
(SEQ ID NO: 77)
(SEQ ID NO: 74 +
SEQ ID NO: 77)
SEQ ID NO: 75 +
SEQ ID NO: 77)
SEQ ID NO: 76 +
SEQ ID NO: 77)
(SEQ ID NO: 78)
(SEQ ID NO: 74 +
SEQ ID NO: 78)
(SEQ ID NO: 75 +
SEQ ID NO: 78)
(SEQ ID NO: 76 +
SEQ ID NO: 78)
(SEQ ID NO: 79)
(SEQ ID NO: 74 +
SEQ ID NO: 79)
(SEQ ID NO: 75 +
SEQ ID NO: 79)
(SEQ ID NO: 76 +
SEQ ID NO: 79)
(SEQ ID NO: 80)
(SEQ ID NO: 74 +
SEQ ID NO: 80)
(SEQ ID NO: 75 +
SEQ ID NO: 80)
(SEQ ID NO: 76 +
SEQ ID NO: 80)
[122] В некоторых вариантах реализации данного изобретения описанное в данном документе антитело против CLDN18.2 содержит область VH и область VL, как показано в Таблице 8.
(SEQ ID NO: 85)
(SEQ ID NO: 86)
(SEQ ID NO: 87)
(SEQ ID NO: 88)
(SEQ ID NO: 81)
(SEQ ID NO: 85 +
SEQ ID NO: 81)
(SEQ ID NO: 86 +
SEQ ID NO: 81)
(SEQ ID NO: 87 +
SEQ ID NO: 81)
(SEQ ID NO: 88 +
SEQ ID NO: 81)
(SEQ ID NO: 82)
(SEQ ID NO: 85 +
SEQ ID NO: 82)
(SEQ ID NO: 86 +
SEQ ID NO: 82)
(SEQ ID NO: 87 +
SEQ ID NO: 82)
(SEQ ID NO: 88 +
SEQ ID NO: 82)
(SEQ ID NO: 83)
(SEQ ID NO: 85 +
SEQ ID NO: 83)
(SEQ ID NO: 86 +
SEQ ID NO: 83)
(SEQ ID NO: 87 +
SEQ ID NO: 83)
(SEQ ID NO: 88 +
SEQ ID NO: 83)
(SEQ ID NO: 84)
(SEQ ID NO: 85 +
SEQ ID NO: 84)
(SEQ ID NO: 86 +
SEQ ID NO: 84)
(SEQ ID NO: 87 +
SEQ ID NO: 84)
(SEQ ID NO: 88 +
SEQ ID NO: 84)
[123] В некоторых вариантах реализации данного изобретения описанное в данном документе антитело против CLDN18.2 содержит область VH и область VL, как показано в Таблице 9.
(SEQ ID NO: 93)
(SEQ ID NO: 94)
(SEQ ID NO: 95)
(SEQ ID NO: 96)
(SEQ ID NO: 97)
(SEQ ID NO: 89)
(SEQ ID NO: 93+SEQ ID NO: 89)
(SEQ ID NO: 94+SEQ ID NO: 89)
(SEQ ID NO: 95+SEQ ID NO: 89)
(SEQ ID NO: 96+SEQ ID NO: 89)
(SEQ ID NO: 97+SEQ ID NO: 89)
(SEQ ID NO: 90)
(SEQ ID NO: 93+SEQ ID NO: 90)
(SEQ ID NO: 94+SEQ ID NO: 90)
(SEQ ID NO: 95+SEQ ID NO: 90)
(SEQ ID NO: 96+SEQ ID NO: 90)
(SEQ ID NO: 97+SEQ ID NO: 90)
(SEQ ID NO: 91)
(SEQ ID NO: 93+SEQ ID NO: 91)
(SEQ ID NO: 94+SEQ ID NO: 91)
(SEQ ID NO: 95+SEQ ID NO: 91)
(SEQ ID NO: 96+SEQ ID NO: 91)
(SEQ ID NO: 97+SEQ ID NO: 91)
(SEQ ID NO: 92)
(SEQ ID NO: 93+SEQ ID NO: 92)
(SEQ ID NO: 94+SEQ ID NO: 92)
(SEQ ID NO: 95+SEQ ID NO: 92)
(SEQ ID NO: 96+SEQ ID NO: 92)
(SEQ ID NO: 97+SEQ ID NO: 92)
[124] В некоторых вариантах реализации данного изобретения описанное в данном документе антитело против CLDN18.2 содержит каркасную область, выбранную из IgM, IgG (например, IgG1, IgG2, IgG3 или IgG4), IgA или IgE. В некоторых случаях антитело против CLDN18.2 содержит каркасную область IgM. В некоторых случаях антитело против CLDN18.2 содержит каркасную область IgG (например, IgG1, IgG2, IgG3 или IgG4). В некоторых случаях антитело против CLDN18.2 содержит каркасную область IgG1. В некоторых случаях антитело против CLDN18.2 содержит каркасную область IgG2.
[125] В некоторых вариантах реализации данного изобретения антитело против CLDN18.2 содержит одну или большее число мутаций в каркасной области, например, в домене CH1, домене CH2, домене CH3, шарнирной области, или их комбинацию. В некоторых случаях одна или большее число мутаций модулируют взаимодействия рецептора Fc, например, для усиления эффекторных функций Fc, таких как АЗКЦ и (или) комплементзависимая цитотоксичность (КЗЦ). В некоторых случаях одна или большее число мутаций стабилизируют антитело и (или) увеличивают период полужизни антитела. В дополнительных случаях одна или большее число мутаций модулируют гликозилирование.
[126] В некоторых вариантах реализации данного изобретения область Fc содержит одну или большее число мутаций, которые модулируют взаимодействия рецептора Fc, например, для усиления эффекторных функций, таких как АЗКЦ и (или) КЗЦ. В таких случаях иллюстративные остатки, которые при мутации модулируют эффекторные функции, включают в себя S239, F243, R292, Y300, V305, P396, K326, A330, I332 или E333, при этом положение остатка соответствует IgG1, а нумерация остатков приведена в соответствии с нумерацией по Кабату (EU index of Kabat et al 1991 Sequences of Proteins of Immunological Interest). В некоторых случаях указанные одна или большее число мутаций включают в себя S239D, F243L, R292P, Y300L, V305I, P396L, K326W, A330L, I332E, E333A, E333S, или их комбинацию. В некоторых случаях указанные одна или большее число мутаций включают в себя S239D, I332E, или их комбинацию. В некоторых случаях указанные одна или большее число мутаций включают в себя F243L, R292P, Y300L, V305I, P396L, I332E, или их комбинацию. В некоторых случаях указанные одна или большее число мутаций включают в себя S239D, A330L, I332E, или их комбинацию. В некоторых случаях указанные одна или большее число мутаций включают в себя K326W, E333S, или их комбинацию. В некоторых случаях указанная мутация включает в себя E333A.
[127] В некоторых случаях антитело против CLDN18.2 имеет общий связывающий эпитоп с референсным антителом 175D10.
[128] В некоторых случаях антитело против CLDN18.2 обладает активностью перекрестного связывания с белком CLDN18.2 мыши и яванской макаки.
Получение антител
[129] В некоторых вариантах реализации данного изобретения антитела против CLDN18.2 получают в соответствии со стандартным протоколом путем инъекции продуцирующему животному антигенной композиции. См., например, работу Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, 1988. При использовании всего белка или большей части белка антитела могут быть получены путем иммунизации продуцирующего животного указанным белком и подходящим адъювантом (например, адъювантом Фрейнда, полным адъювантом Фрейнда, эмульсиями масла в воде и т. д.). Когда используется пептид меньшего размера, выгодно конъюгировать пептид с молекулой большего размера для получения иммуностимулирующего конъюгата. Обычно используемые конъюгированные белки, которые коммерчески доступны для такого применения, включают в себя бычий сывороточный альбумин (БСА) и гемоцианин моллюска Megathura crenulata (англ. «KLH»). Чтобы вырабатывать антитела к конкретным эпитопам, можно использовать пептиды, полученные из полной последовательности. В качестве альтернативы, чтобы генерировать антитела к относительно коротким пептидным частям белка-мишени, может быть вызван гипериммунный ответ, если полипептид соединен с белком-носителем, таким как овальбумин, БСА или KLH.
[130] Поликлональные или моноклональные антитела против CLDN18.2 могут быть получены от животных, которые были генетически изменены с целью продуцирования иммуноглобулинов человека. Трансгенное животное может быть получено путем первоначального получения животного с генным «нокаутом», которое не продуцирует естественные антитела животного, и стабильной трансформации такого животного локусом антитела человека (например, с использованием искусственной хромосомы человека). В таких случаях животное вырабатывает только антитела человека. Способы получения таких животных и получения из них антител описаны в патентах США № 6162963 и № 6150584, включенных в данный документ посредством ссылки в полном объеме. Такие антитела можно назвать ксеногенными антителами человека.
[131] В качестве альтернативы, антитела против CLDN18.2 можно получить из фаговых библиотек, содержащих вариабельные области человека. См. патент США № 6174708, включенный в данный документ посредством ссылки в полном объеме.
[132] В некоторых аспектах любого из вариантов реализации данного изобретения, раскрытых в данном документе, антитело против CLDN18.2 продуцируется гибридомой.
[133] Для моноклональных антител против CLDN18.2 гибридомы могут быть сформированы путем выделения стимулированных иммунных клеток, таких как клетки селезенки инокулированного животного. Эти клетки затем могут быть слиты с иммортализованными клетками, такими как клетки миеломы или трансформированные клетки, которые способны неограниченно реплицироваться в культуре клеток, тем самым получая бессмертную линию клеток, секретирующих иммуноглобулин. Используемая иммортализованная клеточная линия может быть выбрана с дефицитом ферментов, необходимых для использования определенных питательных веществ. Многие такие клеточные линии (такие как миеломы) известны специалистам в данной области техники и включают в себя, например, тимидинкиназу (ТК) или гипоксантин-гуанинфосфорибоксилтрансферазу (ГГФРТ, англ. «HGPRT»). Наличие таких дефицитов позволяет отобрать слитые клетки в соответствии с их способностью расти, например, на среде с гипоксантинаминоптеринтимидином (ГАТ, англ. «HAT»).
[134] Кроме того, антитело против CLDN18.2 можно получить с помощью генной инженерии.
[135] Описанные в данном документе антитела против CLDN18.2 могут иметь пониженную склонность вызывать нежелательный иммунный ответ у людей, например, анафилактический шок, а также могут проявлять пониженную склонность к праймированию иммунного ответа, который предотвращал бы повторное введение доз терапевтических антител или агентов визуализации (например, ответ человека на антитело мыши - ОЧАМ, англ. «НАМА»). Такие антитела против CLDN18.2 включают в себя, но не ограничиваются ими, гуманизированные, химерные или ксеногенные антитела человека против CLDN18.2.
[136] Химерные антитела против CLDN18.2 могут быть получены, например, рекомбинантными способами путем объединения вариабельных областей легкой и тяжелой цепи мыши (VK и VH), полученных из клона гибридомы мыши (или другого животного происхождения), с константными областями легкой и тяжелой цепей человека, чтобы получить антитело с преимущественно человеческими доменами. Получение таких химерных антител хорошо известно в данной области техники и может быть достигнуто стандартными способами (как описано, например, в патенте США № 5624659, включенном в данный документ посредством ссылки в полном объеме).
[137] Термин «гуманизированные» применительно к нечеловеческим антителам (например, к антителам грызунов или приматов) обозначает гибридные иммуноглобулины, цепи иммуноглобулина или их фрагменты, которые содержат минимальную последовательность, полученную из нечеловеческого иммуноглобулина. По большей части гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки из области, определяющей комплементарность (CDR), реципиента заменяются остатками из CDR видов, отличных от человека (донорское антитело), таких как мышь, крыса, кролик или примат, имеющими желаемую специфичность, аффинность и функциональную возможность. В некоторых случаях остатки Fv каркасной области (FR) иммуноглобулина человека заменяются соответствующими остатками от видов, отличных от человека. Гуманизированные антитела могут содержать остатки, которые не присутствуют ни в антителе реципиента, ни в импортированных последовательностях CDR или каркасных участков. Такие модификации осуществляют с целью дополнительного улучшения и оптимизации характеристик антитела, а также для минимизации иммуногенности при введении в организм человека. В некоторых примерах гуманизированное антитело будет содержать по существу все из по меньшей мере одного и, как правило, двух вариабельных доменов, в которых все или по существу все области CDR соответствуют таковым из нечеловеческого иммуноглобулина, и все или по существу все области FR являются таковым из последовательности иммуноглобулина человека. Гуманизированное антитело также может содержать по меньшей мере часть константной области иммуноглобулина (Fc), как правило, из иммуноглобулина человека.
[138] Гуманизированные антитела могут быть сконструированы так, чтобы они содержали иммуноглобулиновые домены, подобные человеческим, и включали в себя только определяющие комплементарность области антитела животного происхождения. Это может быть достигнуто путем тщательного изучения последовательности гипервариабельных петель вариабельных областей моноклональной антигенсвязывающей единицы или моноклонального антитела и подгонки их к структуре антигенсвязывающей единицы человека или цепям антитела человека. См., например, патент США № 6187287, включенный в данный документ посредством ссылки в полном объеме.
[139] Способы гуманизации нечеловеческих антител хорошо известны в данной области техники. «Гуманизированные» антитела представляют собой антитела, в которых по меньшей мере часть последовательности была изменена по сравнению с ее исходной формой, чтобы сделать ее более похожей на иммуноглобулины человека. В некоторых версиях константные (C) области тяжелой (H) цепи и легкой (L) цепи заменены человеческой последовательностью. Это может быть гибридный полипептид, содержащий вариабельную (V) область и гетерологичную область C иммуноглобулина. В некоторых версиях участки, определяющие комплементарность (CDR), содержат последовательности антител, не относящиеся к человеку, в то время как каркасные области V также были преобразованы в последовательности человека. См., например, EP 0329400. В некоторых версиях области V гуманизированы путем конструирования консенсусных последовательностей областей V человека и мыши, и преобразования остатков вне CDR, которые различаются между консенсусными последовательностями.
[140] В принципе, каркасная последовательность из гуманизированного антитела может служить матрицей для трансплантации CDR; однако было продемонстрировано, что прямая замена CDR в такой каркасной области может привести к значительной потере аффинности связывания с антигеном. Glaser et al. (1992) J. Immunol. 149: 2606; Tempest et al. (1992) Biotechnology 9: 266; and Shalaby et al. (1992) J. Exp. Med. 17: 217. Чем более гомологично антитело человека (HuAb) исходному антителу мыши (muAb), тем меньше вероятность того, что каркас человека внесет искажения в CDR мыши, которые могут снизить аффинность. Основываясь на поиске гомологии последовательностей в базе данных последовательностей антител, HuAb IC4 обеспечивает хорошую гомологию каркасной области с muM4TS.22, хотя также могут быть подходящими другие высокогомологичные HuAb, особенно L-цепи каппа из подгруппы I человека или H-цепи из подгруппы III человека. Kabat et al. (1987). Доступны различные компьютерные программы, такие как ENCAD (Levitt et al. (1983) J. Mol. Biol. 168: 595), для предсказания идеальной последовательности для области V. Таким образом, данное изобретение охватывает HuAb с различными вариабельными (V) участками. Специалист в данной области техники может определить подходящие последовательности для области V и оптимизировать эти последовательности. Способы получения антител с пониженной иммуногенностью также описаны в патенте США № 5270202 и ЕР 699755.
[141] Для достижения этой цели гуманизированные антитела могут быть получены путем анализа исходных последовательностей и различных концептуальных гуманизированных продуктов с применением трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов известны специалистам в данной области техники. Доступны компьютерные программы, которые иллюстрируют и отображают вероятные трехмерные конформационные структуры выбранных последовательностей кандидатных иммуноглобулинов. Проверка этих изображений позволяет анализировать вероятную роль остатков в функционировании последовательности кандидатного иммуноглобулина, т. е. анализировать остатки, которые влияют на способность кандидатного иммуноглобулина связывать его антиген. Таким образом, остатки FR могут быть выбраны и объединены из консенсусной и импортируемой последовательности так, что достигается желательная характеристика антитела, такая как повышенная аффинность к целевому (целевым) антигену (антигенам).
[142] Процесс гуманизации рассматриваемых антигенсвязывающих единиц может быть следующим. Наиболее подходящие вариабельные области тяжелой и легкой цепей акцептора зародышевой линии выбираются на основе гомологии, канонической структуры и физических свойств зародышевых линий антител человека для трансплантации. Выполняется компьютерное моделирование mVH/VL по сравнению с пересаженными hVH/VL и генерируется прототип гуманизированной последовательности антитела. Если моделирование показало необходимость обратных мутаций каркаса, то генерируется второй вариант с указанными изменениями FW. Синтезируются фрагменты ДНК, кодирующие выбранные каркасные области зародышевой линии и CDR мыши. Синтезированные фрагменты ДНК субклонируют в векторы экспрессии IgG и подтверждают последовательности путем секвенирования ДНК. Гуманизированные антитела экспрессируются в клетках, таких как 293F, и соответствующие белки тестируются, например, в анализах фагоцитоза MDM и анализах связывания антигена. Гуманизированные антигенсвязывающие единицы сравнивают с родительскими антигенсвязывающими единицами по аффинности связывания антигена, например, с помощью метода FACS на клетках, экспрессирующих целевой антиген. Если аффинность более чем в 2 раза ниже, чем у родительской антигенсвязывающей единицы, то может быть создан и протестирован второй цикл гуманизированных вариантов, как описано выше.
[143] Как отмечалось выше, антитело против CLDN18.2 может быть «моновалентным» или «поливалентным». В то время как первый имеет один сайт связывания на каждую антигенсвязывающую единицу, последний содержит несколько сайтов связывания, способных связываться с более чем одним антигеном одного или разных типов. В зависимости от количества сайтов связывания антигенсвязывающие единицы могут быть двухвалентными (имеющими два антигенсвязывающих сайта), трехвалентными (имеющими три антигенсвязывающих сайта), четырехвалентными (имеющими четыре антигенсвязывающих сайта) и так далее.
[144] Поливалентные антитела против CLDN18.2 можно дополнительно классифицировать на основе их специфичности связывания. «Моноспецифическое» антитело против CLDN18.2 представляет собой молекулу, способную связываться с одним или большим числом антигенов одного и того же типа. «Мультиспецифическое» антитело против CLDN18.2 представляет собой молекулу, обладающую специфичностью связывания с по меньшей мере двумя разными антигенами. Хотя такие молекулы обычно связывают только два различных антигена (т. е. биспецифические антитела против CLDN18.2), данной экспрессией при использовании в данном документе охватываются антитела с дополнительной специфичностью. В данном изобретении также представлены мультиспецифические антитела против CLDN18.2. Мультиспецифические антитела против CLDN18.2 представляют собой поливалентные молекулы, способные связываться с по меньшей мере двумя разными антигенами, например, биспецифические и триспецифические молекулы, проявляющие специфичность связывания с двумя и тремя различными антигенами, соответственно.
Полинуклеотиды и векторы
[145] В некоторых вариантах реализации, в данном изобретении представлены выделенные нуклеиновые кислоты, кодирующие любое из антител против CLDN18.2, раскрытых в данном документе. В другом варианте реализации, в данном изобретении представлены векторы, содержащие последовательность нуклеиновой кислоты, кодирующую любое из антител против CLDN18.2, раскрытых в данном документе. В некоторых вариантах реализации, в данном изобретении представлены выделенные нуклеиновые кислоты, которые кодируют CDR легкой цепи и CDR тяжелой цепи антитела против CLDN18.2, раскрытого в данном документе.
[146] Рассматриваемые антитела против CLDN18.2 могут быть получены с помощью технологии рекомбинантной ДНК, методик синтетической химии или их комбинации. Например, последовательности, кодирующие желаемые компоненты антител против CLDN18.2, включая CDR легкой цепи и CDR тяжелой цепи, обычно собирают и клонируют в вектор экспрессии с использованием стандартных молекулярных методик, известных в данной области техники. Эти последовательности могут быть собраны из других векторов, кодирующих желаемую последовательность белка, из фрагментов, полученных с помощью ПЦР, с использованием соответствующих матричных нуклеиновых кислот, или путем сборки синтетических олигонуклеотидов, кодирующих желаемые последовательности. Системы экспрессии могут быть созданы путем трансфекции подходящей клетки экспрессирующим вектором, который содержит интересующее антитело против CLDN18.2.
[147] Нуклеотидные последовательности, соответствующие различным областям легких или тяжелых цепей существующего антитела, могут быть легко получены и секвенированы с использованием обычных методик, включая, но не ограничиваясь ими, гибридизацию, ПЦР и секвенирование ДНК. Гибридомные клетки, продуцирующие моноклональные антитела, служат предпочтительным источником нуклеотидных последовательностей антител. Огромное количество гибридомных клеток, продуцирующих массив моноклональных антител, можно получить из государственных или частных репозиториев. Самым крупным депозитным агентом является Американская коллекция типовых культур (atcc.org), которая предлагает разнообразную коллекцию хорошо охарактеризованных клеточных линий гибридомы. В качестве альтернативы, нуклеотиды антител могут быть получены от иммунизированных или неиммунизированных грызунов или людей, и из таких органов, как селезенка и лимфоциты периферической крови. Конкретные методики, применимые для экстракции и синтеза нуклеотидов антител, описаны в работах Orlandi et al.(1989) Proc. Natl. Acad. Sci. U.S.A 86: 3833-3837; Larrick et al. (1989) Biochem. Biophys. Res. Commun. 160: 1250-1255; Sastry et al. (1989) Proc. Natl. Acad. Sci., U.S.A. 86: 5728-5732; и в патенте США № 5969108.
[148] Полинуклеотиды, кодирующие антитела против CLDN18.2, также могут быть модифицированы, например, путем замещения кодирующей последовательности на константные области тяжелой и легкой цепей человека вместо гомологичных нечеловеческих последовательностей. Таким образом получают химерные антитела, которые сохраняют специфичность связывания исходного антитела против CLDN18.2.
[149] Следует также понимать, что полинуклеотиды, воплощенные в данном изобретении, включают в себя те, которые кодируют их функциональные эквиваленты и фрагменты приведенных в качестве примеров полипептидов. Функционально эквивалентные полипептиды включают в себя те, которые усиливают, уменьшают или не влияют значительно на свойства кодируемых ими полипептидов. Функциональные эквиваленты могут представлять собой полипептиды, имеющие консервативные аминокислотные замены, аналоги, включая слитые белки, и мутанты.
[150] Из-за вырожденности генетического кода могут существовать значительные вариации в нуклеотидах кодирующей последовательности антигенсвязывающей единицы, а также в последовательностях, подходящих для конструирования полинуклеотида и векторов согласно данному изобретению. Варианты последовательностей могут иметь модифицированные последовательности ДНК или аминокислот, одну или большее число замен, делеций или добавлений, суммарным эффектом которых является сохранение желаемой антигенсвязывающей активности. Например, в кодирующей области могут быть произведены различные замены, которые либо не изменяют кодируемые аминокислоты, либо приводят к консервативным изменениям. Такие замены охватываются данным изобретением. Консервативные замены, как правило, включают в себя замены в рамках следующих групп: глицин, аланин; валин, изолейцин, лейцин; аспарагиновая кислота, глутаминовая кислота, аспарагин, глутамин; серин, треонин; лизин, аргинин; и фенилаланин, тирозин. В то время как консервативные замены действительно изменяют один или большее число аминокислотных остатков, содержащихся в продуцируемом полипептиде, ожидается, что данные замены не будут влиять на антигенсвязывающую активность образующихся в результате продуцируемых антигенсвязывающих единиц. Нуклеотидные замены, которые не изменяют кодируемые аминокислотные остатки, полезны для оптимизации экспрессии генов в различных системах. Подходящие замены известны специалистам в данной области техники и произведены, например, для отражения предпочтительного использования кодонов в системах экспрессии.
[151] При желании рекомбинантные полинуклеотиды могут содержать гетерологичные последовательности, которые облегчают обнаружение экспрессии и очистку продукта гена. Примеры таких последовательностей известны в данной области техники и включают в себя те, которые кодируют репортерные белки, такие как β-галактозидаза, β-лактамаза, хлорамфениколацетилтрансфераза (ХАТ, англ. «CAT»), люцифераза, зеленый флуоресцентный белок (ЗФБ, англ. «GFP») и их производные. Другие гетерологичные последовательности, которые облегчают очистку, могут кодировать эпитопы, такие как Myc, HA (полученный из гемагглютинина вируса гриппа), His-6, FLAG или Fc-часть иммуноглобулина, глутатион-S-трансфераза (ГСТ, англ. «GST») и мальтозосвязывающий белок (МСБ, англ. «MBP»).
[152] Раскрытые в данном документе полинуклеотиды могут быть конъюгированы с множеством химически функциональных фрагментов, описанных выше. Обычно используемые фрагменты включают в себя метки, способные продуцировать детектируемый сигнал, сигнальные пептиды, агенты, которые усиливают иммунологическую реактивность, агенты, которые облегчают связывание с твердой подложкой, носители вакцины, модификаторы биологического ответа, парамагнитные метки и лекарственные средства. Указанные фрагменты могут быть ковалентно связаны полинуклеотидом рекомбинантно или другими способами, известными в данной области техники.
[153] Раскрытые в данном документе полинуклеотиды могут содержать дополнительные последовательности, такие как дополнительные кодирующие последовательности в одной и той же единице транскрипции, контролирующие элементы, такие как промоторы, сайты связывания рибосом и сайты полиаденилирования, дополнительные единицы транскрипции под контролем одного и того же или другого промотора, последовательности, которые обеспечивают клонирование, экспрессию и трансформацию клетки-хозяина, и любую такую конструкцию, которая может быть желательной для обеспечения вариантов реализации данного изобретения.
[154] Раскрытые в данном документе полинуклеотиды могут быть получены с использованием химического синтеза, методов рекомбинантного клонирования, ПЦР или любой их комбинации. Способы химического синтеза полинуклеотидов хорошо известны в данной области техники и не нуждаются в подробном описании в данном документе. Специалист в данной области техники может применять данные о последовательностях, представленные в данном документе, для получения желаемого полинуклеотида с помощью синтезатора ДНК или заказа в коммерческой службе.
[155] Полинуклеотиды, содержащие желаемую последовательность, могут быть вставлены в подходящий вектор, который в свою очередь может быть введен в подходящую клетку-хозяина для репликации и амплификации. Соответственно, в данном документе предусматривается множество векторов, содержащих один или большее число полинуклеотидов, описанных выше. Также представлены выбираемые библиотеки экспрессионных векторов, содержащие по меньшей мере один вектор, кодирующий антитело против CLDN18.2, раскрытое в данном документе.
[156] Векторы обычно содержат последовательности контроля транскрипции или трансляции, необходимые для экспрессии антигенсвязывающих единиц. Подходящие последовательности для контроля транскрипции или трансляции включают в себя, но не ограничиваются ими, точку начала репликации, промотор, энхансер, области связывания репрессора, сайты инициации транскрипции, сайты связывания рибосом, сайты инициации трансляции и сайты терминации для транскрипции и трансляции.
[157] Выбор промоторов во многом будет зависеть от клеток-хозяев, в которые вводится вектор. Также возможно использовать промоторы, в нормальных условиях связанные с желаемым геном легкой или тяжелой цепи, при условии, что такие контрольные последовательности совместимы с системой клетки-хозяина. Также можно использовать клеточноспецифические или тканеспецифические промоторы. Огромное разнообразие тканеспецифических промоторов описано и используется специалистами в данной области техники. Иллюстративные промоторы, действующие в определенных клетках животных, включают в себя промоторы, специфичные для гепатоцитов, и промоторы, специфичные для сердечной мышцы. В зависимости от выбора типов клеток-реципиентов специалистам в данной области известны и другие подходящие клеточноспецифические или тканеспецифические промоторы, применимые для конструирования векторов экспрессии согласно данному изобретению.
[158] Используя известные методики молекулярного клонирования или генной инженерии, соответствующие последовательности контроля транскрипции, энхансеры, терминаторы или любой другой генетический элемент, известный в данной области, могут быть интегрированы в оперативную взаимосвязь, необязательно дополнительно с интактными выбираемыми генами слияния, которые будут экспрессироваться в соответствии с данным изобретением. В дополнение к описанным выше элементам векторы могут содержать селектируемый маркер (например, ген, кодирующий белок, необходимый для выживания или роста клетки-хозяина, трансформированной вектором), хотя такой маркерный ген может переноситься на другую полинуклеотидную последовательность, совместно введенную в клетку хозяина.
[159] Описанные в данном документе полинуклеотиды и векторы имеют несколько конкретных применений. Они полезны, например, в системах экспрессии для продукции антигенсвязывающих единиц. Такие полинуклеотиды полезны в качестве праймеров для осуществления амплификации желаемых полинуклеотидов. Кроме того, полинуклеотиды также применимы в фармацевтических композициях, включая вакцины, диагностические средства и лекарственные средства.
[160] Клетки хозяина можно использовать, среди прочего, в качестве хранилищ рассматриваемых полинуклеотидов, векторов, или в качестве носителей для продуцирования и скрининга желаемых антител против CLDN18.2 на основе их специфичности связывания с антигеном.
[161] Соответственно, в данном изобретении представлен способ идентификации антитела против CLDN18.2, которое обладает иммунореактивностью в отношении желаемого антигена. Такой способ может включать в себя следующие этапы: (а) получение генетически разнообразной библиотеки антител против CLDN18.2, где библиотека содержит по меньшей мере одно антитело против CLDN18.2; (b) приведение в контакт библиотеки антител против CLDN18.2 с желаемым антигеном; (c) обнаружение специфического связывания между антителами против CLDN18.2 и антигеном, тем самым идентифицируя антитело против CLDN18.2, которое обладает иммунореактивностью в отношении желаемого антигена.
[162] Способность антитела против CLDN18.2 специфически связываться с желаемым антигеном может быть протестирована с помощью множества процедур, хорошо известных в данной области техники. См. работу Harlow and Lane (1988) Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, New York; Gherardi et al. (1990) J. Immunol. Meth. 126: 61-68. Обычно антитела против CLDN18.2, проявляющие желаемую специфичность связывания, могут быть обнаружены непосредственно с помощью иммуноанализов, например, путем взаимодействия меченых антител против CLDN18.2 с антигенами, иммобилизованными на твердой подложке или субстрате. Обычно субстрат, к которому прикреплен антиген, изготавливается из материала, демонстрирующего низкий уровень неспецифического связывания во время иммуноанализа. Иллюстративная твердая подложка изготовлена из одного или большего числа из следующих типов материалов: пластиковые полимеры, стекло, целлюлоза, нитроцеллюлоза, полупроводящий материал и металл. В некоторых примерах субстрат представляет собой чашку Петри, гранулы для хроматографии, магнитные гранулы и им подобное.
[163] Для таких твердофазных анализов не вступившие в реакцию антитела против CLDN18.2 удаляют путем промывания. Однако в жидкофазном анализе не вступившие в реакцию антитела против CLDN18.2 удаляются с помощью других методик разделения, таких как фильтрация или хроматография. После связывания антигена с мечеными антителами против CLDN18.2 определяют количество связанной метки. Разновидностью этого метода является конкурентный анализ, в котором антиген связывается до насыщения с исходной связывающей молекулой. Когда популяция рассматриваемого антитела против CLDN18.2 вводится в комплекс, только те, которые проявляют более высокую аффинность связывания, смогут конкурировать и, таким образом, оставаться связанными с антигеном.
[164] В качестве альтернативы, специфическое связывание с данным антигеном можно оценить путем сортировки клеток, которая включает в себя презентацию желаемого антигена на клетках, которые необходимо отсортировать, затем мечение клеток-мишеней антителами против CLDN18.2, которые связаны с детектируемыми агентами, с последующим разделением меченых клеток от немеченых в сортировщике клеток. Сложным методом разделения клеток является сортировка клеток с активированной флуоресценцией (FACS). Клетки, перемещающиеся одна за другой в тонком потоке, пропускаются через луч лазера, и затем измеряется флуоресценция каждой клетки, связанной флуоресцентно меченым антителом против CLDN18.2.
[165] Последующий анализ элюированных антител против CLDN18.2 может включать в себя секвенирование белка для определения аминокислотных последовательностей легких и тяжелых цепей. На основе выведенных аминокислотных последовательностей кДНК, кодирующая антитела против CLDN18.2, затем может быть получена с помощью методик рекомбинантного клонирования, включая ПЦР, скрининг библиотек, поиск гомологии в существующих базах данных нуклеиновых кислот или любую их комбинацию. Обычно используемые базы данных включают в себя GenBank, EMBL, DDBJ, PDB, SWISS-PROT, EST, STS, GSS и HTGS, но не ограничиваются ими.
[166] Когда библиотека антител против CLDN18.2 отображается на фаговых или бактериальных частицах, отбор предпочтительно проводят с использованием аффинной хроматографии. Данный метод обычно заключается в связывании библиотеки фаговых антител против CLDN18.2 с покрытыми антигеном планшетами, матрицами колонок, клетками или с биотинилированным антигеном в растворе с последующим захватом. Связанные с твердой фазой фаги или бактерии промывают, а затем элюируют растворимым гаптеном, кислотой или щелочью. В качестве альтернативы можно использовать возрастающие концентрации антигена для диссоциации антител против CLDN18.2 от аффинной матрицы. Для некоторых антител против CLDN18.2 с чрезвычайно высокой аффинностью или авидностью к антигену для эффективного элюирования может потребоваться высокий pH или мягкий восстанавливающий раствор, как описано в WO 92/01047.
[167] Эффективность отбора, вероятно, будет зависеть от комбинации нескольких факторов, включая кинетику диссоциации во время отмывки, а также от того, могут ли множественные антитела против CLDN18.2 на одном фаге или бактерии одновременно связываться с антигенами на твердой подложке. Например, антитела с быстрой кинетикой диссоциации (и слабой аффинностью связывания) могут быть сохранены путем использования коротких промывок, поливалентного отображения и высокой плотности покрытия антигена на твердой подложке. И наоборот, отбору антител против CLDN18.2 с медленной кинетикой диссоциации (и хорошей аффинностью связывания) можно способствовать при использовании длительных промывок, одновалентных фагов и низкой плотности покрытия антигена.
[168] При желании библиотека антител против CLDN18.2 может быть предварительно отобрана против неродственного антигена для противодействия отбору нежелательных антител. Указанная библиотека также может быть предварительно отобрана против родственного антигена, чтобы изолировать, например, антиидиотипические антитела.
Клетки-хозяева
[169] В некоторых вариантах реализации данного изобретения представлены клетки-хозяева, экспрессирующие любое одно из антител против CLDN18.2, описанных в данном документе. Рассматриваемая клетка-хозяин обычно содержит нуклеиновую кислоту, кодирующую любое одно из антител против CLDN18.2, описанных в данном документе.
[170] В данном изобретении представлены клетки-хозяева, трансфицированные полинуклеотидами, векторами или библиотекой векторов, описанными выше. Указанные векторы могут быть введены в подходящую прокариотическую или эукариотическую клетку любым из ряда подходящих средств, включая электропорацию, баллистическую трансфекцию; липофекцию, инфекцию (когда вектор связан с инфекционным агентом), трансфекцию с использованием хлорида кальция, хлорида рубидия, фосфата кальция, ДЭАЭ-декстрана или других веществ. Выбор способов введения векторов часто зависит от особенностей клетки-хозяина.
[171] Для большинства животных клеток любой из вышеупомянутых способов подходит для доставки вектора. Предпочтительными клетками животных являются клетки позвоночных, предпочтительно - клетки млекопитающих, способные экспрессировать экзогенно введенные генные продукты в большом количестве, например, на уровне миллиграммов. Неограничивающими примерами предпочтительных клеток являются клетки NIH3T3, COS, HeLa и клетки CHO.
[172] После введения в подходящую клетку-хозяина экспрессию антител против CLDN18.2 можно определить с помощью любого анализа нуклеиновой кислоты или белка, известного в данной области техники. Например, присутствие транскрибированной мРНК CDR легкой цепи или CDR тяжелой цепи или антитела против CLDN18.2 может быть обнаружено и (или) количественно определено с помощью обычных анализов гибридизации (например, Нозерн-блоттинг), процедур амплификации (например, ПЦР с обратной транскрипцией - ОТ-ПЦР), SAGE (патент США № 5695937) и технологий на основе массивов (см., например, патенты США № 5405783, № 5412087 и № 5445934) с использованием зондов, комплементарных любой области полинуклеотида, кодирующего антитело против CLDN18.2.
[173] Экспрессию вектора также можно определить путем исследования экспрессированного антитела против CLDN18.2. В данной области доступны различные методики анализа белков. Они включают в себя, но не ограничиваются ими, радиоиммуноанализы, твердофазные ИФА (твердофазные иммуноферментные анализы), иммуноанализы по типу «сэндвич», иммунорадиометрические анализы, иммуноанализы in situ (с использованием, например, коллоидного золота, ферментных или радиоизотопных меток), вестерн-блоттинг, анализы иммунопреципитации, иммунофлуоресцентные анализы и ДСН-ПААГ.
Полезная нагрузка
[174] В некоторых вариантах реализации данного изобретения описанное в данном документе антитело против CLDN18.2 дополнительно конъюгировано к полезной нагрузке. В некоторых случаях указанная полезная нагрузка конъюгирована непосредственно к антителу против CLDN18.2. В других случаях указанная полезная нагрузка конъюгирована к антителу против CLDN18.2 посредством линкера. В некоторых случаях полезная нагрузка включает в себя небольшую молекулу, белок или его функциональный фрагмент, пептид, или полимер нуклеиновой кислоты.
[175] В некоторых случаях число полезных нагрузок, конъюгированных к антителу против CLDN18.2 (например, соотношение лекарственное средство/антитело, или СЛСАТ), составляет примерно 1 : 1, т. е. одна полезная нагрузка на одно антитело против CLDN18.2. В некоторых случаях соотношение полезной нагрузки к антителу против CLDN18.2 составляет примерно 2 : 1, 3 : 1, 4 : 1, 5 : 1, 6 : 1, 7 : 1, 8 : 1, 9 : 1, 10 : 1, 11 : 1, 12 : 1, 13 : 1, 14 : 1, 15 : 1, 16 : 1, 17 : 1, 18 : 1, 19 : 1 или 20 : 1. В некоторых случаях соотношение полезной нагрузки к антителу против CLDN18.2 составляет около 2 : 1. В некоторых случаях соотношение полезной нагрузки к антителу против CLDN18.2 составляет около 3 : 1. В некоторых случаях соотношение полезной нагрузки к антителу против CLDN18.2 составляет около 4 : 1. В некоторых случаях соотношение полезной нагрузки к антителу против CLDN18.2 составляет около 6 : 1. В некоторых случаях соотношение полезной нагрузки к антителу против CLDN18.2 составляет около 8 : 1. В некоторых случаях соотношение полезной нагрузки к антителу против CLDN18.2 составляет около 12 : 1.
[176] В некоторых вариантах реализации данного изобретения указанная полезная нагрузка представляет собой небольшую молекулу. В некоторых случаях указанная небольшая молекула представляет собой цитотоксическую полезную нагрузку. Примеры цитотоксических полезных нагрузок включают в себя, но не ограничиваются ими, агенты, разрушающие микротрубочки, агенты, модифицирующие ДНК, или ингибиторы Akt.
[177] В некоторых вариантах реализации данного изобретения указанная полезная нагрузка включает в себя агент, разрушающий микротрубочки. Иллюстративные агенты, разрушающие микротрубочки, включают в себя следующие, но не ограничиваются ими: 2-метоксиэстрадиол, ауристатин, халконы, колхицин, комбретастатин, криптофицин, диктиостатин, дискодермолид, доластаин, элеутеробин, эпотилон, галихондрин, лаулималид, майтансин, носкапиноид, паклитаксел, пелорузид, фомопсин, подофиллотоксин, ризоксин, спонгистатин, таксан, тубулизин, алкалоид барвинка, винорелбин или их производные либо аналоги.
[178] В некоторых вариантах реализации данного изобретения тубулизин представляет собой аналог или производное тубулизина, например, как описано в патентах США № 8580820 и № 8980833, и в патентных публикациях США № 20130217638, № 20130224228 и № 201400363454.
[179] В некоторых вариантах реализации данного изобретения майтансин представляет собой майтансиноид. В некоторых вариантах реализации данного изобретения майтансиноид представляет собой DM1, DM4 или анзамитоцин. В некоторых вариантах реализации данного изобретения майтансиноид представляет собой DM1. В некоторых вариантах реализации данного изобретения майтансиноид представляет собой DM4. В некоторых вариантах реализации данного изобретения майтансиноид представляет собой анзамитоцин. В некоторых вариантах реализации данного изобретения майтансиноид представляет собой производное или аналог майтансиноида, например, как описано в патентах США № 5208020, № 5416064, № 7276497 и № 6716821, или в патентных публикациях США № 2013029900 и № US20130323268.
[180] В некоторых вариантах реализации данного изобретения указанная полезная нагрузка представляет собой доластаин или его производное либо аналог. В некоторых вариантах реализации данного изобретения доластатин представляет собой доластатин 10 или доластатин 15, или их производные либо аналоги. В некоторых вариантах реализации данного изобретения аналог доластатина 10 представляет собой ауристатин, соблидотин, симплостатин 1 или симплостатин 3. В некоторых вариантах реализации данного изобретения аналог доластатина 15 представляет собой цемадотин или тасидотин.
[181] В некоторых вариантах реализации данного изобретения аналог доластатина 10 представляет собой ауристатин или производное ауристатина. В некоторых вариантах реализации данного изобретения ауристатин или производное ауристатина представляет собой ауристатин E (AE), ауристатин F (AF), сложный эфир ауристатина E5 и бензоилвалериановой кислоты (AEVB), монометилауристатин E (MMAE), монометилауристатин F (MMAF) или монометилауристатин D (MMAD), ауристатин PE или ауристатин PYE. В некоторых вариантах реализации данного изобретения указанное производное ауристатина представляет собой монометилауристатин E (MMAE). В некоторых вариантах реализации данного изобретения указанное производное ауристатина представляет собой монометилауристатин F (MMAF). В некоторых вариантах реализации данного изобретения ауристатин представляет собой производное или аналог ауристатина, например, как описано в патентах США № 6884869, № 7659241, № 7498298, № 7964566, № 7750116, № 8288352, № 8703714 и № 8871720.
[182] В некоторых вариантах реализации данного изобретения указанная полезная нагрузка включает в себя агент, модифицирующий ДНК. В некоторых вариантах реализации агент, модифицирующий ДНК, включает в себя расщепители ДНК, интеркаляторы ДНК, ингибиторы транскрипции ДНК или агенты, перекрестно сшивающие ДНК. В некоторых случаях расщепитель ДНК включает в себя блеомицин А2, калихеамицин или их производные либо аналоги. В некоторых случаях интеркалятор ДНК включает в себя доксорубицин, эпирубицин, PNU-159682, дуокармицин, пирролобензодиазепин, олигомицин C, даунорубицин, валрубицин, топотекан или их производные либо аналоги. В некоторых случаях ингибитор транскрипции ДНК включает в себя дактиномицин. В некоторых случаях агент, перекрестно сшивающий ДНК, включает в себя митомицин С.
[183] В некоторых вариантах реализации данного изобретения агент, модифицирующий ДНК, включает в себя амсакрин, антрациклин, камптотецин, доксорубицин, дуокармицин, ендиин, этопозид, индолинобензодиазепин, нетропсин, тенипозид или их производные либо аналоги.
[184] В некоторых вариантах реализации данного изобретения антрациклин представляет собой доксорубицин, даунорубицин, эпирубицин, идарубицин, митомицин-C, дактиномицин, митрамицин, неморубицин, пиксантрон, сабарубицин или валрубицин.
[185] В некоторых вариантах реализации данного изобретения аналог камптотецина представляет собой топотекан, иринотекан, силатекан, коситекан, экзатекан, луртотекан, гиматекан, белотекан, рубитекан или SN-38.
[186] В некоторых вариантах реализации данного изобретения дуокармицин представляет собой дуокармицин A, дуокармицин B1, дуокармицин B2, дуокармицин C1, дуокармицин C2, дуокармицин D, дуокармицин SA или CC-1065. В некоторых вариантах реализации данного изобретения ендиин представляет собой калихеамицин, эсперамицин или динемицин А.
[187] В некоторых вариантах реализации данного изобретения пирролобензодиазепин представляет собой антрамицин, аббеймицин, чикамицин, DC-81, мазетрамицин, неотрамицины A, неотрамицин B, поротрамицин, протракарцин, сибаномицин (DC-102), сибиромицин или томаймицин. В некоторых вариантах реализации данного изобретения пирролобензодиазепин представляет собой производное томаймицина, например, как описано в патентах США № 8404678 и № 8163736. В некоторых вариантах реализации данного изобретения пирролобензодиазепин является таким, как описано в патентах США № 8426402, № 8802667, № 8809320, № 6562806, № 6608192, № 7704924, № 7067511, № US7612062, № 7244724, № 7528126, № 7049311, № 8633185, № 8501934 и № 8697688, а также в патентной публикации США № 20140294868.
[188] В некоторых вариантах реализации данного изобретения пирролобензодиазепин представляет собой димер пирролобензодиазепина. В некоторых вариантах реализации данного изобретения указанный димер ПБД представляет собой симметричный димер. Примеры симметричных димеров ПБД включают в себя, но не ограничиваются ими, SJG-136 (SG-2000), ZC-423 (SG2285), SJG-720, SJG-738, ZC-207 (SG2202) и DSB-120 (Таблица 2). В некоторых вариантах реализации данного изобретения указанный димер ПБД представляет собой несимметричный димер. Примеры несимметричных димеров ПБД включают в себя, но не ограничиваются ими, производные SJG-136, такие как описанные в патентах США № 8697688 и № 9242013, а также в патентной публикации США № 20140286970.
[189] В некоторых вариантах реализации данного изобретения указанная полезная нагрузка включает в себя ингибитор Akt. В некоторых случаях ингибитор Akt включает в себя ипатасертиб (GDC-0068) или его производные.
[190] В некоторых вариантах реализации данного изобретения указанная полезная нагрузка включает в себя ингибитор полимеразы, включая, но не ограничиваясь ими, ингибиторы полимеразы II, такие как α-аманитин, и ингибиторы поли(АДФ-рибозо)-полимеразы (ПАРП, англ. «PARP»). Примеры ингибиторов ПАРП включают в себя, но не ограничиваются ими, Инипариб (BSI 201), Талазопариб (BMN-673), Олапариб (AZD-2281), Олапариб, Рукапариб (AG014699, PF-01367338), Велипариб (ABT-888), CEP 9722 , MK 4827, BGB-290 или 3-аминобензамид.
[191] В некоторых вариантах реализации данного изобретения указанная полезная нагрузка включает в себя детектируемый фрагмент. Примеры детектируемых фрагментов включают в себя флуоресцентные красители; ферменты; субстраты; хемилюминесцентные фрагменты; специфические связывающие фрагменты, такие как стрептавидин, авидин или биотин; или радиоизотопы.
[192] В некоторых вариантах реализации данного изобретения указанная полезная нагрузка включает в себя иммуномодулирующий агент. Полезные иммуномодулирующие агенты включают в себя антигормоны, которые блокируют действие гормонов на опухоли, и иммуносупрессивные агенты, которые подавляют продукцию цитокинов, подавляют экспрессию аутоантигена или маскируют антигены ГКГ. Репрезентативные антигормоны включают в себя, например, тамоксифен, ралоксифен, 4(5)-имидазолы - ингибиторы ароматазы, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY 117018, онапристон и торемифен; и антиандрогены, такие как флутамид, нилутамид, бикалютамид, лейпролид и госерелин; и антиадренальные агенты. Иллюстративные иммуносупрессивные агенты включают в себя следующие, но не ограничиваются ими: 2-амино-6-арил-5-замещенные пиримидины, азатиоприн, циклофосфамид, бромокриптин, даназол, дапсон, глутаральдегид, антиидиотипические антитела к антигенам ГКГ и фрагментам ГКГ, циклоспорин А, стероиды, такие как глюкокортикостероиды, стрептокиназа или рапамицин.
[193] В некоторых вариантах реализации данного изобретения указанная полезная нагрузка включает в себя иммуномодулятор. Примеры иммуномодуляторов включают в себя следующие, но не ограничиваются ими: ганцикловир, этанерцепт, такролимус, сиролимус, воклоспорин, циклоспорин, рапамицин, циклофосфамид, азатиоприн, микофенолгат мофетил, метотрекстрат, глюкокортикоиды и их аналоги, ксантины, факторы роста стволовых клеток, лимфотоксины, гематопоэтические факторы, ксилокортикоидные факторы, фактор некроза опухоли (ФНО) (например, ФНО-α), интерлейкины (например, интерлейкин-1 (ИЛ-1), ИЛ-2, ИЛ-3, ИЛ-6, ИЛ-10, ИЛ-12, ИЛ-18 и ИЛ-21), колониестимулирующие факторы (например, гранулоцитарный колониестимулирующий фактор (Г-КСФ) и гранулоцитарно-моноцитарный колониестимулирующий фактор (ГМ-КСФ)), интерфероны (например, интерфероны-альфа, интерферон-бета, интерферон-гамма), фактор роста стволовых клеток, обозначенный как «фактор S1», эритропоэтин и тромбопоэтин, или их комбинация.
[194] В некоторых вариантах реализации данного изобретения указанная полезная нагрузка включает в себя иммунотоксин. Иммунотоксины включают в себя следующие, но не ограничиваются ими: рицин, радионуклиды, противовирусный белок из лаконоса, экзотоксин A из Pseudomonas, дифтерийный токсин, цепь рицина A, грибковые токсины, такие как ферменты рестриктоцин и фосфолипаза. См., в целом, “Chimeric Toxins,” Olsnes and Pihl, Pharmac. Ther. 15: 355-381 (1981); и “Monoclonal Antibodies for Cancer Detection and Therapy,” eds. Baldwin and Byers, pp. 159-179, 224-266, Academic Press (1985).
[195] В некоторых случаях указанная полезная нагрузка включает в себя полимер нуклеиновой кислоты. В таких случаях полимер нуклеиновой кислоты включает в себя короткую интерферирующую нуклеиновую кислоту (киНК, англ. «siNA»), короткую интерферирующую РНК (киРНК, англ. «siRNA»), двухцепочечную РНК (дцРНК, англ. «dsRNA»), микро-РНК (миРНК, англ. «miRNA»), короткую шпилечную РНК (кшРНК, англ. «shRNA») и антисмысловой олигонуклеотид. В других случаях полимер нуклеиновой кислоты включает в себя мРНК, кодирующую, например, цитотоксический белок или пептид, либо белок или пептид, запускающие апоптоз. Примеры цитотоксических белков или пептидов включают в себя бактериальный цитотоксин, такой как токсин, образующий альфа-поры (например, цитолизин A из E. coli), токсин, образующий бета-поры (например, α-гемолизин, PVL - лейкоцидин Пантона - Валентайна, аэролизин, клостридиальный эпсилон-токсин, энтеротоксин Clostridium perfringens), бинарные токсины (токсин сибирской язвы, токсин отека, токсин C2 из C. botulinum, токсин из C. spirofome, йота-токсин из C. perfringens, цитолетальные токсины из C. difficile (A и B)), прион, параспорин, холестерин-зависимые цитолизины (например, пневмолизин), малый порообразующий токсин (например, грамицидин A), цианотоксин (например, микроцистины, нодулярины), гемотоксин, нейротоксин (например, ботулиновый нейротоксин), цитотоксин, холерный токсин, дифтерийный токсин, экзотоксин А из Pseudomonas, столбнячный токсин, или иммунотоксин (идарубицин, рицин A, CRM9, противовирусный белок из лаконоса, DT). Примеры белков или пептидов, запускающих апоптоз, включают в себя фактор-1, активирующий апоптозную протеазу (Apaf-1), цитохром c, белки-инициаторы каспазы (CASP2, CASP8, CASP9, CASP10), фактор индукции апоптоза (AIF), p53, p73, p63, Bcl-2, Bax, гранзим B, поли-АДФ-рибозополимераза (ПАРП) и P 21-активированная киназа 2 (PAK2). В дополнительных случаях полимер нуклеиновой кислоты включает в себя ловушку нуклеиновой кислоты. В некоторых случаях ловушка нуклеиновой кислоты представляет собой имитатор белок-связывающих нуклеиновых кислот, например, имитатор связывания белка на основе РНК. Примеры ловушек нуклеиновых кислот включают в себя ловушку трансактивирующей области (TAR) и ловушку элемента ответа Rev (RRE).
[196] В некоторых случаях полезная нагрузка представляет собой аптамер. Аптамеры представляют собой небольшие олигонуклеотидные или пептидные молекулы, которые связываются со специфическими молекулами-мишенями. Примеры аптамеров нуклеиновых кислот включают в себя аптамеры ДНК, аптамеры РНК или аптамеры КсНК, которые представляют собой аптамеры РНК и (или) ДНК, содержащие один или большее число не встречающихся в природе нуклеотидов. Примеры аптамеров нуклеиновых кислот включают в себя ARC19499 (Archemix Corp.), REG1 (Regado Biosciences) и ARC1905 (Ophthotech).
[197] Нуклеиновые кислоты в соответствии с вариантами реализации данного изобретения, описанными в данном документе, необязательно включают в себя встречающиеся в природе нуклеиновые кислоты, либо один или большее число аналогов нуклеотидов, либо имеют структуру, которая в остальном отличается от структуры встречающейся в природе нуклеиновой кислоты. Например, 2'-модификации включают в себя галогено-, алкокси- и аллилокси- группы. В некоторых вариантах реализации данного изобретения группа 2'-OH заменена группой, выбранной из H, OR, R, галогена, SH, SR, NH2, NHR, NR2 или CN, где R представляет собой C1-C6 алкил, алкенил, или алкинил, и галоген представляет собой F, Cl, Br или I. Примеры модифицированных связей включают в себя фосфоротиоатные и 5'-N-фосфорамидитные связи.
[198] Нуклеиновые кислоты, имеющие множество различных аналогов нуклеотидов, модифицированные скелеты или не встречающиеся в природе межнуклеозидные связи, используются в соответствии с вариантами реализации данного изобретения, описанными в данном документе. В некоторых случаях нуклеиновые кислоты содержат природные нуклеозиды (например, аденозин, тимидин, гуанозин, цитидин, уридин, дезоксиаденозин, дезокситимидин, дезоксигуанозин и дезоксицитидин) или модифицированные нуклеозиды. Примеры модифицированных нуклеотидов включают в себя нуклеозид с модифицированный основанием (например, арацитидин, инозин, изогуанозин, небуларин, псевдоуридин, 2,6-диаминопурин, 2-аминопурин, 2-тиотимидин, 3-деаза-5-азацитидин, 2'-дезоксиуридин, 3-ниторпиррол, 4-метилиндол, 4-тиуридин, 4-тиотимидин, 2-аминоаденозин, 2-тиотимидин, 2-тиоуридин, 5-бромоцитидин, 5-йодоуридин, инозин, 6-азауридин, 6-хлорпурин, 7-деазааденозин, 7-дезазагуанозин, 8-азааденозин, 8-азидоаденозин, бензимидазол, M1-метиладенозин, пирролопиримидин, 2-амино-6-хлоропурин, 3-метиладенозин, 5-пропинилцитидин, 5-пропинилуридин, 5-бромоуридин, 5-фтороуридин, 5-метилцитидин, 7-деазааденозин, 7-деазагуанозин, 8-оксоаденозин, 8-оксогуанозин, O(6)-метилгуанин и 2-тиоцитидин), химически или биологически модифицированные основания (например, метилированные основания), с модифицированными сахарами (например, с 2'-фторорибоза, 2'-аминорибоза, 2'-азидорибоза, 2'-O-метилрибоза, L-энантиомерные нуклеозиды арабиноза и гексоза), с модифицированными фосфатными группами (например, фосфоротиоатные и 5'-N-фосфорамидитные связи) и их комбинации. Природные и модифицированные нуклеотидные мономеры для химического синтеза нуклеиновых кислот легко доступны. В некоторых случаях нуклеиновые кислоты, содержащие такие модификации, проявляют улучшенные свойства по сравнению с нуклеиновыми кислотами, состоящими только из встречающихся в природе нуклеотидов. В некоторых вариантах реализации данного изобретения описанные в данном документе модификации нуклеиновых кислот используются для уменьшения и (или) предотвращения расщепления нуклеазами (например, экзонуклеазами, эндонуклеазами и т. д.). Например, структура нуклеиновой кислоты может быть стабилизирована путем включения аналогов нуклеотидов на 3'-конце одной или обеих цепей для уменьшения расщепления.
[199] Различные модификации нуклеотидов и (или) структуры каркаса могут существовать в различных положениях в нуклеиновой кислоте. Такая модификация включает в себя морфолины, пептидные нуклеиновые кислоты (ПНК), метилфосфонатные нуклеотиды, тиолфосфонатные нуклеотиды, 2'-фтор N3-P5'-фосфорамидиты, 1',5'-ангидрогекситоловые нуклеиновые кислоты (АНК) или их комбинацию.
Химия конъюгации
[200] В некоторых случаях полезная нагрузка конъюгирована с описанным в данном документе антителом против CLDN18.2 путем естественного лигирования. В некоторых случаях конъюгация является такой, как описано в следующих работах: Dawson, et al. “Synthesis of proteins by native chemical ligation,” Science 1994, 266, 776-779; Dawson, et al. “Modulation of Reactivity in Native Chemical Ligation through the Use of Thiol Additives,” J. Am. Chem. Soc. 1997, 119, 4325-4329; Hackeng, et al. “Protein synthesis by native chemical ligation: Expanded scope by using straightforward methodology.,” Proc. Natl. Acad. Sci. USA 1999, 96, 10068-10073; или Wu, et al. “Building complex glycopeptides: Development of a cysteine-free native chemical ligation protocol,” Angew. Chem. Int. Ed. 2006, 45, 4116-4125. В некоторых случаях конъюгация является такой, как описано в патенте США № 8936910.
[201] В некоторых случаях полезная нагрузка конъюгирована с описанным в данном документе антителом против CLDN18.2 с помощью сайт-направленной методики с использованием технологии «бесследного» связывания (Philochem). В некоторых случаях технология «бесследного» связывания использует N-концевую 1,2-аминотиоловую группу на связывающем фрагменте, который затем конъюгируется с молекулой полинуклеиновой кислоты, содержащей альдегидную группу. (см. Casi et al., “Site-specific traceless coupling of potent cytotoxic drugs to recombinant antibodies for pharmacodelivery,” JACS 134(13): 5887-5892 (2012)).
[202] В некоторых случаях полезная нагрузка конъюгирована с описанным в данном документе антителом против CLDN18.2 с помощью сайт-направленной методики с использованием не встречающейся в природе аминокислоты, встроенной в связывающий фрагмент. В некоторых случаях не встречающаяся в природе аминокислота включает в себя p-ацетилфенилаланин (pAcPhe). В некоторых случаях кетогруппа pAcPhe селективно связана с конъюгирующим фрагментом - производным алкоксиамина, с образованием оксимной связи (см. работу Axup et al., “Synthesis of site-specific antibody-drug conjugates using unnatural amino acids,” PNAS 109(40): 16101-16106 (2012)).
[203] В некоторых случаях полезная нагрузка конъюгирована с антителом против CLDN18.2, описанным в данном документе, с помощью сайт-направленной методики с использованием процесса, катализируемого ферментом. В некоторых случаях в сайт-направленной методике применяется технология SMARTag™ (Redwood). В некоторых случаях технология SMARTag™ включает в себя образование остатка формилглицина (FGly) из цистеина с помощью формилглицин-генерирующего фермента (ФГФ, англ. «FGE») посредством процесса окисления в присутствии альдегидной метки и последующего конъюгирования FGly с молекулой алкилгидрин-функционализированной полинуклеиновой кислоты посредством лигирования с гидразином по реакции Пикте-Шпенглера (англ. «HIPS»). (см. Wu et al., “Site-specific chemical modification of recombinant proteins produced in mammalian cells by using the genetically encoded aldehyde tag,” PNAS 106(9): 3000-3005 (2009); Agarwal, et al., “A Pictet-Spengler ligation for protein chemical modification,” PNAS 110(1): 46-51 (2013)).
[204] В некоторых случаях процесс, катализируемый ферментами, включает в себя микробную трансглутаминазу (мТГ, англ. «mTG»). В некоторых случаях полезная нагрузка конъюгирована с антителом против CLDN18.2 с использованием процесса, катализируемого микробной трансглутаминзой. В некоторых случаях мТГ катализирует образование ковалентной связи между амидной боковой цепью глутамина в последовательности узнавания и первичным амином функционализированной молекулы полинуклеиновой кислоты. В некоторых случаях мТГ получают из Streptomyces mobarensis (см. Strop et al., “Location matters: site of conjugation modulates stability and pharmacokinetics of antibody drug conjugates,” Chemistry and Biology 20(2) 161-167 (2013)).
[205] В некоторых случаях полезная нагрузка конъюгирована с антителом против CD38, антителом против ICAM1 или мультиспецифическим антителом (например, биспецифическим антителом против CD38/ICAM1), описанным в данном документе, способом, описанным в публикации PCT № WO2014/140317, в котором используется специфическая для последовательности транспептидаза.
[206] В некоторых случаях полезная нагрузка конъюгирована с антителом против CLDN18.2, описанным в данном документе, способом, описанным в патентных публикациях США № 2015/0105539 и № 2015/0105540.
Линкер
[207] В некоторых случаях описанный выше линкер включает в себя природный или синтетический полимер, состоящий из длинных цепей разветвленных или неразветвленных мономеров и (или) поперечно-сшитой сети мономеров в двух или трех измерениях. В некоторых случаях указанный линкер включает в себя полисахарид, лигнин, каучук или полиалкиленоксид (например, полиэтиленгликоль).
[208] В некоторых случаях указанный линкер включает в себя, но не ограничивается ими, альфа-, омега-дигидроксилполиэтиленгликоль, биоразлагаемый полимер на основе лактона, например, полиакриловую кислоту, полилактидную кислоту (ПЛК), полигликолевую кислоту (ПГК), полипропилен, полистирол, полиолефин, полиамид, полицианоакрилат, полиимид, полиэтилентерефталат (ПЭТ, ПЭТГ), полиэтиленовый терефталат (ПЭТФ), политетраметиленгликоль (ПТГ) или полиуретан, а также их смеси. Используемый в контексте данного документа термин «смесь» относится к использованию различных полимеров в одном и том же соединении, а также к блок-сополимерам. В некоторых случаях блок-сополимеры представляют собой полимеры, в которых по меньшей мере одна часть полимера построена из мономеров другого полимера. В некоторых случаях линкер содержит полиалкиленоксид. В некоторых случаях линкер содержит ПЭГ. В некоторых случаях линкер содержит полиэтиленимид (ПЭИ) или гидроксиэтилкрахмал (ГЭК).
[209] В некоторых случаях полиалкиленоксид (например, ПЭГ) представляет собой полидисперсное или монодисперсное соединение. В некоторых случаях полидисперсный материал содержит дисперсно распределенный материал с различной молекулярной массой, характеризующийся средневзвешенным (средневесовым) размером и дисперсностью. В некоторых случаях монодисперсный ПЭГ состоит из молекул одного размера. В некоторых вариантах реализации данного изобретения линкер представляет собой поли- или монодисперсный полиалкиленоксид (например, ПЭГ), и указанная молекулярная масса представляет собой среднюю молекулярную массу молекул полиалкиленоксида, например, ПЭГ.
[210] В некоторых вариантах реализации данного изобретения линкер содержит полиалкиленоксид (например, ПЭГ), и молекулярная масса указанного полиалкиленоксида (например, ПЭГ) составляет около 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1100, 1200, 1300, 1400, 1450, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900, 3000, 3250, 3350, 3500, 3750, 4000, 4250, 4500, 4600, 4750, 5000, 5500, 6000, 6500, 7000, 7500, 8000, 10000, 12000, 20000, 35000, 40000, 50000, 60000 или 100000 Да.
[211] В некоторых вариантах реализации данного изобретения полиалкиленоксид (например, ПЭГ) представляет собой дискретный ПЭГ, в котором дискретный ПЭГ представляет собой полимерный ПЭГ, содержащий больше чем одну повторяющуюся единицу этиленоксида. В некоторых случаях дискретный ПЭГ (дПЭГ, англ. «dPEG») содержит от 2 до 60, от 2 до 50 или от 2 до 48 повторяющихся единиц этиленоксида. В некоторых случаях дПЭГ содержит около 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 24, 26, 28, 30, 35, 40, 42, 48, 50 или большее число повторяющихся единиц этиленоксида. В некоторых случаях дПЭГ содержит около 2 или большее число повторяющихся единиц этиленоксида. В некоторых случаях дПЭГ синтезируют как соединение с одной молекулярной массой из чистого (например, чистотой около 95%, 98%, 99% или 99,5%) исходного материала ступенчатым образом. В некоторых случаях дПЭГ имеет конкретную молекулярную массу, а не среднюю молекулярную массу. В некоторых случаях описанный в данном документе дПЭГ представляет собой дПЭГ от Quanta Biodesign, LMD.
[212] В некоторых вариантах реализации данного изобретения указанный линкер представляет собой дискретный ПЭГ, который необязательно содержит от 2 до 60, от 2 до 50 или от 2 до 48 повторяющихся единиц этиленоксида. В некоторых случаях указанный линкер содержит дПЭГ, состоящий из 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 24, 26, 28, 30, 35, 40, 42, 48, 50 или большего числа повторяющихся единиц этиленоксида. В некоторых случаях указанный линкер представляет собой дПЭГ от Quanta Biodesign, LMD.
[213] В некоторых вариантах реализации данного изобретения указанный линкер представляет собой полипептидный линкер. В некоторых случаях указанный полипептидный линкер содержит по меньшей мере 2, 3, 4, 5, 6, 7, 8, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100 или большее число аминокислотных остатков. В некоторых случаях указанный полипептидный линкер содержит по меньшей мере 2, 3, 4, 5, 6, 7, 8 или большее число аминокислотных остатков. В некоторых случаях указанный полипептидный линкер содержит по большей мере 2, 3, 4, 5, 6, 7, 8 или меньшее число аминокислотных остатков. В некоторых случаях указанный полипептидный линкер представляет собой расщепляемый полипептидный линкер (например, ферментативно или химически расщепляемый). В некоторых случаях указанный полипептидный линкер представляет собой нерасщепляемый полипептидный линкер. В некоторых случаях указанный полипептидный линкер включает в себя Val-Cit (валин-цитруллин), Gly-Gly-Phe-Gly, Phe-Lys, Val-Lys, Gly-Phe-Lys, Phe-Phe-Lys, Ala-Lys, Val-Arg, Phe-Cit, Phe-Arg, Leu-Cit, Ile-Cit, Trp-Cit, Phe-Ala, Ala-Leu-Ala-Leu или Gly-Phe-Leu-Gly. В некоторых случаях указанный полипептидный линкер включает в себя пептид, такой как: Val-Cit (валин-цитруллин), Gly-Gly-Phe-Gly, Phe-Lys, Val-Lys, Gly-Phe-Lys, Phe-Phe-Lys, Ala-Lys, Val-Arg, Phe-Cit, Phe-Arg, Leu-Cit, Ile-Cit, Trp-Cit, Phe-Ala, Ala-Leu-Ala-Leu или Gly-Phe-Leu-Gly. В некоторых случаях указанный полипептидный линкер включает в себя L-аминокислоты, D-аминокислоты или смесь как L-, так и D-аминокислот.
[214] В некоторых случаях указанный линкер включает в себя гомобифункциональный линкер. Иллюстративные гомобифункциональные линкеры включают в себя следующие, но не ограничиваются ими: реагент Ломанта - дитиобис(сукцинимидилпропионат) (ДСП, англ. «DSP»), 3'3'-дитиобис(сульфосукцинимидилпропионат) (ДТССП, англ. «DTSSP»), дисукцинимидилсуберат (ДСС, англ. «DSS»), бис(сульфосукцинимидил)суберат (БС, англ. «BS»), дисукцинимидил тартрат (ДСТ, англ. «DST»), дисульфосукцинимидил тартрат (сульфо-ДСТ, англ. «sulfo-DST»), этиленгликобис(сукцинимидилсукцинат) (ЭГС, англ. «EGS»), дисукцинимидилглутарат (ДСГ, англ. «DSG»), N, N'-дисукцинимидилкарбонат (ДСК, англ. «DSC»), диметиладипимидат (ДМА, англ. «DMA»), диметилпимелимидат (ДМП, англ. «DMP»), диметилсуберимидат (ДМС, англ. «DMS»), диметил-3,3'-дитиобиспропионимидат (ДТБП, англ. «DTBP»), 1,4-ди-3'-(2'-пиридилдитио)пропионамидо)бутан (ДПДПБ, англ. «DPDPB»), бисмалеимидогексан (БМГ, англ. «BMH»), арилгалогенидосодержащее соединение (ДФДНБ, англ. «DFDNB»), такое как, например, 1,5-дифтор-2,4-динитробензол или 1,3-дифтор-4,6-динитробензол, 4,4'-дифтор-3,3'-динитрофенилсульфон (ДФДНФС, англ. «DFDNPS»), бис-[β-(4-азидосалициламидо)этил]дисульфид (БАСЭД, англ. «BASED»), формальдегид, глутаральдегид, 1,4-бутандиолдиглицидиловый эфир, дигидразид адипиновой кислоты, карбогидразид, о-толуидин, 3,3'-диметилбензидин, бензидин, α,α′-p-диаминодифенил, дийод-p-ксилолсульфоновая кислота, N, N′-этилен-бис(йодацетамид) или N, N′-гексаметилен-бис(йодацетамид).
[215] В некоторых вариантах реализации данного изобретения указанный линкер включает в себя гетеробифункциональный линкер. Иллюстративные гетеробифункциональные линкеры включают в себя следующие, но не ограничиваются ими: аминореактивные и сульфгидрильные поперечно-сшивающие агенты, такие как N-сукцинимидил-3-(2-пиридилдитио)пропионат (сПДП, англ. «sPDP»), длинноцепочечный N-сукцинимидил-3-(2-пиридилдитио)пропионат (ДЦ-сПДП, англ. «LC-sPDP»), водорастворимый длинноцепочечный N-сукцинимидил 3-(2-пиридилдитио)пропионат (сульфо-ДЦ-сПДП, англ. «sulfo-LC-sPDP»), сукцинимидилоксикарбонил-α-метил-α-(2-пиридилдитио)толуол (сМПТ, англ. «sMPT»), сульфосукцинимидил-6-[α-метил-α-(2-пиридилдитио)толуамидо]гексаноат (сульфо-ДЦ-сМПТ, англ. «sulfo-LC-sMPT»), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (сМЦК, англ. «sMCC»), сульфосукцинимидил-4-(N-малеимидометил) циклогексан-1-карбоксилат (сульфо сМЦК, англ. «sulfo-sMCC»), сложный эфир m-малеимидобензоил-N-гидроксисукцинимида (МБс, англ. «MBs»), сложный эфир m-малеимидобензоил-N-гидроксисульфосукцинимида (сульфо-МБс, англ. «sulfo-MBs»), N-сукцинимидил(4-йодоактеил)аминобензоат (сИАБ, англ. «sIAB»), сульфосукцинимидил(4-йодоактеил)аминобензоат (сульфо-сИАБ, англ. «sulfo-sIAB»), сукцинимидил-4-(p-малеимидофенил)бутират (сМФБ, англ. «sMPB»), сульфосукцинимидил-4-(p-малеимидофенил)бутират (сульфо-сМФБ, англ. «sulfo-sMPB»), сложный эфир N-(γ-малеимидобутирилокси)сукцинимида (ГМБс, англ. «GMBs»), сложный эфир N-(γ-малеимидобутирилокси)сульфосукцинимида (сульфо-ГМБс, англ. «sulfo-GMBs»), сукцинимидил 6-((йодацетил)амино)гексаноат (сИАГ, англ. «sIAX»), сукцинимидил 6-[6-((йодацетил)амино)гексаноил)амино]гексаноат (сИАГГ, англ. «sIAXX»), сукцинимидил 4-(((йодацетил)амино)метил)циклогексан-1-карбоксилат (сИАК, англ. «sIAC»), сукцинимидил 6-((((4-йодацетил)амино)метил)циклогексан-1-карбонил)амино)гексаноат (сИАКГ, англ. «sIACX»), p-нитрофенилйодацетат (НФИА, англ. «NPIA»), карбонилреактивные и сульфгидрилреактивные перекрестно сшивающие линкеры, такие как гидразид 4-(4-N-малеимидофенил)масляной кислоты (ГМФМ, англ. «MPBH»), 4-(N-малеимидометил)циклогексан-1-карбоксилгидразид-8 (M2C2H), 3-(2-пиридилдитио)пропионилгидразид (ПДПГ, англ. «PDPH»), аминореактивные и фотореактивные перекрестно сшивающие линкеры, такие как N-гидроксисукцинимидил-4-азидосалициловая кислота (N-Гс-АсК, англ. «NHs-AsA»), N-гидроксисульфосукцинимидил-4-азидосалициловая кислота (сульфо-N-Гс-АсК, англ. «sulfo-NHs-AsA»), сульфосукцинимидил-(4-азидосалициламидо)гексаноат (сульфо-N-Гс-ЛС-АсК, англ. «sulfo-NHs-LC-AsA»), сульфосукцинимидил-2-(ρ- азидосалициламидо)этил-1,3'-дитиопропионат (сАсД, англ. «sAsD»), N-гидроксисукцинимидил-4-азидобензоаат (ГсАБ, англ. «HsAB»), N-гидроксисульфосукцинимидил-4-азидобензоат (сульфо-ГсАБ, англ. «sulfo-HsAB»), N-сукцинимидил-6-(4'-азидо-2'-нитрофениламино)гексаноат (сАНФАГ, англ. «sANPAH»), сульфосукцинимидил-6-(4'-азидо 2'-нитрофениламино)гексаноат (сульфо-сАНФАГ, англ. «sulfo-sANPAH»), N-5-азидо-2-нитробензоилоксисукцинимид (АНБ-НОс, англ. «ANB-NOs»), сульфосукцинимидил-2-(m-азидо-о-нитробензамидо)этил-1,3'-дитиопропионат (сАНД, англ. «sAND»), N-сукцинимидил-4-(4-азидофенил)-1,3'-дитиопропионат (сАДП, англ. «sADP»), N-сульфосукцинимидил-(4-азидофенил)-1,3'-дитиопропионат (сульфо-сАДП, англ. «sulfo-sADP»), сульфосукцинимидил-4-(ρ- азидофенил)бутират (сульфо-сАФБ, англ. «sulfo-sAPB»), сульфосукцинимидил-2-(7-азидо-4-метилкумарин-3-ацетамид)этил-1,3'-дитиопропионат (сАЭД, англ. «sAED»), сульфосукцинимидил-7-азидо-4-метилкумарин-3-ацетат (сульфо-сАМКА, англ. «sulfo-sAMCA»), ρ-нитрофенилдиазопируват (ρ-НФДП, англ. «ρNPDP»), ρ-нитрофенил-2-диазо-3,3,3-трифторпропионат (ρ-НФ-ДФП, англ. «PNP-DTP»), сульфгидрилреактивные и фотореактивные перекрестно сшивающие линкеры, такие как 1-(ρ-азидосалициламидо)-4-(йодацетамидо)бутан (АсИБ, англ. «AsIB»), N-[4-(ρ-азидосалициламидо)бутил]-3'-(2'-пиридилдитио)пропионамид (АПДП, англ. «APDP»), бензофенон-4-йодацетамид, бензофенон-4-малеимид, карбонилреактивные и фотореактивные перекрестно сшивающие линкеры, такие как ρ-азидобензоилгидразид (АБГ, англ. «ABH»), карбоксилатреактивные и фотореактивные перекрестно сшивающие линкеры, такие как 4-(ρ-азидосалициламидо)бутиламин (АсАБ, англ. «AsBA»), а также аргининреактивные и фотоактивные перекрестно сшивающие линкеры, такие как ρ-азидофенилглиоксаль (АФГ, англ. «APG»).
[216] В некоторых вариантах реализации данного изобретения указанный линкер содержит группу бензойной кислоты или ее производные. В некоторых случаях указанная группа бензойной кислоты или ее производные включают в себя парааминобензойную кислоту (ПАБК, англ. «PABA»). В некоторых случаях указанная группа бензойной кислоты или ее производные включают в себя гамма-аминомасляную кислоту (ГАМК, англ. «GABA»).
[217] В некоторых вариантах реализации данного изобретения указанный линкер содержит одну или большее число из следующих: малеимидную группу, пептидный фрагмент и (или) группу бензойной кислоты в любой комбинации. В некоторых вариантах реализации данного изобретения указанный линкер содержит комбинацию из малеимидной группы, пептидного фрагмента и (или) группы бензойной кислоты. В некоторых случаях указанная малеимидная группа представляет собой малеимидокапроил (мк, англ. «mc»). В некоторых случаях указанная пептидная группа представляет собой val-cit. В некоторых случаях указанная группа бензойной кислоты представляет собой ПАБК. В некоторых случаях указанный линкер содержит группу мк-val-cit. В некоторых случаях указанный линкер содержит группу val-cit-ПАБК. В дополнительных случаях указанный линкер содержит группу мк-val-cit-ПАБК.
[218] В некоторых вариантах реализации данного изобретения указанный линкер представляет собой саморасщепляющийся линкер или самоустраняющийся линкер. В некоторых случаях указанный линкер представляет собой саморасщепляющийся линкер. В других случаях указанный линкер представляет собой самоустраняющийся линкер (например, линкер, самоустраняющийся путем циклизации). В некоторых случаях указанный линкер включает в себя линкер, описанный в патенте США № 9089614 или публикации РСТ № WO2015038426.
[219] В некоторых вариантах реализации данного изобретения указанный линкер представляет собой линкер дендритного типа. В некоторых случаях указанный линкер дендритного типа включает в себя разветвленный многофункциональный линкерный фрагмент. В некоторых случаях указанный линкер дендритного типа включает в себя полиамидоаминовые дендримеры (ПАМАМ-дендримеры).
[220] В некоторых вариантах реализации данного изобретения указанный линкер представляет собой бесследный линкер или линкер, в котором после расщепления не остается линкерный фрагмент (например, атом или линкерная группа) для антитела или полезной нагрузки. Иллюстративные бесследные линкеры включают в себя следующие, но не ограничиваются ими: германиевые линкеры, кремниевые линкеры, серные линкеры, селеновые линкеры, азотные линкеры, фосфорные линкеры, борные линкеры, хромовые линкеры или фенилгидразидные линкеры. В некоторых случаях указанный линкер представляет собой бесследный арил-триазеновый линкер, как описано в работе Hejesen, et al., “A traceless aryl-triazene linker for DNA-directed chemistry,” Org Biomol Chem 11(15): 2493-2497 (2013). В некоторых случаях указанный линкер представляет собой бесследный линкер, описанный в работе Blaney, et al., “Traceless solid-phase organic synthesis,” Chem. Rev. 102: 2607-2024 (2002). В некоторых случаях указанный линкер представляет собой бесследный линкер, как описано в патенте США № 6821783.
Способы применения
[221] В некоторых вариантах реализации в данном документе раскрыт способ лечения субъекта, имеющего рак, который характеризуется сверхэкспрессией белка CLDN18.2. В некоторых случаях указанный способ включает в себя введение субъекту антитела против CLDN18.2, описанного в данном документе, или фармацевтической композиции, содержащей антитело против CLDN18.2, для лечения рака у субъекта. В некоторых случаях рак представляет собой рак желудочно-кишечного тракта. Примеры рака желудочно-кишечного тракта включают в себя рак пищевода, рак желчного пузыря и желчных путей, рак печени, рак поджелудочной железы, рак желудка, рак тонкого кишечника, рак толстого кишечника, рак толстой кишки, рак прямой кишки и (или) рак ануса.
[222] В некоторых случаях рак желудочно-кишечного тракта представляет собой рак желудка (гастрический рак). В некоторых случаях рак желудка (гастрический рак) включает в себя аденокарциномы желудка, лимфому желудка, стромальную опухоль желудочно-кишечного тракта (СОЖКТ, англ. «GIST»), карциноидную опухоль, плоскоклеточную карциному, мелкоклеточную карциному или лейомиосаркому.
[223] В некоторых случаях рак желудочно-кишечного тракта представляет собой рак поджелудочной железы. В некоторых случаях рак поджелудочной железы включает в себя экзокринную опухоль, такую как аденокарцинома поджелудочной железы, ацинарно-клеточная карцинома, внутрипротоковая папиллярно-муцинозная неоплазма (ВПМН, англ. «IPMN») или муцинозная цистаденокарцинома; или нейроэндокринную опухоль поджелудочной железы (НЭОПЖ, англ. «PNET») (также известную как опухоль островковых клеток поджелудочной железы), такую как гастринома, глюкагонома, инсулинома, соматостатинома, ВИПома (англ. «VIPoma») или нефункциональная опухоль островковых клеток поджелудочной железы.
[224] В некоторых случаях рак желудочно-кишечного тракта представляет собой рак пищевода. В некоторых случаях рак пищевода включает в себя аденокарциному пищевода, плоскоклеточную карциному или мелкоклеточную карциному.
[225] В некоторых случаях рак желудочно-кишечного тракта представляет собой холангиокарциному.
[226] В некоторых случаях рак представляет собой рак легкого. В некоторых случаях рак легкого включает в себя немелкоклеточный рак легкого (НМКРЛ, англ. «NSCLC»), такой как аденокарцинома легкого, плоскоклеточная карцинома или мелкоклеточная карцинома; или мелкоклеточный рак легкого (МКРЛ, англ. «SCLC»).
[227] В некоторых случаях рак представляет собой рак яичника. В некоторых случаях рак яичника включает в себя эпителиальноклеточную опухоль яичника, эмбриональноклеточную опухоль яичника, стромальную опухоль яичника или первичную перитонеальную карциному.
[228] В некоторых вариантах осуществления данного изобретения указанный способ дополнительно включает в себя введение субъекту дополнительного терапевтического агента. В некоторых случаях указанный дополнительный терапевтический агент представляет собой химиотерапевтический агент, иммунотерапевтический агент, нацеленный терапевтический агент, терапевтический агент на основе гормона или терапевтический агент на основе стволовых клеток.
[229] В некоторых случаях указанный дополнительный терапевтический агент включает в себя химиотерапевтический агент. Примеры химиотерапевтических агентов включают в себя следующие, но не ограничиваются ими: алкилирующие агенты, такие как циклофосфамид, мехлорэтамин, хлорамбуцил, мелфалан, дакарбазин или нитрозомочевины; антрациклины, такие как даунорубицин, доксорубицин, эпирубицин, идарубицин, митоксантрон или валрубицин; разрушители цитоскелета, такие как паклитаксел, доцетаксел, абраксан или таксотер; эпотилоны; ингибиторы гистондеацетилазы, такие как вориностат или ромидепсин; ингибиторы топоизомеразы I, такие как иринотекан или топотекан; ингибиторы топоизомеразы II, такие как этопозид, тенипозид или тафлупозид; ингибиторы киназ, такие как бортезомиб, эрлотиниб, гефитиниб, иматиниб, вемурафениб или висмодегиб; аналоги нуклеотидов и аналоги-предшественники, такие как азацитидин, азатиоприн, капецитабин, цитарабин, доксифлуридин, фторурацил, гемцитабин, гидрозимочевина, меркаптопурин, метотрексат или тиогуанин; агенты на основе платины, такие как карбоплатин, цисплатин или оксалиплатин; ретиноиды, такие как третиноин, алитретиноин или бексаротен; или алкалоиды барвинка и их производные, такие как винбластин, винкристин, виндезин или винорелбин.
[230] В некоторых вариантах реализации данного изобретения указанный дополнительный терапевтический агент представляет собой иммунотерапевтический агент. В некоторых случаях иммунотерапия представляет собой адоптивную клеточную терапию. Иллюстративная адоптивная клеточная терапия включает в себя AFP TCR, MAGE-A10 TCR или NY-ESO-TCR от Adaptimmune; ACTR087/ритуксимаб от Unum Therapeutics; терапия CAR-T-клетками против BCMA, терапия «бронированными» CAR-T-клетками против CD19, JCAR014, JCAR018, JCAR020, JCAR023, JCAR024 или JTCR016 от Juno Therapeutics; JCAR017 от Celgene/Juno Therapeutics; терапия CAR-T-клетками против CD19 от Intrexon; терапия CAR-T-клетками против CD19, аксикабтаген цилолейцел, KITE-718, KITE-439 или NY-ESO-1 T-клеточнорецепторная терапия от Kite Pharma; терапия CAR-T-клетками против CEA от Sorrento Therapeutics; терапия CAR-T-клетками против PSMA от TNK Therapeutics/Sorrento Therapeutics; ATA520 от Atara Biotherapeutics; AU101 и AU105 от Aurora BioPharma; балталейцел-T (CMD-003) от Cell Medica; bb2121 от Bluebird Bio; BPX-501, BPX-601 или BPX-701 от Bellicum Pharmaceuticals; BSK01 от Kiromic; IMCgp100 от Immunocore; JTX-2011 от Jounce Therapeutics; LN-144 или LN-145 от Lion Biotechnologies; MB-101 или MB-102 от Mustang Bio; NKR-2 от Celyad; PNK-007 от Celgene; тисагенлеклейцел-T от Novartis Pharmaceuticals; или TT12 от Tessa Therapeutics.
[231] В некоторых случаях иммунотерапия представляет собой терапию на основе дендритных клеток.
[232] В некоторых случаях иммунотерапия включает в себя терапию на основе цитокинов, которая включает в себя, например, интерлейкин (ИЛ), такой как ИЛ-2, ИЛ-15 или ИЛ-21, интерферон-альфа (ИФН-α) или гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ, англ. «GM-CSF»).
[233] В некоторых случаях иммунотерапия включает в себя модулятор иммунных контрольных точек. Иллюстративные модуляторы иммунных контрольных точек включают в себя модуляторы PD-1, такие как ниволумаб (препарат Опдиво) от Bristol-Myers Squibb, пембролизумаб (препарат Кейтруда) от Merck, AGEN 2034 от Agenus, BGB-A317 от BeiGene, Bl-754091 от Boehringer-Ingelheim Pharmaceuticals, CBT-501 (генолимзумаб) от CBT Pharmaceuticals, INCSHR1210 от Incyte, JNJ-63723283 от Janssen Research & Development, MEDI0680 от MedImmune, MGA 012 от MacroGenics, PDR001 от Novartis Pharmaceuticals, PF-06801591 от Pfizer, REGN2810 (SAR439684) от Regeneron Pharmaceuticals/Sanofi или TSR-042 от TESARO; модуляторы CTLA-4, такие как ипилимумаб (препарат Ервой) или AGEN 1884 от Agenus; модуляторы PD-L1, такие как дурвалумаб (препарат Имфинзи) от AstraZeneca, атезолизумаб (MPDL3280A) от Genentech, авелумаб от EMD Serono/Pfizer, CX-072 от CytomX Therapeutics, FAZ053 от Novartis Pharmaceuticals, KN035 от 3D Medicine/Alphamab, LY3300054 от Eli Lilly или M7824 (ловушка для PD-L1/ТФР-β) от EMD Serono; модуляторы LAG3, такие как BMS-986016 от Bristol-Myers Squibb, IMP701 от Novartis Pharmaceuticals, LAG525 от Novartis Pharmaceuticals или REGN3767 от Regeneron Pharmaceuticals; модуляторы OX40, такие как BMS-986178 от Bristol-Myers Squibb, GSK3174998 от GlaxoSmithKline, INCAGN1949 от Agenus/Incyte, MEDI0562 от MedImmune, PF-04518600 от Pfizer или RG7888 от Genentech; модуляторы GITR, такие как GWN323 от Novartis Pharmaceuticals, INCAGN1876 от Agenus/Incyte, MEDI1873 от MedImmune, MK-4166 от Merck или TRX518 от Leap Therapeutics; модуляторы KIR, такие как лирилумаб от Bristol-Myers Squibb; или модуляторы TIM, такие как MBG453 от Novartis Pharmaceuticals или TSR-022 от Tesaro.
[234] В некоторых случаях указанный дополнительный терапевтический агент включает в себя терапевтический агент на основе гормона. Иллюстративные терапевтические агенты на основе гормонов включают в себя следующие, но не ограничиваются ими: ингибиторы ароматазы, такие как летрозол, анастрозол, экземестан или аминоглутетимид; аналоги гонадотропин-высвобождающего гормона (ГнВГ, англ. «GnRH»), такие как лейпрорелин или гозерелин; селективные модуляторы рецепторов эстрогена (СМРЭ, англ. «SERM»), такие как тамоксифен, ралоксифен, торемифен или фулвестрант; антиандрогены, такие как флутамид или бикалутамид; прогестогены, такие как ацетат мегестрола или ацетат медроксипрогестерона; андрогены, такие как флуоксиместерон; эстрогены, такие как эстроген, диэтилстилбестрол (ДЭС, англ. «DES»), Эстраце или фосфат полиэстрадиола; или аналоги соматостатина, такие как октреотид.
[235] В некоторых случаях указанный дополнительный терапевтический агент представляет собой терапевтический агент первой линии.
[236] В некоторых вариантах реализации данного изобретения указанное антитело против CLDN18.2 и указанный дополнительный терапевтический агент вводят одновременно.
[237] В некоторых случаях указанное антитело против CLDN18.2 и указанный дополнительный терапевтический агент вводят последовательно. В некоторых случаях указанное антитело против CLDN18.2 вводят указанному субъекту до введения указанного дополнительного терапевтического агента. В других случаях указанное антитело против CLDN18.2 вводят указанному субъекту после введения указанного дополнительного терапевтического агента.
[238] В некоторых случаях указанный дополнительный терапевтический агент и указанное антитело против CLDN18.2 формулируют в виде раздельных доз.
[239] В некоторых случаях указанный субъект перенес хирургическую операцию. В некоторых случаях указанное антитело против CLDN18.2 и, необязательно, указанный дополнительный терапевтический агент вводят указанному субъекту после хирургической операции. В некоторых случаях указанное антитело против CLDN18.2 и, необязательно, указанный дополнительный терапевтический агент вводят указанному субъекту до хирургической операции.
[240] В некоторых случаях указанный субъект перенес воздействие радиацией. В некоторых случаях указанное антитело против CLDN18.2 и, необязательно, указанный дополнительный терапевтический агент вводят указанному субъекту во время или после лучевой терапии. В некоторых случаях указанное антитело против CLDN18.2 и, необязательно, указанный дополнительный терапевтический агент вводят указанному субъекту до проведения лучевой терапии.
[241] В некоторых случаях указанный субъект представляет собой человека.
[242] В некоторых вариантах реализации, в данном документе также описан способ индукции эффекта уничтожения клеток. В некоторых случаях указанный способ включает в себя приведение в контакт множества клеток с антителом против CLDN18.2, содержащим полезную нагрузку, в течение периода времени, достаточного для интернализации антитела против CLDN18.2 и, таким образом, для индукции эффекта уничтожения клеток. В некоторых случаях указанная полезная нагрузка включает в себя майтансиноид, ауристатин, таксоид, калихеамицины, дуокармицин, аматоксин или их производное. В некоторых случаях указанная полезная нагрузка включает в себя ауристатин или его производное. В некоторых случаях указанная полезная нагрузка представляет собой монометилауристатин E (MMAE). В некоторых случаях указанная полезная нагрузка представляет собой монометилауристатин F (MMAF).
[243] В некоторых случаях указанная клетка представляет собой раковую клетку. В некоторых случаях указанная клетка представляет собой клетку из рака желудочно-кишечного тракта. В некоторых случаях указанный рак желудочно-кишечного тракта представляет собой рак желудка. В некоторых случаях указанный рак желудочно-кишечного тракта представляет собой рак поджелудочной железы. В некоторых случаях указанный рак желудочно-кишечного тракта представляет собой рак пищевода или холангиокарциному.В некоторых случаях указанная клетка происходит из рака легкого или рака яичника.
[244] В некоторых вариантах реализации данного изобретения указанный способ представляет собой способ in vitro.
[245] В некоторых вариантах реализации данного изобретения указанный способ представляет собой способ in vivo.
Фармацевтические композиции
[246] В некоторых вариантах реализации данного изобретения антитело против CLDN18.2 дополнительно формулируют в виде фармацевтической композиции. В некоторых случаях указанную фармацевтическую композицию формулируют для введения субъекту многими путями введения, включая следующие, но не ограничиваясь ими: парентеральный (например, внутривенный, подкожный, внутримышечный, внутриартериальный, внутрикожный, интраперитонеальный, интравитреальный, интрацеребральный или интрацеребровентрикулярный), пероральный, интраназальный, буккальный, ректальный или чрескожный пути введения. В некоторых случаях описанную в данном документе фармацевтическую композицию формулируют для парентерального (например, внутривенного, подкожного, внутримышечного, внутриартериального, внутрикожного, интраперитонеального, интравитреального, интрацеребрального или интрацеребровентрикулярного) введения. В некоторых случаях описанную в данном документе фармацевтическую композицию формулируют для перорального введения. В других некоторых случаях описанную в данном документе фармацевтическую композицию формулируют для интраназального введения.
[247] В некоторых вариантах реализации данного изобретения указанные фармацевтические композиции включают в себя следующие, но не ограничиваются ими: водные жидкие дисперсии, самоэмульгирующиеся дисперсии, твердые растворы, липосомальные дисперсии, аэрозоли, твердые лекарственные формы, порошки, составы с немедленным высвобождением, составы с контролируемым высвобождением, составы с быстрым расплавлением, таблетки, капсулы, пилюли, составы с замедленным высвобождением, составы с пролонгированным высвобождением, составы с пульсирующим высвобождением, составы в виде множества частиц (например, составы с наночастицами) и смешанные составы с немедленным и контролируемым высвобождениями.
[248] В некоторых случаях указанный фармацевтический состав включает в себя составы в виде множества частиц. В некоторых случаях указанный фармацевтический состав включает в себя составы с наночастицами. Иллюстративные составы с наночастицами включают в себя следующие, но не ограничиваются ими: парамагнитные наночастицы, суперпарамагнитные наночастицы, металлические наночастицы, фуллереноподобные материалы, неорганические нанотрубки, дендримеры (например, с ковалентно присоединенными хелатами металлов), нановолокна, нанорога, нанолуковицы, наностержни, нанонити и квантовые точки. В некоторых случаях наночастица представляет собой металлическую наночастицу, например, наночастицу скандия, титана, ванадия, хрома, марганца, железа, кобальта, никеля, меди, цинка, иттрия, циркония, ниобия, молибдена, рутения, родия, палладия, серебра, кадмия, гафния, тантала, вольфрама, рения, осмия, иридия, платины, золота, гадолиния, алюминия, галлия, индия, олова, таллия, свинца, висмута, магния, кальция, стронция, бария, лития, натрия, калия, бора, кремния, фосфора, германия, мышьяка, сурьмы и их комбинации, сплавы или оксиды.
[249] В некоторых случаях наночастица включает в себя ядро или ядро и оболочку, как в наночастице типа ядро-оболочка. В некоторых случаях наночастица имеет по меньшей мере одно измерение размером менее чем около 500 нм, 400 нм, 300 нм, 200 нм или 100 нм.
[250] В некоторых вариантах реализации данного изобретения указанные фармацевтические композиции содержат носитель или материалы-носители, выбранные на основе совместимости с композицией, раскрытой в данном документе, и характеристик профиля высвобождения желаемой дозированной формы. Иллюстративные материалов-носителей включают в себя, например, связывающие агенты, суспендирующие агенты, дезинтегрирующие агенты, наполнители, поверхностно-активные вещества, солюбилизаторы, стабилизаторы, смазки, смачивающие агенты, разбавители и тому подобное. Фармацевтически совместимые материалы-носители включают в себя следующие, но не ограничиваются ими: аравийская камедь, желатин, коллоидный диоксид кремния, глицерофосфат кальция, лактат кальция, мальтодекстрин, глицерин, силикат магния, поливинилпирроллидон (ПВП, англ. «PVP»), холестерол, сложные эфиры холестерола, казеинат натрия, соевый лецитин, таурохолевая кислота, фосфатидилхолин, хлорид натрия, трикальцийфосфат, дикальцийфосфат, целлюлоза и конъюгаты целлюлозы, сахара, стеароиллактилат натрия, каррагенан, моноглицерид, диглицерид, прежелатинизированный крахмал и тому подобное. См., например, Remington: The Science and Practice of Pharmacy, Nineteenth Ed (Easton, Pa.: Mack Publishing Company, 1995); Hoover, John E., Remington’s Pharmaceutical Sciences, Mack Publishing Co., Easton, Pennsylvania 1975; Liberman, H.A. and Lachman, L., Eds., Pharmaceutical Dosage Forms, Marcel Decker, New York, N.Y., 1980; и Pharmaceutical Dosage Forms and Drug Delivery Systems, Seventh Ed. (Lippincott Williams & Wilkins1999).
[251] В некоторых случаях указанные фармацевтические композиции дополнительно включают в себя агенты, регулирующие pH, или буферные агенты, которые включают в себя кислоты, такие как уксусная, борная, лимонная, молочная, фосфорная и соляная кислоты; основания, такие как гидроксид натрия, фосфат натрия, борат натрия, цитрат натрия, ацетат натрия, лактат натрия и трис-гидроксиметиламинометан; и буферы, такие как цитрат/декстроза, бикарбонат натрия и хлорид аммония. Такие кислоты, основания и буферы включены в количестве, необходимом для поддержания pH композиции в приемлемом диапазоне.
[252] В некоторых случаях указанные фармацевтические композиции включают в себя одну или большее число солей в количестве, необходимом для приведения осмоляльности композиции в приемлемый диапазон. Такие соли включают в себя соли, содержащие катионы натрия, калия или аммония и анионы хлорида, цитрата, аскорбата, бората, фосфата, бикарбоната, сульфата, тиосульфата или бисульфита; подходящие соли включают в себя хлорид натрия, хлорид калия, тиосульфат натрия, бисульфит натрия и сульфат аммония.
[253] В некоторых случаях указанные фармацевтические композиции дополнительно включают в себя разбавитель, который используется для стабилизации соединений, поскольку они могут обеспечить более стабильную среду. Соли, растворенные в забуференных растворах (которые также могут обеспечивать контроль pH или поддержание pH), используются в качестве разбавителей в данной области техники, и включают в себя, но не ограничиваются им, фосфатно-солевой буферный раствор. В определенных случаях разбавители увеличивают объем композиции для облегчения сжатия или создают достаточный объем для гомогенной смеси для заполнения капсул. Такие соединения могут включать в себя, например, лактозу, крахмал, маннит, сорбит, декстрозу, микрокристаллическую целлюлозу, такую как авицел (Avicel®); двухосновный фосфат кальция, дигидрат дикальцийфосфата; трикальцийфосфат, фосфат кальция; безводную лактозу, высушенную распылением лактозу; прежелатинизированный крахмал, прессованный сахар, такой как Di-Pac® (Amstar); маннит, гидроксипропилметилцеллюлозу, стеарат ацетата гидроксипропилметилцеллюлозы, разбавители на основе сахарозы, кондитерский сахар; моногидрат одноосновного сульфата кальция, дигидрат сульфата кальция; тригидрат лактата кальция, декстраты; гидролизованные сухие вещества злаков, амилозу; порошкообразную целлюлозу, карбонат кальция; глицин, каолин; маннит, хлорид натрия; инозит, бентонит и тому подобное.
[254] В некоторых случаях указанные фармацевтические композиции включают в себя дезинтегрирующие агенты или разрыхлители для облегчения разрушения или дезинтеграции субстанции. Термин «дезинтеграция» включает в себя как растворение, так и диспергирование лекарственной формы при контакте с желудочно-кишечной жидкостью. Примеры дезинтегрирующих агентов включают в себя крахмал, например, природный крахмал, такой как кукурузный крахмал или картофельный крахмал, прежелатинизированный крахмал, такой как National 1551 или Amijel®, или крахмалгликолят натрия, такой как Promogel® или Explotab®; целлюлозу, такую как продукт переработки древесины, микрокристаллическую целлюлозу, например, Avicel®, Avicel® PH101, Avicel® PH102, Avicel® PH105, Elcema® P100, Emcocel®, Vivacel®, Ming Tia® и Solka-Floc®; метилцеллюлозу, кроскармеллозу или поперечно-сшитую целлюлозу, такую как поперечно-сшитая карбоксиметилцеллюлоза натрия (Ac-Di-Sol®), поперечно-сшитая карбоксиметилцеллюлоза или поперечно-сшитая кроскармеллоза; поперечно-сшитый крахмал, такой как крахмалгликолят натрия; поперечно-сшитый полимер, такой как кросповидон; поперечно-сшитый поливинилпирролидон; альгинат, такой как альгиновая кислота или соль альгиновой кислоты, такая как альгинат натрия; глину, такую как Veegum® HV (силикат магния-алюминия); камедь, такую как агар, гуаровая камедь, смола плодов рожкового дерева, карайя, пектин или трагакант; крахмалгликолят натрия; бентонит; природную губку; поверхностно-активное вещество; смолу, такую как катионообменная смола; цитрусовую пульпу; лаурилсульфат натрия; лаурилсульфат натрия в сочетании с крахмалом; и тому подобное.
[255] В некоторых случаях указанные фармацевтические композиции включают в себя наполнители, такие как лактоза, карбонат кальция, фосфат кальция, двухосновный фосфат кальция, сульфат кальция, микрокристаллическая целлюлоза, порошкообразная целлюлоза, декстроза, декстраты, декстран, крахмалы, прежелатинизированный крахмал, сахароза, ксилит, лактит, маннит, сорбит, хлорид натрия, полиэтиленгликоль и тому подобное.
[256] Смазывающие вещества и вещества, способствующие скольжению, также необязательно включены в описанные в данном документе фармацевтические композиции для предотвращения, уменьшения или ингибирования адгезии или трения материалов. Иллюстративные смазывающие вещества включают в себя, например, стеариновую кислоту, гидроксид кальция, тальк, стеарил-фумарат натрия; углеводород, такой как минеральное масло, или гидрогенизированное растительное масло, такое как гидрогенизированное соевое масло (Sterotex®), высшие жирные кислоты и их соли с щелочными металлами и щелочноземельными металлами, такими как алюминий, кальций, магний, цинк; стеариновую кислоту, стеараты натрия, глицерол, тальк, воски, Stearowet®, борную кислоту, бензоат натрия, ацетат натрия, хлорид натрия, лейцин, полиэтиленгликоль (например, ПЭГ-4000) или метоксиполиэтиленгликоль, такой как Carbowax™, олеат натрия, бензоат натрия, глицерилбегенат, полиэтиленгликоль, лаурилсульфат магния или лаурилсульфат натрия, коллоидный диоксид кремния, такой как Syloid™, Cab-O-Sil®, крахмал, такой как кукурузный крахмал, силиконовое масло, поверхностно-активное вещество и тому подобное.
[257] Пластификаторы включают в себя соединения, используемые для смягчения материала микрокапсулирования или пленочных покрытий, чтобы сделать их менее хрупкими. Подходящие пластификаторы включают в себя, например, полиэтиленгликоли, такие как ПЭГ 300, ПЭГ 400, ПЭГ 600, ПЭГ 1450, ПЭГ 3350 и ПЭГ 800, стеариновую кислоту, пропиленгликоль, олеиновую кислоту, триэтилцеллюлозу и триацетин. Пластификаторы также могут действовать как диспергирующие или смачивающие агенты.
[258] Солюбилизаторы включают в себя такие соединения, как триацетин, триэтилцитрат, этилолеат, этилкаприлат, лаурилсульфат натрия, докузат натрия, витамин E ТПГС (токоферилполиэтиленгликольсукцинат, англ. «TPGS»), диметилацетамид, N-метилпирролидон, N-гидроксиэтилпирролидон, поливинилпирролидон, гидроксипропилметилцеллюлоза, гидроксипропилциклодекстрины, этанол, н-бутанол, изопропиловый спирт, холестерол, соли желчных кислот, полиэтиленгликоль 200-600, гликофурол, транскутол, пропиленгликоль и диметилизосорбид, и тому подобное.
[259] Стабилизаторы включают в себя соединения, такие как любые антиоксидантные агенты, буферы, кислоты, консерванты и тому подобное.
[260] Суспендирующие агенты включают в себя такие соединения, как поливинилпирролидон, например, поливинилпирролидон K12, поливинилпирролидон K17, поливинилпирролидон K25 или поливинилпирролидон K30, сополимер винилпирролидона/винилацетата (S630), полиэтиленгликоль, например, полиэтиленгликоль может иметь молекулярную массу от около 300 до около 6000, или от около 3350 до около 4000, или от около 7000 до около 5400, карбоксиметилцеллюлоза натрия, метилцеллюлоза, гидроксипропилметилцеллюлоза, стеарат ацетата гидроксиметилцеллюлозы, полисорбат-80, гидроксиэтилцеллюлоза, альгинат натрия, камеди, такие как, например, трагакантовая камедь и аравийская камедь, гуаровая камедь, ксантаны, включая ксантановую камедь, сахара, целлюлозу, такую как, например, карбоксиметилцеллюлоза натрия, метилцеллюлоза, карбоксиметилцеллюлоза натрия, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза, полисорбат-80, альгинат натрия, полиэтаноксилированный сорбитан монолаурат, полиэтаноксилированный сорбитан монолаурат, повидон и тому подобное.
[261] Поверхностно-активные вещества включают в себя такие соединения, как лаурилсульфат натрия, докузат натрия, твин 60 или твин 80, триацетин, витамин E ТПГС, сорбитанмоноолеат, полиоксиэтиленсорбитанмоноолеат, полисорбаты, полаксомеры, соли желчных кислот, глицерилмоностеарат, сополимеры этиленоксида и пропиленоксида, например, Pluronic® (BASF) и тому подобное. Дополнительные поверхностно-активные вещества включают в себя глицериды жирных кислот полиоксиэтилена и растительные масла, например, полиоксиэтилен (60) гидрогенизированное касторовое масло; и полиоксиэтиленалкиловые эфиры и алкилфениловые эфиры, например, октоксинол 10, октоксинол 40. Иногда поверхностно-активные вещества добавляют для повышения физической стабильности или для других целей.
[262] Агенты, повышающие вязкость, включают в себя, например, метилцеллюлозу, ксантановую камедь, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, стеарат ацетата гидроксипропилметилцеллюлозы, фталат гидроксипропилметилцеллюлозы, карбомер, поливиниловый спирт, альгинаты, аравийскую камедь и их комбинации.
[263] Смачивающие агенты включают в себя такие соединения, как олеиновая кислота, моностеарат глицерина, моноолеат сорбитана, монолаурат сорбитана, олеат триэтаноламина, моноолеат полиоксиэтиленсорбитана, монолаурат полиоксиэтиленсорбитана, докузат натрия, олеат натрия, лаурилсульфат натрия, докузат натрия, триацетин, твин 80, витамин E ТПГС, соли аммония и тому подобное.
Схемы лечения
[264] В некоторых вариантах реализации описанные в данном документе фармацевтические композиции вводят в целях терапевтического применения. В некоторых вариантах реализации данного изобретения фармацевтическую композицию вводят один раз в сутки, два раза в сутки, три раза в сутки или большее число раз в сутки. Фармацевтическую композицию вводят ежедневно, каждый день, через день, пять дней в неделю, один раз в неделю, через неделю, две недели в месяц, три недели в месяц, один раз в месяц, два раза в месяц, три раза в месяц, или большее число раз. Фармацевтическую композицию вводят в течение по меньшей мере 1 месяца, 2 месяцев, 3 месяцев, 4 месяцев, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, 12 месяцев, 18 месяцев, 2 лет, 3 лет и большего периода времени.
[265] В случае, когда состояние пациента действительно улучшается, по усмотрению врача введение композиции осуществляется непрерывно; в качестве альтернативы, доза вводимой композиции временно снижается или временно приостанавливается на определенный период времени (так называемые «лекарственные каникулы»). В некоторых случаях продолжительность лекарственных каникул варьирует от 2 суток до 1 года, включая, только в качестве примера, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток, 10 суток, 12 суток, 15 суток, 20 суток, 28 суток, 35 суток, 50 суток, 70 суток, 100 суток, 120 суток, 150 суток, 180 суток, 200 суток, 250 суток, 280 суток, 300 суток, 320 суток, 350 суток или 365 суток. Снижение дозы в течение лекарственных каникул составляет от 10% до 100%, включая, только в качестве примера, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100%.
[266] После того, как наступило улучшение состояния пациента, при необходимости вводят поддерживающую дозу. Затем можно уменьшить дозу или частоту введения, или оба параметра, в зависимости от симптомов, до уровня, при котором сохраняется облегчение заболевания, расстройства или патологического состояния.
[267] В некоторых вариантах реализации данного изобретения количество данного агента, которое соответствует такому количеству, варьирует в зависимости от таких факторов, как конкретное соединение, тяжесть заболевания, особенности (например, масса тела) субъекта или реципиента, нуждающегося в лечении, но, тем не менее, его можно определить способом, известным в данной области техники, в соответствии с конкретными обстоятельствами, характерными для данного случая, включая, например, конкретный вводимый агент, путь введения, и субъекта или реципиента, проходящего лечение. В некоторых случаях, требуемая доза может быть для удобства представлена в виде одной дозы или дробных доз, вводимых одновременно (или в течение короткого периода времени) или с соответствующими интервалами, например, в виде двух, трех, четырех или более субдоз в сутки.
[268] Вышеупомянутые диапазоны являются лишь предположительными, так как количество переменных в отношении индивидуальной схемы лечения велико, и значительные отклонения от этих рекомендуемых значений не является редкостью. Такие дозы изменяются в зависимости от ряда переменных, не ограничивающихся активностью используемого соединения, заболеванием или состоянием, подлежащим лечению, способом введения, потребностями отдельного субъекта, серьезностью заболевания или состояния, подлежащего лечению, и усмотрением практикующего специалиста.
[269] В некоторых вариантах реализации данного изобретения токсичность и терапевтическую эффективность таких схем лечения определяют посредством стандартных фармацевтических процедур на культурах клеток или экспериментальных животных, включая, но не ограничиваясь ими, определение LD50 (дозы, летальной для 50% популяции) и ED50 (дозы, терапевтически эффективной у 50% популяции). Соотношение дозы токсичного эффекта и дозы терапевтического эффекта представляет собой терапевтический индекс и выражается в виде соотношения между LD50 и ED50. Соединения, демонстрирующие высокие терапевтические индексы, являются предпочтительными. Данные, полученные в анализах на культуре клеток и исследованиях на животных, применяют при разработке диапазона доз для применения у человека. Доза таких соединений, предпочтительно, лежит в пределах диапазона циркулирующих концентраций, которые включают ED50 с минимальной токсичностью. Доза варьирует в пределах данного диапазона в зависимости от используемой лекарственной формы и применяемого пути введения.
Наборы и готовые изделия
[270] В некоторых вариантах реализации, в данном документе описаны наборы и готовые изделия для использования с одной или большим числом композиций и способов, описанных в данном документе. Такие наборы включают в себя носитель, упаковку или контейнер, которые разделены на отсеки для приема одного или большего числа контейнеров, таких как флаконы, пробирки и тому подобное, при этом каждый из контейнеров содержит один из отдельных элементов, используемых в способе, описанном в данном документе. Пригодные контейнеры включают в себя, например, бутыли, флаконы, шприцы и пробирки. В одном варианте реализации данного изобретения контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик.
[271] Предоставленные в данном документе готовые изделия содержат упаковочные материалы. Примеры фармацевтических упаковочных материалов включают в себя следующие, но не ограничиваются ими: блистерные упаковки, бутыли, пробирки, пакеты, контейнеры, флаконы и любой упаковочный материал, подходящий для выбранного состава и предполагаемых способа введения и лечения.
[272] Например, контейнер (-ы) включает (-ют) в себя антитело против CLDN18.2, как описано в данном документе, клетки-хозяева для продуцирования одного или большего числа антител, описанных в данном документе, и (или) векторы, содержащие молекулы нуклеиновой кислоты, которые кодируют описанные в данном документе антитела. Такие наборы необязательно включают в себя идентифицирующее описание или этикетку, или инструкции, относящиеся к их применению в способах, описанных в данном документе.
[273] В набор обычно входят этикетки с указанием содержимого и (или) инструкций по применению, а также вкладыши в упаковку с инструкциями по применению. Также обычно включается набор инструкций.
[274] В одном варианте реализации данного изобретения этикетка находится на контейнере или связана с ним. В одном варианте реализации данного изобретения этикетка находится на контейнере, когда буквы, числа или другие символы, образующие этикетку, прикреплены, отформованы или вытравлены на самом контейнере; этикетка связана с контейнером, когда она присутствует в емкости или носителе, который также удерживает контейнер, например, в виде вкладыша в упаковку. В одном варианте реализации данного изобретения этикетка используется для обозначения того, что содержимое должно использоваться для конкретного терапевтического применения. На этикетке также указаны инструкции по использованию содержимого, например, в описанных в данном документе способах.
[275] В определенных вариантах реализации данного изобретения фармацевтические композиции представлены в упаковке или дозирующем устройстве, которые содержат одну или большее число стандартных дозированных форм, содержащих соединение, представленное в данном документе. Упаковка, например, содержит металлическую или пластиковую фольгу, например, блистерную упаковку. В одном варианте реализации данного изобретения к упаковке или дозирующему устройству прилагаются инструкции по применению. В одном варианте реализации данного изобретения упаковка или дозатор также сопровождается уведомлением, связанным с контейнером, по форме, предписанной правительственным агентством, регулирующим производство, использование или продажу фармацевтических препаратов, причем это уведомление отражает одобрение указанным агентством данной формы препарата для введения человеку или для применения в ветеринарии. Такое уведомление, например, представляет собой маркировку, одобренную Управлением по санитарному надзору за качеством пищевых продуктов и лекарственных препаратов США, для лекарственных препаратов, отпускаемых по рецепту, или утвержденный вкладыш в упаковку. В одном варианте реализации данного изобретения композиции, содержащие соединение, представленное в данном документе, формулируют в совместимом фармацевтическом носителе, также получают, помещают в соответствующий контейнер и маркируют для лечения указанного патологического состояния.
Определенная терминология
[276] Если не указано иное, все технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понимается специалистом в области техники, к которой принадлежит заявленный объект изобретения. Следует понимать, что общее изложенное выше описание и последующее подробное описание являются только иллюстративными и пояснительными, и не являются ограничивающими для какого-либо заявленного объекта изобретения. В данной заявке использование единственного числа включает в себя использование множественного числа, если специально не указано иное. Следует отметить, что, при использовании в данном описании и прилагаемой формуле изобретения, единственное число включает в себя ссылку на множественное число, если из контекста явно не следует иное. В данной заявке использование «или» означает «и (или)», если не указано иное. Кроме того, использование термина «включая в себя», а также других форм, таких как «включают в себя», «включает в себя» и «включено», не является ограничивающим.
[277] При использовании в данном документе, диапазоны и количества могут быть выражены как «около» определенного значения или диапазона. «Около» также включает в себя точное количество. Следовательно, «около 5 мкл» означает «около 5 мкл», а также «5 мкл». Обычно термин «около» включает в себя количество, которое, как ожидается, находится в пределах экспериментальной ошибки, например, в пределах 15%, 10% или 5%.
[278] Заголовки разделов, используемые в данном документе, предназначены только для организационных целей и не могут быть истолкованы как ограничивающие описанный объект.
[279] При использовании в данном документе, термины «индивидуум (-ы)», «субъект (-ы)» и «пациент (-ы)» означают любое млекопитающее. В некоторых вариантах реализации данного изобретения млекопитающее представляет собой человека. В некоторых вариантах реализации данного изобретения млекопитающее не представляет собой человека. Ни один из терминов не требует или не ограничен ситуациями, которые характеризуются наблюдением (например, постоянным или периодическим) со стороны работника системы здравоохранения (например, врача, дипломированной медицинской сестры, практикующей медицинской сестры, помощника врача, санитара или работника хосписа).
[280] Термины «полипептид», «пептид» и «белок», используемые в данном документе взаимозаменяемо, относятся к полимерам аминокислот любой длины. Указанный полимер может быть линейным, циклическим или разветвленным, он может содержать модифицированные аминокислоты, и в него можно встроить неаминокислоты. Данные термины также охватывают полимеры аминокислот, которые были модифицированы, например, посредством сульфатирования, гликозилирования, липидирования, ацетилирования, фосфорилирования, йодирования, метилирования, окисления, протеолитического процессинга, фосфорилирования, пренилирования, рацемизации, селеноилирования, присоединения аминокислоты к белкам, опосредованного переносом РНК, такого как аргинилирование, убиквитинирование или любые другие манипуляции, такие как конъюгация с метящим компонентом.
[281] При использовании в данном документе, термин «аминокислота» относится либо к встречающимся в природе и (или) к не встречающимся в природе, либо к синтетическим аминокислотам, включая глицин и оптические изомеры D или L, а также аналоги аминокислот и пептидомиметики.
[282] Полипептид, «полученный из», или аминокислотная последовательность, «полученная из» обозначенного белка или полипептида относится к происхождению полипептида. Предпочтительно, полипептид имеет аминокислотную последовательность, которая по существу идентична последовательности полипептида, закодированного в указанной последовательности, или ее части, где эта часть состоит из по меньшей мере 10-20 аминокислот, или по меньшей мере 20-30 аминокислот, или по меньшей мере 30-50 аминокислот, или который иммунологически идентифицируется с полипептидом, закодированным в указанной последовательности. Эта терминология также включает в себя полипептид, экспрессируемый из обозначенной последовательности нуклеиновой кислоты.
[283] Согласно нумерации по Кабату, области CDR в составе молекулы тяжелой цепи антитела обычно присутствуют в аминокислотных положениях с 31 по 35, что необязательно может включать в себя одну или две дополнительные аминокислоты после аминокислотного положения 35 (обозначаемые в системе нумерации по Кабату как 35A и 35B) (CDR1), в аминокислотных положениях с 50 по 65 (CDR2) и в аминокислотных положениях с 95 по 102 (CDR3). Согласно нумерации по Кабату, области CDR в составе молекулы легкой цепи антитела обычно присутствуют в аминокислотных положениях с 24 по 34 (CDR1), в аминокислотных положениях с 50 по 56 (CDR2) и в аминокислотных положениях с 89 по 97 (CDR3). Как хорошо известно специалистам в данной области техники, использующих систему нумерации по Кабату, действительная линейная аминокислотная последовательность вариабельного домена антитела может содержать меньшее число аминокислот или дополнительные аминокислоты из-за укорочения или удлинения FR и (или) CDR и, соответственно, номер положения аминокислоты по Кабату не всегда соответствует ее номеру в линейной аминокислотной последовательности.
ПРИМЕРЫ
[284] Следующие примеры приведены исключительно в иллюстративных целях и не ограничивают объем прилагаемой формулы данного изобретения.
Пример 1 - Мишени и реагенты
[285] Клетки HEK293 и CHO, сверхэкспрессирующие CLDN18.2, были созданы в NovoBioSci и Genomeditech для целей иммунизации и скрининга. Клетки HEK293, экспрессирующие CLDN18.2, коэкспрессировали с ЗФБ (зеленый флуоресцирующий белок, англ. «GFP») посредством УВПР (участок внутренней посадки рибосомы, англ. «IRES»). Экспрессия ЗФБ и CLDN18.2 была продемонстрирована путем окрашивания коммерчески доступным флуоресцентно меченым антителом против CLDN18 (ab203563) (Фиг. 1). Экспрессию CLDN18.2 на клетках СНО подтверждали с помощью секвенирования ДНК.
Пример 2 - Иммунизация
[286] Иммунизацию крыс для выработки антител проводили с использованием следующего графика иммунизации (Таблица 10). Кратко, в первых двух иммунизациях использовали два типа конструкций ДНК - либо только внеклеточные петли 1 (ВКП1, англ. «ECL1», Фиг. 3), либо полноразмерную ДНК CLDN18.2 (ПР ДНК, Фиг. 2). Третья иммунизация проводилась клетками HEK293, сверхэкспрессирующими CLDN18.2, а четвертая иммунизация проводилась с использованием либо соответствующей ДНК, либо ДНК с клетками, сверхэкспрессирующими CLDN18.2. Финальная бустерная иммунизация проводилась с использованием клеток HEK293, сверхэкспрессирующих CLDN18.2. Для слияния использовали четырех крыс.
[287] Таблица 10. Схема иммунизации крыс.
Клетки HEK293-CLDN18.2
Клетки HEK293-CLDN18.2
4519*
4520*
4522
4523
4472
4473
4516
4517
* крыса выбрана для слияния
[288] Для иммунизации мышей (Таблица 11) клетки CHO или HEK293, сверхэкспрессирующие CLDN18.2, использовали в 4 раундах иммунизации плюс финальный бустер. В каждой группе использовали четырех мышей и проводили 3 слияния для создания гибридом.
[289] Таблица 11. Схема иммунизации мышей.
6376*
6377
6378*
6380
6381
6382*
* мышь выбрана для слияния
Пример 3 - Скрининг первичных клонов гибридомы путем связывания FACS
[290] Надосадочные жидкости гибридом, специфически связывающиеся с CHO-CLDN18.2. В общей сложности 80 96-луночных планшетов были засеяны и подвергнуты скринингу с помощью основанного на клетках твердофазного ИФА материала из гибридомы иммунизированных животных. 194 клона были идентифицированы как положительные на основании значения оптической плотности OD > 0,3. Для получения антител, которые специфически связываются с CLDN18.2, но не с CLDN 18.1, были подвергнуты скринингу гибридомы от иммунизации крыс и (или) мышей сконструированными клеточными линиями CHO-CLDN18.1 и CHO-CLDN18.2. Кратко, 50 мкл клеток CHO-CLDN18.1 или CHO-CLDN18.2 (плотность клеток: 2×106 клеток/мл, жизнеспособность: > 90%) инкубировали с равным объемом надосадочной жидкости гибридомы в 96-луночном планшете при температуре 4°C в течение 1 часа. После промывания буфером для FACS (ФСБД - фосфатно-солевой буфер Дульбекко, англ. «DPBS», содержащий 2% ЭТС - эмбриональной телячьей сыворотки, англ. «FBS») смесь клетки - антитело окрашивали вторичным антителом (IgG козы против крысы (H+L) iFlour 647 от Genscript, или IgG кролика против мыши, конъюгированный с Alexa Flour® 647, от Jackson ImmunoResearch). Наконец, смесь промывали и ресуспендировали в буфере для FACS и подвергали анализу FACS на цитометре BD FACS Celesta. Необработанные данные анализировали с помощью программного обеспечения FlowJo.
[291] 7 гибридом от иммунизированных крыс и 31 гибридом от иммунизированных мышей показали более сильное специфическое связывание с CHO-CLDN18.2 по сравнению с их соответствующим связыванием с клетками CHO-CLDN18.1.
Пример 4 - Очищенные антитела специфически связываются с CHO-CLDN18.2
[292] Очищенные антитела получали из надосадочных жидкостей путем аффинной очистки с протеином G. Кратко, надосадочную жидкость гибридомы центрифугировали при 8000 об/мин и температуре 4°C в течение 30 минут. Затем надосадочную жидкость фильтровали через мембрану для микрофильтрации калибра 0,22 мкм. К надосадочной жидкости добавляли NaCl из расчета 1 г NaCl на 10 мл надосадочной жидкости. Образец надосадочной жидкости загружали в колонку для очистки со скоростью 3 мл в минуту при температуре 4°С. Смолу с протеином G уравновешивали с помощью 1 х ФСБ в количестве 4-5 объемов колонки, затем промывали буфером для элюата (0,1 М Трис, pH 12). Затем в пробирку для сбора, содержащую элюированное антитело, немедленно добавляли нейтрализующий буфер для нейтрализации pH. Далее элюированные антитела подвергали диализу против 1хФСБ при комнатной температуре в течение 2 часов. Впоследствии антитело хранили для анализа.
[293] Очищенные антитела крыс тестировали в анализе связывания с использованием клеток, сверхэкспрессирующих CLDN18.2 или CLDN18.1, в соответствии с методом, описанным выше. 4 очищенных антитела крыс - 181B7B7, 193H11D8, 184A10D8 и 282A12F3 - показали специфическое связывание с CLDN18.2, но не с CLDN 18.1. В частности, антитело 282A12F3 продемонстрировало более сильное связывание с CLDN18.2, чем референсное антитело 175D10, а два очищенных антитела крыс -101C6A8 и 186A4B9 - связывались как с CLDN18.1, так и с CLDN18.2.
[294] 18 очищенных антител мышей, в том числе 325F12H3, 325E8C8, 328G2C4, 350G12E1, 357B8F8, 360F1G1, 364D1A7, 382A11H12, 399H6A10, 406D10H7, 408B9D4, 409E2C5, 413B5B4, 413H9F8, 416E8G10, 417H3B1, 420G5E2 и 429G1B7, продемонстрировали специфическое связывание с CLDN18.2, но не с CLDN18.1. В частности, 325E8C8, 350G12E1, 357B8F8, 364D1A7, 408B9D4 и 413H9F8 продемонстрировали более сильное связывание с CHO-CLDN18.2, чем референсное антитело 175D10.
Пример 5 - Кривая связывания очищенных антител
[295] Кривые связывания были построены для ранжирования аффинностей связывания гибридомных антител. Кратко, в общей сложности по 1×105 клеток CHO-CLDN18.2 для каждой лунки высевали в 96-луночный планшет и дважды промывали буфером для FACS (ФСБД, содержащий 2% ЭТС). Клетки инкубировали с серией разведенных очищенных гибридомных антител в течение 1 ч. После инкубации первичных антител клетки дважды промывали буфером для FACS. Затем клетки окрашивали вторичным антителом (IgG кролика против мыши, конъюгированный с Alexa Flour® 647 от Jackson ImmunoResearch). Сигналы Alexa Fluor 647 от окрашенных клеток детектировали на цитометре BD FACS Celesta и определяли средние геометрические сигналы флуоресценции. Для анализа использовали программное обеспечение FlowJo. Данные наносили на график в виде логарифма концентрации антител в зависимости от среднего сигнала флуоресценции. Нелинейный регрессионный анализ выполняли с помощью GraphPad Prism 6 (программное обеспечение от GraphPad) и рассчитывали значения EC50.
[296] Как показано на Фиг. 4А - Фиг. 4С, очищенные антитела против CLDN18.2, выработанные мышами, показали дозозависимое связывание с клетками CHO-CLDN18.2. Пять антител - 325E8C8, 350G12E1, 364D1A7, 408B9D4 и 413H9F8 - из 18 протестированных антител показали наивысшее максимальное связывание по сравнению с референсным антителом 175D10 (Фиг. 4A). Пять антител - 417H3B1, 413B5B4, 357B8F8, 360F1G1 и 429G1B7 - показали более высокое максимальное связывание, чем у 175D10, но более низкое, чем у антител 325E8C8, 350G12E1, 364D1A7, 408B9D4 и 413H9F8 (Фиг. 4B). Дополнительные протестированные антитела показали аналогичное или более слабое максимальное связывание по сравнению с 175D10 (Фиг. 4C). EC50 отобранных антител против CLDN18.2 относительно CLDN18.2 составляли примерно 10 нМ или меньше (Таблица 12).
[297] Таблица 12. Аффинности связывания (EC50) с клетками CHO-CLDN18.2 антител, полученных из клонов гибридомы иммунизированных мышей.
[298] Термин «н/п», используемый в данном документе и в следующих таблицах, означает «не применимо».
Пример 6 - Связывание антител с клеточными линиями рака желудка
[299] Клеточные линии рака желудка SNU601 и SNU620 обладают эндогенной экспрессией CLDN18.2. Экспрессию CLDN18.2 на клетках SNU601 и SNU620 подтверждали с помощью ОТ-ПЦР с использованием специфичных для CLDN18.2 праймеров и секвенирования ДНК. Клетки SNU601 и SNU620 с высоким уровнем экспрессии CLDN18.2 были отсортированы для анализа связывания. Анализ связывания выполняли так, как описано ранее. Клоны 282A12 и 101C6, выработанные крысами, и референсное антитело 175D10, все связывались с линией рака желудка SNU601, но клоны 282A12 и 101C6 также связывались с SU620 (Фиг. 5A и Фиг. 5B).
[300] Клеточную линию SNU620 использовали для определения аффинности связывания моноклональных антител мышей с эндогенно экспрессируемым CLDN18.2. Все положительные антитела иммунизированных мышей тестировали в конечной концентрации 10 мкг/мл. 15 из 18 моноклональных антител мышей, включая 325F12H3, 325E8C8, 328G2C4, 350G12E1, 360F1G1, 364D1A7, 406D10H7, 408B9D4, 409E2C5, 413B5B4, 413H9F8, 416E8G10, 417H3B1, 420G5E2, и 429G1B7, показали более сильное связывание с SU620 по сравнению с 175D10. В частности, 413H9F8, 364D1A7 и 408B9D4 обладают сильным связыванием с раковыми клетками SNU620.
[301] Подводя итог, антитела, такие как 282A12F3, 364D1A7 и 413H9F8, специфически связываются с CHO-CLDN18.2 и с клеточной линией рака желудка SNU620 (Таблица 13).
[302] Таблица 13. Сводное описание активностей связывания антител, специфичных к CLDN18.2.
Пример 7 - Химеризация
[303] Антитела мыши и крысы химеризовали путем экспрессии вариабельной области легкой цепи мыши и крысы в плазмиде pCDNA3.1(+), которая содержит последовательность ДНК, кодирующую аминокислоты сигнальной последовательности и константную область IgG1 человека. Последовательности константных областей тяжелой и легкой цепей (CH и CL) IgG1 человека показаны в Таблице 4.
[304] Аффинности связывания химерных антител с клеточной линией CHO-CLDN18.2 определяли так, как описано ранее. Как показано на Фиг. 6А - Фиг. 6D, химерные антитела 282A12F3, 64D1A7 и 413H9F8 специфически связываются с CLDN18.2. Химерные антитела 282A12F3, 64D1A7 и 413H9F8 показали более сильные аффинности связывания по сравнению с референсным антителом 175D10.
Пример 8 - Анализ последовательности антител и удаление сайтов посттрансляционной модификации
[305] Последовательности антител, полученных с помощью гибридомной технологии, анализировали на предмет посттрансляционных модификаций (ПТМ), которые иногда вызывают проблемы во время разработки терапевтического белка, такие как повышенная гетерогенность, пониженная биоактивность, пониженная стабильность, иммуногенность, фрагментация и агрегация. Потенциальное воздействие ПТМ зависит от их местонахождения и, в некоторых случаях, от воздействия растворителей. CDR всех последовательностей анализировали на дезаминирование аспарагина, изомеризацию аспартата, свободные тиоловые группы цистеина, N-гликозилирование, окисление и фрагментацию по потенциальным сайтам гидролиза.
[306] Множественные выравнивания родительских последовательностей с последовательностями зародышевой линии человека выполняли с использованием инструмента Igblast. На основании выравнивания последовательности родительского антитела с зародышевыми линиями человека были идентифицированы записи с наивысшей гомологией.
[307] Структурные модели антител 282A12F3, 413H9F8 и 364D1A7 были созданы с использованием индивидуального протокола построения моделей гомологии. Фрагменты предполагаемых структурных шаблонов были оценены, ранжированы и выбраны из базы данных PDB на основе их идентичности целевой последовательностей, а также качественных кристаллографических измерений структуры матрицы. На основании данных моделирования гомологии для 282A12F3, 413H9F8, 364D1A7 по отдельности были идентифицированы уязвимые остатки в каркасной области (FR) и областях CDR, были выделены потенциальные сайты ПТМ на поверхности структуры белка. На основании данных анализа ПТМ и идентичности последовательностей для матрицы зародышевой линии человека три антитела - 282A12F3, 413H9F8 и 364D1A7 - использовали в качестве родительских антител для дальнейшей гуманизации.
[308] Тест на связывание мутантов с удаленными сайтами ПТМ тестировали на клетках, экспрессирующих CLDN18.2 или CLDN18.1, вместе с референсным антителом 175D10 в качестве положительного контроля. Как показано на Фиг. 7A - Фиг. 10B, после потенциального удаления сайта ПТМ, 282A12F3-VH-N60Q, 282A12F3-VH-N60E и 282A12F3(T62A) из клона 282A12F3, 413H9F8-VL-N31E, 413H9F8-VL-S32L и 413H9F8-VL-S32V из клона 413H9F8, а также 364D1A7-VL-N31E, 364D1A7-VL-S32L и 364D1A7-VL-S32V из клона 364D1A7 показали специфическое связывание с линиями клеток CHO-CLDN18.2 вместо линий клеток CHO-CLDN18.1. Все антитела с потенциальным удалением сайта ПТМ имели более сильное связывание по сравнению с референсным антителом 175D10 с клетками CHO-CLDN18.2. 357B8F8-VH-N60E-VL-N31E, 357B8F8-VH-N60E-VL-S32I, 357B8F8-VH-S61I-VL-N31E и 357B8F8-VH-S61I-VL-S32I из клона 357B8F8 показали специфическое связывание с клетками CHO-CLDN18.2, однако только антитело 357B8F8-VH-S61I-VL-S32I показало аффинность связывания с CHO-CLDN18.2, сравнимую с таковой у 175D10 (xi175D10).
[309] Химерные клоны с мутациями удаления ПТМ тестировали на их связывание с клетками SNU620 с эндогенной экспрессией CLDN18.2 так, как описано выше. Как показано на Фиг. 11A - Фиг. 11C, оба варианта 413H9F8 и 364D1A7 связываются с SNU620 на разных уровнях. Мутанты S32V и S32L показали лучшую связывающую активность с клетками CHO-CLDN18.2 и SNU620, чем мутант N31E. Клон 413H9F8 показал лучшую связывающую активность с CLDN18.2, чем 364D1A7. Химерный 357B8F8и его варианты с удалением сайта ПТМ не могли связываться с линией раковых клеток SNU620, что похоже на показатели референсного антитела 175D10.
Пример 9 - Конкурентное связывание химерных антител
[310] Чтобы исследовать группу связывания эпитопа CLDN18.2-связывающих антител, четыре химерных антитела были протестированы на их активность конкурентного связывания с использованием клеток CHO-CLDN18.2. Рабочую концентрацию каждого антитела определяли с помощью анализа связывания на основе клеток CHO-CLDN18.2. Клетки собирали и промывали с помощью ФСБ, затем 1×105 клеток в 50 мкл в ФСБ добавляли в 96-луночный планшет. Тестируемые антитела разбавляли из расчета 60 мкг/мл с помощью ФСБ в 3-кратных сериях для 12 точек, и 50 мкл разведенных антител смешивали с клетками, и инкубировали при температуре 4°C в течение 120 мин. Затем лунки промывали с помощью ФСБ. Для анализа конкурентного связывания добавляли по 100 мкл меченых биотином антител против CLDN18.2 в рабочей концентрации (5, 1, 0,5 и 1 мкг/мл антител xi175D10, 282A12F3 (T62A), 413H9F8-VL-S32V и 364D1A7-VL-S32V, соответственно). Меченый биотином Fc козы против IgG человека добавляли в разведении 1 : 800 в концентрации 100 мкл/лунку в качестве контроля. Планшеты инкубировали при температуре 4°C в течение 40 минут. Меченый аллофикоцианином стрептавидин (1:1700) использовали для обнаружения антитела, меченого биотином. Для измерения связывания проводили проточную цитометрию.
[311] Связывание 175D10 на клетках CHO-CLDN18.2 полностью ингибировалось антителами 282A12F3 (T62A), 413H9F8-VL-S32V или 364D1A7-VL-32V (Фиг. 12A - Фиг. 12D). Связывание 282A12 (T62A) на клетках CHO-CLDN18.2 полностью ингибировалось антителами 413H9F8-VL-S32V или 364D1A7-VL-S32V, и частично ингибировалось антителом 175D10. Связывание 413H9F8-VL-S32V и 364D1A7-VL-S32V на клетках CHO-CLDN18.2 частично ингибировалось антителами 175D10 или 282A12F3 (T62A).
Пример 10 - Активность перекрестного связывания CLDN18.2 мыши и яванской макаки
[312] Видовая перекрестная реактивность позволяет оценить клинического кандидата на фармакологических моделях (мыши) и моделях токсичности (яванская макака). Видовая перекрестная реактивность антител против CLDN18.2 человека определялась с помощью основанного на клетках анализа связывания. Связывание идентифицированных моноклональных антител с CLDN18.2 мыши и яванской макаки анализировали с помощью проточной цитометрии. Клетки HEK293 кратковременно котрансфицировали маркером флуоресценции и CLDN18.2 мыши, и CLDN18.2 яванской макаки. Кратко, по 2.5 × 106 клеток HEK-293 на чашку высаживали в две чашки размером 10 см2 с 10 мл среды DMEM для каждой чашки. Через 24 ч после посадки клетки трансфицировали плазмидами ЗФБ-CLDN18.2 мыши и ЗФБ-CLDN18.2 яванской макаки. Общую плазмидную массу в 10 мкг на чашку трансфицировали с использованием 20 мкл липофектамина 2000 (Lipofectamine, Life Technologies). Культуральную среду заменяли через 5 ч после трансфекции. Через 48 часов после трансфекции клетки диссоциировали и готовили для определения аффинности связывания. Стабильная линия клеток HEK293-ЗФБ-CLDN18.2, которая экспрессирует CLDN18.2 человека, была использована для обнаружения ЗФБ-CLDN18.2 человека.
[313] Аффинности связывания антител против CLDN18.2 человека определяли на клетках, сверхэкспрессирующих CLDN18.2 человека, мыши и яванской макаки. Кратко, по 1 × 105 клеток для каждой лунки высевали в 96-луночный планшет и дважды промывали буфером для FACS (ФСБД, содержащий 2% ЭТС). Клетки инкубировали с последовательно разведенными антителами против CLDN18.2 в течение 1 ч. Контрольную группу составили раковые клетки, инкубированные с IgG1 человека. После инкубации с первичными антителами клетки дважды промывали буфером для FACS. Затем клетки окрашивали меченым Alexa Fluor 647 вторичным антителом против IgG человека (Jackson ImmunoResearch Laboratories) в течение 30 минут при температуре 4°C. Сигналы Alexa Fluor 647 и ЗФБ от окрашенных клеток детектировали на цитометре BD FACS Celesta и определяли средние геометрические сигналы флуоресценции. Для анализа использовали программное обеспечение FlowJo. Данные наносили на график в виде зависимости концентрации антитела от среднего соотношения флуоресценции Alexa Fluor 647/ЗФБ. Нелинейный регрессионный анализ проводили с помощью GraphPad Prism 6 (программное обеспечение от GraphPad). Как показано на Фиг. 13A - Фиг. 13E, варианты химерных антител 413H9F8, 364D1A7 и 357B8F8, гуманизированного 282A12 (T62A) (hz282-11) и референсного антитела 175D10 перекрестно реагировали с CLDN18.2 мыши и яванской макаки. Все протестированные антитела показали более сильное связывание с CLDN18.2 человека по сравнению со связыванием с CLDN18.2 мыши и яванской макаки.
Пример 11 - Антителозависимая клеточная цитотоксичность (АЗКЦ) химерных антител
[314] Химерные антитела против CLDN18.2 индуцировали специфическую АЗКЦ на клетках CHO-CLDN18.2.
[315] Специфичность АЗКЦ, индуцированной антителами против CLDN18.2, тестировали на клетках CHO-CLDN18.1 и CHO-CLDN18.2. Клетки-мишени - CHO-CLDN18.1 и CHO-CLDN18.2 - метили с помощью карбоксифлуоресцеин-сукцинимидилового эфира (КФСЭ, англ. «CFSE», от Life technology) в конечной концентрации 2,5 мкМ в течение 30 мин. Концентрация меченых клеток-мишеней была доведена до 2 × 105 клеток/мл, эффекторные клетки (FcR-TANK (CD16A-15V), которые представляли собой сконструированную линию клеток NK92 со сверхэкспрессией CD16a, разработанную ImmuneOnco) была доведена до 8 × 105 клеток/мл. Затем по 50 мкл суспензии клеток-мишеней, по 100 мкл суспензии эффекторных клеток и по 50 мкл серийно разведенных антител смешивали в каждой лунке (соотношение эффекторные клетки/клетки-мишени составляло 8 : 1). Для каждой концентрации антитела готовили дублирующие лунки. Контрольную группу составили раковые клетки, инкубированные только с эффекторными клетками. После инкубации при температуре 37°C в 5% CO2 в течение 4-16 ч, добавляли 1 мкг/мл 7-AAD (Invitrogen) и анализировали методом проточной цитометрии (BD FACS Celesta). АЗКЦ рассчитывали по следующей формуле: % АЗКЦ = % 7-AAD-положительных клеток с антителом - % 7-AAD-положительных клеток без антитела.
[316] Антитела против CLDN18.2 и клетки FcR-TANK (CD16A-15V) индуцировали АЗКЦ в линии клеток желудка NCI-N87-CLDN18.2
[317] АЗКЦ химерных антител и гуманизированных антител тестировали на раковых клетках NCI-N87. Клетки-мишени метили с помощью КФСЭ (Life technology) в конечной концентрации 2,5 мкМ в течение 30 мин. Концентрацию меченых клеток-мишеней доводили до 2 × 105 клеток/мл, концентрацию эффекторных клеток (FcR-TANK (CD16A-15V)) доводили до 8 × 105 клеток/мл. Затем по 50 мкл суспензии клеток-мишеней, по 100 мкл суспензии эффекторных клеток и по 50 мкл серийно разведенных антител смешивали в каждой лунке (соотношение эффекторные клетки/клетки-мишени составляло 8 : 1). Для каждой концентрации антитела готовили дублирующие лунки. Контрольную группу составили раковые клетки, инкубированные только с эффекторными клетками. После инкубации при температуре 37°C в 5% CO2 в течение 4-16 ч, добавляли 1 мкг/мл 7-AAD (Invitrogen) и анализировали методом проточной цитометрии (BD FACS Celesta). АЗКЦ рассчитывали по следующей формуле: % АЗКЦ = % 7-AAD-положительных клеток с антителом - % 7-AAD-положительных клеток без антитела.
[318] Мононуклеарные клетки периферической крови (МКПК) индуцировали АЗКЦ в линии клеток рака желудка NUGC4-CLDN18.2
[319] АЗКЦ химерных антител и гуманизированных антител, индуцированную МКПК, тестировали на клетках рака желудка NUGC4-CLDN18.2. Криоконсервированные МКПК (AllCells) от здорового субъекта размораживали за день до анализа и культивировали в течение ночи в среде RPMI с 10% ЭТС и с 200 МЕ ИЛ-2 (R&D) в инкубаторе с CO2. Клетки-мишени метили с помощью КФСЭ (Life technology) в конечной концентрации 2,5 мкМ в течение 15 мин. После окрашивания концентрацию клеток доводили до 6 × 104 клеток/мл и смешивали с двукратным объемом МКПК, которые доводили до 1 × 106 клеток/мл (соотношение эффекторные клетки/клетки-мишени составляло 40 : 1). Затем в каждой лунке смешивали по 150 мкл смешанной суспензии клеток-мишеней и эффекторных клеток и по 50 мкл серийно разведенных антител. Для каждой концентрации антитела готовили дублирующие лунки. Клетки-мишени сами по себе составили контрольную группы. После инкубации при температуре 37°C в 5% CO2 в течение 5 ч, добавляли 1 мкг/мл ПИ (Invitrogen) и анализировали методом проточной цитометрии (BD FACS Celesta). Специфическую цитотоксичность рассчитывали по следующей формуле: специфическая цитотоксичность = % ПИ-положительных клеток с антителом -% ПИ-положительных клеток без антитела.
[320] Опухолеспецифические мАт могут проявлять свои эффекты через механизмы, основанные на Fc, включая антителозависимую клеточно-опосредованную цитотоксичность (АЗКЦ). Функцию АЗКЦ специфических химерных антител против CLDN18.2 анализировали на основе АЗКЦ, индуцированной линией NK-клеток или МКПК, в присутствии выбранных антител. Как показано на Фиг. 14A - Фиг. 14B, химерные антитела были проанализированы на предмет их способности индуцировать АЗКЦ с FcR-TANK (CD16A-15V) против клеток CHO со стабильной экспрессией CLDN18.1 человека (CHO-CLDN18.1) или CLDN18.2 человека (CHO-CLDN18.2). Специфические антитела против CLDN18.2-282A12F3 (T62A), xi175D10, 413H9F8 и 364D1A7 - индуцировали АЗКЦ-опосредованный лизис клеток CHO-CLDN18.2, но не CHO-CLDN18.1. Клон 101C6, который связывается как с CLDN18.1, так и с CLDN18.2, индуцировал активность АЗКЦ как против клеток CHO-CLDN18.1, так и против клеток CHO-CLDN18.2. Специфическая активность АЗКЦ антител 282A12F3 (T62A), xi175D10, 413H9F8 и 364D1A согласуется с их профилями специфического связывания с CLDN18.2.
[321] Линию рака желудка NCI-N87 со стабильной экспрессией CLDN18.2 человека (NCI-N87-CLDN18.2) использовали в качестве клетки-мишени для тестирования химерных антител в отношении их активности АЗКЦ. Как показано на Фиг. 15 и в Таблице 14, 282A12F3 (T62A), референсное антитело 175D10, антитела 413H9F8 и 364D1A7 индуцировали АЗКЦ-опосредованный лизис клеток NCI-N87-CLDN18.2. Клоны 282A12F3, 413H9F8 и 364D1A7 показали более высокую активность АЗКЦ, чем референсное антитело 175D10, тогда как 357B8F8 показал меньшую активность. Было показано, что варианты по Fc S239D/I332E опосредуют повышенную активность АЗКЦ у антител (Lazar, et al., “Engineered antibody Fc variants with enhanced effector funciton,” PNAS USA 2006; 103: 4005-4010). Мутации S239D/I332E в Fc антитела 175D10 были введены для усиления активности АЗКЦ (175D10-V2). Как показано на Фиг. 15 и в Таблице 14, антитело 175D10 с мутациями S239D/I332E в Fc (xi175D10-V2) имело более сильную активность АЗКЦ, чем его родительское антитело 175D10.
[322] Для дальнейшего подтверждения функции специфических антител против CLDN18.2, криоконсервированные МКПК от здоровых доноров-людей использовали для тестирования их активности АЗКЦ против другой линии рака желудка - NUGC4 со стабильной экспрессией CLDN18.2 (NUGC4-CLDN18.2). Как показано на Фиг. 16 и в Таблице 15, антитела 282A12F3 (T62A), xi175D10, 413H9F8 и 364D1A7 индуцировали АЗКЦ-опосредованный лизис клеток NUGC4-CLDN18.2 в зависимости от концентрации. Антитела 282A12F3, 357B8F8, 413H9F8 и 364D1A7 показали более высокую активность АЗКЦ, чем референсное антитело 175D10, а антитело 413H9F8 показало самую высокую максимальную специфическую цитотоксичность.
[323] Таблица 14. Активность АЗКЦ химерных антител на клеточной линии NCI-N87-18.2
* Среднее значение 2 независимых экспериментов
[324] Таблица 15. Активность АЗКЦ химерных антител на клеточной линии NUGC4-CLDN18.2
* Данные от 1 донора. Остальные данные указаны как среднее для 3 доноров.
Пример 12 - Комплементзависимая цитотоксичность (КЗЦ) химерных антител
[325] В некоторых случаях опухолеспецифические мАт также проявляют свои эффекты через комплементзависимую цитотоксичность (КЗЦ). Сыворотку крови человека и клеточные линии CHO-CLDN18.2 использовали для проверки функции КЗЦ химерных антител. По 50 мкл 3×104 клеток CHO-CLDN18.2 смешивали с 25 мкл серийно разведенных химерных мАт против CLDN18.2 человека. Проводили инкубацию в течение 15 ~ 30 мин при комнатной температуре. Добавляли по 25 мкл 40% сыворотки крови человека, чтобы получить конечную концентрацию сыворотки крови в 10%. После инкубации при температуре 37°C в 5% CO2 в течение 30 мин, добавляли 1 мкг/мл ПИ (Invitrogen) и анализировали методом проточной цитометрии (BD FACS Celesta).
[326] Как показано на Фиг. 17, химерные антитела 282A12F3 (T62A), xi175D10, 413H9F8-VL-S32V и 364D1A7-VL-S32V индуцировали КЗЦ-опосредованный лизис клеток CHO-CLDN18.2. Антитела 282A12F3 (T62A), 413H9F8-VL-S32V и 364D1A7-VL-S32V индуцировали более сильную КЗЦ по сравнению с референсным антителом 175D10.
Пример 13 - Гуманизация иллюстративных антител против CLDN18.2
[327] Гуманизация антитела 282A12F3
[328] Гуманизацию антитела мыши проводили путем пересадки остатков CDR из антитела мыши на каркас зародышевой линии человека. Сначала последовательности областей VH и VL выбранных кандидатов сравнивали с последовательностями зародышевой линии человека, и выбирали наиболее подходящие акцепторы зародышевой линии на основе гомологии, канонической структуры и физических свойств. Впоследствии были сгенерированы модели структуры кандидатов с использованием моделирования гомологии. Области CDR как в тяжелой, так и в легкой цепях антител-кандидатов фиксировали, и мышиные каркасы заменяли выбранными каркасами зародышевой линии человека. Различные остатки между каркасами мыши и человека, которые потенциально влияют на конформацию CDR, подвергались обратной мутации. Фрагменты ДНК, кодирующие сконструированные гуманизированные варианты, были синтезированы и субклонированы в векторы экспрессии IgG. Последовательности ДНК были подтверждены секвенированием. Различные комбинации гуманизированных тяжелых и легких цепей котрансфицировали в клетки CHO-K1 для экспрессии. Гуманизированные антитела сравнивали с родительскими антителами относительно их аффинности связывания антигена, например, с помощью метода FACS на клетках, экспрессирующих целевой антиген.
[329] Был один сайт гликозилирования в последовательности VH, который был изменен с T на A. Данная последовательность также не содержала свободного цистеина или мотивов деградации Asn/Asp NG или DG. Исходную последовательность VH 282A12 (SEQ ID NO: 40) и 282A12 VL (SEQ ID NO: 44) вводили в BLAST для анализа, и впоследствии выбирали последовательность наилучшего сайта мутации согласно анализу гомологии для прививки CDR.
[330] SEQ ID NO: 65-68 иллюстрируют 4 последовательности VH вариантов 282A12, а SEQ ID NO: 69-73 иллюстрируют 5 последовательностей VL вариантов 282A12.
[331] Таблица 6 иллюстрирует гуманизированные комбинации тяжелых и легких цепей 282A12F3 (T62A).
[332] Гуманизация антитела 413H9F8-VL-S32V
[333] Для схемы гуманизации антитела 413H9F8-VL-S32V были использованы две стратегии с немного отличающимся подходом к пересадке CDR. SEQ ID NO: 74-76 иллюстрируют 3 последовательности VH вариантов 413H9F8, а SEQ ID NO: 77-80 иллюстрируют последовательности VL 4 вариантов 413H9F8, в которых используется первая стратегия. Таблица 7 иллюстрирует гуманизированные комбинации тяжелых и легких цепей производных 413H9F8-VL-S32V.
[334] В соответствии со второй стратегией SEQ ID NO: 81-84 иллюстрируют 4 последовательности VH вариантов 413H9F8, а SEQ ID NO: 85-88 иллюстрируют 4 последовательности VL вариантов 413H9F8L. Таблица 8 иллюстрирует гуманизированные комбинации тяжелых и легких цепей производных 413H9F8-VL-S32V.
[335] Гуманизация 364D1A7-VL-S32V
[336] SEQ ID NO: 89-92 иллюстрируют 4 последовательности VH вариантов 364D1A7, а SEQ ID NO: 93-97 иллюстрируют 5 последовательностей VL вариантов 364D1A7. Таблица 9 иллюстрирует гуманизированные комбинации тяжелых и легких цепей производных 364D1A7-VL-S32V.
Пример 14 - Связывающая активность гуманизированных антител 282A12F3 (T62A)
[337] Аффинности связывания и специфичность гуманизированных антител сравнивали с таковыми для родительского антитела с помощью анализа FACS с использованием клеток CHO-CLDN18.1 и CHO-CLDN18.2, описанных выше. Как показано на Фиг. 18A - Фиг. 18B, гуманизированные клоны 282A12F3 (T62A), включая hz282-3, hz282-4, hz282-8, hz282-10, hz282-11, hz282-12, hz282-15, hz282-19 и hz282-10, показали аффинность связывания с CHO-CLDN18.2, сходную с таковой для 282A12F3 (T62A). Ни один из гуманизированных клонов не связывался с CHO-CLDN18.1. Эти данные показывают, что гуманизированные антитела 282A12F3 (T62A) сохранили специфичность связывания и аффинность к CLDN18.2.
[338] Аффинности связывания гуманизированных клонов 282A12T62A были дополнительно подтверждены на клеточной линии рака желудка SNU620. Как показано на Фиг. 19A - Фиг. 19B, большинство гуманизированных клонов 282A12T62A показали высокую аффинность связывания с раковыми клетками SNU620. Антитела, содержащие тяжелые цепи 282A2-VHg0, например, hz282-1, hz282-5, hz282-9, hz282-13 и hz282-17, не связывались с SNU620, что указывает на то, что по меньшей мере 2 остатка, K и V, в FR3 области Vh 282A12 (T62A) участвуют в связывании со SNU620 (Таблица 6).
[339] Данные по аффинности и специфичности связывания обобщены в Таблице 16. Большинство гуманизированных антител 282A12 (T62A) сохранили специфичность и аффинность родительских антител.
[340] Таблица 16. Сводная информация об активности связывания гуманизированных антител 282A12 (T62A) на линии раковых клеток CHO-CLDN18.2 и SNU620.
«-» - не проверено или не применимо
[341] Пример 15 - Связывающая активность гуманизированных антител 413H9F8-VL-S32V и 364D1A7-VL-S32V
[342] Аффинности связывания и специфичность гуманизированных антител 413H9F8-VL-S32V и 364D1A7-VL-S32V сравнивали с таковыми для родительских антител с помощью анализа FACS с использованием клеток CHO-CLDN18.1 и CHO-CLDN18.2. Как показано на Фиг. 20A - Фиг. 20D, Фиг. 21A - Фиг. 21D, в Таблице 17 и Таблице 18, все протестированные гуманизированные антитела 413H9F8-VL-S32V показали аффинность связывания на клетках CHO-CLDN18.2, сравнимую с таковой у 413H9F8-VL-S32V. Как показано на Фиг. 22А - Фиг. 22Е и в Таблице 19, все протестированные гуманизированные антитела 364D1A7-VL-S32V показали аффинность связывания на клетках CHO-CLDN18.2, сравнимую с таковой у 364D1A7-VL-S32V. Аффинности связывания гуманизированных антител 413H9F8-VL-S32V и 364D1A7-VL-S32V были дополнительно подтверждены на линии раковых клеток желудка SNU620. Как показано на Фиг. 23А - Фиг. 23C, все протестированные гуманизированные антитела 413H9F8-VL-S32V и 364D1A7-VL-S32V показали аффинности связывания на клетках рака желудка SNU620, сравнимые с таковыми у их родительских антител. Эти данные показывают, что гуманизированные антитела 413H9F8-VL-S32V и 364D1A7-VL-S32V сохранили специфичность связывания и аффинность связывания.
[343] Таблица 17. EC50 связывания гуманизированных антител 413H9F8-VL-S32V (стратегия 1) на клетках CHO-CLDN18.2.
[344] Таблица 18. EC50 связывания гуманизированных антител 413H9F8-VL-S32V (по стратегии 2) на клетках CHO-CLDN18.2.
[345] Таблица 19. EC50 связывания гуманизированных антител 364D1A7 на клетках CHO-CLDN18.2.
Пример 16 - Функция АЗКЦ иллюстративных гуманизированных антител
[346] CLDN18.2-специфическая активность АЗКЦ гуманизированных антител была подтверждена на клеточных линиях CHO-CLDN18.1 и CHO-CLDN18.2 так, как описано выше. Как показано на Фиг. 14A - Фиг. 14B, гуманизированные антитела 413H9F8-H1L1 и 364D1A7-H1L1 индуцировали АЗКЦ-опосредованный лизис клеток CHO-CLDN18.2, но не клеток CHO-CLDN18.1. Это указывает на то, что гуманизированные антитела сохранили целевую специфичность своих родительских антител.
[347] Была проанализирована эффективность АЗКЦ вариантов гуманизированных антител и родительских антител. Кратко, эффекторные клетки FcR-TANK (CD16A-15V) смешивали с клетками-мишенями NCI-N87-CLDN18.2, мечеными с помощью КФСЭ, при соотношении эффектор : клетки-мишени, составляющем 8 : 1. Смешанные клетки культивировали с гуманизированными антителами в течение 4 часов. Эффективность АЗКЦ анализировали и рассчитывали так, как описано выше. Как показано на Фиг. 24А - Фиг. 24С и в Таблице 20, почти все из протестированных гуманизированных антител 413H9F8-VL-S32V и 364D1A7-VL-S32V показали сходную активность АЗКЦ по сравнению с их соответствующими родительскими антителами. Активность АЗКЦ гуманизированных антител дополнительно тестировали с помощью МКПК против клеток рака желудка NUGC4-CLDN18.2 так, как описано выше. Как показано на Фиг. 25А - Фиг. 25С и в Таблице 21, почти все из протестированных гуманизированных антител 413H9F8-VL-S32V и 364D1A7-VL-S32V показали сходную активность АЗКЦ по сравнению с их соответствующими родительскими антителами.
[348] Таблица 20. EC50 и максимальная активность АЗКЦ гуманизированных антител 413H9F8 и 364D1A7 с клетками FcR-TANK (CD16A-15V) против клеток рака желудка NCI-N87-CLDN18.2.
[349] Таблица 21. EC50 и максимальная активность АЗКЦ гуманизированных антител 413H9F8 и 364D1A7 с МКПК против клеток рака желудка NUGC4-CHO18.2.
при 6,67 нМ
* Данные от 1 донора. Остальные данные указаны как среднее для 3 доноров.
Пример 17 - активность АЗКЦ вариантов по Fc гуманизированных антител против CLDN18.2.
[350] Существует 4 основных аллотипа IgG1 человека, включая G1m1 (D356/L358), G1m-1 (E356/M358), G1m3 (R214) и G1m17 (K214), которые различаются по своей тяжелой цепи. Данные аллотипы наследуются кодоминантным менделевским способом, и различные наборы комбинаций обнаруживаются в популяциях африканцев, белых и монголоидов (PMID: 25368619, 26685205). Антитела против CLDN18.2, которые были включены в данные исследования, имеют варианты по Fc с D356/L358 или E356/M358. Например, референсное антитело Xi175D10 имеет вариант по Fc с D356/L358. Примечательно, что антитела с вариантами по Fc D356/L358 и E356/M358 обладают сходной активностью АЗКЦ (данные не показаны). Суффикс «DL» в наименовании был добавлен для обозначения антител с D356/L358 в их Fc, в то время как для антител варианта E356/M358 не было добавлено никакого конкретного именного суффикса. Были разработаны различные подходы к конструированию Fc, включая мутации S239D/I332E и F243L/R292P/Y300L/V305I/P396L, для усиления эффекторных функций антител (PMID: 29070978).
[351] Антитела против CLDN18.2 с вариантами по Fc S239D/I332E или F243L/R292P/Y300L/V305I/P396L были созданы для улучшения их эффекторных функций. Суффикс «V2» в наименовании был добавлен для антител с вариантом по Fc S239D/I332E, а суффикс «MG» в наименовании был добавлен для антител с вариантом по Fc F243L/R292P/Y300L/V305I/P396L.
[352] Эффекты АЗКЦ антител против CLDN18.2 с различными вариантами по Fc оценивали на клеточных линиях CHO-CLDN18.2 так, как описано выше. Кратко, эффекторные клетки FcR-TANK (CD16A-15V) смешивали с клетками-мишенями CHO-CLDN18.2, меченными с помощью КФСЭ, в соотношении эффектор : клетка-мишень, равном 4:1. Смешанные клетки культивировали с антителами в течение 4 часов. Эффект АЗКЦ анализировали и рассчитывали так, как описано выше. Как показано на Фиг. 31 и в Таблице 22, как 413H9F8-cp2-V2-DL, так и 413H9F8-cp2-MG-DL показали повышенную активность АЗКЦ по сравнению с их родительскими антителами 413H9F8-cp2.
[353] Таблица 22. Активность АЗКЦ вариантов 413H9F8-cp2 с клетками FcR-TANK (CD16A-15V) против клеток CHO-CLDN18.2.
н/п=не применимо
[354] Активность АЗКЦ гуманизированных антител дополнительно тестировали с помощью МКПК против клеток рака желудка NUGC4-CLDN18.2 так, как описано выше. Гуманизированные антитела 413H9F8-cp2 и 413H9F8-H2L2 с различными вариантами по Fc анализировали на предмет их способности индуцировать АЗКЦ с МКПК человека против клеток NUGC4-CLDN18.2 при соотношении эффектор : клетка-мишень, равном 40:1; клетки культивировали в течение 5 часов. Данные получены для МКПК, полученных от одного здорового донора. Каждая точка данных представляет собой среднее значение дубликатов. Как показано на Фиг. 32 и в Таблице 23, как варианты «V2», так и варианты «MG» антител 413H9F8-H2L2 и 413H9F8-cp2 показали повышенную активность АЗКЦ по сравнению с их соответствующими родительскими антителами.
[355] Таблица 23. Активность АЗКЦ вариантов 413H9F8-cp2 и 413H9F8-H2L2 с МКПК человека против клеточной линии рака желудка NUGC4-CLDN18.2.
н/п=не применимо
Пример 18 - Активность КЗЦ выбранных гуманизированных антител
[356] Активность КЗЦ вариантов гуманизированных антител анализировали для сравнения их функции КЗЦ с родительскими антителами так, как описано выше. Как показано на Фиг. 26А - Фиг. 26B и в Таблице 24, почти все из протестированных гуманизированных клонов 413H9F8-VL-S32V и 364D1A7-VL-S32V показали сходную активность КЗЦ по сравнению с их соответствующими родительскими антителами.
[357] Таблица 24. EC50 выбранных гуманизированных клонов 413H9F8 и 364D1A7 в КЗЦ, индуцированной сывороткой крови человека, против клеток CHO-CHO18.2.
Пример 19 - Интернализация антител против CLDN18.2 опухолевыми клетками.
[358] Интернализацию антитела опухолевыми клетками определяли косвенно путем определения удерживания антитела на клеточной поверхности после инкубации при температуре 37°С для индукции интернализации антитела. Кратко, клетки NUGC4-CLDN18.2 и NCI-N87-CLDN18.2 собирали и промывали промывочным буфером (ФСБ с 1% ЭТС), и доводили до 1×105 клеток/50 мкл. Антитела разбавляли до 20 мкг/мл, по 50 мкл разбавленных антител смешивали с клетками в объемном соотношении, равном 1:1, с последующей инкубацией на ледяной бане в течение 30 мин. Клетки дважды промывали предварительно охлажденным промывочным буфером и ресуспендировали в 800 мкл предварительно охлажденного промывочного буфера. По 100 мкл клеточной суспензии добавляли в 96-луночный планшет в разные моменты времени и инкубировали при температуре 37°С. Добавляли по 200 мкл предварительно охлажденного промывочного буфера, чтобы обеспечить температурные условия, останавливающие эндоцитоз, для всех образцов. Образцы, инкубированные на ледяной бане, были приняты в качестве контроля без интернализации или с минимальной интернализацией. После однократной промывки добавляли по 100 мкл/лунку 2-го антитела (антитело козы против IgG Fc γ человека, меченое AF647, от Jackson, #109-606-170, разведение 1:800) и инкубировали на ледяной бане в течение 30 минут. Клетки дважды промывали предварительно охлажденным промывочным буфером и ресуспендировали в 200 мкл предварительно охлажденного промывочного буфера, а затем анализировали с помощью метода проточной цитометрии (на цитометре BD FACS Celesta).
[359] % интернализации антител = [СИФ (инкубация на ледяной бане) - СИФ (инкубация при 37°С в течение разного времени)] / СИФ (инкубация на ледяной бане) x 100%.
[360] Как показано на Фиг. 33 A, Xi175D10-V2 и 282A12F3 (включая варианты Xi282A12F3(T62A)-V2-DL, hz282-11-V2 и hz282-15-V2) были быстро интернализованы клетками NUGC4-CLDN18.2, и больше чем 80% антител были интернализованы после инкубации при температуре 37°С в течение 2 часов. Около 50% антител Xi350G12E1-V2-DL и Xi325E8C80V2-DL были интернализованы клетками NUGC4-CLDN18.2 после инкубации при температуре 37°С в течение 2 часов. Было заметно, что менее 15% антител 413H9F8-VL-S32V-V2-DL и Xi408B9D4-V2-DL, Xi417H3B1-V2-DL, Xi328G2C4-V2-DL и Xi325F12H3-V2-DL были интернализованы клетками NUGC4-CLDN18.2 после инкубации при температуре 37°С в течение 2 часов. Клетки NCI-N87-CLDN18.2 также использовали для анализа интернализации (Фиг. 33 B). В частности, больше чем 50% антител Xi175D10-V2, 282A12F3 (включая варианты Xi282A12F3(T62A)-V2-DL, hz282-11-V2 и hz282-15-V2), xi350G12E1-V2-DL и Xi325E8C80V2-DL были интернализованы клетками NCI-N87-CLDN18.2 после инкубации при температуре 37°С в течение 2 часов. Меньше чем 30% антител 413H9F8-VL-S32V-V2-DL, Xi408B9D4-V2-DL, Xi417H3B1-V2-DL, Xi328G2C4-V2-DL и Xi325F12H3-V2-DL были интернализованы клетками NCI-N87-CLDN18.2 после инкубации при температуре 37°С в течение 2 часов.
[361] В совокупности, взаимодействие 282A12F3 с CLDN18.2, сверхэкспрессируемым на клеточных линиях рака желудка, приводит к высокому уровню интернализации данного антитела, тогда как антитела 413H9F8-VL-S32V-V2-DL, Xi408B9D4-V2-DL, Xi417H3B1-V2-DL, Xi328G2C4-V2-DL и Xi325F12H3-V2-DL вызывают интернализацию антител лишь от минимальной до легкой, антитела Xi175D10-V2, Xi325E8C80V2-DL и xi350G12E1-V2-DL индуцируют от среднего до высокого уровня интернализации.
Пример 20 - Конъюгация антитело - лекарственное средство
[362] Голые антитела 175D10 (xi175D10), 282A12F3 (T62A) и антитела изотипического контроля IgG1 человека были конъюгированы с мк-вц-PAB-MMAE, производным монометилауристатина E (MMAE), содержащим расщепляемый линкер валин-цитруллин (вц, англ. «vc») (Фиг. 27). Кратко, антитела размораживали в холодильнике при температуре 4°C в течение более 4 часов и подвергали диализу против буфера для конъюгации (25 мМ Na2B4O7, 25 мМ NaCl, 1 мМ диэтилентриаминпентауксусной кислоты (ДТПК, англ. «DTPA»), pH 7,4) при температуре 4°C в течение ночи. Антитела восстанавливали добавлением свежеприготовленного рабочего раствора трис(2-карбоксиэтил)фосфина (ТКЭФ, англ. «TCEP»; 5 мМ ТКЭФ в буфере для конъюгации цистеин-малеимид, ТКЭФ-HCl), инкубируя на водяной бане при температуре 25°C в течение 2 часов. Антитело конъюгировали со свежеприготовленным рабочим раствором мк-вц-PAB-MMAE (XDCExplorer) в ДМСО (10 мМ) в соотношении 6 в присутствии 10% об./об. органического растворителя (ДМСО), инкубируя смесь на водяной бане при температуре 25°C в течение 2 часов. Конъюгацию антитело - лекарственное средство подвергали диализу против буфера для диализа с L-гистидином (20 мМ L-гистидина, pH 5,5) при температуре 4°C в течение ночи с одной заменой буфера для диализа через 4 часа. Конечный продукт экстрагировали и фильтровали через фильтр калибра 0,2 мкм, и качество анализировали с помощью метода высокоэффективной жидкостной хроматографии с гидрофобными взаимодействиями (ВЭЖХ-ГВ, англ. «HIC-HPLC»). Результат ВЭЖХ-ГВ показал, что значение соотношения лекарственное средство/антитело (СЛСАТ, англ. «DAR») для всех конъюгатов варьировало от 3,5 до 4,0 (Таблица 25). С увеличением молярного соотношения ТКЭФ значение СЛСАТ для КАТЛС также увеличивалось.
[363] Таблица 25. Значение СЛСАТ для КАТЛС.
(%)
(%)
(%)
(%)
(%)
Пример 21 - Активность КЗЦ по уничтожению клеток с клеточной линией HEK293-CLDN18.2
[364] Цитотоксичность xi-175D10-вцMMAE, 282A12F3 (T62A)-вцMMAE и чIgG1-вцMMAE (с 3-мя различными СЛСАТ), а также соответствующих «голых» антител тестировали на клеточной линии HEK29 с избыточной экспрессией CLDN18.2 (HK293-CLDN18.2). Кратко, клетки HK293-CLDN18.2 высевали в 96-луночный планшет и выращивали в течение ночи при температуре 37°C в 5% CO2. Голые антитела и КАТЛС готовили в 4-кратной концентрации (60 мкг/мл, 400 нМ) и серийно разводили в 5 раз в среде для роста клеток. По 100 мкл первичного разведения смешивали со 100 мкл среды для получения двукратной концентрации. По 50 мкл каждого разведения комплекса добавляли к клеткам в трех повторностях. Клетки инкубировали в течение 5 дней при температуре 37°C в 5% CO2. Цитотоксичность определяли с помощью набора для люминесцентного анализа жизнеспособности клеток CellTiter Glo Luminescent Cell Viability Assay kit (Promega). Для определения жизнеспособности клеток добавляли по 100 мкл/лунку реагента CellTiter Glo. Инкубировали при комнатной температуре на шейкере в течение 10 минут, регистрировали люминесценцию на аппарате Envision.
[365] Как показано на Фиг. 28A - Фиг. 28B, на жизнеспособность клеток не влияла обработка голыми антителами, тогда как жизнеспособность клеток снижалась в зависимости от концентрации при обработке с помощью КАТЛС 282A12F3 (T62A)-вцMMAE и xi175D10-вцMMAE. Более того, 282A12F3 (T62A)-вцMMAE был более эффективным в индукции гибели клеток по сравнению с xi175D10-вцMMAE. КАТЛС 282A12F3 (T62A)-вцMMAE и xi175D10-вцMMAE не влияли на жизнеспособность клеток HEK293, которые являются отрицательными относительно CLDN18.2. Это указывает на то, что КАТЛС 282A12F3 (T62A)-вцMMAE и xi175D10-вцMMAE специфически подавляют жизнеспособность CLDN18.2-положительных клеток.
Пример 22 - Активность КАТЛС по уничтожению клеток с клеточной линией NCI-N87-CLDN18.2
[366] Две клеточные линии рака желудка с избыточной экспрессией CLDN18.2 - клетки NCI-N87-CLDN18.2 и NUGC4-CLDN18.2 - использовали для тестирования активности КАТЛС в отношении уничтожения клеток так, как описано выше. Как показано на Фиг. 29А - Фиг. 29B, жизнеспособность клеток снижалась в зависимости от концентрации при обработке с помощью КАТЛС 282A12F3 (T62A)- вцMMAE и xi175D10-вцMMAE. Более того, КАТЛС 282A12 (T62A)-вцMMAE индуцировал более высокую степень уничтожения клеток, чем xi175D10-вцMMAE. Клетки линии NUGC4-CLDN18.2 были менее чувствительны к гибели клеток, индуцированной с помощью КАТЛС, по сравнению с клетками NCI-N87-CLDN18.2.
Пример 23 - Активность КАТЛС по уничтожению клеток, продемонстрированная на клетках, которые менее чувствительны к АЗКЦ
[367] В анализе КАТЛС-зависимого уничтожения клеток использовали линию клеток рака поджелудочной железы PANC-1-CLDN18.2, которая была стабильно трансфицирована CLDN18.2 и, как было показано, менее чувствительна к АЗКЦ, опосредованной химерным антителом 282A12F3 (T62A) (Фиг. 30A). Как показано на Фиг. 30B, как 282A12F3 (T62A)-вцMMAE, так и xi175D10-вцMMAE ингибировали жизнеспособность клеток PANC-1-CLDN18.2 в зависимости от концентрации, а 282A12F3 (T62A)-вцMMAE был более активным, чем xi175D10-вцMMAE, в индукции гибели клеток PANC-1-CLDN18.2.
[368] Таким образом, КАТЛС против CLDN18.2 убивали клеточные линии, которые сверхэкспрессировали CLDN18.2, включая HEK293-CLDN18.2, NCI-N87-CLDN18.2 и NUGC4-CLDN18.2. 282A12F3 (T62A)-вцMMAE был более эффективным, чем xi175D10-вцMMAE, в ингибировании жизнеспособности тестируемых клеточных линий. Более того, не наблюдалось, чтобы соотношение лекарственное средство - антитело в диапазоне от 3,5 до 4,0 модулировало активность КАТЛС по уничтожению клеток (Таблица 26).
[369] Таблица 26. Активность КАТЛС по уничтожению CLDN18.2-специфичных клеток
(нМ)
(нМ)
(нМ)
(нМ)
(нМ)
Пример 24 - Эффективность антител против CLDN18.2 в модели ксенотрансплантата, полученного от пациента (КПП) с раком желудка человека GA0006, у «голых» мышей.
[370] Эффективность антител против CLDN18.2 in vivo тестировали на модели ксенотрансплантата, полученного от пациента, у «голых» мышей. GA0006 был получен из желудка пациента из Азии с раком желудка, которому был поставлен патологоанатомический диагноз аденокарциномы с множественными копиями ERBB2. Высокая экспрессия CLDN18.2 на клетках GA0006 была подтверждена иммуногистохимическими (ИГХ) анализами и методом цитометрии (FACS) с антителами против CLDN18.2 (данные не показаны). Голым мышам BALB/c подкожно инокулировали опухоли размером около 3 мм × 3 мм × 3 мм в правую лодыжку. Мышей случайным образом разделили на 8 групп (по 8 мышей в группе): ФСБ, изотип чIgG1 (100 мг/кг), xi175D10-V2, 413H9F8-H2L2-V2-DL и 413H9F8-cp2-V2-DL (50 мг/кг и 100 мг/кг), когда средний размер опухоли достиг около 100 мм3. Коэффициент вариации (КВ, англ. «CV») объема опухоли составлял меньше чем 40%, и его рассчитывали по следующей формуле: КВ=СО/МОО × 100%, где СО (англ. «SD») - стандартная ошибка, МОО (англ. «MTV») - медиана объема опухоли. День рандомизации регистрировали как день 0. Воздействие на мышей начинали в день 0. Антитела вводили 3 раза в неделю в течение 3 недель с чередованием внутривенной и внутрибрюшинной инъекций. Размеры опухолей контролировали два раза в неделю.
[371] Как показано на Фиг. 34, воздействие с помощью 50 мг/кг антитела xi175D10-V2 или антитела 413H9F8-H2L2-V2-DL замедляла рост опухоли по сравнению с группой изотипического контроля (100 мг/кг), хоть различия и не были статистически значимыми (p > 0,05). Воздействие с помощью 100 мг/кг антитела xi175D10-V2 и антитела 413H9F8-H2L2-V2-DL значительно ингибировала рост опухоли по сравнению с воздействием изотипическим контролем (100 мг/кг) (p < 0,05 и p < 0,01). Воздействие с помощью как 50 мг/кг, так и 100 мг/кг антитела 413H9F8-cp2-V2-DL значительно ингибировала рост опухоли по сравнению с воздействием изотипическим контролем (100 мг/кг) (p < 0,0001). Воздействие с помощью 50 мг/кг антитела 413H9F8-cp2-V2-DL значительно ингибировала рост опухоли по сравнению с воздействием антителами xi175D10-V2 (50 мг/кг) и 413H9F8-H2L2-V2-DL (50 мг/кг) (p < 0,0001 и p < 0,01). Воздействие с помощью 100 мг/кг антитела 413H9F8-cp2-V2-DL значительно ингибировала рост опухоли по сравнению с воздействием антителами xi175D10-V2 (100 мг/кг) и 413H9F8-H2L2-V2-DL (100 мг/кг) (p < 0,001 и p < 0,0001).
Пример 25 - Эффективность антител против CLDN18.2 в моделях ксенотрансплантатов мышей с раком поджелудочной железы у мышей Nu/Nu.
[372] Эффективность антител против CLDN18.2 in vivo тестировали на подкожных моделях ксенотрансплантатов рака поджелудочной железы у мышей Nu/Nu. Клеточная линия рака поджелудочной железы MIA Paca-2, сверхэкспрессирующая CLDN18.2 (MIA Paca-2-CLDN18.2), содержалась in vitro в виде монослойной культуры в среде DMEM с добавлением 10% эмбриональной телячьей сыворотки, 2,5% лошадиной сыворотки, 1% пенициллина/стрептомицина и 5 мкг/мл бластицидина при температуре 37°C в атмосфере воздуха с 5% CO2. Клетки MIA Paca-2-CLDN18.2 рутинно субкультивировали дважды в неделю обработкой трипсином-ЭДТА. Клетки MIA Paca-2-CLDN18.2, растущие в фазе экспоненциального роста, собирали и подсчитывали для инокуляции опухоли. Голым мышам Nu/Nu - самкам в возрасте 4-6 недель - подкожно инокулировали по 5 × 106 клеток MIA Paca-2-CLDN18.2 в 0,2 мл ФСБ (с добавлением матригеля, ФСБ : матригель=1 : 1) для развития опухоли. Воздействие на мышей Nu/Nu, несущих опухоль Paca-2-CLDN18.2 (10 мышей в группе), начинали через 3 суток после инокуляции опухоли. Антитела против CLDN18.2 (10 мг/кг и 40 мг/кг) вводили по 2 раза в неделю в течение 5 недель с чередованием внутривенной и внутрибрюшинной инъекций. Мышей Nu/Nu, несущих опухоль, получавших ФСБ или изотипический контроль (чIgG1, 40 мг/кг), использовали в качестве отрицательного контроля.
[373] У мышей, получавших антитела Xi175D10-V2, 413H9F8-H2L2-V2-DL в дозах по 10 мг/кг и 40 мг/кг, проявилась значительная задержка роста опухоли по сравнению с мышами, получавшими ФСБ или изотипический контроль (40 мг/кг) (p < 0,01) (Фиг. 35 A-D). Мыши, получавшие антитело 413H9F8-cp2-V2-DL в дозе 40 мг/кг, значительно ингибировали рост опухоли по сравнению с мышами, получавшими ФСБ или изотипический контроль (40 мг/кг) (р < 0,01) (Фиг. 35А и Е). Мыши, получавшие антитело 413H9F8-cp2-V2-DL в дозе 10 мг/кг, ингибировали рост опухоли, но без значительного отличия по сравнению с мышами, получавшими ФСБ или изотипический контроль (40 мг/кг) (Фиг. 35А и Е).
Пример 26 - Комбинаторные эффективности антител против CLD1N8.2 и химиотерапии в модели ксенотрансплантата, полученного от пациента (КПП) с раком желудка человека GA0006
[374] КПП-модель мышей была создана так, как описано выше. Воздействие на мышей начинали в день 0. На мышей с опухолями воздействовали ФСБ, ЭОФ (1,25 мг/кг эпирубицина, 3,25 мг/кг оксалиплатина и 56,25 мг/кг 5-фторурацила), антителом xi175D10-V2 (40 мг/кг) в комбинации с ЭОФ или антителом 413H9F8-H2L2-V2-DL (40 мг/кг) в комбинации с ЭОФ. ЭОФ вводили внутрибрюшинно один раз в неделю. Антитела вводили по 3 раза в неделю с чередованием внутривенной и внутрибрюшинной инъекций. Размер опухоли контролировали два раза в неделю. Всего было проведено 5-кратное введение ЭОФ и 14-кратное воздействие антителами.
[375] Как показано на Фиг. 36, воздействие одним лишь ЭОФ или ЭОФ в комбинации с антителом xi175D10-V2 или 413H9F8-H2L2-V2-DL значительно ингибировало рост опухоли по сравнению с воздействием ФСБ (p < 0,01). Антитело 413H9F8-H2L2-V2-DL в комбинации с ЭОФ продемонстрировало улучшенный эффект по сравнению с воздействием одним лишь ЭОФ (p < 0,01). Тем не менее, антитело xi175D10-V2 в комбинации с ЭОФ не продемонстрировало улучшенный эффект по сравнению с воздействием одним лишь ЭОФ (p=0,147). Более того, комбинация антитела 413H9F8-H2L2-V2-DL с ЭОФ превосходила комбинацию антитела xi175D10-V2 с ЭОФ (p < 0,05).
Пример 27
[376] Таблица 27 иллюстрирует последовательности тяжелой цепи и легкой цепи референсного антитела 175D10 (xi175D10).
[377] Несмотря на то, что в данном документе были продемонстрированы и описаны предпочтительные варианты реализации данного изобретения, специалистам в данной области техники очевидно, что такие варианты реализации предложены исключительно в качестве примера. Многочисленные вариации, изменения и замены могут быть внесены специалистами в данной области техники без отклонения от описания данного изобретения. Следует понимать, что при реализации данного изобретения на практике можно применять различные альтернативы вариантов реализации данного изобретения, описанных в данном документе. Предполагается, что следующая формула изобретения определяет объем данного изобретения, и что ею охватываются способы и структуры в пределах объема данной формулы изобретения и их эквиваленты.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ЗЛИП ХОЛДИНГ ЛИМИТЕД
<120> АНТИТЕЛА ПРОТИВ КЛАУДИНА И ИХ ПРИМЕНЕНИЕ
<130> 112047-0028-8006.RU00
<140> Не присвоен
<141> Не присвоен
<150> PCT/CN2019/123588
<151> 2019-12-06
<150> PCT/CN2018/119797
<151> 2018-12-07
<160> 101
<170> PatentIn version 3.5
<210> 1
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 1
Gly Phe Ser Leu Thr Ser Tyr Asn Val Tyr
1. 5 10
<210> 2
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 2
Val Ile Trp Asn Thr Gly Ala Thr Arg Tyr Asn Ser Thr Leu Lys Ser
1. 5 10 15
<210> 3
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 3
Asp Ser Ala Met Pro Ala Ile Pro Phe Ala Tyr
1. 5 10
<210> 4
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 4
Val Ile Trp Asn Thr Gly Ala Thr Arg Tyr Gln Ser Thr Leu Lys Ser
1. 5 10 15
<210> 5
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 5
Val Ile Trp Asn Thr Gly Ala Thr Arg Tyr Glu Ser Thr Leu Lys Ser
1. 5 10 15
<210> 6
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 6
Val Ile Trp Asn Thr Gly Ala Thr Arg Tyr Asn Ser Ala Leu Lys Ser
1. 5 10 15
<210> 7
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 7
Gly Phe Thr Phe Ser Ser Phe Gly Met His
1. 5 10
<210> 8
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 8
Tyr Ile Ser Ser Gly Ser Ser Pro Ile Tyr Tyr Val Asp Lys Leu Lys
1. 5 10 15
Gly
<210> 9
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 9
Ala Gly Tyr Ala Val Arg Asn Ala Leu Asp Tyr
1. 5 10
<210> 10
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 10
Ser Phe Gly Met His
1. 5
<210> 11
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 11
Tyr Ile Ser Ser Gly Ser Gly Ser Ile Tyr Tyr Ala Asp Thr Val Lys
1. 5 10 15
Gly
<210> 12
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 12
Ala Thr Ser Tyr Tyr Tyr Gly Asn Ala Leu Glu Tyr
1. 5 10
<210> 13
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 13
Gly Phe Ser Leu Thr Ser Tyr Gly Val His
1. 5 10
<210> 14
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 14
Val Ile Trp Pro Gly Gly Asn Thr Asn Tyr Asn Ser Ala Leu Met Ser
1. 5 10 15
<210> 15
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 15
Asp Arg Arg Leu Ala Met Asp Tyr
1. 5
<210> 16
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 16
Val Ile Trp Pro Gly Gly Asn Thr Asn Tyr Glu Ser Ala Leu Met Ser
1. 5 10 15
<210> 17
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 17
Val Ile Trp Pro Gly Gly Asn Thr Asn Tyr Asn Ile Ala Leu Met Ser
1. 5 10 15
<210> 18
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 18
Lys Ser Ser Gln Ser Leu Phe Gly Ser Val Arg Gln Lys Asn Tyr Leu
1. 5 10 15
Ala
<210> 19
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 19
Leu Ala Ser Thr Arg Glu Ser
1. 5
<210> 20
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 20
Gln Gln Tyr Tyr Asp Ile Pro Trp Thr
1. 5
<210> 21
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 21
Lys Ser Ser Gln Ser Leu Leu Asn Ser Gly Asn Gln Lys Asn Tyr Leu
1. 5 10 15
Ala
<210> 22
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 22
Gly Ala Ser Thr Arg Glu Ser
1. 5
<210> 23
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 23
Gln Asn Asp Leu Phe Tyr Pro Leu Thr
1. 5
<210> 24
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 24
Lys Ser Ser Gln Ser Leu Leu Asp Ser Gly Asn Gln Lys Asn Tyr Leu
1. 5 10 15
Ala
<210> 25
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 25
Lys Ser Ser Gln Ser Leu Leu Glu Ser Gly Asn Gln Lys Asn Tyr Leu
1. 5 10 15
Ala
<210> 26
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 26
Lys Ser Ser Gln Ser Leu Leu Asn Leu Gly Asn Gln Lys Asn Tyr Leu
1. 5 10 15
Ala
<210> 27
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 27
Lys Ser Ser Gln Ser Leu Leu Asn Val Gly Asn Gln Lys Asn Tyr Leu
1. 5 10 15
Ala
<210> 28
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 28
Lys Ser Ser Gln Ser Leu Phe Asn Ser Gly Asn Gln Lys Asn Tyr Leu
1. 5 10 15
Thr
<210> 29
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 29
Trp Ala Ser Thr Arg Lys Ser
1. 5
<210> 30
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 30
Gln Asn Val Tyr Ser Tyr Pro Leu Thr
1. 5
<210> 31
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 31
Lys Ser Ser Gln Ser Leu Phe Asp Ser Gly Asn Gln Lys Asn Tyr Leu
1. 5 10 15
Thr
<210> 32
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 32
Lys Ser Ser Gln Ser Leu Phe Glu Ser Gly Asn Gln Lys Asn Tyr Leu
1. 5 10 15
Thr
<210> 33
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 33
Lys Ser Ser Gln Ser Leu Phe Asn Leu Gly Asn Gln Lys Asn Tyr Leu
1. 5 10 15
Thr
<210> 34
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 34
Lys Ser Ser Gln Ser Leu Phe Asn Val Gly Asn Gln Lys Asn Tyr Leu
1. 5 10 15
Thr
<210> 35
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 35
Lys Ser Ser Gln Ser Leu Leu Asn Ser Gly Asn Gln Lys Asn Tyr Leu
1. 5 10 15
Thr
<210> 36
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 36
Trp Ala Ser Thr Arg Glu Ser
1. 5
<210> 37
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 37
Gln Asn Asp Tyr Ser Tyr Pro Phe Thr
1. 5
<210> 38
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 38
Lys Ser Ser Gln Ser Leu Leu Glu Ser Gly Asn Gln Lys Asn Tyr Leu
1. 5 10 15
Thr
<210> 39
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 39
Lys Ser Ser Gln Ser Leu Leu Asn Ile Gly Asn Gln Lys Asn Tyr Leu
1. 5 10 15
Thr
<210> 40
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 40
Gln Val Gln Leu Lys Glu Ser Gly Pro Val Leu Val Gln Pro Ser Gln
1. 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ala Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Asn Val Tyr Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Trp Asn Thr Gly Ala Thr Arg Tyr Asn Ser Thr Leu Lys
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Thr Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Glu Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Asp Ser Ala Met Pro Ala Ile Pro Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 41
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 41
Gln Val Gln Leu Lys Glu Ser Gly Pro Val Leu Val Gln Pro Ser Gln
1. 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ala Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Asn Val Tyr Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Trp Asn Thr Gly Ala Thr Arg Tyr Gln Ser Thr Leu Lys
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Thr Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Glu Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Asp Ser Ala Met Pro Ala Ile Pro Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 42
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 42
Gln Val Gln Leu Lys Glu Ser Gly Pro Val Leu Val Gln Pro Ser Gln
1. 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ala Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Asn Val Tyr Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Trp Asn Thr Gly Ala Thr Arg Tyr Glu Ser Thr Leu Lys
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Thr Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Glu Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Asp Ser Ala Met Pro Ala Ile Pro Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 43
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 43
Gln Val Gln Leu Lys Glu Ser Gly Pro Val Leu Val Gln Pro Ser Gln
1. 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ala Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Asn Val Tyr Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Trp Asn Thr Gly Ala Thr Arg Tyr Asn Ser Ala Leu Lys
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Thr Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Glu Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Asp Ser Ala Met Pro Ala Ile Pro Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 44
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 44
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Ala Val Ser Ala Gly
1. 5 10 15
Glu Thr Val Thr Ile Asn Cys Lys Ser Ser Gln Ser Leu Phe Gly Ser
20 25 30
Val Arg Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ser Pro Lys Leu Leu Ile Tyr Leu Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ile Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Lys Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Asp Ile Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Leu
100 105 110
Lys
<210> 45
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 45
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Ser Val Gln Pro Gly Gly
1. 5 10 15
Ser Arg Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Gly Ser Ser Pro Ile Tyr Tyr Val Asp Lys Leu
50 55 60
Lys Gly Arg Phe Thr Val Ser Arg Asp Asn Pro Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Thr Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Ala Gly Tyr Ala Val Arg Asn Ala Leu Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ser Ile Thr Val Ser Ser
115 120
<210> 46
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 46
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Ser Val Ser Val Gly
1. 5 10 15
Glu Lys Val Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Thr Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Gly Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ile Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Phe Cys Gln Asn
85 90 95
Asp Leu Phe Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu
100 105 110
Lys
<210> 47
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 47
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Ser Val Ser Val Gly
1. 5 10 15
Glu Lys Val Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Thr Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Gly Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ile Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Phe Cys Gln Asn
85 90 95
Asp Leu Phe Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu
100 105 110
Lys
<210> 48
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 48
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Ser Val Ser Val Gly
1. 5 10 15
Glu Lys Val Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Glu Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Thr Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Gly Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ile Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Phe Cys Gln Asn
85 90 95
Asp Leu Phe Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu
100 105 110
Lys
<210> 49
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 49
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Ser Val Ser Val Gly
1. 5 10 15
Glu Lys Val Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Leu
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Thr Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Gly Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ile Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Phe Cys Gln Asn
85 90 95
Asp Leu Phe Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu
100 105 110
Lys
<210> 50
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 50
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Ser Val Ser Val Gly
1. 5 10 15
Glu Lys Val Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Val
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Thr Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Gly Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ile Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Phe Cys Gln Asn
85 90 95
Asp Leu Phe Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu
100 105 110
Lys
<210> 51
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 51
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1. 5 10 15
Ser Arg Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Gly Ser Gly Ser Ile Tyr Tyr Ala Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Leu Ser Arg Asp Asn Pro Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Thr Ser Leu Arg Ser Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Thr Ser Tyr Tyr Tyr Gly Asn Ala Leu Glu Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser
115
<210> 52
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 52
Asp Val Val Leu Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Glu Gly
1. 5 10 15
Glu Lys Val Ser Met Ser Cys Lys Ser Ser Gln Ser Leu Phe Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Thr Pro Thr Leu Leu Ile Tyr Trp Ala Ser Thr Arg Lys Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Asn Thr Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Val Tyr Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Asp Leu
100 105 110
Lys
<210> 53
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 53
Asp Val Val Leu Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Glu Gly
1. 5 10 15
Glu Lys Val Ser Met Ser Cys Lys Ser Ser Gln Ser Leu Phe Asp Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Thr Pro Thr Leu Leu Ile Tyr Trp Ala Ser Thr Arg Lys Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Asn Thr Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Val Tyr Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Asp Leu
100 105 110
Lys
<210> 54
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 54
Asp Val Val Leu Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Glu Gly
1. 5 10 15
Glu Lys Val Ser Met Ser Cys Lys Ser Ser Gln Ser Leu Phe Glu Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Thr Pro Thr Leu Leu Ile Tyr Trp Ala Ser Thr Arg Lys Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Asn Thr Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Val Tyr Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Asp Leu
100 105 110
Lys
<210> 55
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 55
Asp Val Val Leu Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Glu Gly
1. 5 10 15
Glu Lys Val Ser Met Ser Cys Lys Ser Ser Gln Ser Leu Phe Asn Leu
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Thr Pro Thr Leu Leu Ile Tyr Trp Ala Ser Thr Arg Lys Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Asn Thr Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Val Tyr Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Asp Leu
100 105 110
Lys
<210> 56
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 56
Asp Val Val Leu Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Glu Gly
1. 5 10 15
Glu Lys Val Ser Met Ser Cys Lys Ser Ser Gln Ser Leu Phe Asn Val
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Thr Pro Thr Leu Leu Ile Tyr Trp Ala Ser Thr Arg Lys Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Asn Thr Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Val Tyr Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Asp Leu
100 105 110
Lys
<210> 57
<211> 116
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 57
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1. 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Gly Val His Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Pro Gly Gly Asn Thr Asn Tyr Asn Ser Ala Leu Met
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Arg Asp Arg Arg Leu Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val
100 105 110
Thr Val Ser Ser
115
<210> 58
<211> 116
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 58
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1. 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Gly Val His Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Pro Gly Gly Asn Thr Asn Tyr Glu Ser Ala Leu Met
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Arg Asp Arg Arg Leu Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val
100 105 110
Thr Val Ser Ser
115
<210> 59
<211> 116
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 59
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1. 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Gly Val His Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Pro Gly Gly Asn Thr Asn Tyr Asn Ile Ala Leu Met
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Arg Asp Arg Arg Leu Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val
100 105 110
Thr Val Ser Ser
115
<210> 60
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 60
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1. 5 10 15
Glu Lys Val Thr Met Thr Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ile Leu Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 61
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 61
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1. 5 10 15
Glu Lys Val Thr Met Thr Cys Lys Ser Ser Gln Ser Leu Leu Glu Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ile Leu Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 62
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 62
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1. 5 10 15
Glu Lys Val Thr Met Thr Cys Lys Ser Ser Gln Ser Leu Leu Asn Ile
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ile Leu Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 63
<211> 330
<212> Белок
<213> Homo sapiens
<400> 63
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1. 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 64
<211> 107
<212> Белок
<213> Homo sapiens
<400> 64
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1. 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 65
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 65
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1. 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Asn Val Tyr Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Trp Asn Thr Gly Ala Thr Arg Tyr Asn Ser Ala Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Asp Ser Ala Met Pro Ala Ile Pro Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 66
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 66
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1. 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Asn Val Tyr Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Trp Asn Thr Gly Ala Thr Arg Tyr Asn Ser Ala Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Asp Ser Ala Met Pro Ala Ile Pro Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 67
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 67
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1. 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Asn Val Tyr Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Trp Asn Thr Gly Ala Thr Arg Tyr Asn Ser Ala Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Lys Asp Thr Ser Lys Ser Gln Val Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Asp Ser Ala Met Pro Ala Ile Pro Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 68
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 68
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1. 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ala Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Asn Val Tyr Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Trp Asn Thr Gly Ala Thr Arg Tyr Asn Ser Ala Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Lys Asp Thr Ser Lys Ser Gln Val Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Asp Ser Ala Met Pro Ala Ile Pro Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 69
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 69
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1. 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Leu Phe Gly Ser
20 25 30
Val Arg Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Leu Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Asp Ile Pro Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 70
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 70
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1. 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Leu Phe Gly Ser
20 25 30
Val Arg Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ser Pro Lys Leu Leu Ile Tyr Leu Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Lys Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Asp Ile Pro Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 71
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 71
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ser Ser Gln Ser Leu Phe Gly Ser
20 25 30
Val Arg Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys
35 40 45
Ala Pro Lys Leu Leu Ile Tyr Leu Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Asp Ile Pro Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 72
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 72
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ser Ser Gln Ser Leu Phe Gly Ser
20 25 30
Val Arg Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys
35 40 45
Ser Pro Lys Leu Leu Ile Tyr Leu Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Lys Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Asp Ile Pro Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 73
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 73
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1. 5 10 15
Asp Arg Val Thr Ile Asn Cys Lys Ser Ser Gln Ser Leu Phe Gly Ser
20 25 30
Val Arg Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys
35 40 45
Ser Pro Lys Leu Leu Ile Tyr Leu Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Lys Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Asp Ile Pro Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 74
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 74
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Ser Gly Ser Ser Pro Ile Tyr Tyr Val Asp Lys Leu
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Gly Tyr Ala Val Arg Asn Ala Leu Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 75
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 75
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Gly Ser Ser Pro Ile Tyr Tyr Val Asp Lys Leu
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Gly Tyr Ala Val Arg Asn Ala Leu Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 76
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 76
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Gly Ser Ser Pro Ile Tyr Tyr Val Asp Lys Leu
50 55 60
Lys Gly Arg Phe Thr Val Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Gly Tyr Ala Val Arg Asn Ala Leu Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 77
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 77
Glu Ile Val Met Thr Gln Ser Pro Pro Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Val Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Val
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Arg Leu Leu Ile Tyr Gly Ala Ser Thr Arg Glu Ser Gly Ile
50 55 60
Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Leu Phe Tyr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 78
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 78
Asp Ile Val Met Thr Gln Ser Pro Pro Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Val Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Val
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Arg Leu Leu Ile Tyr Gly Ala Ser Thr Arg Glu Ser Gly Ile
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Leu Phe Tyr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 79
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 79
Asp Ile Val Met Thr Gln Ser Pro Pro Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Val Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Val
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Lys Leu Leu Ile Tyr Gly Ala Ser Thr Arg Glu Ser Gly Ile
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Leu Phe Tyr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 80
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 80
Asp Ile Val Met Thr Gln Ser Pro Pro Thr Leu Ser Leu Ser Pro Gly
1. 5 10 15
Glu Arg Val Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Val
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Lys Leu Leu Ile Tyr Gly Ala Ser Thr Arg Glu Ser Gly Ile
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Asn
85 90 95
Asp Leu Phe Tyr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 81
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 81
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Ser Gly Ser Ser Pro Ile Tyr Tyr Val Asp Lys Leu
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Gly Tyr Ala Val Arg Asn Ala Leu Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 82
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 82
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Gly Ser Ser Pro Ile Tyr Tyr Val Asp Lys Leu
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Gly Tyr Ala Val Arg Asn Ala Leu Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 83
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 83
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Gly Ser Ser Pro Ile Tyr Tyr Val Asp Lys Leu
50 55 60
Lys Gly Arg Phe Thr Val Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Gly Tyr Ala Val Arg Asn Ala Leu Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 84
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 84
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Gly Ser Ser Pro Ile Tyr Tyr Val Asp Lys Leu
50 55 60
Lys Gly Arg Phe Thr Val Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Thr Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Gly Tyr Ala Val Arg Asn Ala Leu Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 85
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 85
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1. 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Leu Leu Asn Val
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Gly Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Leu Phe Tyr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 86
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 86
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1. 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Leu Leu Asn Val
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Gly Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Phe Cys Gln Asn
85 90 95
Asp Leu Phe Tyr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 87
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 87
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1. 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Leu Leu Asn Val
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Gly Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ile Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Phe Cys Gln Asn
85 90 95
Asp Leu Phe Tyr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 88
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 88
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1. 5 10 15
Glu Arg Ala Thr Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Val
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Gly Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ile Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Phe Cys Gln Asn
85 90 95
Asp Leu Phe Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 89
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 89
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Ser Gly Ser Gly Ser Ile Tyr Tyr Ala Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Ser Tyr Tyr Tyr Gly Asn Ala Leu Glu Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 90
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 90
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Gly Ser Gly Ser Ile Tyr Tyr Ala Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Pro Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Ser Tyr Tyr Tyr Gly Asn Ala Leu Glu Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 91
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 91
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Gly Ser Gly Ser Ile Tyr Tyr Ala Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Leu Ser Arg Asp Asn Pro Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Ser Tyr Tyr Tyr Gly Asn Ala Leu Glu Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 92
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 92
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1. 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Gly Ser Gly Ser Ile Tyr Tyr Ala Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Leu Ser Arg Asp Asn Pro Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Ser Tyr Tyr Tyr Gly Asn Ala Leu Glu Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 93
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 93
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1. 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Leu Phe Asn Val
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Lys Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Val Tyr Ser Tyr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 94
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 94
Asp Ile Val Leu Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1. 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Leu Phe Asn Val
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Thr Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Lys Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Val Tyr Ser Tyr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 95
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 95
Asp Val Val Leu Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1. 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Leu Phe Asn Val
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Thr Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Lys Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Val Tyr Ser Tyr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 96
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 96
Asp Val Val Leu Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1. 5 10 15
Glu Arg Ala Thr Ile Ser Cys Lys Ser Ser Gln Ser Leu Phe Asn Val
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Thr Pro Thr Leu Leu Ile Tyr Trp Ala Ser Thr Arg Lys Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Val Tyr Ser Tyr Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 97
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 97
Asp Val Val Leu Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1. 5 10 15
Glu Arg Ala Thr Ile Ser Cys Lys Ser Ser Gln Ser Leu Phe Asn Val
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Thr Pro Thr Leu Leu Ile Tyr Trp Ala Ser Thr Arg Lys Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Val Tyr Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 98
<211> 467
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 98
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1. 5 10 15
Val His Ser Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg
20 25 30
Pro Gly Ala Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Ser Tyr Trp Ile Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu
50 55 60
Glu Trp Ile Gly Asn Ile Tyr Pro Ser Asp Ser Tyr Thr Asn Tyr Asn
65 70 75 80
Gln Lys Phe Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser
85 90 95
Thr Ala Tyr Met Gln Leu Ser Ser Pro Thr Ser Glu Asp Ser Ala Val
100 105 110
Tyr Tyr Cys Thr Arg Ser Trp Arg Gly Asn Ser Phe Asp Tyr Trp Gly
115 120 125
Gln Gly Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
130 135 140
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
145 150 155 160
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
165 170 175
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
180 185 190
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
195 200 205
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
210 215 220
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
225 230 235 240
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
245 250 255
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
260 265 270
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
275 280 285
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
290 295 300
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
305 310 315 320
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
325 330 335
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
340 345 350
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
355 360 365
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
370 375 380
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
385 390 395 400
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
405 410 415
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
420 425 430
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
435 440 445
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
450 455 460
Pro Gly Lys
465
<210> 99
<211> 240
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 99
Met Glu Ser Gln Thr Gln Val Leu Met Ser Leu Leu Phe Trp Val Ser
1. 5 10 15
Gly Thr Cys Gly Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr
20 25 30
Val Thr Ala Gly Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser
35 40 45
Leu Leu Asn Ser Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln
50 55 60
Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg
65 70 75 80
Glu Ser Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp
85 90 95
Phe Thr Leu Thr Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr
100 105 110
Tyr Cys Gln Asn Asp Tyr Ser Tyr Pro Phe Thr Phe Gly Ser Gly Thr
115 120 125
Lys Leu Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe
130 135 140
Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys
145 150 155 160
Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val
165 170 175
Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln
180 185 190
Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser
195 200 205
Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His
210 215 220
Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230 235 240
<210> 100
<211> 786
<212> ДНК
<213> Homo sapiens
<400> 100
atgtccacca ccacatgcca agtggtggcg ttcctcctgt ccatcctggg gctggccggc
60
tgcatcgcgg ccaccgggat ggacatgtgg agcacccagg acctgtacga caaccccgtc
120
acctccgtgt tccagtacga agggctctgg aggagctgcg tgaggcagag ttcaggcttc
180
accgaatgca ggccctattt caccatcctg ggacttccag ccatgctgca ggcagtgcga
240
gccctgatga tcgtaggcat cgtcctgggt gccattggcc tcctggtatc catctttgcc
300
ctgaaatgca tccgcattgg cagcatggag gactctgcca aagccaacat gacactgacc
360
tccgggatca tgttcattgt ctcaggtctt tgtgcaattg ctggagtgtc tgtgtttgcc
420
aacatgctgg tgactaactt ctggatgtcc acagctaaca tgtacaccgg catgggtggg
480
atggtgcaga ctgttcagac caggtacaca tttggtgcgg ctctgttcgt gggctgggtc
540
gctggaggcc tcacactaat tgggggtgtg atgatgtgca tcgcctgccg gggcctggca
600
ccagaagaaa ccaactacaa agccgtttct tatcatgcct caggccacag tgttgcctac
660
aagcctggag gcttcaaggc cagcactggc tttgggtcca acaccaaaaa caagaagata
720
tacgatggag gtgcccgcac agaggacgag gtacaatctt atccttccaa gcacgactat
780
gtgtaa
786
<210> 101
<211> 390
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 101
atggagacag acacactcct gctatgggta ctgctgctct gggttccagg ttccactggt
60
gacgcggccc agccggccag gcgcgcgcgc cgtacgaagc ttggtaccga gctcggatcc
120
actccagtgt ggtggaattc tgcagatggc cgcatggacc agtggagcac ccaagacttg
180
tacaacaacc ccgtaacagc tgttttcaac taccaggggc tgtggcgctc ctgtgtccga
240
gagagctctg gcttcaccga gtgccggggc tacttcaccc tgctggggct gccagccatg
300
ctgcaggcag tgcgagcggc catccagcac agtggcggcc gctcgaggag ggcccgaaca
360
aaaactcatc tcagaagagg atctgaatag
390
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛО ПРОТИВ КЛАУДИНА 18A2 И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2811431C2 |
| НОВЫЕ АНТИ-CLDN18.2 АНТИТЕЛА | 2020 |
|
RU2830887C2 |
| КОНЪЮГАТЫ ЛЕКАРСТВЕННЫХ СРЕДСТВ, СОДЕРЖАЩИЕ АНТИТЕЛА ПРОТИВ КЛАУДИНА 18.2 | 2016 |
|
RU2841168C2 |
| АГЕНТЫ ДЛЯ ЛЕЧЕНИЯ ЭКСПРЕССИРУЮЩИХ КЛАУДИН РАКОВЫХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2798990C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ С ИСПОЛЬЗОВАНИЕМ АНТИТЕЛ ПРОТИВ КЛАУДИНА 18.2 ДЛЯ ЛЕЧЕНИЯ РАКА | 2014 |
|
RU2792932C2 |
| АНТИ-PRE-S1 HBV АНТИТЕЛА | 2016 |
|
RU2739955C2 |
| НОВЫЕ КОМПОЗИЦИИ АНТИТЕЛ ДЛЯ ИММУНОТЕРАПИИ РАКА | 2019 |
|
RU2804490C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ПРОГНОЗИРОВАНИЯ ТЕРАПЕВТИЧЕСКОЙ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ И ПРОГНОЗА ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2016 |
|
RU2785291C2 |
| БИСПЕЦИФИЧЕСКИЕ ТРЕХВАЛЕНТНЫЕ АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С КЛАУДИНОМ 6 ИЛИ КЛАУДИНОМ 18.2, И CD3, ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ С ЭКСПРЕССИЕЙ КЛАУДИНА | 2017 |
|
RU2798988C2 |
| АНТИ-CLDN АНТИТЕЛО, ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЕГО ОБНАРУЖЕНИЯ | 2020 |
|
RU2801315C2 |

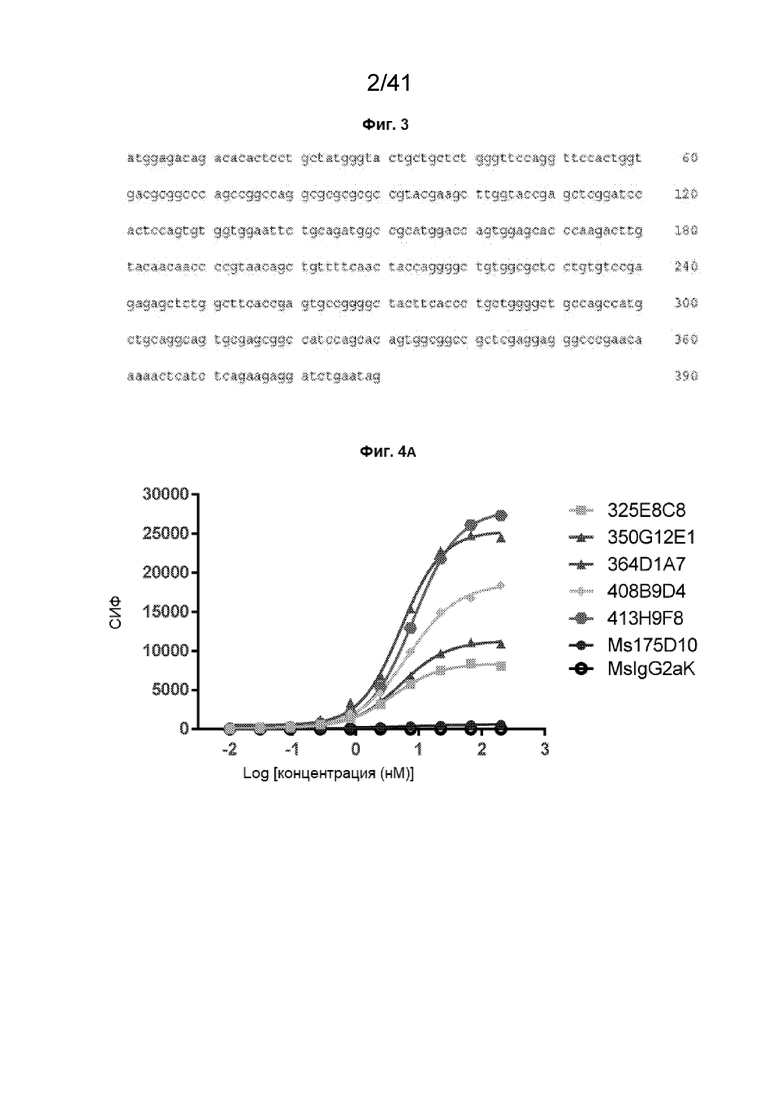
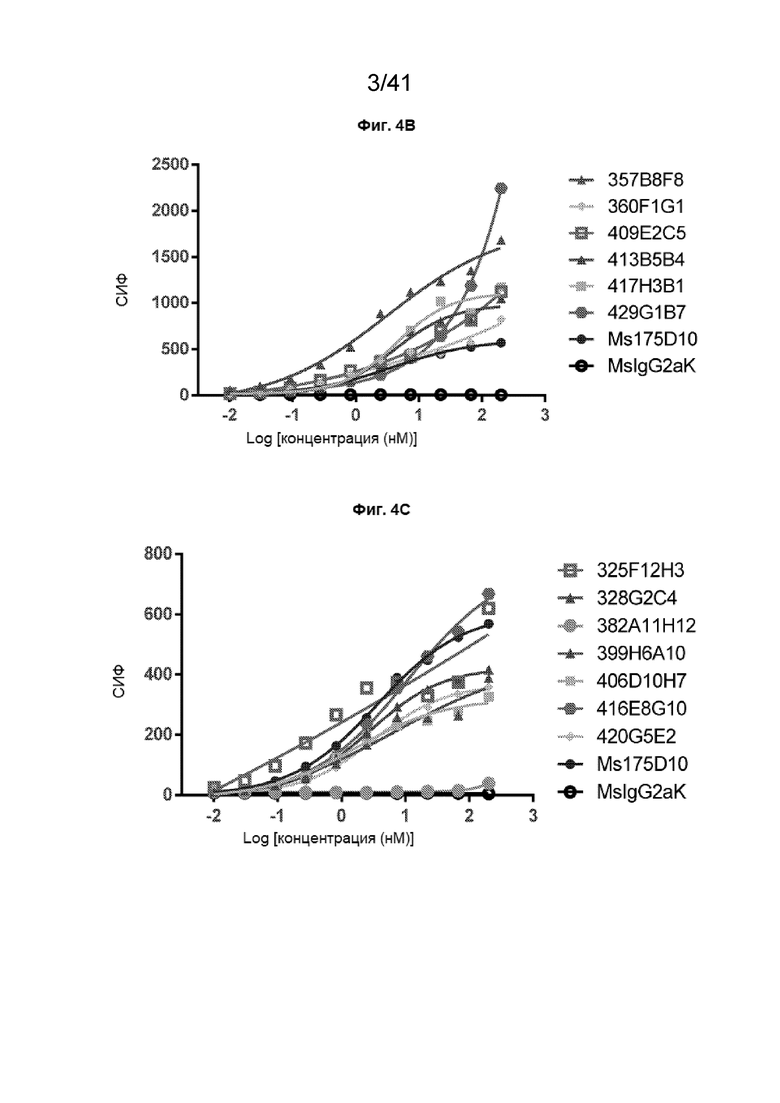


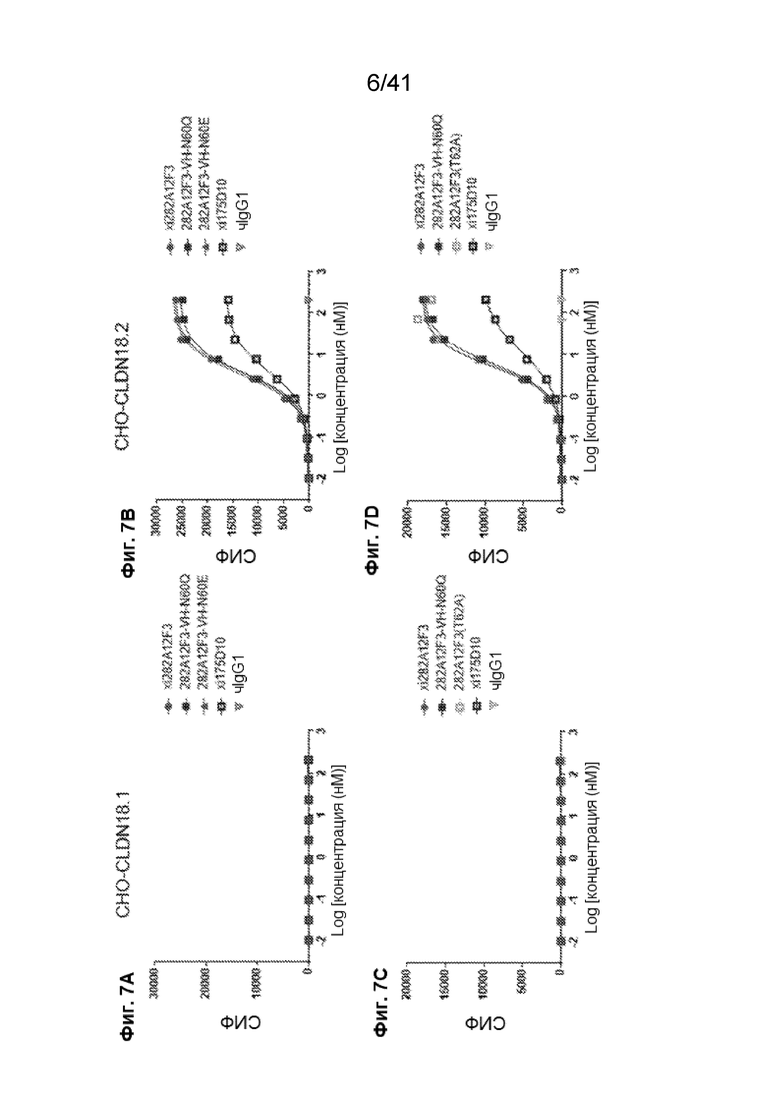
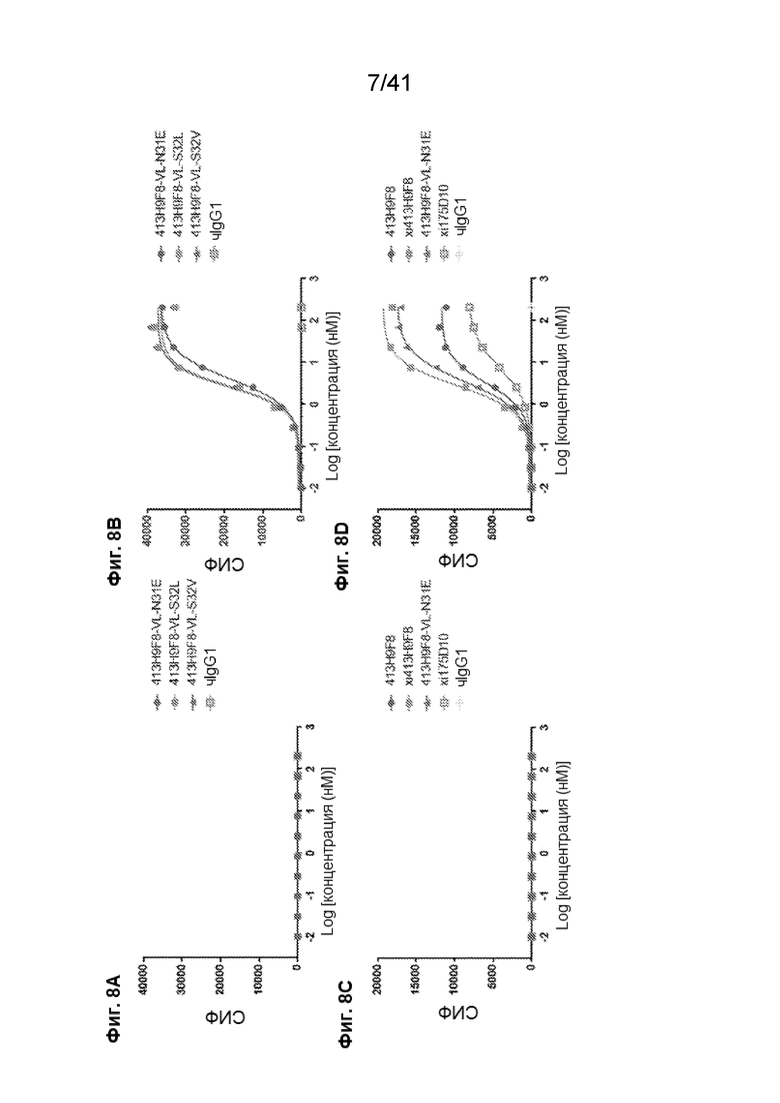

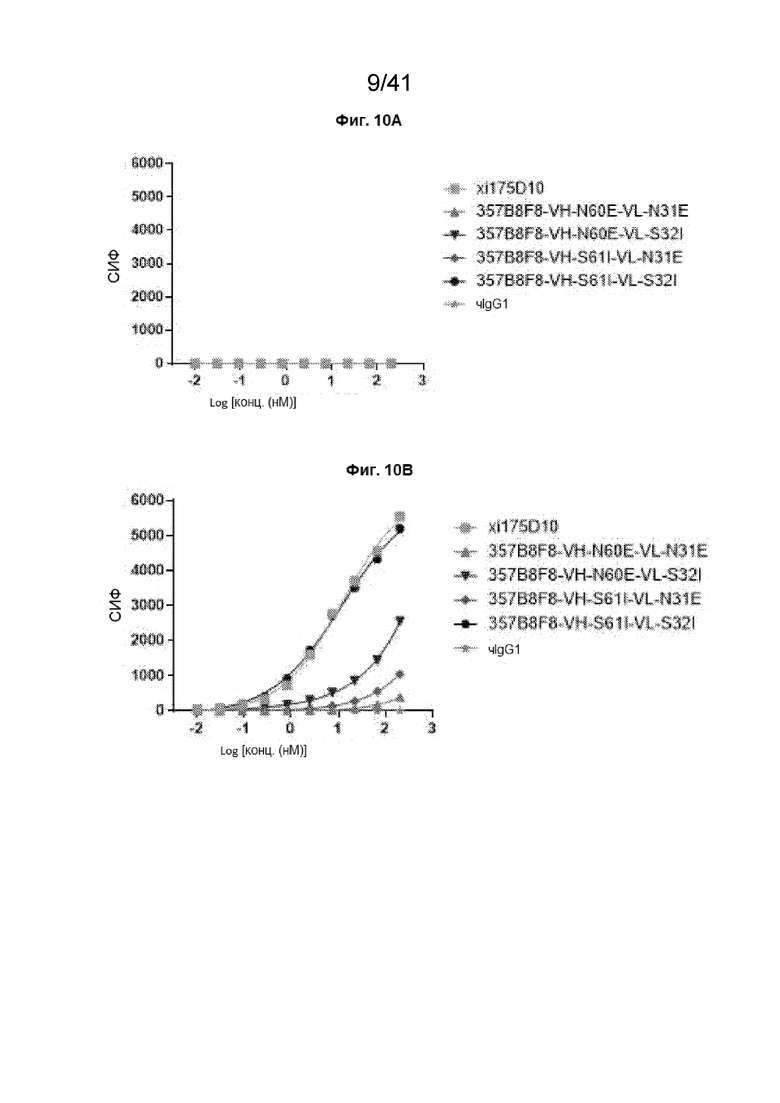
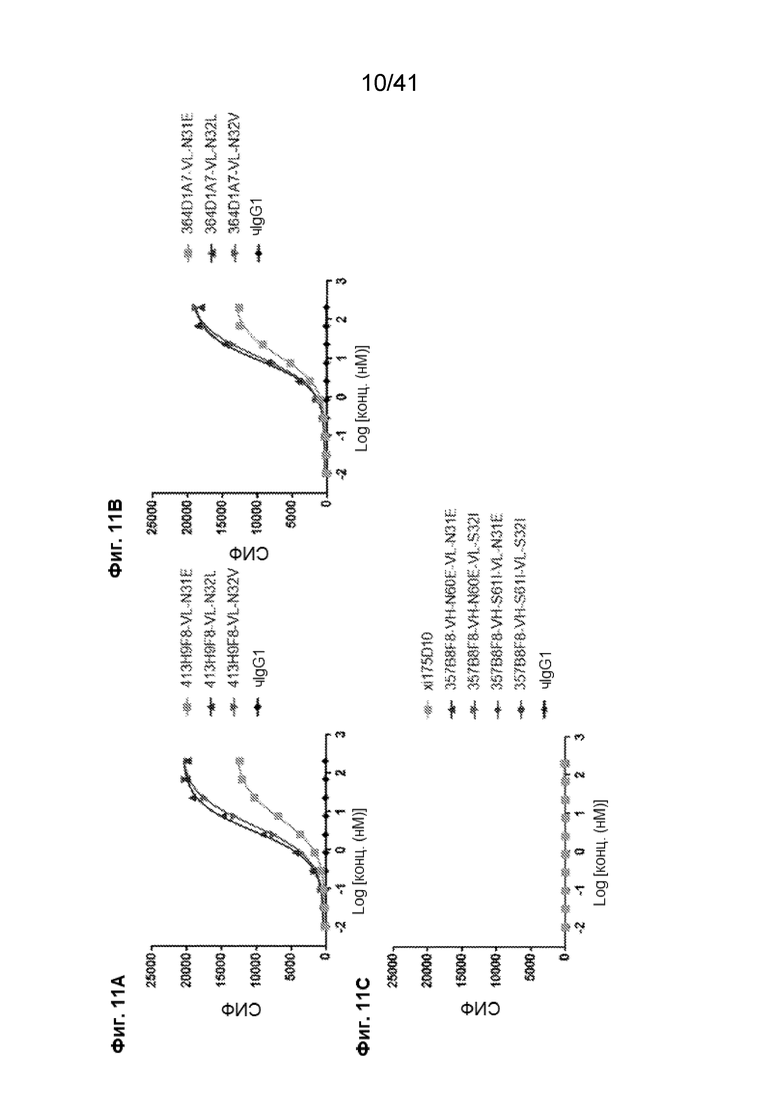
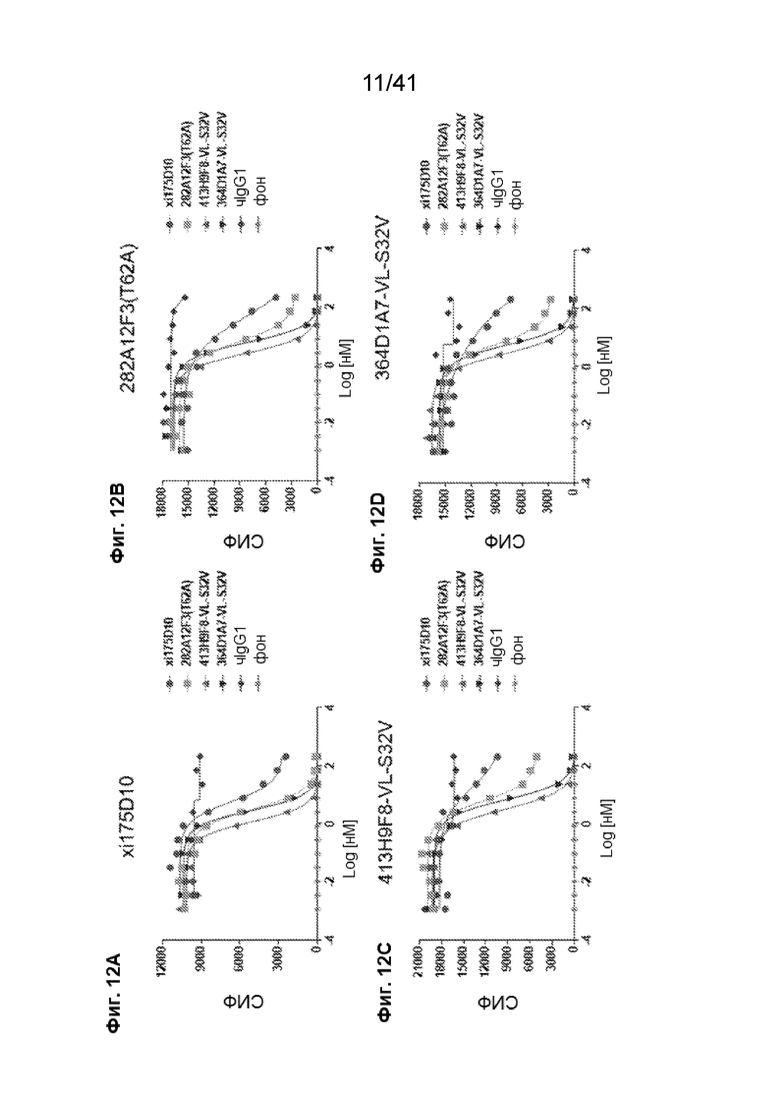
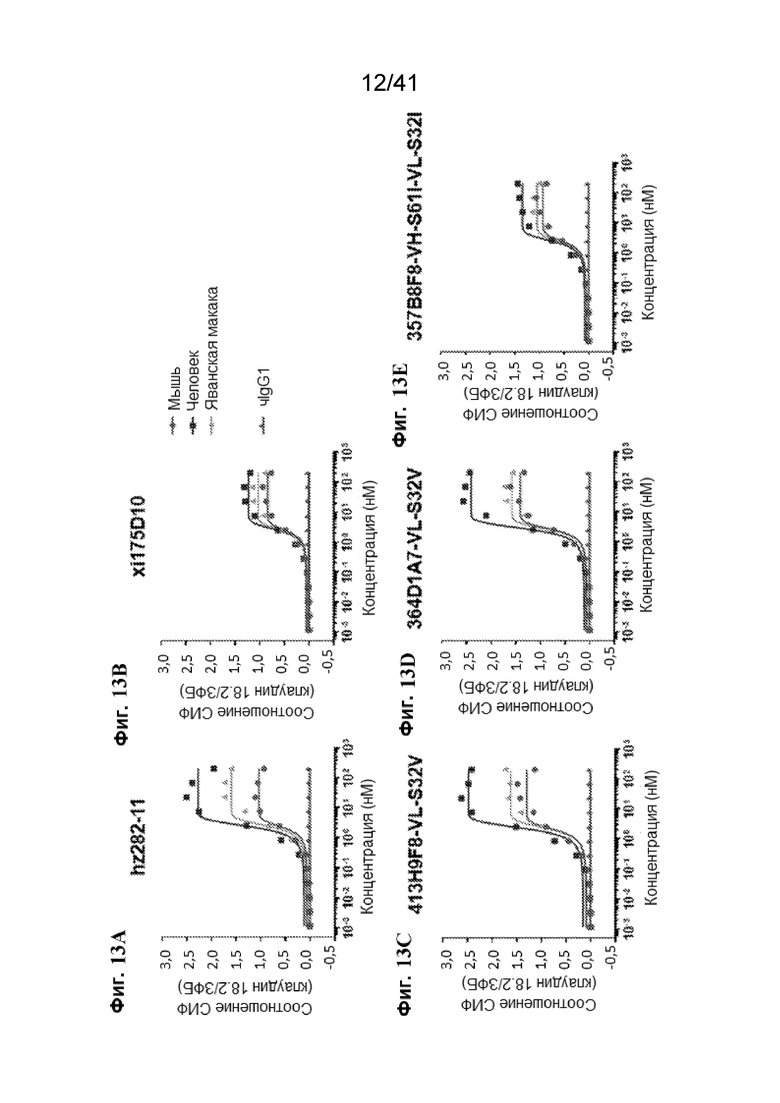
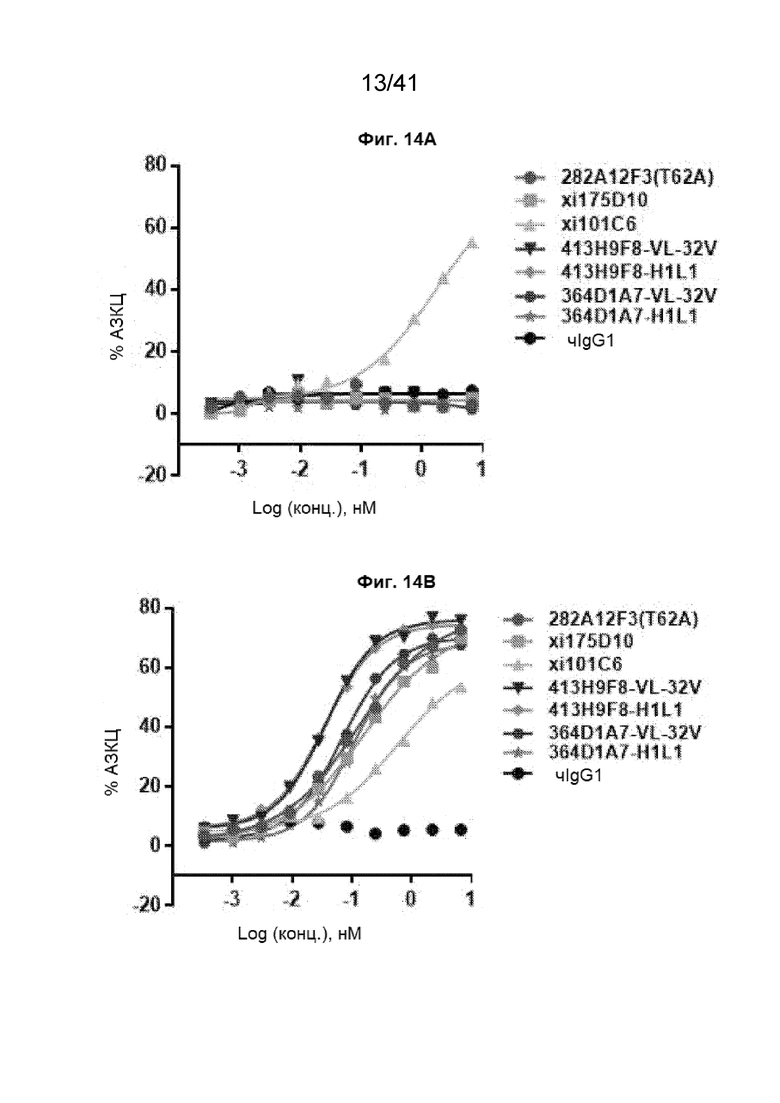


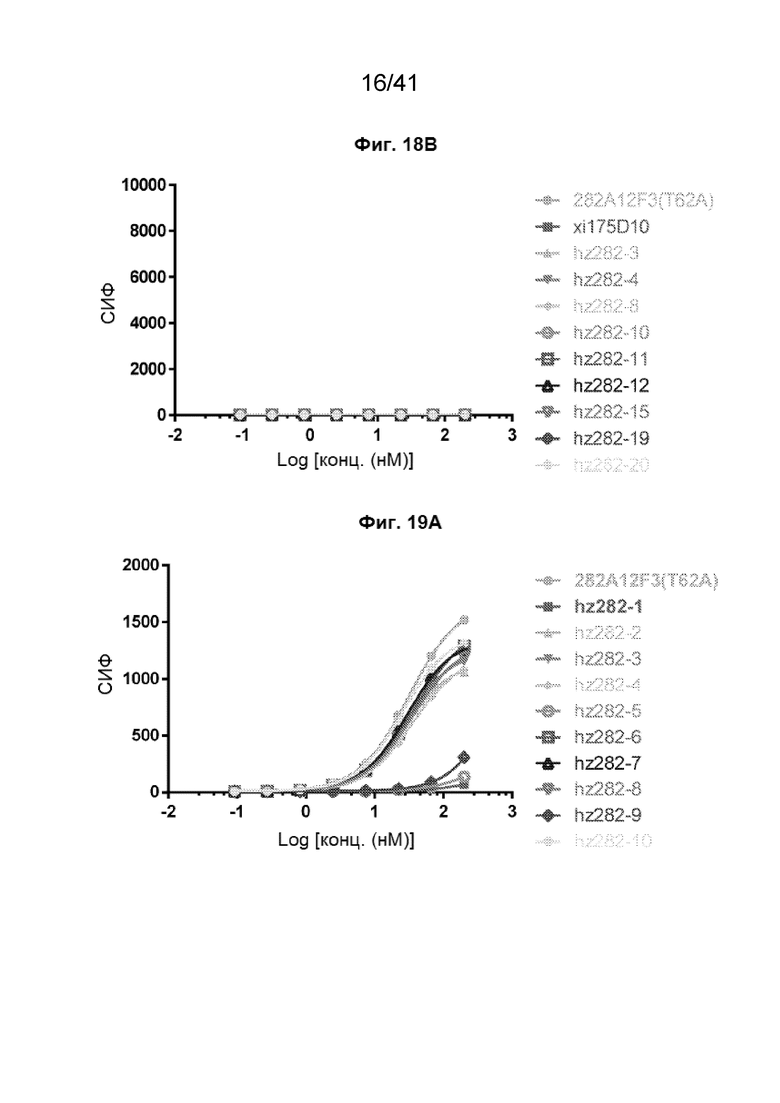
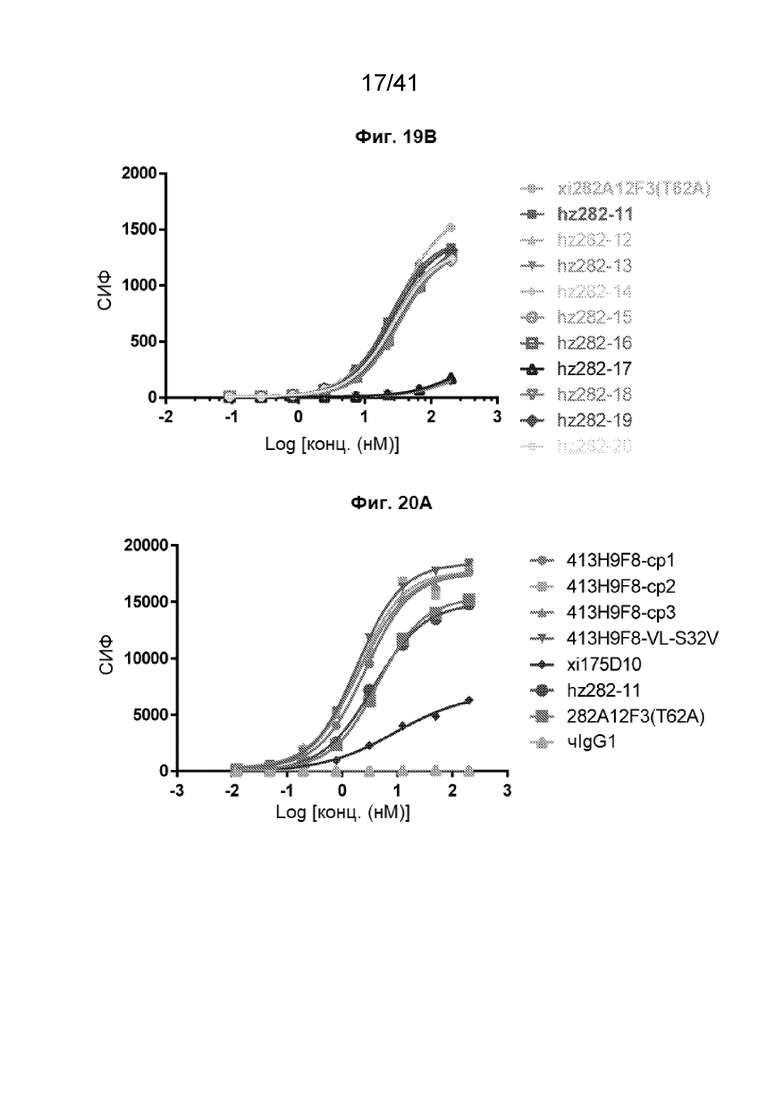
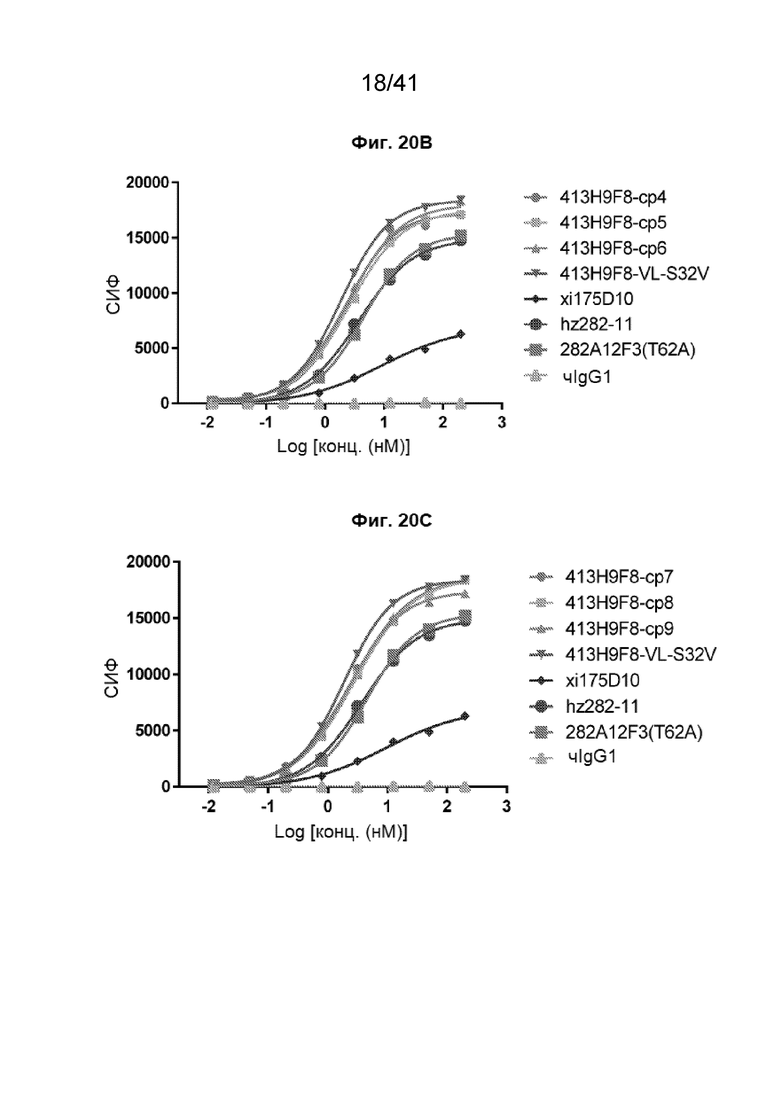

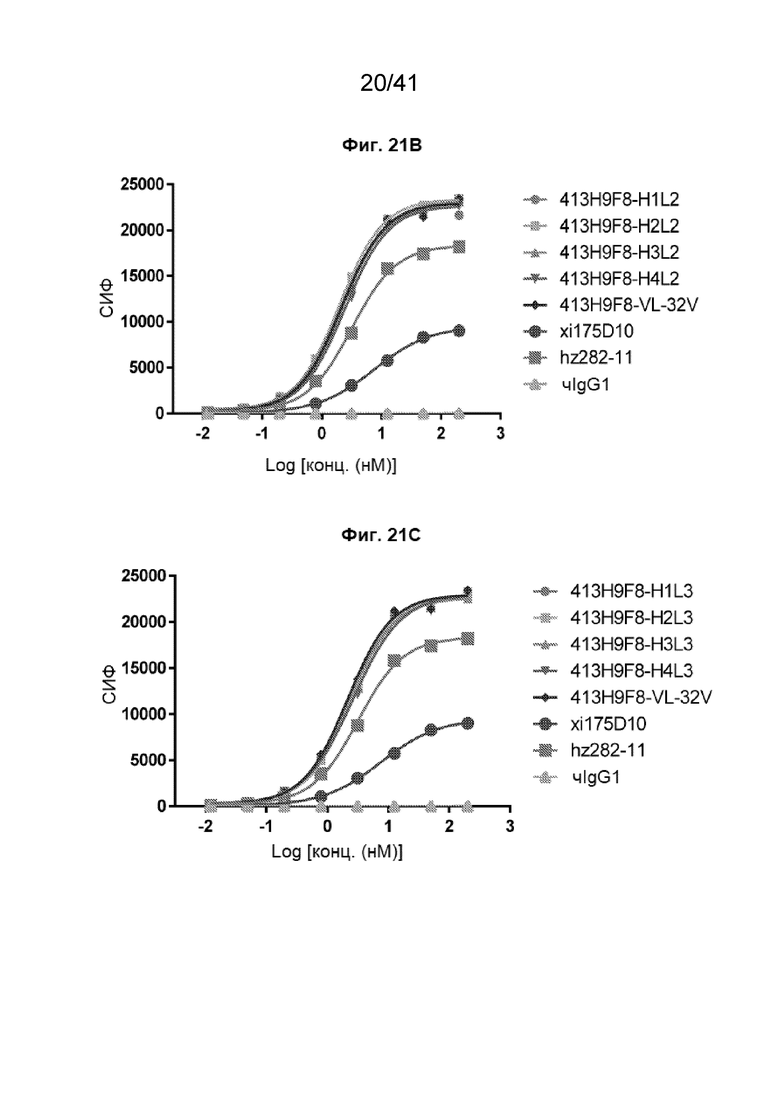


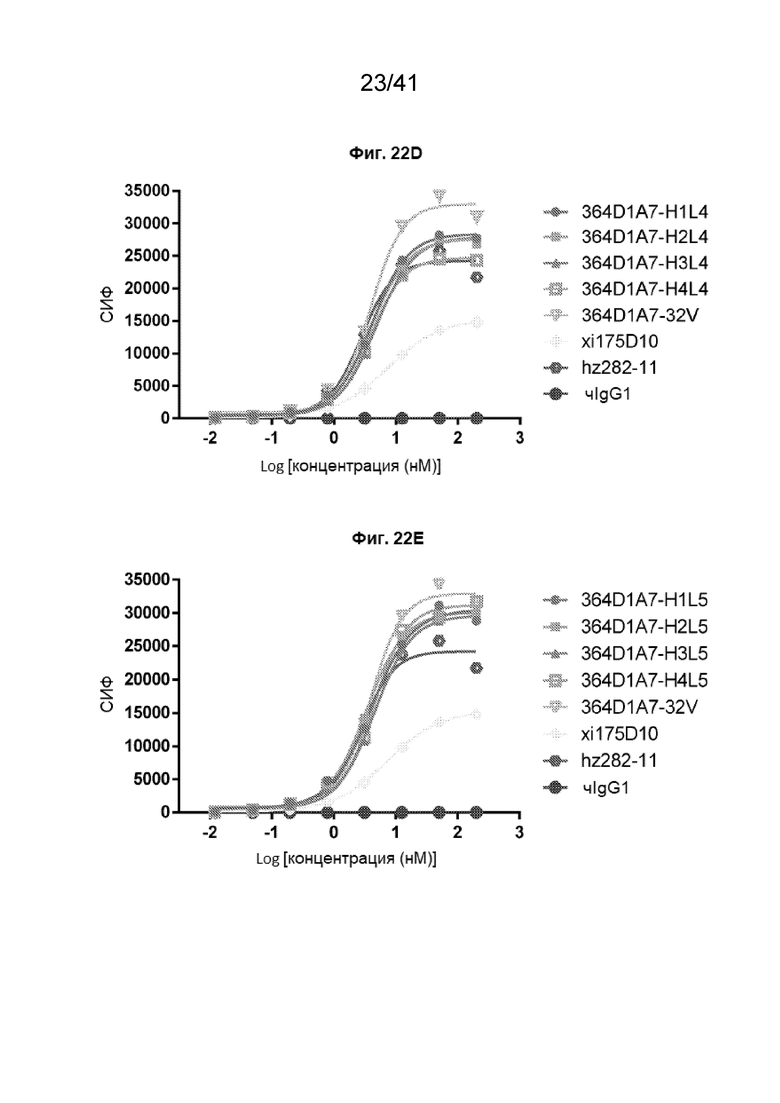
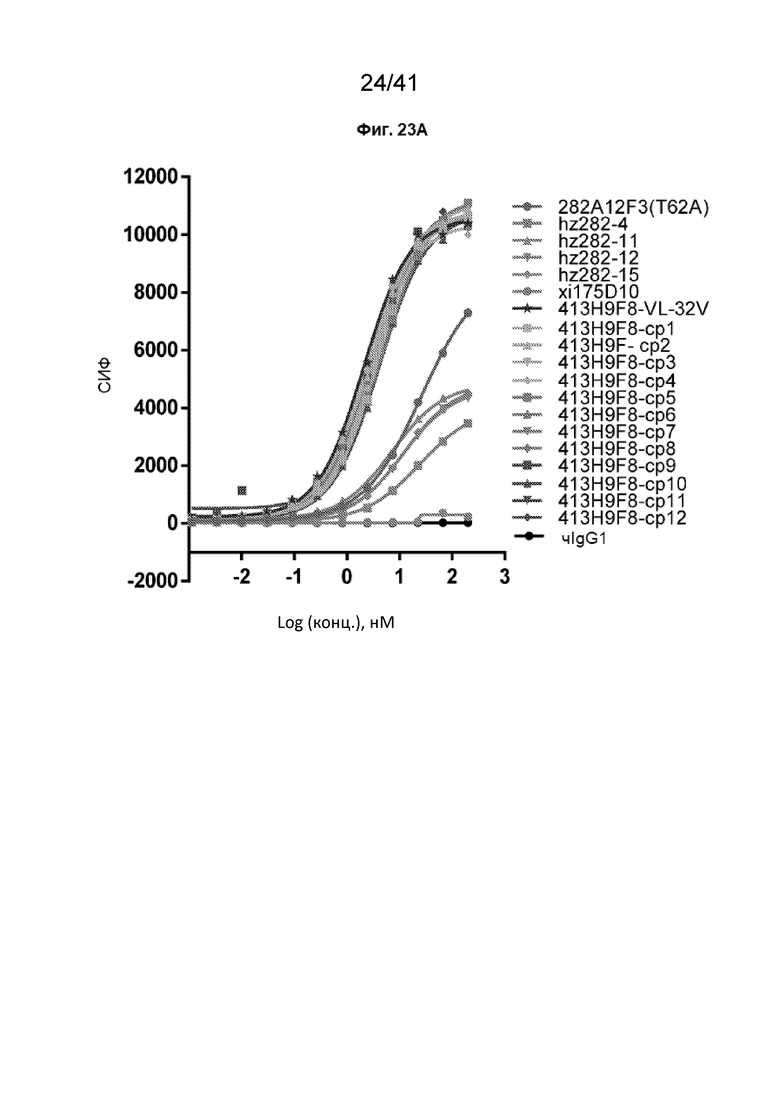

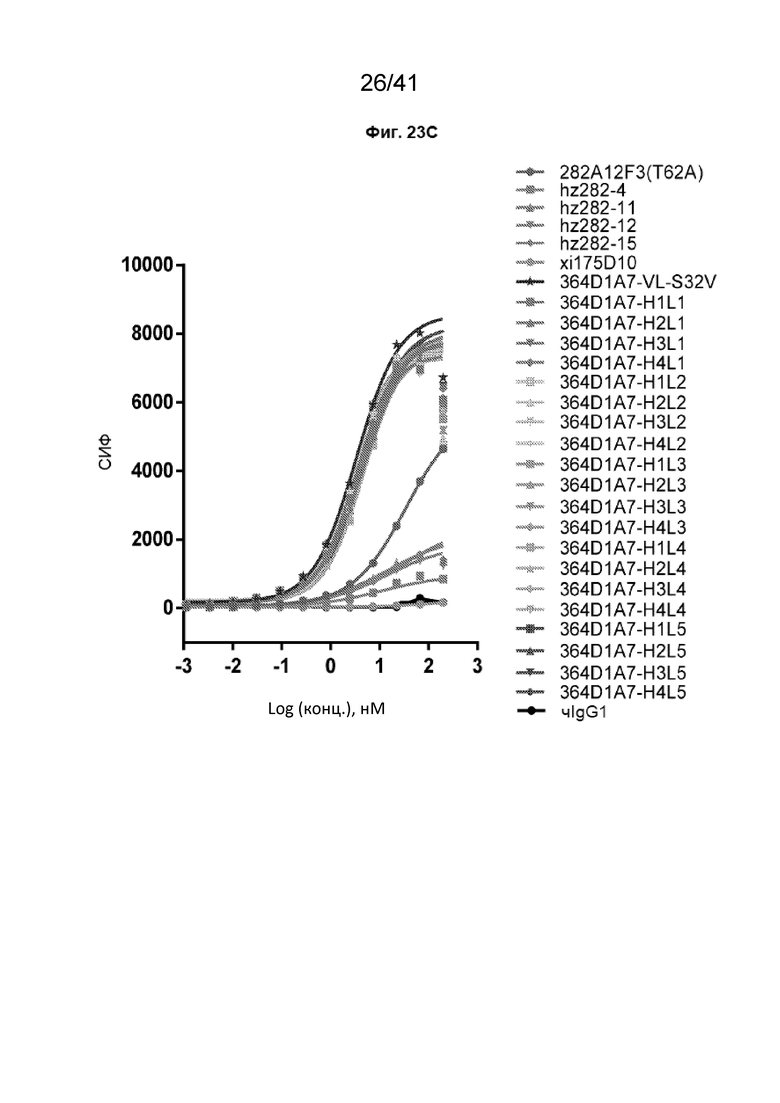

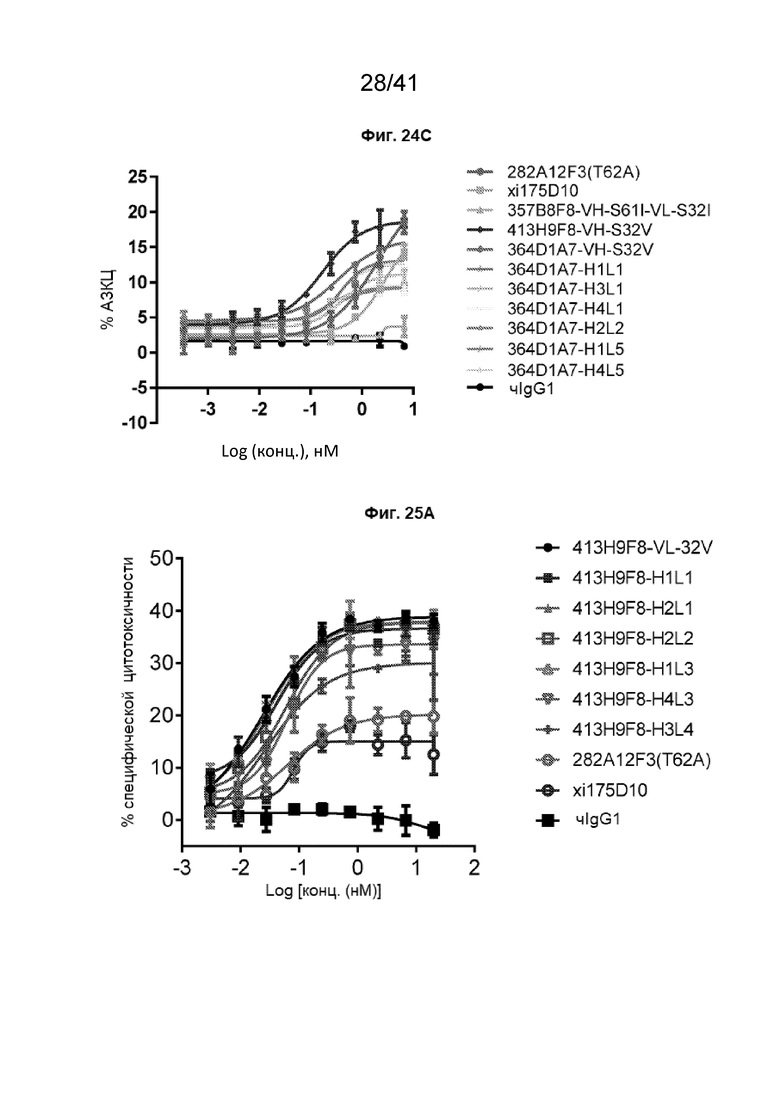
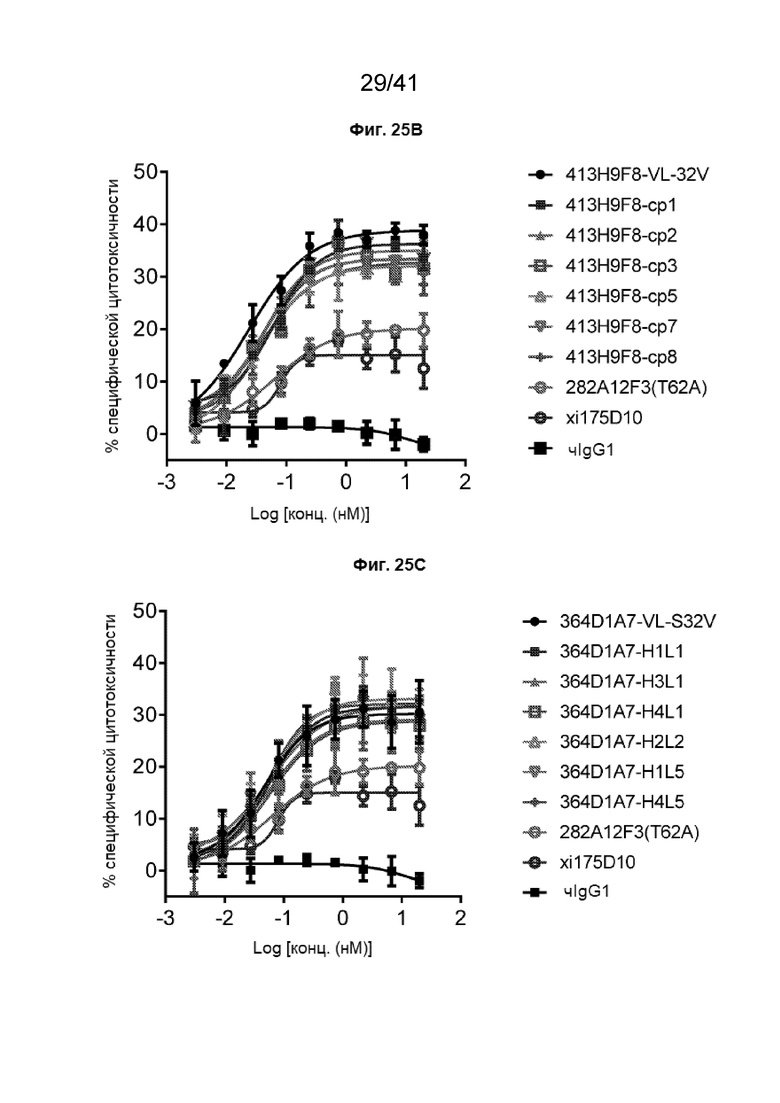
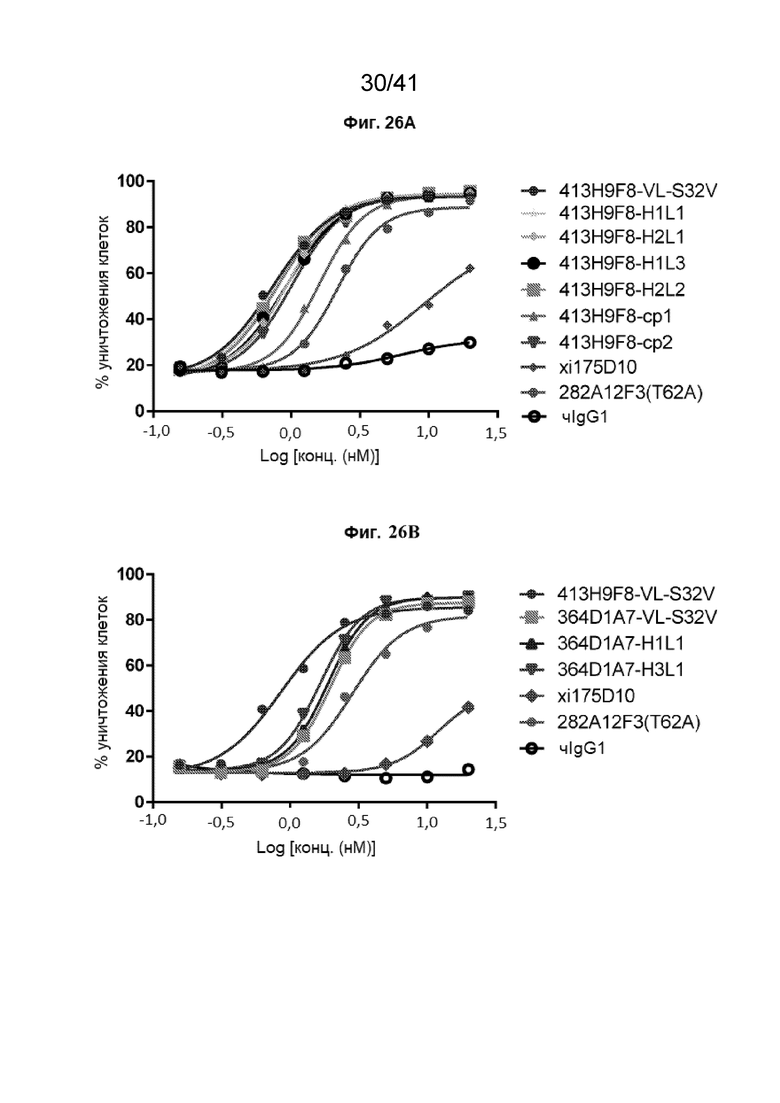
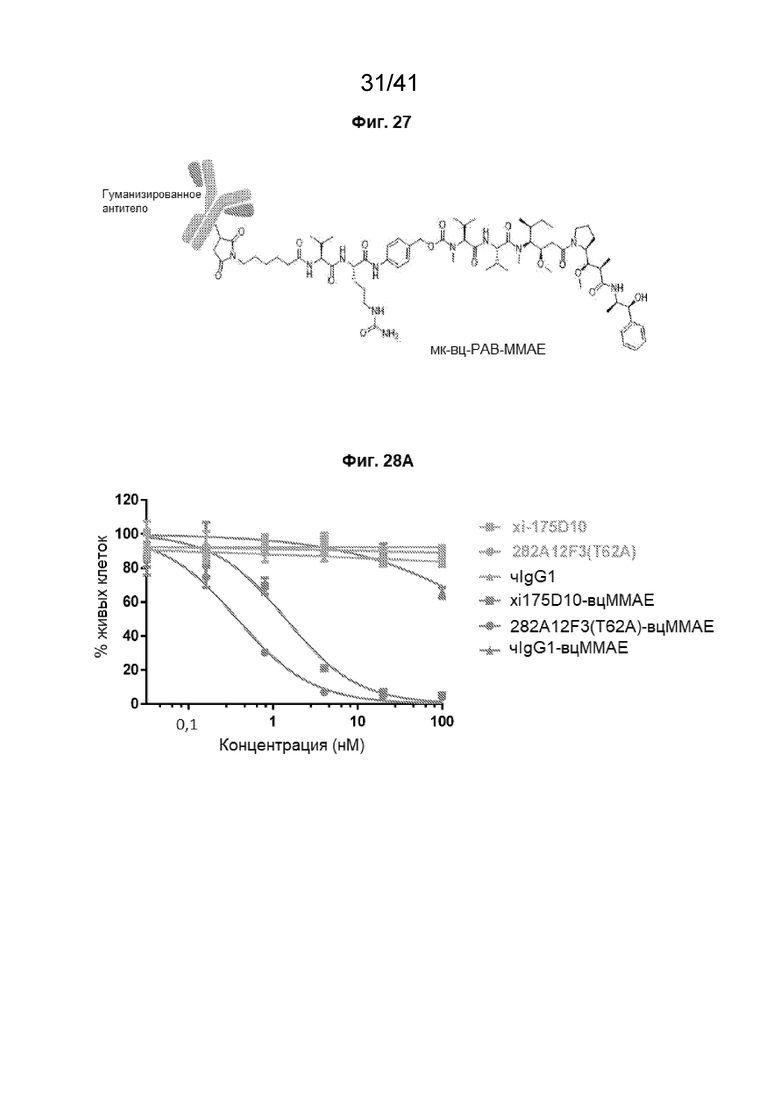
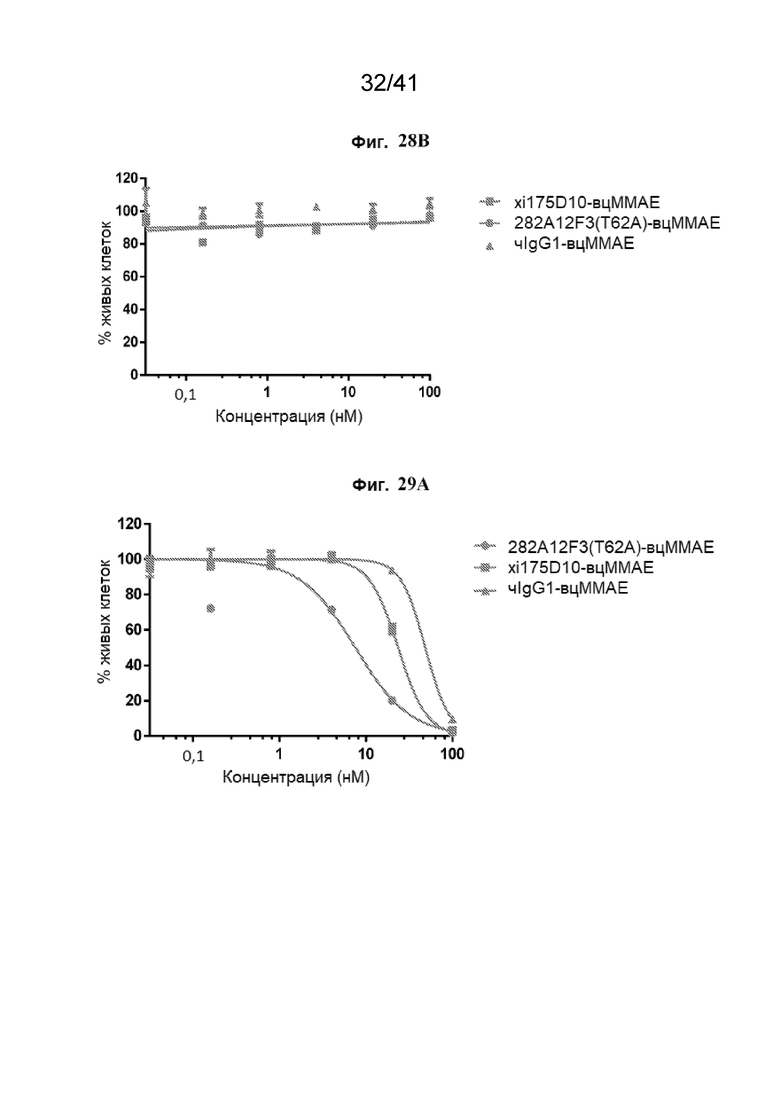
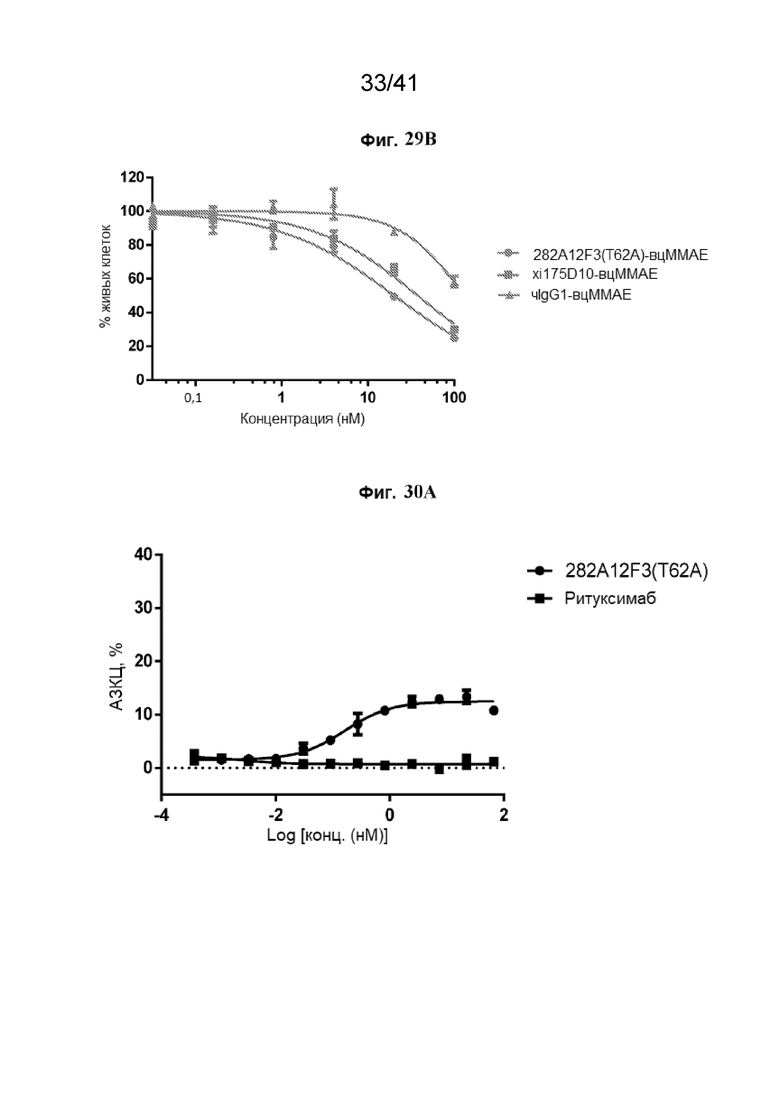
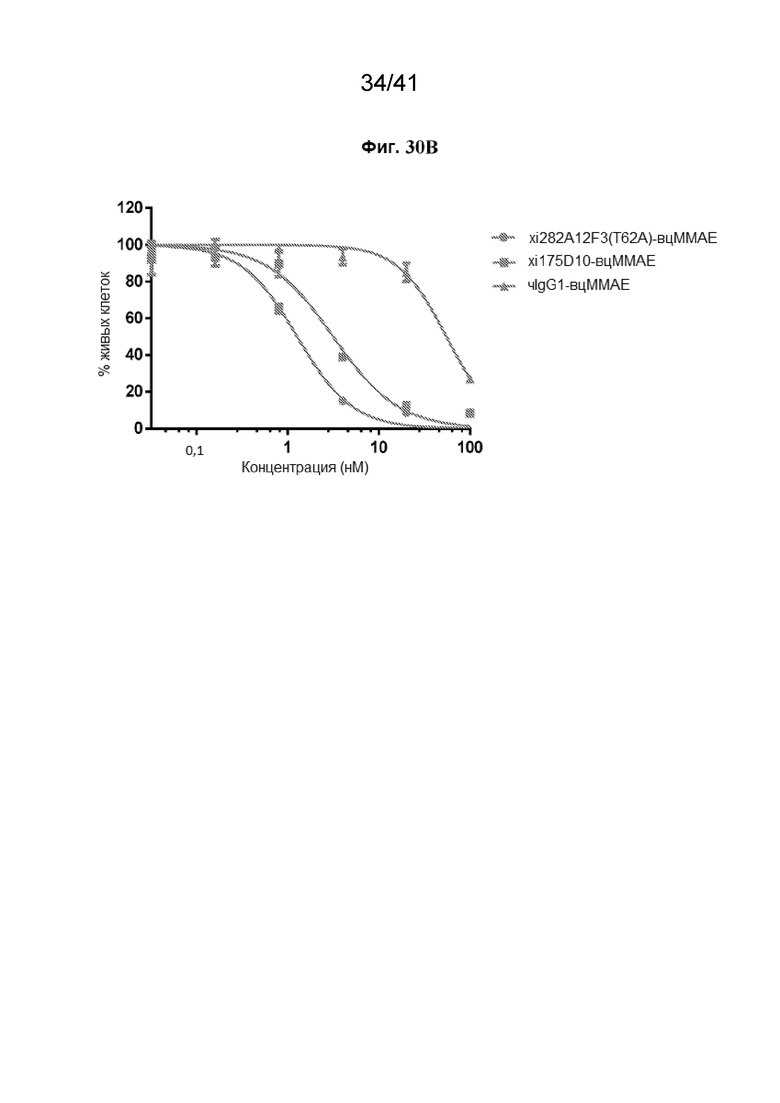
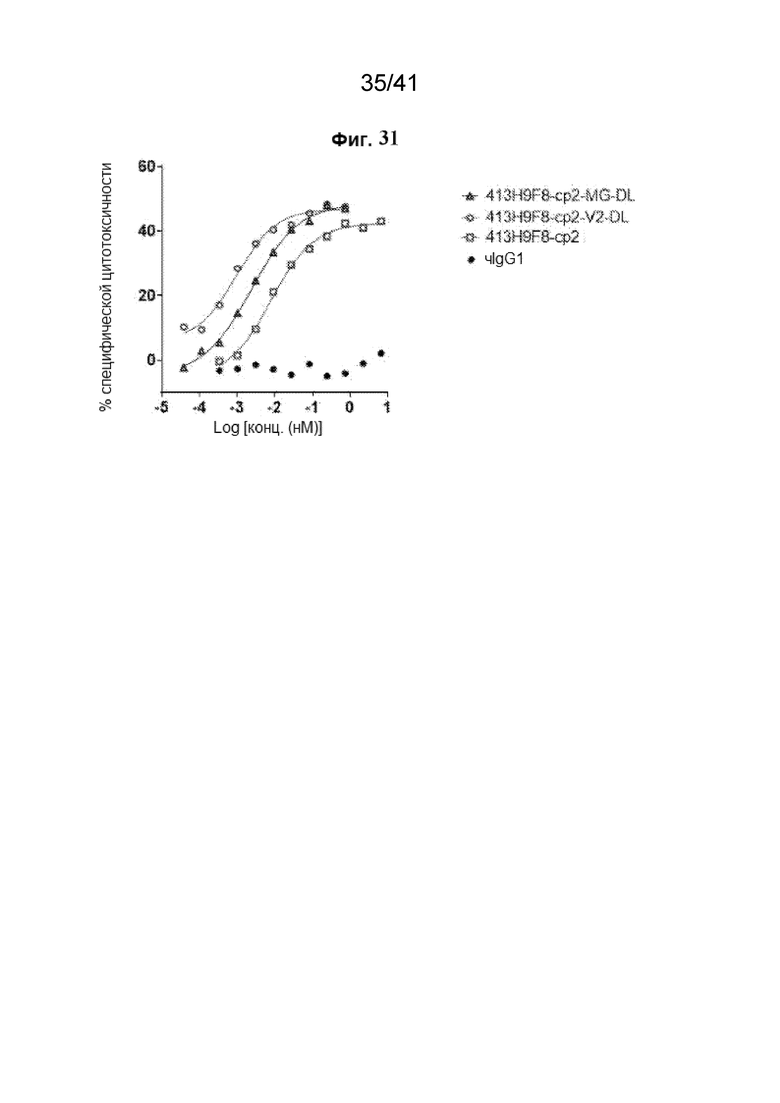

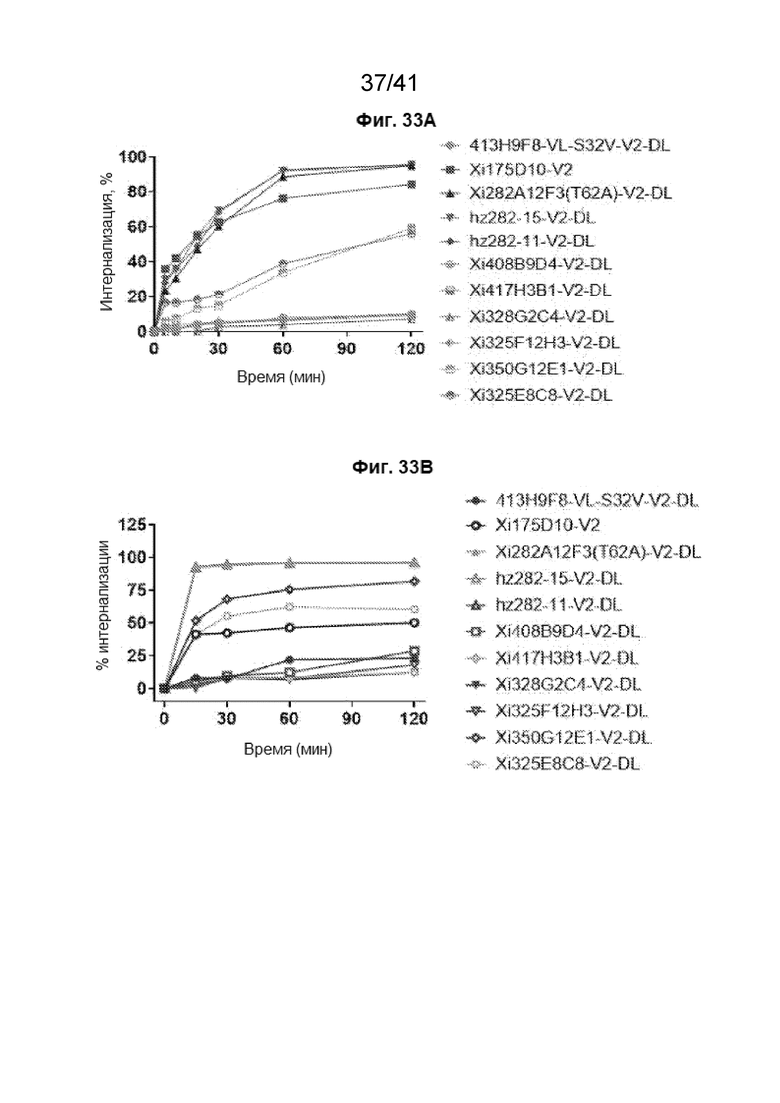
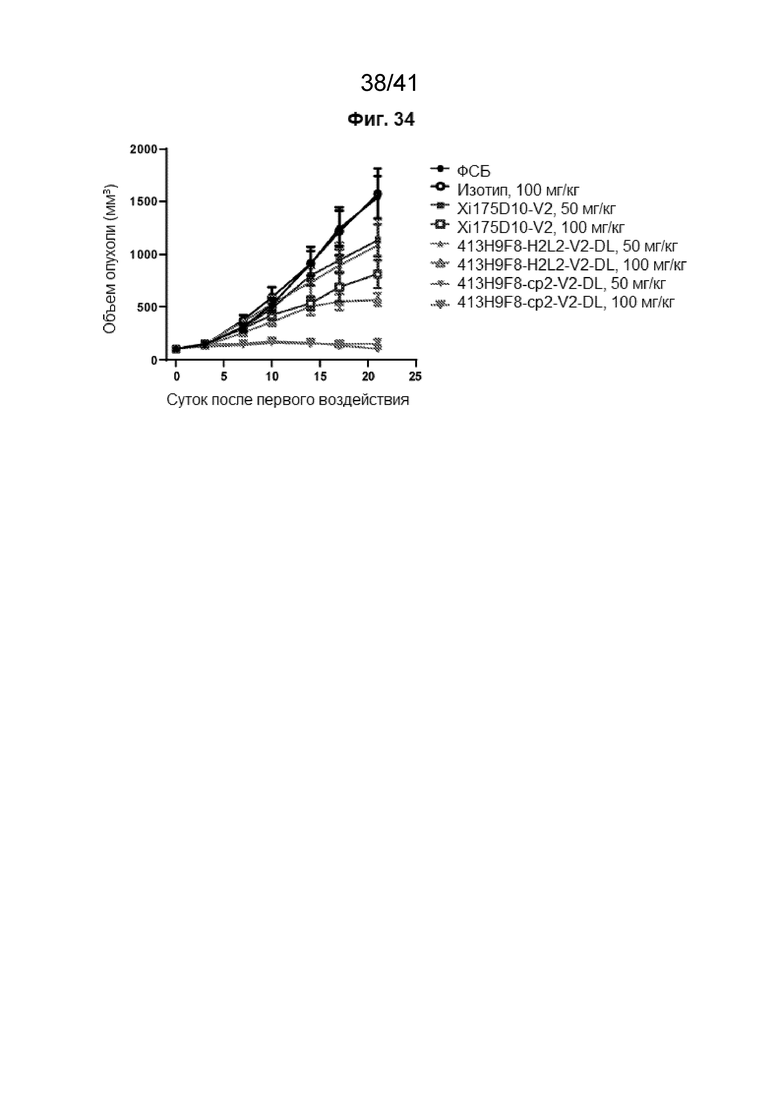
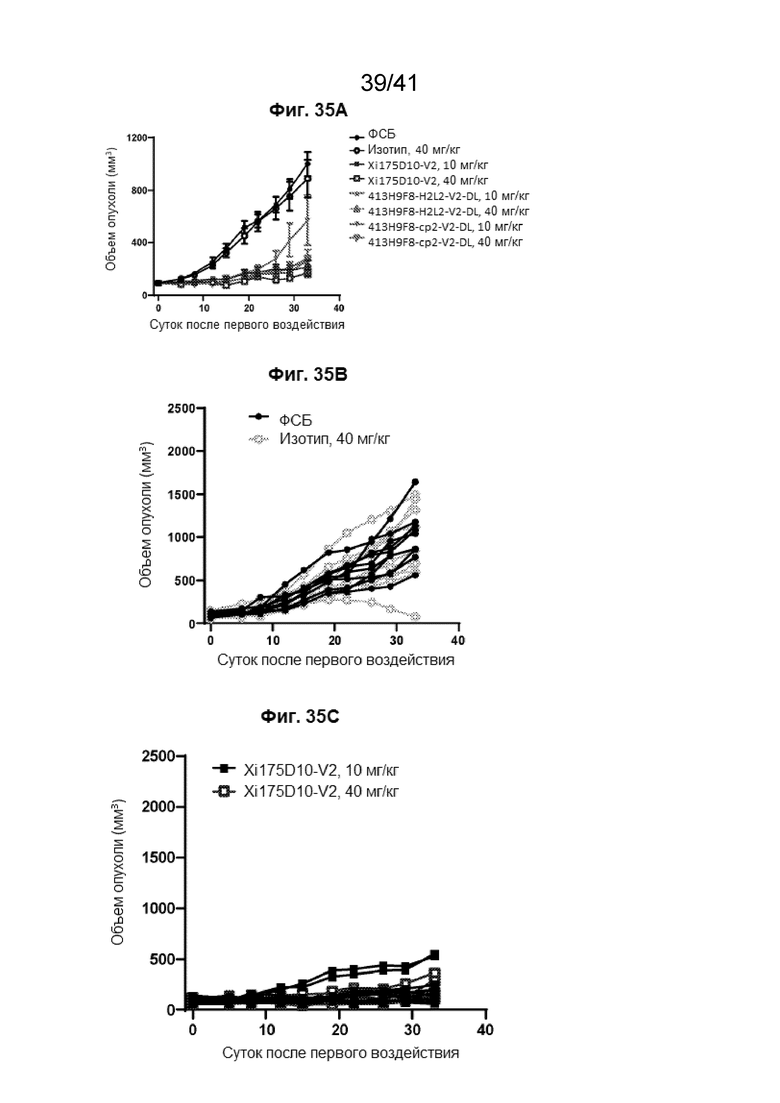
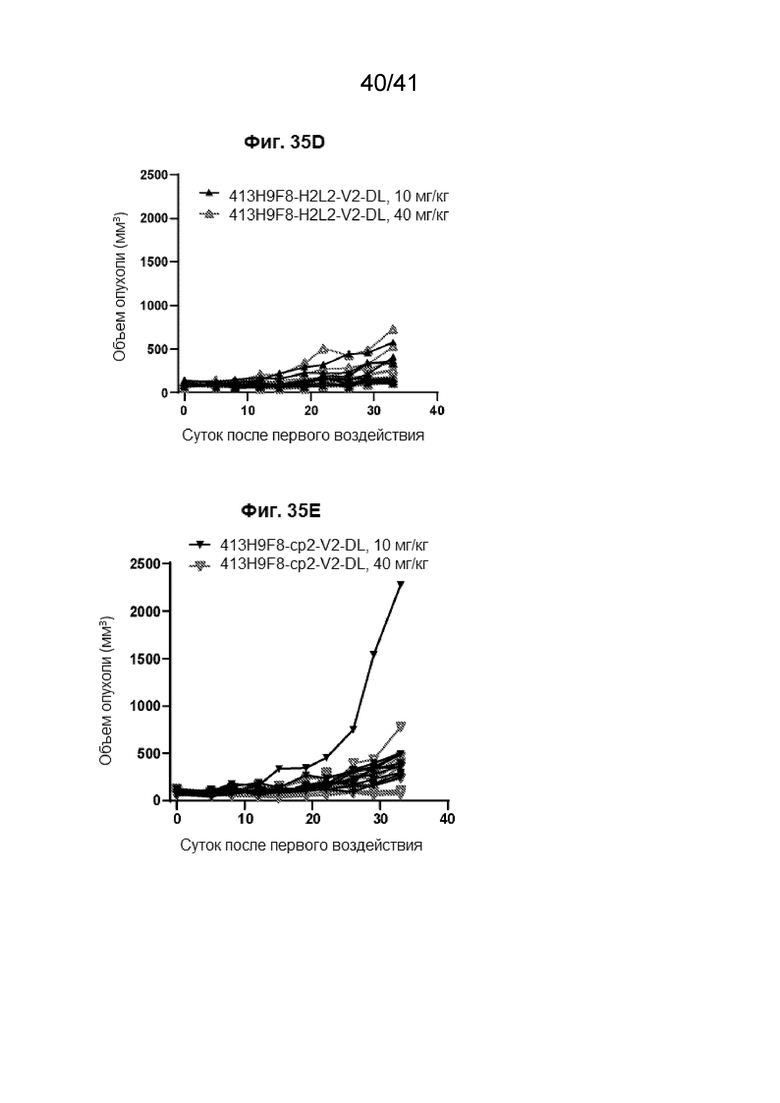

Группа изобретений относится к биотехнологии. Представлены: антитело или его связывающий фрагмент, которые специфически связываются с CLDN18.2, конъюгат анти-CLDN18.2 антитела, полимер нуклеиновой кислоты, кодирующий анти-CLDN18.2 антитело или его связывающий фрагмент, вектор экспрессии, содержащий полимер нуклеиновой кислоты и фармацевтическая композиция для лечения злокачественной опухоли. Изобретение позволяет получить новые антитела с высокой аффинностью к CLDN18.2. 5 н. и 9 з.п. ф-лы, 36 ил., 27 табл., 27 пр.
1. Анти-CLDN18.2 антитело или его связывающий фрагмент, которое содержит вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL),
где область VH содержит:
последовательность CDR1, состоящую из SEQ ID NO: 7;
последовательность CDR2, состоящую из SEQ ID NO: 8; и
последовательность CDR3, состоящую из SEQ ID NO: 9,
и где область VL содержит:
последовательность CDR1, выбранную из SEQ ID NO: 21 или 24-27;
последовательность CDR2, состоящую из SEQ ID NO: 22; и
последовательность CDR3, состоящую из SEQ ID NO: 23.
2. Анти-CLDN18.2 антитело или его связывающий фрагмент по п.1, где анти-CLDN18.2 антитело представляет собой полноразмерное антитело.
3. Анти-CLDN18.2 антитело или его связывающий фрагмент по п.1, где анти-CLDN18.2 антитело представляет собой связывающий фрагмент.
4. Анти-CLDN18.2 антитело или его связывающий фрагмент по любому из пп.1-3, где анти-CLDN18.2 антитело или его связывающий фрагмент включает моновалентный Fab', бивалентный Fab2, одноцепочечный вариабельный фрагмент (scFv), диатело, миниантитело, наноантитело, однодоменное антитело (sdAb) или антитело верблюдовых или их связывающий фрагмент.
5. Анти-CLDN18.2 антитело или его связывающий фрагмент по любому из пп.1-3, где анти-CLDN18.2 антитело или его связывающий фрагмент включает гуманизированное антитело или его связывающий фрагмент, химерное антитело или его связывающий фрагмент, моноклональное антитело или его связывающий фрагмент или биспецифическое антитело или его связывающий фрагмент.
6. Анти-CLDN18.2 антитело или его связывающий фрагмент по любому из пп.1-5, где анти-CLDN18.2 антитело или его связывающий фрагмент включает гуманизированное антитело или его связывающий фрагмент.
7. Анти-CLDN18.2 антитело или его связывающий фрагмент по п.6, где гуманизированное антитело или его связывающий фрагмент содержит
область VH, которая по меньшей мере на 80%, 85%, 90%, 95% или 100% идентична SEQ ID NO: 74-76, и
область VL, которая по меньшей мере на 80%, 85%, 90%, 95% или 100% идентична SEQ ID NO: 77-80.
8. Анти-CLDN18.2 антитело или его связывающий фрагмент по любому из пп.1-7, где анти-CLDN18.2 антитело или его связывающий фрагмент содержит каркас IgM, или каркас IgG2, или каркас IgG1.
9. Анти-CLDN18.2 антитело или его связывающий фрагмент по любому из пп.1-8, где анти-CLDN18.2 антитело или его связывающий фрагмент содержит одну или несколько мутаций в области Fс, например, где одна или несколько мутаций, включают мутацию
в аминокислотном положении S239,
в аминокислотном положении I332,
в аминокислотном положении F243,
в аминокислотном положении R292,
в аминокислотном положении Y300,
в аминокислотном положении V305,
в аминокислотном положении P396 или их комбинацию,
в частности, где одна или несколько мутаций в области Fс усиливают ADCC по сравнению с эталонным антителом 175D10.
10. Конъюгат анти-CLDN18.2 антитела, содержащий антитело или его связывающий фрагмент по любому из пп.1-9, конъюгированное с цитотоксической полезной нагрузкой для лечения злокачественной опухоли, которая характеризуется сверхэкспрессией CLDN18.2.
11. Полимер нуклеиновой кислоты, кодирующий анти-CLDN18.2 антитело или его связывающий фрагмент по любому из пп.1-10.
12. Вектор экспрессии, содержащий полимер нуклеиновой кислоты по п.11.
13. Фармацевтическая композиция для лечения злокачественной опухоли, которая характеризуется сверхэкспрессией белка CLDN18.2, где композиция содержит:
анти-CLDN18.2 антитело, его связывающий фрагмент или конъюгат антитела по любому из пп.1-10; и
фармацевтически приемлемый эксципиент.
14. Фармацевтическая композиция по п.13, где злокачественная опухоль представляет собой рак желудочно-кишечного тракта, рак желудка, рак поджелудочной железы, рак пищевода, холангиокарциному, рак легкого или рак яичника.
| CN 103694353 A, 02.04.2014 | |||
| WO 2007059997 A1, 31.05.2007 | |||
| WO 2013174509 A1, 28.11.2013 | |||
| WO 2014146778 A1, 25.09.2014 | |||
| АНТИТЕЛА ПРОТИВ КЛАУДИНА 18.2 ДЛЯ ДИАГНОСТИКИ РАКА | 2013 |
|
RU2661772C2 |
Авторы
Даты
2024-03-25—Публикация
2019-12-06—Подача