Область изобретения
Настоящее изобретение относится к новому модифицированному полипептиду с ослабленной активностью цитратсинтазы, к микроорганизму, включающему этот модифицированный полипептид, и к способу получения L-аминокислот с использованием этого микроорганизма.
Предшествующий уровень техники
Микроорганизм рода Corynebacterium, в частности, Corynebacterium glutamicum, представляет собой грамположительный микроорганизм, который широко используется в производстве L-аминокислот и других полезных веществ. Для получения L-аминокислот и других полезных веществ проводятся различные исследования, нацеленные на разработку микроорганизмов с высокоэффективной продукцией и технологий ферментационных процессов. Например, в основном используют подходы, специфические в отношении желаемого вещества, такие как увеличение экспрессии генов, кодирующих ферменты, вовлеченные в биосинтез L-лизина, или удаление генов, не являющихся необходимыми для биосинтеза (US 8048650 В2).
В то же самое время, такие L-аминокислоты, как L-лизин, L-треонин, L-метионин, L-изолейцин и L-глицин, представляют собой аминокислоты - производные аспартата, и уровень биосинтеза оксалоацетата (т.е. предшественника аспартата) может влиять на уровни биосинтеза этих L-аминокислот.
Цитратсинтаза (CS) представляет собой фермент, который продуцирует цитрат путем катализирования конденсации ацетил-СоА и оксалоацетата, которые продуцируются во время процесса роста микроорганизма, и он также представляет собой важный фермент для определения потока углерода в пути ТСА (цикл трикарбоновых кислот).
О фенотипических изменениях у штаммов, продуцирующих L-лизин, вследствие делеции гена gltA, кодирующего цитратсинтазу, сообщали ранее в литературе (Ooyen et al., Biotechnol. Bioeng., 109(8): 2070-2081, 2012). Тем не менее, эти штаммы с делецией гена gltA обладают недостатками, заключающимися в том, что подавляется не только их рост, а также существенно уменьшаются скорости накопления сахара, тем самым приводя к низкой продукции лизина в единицу времени. Соответственно, сохраняется потребность в исследованиях, в которых может рассматриваться как эффективное увеличение способности продуцировать L-аминокислоты, так и рост штаммов.
Техническая проблема
Авторы настоящего изобретения подтвердили, что когда используют новый модифицированный полипептид, в котором активность цитратсинтазы ослаблена до определенного уровня, тогда увеличивается количество продуцируемых L-аминокислот, таким образом, завершая настоящее изобретение.
Техническое решение
Одна из задач настоящего изобретения заключается в том, чтобы предложить модифицированный полипептид, обладающий цитратсинтазной активностью, где аминокислота, соответствующая положению 312 от N-конца полипептида, состоящего из аминокислотной последовательности SEQ ID NO: 1, заменена другой аминокислотой.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить полинуклеотид, кодирующий этот модифицированный полипептид.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить вектор, включающий этот полинуклеотид.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить микроорганизм, продуцирующий L-аминокислоту, включающий модифицированный полипептид, полинуклеотид, кодирующий этот модифицированный полипептид, или вектор, включающий этот полинуклеотид.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить способ получения L-аминокислоты, включающий культивирование в среде указанного микроорганизма, включающего этот модифицированный полипептид, полинуклеотид, кодирующий этот модифицированный полипептид, или вектор, включающий этот полинуклеотид.
Благоприятные эффекты
Когда культивируют микроорганизм рода Corynebacterium, продуцирующий L-аминокислоту, в котором активность цитратсинтазы в отношении субстрата модифицирована, тогда L-аминокислота может продуцироваться с высоким выходом по сравнению с микроорганизмом, несущими существующий немодифицированный полипептид.
Подробное описание предпочтительных воплощений
Настоящее изобретение подробно раскрыто далее. В то же самое время, соответствующие описания и воплощения, раскрытые здесь, также могут быть применены в отношении соответственно других описаний и воплощений. То есть, все комбинации различных элементов, раскрытых в настоящем изобретении, входят в объем настоящего изобретения. Кроме того, объем настоящего изобретения не ограничен конкретным описанием, приведенным ниже.
В одном из аспектов настоящего изобретения может быть предложен модифицированный полипептид, обладающий цитратсинтазной активностью, где аминокислота, соответствующая положению 312 от N-конца полипептида, состоящего из аминокислотной последовательности SEQ ID NO: 1, заменена другой аминокислотой.
В настоящем изобретении аминокислотная последовательность SEQ ID NO: 1 может относиться к аминокислотной последовательности, обладающей цитратсинтазной активностью, и, в частности, может относиться к белковой последовательности, обладающей цитратсинтазной активностью, кодируемой геном gltA. Аминокислотная последовательность SEQ ID NO: 1 может быть получена из GenBank в NCBI (Национальный центр биотехнологической информации), которая представляет собой известную базу данных. Например, аминокислотная последовательность SEQ ID NO: 1 может происходить из Corynebacterium glutamicum, но не ограничивается этим, и может включать любую аминокислотную последовательность белка, обладающего той же самой активностью, что и активность белка, включающего без ограничения вышеприведенную аминокислотную последовательность. Кроме того, белок, обладающий цитратсинтазной активностью по настоящему изобретению, может представлять собой белок, включающий аминокислотную последовательность SEQ ID NO: 1, и может включать мутацию, которая может возникать из-за вставки антисмысловой последовательности выше или ниже аминокислотной последовательности SEQ ID NO, природную мутацию или молчащую мутацию, и для специалиста в данной области техники понятно, что любой белок, обладающий той же самой или соответствующей активностью, что и белок, включающий аминокислотную последовательность SEQ ID NO: 1, может попасть в число белков, обладающих цитратсинтазной активностью согласно настоящему изобретению. В конкретном примере белок, обладающий цитратсинтазной активностью по настоящему изобретению, может представлять собой белок, включающий аминокислотную последовательность SEQ ID NO: 1, или белок, состоящий из аминокислотной последовательности, обладающей гомологией или идентичностью 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% или более с аминокислотной последовательностью SEQ ID NO: 1. Кроме того, понятно, что любой белок, обладающий аминокислотной последовательностью, в котором часть аминокислотной последовательности делетирована, модифицирована, подвергнута замене или вставке, также может оказаться среди белков, предназначенных для модификации согласно настоящему изобретению, при условии, что этот белок обладает такой гомологией или идентичностью, и демонстрирует действие, соответствующее действию вышеприведенного белка.
Используемый здесь термин "цитратсинтаза (CS)" относится к ферменту, который продуцирует цитрат посредством катализирования конденсации ацетил-СоА и оксалоацетата, которые продуцируются во время гликолиза микроорганизма, и она представляет собой важный фермент, который определяет поток углерода в цикле трикарбоновых кислот (ТСА). В частности, цитратсинтаза может действовать как регулятор скорости на первой стадии цикла трикарбоновых кислот в качестве фермента для синтеза цитрата. Кроме того, цитратсинтаза катализирует реакцию конденсации двухуглеродного ацетатного остатка из ацетил-СоА и молекулы 4-углеродного оксалоацетата с образованием 6-углеродного ацетата. В настоящем изобретении цитратсинтаза может быть использована взаимозаменяемо с "ферментом для синтеза цитрата", "CS", " белком gltA" или "gltA".
Используемый здесь термин "вариант" относится к полипептиду, обладающему по меньшей мере одной аминокислотной последовательностью, отличающейся от описанной последовательности консервативными заменами и/или модификациями, так что функции или свойства белка сохраняются. Модифицированные полипептиды отличаются от идентифицированной последовательности заменой, делецией или вставкой нескольких аминокислот. Такие варианты, как правило, могут быть идентифицированы модификацией одной из вышеприведенных полипептидных последовательностей и путем оценки свойств модифицированного полипептида. То есть, способность вариантов может быть усилена, оставлена неизменной или уменьшена по сравнению с нативным белком. Такие варианты в общем могут быть идентифицированы модифицированием вышеприведенных полипептидных последовательностей и путем оценки реакционной способности модифицированного полипептида. Кроме того, некоторые варианты могут включать варианты, в которых один или более чем один фрагмент, такой как N-концевая лидерная последовательность или трансмембранный домен, были удалены. Другие варианты могут включать варианты, в которых удален фрагмент из N- и/или С-конца зрелого белка.
Используемый здесь термин "консервативная замена" относится к замене аминокислоты другой аминокислотой, обладающей похожими структурными и/или химическими свойствами. Например, вариант может иметь по меньшей мере одну консервативную замену при сохранении по меньшей мере одной биологической активности. Такая аминокислотная замена, как правило, может происходить на основе сходства полярности, заряда, растворимости, гидрофобности, гидрофильности и/или амфипатической природы остатка. Например, положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин; отрицательно заряженные (кислотные) аминокислоты включают глутаминовую кислоту и аспарагиновую кислоту; ароматические аминокислоты включают фенилаланин, триптофан и тирозин; и гидрофобные аминокислоты включают аланин, валин, изолейцин, лейцин, метионин, фенилаланин, пролин, глицин и триптофан. Как правило, консервативная замена оказывает небольшое влияние или не оказывает влияния на активность продуцированного полипептида.
Кроме того, варианты также могут включать делецию или добавление аминокислот, которые обладают минимальным влиянием на свойства и вторичную структуру полипептида. Например, полипептид может быть конъюгирован с сигнальной (или лидерной) последовательностью по N-концу белка, вовлеченной в перенос белков котрансляционно или посттрансляционно. Кроме того, полипептид также может быть конъюгирован с другой последовательностью или линкером для идентификации, очистки или синтеза полипептида.
Использованный здесь термин "модифицированный полипептид, обладающий цитратсинтазной активностью" относится к полипептиду, обладающему цитратсинтазной активностью, которая ослаблена по сравнению с диким типом путем замены части аминокислотной последовательности полипептида, обладающего цитратсинтазной активностью. В настоящем изобретении может быть ссылка на модифицированный полипептид, который может эффективно устанавливать баланс потока углерода путем модификации по меньшей мере одной аминокислоты в аминокислотной последовательности полипептида, обладающего цитратсинтазной активностью, и, таким образом, его активность ослаблена по сравнению с активностью дикого типа.
В частности, в различных белках, обладающих цитратсинтазной активностью, модифицированный полипептид может представлять собой модифицированный полипептид, в котором аминокислота, соответствующая положению 312 в аминокислотной последовательности SEQ ID NO: 1, заменена другой аминокислотой. "Другая аминокислота" может относиться к отличающейся от аминокислоты до замены, и она может представлять собой любую аминокислоту за исключением аминокислоты до замены.
Конкретней, в различных белках, обладающих цитратсинтазной активностью, модифицированный полипептид может представлять собой модифицированный полипептид, в котором метионин, соответствующий положению 312 в аминокислотной последовательности SEQ ID NO: 1, заменен другой аминокислотой. Метионин может быть заменен на любую одну или более чем одну аминокислоту, выбранную из группы, состоящей из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутаминовой кислоты, глутамина, глицина, гистидина, изолейцина, лейцина, лизина, фенилаланина, пролина, серина, треонина, триптофана, тирозина и валина, и более конкретно, она может представлять собой модифицированную аминокислоту, замененную на изолейцин, но не ограничивается ими.
Кроме того, не только природные аминокислоты, но также не встречающиеся в природе аминокислоты могут быть включены в число заменяющих аминокислотных остатков. Не встречающиеся в природе аминокислоты могут представлять собой, например, D-аминокислоты, гомо-аминокислоты, бета-гомо-аминокислоты, N-метил-аминокислоты, альфа-метил-аминокислоты, необычные аминокислоты (например цитруллин, нафтилаланин и т.п.), но не ограничиваются ими. В то же самое время в настоящем изобретении под выражением " заменена конкретная аминокислота " понимают, что была заменена аминокислота, отличная от аминокислоты до замены, хотя последнее не указывает на то, что другая аминокислота была заменена.
Использованный здесь термин "соответствующий" относится к аминокислотному остатку в положении, указанном в белке или пептиде, или к аминокислотному остатку, который похож, идентичен или гомологичен остатку, указанному в белке или пептиде. Как она использована здесь, "соответствующая область", как правило, относится к схожему положению в родственном белке или референсном белке.
В настоящем изобретении может быть использована специфическая нумерация положений аминокислотных остатков в используемом здесь полипептиде. Например, возможно перенумеровать положения аминокислотных остатков в полипептиде по настоящему изобретению в соответствующие положения путем выравнивания полипептидной последовательности по настоящему изобретению с желаемым полипептидом, с которым производится сравнение.
Модифицированный полипептид, обладающий цитратсинтазной активностью, предложенный в настоящем изобретении, может обладать улучшенной способностью продуцировать L-аминокислоту по сравнению с полипептидом до модификации путем замены аминокислоты в конкретном положении в описанной выше цитратсинтазе.
Модифицированный полипептид может обладать гомологией последовательности 80% или более и менее чем 100% с аминокислотной последовательностью SEQ ID NO: 1, но не ограничивается этим. В частности, модифицированный полипептид по настоящему изобретению может обладать гомологией по меньшей мере 80%, 90%, 95%, 96%, 97%, 98% или 99% с аминокислотной последовательностью SEQ ID NO: 1. Кроме того, ясно, что дополнительно к аминокислотной последовательности в положении 312 любой белок, имеющий аминокислотную последовательность, в которой часть этой аминокислотной последовательности подвергнута делетированию, модификации, замене или вставке, также может попадать в объем настоящего изобретения при условии, что этот белок обладает такой гомологией и демонстрирует эффекты, соответствующие эффектам вышеприведенного белка.
Кроме того, в настоящем изобретении, хотя в описании присутствует "белок или полипептид, имеющий аминокислотную последовательность конкретной SEQ ID NO", понятно, что любой белок, который имеет делецию, модификацию, замену или вставку в части аминокислотной последовательности, также может быть использован в настоящем изобретении при условии, что этот белок обладает активностью, по существу такой же или эквивалентной активности полипептида, состоящего из аминокислотной последовательности соответствующей SEQ ID NO. Например, в случае, когда белок или полипептид обладает активностью, которая является такой же или эквивалентной активности модифицированного полипептида, не исключена мутация, которая может возникать из-за вставки антисмысловой последовательности ниже или выше аминокислотной последовательности соответствующей SEQ ID NO, встречающаяся в природе мутация или молчащая мутация в дополнение к модификации в положении 312, которая обеспечивает конкретную активность, и понятно, что белок или полипептид, обладающий такой вставкой последовательности или мутацией, также находится в объеме настоящего изобретения.
Модифицированный полипептид, в котором аминокислота, соответствующая положению 312 в аминокислотной последовательности SEQ ID NO: 1, заменена другой аминокислотой, может включать аминокислотную последовательность SEQ ID NO: 3. Конкретней, модифицированный полипептид, в котором метионин, соответствующий положению 312 в аминокислотной последовательности SEQ ID NO: 1, заменен на изолейцин, может состоять из аминокислотной последовательности SEQ ID NO: 3. Кроме того, модифицированный полипептид может включать аминокислотную последовательность, обладающую гомологией 80% или более и менее чем 100% с аминокислотной последовательностью SEQ ID NO: 3, но не ограничивается ими. В частности, модифицированный полипептид по настоящему изобретению может включать аминокислотную последовательность SEQ ID NO: 3 или полипептид, обладающий гомологией по меньшей мере 80%, 90%, 95%, 96%, 97%, 98% или 99% с аминокислотной последовательностью SEQ ID NO: 3. Кроме того, понятно, что любой белок, имеющий аминокислотную последовательность, в которой часть аминокислотной последовательности подвергнута делеции, модификации, замене или вставке, в дополнение к аминокислотной последовательности в положении 312, также может быть использован в настоящем изобретении при условии, что этот белок обладает такой гомологией и включает аминокислотную последовательность, демонстрирующую эффект, соответствующий эффекту вышеприведенного белка.
В случае микроорганизма, включающего модифицированный полипептид с ослабленной цитратсинтазной активностью для задач настоящего изобретения, он обладает особенностью, заключающейся в том, что выход L-аминокислоты увеличен при скорость потребления сахара, схожей со скоростью потребления сахара контролем. Таким образом, можно сделать вывод, что продуцируемое количество L-аминокислот может быть увеличено посредством подходящего баланса между потоком углерода в цикл ТСА и потребляемым количеством оксалоацетата, используемого в качестве предшественника биосинтеза L-аминокислоты, путем регулирования активности цитратсинтазы.
Используемый здесь термин "гомология" относится к проценту идентичности между двумя полинуклеотидными или полипептидными группировками. Он также может относиться к степени соответствия с заданной аминокислотной последовательностью или нуклеотидной последовательностью, и может быть выражен в виде процентной доли. В описании настоящего изобретения гомологичная последовательность, обладающая активностью, которая идентична или схожа с активностью данной аминокислотной последовательности или нуклеотидной последовательности, может быть указана в терминах "% гомологии". Гомология между последовательностью от одной группировки к другой может быть определена при помощи способов, известных в области техники. Например, гомология может быть подтверждена с использованием стандартного программного обеспечения для расчета таких параметров, как оценка, идентичность и сходство, в частности BLAST 2.0, или путем сравнения последовательностей посредством гибридизационных экспериментов по Саузерну в условиях с определенной строгостью. Определенные подходящие условия гибридизации находятся в объеме соответствующего уровня техники, и могут быть определены при помощи способа, хорошо известного специалисту в данной области техники (например, J. Sambrook et al., Molecular Cloning, A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory press, Cold Spring Harbor, New York, 1989; F.M. Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., New York).
В еще одном аспекте настоящего изобретения может быть предложен полинуклеотид, кодирующий модифицированный полипептид, обладающий цитратсинтазной активностью, где аминокислота, соответствующая положению 312 от N-конца полипептида, состоящего из аминокислотной последовательности SEQ ID NO: 1, заменена другой аминокислотой.
Аминокислотная последовательность SEQ ID NO: 1, цитратсинтаза, и модифицированный полипептид являются такими как описано выше.
Используемый здесь термин "полинуклеотид", который представляет собой полимер из нуклеотидов, состоящий из нуклеотидных мономеров, связанных в цепочку посредством ковалентных связей, представляет собой цепь ДНК или РНК, имеющую по меньшей мере определенную длину, и, конкретней, может относиться к фрагменту полинуклеотида, кодирующему вариант.
Полинуклеотид по настоящему изобретению может включать без ограничения любую полинуклеотидную последовательность, кодирующую модифицированный полипептид по настоящему изобретению, который обладает цитратсинтазной активностью. В описании настоящего изобретения ген, кодирующий аминокислотную последовательность цитратсинтазы, может представлять собой ген gltA, и этот ген может происходить из Corynebacterium glutamicum, но не ограничивается этим. Кроме того, этот ген может представлять собой нуклеотидную последовательность, кодирующую аминокислотную последовательность SEQ ID NO: 1, и конкретней, он может представлять собой последовательность, включающую нуклеотидную последовательность SEQ ID NO: 2, но не ограничивается этим.
В частности, полинуклеотид по настоящему изобретению может претерпевать различные модификации в кодирующей области в объеме, в котором не изменяется аминокислотная последовательность полипептида вследствие вырожденности кодонов или с учетом кодонов, которые являются предпочтительными в организме, в котором должен экспрессироваться полипептид. В частности, любая полинуклеотидная последовательность, кодирующая модифицированный полипептид, в котором аминокислота, соответствующая положению 312 в аминокислотной последовательности SEQ ID NO: 1, заменена другой аминокислотой, может быть включена без ограничения. Например, модифицированный полипептид по настоящему изобретению может представлять собой полинуклеотидную последовательность, кодирующую аминокислотную последовательность SEQ ID NO: 3, но не ограничивается этим. Конкретней, модифицированный полипептид по настоящему изобретению может представлять собой полипептид, который состоит из полинуклеотидной последовательности SEQ ID NO: 4, но не ограничивается этим.
Кроме того, без ограничения может быть включен зонд, который может быть получен из известной генной последовательности, например, любой последовательности, которая может гибридизоваться в строгих условиях с последовательностью, комплементарной всей или части нуклеотидной последовательности, для кодирования белка, обладающего цитратсинтазной активностью, в котором аминокислота в положении 312 в аминокислотной последовательности SEQ ID NO: 1 заменена другой аминокислотой. Термин "строгие условия" относится к условиям, при которых допускается специфическая гибридизация между полинуклеотидами. Такие условия специально описаны в литературе (например, J. Sambrook et al., выше). Например, строгие условия могут включать условия, при которых гены, обладающие высокой гомологией или идентичностью 40% или выше, в частности, 90% или выше, конкретней 95% или выше, еще конкретней 97% или выше, еще конкретней 99% или выше, гибридизуются друг с другом, а гены, обладающие гомологией или идентичностью ниже чем вышеприведенные гомологии или идентичности, не гибридизуются друг с другом, или обычные условия отмывки при гибридизации по Саузерну (т.е., однократная отмывка, в частности, два или три раза при концентрации соли и температуре, соответствующих 60°С, 1 × SSC (раствор цитрата и хлорида натрия), 0,1% SDS (додецилсульфат натрия), в частности, 60°С, 0,1 × SSC, 0,1% SDS, и конкретней 68°С, 0,1 × SSC, 0,1% SDS).
Для гибридизации требуется, чтобы две нуклеиновые кислоты содержали комплементарные последовательности, хотя ошибки спаривания между основаниями возможны в зависимости от строгости условий гибридизации. Термин "комплементарный" используют для описания взаимодействия между нуклеотидными основаниями, которые могут гибридизоваться друг с другом. Например, в случае ДНК аденозин комплементарен тимину и цитозин комплементарен гуанину. Таким образом, настоящее изобретение может включать фрагменты выделенных нуклеиновых кислот, комплементарные всей последовательности, а также последовательностям нуклеиновых кислот, по существу похожим на нее.
В частности, полинуклеотиды, обладающие гомологией или идентичностью, могут быть обнаружены с использованием условий гибридизации, включающих стадию гибридизации при величине Tm 55°С в вышеописанных условиях. Кроме того, величина Tm может составлять 60°С, 63°С или 65°С, но не ограничивается ими, и может быть подходящим образом скорректирована специалистом в данной области техники в зависимости от задачи.
Подходящая строгость условий для гибридизации полинуклеотидов зависит от длины полинуклеотидов и степени комплементарности, и эти переменные хорошо известны в области техники (смотри Sambrook et al., выше, 9.50-9.51, 11.7-11.8).
В еще одном аспекте настоящего изобретения может быть предложен вектор, включающий полинуклеотид, кодирующий модифицированный полипептид, обладающий цитратсинтазной активностью, где аминокислота, соответствующая положению 312 от N-конца полипептида, состоящего из аминокислотной последовательности SEQ ID NO: 1, заменена другой аминокислотой.
Аминокислотная последовательность SEQ ID NO: 1, цитратсинтаза, модифицированный полипептид и полинуклеотид являются такими, как описано выше.
Используемый здесь термин "вектор" относится к ДНК продукту, содержащему нуклеотидную последовательность полинуклеотида, кодирующего желаемый полипептид, который функционально связан с подходящей регуляторной последовательностью для экспрессии желаемого полипептида в подходящем хозяине. Регуляторная последовательность может включать промотор, способный инициировать транскрипцию, любую операторную последовательность для регуляции такой транскрипции, последовательность, кодирующую подходящий сайт для связывания с рибосомой на мРНК, и последовательности, регулирующие прекращение транскрипции и трансляции. После трансформации в подходящую клетку-хозяина вектор может реплицироваться или функционировать независимо от генома хозяина, или сам может быть интегрирован в геном.
Вектор, используемый в настоящем изобретении, не ограничен конкретным образом, и может быть использован любой вектор, известный в области техники. Примеры обычно используемого вектора могут включать природные или рекомбинантные плазмиды, космиды, вирусы и бактериофаги. Например в качестве фагового вектора или космидного вектора могут быть использованы pWE15, М13, MBL3, MBL4, IXII, ASHII, APII, t10, t11, Charon4A, Charon21A и т.п, и в качестве плазмидного вектора могут быть использованы векторы на основе pBR, pUC, pBluescriptII, pGEM, pTZ, pCL, pET и т.п. В частности, могут быть использованы векторы pCR2.1, pDC, pDZ, pACYC177, pACYC184, pCL, pECCG117, pUC19, pBR322, pMW118, pCC1BAC и т.п.
Вектор, который может быть использован в настоящем изобретении, не ограничен конкретным образом, и может быть использован любой известный экспрессионный вектор. Кроме того, полинуклеотид, кодирующий желаемый полипептид, может быть встроен в хромосому с использованием вектора для внутриклеточного встраивания в хромосому. Встраивание полинуклеотида в хромосому может быть произведено без ограничения при помощи любого способа, известного в области техники (например, при помощи гомологичной рекомбинации). Кроме того, вектор может дополнительно включать селективный маркер для подтверждения встраивания в хромосому. Селективный маркер предназначен для отбора клеток, трансформированных вектором, то есть для подтверждения того, что встроена желаемая молекула нуклеиновой кислоты. Могут быть использованы маркеры, обеспечивающие селективные фенотипы, такие как резистентность к лекарственным средствам, потребность в питательных веществах, резистентность к цитотоксическим агентам и экспрессия поверхностных белков. При обработке селективным агентом только клетки, экспрессирующие селективные маркеры, могут выжить или проявлять другие фенотипические признаки, и, таким образом, могут быть отобраны трансформированные клетки.
Используемый здесь термин "трансформация" относится к введению вектора, содержащего полинуклеотид, кодирующий желаемый белок, в клетку-хозяина таким образом, что белок, кодируемый этим полинуклеотидом, может экспрессироваться в данной клетке-хозяине. Пока трансформированный полинуклеотид может экспрессироваться в клетке-хозяине, не важно, интегрирован ли трансформированный полинуклеотид в хромосому клетки-хозяина и находится в ней, или расположен за пределами хромосомы, и оба случая могут быть включены.
Кроме того, полинуклеотид может включать ДНК и РНК, кодирующие желаемый белок.
Полинуклеотид может быть введен в любой форме при условии, что он может быть введен в клетку-хозяина и экспрессироваться в ней. Например, полинуклеотид может быть введен в клетку-хозяина в форме экспрессионной кассеты, которая представляет собой генетическую конструкцию, включающую все необходимые элементы, требующиеся для ее автономной экспрессии. Экспрессионная кассета традиционно может содержать промотор, функционально связанный с полинуклеотидом, сигнал терминации транскрипции, сайт связывания с рибосомой и сигнал терминации трансляции. Экспрессирующаяся кассета может находиться в форме экспрессионного вектора, способного к саморепликации. Кроме того, полинуклеотид без ограничения может быть введен в клетку-хозяина сам по себе и функционально связан с последовательностью, требующейся для его экспрессии в клетке-хозяине. Способ трансформации включает любой способ встраивания полинуклеотида в клетку и может быть осуществлен путем выбора подходящего стандартного способа, известного в области техники, в зависимости от клетки-хозяина. Например, способ может включать электропорацию, осаждение фосфатом кальция (Са(H2PO4)2, CaHPO4 или Са3(PO4)2), осаждение хлоридом кальция (CaCl2), микроинъекцию, способ с использованием полиэтиленгликоля (PEG), способ с использованием DEAE (диэтиламиноэтил)-декстрана, способ с использованием катионных липосом, способ с использованием ацетата лития-DMSO (диметилсульфоксид) и т.п, но не ограничиваться ими.
Кроме того, используемый здесь термин "функционально связанный" может означать, что полинуклеотидная последовательность функционально связана с промоторной последовательностью, которая инициирует и опосредует транскрипцию полинуклеотида, кодирующего желаемый белок по настоящему изобретению. Функциональное связывание может быть осуществлено с использованием способа рекомбинации генов, известного в области техники, и сайт-специфического расщепления ДНК, и связывание может быть осуществлено с использованием ферментов для расщепления и лигирования, известных в области техники, и т.п, но функциональная связь не ограничивается ими.
В еще одном аспекте настоящего изобретения может быть предложен микроорганизм, продуцирующий L-аминокислоту, включающий модифицированный полипептид, обладающий цитратсинтазной активностью, где аминокислота, соответствующая положению 312 от N-конца полипептида, состоящего из аминокислотной последовательности SEQ ID NO: 1, заменена другой аминокислотой, полинуклеотид, кодирующий этот модифицированный полипептид, и вектор, включающий этот полинуклеотид.
Аминокислотная последовательность SEQ ID NO: 1, цитратсинтаза, модифицированный полипептид, нуклеотид и вектор являются такими, как описано выше.
Микроорганизм может представлять собой микроорганизм, который включает полинуклеотид, кодирующий модифицированный полипептид, или который трансформирован вектором, включающим полинуклеотид, кодирующий модифицированный полипептид, но не ограничивается ими.
Кроме того, микроорганизм может обладать улучшенной способностью продуцировать L-аминокислоты без подавления роста или скорости потребления сахара этим микроорганизмом по сравнению с микроорганизмом, включающим полипептид дикого типа. Таким образом, L-аминокислота может быть получена с высоким выходом из этих микроорганизмов.
Используемый здесь термин "микроорганизм, включающий модифицированный полипептид", относится к микроорганизму, который в природе обладает слабой способностью продуцировать L-аминокислоты, или к микроорганизму, обеспеченному способностью продуцировать L-аминокислоты, родительский штамм которого не обладал способностью продуцировать L-аминокислоты. В частности, микроорганизм представляет собой микроорганизм, экспрессирующий модифицированный полипептид, включающий по меньшей мере одну модификацию аминокислоты в полипептиде, обладающий цитратсинтазной активностью, и модификация аминокислоты может включать замену аминокислоты, соответствующей положению 312 от N-конца аминокислотной последовательности SEQ ID NO: 1, другой аминокислотой. Модифицированный полипептид, обладающий цитратсинтазной активностью, экспрессирующийся микроорганизмами, может обладать ослабленной активностью, но не ограничивается ими.
Микроорганизм может представлять собой клетку или микроорганизм, который включает полинуклеотид, кодирующий модифицированный полипептид, или который трансформирован вектором, включающим полинуклеотид, кодирующий модифицированный полипептид, таким образом, что модифицированный полипептид может экспрессироваться. Для задач настоящего изобретения может быть использована любая клетка-хозяин или микроорганизм, при условии, что она(он) может продуцировать L-аминокислоту за счет включения модифицированного полипептида.
Используемый здесь термин "микроорганизм, продуцирующий L-аминокислоту", включает все природные или искусственно генетически модифицированные микроорганизмы, и он может представлять собой микроорганизм, в котором конкретный механизм усилен или ослаблен вследствие встраивания чужеродного гена или усиления или ослабления активности эндогенного гена, и для задачи продуцирования L-аминокислоты он может представлять собой микроорганизм, в котором осуществлена генетическая модификация или активность ослаблена. Для задач настоящего изобретения микроорганизм, продуцирующий L-аминокислоту, может относиться к микроорганизму, который включает модифицированный полипептид, таким образом, что он может продуцировать желаемую L-аминокислоту в избыточном количестве из источника углерода в среде по сравнению с диким типом или немодифицированным микроорганизмом. В описании настоящего изобретения "микроорганизм, продуцирующий L-аминокислоту", может быть использован взаимозаменяемо с "микроорганизмом, обладающим способностью продуцировать L-аминокислоту", или "продуцирующий L-аминокислоту микроорганизм".
L-аминокислота, продуцируемая микроорганизмом, продуцирующим L-аминокислоту, может представлять собой любую одну или более чем одну, выбранную из группы, состоящей из лейцина, лизина, валина, изолейцина и о-ацетилгомосерина, но не ограничивается ими.
Конкретные примеры микроорганизма, продуцирующего L-аминокислоту, могут включать штамм микроорганизма рода Escherichia, Serratia, Erwinia, Enterobacteria, Salmonella, Streptomyces, Pseudomonas, Brevibacterium, Corynebacterium, и т.п. и, в частности, микроорганизм рода Corynebacterium, и, конкретней, Corynebacterium glutamicum, но не ограничивается ими.
В частности, микроорганизм, продуцирующий L-аминокислоту, может представлять собой штамм CJL-8100, обладающий способностью продуцировать L-лейцин за счет введения варианта изопропилмалеатсинтазы [leuA_(R558H, G561D)] в микроорганизм рода Corynebacterium, Corynebacterium CJ3P (Binder et al., Genome Biology 2012, 13:R40), обладающий способностью продуцировать L-лизин за счет введения трех мутаций [pyc(P458S), hom(V59A), lysC(T311I)] в микроорганизмы рода Corynebacterium, Corynebacterium KCCM11201P, который представляет собой штамм, продуцирующий валин (US 8465962 В2), Corynebacterium KCCM11248P, который представляет собой штамм, продуцирующий L-изолейцин (Корейский патент №10-1335789), или Corynebacterium glutamicum, обладающий способностью продуцировать О-ацетилгомосерин за счет делеции гена metB, кодирующего цистатионингамма-синтазу, включенную в путь деградации О-ацетилгомосерина, и гена metY, кодирующего O-ацетилгомосерин-(тиол)-лиазу в микроорганизме рода Corynebacterium, и путем введения мутации (L377K) (US 10662450 В2) для высвобождения ингибирования по типу обратной связи для L-лизина и L-треонина гена lysC, кодирующего аспартаткиназу, для увеличения биосинтеза О-ацетилгомосерина, но не ограничивается ими. Для задач настоящего изобретения микроорганизм, продуцирующий L-аминокислоту, может также включать модифицированный полипептид для увеличения способности продуцировать желаемую L-аминокислоту.
Использованный здесь "микроорганизм рода Corynebacterium" может в частности представлять собой Corynebacterium glutamicum, Corynebacterium ammoniagenes, Brevibacterium lactofermentum, Brevibacterium flavum, Corynebacterium thermoaminogenes, Corynebacterium efficiens и т.п., но не обязательно ограничиваться ими. Конкретней, микроорганизм рода Corynebacterium по настоящему изобретению может представлять собой Corynebacterium glutamicum, в котором выход L-аминокислоты увеличен при наличии схожей скорости потребления сахара, хотя цитратсинтазная активность ослаблена по сравнению с не модифицированным микроорганизмом.
В еще одном аспекте настоящего изобретения может быть предложен способ получения L-аминокислоты, включающий:
культивирование в среде микроорганизма, включающего модифицированный полипептид, обладающий цитратсинтазной активностью, где аминокислота, соответствующая положению 312 от N-конца полипептида, состоящего из аминокислотной последовательности SEQ ID NO: 1, заменена другой аминокислотой, полинуклеотид, кодирующий этот модифицированный полипептид, или вектор, включающий этот полинуклеотид.
Аминокислотная последовательность SEQ ID NO: 1, цитратсинтаза, модифицированный полипептид, полинуклеотид, вектор и микроорганизм являются такими как описано выше.
Способ может быть легко определен специалистом в данной области техники оптимизированными условиями культивирования и условиями ферментативной активности, известными в области техники. В частности, микроорганизм может культивироваться посредством известной периодической культуры, непрерывной культуры, подпитываемой культуры и т.п, но конкретно не ограничен ими. В частности, условия культивирования не ограничены конкретным образом, но рН (например, рН 5 - рН 9, в частности, рН 6 - рН 8, и конкретней, рН 6,8) может быть подходящим образом скорректирован с использованием основного соединения (например, гидроксида натрия, гидроксида калия или аммиака) или кислотного соединения (например, ортофосфорной кислоты или серной кислоты). Аэробные условия могут поддерживаться путем добавления в культуру кислорода или содержащей кислород смеси газов. Температура в культуре может поддерживаться на уровне от 20°С до 45°С, и, конкретно, на уровне от 25°С до 40°С, и выращивание может быть осуществлено в течение, приблизительно, от 10 до 160 часов, но условия культивирования не ограничиваются ими. L-аминокислота, продуцируемая в культуре, может быть секретирована в среду или может оставаться внутри клеток.
Кроме того, в используемой культуральной среде источники углерода, такие как, без ограничения, сахара и углеводы (например, глюкоза, сахароза, лактоза, фруктоза, мальтоза, меласса, крахмал и целлюлоза), масла и жиры (например, соевое масло, подсолнечное масло, арахисовое масло и кокосовое масло), жирные кислоты (например, пальмитиновая кислота, стеариновая кислота и линолевая кислота), спирты (например, глицерин и этанол) и органические кислоты (например, уксусная кислота), могут быть использованы сами по себе или в комбинации; источники азота, такие как, без ограничения, азотсодержащие органические соединения (например, пептон, дрожжевой экстракт, мясной сок, солодовый экстракт, жидкий кукурузный экстракт, соевая мука и мочевина) или неорганические соединения (например, сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония), могут быть использованы сами по себе или в комбинации; и источники калия, такие как, без ограничения, дигидрофосфат калия, гидрофосфат калия или соответствующие натрийсодержащие соли, могут быть использованы сами по себе или в комбинации. Кроме того, другие необходимые ростостимулирующие вещества, включая соли металлов (например, сульфат магния или сульфат железа), аминокислоты и витамины могут содержаться в среде, но необходимые ростостимулирующие вещества не ограничиваются ими.
Способ может дополнительно включать стадию выделения L-аминокислот из культуральной среды или микроорганизма после стадии культивирования, но не ограничивается этим.
В способе выделения L-аминокислоты, продуцируемой на стадии культивирования, возможно собирать желаемую аминокислоту из культурального раствора с использованием подходящего способа, известного в области техники, согласно со способом культивирования. Например, могут быть использованы центрифугирование, фильтрование, анионообменная хроматография, кристаллизация, ВЭЖХ (высокоэффективная жидкостная хроматография) и т.п, и желаемая L-аминокислота может быть выделена из среды или микроорганизма с использованием подходящего способа, известного в области техники.
Кроме того, стадия выделения может включать процесс очистки, и процесс очистки может быть осуществлен с использованием подходящего способа, известного в области техники. Таким образом, выделяемая L-аминокислота может находиться в очищенной форме или среде для ферментации микроорганизмов, содержащей L-аминокислоту.
Продуцируемая L-аминокислота может представлять собой любую одну или более чем одну аминокислоту, выбранную из группы, состоящей из лейцина, лизина, валина, изолейцина и о-ацетилгомоцистеина, но не ограничивается ими.
В еще одном аспекте настоящего изобретения может быть предложена композиция для продуцирования L-аминокислоты, включающая микроорганизм рода Corynebacterium, содержащий модифицированный полипептид, обладающий цитратсинтазной активностью, или его культуру.
Микроорганизм может представлять собой микроорганизм рода Corynebacterium, или, в частности, Corynebacterium glutamicum, но не ограничивается ими. Микроорганизм является таким, как описано выше
Композиция для продуцирования L-аминокислоты, может означать композицию, способную продуцировать L-аминокислоту при помощи модифицированного полипептида по настоящему изобретению, который обладает цитратсинтазной активностью. Композиция может включать без ограничения модифицированный полипептид, обладающий цитратсинтазной активностью, или конфигурацию, способную управлять модифицированным полипептидом, обладающим цитратсинтазной активностью. Модифицированный полипептид, обладающий цитратсинтазной активностью, может находиться в форме, включенной в вектор таким образом, чтобы экспрессировать ген, функционально связанный в клетке-хозяине, в которую он введен.
Композиция может дополнительно включать криопротектор или эксципиент. Криопротектор или эксципиент может представлять собой неприродное вещество или природное вещество, но не ограничивается ими. В еще одном воплощении криопротектор или эксципиент может представлять собой вещество, которое в природе не контактирует с микроорганизмом, или вещество, которое в природе не содержится одновременно с микроорганизмом, но не ограничивается ими.
В еще одном аспекте настоящего изобретения может быть предложено применение микроорганизма рода Corynebacterium, который включает модифицированный полипептид, обладающий цитратсинтазной активностью, для продуцирования L-аминокислоты.
Способ реализации изобретения
Далее, описание настоящего изобретения будет раскрыто подробно при помощи примеров. Тем не менее, эти примеры приведены исключительно для иллюстративных задач, и не предполагается, что они ограничивают объем описания настоящего изобретения.
Пример 1: Открытие мутации gltA
1-1. Конструирование вектора, включающего gltA
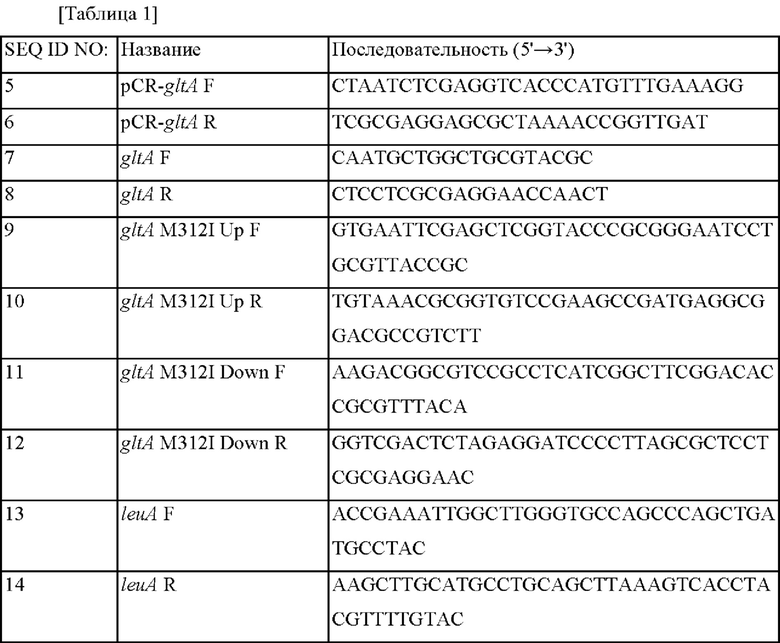
Для конструирования библиотеки мутаций gltA, обладающей цитратсинтазной активностью, сначала конструировали рекомбинантный вектор, содержащий часть gltA. Аминокислотная последовательность и нуклеотидная последовательность gltA дикого типа являются такими же как SEQ ID NO: 1 и SEQ ID NO: 2, соответственно. ПЦР осуществляли с использованием хромосомной ДНК штамма дикого типа Corynebacterium glutamicum в качестве матрицы вместе с праймерами SEQ ID NO: 5 и SEQ ID NO: 6, и амплифицированный продукт клонировали в вектор pCR2.1 E. coli с использованием набора для клонирования ТОРО (Invitrogen) с получением pCR-gltA.
1-2. Конструирование библиотеки мутаций gltA
Библиотеку мутаций gltA конструировали на основе вектора, сконструированного в примере 1-1. Библиотеку конструировали с использованием набора для ПЦР пониженной точности (clontech Diversify® PCR Random Mutagenesis Kit). Реакцию ПЦР осуществляли с использованием SEQ ID NO: 5 и SEQ ID NO: 6 в качестве праймеров в условиях, в которых может возникать мутация. В частности, ПЦР осуществляли путем предварительного нагревания при 94°С в течение 30 секунд с последующими 25 циклами денатурации при 94°С в течение 30 секунд и полимеризацией при 68°С в течение полутора минут при условиях, в которых от 0 до 3 мутаций возникают на 1000 п.о. Полученные таким образом продукты ПЦР использовали в качестве мегапраймера (от 500 нг до 125 нг), который подвергали 25 циклам денатурации при 95°С в течение 50 секунд, отжигая при 60°С в течение 50 секунд, и полимеризации при 68°С в течение 12 минут, обрабатывали DpnI и трансформировали в Е. coli DH5α, и трансформированные Е. coli DH5α высевали на чашки с твердой средой LB (лизогенная среда), содержащей канамицин (25 мг/л). Отбирали 20 видов трансформированных колоний, и полученные из них плазмиды подвергали анализу путем полинуклеотидного секвенирования. В результате подтвердили, что были получены мутации в сайтах, отличных друг от друга, с частотой 2 мутации/п.о. В результате отобрали приблизительно 20000 трансформированных колоний Е. coli и из них экстрагировали плазмиды и назвали библиотекой pTOPO-gltA.
Праймеры, использованные в этом примере, представлены в Таблице 1 ниже.
Пример 2: Оценка сконструированной библиотеки и отбор вариантов
Библиотеку pTOPO-gltA, сконструированную в примере 1-2, трансформировали в Corynebacterium glutamicun АТСС13032 путем электропорации, и затем высевали на чашки с питательной средой, содержащей 25 мг/л канамицина, с получением колоний 10000 штаммов, в которые был встроен мутантный ген, и каждую колонию называли соответственно от ATCC13032/pTOPO_gltA(mt)1 до ATCC13032/pTOPO_gltA(mt) 10000.
Оценку титра ферментации для каждой колонии для идентификации колоний с увеличенной продукцией лейцина среди полученных 10000 колоний осуществляли следующим образом.
- Среда для продуцирования: глюкоза 100 г, (NH4)2SO4 40 г, соевый белок 2,5 г, кукурузный экстракт 5 г, мочевина 3 г, KH2PO4 1 г, MgSO4⋅7H2O 0,5 г, биотин 100 мкг, тиамин HCl 1000 мкг, кальций-пантотеновая кислота 2000 мкг, никотинамид 3000 мкг, СаСО3 30 г (на основе 1 л дистиллированной воды), рН 7,0
Каждую колонию инокулировали с помощью платиновой петли во флакон с угловой перегородкой, содержащий 25 мкг/мл канамицина в 25 мл автоклавированной среды для продуцирования, и культивировали при встряхивании при 30°С при 200 об./мин в течение 60 часов. После завершения культивирования количество продуцированного лейцина измеряли при помощи способа с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ, SHIMAZDU LC20A) для отбора одного штамма, обладающего наиболее улучшенной лейцин-родуцирующей способностью по сравнению с штаммом Corynebacterium glutamicum дикого типа. Концентрация продуцированного лейцина в выбранных штаммах представлена в Таблице 2 ниже.

Затем для подтверждения генетической мутации в мутантном штамме осуществляли ПЦР с использованием праймеров SEQ ID NO: 7 и SEQ ID NO: 8 на основе штамма ATCC13032/pTOPO_gltA(mt)3142, а затем секвенирование для сравнения гена gltA с АТСС13032 дикого типа. В результате подтвердили, что вышеприведенный штамм содержал мутацию в гене gltA.
В частности, подтвердили, что G, который представлял собой 936-й нуклеотид гена gltA в штамме ATCC13032/pTOPO_gltA(mt)3142, был заменен на С. Последняя представляет собой мутацию, при которой метионин в положении 312 в аминокислотной последовательности gltA заменен изолейцином. Таким образом, в следующих примерах сделана попытка утановить, оказывает ли эта мутация влияние на количество продуцированного лейцина в микроорганизмах рода Corynebacterium.
Пример 3: Подтверждение лейцин-продуцирующей способности отобранного мутанта gltA
3-1. Конструирование инсерционного вектора, содержащего мутацию gltA
Для введения в штамм мутации, выбранной в Примере 2, была предпринята попытка сконструировать инсерционный вектор. Вектор для введения мутации gltA(M312I) конструировали с использованием метода сайт-направленного мутагенеза. ПЦР осуществляли с использованием хромосомной ДНК штамма дикого типа Corynebacterium glutamicum в качестве матрицы вместе с парой праймеров SEQ ID NO: 9 и 10 и парой праймеров SEQ ID NO: 11 и 12. ПЦР осуществляли путем денатурации при 94°С в течение 5 минут, а затем 30 циклов денатурации при 94°С в течение 30 секунд, отжигая при 55°С в течение 30 секунд, и полимеризации при 72°С в течение полутора минут, и затем полимеризации при 72°С в течение 5 минут. В результате были сконструированы вектор pDC, в котором результирующий генный фрагмент был расщеплен ферментом рестрикции SmaI, и вектор pDC-gltA(M312I), в котором метионин, который представляет собой 312-ую аминокислоту, был заменен изолейцином путем связывания и клонирования гомологичной последовательности из 15 нуклеотидов по концам фрагментов ДНК с использованием фермента слияния.
3-2. Введение варианта в АТСС13032 и его оценка
Вектор pDC-gltA (M312I), сконструированный в примере 3-1, трансформировали в АТСС13032, и штамм, у которого вектор был встроен в хромосому путем рекомбинации гомологичной последовательности, отбирали в среде, содержащей 25 мг/л канамицина. Отобранный первичный штамм вновь подвергали вторичному кроссоверу и отбирали штамм, в который была введена мутация желаемого гена. Введение мутации гена gltA в окончательно трансформированный штамм подтверждали путем осуществления ПЦР с использованием праймеров SEQ ID NO: 7 и SEQ ID NO: 8, и затем анализа основной последовательности, таким образом, подтверждая то, что мутация введена в штамм. Сконструированный штамм назвали ATCC13032_gltA_M312I.
Для оценки лейцинп-родуцирующей способности штамма ATCC13032_gltA_M312I, сконструированного выше, также осуществляли оценку титра при ферментации в колбе. Каждый из Corynebacterium glutamicum АТСС13032, который представляет собой родительский штамм, и сконструированного выше ATCC13032_gltA_M312I инокулировали при помощи платиновой петли в колбу с угловой перегородкой на 250 мл, содержащую 25 мл среды для продуцирования примером 2, и культивировали со встряхиванием при 200 об./мин при 30°С в течение 60 часов для продуцирования лейцина. После завершения культивирования количество продуцированного лейцина измеряли при помощи ВЭЖХ. Концентрация лейцина в культуральной среде для каждого протестированного штамма представлена в Таблице 3 ниже.

Пример 4: Подтверждение лейцин-продуцирующей способности отобранной мутации gltA в лейцин-продуцирующих штаммах
Хотя штамм дикого типа рода Corynebacterium продуцирует лейцин, продуцируются лишь его следовые количества. Соответственно, был сконструирован лейцин-продуцирующий штамм, происходящий из АТСС13032, и проводили эксперимент для подтверждения лейцин-продуцирующей способности путем введения отобранной мутации. Конкретный эксперимент приведен далее.
4-1. Конструирование лейцин-продуцирующего штамма CJL-8100
Для конструирования штамма, продуцирующего лейцин в высокой концентрации, происходящего из АТСС13032, был сконструирован вариант штамма CJL-8100 с введенной изопропилмалатсинтазой (далее именуемой как "IPMS"). Мутация включает мутацию, в которой G, представляющий собой 1673-ий нуклеотид гена leuA, кодирующего IPMS, заменен на А, так что аргинин, представляющий собой 558-ую аминокислоту белка IPMS, заменен гистидином, и мутацию, в которой GC, представляющий собой 1682-ий и 1683-ий нуклеотиды, заменен на AT, так что глицин, представляющий собой 561-ую аминокислоту, заменен аспарагиновой кислотой.
Вектор pDC-leuA (R558H, G561D), содержащий мутацию leuA, трансформировали в АТСС13032, и штамм, у которого вектор был встроен в хромосому путем рекомбинации гомологичной последовательности, отбирали в среде, содержащей 25 мг/л канамицина. Отобранный первичный штамм вновь подвергали вторичному кроссоверу и отбирали штамм, в который была введена мутация гена leuA. Введение мутации в окончательно трансформированный штамм подтверждали путем осуществления ПЦР с использованием праймеров с SEQ ID NO: 13 и SEQ ID NO: 14, и затем анализа основной последовательности, таким образом, подтверждая, что мутация была введена. Штамм ATCC13032_leuA_(R558H, G561D), трансформированый вектором pDC-leuA (R558H, G561D), был назван CJL-8100.
4-2. Введение варианта gltA в штамм CJL-8100 его оценка
CJL-8100, представляющий собой лейцин-продуцирующий штамм, трансформировали вектором pDC-gltA (M312I), сконструированным в примере 3-1, и отбирали штамм, у которого вектор был встроен в хромосому путем рекомбинации гомологичной последовательности, в среде, содержащей 25 мг/л канамицина. Отобранный первичный штамм вновь подвергали вторичному кроссоверу и отбирали штамм, в который была введена мутация желаемого гена. Введение мутации гена gltA в окончательно трансформированный штамм подтверждали путем осуществления ПЦР с использованием праймеров с SEQ ID NO: 7 и SEQ ID NO: 8, и затем анализа основной последовательности, таким образом, подтверждая, что мутация gltA была введена в штамм. Сконструированный CJL8100_gltA_M312I был назван СА13-8104 и депонирован в Корейском центре культур микроорганизмов (KCCM), представляющим собой Уполномоченный международный депозитарий Будапешским соглашением, 20 декабря 2019 года под идентификационным номером KCCM 12649Р.
Оценивали лейцин-продуцирующую способность сконструированного выше штамма СА13-8104. Культивирование в колбе осуществляли тем же самым образом, как в Примере 2, и после завершения культивирования количество продуцированного лейцина измеряли способом с использованием ВЭЖХ, и результаты культивирования представлены в Таблице 4 ниже.

Как видно из Таблицы 4, было подтверждено, что лейцин-продуцирующий штамм Corynebacterium glutamicum CJL8100 значительно улучшал лейцин-продуцирующую способность по сравнению с родительским штаммом Corynebacterium glutamicum АТСС13032. Кроме того, было подтверждено, что штамм CJL8104, представляющий собой лейцин-продуцирующий штамм, являющийся результатом введения мутации gltA M312I в штамм Corynebacterium glutamicum CJL8100, обладал улучшенной на 10% лейцин-продуцирующей способностью по сравнению с родительским штаммом CJL8100.
Кроме того, лейцин-продуцирующий штамм CJL-8100 путем электропорации трансформировли pTOPO-gltA(mt)3142 из библиотеки pTOPO-gltA, сконструированной в Примере 1-2, и затем отбирали штамм, трансформированный вектором, в среде, содержащей 25 мг/л канамицина. Отобранный штамм был назван CJL8100/pTOPO_gltA(mt)3142.
Оценивали лейцин-продуцирующую способность сконструированного выше штамма CJL8100/pTOPO_gltA(mt)3142. Культивирование в колбе осуществляли тем же самым образом, как в Примере 2, и после завершения культивирования количество продуцированного лейцина измеряли способом с использованием ВЭЖХ, и результаты культивирования представлены в Таблице 5 ниже.

Результаты вышеприведенного примера могут подтвердить, что аминокислота в положении 312 аминокислотной последовательности gltA, представляющей собой цитратсинтазу, представляет собой важное положение для активности фермента gltA.
Пример 5: Конструирование штамма CJ3P, в который был введен мутантный штамм gltA (M312I), и анализ количества продуцируемого лизина
Для проверки того, имеет ли место эффект изменения цитратсинтазной активности даже в штамме, принадлежащем к Corynebacterium glutamicum, который продуцирует L-лизин, конструировали штамм, в который была введена мутация gltA (M312I), на основе Corynebacterium glutamicum CJ3P (Binder et al., Genome Biology 2012, 13:R40), обладающего L-лизин-продуцирующей способностью, путем введения трех видов мутаций в штаммы дикого типа [рус (P458S), hom (V59A), lysC (T311I)] тем же самым образом, как в Примере 3. Сконструированный таким образом штамм был назван CJ3P::gltA (M312I). В штамме CJ3P, который представляет собой контрольную группу, и в CJ3P::gltA (M312I) измеряли количество лизина, продуцируемого следующим образом. Во-первых, каждый штамм инокулировали в колбу с угловой перегородкой на 250 мл, содержащую 25 мл посевной среды, и культивировали со встряхиванием при 200 об./мин при 30°С в течение 20 часов. Затем 1 мл раствора посевной культуры инокулировали в колбу с угловой перегородкой на 250 мл, содержащую 24 мл среды для продуцирования, и культивировали со встряхиванием при 200 об./мин при 32°С в течение 72 часов. Композиции посевной среды и среды для продуцирования представлены ниже. После завершения культивирования концентрацию L-лизин измеряли с использованием ВЭЖХ (Waters 2478), и результаты представлены в Таблице 6.
<Посевная среда (рН 7,0)>
Глюкоза 20 г, пептон 10 г, дрожжевой экстракт 5 г, мочевина 1,5 г, KH2PO4 4 г, K2HPO4 8 г, MgSO4⋅7H2O 0,5 г, биотин 100 мкг, тиамин HCl 1000 мкг, кальций-пантотеновая кислота 2000 мкг, никотинамид 2000 мкг (на основе 1 л дистиллированной воды)
<Среда для продуцирования (рН 7,0)>
Глюкоза 100 г, (NH4)2SO4 40 г, соевый белок 2,5 г, кукурузный экстракт 5 г, мочевина 3 г, KH2PO4 1 г, MgSO4⋅7H2O 0,5 г, биотин 100 мкг, тиамин HCl 1000 мкг, кальций-пантотеновая кислота 2000 мкг, никотинамид 3000 мкг, СаСО3 30 г (на основе 1 л дистиллированной воды).

Как видно из Таблицы 6, штамм CJ3P::gltA(M312I), в котором мутацию gltA(M312I) вводили в Corynebacterium glutamicum CJ3P, представляющий собой лизин-продуцирующий штамм, имело место увеличение количества продуцируемого лизина до 127% по сравнению с родительским штаммом.
Пример 6: Подтверждение валин-продуцирующей способности отобранной мутации gltA в валин-продуцирующем штамме
Для проверки того, обладает ли отобранная мутация эффектом в отношении валина, представляющий собой типичную аминокислоту с разветвленной цепью, как и лейцин, провели эксперимент по подтверждению валин-продуцирующей способности путем введения отобранной мутации в валин-продуцирующий штамм KCCM11201P (US 8465962 В2) рода Corynebacterium.
KCCM11201P трансформировали вектором pDC-gltA (M312I), сконструированным в Примере 3-1, и отбирали штамм, у которого вектор был встроен в хромосому, путем рекомбинации гомологичной последовательности, в среде, содержащей 25 мг/л канамицина. Отобранный первичный штамм вновь подвергали вторичному кроссоверу и отбирали штамм, в который была введена мутация желаемого гена. Введение мутации гена gltA в окончательно трансформированный штамм подтверждали путем осуществления ПЦР с использованием праймеров с SEQ ID NO: 7 и SEQ ID NO: 8, и затем анализа основной последовательности, тем самым подтверждая, что мутация gltA была введена в штамм. Сконструированный таким образом штамм был назван KCCM11201P - gltA(M312I).
Оценивали валин-продуцирующую способность сконструированного выше штамма KCCM11201P-gltA(M312I). Культивирование в колбе осуществляли так же, как в примере 2-2, и после завершения культивирования количество продуцированного валина измеряли способом с использованием ВЭЖХ, и результаты культивирования представлены в Таблице 7 ниже.

Как видно из Таблицы 7, было подтверждено, что штамм KCCM11201P-gltA(M312I), в котором мутация gltA M312I была введена в штамм Corynebacterium glutamicum KCCM11201P, представляющий собой валин-продуцирующий штамм, обладал на 7% увеличенной валин-продуцирующей способностью по сравнению с KCCM11201P, представляющим собой родительский штамм.
Вышеприведенные результаты могут подтвердить, что аминокислота в положении 312 аминокислотной последовательности gltA, представляющей собой цитратсинтазу, представляет собой важное положение для активности фермента gltA.
Пример 7: Подтверждение L-изолейцин-продуцирующей способности отобранной мутации gltA в изолейцин-продуцирующем штамме
7-1. Конструирование L-изолейцинового штамма с введенной мутацией gltA(M312I) ORF (открытая рамка считывания) в L-изолейцин-продуцирующий штамм Corynebacterium glutamicum KCCM11248P, и оценка его L-изолейцин-продуцирующей способности
Штамм, для которого рекомбинантная плазмида pDC-gltA (M312I), сконструированная в Примере 3-1, была введена в Corynebacterium glutamicum KCCM11248P, представляющий собой L-изолейцин-продуцирующий штамм (Корейский патент №10-1335789), получали путем гомологичной рекомбинации на хромосоме таким же образом, как в Примере 4, и назвали KCCM11248P::gltA(M312I). Сконструированные таким образом штаммы культивировали следующим образом для сравнения изолейцин-продуцирующей способности.
Каждый штамм инокулировали в колбу с угловой перегородкой на 250 мл, содержащую 25 мл посевной среды, и культивировали со встряхиванием при 200 об./мин при 30°С в течение 20 часов. Затем 1 мл раствора посевной среды инокулировали в колбу с угловой перегородкой на 250 мл, содержащий 24 мл среды для продуцирования и культивировали со встряхиванием при 200 об./мин при 30°С в течение 48 часов. Композиции посевной среды и среды для продуцирования представлены ниже.
<Посевная среда (рН 7,0)>
Глюкоза 20 г, пептон 10 г, дрожжевой экстракт 5 г, мочевина 1,5 г, KH2PO4 4 г, K2HPO4 8 г, MgSO4⋅7H2O 0,5 г, биотин 100 мкг, тиамин HCl 1000 мкг, кальций-пантотеновая кислота 2000 мкг, никотинамид 2000 мкг (на основе 1 л дистиллированной воды)
<Среда для продуцирования (рН 7,0)>
Глюкоза 50 г, (NH4)2SO4 12,5 г, соевый белок 2,5 г, кукурузный экстракт 5 г, мочевина 3 г, KH2PO4 1 г, MgSO4⋅7Н2О 0,5 г, биотин 100 мкг, тиамин HCl 1000 мкг, кальций-пантотеновая кислота 2000 мкг, никотинамид 3000 мкг, СаСО3 30 г (на основе 1 л дистиллированной воды)
После завершения культивирования L-изолейцин-продуцирующую способность измеряли при помощи ВЭЖХ. Концентрация L-изолейцина в культуральной растворе для каждого из тестируемых штаммов представлена в Таблице 8 ниже.
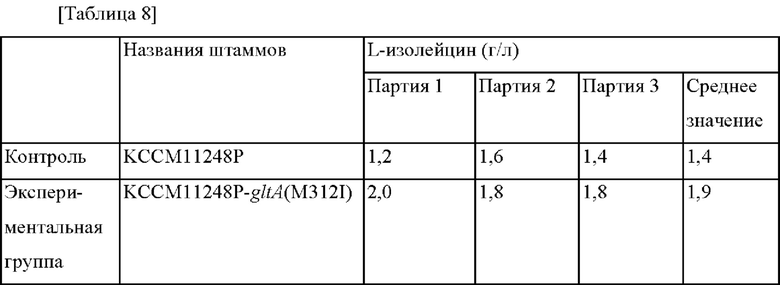
Как видно из Таблицы 8, было подтверждено, что концентрация L-изолейцина увеличивалась приблизительно на 36% в KCCM11248P::gltA (M312I), в который была введена мутация gltA (M312I), по сравнению с L-изолейцин-продуцирующим штаммом KCCM11248P. На основании этого результата было подтверждено, что L-изолейцин-продуцирующая способность может быть улучшена с помощью мутации в гене gltA (M312I).
Вышеприведенные результаты свидетельствуют о том, что введение мутации gltA (M312I) в L-изолейцин-продуцирующий штамм рода Corynebacterium эффективно для продуцирования L-изолейцина.
7-2. Конструирование L-изолейцинового штамма с введенной мутацией gltA(M312I) ORF в штамм Corynebacterium glutamicum дикого типа АТСС13032, и оценка его L-изолейцин-продуцирующей способности
Для подтверждения эффекта введения мутации gltA(M312I) на L-изолейцин-продуцирующую способность конструировали штамм на основе штамма Corynebacterium glutamicum АТСС13032 (далее WT), в который был введен вариант lysC(L377K) (Корейский патент №10-2011994) и вариант hom(R407H), и мутацию ilvA (V323A) (Appl. Enviro. Microbiol., Dec. 1995, p. 4315-4320) вводили в ген, кодирующий известную треониндегидратазу (L-треониндегидратазу) для сравнения L-изолейцин-продуцирующей способности.
ПЦР осуществляли с использованием хромосомной ДНК WT в качестве матрицы с праймерами с SEQ ID NO: 15 и 16 или SEQ ID NO: 17 и 18. Последовательности используемых праймеров представлены в Таблице 9 ниже.

ПЦР осуществляли в условиях ПЦР денатурации при 95°С в течение 5 минут, а затем 30 циклов денатурации при 95°С в течение 30 секунд, отжигая при 55°С в течение 30 секунд, и полимеризации при 72°С в течение 30 секунд, и затем полимеризации при 72°С в течение 7 минут. В результате был получен фрагмент ДНК 509 п.о. по 5' области выше и фрагмент ДНК 520 п.о. по 3' области ниже вокруг мутации гена lysC.
С использованием двух амплифицированных фрагментов ДНК в качестве матриц ПЦР осуществляли с праймерами с SEQ ID NO: 15 и 18 путем денатурации при 95°С в течение 5 минут, а затем 30 циклов денатурации при 95°С в течение 30 секунд, отжигая при 55°С в течение 30 секунд, и полимеризации при 72°С в течение 60 секунд, и затем полимеризации при 72°С в течение 7 минут. В результате амплифицировали фрагмент ДНК 1011 п.о., содержащий мутацию гена lysC, кодирующего аспартокиназный вариант, в котором 377-ой лейцин был заменен лизином.
Вектор pDZ (Корейский патент №0924065), который не может реплицироваться в Corynebacterium glutamicum, и фрагменты ДНК 1011 п.о. обрабатывали ферментом рестрикции XbaI, лигировали с использованием фермента для лигирования ДНК и затем клонировали с получением плазмиды, которую назвали pDZ-lysC (L377K).
Полученный выше вектор pDZ-lysC (L377K) вводили в штамм WT при помощи способа с использованием электрического импульса (Appl. Microbiol. Biothcenol. (1999, 52:541-545)) и затем трансформированный штамм получали в селективной среде, содержащей 25 мг/л канамицина. Путем вторичного кроссовера получали WT::lysC (L377K), который представляет собой штамм, в котором в ген lysC вводили нуклеотидную мутацию путем встраивания фрагмента ДНК в хромосому. Ген, в который была введена нуклеотидная мутация, окончательно подтверждали с помощью ПЦР с использованием праймеров с SEQ ID NO: 15 и 18, а затем путем секвенирования, и сравнивали последовательность с последовательностью гена lysC дикого типа.
Дополнительно, для конструирования вектора, в который введен hom(R407H), осуществляли ПЦР с использованием геномной ДНК WT в качестве матрицы с праймерами с SEQ ID NO: 19 и 20 и SEQ ID NO: 21 и 22. Последовательности используемых праймеров представлены в Таблице 10 ниже.

ПЦР осуществляли в условиях ПЦР денатурации при 95°С в течение 5 минут, а затем 30 циклов денатурации при 95°С в течение 30 секунд, отжигая при 55°С в течение 30 секунд, и полимеризации при 72°С в течение 30 секунд, и затем полимеризации при 72°С в течение 7 минут. В результате был получен фрагмент ДНК 220 п.о. по 5' области выше и фрагмент ДНК 220 п.о. по 3' области ниже вокруг мутации гена hom. С использованием двух амплифицированных фрагментов ДНК в качестве матриц ПЦР осуществляли с использованием праймеров с SEQ ID NO: 5 и 8. ПЦР осуществляли в условиях ПЦР амплификации путем денатурации при 95°С в течение 5 минут, а затем 30 циклов денатурации при 95°С в течение 30 секунд, отжигая при 55°С в течение 30 секунд, и полимеризации при 72°С в течение 30 секунд, и затем полимеризации при 72°С в течение 7 минут. В результате амплифицировали фрагмент ДНК 440 п.о., содержащий мутацию гена hom.
Вектор pDZ, использованный выше, и фрагменты ДНК 440 п.о. обрабатывали ферментом рестрикции XbaI, лигировали с использованием фермента для лигирования ДНК и затем клонировали с получением плазмиды, которую назвали pDZ-hom(R407H).
Полученный выше вектор pDZ-hom(R407H) вводили в штамм WT::lysC(L377K) при помощи способа с использованием электрического импульса и затем трансформированный штамм получали в селективной среде, содержащей 25 мг/л канамицина. Путем вторичного кроссовера получали WT::lysC(L377K)-hom(R407H), который представляет собой штамм, в который была введена нуклеотидная мутация в ген hom путем встраивания фрагмента ДНК в хромосому.
Штамм, в котором рекомбинантную плазмиду pDC-gltA (M312I), сконструированную в Примере 3-1, вводили в штамм WT::lysC(L377K)-hom (R407H), получали путем гомологичной рекомбинации на хромосоме таким же образом, как в вышеприведенном примере, и назвали WT::lysC(L377K)-hom(R407H)-gltA(M312I).
Конструировали пару праймеров (SEQ ID NO: 23 и 24) для амплификации 5' области выше и пару праймеров (SEQ ID NO: 25 и 26) для амплификации 3' области ниже вокруг сайта мутации для конструирования вектора, в который вводили известную мутацию ilvA (V323A), на основе гена ilvA. Праймеры с SEQ ID NO: 23 и 26 встраивали при помощи сайта для фермента рестрикции BamHI (указанного путем подчеркивания) по каждому концу, и праймеры с SEQ ID NO: 24 и 25 конструировали для кроссовера друг с другом таким образом, чтобы располагать мутации путем нуклеотидных замен (указанных путем подчеркивания) по обозначенным сайтам. Последовательности праймеров представлены в таблице 11 ниже.

ПЦР осуществляли с использованием хромосомной ДНК WT в качестве матрицы с праймерами с SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 и SEQ ID NO: 26. ПЦР осуществляли в условиях ПЦР денатурации при 95°С в течение 5 минут, а затем 30 циклов денатурации при 95°С в течение 30 секунд, отжигая при 55°С в течение 30 секунд, и полимеризации при 72°С в течение 30 секунд, и затем полимеризации при 72°С в течение 7 минут. В результате получали фрагмент ДНК 627 п.о. по 5' области выше и фрагмент ДНК 608 п.о. по 3' области ниже вокруг мутации гена ilvA.
С использованием двух амплифицированных фрагментов ДНК в качестве матриц ПЦР осуществляли с использованием праймеров с SEQ ID NO: 23 и 26 путем денатурации при 95°С в течение 5 минут, а затем 30 циклов денатурации при 95°С в течение 30 секунд, отжигая при 55°С в течение 30 секунд, и полимеризации при 72°С в течение 60 секунд, и затем полимеризации при 72°С в течение 7 минут. В результате амплифицировали фрагмент ДНК 1217 п.о., содержащий мутацию гена ilvA, кодирующего вариант ilvA, в котором валин в положении 323 был заменен аланином.
Вектор pECCG117 (Корейский патент №10-0057684) и фрагменты ДНК 1011 п.о. обрабатывали ферментом рестрикции BamHI, лигировали с использованием фермента для лигирования ДНК и затем клонировали с получением плазмиды, которую назвали pECCG117-ilvA(V323A).
Конструировали штамм, в котором вектор pECCG117-ilvA(V323A) был введен в АТСС13032::hom(R407H)-lysC(L377K)-gltA(M312I) вышеприведенного примера. Дополнительно в качестве контроля также конструировали штамм, в котором только мутация ilvA (V323A) была введена в АТСС13032::hom (R407H)-lysC (L377K).
Сконструированные таким образом штаммы культивировали таким же образом, как способ культивирования в колбе, представленный в Примере 4-1, для анализа концентрации L-изолейцина в культуральном растворе, и результаты представлены в Таблице 12 ниже.
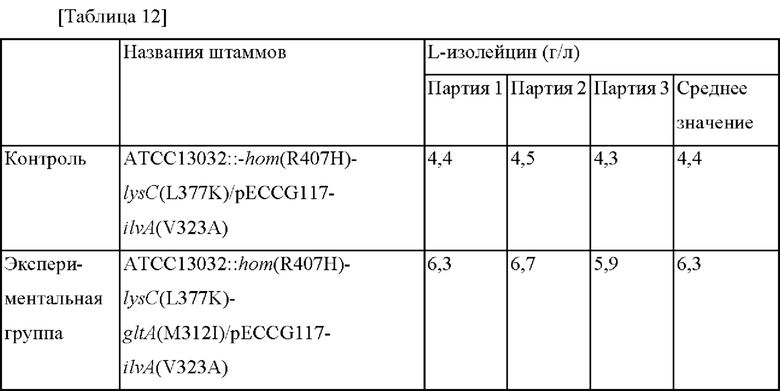
Как видно из Таблицы 12, было подтверждено, что концентрация L-изолейцина увеличивалась приблизительно на 43% в ATCC13032::hom(R407H)-lysC(L377K)-gltA(M312I)/pECCG117-ilvA(V323A), в который была введена мутация gltA (M312I), по сравнению с штаммом дикого типа ATCC13032::-hom(R407H)-lysC(L377K)/pECCG117-ilvA(V323A).
Вышеприведенные результаты указывают на то, что введение мутации gltA (M312I) в L-изолейцин-продуцирующий штамм рода Corynebacterium эффективно для продукции L-изолейцина.
Пример 8: Конструирование штаммов, обладающих улучшенной О-ацетилгомосерин-продуцирующей способностью, и оценка О-ацетилгомосерин-продуцирующей способности
Для исследования эффекта введения мутации gltA(M312I) на продукцию О-ацетилгомосерина конструировали О-ацетилгомосерин-продуцирующие штаммы путем делеции гена metB, кодирующего цистатионин-гамма-синтазу, в пути деградации О-ацетилгомосерина, и гена metY, кодирующего O-ацетилгомосерин-(тиол)-лиазу в пути деградации О-ацетилгомосерина, и путем введения мутации (L377K) (US 10662450 В2) для того, чтобы вызвать ингибирование по типу обратной связи для L-лизина и L-треонина, в ген lysC (SEQ ID NO: 11), кодирующий аспартокиназу, для увеличения биосинтеза О-ацетилгомосерина.
Во первых, для делеции гена metB этот ген metB, кодирующий цистатионин-гамма-синтазу в пути деградации О-ацетилгомосерина, получали путем ПЦР с использованием хромосомной ДНК Corynebacterium glutamicum АТСС13032 в качестве матрицы. Информация о нуклеотидной последовательности в гене metB (регистрационный номер в NCBI Ncgl2360, SEQ ID NO: 27) получена из Национальных институтов здравоохранения США (NIH GenBank). На основе этой информации синтезировали праймеры (SEQ ID NO: 28 и 29), которые включают N-концевую область и линкерную область гена metB, и праймеры (SEQ ID NO: 30 и 31), которые включают С-концевую область и линкерную область. Последовательности праймеров представлены в таблице 13 ниже.

ПЦР осуществляли с использованием хромосомной ДНК АТСС13032 в качестве матрицы с праймерами с SEQ ID NO: 28 и 29 и SEQ ID NO: 30 и 31. В качестве полимеразы использовали ДНК-полимер азу с высокой степенью надежности PfuUltra™ (Stratagene), и ПЦР осуществляли путем повторения 30 циклов денатурации при 96°С в течение 30 секунд, отжигая при 53°С в течение 30 секунд, и полимеризации при 72°С в течение 1 минуты. В результате получали амплифицированный ген 558 п.о., который включает N-концевую область и линкерную область гена metB, и амплифицированный ген 527 п.о., который включает С-концевую область и линкерную область гена metB.
ПЦР осуществляли с использованием двух амплифицированных генов ДНК, полученных выше в качестве матриц, путем повторения 10 циклов денатурации при 96°С в течение 60 секунд, отжигая при 50°С в течение 60 секунд, и полимеризации при 72°С в течение 1 минуты, и после добавления праймеров с SEQ ID NO: 2 и 5 реакцию полимеризации дополнительно повторяли 20 раз. В результате получали кассету инактивации 1064 п.о., включающую N-конец-линкер-С-конец гена metB. Полученный в результате ген обрабатывали ферментами рестрикции XbaI и SalI, по концу фрагмента ПЦР, полученного при помощи ПЦР, и лигировали в вектор pDZ (US 9109242 В2), обрабатывали ферментами рестрикции XbaI и SalI и клонировали в окончательную конструкцию рекомбинантный вектор pDZ-ΔmetB, в который была клонирована кассета инактивации metB.
Сконструированный таким образом вектор pDZ-ΔmetB трансформировали в АТСС13032 при помощи способа с использованием электрического импульса, и путем процесса второго кроссовера получали АТСС13032ΔmetB, в котором ген metB был инактивирован в хромосоме. Инактивированный ген metB окончательно подтверждали путем сравнения с АТСС13032, в котором ген metB не был инактивирован, после ПЦР, проведенной с использованием праймеров с SEQ ID NO: 28 и 31.
Для делеции гена metY, который кодирует фермент, вовлеченный в еще один путь деградации О-ацетилгомосерина, ген metY, кодирующий О-ацетилгомосерин(тиол)-лиазу в пути деградации О-ацетилгомосерина получали при помощи ПЦР, проводимой с использованием хромосомной ДНК Corynebacterium glutamicum АТСС13032 в качестве матрицы. Информация о нуклеотидной последовательности гена metY (регистрационный номер NCBI Ncgl0625, SEQ ID NO: 32) получали из Национальных институтов здравоохранения США (NIH GenBank). На основе этой информации синтезировали праймеры (SEQ ID NO: 33 и 34), включающие N-концевую область и линкерную область гена metY, и праймеры (SEQ ID NO: 35 и 36), включающие С-концевую область и линкерную область гена metY. Последовательности праймеров представлены в Таблице 14 ниже.

ПЦР осуществляли с использованием хромосомной ДНК из АТСС13032 в качестве матрицы с праймерами с SEQ ID NO: 33 и 34 и SEQ ID NO: 35 и 36. В качестве полимеразы использовали ДНК-полимеразу PfuUltra™ с высокой степенью надежности (Stratagene), и ПЦР осуществляли путем повторения 30 циклов денатурации при 96°С в течение 30 секунд, отжигая при 53°С в течение 30 секунд, и полимеризации при 72°С в течение 1 минуты. В результате получали амплифицированный ген 548 п.о., который включает N-концевую область и линкерную область гена metY, и амплифицированный ген 550 п.о., который включает С-концевую область и линкерную область гена metY. ПЦР осуществляли с использованием двух амплифицированных генов ДНК, полученных выше, в качестве матриц путем повторения 10 циклов денатурации при 96°С в течение 60 секунд, отжигая при 50°С в течение 60 секунд, и полимеризации при 72°С в течение 1 минуты, и после добавления праймеров с SEQ ID NO: 33 и 34 реакцию полимеризации дополнительно повторяли 20 раз. В результате получали инактивирующую кассету 1077 п.о., включающую N-конец-линкер-С-конец гена metY. Получающийся в результате ген обрабатывали ферментами рестрикции XbaI и SalI по концу полученного при помощи ПЦР фрагмента, и лигировали с вектором pDZ (US 9109242 В2), обработанным ферментами рестрикции XbaI и SalI, и в окончательную конструкцию клонировали в рекомбинантный вектор pDZ-ΔmetY, в который была клонирована кассета инактивации metY.
Сконструированный таким образом вектор pDZ-ΔmetY трансформировали в штамм АТСС13032 ΔmetB при помощи способа с использованием электрического импульса, и при помощи процесса второго кроссовера получали АТСС13032 ΔmetB ΔmetY, в котором ген metY был инактивирован в хромосоме. Инактивированный ген metY окончательно подтверждали путем сравнения с АТСС13032, в котором ген metY не был инактивирован после проведения ПЦР с использованием праймеров с SEQ ID NO: 7 и 10.
Для увеличения продукции О-ацетилгомосерина вектор pDZ-lysC (L377K), сконструированный в примере 7-2, трансформировали в штамм АТСС13032 ΔmetB ΔmetY при помощи способа с использованием электрического импульса для введения мутации (L377K) (US 10662450 В2) для того, чтобы вызвать ингибирование по типу обратной связи для L-лизина и L-треонина гена lysC, в ген lysC (SEQ ID NO: 11), кодирующий аспартокиназу, полученный из Corynebacterium glutamicum АТСС13032. Затем Corynebacterium glutamicum АТСС13032 ΔmetB ΔmetY lysC (L377K), в котором нуклеотидную мутацию вводили в ген lysC в хромосоме, получали путем процесса вторичного кроссовера. Ген, в который была введена нуклеотидная мутация, окончательно подтверждали при помощи ПЦР, проводимой с использованием праймеров с SEQ ID NO: 15 и 18, с последующим секвенированием, и сравнения последовательности с геном lysC дикого типа.
Вектором pDC-gltA (M312I), сконструированным в примере 3-1, трансформировали штамм АТСС13032 ΔmetB ΔmetY lysC (L377K) при помощи способа с использованием электрического импульса, и путем процесса вторичного кроссовера получали Corynebacterium glutamicum АТСС13032 ΔmetB ΔmetY lysC (L377K) gltA (M312I), в котором нуклеотидная мутация была введена в ген gltA в хромосоме. Введение мутации гена gltA в окончательно трансформированный штамм подтверждали путем осуществления ПЦР с использованием праймеров с SEQ ID NO: 7 и SEQ ID NO: 8, и затем анализа основной последовательности, таким образом подтверждая, что мутация была введена в штамм.
Для сравнения О-ацетилгомосерин-продуцирующей способности сконструированных выше штаммов Corynebacterium glutamicum АТСС13032 ΔmetB ΔmetY lysC (L377K) и ATCC13032 ΔmetB ΔmetY lysC (L377K) gltA(M312I) эти штаммы культивировали способом, описанным выше, и О-ацетилгомосерин анализировали в культуральной среде.
Штаммы инокулировали в колбу на 250 мл с угловой перегородкой, содержащую 25 мл следующей среды (инокулирующая петля), и культивировали со встряхиванием при 200 об./мин при 37°С в течение 20 часов. Концентрацию О-ацетилгомосерина анализировали с использованием ВЭЖХ, и анализируемая концентрация представлена в Таблице 15 ниже.
Среда для продуцирования L-O-ацетилгомосерина (рН 7,2)
Глюкоза 30 г, KH2PO4 2 г, мочевина 3 г, (NH4)SO4 40 г, пептон 2,5 г, CSL (Sigma) 5 г (10 мл), MgSO4⋅7H2O 0,5 г, метионин 400 мг, СаСО3 20 г (на основе 1 л дистиллированной воды)

Как видно из результатов, представленных в Таблице 15, было подтверждено, что штамм АТСС13032 ΔmetB ΔmetY lysC(L377K) gltA(M312I), в который введена мутация gltA(M312I), обладал улучшенной на 31% О-ацетил-L-гомосерин-продуцирующей способностью по сравнению с штаммом АТСС13032 ΔmetB ΔmetY lysC(L377K).
Посредством вышеприведенных результатов может быть подтверждено, что 312-ая аминокислота в аминокислотной последовательности gltA, которая представляет собой цитратсинтазу, представляет собой важное положение для активности фермента gltA.
Специалисту в данной области техники понятно, что описание настоящего изобретения может быть воплощено в других специфических формах без отступления от сущности или существенных характеристик. В этой связи, описанные воплощения следует рассматривать во всех случаях только как иллюстративные, а не ограничивающие. Таким образом, объем описанием настоящего изобретения указан в формуле изобретения, нежели чем в предшествующем описании. Все изменения, которые осуществляются в пределах значения и диапазона эквивалентности формула изобретения должна охватывать в пределах объема описанием настоящего изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> CJ CheilJedang Corporation
<120> НОВЫЙ МОДИФИЦИРОВАННЫЙ ПОЛИПЕПТИД C ОСЛАБЛЕННОЙ АКТИВНОСТЬЮ
ЦИТРАТСИНТАЗЫ И СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ С ЕГО
ИСПОЛЬЗОВАНИЕМ
<130> OPA20120
<150> KR 10-2020-0010823
<151> 2020-01-30
<160> 37
<170> KoPatentIn 3.0
<210> 1
<211> 437
<212> PRT
<213> Unknown
<220>
<223> gltA аминокислотная
<400> 1
Met Phe Glu Arg Asp Ile Val Ala Thr Asp Asn Asn Lys Ala Val Leu
1 5 10 15
His Tyr Pro Gly Gly Glu Phe Glu Met Asp Ile Ile Glu Ala Ser Glu
20 25 30
Gly Asn Asn Gly Val Val Leu Gly Lys Met Leu Ser Glu Thr Gly Leu
35 40 45
Ile Thr Phe Asp Pro Gly Tyr Val Ser Thr Gly Ser Thr Glu Ser Lys
50 55 60
Ile Thr Tyr Ile Asp Gly Asp Ala Gly Ile Leu Arg Tyr Arg Gly Tyr
65 70 75 80
Asp Ile Ala Asp Leu Ala Glu Asn Ala Thr Phe Asn Glu Val Ser Tyr
85 90 95
Leu Leu Ile Asn Gly Glu Leu Pro Thr Pro Asp Glu Leu His Lys Phe
100 105 110
Asn Asp Glu Ile Arg His His Thr Leu Leu Asp Glu Asp Phe Lys Ser
115 120 125
Gln Phe Asn Val Phe Pro Arg Asp Ala His Pro Met Ala Thr Leu Ala
130 135 140
Ser Ser Val Asn Ile Leu Ser Thr Tyr Tyr Gln Asp Gln Leu Asn Pro
145 150 155 160
Leu Asp Glu Ala Gln Leu Asp Lys Ala Thr Val Arg Leu Met Ala Lys
165 170 175
Val Pro Met Leu Ala Ala Tyr Ala His Arg Ala Arg Lys Gly Ala Pro
180 185 190
Tyr Met Tyr Pro Asp Asn Ser Leu Asn Ala Arg Glu Asn Phe Leu Arg
195 200 205
Met Met Phe Gly Tyr Pro Thr Glu Pro Tyr Glu Ile Asp Pro Ile Met
210 215 220
Val Lys Ala Leu Asp Lys Leu Leu Ile Leu His Ala Asp His Glu Gln
225 230 235 240
Asn Cys Ser Thr Ser Thr Val Arg Met Ile Gly Ser Ala Gln Ala Asn
245 250 255
Met Phe Val Ser Ile Ala Gly Gly Ile Asn Ala Leu Ser Gly Pro Leu
260 265 270
His Gly Gly Ala Asn Gln Ala Val Leu Glu Met Leu Glu Asp Ile Lys
275 280 285
Ser Asn His Gly Gly Asp Ala Thr Glu Phe Met Asn Lys Val Lys Asn
290 295 300
Lys Glu Asp Gly Val Arg Leu Met Gly Phe Gly His Arg Val Tyr Lys
305 310 315 320
Asn Tyr Asp Pro Arg Ala Ala Ile Val Lys Glu Thr Ala His Glu Ile
325 330 335
Leu Glu His Leu Gly Gly Asp Asp Leu Leu Asp Leu Ala Ile Lys Leu
340 345 350
Glu Glu Ile Ala Leu Ala Asp Asp Tyr Phe Ile Ser Arg Lys Leu Tyr
355 360 365
Pro Asn Val Asp Phe Tyr Thr Gly Leu Ile Tyr Arg Ala Met Gly Phe
370 375 380
Pro Thr Asp Phe Phe Thr Val Leu Phe Ala Ile Gly Arg Leu Pro Gly
385 390 395 400
Trp Ile Ala His Tyr Arg Glu Gln Leu Gly Ala Ala Gly Asn Lys Ile
405 410 415
Asn Arg Pro Arg Gln Val Tyr Thr Gly Asn Glu Ser Arg Lys Leu Val
420 425 430
Pro Arg Glu Glu Arg
435
<210> 2
<211> 1314
<212> DNA
<213> Unknown
<220>
<223> gltA нуклеотидная
<400> 2
atgtttgaaa gggatatcgt ggctactgat aacaacaagg ctgtcctgca ctaccccggt
60
ggcgagttcg aaatggacat catcgaggct tctgagggta acaacggtgt tgtcctgggc
120
aagatgctgt ctgagactgg actgatcact tttgacccag gttatgtgag cactggctcc
180
accgagtcga agatcaccta catcgatggc gatgcgggaa tcctgcgtta ccgcggctat
240
gacatcgctg atctggctga gaatgccacc ttcaacgagg tttcttacct acttatcaac
300
ggtgagctac caaccccaga tgagcttcac aagtttaacg acgagattcg ccaccacacc
360
cttctggacg aggacttcaa gtcccagttc aacgtgttcc cacgcgacgc tcacccaatg
420
gcaaccttgg cttcctcggt taacattttg tctacctact accaggacca gctgaaccca
480
ctcgatgagg cacagcttga taaggcaacc gttcgcctca tggcaaaggt tccaatgctg
540
gctgcgtacg cacaccgcgc acgcaagggt gctccttaca tgtacccaga caactccctc
600
aatgcgcgtg agaacttcct gcgcatgatg ttcggttacc caaccgagcc atacgagatc
660
gacccaatca tggtcaaggc tctggacaag ctgctcatcc tgcacgctga ccacgagcag
720
aactgctcca cctccaccgt tcgtatgatc ggttccgcac aggccaacat gtttgtctcc
780
atcgctggtg gcatcaacgc tctgtccggc ccactgcacg gtggcgcaaa ccaggctgtt
840
ctggagatgc tcgaagacat caagagcaac cacggtggcg acgcaaccga gttcatgaac
900
aaggtcaaga acaaggaaga cggcgtccgc ctcatgggct tcggacaccg cgtttacaag
960
aactacgatc cacgtgcagc aatcgtcaag gagaccgcac acgagatcct cgagcacctc
1020
ggtggcgacg atcttctgga tctggcaatc aagctggaag aaattgcact ggctgatgat
1080
tacttcatct cccgcaagct ctacccgaac gtagacttct acaccggcct gatctaccgc
1140
gcaatgggct tcccaactga cttcttcacc gtattgttcg caatcggtcg tctgccagga
1200
tggatcgctc actaccgcga gcagctcggt gcagcaggca acaagatcaa ccgcccacgc
1260
caggtctaca ccggcaacga atcccgcaag ttggttcctc gcgaggagcg ctaa
1314
<210> 3
<211> 437
<212> PRT
<213> Artificial Sequence
<220>
<223> gltA M312I аминокислотная
<400> 3
Met Phe Glu Arg Asp Ile Val Ala Thr Asp Asn Asn Lys Ala Val Leu
1 5 10 15
His Tyr Pro Gly Gly Glu Phe Glu Met Asp Ile Ile Glu Ala Ser Glu
20 25 30
Gly Asn Asn Gly Val Val Leu Gly Lys Met Leu Ser Glu Thr Gly Leu
35 40 45
Ile Thr Phe Asp Pro Gly Tyr Val Ser Thr Gly Ser Thr Glu Ser Lys
50 55 60
Ile Thr Tyr Ile Asp Gly Asp Ala Gly Ile Leu Arg Tyr Arg Gly Tyr
65 70 75 80
Asp Ile Ala Asp Leu Ala Glu Asn Ala Thr Phe Asn Glu Val Ser Tyr
85 90 95
Leu Leu Ile Asn Gly Glu Leu Pro Thr Pro Asp Glu Leu His Lys Phe
100 105 110
Asn Asp Glu Ile Arg His His Thr Leu Leu Asp Glu Asp Phe Lys Ser
115 120 125
Gln Phe Asn Val Phe Pro Arg Asp Ala His Pro Met Ala Thr Leu Ala
130 135 140
Ser Ser Val Asn Ile Leu Ser Thr Tyr Tyr Gln Asp Gln Leu Asn Pro
145 150 155 160
Leu Asp Glu Ala Gln Leu Asp Lys Ala Thr Val Arg Leu Met Ala Lys
165 170 175
Val Pro Met Leu Ala Ala Tyr Ala His Arg Ala Arg Lys Gly Ala Pro
180 185 190
Tyr Met Tyr Pro Asp Asn Ser Leu Asn Ala Arg Glu Asn Phe Leu Arg
195 200 205
Met Met Phe Gly Tyr Pro Thr Glu Pro Tyr Glu Ile Asp Pro Ile Met
210 215 220
Val Lys Ala Leu Asp Lys Leu Leu Ile Leu His Ala Asp His Glu Gln
225 230 235 240
Asn Cys Ser Thr Ser Thr Val Arg Met Ile Gly Ser Ala Gln Ala Asn
245 250 255
Met Phe Val Ser Ile Ala Gly Gly Ile Asn Ala Leu Ser Gly Pro Leu
260 265 270
His Gly Gly Ala Asn Gln Ala Val Leu Glu Met Leu Glu Asp Ile Lys
275 280 285
Ser Asn His Gly Gly Asp Ala Thr Glu Phe Met Asn Lys Val Lys Asn
290 295 300
Lys Glu Asp Gly Val Arg Leu Ile Gly Phe Gly His Arg Val Tyr Lys
305 310 315 320
Asn Tyr Asp Pro Arg Ala Ala Ile Val Lys Glu Thr Ala His Glu Ile
325 330 335
Leu Glu His Leu Gly Gly Asp Asp Leu Leu Asp Leu Ala Ile Lys Leu
340 345 350
Glu Glu Ile Ala Leu Ala Asp Asp Tyr Phe Ile Ser Arg Lys Leu Tyr
355 360 365
Pro Asn Val Asp Phe Tyr Thr Gly Leu Ile Tyr Arg Ala Met Gly Phe
370 375 380
Pro Thr Asp Phe Phe Thr Val Leu Phe Ala Ile Gly Arg Leu Pro Gly
385 390 395 400
Trp Ile Ala His Tyr Arg Glu Gln Leu Gly Ala Ala Gly Asn Lys Ile
405 410 415
Asn Arg Pro Arg Gln Val Tyr Thr Gly Asn Glu Ser Arg Lys Leu Val
420 425 430
Pro Arg Glu Glu Arg
435
<210> 4
<211> 1314
<212> DNA
<213> Artificial Sequence
<220>
<223> gltA M312I нуклеотидная
<400> 4
atgtttgaaa gggatatcgt ggctactgat aacaacaagg ctgtcctgca ctaccccggt
60
ggcgagttcg aaatggacat catcgaggct tctgagggta acaacggtgt tgtcctgggc
120
aagatgctgt ctgagactgg actgatcact tttgacccag gttatgtgag cactggctcc
180
accgagtcga agatcaccta catcgatggc gatgcgggaa tcctgcgtta ccgcggctat
240
gacatcgctg atctggctga gaatgccacc ttcaacgagg tttcttacct acttatcaac
300
ggtgagctac caaccccaga tgagcttcac aagtttaacg acgagattcg ccaccacacc
360
cttctggacg aggacttcaa gtcccagttc aacgtgttcc cacgcgacgc tcacccaatg
420
gcaaccttgg cttcctcggt taacattttg tctacctact accaggacca gctgaaccca
480
ctcgatgagg cacagcttga taaggcaacc gttcgcctca tggcaaaggt tccaatgctg
540
gctgcgtacg cacaccgcgc acgcaagggt gctccttaca tgtacccaga caactccctc
600
aatgcgcgtg agaacttcct gcgcatgatg ttcggttacc caaccgagcc atacgagatc
660
gacccaatca tggtcaaggc tctggacaag ctgctcatcc tgcacgctga ccacgagcag
720
aactgctcca cctccaccgt tcgtatgatc ggttccgcac aggccaacat gtttgtctcc
780
atcgctggtg gcatcaacgc tctgtccggc ccactgcacg gtggcgcaaa ccaggctgtt
840
ctggagatgc tcgaagacat caagagcaac cacggtggcg acgcaaccga gttcatgaac
900
aaggtcaaga acaaggaaga cggcgtccgc ctcatcggct tcggacaccg cgtttacaag
960
aactacgatc cacgtgcagc aatcgtcaag gagaccgcac acgagatcct cgagcacctc
1020
ggtggcgacg atcttctgga tctggcaatc aagctggaag aaattgcact ggctgatgat
1080
tacttcatct cccgcaagct ctacccgaac gtagacttct acaccggcct gatctaccgc
1140
gcaatgggct tcccaactga cttcttcacc gtattgttcg caatcggtcg tctgccagga
1200
tggatcgctc actaccgcga gcagctcggt gcagcaggca acaagatcaa ccgcccacgc
1260
caggtctaca ccggcaacga atcccgcaag ttggttcctc gcgaggagcg ctaa
1314
<210> 5
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> pCR-gltA F
<400> 5
ctaatctcga ggtcacccat gtttgaaagg
30
<210> 6
<211> 27
<212> DNA
<213> Artificial Sequence
<220>
<223> pCR-gltA R
<400> 6
tcgcgaggag cgctaaaacc ggttgat
27
<210> 7
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> gltA F
<400> 7
caatgctggc tgcgtacgc
19
<210> 8
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> gltA R
<400> 8
ctcctcgcga ggaaccaact
20
<210> 9
<211> 42
<212> DNA
<213> Artificial Sequence
<220>
<223> gltA M312I Up F
<400> 9
gtgaattcga gctcggtacc cgcgggaatc ctgcgttacc gc
42
<210> 10
<211> 42
<212> DNA
<213> Artificial Sequence
<220>
<223> gltA M312I Up R
<400> 10
tgtaaacgcg gtgtccgaag ccgatgaggc ggacgccgtc tt
42
<210> 11
<211> 42
<212> DNA
<213> Artificial Sequence
<220>
<223> gltA M312I Down F
<400> 11
aagacggcgt ccgcctcatc ggcttcggac accgcgttta ca
42
<210> 12
<211> 42
<212> DNA
<213> Artificial Sequence
<220>
<223> gltA M312I Down R
<400> 12
ggtcgactct agaggatccc cttagcgctc ctcgcgagga ac
42
<210> 13
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> leuA F
<400> 13
accgaaattg gcttgggtgc cagcccagct gatgcctac
39
<210> 14
<211> 42
<212> DNA
<213> Artificial Sequence
<220>
<223> leuA R
<400> 14
aagcttgcat gcctgcagct taaagtcacc tacgttttgt ac
42
<210> 15
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> lysC up F
<400> 15
tcctctagag ctgcgcagtg ttgaatacg
29
<210> 16
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> lysC up R
<400> 16
tggaaatctt ttcgatgttc acgttgacat
30
<210> 17
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> lysC down F
<400> 17
acatcgaaaa gatttccacc tctgagattc
30
<210> 18
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> lysC down R
<400> 18
gactctagag ttcacctcag agacgatta
29
<210> 19
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> hom up F
<400> 19
tcctctagac tggtcgcctg atgttctac
29
<210> 20
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> hom up R
<400> 20
cacgatcaga tgtgcatcat cat
23
<210> 21
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> hom down F
<400> 21
atgatgatgc acatctgatc gtg
23
<210> 22
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> hom down R
<400> 22
gactctagat tagtcccttt cgaggcgga
29
<210> 23
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> ilvA V323A up F
<400> 23
acggatccca gactccaaag caaaagcg
28
<210> 24
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> ilvA V323A up R
<400> 24
acaccacggc agaaccaggt gcaaaggaca
30
<210> 25
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> ilvA V323A down F
<400> 25
ctggttctgc cgtggtgtgc atcatctctg
30
<210> 26
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> ilvA V323A down R
<400> 26
acggatccaa ccaaacttgc tcacactc
28
<210> 27
<211> 1161
<212> DNA
<213> Unknown
<220>
<223> Corynebacterium glutamicum metB
<400> 27
ttgtcttttg acccaaacac ccagggtttc tccactgcat cgattcacgc tgggtatgag
60
ccagacgact actacggttc gattaacacc ccaatctatg cctccaccac cttcgcgcag
120
aacgctccaa acgaactgcg caaaggctac gagtacaccc gtgtgggcaa ccccaccatc
180
gtggcattag agcagaccgt cgcagcactc gaaggcgcaa agtatggccg cgcattctcc
240
tccggcatgg ctgcaaccga catcctgttc cgcatcatcc tcaagccggg cgatcacatc
300
gtcctcggca acgatgctta cggcggaacc taccgcctga tcgacaccgt attcaccgca
360
tggggcgtcg aatacaccgt tgttgatacc tccgtcgtgg aagaggtcaa ggcagcgatc
420
aaggacaaca ccaagctgat ctgggtggaa accccaacca acccagcact tggcatcacc
480
gacatcgaag cagtagcaaa gctcaccgaa ggcaccaacg ccaagctggt tgttgacaac
540
accttcgcat ccccatacct gcagcagcca ctaaaactcg gcgcacacgc agtcctgcac
600
tccaccacca agtacatcgg aggacactcc gacgttgttg gcggccttgt ggttaccaac
660
gaccaggaaa tggacgaaga actgctgttc atgcagggcg gcatcggacc gatcccatca
720
gttttcgatg catacctgac cgcccgtggc ctcaagaccc ttgcagtgcg catggatcgc
780
cactgcgaca acgcagaaaa gatcgcggaa ttcctggact cccgcccaga ggtctccacc
840
gtgctctacc caggtctgaa gaaccaccca ggccacgaag tcgcagcgaa gcagatgaag
900
cgcttcggcg gcatgatctc cgtccgtttc gcaggcggcg aagaagcagc taagaagttc
960
tgtacctcca ccaaactgat ctgtctggcc gagtccctcg gtggcgtgga atccctcctg
1020
gagcacccag caaccatgac ccaccagtca gctgccggct ctcagctcga ggttccccgc
1080
gacctcgtgc gcatctccat tggtattgaa gacattgaag acctgctcgc agatgtcgag
1140
caggccctca ataaccttta g
1161
<210> 28
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> metB_N_del F
<400> 28
tctagacgcc cgcatactgg cttc
24
<210> 29
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> metB_N_del R
<400> 29
cccatccact aaacttaaac agatgtgatc gcccggc
37
<210> 30
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> metB_C_del F
<400> 30
tgtttaagtt tagtggatgg ggaagaacca cccaggcc
38
<210> 31
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> metB_C_del R
<400> 31
gtcgaccaat cgtccagagg gcg
23
<210> 32
<211> 1314
<212> DNA
<213> Unknown
<220>
<223> Corynebacterium glutamicum metY
<400> 32
atgccaaagt acgacaattc caatgctgac cagtggggct ttgaaacccg ctccattcac
60
gcaggccagt cagtagacgc acagaccagc gcacgaaacc ttccgatcta ccaatccacc
120
gctttcgtgt tcgactccgc tgagcacgcc aagcagcgtt tcgcacttga ggatctaggc
180
cctgtttact cccgcctcac caacccaacc gttgaggctt tggaaaaccg catcgcttcc
240
ctcgaaggtg gcgtccacgc tgtagcgttc tcctccggac aggccgcaac caccaacgcc
300
attttgaacc tggcaggagc gggcgaccac atcgtcacct ccccacgcct ctacggtggc
360
accgagactc tattccttat cactcttaac cgcctgggta tcgatgtttc cttcgtggaa
420
aaccccgacg accctgagtc ctggcaggca gccgttcagc caaacaccaa agcattcttc
480
ggcgagactt tcgccaaccc acaggcagac gtcctggata ttcctgcggt ggctgaagtt
540
gcgcaccgca acagcgttcc actgatcatc gacaacacca tcgctaccgc agcgctcgtg
600
cgcccgctcg agctcggcgc agacgttgtc gtcgcttccc tcaccaagtt ctacaccggc
660
aacggctccg gactgggcgg cgtgcttatc gacggcggaa agttcgattg gactgtcgaa
720
aaggatggaa agccagtatt cccctacttc gtcactccag atgctgctta ccacggattg
780
aagtacgcag accttggtgc accagccttc ggcctcaagg ttcgcgttgg ccttctacgc
840
gacaccggct ccaccctctc cgcattcaac gcatgggctg cagtccaggg catcgacacc
900
ctttccctgc gcctggagcg ccacaacgaa aacgccatca aggttgcaga attcctcaac
960
aaccacgaga aggtggaaaa ggttaacttc gcaggcctga aggattcccc ttggtacgca
1020
accaaggaaa agcttggcct gaagtacacc ggctccgttc tcaccttcga gatcaagggc
1080
ggcaaggatg aggcttgggc atttatcgac gccctgaagc tacactccaa ccttgcaaac
1140
atcggcgatg ttcgctccct cgttgttcac ccagcaacca ccacccattc acagtccgac
1200
gaagctggcc tggcacgcgc gggcgttacc cagtccaccg tccgcctgtc cgttggcatc
1260
gagaccattg atgatatcat cgctgacctc gaaggcggct ttgctgcaat ctag
1314
<210> 33
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> metY_N_del F
<400> 33
tctagaccat cctgcaccat ttag
24
<210> 34
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> metY_N_del R
<400> 34
cccatccact aaacttaaac acgctcctgc caggttc
37
<210> 35
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> metY_C_del F
<400> 35
tgtttaagtt tagtggatgg gcttggtacg caaccaagg
39
<210> 36
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> metY_C_del R
<400> 36
gtcgacgatt gctccggctt cgg
23
<210> 37
<211> 1266
<212> DNA
<213> Unknown
<220>
<223> Corynebacterium glutamicum lysC
<400> 37
gtggccctgg tcgtacagaa atatggcggt tcctcgcttg agagtgcgga acgcattaga
60
aacgtcgctg aacggatcgt tgccaccaag aaggctggaa atgatgtcgt ggttgtctgc
120
tccgcaatgg gagacaccac ggatgaactt ctagaacttg cagcggcagt gaatcccgtt
180
ccgccagctc gtgaaatgga tatgctcctg actgctggtg agcgtatttc taacgctctc
240
gtcgccatgg ctattgagtc ccttggcgca gaagcccaat ctttcacggg ctctcaggct
300
ggtgtgctca ccaccgagcg ccacggaaac gcacgcattg ttgatgtcac tccaggtcgt
360
gtgcgtgaag cactcgatga gggcaagatc tgcattgttg ctggtttcca gggtgttaat
420
aaagaaaccc gcgatgtcac cacgttgggt cgtggtggtt ctgacaccac tgcagttgcg
480
ttggcagctg ctttgaacgc tgatgtgtgt gagatttact cggacgttga cggtgtgtat
540
accgctgacc cgcgcatcgt tcctaatgca cagaagctgg aaaagctcag cttcgaagaa
600
atgctggaac ttgctgctgt tggctccaag attttggtgc tgcgcagtgt tgaatacgct
660
cgtgcattca atgtgccact tcgcgtacgc tcgtcttata gtaatgatcc cggcactttg
720
attgccggct ctatggagga tattcctgtg gaagaagcag tccttaccgg tgtcgcaacc
780
gacaagtccg aagccaaagt aaccgttctg ggtatttccg ataagccagg cgaggctgcg
840
aaggttttcc gtgcgttggc tgatgcagaa atcaacattg acatggttct gcagaacgtc
900
tcttctgtag aagacggcac caccgacatc accttcacct gccctcgttc cgacggccgc
960
cgcgcgatgg agatcttgaa gaagcttcag gttcagggca actggaccaa tgtgctttac
1020
gacgaccagg tcggcaaagt ctccctcgtg ggtgctggca tgaagtctca cccaggtgtt
1080
accgcagagt tcatggaagc tctgcgcgat gtcaacgtga acatcgaatt gatttccacc
1140
tctgagattc gtatttccgt gctgatccgt gaagatgatc tggatgctgc tgcacgtgca
1200
ttgcatgagc agttccagct gggcggcgaa gacgaagccg tcgtttatgc aggcaccgga
1260
cgctaa
1266
<---
Изобретение относится к биотехнологии и представляет собой модифицированный полипептид, обладающий цитратсинтазной активностью, где аминокислота, соответствующая положению 312 от N-конца полипептида, состоящего из аминокислотной последовательности SEQ ID NO: 1, заменена другой аминокислотой. Изобретение относится также к модифицированному полипептиду, обладающему цитратсинтазной активностью и обладающему гомологией последовательности 80% или более и менее чем 100% с аминокислотной последовательностью SEQ ID NO: 1, где аминокислота, соответствующая положению 312 от N-конца полипептида, состоящего из аминокислотной последовательности SEQ ID NO: 1, заменена другой аминокислотой. Изобретение позволяет эффективно получить L-аминокислоту с использованием микроорганизма, содержащего один из указанных модифицированных полипептидов. 7 н. и 7 з.п. ф-лы, 15 табл., 8 пр.
1. Модифицированный полипептид, обладающий цитратсинтазной активностью, где аминокислота, соответствующая положению 312 от N-конца полипептида, состоящего из аминокислотной последовательности SEQ ID NO: 1, заменена другой аминокислотой.
2. Модифицированный полипептид по п. 1, где аминокислота, соответствующая положению 312, заменена изолейцином.
3. Модифицированный полипептид, обладающий цитратсинтазной активностью и обладающий гомологией последовательности 80% или более и менее чем 100% с аминокислотной последовательностью SEQ ID NO: 1, где аминокислота, соответствующая положению 312 от N-конца полипептида, состоящего из аминокислотной последовательности SEQ ID NO: 1, заменена другой аминокислотой.
4. Модифицированный полипептид по п. 1, который состоит из аминокислотной последовательности SEQ ID NO: 3.
5. Полинуклеотид, кодирующий модифицированный полипептид по любому из пп. 1-4.
6. Вектор экспрессии, содержащий полинуклеотид по п. 5.
7. Микроорганизм, продуцирующий L-аминокислоту, содержащий модифицированный полипептид по любому из пп. 1-4, полинуклеотид, кодирующий этот модифицированный полипептид, или вектор, содержащий этот полинуклеотид.
8. Микроорганизм по п. 7, где L-аминокислота представляет собой любую одну или более чем одну аминокислоту, выбранную из группы, состоящей из лейцина, лизина, валина, изолейцина и O-ацетилгомосерина.
9. Микроорганизм по п. 7, который представляет собой микроорганизм рода Corynebacterium.
10. Микроорганизм по п. 9, где микроорганизм рода Corynebacterium представляет собой Corynebacterium glutamicum.
11. Способ получения L-аминокислоты, включающий:
культивирование в среде микроорганизма, содержащего модифицированный полипептид по любому из пп. 1-4, полинуклеотид, кодирующий этот модифицированный полипептид, или вектор, содержащий этот полинуклеотид.
12. Способ по п. 11, который дополнительно включает выделение L-аминокислоты из культуральной среды или микроорганизма.
13. Способ по п. 12, где L-аминокислота представляет собой любую одну или более чем одну аминокислоту, выбранную из группы, состоящей из лейцина, лизина, валина, изолейцина и O-ацетилгомосерина.
14. Применение микроорганизма, продуцирующего L-аминокислоту, для получения L-аминокислоты, где указанный микроорганизм содержит модифицированный полипептид, обладающий цитратсинтазной активностью, в котором аминокислота, соответствующая положению 312 от N-конца полипептида, состоящего из аминокислотной последовательности SEQ ID NO: 1, заменена другой аминокислотой; полинуклеотид, кодирующий этот модифицированный полипептид; или вектор, содержащий этот полинуклеотид.
| Микроорганизм, продуцирующий путресцин или орнитин, и способ получения путресцина или орнитина с использованием этого микроорганизма | 2016 |
|
RU2691303C1 |
| БАКТЕРИЯ СЕМЕЙСТВА Enterobacteriaceae - ПРОДУЦЕНТ L-АСПАРАГИНОВОЙ КИСЛОТЫ ИЛИ МЕТАБОЛИТОВ, ПРОИЗВОДНЫХ L-АСПАРАГИНОВОЙ КИСЛОТЫ, И СПОСОБ ПОЛУЧЕНИЯ L-АСПАРАГИНОВОЙ КИСЛОТЫ ИЛИ МЕТАБЛИТОВ, ПРОИЗВОДНЫХ L-АСПАРАГИНОВОЙ КИСЛОТЫ | 2011 |
|
RU2472853C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-ГЛУТАМИНОВОЙ КИСЛОТЫ | 1999 |
|
RU2225881C2 |
| СПОСОБ ПЕРЕРАБОТКИ КОБАЛЬТОВОГО КЕКА | 1988 |
|
RU2041276C1 |
| EP 3109318 B1, 05.06.2019 | |||
| Скользящая опалубка для возведения железобетонных сооружений | 1968 |
|
SU547516A1 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ | 2008 |
|
RU2405040C2 |
Авторы
Даты
2023-10-13—Публикация
2020-08-04—Подача