[Область техники]
Описание относится к искусственной рекомбинантной хромосоме и ее применению, а более конкретно, к искусственной рекомбинантной хромосоме, полученной путем рекомбинации двух или более хромосом, и к получению трансгенного животного с использованием клетки, включающей ее.
[Уровень техники]
Трансгенные животные могут способствовать развитию генной инженерии путем экспрессии ДНК, кодирующей экзогенный белок, или инактивирующей эндогенный ген.
Для получения трансгенного животного, как правило, ДНК, кодирующую экзогенный белок, вставляют в геном животной клетки, и получают животное с использованием полученной таким образом клетки. Здесь для вставки ДНК, кодирующей экзогенный белок, в геном животной клетки, используется вектор, содержащий ДНК, кодирующую экзогенный белок, а для получения вектора клонируется ДНК, кодирующая экзогенный белок.
[Описание]
[Техническая проблема]
Для получения трансгенного животного, как правило, ДНК, кодирующую экзогенный белок, вставляют в геном животной клетки, и получают животное с использованием полученной таким образом клетки. Здесь для вставки ДНК, кодирующей экзогенный белок, в геном животной клетки, используется вектор, содержащий ДНК, кодирующую экзогенный белок, а для получения вектора клонируется ДНК, кодирующая экзогенный белок. В этом методе используется один, два или более векторов в зависимости от размера ДНК, кодирующей экзогенный белок. Например, когда размер ДНК, кодирующей экзогенный белок, составляет несколько десятков тысяч пар нуклеотидов или более, ДНК, кодирующая экзогенный белок, фрагментируется, а затем вставляется с использованием нескольких векторов. Когда ДНК вставляется с использованием множества векторов вместо одного вектора, возникает проблема, заключающаяся в том, что снижается эффективность выхода клеток, в которые вставлена полноразмерная ДНК, кодирующая экзогенный белок.
Для решения вышеупомянутой проблемы настоящее изобретение относится к обеспечению способа эффективной вставки гена, который должен быть вставлен в геном животной клетки, независимо от размера вставляемого гена.
Настоящее изобретение также относится к созданию искусственной рекомбинантной хромосомы и к способу ее получения.
Настоящее изобретение также относится к обеспечению клетки, включающей искусственную рекомбинантную хромосому, и способу ее получения.
Настоящее изобретение также относится к обеспечению способа получения трансгенного животного с использованием клетки, включающей искусственную рекомбинантную хромосому.
[Техническое решение]
Для решения технических проблем в одном аспекте описания предложен способ вставки полноразмерного гена (кодирующей области, некодирующей области и т.д.). Для вставки в геном животной клетки без отдельного клонирования. В другом аспекте описания предложен способ получения трансгенного животного с использованием трансгенной животной клетки, полученной, как описано выше.
Согласно аспекту описания в настоящем изобретении предложен способ получения клетки, включающей одну или более искусственных рекомбинантных хромосом.
В одном варианте осуществления способ получения клетки, включающей одну или более искусственных рекомбинантных хромосом, может включать:
i) подготовку первой клетки-мишени и второй клетки-мишени,
ii) получение одной или более микроклеток с использованием второй клетки-мишени,
iii) получение слитой клетки с использованием первой клетки-мишени и одной или более микроклеток; и
iv) получение клетки, включающей искусственную рекомбинантную хромосому, путем обработки слитой клетки сайт-специфической рекомбиназой (SSR).
Первая клетка-мишень может содержать первую хромосому-мишень.
Вторая клетка-мишень может содержать вторую хромосому-мишень.
Здесь первая хромосома-мишень может включать в себя первую часть, первую последовательность распознавания рекомбиназы (первую RRS) и первый фрагмент. Первая RRS может располагаться между первой частью и первым фрагментом.
Здесь вторая хромосома-мишень может включать в себя вторую часть, вторую последовательность распознавания рекомбиназы (вторую RRS) и второй фрагмент. Вторая RRS может располагаться между второй частью и вторым фрагментом.
Одна или более микроклеток могут содержать вторую хромосому-мишень или ее фрагмент.
Здесь фрагмент второй хромосомы-мишени может включать в себя вторую RRS и второй фрагмент.
Слитая клетка может содержать первую хромосому-мишень и вторую хромосому-мишень или первую хромосому-мишень и фрагмент второй хромосомы-мишени.
SSR может вызывать рекомбинацию путем распознавания спаривания первой RRS, присутствующей в первой хромосоме-мишени, и второй RRS, присутствующей во второй хромосоме-мишени.
Здесь первый фрагмент, присутствующий в первой хромосоме-мишени, может обмениваться на второй фрагмент, присутствующий во второй хромосоме-мишени, путем рекомбинации.
Таким образом, может быть получена первая искусственная рекомбинантная хромосома, содержащая первую часть и второй фрагмент.
Здесь клетка, включающая первую искусственную рекомбинантную хромосому, может не включать вторую хромосому-мишень.
Клетка, включающая одну или более искусственных рекомбинантных хромосом, может дополнительно содержать вторую искусственную рекомбинантную хромосому. Здесь вторая искусственная рекомбинантная хромосома может включать в себя вторую часть и первый фрагмент.
Первая часть может включать один из теломерных концов, расположенных с обеих сторон первой хромосомы-мишени. Здесь первый фрагмент может включать в себя другой из теломерных концов, расположенных с обеих сторон первой хромосомы-мишени.
Вторая часть может включать один из теломерных концов, расположенных с обеих сторон второй хромосомы-мишени. Здесь второй фрагмент может включать другой из теломерных концов, расположенных с обеих сторон второй хромосомы-мишени.
Первая RRS может быть выбрана из loxP и варианта loxP, а вторая RRS может быть выбрана из loxP и варианта loxP. Здесь первая RRS может иметь возможность спариваться со второй RRS. Здесь SSR может быть Cre-рекомбиназой, и SSR может быть способна распознавать первую RRS и вторую RRS.
В качестве альтернативы, первая RRS может быть выбрана из FRT, attP, attB, ITR и их вариантов, а вторая RRS может быть выбрана из FRT, attP, attB, ITR и их вариантов. Здесь первая RRS может иметь возможность спариваться со второй RRS. Здесь SSR может быть выбрана из флиппазы (FLP), интегразы и транспозазы, и SSR может быть способна распознавать первую RRS и вторую RRS.
Клетка, включающая одну или более искусственных рекомбинантных хромосом, может претерпевать клеточное деление (митоз) или мейоз.
В другом варианте осуществления способ получения клетки, включающей одну или более искусственных рекомбинантных хромосом, может включать:
i) подготовку первой клетки-мишени и второй клетки-мишени,
ii) получение одной или более микроклеток с использованием второй клетки-мишени,
iii) получение слитой клетки с использованием первой клетки-мишени и одной или более микроклеток; и
iv) получение клетки, включающей искусственную рекомбинантную хромосому, путем обработки слитой клетки сайт-специфической рекомбиназой (SSR).
Первая клетка-мишень может содержать первую хромосому-мишень.
Здесь первая хромосома-мишень может включать в себя первую часть, первую последовательность распознавания рекомбиназы (первую RRS), первый фрагмент, вторую последовательность распознавания рекомбиназы (вторую RRS) и вторую часть.
Здесь первая часть может включать один из теломерных концов, расположенных с обеих сторон первой хромосомы-мишени, а вторая часть может включать другой из теломерных концов, расположенных с обеих сторон первой хромосомы-мишени.
Здесь первый фрагмент может быть расположен между первой RRS и второй RRS.
Вторая клетка-мишень может содержать вторую хромосому-мишень.
Здесь вторая хромосома-мишень может включать третью часть, третью последовательность распознавания рекомбиназы (третью RRS), второй фрагмент, четвертую последовательность распознавания рекомбиназы (четвертую RRS) и четвертую часть.
Здесь третья часть может включать один из теломерных концов, расположенных с обеих сторон второй хромосомы-мишени, а четвертая часть может включать другой из теломерных концов, расположенных с обеих сторон второй хромосомы-мишени.
Здесь второй фрагмент может быть расположен между третьей RRS и четвертой RRS.
Одна или более микроклеток могут содержать вторую хромосому-мишень или ее фрагмент.
Здесь фрагмент второй хромосомы-мишени может включать третью RRS, второй фрагмент и четвертую RRS.
Слитая клетка может содержать первую хромосому-мишень и вторую хромосому-мишень или первую хромосому-мишень и фрагмент второй хромосомы-мишени.
SSR может вызывать рекомбинацию путем распознавания спаривания первой RRS, присутствующей в первой хромосоме-мишени, и третьей RRS, присутствующей во второй хромосоме-мишени, и спаривания второй RRS, присутствующей в первой хромосоме-мишени, и четвертой RRS, присутствующей во второй хромосоме-мишени.
Здесь первый фрагмент, присутствующий в первой хромосоме-мишени, может обмениваться на второй фрагмент, присутствующий во второй хромосоме-мишени, посредством рекомбинации.
Таким образом, может быть получена первая искусственная рекомбинантная хромосома, включающая первую часть, второй фрагмент и вторую часть.
Здесь клетка, включающая первую искусственную рекомбинантную хромосому, может не включать вторую хромосому-мишень.
Клетка, включающая одну или более искусственных рекомбинантных хромосом, может дополнительно содержать вторую искусственную рекомбинантную хромосому. Здесь вторая искусственная рекомбинантная хромосома может включать третью часть, первый фрагмент и четвертую часть.
Первая часть может включать центромеру первой хромосомы-мишени. В качестве альтернативы, первый фрагмент может включать центромеру первой хромосомы-мишени.
Третья часть может включать центромеру второй хромосомы-мишени. Второй фрагмент может включать центромеру второй хромосомы-мишени.
Первая RRS может быть выбрана из loxP и вариантов loxP, а третья RRS может быть выбрана из loxP и вариантов loxP. Здесь первая RRS может иметь возможность спариваться с третьей RRS.
Вторая RRS может быть выбрана из loxP и вариантов loxP, а четвертая RRS может быть выбрана из loxP и вариантов loxP. Здесь вторая RRS может иметь возможность спариваться с четвертой RRS.
Здесь SSR может быть Cre-рекомбиназой.
В качестве альтернативы, первая RRS может быть выбрана из FRT, attP, attB, ITR и их вариантов, а третья RRS может быть выбрана из FRT, attP, attB, ITR и их вариантов. Здесь первая RRS может иметь возможность спариваться с третьей RRS.
Вторая RRS может быть выбрана из FRT, attP, attB, ITR и их вариантов, а четвертая RRS может быть выбрана из FRT, attP, attB, ITR и их вариантов. Здесь вторая RRS может иметь возможность спариваться с четвертой RRS.
Здесь SSR может быть выбрана из флиппазы (FLP), интегразы и транспозазы.
Клетка, включающая одну или более искусственных рекомбинантных хромосом, может претерпевать деление соматических клеток (митоз) или мейоз.
Согласно другому аспекту описания в настоящем изобретении предложен способ получения трансгенного животного, отличного от человека, с использованием клетки, включающей одну или более искусственных рекомбинантных хромосом.
В одном варианте осуществления способ получения трансгенного животного, отличного от человека, с использованием клетки, включающей одну или более искусственных рекомбинантных хромосом, может включать:
i) подготовку первой клетки-мишени и второй клетки-мишени,
ii) получение одной или более микроклеток с использованием второй клетки-мишени,
iii) получение слитой клетки с использованием первой клетки-мишени и одной или более микроклеток; и
iv) получение клетки, включающей искусственную рекомбинантную хромосому, путем обработки слитой клетки сайт-специфической рекомбиназой (SSR); и
v) имплантацию химерной бластоцисты, содержащей первую искусственную рекомбинантную хромосому, в матку суррогатной матери для получения потомства.
Первая клетка-мишень может быть эмбриональной стволовой клеткой.
Первая клетка-мишень может содержать первую хромосому-мишень. Вторая клетка-мишень может содержать вторую хромосому-мишень.
Здесь первая хромосома-мишень может включать в себя первую часть, первую последовательность распознавания рекомбиназы (первую RRS) и первый фрагмент. Первая RRS может располагаться между первой частью и первым фрагментом.
Здесь вторая хромосома-мишень может включать в себя вторую часть, вторую последовательность распознавания рекомбиназы (вторую RRS) и второй фрагмент. Вторая RRS может располагаться между второй частью и вторым фрагментом.
Одна или более микроклеток могут содержать вторую хромосому-мишень или ее фрагмент. Здесь фрагмент второй хромосомы-мишени может включать в себя вторую RRS и второй фрагмент.
Слитая клетка может содержать первую хромосому-мишень и вторую хромосому-мишень или первую хромосому-мишень и фрагмент второй хромосомы-мишени.
SSR может вызывать рекомбинацию путем распознавания спаривания первой RRS, присутствующей в первой хромосоме-мишени, и второй RRS, присутствующей во второй хромосоме-мишени.
Здесь первый фрагмент, присутствующий в первой хромосоме-мишени, может быть заменен вторым фрагментом, присутствующим во второй хромосоме-мишени.
Таким образом, может быть получена первая искусственная рекомбинантная хромосома, включающая первую часть и второй фрагмент.
Здесь клетка, включающая первую искусственную рекомбинантную хромосому, может не включать вторую хромосому-мишень.
Химерная бластоциста может быть получена путем инъекции клетки, включающей первую искусственную хромосому, в бластоцисту.
В другом варианте осуществления способ получения трансгенного животного, отличного от человека, с использованием клетки, содержащей одну или более искусственных рекомбинантных хромосом, может включать:
i) подготовку первой клетки-мишени и второй клетки-мишени,
ii) получение одной или более микроклеток с использованием второй клетки-мишени,
iii) получение слитой клетки с использованием первой клетки-мишени и одной или более микроклеток; и
iv) получение клетки, включающей искусственную рекомбинантную хромосому, путем обработки слитой клетки сайт-специфической рекомбиназой (SSR); и
v) имплантацию химерной бластоцисты, содержащей первую искусственную рекомбинантную хромосому, в матку суррогатной матери для получения потомства.
Первая клетка-мишень может быть эмбриональной стволовой клеткой.
Первая клетка-мишень может содержать первую хромосому-мишень. Вторая клетка-мишень может содержать вторую хромосому-мишень.
Первая хромосома-мишень может включать первую часть, первую последовательность распознавания рекомбиназы (первую RRS), первый фрагмент, вторую последовательность распознавания рекомбиназы (вторую RRS) и вторую часть.
Здесь первая часть может включать один из теломерных концов, расположенных с обеих сторон первой хромосомы-мишени, а вторая часть может включать другой из теломерных концов, расположенных с обеих сторон первой хромосомы-мишени.
Здесь первый фрагмент может быть расположен между первой RRS и второй RRS.
Вторая хромосома-мишень может включать третью часть, третью последовательность распознавания рекомбиназы (третью RRS), второй фрагмент, четвертую последовательность распознавания рекомбиназы (четвертую RRS) и четвертую часть.
Здесь третья часть может включать один из теломерных концов, расположенных с обеих сторон второй хромосомы-мишени, а четвертая часть может включать другой из теломерных концов, расположенных с обеих сторон второй хромосомы-мишени.
Здесь второй фрагмент может быть расположен между третьей RRS и четвертой RRS.
Одна или более микроклеток содержит вторую хромосому-мишень или ее фрагмент. Здесь фрагмент второй хромосомы-мишени может включать третью RRS, второй фрагмент и четвертую RRS.
Слитая клетка может содержать первую хромосому-мишень и вторую хромосому-мишень или первую хромосому-мишень и фрагмент второй хромосомы-мишени.
SSR может вызывать рекомбинацию путем распознавания спаривания первой RRS, присутствующей в первой хромосоме-мишени, и третьей RRS, присутствующей во второй хромосоме-мишени, и спаривания второй RRS, присутствующей в первой хромосоме-мишени, и четвертой RRS, присутствующей во второй хромосоме-мишени.
Здесь первый фрагмент, присутствующий в первой хромосоме-мишени, может обмениваться на второй фрагмент, присутствующий во второй хромосоме-мишени.
Таким образом, может быть получена первая искусственная рекомбинантная хромосома, включающая первую часть, второй фрагмент и вторую часть.
Здесь клетка, включающая первую искусственную рекомбинантную хромосому, может не включать вторую хромосому-мишень.
Химерная бластоциста может быть получена путем инъекции клетки, включающей первую искусственную хромосому, в бластоцисту.
[Благоприятные эффекты]
Согласно технологии, раскрытой в описании, продемонстрированы следующие эффекты.
Во-первых, может быть обеспечена искусственная рекомбинантная хромосома и способ ее получения. Кроме того, может быть обеспечена искусственная рекомбинантная хромосома, содержащая более крупный сегмент экзогенной ДНК.
Во-вторых, может быть обеспечена клетка, включающая искусственную рекомбинантную хромосому, и способ ее получения. Кроме того, может быть обеспечена клетка, включающая искусственную рекомбинантную хромосому, и способ ее получения, путем обеспечения более крупногосегмента экзогенной ДНК хромосоме-мишени.
В-третьих, может быть обеспечен способ получения трансгенного животного с использованием клетки, включающей искусственную рекомбинантную хромосому. Кроме того, может быть обеспечен способ получения трансгенного животного с использованием клетки, включающей искусственную рекомбинантную хромосому, путем обеспечения более крупногосегмента экзогенной ДНК хромосоме-мишени.
[Описание чертежей]
ФИГ. 1 представляет собой блок-схему согласно примеру варианта осуществления.
ФИГ.2-10 представляют собой схематические диаграммы, иллюстрирующие получение искусственной рекомбинантной хромосомы из хромосомы-мишени, соответственно.
ФИГ. 11 представляет собой схематическую диаграмму, иллюстрирующую получение первой хромосомы-мишени путем предоставления первой донорной ДНК и второй донорной ДНК первой исходной хромосоме, не являющейся мишенью
ФИГ. 12 представляет собой схематическую диаграмму, иллюстрирующую получение второй хромосомы-мишени путем предоставления третьей донорной ДНК и четвертой донорной ДНК второй исходной хромосоме, не являющейся мишенью.
ФИГ. 13 представляет собой схематическую диаграмму, иллюстрирующую получение первой искусственной рекомбинантной хромосомы и второй искусственной рекомбинантной хромосомы из первой хромосомы-мишени и второй хромосомы-мишени.
ФИГ. 14 представляет собой схематическую диаграмму, иллюстрирующую получение конечной искусственной рекомбинантной хромосомы из первой искусственной рекомбинантной хромосомы.
ФИГ. 15 представляет собой схематическую диаграмму, иллюстрирующую получение первой хромосомы-мишени путем предоставления первой донорной ДНК и второй донорной ДНК первой исходной хромосоме, не являющейся мишенью.
ФИГ. 16 представляет собой схематическую диаграмму, иллюстрирующую инверсию целевого гена первой хромосомы-мишени.
ФИГ. 17 представляет собой схематическую диаграмму, иллюстрирующую получение второй хромосомы-мишени путем предоставления третьей донорной ДНК и четвертой донорной ДНК второй исходной хромосоме, не являющейся мишенью.
ФИГ. 18 представляет собой схематическую диаграмму, иллюстрирующую инверсию целевого гена второй хромосомы-мишени.
ФИГ. 19 представляет собой схематическую диаграмму, иллюстрирующую получение первой искусственной рекомбинантной хромосомы и второй искусственной рекомбинантной хромосомы из первой хромосомы-мишени и второй хромосомы-мишени.
ФИГ. 20 представляет собой схематическую диаграмму, иллюстрирующую получение конечной искусственной рекомбинантной хромосомы из первой искусственной рекомбинантной хромосомы.
ФИГ. 21-24 представляют собой схематические изображения структуры ДНК хромосомы-мишени согласно примеру варианта осуществления, соответственно.
ФИГ. 25 и 26 иллюстрируют результаты селекции клетки-мишени согласно примеру варианта осуществления, соответственно.
ФИГ. 27 иллюстрирует микроклетку согласно примеру варианта осуществления.
ФИГ. 28 иллюстрирует способ получения слитой клетки согласно примеру варианта осуществления.
ФИГ. 29 иллюстрирует слитую клетку, включающую в себя хромосому-мишень, согласно примеру варианта осуществления.
ФИГ. 30 иллюстрирует слитую клетку, включающую искусственную рекомбинантную хромосому согласно примеру варианта осуществления.
ФИГ. 31-33 иллюстрируют сравнение слитой клетки, включающей искусственную рекомбинантную хромосому, со слитой клеткой, включающей хромосому-мишень, согласно примеру варианта осуществления.
ФИГ. 34 и 35 иллюстрируют результаты селекции слитой клетки, включающей искусственную рекомбинантную хромосому, и подтверждения искусственной рекомбинантной хромосомы согласно примеру варианта осуществления.
[Способы по изобретению]
Если не указано иное, все технические и научные термины, используемые в описании, имеют те же значения, которые обычно понимаются средним специалистом в области, к которой принадлежит настоящее изобретение. Хотя способы и материалы, подобные или эквивалентные тем, которые приведены в описании, можно использовать на практике или в экспериментах по настоящему изобретению, подходящие методы и материалы описаны ниже. Все публикации, заявки на патенты, патенты и другие ссылки, упомянутые в описании, полностью включены посредством ссылки. Кроме того, материалы, методы и примеры являются просто иллюстративными и не предназначены для ограничения.
Далее будет описано настоящее изобретение.
Описание относится к получению искусственной рекомбинантной хромосомы и клетки, включающей ее.
Трансгенное животное представляет собой животное, которому введен искусственный признак, которое используется для изучения различных заболеваний и механизмов, а также для разработки терапевтического агента. Для получения трансгенного животного способ получения трансгенного животного включает процесс введения желаемого признака в клетку животного. С этой целью в настоящее время используется метод, использующий вектор клонирования.
Метод с использованием вектора клонирования представляет собой метод клонирования желаемого признака, то есть целевого гена, который желательно экспрессировать у трансгенного животного, и доставки искусственно созданного вектора в клетку животного для вставки гена в геном. Такой метод использует плазмиду, бактериальную искусственную хромосому (BAC) или искусственнуюдрожжевую хромосому(YAC). ВАС или YAC по сравнению с плазмидой представляют собой конструкцию ДНК, которая может нести более крупный фрагмент (150 ~ 350 т.п.н.) и широко используется для трансформации. В частности, из-за того преимущества, что ВАС или YAC, по сравнению с плазмидой, могут нести относительно более крупный фрагмент, они используются для трансдукции крупного целевого гена.
Однако для крупного целевого гена необходимо множество ВАС или YAC. Например, когда получают мышь, продуцирующую человеческое антитело, для получения мыши необходимо получить мышиную клетку, в которую введен ген человеческого иммуноглобулина (Ig). Для этого необходимо получить вектор трансформации, клонирующий ген тяжелой цепи иммуноглобулина человека (IGH) размером 1250 тысяч пар нуклеотидов (т.п.н.). Когда вектор трансформации представляет собой ВАС, получают по меньшей мере от 4 до 9 ВАС, соответственно, содержащих разные фрагменты ДНК. Полученные таким образом ВАС последовательно вводят в клетку мыши для встраивания в геном. То есть первый ВАС вводят в клетку мыши для вставки в геном, и селектируют первую мышиную клетку со вставленным ВАС. Второй ВАС вводят в отселектированную клетку мыши для вставки в геном, и снова селектируют вторую мышиную клетку со вставленным ВАС. Чтобы отселектировать такую мышиную клетку, в которой целевой ген, то есть полноразмерный ген IGH человека (вся ДНК), вставлен в геном, необходимо повторить описанный выше процесс. Такой повторяющийся процесс является фактором снижения выхода клеток мыши, в которые вставлен полноразмерный целевой ген. Кроме того, возникают такие проблемы, как затраты времени и потребления, вызванные повторением введения признака и выбора. Более того, время и затраты создания нескольких BAC значительны.
Для решения этих проблем в настоящем изобретении разработана технология трансформации с использованием рекомбинации между хромосомами.
Описание показывает, что традиционные системы, использующие векторы трансформации, такие как ВАС и YAC, могут быть заменены получением искусственной рекомбинантной хромосомы путем рекомбинации между хромосомами.
Метод, раскрытый в описании, описывает метод трансдукции (трансформации) с использованием хромосомы, а не ВАС или YAC. Метод трансформации с использованием хромосомы вместо ВАС или YAC, которые использовались в обычном методе, заключается во вставке целевого гена в геном животного путем введения одной хромосомы в животную клетку и рекомбинации, а также создания трансформированной (трансдуцированной) животной клетки.
Метод трансформации с использованием хромосомы, раскрытый в описании, можно в основном разделить на три стадии.
Первой стадией является искусственное манипулирование хромосомой, содержащей целевой ген, то есть ген для трансдукции (трансформации), и хромосомой, в которую целевой ген будет вставлен, чтобы включить элемент, необходимый для рекомбинации. Этот процесс может быть выполнен в донорной клетке, содержащей хромосому, содержащую целевой ген, и реципиентной клетке, содержащей хромосому, в которую будет вставлен целевой ген. Элемент, необходимый для рекомбинации, может быть фактором, который делает возможной рекомбинацию с использованием рекомбиназы или гомологичной рекомбинации. Например, когда используется рекомбиназа, сайт, распознаваемый рекомбиназой, может считаться элементом, необходимым для рекомбинации. В одном примере, когда используется Cre-рекомбиназа, элементом, необходимым для рекомбинации, может быть loxP. В другом примере, когда используется рекомбиназа флиппаза (FLP), элементом, необходимым для рекомбинации, может быть FRT. Цель этого процесса заключается в предоставлении сайта, который может распознаваться рекомбиназой, или гомологичного сайта для гомологичной рекомбинации при рекомбинации между хромосомами. Процесс должен быть разработан с учетом положений и спаривания элемента, необходимого для рекомбинации, который включен в хромосому, содержащую целевой ген, и элемента, необходимого для рекомбинации, который включен в хромосому, в которую будет вставлен целевой ген. Положения могут быть в высокой степени связаны с положением вставки целевого гена, и спаривание может определять успех рекомбинации и тип рекомбинации. Посредством вышеописанного процесса получают клетку (донорную клетку), имеющую хромосому, содержащую целевой ген, в который вставлен элемент, необходимый для рекомбинации, и клетку (реципиентную клетку), имеющую хромосому, в которую вставлен элемент, необходимый для рекомбинации. Здесь элемент, необходимый для рекомбинации, который включен в хромосому донорной клетки, соединен с элементом, необходимым для рекомбинации, который включен в хромосому реципиентной клетки.
Вторая стадия предназначена для получения микроклеток и слияние клеток с их использованием. В этом процессе используется клетка (донорная клетка), полученная в предыдущем процессе, и микроклетка, полученная в результате этого процесса, имеет хромосому, содержащую целевой ген, в который вставлен элемент, необходимый для рекомбинации. В качестве альтернативы, микроклетка, полученная с помощью этого процесса, имеет фрагмент хромосомы, содержащий целевой ген, в который вставлен элемент, необходимый для рекомбинации, при этом фрагмент включает целевой ген, в который вставлен элемент, необходимый для рекомбинации. Этот процесс может быть выполнен с использованием переноса хромосом, опосредованного микроклетками (MMCT), который традиционно известен в данной области. MMCT представляет собой технологию, обычно используемую для переноса хромосомы от донорной клетки к реципиентной клетке (Thorfinn Ege et al., 1974; Thorfinn Ege et al., 1977). Микроклетка, полученная посредством этого процесса, включает хромосому или хромосомный фрагмент, который не является вектором клонирования, таким как плазмида, реплицируемая путем искусственного клонирования. Кроме того, хромосома или фрагмент хромосомы включает элемент, необходимый для рекомбинации, который соединен с элементом, необходимым для рекомбинации, включенным в реципиентную клетку. Полученная микроклетка сливается с реципиентной клеткой. Посредством этого процесса хромосома донорной клетки, содержащая целевой ген, в который вставлен элемент, необходимый для рекомбинации, вводится (переносится) в реципиентную клетку посредством слияния микроклеток.
Третья стадия заключается в получении клетки, имеющей искусственную рекомбинантную хромосому, с использованием рекомбиназы или гомологичной рекомбинации. Этот процесс должен вызвать рекомбинацию между хромосомами путем обработки клетки, полученной в предыдущем процессе, то есть слитой клетки, полученной путем слияния клеток, рекомбиназой или фактором, индуцированным гомологичной рекомбинацией. В этом процессе, когда обрабатывают рекомбиназой, индуцируется рекомбинация между хромосомами, имеющими сайт, распознаваемый рекомбиназой, то есть элемент, необходимый для рекомбинации. Другими словами, индуцируется рекомбинация между хромосомой, имеющей целевой ген, содержащий элемент, необходимый для рекомбинации, и хромосомой, в которую будет вставлен целевой ген, имеющей элемент, необходимый для рекомбинации. В результате создается новая искусственная рекомбинантная хромосома путем транслокации целевого гена, обусловленной рекомбинацией между двумя хромосомами. Здесь сгенерированная искусственная рекомбинантная хромосома представляет собой хромосому, в которой целевой ген вставлен в хромосому, в которую будет вставлен желаемый признак (целевой ген). Другими словами, сгенерированная искусственная рекомбинантная хромосома представляет собой хромосому, созданную путем вставки части хромосомы донорной клетки (т. е., целевого гена) в хромосому реципиентной клетки (т. е., хромосому, в которую будет вставлен целевой ген) посредством рекомбинации между хромосомами. Трансгенное животное может быть получено с использованием клетки, имеющей искусственную рекомбинантную хромосому.
Как описано с использованием вышеописанных примеров, когда получают мышь, продуцирующую человеческое антитело, ген IGH человека размером 1250 т.п.н. следует ввести в клетку мыши. При использовании метода трансформации с использованием хромосомы, раскрытой в описании, хромосома, содержащая человеческий ген IGH, то есть человеческая хромосома 14, вводится в клетку мыши. Здесь хромосома, содержащая ген IGH человека, представляет собой хромосому, искусственно измененную для включения элемента, необходимого для рекомбинации на обоих концах целевого гена, то есть гена IGH человека. Для введения или доставки хромосомы 14 человека в клетку мыши может быть использован перенос хромосом, опосредованный микроклетками (MMCT). Слитая клетка, в которой слиты микроклетка и клетка мыши, продуцируется с помощью MMCT и включает цельные хромосомы клетки мыши и хромосому 14 человека. Рекомбинация между введенной хромосомой 14 человека и хромосомой, в которую желательно вставить целевой ген (например, хромосому 12 мыши, содержащую ген IGH мыши), индуцируется обработкой слитой клетки рекомбинантным ферментом. Здесь хромосома, в которую желательно вставить целевой ген (например, хромосому 12 мыши, содержащую ген IGH мыши), представляет собой искусственно полученную хромосому для включения элемента, необходимого для рекомбинации в локусе, в который желательно вставить целевой ген (например, оба конца гена IGH мыши) типа хромосомы 14 человека. Посредством процесса индукции рекомбинации ген IGH человека в хромосоме 14 человека вставляется или заменяется локусом, в который желательно вставить целевой ген (например, локус IGH мыши). Для вставки ген IGH человека может быть вставлен выше или ниже локуса гена IGH мыши. Для замены ген IGH мыши, расположенный в локусе IGH мыши, можно заменить геном IGH человека. Рекомбинация (вставка или замена) может варьироваться в зависимости от конструкции элемента, необходимого для рекомбинации. Описанный выше вариант осуществления является просто примером, и целевой ген может быть выборочно модифицирован и диверсифицирован.
В способе трансформации с использованием хромосомы, который раскрыт в описании, используется хромосома, присутствующая в клетке, без стадии искусственного клонирования, и он имеет техническое отличие от традиционной системы, использующей векторы трансформации, такие как BAC и YAC. Кроме того, метод трансформации с использованием хромосомы, который раскрывается в описании, представляет собой новую технологию, которая может решать проблемы (эффективность, время, затраты и т.д.) традиционного уровня техники за счет значительного сокращения количества последовательных введений с использованием векторов трансформации, таких как ВАС и YAC, когда вводится целевой ген, в частности, крупный целевой ген.
Согласно способу трансформации с использованием хромосомы, который раскрывается в описании, вводимый ген, то есть полную последовательность целевого гена не клонируют. Чтобы ввести один целевой ген в геном в соответствии со способом трансформации с использованием хромосомы, который раскрыт в описании, после слияния клеток слитую клетку обрабатывают рекомбиназой (или фактором, индуцированным гомологичной рекомбинацией) для рекомбинации хромосом и дополнительно не сливают с микроклеткой. Однако когда есть два или более целевых гена, и каждый целевой ген расположен на другой хромосоме, метод трансформации с использованием хромосомы осуществляют путем введения каждого целевого гена в геном, и в это время осуществляют дополнительно стадию слияния микроклетки для введения второго целевого гена в клетку, в которую вводится первый целевой ген, сгенерированный методом трансформации с использованием хромосомы.
Далее будет подробно описан способ трансформации с использованием хромосомы, который раскрыт в описании, то есть способ получения искусственной рекомбинантной хромосомы.
Один аспект описания относится к искусственной рекомбинантной хромосоме.
«Искусственная рекомбинантная хромосома» относится к хромосоме, в которой две или более хромосомы, полученные из двух или более исходных клеток, частично рекомбинированы. Кроме того, искусственная рекомбинантная хромосома также включает хромосому, образованную путем репликации хромосомы, в которой две или более хромосомы, полученные из двух или более исходных клеток, частично рекомбинированы. В одном примере искусственная рекомбинантная хромосома может быть хромосомой, в которой хромосома, полученная из первой исходной клетки, и хромосома, полученная из второй исходной клетки, частично рекомбинированы. Здесь хромосома, полученная из первой исходной клетки, может быть первой исходной хромосомой, и первая исходная хромосома может быть включена в первую исходную клетку. Здесь хромосома, полученная из второй исходной клетки, может быть второй исходной хромосомой, а вторая исходная хромосома может быть включена во вторую исходную клетку.
Клетка, включающая по меньшей мере одну или более искусственных рекомбинантных хромосом, называется «рекомбинантной клеткой». Здесь рекомбинантная клетка включает по меньшей мере одну или более искусственных рекомбинантных хромосом и по меньшей мере одну или более исходных хромосом.
«Исходная хромосома» относится к хромосоме, предоставленной для получения искусственной рекомбинантной хромосомы. Исходная хромосома включает как естественную, так и искусственно полученную хромосому. Естественная хромосома представляет собой естественную хромосому, которая представляет собой интактную хромосому без каких-либо искусственных модификаций. Например, нервная клетка человека имеет 46 естественных хромосом. Искусственно полученная хромосома относится к хромосоме, полученной путем искусственной модификации естественной хромосомы. Здесь искусственная модификация включает делецию, вставку или замену одного или более нуклеотидов, составляющих естественную хромосому, или их комбинацию. Искусственно полученная хромосома включает в себя все из хромосомы-мишени, которая будет описана ниже, хромосомы, созданной в процессе ее получения, и хромосомы, включающие искусственную модификацию, отличную от цели создания хромосомы-мишени. Например, помимо цели получения хромосомы-мишени, хромосома, включающая искусственную модификацию, может быть хромосомой, в которую вставлена экзогенная нуклеиновая кислота, кодирующая экзогенный белок для его экспрессии.
«Исходная клетка» относится к клетке, включающей исходную хромосому. Исходная клетка может включать как клетку, включающую естественную хромосому, так и клетку, включающую искусственно полученную хромосому. Здесь клетка, включающая искусственно полученную хромосому, включает всю клетку-мишень, включающую хромосому-мишень, клетку, созданную в процессе ее получения, и клетку, включающую хромосому с искусственной модификацией, отличной от цели создания хромосомы-мишени. Кроме того, клетка, включающая хромосому, отличную от искусственной рекомбинантной хромосомы, то есть клетка, не содержащая искусственную рекомбинантную хромосому, также может называться исходной клеткой в настоящем изобретении.
Искусственная рекомбинантная хромосома
Искусственная рекомбинантная хромосома может быть хромосомой, полученной путем рекомбинации части хромосомной последовательности, полученной из первой исходной хромосомы, и всей хромосомной последовательности, полученной из второй исходной хромосомы.
Искусственная рекомбинантная хромосома может быть хромосомой, полученной путем рекомбинации всей хромосомной последовательности, полученной из первой исходной хромосомы, и части хромосомной последовательности, полученной из второй исходной хромосомы.
Искусственная рекомбинантная хромосома может быть хромосомой, полученной путем рекомбинации всей хромосомной последовательности, полученной из первой исходной хромосомы, и всей хромосомной последовательности, полученной из второй исходной хромосомы.
Искусственная рекомбинантная хромосома может быть хромосомой, полученной путем рекомбинации части последовательности хромосомы, полученной из первой исходной хромосомы, и части хромосомной последовательности второй исходной хромосомы.
Первая исходная хромосома может быть включена в первую исходную клетку.
Вторая исходная хромосома может быть включена во вторую исходную клетку.
Первая исходная хромосома может происходить из первой исходной клетки.
Вторая исходная хромосома может происходить из второй исходной клетки.
Первая исходная хромосома включена в первую исходную клетку, а вторая исходная хромосома может быть включена во вторую исходную клетку. В этом случае первая исходная клетка и вторая исходная клетка могут быть клетками одного типа. Например, первая исходная клетка и вторая исходная клетка могут быть фибробластами мыши и присутствовать как отдельные клетки. Первая исходная хромосома может отличаться от второй исходной хромосомы. В качестве альтернативы, первая исходная хромосома и вторая исходная хромосома могут быть гомологичными хромосомами.
Первая исходная клетка и вторая исходная клетка могут происходить от одного и того же индивидуума.
Первая исходная клетка и вторая исходная клетка могут происходить от разных индивидуумов. Здесь разные индивидуумы могут включать гомологичных и гетерологичных индивидуумов.
Исходная клетка может происходить из клетки человека.
Исходная клетка может быть получена из клетки, отличной от человеческой. Например, клетка, отличная от человеческой, может происходить из клетки мыши, клетки крысы, клетки грызунов, клетки горала, клетки крупного рогатого скота или клетки копытных животных, но настоящее изобретение этим не ограничивается.
Исходная клетка может происходить из соматической клетки. Например, соматическая клетка может быть, например, фибробластом (клеткой фибробласта), но настоящее изобретение этим не ограничивается.
Исходная клетка может происходить из иммунной клетки. Например, иммунная клетка может быть B-клеткой, T-клеткой, NK-клеткой, макрофагом, нейтрофилом, базофилом или эозинофилом, но настоящее изобретение этим не ограничивается.
Исходная клетка может происходить из зародышевой клетки. Например, половая клетка может относиться к сперматозоиду, сперматоциту, сперматогониальной стволовой клетке, яйцеклетке, ооциту, оогониальной стволовой клетке или оплодотворенной яйцеклетке, но настоящее изобретение этим не ограничивается.
Исходная клетка может происходить из стволовой клетки. Например, стволовая клетка может происходить из эмбриональной стволовой клетки (ES-клетки), взрослой стволовой клетки, стволовой клетки пуповинной крови, сперматогониальной стволовой клетки или оогониальной стволовой клетки, но настоящее изобретение этим не ограничивается.
В одном примере варианта осуществления искусственная рекомбинантная хромосома может включать в себя первый фрагмент и второй фрагмент.
Первый фрагмент может быть частью первой исходной хромосомы первой исходной клетки.
Здесь первый фрагмент может включать в себя первую теломеру. Первая теломера может быть одной из обеих теломер первой исходной хромосомы.
Здесь первая исходная клетка может быть клеткой человека, клеткой мыши, клеткой крысы, клеткой грызунов, клеткой горала, клеткой крупного рогатого скота или клеткой копытного животного.
Второй фрагмент может быть частью второй исходной хромосомы второй исходной клетки.
Здесь второй фрагмент может включать центромеру и вторую теломеру. Центромера может быть центромерой второй исходной хромосомы. Вторая теломера может быть одной из обеих теломер второй исходной хромосомы.
Здесь вторая исходная клетка может быть клеткой человека, клеткой мыши, клеткой крысы, клеткой грызунов, клеткой горала, клеткой крупного рогатого скота или клеткой копытного животного.
Здесь вторая исходная клетка и первая исходная клетка могут происходить от гетерологичных индивидуумов. Например, когда первая исходная клетка является клеткой человека, вторая исходная клетка может быть клеткой мыши.
В качестве альтернативы, вторая исходная клетка и первая исходная клетка могут происходить от гомологичных индивидуумов. Например, когда первая исходная клетка является клеткой человека, вторая исходная клетка может быть клеткой человека.
Первый фрагмент и второй фрагмент могут быть связаны фосфодиэфирной связью.
Искусственная рекомбинантная хромосома может иметь две теломеры, полученные от гетерологичных индивидуумов.
Искусственная рекомбинантная хромосома может иметь две теломеры разной длины.
Здесь искусственная рекомбинантная хромосома может не совпадать с первой исходной хромосомой, и искусственная рекомбинантная хромосома может не совпадать со второй исходной хромосомой.
В другом примере варианта осуществления искусственная рекомбинантная хромосома может включать первый фрагмент, второй фрагмент и третий фрагмент.
Первый фрагмент может быть частью первой исходной хромосомы первой исходной клетки.
Здесь первая исходная клетка может быть клеткой человека, клеткой мыши, клеткой крысы, клеткой грызунов, клеткой горала, клеткой крупного рогатого скота или клеткой копытного животного.
Второй фрагмент может быть частью второй исходной хромосомы второй исходной клетки.
Здесь второй фрагмент может включать центромеру и первую теломеру. Центромера может быть центромерой второй исходной хромосомы. Первая теломера может быть одной из обеих теломер второй исходной хромосомы.
Третий фрагмент может быть частью второй исходной хромосомы второй исходной клетки.
Здесь третий фрагмент может включать в себя вторую теломеру. Вторая теломера может быть одной из обеих теломер второй исходной хромосомы.
Здесь вторая исходная клетка может быть клеткой человека, клеткой мыши, клеткой крысы, клеткой грызунов, клеткой горала, клеткой крупного рогатого скота или клеткой копытного животного.
Здесь вторая исходная клетка и первая исходная клетка могут происходить от гетерологичных индивидуумов. Например, когда первая исходная клетка является клеткой человека, вторая исходная клетка может быть клеткой мыши.
В качестве альтернативы, вторая исходная клетка и первая исходная клетка могут происходить от гомологичных индивидуумов. Например, когда первая исходная клетка является клеткой человека, вторая исходная клетка может быть клеткой человека.
Первый фрагмент и второй фрагмент могут быть связаны фосфодиэфирной связью.
Первый фрагмент и третий фрагмент могут быть связаны фосфодиэфирной связью.
Искусственная рекомбинантная хромосома может состоять из последовательности [второй фрагмент]-[первый фрагмент]-[третий фрагмент].
Здесь первый фрагмент может иметь инверитрованную форму. Здесь инвертированная форма может быть инверсией первого фрагмента, присутствующего в первой исходной хромосоме. В этом случае в клетке, содержащей искусственную рекомбинантную хромосому, ген, включенный в первый фрагмент, может не экспрессироваться как белок. В качестве альтернативы, клетка, включающая искусственную рекомбинантную хромосому, может иметь другой профиль экспрессии гена, включенного в первый фрагмент, по сравнению с первой исходной клеткой, включающей первую исходную хромосому.
Искусственная рекомбинантная хромосома может иметь обе теломеры, полученные от одного и того же индивидуума.
Здесь искусственная рекомбинантная хромосома может не совпадать с первой исходной хромосомой, и искусственная рекомбинантная хромосома может не совпадать со второй исходной хромосомой.
Еще в одном примере варианта осуществления искусственная рекомбинантная хромосома может включать в себя первый фрагмент, второй фрагмент и третий фрагмент.
Первый фрагмент может быть частью первой исходной хромосомы первой исходной клетки.
Здесь первый фрагмент может включать центромеру. Центромера может быть центромерой первой исходной хромосомы.
Здесь первая исходная клетка может быть клеткой человека, клеткой мыши, клеткой крысы, клеткой грызунов, клеткой горала, клеткой крупного рогатого скота или клеткой копытного животного.
Второй фрагмент может быть частью второй исходной хромосомы второй исходной клетки.
Здесь второй фрагмент может включать первую теломеру. Первая теломера может быть одной из обеих теломер второй исходной хромосомы.
Третий фрагмент может быть частью второй исходной хромосомы второй исходной клетки.
Здесь третий фрагмент может включать в себя вторую теломеру. Вторая теломера может быть одной из обеих теломер второй исходной хромосомы.
Здесь вторая исходная клетка может быть клеткой человека, клеткой мыши, клеткой крысы, клеткой грызунов, клеткой горала, клеткой крупного рогатого скота или клеткой копытного животного.
Здесь вторая исходная клетка и первая исходная клетка могут происходить от гетерологичных индивидуумов. Например, когда первая исходная клетка является клеткой человека, вторая исходная клетка может быть клеткой мыши.
В качестве альтернативы, вторая исходная клетка и первая исходная клетка могут происходить от гомологичных индивидуумов. Например, когда первая исходная клетка является клеткой человека, вторая исходная клетка может быть клеткой человека.
Первый фрагмент и второй фрагмент могут быть связаны фосфодиэфирной связью.
Первый фрагмент и третий фрагмент могут быть связаны фосфодиэфирной связью.
Искусственная рекомбинантная хромосома может состоять из последовательности [второй фрагмент]-[первый фрагмент]-[третий фрагмент].
Здесь первый фрагмент может иметь инверитрованную форму. Здесь инвертированная форма может быть инверсией первого фрагмента, присутствующего в первой исходной хромосоме. В этом случае в клетке, содержащей искусственную рекомбинантную хромосому, ген, включенный в первый фрагмент, может не экспрессироваться как белок. В качестве альтернативы, клетка, включающая искусственную рекомбинантную хромосому, может иметь другой профиль экспрессии гена, включенного в первый фрагмент, по сравнению с первой исходной клеткой, включающей первую исходную хромосому.
Искусственная рекомбинантная хромосома может иметь обе теломеры, полученные от одного и того же индивидуума.
Здесь искусственная рекомбинантная хромосома может не совпадать с первой исходной хромосомой, и искусственная рекомбинантная хромосома может не совпадать со второй исходной хромосомой.
Еще в одном примере варианта осуществления искусственная рекомбинантная хромосома может включать в себя первый фрагмент, второй фрагмент и третий фрагмент.
Первый фрагмент может быть частью первой исходной хромосомы первой исходной клетки.
Здесь первый фрагмент может включать в себя первую теломеру. Первая теломера может быть одной из обеих теломер первой исходной хромосомы.
Здесь первая исходная клетка может быть клеткой человека, клеткой мыши, клеткой крысы, клеткой грызунов, клеткой горала, клеткой крупного рогатого скота или клеткой копытного животного.
Второй фрагмент может быть частью второй исходной хромосомы второй исходной клетки.
Здесь второй фрагмент может включать центромеру. Центромера может быть центромерой второй исходной хромосомы.
Здесь вторая исходная клетка может быть клеткой человека, клеткой мыши, клеткой крысы, клеткой грызунов, клеткой горала, клеткой крупного рогатого скота или клеткой копытного животного.
Третий фрагмент может быть частью третьей исходной хромосомы третьей исходной клетки.
Здесь третий фрагмент может включать в себя вторую теломеру. Вторая теломера может быть одной из обеих теломер третьей исходной хромосомы.
Здесь третья исходная клетка может быть клеткой человека, клеткой мыши, клеткой крысы, клеткой грызунов, клеткой горала, клеткой крупного рогатого скота или клеткой копытного животного.
Здесь третья исходная клетка может происходить от гетерологичного индивидуума по отношению к первой исходной клетке и второй исходной клетке. Например, когда первая исходная клетка и вторая исходная клетка являются клетками человека, третья исходная клетка может быть клеткой мыши. В качестве альтернативы, например, когда первая исходная клетка является клеткой человека, а вторая исходная клетка является клеткой мыши, третья исходная клетка может быть клеткой крысы.
В качестве альтернативы, третья исходная клетка и первая исходная клетка происходят от гетерологичных индивидуумов, а третья исходная клетка и вторая исходная клетка происходят от гомологичных индивидуумов. Например, когда первая исходная клетка является клеткой человека, а вторая исходная клетка является клеткой мыши, третья исходная клетка может быть клеткой мыши.
В качестве альтернативы, третья исходная клетка и первая исходная клетка происходят от гомологичных индивидуумов, а третья исходная клетка и вторая исходная клетка происходят от гетерологичных индивидуумов. Например, когда первая исходная клетка является клеткой мыши, а вторая исходная клетка является клеткой крысы, третья исходная клетка может быть клеткой мыши.
Первый фрагмент и второй фрагмент могут быть связаны фосфодиэфирной связью.
Второй фрагмент и третий фрагмент могут быть связаны фосфодиэфирной связью.
Искусственная рекомбинантная хромосома может состоять из последовательности [первый фрагмент] - [второй фрагмент] - [третий фрагмент].
Здесь второй фрагмент может иметь инверитрованную форму. Здесь инвертированная форма может быть инверсией второго фрагмента, присутствующего во второй исходной хромосоме. В этом случае в клетке, содержащей искусственную рекомбинантную хромосому, ген, включенный во второй фрагмент, может не экспрессироваться в виде белка. В качестве альтернативы, клетка, включающая искусственную рекомбинантную хромосому, может иметь другой профиль экспрессии гена, включенного во второй фрагмент, по сравнению со второй исходной клеткой, включающей вторую исходную хромосому.
Искусственная рекомбинантная хромосома может содержать оба конца теломеры, происходящие от одного и того же индивидуума.
В качестве альтернативы искусственная рекомбинантная хромосома может содержать две теломеры, происходящие от гетерологичных индивидуумов. Искусственная рекомбинантная хромосома может содержать две теломеры разной длины.
Здесь искусственная рекомбинантная хромосома не совпадает с первой исходной хромосомой, второй исходной хромосомой или третьей исходной хромосомой.
Другой аспект описания относится к способу получения искусственной рекомбинантной хромосомы.
Искусственная рекомбинантная хромосома может быть получена из исходной хромосомы.
Исходной хромосомой может быть искусственно полученная хромосома.
Искусственно полученная хромосома может быть хромосомой-мишенью.
«Хромосома-мишень» означает хромосому, дополнительно включающую в себя один или более составляющих элементов естественной хромосомы для рекомбинации. В одном примере хромосомой-мишенью может быть хромосома, дополнительно включающая один или более сайтов распознавания рекомбиназы (RRS) на естественной хромосоме. В другом примере хромосомой-мишенью может быть хромосома, дополнительно включающая одну или более искусственных последовательностей для обмена хромосом (ASCE) на естественной хромосоме.
Хромосома-мишень может быть получена из естественной хромосомы.
Описания, относящиеся к исходной хромосоме, такие же, как описано выше.
В одном примере первая хромосома-мишень может быть получена из первой естественной хромосомы. Первая хромосома-мишень может включать в себя один или множество RRS на первой естественной хромосоме. Первая хромосома-мишень может включать одну или более ASCE на первой естественной хромосоме.
В другом примере вторая хромосома-мишень может быть получена из второй естественной хромосомы. Вторая хромосома-мишень может включать один или множество RRS на второй естественной хромосоме. Вторая хромосома-мишень может включать одну или более ASCE на второй естественной хромосоме.
«Сайт распознавания рекомбиназы (RRS)» означает последовательность нуклеиновой кислоты, которая может обеспечивать сайт рекомбинации с помощью сайт-специфической рекомбиназы. В одном примере RRS может быть сайтом loxP или его вариантом (Таблица 1). В другом примере RRS может быть сайтом FRT или его вариантом. В одном примере RRS может быть attP/attB или его вариантом. В другом примере RRS может быть последовательностью инвертированного концевого повтора (ITR) или ее вариантом, которая распознается одной или более транспозазами. Однако RRS этим не ограничивается.
Для создания хромосомы-мишени из естественной хромосомы может использоваться система сайт-специфической рекомбинации. Система сайт-специфической рекомбинации представляет собой систему, в которой используется SSR, действующая на RRS, и она известна в данной области. Система сайт-специфической рекомбинации может включать Cre-lox. Система сайт-специфической рекомбинации может включать FLP/FRT. Система сайт-специфической рекомбинации может включать интегразу φC31-attP/attB. Система сайт-специфической рекомбинации может включать транспозон-ITR. Однако система сайт-специфической рекомбинации, опосредованная RRS и SSR, не ограничивается этим, и в качестве SSR используются различные типы рекомбиназ, интеграз, ресольваз или траспозаз, и в зависимости от SSR, RRS можно модифицировать в различных формах и создавать.
RRS может быть известной последовательностью. В одном примере RRS может быть loxP или его вариантом.
Например, вариант loxP может быть одним или более из Lox m2/71, Lox m2/66, Lox71 и Lox66. Последовательности ДНК вариантов loxP раскрыты в Таблице 1 ниже. Здесь и далее номер последовательности указан как SEQ ID NO:
[Таблица 1]
Последовательности ДНК вариантов loxP
RRS может быть известной последовательностью. В другом примере RRS может быть сайтом FRT или его вариантом.
Еще в одном примере RRS может быть attP/attB или ее вариантом. Еще в одном примере RRS может быть последовательностью ITR или ее вариантом, которая распознается транспозазой. Здесь ITR может быть ITR транспозона, который может включать последовательность концевого повтора транспозона (TR). Например, последовательность ITR транспозона может включать концевой повтор piggyBac (PB-TR).
Последовательности ДНК RRS и их вариантов перечислены в Таблице 2 ниже.
[Таблица 2]
Последовательности ДНК RRS
«Искусственная последовательность для обмена хромосом (ASCE)» означает последовательность нуклеиновой кислоты, которая обеспечивает сайт рекомбинации посредством гомологичной рекомбинации (HR). ASCE может быть искусственной последовательностью. ASCE может быть искусственной последовательностью, включенной в хромосому-мишень. Например, первая хромосома-мишень может включать первую ASCE. Вторая хромосома-мишень может включать в себя вторую ASCE. Здесь первая ASCE, включенная в первую хромосому-мишень, и вторая ASCE, включенная во вторую хромосому-мишень, могут использоваться в последующей гомологичной рекомбинации.
Для создания хромосомы-мишени из естественной хромосомы можно использовать гомологичную рекомбинацию. Гомологичная рекомбинация может быть осуществлена путем двухцепочечного разрыва (DSB) и/или одноцепочечного разрыва (SSB) хромосомы. SSB и/или DSB могут присутствовать естественным образом. SSB и/или DSB могут быть созданы кластогеном (фактором, вызывающим хромосомную аномалию). Кластогеном может быть ионизирующее излучение, УФ, рентгеновские лучи, γ-лучи, активные формы кислорода или конкретное химическое вещество. Конкретным химическим веществом может быть, например, блеомицин, гидроксимочевина, камптотецин, 4-нитрохинолин-1-оксид (4-NQO), цисплатин или метилирующий агент, такой как EMS или MMS, но настоящее изобретение этим не ограничивается. SSB и/или DSB могут генерироваться с помощью сконструированных нуклеаз. Например, SSB и/или DSB могут генерироваться любой одной или более нуклеазами типа «цинковые пальцы» (ZFN), эффекторными нуклеазами, подобными активатору транскрипции (TALEN), и короткие палиндромные повторы, регулярно расположенные группами/CRISPR-ассоциированным белком (CRISPR/Cas).
В одном примере вариантов осуществления искусственная рекомбинантная хромосома может быть получена с помощью по меньшей мере двух или более хромосом-мишеней.
По меньшей мере, две или более хромосом-мишеней могут включать первую хромосому-мишень и вторую хромосому-мишень.
Здесь первая хромосома-мишень может включать в себя один или более RRS.
Здесь вторая хромосома-мишень может включать один или более RRS.
Здесь RRS, включенные в первую хромосому-мишень, и RRS, включенные во вторую хромосому-мишень, могут распознаваться сайт-специфической рекомбиназой (SSR). Здесь RRS, включенный в первую хромосому-мишень, и RRS, включенный во вторую хромосому-мишень, могут спариваться друг с другом.
Искусственная рекомбинантная хромосома может включать часть первой хромосомы-мишени и часть второй хромосомы-мишени.
Здесь искусственная рекомбинантная хромосома может быть создана посредством сайт-специфической рекомбинации с использованием спаривания RRS, включенного в первую хромосому-мишень, и RRS, включенного во вторую хромосому-мишень.
В одном примере, когда первая хромосома-мишень состоит из последовательности [первый фрагмент] - [первый RRS] - [второй фрагмент], вторая хромосома-мишень состоит из последовательности [третий фрагмент] - [второй RRS] - [четвертый фрагмент],
искусственная рекомбинантная хромосома может состоять из последовательности [первый фрагмент] - [третий фрагмент], [первый фрагмент] - [четвертый фрагмент], [третий фрагмент] - [второй фрагмент] или [второй фрагмент] - [четвертый фрагмент].
В качестве альтернативы искусственная рекомбинантная хромосома может состоять из последовательности [первый фрагмент] - [первый RRS] - [третий фрагмент], [первый фрагмент] - [первый RRS] - [четвертый фрагмент], [третий фрагмент] - [первый RRS] - [второй фрагмент] или [второй фрагмент] - [первый RRS] - [четвертый фрагмент].
В качестве альтернативы искусственная рекомбинантная хромосома может состоять из последовательности [первый фрагмент] - [второй RRS] - [третий фрагмент], [первый фрагмент] - [второй RRS] - [четвертый фрагмент], [третий фрагмент] - [второй RRS] - [второй фрагмент] или [второй фрагмент] - [второй RRS] - [четвертый фрагмент].
В качестве альтернативы, искусственная рекомбинантная хромосома может состоять из последовательности [первый фрагмент] - [третий RRS] - [третий фрагмент], [первый фрагмент] - [третий RRS] - [четвертый фрагмент], [третий фрагмент] - [третий RRS] - [второй фрагмент] или [второй фрагмент] - [третий RRS] - [четвертый фрагмент]. Здесь третьим RRS может быть RRS, сгенерированный путем рекомбинации первого RRS и второго RRS, и может не совпадать с первым RRS и вторым RRS.
В другом примере, когда первая хромосома-мишень состоит из последовательности [первый фрагмент] - [первый RRS] - [второй фрагмент] - [второй RRS] - [третий фрагмент], а вторая хромосома-мишень состоит из последовательности [четвертый фрагмент] - [третий RRS] - [пятый фрагмент] - [четвертый RRS] - [шестой фрагмент], искусственная рекомбинантная хромосома может состоять из последовательности [первый фрагмент] - [пятый фрагмент] - [третий фрагмент] или [четвертый фрагмент] - [второй фрагмент] - [шестой фрагмент].
В качестве альтернативы искусственная рекомбинантная хромосома может состоять из последовательности [первый фрагмент] - [первый RRS] - [пятый фрагмент] - [второй RRS] - [третий фрагмент], [первый фрагмент] - [первый RRS] - [пятый фрагмент] - [четвертый RRS] - [третий фрагмент], [первый фрагмент] - [третий RRS] - [пятый фрагмент] - [второй RRS] - [третий фрагмент], [первый фрагмент] - [третий RRS] - [пятый фрагмент] - [четвертый RRS] - [третий фрагмент], [четвертый фрагмент] - [первый RRS] - [второй фрагмент] - [второй RRS] - [шестой фрагмент], [четвертый фрагмент] - [первый RRS] - [второй фрагмент] - [четвертый RRS] - [шестой фрагмент], [четвертый фрагмент] - [третий RRS] - [второй фрагмент] - [второй RRS] - [шестой фрагмент] или [четвертый фрагмент] - [третий RRS] - [второй фрагмент] - [четвертый RRS] - [шестой фрагмент].
В качестве альтернативы, искусственная рекомбинантная хромосома может состоять из последовательности [первый фрагмент] - [пятый RRS] - [пятый фрагмент] - [второй RRS] - [третий фрагмент], [первый фрагмент] - [пятый RRS] - [пятый фрагмент] - [четвертый RRS] - [третий фрагмент], [четвертый фрагмент] - [пятый RRS] - [второй фрагмент] - [второй RRS] - [шестой фрагмент] или [четвертый фрагмент] - [пятый RRS] - [второй фрагмент] - [четвертый RRS] - [шестой фрагмент]. Здесь пятый RRS может быть RRS, сгенерированным путем рекомбинации первого RRS и третьего RRS, и может не совпадать с первым RRS и третьим RRS.
В качестве альтернативы искусственная рекомбинантная хромосома может состоять из последовательности [первый фрагмент] - [первый RRS] - [пятый фрагмент] - [шестой RRS] - [третий фрагмент], [первый фрагмент] - [третий RRS] - [пятый фрагмент] - [шестой RRS] - [третий фрагмент], [четвертый фрагмент] - [первый RRS] - [второй фрагмент] - [шестой RRS] - [шестой фрагмент] или [четвертый фрагмент] - [третий RRS] - [второй фрагмент] - [шестой RRS] - [шестой фрагмент]. Здесь шестой RRS может быть RRS, сгенерированным путем рекомбинации второго RRS и четвертого RRS, и может не совпадать со вторым RRS и четвертым RRS.
В качестве альтернативы, искусственная рекомбинантная хромосома может состоять из последовательности [первый фрагмент] - [пятый RRS] - [пятый фрагмент] - [шестой RRS] - [третий фрагмент] или [четвертый фрагмент] - [пятый RRS] - [второй фрагмент] - [шестой RRS] - [шестой фрагмент]. Здесь пятым RRS может быть RRS, сгенерированный путем рекомбинации первого RRS и третьего RRS, и может не совпадать с первым RRS и третьим RRS. Здесь шестым RRS может быть RRS, сгенерированный путем рекомбинации второго RRS и четвертого RRS, и может не совпадать со вторым RRS и четвертым RRS.
В другом примере варианта осуществления искусственная рекомбинантная хромосома может быть получена с помощью по меньшей мере двух или более хромосом-мишеней.
По меньшей мере, две или более хромосомы-мишени могут включать первую хромосому-мишень и вторую хромосому-мишень.
Здесь первая хромосома-мишень может включать одну или более ASCE.
Здесь вторая хромосома-мишень может включать одну или более ASCE.
Здесь ASCE, включенные в первую хромосому-мишень, могут быть последовательностями, гомологичными последовательностям, включенным во вторую хромосому-мишень.
Искусственная рекомбинантная хромосома может включать часть первой хромосомы-мишени и часть второй хромосомы-мишени.
Здесь искусственная рекомбинантная хромосома может быть создана путем гомологичной рекомбинации с использованием гомологии ASCE, включенной в первую хромосому-мишень, и ASCE, включенной во вторую хромосому-мишень.
В одном примере, когда первая хромосома-мишень состоит из последовательности [первый фрагмент] - [первая ASCE] - [второй фрагмент] - [вторая ASCE] - [третий фрагмент], а вторая хромосома-мишень состоит из последовательности [четвертый фрагмент] - [третья ASCE] - [пятый фрагмент] - [четвертая ASCE] - [шестой фрагмент], искусственная рекомбинантная хромосома может состоять из последовательности [первый фрагмент] - [пятый фрагмент] - [третий фрагмент] или [четвертый фрагмент] - [второй фрагмент] - [шестой фрагмент].
В качестве альтернативы искусственная рекомбинантная хромосома может состоять из последовательности [первый фрагмент] - [первая ASCE] - [пятый фрагмент] - [вторая ASCE] - [третий фрагмент], [первый фрагмент] - [первая ASCE] - [пятый фрагмент] - [четвертая ASCE] - [третий фрагмент], [первый фрагмент] - [третья ASCE] - [пятый фрагмент] - [вторая ASCE] - [третий фрагмент], [первый фрагмент] - [третья ASCE] - [пятый фрагмент] - [четвертая ASCE] - [третий фрагмент], [четвертый фрагмент] - [первая ASCE] - [второй фрагмент] - [вторая ASCE] - [шестой фрагмент], [четвертый фрагмент] - [первая ASCE] - [второй фрагмент] - [четвертая ASCE] - [шестой фрагмент], [четвертый фрагмент] - [третья ASCE] - [второй фрагмент] - [вторая ASCE] - [шестой фрагмент] или [четвертый фрагмент] - [третья ASCE] - [второй фрагмент] - [четвертая ASCE] - [шестой фрагмент].
Еще один аспект описания относится к способу получения клетки, включающей одну или более искусственных рекомбинантных хромосом.
В способе получения клетки, включающей одну или более искусственных рекомбинантных хромосом, может использоваться слияние клеток.
«Слияние клеток» означает слияние двух или более клеток; и/или слияние одной или более клеток с одним или более аналогами клеток. Здесь слияние может представлять собой получение одной клетки путем объединения (или смешивания) двух или более клеток; и/или получение одной клетки путем объединения (или смешивания) одной или более клеток и одного или более аналогов клеток. В данном случае аналогами клеток могут быть клетки или полученные из клеток материалы, которые включают часть генома или часть цельных хромосом, но не подвергаются нормальному соматическому делению (митозу) или мейозу.
В результате слияния клеток может образоваться слитая клетка.
«Слитая клетка» означает клетку, полученную таким образом, что исходная клетка содержит одну или более хромосом или фрагментов хромосом. Здесь одна или более хромосом или фрагментов хромосом представляют собой хромосомы или фрагменты хромосом, дополнительно добавленные, не встречающиеся в природе в исходной клетке. Здесь одна или более хромосом или фрагментов хромосом могут представлять собой исходную хромосому, фрагмент исходной хромосомы, искусственную рекомбинантную хромосому или фрагмент искусственной рекомбинантной хромосомы.
Слитая клетка может быть клеткой, в которой одна или более исходных хромосом или фрагментов исходных хромосом включены в исходную клетку. Здесь одна или более исходных хромосом или исходных хромосомных фрагментов могут быть хромосомами или фрагментами хромосом, которые дополнительно добавляют к исходной клетке, и которые не встречаются в природе в исходной клетке.
Например, когда фибробласт человека является исходной клеткой, слитая клетка может представлять собой слитую клетку - фибробласт человека, включающий одну или более хромосом, полученных из фибробластов мыши. Здесь слитая клетка - фибробласт человека может иметь геном, отличный от генома фибробласта человека, то есть исходной клетки, а также может иметь геном, отличный от фибробласта мыши. Здесь слитая клетка - фибробласт человека может включать 2n (46) хромосом, происходящих из фибробластов человека, и одну хромосому, происходящую из фибробластов мыши. В качестве альтернативы, слитая клетка - фибробласт человека может включать 2n-1 (45) хромосом, происходящих из фибробластов человека, и одну хромосому, происходящую из фибробластов мыши.
Слитая клетка может быть клеткой, в которой одна или более рекомбинантных хромосом содержатся в исходной клетке. Здесь одна или более рекомбинантных хромосом могут быть получены путем рекомбинации между хромосомами в слитой клетке. Здесь рекомбинантная хромосома может быть искусственной рекомбинантной хромосомой.
Например, когда эмбриональная стволовая клетка мыши (ESC) является исходной клеткой, слитая клетка может быть слитой ESC мыши, включающей одну или более хромосом, полученных из фибробласта человека. Здесь слитая ESC мыши может иметь геном, отличный от ESC мыши, то есть исходной клетки, а также может иметь геном, отличный от фибробласта человека. Здесь слитая ESC мыши может включать 2n (40) хромосом, происходящих из ESC мыши, и одну хромосому, происходящую из фибробластов человека. В качестве альтернативы, слитая ESC мыши может включать 2n-1 (39) хромосом, происходящих из ESC мыши, и одну хромосому, происходящую из фибробластов человека. В качестве альтернативы, слитая ESC мыши может включать 2n-1 (39) хромосом, происходящих из ESC мыши, и две рекомбинантные хромосомы, при этом две рекомбинантные хромосомы могут быть получены путем рекомбинации между одной хромосомой, происходящей из ESC мыши, и одной хромосомой, происходящей из фибробластов человека. В качестве альтернативы, слитая ESC мыши может включать 2n-1 (39) хромосом, происходящих из ESC мыши, и одну рекомбинантную хромосому, при этом одна рекомбинантная хромосома может быть получена путем рекомбинации между одной хромосомой, происходящей из ESC мыши, и одной хромосомой, происходящей из фибробластов человека.
Слитая клетка может быть животной клеткой, имеющей 2n+1 хромосом.
Слитая клетка может быть животной клеткой, имеющей 2n хромосом. Здесь 2n хромосом могут включать по меньшей мере одну искусственную рекомбинантную хромосому.
Слитая клетка может представлять собой клетку, включающую одну или более искусственных рекомбинантных хромосом.
Слитая клетка может претерпевать нормальное соматическое деление (митоз) или мейоз.
Слитая клетка может быть животной зародышевой клеткой, имеющей n+1 хромосом.
Слитая клетка может быть животной зародышевой клеткой, имеющей n хромосом. Здесь n хромосом может включать по меньшей мере одну искусственную рекомбинантную хромосому.
Слитая клетка может включать клетку, включающую одну или более искусственных рекомбинантных хромосом.
Описания, относящиеся к искусственной рекомбинантной хромосоме, такие же, как описано выше.
В одном примере варианта осуществления способ получения клетки, включающей одну или более искусственных рекомбинантных хромосом, может включать:
i) получение клеток-мишеней;
ii) получение микроклетки с использованием клетки-мишени;
iii) получение слитой клетки с использованием микроклетки; и
iv) получение клетки, включающей искусственную рекомбинантную хромосому, с использованием слитой клетки.
Клетки-мишени, полученные на стадии i), могут включать две или более клетки-мишени.
Здесь две или более клетки-мишени могут включать донорную клетку и реципиентную клетку.
Клетка-мишень, используемая на стадии ii), может быть донорной клеткой.
Микроклетка, используемая на стадии iii), может быть слита с реципиентной клеткой.
Каждая стадия будет подробно описана ниже.
i) Получение клеток-мишеней
Клетки-мишени, полученные на стадии i), могут включать две или более клетки-мишени.
Две или более клетки-мишени могут включать донорную клетку и реципиентную клетку. Донорная клетка может быть клеткой, включающей одну или более хромосом-мишеней, а реципиентная клетка может быть клеткой, включающей одну или более хромосом-мишеней. Здесь хромосома-мишень, включенная в донорную клетку, может быть связана с хромосомой-мишенью, включенной в реципиентную клетку. Ассоциация может представлять собой возможность спаривания или гомологичного связывания между составляющими элементами, которые могут вызывать рекомбинацию между хромосомой-мишенью, включенной в донорную клетку, и хромосомой-мишенью, включенной в реципиентную клетку.
Здесь составляющим элементом может быть RRS или ASCE, которые были описаны выше.
Ассоциация может представлять собой спаривание RRS, присутствующего в хромосоме-мишени, включенной в донорную клетку, и RRS, присутствующего в хромосоме-мишени, включенной в реципиентную клетку.
Например, хромосома-мишень, включенная в донорную клетку, включает в себя один или более RRS (например, первый RRS), а хромосома-мишень, включенная в реципиентную клетку, включает в себя один или более RRS (например, второй RRS). Здесь RRS (например, первый RRS) хромосомы-мишени, включенной в донорную клетку, и RRS (например, второй RRS) хромосомы-мишени, включенной в реципиентную клетку, могут быть спроектированы так, чтобы быть спаренными друг с другом.
В другом примере, когда хромосома-мишень, включенная в донорную клетку, включает два или более RRS (например, первый RRS и второй RRS), а хромосома-мишень, включенная в клетку-реципиент, включает два или более RRS (например, третий RRS и четвертый RRS), один RRS (например, первый RRS) хромосомы-мишени, включенной в донорную клетку, и один из двух RRS (например, третий RRS и четвертый RRS) хромосомы-мишени, включенной вреципиентную клетку, должны быть разработаны для спаривания друг с другом, и, кроме того, другой RRS (например, второй RRS) хромосомы-мишени, включенной в донорную клетку, и другой из двух RRS (например, третий и четвертый RRS) хромосомы-мишени, включенной в реципиентную клетку, должны быть разработаны для спаривания друг с другом.
Ассоциация может представлять собой гомологичное связывание между ASCE, присутствующей в хромосоме-мишени, включенной в донорную клетку, и ASCE, присутствующей в хромосоме-мишени, включенной в реципиентную клетку.
На стадии i) может быть получена клетка-мишень, то есть донорная клетка и реципиентная клетка.
Донорная клетка и реципиентная клетка могут быть получены независимо в соответствии со способом, который будет описан ниже.
«Клетка-мишень» означает один тип исходных клеток, который представляет собой клетку, включающую одну или более хромосом-мишеней.
Клетка-мишень может включать по меньшей мере одну хромосому-мишень.
Клетка-мишень может включать одну или более естественных хромосом.
Описание хромосомы-мишени такое, как описано выше.
Описание естественной хромосомы такое, как описано выше.
Клетка-мишень может происходить из клетки человека. Клетка-мишень может происходить из клетки, отличной от человеческой. Например, клетка, отличная от человеческой, может происходить из клетки мыши, клетки крысы, клетки грызунов, клетки горала, клетки крупного рогатого скота или клетки копытных животных, но настоящее изобретение этим не ограничивается.
Клетка-мишень может происходить из соматической клетки. Например, соматическая клетка может быть, например, фибробластом, но настоящее изобретение этим не ограничивается.
Клетка-мишень может происходить из иммунной клетки. Например, иммунная клетка может быть B-клеткой, T-клеткой, NK-клеткой, макрофагом, нейтрофилом, базофилом или эозинофилом, но настоящее изобретение этим не ограничивается.
Клетка-мишень может происходить из зародышевой клетки. Например, клеткой-мишенью может быть сперматазоид, сперматоцит, сперматогониальная стволовая клетка, яйцеклетка, ооцит, оогониальная стволовая клетка или оплодотворенная яйцеклетка, но настоящее изобретение этим не ограничивается.
Клетка-мишень может происходить из стволовой клетки. Например, стволовая клетка может происходить из эмбриональной стволовой клетки (ES-клетки), взрослой стволовой клетки, стволовой клетки пуповинной крови, сперматогониальной стволовой клетки или оогониальной стволовой клетки, но настоящее изобретение этим не ограничивается.
Клетка-мишень может быть получена из клетки, включающей естественную хромосому и/или хромосому с искусственной модификацией, отличной от цели получения хромосомы-мишени.
Клетка, включающая естественную хромосому и/или хромосому с искусственной модификацией, отличной от цели получения хромосомы-мишени, является одним типом исходной клетки, и описание исходной клетки приведено выше. Клетка, включающая естественную хромосому и/или хромосому с искусственной модификацией, отличной от цели получения хромосомы-мишени, раскрыта ниже как исходная клетка, не являющаяся мишенью, а также естественная хромосома и/или хромосома с искусственной модификацией, отличной от цели получения хромосомы-мишени, ниже раскрыта как исходная хромосома, не являющаяся мишенью.
Клетка-мишень может быть получена из исходной клетки, не являющейся мишенью.
Например, первая клетка-мишень может быть получена из первой исходной клетки, не являющейся мишенью. Первая клетка-мишень может быть получена путем замены одной и/или двух или более исходных хромосом, не являющихся мишенью, включенных в первую исходную клетку, не являющуюся мишенью, на хромосому-мишень.
Например, вторая клетка-мишень может быть получена из второй исходной клетки, не являющейся мишенью. Вторая клетка-мишень может быть получена путем замены одной и/или двух или более исходных хромосом, не являющихся мишенью, включенных во вторую исходную клетку, не являющуюся мишенью, на хромосому-мишень.
Клетка-мишень может быть получена путем предоставления донорной ДНК исходной клетке, не являющейся мишенью.
Донорная ДНК может включать по меньшей мере один RRS и по меньшей мере одно гомологичное плечо для исходной хромосомы, не являющейся мишенью.
Например, донорная ДНК может представлять собой последовательность, включающую любой из вариантов LoxP, описанных в Таблице 1, и гомологичное плечо для исходной хромосомы, не являющейся мишенью.
Донорная ДНК может представлять собой последовательность, включающую по меньшей мере одну ASCE и по меньшей мере одно гомологичное плечо для исходной хромосомы, не являющейся мишенью.
Донорная ДНК может дополнительно включать ген маркера селекции. В донорной ДНК есть один или более генов-маркеров селекции. Ген маркера селекции может представлять собой ген флуоресцентного белка, ген устойчивости к антибиотику, последовательность-мишень FISH или его инвертированный ген. Геном флуоресцентного белка и его инвертированным геном могут быть известные последовательности. Например, геном флуоресцентного белка может быть один или более из гена GFP, гена YFP, гена RFP и гена mCherry, но настоящее изобретение этим не ограничивается. Геном устойчивости к антибиотику и его инвертированным геном могут быть известные последовательности. Например, геном устойчивости к антибиотику может быть один или более из гена устойчивости к гигромицину, гена устойчивости к неомицину, гена устойчивости к канамицину, гена устойчивости к бластицидину, гена устойчивости к зеоцину и гена puroΔTK, но настоящее изобретение этим не ограничивается. Последовательность-мишень FISH и ее инвертированный ген могут быть известными последовательностями.
Донорная ДНК может дополнительно включать последовательность ITR транспозона. Транспозон может быть PiggyBac. Например, последовательность ITR транспозона может представлять собой правую (3’) ITR-последовательность PiggyBac и/или левую (5’) ITR-последовательность PiggyBac, приведенные в Таблице 2. ITR транспозона может включать последовательность концевого повтора транспозона (TR). Например, последовательность ITR транспозона может включать концевой повтор piggyBac (PB-TR).
Например, донорная ДНК может дополнительно включать ITR-последовательность транспозона в положении, смежном с гомологичным плечом исходной хромосомы, не являющейся мишенью.
Например, донорная ДНК может дополнительно включать ITR-последовательность транспозона в положении, смежном с RRS или ASCE.
Донорная ДНК может быть предоставлена исходной клетке, не являющейся мишенью, с использованием известного метода трансфекции. Например, в способе трансфекции можно использовать метод вирусной трансфекции, метод трансфекции с реагентом или метод физической трансфекции. В способе вирусной трансфекции можно использовать, например, лентивирус. В способе трансфекции с реагентом можно использовать, например, фосфат кальция, катионный липид, DEAE-декстран или полиэтиленимин (PEI). В методе физической трансфекции можно использовать, например, электропорацию. Кроме того, для трансфекции можно использовать липосомы, но настоящее изобретение этим не ограничивается.
Донорная ДНК может быть вставлена в последовательность-мишень исходной хромосомы, не являющейся мишенью.
Последовательность-мишень может быть последовательностью на исходной хромосоме, не являющейся мишенью, предоставленной для вставки RRS или ASCE, которая является локусом гена и/или негенетической последовательностью. Последовательность-мишень может быть определена с помощью конструкции in silico.
В одном примере, RRS или ASCE могут быть вставлены выше гена-мишени, присутствующего в исходной хромосоме, не являющейся мишенью. Следовательно, донорная ДНК, обеспечивающая RRS или ASCE, может включать гомологичное плечо для одной области выше гена-мишени.
В одном примере RRS или ASCE могут быть вставлены ниже гена-мишени, присутствующего в исходной хромосоме, не являющейся мишенью. Следовательно, донорная ДНК, обеспечивающая RRS или ASCE, может включать гомологичное плечо для одной области ниже гена-мишени.
Донорная ДНК может быть вставлена в последовательность-мишень исходной хромосомы, не являющейся мишенью, посредством гомологичной рекомбинации.
Чтобы выполнить гомологичную рекомбинацию последовательности-мишени, может быть включена стадия генерации SSB и/или DSB. SSB и/или DSB могут присутствовать естественным образом. SSB и/или DSB могут быть созданы кластогеном (фактором, вызывающим хромосомную аномалию). Кластогеном может быть ионизирующее излучение, УФ, рентгеновские лучи, γ-лучи, активные формы кислорода или конкретное химическое вещество. Конкретным химическим веществом может быть, например, блеомицин, гидроксимочевина, камптотецин, 4-нитрохинолин-1-оксид (4-NQO), цисплатин или метилирующий агент, такой как EMS или MMS, но настоящее изобретение этим не ограничивается. SSB и/или DSB могут генерироваться с помощью сконструированных нуклеаз. Например, SSB и/или DSB могут генерироваться любой одной или более нуклеазами типа «цинковые пальцы» (ZFN), эффекторными нуклеазами, подобными активатору транскрипции (TALEN), и короткие палиндромные повторы, регулярно расположенные группами/CRISPR-ассоциированным белком (CRISPR/Cas).
Клетка-мишень, полученная описанным выше способом, может включать по меньшей мере одну хромосому-мишень.
Здесь хромосома-мишень может быть сгенерирована различными способами в соответствии с составом донорной ДНК.
В одном примере, когда донорная ДНК включает единственный RRS, хромосома-мишень может быть хромосомой-мишенью, включающей один RRS.
В другом примере, когда донорная ДНК включает два или более RRS, хромосома-мишень может быть хромосомой-мишенью, включающей два или более RRS.
Еще в одном примере, когда донорная ДНК включает единственный RRS и ген маркера селекции, хромосома-мишень может быть хромосомой-мишенью, включающей единственный RRS и ген маркера селекции.
Еще в одном примере, когда донорная ДНК включает одну последовательность RRS и ITR транспозона, хромосома-мишень может быть хромосомой-мишенью, включающей одну последовательность RRS и последовательность ITR транспозона.
Еще в одном примере, когда донорная ДНК включает единственный RRS, ген маркера селекции и последовательность ITR транспозона, хромосома-мишень может быть хромосомой-мишенью, включающей единственный RRS, ген маркера селекции и последовательность ITR транспозона.
Еще в одном примере, когда донорная ДНК включает два или более RRS, ген маркера селекции и последовательность ITR транспозона, хромосома-мишень может быть хромосомой-мишенью, включающей два или более RRS, ген маркера селекции и последовательность ITR транспозона.
В одном примере, когда донорная ДНК включает одну ASCE, хромосома-мишень может быть хромосомой-мишенью, включающей одну ASCE.
В другом примере, когда донорная ДНК включает две или более ASCE, хромосома-мишень может быть хромосомой-мишенью, включающей две или более ASCE.
Еще в одном примере, когда донорная ДНК включает одну ASCE и ген маркера селекции, хромосома-мишень может быть хромосомой-мишенью, включающей одну ASCE и ген маркера селекции.
Еще в одном примере, когда донорная ДНК включает одну последовательность ASCE и ITR транспозона, хромосома-мишень может быть хромосомой-мишенью, включающей одну ASCE и последовательность ITR транспозона.
Еще в одном примере, когда донорная ДНК включает одиночную ASCE, ген маркера селекции и последовательность ITR транспозона, хромосома-мишень может быть хромосомой-мишенью, включающей одиночную ASCE, ген маркера селекции и последовательность ITR транспозона.
Еще в одном примере, когда донорная ДНК включает два или более ASCE, ген маркера селекции и последовательность ITR транспозона, хромосома-мишень может быть хромосомой-мишенью, включающей две или более ASCE, ген маркера селекции и последовательность ITR транспозона.
i-1) Клетка, содержащая хромосому с одним встроенным RRS
Согласно описанному здесь примеру варианта осуществления может быть предоставлена клетка-мишень, включающая хромосому-мишень, и способ ее получения. Хромосома-мишень может включать единственный RRS.
Единственный RRS может представлять собой RRS, используемый при создании искусственной рекомбинантной хромосомы.
Описание RRS и хромосомы-мишени такое же, как описано выше.
Клетка-мишень, включающая хромосому-мишень, содержащую единственный RRS, может быть получена путем предоставления донорной ДНК, содержащей RRS, исходной клетке, не являющейся мишенью.
Донорная ДНК может быть донорной ДНК, имеющей единственный RRS и гомологичное плечо для исходной хромосомы, не являющейся мишенью.
Например, донорная ДНК может представлять собой последовательность, включающую любой из вариантов LoxP, приведенных в Таблице 1, и гомологичное плечо исходной хромосомы, не являющейся мишенью. Здесь варианты LoxP могут быть использованы для создания искусственной рекомбинантной хромосомы.
Здесь донорная ДНК может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона. Описание гена маркера селекции и последовательности ITR транспозона такое же, как приведено выше.
Здесь донорная ДНК может дополнительно включать дополнительный RRS. Здесь дополнительный RRS может представлять собой RRS, который не используется при создании искусственной рекомбинантной хромосомы.
Например, донорная ДНК может представлять собой последовательность, включающую любой из вариантов LoxP, приведенных в таблице 1, FRT, ITR транспозона, ген устойчивости к антибиотикам и гомологичное плечо для исходной хромосомы, не являющейся мишенью. Здесь FRT и ITR транспозона могут представлять собой RRS, который является дополнительным RRS, не используемым при создании искусственной рекомбинантной хромосомы.
Донорная ДНК может быть предоставлена исходной клетке, не являющейся мишенью, с использованием известного метода трансфекции. Описание метода трансфекции приведено выше.
Клетка-мишень, включающая хромосому-мишень, содержащую единственный RRS, может быть получена с использованием донорной ДНК, предоставленной исходной клетке, не являющейся мишенью. Донорная ДНК, предоставленная исходной клетке, не являющейся мишенью, может быть вставлена в целевую последовательность исходной хромосомы, не являющейся мишенью, и заменена в хромосоме-мишени. Клетка, включающая хромосому-мишень, является клеткой-мишенью.
Чтобы получить клетку-мишень, донорную ДНК, имеющую единственный RRS, можно трансфецировать в исходную клетку, не являющуюся мишенью.
Донорная ДНК может включать единственный RRS и гомологичное плечо для исходной хромосомы, не являющейся мишенью.
Единственный RRS может представлять собой RRS, используемый при создании искусственной рекомбинантной хромосомы.
Здесь донорная ДНК может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона. Описание гена маркера селекции и последовательности ITR транспозона такое же, как приведено выше.
Здесь донорная ДНК может дополнительно включать дополнительный RRS. Здесь дополнительный RRS может представлять RRS, который не используется при создании искусственной рекомбинантной хромосомы.
В одном примере варианта осуществления клетка-мишень, имеющая одну хромосому-мишень, может быть получена с использованием одной донорной ДНК.
Здесь клетка-мишень может быть донорной клеткой.
Донорная ДНК может представлять собой последовательность, включающую любую последовательность, выбранную из вариантов LoxP, приведенных в таблице 1, и гомологичное плечо для исходной хромосомы, не являющейся мишенью.
Здесь гомологичное плечо может быть последовательностью, гомологичной части последовательности исходной хромосомы, не являющейся мишенью.
Донорная ДНК может быть введена в исходную клетку, не являющуюся мишенью. Здесь донорная ДНК может иметь гомологичное плечо для исходной хромосомы, не являющейся мишенью, включенной в исходную клетку, не являющуюся мишенью.
Здесь донорная ДНК может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона. Описание гена маркера селекции и последовательности ITR транспозона такое же, как приведено выше.
Здесь донорная ДНК может дополнительно включать дополнительный RRS. Здесь дополнительный RRS может представлять собой RRS, который не используется при создании искусственной рекомбинантной хромосомы.
Хромосома-мишень может включать вариант LoxP, включенный в донорную ДНК.
Здесь хромосома-мишень может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Здесь хромосома-мишень может дополнительно включать дополнительный RRS.
Реципиентная клетка для донорной клетки может быть получена с использованием одной донорной ДНК. В данном случае донорная ДНК может быть последовательностью, включающей вариант LoxP, способный к спариванию с вариантом LoxP, включенным в донорную ДНК, используемую для получения донорной клетки, и гомологичное плечо для исходной хромосомы, не являющейся мишенью.
В другом примере варианта осуществления клетка-мишень, имеющая две или более хромосомы-мишени, может быть получена с использованием двух или более донорных ДНК.
Здесь клетка-мишень может быть донорной клеткой.
Две или более донорных ДНК могут включать первую донорную ДНК и вторую донорную ДНК.
Первая донорная ДНК может представлять собой последовательность, включающую одну, выбранную из вариантов LoxP, приведенных в Таблице 1, и гомологичное плечо для первой исходной хромосомы, не являющейся мишенью. Здесь гомологичные плечи могут быть последовательностью, гомологичной части последовательности первой исходной хромосомы, не являющейся мишенью.
Вторая донорная ДНК может представлять собой последовательность, включающую одну, выбранную из вариантов LoxP, приведенных в Таблице 1, и гомологичное плечо для второй исходной хромосомы, не являющейся мишенью. Здесь гомологичные плечи могут быть последовательностью, гомологичной части последовательности второй исходной хромосомы, не являющейся мишенью.
Первая донорная ДНК и вторая донорная ДНК могут быть введены в исходную клетку, не являющуюся мишенью. Здесь первая донорная ДНК и вторая донорная ДНК могут иметь гомологичные плечи для первой исходной хромосомы, не являющейся мишенью и второй исходной хромосомы, не являющейся мишенью, включенных в исходную клетку, не являющуюся мишенью, соответственно.
Здесь каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона. Описание гена маркера селекции и последовательности ITR транспозона такое же, как приведено выше.
Здесь каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать дополнительный RRS. Здесь дополнительный RRS может представлять собой RRS, который не используется при создании искусственной рекомбинантной хромосомы.
Две или более хромосомы-мишени могут включать первую хромосому-мишень и вторую хромосому-мишень.
Здесь первая хромосома-мишень может включать вариант LoxP, включенный в первую донорную ДНК.
Здесь вторая хромосома-мишень может включать вариант LoxP, включенный во вторую донорную ДНК.
Здесь вариант LoxP, включенный в первую донорную ДНК, может быть таким же, как и вариант, включенный во вторую донорную ДНК, или отличаться от него.
Здесь каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Здесь каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать дополнительный RRS.
Реципиентная клетка для донорной клетки может быть получена с использованием двух или более донорных ДНК (третьей донорной ДНК и четвертой донорной ДНК). Здесь третья донорная ДНК может быть последовательностью, включающей вариант LoxP, способный к спариванию с вариантом LoxP, включенным в первую донорную ДНК, используемую в получении донорной клетки, и гомологичное плечо для исходной хромосомы, не являющейся мишенью. Здесь четвертая донорная ДНК может представлять собой последовательность, включающую вариант LoxP, способный к спариванию с вариантом LoxP, включенным во вторую донорную ДНК, используемую в получении донорной клетки, и гомологичное плечо для исходной хромосомы, не являющейся мишенью.
Для получения двух или более различных клеток-мишеней первая донорная ДНК, имеющая первый RRS, может быть трансфецирована в первую исходную клетку, не являющуюся мишенью. Кроме того, вторая донорная ДНК, имеющая второй RRS, может быть трансфецирована во вторую исходную клетку, не являющуюся мишенью.
Единственный RRS может представлять собой RRS, используемым при создании искусственной рекомбинантной хромосомы.
Каждая из первой донорной ДНК и второй донорной ДНК может включать гомологичное плечо для исходной хромосомы, не являющейся мишенью.
Здесь первая донорная ДНК может иметь первый RRS и гомологичное плечо для первой исходной хромосомы, не являющейся мишенью. Гомологичное плечо может быть последовательностью, гомологичной части последовательности первой исходной хромосомы, не являющейся мишенью.
Вторая донорная ДНК может иметь второй RRS и гомологичное плечо для второй исходной хромосомы, не являющейся мишенью. Гомологичное плечо может быть последовательностью, гомологичной части последовательности второй исходной хромосомы, не являющейся мишенью.
Здесь каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона. Описание гена маркера селекции и последовательности ITR транспозона такое же, как приведено выше.
Здесь каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать дополнительный RRS. Здесь дополнительный RRS может представлять собой RRS, который не используется при создании искусственной рекомбинантной хромосомы.
В одном примере варианта осуществления две или более клетки-мишени могут быть получены с использованием двух или более донорных ДНК.
Две или более донорных ДНК могут включать первую донорную ДНК и вторую донорную ДНК.
Первая донорная ДНК может представлять собой последовательность, включающую любую последовательность, выбранную из вариантов LoxP, приведенных в Таблице 1, и гомологичное плечо для первой исходной хромосомы, не являющейся мишенью. Здесь гомологичное плечо может быть последовательностью, гомологичной части последовательности первой исходной хромосомы, не являющейся мишенью.
Вторая донорная ДНК может представлять собой последовательность, включающую одну, выбранную из вариантов LoxP, приведенных в Таблице 1, и гомологичное плечо для второй исходной хромосомы, не являющейся мишенью. Здесь гомологичное плечо может быть последовательностью, гомологичной части последовательности второй исходной хромосомы, не являющейся мишенью. Здесь выбранный вариант LoxP может быть спарен с вариантом LoxP, включенным в первую донорную ДНК.
Здесь каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона. Описание гена маркера селекции и последовательности ITR транспозона такое же, как приведено выше.
Здесь каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать дополнительный RRS. Здесь дополнительный RRS может представлять собой RRS, который не используется при создании искусственной рекомбинантной хромосомы.
Первая донорная ДНК может быть введена в первую исходную клетку, не являющуюся мишенью. Вторая донорная ДНК может быть введена во вторую исходную клетку, не являющуюся мишенью. Здесь первая донорная ДНК может иметь гомологичное плечо для первой исходной хромосомы, не являющейся мишенью, включенной в первую исходную клетку, не являющуюся мишенью. Вторая донорная ДНК может иметь гомологичное плечо для второй исходной хромосомы, не являющейся мишенью, включенной во вторую исходную клетку, не являющуюся мишенью.
Две или более клетки-мишени могут включать в себя первую клетку-мишень и вторую клетку-мишень.
Здесь первая клетка-мишень может быть донорной клеткой, а вторая клетка-мишень может быть реципиентной клеткой.
Здесь первая клетка-мишень может включать первую хромосому-мишень, включающую вариант LoxP, включенный в первую донорную ДНК.
Здесь вторая клетка-мишень может включать вторую хромосому-мишень, включающую вариант LoxP, включенный во вторую донорную ДНК.
Здесь вариант LoxP, включенный в первую донорную ДНК, может быть таким же, как и вариант, включенный во вторую донорную ДНК, или отличаться от него.
Здесь вариант LoxP, включенный в первую донорную ДНК, может быть спарен с вариантом, включенным во вторую донорную ДНК.
Здесь каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Здесь каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать дополнительный RRS.
i-2) Клетка, содержащая хромосому с двумя встроенными RRS
Согласно другому примеру варианта осуществления, раскрытому в настоящем описании, может быть предоставлена клетка-мишень, включающая хромосому-мишень, и способ ее получения. Хромосома-мишень может включать два или более RRS.
Два или более RRS могут представлять собой RRS, используемые при создании искусственной рекомбинантной хромосомы.
Описание RRS и хромосомы-мишени такое же, как описано выше.
Клетка-мишень, включающая хромосому-мишень, включающую два или более RRS, может быть получена путем предоставления донорной ДНК, содержащей RRS, исходной клетке, не являющейся мишенью.
Донорная ДНК может быть предоставлена исходной клетке, не являющейся мишенью, с использованием известного метода трансфекции. Описание метода трансфекции приведено выше.
Клетка-мишень, включающая хромосому-мишень, включающую два или более RRS, может быть получена с использованием донорной ДНК, предоставленной исходной клетке, не являющейся мишенью. Донорная ДНК, предоставленная исходной клетке, не являющейся мишенью, может быть вставлена в целевую последовательность исходной хромосомы, не являющейся мишенью и заменена на хромосому-мишень. Клетка, включающая хромосому-мишень, может быть клеткой-мишенью.
Для получения клетки-мишени донорная ДНК, имеющая два или более RRS, может быть трансфецирована в исходную клетку, не являющуюся мишенью.
Два или более RRS могут представлять собой RRS, используемые при создании искусственной рекомбинантной хромосомы.
Донорная ДНК может включать два или более RRS и гомологичное плечо для исходной хромосомы, не являющейся мишенью.
Здесь донорная ДНК может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона. Описание гена маркера селекции и последовательности ITR транспозона такое же, как приведено выше.
Здесь донорная ДНК может дополнительно включать дополнительный RRS. Здесь дополнительный RRS может представлять собой RRS, который не используется при создании искусственной рекомбинантной хромосомы.
В одном примере варианта осуществления клетка-мишень, имеющая одну хромосому-мишень, может быть получена с использованием одной донорной ДНК.
Здесь клетка-мишень может быть донорной клеткой.
Донорная ДНК может включать два или более RRS.
Два или более RRS могут включать в себя первый RRS и второй RRS.
Здесь первый RRS может быть выбран из вариантов LoxP, приведенных в Таблице 1.
Здесь второй RRS может быть выбран из вариантов LoxP, приведенных в Таблице 1.
Здесь первый RRS и второй RRS могут быть одинаковыми или отличаться друг от друга.
Донорная ДНК может включать последовательности, включающие два или более гомологичных плеча для исходной хромосомы, не являющейся мишенью.
Два или более гомологичных плеча могут включать первое гомологичное плечо и второе гомологичное плечо.
Здесь первое гомологичное плечо может быть последовательностью, гомологичной части последовательности исходной хромосомы, не являющейся мишенью.
Здесь второе гомологичное плечо может быть последовательностью, гомологичной части последовательности исходной хромосомы, не являющейся мишенью.
Здесь первое гомологичное плечо может иметь последовательность, отличную от второго гомологичного плеча.
Донорная ДНК может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона. Описание гена маркера селекции и последовательности ITR транспозона такое же, как приведено выше.
Донорная ДНК может дополнительно включать дополнительный RRS. Здесь дополнительный RRS может представлять собой RRS, который не используется при создании искусственной рекомбинантной хромосомы.
Донорная ДНК может быть введена в исходную клетку, не являющуюся мишенью. Здесь донорная ДНК может иметь два или более гомологичных плеча для исходной хромосомы, не являющейся мишенью, включенной в исходную клетку, не являющуюся мишенью.
Хромосома-мишень может включать первый RRS и второй RRS, которые включены в донорную ДНК.
Здесь первый RRS и второй RRS могут быть одинаковыми или отличаться друг от друга.
Хромосома-мишень может включать два или более вариантов LoxP.
Здесь хромосома-мишень может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Здесь хромосома-мишень может дополнительно включать дополнительный RRS.
Реципиентная клетка для донорной клетки может быть получена с использованием одной или более донорных ДНК. Здесь донорная ДНК может быть последовательностью, включающей третий RRS, способный к спариванию с первым RRS, включенным в донорную ДНК, используемую в получении донорной клетки, и гомологичное плечо для исходной хромосомы, не являющейся мишенью. Кроме того, донорная ДНК может представлять собой последовательность, включающую четвертый RRS, способный к спариванию со вторым RRS, включенным в донорную ДНК, используемую в получении донорной клетки, и гомологичное плечо для исходной хромосомы, не являющейся мишенью.
В другом примере варианта осуществления клетка-мишень, имеющая одну хромосому-мишень, может быть получена с использованием двух или более донорных ДНК.
Здесь клетка-мишень может быть донорной клеткой.
Две или более донорных ДНК могут включать первую донорную ДНК и вторую донорную ДНК.
Первая донорная ДНК может представлять собой последовательность, включающую одну, выбранную из вариантов LoxP, приведенных в Таблице 1, и первое гомологичное плечо для исходной хромосомы, не являющейся мишенью.
Вторая донорная ДНК может представлять собой последовательность, включающую одну, выбранную из вариантов LoxP, приведенных в Таблице 1, и второе гомологичное плечо для исходной хромосомы, не являющейся мишенью.
Здесь первое гомологичное плечо может быть последовательностью, гомологичной части последовательности исходной хромосомы, не являющейся мишенью.
Здесь второе гомологичное плечо может быть последовательностью, гомологичной части последовательности исходной хромосомы, не являющейся мишенью.
Здесь первое гомологичное плечо может иметь последовательность, отличную от второго гомологичного плеча.
Каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона. Описание гена маркера селекции и последовательности ITR транспозона такое же, как приведено выше.
Каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать дополнительный RRS. Здесь дополнительный RRS может представлять собой RRS, который не используется при создании искусственной рекомбинантной хромосомы.
Первая донорная ДНК и вторая донорная ДНК могут быть введены в исходную клетку, не являющуюся мишенью. Здесь каждая из первой донорной ДНК и второй донорной ДНК может иметь гомологичное плечо для исходной хромосомы, не являющейся мишенью, включенной в исходную клетку, не являющуюся мишенью.
Хромосома-мишень может включать два или более вариантов LoxP.
Здесь один из двух или более вариантов LoxP может быть вариантом LoxP, включенным в первую донорную ДНК. Другой из двух или более вариантов LoxP может быть вариантами LoxP, включенными во вторую донорную ДНК.
Здесь вариант LoxP, включенный в первую донорную ДНК, может быть таким же, как и вариант, включенный во вторую донорную ДНК, или отличаться от него.
Хромосома-мишень может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Здесь хромосома-мишень может дополнительно включать дополнительный RRS.
Реципиентная клетка для донорной клетки может быть получена с использованием двух или более донорных ДНК (третьей донорной ДНК и четвертой донорной ДНК). Здесь третья донорная ДНК может быть последовательностью, включающей вариант LoxP, способный к спариванию с вариантом LoxP, включенным в первую донорную ДНК, используемую в получении донорной клетки, и гомологичное плечо для исходной хромосомы, не являющейся мишенью. Здесь четвертая донорная ДНК может быть последовательностью, включающей вариант LoxP, способный к спариванию с вариантом LoxP, включенным во вторую донорную ДНК, используемую в получении донорной клетки, и гомологичное плечо для исходной хромосомы, не являющейся мишенью.
Еще в одном примере варианта осуществления клетка-мишень, имеющая две или более хромосомы-мишени, может быть получена с использованием двух или более донорных ДНК.
Здесь клетка-мишень может быть донорной клеткой.
Две или более донорных ДНК могут включать первую донорную ДНК и вторую донорную ДНК.
Первая донорная ДНК может включать два или более RRS. Здесь два или более RRS могут включать в себя первый RRS и второй RRS.
Вторая донорная ДНК может включать два или более RRS. Здесь два или более RRS могут включать в себя третий RRS и четвертый RRS.
Здесь первый RRS может быть выбран из вариантов LoxP, приведенных в Таблице 1.
Здесь второй RRS может быть выбран из вариантов LoxP, приведенных в Таблице 1.
Здесь третий RRS может быть выбран из вариантов LoxP, приведенных в Таблице 1.
Здесь четвертый RRS может быть выбран из вариантов LoxP, приведенных в Таблице 1.
Здесь все из первого RRS, второго RRS, третьего RRS и четвертого RRS могут быть одинаковыми или отличаться друг от друга. В качестве альтернативы, первый RRS, второй RRS, третий RRS и четвертый RRS могут быть частично одинаковыми или отличаться друг от друга. Например, первый RRS и третий RRS могут быть одинаковыми, а второй RRS и четвертый RRS могут отличаться от первого RRS. В качестве альтернативы, первый RRS и четвертый RRS могут быть одинаковыми, и второй RRA и третий RRS могут быть одинаковыми. В качестве альтернативы, все из первого RRS, второго RRS, третьего RRS и четвертого RRS могут отличаться друг от друга. В качестве альтернативы, все из первого RRS, второго RRS, третьего RRS и четвертого RRS могут быть одинаковыми.
Первая донорная ДНК может включать последовательность, включающую два или более гомологичных плеча для первой исходной хромосомы, не являющейся мишенью. Здесь два или более гомологичных плеча могут включать в себя первое гомологичное плечо и второе гомологичное плечо.
Здесь первое гомологичное плечо может быть последовательностью, гомологичной части последовательности первой исходной хромосомы, не являющейся мишенью.
Здесь второе гомологичное плечо может быть последовательностью, гомологичной части последовательности первой исходной хромосомы, не являющейся мишенью.
Здесь первое гомологичное плечо может иметь последовательность, отличную от второго гомологичного плеча.
Вторая донорная ДНК может включать последовательность, включающую два или более гомологичных плеча для второй исходной хромосомы, не являющейся мишенью. Здесь два или более гомологичных плеча могут включать третье гомологичное плечо и четвертое гомологичное плечо.
Здесь третье гомологичное плечо может быть последовательностью, гомологичной части последовательности второй исходной хромосомы, не являющейся мишенью.
Здесь четвертое гомологичное плечо может быть последовательностью, гомологичной части последовательности второй исходной хромосомы, не являющейся мишенью.
Здесь третье гомологичное плечо может иметь последовательность, отличную от четвертого гомологичного плеча.
Каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона. Описание гена маркера селекции и последовательности ITR транспозона такое же, как приведено выше.
Здесь каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать дополнительный RRS. Здесь дополнительный RRS может представлять собой RRS, который не используется при создании искусственной рекомбинантной хромосомы.
Первая донорная ДНК и вторая донорная ДНК могут быть введены в исходную клетку, не являющуюся мишенью. Здесь первая донорная ДНК может иметь гомологичные плечи для первой исходной хромосомы, не являющейся мишенью, включенной в исходную клетку, не являющуюся мишенью. Вторая донорная ДНК может иметь гомологичные плечи для второй исходной хромосомы, не являющейся мишенью, включенной в исходную клетку, не являющуюся мишенью.
Две или более хромосомы-мишени могут включать первую хромосому-мишень и вторую хромосому-мишень.
Здесь первая хромосома-мишень может включать в себя первый RRS и второй RRS. Здесь первый RRS и второй RRS могут быть одинаковыми или отличаться друг от друга.
Здесь вторая хромосома-мишень может включать в себя третий RRS и четвертый RRS. Здесь третий RRS и четвертый RRS могут быть одинаковыми или отличаться друг от друга.
Первая хромосома-мишень может включать два или более вариантов LoxP.
Вторая хромосома-мишень может включать два или более вариантов LoxP.
Здесь каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Здесь каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать дополнительный RRS.
Реципиентная клетка для донорной клетки может быть получена с использованием двух или более донорных ДНК (третьей донорной ДНК и четвертой донорной ДНК). Здесь третья донорная ДНК может быть последовательностью, включающей пятый RRS и шестой RRS, способные спариваться с первым и вторым RRS, включенными в первую донорную ДНК, используемую для получения донорной клетки, соответственно, и гомологичное плечо для исходной хромосомы, не являющейся мишенью. Здесь четвертая донорная ДНК может быть последовательностью, включающей седьмой RRS и восьмой RRS, способные спариваться с третьим и четвертым RRS, включенными во вторую донорную ДНК, используемую в получении донорной клетки, соответственно, и гомологичное плечо для исходной хромосомы, не являющейся мишенью.
Для получения двух или более различных клеток-мишеней первая донорная ДНК, имеющая два или более RRS, может быть трансфецирована в первую исходную клетку, не являющуюся мишенью. Кроме того, вторая донорная ДНК, имеющая два или более RRS, может быть трансфецирована во вторую исходную клетку, не являющуюся мишенью.
Два или более RRS могут представлять собой RRS, используемые при создании искусственной рекомбинантной хромосомы.
Каждая из первой донорной ДНК и второй донорной ДНК может включать гомологичное плечо для исходной хромосомы, не являющейся мишенью.
Первая донорная ДНК может иметь первую RRS, вторую RRS и гомологичное плечо для первой исходной хромосомы, не являющейся мишенью.
Вторая донорная ДНК может иметь третий RRS, четвертый RRS и гомологичное плечо для второй исходной хромосомы, не являющейся мишенью.
Здесь каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона. Описание гена маркера селекции и последовательности ITR транспозона такое же, как приведено выше.
Здесь каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать дополнительный RRS. Здесь дополнительный RRS может представлять собой RRS, который не используется при создании искусственной рекомбинантной хромосомы.
В одном примере варианта осуществления две или более клетки-мишени могут быть получены с использованием двух или более донорных ДНК.
Две или более донорных ДНК могут включать первую донорную ДНК и вторую донорную ДНК.
Первая донорная ДНК может включать два или более RRS. Здесь два или более RRS могут включать в себя первый RRS и второй RRS.
Вторая донорная ДНК может включать два или более RRS. Здесь два или более RRS могут включать в себя третий RRS и четвертый RRS.
Здесь первый RRS может быть выбран из вариантов LoxP, приведенных в Таблице 1.
Здесь второй RRS может быть выбран из вариантов LoxP, приведенных в Таблице 1.
Здесь третий RRS может быть выбран из вариантов LoxP, приведенных в Таблице 1.
Здесь четвертый RRS может быть выбран из вариантов LoxP, приведенных в Таблице 1.
Здесь все из первого RRS, второго RRS, третьего RRS и четвертого RRS могут быть одинаковыми или отличаться друг от друга. В качестве альтернативы, все из первого RRS, второго RRS, третьего RRS и четвертого RRS могут частично быть одинаковыми или отличаться друг от друга. Например, первый RRS и четвертый RRS могут быть одинаковыми, а второй RRS и третий RRS могут отличаться от первого RRS. В качестве альтернативы, второй RRS и четвертый RRS могут быть одинаковыми, а первый RRA и третий RRS могут быть одинаковыми. В качестве альтернативы, все из первого RRS, второго RRS, третьего RRS и четвертого RRS могут отличаться друг от друга. В качестве альтернативы, все из первого RRS, второго RRS, третьего RRS и четвертого RRS могут быть одинаковыми.
Первая донорная ДНК может включать последовательность, включающую два или более гомологичных плеча для первой исходной хромосомы, не являющейся мишенью. Здесь два или более гомологичных плеча могут включать в себя первое гомологичное плечо и второе гомологичное плечо.
Здесь первое гомологичное плечо может быть последовательностью, гомологичной части последовательности первой исходной хромосомы, не являющейся мишенью.
Здесь второе гомологичное плечо может быть последовательностью, гомологичной части последовательности первой исходной хромосомы, не являющейся мишенью.
Здесь первое гомологичное плечо может быть последовательностью, отличной от второго гомологичного плеча.
Вторая донорная ДНК может включать последовательность, включающую два или более гомологичных плеча для второй исходной хромосомы, не являющейся мишенью. Здесь два или более гомологичных плеча могут включать третье гомологичное плечо и четвертое гомологичное плечо.
Здесь третье гомологичное плечо может быть последовательностью, гомологичной части последовательности второй исходной хромосомы, не являющейся мишенью.
Здесь четвертое гомологичное плечо может быть последовательностью, гомологичной части последовательности второй исходной хромосомы, не являющейся мишенью.
Здесь третье гомологичное плечо может иметь последовательность, отличную от четвертого гомологичного плеча.
Здесь каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона. Описание гена маркера селекции и последовательности ITR транспозона такое же, как приведено выше.
Здесь каждая из первой донорной ДНК и второй донорной ДНК может включать дополнительный RRS. Здесь дополнительный RRS может представлять собой RRS, который не используется при создании искусственной рекомбинантной хромосомы.
Первая донорная ДНК может быть введена в первую исходную клетку, не являющуюся мишенью. Вторая донорная ДНК может быть введена во вторую исходную клетку, не являющуюся мишенью. Здесь первая донорная ДНК может иметь гомологичное плечо для первой исходной хромосомы, не являющейся мишенью, включенной в первую исходную клетку, не являющуюся мишенью. Вторая донорная ДНК может иметь гомологичное плечо для второй исходной хромосомы, не являющейся мишенью, включенной во вторую исходную клетку, не являющуюся мишенью.
Две или более клетки-мишени могут включать в себя первую клетку-мишень и вторую клетку-мишень.
Здесь первая клетка-мишень может быть донорной клеткой, а вторая клетка-мишень может быть реципиентной клеткой.
Здесь первая клетка-мишень может включать в себя первую хромосому-мишень, включающую первый и второй RRS.
Здесь вторая клетка-мишень может включать в себя вторую хромосому-мишень, включающую третий и четвертый RRS. Третий RRS может быть спарен с одним из первого RRS и второго RRS, а четвертый RRS может быть спарен с другим из первого RRS и второго RRS.
Здесь каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Здесь каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать дополнительный RRS.
i-3) Клетка, содержащая хромосому с одной встроенной ASCE
Согласно описанному здесь примеру варианта осуществления может быть предоставлена клетка-мишень, включающая хромосому-мишень, и способ ее получения. Хромосома-мишень может включать одну ASCE.
Описание ASCE и хромосомы-мишени такое, как приведено выше.
Клетка-мишень, включающая хромосому-мишень, включающую единственную ASCE, может быть получена путем предоставления донорной ДНК, имеющей ASCE, исходной клетке, не являющейся мишенью.
Донорная ДНК может быть предоставлена исходной клетке, не являющейся мишенью, с использованием известного метода трансфекции. Описание метода трансфекции приведено выше.
Клетка-мишень, включающая хромосому-мишень, имеющую единственную ASCE, может быть получена с использованием донорной ДНК, предоставленной исходной клетке, не являющейся мишенью. Донорная ДНК, предоставленная исходной клетке, не являющейся мишенью, может быть вставлена в целевую последовательность исходной хромосомы, не являющейся мишенью, и заменена в хромосоме-мишени. Клетка, включающая хромосому-мишень, является клеткой-мишенью.
Для получения клетки-мишени донорная ДНК, имеющая единственную ASCE, может быть трансфецирована в исходную клетку, не являющуюся мишенью.
Донорная ДНК может включать единственную ASCE и гомологичное плечо для исходной хромосомы, не являющейся мишенью.
Единственная ASCE может представлять собой ASCE, используемую при создании искусственной рекомбинантной хромосомы.
Здесь донорная ДНК может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона. Описание гена маркера селекции и последовательности ITR транспозона такое же, как приведено выше.
Здесь донорная ДНК может дополнительно включать дополнительный RRS. Здесь дополнительный RRS может представлять собой RRS, который не используется при создании искусственной рекомбинантной хромосомы.
В одном примере варианта осуществления клетка-мишень, имеющая одну хромосому-мишень, может быть получена с использованием одной донорной ДНК.
Донорная ДНК может представлять собой последовательность, включающую одну ASCE и гомологичное плечо для исходной хромосомы, не являющейся мишенью.
Донорная ДНК может быть введена в исходную клетку, не являющуюся мишенью. Здесь донорная ДНК может иметь гомологичное плечо для исходной хромосомы, не являющейся мишенью, включенной в исходную клетку, не являющуюся мишенью.
Здесь донорная ДНК может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона. Описание гена маркера селекции и последовательности ITR транспозона такое же, как приведено выше.
Здесь донорная ДНК может дополнительно включать дополнительный RRS. Здесь дополнительный RRS может представлять собой RRS, который не используется при создании искусственной рекомбинантной хромосомы.
Хромосома-мишень может включать единственную ASCE, включенную в донорную ДНК.
Здесь хромосома-мишень может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Здесь хромосома-мишень может дополнительно включать дополнительный RRS.
В другом примере варианта осуществления клетка-мишень, имеющая две или более хромосомы-мишени, может быть получена с использованием двух или более донорных ДНК.
Две или более донорных ДНК могут включать первую донорную ДНК и вторую донорную ДНК.
Первая донорная ДНК может представлять собой последовательность, включающую первую ASCE и гомологичное плечо для первой исходной хромосомы, не являющейся мишенью. Здесь гомологичные плечи могут быть последовательностью, гомологичной части последовательности первой исходной хромосомы, не являющейся мишенью.
Вторая донорная ДНК может быть последовательностью, включающей вторую ASCE и гомологичное плечо для второй исходной хромосомы, не являющейся мишенью. Здесь гомологичное плечо может быть последовательностью, гомологичной части последовательности второй исходной хромосомы, не являющейся мишенью.
Здесь первая ASCE и вторая ASCE могут быть одинаковыми или отличаться друг от друга.
Каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать ген маркера селекции и/или ITR транспозона. Описание гена маркера селекции и последовательности ITR транспозона такое же, как приведено выше.
Здесь каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать дополнительный RRS. Здесь дополнительный RRS может представлять собой RRS, который не используется при создании искусственной рекомбинантной хромосомы.
Первая донорная ДНК и вторая донорная ДНК могут быть введены в исходную клетку, не являющуюся мишенью. Здесь каждая из первой донорной ДНК и второй донорной ДНК может иметь каждое гомологичное плечо для первой исходной хромосомы, не являющейся мишенью и второй исходной хромосомы, не являющейся мишенью, включенных в исходную клетку, не являющуюся мишенью.
Две или более хромосомы-мишени могут включать первую хромосому-мишень и вторую хромосому-мишень.
Здесь первая хромосома-мишень может включать первую ASCE.
Здесь вторая хромосома-мишень может включать вторую ASCE.
Здесь каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Здесь каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать дополнительный RRS.
Для получения двух или более различных клеток-мишеней первая донорная ДНК, имеющая первую ASCE, может быть трансфецирована в первую исходную клетку, не являющуюся мишенью. Кроме того, вторая донорная ДНК, имеющая вторую ASCE, может быть трансфецирована во вторую исходную клетку, не являющуюся мишенью.
Каждая из первой донорной ДНК и второй донорной ДНК может включать гомологичное плечо для исходной хромосомы, не являющейся мишенью.
Первая донорная ДНК может иметь первую ASCE и гомологичное плечо для первой исходной хромосомы, не являющейся мишенью.
Вторая донорная ДНК может иметь вторую ASCE и гомологичное плечо для второй исходной хромосомы, не являющейся мишенью.
Каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона. Описание гена маркера селекции и последовательности ITR транспозона такое же, как приведено выше.
Здесь каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать дополнительный RRS. Здесь дополнительный RRS может представлять собой RRS, который не используется при создании искусственной рекомбинантной хромосомы.
В одном примере варианта осуществления две или более клетки-мишени могут быть получены с использованием двух или более донорных ДНК.
Две или более донорных ДНК могут включать первую донорную ДНК и вторую донорную ДНК.
Первая донорная ДНК может представлять собой последовательность, включающую первую ASCE и гомологичное плечо для первой исходной хромосомы, не являющейся мишенью. Здесь гомологичное плечо может быть последовательностью, гомологичной части последовательности первой исходной хромосомы, не являющейся мишенью.
Вторая донорная ДНК может быть последовательностью, включающей вторую ASCE и гомологичное плечо для второй исходной хромосомы, не являющейся мишенью. Здесь гомологичное плечо может быть последовательностью, гомологичной части последовательности второй исходной хромосомы, не являющейся мишенью.
Здесь первая ASCE и вторая ASCE могут быть одинаковыми или отличаться друг от друга.
Каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона. Описание гена маркера селекции и последовательности ITR транспозона такое же, как приведено выше.
Здесь каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать дополнительный RRS. Здесь дополнительный RRS может представлять собой RRS, который не используется при создании искусственной рекомбинантной хромосомы.
Первая донорная ДНК может быть введена в первую исходную клетку, не являющуюся мишенью. Вторая донорная ДНК может быть введена во вторую исходную клетку, не являющуюся мишенью. Здесь первая донорная ДНК может иметь гомологичное плечо для первой исходной хромосомы, не являющейся мишенью, в первой исходной клетке, не являющейся мишенью. Вторая донорная ДНК может иметь гомологичное плечо для второй исходной хромосомы, не являющейся мишенью, во второй исходной клетке, не являющейся мишенью.
Две или более клетки-мишени могут включать в себя первую клетку-мишень и вторую клетку-мишень.
Здесь первая клетка-мишень может включать первую хромосому-мишень, имеющую первую ASCE.
Здесь вторая клетка-мишень может включать в себя вторую хромосому-мишень, имеющую вторую ASCE.
Здесь каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Здесь первая хромосома-мишень и вторая хромосома-мишень могут дополнительно включать дополнительный RRS.
i-4) Клетка, содержащая хромосому с двумя встроенными ASCE
Согласно другому примеру варианта осуществления, раскрытому в настоящем описании, может быть предоставлена клетка-мишень, включающая хромосому-мишень, и способ ее получения. Хромосома-мишень может включать две или более ASCE.
Две или более ASCE могут представлять собой ASCE, используемые при создании искусственной рекомбинантной хромосомы.
Описание ASCE и хромосомы-мишени такое, как приведено выше.
Клетка-мишень, включающая хромосому-мишень, имеющую две или более ASCE, может быть получена путем предоставления донорной ДНК, имеющей ASCE, исходной клетке, не являющейся мишенью.
Донорная ДНК может быть предоставлена исходной клетке, не являющейся мишенью, с использованием известного метода трансфекции. Описание метода трансфекции приведено выше.
Клетка-мишень, включающая хромосому-мишень, имеющую две или более ASCE, может быть получена с использованием донорной ДНК, предоставленной исходной клетке, не являющейся мишенью. Донорная ДНК, предоставленная исходной клетке, не являющейся мишенью, может быть вставлена в целевую последовательность исходной хромосомы, не являющейся мишенью, и заменена в хромосоме-мишени. Клетка, включающая хромосому-мишень, является клеткой-мишенью.
Для получения клетки-мишени донорная ДНК, имеющая две или более ASCE, может быть трансфецирована в исходную клетку, не являющуюся мишенью.
Донорная ДНК может включать две или более ASCE и гомологичное плечо для исходной хромосомы, не являющейся мишенью.
Две или более ASCE могут представлять собой ASCE, используемые при создании искусственной рекомбинантной хромосомы.
Здесь донорная ДНК может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона. Описание гена маркера селекции и последовательности ITR транспозона такое же, как приведено выше.
Здесь донорная ДНК может дополнительно включать дополнительный RRS. Здесь дополнительный RRS может представлять собой RRS, который не используется при создании искусственной рекомбинантной хромосомы.
В одном примере варианта осуществления клетка-мишень, имеющая одну хромосому-мишень, может быть получена с использованием одной донорной ДНК.
Донорная ДНК может включать две или более ASCE.
Две или более ASCE могут включать в себя первую ASCE и вторую ASCE.
Здесь первая ASCE и вторая ASCE могут быть одинаковыми или отличаться друг от друга.
Донорная ДНК может включать последовательность, включающую два или более гомологичных плеча для исходной хромосомы, не являющейся мишенью.
Два или более гомологичных плеча могут включать первое гомологичное плечо и второе гомологичное плечо.
Здесь первое гомологичное плечо может быть последовательностью, гомологичной части последовательности исходной хромосомы, не являющейся мишенью.
Здесь второе гомологичное плечо может быть последовательностью, гомологичной части последовательности исходной хромосомы, не являющейся мишенью.
Здесь первое гомологичное плечо может иметь последовательность, отличную от второго гомологичного плеча.
Донорная ДНК может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона. Описание гена маркера селекции и последовательности ITR транспозона такое же, как приведено выше.
Здесь донорная ДНК может дополнительно включать дополнительный RRS. Здесь дополнительный RRS может представлять собой RRS, который не используется при создании искусственной рекомбинантной хромосомы.
Донорная ДНК может быть введена в исходную клетку, не являющуюся мишенью. Здесь донорная ДНК может иметь два или более гомологичных плеча для исходной хромосомы, не являющейся мишенью, включенной в исходную клетку, не являющуюся мишенью.
Хромосома-мишень может включать первую ASCE и вторую ASCE, которые включены в донорную ДНК.
Здесь первая ASCE и вторая ASCE могут быть одинаковыми или отличаться друг от друга.
Хромосома-мишень может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Хромосома-мишень может дополнительно включать дополнительный RRS.
В другом примере варианта осуществления клетка-мишень, имеющая одну хромосому-мишень, может быть получена с использованием двух или более донорных ДНК.
Две или более донорных ДНК могут включать первую донорную ДНК и вторую донорную ДНК.
Первая донорная ДНК может представлять собой последовательность, включающую первую ASCE и первое гомологичное плечо для исходной хромосомы, не являющейся мишенью.
Вторая донорная ДНК может быть последовательностью, включающей вторую ASCE и второе гомологичное плечо для исходной хромосомы, не являющейся мишенью.
Здесь первая ASCE и вторая ASCE могут быть одинаковыми или отличаться друг от друга.
Здесь первое гомологичное плечо может быть последовательностью, гомологичной части последовательности исходной хромосомы, не являющейся мишенью.
Здесь второе гомологичное плечо может быть последовательностью, гомологичной части последовательности исходной хромосомы, не являющейся мишенью.
Здесь первое гомологичное плечо может иметь последовательность, отличную от второго гомологичного плеча.
Каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона. Описание гена маркера селекции и последовательности ITR транспозона такое же, как приведено выше.
Здесь каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать дополнительный RRS. Здесь дополнительный RRS может представлять собой RRS, который не используется при создании искусственной рекомбинантной хромосомы.
Первая донорная ДНК и вторая донорная ДНК могут быть введены в исходную клетку, не являющуюся мишенью. Здесь каждая из первой донорной ДНК и второй донорной ДНК может иметь гомологичное плечо для исходной хромосомы, не являющейся мишенью, включенной в исходную клетку, не являющуюся мишенью.
Хромосома-мишень может включать две или более ASCE.
Здесь одна из двух или более ASCE может быть первой ASCE, включенной в первую донорную ДНК. Другая из двух или более ASCE может быть второй ASCE, включенной во вторую донорную ДНК.
Хромосома-мишень может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Хромосома-мишень может дополнительно включать дополнительный RRS.
Еще в одном примере варианта осуществления клетка-мишень, имеющая две или более хромосомы-мишени, может быть получена с использованием двух или более донорных ДНК.
Две или более донорных ДНК могут включать первую донорную ДНК и вторую донорную ДНК.
Первая донорная ДНК может включать две или более ASCE. Здесь две или более ASCE могут включать в себя первую ASCE и вторую ASCE.
Вторая донорная ДНК может включать две или более ASCE. Здесь две или более ASCE могут включать в себя третью ASCE и четвертую ASCE.
Здесь все из первой ASCE, второй ASCE, третьей ASCE и четвертой ASCE могут быть одинаковыми или отличаться друг от друга. В качестве альтернативы, первая ASCE, вторая ASCE, третья ASCE и четвертая ASCE могут частично быть одинаковыми или отличаться друг от друга. Например, первая ASCE и третья ASCE могут быть одинаковыми, а вторая ASCE и четвертая ASCE могут отличаться от первой ASCE. В качестве альтернативы, первая ASCE и четвертая ASCE могут быть одинаковыми, а вторая ASCE и третья ASCE могут быть одинаковыми. В качестве альтернативы, все из первой ASCE, второй ASCE, третьей ASCE и четвертой ASC могут отличаться друг от друга. В качестве альтернативы все из первой ASCE, второй ASCE, третьей ASCE и четвертой ASC могут быть одинаковыми.
Первая донорная ДНК может включать последовательность, включающую два или более гомологичных плеча для первой исходной хромосомы, не являющейся мишенью. Здесь два или более гомологичных плеча могут включать в себя первое гомологичное плечо и второе гомологичное плечо.
Здесь первое гомологичное плечо может быть последовательностью, гомологичной части последовательности первой исходной хромосомы, не являющейся мишенью.
Здесь второе гомологичное плечо может быть последовательностью, гомологичной части последовательности первой исходной хромосомы, не являющейся мишенью.
Здесь первое гомологичное плечо может иметь последовательность, отличную от второго гомологичного плеча.
Вторая донорная ДНК может включать последовательность, включающую два или более гомологичных плеча для второй исходной хромосомы, не являющейся мишенью. Здесь два или более гомологичных плеча могут включать третье гомологичное плечо и четвертое гомологичное плечо.
Здесь третье гомологичное плечо может быть последовательностью, гомологичной части последовательности второй исходной хромосомы, не являющейся мишенью.
Здесь четвертое гомологичное плечо может быть последовательностью, гомологичной части последовательности второй исходной хромосомы, не являющейся мишенью.
Здесь третье гомологичное плечо может иметь последовательность, отличную от четвертого гомологичного плеча.
Каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона. Описание гена маркера селекции и последовательности ITR транспозона такое же, как приведено выше.
Каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать дополнительный RRS. Здесь дополнительный RRS может представлять собой RRS, который не используется при создании искусственной рекомбинантной хромосомы.
Первая донорная ДНК и вторая донорная ДНК могут быть введены в исходную клетку, не являющуюся мишенью. Здесь первая донорная ДНК может иметь гомологичное плечо для первой исходной хромосомы, не являющейся мишенью, включенной в исходную клетку, не являющуюся мишенью. Вторая донорная ДНК может иметь гомологичное плечо для второй хромосомы, не являющейся мишенью, включенной в исходную клетку, не являющуюся мишенью.
Две или более хромосомы-мишени могут включать первую хромосому-мишень и вторую хромосому-мишень.
Здесь первая хромосома-мишень может включать в себя первую ASCE и вторую ASCE. Здесь первая ASCE и вторая ASCE могут быть одинаковыми или отличаться друг от друга.
Здесь вторая хромосома-мишень может включать третью ASCE и четвертую ASCE. Здесь третья ASCE и четвертая ASCE могут быть одинаковыми или отличаться друг от друга.
Здесь каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Здесь каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать дополнительный RRS.
Для получения двух или более различных клеток-мишеней первая донорная ДНК, имеющая первую ASCE, может быть трансфецирована в первую исходную клетку, не являющуюся мишенью. Кроме того, вторая донорная ДНК, имеющая вторую ASCE, может быть трансфецирована во вторую исходную клетку, не являющуюся мишенью.
Две или более ASCE могут представлять собой ASCE, используемые при создании искусственной рекомбинантной хромосомы.
Каждая из первой донорной ДНК и второй донорной ДНК может включать гомологичное плечо для исходной хромосомы, не являющейся мишенью.
Первая донорная ДНК может иметь первую ASCE, вторую ASCE и гомологичное плечо для первой исходной хромосомы, не являющейся мишенью.
Вторая донорная ДНК может иметь третью ASCE, четвертую ASCE и гомологичное плечо для второй исходной хромосомы, не являющейся мишенью.
Каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона. Описание гена маркера селекции и последовательности ITR транспозона такое же, как приведено выше.
Каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать дополнительный RRS. Здесь дополнительный RRS может представлять собой RRS, который не используется при создании искусственной рекомбинантной хромосомы.
В одном примере варианта осуществления две или более клетки-мишени могут быть получены с использованием двух или более донорных ДНК.
Две или более донорных ДНК могут включать первую донорную ДНК и вторую донорную ДНК.
Первая донорная ДНК может включать две или более ASCE. Здесь две или более ASCE могут включать в себя первую ASCE и вторую ASCE.
Вторая донорная ДНК может включать две или более ASCE. Здесь две или более ASCE могут включать в себя третью ASCE и четвертую ASCE.
Здесь все из первой ASCE, второй ASCE, третьей ASCE и четвертой ASCE могут быть одинаковыми или отличаться друг от друга. В качестве альтернативы, первая ASCE, вторая ASCE, третья ASCE и четвертая ASCE могут частично быть одинаковыми или отличаться друг от друга. Например, первая ASCE и четвертая ASCE могут быть одинаковыми, а вторая ASCE и третья ASCE могут отличаться от первой ASCE. В качестве альтернативы, вторая ASCE и четвертая ASCE могут быть одинаковыми, а первая ASCE и третья ASCE могут быть одинаковыми. В качестве альтернативы, все из первой ASCE, второй ASCE, третьей ASCE и четвертой ASC могут отличаться друг от друга. В качестве альтернативы, первая ASCE, вторая ASCE, третья ASCE и четвертая ASCE могут быть одинаковыми.
Первая донорная ДНК может включать последовательность, включающую два или более гомологичных плеча для первой исходной хромосомы, не являющейся мишенью. Здесь два или более гомологичных плеча могут включать в себя первое гомологичное плечо и второе гомологичное плечо.
Здесь первое гомологичное плечо может быть последовательностью, гомологичной части последовательности первой исходной хромосомы, не являющейся мишенью.
Здесь второе гомологичное плечо может быть последовательностью, гомологичной части последовательности первой исходной хромосомы, не являющейся мишенью.
Здесь первое гомологичное плечо может иметь последовательность, отличную от второго гомологичного плеча.
Вторая донорная ДНК может включать последовательность, включающую два или более гомологичных плеча для второй исходной хромосомы, не являющейся мишенью. Здесь два или более гомологичных плеча могут включать третье гомологичное плечо и четвертое гомологичное плечо.
Здесь третье гомологичное плечо может быть последовательностью, гомологичной части последовательности второй исходной хромосомы, не являющейся мишенью.
Здесь четвертое гомологичное плечо может быть последовательностью, гомологичной части последовательности второй исходной хромосомы, не являющейся мишенью.
Здесь третье гомологичное плечо может иметь последовательность, отличную от четвертого гомологичного плеча.
Каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона. Описание гена маркера селекции и последовательности ITR транспозона такое же, как приведено выше.
Каждая из первой донорной ДНК и второй донорной ДНК может дополнительно включать дополнительный RRS. Здесь дополнительный RRS может представлять собой RRS, который не используется при создании искусственной рекомбинантной хромосомы.
Первая донорная ДНК может быть введена в первую исходную клетку, не являющуюся мишенью. Вторая донорная ДНК может быть введена во вторую исходную клетку, не являющуюся мишенью. Здесь первая донорная ДНК может иметь гомологичное плечо для первой исходной хромосомы, не являющейся мишенью, включенной в первую исходную клетку, не являющуюся мишенью. Вторая донорная ДНК может иметь гомологичное плечо для второй хромосомы, не являющейся мишенью, включенной во вторую исходную клетку, не являющуюся мишенью.
Две или более клетки-мишени могут включать в себя первую клетку-мишень и вторую клетку-мишень.
Здесь первая клетка-мишень может включать первую хромосому-мишень, включающую первую ASCE и вторую ASCE.
Здесь вторая клетка-мишень может включать в себя вторую хромосому-мишень, включающую третью ASCE и четвертую ASCE.
Здесь каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Здесь каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать дополнительный RRS.
В примере получения клетки-мишени, чтобы получить реципиентную клетку, можно использовать первую донорную ДНК и вторую донорную ДНК для получения эмбриональной стволовой клетки-мишени (ESC) из ESC.
Первая донорная ДНК может включать первое гомологичное плечо, используемое для нацеливания на 5'-конец вариабельной области (включая все V-сегменты и J-сегменты) локуса легкой цепи Ig (IgL) генома ESC, концевой повтор piggyBac (PB-TR), промотор, loxm2/66 (первый RRS), первый ген устойчивости к антибиотику и второе гомологичное плечо, используемое для нацеливания на 5'-конец вариабельной области локуса IgL в геноме ESC.
Вторая донорная ДНК может включать третье гомологичное плечо, используемое для нацеливания на 3'-конец вариабельной области (включая все V-сегменты и J-сегменты) локуса IgL генома ESC, промотор, второй ген устойчивости к антибиотику (ген устойчивости к зеоцину), lox71 (второй RRS) и четвертое гомологичное плечо, используемое для нацеливания на 3'-конец вариабельной области локуса IgL в геноме ESC.
Клетка, в которой первая донорная ДНК вставлена в геном ESC, может быть отселектирована с использованием первого антибиотика.
Клетка, в которой вторая донорная ДНК вставлена в геном ESC, может быть отселектирована с использованием второго антибиотика.
Здесь первая донорная ДНК и вторая донорная ДНК могут быть последовательно, случайным образом или одновременно введены в ESC.
Здесь клетка с геномом, в который вставлены все из первой донорной ДНК и второй донорной ДНК, может быть отселектирована с использованием первого антибиотика и второго антибиотика. Отселектированная клетка, созданная, как описано выше, то есть клетка, отселектированная первым антибиотиком и вторым антибиотиком, может быть ESC-мишенью.
Кроме того, для получения донорной клетки используются третья донорная ДНК и четвертая донорная ДНК для получения фибробласта-мишени из фибробласта.
Третья донорная ДНК может включать первое гомологичное плечо, используемое для нацеливания на 5'-конец вариабельной области (включая все V-сегменты и J-сегменты) локуса легкой цепи Ig (IgL) генома фибробласта, промотор, ген, кодирующий флуоресцентный белок, lox66 (третий RRS), и второе гомологичное плечо, используемое для нацеливания на 5'-конец вариабельной области локуса IgL в геноме фибробласта.
Четвертый вектор может включать третье гомологичное плечо, используемое для нацеливания на 3'-конец вариабельной области (включая все V-сегменты и J-сегменты) локуса IgL генома фибробласта, промотор, ген устойчивости к антибиотику, loxm2/71 (четвертый RRS) и четвертое гомологичное плечо, используемое для нацеливания на 3'-конец вариабельной области локуса IgL в геноме фибробласта.
Клетка, в которой третья донорная ДНК вставлена в геном фибробласта, может быть отселектирована с использованием флуоресцентного белка.
Клетка, в которой четвертая донорная ДНК вставлена в геном фибробласта, может быть отселектирована с использованием антибиотика.
Здесь третья донорная ДНК и четвертая донорная ДНК могут быть последовательно, случайным образом или одновременно введены в фибробласт.
Здесь клетка с геномом, в который вставлены все из третьей донорной ДНК и четвертой донорной ДНК, может быть отселектирована с использованием флуоресцентного белка и антибиотика. Отселектированная клетка, созданная, как описано выше, то есть клетка, отселектированная флуоресцентным белком и антибиотиком, может быть фибробластом-мишенью.
Хромосома, включающая локус легкой цепи Ig (IgL) полученной реципиентной клетки, может включать первый RRS и второй RRS. Кроме того, хромосома, включающая локус IgL полученной донорной клетки, может включать третий RRS и четвертый RRS.
Здесь первый RRS может быть спарен с одним из третьего RRS и четвертого RRS, а второй RRS может быть спарен с другим из третьего RRS и четвертого RRS.
Примеры, описанные выше, являются лишь иллюстративными, и каждый составляющий элемент (клетки, не являющиеся мишенью, донорная ДНК, хромосомы-мишени и клетки-мишени (донорные клетки и реципиентные клетки) и т.д.) может быть модифицирован или изменен различными способами в зависимости от цели.
ii) Получение микроклетки
«Микроклетка» означает любую одну из частей, разделенных на две или более посредством воздействия на одну клетку искусственной манипуляции, определенного реагента или определенного условия. Кроме того, микроклетка означает аналог клетки, который включает одну или более хромосом или фрагментов хромосом, но не подвергается соматическому делению клетки (митозу) или мейозу. В одном примере микроклетка может быть любой, полученной путем деления одной животной клетки на две или более клеток или клеточных аналогов. В другом примере микроклетка может быть любой, полученной путем деления одной животной клетки по количеству хромосом, то есть 2n или более. Например, когда животная клетка представляет собой фибробласт человека, микроклетка может быть любой, полученной путем деления фибробласта человека по количеству хромосом, то есть 2n (46) или более. В этом случае фибробласт человека можно разделить на 46 или более микроклеток.
Микроклетка может включать одну или более хромосом или фрагментов хромосом.
Здесь одна или более хромосом или фрагментов хромосом могут быть исходной хромосомой или фрагментом исходной хромосомы.
Микроклетка может быть аналогом клетки, который не может подвергаться нормальному делению соматических клеток или мейозу.
Микроклетка может иметь часть цитоплазмы клетки.
Микроклетка может иметь часть клеточной мембраны клетки.
Микроклетка может иметь часть нуклеоплазмы клетки.
Согласно одному аспекту, раскрытому в настоящем описании, может быть предоставлен способ разделения клетки-мишени на микроклетки.
«Разделение клетки на микроклетки» означает получение микроклеток с использованием одной или более клеток. Здесь разделение клетки на микроклетки означает получение множества клеток или аналогов клеток из одной клетки. Описание микроклетки приведено выше.
Описание клетки-мишени такое же, как приведено выше.
Клетка-мишень может быть донорной клеткой.
В способе получения микроклетки из клетки-мишени может использоваться известный метод. Это раскрыто в литературе [Thorfinn Ege et al 1974; Thorfinn Ege et al 1977].
В одном примере варианта осуществления микроклетка может быть получена посредством микронуклеации для получения микроядерной клетки путем обработки клетки-мишени ингибитором микротрубочек; и энуклеации для получения микроклетки центрифугированием после обработки микроядерных клеток ингибитором микрофиламентов.
Здесь клетка-мишень может быть донорной клеткой.
Здесь ингибитором микротрубочек может быть материал, который ингибирует удлинение микротрубочек. Например, ингибитором микротрубочек может быть один или более из колхицина, нокодазола и колцемида.
Здесь ингибитором микрофиламентов может быть материал, который ингибирует удлинение микрофиламентов. Например, ингибитором микрофиламентов может быть цитохалазин B.
Здесь центрифугирование можно проводить в градиенте перколла.
Ядерная мембрана клетки-мишени может быть разделена на две или более небольших везикулы посредством микронуклеации.
Клеточная мембрана клетки-мишени может быть разделена на две или более небольших везикулы путем энуклеации.
Микроклетка, сформированная, как описано выше, может включать в себя хромосому-мишень или фрагмент хромосомы-мишени. Здесь хромосома-мишень или фрагмент хромосомы-мишени могут включать по меньшей мере один или более RRS. В качестве альтернативы хромосома-мишень или фрагмент хромосомы-мишени могут включать по меньшей мере одну или более ASCE. Здесь RRS может быть спарен с RRS, расположенным на хромосоме-мишени, включенной в клетку-мишень, с которой слита микроклетка. Здесь ASCE может образовывать комплементарные связи с ASCE, расположенной на хромосоме-мишени, включенной в клетку-мишень, с которой слита микроклетка.
Например, микроклетка может включать в себя хромосому-мишень, включая первый RRS. Здесь первый RRS может быть спарен со вторым RRS, расположенным на хромосоме-мишени, включенной в клетку-мишень, с которой слита микроклетка.
В другом примере микроклетка может включать в себя хромосому-мишень, включая первый RRS и второй RRS. Клетка-мишень, с которой слита микроклетка, может иметь хромосому-мишень, включающую третий RRS и четвертый RRS. Здесь первый RRS может быть спарен с одним из третьего RRS и четвертого RRS, а второй RRS может быть спарен с другим из третьего RRS и четвертого RRS.
ii-1) Микроклетка, содержащая хромосому с встроенным RRS
Согласно одному примеру варианта осуществления, раскрытому в настоящем описании, может быть предоставлена микроклетка, включающая в себя хромосому-мишень, и способ ее получения. Хромосома-мишень может включать единственный RRS. Хромосома-мишень может включать два или более RRS.
RRS и хромосома-мишень были описаны выше.
Микроклетка, включающая в себя хромосому-мишень, имеющую RRS, может быть получена из клетки-мишени. Клетка-мишень может быть клеткой-мишенью, включающей хромосому-мишень, имеющую RRS. Хромосома-мишень, имеющая RRS, описана выше.
Согласно примеру варианта осуществления микроклетка может быть получена из клетки-мишени. Клетка-мишень может включать в себя хромосому-мишень, включающую RRS. Здесь клетка-мишень может быть донорной клеткой.
Микроклетка может быть получена путем микронуклеации для получения микроядерной клетки путем обработки клетки-мишени, включающей хромосому-мишень, имеющую RRS, ингибитором микротрубочек; и энуклеации для получения микроклеток центрифугированием после обработки микроядерных клеток ингибитором микрофиламентов.
Здесь ингибитором микротрубочек может быть материал, который ингибирует удлинение микротрубочек. Например, ингибитором микротрубочек может быть один или более из колхицина, нокодазола и колцемида.
Здесь ингибитором микрофиламентов может быть материал, который ингибирует удлинение микрофиламентов. Например, ингибитором микрофиламентов может быть цитохалазин B.
Здесь центрифугирование можно проводить в градиенте перколла.
Микроклетка может включать одну или более хромосом, не являющихся мишенью, или их фрагментов.
Микроклетка может включать в себя хромосому-мишень, имеющую RRS и его фрагмент. Здесь микроклетка может дополнительно включать одну или более хромосом, не являющихся мишенью, или их фрагментов.
Согласно другому примеру варианта осуществления, микроклетка может быть получена как микроклетка, включающая одну хромосому или ее фрагмент. Хромосома может быть хромосомой-мишенью, имеющей RRS. Хромосома может быть исходной хромосомой, не являющейся мишенью.
Микроклетка, включающая одну хромосому или ее фрагмент, может быть получена путем микронуклеации для получения микроядерной клетки путем обработки клетки-мишени, включающей хромосому-мишень, имеющую RRS, ингибитором микротрубочек; энуклеации для получения микроклеток центрифугированием после обработки микроядерных клеток ингибитором микрофиламентов; и фильтрации микроклеток.
Здесь клетка-мишень может быть донорной клеткой.
Здесь ингибитором микротрубочек может быть материал для ингибирования удлинения микротрубочек. Например, ингибитором микротрубочек может быть один или более из колхицина, нокодазола и колцемида.
Здесь ингибитором микрофиламентов может быть материал, который ингибирует удлинение микрофиламентов. Например, ингибитором микрофиламентов может быть цитохалазин B.
Здесь центрифугирование можно проводить в градиенте перколла.
Здесь фильтрация может выполняться с использованием мембранного фильтра.
Размер пор мембранного фильтра может составлять от 3 до 10 мкм.
Размер пор мембранного фильтра может составлять от 5 до 8 мкм.
Согласно еще одному примеру варианта осуществления, микроклетка может быть получена как микроклетка, включающая две хромосомы и их фрагменты. Две хромосомы могут включать хромосому-мишень, имеющую RRS, и/или исходную хромосому, не являющуюся мишенью.
Микроклетка, включающая две хромосомы и их фрагменты, может быть получена путем микронуклеации для получения микроядерной клетки путем обработки клетки-мишени, включающей две или более хромосомы-мишени, имеющие RRS, ингибитором микротрубочек; энуклеации для получения микроклеток путем центрифугирования после обработки микроядерных клеток ингибитором микрофиламентов; и фильтрации микроклеток.
Здесь клетка-мишень может быть донорной клеткой.
Здесь ингибитором микротрубочек может быть материал, который ингибирует удлинение микротрубочек. Например, ингибитором микротрубочек может быть один или более из колхицина, нокодазола и колцемида.
Здесь ингибитором микрофиламентов может быть материал, который ингибирует удлинение микрофиламентов. Например, ингибитором микрофиламентов может быть цитохалазин B.
Здесь центрифугирование можно проводить в градиенте перколла.
Здесь фильтрация может выполняться с использованием мембранного фильтра.
Размер пор мембранного фильтра может составлять от 8 до 15 мкм.
Согласно еще одному примеру варианта осуществления, микроклетка может быть получена как микроклетка, включающая три хромосомы или их фрагменты. Эти три хромосомы могут включать хромосому-мишень, имеющую RRS, и/или исходную хромосому, не являющуюся мишенью.
Микроклетка, включающая три хромосомы или их фрагменты, может быть получена путем микронуклеации для получения микроядерной клетки путем обработки клетки-мишени, включающей две или более хромосомы-мишени, имеющие RRS, ингибитором микротрубочек; энуклеации для получения микроклеток путем центрифугирования после обработки микроядерных клеток ингибитором микрофиламентов; и фильтрации микроклеток.
Здесь клетка-мишень может быть донорной клеткой.
Здесь ингибитором микротрубочек может быть материал, который ингибирует удлинение микротрубочек. Например, ингибитором микротрубочек может быть один или более из колхицина, нокодазола и колцемида.
Здесь ингибитором микрофиламентов может быть материал, который ингибирует удлинение микрофиламентов. Например, ингибитором микрофиламентов может быть цитохалазин B.
Здесь центрифугирование можно проводить в градиенте перколла.
Здесь фильтрация может выполняться с использованием мембранного фильтра.
Размер пор мембранного фильтра может составлять от 12 до 20 мкм.
Количество хромосом, включенных в микроклетку, не ограничивается раскрытыми примерами вариантов осуществления. Количество хромосом, включенных в микроклетку, может быть выбрано размером пор мембранного фильтра.
ii-2) Микроклетка, содержащая хромосому с встроенной ASCE
Согласно одному примеру варианта осуществления, раскрытому в настоящем описании, может быть предоставлена микроклетка, включающая в себя хромосому-мишень, и способ ее получения. Хромосома-мишень может включать одну ASCE. Хромосома-мишень может включать две или более ASCE.
ASCE и хромосома-мишень были описаны выше.
Микроклетка, включающая хромосому-мишень, имеющую ASCE, может быть получена из клетки-мишени. Клетка-мишень может быть клеткой-мишенью, включающей хромосому-мишень, имеющую ASCE. Хромосома-мишень, имеющая ASCE, была описана выше. Здесь клетка-мишень может быть донорной клеткой.
Согласно примеру варианта осуществления микроклетка может быть получена из клетки-мишени. Клетка-мишень может включать хромосому-мишень, имеющую ASCE. Здесь клетка-мишень может быть донорной клеткой.
Микроклетка может быть получена путем микронуклеации для получения микроядерной клетки путем обработки клетки-мишени, включающей хромосому-мишень, имеющую ASCE, ингибитором микротрубочек; и энуклеации для получения микроклеток путем центрифугирования после обработки микроядерных клеток ингибитором микрофиламентов.
Здесь ингибитором микротрубочек может быть материал, который ингибирует удлинение микротрубочек. Например, ингибитором микротрубочек может быть один или более из колхицина, нокодазола и колцемида.
Здесь ингибитором микрофиламентов может быть материал, который ингибирует удлинение микрофиламентов. Например, ингибитором микрофиламентов может быть цитохалазин B.
Здесь центрифугирование можно проводить в градиенте перколла.
Микроклетка может включать одну или более хромосом, не являющихся мишенью, или их фрагментов.
Микроклетка может включать хромосому-мишень, имеющую ASCE или ее фрагмент. Здесь микроклетка может дополнительно включать одну или более хромосом, не являющихся мишенью, или их фрагментов.
Согласно другому примеру варианта осуществления, микроклетка может быть получена как микроклетка, включающая одну хромосому или ее фрагмент. Хромосома может быть хромосомой-мишенью, имеющей ASCE. Хромосома может быть исходной хромосомой, не являющейся мишенью.
Микроклетка, включающая одну хромосому или ее фрагмент, может быть получена путем микронуклеации для получения микроядерной клетки путем обработки клетки-мишени, включающей хромосому-мишень, имеющую ASCE, ингибитором микротрубочек; энуклеации для получения микроклеток путем центрифугирования после обработки микроядерных клеток ингибитором микрофиламентов; и фильтрации микроклеток.
Здесь клетка-мишень может быть донорной клеткой.
Здесь ингибитором микротрубочек может быть материал, который ингибирует удлинение микротрубочек. Например, ингибитором микротрубочек может быть один или более из колхицина, нокодазола и колцемида.
Здесь ингибитором микрофиламентов может быть материал, который ингибирует удлинение микрофиламентов. Например, ингибитором микрофиламентов может быть цитохалазин B.
Здесь центрифугирование можно проводить в градиенте перколла.
Здесь фильтрация может выполняться с использованием мембранного фильтра.
Размер пор мембранного фильтра может составлять от 3 до 10 мкм.
Размер пор мембранного фильтра может составлять от 5 до 8 мкм.
Согласно еще одному примеру варианта осуществления, микроклетка может быть получена как микроклетка, включающая две хромосомы и их фрагменты. Две хромосомы могут включать хромосому-мишень, имеющую ASCE, и/или исходную хромосому, не являющуюся мишенью.
Микроклетка, включающая две хромосомы и их фрагменты, может быть получена путем микронуклеации для получения микроядерной клетки путем обработки клетки-мишени, включающей две или более хромосомы-мишени, имеющие ASCE, с помощью ингибитора микротрубочек; энуклеации для получения микроклеток путем центрифугирования после обработки микроядерных клеток ингибитором микрофиламентов; и фильтрации микроклеток.
Здесь клетка-мишень может быть донорной клеткой.
Здесь ингибитором микротрубочек может быть материал, который ингибирует удлинение микротрубочек. Например, ингибитором микротрубочек может быть один или более из колхицина, нокодазола и колцемида.
Здесь ингибитором микрофиламентов может быть материал, который ингибирует удлинение микрофиламентов. Например, ингибитором микрофиламентов может быть цитохалазин B.
Здесь центрифугирование можно проводить в градиенте перколла.
Здесь фильтрация может выполняться с использованием мембранного фильтра.
Размер пор мембранного фильтра может составлять от 8 до 15 мкм.
Согласно примеру варианта осуществления, микроклетка может быть получена как микроклетка, включающая три хромосомы или их фрагменты. Эти три хромосомы могут включать хромосому-мишень, имеющую ASCE, и/или исходную хромосому, не являющуюся мишенью.
Микроклетка, включающая три хромосомы или их фрагменты, может быть получена путем микронуклеации для получения микроядерной клетки путем обработки клетки-мишени, включающей две или более хромосомы-мишени, имеющие ASCE, с помощью ингибитора микротрубочек; энуклеации для получения микроклеток путем центрифугирования после обработки микроядерных клеток ингибитором микрофиламентов; и фильтрации микроклеток.
Здесь клетка-мишень может быть донорной клеткой.
Здесь ингибитором микротрубочек может быть материал, который ингибирует удлинение микротрубочек. Например, ингибитором микротрубочек может быть один или более из колхицина, нокодазола и колцемида.
Здесь ингибитором микрофиламентов может быть материал, который ингибирует удлинение микрофиламентов. Например, ингибитором микрофиламентов может быть цитохалазин B.
Здесь центрифугирование можно проводить в градиенте перколла.
Здесь фильтрация может выполняться с использованием мембранного фильтра.
Размер пор мембранного фильтра может составлять от 12 до 20 мкм.
Количество хромосом, включенных в микроклетку, не ограничивается раскрытыми вариантами осуществления. Количество хромосом, включенных в микроклетку, может быть выбрано размером пор мембранного фильтра.
В примере получения микроклетки фибробласт-мишень можно обработать колцемидом. Здесь микроядерные клетки могут быть получены благодаря индукции микронуклеации с помощью обработки колцемидом.
Микроклетку можно выделить обработкой полученных микроядерных клеток цитохалазином B и проведением центрифугирования.
Посредством вышеописанного процесса микроклетка может быть произведена и получена из фибробласта-мишени.
Описанные выше примеры являются лишь примерами, и каждый составляющий элемент (клетка-мишень, микроклетка и т.п.) может быть модифицирован или изменен различными способами в соответствии с назначением.
iii) Получение слитых клеток с использованием микроклеток.
В одном из раскрытых в настоящем описании аспектов могут быть предоставлены первая слитая клетка и способ ее получения.
Первая слитая клетка может быть клеткой, дополнительно имеющей одну или более хромосом или их фрагментов в дополнение к исходной клетке.
Здесь первая слитая клетка может быть клеткой, имеющей множество хромосом, больше, чем общее количество хромосом, составляющих исходную клетку. Например, когда общее количество хромосом исходной клетки равно 2n (40), первая слитая клетка может быть клеткой, имеющей 2n+1 (41) хромосом. В этом случае первая слитая клетка может быть клеткой, имеющей общее количество хромосом (2n, то есть 40) исходной клетки и одну дополнительную хромосому.
Первая слитая клетка может включать по меньшей мере одну хромосому-мишень. Здесь хромосома-мишень может быть хромосомой, которая дополнительно включена в первую слитую клетку.
Первая слитая клетка может включать по меньшей мере две хромосомы-мишени. Здесь одна из двух или более хромосом-мишеней может быть одной из цельных хромосом исходной клетки, присутствующих в первой слитой клетке. Другая из двух или более хромосом-мишеней может быть хромосомой, которая дополнительно включена в первую слитую клетку.
Первая слитая клетка может включать по меньшей мере две хромосомы-мишени. Здесь две или более хромосомы-мишени могут быть хромосомами, дополнительно включенными в первую слитую клетку. В этом случае первая слитая клетка может быть клеткой, имеющей две или более дополнительных хромосомы в исходной клетке, а первая слитая клетка может быть клеткой, имеющей цельные хромосомы исходной клетки и две или более дополнительных хромосомы.
Первая слитая клетка может быть получена путем слияния одной или более исходных клеток и одной или более микроклеток. В способе получения первой слитой клетки путем слияния микроклетки и исходной клетки может использоваться известный способ. Он раскрыт в литературе [Fournier RE et al 1977; McNeill CA et al 1980]. В качестве примера приводится ссылка на Tomizuka et al., Nature Genetics, 16: 133 (1997).
Первая слитая клетка может быть получена путем слияния клетки-мишени и одной или более микроклеток.
Здесь клетка-мишень может быть реципиентной клеткой.
Здесь одна или более микроклеток могут быть получены из донорной клетки.
Описания клетки-мишени (первой клетки-мишени) и микроклетки приведены выше.
Микроклетка может быть получена с использованием клетки-мишени (второй клетки-мишени).
Здесь первая клетка-мишень может происходить от того же индивидуума, что и вторая клетка-мишень.
Здесь первая клетка-мишень и вторая клетка-мишень могут происходить от различных индивидуумов. Различные индивидуумы включают как гомологичных, так и гетерологичных.
Например, первой клеткой-мишенью может быть эмбриональная стволовая клетка мыши (ES-клеткой). Здесь второй клеткой-мишенью может быть человеческий фибробласт.
Например, первой клеткой-мишенью может быть ES-клетка мыши. Здесь второй клеткой-мишенью может быть фибробласт мыши.
Микроклетка может включать одну или более хромосом-мишеней или их фрагментов. Здесь одна или более хромосом-мишеней или их фрагментов могут включать один или более RRS. В качестве альтернативы, одна или более хромосом-мишеней или их фрагментов могут включать одну или более ASCE. Здесь один или более RRS могут быть спарены с одним или более RRS, включенными в первую клетку-мишень. В качестве альтернативы, одна или более ASCE могут образовывать комплементарные связи с одной или более ASCE, включенными в первую клетку-мишень.
Когда существует множество микроклеток, по меньшей мере, одна микроклетка может включать одну или более хромосом-мишеней или их фрагментов. Здесь одна или более хромосом-мишеней или их фрагментов могут включать один или более RRS. В качестве альтернативы, одна или более хромосом-мишеней или их фрагментов могут включать одну или более ASCE. Здесь один или более RRS могут быть спарены с одним или более RRS, включенными в первую клетку-мишень. В качестве альтернативы, одна или более ASCE могут образовывать комплементарные связи с одной или более ASCE, включенными в первую клетку-мишень.
В одном примере варианта осуществления первая слитая клетка может быть получена путем слияния клетки-мишени (первой клетки-мишени) и первой микроклетки. Здесь первая микроклетка может включать в себя одну или более хромосом-мишеней или их фрагментов. Здесь одна или более хромосом-мишеней или их фрагментов могут включать в себя один или более RRS (первый RRS). Клетка-мишень (первая клетка-мишень) может включать в себя хромосому-мишень, имеющую один или более RRS (второй RRS). Здесь первый RRS может быть спарен со вторым RRS.
В другом примере варианта осуществления первая слитая клетка может быть получена путем слияния клетки-мишени (первой клетки-мишени) и первой микроклетки. Здесь первая микроклетка может включать в себя одну или более хромосом-мишеней или их фрагментов. Здесь одна или более хромосом-мишеней или их фрагментов могут включать два или более RRS (первый RRS и второй RRS). Клетка-мишень (первая клетка-мишень) может включать в себя хромосому-мишень, включающую два или более RRS (третий RRS и четвертый RRS). Здесь первый RRS может быть спарен с одним из третьего RRS и четвертого RRS, а второй RRS может быть спарен с другим из третьего RRS и четвертого RRS.
В другом примере варианта осуществления первая слитая клетка может быть получена путем слияния клетки-мишени (первой клетки-мишени), первой микроклетки и второй микроклетки. Здесь первая микроклетка может включать в себя одну или более хромосом-мишеней или их фрагментов. Вторая микроклетка может включать одну или более исходных хромосом, не являющихся мишенью, или их фрагментов. Здесь одна или более хромосом-мишеней или их фрагментов могут включать в себя один или более RRS (первый RRS). Клетка-мишень (первая клетка-мишень) может включать в себя хромосому-мишень, включающую один или более RRS (второй RRS). Здесь первый RRS может быть спарен со вторым RRS.
Еще в одном примере варианта осуществления первая слитая клетка может быть получена слиянием клеток-мишеней (первой клетки-мишени), первой микроклетки и второй микроклетки. Здесь первая микроклетка может включать в себя одну или более хромосом-мишеней или их фрагментов. Вторая микроклетка может включать одну или более хромосом-мишеней или их фрагментов. В этом случае хромосома-мишень, включенная в первую микроклетку, может быть такой же, как хромосома-мишень, включенная во вторую микроклетку, или отличаться от нее. Здесь хромосома-мишень, включенная в первую микроклетку, может включать в себя один или более RRS (первый RRS). Клетка-мишень (первая клетка-мишень) может включать в себя хромосому-мишень, включающую один или более RRS (второй RRS). Здесь первый RRS может быть спарен со вторым RRS.
Еще в одном примере варианта осуществления первая слитая клетка может быть получена путем слияния клеток-мишеней (первой клетки-мишени), первой микроклетки, второй микроклетки, третьей микроклетки и n-й микроклетки. Здесь одна или более микроклеток из первой микроклетки, второй микроклетки, третьей микроклетки и n-й микроклетки могут включать в себя одну или более хромосом-мишеней или их фрагментов.
Согласно примеру варианта осуществления, способ получения первой слитой клетки может включать слияние клеток, выполняемое посредством приведения клетки-мишени (первой клетки-мишени) и одной или более микроклеток в контакт друг с другом; и обработку клетки-мишени и микроклетки положительно заряженным поверхностно-активным веществом.
Описание клетки-мишени такое же, как приведено выше.
Клетка-мишень (первая клетка-мишень) может включать одну или более хромосом-мишеней.
Микроклетка может быть получена с использованием клетки-мишени (второй клетки-мишени). Описание микроклетки приведено выше.
Здесь первая клетка-мишень может происходить от того же индивидуума, что и вторая клетка-мишень.
Здесь первая клетка-мишень и вторая клетка-мишень могут происходить от различных индивидуумов. Различные индивидуумы включают как гомологичных, так и гетерологичных.
Например, первой клеткой-мишенью может быть ES-клетка мыши. Здесь второй клеткой-мишенью может быть человеческий фибробласт.
Например, первой клеткой-мишенью может быть ES-клетка мыши. Здесь второй клеткой-мишенью может быть фибробласт мыши.
Микроклетка может включать одну или более хромосом-мишеней или их фрагментов.
Когда существует множество микроклеток, по меньшей мере, одна микроклетка может включать одну или более хромосом-мишеней или их фрагментов.
Приведение клетки-мишени (первой клетки-мишени) и одной или более микроклеток в контакт друг с другом может заключаться в локализации клетки-мишени (первой клетки-мишени) и одной или более микроклеток в одной и той же среде или буфере.
Положительно заряженным поверхностно-активным веществом может быть полиэтиленгликоль (ПЭГ).
Когда имеется множество микроклеток, каждая из множества микроклеток может быть последовательно слита с клеткой-мишенью (первой клеткой-мишенью).
Когда имеется множество микроклеток, множество микроклеток может быть слито с клеткой-мишенью (первой клеткой-мишенью) за один раз.
Когда имеется множество микроклеток, множество микроклеток может быть случайным образом слито с клеткой-мишенью (первой клеткой-мишенью).
Согласно другому примеру варианта осуществления способ получения первой слитой клетки может включать слияние клеток, выполняемое посредством приведения клетки-мишени (первой клетки-мишени) и одной или более микроклеток в контакт друг с другом; и обработку микроклеток и клетки-мишени (первой клетки-мишени) митогеном и положительно заряженным поверхностно-активным веществом.
Описание клетки-мишени такое же, как приведено выше.
Клетка-мишень (первая клетка-мишень) может включать одну или более хромосом-мишеней.
Микроклетка может быть получена с использованием клетки-мишени (второй клетки-мишени). Описание микроклетки приведено выше.
Здесь первая клетка-мишень может происходить от того же индивидуума, что и вторая клетка-мишень.
Здесь первая клетка-мишень и вторая клетка-мишень могут происходить от различных индивидуумов. Различные индивидуумы могут включать как гомологичных, так и гетерологичных индивидуумов.
Например, первой клеткой-мишенью может быть ES-клетка мыши. Здесь второй клеткой-мишенью может быть человеческий фибробласт.
Например, первой клеткой-мишенью может быть ES-клетка мыши. Здесь второй клеткой-мишенью может быть фибробласт мыши.
Микроклетка может включать одну или более хромосом-мишеней или их фрагментов.
Когда существует множество микроклеток, по меньшей мере, одна микроклетка может включать одну или более хромосом-мишеней или их фрагментов.
Приведение клетки-мишени (первой клетки-мишени) и одной или более микроклеток в контакт друг с другом может заключаться в локализации клетки-мишени (первой клетки-мишени) и одной или более микроклеток в одной и той же среде или буфере.
Митогеном может быть фитогемагглютинин-P (PHA-P).
Положительно заряженным поверхностно-активным веществом может быть ПЭГ.
Когда имеется множество микроклеток, каждая из множества микроклеток может быть последовательно слита с клеткой-мишенью (первой клеткой-мишенью).
Когда имеется множество микроклеток, множество микроклеток может быть слито с клеткой-мишенью (первой клеткой-мишенью) за один раз.
Когда имеется множество микроклеток, множество микроклеток может быть случаным образом слито с клеткой-мишенью (первой клеткой-мишенью).
iii-1) Первая слитая клетка, содержащая хромосому с встроенным RRS
Согласно раскрытому в настоящем описании примеру варианта осуществления может быть предоставлена первая слитая клетка, включающая две или более хромосомы-мишени, и способ ее получения.
Две или более хромосомы-мишени могут быть хромосомами-мишенями, каждая из которых имеет по меньшей мере один RRS.
Две или более хромосомы-мишени могут быть первой хромосомой-мишенью и второй хромосомой-мишенью.
Первая хромосома-мишень может быть хромосомой-мишенью, включающей по меньшей мере один RRS.
Вторая хромосома-мишень может быть хромосомой-мишенью, включающей по меньшей мере один RRS.
В одном примере первая хромосома-мишень может включать в себя первый RRS, а вторая хромосома-мишень может включать в себя второй RRS. Здесь первый RRS может быть таким же, как второй RRS, или отличаться от него.
В другом примере первая хромосома-мишень может включать в себя первый RRS и второй RRS, а вторая хромосома-мишень может включать в себя третий RRS и четвертый RRS. Здесь все, первый RRS, второй RRS, третий RRS и четвертый RRS, одинаковы или отличаются друг от друга. В качестве альтернативы, первый RRS, второй RRS, третий RRS и четвертый RRS могут быть частично одинаковыми или отличаться друг от друга.
Здесь каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Первая слитая клетка может включать в себя первую хромосому-мишень и вторую хромосому-мишень.
Первая хромосома-мишень может быть получена из первой клетки-мишени. Вторая хромосома-мишень может быть получена из микроклетки. Здесь микроклетка может быть получена с использованием второй клетки-мишени, включающей вторую хромосому-мишень. В этом случае первой слитой клеткой может быть слитая клетка, имеющая цельные хромосомы первой клетки-мишени и второй хромосомы-мишени.
В качестве альтернативы, первая хромосома-мишень может быть получена из микроклетки. Вторая хромосома-мишень может быть получена из второй клетки-мишени. Здесь микроклетка может быть получена с использованием первой клетки-мишени, включающей первую хромосому-мишень. В этом случае первой слитой клеткой может быть слитая клетка, имеющая цельные хромосомы второй клетки-мишени и первой хромосомы-мишени.
Описание хромосомы-мишени, клетки-мишени и микроклетки приведено выше.
Согласно примеру варианта осуществления способ получения первой слитой клетки, включающей две или более хромосомы-мишени, может включать слияние клеток, выполняемое посредством приведения в контакт первой клетки-мишени и одной или более микроклеток; и обработку первой клетки-мишени и микроклетки положительно заряженным поверхностно-активным веществом.
Первая клетка-мишень может включать одну или более хромосом-мишеней.
Первая клетка-мишень может включать первую хромосому-мишень.
Здесь первая хромосома-мишень может включать по меньшей мере один RRS.
Здесь один или более RRS, включенных в первую хромосому-мишень, могут быть одним или более, выбранными из вариантов LoxP, приведенных в Таблице 1.
Микроклетка может быть получена с использованием второй клетки-мишени. Здесь вторая клетка-мишень может включать одну или более хромосом-мишеней. Вторая клетка-мишень может включать в себя вторую хромосому-мишень.
Здесь первая клетка-мишень может происходить от того же индивидуума, что и вторая клетка-мишень.
Здесь первая клетка-мишень и вторая клетка-мишень могут происходить от различных индивидуумов. Различные индивидуумы могут включать как гомологичных, так и гетерологичных.
Например, первой клеткой-мишенью может быть ES-клетка мыши. Здесь второй клеткой-мишенью может быть человеческий фибробласт.
Например, первой клеткой-мишенью может быть ES-клетка мыши. Здесь второй клеткой-мишенью может быть фибробласт мыши.
Микроклетка может включать одну или более хромосом-мишеней или их фрагментов. Здесь микроклетка может включать в себя вторую хромосому-мишень или ее фрагмент.
Здесь вторая хромосома-мишень может включать по меньшей мере один RRS.
Здесь один или более RRS, включенных во вторую хромосому-мишень, могут быть одним или более, выбранными из вариантов LoxP, приведенных в Таблице 1.
Здесь один или более RRS, включенных во вторую хромосому-мишень, могут быть такими же или отличаться от одного или более RRS, включенных в первую хромосому-мишень.
Здесь один или более RRS, включенных во вторую хромосому-мишень, могут быть спарены с одним или более RRS, включенными в первую хромосому-мишень.
Здесь каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Приведение первой клетки-мишени и одной или более микроклетки в контакт друг с другом может заключаться в локализации клетки-мишени и одной или более микроклеток в одной и той же среде или буфере.
Положительно заряженным поверхностно-активным веществом может быть ПЭГ.
На стадии обработки первой клетки-мишени и микроклетки положительно заряженным поверхностно-активным веществом клетки можно дополнительно обработать митогеном.
Митогеном может быть PHA-P.
Согласно другому примеру варианта осуществления, способ получения первой слитой клетки, включающей две или более хромосомы-мишени, может включать слияние клеток, выполняемое путем приведения первой клетки-мишени и одной или более микроклеток в контакт друг с другом; и обработку первой клетки-мишени и микроклетки положительно заряженным поверхностно-активным веществом.
Первая клетка-мишень может включать одну или более хромосом-мишеней.
Первая клетка-мишень может включать первую хромосому-мишень.
Первая хромосома-мишень может включать по меньшей мере два или более RRS.
Здесь два или более RRS могут быть первым RRS и вторым RRS.
Здесь каждый из первого RRS и второго RRS может быть одним или более, выбранными из вариантов LoxP, приведенных в Таблице 1.
Здесь первый RRS может быть таким же, как второй RRS, или отличаться от него.
Микроклетка может быть получена с использованием второй клетки-мишени. Здесь вторая клетка-мишень может включать одну или более хромосом-мишеней. Вторая клетка-мишень может включать в себя вторую хромосому-мишень.
Здесь первая клетка-мишень может происходить от того же индивидуума, что и вторая клетка-мишень.
Здесь первая клетка-мишень и вторая клетка-мишень могут происходить от различных индивидуумов. Различные индивидуумы включают как гомологичных, так и гетерологичных.
Например, первой клеткой-мишенью может быть ES-клетка мыши. Здесь второй клеткой-мишенью может быть человеческий фибробласт.
Например, первой клеткой-мишенью может быть ES-клетка мыши. Здесь второй клеткой-мишенью может быть фибробласт мыши.
Микроклетка может включать одну или более хромосом-мишеней или их фрагментов. Здесь микроклетка может включать в себя вторую хромосому-мишень или ее фрагмент.
Вторая хромосома-мишень может включать по меньшей мере два RRS.
Здесь два или более RRS могут включать в себя третий RRS и четвертый RRS.
Здесь каждый из третьего RRS и четвертого RRS может быть одним или более, выбранными из вариантов LoxP, приведенных в Таблице 1.
Здесь третий RRS может быть таким же, как четвертый RRS, или отличаться от него.
Здесь третий RRS может быть спарен с первым RRS и/или вторым RRS.
Здесь четвертый RRS может быть спарен с первым RRS и/или вторым RRS.
Здесь каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Приведение первой клетки-мишени и одной или более микроклетки в контакт друг с другом может заключаться в локализации клетки-мишени и одной или более микроклеток в одной и той же среде или буфере.
Положительно заряженным поверхностно-активным веществом может быть ПЭГ.
На стадии обработки первой клетки-мишени и микроклетки положительно заряженным поверхностно-активным веществом клетки можно дополнительно обработать митогеном.
Митогеном может быть PHA-P.
iii-2) Первая слитая клетка, содержащая хромосому с встроенной ASCE
Согласно раскрытому в настоящем описании примеру варианта осуществления может быть предоставлена первая слитая клетка, включающая две или более хромосомы-мишени, и способ ее получения.
Две или более хромосом-мишеней могут быть хромосомами-мишенями, каждая из которых имеет по меньшей мере одну ASCE.
Две или более хромосомы-мишени могут быть первой хромосомой-мишенью и второй хромосомой-мишенью.
Первой хромосомой-мишенью может быть хромосома-мишень, включающая по меньшей мере одну ASCE.
Второй хромосомой-мишенью может быть хромосома-мишень, включающая по меньшей мере одну ASCE.
В одном примере первая хромосома-мишень может включать первую ASCE, а вторая хромосома-мишень может включать вторую ASCE. Здесь первая ASCE может быть такой же, как вторая ASCE, или отличаться от нее.
В другом примере первая хромосома-мишень может включать в себя первую ASCE и вторую ASCE, а вторая хромосома-мишень может включать третью ASCE и четвертую ASCE. Здесь все, первая ASCE, вторая ASCE, третья ASCE и четвертая ASCE одинаковы или отличаются друг от друга. В качестве альтернативы, первая ASCE, вторая ASCE, третья ASCE и четвертая ASCE могут частично быть одинаковыми или отличаться друг от друга.
Здесь каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Первая слитая клетка может включать в себя первую хромосому-мишень и вторую хромосому-мишень.
Первая хромосома-мишень может быть получена из первой клетки-мишени. Вторая хромосома-мишень может быть получена из микроклетки. Здесь микроклетка может быть получена с использованием второй клетки-мишени, включающей вторую хромосому-мишень. В этом случае первой слитой клеткой может быть слитая клетка, имеющая цельные хромосомы первой клетки-мишени и второй хромосомы-мишени.
В качестве альтернативы, первая хромосома-мишень может быть получена из микроклетки. Вторая хромосома-мишень может быть получена из второй клетки-мишени. Здесь микроклетка может быть получена с использованием первой клетки-мишени, включающей первую хромосому-мишень. В этом случае первой слитой клеткой может быть слитая клетка, имеющая цельные хромосомы второй клетки-мишени и первой хромосомы-мишени.
Описание хромосомы-мишени, клетки-мишени и микроклетки приведено выше.
Согласно примеру варианта осуществления способ получения первой слитой клетки, включающей две или более хромосомы-мишени, может включать слияние клеток, выполняемое посредством приведения в контакт первой клетки-мишени и одной или более микроклеток; и обработку первой клетки-мишени и микроклетки положительно заряженным поверхностно-активным веществом.
Первая клетка-мишень может включать одну или более хромосом-мишеней.
Первая клетка-мишень может включать первую хромосому-мишень.
Здесь первая хромосома-мишень может включать по меньшей мере одну ASCE.
Микроклетка может быть получена с использованием второй клетки-мишени. Здесь вторая клетка-мишень может включать одну или более хромосом-мишеней. Вторая клетка-мишень может включать в себя вторую хромосому-мишень.
Здесь первая клетка-мишень может происходить от того же индивидуума, что и вторая клетка-мишень.
Здесь первая клетка-мишень и вторая клетка-мишень могут происходить от различных индивидуумов. Различные индивидуумы могут включать как гомологичных, так и гетерологичных.
Например, первой клеткой-мишенью может быть ES-клетка мыши. Здесь второй клеткой-мишенью может быть человеческий фибробласт.
Например, первой клеткой-мишенью может быть ES-клетка мыши. Здесь второй клеткой-мишенью может быть фибробласт мыши.
Микроклетка может включать одну или более хромосом-мишеней или их фрагментов. Здесь микроклетка может включать в себя вторую хромосому-мишень или ее фрагмент.
Здесь вторая хромосома-мишень может включать по меньшей мере одну ASCE.
Здесь одна или более ASCE, включенных во вторую хромосому-мишень, могут быть одинаковыми или отличаться от одной или более ASCE, включенных в первую хромосому-мишень.
Здесь одна или более ASCE, включенных во вторую хромосому-мишень, могут образовывать комплементарные связи с одной или более ASCE, включенными в первую хромосому-мишень.
Здесь каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Приведение первой клетки-мишени и одной или более микроклетки в контакт друг с другом может заключаться в локализации клетки-мишени и одной или более микроклеток в одной и той же среде или буфере.
Положительно заряженным поверхностно-активным веществом может быть ПЭГ.
На стадии обработки первой клетки-мишени и микроклетки положительно заряженным поверхностно-активным веществом клетки можно дополнительно обработать митогеном.
Митогеном может быть PHA-P.
Согласно другому примеру варианта осуществления, способ получения первой слитой клетки, включающей две или более хромосомы-мишени, может включать слияние клеток, выполняемое путем приведения первой клетки-мишени и одной или более микроклеток в контакт друг с другом; и обработку первой клетки-мишени и микроклетки положительно заряженным поверхностно-активным веществом.
Первая клетка-мишень может включать одну или более хромосом-мишеней.
Первая клетка-мишень может включать первую хромосому-мишень.
Первая хромосома-мишень может включать по меньшей мере две или более ASCE.
Здесь две или более ASCE могут быть первой ASCE и второй ASCE.
Здесь первая ASCE может быть такой же, как вторая ASCE, или отличаться от нее.
Микроклетка может быть получена с использованием второй клетки-мишени. Здесь вторая клетка-мишень может включать одну или более хромосом-мишеней. Вторая клетка-мишень может включать в себя вторую хромосому-мишень.
Здесь первая клетка-мишень может происходить от того же индивидуума, что и вторая клетка-мишень.
Здесь первая клетка-мишень и вторая клетка-мишень могут происходить от различных индивидуумов. Различные индивидуумы включают как гомологичных, так и гетерологичных.
Например, первой клеткой-мишенью может быть ES-клетка мыши. Здесь второй клеткой-мишенью может быть человеческий фибробласт.
Например, первой клеткой-мишенью может быть ES-клетка мыши. Здесь второй клеткой-мишенью может быть фибробласт мыши.
Микроклетка может включать одну или более хромосом-мишеней или их фрагментов. Здесь микроклетка может включать в себя вторую хромосому-мишень или ее фрагмент.
Вторая хромосома-мишень может включать по меньшей мере две ASCE.
Здесь две или более ASCE могут включать третью ASCE и четвертую ASCE.
Здесь третья ASCE может быть такой же, как четвертая ASCE, или отличаться от нее.
Здесь третья ASCE может образовывать комплементарные связи с первой ASCE и/или второй ASCE.
Здесь четвертая ASCE может образовывать комплементарные связи с первой ASCE и/или второй ASCE.
Каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Приведение первой клетки-мишени и одной или более микроклетки в контакт друг с другом может заключаться в локализации клетки-мишени и одной или более микроклеток в одной и той же среде или буфере.
Положительно заряженным поверхностно-активным веществом может быть ПЭГ.
На стадии обработки первой клетки-мишени и микроклетки положительно заряженным поверхностно-активным веществом клетки можно дополнительно обработать митогеном.
Митогеном может быть PHA-P.
В примере получения слитой клетки слияние клеток может быть выполнено путем смешивания микроклетки и клетки-мишени в определенном соотношении.
Здесь конкретное соотношение (микроклетка:клетка-мишень) может составлять 1:1, 1:2, 1:3, 1:4, 1:5, 1:6 1:7, 1:8, 1:9 или 1:10. В качестве альтернативы конкретное соотношение может составлять 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1 или 10:1.
Здесь конкретное соотношение может варьироваться в зависимости от цели. Например, по сравнению со случаем получения слитой клетки, имеющей 2n+3 хромосомы, при получении слитой клетки, имеющей 2n+1 хромосомы, количество микроклеток на количество клеток-мишеней может быть меньше.
Здесь конкретное соотношение может быть установлено как любое соотношение с учетом различных факторов, включающих цель, время слияния клеток, выделение слитых клеток и т.д.
Примеры, описанные выше, являются просто примерами, и каждый составляющий элемент (клетка-мишень, микроклетка, слитая клетка и т.д.) может быть по-разному модифицирован или изменен в соответствии с назначением.
iv) Получение клетки, включающей искусственную рекомбинантную хромосому, с использованием слитой клетки.
В соответствии с раскрытым в настоящем описании аспектом может быть предоставлена клетка, включающая искусственную рекомбинантную хромосому, и способ ее получения.
Искусственная рекомбинантная хромосома описана выше.
Клетка, включающая искусственную рекомбинантную хромосому, может быть получена с использованием описанной выше первой слитой клетки.
Первая слитая клетка может включать две или более хромосомы-мишени.
Здесь две или более хромосом-мишенейы могут быть первой хромосомой-мишенью и второй хромосомой-мишенью.
Здесь каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Искусственная рекомбинантная хромосома может быть получена путем рекомбинации первой хромосомы-мишени и второй хромосомы-мишени.
В одном примере, когда первая хромосома-мишень (1) включает первую часть (11) и первый фрагмент (12), а вторая хромосома-мишень (2) включает вторую часть (21) и второй фрагмент (22), искусственная рекомбинантная хромосома может быть первой искусственной рекомбинантной хромосомой (3), включающей первую часть (11) и второй фрагмент (22). В качестве альтернативы, искусственная рекомбинантная хромосома может быть искусственной рекомбинантной хромосомой (4), включающей вторую часть (21) и первый фрагмент (12) (ФИГ. 2 и 9).
В другом примере, когда первая хромосома-мишень (1) включает первую часть (11) и фрагменты (12) на обоих концах, а вторая хромосома-мишень (2) включает вторую часть (21) и фрагменты (22) на обоих концах, то искусственная рекомбинантная хромосома может быть первой искусственной рекомбинантной хромосомой (3), включающей первую часть (11) и фрагменты (22) на обоих концах второй хромосомы-мишени. В качестве альтернативы, искусственная рекомбинантная хромосома может включать искусственную рекомбинантную хромосому (4), включающую вторую часть (21) и фрагменты (12) на обоих концах первой хромосомы-мишени (ФИГ. 3).
Еще в одном примере, когда первая хромосома-мишень (1) включает часть (11), включающую оба конца и первый фрагмент (12), а вторая хромосома-мишень (2) включает часть (21), включающую оба конца и второй фрагмент (22), то искусственная рекомбинантная хромосома может быть первой искусственной рекомбинантной хромосомой (3), включающей часть (11), включающую оба конца первой хромосомы-мишени и второй фрагмент (22). В качестве альтернативы, искусственная рекомбинантная хромосома может включать искусственную рекомбинантную хромосому (4), включающую часть (21), включающую оба конца второй хромосомы-мишени, и второй фрагмент (12) (ФИГ. 4 и 7).
В другом примере, когда первая хромосома-мишень (1) включает часть (11), включающую оба конца, первую часть (13), первый фрагмент (12) и второй фрагмент (14), а вторая хромосома-мишень (2) включает часть (21), включающую оба конца, вторую часть (23), третий фрагмент (22) и четвертый фрагмент (24), то искусственная рекомбинантная хромосома может быть первой искусственной рекомбинантной хромосомой (3), включающей часть (11), включающей оба конца первой хромосомы-мишени, третий фрагмент (22), первую часть (13) и четвертый фрагмент (24). В качестве альтернативы, искусственная рекомбинантная хромосома может быть искусственной рекомбинантной хромосомой (4), включающей часть (21), включающую оба конца второй хромосомы-мишени, первый фрагмент (12), вторую часть (23) и второй фрагмент (14). (ФИГ. 5 и 6).
Еще в одном примере, когда первая хромосома-мишень (1) включает в себя часть (11), включающую оба конца и первый фрагмент (12), а вторая хромосома-мишень (2) включает первую часть (21) и вторую часть (22), то искусственная рекомбинантная хромосома может быть искусственной рекомбинантной хромосомой (4), включающей первую часть (21), первый фрагмент (12) и вторую часть (22) (ФИГ. 8).
В другом примере, когда первая хромосома-мишень (1) включает часть (11), включающую оба конца и первый фрагмент (12), вторая хромосома-мишень (2) включает часть (21), включающую оба конца и второй фрагмент (22), то искусственная рекомбинантная хромосома может быть первой искусственной рекомбинантной хромосомой (3), включающей часть (11), включающую оба конца первой хромосомы-мишени и инвертированный второй фрагмент (22). Здесь инвертированный второй фрагмент может быть получен путем инверсии второго фрагмента (22), присутствующего во второй хромосоме-мишени (2). В этом случае в клетке, включающей первую искусственную рекомбинантную хромосому, ген, включенный во второй инвертированный фрагмент, может не экспрессироваться в виде белка. В качестве альтернативы, клетка, включающая первую искусственную рекомбинантную хромосому, может иметь другой профиль экспрессии гена, включенного во второй фрагмент, по сравнению с первой слитой клеткой, включающей вторую хромосому-мишень. В качестве альтернативы, искусственная рекомбинантная хромосома может быть искусственной рекомбинантной хромосомой (4), включающей часть (21), включающую оба конца второй хромосомы-мишени и инвертированный первый фрагмент (12). Здесь инвертированный первый фрагмент может быть получен путем инверсии первого фрагмента (12), присутствующего в первой хромосоме-мишени (1). В этом случае в клетке, содержащей вторую искусственную рекомбинантную хромосому, ген, включенный в инвертированный первый фрагмент, может не экспрессироваться в виде белка. В качестве альтернативы, клетка, включающая вторую искусственную рекомбинантную хромосому, может иметь другой профиль экспрессии гена, включенного в первый фрагмент, по сравнению с первой слитой клеткой (ФИГ. 10).
Искусственная рекомбинантная хромосома может дополнительно включать RRS и/или ASCE.
Искусственная рекомбинантная хромосома может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
iv-1) RRS-SSR-опосредованный хромосомный обмен
В соответствии с примером варианта осуществления, раскрытым в настоящем описании, может быть предоставлена клетка, включающая искусственную рекомбинантную хромосому, с использованием метода хромосомного обмена, опосредованного RRS-SSR, и способ ее получения (ФИГ. 13-19).
Клетка, включающая искусственную рекомбинантную хромосому, может быть получена с использованием описанной выше первой слитой клетки.
Первая слитая клетка может включать две или более хромосомы-мишени.
Две или более хромосомы-мишени могут включать первую хромосому-мишень и вторую хромосому-мишень.
Здесь первая хромосома-мишень может включать в себя один или более RRS.
Здесь вторая хромосома-мишень может включать один или более RRS.
Здесь один или более RRS, включенных в первую хромосому-мишень, могут быть такими же или отличаться от одного или более RRS, включенных во вторую хромосому-мишень.
Здесь один или более RRS, включенных в первую хромосому-мишень, могут быть спарены с одним или более RRS, включенными во вторую хромосому-мишень.
Здесь RRS может быть известной последовательностью. В одном примере RRS может быть выбран из вариантов LoxP, приведенных в Таблице 1.
Здесь пара может быть парой из двух или более вариантов LoxP, и эта пара может распознаваться SSR.
В одном примере пара из двух или более вариантов LoxP может включать в себя Lox 71 и Lox 66.
В одном примере пара из двух или более вариантов LoxP может включать в себя Lox m2/71 и Lox m2/66.
В одном примере спаривание Lox m2/71 и Lox m2/66 может распознаваться SSR.
В одном примере спаривание Lox 71 и Lox 66 может распознаваться SSR.
Первая хромосома-мишень и вторая хромосома-мишень могут дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Искусственная рекомбинантная хромосома может включать один или более RRS.
Искусственная рекомбинантная хромосома может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
В одном примере варианта осуществления способ получения клетки, включающей искусственную рекомбинантную хромосому, может включать обработку первой слитой клетки SSR.
Описание первой слитой клетки такое же, как приведено выше.
Первая слитая клетка может включать две или более хромосомы-мишени.
Две или более хромосомы-мишени могут включать первую хромосому-мишень и вторую хромосому-мишень.
Здесь первая хромосома-мишень может включать в себя один или более RRS (первый RRS), первый фрагмент и первую часть.
Здесь вторая хромосома-мишень может включать в себя один или более RRS (второй RRS), второй фрагмент и вторую часть.
В одном примере первым RRS может быть один из Lox 71 и Lox 66. Здесь вторым RRS может быть другой из Lox 71 и Lox 66. Например, когда первым RRS является Lox 71, вторым RRS может быть Lox 66.
В другом примере первым RRS может быть один из Lox m2/71 и Lox m2/66. Здесь вторым RRS может быть другой из Lox m2/71 и Lox m2/66. Например, когда первым RRS является Lox m2/71, вторым RRS может быть Lox m2/66.
Здесь первый RRS может быть спарен со вторым RRS.
Здесь сайт, в котором спарены первый RRS и второй RRS, может распознаваться SSR.
Каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Обработка первой слитой клетки SSR может заключаться во введении или доставке SSR в первую слитую клетку в форме белка.
Здесь введение или доставка в форме белка может осуществляться электропорацией, микроинъекцией, транзиторным сжатием или сдавливанием клеток (например, как описано в [Lee, et al, (2012) Nano Lett.12, 6322-6327]), липид-опосредованной трансфекцией, наночастицами, липосомами, пептид-опосредованной доставкой или их комбинацией.
В качестве альтернативы, обработка первой слитой клетки SSR может заключаться во введении или доставке вектора, имеющего последовательность нуклеиновой кислоты, кодирующую SSR, в первую слитую клетку.
Здесь вектором может быть вирусный вектор или рекомбинантный вирусный вектор. Вирус может представлять собой ретровирус, лентивирус, аденовирус, аденоассоциированный вирус (AAV), вирус осповакцины, поксвирус или вирус простого герпеса, но настоящее изобретение этим не ограничивается.
Здесь введение или доставка вектора может заключаться в доставке вектора в исходную клетку, не являющуюся мишенью, с использованием известного метода трансфекции. Например, в способе трансфекции можно использовать метод вирусной трансфекции, метод реактивной трансфекции или метод физической трансфекции. В способе вирусной трансфекции можно использовать, например, лентивирус. В способе трансфекции с реагентом можно использовать, например, фосфат кальция, катионный липид, DEAE-декстран или полиэтиленимин (PEI). В методе физической трансфекции можно использовать, например, электропорацию. Кроме того, для трансфекции можно использовать липосомы, но настоящее изобретение этим не ограничивается.
SSR может индуцировать хромосомный обмен.
В одном примере SSR может представлять собой Cre-рекомбиназу. Аминокислотная последовательность Cre-рекомбиназы раскрыта в Таблице 3 ниже. Однако Cre-рекомбиназа, раскрытая в Таблице 3 ниже, является примером Cre-рекомбиназы для Lox 71 и Lox 66, но настоящее изобретение этим не ограничивается. Однако Cre-рекомбиназа, раскрытая в Таблице 3 ниже, является примером Cre-рекомбиназы для Lox m2/71 и Lox m2/66, но настоящее изобретение этим не ограничивается.
[Таблица 3]
Аминокислотные последовательности рекомбиназ Cre
Lox 66
Lox m2/66
Клетка, включающая искусственную рекомбинантную хромосому, полученную описанным выше способом, может включать по меньшей мере одну или более искусственных рекомбинантных хромосом.
Здесь одна или более искусственных рекомбинантных хромосом могут быть первой искусственной рекомбинантной хромосомой, включающей первый фрагмент и вторую часть. Здесь первая искусственная рекомбинантная хромосома может дополнительно включать первый RRS и/или второй RRS. В качестве альтернативы первая искусственная рекомбинантная хромосома может включать третий RRS. Третий RRS может представлять собой RRS, полученный путем рекомбинации первого RRS и второго RRS.
В качестве альтернативы, одна или более искусственных рекомбинантных хромосом могут быть второй искусственной рекомбинантной хромосомой, включающей второй фрагмент и первую часть. Здесь вторая искусственная рекомбинантная хромосома может дополнительно включать первый RRS и/или второй RRS. В качестве альтернативы вторая искусственная рекомбинантная хромосома может включать третий RRS. Третий RRS может представлять собой RRS, полученный путем рекомбинации первого RRS и второго RRS.
Здесь одна или более искусственных рекомбинантных хромосом могут дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
В другом примере варианта осуществления способ получения клетки, включающей искусственную рекомбинантную хромосому, может включать обработку первой слитой клетки SSR.
Описание первой слитой клетки такое же, как приведено выше.
Первая слитая клетка может включать две или более хромосомы-мишени.
Две или более хромосомы-мишени могут включать первую хромосому-мишень и вторую хромосому-мишень.
Здесь первая хромосома-мишень может включать в себя два или более RRS (первый RRS и второй RRS), первый фрагмент, первую часть и вторую часть.В одном примере первая хромосома-мишень может состоять из последовательности [первая часть] - [первый RRS] - [первый фрагмент] - [второй RRS] - [вторая часть].
Здесь вторая хромосома-мишень может включать два или более RRS (третий RRS и четвертый RRS), второй фрагмент, третью часть и четвертую часть. В одном примере вторая хромосома-мишень может состоять из последовательности [третья часть] - [третий RRS] - [второй фрагмент] - [четвертый RRS] - [четвертая часть].
В одном примере первым RRS может представлять собой один из Lox 71 и Lox 66. Здесь третий RRS или четвертый RRS может представлять собой другой из Lox 71 и Lox 66. Например, когда первым RRS является Lox 71, третьим RRS может быть Lox 66. В качестве альтернативы, когда первым RRS является Lox 71, четвертым RRS может быть Lox 66.
В другом примере вторым RRS может быть один из Lox m2/71 и Lox m2/66. Здесь третьим или четвертым RRS может быть другой из Lox m2/71 и Lox m2/66. Например, когда вторым RRS является Lox m2/71, третьим RRS может быть Lox m2/66. В качестве альтернативы, когда вторым RRS является Lox m2/71, четвертым RRS может быть Lox m2/66.
Здесь первый RRS может быть спарен с третьим RRS или четвертым RRS.
Здесь второй RRS может быть спарен с третьим RRS или четвертым RRS.
Например, первый RRS может быть спарен с третьим RRS, а второй RRS может быть спарен с четвертым RRS. В качестве альтернативы, первый RRS может быть спарен с четвертым RRS, а второй RRS может быть спарен с третьим RRS.
Здесь сайт, где первый RRS спарен с третьим RRS или четвертым RRS, может распознаваться SSR.
Здесь сайт, где второй RRS спарен с третьим RRS или четвертым RRS, может распознаваться SSR.
Каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Обработка первой слитой клетки SSR может заключаться во введении или доставке SSR в первую слитую клетку в форме белка или последовательности нуклеиновой кислоты, кодирующей SSR, в первую слитую клетку. Здесь описание введения или доставки такое, как приведено выше.
SSR может индуцировать хромосомный обмен.
В одном примере SSR может представлять собой Cre-рекомбиназу.
Клетка, включающая искусственную рекомбинантную хромосому, полученную описанным выше способом, может включать по меньшей мере одну или более искусственных рекомбинантных хромосом.
Здесь одна или более искусственных рекомбинантных хромосом могут быть первой искусственной рекомбинантной хромосомой, включающей третью часть, первый фрагмент и четвертую часть. Здесь первая искусственная рекомбинантная хромосома может дополнительно включать в себя первый RRS, второй RRS, третий RRS и/или четвертый RRS. В качестве альтернативы первая искусственная рекомбинантная хромосома может включать пятый RRS. Пятый RRS может быть RRS, полученным путем рекомбинации двух спаренных RRS из первого RRS, второго RRS, третьего RRS и четвертого RRS.
В качестве альтернативы, одна или более искусственных рекомбинантных хромосом могут представлять собой вторую искусственную рекомбинантную хромосому, включающую первую часть, второй фрагмент и вторую часть. Здесь вторая искусственная рекомбинантная хромосома может дополнительно включать в себя первый RRS, второй RRS, третий RRS и/или четвертый RRS. В качестве альтернативы вторая искусственная рекомбинантная хромосома может включать пятый RRS. Пятым RRS может быть RRS, полученный путем рекомбинации двух спаренных RRS из первого RRS, второго RRS, третьего RRS и четвертого RRS.
Здесь одна или более искусственных рекомбинантных хромосом могут дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Еще в одном примере варианта осуществления способ получения клетки, включающей искусственную рекомбинантную хромосому, может включать обработку первой слитой клетки SSR.
Описание первой слитой клетки такое же, как приведено выше.
Первая слитая клетка может включать две или более хромосомы-мишени.
Две или более хромосомы-мишени могут включать первую хромосому-мишень и вторую хромосому-мишень.
Здесь первая хромосома-мишень может включать в себя два или более RRS (первый RRS и второй RRS), первый фрагмент, первую часть и вторую часть. В одном примере первая хромосома-мишень может состоять из последовательности [первая часть] - [первый RRS] - [первый фрагмент] - [второй RRS] - [вторая часть].
Здесь первый фрагмент может дополнительно включать в себя третий RRS и четвертый RRS. В этом случае третий RRS может быть спарен с четвертым RRS.
Здесь вторая хромосома-мишень может включать два или более RRS (пятый RRS и шестой RRS), второй фрагмент, третью часть и четвертую часть. В одном примере вторая хромосома-мишень может состоять из последовательности [третья часть] - [пятый RRS] - [второй фрагмент] - [шестой RRS] - [четвертая часть].
Здесь второй фрагмент может дополнительно включать седьмой RRS и восьмой RRS. В этом случае седьмой RRS может быть спарен с восьмым RRS.
В одном примере первым RRS может представлять собой один из Lox 71 и Lox 66. Здесь шестым RRS может представлять собой другой из Lox 71 и Lox 66. Например, когда первым RRS является Lox 71, шестым RRS может быть Lox 66.
В другом примере вторым RRS может быть один из Lox m2/71 и Lox m2/66. Здесь пятым RRS может быть другой из Lox m2/71 и Lox m2/66. Например, когда вторым RRS является Lox m2/71, пятым RRS может быть Lox m2/66.
Здесь первый RRS может быть спарен с шестым RRS.
Здесь второй RRS может быть спарен с пятым RRS.
Здесь сайт, в котором спарены первый RRS и шестой RRS, может распознаваться SSR.
Здесь сайт, в котором спарены второй RRS и пятый RRS, может распознаваться SSR.
Каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Обработка первой слитой клетки SSR может заключаться во введении или доставке SSR в первую слитую клетку в форме белка или вектора, включающего последовательность нуклеиновой кислоты, кодирующую ее. Здесь описание введения или доставки такое, как приведено выше.
SSR может индуцировать хромосомный обмен.
В одном примере SSR может представлять собой Cre-рекомбиназу.
Клетка, включающая искусственную рекомбинантную хромосому, полученную описанным выше способом, может включать по меньшей мере одну или более искусственных рекомбинантных хромосом.
Здесь одна или более искусственных рекомбинантных хромосом может быть первой искусственной рекомбинантной хромосомой, включающей третью часть, инвертированный первый фрагмент и четвертую часть. Здесь инвертированный первый фрагмент может быть получен путем инверсии первого фрагмента, включенного в первую хромосому-мишень. Здесь первая искусственная рекомбинантная хромосома может дополнительно включать в себя первый RRS, второй RRS, пятый RRS и/или шестой RRS. В качестве альтернативы первая искусственная рекомбинантная хромосома может дополнительно включать девятый RRS. Девятым RRS может быть RRS, полученный путем рекомбинации двух спаренных RRS из первого RRS, второго RRS, пятого RRS и шестого RRS.
В качестве альтернативы здесь одна или более искусственных рекомбинантных хромосом может быть второй искусственной рекомбинантной хромосомой, включающей первую часть, инвертированный второй фрагмент и вторую часть. Здесь инвертированный второй фрагмент может быть получен путем инверсии второго фрагмента, включенного во вторую хромосому-мишень. Здесь вторая искусственная рекомбинантная хромосома может дополнительно включать в себя первый RRS, второй RRS, пятый RRS и/или шестой RRS. В качестве альтернативы вторая искусственная рекомбинантная хромосома может дополнительно включать девятый RRS. Девятым RRS может быть RRS, полученный путем рекомбинации двух спаренных RRS из первого RRS, второго RRS, пятого RRS и шестого RRS.
Здесь одна или более искусственных рекомбинантных хромосом могут дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
В клетке, включающей первую искусственную рекомбинантную хромосому, ген, включенный в инвертированный первый фрагмент, может не экспрессироваться как белок. В качестве альтернативы, клетка, включающая первую искусственную рекомбинантную хромосому, может иметь другой профиль экспрессии гена, включенного в первый фрагмент, по сравнению с первой слитой клеткой, включающей первую хромосому-мишень.
В клетке, включающей вторую искусственную рекомбинантную хромосому, ген, включенный во второй инвертированный фрагмент, может не экспрессироваться как белок. В качестве альтернативы, клетка, включенная во вторую искусственную рекомбинантную хромосому, может иметь другой профиль экспрессии гена, включенного во второй фрагмент, по сравнению с первой слитой клеткой, включающей вторую хромосому-мишень.
В клетке, включающей искусственную рекомбинантную хромосому, полученную описанным выше способом, можно контролировать экспрессию конкретного гена при определенных условиях.
Конкретным условием может быть обработка клетки, включающей искусственную рекомбинантную хромосому, с помощью SSR. Здесь конкретным геном может быть ген, включенный в искусственную рекомбинантную хромосому.
В одном примере в клетке, содержащей первую искусственную рекомбинантную хромосому, конкретный ген может присутствовать в инвертированном первом фрагменте первой искусственной рекомбинантной хромосомы. Здесь конкретный ген может присутствовать в инвертированной форме. В этом случае клетка, содержащая первую искусственную рекомбинантную хромосому, может быть обработана SSR. В обработанной SSR клетке, включающей первую искусственную рекомбинантную хромосому, инвертированный первый фрагмент может быть реинвертирован. Реинверсия может быть вызвана спариванием третьего RRS и четвертого RRS, включенных в первый фрагмент, и SSR, распознающей это. Клетка, включающая первую искусственную рекомбинантную хромосому, включающую реинвертированный первый фрагмент, может позволить конкретному гену экспрессировать белок.
В другом примере в клетке, содержащей вторую искусственную рекомбинантную хромосому, конкретный ген может присутствовать во втором инвертированном фрагменте второй искусственной рекомбинантной хромосомы. Здесь конкретный ген может присутствовать в инвертированной форме. В этом случае клетка, содержащая вторую искусственную рекомбинантную хромосому, может быть обработана SSR. В обработанной SSR клетке, содержащей вторую искусственную рекомбинантную хромосому, инвертированный второй фрагмент может быть реинвертирован. Реинверсия может быть вызвана спариванием седьмого RRS и восьмого RRS, включенных во второй фрагмент, и SSR, распознающей это. Клетка, включающая вторую искусственную рекомбинантную хромосому, включающую реинвертированный второй фрагмент, может позволить конкретному гену экспрессировать белок.
Кроме того, животное, включающее клетку, включающую искусственную рекомбинантную хромосому, полученную описанным выше способом, может регулировать экспрессию конкретного гена. Здесь конкретным условием может быть введение или доставка SSR животному.
Кроме того, животное, полученное с использованием клетки, включающей искусственную рекомбинантную хромосому, полученную описанным выше способом, может регулировать экспрессию конкретного гена. Здесь конкретным условием может быть введение или доставка SSR животному.
iv-2) Хромосомный обмен, опосредованный ASCE-HR
Согласно раскрытому в настоящем описании примеру варианта осуществления может быть предоставлена клетка, включающая искусственную рекомбинантную хромосому, с использованием метода обмена хромосом, опосредованного ASCE-HR, и способ ее получения.
Клетка, включающая искусственную рекомбинантную хромосому, может быть получена с использованием описанной выше первой слитой клетки.
Первая слитая клетка может включать две или более хромосомы-мишени.
Две или более хромосомы-мишени могут включать первую хромосому-мишень и вторую хромосому-мишень.
Здесь первая хромосома-мишень может включать одну или более ASCE.
Здесь вторая хромосома-мишень может включать одну или более ASCE.
Здесь одна или более ASCE, включенных в первую хромосому-мишень, могут быть такими же или отличаться от тех, которые включены во вторую хромосому-мишень.
Здесь одна или более ASCE, включенных в первую хромосому-мишень, могут образовывать комплементарные связи с теми, которые включены во вторую хромосому-мишень.
Здесь одна или более ASCE, включенных в первую хромосому-мишень, и одна или более ASCE, включенных во вторую хромосому-мишень, могут быть нуклеиновыми кислотами, включающими нуклеотиды, имеющие по меньшей мере 80% гомологии или более.
Здесь каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
В одном примере варианта осуществления способ получения клетки, включающей искусственную рекомбинантную хромосому, может включать обработку первой слитой клетки фактором, индуцирующим гомологичную рекомбинацию.
Описание первой слитой клетки такое же, как приведено выше.
Первая слитая клетка может включать две или более хромосомы-мишени.
Две или более хромосомы-мишени могут быть первой хромосомой-мишенью и второй хромосомой-мишенью.
Здесь первая хромосома-мишень может включать в себя одну или более ASCE (первая ASCE), первый фрагмент и первую часть.
Здесь вторая хромосома-мишень может включать в себя одну или более ASCE (вторая ASCE), второй фрагмент и вторую часть.
Здесь первая ASCE может образовывать комплементарные связи со второй ASCE.
Здесь первая ASCE и вторая ASCE могут быть нуклеиновыми кислотами, включающими нуклеотиды, имеющие по меньшей мере 80% гомологии или более.
Здесь каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Фактор, индуцирующий гомологичную рекомбинацию, может быть фактором, индуцирующим двухцепочечный разрыв (DSB) первой хромосомы-мишени и/или второй хромосомы-мишени.
Фактор, индуцирующий гомологичную рекомбинацию, может быть фактором, индуцирующим одноцепоченый разрыв (SSB) первой хромосомы-мишени и/или второй хромосомы-мишени.
Здесь фактором, вызывающим гомологичную рекомбинацию, может быть кластоген (фактор, который вызывает хромосомную аномалию). Кластогеном может быть ионизирующее излучение, УФ, рентгеновские лучи, гамма-лучи, активные формы кислорода или конкретное химическое вещество. Конкретным химическим веществом может быть, например, блеомицин, гидроксимочевина, камптотецин, 4-нитрохинолин-1-оксид (4-NQO), цисплатин или метилирующий агент, такой как EMS или MMS, но настоящее изобретение этим не ограничивается.
Здесь фактором, индуцирующим гомологичную рекомбинацию, могут быть сконструированные нуклеазы. Сконструированные нуклеазы могут быть нуклеазами «цинковые пальцы» (ZFN), эффекторными нуклеазами, подобными активаторам транскрипции (TALEN), или короткие палиндромные повторы, регулярно расположенные группами/CRISPR-ассоциированным белком (CRISPR/Cas).
Здесь сконструированные нуклеазы могут быть введены или доставлены в первую слитую клетку в форме белка или вектора, включающего последовательность нуклеиновой кислоты, кодирующую их. Введение или доставка в форме белка может осуществляться электропорацией, микроинъекцией, транзиторным сжатием или сдавливанием клеток (например, как описано в [Lee, et al, (2012) Nano Lett.12, 6322-6327]), липид-опосредованной трансфекцией, наночастицами, липосомами, пептид-опосредованной доставкой или их комбинацией. Вектор может быть вирусным вектором или рекомбинантным вирусным вектором. Вирус может представлять собой ретровирус, лентивирус, аденовирус, аденоассоциированный вирус (AAV), вирус осповакцины, поксвирус или вирус простого герпеса, но настоящее изобретение этим не ограничивается. Здесь введение или доставка в форме вектора может осуществляться в исходную клетку, не являющуюся мишенью, с использованием известного метода трансфекции. Например, метод трансфекции может представлять собой метод вирусной трансфекции, метод трансфекции с реагентом или метод физической трансфекции. В способе вирусной трансфекции можно использовать, например, лентивирус. В способе трансфекции с реагентом можно использовать, например, фосфат кальция, катионный липид, DEAE-декстран или PEI. В методе физической трансфекции можно использовать, например, электропорацию. Кроме того, для трансфекции можно использовать липосомы, но настоящее изобретение этим не ограничивается.
Гомологичная рекомбинация с использованием DSB или SSB может индуцировать хромосомный обмен.
Клетка, включающая искусственную рекомбинантную хромосому, полученную описанным выше способом, может включать по меньшей мере одну или более искусственных рекомбинантных хромосом.
Здесь одна или более искусственных рекомбинантных хромосом может быть первой искусственной рекомбинантной хромосомой, включающей первый фрагмент и вторую часть. Здесь первая искусственная рекомбинантная хромосома может дополнительно включать первую ASCE и/или вторую ASCE. В качестве альтернативы первая искусственная рекомбинантная хромосома может включать третью ASCE. Третьей ASCE может быть ASCE, полученная путем рекомбинации первой ASCE и второй ASCE.
В качестве альтернативы здесь одна или более искусственных рекомбинантных хромосом могут быть второй искусственной рекомбинантной хромосомой, включающей второй фрагмент и первую часть. Здесь вторая искусственная рекомбинантная хромосома может дополнительно включать первую ASCE и/или вторую ASCE. В качестве альтернативы вторая искусственная рекомбинантная хромосома может включать третью ASCE. Третьей ASCE может быть ASCE, полученная путем рекомбинации первой ASCE и второй ASCE.
Здесь одна или более искусственных рекомбинантных хромосом могут дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
В другом примере варианта осуществления способ получения клетки, включающей искусственную рекомбинантную хромосому, может включать обработку первой слитой клетки фактором, индуцирующим гомологичную рекомбинацию.
Описание первой слитой клетки такое же, как приведено выше.
Первая слитая клетка может включать две или более хромосомы-мишени.
Две или более хромосомы-мишени могут включать первую хромосому-мишень и вторую хромосому-мишень.
Здесь первая хромосома-мишень может включать две или более ASCE (первая ASCE и вторая ASCE), первый фрагмент, первую часть и вторую часть. В одном примере первая хромосома-мишень может состоять из последовательности [первая часть] - [первая ASCE] - [первый фрагмент] - [вторая ASCE] - [вторая часть].
Здесь вторая хромосома-мишень может включать две или более ASCE (третья ASCE и четвертая ASCE), второй фрагмент, третью часть и четвертую часть. В одном примере вторая хромосома-мишень может состоять из последовательности [третья часть] - [третья ASCE] - [второй фрагмент] - [четвертая ASCE] - [четвертая часть].
Здесь первая ASCE может образовывать комплементарные связи с третьей ASCE или четвертой ASCE. В этом случае первой ASCE может быть нуклеиновая кислота, включающая нуклеотиды, имеющие по меньшей мере 80% гомологии или более с третьей ASCE или четвертой ASCE.
Здесь вторая ASCE может образовывать комплементарные связи с третьей ASCE или четвертой ASCE. В этом случае вторая ASCE может включать нуклеиновую кислоту, включающую нуклеотиды, имеющие по меньшей мере 80% гомологии или более с третьей ASCE или четвертой ASCE.
Здесь каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Фактор, индуцирующий гомологичную рекомбинацию, может представлять собой фактор, индуцирующий DSB первой хромосомы-мишени и/или второй хромосомы-мишени.
Фактор, индуцирующий гомологичную рекомбинацию, может представлять собой фактор, индуцирующий SSB первой хромосомы-мишени и/или второй хромосомы-мишени.
Здесь фактором, вызывающим гомологичную рекомбинацию, может быть кластоген (фактор, который вызывает хромосомную аномалию). Кластогеном может быть ионизирующее излучение, УФ, рентгеновские лучи, гамма-лучи, активные формы кислорода или конкретное химическое вещество. Конкретным химическим веществом может быть, например, блеомицин, гидроксимочевина, камптотецин, 4-нитрохинолин-1-оксид (4-NQO), цисплатин или метилирующий агент, такой как EMS или MMS, но настоящее изобретение этим не ограничивается.
Здесь фактором, индуцирующим гомологичную рекомбинацию, могут быть сконструированные нуклеазы. Сконструированные нуклеазы могут представлять собой ZFN, TALEN или CRISPR/Cas.
Здесь сконструированные нуклеазы могут быть введены или доставлены в первую слитую клетку в форме белка или вектора, включающего последовательность нуклеиновой кислоты, кодирующую их. Описание индукции или доставки такое, как приведено выше.
Гомологичная рекомбинация с использованием DSB или SSB может индуцировать хромосомный обмен.
Клетка, включающая искусственную рекомбинантную хромосому, полученную описанным выше способом, может включать по меньшей мере одну или более искусственных рекомбинантных хромосом.
Здесь одна или более искусственных рекомбинантных хромосом может быть первой искусственной рекомбинантной хромосомой, включающей третью часть, первый фрагмент и четвертую часть. Здесь первая искусственная рекомбинантная хромосома может дополнительно включать первую ASCE, вторую ASCE, третью ASCE и/или четвертую ASCE. В качестве альтернативы первая искусственная рекомбинантная хромосома может включать пятую ASCE. Пятой ASCE может быть ASCE, полученная путем рекомбинации двух комплементарно связанных ASCE из первой ASCE, второй ASCE, третьей ASCE и четвертой ASCE.
В качестве альтернативы, здесь одна или более искусственных рекомбинантных хромосом может представлять собой вторую искусственную рекомбинантную хромосому, включающую первую часть, второй фрагмент и вторую часть. Здесь вторая искусственная рекомбинантная хромосома может дополнительно включать первую ASCE, вторую ASCE, третью ASCE и/или четвертую ASCE. В качестве альтернативы вторая искусственная рекомбинантная хромосома может включать пятую ASCE. Пятой ASCE может быть ASCE, полученная путем рекомбинации двух комплементарно связанных ASCE из первой ASCE, второй ASCE, третьей ASCE и четвертой ASCE.
Здесь одна или более искусственных рекомбинантных хромосом могут дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Еще в одном примере варианта осуществления способ получения клетки, включающей искусственную рекомбинантную хромосому, может включать обработку первой слитой клетки фактором, индуцирующим гомологичную рекомбинацию.
Описание первой слитой клетки такое же, как приведено выше.
Первая слитая клетка может включать две или более хромосомы-мишени.
Две или более хромосомы-мишени могут включать первую хромосому-мишень и вторую хромосому-мишень.
Здесь первая хромосома-мишень может включать две или более ASCE (первая ASCE и вторая ASCE), первый фрагмент, первую часть и вторую часть. В одном примере первая хромосома-мишень может состоять из последовательности [первая часть] - [первая ASCE] - [первый фрагмент] - [вторая ASCE] - [вторая часть].
Здесь первый фрагмент может дополнительно включать в себя третью ASCE и четвертую ASCE. В этом случае третья ASCE может образовывать комплементарные связи с четвертой ASCE.
Здесь вторая хромосома-мишень может включать две или более ASCE (пятая ASCE и шестая ASCE), второй фрагмент, третью часть и четвертую часть. В одном примере вторая хромосома-мишень может состоять из последовательности [третья часть] - [пятая ASCE] - [второй фрагмент] - [шестая ASCE] - [четвертая часть].
Здесь второй фрагмент может дополнительно включать седьмую ASCE и восьмую ASCE. В этом случае седьмая ASCE может образовывать комплементарные связи с восьмой ASCE.
Первая ASCE может образовывать комплементарные связи с шестой ASCE. В этом случае первая ASCE может быть нуклеиновой кислотой, имеющей нуклеотиды, имеющие по меньшей мере 80% гомологии или более с шестой ASCE.
Вторая ASCE может образовывать комплементарные связи с пятой ASCE. В этом случае вторая ASCE может быть нуклеиновой кислотой, имеющей нуклеотиды, по меньшей мере, имеющие по меньшей мере 80% гомологии или более с пятой ASCE.
Каждая из первой хромосомы-мишени и второй хромосомы-мишени может дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
Фактор, индуцирующий гомологичную рекомбинацию, может представлять собой фактор, индуцирующий DSB первой хромосомы-мишени и/или второй хромосомы-мишени.
Фактор, индуцирующий гомологичную рекомбинацию, может представлять собой фактор, индуцирующий SSB первой хромосомы-мишени и/или второй хромосомы-мишени.
Здесь фактором, индуцирующим гомологичную рекомбинацию, может быть кластоген (фактор, который вызывает хромосомную аномалию). Кластогеном может быть ионизирующее излучение, УФ, рентгеновские лучи, гамма-лучи, активные формы кислорода или конкретное химическое вещество. Конкретным химическим веществом может быть, например, блеомицин, гидроксимочевина, камптотецин, 4-нитрохинолин-1-оксид (4-NQO), цисплатин или метилирующий агент, такой как EMS или MMS, но настоящее изобретение этим не ограничивается.
Здесь фактором, индуцирующим гомологичную рекомбинацию, могут быть сконструированные нуклеазы. Сконструированные нуклеазы могут представлять собой ZFN, TALEN или CRISPR/Cas.
Здесь сконструированные нуклеазы могут быть введены или доставлены в первую слитую клетку в форме белка или вектора, включающего последовательность нуклеиновой кислоты, кодирующую их. Описание индукции или доставки такое, как приведено выше.
Гомологичная рекомбинация с использованием DSB или SSB может индуцировать хромосомный обмен.
Клетка, включающая искусственную рекомбинантную хромосому, полученную описанным выше способом, может включать по меньшей мере одну или более искусственных рекомбинантных хромосом.
Здесь одна или более искусственных рекомбинантных хромосом может представлять собой первую искусственную рекомбинантную хромосому, включающую третью часть, инвертированный первый фрагмент и четвертую часть. Здесь инвертированный первый фрагмент может быть получен путем инверсии первого фрагмента, включенного в первую хромосому-мишень. Здесь первая искусственная рекомбинантная хромосома может дополнительно включать первую ASCE, вторую ASCE, пятую ASCE и/или шестую ASCE. В качестве альтернативы первая искусственная рекомбинантная хромосома может дополнительно включать девятую ASCE. Девятой ASCE может быть ASCE, полученная путем рекомбинации двух спаренных ASCE из первой ASCE, второй ASCE, пятой ASCE и шестой ASCE.
В качестве альтернативы здесь одна или более искусственных рекомбинантных хромосом может представлять собой вторую искусственную рекомбинантную хромосому, включающую первую часть, инвертированный второй фрагмент и вторую часть. Здесь инвертированный второй фрагмент может быть получен путем инверсии второго фрагмента, включенного во вторую хромосому-мишень. Здесь вторая искусственная рекомбинантная хромосома может дополнительно включать первую ASCE, вторую ASCE, пятую ASCE и/или шестую ASCE. В качестве альтернативы вторая искусственная рекомбинантная хромосома может дополнительно включать девятую ASCE. Девятой ASCE может быть ASCE, полученная путем рекомбинации двух спаренных ASCE из первой ASCE, второй ASCE, пятой ASCE и шестой ASCE.
Здесь одна или более искусственных рекомбинантных хромосом могут дополнительно включать ген маркера селекции и/или последовательность ITR транспозона.
В клетке, содержащей первую искусственную рекомбинантную хромосому, ген, включенный в инвертированный первый фрагмент, может не экспрессироваться как белок. В качестве альтернативы, клетка, включающая первую искусственную рекомбинантную хромосому, может иметь другой профиль экспрессии гена, включенного в первый фрагмент, по сравнению с первой слитой клеткой, включающей первую хромосому-мишень.
В клетке, содержащей вторую искусственную рекомбинантную хромосому, ген, включенный во второй инвертированный фрагмент, может не экспрессироваться как белок. В качестве альтернативы, клетка, включенная во вторую искусственную рекомбинантную хромосому, может иметь другой профиль экспрессии гена, включенного во второй фрагмент, по сравнению с первой слитой клеткой, включающей вторую хромосому-мишень.
В клетке, включающей искусственную рекомбинантную хромосому, полученную описанным выше способом, можно контролировать экспрессию конкретного гена при определенных условиях.
Конкретным условием может быть обработка клетки, включающей искусственную рекомбинантную хромосому, фактором, индуцирующим гомологичную рекомбинацию. Здесь конкретным геном может быть ген, включенный в искусственную рекомбинантную хромосому.
В одном примере в клетке, содержащей первую искусственную рекомбинантную хромосому, конкретный ген может присутствовать в инвертированном первом фрагменте первой искусственной рекомбинантной хромосомы. Здесь конкретный ген может присутствовать в инвертированной форме. В этом случае клетка, содержащая первую искусственную рекомбинантную хромосому, может быть обработана фактором, индуцирующим гомологичную рекомбинацию. В клетке, содержащей первую искусственную рекомбинантную хромосому, обработанную фактором, индуцирующим гомологичную рекомбинацию, инвертированный первый фрагмент может быть реинвертирован. Реинверсия может быть вызвана комплементарным связыванием третьей ASCE и четвертой ASCE, включенных в первый фрагмент. В клетке, содержащей первую искусственную рекомбинантную хромосому, включающую реинвертированный первый фрагмент, специфический ген может быть экспрессирован с образованием белка.
В другом примере в клетке, содержащей вторую искусственную рекомбинантную хромосому, конкретный ген может присутствовать во втором инвертированном фрагменте второй искусственной рекомбинантной хромосомы. Здесь конкретный ген может присутствовать в инвертированной форме. В этом случае клетка, содержащая вторую искусственную рекомбинантную хромосому, может быть обработана фактором, индуцирующим гомологичную рекомбинацию. В клетке, содержащей вторую искусственную рекомбинантную хромосому, обработанную фактором, индуцирующим гомологичную рекомбинацию, инвертированный второй фрагмент может быть реинвертирован. Реинверсия может быть вызвана комплементарным связыванием седьмой ASCE и восьмой ASCE, включенных во второй фрагмент. В клетке, содержащей вторую искусственную рекомбинантную хромосому, включающую реинвертированный второй фрагмент, специфический ген может быть экспрессирован с образованием белка.
Кроме того, у животного, включающего клетку, включающую искусственную рекомбинантную хромосому, полученную описанным выше способом, можно контролировать экспрессию конкретного гена. В данном случае конкретное условие может заключаться во введении или доставке фактора, вызывающего гомологичную рекомбинацию, животному.
Кроме того, у животного, полученного с использованием клетки, включающей искусственную рекомбинантную хромосому, полученную описанным выше способом, можно контролировать экспрессию конкретного гена. Здесь конкретным условием может быть индукция или доставка фактора, индуцирующего гомологичную рекомбинацию, животному.
Раскрытый в настоящем описании способ получения искусственной рекомбинантной хромосомы может называться технологией искусственного межвидового обмена хромосомными сегментами (AiCE). AiCE предназначена для обмена первого фрагмента первой хромосомы-мишени на второй фрагмент второй хромосомы-мишени для формирования искусственной рекомбинантной хромосомы. AiCE предназначена для обмена первого фрагмента первой хромосомы-мишени на третий фрагмент второй хромосомы-мишени и обмена второго фрагмента первой хромосомы-мишени на четвертый фрагмент третьей хромосомы-мишени для образования искусственной рекомбинантной хромосомы. Здесь получение искусственной рекомбинантной хромосомы не ограничивается количеством фрагментов. Например, первый фрагмент первой хромосомы-мишени, второй фрагмент второй хромосомы-мишени и третий фрагмент третьей хромосомы-мишени могут быть использованы для образования искусственной рекомбинантной хромосомы.Например, первый фрагмент первой хромосомы-мишени, второй фрагмент второй хромосомы-мишени, третий фрагмент третьей хромосомы-мишени и n-ый фрагмент хромосомы-мишени могут быть использованы для образования искусственной рекомбинантной хромосомы.
iv-3) Удаление составляющего элемента для рекомбинации
В другом раскрытом в настоящем описании аспекте клетка, включающая искусственную рекомбинантную хромосому, и способ ее получения могут дополнительно включать удаление составляющего элемента для рекомбинации (ФИГ. 20).
В способе получения клетки, включающей искусственную рекомбинантную хромосому, может использоваться метод хромосомного обмена, опосредованный RRS-SSR, или метод хромосомного обмена, опосредованный ASCE-HR.
Описания метода обмена хромосом, опосредованного RRS-SSR, и метода обмена хромосом, опосредованного ASCE-HR, приведены выше.
Способ получения клетки, включающей искусственную рекомбинантную хромосому, может дополнительно включать удаление составляющего элемента для рекомбинации.
Здесь составляющим элементом для рекомбинации может быть RRS или ASCE.
Здесь составляющий элемент для рекомбинации может быть включен в искусственную рекомбинантную хромосому.
Удаление составляющего элемента для рекомбинации может использовать систему транспозона. Система транспозона может использовать метод, известный в данной области. В качестве известного метода можно сделать ссылки на Fraser, MJ et al. («Acquisition of Host Cell DNA Sequences by Baculoviruses: Relationship Between Host DNA Insertions and FP Mutants of Autographa californica and Galleria mellonella Nuclear Polyhedrosis Viruses,» 1983, Journal of Virology. 47 (2): 287-300.); Sarkar, A. et al. («Molecular evolutionary analysis of the widespread piggyBac transposon family and related «domesticated» sequences» 2003, Molecular Genetics and Genomics. 270 (2): 173-180); Bouallègue, M et al. («Molecular Evolution of piggyBac Superfamily: From Selfishness to Domestication» 2017, Genome Biology and Evolution. 9 (2): 323-339); Grabundzija I et al. («Comparative analysis of transposable element vector systems in human cells» 2010, Mol. Ther. 18 (6): 1200-1209); Cadiñanos, J and Bradley, A («Generation of an inducible and optimized piggyBac transposon system» 2007, Nucleic Acids Research. 35 (12): e87); Izsvák Z and Ivics Z («Sleeping beauty transposition: biology and applications for molecular therapy» 2004, Mol. Ther. 9 (2): 147-156); Mátés L et al. («Molecular evolution of a novel hyperactive Sleeping Beauty transposase enables robust stable gene transfer in vertebrates» 2009, Nat. Genet. 41 (6): 753-761); and Yusa, K. et al. («A hyperactive piggyBac transposase for mammalian applications» 2011, Proceedings of the National Academy of Sciences. 108 (4): 1531-1536), но настоящее изобретение этим не ограничивается.
Клетка, включающая искусственную рекомбинантную хромосому, полученную описанным выше способом (способ, включающий удаление составляющего элемента для рекомбинации), может включать по меньшей мере одну или более искусственных рекомбинантных хромосом, которые не включают составляющий элемент для рекомбинации.
Здесь клетка, включающая искусственную рекомбинантную хромосому, может включать по меньшей мере одну или более искусственных рекомбинантных хромосом, которые не включают RRS.
Здесь клетка, включающая искусственную рекомбинантную хромосому, может включать по меньшей мере одну или более искусственных рекомбинантных хромосом, которые не включают ASCE.
В дальнейшем для удобства описания искусственная рекомбинантная хромосома, которая не включает составляющий элемент для рекомбинации, описана как конечная искусственная рекомбинантная хромосома.
В одном примере варианта осуществления способ получения клетки, включающей искусственную рекомбинантную хромосому, может включать:
a) обработку первой слитой клетки SSR; и
b) обработку клетки (второй слитой клетки), образованной на стадии а), транспозазой или нуклеиновой кислотой, кодирующей ее.
В другом примере варианта осуществления способ получения клетки, включающей искусственную рекомбинантную хромосому, может включать:
а) обработку первой слитой клетки фактором, индуцирующим гомологичную рекомбинацию; и
b) обработку клетки (второй слитой клетки), образованной на стадии а), транспозазой или нуклеиновой кислотой, кодирующей ее.
Описание а) обработки первой слитой клетки SSR и а) обработки первой слитой клетки, образованной на стадии а), фактором, индуцирующим гомологичную рекомбинацию, аналогично описанию в iv-1 и iv-2.
Клетка (вторая слитая клетка), полученная на стадии а), может представлять собой клетку, включающую искусственную рекомбинантную хромосому.
Здесь искусственная рекомбинантная хромосома может представлять собой искусственную рекомбинантную хромосому, включающую по меньшей мере один или более RRS или ASCE.
Здесь искусственная рекомбинантная хромосома может включать по меньшей мере одну или более последовательностей ITR транспозона.
Здесь искусственная рекомбинантная хромосома может дополнительно включать ген маркера селекции.
Вторая слитая клетка может включать одну или более искусственных рекомбинантных хромосом, включающих по меньшей мере один или более RRS или ASCE.
Вторая слитая клетка может включать одну или более искусственных рекомбинантных хромосом, включающих по меньшей мере одну или более последовательностей ITR транспозона.
Транспозаза может представлять собой транспозазу PiggyBac (транспозаза PB) или транспозазу Sleeping Beauty (транспозаза SB).
Здесь аминокислотная последовательность транспозазы PB раскрыта в Таблице 4 ниже. Однако транспозаза PB, раскрытая в Таблице 4 ниже, может быть представлена в качестве примера, но настоящее изобретение этим не ограничивается.
[Таблица 4]
Аминокислотные последовательности транспозаз PiggyBac
Обработка транспозазой или нуклеиновой кислотой, кодирующей ее, может заключаться во введении или доставке в форме белка или вектора, включающего последовательность нуклеиновой кислоты, кодирующую ее. Здесь описание введения или доставки такое, как приведено выше.
Клетка, включающая искусственную рекомбинантную хромосому, полученную описанным выше способом, может включать по меньшей мере одну или более конечных искусственных рекомбинантных хромосом.
Здесь одна или более конечных искусственных рекомбинантных хромосом могут быть искусственными рекомбинантными хромосомами, которые не включают RRS.
Здесь одна или более конечных искусственных рекомбинантных хромосом могут быть искусственными рекомбинантными хромосомами, которые не включают ASCE.
В дальнейшем для удобства описания клетка, включающая одну или более конечных искусственных рекомбинантных хромосом, описывается как конечная рекомбинантная клетка.
В качестве примера способа получения клетки, включающей искусственную рекомбинантную хромосому с использованием слитой клетки, клетка, содержащая искусственную рекомбинантную хромосому, может быть получена обработкой слитой клетки, полученной слиянием клетки-мишени, включающей первую хромосому-мишень, и микроклетки, включающей вторую хромосому-мишень, с использованием Cre-рекомбиназы.
Здесь слитая клетка может включать первую хромосому-мишень и вторую хромосому-мишень.
Здесь первая хромосома-мишень может включать в себя первый RRS и второй RRS. Здесь один или более генов (описанных ниже как ген A для удобства описания) могут быть включены между первым RRS и вторым RRS.
Здесь вторая хромосома-мишень может включать третий RRS и четвертый RRS. Здесь один или более генов (описанных ниже как ген B для удобства описания) могут быть включены между третьим RRS и четвертым RRS.
Здесь ген А, включенный в первую хромосому-мишень, может быть геном, таким же или отличным от гена В, включенного во вторую хромосому-мишень.
Первый RRS, присутствующий в первой хромосоме-мишени, может быть спарен с третьим RRS, присутствующим во второй хромосоме-мишени, и второй RRS, присутствующий в первой хромосоме-мишени, может быть спарен с четвертым RRS, присутствующим во второй хромосоме-мишени.
В качестве альтернативы, первый RRS, присутствующий в первой хромосоме-мишени, может быть спарен с четвертым RRS, присутствующим во второй хромосоме-мишени, и второй RRS, присутствующий в первой хромосоме-мишени, может быть спарен с третьим RRS, присутствующим во второй хромосоме-мишени.
Спаривание может распознаваться Cre-рекомбиназой. В результате может быть индуцирована рекомбинация.
Путем рекомбинации с использованием спаривания и Cre-рекомбиназы может быть получена искусственная рекомбинантная хромосома.
Искусственная рекомбинантная хромосома может быть получена путем обмена гена A первой хромосомы-мишени на ген B.
В качестве альтернативы, искусственная рекомбинантная хромосома может быть получена путем обмена гена B второй хромосомы-мишени на ген A.
Клетку, включающую искусственную рекомбинантную хромосому, можно дополнительно обработать транспозазой.
Здесь обработка транспозазой может заключаться в удалении RRS, присутствующего в искусственной рекомбинантной хромосоме.
Описанные выше примеры являются просто примерами, и каждый составляющий элемент (хромосома-мишень, клетка-мишень, микроклетка, слитая клетка, искусственная рекомбинантная хромосома, рекомбиназа, клетка, имеющая искусственную рекомбинантную хромосому и т.д.) может быть модифицирован или изменен различными способами в зависимости от цели.
v) Методы селекции
Согласно раскрытому в настоящем описании аспекту, способ получения клетки, включающей одну или более искусственных рекомбинантных хромосом, может дополнительно включать способ селекции конкретной клетки.
Специфическая клетка может быть клеткой-мишенью, микроклеткой, первой слитой клеткой, второй слитой клеткой и/или конечной рекомбинантной клеткой.
Описания клетки-мишени, микроклетки, первой слитой клетки, второй слитой клетки и конечной рекомбинантной клетки приведены выше.
Метод селекции может быть дополнительно добавлен к вышеописанным i) - iv).
Метод селекции может заключаться в селекции конкретной клетки с использованием инвертированного гена.
Здесь инвертированный ген может быть инвертированным геном маркера селекции. Инвертированный ген маркера селекции может быть получен путем инверсии гена маркера селекции. Описание гена маркера селекции приведено выше.
Здесь конкретной клеткой может быть клетка-мишень, микроклетка, первая слитая клетка, вторая слитая клетка и/или конечная рекомбинантная клетка.
Согласно примеру варианта осуществления конкретная клетка может быть отселектирована реинвертированным геном устойчивости к антибиотикам.
Геном устойчивости к антибиотику может быть один или более из гена устойчивости к гигромицину, гена устойчивости к неомицину, гена устойчивости к канамицину, гена устойчивости к бластицидину, гена устойчивости к зеоцину и гена puroΔTK, но настоящее изобретение не ограничивается этим.
Например, когда селектируется клетка-мишень, включающая в себя хромосому-мишень со встроенной донорной ДНК, донорная ДНК может включать инвертированный ген устойчивости к антибиотику и FRT. Когда клетка-мишень, включающая хромосому-мишень со встроенной донорной ДНК, обрабатывается рекомбиназой, то есть флиппазой (FLP), инвертированный ген устойчивости к антибиотику может быть реинвертирован. В результате реинвертированный ген устойчивости к антибиотику может нормально экспрессироваться, и клетка-мишень, включающая хромосому-мишень со встроенной донорной ДНК, может быть отселектирована из обработанных FLP клеток путем обработки антибиотиком.
Согласно другому примеру варианта осуществления конкретная клетка может быть отселектирована с помощью реинвертированного гена флуоресцентного белка.
Геном флуоресцентного белка может быть один или более из гена GFP, гена YFP, гена RFP и гена mCherry, но настоящее изобретение этим не ограничивается.
Например, когда отбирают клетку-мишень, включающую в себя хромосому-мишень со встроенной донорной ДНК, донорная ДНК может включать в себя инвертированный ген GFP и FRT. Когда клетка-мишень, включающая хромосому-мишень со встроенной донорной ДНК, обрабатывается рекомбиназой, то есть флиппазой (FLP), инвертированный ген GFP может быть реинвертирован. В результате реинвертированный ген GFP может нормально экспрессироваться, и клетка-мишень, включающая хромосому-мишень со встроенной донорной ДНК, может быть отселектирована из обработанных FLP клеток посредством детектирования флуоресцентного белка.
Согласно еще одному примеру варианта осуществления конкретная клетка может быть отселектирована с помощью инвертированного гена, кодирующего флуоресцентный белок.
Ген, кодирующий флуоресцентный белок, может представлять собой один или более из гена GFP, гена YFP, гена RFP и гена mCherry, но настоящее изобретение этим не ограничивается.
Например, когда производят селекцию клетки-мишени, включающей в себя хромосому-мишень со встроенной донорной ДНК, донорная ДНК может включать ген mCherry и FRT. Когда клетка-мишень, включающая хромосому-мишень со встроенной донорной ДНК, обрабатывается рекомбиназой, то есть флиппазой (FLP), ген mCherry может быть инвертирован. В результате инвертированный ген mCherry не может нормально экспрессироваться, и клетка-мишень, включающая в себя хромосому-мишень со встроенной донорной ДНК, может быть отселектирована из обработанных FLP клеток посредством детектирования флуоресцентного белка.
Метод селекции может заключаться в отборе конкретной клетки с использованием маркера селекции.
Здесь маркер селекции может быть геном маркера селекции. Описание гена маркера селекции приведено выше.
Здесь конкретной клеткой может быть клетка-мишень, микроклетка, первая слитая клетка, вторая слитая клетка и/или конечная рекомбинантная клетка.
Согласно примеру варианта осуществления конкретная клетка может быть отселектирована путем детектирования флуоресцентного белка.
Для детектирования флуоресцентного белка по меньшей мере одна или более хромосом, включенных в конкретную клетку, могут включать ген, кодирующий флуоресцентный белок.
Здесь по меньшей мере одна или более хромосом могут представлять собой хромосому-мишень, искусственную рекомбинантную хромосому и/или конечную рекомбинантную хромосому. Описания хромосомы-мишени, искусственной рекомбинантной хромосомы и конечной рекомбинантной хромосомы приведены выше.
Геном, кодирующим флуоресцентный белок, может быть один или более из гена GFP, гена YFP, гена RFP или гена mCherry, но настоящее изобретение этим не ограничивается.
Согласно примеру варианта осуществления из среды, в которой смешаны конкретные клетки и исходные клетки, не являющиеся мишенью, конкретные клетки могут быть отселектированы путем детектирования флуоресцентного белка.
Например, когда конкретная клетка является клеткой-мишенью, клетка-мишень может включать в себя хромосому-мишень, в которую вставлен ген GFP. В этом случае конкретная клетка, то есть клетка-мишень, может быть отселектирована от неспецифической исходной клетки посредством детектирования зеленой флуоресценции.
Из среды, в которой смешаны две или более конкретных клетки, одна конкретная представляющая интерес клетка может быть отселектирована путем детектирования флуоресцентного белка.
Здесь две или более клетки могут представлять собой две или более, выбранные из клетки-мишени, микроклетки, первой слитой клетки, второй слитой клетки и конечной рекомбинантной клетки.
Например, когда две или более конкретных клетки включают первую слитую клетку и вторую слитую клетку, вторая слитая клетка может включать искусственную рекомбинантную хромосому, в которую вставлен ген mCherry. Здесь одна конкретная представляющая интерес клетка, то есть вторая слитая клетка, может быть отселектирована из первой слитой клетки посредством детектирования флуоресценции mCherry.
Согласно другому примеру варианта осуществления конкретная клетка может быть отселектирована по устойчивости к антибиотикам.
Для детектирования устойчивости к антибиотикам по меньшей мере одна или более хромосом, включенных в конкретную клетку, могут включать ген устойчивости к антибиотикам.
Здесь по меньшей мере одна или более хромосом могут включать хромосому-мишень, искусственную рекомбинантную хромосому и/или конечную рекомбинантную хромосому. Описания хромосомы-мишени, искусственной рекомбинантной хромосомы и конечной рекомбинантной хромосомы приведены выше.
Ген устойчивости к антибиотику может включать любой один или более из гена устойчивости к гигромицину, гена устойчивости к неомицину, гена устойчивости к канамицину, гена устойчивости к бластицидину, гена устойчивости к зеоцину и гена puroΔTK, но настоящее изобретение не ограничивается этим.
Согласно примеру варианта осуществления из среды, в которой смешаны конкретные клетки и исходные клетки, не являющиеся мишенью, конкретные клетки могут быть отселектированы путем детектирования устойчивости к антибиотикам.
Например, когда конкретная клетка является клеткой-мишенью, эта клетка-мишень может включать конкретную хромосому, в которую вставлен ген устойчивости к гигромицину. Здесь конкретная клетка, то есть клетка-мишень, может быть отселектирована от неспецифической исходной клетки посредством детектирования устойчивости к антибиотику гигромицину.
Из среды, в которой смешаны две или более конкретные клетки, одна конкретная представляющая интерес клетка может быть отселектирована путем детектирования устойчивости к антибиотикам.
Здесь две или более конкретных клеток могут представлять собой две или более, выбранные из клетки-мишени, микроклетки, первой слитой клетки, второй слитой клетки и конечной рекомбинантной клетки.
Например, когда две или более конкретные клетки включают первую слитую клетку и вторую слитую клетку, вторая слитая клетка может включать искусственную рекомбинантную хромосому, в которую вставлен ген устойчивости к неомицину. Здесь одна конкретная представляющая интерес клетка, то есть вторая слитая клетка, может быть отселектирована от первой слитой клетки посредством детектирования устойчивости к антибиотику неомицину.
Согласно еще одному примеру варианта осуществления конкретная клетка может быть отселектирована с помощью deadCas9-репортера (dCas9-Репортер). Репортер может включать маркер. Репортер может включать, например, флуоресцентный маркер. Репортер может дополнительно включать аптамер и/или агент. Аптамер и/или агент могут обеспечивать аффинность связывания с конкретным веществом.
Аптамер может иметь, например, аффинность связывания с dCas9.
Агент может иметь, например, аффинность связывания с dCas9. Агент может быть, например, антителом против dCas9 или вариантом антитела. Вариант антитела может включать, например, любой один или более из антигенсвязывающего фрагмента (Fab), F(ab)'2, моноспецифического Fab2, биспецифического Fab2, триспецифического Fab2, моновалентного Ig, одноцепочечного вариабельного фрагмента (scFv ), биспецифического диантитела, одноцепочечного вариабельного фрагмента-кристаллизующегося фрагмента (scFv-Fc), миниантитела, рецептора нового антигена иммуноглобулина (IgNAR), рецептора нового антигена вариабельной области (V-NAR), иммуноглобулина G, состоящего из тяжелой цепи(hcIgG) и вариабельного домена антитела, состоящего из тяжелой цепи (VhH), но настоящее изобретение этим не ограничивается.
Для детектирования dCas9-репортера конкретную клетку можно обработать гРНК или кодирующей ее нуклеиновой кислотой.
гРНК может связываться с последовательностью-мишенью гРНК. Последовательность-мишень гРНК может включать смысловую последовательность для гРНК. Последовательность-мишень гРНК может включать антисмысловую последовательность для гРНК. Последовательность-мишень гРНК может не присутствовать в исходной хромосоме, не являющейся мишенью, но может быть выбрана из последовательностей, присутствующих в хромосоме-мишени и искусственной рекомбинантной хромосоме. Последовательность-мишень гРНК может быть вставлена в последовательность-мишень исходной хромосомы, не являющейся мишенью, с помощью донорной ДНК. Исходная хромосома, не являющаяся мишенью, и последовательность-мишень описаны выше.
Кандидатная группа последовательности-мишени гРНК и/или гРНК может быть извлечена с помощью дизайна in silico.
Согласно примеру варианта осуществления, из среды, в которой смешаны конкретная клетка и исходная клетка, не являющаяся мишенью, конкретная клетка может быть отселектирована путем детектирования dCas9-репортера (dCas9-Репортер).
Например, конкретная клетка может включать хромосому-мишень или искусственную рекомбинантную хромосому, которая включает последовательность-мишень гРНК. Здесь конкретная клетка может быть отселектирована от исходных клеток, не являющихся мишенями, путем обработки гРНК, dCas9 и репортерным аптамером и путем детектирования маркера, включенного в репортерный аптамер.
Из среды, в которой смешаны две или более конкретных клеток, одна конкретная представляющая интерес клетка может быть отселектирована путем детектирования dCas9-репортера.
Например, когда две или более конкретных клеток представляют собой группу микроклеток, а одна конкретная представляющая интерес клетка представляет собой микроклетку, включающую хромосому-мишень, хромосома-мишень может включать последовательность-мишень гРНК. Здесь микроклетка, включающая хромосому-мишень, может быть отселектирована от группы микроклеток путем обработки гРНК, dCas9 и репортерным аптамером и путем детектирования маркера, включенного в репортерный аптамер.
Согласно другому примеру варианта осуществления конкретная клетка может быть отселектирована флуоресцентной гибридизацией in situ (FISH). В качестве примера FISH можно использовать антитело-репортер. Антитело-репортер можно использовать для детектирования целевой последовательности с использованием специфической для хромосомы структуры конденсации и/или аффинности связывания антитела с конкретной последовательностью хромосомы. Для FISH с использованием антитела-репортера может использоваться известный метод.
Конкретная клетка может включать хромосому, включающую последовательность-мишень антитела.
Здесь хромосома, включающая последовательность-мишень антитела, может включать хромосому-мишень, искусственную рекомбинантную хромосому и/или конечную рекомбинантную хромосому. Описания хромосомы-мишени, искусственной рекомбинантной хромосомы и конечной рекомбинантной хромосомы приведены выше.
Для детектирования FISH специфическая клетка может быть обработана антителом-репортером. Антитело-репортер может означать конструкцию, в которой первичное антитело и репортер связаны. Кроме того, антитело-репортер может означать конструкцию, в которой вторичное антитело, обладающее аффинностью связывания с одной областью первичного антитела, и репортер связаны. В этом случае обработка антителом-репортером может включать предоставление конструкции вторичное антитело-репортер в течение времени после обработки первичным антителом.
Антитело может связываться с последовательностью-мишенью антитела на хромосоме.
Кандидатная группа последовательностей-мишеней антител и/или антител может быть извлечена с помощью дизайна in silico.
Согласно примеру варианта осуществления из среды, в которой смешаны две или более конкретные клетки, одна конкретная представляющая интерес клетка может быть выбрана с помощью детектирования FISH.
Здесь две или более конкретные клетки могут представлять собой две или более, выбранные из клетки-мишени, микроклетки, первой слитой клетки, второй слитой клетки и конечной рекомбинантной клетки.
Например, когда две или более конкретные клетки представляют собой первую слитую клетку и вторую слитую клетку, вторая слитая клетка может включать искусственную рекомбинантную хромосому, включающую последовательность-мишень антитела. Здесь вторая слитая клетка может быть отселектирована от первой слитой клетки путем обработки антитела-репортера и детектирования маркера, включенного в репортер. Антитело может связываться с последовательностью-мишенью антитела. Последовательность-мишень антитела представляет собой одну область искусственной рекомбинантной хромосомы.
Один аспект описания относится к способу получения животного с использованием клетки, включающей одну или более искусственных рекомбинантных хромосом.
В способе получения животного может использоваться клетка, включающая одну или более искусственных рекомбинантных хромосом.
Животным может быть животное, отличное от человека.
Здесь животным, отличным от человека, может быть мышь, крыса, кролик, коза, овца, свинья, корова, лошадь или обезьяна, но настоящее изобретение этим не ограничивается.
Животное может быть трансгенным (трансформированным) животным, отличным от человека.
Здесь трансформация может быть вызвана одной или более искусственными рекомбинантными хромосомами.
Здесь трансгенное (трансформированное) животное, отличное от человека, может иметь один или более различных фенотипов по сравнению с животным дикого типа, отличным от человека. Один или более различных фенотипов могут быть вызваны одной или более искусственными рекомбинантными хромосомами.
Описание клетки, включающей одну или более искусственных рекомбинантных хромосом, такое же, как приведено выше.
Клетка, включающая одну или более искусственных рекомбинантных хромосом, может представлять собой вторую слитую клетку или конечную рекомбинантную клетку.
Описание второй слитой клетки и конечной рекомбинантной клетки такое же, как приведено выше.
Перенос ядра соматической клетки (SCNT)
Согласно описанному в настоящем описании примеру варианта осуществления получают потомство, полученное из второй слитой клетки или конечной рекомбинантной клетки.
Согласно другому примеру варианта осуществления, раскрытому в настоящем описании, предоставляется способ получения потомства из второй слитой клетки или конечной рекомбинантной клетки.
Потомство, полученное из второй слитой клетки или конечной рекомбинантной клетки, может быть получено с помощью SCNT. SCNT можно использовать для получения донорного ядра из второй слитой клетки или конечной рекомбинантной клетки, для получения клонированной яйцеклетки путем трансплантации донорного ядра в энуклеированную яйцеклетку и для создания потомства путем трансплантации клонированной яйцеклетки в матку суррогата, и для SCNT может использоваться известный метод. Согласно описанному здесь примеру варианта осуществления получают потомство, полученное из второй слитой клетки или конечной рекомбинантной клетки. («Sheep cloned by nuclear transfer from a cultured cell line» 1996, Nature. 380 (6569): 64-6); Gupta, M. K et al. («Transgenic Chicken, Mice, Cattle, and Pig Embryos by Somatic Cell Nuclear Transfer into Pig Oocytes» 2013, Cellular Reprogramming. 15 (4): 322-328); или Li, J et al. («Human embryos derived by somatic cell nuclear transfer using an alternative enucleation approach» 2009, Cloning and Stem Cells. 11 (1): 39-50), но настоящее изобретение этим не ограничивается.
Развитие из эмбриона
Согласно раскрытому в настоящем описании примеру варианта осуществления получают потомство, полученное из второй слитой клетки или конечной рекомбинантной клетки.
Согласно другому примеру варианта осуществления, раскрытому в настоящем описании, предоставляется способ получения потомства из второй слитой клетки или конечной рекомбинантной клетки.
Потомство от второй слитой клетки или конечной рекомбинантной клетки может быть получено в ходе эмбрионального развития. Эмбриональное развитие заключается в развитии потомства от эмбриона путем имплантации эмбриона в матку суррогатной матери и может использоваться известным способом.
Здесь эмбрионом может быть вторая слитая клетка или конечная рекомбинантная клетка.
Инъекция бластоцисты
Согласно раскрытому в настоящем описании примеру варианта осуществления получают потомство, полученное из второй слитой клетки или конечной рекомбинантной клетки.
Согласно другому примеру варианта осуществления, раскрытому в настоящем описании, предоставляется способ получения потомства из второй слитой клетки или конечной рекомбинантной клетки.
Потомство, полученное из второй слитой клетки или конечной рекомбинантной клетки, может быть получено путем инъекции бластоцисты. Инъекция бластоцисты может использоваться для развития потомства путем трансплантации генномодифицированной эмбриональной стволовой клетки (ES-клетки) на стадии бластулы, с получением тем самым химерной бластоцисты и имплантации химерной бластоцисты в матку суррогатной матери, и может использоваться известный метод.
Здесь, генномодифицированная ES-клетка может быть второй слитой клеткой или конечной рекомбинантной клеткой.
[Примеры]
Далее по тексту настоящее изобретение будет описано более подробно с отсылкой на примеры.
Примеры предоставлены исключительно для более полного описания настоящего изобретения, и для специалистов в данной области будет очевидно, что объем настоящего изобретения не ограничивается следующими примерами.
Пример 1. Получение искусственной рекомбинантной хромосомы с использованием одного RRS и трансгенного животного с использованием того же
Этот пример представляет собой конкретный экспериментальный пример для обеспечения метода трансформации-введения с использованием раскрытой в настоящем описании хромосомы и относится к клетке, содержащей искусственную рекомбинантную хромосому, в которой целевой ген вставлен в конкретный сайт посредством рекомбинации между хромосомами, и к методу получения трансгенной мыши, используя то же самое. В нижеследующем описании предложены общие примеры, касающиеся клетки, в которой ген, кодирующий флуоресцентный белок, вставлен в конец вариабельной области локуса тяжелой цепи иммуноглобулина (IgH) с использованием одного RRS, и получения трансгенной мыши с использованием того же самого, которые представляют собой просто примеры использования искусственной рекомбинантной хромосомы, но настоящее изобретение не ограничивается этим. Представляющая интерес искусственная рекомбинантная хромосома может быть получена путем модификации примеров, которые будут описаны ниже, различными способами или путем добавления различных методов, отличных от примеров, которые будут описаны ниже.
Пример 1-1. Конструкция вектора для получения клетки-мишени
Первый донор ДНК (первый вектор) был разработан для получения эмбриональной стволовой клетки мыши (mESC) в качестве mESC-мишени, а второй донор ДНК (второй вектор) был разработан для получения человеческого фибробласта в качестве человеческого фибробласта-мишени.
Taq, использованная в реакции ПЦР, представляла собой стандартную taq для ПЦР, которая представляет собой GoTaq G2 green (Promega, США), и PrimeSTAR (Takara, Япония) использовали в качестве полимеразы для получения тупых концов, а SimpliAmp (Thermo Fisher Scientific, США) использовали в качестве термоциклера. T-blunt вектор (Solgent, Корея) использовали в качестве Т-вектора при получении клона и секвенировании ДНК, а в качестве компетентной клетки использовали HIT-компетентную клетку (RBC Bioscience, США). Все ферменты рестрикции, используемые при рекомбинации ДНК, были приобретены в New England Biolabs (NEB), а лигаза, используемая при лигировании ДНК, представляла собой ДНК-лигазу Т4 (Takara, Япония).
Первый донор ДНК (первый вектор), который будет использоваться в нацеливании на ESC мыши, состоит из последовательности фланкирующей области (M002), которая будет использоваться для нацеливания на 5'-конец вариабельной области локуса мышиного IgH (IgHV), гена устойчивости к неомицину (NeoR), loxp, последовательности фланкирующей области (M001), которая будет использоваться для нацеливания на 5'-конец мышиного IgHV, ген TK, используемый при отрицательной селекции, гена устойчивости к ампициллину (AmpR), который будет использоваться в бактериально-положительной селекции и последовательности начала репликации. В случае NeoR вектор pCMV6-AC-GFP амплифицировали в качестве матрицы методом ПЦР с выступающими концами с использованием прямого праймера, специфичного для гена промотора SV40 (GSP) , включающего сайт EcoRI (Таблица 5. SEQ ID NO: 1), и обратных праймеров (Таблица 5. SEQ ID NO: 2, 3) на мостик, включающий последовательность loxP и сайт SalI. ПЦР-амплификацию проводили с геномной ДНК мыши J1 в качестве матрицы по отношению к M001 и M002 с использованием GSP, имеющего сайты SalI и XhoI (Таблица 5. SEQ ID NO: 4 и 5) и GSP, имеющего сайты BamHI и EcoRI (Таблица 5, SEQ ID NO: 6, 7). Все продукты ПЦР клонировали после лигирования с вектором T-blunt, а затем подтверждали их последовательности оснований ДНК. Плазмиды, полученные из всех клонов, расщепляли с использованием ферментов рестрикции, действующих на сайты рестрикции на обоих концах, и лигировали с вектором pOSdupdel, обработанным BamHI и XhoI, с использованием ДНК-лигазы Т4 (ФИГ. 21).
Второй донор ДНК (второй вектор), который будет использоваться для нацеливания на фибробласты человека, состоит из последовательности фланкирующей области (H002), которая будет использоваться для нацеливания на 5'-конец вариабельной области локуса человеческого IgH (IgHV), turboGFP-NeoR, loxP , последовательности фланкирующей области (H001), которая будет использоваться для нацеливания на 5'-конец человеческого IgHV, гена TK, который будет использоваться при отрицательной селекции, AmpR, который будет использоваться при бактериальной положительной селекции, и последовательности начала репликации. В случае turboGFP-NeoR для удаления сайта множественного клонирования (MCS) матричного вектора (pCMV6-AC-GFP) промотор CMV и продукты ПЦР turboGFP-NeoR подвергали лигированию по тупым концам. Промотор CMV подвергали ПЦР с выступающими концами с использованием прямого GSP (Таблица 5. SEQ ID NO: 8) с сайтом HindIII и PrimeSTAR в качестве обратного GSP (Таблица 5. SEQ ID NO: 9), и turboGFP-NeoR подвергали ПЦР с выступающими концами с использованием прямого GSP (Таблица 5. SEQ ID NO: 10) и PrimeSTAR в качестве обратных праймеров (Таблица 5. SEQ ID NO: 2, 3) с последовательностью loxP и сайтом SalI. ПЦР-амплификацию проводили с геномной ДНК фибробластов человека в качестве матрицы в отношении H001 и H002 с использованием GSP (Таблица 5. SEQ ID NO: 11, 12) с сайтами SalI и XhoI и GSP (Таблица 5. SEQ ID NO: 13, 14) с сайтами BamHI и HindIII. Все продукты ПЦР клонировали после лигирования с вектором T-blunt, а затем подтверждали их последовательности оснований ДНК. Плазмиды, полученные из всех клонов, расщепляли с использованием ферментов рестрикции, действующих на сайты рестрикции на обоих концах, и лигировали с вектором pOSdupdel, обработанным BamHI и XhoI, с использованием ДНК-лигазы Т4 (ФИГ. 22).
[Таблица 5]
Праймеры, используемые при конструировании векторов, и их последовательности ДНК
gaagttatcggtcgacgtcgg
GAATTCCACCATGAAAAAGCCTGAACTCAC
GGATCCTAAGATACATTGATG
AATCGATCCCCAGCATGCCTGCTATTGTCTTC
ACTTAAGCACCATGGGGACCGAGTACAAGCCCAC
Пример 1-2. Получение клетки, включающей хромосому с одним встроенным RRS
Пример 1-2-1. Получение клетки-мишени человека, включающей хромосому человека с встроенным loxP
Используемые здесь дермальные фибробласты человека (hDF) были приобретены у компании Cell Engineering for Origin (CEFO; Сеул, Корея). В качестве основной среды для пролиферации и поддержания клеток использовали среду Игла, модифицированную Дульбекко (DMEM; Corning, Mannasas, VA, USA), с добавлением 10% фетальной бычьей сыворотки (FBS; Corning, Маннасас, Вирджиния, США) и 1% пенициллин-стрептомицин (Corning, Маннасас, Вирджиния, США), и клетки инкубировали в инкубаторе, поддерживаемом при 5% CO2, 95% влажности и 37°C. Транзиторную трансфекцию проводили с использованием Липофектамина 3000 (Invitrogen, Карлсбад, Калифорния, США). Трансфекцию выполняли путем добавления 1×106 клеток к FBS и DMEM без антибиотиков, добавляя туда 10 мкг второго донора ДНК (второй вектор), однократно расщепленной ферментом NotI (New England Biolabs, Ипсвич, Массачусетс, США), путем перемешивания реагента Липофектамин 3000 и инкубирования клеток при комнатной температуре в течение 5 минут. Клетки инкубировали от 24 до 48 часов в инкубаторе, поддерживаемом при 5% CO2, 95% влажности и 37°C (ФИГ. 25).
Чтобы подтвердить, вставлен ли второй донор ДНК (второй вектор) в DF человека, была отселектирована клетка с использованием гена устойчивости к антибиотику, присутствующего во втором доноре ДНК (втором векторе). Селекцию проводили посредством экспрессии гена устойчивости к неомицину, присутствующего во втором доноре ДНК (втором векторе), вставленном в DF человека. Используемым здесь антибиотиком был G418 (Life Technologies, Нью-Йорк, США), и концентрацию G418 при селекции клеток измеряли с использованием набора для подсчета клеток-8 (CCK-8; Dogindo, Кумамото, Япония). HDF трансфецировали вторым донором ДНК (вторым вектором) и 48 часов спустя обрабатывали 400 мкг/мл G418. Процесс селекции клеток выполняли в течение 4-6 недель, и сформированный клон со вставкой loxP инкубировали путем заполнения. Отселектированные hDF подтверждали посредством экспрессии GFP с использованием флуоресцентного микроскопа (Olympus Corporation, Токио, Япония) (ФИГ. 25).
В результате подтверждали экспрессию GFP, которым был помечен второй донор ДНК (второй вектором) в отселектированном дермальном фибробласте человека. На основании этого можно подтвердить, что второй донор ДНК (второй вектор) был вставлен в дермальный фибробласт человека.
Пример 1-2-2. Получение мышиной клетки-мишени, включающей хромосому мыши с встроенным loxP
Используемые здесь эмбриональные стволовые клетки мыши J1 (J1 mESC) были предоставлены компанией Macrogen (Сеул, Корея). При культивировании J1 mESC использовали чашку, покрытую 0,1% желатином, и среду 2i использовали в качестве основной среды для пролиферации и поддержания клеток. Культуральную среду готовили путем добавления в среду N2B27 без FBS ингибитора MEK PD0325901 (1 мкМ) и ингибитора GSK3 CHIR99021 (3 мкМ) (оба от Sigma Aldrich, Сент-Луис, Миссури, США) и 1000 Ед/мл LIF (Millipore, Биллерика, Массачусетс, США). Клетки инкубировали в инкубаторе, поддерживаемом при 5% CO2, 95% влажности и 37°C. Транзиторную трансфекцию проводили с использованием Липофектамина 3000. Трансфекцию выполняли путем добавления 1×106 клеток к FBS и Opti-MEM без антибиотиков (Thermo Scientific, Уолтем, Массачусетс, США), добавляя туда 10 мкг первого донора ДНК (первый вектор), расщепленного NotI, путем смешивания с липофектамином 3000 и инкубирования клеток при комнатной температуре в течение 5 минут. Клетки инкубировали от 24 до 48 часов в инкубаторе при 5% CO2, 95% влажности и 37°C (ФИГ. 26).
Чтобы подтвердить, был ли вставлен первый донор ДНК (первый вектор) в mESC, клетку селектировали посредством экспрессии гена устойчивости к неомицину, присутствующего в первом доноре ДНК (первом векторе). Используемым здесь антибиотиком был G418 (Life Technologies, Grand Island, NY, USA), и концентрацию G418 при селекции клеток измеряли с использованием набора для подсчета клеток-8 (CCK-8; Dogindo, Кумамото, Япония). MESC трансфецировали первым донором ДНК (первым вектором) и через 48 часов обрабатывали 150 мкг/мл G418. Процесс селекции клеток выполняли в течение 4-6 недель, и сформированный клон с встроенным loxP культивировали путем заполнения. Отселектированные mESC подтверждали экспрессией mCherry с использованием флуоресцентного микроскопа (фиг. 26).
В результате была подтверждена экспрессия mCherry, которым был помечен первый донор ДНК (первый вектор) в отселектированной mESC. На основании этого можно подтвердить, что первый донор ДНК (первый вектор) был вставлен в mESC.
Пример 1-3. Получение микроклеток с использованием клетки-мишени человека
Микронуклеацию выполняли с использованием колцемида (Life Technologies, Гранд-Айленд, Нью-Йорк, США). Через день после того, как 1х106 дермальных фибробластов человека, отселектированных с использованием G418, были помещены в чашку 100мм, среду заменяли на 20% FBS-содержащую среду DMEM, фибробласты обрабатывали 0,1 мкг/мл колцемида и инкубировали в течение 48 часов в инкубаторе, поддерживаемом при 5% CO2, 95% влажности и 37°C. Человеческие клетки с индуцированной микронуклеацией отделяли с использованием tryLE (Life Technologies, Гранд-Айленд, Нью-Йорк, США), промывали бессывороточной DMEM и подвергали центрифугированию (LABOGENE Co., Ltd, Корея) при 1000 об/мин в течение 5 минут. Клетки, подвергнутые центрифугированию, суспендировали в предварительно нагретой бессывороточной среде DMEM: Percoll ((Sigma Aldrich, Сент-Луис, Миссури, США) (1:1 (об:об)) и обрабатывали цитохалзином B (Sigma Aldrich, Сент-Луис, Миссури, США), так что конечная концентрация составила 10 мкг/мл. Цельные клетки и микроклетки выделяли центрифугированием (LABOGENE) при 16000 g и от 34 до 37°C в течение 1-1, 5 часов. Выделенные цельные клетки и микроклетки переносили в пробирку на 50 мл и туда добавляли бессывороточную среду DMEM с последующим центрифугированием при 500 g в течение 10 минут. Супернатант осторожно удаляли, 10 мл бессывороточной среды DMEM добавляли к осадку, прикрепленному к поверхности пробирки, и микроклетки размером 8 мкм или меньше выделяли с использованием фильтра 8 мкм (GE Healthcare, ЧИкаго, Иллинойс, США). Супернатант, содержащий выделенные микроклетки, снова центрифугировали при 400 g в течение 10 минут. Центрифугированные микроклетки выделяли с использованием фильтра 5 мкм аналогично методу с использованием фильтра 8 мкм. Окончательно выделенные микроклетки подсчитывали с помощью оптического микроскопа Nikon eclipse TS100 (Nikon Instruments, Мелвилл, Нью-Йорк, США).
В результате был использован оптический микроскоп, чтобы подтвердить, что дермальные фибробласты человека были обработаны колцемидом, а затем образовались микроядра, морфология которых совпадает с морфологией, описанной в предыдущей статье. Кроме того, с помощью оптической микроскопии было подтверждено, что микроклетки были выделены по размеру в процессе энуклеации образованных микроядер с использованием цитохалазина B и выделения микроклеток по размеру. Таким образом, было продемонстрировано, что микроклетки были удовлетворительным образом получены и изолированы от цельных клеток человека, то есть дермальных фибробластов человека (ФИГ. 27).
Пример 1-4. Получение слитой клетки микроклетка-мышиная клетка-мишень
Были приготовлены выделенная микроклетка (микроклетка человека) и mESC, которая будет использоваться в качестве реципиентной клетки. mESC обрабатывали TryLE и центрифугировали. Центрифугированные mESC промывали 1xDPBS (Welgene, Корея) и подсчитывали количество клеток с помощью гемацитометра. Слияние человеческой микроклетки и mESC выполняли с использованием белка HVJ-E (Cosmo Bio Co., Ltd., Токио, Япония) суспензионным методом. Расчетное соотношение человеческих микроклеток и mESC составляло 1:4. Каждую из подготовленных человеческих микроклеток и mESC промывали 500 мкл холодного 1xбуфера для слияния клеток. Раствор человеческих микроклеток и mESC в буфере центрифугировали при 300 g в течение 5 минут при 4°C. 25 мкл 1хбуфера для слияния клеток добавляли на 2×105 mESC, и такой же объем 1хбуфера для слиянияклеток добавляли к человеческим микроклеткам. mESC и человеческие микроклетки смешивали вместе, и к клеткам добавляли от 5 до 10 мкл белка HVJ-E, а затем клетки оставляли на льду на 5 минут. Смесь оставляли на водяной бане при 37°C на 15 минут. Здесь смесь отбирали каждые 5 минут.после слияния человеческих микроклеток и mESC смесь центрифугировали при 300 g в течение 5 минут для удаления оставшегося белка HVJ-E. Слитые клетки добавляли в чашку, содержащую культуральную среду mESC, а затем инкубировали в течение 48 часов в инкубаторе, поддерживаемом при 5% CO2, 95% влажности и 37°C.
В результате после слияния человеческих микроклеток и mESC смесь добавляли к культуральной среде и наблюдали с помощью микроскопа, чтобы показать, что mESC и микроклетки были слиты. Поскольку метод с использованием белка HVJ-E представляет собой суспензионный метод (выполняемый для проведения эксперимента с отдельными клетками, поскольку морфология пролиферации mESC представляет собой форму колонии), процесс слияния в реальном времени не может быть подтвержден, но подтвержден косвенно (ФИГ. 28).
Пример 1-5. Получение клетки, включающей искусственную рекомбинантную хромосому, с использованием слитой клетки
Пример 1-5-1. Получение клетки, включающей искусственную рекомбинантную хромосому, с использованием слитой клетки
Для получения искусственной рекомбинантной хромосомы в слитой клетке, образованной в примере 1-4, 1х106 слитых клеток добавляли к 100 мкл FBS и Opti-MEM без антибиотиков. Здесь для экспрессии Cre-рекомбиназы добавляли 10 мкг вектора pCMV-Cre (System Biosciences, LLC, Пало-Альто, Калифорния, США) с последующей трансфекцией при 125 В и 5 мс с двойными импульсами. После добавления 300 мкл среды 2i и ее тщательного перемешивания с клетками, клетки добавляли в 100мм-чашку и инкубировали в течение 48 часов в инкубаторе, поддерживаемом при 5% CO2, 95% влажности и 37°C для индукции рекомбинация между хромосомами.
Через сорок восемь часов обе из группы, в которой слитая клетка не была трансфецирована вектором pCMV-Cre (-Cre), и группы, в которой слитая клетка была трансфецирована вектором pCMV-Cre (+ Cre), подвергались обработке с использованием 150 мкг/мл G418. Клетки селектировали в течение 10-14 дней и также обрабатывали 150 мкг/мл G418 каждые 2-3 дня при замене среды. Наблюдение за отселектированными клетками подтверждали с помощью флуоресцентного микроскопа (Olympus).
В результате было подтверждено, что специфическая транслокация происходит в сайте loxP за счет Cre-рекомбиназы в слитых клетках. То есть хромосома hDF (хромосома, включающая ген GFP, вставленный вторым донором ДНК) была перенесена в mESC с использованием человеческих микроклеток, а искусственная рекомбинантная хромосома рекомбинирована путем спаривания loxP, расположенного на хромосоме hDF (хромосома, включающая ген GFP, вставленный вторым донором ДНК), и loxP, расположенного на хромосоме mESC (хромосомы, включающие ген mCherry, вставленный первым донором ДНК), и с использованием Cre-рекомбиназы. Полученная искусственная рекомбинантная хромосома была идентифицирована только по экспрессии GFP, происходящей в хромосоме mESC, в которой имела место экспрессия mCherry. Таким образом, было подтверждено, что возможен перенос хромосом через микроклетку человека и рекомбинацию между хромосомами с использованием Cre-loxP (ФИГ. 29-31).
Пример 1-5-2. Подтверждение искусственной рекомбинантной хромосомы с использованием флуоресцентной гибридизации in situ (FISH)
FISH процесс
Чтобы сконструировать зонд ВАС мыши и зонд ВАС человека, RP23-192K16 использовали в качестве образца мыши, а CTD-2572o2 использовали в качестве образца человека. ДНК ВАС получали с использованием набора Plasmid Maxi (Qiagen, Германия), а зонд ВАС конструировали с использованием набора Tag FISH Tag™ DNA Multicolor Kit (Thermo Fisher, США). Зонд ВАС мыши был помечен флуоресцентным красителем Alexa 488, а зонд ВАС человека был помечен флуоресцентным красителем Alexa 555 (ФИГ. 34).
Препарат, используемый в FISH, обрабатывали колцемидом (Life Technologies, Гранд-Айленд, Нью-Йорк, США) и гипотоническим раствором (75 мМ KCl) для диффузии метафазной хромосомы клетки и получали с помощью основного метода фиксации метанолом:уксусной кислотой (3:1).
Эксперимент FISH проводили в соответствии с основными инструкциями для набора FISH Tag™ DNA Multicolor Kit (Thermo Fisher, США). Препарат пермеабилизовали в 0,05% пепсина (Sigma Aldrich, Сент-Луис, Миссури, США)/10 мМ раствор HCl при 37°C в течение 10 минут.препарат дегидратировали разведениями этанола (70%, 85% и 100%) в течение одной минуты при комнатной температуре, а затем сушили на воздухе. Для гибридизации препарат денатурировали 70% формамидом (Sigma Aldrich) и 2xSSC (Sigma Aldrich) при pH 7 и 72°C в течение 2 минут, дегидратировали разведениями этанола (70%, 80% и 95%) при -20°C в течение 2 минут, а затем сушили на воздухе. Конечная концентрация каждого из человеческого зонда BAC и мышиного зонда BAC составляла 4 нг/мкл. 2,5 мкл каждого зонда ДНК, 65% формамид и 2xSSC денатурировали при 72°C в течение 5 минут и охлаждали на льду, и каждый препарат обрабатывали 10 мкл полученного раствора и закрывали покровным стеклом, а затем с четырех сторон препарат герметизировали резиновым клеем. Гибридизацию проводили в камере, поддерживаемой во влажных условиях при 37°C в течение ночи. После этого препарат погружали в 2xSSC для удаления покровного стекла, уравновешивали с использованием 0,4xSSC при комнатной температуре, помещали в 0,4xSSC при 73°C на 2 минуты, а затем промывали, добавляя фосфатно-буферный солевой раствор (PBS) при комнатной температуре. Окрашивание ядер выполняли с использованием гистологической среды Vectashield и DAPI (Vector Laboratories, Бурлингейм, Калифорния, США).
Препарат наблюдали под конфокальным микроскопом LSM 800 (Carl Zeiss, Германия) с помощью Airyscan. Препарат наблюдали с использованием 40x/1.2 линзы объектива Plan-Apochromat и 63x/1.4 масляной линзы объектива NA Plan-Apochromat, и изображение конфокального микроскопа анализировали с использованием программного обеспечения Zeiss Zen Blue.
Результат FISH
После селекции клетки, содержащей искусственную рекомбинантную хромосому, проводили эксперимент FISH с использованием зонда ВАС человека, специфичного для хромосомы 14 человека (Alexa 555), и зонда ВАС мыши, специфичного для хромосомы 15 мыши (Alexa 488). Хромосому клетки подтверждали окрашиванием DAPI (40x) и с использованием масляной линзы 63x. Флуоресценция зонда ВАС человека (Alexa 555) и зонда ВАС мыши (Alexa 488) наблюдалась в одном и том же месте в слитой клетке, имеющей искусственную рекомбинантную хромосому, подтверждая, что конец хромосомы 12 мыши размером 4,1 Mb был перенесен на конец хромосомы 14 человека (ФИГ. 34 и 35).
Пример 1-6. Получение трансгенного животного с использованием клетки, включающей искусственную рекомбинантную хромосому
Для получения трансгенного животного с использованием клетки, имеющей искусственную рекомбинантную хромосому, клетку, имеющую искусственную рекомбинантную хромосому, полученную в Примере 1-5, обрабатывали FIAU. Клетку, полученную после обработки, имплантировали в бластулу путем инъекции бластоцисты, в результате чего образуется химерная бластоциста. Полученную химерную бластоцисту имплантировали в матку суррогатной матери с получением посредством этого потомства мыши. Полученное потомство мыши представляет собой химерно-трансгенную мышь и гетерозиготную трансгенную мышь или гомозиготную трансгенную мышь, полученную путем скрещивания химерно-трансгенных мышей.
Полученная трансгенная мышь представляет собой мышь, имеющую ген GFP на 5’-конце IgHV в геноме мыши. Здесь трансгенная мышь может быть получена различными способами, кроме инъекции бластоцисты.
Пример 2. Получение искусственной рекомбинантной хромосомы с использованием двух RRS и получение трансгенного животного с использованием того же
Этот пример представляет собой экспериментальный пример для подтверждения метода введения трансформации с использованием раскрытой здесь хромосомы и относится к клетке, включающей искусственную рекомбинантную хромосому, в которую вставлен ген, представляющий интерес, в конкретное положение путем рекомбинации между хромосомами, и к способу получения трансгенной мыши с использованием того же самого. В нижеследующем описании представлены общие примеры, касающиеся клетки, в которой ген устойчивости к антибиотикам вставлен в конец вариабельной области локуса IgH с использованием двух RRS, и продуцирования трансгенной мыши с использованием того же, которые являются просто примерами с использованием искусственной рекомбинантной хромосомы, но настоящее изобретение этим не ограничивается. Представляющая интерес искусственная рекомбинантная хромосома может быть получена путем модификации примеров, которые будут описаны ниже, различными способами или путем добавления различных методов, отличных от примеров, которые будут описаны ниже.
Пример 2-1. Конструкция вектора для получения клетки-мишени
Первый донор ДНК (первый вектор) был разработан для получения эмбриональной стволовой клетки мыши (mESC) в качестве mESC-мишени, а второй донор ДНК (второй вектор) был разработан для получения человеческого фибробласта в качестве человеческого фибробласта-мишени.
Taq, использованная в реакции ПЦР, представляла собой стандартную taq для ПЦР, которая представляет собой GoTaq G2 green (Promega, США), и PrimeSTAR (Takara, Япония) использовали в качестве полимеразы для получения тупых концов, а SimpliAmp (Thermo Fisher Scientific, США) использовали в качестве термоциклера. T-blunt вектор (Solgent, Корея) использовали в качестве Т-вектора при получении клона и секвенировании ДНК, а в качестве компетентной клетки использовали HIT-компетентную клетку (RBC Bioscience, США). Все ферменты рестрикции, используемые при рекомбинации ДНК, были приобретены в New England Biolabs (NEB), а лигаза, используемая при лигировании ДНК, представляла собой ДНК-лигазу Т4 (Takara, Япония).
Первый донор ДНК (первый вектор), который будет использоваться для нацеливания на ESC мыши, состоит из M002, промотора CMV, loxm2/71, гена устойчивости к гигромицину (HygroR), lox66, M001, гена TK, который будет использоваться при отрицательной селекции, AmpR для использования в бактериальной положительной селекции и последовательности начала репликации. В случае промотора CMV, ПЦР с выступающими концами выполняли с вектором pCMV6-AC-GFP в качестве матрицы с использованием прямого GSP, имеющего сайт XhoI (Таблица 5. SEQ ID NO: 15) и обратного GSP, имеющего сайт KpnI (Таблица 5. SEQ ID NO: 16).В случае HygroR ПЦР с выступающими концами выполняли с вектором pSecTag2-hygroA в качестве матрицы с использованием прямого GSP, имеющего сайт KpnI и loxm2/71 (Таблица 5. SEQ ID NO: 17) и обратного GSP, имеющего lox66 и сайт SalI (Таблица 5. SEQ ID NO: 18). Промотор CMV и продукт ПЦР HygroR лигировали с вектором T-blunt и затем клонировали с последующим подтверждением последовательностей оснований ДНК. Плазмиды, полученные из двух клонов, расщепляли с использованием фермента рестрикции, действующего на сайты рестрикции на обоих концах, а затем лигировали с первым вектором из примера 1-1, который был обработан XhoI и SalI, с использованием ДНК-лигазы Т4 (ФИГ. 23).
Второй донор ДНК (второй вектор), который будет использоваться для нацеливания на фибробласты человека, состоит из H002, lox71, инвертированного puro∆TK, loxm2/66, NeoR, H001, гена TK для использования в отрицательной селекции, AmpR для использования в положительной бактериальной селекции и последовательности начала репликации. В случае инвертированной puro∆TK ПЦР с выступающими концами выполняли с синтетической ДНК в качестве матрицы с использованием прямого GSP, имеющего сайт XhoI и lox71 (Таблица 5. SEQ ID NO: 19), и обратного GSP, содержащего loxm2/66 и HindIII (Таблица 5. SEQ ID NO: 20). В случае NeoR, ПЦР с выступающими концами выполняли с вектором pCMV6-AC-GFP в качестве матрицы с использованием прямого GSP, имеющего HindIII (Таблица 5. SEQ ID NO: 21), и обратного GSP, содержащего SalI (Таблица 5. SEQ ID NO: 22). Продукты ПЦР puro∆TK-loxm2/66 с инвертированным lox71 и NeoR клонировали после лигирования с вектором T-blunt, и подтверждали их последовательности оснований ДНК. Плазмиды, полученные из двух клонов, расщепляли с использованием фермента рестрикции, действующего на сайты рестрикции на обоих концах, а затем лигировали со вторым вектором из примера 1-1, обработанным XhoI и SalI, с использованием ДНК-лигазы Т4 (ФИГ. 24).
Пример 2-2. Получение клетки, включающей хромосомы с двумя встроенными RRS
Пример 2-2-1. Получение клетки-мишени человека, включающей хромосомы человека с двумя встроенными loxP
Используемая здесь клеточная линия клеток нормальных фибробластов крайней плоти человека (BJ) была приобретена в ATCC (Манассас, Вирджиния, США). В качестве основной культуральной среды для пролиферации и поддержания клеток использовали среду Игла, модифицированную Дульбекко (DMEM; Corning, Маннасас, Вирджиния, США), содержащую 10% фетальной бычьей сыворотки (FBS; Corning, Mannasas, VA, USA) и 1% пенициллин-стрептомицин (Corning, Маннасас, Вирджиния, США), и клетки инкубировали в инкубаторе, поддерживаемом при 5% CO2, 95% влажности и 37°C. Транзиторную трансфекцию проводили с использованием электропоратора Nepa21 (NEPAGENE Co., Ltd., Чиба, Япония). Трансфекцию проводили при 150 В и 7,5 мс с двойными импульсами путем добавления 1х106 клеток к 100 мкл FBS и Opti-MEM без антибиотиков, добавляя туда 10 мкг второго донора ДНК (второй вектор) с одним расщеплением по NotI. После добавления 300 мкл среды, содержащей 10% FBS, ее тщательного перемешивания с клетками, клетки добавляли в чашку 100мм и инкубировали в течение 24-48 часов в инкубаторе, поддерживаемом при 5% CO2, 95% влажности и 37°C.
Чтобы подтвердить, был ли второй донор ДНК (второй вектор) встроен в клеточную линию человека BJ, клетку селектировали с использованием гена устойчивости к антибиотику, присутствующему во втором доноре ДНК (втором векторе). Клетку селектировали из линии клеток BJ посредством экспрессии гена устойчивости к неомицину, присутствующего во втором доноре ДНК (втором векторе). Используемым здесь антибиотиком был G418 (Life Technologies, Нью-Йорк, США), и концентрацию G418 при селекции клеток измеряли с использованием набора для подсчета клеток-8 (CCK-8; Dogindo, Кумамото, Япония). Клетки BJ трансфецировали вторым донором ДНК (второй вектор) и через 48 часов обрабатывали 300 мкг/мл G418. Процесс селекции клеток выполняли в течение 4-6 недель, и сформированный клон со вставкой loxP инкубировали путем заполнения.
В результате, подтверждая экспрессию гена устойчивости к антибиотику, встроенного во второй донор ДНК (второй вектор), было показано, что все клетки погибли в течение периода селекции в контрольной группе, но колонии были идентифицированы во время периода селекции в группе, в которую был встроен второй донор ДНК (второй вектор). Поскольку пролиферация и поддержание клеток продолжались даже при непрерывном добавлении антибиотиков, можно видеть, что экспрессия второго донора ДНК (второго вектора) происходит непрерывно.
Пример 2-2-2. Получение мышиной клетки-мишени, включающей мышиные хромосомы с двумя встроенными loxP
Используемые здесь эмбриональные стволовые клетки мыши J1 (J1 mESC) были предоставлены компанией Macrogen (Сеул, Корея). J1 mESC помещали в чашку, покрытую 0,1% желатином, и в качестве основной культуральной среды для пролиферации и поддержания клеток использовали среду 2i, приготовленную путем добавления ингибитора MEK PD0325901 (1 мкМ) и ингибитора GSK3 CHIR99021 (3 мкМ) (оба от Sigma Aldrich, Сент-Луис, Миссури, США) и 1000 Ед/мл LIF (Millipore, Биллерика, Массачусетс, США) в среду N2B27 без FBS. Клетки инкубировали в инкубаторе, поддерживаемом при 5% CO2, 95% влажности и 37 °C. Транзиторную трансфекцию проводили с использованием электропоратора Nepa21 (NEPAGENE Co., Ltd., Чиба, Япония). Трансфекцию выполняли при 125 В и 5 мс с двойными импульсами, добавляя 1х106 клеток к 100 мкл Opti-MEM, не содержащей антибиотиков и FBS, и добавляя туда 10 мкг первого донора ДНК (первого вектора), однократно расщепленного с помощью NotI. После добавления 300 мкл среды 2i и ее тщательного перемешивания с клетками клетки высевали в чашку 100мм и инкубировали от 24 до 48 часов в инкубаторе, поддерживаемом при 5% CO2, 95% влажности и 37°C.
Чтобы подтвердить, был ли первый донор ДНК (первый вектор) вставлен в mESC, клетку селектировали посредством экспрессии гена устойчивости к гигромицину, присутствующего в первом доноре ДНК (первом векторе). Используемым здесь антибиотиком был гигромицин B (Fujifilm Wako Pure Chemical Corporation, Осака, ЯПОНИЯ), и концентрацию гигромицина для селекции клеток измеряли с использованием набора для подсчета клеток-8 (CCK-8; Dogindo, Кумамото, Япония). mESC трансфецировали первым донором ДНК (первым вектором) и через 48 часов обрабатывали 32 мкг/мл гигромицина. Процесс селекции клеток выполняли в течение 4-6 недель, и сформированный клон с встроенным loxP культивировали путем заполнения.
В результате, подтверждая экспрессию гена устойчивости к антибиотикам, встроенного в первый донор ДНК (первый вектор), было показано, что все клетки погибли в течение периода селекции в контрольной группе, но колонии были идентифицированы во время периода селекции в группе, в которую был встроен первый донор ДНК (первый вектор). Поскольку пролиферация и поддержание клеток продолжались даже при непрерывном добавлении антибиотиков, можно видеть, что экспрессия нацеливающего вектора происходила непрерывно.
Пример 2-3. Получение микроклеток с использованием клетки-мишени человека
Микронуклеацию выполняли с использованием колцемида (Life Technologies, Гранд-Айленд, Нью-Йорк, США). Через день после того как 1х106 клеток клеточной линии нормальных фибробластов крайней плоти человека (BJ), отселектированных с использованием G418, высевали в чашку 100мм, среду заменяли на среду DMEM, содержащую 20% FBS, и клетки обрабатывали 0,1 мкг/мл колцемида и инкубировали в течение 48 часов в инкубаторе, поддерживаемом при 5% CO2, 95% влажности и 37°C. Человеческие клетки с индуцированной микронуклеацией, открепляли с использованием tryLE (Life Technologies, Гранд-Айленд, Нью-Йорк, США), промывали бессывороточной DMEM и подвергали центрифугированию (LABOGENE Co., Ltd, Корея) при 1000 об/мин в течение 5 минут. Клетки, подвергнутые центрифугированию, суспендировали в предварительно нагретой бессывороточной среде DMEM:Percoll ((Sigma Aldrich, Сент-Луис, Миссури, США) (1:1 (об:об)) и обрабатывали цитохалзином B (Sigma Aldrich, Сент-Луис, Миссури, США), так что конечная концентрация составила 10 мкг/мл. Цельные клетки и микроклетки выделяли центрифугированием (LABOGENE) при 16000 g при 34-37°C в течение 1-1, 5 часов. Выделенные цельные клетки и микроклетки переносили в пробирку на 50 мл и туда добавляли бессывороточную среду DMEM с последующим центрифугированием при 500 g в течение 10 минут. Супернатант осторожно удаляли, 10 мл бессывороточной среды DMEM добавляли к осадку, прикрепленному к поверхности пробирки, и микроклетки размером 8 мкм или меньше выделяли с использованием фильтра 8 мкм (GE Healthcare, ЧИкаго, Иллинойс, США). Супернатант, содержащий выделенные микроклетки, снова центрифугировали при 400 g в течение 10 минут. Центрифугированные микроклетки выделяли с использованием фильтра 5 мкм аналогично методу с использованием фильтра 8 мкм. Окончательно выделенные микроклетки подсчитывали с помощью оптического микроскопа Nikon eclipse TS100 (Nikon Instruments, Мелвилл, Нью-Йорк, США).
В результате был использован оптический микроскоп, чтобы подтвердить, что клеточная линия нормальных фибробластов крайней плоти человека (BJ) была обработана колцемидом, а затем образовались микроядра, которые имеют такую же морфологию, как описано в предыдущей статье. Кроме того, с помощью оптической микроскопии было подтверждено, что микроклетки были выделены по размеру в процессе энуклеации образованных микроядер с использованием цитохалазина B и выделения микроклеток по размеру. Таким образом, было продемонстрировано, что микроклетки были удовлетворительным образом получены и изолированы от цельных человеческих клеток, то есть клеточной линии нормальных фибробластов крайней плоти человека (BJ).
Пример 2-4. Получение слитой клетки микроклетка-мышиная клетка-мишень
Были приготовлены выделенные микроклетки (человеческие микроклетки) и mESC для использования в качестве реципиентных клеток. mESC обрабатывали TryLE и центрифугировали. Центрифугированные mESC промывали 1xDPBS (Welgene, Корея) и подсчитывали количество клеток с помощью гемацитометра. Слияние человеческих микроклеток и mESC проводили с использованием белка HVJ-E (Cosmo Bio Co., Ltd., Токио, Япония) суспензионным методом. Расчетное соотношение человеческих микроклеток и mESC составляло 1:4. Каждую из подготовленных человеческих микроклеток и mESC промывали 500 мкл холодного 1xбуфера для слияния клеток. Центрифугирование проводили с растворами человеческих микроклеток и mESC, содержащихся в буфере, при 300 g в течение 5 минут при 4°C. 25 мкл 1х буфера для слияния клеток добавляли на 2х105 mESC, и такой же объем 1хбуфера для слияния клеток добавляли к человеческим микроклеткам. mESC и человеческие микроклетки смешивали вместе и добавляли к ним от 5 до 10 мкл белка HVJ-E, а затем клетки оставляли на льду на 5 минут. Смесь оставляли на водяной бане при 37°C на 15 минут. Здесь смесь отбирали каждые 5 минут.после завершения слияния человеческих микроклеток и mESC оставшийся белок HVJ-E удаляли центрифугированием при 300 g в течение 5 минут. Слитые клетки помещали в чашку, содержащую культуральную среду mESC, а затем инкубировали в течение 48 часов в инкубаторе, поддерживаемом при 5% CO2, 95% влажности и 37°C.
В результате после слияния человеческих микроклеток и mESC смесь добавляли к культуральной среде и наблюдали с помощью микроскопа, чтобы показать, что mESC и микроклетки были слиты. Поскольку метод с использованием белка HVJ-E представляет собой суспензионный метод (выполняемый для проведения эксперимента с отдельными клетками, поскольку морфология пролиферации mESC представляет собой форму колонии), процесс слияния в реальном времени не может быть подтвержден, но подтвержден косвенно.
Пример 2-5. Получение клетки, включающей искусственную рекомбинантную хромосому, с использованием слитой клетки
Для получения искусственной рекомбинантной хромосомы в слитой клетке, образованной в примере 2-4, 1х106 слитых клеток добавляли к 100 мкл среды Opti-MEM, не содержащей антибиотиков и FBS. Здесь для экспрессии Cre-рекомбиназы добавляли 10 мкг вектора pCMV-Cre (System Biosciences, LLC, Пало-Альто, Калифорния, США) с последующей трансфекцией при 125 В и 5 мс с двойными импульсами. После добавления 300 мкл среды 2i и ее тщательного перемешивания с клетками, клетки добавляли в чашку 100мм и инкубировали в течение 48 часов в инкубаторе, поддерживаемом при 5% CO2, 95% влажности и 37°C.
Через 48 часов 5×104 слитых клеток высевали в 6-луночный планшет и обрабатывали 0,6 мкг/мл пуромицина. Концентрацию пуромицина определяли как подходящую концентрацию с использованием набора для подсчета клеток-8 (CCK-8; Dogindo, Кумамото, Япония). Клетки наращивали в течение одной недели и обрабатывали свежей средой и пуромицином каждые 2 или 3 дня. Для фиксации и окрашивания клеток использовали кристаллический фиолетовый (Sigma Aldrich, Сент-Луис, Миссури, США) и подсчитывали колонии mESC размером приблизительно 70 мкм. График был построен с помощью GraphPad PRISM (версия 5.01), а статистическая значимость между 3 группами оценивалась с помощью однофакторного дисперсионного анализа.
В результате процесс селекции клетки, включающей искусственную рекомбинантную хромосому, также был описан в примере 2-1, но клетку селектировали путем нормальной экспрессии гена устойчивости к пуромицину, инвертированного Cre-рекомбиназой, которой обрабатывали слитую клетку. То есть хромосома (хромосома, включающая инвертированный ген puro∆TK, вставленный вторым донором ДНК) линии клеток человека BJ была перенесена в mESC через человеческую микроклетку, и была получена искусственная рекомбинантная хромосома, рекомбинированная путем спаривания (спаривание первого loxP и четвертого loxP; и спаривание второго loxP и третьего loxP) двух loxP (первого loxP и второго loxP), расположенных на хромосоме BJ (хромосома, включающая инвертированный ген puro∆TK, вставленный вторым донором ДНК), и двух loxP (третий loxP и четвертый loxP), расположенных на хромосоме mESC (хромосома, включающая ген устойчивости к гигромицину, вставленный первым донором ДНК), и с помощью Cre-рекомбиназы. Полученная искусственная рекомбинантная хромосома включала реинвертированный ген puro∆TK, и выживаемость клетки подтверждали обработкой каждой группы пуромицином. В результате было подтверждено, что пролиферация mESC происходит в группе, подверженной экспрессии Cre-рекомбиназы. Следовательно, можно видеть, что ген puro∆TK в норме экспрессировался путем продукции искусственной рекомбинантной хромосомы (ФИГ. 32 и 33).
Пример 2-6. Получение трансгенного животного с использованием клетки, включающей искусственную рекомбинантную хромосому
Для получения трансгенного животного с использованием клетки, включающей искусственную рекомбинантную хромосому, клетку, включающую искусственную рекомбинантную хромосому, полученную в примере 2-5, обрабатывали FIAU. Клетки, полученные после обработки, имплантировали в бластулы путем инъекции бластоцисты, тем самым конструируя химерные бластоцисты. Сконструированные химерные бластоцисты имплантировали в матку суррогатной матери, чтобы произвести потомство мыши. Полученное потомство мыши представляет собой химерно-трансгенную мышь и гетерозиготную трансгенную мышь или гомозиготную трансгенную мышь, полученную путем скрещивания химерно-трансгенных мышей.
Полученная трансгенная мышь представляет собой мышь, имеющую ген puro∆TK в геноме мыши. Здесь трансгенная мышь может быть получена различными способами, кроме инъекции бластоцисты.
Пример 3. Получение трансгенного животного с использованием искусственной рекомбинантной хромосомы
Этот пример относится к способу получения гуманизированной мыши и, в частности, к трансгенной мыши, имеющей хромосому с гуманизированным специфическим геном, то есть искусственной рекомбинантной хромосомой. Следующее описание относится к общим примерам получения трансгенной мыши, у которой вариабельная область локуса IgH гуманизирована, что является просто примером использования искусственной рекомбинантной хромосомы, но настоящее изобретение этим не ограничивается. Интересующая искусственная рекомбинантная хромосома может быть получена путем модификации примеров, описанных ниже, различными способами и путем добавления различных методов, отличных от примеров, описанных ниже.
Пример 3-1. Конструкция вектора для получения клетки-мишени
Для получения mESC-мишеней из эмбриональных стволовых клеток мыши (mESC) готовят первый донор ДНК (первый вектор) и второй донор ДНК (второй вектор).
Первый вектор состоит из первого гомологичного плеча, который будет использоваться для нацеливания на 5'-конец вариабельной области (все V-сегменты, D-сегменты и J-сегменты) локуса IgH мыши, концевого повтора piggyBac (PB-TR), промотор, loxm2/66 (первый RRS), гена устойчивости к бластицидину, промотора, FRT и второго гомологичного плеча, которое будут использоваться для нацеливания на 5'-конец вариабельной области локуса мышиного IgH.
Второй вектор состоит из третьего гомологичного плеча, которое будет использоваться для нацеливания на 3'-конец вариабельной области (все V-сегменты, D-сегменты и J-сегменты) локуса IgH мыши, инвертированного гена устойчивости к гигромицину, FRT, lox71 (второй RRS), промотора, гена устойчивости к неомицину (NeoR), концевого повтора piggyBac (PB-TR) и четвертого гомологичного плеча, которое будет использоваться для нацеливания на 3'-конец вариабельной области локуса мышиного IgH.
Для получения человеческого фибробласта, который будет представлять собой человеческий фибробласт-мишень, используются третий донор ДНК (третий вектор) и четвертый донор ДНК (четвертый вектор).
Третий вектор состоит из пятого гомологичного плеча, которое будет использоваться для нацеливания на 5'-конец вариабельной области (все V-сегменты, D-сегменты и J-сегменты) локуса человеческого IgH, промотора, гена устойчивости к бластицидину, lox66 (третий RRS), промотора, FRT и шестого гомологичного плеча, которое будут использоваться для нацеливания на 5'-конец вариабельной области локуса человеческого IgH.
Четвертый вектор состоит из седьмого гомологичного плеча, которое будет использоваться для нацеливания на 3'-конец вариабельной области (все V-сегменты, D-сегменты и J-сегменты) локуса человеческого IgH, концевого повтора piggyBac (PB-TR), инвертированного гена устойчивости к гигромицину, FRT, инвертированного гена puroΔTK, loxm2/71 (четвертый RRS), промотора, гена устойчивости к неомицину (NeoR) и восьмого гомологичного плеча, которое будет использоваться для нацеливания на 3' конец вариабельной области локуса человеческого IgH.
Здесь доноры ДНК могут быть разработаны в различных формах в соответствии с назначением, и конструкция может быть изменена, чтобы дополнительно включать в себя различные элементы для процесса селекции.
Пример 3-2. Получение клетки, включающей хромосому со встроенным RRS
Пример 3-2-1. Получение клетки-мишени человека, включающей хромосому человека со встроенным RRS
Используемые здесь фибробласты человека культивировали для пролиферации и поддержания в среде, содержащей среду Игла, модифицированную Дульбекко (DMEM; Corning, Mannasas, VA, USA), содержащую 10% фетальной бычьей сыворотки (FBS; Corning, Маннасас, Вирджиния, США) и 1% пенициллин-стрептомицин (Corning, Маннасас, Вирджиния, США), и в инкубаторе, поддерживаемом при 5% CO2, 95% влажности и 37°C. Транзиторную трансфекцию проводили с использованием Липофектамина 3000 (Invitrogen, Карлсбад, Калифорния, США) или электропоратора Nepa21 (NEPAGENE Co., Ltd., Чиба, Япония). Транзиторную трансфекцию осуществляли путем посева 1х106 клеток в среде без FBS и без антибиотиков, путем добавления к ней 10 мкг третьего вектора, смешивания с ним реагента Липофектамин 3000 и инкубации клеток при комнатной температуре в течение 5 минут. В качестве альтернативы добавляли 10 мкг третьего вектора для проведения трансфекции при 150 В и 7. 5 мс с двойными импульсами. Трансфецированные клетки инкубировали от 24 до 48 часов в инкубаторе, поддерживаемом при 5% CO2, 95% влажности и 37°C.
Чтобы подтвердить, вставлен ли третий вектор на 5’-конце вариабельной области локуса человеческого IgH, вставка третьего вектора подтверждается в соответствии с выживаемостью клетки, подтвержденной обработкой трансфецированных клеток бластицидином. После обработки бластицидином выжившие клетки получали и трансфецировали четвертым вектором тем же способом, который использовали для третьего вектора. Трансфецированные клетки инкубировали от 24 до 48 часов в инкубаторе, поддерживаемом при 5% CO2, 95% влажности и 37°C. Чтобы подтвердить, вставлен ли четвертый вектор на 3’-конце вариабельной области локуса человеческого IgH, вставку четвертого вектора подтверждали обработкой трансфецированной клетки G418 (Life Technologies, Нью-Йорк, США). После обработки G418 получали выжившие клетки.
Чтобы подтвердить, вставлены ли третий вектор и четвертый вектор в одну и ту же хромосому (хромосому, имеющую локус человеческого IgH), клетки, полученные после обработки G418, обрабатывали рекомбиназой флиппазой (FLP). Когда третий вектор и четвертый вектор вставлены в одну и ту же хромосому, вариабельная область локуса человеческого IgH инвертируется путем индукции рекомбинации с помощью FRT, присутствующего в двух векторах и в обработанном FLP. Чтобы подтвердить это, клетки, в которых индуцируется рекомбинация FRT-FLP, обрабатывают зеоцином, а затем, в соответствии с выживаемостью клеток, подтверждают вставку третьего вектора и четвертого вектора в одну и ту же хромосому. После обработки зеоцином получали выжившие клетки. Полученные клетки представляют собой клетки, содержащие хромосому, в которой lox66 (третий RRS) и loxm2/71 (четвертый RRS) вставлены на обоих концах вариабельной области локуса человеческого IgH, соответственно. Поскольку соматическая клетка обычно имеет два аллеля, такой процесс селекции обычно выполняется для исключения случая, когда только один из третьего вектора и четвертого вектора вставляется в два аллеля.
Здесь при наличии нескольких векторов введение вектора может производиться последовательно, случайным образом или одновременно. Процесс селекции клетки с введенным вектором может быть изменен различными способами в соответствии с элементом, встроенным в вектор.
Пример 3-2-2. Получение мышиной клетки-мишени, включающей хромосому мыши с встроенным RRS
Используемые здесь эмбриональные стволовые клетки мыши (mESC) культивировали в основной среде, то есть в среде 2i, которую готовят путем добавления в среду N2B27 без FBS ингибитора MEK PD0325901 (1 мкМ) и ингибитора GSK3 CHIR99021 (3 мкМ) (оба от Sigma Aldrich, Сент-Луис, Миссури, США) и 1000 Ед/мл LIF (Millipore, Биллерика, Массачусетс, США) в инкубаторе, поддерживаемом при 5% CO2, 95% влажности и 37°C для пролиферации и поддержания. Транзиторную трансфекцию проводили с использованием Липофектамина 3000 или электропоратора Nepa21 (NEPAGENE Co., Ltd., Чиба, Япония). Транзиторную трансфекцию проводили, высевая 1х106 клеток в среду, не содержащую антибиотиков и FBS, добавляя к ней 10 мкг первого вектора, смешивая с ними реагент Липофектамин 3000 и инкубируя клетки при комнатной температуре в течение 5 минут. В качестве альтернативы добавляли 10 мкг первого вектора для проведения трансфекции при 125 В и 5 мс с двойными импульсами. Трансфецированные клетки инкубировали от 24 до 48 часов в инкубаторе, поддерживаемом при 5% CO2, 95% влажности и 37°C.
Чтобы подтвердить, вставлен ли первый вектор на 5’-конце вариабельной области локуса мышиного IgH, вставку первого вектора подтверждали в соответствии с выживаемостью клетки после обработки трансфецированной клетки бластицидином. После обработки бластицидином получали выжившие клетки и затем трансфецировали вторым вектором тем же способом, что и первый вектор. Трансфецированные клетки инкубировали от 24 до 48 часов в инкубаторе, поддерживаемом при 5% CO2, 95% влажности и 37°C. Чтобы подтвердить, вставлен ли второй вектор на 3'-конец вариабельной области локуса мышиного IgH, вставку второго вектора подтверждали в соответствии с выживаемостью клетки после обработки трансфецированной клетки G418 (Life Technologies, Нью-Йорк, США). После обработки G418 получали выжившие клетки.
Чтобы подтвердить, вставлены ли первый вектор и второй вектор в одну и ту же хромосому (хромосому, имеющую локус мышиного IgH), клетки, полученные после обработки G418, обрабатывали рекомбиназой, то есть флиппазой (FLP). Когда первый вектор и второй вектор встраиваются в одну и ту же хромосому, вариабельная область локуса мышиного IgH инвертируется путем индукции рекомбинации посредством FRT, присутствующего в двух векторах и в обработанном FLP. Чтобы подтвердить это, клетки, в которых индуцируется рекомбинация FRT-FLP, обрабатывали зеоцином, а затем, в соответствии с выживаемостью клеток, подтверждали вставку первого вектора и второго вектора в одну и ту же хромосому. После обработки зеоцином получали выжившие клетки. Полученные клетки представляют собой клетки, содержащие хромосому, в которых loxm2/66 (первый RRS) и lox71 (второй RRS) встроены на обоих концах вариабельной области локуса IgH мыши, соответственно. Поскольку соматическая клетка обычно имеет два аллеля, такой процесс селекции обычно исключает случай, когда только один из первого вектора и второго вектора вставляется в два аллеля.
Здесь, когда имеется несколько векторов, введение вектора может выполняться последовательно, случайным образом или одновременно. Процесс селекции клетки с введенным вектором может быть изменен различными способами в соответствии с элементом, встроенным в вектор.
Пример 3-3. Получение микроклеток с использованием клетки-мишени человека
Микронуклеацию проводят с использованием колцемида (Life Technologies, Гранд-Айленд, Нью-Йорк, США). Через день после того, как выбранные клетки-мишени человека (клетка, включающая хромосому, в которую lox66 (третий RRS) и loxm2/71 (четвертый RRS) вставлены на обоих концах вариабельной области локуса человеческого IgH, соответственно) наращивали до 1×106 клеток, среду заменяли на DMEM, содержащую 20% FBS, а затем клетки обрабатывали 0, 1 мкг/мл колцемида и инкубировали в течение 48 часов в инкубаторе, поддерживаемом при 5% CO2, 95% влажности и 37°C. Человеческие клетки-мишени с индуцированной микронуклеацией открепляли с использованием tryLE (Life Technologies, Гранд-Айленд, Нью-Йорк, США) и промывали бессывороточной средой DMEM с последующим центрифугированием (LABOGENE CO. ,Ltd, КОРЕЯ) при 1000 об/мин в течение 5 минут. Клетки, подвергнутые центрифугированию, суспендировали в предварительно нагретой бессывороточной среде DMEM: Percoll ((Sigma Aldrich, Сент-Луис, Миссури, США) (1:1 (об:об)) и обрабатывали цитохалзином B (Sigma Aldrich, St Луис, Миссури, США), так что конечная концентрация составила 10 мкг/мл. Цельные клетки и микроклетки выделяли центрифугированием (LABOGENE) при 16000 g и от 34 до 37°C в течение 1-1, 5 часов. Выделенные цельные клетки и микроклетки переносили в пробирку на 50 мл и туда добавляли бессывороточную среду DMEM с последующим центрифугированием при 500 g в течение 10 минут. Супернатант осторожно удаляли, 10 мл бессывороточной среды DMEM добавляли к осадку, прикрепленному к поверхности пробирки, и микроклетки размером 8 мкм или менее выделяли с помощью фильтра 8 мкм (GE Healthcare, Чикаго, Иллинойс, США). Супернатант, содержащий выделенные микроклетки, снова центрифугировали при 400 g в течение 10 минут. Центрифугированные микроклетки выделяли с использованием фильтра 5 мкм аналогично методу с фильтром 8 мкм. Окончательно выделенные микроклетки подсчитывали с помощью оптического микроскопа Nikon eclipse TS100 (Nikon Instruments, Мелвилл, Нью-Йорк, США). Следовательно, микроклетки получали из цельных клеток человека.
Пример 3-4. Получение слитой клетки микроклетки-мышиной клетки-мишени
Готовили выделенные человеческие микроклетки и мышиные клетки-мишени (клетки, включающие хромосому, в которой loxm2/66 (первый RRS) и lox71 (второй RRS) вставлены на обоих концах вариабельной области локуса IgH мыши, соответственно) для использования в качестве реципиентных клеток. Мышиные клетки-мишени обрабатывали TryLE с последующим центрифугированием. Центрифугированные мышиные клетки-мишени промывали 1xDPBS и подсчитывали количество клеток с помощью гемацитометра. Слияние человеческих микроклеток и мышиных клеток-мишеней выполняли с использованием белка HVJ-E (Cosmo Bio Co. , Ltd. , Токио, Япония) суспензионным методом. Расчетное соотношение человеческих микроклеток и мышиных клеток-мишеней составляет 1:4. Каждые из подготовленных человеческих микроклеток и мышиных клеток-мишеней промывали 500 мкл холодного 1xбуфера для слияния клеток. Центрифугирование проводили с растворами человеческих микроклеток и мышиных клеток-мишеней, содержащихся в буфере, при 300 g и 4°C в течение 5 минут. 25 мкл 1xбуфера для слияния клеток добавляли на 2х105 мышиных клеток-мишеней, и такой же объем 1xбуфера для слияния клеток добавляли к человеческим микроклеткам. Мышиные клетки-мишени и человеческие микроклетки смешивали вместе и добавляли к ним от 5 до 10 мкл белка HVJ-E, а затем клетки оставляли на льду на 5 минут. Смесь оставляли на водяной бане при 37°C на 15 минут. Здесь смесь отбирали каждые 5 минут.после завершения слияния человеческих микроклеток и мышинвх клеток-мишеней оставшийся белок HVJ-E удаляли центрифугированием при 300 g в течение 5 минут. Слитые клетки помещали в чашку, содержащую среду для культивирования мышиных клеток-мишеней, а затем инкубировали в течение 48 часов в инкубаторе, поддерживаемом при 5% CO2, 95% влажности и 37°C. Полученная слитая клетка представляет собой клетку, включающую хромосому-мишень человека (хромосому, включающую вариабельную область локуса человеческого IgH, в которую были вставлены lox66 (третий RRS) и loxm2/71 (четвертый RRS)) и хромосому-мишень мыши (хромосому, включающую вариабельную область локуса мышиного IgH, в которую были вставлены loxm2/66 (первый RRS) и lox71 (второй RRS)).
Пример 3-5. Получение клетки, включающей искусственную рекомбинантную хромосому, с использованием слитой клетки
Человеческие микроклетки и мышиные клетки-мишени сливали, и слитые клетки стабилизировали в течение 48 часов. 100 мкл Opti-MEM без антибиотиков и без FBS добавляли к 1х106 слитых клеток. Здесь 10 мкг вектора pCMV-Cre (System Biosciences, LLC, Пало-Альто, Калифорния, США) добавляли для выполнения трансфекции при 125 В и 5 мс с двойными импульсами. Добавляли 300 мкл среды 2i и хорошо перемешивали с клетками, клетки переносили в чашку 100мм и инкубировали в течение 48 часов в инкубаторе, поддерживаемом при 5% CO2, 95% влажности и 37°C.
Чтобы подтвердить, продуцируется ли искусственная рекомбинантная хромосома в слитых клетках, обработанных Cre-рекомбиназой, слитые клетки, обработанные Cre-рекомбиназой, обрабатывали антибиотиками (пуромицином, G418 и гигромицином). В слитых клетках, обработанных Cre-рекомбиназой, рекомбинация между человеческой хромосомой-мишенью (хромосома, включающая вариабельную область локуса человеческого IgH, в которую были вставлены lox66 (третий RRS) и loxm2/71 (четвертый RRS)) и мышиной хромосомой-мишенью (хромосома, включающая вариабельную область локуса мышиного IgH, в которую были вставлены loxm2/66 (первый RRS) и lox71 (второй RRS)), индуцируется Cre-рекомбиназой. Первый RRS в хромосоме-мишени мыши спарен с четвертым RRS в хромосоме-мишени человека, а второй RRS в хромосоме-мишени мыши спарен с третьим RRS в хромосоме-мишени человека. Пары RRS распознаются Cre-рекомбиназой, чтобы вызвать рекомбинацию.
В результате была создана первая искусственная рекомбинантная хромосома, в которой вариабельная область локуса мышиного IgH хромосомы-мишени мыши была заменена вариабельной областью человеческого IgH, и вторая искусственная рекомбинантная хромосома, в которой вариабельная область локуса человеческого IgH хромосомы-мишени человека была заменена вариабельной областью мышиного IgH. В первой искусственной рекомбинантной хромосоме часть, за исключением вариабельной области локуса человеческого IgH, имеет мышиный ген (например, константная область локуса IgH мыши представляет собой ген мыши). Во второй искусственной рекомбинантной хромосоме часть, за исключением вариабельной области локуса мышиного IgH, имеет человеческий ген (например, константная область локуса человеческого IgH представляет собой человеческий ген).
После обработки антибиотиками (пуромицин, G418 и гигромицин) получали выжившие клетки. Полученные клетки представляют собой клетки, включающие первую искусственную рекомбинантную хромосому и вторую искусственную рекомбинантную хромосому, а также клетки, не включающие человеческую хромосому-мишень и мышиную хромосому-мишень.
Полученная первая искусственная рекомбинантная хромосома может включать пятый RRS и шестой RRS. Пятый и шестой RRS представляют собой RRS, полученные рекомбинацией между первым RRS и четвертым RRS и рекомбинацией между вторым RRS и третьим RRS. Кроме того, полученная вторая искусственная рекомбинантная хромосома может включать седьмой RRS и восьмой RRS. Седьмой RRS и восьмой RRS представляют собой RRS, полученные рекомбинацией между первым RRS и четвертым RRS и рекомбинацией между вторым RRS и третьим RRS.
RRS (пятый RRS, шестой RRS, седьмой RRS и восьмой RRS), ген puroΔTK, ген устойчивости к неомицину (NeoR), ген устойчивости к гигромицину и FRT, включенные в первую искусственную рекомбинантную хромосому и вторую искусственную рекомбинантную хромосому, удаляются обработкой полученных клеток, включающих первую искусственную рекомбинантную хромосому и вторую искусственную рекомбинантную хромосому, транспозазой piggyBac. В данном случае клетки, включающие искусственные рекомбинантные хромосомы, из которых удалены RRS (пятый RRS, шестой RRS, седьмой RRS и восьмой RRS), ген puroΔTK, ген устойчивости к неомицину (NeoR), ген устойчивости к зеоцину и FRT, удаляются путем обработки фиалуридином (FIAU).
Искусственная рекомбинантная хромосома может быть рекомбинирована различными способами в соответствии с положением, направлением и спариванием RRS. Чтобы создать интересующую искусственную рекомбинантную хромосому, искусственную рекомбинантную хромосому можно получить, изменив конструкцию донора ДНК, как описано выше.
Пример 3-6. Получение трансгенного животного с использованием клетки, включающей искусственную рекомбинантную хромосому
Для получения трансгенного животного с использованием клетки, включающей искусственную рекомбинантную хромосому, клетку, включающую искусственную рекомбинантную хромосому, полученную в примере 3-5, обрабатывали FIAU. Клетки, полученные после обработки, имплантировали в бластулу путем инъекции бластоцисты, в результате чего образуется химерная бластоциста. Полученную химерную бластоцисту имплантировали в матку суррогатной матери, в результате чего получали потомство мышей. Полученное потомство мышей представляет собой химерно-трансгенную мышь, а гетерозиготную трансгенную мышь или гомозиготную трансгенную мышь получали путем скрещивания химерно-трансгенных мышей.
У полученной трансгенной мыши вариабельная область локуса IgH в геноме может быть гуманизирована, и трансгенная мышь может быть использована для получения гуманизированного антитела и/или полностью человеческого антитела.
Здесь трансгенная мышь может быть получена различными способами, кроме инъекции бластоцисты.
Хотя варианты осуществления были описаны со ссылкой на ограниченные варианты осуществления и чертежи, как описано выше, для специалистов в данной области возможны различные модификации и изменения. Например, подходящие результаты могут быть достигнуты, даже если описанные методы выполняются в порядке, отличном от порядка вышеописанных способов, или заменяются другими составляющими элементами или эквивалентами. Следовательно, другие варианты осуществления, примеры и эквиваленты формулы изобретения находятся в пределах объема формулы изобретения, описанной ниже.
[Список последовательностей в свободной форме]
SEQ ID NO: 1-22 представляют собой последовательности праймеров, SEQ ID NO: 23-31 представляют собой последовательности RRS, а SEQ ID NO: 32 и 33 представляют собой аминокислотные последовательности рекомбиназы.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Humab Co., Ltd.
<120> Искусственная рекомбинантная хромосома и ее применение
<130> OPP19-085-PCT-AU
<150> US 62/833489
<151> 2019-04-12
<150> KR 10-2019-0042840
<151> 2019-04-12
<160> 33
<170> KoPatentIn 3.0
<210> 1
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 1
gaattcggct gtggaatgtg tgtcagttag ggtg 34
<210> 2
<211> 77
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 2
cttatcatgt ctgtataccg tcgcgccacc ataacttcgt atagcataca ttatacgaag 60
ttatcggtcg acgtcgg 77
<210> 3
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 3
ccgacgtcga ccgataactt 20
<210> 4
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 4
acgcgtcgac aggatttgga cctgagcata ct 32
<210> 5
<211> 31
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 5
ccgctcgagg aggccaagag aggctaaagc c 31
<210> 6
<211> 31
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 6
cgcggatccc attctcccat ctccaattta t 31
<210> 7
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 7
ggaattcttt tgtaacccct agacagatg 29
<210> 8
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 8
aagcttccgc catgttgaca ttg 23
<210> 9
<211> 16
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 9
cggccgccct atagtg 16
<210> 10
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 10
agatggagag cgacgagagc ggcct 25
<210> 11
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 11
acgcgtcgac tgcgtgagat cttttcttgg gg 32
<210> 12
<211> 31
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 12
ccgctcgagt ccacacaccc aagtcattcg a 31
<210> 13
<211> 31
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 13
cgcggatccc tgaagccaac caagtttagg a 31
<210> 14
<211> 31
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 14
cccaagcttc acatggtgaa cccaaacact c 31
<210> 15
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 15
atcctcgagg acattgatta ttgactag 28
<210> 16
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 16
attggtaccc tcggccgccc tatag 25
<210> 17
<211> 73
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 17
ataggtacct accgttcgta tatggtttct tatacgaagt tatgaattcc accatgaaaa 60
agcctgaact cac 73
<210> 18
<211> 64
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 18
atcgtcgact accgttcgta taatgtatgc tatacgaagt tatggatcct aagatacatt 60
gatg 64
<210> 19
<211> 74
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 19
attctcgaga taacttcgta taatgtatgc tatacgaacg gtaatcgatc cccagcatgc 60
ctgctattgt cttc 74
<210> 20
<211> 76
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 20
ctcaagctta taacttcgta tatggtttct tatacgaacg gtacttaagc accatgggga 60
ccgagtacaa gcccac 76
<210> 21
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 21
cgcaagcttg tgtgtcagtt agggtgtg 28
<210> 22
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 22
atcgtcgact aagatacatt gatgagtttg 30
<210> 23
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> loxp вариант
<400> 23
taccgttcgt atatggtttc ttatacgaag ttat 34
<210> 24
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> loxp вариант
<400> 24
ataacttcgt atatggtttc ttatacgaac ggta 34
<210> 25
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> loxp вариант
<400> 25
taccgttcgt atagcataca ttatacgaag ttat 34
<210> 26
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> loxp вариант
<400> 26
ataacttcgt atagcataca ttatacgaac ggta 34
<210> 27
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<223> сайт распознавания рекомбиназы
<400> 27
gaagttccta tactttctag agaataggaa cttcggaata ggaacttc 48
<210> 28
<211> 100
<212> ДНК
<213> Искусственная последовательность
<220>
<223> сайт распознавания рекомбиназы
<400> 28
cccaggtcag aagcggtttt cgggagtagt gccccaactg gggtaacctt tgagttctct 60
cagttggggg cgtagggtcg ccgacatgac acaaggggtt 100
<210> 29
<211> 70
<212> ДНК
<213> Искусственная последовательность
<220>
<223> сайт распознавания рекомбиназы
<400> 29
ctcgaagccg cggtgcgggt gccagggcgt gcccttgggc tccccgggcg cgtactccac 60
ctcacccatc 70
<210> 30
<211> 63
<212> ДНК
<213> Искусственная последовательность
<220>
<223> сайт распознавания рекомбиназы
<400> 30
ccctagaaag ataatcatat tgtgacgtac gttaaagata atcatgcgta aaattgacgc 60
atg 63
<210> 31
<211> 35
<212> ДНК
<213> Искусственная последовательность
<220>
<223> сайт распознавания рекомбиназы
<400> 31
catgcgtcaa ttttacgcag actatctttc taggg 35
<210> 32
<211> 342
<212> Белок
<213> Искусственная последовательность
<220>
<223> Cre-рекомбиназа
<400> 32
Ser Asn Leu Leu Thr Val His Gln Asn Leu Pro Ala Leu Pro Val Asp
1 5 10 15
Ala Thr Ser Asp Glu Val Arg Lys Asn Leu Met Asp Met Phe Arg Asp
20 25 30
Arg Gln Ala Phe Ser Glu His Thr Trp Lys Met Leu Leu Ser Val Cys
35 40 45
Arg Ser Trp Ala Ala Trp Cys Lys Leu Asn Asn Arg Lys Trp Phe Pro
50 55 60
Ala Glu Pro Glu Asp Val Arg Asp Tyr Leu Leu Tyr Leu Gln Ala Arg
65 70 75 80
Gly Leu Ala Val Lys Thr Ile Gln Gln His Leu Gly Gln Leu Asn Met
85 90 95
Leu His Arg Arg Ser Gly Leu Pro Arg Pro Ser Asp Ser Asn Ala Val
100 105 110
Ser Leu Val Met Arg Arg Ile Arg Lys Glu Asn Val Asp Ala Gly Glu
115 120 125
Arg Ala Lys Gln Ala Leu Ala Phe Glu Arg Thr Asp Phe Asp Gln Val
130 135 140
Arg Ser Leu Met Glu Asn Ser Asp Arg Cys Gln Asp Ile Arg Asn Leu
145 150 155 160
Ala Phe Leu Gly Ile Ala Tyr Asn Thr Leu Leu Arg Ile Ala Glu Ile
165 170 175
Ala Arg Ile Arg Val Lys Asp Ile Ser Arg Thr Asp Gly Gly Arg Met
180 185 190
Leu Ile His Ile Gly Arg Thr Lys Thr Leu Val Ser Thr Ala Gly Val
195 200 205
Glu Lys Ala Leu Ser Leu Gly Val Thr Lys Leu Val Glu Arg Trp Ile
210 215 220
Ser Val Ser Gly Val Ala Asp Asp Pro Asn Asn Tyr Leu Phe Cys Arg
225 230 235 240
Val Arg Lys Asn Gly Val Ala Ala Pro Ser Ala Thr Ser Gln Leu Ser
245 250 255
Thr Arg Ala Leu Glu Gly Ile Phe Glu Ala Thr His Arg Leu Ile Tyr
260 265 270
Gly Ala Lys Asp Asp Ser Gly Gln Arg Tyr Leu Ala Trp Ser Gly His
275 280 285
Ser Ala Arg Val Gly Ala Ala Arg Asp Met Ala Arg Ala Gly Val Ser
290 295 300
Ile Pro Glu Ile Met Gln Ala Gly Gly Trp Thr Asn Val Asn Ile Val
305 310 315 320
Met Asn Tyr Ile Arg Asn Leu Asp Ser Glu Thr Gly Ala Met Val Arg
325 330 335
Leu Leu Glu Asp Gly Asp
340
<210> 33
<211> 594
<212> Белок
<213> Искусственная последовательность
<220>
<223> Транспозаза Piggy Bac
<400> 33
Met Gly Ser Ser Leu Asp Asp Glu His Ile Leu Ser Ala Leu Leu Gln
1 5 10 15
Ser Asp Asp Glu Leu Val Gly Glu Asp Ser Asp Ser Glu Ile Ser Asp
20 25 30
His Val Ser Glu Asp Asp Val Gln Ser Asp Thr Glu Glu Ala Phe Ile
35 40 45
Asp Glu Val His Glu Val Gln Pro Thr Ser Ser Gly Ser Glu Ile Leu
50 55 60
Asp Glu Gln Asn Val Ile Glu Gln Pro Gly Ser Ser Leu Ala Ser Asn
65 70 75 80
Arg Ile Leu Thr Leu Pro Gln Arg Thr Ile Arg Gly Lys Asn Lys His
85 90 95
Cys Trp Ser Thr Ser Lys Ser Thr Arg Arg Ser Arg Val Ser Ala Leu
100 105 110
Asn Ile Val Arg Ser Gln Arg Gly Pro Thr Arg Met Cys Arg Asn Ile
115 120 125
Tyr Asp Pro Leu Leu Cys Phe Lys Leu Phe Phe Thr Asp Glu Ile Ile
130 135 140
Ser Glu Ile Val Lys Trp Thr Asn Ala Glu Ile Ser Leu Lys Arg Arg
145 150 155 160
Glu Ser Met Thr Gly Ala Thr Phe Arg Asp Thr Asn Glu Asp Glu Ile
165 170 175
Tyr Ala Phe Phe Gly Ile Leu Val Met Thr Ala Val Arg Lys Asp Asn
180 185 190
His Met Ser Thr Asp Asp Leu Phe Asp Arg Ser Leu Ser Met Val Tyr
195 200 205
Val Ser Val Met Ser Arg Asp Arg Phe Asp Phe Leu Ile Arg Cys Leu
210 215 220
Arg Met Asp Asp Lys Ser Ile Arg Pro Thr Leu Arg Glu Asn Asp Val
225 230 235 240
Phe Thr Pro Val Arg Lys Ile Trp Asp Leu Phe Ile His Gln Cys Ile
245 250 255
Gln Asn Tyr Thr Pro Gly Ala His Leu Thr Ile Asp Glu Gln Leu Leu
260 265 270
Gly Phe Arg Gly Arg Cys Pro Phe Arg Met Tyr Ile Pro Asn Lys Pro
275 280 285
Ser Lys Tyr Gly Ile Lys Ile Leu Met Met Cys Asp Ser Gly Thr Lys
290 295 300
Tyr Met Ile Asn Gly Met Pro Tyr Leu Gly Arg Gly Thr Gln Thr Asn
305 310 315 320
Gly Val Pro Leu Gly Glu Tyr Tyr Val Lys Glu Leu Ser Lys Pro Val
325 330 335
His Gly Ser Cys Arg Asn Ile Thr Cys Asp Asn Trp Phe Thr Ser Ile
340 345 350
Pro Leu Ala Lys Asn Leu Leu Gln Glu Pro Tyr Lys Leu Thr Ile Val
355 360 365
Gly Thr Val Arg Ser Asn Lys Arg Glu Ile Pro Glu Val Leu Lys Asn
370 375 380
Ser Arg Ser Arg Pro Val Gly Thr Ser Met Phe Cys Phe Asp Gly Pro
385 390 395 400
Leu Thr Leu Val Ser Tyr Lys Pro Lys Pro Ala Lys Met Val Tyr Leu
405 410 415
Leu Ser Ser Cys Asp Glu Asp Ala Ser Ile Asn Glu Ser Thr Gly Lys
420 425 430
Pro Gln Met Val Met Tyr Tyr Asn Gln Thr Lys Gly Gly Val Asp Thr
435 440 445
Leu Asp Gln Met Cys Ser Val Met Thr Cys Ser Arg Lys Thr Asn Arg
450 455 460
Trp Pro Met Ala Leu Leu Tyr Gly Met Ile Asn Ile Ala Cys Ile Asn
465 470 475 480
Ser Phe Ile Ile Tyr Ser His Asn Val Ser Ser Lys Gly Glu Lys Val
485 490 495
Gln Ser Arg Lys Lys Phe Met Arg Asn Leu Tyr Met Ser Leu Thr Ser
500 505 510
Ser Phe Met Arg Lys Arg Leu Glu Ala Pro Thr Leu Lys Arg Tyr Leu
515 520 525
Arg Asp Asn Ile Ser Asn Ile Leu Pro Asn Glu Val Pro Gly Thr Ser
530 535 540
Asp Asp Ser Thr Glu Glu Pro Val Met Lys Lys Arg Thr Tyr Cys Thr
545 550 555 560
Tyr Cys Pro Ser Lys Ile Arg Arg Lys Ala Asn Ala Ser Cys Lys Lys
565 570 575
Cys Lys Lys Val Ile Cys Arg Glu His Asn Ile Asp Met Cys Gln Ser
580 585 590
Cys Phe
<---
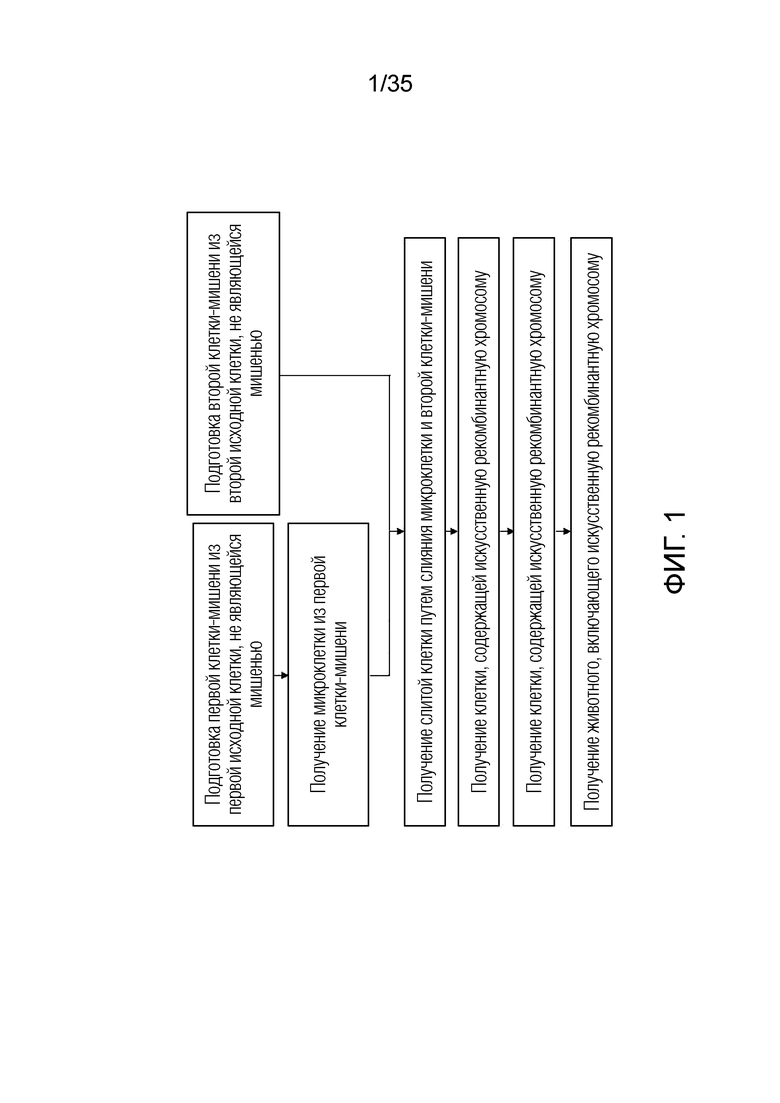
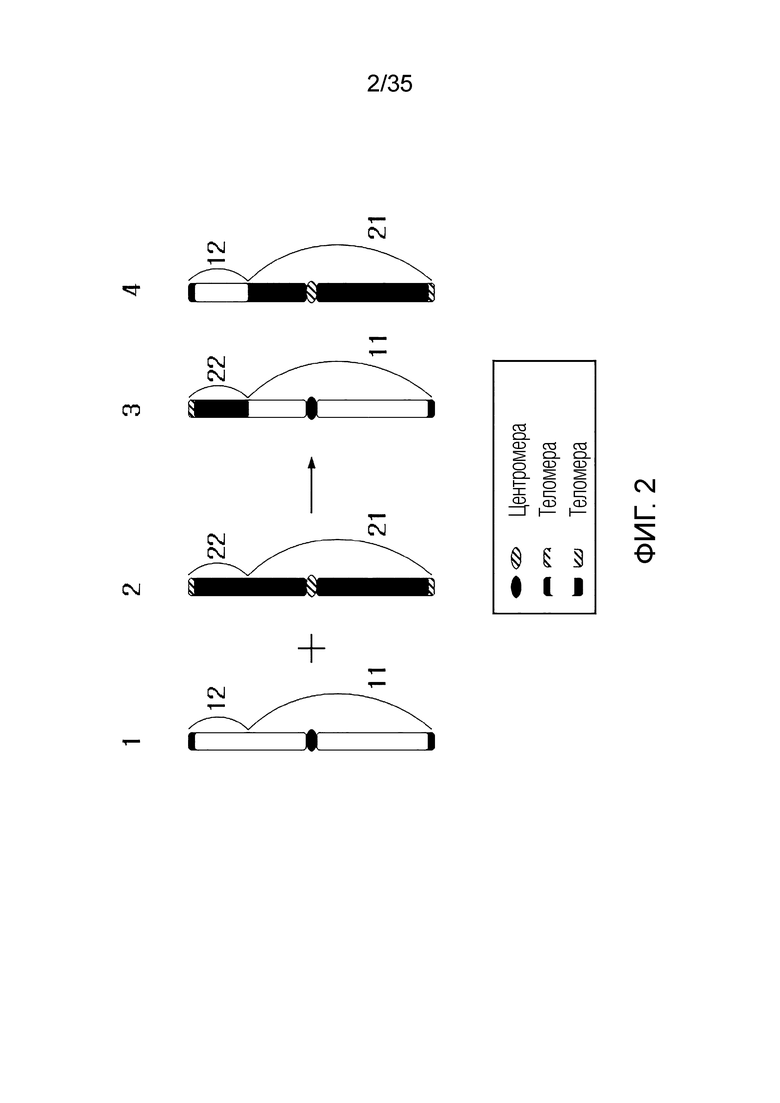
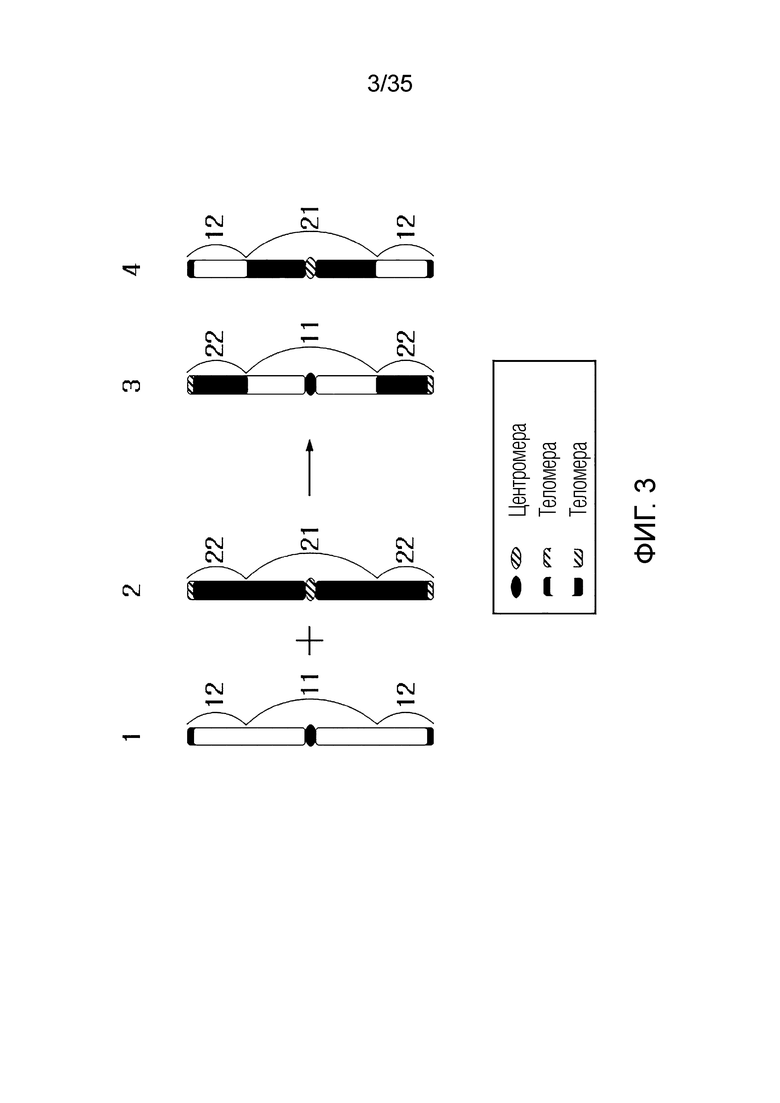
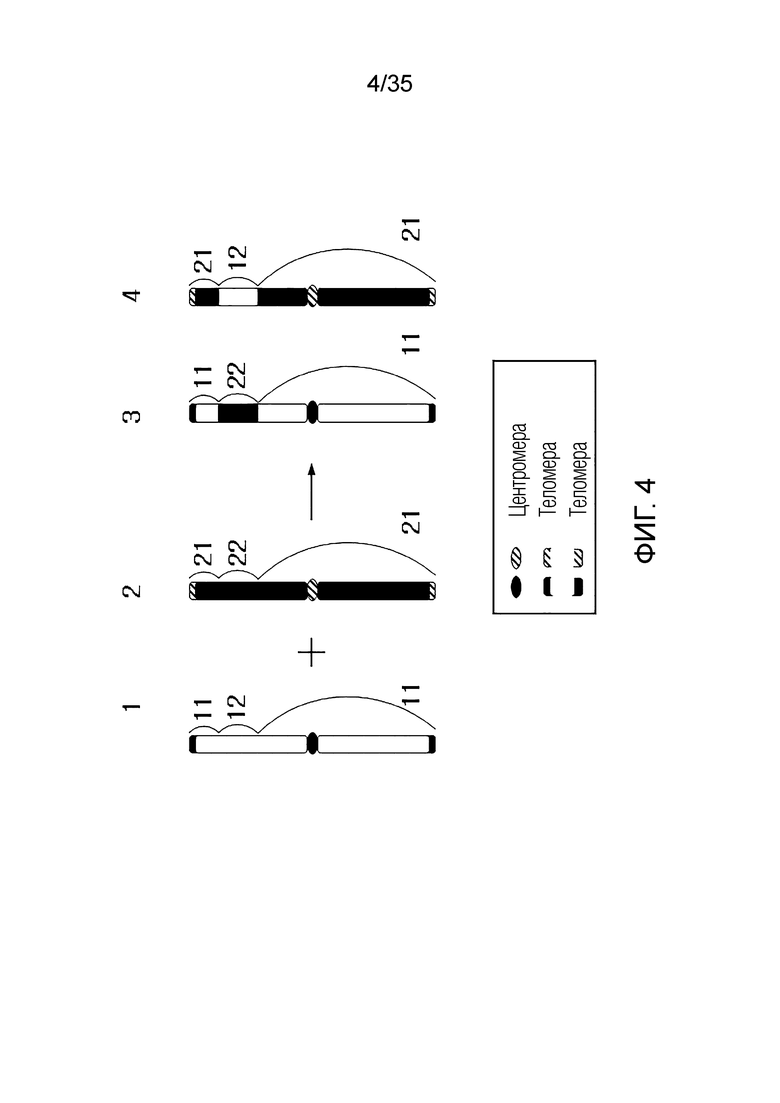
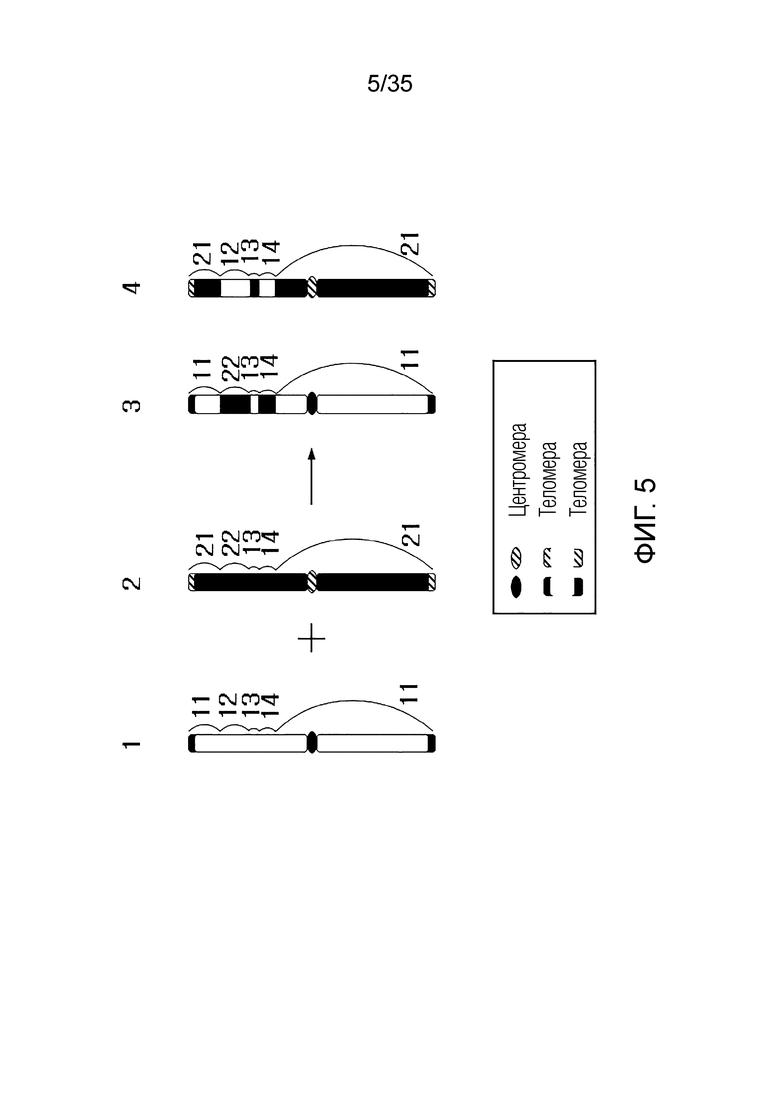
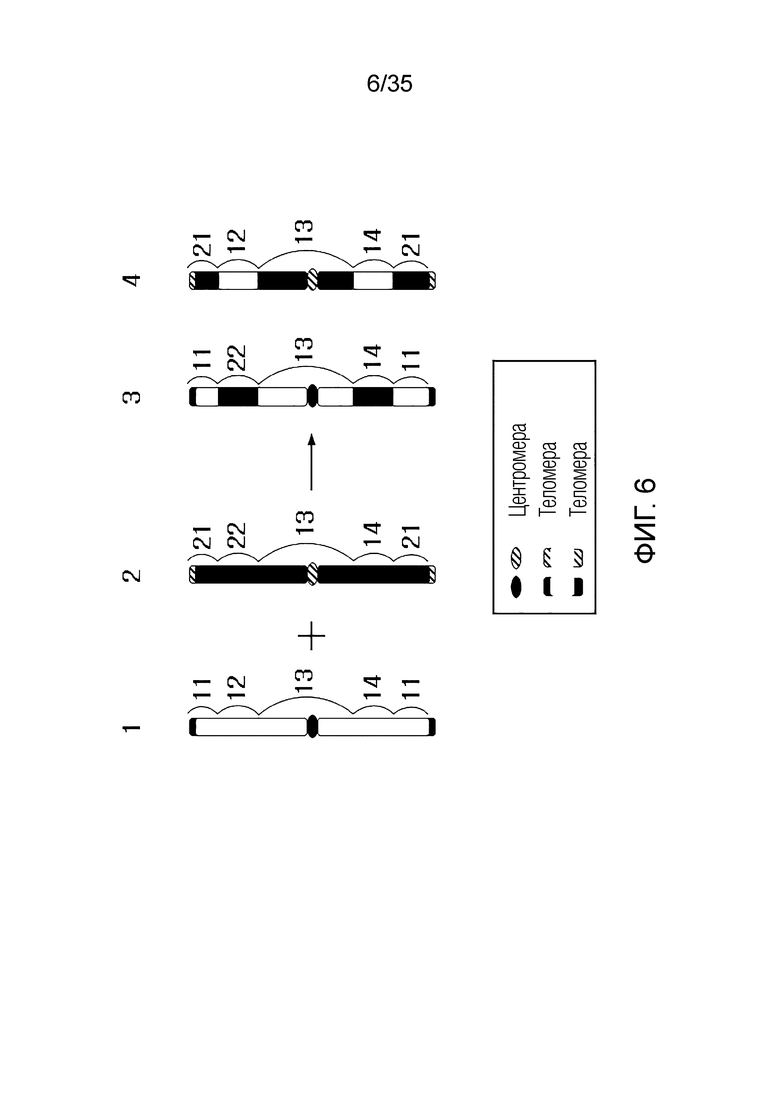
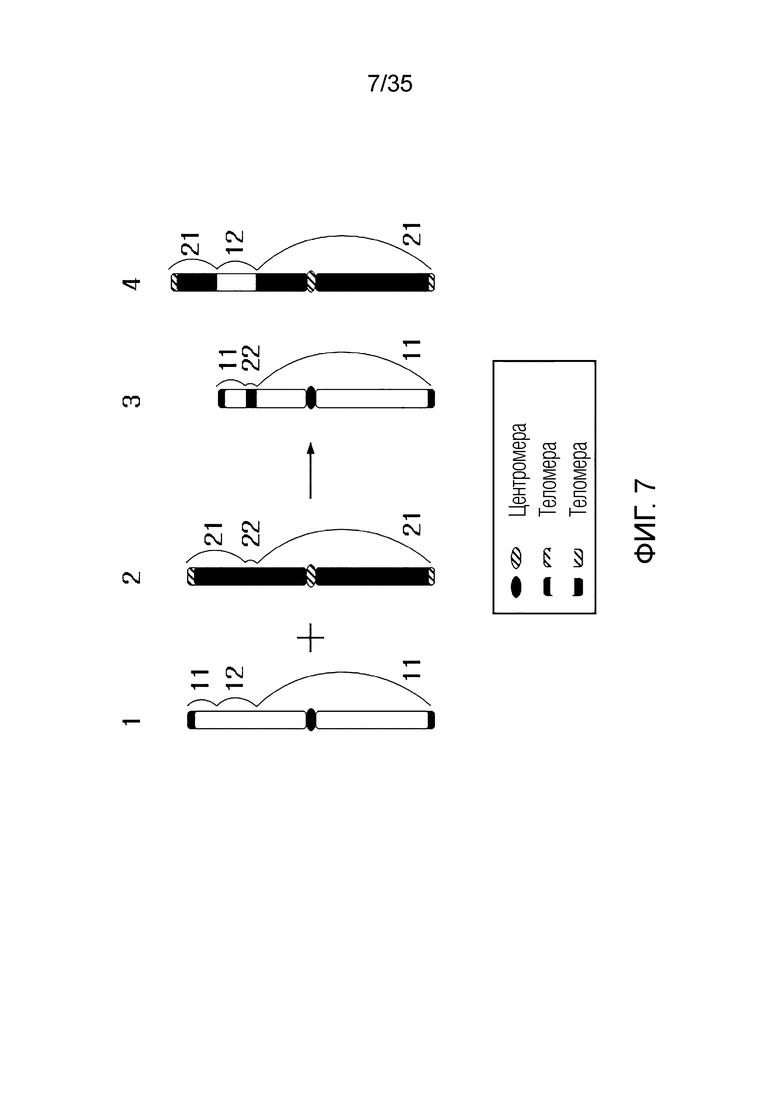
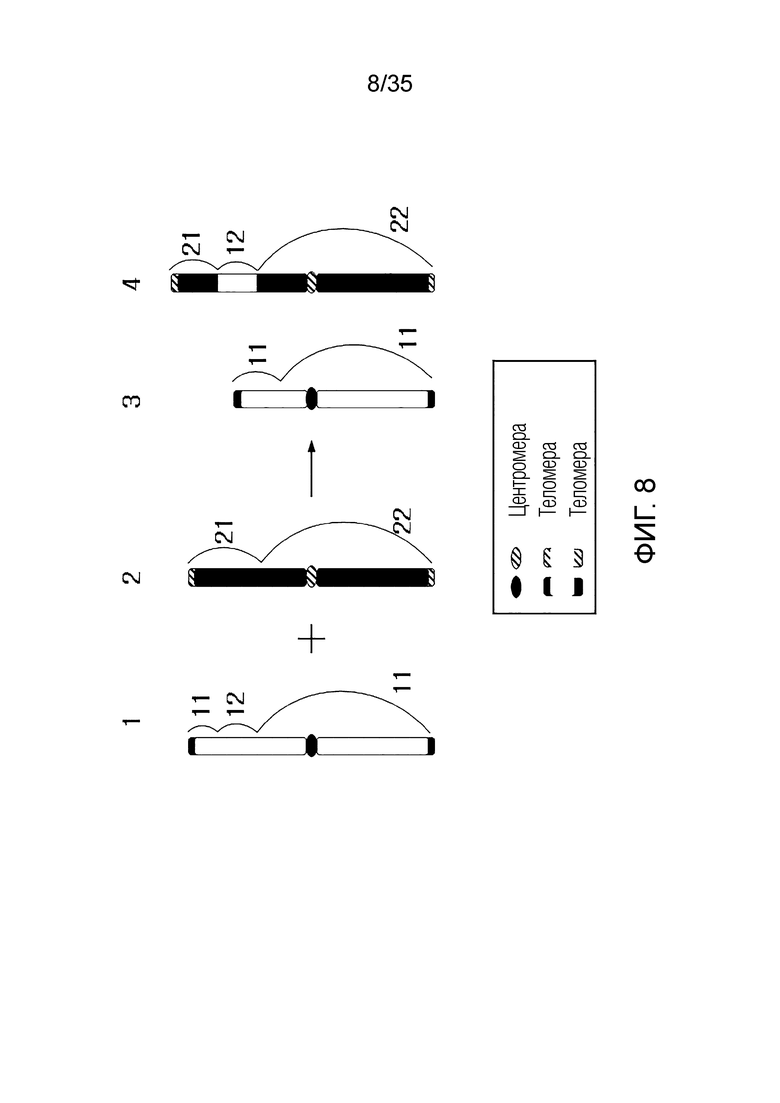
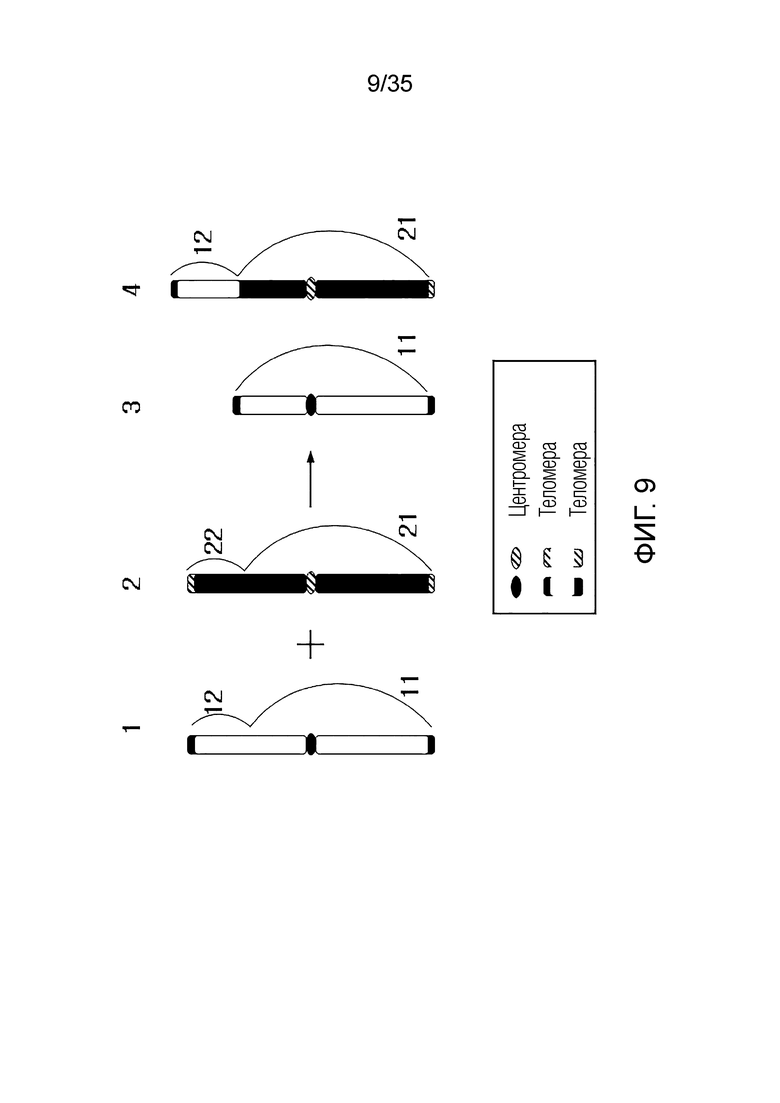
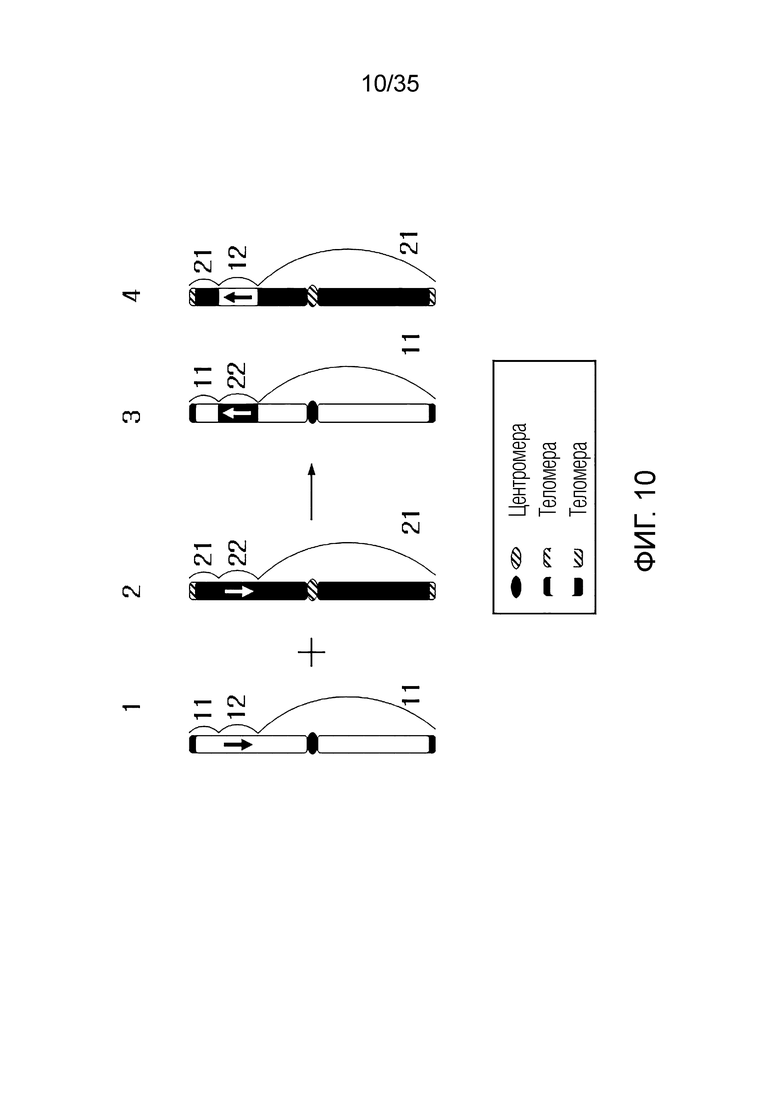
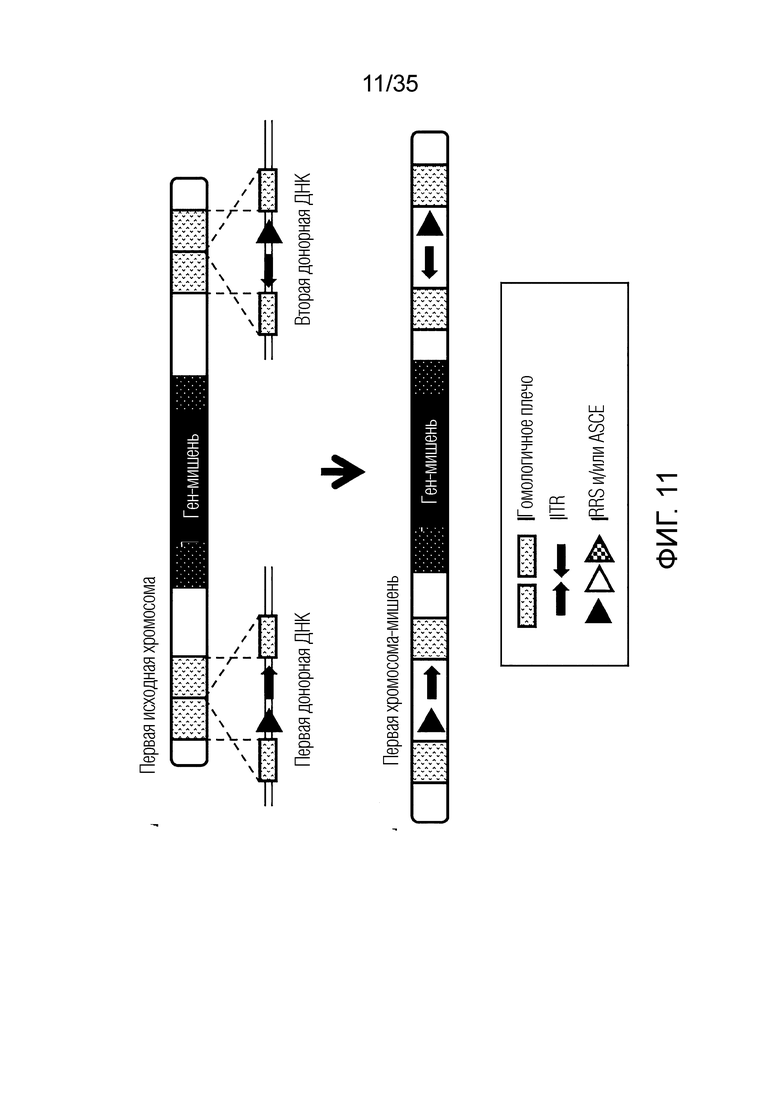
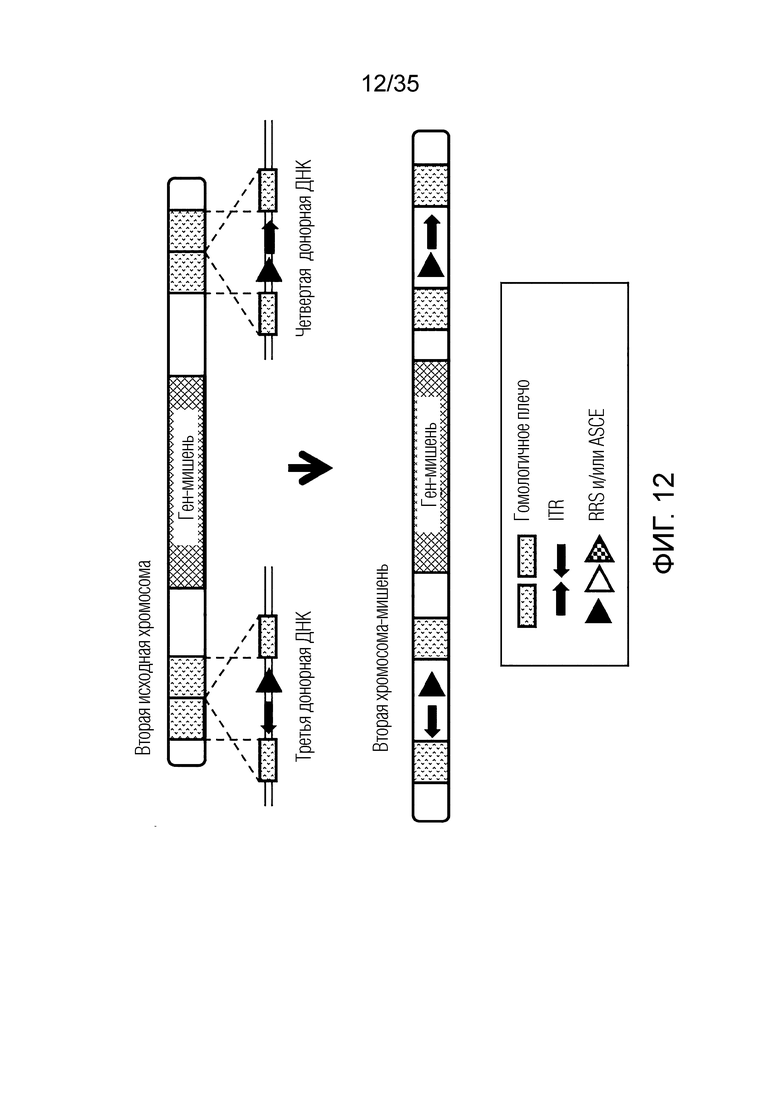
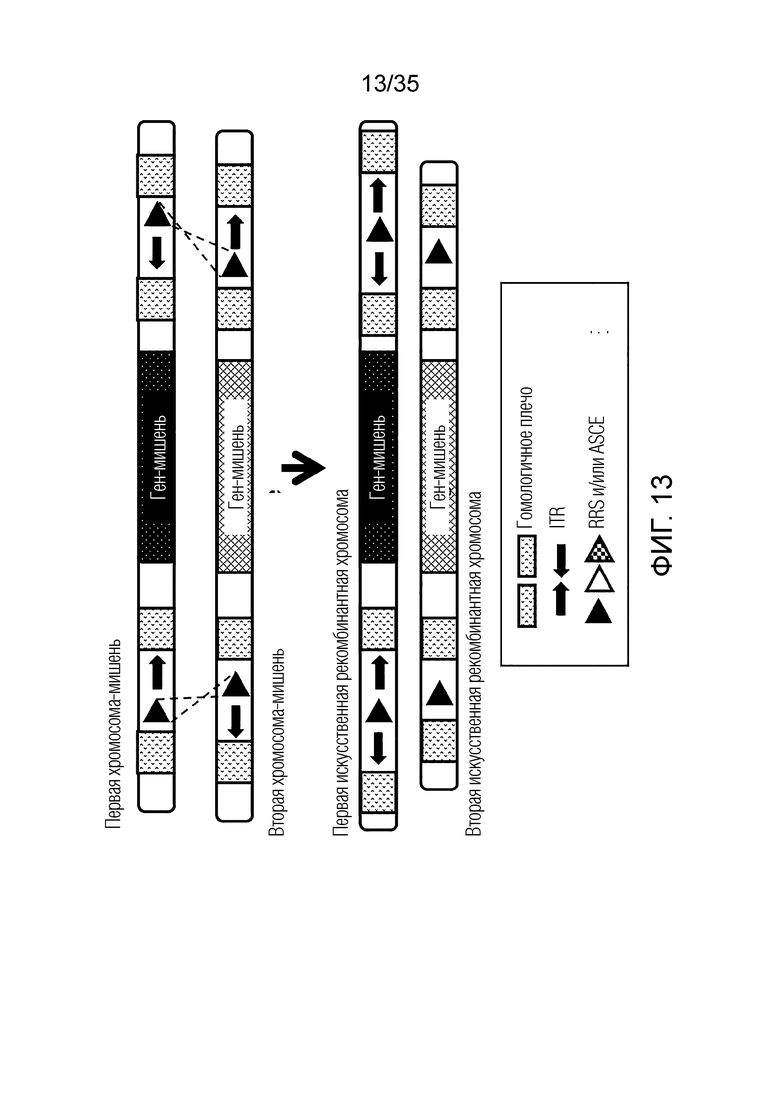
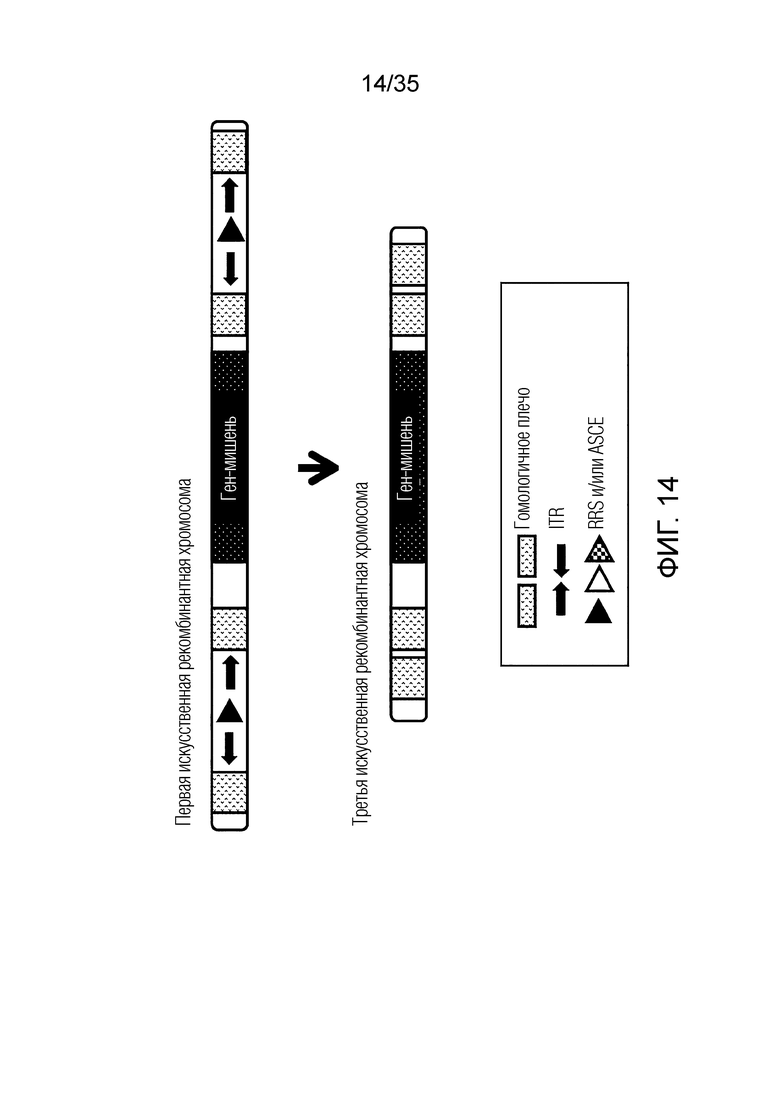
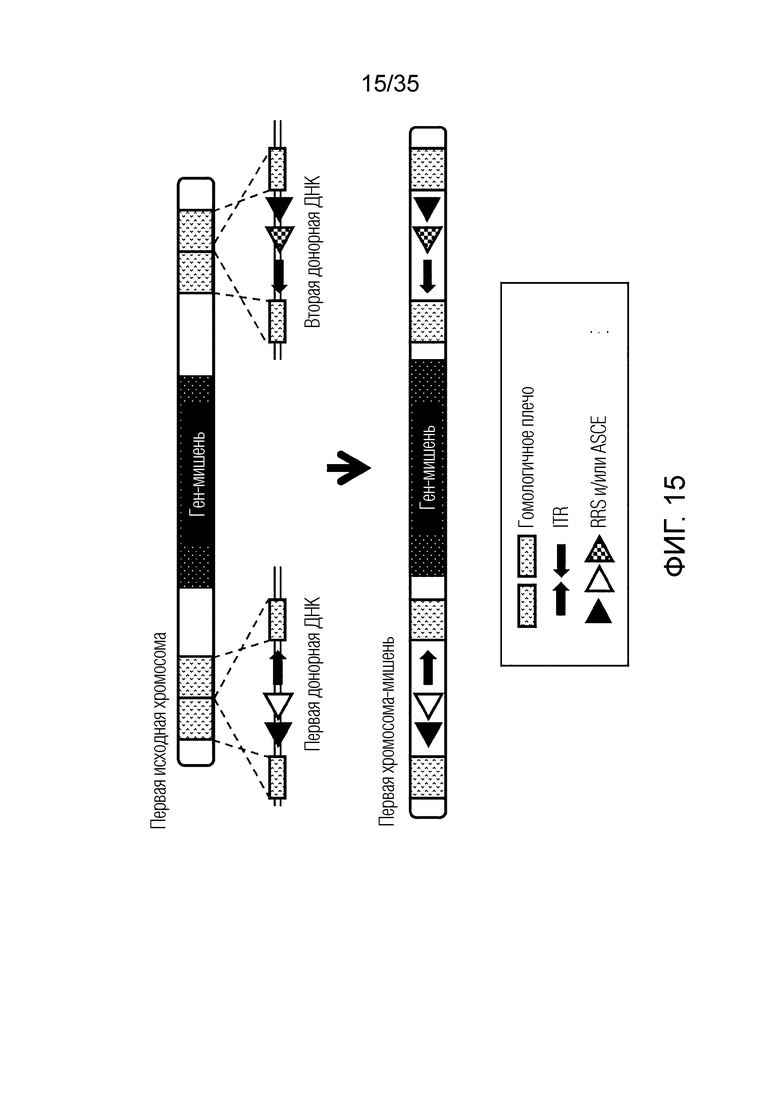
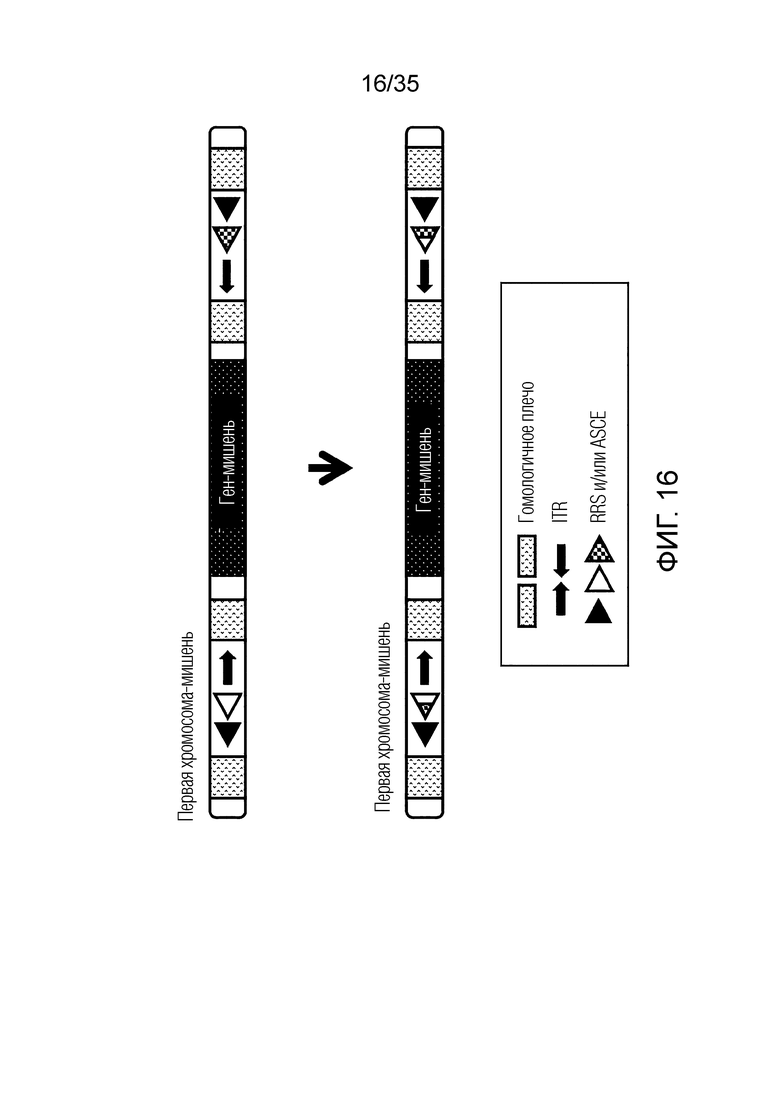
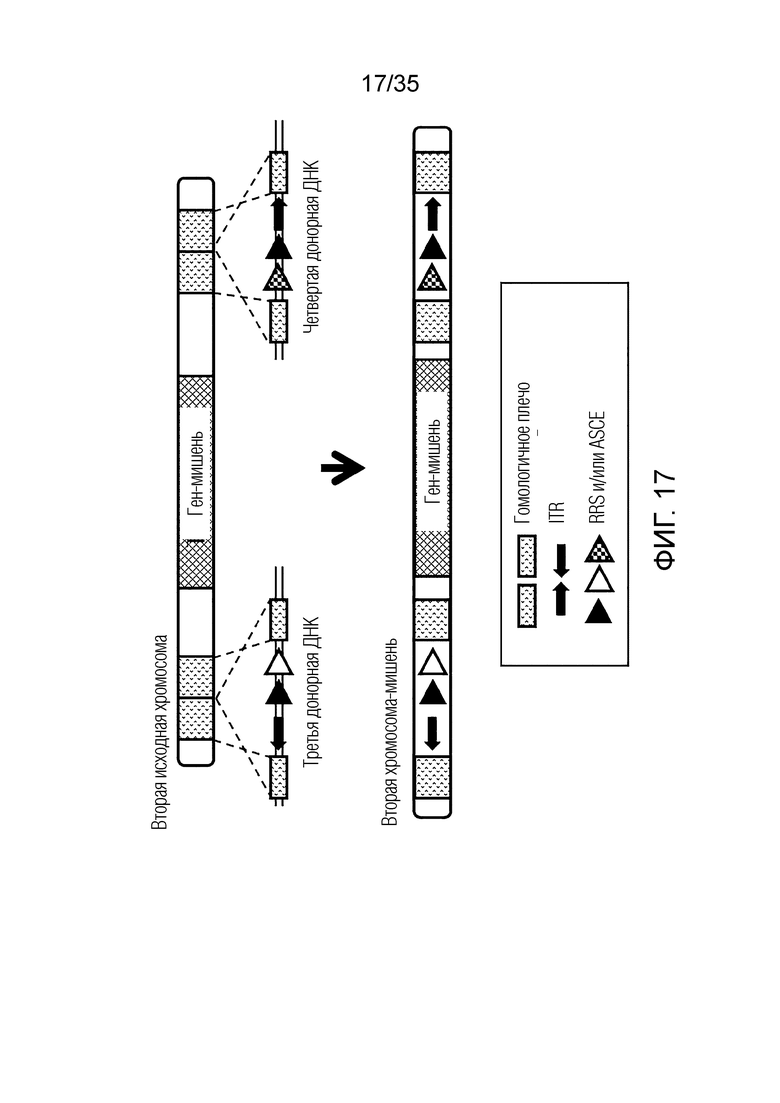
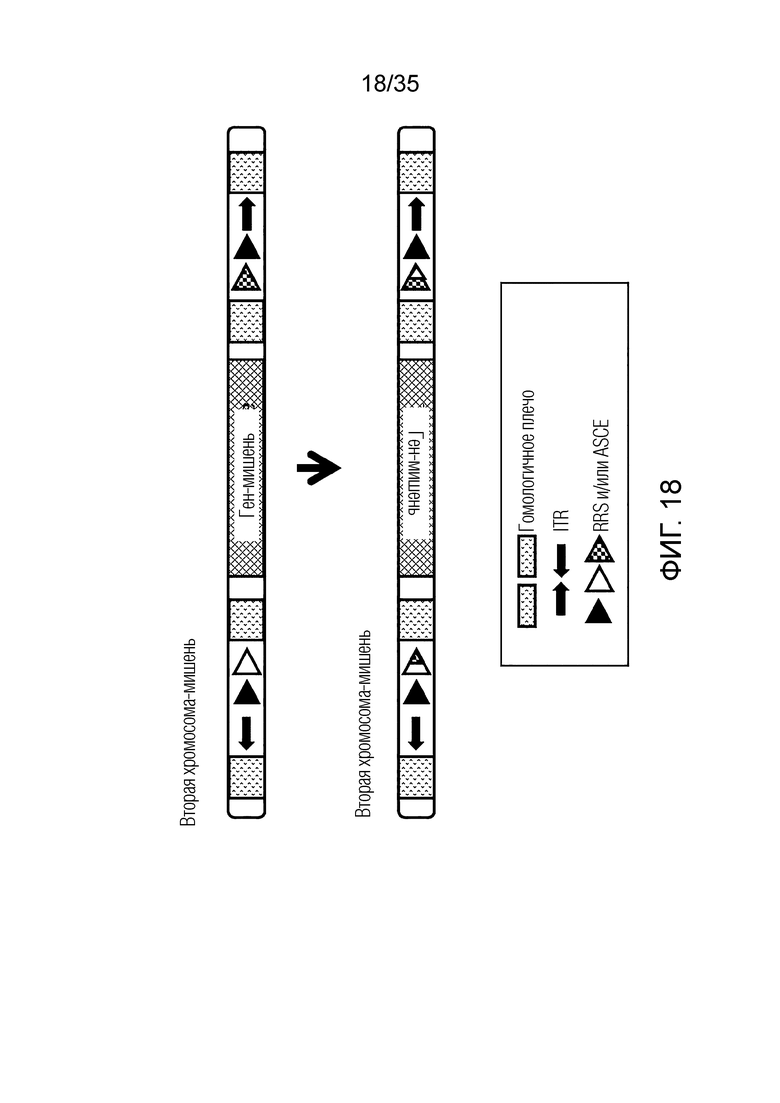
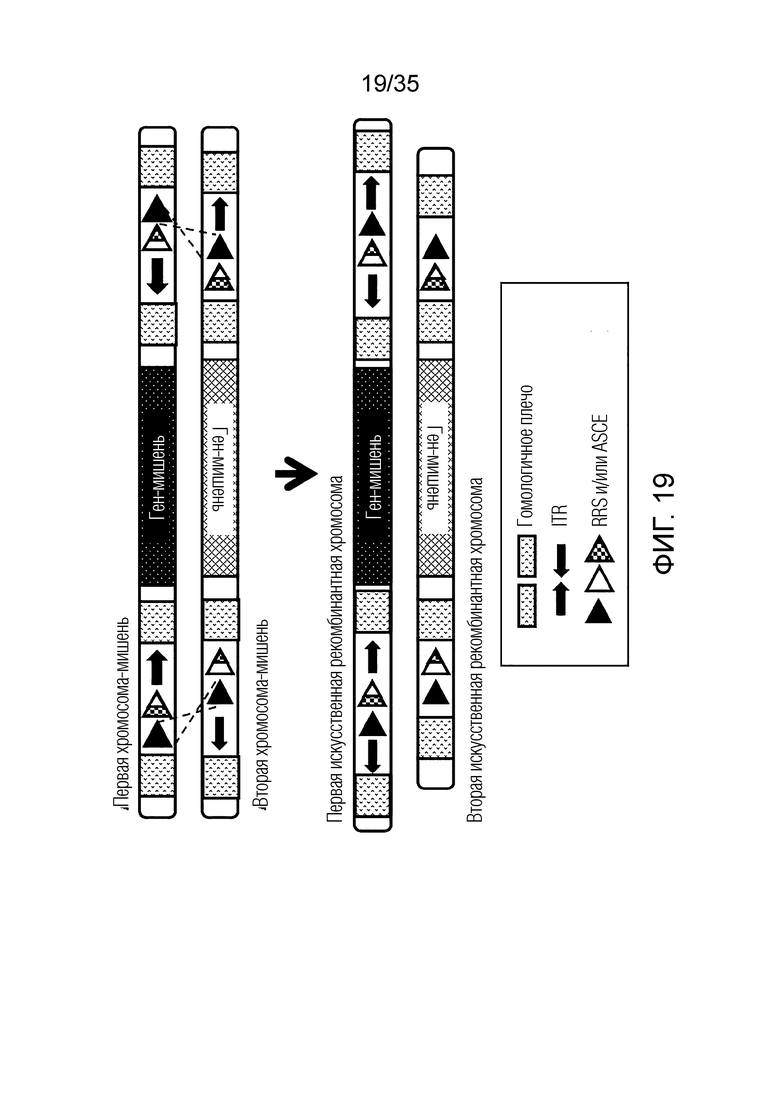
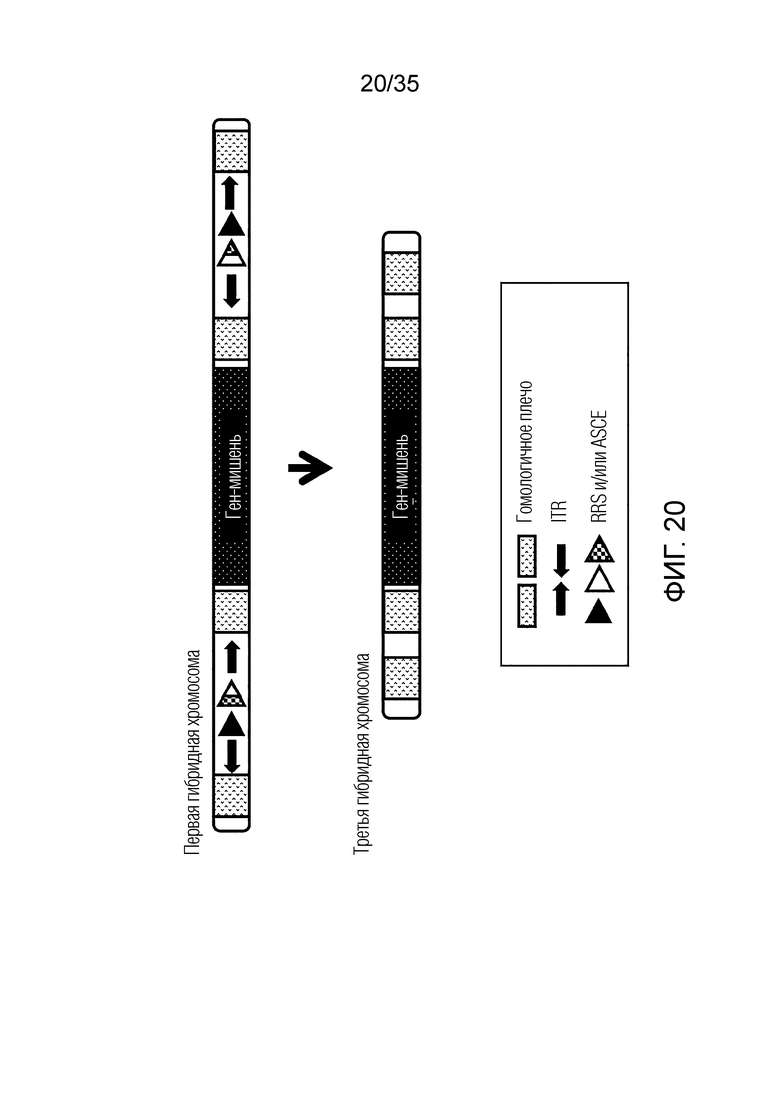
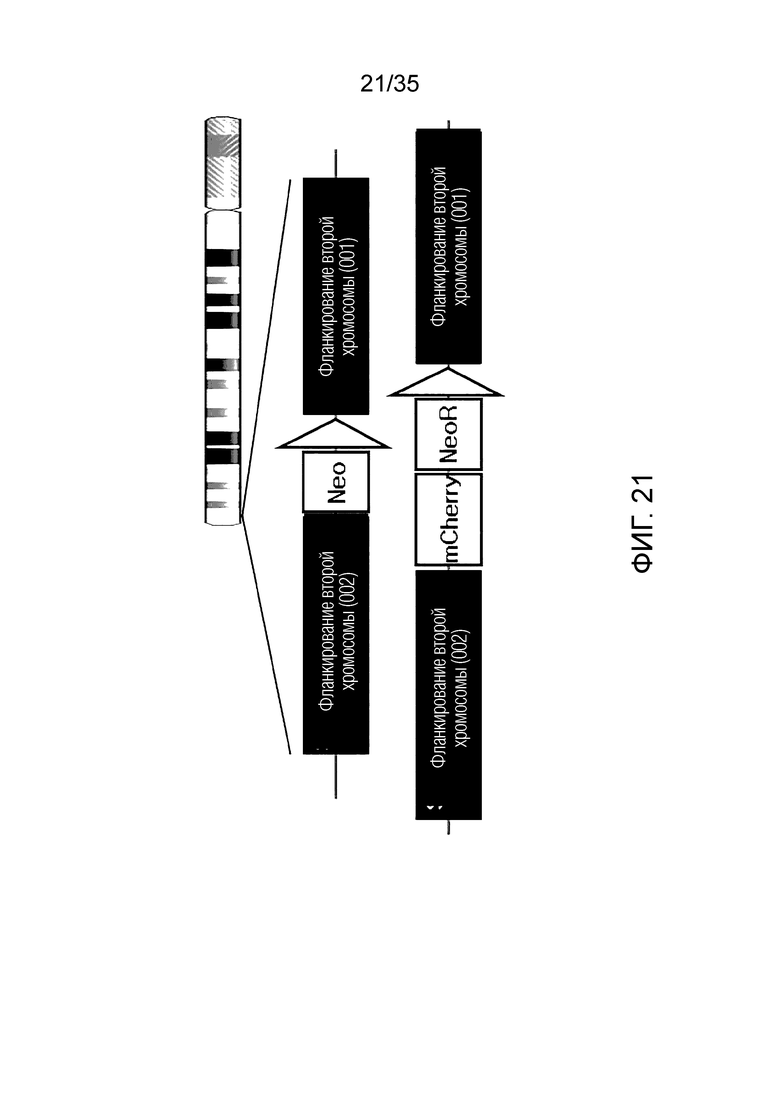
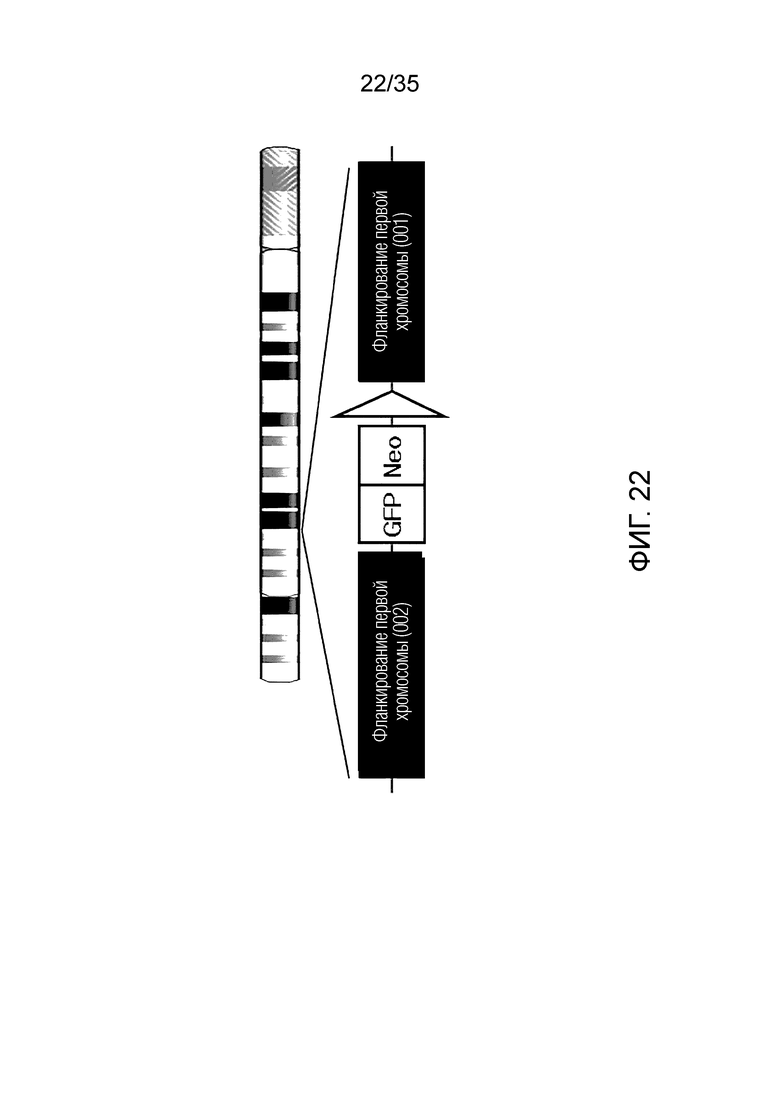
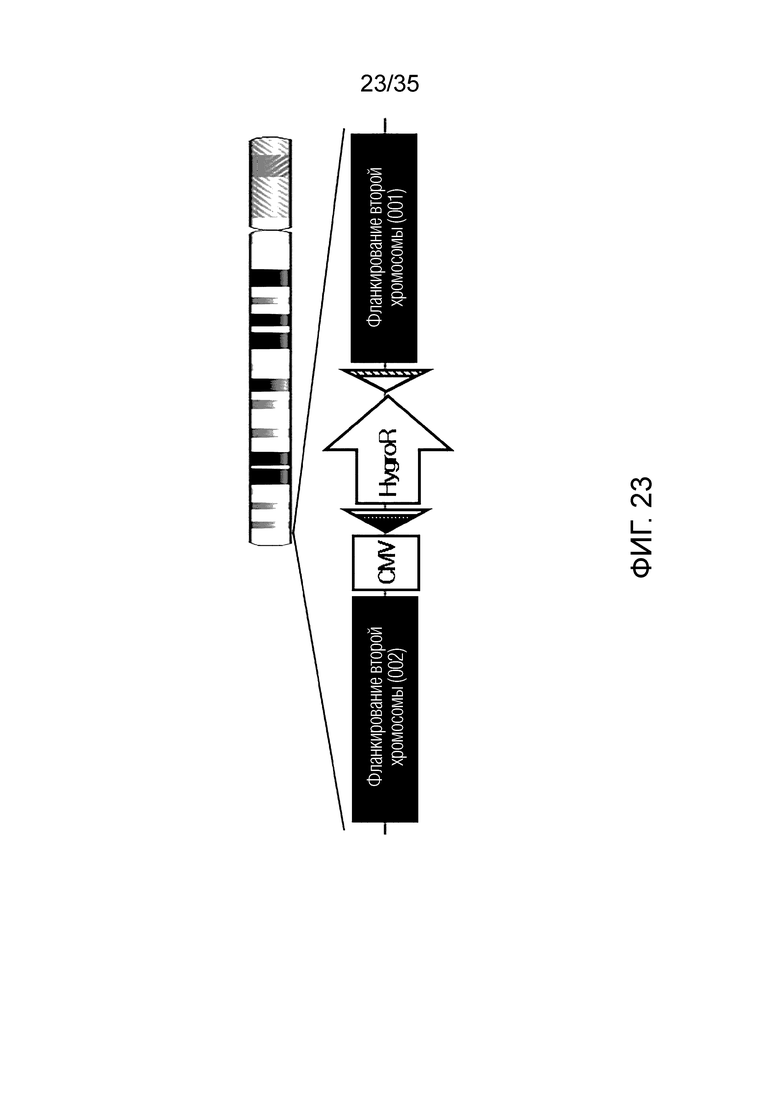
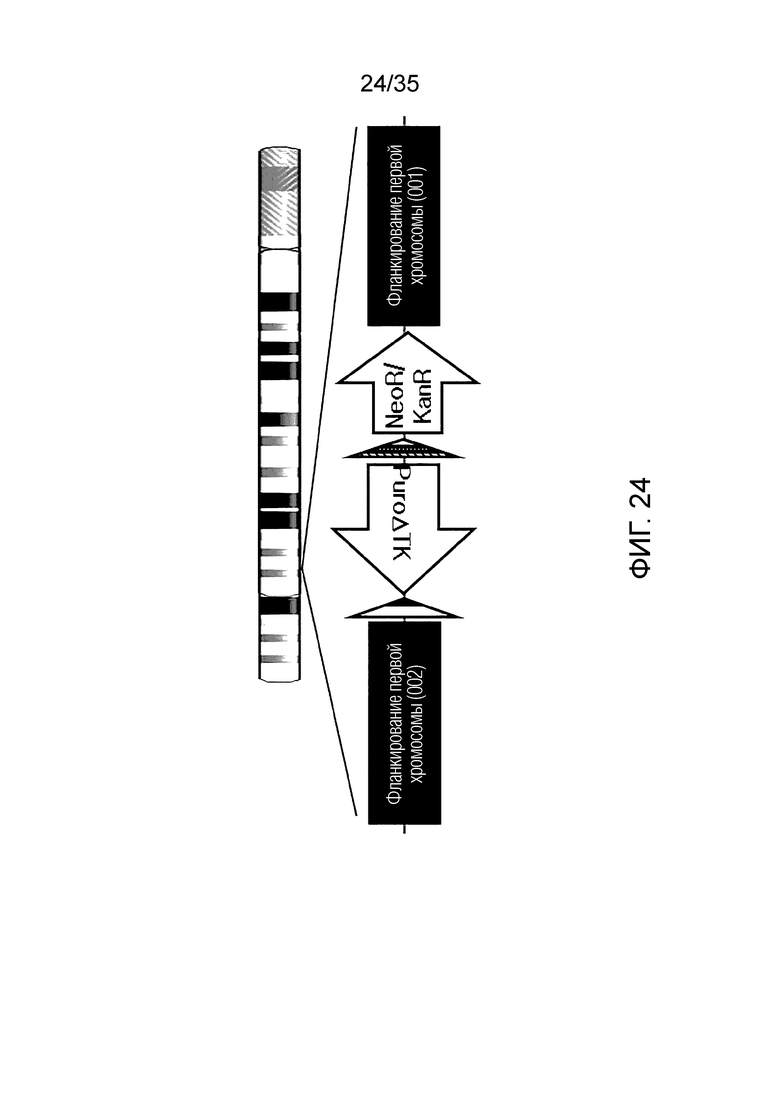








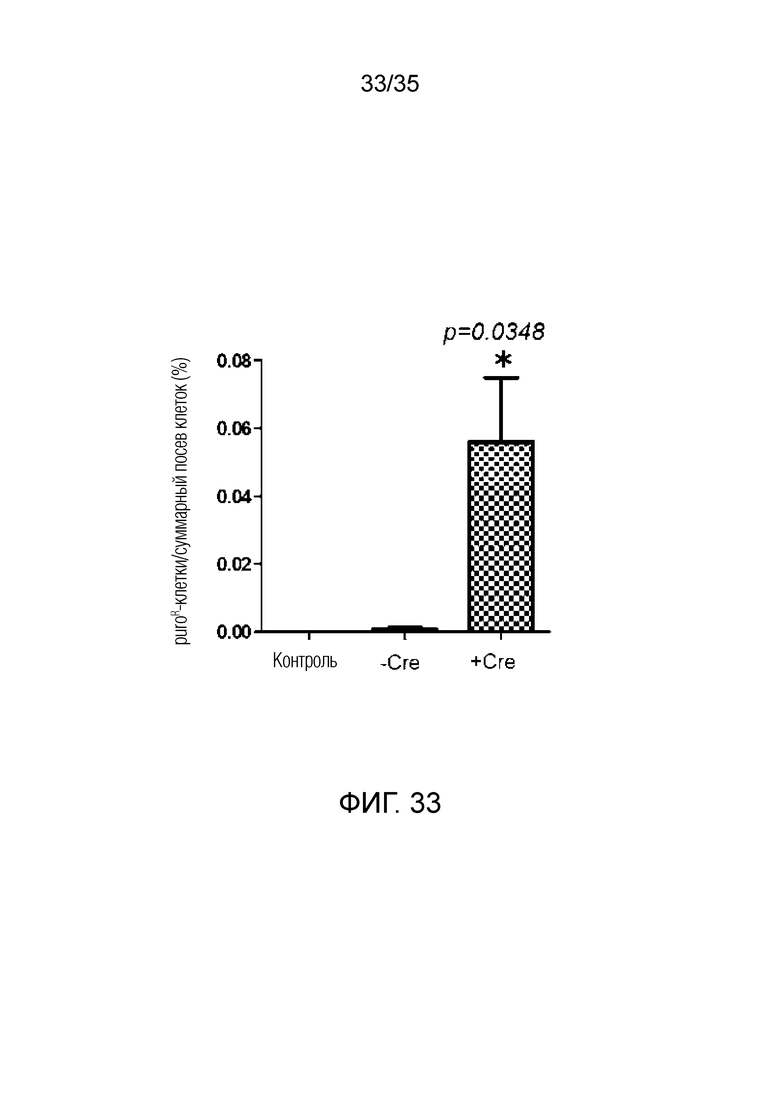
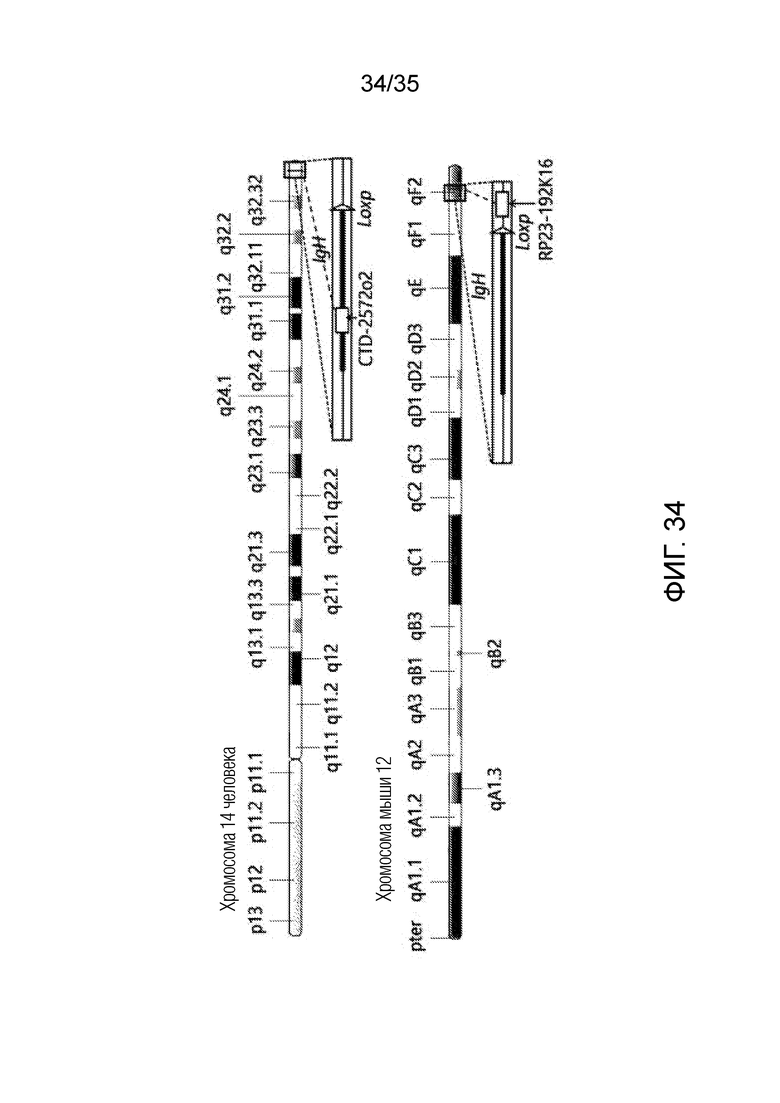
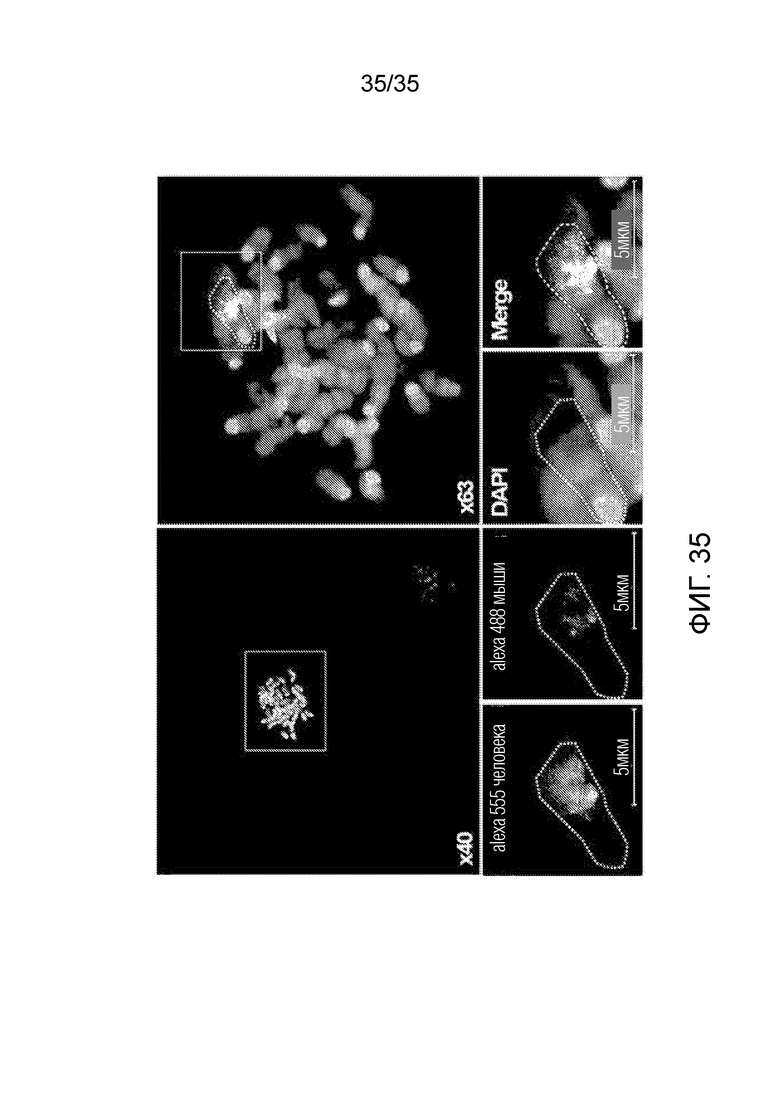
Изобретение относится к области биотехнологии, в частности к способу получения клетки трансгенной мыши, включающей искусственную рекомбинантную хромосому, предусматривающему подготовку человеческой клетки, содержащей первую хромосому человека, обработку человеческой клетки для получения сконструированной человеческой клетки, обработку сконструированной человеческой клетки для получения первой человеческой микроклетки, содержащей первую сконструированную хромосому человека, подготовку мышиной ES-клетки, содержащей первую хромосому мыши, обработку мышиной ES-клетки для получения сконструированной мышиной ES-клетки, содержащей вторую сконструированную хромосому мыши, приведение сконструированной ES-мышиной клетки в контакт с первой человеческой микроклеткой, а также применение сайт-специфической рекомбиназы (SSR). Также раскрыт способ получения трансгенной мыши с использованием клетки трансгенной мыши, включающей искусственную рекомбинантную хромосому. Изобретение эффективно для получения клетки мыши, включающей искусственную рекомбинантную хромосому. 2 н. и 8 з.п. ф-лы, 35 ил., 5 табл., 3 пр.
1. Способ получения клетки трансгенной мыши, включающей искусственную рекомбинантную хромосому, включающий:
i) подготовку человеческой клетки, содержащей первую хромосому человека, содержащей природную центромеру человека, ген иммуноглобулина (ген Ig) человека и природную теломеру человека;
ii) обработку человеческой клетки для получения сконструированной человеческой клетки, содержащей первую сконструированную хромосому человека, которая включает ген Ig человека, расположенный между первой последовательностью распознавания рекомбиназы (первой RRS) и второй последовательностью распознавания рекомбиназы (второй RRS),
при этом первая RRS и вторая RRS расположены между природной центромерой человека и природной теломерой человека первой сконструированной хромосомы человека соответственно;
iii) обработку сконструированной человеческой клетки для получения первой человеческой микроклетки, содержащей первую сконструированную хромосому человека;
iv) подготовку мышиной ES-клетки, содержащей первую хромосому мыши, содержащую природную центромеру мыши, ген Ig мыши и природную теломеру мыши;
v) обработку мышиной ES-клетки для получения сконструированной мышиной ES-клетки, содержащей вторую сконструированную хромосому мыши, которая включает ген Ig мыши, расположенный между третьей последовательностью распознавания рекомбиназы (третьей RRS) и четвертой последовательностью распознавания рекомбиназы (четвертой RRS),
при этом третья RRS и четвертая RRS расположены между природной центромерой мыши и природной теломерой мыши второй сконструированной хромосомы мыши соответственно, и
при этом первая RRS способна соединяться с третьей RRS, а вторая RRS способна соединяться с четвертой RRS;
vi) приведение сконструированной ES-мышиной клетки в контакт с первой человеческой микроклеткой для получения слитой клетки, содержащей первую сконструированную хромосому человека и вторую сконструированную хромосому мыши; и
vii) применение сайт-специфической рекомбиназы (SSR) к слитой клетке вызывает межхромосомный обмен между геном Ig человека из первой сконструированной хромосомы человека и геном Ig мыши из второй сконструированной хромосомы мыши в слитой клетке, так что продуцируется клетка трансгенной мыши, которая содержит искусственную рекомбинантную хромосому,
при этом искусственная рекомбинантная хромосома содержит природную центромеру мыши, природную теломеру мыши и ген Ig человека, который расположен между природной центромерой мыши и природной теломерой мыши,
при этом искусственная рекомбинантная хромосома не содержит ген Ig мыши.
2. Способ по п.1,
в котором первая RRS выбрана из loxP и варианта loxP, и
в котором третья RRS выбрана из loxP и варианта loxP.
3. Способ по п.1 или 2,
в котором вторая RRS выбрана из loxP и варианта loxP, и
в котором четвертая RRS выбрана из loxP и варианта loxP.
4. Способ по п.2 или 3,
в котором SSR представляет собой Cre-рекомбиназу.
5. Способ по п.1,
в котором первая RRS выбрана из FRT, attP, attB, ITR и их вариантов, и
в котором третья RRS выбрана из FRT, attP, attB, ITR и их вариантов.
6. Способ по п.1 или 5,
в котором вторая RRS выбрана из FRT, attP, attB, ITR и их вариантов, и
в котором четвертая RRS выбрана из FRT, attP, attB, ITR и их вариантов.
7. Способ по п.5 или 6,
в котором SSR выбрана из флиппазы (FLP), интегразы и транспозазы.
8. Способ по любому из пп.1-7,
в котором клетка трансгенной мыши, содержащая искусственную рекомбинантную хромосому, может претерпевать митоз или мейоз.
9. Способ по любому из пп.1-8,
в котором клетка трансгенной мыши, содержащая искусственную рекомбинантную хромосому, настроена для экспрессии гена Ig человека.
10. Способ получения трансгенной мыши с использованием клетки трансгенной мыши, включающей искусственную рекомбинантную хромосому, включающий:
i) подготовку мышиной ES-клетки, содержащей первую хромосому мыши, содержащую природную центромеру мыши, ген Ig мыши и природную теломеру мыши;
ii) обработку человеческой клетки для получения сконструированной человеческой клетки, содержащей первую сконструированную хромосому человека, которая включает ген Ig человека, расположенный между первой последовательностью распознавания рекомбиназы (первой RRS) и второй последовательностью распознавания рекомбиназы (второй RRS),
при этом первая RRS и вторая RRS расположены между природной центромерой человека и природной теломерой человека первой сконструированной хромосомы человека соответственно;
iii) обработку сконструированной человеческой клетки для получения первой человеческой микроклетки, содержащей первую сконструированную хромосому человека;
iv) подготовку мышиной ES-клетки, содержащей первую хромосому мыши, содержащую природную центромеру мыши, ген Ig мыши и природную теломеру мыши;
v) обработку мышиной ES-клетки для получения сконструированной мышиной ES-клетки, содержащей вторую сконструированную хромосому мыши, которая включает ген Ig мыши, расположенный между третьей последовательностью распознавания рекомбиназы (третьей RRS) и четвертой последовательностью распознавания рекомбиназы (четвертой RRS),
при этом третья RRS и четвертая RRS расположены между природной центромерой мыши и природной теломерой мыши второй сконструированной хромосомы мыши соответственно, и
при этом первая RRS способна соединяться с третьей RRS, и вторая RRS способна соединяться с четвертой RRS;
vi) приведение сконструированной мышиной ES-клетки в контакт с первой человеческой микроклеткой с получением слитой клетки, содержащей первую сконструированную хромосому человека и вторую сконструированную хромосому мыши;
vii) применение сайт-специфической рекомбиназы (SSR) к слитой клетке вызывает межхромосомный обмен между геном Ig человека первой сконструированной хромосомы человека и геном Ig мыши второй сконструированной мышиной хромосомы в слитой клетке, так что продуцируется трансгенная клетка мыши, содержащая искусственную рекомбинантную хромосому,
при этом искусственная рекомбинантная хромосома содержит природную центромеру мыши, природную теломеру мыши и ген Ig человека, который расположен между природной центромерой мыши и природной теломерой мыши,
при этом искусственная рекомбинантная хромосома не содержит ген Ig мыши; и
viii) имплантацию химерной бластоцисты, содержащей искусственную рекомбинантную хромосому, в матку суррогатной матери для получения потомства,
где химерную бластоцисту получают путем инъекции трансгенной мышиной клетки, включающей искусственную рекомбинантную хромосому, в бластоцисту.
| SHOKO TAKEHARA et al | |||
| A novel transchromosomic system: stable maintenance of an engineered Mb-sized human genomic fragment translocated to a mouse chromosome terminal region, Transgenic Research, 2014, 23(3), 441-453 | |||
| HELEN A.C | |||
| WALLACE et al | |||
| Manipulating the Mouse Genome to Engineer Precise Functional Syntenic Replacements with Human Sequence, |
Авторы
Даты
2024-01-11—Публикация
2019-11-12—Подача