ОБЛАСТЬ ТЕХНИКИ
Настоящая заявка испрашивает приоритет на основании корейских патентных заявок № 10-2020-0052513 и 10-2020-0052913, поданных 29 апреля 2020 года, которые включены в настоящую заявку посредством ссылки в полном объеме.
Настоящее изобретение относится к варианту интерферона-бета человека с двойной мутацией и к способу улучшения стабильности варианта интерферона-бета человека и, более конкретно, к варианту интерферона-бета человека, содержащему аминокислотную последовательность, включающую замену серином цистеина в аминокислотном положении 17 интерферона-бета человека и замену треонином аргинина в аминокислотном положении 27 интерферона-бета человека, и к способу улучшения стабильности варианта R27T интерферона-бета человека, включающему стадию замены серином цистеина в аминокислотном положении 17 в варианте R27T интерферона-бета человека, в котором аргинин в аминокислотном положении 27 интерферона-бета человека заменен треонином.
УРОВЕНЬ ТЕХНИКИ
Интерфероны (IFN) представляют собой тип цитокинов, обладают противовирусной активностью и выполняют функции ингибирования пролиферации клеток и регулирования врожденных иммунных ответов, и среди них интерферон-бета (IFN-β) представляет собой глобулярный белок с пятью альфа-спиралями, размер которого составляет 22 кДа и становится равным 18 кДа при удалении сахарных цепей (Arduini etc., Protein Science 8: pp1867-1877, 1999).
Активно ведутся исследования по клиническому применению интерферона-бета, и, в частности, интерферон-бета находится в центре внимания как препарат для облегчения, уменьшения или лечения симптомов рассеянного склероза.
Интерферон-бета обладает различными иммунологическими активностями, такими как противовирусная активность, ингибирование роста клеток или антипролиферативная активность, активность усиления цитотоксичности лимфоцитов, иммуномодулирующая активность, индукция дифференцировки или ингибирующая активность в отношении клеток-мишеней, активность активации макрофагов, повышенная активность продукции цитокинов, повышенная активность цитотоксических Т-клеток, повышенная активность естественных киллеров и т. д., помимо рассеянного склероза. Соответственно, сообщается, что интерферон-бета эффективен при лечении рака, аутоиммунных нарушений, вирусных инфекций, заболеваний, связанных с ВИЧ, гепатита С, ревматоидного артрита и тому подобного.
В настоящее время для лечения используются два типа интерферона-бета. Во-первых, интерферон-бета-1a представляет собой гликозилированный белок, который получают из яичника китайского хомячка (CHO), включающего ген интерферона-бета человека, состоит из 166 аминокислотных остатков и имеет размер 22 кДа. Во-вторых, интерферон-бета-1b представляет собой белок, состоящий из 165 аминокислотных остатков, получаемый из E. coli, в котором удален сахар, удален остаток метионина в первом аминокислотном положении, а 17-й остаток цистеина заменен серином. Интерферон-бета-1a, который в настоящее время доступен на рынке, включает Rebif и Avonex, а интерферон-бета-1b включает Betaseron и Extavia.
С другой стороны, интерферон-бета человека также является видом гликопротеина, и поскольку часть сахарной цепи, связанная с белком, играет важную роль в активности белка, в случае гликопротеина его активность может быть увеличена при добавлении сахарных цепей. То есть известно, что гликозилирование белка может влиять на многие биохимические свойства, такие как стабильность, растворимость, внутриклеточная транспортная активность, фармакокинетика и антигенность.
Соответственно, сообщалось о примере получения варианта интерферона-бета человека с повышенной или улучшенной активностью или функцией путем введения сахарной цепи в гликопротеин, природный интерферон-бета человека (корейский патент № 0781666). В контексте настоящего документа вариант R27T интерферона-бета человека представляет собой рекомбинантный вариант интерферона-бета человека (далее rhINF-β), сконструированный путем замены треонином (Thr) аргинина (Arg) в положении 27 для дополнительного гликозилирования в положении 25 интерферона-бета-1a, и проявляет эффекты повышенной стабильности, сниженной склонности к агрегации белка и увеличенного периода полувыведения по сравнению с интерфероном-бета-1a дикого типа (Rebif). То есть R27T представляет собой биологически улучшенный вариант rhINF-β, получаемый за счет дополнительного гликозилирования посредством сайт-направленного мутагенеза.
Между тем, одной из основных задач при разработке белковых препаратов является обеспечение белка, который обеспечивает достаточную химическую, физическую и биологическую стабильность, чтобы продемонстрировать улучшенную стабильность в процессе очистки и хранения. Однако все еще трудно достичь высокой стабильности из-за различной присущей восприимчивости к протеолитическим путям и сложности белковых структур с различными уровнями макромолекулярных, вторичных, третичных и четвертичных структур белка.
Инсулин в качестве первого рекомбинантного пептидного гормона был впервые одобрен в 1982 году и успешно производится в течение более 30 лет, и после этого на сегодняшний день сообщалось о случаях успешного получения множества рекомбинантных белковых/пептидных препаратов. Однако в процессе разработки биофармацевтических препаратов, в частности при разработке рецептур, по-прежнему возникают трудности, связанные с различными факторами, такими как агрегация белков, физико-химическая нестабильность, низкий период полувыведения, низкая растворимость и фармакокинетические свойства.
В частности, агрегация и деградация белков являются одной из основных проблем, которые легко возникают почти во всех биофармацевтических процессах, в которых терапевтические белки структурно/термодинамически нестабильны в растворе во время хранения. Поскольку терапевтические белки чувствительны к структурным изменениям из-за различных факторов во время очистки, обработки и хранения, эти проблемы могут усугубляться, когда белки подвергаются воздействию жестких условий, таких как повторное замораживание/размораживание и хранение в буферах с различным рН. Кроме того, поскольку биофармацевтические препараты на основе белков имеют возможность физической деградации, например, образования нерастворимых частиц из-за разворачивания, агрегации и ненативного сворачивания, важно избегать агрегации белка или физической денатурации и максимизировать стабильность.
В 2004 году были разработаны мутированные белки интерферона-бета, вызывающие мутацию гликозилирования интерферона (корейский патент № 781666), и проведены исследования по применению таких белков в качестве терапевтических агентов. Поскольку интерферон-бета менее стабилен, в процессе очистки часто происходят реакции деградации, такие как расщепление пептидных связей, дезамидирование и окисление метионина до сульфида метионина и дисульфидный обмен (US2012/0177603), но необходимо учитывать эти реакции деградации.
Соответственно, необходимо разработать вариант интерферона-бета человека, который демонстрирует более высокую эффективность, чем фармацевтический эффект природного интерферона-бета, и требуется способ получения варианта интерферона-бета человека с высоким выходом.
РАСКРЫТИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ЗАДАЧА
Соответственно, авторы настоящего изобретения предприняли попытку разработать вариант интерферона-бета с превосходным фармацевтическим эффектом и улучшенной эффективностью очистки по сравнению с природным интерфероном-бета. В результате авторы настоящего изобретения подтвердили, что вариант интерферона-бета человека, содержащий аминокислотную последовательность, включающую замену серином цистеина в аминокислотном положении 17 и замену треонином аргинина в аминокислотном положении 27 интерферона-бета человека, имел отличную активность интерферона-бета и отличную эффективность в процессе очистки, чтобы его можно было использовать для получения нового интерферона-бета.
Кроме того, авторы настоящего изобретения провели интенсивные исследования для разработки способа улучшения стабильности варианта R27T, который представляет собой вариант интерферона-бета человека, более конкретно, стабильности при очистке, стабильности при хранении и стабильности при замораживании/размораживании, и обнаружили, что возможно достичь поставленной цели путем замены серином цистеина в аминокислотном положении 17, который был 17-й аминокислотой варианта R27T, и таком образом пришли к настоящему изобретению.
Таким образом, задачей настоящего изобретения является обеспечение варианта интерферона-бета человека, содержащего аминокислотную последовательность, включающую замену серином цистеина в аминокислотном положении 17 и замену треонином аргинина в аминокислотном положении 27 интерферона-бета человека.
Другой задачей настоящего изобретения является обеспечение полинуклеотида, кодирующего указанный вариант интерферона-бета человека.
Еще одной задачей настоящего изобретения является обеспечение вектора экспрессии, экспрессирующего интерферон-бета человека в клетке животного, содержащего указанный полинуклеотид.
Еще одной задачей настоящего изобретения является обеспечение клетки животного, трансформированной указанным вектором.
Еще одной задачей настоящего изобретения является обеспечение способа получения варианта интерферона-бета человека, включающего культивирование указанной клетки животного.
Еще одной задачей настоящего изобретения является обеспечение фармацевтической композиции, содержащей указанный вариант интерферона-бета человека в качестве активного ингредиента.
Еще одной задачей настоящего изобретения является обеспечение фармацевтической композиции, состоящей из указанного варианта интерферона-бета человека в качестве активного ингредиента.
Еще одной задачей настоящего изобретения является обеспечение фармацевтической композиции, по существу состоящей из указанного варианта интерферона-бета человека в качестве активного ингредиента.
Еще одной задачей настоящего изобретения является обеспечение способа улучшения стабильности варианта R27T интерферона-бета человека, включающего замену серином цистеина в аминокислотном положении 17 в варианте R27T интерферона-бета человека, в котором аргинин в аминокислотном положении 27 интерферона-бета человека заменен треонином.
Еще одной задачей настоящего изобретения является обеспечение применения указанного варианта интерферона-бета человека для получения агента, оказывающего фармацевтический эффект природного интерферона-бета человека на заболевание, выбранное из группы, состоящей из рассеянного склероза, рака, аутоиммунных нарушений, вирусной инфекции, заболеваний, связанных с ВИЧ, и гепатита С.
Еще одной задачей настоящего изобретения является обеспечение способа лечения заболевания, выбранного из группы, состоящей из рассеянного склероза, рака, аутоиммунных нарушений, вирусной инфекции, заболеваний, связанных с ВИЧ, и гепатита С, включающего введение эффективной дозы композиции, обладающей фармацевтическим эффектом природного интерферона-бета человека и содержащей указанный вариант интерферона-бета человека, нуждающемуся в этом субъекту.
ТЕХНИЧЕСКОЕ РЕШЕНИЕ
Для решения этой задачи согласно настоящему изобретению предложен вариант интерферона-бета человека, содержащий аминокислотную последовательность, включающую замену серином цистеина в аминокислотном положении 17 и замену треонином аргинина в аминокислотном положении 27 интерферона-бета человека.
Для решения другой задачи согласно настоящему изобретению предложен полинуклеотид, кодирующий указанный вариант интерферона-бета человека.
Для решения еще одной задачи согласно настоящему изобретению предложен вектор экспрессии, экспрессирующий интерферон-бета человека в клетке животного, содержащий указанный полинуклеотид.
Для решения еще одной задачи согласно настоящему изобретению предложена клетка животного, трансформированная указанным вектором.
Для решения еще одной задачи согласно настоящему изобретению предложен способ получения варианта интерферона-бета человека, включающий культивирование указанной клетки животного.
Для решения еще одной задачи согласно настоящему изобретению предложена фармацевтическая композиция, содержащая указанный вариант интерферона-бета человека в качестве активного ингредиента.
Кроме того, согласно настоящему изобретению предложена фармацевтическая композиция, состоящая из указанного варианта интерферона-бета человека в качестве активного ингредиента.
Кроме того, согласно настоящему изобретению предложена фармацевтическая композиция, по существу состоящая из указанного варианта интерферона-бета человека в качестве активного ингредиента.
Для решения еще одной задачи согласно настоящему изобретению предложен способ улучшения стабильности варианта R27T интерферона-бета человека, включающий замену серином цистеина в аминокислотном положении 17 в варианте R27T интерферона-бета человека, в котором аргинин в аминокислотном положении 27 интерферона-бета человека заменен треонином.
Для решения еще одной задачи согласно настоящему изобретению предложено применение указанного варианта интерферона-бета человека для получения агента, оказывающего фармацевтический эффект природного интерферона-бета человека на заболевание, выбранное из группы, состоящей из рассеянного склероза, рака, аутоиммунных нарушений, вирусной инфекции, заболеваний, связанных с ВИЧ, и гепатита С.
Для решения еще одной задачи согласно настоящему изобретению предложен способ лечения заболевания, выбранного из группы, состоящей из рассеянного склероза, рака, аутоиммунных нарушений, вирусной инфекции, заболеваний, связанных с ВИЧ, и гепатита С, включающий введение эффективной дозы композиции, обладающей фармацевтическим эффектом природного интерферона-бета человека и содержащей указанный вариант интерферона-бета человека, нуждающемуся в этом субъекту.
Далее настоящее изобретение будет описано подробно.
Вариант интерферона-бета человека с двойной мутацией согласно настоящему изобретению представляет собой вариант интерферона-бета человека, содержащий аминокислотную последовательность, включающую замену серином цистеина в аминокислотном положении 17 и замену треонином аргинина в аминокислотном положении 27 интерферона-бета человека.
В настоящем изобретении «вариант интерферона-бета человека» представляет собой все полипептиды, имеющие всю или часть аминокислотной последовательности, полученной из интерферона-бета человека, и обладающие активностью интерферона-бета человека, при этом включающие замену серином цистеина в аминокислотном положении 17 и замену треонином аргинина в аминокислотном положении 27 в природном интерфероне-бета человека.
«Активность интерферона-бета человека» в контексте настоящего документа определена как один или более видов активности, которых достаточно, чтобы идентифицировать любой полипептид как интерферона-бета человека, среди известных видов активности интерферона-бета человека. Эти виды активности могут включать, например, активность уменьшения, облегчения или лечения рассеянного склероза, противовирусную активность, активность ингибирования роста клеток, активность подавления роста, антипролиферативную активность, активность усиления токсичности лимфоцитов, иммунорегулирующую активность, активность индукции дифференцировки или ингибирования клеток-мишеней, повышенную активность продукции цитокинов, повышенную активность цитотоксических Т-клеток, повышенную активность макрофагов, повышенную активность естественных киллеров, активность предупреждения или лечения рака, активность предупреждения или лечения аутоиммунных нарушений, активность предупреждения или лечения вирусной инфекции, активность предупреждения или лечения заболеваний, связанных с ВИЧ, активность предупреждения или лечения гепатита С, активность предупреждения или лечения ревматоидного артрита и тому подобное.
Вариант интерферона-бета человека с двойной мутацией согласно настоящему изобретению наиболее предпочтительно представляет собой полипептид, содержащий аминокислотную последовательность, включающую замену серином цистеина в аминокислотном положении 17 и замену треонином аргинина в аминокислотном положении 27 в природном интерфероне-бета человека, имеющем аминокислотную последовательность SEQ ID NO: 1.
В настоящем изобретении вариант, включающий замену серином цистеина в аминокислотном положении 17 и замену треонином аргинина в аминокислотном положении 27 в природном интерфероне-бета человека, может содержать аминокислотную последовательность SEQ ID NO: 3, в частности, по существу состоять из аминокислотной последовательности SEQ ID NO: 3, более конкретно, состоять из аминокислотной последовательности SEQ ID NO: 3, но не ограничивается перечисленным.
SEQ ID NO: 1:
MSYNLLGFLQRSSNFQCQKLLWQLNGRLEYCLKDRMNFDIPEEIKQLQQFQKEDAALTIYEMLQNIFAIFRQDSSSTGWNETIVENLLANVYHQINHLKTVLEEKLEKEDFTRGKLMSSLHLKRYYGRILHYLKAKEYSHCAWTIVRVEILRNFYFINRLTGYLRN
SEQ ID NO: 3:
MSYNLLGFLQRSSNFQSQKLLWQLNGTLEYCLKDRMNFDIPEEIKQLQQFQKEDAALTIYEMLQNIFAIFRQDSSSTGWNETIVENLLANVYHQINHLKTVLEEKLEKEDFTRGKLMSSLHLKRYYGRILHYLKAKEYSHCAWTIVRVEILRNFYFINRLTGYLRN
Кроме того, вариант интерферона-бета человека согласно настоящему изобретению может представлять собой вариант интерферона-бета человека, включающий замену серином цистеина в аминокислотном положении 17 и замену треонином аргинина в аминокислотном положении 27 интерферона-бета человека с SEQ ID NO: 1, который обладает по меньшей мере 90% гомологией последовательности с интерфероном-бета дикого типа с SEQ ID NO: 1 и обладает активностью интерферона-бета.
Термин «вариант» в контексте настоящего документа относится к белку, в котором одна или более аминокислот отличаются от указанной последовательности за счет консервативных замен и/или модификаций, но функции или свойства белка сохраняются. Вариант отличается от идентифицированной последовательности заменой, делецией или добавлением нескольких аминокислот. Такой вариант, как правило, может быть идентифицирован путем модификации одной или более аминокислот аминокислотной последовательности или белка и оценки модифицированного белка. То есть способность варианта может быть повышена, неизменна или снижена по сравнению с нативным белком. Кроме того, некоторые варианты могут включать варианты, в которых удалены одна или более частей, таких как N-концевая лидерная последовательность или трансмембранный домен. Другие варианты могут включать варианты, в которых удалена часть с N- и/или C-конца зрелого белка. Термин «вариант» может быть использован применительно к модификации, модифицированному белку, модифицированному полипептиду, мутанту, мутеину, дивергенту, варианту и т. д., и любой термин, используемый в значении модификации, не ограничивается перечисленным. Для целей настоящего изобретения вариант может иметь повышенную активность мутированного белка по сравнению с природным белком дикого типа или немодифицированным белком, но не ограничивается перечисленным.
Термин «консервативная замена», используемый в настоящем документе, означает замену одной аминокислоты другой аминокислотой, имеющей схожее структурное и/или химическое свойство. Вариант может иметь, например, одну или более консервативных замен при сохранении одного или более видов биологической активности. Эти аминокислотные замены обычно могут иметь место на основе полярности, заряда, растворимости и сходства гидрофобной, гидрофильной и/или амфипатической природы остатков. Например, среди аминокислот с электрически заряженными аминокислотными боковыми группами положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин, а отрицательно заряженные (кислые) аминокислоты включают глутаминовую кислоту и аспарагиновую кислоту. Среди аминокислот с незаряженными аминокислотными боковыми группами неполярные аминокислоты включают глицин, аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан и пролин, а полярные или гидрофильные аминокислоты включают серин, треонин, цистеин, тирозин, аспарагин и глутамин. Среди неполярных аминокислот ароматические аминокислоты включают фенилаланин, триптофан и тирозин.
Кроме того, вариант может дополнительно включать делецию или добавление аминокислот, которые оказывают минимальное влияние на свойства и вторичную структуру полипептида. Например, полипептид может быть конъюгирован с сигнальной (или лидерной) последовательностью на N-конце белка, участвующей в переносе белка котрансляционно или посттрансляционно.
В одном из аспектов настоящего изобретения вариант интерферона-бета человека может включать аминокислотную последовательность, в которой треонин фиксирован в аминокислотном положении 27 и серин фиксирован в аминокислотном положении 17 белка интерферона-бета человека дикого типа с SEQ ID NO: 1, и обладающую по меньшей мере 80% гомологией или идентичностью, но не ограничивается перечисленным. В частности, вариант настоящего изобретения может включать белок, обладающий по меньшей мере 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% гомологией или идентичностью аминокислотной последовательности SEQ ID NO: 3. Кроме того, если вариант представляет собой аминокислотную последовательность, обладающую такой гомологией или идентичностью и проявляющей эффективность, соответствующую указанному белку, очевидно, что белок, имеющий аминокислотную последовательность, в которой, в дополнение к аминокислотам в положениях 27 и 17 белка интерферона-бета человека дикого типа с SEQ ID NO: 1, часть последовательности удалена, модифицирована, заменена или добавлена, также включен в объем настоящего изобретения.
Термин «гомология» или «идентичность», используемый в настоящем документе, означает степень, связанную с двумя заданными аминокислотными последовательностями, и может быть представлен в виде процента. Термины «гомология» или «идентичность» часто могут использоваться взаимозаменяемо.
То, имеют ли какие-либо две белковые последовательности гомологию, сходство или идентичность, можно определить с использованием известных компьютерных алгоритмов, таких как программа «FASTA», в которой используются параметры по умолчанию, известные в данной области техники. В качестве альтернативы, для определения может быть использован алгоритм Нидлмана-Вунша, реализуемый в программе Needleman (версия 5.0.0 или более поздняя) пакета EMBOSS (включая пакет программ GCG). Например, гомология, сходство или идентичность могут быть определены с использованием BLAST или ClustalW в базе данных Национального центра биотехнологической информации.
Кроме того, настоящее изобретение относится к полинуклеотиду, кодирующему вариант интерферона-бета человека с двойной мутацией согласно настоящему изобретению.
В контексте настоящего документа термин «полинуклеотид» определен как значение, которое включает одноцепочечные или двухцепочечные полимеры РНК, ДНК или РНК-ДНК.
Специалисты в данной области техники могут легко получить полинуклеотид, кодирующий аминокислотную последовательность, на основе заданной аминокислотной последовательности, при условии использования его или ее обычных способностей.
Согласно настоящему изобретению также предложен вектор экспрессии в клетке животного, содержащий указанный полинуклеотид, способный экспрессировать вариант интерферона-бета человека согласно настоящему изобретению в клетке животного.
Вариант интерферона-бета человека с двойной мутацией согласно настоящему изобретению дополнительно включает 1 или 2 сахарные цепи по сравнению с природным вариантом интерферона-бета человека, но, учитывая, что эти сахарные цепи обычно встречаются в клетке животного, вектор экспрессии в клетке животного, в частности, в основном включает:
(i) полинуклеотид, кодирующий вариант интерферона-бета человека, как описано выше;
(ii) промотор, функционально связанный с нуклеотидной последовательностью согласно (i) с образованием молекулы РНК;
(iii) полинуклеотид, кодирующий лидерную последовательность;
(iv) точку начала репликации; и
(v) 3’-нетранслируемый сайт, который вызывает полиаденилирование 3’-конца молекулы РНК.
Указанный выше промотор относится к последовательности, способной активировать транскрипцию, но такая последовательность известна в данной области техники, и, аналогичным образом, 3’-нетранслируемый сайт, который служит для стабилизации лидерной последовательности и мРНК для транспорта транслированного белка в эндоплазматический ретикулум, где происходит гликозилирование, также известен в данной области техники.
При этом вектор экспрессии согласно настоящему изобретению может необязательно включать репортерный ген (например, люциферазы и β-глюкуронидазы), ген, придающий устойчивость к антибиотику (например, неомицину, карбенициллину, канамицину, спектиномицину, гигромицину и т. д.), ген маркера отбора или тому подобное, и может необязательно включать энхансер.
При этом примеры векторов, которые могут быть использованы в качестве вектора экспрессии в клетке животного согласно настоящему изобретению, могут включать pSV2-neo, pCAGGS, pcDL-SRα296, pAc373 и тому подобное, но эти иллюстративные векторы могут включать промотор, лидер, 3’-нетранслируемый сайт, репортерный ген, ген маркера отбора, энхансер и тому подобное, как описано выше, если это необходимо.
Согласно настоящему изобретению предложена клетка животного, трансформированная указанным вектором экспрессии, и способ получения варианта интерферона-бета человека путем культивирования указанной клетки животного.
В контексте настоящего документа трансформация относится к модификации генотипа клетки-хозяина путем введения экзогенного полинуклеотида (в настоящем изобретении это означает полинуклеотид, кодирующий вариант интерферона-бета человека с двойной мутацией) и означает введение экзогенного полинуклеотида в клетку-хозяина независимо от способа, используемого для трансформации. Экзогенный полинуклеотид, введенный в клетку-хозяина, может интегрироваться и сохраняться или не интегрироваться, но сохраняться в геноме клетки-хозяина, и настоящее изобретение включает и то, и другое.
При этом в контексте настоящего документа клетка животного включает клетку млекопитающего и клетку насекомого, которые могут быть использованы для продуцирования рекомбинантных белков. Примеры клеток животных, которые могут быть использованы в настоящем изобретении, могут включать клетки COS, клетки CHO, клетки C-127, клетки BHK, клетки Hep I крысы, клетки Hep II крысы, клетки TCMK, клетки легкого человека, клетки опухоли печени человека, клетки HepG2, гепатоциты мыши, клетки DUKX, клетки 293 и тому подобное, и примеры клеток насекомых могут включать клетки культуры тутового шелкопряда.
В еще одном аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая вариант интерферона-бета человека согласно настоящему изобретению, как описано выше.
Интерферон-бета человека, включенный в фармацевтическую композицию согласно настоящему изобретению, в основном применяли в качестве терапевтического агента при рассеянном склерозе, но сообщается, что он также применяется для лечения рака, аутоиммунных нарушений, вирусных инфекций, заболеваний, связанных с ВИЧ, гепатита С и т. д., и постоянно сообщается о фармацевтическом эффекте.
По этой причине следует иметь в виду, что фармацевтический эффект фармацевтической композиции согласно настоящему изобретению включает не только фармацевтический эффект в качестве терапевтического агента при рассеянном склерозе, но и все другие фармацевтические эффекты интерферона-бета человека.
Кроме того, такой фармацевтический эффект следует понимать как значение, которое включает не только фармацевтические эффекты, известные на сегодняшний день, но и фармацевтические эффекты, которые будут обнаружены позднее в качестве фармацевтических эффектов интерферона-бета человека.
Поскольку фармацевтическая композиция согласно настоящему изобретению характеризуется тем, что она включает вариант интерферона-бета человека с повышенной активностью или функцией, полученный согласно настоящему изобретению, даже если фармацевтическая композиция согласно настоящему изобретению проявляет не только известные на сегодняшний день фармацевтические эффекты, но также фармацевтические эффекты препарата, которые будут обнаружены позднее, объем настоящего изобретения не является необоснованно расширенным.
Тем не менее, вариант интерферона-бета человека в основном применяли в качестве терапевтического агента при рассеянном склерозе, и уже были обнаружены терапевтические эффекты при раке, аутоиммунных нарушениях, вирусных инфекциях, заболеваниях, связанных с ВИЧ, гепатите С и т. д., так что фармацевтический эффект предпочтительно представляет собой эти фармацевтические эффекты.
При этом фармацевтическая композиция согласно настоящему изобретению может быть введена перорально или другими способами, включающими трансдермальный, подкожный, внутривенный или внутримышечный.
В качестве альтернативы, фармацевтические композиции согласно настоящему изобретению могут быть представлены в различных составах, и в случае составов они могут быть получены с использованием обычно используемых разбавителей или эксципиентов, таких как наполнители, разбавители, связующие вещества, смачивающие агенты, разрыхлители и поверхностно-активные вещества.
Кроме того, в суточной дозе фармацевтических композиций согласно настоящему изобретению фармацевтические композиции могут быть введены в количестве, уже известном в данной области техники, но в целом могут быть введены один раз или разделены на несколько раз в диапазоне от 0,01 до 5 мг/кг массы тела. Однако, поскольку фактическая доза фармацевтической композиции согласно настоящему изобретению определяется в соответствии с несколькими связанными факторами, такими как способ введения, возраст, пол и масса тела пациента и тяжесть состояния пациента, не следует считать, что доза ограничивает объем настоящего изобретения в каком-либо отношении.
Согласно настоящему изобретению также предложен способ улучшения стабильности варианта R27T интерферона-бета человека, включающий замену серином цистеина в аминокислотном положении 17 в варианте R27T интерферона-бета человека, в котором аргинин в аминокислотном положении 27 интерферона-бета человека заменен треонином.
В одном из вариантов осуществления настоящего изобретения после замены серином цистеина в аминокислотном положении 17 в варианте R27T интерферона-бета человека (C17S) и очистки подтверждали изменения гликозилирования вариантов с мутацией C17S и без нее с помощью ОФ-ВЭЖХ (обращенно-фазовая высокоэффективная жидкостная хроматография). В результате было подтверждено, что степень дигликозилирования варианта R27T с C17S после очистки белка был улучшен по сравнению с вариантом R27T без C17S.
В другом варианте осуществления настоящего изобретения после замены серином цистеина в аминокислотном положении 17 в варианте R27T интерферона-бета человека (C17S) и очистки оценивали стабильность при хранении в фосфатном буфере и уксуснокислом буфере с рН от 2,0 до 6,0. В результате было подтверждено, что степень сохранения белка в каждом буфере для варианта R27T с C17S была улучшена по сравнению с вариантом R27T без C17S.
В еще одном варианте осуществления настоящего изобретения после замены серином цистеина в аминокислотном положении 17 варианта R27T интерферона-бета человека (C17S) и очистки выполняли анализ методом SEC (эксклюзионная хроматография)-ВЭЖХ при многократном замораживании/размораживании для подтверждения соотношения мономеров белка. В результате было подтверждено, что после многократного процесса замораживания/размораживания соотношение мономеров варианта R27T с C17S было улучшено по сравнению с вариантом R27T без C17S.
В настоящем изобретении «вариант R27T интерферона-бета человека» представляет собой все полипептиды, которые имеют всю или часть аминокислотной последовательности, полученной из интерферона-бета человека, и обладают активностью интерферона-бета человека, при этом включающие замену треонином аргинина в аминокислотном положении 27 в интерфероне-бета человека дикого типа с SEQ ID NO: 1.
В настоящем изобретении вариант R27T интерферона-бета человека, в котором аргинин в аминокислотном положении 27 интерферона-бета человека заменен треонином, может содержать аминокислотную последовательность SEQ ID NO: 2, в частности, по существу состоять из аминокислотной последовательности SEQ ID NO: 2, более конкретно, состоять из аминокислотной последовательности SEQ ID NO: 2, но не ограничивается перечисленным.
SEQ ID NO: 2:
MSYNLLGFLQRSSNFQCQKLLWQLNGTLEYCLKDRMNFDIPEEIKQLQQFQKEDAALTIYEMLQNIFAIFRQDSSSTGWNETIVENLLANVYHQINHLKTVLEEKLEKEDFTRGKLMSSLHLKRYYGRILHYLKAKEYSHCAWTIVRVEILRNFYFINRLTGYLRN
Кроме того, вариант R27T интерферона-бета человека может включать аминокислотную последовательность, в которой треонин фиксирован в аминокислотном положении 27 белка интерферона-бета человека дикого типа с SEQ ID NO: 1, и обладающую по меньшей мере 80% гомологией или идентичностью, но не ограничивается перечисленным. В частности, вариант настоящего изобретения может включать белок, обладающий по меньшей мере 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% гомологией или идентичностью аминокислотной последовательности SEQ ID NO: 2. Кроме того, если вариант представляет собой аминокислотную последовательность, обладающую такой гомологией или идентичностью и проявляющей эффективность, соответствующую указанному белку, очевидно, что белок, имеющий аминокислотную последовательность, в которой, в дополнение к аминокислоте в положении 27 белка интерферона-бета человека дикого типа с SEQ ID NO: 1, часть последовательности удалена, модифицирована, заменена или добавлена, также включен в объем настоящего изобретения.
В настоящем изобретении стадия замены серином цистеина в аминокислотном положении 17 варианта R27T интерферона-бета человека может быть осуществлена известными методами, используемыми для введения точечных мутаций аминокислот в данной области техники, без ограничения.
Например, эта стадия может быть осуществлена методом трансформации клетки-хозяина вектором, включающим полинуклеотид, кодирующий белок, включающий замену треонином аргинина в аминокислотном положении 27 и замену серином цистеина в аминокислотном положении 17 белка интерферона-бета человека дикого типа с SEQ ID NO: 1, и затем культивирования указанной клетки-хозяина в среде.
Связанное с этим подробное описание может быть как таковое применено к способу получения варианта интерферона-бета человека, содержащего двойную мутацию R27T и C17S.
В настоящем изобретении полинуклеотид, кодирующий вариант интерферона-бета человека, может включать любую полинуклеотидную последовательность, кодирующую белок, включающий замену треонином аргинина в аминокислотном положении 27 и замену серином цистеина в аминокислотном положении 17 белка интерферона-бета человека дикого типа с SEQ ID NO: 1, без ограничения. В частности, в настоящем изобретении полинуклеотид может быть по-разному модифицирован в кодирующих областях в пределах диапазона, в котором не происходит изменения аминокислотной последовательности белка из-за вырожденности кодонов или с учетом кодона, предпочтительного в организме для экспрессии белка.
Вариант интерферона-бета человека, продуцируемый культурой, может высвобождаться в среду или может не высвобождаться в среду, а оставаться в клетке.
Способ согласно настоящему изобретению может дополнительно включать стадию выделения варианта R27T интерферона-бета человека, включающего замену серином цистеина в аминокислотном положении 17, из культивируемой клетки или среды.
Способ выделения варианта интерферона-бета человека, продуцированного на стадии культивирования, может представлять собой сбор целевого белка из культуральной среды с использованием подходящего метода, известного в данной области техники, в зависимости от способа культивирования. Например, могут быть использованы центрифугирование, фильтрация, анионообменная хроматография, кристаллизация, ВЭЖХ и тому подобное, и можно выделить желаемые варианты из среды или клетки с помощью надлежащего метода, известного в данной области техники.
Кроме того, стадия выделения может включать процесс очистки и может осуществляться с использованием подходящего метода, известного в данной области техники, например фильтрации с помощью мембраны и тому подобного.
В одном из аспектов настоящего изобретения стабильность может быть выбрана из группы, состоящей из стабильности при очистке, стабильности при хранении и стабильности при замораживании/размораживании.
Стабильность при очистке означает, что степень денатурации белка, которая может иметь место в процессе очистки белка, выделенного из клетки-хозяина или среды для культивирования клеток, снижена, и очистка может включать, не ограничиваясь перечисленным, обычные методы очистки белка в данной области техники. Например, очистка включает высаливание (например, осаждение сульфатом аммония и осаждение фосфатом натрия), осаждение растворителем (осаждение белковой фракции с использованием ацетона, этанола и т. д.), диализ, гель-фильтрацию, ионный обмен и колоночную хроматографию, такую как обращенно-фазовая колоночная хроматография, и предпочтительно может представлять собой колоночную хроматографию.
В одном из аспектов настоящего изобретения стабильность при очистке может означать, что изменение уровня гликозилирования белка снижено до и после процесса очистки белка, описанного выше, и, в частности, может означать, что степень очистки дигликозилированного белка улучшена для варианта R27T интерферона-бета человека.
В другом аспекте настоящего изобретения стабильность при очистке может быть охарактеризована тем, что агрегация и деградация белка снижены во время концентрирования и замены буфера белка. Как правило, белки или полипептиды могут агрегироваться или деградировать в процессе концентрирования и замены буфера, проводимом во время или после процесса очистки, но когда серин заменяет цистеин в аминокислотном положении 17 варианта R27T интерферона-бета человека, денатурация белка в процессе концентрирования и замены буфера может быть снижена.
Белки могут быть концентрированы с использованием методов, известных в данной области техники. Неограничивающие иллюстративные методы, которые могут быть использованы для концентрировании белка, включают ультрафильтрацию, тангенциальную поточную фильтрацию, центробежное концентрирование с использованием мембранного концентратора (например, целлюлозного мембранного концентратора), диализ против водопоглощающего материала (например, водопоглощающего полимера), высаливание (например, с использованием сульфата аммония) и хроматографию (например, эксклюзионную хроматографию).
Ультрафильтрация для концентрирования белка представляет собой метод выделения с использованием давления воды, так что молекулы и растворители проходят через мембрану, состоящую из пор, известных как размер частиц, а также величина отсечки размера. Поскольку молекулы с более высокой молекулярной массой не проходят через мембрану, только молекулы с молекулярной массой, меньшей, чем величина отсечки мембраны, могут проходить через мембрану и образовывать так называемый консервирующий раствор. Соответственно, молекулы, присутствующие в консервирующем растворе, концентрируются по мере прохождения растворителя через мембрану. Ультрафильтрация может быть использована для концентрирования белка или замены буфера, или может быть использована для включения целевого белка в состав желаемого раствора или желаемого буфера.
В конкретном варианте осуществления концентрирование раствора или композиции, содержащих целевой белок, может быть выполнено с помощью тангенциальной поточной фильтрации (TFF). Этот метод особенно эффективен для концентрирования в больших масштабах, т. е. для концентрирования раствора в объеме от 1 литра до нескольких сотен литров. Поэтому этот метод особенно эффективен для получения концентрированных растворов целевого белка в промышленных масштабах.
Метод TFF основан на использовании специального устройства, которое позволяет отфильтрованному раствору течь через полупроницаемую мембрану, через которую могут проходить только молекулы меньшего размера, чем поры мембраны, образуя фильтрат и оставляя более крупный материал для сбора (удерживаемое количество). В методе TFF применяют два различных давления; одно давление предназначено для подачи раствора в систему для циркуляции раствора в системе (давление на входе), а другое давление прикладывают на мембрану, в результате чего небольшие молекулы и растворители пересекают мембрану (давление на мембране). Давление на входе обычно может находиться в диапазоне от 1 до 3 бар, например, от 1,5 до 2 бар. Давление на мембране обычно может составлять больше 1 бара.
Когда TFF используется для концентрирования композиции, концентрированная композиция целевого белка может быть собрана в буфер. Мембрана, подходящая для TFF, обычно может быть изготовлена из регенерированной целлюлозы или полиэфирсульфона (PES). Размер пор мембраны обычно может иметь отсечку по молекулярной массе менее 10000 Mw, например, в диапазоне от 10 до 10000 Mw.
В другом варианте осуществления концентрирование композиции, содержащей целевой полипептид, может быть осуществлено с использованием устройства для центрифугирования. В этом случае целевой белок фильтруется мембраной путем приложения центробежной силы к мембране. Такая мембрана часто характеризуется отсечкой по молекулярной массе (Mw), т. е. максимальным размером молекулы соединения, которое может пройти через мембрану, а соединения с большим размером молекулы не могут пройти через мембрану.
Мембрана может быть изготовлена из полиэфирсульфона (PES) или регенерированной целлюлозы. Примером такого подходящего коммерческого фильтрующего устройства может быть Centricon Plus-80 или Centricon Plus-15, не ограничиваясь перечисленным.
Концентрирование, как правило, может быть осуществлено при от 2000 до 4500 g, например, от 2500 до 4000 g, или от 2750 до 3500 g, или от 3000 до 3500 g, например, 3000 g, или 3100 g, или 3200 g, или 3300 g, или 3400 g, или 3500 g.
Замена буфера композиции, содержащей концентрированный целевой белок, может быть осуществлена путем a) разбавления, например, в 5-15 раз, композиции, содержащей целевой белок, концентрированный в буфере или составе, и b) повторного концентрирования разбавленной композиции и проведения стадии, а затем регулирования добавок буфера или состава в композиции таким образом, чтобы количество добавок буфера или состава в композиции перед проведением этих стадий составляло, например, 5 об./об. % или менее или 1 об./об. % или менее.
В настоящем изобретении стабильность при хранении означает, что степень денатурации белка, которая может иметь место в процессе хранения очищенного варианта R27T интерферона-бета человека в буфере или при изменении состава буфера, снижена.
В настоящем изобретении буфер может иметь рН от 2,0 до 6,0, предпочтительно рН от 2,0 до 5,0 и наиболее предпочтительно рН от 2,0 до 4,0, но не ограничиваясь перечисленным.
В настоящем изобретении буфер может быть выбран из группы, состоящей из уксусной кислоты, фосфорной кислоты, карбоната аммония, фосфата аммония, борной кислоты, лимонной кислоты, молочной кислоты, цитрата калия, метафосфата калия, одноосновного фосфата калия, ацетата натрия, цитрата натрия, раствора лактата натрия, двухосновного фосфата натрия, одноосновного фосфата натрия, бикарбоната, трис(трис(гидроксиметил)аминометана), 3-(N-морфолино)пропансульфоновой кислоты (MOPS), N-(2-гидроксиэтил)пиперазин-N'-(2-этансульфоновой кислоты) (HEPES), 2-(2-амино-2-оксоэтил)аминоэтансульфоновой кислоты (ACES), N-(2-ацетамидо)-2-иминодиуксусной кислоты (ADA), 3-(1,1-диметил-1,2-гидроксиэтиламино-2-пропансульфоновой кислоты (AMPSO), N,N-бис(2-гидроксиэтил)-2-аминоэтансульфоновой кислоты (BES), N,N-бис(2-гидроксиэтилглицина) (бицина), бис-трис-(бис-(2-гидроксиэтил)имино-трис(гидроксиметил)метана, 3-(циклогексиламино)-1-пропансульфоновой кислоты (CAPS), 3-(циклогексиламино)-2-гидрокси-1-пропансульфоновой кислоты (CAPSO), 2-(N-циклогексиламино)этансульфоновой кислоты (CHES), 3-N,N-бис(2-гидроксиэтиламино-2-гидроксипропансульфоновой кислоты (DIPSO), N-(2-гидроксиэтилпиперазин)-N'-(3-пропансульфоновой кислоты) (HEPPS), N-(2-гидроксиэтил)пиперазин-N'-(2-гидроксипропансульфоновой кислоты (HEPPSO), 2-(N-морфолино)этансульфоновой кислоты (MES), триэтаноламина, имидазола, глицина, этаноламина, фосфата, 3-(N-морфолино)-2-гидроксипропансульфоновой кислоты (MOPSO), пиперазин-N,N'-бис(2-этансульфоновой кислоты) (PIPES), пиперазин-N,N'-бис(2-гидроксипропансульфоновой кислоты) (POPSO), N-трисгидроксиметил)метил-3-аминопропансульфоновой кислоты (TAPS), 3-N-трис(гидроксиметил)метиламино-2-гидроксипропансульфоновой кислоты (TAPSO), N-трис(гидроксиметил)метил-2-аминоэтансульфоновой кислоты (TES), N-трис(гидроксиметил)метилглицина (трицина), 2-амино-2-метил-1,3-пропандиола и 2-амино-2-метил-1-пропанола, но не ограничиваясь перечисленным.
В настоящем изобретении стабильность при замораживания/размораживании означает, что при повторении цикла замораживания и размораживания варианта R27T интерферона-бета человека, хранящегося в буфере, возможность денатурации белка снижена.
В одном из аспектов настоящего изобретения стабильность при замораживании/размораживании может быть охарактеризована как стабильность при размораживании после замораживания при температуре от -100°С до -10°С, предпочтительно стабильность при размораживании после замораживания при температуре от -90°С до -30°С, и наиболее предпочтительно стабильность при размораживании после замораживания при температуре от -80°С до -50°С.
В еще одном аспекте настоящего изобретения стабильность при замораживании/размораживании может быть охарактеризована как стабильность при замораживании/размораживании в ацетатном буфере, предпочтительно стабильность при замораживании/размораживании в ацетатном буфере с pH от 3,0 до 5,0.
В еще одном аспекте настоящего изобретения стабильность при замораживании/размораживании может быть охарактеризована как снижение агрегации и деградации белков после трех или более циклов замораживания/размораживания, предпочтительно снижение агрегации и деградации белков после четырех или более циклов замораживания/размораживания и более предпочтительно снижение агрегации и деградации белков после четырех или более циклов замораживания/размораживания.
Биологическая активность интерферона-бета человека может быть изменена за счет взаимодействия с рецептором интерферона типа 1. В настоящем изобретении, чтобы улучшить стабильность варианта R27T интерферона-бета человека, мутированная 17-я аминокислота расположена на поверхности связывания с IFNAR2, рецептором интерферона типа 1, и, в частности, сайты с 15 по 23 являются основными сайтами связывания рецептора, так что биологическая активность также может быть изменена при мутировании любой одной или более аминокислотных последовательностей. В частности, поскольку свободный остаток цистеина обладает более сильной гидрофобностью, чем цистеин, связанный дисульфидными связями, изменение активности может быть вызвано заменой цистеина в аминокислотном положении 17. Как и ожидалось, из-за введения дополнительной мутации C17S в вариант R27T интерферона-бета человека изменение гидрофобности варианта R27T было снижено, но не было оказано никакого влияния на активность белка, а стабильность при очистке, стабильность при хранении и стабильность при замораживании/размораживании были улучшены. Кроме того, введение мутации C17S может улучшить стабильность путем индукции образования водородных связей в белке остатками серина.
Согласно настоящему изобретению предложено применение варианта интерферона-бета человека для получения агента, оказывающего фармацевтический эффект природного интерферона-бета человека на заболевание, выбранное из группы, состоящей из рассеянного склероза, рака, аутоиммунных нарушений, вирусной инфекции, заболеваний, связанных с ВИЧ, и гепатита С.
Согласно настоящему изобретению предложен способ лечения заболевания, выбранного из группы, состоящей из рассеянного склероза, рака, аутоиммунных нарушений, вирусной инфекции, заболеваний, связанных с ВИЧ, и гепатита С, включающий введение эффективной дозы композиции, обладающей фармацевтическим эффектом природного интерферона-бета человека и содержащей вариант интерферона-бета человека, нуждающемуся в этом субъекту.
Термин «эффективная доза» согласно настоящему изобретению означает количество, которое проявляет эффекты улучшения, лечения, предупреждения, обнаружения и диагностики заболевания, выбранного из группы, состоящей из рассеянного склероза, рака, аутоиммунных нарушений, вирусной инфекции, заболеваний, связанных с ВИЧ, и гепатита С, или ингибирования или облегчения заболевания при введении субъекту. «Субъект» может представлять собой животных, предпочтительно млекопитающих, в частности, животных, включающих людей, а также может представлять собой клетки, ткани, органы и тому подобное, полученные от животных. Субъект может представлять собой пациента, нуждающегося в указанных эффектах.
Термин «лечение» согласно настоящему изобретению в полном объеме относится к обеспечению положительной динамики заболевания, выбранного из группы, состоящей из рассеянного склероза, рака, аутоиммунных нарушений, вирусной инфекции, заболеваний, связанных с ВИЧ, и гепатита С, или симптомов заболевания. Лечение может включать лечение или по существу предупреждение заболевания, или улучшение его состояния и включает облегчение, лечение или предупреждение симптома или большинства симптомов, обусловленных раком, но не ограничиваясь перечисленным.
В контексте настоящего документа термин «содержащий» используется в том же значении, что и «включающий» или «характеризующийся», и не исключает дополнительных ингредиентов или стадий способа, которые специально не упомянуты в композиции или способе согласно настоящему изобретению. Термин «состоящий из» означает исключение дополнительных элементов, стадий или ингредиентов, и т. д., если не указано иное. Термин «по существу состоящий из» означает включающий материалы или стадии, которые по существу не влияют на их основные свойства, в дополнение к описанным материалам или стадиям в композиции или способе.
ДОСТИГАЕМЫЕ ПРЕИМУЩЕСТВА
Таким образом, вариант интерферона-бета человека с двойной мутацией, предложенный в настоящем изобретении, значительно улучшает эффективность процесса очистки, обладая при этом превосходной активностью интерферона-бета, так что его можно применять при производстве терапевтического агента с его помощью.
Кроме того, в соответствии со способом улучшения стабильности варианта R27T интерферона-бета человека согласно настоящему изобретению можно обеспечить постоянное качество белка в процессе получения и введения в оборот за счет улучшения стабильности белка в процессе очистки, процессе хранения и процессе замораживания/размораживания при сохранении активности варианта R27T интерферона-бета человека, включающего замену треонином аргинина в аминокислотном положении 27 интерферона-бета человека.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
ФИГ. 1 иллюстрирует условия проведения ПЦР в эксперименте по получению ДНК, экспрессирующей белок.
ФИГ. 2 иллюстрирует обработку рестрикционными ферментами и клонирование в эксперименте по получению ДНК, экспрессирующей белок.
ФИГ. 3 иллюстрирует ход клонирования с использованием ДНК-лигазы T4 (NEB) в эксперименте по получению ДНК, экспрессирующей белок.
ФИГ. 4 иллюстрирует условия проведения ПЦР для отбора колоний в эксперименте по получению ДНК, экспрессирующей белок.
ФИГ. 5A и 5B иллюстрируют результаты наблюдения жизнеспособности клеток после трансдукции ABN 101 (NT) и ABN 101 (CS) (ABN 101 (NT): интерферон-бета с мутацией R27T, ABN 101 (CS): интерферон-бета с двойной мутацией C17S, R27T).
ФИГ. 6A и 6B иллюстрируют результаты периодического культивирования с подпиткой в масштабе 50 мл для ABN 101 (NT) и ABN 101 (CS).
ФИГ. 7 иллюстрирует результаты периодического культивирования с подпиткой в масштабе 1 л для ABN 101 (NT) и ABN 101 (CS).
ФИГ. 8 иллюстрирует концентрирование и замену буфера в эксперименте по подтверждению стабильности варианта интерферона-бета.
ФИГ. 9A и 9B иллюстрируют результаты ОФ-ВЭЖХ варианта интерферона.
ФИГ. 10A-10D иллюстрируют изменения в содержании мономера во время замена буфера варианта интерферона.
ФИГ. 11A-11F иллюстрируют подтверждение сравнения стабильности при замораживании/размораживании (F/T) вариантов интерферона в 20 мМ буфере Na-Pi.
ФИГ. 12A-12C иллюстрируют подтверждение сравнения стабильности F/T вариантов интерферона в 20 мМ буфере Na-OAc.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Далее настоящее изобретение будет описано подробно.
Однако следующие примеры служат только для иллюстрации настоящего изобретения, и содержание настоящего изобретения не ограничивается следующими примерами.
Следующие эксперименты были проведены для получения ABN 101 (NT) - интерферона-бета-1a человека с мутацией R27T, и ABN 101 (CS) - формы с двойной мутацией R27T и C17S.
Методика эксперимента
1. Получение ДНК, экспрессирующей белок
Для клонирования ABN 101 (NT) и ABN 101 (CS) за человеческим промотором вектора pD2535nt-HDP были разработаны праймеры с сайтами рестрикции ферментов XbaI и PacI, и последовательности были следующими.
Прямой: 5’-ggtctagagccaccAtgacca-3’ (SEQ ID NO: 4)
XbaI
Обратный: 5’-cacttagggattaattaatcagttcctcaggtag-3’ (SEQ ID NO: 5)
PacI
Поскольку две вставки заменили цистеин на серин, изменив только 119-ю последовательность ДНК, праймеры для клонирования использовались совместно. Две вставки амплифицировали с помощью AccuPower PCR PreMix (Bioneer), и условия проведения ПЦР показаны на ФИГ. 1 ниже.
Размер продукта ПЦР, полученного с помощью ПЦР, подтверждали с помощью 0,8% агарозного геля, а экстракцию геля проводили с использованием набора MEGAquick-spin™ Plus Total Fragment DNA Purification Kit (Intron). Очищенный продукт ПЦР и вектор pD2535nt-HDP обрабатывали рестрикционными ферментами, как показано на ФИГ. 2, для осуществления клонирования. Все использованные рестрикционные ферменты и их буферы представляли собой продукты от ThermoFisher.
После обработки рестрикционными ферментами была предпринята попытка повысить эффективность клонирования путем получения только чистых фрагментов ДНК с использованием набора MEGAquick-spin™ Plus Total Fragment DNA Purification Kit (Intron), и после очистки использовали ДНК-лигазу T4 (NEB), как показано на ФИГ. 3, для проведения клонирования.
После лигирования проводили трансформацию с использованием продукта DH5a Chemically Competent E. coli (Enzynomics). Сначала клетки DH5a медленно размораживали во льду, а затем полностью добавляли 20 мкл продукта реакции и помещали на лед на 30 минут. Затем применяли тепловой шок при 42°C в течение 30 секунд, а затем стабилизировали на льду в течение 2 минут. Добавляли 400 мкл среды SOC (поставляемой компанией Enzymenomics) и инкубировали при встряхивании при 37°C в течение 1 часа. После заживления клетки, центрифугированные при 3000 об/мин в течение 3 минут, размазывали в среде LB, содержащей 50 мкг канамицина, а затем инкубировали в течение ночи в инкубаторе при 37°C. Колонии, появляющиеся на чашке, отделяли и проводили ПЦР для отбора колоний для подтверждения клонирования. Одну колонию, не перекрывающуюся с другими колониями, соскабливали в максимально возможной степени с помощью наконечника размером 10p, а затем помещали в пробирку AccuPower PCR PreMix (Bioneer). ПЦР проводили с праймерами для ПЦР для отбора колоний вектора pD2535nt-HDP, представленного Horizon, и условия были такими, как показано на ФИГ. 4 ниже.
Размер продукта ПЦР подтверждали с помощью 0,8% агарозного геля для подтверждения завершения клонирования, и в клонированных pD2535nt-HDP::ABN101 (NT) и pD2535nt-HDP::ABN101(CS) проводили подготовку ДНК трансфекции клеток CHO-K1 с помощью nucleobond Xtra Maxi Plus (MACHEREY-NAGEL).
2. Трансдукция
E. coli, имеющую плазмиду экспрессии, инкубировали и собирали в среде LB, содержащей 100 мкг/мл канамицина, и выделяли ДНК с использованием набора QIAGEN Plasmid Midi prep kit. К 50 мкг выделенной ДНК добавляли 30 мкл 10x буфера Cutsmart и 2,5 мкл рестрикционного фермента NrU1-HF с получением конечного объема 300 мкл. Затем выделенную ДНК инкубировали при 37°C в течение 2 часов для линеаризации. Через 2 часа добавляли 30 мкл 1/10 объема 3 M раствора ацетата натрия, рН 5,5, и 750 мкл ледяного этанола и инкубировали в течение ночи при -80°C. На следующий день ДНК, осажденную этанолом, центрифугировали и промывали 70% этанолом с получением ДНК высокой чистоты, и концентрацию измеряли с использованием Nanodrop. В первый день для трансдукции клетки CHO-K1 высевали во встряхиваемую колбу E125 до концентрации 3 x 105/мл с использованием культуральной среды CDFortiCHO с добавлением L-глутамина в концентрации 4 мМ, а затем инкубировали в течение 24 часов в условиях 37°C, 5% CO2 и 125 об/мин. На второй день измеряли количество клеток, высеянных в первый день, и высевали клетки до концентрации 5 x 105/мл и инкубировали в течение 24 часов в условиях 37°C, 5% CO2 и 125 об/мин. На третий день измеряли количество высеянных клеток, чтобы подтвердить, что это количество достигло 1 x 106/мл, и когда оно было достигнуто, клетки, наконец, высевали до концентрации 1 x 106/мл для подготовки трансдукции. 37,5 мкг линеаризованной ДНК и 37,5 мкл реагента Freestyle MAX добавляли к 600 мкл среды OptiPRO SFM и проводили реакцию при комнатной температуре в течение 5 минут. После этого смесь, содержащую ДНК, переносили в смесь, содержащую реагент Freestyle MAX, перемешивали и затем проводили реакцию при комнатной температуре в течение 25 минут. После проведения реакции смесь ДНК и липидов осторожно добавляли к ранее высеянным клеткам CHO-K1. Клетки инкубировали в течение 48 часов в условиях 37°C, 5% CO2 и 125 об/мин для осуществления трансдукции. Через 48 часов трансдукции начинали отбор клеток, устойчивых к метионинсульфоксимину (MSX). В то время как клетки инкубировали в течение приблизительно 25 дней в селективной среде с добавлением 25 или 50 мкM MSX, полностью трансфицированные клетки культивировали и контролировали один раз в каждые 2-3 дня. При контроле каждые 2-3 дня, когда жизнеспособность достигла 70% или более, а количество жизнеспособных клеток достигло 0,5-1,2 x 106/мл, эти клетки отбирали в виде пула, и суспензионную культуру 3 или более раз субкультивировали на селективной среде в условиях 37°C, 5% CO2 и 125 об/мин для стабилизации клеток.
3. Периодическое культивирование с подпиткой
Периодическое культивирование с подпиткой проводили с использованием клеток в состоянии пула, полученных путем трансдукции. 50 мл клеток высевали во встряхиваемую колбу E250 до концентрации 3 x 105/мл с использованием среды CDFortiCHO без MSX и инкубировали в течение около 12 дней в условиях 37°C, 5% CO2 и 125 об/мин. В это время метаболиты глюкозы в среде для культивирования клеток анализировали с использованием cedex bio, и измеряли жизнеспособность клеток и количество жизнеспособных клеток. На 3, 5 и 7 дни добавляли 5% (об./об.) раствор CD Efficient Feed C+, а на 4 и 6 дни добавляли 45% раствор глюкозы. После завершения периодического культивирования с подпиткой культуральную среду центрифугировали, и отбирали только супернатант и хранили в охлажденном или замороженном состоянии.
4. Подтверждение биологической активности интерферона-бета-1а (ELISA)
Величину биологической активности белка, экспрессированного интерфероном бета-1a человека, демонстрируемую помощью полученной экспрессионной клеточной линией, анализировали с помощью набора HuIFN-β ELISA от TORAY Co., Ltd. Культурную среду, полученную с помощью периодического культивирования с подпиткой, первоначально разбавляли в 10000 раз с использованием разбавителя в наборе и последовательно разбавляли в два раза для получения образца, разбавленного в 1280000 раз. Стандартное вещество для измерения биологической активности в наборе готовили с использованием разбавителя от 200 МЕ/мл до 3,125 МЕ/мл согласно протоколу. Планшет для ELISA примировали и подготавливали с использованием промывочного буфера в наборе. После примирования к планшету для ELISA добавляли 100 мкл/лунку подготовленного образца и стандартного вещества, и в каждую лунку добавляли 50 мкл/лунку антитела, конъюгированного с HRP. Планшет инкубировали при 27°C в течение 2 часов и проводили взаимодействие. После завершения реакции планшет промывали, а затем добавляли реагент для проявления цвета при 100 мкл/лунку и инкубировали при 27°C в течение 30 минут, чтобы вызвать реакцию для проявления цвета. Затем для завершения цветной реакции добавляли стоп-раствор при 100 мкл/лунку и проводили детекцию планшета при длине волны 450 нм/эталон 620 нм с использованием спектрофотометра. На основании полученной таким образом оптической плотности строили градуировочную кривую с использованием 4-параметрического метода, и преобразовывали биологическую активность образца. Биологическую активность исходного образца проверяли еще раз путем умножения активности образца, полученного путем преобразования градуировочной кривой, на степень разбавления.
5. Подтверждение экспрессии (концентрации) интерферона-бета-1a (ELISA)
Количество белка, экспрессированного интерфероном бета-1a человека, экспрессированного полученной экспрессионной клеточной линией, анализировали с помощью набора HuIFN-β ELISA от TORAY Co., Ltd. Аналогично методу подтверждения биологической активности, культурную среду, полученную с помощью периодического культивирования с подпиткой, первоначально разбавляли в 10000 раз с использованием разбавителя в наборе и последовательно разбавляли в два раза для получения образца, разбавленного в 1280000 раз. Существующее эталонное стандартное вещество готовили двукратным последовательным разбавлением в концентрации от 2,5 нг/мл до 0,039 нг/мл. Последующий процесс тестирования методом ELISA был таким же, как и метод тестирования ELISA для подтверждения биологической активности. На основании полученной оптической плотности строили градуировочную кривую с использованием 4-параметрического метода и преобразовывали уровень экспрессии интерферона-бета-1a в образце. Концентрацию исходного образца еще раз подтверждали путем умножения уровня экспрессии, полученного путем преобразования из градуировочной кривой, на степень разбавления.
6. Очистка варианта интерферона-бета
Клеточную линию, полученную в приведенном выше примере, инкубировали с использованием клеточной фабрики (Nunc Co., Ltd., кат. № 170069). Каждую экспрессионную клеточную линию субкультивировали в клеточной фабрике при 5 × 104 клеток/мл со средой альфа-MEM, содержащей 10% FBS, и инкубирована при 5% CO2 и 37°C в течение 72 часов для подтверждения роста клеток. После трехкратной промывки PBS компоненты сыворотки удаляли в максимально возможной степени, а среду заменяли бессовороточной средой (Sigma C8730). После замены на бессывороточную среду культуральную среду собирали каждые 24 часа и добавляли новую бессывороточную среду. Культурную среду собирали в общей сложности 4 раза и очищали. После заполнения колонки XK50/20 (Amersham-Pharmacia) 200 мл голубой сефарозной смолы (Amersham-Pharmacia) пропускали 10 к.о. (колоночный объем) буфера А (20 мМ фосфата натрия, 1 М NaCl, pH 7,4) до достижения равновесного состояния. Стерилизованный и отфильтрованный культуральный раствор пропускали через колонку в равновесном состоянии со скоростью потока 20 мл/мин и контролировали путем подключения УФ-детектора с длиной волны 280 нм. Через колонку пропускали буфер B (20 мМ фосфата натрия, 1 М NaCl, 30% этиленгликоль, pH 7,4) для смывания неадсорбированных компонентов, и белок, присоединенный к смоле, элюировали буфером C (20 мМ фосфата натрия, 1 М NaCl, 60% этиленгликоль, pH 7,4). Элюат подвергали диализу против натрий-фосфатного буфера (PBS), концентрировали с помощью концентратора (Centricon, порог отсечки 10000) и подвергали диализу против натрий-фосфатного буфера (PBS).
7. Сравнение эффективности очистки дигликозилирования для варианта R27T интерферона-бета и двойного варианта интерферона-бета (R27T и C17S)
В варианте интерферона-бета ABN 101 (NT) и двойном варианте интерферон-бета ABN 101 (CS), очищенных с использованием голубой сефарозной смолы, измеряли содержание дигликозилированного варианта интерферона-бета с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ).
После разбавления каждого варианта интерферона до 0,5 мг/мл смешивали ацетонитрил (ACN) в исходном соотношении подвижной фазы и затем анализировали. Анализ методом ОФ-ВЭЖХ проводили с помощью колонки YMC-C4, и растворители, используемые в ней, были следующими. Подвижную фазу A использовали после смешивания 0,1% трифторуксусной кислоты (TFA) с трижды дистиллированной водой и последующей дегазации в течение 1 часа после 0,2 мкм PVDF (поливинилиденфторид)-фильтра. Подвижную фазу B использовали после смешивания 0,1% TFA с ACN и последующей дегазации в течение приблизительно 1 часа после 0,2 мкм PVDF-фильтра.
Условия проведения анализа указаны в следующей таблице.
8. Подтверждение стабильности варианта интерферона-бета в зависимости от изменения состава буфера
В каждом из варианта интерферона-бета ABN 101 (NT) и двойного варианта интерферона-бета ABN 101 (CS), очищенных с использованием голубой сефарозной смолы, каждый буфер заменяли с использованием centricon. Чтобы подтвердить степень ухудшения качества из-за агрегации, происходящей во время замены буфера в препаратах интерферона, получали каждый белок, элюированный с голубой сефарозной смолы, а затем проводили концентрирование и замену буфера в объемном соотношении приблизительно 7 раз с использованием 20 мМ натрий-фосфатного буфера (pH 2,9) в centricon. После завершения замены буфера с помощью centricon измеряли концентрацию белка при длине волны 280 нм с помощью УФ-спектрофотометра после шприцевого PES (полиэфирсульфон)-фильтра на 0,2 мкм для подтверждения степени сохранения.
Кроме того, для подтверждения стабильности при хранении по отношению к другим буферам, входящим в состав препарата, белки, подвергнутые замене буфера на 20 мМ фосфата (рН 2,9), снова подвергали замене буфера на 20 мМ ацетата натрия (рН 3,8) с использованием centricon при том же уровне объемного соотношения, соответственно. Процесс проиллюстрирован на ФИГ. 8.
9. Подтверждение стабильности при хранении при замораживании/размораживании в зависимости от изменения состава буфера
Для подтверждения стабильности при замораживании/размораживании для препарата интерферона, содержащего каждый из буферов, 3 или 5 раз проводили цикл замораживания/размораживания, состоявший в замораживании при -70°C в течение 12 часов или более и размораживания при 25°C в течение 4 часов, а затем проводили анализ методом эксклюзионной высокоэффективной жидкостной хроматографии (SEC-ВЭЖХ). Стабильность при хранении вариантов интерферона-бета измеряли путем подтверждения соотношения агрегации, проанализированной с помощью высокомолекулярных (HMW) соединений, и деградации, проанализированной с помощью низкомолекулярных (LMW) соединений, для анализа степени изменения мономера белка. Для SEC-ВЭЖХ использовали эксклюзионную колонку (TSKG2000) от Tosoh Co., Ltd. и использовали следующие растворители. Подвижную фазу A использовали путем смешивания трижды дистиллированной воды и дегазации в течение 1 часа после 0,2 мкм PVDF-фильтра, а подвижную фазу B использовали путем смешивания 150 мМ хлорида натрия и 100 мМ дигидрата двухосновного фосфата натрия с трижды дистиллированной водой, а затем доведения до pH 7,0 фосфорной кислотой и дегазации после 0,2 мкм PVDF-фильтра.
Условия проведения анализа указаны в следующей таблице.
GFS: 10 мкл
Результаты и интерпретация
1. Результат развития пула в зависимости от концентрации MSX после генной трансдукции ABN 101 (NT) и ABN 101 (CS)
После трансдукции клеток CHO-K1 ДНК, клонированной в вектор pD2535nt-HDP, количество и жизнеспособность клеток подтверждали через 48 часов, и на основании количества и жизнеспособности клеток проводили отбор резистентных клеток с двумя концентрациями MSX в течение 25 дней. В результате ABN 101(NT) дал резистентные клетки раньше, чем ABN 101(CS), а в случае 50 мкМ ABN 101(CS) было показано конечное количество жизнеспособных клеток 3 x 105/мл и жизнеспособность 48%, так что было подтверждено, что в последнем случае резистентные клетки были получены медленнее всего. Хотя жизнеспособность была низкой, было определено, что рост и жизнеспособность были затронуты в зависимости от экспрессии интерферона-бета-1a. Их результаты проиллюстрированы на ФИГ. 5A и 5B.
2. Результаты периодического культивирования с подпиткой в состоянии пула ABN 101 (NT) и ABN 101 (CS)
Результаты проведения периодического культивирования с подпиткой в масштабе 50 мл в состоянии пула были следующими. Как в пуле ABN 101 (NT), так и в пуле ABN 101 (CS) было подтверждено, что жизнеспособность сохранялась дольше в пуле с концентрацией MSX 50 мкM по сравнению с 25 мкM, и было подтверждено, что количество жизнеспособных клеток было меньше в пуле с концентрацией MSX 50 мкM по сравнению с 25 мкM. Однако, хотя количество жизнеспособных клеток было меньше в пуле с концентрацией MSX 50 мкM по сравнению с 25 мкM, биологическая активность интерферона-бета-1a в культуральной среде в последний день периодического культивирования с подпиткой была выше, и было подтверждено, что биологическая активность пула ABN 101(CS) была по меньшей мере в 2 раза выше, чем у пула ABN 101(NT). Результаты проиллюстрированы на ФИГ. 6A и 6B.
3. Результаты периодического культивирования с подпиткой в масштабе 1 л для пулов ABN 101 (NT) и ABN 101 (CS)
Основываясь на приведенных выше результатах мелкомасштабного периодического культивирования с подпиткой, проводили периодическое культивирование с подпиткой в масштабе 1 л с использованием пула с концентрацией MSX 50 мкМ. В результате биологическая активность на 4-й день культивирования составляла 0,69 ММЕ/мл для ABN 101(NT) и 5,99 ММЕ/мл для ABN 101(CS), так что было подтверждено, что биологическая активность ABN 101(CS) была приблизительно в 8,6 раза выше. При сравнении биологической активности на 12-й день культивирования было подтверждено, что биологическая активность ABN 101 (CS) была приблизительно в 4,5 раза выше. Результаты проиллюстрированы на ФИГ. 7.
4. Результат очистки варианта интерферона-бета
В результате очистки варианта интерферона-бета эффективность очистки была выше, чем у обычного интерферона-бета человека. В результате было подтверждено, что вариант интерферона-бета человека, содержащий аминокислотную последовательность, включающую замену серином цистеина в аминокислотном положении 17 и замену треонином аргинина в аминокислотном положении 27, обладал более высокой эффективностью очистки.
5. Результат степени очистки дигликозилирования для варианта R27T интерферона-бета и двойного варианта интерферона-бета (R27T и C17S)
Варианты интерферон-бета, очищенные с использованием голубой сефарозной смолы, анализировали на содержание дигликозилирования:моногликозилирования, соответственно. В результате, как показано в таблице 5 и на ФИГ. 9A и 9B ниже, было подтверждено, что содержание дигликозилирования у двойного варианта ABN 101 (CS) было приблизительно на 10% выше, чем у ABN 101 (NT). Не было отмечено существенной разницы при сравнении биологической активности каждого вещества с помощью ELISA, но было подтверждено, что эффективность очистки дигликозилированного белка была высокой, когда вариант интерферона-бета экспрессировался и очищался в одном и том же масштабе.
6. Результат по стабильности варианта интерферона-бета в зависимости от изменения состава буфера
Чтобы подтвердить стабильность варианта интерферона-бета для каждого состава буфера, определяли степень сохранения белка и проводили анализ методом SEC-ВЭЖХ путем замены каждого буфера с помощью centricon. Когда каждый белок очищали, а затем буфер заменяли посредством 20 мМ фосфата натрия (pH 2,9), было подтверждено, что степень его сохранения была высокой для ABN 101 (CS), как показано в таблице 6 ниже.
Кроме того, степень сохранения подтверждали путем замены буфера посредством 20 мМ ацетата натрия (pH 3,8) с использованием centricon таким же образом, чтобы снова заменить буфер каждого белка, подвергнутого замене соответствующим буфером, буфером на основе другого состава. В результате было подтверждено, что степень сохранения ABN 101 (CS) также была выше, чем у ABN 101 (NT), при замене буфером на основе ацетата, как показано в таблице 7. Это интерпретировали как структурную стабильность белка в отношении физических факторов, таких как centricon, за счет повышения стабильности двойного варианта.
Степень сохранения белка и результат анализа мономера для каждого изменения состава буфера представлены в таблице 8 и на ФИГ. 10A-10D ниже.
7. Результат стабильности при замораживании/размораживании в зависимости от изменения состава буфера
Чтобы подтвердить стабильность при замораживании/размораживании (F/T) варианта интерферона-бета в зависимости от состава буфера, вариант интерферона в форме с замененным буфером повторно замораживали и размораживали 3 раза или 5 раз, соответственно, и подтверждали степень изменения мономера с помощью анализа методом SEC-ВЭЖХ. В результате, когда варианты интерферона хранили в буфере на основе 20 мМ фосфата натрия (pH 2,9) и подвергали повторному замораживанию-размораживанию, разница между двумя вариантами интерферона-бета не была значительной (см. таблицу 9, таблицу 10 и ФИГ. 11A-11F).
Однако в результате анализа путем замены буфера посредством 20 мМ ацетата натрия (pH 3,8) и проведения теста на замораживание-размораживание ABN 101 (CS) сохранил содержание мономера, но ABN 101 (NT) продемонстрировал быстрое увеличение доли HMW по сравнению с ABN 101 (CS) (5-кратное увеличение) (см. таблицу 11, таблицу 12 и ФИГ. 12A-12C). Благодаря этим результатам можно ожидать, что нестабильность при хранении лекарственного препарата интерферона-бета на основе ацетата может быть компенсирована за счет повышающего стабильность эффекта двойного варианта ABN 101(CS).
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Таким образом, согласно настоящему изобретению предложен вариант интерферона-бета человека, содержащий аминокислотную последовательность, включающую замену треонином аргинина в аминокислотном положении 27 и замену серином цистеина в аминокислотном положении 17 интерферона-бета человека. Согласно настоящему изобретению предложен вариант интерферона-бета человека с улучшенной эффективностью очистки, который может быть с пользой использован при производстве терапевтического агента с его помощью и, таким образом, имеет превосходную промышленную применимость.
--->
Перечень последовательностей
<110> АБИОН ИНК.
<120> ВАРИАНТ ИНТЕРФЕРОНА-БЕТА ЧЕЛОВЕКА С ДВОЙНОЙ МУТАЦИЕЙ И СПОСОБ
УЛУЧШЕНИЯ СТАБИЛЬНОСТИ ВАРИАНТА ИНТЕРФЕРОНА-БЕТА ЧЕЛОВЕКА
<130> OP21-0051/PCT
<150> KR 10-2020-0052513
<151> 2020-04-29
<150> KR 10-2020-0052913
<151> 2020-04-29
<160> 5
<170> KoPatentIn 3.0
<210> 1
<211> 166
<212> Белок
<213> Искусственная последовательность
<220>
<223> Белок интерферон-бета человека
<400> 1
Met Ser Tyr Asn Leu Leu Gly Phe Leu Gln Arg Ser Ser Asn Phe Gln
1 5 10 15
Cys Gln Lys Leu Leu Trp Gln Leu Asn Gly Arg Leu Glu Tyr Cys Leu
20 25 30
Lys Asp Arg Met Asn Phe Asp Ile Pro Glu Glu Ile Lys Gln Leu Gln
35 40 45
Gln Phe Gln Lys Glu Asp Ala Ala Leu Thr Ile Tyr Glu Met Leu Gln
50 55 60
Asn Ile Phe Ala Ile Phe Arg Gln Asp Ser Ser Ser Thr Gly Trp Asn
65 70 75 80
Glu Thr Ile Val Glu Asn Leu Leu Ala Asn Val Tyr His Gln Ile Asn
85 90 95
His Leu Lys Thr Val Leu Glu Glu Lys Leu Glu Lys Glu Asp Phe Thr
100 105 110
Arg Gly Lys Leu Met Ser Ser Leu His Leu Lys Arg Tyr Tyr Gly Arg
115 120 125
Ile Leu His Tyr Leu Lys Ala Lys Glu Tyr Ser His Cys Ala Trp Thr
130 135 140
Ile Val Arg Val Glu Ile Leu Arg Asn Phe Tyr Phe Ile Asn Arg Leu
145 150 155 160
Thr Gly Tyr Leu Arg Asn
165
<210> 2
<211> 166
<212> Белок
<213> Искусственная последовательность
<220>
<223> Мутеин R27T интерферона-бета человека (ABN101(NT))
<400> 2
Met Ser Tyr Asn Leu Leu Gly Phe Leu Gln Arg Ser Ser Asn Phe Gln
1 5 10 15
Cys Gln Lys Leu Leu Trp Gln Leu Asn Gly Thr Leu Glu Tyr Cys Leu
20 25 30
Lys Asp Arg Met Asn Phe Asp Ile Pro Glu Glu Ile Lys Gln Leu Gln
35 40 45
Gln Phe Gln Lys Glu Asp Ala Ala Leu Thr Ile Tyr Glu Met Leu Gln
50 55 60
Asn Ile Phe Ala Ile Phe Arg Gln Asp Ser Ser Ser Thr Gly Trp Asn
65 70 75 80
Glu Thr Ile Val Glu Asn Leu Leu Ala Asn Val Tyr His Gln Ile Asn
85 90 95
His Leu Lys Thr Val Leu Glu Glu Lys Leu Glu Lys Glu Asp Phe Thr
100 105 110
Arg Gly Lys Leu Met Ser Ser Leu His Leu Lys Arg Tyr Tyr Gly Arg
115 120 125
Ile Leu His Tyr Leu Lys Ala Lys Glu Tyr Ser His Cys Ala Trp Thr
130 135 140
Ile Val Arg Val Glu Ile Leu Arg Asn Phe Tyr Phe Ile Asn Arg Leu
145 150 155 160
Thr Gly Tyr Leu Arg Asn
165
<210> 3
<211> 166
<212> Белок
<213> Искусственная последовательность
<220>
<223> Двойной мутеин R27T, C17S интерферона-бета человека (ABN101(CS))
<400> 3
Met Ser Tyr Asn Leu Leu Gly Phe Leu Gln Arg Ser Ser Asn Phe Gln
1 5 10 15
Ser Gln Lys Leu Leu Trp Gln Leu Asn Gly Thr Leu Glu Tyr Cys Leu
20 25 30
Lys Asp Arg Met Asn Phe Asp Ile Pro Glu Glu Ile Lys Gln Leu Gln
35 40 45
Gln Phe Gln Lys Glu Asp Ala Ala Leu Thr Ile Tyr Glu Met Leu Gln
50 55 60
Asn Ile Phe Ala Ile Phe Arg Gln Asp Ser Ser Ser Thr Gly Trp Asn
65 70 75 80
Glu Thr Ile Val Glu Asn Leu Leu Ala Asn Val Tyr His Gln Ile Asn
85 90 95
His Leu Lys Thr Val Leu Glu Glu Lys Leu Glu Lys Glu Asp Phe Thr
100 105 110
Arg Gly Lys Leu Met Ser Ser Leu His Leu Lys Arg Tyr Tyr Gly Arg
115 120 125
Ile Leu His Tyr Leu Lys Ala Lys Glu Tyr Ser His Cys Ala Trp Thr
130 135 140
Ile Val Arg Val Glu Ile Leu Arg Asn Phe Tyr Phe Ile Asn Arg Leu
145 150 155 160
Thr Gly Tyr Leu Arg Asn
165
<210> 4
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой праймер Xba1
<400> 4
ggtctagagc caccatgacc a 21
<210> 5
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный праймер Pac1
<400> 5
cacttaggga ttaattaatc agttcctcag gtag 34
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ ВАРИАНТ РН20 ГИАЛУРОНИДАЗЫ ЧЕЛОВЕКА, И ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ПОДКОЖНОГО ВВЕДЕНИЯ | 2020 |
|
RU2810952C2 |
| АНТИТЕЛА ПРОТИВ ИНТЕРФЕРОНА БЕТА И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2750454C2 |
| НОВЫЕ ВАРИАНТЫ ГИАЛУРОНИДАЗЫ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2019 |
|
RU2766680C1 |
| КОНЬЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО, ВКЛЮЧАЮЩИЕ АНТИТЕЛО ПРОТИВ ЧЕЛОВЕЧЕСКОГО DLK1, И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2801630C2 |
| Рекомбинантный Fab-scFv на основе нейтрализующего антитела против интерферона бета-1а человека и антитела против рецептора ErbB2 человека | 2019 |
|
RU2748953C1 |
| Фармацевтическая композиция, содержащая инсулин и глюкагон | 2019 |
|
RU2823246C2 |
| Гуманизированное нейтрализующее антитело к интерферону-бета человека | 2019 |
|
RU2737466C1 |
| Слитый белок, содержащий вариант CCL3, и его применение | 2017 |
|
RU2727715C2 |
| Композиция для лечения гиперлипидемии, содержащая производное оксинтомодулина | 2013 |
|
RU2768853C1 |
| ВАРИАНТ ЧЕЛОВЕЧЕСКОГО ИНТЕРЛЕЙКИНА-2 ИЛИ ЕГО ПРОИЗВОДНОЕ | 2019 |
|
RU2799437C2 |
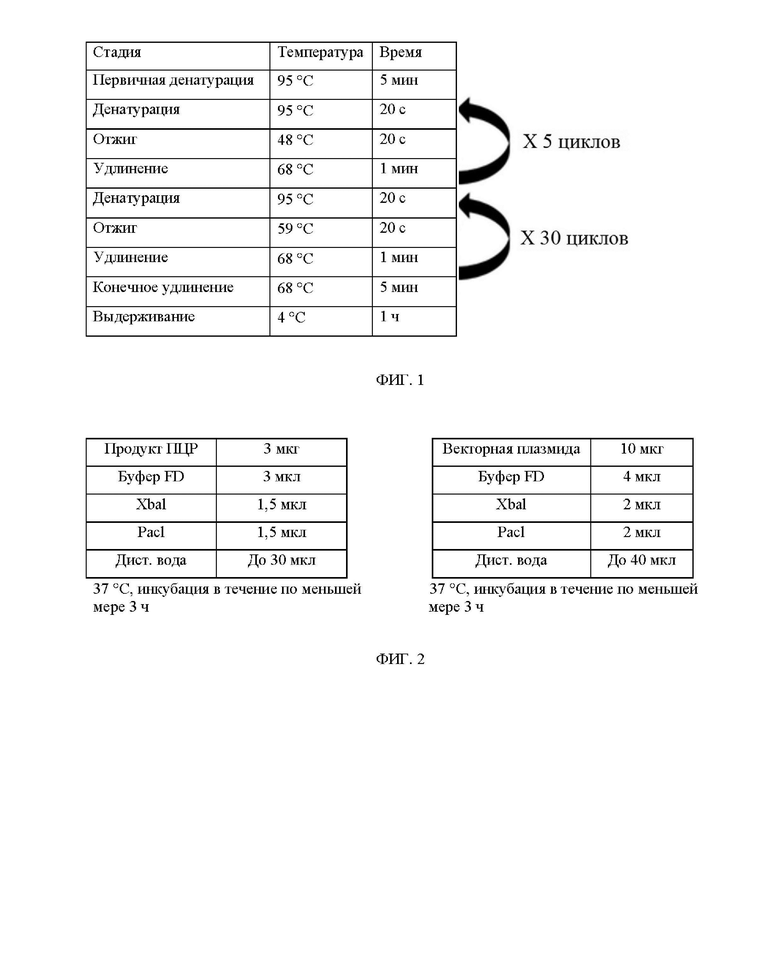
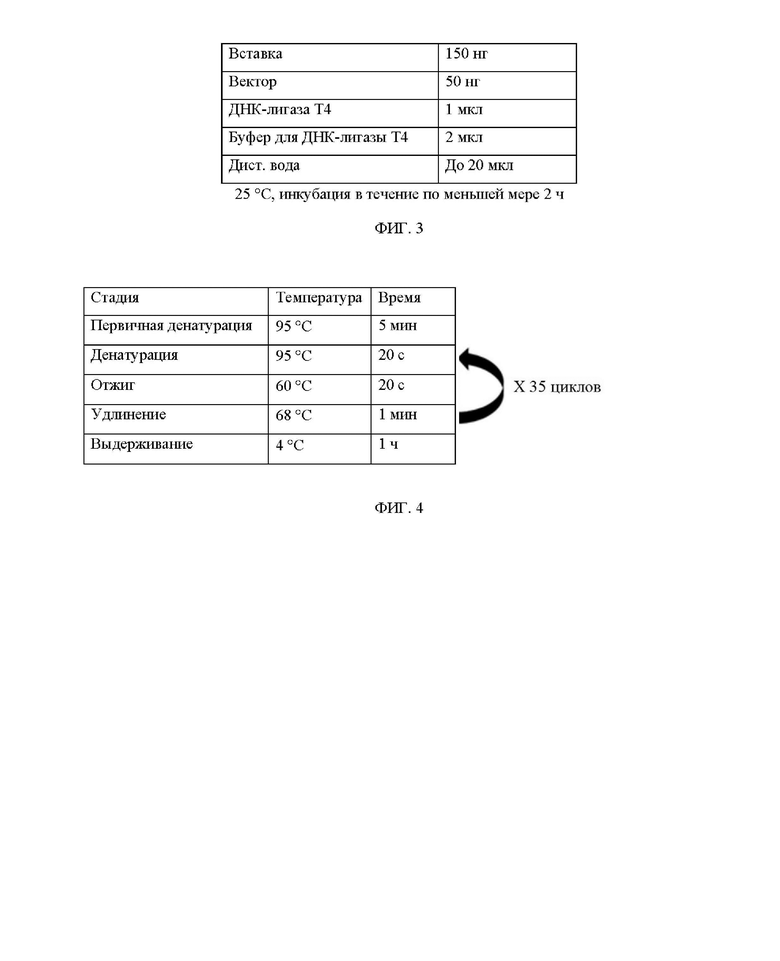

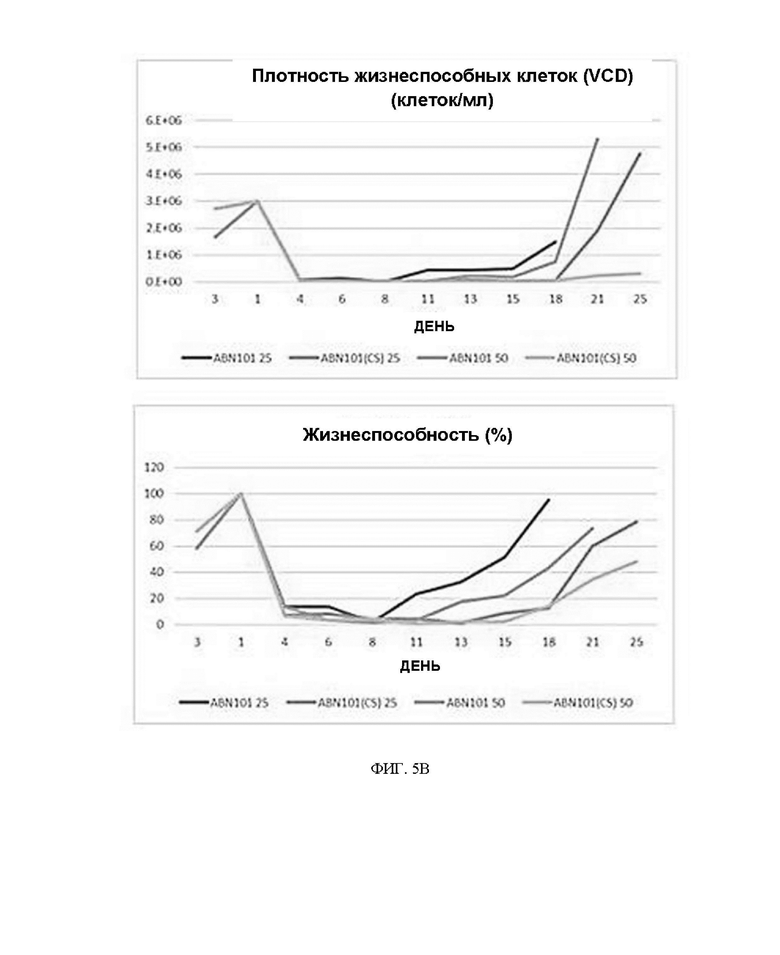
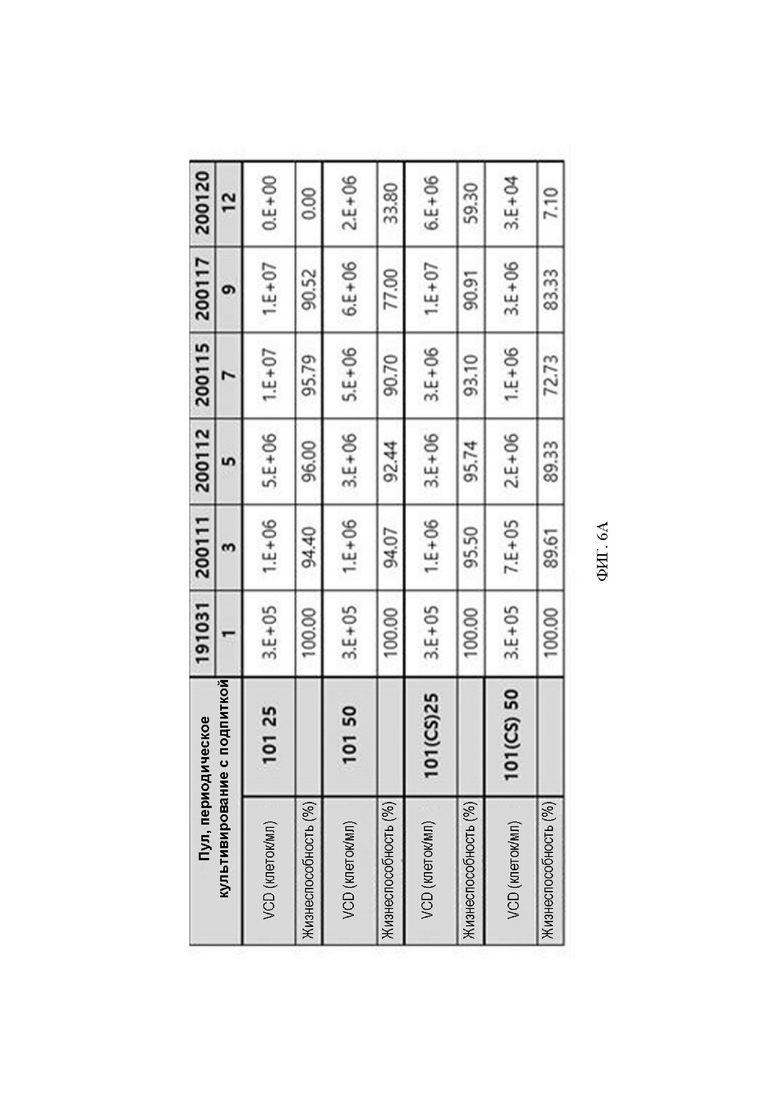
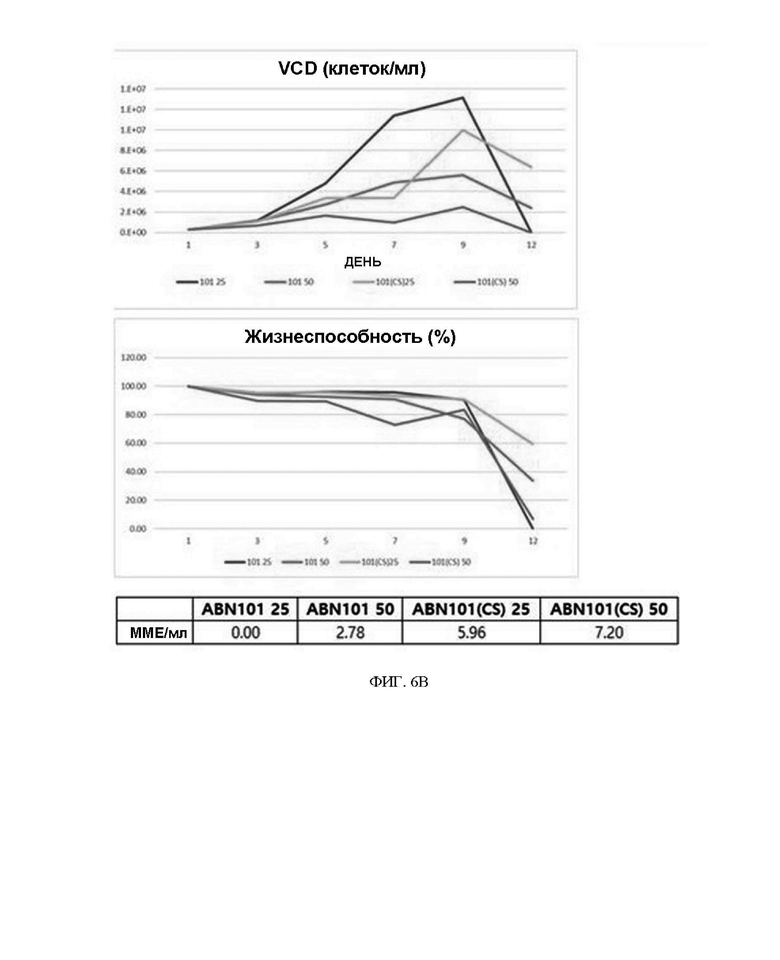
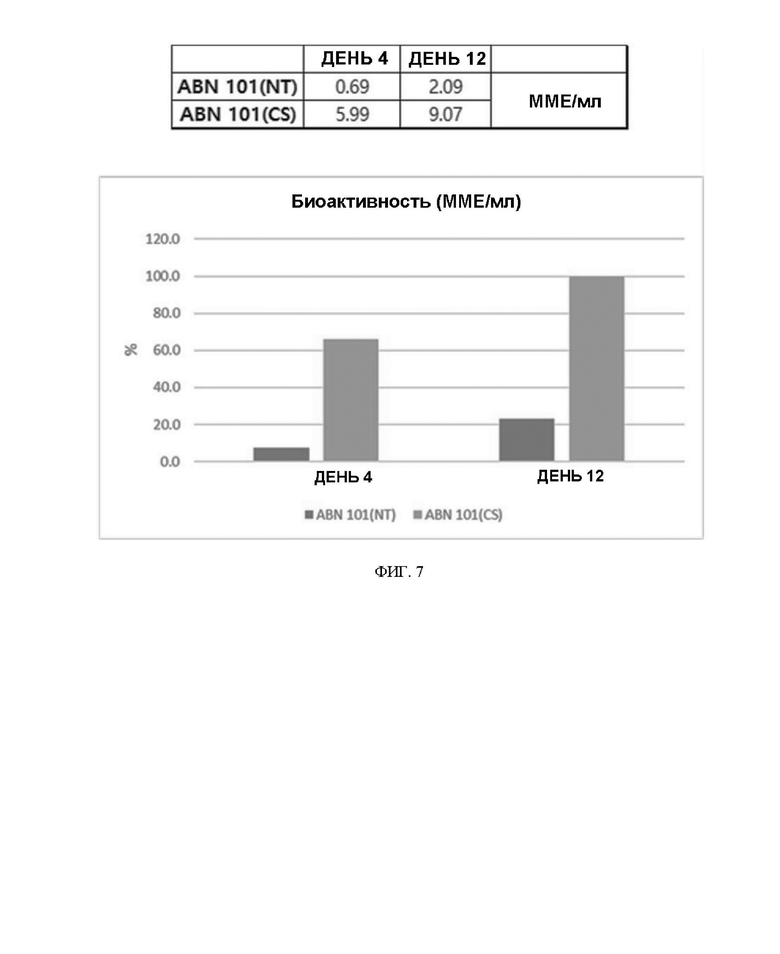
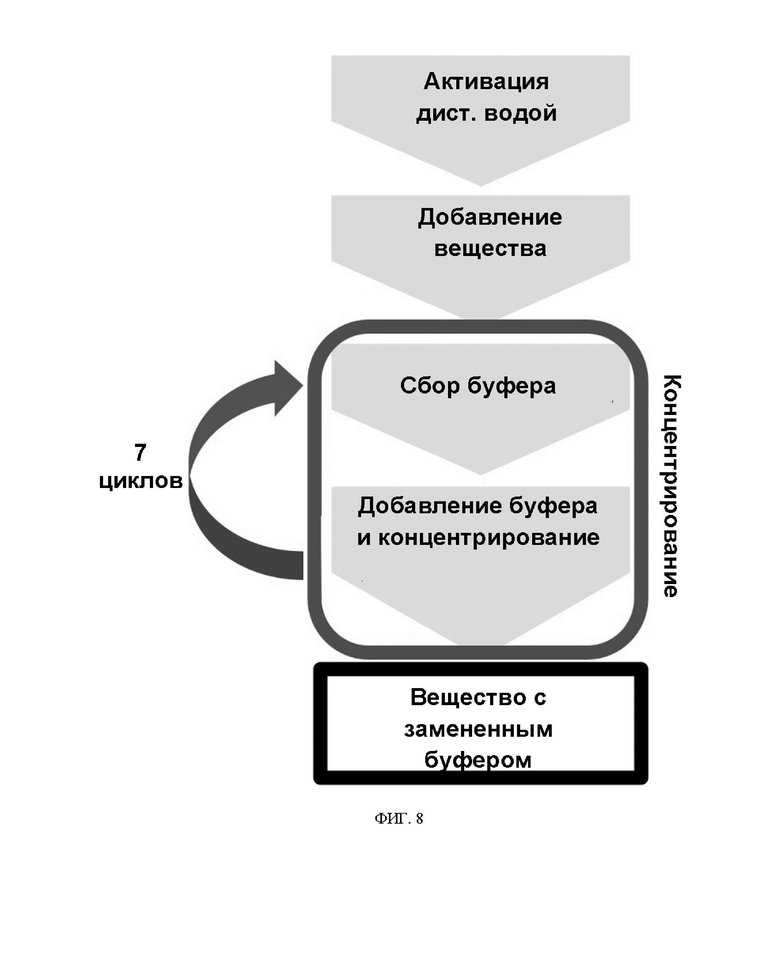
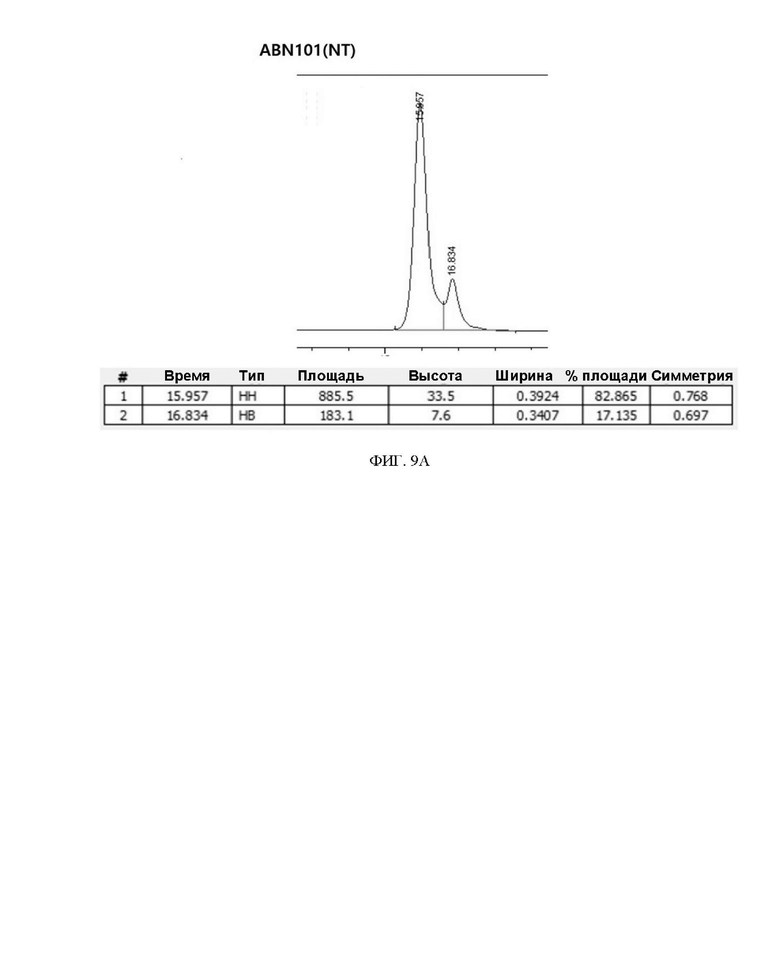
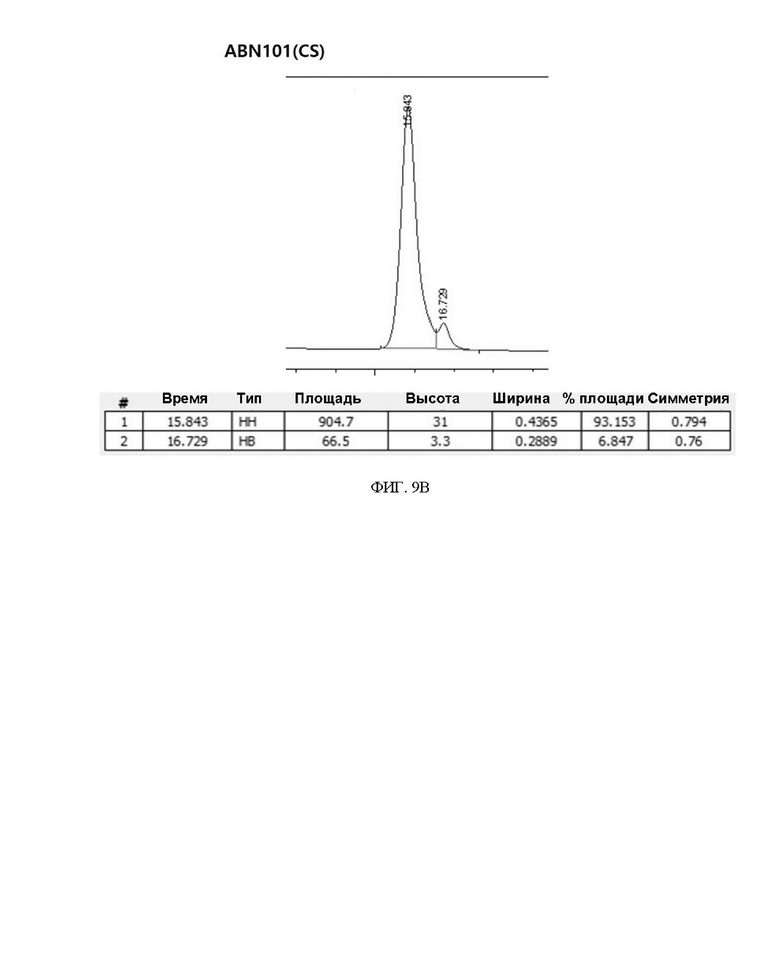
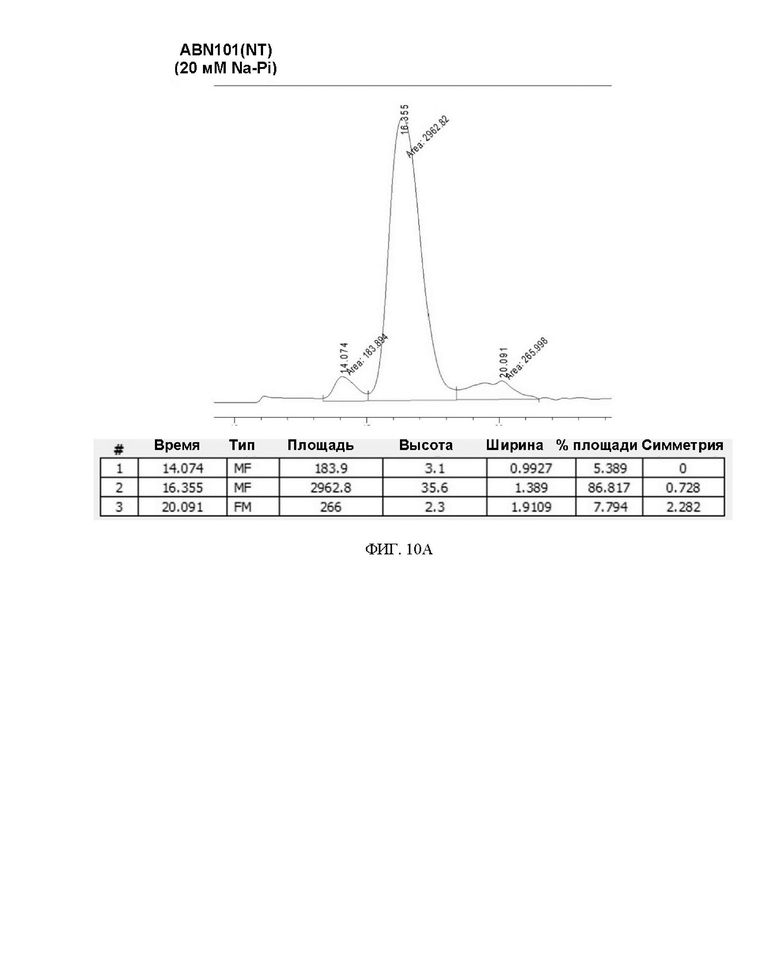
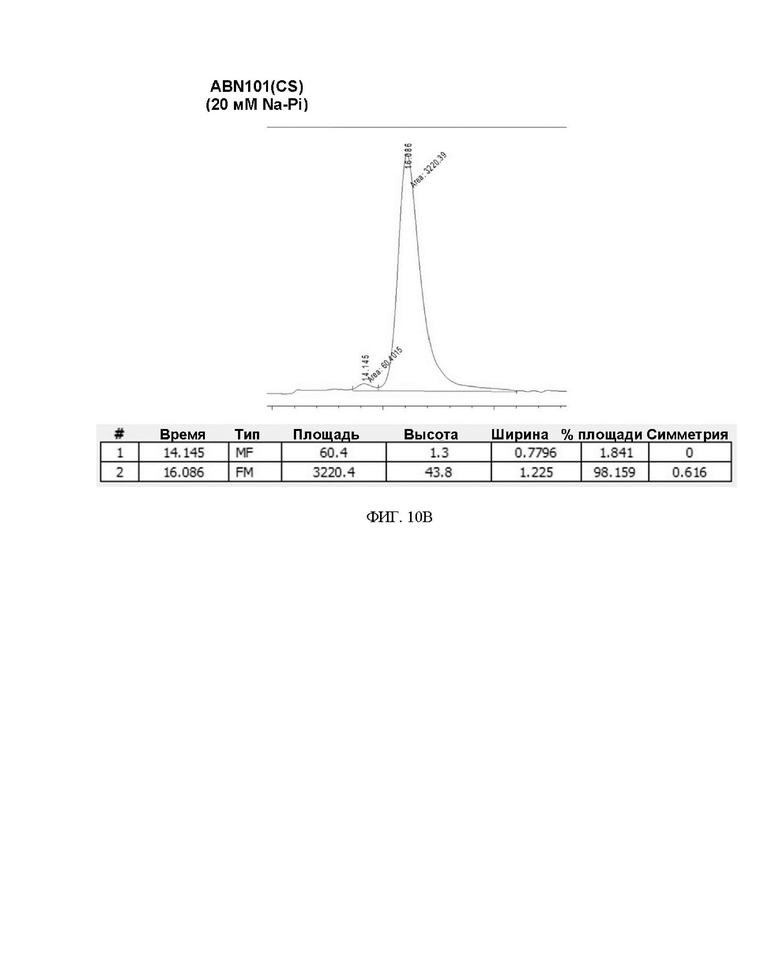
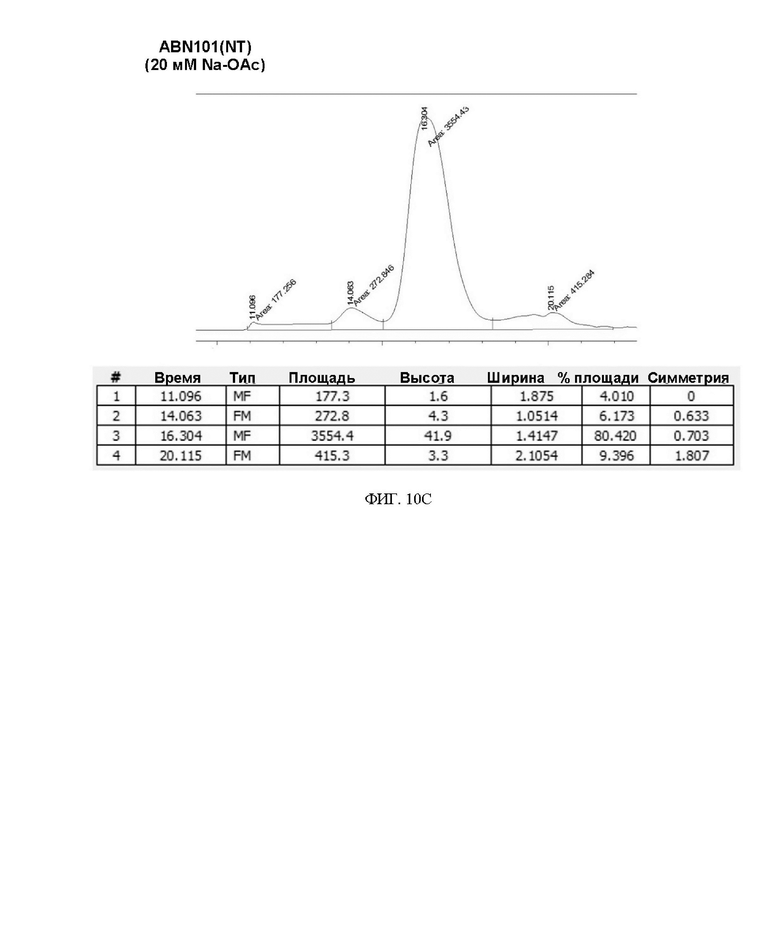
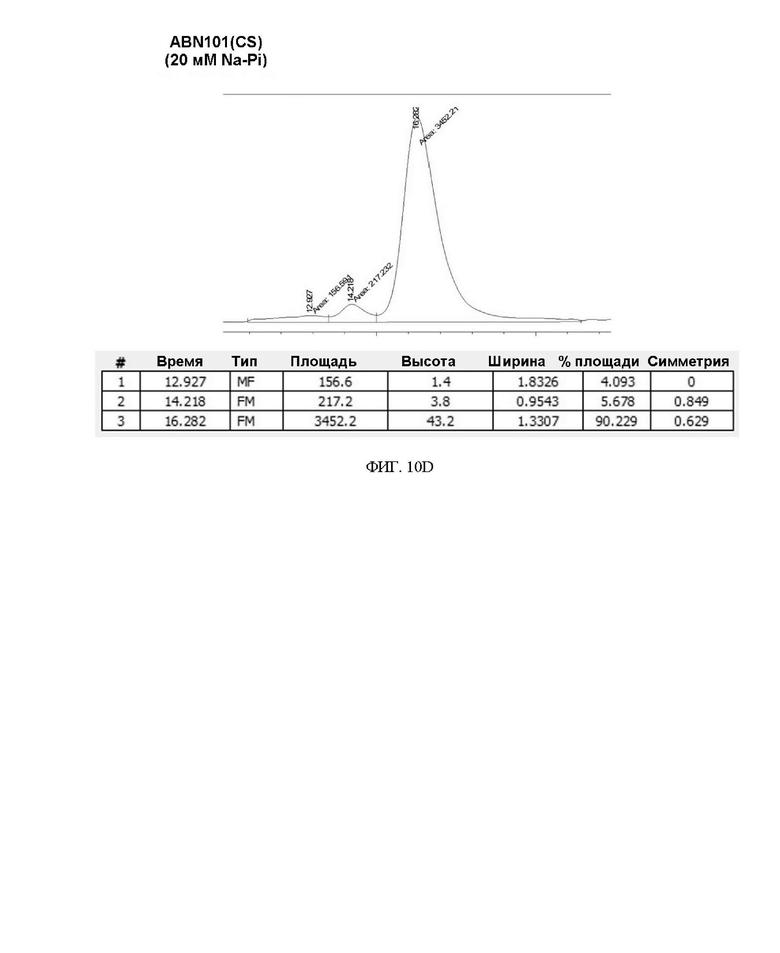
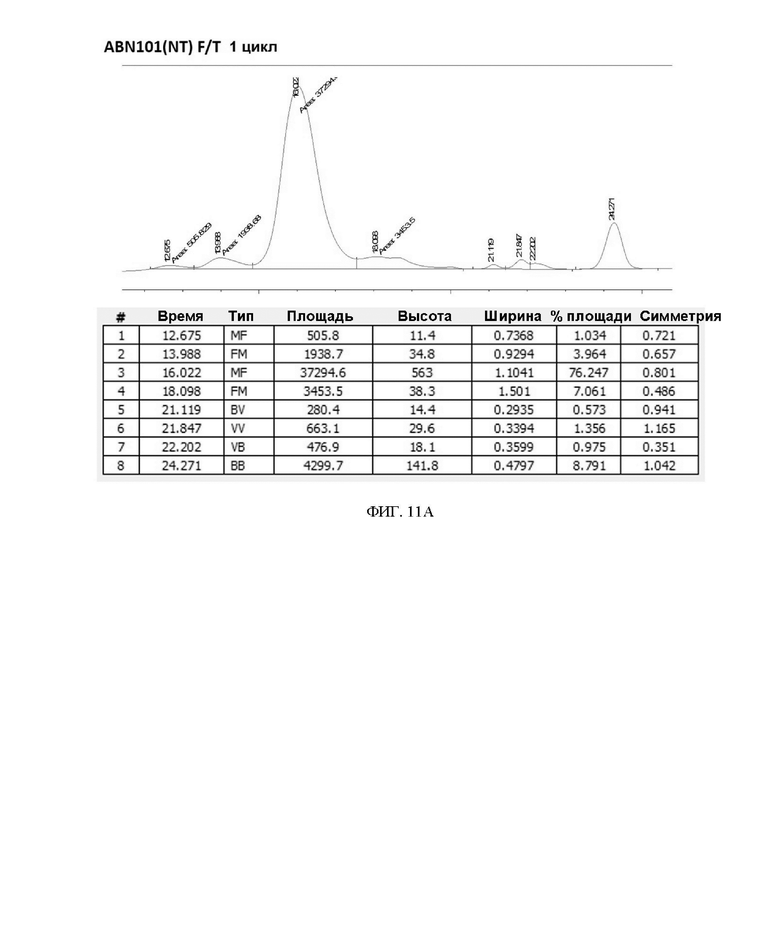
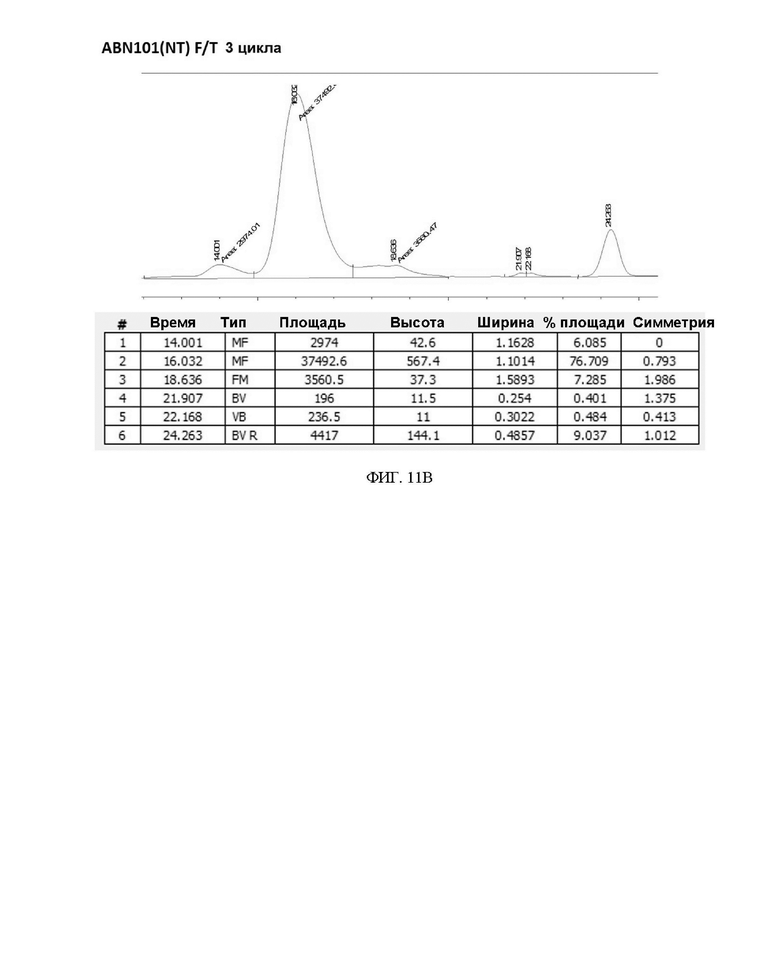
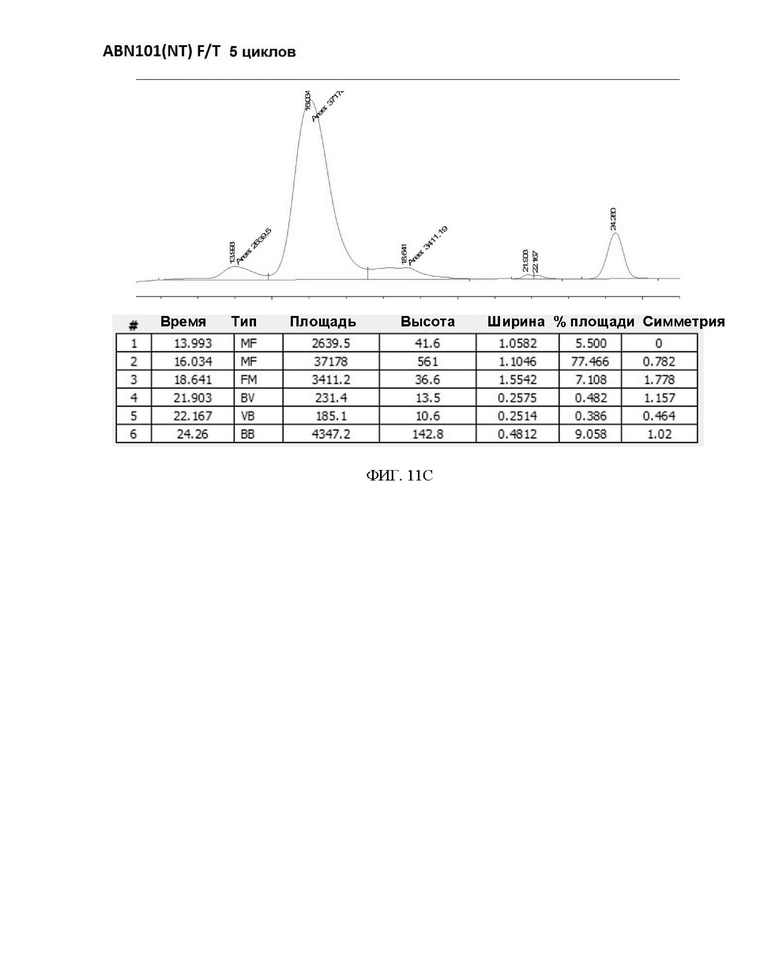
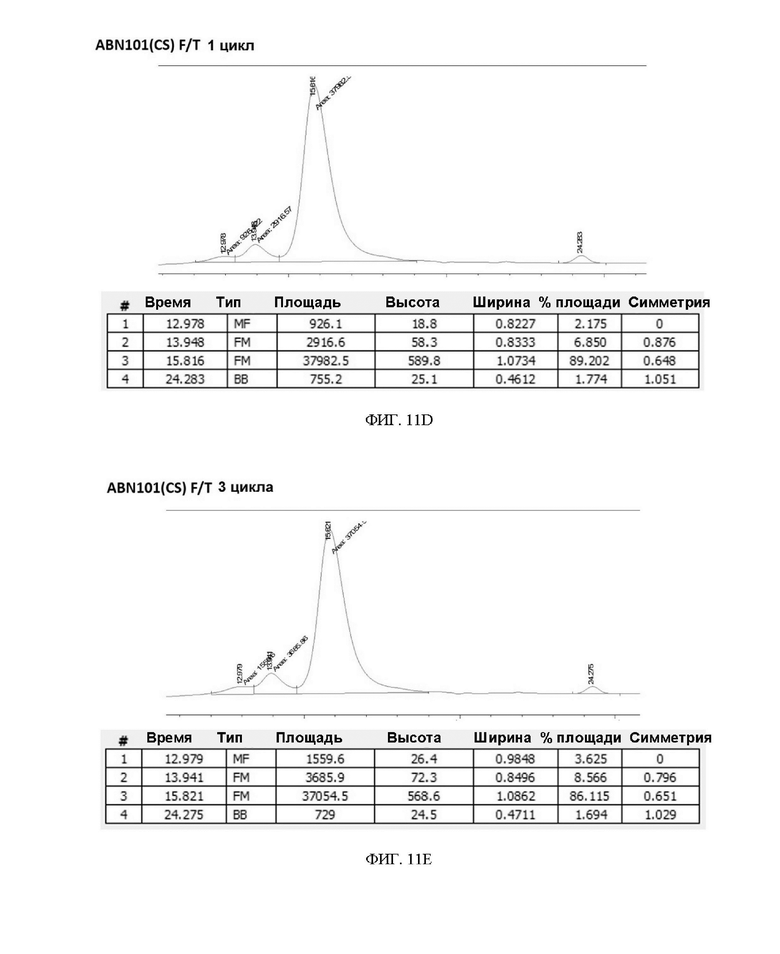
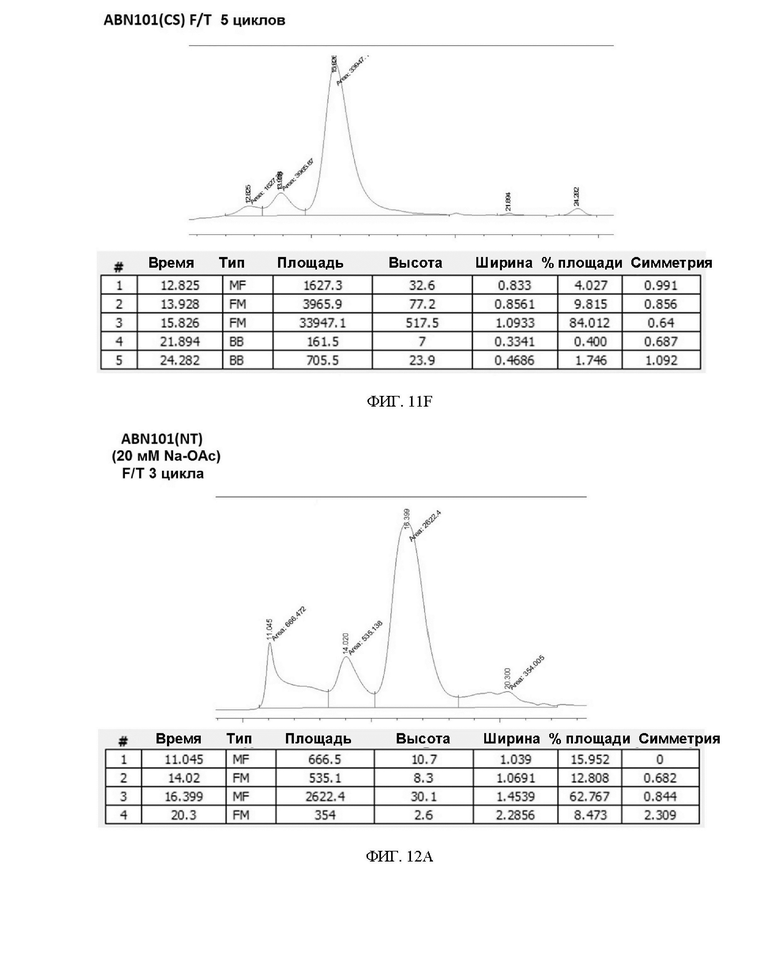
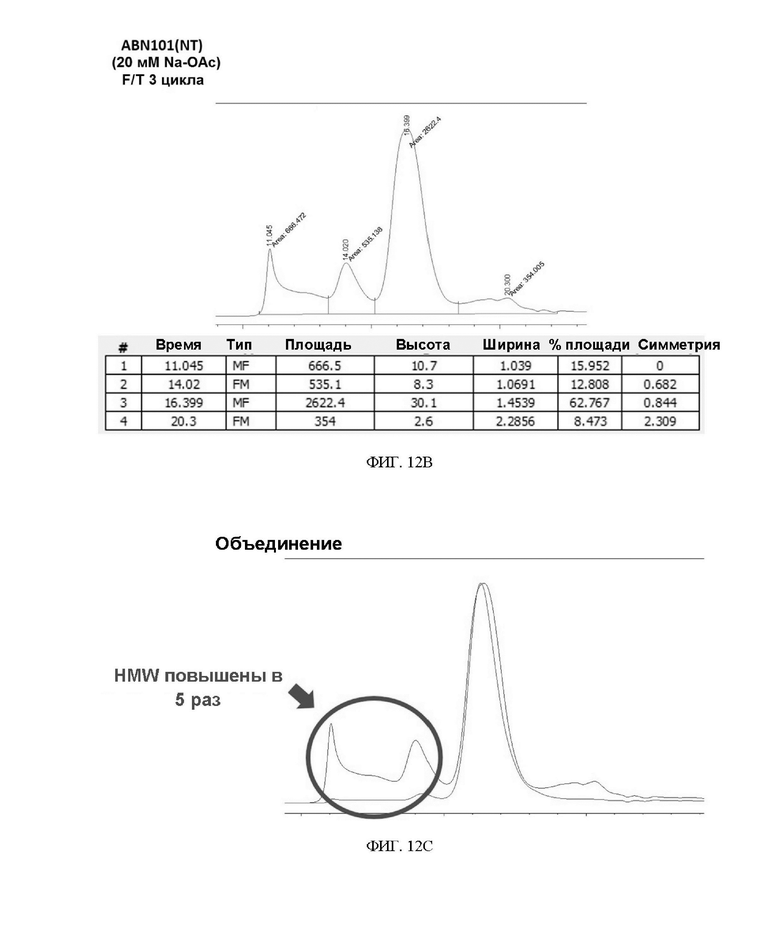
Настоящее изобретение относится к биотехнологии, в частности к варианту интерферона-бета человека с двойной мутацией, и к способу улучшения стабильности варианта интерферона-бета человека и, более конкретно, к варианту интерферона-бета человека, включающему аминокислотную последовательность, включающую замену серином цистеина в аминокислотном положении 17 интерферона-бета человека и замену треонином аргинина в аминокислотном положении 27 интерферона-бета человека, и к способу улучшения стабильности варианта R27T интерферона-бета человека, включающему стадию замены серином серина в аминокислотном положении 17 в варианте R27T интерферона-бета человека, в котором аргинин в аминокислотном положении 27 интерферона-бета человека заменен треонином. 10 н. и 11 з.п. ф-лы, 12 ил., 12 табл.
1. Вариант интерферона-бета человека, содержащий аминокислотную последовательность, включающую замену серином цистеина в аминокислотном положении 17 и замену треонином аргинина в аминокислотном положении 27 интерферона-бета человека,
где вариант интерферона-бета человека сохраняет активность интерферона-бета человека.
2. Полинуклеотид, кодирующий вариант интерферона-бета человека по п. 1.
3. Полинуклеотид по п. 2, где вариант интерферона-бета человека представляет собой вариант интерферона-бета человека, содержащий аминокислотную последовательность SEQ ID NO: 3.
4. Вектор экспрессии, экспрессирующий вариант интерферона-бета человека по п. 1 в клетке животного, содержащий полинуклеотид по п. 2.
5. Клетка животного, трансформированная вектором экспрессии по п. 4, где клетка животного предназначена для получения варианта интерферона-бета человека по п. 1.
6. Способ получения варианта интерферона-бета человека по п. 1, включающий культивирование клетки животного по п. 5.
7. Фармацевтическая композиция, содержащая вариант интерферона-бета человека по п. 1 в качестве активного ингредиента, где фармацевтическая композиция обладает фармацевтическим эффектом природного интерферона-бета человека.
8. Фармацевтическая композиция по п. 7, где фармацевтическая композиция обладает фармацевтическим эффектом природного интерферона-бета человека, и указанный фармацевтический эффект представляет собой фармацевтический эффект предупреждения или лечения заболевания, выбранного из группы, состоящей из рассеянного склероза, рака, аутоиммунного нарушения, вирусной инфекции, заболеваний, связанных с ВИЧ, и гепатита С.
9. Способ улучшения стабильности варианта R27T интерферона-бета человека, включающий замену серином цистеина в аминокислотном положении 17 в варианте R27T интерферона-бета человека, в котором аргинин в аминокислотном положении 27 интерферона-бета человека заменен треонином.
10. Способ по п. 9, где вариант R27T интерферона-бета человека состоит из аминокислотной последовательности SEQ ID NO: 2.
11. Способ по п. 9, где стабильность выбрана из группы, состоящей из стабильности при очистке, стабильности при хранении и стабильности при замораживании/размораживании.
12. Способ по п. 11, где стабильность при очистке улучшает эффективность очистки дигликозилированных белков.
13. Способ по п. 11, где стабильность при очистке снижает агрегацию и деградацию белка во время концентрирования и замены буфера.
14. Способ по п. 11, где стабильность при хранении представляет собой стабильность при хранении в буфере с рН от 2,0 до 6,0.
15. Способ по п. 14, где буфер представляет собой буфер, выбранный из группы, состоящей из уксусной кислоты, фосфорной кислоты, карбоната аммония, фосфата аммония, борной кислоты, лимонной кислоты, молочной кислоты, цитрата калия, метафосфата калия, одноосновного фосфата калия, ацетата натрия, цитрата натрия, раствора лактата натрия, двухосновного фосфата натрия, одноосновного фосфата натрия, бикарбоната, трис(трис(гидроксиметил)аминометана), 3-(N-морфолино)пропансульфоновой кислоты (MOPS), N-(2-гидроксиэтил)пиперазин-N'-(2-этансульфоновой кислоты) (HEPES), 2-(2-амино-2-оксоэтил)аминоэтансульфоновой кислоты (ACES), N-(2-ацетамидо)-2-иминодиуксусной кислоты (ADA), 3-(1,1-диметил-1,2-гидроксиэтиламино-2-пропансульфоновой кислоты (AMPSO), N,N-бис(2-гидроксиэтил)-2-аминоэтансульфоновой кислоты (BES), N,N-бис(2-гидроксиэтилглицина) (бицина), бис-трис-(бис-(2-гидроксиэтил)имино-трис(гидроксиметил)метана, 3-(циклогексиламино)-1-пропансульфоновой кислоты (CAPS), 3-(циклогексиламино)-2-гидрокси-1-пропансульфоновой кислоты (CAPSO), 2-(N-циклогексиламино)этансульфоновой кислоты (CHES), 3-N,N-бис(2-гидроксиэтиламино-2-гидроксипропансульфоновой кислоты (DIPSO), N-(2-гидроксиэтилпиперазин)-N'-(3-пропансульфоновой кислоты) (HEPPS), N-(2-гидроксиэтил)пиперазин-N'-(2-гидроксипропансульфоновой кислоты (HEPPSO), 2-(N-морфолино)этансульфоновой кислоты (MES), триэтаноламина, имидазола, глицина, этаноламина, фосфата, 3-(N-морфолино)-2-гидроксипропансульфоновой кислоты (MOPSO), пиперазин-N,N'-бис(2-этансульфоновой кислоты) (PIPES), пиперазин-N,N'-бис(2-гидроксипропансульфоновой кислоты) (POPSO), N-трисгидроксиметил)метил-3-аминопропансульфоновой кислоты (TAPS), 3-N-трис(гидроксиметил)метиламино-2-гидроксипропансульфоновой кислоты (TAPSO), N-трис(гидроксиметил)метил-2-аминоэтансульфоновой кислоты (TES), N-трис(гидроксиметил)метилглицина (трицина), 2-амино-2-метил-1,3-пропандиола и 2-амино-2-метил-1-пропанола.
16. Способ по п. 11, где стабильность при замораживании/размораживании представляет собой стабильность при размораживании после замораживания при температуре от -100 °C до -10 °C.
17. Способ по п. 11, где стабильность при замораживании/размораживании представляет собой стабильность при замораживании/размораживании в уксуснокислом буфере.
18. Способ по п. 11, где стабильность при замораживании/размораживании снижает агрегацию и деградацию белка после 3 или более циклов замораживания/размораживания.
19. Применение варианта интерферона-бета человека по п. 1 для получения агента, оказывающего фармацевтический эффект природного интерферона-бета человека на заболевание, выбранное из группы, состоящей из рассеянного склероза, рака, аутоиммунных нарушений, вирусной инфекции, заболеваний, связанных с ВИЧ, и гепатита С.
20. Способ лечения заболевания, выбранного из группы, состоящей из рассеянного склероза, рака, аутоиммунных нарушений, вирусной инфекции, заболеваний, связанных с ВИЧ, и гепатита С, включающий введение эффективного количества композиции, обладающей фармацевтическим эффектом природного интерферона-бета человека и содержащей вариант интерферона-бета человека по п. 1, нуждающемуся в этом субъекту.
21. Вариант интерферона-бета человека, включающий замену серином цистеина в аминокислотном положении 17 и замену треонином аргинина в аминокислотном положении 27 интерферона-бета человека с SEQ ID NO: 1, обладающий по меньшей мере 90% гомологией последовательности с интерфероном-бета дикого типа с SEQ ID NO: 1 и обладающий активностью интерферона-бета человека.
| KR 1020180038290 A, 16.04.2018 | |||
| KR 1020160120239 A, 17.10.2016 | |||
| EP 3524231 A2, 14.08.2019 | |||
| EP 1809661 B1, 18.05.2011 | |||
| EP 3492107 A1, 20.04.2005 | |||
| ДЕАМИДИРОВАННЫЙ ИНТЕРФЕРОН-БЕТА | 2005 |
|
RU2404190C2 |
Авторы
Даты
2024-01-22—Публикация
2021-04-29—Подача