Настоящая заявка испрашивает приоритет заявки PCT № PCT/CN2018/105162 от 12 сентября, 2018. Полное содержание которой включено в настоящее описание в качестве ссылки.
Область техники
Настоящее описание относится к антителам против TNFRSF9 (член суперсемейства рецепторов фактора некроза опухолей 9), антигенсвязывающим фрагментам и их применениям.
УРОВЕНЬ ТЕХНИКИ
Онкологическое заболевание в настоящее время является одним из заболеваний, которые имеют самую высокую смертность среди людей. Согласно статистическим данным Всемирной организации здравоохранения, в 2012 году число случаев заболеваемости онкологическими заболеваниями и смертности в мире достигло 14 миллионов и 8,2 миллионов, соответственно. В Китае впервые диагностировано 3,07 миллиона случаев онкологических заболеваний, а число погибших составило 2,2 миллиона.
Недавний клинический и коммерческий успех противоопухолевых антител вызвал большой интерес к терапии на основе антител. Существует необходимость в разработке противоопухолевых антител для использования в различных терапевтических средствах на основе антител для лечения онкологических заболеваний.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее описание относится к антителам против TNFRSF9 (член суперсемейства рецепторов фактора некроза опухолей 9; также известный как «1BB» или «CD137»), антигенсвязывающим фрагментам и их применениям.
В одном аспекте изобретение относится к антителу или его антигенсвязывающему фрагменту, который связывается с 4-1BB (член 9 суперсемейства рецепторов TNF), содержащим вариабельную область тяжелой цепи (VH), содержащую области, определяющие комплементарность, (CDR) 1, 2 и 3, где область VH CDR1 содержит аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95%, или 100% идентична выбранной аминокислотной последовательности VH CDR1, область VH CDR2 содержит аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95%, или 100% идентична выбранной аминокислотной последовательности VH CDR2, а область VH CDR3 содержит аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95%, или 100% идентична выбранной аминокислотной последовательности VH CDR3; и вариабельную область легкой цепи (VL), содержащую CDR 1, 2 и 3, где область VL CDR1 содержит аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95%, или 100% идентична выбранной аминокислотной последовательности VL CDR1, область VL CDR2 содержит аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95%, или 100% идентична выбранной аминокислотной последовательности VL CDR2, а область VL CDR3 содержит аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95%, или 100% идентична выбранной аминокислотной последовательности VL CDR3, где выбранные аминокислотные последовательности VH CDR 1, 2 и 3 и выбранные аминокислотные последовательности VL CDR, 1, 2 и 3 являются одними из следующих:
(1) выбранные аминокислотные последовательности VH CDR 1, 2, 3 представлены в SEQ ID NO:1, 2, 3, соответственно, и выбранные аминокислотные последовательности VL CDR 1, 2, 3 представлены в SEQ ID NO:4, 5, 6, соответственно;
(2) выбранные аминокислотные последовательности VH CDR 1, 2, 3 представлены в SEQ ID NO:7, 8, 9, соответственно, и выбранные аминокислотные последовательности VL CDR 1, 2, 3 представлены в SEQ ID NO:10, 11, 12, соответственно;
(3) выбранные аминокислотные последовательности VH CDR 1, 2, 3 представлены в SEQ ID NO:13, 14, 15, соответственно, а выбранные аминокислотные последовательности VL CDR 1, 2, 3 представлены в SEQ ID NO:16, 17, 18, соответственно;
(4) выбранные аминокислотные последовательности VH CDR 1, 2, 3 представлены в SEQ ID NO:19, 20, 21, соответственно, и выбранные аминокислотные последовательности VL CDR 1, 2, 3 представлены в SEQ ID NO:22, 23, 24, соответственно;
(5) выбранные аминокислотные последовательности VH CDR 1, 2, 3 представлены в SEQ ID NO:25, 26, 27, соответственно, и выбранные аминокислотные последовательности VL CDR 1, 2, 3 представлены в SEQ ID NO:28, 29, 30, соответственно;
(6) выбранные аминокислотные последовательности VH CDR 1, 2, 3 представлены в SEQ ID NO:31, 32, 33, соответственно, и выбранные аминокислотные последовательности VL CDR 1, 2, 3 представлены в SEQ ID NO:34, 35, 36, соответственно;
(7) выбранные аминокислотные последовательности VH CDR 1, 2, 3 представлены в SEQ ID NO:37, 38, 39, соответственно, и выбранные аминокислотные последовательности VL CDR 1, 2, 3 представлены в SEQ ID NO:40, 41, 42, соответственно;
(8) выбранные аминокислотные последовательности VH CDR 1, 2, 3 представлены в SEQ ID NO:43, 44, 45, соответственно, и выбранные аминокислотные последовательности VL CDR 1, 2, 3 представлены в SEQ ID NO:46, 47, 48, соответственно;
(9) выбранные аминокислотные последовательности VH CDR 1, 2, 3 представлены в SEQ ID NO:49, 50, 51, соответственно, и выбранные аминокислотные последовательности VL CDR 1, 2, 3 представлены в SEQ ID NO:52, 53, 54, соответственно;
(10) выбранные аминокислотные последовательности VH CDR 1, 2, 3 представлены в SEQ ID NO:55, 56, 57, соответственно, и выбранные аминокислотные последовательности VL CDR 1, 2, 3 представлены в SEQ ID NO:58, 59, 60, соответственно;
(11) выбранные аминокислотные последовательности VH CDR 1, 2, 3 представлены в SEQ ID NO:61, 62, 63, соответственно, и выбранные аминокислотные последовательности VL CDR 1, 2, 3 представлены в SEQ ID NO:64, 65, 66, соответственно;
(12) выбранные аминокислотные последовательности VH CDR 1, 2, 3 представлены в SEQ ID NO:67, 68, 69, соответственно, и выбранные аминокислотные последовательности VL CDR 1, 2, 3 представлены в SEQ ID NO:70, 71, 72, соответственно;
(13) выбранные аминокислотные последовательности VH CDR 1, 2, 3 представлены в SEQ ID NO:73, 74, 75, соответственно, и выбранные аминокислотные последовательности VL CDR 1, 2, 3 представлены в SEQ ID NO:76, 77, 78, соответственно;
(14) выбранные аминокислотные последовательности VH CDR 1, 2, 3 представлены в SEQ ID NO:79, 80, 81, соответственно, и выбранные аминокислотные последовательности VL CDR 1, 2, 3 представлены в SEQ ID NO:82, 83, 84, соответственно;
(15) выбранные аминокислотные последовательности VH CDR 1, 2, 3 представлены в SEQ ID NO:85, 86, 87, соответственно, и выбранные аминокислотные последовательности VL CDR 1, 2, 3 представлены в SEQ ID NO:88, 89, 90, соответственно;
(16) выбранные аминокислотные последовательности VH CDR 1, 2, 3 представлены в SEQ ID NO:91, 92, 93, соответственно, и выбранные аминокислотные последовательности VL CDR 1, 2, 3 представлены в SEQ ID NO:94, 95, 96, соответственно;
(17) выбранные аминокислотные последовательности VH CDR 1, 2, 3 представлены в SEQ ID NO:97, 98, 99, соответственно, и выбранные аминокислотные последовательности VL CDR 1, 2, 3 представлены в SEQ ID NO:100, 101, 102, соответственно;
(18) выбранные аминокислотные последовательности VH CDR 1, 2, 3 представлены в SEQ ID NO:103, 104, 105, соответственно, и выбранные аминокислотные последовательности VL CDR 1, 2, 3 представлены в SEQ ID NO:106, 107, 108, соответственно;
В некоторых вариантах осуществления VH содержит CDR 1, 2, 3 с аминокислотными последовательностями, представленными в SEQ ID NO:1, 2 и 3, соответственно, и VL содержит CDR 1, 2, 3 с аминокислотными последовательностями, представленными в SEQ ID NO:4, 5 и 6, соответственно.
В некоторых вариантах осуществления VH содержит CDR 1, 2, 3 с аминокислотными последовательностями, представленными в SEQ ID NO:7, 8 и 9, соответственно, и VL содержит CDR 1, 2, 3 с аминокислотными последовательностями, представленными в SEQ ID NO:10, 11 и 12, соответственно.
В некоторых вариантах осуществления VH содержит CDR 1, 2, 3 с аминокислотными последовательностями, представленными в SEQ ID NO:13, 14 и 15, соответственно, и VL содержит CDR 1, 2, 3 с аминокислотными последовательностями, представленными в SEQ ID NO:16, 17 и 18, соответственно.
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент специфически связываются с 4-1BB человека. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент представляют собой гуманизированное антитело или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент представляют собой одноцепочечный вариабельный фрагмент (scFV).
В одном аспекте описание также относится к нуклеиновой кислоте, содержащей полинуклеотид, кодирующий полипептид, содержащий:
(1) тяжелую цепь иммуноглобулина или ее фрагмент, содержащие вариабельную область тяжелой цепи (VH), содержащую области, определяющие комплементарность, (CDR) 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:1, 2, и 3, соответственно, и где VH, спариваясь с вариабельной областью легкой цепи (VL), содержащей аминокислотную последовательность, представленную в SEQ ID NO:225, 226, 227, 228 или 244, связывается с 4-1BB;
(2) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:4, 5 и 6, соответственно, и где VL, спариваясь с VH, содержащей аминокислотную последовательность, представленную в SEQ ID NO:221, 222, 223, 224, или 243, связывается с 4-1BB;
(3) тяжелую цепь иммуноглобулина или ее фрагмент, содержащие вариабельную область тяжелой цепи (VH), содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:7, 8 и 9, соответственно, и где VH, спариваясь с вариабельной областью легкой цепи (VL), содержащей аминокислотную последовательность, представленную в SEQ ID NO:232, 233, 234, 235, или 246, связывается с 4-1BB;
(4) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:10, 11 и 12, соответственно, и где VL, спариваясь с VH, содержащей аминокислотную последовательность, представленную в SEQ ID NO:229, 230, 231 или 245, связывается с 4-1BB;
(5) тяжелую цепь иммуноглобулина или ее фрагмент, содержащие вариабельную область тяжелой цепи (VH), содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:13, 14 и 15, соответственно, и где VH, спариваясь с вариабельной областью легкой цепи (VL), содержащей аминокислотную последовательность, представленную в SEQ ID NO:239, 240, 241, 242, или 248, связывается с 4-1BB;
(6) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:16, 17 и 18, соответственно, и где VL, спариваясь с VH, содержащей аминокислотную последовательность, представленную в SEQ ID NO:236, 237, 238, или 247, связывается с 4-1BB;
(7) тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VH, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:19, 20, 21, соответственно, и где VH, спариваясь с VL, содержащей аминокислотную последовательность, представленную в SEQ ID NO:250, связывается с 4-1BB;
(8) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:22, 23, 24, соответственно, и где VL, спариваясь с VH, содержащей аминокислотную последовательность, представленную в SEQ ID NO:249, связывается с 4-1BB;
(9) тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VH, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:25, 26, 27, соответственно, и где VH, спариваясь с VL, содержащей аминокислотную последовательность, представленную в SEQ ID NO:252, связывается с 4-1BB;
(10) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:28, 29 и 30, соответственно, и где VL, спариваясь с VH, содержащей аминокислотную последовательность, представленную в SEQ ID NO:251, связывается с 4-1BB;
(11) тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VH, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:31, 32, 33, соответственно, и где VH, спариваясь с VL, содержащей аминокислотную последовательность, представленную в SEQ ID NO:254, связывается с 4-1BB;
(12) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 2, 3 и 34, содержащие аминокислотные последовательности, представленные в SEQ ID NO:34, 35, 36, соответственно, и где VL, спариваясь с VH, содержащей аминокислотную последовательность, представленную в SEQ ID NO:253, связывается с 4-1BB;
(13) тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VH, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:37, 38, 39, соответственно, и где VH, спариваясь с VL, содержащей аминокислотную последовательность, представленную в SEQ ID NO:256, связывается с 4-1BB;
(14) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:40, 41, 42, соответственно, и где VL, спариваясь с VH, содержащей аминокислотную последовательность, представленную в SEQ ID NO:255, связывается с 4-1BB;
(15) тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VH, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:43, 44, 45, соответственно, и где VH, спариваясь с VL, содержащей аминокислотную последовательность, представленную в SEQ ID NO:258, связывается с 4-1BB;
(16) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:46, 47, 48, соответственно, и где VL, спариваясь с VH, содержащей аминокислотную последовательность, представленную в SEQ ID NO:257, связывается с 4-1BB;
(17) тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VH, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:49, 50, 51, соответственно, и где VH, спариваясь с VL, содержащей аминокислотную последовательность, представленную в SEQ ID NO:260, связывается с 4-1BB;
(18) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:52, 53, 54, соответственно, и где VL, спариваясь с VH, содержащей аминокислотную последовательность, представленную в SEQ ID NO:259, связывается с 4-1BB;
(19) тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VH, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:55, 56, 57, соответственно, и где VH, спариваясь с VL, содержащей аминокислотную последовательность, представленную в SEQ ID NO:262, связывается с 4-1BB;
(20) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:58, 59, 60, соответственно, и где VL, спариваясь с VH, содержащей аминокислотную последовательность, представленную в SEQ ID NO:261, связывается с 4-1BB;
(21) тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VH, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:61, 62, 63, соответственно, и где VH, спариваясь с VL, содержащей аминокислотную последовательность, представленную в SEQ ID NO:264, связывается с 4-1BB;
(22) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:64, 65, 66, соответственно, и где VL, спариваясь с VH, содержащей аминокислотную последовательность, представленную в SEQ ID NO:263, связывается с 4-1BB;
(23) тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VH, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:67, 68, 69, соответственно, и где VH, спариваясь с VL, содержащей аминокислотную последовательность, представленную в SEQ ID NO:266, связывается с 4-1BB;
(24) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:70, 71, 72, соответственно, и где VL, спариваясь с VH, содержащей аминокислотную последовательность, представленную в SEQ ID NO:265, связывается с 4-1BB;
(25) тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VH, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:73, 74, 75, соответственно, и где VH, спариваясь с VL, содержащей аминокислотную последовательность, представленную в SEQ ID NO:268, связывается с 4-1BB;
(26) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:76, 77, 78, соответственно, и где VL, спариваясь с VH, содержащей аминокислотную последовательность, представленную в SEQ ID NO:267, связывается с 4-1BB;
(27) тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VH, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:79, 80, 81, соответственно, и где VH, спариваясь с VL, содержащей аминокислотную последовательность, представленную в SEQ ID NO:270, связывается с 4-1BB;
(28) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:82, 83, 84, соответственно, и где VL, спариваясь с VH, содержащей аминокислотную последовательность, представленную в SEQ ID NO:269, связывается с 4-1BB;
(29) тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VH, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:85, 86, 87, соответственно, и где VH, спариваясь с VL, содержащей аминокислотную последовательность, представленную в SEQ ID NO:272, связывается с 4-1BB;
(30) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:88, 89, 90, соответственно, и где VL, спариваясь с VH, содержащей аминокислотную последовательность, представленную в SEQ ID NO:271, связывается с 4-1BB;
(31) тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VH, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:91, 92, 93, соответственно, и где VH, спариваясь с VL, содержащей аминокислотную последовательность, представленную в SEQ ID NO:274, связывается с 4-1BB;
(32) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:94, 95, 96, соответственно, и где VL, спариваясь с VH, содержащей аминокислотную последовательность, представленную в SEQ ID NO:273, связывается с 4-1BB;
(33) тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VH, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:97, 98, 99, соответственно, и где VH, спариваясь с VL, содержащей аминокислотную последовательность, представленную в SEQ ID NO:276, связывается с 4-1BB;
(34) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:100, 101, 102, соответственно, и где VL, спариваясь с VH, содержащей аминокислотную последовательность, представленную в SEQ ID NO:275, связывается с 4-1BB;
(35) тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VH, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:103, 104, 105, соответственно, и где VH, спариваясь с VL, содержащей аминокислотную последовательность, представленную в SEQ ID NO:278, связывается с 4-1BB;
(36) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:106, 107, 108, соответственно, и где VL, спариваясь с VH, содержащей аминокислотную последовательность, представленную в SEQ ID NO:277, связывается с 4-1BB;
В некоторых вариантах осуществления нуклеиновая кислота содержит полинуклеотид, кодирующий полипептид, содержащий тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VH, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:1, 2, и 3, соответственно.
В некоторых вариантах осуществления нуклеиновая кислота содержит полинуклеотид, кодирующий полипептид, содержащий легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:4, 5, и 6, соответственно.
В некоторых вариантах осуществления нуклеиновая кислота содержит полинуклеотид, кодирующий полипептид, содержащий тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VH, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:7, 8, и 9, соответственно.
В некоторых вариантах осуществления нуклеиновая кислота содержит полинуклеотид, кодирующий полипептид, содержащий легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:10, 11, и 12, соответственно.
В некоторых вариантах осуществления нуклеиновая кислота содержит полинуклеотид, кодирующий полипептид, содержащий тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VH, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:13, 14 и 15, соответственно.
В некоторых вариантах осуществления нуклеиновая кислота содержит полинуклеотид, кодирующий полипептид, содержащий легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, представленные в SEQ ID NO:16, 17 и 18, соответственно.
В некоторых вариантах осуществления VH, спариваясь с VL, специфически связывается с человеческим 4-1BB, или VL, спариваясь с VH, специфически связывается с человеческим 4-1BB.
В некоторых вариантах осуществления тяжелая цепь иммуноглобулина или ее фрагмент представляют собой тяжелую цепь гуманизированного иммуноглобулина или ее фрагмент, и легкая цепь иммуноглобулина или ее фрагмент представляют собой легкую цепь гуманизированного иммуноглобулина или ее фрагмент.
В некоторых вариантах осуществления нуклеиновая кислота кодирует одноцепочечный вариабельный фрагмент (scFv). В некоторых вариантах осуществления нуклеиновая кислота представляет собой кДНК.
В одном аспекте изобретение относится к вектору, содержащему одну или более нуклеиновых кислот, как описано в настоящем документе. В одном аспекте описание также относится к вектору, содержащему одну или более нуклеиновых кислот, как описано в настоящем документе. В некоторых вариантах осуществления вектор кодирует область VL и область VH, которые вместе связываются с 4-1BB.
В одном аспекте описание относится к паре векторов, где каждый вектор содержит одну из нуклеиновых кислот, как описано в настоящем документе, где вместе пара векторов кодирует область VL и область VH, которые вместе связываются с 4-1BB.
В одном аспекте описание относится к клетке, содержащей вектор или пару векторов, как описано в настоящем документе. В некоторых вариантах осуществления клетка представляет собой клетку CHO.
В одном аспекте описание относится к клетке, содержащей одну или более нуклеиновых кислот, как описано в настоящем документе. В одном аспекте описание относится к клетке, содержащей две нуклеиновые кислоты, как описано в настоящем документе. В некоторых вариантах осуществления две нуклеиновые кислоты вместе кодируют область VL и область VH, которые вместе связываются с 4-1BB.
В одном аспекте описание относится к способу получения антитела или его антигенсвязывающего фрагмента, где способ включает
(a) культивирование клетки, как описано в настоящем документе, в условиях, достаточных для того, чтобы клетка продуцировала антитело или антигенсвязывающий фрагмент; и
(b) сбор антитела или антигенсвязывающего фрагмента, продуцируемых клеткой.
В одном аспекте описание относится к антителу или его антигенсвязывающему фрагменту, которые связывается с 4-1BB, содержащим вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95% или 100% идентична выбранной последовательности VH, и вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность, которая, по меньшей мере, на 80%, 85%, 90%, 95% или 100% идентична выбранной последовательности VL, где выбранная последовательность VH и выбранная последовательность VL представляют собой одну из следующих:
(1) выбранная последовательность VH представляет собой SEQ ID NO:221, 222, 223, 224 или 243, и выбранная последовательность VL представляет собой SEQ ID NO:225, 226, 227, 228 или 244;
(2) выбранная последовательность VH представляет собой SEQ ID NO:229, 230, 231 или 245, и выбранная последовательность VL представляет собой SEQ ID NO:232, 233, 234, 235 или 246;
(3) выбранная последовательность VH представляет собой SEQ ID NO:236, 237, 238 или 247, и выбранная последовательность VL представляет собой SEQ ID NO:239, 240, 241, 242 или 248;
(4) выбранная последовательность VH представляет собой SEQ ID NO:249, и выбранная последовательность VL представляет собой SEQ ID NO:250;
(5) выбранная последовательность VH представляет собой SEQ ID NO:251, и выбранная последовательность VL представляет собой SEQ ID NO:252;
(6) выбранная последовательность VH представляет собой SEQ ID NO:253, и выбранная последовательность VL представляет собой SEQ ID NO:254;
(7) выбранная последовательность VH представляет собой SEQ ID NO:255, и выбранная последовательность VL представляет собой SEQ ID NO:256;
(8) выбранная последовательность VH представляет собой SEQ ID NO:257, и выбранная последовательность VL представляет собой SEQ ID NO:258;
(9) выбранная последовательность VH представляет собой SEQ ID NO:259, и выбранная последовательность VL представляет собой SEQ ID NO:260;
(10) выбранная последовательность VH представляет собой SEQ ID NO:261, и выбранная последовательность VL представляет собой SEQ ID NO:262;
(11) выбранная последовательность VH представляет собой SEQ ID NO:263, и выбранная последовательность VL представляет собой SEQ ID NO:264;
(12) выбранная последовательность VH представляет собой SEQ ID NO:265, и выбранная последовательность VL представляет собой SEQ ID NO:266;
(13) выбранная последовательность VH представляет собой SEQ ID NO:267, и выбранная последовательность VL представляет собой SEQ ID NO:268;
(14) выбранная последовательность VH представляет собой SEQ ID NO:269, и выбранная последовательность VL представляет собой SEQ ID NO:270;
(15) выбранная последовательность VH представляет собой SEQ ID NO:271, и выбранная последовательность VL представляет собой SEQ ID NO:272;
(16) выбранная последовательность VH представляет собой SEQ ID NO:273, и выбранная последовательность VL представляет собой SEQ ID NO:274;
(17) выбранная последовательность VH представляет собой SEQ ID NO:275, и выбранная последовательность VL представляет собой SEQ ID NO:276;
(18) выбранная последовательность VH представляет собой SEQ ID NO:277, и выбранная последовательность VL представляет собой SEQ ID NO:278;
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент специфически связываются с 4-1BB человека.
В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент представляют собой гуманизированное антитело или его антигенсвязывающий фрагмент.
В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент представляют собой одноцепочечный вариабельный фрагмент (scFV).
В одном аспекте изобретение относится к конъюгату антитело-лекарственное средство, содержащему антитело или его антигенсвязывающий фрагмент, как описано в настоящем документе, ковалентно связанный с терапевтическим агентом. В некоторых вариантах осуществления терапевтический агент представляет собой цитотоксический или цитостатический агент.
В одном аспекте изобретение относится к способу лечения онкологического пациента, где способ включает введение пациенту терапевтически эффективного количества композиции, содержащей антитело или его антигенсвязывающий фрагмент, как описано в настоящем документе, или конъюгат антитело-лекарственное средство, как описано в настоящем документе.
В некоторых вариантах осуществления у пациента имеется солидная опухоль. В некоторых вариантах осуществления онкологическое заболевание представляет собой рак молочной железы, рак ротоглотки, рак яичников, В-клеточную лимфому или неходжкинскую лимфому. В некоторых вариантах осуществления онкологическое заболевание представляет собой немелкоклеточный рак легкого (NSCLC), меланому, B-клеточную неходжкинскую лимфому, колоректальный рак или множественную миелому.
В одном аспекте описание относится к способу уменьшения скорости роста опухоли, где способ включает введение пациенту эффективного количества композиции, содержащей антитело или его антигенсвязывающий фрагмент, как описано в настоящем документе, или конъюгат антитело-лекарственное средство, как описано в настоящем документе.
В одном аспекте описание относится к способу уничтожения опухоли, где способ включает введение пациенту эффективного количества композиции, содержащей антитело или его антигенсвязывающий фрагмент, как описано в настоящем документе, или конъюгат антитело-лекарственное средство, как описано в настоящем документе.
В одном аспекте описание относится к фармацевтической композиции, содержащей антитело или его антигенсвязывающий фрагмент, как описано в настоящем документе, и фармацевтически приемлемый носитель.
В одном аспекте описание относится к фармацевтической композиции, содержащей конъюгат антитело-лекарственное средство, как описано в настоящем документе, и фармацевтически приемлемый носитель.
В некоторых вариантах осуществления, антитело представляет собой IgG1. В некоторых вариантах осуществления антитело представляет собой человеческое антитело IgG1.
В одном аспекте описание относится к антителу IgG1 или его антигенсвязывающему фрагменту, которые связываются с 4-1BB и которые содержат вариабельную область тяжелой цепи (VH), содержащую области, определяющие комплементарность, (CDR) 2, 3 и 1, где область VH CDR1 содержит аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95%, или 100% идентична выбранной аминокислотной последовательности VH CDR1, область VH CDR2 содержит аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95%, или 100% идентична выбранной аминокислотной последовательности VH CDR2, а область VH CDR3 содержит аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95%, или 100% идентична выбранной аминокислотной последовательности VH CDR3; и вариабельную область легкой цепи (VL), содержащую CDR 2, 3 и 1, где область VL CDR1 содержит аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95%, или 100% идентична выбранной аминокислотной последовательности VL CDR1, область VL CDR2 содержит аминокислотную последовательность, которая по меньшей мере на 80% идентична выбранной аминокислотной последовательности VL CDR2, а область VL CDR3 содержит аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95% или 100% идентична выбранной аминокислотной последовательности VL CDR3, где выбранные аминокислотные последовательности VH CDR 2, 3 и 1 и выбранные аминокислотные последовательности VL CDR, 2, 3 и 3 выбирают из одного из антител, представленных в Таблице 3. В некоторых вариантах осуществления антитело представляет собой человеческое антитело IgG1.
В одном аспекте описание относится к антителу IgG1 или его антигенсвязывающему фрагменту, которые связываются с 4-1BB и которые содержат вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95% или 100% идентична выбранной последовательности VH, и вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность, которая, по меньшей мере, на 80%, 85%, 90%, 95% или 100% идентична выбранной последовательности VL, где выбранная последовательность VH и выбранная последовательность VL выбираются из одного из антител, представленных в Таблице 3. В некоторых вариантах осуществления антитело представляет собой человеческое антитело IgG1.
В одном аспекте описание относится к способу лечения онкологического пациента, где способ включает введение пациенту терапевтически эффективного количества антитела IgG1 против 4-1BB или его антигенсвязывающего фрагмента и терапевтически эффективного количества антитела против PD-1 или его антигенсвязывающего фрагмента.
В некоторых вариантах осуществления антитело против PD-1 представляет собой антитело IgG4 против PD-1. В некоторых вариантах осуществления антитело против PD-1 представляет собой пембролизумаб.
В одном аспекте описание относится к способу лечения онкологического пациента, где способ включает введение пациенту терапевтически эффективного количества антитела IgG1 против 4-1BB или его антигенсвязывающего фрагмента и терапевтически эффективного количества антитела против CTLA4 или его антигенсвязывающего фрагмента.
В некоторых вариантах осуществления антитело против CTLA4 представляет собой антитело IgG1 против CTLA или антитело IgG2 против CTLA. В некоторых вариантах осуществления антитело против CTLA4 представляет собой ипилимумаб или тремелимумаб.
Используемый в настоящем описании термин «злокачественное новообразование» относится к клеткам, обладающим способностью к автономному росту. Примеры таких клеток включают клетки, имеющие аномальное состояние или состояние, отличающееся быстрым ростом пролиферирующих клеток. Подразумевается, что этот термин включает злокачественные образования, например опухоли; онкогенные процессы, метастатические ткани и злокачественно трансформированные клетки, ткани или органы, независимо от гистопатологического типа или стадии инвазивности. Также включены злокачественные новообразования различных систем органов, таких как дыхательная, сердечно-сосудистая, почечная, репродуктивная, гематологическая, неврологическая, печеночная, желудочно-кишечная и эндокринная системы; а также аденокарциномы, которые включают злокачественные новообразования, такие как большинство видов рака толстой кишки, почечно-клеточный рак, рак предстательной железы и/или тестикулярные опухоли, немелкоклеточный рак легкого и рак тонкой кишки. Злокачественное новообразование, которое «возникает естественным путем», включает любое злокачественное новообразование, которое не индуцируется экспериментально имплантацией опухолевых клеток индивидууму, и включает, например, самопроизвольно возникающее злокачественное новообразование, злокачественное новообразование, вызванное воздействием на пациента канцерогена(канцерогенов), злокачественное новообразование, возникающее в результате вставки трансгенного онкогена или нокаута гена-супрессора опухоли, и злокачественное новообразование, вызванное инфекциями, например, вирусными инфекциями. Термин «карцинома» известен в данной области и относится к злокачественным новообразованиям эпителиальных или эндокринных тканей. Термин также включает карциносаркомы, которые включают злокачественные опухоли, состоящие из карциноматозных и саркоматозных тканей. «Аденокарцинома» относится к карциноме, происходящей из железистой ткани или в которой опухолевые клетки образуют узнаваемые железистые структуры. Термин «саркома» известен в данной области и относится к злокачественным опухолям мезенхимального происхождения. Термин «гематопоэтические неопластические расстройства» включает заболевания, связанные с гиперпластическими/неопластическими клетками гематопоэтического происхождения. Гематопоэтическое неопластическое расстройство может возникать из-за миелоидных, лимфоидных или эритроидных линий или их клеток-предшественников.
Используемый в настоящем описании термин «антитело» относится к любой антигенсвязывающей молекуле, которая содержит по меньшей мере одну (например, одну, две, три, четыре, пять или шесть) область, определяющую комплементарность, (CDR) (например, любую из трех CDR из легкой цепи иммуноглобулина или любую из трех CDR из тяжелой цепи иммуноглобулина), и которая способна специфически связываться с эпитопом. Неограничивающие примеры антител включают: моноклональные антитела, поликлональные антитела, полиспецифические антитела (например, биспецифические антитела), одноцепочечные антитела, химерные антитела, человеческие антитела и гуманизированные антитела. В некоторых вариантах осуществления антитело может содержать Fc-область человеческого антитела. Термин антитело также включает производные, например биспецифические антитела, одноцепочечные антитела, диантитела, линейные антитела и полиспецифические антитела, образованные из фрагментов антител.
Используемый в настоящем описании термин «антигенсвязывающий фрагмент» относится к части полноразмерного антитела, где часть антитела способна специфически связываться с антигеном. В некоторых вариантах осуществления антигенсвязывающий фрагмент содержит по меньшей мере один вариабельный домен (например, вариабельный домен тяжелой цепи или вариабельный домен легкой цепи). Неограничивающие примеры фрагментов антител включают, например, фрагменты Fab, Fab’, F(ab’)2 и Fv.
Используемый в настоящем описании термин «человеческое антитело» относится к антителу, которое кодируется эндогенной нуклеиновой кислотой (например, реаранжированным локусом тяжелой или легкой цепи иммуноглобулина человека), присутствующей в организме человека. В некоторых вариантах осуществления человеческое антитело собирают у человека или продуцируют в культуре клеток человека (например, в человеческих гибридомных клетках). В некоторых вариантах осуществления человеческое антитело продуцируется в клетке, не являющейся человеческой, (например, в клеточной линии мыши или хомяка). В некоторых вариантах осуществления человеческое антитело продуцируется в бактериальной или дрожжевой клетке. В некоторых вариантах осуществления в трансгенном животном, но не в человеке (как например, у крупного рогатого скота), продуцируется человеческое антитело, содержащее нереаранжированный или реаранжированный локус иммуноглобулина человека (например, локус тяжелой или легкой цепи иммуноглобулина человека).
Используемый в настоящем описании термин «химерное антитело» относится к антителу, которое содержит последовательность, присутствующую по меньшей мере в двух разных антителах (например, антителах от двух разных видов млекопитающих, таких как человеческое и мышиное антитело). Неограничивающим примером химерного антитела является антитело, содержащее последовательности вариабельного домена (например, всю или часть последовательности вариабельного домена легкой цепи и/или тяжелой цепи) антитела, не являющегося человеческим, (например, мышиного), и константные домены человеческого антитела. Дополнительные примеры химерных антител описаны в настоящем документе и известны в данной области.
Используемый в настоящем описании термин «гуманизированное антитело» относится к антителу животного, но не человека, которое содержит минимальную последовательность, полученную из (например, мышиного) иммуноглобулина животного, но не человека, и содержит последовательности, полученные из человеческого иммуноглобулина. В неограничивающих примерах гуманизированные антитела представляют собой человеческие антитела (реципиентные антитела), в которых остатки гипервариабельной (например, CDR) области реципиентного антитела заменены остатками гипервариабельной (например, CDR) области из антитела животного, но не человека, (например, донорное антитело), например антитело мыши, крысы или кролика, имеющее желаемую специфичность, аффинность и способность. В некоторых вариантах осуществления каркасные остатки Fv человеческого иммуноглобулина заменены соответствующими нечеловеческими (например, мышиными) остатками иммуноглобулина. В некоторых вариантах осуществления гуманизированные антитела могут содержать остатки, которые не обнаружены в реципиентном антителе или в донорном антителе. Эти модификации могут быть сделаны для дальнейшего улучшения характеристик антител. В некоторых вариантах осуществления гуманизированное антитело содержит практически все из по меньшей мере одного, а обычно двух вариабельных доменов, в которых все или практически все гипервариабельные петли (CDR) соответствуют таковым иммуноглобулина животного, но не человека (например, мыши) и все или практически все каркасные области соответствуют таковым из человеческого иммуноглобулина. Гуманизированное антитело также может содержать, по меньшей мере, часть константной области иммуноглобулина (Fc), как правило, иммуноглобулина человека. Гуманизированные антитела могут быть получены с использованием методов молекулярной биологии, известных в данной области. Неограничивающие примеры способов получения гуманизированных антител описаны в настоящем документе.
В контексте настоящего описания термин «одноцепочечное антитело» относится к одному полипептиду, который содержит по меньшей мере два вариабельных домена иммуноглобулина (например, вариабельный домен тяжелой или легкой цепи иммуноглобулина млекопитающих), который способен специфически связываться с антигеном. Неограничивающие примеры одноцепочечных антител описаны в настоящем документе.
Используемый в настоящем описании термин «мультимерное антитело» относится к антителу, которое содержит четыре или более (например, шесть, восемь или десять) вариабельных доменов иммуноглобулина. В некоторых вариантах осуществления мультимерное антитело способно сшивать одну целевую молекулу (например, 4-1BB) по меньшей мере с одной второй целевой молекулой (например, HER2) на поверхности клетки млекопитающего (например, Т-клетки человека).
Используемые в настоящем описании термины «индивидуум» и «пациент» используются взаимозаменяемо по всему описанию и описывают животное, человека или не человека, которому предоставляется лечение в соответствии со способами по настоящему изобретению. Ветеринарные и не ветеринарные применения предусмотрены настоящим изобретением. Пациентом-человеком может быть взрослый человек или молодой человек (например, в возрасте до 18 лет). Помимо человека, пациенты включают, но не ограничиваются ими, мышей, крыс, хомяков, морских свинок, кроликов, хорьков, кошек, собак и приматов. Включены, например, приматы (например, обезьяны, шимпанзе, гориллы и т. п.), грызуны (например, крысы, мыши, песчанки, хомяки, хорьки, кролики), зайцеобразные, свиньи (например, свиньи, карликовая свинья), лошади, собаки, кошки, крупный рогатый скот и другие домашние, сельскохозяйственные и зоопарковые животные.
Используемые в настоящем описании выражения, когда речь идет об антителе, «специфическое связывание» и «специфически связываются» означают, что антитело предпочтительнее взаимодействует со своей молекулой-мишенью (например, 4-1BB) по сравнению с другими молекулами, потому что взаимодействие зависит от присутствия конкретной структуры (т.е. антигенная детерминанта или эпитоп) молекулы-мишени. Другими словами, реагент распознает и связывается с молекулами, которые включают определенную структуру, а не со всеми молекулами в целом. Антитело, которое специфически связывается с молекулой-мишенью, может называться антителом, специфичным к мишени. Например, антитело, которое специфически связывается с молекулой 4-1BB, может называться 4-1BB-специфическим антителом или антителом против 4-1BB.
Используемые в настоящем описании термины «полипептид», «пептид» и «белок» используются взаимозаменяемо для обозначения полимеров аминокислот любой длины, по меньшей мере, из двух аминокислот.
Используемые в настоящем описании термины «полинуклеотид», «молекула нуклеиновой кислоты» и «последовательность нуклеиновой кислоты» используются в настоящем описании взаимозаменяемо для обозначения полимеров нуклеотидов любой длины, по меньшей мере, из двух нуклеотидов и включают, без ограничения, ДНК, РНК, ДНК/РНК-гибриды и их модификации.
Если не определено иначе, то все технические и научные термины, использованные в настоящем документе, имеют тот же смысл, который вкладывается в них обычным специалистом области, к которой принадлежит настоящее изобретение. Материалы и методы описаны в настоящем документе для применения в настоящем изобретении; другие подходящие материалы и методы, известные в данной области, также могут использоваться. Материалы, методы и примеры являются иллюстративными и не предназначены для ограничения. Все публикации, патентные заявки, патенты, последовательности, занесения в базы данных и другие ссылки, упомянутые в настоящем документе, включены ссылкой в полном объеме. В случае противоречий, они будут урегулированы настоящим описанием изобретения, включающим определения.
Другие признаки и преимущества изобретения будут очевидны из следующего подробного описания и чертежей, и из формулы изобретения.
Описание Чертежей
ФИГ. 1 представляет собой блок-схему, показывающую первую часть иллюстративного протокола получения антител против h4-1BB.
ФИГ. 2 представляет собой блок-схему, показывающую вторую часть иллюстративного протокола получения антител против h4-1BB.
ФИГ. 3 представляет собой набор результатов проточной цитометрии, показывающих активность связывания антител против h4-1BB с человеческим 4-1BB.
ФИГ. 4 представляет собой набор графиков, показывающих результаты анализа проточной цитометрии перекрестной реактивности антител против h4-1BB с 4-1BB обезьяны (CHO-r4-1BB), мыши 4-1BB (CHO-m4-1BB) и с химерой 4-1BB человек-мышь (CHO-c4-1BB). NC означает отрицательный контроль.
ФИГ. 5 представляет собой график, показывающий результаты поверхностного плазмонного резонанса (SPR) с использованием химерного антитела против h4-1BB, 16-1С4-mHvKv-IgG4 и человеческого 4-1BB.
ФИГ. 6 представляет собой график, показывающий результаты поверхностного плазмонного резонанса (SPR) с использованием химерного антитела против h4-1BB, 29-6А5-mHvKv-IgG4 и человеческого 4-1BB.
ФИГ. 7 представляет собой график, показывающий изменение с течением времени массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных мышиными антителами 1C4 и 5F9 против h4-1BB и урелумабом.
ФИГ. 8 представляет собой график, показывающий процентное изменение с течением времени массы тела у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных мышиными антителами 1C4 и 5F9 против h4-1BB и урелумабом.
ФИГ. 9 представляет собой график, показывающий изменение с течением времени размера опухоли у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных мышиными антителами 1C4 и 5F9 против h4-1BB и урелумабом.
ФИГ. 10 представляет собой график, показывающий изменение с течением времени массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных мышиными антителами 29-6A5, 29-4A10, 29-5F10, 45-8F1, 45-4B9 против h4-1BB и урелумабом.
ФИГ. 11 представляет собой график, показывающий процентное изменение с течением времени массы тела у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных мышиными антителами 29-6A5, 29-4A10, 29-5F10, 45-8F1, 45-4B9 против h4-1BB и урелумабом.
ФИГ. 12 представляет собой график, показывающий изменение с течением времени размера опухоли у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных мышиными антителами против h4-1BB, 29-6A5, 29-4A10, 29-5F10, 45-8F1, 45-4B9 и урелумабом.
ФИГ. 13 представляет собой график, показывающий изменение с течением времени массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных урелумабом, и мышиными антителами против h4-1BB, 45-8E2, 45-7E9, 45-7G9., 45-2B3 и 45-2C11.
ФИГ. 14 представляет собой график, показывающий процентное изменение с течением времени массы тела у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных урелумабом, и мышиными антителами против h4-1BB, 45-8E2, 45-7E9, 45-7G9, 45-2B3 и 45-2C11.
ФИГ. 15 представляет собой график, показывающий изменение с течением времени размера опухоли у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных урелумабом, и мышиными антителами против h4-1BB, 45-8E2, 45-7E9, 45-7G9, 45-2B3 и 45-2C11.
ФИГ. 16 представляет собой график, показывающий изменение с течением времени массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных урелумабом, и мышиными антителами против h4-1BB, 16-1C4, 55-8F6, и 54-8B11.
ФИГ. 17 представляет собой график, показывающий процентное изменение с течением времени массы тела у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных урелумабом, и мышиными антителами против h4-1BB, 16-1C4, 55-8F6, и 54-8B11.
ФИГ. 18 представляет собой график, показывающий изменение с течением времени размера опухоли у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных урелумабом, и мышиными антителами против h4-1BB, 16-1C4, 55-8F6, и 54-8B11.
ФИГ. 19 представляет собой график, показывающий изменение с течением времени массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных урелумабом, и мышиными антителами против h4-1BB, 54-1A11, 55-1E3, 55-8H5, и 56-2A6.
ФИГ. 20 представляет собой график, показывающий процентное изменение с течением времени массы тела у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных урелумабом, и мышиными антителами против h4-1BB, 54-1A11, 55-1E3, 55-8H5, и 56-2A6.
ФИГ. 21 представляет собой график, показывающий изменение с течением времени размера опухоли у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных урелумабом, и мышиными антителами против h4-1BB, 54-1A11, 55-1E3, 55-8H5, и 56-2A6.
ФИГ. 22 представляет собой график, показывающий изменение с течением времени массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных урелумабом, и мышиными антителами против h4-1BB, 58-4B8, 69-3C2, и 69-4B11.
ФИГ. 23 представляет собой график, показывающий процентное изменение с течением времени массы тела у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных урелумабом, и мышиными антителами против h4-1BB, 58-4B8, 69-3C2, и 69-4B11.
ФИГ. 24 представляет собой график, показывающий изменение с течением времени размера опухоли у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных урелумабом, и мышиными антителами против h4-1BB, 58-4B8, 69-3C2, и 69-4B11.
ФИГ. 25 представляет собой график, показывающий изменение с течением времени массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 30-5F9-mHvKv-IgG2, 30-5F9-mHvKv- IgG4, 16-1C4-mHvKv-IgG2, 16-1C4-mHvKv-IgG4, 16-1C4-mHvKv-IgG1, 30-5F9, 16-1C4, утомилумабом и урелумабом.
ФИГ. 26 представляет собой график, показывающий процентное изменение с течением времени массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 30-5F9-mHvKv-IgG2, 30-5F9-mHvKv- IgG4, 16-1C4-mHvKv-IgG2, 16-1C4-mHvKv-IgG4, 16-1C4-mHvKv-IgG1, 30-5F9, 16-1C4, утомилумабом и урелумабом.
ФИГ. 27 представляет собой график, показывающий изменение с течением времени размера опухоли гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 30-5F9-mHvKv-IgG2, 30-5F9-mHvKv- IgG4, 16-1C4-mHvKv-IgG2, 16-1C4-mHvKv-IgG4, 16-1C4-mHvKv-IgG1, 30-5F9, 16-1C4, утомилумабом и урелумабом.
ФИГ. 28 представляет собой график, показывающий изменение с течением времени массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 16-1C4-mHvKv-IgG2, 29-6A5-mHvKv- IgG2, 30-5F9-mHvKv-IgG2, 45-2B3-mHvKv-IgG2, 45-7E9-mHvKv-IgG2, 45-7G9-mHvKv-IgG2, 45-8E2-mHvKv-IgG2, 45-8F1-mHvKv-IgG2, и урелумабом.
ФИГ. 29 представляет собой график, показывающий процентное изменение с течением времени массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 16-1C4-mHvKv-IgG2, 29-6A5-mHvKv- IgG2, 30-5F9-mHvKv-IgG2, 45-2B3-mHvKv-IgG2, 45-7E9-mHvKv-IgG2, 45-7G9-mHvKv-IgG2, 45-8E2-mHvKv-IgG2, 45-8F1-mHvKv-IgG2, и урелумабом.
ФИГ. 30 представляет собой график, показывающий изменение с течением времени размера опухоли гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 16-1C4-mHvKv-IgG2, 29-6A5-mHvKv- IgG2, 30-5F9-mHvKv-IgG2, 45-2B3-mHvKv-IgG2, 45-7E9-mHvKv-IgG2, 45-7G9-mHvKv-IgG2, 45-8E2-mHvKv-IgG2, 45-8F1-mHvKv-IgG2, и урелумабом.
ФИГ. 31 представляет собой график, показывающий изменение с течением времени массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 6A5-H1K2-IgG2, 6A5-H1K3-IgG2, 6A5- H2K2-IgG2, 6A5 и урелумабом.
ФИГ. 32 представляет собой график, показывающий процентное изменение с течением времени массы тела у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 6A5-H1K2-IgG2, 6A5-H1K3-IgG2, 6A5-H2K2-IgG2, 6A5 и урелумабом.
ФИГ. 33 представляет собой график, показывающий изменение с течением времени размера опухоли у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 6A5-H1K2-IgG2, 6A5-H1K3-IgG2, 6A5- H2K2-IgG2, 6A5 и урелумабом.
ФИГ. 34 представляет собой график, показывающий изменение с течением времени массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 1C4-H1K1-IgG4, 1C4-H1K2-IgG4, 5F9-H1K1-IgG4, 5F9-H1K2-IgG4, 16-1C4, 30-5F9 и урелумабом.
ФИГ. 35 представляет собой график, показывающий процентное изменение с течением времени массы тела у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 1C4-H1K1-IgG4, 1C4-H1K2-IgG4, 5F9-H1K1-IgG4, 5F9-H1K2-IgG4, 16-1C4, 30-5F9 и урелумабом.
ФИГ. 36 представляет собой график, показывающий изменение с течением времени размера опухоли у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 1C4-H1K1-IgG4, 1C4-H1K2-IgG4, 5F9-H1K1-IgG4, 5F9-H1K2-IgG4, 16-1C4, 30-5F9 и урелумабом.
ФИГ. 37 представляет собой график, показывающий изменение с течением времени массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 16-1C4-mHvKv-IgG1 (G2), 16-1C4-mHvKv-IgG2 (G3), 16-1C4-mHvKv-IgG4 (G4), 16-1C4 (G5) и урелумабом (G6).
ФИГ. 38 представляет собой график, показывающий процентное изменение с течением времени массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 16-1C4-mHvKv-IgG1 (G2), 16-1C4-mHvKv-IgG2 (G3), 16-1C4-mHvKv-IgG4 (G4), 16-1C4 (G5) и урелумабом (G6).
ФИГ. 39 представляет собой график, показывающий изменение с течением времени размера опухоли гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 16-1C4-mHvKv-IgG1 (G2), 16-1C4-mHvKv-IgG2 (G3), 16-1C4-mHvKv-IgG4 (G4), 16-1C4 (G5) и урелумабом (G6).
ФИГ. 40 представляет собой график, показывающий изменение с течением времени массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 54-8B11-mHvKv-IgG2 (G2), 55-8F6-mHvKv-IgG2 (G3), 56-2A6-mHvKv-IgG2 (G4), 69-3C2-mHvKv-IgG2 (G5), 61-6A7-mHvKv-IgG2 (G6), 70-6F10-mHvKv-IgG2 (G7), 70-3F9-mHvKv-IgG2 (G8), 45-4B9-mHvkv-IgG2 (G9) и урелумабом (G10).
ФИГ. 41 представляет собой график, показывающий процентное изменение с течением времени массы тела у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 54-8B11-mHvKv-IgG2 (G2), 55-8F6-mHvKv-IgG2 (G3), 56-2A6-mHvKv-IgG2 (G4), 69-3C2-mHvKv-IgG2 (G5), 61-6A7-mHvKv-IgG2 (G6), 70-6F10-mHvKv- IgG2 (G7), 70-3F9-mHvKv-IgG2 (G8), 45-4B9-mHvkv-IgG2 (G9) и урелумабом (G10).
ФИГ. 42 представляет собой график, показывающий изменение с течением времени размера опухоли у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 54-8B11-mHvKv-IgG2 (G2), 55-8F6 -mHvKv-IgG2 (G3), 56-2A6-mHvKv-IgG2 (G4), 69-3C2-mHvKv-IgG2 (G5), 61-6A7-mHvKv-IgG2 (G6), 70-6F10-mHvKv-IgG2 (G7), 70-3F9-mHvKv-IgG2 (G8), 45-4B9-mHvkv-IgG2 (G9) и урелумабом (G10).
ФИГ. 43 представляет собой график, показывающий изменение с течением времени массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 6A5-H1K2-IgG2, 6A5-H1K3-IgG2, 1C4-H1K1-IgG2, 1C4-H1K2-IgG2, 5F9-H1K1-IgG2, 5F9-H1K2-IgG2, 16-1C4-mHvKv-IgG2, 29-6A5-mHvKv-IgG2, 30-5F9-mHvKv-IgG2 и урелумабом.
ФИГ. 44 представляет собой график, показывающий процентное изменение с течением времени массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 6A5-H1K2-IgG2, 6A5-H1K3-IgG2, 1C4-H1K1-IgG2, 1C4-H1K2-IgG2, 5F9-H1K1-IgG2, 5F9-H1K2-IgG2, 16-1C4-mHvKv-IgG2, 29-6A5-mHvKv-IgG2, 30-5F9-mHvKv-IgG2 и урелумабом.
ФИГ. 45 представляет собой график, показывающий изменение с течением времени размера опухоли гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 6A5-H1K2-IgG2, 6A5-H1K3-IgG2, 1C4-H1K1-IgG2, 1C4-H1K2-IgG2, 5F9-H1K1-IgG2, 5F9-H1K2-IgG2, 16-1C4-mHvKv-IgG2, 29-6A5-mHvKv-IgG2, 30-5F9-mHvKv-IgG2 и урелумабом.
ФИГ. 46 представляет собой график, показывающий изменение с течением времени массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, урелумаб-IgG1, урелумаб-IgG2, урелумаб-IgG4, урелумаб- IgG1-N297A, урелумаб-IgG1-FC-SI и урелумаб-IgG1-FC-V11.
ФИГ. 47 представляет собой график, показывающий процентное изменение с течением времени массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, урелумаб-IgG1, урелумаб-IgG2, урелумаб-IgG4, урелумаб- IgG1-N297A, урелумаб-IgG1-FC-SI и урелумаб-IgG1-FC-V11.
ФИГ. 48 представляет собой график, показывающий изменение с течением времени размера опухоли у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, урелумаб-IgG1, урелумаб-IgG2, урелумаб-IgG4, урелумаб- IgG1-N297A, урелумаб-IgG1-FC-SI и урелумаб-IgG1-FC-V11.
ФИГ. 49 представляет собой график, показывающий изменение с течением времени массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 16-1C4-mHvKv-IgG1, 16-1C4-mHvKv- IgG2, 16-1C4-mHvKv-IgG4, 16-1C4-mHvKv-IgG1-FC-V11, 16-1C4-mHvKv-IgG1-FC-SI, 16-1C4 и урелумабом.
ФИГ. 50 представляет собой график, показывающий процентное изменение с течением времени массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 16-1C4-mHvKv-IgG1, 16-1C4-mHvKv- IgG2, 16-1C4-mHvKv-IgG4, 16-1C4-mHvKv-IgG1-FC-V11, 16-1C4-mHvKv-IgG1-FC-SI, 16-1C4 и урелумабом.
ФИГ. 51 представляет собой график, показывающий изменение с течением времени размера опухоли у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 16-1C4-mHvKv-IgG1, 16-1C4-mHvKv- IgG2, 16-1C4-mHvKv-IgG4, 16-1C4-mHvKv-IgG1-FC-V11, 16-1C4-mHvKv-IgG1-FC-SI, 16-1C4 и урелумабом.
На ФИГ. 52 перечислены последовательности CDR нескольких антител против h4-1BB и последовательности CDR их гуманизированных антител против h4-1BB, как определено нумерацией Kabat.
На ФИГ. 53 перечислены последовательности CDR нескольких антител против h4-1BB и последовательности CDR их гуманизированных антител против h4-1BB, как определено нумерацией Chothia.
На ФИГ. 54 перечислены аминокислотные последовательности 4-1BB человека («h4-1BB»), 4-1BB мыши («m4-1BB»), 4-1BB обезьяны («rm4-1BB» или «r4-1BB») и химерных 4-1BB («chi4-1BB» или «c4-1BB»).
На ФИГ. 55 перечислены аминокислотные последовательности вариабельных областей тяжелой цепи и вариабельных областей легкой цепи гуманизированных антител на основе 1C4.
На ФИГ. 56 перечислены аминокислотные последовательности вариабельных областей тяжелой цепи и вариабельных областей легкой цепи гуманизированных антител на основе 6A5.
На ФИГ. 57 перечислены аминокислотные последовательности вариабельных областей тяжелой цепи и вариабельных областей легкой цепи гуманизированных антител на основе 5F9.
На ФИГ. 58 перечислены аминокислотные последовательности вариабельных областей тяжелой цепи и вариабельных областей легкой цепи нескольких мышиных антител против h4-1BB.
ФИГ. 59 представляет собой график, показывающий изменение с течением времени массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, Урелумаб-mIgG1 (G2), Урелумаб-mIgG2A (G3), 16-1C4-mHvKv-mIgG1 (G4), 16-1C4-mHvKv-mIgG2A (G5), Урелумаб (G6), Урелумаб-IgG1 (G7), 16-1C4-mHvKv-IgG1 (G8) и 16-1C4-mHvKv -IgG4 (G9).
ФИГ. 60 представляет собой график, показывающий процентное изменение с течением времени массы тела у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, Урелумаб-mIgG1 (G2), Урелумаб-mIgG2A ( G3), 16-1C4-mHvKv-mIgG1 (G4), 16-1C4-mHvKv-mIgG2A (G5), Урелумаб (G6), Урелумаб-IgG1 (G7), 16-1C4-mHvKv-IgG1 (G8) и 16- 1C4-mHvKv-IgG4 (G9).
ФИГ. 61 представляет собой график, показывающий изменение с течением времени размера опухоли у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB Урелумаб-mIgG1 (G2), Урелумаб-mIgG2A (G3), 16-1C4-mHvKv-mIgG1 (G4), 16-1C4-mHvKv-mIgG2A (G5), Урелумаб (G6), Урелумаб-IgG1 (G7), 16-1C4-mHvKv-IgG1 (G8) и 16-1C4-mHvKv -IgG4 (G9).
ФИГ. 62 представляет собой график, показывающий изменение с течением времени массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, урелумаб, урелумаб-IgG1, 1C4-mHvKv-IgG1, 1C4- mHvKv-IgG4, 1C4-H1K1-IgG1, 1C4-H1K1-IgG4, 1C4-H1K2-IgG1, 1C4-H1K2-IgG4, 6A5-H1K2-IgG1, 5F9-H1K1-IgG1 и 1C4-mHvK1.
ФИГ. 63 представляет собой график, показывающий процентное изменение с течением времени массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, урелумаб, урелумаб-IgG1, 1C4-mHvKv-IgG1, 1C4- mHvKv-IgG4, 1C4-H1K1-IgG1, 1C4-H1K1-IgG4, 1C4-H1K2-IgG1, 1C4-H1K2-IgG4, 6A5-H1K2-IgG1, 5F9-H1K1-IgG1 и 1C4-mHvK1.
ФИГ. 64 представляет собой график, показывающий изменение с течением времени размера опухоли у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, урелумаб, урелумаб-IgG1, 1C4-mHvKv-IgG1, 1C4- mHvKv-IgG4, 1C4-H1K1-IgG1, 1C4-H1K1-IgG4, 1C4-H1K2-IgG1, 1C4-H1K2-IgG4, 6A5-H1K2-IgG1, 5F9-H1K1-IgG1 и 1C4-mG1-mHvK.
ФИГ. 65 представляет собой график, показывающий изменение массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 1C4-IgG1-H1K1, 1C4-IgG4-H1K1, урелумаб- IgG1, урелумаб-IgG4, Keytruda-IgG4, 1C4-IgG1-H1K1+Keytruda-IgG4, 1C4-IgG4-H1K1+Keytruda-IgG4, урелумаб-IgG1+Keytruda-IgG4 и IgG4-IgG4+Keytruda.
ФИГ. 66 представляет собой график, показывающий процентное изменение массы тела гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 1C4-IgG1-H1K1, 1C4-IgG4-H1K1, урелумаб- IgG1, урелумаб-IgG4, Keytruda-IgG4, 1C4-IgG1-H1K1+Keytruda-IgG4, 1C4-IgG4-H1K1+Keytruda-IgG4, урелумаб-IgG1+Keytruda-IgG4 и IgG4-IgG4+Keytruda.
ФИГ. 67 представляет собой график, показывающий изменение с течение времени размера опухоли гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками MC-38, обработанных антителами против h4-1BB, 1C4-IgG1-H1K1, 1C4-IgG4-H1K1, урелумаб- IgG1, урелумаб-IgG4, Keytruda-IgG4, 1C4-IgG1-H1K1+Keytruda-IgG4, 1C4-IgG4-H1K1+Keytruda-IgG4, урелумаб-IgG1+Keytruda-IgG4 и IgG4-IgG4+Keytruda.
ФИГ. 68 представляет собой график, показывающий изменение с течением времени массы тела у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками B16-F10, обработанных различными антителами против h4-1BB.
ФИГ. 69 представляет собой график, показывающий процентное изменение с течением времени массы тела у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками B16-F10, обработанных различными антителами против h4-1BB.
ФИГ. 70 представляет собой график, показывающий изменение с течением времени размера опухоли у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками B16-F10, обработанных различными антителами против h4-1BB.
ФИГ. 71 представляет собой график, показывающий изменение с течением времени массы тела у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками EL4, обработанных различными антителами против h4-1BB.
ФИГ. 72 представляет собой график, показывающий процентное изменение с течением времени массы тела у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками EL4, обработанных различными антителами против h4-1BB.
ФИГ. 73 представляет собой график, показывающий изменение с течением времени размера опухоли у гуманизированных мышей 4-1BB (B-h4-1BB) с опухолевыми клетками EL4, обработанных различными антителами против h4-1BB.
ФИГ. 74-75 представляют собой диаграммы, показывающие две процедуры сортировки активированных флуоресценцией клеток (FACS) для анализа образцов селезенки.
ФИГ. 76-77 представляют собой диаграммы, показывающие две процедуры FACS для анализа образцов опухоли.
ФИГ. 78A представляет собой график, показывающий процентное содержание CD45+ клеток в опухолевых клетках.
ФИГ. 78B представляет собой график, показывающий количество CD45+ клеток в опухолевых клетках.
ФИГ. 78C представляет собой график, показывающий процентное содержание CD11b+ клеток в опухолевых клетках.
ФИГ. 78D представляет собой график, показывающий процентное содержание NK-клеток в CD45+ клетках в образце опухоли.
ФИГ. 79A представляет собой график, показывающий процентное содержание CD3+ клеток в CD45+ клетках в образце опухоли.
ФИГ. 79B представляет собой график, показывающий процентное содержание CD8+ клеток в CD3+ клетках в образце опухоли.
ФИГ. 79C представляет собой график, показывающий процентное содержание CD4+FoxP3- клеток в CD3+ клетках в образце опухоли.
ФИГ. 79D представляет собой график, показывающий процентное содержание клеток Treg в CD3+ клетках в образце опухоли.
ФИГ. 80A представляет собой график, показывающий процентное содержание hCD137+ клеток в NK-клетках в образце опухоли.
ФИГ. 80B представляет собой график, показывающий процентное содержание CD137+ клеток в CD3+ клетках в образце опухоли.
ФИГ. 80C представляет собой график, показывающий процентное содержание hCD137+ клеток в CD8+ клетках в образце опухоли.
ФИГ. 80D представляет собой график, показывающий процентное содержание hCD137+ клеток в CD4+FoxP3- клетках в образце опухоли.
ФИГ. 80E представляет собой график, показывающий процентное содержание hCD137+клеток в Treg-клетках в образце опухоли.
ФИГ. 81A представляет собой график, показывающий количество hCD137+клеток в NK-клетках в образце опухоли.
ФИГ. 81B представляет собой график, показывающий количество hCD137+клеток в CD3+клетках в образце опухоли.
ФИГ. 81C представляет собой график, показывающий количество hCD137+клеток в CD8+ клетках в образце опухоли.
ФИГ. 81D представляет собой график, показывающий количество hCD137+клеток в CD4+FoxP3- клетках в образце опухоли.
ФИГ. 81E представляет собой график, показывающий количество hCD137+клеток в Treg-клетках в образце опухоли.
ФИГ. 82A представляет собой график, показывающий процентное содержание CD8+/Treg клеток в CD3+ клетках в образце опухоли.
ФИГ. 82B представляет собой график, показывающий процентное содержание Ki67+ клеток в CD8+ клетках в образце опухоли.
ФИГ. 82C представляет собой график, показывающий процентное содержание Ki67+ клеток в CD4+FoxP3- клетках в образце опухоли.
ФИГ. 82D представляет собой график, показывающий процентное содержание Ki67+ клеток в Treg-клетках в образце опухоли.
ФИГ. 83A представляет собой график, показывающий количество Eomes+клеток в CD8+ клетках в образце опухоли.
ФИГ. 83B представляет собой график, показывающий количество Eomes+клеток в CD4+FoxP3+ клетках в образце опухоли.
ФИГ. 83C представляет собой график, показывающий количество T-bet+клеток в CD8+ клетках в образце опухоли.
ФИГ. 83D представляет собой график, показывающий количество T-bet+клеток в CD4+FoxP3+ клетках в образце опухоли.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее описание относится к примерам антител, их антигенсвязывающих фрагментов, которые связываются с TNFRSF9 (член суперсемейства рецепторов фактора некроза опухолей 9; также известный как «4-1BB» или «CD137»).
4-1BB и онкологические заболевания
Иммунная система может различать нормальные клетки в организме и те, которые она считает «чужеродными», что позволяет иммунной системе атаковать чужеродные клетки, оставляя нормальные клетки в покое. Этот механизм иногда включает белки, называемые иммунными контрольными точками. Иммунные контрольные точки представляют собой молекулы в иммунной системе, которые либо увеличивают сигнал (костимулирующие молекулы), либо понижают сигнал.
Ингибиторы контрольных точек могут предотвращать атаку иммунной системы на нормальные ткани и тем самым предотвращать аутоиммунные заболевания. Многие опухолевые клетки также экспрессируют ингибиторы контрольных точек. Эти опухолевые клетки избегают иммунного надзора, кооптируя определенные пути иммунных контрольных точек, особенно в Т-клетках, которые специфичны для опухолевых антигенов (Creelan, Benjamin C. «Update on immune checkpoint inhibitors in lung cancer.» Cancer Control 21.1 (2014): 80-89). Поскольку многие иммунные контрольные точки инициируются взаимодействиями лиганд-рецептор, они могут быть легко заблокированы антителами против лигандов и/или их рецепторов.
4-1BB («TNFRSF9» или «CD137») является членом семейства рецепторов фактора некроза опухоли (TNF). Он имеет три сайта N-гликозилирования и один потенциальный сайт O-гликозилирования. Это трансмембранный белок типа I, который в основном экспрессируется на поверхности Т-клеток, клеток-натуральных киллеров (NK), нейтрофилов и дендритных клеток (DC). Ген CD137 человека расположен в области 1P36 (хромосома 1) с NCBI ID гена 3604 и кодирует 255 аминокислот. Молекула человеческого белка CD137 имеет две формы: мембраносвязанную и растворимую, кодируемые мРНК 2,8 т.п.н. и 1,4 т.п.н., соответственно. Растворимая форма не имеет трансмембранного домена. Лигандом для CD137 является CD137L (4-1BBL). CD137L принадлежит к суперсемейству TNF и экспрессируется на поверхности антигенпрезентирующих клеток, включая, например, дендритные клетки, В-клетки и макрофаги. Синергетический стимулирующий сигнал, создаваемый взаимодействием CD137 и его рецептора CD137L, вызывает активацию и пролиферацию Т-клеток и NK-клеток, а также продукцию цитокинов.
Ген CD137 мыши расположен в области 4E2 (хромосома 4) с NCBI ID гена 21942. Белок CD137 человека примерно на 58% идентичен белку CD137 мыши. CD137 человека имеет заметные отличия в своем цитоплазматическом хвосте от CD137 мыши. В частности, единственный остаток тирозина в цитоплазматическом домене CD137 находится в положении 220 CD137 человека и в положении 254 CD137 мыши. CD137 человека также отклоняется от CD137 мыши в предполагаемом сайте связывания Lck, при этом CD137 мыши экспрессирует мотив CXCP связывания Lck, тогда как в CD137 человека эта последовательность заменена на CXFP. И человеческий, и мышиный CD137 имеют два общих сайта для связывания TNFR-ассоциированного фактора 2, адаптивного белка, который необходим для опосредования последующих сигнальных событий, ведущих к продукции цитокинов (например, IL-2) в ответ на передачу сигналов CD137L.
Аномальная экспрессия CD137 и его лиганда в опухолевой ткани указывает на то, что CD137 и его лиганд могут иметь нарушение или инактивацию костимулирующего сигнала во время туморогенеза. В частности, экспрессия CD137 в стенках сосудов опухоли коррелирует со злокачественными новообразованиями опухоли, и данные показывают, что агонистические антитела против CD137 могут действовать на эндотелиальные клетки опухоли, усиливая рекрутирование активированных Т-лимфоцитов, что предполагает дополнительный механизм действия, который может объяснить иммунотерапевтические эффекты агонистических антител CD137.
Большое количество исследований показали, что CD137 является одной из потенциальных мишеней противоопухолевой биологической терапии. Антитело против CD137 может уничтожать опухолевые клетки или ингибировать рост опухоли, вероятно, за счет активации и пролиферации Т-клеток и NK-клеток, увеличения выработки цитокинов, усиления иммунного ответа и/или рекрутирования активированных Т-лимфоцитов к опухоли. На сегодняшний день два антитела к пути CD137 (Урелумаб (BMS-663513) от Bristol-Myers Squibb и Утомилумаб (PF-05082566) от Pfizer) были протестированы в клинических испытаниях для лечения меланомы, лимфомы, неходжкинской лимфомы и некоторых прогрессирующих солидных опухолей. Некоторые клинические испытания уже дали многообещающие предварительные клинические результаты. Например, PF-05082566 может уменьшать 40% фолликулярных лимфом (FL) с минимальными побочными эффектами, подобно ингибиторам PD-1; его использовали в комбинации с другими лекарственными средствами, включая, например, антитело против PD-1 или антитело против OX40. Предварительные экспериментальные данные также показывают, что лекарственные средства, направленные против опухоли, могут увеличивать экспрессию CD137 на поверхности NK-клеток. Таким образом, если антитело против CD137 вводить в комбинации с лекарственными средствами, направленными на опухоль, это может усилить эффект уничтожения NK-клеток и улучшить терапевтический эффект.
Подробное описание CD137 и его функции можно найти, например, в Wen et al., «4-1BB ligand-mediated costimulation of human T cells induces CD4 and CD8 T cell expansion, cytokine production, and the development of cytolytic effector function,» The Journal of Immunology 168.10 (2002): 4897-4906; Broll et al., «CD137 expression in tumor vessel walls: high correlation with malignant tumors,» American journal of clinical pathology 115.4 (2001): 543-549; and Palazón et al., «Agonist anti-CD137 mAb act on tumor endothelial cells to enhance recruitment of activated T lymphocytes,» Cancer research 71.3 (2011): 801-811; Kang, et al., «Anti-CD137 suppresses tumor growth by blocking reverse signaling by CD137 ligand.» Cancer research (2017): canres-0610; описание каждой из которых включено в настоящее описание в качестве ссылки в полном объеме.
Настоящее описание относится к антителам против 4-1BB, их антигенсвязывающим фрагментам и способам применения этих антител против 4-1BB и антигенсвязывающих фрагментов для ингибирования роста опухоли и лечения онкологических заболеваний.
Антитела и антигенсвязывающие фрагменты
Настоящее описание относится к антителам против 4-1BB и их антигенсвязывающим фрагментам, которые содержат области, определяющие комплементарность, (CDR), вариабельные области тяжелой цепи, вариабельные области легкой цепи, тяжелые цепи или легкие цепи, описанные в настоящем документе.
Как правило, антитела (также называемые иммуноглобулинами) состоят из двух классов полипептидных цепей, легких цепей и тяжелых цепей. Неограничивающее антитело по настоящему изобретению может представлять собой интактное антитело с четырьмя иммуноглобулиновыми цепями, содержащее две тяжелые цепи и две легкие цепи. Тяжелая цепь антитела может быть любого изотипа, включая IgM, IgG, IgE, IgA или IgD, или подкласса, включая IgG1, IgG2, IgG2a, IgG2b, IgG3, IgG4, IgE1, IgE2 и т. д. Легкая цепь может быть легкой цепью каппа или легкой цепью лямбда. Антитело может содержать две идентичные копии легкой цепи и две идентичные копии тяжелой цепи. Тяжелые цепи, каждая из которых содержит один вариабельный домен (или вариабельную область, VH) и множество константных доменов (или константных областей), связываются друг с другом посредством дисульфидной связи в своих константных доменах, образуя «стебель» антитела. Легкие цепи, каждая из которых содержит один вариабельный домен (или вариабельную область, VL) и один константный домен (или константную область), каждая связывается с одной тяжелой цепью посредством дисульфидной связи. Вариабельная область каждой легкой цепи выровнена с вариабельной областью тяжелой цепи, с которой она связана. Вариабельные области как легких цепей, так и тяжелых цепей содержат три гипервариабельные области, расположенные между более консервативными каркасными областями (FR).
Эти гипервариабельные области, известные как области, определяющие комплементарность, (CDR), образуют петли, которые включают основную антигенсвязывающую поверхность антитела. Четыре каркасных области в основном принимают конформацию бета-листа, а CDR образуют петли, соединяющие, а в некоторых случаях образующие часть структуры бета-листа. CDR в каждой цепи удерживаются в непосредственной близости от каркасных областей и, вместе с CDR из другой цепи, способствуют образованию антигенсвязывающей области.
Способы идентификации областей CDR антитела путем анализа аминокислотной последовательности антитела хорошо известны, и обычно используется ряд определений CDR. Определение Kabat основано на вариабельности последовательности, а определение Chothia основано на расположении структурных петлевых областей. Более поздним определением CDR является определение IMGT. Определение IMGT основано на базе данных IMGT, в которой собрана информация о нуклеотидных последовательностях иммуноглобулинов (IG), Т-клеточных рецепторов (TcR) и молекул главного комплекса гистосовместимости (MHC). Предлагается единая система нумерации для последовательностей IG и TcR на основе выравнивания более 5000 последовательностей вариабельных областей IG и TcR, принимая во внимание и комбинируя определение FR и CDR по Kabat, структурные данные и характеристику гипервариабельных петель Chothia. Схема нумерации IMGT не делает различий между различными иммуноглобулинами (т.е. IG или TcR), типом цепи (т.е. тяжелой или легкой) или видами. Эти методы идентификации областей CDR и различные определения описаны, например, в публикации Martin, «Protein sequence and structure analysis of antibody variable domains,» Antibody engineering, Springer Berlin Heidelberg, 2001. 422-439; Abhinandan, et al. «Analysis and improvements to Kabat and structurally correct numbering of antibody variable domains,» Molecular immunology 45.14 (2008): 3832-3839; Wu, T.T. and Kabat, E.A. (1970) J. Exp. Med. 132: 211-250; Martin et al., Methods Enzymol. 203: 121-53 (1991); Morea et al., Biophys Chem. 68(1-3):9-16 (Oct. 1997); Morea et al., J. Mol Biol. 275(2):269-94 (Jan.1998); Chothia et al., Nature 342(6252):877-83 (Dec. 1989); Ponomarenko and Bourne, BMC Structural Biology 7:64 (2007); Lefranc, et al., «IMGT unique numbering for immunoglobulin and T cell receptor variable domains and Ig superfamily V-like domains.» Developmental & Comparative Immunology 27.1 (2003): 55-77; Kunik, et al., «Structural consensus among antibodies defines the antigen binding site.» PLoS computational biology 8.2 (2012): e1002388; каждая из которых включена в настоящее описание в качестве ссылки в полном объеме.
CDR важны для распознавания эпитопа антигена. Используемый в настоящем описании термин «эпитоп» представляет собой наименьшую часть молекулы-мишени, способную специфически связываться с антигенсвязывающим доменом антитела. Минимальный размер эпитопа может составлять примерно три, четыре, пять, шесть или семь аминокислот, но эти аминокислоты не обязательно должны быть в последовательной линейной последовательности первичной структуры антигена, поскольку эпитоп может зависеть от трехмерной конфигурации на основе вторичной и третичной структуры антигена.
В некоторых вариантах осуществления антитело представляет собой интактную молекулу иммуноглобулина (например, IgG1, IgG2a, IgG2b, IgG3, IgM, IgD, IgE, IgA). Подклассы IgG (IgG1, IgG2, IgG3 и IgG4) высоко консервативны, различаются по своей константной области, особенно по своим шарнирам и верхним доменам CH2. Последовательности и различия подклассов IgG известны в данной области и описаны, например, в Vidarsson, et al., «IgG subclasses and allotypes: from structure to effector functions.» Frontiers in immunology 5 (2014); Irani, et al. «Molecular properties of human IgG subclasses and their implications for designing therapeutic monoclonal antibodies against infectious diseases.» Molecular immunology 67.2 (2015): 171-182; Shakib, Farouk, ed. The human IgG subclasses: molecular analysis of structure, function and regulation. Elsevier, 2016; каждая из которых включена в настоящее описание в качестве ссылки в полном объеме.
Антитело также может представлять собой молекулу иммуноглобулина, происходящую из любого вида (например, человека, грызуна, мыши, крысы, верблюда). Антитела, раскрытые в настоящем описании, также включают, но не ограничиваются ими, поликлональные, моноклональные, моноспецифические, полиспецифические антитела и химерные антитела, которые включают связывающий домен иммуноглобулина, слитый с другим полипептидом. Термин «антигенсвязывающий домен» или «антигенсвязывающий фрагмент» означает часть антитела, которая сохраняет специфическую связывающую активность интактного антитела, т. е. любую часть антитела, которая способна специфически связываться с эпитопом на молекуле-мишени интактного антитела. Он включает, например, Fab, Fab', F(ab')2 и варианты этих фрагментов. Таким образом, в некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент может быть, например, scFv, Fv, Fd, dAb, биспецифическим антителом, биспецифическим scFv, диантителом, линейным антителом, одноцепочечной молекулой антитела, полиспецифическим антителом, образованным из фрагментов антитела, и любым полипептидом, который включает домен связывания, который является доменом связывания антитела или гомологичен ему. Неограничивающие примеры антигенсвязывающих доменов включают, например, CDR тяжелой и/или легкой цепи интактного антитела, вариабельные области тяжелой и/или легкой цепи интактного антитела, полноразмерные тяжелые или легкие цепи интактного антитела или индивидуальную CDR из тяжелой цепи или легкой цепи интактного антитела.
В некоторых вариантах осуществления антигенсвязывающий фрагмент может образовывать часть химерного антигенного рецептора (CAR). В некоторых вариантах осуществления химерный антигенный рецептор представляет собой слияния одноцепочечных вариабельных фрагментов (scFv), как описано в настоящем документе, слитых с трансмембранным доменом CD3-дзета и эндодоменом. В некоторых вариантах осуществления химерный антигенный рецептор также содержит внутриклеточные сигнальные домены от различных рецепторов костимулирующих белков (например, CD28, 41BB, ICOS). В некоторых вариантах осуществления химерный антигенный рецептор содержит несколько сигнальных доменов, например CD3z-CD28-41BB или CD3z-CD28-OX40, для повышения эффективности. Таким образом, в одном аспекте в описании дополнительно представлены клетки (например, Т-клетки), которые экспрессируют химерные антигенные рецепторы, как описано в настоящем документе.
В некоторых вариантах осуществления scFV имеет один вариабельный домен тяжелой цепи и один вариабельный домен легкой цепи. В некоторых вариантах осуществления scFV имеет два вариабельных домена тяжелой цепи и два вариабельных домена легкой цепи. В некоторых вариантах осуществления scFV имеет две антигенсвязывающие области, и две антигенсвязывающие области могут связываться с соответствующими антигенами-мишенями.
Антитела против 4-1BB и антигенсвязывающие фрагменты
Настоящее описание относится к антителам и их антигенсвязывающим фрагментам, которые специфически связываются с 4-1BB. Описанные в настоящем документе антитела и антигенсвязывающие фрагменты способны связываться с 4-1BB и могут способствовать сигнальному пути 4-1BB, таким образом, усиливая иммунный ответ.
Описание относится к нескольким антителам против 4-1BB, например, 16-1C4 («1C4»), 29-6A5 («6A5»), 30-5F9 («5F9»), 45-2B3 («2B3»), 45-4B9 («4B9»), 45-7E9 («7E9»), 45-7G9 («7G9»), 45-8E11 («8E11»), 45-8E2 («8E2»), 45-8F1 («8F1»), 54-8B11 («8B11»), 55-8F6 («8F6»), 56-2A6 («2A6»), 59-5E4 («5E4»), 61-6A7 («6A7»), 69- 3C2 («3C2»), 70-3F9 («3F9») и 70-6F10 («6F10»), включая, например, мышиные антитела, их химерные антитела и их гуманизированные антитела. Последовательности CDR (определение Kabat) и последовательности вариабельной области тяжелой цепи и вариабельной области легкой цепи некоторых из описанных антител показаны в таблице ниже. Последовательности CDR (определение Chothia) представлены на ФИГ. 53.
Таблица 1
Например, как показано в таблице выше, ФИГ. 52 и ФИГ. 53, последовательности CDR для 1C4 и антител, полученных на основе 1C4 (например, химерных антител или гуманизированных антител), включают CDR вариабельного домена тяжелой цепи, SEQ ID NO:1-3 и CDR вариабельного домена легкой цепи, SEQ ID NO:4-6 в соответствии с нумерацией Kabat. CDR также могут быть определены системой Chothia. Под нумерацией Chothia последовательности CDR вариабельного домена тяжелой цепи представлены в SEQ ID NO:109-111, а последовательности CDR вариабельного домена легкой цепи представлены в SEQ ID NO:112-114.
Подобным образом, последовательности CDR для 6A5 и для антител, полученных на основе 6A5, включают CDR вариабельного домена тяжелой цепи, SEQ ID NO:7-9 и CDR вариабельного домена легкой цепи, SEQ ID NO:10-12, как определено нумерацией Kabat. При нумерации Chothia последовательности CDR вариабельного домена тяжелой цепи представлены в SEQ ID NO:115-117, а CDR вариабельного домена легкой цепи представлены в SEQ ID NO:118-120.
Последовательности CDR для 5F9 и для антител, полученных на основе 5F9, включают CDR вариабельного домена тяжелой цепи, SEQ ID NO:13-15, и CDR вариабельного домена легкой цепи, SEQ ID NO:16-18, как определено нумерацией Kabat. При нумерации Chothia последовательности CDR вариабельного домена тяжелой цепи представлены в SEQ ID NO:121-123, а CDR вариабельного домена легкой цепи представлены в SEQ ID NO:124-126.
Аналогичным образом, последовательности CDR (Kabat) и последовательности VH и VL для 2B3, 4B9, 7E9, 7G9, 8E11, 8E2, 8F1, 8B11, 8F6, 2A6, 5E4, 6A7, 3C2, 3F9, 6F10 и антител, полученных из этих антител, представлены в Таблице 1. Последовательность CDR (Chothia) для 2B3, 4B9, 7E9, 7G9, 8E11, 8E2, 8F1, 8B11, 8F6, 2A6, 5E4, 6A7, 3C2, 3F9, 6F10 и антитела, полученных из этих антител, представлены на ФИГ. 53.
Также представлены аминокислотные последовательности вариабельных областей тяжелой цепи и вариабельной области легкой цепи гуманизированных антител. Поскольку существуют различные способы гуманизации антитела мыши (например, последовательность может быть модифицирована различными аминокислотными заменами), тяжелая цепь и легкая цепь антитела могут иметь более одной версии гуманизированных последовательностей. Аминокислотные последовательности вариабельных областей тяжелой цепи гуманизированного антитела 1C4 представлены в SEQ ID NO:221-224. Аминокислотные последовательности вариабельных областей легкой цепи гуманизированного антитела 1C4 представлены в SEQ ID NO:225-228. Любая из этих последовательностей вариабельной области тяжелой цепи (SEQ ID NO:221-224) может быть спарена с любой из этих последовательностей вариабельной области легкой цепи (SEQ ID NO:225-228).
Аналогично, аминокислотные последовательности вариабельной области тяжелой цепи гуманизированного антитела 6A5 представлены в SEQ ID NO:229-231. Аминокислотные последовательности вариабельной области легкой цепи гуманизированного антитела 6A5 представлены в SEQ ID NO:232-235. Любая из этих последовательностей вариабельной области тяжелой цепи (SEQ ID NO:229-231) может быть спарена с любой из этих последовательностей вариабельной области легкой цепи (SEQ ID NO:232-235).
Аминокислотные последовательности вариабельных областей тяжелой цепи гуманизированного антитела 5F9 представлены в SEQ ID NO:236-238. Аминокислотные последовательности вариабельной области легкой цепи гуманизированного антитела 6A5 представлены в SEQ ID NO:239-242. Любая из этих последовательностей вариабельной области тяжелой цепи (SEQ ID NO:236-238) может быть спарена с любой из этих последовательностей вариабельной области легкой цепи (SEQ ID NO:239-242).
Как показано на ФИГ. 55-57, процент гуманизации означает процент идентичности последовательности вариабельной области тяжелой цепи или легкой цепи по сравнению с последовательностями человеческого антитела в базе данных Международной иммуногенетической информационной системы (IMGT). Лучший вариант означает, что последовательность вариабельной области тяжелой цепи или легкой цепи ближе к конкретному виду, чем к другим видам. Например, лучший вариант относительно человека означает, что последовательность ближе к человеку, чем к другим видам. Лучший вариант относительно человека и Macaca flavicularis означает, что последовательность имеет одинаковый процент идентичности с человеческой последовательностью и последовательностью Macaca flavicularis, и эти проценты идентичности являются самыми высокими по сравнению с последовательностями других видов. В некоторых вариантах осуществления процент гуманизации составляет более чем 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93% 94% или 95%. Подробное описание того, как определять процент гуманизации и как определять лучшие варианты, известно в данной области техники и описано, например, в Jones, et al. "The INNs and outs of antibody nonproprietary names." MAbs. Vol. 8. № 1 Taylor & Francis, 2016, которая включена в настоящее описание в качестве ссылки в полном объеме. Высокий процент гуманизации часто имеет различные преимущества, например, более безопасен и более эффективен для людей, с большей вероятностью переносится человеком и/или с меньшей вероятностью имеет побочные эффекты.
Настоящее описание также относится к химерным антителам. Эти химерные антитела имеют VH и VL мышиных антител. Однако константные домены этих химерных антител имеют происхождение из человеческих антител (например, человеческого IgG1, человеческого IgG2, человеческого IgG3 или человеческого IgG4). Эти химерные антитела обозначены как mHvKv-IgG.
Некоторые из химерных антител и гуманизированных антител, которые описаны в настоящем описании, показаны в таблице ниже.
Таблица 2
Кроме того, в некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты, описанные в настоящем документе, также могут содержать одну, две или три CDR вариабельной области тяжелой цепи, выбранные из группы SEQ ID NO:1-3, SEQ ID NO:7-9, SEQ ID NO:13-15, SEQ ID NO:19-21, SEQ ID NO:25-27, SEQ ID NO:31-33, SEQ ID NO:37-39, SEQ ID NO:43-45, SEQ ID NO:49-51, SEQ ID NO:55-57, SEQ ID NO:61-63, SEQ ID NO:67-69, SEQ ID NO:73-75, SEQ ID NO:79-81, SEQ ID NO:85-87, SEQ ID NO:91-93, SEQ ID NO:97-99 или SEQ ID NO:103-105; и/или одну, две или три CDR вариабельной области легкой цепи, выбранные из группы SEQ ID NO:4-6, SEQ ID NO:10-12, SEQ ID NO:16-18, SEQ ID NO:22-24, SEQ ID NO:28-30, SEQ ID NO:34-36, SEQ ID NO:40-42, SEQ ID NO:46-48, SEQ ID NO:52-54, SEQ ID NO:58-60, SEQ ID NO:64-66, SEQ ID NO:70-72, SEQ ID NO:76-78, SEQ ID NO:82-84, SEQ ID NO:88-90, SEQ ID NO:94-96, SEQ ID NO:100-102 или SEQ ID NO:106-108.
В некоторых вариантах осуществления антитела могут иметь вариабельную область тяжелой цепи (VH), содержащую области, определяющие комплементарность (CDR) 1, 2, 3, где область CDR1 содержит или состоит из аминокислотной последовательности, которая по меньшей мере на 80%, 85%, 90% или 95% идентична выбранной аминокислотной последовательности VH CDR1, область CDR2 содержит или состоит из аминокислотной последовательности, которая по меньшей мере на 80, 85, 90 или 95% идентична выбранной аминокислотной последовательности VH CDR2, и область CDR3 содержит или состоит из аминокислотной последовательности, которая по меньшей мере на 80, 85, 90 или 95% идентична выбранной аминокислотной последовательности VH CDR3, и вариабельную области легкой цепи (VL), содержащую CDR 1, 2, 3, где область CDR1 содержит или состоит из аминокислотной последовательности, которая по меньшей мере на 80%, 85%, 90% или 95% идентична выбранной аминокислотной последовательности VL CDR1, область CDR2 содержит или состоит из аминокислотной последовательности, которая, по меньшей мере, на 80%, 85%, 90% или 95% идентична выбранной последовательности аминокислот VL CDR2, область CDR3 содержит или состоит из аминокислотной последовательности, которая по меньшей мере на 80, 85, 90 или 95% идентична выбранной аминокислотной последовательности VL CDR3. Выбранные аминокислотные последовательности VH CDR 1, 2, 3 и выбранные аминокислотные последовательности VL CDR 1, 2, 3 показаны на ФИГ. 52 (Kabat CDR) и ФИГ. 53 (Chothia CDR).
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, описанные в настоящем документе, могут содержать вариабельный домен тяжелой цепи, содержащий одну, две или три CDR, выбранных из SEQ ID NO:1-3, SEQ ID NO:7-9, SEQ ID NO:13-15, SEQ ID NO:19-21, SEQ ID NO:25-27, SEQ ID NO:31-33, SEQ ID NO:37-39, SEQ ID NO:43-45, SEQ ID NO:49-51, SEQ ID NO:55-57, SEQ ID NO:61-63, SEQ ID NO:67-69, SEQ ID NO:73-75, SEQ ID NO:79-81, SEQ ID NO:85-87, SEQ ID NO:91-93, SEQ ID NO:97-99 или SEQ ID NO:103-105 с одной или двумя аминокислотными вставками, делециями или заменами или при их отсутствии на одной, двух или трех из выбранных CDR. Например, антитело или антигенсвязывающий фрагмент, описанные в настоящем документе, могут содержать вариабельный домен тяжелой цепи, содержащий одну, две или три CDR SEQ ID NO:1 с одной или двумя аминокислотными вставками, делециями или заменами или при их отсутствии; SEQ ID NO:2 с одной или двумя аминокислотными вставками, делециями или заменами или при их отсутствии; SEQ ID NO:3 с одной или двумя аминокислотными вставками, делециями или заменами или при их отсутствии.
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, описанные в настоящем документе, могут содержать вариабельный домен легкой цепи, содержащий одну, две или три CDR, выбранных из SEQ ID NO:4-6, SEQ ID NO:10-12, SEQ ID NO:16-18, SEQ ID NO:22-24, SEQ ID NO:28-30, SEQ ID NO:34-36, SEQ ID NO:40-42, SEQ ID NO:46-48, SEQ ID NO:52-54, SEQ ID NO:58-60, SEQ ID NO:64-66, SEQ ID NO:70-72, SEQ ID NO:76-78, SEQ ID NO:82-84, SEQ ID NO:88-90, SEQ ID NO:94-96, SEQ ID NO:100-102 или SEQ ID NO:106-108 с одной или двумя аминокислотными вставками, делециями или заменами или при их отсутствии на одной, двух или трех из выбранных CDR. Например, антитело или антигенсвязывающий фрагмент, описанные в настоящем документе, могут содержать вариабельный домен легкой цепи, содержащий одну, две или три CDR SEQ ID NO:4 с одной или двумя аминокислотными вставками, делециями или заменами или при их отсутствии; SEQ ID NO:5 с одной или двумя аминокислотными вставками, делециями или заменами или при их отсутствии; SEQ ID NO:6 с одной или двумя аминокислотными вставками, делециями или заменами или при их отсутствии.
В некоторых вариантах осуществления CDR с одной или двумя аминокислотными вставками, делециями или заменами или при их отсутствии показаны в Таблице 1, Таблице 3, на ФИГ. 52 и ФИГ. 53.
Вставки, делеции и замены могут быть в последовательности CDR или на одном или обоих концевых участках последовательности CDR.
Описание также относится к антителам или их антигенсвязывающим фрагментам, которые связываются с 4-1BB, где антитела или антигенсвязывающие фрагменты содержат VH CDR1, VH CDR2, VH CDR3, VL CDR1, VL CDR2 и VL CDR3. В некоторых вариантах осуществления последовательности для VH CDR1, VH CDR2, VH CDR3, VL CDR1, VL CDR2 и VL CDR3 определяются на основе различных определений CDR, известных в данной области, например определения Kabat, определения Chothia или определения IMGT. Последовательности VH CDR1, VH CDR2, VH CDR3, VL CDR1, VL CDR2 и VL CDR3 представлены в Таблице 1, Таблице 3, на ФИГ. 52 и ФИГ. 53.
Описание также относится к антителам или их антигенсвязывающим фрагментам, которые связываются с 4-1BB. Антитела или их антигенсвязывающие фрагменты содержат вариабельную область тяжелой цепи (VH), содержащую или состоящую из аминокислотной последовательности, которая по меньшей мере на 80%, 85%, 90% или 95% идентична выбранной последовательности VH, и вариабельную область легкой цепи (VL), содержащую или состоящую из аминокислотной последовательности, которая по меньшей мере на 80%, 85%, 90% или 95% идентична выбранной последовательности VL. В некоторых вариантах осуществления выбранная последовательность VH и выбранная последовательность VL представлены в Таблице 1 и Таблице 3. В некоторых вариантах осуществления выбранная последовательность VH представляет собой SEQ ID NO:221, 222, 223, 224 или 243, а выбранная последовательность VL представляет собой SEQ ID NO:225, 226, 227, 228 или 244. В некоторых вариантах осуществления выбранная последовательность VH представляет собой SEQ ID NO:229, 230, 231 или 245, а выбранная последовательность VL представляет собой SEQ ID NO:232, 233, 234, 235 или 246. В некоторых вариантах осуществления выбранная последовательность VH представляет собой SEQ ID NO:236, 237, 238 или 247, а выбранная последовательность VL представляет собой SEQ ID NO:239, 240, 241, 242 или 248.
Описание также относится к нуклеиновой кислоте, содержащей полинуклеотид, кодирующий полипептид, содержащий тяжелую цепь иммуноглобулина или легкую цепь иммуноглобулина. Тяжелая цепь иммуноглобулина или легкая цепь иммуноглобулина содержит CDR, как показано в Таблице 1, Таблице 3, на ФИГ. 52 или ФИГ. 53, или содержит последовательности, показанные в Таблице 1, Таблице 3 и на ФИГ. 55-58. Когда полипептиды спарены с соответствующим полипептидом (например, соответствующей вариабельной областью тяжелой цепи или соответствующей вариабельной областью легкой цепи), спаренные полипептиды связываются с 4-1BB (например, человеческим 4-1BB).
В некоторых аспектах описание также относится к антителу или его антигенсвязывающему фрагменту, которые перекрестно конкурируют за связывание с 4-1BB (например, с человеческим 4-1BB) с эталонным антителом или его антигенсвязывающим фрагментом (например, любым антителом против 4-1BB или антигенсвязывающим фрагментом, как описано в настоящем документе).
Антитела против 4-1BB и антигенсвязывающие фрагменты также могут быть вариантами антител (включая производные и конъюгаты) антител или фрагментов антител и полиспецифических (например, биспецифических) антител или фрагментов антител. Дополнительные антитела, представленные в настоящем документе, представляют собой поликлональные, моноклональные, полиспецифические (мультимерные, например, биспецифические), человеческие антитела, химерные антитела (например, химеры человек-мышь), одноцепочечные антитела, внутриклеточные антитела (т. е. интраантитела) и их антигенсвязывающие фрагменты. Антитела или их антигенсвязывающие фрагменты могут быть любого типа (например, IgG, IgE, IgM, IgD, IgA и IgY) или любого подкласса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2). В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент представляет собой антитело IgG или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент представляет собой антитело IgG1 или его антигенсвязывающий фрагмент.
Фрагменты антител пригодны для использования в предложенных способах при условии, что они сохраняют желаемую аффинность и специфичность полноразмерного антитела. Таким образом, фрагмент антитела, который связывается с 4-1BB, сохранит способность связываться с 4-1BB. Фрагмент Fv представляет собой фрагмент антитела, который содержит полный сайт распознавания и связывания антигена. Эта область состоит из димера одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи в тесной ассоциации, которая может быть ковалентной по своему характеру, например, в scFv. Именно в этой конфигурации три CDR каждого вариабельного домена взаимодействуют, определяя антигенсвязывающий сайт на поверхности димера VH-VL. В совокупности шесть CDR или их подгруппа придают антителу антигенсвязывающую специфичность. Однако даже один вариабельный домен (или половина Fv, содержащего только три CDR, специфичных для антигена) может обладать способностью распознавать и связывать антиген, хотя обычно с более низкой аффинностью, чем весь сайт связывания.
Одноцепочечные фрагменты антител Fv или (scFv) содержат домены (или области) VH и VL антитела, где эти домены присутствуют в одной полипептидной цепи. Как правило, полипептид scFv дополнительно содержит полипептидный линкер между доменами VH и VL, который позволяет sсFv образовывать требуемую структуру для связывания антигена.
Fab-фрагмент содержит вариабельный и константный домен легкой цепи, а также вариабельный домен и первый константный домен (CH1) тяжелой цепи. Фрагменты антитела F(ab')2 содержат пару Fab-фрагментов, которые обычно ковалентно связаны вблизи своих карбоксиконцов посредством шарнирных цистеинов между ними. Другие химические конденсации фрагментов антител также известны в данной области.
Диантитела представляют собой небольшие фрагменты антител с двумя антигенсвязывающими сайтами, которые содержат VH, связанную с VL в одной и той же полипептидной цепи (VH и VL). При использовании линкера, который является слишком коротким чтобы позволить спаривание между двумя вариабельными доменами на одной и той же цепи, домены диантитела вынуждены спариваться с комплементарными доменами связывания другой цепи и создают два антигенсвязывающих сайта.
Линейные антитела содержат пару тандемных сегментов Fd (VH-CH1-VH-CH1), которые вместе с комплементарными полипептидами легкой цепи образуют пару антигенсвязывающих областей. Линейные антитела могут быть биспецифическими или моноспецифическими.
Антитела и фрагменты антител по настоящему изобретению могут быть модифицированы в Fc-области для обеспечения желаемых эффекторных функций или желаемого периода полужизни в сыворотке.
Мультимеризация антител может быть достигнута посредством естественной агрегации антител или с помощью химических или рекомбинантных способов связывания, известных в данной области. Например, некоторый процент препаратов очищенных антител (например, очищенных молекул IgG1) спонтанно образуют белковые агрегаты, содержащие гомодимеры антител и другие мультимеры антител более высокого порядка.
Альтернативно, гомодимеры антител могут быть получены с помощью методов химической связи, известных в данной области. Например, для образования мультимеров антител можно использовать гетеробифункциональные сшивающие агенты, включая, но не ограничиваясь ими, SMCC (сукцинимидил-4-(малеимидометил) циклогексан-1-карбоксилат) и SATA (N-сукцинимидил-S-ацетилтиоацетат). Иллюстративный протокол для образования гомодимеров антител описан в Ghetie et al. (Proc. Natl. Acad. Sci. U.S.A. 94: 7509-7514, 1997). Гомодимеры антител можно превратить в гомодимеры Fab’2 путем расщепления пепсином. Другой способ образования гомодимеров антител заключается в использовании аутофильного пептида T15, описанного в Zhao et al. (J. Immunol. 25: 396-404, 2002).
В некоторых вариантах осуществления полиспецифическое антитело представляет собой биспецифическое антитело. Биспецифические антитела могут быть получены путем конструирования интерфейса между парой молекул антител, чтобы максимизировать процент гетеродимеров, которые извлекают из культуры рекомбинантных клеток. Например, интерфейс может содержать, по меньшей мере, часть домена СН3 константного домена антитела. В этом методе одна или более небольших боковых цепей аминокислот из интерфейса первой молекулы антитела заменяются более крупными боковыми цепями (например, тирозином или триптофаном). Компенсирующие «полости» идентичного или сходного размера с крупной боковой цепью (цепями) создаются в интерфейсе второй молекулы антитела путем замены крупных боковых цепей аминокислот меньшими (например, аланином или треонином). Это обеспечивает механизм повышения выхода гетеродимера по отношению к другим нежелательным конечным продуктам, таким как гомодимеры. Этот метод описан, например, в WO 96/27011, которая включена в настоящее описание в качестве ссылки в полном объеме.
Биспецифические антитела включают сшитые или «гетероконъюгатные» антитела. Например, одно из антител в гетероконъюгате может быть связано с авидином, а другое - с биотином. Гетероконъюгатные антитела также могут быть получены с использованием любых удобных способов сшивки. Подходящие сшивающие агенты и методы сшивания хорошо известны в данной области и раскрыты в Патенте США № 4676980, который включен в настоящее описание в качестве ссылки в полном объеме.
Способы получения биспецифических антител из фрагментов антител также известны в данной области. Например, биспецифические антитела могут быть получены с использованием химической связи. Brennan et al. (Science 229: 81, 1985) описывают процедуру, при которой интактные антитела протеолитически расщепляются с образованием F(ab')2-фрагментов. Эти фрагменты восстанавливаются в присутствии дитиольного комплексообразующего агента арсенита натрия и предотвращают образование межмолекулярных дисульфидных связей. Полученные Fab'-фрагменты затем превращаются в производные тионитробензоата (TNB). Затем одно из производных Fab' TNB превращается в Fab' тиол путем восстановления меркаптоэтиламином и смешивается с эквимолярным количеством другого производного Fab' TNB с образованием биспецифического антитела.
Любое из антител или антигенсвязывающих фрагментов, описанных в настоящем документе, может быть конъюгировано со стабилизирующей молекулой (например, с молекулой, которая увеличивает период полужизни антитела или его антигенсвязывающего фрагмента в организме пациента или в растворе). Неограничивающие примеры стабилизирующих молекул включают: полимер (например, полиэтиленгликоль) или белок (например, сывороточный альбумин, такой как сывороточный альбумин человека). Конъюгация стабилизирующей молекулы может увеличивать период полужизни или увеличивать биологическую активность антитела или антигенсвязывающего фрагмента in vitro (например, в культуре ткани или при хранении в виде фармацевтической композиции) или in vivo (например, в организме человека).
В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты, описанные в настоящем документе, могут быть конъюгированы с терапевтическим агентом. Конъюгат антитело-лекарственное средство, содержащий антитело или его антигенсвязывающий фрагмент, может ковалентно или нековалентно связываться с терапевтическим агентом. В некоторых вариантах осуществления терапевтический агент представляет собой цитотоксический или цитостатический агент (например, цитохалазин B, грамицидин D, бромид этидия, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрацин, майтансиноиды такие как DM-1 и DM-4, дион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол, пуромицин, эпирубицин, циклофосфамид и аналоги).
Характеристики антител
В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты, описанные в настоящем документе, могут блокировать связывание между 4-1BB и лигандом 4-1BB (4-1BBL).
В некоторых вариантах осуществления путем связывания с 4-1BB антитело может активировать иммунный ответ. Таким образом, в некоторых вариантах осуществления описанные в настоящем документе антитела или их антигенсвязывающие фрагменты являются агонистами 4-1BB. В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты являются антагонистами 4-1BB.
В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты, как описано в настоящем документе, могут увеличивать иммунный ответ, активность или количество иммунных клеток (например, Т-клеток, клеток-натуральных киллеров (NK), нейтрофилов, дендритных клеток (DC), макрофагов, антигенпрезентирующих клеток, CD8+ и/или CD4+ Т-клеток) по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, в 2 раза, 3 раза, 5 раза, 10 раз или в 20 раз. В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты, как описано в настоящем документе, могут снижать активность или количество иммунных клеток по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%., 90%, 100%, в 2 раза, 3 раза, 5 раз, 10 раз или в 20 раз.
В некоторых вариантах осуществления антитело (или его антигенсвязывающие фрагменты) специфически связывается с 4-1BB (например, 4-1BB человека, 4-1BB обезьяны, 4-1BB мыши и/или химерным 4-1BB) со скоростью диссоциации (koff) менее чем 0,1 с-1, менее чем 0,01 с-1, менее чем 0,001 с-1, менее чем 0,0001 с-1 или менее чем 0,00001 с-1. В некоторых вариантах осуществления скорость диссоциации (koff) составляет более чем 0,01 с-1, более чем 0,001 с-1, более чем 0,0001 с-1, более чем 0,00001 с-1 или более чем 0,000001 с-1.
В некоторых вариантах осуществления скорость кинетической ассоциации (kon) составляет более чем 1×102/Mс, более чем 1×103/Mс, более чем 1×104/Mс, более чем 1×105/Mс или более чем 1×106/Mс. В некоторых вариантах осуществления изобретения скорость кинетической ассоциации (kon) составляет менее чем 1х105/Mс, менее чем 1х106/Mс или менее чем 1х107/Mс.
Аффинности можно вывести из отношения кинетических констант скорости (KD=koff/kon). В некоторых вариантах осуществления KD составляет менее чем 1×10-6 M, менее чем 1×10-7 M, менее чем 1×10-8 M, менее чем 1×10-9 M или менее чем 1×10-10. М. В некоторых вариантах осуществления KD составляет менее чем 50 нМ, 40 нМ, 30 нМ, 20 нМ, 15 нМ, 10 нМ, 9 нМ, 8 нМ, 7 нМ, 6 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ или 1 нМ. В некоторых вариантах осуществления KD составляет больше чем 1×10-7 M, больше чем 1×10-8 M, больше чем 1×10-9 M, больше чем 1×10-10 M, больше чем 1×10-11 M или больше чем 1х10-12 М. В некоторых вариантах осуществления антитело связывается с человеческим 4-1BB с KD менее или равным примерно 0,9 нМ, 0,8 нМ, 0,7 нМ, 0,6 нМ, 0,5 нМ, 0,4 нМ, 0,3 нМ, 0,2 нМ или 0,1 нМ. В некоторых вариантах осуществления антитело связывается с человеческим 4-1BB с KD менее или равным примерно 0,5 или 0,4 нМ.
Общие методы измерения аффинности антитела к антигену включают, например, ИФА, RIA и поверхностный плазмонный резонанс (SPR). В некоторых вариантах осуществления антитело связывается с 4-1BB человека (SEQ ID NO:217), 4-1BB обезьяны (например, 4-1BB макаки-резус, SEQ ID NO:219), химерным 4-1BB (SEQ ID NO:220) и/или мышиным 4-1BB (SEQ ID NO:218). В некоторых вариантах осуществления антитело не связывается с 4-1BB человека (SEQ ID NO:217), 4-1BB обезьяны (например, 4-1BB макаки-резус, SEQ ID NO:219; или 4-1BB яванского макака), химерным 4 -1BB (SEQ ID NO:220) и/или мышиным 4-1BB (SEQ ID NO:218).
В некоторых вариантах осуществления определяют термическую стабильность. Антитела или антигенсвязывающие фрагменты, как описано в настоящем документе, могут иметь Tm более чем 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94 или 95°C.
Поскольку IgG можно описать как многодоменный белок, кривая плавления иногда показывает два перехода или три перехода с первой температурой денатурации Tm D1, второй температурой денатурации Tm D2 и, необязательно, третьей температурой денатурации Tm D3. Когда имеется два пика, один пик указывает на денатурацию Fc-доменов (Tm D1), а другой пик указывает на денатурацию Fab-доменов (Tm D2).
В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты, как описано в настоящем документе, имеют Tm D1 более чем 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75., 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94 или 95°C. В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты, как описано в настоящем документе, имеют Tm D2 более чем 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75., 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94 или 95°C. В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты, как описано в настоящем документе, имеют Tm D3 более чем 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75., 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94 или 95 °C.
В некоторых вариантах осуществления Tm, Tm D1, Tm D2, Tm D3 составляют менее чем 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76., 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94 или 95°C.
В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты, как описано в настоящем документе, не образуют агрегации, когда температура составляет менее чем 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73., 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94 или 95°C.
В некоторых вариантах осуществления антитело имеет процент ингибирования роста опухоли (TGI%), который составляет более чем 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 110%, 120%, 130%, 140%, 150%, 160%, 170%, 180%, 190% или 200%. В некоторых вариантах осуществления антитело имеет процент ингибирования роста опухоли, который составляет менее чем 60%, 70%, 80%, 90%, 100%, 110%, 120%, 130%, 140%, 150%, 160%, 170%, 180%, 190% или 200%. TGI% может быть определен, например, через 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 дней после начала лечения или через 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев после начала лечения. Используемый в настоящем описании процент ингибирования роста опухоли (TGI%) рассчитывается по следующей формуле:
TGI (%) = [1- (Ti-T0)/(Vi-V0)]×100
Ti представляет собой средний объем опухоли в группе обработки в день i. T0 представляет собой средний объем опухоли в группе обработки в нулевой день. Vi представляет собой средний объем опухоли в контрольной группе в день i. V0 представляет собой средний объем опухоли в контрольной группе в нулевой день.
В некоторых вариантах осуществления, описанные в настоящем документе антитела или их антигенсвязывающие фрагменты являются агонистами 4-1BB. В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты, описанные в настоящем документе, являются антагонистами 4-1BB. В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты могут увеличивать или уменьшать передачу сигнала 4-1BB в клетке-мишени, которая экспрессирует 4-1BB.
В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты могут усиливать функцию иммунных клеток (например, CD8+ T-клеток, CD4+ T-клеток, B-клеток, клеток-натуральных киллеров, нейтрофилов, моноцитов, макрофагов и/или дендритных клеток), например, посредством увеличение пролиферации иммунных клеток и/или увеличение продуцирования цитокинов иммунной клеткой (например, по сравнению с пролиферацией и/или продуцированием цитокинов до обработки антителами или антигенсвязывающими фрагментами). В некоторых вариантах осуществления цитокин представляет собой гамма-интерферон.
В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты увеличивают количество внутриопухолевых (инфильтрирующих) CD8+ эффекторных Т-клеток (например, общее количество CD8+ эффекторных Т-клеток или, например, процент CD8+ в CD45+ клетках), например, по сравнению с количеством внутриопухолевых (инфильтрирующих) эффекторных CD8+ Т-клеток до обработки. В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты увеличивают количество внутриопухолевых (инфильтрирующих) CD8+ эффекторных Т-клеток, которые экспрессируют гамма-интерферон (например, процент CD8+ клеток, которые экспрессируют гамма-интерферон, в общем количестве CD8+ клеток), например, по сравнению с количеством внутриопухолевых (инфильтрующих) CD8+ Т-клеток, которые экспрессируют гамма-интерферон, до обработки антителом против 4-1BB человека.
В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты увеличивают количество внутриопухолевых (инфильтрирующих) CD4+ эффекторных Т-клеток (например, общее количество CD4+ эффекторных Т-клеток или, например, процент CD4+ клеток в CD45+ клетках), например, по сравнению с количеством внутриопухолевых (инфильтрирующих) CD4+ Т-клеток до обработки антителами или антигенсвязывающими фрагментами. В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты увеличивают количество внутриопухолевых (инфильтрирующих) CD4+ эффекторных Т-клеток, которые экспрессируют гамма-интерферон (например, суммарное количество CD4+ клеток, экспрессирующих гамма-интерферон,, или, например, процентное содержание CD4+ клеток, экспрессирующих гамма-интерферон, в общем количестве CD4+ клеток), например, по сравнению с количеством внутриопухолевых (инфильтрирующих) CD4+ Т-клеток, которые экспрессируют гамма-интерферон до обработки.
В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты усиливают функцию Т-клеток памяти, например, за счет увеличения пролиферации Т-клеток памяти и/или увеличения продуцирования цитокинов (например, гамма-интерферона) Т-клетками памяти.
В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты имеют функциональную область Fc. В некоторых вариантах осуществления эффекторная функция функциональной Fc-области представляет собой антителозависимую клеточно-опосредованную цитотоксичность (ADCC). В некоторых вариантах осуществления эффекторной функцией функциональной Fc-области является фагоцитоз. В некоторых вариантах осуществления эффекторной функцией функциональной Fc-области является ADCC и фагоцитоз. В некоторых вариантах осуществления область Fc представляет собой IgG1 человека, IgG2 человека, IgG3 человека или IgG4 человека.
В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты не имеют функциональной Fc-области. Например, антитела или антигенсвязывающие фрагменты представляют собой фрагменты Fab, Fab’, F(ab’)2 и Fv.
Антитело IgG1 против h4-1BB
Настоящее описание также демонстрирует, что антитела подкласса IgG1 неожиданно обладают гораздо лучшим ингибирующим действием на опухоль, чем другие подклассы. Основываясь на результатах и не ограничиваясь какой-либо теорией, была выдвинута гипотеза, что антитело против h1BB ингибирует рост опухоли, прежде всего, посредством антителозависимой клеточно-опосредованной цитотоксичности (ADCC). FcγRIIIa является основным рецептором, участвующим в активации ADCC. Подклассы IgG различаются по своей способности связываться с FcγRIIIa, и это дифференциальное связывание определяет их способность вызывать ряд функциональных ответов (например, ADCC). Таким образом, это может быть связано с тем, что подкласс IgG1 может иметь более сильную аффинность связывания с FcγRIIIa, антитела IgG1 обладают лучшим ингибирующим действием на опухоль, чем другие подклассы. Следовательно, в некоторых вариантах осуществления настоящее описание относится к антителу IgG1 (например, человеческому антителу IgG1), которое имеет CDR, VH и VL, как описано в настоящем документе.
В некоторых вариантах осуществления антитело IgG1 или его антигенсвязывающий фрагмент имеет CDR (например, в определении Kabat, определении Chothia или определении IMGT), VH и VL, как показано в таблице ниже. Таким образом, настоящее описание относится к антителу IgG1 (например, человеческому антителу IgG1 или гуманизированному антителу IgG1), содержащему вариабельную область тяжелой цепи (VH), содержащую области, определяющие комплементарность, (CDR) 1, 2 и 3, где область VH CDR1 содержит аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95% или 100% идентична выбранной аминокислотной последовательности VH CDR1, область VH CDR2 содержит аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95% или 100% идентична выбранной аминокислотной последовательности VH CDR2, а область VH CDR3 содержит аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95% или 100% идентична выбранной аминокислотной последовательности VH CDR3; и вариабельную область легкой цепи (VL), содержащую CDR 1, 2 и 3, где область VL CDR1 содержит аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95% или 100% идентична выбранной аминокислотной последовательности VL CDR1, область VL CDR2 содержит аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95% или 100% идентична выбранной аминокислотной последовательности VL CDR2, и область VL CDR3 содержит аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95% или 100% идентична выбранной аминокислотной последовательности VL CDR3, где VH CDR1, VH CDR2, VH CDR3, VL CDR1, VL CDR2, VL CDR3 представлены в Таблице 3. В некоторых вариантах осуществления CDR антитела IgG1 или его антигенсвязывающего фрагмента определены по определению Kabat, определению Chothia или определению IMGT. В некоторых вариантах осуществления VH CDR1, VH CDR2, VH CDR3, VL CDR1, VL CDR2, VL CDR3 (CDR, как определено согласно определению Kabat) антитела IgG1 или его антигенсвязывающего фрагмента имеют последовательности, которые представлены в Таблице 3. В некоторых вариантах осуществления VH CDR1, VH CDR2, VH CDR3, VL CDR1, VL CDR2, VL CDR3 (CDR, как определено согласно определению IMGT) антитела IgG1 или его антигенсвязывающего фрагмента имеют последовательности, которые представлены в Таблице 3.
В некоторых вариантах осуществления настоящее описание относится к антителу или его антигенсвязывающему фрагменту, который связывается с 4-1BB, содержащим вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95% или на 100% идентична выбранной последовательности VH, и вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность, которая по меньшей мере на 80%, 85%, 90%, 95% или 100% идентична выбранной последовательности VL, где выбранная последовательность VH и выбранная последовательность VL представлены в Таблице ниже.
Таблица 3
SEQ ID:
SEQ ID:
SEQ ID:
SEQ ID:
SEQ ID:
SEQ ID:
SEQ ID:
SEQ ID:
Кроме того, описанные в настоящем документе антитела могут иметь различные мутации. В некоторых вариантах осуществления антитела (например, антитела IgG1) могут иметь мутацию N297A (нумерация EU), мутации FC-SI (нумерация EU: F243L/R292P/Y300L/V305I/P396L) или мутации FC-V11 (нумерация EU: (G237D/P238D/H268D/P271G/A330R). В некоторых вариантах осуществления Fc-область антител, описанных в настоящем документе, может иметь одну или более из следующих мутаций: N297A, F243L, R292P, Y300L, V305I, P396L, G237D, P238D, H268D, P271G и A330R.
Способы получения антител против 4-1BB
Выделенный фрагмент 4-1BB человека можно использовать в качестве иммуногена для генерации антител с использованием стандартных методик получения поликлональных и моноклональных антител. Поликлональные антитела могут быть получены у животных путем множества инъекций (например, подкожных или внутрибрюшинных инъекций) антигенного пептида или белка. В некоторых вариантах осуществления антигенный пептид или белок инъецируют по меньшей мере с одним адъювантом. В некоторых вариантах осуществления антигенный пептид или белок можно конъюгировать с агентом, который является иммуногенным для видов, которые должны быть иммунизированы. Животным можно вводить антигенный пептид или белок более одного раза (например, два, три или четыре раза).
Можно использовать полноразмерный полипептид или белок или, в качестве альтернативы, можно использовать их антигенные пептидные фрагменты в качестве иммуногенов. Антигенный пептид белка содержит по меньшей мере 8 (например, по меньшей мере 10, 15, 20 или 30) аминокислотных остатков аминокислотной последовательности 4-1BB и охватывает эпитоп белка, так что антитело, индуцированное против пептида, образует специфический иммунный комплекс с белком. Как описано выше, полноразмерная последовательность человеческого 4-1BB известна в данной области (SEQ ID NO:217).
Иммуноген обычно используется для получения антител путем иммунизации подходящего субъекта (например, человека или трансгенного животного, экспрессирующего по меньшей мере один локус иммуноглобулина человека). Подходящий иммуногенный препарат может содержать, например, рекомбинантно экспрессируемый или химически синтезированный полипептид (например, фрагмент 4-1BB человека). Препарат может дополнительно включать адъювант, такой как полный или неполный адъювант Фрейнда, или подобный иммуностимулирующий агент.
Поликлональные антитела могут быть получены, как описано выше, путем иммунизации подходящего индивидуума полипептидом 4-1BB или его антигенным пептидом (например, частью 4-1BB) в качестве иммуногена. Титр антител у иммунизированного индивидуума можно контролировать с течением времени стандартными методами, такими как иммуноферментный анализ (ИФА) с использованием иммобилизованного полипептида или пептида 4-1BB. При желании молекулы антител могут быть выделены из млекопитающего (например, из крови) и дополнительно очищены хорошо известными методами, такими как хроматография на протеине A, протеине G, для получения фракции IgG. В подходящее время после иммунизации, например, когда титры специфических антител являются наивысшими, у индивидуума можно получить клетки, продуцирующие антитела, и использовать их для получения моноклональных антител стандартными методами, такими как метод гибридомы, первоначально описанный Kohler et al. (Nature 256: 495-497, 1975), метод гибридомы B-клеток человека (Kozbor et al., Immunol. Сегодня 4:72, 1983), метод EBV-гибридомы (Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc., стр. 77-96, 1985), или метод триомы. Технология получения гибридом хорошо известна (см., как правило, Current Protocols in Immunology, 1994, Coligan et al. (Eds.), John Wiley & Sons, Inc., New York, NY). Клетки гибридомы, продуцирующие моноклональные антитела, выявляют путем скрининга супернатантов гибридомной культуры на антитела, которые связывают интересующий полипептид или эпитоп, например, с использованием стандартного анализа ИФА.
Варианты антител или антигенсвязывающих фрагментов, описанные в настоящем документе, могут быть получены путем введения соответствующих нуклеотидных изменений в ДНК, кодирующую человеческое, гуманизированное или химерное антитело, или его антигенсвязывающий фрагмент, описанный в настоящем документе, или путем пептидного синтеза. Такие варианты включают, например, делеции, вставки или замены остатков в аминокислотных последовательностях, которые составляют антигенсвязывающий сайт антитела или антигенсвязывающий домен. В популяции таких вариантов некоторые антитела или антигенсвязывающие фрагменты будут иметь повышенную аффинность к белку-мишени, например, 4-1BB. Любая комбинация делеций, вставок и/или их комбинации могут быть сделаны для получения антитела или его антигенсвязывающего фрагмента, который обладает повышенной аффинностью связывания с мишенью. Аминокислотные замены, введенные в антитело или антигенсвязывающий фрагмент, также могут изменять или вводить новые посттрансляционные модификации в антитело или антигенсвязывающий фрагмент, такие как изменение (например, увеличение или уменьшение) количества сайтов гликозилирования, изменение типа сайта гликозилирования (например, изменение аминокислотной последовательности таким образом, что другой сахар присоединяется ферментами, присутствующими в клетке) или введение новых сайтов гликозилирования.
Антитела, раскрытые в настоящем описании, могут быть получены из любых видов животных, включая млекопитающих. Неограничивающие примеры природных антител включают антитела с происхождением от людей, приматов, например, обезьян и человекообразных обезьян, коров, свиней, лошадей, овец, верблюдовых (например, верблюдов и лам), кур, коз и грызунов (например, крыс, мышей, хомяков и кроликов), включая трансгенных грызунов, генетически сконструированных для продуцирования человеческих антител.
Человеческие и гуманизированные антитела включают антитела, имеющие вариабельные и константные области, полученные из (или имеющие ту же аминокислотную последовательность, что и у полученной последовательности) последовательностей иммуноглобулина зародышевой линии человека. Антитела человека могут включать аминокислотные остатки, не кодируемые последовательностями иммуноглобулина зародышевой линии человека (например, мутации, введенные случайным или сайт-специфическим мутагенезом in vitro или соматической мутацией in vivo), например, в CDR.
Гуманизированное антитело, как правило, имеет человеческий каркас (FR) с трансплантированными CDR, не являющимися человеческими. Таким образом, гуманизированное антитело имеет одну или более аминокислотных последовательностей, введенных в него из источника, который не является человеком. Эти аминокислотные остатки, не являющиеся человеческими, часто называют «импортными» остатками, которые обычно берут из «импортного» вариабельного домена. Гуманизация может быть в основном выполнена, например, путем замены CDR или последовательностей CDR грызунов на соответствующие последовательности человеческого антитела. Эти методы описаны, например, в Jones et al., Nature, 321: 522-525 (1986); Riechmann et al., Nature, 332: 323-327 (1988); Verhoeyen et al., Science, 239: 1534-1536 (1988); каждая из которых включена в настоящее описание в качестве ссылки в полном объеме. Соответственно, «гуманизированные» антитела представляют собой химерные антитела, в которых по существу меньше, чем интактный человеческий V-домен, заменен соответствующей последовательностью из вида, отличного от человека. На практике гуманизированные антитела обычно представляют собой антитела мыши, в которых некоторые остатки CDR и некоторые остатки FR заменены остатками из аналогичных сайтов в антителах человека.
Выбор человеческих доменов VH и VL для использования при создании гуманизированных антител очень важен для снижения иммуногенности. В соответствии с так называемым методом «наилучшего соответствия» последовательность V-домена мышиного антитела подвергается скринингу против всей библиотеки известных последовательностей человеческого домена. Последовательность человека, наиболее близкая к последовательности мыши, затем принимается в качестве FR человека для гуманизированного антитела (Sims et al., J. Immunol., 151: 2296 (1993); Chothia et al., J. Mol. Биол., 196: 901 (1987)).
Кроме того, важно, чтобы антитела были гуманизированы с сохранением высокой специфичности и аффинности к антигену и других благоприятных биологических свойств. Для достижения этой цели гуманизированные антитела могут быть получены путем анализа родительских последовательностей и различных концептуальных гуманизированных продуктов с использованием трехмерных моделей родительских и гуманизированных последовательностей. Трехмерные иммуноглобулиновые модели широко доступны и хорошо знакомы специалистам в данной области. Доступны компьютерные программы, которые иллюстрируют и отображают возможные трехмерные конформационные структуры выбранных кандидатных последовательностей иммуноглобулинов. Просмотр этих выведенных данных позволяет анализировать вероятную роль некоторых остатков в функционировании кандидатной последовательности иммуноглобулина, т. е. проводить анализ остатков, которые влияют на способность кандидатного иммуноглобулина связываться с антигеном. Таким образом, FR-остатки могут быть выбраны и объединены из реципиента и импортируемых последовательностей так, чтобы достигалась целевая характеристика антитела, такая как повышенная аффинность к целевому антигену.
Обычно варианты аминокислотной последовательности человеческого, гуманизированного или химерного антитела против 4-1BB будут содержать аминокислотную последовательность, имеющую, по меньшей мере, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичности с последовательностью, присутствующей в легкой или тяжелой цепи исходного антитела.
Идентичность в отношении исходной последовательности обычно представляет собой процент аминокислотных остатков, присутствующих в последовательности-кандидате, которые идентичны последовательности, присутствующей в человеческом, гуманизированном или химерном антителе против 4-1BB или в его фрагменте, после выравнивания последовательностей и введения пробелов, если необходимо, для достижения максимальной процентной идентичности последовательности, и без учета каких-либо консервативных замен как части идентичности последовательности.
Могут быть сделаны дополнительные модификации антител против 4-1BB или антигенсвязывающих фрагментов. Например, остаток(остатки) цистеина может быть введен в Fc-область, тем самым обеспечивая образование межцепочечной дисульфидной связи в этой области. Полученное таким образом гомодимерное антитело может иметь любое увеличенное время полужизни in vitro и/или in vivo. Гомодимерные антитела с увеличенным периодом полужизни in vitro и/или in vivo также могут быть получены с использованием гетеробифункциональных сшивающих агентов, как описано, например, в Wolff et al. (Cancer Res. 53: 2560-2565, 1993). В качестве альтернативы можно сконструировать антитело, которое имеет двойные Fc-области (см., например, Stevenson et al., Anti-Cancer Drug Design 3: 219-230, 1989).
В некоторых вариантах осуществления ковалентная модификация может быть выполнена для антитела против 4-1BB или его антигенсвязывающего фрагмента. Эти ковалентные модификации могут быть сделаны химическим или ферментативным синтезом или ферментативным или химическим расщеплением. Другие типы ковалентных модификаций антитела или фрагмента антитела вводятся в молекулу путем взаимодействия целевых аминокислотных остатков антитела или фрагмента с органическим дериватизирующим агентом, который способен реагировать с выбранными боковыми цепями или N- или C-концевыми остатками.
В некоторых вариантах осуществления представлены варианты антител, имеющие углеводную структуру, в которой отсутствует фукоза, присоединенная (прямо или косвенно) к Fc-области. Например, количество фукозы в таком антителе может составлять от 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. Количество фукозы определяется путем расчета среднего количества фукозы в сахарной цепи в Asn297 относительно суммы всех гликоструктур, присоединенных к Asn 297 (например, сложных, гибридных и высокоманнозных структур), как измерено с помощью масс-спектрометрии MALDI-TOF, как описано, например, в WO 2008/077546. Asn297 относится к остатку аспарагина, находящемуся примерно в положении 297 в Fc-области (нумерация EU остатков Fc-области; или положение 314 в нумерации Kabat); однако Asn297 может также располагаться примерно на ± 3 аминокислоты выше или ниже положения 297, то есть между положениями 294 и 300, из-за незначительных вариаций последовательности в антителах. Такие варианты фукозилирования могут иметь улучшенную функцию ADCC. В некоторых вариантах осуществления для уменьшения гетерогенности гликанов Fc-область антитела может быть дополнительно сконструирована путем замены аспарагина в положении 297 на аланин (N297A).
В некоторых вариантах осуществления для повышения эффективности продукции за счет предотвращения обмена Fab-плеча область Fc антител была дополнительно сконструирована путем замены серина в положении 228 (нумерация ЕС) IgG4 на пролин (S228P). Подробное описание мутации S228 описано, например, в Silva et al. «The S228P mutation prevents in vivo and in vitro IgG4 Fab-arm exchange as demonstrated using a combination of novel quantitative immunoassays and physiological matrix preparation.» Journal of Biological Chemistry 290.9 (2015): 5462-5469, которая включена в настоящее описание в качестве ссылки в полном объеме.
В некоторых аспектах описание также относится к применению антител или их антигенсвязывающих фрагментов, описанных в настоящем документе, для производства лекарственного средства для лечения онкологического заболевания.
Рекомбинантные векторы
Настоящее описание также относится к рекомбинантным векторам (например, экспрессирующим векторам), которые включают выделенный полинуклеотид, раскрытый в настоящем документе (например, полинуклеотид, кодирующий полипептид, раскрытый в настоящем документе), клетки-хозяева, в которые вводят рекомбинантные векторы (т.е. такие, что клетки-хозяева содержат полинуклеотид и/или вектор, содержащий полинуклеотид), и продуцирование полипептидов рекомбинантных антител или их фрагментов с помощью рекомбинантных методов.
Используемый в настоящем описании термин «вектор» представляет собой любую конструкцию, способную доставлять один или более представляющих интерес полинуклеотидов в клетку-хозяин, когда вектор вводится в клетку-хозяин. «Экспрессирующий вектор» способен доставлять и экспрессировать один или более представляющих интерес полинуклеотидов в виде кодируемого полипептида в клетку-хозяин, в которую был введен экспрессирующий вектор. Таким образом, в экспрессирующем векторе интересующий полинуклеотид располагается для экспрессии в векторе, будучи функционально связанным с регуляторными элементами, такими как промотор, энхансер и/или поли-А-хвост, либо внутри вектора, либо в геноме клетки-хозяин находится в сайте интеграции или около него или фланкирует сайт интеграции интересующего полинуклеотида, так что интересующий полинуклеотид будет транслироваться в клетке-хозяине, в которую вводили экспрессирующий вектор.
Вектор можно ввести в клетку-хозяина способами, известными в данной области, например, электропорацией, химической трансфекцией (например, DEAE-декстраном), трансформацией, трансфекцией и инфицированием и/или трансдукцией (например, с использованием рекомбинантного вируса). Таким образом, неограничивающие примеры векторов включают вирусные векторы (которые можно использовать для генерирования рекомбинантного вируса), депротеинизированную ДНК или РНК, плазмиды, космиды, фаговые векторы и экспрессирующие векторы ДНК или РНК, связанные с катионными конденсирующими агентами.
В некоторых реализациях описанный в настоящем документе полинуклеотид (например, полинуклеотид, кодирующий описанный в настоящем документе полипептид) вводится с использованием системы вирусной экспрессии (например, вируса коровьей оспы или другого вируса оспы, ретровируса или аденовируса), которая может включать использование непатогенного (дефектного) вируса, способного к репликации, или может использовать вирус с дефектом репликации. В последнем случае размножение вируса обычно происходит только в дополняющих клетках, упаковывающих вирус. Подходящие системы раскрыты, например, в Fisher-Hoch et al., 1989, Proc. Natl. Acad. Sci. USA 86: 317-321; Flexner et al., 1989, Ann. N.Y. Acad Sci. 569:86-103; Flexner et al., 1990, Vaccine, 8:17-21; Пат. США No. 4603112, 4769330, и 5017487; WO 89/01973; Пат. США № 4777127; GB 2 200 651; EP 0,345,242; WO 91/02805; Berkner-Biotechniques, 6: 616-627, 1988; Rosenfeld et al., 1991, Science, 252: 431-434; Kolls et al., 1994, Proc. Natl. Acad. Sci. USA, 91: 215-219; Kass-Eisler et al., 1993, Proc. Natl. Acad. Sci. США, 90: 11498-11502; Guzman et al., 1993, Circulation, 88: 2838-2848; и Guzman et al., 1993, Cir. Res., 73: 1202-1207. Методы включения ДНК в такие системы экспрессии хорошо известны специалистам в данной области. ДНК также может быть «депротеинизированной», как описано, например, в Ulmer et al., 1993, Science, 259: 1745-1749, и Cohen, 1993, Science, 259: 1691-1692. Поглощение депротеинизированной ДНК может быть увеличено путем нанесения ДНК на биодеградируемые гранулы, которые эффективно транспортируются в клетки.
Для экспрессии вставка ДНК, содержащая полинуклеотид, кодирующий антитело или кодирующий полипептид, описанный в настоящем документе, может быть функционально связан с подходящим промотором (например, гетерологичным промотором), таким как промотор PL фага лямбда, lac, trp и tac промоторы, ранние и поздние промоторы SV40 и промоторы ретровирусных LTR, и это лишь некоторые из них. Другие подходящие промоторы известны специалисту в данной области. Экспрессирующие конструкции могут дополнительно содержать сайты инициации, терминации транскрипции и, в транскрибируемой области, сайт связывания рибосомы для трансляции. Кодирующая часть зрелых транскриптов, экспрессируемых этими конструкциями, может включать в себя кодон инициации трансляции в начале и терминирующий кодон (UAA, UGA или UAG), соответствующим образом расположенный на конце полипептида, подлежащего трансляции.
Как указано, экспрессирующие векторы могут включать по меньшей мере один селектируемый маркер. Такие маркеры включают гены устойчивости к дигидрофолатредуктазе или неомицину для культуры эукариотических клеток и гены устойчивости к тетрациклину или ампициллину для культивирования в E.coli и других бактериях. Репрезентативные примеры подходящих хозяев включают, но не ограничиваются ими, бактериальные клетки, такие как клетки E.coli, Streptomyces и Salmonella typhimurium; грибные клетки, такие как дрожжевые клетки; клетки насекомых, такие как клетки Drosophila S2 и Spodoptera Sf9; животные клетки, такие как клетки СНО, COS, меланомы Bowes и клетки HK 293; и растительные клетки. Подходящие культуральные среды и условия для клеток-хозяев, описанные в настоящем документе, известны в данной области.
Неограничивающие векторы для использования в бактериях включают pQE70, pQE60 и pQE-9, доступные от Qiagen; векторы pBS, векторы Phagescript, векторы Bluescript, pNH8A, pNH16a, pNH18A, pNH46A, доступные от Stratagene; и ptrc99a, pKK223-3, pKK233-3, pDR540, pRIT5, доступные от Pharmacia. Неограничивающие эукариотические векторы включают pWLNEO, pSV2CAT, pOG44, pXT1 и pSG, доступные от Stratagene; и pSVK3, pBPV, pMSG и pSVL, доступные от Pharmacia. Другие подходящие векторы будут очевидны для специалиста.
Неограничивающие бактериальные промоторы, подходящие для использования, включают промоторы E.coli lacI и lacZ, промоторы T3 и T7, промотор gpt, промоторы лямбда PR и PL и промотор trp. Подходящие эукариотические промоторы включают немедленный ранний промотор CMV, промотор тимидинкиназы HSV, ранний и поздний промоторы SV40, промоторы ретровирусных LTR, такие как промоторы вируса саркомы Рауса (RSV), и промоторы металлотионеина, такие как промотор металлотионеина-I мыши.
В дрожжах Saccharomyces cerevisiae может быть использован ряд векторов, содержащих конститутивные или индуцируемые промоторы, такие как промоторы альфа-фактора, алкогольоксидазы и PGH. Для обзоров см. Ausubel et al. (1989) Current Protocols in Molecular Biology, John Wiley & Sons, New York, N.Y, и Grant et al., Methods Enzymol., 153: 516-544 (1997).
Введение конструкции в клетку-хозяина может осуществляться кальцийфосфатной трансфекцией, трансфекцией, опосредованной DEAE-декстраном, трансфекцией, опосредованной катионными липидами, электропорацией, трансдукцией, инфекцией или другими методами. Такие методы описаны во многих стандартных лабораторных руководствах, таких как Davis et al., Basic Methods In Molecular Biology (1986), которые включены в настоящее описание в качестве ссылки в полном объеме.
Транскрипция ДНК, кодирующей антитело по настоящему изобретению, высшими эукариотами может быть увеличена путем введения энхансерной последовательности в вектор. Энхансеры являются cis-действующими элементами ДНК, обычно примерно от 10 до 300 п.н., которые действуют повышая транскрипционную активность промотора в данном типе клеток-хозяев. Примеры энхансеров включают энхансер SV40, который расположен в участке позднего начала репликации на расстоянии 100-270 п.н., энхансер раннего промотора цитомегаловируса, энхансер полиомы на участке позднего начала репликации и энхансеры аденовируса.
Для секреции транслированного белка в межклеточное пространство эндоплазматического ретикулума, в периплазматическое пространство или во внеклеточную среду соответствующие сигналы секреции могут быть включены в экспрессированный полипептид. Сигналы могут быть эндогенными по отношению к полипептиду или могут быть гетерологичными сигналами.
Полипептид (например, антитело) может экспрессироваться в модифицированной форме, такой как гибридный белок (например, GST-гибрид) или с гистидиновой меткой, и может включать не только сигналы секреции, но также дополнительные гетерологичные функциональные области. Например, область дополнительных аминокислот, в частности заряженных аминокислот, может быть добавлена к N-концу полипептида для улучшения стабильности и устойчивости в клетке-хозяине, во время очистки или во время последующей обработки и хранения. Также пептидные фрагменты могут быть добавлены к полипептиду для облегчения очистки. Такие области могут быть удалены до конечного получения полипептида. Добавление пептидных фрагментов к полипептидам для того чтобы вызвать секрецию или экскрецию, для улучшения стабильности и облегчения очистки, среди прочего, являются известными и обычными методами в данной области.
Описание также относится к последовательности нуклеиновой кислоты, которая по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%., 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентична любой нуклеотидной последовательности, как описано в настоящем документе, и аминокислотной последовательности, которая по меньшей мере на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентична любой аминокислотной последовательности, как описано в настоящем документе.
Описание также относится к последовательности нуклеиновой кислоты, которая имеет гомологию по меньшей мере 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%., 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% с любой нуклеотидной последовательностью, как описано в настоящем документе, и к аминокислотной последовательности, которая имеет гомологию по меньшей мере 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% с любой аминокислотной последовательностью, как описано в настоящем документе.
В некоторых вариантах осуществления описание относится к нуклеотидным последовательностям, кодирующим любые пептиды, которые описаны в настоящем документе, или любым аминокислотным последовательностям, которые кодируются любыми нуклеотидными последовательностями, описанными в настоящем документе. В некоторых вариантах осуществления последовательность нуклеиновой кислоты составляет менее чем 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 150, 200, 250, 300, 350, 400, 500 или 600 нуклеотидов. В некоторых вариантах осуществления аминокислотная последовательность составляет менее чем 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150., 160, 170, 180, 190, 200, 250, 300, 350 или 400 аминокислотных остатков.
В некоторых вариантах осуществления аминокислотная последовательность (i) содержит аминокислотную последовательность; или (ii) состоит из аминокислотной последовательности, где аминокислотная последовательность представляет собой любую из описанных в настоящем документе последовательностей.
В некоторых вариантах осуществления последовательность нуклеиновой кислоты (i) содержит последовательность нуклеиновой кислоты; или (ii) состоит из последовательности нуклеиновой кислоты, где последовательность нуклеиновой кислоты представляет собой любую из описанных в настоящем документе последовательностей.
Чтобы определить процент идентичности двух аминокислотных последовательностей или двух последовательностей нуклеиновых кислот, последовательности выравнивают для целей оптимального сравнения (например, могут быть введены пробелы в одной или обеих из первой и второй аминокислотной или нуклеотидной последовательности для оптимального выравнивание, и негомологичные последовательности можно не принимать во внимание для целей сравнения). Длина эталонной последовательности, выровненной для целей сравнения, составляет, по меньшей мере, 80% длины эталонной последовательности, и в некоторых вариантах осуществления составляет, по меньшей мере, 90%, 95% или 100%. Затем сравниваются аминокислотные остатки или нуклеотиды в соответствующих положениях аминокислот или нуклеотидов. Если положение в первой последовательности занято тем же аминокислотным остатком или нуклеотидом что и в соответствующем положении второй последовательности, то молекулы являются идентичными по этому положению (при использовании в настоящем описании «идентичность» аминокислоты или нуклеиновой кислоты эквивалентна «гомологии» аминокислоты или нуклеиновой кислоты). Процент идентичности между двумя последовательностями является функцией числа идентичных положений совместно с последовательностями, принимая во внимание число пробелов и длину каждого пробела, которые должны появляться для оптимального выравнивания двух последовательностей. В целях настоящего изобретения сравнение последовательностей и определение процента идентичности между двумя последовательностями может быть выполнено с использованием матрицы оценки Blossum 62 с штрафом за пробел 12, штрафом за расширение пробела 4 и штрафом за сдвиг пробела 5.
Процент остатков со сходными физико-химическими свойствами (процент гомологии), например лейцин и изолейцин также можно использовать для измерения сходства последовательностей. Семейства аминокислотных остатков, обладающих сходными физико-химическими свойствами, определены в данной области. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), с кислыми боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), с незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), с неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), с бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и с ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Процент гомологии во многих случаях выше, чем процент идентичности.
Способы лечения
Антитела или антитела или их антигенсвязывающие фрагменты по настоящему изобретению могут быть использованы для различных терапевтических целей. В одном аспекте описание относится к способам лечения онкологического заболевания у пациента, способам снижения скорости увеличения объема опухоли у пациента с течением времени, способам снижения риска развития метастазирования или способам снижения риска развития дополнительного метастазирования у пациента. В некоторых вариантах осуществления лечение может останавливать, замедлять, тормозить или ингибировать прогрессирование онкологического заболевания. В некоторых вариантах осуществления лечение может приводить к уменьшению количества, тяжести и/или продолжительности одного или более симптомов онкологического заболевания у пациента.
В одном аспекте в описании представлены способы, которые включают введение терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента, раскрытого в настоящем документе, пациенту, который в этом нуждается (например, пациенту, который имеет онкологическое заболевание, у которого идентифицировано или диагностировано онкологическое заболевание), например, рак молочной железы (например, трижды негативный рак молочной железы), карциноидный рак, рак шейки матки, рак эндометрия, глиому, рак головы и шеи, рак печени, рак легкого, мелкоклеточный рак легкого, лимфома, меланома, рак яичников, рак поджелудочной железы, рак предстательной железы, рак почки, колоректальный рак, рак желудка, рак яичек, рак щитовидной железы, рак мочевого пузыря, рак уретры или гемобластозы. В некоторых вариантах осуществления онкологическое заболевание представляет собой неоперабельную меланому или метастатическую меланому, немелкоклеточный рак легкого (NSCLC), мелкоклеточный рак легкого (SCLC), рак мочевого пузыря или метастатический гормонорезистентный рак предстательной железы. В некоторых вариантах осуществления у пациента имеется солидная опухоль. В некоторых вариантах осуществления онкологическое заболевание представляет собой плоскоклеточную карциному головы и шеи (SCCHN), почечно-клеточную карциному (RCC), трижды негативный рак молочной железы (TNBC) или колоректальную карциному. В некоторых вариантах осуществления у пациента имеется лимфома Ходжкина. В некоторых вариантах осуществления у пациента имеется трижды негативный рак молочной железы (TNBC), рак желудка, уротелиальный рак, карцинома из клеток Меркеля или рак головы и шеи. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент представляет собой антитело против 4-1BB или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело представляет собой антитело IgG1 против 4-1BB (например, человеческое антитело IgG1 против 4-1BB).
В некоторых вариантах осуществления композиции и способы, раскрытые в настоящем описании, можно использовать для лечения пациентов с риском развития онкологического заболевания. Пациентов, имеющих онкологические заболевания, можно идентифицировать различными способами, известными в данной области.
Кроме того, поскольку антитела против 4-1BB могут стимулировать иммунный ответ, в описании представлены способы лечения инфекции у пациента. Типы инфекции включают, например, бактериальные, грибковые, вирусные, протозойные и паразитарные заболевания. В некоторых вариантах осуществления лечение может остановить, замедлить, затормозить или подавить прогрессирование заболевания. Кроме того, лечение антителом 4-1BB (например, агонистическим антителом или антагонистическим антителом) также можно использовать для лечения аутоиммунного заболевания, астмы и, кроме того, в качестве средства для улучшения вакцинации. Эти способы обычно включают введение терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента, раскрытого в настоящем описании, пациенту, нуждающемуся в этом.
Используемый в настоящем описании термин «эффективное количество» означает количество или дозировку, достаточную для достижения полезных или желаемых результатов, включая остановку, замедление, задержку или ингибирование прогрессирования заболевания, например, онкологического заболевания или аутоиммунного заболевания. Эффективное количество будет варьироваться в зависимости, например, от возраста и массы тела пациента, которому следует вводить антитело, антигенсвязывающий фрагмент, полинуклеотид, кодирующий антитело, вектор, содержащий полинуклеотид, и/или их композиции, в зависимости от степень тяжести симптомов и пути введения, и, таким образом, введение можно определить в индивидуальном порядке.
Эффективное количество может вводиться посредством одного или более введений. Например, эффективное количество антитела или антигенсвязывающего фрагмента представляет собой количество, достаточное для улучшения, остановки, стабилизации, обращения вспять, ингибирования, замедления и/или задержки прогрессирования онкологического заболевания у пациента, или количество, достаточное для улучшения, остановки, стабилизации, обращения вспять, замедления и/или задержки пролиферации клетки (например, клетки, подвергшейся биопсии, любой из опухолевых клеток, описанных в настоящем документе, или линии клеток (например, опухолевой клеточной линии)) in vitro. Как понятно в данной области, эффективное количество антитела или антигенсвязывающего фрагмента может варьироваться в зависимости, в частности, от истории болезни пациента, а также от других факторов, таких как тип (и/или дозировка) используемого антитела.
Эффективные количества и схемы введения антител, полинуклеотидов, кодирующих антитела, и/или композиций, раскрытых в настоящем описании, могут быть определены эмпирически, и такие определения в компетенции специалистов в данной области. Специалистам в данной области будет понятно, что дозировка, которая должна быть введена, будет варьироваться в зависимости, например, от млекопитающего, которое получает антитела, полинуклеотиды, кодирующие антитела, и/или композиции, раскрытые в настоящем описании, от пути введения, конкретного типа используемых антител, полинуклеотидов, кодирующих антитела, антигенсвязывающих фрагментов и/или композиций, раскрытых в настоящем описании, и других лекарственных средств, вводимых млекопитающему. Руководство по выбору подходящих доз для антитела или антигенсвязывающего фрагмента можно найти в литературе по терапевтическому применению антител и антигенсвязывающих фрагментов, например, Handbook of Monoclonal Antibodies, Ferrone et al., Eds., Noges Publications, Park Ridge, NJ, 1985, гл. 22 and pp. 303-357; Smith et al., Antibodies in Human Diagnosis and Therapy, Haber et al., eds., Raven Press, New York, 1977, pp. 365-389.
Типичная суточная доза эффективного количества антитела составляет от 0,01 мг/кг до 100 мг/кг. В некоторых вариантах осуществления дозировка может составлять менее чем 100 мг/кг, 10 мг/кг, 9 мг/кг, 8 мг/кг, 7 мг/кг, 6 мг/кг, 5 мг/кг, 4 мг/кг, 3 мг/кг, 2 мг/кг, 1 мг/кг, 0,5 мг/кг или 0,1 мг/кг. В некоторых вариантах осуществления дозировка может составлять более чем 10 мг/кг, 9 мг/кг, 8 мг/кг, 7 мг/кг, 6 мг/кг, 5 мг/кг, 4 мг/кг, 3 мг/кг, 2 мг/кг, 1 мг/кг, 0,5 мг/кг, 0,1 мг/кг, 0,05 мг/кг или 0,01 мг/кг. В некоторых вариантах осуществления дозировка составляет примерно 10 мг/кг, 9 мг/кг, 8 мг/кг, 7 мг/кг, 6 мг/кг, 5 мг/кг, 4 мг/кг, 3 мг/кг, 2 мг/кг, 1 мг/кг, 0,9 мг/кг, 0,8 мг/кг, 0,7 мг/кг, 0,6 мг/кг, 0,5 мг/кг, 0,4 мг/кг, 0,3 мг/кг, 0,2 мг/кг или 0,1 мг/кг.
В любом из способов, описанных в настоящем документе, по меньшей мере одно антитело, его антигенсвязывающий фрагмент или фармацевтическая композиция (например, любое из антител, антигенсвязывающих фрагментов или фармацевтических композиций, описанных в настоящем документе) и, необязательно, по меньшей мере, один дополнительный терапевтический агент можно вводить пациенту по меньшей мере один раз в неделю (например, один раз в неделю, два раза в неделю, три раза в неделю, четыре раза в неделю, один раз в день, два раза в день или три раза в день). В некоторых вариантах осуществления по меньшей мере два разных антитела и/или антигенсвязывающих фрагмента вводят в одной и той же композиции (например, жидкой композиции). В некоторых вариантах осуществления по меньшей мере одно антитело или антигенсвязывающий фрагмент и по меньшей мере один дополнительный терапевтический агент вводят в одной и той же композиции (например, жидкой композиции). В некоторых вариантах осуществления по меньшей мере одно антитело или антигенсвязывающий фрагмент и по меньшей мере один дополнительный терапевтический агент вводят в двух разных композициях (например, жидкой композиции, содержащей по меньшей мере одно антитело или антигенсвязывающий фрагмент, и твердой пероральной композиции, содержащей хотя бы один дополнительный терапевтический агент). В некоторых вариантах осуществления по меньшей мере один дополнительный терапевтический агент вводят в виде пилюли, таблетки или капсулы. В некоторых вариантах осуществления, по меньшей мере, один дополнительный терапевтический агент вводят в пероральной композиции с замедленным высвобождением.
В некоторых вариантах осуществления один или более дополнительных терапевтических агентов можно вводить пациенту до или после введения по меньшей мере одного антитела, фрагмента антигенсвязывающего антитела или фармацевтической композиции (например, любого из антител, антигенсвязывающих фрагментов антител или фармацевтических композиций, описанных в настоящем документе). В некоторых вариантах осуществления один или более дополнительных терапевтических агентов и по меньшей мере одно антитело, фрагмент антигенсвязывающего антитела или фармацевтическая композиция (например, любое из антител, фрагментов антигенсвязывающего антитела или фармацевтических композиций, описанных в настоящем документе) вводят пациенту так, что имеет место перекрывание биоактивного периода одного или более дополнительных терапевтических агентов и по меньшей мере одного антитела или антигенсвязывающего фрагмента (например, любого из антител или антигенсвязывающих фрагментов, описанных в настоящем документе) у пациента.
В некоторых вариантах осуществления пациенту можно вводить по меньшей мере одно антитело, фрагмент антигенсвязывающего антитела или фармацевтическую композицию (например, любое из антител, фрагментов антигенсвязывающих антител или фармацевтических композиций, описанных в настоящем документе) в течение длительного периода времени (например, в течение периода, составляющего по меньшей мере 1 неделю, 2 недели, 3 недели, 1 месяц, 2 месяца, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, 12 месяцев, 1 год, 2 года, 3 года, 4 года или 5 лет). Квалифицированный медицинский работник может определить продолжительность периода лечения, используя любой из описанных здесь способов для диагностики или отслеживания эффективности лечения (например, наблюдения по меньшей мере одного симптома онкологического заболевания). Как описано в настоящем документе, квалифицированный медицинский работник может также изменить идентичность и количество (например, увеличение или уменьшение) антител или фрагментов антигенсвязывающих антител (и/или одного или нескольких дополнительных терапевтических агентов), вводимых пациенту, а также может регулировать (например, увеличить или уменьшить) дозировку или частоту введения по меньшей мере одного антитела или антигенсвязывающего фрагмента антитела (и/или одного или более дополнительных терапевтических агентов) у пациента на основе оценки эффективности лечения (например, с использованием любого из способов, описанных в настоящем документе и известных в данной области).
В некоторых вариантах осуществления пациенту можно вводить один или более дополнительных терапевтических агентов. Дополнительный терапевтический агент может включать один или более ингибиторов, выбранных из группы, состоящей из ингибитора B-Raf, ингибитора EGFR, ингибитора MEK, ингибитора ERK, ингибитора K-Ras, ингибитора c- Met, ингибитора киназы анапластической лимфомы (ALK), ингибитора фосфатидилинозитол-3-киназы (PI3K), ингибитора Akt, ингибитора mTOR, двойного ингибитора PI3K/mTOR, ингибитора тирозинкиназы Брутона (BTK) и ингибитора изоцитратдегидрогеназы 1 (IDH1) и/или изоцитратдегидрогеназы 2 (IDH2). В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой ингибитор индоламин-2,3-диоксигеназы-1) (IDO1) (например, эпакадостат).
В некоторых вариантах осуществления дополнительный терапевтический агент может включать один или более ингибиторов, выбранных из группы, состоящей из ингибитора HER3, ингибитора LSD1, ингибитора MDM2, ингибитора BCL2, ингибитора CHK1, ингибитора активированного сигнального пути hedgehog, и агента, избирательно разрушающего рецептор эстрогена.
В некоторых вариантах осуществления дополнительный терапевтический агент может включать один или более терапевтических агентов, выбранных из группы, состоящей из трабектина, наб-паклитаксела, требананиба, пазопаниба, цедираниба, пальбоциклиба, эверолимуса, фторпиримидина, IFL, регорафениба, реолизина, алимта, зукадиа, сутента, темсиролимуса, акситиниба, эверолимуса, сорафениба, вотриента, пазопаниба, IMA-901, AGS-003, кабозантиниба, винфлунина, ингибитора Hsp90, Ad-GM-CSF, темазоломида, IL-2, IFNa, винбластина, циклобластина, таломида, дакарбазина, циклофосфамида, леналидомида, азацитидина, леналидомида, бортезомида, амрубицина, карфилзомиба, пралатрексата и энзастаурина.
В некоторых вариантах осуществления дополнительный терапевтический агент может включать один или более терапевтических агентов, выбранных из группы, состоящей из адъюванта, агониста TLR, фактора некроза опухоли (TNF) альфа, IL-1, HMGB1, антагониста IL-10, IL -4, антагонист IL-13, антагониста IL-17, антагониста HVEM, агониста ICOS, лечения, направленного на CX3CL1, лечения, направленного на CXCL9, лечения, направленного на CXCL10, лечения, направленного на CCL5, агониста LFA-1, агониста ICAM1 и агониста селектина.
В некоторых вариантах осуществления пациенту вводят карбоплатин, наб-паклитаксел, паклитаксел, цисплатин, пеметрексед, гемцитабин, FOLFOX или FOLFIRI.
В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой антитело против OX40, антитело против PD-L1, антитело против PD-L2, антитело против LAG-3, антитело против TIGIT, антитело против BTLA, антитело против CTLA-4 или антитело против GITR.
В некоторых вариантах осуществления дополнительная терапия представляет собой химиотерапию или химиолучевую терапию. В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой антитело против CTLA4 (например, ипилимумаб), антитело против CD20 (например, ритуксимаб), антитело против EGFR (например, цетуксимаб), антитело против CD319 (например, элотузумаб) или антитело против PD1 (например, ниволумаб).
В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой антитело, которое специфически связывается с PD-1, CTLA-4, BTLA, PD-L1, CD27, CD28, CD40, CD47, CD137, CD154, TIGIT, TIM-3, GITR или OX40.
Настоящее описание также демонстрирует, что комбинация антител против 4-1BB подкласса IgG1 с дополнительными терапевтическими агентами имеет лучший ингибирующий эффект на опухоль, чем комбинация антител против 4-1BB подкласса IgG4 с некоторыми дополнительными терапевтическими агентами. Таким образом, в одном аспекте настоящее описание относится к способам лечения пациента или уничтожения опухолей путем введения пациенту терапевтически эффективного количества антитела против 4-1BB IgG1 или его антигенсвязывающего фрагмента и дополнительного терапевтического агента. В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой антитело против PD-1, антитело против CTLA4 или антитело против OX40.
Фармацевтические композиции и пути введения
В настоящем документе также представлены фармацевтические композиции, которые содержат по меньшей мере одно (например, одно, два, три или четыре) антитело или антигенсвязывающий фрагмент, описанные в настоящем документе. Два или более (например, два, три или четыре) любых антитела или антигенсвязывающих фрагментов, описанных в настоящем документе, могут присутствовать в фармацевтической композиции в любой комбинации. Фармацевтические композиции могут быть прготовлены любым способом, известным в данной области.
Фармацевтические композиции приготовлены таким образом, чтобы они были совместимы с предполагаемым путем введения (например, внутривенным, внутриартериальным, внутримышечным, внутрикожным, подкожным или внутрибрюшинным). Композиции могут включать стерильный разбавитель (например, стерильную воду или физиологический раствор), нелетучее масло, полиэтиленгликоль, глицерин, пропиленгликоль или другие синтетические растворители, антибактериальные или противогрибковые агенты, такие как бензиловый спирт или метилпарабены, хлорбутанол, фенол, аскорбиновая кислота, тимеросал и тому подобное, антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия, хелатирующие агенты, такие как этилендиаминтетрауксусная кислота, буферы, такие как ацетаты, цитраты или фосфаты, и изотонические агенты, такие как сахара (например, декстроза), многоатомные спирты (например, маннит или сорбит) или соли (например, хлорид натрия) или любую их комбинацию. Липосомные суспензии также можно использовать в качестве фармацевтически приемлемых носителей (см., например, Патент № 4522811). Препараты композиций могут быть приготовлены и заключены в ампулы, одноразовые шприцы или флаконы с многократными дозами. При необходимости (как, например, в инъецируемых составах) надлежащая текучесть может поддерживаться, например, путем использования покрытия, такого как лецитин или поверхностно-активное вещество. Абсорбция антитела или его антигенсвязывающего фрагмента может быть продлена путем включения агента, замедляющего абсорбцию (например, моностеарата алюминия и желатина). Альтернативно, контролируемое высвобождение может быть достигнуто с помощью имплантатов и микрокапсулированных систем доставки, которые могут включать биоразлагаемые, биосовместимые полимеры (например, этиленвинилацетат, полиангидриды, полигликолевую кислоту, коллаген, полиортоэфиры и полимолочную кислоту; Alza Corporation и Nova Pharmaceutical, Inc.).
Композиции, содержащие одно или более из любых антител или антигенсвязывающих фрагментов, описанных в настоящем документе, могут быть прготовлены для парентерального (например, внутривенного, внутриартериального, внутримышечного, внутрикожного, подкожного или внутрибрюшинного) введения в виде стандартной лекарственной формы (т. е. физически дискретных единиц, содержащих заранее определенное количество активного соединения для простоты введения и единообразия дозировки).
Токсичность и терапевтическая эффективность композиций можно определить стандартными фармацевтическими процедурами на культурах клеток или экспериментальных животных (например, обезьянах). Можно, например, определить LD50 (доза, летальная для 50% популяции) и ED50 (доза, терапевтически эффективная для 50% популяции): терапевтический индекс представляет собой соотношение LD50: ED50. Агенты, которые демонстрируют высокие терапевтические индексы, являются предпочтительными. Если агент проявляет нежелательный побочный эффект, следует проявлять осторожность, чтобы минимизировать потенциальный ущерб (т. е. уменьшить нежелательные побочные эффекты). Токсичность и терапевтическая эффективность могут быть определены другими стандартными фармацевтическими процедурами.
Данные, полученные из анализов клеточных культур и исследований на животных, могут быть использованы для определения подходящей дозировки любого данного агента для использования у пациента (например, человека). Терапевтически эффективное количество одного или более (например, одного, двух, трех или четырех) антител или их антигенсвязывающих фрагментов (например, любого из антител или фрагментов антител, описанных в настоящем документе) будет количеством, которое лечит заболевание у пациента (например, уничтожает опухолевые клетки) у пациента (например, у пациента-человека, идентифицированного как имеющего онкологическое заболевание), или у пациента, идентифицированного как подверженного риску развития заболевания (например, у пациента, у которого ранее развилось онкологическое заболевание, но теперь он был излечен), снижает тяжесть, частоту и/или продолжительность одного или более симптомов заболевания у пациента (например, человека). Эффективность и дозировка любого из антител или антигенсвязывающих фрагментов, описанных в настоящем документе, может быть определена специалистом здравоохранения или ветеринаром с использованием методов, известных в данной области, а также путем наблюдения одного или более симптомов заболевания у пациента (например, человека). Определенные факторы могут влиять на дозировку и время, необходимые для эффективного лечения пациента (например, тяжесть заболевания или расстройства, предыдущее лечение, общее состояние здоровья и/или возраст пациента, а также наличие других заболеваний).
Примеры доз включают количество в миллиграммах или микрограммах любого из антител или антигенсвязывающих фрагментов, описанных в настоящем документе, на килограмм веса пациента (например, от примерно 1 мкг/кг до примерно 500 мг/кг; от примерно 100 мкг/кг до примерно 500 мг/кг; от примерно 100 мкг/кг до примерно 50 мг/кг; от примерно 10 мкг/кг до примерно 5 мг/кг; от примерно 10 мкг/кг до примерно 0,5 мг/кг; от примерно 1 мкг/кг до примерно 50 мкг/кг; от примерно 500 мкг/кг до примерно 5 мг/кг или от примерно 500 мкг/кг до примерно 2 мг/кг). Хотя эти дозы охватывают широкий диапазон, специалист в данной области поймет, что терапевтические агенты, включая антитела и их антигенсвязывающие фрагменты, различаются по своей эффективности, и эффективные количества могут быть определены способами, известными в данной области. Как правило, сначала вводят относительно низкие дозы, а лечащий врач или ветеринарный врач (в случае терапевтического применения) или исследователь (на стадии разработки) могут впоследствии и постепенно увеличивать дозу до соответствующего получаемого ответа. Кроме того, подразумевается, что конкретный уровень дозы для любого конкретного пациента будет зависеть от множества факторов, включая активность конкретного используемого соединения, возраст, массу тела, общее состояние здоровья, пол и рацион питания пациента, время введения, путь введения, скорость выведения и время полужизни антитела или фрагмента антитела in vivo.
Фармацевтические композиции могут быть включены в контейнер, упаковку или дозатор вместе с инструкциями для введения. Описание также относится к способам производства антител или их антигенсвязывающих фрагментов для различных применений, как описано в настоящем документе.
ПРИМЕРЫ
Настоящее изобретение дополнительно описано следующими примерами, которые не ограничивают рамки изобретения, описанные формуле изобретения.
Пример 1. Получение мышиных антител против h4-1BB
Для создания мышиных антител против человеческого h4-1BB (hh4-1BB; SEQ ID NO:217) мышей BALB/возрастом 6-8 недель иммунизировали человеческим h4-1BB. Антитела против hh4-1BB собирали способами, описанными ниже и показанными на ФИГ. 1 и ФИГ. 2.
Иммунизация мышей
Самок мышей BALB/c в возрасте 6-8 недель иммунизировали His-меченными человеческими белками h4-1BB в дозе 20 мкг/мышь в концентрации 100 мкг/мл. Белки h4-1BB человека с маркером his эмульгировали с адъювантом и инъецировали в четыре положения на спине мышей. Для первой подкожной (s.c.) инъекции разбавленный антиген эмульгировали с полным адъювантом Фрейнда (CFA) в равном объеме. В следующих подкожных инъекциях белок эмульгировали с неполным адъювантом Фрейнда (IFA) в равном объеме. Через три дня после третьей инъекции или бустерной иммунизации кровь (сыворотку) собирали и анализировали на титр антител с использованием ИФА.
В другом эксперименте иммунизировали самок мышей BALB/c в возрасте 6-8 недель путем введения экспрессирующей плазмиды, кодирующей человеческий h4-1BB, мышам. Плазмиды, кодирующие антиген, вводили в переднюю большеберцовую мышцу (внутримышечная инъекция; внутримышечная инъекция) мышей с использованием генных пушек в концентрации 1000 мкг/мкл при 60 мкг на мышь. Было выполнено по меньшей мере четырех инъекций с промежутком по меньшей мере 14 дней между двумя инъекциями. Кровь (сыворотку) собрали через семь дней после последней иммунизации, и сыворотку проверяли на титр антител с помощью ИФА.
Процедуры для усиления иммунизации также проводили по меньшей мере через четырнадцать дней после предыдущей иммунизации (либо путем инъекции плазмиды, либо путем введения белков). Клетки СНО, которые экспрессируют антиген h4-1BB на поверхности, внутривенно инъецировали мышам через хвостовые вены. Затем селезенку собирали через четыре дня после инъекции.
Слияние клеток SP2/0 и клеток селезенки
Ткани селезенки измельчали. Клетки селезенки сначала отбирали с помощью микрогранул CD3ε и микрогранул с антителом против мышиного IgM, а затем сливали с клетками SP2/0. Затем клетки высевали в 96-луночные планшеты со средой гипоксантин-аминоптерин-тимидин (HAT).
Первичный скрининг гибридомы
Первичный скрининг супернатанта гибридомы в 96-луночных планшетах проводили с использованием сортировки флуоресцентно-активированных клеток (FACS) в соответствии со стандартными процедурами. Клетки яичника китайского хомячка (СНО) добавляли в 96-луночные планшеты (2х104 клеток на лунку) перед скринингом. Использовали 50 мкл супернатанта. Антитела, которые были использованы в экспериментах, представляли собой
(1) Конъюгированный с флуоресцеином (FITC) AffiniPure козий F(ab)2-фрагмент против мышиного IgG, специфичный для Fcγ-фрагмента, и
(2) Alexa Fluor®-647-конъюгированный AffiniPure козий F(ab)2-фрагмент против человеческого IgG, специфичный для Fcγ-фрагмента.
Субклонирование
Субклонирование проводили с использованием ClonePix2. Вкратце, положительные лунки, идентифицированные во время первичного скрининга, переносили в полутвердую среду, и IgG-положительные клоны идентифицировали и тестировали. Использовали FITC-конъюгипрованное антитело Fc против мышиного IgG.
Асцитная жидкость антител
1×106 положительных клеток гибридомы вводили внутрибрюшинно мышам B-NDGTM (Beijing Biocytogen, Пекин, Китай). Моноклональные антитела получали путем выращивания клеток гибридомы в брюшной полости мыши. Клетки гибридомы размножались и производили асцитную жидкость в брюшной полости мышей. Жидкость содержала высокую концентрацию антител, которые можно собирать для последующего использования.
Очистка антител
Антитела в асцитной жидкости очищали с использованием белковой хроматографии GE AKTA (GE Healthcare, Чикаго, Иллинойс, США). Получали по меньшей мере 27 мышиных антител. Было выбрано несколько антител из-за желаемых свойств. Эти выбранные мышиные антитела, полученные описанными выше способами, включают, например, 16-1C4 («1C4»), 29-6A5 («6A5»), 30-5F9 («5F9»), 45-2B3 («2B3»), 45. -4B9 («4B9»), 45-7E9 («7E9»), 45-7G9 («7G9»), 45-8E11 («8E11»), 45-8E2 («8E2»), 45-8F1 («8F1»), 54-8B11 («8B11»), 55-8F6 («8F6»), 56-2A6 («2A6»), 59-5E4 («5E4»), 61-6A7 («6A7»), 69- 3C2 («3C2»), 70-3F9 («3F9») и 70-6F10 («6F10») и т. д.
Определяли области VH, VL и CDR антител. Аминокислотные последовательности CDR1, CDR2, CDR3 тяжелой цепи и CDR1, CDR2 и CDR3 легкой цепи этих антител показаны в Таблице 1 на ФИГ. 52 и ФИГ. 53.
Пример 2. Гуманизация мышиных антител
Отправной точкой для гуманизации были мышиные антитела (например, 1C4, 6A5, и 5F9). Были определены аминокислотные последовательности для вариабельной области тяжелой цепи и вариабельной области легкой цепи этих мышиных антител.
Были сконструированы четыре гуманизированных варианта вариабельной области тяжелой цепи (SEQ ID NO:221-224) и четыре гуманизированных варианта вариабельной области легкой цепи (SEQ ID NO:225-228) для 1C4, содержащие различные модификации или замены.
Были сконструированы три гуманизированных варианта вариабельной области тяжелой цепи (SEQ ID NO:229-231) и четыре гуманизированных варианта вариабельной области легкой цепи (SEQ ID NO:232-235) для 6A5, содержащие различные модификации или замены.
Были сконструированы три гуманизированных варианта вариабельной области тяжелой цепи (SEQ ID NO:236-238) и четыре гуманизированных варианта вариабельной области легкой цепи (SEQ ID NO:239-242) для 5F9, содержащие различные модификации или замены.
Эти гуманизированные варианты вариабельной области тяжелой цепи можно комбинировать с любыми вариантами вариабельной области легкой цепи на основе того же антитела мыши. Например, 1C4-H1 (SEQ ID NO:221) можно комбинировать с любым вариантом вариабельной области гуманизированной легкой цепи на основе того же мышиного антитела 1C4 (например, SEQ ID NO:225-228), и антитело будет помечено соответствующим образом. Например, если 1C4-H1 комбинируется с 1C4-K3 (SEQ ID NO:227), то антитело помечается как 1C4-H1K3.
Пример 3. Связывающая активность антител против h4-1BB человека
Антитела против h4-1BB собирали из асцитной жидкости мышей и очищали хроматографией. В каждую лунку планшета добавляли 25 мкл клеток СНО, транзиторно трансфецированных человеческим 4-1BB. Очищенные антитела титровали до конечных концентраций 10, 1, 0,1, 0,01, 0,001 мкг/мл. Титрованные антитела добавляли в каждую лунку при 4°C и инкубировали в течение 30 минут.
После двукратной промывки фосфатно-солевым буфером (PBS) (1200 об/мин, 5 минут) в каждую лунку добавляли 50 мкл меченного FITC антитела против IgG Fc мыши (анти-mIgG Fc-FITC) в разведении 1:100. и инкубировали в течение 30 минут при 4°C с последующей промывкой PBS (1200 об/мин, 5 минут). Сигнал для FITC детектировали с помощью проточной цитометрии.
Как показано на ФИГ. 3, 1C4 и 5F9 обладали сильной связывающей активностью с h4-1BB. На ФИГ. 3 NC означает отрицательный контроль.
В таблице ниже суммированы данные по проценту протестированных клеток, которые имели сигналы FITC в анализе проточной цитометрии. Более высокий процент при более низкой концентрации антител указывает на более высокую аффинность связывания.
Таблица 4
Пример 4. Перекрестная реактивность антител против h4-1BB против 4-1BB обезьяны, мыши и химерного 4-1BB человек-мышь
В каждом эксперименте клетки СНО трансфецировали 4-1BB мыши (m4-1BB, SEQ ID NO:218), 4-1BB обезьяны (макака-резус) (r4-1BB, SEQ ID NO:219) или химерным (мышь и человек) 4-1BB (c4-1BB, SEQ ID NO:220).
В каждую лунку добавляли 25 мкл клеток СНО. 25 мкл очищенных антител против h4-1BB (1 мкг/мл) добавляли в каждую лунку и инкубировали при 4°C в течение 30 минут.
После двукратной промывки PBS (1200 об/мин, 5 мин) 50 мкл FITC-меченного Fc антитела против IgG мыши (анти-mIgG Fc-FITC) добавляли в каждую лунку при разведении 1:100 с последующей инкубацией при 4 °C. в течение 30 минут, а затем промывали PBS (1200 об/мин, 5 минут). В некоторых случаях вместо этого для мечения антитела использовали меченное PE антитело Fc против IgG мыши (anti-mIgG Fc-PE) и добавляли в каждую тестируемую лунку при разведении 1:500. Сигналы для FITC и PE определяли с помощью проточной цитометрии.
Как показано на ФИГ. 4, 1C4 и 5F9 не реагировали перекрестно с мышиным 4-1BB, но обладали сильной перекрестной реактивностью с 4-1BB обезьяны (r4-1BB) и сильной перекрестной реактивностью с химерным 4-1BB (c4-1BB). На ФИГ. 4 NC означает отрицательный контроль.
Перекрестная реактивность тестируемых антител с 4-1BB обезьяны (r4-1BB), мыши (m4-1BB) и химерным 4-1BB (c4-1BB) человек-мышь суммирована в таблице ниже.
Таблица 5
Пример 5. Аффинность связывания антител против h4-1BB
Аффинность связывания антител против h4-1BB измеряли с использованием поверхностного плазмонного резонанса (SPR) с использованием биосенсора Biacore (Biacore, INC, Piscataway N.J.) T200, снабженного сенсорными чипами с предварительно иммобилизованным Протеином А.
Химерное антитело против h4-1BB, 16-1C4-mHvKv-IgG4 (1 мкг/мл) вводили в биосенсор Biacore T200 со скоростью 10 мкл/мин в течение 20 секунд для достижения желаемой плотности белка (около 51,6 единиц ответа (RU)). Затем вводили меченные гистидином человеческие белки 4-1BB (h4-1BB-His) в концентрациях 800, 200, 50, 12,5, 3,125 нМ со скоростью 30 мкл/мин в течение 180 секунд. За диссоциацией наблюдали в течение 300 секунд. Чип регенерировали после последней инъекции каждого титрования глицином (pH 2,0, 30 мкл/мин в течение 5 секунд). Результат для 16-1C4-mHvKv-IgG4 показан на ФИГ. 5.
Кинетические скорости ассоциации (kon) и скорости диссоциации (koff) были получены одновременно путем аппроксимации данных в глобальном масштабе к модели связывания Ленгмюра 1: 1 (Karlsson, R. Roos, H. Fagerstam, L. Petersson, B., 1994. Methods Enzymology 6. 99-110) с помощью оценочного программного обеспечения Biacore T200 Evaluation Software 3.0. Аффинности рассчитывали как частное от кинетических констант скорости (KD=koff/kon).
Как будет понятно специалисту в данной области, тот же метод с соответствующими корректировками параметров (например, концентрации антитела) был выполнен для каждого тестируемого антитела. Например, результаты 29-6A5-mHvKv-IgG2 показаны на ФИГ. 6. Результаты для тестируемых антител приведены в таблице ниже.
Таблица 6
kon (1/Mс)
koff (1/с)
KD (M)
Как описано в Примере 1, 16-1C4, 29-6A5, 30-5F9, 45-2B3, 45-4B9, 45-7E9, 45-7G9, 45-8E11, 45-8E2, 45-8F1, 54-8B11, 55-8F6, 56-2A6, 59-5E4, 61-6A7, 69-3C2, 70-3F9 и 70-6F10 представляют собой мышиные антитела против h4-1BB. На основе этих мышиных антител против h4-1BB были получены химерные антитела против h4-1BB, включая, например, 16-1C4-mHvKv-IgG4, 29-6A5-mHvKv-IgG2, 30-5F9-mHvKv-IgG4, 45-2B3- mHvKv-IgG2, 45-4B9-mHvKv-IgG2, 45-7E9-mHvKv-IgG2, 45-7G9-mHvKv-IgG2, 45-8E11-mHvKv-IgG2, 45-8E2-mHvKv-IgG2, 45-8F1-mHvKv- IgG2, 54-8B11-mHvKv-IgG2, 55-8F6-mHvKv-IgG2, 56-2A6-mHvKv-IgG2, 59-5E4-mHvKv -IgG2, 61-6A7-mHvKv-IgG2, 69-3C2-mHvKv-IgG2, 70-3F9-mHvKv-IgG2 и 70-6F10-mHvKv-IgG2. Химерные антитела содержат вариабельный домен тяжелой цепи и вариабельный домен легкой цепи из соответствующих антител мыши против h4-1BB и константные домены из человеческих антител IgG (включая, например, домены CL, CH1, CH2 и CH3).
Тестируемые антитела также включают гуманизированные антитела, например, 1C4-H1K1-IgG4, 1C4-H1K2-IgG4, 1C4-H1K3-IgG4, 1C4-H1K4-IgG4, 1C4-H2K1-IgG4, 1C4-H2K2-IgG4, 1C4-H2K3-IgG4, 1C4-H2K4-IgG4, 1C4-H3K1-IgG4, 1C4-H3K2-IgG4, 1C4-H3K3-IgG4, 1C4-H3K4-IgG4, 1C4-H4K1-IgG4, 1C4-H4K2-IgG4, 1C4-H4K3-IgG4, 1C4-H4K4-IgG4, 5F9-H1K1-IgG4, 5F9-H1K2-IgG4, 5F9-H1K3-IgG4, 5F9-H1K4-IgG4, 5F9-H2K1-IgG4, 5F9-H2K2-IgG4, 5F9-H2K3-IgG4, 5F9-H2K4-IgG4, 5F9-H3K1-IgG4, 5F9-H3K2-IgG4, 5F9-H3K3-IgG4, 5F9-H3K4-IgG4, 6A5-H1K1-IgG2, 6A5-H1K2-IgG2, 6A5-H1K3-IgG2, 6A5-H1K4-IgG2, 6A5-H2K1-IgG2, 6A5-H2K2-IgG2, 6A5-H2K3-IgG2, 6A5-H2K4-IgG2, 6A5-H3K1-IgG2, 6A5-H3K2-IgG2, 6A5-H3K3-IgG2, и 6A5-H3K4-IgG2 и так далее. Гуманизированные антитела имеют константные домены антител человека (включая, например, домены CL, CH1, CH2 и CH3). Гуманизированные вариабельные домены тяжелой цепи пронумерованы H1, H2, H3 и т. д.; а гуманизированные вариабельные домены легкой цепи пронумерованы K1, K2, K3 и т. д. Последовательности гуманизированных вариабельных доменов суммированы на ФИГ. 55, ФИГ. 56 и ФИГ. 57. Например, 1C4-H1K1-IgG4 основано на антителе мыши 1C4 и имеет гуманизированный вариабельный домен H1 тяжелой цепи (SEQ ID NO:221) и гуманизированный вариабельный домен K1 легкой цепи (SEQ ID NO:225). Аналогичным образом, 5F9-H3K2-IgG4 основано на антителе 5F9 мыши и имеет гуманизированный вариабельный домен H3 тяжелой цепи (SEQ ID NO:236) и гуманизированный вариабельный домен K2 легкой цепи 5F9 (SEQ ID NO:240).
Пример 6. Термическая стабильность антител против h4-1BB
Термофлуоресцентный анализ (Thermofluor assay) выполняли с использованием набора красителей Protein Thermal Shift™ (Thermo Fisher Scientific) и систем ПЦР в реальном времени QuantStudio™ 5 (Thermo Fisher Scientific). В этом анализе измеряли термостабильность с использованием флуоресцентного красителя, который связывается с гидрофобными участками, открытыми по мере разворачивания белка.
Эксперименты проводили согласно протоколу производителя. Смешивали 2 мкл антитела, 10,5 мкл воды, 5 мкл белкового буфера для термического сдвига и 2,5 мкл разбавленного белкового красителя для термического сдвига. Образцы нагревали до 25°C со скоростью 1,6°C/секунду, а затем нагревали до 99°C со скоростью 0,05°C/секунду.
В таблице ниже суммированы значения Tm для нескольких гуманизированных или химерных антител против h4-1BB.
Таблица 7
(константные домены)
Результаты показывают, что антитела против h4-1BB, описанные в настоящем документе, имеют более высокую Tm, чем утомилумаб и урелумаб.
Пример 7. In vivo тестирование мышиных антител против h4-1BB
Чтобы протестировать антитела против h4-1BB in vivo и предсказать эффекты этих антител у человека, была создана модель мыши с гуманизированным 4-1BB. Модель гуманизированной мыши 4-1BB была сконструирована для экспрессии химерного белка 4-1BB (SEQ ID NO:220), где часть внеклеточной области белка 4-1BB мыши была заменена соответствующей внеклеточной областью 4-1BB человека. Аминокислотные остатки 1-183 мышиного 4-1BB (SEQ ID NO:218) были заменены аминокислотными остатками 1-184 человеческого 4-1BB (SEQ ID NO:217). Модель гуманизированных мышей (B-h4-1BB) представляет собой новый инструмент для тестирования новых терапевтических методов лечения в клинических условиях путем значительного уменьшения разницы между клиническим исходом у человека и обычных мышей, экспрессирующих мышиный 4-1BB. Подробное описание модели мыши с гуманизированным 4-1BB можно найти в документе PCT/CN2017/120388, который включен в настоящее описание в качестве ссылки в полном объеме.
Антитела против h4-1BB испытывали на прдмет их влияния на рост опухоли in vivo на модели карциномы толстой кишки. Примерно 5×105 опухолевых клеток рака МС-38 (клетки аденокарциномы толстой кишки) вводили подкожно мышам B-h4-1BB. Когда объем опухолей у мышей достигал 150±50 мм3, мышей случайным образом распределяли по разным группам в зависимости от объема опухоли.
Затем мышам внутрибрюшинно вводили физиологический раствор (PS) и антитела против h4-1BB путем внутрибрюшинного введения (i.p.).
Вводимый объем рассчитывали на основе массы мыши при 1 мг/кг или 3 мг/кг. Измеряли длину длинной оси и короткой оси опухоли, и рассчитывали объем опухоли как 0,5×(длинная ось)×(короткая ось)2. Массу мышей также измеряли перед инъекцией, когда мышей помещали в разные группы (до первой инъекции антитела), дважды в неделю в течение периода инъекции антитела и перед эвтаназией.
Процент ингибирования роста опухоли (TGI%) рассчитывали по следующей формуле: TGI (%) = [1-(Ti-T0)/(Vi-V0)]×100. Ti представляет собой средний объем опухоли в группе обработки в день i. T0 представляет собой средний объем опухоли в группе обработки в нулевой день. Vi представляет собой средний объем опухоли в контрольной группе в день i. V0 представляет собой средний объем опухоли в контрольной группе в нулевой день.
Т-тест выполняли для статистического анализа. TGI% выше 60% указывает на явное подавление роста опухоли. P <0,05 представляет собой порог, указывающий на значительную разницу.
Результаты in vivo для мышиных антител против h4-1BB, 16-1C4 («1C4») и 30-5F9 («5F9»)
В каждой группе мышам B-h4-1BB вводили физиологический раствор (PS) (G1), 1 мг/кг урелумаба (G2), 3 мг/кг урелумаба (G3), 1 мг/кг мышиных антител против h4-1BB, 16-1C4 (G4), 3 мг/кг 16-1C4 (G5), 1 мг/кг мышиного антитела против h4-1BB 30-5F9 (G6) или 3 мг/кг 30-5F9 (G7).
Таблица 8.
Массу мышей контролировали в течение всего периода обработки. Средняя масса мышей в разных группах увеличивалась в разной степени (ФИГ. 7 и ФИГ. 8). Не наблюдалось явной разницы в массе между разными группами в конце периода лечения. Результаты показали, что 1C4 и 6A5 хорошо переносятся и не являются явно токсичными для мышей.
Размер опухоли в группах, получавших урелумаб, 1C4 или 6A5, уменьшился (ФИГ. 9).
TGI% на 19 день (19 дней после группирования) также рассчитывали, как показано в таблице ниже.
Таблица 9.
0
6
13
19
±17
±40
±75
±244
±17
±51
±42
±47
±19
±58
±30
±15
±18
±44
±27
±9
±22
±34
±20
±13
±19
±61
±42
±77
±18
±71
±55
±137
Результаты показали, что антитела 1C4 и 5F9 против h4-1BB значительно ингибировали рост опухоли. Кроме того, 1C4 и 5F9 имели одинаковый TGI% при 1 мг/кг и 3 мг/кг. Этот результат предполагает, что более высокая доза 1C4 и 5F9 явно не улучшает эффекты, ингибирующие опухоль.
Результаты in vivo для мышиных антител против h4-1BB 29-6A5 («6A5»), 29-4A10 («4A10»), 29-5F10 («5F10»), 45-8F1 («8F1») и 45- 4B9 («4B9»)
Мышам B-h4-1BB вводили физиологический раствор (PS) в качестве контроля (G1), 3 мг/кг 29-6A5 (G2), 3 мг/кг 29-4A10 (G3), 3 мг/кг 29-5F10 (G4)., 3 мг/кг 45-8F1 (G5) и 3 мг/кг 45-4B9 (G6). Для сравнения мышам также вводили урелумаб в дозе 3 мг/кг (G7).
Таблица 10.
Массу мышей контролировали в течение всего периода обработки. Масса мышей в разных группах увеличивалась в конце периода обработки (ФИГ. 10 и ФИГ. 11). Явной разницы в массе между разными группами не наблюдалось. Результаты показали, что эти антитела против h4-1BB хорошо переносились и не были явно токсичными для мышей. Размер опухоли в группах, получавших 29-6A5, 29-4A10, 29-5F10, 45-8F1 и 45-4B9, показан на ФИГ. 12.
TGI% на 17 день (17 дней после группирования) также рассчитывали, как показано в таблице ниже.
Таблица 11
0
7
14
17
±7
±56
±190
±282
±7
±34
±67
±87
±6
±40
±222
±242
±10
±64
±115
±132
±7
±24
±25
±35
±8
±29
±63
±67
±10
±40
±99
±131
Результаты показали, что все антитела против h4-1BB, 6A5, 4A10, 8F1, 4B9 ингибировали рост опухоли. Кроме того, 6A5 и 8F1 имели более высокий TGI%, чем другие протестированные антитела (например, Урелумаб).
Результаты in vivo для мышиных антител против h4-1BB 45-8E2 («8E2»), 45-7E9 («7E9»), 45-7G9 («7G9»), 45-2B3 («2B3») и 45- 2C11 («2C11»)
Мышам B-h4-1BB вводили физиологический раствор (PS) в качестве контроля (G1), 1 мг/кг 45-8E2 (G2), 1 мг/кг 45-7E9 (G3), 1 мг/кг 45-7G9. (G4), 1 мг/кг 45-2B3 (G5) и 1 мг/кг 45-2C11 (G6). Для сравнения мышам также вводили урелумаб в дозе 1 мг/кг (G7).
Таблица 12.
Массу мышей контролировали в течение всего периода обработки. Средняя масса мышей в разных группах увеличивалась в конце периода обработки (ФИГ. 13 и ФИГ. 14). Существенной разницы в массе между разными группами не наблюдалось. Результаты показали, что эти антитела против h4-1BB хорошо переносились и не были явно токсичными для мышей.
По сравнению с контрольной группой все 45-8E2, 45-7E9, 45-7G9, 45-2B3 и 45-2C11 ингибировали рост опухоли (ФИГ. 15). TGI% на 24 день (24 дней после группирования) также рассчитывали, как показано в таблице ниже.
Таблица 13
0
10
17
24
±16
±20
±102
±180
±11
±67
±53
±37
±10
±13
±12
±3
±9
±42
±34
±39
±11
±21
±38
±54
±12
±28
±53
±100
±15
±60
±144
±265
Результаты показали, что антитела против h4-1BB 45-8E2, 45-7E9, 45-7G9, 45-2B3 и 45-2C11 все значительно ингибировали рост опухоли. Кроме того, 45-8E2, 45-7E9, 45-7G9, 45-2B3 и 45-2C11 имели более высокий TGI%, чем урелумаб.
Результаты in vivo для мышиных антител против h4-1BB 16-1C4 («1C4»), 55-8F6 («8F6») и 54-8B11 («8B11»)
Мышам B-h4-1BB вводили физиологический раствор (PS) в качестве контроля (G1), 1 мг/кг 16-1C4 (G2), 1 мг/кг 55-8F6 (G3) и 1 мг/кг 54- 8B11 (G4). Для сравнения мышам также вводили урелумаб в дозе 1 мг/кг (G5).
Таблица 14
Массу мышей контролировали в течение всего периода обработки. Средняя масса мышей в разных группах увеличивалась в конце периода обработки (ФИГ. 16 и ФИГ. 17). Явной разницы в массе между разными группами не наблюдалось. Результаты показали, что эти антитела против h4-1BB хорошо переносились и не были явно токсичными для мышей. По сравнению с контрольной группой, все 16-1C4, 55-8F6 и 54-8B11 ингибировали рост опухоли (ФИГ. 18).
TGI% на 24 день (24 дней после группирования) также рассчитывали, как показано в таблице ниже.
Таблица 15.
0
10
17
24
±22
±72
±127
±268
±20
±55
±130
±181
±21
±59
±111
±220
±24
±82
±111
±164
±21
±19
±10
±0
Результаты показали, что антитела против h4-1BB, 16-1C4, 55-8F6 и 54-8B11 значительно ингибировали рост опухоли.
Результаты in vivo для мышиных антител против h4-1BB 54-1A11 («1A11»), 55-1E3 («1E3»), 55-8H5 («8H5») и 56-2A6 («2A6»)
Мышам B-h4-1BB вводили физиологический раствор (PS) (G1), 1 мг/кг 54-1A11 (G2), 1 мг/кг 55-1E3 (G3), 1 мг/кг 55-8H5 (G4), и 1 мг/кг 56-2A6 (G5). Для сравнения мышам также вводили урелумаб в дозе 1 мг/кг (G6).
Таблица 16.
Массу мышей контролировали в течение всего периода обработки. Средняя масса мышей в разных группах увеличивалась в конце периода обработки (ФИГ. 19 и ФИГ. 20). Явной разницы в массе между разными группами не наблюдалось. Результаты показали, что эти антитела против h4-1BB хорошо переносились и не были явно токсичными для мышей. Размер опухоли для каждой группы показан на ФИГ. 21.
TGI% на 24 день (24 дней после группирования) также рассчитывали, как показано в таблице ниже.
Таблица 17.
0
10
17
24
±5
±92
±162
±264
±6
±42
±85
±190
±10
±121
±195
±331
±9
±120
±149
±159
±5
±28
±41
±132
±8
±21
±18
±44
Результаты показали, что антитела против h4-1BB, 54-1A11, 55-8H5 и 56-2A6 значительно ингибировали рост опухоли. 55-1E3 не был эффективным в ингибировании роста опухоли.
Результаты in vivo для мышиных антител против h4-1BB 58-4B8 («4B8»), 69-3C2 («3C2») и 69-4B11 («4B11»)
Мышам B-h4-1BB вводили физиологический раствор (PS) (G1), 1 мг/кг 58-4B8 (G2), 1 мг/кг 69-3C2 (G3) и 1 мг/кг 69-4B11 (G4). . Для сравнения мышам также вводили урелумаб в дозе 1 мг/кг (G5).
Таблица 18.
Массу мышей контролировали в течение всего периода обработки. Масса мышей в разных группах увеличивалась (ФИГ. 22 и ФИГ. 23). Явной разницы в массе между разными группами не наблюдалось. Результаты показали, что эти антитела против h4-1BB хорошо переносились и не были явно токсичными для мышей. Размер опухоли для каждой группы показан на ФИГ. 24.
TGI% на 25 день (25 дней после группирования) также рассчитывали, как показано в таблице ниже.
Таблица 19
0
11
18
25
±7
±65
±119
±230
±8
±100
±158
±228
±9
±104
±112
±76
±6
±102
±169
±295
±7
±84
±109
±221
Результаты показали, что антитела против h4-1BB 58-4B8, 69-3C2 и 69-4B11 значительно ингибировали рост опухоли.
Пример 8. Тестирование химерных антител против h4-1BB in vivo
Химерные антитела против h4-1BB тестировали на мышах с гуманизированным 4-1BB (B-h4-1BB), чтобы определить их влияние на рост опухоли in vivo. Опухолевые клетки рака MC-38 (клетки аденокарциномы толстой кишки) вводили подкожно мышам B-h4-1BB. Когда объем опухолей у мышей достигал 150 ± 50 мм3, мышей случайным образом распределяли по разным группам в зависимости от объема опухоли.
Результаты in vivo для 30-5F9-mHvKv-IgG2, 30-5F9-mHvKv-IgG4, 16-1C4-mHvKv-IgG2, 16-1C4-mHvKv-IgG4, 16-1C4-mHvKv-IgG1
Мышам B-h4-1BB вводили физиологический раствор (PS) (G1), 30-5F9-mHvKv-IgG2 (G2), 30-5F9-mHvKv-IgG4 (G3), 16-1C4-mHvKv-IgG2 (G4)., 16-1C4-mHvKv-IgG4 (G5), 16-1C4-mHvKv-IgG1 (G6), 30-5F9 (G7), 16-1C4 (G8), утомилумаб (G9) и урелумаб (G10).
Таблица 20.
Массу мышей контролировали в течение всего периода обработки. Средняя масса мышей в разных группах увеличивалась в конце периода обработки (ФИГ. 25 и ФИГ. 26). Явной разницы в массе между разными группами не наблюдалось. Результаты показали, что эти антитела против h4-1BB хорошо переносились и не были явно токсичными для мышей. Размер опухоли для каждой группы показан на ФИГ. 27.
TGI% на 24 день (24 дней после группирования) также рассчитывали, как показано в таблице ниже.
Таблица 21
0
10
17
24
±6
±87
±225
±546
±14
±187
±368
±1063
±12
±31
±73
±257
±9
±167
±259
±267
±6
±60
±173
±458
±8
±40
±42
±30
±12
±30
±87
±182
±9
±117
±120
±70
±7
±33
±18
±98
±8
±53
±125
±169
Результаты показали, что все эти антитела против h4-1BB могут ингибировать рост опухоли. В частности, подкласс IgG1 16-1C4-mHvKv (G6) имел более высокий процент TGI, чем подкласс IgG2 (G4) и подкласс IgG4 (G5).
Результаты in vivo для 16-1C4-mHvKv-IgG2, 29-6A5-mHvKv-IgG2, 30-5F9-mHvKv-IgG2, 45-2B3-mHvKv-IgG2, 45-7E9-mHvKv-IgG2, 45-7G9-mHvKv- IgG2, 45-8E2-mHvKv-IgG2 и 45-8F1-mHvKv-IgG2
Мышам B-h4-1BB вводили физиологический раствор (PS) (G1), 16-1C4-mHvKv-IgG2 (G2), 29-6A5-mHvKv-IgG2 (G3), 30-5F9-mHvKv-IgG2 (G4), 45-2B3-mHvKv-IgG2 (G5), 45-7E9-mHvKv-IgG2 (G6), 45-7G9-mHvKv-IgG2 (G7), 45-8E2-mHvKv-IgG2 (G8), 45-8F1-mHvKv -IgG2 (G9) и Урелумаб (G10).
Таблица 22
Массу мышей контролировали в течение всего периода обработки. Средняя масса мышей в разных группах увеличивалась в конце периода обработки (ФИГ. 28 и ФИГ. 29). Явной разницы в массе между разными группами не наблюдалось. Результаты показали, что эти антитела против h4-1BB хорошо переносились и не были явно токсичными для мышей. Размер опухоли для каждой группы показан на ФИГ. 30.
TGI% на 21 день (21 дней после группирования) также рассчитывали, как показано в таблице ниже.
Таблица 23.
0
7
14
21
±4
±41
±95
±239
±8
±43
±91
±195
±6
±59
±122
±194
±8
±37
±39
±94
±6
±27
±59
±107
±7
±51
±245
±598
±5
±24
±82
±194
±8
±33
±63
±181
±7
±33
±106
±227
±7
±49
±72
±76
Результаты показали, что все эти химерные антитела могут в разной степени ингибировать рост опухоли.
Пример 9. Тестирование гуманизированных антител против h4-1BB in vivo
Гуманизированные антитела против h4-1BB тестировали на мышах с гуманизированным h4-1BB (B-h4-1BB), чтобы продемонстрировать их влияние на рост опухоли in vivo. Опухолевые клетки рака MC-38 (клетки аденокарциномы толстой кишки) вводили подкожно мышам B-h4-1BB. Когда объем опухолей у мышей достигал 150 ± 50 мм3, мышей случайным образом распределяли по разным группам в зависимости от объема опухоли.
Результаты in vivo для гуманизированных антител против 4-1BB, 6A5-H1K2-IgG2, 6A5-H1K3-IgG2 и 6A5-H2K2-IgG2
В группе G1 мышам B-h4-1BB вводили физиологический раствор (PS) в качестве контроля. В группах обработки мышам вводили 6A5-H1K2-IgG2 (G2), 6A5-H1K3-IgG2 (G3), 6A5-H2K2-IgG2 (G4), 6A5 (G5) и урелумаб (G6).
Таблица 24.
Массу мышей контролировали в течение всего периода обработки. Средняя масса мышей в разных группах увеличивалась в конце периода обработки (ФИГ. 31 и ФИГ. 32). Явной разницы в массе между разными группами не наблюдалось. Результаты показали, что эти антитела против h4-1BB хорошо переносились и не были явно токсичными для мышей. Размер опухоли для каждой группы показан на ФИГ. 33.
TGI% на 21 день (21 дней после группирования) также рассчитывали, как показано в таблице ниже.
Таблица 25.
0
7
14
21
±6
±52
±202
±341
±7
±18
±49
±132
±7
±20
±29
±61
±7
±26
±56
±118
±6
±29
±66
±97
±7
±29
±65
±130
Результаты показали, что все эти гуманизированные антитела против h4-1BB (G2, G3 и G4) могут ингибировать рост опухоли.
Результаты in vivo для гуманизированных антител против 4-1BB 1C4-H1K1-IgG4, 1C4-H1K2-IgG4, 5F9-H1K1-IgG4 и 30-5F9-H1K2-IgG4
В группе G1 мышам B-h4-1BB вводили физиологический раствор (PS) в качестве контроля. В группах обработки: мышам вводили 1C4-H1K1-IgG4 (G2), 1C4-H1K2-IgG4 (G3), 5F9-H1K1-IgG4 (G4), 5F9-H1K2-IgG4 (G5), 16-1C4 (G6), 30-5F9 (G7) и урелумаб (G8).
Таблица 26.
Массу мышей контролировали в течение всего периода обработки. Средняя масса мышей в разных группах увеличивалась в конце периода обработки (ФИГ. 34 и ФИГ. 35). Явной разницы в массе между разными группами не наблюдалось. Результаты показали, что эти антитела против h4-1BB хорошо переносились и не были явно токсичными для мышей. Размер опухоли для каждой группы показан на ФИГ. 36.
TGI% на 25 день (25 дней после группирования) также рассчитывали, как показано в таблице ниже.
Таблица 27
0
11
18
25
±5
±88
±236
±340
±6
±20
±86
±166
±6
±22
±57
±115
±6
±91
±268
±609
±6
±46
±65
±83
±6
±28
±38
±70
±5
±28
±79
±140
±7
±89
±171
±294
Результаты показали, что эти гуманизированные антитела против h4-1BB обладают различными эффектами ингибирования опухоли.
Пример 10 Тестирование in vivo антител IgG1, IgG2 и IgG4
Опухолевые клетки рака MC-38 (клетки аденокарциномы толстой кишки) вводили подкожно мышам B-h4-1BB. Когда объем опухолей у мышей достигал 150 ± 50 мм3, мышей случайным образом распределяли по разным группам в зависимости от объема опухоли.
В группе G1 мышам B-h4-1BB вводили физиологический раствор (PS) в качестве контроля. Мышам вводили химерные антитела против h4-1BB, 16-1C4-mHvKv-IgG1 (G2), 16-1C4-mHvKv-IgG2 (G3), 16-1C4-mHvKv-IgG4 (G4), мышиные антитела против h4-1BB, 16-1C4 (G5) и урелумаб (G6).
Таблица 28.
Массу мышей контролировали в течение всего периода обработки. Средняя масса мышей в разных группах увеличивалась в конце периода обработки (ФИГ. 37 и ФИГ. 38). Явной разницы в массе между разными группами не наблюдалось. Результаты показали, что эти антитела против h4-1BB хорошо переносились и не были явно токсичными для мышей. Размер опухоли для каждой группы показан на ФИГ. 39.
TGI% на 25 день (25 дней после группирования) также рассчитывали, как показано в таблице ниже.
Таблица 29.
0
11
18
25
±7
±74
±121
±176
±7
±34
±14
±0
±6
±75
±148
±250
±6
±42
±73
±150
±7
±52
±92
±109
±7
±89
±102
±63
Результаты показали, что все эти антитела против h4-1BB ингибировали рост опухоли. В частности, подкласс IgG1 имел более высокий процент TGI, чем подклассы IgG2 и IgG4.
Пример 11. Тестирование химерных антител IgG2 против h4-1BB in vivo
Опухолевые клетки рака MC-38 (клетки аденокарциномы толстой кишки) вводили подкожно мышам B-h4-1BB. Когда объем опухолей у мышей достигал 150 ± 50 мм3, мышей случайным образом распределяли по разным группам в зависимости от объема опухоли.
В группе G1 мышам B-h4-1BB вводили физиологический раствор (PS) в качестве контроля. В группах обработки мышам вводили химерные антитела против h4-1BB 54-8B11-mHvKv-IgG2 (G2), 55-8F6-mHvKv-IgG2 (G3), 56-2A6-mHvKv-IgG2 (G4), 69-3C2-mHvKv-IgG2 (G5), 61-6A7-mHvKv-IgG2 (G6), 70-6F10-mHvKv-IgG2 (G7), 70-3F9-mHvKv-IgG2 (G8), 45-4B9-mHvkv-IgG2 (G9) и также урелумаб (G10) посредством внутрибрюшинной (i. p.) инъекции.
Таблица 30.
Массу мышей контролировали в течение всего периода обработки. Средняя масса мышей в разных группах увеличивалась в конце периода обработки (ФИГ. 40 и ФИГ. 41). Явной разницы в массе между разными группами не наблюдалось. Результаты показали, что эти антитела против h4-1BB хорошо переносились и не были явно токсичными для мышей. Размер опухоли для каждой группы показан на ФИГ. 42.
TGI% на 27 день (27 дней после группирования) также рассчитывали, как показано в таблице ниже.
Таблица 31.
0
10
20
27
±4
±46
±219
±477
±9
±40
±111
±221
±5
±8
±15
±18
±9
±36
±123
±305
±6
±49
±64
±128
±9
±10
±38
±63
±11
±39
±65
±117
±3
±45
±265
±440
±7
±48
±78
±180
±6
±19
±12
±11
Результаты показали, что эти химерные антитела против h4-1BB обладают различными эффектами ингибирования опухоли.
Пример 12. Тестирование in vivo гуманизированных и химерных антител IgG2 против 4-1BB
Опухолевые клетки рака MC-38 вводили подкожно мышам B-h4-1BB. Когда опухоли у мышей достигали объема 150 ± 50 мм3, мышей случайным образом распределяли в разные группы в зависимости от объема опухоли, и им вводили разные антитела, как показано в таблице ниже.
Таблица 32.
Массу мышей контролировали в течение всего периода обработки. Средняя масса мышей в разных группах увеличивалась в конце периода обработки (ФИГ. 43 и ФИГ. 44). Явной разницы в массе между разными группами не наблюдалось. Результаты показали, что эти антитела против h4-1BB хорошо переносились и не были явно токсичными для мышей. Размер опухоли для каждой группы показан на ФИГ. 45.
TGI% на 21 день (21 дней после группирования) также рассчитывали, как показано в таблице ниже.
Таблица 33.
0
6
13
17
±6
±27
±111
±198
±8
±27
±31
±89
±7
±28
±81
±222
±7
±28
±31
±75
±8
±27
±50
±92
±7
±26
±43
±89
±6
±16
±37
±49
±7
±25
±72
±116
±7
±55
±100
±232
±7
±26
±43
±101
±8
±29
±41
±26
Результаты показали, что эти гуманизированные и химерные антитела обладают различными эффектами ингибирования опухоли.
Пример 13. Человеческие антитела IgG1 против 4-1BB обладают большей эффективностью, чем другие подклассы IgG.
Основываясь на результатах 16-1C4-mHvKv-IgG1, как описано выше, было выдвинуто предположение, что для тех же самых VH и VL подкласс IgG1 обладает лучшими эффектами ингибирования опухоли, чем другие подклассы IgG. Различные подклассы антител IgG к h4-1BB тестировали на гуманизированных мышах 4-1BB (B-h4-1BB), чтобы определить их влияние на рост опухоли in vivo. Кроме того, также тестировали антитела IgG1 с мутацией N297A (нумерация EU), антитела IgG1 с мутациями FC-SI (нумерация EU: F243L/R292P/Y300L/V305I/P396L) и антитела IgG1 с мутациями FC-V11 (G237D/P238D/H268D/P271G/A330R). Мутация N297A может снизить эффекты ADCC. Мутации FC-SI могут увеличивать аффинность связывания почти со всеми рецепторами Fc, особенно с FcγRIIIA/IIA, и могут усиливать эффекты ADCC. Мутация FC-V11 может увеличивать аффинность связывания с FcγRIIB, но не увеличивает аффинность связывания с FcγRIIA и, таким образом, снижает аффинность связывания с FcγRIIIA.
Опухолевые клетки рака MC-38 (клетки аденокарциномы толстой кишки) вводили подкожно мышам B-h4-1BB. Когда опухоли у мышей достигали объема 150±50 мм3, мышей случайным образом распределяли в разные группы в зависимости от объема опухоли, и им вводили разные антитела, как показано в таблице ниже. Урелумаб представляет собой полностью человеческое моноклональное антитело IgG4. Антитело урелумаб-IgG1 имеет VH и VL из урелумаба, а константные домены относятся к подклассу IgG1. Точно так же урелумаб-IgG2 антитело имеет VH- и VL-форму урелумаба, а константные домены относятся к подклассу IgG2. Антитело урелумаб-IgG4 имеет константные домены из человеческого IgG4.
Таблица 34.
Массу мышей контролировали в течение всего периода обработки. Средняя масса мышей в разных группах увеличивалась в конце периода обработки (ФИГ. 46 и ФИГ. 47). Явной разницы в массе между разными группами не наблюдалось. Результаты показали, что эти антитела против h4-1BB хорошо переносились и не были явно токсичными для мышей. Размер опухоли для каждой группы показан на ФИГ. 48.
TGI% на 25 день (25 дней после группирования) также рассчитывали, как показано в таблице ниже.
Таблица 35
0
11
18
25
±5
±97
±338
±477
±6
±40
±38
±50
±6
±48
±110
±195
±7
±58
±64
±111
±5
±44
±91
±181
±6
±65
±111
±138
±5
±31
±67
±188
Результаты подтвердили, что подклассы антител IgG1 против h4-1BB обладают более сильным эффектом ингибирования опухоли по сравнению с подклассами IgG2 и IgG4.
Пример 14. Химерные антитела IgG1 против 4-1BB обладают большей эффективностью, чем другие подклассы IgG.
Эксперименты повторяли для тестирования различных подклассов антител IgG против h4-1BB. Опухолевые клетки рака MC-38 (клетки аденокарциномы толстой кишки) вводили подкожно мышам B-h4-1BB. Когда опухоли у мышей достигали объема 150 ± 50 мм3, мышей случайным образом распределяли в разные группы в зависимости от объема опухоли, и вводили им разные антитела один раз в неделю (QW), как показано в таблице ниже.
Таблица 36
Массу мышей контролировали в течение всего периода обработки. Средняя масса мышей в разных группах увеличивалась в конце периода обработки (ФИГ. 49 и ФИГ. 50). Явной разницы в массе между разными группами не наблюдалось. Результаты показали, что эти антитела против h4-1BB хорошо переносились и не были явно токсичными для мышей. Размер опухоли для каждой группы показан на ФИГ. 51.
TGI% на 25 день (25 дней после группирования) также рассчитывали, как показано в таблице ниже.
Таблица 37
0
11
18
25
±7
±151
±293
±435
±6
±21
±62
±204
±7
±77
±170
±414
±5
±61
±165
±452
±6
±74
±176
±352
±6
±44
±52
±41
±7
±36
±133
±247
±5
±59
±132
±271
Результаты снова подтвердили, что подклассы IgG1 обладают более сильным эффектом ингибирования опухоли по сравнению с подклассами IgG2 и IgG4.
Пример 15. Химерные и человеческие антитела IgG1 против 4-1BB обладают большей эффективностью, чем другие подклассы IgG.
Эксперименты повторяли для тестирования различных подклассов химерных и человеческих антител IgG против h4-1BB. mIgG2A и человеческий IgG1 обладают лучшими эффектами ADCC, а mIgG1 и человеческий IgG4 имеют более слабые эффекты ADCC или не проявляют их вообще.
Опухолевые клетки рака MC-38 (клетки аденокарциномы толстой кишки) вводили подкожно мышам B-h4-1BB. Когда опухоли у мышей достигали объема 150 ± 50 мм3, мышей случайным образом распределяли в разные группы в зависимости от объема опухоли, и вводили им разные антитела один раз в неделю (QW), как показано в таблице ниже.
Таблица 38
Массу мышей контролировали в течение всего периода обработки. Средняя масса мышей в разных группах увеличивалась в конце периода обработки (ФИГ. 59 и ФИГ. 60). Явной разницы в массе между разными группами не наблюдалось. Результаты показали, что эти антитела против h4-1BB хорошо переносились и не были явно токсичными для мышей. Размер опухоли для каждой группы показан на ФИГ. 61.
TGI% на 24 день (24 дней после группирования) также рассчитывали, как показано в таблице ниже.
Таблица 39
0
10
17
24
±4
±30
±104
±149
±4
±34
±87
±171
±4
±21
±29
±21
±4
±41
±91
±183
±4
±70
±53
±171
±5
±40
±122
±312
±6
±34
±51
±88
±11
±28
±38
±87
15
±28
±76
±215
Результаты снова подтвердили, что подклассы mIgG2A или человеческого IgG1 обладают более сильным эффектом ингибирования опухоли по сравнению с подклассами mIgG1 или человеческого IgG4. Таким образом, результаты показывают, что антитела против 4-1BB ингибируют рост опухоли, прежде всего, через ADCC.
Пример 16. Антитела IgG1 против 4-1BB обладали более сильным эффектом ингибирования опухоли по сравнению с антителами IgG4 против 4-1BB .
Опухолевые клетки рака MC-38 (клетки аденокарциномы толстой кишки) вводили подкожно мышам B-h4-1BB. Когда опухоли у мышей достигали объема 100~150 мм3, мышей случайным образом распределяли в разные группы в зависимости от объема опухоли, и им вводили разные антитела, как показано в таблице ниже. Как обсуждалось выше, Урелумаб является полностью человеческим моноклональным антителом IgG4. Антитело урелумаб-IgG1 имеет VH и VL из урелумаба, а константные домены относятся к подклассу IgG1.
Таблица 40
Массу мышей контролировали в течение всего периода обработки. Средняя масса мышей в разных группах увеличивалась в конце периода обработки (ФИГ. 62 и ФИГ. 63). Никаких явных различий в массе между разными группами не наблюдалось. Результаты показали, что эти антитела против h4-1BB хорошо переносились и не были явно токсичными для мышей. Размер опухоли для каждой группы показан на ФИГ. 64.
TGI% на 24 день (24 дней после группирования) также рассчитывали, как показано в таблице ниже.
Таблица 41
0
10
17
24
±3
±36
±115
±217
±4
±55
±160
±390
±4
±47
±88
±205
±4
±21
±21
±23
±4
±59
±120
±254
±3
±62
±54
±64
±4
±42
±97
±273
±4
±30
±29
±48
±3
±30
±107
±235
±3
±21
±12
±9
±3
±22
±27
±33
±3
±71
±137
±217
Результаты подтвердили, что антитела урелумаб-IgG1 обладают более сильным эффектом ингибирования опухоли по сравнению с урелумабом (IgG4); Антитела 16-1C4-mHvKv-IgG1 обладали более сильным эффектом ингибирования опухоли по сравнению с антителами 16-1C4-mHvKv-IgG4; Антитела 1C4-H1K1-IgG1 обладали более сильным эффектом ингибирования опухоли по сравнению с антителами 1C4-H1K1-IgG4; Антитела 1C4-H1K2-IgG1 обладали более сильным эффектом ингибирования опухоли по сравнению с антителами 1C4-H1K2-IgG4. Таким образом, результат показал, что для одних и тех же антигенсвязывающих доменов антитела IgG1 обладают более сильным эффектом ингибирования опухоли по сравнению с антителами IgG4.
Пример 17. Комбинированная терапия антителами против h4-1BB
Опухолевые клетки рака MC-38 (клетки аденокарциномы толстой кишки), экспрессирующие человеческий PD-L1, вводили подкожно мышам B-h4-1BB. Когда опухоли у мышей достигали объема примерно 400 мм3, мышей случайным образом распределяли в разные группы в зависимости от объема опухоли, и им вводили разные антитела, как показано в таблице ниже. Keytruda (пембролизумаб) представляет собой гуманизированное антитело IgG4 против PD-1.
Таблица 42
Keytruda-IgG4
Keytruda-IgG4
Keytruda-IgG4
Keytruda-IgG4
Массу мышей контролировали в течение всего периода обработки. Средняя масса мышей в разных группах увеличивалась в конце периода обработки (ФИГ. 65 и ФИГ. 66). Никаких явных различий в массе между разными группами не наблюдалось. Результаты показали, что эти антитела против h4-1BB хорошо переносились и не были явно токсичными для мышей. Размер опухоли для каждой группы показан на ФИГ. 67.
TGI% на 25 день (25 дней после группирования) также рассчитывали, как показано в таблице ниже.
Таблица 43
0
11
18
25
±20
±275
±508
±769
±23
±104
±187
±471
±22
±202
±452
±578
±24
±239
±441
±366
±29
±228
±257
±554
±29
±188
±515
±538
±24
±51
±65
±125
±22
±76
±155
±341
±27
±65
±53
±95
±24
±151
±379
±705
Результаты подтвердили, что антитела 1C4-H1K1-IgG1 обладают более сильным эффектом ингибирования опухоли по сравнению с антителами 1C4 -H1K1-IgG4; и антитела урелумаб-IgG1 обладали более сильным эффектом ингибирования опухоли по сравнению с антителами урелумаб-IgG4. Кроме того, результаты показали, что комбинация антител против 4-1BB с антителами против PD-1 имела более сильные эффекты ингибирования опухоли по сравнению с обработкой с использованием одного антитела против 4-1 или с использованием антитела против PD-1 индивидуально. Кроме того, комбинация антитела IgG1 против 4-1BB с антителом против PD-1 имела более сильные эффекты ингибирования опухоли по сравнению с комбинацией антитела IgG4 против 4-1BB с антителом против PD-1.
Пример 18. Тестирование in vivo на опухолевых клетках меланомы
Клетки B16-F10 (линия клеток меланомы), экспрессирующие PD-L1 человека, вводили подкожно мышам B-h4-1BB. Когда опухоли у мышей достигали объема 100~150 мм3, мышей случайным образом распределяли в разные группы в зависимости от объема опухоли, и им вводили разные антитела, как показано в таблице ниже.
Таблица 44
Keytruda-IgG4
Массу мышей контролировали в течение всего периода обработки. Средняя масса мышей в разных группах увеличивалась в конце периода обработки (ФИГ. 68 и ФИГ. 69). Никаких явных различий в массе между разными группами не наблюдалось. Результаты показали, что эти антитела против h4-1BB хорошо переносились и не были явно токсичными для мышей. Размер опухоли для каждой группы показан на ФИГ. 70.
TGI% на 18 день (18 дней после группирования) также рассчитывали, как показано в таблице ниже.
Таблица 45
0
4
11
18
±5
±85
±280
±643
±6
±60
±323
±578
±5
±73
±545
±622
±5
±55
±243
±401
Результаты показали, что антитела IgG1 против h4-1BB обладают превосходным эффектом ингибирования опухоли в отношении опухолевых клеток меланомы, а комбинация с антителами IgG1 против h4-1BB с антителами против PD-1 может дополнительно улучшить эффекты ингибирования опухоли. В то время как TGI% в G3 составлял 81,0%, TGI% рассчитывали на основе только 4 выживших мышей, а коэффициент выживаемости в G3 составлял только 4/8. Напротив, выживаемость в G4 составляла 7/8. Результаты показали, что комбинированная обработка значительно улучшало выживаемость.
Пример 19. Тестирование in vivo на опухолевых клетках лимфомы
Клетки EL4 (опухолевые клетки лимфомы) вводили подкожно мышам B-h4-1BB. Когда опухоли у мышей достигали объема 100~150 мм3, мышей случайным образом распределяли в разные группы в зависимости от объема опухоли, и им вводили разные антитела, как показано в таблице ниже.
Таблица 46
Keytruda-IgG4
Массу мышей контролировали в течение всего периода обработки. Средняя масса мышей в разных группах увеличивалась в конце периода обработки (ФИГ. 71 и ФИГ. 72). Явной разницы в массе между разными группами не наблюдалось. Результаты показали, что эти антитела против h4-1BB хорошо переносились и не были явно токсичными для мышей. Размер опухоли для каждой группы показан на ФИГ. 73.
TGI% на 17 день (17 дней после группирования) также рассчитывали, как показано в таблице ниже.
Таблица 47
0
3
10
17
±1
±23
±158
±157
±2
±54
±115
±507
±2
±42
±127
±256
±1
±52
±85
±264
Результаты показали, что антитела IgG1 к h4-1BB обладают превосходным эффектом ингибирования опухоли против опухолевых клеток лимфомы, а комбинация с антителами IgG1 против h4-1BB с антителами против PD-1 может дополнительно улучшить эффекты ингибирования опухолей.
Пример 20. Дополнительный анализ эффектов гуманизированных антител против 4-1BB
Опухолевые клетки рака MC-38 (клетки аденокарциномы толстой кишки) вводили подкожно мышам B-h4-1BB. Когда опухоли у мышей достигали объема прмерно 200 ± 50 мм3, мышей случайным образом распределяли в разные группы в зависимости от объема опухоли, и им вводили разные антитела, как показано в таблице ниже.
Таблица 48
Через два дня после введения мышей умерщвляли. Образцы опухоли и образцы селезенки были собраны для дальнейшего анализа. Массу мышей также регистрировали, как показано в таблице ниже. Никаких явных различий в массе между разными группами не наблюдалось.
Таблица 49
0
2
±0,5
±0,5
±0,5
±0,5
±0,3
±0,3
±0,5
±0,6
±0,5
±0,5
Собранные образцы опухоли и селезенки измельчали и обрабатывали гидролизующими ферментами. Смесь инкубировали при 37°C в течение 60 минут, фильтровали, промывали и ресуспендировали в виде суспензии отдельных клеток.
Клетки инкубировали с флуоресцентно меченными антителами и анализировали проточной цитометрией. Образцы селезенки обрабатывали в соответствии с процедурами, показанными на ФИГ. 74 и ФИГ. 75. Образцы опухолей обрабатывали в соответствии с процедурами, показанными на ФИГ. 76 и ФИГ. 77.
Результаты показаны на ФИГ. 78-83. Как показано на ФИГ. 79D, антитела IgG1 против 4-1BB могут эффективно снижать процент Treg-клеток в опухолях, тем самым увеличивая иммунный ответ. Результат также согласуется с результатом на ФИГ. 82A, где более низкое отношение CD8 к Treg связано с неблагоприятным исходом. Кроме того, результаты на ФИГ. 82A также объясняют, что антитело 1C4 против 4-1BB обладает более сильным эффектом ингибирования опухоли по сравнению с урелумабом.
Пример 21. Дополнительные тесты на антителах IgG1 против h4-1BB
Эксперименты повторяли для тестирования различных подклассов антител IgG против h4-1BB.
Опухолевые клетки рака MC-38 (клетки аденокарциномы толстой кишки) вводили подкожно мышам B-h4-1BB. Когда опухоли у мышей достигали объема 150 ± 50 мм3, мышей случайным образом помещали в разные группы в зависимости от объема опухоли (например, n=5), и им вводили версии IgG1, IgG2 и IgG4 антител, выбранные из Таблицы 1, Таблицы 2 и/или Таблицы 4 посредством i.p. введения дважды в неделю в дозах 1мг/кг или 3 мг/кг. Всего выполняли 6 введений. Физиологический раствор (PS) вводили одной группе мышей в качестве контроля.
В течение всего периода обработки контролировали массу мышей и размер опухоли. TGI% рассчитывали в конце периода обработки.
Ожидается, что подклассы IgG1 антител против h4-1BB имеют более высокий TGI%, таким образом, лучшие эффекты ингибирования опухоли по сравнению с подклассами IgG2 и IgG4.
Другие варианты осуществления
Следует понимать, что хотя изобретение приведено вместе с подробным описанием, представленное выше описание предназначено для иллюстрации и не ограничивает объем изобретения, который определен объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации находятся в пределах представленной ниже формулы изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ЮКЬЮР (БЭЙЦЗИН) БАЙОФАРМА КО., ЛТД
<120> АНТИТЕЛА ПРОТИВ TNFRSF9 И ИХ ПРМЕНЕНИЕ
<130> 1
<160> 518
<170> PatentIn version 3.5
<210> 1
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 1
Ser Ser Tyr Ile Asn
1 5
<210> 2
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 2
Trp Ile Phe Ala Gly Thr Gly Gly Thr Tyr Tyr Asn Gln Lys Phe Thr
1 5 10 15
Gly
<210> 3
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 3
His Ser Pro Arg Ala Thr Leu Phe Asp Phe
1 5 10
<210> 4
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 4
Arg Ala Ser Ser Ser Val Asn His Met His
1 5 10
<210> 5
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 5
Ala Thr Ser Asn Leu Ala Ser
1 5
<210> 6
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 6
Gln Gln Trp Ser Ser Asn Pro Tyr Thr
1 5
<210> 7
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 7
Ser Tyr Trp Ile Asn
1 5
<210> 8
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 8
Asn Ile Tyr Pro Ser Asp Ser Tyr Thr Asn Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 9
<211> 12
<212> Белок
<213> Искусственная последовательность
<400> 9
Thr Trp Glu Phe Tyr Tyr Asp Ser Val Phe Asp Tyr
1 5 10
<210> 10
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 10
Lys Ala Ser Gln Asp Ile Asn Ser Tyr Leu Ser
1 5 10
<210> 11
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 11
Arg Ala Asn Arg Leu Val Asp
1 5
<210> 12
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 12
Leu Gln Tyr Asp Glu Leu Pro Pro Thr
1 5
<210> 13
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 13
Thr Tyr Asp Ile Ser
1 5
<210> 14
<211> 16
<212> Белок
<213> Искусственная последовательность
<400> 14
Val Ile Trp Thr Gly Gly Gly Thr Asn Tyr Asn Ser Ser Phe Met Ser
1 5 10 15
<210> 15
<211> 3
<212> Белок
<213> Искусственная последовательность
<400> 15
Val Asp Tyr
1
<210> 16
<211> 16
<212> Белок
<213> Искусственная последовательность
<400> 16
Arg Ser Ser Gln Ser Leu Val His Ser Asn Gly Asn Thr Tyr Leu His
1 5 10 15
<210> 17
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 17
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 18
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 18
Ser Gln Asn Thr His Val Pro Trp Thr
1 5
<210> 19
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 19
Thr Ser Trp Met Asn
1 5
<210> 20
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 20
Arg Ile Tyr Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Arg Phe Lys
1 5 10 15
Gly
<210> 21
<211> 12
<212> Белок
<213> Искусственная последовательность
<400> 21
Leu Asp Gly Tyr Tyr Glu Val Phe Tyr Phe Asp Tyr
1 5 10
<210> 22
<211> 16
<212> Белок
<213> Искусственная последовательность
<400> 22
Lys Ser Ser Gln Ser Leu Leu Tyr Ser Asn Gly Lys Thr Tyr Leu Asn
1 5 10 15
<210> 23
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 23
Leu Val Ser Lys Leu Asp Ser
1 5
<210> 24
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 24
Phe Gln Gly Thr His Phe Pro Trp Thr
1 5
<210> 25
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 25
Thr Tyr Val Met Tyr
1 5
<210> 26
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 26
Tyr Ile Asn Pro Tyr Asn Asp Asp Ile Arg Tyr Asn Glu Lys Phe Lys
1 5 10 15
Gly
<210> 27
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 27
Gln Gly Gly Asp Tyr
1 5
<210> 28
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 28
Arg Ala Ser Lys Asn Ile Asn Lys Tyr Leu Ala
1 5 10
<210> 29
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 29
Ser Gly Ser Thr Leu Gln Ser
1 5
<210> 30
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 30
Gln Gln Tyr Asn Glu Tyr Pro Leu Thr
1 5
<210> 31
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 31
Thr Tyr Gly Val His
1 5
<210> 32
<211> 16
<212> Белок
<213> Искусственная последовательность
<400> 32
Val Ile Trp Ser Asp Gly Asn Thr Asp Tyr Asn Asp Ala Phe Ile Ser
1 5 10 15
<210> 33
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 33
Asn Ser Ile Thr Ser Val Ser Phe Asp Cys
1 5 10
<210> 34
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 34
Lys Ala Ser Gln Asn Val Gly Thr Thr Val Ala
1 5 10
<210> 35
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 35
Ser Ala Ser Tyr Arg Tyr Ser
1 5
<210> 36
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 36
Gln Gln Tyr Asn Ser Tyr Pro Leu Thr
1 5
<210> 37
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 37
Asn Tyr Trp Ile His
1 5
<210> 38
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 38
Asn Ile Tyr Pro Ala Ser Asp Tyr Thr Asn Tyr Asp Glu Lys Phe Lys
1 5 10 15
Asn
<210> 39
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 39
Gly Tyr Phe Gly Ser Leu Asp Tyr
1 5
<210> 40
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 40
Arg Ala Ser Gln Pro Ile Gly Thr Gly Ile His
1 5 10
<210> 41
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 41
Ser Ala Ser Glu Ser Ile Ser
1 5
<210> 42
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 42
Gln Gln Ser Tyr Ser Trp Pro Thr Thr
1 5
<210> 43
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 43
Ser Asn Trp Met His
1 5
<210> 44
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 44
Val Ile Tyr Pro Gly Asn Ser Asp Thr Ser Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 45
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 45
Gly Ile Thr Thr Ala Pro Glu Tyr
1 5
<210> 46
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 46
Lys Ala Ser Glu Asn Val Gly Ile Tyr Val Ser
1 5 10
<210> 47
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 47
Gly Ala Ser Asn Arg Tyr Thr
1 5
<210> 48
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 48
Gly His Thr Tyr Asn Tyr Pro Phe Thr
1 5
<210> 49
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 49
Arg Tyr Trp Met Ser
1 5
<210> 50
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 50
Glu Ile His Pro Asp Ser Ser Ala Ile Asn Tyr Thr Pro Ser Leu Lys
1 5 10 15
Asp
<210> 51
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 51
Ser Tyr Tyr Gly Arg Val Phe Asp Tyr
1 5
<210> 52
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 52
Arg Ala Ser Gln Ser Ile Ser Asp Tyr Leu His
1 5 10
<210> 53
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 53
Tyr Ala Ser Gln Ser Ile Ser
1 5
<210> 54
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 54
Gln Asp Gly His Ser Phe Pro Pro Thr
1 5
<210> 55
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 55
Ser Tyr Trp Met His
1 5
<210> 56
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 56
Val Ile Tyr Pro Gly Asn Ser Asp Thr Ser Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 57
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 57
Gly Ile Thr Thr Ala Pro Asp Tyr
1 5
<210> 58
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 58
Lys Ala Ser Glu Asn Val Gly Ile His Val Ser
1 5 10
<210> 59
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 59
Gly Ala Ser Ser Gly Tyr Asn
1 5
<210> 60
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 60
Gly Gln Thr Tyr Ser Tyr Pro Phe Thr
1 5
<210> 61
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 61
Asn Tyr Gly Met Asn
1 5
<210> 62
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 62
Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Asp Asp Phe Lys
1 5 10 15
Gly
<210> 63
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 63
Arg Glu Tyr Tyr Pro Trp Val Phe Val Tyr
1 5 10
<210> 64
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 64
Ser Ala Ser Ser Ser Val Ser Tyr Met His
1 5 10
<210> 65
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 65
Asp Thr Ser Lys Leu Ala Ser
1 5
<210> 66
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 66
Phe Gln Gly Ser Gly Tyr Pro Leu Thr
1 5
<210> 67
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 67
Ser Tyr Trp Ile Asn
1 5
<210> 68
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 68
Asn Ile Tyr Pro Ser Asp Ser Tyr Thr Asn Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 69
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 69
Phe His Tyr Gly Ser Ser Pro Phe Asp Asn
1 5 10
<210> 70
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 70
Arg Ala Ser Gln Asp Ile Ser His Tyr Leu Asn
1 5 10
<210> 71
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 71
Tyr Thr Ser Arg Leu His Ser
1 5
<210> 72
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 72
Gln Gln Gly His Thr Leu Pro Arg Thr
1 5
<210> 73
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 73
Asn Tyr Gly Met Asn
1 5
<210> 74
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 74
Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Asp Asp Phe Lys
1 5 10 15
Gly
<210> 75
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 75
Arg Asp Tyr Leu Gly Ala Met Asp Tyr
1 5
<210> 76
<211> 12
<212> Белок
<213> Искусственная последовательность
<400> 76
Arg Ala Ser Ser Ser Val Ser Ser Ser Tyr Leu His
1 5 10
<210> 77
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 77
Ser Thr Ser Asn Leu Ala Ser
1 5
<210> 78
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 78
Gln Gln Tyr Ser Ala Tyr Leu Tyr Thr
1 5
<210> 79
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 79
Thr Tyr Trp Ile Asn
1 5
<210> 80
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 80
Asn Ile Tyr Pro Ser Asp Ser Tyr Thr Asn Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 81
<211> 13
<212> Белок
<213> Искусственная последовательность
<400> 81
Glu Ala Gly Asp Gly Thr His Tyr Tyr Ala Ile Asp Tyr
1 5 10
<210> 82
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 82
Lys Ala Ser Glu Asn Val Gly Thr Tyr Val Ser
1 5 10
<210> 83
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 83
Gly Ala Ser Asn Arg Tyr Pro
1 5
<210> 84
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 84
Gly Gln Gly Tyr Ser Tyr Leu Arg Thr
1 5
<210> 85
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 85
Asp Tyr Tyr Met His
1 5
<210> 86
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 86
Trp Ile Asp Pro Glu Asn Gly Asn Thr Ile Tyr Asp Pro Lys Phe Gln
1 5 10 15
Asp
<210> 87
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 87
Gly Leu Pro Trp Tyr Phe Asp Tyr
1 5
<210> 88
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 88
Ser Ala Ser Ser Ser Val Ser Asp Met Asn
1 5 10
<210> 89
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 89
Leu Thr Ser Asn Leu Ser Ser
1 5
<210> 90
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 90
Gln Gln Trp Ser Gly Asn Pro Leu Thr
1 5
<210> 91
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 91
Ser Phe Gly Met His
1 5
<210> 92
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 92
Tyr Ile Ser Ser Gly Ser Ser Ala Ile Tyr Tyr Ala Asp Thr Val Lys
1 5 10 15
Gly
<210> 93
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 93
Asp Trp Val Asp Tyr
1 5
<210> 94
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 94
Arg Ala Ser Glu Asn Ile Tyr Ser Asn Leu Val
1 5 10
<210> 95
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 95
Thr Ala Thr Lys Leu Thr Asn
1 5
<210> 96
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 96
Gln His Phe Trp Asp Thr Pro Tyr Thr
1 5
<210> 97
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 97
Ser Tyr Trp Ile Asn
1 5
<210> 98
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 98
Asn Ile Phe Pro Ser Asp Ser Tyr Thr Asn Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 99
<211> 14
<212> Белок
<213> Искусственная последовательность
<400> 99
Phe Gly Ser Ser Gly Tyr Pro Asp Tyr Tyr Thr Met Glu Tyr
1 5 10
<210> 100
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 100
Arg Ala Ser Gly Asn Ile Asp Asn Tyr Leu Ala
1 5 10
<210> 101
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 101
Asn Ala Lys Thr Leu Ala Glu
1 5
<210> 102
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 102
Gln Gln Tyr Trp Thr Ile Pro Tyr Thr
1 5
<210> 103
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 103
Asn Ser Trp Met Asn
1 5
<210> 104
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 104
Arg Ile Tyr Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe Lys
1 5 10 15
Gly
<210> 105
<211> 12
<212> Белок
<213> Искусственная последовательность
<400> 105
Leu Asp Gly Asn Tyr Tyr Tyr Trp Tyr Phe Asp Val
1 5 10
<210> 106
<211> 16
<212> Белок
<213> Искусственная последовательность
<400> 106
Lys Ser Ser Gln Ser Leu Leu Asp Ser Asp Gly Lys Thr Tyr Leu Asn
1 5 10 15
<210> 107
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 107
Leu Val Ser Lys Leu Asp Ser
1 5
<210> 108
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 108
Trp Gln Gly Thr His Phe Pro Gln Thr
1 5
<210> 109
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 109
Gly Phe Thr Phe Ser Ser Ser Tyr Ile Asn
1 5 10
<210> 110
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 110
Phe Ala Gly Thr Gly Gly
1 5
<210> 111
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 111
His Ser Pro Arg Ala Thr Leu Phe Asp Phe
1 5 10
<210> 112
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 112
Arg Ala Ser Ser Ser Val Asn His Met His
1 5 10
<210> 113
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 113
Ala Thr Ser Asn Leu Ala Ser
1 5
<210> 114
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 114
Gln Gln Trp Ser Ser Asn Pro Tyr Thr
1 5
<210> 115
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 115
Gly Tyr Thr Phe Ser Ser Tyr Trp Ile Asn
1 5 10
<210> 116
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 116
Tyr Pro Ser Asp Ser Tyr
1 5
<210> 117
<211> 12
<212> Белок
<213> Искусственная последовательность
<400> 117
Thr Trp Glu Phe Tyr Tyr Asp Ser Val Phe Asp Tyr
1 5 10
<210> 118
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 118
Lys Ala Ser Gln Asp Ile Asn Ser Tyr Leu Ser
1 5 10
<210> 119
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 119
Arg Ala Asn Arg Leu Val Asp
1 5
<210> 120
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 120
Leu Gln Tyr Asp Glu Leu Pro Pro Thr
1 5
<210> 121
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 121
Gly Phe Ser Leu Thr Thr Tyr Asp Ile Ser
1 5 10
<210> 122
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 122
Trp Thr Gly Gly Gly
1 5
<210> 123
<211> 3
<212> Белок
<213> Искусственная последовательность
<400> 123
Val Asp Tyr
1
<210> 124
<211> 16
<212> Белок
<213> Искусственная последовательность
<400> 124
Arg Ser Ser Gln Ser Leu Val His Ser Asn Gly Asn Thr Tyr Leu His
1 5 10 15
<210> 125
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 125
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 126
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 126
Ser Gln Asn Thr His Val Pro Trp Thr
1 5
<210> 127
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 127
Gly Tyr Ala Phe Ser Thr Ser Trp Met Asn
1 5 10
<210> 128
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 128
Tyr Pro Gly Asp Gly Asp
1 5
<210> 129
<211> 12
<212> Белок
<213> Искусственная последовательность
<400> 129
Leu Asp Gly Tyr Tyr Glu Val Phe Tyr Phe Asp Tyr
1 5 10
<210> 130
<211> 16
<212> Белок
<213> Искусственная последовательность
<400> 130
Lys Ser Ser Gln Ser Leu Leu Tyr Ser Asn Gly Lys Thr Tyr Leu Asn
1 5 10 15
<210> 131
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 131
Leu Val Ser Lys Leu Asp Ser
1 5
<210> 132
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 132
Phe Gln Gly Thr His Phe Pro Trp Thr
1 5
<210> 133
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 133
Gly Tyr Thr Phe Thr Thr Tyr Val Met Tyr
1 5 10
<210> 134
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 134
Asn Pro Tyr Asn Asp Asp
1 5
<210> 135
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 135
Gln Gly Gly Asp Tyr
1 5
<210> 136
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 136
Arg Ala Ser Lys Asn Ile Asn Lys Tyr Leu Ala
1 5 10
<210> 137
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 137
Ser Gly Ser Thr Leu Gln Ser
1 5
<210> 138
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 138
Gln Gln Tyr Asn Glu Tyr Pro Leu Thr
1 5
<210> 139
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 139
Gly Phe Ser Leu Thr Thr Tyr Gly Val His
1 5 10
<210> 140
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 140
Trp Ser Asp Gly Asn
1 5
<210> 141
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 141
Asn Ser Ile Thr Ser Val Ser Phe Asp Cys
1 5 10
<210> 142
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 142
Lys Ala Ser Gln Asn Val Gly Thr Thr Val Ala
1 5 10
<210> 143
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 143
Ser Ala Ser Tyr Arg Tyr Ser
1 5
<210> 144
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 144
Gln Gln Tyr Asn Ser Tyr Pro Leu Thr
1 5
<210> 145
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 145
Gly Tyr Thr Phe Ser Asn Tyr Trp Ile His
1 5 10
<210> 146
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 146
Tyr Pro Ala Ser Asp Tyr
1 5
<210> 147
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 147
Gly Tyr Phe Gly Ser Leu Asp Tyr
1 5
<210> 148
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 148
Arg Ala Ser Gln Pro Ile Gly Thr Gly Ile His
1 5 10
<210> 149
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 149
Ser Ala Ser Glu Ser Ile Ser
1 5
<210> 150
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 150
Gln Gln Ser Tyr Ser Trp Pro Thr Thr
1 5
<210> 151
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 151
Gly Tyr Ser Phe Thr Ser Asn Trp Met His
1 5 10
<210> 152
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 152
Tyr Pro Gly Asn Ser Asp
1 5
<210> 153
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 153
Gly Ile Thr Thr Ala Pro Glu Tyr
1 5
<210> 154
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 154
Lys Ala Ser Glu Asn Val Gly Ile Tyr Val Ser
1 5 10
<210> 155
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 155
Gly Ala Ser Asn Arg Tyr Thr
1 5
<210> 156
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 156
Gly His Thr Tyr Asn Tyr Pro Phe Thr
1 5
<210> 157
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 157
Gly Phe Asp Phe Ser Arg Tyr Trp Met Ser
1 5 10
<210> 158
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 158
His Pro Asp Ser Ser Ala
1 5
<210> 159
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 159
Ser Tyr Tyr Gly Arg Val Phe Asp Tyr
1 5
<210> 160
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 160
Arg Ala Ser Gln Ser Ile Ser Asp Tyr Leu His
1 5 10
<210> 161
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 161
Tyr Ala Ser Gln Ser Ile Ser
1 5
<210> 162
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 162
Gln Asp Gly His Ser Phe Pro Pro Thr
1 5
<210> 163
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 163
Gly Tyr Ser Phe Thr Ser Tyr Trp Met His
1 5 10
<210> 164
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 164
Tyr Pro Gly Asn Ser Asp
1 5
<210> 165
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 165
Gly Ile Thr Thr Ala Pro Asp Tyr
1 5
<210> 166
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 166
Lys Ala Ser Glu Asn Val Gly Ile His Val Ser
1 5 10
<210> 167
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 167
Gly Ala Ser Ser Gly Tyr Asn
1 5
<210> 168
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 168
Gly Gln Thr Tyr Ser Tyr Pro Phe Thr
1 5
<210> 169
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 169
Lys Phe Thr Phe Thr Asn Tyr Gly Met Asn
1 5 10
<210> 170
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 170
Asn Thr Tyr Thr Gly Glu
1 5
<210> 171
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 171
Arg Glu Tyr Tyr Pro Trp Val Phe Val Tyr
1 5 10
<210> 172
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 172
Ser Ala Ser Ser Ser Val Ser Tyr Met His
1 5 10
<210> 173
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 173
Asp Thr Ser Lys Leu Ala Ser
1 5
<210> 174
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 174
Phe Gln Gly Ser Gly Tyr Pro Leu Thr
1 5
<210> 175
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 175
Gly Tyr Ile Phe Thr Ser Tyr Trp Ile Asn
1 5 10
<210> 176
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 176
Tyr Pro Ser Asp Ser Tyr
1 5
<210> 177
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 177
Phe His Tyr Gly Ser Ser Pro Phe Asp Asn
1 5 10
<210> 178
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 178
Arg Ala Ser Gln Asp Ile Ser His Tyr Leu Asn
1 5 10
<210> 179
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 179
Tyr Thr Ser Arg Leu His Ser
1 5
<210> 180
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 180
Gln Gln Gly His Thr Leu Pro Arg Thr
1 5
<210> 181
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 181
Gly Tyr Thr Phe Thr Asn Tyr Gly Met Asn
1 5 10
<210> 182
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 182
Asn Thr Tyr Thr Gly Glu
1 5
<210> 183
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 183
Arg Asp Tyr Leu Gly Ala Met Asp Tyr
1 5
<210> 184
<211> 12
<212> Белок
<213> Искусственная последовательность
<400> 184
Arg Ala Ser Ser Ser Val Ser Ser Ser Tyr Leu His
1 5 10
<210> 185
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 185
Ser Thr Ser Asn Leu Ala Ser
1 5
<210> 186
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 186
Gln Gln Tyr Ser Ala Tyr Leu Tyr Thr
1 5
<210> 187
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 187
Gly Tyr Thr Phe Thr Thr Tyr Trp Ile Asn
1 5 10
<210> 188
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 188
Tyr Pro Ser Asp Ser Tyr
1 5
<210> 189
<211> 13
<212> Белок
<213> Искусственная последовательность
<400> 189
Glu Ala Gly Asp Gly Thr His Tyr Tyr Ala Ile Asp Tyr
1 5 10
<210> 190
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 190
Lys Ala Ser Glu Asn Val Gly Thr Tyr Val Ser
1 5 10
<210> 191
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 191
Gly Ala Ser Asn Arg Tyr Pro
1 5
<210> 192
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 192
Gly Gln Gly Tyr Ser Tyr Leu Arg Thr
1 5
<210> 193
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 193
Gly Phe Asn Ile Lys Asp Tyr Tyr Met His
1 5 10
<210> 194
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 194
Asp Pro Glu Asn Gly Asn
1 5
<210> 195
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 195
Gly Leu Pro Trp Tyr Phe Asp Tyr
1 5
<210> 196
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 196
Ser Ala Ser Ser Ser Val Ser Asp Met Asn
1 5 10
<210> 197
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 197
Leu Thr Ser Asn Leu Ser Ser
1 5
<210> 198
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 198
Gln Gln Trp Ser Gly Asn Pro Leu Thr
1 5
<210> 199
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 199
Gly Phe Ser Phe Ser Ser Phe Gly Met His
1 5 10
<210> 200
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 200
Ser Ser Gly Ser Ser Ala
1 5
<210> 201
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 201
Asp Trp Val Asp Tyr
1 5
<210> 202
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 202
Arg Ala Ser Glu Asn Ile Tyr Ser Asn Leu Val
1 5 10
<210> 203
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 203
Thr Ala Thr Lys Leu Thr Asn
1 5
<210> 204
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 204
Gln His Phe Trp Asp Thr Pro Tyr Thr
1 5
<210> 205
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 205
Gly Tyr Thr Phe Thr Ser Tyr Trp Ile Asn
1 5 10
<210> 206
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 206
Phe Pro Ser Asp Ser Tyr
1 5
<210> 207
<211> 14
<212> Белок
<213> Искусственная последовательность
<400> 207
Phe Gly Ser Ser Gly Tyr Pro Asp Tyr Tyr Thr Met Glu Tyr
1 5 10
<210> 208
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 208
Arg Ala Ser Gly Asn Ile Asp Asn Tyr Leu Ala
1 5 10
<210> 209
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 209
Asn Ala Lys Thr Leu Ala Glu
1 5
<210> 210
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 210
Gln Gln Tyr Trp Thr Ile Pro Tyr Thr
1 5
<210> 211
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 211
Gly Tyr Ala Phe Asn Asn Ser Trp Met Asn
1 5 10
<210> 212
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 212
Tyr Pro Gly Asp Gly Asp
1 5
<210> 213
<211> 12
<212> Белок
<213> Искусственная последовательность
<400> 213
Leu Asp Gly Asn Tyr Tyr Tyr Trp Tyr Phe Asp Val
1 5 10
<210> 214
<211> 16
<212> Белок
<213> Искусственная последовательность
<400> 214
Lys Ser Ser Gln Ser Leu Leu Asp Ser Asp Gly Lys Thr Tyr Leu Asn
1 5 10 15
<210> 215
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 215
Leu Val Ser Lys Leu Asp Ser
1 5
<210> 216
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 216
Trp Gln Gly Thr His Phe Pro Gln Thr
1 5
<210> 217
<211> 255
<212> Белок
<213> human
<400> 217
Met Gly Asn Ser Cys Tyr Asn Ile Val Ala Thr Leu Leu Leu Val Leu
1 5 10 15
Asn Phe Glu Arg Thr Arg Ser Leu Gln Asp Pro Cys Ser Asn Cys Pro
20 25 30
Ala Gly Thr Phe Cys Asp Asn Asn Arg Asn Gln Ile Cys Ser Pro Cys
35 40 45
Pro Pro Asn Ser Phe Ser Ser Ala Gly Gly Gln Arg Thr Cys Asp Ile
50 55 60
Cys Arg Gln Cys Lys Gly Val Phe Arg Thr Arg Lys Glu Cys Ser Ser
65 70 75 80
Thr Ser Asn Ala Glu Cys Asp Cys Thr Pro Gly Phe His Cys Leu Gly
85 90 95
Ala Gly Cys Ser Met Cys Glu Gln Asp Cys Lys Gln Gly Gln Glu Leu
100 105 110
Thr Lys Lys Gly Cys Lys Asp Cys Cys Phe Gly Thr Phe Asn Asp Gln
115 120 125
Lys Arg Gly Ile Cys Arg Pro Trp Thr Asn Cys Ser Leu Asp Gly Lys
130 135 140
Ser Val Leu Val Asn Gly Thr Lys Glu Arg Asp Val Val Cys Gly Pro
145 150 155 160
Ser Pro Ala Asp Leu Ser Pro Gly Ala Ser Ser Val Thr Pro Pro Ala
165 170 175
Pro Ala Arg Glu Pro Gly His Ser Pro Gln Ile Ile Ser Phe Phe Leu
180 185 190
Ala Leu Thr Ser Thr Ala Leu Leu Phe Leu Leu Phe Phe Leu Thr Leu
195 200 205
Arg Phe Ser Val Val Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe
210 215 220
Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly
225 230 235 240
Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
245 250 255
<210> 218
<211> 256
<212> Белок
<213> Mouse
<400> 218
Met Gly Asn Asn Cys Tyr Asn Val Val Val Ile Val Leu Leu Leu Val
1 5 10 15
Gly Cys Glu Lys Val Gly Ala Val Gln Asn Ser Cys Asp Asn Cys Gln
20 25 30
Pro Gly Thr Phe Cys Arg Lys Tyr Asn Pro Val Cys Lys Ser Cys Pro
35 40 45
Pro Ser Thr Phe Ser Ser Ile Gly Gly Gln Pro Asn Cys Asn Ile Cys
50 55 60
Arg Val Cys Ala Gly Tyr Phe Arg Phe Lys Lys Phe Cys Ser Ser Thr
65 70 75 80
His Asn Ala Glu Cys Glu Cys Ile Glu Gly Phe His Cys Leu Gly Pro
85 90 95
Gln Cys Thr Arg Cys Glu Lys Asp Cys Arg Pro Gly Gln Glu Leu Thr
100 105 110
Lys Gln Gly Cys Lys Thr Cys Ser Leu Gly Thr Phe Asn Asp Gln Asn
115 120 125
Gly Thr Gly Val Cys Arg Pro Trp Thr Asn Cys Ser Leu Asp Gly Arg
130 135 140
Ser Val Leu Lys Thr Gly Thr Thr Glu Lys Asp Val Val Cys Gly Pro
145 150 155 160
Pro Val Val Ser Phe Ser Pro Ser Thr Thr Ile Ser Val Thr Pro Glu
165 170 175
Gly Gly Pro Gly Gly His Ser Leu Gln Val Leu Thr Leu Phe Leu Ala
180 185 190
Leu Thr Ser Ala Leu Leu Leu Ala Leu Ile Phe Ile Thr Leu Leu Phe
195 200 205
Ser Val Leu Lys Trp Ile Arg Lys Lys Phe Pro His Ile Phe Lys Gln
210 215 220
Pro Phe Lys Lys Thr Thr Gly Ala Ala Gln Glu Glu Asp Ala Cys Ser
225 230 235 240
Cys Arg Cys Pro Gln Glu Glu Glu Gly Gly Gly Gly Gly Tyr Glu Leu
245 250 255
<210> 219
<211> 254
<212> Белок
<213> Monkey
<400> 219
Met Gly Asn Ser Cys Tyr Asn Ile Val Ala Thr Leu Leu Leu Val Leu
1 5 10 15
Asn Phe Glu Arg Thr Arg Ser Leu Gln Asp Leu Cys Ser Asn Cys Pro
20 25 30
Ala Gly Thr Phe Cys Asp Asn Asn Arg Ser Gln Ile Cys Ser Pro Cys
35 40 45
Pro Pro Asn Ser Phe Ser Ser Ala Gly Gly Gln Arg Thr Cys Asp Ile
50 55 60
Cys Arg Gln Cys Lys Gly Val Phe Lys Thr Arg Lys Glu Cys Ser Ser
65 70 75 80
Thr Ser Asn Ala Glu Cys Asp Cys Ile Ser Gly Tyr His Cys Leu Gly
85 90 95
Ala Glu Cys Ser Met Cys Glu Gln Asp Cys Lys Gln Gly Gln Glu Leu
100 105 110
Thr Lys Lys Gly Cys Lys Asp Cys Cys Phe Gly Thr Phe Asn Asp Gln
115 120 125
Lys Arg Gly Ile Cys Arg Pro Trp Thr Asn Cys Ser Leu Asp Gly Lys
130 135 140
Ser Val Leu Val Asn Gly Thr Lys Glu Arg Asp Val Val Cys Gly Pro
145 150 155 160
Ser Pro Ala Asp Leu Ser Pro Gly Ala Ser Ser Ala Thr Pro Pro Ala
165 170 175
Pro Ala Arg Glu Pro Gly His Ser Pro Gln Ile Ile Phe Phe Leu Ala
180 185 190
Leu Thr Ser Thr Val Val Leu Phe Leu Leu Phe Phe Leu Val Leu Arg
195 200 205
Phe Ser Val Val Lys Arg Ser Arg Lys Lys Leu Leu Tyr Ile Phe Lys
210 215 220
Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys
225 230 235 240
Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
245 250
<210> 220
<211> 257
<212> Белок
<213> Искусственная последовательность
<400> 220
Met Gly Asn Ser Cys Tyr Asn Ile Val Ala Thr Leu Leu Leu Val Leu
1 5 10 15
Asn Phe Glu Arg Thr Arg Ser Leu Gln Asp Pro Cys Ser Asn Cys Pro
20 25 30
Ala Gly Thr Phe Cys Asp Asn Asn Arg Asn Gln Ile Cys Ser Pro Cys
35 40 45
Pro Pro Asn Ser Phe Ser Ser Ala Gly Gly Gln Arg Thr Cys Asp Ile
50 55 60
Cys Arg Gln Cys Lys Gly Val Phe Arg Thr Arg Lys Glu Cys Ser Ser
65 70 75 80
Thr Ser Asn Ala Glu Cys Asp Cys Thr Pro Gly Phe His Cys Leu Gly
85 90 95
Ala Gly Cys Ser Met Cys Glu Gln Asp Cys Lys Gln Gly Gln Glu Leu
100 105 110
Thr Lys Lys Gly Cys Lys Asp Cys Cys Phe Gly Thr Phe Asn Asp Gln
115 120 125
Lys Arg Gly Ile Cys Arg Pro Trp Thr Asn Cys Ser Leu Asp Gly Lys
130 135 140
Ser Val Leu Val Asn Gly Thr Lys Glu Arg Asp Val Val Cys Gly Pro
145 150 155 160
Ser Pro Ala Asp Leu Ser Pro Gly Ala Ser Ser Val Thr Pro Pro Ala
165 170 175
Pro Ala Arg Glu Pro Gly His Ser Leu Gln Val Leu Thr Leu Phe Leu
180 185 190
Ala Leu Thr Ser Ala Leu Leu Leu Ala Leu Ile Phe Ile Thr Leu Leu
195 200 205
Phe Ser Val Leu Lys Trp Ile Arg Lys Lys Phe Pro His Ile Phe Lys
210 215 220
Gln Pro Phe Lys Lys Thr Thr Gly Ala Ala Gln Glu Glu Asp Ala Cys
225 230 235 240
Ser Cys Arg Cys Pro Gln Glu Glu Glu Gly Gly Gly Gly Gly Tyr Glu
245 250 255
Leu
<210> 221
<211> 119
<212> Белок
<213> Искусственная последовательность
<400> 221
Gln Val Gln Met Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Tyr Ile Asn Trp Leu Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Phe Ala Gly Thr Gly Gly Thr Tyr Tyr Asn Gln Lys Phe
50 55 60
Thr Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg His Ser Pro Arg Ala Thr Leu Phe Asp Phe Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 222
<211> 119
<212> Белок
<213> Искусственная последовательность
<400> 222
Gln Val Gln Met Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Tyr Ile Asn Trp Leu Arg Gln Ala Pro Gly Gln Ser Leu Glu Trp Ile
35 40 45
Gly Trp Ile Phe Ala Gly Thr Gly Gly Thr Tyr Tyr Asn Gln Lys Phe
50 55 60
Thr Gly Arg Val Gln Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg His Ser Pro Arg Ala Thr Leu Phe Asp Phe Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 223
<211> 119
<212> Белок
<213> Искусственная последовательность
<400> 223
Gln Val Gln Met Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Tyr Ile Asn Trp Leu Arg Gln Ala Pro Gly Gln Ser Leu Glu Trp Ile
35 40 45
Gly Trp Ile Phe Ala Gly Thr Gly Gly Thr Tyr Tyr Asn Gln Lys Phe
50 55 60
Thr Gly Arg Ala Gln Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg His Ser Pro Arg Ala Thr Leu Phe Asp Phe Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 224
<211> 119
<212> Белок
<213> Искусственная последовательность
<400> 224
Gln Gly Gln Met Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Thr Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Tyr Ile Asn Trp Leu Arg Gln Ala Pro Gly Gln Ser Leu Glu Trp Ile
35 40 45
Ala Trp Ile Phe Ala Gly Thr Gly Gly Thr Tyr Tyr Asn Gln Lys Phe
50 55 60
Thr Gly Arg Ala Gln Leu Thr Val Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg His Ser Pro Arg Ala Thr Leu Phe Asp Phe Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 225
<211> 106
<212> Белок
<213> Искусственная последовательность
<400> 225
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Ser Ser Val Asn His Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Ala Leu Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro Glu
65 70 75 80
Asp Phe Ala Val Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 226
<211> 106
<212> Белок
<213> Искусственная последовательность
<400> 226
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Ser Ser Val Asn His Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Ala Leu Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 227
<211> 106
<212> Белок
<213> Искусственная последовательность
<400> 227
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Met Ser Cys Arg Ala Ser Ser Ser Val Asn His Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Phe Ser Pro Arg Ala Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 228
<211> 106
<212> Белок
<213> Искусственная последовательность
<400> 228
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Ala Ser Pro Gly
1 5 10 15
Glu Arg Val Thr Met Ser Cys Arg Ala Ser Ser Ser Val Asn His Met
20 25 30
His Trp Tyr Gln Gln Arg Pro Gly Phe Ser Pro Arg Ala Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Leu Glu Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 229
<211> 121
<212> Белок
<213> Искусственная последовательность
<400> 229
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Ser Tyr
20 25 30
Trp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asn Ile Tyr Pro Ser Asp Ser Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Thr Trp Glu Phe Tyr Tyr Asp Ser Val Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 230
<211> 121
<212> Белок
<213> Искусственная последовательность
<400> 230
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Ser Tyr
20 25 30
Trp Ile Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Ser Asp Ser Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Ala Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Thr Trp Glu Phe Tyr Tyr Asp Ser Val Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 231
<211> 121
<212> Белок
<213> Искусственная последовательность
<400> 231
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Ser Tyr
20 25 30
Trp Ile Asn Trp Val Lys Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Ser Asp Ser Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Thr Trp Glu Phe Tyr Tyr Asp Ser Val Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Leu Thr Val Ser Ser
115 120
<210> 232
<211> 107
<212> Белок
<213> Искусственная последовательность
<400> 232
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Ile Asn Ser Tyr
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Asn Arg Leu Val Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Gln Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Glu Leu Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 233
<211> 107
<212> Белок
<213> Искусственная последовательность
<400> 233
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Ile Asn Ser Tyr
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Thr Leu Ile
35 40 45
Tyr Arg Ala Asn Arg Leu Val Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Gln Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Glu Leu Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 234
<211> 107
<212> Белок
<213> Искусственная последовательность
<400> 234
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Ile Asn Ser Tyr
20 25 30
Leu Ser Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Thr Leu Ile
35 40 45
Tyr Arg Ala Asn Arg Leu Val Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Gln Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Glu Leu Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 235
<211> 107
<212> Белок
<213> Искусственная последовательность
<400> 235
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Ile Asn Ser Tyr
20 25 30
Leu Ser Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Thr Leu Ile
35 40 45
Tyr Arg Ala Asn Arg Leu Val Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Gln Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Glu Leu Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 236
<211> 111
<212> Белок
<213> Искусственная последовательность
<400> 236
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Thr Tyr
20 25 30
Asp Ile Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Trp Thr Gly Gly Gly Thr Asn Tyr Asn Ser Ser Phe Met
50 55 60
Ser Arg Val Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Glu
85 90 95
Arg Val Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
100 105 110
<210> 237
<211> 111
<212> Белок
<213> Искусственная последовательность
<400> 237
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Thr Tyr
20 25 30
Asp Ile Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Thr Gly Gly Gly Thr Asn Tyr Asn Ser Ser Phe Met
50 55 60
Ser Arg Val Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ile Tyr Tyr Cys Glu
85 90 95
Arg Val Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
100 105 110
<210> 238
<211> 111
<212> Белок
<213> Искусственная последовательность
<400> 238
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Thr Tyr
20 25 30
Asp Ile Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Thr Gly Gly Gly Thr Asn Tyr Asn Ser Ser Phe Met
50 55 60
Ser Arg Val Thr Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ile Tyr Tyr Cys Glu
85 90 95
Arg Val Asp Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser Ser
100 105 110
<210> 239
<211> 112
<212> Белок
<213> Искусственная последовательность
<400> 239
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Ala Phe Thr Phe Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Asn
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 240
<211> 112
<212> Белок
<213> Искусственная последовательность
<400> 240
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Ala Phe Thr Phe Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Asn
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 241
<211> 112
<212> Белок
<213> Искусственная последовательность
<400> 241
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Ala Phe Thr Phe Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Asn
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 242
<211> 112
<212> Белок
<213> Искусственная последовательность
<400> 242
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Asp Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Ala Phe Thr Phe Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Asn
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 243
<211> 119
<212> Белок
<213> Искусственная последовательность
<400> 243
Gln Gly Gln Met Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Thr Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Tyr Ile Asn Trp Leu Lys Gln Lys Pro Gly Gln Ser Leu Glu Trp Ile
35 40 45
Ala Trp Ile Phe Ala Gly Thr Gly Gly Thr Tyr Tyr Asn Gln Lys Phe
50 55 60
Thr Gly Lys Ala Gln Leu Thr Val Asp Thr Ser Ser Gly Thr Ala Tyr
65 70 75 80
Met Gln Phe Ser Ser Leu Thr Thr Glu Asp Ser Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg His Ser Pro Arg Ala Thr Leu Phe Asp Phe Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 244
<211> 106
<212> Белок
<213> Искусственная последовательность
<400> 244
Gln Ile Val Leu Ser Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Val Asn His Met
20 25 30
His Trp Tyr Gln Gln Arg Thr Gly Phe Ser Pro Lys Ala Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 245
<211> 121
<212> Белок
<213> Искусственная последовательность
<400> 245
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Ser Tyr
20 25 30
Trp Ile Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Ser Asp Ser Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Pro Thr Ser Asp Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Thr Trp Glu Phe Tyr Tyr Asp Ser Val Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Leu Thr Val Ser Ser
115 120
<210> 246
<211> 107
<212> Белок
<213> Искусственная последовательность
<400> 246
Asp Ile Lys Met Thr Gln Ser Pro Ser Ser Met Tyr Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Ile Asn Ser Tyr
20 25 30
Leu Ser Trp Phe Gln Gln Lys Pro Gly Lys Ser Pro Lys Thr Leu Ile
35 40 45
Tyr Arg Ala Asn Arg Leu Val Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Gln Asp Tyr Ser Leu Thr Ile Ser Ser Leu Glu Tyr
65 70 75 80
Glu Asp Met Gly Ile Tyr Tyr Cys Leu Gln Tyr Asp Glu Leu Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 247
<211> 111
<212> Белок
<213> Искусственная последовательность
<400> 247
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Thr Tyr
20 25 30
Asp Ile Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Thr Gly Gly Gly Thr Asn Tyr Asn Ser Ser Phe Met
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Asn Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Val Asp Asp Thr Ala Ile Tyr Tyr Cys Glu
85 90 95
Arg Val Asp Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser Ser
100 105 110
<210> 248
<211> 112
<212> Белок
<213> Искусственная последовательность
<400> 248
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Ala Phe Thr Phe Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Ser Gln Asn
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 249
<211> 121
<212> Белок
<213> Искусственная последовательность
<400> 249
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Thr Ser Gly Tyr Ala Phe Ser Thr Ser
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Tyr Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Arg Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Leu Gln Leu Ser Ser Leu Thr Ser Val Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Leu Asp Gly Tyr Tyr Glu Val Phe Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Leu Thr Val Ser Ser
115 120
<210> 250
<211> 112
<212> Белок
<213> Искусственная последовательность
<400> 250
Asp Val Val Met Thr Gln Thr Pro Leu Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Asn Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Ile Tyr Tyr Cys Phe Gln Gly
85 90 95
Thr His Phe Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 251
<211> 114
<212> Белок
<213> Искусственная последовательность
<400> 251
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Val Met Tyr Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Asp Ile Arg Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ser Asp Arg Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Leu Cys
85 90 95
Ala Arg Gln Gly Gly Asp Tyr Trp Gly Gln Gly Thr Ile Leu Thr Val
100 105 110
Ser Ser
<210> 252
<211> 107
<212> Белок
<213> Искусственная последовательность
<400> 252
Asp Val Gln Ile Thr Gln Ser Pro Ser Tyr Leu Ala Ala Ser Pro Gly
1 5 10 15
Glu Thr Ile Thr Val Asn Cys Arg Ala Ser Lys Asn Ile Asn Lys Tyr
20 25 30
Leu Ala Trp Tyr Gln Glu Lys Pro Gly Lys Thr Asn Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr His Cys Gln Gln Tyr Asn Glu Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Met Lys
100 105
<210> 253
<211> 118
<212> Белок
<213> Искусственная последовательность
<400> 253
Gln Val Gln Leu Lys Gln Ser Gly Pro Gly Leu Val Gln Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Thr Tyr
20 25 30
Gly Val His Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Ser Asp Gly Asn Thr Asp Tyr Asn Asp Ala Phe Ile
50 55 60
Ser Arg Leu Ser Ile Thr Lys Asp Asn Ser Thr Ser Gln Val Phe Phe
65 70 75 80
Lys Met Asn Gly Leu Gln Ala Asp Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Arg Asn Ser Ile Thr Ser Val Ser Phe Asp Cys Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser
115
<210> 254
<211> 107
<212> Белок
<213> Искусственная последовательность
<400> 254
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Thr
20 25 30
Val Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ser Pro Lys Ala Leu Ile
35 40 45
Cys Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Val Gln Ser
65 70 75 80
Glu Asp Leu Ala Glu Tyr Phe Cys Gln Gln Tyr Asn Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 255
<211> 117
<212> Белок
<213> Искусственная последовательность
<400> 255
Gln Val Gln Leu Gln Gln Pro Gly Ser Ala Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Asn Tyr
20 25 30
Trp Ile His Trp Val Lys Gln Arg His Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Ala Ser Asp Tyr Thr Asn Tyr Asp Glu Lys Phe
50 55 60
Lys Asn Lys Gly Thr Leu Thr Val Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met His Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Gly Tyr Phe Gly Ser Leu Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ala
115
<210> 256
<211> 107
<212> Белок
<213> Искусственная последовательность
<400> 256
Asp Ile Leu Leu Thr Gln Ser Pro Ala Ile Leu Ser Val Asn Pro Gly
1 5 10 15
Glu Arg Val Ser Phe Ser Cys Arg Ala Ser Gln Pro Ile Gly Thr Gly
20 25 30
Ile His Trp Tyr Gln Gln Arg Thr Asn Gly Ser Pro Arg Leu Leu Ile
35 40 45
Lys Ser Ala Ser Glu Ser Ile Ser Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Asn Val Glu Ser
65 70 75 80
Asp Asp Val Gly Asp Tyr Tyr Cys Gln Gln Ser Tyr Ser Trp Pro Thr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Lys Ile Asn
100 105
<210> 257
<211> 117
<212> Белок
<213> Искусственная последовательность
<400> 257
Glu Val Gln Leu Gln Gln Ser Gly Thr Val Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Ser Asn
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Tyr Pro Gly Asn Ser Asp Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Lys Leu Thr Ala Val Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Asn Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Ile Thr Thr Ala Pro Glu Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 258
<211> 107
<212> Белок
<213> Искусственная последовательность
<400> 258
Asn Ile Val Met Thr Gln Ser Pro Lys Ser Met Ser Met Ser Val Gly
1 5 10 15
Glu Arg Val Thr Leu Ser Cys Lys Ala Ser Glu Asn Val Gly Ile Tyr
20 25 30
Val Ser Trp Tyr Gln Gln Lys Pro Glu Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Ala Thr Asp Phe Thr Leu Thr Ile Ser Ser Val Gln Pro
65 70 75 80
Glu Asp Leu Ala Asp Tyr His Cys Gly His Thr Tyr Asn Tyr Pro Phe
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 259
<211> 118
<212> Белок
<213> Искусственная последовательность
<400> 259
Glu Val Lys Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Asp Phe Ser Arg Tyr
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile His Pro Asp Ser Ser Ala Ile Asn Tyr Thr Pro Ser Leu
50 55 60
Lys Asp Lys Phe Ile Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Lys Val Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Ser Tyr Tyr Gly Arg Val Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser
115
<210> 260
<211> 107
<212> Белок
<213> Искусственная последовательность
<400> 260
Asp Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Thr Pro Gly
1 5 10 15
Asp Arg Val Ser Leu Ser Cys Arg Ala Ser Gln Ser Ile Ser Asp Tyr
20 25 30
Leu His Trp Tyr Gln Gln Lys Ser His Glu Ser Pro Arg Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Gln Ser Ile Ser Gly Ile Pro Pro Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Ser Asp Phe Thr Leu Ser Ile Asn Ser Val Glu Pro
65 70 75 80
Glu Asp Val Gly Met Tyr Tyr Cys Gln Asp Gly His Ser Phe Pro Pro
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 261
<211> 117
<212> Белок
<213> Искусственная последовательность
<400> 261
Glu Val Gln Leu Gln Gln Ser Gly Thr Val Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Tyr Pro Gly Asn Ser Asp Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Lys Leu Thr Ala Val Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Asp Leu Ser Ser Leu Thr Asn Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Ile Thr Thr Ala Pro Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 262
<211> 107
<212> Белок
<213> Искусственная последовательность
<400> 262
Asn Ile Val Met Thr Gln Ser Pro Lys Ser Met Ser Met Ser Val Gly
1 5 10 15
Glu Arg Val Thr Leu Ser Cys Lys Ala Ser Glu Asn Val Gly Ile His
20 25 30
Val Ser Trp Tyr Gln Gln Lys Pro Glu Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Ser Gly Tyr Asn Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Ala Thr Asp Phe Thr Leu Thr Ile Ser Ser Val Gln Pro
65 70 75 80
Glu Asp Leu Ala Asp Tyr His Cys Gly Gln Thr Tyr Ser Tyr Pro Phe
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 263
<211> 119
<212> Белок
<213> Искусственная последовательность
<400> 263
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Lys Phe Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Ala Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Asp Phe Ser Leu Glu Thr Ser Ala Thr Thr Ala Tyr
65 70 75 80
Leu Gln Ile Asn Asn Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Arg Glu Tyr Tyr Pro Trp Val Phe Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ala
115
<210> 264
<211> 106
<212> Белок
<213> Искусственная последовательность
<400> 264
Glu Asn Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Ser Ser Thr Ser Pro Lys Leu Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Gly Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Asn Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Ala Glu
65 70 75 80
Asp Val Ala Thr Tyr Tyr Cys Phe Gln Gly Ser Gly Tyr Pro Leu Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 265
<211> 119
<212> Белок
<213> Искусственная последовательность
<400> 265
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Ser Tyr
20 25 30
Trp Ile Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Ser Asp Ser Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Phe His Tyr Gly Ser Ser Pro Phe Asp Asn Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 266
<211> 107
<212> Белок
<213> Искусственная последовательность
<400> 266
Asp Ile Gln Met Thr Gln Ser Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser His Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Phe Ala Thr Tyr Phe Cys Gln Gln Gly His Thr Leu Pro Arg
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 267
<211> 118
<212> Белок
<213> Искусственная последовательность
<400> 267
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Phe Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Glu Ile Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Asn Asn Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Arg Asp Tyr Leu Gly Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser
115
<210> 268
<211> 108
<212> Белок
<213> Искусственная последовательность
<400> 268
Glu Asn Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Val Ser Ser Ser
20 25 30
Tyr Leu His Trp Tyr Gln Gln Lys Ser Gly Ala Ser Pro Lys Leu Trp
35 40 45
Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Val Glu
65 70 75 80
Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Ala Tyr Leu
85 90 95
Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 269
<211> 122
<212> Белок
<213> Искусственная последовательность
<400> 269
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Ile Asn Trp Val Arg Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Ser Asp Ser Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Ser Leu Thr Val Asp Lys Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Ala Gly Asp Gly Thr His Tyr Tyr Ala Ile Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 270
<211> 107
<212> Белок
<213> Искусственная последовательность
<400> 270
Asn Ile Val Met Thr Gln Ser Pro Lys Ser Met Ser Met Ser Val Gly
1 5 10 15
Glu Arg Val Thr Leu Ser Cys Lys Ala Ser Glu Asn Val Gly Thr Tyr
20 25 30
Val Ser Trp Tyr Gln Gln Lys Pro Glu Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Arg Tyr Pro Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Ala Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Leu Ala Asp Tyr His Cys Gly Gln Gly Tyr Ser Tyr Leu Arg
85 90 95
Thr Phe Gly Gly Gly Thr Asn Leu Glu Ile Lys
100 105
<210> 271
<211> 117
<212> Белок
<213> Искусственная последовательность
<400> 271
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Leu Val Lys Leu Ser Cys Lys Ala Ser Gly Phe Asn Ile Lys Asp Tyr
20 25 30
Tyr Met His Trp Val Lys Arg Arg Pro Glu Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Asp Pro Glu Asn Gly Asn Thr Ile Tyr Asp Pro Lys Phe
50 55 60
Gln Asp Lys Ala Ser Ile Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Leu Gln Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Glu Gly Leu Pro Trp Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 272
<211> 106
<212> Белок
<213> Искусственная последовательность
<400> 272
Gln Ile Ile Leu Thr Gln Ser Pro Ala Leu Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Asp Met
20 25 30
Asn Trp Tyr Gln Gln Lys Pro Arg Ser Ser Pro Thr Pro Trp Ile Tyr
35 40 45
Leu Thr Ser Asn Leu Ser Ser Gly Val Pro Asp Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Gly Asn Pro Leu Thr
85 90 95
Phe Gly Ala Gly Thr Arg Leu Glu Leu Lys
100 105
<210> 273
<211> 114
<212> Белок
<213> Искусственная последовательность
<400> 273
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Arg Lys Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Phe
20 25 30
Gly Met His Trp Met Arg Gln Ala Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Gly Ser Ser Ala Ile Tyr Tyr Ala Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Pro Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Thr Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Asp Trp Val Asp Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val
100 105 110
Ser Ser
<210> 274
<211> 107
<212> Белок
<213> Искусственная последовательность
<400> 274
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Val Ser Val Gly
1 5 10 15
Glu Thr Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr Ser Asn
20 25 30
Leu Val Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Thr Ala Thr Lys Leu Thr Asn Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gln Tyr Ser Leu Lys Ile Asn Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Gly Thr Tyr Tyr Cys Gln His Phe Trp Asp Thr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Met Lys
100 105
<210> 275
<211> 123
<212> Белок
<213> Искусственная последовательность
<400> 275
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Ile Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Phe Pro Ser Asp Ser Tyr Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Ala Lys Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Phe Gly Ser Ser Gly Tyr Pro Asp Tyr Tyr Thr Met Glu Tyr
100 105 110
Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 276
<211> 107
<212> Белок
<213> Искусственная последовательность
<400> 276
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Glu Thr Val Thr Ile Thr Cys Arg Ala Ser Gly Asn Ile Asp Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Asn Ala Lys Thr Leu Ala Glu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Tyr Ser Leu Lys Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Gly Ser Tyr His Cys Gln Gln Tyr Trp Thr Ile Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 277
<211> 121
<212> Белок
<213> Искусственная последовательность
<400> 277
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Asn Asn Ser
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Tyr Pro Gly Asp Gly Asp Thr Asp Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Val Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Leu Asp Gly Asn Tyr Tyr Tyr Trp Tyr Phe Asp Val Trp Gly
100 105 110
Ala Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 278
<211> 112
<212> Белок
<213> Искусственная последовательность
<400> 278
Asp Val Val Met Thr Gln Thr Pro Leu Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Gln Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 279
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 279
Gly Tyr Tyr Trp Ser
1 5
<210> 280
<211> 16
<212> Белок
<213> Искусственная последовательность
<400> 280
Glu Ile Asn His Gly Gly Tyr Val Thr Tyr Asn Pro Ser Leu Glu Ser
1 5 10 15
<210> 281
<211> 13
<212> Белок
<213> Искусственная последовательность
<400> 281
Asp Tyr Gly Pro Gly Asn Tyr Asp Trp Tyr Phe Asp Leu
1 5 10
<210> 282
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 282
Arg Ala Ser Gln Ser Val Ser Ser Tyr Leu Ala
1 5 10
<210> 283
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 283
Asp Ala Ser Asn Arg Ala Thr
1 5
<210> 284
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 284
Gln Gln Arg Ser Asn Trp Pro Pro Ala Leu Thr
1 5 10
<210> 285
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 285
Asp Tyr Trp Met Ser
1 5
<210> 286
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 286
Asp Ile Lys Asn Asp Gly Ser Tyr Thr Asn Tyr Ala Pro Ser Leu Thr
1 5 10 15
Asn
<210> 287
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 287
Glu Leu Thr Gly Thr
1 5
<210> 288
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 288
Lys Ser Ser Gln Ser Leu Leu Ser Ser Gly Asn Gln Lys Asn Tyr Leu
1 5 10 15
Ala
<210> 289
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 289
Tyr Ala Ser Thr Arg Gln Ser
1 5
<210> 290
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 290
Leu Gln Tyr Asp Arg Tyr Pro Phe Thr
1 5
<210> 291
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 291
Ser Thr Tyr Trp Ile Ser
1 5
<210> 292
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 292
Lys Ile Tyr Pro Gly Asp Ser Tyr Thr Asn Tyr Ser Pro Ser Phe Gln
1 5 10 15
Gly
<210> 293
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 293
Arg Gly Tyr Gly Ile Phe Asp Tyr
1 5
<210> 294
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 294
Ser Gly Asp Asn Ile Gly Asp Gln Tyr Ala His
1 5 10
<210> 295
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 295
Gln Asp Lys Asn Arg Pro Ser
1 5
<210> 296
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 296
Ala Thr Tyr Thr Gly Phe Gly Ser Leu Ala Val
1 5 10
<210> 297
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 297
Asp Tyr Tyr Met Asn
1 5
<210> 298
<211> 19
<212> Белок
<213> Искусственная последовательность
<400> 298
Tyr Ile Ser Ser Ser Ala Ser Gly Ser Thr Ile Tyr Tyr Ala Asp Ser
1 5 10 15
Val Lys Gly
<210> 299
<211> 13
<212> Белок
<213> Искусственная последовательность
<400> 299
Val Val Pro Ala Gly Ser Gly Trp Arg Trp Phe Asp Pro
1 5 10
<210> 300
<211> 14
<212> Белок
<213> Искусственная последовательность
<400> 300
Thr Gly Ile Ser Ser Asp Val Gly Ala Tyr Asp Tyr Val Ser
1 5 10
<210> 301
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 301
Glu Val Ser Lys Arg Pro Ser
1 5
<210> 302
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 302
Ser Ser His Ala Gly Ser Asn Asn Phe Tyr Val
1 5 10
<210> 303
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 303
Ser Asn Ser Ala Ala Trp Asn
1 5
<210> 304
<211> 18
<212> Белок
<213> Искусственная последовательность
<400> 304
Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Asn Asp Tyr Ala Pro Ser Val
1 5 10 15
Glu Ser
<210> 305
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 305
Asp Pro Pro Tyr Val Leu Ser Thr Phe Asp Ile
1 5 10
<210> 306
<211> 13
<212> Белок
<213> Искусственная последовательность
<400> 306
Thr Arg Ser Ser Gly Asn Ile Ala Ser Phe Tyr Val Gln
1 5 10
<210> 307
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 307
Glu Asp Asp Gln Arg Pro Ser
1 5
<210> 308
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 308
Gln Ser Tyr Asp Thr Asn Asn Val Ile
1 5
<210> 309
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 309
Ser Asn Ser Ala Ala Trp Asn
1 5
<210> 310
<211> 18
<212> Белок
<213> Искусственная последовательность
<400> 310
Arg Thr Tyr Tyr Arg Ser Arg Trp Tyr Ser Asp Tyr Ala Ser Ser Val
1 5 10 15
Glu Ser
<210> 311
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 311
Asp Pro Pro Tyr Val Leu Ser Thr Phe Asp Ile
1 5 10
<210> 312
<211> 13
<212> Белок
<213> Искусственная последовательность
<400> 312
Thr Arg Ser Ser Gly Asn Ile Ala Ser Phe Tyr Val Gln
1 5 10
<210> 313
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 313
Glu Asp Asp Gln Arg Pro Ser
1 5
<210> 314
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 314
Gln Ser Tyr Asp Thr Asn Asn Val Ile
1 5
<210> 315
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 315
Ser Asp Ser Ala Ala Trp Asn
1 5
<210> 316
<211> 18
<212> Белок
<213> Искусственная последовательность
<400> 316
Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Asn Asp Tyr Ala Pro Ser Val
1 5 10 15
Glu Ser
<210> 317
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 317
Asp Pro Pro Tyr Val Leu Ser Thr Phe Asp Ile
1 5 10
<210> 318
<211> 13
<212> Белок
<213> Искусственная последовательность
<400> 318
Thr Arg Ser Ser Gly Asn Ile Ala Ser Phe Tyr Val Gln
1 5 10
<210> 319
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 319
Glu Asp Asp Gln Arg Pro Ser
1 5
<210> 320
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 320
Gln Ser Tyr Asp Thr Asn Asn Val Ile
1 5
<210> 321
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 321
Ser Asn Ser Ala Ala Trp Asn
1 5
<210> 322
<211> 18
<212> Белок
<213> Искусственная последовательность
<400> 322
Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Asn Asp Tyr Ala Pro Ser Val
1 5 10 15
Glu Ser
<210> 323
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 323
Asp Pro Pro Tyr Val Leu Ser Thr Phe Asp Ile
1 5 10
<210> 324
<211> 13
<212> Белок
<213> Искусственная последовательность
<400> 324
Thr Arg Ser Ser Gly Asn Ile Ala Ser Phe Tyr Val Gln
1 5 10
<210> 325
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 325
Asp Asp Asp Gln Arg Pro Ser
1 5
<210> 326
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 326
Gln Ser Tyr Asp Thr Asn Asn Val Ile
1 5
<210> 327
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 327
Ser Asn Ser Ala Ala Trp Asn
1 5
<210> 328
<211> 18
<212> Белок
<213> Искусственная последовательность
<400> 328
Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Asn Asp Tyr Ala Pro Ser Val
1 5 10 15
Glu Ser
<210> 329
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 329
Asp Pro Pro Tyr Val Leu Ser Thr Phe Asp Ile
1 5 10
<210> 330
<211> 13
<212> Белок
<213> Искусственная последовательность
<400> 330
Thr Arg Ser Ser Gly Asn Ile Ala Ser Phe Tyr Val Gln
1 5 10
<210> 331
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 331
Glu Asp Asp Gln Arg Pro Ser
1 5
<210> 332
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 332
Gln Ser Tyr Asp Thr Asn Lys Val Ile
1 5
<210> 333
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 333
Ser Asn Ser Ala Ala Trp Asn
1 5
<210> 334
<211> 18
<212> Белок
<213> Искусственная последовательность
<400> 334
Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Asn Asp Tyr Ala Pro Ser Val
1 5 10 15
Glu Ser
<210> 335
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 335
Asp Pro Pro Tyr Val Leu Ser Thr Phe Asp Ile
1 5 10
<210> 336
<211> 13
<212> Белок
<213> Искусственная последовательность
<400> 336
Thr Arg Ser Ser Gly Asn Ile Ala Ser Phe Tyr Val Gln
1 5 10
<210> 337
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 337
Glu Asp Asp Gln Arg Pro Ser
1 5
<210> 338
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 338
Gln Ser Tyr Asp Ile Asn Lys Val Ile
1 5
<210> 339
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 339
Ser Asn Ser Ala Ala Trp Asn
1 5
<210> 340
<211> 18
<212> Белок
<213> Искусственная последовательность
<400> 340
Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Asn Asp Tyr Ala Pro Ser Val
1 5 10 15
Glu Ser
<210> 341
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 341
Asp Pro Pro Tyr Val Leu Ser Thr Phe Asp Ile
1 5 10
<210> 342
<211> 13
<212> Белок
<213> Искусственная последовательность
<400> 342
Thr Arg Ser Ser Gly Asn Ile Ala Ser Phe Tyr Val Gln
1 5 10
<210> 343
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 343
Asp Asp Asp Gln Arg Pro Ser
1 5
<210> 344
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 344
Gln Ser Tyr Asp Ile Asn Lys Val Ile
1 5
<210> 345
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 345
Gly Tyr Met Pro Asp Gly Tyr Tyr
1 5
<210> 346
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 346
Ile Asn Pro Arg Thr Gly Gly Thr
1 5
<210> 347
<211> 13
<212> Белок
<213> Искусственная последовательность
<400> 347
Ala Arg Glu Gly Ala Ala Phe Arg Leu Glu Leu Asp Ala
1 5 10
<210> 348
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 348
Asn Ile Gly Ser Lys Ser
1 5
<210> 349
<211> 3
<212> Белок
<213> Искусственная последовательность
<400> 349
Tyr Asp Ser
1
<210> 350
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 350
Gln Val Trp Asp Ser Ser Ser Val Val
1 5
<210> 351
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 351
Gly Tyr Ser Phe Thr Gly Tyr Tyr
1 5
<210> 352
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 352
Val Asn Pro Lys Ser Gly Gly Thr
1 5
<210> 353
<211> 13
<212> Белок
<213> Искусственная последовательность
<400> 353
Ala Arg Glu Gly Trp Ala Arg Arg Ile Asp Leu Asp Glu
1 5 10
<210> 354
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 354
Asn Ile Gly Ser Lys Ser
1 5
<210> 355
<211> 3
<212> Белок
<213> Искусственная последовательность
<400> 355
Tyr Asp Ser
1
<210> 356
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 356
Gln Val Trp Asp Ser Ser Ser Val Val
1 5
<210> 357
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 357
Gly Tyr Ser Phe Ser Gly Tyr Tyr
1 5
<210> 358
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 358
Val Asn Pro Met Ser Gly Gly Thr
1 5
<210> 359
<211> 13
<212> Белок
<213> Искусственная последовательность
<400> 359
Ala Arg Glu Gly Met Ala Met Arg Leu Glu Leu Asp Lys
1 5 10
<210> 360
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 360
Asn Ile Gly Ser Lys Ser
1 5
<210> 361
<211> 3
<212> Белок
<213> Искусственная последовательность
<400> 361
Tyr Asp Ser
1
<210> 362
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 362
Gln Val Trp Asp Ser Ser Ser Val Val
1 5
<210> 363
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 363
Gly Tyr Asn Phe Gly Gly Tyr Tyr
1 5
<210> 364
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 364
Val Asn Pro His Ser Gly Gly Thr
1 5
<210> 365
<211> 13
<212> Белок
<213> Искусственная последовательность
<400> 365
Ala Arg Glu Gly Glu Ala Trp Gly Leu Asp Leu Asp Leu
1 5 10
<210> 366
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 366
Asn Ile Gly Ser Lys Ser
1 5
<210> 367
<211> 3
<212> Белок
<213> Искусственная последовательность
<400> 367
Tyr Asp Ser
1
<210> 368
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 368
Gln Val Trp Asp Ser Ser Ser Val Val
1 5
<210> 369
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 369
Gly Tyr Asn Trp Thr Gly Tyr Tyr
1 5
<210> 370
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 370
Ile Asn Pro Met Ala Gly Gly Thr
1 5
<210> 371
<211> 13
<212> Белок
<213> Искусственная последовательность
<400> 371
Ala Arg Glu Gly Trp Ala Arg Gly Val Glu Leu Asp Met
1 5 10
<210> 372
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 372
Asn Ile Gly Ser Lys Ser
1 5
<210> 373
<211> 3
<212> Белок
<213> Искусственная последовательность
<400> 373
Tyr Asp Ser
1
<210> 374
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 374
Gln Val Trp Asp Ser Ser Ser Val Val
1 5
<210> 375
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 375
Gly Tyr Gln Met Arg Gly Tyr Tyr
1 5
<210> 376
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 376
Ile Asn Pro Asn Ser Gly Gly Thr
1 5
<210> 377
<211> 13
<212> Белок
<213> Искусственная последовательность
<400> 377
Ala Arg Glu Gly Glu Ala Val Gly Leu Asp Leu Asp Tyr
1 5 10
<210> 378
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 378
Asn Ile Gly Ser Lys Ser
1 5
<210> 379
<211> 3
<212> Белок
<213> Искусственная последовательность
<400> 379
Tyr Asp Ser
1
<210> 380
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 380
Gln Val Trp Asp Ser Ser Ser Val Val
1 5
<210> 381
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 381
Gly Tyr Asn Phe Gly Gly Tyr Tyr
1 5
<210> 382
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 382
Val Asn Pro Lys Ser Gly Gly Thr
1 5
<210> 383
<211> 13
<212> Белок
<213> Искусственная последовательность
<400> 383
Ala Arg Glu Gly Glu Ala Val Gly Leu Asp Leu Asp Tyr
1 5 10
<210> 384
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 384
Asn Ile Gly Ser Lys Ser
1 5
<210> 385
<211> 3
<212> Белок
<213> Искусственная последовательность
<400> 385
Tyr Asp Ser
1
<210> 386
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 386
Gln Val Trp Asp Ser Ser Ser Val Val
1 5
<210> 387
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 387
Gly Tyr Thr Phe Thr Gly Tyr Tyr
1 5
<210> 388
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 388
Ile Asn Pro Asn Ser Gly Gly Thr
1 5
<210> 389
<211> 13
<212> Белок
<213> Искусственная последовательность
<400> 389
Ala Arg Glu Gly Glu Ala Val Gly Leu Asp Leu Asp Tyr
1 5 10
<210> 390
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 390
Asn Ile Gly Ser Lys Ser
1 5
<210> 391
<211> 3
<212> Белок
<213> Искусственная последовательность
<400> 391
Tyr Asp Ser
1
<210> 392
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 392
Gln Val Trp Asp Ser Ser Ser Val Val
1 5
<210> 393
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 393
Gly Tyr Thr Phe Thr Gly Tyr Tyr
1 5
<210> 394
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 394
Ile Asn Pro Asn Ser Gly Gly Thr
1 5
<210> 395
<211> 13
<212> Белок
<213> Искусственная последовательность
<400> 395
Ala Arg Glu Gly Glu Ala Val Gly Leu Asp Leu Asp Tyr
1 5 10
<210> 396
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 396
Asn Ile Gly Ser Lys Ser
1 5
<210> 397
<211> 3
<212> Белок
<213> Искусственная последовательность
<400> 397
Tyr Asp Ser
1
<210> 398
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 398
Gln Val Trp Asp Ser Ser Ser Val Val
1 5
<210> 399
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 399
Gly Tyr Thr Phe Thr Ser Tyr Tyr Ile Tyr
1 5 10
<210> 400
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 400
Asn Ile Trp Pro Gly Asn Gly Gly Thr Phe Tyr Gly Glu Lys Phe Met
1 5 10 15
Gly
<210> 401
<211> 12
<212> Белок
<213> Искусственная последовательность
<400> 401
Arg Pro Asp Tyr Ser Gly Asp Asp Tyr Phe Asp Tyr
1 5 10
<210> 402
<211> 13
<212> Белок
<213> Искусственная последовательность
<400> 402
Lys Leu Asn Ser Gly Asn Ile Gly Ser Tyr Tyr Val His
1 5 10
<210> 403
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 403
Arg Asp Asp Lys Arg Pro Asp
1 5
<210> 404
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 404
His Ser Tyr Asp Ser Thr Ile Thr Pro Val
1 5 10
<210> 405
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 405
Asp Tyr Thr Phe Asn Asp Tyr Trp Val Ser
1 5 10
<210> 406
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 406
Glu Ile Tyr Pro Asn Ser Gly Ala Thr Asn Phe Asn Gly Lys Phe Arg
1 5 10 15
Gly
<210> 407
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 407
Glu Tyr Thr Arg Asp Trp Phe Ala Tyr
1 5
<210> 408
<211> 16
<212> Белок
<213> Искусственная последовательность
<400> 408
Arg Ser Ser Gln Ser Leu Leu Asp Ser Asp Gly Asn Thr Tyr Leu Tyr
1 5 10 15
<210> 409
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 409
Leu Val Ser Asn Leu Gly Ser
1 5
<210> 410
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 410
Met Gln Pro Thr His Ala Pro Tyr Thr
1 5
<210> 411
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 411
Asp Tyr Thr Phe Asn Asp Tyr Trp Val Ser
1 5 10
<210> 412
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 412
Glu Ile Tyr Pro Asn Ser Gly Ala Thr Asn Phe Asn Gly Lys Phe Arg
1 5 10 15
Gly
<210> 413
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 413
Glu Tyr Thr Arg Asp Trp Phe Ala Tyr
1 5
<210> 414
<211> 16
<212> Белок
<213> Искусственная последовательность
<400> 414
Arg Ser Ser Gln Ser Leu Leu Asp Ser Asp Gly Asn Thr Tyr Leu Tyr
1 5 10 15
<210> 415
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 415
Leu Val Ser Asn Leu Gly Ser
1 5
<210> 416
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 416
Gln Pro Thr His Ala Pro Tyr Thr
1 5
<210> 417
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 417
Gly Phe Thr Phe Gly Tyr Ser Tyr
1 5
<210> 418
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 418
Ile Gly Ser Gly Ser Ser Tyr Thr
1 5
<210> 419
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 419
Ala Arg Val Tyr Ser Ser Pro Gly Ile Asp Tyr
1 5 10
<210> 420
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 420
Gln Ser Ile Ser Ser Tyr
1 5
<210> 421
<211> 3
<212> Белок
<213> Искусственная последовательность
<400> 421
Ala Ala Ser
1
<210> 422
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 422
Gln Gln Tyr Tyr Thr Trp Val Pro Phe Thr
1 5 10
<210> 423
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 423
Gly Phe Asn Phe Gly Tyr Ser Tyr
1 5
<210> 424
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 424
Ile Gly Ser Thr Ser Ser His Thr
1 5
<210> 425
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 425
Ala Arg Val Tyr Ser Ser Pro Gly Ile Asp Tyr
1 5 10
<210> 426
<211> 6
<212> Белок
<213> Искусственная последовательность
<400> 426
Gln Ser Ile Gly Ser Thr
1 5
<210> 427
<211> 3
<212> Белок
<213> Искусственная последовательность
<400> 427
Gly Ala Ser
1
<210> 428
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 428
Gln Gln Tyr Tyr Thr Trp Val Pro Phe Thr
1 5 10
<210> 429
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 429
Asp Tyr Ala Met His
1 5
<210> 430
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 430
Gly Ile Ser Thr Tyr Asn Gly Asp Ala Ser Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 431
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 431
Ser Asn Tyr Gly Tyr Ala Met Asp Tyr
1 5
<210> 432
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 432
Lys Ser Ser Gln Ser Leu Leu Tyr Ser Ser Asn Gln Lys Asn Tyr Leu
1 5 10 15
Ala
<210> 433
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 433
Trp Ala Ser Thr Arg Glu Ser
1 5
<210> 434
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 434
Gln Gln Tyr Leu Ser Tyr Pro Trp Thr
1 5
<210> 435
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 435
Thr Tyr Ala Met His
1 5
<210> 436
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 436
Tyr Ile Asn Pro Thr Thr Val Tyr Thr Ile Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 437
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 437
Leu Gly Gly His Trp Tyr Phe Asp Val
1 5
<210> 438
<211> 15
<212> Белок
<213> Искусственная последовательность
<400> 438
Arg Ala Ser Glu Ser Val Asp Asn Tyr Gly Ile Ser Phe Met Asn
1 5 10 15
<210> 439
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 439
Ser Ala Ser Asn Gln Gly Ser
1 5
<210> 440
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 440
Gln Gln Ser Lys Glu Val Pro Trp Thr
1 5
<210> 441
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 441
Gly Tyr Trp Ile Glu
1 5
<210> 442
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 442
Glu Ile Leu Pro Gly Gly Gly Thr Val Tyr Tyr Asn Glu Lys Phe Lys
1 5 10 15
Gly
<210> 443
<211> 8
<212> Белок
<213> Искусственная последовательность
<400> 443
Trp Gly Arg Ser Trp Phe Thr His
1 5
<210> 444
<211> 16
<212> Белок
<213> Искусственная последовательность
<400> 444
Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu
1 5 10 15
<210> 445
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 445
Glu Val Ser Asn Arg Phe Ser
1 5
<210> 446
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 446
Phe Gln Gly Ser His Val Pro Arg Thr
1 5
<210> 447
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 447
Ser Tyr Trp Met Asp
1 5
<210> 448
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 448
Asn Ile Tyr Pro Asp Ser Gly Gly Thr Asn Tyr Ala Glu Lys Phe Lys
1 5 10 15
Ser
<210> 449
<211> 12
<212> Белок
<213> Искусственная последовательность
<400> 449
Glu Glu Ala Leu Gly Gly Tyr Tyr Glu Leu Thr Tyr
1 5 10
<210> 450
<211> 15
<212> Белок
<213> Искусственная последовательность
<400> 450
Arg Ala Ser Gln Ser Val Ser Thr Ser Ser Tyr Ser Tyr Met His
1 5 10 15
<210> 451
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 451
Tyr Ala Ser Asn Leu Glu Ser
1 5
<210> 452
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 452
Gln His Ser Trp Glu Ile Pro Tyr Thr
1 5
<210> 453
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 453
Asn Tyr Trp Leu Gly
1 5
<210> 454
<211> 17
<212> Белок
<213> Искусственная последовательность
<400> 454
Asp Ile Tyr Pro Gly Asn Gly Asn Asn Tyr Tyr Ser Glu Lys Phe Lys
1 5 10 15
Asp
<210> 455
<211> 10
<212> Белок
<213> Искусственная последовательность
<400> 455
His Gly Ser Phe Arg Ser Ala Met Asp Tyr
1 5 10
<210> 456
<211> 11
<212> Белок
<213> Искусственная последовательность
<400> 456
Arg Ala Ser Glu Asn Ile Tyr Ser Tyr Leu Ala
1 5 10
<210> 457
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 457
Asn Ala Lys Thr Leu Ala Asp
1 5
<210> 458
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 458
Gln His His Tyr Gly Thr Pro Pro Thr
1 5
<210> 459
<211> 121
<212> Белок
<213> Искусственная последовательность
<400> 459
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Ser Pro Glu Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn His Gly Gly Tyr Val Thr Tyr Asn Pro Ser Leu Glu
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Asp Tyr Gly Pro Gly Asn Tyr Asp Trp Tyr Phe Asp Leu Trp Gly
100 105 110
Arg Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 460
<211> 109
<212> Белок
<213> Искусственная последовательность
<400> 460
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Pro
85 90 95
Ala Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 461
<211> 114
<212> Белок
<213> Искусственная последовательность
<400> 461
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Ile Lys Asn Asp Gly Ser Tyr Thr Asn Tyr Ala Pro Ser Leu
50 55 60
Thr Asn Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Leu Thr Gly Thr Trp Gly Gln Gly Thr Met Val Thr Val
100 105 110
Ser Ser
<210> 462
<211> 113
<212> Белок
<213> Искусственная последовательность
<400> 462
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Leu Leu Ser Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Tyr Ala Ser Thr Arg Gln Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Leu Gln
85 90 95
Tyr Asp Arg Tyr Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 463
<211> 116
<212> Белок
<213> Искусственная последовательность
<400> 463
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Ser Thr Tyr
20 25 30
Trp Ile Ser Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Lys Ile Tyr Pro Gly Asp Ser Tyr Thr Asn Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Tyr Gly Ile Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 464
<211> 108
<212> Белок
<213> Искусственная последовательность
<400> 464
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Ser Ile Thr Cys Ser Gly Asp Asn Ile Gly Asp Gln Tyr Ala
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Val Leu Val Ile Tyr
35 40 45
Gln Asp Lys Asn Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Ala Thr Tyr Thr Gly Phe Gly Ser Leu
85 90 95
Ala Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 465
<211> 124
<212> Белок
<213> Искусственная последовательность
<400> 465
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Val Ser Asp Tyr
20 25 30
Tyr Met Asn Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Ser Ser Ala Ser Gly Ser Thr Ile Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Asn Asn Ser
65 70 75 80
Leu Tyr Leu His Met Asp Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr
85 90 95
Phe Cys Ala Arg Val Val Pro Ala Gly Ser Gly Trp Arg Trp Phe Asp
100 105 110
Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 466
<211> 111
<212> Белок
<213> Искусственная последовательность
<400> 466
Gln Ser Val Leu Ile Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Thr Gly Ile Ser Ser Asp Val Gly Ala Tyr
20 25 30
Asp Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Val Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Ser Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asp Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser His Ala Gly Ser
85 90 95
Asn Asn Phe Tyr Val Phe Gly Thr Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 467
<211> 123
<212> Белок
<213> Искусственная последовательность
<400> 467
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Asn Asp Tyr Ala
50 55 60
Pro Ser Val Glu Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Ser Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Asp Pro Pro Tyr Val Leu Ser Thr Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 468
<211> 110
<212> Белок
<213> Искусственная последовательность
<400> 468
Asn Phe Met Leu Thr Gln Pro Pro Ser Val Ser Glu Ser Pro Gly Lys
1 5 10 15
Thr Val Thr Ile Ser Cys Thr Arg Ser Ser Gly Asn Ile Ala Ser Phe
20 25 30
Tyr Val Gln Trp Phe Gln Gln Arg Pro Gly Ser Ser Pro Thr Thr Val
35 40 45
Ile Tyr Glu Asp Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Ile Asp Arg Ser Ser Asn Ser Ala Ser Leu Thr Ile Ser Gly
65 70 75 80
Leu Thr Thr Asp Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Thr
85 90 95
Asn Asn Val Ile Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 469
<211> 123
<212> Белок
<213> Искусственная последовательность
<400> 469
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Thr Tyr Tyr Arg Ser Arg Trp Tyr Ser Asp Tyr Ala
50 55 60
Ser Ser Val Glu Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Ser Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Asp Pro Pro Tyr Val Leu Ser Thr Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 470
<211> 110
<212> Белок
<213> Искусственная последовательность
<400> 470
Asn Phe Met Leu Thr Gln Pro Pro Ser Val Ser Glu Ser Pro Gly Lys
1 5 10 15
Thr Val Thr Ile Ser Cys Thr Arg Ser Ser Gly Asn Ile Ala Ser Phe
20 25 30
Tyr Val Gln Trp Phe Gln Gln Arg Pro Gly Ser Ser Pro Thr Thr Val
35 40 45
Ile Tyr Glu Asp Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Ile Asp Arg Ser Ser Asn Ser Ala Ser Leu Thr Ile Ser Gly
65 70 75 80
Leu Thr Thr Asp Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Thr
85 90 95
Asn Asn Val Ile Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 471
<211> 123
<212> Белок
<213> Искусственная последовательность
<400> 471
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asp
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Asn Asp Tyr Ala
50 55 60
Pro Ser Val Glu Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Ser Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Asp Pro Pro Tyr Val Leu Ser Thr Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 472
<211> 110
<212> Белок
<213> Искусственная последовательность
<400> 472
Asn Phe Met Leu Thr Gln Pro Pro Ser Val Ser Glu Ser Pro Gly Lys
1 5 10 15
Thr Val Thr Ile Ser Cys Thr Arg Ser Ser Gly Asn Ile Ala Ser Phe
20 25 30
Tyr Val Gln Trp Phe Gln Gln Arg Pro Gly Ser Ser Pro Thr Thr Val
35 40 45
Ile Tyr Glu Asp Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Ile Asp Arg Ser Ser Asn Ser Ala Ser Leu Thr Ile Ser Gly
65 70 75 80
Leu Thr Thr Asp Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Thr
85 90 95
Asn Asn Val Ile Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 473
<211> 123
<212> Белок
<213> Искусственная последовательность
<400> 473
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Asn Asp Tyr Ala
50 55 60
Pro Ser Val Glu Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Ser Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Asp Pro Pro Tyr Val Leu Ser Thr Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 474
<211> 110
<212> Белок
<213> Искусственная последовательность
<400> 474
Asn Phe Met Leu Thr Gln Pro Pro Ser Val Ser Glu Ser Pro Gly Lys
1 5 10 15
Thr Val Thr Ile Ser Cys Thr Arg Ser Ser Gly Asn Ile Ala Ser Phe
20 25 30
Tyr Val Gln Trp Phe Gln Gln Arg Pro Gly Ser Ser Pro Thr Thr Val
35 40 45
Ile Tyr Asp Asp Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Ile Asp Arg Ser Ser Asn Ser Ala Ser Leu Thr Ile Ser Gly
65 70 75 80
Leu Thr Thr Asp Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Thr
85 90 95
Asn Asn Val Ile Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 475
<211> 123
<212> Белок
<213> Искусственная последовательность
<400> 475
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Asn Asp Tyr Ala
50 55 60
Pro Ser Val Glu Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Ser Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Asp Pro Pro Tyr Val Leu Ser Thr Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 476
<211> 110
<212> Белок
<213> Искусственная последовательность
<400> 476
Asn Phe Met Leu Thr Gln Pro Pro Ser Val Ser Glu Ser Pro Gly Lys
1 5 10 15
Thr Val Thr Ile Ser Cys Thr Arg Ser Ser Gly Asn Ile Ala Ser Phe
20 25 30
Tyr Val Gln Trp Phe Gln Gln Arg Pro Gly Ser Ser Pro Thr Thr Val
35 40 45
Ile Tyr Glu Asp Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Ile Asp Arg Ser Ser Asn Ser Ala Ser Leu Thr Ile Ser Gly
65 70 75 80
Leu Thr Thr Asp Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Thr
85 90 95
Asn Lys Val Ile Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 477
<211> 123
<212> Белок
<213> Искусственная последовательность
<400> 477
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Asn Asp Tyr Ala
50 55 60
Pro Ser Val Glu Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Ser Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Asp Pro Pro Tyr Val Leu Ser Thr Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 478
<211> 110
<212> Белок
<213> Искусственная последовательность
<400> 478
Asn Phe Met Leu Thr Gln Pro Pro Ser Val Ser Glu Ser Pro Gly Lys
1 5 10 15
Thr Val Thr Ile Ser Cys Thr Arg Ser Ser Gly Asn Ile Ala Ser Phe
20 25 30
Tyr Val Gln Trp Phe Gln Gln Arg Pro Gly Ser Ser Pro Thr Thr Val
35 40 45
Ile Tyr Glu Asp Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Ile Asp Arg Ser Ser Asn Ser Ala Ser Leu Thr Ile Ser Gly
65 70 75 80
Leu Thr Thr Asp Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Ile
85 90 95
Asn Lys Val Ile Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 479
<211> 123
<212> Белок
<213> Искусственная последовательность
<400> 479
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Asn Asp Tyr Ala
50 55 60
Pro Ser Val Glu Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Ser Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Asp Pro Pro Tyr Val Leu Ser Thr Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 480
<211> 110
<212> Белок
<213> Искусственная последовательность
<400> 480
Asn Phe Met Leu Thr Gln Pro Pro Ser Val Ser Glu Ser Pro Gly Lys
1 5 10 15
Thr Val Thr Ile Ser Cys Thr Arg Ser Ser Gly Asn Ile Ala Ser Phe
20 25 30
Tyr Val Gln Trp Phe Gln Gln Arg Pro Gly Ser Ser Pro Thr Thr Val
35 40 45
Ile Tyr Asp Asp Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Ile Asp Arg Ser Ser Asn Ser Ala Ser Leu Thr Ile Ser Gly
65 70 75 80
Leu Thr Thr Asp Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Ile
85 90 95
Asn Lys Val Ile Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 481
<211> 120
<212> Белок
<213> Искусственная последовательность
<400> 481
Gln Met Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Met Pro Asp Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Arg Thr Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Ala Ala Phe Arg Leu Glu Leu Asp Ala Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 482
<211> 106
<212> Белок
<213> Искусственная последовательность
<400> 482
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Tyr Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Val Val
85 90 95
Phe Gly Gly Gly Thr Gln Leu Thr Val Leu
100 105
<210> 483
<211> 120
<212> Белок
<213> Искусственная последовательность
<400> 483
Gln Met Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Val Asn Pro Lys Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Trp Ala Arg Arg Ile Asp Leu Asp Glu Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 484
<211> 106
<212> Белок
<213> Искусственная последовательность
<400> 484
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Tyr Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Val Val
85 90 95
Phe Gly Gly Gly Thr Gln Leu Thr Val Leu
100 105
<210> 485
<211> 117
<212> Белок
<213> Искусственная последовательность
<400> 485
Gln Met Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Ser Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Val Asn Pro Met Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Met Ala Met Arg Leu Glu Leu Asp Lys Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr
115
<210> 486
<211> 106
<212> Белок
<213> Искусственная последовательность
<400> 486
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Tyr Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Val Val
85 90 95
Phe Gly Gly Gly Thr Gln Leu Thr Val Leu
100 105
<210> 487
<211> 120
<212> Белок
<213> Искусственная последовательность
<400> 487
Gln Met Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Asn Phe Gly Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Val Asn Pro His Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Glu Ala Trp Gly Leu Asp Leu Asp Leu Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 488
<211> 106
<212> Белок
<213> Искусственная последовательность
<400> 488
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Tyr Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Val Val
85 90 95
Phe Gly Gly Gly Thr Gln Leu Thr Val Leu
100 105
<210> 489
<211> 120
<212> Белок
<213> Искусственная последовательность
<400> 489
Gln Met Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Asn Trp Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Met Ala Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Trp Ala Arg Gly Val Glu Leu Asp Met Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 490
<211> 106
<212> Белок
<213> Искусственная последовательность
<400> 490
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Tyr Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Val Val
85 90 95
Phe Gly Gly Gly Thr Gln Leu Thr Val Leu
100 105
<210> 491
<211> 120
<212> Белок
<213> Искусственная последовательность
<400> 491
Gln Met Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Asn Phe Gly Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Val Asn Pro Lys Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Glu Ala Val Gly Leu Asp Leu Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 492
<211> 106
<212> Белок
<213> Искусственная последовательность
<400> 492
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Tyr Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Val Val
85 90 95
Phe Gly Gly Gly Thr Gln Leu Thr Val Leu
100 105
<210> 493
<211> 120
<212> Белок
<213> Искусственная последовательность
<400> 493
Gln Met Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Leu Glu Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Glu Ala Val Gly Leu Asp Leu Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 494
<211> 106
<212> Белок
<213> Искусственная последовательность
<400> 494
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Tyr Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Val Val
85 90 95
Phe Gly Gly Gly Thr Gln Leu Thr Val Leu
100 105
<210> 495
<211> 120
<212> Белок
<213> Искусственная последовательность
<400> 495
Gln Met Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Leu Glu Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Glu Ala Val Gly Leu Asp Leu Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 496
<211> 106
<212> Белок
<213> Искусственная последовательность
<400> 496
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Tyr Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Val Val
85 90 95
Phe Gly Gly Gly Thr Gln Leu Thr Val Leu
100 105
<210> 497
<211> 120
<212> Белок
<213> Искусственная последовательность
<400> 497
Gln Met Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Glu Ala Val Gly Leu Asp Leu Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 498
<211> 106
<212> Белок
<213> Искусственная последовательность
<400> 498
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Tyr Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Val Val
85 90 95
Phe Gly Gly Gly Thr Gln Leu Thr Val Leu
100 105
<210> 499
<211> 121
<212> Белок
<213> Искусственная последовательность
<400> 499
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Ile Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Trp Pro Gly Asn Gly Gly Thr Phe Tyr Gly Glu Lys Phe
50 55 60
Met Gly Arg Ala Thr Phe Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Pro Asp Tyr Ser Gly Asp Asp Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 500
<211> 111
<212> Белок
<213> Искусственная последовательность
<400> 500
Ser Val Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Lys Leu Asn Ser Gly Asn Ile Gly Ser Tyr
20 25 30
Tyr Val His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Thr Met
35 40 45
Ile Tyr Arg Asp Asp Lys Arg Pro Asp Gly Ile Pro Glu Arg Phe Ser
50 55 60
Gly Ser Ser Asp Ser Ser Ser Asn Ser Ala Phe Leu Thr Ile Ser Gly
65 70 75 80
Val Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys His Ser Tyr Asp Ser
85 90 95
Thr Ile Thr Pro Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 501
<211> 118
<212> Белок
<213> Искусственная последовательность
<400> 501
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Asp Tyr Thr Phe Asn Asp Tyr
20 25 30
Trp Val Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Tyr Pro Asn Ser Gly Ala Thr Asn Phe Asn Gly Lys Phe
50 55 60
Arg Gly Arg Ala Thr Leu Thr Val Asp Asn Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Glu Tyr Thr Arg Asp Trp Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 502
<211> 112
<212> Белок
<213> Искусственная последовательность
<400> 502
Asp Val Val Leu Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Tyr Trp Phe Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Arg Leu Ile Tyr Leu Val Ser Asn Leu Gly Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Pro
85 90 95
Thr His Ala Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 503
<211> 118
<212> Белок
<213> Искусственная последовательность
<400> 503
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Asp Tyr Thr Phe Asn Asp Tyr
20 25 30
Trp Val Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Tyr Pro Asn Ser Gly Ala Thr Asn Phe Asn Gly Lys Phe
50 55 60
Arg Gly Arg Ala Thr Leu Thr Val Asp Asn Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Glu Tyr Thr Arg Asp Trp Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 504
<211> 112
<212> Белок
<213> Искусственная последовательность
<400> 504
Asp Val Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Asn Thr Tyr Leu Tyr Trp Phe Gln Gln Lys Pro Gly Lys Ala
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Asn Leu Gly Ser Gly Val Pro
50 55 60
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Met Gln Pro
85 90 95
Thr His Ala Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 505
<211> 117
<212> Белок
<213> Искусственная последовательность
<400> 505
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gly Tyr Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Val Ser
35 40 45
Ser Ile Gly Ser Gly Ser Ser Tyr Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Val Tyr Ser Ser Pro Gly Ile Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 506
<211> 107
<212> Белок
<213> Искусственная последовательность
<400> 506
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Thr Trp Val Pro
85 90 95
Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
100 105
<210> 507
<211> 120
<212> Белок
<213> Искусственная последовательность
<400> 507
Val His Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro
1 5 10 15
Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Phe Gly
20 25 30
Tyr Ser Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
35 40 45
Trp Val Ser Ser Ile Gly Ser Thr Ser Ser His Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Val Tyr Ser Ser Pro Gly Ile Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 508
<211> 107
<212> Белок
<213> Искусственная последовательность
<400> 508
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly Ser Thr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Thr Trp Val Pro
85 90 95
Phe Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 509
<211> 118
<212> Белок
<213> Искусственная последовательность
<400> 509
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Val
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Met His Trp Val Lys Gln Ser His Val Lys Ser Leu Glu Trp Ile
35 40 45
Gly Gly Ile Ser Thr Tyr Asn Gly Asp Ala Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Met Thr Val Asp Lys Ser Ser Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Val Arg Leu Thr Ser Glu Asp Ser Ala Ile Tyr Tyr Cys
85 90 95
Ala Pro Ser Asn Tyr Gly Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser
115
<210> 510
<211> 113
<212> Белок
<213> Искусственная последовательность
<400> 510
Asp Ile Val Met Ser Gln Ser Pro Ser Ser Leu Ala Val Ser Val Gly
1 5 10 15
Glu Lys Val Ser Val Ser Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Ser Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Lys Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Leu Ser Tyr Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Asn
<210> 511
<211> 118
<212> Белок
<213> Искусственная последовательность
<400> 511
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Thr Tyr
20 25 30
Ala Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Thr Thr Val Tyr Thr Ile Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Gly Gly His Trp Tyr Phe Asp Val Trp Gly Ala Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 512
<211> 111
<212> Белок
<213> Искусственная последовательность
<400> 512
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Asn Tyr
20 25 30
Gly Ile Ser Phe Met Asn Trp Phe Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ser Ala Ser Asn Gln Gly Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Ser Leu Asn Ile His
65 70 75 80
Pro Met Glu Glu Asp Asp Thr Ala Met Tyr Phe Cys Gln Gln Ser Lys
85 90 95
Glu Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 513
<211> 117
<212> Белок
<213> Искусственная последовательность
<400> 513
Gln Val Gln Leu Gln Gln Ser Gly Thr Glu Leu Met Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Gly Tyr
20 25 30
Trp Ile Glu Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Leu Pro Gly Gly Gly Thr Val Tyr Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Phe Thr Ala Glu Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Val Gln Leu Ser Ser Leu Thr Thr Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Trp Gly Arg Ser Trp Phe Thr His Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 514
<211> 112
<212> Белок
<213> Искусственная последовательность
<400> 514
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Glu Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Ile Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 515
<211> 121
<212> Белок
<213> Искусственная последовательность
<400> 515
Gln Val Gln Leu Gln Gln Pro Glu Ser Glu Leu Val Arg Pro Gly Gly
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asp Trp Val Lys Gln Arg His Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Asp Ser Gly Gly Thr Asn Tyr Ala Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met His Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Glu Glu Ala Leu Gly Gly Tyr Tyr Glu Leu Thr Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ala
115 120
<210> 516
<211> 111
<212> Белок
<213> Искусственная последовательность
<400> 516
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Gln Ser Val Ser Thr Ser
20 25 30
Ser Tyr Ser Tyr Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Lys Tyr Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile His
65 70 75 80
Pro Val Glu Glu Glu Asp Thr Ala Thr Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Ile Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Glu
100 105 110
<210> 517
<211> 119
<212> Белок
<213> Искусственная последовательность
<400> 517
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Thr
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Trp Leu Gly Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Gly Asn Gly Asn Asn Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Val Tyr
65 70 75 80
Ile Arg Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg His Gly Ser Phe Arg Ser Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser
115
<210> 518
<211> 107
<212> Белок
<213> Искусственная последовательность
<400> 518
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Pro Ser Ala Ser Val Gly
1 5 10 15
Glu Thr Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Asn Ala Lys Thr Leu Ala Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gln Phe Ser Leu Lys Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Gly Ser Tyr Tyr Cys Gln His His Tyr Gly Thr Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА ПРОТИВ CD40 И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2796413C2 |
| АНТИТЕЛА ПРОТИВ OX40 И ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2783314C2 |
| АНТИТЕЛА ПРОТИВ CTLA4 И ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2779312C2 |
| АНТИТЕЛО ДЛЯ СПЕЦИФИЧЕСКОГО СВЯЗЫВАНИЯ С РЕЦЕПТОРОМ ИНТЕРЛЕЙКИНА 4 | 2017 |
|
RU2774446C2 |
| АНТИТЕЛО ПРОТИВ КЛАУДИНА 18A2 И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2811431C2 |
| БЕЛКИ УПРАВЛЕНИЯ, НАВИГАЦИИ И КОНТРОЛЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2019 |
|
RU2811457C2 |
| МУЛЬТИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2018 |
|
RU2837770C2 |
| Антитело против FXI/FXIA, его антигенсвязывающий фрагмент и фармацевтическое применение | 2021 |
|
RU2838408C1 |
| КОНЬЮГАТ АНТИТЕЛА К КЛАУДИНУ И ЛЕКАРСТВЕННОГО СРЕДСТВА И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2826119C1 |
| МУЛЬТИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2018 |
|
RU2811477C2 |
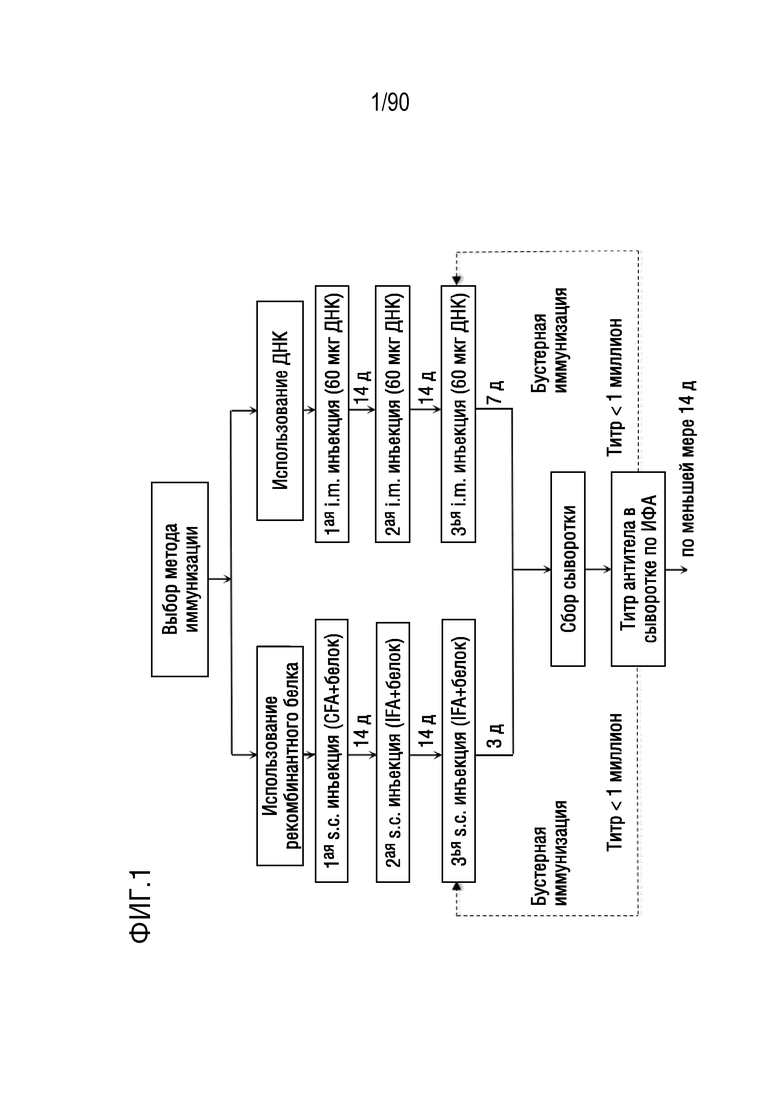
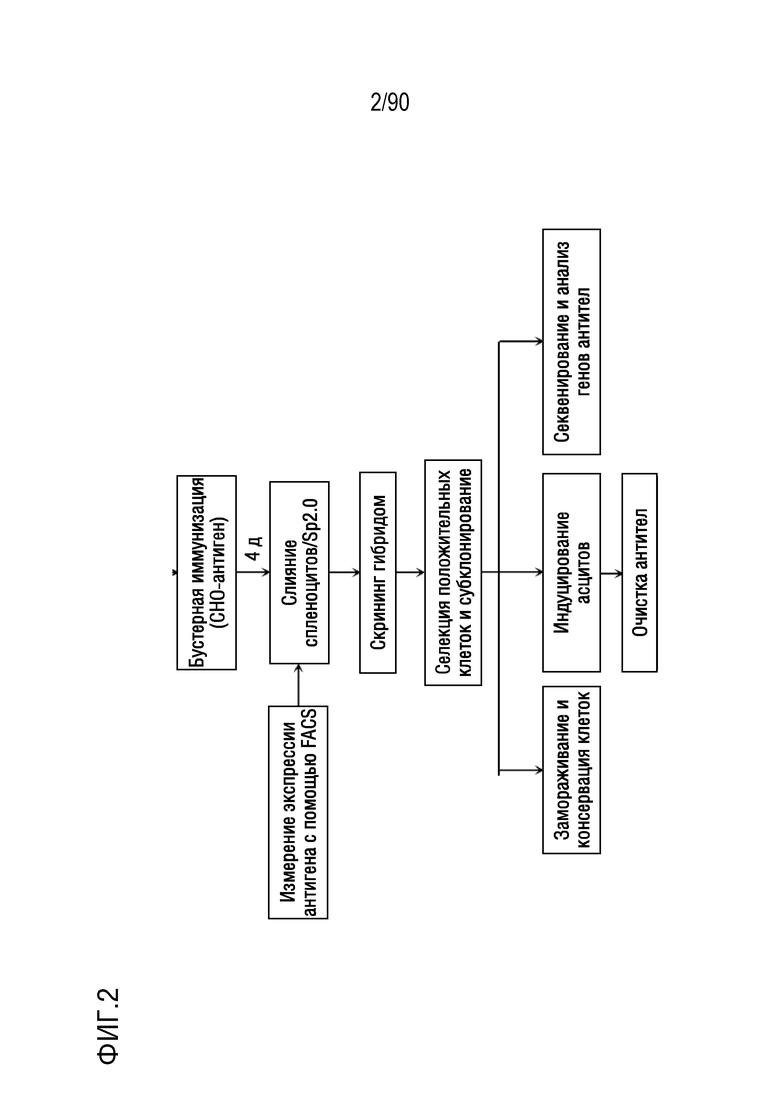
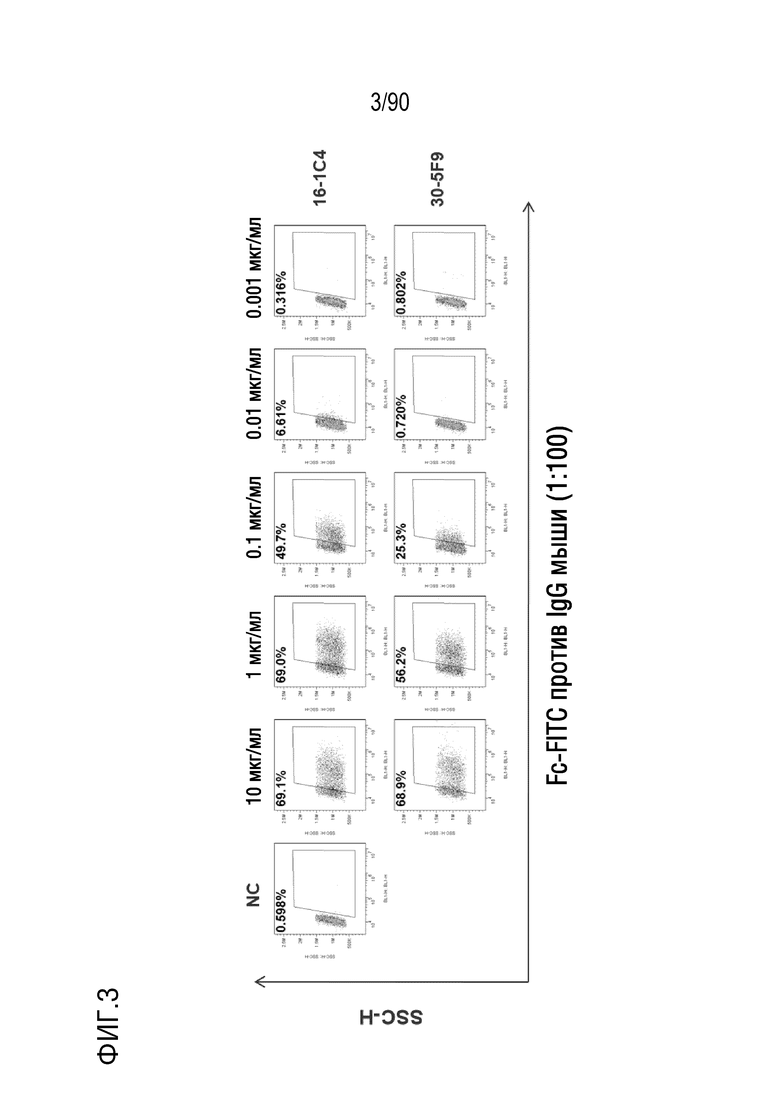

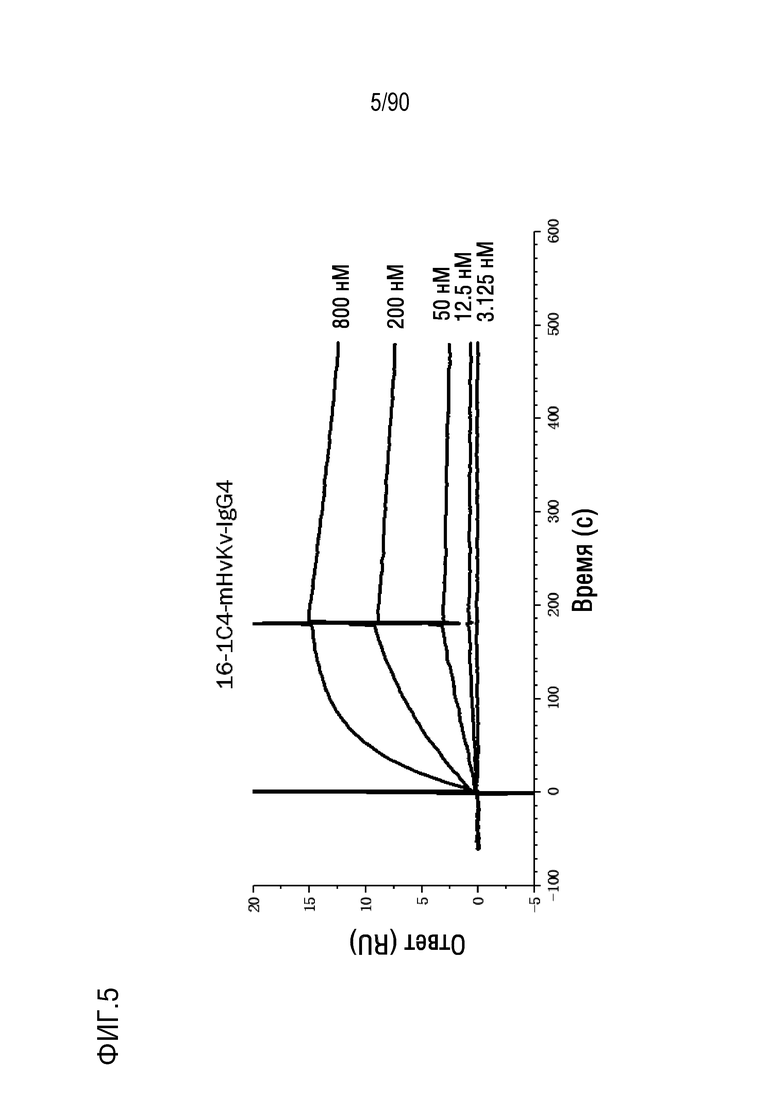

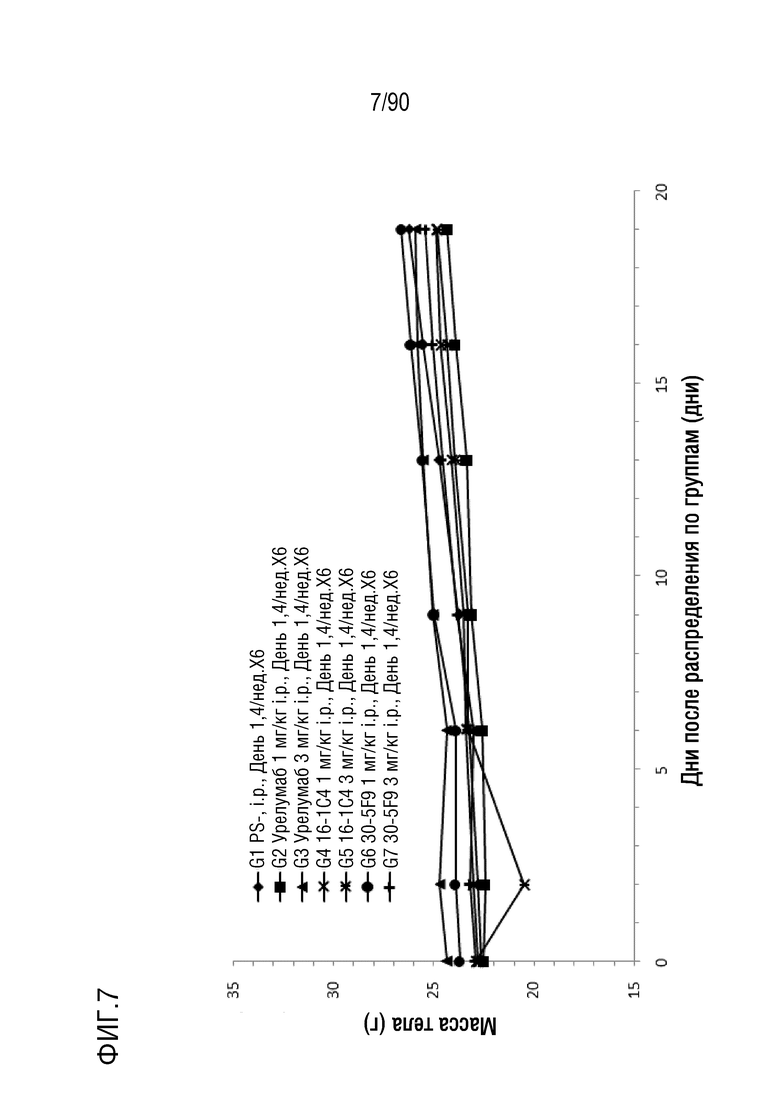
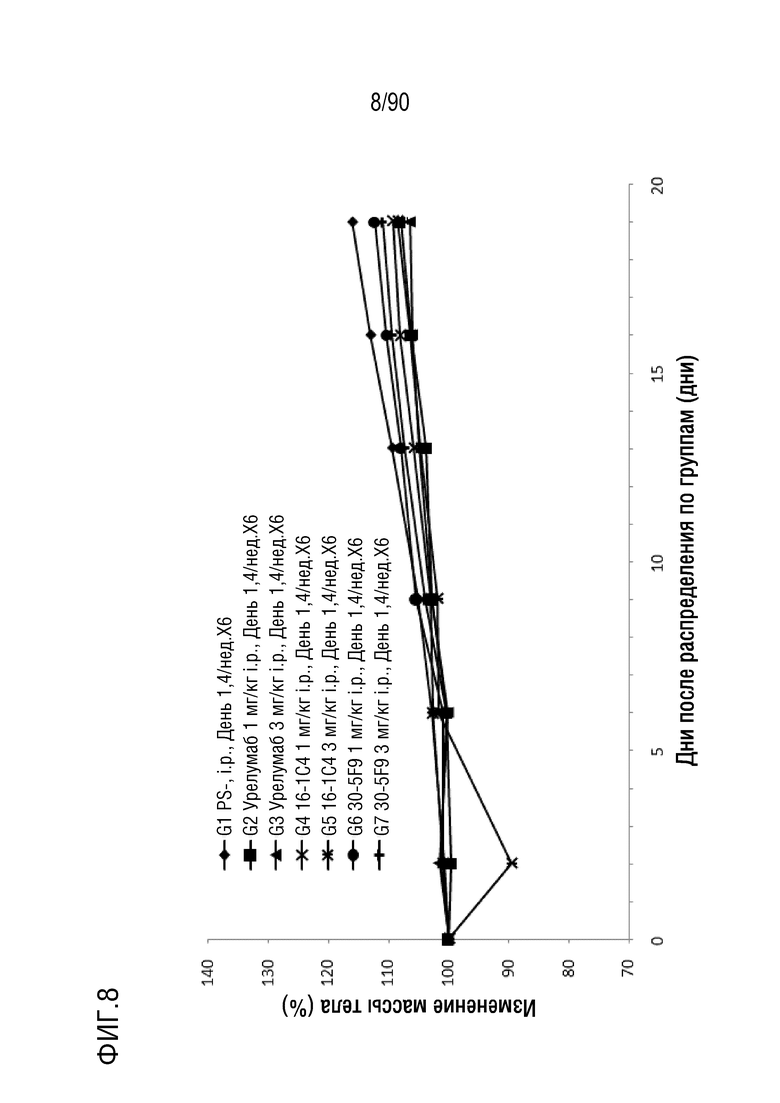
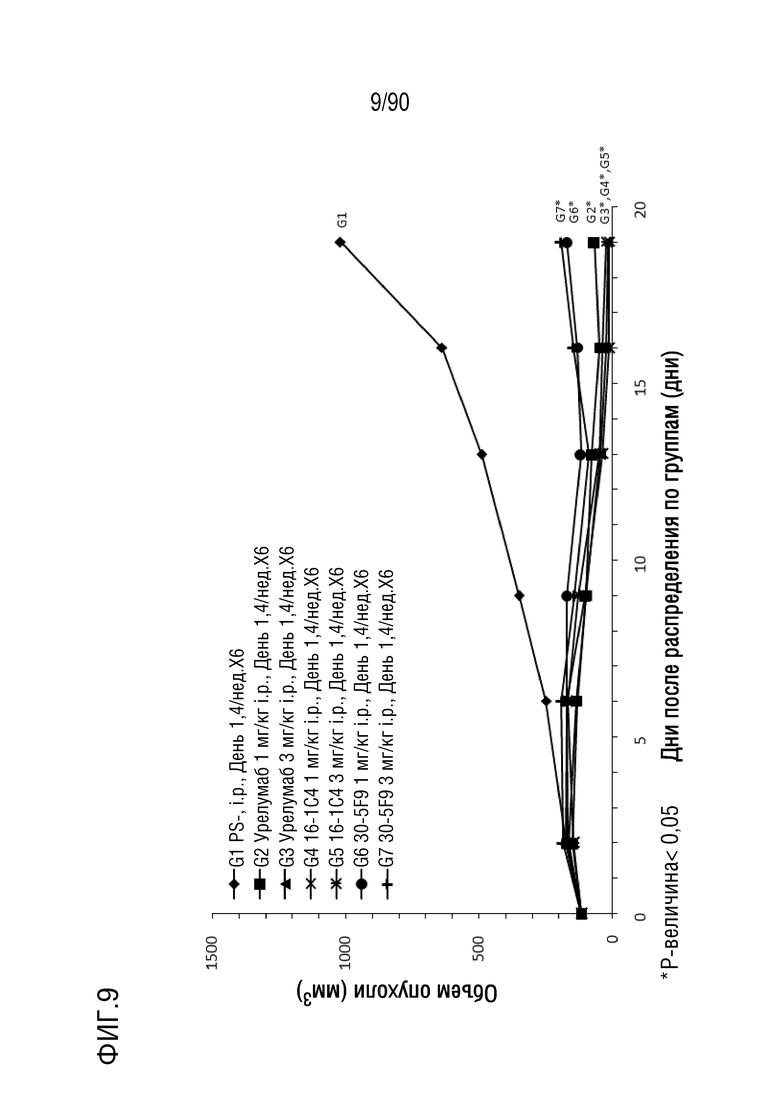

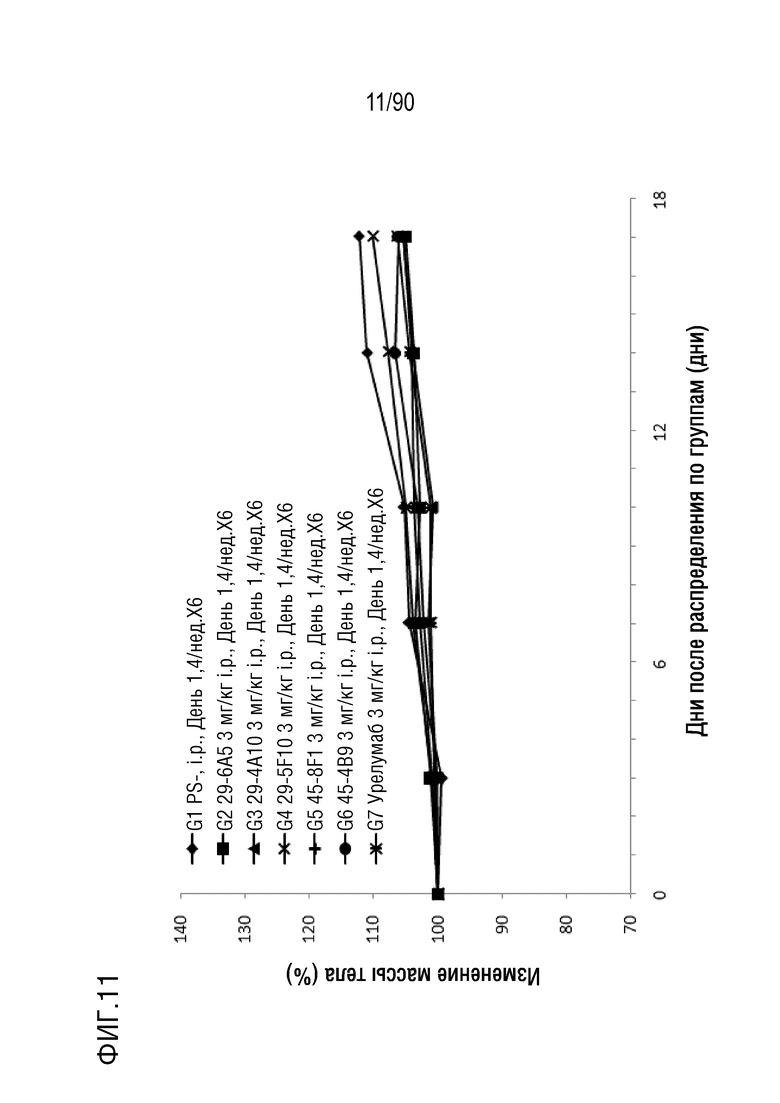
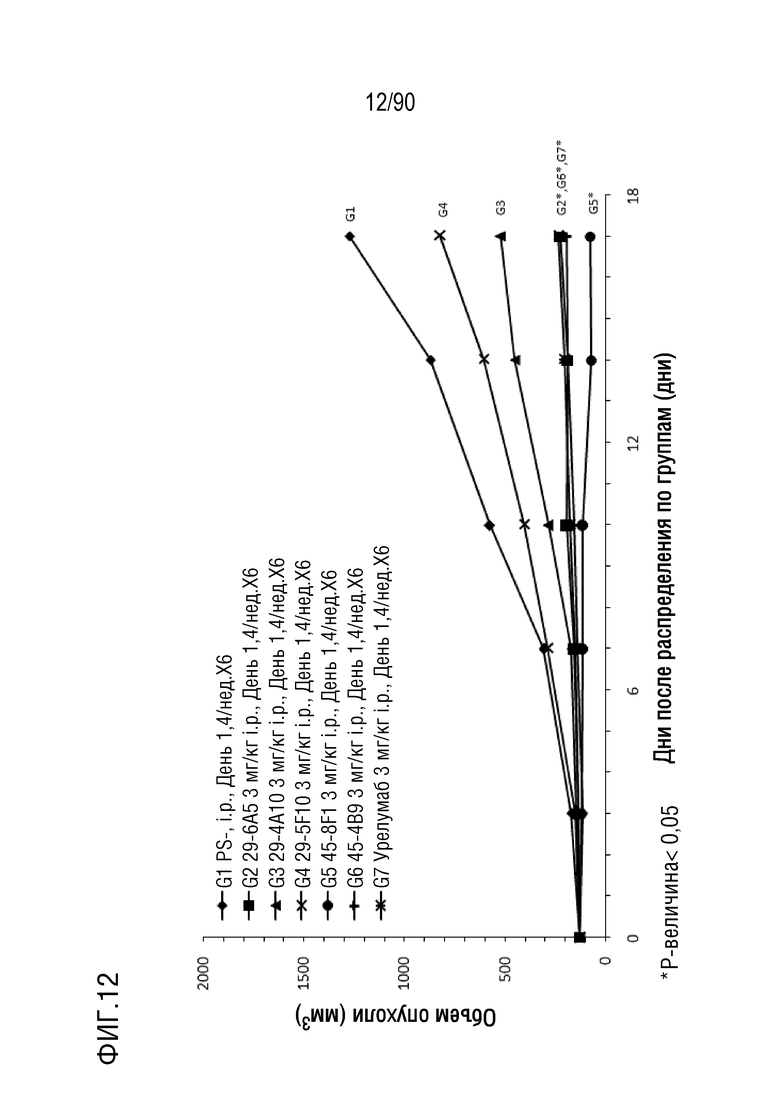

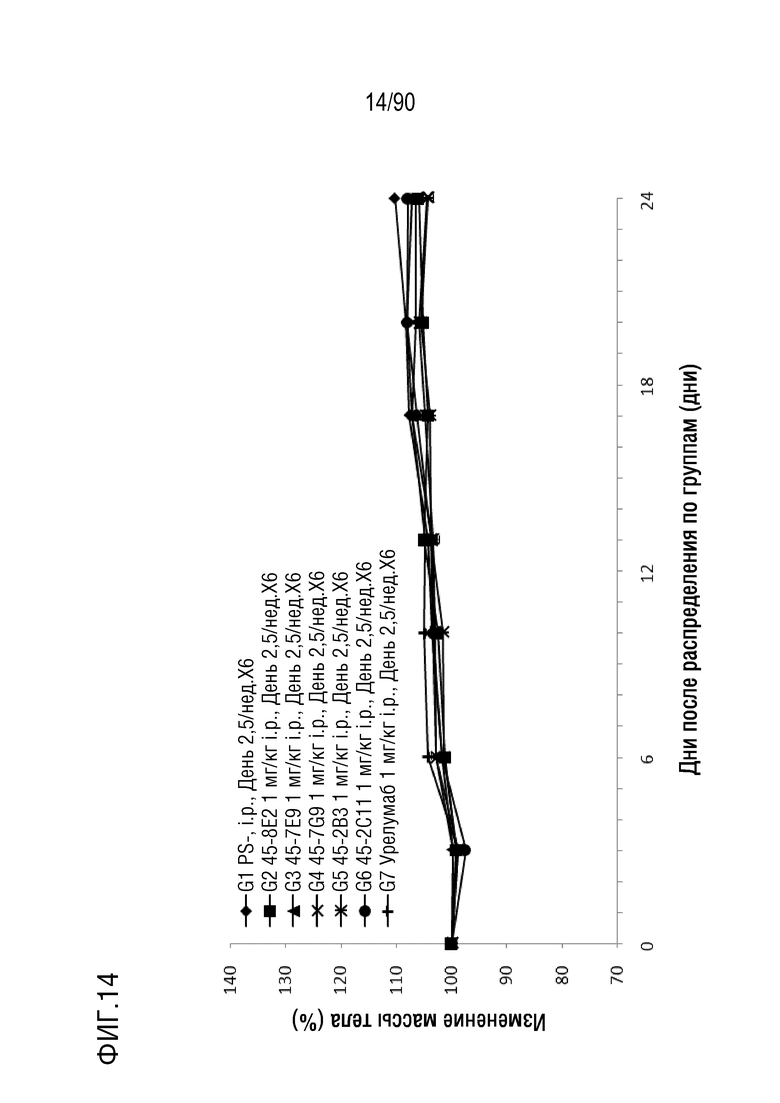
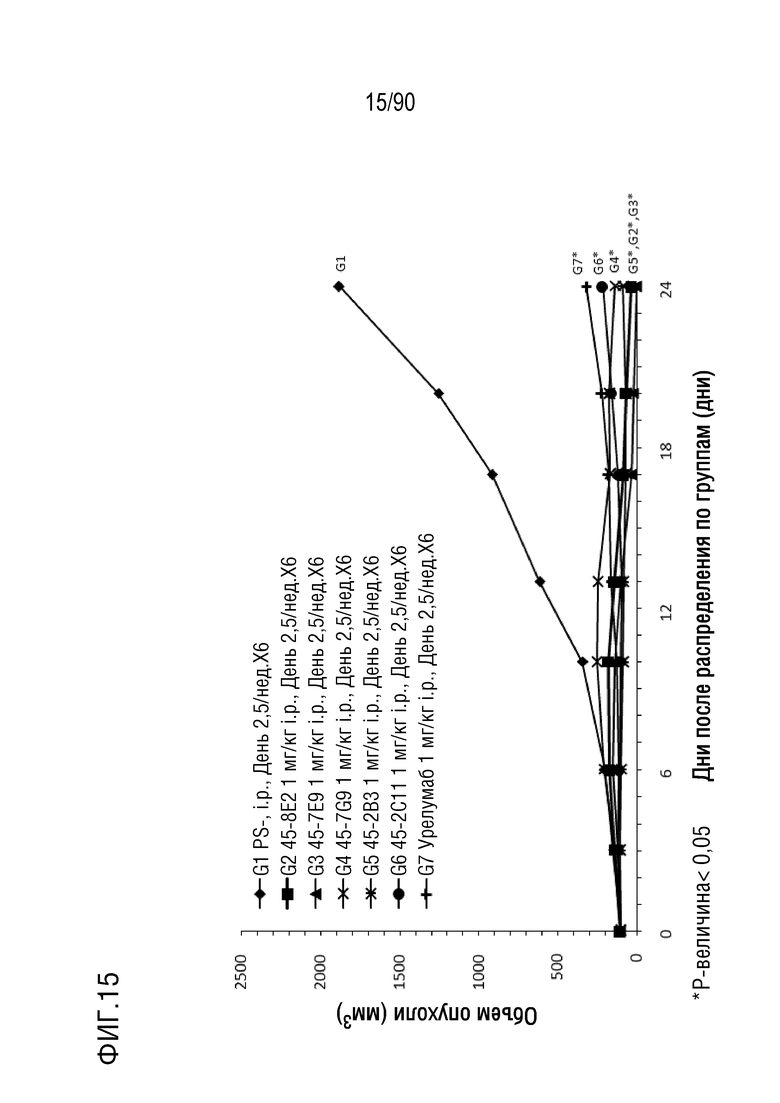
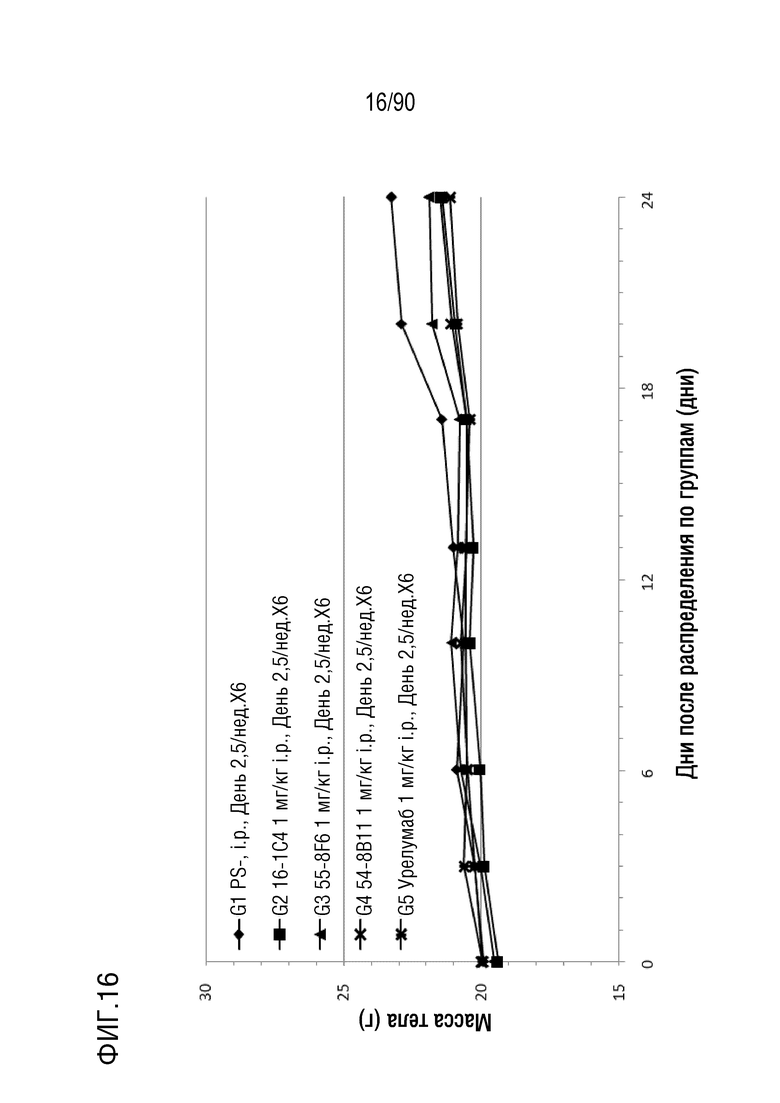
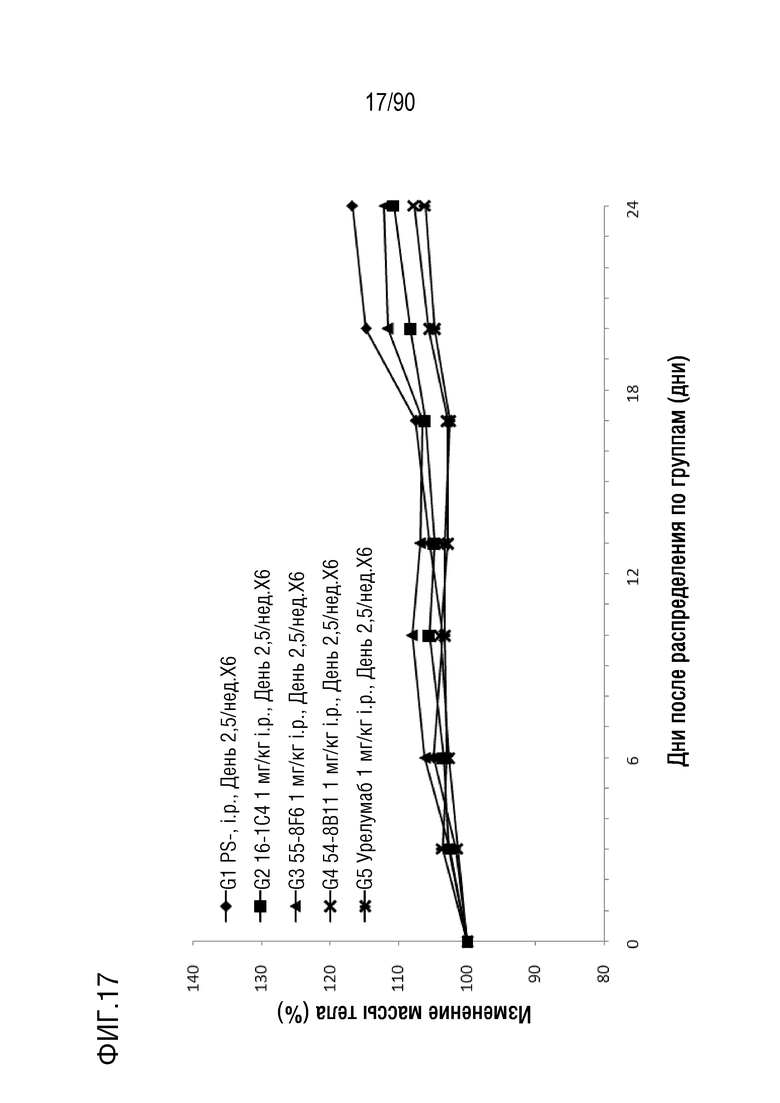
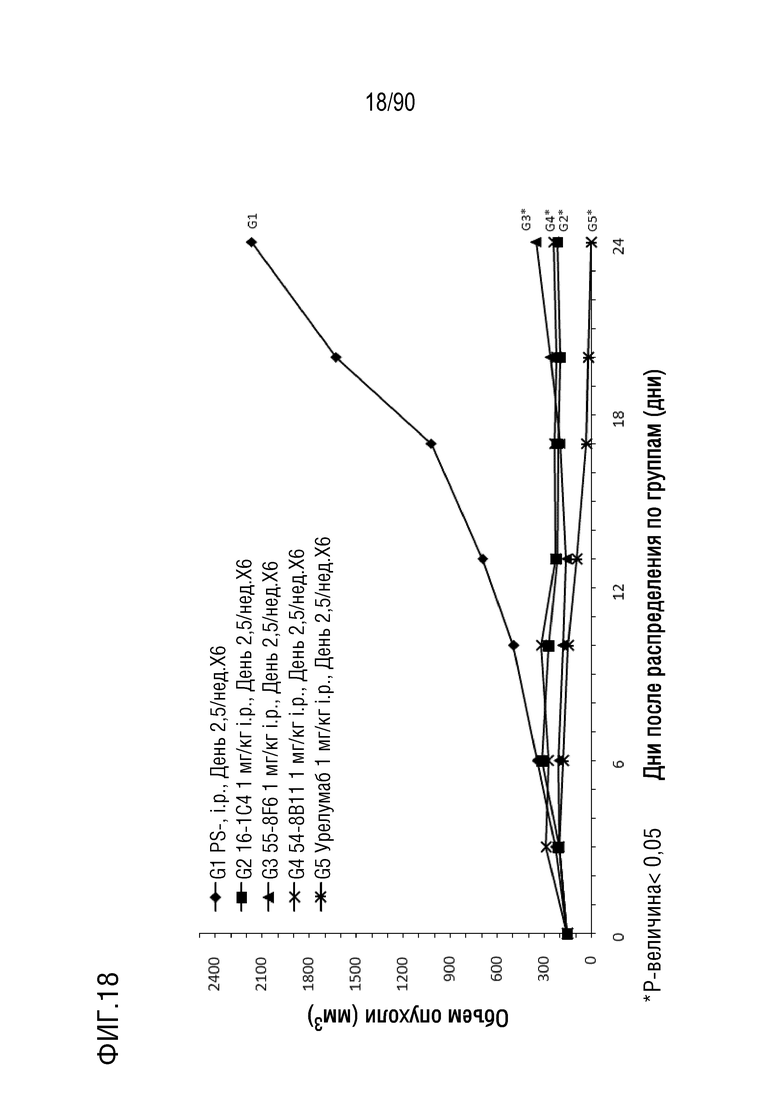
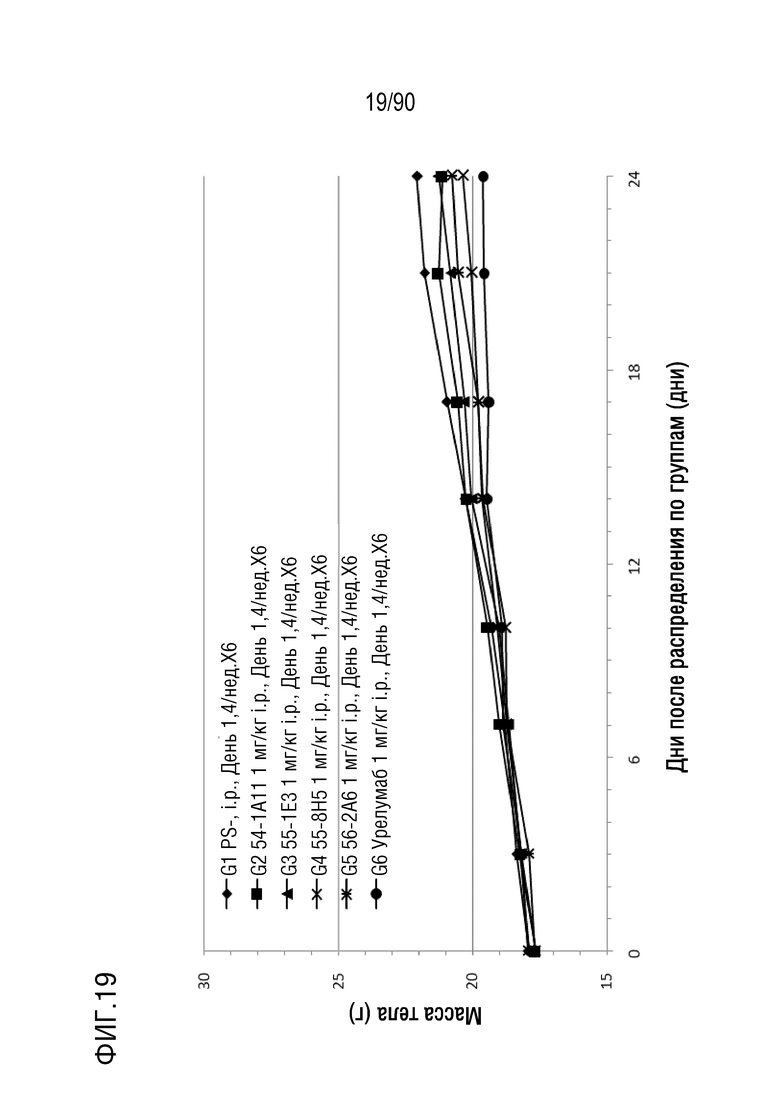

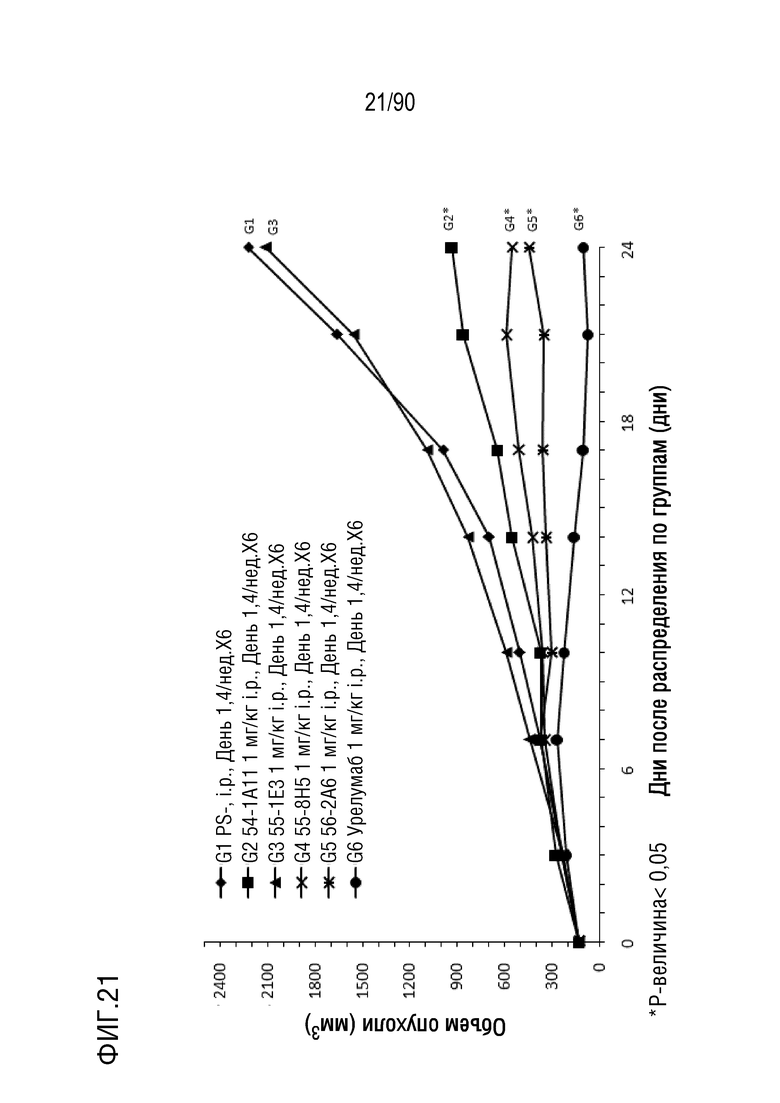
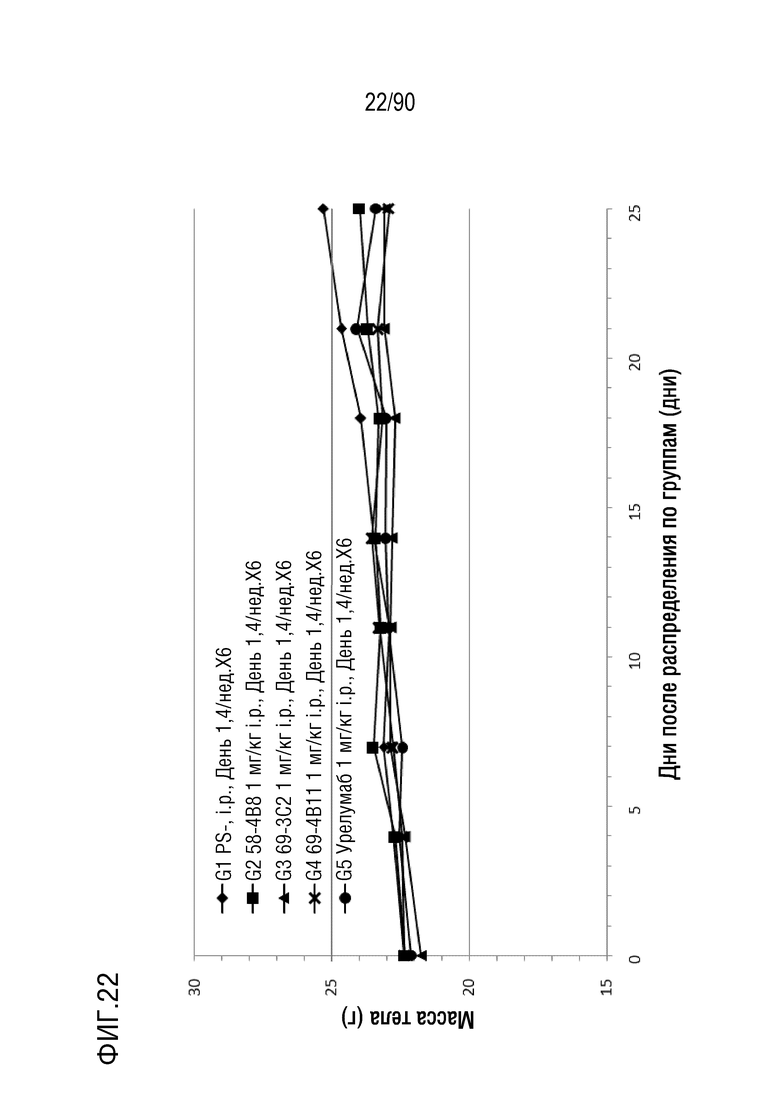
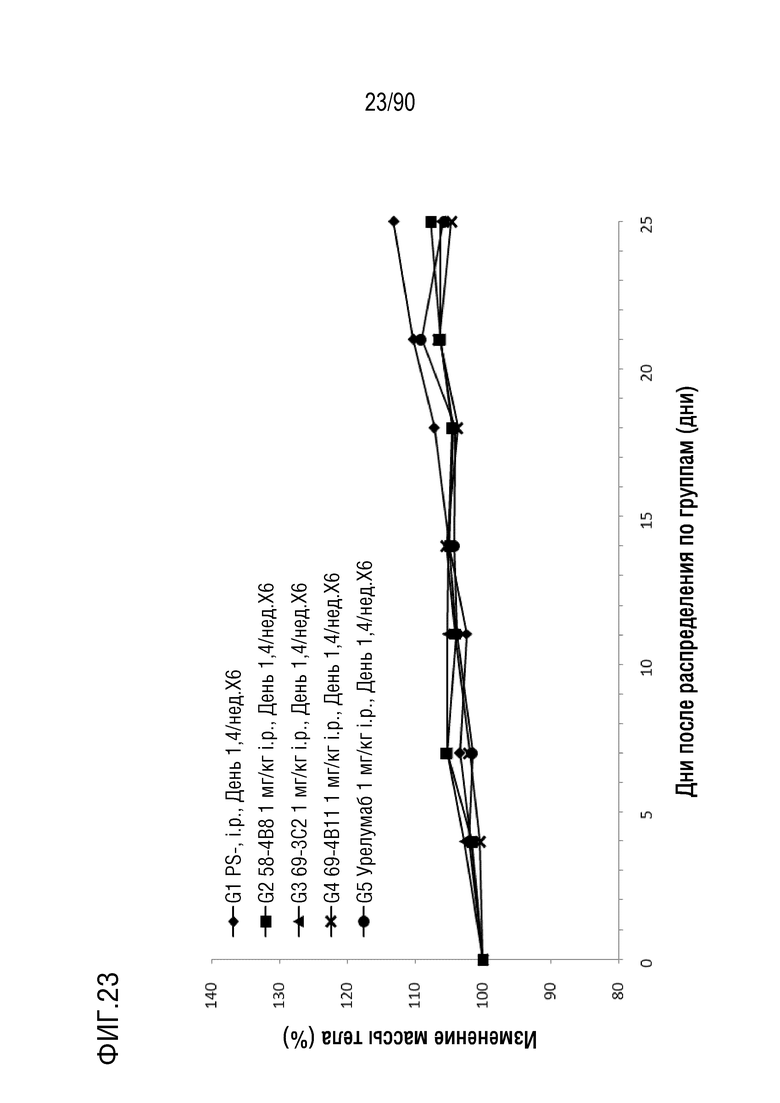
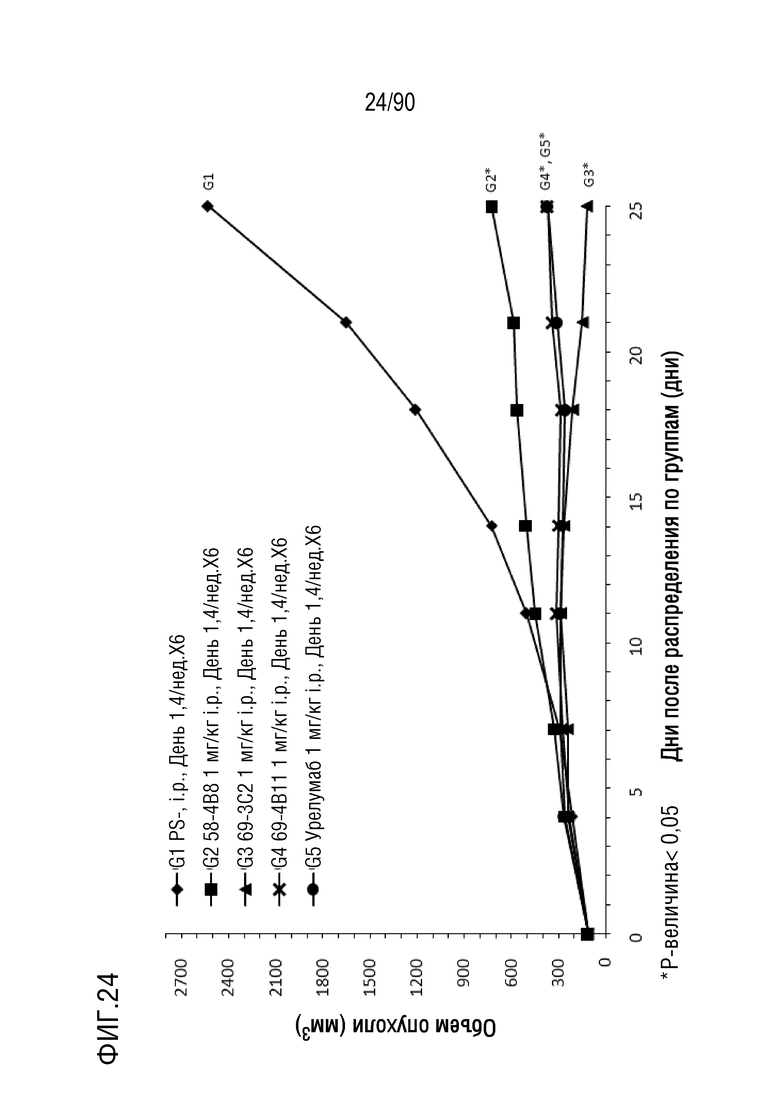

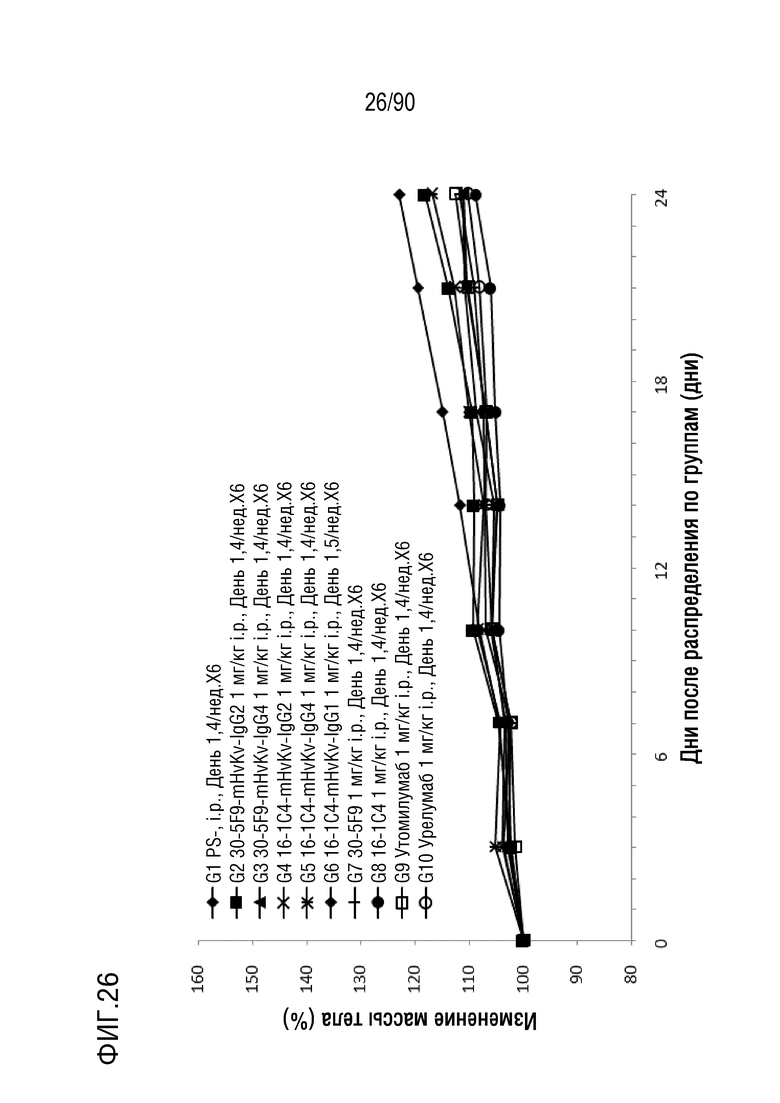
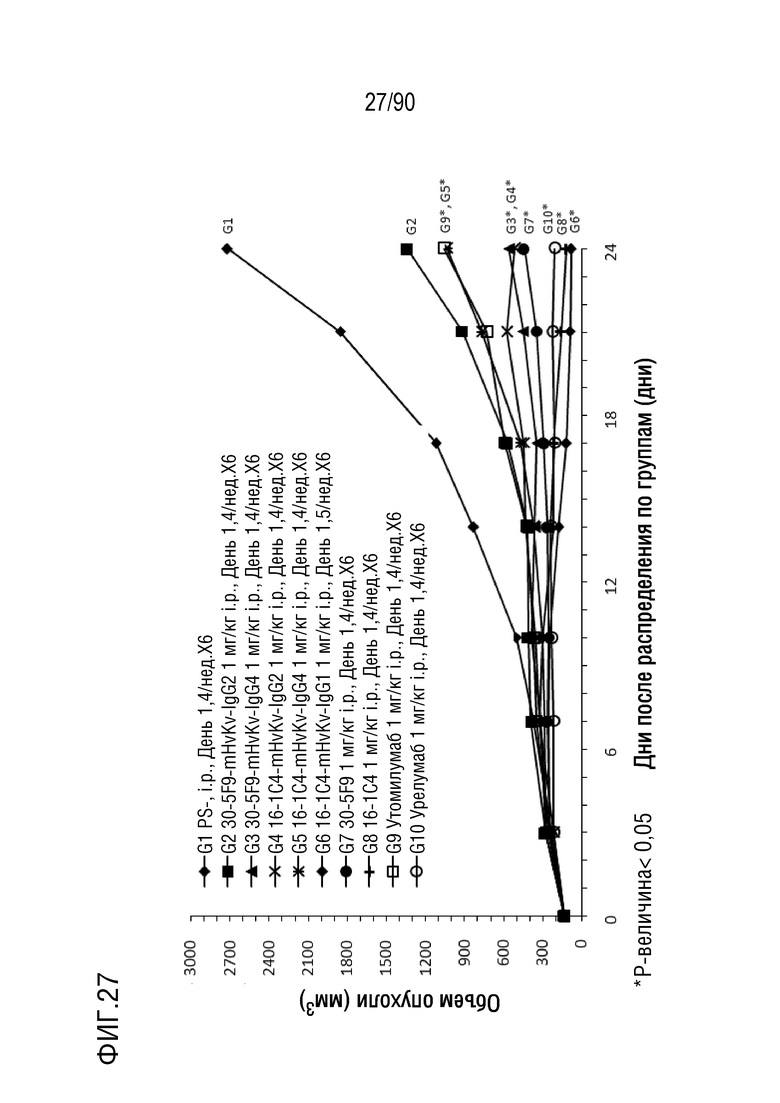

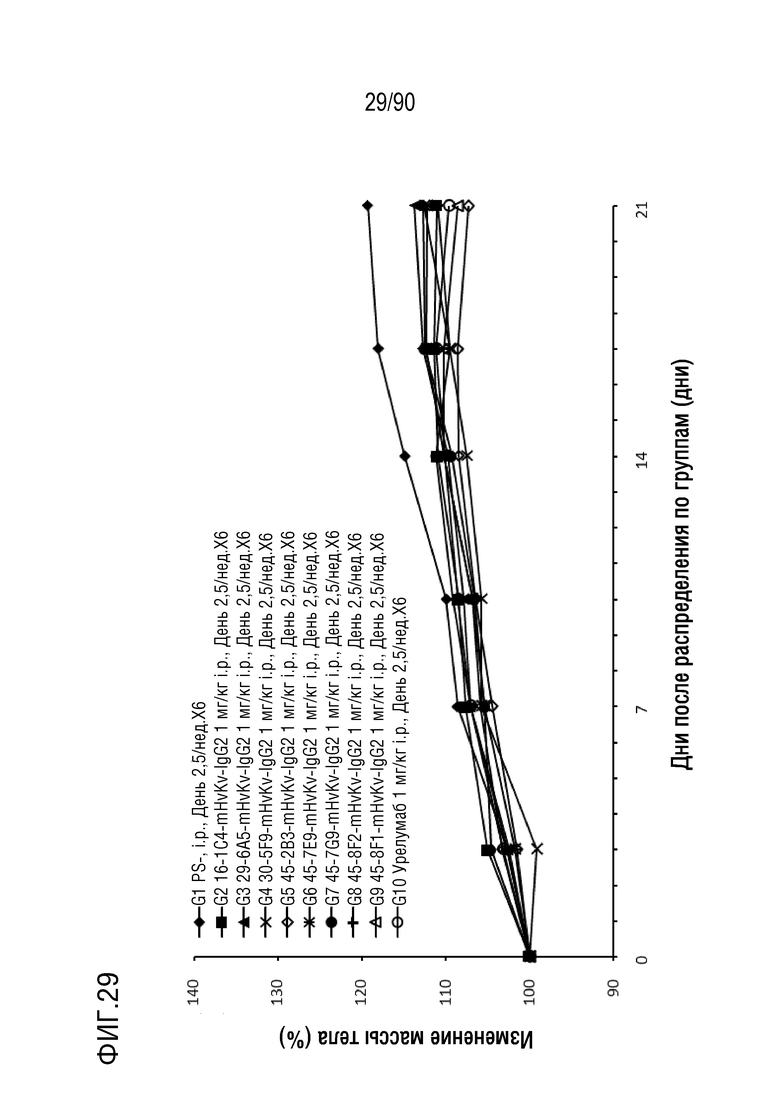
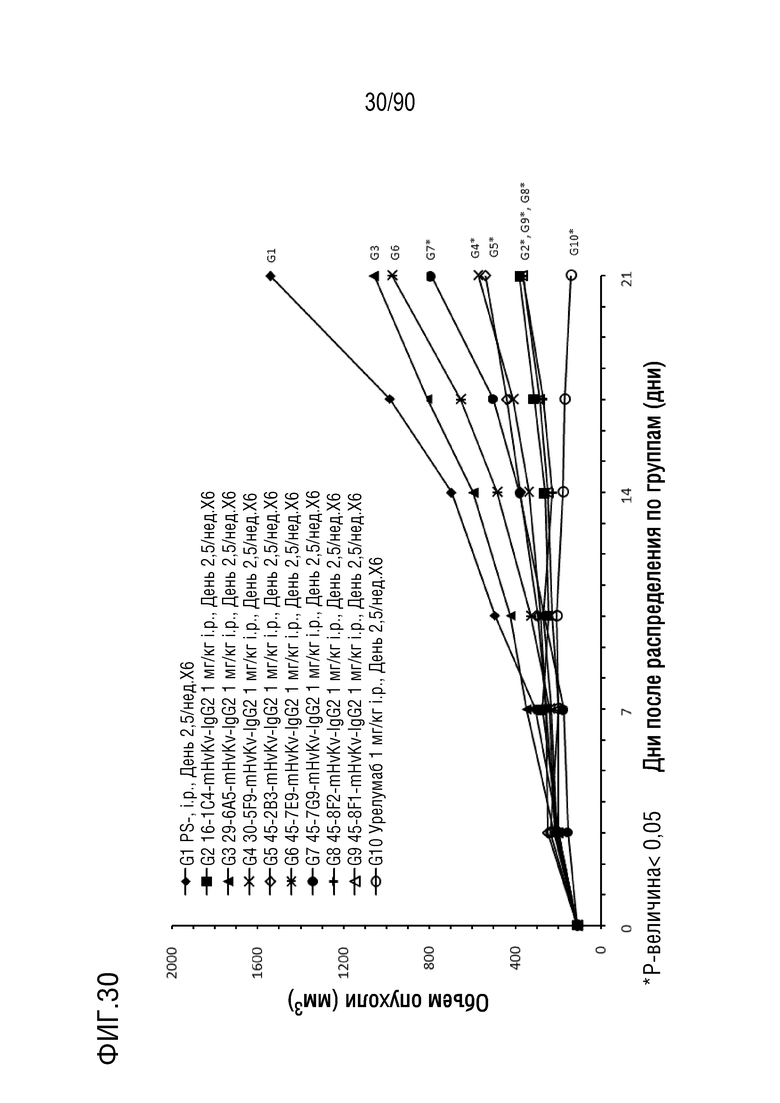
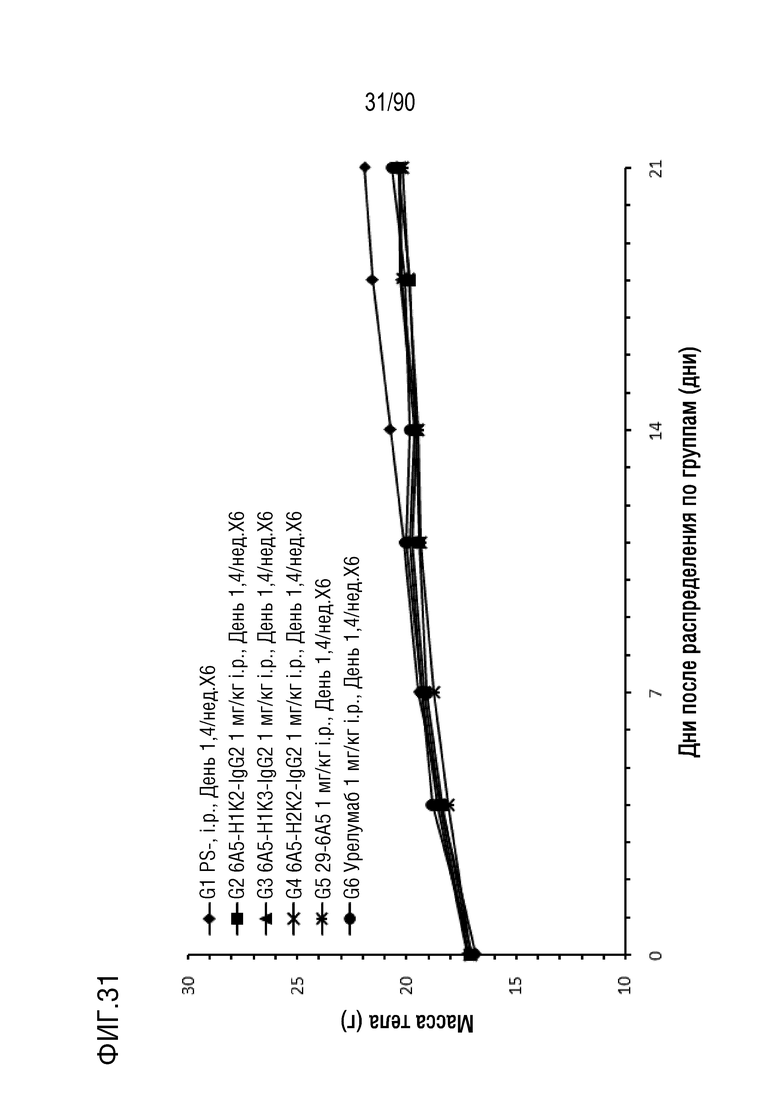
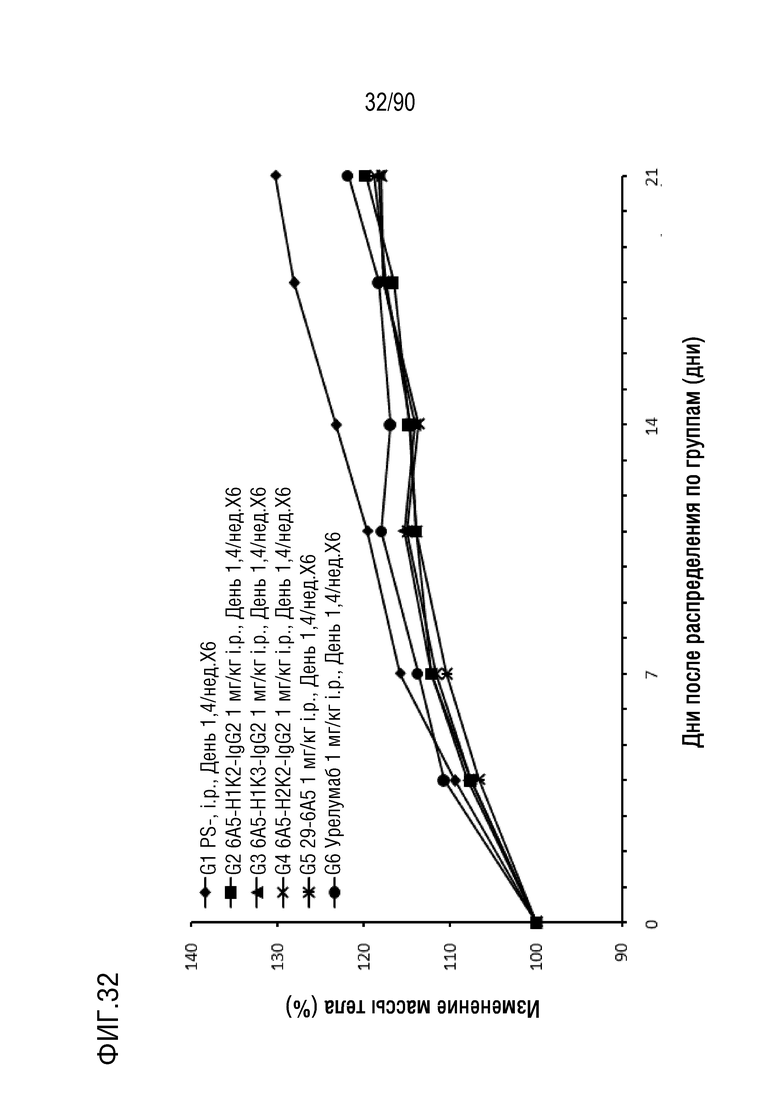
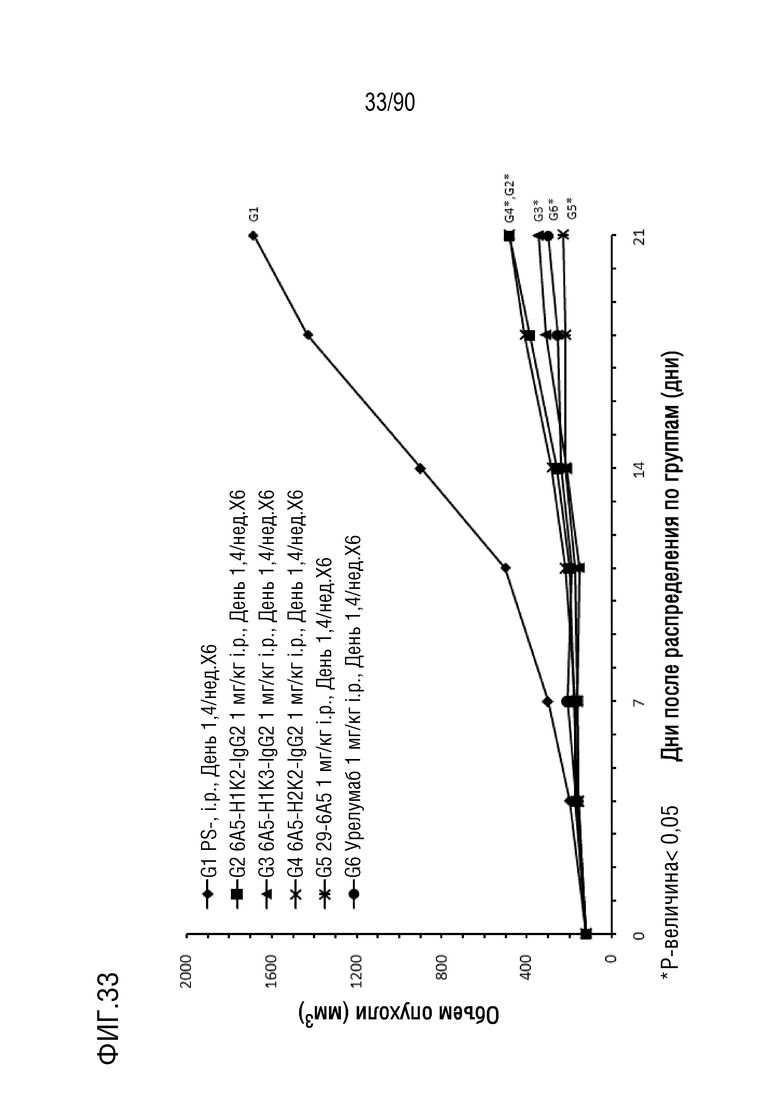
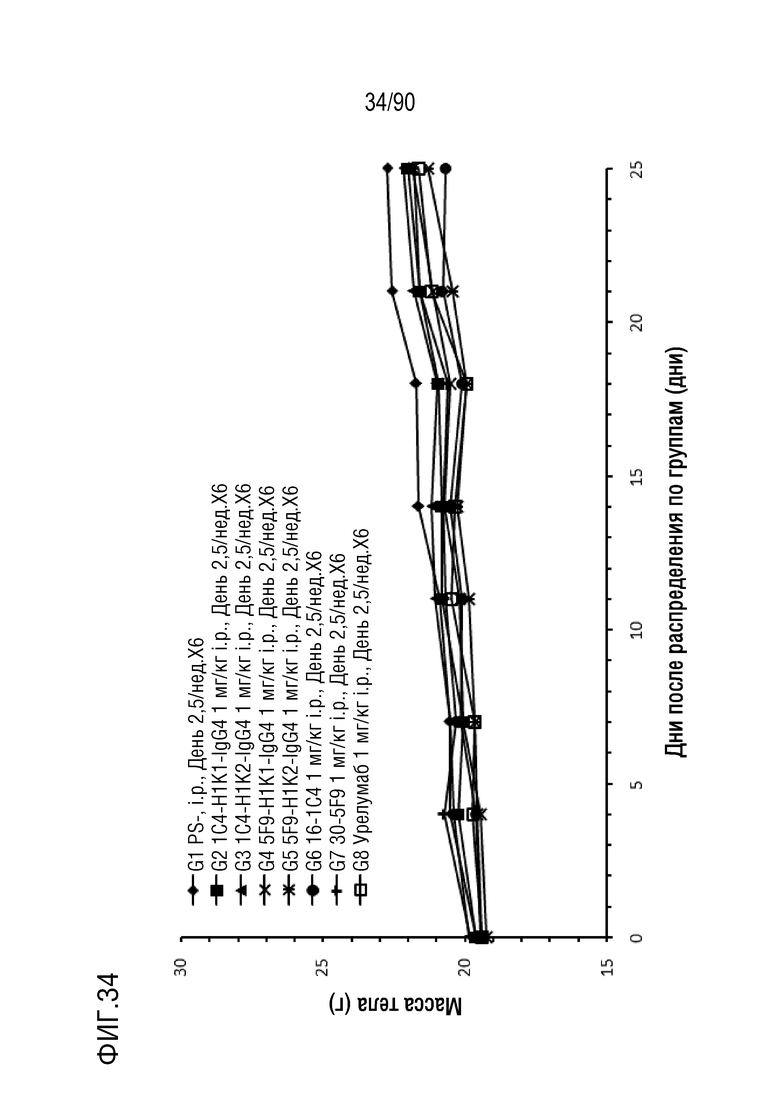

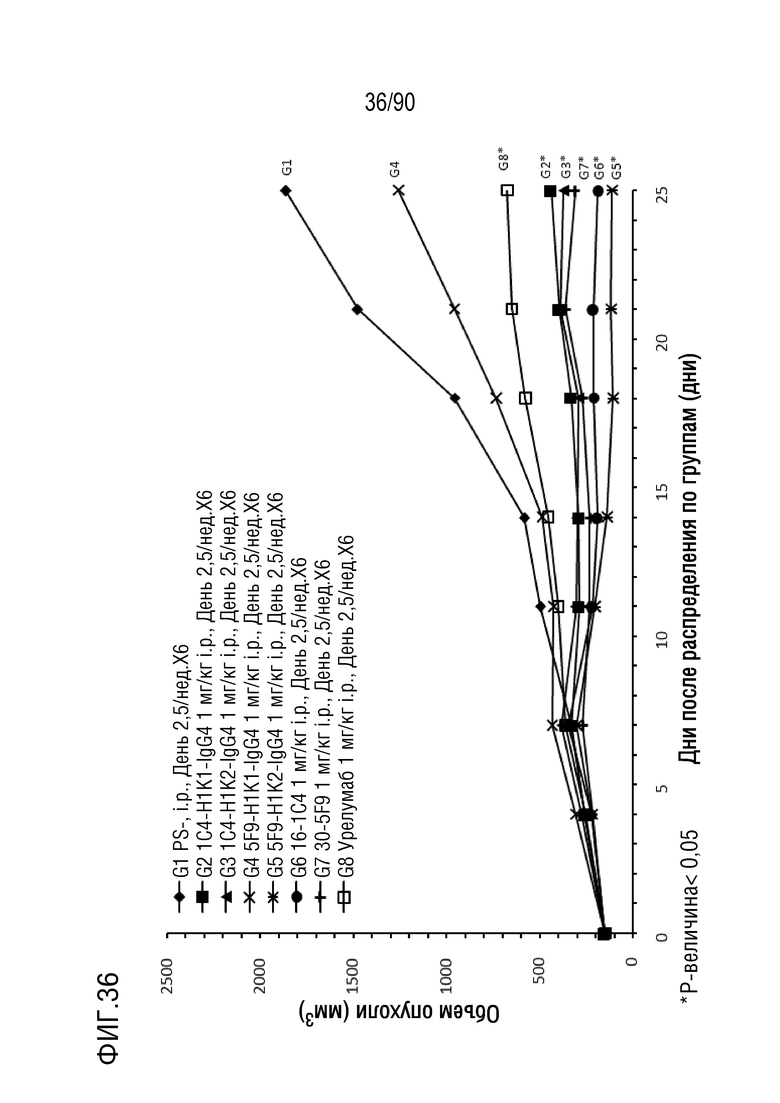
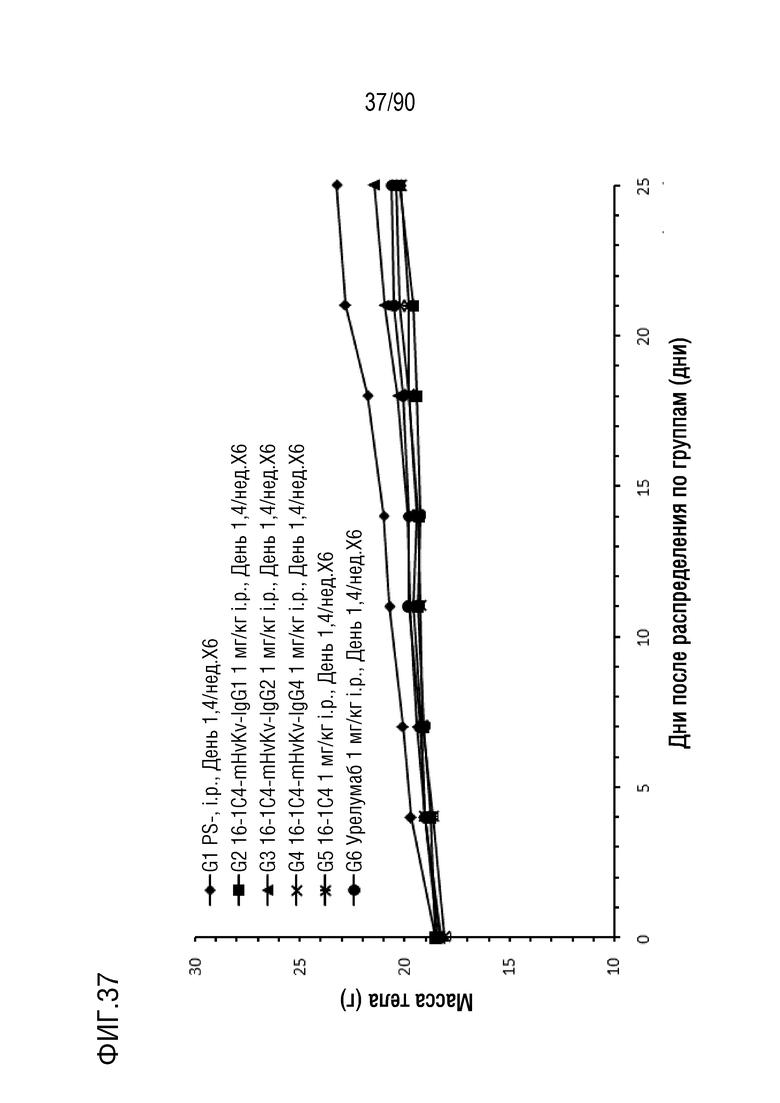
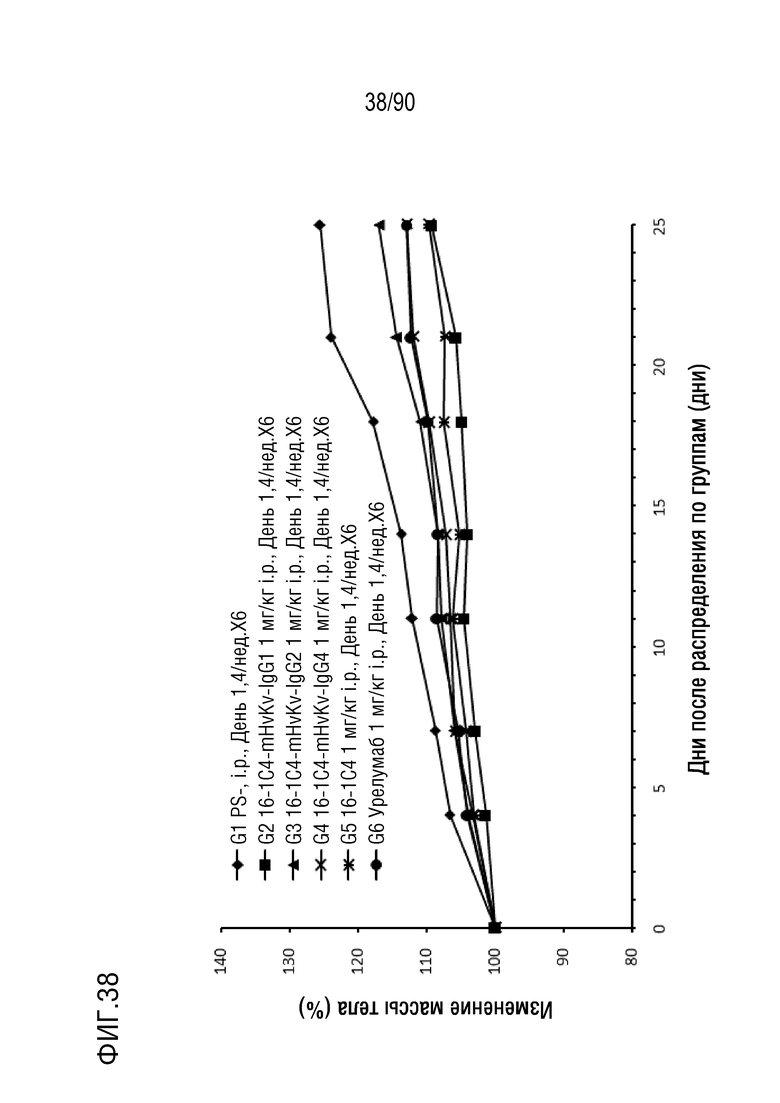
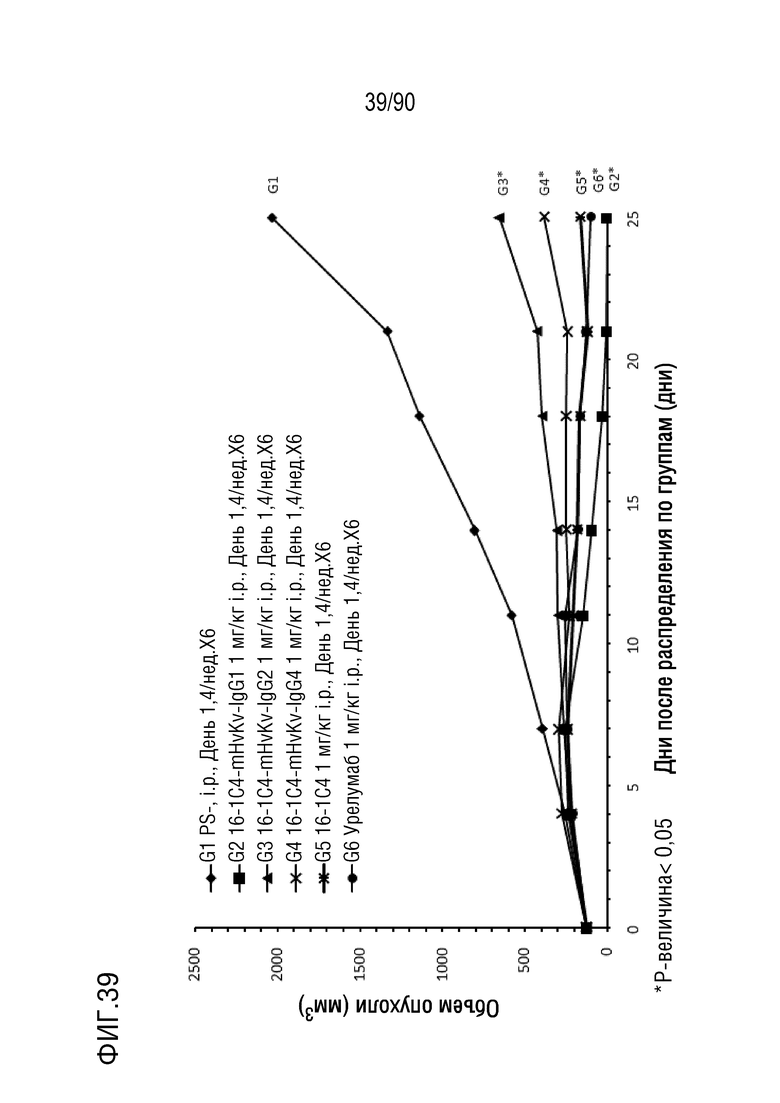
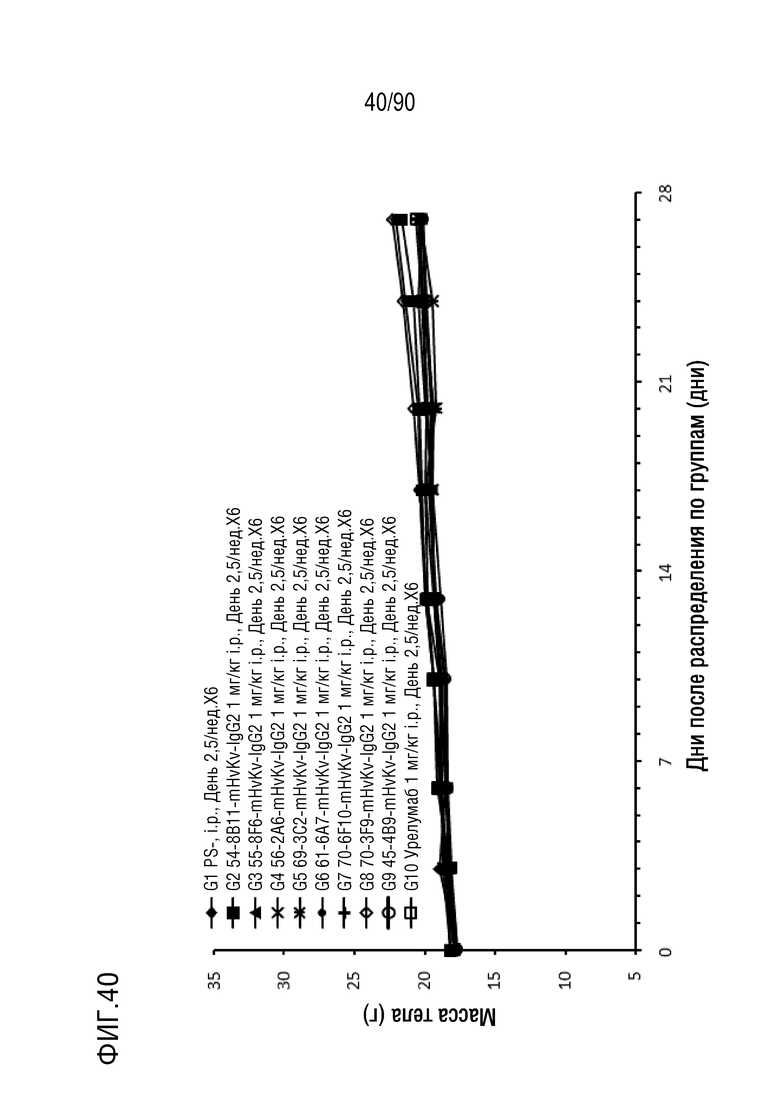
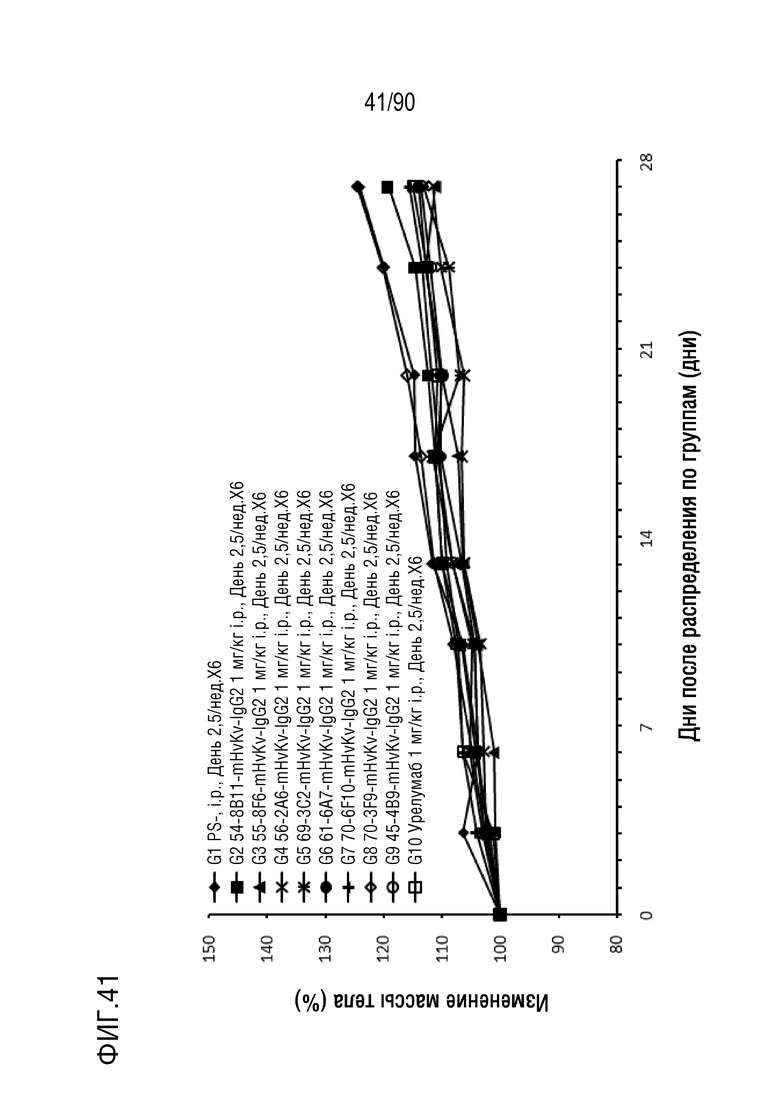

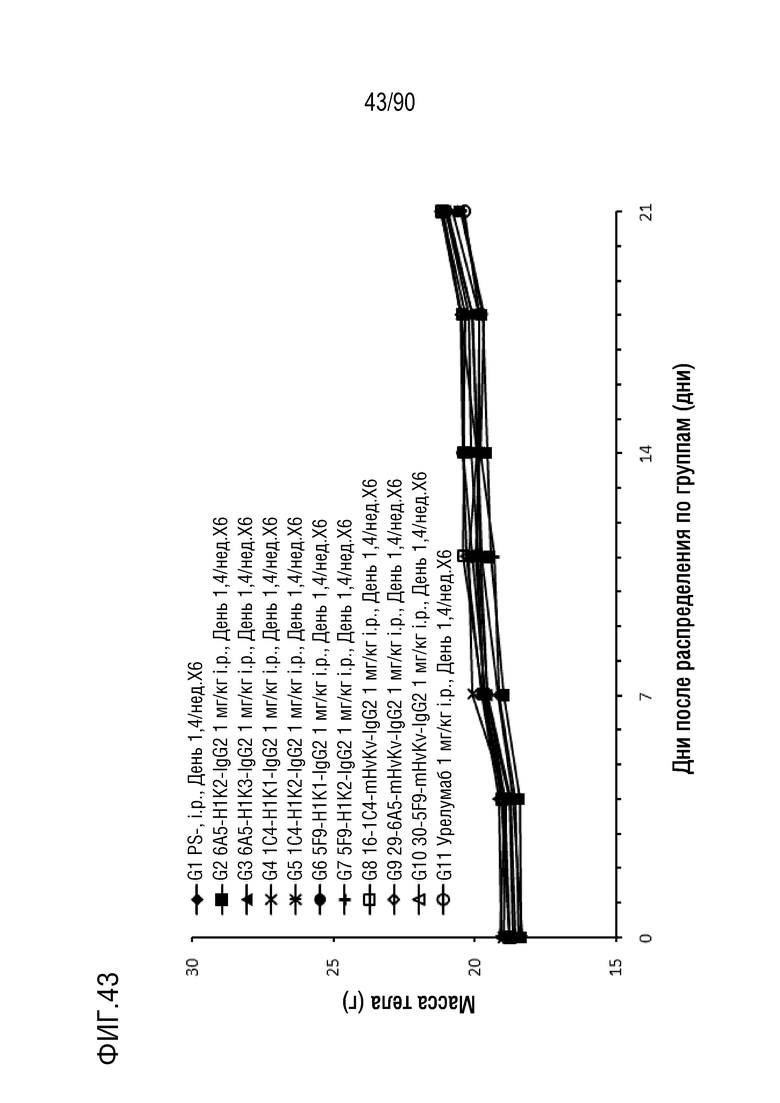
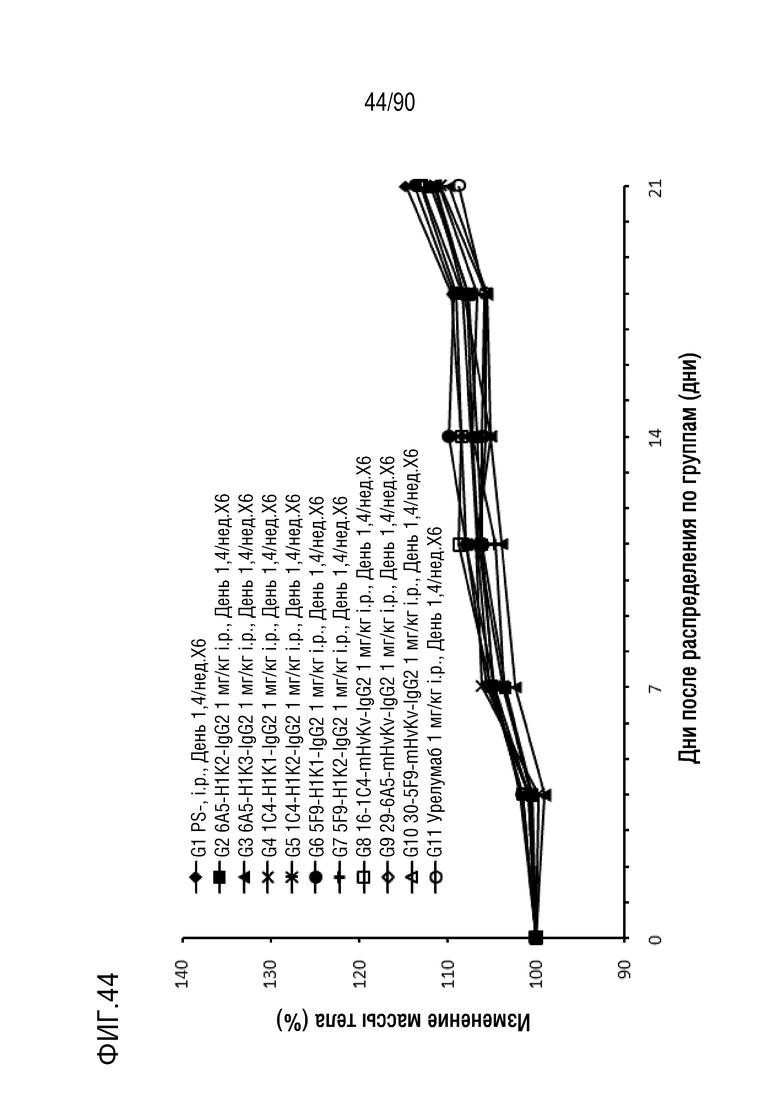
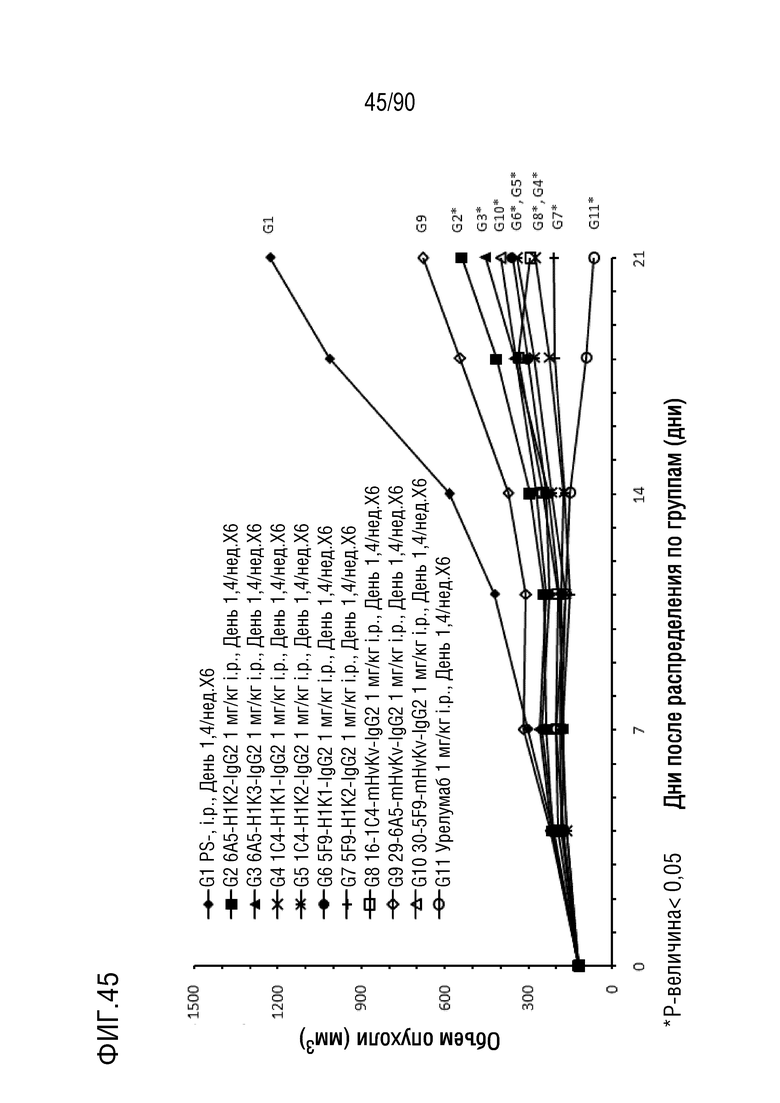
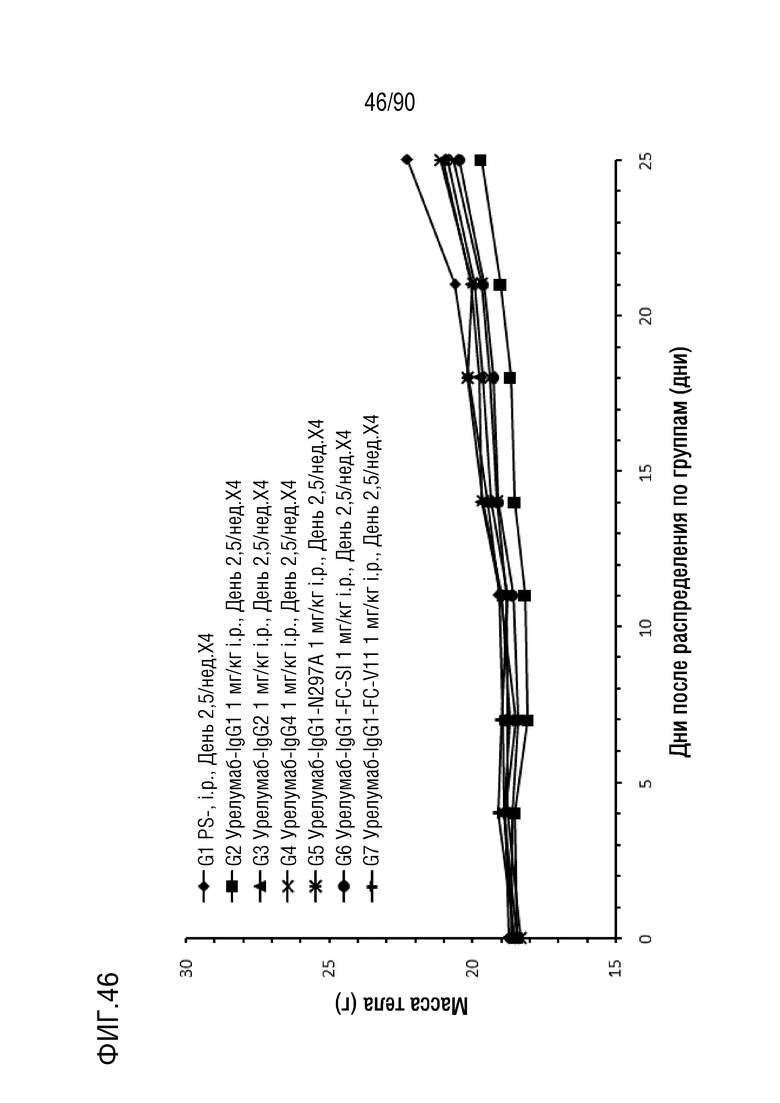
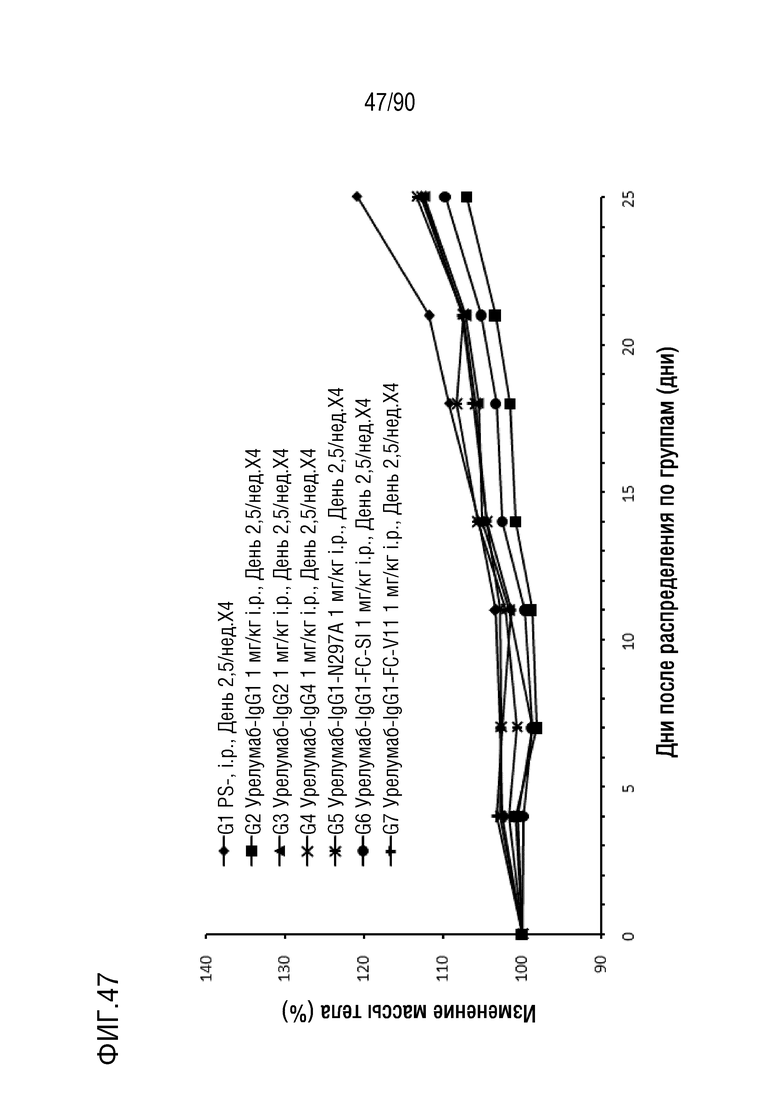
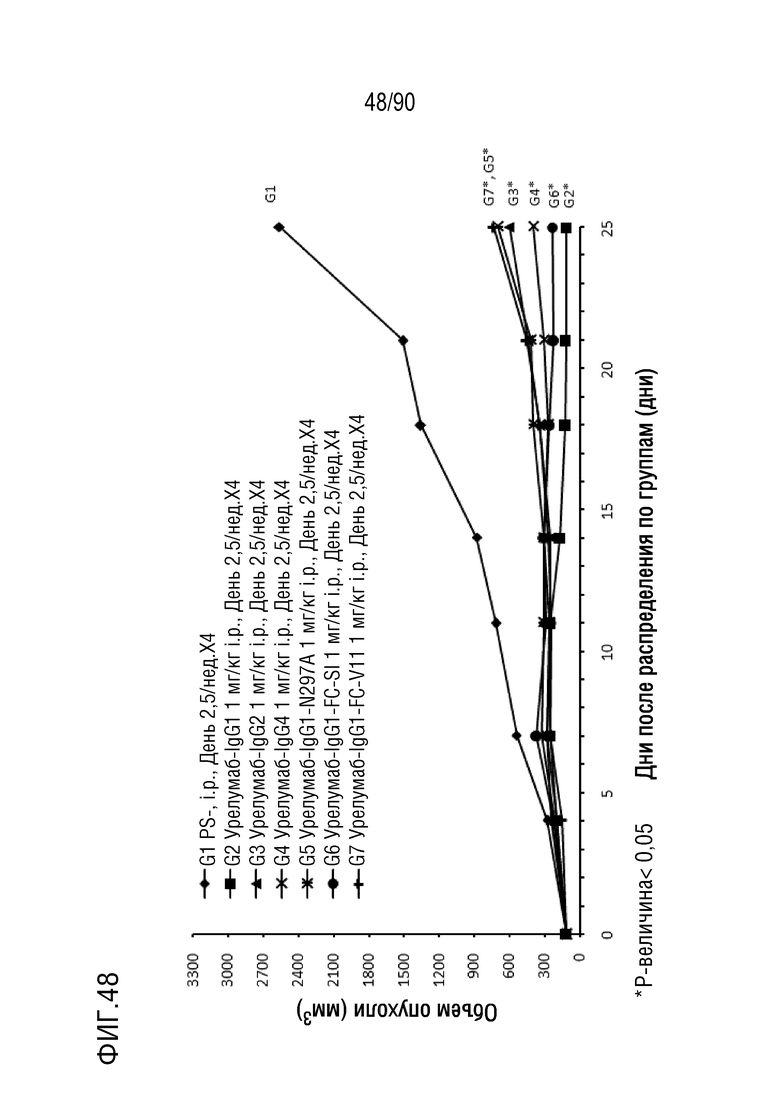
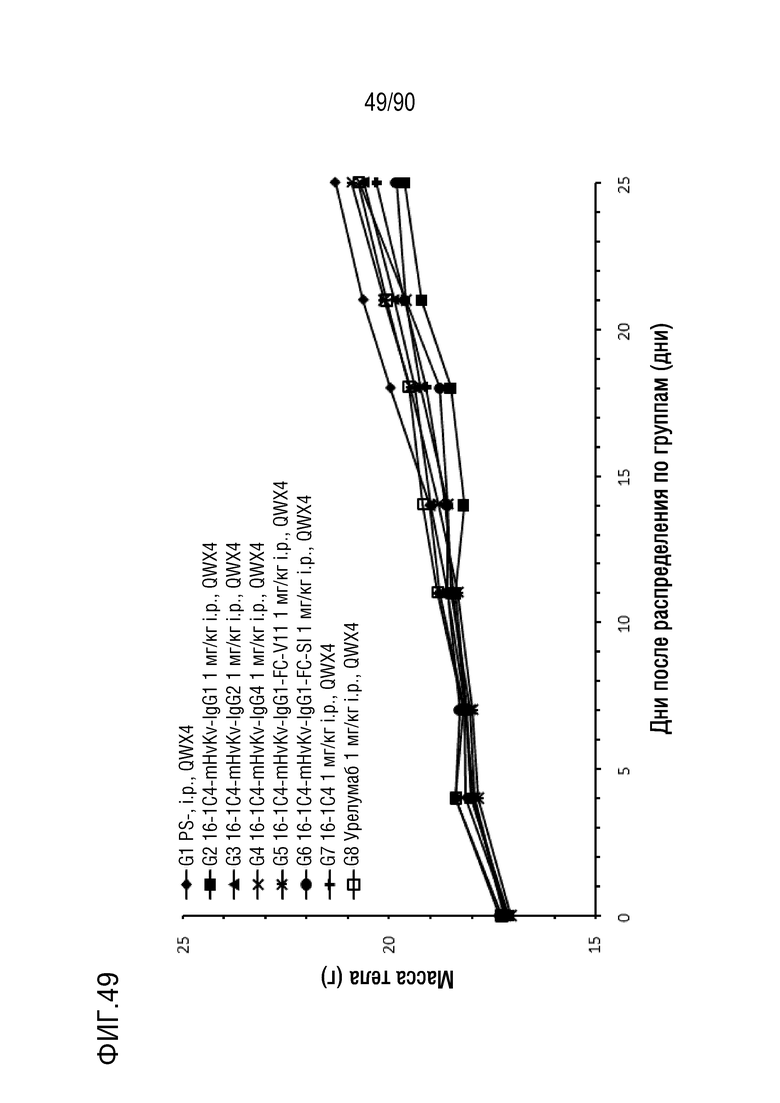
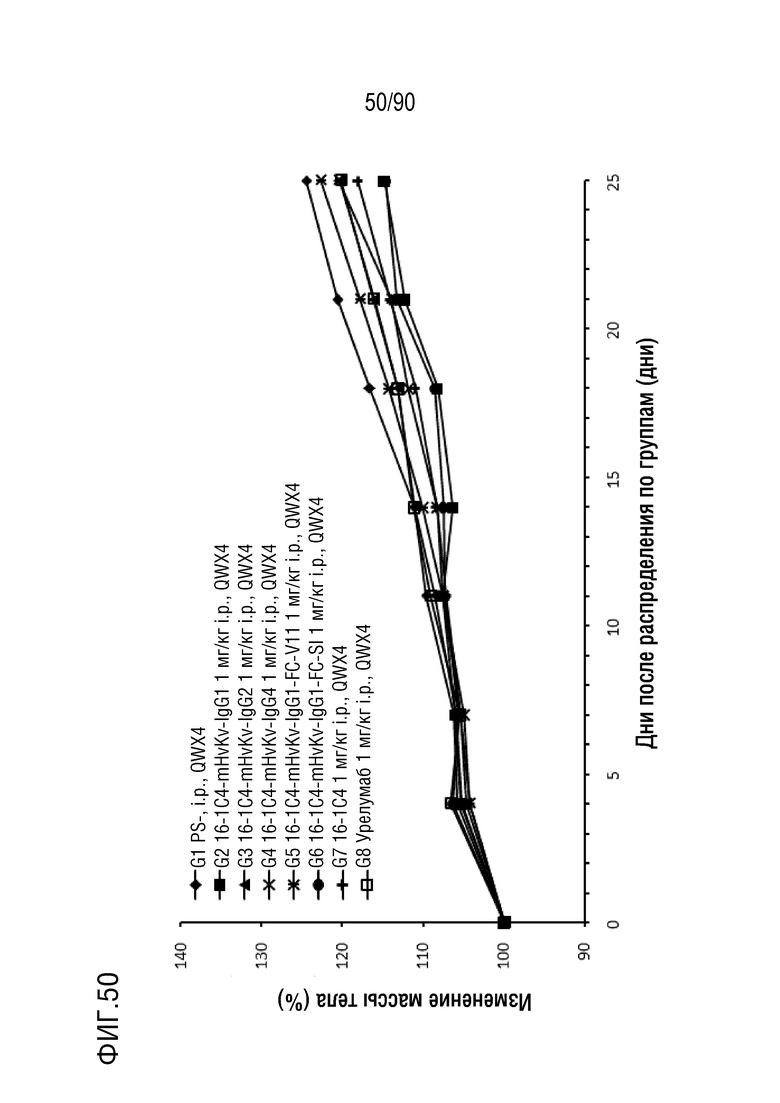
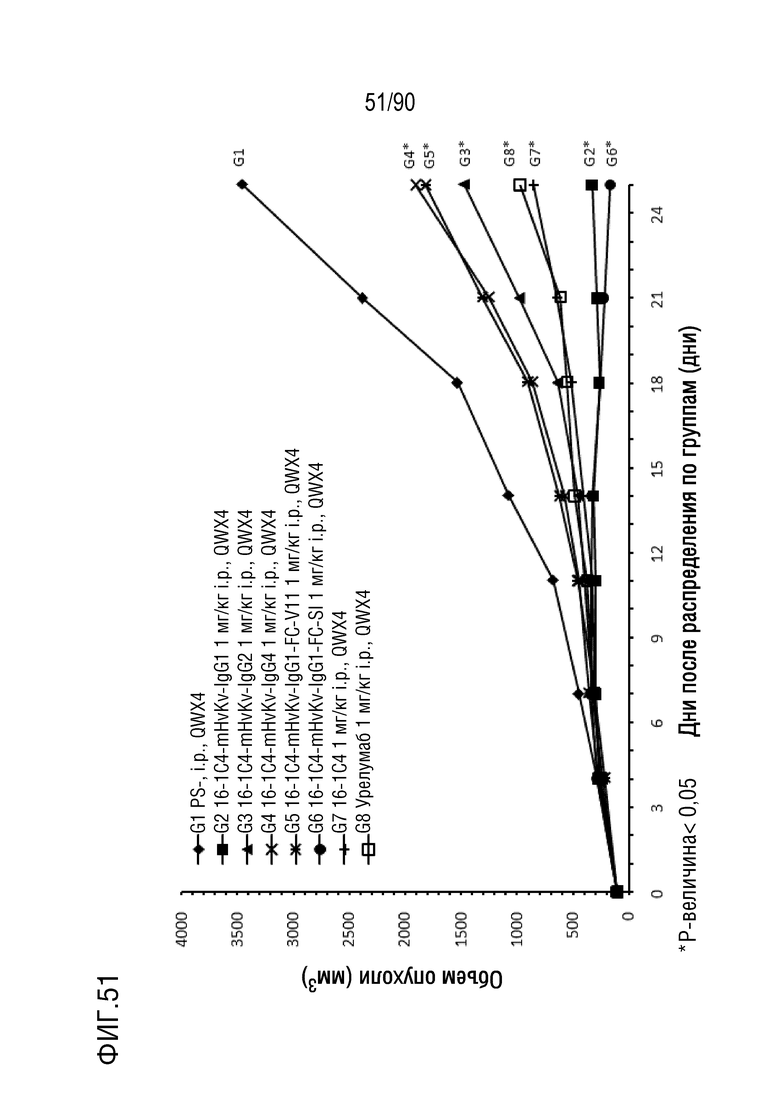
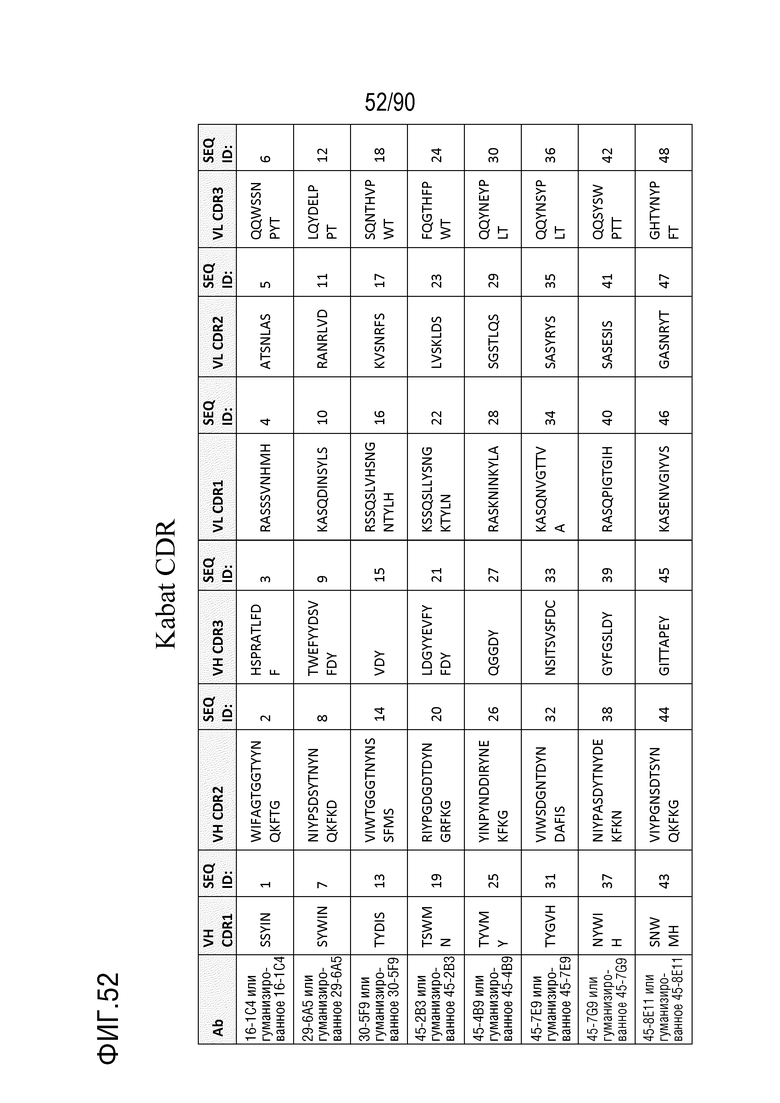
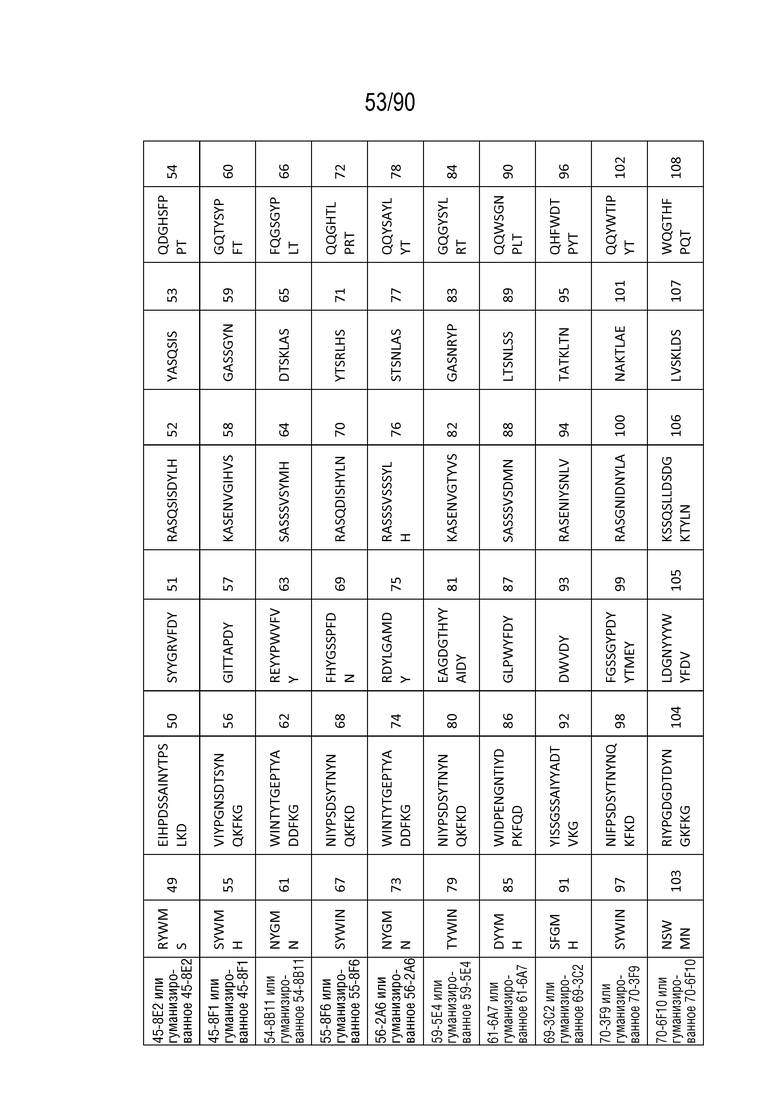
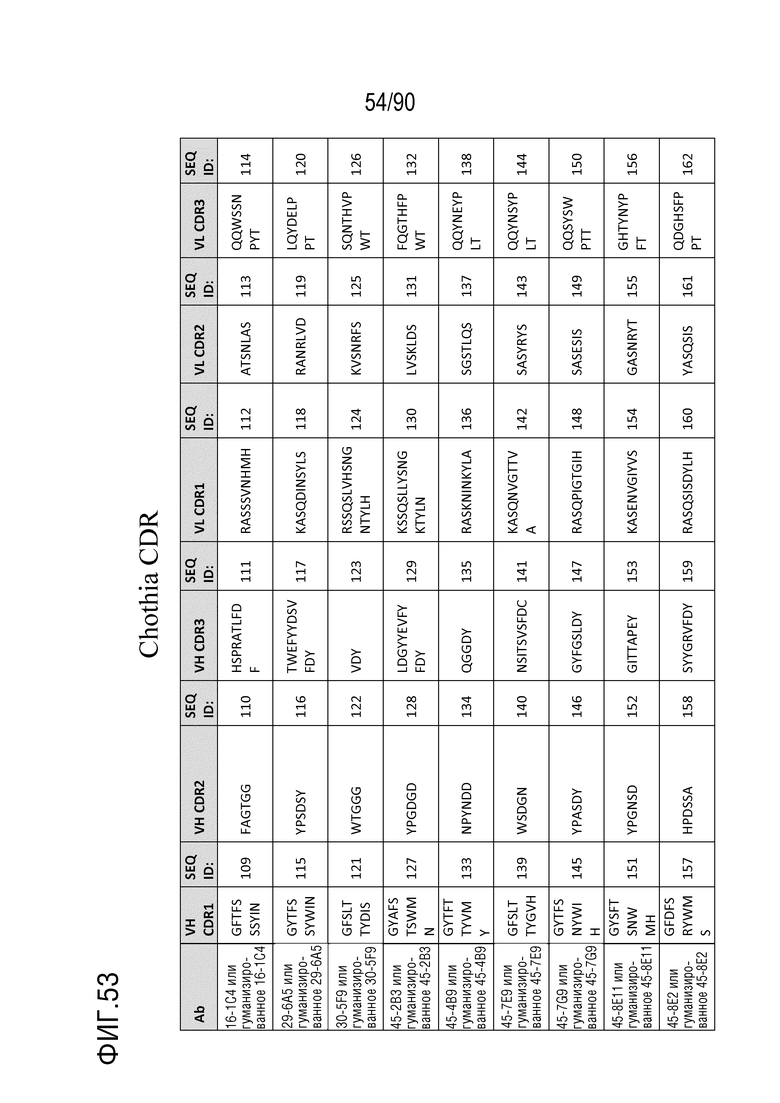
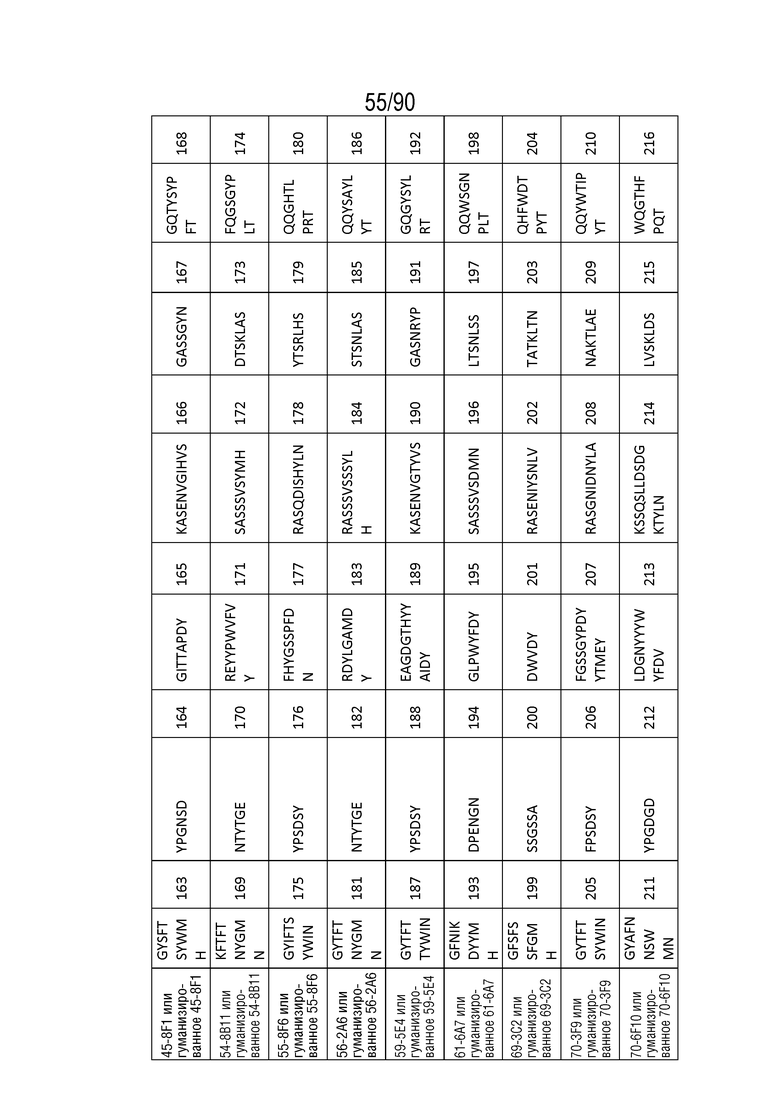
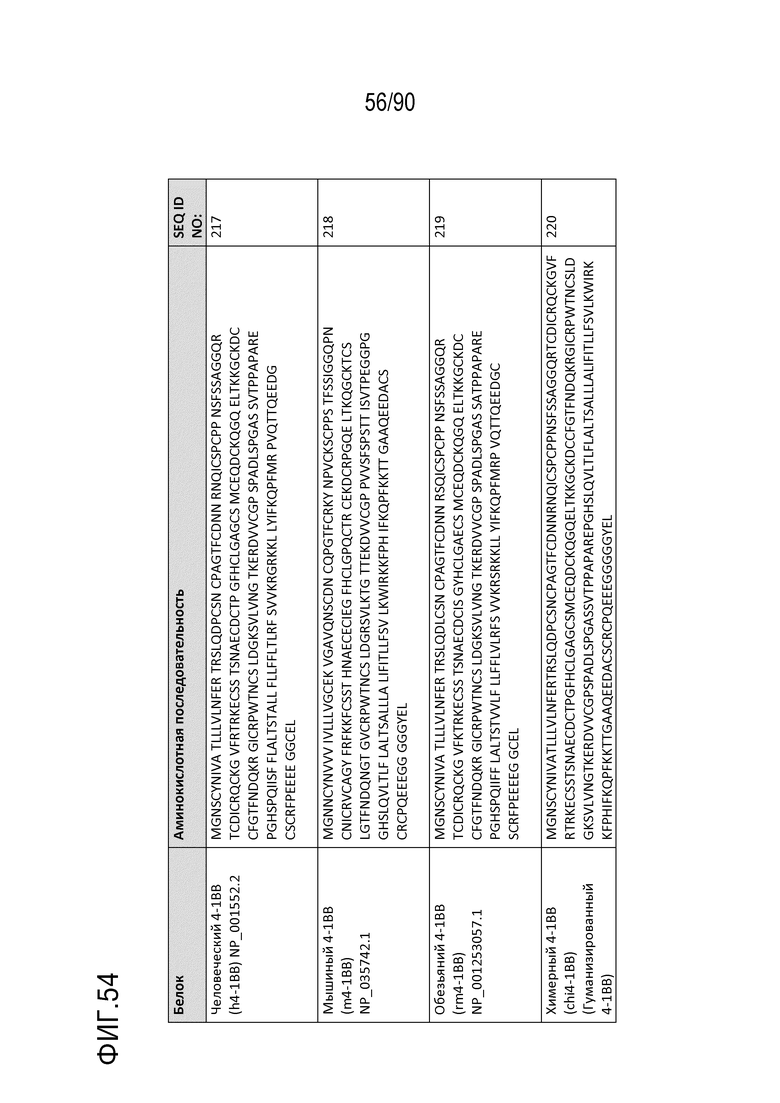
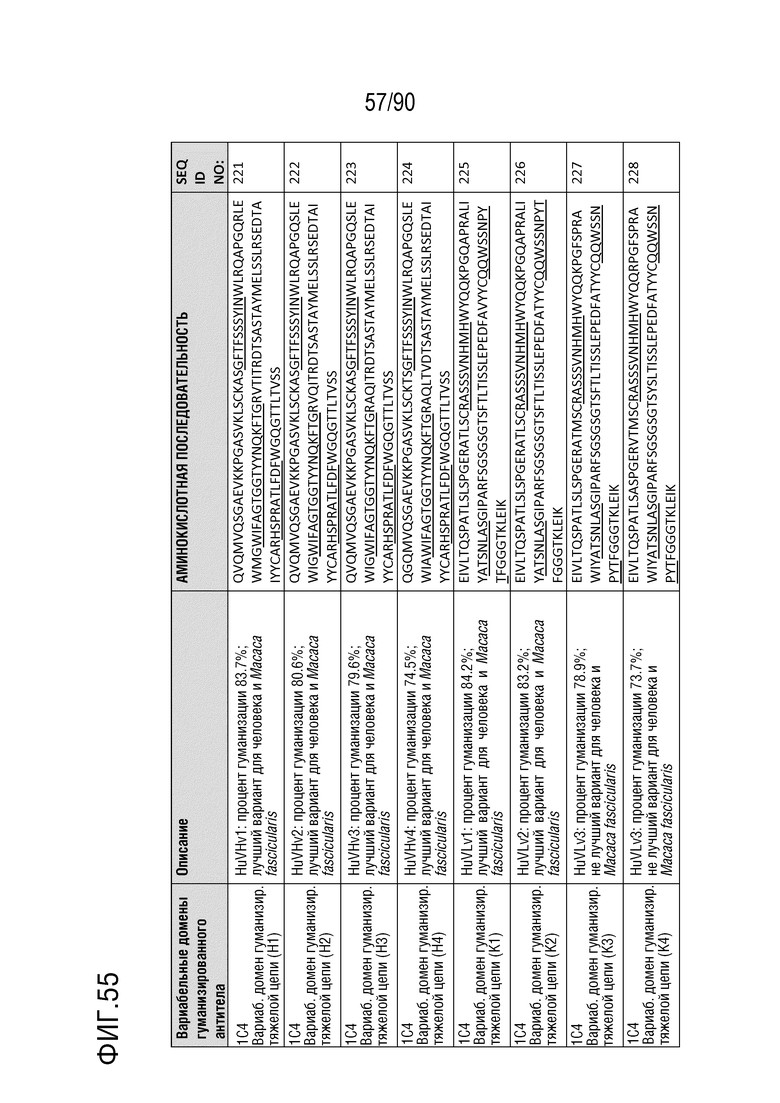
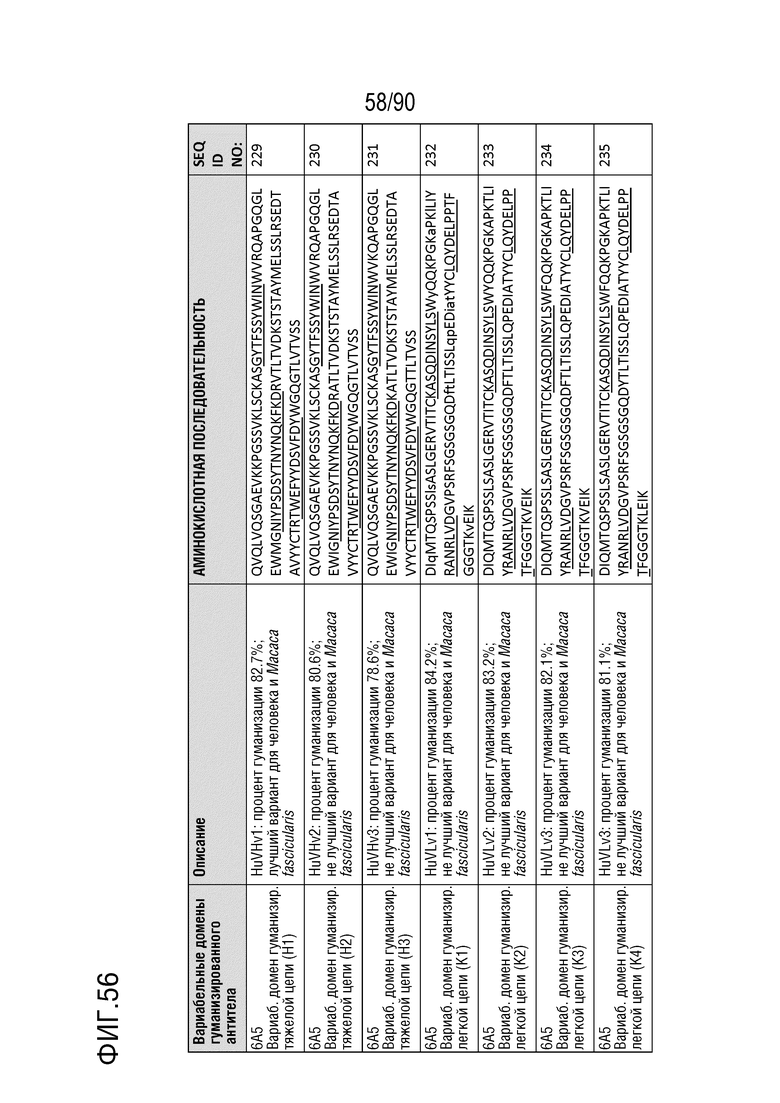








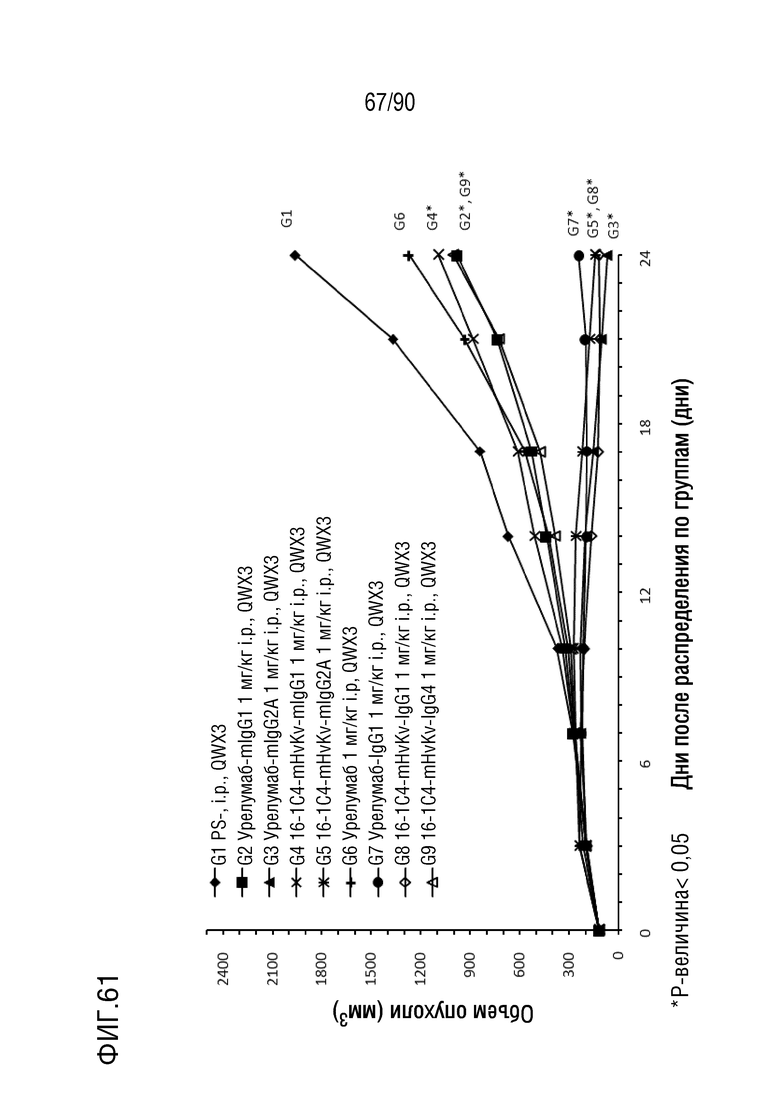
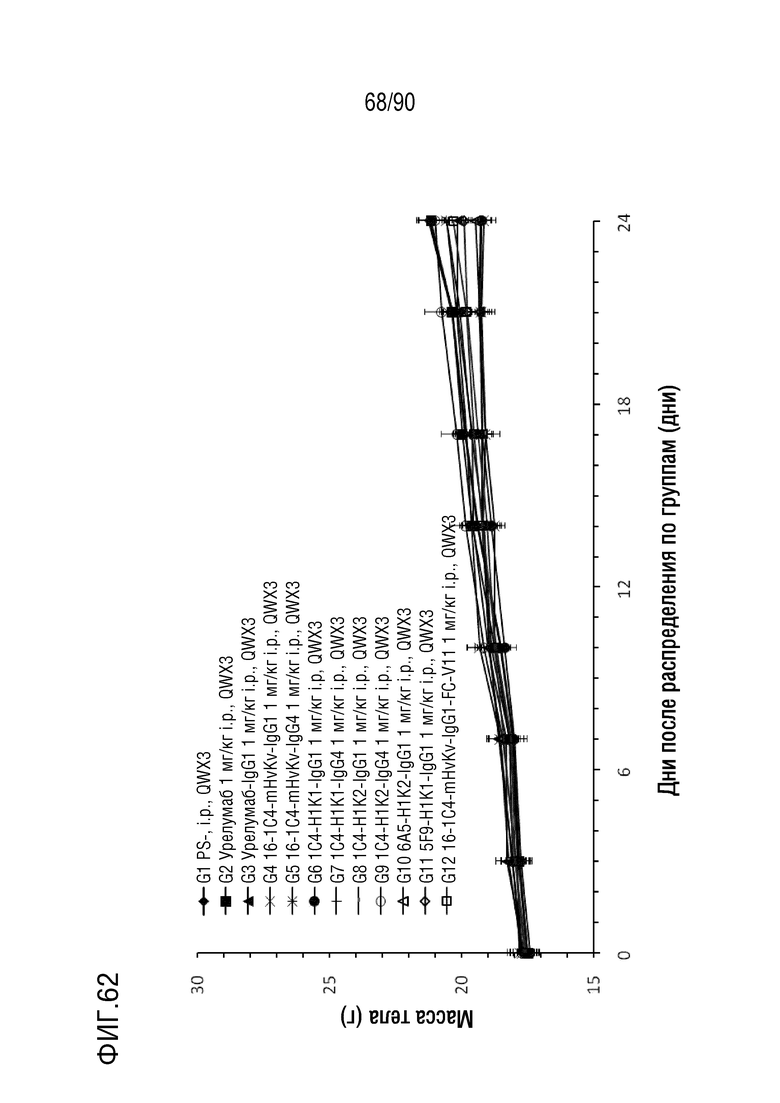
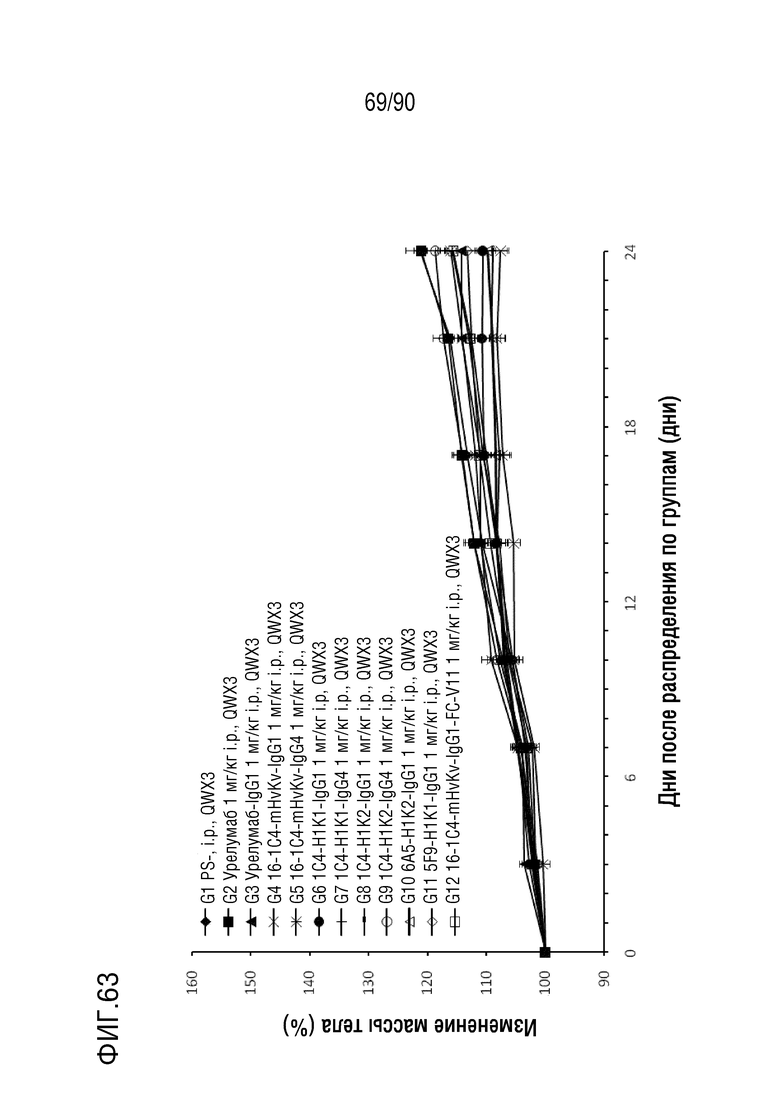
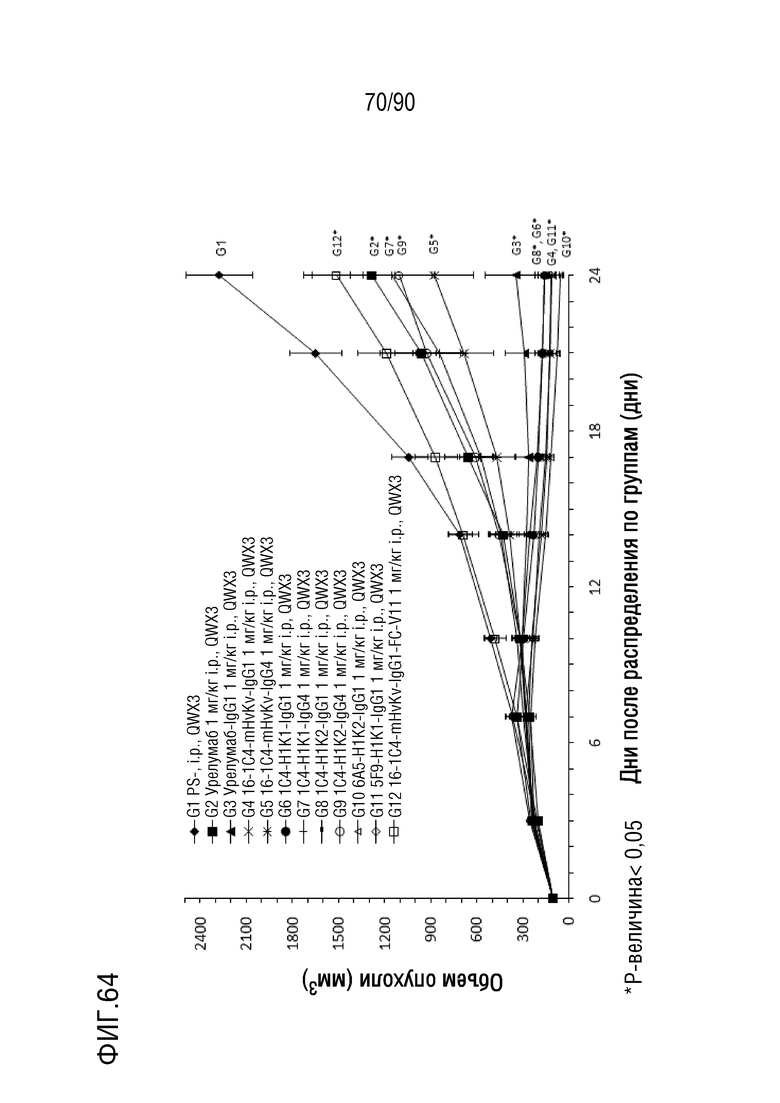

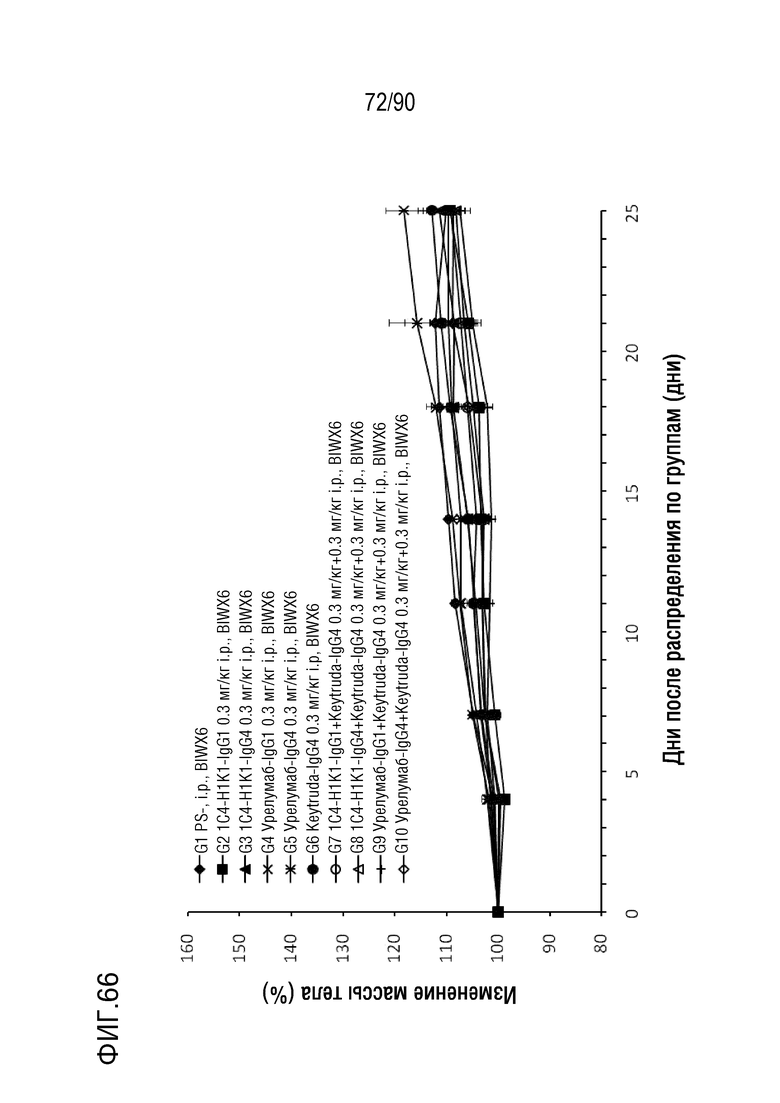
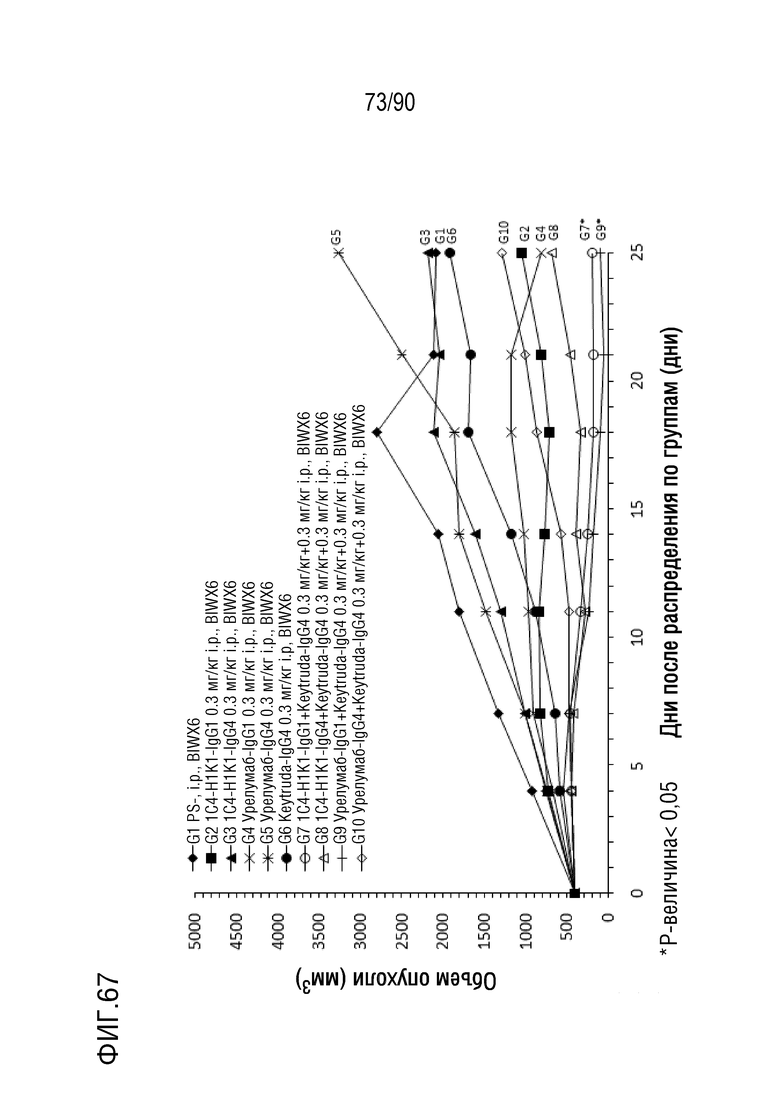
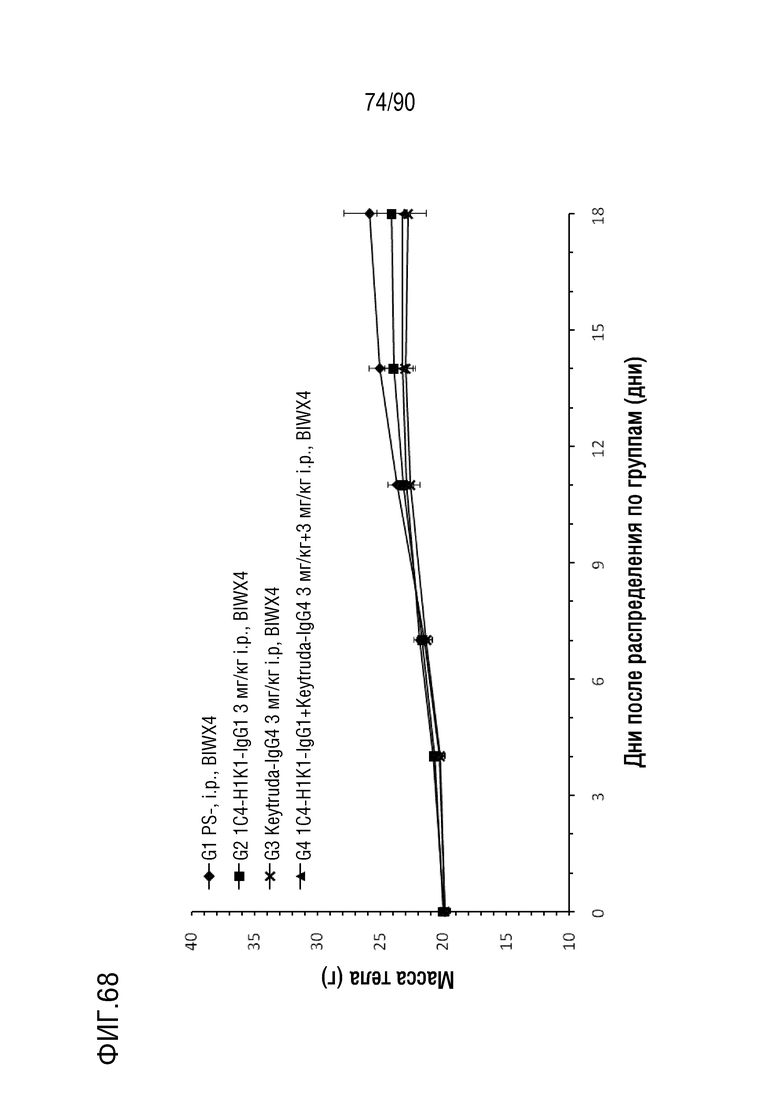
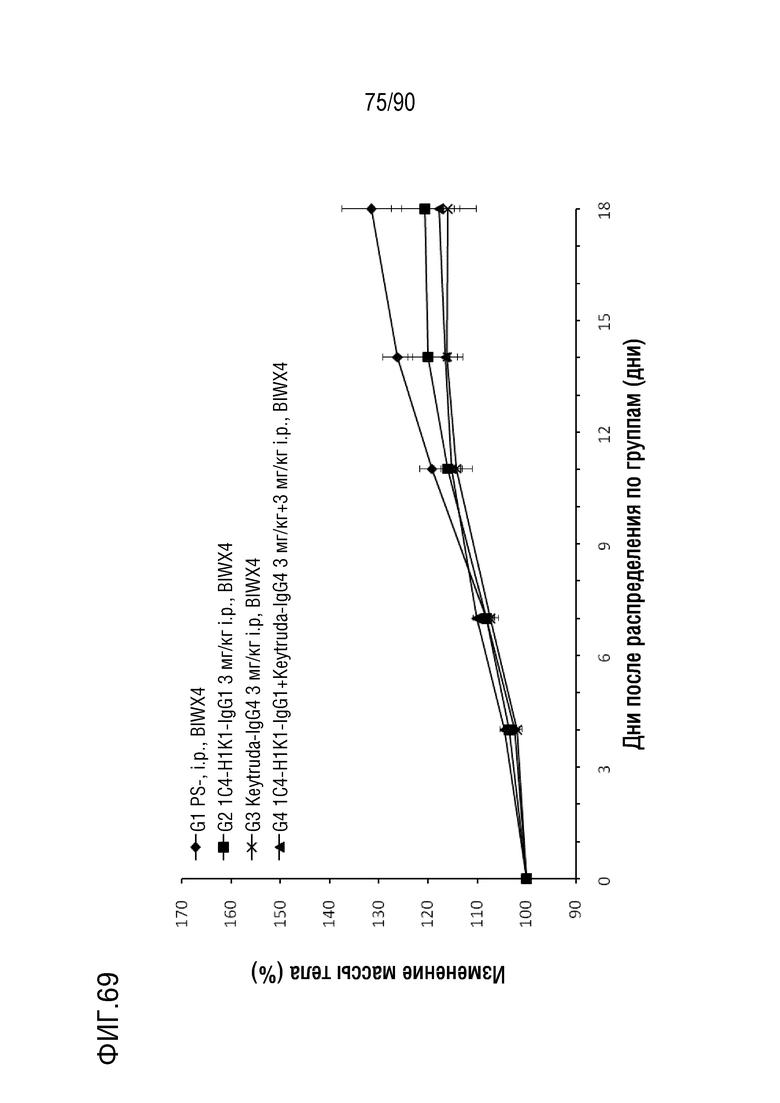
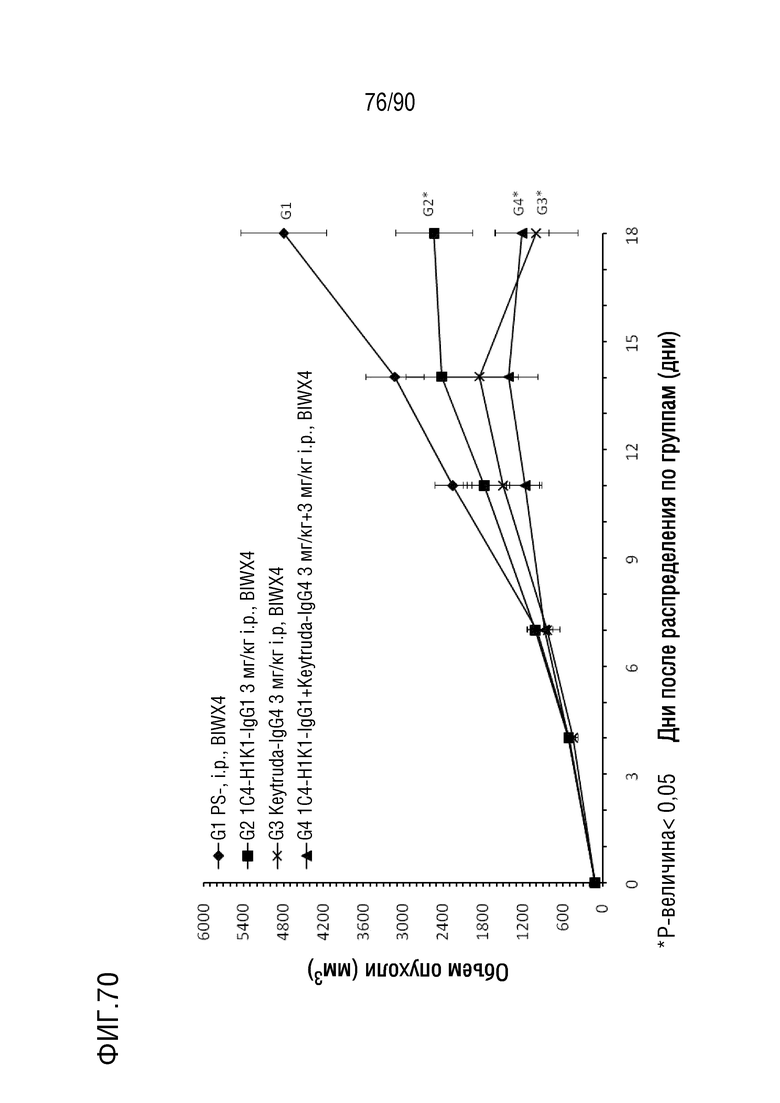
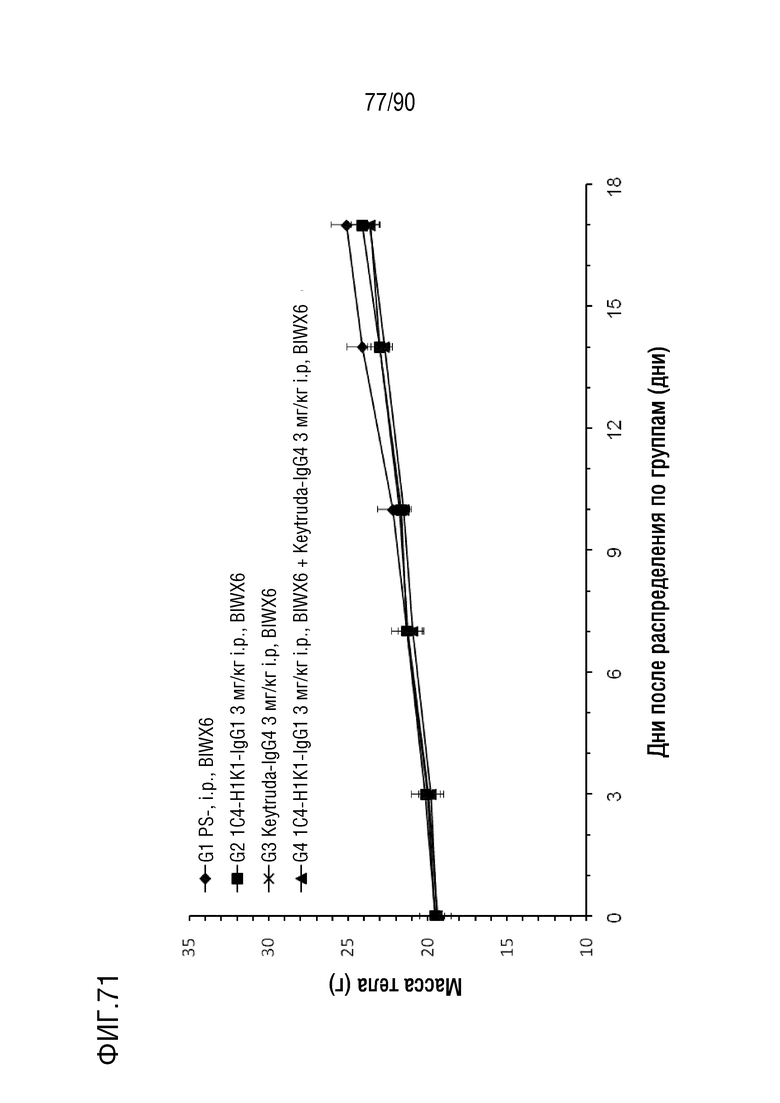
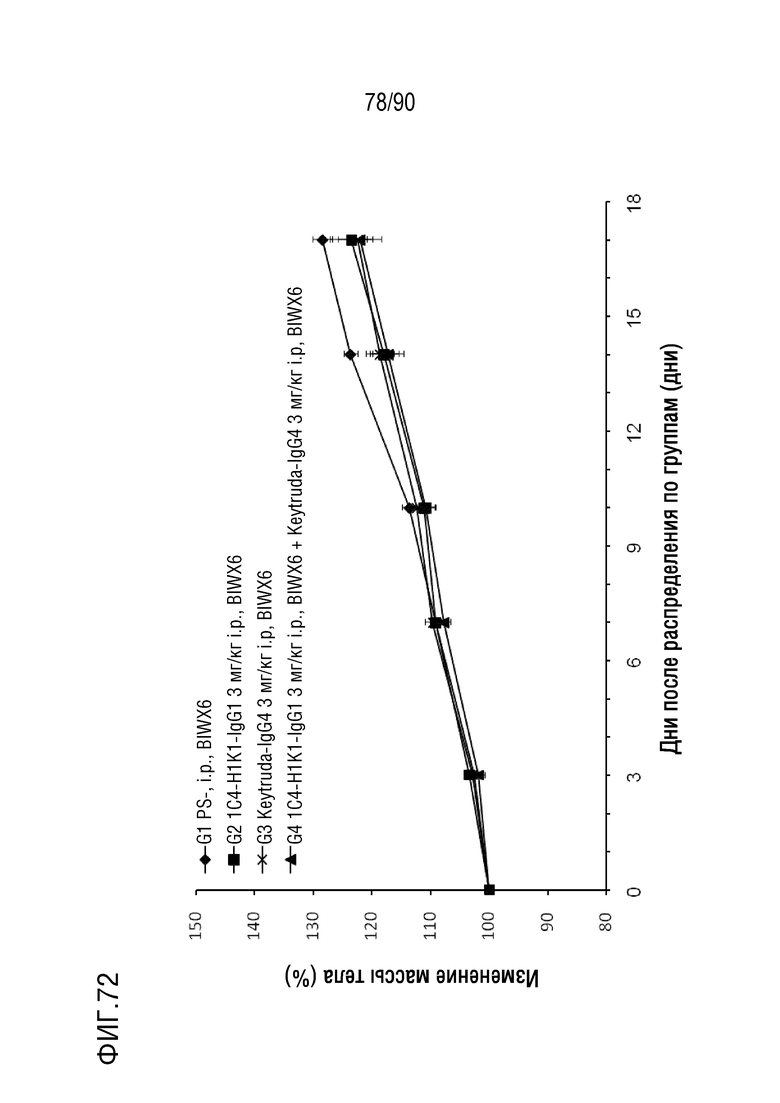
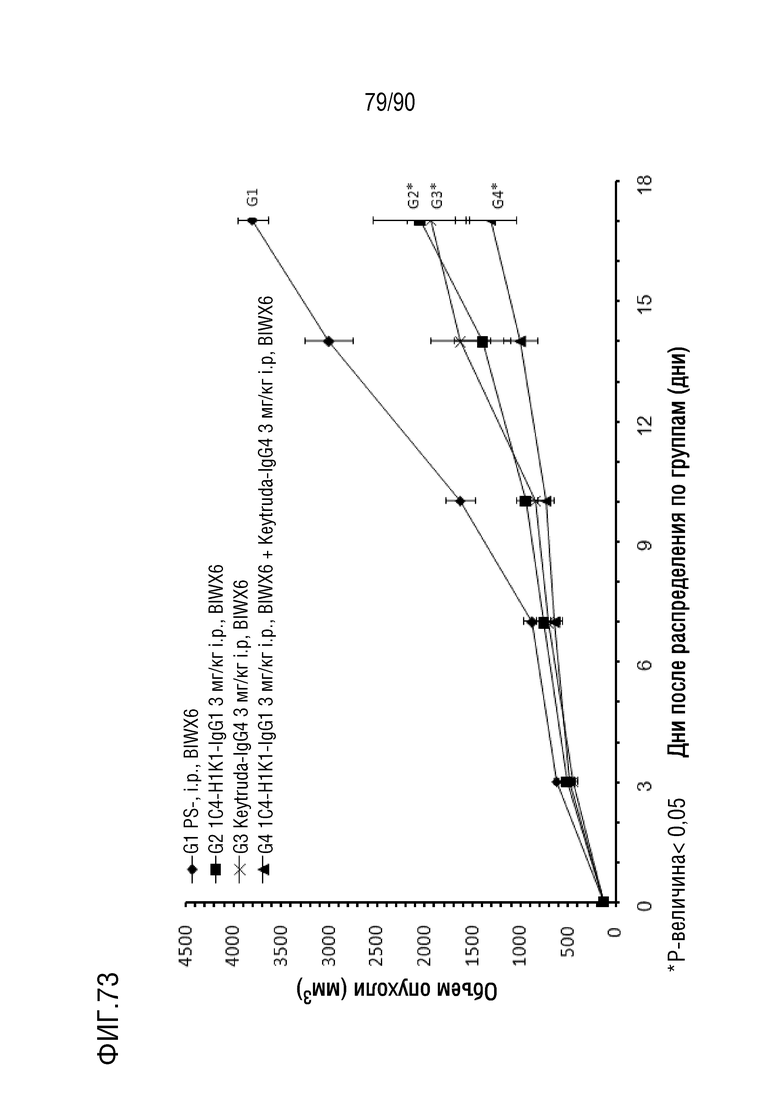
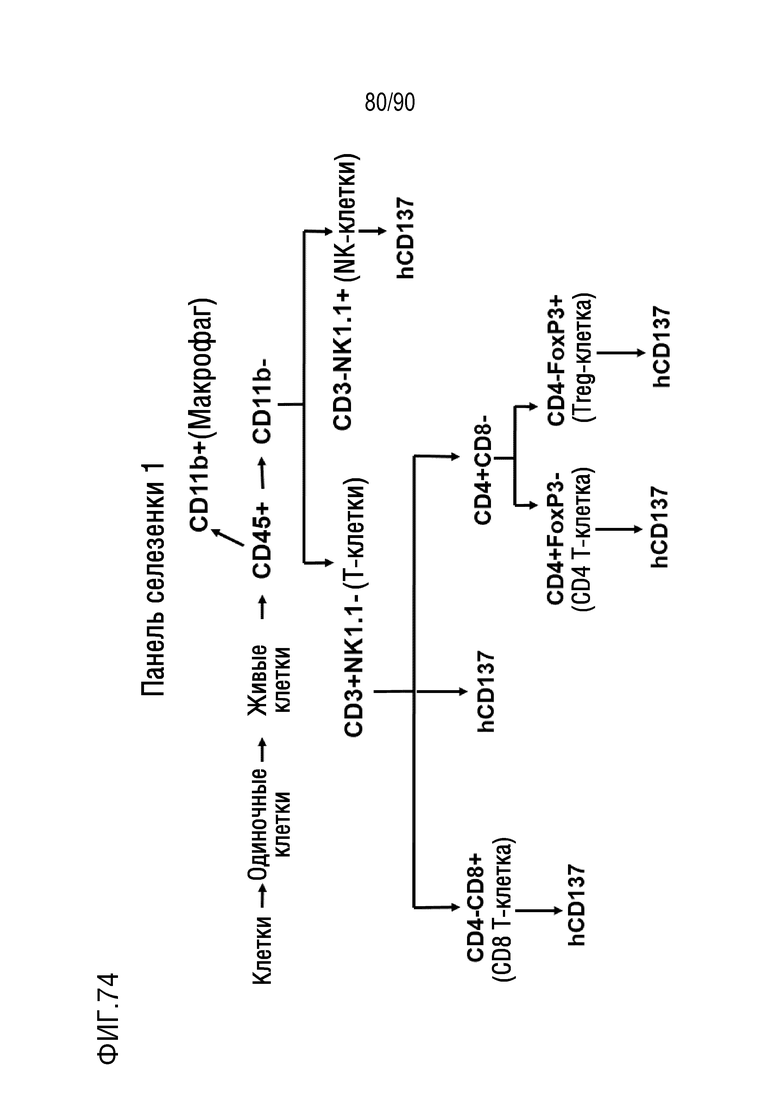
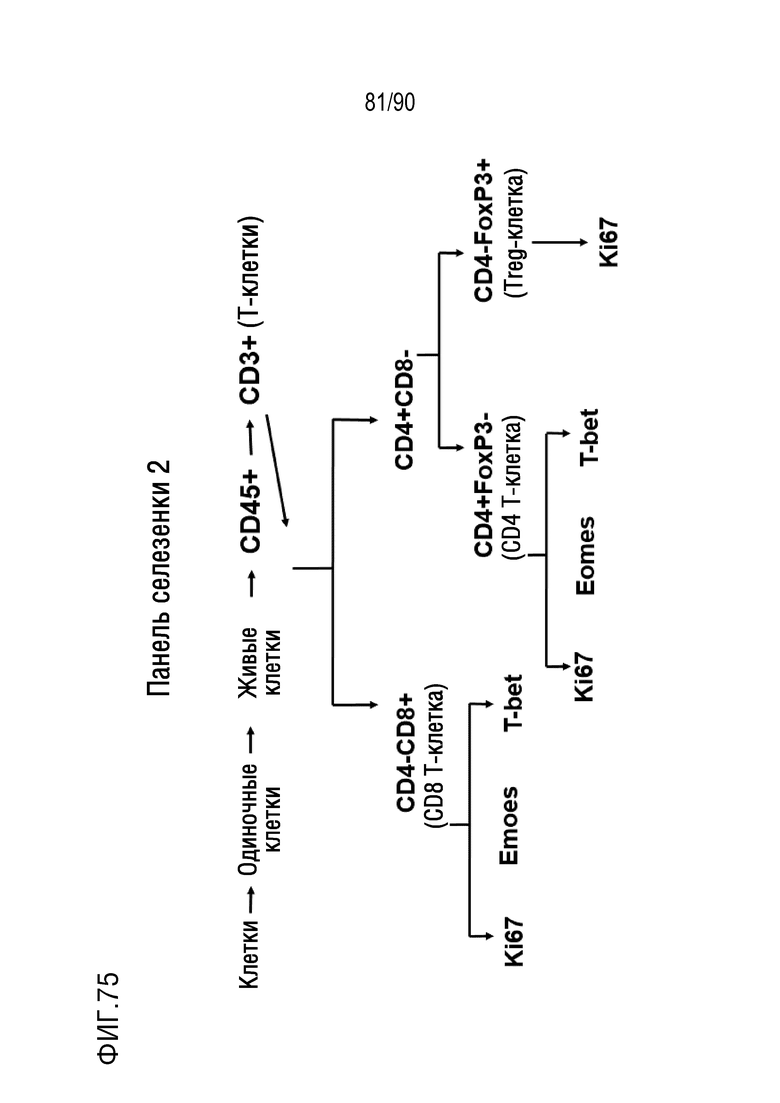
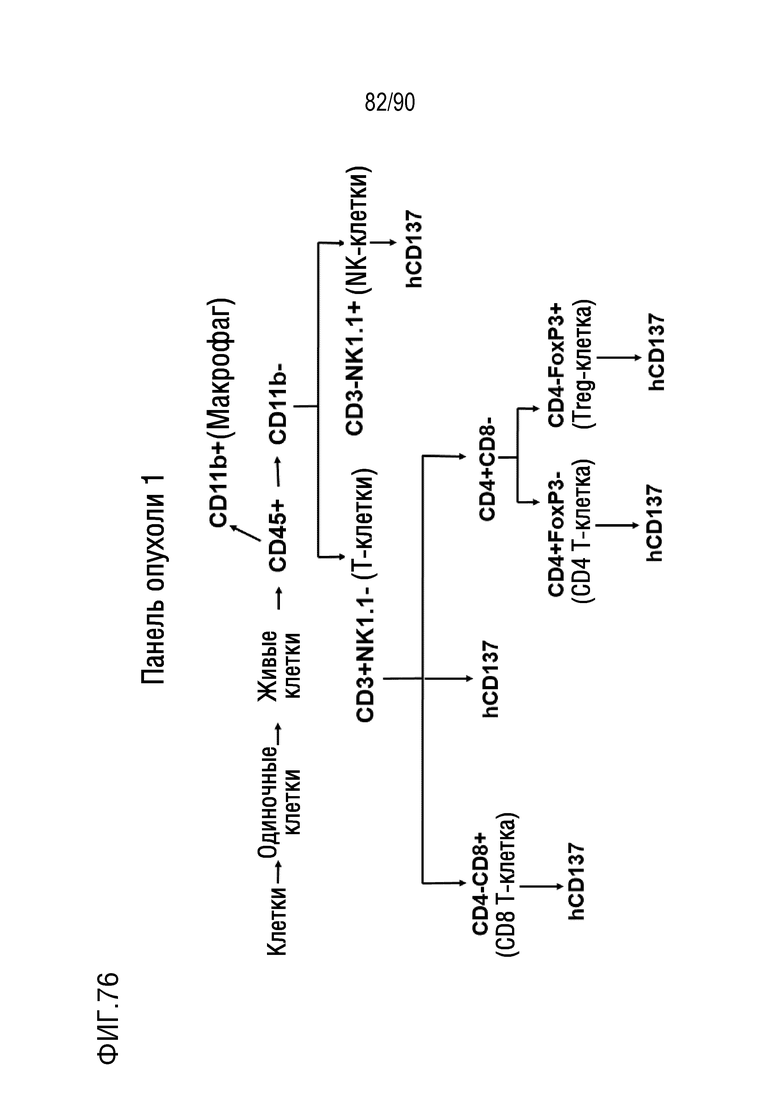

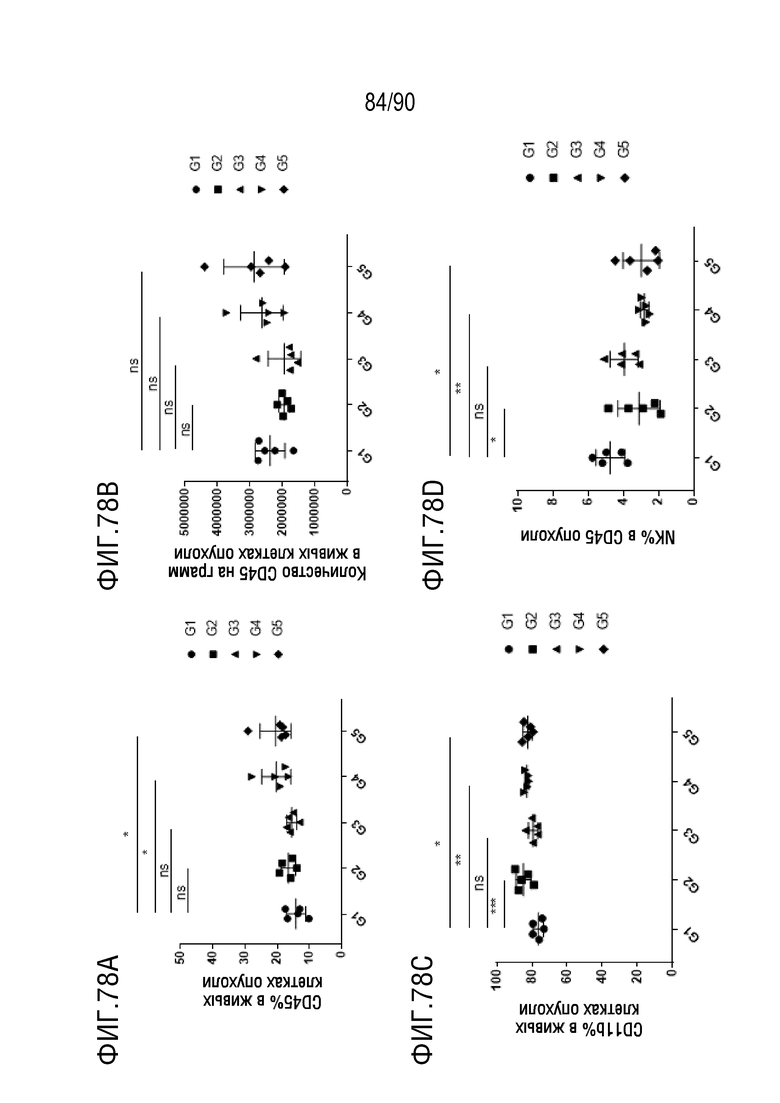
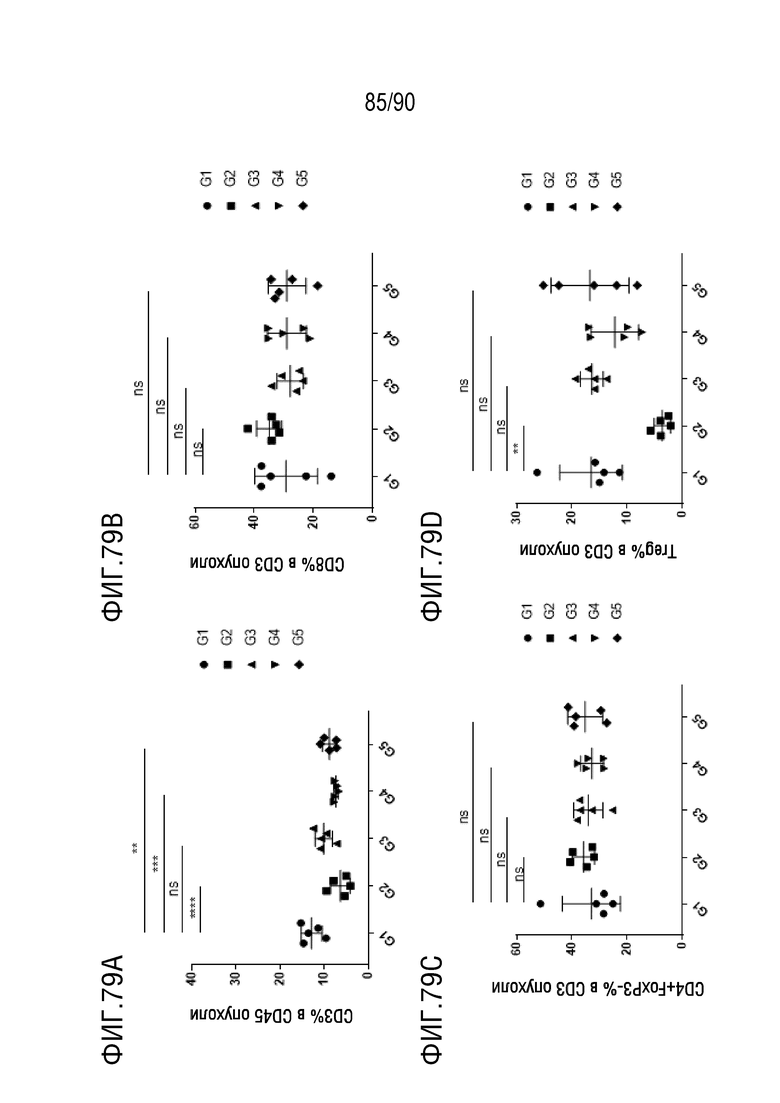
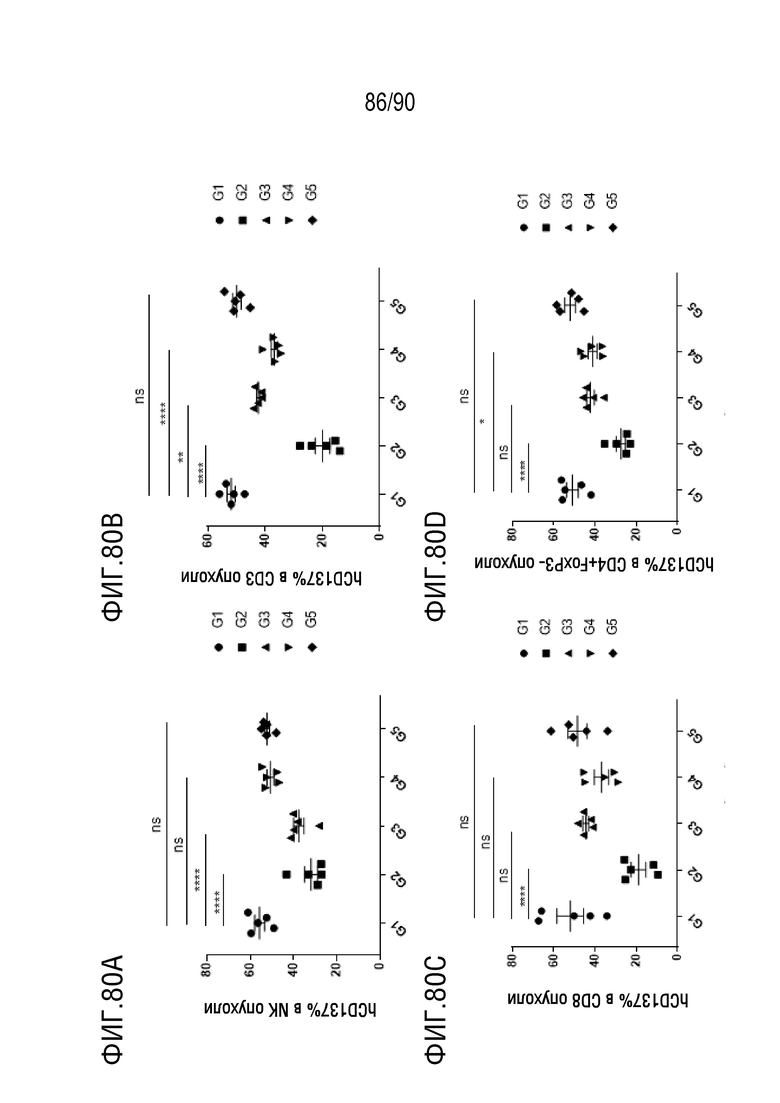
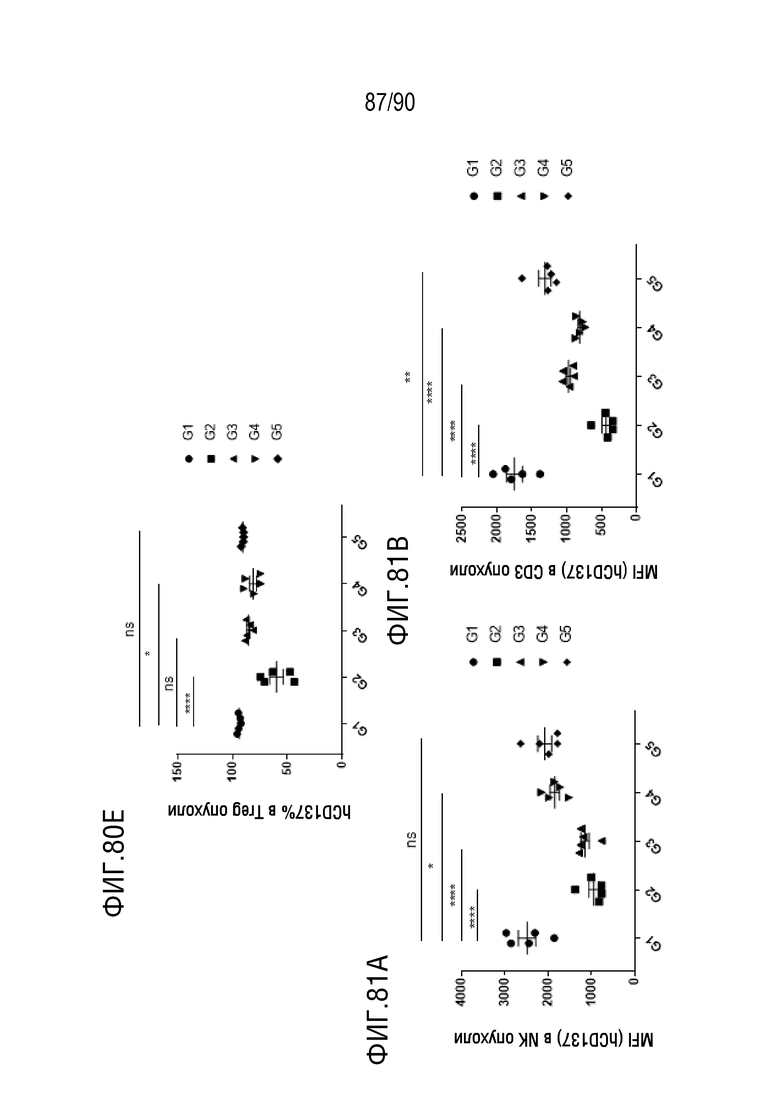
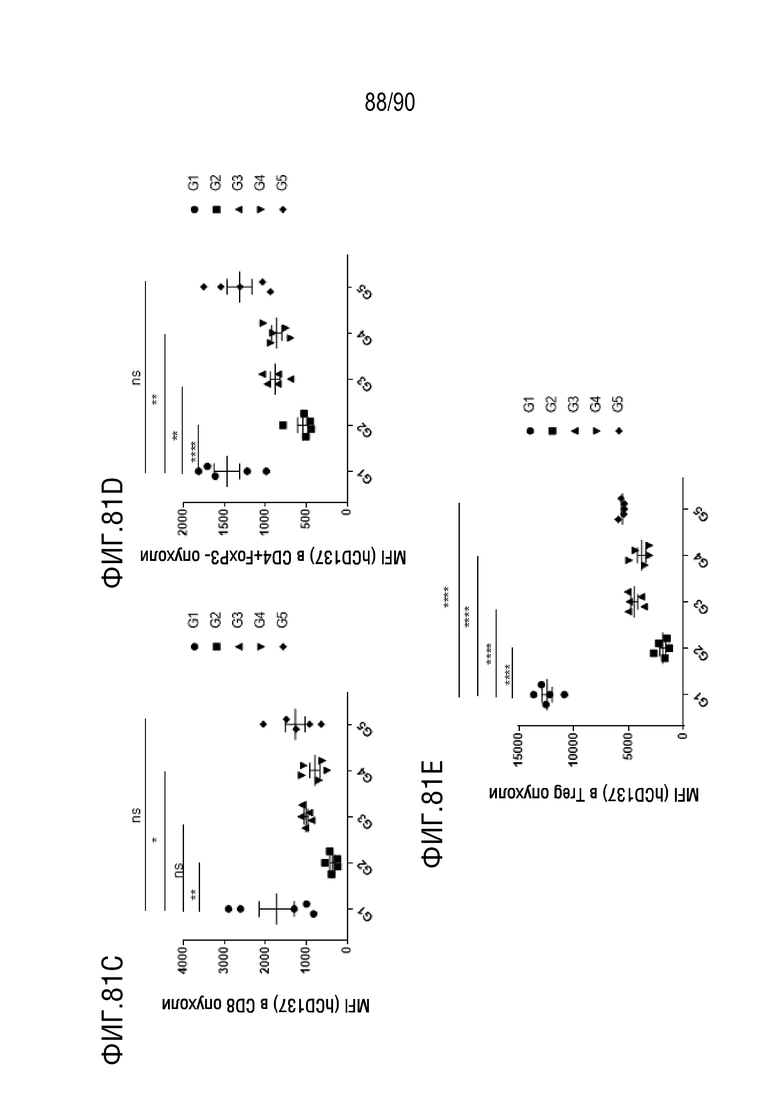
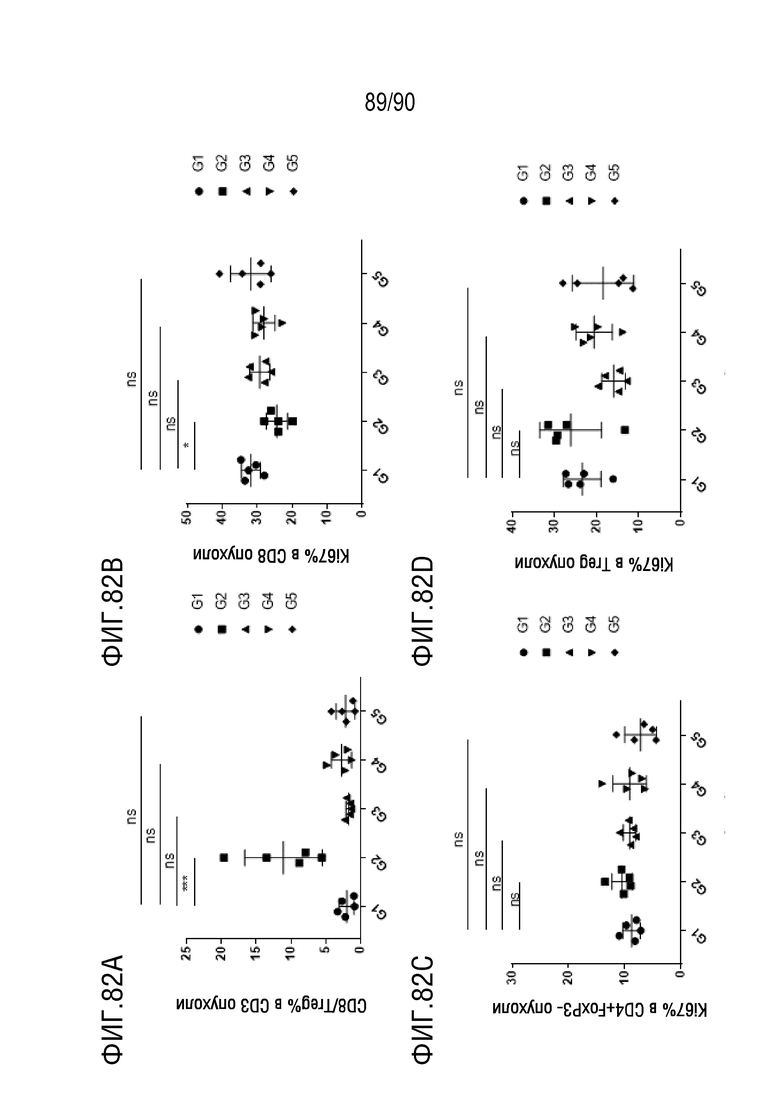

Изобретение относится к области биотехнологии, а именно к антителу или его антигенсвязывающему фрагменту, которые связываются с 4-1BB. Также раскрыто применение вышеуказанного антитела или его антигенсвязывающего фрагмента для получения биспецифического антитела. Изобретение эффективно для лечения онкологических заболеваний. 4 н. и 11 з.п. ф-лы, 83 ил., 49 табл., 21 пр.
1. Антитело или его антигенсвязывающий фрагмент, который связывается с 4-1BB (член 9 суперсемейства рецепторов TNF), содержащие:
вариабельную область тяжелой цепи (VH), содержащую области, определяющие комплементарность, (CDR) 1, 2 и 3, где
область VH CDR1 содержит аминокислотную последовательность, которая идентична выбранной аминокислотной последовательности VH CDR1,
область VH CDR2 содержит аминокислотную последовательность, которая идентична выбранной аминокислотной последовательности VH CDR2, и
область VH CDR3 содержит аминокислотную последовательность, которая идентична выбранной аминокислотной последовательности VH CDR3; и
вариабельную область легкой цепи (VL), содержащую CDR 1, 2 и 3, где
область VL CDR1 содержит аминокислотную последовательность, которая идентична выбранной аминокислотной последовательности VL CDR1,
область VL CDR2 содержит аминокислотную последовательность, которая идентична выбранной аминокислотной последовательности VL CDR2, и
область VL CDR3 содержит аминокислотную последовательность, которая идентична выбранной аминокислотной последовательности VL CDR3,
где выбранные аминокислотные последовательности VH CDR 1, 2 и 3 и выбранные аминокислотные последовательности VL CDR 1, 2 и 3 представляют собой одну из следующих:
(1) выбранные аминокислотные последовательности VH CDR 1, 2, 3 с SEQ ID NO: 1, 2, 3 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 с SEQ ID NO: 4, 5, 6 соответственно;
(2) выбранные аминокислотные последовательности VH CDR 1, 2, 3 с SEQ ID NO: 7, 8, 9 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 с SEQ ID NO: 10, 11, 12 соответственно;
(3) выбранные аминокислотные последовательности VH CDR 1, 2, 3 с SEQ ID NO: 13, 14, 15 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 с SEQ ID NO: 16, 17, 18 соответственно;
(4) выбранные аминокислотные последовательности VH CDR 1, 2, 3 с SEQ ID NO: 19, 20, 21 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 с SEQ ID NO: 22, 23, 24 соответственно;
(5) выбранные аминокислотные последовательности VH CDR 1, 2, 3 с SEQ ID NO: 25, 26, 27 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 с SEQ ID NO: 28, 29, 30 соответственно;
(6) выбранные аминокислотные последовательности VH CDR 1, 2, 3 с SEQ ID NO: 31, 32, 33 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 с SEQ ID NO: 34, 35, 36 соответственно;
(7) выбранные аминокислотные последовательности VH CDR 1, 2, 3 с SEQ ID NO: 37, 38, 39 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 с SEQ ID NO: 40, 41, 42 соответственно;
(8) выбранные аминокислотные последовательности VH CDR 1, 2, 3 с SEQ ID NO: 49, 50, 51 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 с SEQ ID NO: 52, 53, 54 соответственно;
(9) выбранные аминокислотные последовательности VH CDR 1, 2, 3 с SEQ ID NO: 55, 56, 57 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 с SEQ ID NO: 58, 59, 60 соответственно;
(10) выбранные аминокислотные последовательности VH CDR 1, 2, 3 с SEQ ID NO: 61, 62, 63 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 с SEQ ID NO: 64, 65, 66 соответственно;
(11) выбранные аминокислотные последовательности VH CDR 1, 2, 3 с SEQ ID NO: 67, 68, 69 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 с SEQ ID NO: 70, 71, 72 соответственно;
(12) выбранные аминокислотные последовательности VH CDR 1, 2, 3 с SEQ ID NO: 73, 74, 75 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 с SEQ ID NO: 76, 77, 78 соответственно;
(13) выбранные аминокислотные последовательности VH CDR 1, 2, 3 с SEQ ID NO: 85, 86, 87 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 с SEQ ID NO: 88, 89, 90 соответственно;
(14) выбранные аминокислотные последовательности VH CDR 1, 2, 3 с SEQ ID NO: 91, 92, 93 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 с SEQ ID NO: 94, 95, 96 соответственно;
(15) выбранные аминокислотные последовательности VH CDR 1, 2, 3 с SEQ ID NO: 97, 98, 99 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 с SEQ ID NO: 100, 101, 102 соответственно;
(16) выбранные аминокислотные последовательности VH CDR 1, 2, 3 с SEQ ID NO: 103, 104, 105 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 с SEQ ID NO: 106, 107, 108 соответственно;
(17) выбранные аминокислотные последовательности VH CDR 1, 2, 3 c SEQ ID NO: 109, 110, 111 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 c SEQ ID NO: 112, 113, 114 соответственно;
(18) выбранные аминокислотные последовательности VH CDR 1, 2, 3 c SEQ ID NO: 115, 116, 117 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 c SEQ ID NO: 118, 119, 120 соответственно;
(19) выбранные аминокислотные последовательности VH CDR 1, 2, 3 c SEQ ID NO: 121, 122, 123 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 c SEQ ID NO: 124, 125, 126 соответственно;
(20) выбранные аминокислотные последовательности VH CDR 1, 2, 3 c SEQ ID NO: 127, 128, 129 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 c SEQ ID NO: 130, 131, 132 соответственно;
(21) выбранные аминокислотные последовательности VH CDR 1, 2, 3 c SEQ ID NO: 133, 134, 135 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 c SEQ ID NO: 136, 137, 138 соответственно;
(22) выбранные аминокислотные последовательности VH CDR 1, 2, 3 c SEQ ID NO: 139, 140, 141 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 c SEQ ID NO: 142, 143, 144 соответственно;
(23) выбранные аминокислотные последовательности VH CDR 1, 2, 3 c SEQ ID NO: 145, 146, 147 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 c SEQ ID NO: 148, 149, 150 соответственно;
(24) выбранные аминокислотные последовательности VH CDR 1, 2, 3 c SEQ ID NO: 157, 158, 159 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 c SEQ ID NO: 160, 161, 162 соответственно;
(25) выбранные аминокислотные последовательности VH CDR 1, 2, 3 c SEQ ID NO: 163, 164, 165 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 c SEQ ID NO: 166, 167, 168 соответственно;
(26) выбранные аминокислотные последовательности VH CDR 1, 2, 3 c SEQ ID NO: 169, 170, 171 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 c SEQ ID NO: 172, 173, 174 соответственно;
(27) выбранные аминокислотные последовательности VH CDR 1, 2, 3 c SEQ ID NO: 175, 176, 177 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 c SEQ ID NO: 178, 179, 180 соответственно;
(28) выбранные аминокислотные последовательности VH CDR 1, 2, 3 c SEQ ID NO: 181, 182, 183 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 c SEQ ID NO: 184, 185, 186 соответственно;
(29) выбранные аминокислотные последовательности VH CDR 1, 2, 3 c SEQ ID NO: 193, 194, 195 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 c SEQ ID NO: 196, 197, 198 соответственно;
(30) выбранные аминокислотные последовательности VH CDR 1, 2, 3 c SEQ ID NO: 199, 200, 201 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 c SEQ ID NO: 202, 203, 204 соответственно;
(31) выбранные аминокислотные последовательности VH CDR 1, 2, 3 c SEQ ID NO: 205, 206, 207 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 c SEQ ID NO: 208, 209, 210 соответственно; и
(32) выбранные аминокислотные последовательности VH CDR 1, 2, 3 c SEQ ID NO: 211, 212, 213 соответственно и
выбранные аминокислотные последовательности VL CDR 1, 2, 3 c SEQ ID NO: 214, 215, 216 соответственно.
2. Антитело или его антигенсвязывающий фрагмент по п.1, где VH содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO: 1, 2 и 3 соответственно и VL содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO: 4, 5 и 6 соответственно согласно нумерации Кэбат; или
где VH содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO: 109, 110 и 111 соответственно и VL содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO: 112, 113 и 114 соответственно согласно нумерации Chothia.
3. Антитело или его антигенсвязывающий фрагмент по п.1, где VH содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO: 7, 8 и 9 соответственно и VL содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO: 10, 11 и 12 соответственно согласно нумерации Кэбат; или
где VH содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO: 115, 116 и 117 соответственно и VL содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO: 118, 119 и 120 соответственно согласно нумерации Chothia.
4. Антитело или его антигенсвязывающий фрагмент по п.1, где VH содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO: 13, 14 и 15 соответственно и VL содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO: 16, 17 и 18 соответственно согласно нумерации Кэбат; или
где VH содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO: 121, 122 и 123 соответственно и VL содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO: 124, 125 и 126 соответственно согласно нумерации Chothia.
5. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-4, где антитело или его антигенсвязывающий фрагмент специфически связываются с человеческим 4-1BB.
6. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-5, где антитело или его антигенсвязывающий фрагмент представляют собой гуманизированное антитело или его антигенсвязывающий фрагмент.
7. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-6, где антитело или его антигенсвязывающий фрагмент представляют собой одноцепочечный вариабельный фрагмент (scFV).
8. Применение антитела или его антигенсвязывающего фрагмента по любому из пп.1-7 для получения биспецифического антитела.
9. Антитело или его антигенсвязывающий фрагмент, которые связываются с 4-1BB, содержащие
вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность, которая идентична выбранной последовательности VH, и
вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность, которая идентична выбранной последовательности VL,
где выбранная последовательность VH и выбранная последовательность VL представляют собой одну из следующих:
(1) выбранная последовательность VH представляет собой SEQ ID NO: 221 и
выбранная последовательность VL представляет собой SEQ ID NO: 225 или 226;
(2) выбранная последовательность VH представляет собой SEQ ID NO: 243 и
выбранная последовательность VL представляет собой SEQ ID NO: 244;
(3) выбранная последовательность VH представляет собой SEQ ID NO: 229 и
выбранная последовательность VL представляет собой SEQ ID NO: 233 или 234;
(4) выбранная последовательность VH представляет собой SEQ ID NO: 230 и
выбранная последовательность VL представляет собой SEQ ID NO: 233;
(5) выбранная последовательность VH представляет собой SEQ ID NO: 245 и
выбранная последовательность VL представляет собой SEQ ID NO: 246;
(6) выбранная последовательность VH представляет собой SEQ ID NO: 247 и
выбранная последовательность VL представляет собой SEQ ID NO: 248;
(7) выбранная последовательность VH представляет собой SEQ ID NO: 236 и
выбранная последовательность VL представляет собой SEQ ID NO: 239 или 240;
(8) выбранная последовательность VH представляет собой SEQ ID NO: 249 и
выбранная последовательность VL представляет собой SEQ ID NO: 250;
(9) выбранная последовательность VH представляет собой SEQ ID NO: 251 и
выбранная последовательность VL представляет собой SEQ ID NO: 252;
(10) выбранная последовательность VH представляет собой SEQ ID NO: 253 и
выбранная последовательность VL представляет собой SEQ ID NO: 254;
(11) выбранная последовательность VH представляет собой SEQ ID NO: 255 и
выбранная последовательность VL представляет собой SEQ ID NO: 256;
(12) выбранная последовательность VH представляет собой SEQ ID NO: 259 и
выбранная последовательность VL представляет собой SEQ ID NO: 260;
(13) выбранная последовательность VH представляет собой SEQ ID NO: 261 и
выбранная последовательность VL представляет собой SEQ ID NO: 262;
(14) выбранная последовательность VH представляет собой SEQ ID NO: 263 и
выбранная последовательность VL представляет собой SEQ ID NO: 264;
(15) выбранная последовательность VH представляет собой SEQ ID NO: 265 и
выбранная последовательность VL представляет собой SEQ ID NO: 266;
(16) выбранная последовательность VH представляет собой SEQ ID NO: 267 и
выбранная последовательность VL представляет собой SEQ ID NO: 268;
(17) выбранная последовательность VH представляет собой SEQ ID NO: 271 и
выбранная последовательность VL представляет собой SEQ ID NO: 272;
(18) выбранная последовательность VH представляет собой SEQ ID NO: 273 и
выбранная последовательность VL представляет собой SEQ ID NO: 274;
(19) выбранная последовательность VH представляет собой SEQ ID NO: 275 и
выбранная последовательность VL представляет собой SEQ ID NO: 276; и
(20) выбранная последовательность VH представляет собой SEQ ID NO:277 и
выбранная последовательность VL представляет собой SEQ ID NO: 278.
10. Антитело или его антигенсвязывающий фрагмент по п.9, где
VH содержит последовательность SEQ ID NO: 236 и
VL содержит последовательность SEQ ID NO: 240.
11. Антитело или его антигенсвязывающий фрагмент по п.9, где
VH содержит последовательность SEQ ID NO: 221 и
VL содержит последовательность SEQ ID NO: 225.
12. Антитело или его антигенсвязывающий фрагмент по любому из пп.9-11, где антитело или его антигенсвязывающий фрагмент специфически связываются с 4-1BB человека.
13. Антитело или его антигенсвязывающий фрагмент по любому из пп.9-12, где антитело или его антигенсвязывающий фрагмент представляют собой гуманизированное антитело или его антигенсвязывающий фрагмент.
14. Антитело или его антигенсвязывающий фрагмент по любому из пп.9-13, где антитело или его антигенсвязывающий фрагмент представляют собой одноцепочечный вариабельный фрагмент (scFV).
15. Применение антитела или его антигенсвязывающего фрагмента по любому из пп.9-14 для получения биспецифического антитела.
| US 9783589 B2, 10.10.2017 | |||
| US 6887673 B2, 03.05.2005 | |||
| DASS S VINAY et al., Immunotherapy of cancer with 4-1BB, Mol Cancer Ther, 2012, 11(5), pp.1062-1670 | |||
| EP 3354661 A1, 01.08.2018 | |||
| ЦАРЕВ, И.Л | |||
| и др | |||
| Обзор подходов к иммунотерапии в онкологии | |||
| ИССЛЕДОВАНИЯ И ПРАКТИКА В МЕДИЦИНЕ | |||
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
Авторы
Даты
2024-01-25—Публикация
2019-09-11—Подача