ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к антителам против OX40 (представитель 4 суперсемейства рецепторов TNF, или TNFRSF4) и к их применениям.
УРОВЕНЬ ТЕХНИКИ
Злокачественная опухоль в настоящее время является одним из заболеваний, которые имеют наиболее высокую смертность у человека. В соответствии со статистическими данными Всемирной организации здравоохранения, в 2012 году частота встречаемости злокачественной опухоли по всему миру и смертельных случаев достигала 14 миллионов и 8,2 миллиона, соответственно. В Китае количество вновь диагностированных случаев злокачественной опухоли составило 3,07 миллиона, и число погибших составило 2,2 миллиона.
Недавний клинический и коммерческий успех антител против злокачественной опухоли создал значительный интерес к терапевтическим средствам на основе антител. Существует необходимость в разработке антител против злокачественной опухоли для применения в различных терапевтических средствах на основе антител для лечения злокачественных опухолей.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к антителам против OX40, их антигенсвязывающим фрагментам, и к их применениям.
В одном аспекте настоящее изобретение относится к антителам или их антигенсвязывающим фрагментам, которые связываются с OX40 (представитель 4 суперсемейства рецепторов TNF), содержащим вариабельную область тяжелой цепи (VH), содержащую определяющие комплементарность области (CDR) 1, 2 и 3, где область CDR1 VH содержит аминокислотную последовательность, которая по меньшей мере на 80% идентична выбранной аминокислотной последовательности CDR1 VH, область CDR2 VH содержит аминокислотную последовательность, которая по меньшей мере на 80% идентична выбранной аминокислотной последовательности CDR2 VH, и область CDR3 VH содержит аминокислотную последовательность, которая по меньшей мере на 80% идентична выбранной аминокислотной последовательности CDR3 VH; и вариабельную область легкой цепи (VL), содержащую CDR 1, 2 и 3, где область CDR1 VL содержит аминокислотную последовательность, которая по меньшей мере на 80% идентична выбранной аминокислотной последовательности CDR1 VL, область CDR2 VL содержит аминокислотную последовательность, которая по меньшей мере на 80% идентична выбранной аминокислотной последовательности CDR2 VL, и область CDR3 VL содержит аминокислотную последовательность, которая по меньшей мере на 80% идентична выбранной аминокислотной последовательности CDR3 VL, где выбранные аминокислотные последовательности CDR 1, 2 и 3 VH и выбранные аминокислотные последовательности CDR 1, 2 и 3 VL соответствуют одному из следующих:
(1) выбранные аминокислотные последовательности CDR 1, 2, 3 VH указаны в SEQ ID NO: 1, 2, 3, соответственно, и выбранные аминокислотные последовательности CDR 1, 2, 3 VL указаны в SEQ ID NO: 4, 5, 6, соответственно;
(2) выбранные аминокислотные последовательности CDR 1, 2, 3 VH указаны в SEQ ID NO: 7, 8, 9, соответственно, и выбранные аминокислотные последовательности CDR 1, 2, 3 VL указаны в SEQ ID NO: 10, 11, 12, соответственно;
(3) выбранные аминокислотные последовательности CDR 1, 2, 3 VH указаны в SEQ ID NO: 13, 14, 15, соответственно, и выбранные аминокислотные последовательности CDR 1, 2, 3 VL указаны в SEQ ID NO: 16, 17, 18, соответственно;
(4) выбранные аминокислотные последовательности CDR 1, 2, 3 VH указаны в SEQ ID NO: 19, 20, 21, соответственно, и выбранные аминокислотные последовательности CDR 1, 2, 3 VL указаны в SEQ ID NO: 22, 23, 24, соответственно.
В некоторых вариантах осуществления VH содержит CDR 1, 2, 3 с аминокислотными последовательностями, указанными в SEQ ID NO: 1, 2 и 3, соответственно, и VL содержит CDR 1, 2, 3 с аминокислотными последовательностями, указанными в SEQ ID NO: 4, 5 и 6, соответственно. В некоторых вариантах осуществления VH содержит CDR 1, 2, 3 с аминокислотными последовательностями, указанными в SEQ ID NO: 13, 14 и 15, соответственно, и VL содержит CDR 1, 2, 3 с аминокислотными последовательностями, указанными в SEQ ID NO: 16, 17 и 18, соответственно.
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент специфически связывается с OX40 человека.
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляет собой гуманизированное антитело или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляет собой одноцепочечный вариабельный фрагмент (scFV).
В одном аспекте изобретение также относится к нуклеиновым кислотам, содержащим полинуклеотид, кодирующий полипептид, содержащий:
(1) тяжелую цепь иммуноглобулина или ее фрагмент, содержащие вариабельную область тяжелой цепи (VH), содержащую определяющие комплементарность области (CDR) 1, 2 и 3, содержащие аминокислотные последовательности, указанные в SEQ ID NO: 1, 2 и 3, соответственно, и где VH, когда она находится в паре с вариабельной областью легкой цепи (VL), содержащей аминокислотную последовательность, указанную в SEQ ID NO: 56, 57, 58 или 80, связывается с OX40;
(2) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, указанные в SEQ ID NO: 4, 5, и 6, соответственно, и где VL, когда она находится в паре с VH, содержащей аминокислотную последовательность, указанную в SEQ ID NO: 53, 54, 55 или 79, связывается с OX40;
(3) тяжелую цепь иммуноглобулина или ее фрагмент, содержащие вариабельную область тяжелой цепи (VH), содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, указанные в SEQ ID NO: 7, 8 и 9, соответственно, и где VH, когда она находится в паре с вариабельной областью легкой цепи (VL), содержащей аминокислотную последовательность, указанную в SEQ ID NO: 62, 63, 64, 65 или 82, связывается с OX40; или
(4) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, указанные в SEQ ID NO: 10, 11 и 12, соответственно, и где VL, когда она находится в паре с VH, содержащей аминокислотную последовательность, указанную в SEQ ID NO: 59, 60, 61 или 81, связывается с OX40;
(5) тяжелую цепь иммуноглобулина или ее фрагмент, содержащие вариабельную область тяжелой цепи (VH), содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, указанные в SEQ ID NO: 13, 14 и 15, соответственно, и где VH, когда она находится в паре с вариабельной областью легкой цепи (VL), содержащей аминокислотную последовательность, указанную в SEQ ID NO: 69, 70, 71, 72 или 84, связывается с OX40;
(6) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, указанные в SEQ ID NO: 16, 17 и 18, соответственно, и где VL, когда она находится в паре с VH, содержащей аминокислотную последовательность, указанную в SEQ ID NO: 66, 67, 68 или 83, связывается с OX40;
(7) тяжелую цепь иммуноглобулина или ее фрагмент, содержащие вариабельную область тяжелой цепи (VH), содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, указанные в SEQ ID NO: 19, 20 и 21, соответственно, и где VH, когда она находится в паре с вариабельной областью легкой цепи (VL), содержащей аминокислотную последовательность, указанную в SEQ ID NO: 76, 77, 78 или 86, связывается с OX40;
(8) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, указанные в SEQ ID NO: 22, 23 и 24, соответственно, и где VL, когда она находится в паре с VH, содержащей аминокислотную последовательность, указанную в SEQ ID NO: 73, 74, 75 или 85, связывается с OX40.
В некоторых вариантах осуществления нуклеиновая кислота содержит полинуклеотид, кодирующий полипептид, содержащий тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VH, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, указанные в SEQ ID NO: 1, 2 и 3, соответственно.
В некоторых вариантах осуществления нуклеиновая кислота содержит полинуклеотид, кодирующий полипептид, содержащий легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, указанные в SEQ ID NO: 4, 5 и 6, соответственно.
В некоторых вариантах осуществления нуклеиновая кислота содержит полинуклеотид, кодирующий полипептид, содержащий тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VH, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, указанные в SEQ ID NO: 13, 14 и 15, соответственно.
В некоторых вариантах осуществления нуклеиновая кислота содержит полинуклеотид, кодирующий полипептид, содержащий легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности, указанные в SEQ ID NO: 16, 17 и 18, соответственно.
В некоторых вариантах осуществления VH, когда она находится в паре с VL, специфически связывается с OX40 человека, или VL, когда она находится в паре с VH, специфически связывается с OX40 человека.
В некоторых вариантах осуществления тяжелая цепь иммуноглобулина или ее фрагмент представляет собой гуманизированную тяжелую цепь иммуноглобулина или ее фрагмент, и легкая цепь иммуноглобулина или ее фрагмент представляет собой гуманизированную легкую цепь иммуноглобулина или ее фрагмент.
В некоторых вариантах осуществления нуклеиновая кислота кодирует одноцепочечный вариабельный фрагмент (scFv). В некоторых вариантах осуществления нуклеиновая кислота представляет собой кДНК.
В одном аспекте изобретение также относится к векторам, содержащим одну или несколько нуклеиновых кислот, как описано в настоящем описании. В некоторых вариантах осуществления вектор кодирует область VL и область VH, которые вместе связываются с OX40.
В одном аспекте изобретение относится к паре векторов, где каждый вектор содержит одну из нуклеиновых кислот, как описано в настоящем описании, где вместе пара векторов кодируют область VL и область VH, которые вместе связываются с OX40.
В другом аспекте изобретение также относится к клетке, содержащей вектор или пару векторов, как описано в настоящем описании. В некоторых вариантах осуществления клетка представляет собой клетку CHO.
В одном аспекте изобретение также относится к клеткам, содержащим одну или несколько нуклеиновых кислот, как описано в настоящем описании, или к клеткам, содержащим две нуклеиновых кислоты, как описано в настоящем описании. В некоторых вариантах осуществления две нуклеиновых кислоты вместе кодируют область VL и область VH, которые вместе связываются с OX40.
В другом аспекте изобретение относится к способам получения антитела или его антигенсвязывающего фрагмента. Способы вовлекают культивирование клетки, как описано в настоящем описании, в условиях, достаточных, чтобы клетка продуцировала антитело или антигенсвязывающий фрагмент; и сбор антитела или антигенсвязывающего фрагмента, продуцированного клеткой.
В одном аспекте изобретение относится к антителам или их антигенсвязывающим фрагментам, которые связываются с OX40, содержащим вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность, которая по меньшей мере на 90% идентична выбранной последовательности VH, и вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность, которая по меньшей мере на 90% идентична выбранной последовательности VL, где выбранная последовательность VH и выбранная последовательность VL представляют собой одно из следующих:
(1) выбранная последовательность VH представляет собой SEQ ID NO: 53, 54, 55 или 79, и выбранная последовательность VL представляет собой SEQ ID NO: 56, 57, 58 или 80;
(2) выбранная последовательность VH представляет собой SEQ ID NO: 59, 60, 61 или 81, и выбранная последовательность VL представляет собой SEQ ID NO: 62, 63, 64, 65 или 82;
(3) выбранная последовательность VH представляет собой SEQ ID NO: 66, 67, 68 или 83, и выбранная последовательность VL представляет собой SEQ ID NO: 69, 70, 71, 72 или 84;
(4) выбранная последовательность VH представляет собой SEQ ID NO: 73, 74, 75 или 85, и выбранная последовательность VL представляет собой SEQ ID NO: 76, 77, 78 или 86.
В некоторых вариантах осуществления VH содержит последовательность SEQ ID NO: 53 и VL содержит последовательность SEQ ID NO: 56.
В некоторых вариантах осуществления VH содержит последовательность SEQ ID NO: 55 и VL содержит последовательность SEQ ID NO: 58.
В некоторых вариантах осуществления VH содержит последовательность SEQ ID NO: 55 и VL содержит последовательность SEQ ID NO: 56.
В некоторых вариантах осуществления VH содержит последовательность SEQ ID NO: 73 и VL содержит последовательность SEQ ID NO: 77.
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент специфически связывается с OX40 человека.
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляет собой гуманизированное антитело или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент представляет собой одноцепочечный вариабельный фрагмент (scFV).
В одном аспекте изобретение также относится к конъюгату антитело-лекарственное средство, содержащему антитело или его антигенсвязывающий фрагмент, ковалентно или не ковалентно связанные с терапевтическим средством. В некоторых вариантах осуществления терапевтическое средство представляет собой цитотоксическое или цитостатическое средство (например, цитохалазин B, грамицидин D, бромид этидия, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрацин, майтанзиноиды, такие как DM-1 и DM-4, дион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол, пуромицин, эпирубицин, и циклофосфамид и аналоги).
В одном аспекте изобретение также относится к способу лечения индивидуума, имеющего злокачественную опухоль. Способы вовлекают введение индивидууму терапевтически эффективного количества композиции, содержащей антитело или его антигенсвязывающий фрагмент, или конъюгаты антитело-лекарственное средство, как описано в настоящем описании.
В некоторых вариантах осуществления индивидуум имеет солидную опухоль. В некоторых вариантах осуществления злокачественная опухоль представляет собой нерезектабельную меланому или метастазирующую меланому.
В некоторых вариантах осуществления злокачественная опухоль представляет собой немелкоклеточный рак легкого (NSCLC), плоскоклеточную карциному головы и шеи (SCCHN), почечноклеточный рак (RCC), меланому, рак мочевого пузыря, тройной негативный рак молочной железы (TNBC), или карциному ободочной и прямой кишки.
В одном аспекте изобретение относится к способам снижения скорости роста опухоли. Способы вовлекают приведение в контакт опухолевой клетки с эффективным количеством композиции, содержащей антитело или его антигенсвязывающий фрагмент, или конъюгаты антитело-лекарственное средство, как описано в настоящем описании.
В другом аспекте изобретение относится к способам уничтожения опухолевой клетки. Способы вовлекают приведение в контакт опухолевой клетки с эффективным количеством композиции, содержащей антитело или его антигенсвязывающий фрагмент, или конъюгаты антитело-лекарственное средство, как описано в настоящем описании.
В одном аспекте изобретение относится к фармацевтическим композициям, содержащим антитело или его антигенсвязывающий фрагмент, как описано в настоящем описании, и фармацевтически приемлемый носитель.
В другом аспекте изобретение относится к фармацевтическим композициям, содержащим конъюгаты антитело-лекарственное средство, как описано в настоящем описании, и фармацевтически приемлемый носитель.
Как используют в рамках изобретения, термин "злокачественная опухоль" относится к клеткам, обладающим способностью к автономному росту. Примеры таких клеток включают клетки, имеющие аномальный статус или состояние, характеризующиеся быстрой пролиферацией и ростом клеток. Также подразумевается, что термин включает злокачественные образования, например, опухоли; онкогенные процессы, метастатические ткани и злокачественно трансформированные клетки, ткани или органы, независимо от гистологического типа или стадии инвазивности. Также включены злокачественные опухоли различных систем органов, таких как дыхательная, сердечно-сосудистая, почечная, репродуктивная, гематологическая, неврологическая, печеночная, желудочно-кишечная и эндокринная системы; а также аденокарциномы, которые включают злокачественные опухоли, такие как большинство случаев рака толстого кишечника, почечно-клеточную карциному, рак предстательной железы и/или опухоли яичка, немелкоклеточную карциному легкого и рак тонкого кишечника. Злокачественная опухоль, которая является "естественным образом возникшей", включает любую злокачественную опухоль, которая не является экспериментально индуцированной посредством имплантации злокачественных клеток индивидууму, и включает, например, спонтанно возникшую злокачественную опухоль, злокачественную опухоль, вызванную воздействием на пациента канцерогена(ов), злокачественную опухоль в результате встраивания трансгенного онкогена или нокаута гена опухолевой супрессии, и злокачественную опухоль, вызванную инфекциями, например, вирусными инфекциями. Термин "карцинома" является известным в данной области и относится к злокачественным опухолям эпителиальных или эндокринных тканей. Также термин включает карциносаркомы, которые включают злокачественные опухоли, состоящие из карциноматозных и саркоматозных тканей. "Аденокарцинома" относится к карциноме, которая происходит из железистой ткани или в которой опухолевые клетки образуют поддающиеся распознаванию железистые структуры. Термин "саркома" является известным в данной области и относится к злокачественным опухолям мезенхимального происхождения. Термин "гематологические неопластические нарушения" включает заболевания, вовлекающие гиперпластические/неопластические клетки гемопоэтического происхождения. Гемопоэтическое неопластическое нарушение может возникать из миелоидных, лимфоидных или эритроидных линий клеток, или из их клеток-предшественников.
Как используют в рамках изобретения, термин "антитело" относится к любой антигенсвязывающей молекуле, которая содержит по меньшей мере одну (например, одну, две, три, четыре, пять или шесть) определяющих комплементарность областей (CDR) (например, все три CDR из легкой цепи иммуноглобулина или любые три CDR из тяжелой цепи иммуноглобулина) и способна специфически связываться с эпитопом. Неограничивающие примеры антител включают: моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела), одноцепочечные антитела, химерные антитела, антитела человека и гуманизированные антитела. В некоторых вариантах осуществления антитело может содержать Fc-область антитела человека. Термин "антитело" также включает производные, например, биспецифические антитела, одноцепоченые антитела, диантитела, линейные антитела и полиспецифические антитела, образованные из фрагментов антител.
Как используют в рамках изобретения, термин "антигенсвязывающий фрагмент" относится к части полноразмерного антитела, где часть антитела способна специфически связываться с антигеном. В некоторых вариантах осуществления антигенсвязывающий фрагмент содержит по меньшей мере один вариабельный домен (например, вариабельный домен тяжелой цепи или вариабельный домен легкой цепи). Неограничивающие примеры фрагментов антител включают, например, Fab, Fab’, F(ab’)2 и Fv-фрагменты.
Как используют в рамках изобретения, термин "антитело человека" относится к антителу, которое кодируется эндогенной нуклеиновой кислотой (например, реарранжированным локусом тяжелой или легкой цепи иммуноглобулина человека), присутствующей у человека. В некоторых вариантах осуществления антитело человека получено от человека или продуцировано культурой клеток человека (например, гибридомные клетки человека). В некоторых вариантах осуществления антитело человека продуцируется клеткой, не являющейся человеческой (например, клеточная линия мыши или хомячка). В некоторых вариантах осуществления антитело человека продуцируется бактериальной или дрожжевой клеткой. В некоторых вариантах осуществления антитело человека продуцируется у трансгенного не являющегося человеком животного (например, животного семейства бычьих), содержащего нереарранжированный или реарранжированный локус иммуноглобулина человека (например, локус тяжелой или легкой цепи иммуноглобулина человека).
Как используют в рамках изобретения, термин "химерное антитело" относится к антителу, которое содержит последовательность, присутствующую по меньшей мере в двух различных антителах (например, антителах из двух различных видов млекопитающих, таких как антитело человека и мыши). Неограничивающим примером химерного антитела является антитело, содержащее последовательности вариабельных доменов (например, всю или часть последовательности вариабельного домена легкой цепи и/или тяжелой цепи) не являющегося человеческим антитела (например, мыши) и константные домены антитела человека. Дополнительные примеры химерных антител описаны в настоящем описании и известны в данной области.
Как используют в рамках изобретения, термин "гуманизированное антитело" относится к не являющемуся человеческим антителу, которое содержит минимальную последовательность, происходящую из не являющегося человеческим иммуноглобулина (например, мыши), и содержит последовательности, происходящие из иммуноглобулина человека. В неограничивающих примерах гуманизированные антитела представляют собой антитела человека (реципиентное антитело), в которых остатки гипервариабельной области (например, CDR) реципиентного антитела заменены остатками гипервариабельной области (например, CDR) не являющегося человеческим антитела (например, донорное антитело), например, антитела мыши, крысы или кролика, имеющего требуемую специфичность, аффинность или емкость. В некоторых вариантах осуществления каркасные остатки Fv иммуноглобулина человека заменены соответствующими остатками не являющегося человеческим иммуноглобулина (например, мыши). В некоторых вариантах осуществления гуманизированные антитела могут содержать остатки, которые не встречаются ни в реципиентном антителе, ни в донорном антителе. Эти модификации можно вносить для дальнейшего повышения эффективности антитела. В некоторых вариантах осуществления гуманизированное антитело содержит по существу все из по меньшей мере одного, и, как правило, двух вариабельных доменов, в которых все или по существу все из гипервариабельных петель (CDR) соответствуют гипервариабельным петлям не являющегося человеческим иммуноглобулина (например, мыши), и все или по существу все из каркасных областей представляют собой каркасные области иммуноглобулина человека. Гуманизированное антитело также может содержать по меньшей мере часть константной области (Fc) иммуноглобулина, как правило, константной области иммуноглобулина человека. Гуманизированные антитела можно получать с использованием способов молекулярной биологии, известных в данной области. Неограничивающие примеры способов получения гуманизированных антитела описаны в настоящем описании.
Как используют в рамках изобретения, термин "одноцепочечное антитело" относится к единому полипептиду, содержащему по меньшей мере два вариабельных домена иммуноглобулина (например, вариабельный домен тяжелой цепи или легкой цепи иммуноглобулина млекопитающих), который способен специфически связываться с антигеном. Неограничивающие примеры одноцепочечных антител описаны в настоящем описании.
Как используют в рамках изобретения, термин "мультимерное антитело" относится к антителу, которое содержит четыре или более (например, шесть, восемь или десять) вариабельных доменов иммуноглобулина. В некоторых вариантах осуществления мультимерное антитело способно сшивать одну молекулу-мишень (например, OX40) по меньшей мере с одной второй молекулой-мишенью (например, PD1) на поверхности клетки млекопитающего (например, T-клетки человека).
Как используют в рамках изобретения, термины "индивидуум" и "пациент" используют в настоящем описании взаимозаменяемо, и они описывают животное, как являющееся человеком, так и не являющееся человеком, которому предоставляют лечение способами по настоящему изобретению. Настоящее изобретение предусматривает ветеринарные и не ветеринарные применения. Пациенты-люди могут представлять собой взрослых людей или молодых людей (например, людей в возрасте менее 18 лет). В дополнение к людям, пациенты включают, но не ограничиваются ими, мышей, крыс, хомячков, морских свинок, кроликов, хорьков, кошек, собак и приматов. Они включают, например, не являющихся человеком приматов (например, обезьяна, шимпанзе, горилла и т.п.), грызунов (например, крысы, мыши, песчанки, хомячки, хорьки, кролики), зайцеобразных, свиных (например, свинья, карликовая свинья), лошадиных, собачьих, кошачьих, бычьих и других домашних, сельскохозяйственных и зоопарковых животных.
Как используют в рамках изобретения, при указании на антитело, выражения "специфически связывающийся" и "специфически связывается" означает, что антитело взаимодействует с его молекулой-мишенью (например, OX40), предпочтительно с другими молекулами, поскольку взаимодействие зависит от присутствия конкретной структуры (т.е. антигенная детерминанта или эпитоп) на молекуле-мишени; иными словами, реагент распознает и связывается с молекулами, которые включают специфическую структуру, а не со всеми молекулами в целом. Антитело, которое специфически связывается с молекулой-мишенью, может упоминаться как специфичное к мишени антитело. Например, антитело, которое специфически связывается с молекулой OX40, может упоминаться как OX40-специфическое антитело или антитело против OX40.
Как используют в рамках изобретения, термины "полипептид", "пептид" и "белок" используются взаимозаменяемо для указания на полимеры из аминокислот любой длины, составляющей по меньшей мере две аминокислоты.
Как используют в рамках изобретения, термины "полинуклеотид", "молекула нуклеиновой кислоты" и "последовательность нуклеиновой кислоты" используют в настоящем описании взаимозаменяемо для указания на полимеры из нуклеотидов любой длины, составляющей по меньшей мере два нуклеотида, и они включают, но не ограничиваются ими, ДНК, РНК, гибриды ДНК/РНК и их модификации.
Если не определено иначе, все технические и научные термины, используемые в настоящем описании, обладают тем же значением, которое обычно подразумевает специалист в области, к которой относится настоящее изобретение. В настоящем описании описаны способы и материалы для применения в рамках настоящего изобретения; также можно использовать другие подходящие способы и материалы, известные в данной области. Материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения. Все публикации, патентные заявки, патенты, последовательности, записи баз данных и другие ссылки, упоминаемые в настоящем описании, включены в настоящее описание в качестве ссылок в полном объеме. В случае противоречия настоящее описание, в том числе определения, имеет преимущество.
Другие признаки и преимущества изобретения станут очевидными из приведенного ниже подробного описания и чертежей, и из формулы изобретения.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 представлена блок-схема, демонстрирующая первую часть иллюстративного протокола получения антител против OX40.
На фиг. 2 представлена блок-схема, демонстрирующая вторую часть иллюстративного протокола получения антител против OX40.
На фиг. 3 представлен набор графиков на основе результатов проточной цитометрии, демонстрирующих, что антитела против OX40 блокируют связывание между OX40 и OX40L.
На фиг. 4 представлен набор графиков на основе результатов проточной цитометрии, демонстрирующих, что антитела против OX40 могут связываться с OX40 человека.
На фиг. 5 представлен набор графиков, демонстрирующих результаты проточной цитометрии для перекрестной реактивности антител против OX40 в отношении OX40 обезьяны (rmOX40), мыши (mOX40) и химерного OX40 человека-мыши (chiOX40).
На фиг. 6 представлен график, демонстрирующий скорость ассоциации и скорость диссоциации между химерным антителом против hOX40 (9H3-mHvKv-IgG1) и OX40 человека.
На фиг. 7 представлен график, демонстрирующий массу тела с течением времени у мышей с гуманизированным OX40 (B-hOX40), имеющих опухолевые клетки MC-38, которых лечили антителами мыши против hOX40 07-9H3, 07-9A4, 11-5C1, 17-5D10, 08-6A11 и 14-7F11.
На фиг. 8 представлен график, демонстрирующий процентное изменение массы тела с течением времени у мышей с гуманизированным OX40 (B-hOX40), имеющих опухолевые клетки MC-38, которым вводили антитела мыши против hOX40 07-9H3, 07-9A4, 11-5C1, 17-5D10, 08-6A11 и 14-7F11.
На фиг. 9 представлен график, демонстрирующий размер опухоли с течением времени у мышей с гуманизированным OX40 (B-hOX40), имеющих опухолевые клетки MC-38, которым вводили антитела мыши против hOX40 07-9H3, 07-9A4, 11-5C1, 17-5D10, 08-6A11 и 14-7F11.
На фиг. 10 представлен график, демонстрирующий массу тела с течением времени мышей с гуманизированным OX40 (B-hOX40), имеющих опухолевые клетки MC-38, которым вводили химерные антитела против hOX40.
На фиг. 11 представлен график, демонстрирующий процентное изменение массы тела с течением времени у мышей с гуманизированным OX40 (B-hOX40), имеющих опухолевые клетки MC-38, которым вводили химерные антитела против hOX40.
На фиг. 12 представлен график, демонстрирующий размер опухоли с течением времени у мышей с гуманизированным OX40 (B-hOX40), имеющих опухолевые клетки MC-38, которым вводили химерные антитела против hOX40.
На фиг. 13 представлен график, демонстрирующий массу тела с течением времени у мышей с гуманизированным OX40 (B-hOX40), имеющих опухолевые клетки MC-38, которым вводили гуманизированные антитела против hOX40.
На фиг. 14 представлен график, демонстрирующий процентное изменение массы тела с течением времени у мышей с гуманизирированным OX40 (B-hOX40), имеющих опухолевые клетки MC-38, которым вводили антитела против hOX40.
На фиг. 15 представлен график, демонстрирующий размер опухоли с течением времени у мышей с гуманизированным OX40 (B-hOX40), имеющих опухолевые клетки MC-38, которым вводили гуманизированные антитела против hOX40.
На фиг. 16 приведен набор изображений патологии ткани печени с окрашиванием H&E (400X).
На фиг. 17 приведен набор изображений патологии почки с окрашиванием H&E (400X).
На фиг. 18 приведен набор изображений патологии ткани кишечника с окрашиванием H&E (400X).
На фиг. 19 представлен график, демонстрирующий массе тела с течением времени мышей с гуманизированным OX40 (B-hOX40), имеющих опухолевые клетки MC-38, которым вводили 9H3 и Китруду.
На фиг. 20 представлен график, демонстрирующий процентное изменение массы тела с течением времени у мышей с гуманизированным OX40 (B-hOX40), имеющих опухолевые клетки MC-38, которым вводили 9H3 и Китруду.
На фиг. 21 представлен график, демонстрирующий размер опухоли с течением времени у мышей с гуманизированным OX40 (B-hOX40), имеющих опухолевые клетки MC-38, которым вводили 9H3 и Китруду.
На фиг. 22 представлен график, демонстрирующий массу тела с течением времени у мышей с гуманизированным OX40 (B-hOX40), имеющих злокачественные клетки EL4, которым вводили 9H3 и Китруду.
На фиг 23 представлен график, демонстрирующий процентное изменение массы тела с течением времени у мышей с гуманизированным OX40 (B-hOX40), имеющих злокачественные клетки EL4, которым вводили 9H3 и Китруду.
На фиг. 24 представлен график, демонстрирующий размер опухоли с течением времени у мышей с гуманизированным OX40 (B-hOX40), имеющих злокачественные клетки EL4, которым вводили 9H3 и Китруду.
На фиг. 25 представлен график, демонстрирующий массу тела с течением времени у мышей с гуманизированным OX40 (B-hOX40), имеющих опухолевые клетки MC-38, которым вводили 9H3, антитело против PD1 и/или антитело против PD-L1.
На фиг. 26 представлен график, демонстрирующий процентное изменение массы тела с течением времени у мышей с гуманизированным OX40 (B-hOX40), имеющих опухолевые клетки MC-38, которым вводили 9H3, антитело против PD1 и/или антитело против PD-L1.
На фиг. 27 представлен график, демонстрирующий размер опухоли с течением времени у мышей с гуманизированным OX40 (B-hOX40), имеющих опухолевые клетки MC-38, которым вводили 9H3, антитело против PD1 и антитело против PD-L1.
На фиг. 28 представлен график, демонстрирующий массу тела с течением времени у мышей с гуманизированным OX40 (B-hOX40), имеющих опухолевые клетки MC-38, которым вводили 9H3, антитело против LAG-3, антитело против TIGIT, антитело против BTLA, антитело против CTLA-4 и/или антитело против GITR.
На фиг. 29 представлен график, демонстрирующий процентное изменение массы тела с течением времени у мышей с гуманизированным OX40 (B-hOX40), имеющих опухолевые клетки MC-38, которым вводили 9H3, антитело против LAG-3, антитело против TIGIT, антитело против BTLA, антитело против CTLA-4 и/или антитело против GITR.
На фиг. 30 представлен график, демонстрирующий размер опухоли с течением времени у мышей с гуманизированным OX40 (B-hOX40), имеющих опухолевые клетки MC-38, которым вводили 9H3, антитело против LAG-3, антитело против TIGIT, антитело против BTLA, антитело против CTLA-4 и/или антитело против GITR.
На фиг. 31 приведены последовательности CDR антител против OX40 антитела 9H3, 9A4, 5C1, 5D10 и их гуманизированных антител при определении с использованием нумерации Kabat.
На фиг. 32 приведены CDR последовательности антител против OX40 9H3, 9A4, 5C1, 5D10 и их гуманизированных антител при определении с использованием нумерации Chothia.
На фиг. 33 приведены аминокислотные последовательности OX40 человека, OX40 мыши, OX40 обезьяны и химерного OX40.
На фиг. 34 приведены аминокислотные последовательности вариабельных областей тяжелой цепи и вариабельных областей легкой цепи гуманизированных антител против OX40.
На фиг. 35 приведена аминокислотная последовательность вариабельных областей тяжелой цепи и легкой цепи антител мыши против hOX40 9H3, 9A4, 5C1 и 5D10.
ПОДРОБНОЕ ОПИСАНИЕ
В настоящем описание представлены примеры антител, их антигенсвязывающих фрагментов, которые связываются с OX40 (представитель 4 суперсемейства рецепторов TNF, или TNFRSF4; также известный как CD134).
Процесс активации T-клеток требует TCR для распознавания комплекса MHC-пептид в качестве первого сигнала. Кроме того, он также требует костимулирующих сигналов. OX40 представляет собой класс костимулирующих факторов для T-клеток, который принадлежит суперсемейству рецепторов факторов некроза опухоли (TNFR), и представляет собой трансмембранный белок типа I. OX40 может активировать внутриклеточную передачу сигнала PI3K-AKT, а также передачу сигнала NFAT. Эти сигналы оказывают положительный эффект на пролиферацию и выживаемость T-клеток. Кроме того, OX40 также может регулировать функцию и направление дифференцировки T-клеток.
OX40 на сегодняшний день является единственной костимулирующей молекулой, которая способна к формированию периферической толерантности. Он может нарушать иммунную толерантность опухоли и восстанавливать иммунный надзор. Использование OX40 в качестве новой мишени для иммунотерапии опухолей продемонстрировало определенные положительные эффекты. Однако, поскольку активирующее антитело должно иметь свой эпитоп для связывания и свое состояние, требуемое для точного совпадения с соответствующим лигандом для активации нижеследующего каскада передачи сигнала, которое сходно с ключом, который специфически соответствует замку, разработка этого типа антител является трудоемкой. Настоящее изобретение относится к нескольким антителам против OX40 и гуманизированным антителам против OX40, которые могут эффективно ингибировать рост опухоли и могут использоваться для лечения злокачественных опухолей.
OX40 и злокачественная опухоль
Иммунная система может различать нормальные клетки в организме и клетки, которые она воспринимает как "чужеродные", что позволяет иммунной системе атаковать чужеродные клетки, сохраняя нормальные клетки. Этот механизм иногда вовлекает белки, называемые иммунными точками контроля. Иммунные точки контроля представляют собой молекулы иммунной системы, которые либо включают сигнал (костимулирующие молекулы), либо выключают сигнал.
Ингибиторы иммунной точки контроля могут предотвращать атаку иммунной системы на нормальную ткань и, тем самым, предупреждать аутоиммунные заболевания. Многие опухолевые клетки также экспрессируют ингибиторы иммунной точки контроля. Эти опухолевые клетки ускользают от иммунного надзора посредством вовлечения определенных каскадов иммунных точек контроля, в частности, в T-клетках, специфичных к опухолевым антигенам (Creelan, Benjamin C. "Update on immune checkpoint inhibitors in lung cancer". Cancer Control 21,1 (2014): 80-89). Поскольку многие иммунные точки контроля инициируются взаимодействиями лиганд-рецептор, их можно без труда блокировать антителами против лигандов и/или их рецепторов.
Представитель 4 суперсемейства рецепторов фактора некроза опухоли рецептор (TNFRSF4), также известный как CD134 и OX40, является представителем суперсемейства рецепторов TNFR, которые не экспрессируются конститутивно на покоящихся наивных T-клетках. OX40 представляет собой вторичную костимулирующую молекулу иммунной точки контроля, экспрессируемую через 24-72 часа после активации; ее лиганд, OX40L, также не экспрессируется на покоящихся антигенпредставляющих клетках, а экспрессируется после их активации.
Экспрессия OX40 на поверхности T-клеток мыши, как правило, происходит через от 24 ч до 96 ч после распознавания собственного антигена. Связывание рецептора OX40 на T-клетках (in vitro) с использованием антител-агонистов OX40, прямо стимулирует повышение выживаемости различных подгрупп эффекторных T-клеток. Более того, иммуносупрессивная подгруппа CD4+ T-клеток, называемая регуляторными T-клетками (Treg), также экспрессирует высокие уровни OX40. Следует отметить, что Treg мыши, по-видимому, конститутивно экспрессируют OX40, в то время как в Treg человека уровень OX40 повышается при активации. Treg могут ингибировать эффекторные T-клетки посредством секреции иммуносупрессивных цитокинов, таких как трансформирующий фактор роста-бета (TGFb) и интерлейкин-10 (IL-10). Этим негативным регуляторам может противостоять стимуляция OX40 на эффекторных T-клетках и других костимулирующих рецепторов TNFRSF, таких как 41BB (CD137) и индуцируемый глюкокортикоидами рецептор фактора некроза опухоли (GITR) (CD357).
Передача сигнала OX40 влияет на функцию Treg и снижает их способность к подавлению, предположительно посредством прямого ингибирования экспрессии FoxP3. Передача сигнала OX40 также действует на образование Treg: она является строгим антагонистом TGFb и опосредуемого антигеном конвертирования наивных T-клеток в FoxP3þ Treg.
Поскольку передача сигнала OX40 стимулирует биологическую активность CD4+ и CD8+ T-клеток и противодействует функциям Treg, OX40 представляет собой мишень для иммуномодулирования при иммунотерапии злокачественной опухоли, например, передачу сигнала OX40 можно индуцировать антителами-агонистами, специфичными к OX40. Подробное описание, касающееся OX40 и его роли в качестве иммуномодулирующей мишени для иммунотерапии злокачественной опухоли, может быть найдено, например, в Aspeslagh, et al. "Rationale for anti-OX40 cancer immunotherapy". European Journal of Cancer 52 (2016): 50-66; Curti, et al.". OX40 является мощной иммуностимулирующей мишенью у пациентов со злокачественной опухолью на поздней стадии". Cancer research 73,24 (2013): 7189-7198, которые включены в настоящее описание в качестве ссылок в полном объеме.
Настоящее изобретение относится к нескольким антителам против OX40, их антигенсвязывающим фрагментам и способам применения этих антител против OX40 и антигенсвязывающих фрагментов для ингибирования роста опухоли и для лечения злокачественных опухолей.
Антитела и антигенсвязывающие фрагменты
Настоящее изобретение относится к антителам против OX40 и их антигенсвязывающим фрагментам. Как правило, антитела (также называемые иммуноглобулинами) состоят из двух классов полипептидных цепей: легкие цепи и тяжелые цепи. Неограничивающее антитело по настоящему изобретению может быть интактным антителом из четырех цепей иммуноглобулинов, содержащих две тяжелых цепи и две легких цепи. Тяжелая цепь антитела может представлять собой цепь любого изотипа, включая IgM, IgG, IgE, IgA или IgD, или подизотипа, включая IgG1, IgG2, IgG2a, IgG2b, IgG3, IgG4, IgE1, IgE2 и т.д. Легкая цепь может представлять собой легкую цепь каппа или легкую цепь лямбда. Антитело может содержать две идентичных копии легкой цепи и две идентичных копии тяжелой цепи. Тяжелые цепи, каждая из которых содержит один вариабельный домен (или вариабельную область, VH) и множество константных доменов (или константные области), связаны друг с другом посредством образования дисульфидных связей в их константных доменах с образованием "ствола" антитела. Каждая из легких цепей, каждая из которых содержит один вариабельный домен (или вариабельную область, VL) и один константный домен (или константную область), связана с одной тяжелой цепью посредством образования дисульфидных связей. Вариабельная область каждой легкой цепи находится параллельно вариабельной области тяжелой цепи, с которой она связана. Вариабельные области как легких цепей, так и тяжелых цепей, содержат три гипервариабельных области, чередующиеся с более консервативными каркасными областями (FR).
Эти гипервариабельные области, известные как определяющие комплементарность области (CDR), образуют петли, которые составляют основную антигенсвязывающую поверхность антитела. Четыре каркасных области по большей части принимают конформацию бета-слоев, и CDR формируют петли, соединяющие, и в некоторых случаях образующие часть, структуры бета-слоев. CDR в каждой цепи удерживаются вблизи каркасными областями и с CDR из другой цепи вносят вклад в образование антигенсвязывающей области.
Способы идентификации областей CDR антитела посредством анализа аминокислотной последовательности антитела хорошо известны, и часто используется ряд определений CDR. Определение по Kabat основано на вариабельности последовательностей и определение по Chothia основано на положении областей структурных петель. Эти способы и определения описаны, например, в Martin, "Protein sequence and structure analysis of antibody variable domains," Antibody engineering, Springer Berlin Heidelberg, 2001. 422-439; Abhinandan, et al. "Analysis and improvements to Kabat and structurally correct numbering of antibody variable domains," Molecular immunology 45.14 (2008): 3832-3839; Wu, T.T. and Kabat, E.A. (1970) J. Exp. Med. 132: 211-250; Martin et al., Methods Enzymol. 203:121-53 (1991); Morea et al., Biophys Chem. 68(1-3):9-16 (Oct. 1997); Morea et al., J Mol Biol. 275(2):269-94 (Jan. 1998); Chothia et al., Nature 342(6252):877-83 (Dec. 1989); Ponomarenko and Bourne, BMC Structural Biology 7:64 (2007); каждая из которых включена в настоящее описание в качестве ссылки в полном объеме. Если в настоящем описании не указано конкретно, в настоящем описании по умолчанию используют нумерацию по Kabat.
CDR важны для распознавания эпитопа антигена. Как используют в рамках изобретения, "эпитоп" является наименьшей частью молекулы-мишени, с которой может связываться антигенсвязывающий домен антитела. Минимальный размер антитела может составлять приблизительно три, четыре, пять, шесть или семь аминокислот, однако эти аминокислоты не должны находиться в виде непрерывной линейной последовательности первичной структуры антигена, поскольку эпитоп может зависеть от трехмерной конфигурации антигена, основанной на вторичной и третичной структуре антигена.
В некоторых вариантах осуществления антитело представляет собой интактную молекулу иммуноглобулина (например, IgG1, IgG2a, IgG2b, IgG3, IgM, IgD, IgE, IgA). Подклассы IgG (IgG1, IgG2, IgG3 и IgG4) являются в высокой степени консервативными, отличаются их константными областями и, в частности, их шарнирными областями и верхними CH2-доменами. Последовательности и различия подклассов IgG известны в данной области и описаны, например, в Vidarsson, et al., "IgG subclasses and allotypes: from structure to effector functions." Frontiers in immunology 5 (2014); Irani, et al. "Molecular properties of human IgG subclasses and their implications for designing therapeutic monoclonal antibodies against infectious diseases." Molecular immunology 67.2 (2015): 171-182; Shakib, Farouk, ed. The human IgG subclasses: molecular analysis of structure, function and regulation. Elsevier, 2016; каждая из которых включена в настоящее описание в качестве ссылки в полном объеме.
Антитело также может представлять собой молекулу иммуноглобулина, которая происходит из любого вида (например, человек, грызун, мышь, животное семейства верблюжьих). Антитела, описанные в настоящем описании, также включают, но не ограничиваются ими, поликлональные, моноклональные, моноспецифические, полиспецифические антитела и химерные антитела, которые включают связывающий домен иммуноглобулина, слитый с другим полипептидом. Термин "антигенсвязывающий домен" или "антигенсвязывающий фрагмент" представляет собой часть антитела, которая сохраняет активность интактного антитела в отношении специфического связывания, т.е. любую часть антитела, которая способна специфически связываться с эпитопом на молекуле-мишени интактного антитела. Она включает, например, Fab, Fab', F(ab')2 и варианты этих ферментов. Таким образом, в некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент может представлять собой, например, scFv, Fv, Fd, dAb, биспецифическое антитело, биспецифический scFv, диантитело, линейное антитело, молекулу одноцепочечного антитела, мультиспецифическое антитело, образованное из фрагментов антител, и любой полипептид, который включает связывающий домен, который представляет собой или является гомологичным связывающему домену антитела. Неограничивающие примеры антигенсвязывающих доменов включают, например, CDR тяжелой цепи и/или легкой цепи интактного антитела, вариабельные области тяжелой и/или легкой цепи интактного антитела, полноразмерные тяжелые или легкие цепи интактного антитела, или индивидуальные CDR либо из тяжелой цепи, либо из легкой цепи интактного антитела.
В некоторых вариантах осуществления антигенсвязывающий фрагмент может образовывать часть химерного рецептора антигена (CAR). В некоторых вариантах осуществления химерный рецептор антигена представляет собой слитую конструкцию одноцепочечных вариабельных фрагментов (scFv), как описано в настоящем описании, слитых с трансмембранным доменом и эндодоменом CD3-зета. В некоторых вариантах осуществления химерный рецептор антигена также содержит внутриклеточные сигнальные домены из различных рецепторов костимулирующих белков (например, CD28, 41BB, ICOS). В некоторых вариантах осуществления химерный рецептор антигена содержит множество сигнальных доменов, например, CD3z-CD28-41BB или CD3z-CD28-OX40, для повышения эффективности. Таким образом, в одном аспекте изобретение, кроме того, относится к клеткам (например, T-клеткам), которые экспрессируют химерные рецепторы антигенов, как описано в настоящем описании.
В некоторых вариантах осуществления scFV имеет один вариабельный домен тяжелой цепи и один вариабельный домен легкой цепи.
Антитела против OX40 и антигенсвязывающие фрагменты
Изобретение относится к антителам и их антигенсвязывающим фрагментам, которые специфически связываются с OX40. Антитела и антигенсвязывающие фрагменты, описанные в настоящем описании, способны связываться с OX40 и могут стимулировать каскад передачи сигнала OX40, таким образом усиливая иммунный ответ. Настоящее изобретение относится, например, к антителам мыши против OX40 07-9H3 ("9H3"), 07-9A4 ("9A4"), 11-5C1 ("5C1") и 17-5D10 ("5D10"), и к их химерным антителам, гуманизированным антителам (например, антитела, как показано в таблице 3).
Последовательности CDR для 9H3 и происходящих из 9H3 антител (например, гуманизированных антител) включают CDR вариабельного домена тяжелой цепи, SEQ ID NO: 1-3, и CDR вариабельного домена легкой цепи, SEQ ID NO: 4-6, как определено в соответствии с нумерацией Kabat. CDR также могут быть определены в соответствии с системой Chothia. В соответствии с нумерацией Chothia, последовательности CDR вариабельного домена тяжелой цепи указаны в SEQ ID NO: 25-27, и последовательности CDR вариабельного домена легкой цепи указаны в SEQ ID NO: 28-30.
Аналогично, последовательности CDR для 9A4, и происходящих из 9A4 антител включают CDR вариабельного домена тяжелой цепи, SEQ ID NO: 7-9, и CDR вариабельного домена легкой цепи, SEQ ID NO: 10-12, как определено в соответствии с нумерацией Kabat. В соответствии с нумерацией Chothia, последовательности CDR вариабельного домена тяжелой цепи указаны в SEQ ID NO: 31-33, и CDR вариабельного домена легкой цепи указаны в SEQ ID NO: 34-36.
Последовательности CDR для 5C1, и происходящих из 5C1 антител включают CDR вариабельного домена тяжелой цепи, SEQ ID NO: 13-15, и CDR вариабельного домена легкой цепи, SEQ ID NO: 16-18, как определено в соответствии с нумерацией Kabat. В соответствии с нумерацией Chothia, последовательности CDR вариабельного домена тяжелой цепи указаны в SEQ ID NO: 37-39, и CDR вариабельного домена легкой цепи указаны в SEQ ID NO: 40-42.
Последовательности CDR для 5D10 и происходящих из 5D10 антител включают CDR вариабельного домена тяжелой цепи, SEQ ID NO: 19-21, и CDR вариабельного домена легкой цепи, SEQ ID NO: 22-24, как определено в соответствии с нумерацией Kabat. В соответствии с нумерацией Chothia, последовательности CDR вариабельного домена тяжелой цепи указаны в SEQ ID NO: 43-45, и CDR вариабельного домена легкой цепи указаны в SEQ ID NO: 46-48.
Также предусматривается аминокислотная последовательность вариабельной области тяжелой цепи и вариабельной области легкой цепи гуманизированных антител. Поскольку существуют различные способы гуманизации антител мыши (например, последовательность может быть заменена другими аминокислотами), тяжелая цепь и легкая цепь антитела могут иметь более одной версии гуманизированных последовательностей. Аминокислотные последовательности для вариабельной области тяжелой цепи гуманизированного антитела 9H3 указаны в SEQ ID NO: 53-55. Аминокислотные последовательности для вариабельной области легкой цепи гуманизированного антитела 9H3 указаны в SEQ ID NO: 56-58. Любые из этих последовательностей вариабельной области тяжелой цепи (SEQ ID NO: 53-55) могут находиться в паре с любой из этих последовательностей вариабельной области легкой цепи (SEQ ID NO: 56-58).
Аналогично, аминокислотные последовательности для вариабельной области тяжелой цепи гуманизированного антитела 9A4 указаны в SEQ ID NO: 59-61. Аминокислотные последовательности для вариабельной области легкой цепи гуманизированного антитела 9A4 указаны в SEQ ID NO: 62-65. Любые из этих последовательностей вариабельной области тяжелой цепи (SEQ ID NO: 59-61) могут находиться в паре с любой из этих последовательностей вариабельной области легкой цепи (SEQ ID NO: 62-65).
Аминокислотные последовательности для вариабельной области тяжелой цепи гуманизированного антитела 5C1 указаны в SEQ ID NO: 66-68. Аминокислотные последовательности для вариабельной области легкой цепи гуманизированного антитела 5C1 указаны в SEQ ID NO: 69-72. Любые из этих последовательностей вариабельной области тяжелой цепи (SEQ ID NO: 66-68) могут находиться в паре с любыми из этих последовательностей вариабельной области легкой цепи (SEQ ID NO: 69-72).
Аминокислотные последовательности для вариабельной области тяжелой цепи гуманизированного антитела 5D10 указаны в SEQ ID NO: 73-75. Аминокислотные последовательности для вариабельной области легкой цепи гуманизированного антитела 5D10 указаны в SEQ ID NO: 76-78. Любые из этих последовательностей вариабельной области тяжелой цепи (SEQ ID NO: 73-75) могут находиться в паре с любыми из этих последовательностей вариабельной области легкой цепи (SEQ ID NO: 76-78).
Как показано на фиг. 34 процент гуманизации означает процентную идентичность последовательности вариабельной области тяжелой цепи или легкой цепи по сравнению с последовательностями антител человека в базе данных International Immunogenetics Information System (IMGT). Наилучшее совпадение означает, что последовательность вариабельной области тяжелой цепи или легкой цепи является более близкой к конкретному виду, чем к другому виду. Например, наилучшее совпадение с человеком означает, что последовательность является более близкой к человеку, чем к другим видам. Наилучшее совпадение с человеком и Macaca fascicularis означает, что последовательность имеет одинаковую процентную идентичность с последовательностью человека и с последовательностью Macaca fascicularis, и эта процентная идентичность является наиболее высокой по сравнению с последовательностями другого вида. В некоторых вариантах осуществления процент гуманизации превышает 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94% или 95%. Подробное описание того, как определять процент гуманизации и как определять наилучшие совпадения известно в данной области и представлено, например, в Jones, Tim D., et al. "The INNs and outs of antibody nonproprietary names." MAbs. Vol. 8. No. 1. Taylor & Francis, 2016, которая включена в настоящее описание в качестве ссылки в полном объеме. Высокий процент гуманизации часто имеет различные преимущества, например, является более безопасным и более эффективным для человека, с большей вероятностью будет переноситься человеком и/или с меньшей вероятностью будет иметь побочные эффекты.
Более того, в некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты, описанные в настоящем описании, также могут содержать одну, две или три CDR вариабельной области тяжелой цепи, выбранных из группы SEQ ID NO: 1-3, SEQ ID NO: 7-9, SEQ ID NO: 13-15, SEQ ID NO: 19-21, SEQ ID NO: 25-27, SEQ ID NO: 31-33, SEQ ID NO: 37-39 и SEQ ID NO: 43-45; и/или одну, две или три CDR вариабельной области легкой цепи, выбранных из группы SEQ ID NO: 4-6, SEQ ID NO: 10-12, SEQ ID NO: 16-18, SEQ ID NO: 22-24, SEQ ID NO: 28-30, SEQ ID NO: 34-36, SEQ ID NO: 40-42 и SEQ ID NO: 46-48.
В некоторых вариантах осуществления антитела могут иметь вариабельную область тяжелой цепи (VH), содержащую определяющие комплементарность области (CDR) 1, 2, 3, где область CDR1 содержит или состоит из аминокислотной последовательности, которая по меньшей мере на 80%, 85%, 90% или 95% идентична выбранной аминокислотной последовательности CDR1 VH, область CDR2 содержит или состоит из аминокислотной последовательности, которая по меньшей мере на 80%, 85%, 90% или 95% идентична выбранной аминокислотной последовательности CDR2 VH, и область CDR3 содержит или состоит из аминокислотной последовательности, которая по меньшей мере на 80%, 85%, 90% или 95% идентична выбранной аминокислотной последовательности CDR3 VH, и вариабельную область легкой цепи (VL), содержащую CDR 1, 2, 3, где область CDR1 содержит или состоит из аминокислотной последовательности, которая по меньшей мере на 80%, 85%, 90% или 95% идентична выбранной аминокислотной последовательности CDR1 VL, область CDR2 содержит или состоит из аминокислотной последовательности, которая по меньшей мере на 80%, 85%, 90% или 95% идентична выбранной аминокислотной последовательности CDR2 VL, и область CDR3 содержит или состоит из аминокислотной последовательности, которая по меньшей мере на 80%, 85%, 90% или 95% идентична выбранной аминокислотной последовательности CDR3 VL. Выбранные аминокислотные последовательности CDR 1, 2, 3 VH и выбранные аминокислотные последовательности CDR 1, 2, 3 VL представлены на фиг.31 (CDR по Kabat) и фиг.32 (CDR по Chothia).
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, описанные в настоящем описании, могут содержать вариабельный домен тяжелой цепи, содержащий одну, две или три из CDR SEQ ID NO: 1 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 2 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 3 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот.
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, описанные в настоящем описании, могут содержать вариабельный домен тяжелой цепи, содержащий одну, две или три из CDR SEQ ID NO: 7 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 8 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 9 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот.
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, описанные в настоящем описании, могут содержать вариабельный домен тяжелой цепи, содержащий одну, две или три из CDR SEQ ID NO: 13 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 14 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 15 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот.
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, описанные в настоящем описании, могут содержать вариабельный домен тяжелой цепи, содержащий одну, две или три из CDR SEQ ID NO: 19 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 20 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 21 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот.
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, описанные в настоящем описании, могут содержать вариабельный домен тяжелой цепи, содержащий одну, две или три из CDR SEQ ID NO: 25 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 26 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 27 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот.
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, описанные в настоящем описании, могут содержать вариабельный домен тяжелой цепи, содержащий одну, две или три из CDR SEQ ID NO: 31 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 32 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 33 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот.
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, описанные в настоящем описании, могут содержать вариабельный домен тяжелой цепи, содержащий одну, две или три из CDR SEQ ID NO: 37 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 38 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 39 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот.
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, описанные в настоящем описании, могут содержать вариабельный домен тяжелой цепи, содержащий одну, две или три из CDR SEQ ID NO: 43 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 44 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 45 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот.
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, описанные в настоящем описании, могут содержать вариабельный домен легкой цепи, содержащий одну, две или три из CDR SEQ ID NO: 4 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 5 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 6 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот.
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, описанные в настоящем описании, могут содержать вариабельный домен легкой цепи, содержащий одну, две или три из CDR SEQ ID NO: 10 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 11 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 12 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот.
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, описанные в настоящем описании, могут содержать вариабельный домен легкой цепи, содержащий одну, две или три из CDR SEQ ID NO: 16 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 17 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 18 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот.
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, описанные в настоящем описании, могут содержать вариабельный домен легкой цепи, содержащий одну, две или три из CDR SEQ ID NO: 22 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 23 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 24 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот.
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, описанные в настоящем описании, могут содержать вариабельный домен легкой цепи, содержащий одну, две или три из CDR SEQ ID NO: 28 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 29 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 30 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот.
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, описанные в настоящем описании, могут содержать вариабельный домен легкой цепи, содержащий одну, две или три из CDR SEQ ID NO: 34 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 35 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 36 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот.
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, описанные в настоящем описании, могут содержать вариабельный домен легкой цепи, содержащий одну, две или три из CDR SEQ ID NO: 40 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 41 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 42 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот.
В некоторых вариантах осуществления антитело или антигенсвязывающий фрагмент, описанные в настоящем описании, могут содержать вариабельный домен легкой цепи, содержащий одну, две или три из CDR SEQ ID NO: 46 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 47 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот; SEQ ID NO: 48 с нулем, одной или двумя инсерциями, делециями или заменами аминокислот.
Инсерции, делеции и замены могут находиться в последовательности CDR или на одном или обоих концах последовательности CDR.
Также изобретение относится к антителам или их антигенсвязывающим фрагментам, которые связываются с OX40. Антитела или их антигенсвязывающие фрагменты содержат вариабельную область тяжелой цепи (VH), содержащую или состоящую из аминокислотной последовательности, которая по меньшей мере на 80%, 85%, 90% или 95% идентична выбранной последовательности VH, и вариабельную область легкой цепи (VL), содержащую или состоящую из аминокислотной последовательности, которая по меньшей мере на 80%, 85%, 90% или 95% идентична выбранной последовательности VL. В некоторых вариантах осуществления выбранная последовательность VH представляет собой SEQ ID NO: 53, 54, 55 или 79, и выбранная последовательность VL представляет собой SEQ ID NO: 56, 57, 58 или 80. В некоторых вариантах осуществления выбранная последовательность VH представляет собой SEQ ID NO: 59, 60, 61 или 81, и выбранная последовательность VL представляет собой SEQ ID NO: 62, 63, 64, 65 или 82. В некоторых вариантах осуществления выбранная последовательность VH представляет собой SEQ ID NO: 66, 67, 68 или 83, и выбранная последовательность VL представляет собой SEQ ID NO: 69, 70, 71, 72 или 84. В некоторых вариантах осуществления выбранная последовательность VH представляет собой SEQ ID NO: 73, 74, 75 или 85, и выбранная последовательность VL представляет собой SEQ ID NO: 76, 77, 78 или 86.
Для определения процентной идентичности двух аминокислотных последовательностей или двух последовательностей нуклеиновых кислот последовательности выравнивают для целей оптимального сравнения (например, можно вносить пропуски в одну или обе из первой и второй аминокислотной последовательности или последовательности нуклеиновой кислоты для оптимального выравнивания и негомологичные последовательности можно не рассматривать для целей сравнения). Длина выравниваемой последовательности с целью сравнения составляет по меньшей мере 80% от длины эталонной последовательности, и в некоторых вариантах осуществления составляет по меньшей мере 90%, 95% или 100%. Затем проводят сравнение аминокислотных остатков или нуклеотидов в соответствующих положениях аминокислот или положениях нуклеотидов. Когда положение в первой последовательности занято тем же аминокислотным остатком или нуклеотидом, что и в соответствующем положении во второй последовательности, тогда молекулы являются идентичными в этом положении. Процентная идентичность между двумя последовательностями является функцией количества идентичных положений, которые имеют последовательности, учитывая количество пропусков и длину каждого пропуска, которые необходимо вносить для оптимального выравнивания двух последовательностей. Для целей настоящего изобретения сравнение последовательностей и определение процентной идентичности между двумя последовательностями можно проводить с использованием оценочной матрицы Blossum 62 со штрафом за пропуск 12, штрафом за продолжение пропуска 4, и штрафом за пропуск со сдвигом рамки 5.
Также изобретение относится к нуклеиновой кислоте, содержащей полинуклеотид, кодирующий полипептид, содержащий тяжелую цепь иммуноглобулина или легкую цепь иммуноглобулина. Тяжелая цепь иммуноглобулина или легкая цепь иммуноглобулина содержит CDR, как показано на фиг. 31 или фиг. 32, или имеет последовательности, как показано на фиг. 34 или фиг. 35. Когда полипептиды находятся в паре с соответствующим полипептидом (например, соответствующей вариабельной областью тяжелой цепи или соответствующей вариабельной областью легкой цепи), находящиеся в паре полипептиды связываются с OX40 (например, OX40 человека).
Антитела против OX40 и антигенсвязывающие фрагменты также могут представлять собой варианты антител (включая производные и конъюгаты) или фрагменты антител и мультиспецифические (например, биспецифические) антитела или фрагменты антител. Дополнительные антитела, описанные в настоящем описании, представляют собой поликлональные, моноклональные, мультиспецифические (мультимерные, например, биспецифические), антитела человека, химерные антитела (например, химера человек-мышь), одноцепочечные антитела, внутриклеточно продуцированные антитела (т.е. интраантитела) и их антигенсвязывающие фрагменты. Антитела или их антигенсвязывающие фрагменты могут быть любого типа (например, IgG, IgE, IgM, IgD, IgA и IgY), класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подкласса. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент представляет собой IgG-антитело или его антигенсвязывающий фрагмент.
Фрагменты антител являются пригодными для применения в описанных способах при условии, что они сохраняют желаемую аффинность и специфичность полноразмерного антитела. Таким образом, фрагмент антитела, которое связывается с OX40, сохраняет способность связываться с OX40. Fv-фрагмент представляет собой фрагмент антитела, который содержит полный распознающий и связывающий антиген участок. Эта область состоит из димера из одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи в прочной ассоциации, которая может иметь ковалентную природу, например, в scFv. Именно в этой конфигурации три CDR каждого вариабельного домена взаимодействуют, определяя антигенсвязывающий центр на поверхности димера VH-VL. В совокупности, шесть CDR или их подгруппа сообщают антителу специфичность связывания антигена. Однако даже один вариабельный домен (или половина Fv, содержащего только три CDR, специфичных к антигену) может обладать способностью распознавать и связывать антиген, хотя обычно и с более низкой аффинностью, чем у целого связывающего участка.
Одноцепочечные фрагменты Fv или (scFv) содержат домены VH и VL (или области) антитела, где эти домены находятся в одной полипептидной цепи. Как правило, полипептид scFv дополнительно содержит полипептидный линкер между доменами VH и VL, который позволяет scFv образовывать требуемую структуру для связывания антигена.
Fab-фрагмент содержит вариабельный и константный домен легкой цепи и вариабельный домен и первый константный домен (CH1) тяжелой цепи. F(ab')2-фрагменты антител содержат пару Fab-фрагментов, которые обычно ковалентно связаны вблизи их С-концов остатками цистеина между ними. Также в данной области известны другие химические связи между фрагментами антител.
Диантитела представляют собой небольшие фрагменты антител с двумя антигенсвязывающими центрами, которые содержат VH, связанную с VL, в одной полипептидной цепи (VH и VL). С использованием линкера, который является слишком коротким, чтобы позволить образование пар между двумя доменами на одной цепи, домены вынуждают образовывать пару с комплементарными доменами другой цепи и создавать два антигенсвязывающих центра.
Линейные антитела содержат пару тандемных сегментов Fd (VH-CH1-VH-CH1), которые вместе с комплементарными полипептидами легкой цепи образуют пару антигенсвязывающих областей. Линейные антитела могут быть биспецифическими или моноспецифическими.
Антитела и фрагменты антител по настоящему изобретению могут быть модифицированы в Fc-области для обеспечения желаемых эффекторных функций или времени полужизни в сыворотке.
Мультимеризацию антител можно проводить посредством естественной агрегации антител или способами химического или рекомбинантного связывания, известными в данной области. Например, некоторый процент очищенных препаратов антител (например, очищенных молекул IgG1) спонтанно образует белковые агрегаты, содержащие гомодимеры антител и другие мультимеры антител более высокого порядка.
Альтернативно гомодимеры антител могут быть образованы способами химического связывания, известными в данной области. Например, для получения мультимеров антител можно использовать гетеробифункциональные сшивающие средства, включая, но не ограничиваясь ими, SMCC (сукцинимидил-4-(малеимидометил)циклогексан-1-карбоксилат) и SATA (N-сукцинимидил-S-ацетилтиоацетат). Иллюстративный протокол получения гомодимеров антител описан в Ghetie et al. (Proc. Natl. Acad. Sci. U.S.A. 94: 7509-7514, 1997). Гомодимеры антител можно конвертировать в гомодимеры Fab’2 путем расщепления пепсином. Другим способом получения гомодимеров антител является использование аутофильного пептида T15, описанного в Zhao et al. (J. Immunol. 25:396-404, 2002).
В некоторых вариантах осуществления мультиспецифиеское антитело представляет собой биспецифическое антитело. Биспецифические антитела можно получать путем конструирования поверхности контакта между парой молекул антител для максимизации процента гетеродимеров, которые выделяют из рекомбинантной клеточной культуры. Например, поверхность контакта может содержать по меньшей мере часть CH3-домена константного домена антитела. В этом способе одну или несколько небольших боковых цепей аминокислот с поверхности контакта первой молекулы антитела заменяют более крупными боковыми цепями (например, тирозин или триптофан). На поверхности контакта второй молекулы антитела создают компенсаторные "полости" идентичного или сходного размера с более крупной боковой цепью(ями) путем замены больших боковых цепей аминокислот на меньшие (например, аланин или треонин). Это обеспечивает механизм увеличения выхода гетеродимера относительно нежелательных конечных продуктов, таких как гомодимеры. Этот способ описан, например, в WO 96/27011, которая включена в настоящее описание в качестве ссылки в полном объеме.
Биспецифические антитела антитела включают сшитые антитела или "гетероконъюгаты" антител. Например, одно из антител в гетероконъюгате может быть связано с авидином, а другое с биотином. Гетероконъюгаты антител также можно получать с использованием любых удобных способов сшивания. Подходящие сшивающие агенты и способы сшивания хорошо известны в данной области и описаны в патенте США № 4676980, который включен в настоящее описание в качестве ссылки в полном объеме.
Способы получения биспецифических антител из фрагментов антител также известны в данной области. Например, биспецифические антитела можно получать с использованием химического сшивания. Brennan et al. (Science 229:81, 1985) описывают методику, в которой интактные антитела подвергают протеолитическому расщеплению для получения F(ab’)2-фрагментов. Эти фрагменты восстанавливают в присутствии комплексообразующего агента для дитиола арсенита натрия для стабилизации соседних дитиолов и предотвращения образования межмолекулярных дисульфидов. Затем полученные Fab’-фрагменты конвертируют в производные тионитробензоата (TNB). Затем одно из производных Fab’ с TNB обратно конвертируют в Fab’-тиол посредством восстановления меркаптоэтиламином, а затем смешивают с эквимоляным количеством другого производного Fab’ с TNB с получением биспецифического антитела.
Любые из антител или антигенсвязывающих фрагментов, описанных в настоящем описании, можно конъюгировать со стабилизирующей молекулой (например, молекула, которая увеличивает время полужизни антитела или его антигенсвязывающего фрагмента у индивидуума или в растворе). Неограничивающие примеры стабилизирующих молекул включают: полимер (например, полиэтиленгликоль) или белок (например, сывороточный альбумин, такой как сывороточный альбумин человека). Конъюгация со стабилизирующей молекулой может увеличивать время полужизни или продлевать биологическую активность антитела или антигенсвязывающего фрагмента in vitro (например, в культуре тканей или при хранении в качестве фармацевтической композиции) или in vivo (например, у человека).
В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты, описанные в настоящем описании, можно конъюгировать с терапевтическим средством. Конъюгат антитело-лекарственное средство, содержащий антитело или его антигенсвязывающий фрагмент, может быть ковалентно или нековалентно связан с терапевтическим средством. В некоторых вариантах осуществления терапевтическое средство представляет собой цитотоксическое или цитостатическое средство (например, цитохалазин B, грамицидин D, бромид этидия, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрацин, майтанзиноиды, такие как DM-1 и DM-4, дион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол, пуромицин, эпирубицин и циклофосфамид, и аналоги).
Характеристики антител
Антитела или их антигенсвязывающие фрагменты, описанные в настоящем описании, могут блокировать связывание между OX40 и OX40L.
В некоторых вариантах осуществления посредством связывания с OX40 антитело может стимулировать каскад передачи сигнала OX40 и усиливать иммунный ответ. Таким образом, в некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты, как описано в настоящем описании, являются агонистами OX40. В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты являются агонистами OX40.
В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты, как описано в настоящем описании, могут повышать иммунный ответ, активность OX40, активность или количество T-клеток (например, CD8+ и/или CD4+ клеток) по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, в 2 раза, в 3 раза, в 5 раз, в 10 раз или в 20 раз. В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты, как описано в настоящем описании, могут снижать активность или количество Treg по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, в 2 раза, в 3 раза, в 5 раз, в 10 раз или в 20 раз.
В некоторых вариантах осуществления антитело (или его антигенсвязывающие фрагменты) специфически связывается с OX40 (например, OX40 человека, OX40 обезьяны, OX40 мыши и/или химерный OX40) со скоростью диссоциации (koff) менее 0,1 с-1, менее 0,01 с-1, менее 0,001 с-1, менее 0,0001 с-1 или менее 0,0001 с-1. В некоторых вариантах осуществления скорость диссоциации (koff) превышает 0,01 с-1, превышает 0,001 с-1, превышает 0,0001 с-1, превышает 0,0001 с-1 или превышает 0,00001 с-1.
В некоторых вариантах осуществления кинетическая скорость ассоциации (kon) превышает 1×102/Мс, превышает 1×103/Мс, превышает 1×104/Мс, превышает 1×105/Мс, или превышает 1×106/Мс. В некоторых вариантах осуществления кинетическая скорость ассоциации (kon) составляет менее 1×105/Мс, менее 1×106/Мс или менее 1×107/Мс.
Аффинность может быть установлена из частного кинетических констант скорости (KD=koff/kon). В некоторых вариантах осуществления KD составляет менее 1×10-6 M, менее 1×10-7 M, менее 1×10-8 M, менее 1×10-9 M или менее 1×10-10 M. В некоторых вариантах осуществления KD составляет менее 30 нМ, 20 нМ, 15 нМ, 10 нМ, 9 нМ, 8 нМ, 7 нМ, 6 нМ, 5 нМ, 4 нМ, 3 нМ, 2 нМ или 1 нМ. В некоторых вариантах осуществления KD составляет более чем 1×10-7 M, более чем 1×10-8 M, более чем 1×10-9 M, более чем 1×10-10 M, более чем 1×10-11 M или более чем 1×10-12 M. В некоторых вариантах осуществления антитело связывается с OX40 человека с KD, меньшей или равной приблизительно 1,5 нМ.
Основные способы определения аффинности антитела в отношении антигена включают, например, ELISA, RIA и поверхностный плазмонный резонанс (SPR). В некоторых вариантах осуществления антитело связывается с OX40 человека (SEQ ID NO: 49), OX40 обезьяны (например, OX40 макака резус, SEQ ID NO: 51), химерным OX40 (SEQ ID NO: 52) и/или OX40 мыши (SEQ ID NO: 50). В некоторых вариантах осуществления антитело не связывается с OX40 человека (SEQ ID NO: 49), OX40 обезьяны (например, OX40 макака резус, SEQ ID NO: 51; OX40 яванского макака), химерным OX40 (SEQ ID NO: 52) и/или OX40 мыши (SEQ ID NO: 50).
В некоторых вариантах осуществления определяют термическую стабильность. Антитела или антигенсвязывающие фрагменты, как описано в настоящем описании, могут иметь ™ более 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94 или 95°C. Поскольку IgG может быть описан как мультидоменный белок, кривая плавления иногда демонстрирует два перехода с первой температурой денатурации ™ D1 и второй температурой денатурации ™ D2. Присутствие этих двух пиков часто указывает на денатурацию Fc-доменов (™ D1) и Fab-доменов (™ D2), соответственно. Когда существует два пика ™ обычно относится к ™ D2.
Таким образом, в некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты, как описано в настоящем описании, имеют ™ D1 более 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94 или 95°C. В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты, как описано в настоящем описании, имеют ™ D2 более 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94 или 95°C.
В некоторых вариантах осуществления ™, ™ D1, ™ D2 составляют менее 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94 или 95°C.
В некоторых вариантах осуществления антитело имеет процентное ингибирование роста опухоли (TGI%), превышающее 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 110%, 120%, 130%, 140%, 150%, 160%, 170%, 180%, 190% или 200%. В некоторых вариантах осуществления антитело имеет процентное ингибирование роста опухоли, которое составляет менее 60%, 70%, 80%, 90%, 100%, 110%, 120%, 130%, 140%, 150%, 160%, 170%, 180%, 190% или 200%. TGI% можно определять, например, через 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 суток после начала лечения или через 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев после начала лечения. Как используют в рамках изобретения процентное ингибирование роста опухоли (TGI%) вычисляют с использованием следующей формулы:
TGI (%) = [1-(Ti-T0)/(Vi-V0)]×100
Ti представляет собой средний объем опухоли в группе лечения на сутки i. T0 представляет собой средний объем опухоли в группе лечения на нулевые сутки. Vi представляет собой средний объем опухоли в контрольной группе на сутки i. V0 представляет собой средний объем опухоли в контрольной группе на нулевые сутки.
В некоторых вариантах осуществления антитела или их антигенсвязывающие фрагменты, как описано в настоящем описании, являются агонистами OX40. В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты усиливают передачу сигнала OX40 в клетке-мишени, которая экспрессирует OX40. В некоторых вариантах осуществления передачу сигнала OX40 выявляют посредством мониторинга нижеследующей передачи сигнала NFκB.
В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты усиливают функцию CD4+ эффекторных T-клеток, например, посредством увеличения пролиферации CD4+ эффекторных T-клеток и/или увеличения продукции гамма-интерферона CD4+ эффекторной T-клеткой (например, по сравнению с пролиферацией и/или продукцией цитокинов до лечения антителами или антигенсвязывающими фрагментами). В некоторых вариантах осуществления цитокин представляет собой гамма-интерферон. В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты увеличивают количество внутриопухолевых (инфильтрирующих) CD4+ эффекторных T-клеток (например, общее количество CD4+ эффекторных T-клеток, или например, процент CD4+ клеток в CD45+ клетках), например, по сравнению с количеством противоопухолевых (инфильтрирующих) CD4+ T-клеток до лечения антителами или антигенсвязывающими фрагментами. В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты увеличивают количество противоопухолевых (инфильтрирующих) CD4+ эффекторных T-клеток, которые экспрессируют гамма-интерферон (например, общие CD4+ клетки, экспрессирующие гамма-интерферон, или, например, процент CD4+ клеток, экспрессирующих гамма-интерферон в общих CD4+ клетках), например, по сравнению с количеством внутриопухолевых (инфильтрирующих) CD4+ T-клеток, которые экспрессируют гамма-интерферон, до лечения.
В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты увеличивают количество внутриопухолевых (инфильтрирующих) CD8+ эффекторных T-клеток (например, общее количество CD8+ эффекторных T-клеток или, например, процент CD8+ в CD45+ клетках), например, по сравнению с количеством внутриопухолевых (инфильтрирующих) CD8+ эффекторных T-клеток до лечения. В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты увеличивают количество внутриопухолевых (инфильтрирующих) CD8+ эффекторных T-клеток, которые экспрессируют гамма-интерферон (например, процент CD8+ клеток, которые экспрессируют гамма-интерферон, общих CD8+ клетках), например, по сравнению с количеством противоопухолевых (инфильтрирующих) CD8+ T-клеток, которые экспрессируют гамма-интерферон, до лечения антителом против OX40 человека.
В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты усиливают функцию T-клеток памяти, например, путем усиления пролиферации T-клеток памяти и/или увеличения продуцирования цитокинов (например, гамма-интерферона) клетками памяти.
В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты ингибируют функцию Treg, например, путем снижения подавления посредством Treg функции эффекторных T-клеток (например, пролиферация эффекторных T-клеток и/или секреция T-клеточных цитокинов). В некоторых вариантах осуществления эффекторная T-клетка представляет собой CD4+ эффекторную T-клетку. В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты уменьшают количество внутриопухолевых (инфильтрирующих) Treg (например, общее количество Treg или, например, процент Fox3p+ клеток в CD4+ клетках).
В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты представляют собой истощающее антитело против hOX40 (например, истощает клетки, которые экспрессируют OX40 человека). В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты истощают клетки, которые экспрессируют OX40 человека in vitro. В некоторых вариантах осуществления клетки, экспрессирующие OX40 человека, представляют собой CD4+ эффекторные T-клетки или клетки Treg. В некоторых вариантах осуществления истощение осуществляется посредством ADCC и/или фагоцитоза.
В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты имеют функциональную Fc-область. В некоторых вариантах осуществления эффекторная функция функциональной Fc-области представляет собой антителозависимую клеточно-опосредуемую цитотоксичность (ADCC). В некоторых вариантах осуществления эффекторная функция функциональной Fc-области представляет собой фагоцитоз. В некоторых вариантах осуществления эффекторная функция функциональной Fc-области представляет собой ADCC и фагоцитоз. В некоторых вариантах осуществления Fc-область представляет собой Fc-область IgG1 человека, IgG2 человека, IgG3 человека или IgG4 человека.
В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты не индуцируют апоптоз в клетках, экспрессирующих OX40 (например, Treg).
В некоторых вариантах осуществления антитела или антигенсвязывающие фрагменты не имеют функциональной Fc-области. Например, антитела или антигенсвязывающие фрагменты представляют собой Fab, Fab’, F(ab’)2 и Fv-фрагменты.
Способы получения антител против OX40
Выделенный фрагмент OX40 человека можно использовать в качестве иммуногена для получения антител с использованием стандартных способов получения поликлональных и моноклональных антител. Поликлональные антитела могут быть индуцированы у животных посредством многократных инъекций (например, подкожных или внутрибрюшинных инъекций) антигенного пептида или белка. В некоторых вариантах осуществления антигенный пептид или белок инъецируют по меньшей мере с одним адъювантом. В некоторых вариантах осуществления антигенный пептид или белок может быть конъюгирован со средством, которое является иммуногенным у вида, подлежащего иммунизации. Животным можно инъецировать антигенный пептид или белок более одного раза (например, два раза, три раза или четыре раза).
В качестве иммуногенов можно использовать полноразмерный полипептид или белок или альтернативно можно использовать их антигенные пептидные фрагменты. Антигенный пептид белка содержит по меньшей мере 8 (например, по меньшей мере 10, 15, 20 или 30) аминокислотных остатков аминокислотной последовательности OX40 и охватывает эпитоп белка, так чтобы антитело, индуцированное против пептида, образовывало специфический иммунный комплекс с белком. Как описано выше, полноразмерная последовательность OX40 человека известна в данной области (SEQ ID NO: 49).
Иммуноген, как правило, используют для получения антител посредством иммунизации подходящего индивидуума (например, человека или трансгенного животного, экспрессирующего по меньшей мере один локус иммуноглобулина человека). Подходящий иммуногенный препарат может содержать, например, рекомбинантно экспрессированный или химически синтезированный полипептид (например, фрагмент OX40 человека). Кроме того, препарат может включать адъювант, такой как полный или неполный адъювант Фрейнда, или сходный иммуностимулирующий агент.
Поликлональные антитела можно получать, как описано выше, посредством иммунизации подходящего индивидуума полипептидом OX40, или его антигенным пептидом (например, часть OX40) в качестве иммуногена. Мониторинг титра антител у иммунизированного индивидуума с течением времени можно проводить стандартными способами, такими как твердофазный иммуноферментный анализ (ELISA), с использованием иммобилизованного полипептида или пептида OX40. Если желательно, молекулы антител можно выделять из млекопитающего (например, из крови) и далее очищать хорошо известными способами, такими как хроматография с белком A или с белком G, с получением фракции IgG. В соответствующий момент времени после иммунизации, например, когда титры специфических антител являются наиболее высокими, можно получать продуцирующие антитела клетки от индивидуума и использовать их для получения моноклональных антител стандартными способами, такими как способ гибридом, первоначально описанный Kohler et al. (Nature 256:495-497, 1975), способ гибридом из B-клеток человека (Kozbor et al., Immunol. Today 4:72, 1983), способ EBV-гибридом (Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc., pp. 77-96, 1985) или способы триом. Технология получения гибридом хорошо известна (см., главным образом, Current Protocols in Immunology, 1994, Coligan et al. (Eds.), John Wiley & Sons, Inc., New York, NY). Гибридомные клетки, продуцирующие моноклональное антитело, выявляют посредством скрининга культуральных супернатантов гибридом в отношении антител, которые связывают представляющий интерес полипептид или эпитоп, например, с использованием стандартного анализа ELISA.
Варианты антител или антигенсвязывающих фрагментов, описанных в настоящем описании, можно получать путем внесения соответствующих нуклеотидных изменений в ДНК, кодирующую антитело человека, гуманизированное или химерное, или их антигенсвязывающий фрагмент, описанный в настоящем описании, или посредством пептидного синтеза. Такие варианты включают, например, делеции, инсерции или замены остатков в аминокислотных последовательностях, которые составляют антигенсвязывающий центр антитела или антигенсвязывающий домен. В совокупности таких вариантов некоторые антитела или антигенсвязывающие фрагменты имеют увеличенную аффинность в отношении белка-мишени, например, OX40. Любую комбинацию делеций, инсерций и/или комбинаций можно вносить для получения антитела или его антигенсвязывающего фрагмента, которые обладают увеличенной аффинностью связывания в отношении мишени. Аминокислотные изменения, внесенные в антитело или антигенсвязывающий фрагмент, также могут изменять или вносить новые посттрансляционные модификации в антитело или антигенсвязывающий фрагмент, такие как изменение (например, увеличение или уменьшение) количества участков гликозилирования, изменение типа участка гликозилирования (например, изменение аминокислотной последовательности, так чтобы другой сахар присоединялся ферментами, присутствующими в клетке), или внесение новых участков гликозилирования.
Антитела, описанные в настоящем описании, могут происходить из любого вида животных, включая млекопитающих. Неограничивающие примеры нативных антител включают антитела, происходящие из человека, приматов, например, низших обезьян и высших обезьян, коров, свиней, лошадей, овец, животных семейства верблюжьих (например, верблюдов и лам), кур, коз и грызунов (например, крыс, мышей, хомячков и кроликов), включая трансгенных грызунов, модифицированных способами генной инженерии для продуцирования антител человека.
Антитела человека и гуманизированные антитела включают антитела, имеющие вариабельные и константные области, происходящие из (или имеющие ту же аминокислотную последовательность, что и вариабельные и константные области, происходящие из) последовательностей иммуноглобулинов эмбрионального типа человека. Антитела человека могут включать аминокислотные остатки, не кодируемые последовательностями иммуноглобулинов человека эмбрионального типа (например, мутации, внесенные посредством случайного или сайт-специфического мутагенеза in vitro или посредством соматической мутации in vivo), например, в CDR.
Гуманизированное антитело, как правило, имеет каркасную область человека (FR), в которую трансплантирована CDR не человека. Таким образом, гуманизированное антитело имеет одну или несколько аминокислотных последовательностей, встроенных в него из источника, который не является человеческим. Эти не являющиеся человеческими аминокислотные остатки часто называют "импортными" остатками, которые, как правило, взяты из "импортного" вариабельного домена. Гуманизацию по существу можно проводить, например, посредством замены CDR или последовательностями CDR соответствующих последовательностей антитела человека. Эти способы описаны, например, в Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988); все из которых включены в настоящем описании в качестве ссылки в полном объеме. Таким образом, "гуманизированные" антитела представляют собой химерные антитела, где по существу менее чем интактный V-домен человека заменен соответствующей последовательностью из вида, не являющегося человеком. На практике, гуманизированные антитела, как правило, представляют собой антитела мыши, в которых некоторые остатки CDR и некоторые остатки FR заменены остатками из аналогичных областей антител человека.
Выбор доменов VH и VL человека для применения при получении гуманизированных антител является очень важным для снижения иммуногенности. В соответствии с так называемым способом "наилучшего соответствия" последовательность V-домена антитела мыши подвергают скринингу против целой библиотеки известных последовательностей доменов человека. Затем последовательность человека, которая является наиболее близкой к последовательности мыши, берут в качестве FR человека для гуманизированного антитела (Sims et al., J. Immunol., 151:2296 (1993); Chothia et al., J. Mol. Biol., 196:901 (1987)).
Кроме того, является важным, чтобы антитела гуманизировали с сохранением высокой специфичности и аффинности в отношении антигена и других благоприятных биологических свойств. Для достижения этой цели гуманизированные антитела можно получать способом анализа исходных последовательностей и различных концептуальных гуманизированных продуктов с использованием трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов широко доступны и известны специалистам в данной области. Доступны компьютерные программы, которые иллюстрируют и выводят вероятные трехмерные конформационные структуры выбранных последовательностей иммуноглобулинов, являющихся кандидатами. Исследование этих выделенных данных позволяет анализ вероятной роли остатков в функционировании последовательности иммуноглобулина, являющейся кандидатом, т.е. анализ остатков, которые влияют на способность иммуноглобулина, являющегося кандидатом, связывать его антиген. Таким образом, остатки FR можно выбирать и комбинировать из реципиентных и импортных последовательностей так, чтобы достигать желаемой характеристики антител, такой как увеличенная аффинность в отношении антигена(ов)-мишени.
Обычно варианты аминокислотной последовательности антитела против OX40 человека, гуманизированного или химерного антитела против OX40 содержат аминокислотную последовательность, обладающую по меньшей мере 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% процентной идентичностью с последовательностью, присутствующей в легкой или тяжелой цепи исходного антитела.
Идентичность или гомология в отношении исходной последовательности обычно представляет собой процент аминокислотных остатков, присутствующих в последовательности-кандидате, которые идентичны последовательности, присутствующей в антителе против OX40 или фрагменте человека, гуманизированном или химерном антителе против OX40 или фрагменте, после выравнивания последовательностей и внесения пропусков, если необходимо, для достижения максимальной процентной идентичности последовательностей, и не учитывая какие-либо консервативные замены в качестве части идентичности последовательностей.
Можно вносить дополнительные модификации в антитела против OX40 или антигенсвязывающие фрагменты. Например, в Fc-область можно вносить остаток(и) цистеина, тем самым позволяя образование межцепочечных дисульфидных связей в этой области. Гомодимерное антитело, полученное таким образом, может иметь увеличенное время полужизни in vitro и/или in vivo. Гомодимерные антитела с увеличенным временем полужизни in vitro и/или in vivo также можно получать с использованием гетеробифункциональных сшивающих агентов, как описано, например, в Wolff et al. (Cancer Res. 53:2560-2565, 1993). Альтернативно можно конструировать антитело, которое имеет двойные Fc-области (см., например, Stevenson et al., Anti-Cancer Drug Design 3:219-230, 1989).
В некоторых вариантах осуществления можно вносить ковалентную модификацию в антитело против OX40 или его антигенсвязывающий фрагмент. Эти ковалентные модификации можно вносить посредством химического или ферментативного синтеза, или посредством ферментативного или химического расщепления. Другие типы ковалентных модификаций антитела или фрагмента антитела вносят в молекулу посредством реакции заданных аминокислотных остатков антитела или фрагмента с органическим дериватизирующим агентом, который способен реагировать с отдельными боковыми цепями или N- или C-концевыми остатками.
В некоторых вариантах осуществления антитела предусматриваются варианты, имеющие углеводную структуру, которая лишена присоединенной к ее Fc-области фукозы (прямо или непрямо). Например, количество фукозы в таком антителе может составлять от 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. Количество фукозы определяют путем вычисления среднего количества фукозы в сахарном цепи на Asn297, относительно суммы всех гликоструктур, связанных с Asn 297 (например, комплексные гибридные структуры и структуры с высоким содержанием маннозы) при определении посредством масс-спектрометрии MALDI-TOF, как описано, например, в WO 2008/077546. Asn297 относится к остатку аспарагина, расположенному приблизительно в положении 297 Fc-области (нумерация Eu остатков Fc-области; или положение 314 при нумерации согласно Kabat); однако Asn297 также может находиться приблизительно на ±3 аминокислоты выше или ниже положения 297, т.е. между положениями 294 и 300, вследствие небольшой вариации последовательности в антителах. Такие варианты по фукозилированию могут иметь усиленную функцию ADCC. В некоторых вариантах осуществления для снижения гетерогенности гликанов, Fc-область антитела можно далее модифицировать способами инженерии для замены аспарагина в положении 297 на аланин (N297A).
Рекомбинантные векторы
Настоящее изобретение также относится к рекомбинантным векторам (например, экспрессирующие векторы), которые включают выделенный полинуклеотид, описанный в настоящем описании (например, полинуклеотид, который кодирует полипептид, описанный в настоящем описании), клеткам-хозяевам, в которые рекомбинантные векторы введены (т.е., так что клетки-хозяева содержат полинуклеотид и/или вектор, содержащий полинуклеотид), и к продуцированию полипептидов рекомбинантных антител или их фрагментов рекомбинантными способами.
Как используют в рамках изобретения, "вектор" представляет собой любую конструкцию, способную доставлять один или несколько представляющий интерес полинуклеотид(ов) в клетку-хозяина, когда вектор вводят в клетку-хозяина. "Экспрессирующий вектор" способен доставлять и экспрессировать один или несколько представляющий интерес полинуклеотид(ов) в качестве кодируемого полипептида в клетке-хозяине, в которую экспрессирующий вектор введен. Таким образом, в экспрессирующем векторе представляющий интерес полинуклеотид помещают для экспрессии посредством функционального связывания с регуляторными элементами, такими как промотор, энхансер и/или поли-A-хвостовая часть, либо в векторе, либо в геноме клетки-хозяина в, или вблизи, или посредством фланкирования участка встраивания представляющего интерес полинуклеотида, так чтобы представляющий интерес полинуклеотид транслировался в клетке-хозяине, в которую введен экспрессирующий вектор.
Вектор можно вводить в клетку-хозяина способами, известными в данной области, например, посредством электропорации, химической трансфекции (например, DEAE-декстран), трансформации, трансфекции, и инфицирования и/или трансдукции (например, рекомбинантным вирусом). Таким образом, неограничивающие примеры векторов включают вирусные векторы (которые можно использовать для получения рекомбинантного вируса), голую ДНК или РНК, плазмиды, космиды, фаговые векторы, и векторы, экспрессирующие ДНК или РНК, ассоциированные с катионными конденсирующими агентами.
В некоторых вариантах осуществления полинуклеотид, описанный в настоящем описании (например, полинуклеотид, который кодирует полипептид, описанный в настоящем описании), вводят с использованием вирусной экспрессирующей системы (например, вирус коровьей оспы или другой вирус оспы, ретровирус или аденовирус), что может вовлекать использование непатогенного (дефектного) репликационно-компетентного вируса или может вовлекать использование вируса с дефектной репликацией. В последнем случае увеличение вируса в количестве обычно происходит только в комплементирующих упаковывающих вирус клетках. Подходящие системы описаны, например, в Fisher-Hoch et al., 1989, Proc. Natl. Acad. Sci. USA 86:317-321; Flexner et al., 1989, Ann. N.Y. Acad Sci. 569:86-103; Flexner et al., 1990, Vaccine, 8:17-21; патентах США № 4603112, 4769330 и 5017487; WO 89/01973; патенте США № 4777127; GB 2200651; EP 0345242; WO 91/02805; Berkner-Biotechniques, 6:616-627, 1988; Rosenfeld et al., 1991, Science, 252:431-434; Kolls et al., 1994, Proc. Natl. Acad. Sci. USA, 91:215-219; Kass-Eisler et al., 1993, Proc. Natl. Acad. Sci. USA, 90:11498-11502; Guzman et al., 1993, Circulation, 88:2838-2848; и Guzman et al., 1993, Cir. Res., 73:1202-1207. Способы включения ДНК в такие экспрессирующие системы хорошо известны средним специалистам в данной области. ДНК также может быть "голой", как описано, например, в Ulmer et al., 1993, Science, 259:1745-1749, и Cohen, 1993, Science, 259:1691-1692. Захват голой ДНК может быть увеличен посредством нанесения ДНК на биодеградируемые гранулы, которые эффективно транспортируются в клетки.
Для экспрессии ДНК-вставка, содержащая кодирующий антитело или кодирующий полипептид полинуклеотид, описанный в настоящем описании, может быть функционально связана с соответствующим промотором (например, гетерологичный промотор), таким как промотор PL фага лямбда, промоторы lac, trp и tac E. coli, ранние и поздние промоторы SV40 и промоторы ретровирусных LTR, чтобы перечислить некоторые из них. Другие подходящие промоторы известны квалифицированному специалисту. Экспрессирующие конструкции, кроме того, могут содержать участки для инициации транскрипции, терминации траскрипции и в транскрибируемой области участок связывания рибосомы для трансляции. Кодирующая часть зрелых транскриптов, экспрессируемых конструкциями, может включать кодон инициации трансляции в начале и кодон терминации (UAA, UGA или UAG), соответствующим образом находящийся на конце транслируемого полипептида.
Как указано, экспрессирующие векторы могут включать по меньшей мере один селективный маркер. Такие маркеры включают гены резистентности к дигидрофолатредуктазе или неомицину для культуры эукариотических клеток и гены резистентности к тетрациклину или ампициллину для культивирования в E. coli и других бактериях. Репрезентативные примеры соответствующих хозяев включают, но не ограничиваются ими, бактериальные клетки, такие как клетки E. coli, Streptomyces и Salmonella typhimurium; клетки грибов, такие как клетки дрожжей; клетки насекомых, такие как клетки Drosophila S2 и Spodoptera Sf9; клетки животных, такие как CHO, COS, клетки меланомы Bowes и клетки HK 293; и клетки растений. Подходящие культуральные среды и условия для клеток-хозяев, описанных в настоящем описании, известны в данной области.
Неограничивающие векторы для применения в бактериях включают pQE70, pQE60 и pQE-9, доступные от Qiagen; векторы pBS, векторы Phagescript, векторы Bluescript, pNH8A, pNH16a, pNH18A, pNH46A, доступные от Stratagene; и ptrc99a, pKK223-3, pKK233-3, pDR540, pRIT5, доступные от Pharmacia. Неограничивающие эукариотические векторы включают pWLNEO, pSV2CAT, pOG44, pXT1 и pSG, доступные от Stratagene; и pSVK3, pBPV, pMSG и pSVL, доступные от Pharmacia. Другие подходящие векторы известны специалисту в данной области.
Неограничивающие бактериальные промоторы, пригодные для применения, включают промоторы lacI и lacZ E. coli, промоторы T3 и T7, промотор gpt, промоторы PR и PL лямбда и промотор trp. Подходящие эукариотические промоторы включают предранний промотор CMV, промотор тимидинкиназы HSV, ранние и поздние промоторы SV40, промоторы ретровирусных LTR, такие как промоторы вируса саркомы Рауса (RSV) и промоторы металлотеонеинов, такие как промотор металлотеонеина-I мыши.
В дрожжах Saccharomyces cerevisiae можно использовать ряд векторов, содержащих конститутивные или индуцибельные промоторы, такие как промоторы альфа-фактора, алкогольоксидазы и PGH. Для обзора см. Ausubel et al. (1989) Current Protocols in Molecular Biology, John Wiley & Sons, New York, N.Y, и Grant et al., Methods Enzymol., 153: 516-544 (1997).
Введение конструкции в клетку-хозяина может быть осуществлено посредством трансфекции с фосфатом кальция, опосредуемой DEAE-декстраном трансфекции, опосредуемой катионными липидами трансфекции, электропорации, трансдукции, инфицирования или другими способами. Такие способы описаны во многих стандартных лабораторных практикумах, таких как Davis et al., Basic Methods In Molecular Biology (1986).
Транскрипция ДНК, кодирующей антитела по настоящему изобретению, высшими эукариотами может быть усилена путем встраивания последовательности энхансера в вектор. Энхансеры представляют собой цис-регуляторные элементы ДНК, обычно размером от 10 до 300 п.н., которые действуют, увеличивая транскрипционную активность промотора в данном типе клеток-хозяев. Примеры энхансеров включают промотор SV40, который расположен на поздней стороне ориджина репликации в положении пар оснований 100-270, энхансер раннего промотора цитомегаловируса, энхансер полиомы на поздней стороне ориджина репликации, и энхансеры аденовируса.
Для секреции транслируемого белка в просвет эндоплазматической сети, в периплазматическое пространство или во внеклеточную среду, в экспрессированный полипептид могут быть включены подходящие секреторные сигналы. Сигналы могут быть эндогенными для полипептида или они могут представлять собой гетерологичные сигналы.
Полипептид (например, антитело) может экспрессироваться в модифицированной форме, такой как слитый белок (например, слитая конструкция с GST) или с гистидиновой меткой, и может включать не только секреторные сигналы, но также дополнительные гетерологичные функциональные области. Например, область из дополнительных аминокислот, в частности, заряженных аминокислот, можно присоединять к N-концу полипептида для повышения стабильности и персистенции в клетке-хозяине, в ходе очистки или в ходе последующей обработки и хранения. Также к полипептиду можно присоединять пептидные части для облегчения очистки. Такие области могут быть удалены перед конечным получением полипептида. Добавление пептидных частей к полипептиду для обеспечения секреции или экскреции, для повышения стабильности и для облегчения очистки, среди прочих, является известными и стандартными способами в данной области.
Способы лечения
Антитела или антитело или их антигенсвязывающие фрагменты по настоящему изобретению можно использовать для различных терапевтических целей. В одном аспекте изобретение относится к способам лечения злокачественной опухоли у индивидуума, к способам снижения скорости увеличения объема опухоли у индивидуума с течением времени, к способам снижения риска развития метастазов или к способам снижения риска развития дополнительных метастазов у индивидуума. В некоторых вариантах осуществления лечение может останавливать, замедлять, отсрочивать или ингибировать прогрессирование злокачественной опухоли. В некоторых вариантах осуществления лечение может приводить к снижению количества, тяжести и/или длительности одного или нескольких симптомов злокачественной опухоли у индивидуума.
В одном аспекте изобретение относится к способам, которые включают введение терапевтически эффективного количества антитела или его антигенсвязывающего фрагмента, описанного в настоящем описании, индивидууму, нуждающемуся в этом (например, индивидууму, который имеет, или который идентифицирован или диагностирован как имеющий, злокачественную опухоль, например, рак молочной железы (например, тройной отрицательный рак молочной железы), карциноидную опухоль, рак шейки матки, рак эндометрия, глиому, рак головы и шеи, рак печени, рак легкого, мелкоклеточный рак легкого, лимфому, меланому, рак яичника, рак поджелудочной железы, рак предстательной железы, рак почки, рак ободочной и прямой кишки, рак желудка, рак яичка, рак щитовидной железы, рак мочевого пузыря, рак уретры или гематологическую злокачественную опухоль). В некоторых вариантах осуществления злокачественная опухоль представляет собой нерезектабельную меланому или метастазирующую меланому, немелкоклеточную карциному легких (NSCLC), мелкоклеточный рак легкого (SCLC), рак мочевого пузыря или метастазирующий рефрактерный к гормонам рак предстательной железы). В некоторых вариантах осуществления индивидуум имеет солидную опухоль. В некоторых вариантах осуществления злокачественная опухоль представляет собой плоскоклеточную карциному головы и шеи (SCCHN), почечноклеточный рак (RCC), тройной отрицательный рак молочной железы (TNBC) или карциному ободочной и прямой кишки.
В некоторых вариантах осуществления композиции и способы, описанные в настоящем описании, можно использовать для лечения пациентов, имеющих риск злокачественной опухоли. Пациентов со злокачественной опухолью можно идентифицировать различными способами, известными в данной области.
Как используют в рамках изобретения, под "эффективным количеством" подразумевают количество или дозировку, эффективные для достижения благоприятных или желательных результатов, включая остановку, замедление, отсрочивание или ингибирование заболевания, например, злокачественной опухоли. Эффективное количество может варьироваться в зависимости, например, от возраста и массы тела индивидуума, которому вводят антитело, антигенсвязывающий фрагмент, кодирующий антитело полинуклеотид, вектор, содержащий полинуклеотид, и/или их композиции, подлежащей введению, тяжести симптомов и пути введения и, таким образом, введение может определяться на индивидуальной основе.
Эффективное количество можно вводить посредством одного или нескольких введений. В качестве примера, эффективное количество антитела или антигенсвязывающего фрагмента представляет собой количество, достаточное для смягчения, остановки, стабилизации, обращения вспять, ингибирования, замедления и/или отсрочивания прогрессирования злокачественной опухоли у пациента, или представляет собой количество, достаточное для смягчения, остановки, стабилизации, обращения вспять, замедления и/или отсрочивания пролиферации клетки (например, полученной посредством биопсии клетки, любой из злокачественных клеток, описанных в настоящем описании, или клеточной линии (например, злокачественной клеточной линии)) in vitro. Как понятно в данной области, эффективное количество антитела или антигенсвязывающего фрагмента может варьироваться, в зависимости, среди прочих, от анамнеза пациента, а также от других факторов, таких как тип (и/или дозировка) используемого антитела.
Эффективные количества и схемы введения антител, кодирующих антитела полинуклеотидов и/или композиций, описанных в настоящем описании, можно определять эмпирически, и проведение таких определений входит в пределы способностей специалистов в данной области. Специалистам в данной области будет понятно, что дозировка, которую необходимо вводить, может варьироваться, в зависимости, например, от млекопитающего, которому вводят антитела, кодирующих антитела полинуклеотидов, и/или композиций, описанных в настоящем описании, пути введения, конкретного типа антител, кодирующих антитела полинуклеотидов, антигенсвязывающих фрагментов и/или используемых композиций, описанных в настоящем описании, и других лекарственных средств, вводимых млекопитающему. Руководство по выбору надлежащих доз антитела или антигенсвязывающего фрагмента может быть найдено в литературе по терапевтическим применениям антител и антигенсвязывающих фрагментов, например, Handbook of Monoclonal Antibodies, Ferrone et al., eds., Noges Publications, Park Ridge, N.J., 1985, ch. 22 and pp. 303-357; Smith et al., Antibodies in Human Diagnosis and Therapy, Haber et al., eds., Raven Press, New York, 1977, pp. 365-389.
Типичная суточная дозировка эффективного количества антитела составляет от 0,01 мг/кг до 100 мг/кг. В некоторых вариантах осуществления дозировка может составлять менее 100 мг/кг, 10 мг/кг, 9 мг/кг, 8 мг/кг, 7 мг/кг, 6 мг/кг, 5 мг/кг, 4 мг/кг, 3 мг/кг, 2 мг/кг, 1 мг/кг, 0,5 мг/кг или 0,1 мг/кг. В некоторых вариантах осуществления дозировка может составлять более 10 мг/кг, 9 мг/кг, 8 мг/кг, 7 мг/кг, 6 мг/кг, 5 мг/кг, 4 мг/кг, 3 мг/кг, 2 мг/кг, 1 мг/кг, 0,5 мг/кг, 0,1 мг/кг, 0,05 мг/кг или 0,01 мг/кг. В некоторых вариантах осуществления дозировка составляет приблизительно 10 мг/кг, 9 мг/кг, 8 мг/кг, 7 мг/кг, 6 мг/кг, 5 мг/кг, 4 мг/кг, 3 мг/кг, 2 мг/кг, 1 мг/кг, 0,9 мг/кг, 0,8 мг/кг, 0,7 мг/кг, 0,6 мг/кг, 0,5 мг/кг, 0,4 мг/кг, 0,3 мг/кг, 0,2 мг/кг или 0,1 мг/кг.
В любом из способов, описанных в настоящем описании, по меньшей мере одно антитело, его антигенсвязывающий фрагмент или фармацевтическую композицию (например, любое из антител, антигенсвязывающих фрагментов или фармацевтических композиций, описанных в настоящем описании) и необязательно по меньшей мере одно дополнительное терапевтическое средство можно вводить индивидууму по меньшей мере один раз в неделю (например, один раз в неделю, два раза в неделю, три раза в неделю, четыре раза в неделю, один раз в сутки, два раза в сутки или три раза в сутки). В некоторых вариантах осуществления по меньшей мере два различных антитела и/или антигенсвязывающих фрагмента вводят в одной композиции (например, жидкой композиции). В некоторых вариантах осуществления по меньшей мере одно антитело или антигенсвязывающий фрагмент и по меньшей мере одно дополнительное терапевтическое средство вводят в одной композиции (например, в жидкой композиции). В некоторых вариантах осуществления по меньшей мере одно антитело или антигенсвязывающий фрагмент и по меньшей мере одно дополнительное терапевтическое средство вводят в двух различных композициях (например, жидкая композиция, содержащая по меньшей мере одно антитело или антигенсвязывающий фрагмент, и твердая пероральная композиция, содержащая по меньшей мере одно дополнительное терапевтическое средство). В некоторых вариантах осуществления по меньшей мере одно дополнительное терапевтическое средство вводят в качестве пилюли, таблетки или капсулы. В некоторых вариантах осуществления по меньшей мере одно дополнительное терапевтическое средство вводят в пероральном составе с замедленным высвобождением.
В некоторых вариантах осуществления одно или несколько дополнительных терапевтических средств можно вводить индивидууму до или после введения по меньшей мере одного антитела, антигенсвязывающего фрагмента антитела или фармацевтической композиции (например, любого из антител, антигенсвязывающих фрагментов или фармацевтических композиций, описанных в настоящем описании). В некоторых вариантах осуществления одно или несколько дополнительных терапевтических средств и по меньшей мере одно антитело, антигенсвязывающий фрагмент антитела или фармацевтическую композицию (например, любое из антител, антигенсвязывающих фрагментов антител или фармацевтических композиций, описанных в настоящем описании) вводят индивидууму так, чтобы существовало перекрывание в биологически активном периоде одного или нескольких дополнительных терапевтических средств и по меньшей мере одного антитела или антигенсвязывающего фрагмента (например, любое из антител или антигенсвязывающих фрагментов, описанных в настоящем описании) у индивидуума.
В некоторых вариантах осуществления индивидууму можно вводить по меньшей мере одно антитело, антигенсвязывающий фрагмент антитела или фармацевтическую композицию (например, любое из антител, антигенсвязывающих фрагментов антител или фармацевтических композиций, описанных в настоящем описании) на протяжении длительного периода времени (например, на протяжении периода, составляющего по меньшей мере 1 неделю, 2 недели, 3 недели, 1 месяц, 2 месяца, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, 12 месяцев, 1 год, 2 года, 3 года, 4 года или 5 лет). Квалифицированный медицинский специалист может определить длительность периода лечения с использованием любого из способов, описанных в настоящем описании, для диагностики или наблюдения за эффективностью лечения (например, наблюдение по меньшей мере одного симптома злокачественной опухоли). Как описано в настоящем описании, квалифицированный медицинский специалист также может изменить тип и количество (например, увеличить или снизить) антител или антигенсвязывающих фрагментов антител (и/или одного или нескольких дополнительных терапевтических средств), вводимых индивидууму, и также может скорректировать (например, увеличить или снизить) дозировку или частоту введения по меньшей мере одного антитела или антигенсвязывающего фрагмента антитела (и/или одного или нескольких дополнительных терапевтических средств) индивидууму на основе оценки эффективности лечения (например, с использованием любого из способов, описанных в настоящем описании и известных).
В некоторых вариантах осуществления индивидууму можно вводить одно или несколько дополнительных терапевтических средств. Дополнительное терапевтическое средство может включать один или несколько ингибиторов, выбранных из группы, состоящей из ингибитора B-Raf, ингибитора EGFR, ингибитора MEK, ингибитора ERK, ингибитора K-Ras, ингибитора c-Met, ингибитора киназы анапластической лимфомы (ALK), ингибитора фосфатидилинозитол 3-киназы (PI3K), ингибитора Akt, ингибитора mTOR, двойного ингибитора PI3K/mTOR, ингибитора тирозинкиназы Брутона (BTK) и ингибитора изоцитратдегидрогеназы 1 (IDH1) и/или изоцитратдегидрогеназы 2 (IDH2).
В некоторых вариантах осуществления дополнительное терапевтическое средство может включать один или несколько ингибиторов, выбранных из группы, состоящей из ингибитора HER3, ингибитора LSD1, ингибитора MDM2, ингибитора BCL2, ингибитора CHK1, ингибитора активированного каскада передачи сигнала hedgehog и средства, которое вызывает селективную деградацию рецепторов эстрогена.
В некоторых вариантах осуществления дополнительное терапевтическое средство может включать одно или несколько терапевтических средств, выбранных из группы, состоящей из Трабектедина, наб-паклитаксела, Требананиба, Пазопаниба, Цедираниба, Пальбоциклиба, эверолимуса, фторпиримидина, IFL, регорафениба, Реолизина, Алимты, Зикадии, Сутента, темсиролимуса, акситиниба, эверолимуса, сорафениба, Вотриента, Пазопаниба, IMA-901, AGS-003, кабозантиниба, Винфлунина, ингибитора Hsp90, Ad-GM-CSF, Темазоломида, IL-2, IFNa, винбластина, Таломида, дакарбазина, циклофосфамида, леналидомида, азацитидина, леналидомида, бортезомида, амрубицина, карфилзомиба, пралатрексата и энзастаурина.
В некоторых вариантах осуществления дополнительное терапевтическое средство может включать одно или несколько терапевтических средств, выбранных из группы, состоящей из адъюванта, агониста TLR, фактора некроза опухоли (TNF) альфа, IL-1, HMGB1, антагониста IL-10, антагониста IL-4, антагониста IL-13, антагониста IL-17, антагониста HVEM, агониста ICOS, терапевтического средства, нацеленного на CX3CL1, терапевтического средства, нацеленного на CXCL9, терапевтического средства, нацеленного на CXCL10, терапевтического средства, нацеленного на CCL5, агониста LFA-1, агониста ICAM1 и агониста селектина.
В некоторых вариантах осуществления индивидууму вводят карбоплатин, наб-паклитаксел, паклитаксел, цисплатин, пеметрексед, гемцитабин, FOLFOX или FOLFIRI.
В некоторых вариантах осуществления дополнительное терапевтическое средство представляет собой антитело против PD1, антитело против PD-L1, антитело против LAG-3, антитело против TIGIT, антитело против BTLA, антитело против CTLA-4 или антитело против GITR.
Способы модификации и применения антител против OX40 описаны, например, в US 20150307617, которая включена в настоящее описание в качестве ссылки в полном объеме.
Фармацевтические композиции и пути введения
Также в рамках настоящего изобретения предусматриваются фармацевтические композиции, которые содержат по меньшей мере одно (например, одно, два, три или четыре) из антител или антигенсвязывающих фрагментов, описанных в настоящем описании. Два или более (например, два, три или четыре) из любых из антител или антигенсвязывающих фрагментов, описанных в настоящем описании, могут присутствовать в фармацевтической композиции в любой комбинации. Фармацевтические композиции можно составлять любым способом, известным в данной области.
Фармацевтические композиции составляют так, чтобы они были совместимыми с их предполагаемым путем введения (например, внутривенный, внутриартериальный, внутримышечный, внутрикожный, подкожный или внутрибрюшинный). Композиции могут включать стерильный разбавитель (например, стерильную воду или солевой раствор), жирное масло, полиэтиленгликоль, глицерин, пропиленгликоль или другие синтетические растворители, антибактериальные или противогрибковые средства, такие как бензиловый спирт или метилпарабены, хлорбутанол, фенол, аскорбиновая кислота, тимеросал и т.п., антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия, хелатирующие агенты, такие как этилендиаминтетрауксусная кислота, буферы, такие как ацетаты, цитраты или фосфаты, и средства для обеспечения изотоничности, такие как сахара (например, декстроза), полиспирты (например, маннит или сорбит) или соли (например, хлорид натрия), или любую их комбинацию. Также в качестве фармацевтически приемлемых носителей можно использовать липосомальные суспензии (см., например, патент США № 4522811). Препараты композиций можно составлять и заключать в ампулы, одноразовые шприцы или многодозовые флаконы. Когда это необходимо (например, в инъекционных составах), надлежащую текучесть можно поддерживать, например, с использованием покрытия, такого как лецитин или поверхностно-активное вещество. Всасывание антитела или его антигенсвязывающего фрагмента можно продлевать путем включения средства, которое замедляет всасывание (например, моностеарат алюминия и желатин). Альтернативно, контролируемого высвобождения можно достигать посредством имплантатов и микроинкапсулированных систем доставки, которые могут включать биодеградируемые, биосовместимые полимеры (например, этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, сложные полиортоэфиры и полимолочная кислота; Alza Corporation and Nova Pharmaceutical, Inc.).
Композиции, содержащие одно или несколько из любых из антител или антигенсвязывающих фрагментов, описанных в настоящем описании, можно составлять для парентерального (например, внутривенного, внутриартериального, внутримышечного, внутрикожного, подкожного или внутрибрюшинного) введения в единичной дозированной форме (т.е. физически дискретных единицах, содержащих заданное количество активного соединения для простоты введения и единообразия дозировок).
Токсичность и терапевтическую эффективность композиций можно определять с использованием стандартных фармацевтических методик в клеточных культурах или у экспериментальных животных (например, обезьян). Например, можно определять LD50 (доза, летальная для 50% популяции) и ED50 (доза, терапевтически эффективная для 50% популяции): где терапевтический индекс представляет собой соотношение LD50:ED50. Предпочтительными являются средства, демонстрирующие высокие терапевтические индексы. Когда средство демонстрирует нежелательный побочный эффект, следует позаботиться о минимизации потенциального повреждения (т.е. уменьшения нежелательных побочных эффектов). Токсичность и терапевтическую эффективность можно определять с использованием других стандартных фармацевтических методик.
При составлении дозировок любого данного средства, подходящих для применения у индивидуума (например, у человека) можно использовать данные, полученные для анализов клеточных культур и исследований на животных. Терапевтически эффективное количество одного или нескольких (например, одного, двух, трех или четырех) антител или их антигенсвязывающих фрагментов (например, любого из антител или фрагментов антител, описанных в настоящем описании) представляет собой количество, которое лечит заболевание (например, уничтожает злокачественные клетки) у индивидуума (например, у человека, идентифицированного как имеющего злокачественную опухоль), или у индивидуума, идентифицированного как имеющего риск развития заболевания (например, индивидуума, у которого ранее развилась злокачественная опухоль, но который был вылечен), снижает тяжесть, частоту и/или длительность одного или нескольких симптомов заболевания у индивидуума (например, человека). Эффективность и дозировку любого из антител или антигенсвязывающих фрагментов, описанных в настоящем описании, может определять работник здравоохранения или ветеринарный специалист с использованием способов, известных в данной области, а также посредством наблюдения одного или нескольких симптомов заболевания у индивидуума (например, человека). Определенные факторы могут влиять на дозировку или время, требуемого для эффективного лечения индивидуума (например, тяжесть заболевания или нарушения, предшествующие способы лечения, общее состояние здоровья и/или возраст индивидуума, и наличие других заболеваний).
Иллюстративные дозы включают количества в миллиграммах или микрограммах любого из антител или антигенсвязывающих фрагментов, описанных в настоящем описании, на килограмм массы тела индивидуума (например, от приблизительно 1 мкг/кг до приблизительно 500 мг/кг; от приблизительно 100 мкг/кг до приблизительно 500 мг/кг; от приблизительно 100 мкг/кг до приблизительно 50 мг/кг; от приблизительно 10 мкг/кг до приблизительно 5 мг/кг; от приблизительно 10 мкг/кг до приблизительно 0,5 мг/кг; или от приблизительно 1 мкг/кг до приблизительно 50 мкг/кг). В то время как эти дозы охватывают широкий диапазон, специалисту в данной области будет понятно, что терапевтические средства, включая антитела и их антигенсвязывающие фрагменты, варьируют в отношении их эффективности, и эффективные количества можно определять способами, известными в данной области. Как правило, сначала вводят относительно низкие дозы, а затем лечащий работник здравоохранения или ветеринарный специалист (в случае терапевтического применения) или исследователь (когда он все еще работает на стадии разработки) может последовательно и постепенно увеличивать дозу до тех пор, пока не будет достигнут надлежащий ответ. Кроме того, понятно, что конкретный уровень дозы для любого конкретного индивидуума может зависеть от ряда факторов, включающих активность конкретного используемого соединения, возраст, массу тела, общее состояние здоровья, пол и режим питания индивидуума, время введения, путь введения, скорость экскреции и время полужизни антитела или фрагмента антитела in vivo.
Фармацевтические композиции могут быть включены в контейнер, упаковку или дозатор вместе с инструкциями по введению. Также изобретение относится к способам производства антител или их антигенсвязывающих фрагментов для различных применений, как описано в настоящем описании.
ПРИМЕРЫ
Кроме того, изобретение описано в следующих примерах, которые не ограничивают объем изобретения, описанный в формуле изобретения.
Пример 1. Получение антител мыши против hOX40
Для получения антител мыши против OX40 человека (hOX40; SEQ ID NO: 49), самок мышей BALB/c в возрасте 6-8 недель иммунизировали OX40 человека. Антитела против hOX40 собирали способами, описанными в настоящем описании (фиг. 1 и фиг. 2).
Иммунизация мышей
Самок мышей BALB/c в возрасте 6-8 недель иммунизировали His-меченными белками OX40 в количестве 20 мкг/мышь в концентрации 100 мкг/мл. His-меченные белки OX40 человека эмульгировали адъювантом и инъецировали в четыре положения на спине мышей. Для первой подкожной (п/к) инъекции разбавленный антиген эмульгировали в полном адъюванте Фрейнда (CFA) в равном объеме. При следующих подкожных инъекциях белок эмульгировали в неполном адъюванте Фрейнда (IFA) в равном объеме. Через трое суток после третьей инъекции или вспомогательной иммунизации, проводили взятие крови (сыворотки) и анализировали титр антител с использованием ELISA.
В другом эксперименте самок мышей BALB/c в возрасте 6-8 недель иммунизировали посредством инъекции мышам экспрессирующей плазмиды, кодирующей OX40 человека. Плазмиды, кодирующие антиген, инъецировали в переднюю большеберцовую мышцу (внутримышечная инъекция; в/м инъекция) мышей с использованием генных пушек в концентрации 1000 мкг/мкл в дозе 60 мкг на мышь. Проводили по меньшей мере четыре инъекции с интервалом по меньшей мере 14 суток между инъекциями. Взятие крови (сыворотки) проводили через семь суток после последней иммунизации и сыворотку тестировали в отношении титра антител посредством ELISA.
Методики усиления иммунизации также проводили по меньшей мере через четырнадцать суток после предшествующей иммунизации (посредством инъекции либо плазмиды, либо белков). Клетки CHO, которые экспрессируют антиген OX40 на поверхности, внутривенно инъецировали мышам через хвостовые вены. Селезенки извлекали через четырнадцать суток после инъекции.
Слияние клеток SP2/0 и клеток селезенки
Клетки селезенки растирали. Сначала проводили селекцию клеток селезенки с использованием микрогранул с CD3ε и микрогранул с антителом против IgM мыши, а затем подвергали слиянию с клетками SP2/0. Затем клетки высевали в 96-луночные планшеты со средой с гипоксантином-аминоптерином-тимидином (HAT).
Первичный скрининг гибридом
Первичный скрининг супернатантов гибридом в 96-луночных планшетах проводили с использованием сортировки клеток с активированной флуоресценцией (FACS) в соответствии со стандартными методиками. Перед скринингом в 96-луночные планшеты добавляли клетки яичника китайского хомячка (CHO) (2×104 клеток на лунку). Использовали 50 мкл супернатанта. Антитела, которые использовали в экспериментах, представляли собой
(1) Конъюгированный с флуоресцеином (FITC) F(ab)2-фрагмент козы против IgG мыши, специфичный к Fcγ-фрагменту, и
(2) Конъюгированный с Alexa Fluor® 647 F(ab)2-фрагмент козы против IgG человека, специфичный к Fcγ-фрагменту.
Субклонирование
Субклонирование проводили с использованием ClonePix2. В кратком изложении, содержимое положительных лунок, идентифицированных в ходе первичного скрининга, переносили в полутвердую среду и IgG-положительные клоны идентифицировали и тестировали. Использовали антитело Fc IgG мыши с FITC.
Антитела асцитной жидкости
1×106 положительных гибридомных клеток инъецировали внутрибрюшинно мышам B-NDG® (Beijing Biocytogen, Пекин, Китай). Моноклональные антитела продуцировали путем выращивания гибридомных клеток в брюшной полости мыши. Гибридомные клетки увеличивались в количестве и продуцировали асцитную жидкость в брюшной полости мышей. Жидкость содержала высокую концентрацию антител, которые можно было собирать для последующего применения.
Очистка антител
Антитела в асцитной жидкости очищали с использованием хроматографии AKTA GE с белком (GE Healthcare, Chicago, Illinois, США). Антитела, продуцированные способами, описанными выше, включали 07-9H3 ("9H3"), 07-9A4 ("9A4"), 11-5C1 ("5C1"), 17-5D10 ("5D10"), 08-6A11 ("6A11") и 14-7F11 ("7F11").
Определяли области VH, VL и CDR для некоторых из антител. Аминокислотные последовательности CDR1, CDR2 и CDR3 тяжелой цепи для 9H3 представлены в SEQ ID NO: 1-6 (нумерация Kabat) или SEQ ID NO: 25-30 (нумерация Chothia).
Аминокислотные последовательности CDR1, CDR2 и CDR3 тяжелой цепи и легкой цепи для 9A4 представлены в SEQ ID NO: 7-12 (нумерация Kabat) или SEQ ID NO: 31-36 (нумерация Chothia).
Аминокислотные последовательности CDR1, CDR2 и CDR3 тяжелой цепи и легкой цепи для 5C1 представлены в SEQ ID NO: 13-18 (нумерация Kabat) или SEQ ID NO: 37-42 (нумерация Chothia).
Аминокислотные последовательности CDR1, CDR2 и CDR3 тяжелой цепи и легкой цепи для 5D10 представлены в SEQ ID NO: 19-24 (нумерация Kabat) или SEQ ID NO: 43-48 (нумерация Chothia).
Пример 2. Гуманизация антител мыши
Исходной точкой для гуманизации были антитела мыши (например, 9H3, 9A4, 5C1 и 5D10). Аминокислотные последовательности вариабельной области тяжелой цепи и вариабельной области легкой цепи этих антител мыши определяли.
Конструировали три гуманизированных варианта вариабельной области тяжелой цепи (SEQ ID NO: 53-55) и три гуманизированных варианта вариабельной области легкой цепи (SEQ ID NO: 56-58) для 9H3, содержавших различные перестановки замен.
Конструировали три гуманизированных варианта вариабельной области тяжелой цепи (SEQ ID NO: 59-61) и четыре гуманизированных варианта вариабельной области легкой цепи (SEQ ID NO: 62-65) для 9A4, содержавших различные перестановки замен.
Конструировали три гуманизированных варианта вариабельной области тяжелой цепи (SEQ ID NO: 66-68) и четыре гуманизированных варианта вариабельной области легкой цепи (SEQ ID NO: 69-72) для 5C1, содержавших различные перестановки замен.
Конструировали три гуманизированных варианта вариабельной области тяжелой цепи (SEQ ID NO: 73-75) и три гуманизированных варианта вариабельной области легкой цепи (SEQ ID NO: 76-78) для 5D10, содержащие различные перестановки замен.
Эти гуманизированные варианты вариабельной области тяжелой цепи комбинировали с любыми из соответствующих гуманизированных вариантов вариабельной области легкой цепи. Например, 9H3-H1 (SEQ ID NO: 53) можно комбинировать с любым гуманизированным вариантом вариабельной области легкой цепи 9H3 (например, 9H3-K2 (SEQ ID NO: 57)), и антитело можно метить соответствующим образом (например, 9H3-H1K2).
Затем эти гуманизированные антитела получали с использованием BioLuminate 1.0 (Schrodinger, Шанхай, Китай).
Пример 3. Тестирование in vitro антител мыши против hOX40: блокирование связывания OX40 человека (hOX40) и OX40L человека (hOX40L)
Проводили анализы блокирования для определения того, могут ли антитела против hOX40 блокировать связывание между hOX40 и hOX40L.
Антитела против hOX40 собирали из асцитной жидкости мыши и очищали хроматографией. В каждую лунку планшета добавляли 25 мкл клеток CHO, временно трансфицированных OX40 человека. Очищенные антитела титровали до конечных концентраций 50, 5, 0,5, 0,05, 0,005 мкг/мл. Титрованные антитела добавляли в каждую лукну в количестве 25 мкл на лунку при 4°C и инкубировали в течение 30 минут.
hOX40L-Fc разбавляли 1:200. В каждую лунку добавляли 50 мкл раствора лиганда. Клетки с hOX40L-Fc и антителами инкубировали при 4°C в течение 15 минут.
После промывания фосфатно-солевым буфером (PBS) два раза 50 мкл конъюгат антитела против Fc IgG мыши с фикоэритрином (антитело против Fc mIgG-PE) в разведении 1:500 и в каждую лунку добавляли конъюгат антитела против Fc IgG человека с флуоресцеинизотиоцианатом (антитело против Fc hIgG-FITC) в разведении 1:100, инкубировали в течение 30 минут при 4°C, а затем промывали PBS. Сигналы FITC и PE определяли проточной цитометрией.
Как показано на фиг. 3, когда концентрация антитела мыши против hOX40 9H3 ("07-9H3") возрастала, сигнал FITC снижался, что указывает на то, что связывание между OX40 и OX40L блокировалось антителами против hOX40.
Пример 4. Активность связывания антител против hOX40 с OX40 человека
Антитела против hOX40 собирали из асцитной жидкости мыши и очищали хроматографией. В каждую лунку планшета добавляли 25 мкл клеток CHO, временно трансфицированных OX40 человека. Очищенные антитела титровали до конечных концентраций 50, 5, 0,5, 0,05, 0,005 мкг/мл. Титрованные антитела добавляли в каждую лунку в количестве 25 мкл на лунку при 4°C и инкубировали в течение 30 минут.
После промывания фосфатно-солевым буфером (PBS) два раза в каждую лунку добавляли 50 мкл конъюгата антитела против Fc IgG мыши с фикоэритрином (антитело против Fc mIgG-PE) в разведении 1:500 и инкубировали в течение 30 минут при 4°C, а затем промывали PBS. Определение сигналов PE проводили посредством проточной цитометрии.
Как показано на фиг. 4, когда концентрация антитела мыши против hOX40 9H3 ("07-9H3") возрастала, сигнал PE возрастал, что указывает на то, что 9H3 может связываться с OX40 человека.
Пример 5. Перекрестная реактивность антител против hOX40 в отношении OX40 обезьяны, OX40 мыши и химерного OX40 человека-мыши (chiOX40)
Клетки CHO трансфицировали OX40 макака-резус (rmOX40, SEQ ID NO: 51), OX40 мыши (mOX40, SEQ ID NO: 50) и химерным (мыши и человека) OX40 (chiOX40, SEQ ID NO: 52).
В каждую лунку добавляли 25 мкл клеток CHO. В каждую лунку добавляли 25 мкл очищенных антител против hOX40 (1 мкг/мл) (9H3 или "07-9H3") и инкубировали при 4°C в течение 30 минут.
После промывания PBS (1200 об/мин, 5 мин) два раза в каждую лунку добавляли 50 мкл конъюгата антитела против Fc IgG мыши с флуоресцеинизотиоцианатом (антитело против Fc mIgG-FITC) в разведении 1:500 и инкубировали при 4°C в течение 30 минут с последующим промыванием PBS (1200 об/мин, 5 мин). Сигналы FITC определяли проточной цитометрией.
Как показано на фиг. 5, 9H3 не реагировало перекрестно с OX40 мыши, а имело выраженную перекрестную реактивность в отношении rmOX40 и химерного OX40. На фиг. 5, NC означает отрицательный контроль.
Пример 6. Аффинность связывания антител против hOX40
Антитела тестировали в отношении связывания hOX40. Аффинность антител определяли посредством поверхностного плазмонного резонанса (Biacore T200 biosensor, Biacore, INC, Piscataway N.J.), оборудованного сенсорными чипами с предварительно иммобилизованным белком A.
Антитело против hOX40 9H3-mHvKv-IgG1 (1 мкг/мл) инжектировали в биосенсор Biacore T200 со скоростью 10 мкл/мин в течение 25 секунд до достижения желаемой плотности белка (приблизительно 112 единиц ответа (RU)). Затем инжектировали белки OX40 человека (hOX40-His) в концентрации 100,50,25,12,5,6,25,3,125,1,5625 нМ со скоростью 30 мкл/мин в течение 120 секунд. Проводили мониторинг диссоциации в течение 300 секунд. После последнего инжектирования каждого титрования проводили регенерацию чипа глицином (pH 2,0, 30 мкл/мин в течение 12 секунд). Результат для 9H3-mHvKv-IgG1 представлен на фиг. 6.
Значения кинетической скорости ассоциации (kon) и скорости диссоциации (koff) получали одновременно путем глобальной аппроксимации данных к модели связывания Ленгмюра 1:1 (Karlsson, R. Roos, H. Fagerstam, L. Petersson, B., 1994. Methods Enzymology 6. 99-110) с использованием программного обеспечения Biacore T200 Evaluation Software 3.0. Аффинность определяли из частного кинетических констант скорости (KD=koff/kon).
Указанный способ с необходимыми соответствующими поправками параметров (например, концентрации антител) проводили для всех других тестируемых антител. Результаты для протестированных антител против hOX40 обобщенно представлены в таблице ниже.
Таблица 1
kon (1/Мс)
koff (1/c)
KD (M)
Среди этих протестированных антител 9A4 представляет собой антитело мыши против hOX40 согласно примеру 1. 9H3-mHvKv-IgG1, 5C1-mHvKv-IgG1, 5D10-mHvKv-IgG1 и 9A4-mHvKv-IgG1 представляют собой химерные антитела против hOX40. Они имеют вариабельный домен тяжелой цепи и вариабельный домен легкой цепи из антител мыши против hOX40, и константные домены IgG1-антител человека (CL, CH1, CH2, CH3).
9H3-H2K1-IgG1, 9H3-H2K2-IgG1, 9H3-H2K3-IgG1, 9H3-H3K1-IgG1, 9H3-H3K2-IgG1 и 9H3-H3K3-IgG1 представляют собой гуманизированные антитела. Они имеют константные домены IgG1-антител человека (CL, CH1, CH2, CH3). Число в середине указывает на гуманизированные варианты вариабельных доменов (фиг.34). Например, 9H3-H2K1-IgG1 имеет гуманизированный вариабельный домен H2 тяжелой цепи (SEQ ID NO: 54) и гуманизированный вариабельный домен K1 легкой цепи (SEQ ID NO: 56). Аналогично, 9H3-H2K3-IgG1 имеет гуманизированный вариабельный домен H2 тяжелой цепи 9H3 (SEQ ID NO: 54) и гуманизированный вариабельный домен K3 легкой цепи 9H3 (SEQ ID NO: 58).
Пример 7. Термическая стабильность антител против hOX40
Анализ Thermofluor assay проводили с использованием набора Protein Thermal Shift™ Dye Kit (Thermo Fisher Scientific) и систем QuantStudio™ 5 Real Time PCR Systems (Thermo Fisher Scientific). Этот анализ определял термостабильность с использованием флуоресцентного красителя, который связывается с гидрофобными фрагментами, экспонируемыми при разворачивании белка.
Эксперименты проводили в соответствии с протоколом изготовителя. Смешивали 2 мкл антитела, 10,5 мкл воды, 5 мкл буфера Protein Thermal Shift Buffer, и 2,5 мкл разбавленного красителя Protein Thermal Shift Dye. Образцы нагревали до 25°C со скоростью 1,6°C/секунда, а затем нагревали до 99°C со скоростью 0,05°C/секунда.
Поскольку IgG может быть описан как мультидоменный белок, кривая плавления обычно демонстрирует два перехода с первой температурой денатурации ™ D1 и второй температурой денатурации ™ D2. Наличие этих двух пиков часто указывает на денатурацию доменов Fc и Fab, соответственно. Однако в некоторых случаях можно наблюдать только один пик.
В таблице ниже обобщенно представлена ™ для различных антител против hOX40. Если было два перехода в качестве ™ в таблице ниже указана ™ D2.
Таблица 2
(константные домены)
В таблице 2, за исключением антитела мыши 9H3, все антитела представляют собой либо химерные антитела, либо гуманизированные антитела. Название и последовательности этих антител приведены ниже. Название указывает на источник, вариабельную область и константную область антитела. Например, гуманизированное антитело 5D10 с гуманизированной вариабельной областью H1 тяжелой цепи и гуманизированной вариабельной областью K1 легкой цепи и константными областями IgG1 человека обозначается как 5D10-H1K1-IgG1 в настоящем описании. Аналогично, химерное антитело 5C1 с VH и VL мыши, и константными областями IgG1 человека обозначается как 5C1-mHvKv-IgG1. Более того, для снижения гетерогенности гликанов Fc-область некоторых антител далее модифицировали способами инженерии для замены аспарагина в положении 297 на аланин (N297A).
Таблица 3
В некоторых из протестированных антител наблюдали два перехода. Результаты ™ D1 и ™ D2 для некоторых из протестированных антител представлены в таблицах ниже.
Таблица 4
*Наблюдали только одну кривую перехода.
Результат показывает, что 9H3-H2K1-IgG1, 9H3-H2K2-IgG1 и 9H3-H2K3-IgG1 имеют значительно более низкую ™ D2, чем некоторые другие антитела (например, 9H3-H3K2-IgG1). Является возможно, что гуманизированная цепь H2 9H3 (SEQ ID NO: 54) не является настолько же стабильной, как другие гуманизированные цепи. Этот результат также согласуется с результатами термической стабильности для супернатанта CHO-S (содержащего экспрессированные антитела) при определении посредством FACS.
Таблица 5
Таблица 6
Результаты, приведенные в таблице 5 и таблице 6, показывают, что гуманизированные антитела с константными областями IgG1 и константными областями IgG2 имели сходную ™ D1 и имели сходную ™ D2. Мутация N297A в IgG1 может значительно снижать ™ D1, но не ™ D2. Более того, гуманизированные антитела с константными областями IgG4 имели более низкие ™ D1 и ™ D2.
Пример 8. Тестирование in vivo антител мыши и химерных антител против hOX40
Для тестирования антител против hOX40 in vivo и для прогнозирования эффектов этих антител в организме человека использовали модель на мышах с гуманизированным OX40. Модель на мышах с гуманизированным OX40 создавали для экспрессии химерного белка OX40 (SEQ ID NO: 52), где часть внеклеточной области белка OX40 мыши была заменена внеклеточной областью OX40 человека. Аминокислотные остатки 31-195 OX40 мыши (SEQ ID NO: 50) заменяли аминокислотными остатками 35-197 OX40 человека (SEQ ID NO:49). Модель с гуманизированными мышами (гуманизированные мыши B-hOX40) обеспечивает новый инструмент для тестирования новых способов терапевтического лечения в клинических условиях посредством значительного снижения различий между клиническим исходом у человека и у обычных мышей, экспрессирующих OX40 мыши. Подробное описание, касающееся модели на мышах с гуманизированным OX40, может быть найдено в PCT/CN2017/099575, которая включена в настоящее описание в качестве ссылки в полном объеме.
Антитела против hOX40 тестировали, чтобы продемонстрировать их эффект на рост опухоли in vivo в модели карциномы толстого кишечника. Клетки злокачественной опухоли MC-38 (клетки аденокарциномы толстого кишечника) инъецировали подкожно гуманизированным мышам B-hOX40. Когда опухоли у мышей достигали объема 150±50 мм3, мышей случайным образом распределяли в различные группы, исходя из объема опухоли.
Затем мышам инъецировали физиологический раствор (PS) и антитела против hOX40 посредством внутрибрюшинного введения. Антитело вводили на первые сутки и на четвертые сутки каждой недели в течение 3 недель (всего 6 инъекций).
Объем инъекции вычисляли, исходя из массы мыши, с учетом дозы 3 мг/кг. Длину длинной оси и короткой оси опухоли измеряли и объем опухоли вычисляли как 0,5 × (длинная ось) × (короткая ось)2. Массу мышей также измеряли до инъекции, когда мышей распределяли на группы (до первой инъекции антитела), два раза в неделю в ходе периода инъекции антитела и перед умерщвлением.
Процент ингибирования роста опухоли (TGI%) вычисляли с использованием следующей формулы: TGI (%) = [1-(Ti-T0)/(Vi-V0)]×100. Ti представляет собой средний объем опухоли в группе лечения на сутки i. T0 представляет собой средний объем опухоли в группе лечения на нулевые сутки. Vi представляет собой средний объем опухоли в контрольной группе на сутки i. V0 представляет собой средний объем опухоли в контрольной группе на нулевые сутки.
Для статистического анализа использовали T-критерий. TGI% выше 60% указывает на значительное подавление роста опухоли. P < 0,05 представляет собой пороговое значение для указания значимых отличий.
Результаты in vivo для антител мыши против hOX40 07-9H3, 07-9A4, 11-5C1, 17-5D10, 08-6A11 и 14-7F11
Антитела мыши против hOX40 07-9H3, 07-9A4, 11-5C1, 17-5D10, 08-6A11 и 14-7F11 вводили гуманизированным мышам B-hOX40 (мыши с гуманизированным OX40). Мониторинг массы мышей проводили в ходе всего периода введения. Масса мышей во всех из различных групп возрастала (фиг. 7 и фиг. 8). Не наблюдалось значимых отличий массы между контрольной группой и группами введения антитела против hOX40. Результаты показали, что антитела против hOX40 хорошо переносились и не были токсичными для мышей.
Однако размер опухоли продемонстрировал значимое отличие в группах, в которых вводили антитела 07-9H3, 07-9A4, 11-5C1 и 17-5D10 (фиг. 9).
Также для каждой группы введения вычисляли TGI% на 24 сутки, как показано в таблице ниже.
Таблица 7
Результаты показывают, что 5C1 имело наилучший TGI%. 6A11 и 7F11 не были эффективными в отношении ингибирования роста опухоли.
Результаты in vivo для химерных антител против hOX40
Антитело мыши против hOX40 9H3 и химерные антитела против hOX40 9H3-mHvKv-IgG1, 9H3-mHvKv-IgG2, 9H3-mHvKv-IgG4 и 9H3-mHvKv-IgG1-N297A вводили гуманизированным мышам B-hOX40 (мыши с гуманизированным OX40) посредством внутрибрюшинного введения. Инъецируемое количество вычисляли, исходя из массы мыши, для дозы 3 мг/кг. Антитело вводили на первые сутки и на четвертые сутки каждой недели (всего 5 инъекций).
Мониторинг массы мышей проводили в ходе всего периода введения. Масса мышей во всех из различных групп возрастала (фиг. 10 и фиг. 11). Не наблюдалось значимых отличий массы между контрольной группой и группами введения антитела против hOX40. Результаты показали, что антитела против hOX40 хорошо переносились и не были токсичными для мышей.
Однако размер опухоли продемонстрировал значимое отличие в группах, в которых вводили антитела 9H3-mHvKv-IgG1, 9H3-mHvKv-IgG2, 9H3-mHvKv-IgG4 и 9H3-mHvKv-IgG1-N297A (фиг. 12).
Также для каждой группы введения вычисляли TGI% на 21 сутки, как показано в таблице ниже.
Таблица 8
(3 мг/кг; в/б введение; два раза в неделю; всего 5 инъекций)
(3 мг/кг; в/б введение; два раза в неделю; всего 5 инъекций)
(3 мг/кг; в/б введение; два раза в неделю; всего 5 инъекций)
(3 мг/кг; в/б введение; два раза в неделю; всего 5 инъекций)
(3 мг/кг; в/б введение; два раза в неделю; всего 5 инъекций)
Результаты демонстрируют, что антитело мыши против hOX40 9H3 и химерное антитело против hOX40 9H3-mHvKv-IgG1 и 9H3-mHvKv-IgG2 может значительно ингибировать рост опухоли. Среди их 9H3-mHvKv-IgG1 имело наиболее высокий TGI%.
Пример 9. Тестирование in vivo гуманизированных антител против hOX40
Гуманизированные антитела против hOX40 тестировали у мышей с гуманизированным OX40, чтобы продемонстрировать их эффект на рост опухоли in vivo.
Клетки злокачественной опухоли MC-38 (клетки аденокарциномы толстого кишечника) инъецировали подкожно гуманизированным мышам B-hOX40. Когда опухоли у мышей достигали объема 150±50 мм3, мышей случайным образом распределяли на различные группы, исходя из объема опухоли (8 мышей в каждой группе).
Затем мышам инъецировали IgG человека (контроль) и антитела против hOX40 посредством внутрибрюшинной инъекции в дозе либо 3 мг/кг, либо 1 мг/кг. Антитело вводили на первые сутки и на четвертые сутки каждой недели в течение 3 недель (всего 6 инъекций).
Мониторинг массы мышей проводили в ходе всего периода введения. Масса мышей во всех из различных групп возрастала (фиг. 13 и фиг. 14). Не наблюдалось значимых отличий массы между контрольной группой и группами введения антитела против hOX40. Результаты показали, что антитела против hOX40 хорошо переносились и не были токсичными для мышей.
Размер опухоли продемонстрировал значимое отличие в группах, в которых вводили антитела против hOX40 (фиг. 15).
TGI% на 18 сутки (18 суток после распределения на группы) для каждой группы введения также вычисляли, как показано в таблице ниже.
Таблица 9
Результаты, приведенные выше, демонстрируют, что все антитела против hOX40 могут ингибировать рост опухоли. Среди них 9H3-H3K3-IgG1 (3 мг/кг) имело наиболее высокий процент ингибирования роста опухоли.
Трех мышей в группе G1 и трех мышей в группе G5 отбирали для дальнейшей оценки.
Исследовали ткани печени этих мышей (фиг. 16). Результаты обобщенно представлены в таблицах. Результат показывает, что по сравнению с контрольной группой не наблюдалось значимого повреждения печени.
Таблица 10
Наблюдался один мелкий очаговый участок некроза гепатоцитов.
Также исследовали почку этих мышей (фиг. 17). Результаты обобщенно представлены в таблицах ниже. Результат показывает, что по сравнению с контрольной группой 9H3-H3K3-IgG1 не вызывало серьезных повреждений почек.
Таблица 11
Также исследовали кишечник этих мышей (фиг. 18). Результаты обобщенно представлены в таблицах ниже. Результат демонстрирует, что по сравнению с контрольной группой 9H3-H3K3-IgG1 не вызывает серьезного повреждения кишечника.
Таблица 12
В целом, результаты указывают на то, что 9H3-H3K3-IgG1 не имеет серьезных побочных эффектов у гуманизированных мышей.
Пример 10. Комбинированная терапия с Китрудой
Для оценки эффективности комбинированной терапии антитела против hOX40 вводили мышам с некоторыми другими терапевтическими средствами.
Результаты in vivo для 9H3 и Китруды для клеток злокачественной опухоли MC-38 у гуманизированных мышей
Клетки злокачественной опухоли MC-38 инъецировали подкожно гуманизированным мышам B-hOX40. Когда опухоли у мышей достигали объема 150±50 мм3, мышей случайным образом распределяли на различные группы, исходя из объема опухоли (6 мышей в каждой группе). Затем мышам инъецировали (G1) PS (контроль), (G2) Китруду (0,3 мг/кг) (Merck), (G3) 9H3 (3 мг/кг) и (G4) Китруду (0,3 мг/кг) и 9H3 (3 мг/кг) посредством внутрибрюшинной инъекции. Антитело вводили на первые сутки и четвертые сутки каждой недели в течение 3 недель (всего 6 инъекций).
Мониторинг массы мышей проводили в ходе всего периода введения. Масса мышей во всех из различных групп возрастала (фиг. 19 и фиг. 20). Не наблюдалось значимых отличий массы между контрольной группой и группами введения антитела против hOX40. Результаты показали, что эти антитела хорошо переносились и не были токсичными для мышей.
Размер опухоли продемонстрировал значимое отличие в группах, в которых вводили антитела против hOX40 (фиг. 21). TGI% на 21 сутки (21 сутки после распределения на группы) для каждой группы введения также вычисляли, как показано в таблице ниже.
Таблица 13
(0,3 мг/кг)
(3 мг/кг)
Результат показывает, что 9H3 в комбинации с Китрудой может усиливать эффекты ингибирования роста опухоли.
Результаты in vivo для 9H3 и Китруды для клеток злокачественной опухоли EL4 у гуманизированных мышей
Клетки злокачественной опухоли EL4 (линия опухолевых клеток мыши, происходящая из химически индуцированной лимфомы) инъецировали подкожно гуманизированным мышам B-hOX40. Когда опухоли у мышей достигали объема 150±50 мм3, мышей случайным образом распределяли на различные группы, исходя из объема опухоли (5 мышей в каждой группе). Затем мышам инъецировали (G1) PS (контроль), (G2) 9H3 (3 мг/кг), (G3) Китруду (3 мг/кг) и (G4) Китруду (3 мг/кг) и 9H3 (3 мг/кг) посредством внутрибрюшинной инъекции. Антитело вводили на первые сутки и четвертые сутки каждой недели в течение 3 недель (всего 6 инъекций).
Мониторинг массы мышей проводили в ходе всего периода введения. Масса мышей во всех из различных групп возрастала (фиг. 22 и фиг. 23). Результаты показали, что эти хорошо переносились и не были токсичными для мышей.
Размер опухоли продемонстрировал значимое отличие в группах, в которых вводили 9H3 и комбинацию 9H3 и Китруды (фиг. 24). TGI% на 18 сутки (18 суток после распределения на группы) для каждой группы введения представлен в таблице ниже.
Таблица 14
(3 мг/кг)
(3 мг/кг)
Результат показывает, что сама по себе Китруда не может ингибировать рост опухоли. Однако комбинация Китруды и 9H3 имела лучший TGI%, чем использование 9H3 отдельно.
Пример 11. Комбинированная терапия антителами против PD1 или против PDL1
Для оценки эффективности комбинированной терапии антитела против hOX40 вводили мышам с антителами против PD1 или против PDL1.
Клетки злокачественной опухоли MC-38 инъецировали подкожно гуманизированным мышам B-hOX40. Когда опухоли у мышей достигали объема 150±50 мм3, мышей случайным образом распределяли на различные группы, исходя из объема опухоли (5 мышей в каждой группе). Затем мышам инъецировали (G1) PS (контроль); (G2) 9H3 (1 мг/кг); (G3) mPD-1(RMP1-14) (антитело мыши против mPD1; каталожный номер BioXcell BE0146) (1 мг/кг); (G4) 9H3 (1 мг/кг) и mPD-1(RMP1-14) (1 мг/кг); (G5) mPD-L1(10F.9G2) (антитело мыши против mPDL1; каталожный номер BioXcell BE0101) (1 мг/кг); или (G6) 9H3 (1 мг/кг) и mPD-L1(10F.9G2) (1 мг/кг) посредством внутрибрюшинного введения. Антитело вводили два раза в неделю в течение 3 недель (всего 6 инъекций).
Мониторинг массы мышей проводили в ходе всего периода введения (фиг. 25 и фиг. 26). Результаты показали, что эти антитела не были токсичными для мышей.
Размер опухоли уменьшался в группах, в которых вводили антитела (фиг. 27). TGI% на 25 сутки (25 суток после распределения на группы) для каждой группы введения представлен в таблице ниже.
Таблица 15
(1 мг/кг)
Результаты показывает, что 9H3 в комбинации с mPD-1(RMP1-14) (антитело против PD-1) имело наилучший показатель ингибирования роста опухоли.
Пример 12. Комбинированная терапия антителами против LAG-3, против TIGIT, против BTLA, против CTLA-4 или против GITR
Для оценки эффективности комбинированной терапии антитела против hOX40 вводили мышам с антителами против LAG-3, против TIGIT, против BTLA, против CTLA-4 или против GITR.
Клетки злокачественной опухоли MC-38 инъецировали подкожно гуманизированным мышам B-hOX40. Когда опухоли у мышей достигали объема 150±50 мм3, мышей случайным образом распределяли в различные группы, исходя из объема опухоли (5 мышей в каждой группе). Затем мышам проводили следующие инъекции посредством внутрибрюшинного введения:
(G1) PS (контроль);
(G2) 9H3 (1 мг/кг);
(G3) mLAG-3(C9B7W) (антитело мыши против LAG-3; BioXcell, каталожный номер №: BE0174) (3 мг/кг);
(G4) 9H3 (1 мг/кг) и mLAG-3(C9B7W) (3 мг/кг);
(G5) mTIGIT(1G9) (антитело мыши против mTIGIT; BioXcell, каталожный номер №: BE0274) (3 мг/кг);
(G6) 9H3 (1 мг/кг) и mTIGIT(1G9) (3 мг/кг);
(G7) mBTLA(PJ196) (антитело мыши против mBTLA; BioXcell, каталожный номер №: BE0196) (10 мг/кг);
(G8) 9H3 (1 мг/кг) и mBTLA(PJ196) (10 мг/кг);
(G9) mCTLA-4(9D9) (антитело мыши против mCTLA-4; BioXcell, каталожный номер №: BE0164) (1 мг/кг);
(G10) 9H3 (1 мг/кг) и mCTLA-4(9D9) (1 мг/кг);
(G11) mGITR(DTA-1) (антитело мыши против mGITR; BioXcell, каталожный номер №: BE0063) (0,3 мг/кг);
(G12) 9H3 (1 мг/кг) и mGITR(DTA-1) (0,3 мг/кг).
Антитело вводили два раза в неделю (всего 3 инъекции).
Мониторинг массы мышей проводили в ходе всего периода введения (фиг. 28 и фиг. 29). Результаты показали, что эти антитела не были токсичными для мышей.
В группах введения G2, G3, G4, G6, G8, G10, G11 и G12 размер опухоли уменьшался (фиг. 30). TGI% на 25 сутки (25 сутки после распределения на группы) для каждой группы введения представлен в таблице ниже.
Таблица 16
(1 мг/кг)
(3 мг/кг)
Результат показывает, что 9H3 в комбинации с антителами против LAG-3, против TIGIT, против BTLA, против CTLA-4 или против GITR имело лучшие эффекты ингибирования роста опухоли, чем применение 9H3 отдельно.
Пример 13. Тестирование in vivo гуманизированных антител 9A4, 5C1 и 5D10
Гуманизированные антитела 9A4, 5C1 и 5D10 также тестируют у мышей с гуманизированным OX40 для демонстрации их эффекта на рост опухоли in vivo.
Клетки злокачественной опухоли MC-38 (клетки аденокарциномы толстого кишечника) инъецируют подкожно гуманизированным мышам B-hOX40. Когда опухоли у мышей достигают объема 150±50 мм3, мышей случайным образом распределяют в различные группы, исходя из объема опухоли. Затем мышам инъецируют IgG человека (контроль) и гуманизированные антитела 9A4, 5C1 и 5D10 посредством внутрибрюшинной инъекции в дозе либо 3 мг/кг, либо 1 мг/кг. Антитело вводят на первые сутки и четвертые сутки каждой недели в течение 3 недель (всего 6 инъекций).
Мониторинг массы мышей проводят в ходе всего периода введения. Ожидается, что не будет наблюдаться значимых отличий в массе в контрольной группе и группе введения антитела против hOX40, и что гуманизированные антитела 9A4, 5C1 и 5D10 могут ингибировать рост опухоли у мышей.
ДРУГИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
Следует понимать, что, хотя изобретение описано применительно к его подробному описанию, приведенное выше описание предназначено для иллюстрации, но не для ограничения объема изобретения, который определяется объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации входят в объем прилагаемой ниже формулы изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ЮКЬЮР (БЭЙЦЗИН) БАЙОФАРМА КО., ЛТД
<120> АНТИТЕЛА ПРОТИВ OX40 И ИХ ПРИМЕНЕНИЯ
<130> 20171124
<160> 86
<170> PatentIn version 3.5
<210> 1
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<400> 1
Ser Tyr Gly Val Leu
1 5
<210> 2
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<400> 2
Val Ile Trp Ser Gly Gly Ser Thr Asp Tyr Asn Ala Ala Phe Ile Ser
1 5 10 15
<210> 3
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<400> 3
Glu Glu Phe Gly Tyr
1 5
<210> 4
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<400> 4
Arg Ala Ser Gln Asp Ile Asn Asn Tyr Leu Asn
1 5 10
<210> 5
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<400> 5
Tyr Thr Ser Arg Leu His Ser
1 5
<210> 6
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<400> 6
Gln Gln Thr Asn Thr Leu Pro Trp Thr
1 5
<210> 7
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<400> 7
Asp Tyr Asn Met Asp
1 5
<210> 8
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<400> 8
Asp Ile Asn Pro Asn Tyr Asp Ser Thr Ser Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 9
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<400> 9
Gly Gly Tyr Gly Asn Tyr Val Asp Tyr Phe Asp Tyr
1 5 10
<210> 10
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<400> 10
Lys Ala Ser Glu Asn Val Val Thr Tyr Val Ser
1 5 10
<210> 11
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<400> 11
Gly Ala Ser Asn Arg Tyr Thr
1 5
<210> 12
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<400> 12
Gly Gln Ser Tyr Ser Tyr Pro Tyr Thr
1 5
<210> 13
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<400> 13
Ser Tyr Trp Met His
1 5
<210> 14
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<400> 14
Thr Ile Tyr Pro Gly Asn Ser Asp Thr Ser Asn Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 15
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<400> 15
Phe Tyr Tyr Arg Tyr Glu Asp Tyr Tyr Ala Met Asp Tyr
1 5 10
<210> 16
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<400> 16
Lys Ala Ser Gln Asp Val Asn Thr Ala Val Ala
1 5 10
<210> 17
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<400> 17
Ser Ala Ser Tyr Arg Tyr Thr
1 5
<210> 18
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<400> 18
Gln Gln His Tyr Ser Thr Pro Phe Thr
1 5
<210> 19
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<400> 19
Ser Tyr Gly Val His
1 5
<210> 20
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<400> 20
Val Ile Trp Ala Gly Gly Asn Thr Asn Tyr Asn Ser Ala Leu Met Ser
1 5 10 15
<210> 21
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<400> 21
Tyr Asp Gly Tyr Tyr Gly Trp Phe Ala Tyr
1 5 10
<210> 22
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<400> 22
Arg Ala Ser Gln Asp Ile Ser Tyr Tyr Leu Asn
1 5 10
<210> 23
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<400> 23
Tyr Thr Ser Arg Leu His Ser
1 5
<210> 24
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<400> 24
Gln Gln Gly His Thr Leu Pro Trp Thr
1 5
<210> 25
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<400> 25
Gly Phe Ser Leu Thr Ser Tyr Gly Val Leu
1 5 10
<210> 26
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<400> 26
Trp Ser Gly Gly Ser
1 5
<210> 27
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<400> 27
Glu Glu Phe Gly Tyr
1 5
<210> 28
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<400> 28
Arg Ala Ser Gln Asp Ile Asn Asn Tyr Leu Asn
1 5 10
<210> 29
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<400> 29
Tyr Thr Ser Arg Leu His Ser
1 5
<210> 30
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<400> 30
Gln Gln Thr Asn Thr Leu Pro Trp Thr
1 5
<210> 31
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<400> 31
Gly Tyr Thr Phe Thr Asp Tyr Asn Met Asp
1 5 10
<210> 32
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<400> 32
Asn Pro Asn Tyr Asp Ser
1 5
<210> 33
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<400> 33
Gly Gly Tyr Gly Asn Tyr Val Asp Tyr Phe Asp Tyr
1 5 10
<210> 34
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<400> 34
Lys Ala Ser Glu Asn Val Val Thr Tyr Val Ser
1 5 10
<210> 35
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<400> 35
Gly Ala Ser Asn Arg Tyr Thr
1 5
<210> 36
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<400> 36
Gly Gln Ser Tyr Ser Tyr Pro Tyr Thr
1 5
<210> 37
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<400> 37
Gly Tyr Ser Phe Thr Ser Tyr Trp Met His
1 5 10
<210> 38
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<400> 38
Tyr Pro Gly Asn Ser Asp
1 5
<210> 39
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<400> 39
Phe Tyr Tyr Arg Tyr Glu Asp Tyr Tyr Ala Met Asp Tyr
1 5 10
<210> 40
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<400> 40
Lys Ala Ser Gln Asp Val Asn Thr Ala Val Ala
1 5 10
<210> 41
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<400> 41
Ser Ala Ser Tyr Arg Tyr Thr
1 5
<210> 42
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<400> 42
Gln Gln His Tyr Ser Thr Pro Phe Thr
1 5
<210> 43
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<400> 43
Gly Phe Ser Leu Thr Ser Tyr Gly Val His
1 5 10
<210> 44
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<400> 44
Trp Ala Gly Gly Asn
1 5
<210> 45
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<400> 45
Tyr Asp Gly Tyr Tyr Gly Trp Phe Ala Tyr
1 5 10
<210> 46
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<400> 46
Arg Ala Ser Gln Asp Ile Ser Tyr Tyr Leu Asn
1 5 10
<210> 47
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<400> 47
Tyr Thr Ser Arg Leu His Ser
1 5
<210> 48
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<400> 48
Gln Gln Gly His Thr Leu Pro Trp Thr
1 5
<210> 49
<211> 277
<212> БЕЛОК
<213> Человек
<400> 49
Met Cys Val Gly Ala Arg Arg Leu Gly Arg Gly Pro Cys Ala Ala Leu
1 5 10 15
Leu Leu Leu Gly Leu Gly Leu Ser Thr Val Thr Gly Leu His Cys Val
20 25 30
Gly Asp Thr Tyr Pro Ser Asn Asp Arg Cys Cys His Glu Cys Arg Pro
35 40 45
Gly Asn Gly Met Val Ser Arg Cys Ser Arg Ser Gln Asn Thr Val Cys
50 55 60
Arg Pro Cys Gly Pro Gly Phe Tyr Asn Asp Val Val Ser Ser Lys Pro
65 70 75 80
Cys Lys Pro Cys Thr Trp Cys Asn Leu Arg Ser Gly Ser Glu Arg Lys
85 90 95
Gln Leu Cys Thr Ala Thr Gln Asp Thr Val Cys Arg Cys Arg Ala Gly
100 105 110
Thr Gln Pro Leu Asp Ser Tyr Lys Pro Gly Val Asp Cys Ala Pro Cys
115 120 125
Pro Pro Gly His Phe Ser Pro Gly Asp Asn Gln Ala Cys Lys Pro Trp
130 135 140
Thr Asn Cys Thr Leu Ala Gly Lys His Thr Leu Gln Pro Ala Ser Asn
145 150 155 160
Ser Ser Asp Ala Ile Cys Glu Asp Arg Asp Pro Pro Ala Thr Gln Pro
165 170 175
Gln Glu Thr Gln Gly Pro Pro Ala Arg Pro Ile Thr Val Gln Pro Thr
180 185 190
Glu Ala Trp Pro Arg Thr Ser Gln Gly Pro Ser Thr Arg Pro Val Glu
195 200 205
Val Pro Gly Gly Arg Ala Val Ala Ala Ile Leu Gly Leu Gly Leu Val
210 215 220
Leu Gly Leu Leu Gly Pro Leu Ala Ile Leu Leu Ala Leu Tyr Leu Leu
225 230 235 240
Arg Arg Asp Gln Arg Leu Pro Pro Asp Ala His Lys Pro Pro Gly Gly
245 250 255
Gly Ser Phe Arg Thr Pro Ile Gln Glu Glu Gln Ala Asp Ala His Ser
260 265 270
Thr Leu Ala Lys Ile
275
<210> 50
<211> 272
<212> БЕЛОК
<213> Мышь
<400> 50
Met Tyr Val Trp Val Gln Gln Pro Thr Ala Leu Leu Leu Leu Gly Leu
1 5 10 15
Thr Leu Gly Val Thr Ala Arg Arg Leu Asn Cys Val Lys His Thr Tyr
20 25 30
Pro Ser Gly His Lys Cys Cys Arg Glu Cys Gln Pro Gly His Gly Met
35 40 45
Val Ser Arg Cys Asp His Thr Arg Asp Thr Leu Cys His Pro Cys Glu
50 55 60
Thr Gly Phe Tyr Asn Glu Ala Val Asn Tyr Asp Thr Cys Lys Gln Cys
65 70 75 80
Thr Gln Cys Asn His Arg Ser Gly Ser Glu Leu Lys Gln Asn Cys Thr
85 90 95
Pro Thr Gln Asp Thr Val Cys Arg Cys Arg Pro Gly Thr Gln Pro Arg
100 105 110
Gln Asp Ser Gly Tyr Lys Leu Gly Val Asp Cys Val Pro Cys Pro Pro
115 120 125
Gly His Phe Ser Pro Gly Asn Asn Gln Ala Cys Lys Pro Trp Thr Asn
130 135 140
Cys Thr Leu Ser Gly Lys Gln Thr Arg His Pro Ala Ser Asp Ser Leu
145 150 155 160
Asp Ala Val Cys Glu Asp Arg Ser Leu Leu Ala Thr Leu Leu Trp Glu
165 170 175
Thr Gln Arg Pro Thr Phe Arg Pro Thr Thr Val Gln Ser Thr Thr Val
180 185 190
Trp Pro Arg Thr Ser Glu Leu Pro Ser Pro Pro Thr Leu Val Thr Pro
195 200 205
Glu Gly Pro Ala Phe Ala Val Leu Leu Gly Leu Gly Leu Gly Leu Leu
210 215 220
Ala Pro Leu Thr Val Leu Leu Ala Leu Tyr Leu Leu Arg Lys Ala Trp
225 230 235 240
Arg Leu Pro Asn Thr Pro Lys Pro Cys Trp Gly Asn Ser Phe Arg Thr
245 250 255
Pro Ile Gln Glu Glu His Thr Asp Ala His Phe Thr Leu Ala Lys Ile
260 265 270
<210> 51
<211> 277
<212> БЕЛОК
<213> Обезьяна
<400> 51
Met Cys Val Gly Ala Arg Arg Leu Gly Arg Gly Pro Cys Ala Ala Leu
1 5 10 15
Leu Leu Leu Gly Leu Gly Leu Ser Thr Thr Ala Lys Leu His Cys Val
20 25 30
Gly Asp Thr Tyr Pro Ser Asn Asp Arg Cys Cys Gln Glu Cys Arg Pro
35 40 45
Gly Asn Gly Met Val Ser Arg Cys Asn Arg Ser Gln Asn Thr Val Cys
50 55 60
Arg Pro Cys Gly Pro Gly Phe Tyr Asn Asp Val Val Ser Ala Lys Pro
65 70 75 80
Cys Lys Ala Cys Thr Trp Cys Asn Leu Arg Ser Gly Ser Glu Arg Lys
85 90 95
Gln Pro Cys Thr Ala Thr Gln Asp Thr Val Cys Arg Cys Arg Ala Gly
100 105 110
Thr Gln Pro Leu Asp Ser Tyr Lys Pro Gly Val Asp Cys Ala Pro Cys
115 120 125
Pro Pro Gly His Phe Ser Pro Gly Asp Asn Gln Ala Cys Lys Pro Trp
130 135 140
Thr Asn Cys Thr Leu Ala Gly Lys His Thr Leu Gln Pro Ala Ser Asn
145 150 155 160
Ser Ser Asp Ala Ile Cys Glu Asp Arg Asp Pro Pro Pro Thr Gln Pro
165 170 175
Gln Glu Thr Gln Gly Pro Pro Ala Arg Pro Thr Thr Val Gln Pro Thr
180 185 190
Glu Ala Trp Pro Arg Thr Ser Gln Arg Pro Ser Thr Arg Pro Val Glu
195 200 205
Val Pro Arg Gly Pro Ala Val Ala Ala Ile Leu Gly Leu Gly Leu Ala
210 215 220
Leu Gly Leu Leu Gly Pro Leu Ala Met Leu Leu Ala Leu Leu Leu Leu
225 230 235 240
Arg Arg Asp Gln Arg Leu Pro Pro Asp Ala Pro Lys Ala Pro Gly Gly
245 250 255
Gly Ser Phe Arg Thr Pro Ile Gln Glu Glu Gln Ala Asp Ala His Ser
260 265 270
Ala Leu Ala Lys Ile
275
<210> 52
<211> 270
<212> БЕЛОК
<213> Искусственная последовательность
<400> 52
Met Tyr Val Trp Val Gln Gln Pro Thr Ala Leu Leu Leu Leu Gly Leu
1 5 10 15
Thr Leu Gly Val Thr Ala Arg Arg Leu Asn Cys Val Lys His Thr Tyr
20 25 30
Pro Ser Asn Asp Arg Cys Cys His Glu Cys Arg Pro Gly Asn Gly Met
35 40 45
Val Ser Arg Cys Ser Arg Ser Gln Asn Thr Val Cys Arg Pro Cys Gly
50 55 60
Pro Gly Phe Tyr Asn Asp Val Val Ser Ser Lys Pro Cys Lys Pro Cys
65 70 75 80
Thr Trp Cys Asn Leu Arg Ser Gly Ser Glu Arg Lys Gln Leu Cys Thr
85 90 95
Ala Thr Gln Asp Thr Val Cys Arg Cys Arg Ala Gly Thr Gln Pro Leu
100 105 110
Asp Ser Tyr Lys Pro Gly Val Asp Cys Ala Pro Cys Pro Pro Gly His
115 120 125
Phe Ser Pro Gly Asp Asn Gln Ala Cys Lys Pro Trp Thr Asn Cys Thr
130 135 140
Leu Ala Gly Lys His Thr Leu Gln Pro Ala Ser Asn Ser Ser Asp Ala
145 150 155 160
Ile Cys Glu Asp Arg Asp Pro Pro Ala Thr Gln Pro Gln Glu Thr Gln
165 170 175
Gly Pro Pro Ala Arg Pro Ile Thr Val Gln Pro Thr Glu Ala Trp Pro
180 185 190
Arg Thr Ser Glu Leu Pro Ser Pro Pro Thr Leu Val Thr Pro Glu Gly
195 200 205
Pro Ala Phe Ala Val Leu Leu Gly Leu Gly Leu Gly Leu Leu Ala Pro
210 215 220
Leu Thr Val Leu Leu Ala Leu Tyr Leu Leu Arg Lys Ala Trp Arg Leu
225 230 235 240
Pro Asn Thr Pro Lys Pro Cys Trp Gly Asn Ser Phe Arg Thr Pro Ile
245 250 255
Gln Glu Glu His Thr Asp Ala His Phe Thr Leu Ala Lys Ile
260 265 270
<210> 53
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<400> 53
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Gly Val Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Ser Gly Gly Ser Thr Asp Tyr Asn Ala Ala Phe Ile
50 55 60
Ser Arg Leu Thr Ile Ser Arg Asp Asn Ser Lys Ser Thr Leu Tyr Phe
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Glu Phe Gly Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 54
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<400> 54
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Ile Ser Cys Ala Val Ser Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Gly Val Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Ser Gly Gly Ser Thr Asp Tyr Asn Ala Ala Phe Ile
50 55 60
Ser Arg Leu Thr Ile Ser Arg Asp Asn Ser Lys Ser Thr Val Tyr Phe
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Glu Phe Gly Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 55
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<400> 55
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Ile Ser Cys Ala Val Ser Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Gly Val Leu Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Ser Gly Gly Ser Thr Asp Tyr Asn Ala Ala Phe Ile
50 55 60
Ser Arg Leu Thr Ile Ser Arg Asp Asn Ser Lys Ser Thr Val Tyr Phe
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Glu Glu Phe Gly Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 56
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<400> 56
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Asn Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gly Ala Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Thr Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Val Lys Arg
100 105
<210> 57
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<400> 57
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Asn Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gly Ala Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Thr Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 58
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<400> 58
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Asn Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gly Ala Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Thr Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 59
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<400> 59
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Asn Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Asn Tyr Asp Ser Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Gly Asn Tyr Val Asp Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 60
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<400> 60
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Asn Met Asp Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Asn Tyr Asp Ser Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Gly Asn Tyr Val Asp Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 61
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<400> 61
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Asn Met Asp Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Asn Tyr Asp Ser Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Gly Asn Tyr Val Asp Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Leu Thr Val Ser Ser
115 120
<210> 62
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<400> 62
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Glu Asn Val Val Thr Tyr
20 25 30
Val Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Arg Tyr Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Asp Tyr His Cys Gly Gln Ser Tyr Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 63
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<400> 63
Asn Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Glu Asn Val Val Thr Tyr
20 25 30
Val Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Arg Tyr Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Asp Tyr His Cys Gly Gln Ser Tyr Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 64
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<400> 64
Asn Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Glu Asn Val Val Thr Tyr
20 25 30
Val Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Ala Thr Asp Phe Thr Leu Thr Ile Ser Ser Val Gln Pro
65 70 75 80
Glu Asp Phe Ala Asp Tyr His Cys Gly Gln Ser Tyr Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 65
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<400> 65
Asn Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Glu Asn Val Val Thr Tyr
20 25 30
Val Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Ala Thr Asp Phe Thr Leu Thr Ile Ser Ser Val Gln Pro
65 70 75 80
Glu Asp Phe Ala Asp Tyr His Cys Gly Gln Ser Tyr Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 66
<211> 122
<212> БЕЛОК
<213> Искусственная последовательность
<400> 66
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Thr Ile Tyr Pro Gly Asn Ser Asp Thr Ser Asn Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Lys Leu Thr Ala Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Thr Phe Tyr Tyr Arg Tyr Glu Asp Tyr Tyr Ala Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 67
<211> 122
<212> БЕЛОК
<213> Искусственная последовательность
<400> 67
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Thr Ile Tyr Pro Gly Asn Ser Asp Thr Ser Asn Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Lys Leu Thr Ala Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Thr Phe Tyr Tyr Arg Tyr Glu Asp Tyr Tyr Ala Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 68
<211> 122
<212> БЕЛОК
<213> Искусственная последовательность
<400> 68
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Arg Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Thr Ile Tyr Pro Gly Asn Ser Asp Thr Ser Asn Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Lys Leu Thr Ala Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Thr Phe Tyr Tyr Arg Tyr Glu Asp Tyr Tyr Ala Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 69
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<400> 69
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Asn Ser Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 70
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<400> 70
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 71
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<400> 71
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 72
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<400> 72
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Met Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Val Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 73
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<400> 73
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Gly Val His Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Trp Ala Gly Gly Asn Thr Asn Tyr Asn Ser Ala Leu Met
50 55 60
Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val Ser Leu
65 70 75 80
Lys Met Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Ser Tyr Asp Gly Tyr Tyr Gly Trp Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Val
115
<210> 74
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<400> 74
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Gly Val His Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Ala Gly Gly Asn Thr Asn Tyr Asn Ser Ala Leu Met
50 55 60
Ser Arg Leu Thr Ile Ser Lys Asp Asn Ser Lys Ser Gln Val Ser Leu
65 70 75 80
Lys Met Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Ser Tyr Asp Gly Tyr Tyr Gly Trp Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Val
115
<210> 75
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<400> 75
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Gly Val His Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Ala Gly Gly Asn Thr Asn Tyr Asn Ser Ala Leu Met
50 55 60
Ser Arg Leu Thr Ile Ser Lys Asp Asn Ser Lys Ser Gln Val Ser Leu
65 70 75 80
Lys Met Ser Ser Val Thr Ala Ala Asp Thr Ala Met Tyr Asn Cys Ala
85 90 95
Ser Tyr Asp Gly Tyr Tyr Gly Trp Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Val
115
<210> 76
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<400> 76
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Tyr Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Phe Cys Gln Gln Gly His Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 77
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<400> 77
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Tyr Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gly Ala Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Phe Cys Gln Gln Gly His Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 78
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<400> 78
Asp Ile Gln Met Thr Gln Ser Thr Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Tyr Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gly Ala Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly His Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 79
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<400> 79
Gln Val Gln Leu Lys Gln Ser Gly Pro Gly Leu Val Gln Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Gly Val Leu Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Ser Gly Gly Ser Thr Asp Tyr Asn Ala Ala Phe Ile
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Gln Val Phe Phe
65 70 75 80
Lys Met Asn Ser Leu Gln Ala Asp Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Arg Glu Glu Phe Gly Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ala
<210> 80
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<400> 80
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Asn Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Thr Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 81
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<400> 81
Glu Val Gln Leu Gln Gln Phe Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Asn Met Asp Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Asn Tyr Asp Ser Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Gly Asn Tyr Val Asp Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Leu Thr Val Ser Ser
115 120
<210> 82
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<400> 82
Asn Ile Val Met Thr Gln Ser Pro Lys Ser Met Ser Met Ser Val Gly
1 5 10 15
Glu Arg Val Thr Leu Ser Cys Lys Ala Ser Glu Asn Val Val Thr Tyr
20 25 30
Val Ser Trp Tyr Gln Gln Lys Pro Glu Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Ala Thr Asp Phe Thr Leu Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Asp Tyr His Cys Gly Gln Ser Tyr Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 83
<211> 122
<212> БЕЛОК
<213> Искусственная последовательность
<400> 83
Glu Val Gln Leu Gln Gln Ser Gly Thr Val Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Thr Ile Tyr Pro Gly Asn Ser Asp Thr Ser Asn Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Lys Leu Thr Ala Val Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Asn Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Thr Phe Tyr Tyr Arg Tyr Glu Asp Tyr Tyr Ala Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 84
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<400> 84
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Phe
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 85
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<400> 85
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Gly Val His Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Ala Gly Gly Asn Thr Asn Tyr Asn Ser Ala Leu Met
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Asn Cys Ala
85 90 95
Ser Tyr Asp Gly Tyr Tyr Gly Trp Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Val
115
<210> 86
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<400> 86
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Tyr Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly His Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА ПРОТИВ TNFRSF9 И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2812200C2 |
| АНТИТЕЛА ПРОТИВ CD40 И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2796413C2 |
| АНТИТЕЛА ПРОТИВ CTLA4 И ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2779312C2 |
| Антитело против FXI/FXIA, его антигенсвязывающий фрагмент и фармацевтическое применение | 2021 |
|
RU2838408C1 |
| МОЛЕКУЛЫ АНТИТЕЛ, КОТОРЫЕ СВЯЗЫВАЮТ CD137 И OX40 | 2019 |
|
RU2817602C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, СПЕЦИФИЧЕСКИЕ В ОТНОШЕНИИ КОСТИМУЛЯТОРНОГО TNF-РЕЦЕПТОРА | 2016 |
|
RU2761115C1 |
| АНТИТЕЛА К CD38 И КОМБИНАЦИИ С АНТИТЕЛАМИ К CD3 И CD28 | 2018 |
|
RU2812910C2 |
| БИСПЕЦИФИЧЕСКИЕ 2+1 КОНТОРСТЕЛА | 2018 |
|
RU2797305C2 |
| Антитело против PD-1 и его применение | 2017 |
|
RU2739610C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ АНТИТЕЛА К PD-L1 И ЕЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2766590C2 |

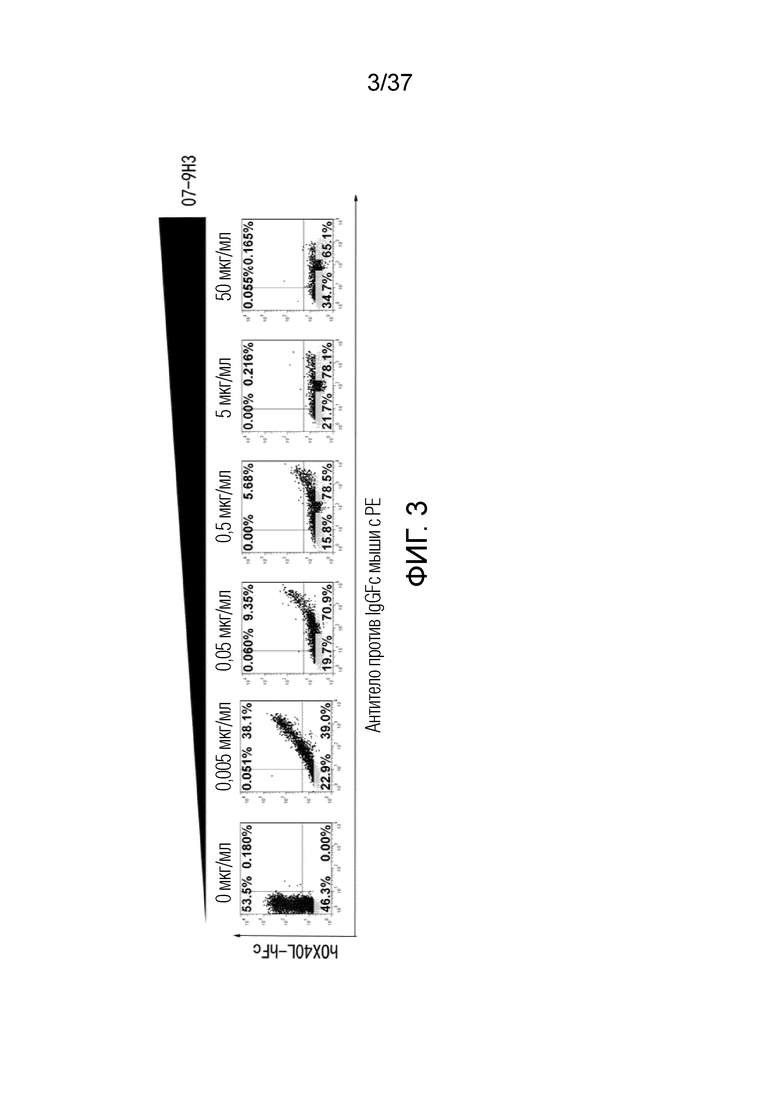
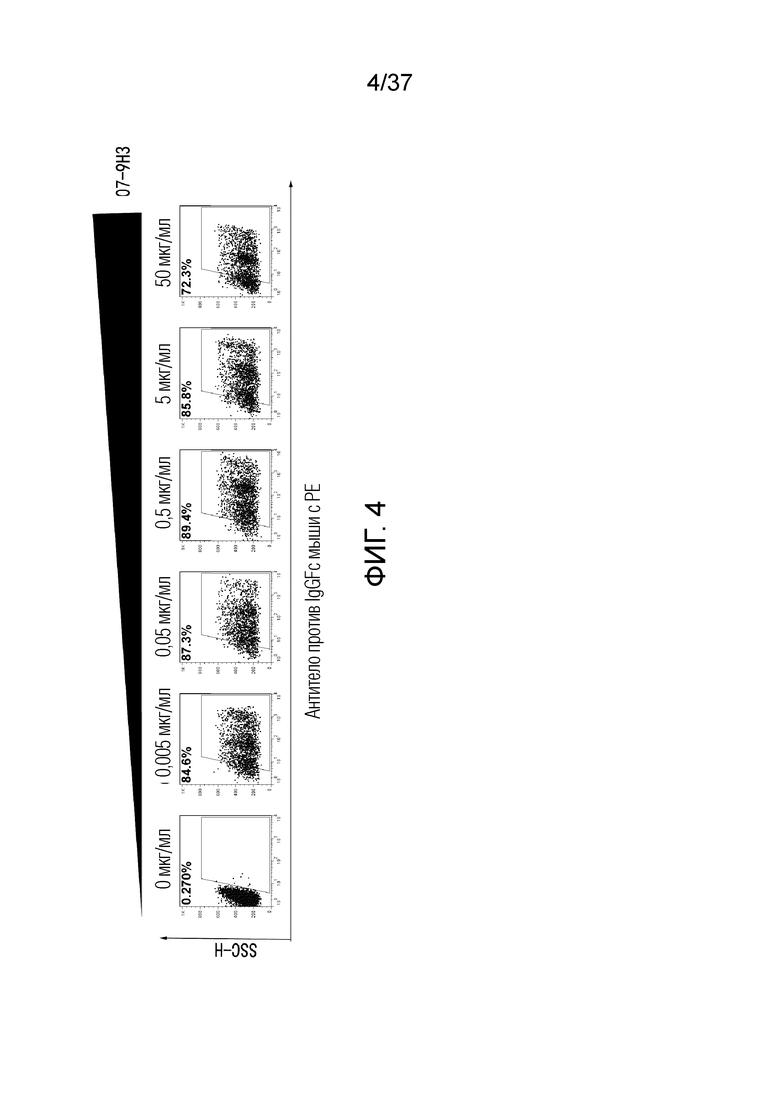
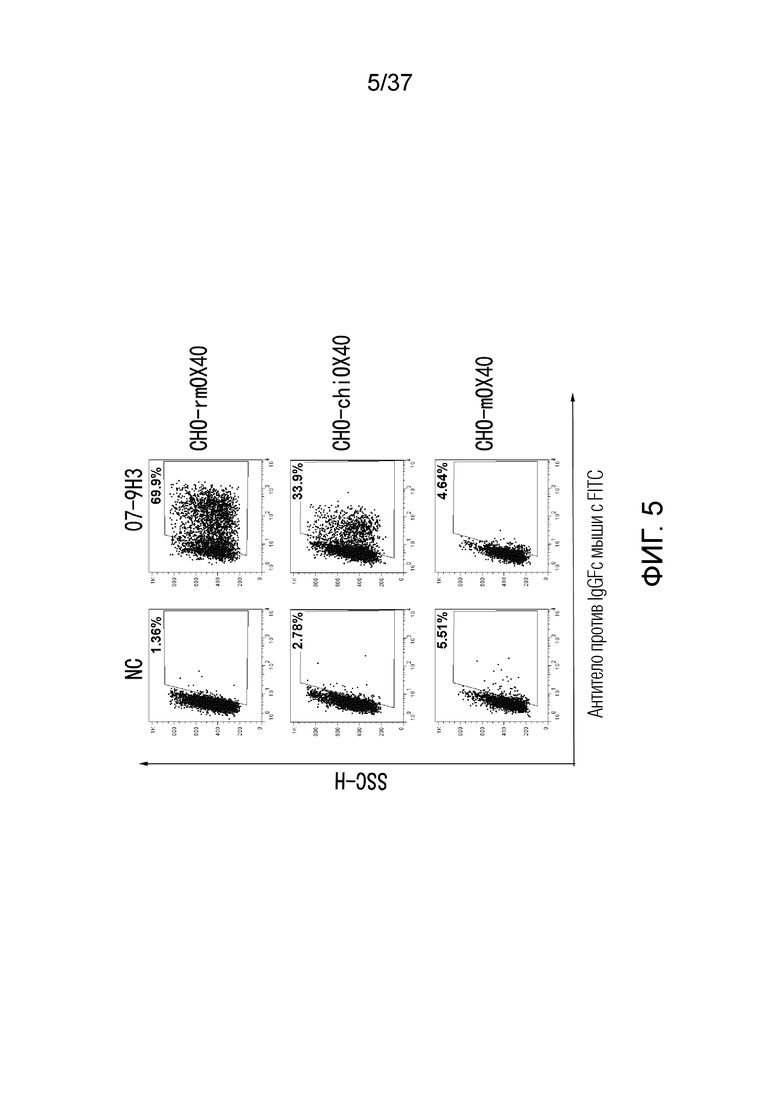
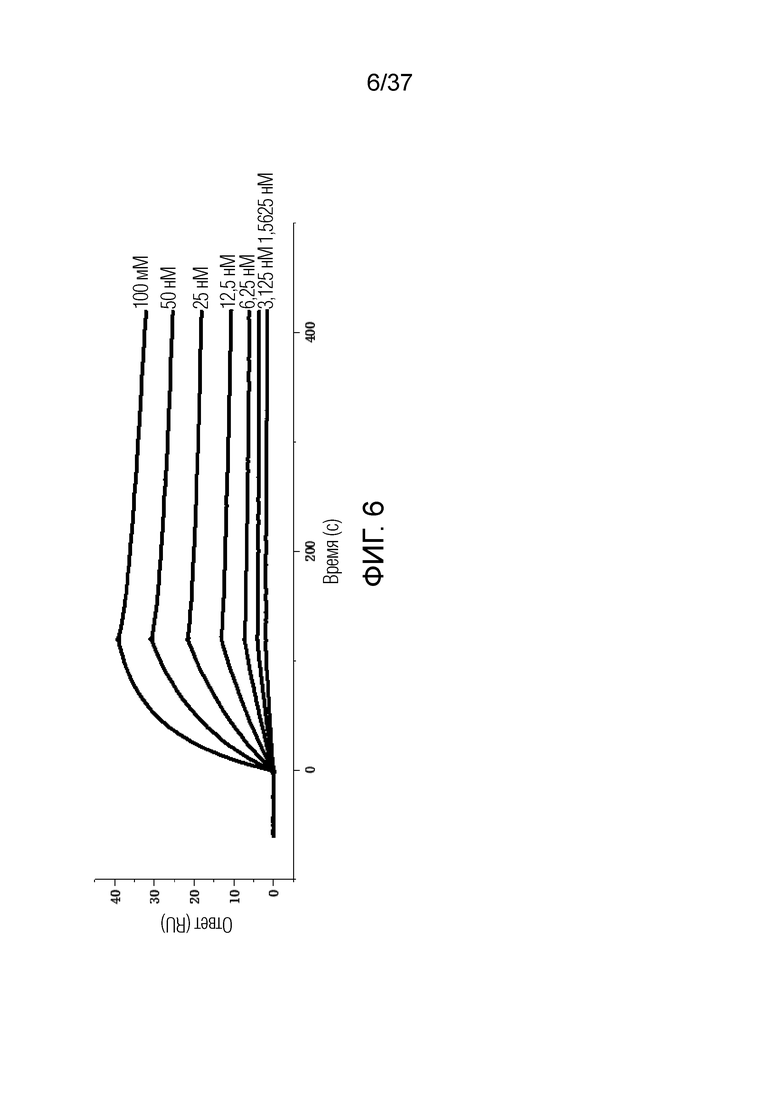
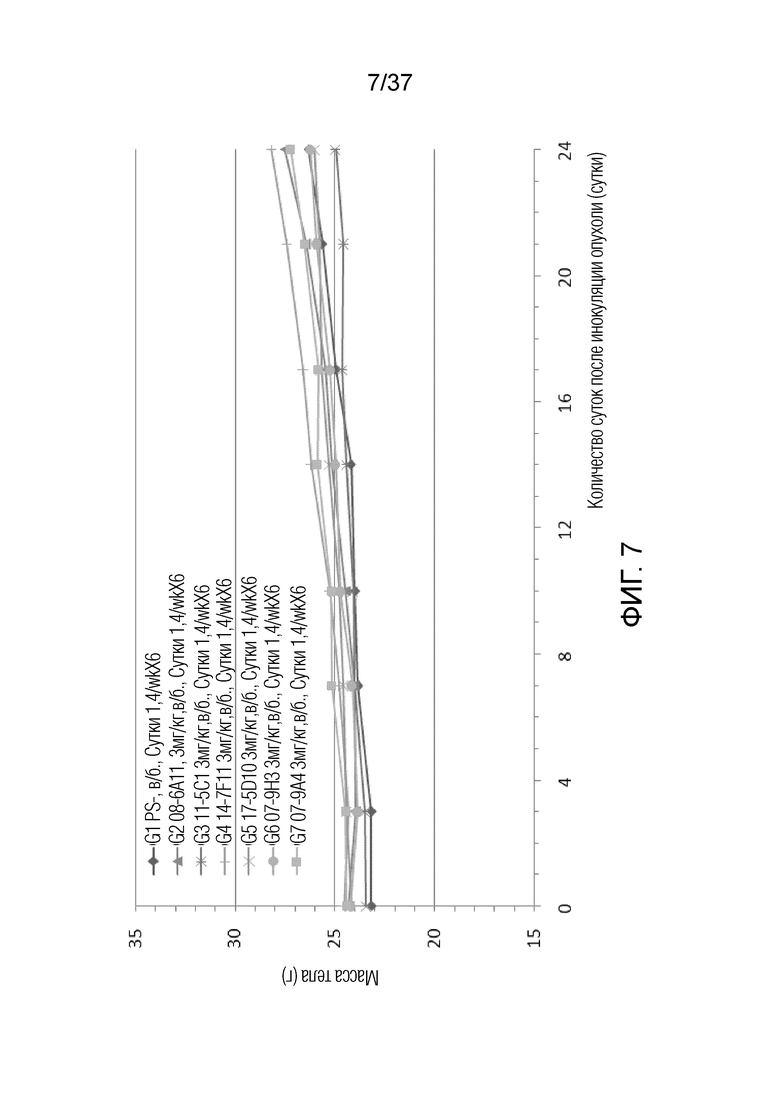
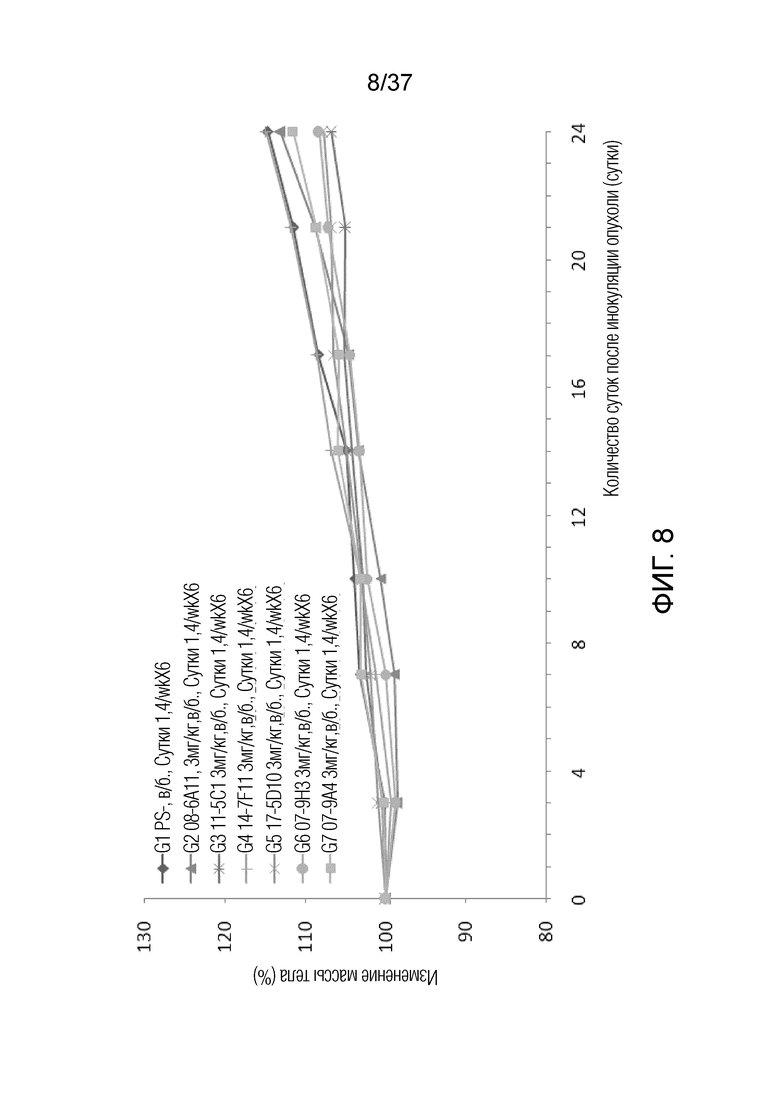

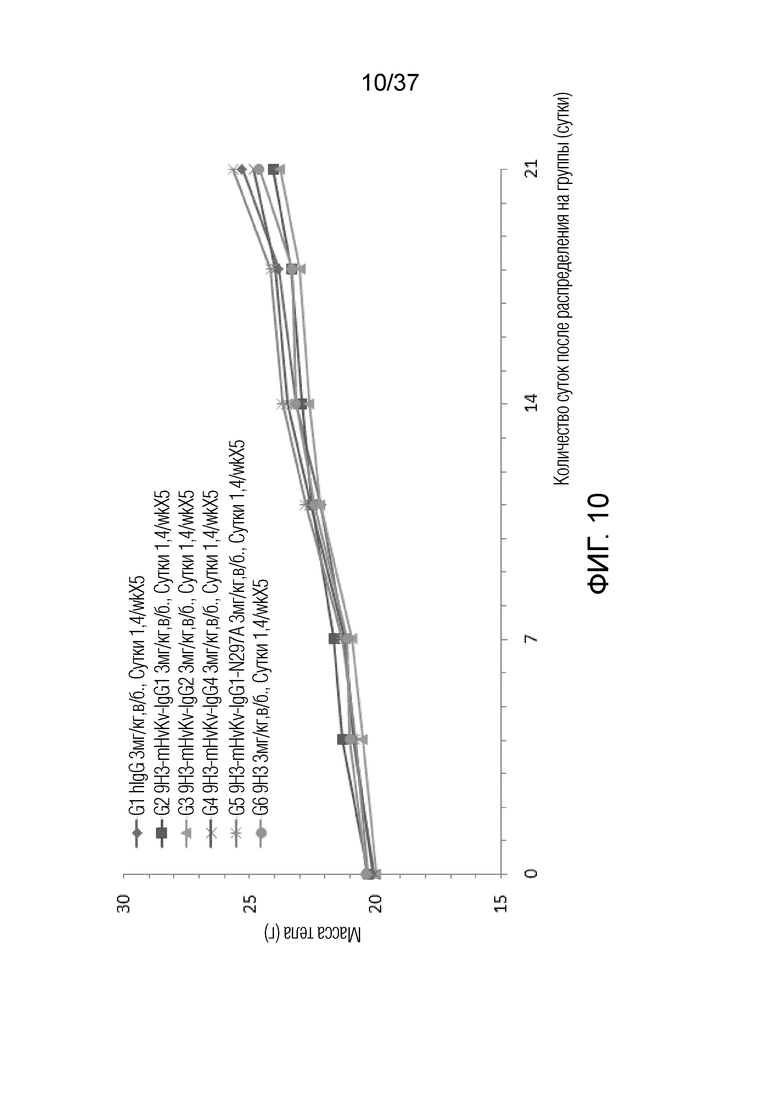

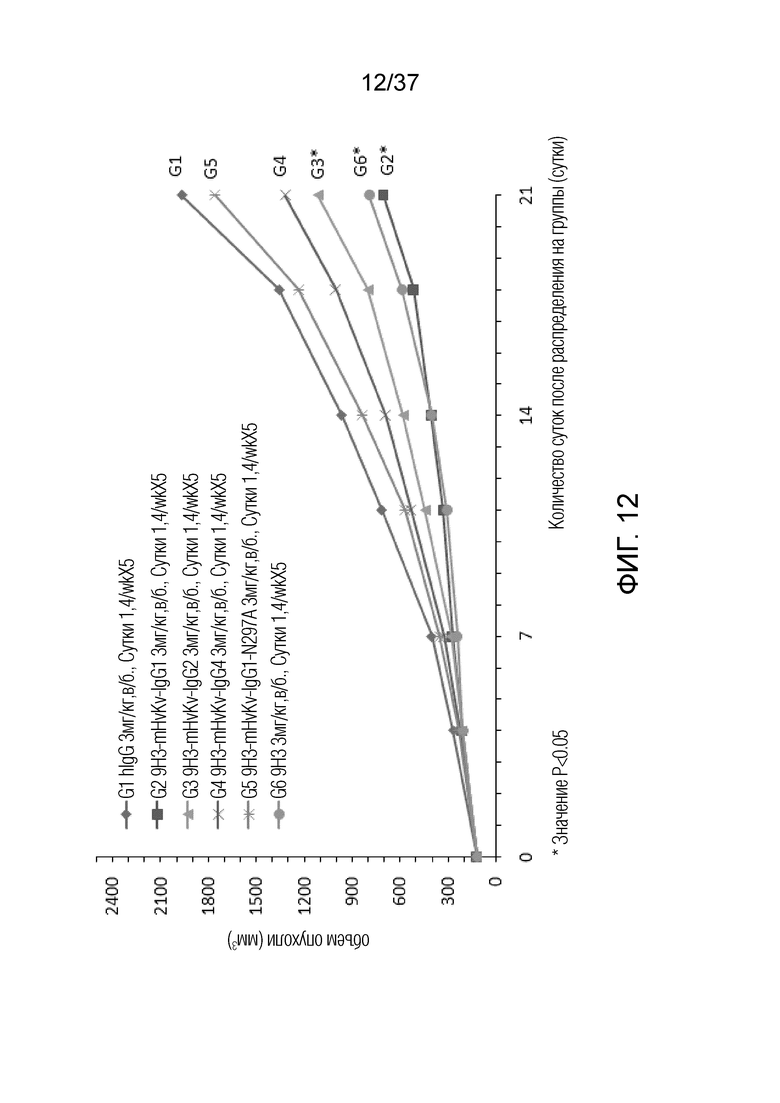
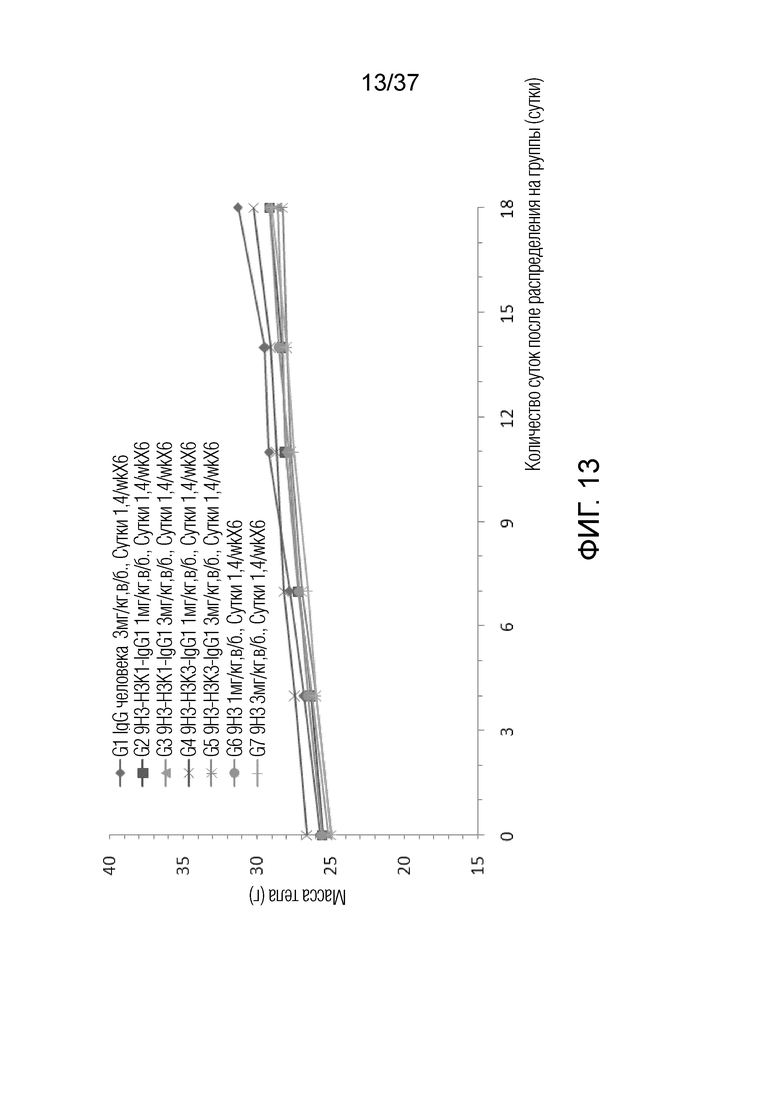
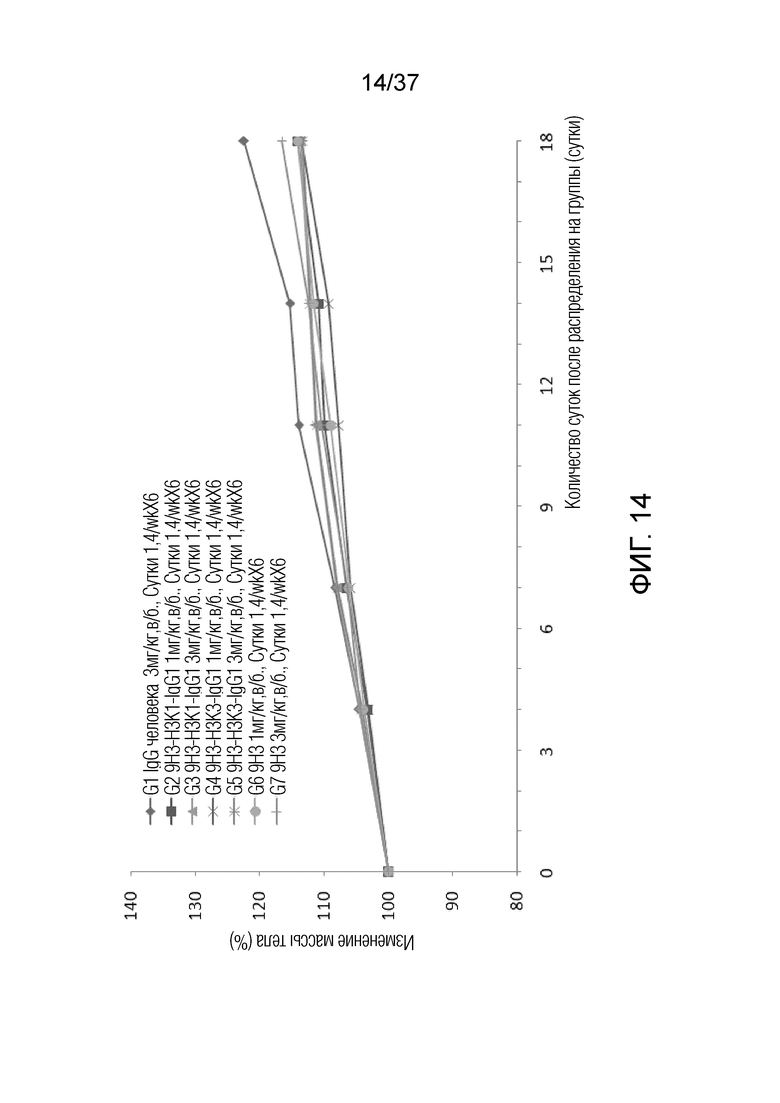
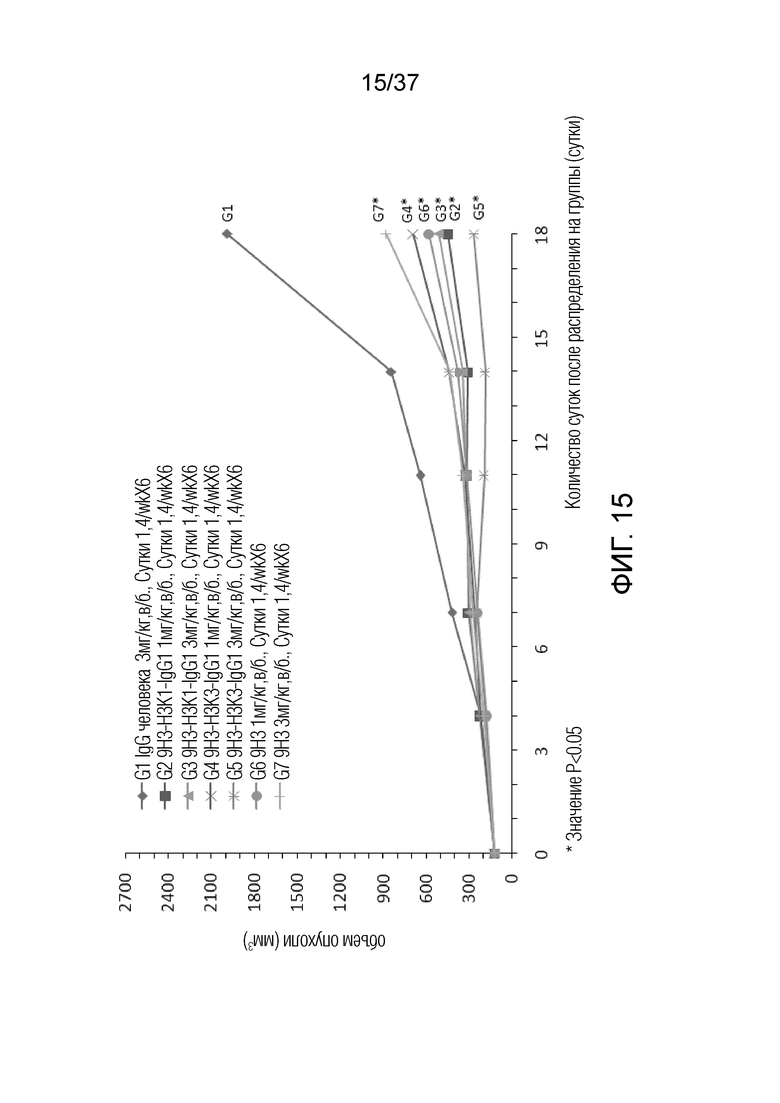
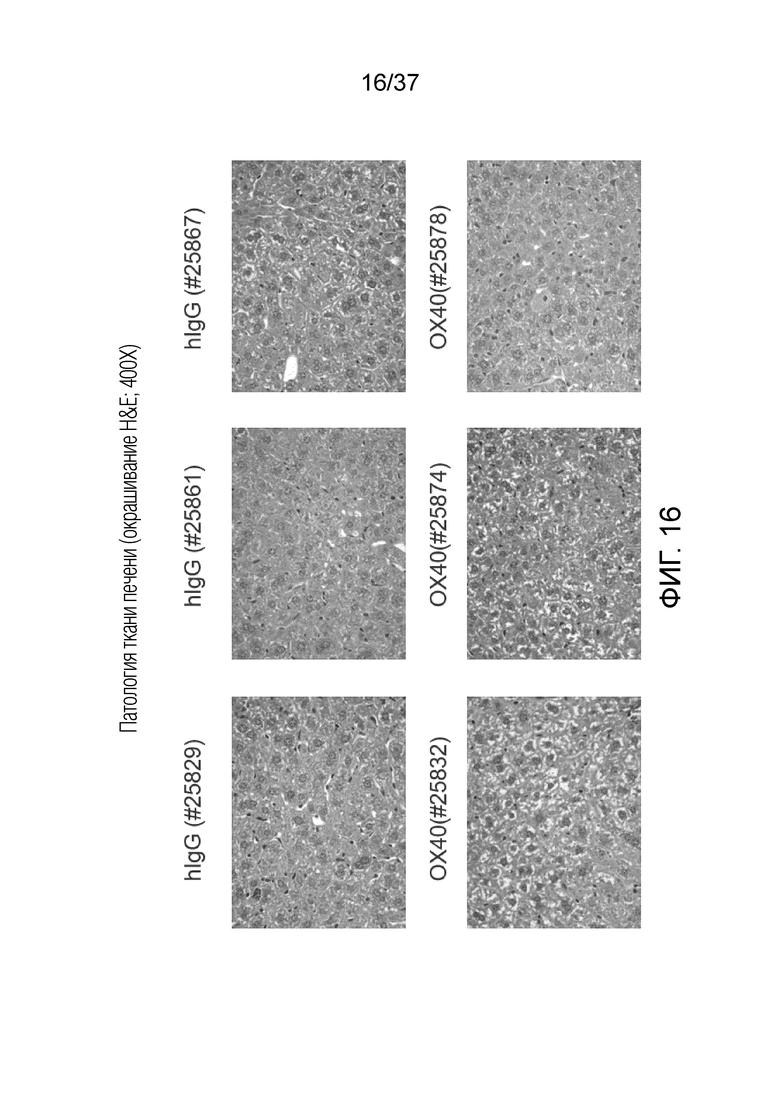
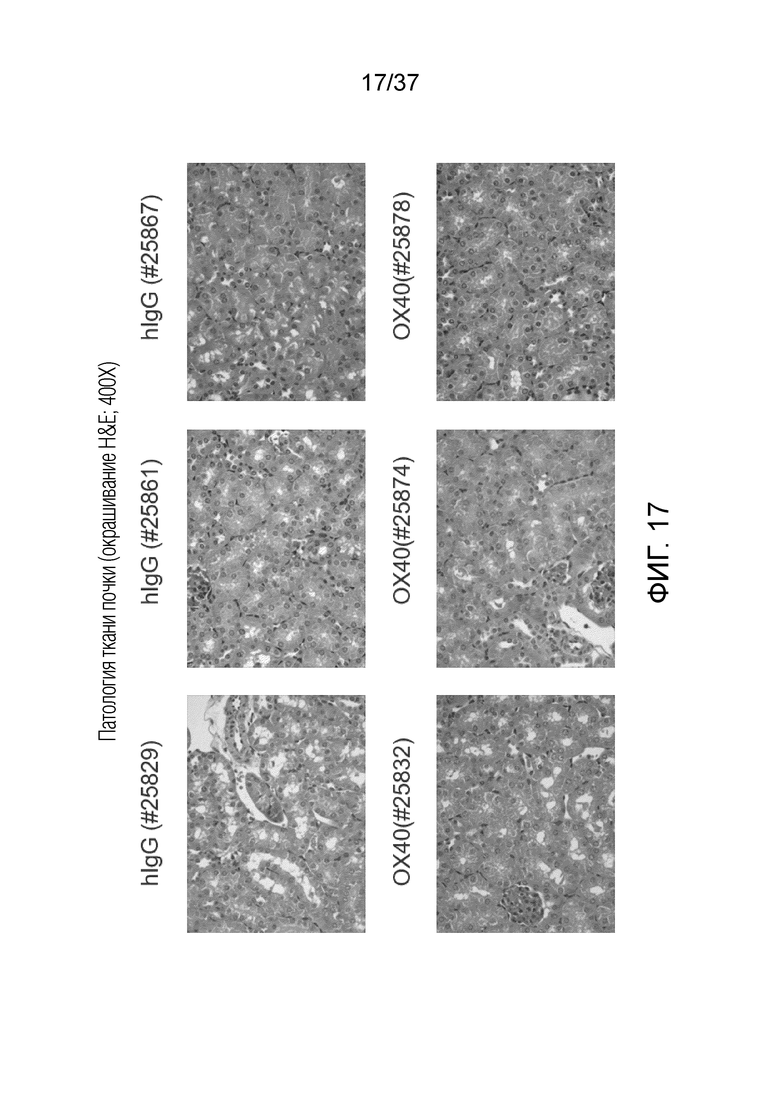
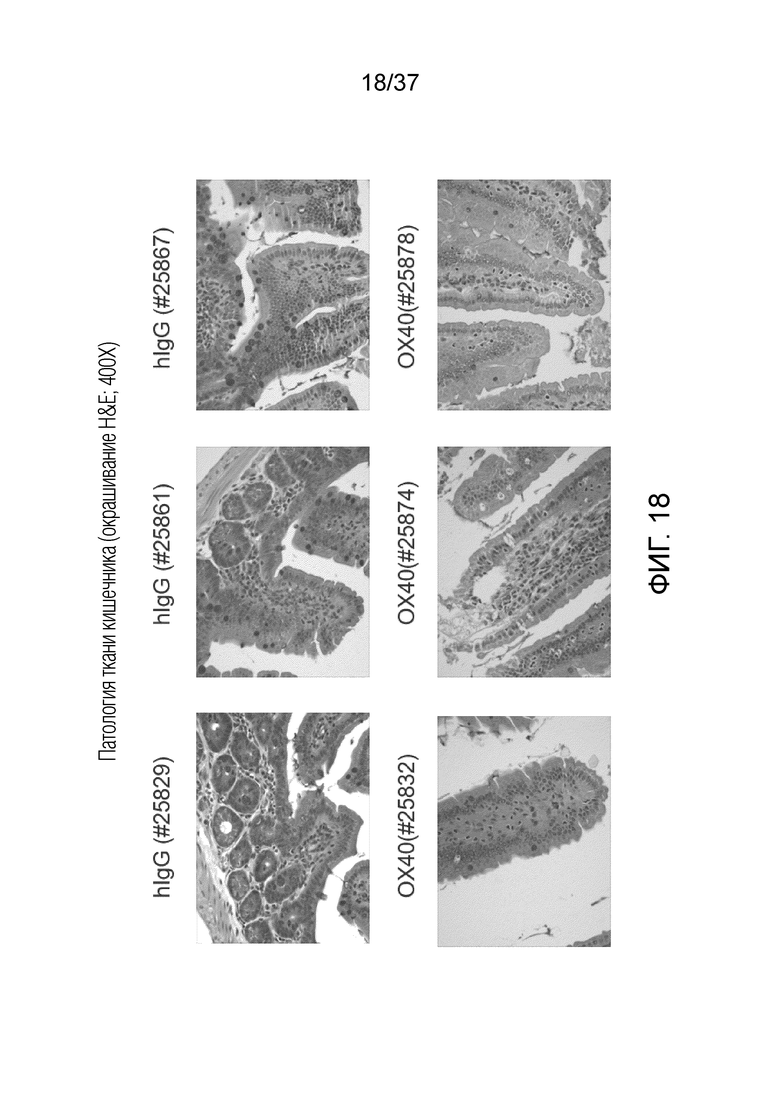
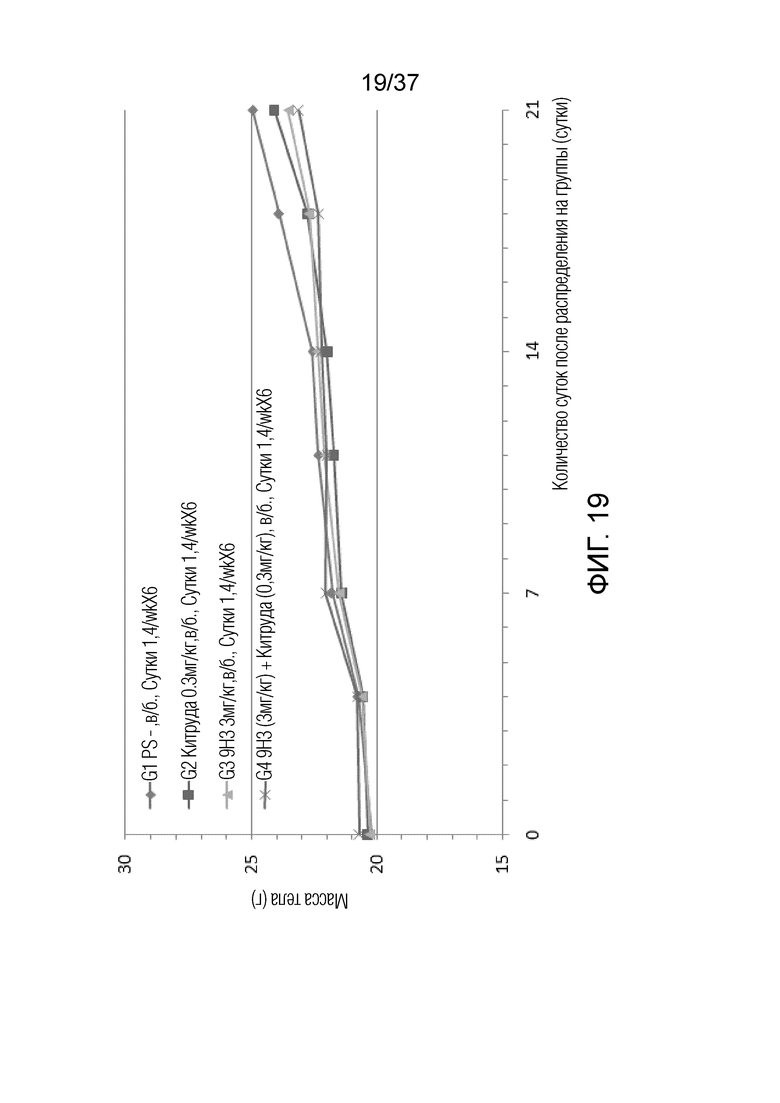

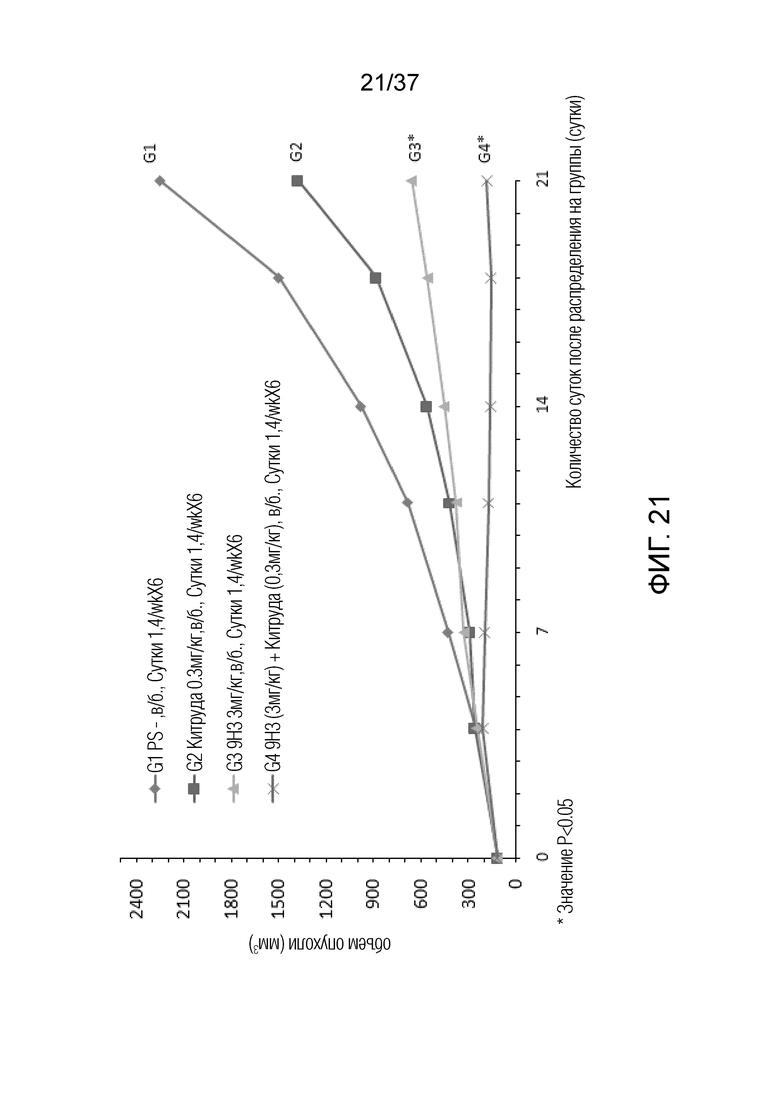
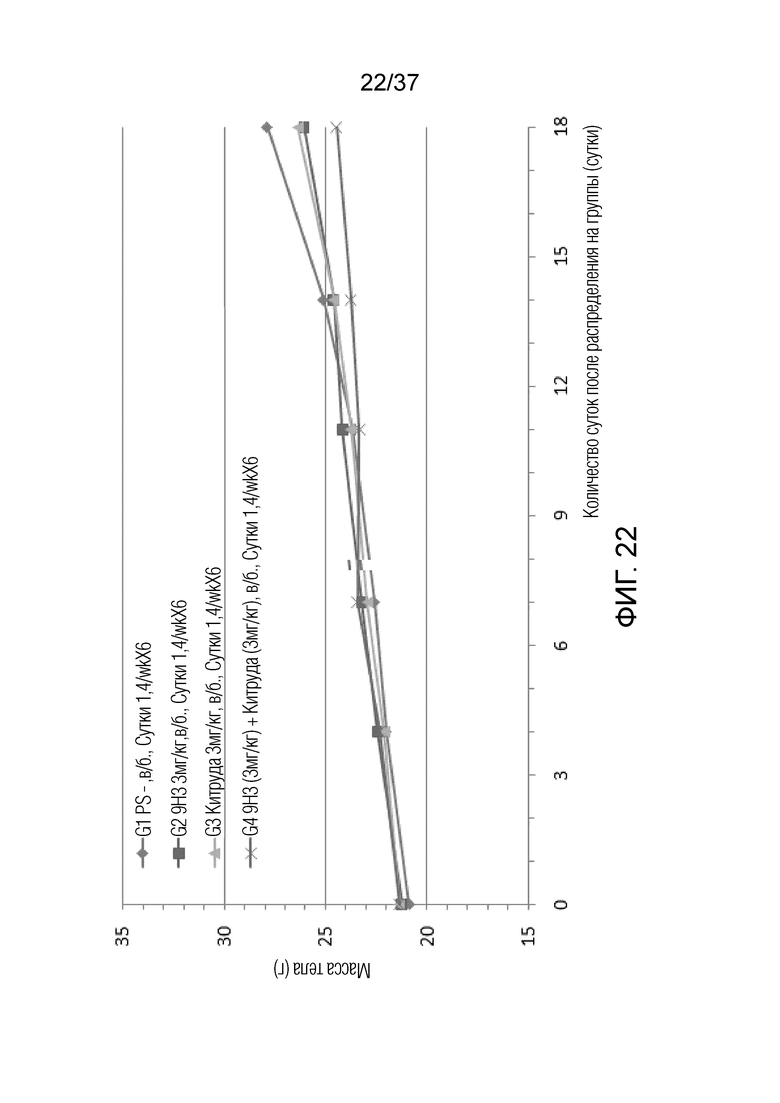
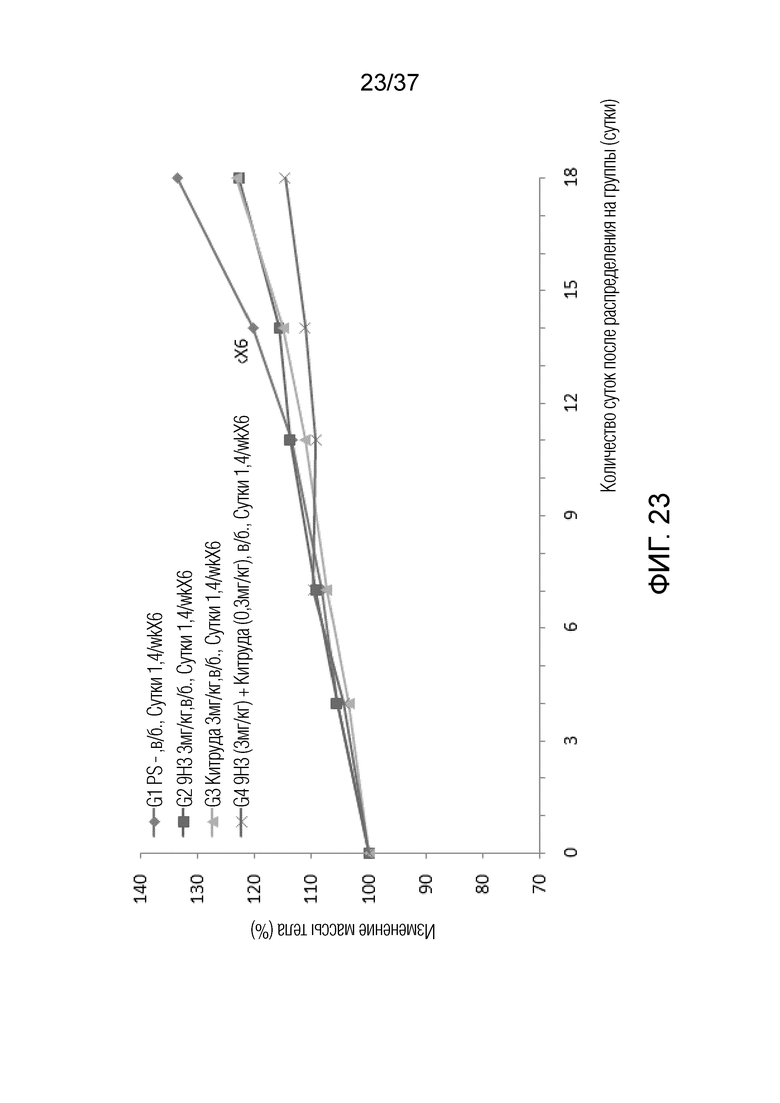
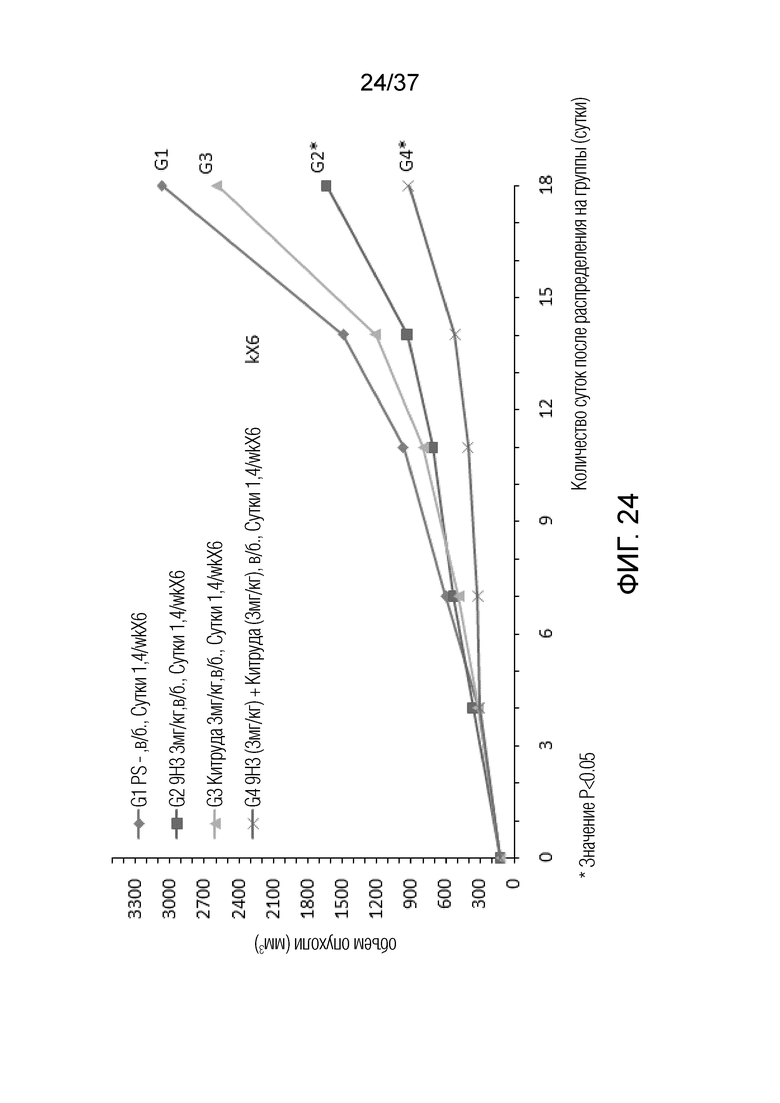
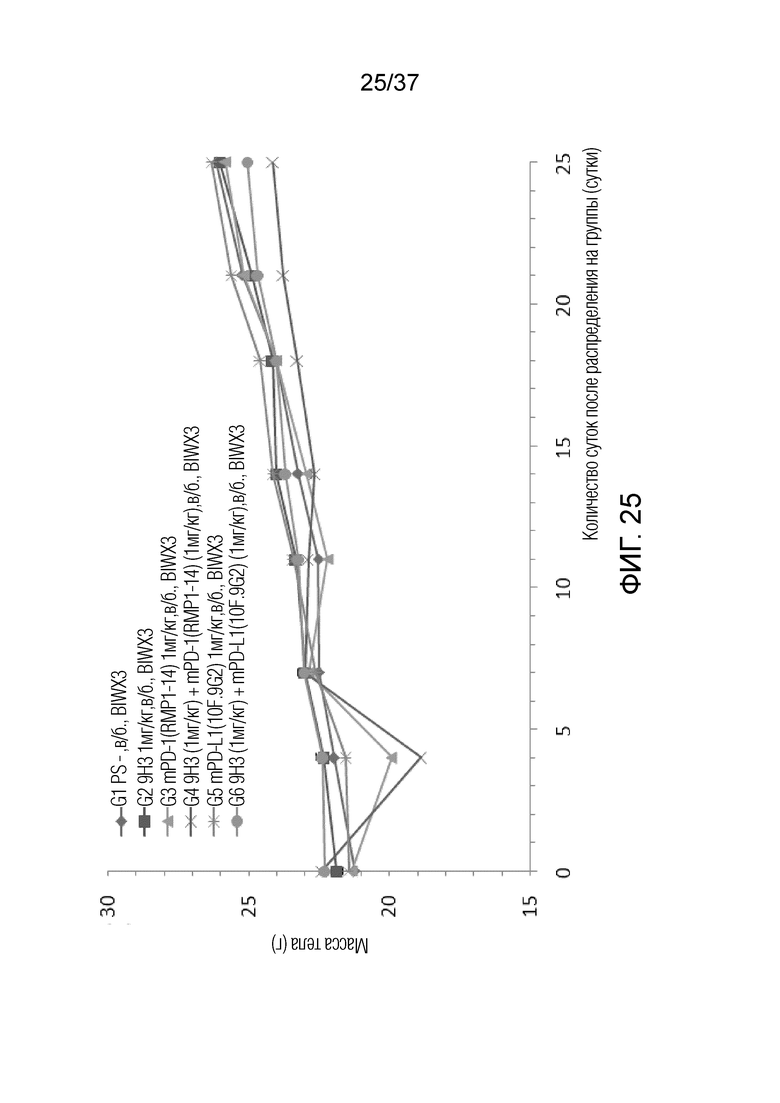
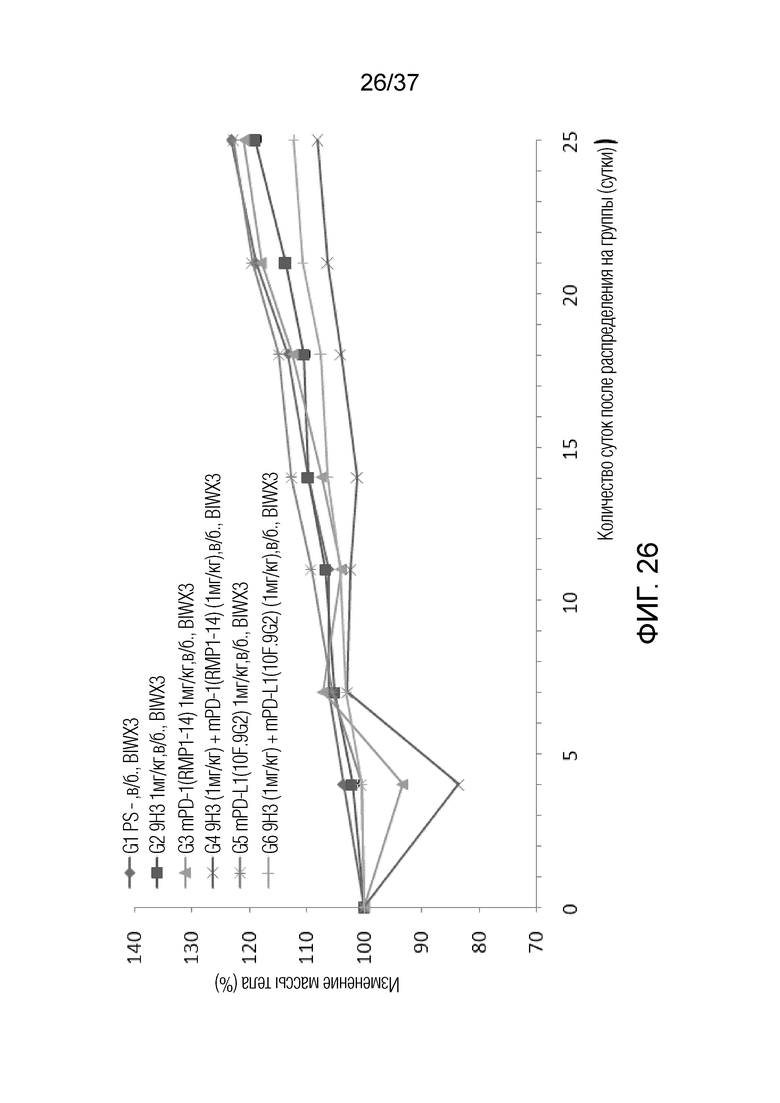
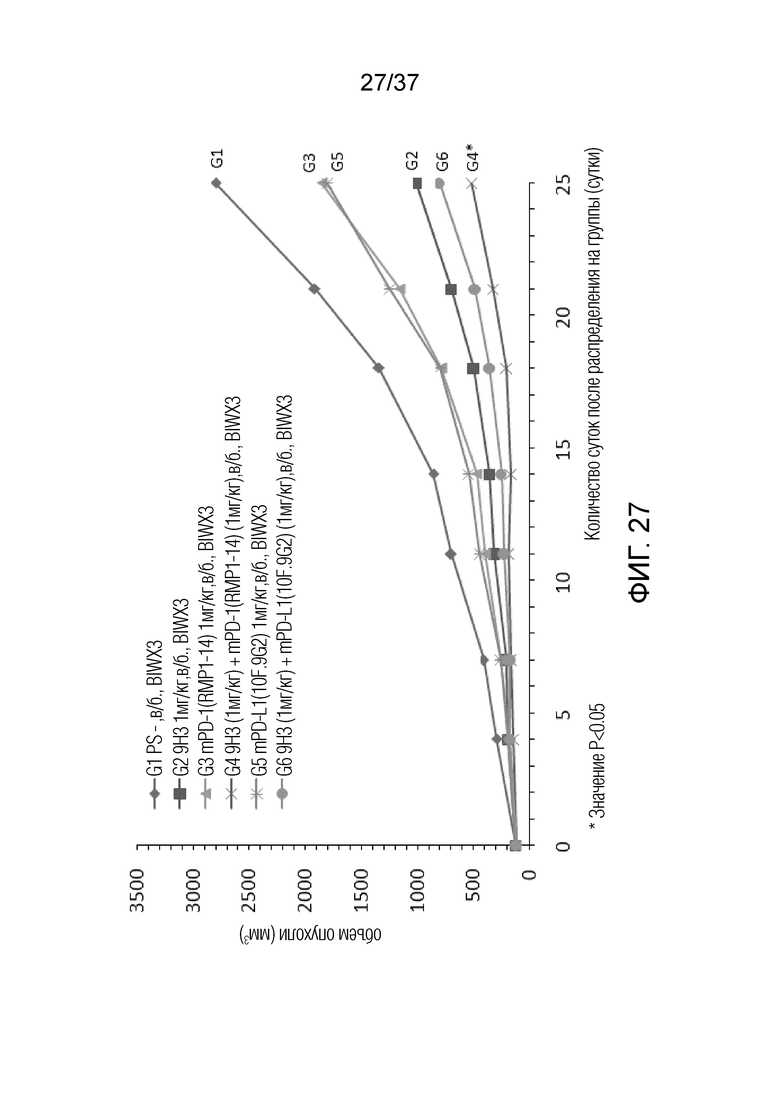

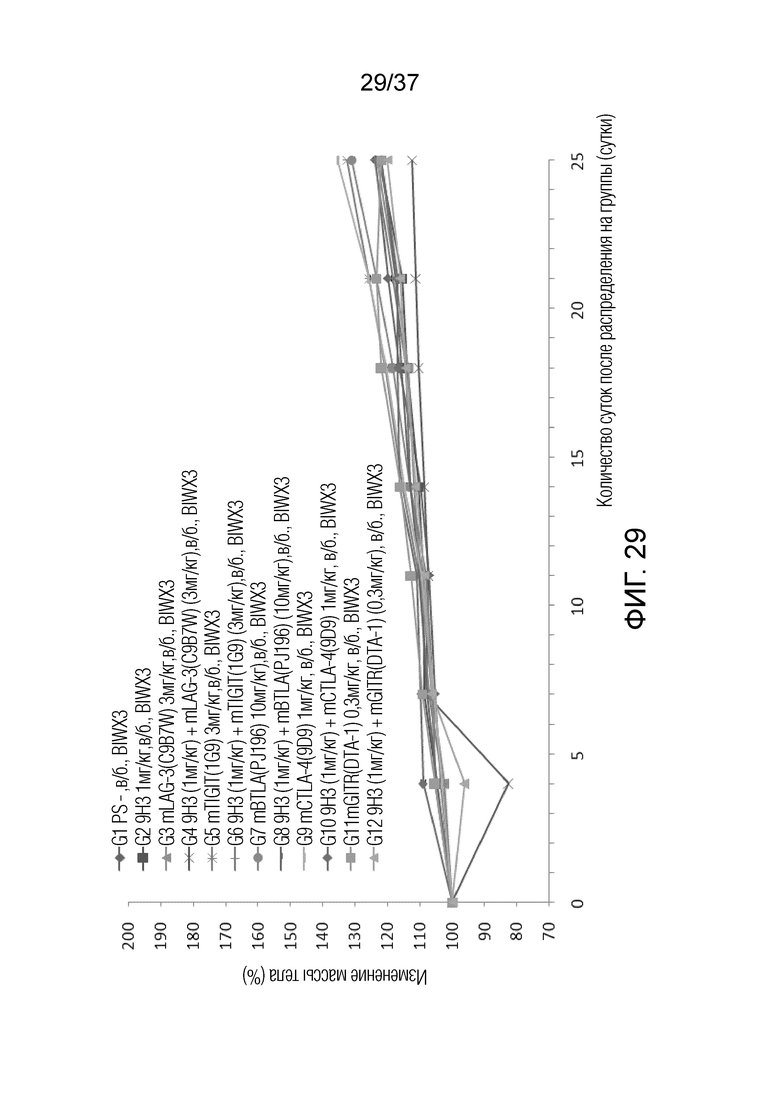
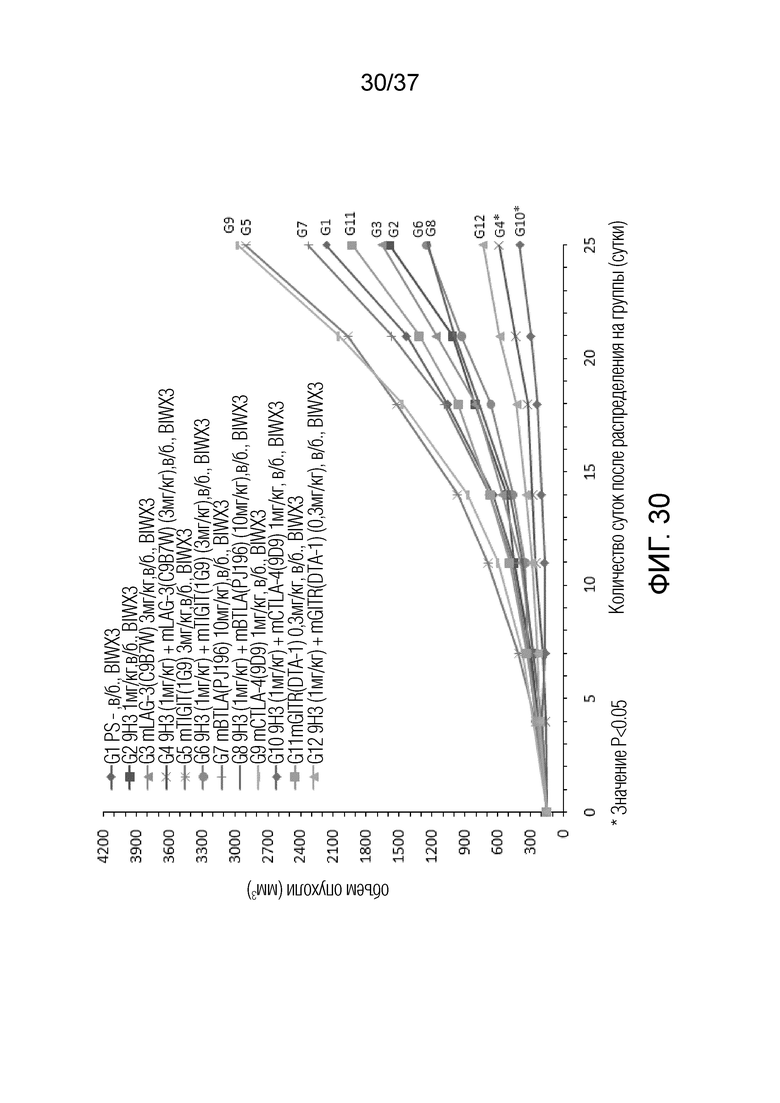
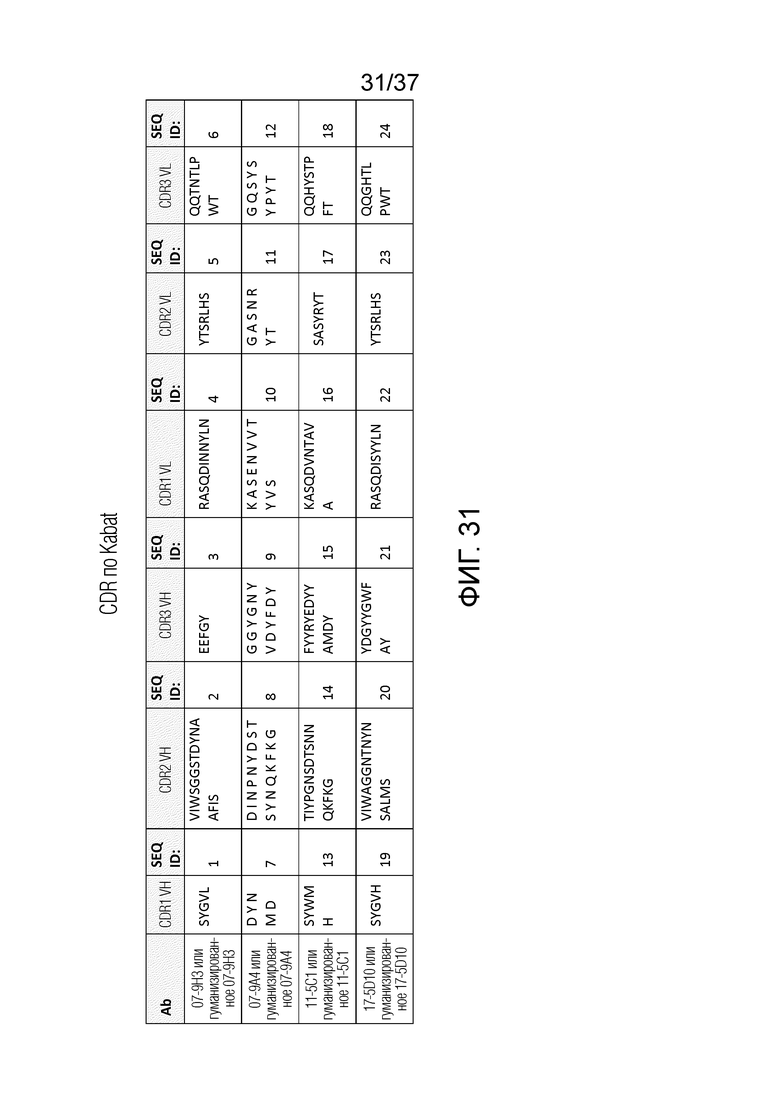
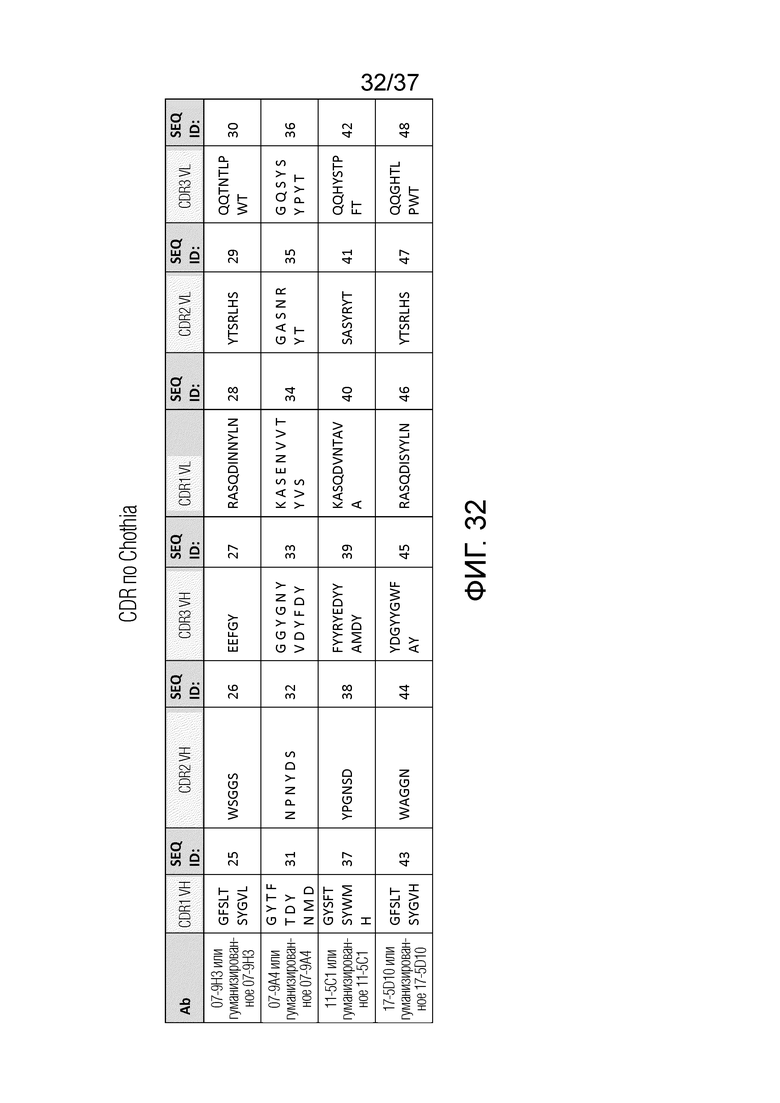
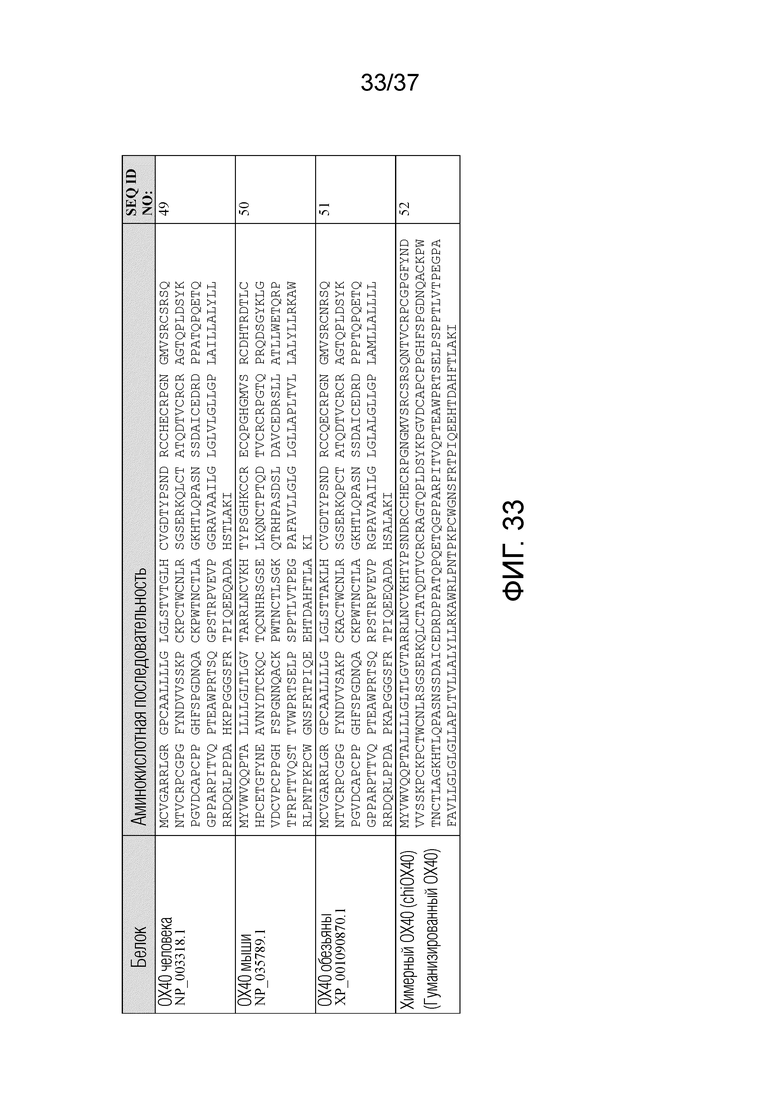
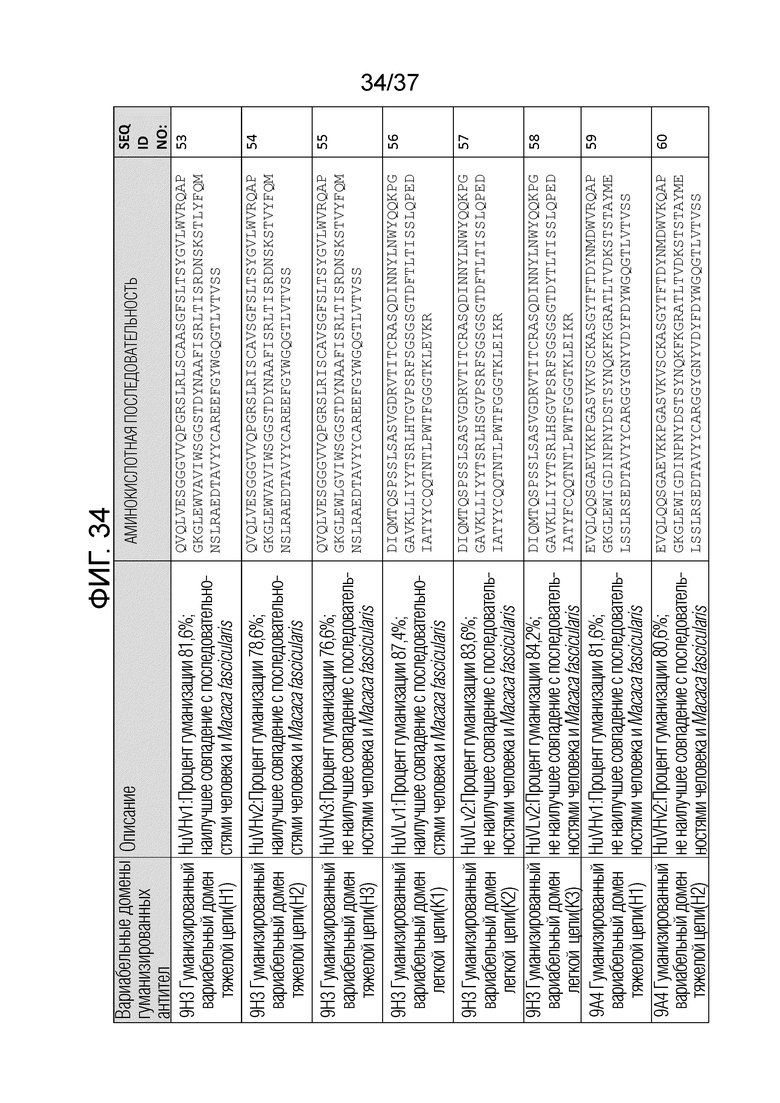
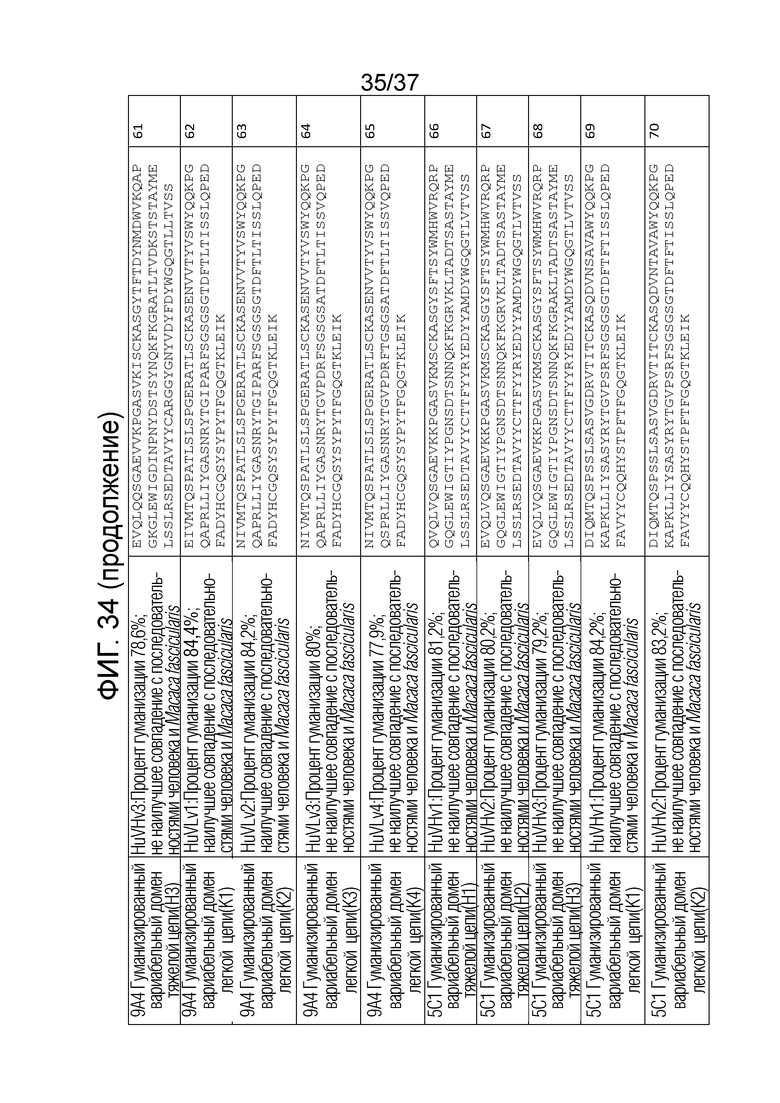


Изобретение относится к области биохимии, в частности к антителу или его антигенсвязывающему фрагменту, которое связывается с OX40, способу его получения, а также к содержащему его конъюгату и композиции. Также раскрыта нуклеиновая кислота, кодирующая цепи антитела или его антигенсвязывающего фрагмента, которое связывается с OX40, а также содержащий ее вектор и клетка. Изобретение также относится к применению вышеуказанного антитела или его антигенсвязывающего фрагмента для получения биспецифического антитела. Изобретение позволяет эффективно осуществлять лечение индивидуума, имеющего злокачественную опухоль. 19 н. и 45 з.п. ф-лы, 35 ил., 16 табл., 13 пр.
1. Антитело или его антигенсвязывающий фрагмент, которое связывается с OX40 (представитель 4 суперсемейства рецепторов TNF), содержащий:
вариабельную область тяжелой цепи (VH), содержащую определяющие комплементарность области (CDR) 1, 2 и 3, где область CDR1 VH содержит аминокислотную последовательность, которая идентична выбранной аминокислотной последовательности CDR1 VH, область CDR2 VH содержит аминокислотную последовательность, которая идентична выбранной аминокислотной последовательности CDR2 VH, и область CDR3 VH содержит аминокислотную последовательность, которая идентична выбранной аминокислотной последовательности VH CDR3; и
вариабельную область легкой цепи (VL), содержащую CDR 1, 2 и 3, где область CDR1 VL содержит аминокислотную последовательность, которая идентична выбранной аминокислотной последовательности CDR1 VL, область CDR2 VL содержит аминокислотную последовательность, которая идентична выбранной аминокислотной последовательности CDR2 VL, и область CDR3 VL содержит аминокислотную последовательность, которая идентична выбранной аминокислотной последовательности CDR3 VL,
где выбранные аминокислотные последовательности CDR 1, 2 и 3 VH и выбранные аминокислотные последовательности CDR 1, 2 и 3 VL являются одними из следующих:
(1) выбранные аминокислотные последовательности CDR 1, 2, 3 VH указаны в SEQ ID NO:1, 2, 3, соответственно, и выбранные аминокислотные последовательности CDR 1, 2, 3 VL указаны в SEQ ID NO:4, 5, 6, соответственно;
(2) выбранные аминокислотные последовательности CDR 1, 2, 3 VH указаны в SEQ ID NO:25, 26, 27, соответственно, и выбранные аминокислотные последовательности CDR 1, 2, 3 VL указаны в SEQ ID NO:28, 29, 30, соответственно;
(3) выбранные аминокислотные последовательности CDR 1, 2, 3 VH указаны в SEQ ID NO:7, 8, 9, соответственно, и выбранные аминокислотные последовательности CDR 1, 2, 3 VL указаны в SEQ ID NO:10, 11, 12, соответственно;
(4) выбранные аминокислотные последовательности CDR 1, 2, 3 VH указаны в SEQ ID NO:31, 32, 33, соответственно, и выбранные аминокислотные последовательности CDR 1, 2, 3 VL указаны в SEQ ID NO:34, 35, 36, соответственно;
(5) выбранные аминокислотные последовательности CDR 1, 2, 3 VH указаны в SEQ ID NO:13, 14, 15, соответственно, и выбранные аминокислотные последовательности CDR 1, 2, 3 VL указаны в SEQ ID NO:16, 17, 18, соответственно;
(6) выбранные аминокислотные последовательности CDR 1, 2, 3 VH указаны в SEQ ID NO:37, 38, 39, соответственно, и выбранные аминокислотные последовательности CDR 1, 2, 3 VL указаны в SEQ ID NO:40, 41, 42, соответственно;
(7) выбранные аминокислотные последовательности CDR 1, 2, 3 VH указаны в SEQ ID NO:19, 20, 21, соответственно, и выбранные аминокислотные последовательности CDR 1, 2, 3 VL указаны в SEQ ID NO:22, 23, 24, соответственно; и
(8) выбранные аминокислотные последовательности CDR 1, 2, 3 VH указаны в SEQ ID NO:43, 44, 45, соответственно, и выбранные аминокислотные последовательности CDR 1, 2, 3 VL указаны в SEQ ID NO:46, 47, 48, соответственно.
2. Антитело или его антигенсвязывающий фрагмент по п.1, где
VH содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO:1, 2 и 3, соответственно, и
VL содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO:4, 5 и 6, соответственно,
где VH CDR 1, 2, 3 и VL CDR 1, 2, 3 определены в соответствии с нумерацией Kabat.
3. Антитело или его антигенсвязывающий фрагмент по п.1, где
VH содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO:7, 8 и 9, соответственно, и
VL содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO:10, 11 и 12, соответственно,
где VH CDR 1, 2, 3 и VL CDR 1, 2, 3 определены в соответствии с нумерацией Kabat.
4. Антитело или его антигенсвязывающий фрагмент по п.1, где
VH содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO:13, 14 и 15, соответственно, и
VL содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO:16, 17 и 18, соответственно,
где VH CDR 1, 2, 3 и VL CDR 1, 2, 3 определены в соответствии с нумерацией Kabat.
5. Антитело или его антигенсвязывающий фрагмент по п.1, где
VH содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO:19, 20 и 21, соответственно, и
VL содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO:22, 23 и 24, соответственно,
где VH CDR 1, 2, 3 и VL CDR 1, 2, 3 определены в соответствии с нумерацией Kabat.
6. Антитело или его антигенсвязывающий фрагмент по п.1, где
VH содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO:25, 26 и 27, соответственно, и
VL содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO:28, 29 и 30, соответственно,
где VH CDR 1, 2, 3 и VL CDR 1, 2, 3 определены в соответствии с нумерацией Chothia.
7. Антитело или его антигенсвязывающий фрагмент по п.1, где
VH содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO:31, 32 и 33, соответственно, и
VL содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO:34, 35 и 36, соответственно,
где VH CDR 1, 2, 3 и VL CDR 1, 2, 3 определены в соответствии с нумерацией Chothia.
8. Антитело или его антигенсвязывающий фрагмент по п.1, где
VH содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO:37, 38 и 39, соответственно, и
VL содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO:40, 41 и 42, соответственно,
где VH CDR 1, 2, 3 и VL CDR 1, 2, 3 определены в соответствии с нумерацией Chothia.
9. Антитело или его антигенсвязывающий фрагмент по п.1, где
VH содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO:43, 44 и 45, соответственно, и
VL содержит CDR 1, 2, 3 с аминокислотными последовательностями SEQ ID NO:46, 47 и 48, соответственно,
где VH CDR 1, 2, 3 и VL CDR 1, 2, 3 определены в соответствии с нумерацией Chothia.
10. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-9, где антитело или антигенсвязывающий фрагмент специфически связывается с OX40 человека.
11. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-10, где антитело или антигенсвязывающий фрагмент представляет собой гуманизированное антитело или его антигенсвязывающий фрагмент.
12. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-11, которое отличается тем, что антигенсвязывающий фрагмент представляет собой одноцепочечный вариабельный фрагмент (scFV).
13. Применение антитела или его антигенсвязывающего фрагмента по любому из пп.1-12 для получения биспецифического антитела.
14. Нуклеиновая кислота для получения антитела или его антигенсвязывающего фрагмента, где нуклеиновая кислота кодирует:
(1) тяжелую цепь иммуноглобулина или ее фрагмент, содержащую VH CDR 1, 2 и 3, содержащие аминокислотные последовательности SEQ ID NO:1, 2 и 3, соответственно, и
где VH, когда она находится в паре с вариабельной областью легкой цепи (VL), содержащей аминокислотную последовательность SEQ ID NO:56, 57, 58 или 80, образует антитело или его антигенсвязывающий фрагмент, содержащий VH и VL, где антитело или его антигенсвязывающий фрагмент может связывать OX40;
(2) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности SEQ ID NO:4, 5 и 6, соответственно, и
где VL, когда она находится в паре с VH, содержащей аминокислотную последовательность SEQ ID NO:53, 54, 55 или 79, образует антитело или его антигенсвязывающий фрагмент, содержащий VH и VL, где антитело или его антигенсвязывающий фрагмент может связывать OX40;
(3) тяжелую цепь иммуноглобулина или ее фрагмент, содержащую VH CDR 1, 2 и 3, содержащие аминокислотные последовательности SEQ ID NO:7, 8 и 9, соответственно, и
где VH, когда она находится в паре с вариабельной областью легкой цепи (VL), содержащей аминокислотную последовательность SEQ ID NO:62, 63, 64, 65 или 82, образует антитело или его антигенсвязывающий фрагмент, содержащий VH и VL, где антитело или его антигенсвязывающий фрагмент может связывать OX40; или
(4) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности SEQ ID NO:10, 11 и 12, соответственно, и
где VL, когда она находится в паре с VH, содержащей аминокислотную последовательность SEQ ID NO:59, 60, 61 или 81, образует антитело или его антигенсвязывающий фрагмент, содержащий VH и VL, где антитело или его антигенсвязывающий фрагмент может связывать OX40;
(5) тяжелую цепь иммуноглобулина или ее фрагмент, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности SEQ ID NO:13, 14 и 15, соответственно, и
где VH, когда она находится в паре с вариабельной областью легкой цепи (VL), содержащей аминокислотную последовательность SEQ ID NO:69, 70, 71, 72 или 84, образует антитело или его антигенсвязывающий фрагмент, содержащий VH и VL, где антитело или его антигенсвязывающий фрагмент может связывать OX40;
(6) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности SEQ ID NO:16, 17 и 18, соответственно, и
где VL, когда она находится в паре с VH, содержащей аминокислотную последовательность SEQ ID NO:66, 67, 68 или 83, образует антитело или его антигенсвязывающий фрагмент, содержащий VH и VL, где антитело или его антигенсвязывающий фрагмент может связывать OX40;
(7) тяжелую цепь иммуноглобулина или ее фрагмент, содержащую VH CDR 1, 2 и 3, содержащие аминокислотные последовательности SEQ ID NO:19, 20 и 21, соответственно, и
где VH, когда она находится в паре с вариабельной областью легкой цепи (VL), содержащей аминокислотную последовательность SEQ ID NO:76, 77, 78 или 86, образует антитело или его антигенсвязывающий фрагмент, содержащий VH и VL, где антитело или его антигенсвязывающий фрагмент может связывать OX40; или
(8) легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности SEQ ID NO:22, 23 и 24, соответственно, и
где VL, когда она находится в паре с VH, содержащей аминокислотную последовательность SEQ ID NO:73, 74, 75 или 85, образует антитело или его антигенсвязывающий фрагмент, содержащий VH и VL, где антитело или его антигенсвязывающий фрагмент может связывать OX40.
15. Нуклеиновая кислота по п.14, где нуклеиновая кислота содержит полинуклеотид, кодирующий полипептид, содержащий тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VH, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности SEQ ID NO:1, 2 и 3, соответственно.
16. Нуклеиновая кислота по п.14, где нуклеиновая кислота содержит полинуклеотид, кодирующий полипептид, содержащий легкую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности SEQ ID NO:4, 5 и 6, соответственно.
17. Нуклеиновая кислота по п.14, где нуклеиновая кислота содержит полинуклеотид, кодирующий полипептид, содержащий легкую цепь иммуноглобулина или ее фрагмент, содержащие VH, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности SEQ ID NO:7, 8 и 9, соответственно.
18. Нуклеиновая кислота по п.14, где нуклеиновая кислота содержит полинуклеотид, кодирующий полипептид, содержащий тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности SEQ ID NO:10, 11 и 12, соответственно.
19. Нуклеиновая кислота по п.14, где нуклеиновая кислота содержит полинуклеотид, кодирующий полипептид, содержащий тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VH, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности SEQ ID NO:13, 14 и 15, соответственно.
20. Нуклеиновая кислота по п.14, где нуклеиновая кислота содержит полинуклеотид, кодирующий полипептид, содержащий тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности SEQ ID NO:16, 17 и 18, соответственно.
21. Нуклеиновая кислота по п.14, где нуклеиновая кислота содержит полинуклеотид, кодирующий полипептид, содержащий тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VH, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности SEQ ID NO:19, 20 и 21, соответственно.
22. Нуклеиновая кислота по п.14, где нуклеиновая кислота содержит полинуклеотид, кодирующий полипептид, содержащий тяжелую цепь иммуноглобулина или ее фрагмент, содержащие VL, содержащую CDR 1, 2 и 3, содержащие аминокислотные последовательности SEQ ID NO:22, 23 и 24, соответственно.
23. Нуклеиновая кислота по любому из пп.14-22, где
VH, когда она в паре с VL, образует антитело или его антигенсвязывающий фрагмент, содержащее VH и VL, где антитело или его антигенсвязывающий фрагмент может специфически связывается с OX40 человека, или
VL, когда она в паре с VH, образует антитело или его антигенсвязывающий фрагмент, содержащий VH и VL, где антитело или его антигенсвязывающий фрагмент может специфически связываться с OX40 человека.
24. Нуклеиновая кислота по любому из пп.14-23, где тяжелая цепь иммуноглобулина или ее фрагмент представляет собой гуманизированную тяжелую цепь антитела или ее фрагмент, и легкая цепь иммуноглобулина или ее фрагмент представляет собой гуманизированную легкую цепь иммуноглобулина или ее фрагмент.
25. Нуклеиновая кислота по любому из пп.14-24, где нуклеиновая кислота кодирует одноцепочечный вариабельный фрагмент (scFv).
26. Нуклеиновая кислота по любому из пп.14-25, где нуклеиновая кислота представляет собой кДНК.
27. Вектор экспрессии, содержащий одну или несколько нуклеиновых кислот по любому из пп.14-26.
28. Вектор экспрессии, содержащий две из нуклеиновых кислот по любому из пп.14-26, где две нуклеиновые кислоты кодируют область VL и область VH, образуя антитело или его антигенсвязывающий фрагмент, содержащее VH область и VL область, где антитело или его антигенсвязывающий фрагмент может связывать OX40.
29. Пара векторов для экспрессии анти-OX40 антитела или его антигенсвязывающего фрагмента,
где каждый вектор экспрессии содержит одну из нуклеиновых кислот по любому из пп.14-26,
где нуклеиновые кислоты кодируют область VL и область VH, образуя антитело или его антигенсвязывающий фрагмент, содержащее область VH и область VL, где антитело или его антигенсвязывающий фрагмент может связывать OX40.
30. Клетка для экспрессии анти-OX40 антитела или его антигенсвязывающего фрагмента, содержащая вектор экспрессии по п.27 или 28 или пару векторов экспрессии по п.29.
31. Клетка по п.30, где клетка представляет собой клетку CHO.
32. Клетка для экспрессии анти-ОХ40 антитела или его антигенсвязывающего фрагмента, содержащая одну или несколько нуклеиновых кислот по любому из пп.14-26.
33. Клетка для экспрессии анти-ОХ40 антитела или его антигенсвязывающего фрагмента, содержащая две из нуклеиновых кислот по любому из пп.14-26.
34. Клетка по п.33, где две нуклеиновые кислоты вместе кодируют область VL и область VH, образуя антитело или его антигенсвязывающий фрагмент, содержащее область VH и область VL, где антитело или его антигенсвязывающий фрагмент может связывать OX40.
35. Способ получения анти-OX40 антитела или его антигенсвязывающего фрагмента, где способ включает
(a) культивирование клетки по любому из пп.30-34 в условиях, достаточных для продуцирования клеткой антитела или антигенсвязывающего фрагмента; и
(b) сбор антитела или антигенсвязывающего фрагмента, продуцированного клеткой.
36. Антитело или его антигенсвязывающий фрагмент, которое связывается с OX40, содержащее
вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность, которая идентична выбранной последовательности VH, и вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность, которая идентична выбранной последовательности VL, где выбранная последовательность VH и выбранная последовательность VL представляют собой одну из следующих:
(1) выбранная последовательность VH представляет собой SEQ ID NO:53, 54, 55 или 79, и выбранная последовательность VL представляет собой SEQ ID NO:56, 57, 58 или 80;
(2) выбранная последовательность VH представляет собой SEQ ID NO:59, 60, 61 или 81, и выбранная последовательность VL представляет собой SEQ ID NO:62, 63, 64, 65 или 82;
(3) выбранная последовательность VH представляет собой SEQ ID NO:66, 67, 68 или 83, и выбранная последовательность VL представляет собой SEQ ID NO:69, 70, 71, 72 или 84; и
(4) выбранная последовательность VH представляет собой SEQ ID NO:73, 74, 75 или 85, и выбранная последовательность VL представляет собой SEQ ID NO:76, 77, 78 или 86.
37. Антитело или его антигенсвязывающий фрагмент по п.36, где VH содержит последовательность SEQ ID NO:53 и VL содержит последовательность SEQ ID NO:56.
38. Антитело или его антигенсвязывающий фрагмент по п.36, где VH содержит последовательность SEQ ID NO:53 и VL содержит последовательность SEQ ID NO:57.
39. Антитело или его антигенсвязывающий фрагмент по п.36, где VH содержит последовательность SEQ ID NO:53 и VL содержит последовательность SEQ ID NO:58.
40. Антитело или его антигенсвязывающий фрагмент по п.36, где VH содержит последовательность SEQ ID NO:54 и VL содержит последовательность SEQ ID NO:56.
41. Антитело или его антигенсвязывающий фрагмент по п.36, где VH содержит последовательность SEQ ID NO:54 и VL содержит последовательность SEQ ID NO:57.
42. Антитело или его антигенсвязывающий фрагмент по п.36, где VH содержит последовательность SEQ ID NO:54 и VL содержит последовательность SEQ ID NO:58.
43. Антитело или его антигенсвязывающий фрагмент по п.36, где VH содержит последовательность SEQ ID NO:55 и VL содержит последовательность SEQ ID NO:58.
44. Антитело или его антигенсвязывающий фрагмент по п.36, где VH содержит последовательность SEQ ID NO:55 и VL содержит последовательность SEQ ID NO:56.
45. Антитело или его антигенсвязывающий фрагмент по п.36, где VH содержит последовательность SEQ ID NO:55 и VL содержит последовательность SEQ ID NO:57.
46. Антитело или его антигенсвязывающий фрагмент по п.36, где VH содержит последовательность SEQ ID NO:59 и VL содержит последовательность SEQ ID NO:62.
47. Антитело или его антигенсвязывающий фрагмент по п.36, где VH содержит последовательность SEQ ID NO:59 и VL содержит последовательность SEQ ID NO:63.
48. Антитело или его антигенсвязывающий фрагмент по п.36, где VH содержит последовательность SEQ ID NO:66 и VL содержит последовательность SEQ ID NO:70.
49. Антитело или его антигенсвязывающий фрагмент по п.36, где VH содержит последовательность SEQ ID NO:67 и VL содержит последовательность SEQ ID NO:70.
50. Антитело или его антигенсвязывающий фрагмент по п.36, где VH содержит последовательность SEQ ID NO:73 и VL содержит последовательность SEQ ID NO:76.
51. Антитело или его антигенсвязывающий фрагмент по п.36, где VH содержит последовательность SEQ ID NO:73 и VL содержит последовательность SEQ ID NO:77.
52. Антитело или его антигенсвязывающий фрагмент по любому из пп.36-51, где антитело или антигенсвязывающий фрагмент специфически связывается с OX40 человека.
53. Антитело или его антигенсвязывающий фрагмент по любому из пп.36-52, где антитело или антигенсвязывающий фрагмент представляет собой гуманизированное антитело или его антигенсвязывающий фрагмент.
54. Антитело или его антигенсвязывающий фрагмент по любому из пп.36-53, отличающееся тем, что антигенсвязывающий фрагмент представляет собой одноцепочечный вариабельный фрагмент (scFv).
55. Применение антитела или его антигенсвязывающего фрагмента по любому из пп.36-54 для получения биспецифического антитела.
56. Конъюгат антитело-лекарственное средство для повышения иммунного ответа, содержащий антитело или его антигенсвязывающий фрагмент по любому из пп.1-12 и 36-54, ковалентно связанное с терапевтическим средством.
57. Конъюгат антитело-лекарственное средство по п.56, где терапевтическое средство представляет собой цитотоксическое или цитостатическое средство.
58. Способ лечения индивидуума, имеющего злокачественную опухоль, где способ включает введение терапевтически эффективного количества композиции, содержащей антитело или его антигенсвязывающий фрагмент по любому из пп.1-12 и 36-54 или конъюгат антитело-лекарственное средство по п.56 или 57, индивидууму.
59. Способ по п.58, где индивидуум имеет солидную опухоль, нерезектабельную меланому или метастазирующую меланому, рак молочной железы, карциноидную опухоль, рак шейки матки, рак эндометрия, глиому, рак головы и шеи, рак печени, рак легкого, лимфому, меланому, рак яичника, рак поджелудочной железы, рак предстательной железы, рак почки, рак ободочной и прямой кишки, рак желудка, рак яичка, рак щитовидной железы, рак мочевого пузыря, рак уретры, гематологическую злокачественную опухоль, немелкоклеточную карциному легких (NSCLC), мелкоклеточный рак легкого (SCLC), рак мочевого пузыря или метастазирующий рефрактерный к гормонам рак предстательной железы, плоскоклеточную карциному головы и шеи (SCCHN), почечноклеточный рак (RCC), тройной отрицательный рак молочной железы (TNBC), саркому или карциному ободочной и прямой кишки.
60. Способ снижения скорости роста опухоли, где способ включает
приведение опухолевой клетки в контакт с эффективным количеством композиции, содержащей антитело или его антигенсвязывающий фрагмент по любому из пп.1-12 и 36-54, или конъюгат антитело-лекарственное средство по п.56 или 57.
61. Способ уничтожения опухолевой клетки, где способ включает
приведение опухолевой клетки в контакт с эффективным количеством композиции, содержащей антитело или его антигенсвязывающий фрагмент по любому из пп.1-12 и 36-54, или конъюгат антитело-лекарственное средство по п.56 или 57.
62. Фармацевтическая композиция для повышения иммунного ответа, содержащая эффективное количество антитела или его антигенсвязывающего фрагмента по любому из пп.1-12 и 36-54 и фармацевтически приемлемый носитель.
63. Фармацевтическая композиция для повышения иммунного ответа, содержащая конъюгат антитело-лекарственное средство по п.56 или 57 и фармацевтически приемлемый носитель.
64. Анти-OX40 антитело или его антигенсвязывающий фрагмент, содержащее вариабельную область тяжелой цепи, содержащую VH CDR 1, 2, 3, и вариабельную область легкой цепи, содержащую VL CDR 1, 2, 3, где
(1) VH CDR 1, 2, 3 идентичны CDR в SEQ ID NO:53, 54, 55 или 79, и VL CDR 1, 2, 3 идентичны CDR в SEQ ID NO:56, 57, 58 или 80;
(2) VH CDR 1, 2, 3 идентичны CDR в SEQ ID NO:59, 60, 61 или 81, и VL CDR 1, 2, 3 идентичны CDR в SEQ ID NO:62, 63, 64, 65 или 82;
(3) VH CDR 1, 2, 3 идентичны CDR в SEQ ID NO:66, 67, 68 или 83, и VL CDR 1, 2, 3 идентичны CDR в SEQ ID NO:69, 70, 71, 72 или 84; или
(4) VH CDR 1, 2, 3 идентичны CDR в SEQ ID NO:73, 74, 75 или 85, и VL CDR 1, 2, 3 идентичны CDR в SEQ ID NO:76, 77, 78 или 86.
| WO 2017096182 A1, 08.06.2017 | |||
| WO 2007062245 A2, 31.05.2007 | |||
| WO 2017063162 A1, 20.04.2017 | |||
| WO 03059245 A2, 24.07.2003 | |||
| RU 2008129111 A, 27.01.2010. |
Авторы
Даты
2022-11-11—Публикация
2017-11-24—Подача