Настоящее изобретение относится к аминопроизводным 4,6 (5,7)-диарилзамещенных пиримидинов и [1,2,4]триазоло[1,5-a]пиримидинов, которые могут быть использованы в качестве ингибиторов высвобождения медиаторов воспаления для лечения больных раком, нейродегенеративными заболеваниями, туберкулезом, COVID-19, сахарным диабетом 2-го типа и другими заболеваниями, обусловленными повышенной активностью иммунных клеток.
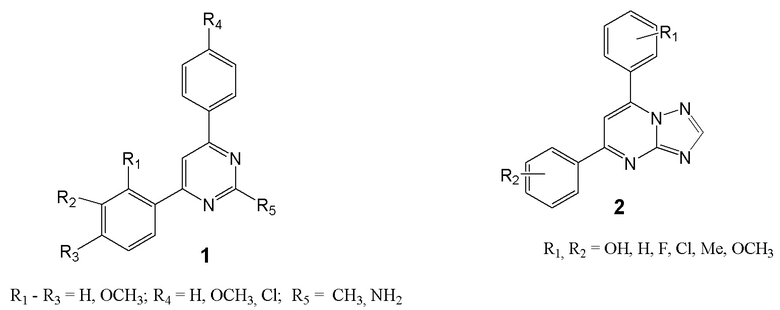
Заявляемые в качестве ингибиторов высвобождения NO и IL-6 аминопроизводные диарилпиримидинов не известны. Аналогами заявляемых веществ по строению являются 2-метил(амино)-4,6-диарилпиримидины формулы 1, не имеющие аминогрупп в арильных фрагментах и обладающие противоопухолевой активностью [Bioorg. Chem., 2018, 78, 130-140] и 5,7-диарил-1,2,4-триазоло-[1,5-α]- пиримидины формулы 2, также не имеющие аминогрупп в арильных заместителях [Curr.Org.Synt., 2020, 17, 73-80].
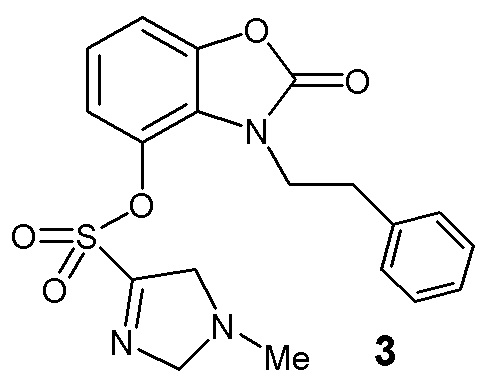
Описано соединение из класса азотсодержащих гетероциклов - дизамещенный бензоксазолон 3 с высокой ингибирующей активностью в отношении высвобождения NO и IL-6 в опытах in vitro, в LPS-индуцированных клетках линии RAW264.7. Соединение показало ингибиторную активность в отношении синтеза NO при 25 мкМ ( IC50 составило 13.44 мкМ), при этом оно также ингибирует высвобождение IL-6 in vitro в концентрации 12.5 мкМ.
Известно также лекарственное средство дексаметазон - стероидный препарат с противовоспалительным действием, подавляющий образование медиаторов воспаления. Его применяют для лечения ревматоидных заболеваний, астмы, аллергий, хронической обструктивной болезни легких, использовали для лечения больных COVID-19. Однако, этот препарат имеет серьезные побочные эффекты - он оказывает иммунодепрессивное действие, повышает склонность к тромбозам, увеличивает артериальное давление и концентрацию глюкозы в крови.
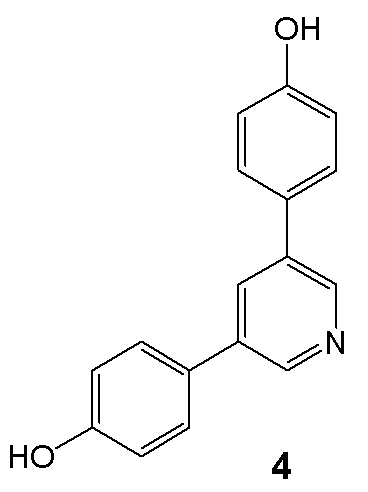
Прототипом изобретения по строению и биологической активности является соединение формулы 4, обладающее ингибирующей активностью в отношении секреции интерлейкина IL-6 (IC50 0,4 мкМ), но его ингибирующая активность в отношении синтеза оксида азота (NO) не описана [Bioorg. Med. Chem.Lett., 1995, 5, No. 18, 2143-2146].
Известен одностадийный трехкомпонентный способ получения 2-метил-4,6-диарилпиримидинов взаимодействием хлоргидрата ацетамидина с ароматическим альдегидом и кетоном в присутствии NaOH, при нагревании без растворителя, однако метод пригоден только для жидких альдегидов и (или) кетонов [J. Heterocycl. Chem., 2009, 46, 890-896].
Описан двухстадийный способ получения 2-метил(амино)-4,6-диарилпиримидинов взаимодействием углекислого гуанидина или хлоргидрата ацетамидина или с халконами, полученными из соответствующих ароматических альдегидов и кетонов. При этом, халконы на основе аминозамещенных ароматических альдегидов и кетонов, например, 4,4’-диаминохалкон известен [Arab. J. Sci. Eng., 2013, 38, 1721-1729], но вовлечение его в реакцию с гуанидином, ацетамидином или 3-амино-1,2,4-триазолом не описано, что (по нашим данным) связано с различными побочными процессами с участием аминогрупп, а также с особенностями их электронного влияния на реакционную способность халкона, которые препятствуют формированию пиримидинового цикла.
Технической проблемой является создание новых биологически активных соединений, подавляющих образование медиаторов воспаления NO и IL-6, а также разработка способа их получения.
Поставленная задача решается тем, что, в качестве ингибиторов синтеза NO и IL-6 предлагаются аминопроизводные 4,6 (5,7)-диарилзамещенных пиримидинов и [1,2,4]триазоло[1,5-a]пиримидинов, объединенные общим изобретательским замыслом и отличающиеся наличием [1,2,4]триазольного кольца, аннелированного к пиримидиновому циклу. Это аминопроизводные 4,6 (5,7)-диарилзамещенных пиримидинов общей формулы A и [1,2,4]триазоло[1,5-a]пиримидинов общей формулы B.
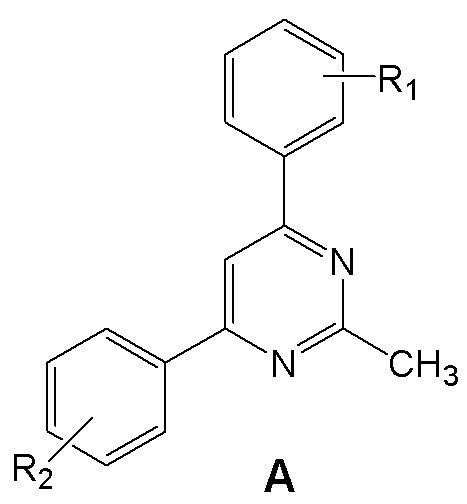
где R1 = атом водорода, фтора или амино-группа (3-NH2 или 4-NH2); R2 = амино-группа (2-NH2 или 4-NH2); R3 = амино- или метильная группа.

где R1 = атом водорода, фтора или амино-группа (3-NH2 или 4-NH2).
Ключевым отличием заявляемых соединений формулы А и В от аналогов по строению является наличие аминоарильных фрагментов в пиримидиновым цикле, а основным отличием заявляемых соединений формулы А и В от прототипа является наличие пиримидинового цикла в молекуле, а также амино-групп в арильных ядрах.
Для получения аминопроизводных 4,6 (5,7)-диарилзамещенных пиримидинов и [1,2,4]триазоло[1,5-a]пиримидинов формулы А и формулы В использовали способ (Схема 1), включающий альдольную конденсацию ароматических альдегидов с кетонами, протекающую в кислых условиях. Далее полученные нитрозамещенные халконы 5 вовлекали в циклизацию с гуанидином, ацетамидином или 3-амино-1,2,4-триазолом при нагревании в ДМФА. Нитро-группу в синтезированных пиримидинах 6а и 6b восстанавливали гидразин гидратом в присутствии никеля Реннея, получая при этом целевые аминопроизводные 4,6 (5,7)-диарилзамещенных пиримидинов общей формулы A или аминопроизводные [1,2,4]триазоло[1,5-a]пиримидинов общей формулы B. Восстановление нитро-группы в соединениях 6a,b, где пиримидиновый цикл уже сформирован, позволило получить целевые соединения А и В c выходом 78 - 86%.
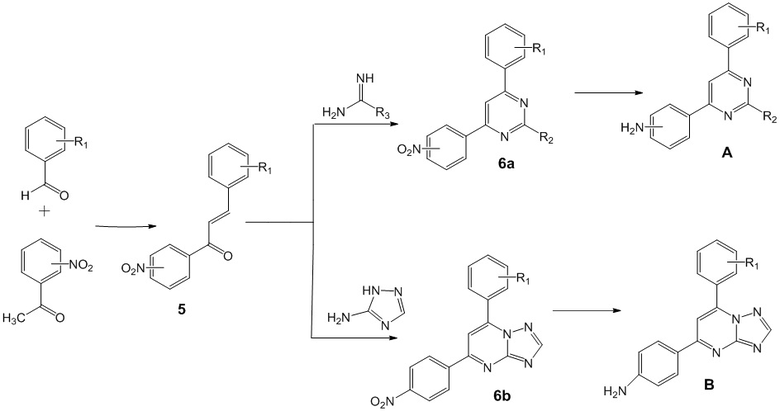
Схема 1. Синтез анилиновых производных пиримидинов общей формулы А и В
Общий метод синтез динитрохалконов 5 (R1=NO2)
К раствору 2 г (0.012 моль) 2- или 4-нитроацетофенона и 2.4 г (0.015 моль) 3- или 4-нитробензальдегида в 30 мл ледяной уксусной кислоте добавляли 0.7 г (0.012 моль) H3BO3 и нагревали с обратным холодильником в течении 24 ч. Выпавший при охлаждении осадок фильтровали, промывали на фильтре 5 порциями по 10 мл водного раствора уксусной кислоты (1:1) 3 - 4 раза и в завершении водой. Полученные продукты 5 (R1=NO2) сушили и кристаллизовали из этанола, ацетонитрила или этилацетата. Выходы составили 78-80%.
Синтез нитро- и фторзамещенных 2-метил-4,6-диарилпиримидинов и 5,7-диарил[1,2,4]триазоло[1,5-a]пиримидина 6а или 6b (R1=NO2 или F)
К раствору 0.5 г (1.6 ммоль) динитрохалкона 5 и 0.18 г (2 ммоль) ацетамидина гидрохлорида (или гуанидина углекислого, или 2-метилизотиуроний йодида) в 20 мл диметилформамида добавляли 0.4 г (3 ммоль) K2CO3 и проводили реакцию при 100°C и перемешивании в течении 32 ч. По завершению реакции реакционную смесь высаживали водой, осадок отфильтровывали. Продукт очищали хроматографически на препаративной колонке (SiO2, элюент: хлороформ или смесь хлороформ - ТГФ (9:1), в случае триазолопримидинов). Выделенные целевые продукты промывали ацетонитрилом при фильтровании на фильтре. Выходы 6а или 6b (R1=NO2 или F) составили 65 - 70%.
Синтез аминозамещенных 2-метил-4,6-дифенилпиримидинов, 4,6-дифенилпиримидин-2-амина, 2-(метилтио)-4,6-дифенилпиримидина и 5,7-дифенил[1,2,4]триазоло[1,5-a]пиримидина формулы А или В
Нитросодержащие пиримидины 6а или 6b (1 ммоль) растворяли в смеси ТГФ и этанола (1:1) при нагревании, добавляли никель Ренея и 2 - 3 мл гидразин гидрата. Восстановление вели до полного исчезновения исходного соединения. Продукты перекристаллизовывали из водного этанола. Выходы целевых соединений А или В составляли 78 - 86%.
В отличие от аналогов по строению и действию, указанные соединения А и В представляют собой аминопроизводные 4,6 (5,7)-диарилзамещенных пиримидинов и [1,2,4]триазоло[1,5-a]пиримидинов для которых наличие ингибирующей активностью в отношении высвобождения NO и IL-6 не было очевидным. Ингибирующая активность соединений в отношении высвобождения NO и IL-6, а также их влияние на жизнеспособность клеток приведена в таблице 1.
Для соединения формулы А (R1 = 4-NH2, R2 = 4-NH2; R3 = CH3) показано, что оно способно защищать от цитокин-опосредованного воспаления и повреждения тканей на животной модели острого поражения легких.
Проведена оценка степени воспалительного процесса в легочной ткани полуколичественным способом [Wang F., Zuo Z., Chen K. et al. Histopathological changes caused by inflammation and oxidative stress in diet-induced-obese mouse following experimental lung injury. Sci Rep. 2018, 8, 14250] на парафиновых срезах, окрашенных гематоксилином и эозином. В качестве препарата сравнения использовали дексаметазон. Срезы тканей легких были исследованы под световым микроскопом (ZEISS, Германия) двойным слепым методом. Степень воспаления оценивалась по всему образцу легкого следующим образом: 0 - присутствие единичных воспалительных клеток; 1 - слабое воспаление, воспалительные клетки инфильтрируют не более 10% легочной ткани, включая межальвеолярные перегородки; 2 - умеренное воспаление, воспалительные клетки инфильтрируют не более 50% структур легкого, но межуточная ткань идентифицируется; 3 - сильное воспаление, воспалительные клетки плотно инфильтрируют более 50% легочной ткани и воздухоносных путей. При этом локализованные вокруг крупных и средних бронхов лимфоидные фолликулы не учитывались в итоговой оценке.
Статистический анализ данных производили с помощью программы Statistika 7.0. Рассчитывались параметры среднего арифметического значения (М), а также 25% и 75% квартили (Q1 и Q3). Сравнения между группами проводили с помощью непараметрического анализа с использованием U критерия Манна-Уитни.
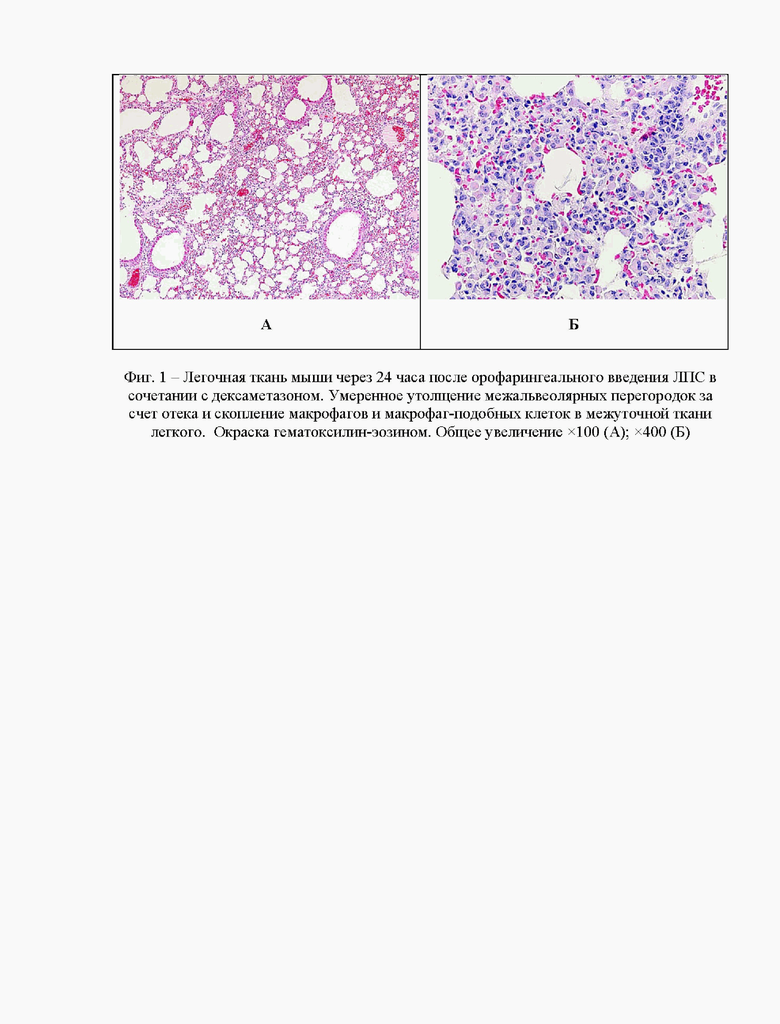
На фиг. 1 приведены результаты морфологического исследования органов и тканей интактных и подопытных животных через 24 часа после однократного орофарингеального введения бактериального липополисахарида в сочетании с дексаметазоном (5 мг/кг внутрибрюшинно). Введение дексаметазона в качестве противовоспалительного агента значительно уменьшало явления воспаления в легочной ткани подопытных мышей.
Так, клеточный состав воспалительного инфильтрата был представлен преимущественно альвеолярными макрофагами и макрофаг-подобными клетками (фиг. 1Б), а утолщение альвеолярных перегородок и межуточный отек, обусловленные преимущественно экссудативным воспалением серозного и серозно-геморрагического характера, были менее выражены (фиг. 1А).
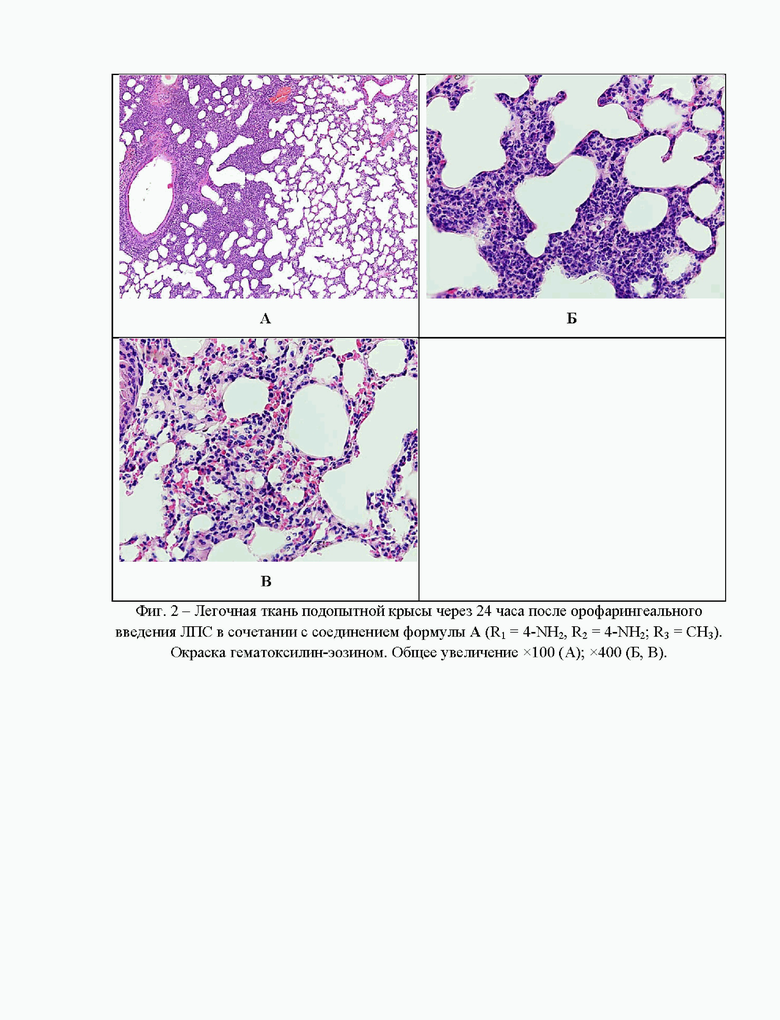
На фиг. 2 приведены результаты морфологического исследования органов и тканей интактных и подопытных животных через 24 часа после орофарингеального введении бактериального липополисахарида в сочетании с соединением формулы А (R1 = 4-NH2, R2 = 4-NH2; R3 = CH3) в дозе 30 мг/кг внутрибрюшинно. При микроскопическом исследовании ткани легких мышей, получавших с соединение формулы А (R1 = 4-NH2, R2 = 4-NH2; R3 = CH3) в качестве противовоспалительного агента, у половины подопытных животных были выявлены все признаки развития сливной гнойной пневмонии: выраженная инфильтрация полиморфно-ядерными нейтрофилами межуточной ткани легкого, наличие гнойного экссудата в просвете альвеол, утолщение и отек альвеолярных перегородок, явления диапедеза эритроцитов в межальвеолярные перегородки. Вследствие того, что воспалительный экссудат в альвеолах снижал объем воздуха в полостях, то в сохранной части легких обнаруживались дистелектазы (фиг. 2А и 2Б).
У второй половины животных патологический процесс был менее выражен и характеризовался преимущественно межуточным отеком и инфильтрацией межальвеолярных перегородок клетками острого воспаления (фиг. 2В).
В тоже время необходимо отметить, что у всех подопытных животных данной группы, несмотря на плотную инфильтрацию воспалительными элементами легочной ткани, значительно менее выражено повреждение альвеолярных перегородок, чем у мышей из экспериментальной группы с ЛПС-индуцированным воспалением.
Обобщенные результаты исследования влияния тестируемых препаратов с противовоспалительным эффектом на модерацию ЛПС-индуцированного воспаления представлены в Таблице 2.
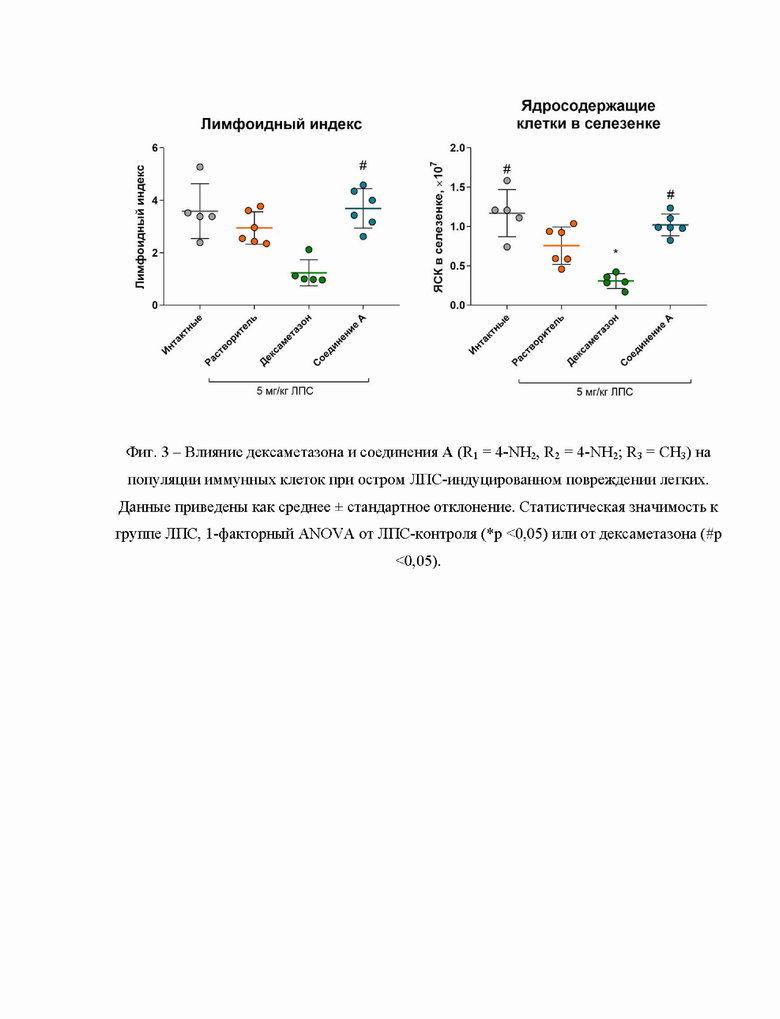
Исследовано влияние дексаметазона и соединения А (R1 = 4-NH2, R2 = 4-NH2; R3 = CH3) на популяции иммунных клеток при остром ЛПС-индуцированном повреждении легких и показано, что соединение А (R1 = 4-NH2, R2 = 4-NH2; R3 = CH3) в отличие от дексаметазона не вызывает угнетения клеточного звена иммунитета (фиг. 3).
(n=6)
(n=6)
[3;3]
р*=0,0007
р*=0,008
р†=0,004
р*=0,004
Примечание: Статистически значимые различия по сравнению с *контролем, †группой с ЛПС-индуцированным воспалением; n - количество животных; р - уровень значимости.
Таким образом, заявляемые соединения по своей способности подавлять синтез оксида азота, а также ингибировать экспрессию IL-6 превосходят по своей активности соединение 4 (прототип), уступая препарату сравнения дексаметазону. Однако, в отличие от дексаметазона, заявляемые соединения не вызывает иммунодепрессии (угнетения клеточного звена иммунитета), что является ценным преимуществом.
Чистоту полученных соединений контролировали методом ТСХ, значения Rf определяли с использованием пластинок ”Sorbfil” (Силикагель СТХ-1А,УФ) (Россия) или “Silufol-UV” (Чехословакия). Структуру полученных соединений доказывали данными элементного анализа (C,H,N,O-анализатор фирмы Karlo Erba). ИК спектры регистрировали на ИК-Фурье спектрометре «Spectrum One» фирмы «PerkinElmer» c помощью приставки диффузного отражения (Diffuse Reflectance Sampling Accessory (DRA)). Спектры ЯМР 1Н соединений записывали в ДМSO-d6 на приборе “Bruker-400” c рабочей частотой 400 мГц и ТМС в качестве внутреннего стандарта. Масс - спектры регистрировали на приборе «Varian МАТ 311-А» c комбинированным FD/EI источником в результате прямого введения пробы в область ионизации. Энергия ионизирующих электронов 70 эВ, ускоряющее напряжение 3 кВ. Температуры плавления определяли на микронагревательном столике «Boetius».
Примеры конкретного выполнения.
Пример 1
4,4'-(2-Метилпиримидин-4,6-диил)дианилин (Соединение формулы А (R1 = 4-NH2, R2 = 4-NH2; R3 = CH3). Желтые кристаллы; Тпл = 200-202°C. Выход: 215 мг (78%). 1H NMR (400 MHz, DMSO-d6) δ, 8.01 (m (AA’BB’), 4 H, Ar), 7.89 (s, 1 H, CH, пиримидин), 6.64 (m (AA’BB’), 4 H, Ar), 5.66 (s, 4 H, NH2), 2.58 (s, 3 H, Me). 13C NMR (101 MHz, DMSO-d6) δ 166.53, 163.10 (2 C), 151.43 (2 C), 128.29 (4 C), 123.68 (2 C), 113.38 (4 C), 104.82, 26.24. HRMS(ESI): вычислено, C17H17N4 [M + H]+: 277.1448, найдено: 277.1449; IR ν = 3379, 3306, 3181, 3075, 1619, 1574, 1510, 1448, 1430, 1372, 1349, 1293, 1239, 1176, 825, 774, 743, 692 см-1. Аналитически вычислено, C17H16N4: C, 73.89; H, 5.84; N, 20.27. Найдено: C, 73.85; H, 5.86; N, 20.24.
Пример 2
3-(6-(4-Аминофенил)-2-метилпиримидин-4-ил)анилин (Соединение формулы А (R1 = 3-NH2, R2 = 4-NH2, R3= СН3). Желтые кристаллы; Тпл = 171-174°C. Выход: 225 мг (82%). 1H NMR (400 MHz, DMSO-d6) δ, 8.02 (m (AA’BB’), 2 H, Ar), 7.95 (s, 1 H, CH, пиримидин), 7.48 (d, 1 H, J = 1.8 Hz, Ar), 7.38 (d, 1 H, J = 8.1 Hz, Ar), 7.16 88 (t, 1 H, J = 7.8 Hz, Ar), 6.71 (dd, 1 H, J = 1.8, 7.8 Hz, Ar), 6.66 (m (AA’BB’), 2 H, Ar), 5.73 (s, 2 H, NH2), 5.25 (s, 2 H, NH2), 2.64 (s, 3 H, Me). 13C NMR (101 MHz, DMSO-d6) δ 166.84, 163.72, 163.65, 151.73, 149.05, 137.60, 129.17, 128.41 (2 C), 123.26, 116.05, 114.65, 113.43 (2 C), 112.17, 106.94, 26.18. HRMS(ESI): вычислено, C17H17N4 [M + H]+: 277.1448, найдено: 277.1448; IR ν = 3451, 3306, 3204, 3053, 3012, 2959, 2920, 2851, 1634, 1607, 1566, 1525, 1514, 1454, 1371, 1311, 1274, 1219, 1186, 1132, 989, 887, 867, 829, 759, 701, 669 см-1. Аналитически вычислено C17H16N4: C, 73.89; H, 5.84; N, 20.27. Найдено: C, 73.83; H, 5.85; N, 20.25.
Пример 3
4-(2-Метил-6-фенилпиримидин-4-ил)анилин (Соединение формулы А (R1 = Н, R2 = 4-NH2; R3 = CH3). Желтые кристаллы; Тпл = 134-135°C. Выход: 224 мг (86%). 1H NMR (400 MHz, DMSO-d6) δ, 8.29 (m, 2 H, Ar), 8.14 (s, 1 H, CH, пиримидин), 8.09 (m (AA’BB’), 2 H, Ar), 7.52 - 7.56 (m, 3 H, Ar), 6.68 (m (AA’BB’), 2 H, Ar), 5.76 (s, 2 H, NH2), 2.67 (s, 3 H, Me). 13C NMR (101 MHz, DMSO-d6) δ 167.01, 164.04, 162.82, 151.80, 136.99, 130.44, 128.67 (2 C), 128.55 (2 C), 126.98 (2 C), 123.17, 113.39 (2 C), 107.12, 26.15. HRMS(ESI): вычислено, C17H16N3 [M + H]+: 262.1339, найдено: 262.1342; IR ν = 3472, 3312, 3194, 3056, 3038, 1633, 1607, 1571, 1527, 1518, 1496, 1453, 1436, 1370, 1306, 1238, 1180, 1075, 832, 761, 691 см-1. Аналитически вычислено C17H15N3: C, 78.13; H, 5.79; N, 16.08. Найдено: C, 78.11; H, 5.82; N, 16.05.
Пример 4
2-(2-Метил-6-фенилпиримидин-4-ил)анилин (Соединение формулы А (R1 = Н, R2 = 2-NH2; R3 = CH3). Бледно-жёлтые кристаллы; Тпл = 138-139°C. Выход: 210 мг (72%). 1H NMR (400 MHz, DMSO-d6) δ, 8.30 (m, 2 H, Ar), 8.19 (s, 1 H, CH, пиримидин), 7.95 (dd, 1 H, J = 1.2, 8.0 Hz, Ar), 7.54 - 7.56 (m, 3 H, Ar), 7.19 (td, 1 H, J = 1.2, 7.1, 8.0 Hz, Ar), 7.03 (s, 1 H, NH2), 6.82 (dd, 1 H, J = 0.9, 8.2 Hz, Ar), 6.65 (td, 1 H, J = 1.0, 7.0, 8.0 Hz, Ar), 2.74 (s, 3 H, Me). 13C NMR (101 MHz, DMSO-d6) δ 166.58, 166.06, 162.98, 149.14, 136.80, 131.49, 130.69, 129.71, 128.78 (2 C), 127.18 (2 C), 116.91, 116.78, 115.58, 109.93, 26.08. HRMS(ESI): вычислено, C17H16N3 [M + H]+: 262.1339, найдено: 262.1340; IR ν = 3454, 3290, 3027, 1609, 1567, 1521, 1494, 1372, 1331, 1310, 1254, 1231, 1153, 1029, 870, 785, 752, 736, 694 632 см-1. Аналитически вычислено C17H15N3: C, 78.13; H, 5.79; N, 16.08. Найдено: C, 78.16; H, 5.73; N, 16.09.
Пример 5
4-(6-(4-Фторфенил)-2-метилпиримидин-4-ил)анилин (Соединение формулы А (R1 = 4-F, R2 = 4-NH2; R3 = CH3). Бледно-желтые кристаллы; Тпл = 149-150°C. Выход: 270 мг (87%). 1H NMR (400 MHz, DMSO-d6) δ, 8.36 (m (AA’BB’C), 2 H, Ar), 8.15 (s, 1 H, CH, пиримидин), 8.08 (m (AA’BB’), 2 H, Ar), 7.36 (m (AA’BB’C), 2 H, Ar), 6.67 (m (AA’BB’), 2 H, Ar), 5.76 (s, 2 H, NH2), 2.66 (s, 3 H, Me). 13C NMR (101 MHz, DMSO-d6) δ 167.02, 164.66, 164.11, 162.21 (d, 1 C, J = 157.4 Hz), 161.73, 151.88, 133.45 (d, 1 C, J = 3.8 Hz), 129.40 (d, 2 C, J = 11.2 Hz), 128.61 (2 C), 123.08, 115.6 (d, 2 C, J = 27.9 Hz), 113.37 (2 C), 106.94, 26.16. HRMS(ESI): вычислено, C17H15FN3 [M + H]+: 280.1245, найдено: 280.1240; IR ν = 3464, 3316, 3184, 1643, 1600, 1578, 1526, 1506, 1435, 1370, 1307, 1221, 1182, 1161, 1098, 1014, 993, 828, 767 см-1. Аналитически вычислено C17H14FN3: C, 73.10; H, 5.05; N, 15.04. Найдено: C, 73.14; H, 5.04; N, 15.05.
Пример 6
4,4'-(2-Аминопиримидин-4,6-диил)дианилин (Соединение формулы А (R1 = 4-NH2, R2 = 4-NH2; R3 = NH2). Желтые кристаллы; Тпл = 255-259°C. Выход: 200 мг (73%). 1H NMR (400 MHz, DMSO-d6) δ, 7.90 (m (AA’BB’), 4 H, Ar), 7.32 (s, 1 H, CH, пиримидин), 6.61 (m (AA’BB’), 4 H, Ar), 6.22 (s, 2 H, NH2), 5.55 (s, 4 H, NH2). 13C NMR (101 MHz, DMSO-d6) δ 164.11 (2 C), 163.57, 150.96 (2 C), 128.01 (4 C), 124.60 (2 C), 113.24 (4 C), 98.22. HRMS(ESI): вычислено, C16H16N5 [M + H]+: 278.1400, найдено: 278.1400; IR ν = 3473, 3440, 3378, 3347, 3168, 1619, 1574, 1564, 1513, 1442, 1427, 1362, 1291, 1241, 1219, 1187, 1176, 815, 796, 785 см-1. Аналитически вычислено C16H15N5: C, 69.29; H, 5.45; N, 25.25. Найдено: C, 69.27; H, 5.48; N, 25.22.
Пример 7
4,4'-([1,2,4]Триазоло[1,5-a]пиримидин-5,7-диил)дианилин дианилин (Соединение формулы B (R1 = 4-NH2). Желтые кристаллы; Тпл = 260-263°C. Выход: 230 мг (77%). 1H NMR (400 MHz, DMSO-d6) δ, 8.52 (s, 1 H, CH, триазолопиримидин), 8.19 (m (AA’BB’), 2 H, Ar), 8.11 (m (AA’BB’), 2 H, Ar), 7.77 (s, 1 H, CH, триазолопиримидин), 6.74 (m (AA’BB’), 2 H, Ar), 6.69 (m (AA’BB’), 2 H, Ar), 6.02 (s, 2 H, NH2), 5.85 (s, 2 H, NH2). 13C NMR (101 MHz, DMSO-d6) δ 160.31, 156.37, 155.08, 152.24, 151.98, 146.97, 131.25 (2 C), 129.18 (2 C), 123.18, 115.94, 113.46 (2 C), 112.94 (2 C), 102.15. HRMS(ESI): вычислено C17H15N6 [M + H]+: 303.1353, найдено: 303.1358; IR ν = 3467, 3315, 3263, 3110, 3034, 1633, 1589, 1540, 1500, 1380, 1307, 1284, 1240, 1175, 1141, 826, 775 см-1. Аналитически вычислено C17H14N6: C, 67.54; H, 4.67; N, 27.80. Найдено: C, 67.55; H, 4.64; N, 27.82.
Пример 8
3-(5-(4-Аминофенил)-[1,2,4]триазоло[1,5-a]пиримидин-7-ил)анилин (Соединение формулы B (R1 = 3-NH2). Бледно-желтые кристаллы; Тпл = 267-270°C. Выход: 250 мг (84%). 1H NMR (400 MHz, DMSO-d6) δ, 8.54 (s, 1 H, CH, триазолопиримидин), 8.10 (m (AA’BB’), 2 H, Ar), 7.77 (s, 1 H, CH, триазолопирмидин), 7.38 (t, 1 H, J = 1.7 Hz, Ar), 7.29 (dt, 1 H, J = 1.4, 7.6 Hz, Ar), 7.25 (t, 1 H, J = 7.6 Hz, Ar), 6.82 (dt, 1 H, J = 1.7, 7.6 Hz, Ar), 6.69 (m (AA’BB’), 2 H, Ar), 6.74 (m (AA’BB’), 2 H, Ar), 6.69 (m (AA’BB’), 2 H, Ar), 5.92 (s, 2 H, NH2), 5.40 (s, 2 H, NH2). 13C NMR (101 MHz, DMSO-d6) δ 160.76, 156.05, 155.33, 152.31, 148.74, 147.51, 130.76, 129.33 (2 C), 129.06, 122.71, 116.83, 116.61, 114.35, 113.51 (2 C), 104.92. HRMS(ESI): вычислено C17H15N6 [M + H]+: 303.1351, найдено: 303.1353; IR ν = 3460, 3339, 3212, 1628, 1579, 1541, 1513, 1498, 1379, 1280, 1255, 1232, 1217, 1183, 1140, 828, 788, 777, 696 см-1. Вычислено C17H14N6: C, 67.54; H, 4.67; N, 27.80. Найдено: C, 67.57; H, 4.63; N, 27.83.
Пример 9
4-(7-(4-Фторфенил)-[1,2,4]триазоло[1,5-a]пиримидин-5-ил)анилин (Соединение формулы B (R1 = 4-F). Желтые кристаллы; Тпл = 239-241°C. Выход: 255 мг (84%). 1H NMR (400 MHz, DMSO-d6) δ, 8.56 (s, 1 H, CH, триазолопиримидин), 8.32 (m (AA’BB’C), 2 H, Ar), 8.13 (m (AA’BB’), 2 H, Ar), 7.63 (s, 1 H, CH, триазолопиримидин), 7.49 (m (AA’BB’C), 2 H, Ar), 6.69 (m (AA’BB’), 2 H, Ar), 5.93 (s, 2 H, NH2). 13C NMR (101 MHz, DMSO-d6) δ 164.65, 162.66, 160.89, 155.67 (d, 1 C, J = 208.9 Hz), 152.39, 145.48, 132.32 (d, 2 C, J = 23.1 Hz), 129.46 (2 C), 126.35 (d, 1 C, J = 8.1 Hz), 122.66, 115.55 (d, 2 C, J = 56.8 Hz), 113.47 (2 C), 105.36. HRMS(ESI): вычислено, C17H13FN5 [M + H]+: 306.1150, найдено: 306.1150; IR ν = 3480, 3322, 3208, 3115, 1634, 1597, 1584, 1545, 1502, 1415, 1377, 1304, 1227, 1178, 1163, 917, 824, 775 см-1. Аналитически вычислено C17H12FN5: C, 66.88; H, 3.96; N, 22.94. Найдено: C, 66.90; H, 3.95; N, 22.95.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения N-замещенных мостиковых 1,2,4-диоксазолидинов | 2023 |
|
RU2804396C1 |
| ПРИМЕНЕНИЕ ГИДРИРОВАННЫХ ПРОИЗВОДНЫХ ПИРРОЛО[3,2,1-IJ]ХИНОЛИН-1-ИЛИДЕН-2-ТИОКСОТИАЗОЛИДИН-4-ОНОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ФАКТОРОВ СВЕРТЫВАНИЯ КРОВИ XA И XIA | 2023 |
|
RU2819897C1 |
| АРИЛСУЛЬФОНИЛМЕТИЛЬНЫЕ ИЛИ АРИЛСУЛЬФОНАМИДНЫЕ ПРОИЗВОДНЫЕ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ РАССТРОЙСТВ, ВОСПРИИМЧИВЫХ К ЛЕЧЕНИЮ ЛИГАНДАМИ ДОФАМИНОВЫХ D РЕЦЕПТОРОВ, С ИХ ПОМОЩЬЮ | 2005 |
|
RU2442781C2 |
| Производные 7-гидроксикумарина, соединенные с остатками монотерпенов через триазольный линкер, как ингибиторы репродукции респираторно-синцитиального вируса (РСВ) | 2024 |
|
RU2826560C1 |
| СПОСОБ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ ФИЗИОЛОГИЧЕСКИХ И/ИЛИ ПАТОФИЗИОЛОГИЧЕСКИХ СОСТОЯНИЙ, ОПОСРЕДУЕМЫХ РЕЦЕПТОРАМИ, СТИМУЛИРУЮЩИМИ СЕКРЕЦИЮ ГОРМОНА РОСТА, ТРИАЗОЛЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2006 |
|
RU2415134C9 |
| Способ получения дигалогенпроизводного 1,2,3,4-тетрагидропиридо- или пиридо[1,2-а]бензимидазол-6,9-диона | 2023 |
|
RU2828349C1 |
| 7-(4-Метоксифенил)-5-фенил-4,5-дигидро-[1,2,4]триазоло[1,5-а]пиримидин как активатор глюкокиназы и ингибитор дипептидилпептидазы типа 4 и способ его получения | 2017 |
|
RU2642432C1 |
| ИНГИБИТОРЫ GCN2 И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2811408C2 |
| СПОСОБ ПОЛУЧЕНИЯ СЛОЖНОГО ЭФИРА 4-ФОРМИЛ-6,7-ДИГИДРОКСИ-БЕНЗО[B]ТИОФЕН-3-КАРБОНОВОЙ КИСЛОТЫ | 2019 |
|
RU2722595C1 |
| ИНГИБИТОРЫ GCN2 И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2811403C2 |
Изобретение относится к области органической и медицинской химии, а именно к соединениям общей формулы А и В, где R1 = атом водорода, фтора или аминогруппа - 3-NH2 или 4-NH2; R2 = аминогруппа 2-NH2 или 4-NH2, представляющим собой аминопроизводные 4,6 (5,7)-диарилзамещенных пиримидинов или [1,2,4]триазоло[1,5-a]пиримидинов. Технический результат изобретения заключается в создании новых биологически активных соединений формулы A и B, подавляющих образование медиаторов воспаления оксида азота NO и интерлейкина 6. Соединения могут быть использованы для лечения больных раком, нейродегенеративными заболеваниями, туберкулезом, COVID-19, сахарным диабетом 2-го типа и другими заболеваниями, обусловленными повышенной активностью иммунных клеток. 3 ил., 2 табл., 9 пр.
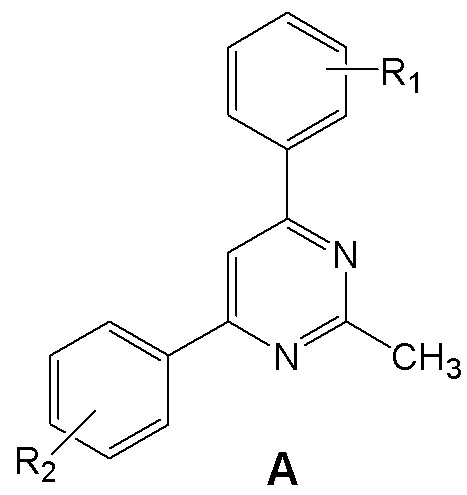

Соединения общей формулы А и В как ингибиторы высвобождения оксида азота NO и интерлейкина 6, представляющие собой аминопроизводные 4,6 (5,7)-диарилзамещенных пиримидинов или [1,2,4]триазоло[1,5-a]пиримидинов:
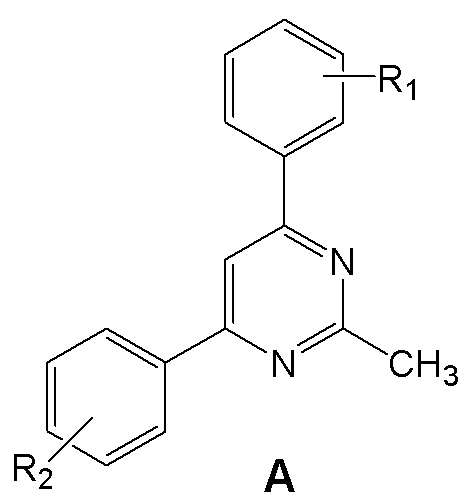 ,
,
где R1 = атом водорода, фтора или аминогруппа - 3-NH2 или 4-NH2; R2 = аминогруппа 2-NH2 или 4-NH2;
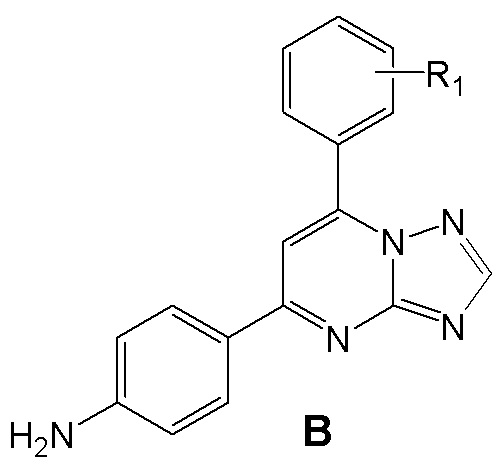 ,
,
где R1 = атом водорода, фтора или аминогруппа - 3-NH2 или 4-NH2.
| TAGAT J.R | |||
| et al | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Med | |||
| Chem | |||
| Lett., 1995, vol.5, no.18, p.2143-2146 | |||
| ATLA S.R | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| AGARWAL | |||
Авторы
Даты
2024-01-30—Публикация
2022-12-06—Подача