Данные связанных заявок
Данная заявка испрашивает приоритет предварительной заявки на патент США No. 61/858866, поданной 26 июля 2013 г. и включенной в данный документ ссылкой в полном объеме и для всех целей.
Заявление государственных интересов
Это изобретение было осуществлено при государственной поддержке согласно P50 HG003170 от Национального научно-исследовательского центра генома человека за выдающиеся достижения в геномике. Правительство имеет определенные права на это изобретение.
Предшествующий уровень техники
Известно редактирование генома с помощью специфических к последовательности нуклеаз. Смотрите источники 1, 2 и 3, которые включены в данный документ ссылкой в полном объеме. Опосредованный нуклеазой разрыв двухцепочечной ДНК (дцДНК) в геноме может быть устранен с помощью двух основных механизмов: негомологичного соединения концов (NHEJ), который часто приводит к введению неспецифических вставок и делеций (indels), или направляемой гомологией репарации (HDR), которая использует гомологичную цепь в качестве шаблона для репарации. См. источник 4 включенный ссылкой в полном объеме. Когда специфичная к последовательности нуклеаза доставляется вместе с гомологичной донорной ДНК-конструкцией, содержащей искомые мутации, эффективности направленного воздействия на ген повышаются в 1000 раз по сравнению только с доставкой донорной конструкции отдельно. См. источник 5, включенный в данный документ ссылкой в полном объеме. Сообщалось об использовании одноцепочечных олигодезоксирибонуклеотидов («ssODNs») в качестве ДНК-доноров. См. источники 21 и 22, включенные в данный документ ссылкой в полном объеме.
Несмотря на большие достижения в области технологий редактирования генов, остаются нерешенными многие проблемы и многие вопросы относительно применения специально сконструированных нуклеаз при конструировании человеческих индуцированных плюрипотентных стволовых клеток («hiPSC»). Во-первых, несмотря на простоту своей конструкции TALEN (эффекторные нуклеазы, подобные активаторам траснкрипции) нацеливаются на определенные последовательности ДНК тандемными копиями доменов RVD (домены вариабельных двух остатков). См. источник 6, включенный в данный документ ссылкой в полном объеме. В то время как модульный характер RVDs упрощает дизайн TALEN, их повторяющиеся последовательности усложняют способы синтеза ДНК-конструкций на их основе (см. источники 2, 9 и 15-19, включенные в данный документ ссылкой в полном объеме), а также делает практически невозможным их совместное применение вместе со средствами доставки генов на основе лентивирусов. См. источник 13, включенный в данный документ ссылкой в полном объеме.
В современной практике NHEJ и HDR часто оцениваются с помощью отдельных анализов. Тесты с эндонуклеазой, чувствительной к некомлементарности (см. источник 14, включенный в данный документ ссылкой в полном объеме) часто используются для оценки NHEJ, но количественная точность этого способа переменчива, и чувствительность ограничивается частотами NHEJ выше ~ 3%. См. источник 15, включенный в данный документ ссылкой в полном объеме. HDR часто оценивается с помощью клонирования и секвенирования, совершенно иной и часто громоздкой процедуры. Чувствительность по-прежнему является проблемой, поскольку, несмотря на высокие частоты редактирования порядка 50% о которых часто сообщалось в случае некоторых типов клеток, таких как U20S и К562 (см. источники 12 и 14, включенные в данный документ ссылкой в полном объеме), в случае hiPSC частоты, как правило, ниже. См. Источник 10, включенный в данный документ ссылкой в полном объеме. В последнее время высокие частоты редактирования были зарегистрированы в hiPSC и hESC, достигнутые с помощью TALENs (см. источник 9, включенный в данный документ ссылкой в полном объеме), и еще более высокие частоты были достигнуты с помощью системы CRISPR Cas9-гидРНК (см. источники 16-19, включенные в данный документ ссылкой в полном объеме. Тем не менее, показатели редактирования на различных участках по всей видимости, сильно отличаются (см. источник 17, включенный в данный документ ссылкой в полном объеме), а в некоторых участках редактирование иногда не обнаруживается вообще (см. источник 20, включенный в данный документ ссылкой в полном объеме).
Бактериальные и архейные системы CRISPR-Cas основываются на коротких направляющих РНК (гидРНК) в комплексе с Cas-белками, которые управляют деградацией комплементарных последовательностей, присутствующих во вторгающихся чужеродных нуклеиновых кислотах. См. Deltcheva, E. et al. CRISPR RNA maturation by trans-encoded small RNA and host factor RNase III. Nature 471, 602-607 (2011); Gasiunas, G., Barrangou, R., Horvath, P. & Siksnys, V. Cas9-crRNA ribonucleoprotein complex mediates specific DNA cleavage for adaptive immunity in bacteria. Proceedings of the National Academy of Sciences of the United States of America 109, E2579-2586 (2012); Jinek, M. et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science 337, 816-821 (2012); Sapranauskas, R. et al. The Streptococcus thermophilus CRISPR/Cas system provides immunity in Escherichia coli. Nucleic acids research 39, 9275-9282 (2011); and Bhaya, D., Davison, M. & Barrangou, R. CRISPR-Cas systems in bacteria and archaea: versatile small RNAs for adaptive defense and regulation. Annual review of genetics 45, 273-297 (2011). Недавнее воссоздание in vitro системы CRISPR II типа из S. pyogenes показало, что crRNA («CRISPR РНК»), слитая, как правило, с транс-кодируемой tracrRNA («транс-активированная CRISPR РНК») достаточны для направления белка Cas9 к специфически расщепляемой последовательности ДНК-мишени, соответствующей crRNA. Экспрессия гидРНК гомологичных сайту-мишени приводит к рекрутированию Cas9 и деградации ДНК-мишени. См. H. Deveau et al., Phage response to CRISPR-encoded resistance in Streptococcus thermophilus. Journal of Bacteriology 190, 1390 (Feb, 2008).
Сущность изобретения
Аспекты настоящего описания относятся к применению модифицированных нуклеаз TALEN (эффекторные нуклеазы, подобные активатору транскрипции) для генетической модификации клетки, такой как соматическая клетка или стволовая клетка. Как известно, TALEN включают повторяющиеся последовательности. Аспекты настоящего раскрытия относятся к способу изменения ДНК-мишени в клетке, в том числе введением в клетку TALEN, утратившую последовательности повторов в 100 п.о. или длиннее, где TALEN расщепляет ДНК-мишени и клетка подвергается негомологичному соединению концов с получением измененной ДНК в клетке. В соответствии с некоторыми аспектами, повторяющиеся последовательности искомой длины были удалены из TALEN. В соответствии с некоторыми аспектами, TALEN была лишена повторяющихся последовательностей определенной искомой длины. В соответствии с некоторыми аспектами, TALEN предоставляется с удаленными повторяющимися последовательностями искомой длины. В соответствии с некоторыми аспектами, TALEN модифицируется, для удаления повторяющихся последовательностей искомой длины. В соответствии с некоторыми аспектами, TALEN сконструирована с удалением повторяющихся последовательностей искомой длины.
Аспекты настоящего изобретения включают способы изменения ДНК-мишени в клетке, в том числе объединением в клетке TALEN, утратившей повторяющиеся последовательности в 100 п.о. или длиннее, и последовательности донорной нуклеиновой кислоты, где TALEN расщепляет ДНК-мишень и донорная последовательность нуклеиновой кислоты встраивается в ДНК клетки. Аспекты настоящего раскрытия направлены на вирус, включающий последовательность нуклеиновой кислоты, кодирующую TALEN, утратившую повторяющиеся последовательности в 100 п.о. или длиннее. Аспекты настоящего раскрытия относятся к клетке, включающей последовательность нуклеиновой кислоты, кодирующую TALEN, утратившую повторяющиеся последовательности в 100 п. н. или длиннее. В соответствии с некоторыми аспектами, описанными в данном документе, TALEN утратила повторяющиеся последовательности в 100 п.о. или длиннее, 90 п.о. или длиннее, 80 п.о. или длиннее, 70 п.о. или длиннее, 60 п.о. или длиннее, 50 п.о. или длиннее, 40 п.о. или длиннее, 30 п.о. или длиннее, 20 п.о. или длиннее, 19 п.о. или длиннее, 18 п.о. или длиннее, 17 п.о. или длиннее, 16 п.о. или длиннее, 15 п.о. или длиннее, 14 п.о. или длиннее, 13 п.о. или длиннее, 12 п.о. или длиннее, на 11 п.о. или длиннее, или 10 пар или длиннее.
Аспекты настоящего раскрытия направлены на изготовление TALE, включающего объединение эндонуклеазы, ДНК-полимеразы, ДНК-лигазы, экзонуклеазы, множество блоков нуклеотидных димеров, кодирующих RVD-домены (домены вариабельных двух остатков) и каркасного вектора TALE-N/TF, включающего сайт расщепления эндонуклеазой, активацию эндонуклеазы для разрезания каркасного вектора TALE-N/TF по сайту разрезания эндонуклеазой, с получением первого конца и второго конца, активацию экзонуклеазы, для создания 3' и 5' выступов на каркасном векторе TALE-N/TF и множестве блоков нуклеотидных димеров и соединения каркасного вектора TALE-N/TF и множества блоков нуклеотидных димеров в искомом порядке, активации ДНК-полимеразы и ДНК-лигазы для соединения каркасного вектора TALE-N/TF и множества блоков нуклеотидных димеров. Специалист в данной области техники легко поймет на основании настоящего описания, как идентифицировать подходящие эндонуклеазы, ДНК-полимеразы, ДНК-лигазы, экзонуклеазы, блоки нуклеотидных димеров, кодирующих RVD-домены и каркасные векторы TALE-N/TF.
Аспекты настоящего описания относятся к способу изменения ДНК-мишени в стволовых клетках, экспрессирующих фермент, который образует комплекс колокализации с РНК, комплементарной ДНК-мишени и который расщепляет ДНК-мишень сайт-специфическим образом, включающий (а) введение в стволовую клетку первой чужеродной нуклеиновой кислоты, кодирующей РНК, комплементарную ДНК-мишени, который направляет фермент на ДНК-мишень, где РНК и фермент являются членами комплекса колокализации на ДНК-мишени, введение в стволовую клетку второй чужеродной нуклеиновой кислоты, кодирующей последовательность донорной нуклеиновой кислоты, где РНК и донорная нуклеотидная последовательность экспрессируются, где РНК и фермент колокализуются с ДНК-мишенью, фермент расщепляет ДНК-мишени и донорная нуклеиновая кислота встраивается в ДНК-мишени, с получением измененной ДНК в стволовой клетке.
Аспекты настоящего раскрытия направлены на стволовую клетку, включающую первую чужеродную нуклеиновую кислоту, кодирующую фермент, который образует комплекс колокализации с РНК, комплементарной ДНК-мишени и который расщепляет ДНК-мишень сайт-специфическим образом.
Аспекты настоящего раскрытия относятся к клетке, включающую первую чужеродную нуклеиновую кислоту, кодирующую фермент, который образует комплекс колокализации с РНК, комплементарной ДНК-мишени и который расщепляет ДНК-мишень сайт-специфическим образом и включающую индуцируемый промотор для содействия экспрессии фермента. Таким образом, экспрессия может регулироваться, например, она может быть запущена и может быть остановлена.
Аспекты настоящего раскрытия нацелены на клетку, включающую первую чужеродную нуклеиновую кислоту, кодирующей фермент, который образует комплекс колокализации с РНК, комплементарной ДНК-мишени и который расщепляет ДНК-мишень сайт-специфическим образом, где первая чужеродная нуклеиновая кислота является удаляемой из геномной ДНК клетки с помощью удаляющего фермента, такого как транспозаза.
Аспекты настоящего раскрытия относятся к способу изменения ДНК-мишени в клетке, экспрессирующей фермент, который образует комплекс колокализации с РНК, комплементарной ДНК-мишени и который расщепляет ДНК-мишень сайт-специфическим образом, который включает (а) введение в клетку первой чужеродной нуклеиновой кислоты, кодирующей последовательность донорной нуклеиновой кислоты, введение в клетку из среды, окружающей клетку, РНК, комплементарной ДНК-мишени, которая направляет фермент на ДНК-мишень, где и РНК и фермент являются членами комплекса колокализации на ДНК-мишени, где последовательность донорной нуклеиновой кислоты экспрессируется, где РНК и фермент колокализованы на ДНК-мишени, фермент расщепляет ДНК-мишень и донорная нуклеиновая кислота встраивается в ДНК-мишень с получением измененной ДНК в клетке.
Аспекты настоящего раскрытия направлены на использование направляемого РНК ДНК-связывающего белка для генетической модификации стволовых клеток. В одном аспекте, стволовая клетка генетически модифицирована для включения нуклеиновой кислоты, кодирующей направляемый РНК ДНК-связывающий белок и стволовая клетка экспрессирует направляемый РНК ДНК-связывающий белок. Согласно конкретному аспекту, донорные нуклеиновые кислоты для введения специфических мутаций оптимизированы для редактирования генома с использованием либо модифицированных TALEN, либо направляемого РНК ДНК-связывающего белка.
Аспекты настоящего раскрытия направлены на модификацию ДНК, например, мультиплексную модификацию ДНК, в стволовой клетке с помощью одной или нескольких направляющих РНК (рибонуклеиновых кислот), для того, чтобы направить фермент, обладающий нуклеазной активностью, экспрессируемый стволовой клеткой, например, ДНК-связывающий белок, имеющий активность нуклеазы, в указанное положение на ДНК (дезоксирибонуклеиновой кислоте), где фермент разрезает ДНК и экзогенная донорная нуклеиновая кислота встраивается в ДНК, например, путем гомологичной рекомбинации. Аспекты настоящего изобретения включают циклические или повторяющиеся стадии модификации ДНК стволовой клетки для создания стволовой клетки, имеющей множество модификаций ДНК внутри клетки. Модификации могут включать введение экзогенных донорных нуклеиновых кислот.
Множественные экзогенные вставки нуклеиновых кислот могут быть осуществлены одиночной стадией введения в стволовую клетку, которая экспрессирует фермент, нуклеиновых кислот, кодирующих множество РНК и множество экзогенных донорных нуклеиновых кислот, например, путем котрансформации, где РНК экспрессируются и где каждая РНК в совокупности направляет фермент на конкретный участок ДНК, фермент разрезает ДНК и одна из множества экзогенных нуклеиновых кислот встраивается в ДНК в месте разреза. Согласно этому аспекту, многие изменения или модификации ДНК в клетке создаются в одиночном цикле.
Множественные экзогенные вставки нуклеиновых кислот в стволовую клетку могут быть осуществлены путем повторных стадий или циклов введения в стволовую клетку, которая экспрессирует фермент, одной или нескольких нуклеиновых кислот, кодирующих одну или несколько РНК или множество РНК и одну или несколько экзогенных нуклеиновых кислот или множество экзогенных нуклеиновых кислот, где РНК экспрессируется и направляет фермент на конкретный участок ДНК, фермент разрезает ДНК и экзогенная нуклеиновая кислота встраивается в ДНК в месте разреза, при этом получается клетка, обладающая несколькими изменениями или вставками экзогенной ДНК в ДНК внутри стволовой клетки. Согласно одному аспекту, стволовая клетка, экспрессирующая фермент, была генетически изменена для экспрессии фермента, например, путем введения в клетку нуклеиновой кислоты, кодирующей фермент, которая может экспрессироваться стволовой клеткой. Таким образом, аспекты настоящего изобретения включают циклические стадии введения РНК в стволовую клетку, которая экспрессирует фермент, введения экзогенной донорной нуклеиновой кислоты в стволовую клетку, которая экспрессирует РНК, образования комплекса колокализации РНК, фермента и ДНК, ферментативное разрезание ДНК ферментом, и вставку донорной нуклеиновой кислоты в ДНК. Цикл или повторение вышеуказанных стадий приводит к мультиплексной генетической модификации стволовых клеток во множестве локусов, т. е. приводит к образованию стволовой клетки, имеющей множество генетических модификаций.
В соответствии с некоторыми аспектами, ДНК-связывающие белки или ферменты в пределах объема настоящего изобретения включают белок, который образует комплекс с направляющей РНК, и с помощью направляющей РНК комплекс направляется к двухцепочечной последовательности ДНК, где комплекс связывается с последовательностью ДНК. Согласно одному аспекту, фермент может быть РНК направляемым ДНК-связывающим белком, таким как РНК направляемый ДНК-связывающий белок системы CRISPR II типа, который связывается с ДНК и направляется РНК. Согласно одному аспекту, направляемый РНК ДНК-связывающий белок представляет собой белок Cas9.
Этот аспект настоящего изобретения может быть отнесен к колокализации РНК и ДНК-связывающего белка с двухцепочечной ДНК. Таким образом, комплекс ДНК-связывающего белка-направляющей РНК может быть использован для расщепления множества участков на двухцепочечной ДНК, с образованием таким образом стволовой клетки с несколькими генетическими модификациями, например, множественными вставками экзогенной донорной ДНК.
В соответствии с некоторыми аспектами, предлагается способ внесения нескольких изменений в ДНК-мишень в стволовой клетке, экспрессирующей фермент, который образует комплекс колокализации с РНК, комплементарной ДНК-мишени и который расщепляет ДНК-мишень сайт-специфическим образом, который включает (а) введение в стволовую клетку первой чужеродной нуклеиновой кислоты, кодирующей одну или несколько РНК, комплементарных ДНК-мишени, которые направляют фермент к ДНК-мишени, где одна или несколько РНК и фермент являются членами комплекса колокализации с ДНК-мишенью, введение в стволовую клетку второй чужеродной нуклеиновой кислоты, кодирующей одну или несколько последовательностей донорной нуклеиновой кислоты, где одна или несколько РНК и одна или несколько последовательностей донорной нуклеиновой кислоты экспрессируются, где одна или несколько РНК и фермент колокализуются с ДНК-мишенью, фермент расщепляет ДНК и донорная нуклеиновая кислота встраивается в ДНК-мишень, с получением таким образом измененной ДНК в стволовой клетке, и повторение стадии (а) несколько раз, для внесения множества изменений в ДНК стволовой клетки.
Согласно одному аспекту, длина РНК составляет от около 10 до около 500 нуклеотидов. Согласно одному аспекту, длина РНК составляет от около 20 до около 100 нуклеотидов.
Согласно одному аспекту, одна или несколько РНК представляют собой направляющую РНК. Согласно одному аспекту, одна или несколько РНК представляют собой химеру tracrRNA-crRNA.
Согласно одному аспекту, ДНК представляет собой геномную ДНК, митохондриальную ДНК, вирусную ДНК или экзогенную ДНК.
Согласно одному аспекту, клетка может быть генетически модифицирована для обратимого включения нуклеиновой кислоты, кодирующей ДНК-связывающий фермент, с использованием вектора, который может быть легко удален с помощью фермента. Полезные векторы и способы известны специалистам в данной области техники и включают лентивирусы, аденоассоциированный вирус, опосредованные нуклеазами и интегразами способы направленной вставки и способы вставки, опосредованные транспозонами. Согласно одному аспекту, нуклеиновая кислота, кодирующая ДНК-связывающую фермент, который был добавлен, например, с помощью кассеты или вектора, к примеру, может быть удалена полностью вместе с кассетой и вектором, не оставляя часть такой нуклеиновой кислоты, кассеты или вектора в геномной ДНК. Такое удаление упоминается в данной области техники как «не оставляющее шрамов» удаление, поскольку геном становится таким же, каким он был до добавления нуклеиновой кислоты, кассеты или вектора.
Одним примерным воплощением вставки и удаления без шрамов является вектор PiggyBac, коммерчески доступный у System Biosciences.
Дополнительные признаки и преимущества определенных воплощений настоящего изобретения станут более очевидными в следующем описании воплощений и чертежей, и из формулы изобретения.
Краткое описание чертежей
Вышеуказанные и другие признаки и преимущества настоящих воплощений будут более понятны из нижеследующего подробного описания иллюстративных воплощений, рассматриваемых вместе с сопроводительными чертежами, где:
Фиг. 1 относится к функциональным тестам re-TALENs в соматических и стволовых клетках человека.
(а) Схематическое изображение экспериментального проекта для тестирования эффективности направленного воздействия на геном. Интегрированная в геном последовательность, кодирующая GFP, нарушается вставкой стоп-кодона и 68 п.о. геномного фрагмента, полученного из локуса AAVS1 (внизу). Восстановление последовательности GFP с помощью нуклеазо-опосредованной гомологичной рекомбинации с помощью донора tGFP (вверху) приводит к образованию клеток GFP+, которые могут быть количественно оценены с помощью FACS. Re-TALENs и TALENs направлено воздействуют на одинаковые последовательности в пределах фрагментов AAVS1.
(b) Столбиковая диаграмма, демонстрирующая процент GFP+ клеток, полученных с помощью только tGFP-донора отдельно, с помощью TALENs с tGFP-донором и re-TALENs с tGFP-донором в локусе-мишени, согласно измерениям с помощью FACS. (N = 3, планки погрешности = SD). Репрезентативные графики FACS показаны ниже.
(с) Схематический обзор, изображающий стратегию направленного воздействия, для нативного локуса AAVS1. Плазмида-донор содержит акцептор сплайсинга (SA) - 2A (саморасщепляющиеся пептиды), ген устойчивости к пуромицину (PURO) и GFP (см. источник 10, включенный в данный документ ссылкой в полном объеме). Места расположения ПЦР-праймеров, используемых для обнаружения успешных событий редактирования, изображены в виде голубых стрелок.
(d) Подвергнутые успешному направленному воздействию клоны PGP1 hiPSCs отбирали на пуромицине (0,5 мкг/мл) в течение 2 недель. Показаны микроскопические изображения трех представительных GFP+ клонов. Клетки также окрашивали по маркерам плюрипотентности TRA-1-60. Измерительная линейка: 200 мкм.
(e) Анализы ПЦР, выполненные на этих моноклональных GFP+ hiPSC клонах, продемонстрировали успешное встраивание донорных кассет в участок AAVS1 (дорожки 1,2,3), в то время как обычные hiPSCs не демонстрировали никаких признаков успешного встраивания (дорожка C).
(f) Отображение последовательности SEQ ID NO: 1.
Фиг. 2 относится к сравнению эффективности направленного воздействия на геном с помощью reTALENs и Cas9-гидРНК на CCR5 в iPSCs.
(а) Схематическое изображение эксперимента по геномной инженерии. В целевой участок пары re-TALEN или Cas9-гидРНК в PGP1 hiPSCs доставляли 90-мер ssODN, несущий 2 п.о. несоответствие относительно геномной ДНК, вместе с конструкциями reTALEN или Cas9-гидРНК. Участки расщепления нуклеазами изображены на фигуре в виде красных стрелок.
(b) Анализ глубоким секвенированием эффективностей HDR и NHEJ для пар re-TALEN (CCR5 #3) и ssODN, или Cas9-гидРНК и ssODN. Изменения в геноме hiPSCs анализировали на основе данных о последовательности, полученной высокопроизводительными способами, с помощью GEAS. Вверху: HDR количественно оценивали из фракции ридов, содержащих 2 п.о. точечные мутации, встроенных в центр ssODN (синий), а активность NHEJ количественно оценивали из фракции делеций (серые)/вставок (красные) в каждом конкретном положении в геноме. Для графиков reTALEN и ssODN, зеленый пунктир нанесен для того, чтобы отметить внешнюю границу участков связывания пар re-TALENs, которые находятся в положениях -26 п.о. и + 26 п.о. относительно центра двух участков связывания re-TALEN. Для графиков Cas9-гидРНК и ssODN, зеленый пунктир отмечает внешнюю границу участка направленного воздействия гидРНК, который находится в положениях -20 и -1 п.о. по отношению к последовательности РАМ. Внизу: распределение по размерам Делеция/Вставка в hiPSCs анализировали по всей популяции NHEJ с обработкой, указанной выше.
(с) Эффективность редактирования генома re-TALENs и Cas9-гидРНК, направленно воздействовавших на CCR5 в PGP1 hiPSCs.
Вверху: схематическое представление участков, подвергшихся направленному редактированию геномов в CCR5. 15 участков для направленного воздействия показаны синими стрелками снизу. Для каждого участка клетки котрансфецировали парой re-TALENs и их соответствующего донорного ssODN, несущего 2 п.о. несовпадение относительно геномной ДНК. Эффективность редактирования генома анализировали через 6 дней после трансфекции. Аналогичным образом, 15 Cas9-гидРНК трансфецировали с соответствующими ssODNs индивидуально в PGP1-hiPSCs для направленного воздействия не те же 15 участков и анализировали эффективность через 6 дней после трансфекции. Внизу: эффективность редактирования генома re-TALENs и Cas9-гидРНК при направленном целевом воздействии на CCR5 в PGP1 hiPSCs. Панели 1 и 2 демонстрируют эффективности NHEJ и HDR, опосредованные reTALENs. Панель 3 и 4 демонстрируют эффективности NHEJ и HDR, опосредованные Cas9-гидРНК. Показатели NHEJ рассчитывали по частоте геномных аллелей, несущих делеции или вставки в подвергнутом направленному воздействию участке; показатели HDR рассчитывали по частоте геномных аллелей, несущих 2 п.о. несоответствия. Панель 5, профиль DNAseI HS для клеточной линии hiPSC из базы данных ENCODE (Duke DNase HS, iPS NIHi7 DS). Следует отметить, что масштабы панелей отличаются.
Фиг. 3 направлена на изучение функциональных параметров, регулирующих ssODN-опосредованную HDR с re-TALENs или Cas9-гидРНК в PGP1 hiPSCs.
(а) PGP1 hiPSCs котрансфецировали с помощью пары re-TALENs (#3) и ssODNs различной длины (50, 70, 90,110, 130 150 170 нуклеотидов). Все ssODNs обладали идентичным 2 п.о. несовпадением относительно геномной ДНК в середине своей последовательности. 90-мерный ssODN достиг оптимального уровня HDR в подвергнутом направленному воздействию геноме. Оценка HDR-, NHEJ-опосредованной эффективности делеции и вставки описана в данном документе.
(b) 90-мерные ssODNs, соответствующие паре re-TALEN # 3, каждая из которых содержит 2 п.о. несовпадение (А) в центре и дополнительное 2 п.о. несовпадение (B) в разных положениях, смещенных от А (где смещения варьировали от -30 п.о. -> 30 п.о.), были использованы для тестирования последствий отклонения от гомологии вдоль ssODN. Эффективность редактирования генома каждого ssODN оценивали в PGP1 hiPSCs. Нижняя столбиковая диаграмма демонстрирует частоту включения только А, только В и А + В в подвергнутом направленному воздействию геноме. Показатели HDR уменьшались по мере увеличения расстояния от центра участка с отклонением по гомологии.
(с) ssODNs, нацеленные на участки с варьирующими расстояниями (-620п.о. ~ 480 п.о.) от участка-мишени пары #3 re-TALEN, были испытаны для оценки максимального расстояния, в пределах которого ssODNs могут быть помещены для введения мутаций. Все ssODNs несли 2 п.о. несоответствие в середине своих последовательностей. Наблюдали минимальную эффективность HDR (<= 0,06%), когда несовпадение в ssODN располагалось на расстоянии 40 п.о. от середины участка связывания пары re-TALEN.
(d) PGP1 hiPSCs котрансфецировали Cas9-гидРНК (AAVS1) и ssODNs различной ориентации (Ос: комлпементарная гидРНК; On: некомплементарная гидРНК) и разной длины (30, 50, 70, 90, 110 нуклеотидов). Все ssODNs обладали идентичными 2 п.о. несовпадениями относительно геномной ДНК в середине своих последовательностей. 70-мерный Ос достигал оптимального значения HDR в подвергнутом направленному воздействию геноме.
Фиг. 4 направлен на использование re-TALENs и ssODNs для получения моноклональных hiPSCс отредактированным геномом без селекции.
(а) Временная шкала эксперимента.
(b) Эффективность редактирования генома пары re-TALENs и ssODN (# 3), оценивали с помощью платформы NGS, описанной на фигуре 2b.
(с) Результаты секвенирования по Сенгеру колоний моноклональных hiPSC после редактирования генома. 2 п.о. гетерогенный генотип (CT/CT->TA/CT) был успешно внедрен в геном колоний PGP 1-IPS-3-11, PGPl-IPS-3-13.
(d) Иммунофлуоресцентное окрашивание подвергнутых направленному воздействию PGPl-IPS-3-11. Клетки окрашивали на маркеры плюрипотентности TRA-1-60 и SSEA4.
(e) Гематоксилин-эозиновое окрашивание срезов тератом, полученных из моноклональных клеток PGPl-IPS-3-11.
Фиг. 5. Дизайн reTALE. (a) Выравнивание последовательности исходного мономера TALE RVD относительно мономеров в re-TALE-16.5 (re-TALE-M1>re-TALE-M17). Нуклеотидные изменения относительно исходной последовательности выделены серым, (b) Тест повторяемости re-TALE с помощью ПЦР. Верхняя панель показывает структуру re-TALE/TALE и позиции праймеров для ПЦР-реакции. Нижняя панель показывает полосы ПЦР в условиях, указанных ниже. Электрофоретическая картина фрагментов ПЦР представлена с помощью исходного шаблона TALE (правая дорожка).
Фиг. 6. Дизайн и практическое осуществление сборки TASA (TALE Single-incubation Assembly), (а) Схематическое представление библиотеки димерных блоков re-TALE для сборки TASA. Представлена библиотека 10 димерных блоков re-TALE, кодирующих два RVDs. Внутри каждого блока, все 16 димеров имеют одну и ту же последовательность, за исключением последовательностей, кодирующих RVD; Димеры в различных блоках имеют отличающиеся последовательности, но спроектированы таким образом, чтобы они имели общие 32 п.о. перекрывания с соседними блоками. Нуклеотидная и аминокислотная последовательности одного димера (Блок 6_AC) представлены справа.
(b) Схематическое представление сборки TASA. На левой панели показан способ сборки TASA: однореакторная реакция инкубации проводится с ферментной смесью/re-TALE блок s/re-TALE-N/TF каркасными векторами. Продукт реакции может быть использован непосредственно для трансформации бактерий. Правая панель демонстрирует механизм TASA. Вектор назначения линеаризуется эндонуклеазой при 37°С для того, чтобы отрезать контрселективную кассету ccdB; экзонуклеаза, которая обрабатывает конец блоков и линеаризованных векторов, экспонирует оцДНК выступы на конце фрагментов, что позволяет блокам и векторным каркасам соединяться в назначенном порядке. При повышении температуры до 50°С, полимеразы и лигазы работают вместе для того, чтобы заделать разрыв, что позволяет получить конечные конструкции, готовые к трансформации.
(с) Эффективность сборки TASA для re-TALEs, обладающих разными длинами мономеров. Используемые для сборки блоки показаны слева, а эффективность сборки представлена справа.
Фиг. 7. Функциональность и целостность последовательности Lenti-reTALEs. Клетки 293T, трансдуцированные lenti-re-TALE-TF показали 36x активацию экспрессии репортера по сравнению с только отрицательным репортером.
Фиг. 8. Чувствительность и воспроизводимость GEAS.
(А) Информационный анализ предела обнаружения HDR. С учетом набора данных re-TALENs (# 10)/ssODN, были определены «риды», содержащие ожидаемое редактирование (HDR) и эти HDR-«риды» систематически удалялись для создания различных искусственных наборов данных с «разведенным» редактирующим сигналом. Наборы данных с 100, 99,8, 99,9, 98,9, 97,8, 89,2, 78,4, 64,9, 21,6, 10,8, 2,2, 1,1, 0,2, 0,1, 0,02 и 0% удалением HDR-«ридов» были сгенерированы для получения искусственных наборов с эффективностью HR в диапазоне 0-0,67%. Для каждого отдельного набора данных, была оценена взаимная информация (mutual information, MI) фонового сигнала (обозначено фиолетовым) и сигнала, полученного в участке направленного воздействия (обозначено зеленым). MI в участке направленного воздействия заметно выше, чем фон, при этом эффективность HDR выше 0,0014%. По оценке предел обнаружения HDR находится в диапазоне от 0,0014% до 0,0071%. Расчет MI описан в данном документе.
(b) Тест воспроизводимости системы оценки редактирования генома. Пары графиков (верхний и нижний) демонстрируют результаты оценки HDR и NHEJ в двух повторах с парой re-TALENs и типом клеток, указанным выше. Для каждого эксперимента независимо были проведены нуклеофекция, направленная амплификация генома, глубокое секвенирование и анализ данных. Разброс повторов при оценке редактирования генома рассчитывали как V2 (|HDRl-HDR2|)/((HDR+HDR2)/2) =AHDR/HDR и V2 (|NHEJ1-NHEJ2|) /((NHEJl+NHEJ2)/2) =ANHEJ/NHEJ, а результаты по разбросу приведены ниже графиков. Средний разброс системы составил (19% + 11% + 4% + 9% + 10% + 35%)/6 = 15%. Факторы, которые могут способствовать разбросу, включают статус клеток при нуклеофекции, эффективность нуклеофекции, охват и качество секвенирования.
Фиг. 9. Статистический анализ эффективностей NHEJ и HDR при использовании reTALENs и Cas9-гидРНК на CCR5.
(а) Корреляция эффективностей HR и NHEJ при использовании reTALENs на одинаковых участках в iPSCs (i= 0,91, P <IX 10-5).
(b) Корреляция эффективностей HR и NHEJ, опосредованных Cas9-гидРНК на одинаковых участках в iPSCs (i= 0,74, р = 0,002).
(с) Корреляция эффективности NHEJ, опосредованной Cas9-гидРНК и температуры Tm целевого участка для гидРНК в iPSCs (г = 0,52, р = 0,04)
Фиг. 10. Корреляционный анализ эффективности редактирования генома и эпигенетического состояния. Корреляции Пирсона использовали для изучения возможных связей между чувствительностью ДНКазы I и эффективностью геномной инженерии (HR, NHEJ). Наблюдаемую корреляцию сравнивали с рандомизированным набором (N = 100000). Наблюдаемые корреляции выше 95-го процентиля или ниже 5-го процентиля моделируемого распределения считались потенциальными ассоциациями. Не наблюдали заметной корреляции между чувствительностью ДНКазы 1 и эффективностью NHEJ/HR.
Фиг. 11. Влияние гомологичного спаривания при ssODN-опосредованном редактировании генома.
(а) В эксперименте, описанном на рисунке 3b, общая HDR снижалось, что измерялось по темпам, с которыми происходило включение среднего 2 п.о. несовпадения (А), по мере того, как росла дистанция на которую вторичные несовпадения В удалялись от А (относительное положение В по отношению к А, к варьирует от -30 до 30 п.о.). Более высокие темпы включения, когда В находится всего лишь в 10 п.о. от A (-10 п.о. и + 10 п.о.) могут отражать меньшую потребность в спаривании ssODN против геномной ДНК, проксимальной к двухцепочечному разрыву ДНК.
(b) Распределение длин генной конверсии вдоль ssODN. На каждом расстоянии В от А, доля событий HDR включает только А, тогда как друга доля включает как А, так и В. Эти два события могут интерпретироваться в терминах трактов конверсии генов (Elliott et al., 1998), в результате чего A+B-события представляют длинные конверсионные тракты, которые выходят за рамки только В и только А событий, представляющие более короткие пути, которые не достигают В. Согласно данной интерпретации, может быть оценено распределение трактов генной конверсии в обоих направлениях вдоль олигонуклеотида (середина ssODN определяется как 0, конверсионные тракты по направлению к 5'-концу ssODN - как «-» направление, а к 3'-концу - как «+» направление). Тракты генной конверсии постепенно уменьшаются по мере увеличения их длин, результат очень похожий на распределение трактов генной конверсии, наблюдаемое с дцДНК-донорами, но на сильно сжатой шкала дистанций в десятки п.о. для одноцепочечных олигодезоксинуклеотидов по сравнению с сотнями пар оснований для дцДНК-доноров.
(с) Анализы трактов генной конверсии с использованием одиночного ssODN, который содержит ряд мутаций, и измерение непрерывных последовательностей включений. Использовали ssODN-донор с тремя парами 2 п.о. несовпадений (оранжевый), разнесенных с интервалом в 10 нуклеотидов в обе стороны от центрального 2 п.о. несовпадения (вверху). Было обнаружено незначительное количество «ридов» геномного секвенирования (см. источник 62, включенный в данный документ ссылкой в полном объеме), несущих >=1 несовпадения, определенных с помощью ssODN среди> 300 000 «ридов» при секвенировании этой области. Все эти «риды» были нанесены на график (внизу), а последовательность «ридов» была закодирована условной окраской. Оранжевый: определенные несоответствия; зеленый: последовательность дикого типа. Геномное редактирование с этими ssODN дало паттерн, в котором средняя мутация отдельно была включена в 85% (53/62) моментов времени, с множеством В- несовпадений, включенных в другие моменты. Хотя количество событий В-включений было слишком низким для оценки распределения длин путей > 10 п. о., ясно, что преобладает область коротких путей от -10 до 10 п.о.
Фиг. 12. Эффективности редактирования генома Cas9-гидРНК нуклеазой и никазами.
PGP1 iPSCs котрансфецировали комбинацией нуклеазы (С2) (Cas9-гидРНК) или никазы (Cс) (Cas9D10A-гидРНК) и ssODNs различной ориентации (Oс и On). Все ssODNs обладали идентичным 2 п.о. несовпадением относительно геномной ДНК в середине своей последовательности. Оценка HDR описана в данном документе.
Фиг. 13. Дизайн и оптимизация последовательности re-TALE.
Последовательность re-TALE подвергали эволюции в течение нескольких циклов дизайна для устранения повторов. В каждом цикле оценивали синонимичные последовательности из каждого повтора. Отбирали те из них, которые имели наибольшее расстояние Хэмминга к эволюционирующей ДНК. Окончательная последовательность имела cai = 0,59 ΔG = -9,8 ккал/моль. Для выполнения общей основы для дизайна синтетического белка использовали пакет R.
Фиг. 14 представляет собой изображение геля, демонстрирующее проверку с помощью ПЦР геномной вставки Cas9 в клетки PGP1. Дорожки 3, 6, 9, 12 являются продуктами ПЦР обычных клеточных линий PGP1.
Фиг. 15 представляет собой график уровня экспрессии мРНК Cas9 при индукции.
Фиг. 16 представляет собой график, показывающий эффективность направленного воздействия на геном РНК с различным дизайном.
Фиг. 17 представляет собой график, показывающий эффективность направленного воздействия на геном 44% гомологичной рекомбинации, достигнутой с помощью химеры направляющей РНК- донорной ДНК.
Фиг. 18 является схемой, демонстрирующей генотип изогенных клеточных линий PGP 1, полученных с помощью системы, описанной в данном документе. PGPl-IPS-BTHH имеет фенотип с однонуклеотидными делециями, как у пациентов с BTHH. PGP 1-NHEJ имеет 4 п.о. делеции, которые образуют мутации со сдвигом рамки считывания другим образом.
Фиг. 19 представляет собой график, показывающий, что кардиомиоциты, полученные из изогенных PGP1 iPS, воспроизводят дефектную выработку АТФ и специфическую активность F1F0 АТФазы, как продемонстрировано в пациент-специфических клетках.
Фиг. 20 показывает последовательности для последовательности re-TALEN-основной и основной последовательности re-TALE-TF.
Подробное описание
Аспекты настоящего изобретения относятся к применению TALEN, которая утратила определенные повторяющиеся последовательности, для инженерии нуклеиновых кислот, например, путем расщепления двухцепочечной нуклеиновой кислоты. Применение TALEN для расщепления двухцепочечной нуклеиновой кислоты может привести к негомологичному соединению концов (NHEJ) или к гомологичной рекомбинации (HR). Аспекты настоящего раскрытия также предусматривают применение TALEN, которая утратила повторяющиеся последовательности, для инженерии нуклеиновых кислот, например, путем расщепления двухцепочечной нуклеиновой кислоты в присутствии донорной нуклеиновой кислоты и введения донорной нуклеиновой кислоты в двухцепочечную нуклеиновую кислоту, например, путем негомологичного соединения концов (NHEJ) или гомологичной рекомбинации (HR).
Эфеекторные нуклеазы, подобные активаторам транскрипции (TALEN) известны в данной области техники и включают искусственные ферменты рестрикции, полученные слиянием ДНК-связывающего домена TAL-эффектора с ДНК-расщепляющим доменом. Ферменты рестрикции являются ферментами, которые разрезают цепи ДНК в определенной последовательности. Эффекторы, подобные активаторам транскрипции (TALE) могут быть сконструированы для связывания с искомой последовательностью ДНК. См. Boch, Jens (February 2011). "TALEs of genome targeting". Nature Biotechnology 29 (2): 135-6, включенный в данный документ ссылкой в полном объеме. Путем объединения такого сконструированного TALE с ДНК-расщепляющим доменом (который разрезает нити ДНК), получается TALEN, которая является ферментом рестрикции, специфичным к любой искомой последовательности ДНК. В соответствии с некоторыми аспектами, TALEN вводят в клетку для целевого редактирования нуклеиновой кислоты in situ, например, для редактирования генома in situ.
Согласно одному аспекту, неспецифический ДНК-расщепляющий домен с конца эндонуклеазы FokI может быть использован для создания гибридных нуклеаз, которые активны в клетках дрожжей, растений и животных. Домен FokI функционирует в виде димера, требующего две конструкции с уникальными ДНК-связывающими доменами для участков в геноме-мишени с правильной ориентацией и расстоянием. Как число аминокислотных остатков между TALE ДНК-связывающим доменом и расщепляющим доменом Fokl, так и количества оснований между двумя отдельными участками связывания TALEN оказывают влияние на активность.
Взаимоотношение между аминокислотной последовательностью и распознаванием ДНК связывающим доменом TALE позволяет создавать конструируемые белки. Компьютерные программы, такие как «DNA Works» могут быть использованы для разработки TALE-конструкций. Другие способы разработки TALE-конструкций известны специалистам в данной области техники. См. Cermak, Т. ; Doyle, E. L. ; Christian, M. ; Wang, L. ; Zhang, Y. ; Schmidt, C; Bailer, J. A. ; Somia, N. V. et al. (2011). "Efficient design and assembly of custom TALEN and other TAL effector-based constructs for DNA targeting". Nucleic Acids Research. doi:10. 1093/nar/gkr218; Zhang, Feng; et. al. (February 2011). "Efficient construction of sequence-specific TAL effectors for modulating mammalian transcription", Nature Biotechnology 29 (2): 149-53; Morbitzer, R. ; Elsaesser, J. ; Hausner, J. ; Lahaye, T. (2011). "Assembly of custom TALE-type DNA binding domains by modular cloning". Nucleic Acids Research. doi:10'1093/nar/gkrl51; Li, Т. ; Huang, S. ; Zhao, X. ; Wright, D. A. ; Carpenter, S. ; Spalding, M. H. ; Weeks, D. P. ; Yang, B. (2011). "Modularly assembled designer TAL effector nucleases for targeted gene knockout and gene replacement in eukaryotes". Nucleic Acids Research. doi"10. 1093/nar/gkrl88; GeipTer, R. ; Scholze, H. ; Hahn, S. ; Streubel, J. ; Bonas, U. ; Behrens, S. E. ; Boch, J. (2011). "Transcriptional Activators of Human Genes with Programmable DNA-Specificity". In Shiu, Shin-Han. PLoS ONE 6 (5): el9509; Weber, E. ; Graetzner, R. ; Werner, S. ; Engler, C; Marillonnet, S. (2011). "Assembly of Designer TAL Effectors by Golden Gate Cloning". In Bendahmane, Mohammed. PLoS One 6 (5): el9722, которые включены в данный документ ссылкой в полном объеме.
В соответствии с типичным аспектом, сразу после сборки гены TALEN можно вставлять в плазмиды, в соответствии с определенными воплощениями; плазмиды затем используются для трансфекции клетки-мишени, при этом генные продукты экспрессируются и входят в ядро для доступа к геному. Согласно типичным аспектам, TALEN, как описано в данном документе, могут быть использованы для редактирования целевой нуклеиновой кислоты, например, генома, с помощью индукции двухцепочечных разрывов (DSB), на которые клетки реагируют посредством механизмов репарации. Примерные механизмы репарации включают негомологичное соединение концов (NHEJ), который восстанавливает ДНК по обе стороны от двухцепочечного разрыва, где имеется весьма незначительное перекрывание для отжига, или такое перекрывание отсутствует вовсе. Этот репаративный механизм индуцирует ошибки в геноме, через вставку или делецию (indel), или хромосомную перестройку; такие ошибки могут сделать генные продукты, кодируемые в данном месте, нефункциональными. См. Miller, Jeffrey; et. al. (February 2011). "A TALE nuclease architecture for efficient genome editing". Nature Biotechnology 29 (2): 143-8, включенный в данный документ ссылкой в полном объеме. Поскольку эта активность может изменяться в зависимости от используемых вида, типа клеток, гена-мишени, и нуклеазы, активность можно контролировать с помощью анализа гетеродуплексного расщепления, который не обнаруживает никакой разницы между двумя аллелеями, амплифицированными с помощью ПЦР. Продукты расщепления могут быть визуализированы на простом агарозном геле или блочной гелевой системе.
В ином случае, ДНК может быть введена в геном посредством NHEJ в присутствии экзогенных фрагментов двухцепочечной ДНК. Управляемая гомологией репарация также может ввести чужеродную ДНК в DSB, поскольку трансфецированные двухцепочечные последовательности используются в качестве шаблонов для ферментов репарации. В соответствии с некоторыми аспектами, TALEN, описанные в данном документе, могут быть использованы для получения стабильно модифицированных человеческих эмбриональных стволовых клеток и клонов индуцированных плюрипотентных стволовых клеток (iPSCs). В соответствии с некоторыми аспектами, TALEN, описанные в данном документе, могут быть использованы для получения нокаутных видов, таких как C. elegans, нокаутные крысы, нокаутные мыши или нокаутные данио-рерио.
Согласно одному аспекту настоящего раскрытия, воплощения нацелены на применение экзогенной ДНК, нуклеазных ферментов, таких как ДНК-связывающие белки и направляющие РНК, для колокализации с ДНК в стволовой клетке и гидролиза или разрезания ДНК с вставкой экзогенной ДНК. Такие ДНК-связывающие белки хорошо известны специалистам в данной области техники, для связывания с ДНК для различных целей. Такие ДНК-связывающие белки могут быть природными. ДНК-связывающие белки, включенные в объем настоящего изобретения, включают те, которые могут направляться РНК, которые называются в данном документе как направляющие РНК. Согласно этому аспекту, направляющая РНК и РНК-направляемый ДНК-связывающий белок образуют комплекс колокализации на ДНК. Такие ДНК-связывающие белки, обладающие нуклеазной активностью, известны специалистам в данной области техники, и включают природные ДНК-связывающие белки, имеющие нуклеазную активность, такие как белки Cas9, присутствующие, например, в системах CRISPR II типа. Такие белки Cas9 и системы CRISPR типа II хорошо описаны в данной области техники. См. Makarova et al., Nature Reviews, Microbiology, Vol. 9, June 2011, pp. 467-477 включая всю дополнительную информацию, включенный в данный документ ссылкой в полном объеме.
Типичные ДНК-связывающие белки имеют функцию нуклеазной активности для внесения одноцепочечных разрывов (ников) или разрезания двухцепочечной ДНК. Такая нуклеазная активность может быть результатом действия ДНК-связывающего белка, имеющего одну или несколько полипептидных последовательностей, демонстрирующих нуклеазную активность. Такие типичные ДНК-связывающие белки могут иметь два отдельных нуклеазных домена, при этом каждый домен отвечает за разрезание или внесение одноцепочечных разрывов конкретной цепи двухцепочечной ДНК. Типичные полипептидные последовательности, имеющие нуклеазную активность, известные специалистам в данной области, включают домен, родственный нуклеазе McrA-HNH и домен RuvC-подобной нуклеазы. Соответственно, типичными ДНК-связывающими белками являются те, которые по своей природе содержат один или несколько из числа домена, родственного нуклеазе McrA-HNH и домен RuvC-подобной нуклеазы.
Типичный ДНК-связывающий белок представляет собой РНК управляемый ДНК-связывающий белок системы CRISPR II типа. Типичный ДНК-связывающий белок представляет собой белок Cas9.
В S. pyogenes, Cas9Сas9 образует двухцепочечной разрыв с тупыми концами на 3 п.о. выше мотива PAM (прилегающий к протоспейсеру мотив) с помощью процесса, опосредованного двумя каталитическими доменами в белке: доменом HNH, который расщепляет комплементарную нить ДНК и доменом подобного RuvC, который расщепляет некомплементарную цепь. См. Jinke et al., Science, 337, 816-821 (2012), включенный в данный документ ссылкой в полном объеме. Белки Cas9, как известно, существуют во многих системах CRISPR типа II, включая те, которые определены в дополнительных документах к Makarova et al., Nature Reviews, Microbiology, Vol. 9, June 2011, pp. 467-477: Methanococcus maripaludis C7; Corynebacterium diphtheriae; Corynebacterium efficiens YS-314; Corynebacterium glutamicum ATCC 13032 Kitasato; Corynebacterium glutamicum ATCC 13032 Bielefeld; Corynebacterium glutamicum R; Corynebacterium kroppenstedtii DSM 44385; Mycobacterium abscessus ATCC 19977; Nocardia farcinica IFM10152; Rhodococcus erythropolis PR4; Rhodococcus jostii RHA1; Rhodococcus opacus B4 uid36573; Acidothermus cellulolyticus 11B; Arthrobacter chlorophenolicus A6; Kribbella flavida DSM 17836 uid43465; Thermomonospora curvata DSM 43183; Bifidobacterium dentium Bdl; Bifidobacterium longum DJO10A; Slackia heliotrinireducens DSM 20476; Persephonella marina EX HI; Bacteroides fragilis NCTC 9434; Capnocytophaga ochracea DSM 7271; Flavobacterium psychrophilum JIP02 86; Akkermansia muciniphila ATCC BAA 835; Roseiflexus castenholzii DSM 13941; Roseiflexus RSI; Synechocystis PCC6803; Elusimicrobium minutum Peil91; бактериальный филотип Rs D17 некультивированной группы 1 Termite; Fibrobacter succinogenes S85; Bacillus cereus ATCC 10987; Listeria innocua;Lactobacillus casei; Lactobacillus rhamnosus GG; Lactobacillus salivarius UCC118; Streptococcus agalactiae A909; Streptococcus agalactiae NEM316; Streptococcus agalactiae 2603; Streptococcus dysgalactiae equisimilis GGS 124; Streptococcus equi zooepidemicus MGCS10565; Streptococcus gallolyticus UCN34 uid46061; Streptococcus gordonii Challis subst CHI; Streptococcus mutans NN2025 uid46353; Streptococcus mutans; Streptococcus pyogenes Ml GAS; Streptococcus pyogenes MGAS5005; Streptococcus pyogenes MGAS2096; Streptococcus pyogenes MGAS9429; Streptococcus pyogenes MGAS10270; Streptococcus pyogenes MGAS6180; Streptococcus pyogenes MGAS315; Streptococcus pyogenes SSI-1; Streptococcus pyogenes MGAS 10750; Streptococcus pyogenes NZ131; Streptococcus thermophiles CNRZ1066; Streptococcus thermophiles LMD-9; Streptococcus thermophiles LMG 18311; Clostridium botulinum A3 Loch Maree; Clostridium botulinum В Eklund 17B; Clostridium botulinum Ba4 657; Clostridium botulinum F Langeland; Clostridium cellulolyticum H10; Finegoldia magna ATCC 29328; Eubacterium rectale ATCC 33656; Mycoplasma gallisepticum; Mycoplasma mobile 163K; Mycoplasma penetrans; Mycoplasma synoviae 53; Streptobacillus moniliformis DSM 12112; Bradyrhizobium BTAil; Nitrobacter hamburgensis X14; Rhodopseudomonas palustris BisB18; Rhodopseudomonas palustris BisB5; Parvibaculum lavamentivorans DS-1; Dinoroseobacter shibae DFL 12; Gluconacetobacter diazotrophicus Pal 5 FAPERJ; Gluconacetobacter diazotrophicus Pal 5 JGI; Azospirillum B510 uid46085; Rhodospirillum rabram ATCC 11170; Diaphorobacter TPSY uid29975; Verminephrobacter eiseniae EF01-2; Neisseria meningitides 053442; Neisseria meningitides alphal4; Neisseria meningitides Z2491; Desulfovibrio salexigens DSM 2638; Campylobacter jejuni doylei 269 97; Campylobacter jejuni 81116; Campylobacter jejuni; Campylobacter lari RM2100; Helicobacter hepaticus; Wolinella succinogenes; Tolumonas auensis DSM 9187; Pseudoalteromonas atlantica T6c; Shewanella pealeana ATCC 700345; Legionella pneumophila Paris; Actinobacillus succinogenes 130Z; Pasteurella multocida; Francisella tularensis novicida U112; Francisella tularensis holarctica; Francisella tularensis FSC 198; Francisella tularensis tularensis; Francisella tularensis WY96-3418; и Treponema denticola ATCC 35405. Соответственно, аспекты настоящего раскрытия направлены на белок Cas9, присутствующий в системе CRISPR II типа.
Белок Cas9 может быть назван специалистом в данной области литературы как Csn1. Белок Cas9 из S. pyogenes показан ниже. См. Deltcheva et al., Nature 471, 602-607 (2011), включенный в данный документ ссылкой в полном объеме.

Согласно одному аспекту, управляемый РНК ДНК-связывающий белок включает гомологи и ортологи Cas9, которые сохраняют способность белка связываться с ДНК, быть управляемыми РНК и разрезать ДНК. Согласно одному аспекту, белок Cas9 включает последовательность, которая представлена в естественном белке Cas9 из S. pyogenes и белковых последовательностях, гомологичных, по меньшей мере, на 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95 %, 98% или 99% к этому белку, и, являющихся ДНК-связывающим белком, таким как направляемый РНК ДНК-связывающий белок.
Согласно одному аспекту предлагается сконструированная система Cas9-гидРНК, которая позволяет осуществить направляемое РНК разрезание генома сайт-специфическим образом в стволовой клетке, при необходимости, и модификацию генома стволовой клетки путем вставки экзогенных донорных нуклеиновых кислот. Направляющие РНК являются комплементарными к участкам-мишеням или локусам-мишеням на ДНК. Направляющие РНК могут быть химерами crRNA-tracrRNA. Направляющие РНК могут быть введены из среды, окружающей клетки. Таким образом, предлагается способ непрерывной модификации клетки, которая осуществляется при внесении направляющих РНК в окружающую среду и при поглощении данных направляющих РНК и при обогащении среды дополнительными направляющими РНК. Обогащение может идти непрерывно. Cas9 связывается с или около ДНК-мишени в геноме. Одна или несколько направляющих РНК связываются с или около ДНК-мишени в геноме. Cas9 разрезает ДНК-мишень в геноме и экзогенная донорская ДНК встраивается в ДНК в месте разреза.
Соответственно, способы направлены на применение направляющей РНК с белком Cas9 и экзогенной донорной нуклеиновой кислотой для мультиплексных вставок экзогенных донорных нуклеиновых кислот в ДНК стволовой клетки, экспрессирующей Cas9, посредством циклической вставки нуклеиновой кислоты, кодирующей РНК (или путем предоставления РНК из окружающей среды) и экзогенной донорной нуклеиновой кислоты, экспрессирующей РНК (или путем поглощения РНК), колокализации РНК, Cas9 и ДНК таким образом, чтобы происходило разрезание ДНК, и вставки экзогенной донорной нуклеиновой кислоты. Стадии способа могут быть циклически повторены любое необходимое количество раз для получения необходимого количества модификаций ДНК. Способы настоящего описания соответственно направлены на редактирование генов-мишеней с помощью белков Cas9 и направляющих РНК, описанных в данном документе, с целью осуществления мультиплексной генетической и эпигенетической инженерии стволовых клеток.
Дальнейшие аспекты настоящего описания направлены на применение ДНК-связывающих белков или систем (например, модифицированных TALENs или Cas9, описанных в данном документе) в целом для мультиплексной вставки экзогенных донорных нуклеиновых кислот в ДНК, такую как геномная ДНК стволовой клетки, например, человеческой стволовой клетки. Специалист в данной области техники легко определит типичные ДНК-связывающие системы на основании настоящего описания.
Клетки в соответствии с настоящим описанием, если не указано иное, включают любую клетку, в которую могут быть введены и в которой могут быть экспрессированы чужеродные нуклеиновые кислоты, как описано в данном документе. Следует понимать, что основные принципы настоящего раскрытия, описанные в данном документе, не ограничиваются типом клеток. Клетки, согласно настоящему изобретению, включают соматические клетки, стволовые клетки, эукариотические клетки, прокариотические клетки, клетки животных, растительные клетки, клетки грибов, клетки, клетки архей, клетки эубактерий и т. п. Клетки включают эукариотические клетки, такие как дрожжевые клетки, растительные клетки и клетки животных. Конкретные клетки включают клетки млекопитающих, такие как клетки человека. Кроме того, клетки включают любую клетку, в которой было бы выгодно или желательно модифицировать ДНК.
Нуклеиновой кислоты включают любую последовательность нуклеиновой кислоты, в случае которой TALEN или направляемый РНК ДНК-связывающий белок, обладающий нуклеазной активностью, как описано в данном документе, могут быть полезны для внесения одноцепочечных разрывов или разрезания. Нуклеиновые кислоты-мишени включают любую последовательность нуклеиновой кислоты, в случае которой комплекс колокализации, как описано в данном документе, может быть полезен для внесения одноцепочечных разрывов или разрезания. Нуклеиновые кислоты-мишени включают гены. Для целей настоящего описания, ДНК, такая как двухцепочечная ДНК, может включать нуклеиновую кислоту-мишень, а комплекс колокализации может связываться или иным образом колокализоваться с ДНК или TALEN может в ином случае связываться с ДНК в или в непосредственной близости или вблизи нуклеиновой кислоты-мишени таким образом, чтобы комплекс колокализации или TALEN оказывали искомый эффект на нуклеиновую кислоту-мишень. Такие нуклеиновые кислоты-мишени могут включать эндогенную (или естественную) нуклеиновую кислоту и экзогенную (или чужеродную) нуклеиновую кислоту. Специалист на основе настоящего описания легко идентифицирует или разработает направляющие РНК и белки Cas9, которые колокализуются с ДНК или TALEN, которые связываются с ДНК, включающей нуклеиновую кислоту-мишень. Специалист также будет способен идентифицировать транскрипционные регуляторные белки или домены, такие как транскрипционные активаторы или транскрипционные репрессоры, которые аналогичным образом колокализуются с ДНК, включающей нуклеиновую кислоту-мишень. ДНК включает геномную ДНК, митохондриальную ДНК, вирусную ДНК или экзогенную ДНК. Согласно одному аспекту, материалы и способы, используемые при практическом осуществлении настоящего изобретения, включают те, которые описаны в Di Carlo, et al., Nucleic Acids Research, 2013, vol. 41, No. 7 4336-4343, включенном в данный документ ссылкой в полном объеме и для всех целей, включая типичные штаммы и среды, плазмидные конструкции, трансформацию плазмид, электропорацию транзиторной гидРНК-кассеты и донорных нуклеиновых кислот, трансформацию гидРНК-плазмиды с донорной ДНК в Cas9-экспрессирующие клетки, индукцию Cas9 галактозой, определение мишеней CRISPR-Cas в геноме дрожжей, и т. д. Дополнительные источники, включая информацию, материалы и методы, полезные для специалиста в данной области при осуществлении изобретения, приведены в Mali,P., Yang,L., Esvelt,K. M., Aach,J., Guell,M., DiCarlo,J. E., Norville,J. E. and Church,G. M. (2013) RNA-Guided human genome engineering via Cas9. Science, 10. 1126fscience. 1232033; Storici,F., Durham,C. L., Gordenin,D. A. and Resnick,M. A. (2003) Chromosomal site-specific double-strand breaks are efficiently targeted for repair by oligonucleotides in yeast. PNAS, 100, 14994-14999 and Jinek,M., Chylinski,K., Fonfara,l., Hauer,M., Doudna,J. A. and Charpentier,E. (2012) A programmable dual-RNA-Guided DNA endonuclease in adaptive bacterial immunity. Science, 337, 816-821, каждый из которых включен в данное описание ссылкой в полном объеме и для всех целей.
Чужеродные нуклеиновые кислоты (т. е. те, которые не являются частью природной композиции нуклеиновых кислот клетки) могут быть введены в клетку с помощью любого способа, известного специалистам в данной области техники для такого введения. Такие способы включают трансфекцию, трансдукцию, вирусную трансдукцию, микроинъекции, липофекцию, нуклеофекцию, бомбардировку наночастицами, трансформацию, конъюгацию и т. п. Специалисту в данной области техники легко понять и адаптировать такие способы, с помощью легко идентифицируемых литературных источников.
Донорные нуклеиновые кислоты включают любую нуклеиновую кислоту, которая будет вставлена в последовательность нуклеиновой кислоты, как описано в данном документе.
Следующие примеры приведены в качестве типичных образцов настоящего описания. Эти примеры не должны быть истолкованы как ограничивающие объем настоящего описания, поскольку они и другие эквивалентные воплощения будут очевидны в свете настоящего описания, чертежей и сопровождающей формулы изобретения.
Пример I
Сборка направляющей РНК
19 п.о. выбранной последовательности-мишени (т. е. 5'-N19 5'-N19-NGG-3 ') были включены в два комплементарных олигонуклеотида 100-мера
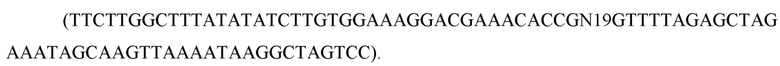
Каждый олигонуклеотид 100-мер суспендировали в концентрации 100 мМ в воде, смешивали с равным объемом и гибридизовали в термоциклере (95°С, 5 мин; линейное уменьшение до 4°С, 0,1°С/сек). Для приготовления вектор назначения, клонирующий вектор с гидРНК (Addgene plasmid ID 41824) линеаризовали с помощью AflII и очищали вектор. Реакцию сборки (10 мкл) гидРНК проводили с 10 нг соединившегося 100 п.о. фрагмента, 100 нг каркаса назначения, IX реакционной смеси для сборки Gibson (New England Biolabs) при 50°С в течение 30 мин. Продукт реакция может быть сразу же трансформирован в бактерии для получения колоний отдельных сборок.
Пример II
Дизайн и Сборка перекодированных TALE
re-TALEs были оптимизированы на разных уровнях для облечения сборки, а также для улучшения экспрессии. ДНК-последовательности вначале вместе оптимизировали для приближения к частоте использования кодонов у человека, и низкой энергии сворачивания мРНК на 5'-конце (GeneGA, Bioconductor). Полученную последовательность подвергали эволюции в течение нескольких циклов для устранения повторов (прямых или инвертированных) длиннее, чем 11 п.о. (см. Фиг. 12). В каждом цикле оценивали синонимичные последовательности для каждого повтора. Отбирали те, у которых было наибольшее расстояние Хэмминга к эволюционирующей ДНК. Последовательность одного из re-TALE, обладающего 16,5 мономерами представлена ниже
CTAACCCCTGAACAGGTAGTCGCTATAGCTTCAAATATCGGGGGCAAGCAAGCACTTGAGACCGTTCAACGACTCCTGCCAGTGCTCTGCCAAGCCCATGGATTGACTCCGGAGCAAGTCGTCGCGATCGCGAGCAACGGCGGGGGGAAGCAGGCGCTGGAAACTGTTCAGAGACTGCTGCCTGTACTTTGTCAGGCGCATGGTCTCACCCCCGAACAGGTTGTCGCAATAGCAAGTAATATAGGCGGTAAGCAAGCCCTAGAGACTGTGCAACGCCTGCTCCCCGTGCTGTGTCAGGCTCACGGTCTGACACCTGAACAAGTTGTCGCGATAGCCAGTCACGACGGGGGAAAACAAGCTCTAGAAACGGTTCAAAGGTTGTTGCCCGTTCTGTGCCAAGCACATGGGTTAACACCCGAACAAGTAGTAGCGATAGCGTCAAATAACGGGGGTAAACAGGCTTTGGAGACGGTACAGCGGTTATTGCCGGTCCTCTGCCAGGCCCACGGACTTACGCCAGAACAGGTGGTTGCAATTGCCTCCAACATCGGCGGGAAACAAGCGTTGGAAACTGTGCAGAGACTCCTTCCTGTTTTGTGTCAAGCCCACGGCTTGACGCCTGAGCAGGTTGTGGCCATCGCTAGCCACGACGGAGGGAAGCAGGCTCTTGAAACCGTACAGCGACTTCTCCCAGTTTTGTGCCAAGCTCACGGGCTAACCCCCGAGCAAGTAGTTGCCATAGCAAGCAACGGAGGAGGAAAACAGGCATTAGAAACAGTTCAGCGCTTGCTCCCGGTACTCTGTCAGGCACACGGTCTAACTCCGGAACAGGTCGTAGCCATTGCTTCCCATGATGGCGGCAAACAGGCGCTAGAGACAGTCCAGAGGCTCTTGCCTGTGTTATGCCAGGCACATGGCCTCACCCCGGAGCAGGTCGTTGCCATCGCCAGTAATATCGGCGGAAAGCAAGCTCTCGAAACAGTACAACGGCTGTTGCCAGTCCTATGTCAAGCTCATGGACTGACGCCCGAGCAGGTAGTGGCAATCGCATCTCACGATGGAGGTAAACAAGCACTCGAGACTGTCCAAAGATTGTTACCCGTACTATGCCAAGCGCATGGTTTAACCCCAGAGCAAGTTGTGGCTATTGCATCTAACGGCGGTGGCAAACAAGCCTTGGAGACAGTGCAACGATTACTGCCTGTCTTATGTCAGGCCCATGGCCTTACTCCTGAGCAAGTCGTAGCTATCGCCAGCAACATAGGTGGGAAACAGGCCCTGGAAACCGTACAACGTCTCCTCCCAGTACTTTGTCAAGCACACGGGTTGACACCGGAACAAGTGGTGGCGATTGCGTCCAACGGCGGAGGCAAGCAGGCACTGGAGACCGTCCAACGGCTTCTTCCGGTTCTTTGCCAGGCTCATGGGCTCACGCCAGAGCAGGTGGTAGCAATAGCGTCGAACATCGGTGGTAAGCAAGCGCTTGAAACGGTCCAGCGTCTTCTGCCGGTGTTGTGCCAGGCGCACGGACTCACACCAGAACAAGTGGTTGCTATTGCTAGTAACAACGGTGGAAAGCAGGCCCTCGAGACGGTGCAGAGGTTACTTCCCGTCCTCTGTCAAGCGCACGGCCTCACTCCAGAGCAAGTGGTTGCGATCGCTTCAAACAATGGTGGAAGACCTGCCCTGGAA
В соответствии с некоторыми аспектами, могут быть использованы TALEs, имеющие, по меньшей мере, 80% идентичность последовательности, по меньшей мере, 85% идентичность последовательности, по меньшей мере, 90% идентичность последовательности, по меньшей мере, 95% идентичность последовательности, по меньшей мере, 98% идентичность последовательности, или, по меньшей мере, 99% идентичность последовательности с приведенной выше последовательностью. Специалист легко поймет, где указанная последовательность может варьировать при сохранении ДНК-связывающей активности TALE.
Димерные блоки re-TALE кодирующие два RVDs (см. Фиг. 6A) получали с помощью двух раундов ПЦР в стандартных условиях Кара HIFI (KPAP), при которых первый раунд ПЦР вводил RVD-кодирующую последовательность, а второй раунд ПЦР приводил к образованию целых димерных блоков с 36 п.о. перекрытием с соседними блоками. ПЦР-продукты очищали с помощью QIAquick 96 PCR Purification Kit (QIAGEN), а концентрации измеряли с помощью Nano-drop. Последовательности праймеров и матриц перечислены в таблице 1 и таблице 2 ниже.
Таблица 1. последовательности блоков re-TALE
Таблица 2. Последовательности праймеров блоков re-TALE
Re-TALENs и векторы назначения re-TALE-TF были сконструированы путем модификации TALE-TF и клонирующего каркаса TALEN (см. источник 24, включенный в данный документ ссылкой в полном объеме). 0,5 RVD-области на векторах были повторно закодированы, а в назначенный участок для клонирования re-TALE был включен сайт разрезания SapI. Последовательности re-TALENs и каркасы re-TALE-TF представлены на Фиг. 20. Плазмиды могут быть предварительно обработаны с помощью SapI (New England Biolabs) в рекомендованных производителем условиях, и очищены с помощью набора для очистки ПЦР QIAquick (QIAGEN).
Однореакторную (10 мкл) реакцию сборки TASA проводили с 200 нг каждого блока, 500 нг каркаса назначения, IX ферментной смеси TASA (2 Ед. SapI, 100 Ед. амплигазы (Epicentre), 2,5 Ед. ДНК-полимеразы (New England Biolabs)) и IX буфер для изотермической реакции сборки, как описано ранее (см. источник 25, включенный в данный документ ссылкой в полном объеме) (5% PEG-8000, 100 мМ Трис-HCl, рН 7,5, 10 мМ MgC12, 10 мМ DTT, 0,2 мМ каждого из четырех dNTP и 1 мМ NAD). Инкубирование проводили при 37°С в течение 5 мин и 50°С в течение 30 мин. Реакция может быть подвергнута непосредственно бактериальной трансформации для получения колоний отдельных сборок. При таком подходе эффективность получения полноразмерного конструкции составила -20% . В ином случае эффективность > 90% может быть достигнута трехступенчатой сборкой. Во-первых, 10 мкл реакции сборки re-TALE осуществляли с 200 нг каждого блока, 1X ферментной смеси re-TALE, (100 Ед. амплигазы, 12,5 мЕд. T5-экзонуклеазы, 2,5 Ед. ДНК-полимеразы Phusion) и IX изотермического буфера для сборки при 50°С в течение 30 мин, а затем проводили стандартизированные реакции ПЦР Кара HIFI, электрофореза в агарозном геле и экстракции из геля QIAquick Gel extraction (Qiagen) для обогащения полноразмерных re-TALEs. 200 нг ампликонов re-TALE затем могут быть смешаны с 500 нг каркаса назначения, предварительно обработанного SapI, 1X изотермического реакционного буфера для сборки re-TALE и инкубировали при 50°С в течение 30 мин. Конечная реакция сборки re-TALE может быть подвергнута непосредственно бактериальной трансформации для получения колоний отдельных сборок. Специалист в данной области техники легко сможет выбрать эндонуклеазы, экзонуклеазы, полимеразы и лигазы из числа тех, которые известны для практического осуществления способов, описанных в данном документе. Например, можно использовать эндонуклеазы типа IIs, такие как: Fok 1, Bts I, Ear I, Sap I. Могут быть использованы титруемые экзонуклеазы, такие как лямбда-экзонуклеаза, Т5-экзонуклеаза и экзонуклеаза III. Могут быть использованы полимеразы, применяемые без горячего старта, такие как, ДНК-полимераза Phusion, ДНК-полимераза Taq и ДНК-полимераза VentR. В данной реакции могут быть использованы термостойкие лигазы, такие как амплигаза, ДНК-лигаза pfu, ДНК-лигаза Taq. Кроме того, в зависимости от конкретного вида используемых ферментов для активации таких эндонуклеаз, экзонуклеаз, полимераз и лигаз могут быть использованы различные условия реакции.
Пример III
Клеточная линия и Клеточная культура
Клетки PGP1 iPS поддерживали в покрытых матригелем (BD Biosciences) планшетах в mTeSRl (StemCell Technologies). Культуры пересевали каждые 5-7 дней с TrypLE Express (Invitrogen). Клетки 293T и 293FT выращивали и поддерживали в модифицированной Дульбекко среде Игла (DMEM, Invitrogen) с высоким содержанием глюкозы с добавлением 10% фетальной бычьей сыворотки (FBS, Invitrogen), пенициллина/стрептомицина (pen/strep, Invitrogen), и незаменимых аминокислот (NEAA, Invitrogen). Клетки К562 выращивали и поддерживали в среде RPMI (Invitrogen) с добавлением 10% фетальной бычьей сыворотки (FBS, Invitrogen 15%) и пенициллина/стрептомицина (pen/strep, Invitrogen). Все клетки поддерживали при 37°С и 5% CO2 в увлажненном инкубаторе.
Была создана стабильная клеточная линия 293Т для детекции эффективности HDR, как описано в источнике 26, включенном в данное описание ссылкой в полном объеме. В частности, репортерную клеточную линию, несущую интегрированные в геном последовательности, кодирующие GFP, разрушали вставкой стоп-кодона и 68 п.о. геномного фрагмента, полученного из локуса AAVS1.
Пример IV
Тест активности re-TALENs
Репортерные клетки 293Т высевали при плотности 2 х 105 клеток на лунку в 24-луночный планшет и трансфецировали их 1 мкг каждой плазмиды re-TALENs и 2 мкг плазмиды с донорной ДНК с использованием Lipofectamine 2000 согласно протоколам производителя. Клетки собирали с помощью TrypLE Express (Invitrogen) через ~ 18 ч после трансфекции и ресуспендировали в 200 мкл среды для анализа проточной цитометрией с использованием анализатора клеток LSRFortessa (BD Biosciences). Данные проточной цитометрии анализировали с использованием FlowJo (FlowJo). По меньшей мере, 25 000 событий анализировали для каждого трансфецированного образца. Для экспериментов по направленному воздействию на эндогенный локус AAVS1 в клетках 293T, процедуры трансфекции были идентичны описанным выше, и отбор на пуромицине был проведен с концентрацией лекарственного средства 3 мкг/мл через 1 неделю после трансфекции.
Пример V
Оценка образования функциональных лентивирусов
Лентивирусные векторы были созданы с помощью стандартных методов ПЦР и клонирования. Лентивирусные плазмиды трансфецировали Lipofectamine 2000 с помощью лентивирусной упаковочной смеси (Invitrogen) в культивируемые клетки 293FT (Invitrogen), с целью получения лентивируса. Надосадочную жидкость собирали через 48 и 72 ч после трансфекции, стерильно фильтровали, и 100 мкл фильтрованной надосадочной жидкости добавляли к 5 х 105 свежих клеток 293Т с полибреном. Титр лентивируса рассчитывали на основании следующей формулы: титр вируса = (процент клеток GFP+ 293T * исходное количество клеток при трансдукции)/(объем исходной вирус-содержащей надосадочной жидкости, используемой в эксперименте трансдукции). Чтобы проверить работоспособность лентивирусов, через 3 дня после трансдукции, лентивирус-трансдуцированные клетки 293T трансфецировали 30 нг плазмиды, несущей репортер mCherry и 500 нг плазмиды pUC19 с помощью Lipofectamine 2000 (Invitrogen). Изображения клеток анализировали с помощью Axio Observer Zl (Zeiss) через 18 часов после трансфекции, после чего клетки собирали с помощью TrypLE Express (Invitrogen) и ресуспендировали в 200 мкл среды для анализа проточной цитометрией с использованием анализатора клеток LSRFortessa (BD Biosciences). Данные проточной цитометрии анализировали с использованием BD FACSDiva (BD Biosciences).
Пример VI
Тест эффективности редактирования генома с помощью re-TALENs и Cas9-гидРНК
PGP1 iPSCs культивировали с ингибитором Rho-киназы (ROCK) Y-27632 (Calbiochem) за 2 ч перед нуклеофекцией. Трансфекцию проводили с помощью P3 Primary Cell 4D-Nucleofector X Kit (Lonza). В частности, клетки собирали с помощью TrypLE Express (Invitrogen) и ресуспендировали 2x106 клеток в 20 мкл смеси для нуклеофекции, содержащей 16,4 мкл раствора Р3 Nucleofector, 3,6 мкл добавки, 1 мкг каждой плазмиды re-TALENs или 1 мкг Cas9 и 1 мкг гидРНК-конструкции, 2мкл 100 мкМ ssODN. Затем смеси переносили в 20мкл полоски Nucleocuvette и проводили нуклеофекцию с помощью программы CB150. Клетки высевали в планшеты, покрытые матригелем в среде mTeSR1 среде с добавлением ингибитора ROCK в течение первых 24 часов. Для эксперимента направленного воздействия на эндогенный локус AAVS1 с помощью донорной двухцепочечной ДНК, проводили такую же процедуру за исключением того, что было использовано 2 мкг донорной двухцепочечной ДНК, а среда mTeSRl была дополнена пуромицином в концентрации 0,5 мкг/мл через 1 неделю после трансфекции.
Информация о reTALENs, гидРНК и ssODNs, используемых в данном примере, приведена в Таблице 3 и Таблице 4 ниже.
Таблица 3. Информация о парах re-TALEN/Cas9-гидРНК, нацеленных на CCR5
целевая последовательность
целевая последовательность
последователь
ность
Целевого участка
ло)
9942
9993
9946
0227
0278
0264
1260
1311
1261
1464
1515
1456
1517
1568
1538
1634
1685
1632
2432
2483
2461
Таблица 4. Дизайн ssODN для изучения ssODN-опосредованного редактирования генома
DSB
*1
*2
*3
0
*4
*5
*6
DSB
bp_9 OM
30-мер
ориен-тация ssODN для направ-ленного воздей-ствия Cas9-гидРНК
50-мер
70-мер
90-мер
110-мер
мер
мер
5-1
5-2
5-3
5-4
5-5
5-6
5-7
5-8
5-9
5-10
5-11
5-12
5-13
5-14
5-15
CC R5
5-1
5-2
5-3
5-7
5-8
Пример VII
Получение библиотеки ампликонов целевых участков
Собирали клетки через 6 дней после нуклеофекции и 0,1 мкл фермента-тканевой протеазы prepGEM (ZyGEM) и 1 мкл буфера prepGEM gold (ZyGEM) добавляли к 8,9 мкл 2~5 X 105 клеток в среде, затем по 1 мкл реакций добавляли в 9 мкл ПЦР-смеси, содержащей 5 мкл готовой смеси 2X КАРА Hifi Hotstart Readymix (КАРА Biosystems) и 100 нМ соответствующих пар праймеров для амплификации. Реакционные смеси инкубировали при 95°С в течение 5 мин с последующими 15 циклами 98°С, 20 с; 65°С, 20 с и 72°С, 20 с. Для добавления адаптерной последовательности Illumina, 5 мкл продуктов реакции затем добавляли в 20 мкл ПЦР-смеси, содержащей 12,5 мкл готовой смеси 2X КАРА HIFI Hotstart Readymix (КАРА Biosystems) и 200 нМ праймеров, несущих адаптерные последовательности Illumina. Реакционные смеси инкубировали при 95°С в течение 5 мин с последующими 25 циклами 98°С, 20 с; 65°C, 20 с и 72°C, 20 с. ПЦР-продукты очищали с помощью набора для очистки ПЦР QIAquick, смешивали приблизительно в одинаковых концентрациях, и секвенировали с помощью персонального секвенатора MiSeq. ПЦР-праймеры перечислены ниже в Таблице 5.
Таблица 5 Последовательности ПЦР-праймеров для участка направленного воздействия в CCR5
CTCGGCATTCCTGCTGAACCGCTCTTCCGATCTCCAAGCAACTAAGTCACAGCA
адаптер
* index-PCR - праймеры приобретены в Epicentre (праймеры ScriptSeq™ Index PCR Primers)
Пример VIII
Система оценки редактирования генома (GEAS)
Для обнаружения редких геномных изменений использовали секвенирование нового поколения. См. источники 27-30, включенные в данный документ ссылкой в полном объеме. Для того, чтобы сделать возможным широкое применение данного подхода для быстрой оценки эффективности HDR и NHEJ в hiPSCS, было создано программное обеспечение, названное «pipeline», для анализа данных инженерии генома. «Pipeline» интегрирована в одиночный модуль Unix, который использует различные инструменты, такие как R, BLAT и FASTX Toolkit.
Разбивка по штрих-коду: Группы образцов объединяли вместе и секвенировали по технологии спаренных концов с длиной прочтения 150 п.о. на секвенаторе MiSeq (PE150) (Illumina Next Gen Sequencing), а далее разделяли на основе ДНК-штрихкодирования с помощью пакета программ FASTX.
Качество фильтрации: Нуклеотиды с низким качеством последовательности (балл Phred <20) были обрезаны. После обрезки, «риды» короче 80 нуклеотидов были отброшены.
Картирование: BLAT использовали для независимого картирования «ридов», полученных секвенированием спаренных концов, на эталонном геноме и на выходе получали файлы *.psl.
Определение вставок/делеций: вставки/делеции были определены как полноразмерные «риды», содержащие 2 блока совпадений при выравнивании. В расчет принимались только «риды», соответствующие этому паттерну в обоих «ридах» спаренных концов. В качестве контроля качества требовались «риды» вставок/делеций, которые обладали минимальным 70 нуклеотидным совпадением с эталонным геномом, а оба блока должны иметь длину, по меньшей мере, 20 нуклеотидов. Размер и положение вставок/делеций рассчитывали по положению каждого блока в эталонном геноме. Негомологичное соединение концов (NHEJ) оценивали как процент «ридов», содержащих вставки/делеции (см. уравнение 1 ниже). Большинство событий NHEJ были обнаружены в непосредственной близости от участка направленного воздействия.
Эффективность рекомбинации, направляемой гомологией (HDR): Сравнение с паттерном (grep) в окне 12 п.о. центрированном по DSB, использовали для подсчета специфических сигнатур, соответствующих «ридам», содержащим эталонную последовательность, модификации эталонной последовательности (предполагаемые 2 п.о. несовпадения), и «риды», содержащие только 1 п.о. мутацию в пределах предполагаемых 2 п.о. несовпадений (2 п.о. предполагаемые несовпадения) (см. уравнение 1 ниже).
Уравнение 1. Оценка NHEJ и HDR
А = риды идентичные эталону: XXXXXABXXXXX
B = риды, содержащие 2 п.о. несовпадения, которые кодируются ssODN: XXXXXabXXXXX
C = риды, содержащие только 1 п.о. мутацию в участке-мишени: например, XXXXXaBXXXXX или XXXXXAbXXXXX
D = риды, содержащие вставки/делеции, как описано выше
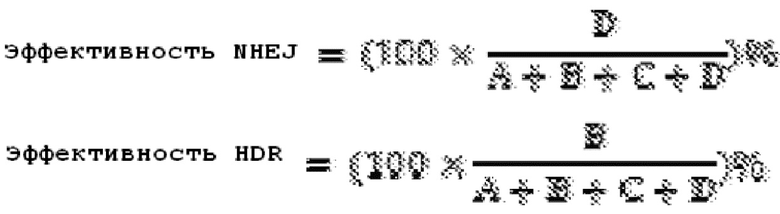
Пример IX
Скрининг Генотипа колонизированных hiPSCs
Человеческие клетки iPS на безфидерных культурах предварительно обрабатывали средой mTesr-1, обогащенной SMC4 (5 мкМ тиазовивин, 1 мкМ CHIR99021, 0,4 мкМ PD0325901, 2 мкМ SB431542) (см. источник 23, включенный в данный документ ссылкой в полном объеме), по меньшей мере, за 2 часа до сортировки FACS. Культуры диссоциировали с помощью аккутазы (Millipore) и ресуспендировали в среде mTesr-1, обогащенной SMC4 и красителем ToPro-3 для проверки жизнеспособности (Invitrogen) в концентрации 1-2 X107/мл. Живые клетки hiPS сортировали по одной клетке с помощью BD FACSAria II SORP UV (BD Biosciences) со 100 мкм соплом в стерильных условиях в 96-луночные планшеты, покрытые облученными мышиными эмбриональными фибробластами CF-1 (Global Stem). Каждая лунка содержала клеточную среду для hES (см. источник 31, включенный в данный документ ссылкой в полном объеме) со 100 нг/мл рекомбинантного человеческого основного фактора роста фибробластов (bFGF) (Millipore) с добавлением SMC4 и 5 мкг/мл фибронектина (Sigma). После сортировки планшеты центрифугировали при 70 x g в течение 3 мин. Образование колоний было отмечено через 4 дня после сортировки, а культуральную среду заменили клеточной средой для hES с SMC4. SMC4 может быть удалена из клеточной среды для hES через 8 дней после сортировки.
Собирали несколько тысяч клеток через 8 дней после флуоресцентно-активируемой сортировки клеток и (FACS) и добавляли 0,1 мкл фермента-тканевой протеазы prepGEM (ZyGEM) и 1 мкл буфера prepGEM gold (ZyGEM) к 8,9 мкл клеток в среде. Реакции затем добавляли к 40 мкл ПЦР-смеси, содержащей 35,5 мл platinum 1,1X Supermix (Invitrogen), 250 нМ каждого dNTP и 400 нМ праймеров. Реакционные смеси инкубировали при 95°С в течение 3 мин с последующими 30 циклами 95°С, 20 с; 65°C, 30 и 72°С, 20 с. Продукты секвенировали по Сенгеру с использованием любого из ПЦР-праймеров таблицы 5 и анализировали последовательности с помощью DNASTAR (DNASTAR).
Пример X
Иммунноокрашивание и анализы тератом, полученных из hiPSCs
Клетки инкубировали в нокаутной среде DMEM/F-12 при 37°С в течение 60 минут с использованием следующих антител: анти-SSEA-4 PE (Millipore) (разбавленное 1: 500); Tra-1-60 (BD Pharmingen) (разбавленное 1: 100). После инкубации клетки промывали три раза нокаутной DMEM/F-12 и фотографировали на на Axio Observer Z.1 (ZIESS).
Для проведения анализа образования тератом, человеческие iPSCs собирали с помощью коллагеназы IV типа (Invitrogen), ресуспендировали клетки в 200 мкл матригеля и вводили внутримышечно в подушечки задних конечностей мышей с нокаутом по Rag2gamma. Тератомы выделяли и фиксировали в формалине через 4-8 недель после инъекции. Тератомы затем анализировали после окрашивания гематоксилином и эозином.
Пример XI
Ориентация локусов генома в соматических клетках человека и стволовых клетках человека с помощью reTALENS
Согласно некоторым аспектам, TALEs, известные специалистам в данной области техники, модифицированы или перекодированы для устранения повторяющихся последовательностей. Такие TALEs, подходящие для модификации и применения в способах редактирования генома в вирусных средствах доставки и в различных клеточных линиях и микроорганизмах, описанных в данном документе, описаны в источниках 2, 7-12, включенных в данных документ ссылкой в полном объеме. Было разработано несколько стратегий для сборки массива повторяющихся TALE RVD (см. источники 14 и 32-34, включенные в данных документ ссылкой в полном объеме. Однако после сборки повторяющиеся последовательности TALE остаются нестабильными, что ограничивает широкую применимость этого инструмента, особенно для вирусных средств доставки гена (см. источники 13 и 35 включенные в данных документ ссылкой в полном объеме. Соответственно, один аспект настоящего изобретения относится к TALEs, лишенных повторов, например, полностью лишенных повторов. Такие перекодированные TALE является эффективными, поскольку позволяют быстрее и проще синтезировать расширенные массивы TALE RVD.
Для устранения повторов, нуклеотидные последовательности массивов TALE RVD эволюционировали вычислительным образом с тем, чтобы минимизировать количество последовательностей-повторов при сохранении аминокислотной композиции. Перекодированные TALE (Re-TALEs), кодирующие 16 тандемных мономеров RVD, распознающих ДНК, плюс конечный полуповтор RVD, лишены любых 12 п.о. повторов (см. Фигуру 5а). Примечательно, что этот уровень перекодирования достаточен для того, чтобы провести амплификацию ПЦР какого-либо конкретного мономера или подраздела из полноразмерного конструкции с re-TALE (см. Фиг. 5b). Усовершенствованный дизайн re-TALEs может быть синтезирован с помощью стандартных технологий синтеза ДНК (см. источник 36, включенный в данный документ ссылкой в полном объеме, без каких дополнительных расходов или процедур, связанных с обогащенными повтрами последовательностями. Кроме того, дизайн перекодированных последовательностей позволяет эффективно собирать конструкции с re-TALE с использованием модифицированной изотермической реакции сборки, как описано в способах данного документа и со ссылкой на Фиг. 6.
NGS-данные по редактированию генома статистически анализировали следующим образом. Для анализа специфичности HDR, использовали точный биномиальный тест для вычисления вероятности наблюдения различных количеств «ридов», содержащих 2 п.о. несовпадения. На основании результатов секвенирования 10 п.о. окон до и после участка направленного воздействия, оценивали максимальные скорости замены оснований двух окон (PI и Р2). С помощью нулевой гипотезы о том, что изменения каждой из двух целевых п.о. были независимыми, была вычислена ожидаемая вероятность обнаружения 2 п.о. несоответствия в участке направленного воздействия случайно как произведение этих двух вероятностей (Р1 * Р2). Учитывая набор данных, содержащих N количество общих ридов и n количество HDR-ридов, мы рассчитали p-значение наблюдаемой эффективности HDR. Для анализа чувствительности HDR, донорные ssODN содержали 2 п.о. несовпадение относительно генома-мишени, что делает вероятной одновременную замену оснований в двух п. о., являющихся мишенями при включении ssODN в геном-мишень. Прочие нецелевые наблюдаемые изменения последовательностей, вероятно, не будут изменяться в это же время. Соответственно, нецелевые изменения были гораздо менее взаимозависимы. Исходя из этих предположений, взаимная информация (MI) была использована для измерения взаимной зависимости одновременных двух изменений пар оснований во всех других парах позиций, и предел обнаружения HDR оценивали как наименьшее HDR, где MI целевого 2 п.о. сайта выше, чем MI всех пар в других позициях. Для данного эксперимента, в оригинальном файле fastq были идентифицированы риды HDR с целевым 2 п.о. несовпадением и набор файлов fastq с разбавленными эффективностями HDR был смоделирован посредством систематического удаления различных количеств ридов HDR из исходного набора данных. Взаимную информацию (MI) вычисляли между всеми парами положений в пределах 20 п.о. окна с центром на участке направленного воздействия. В этих расчетах вычисляется взаимная информация о композиции оснований между любыми двумя позициями. В отличие от меры специфичности HDR, описанной выше, эта мера не оценивает тенденцию пар позиций изменять какие-либо конкретные пары целевых оснований, а только оценивает их тенденцию изменяться в одно и тоже время (см. Фиг. 8А). В таблице 6 приведены эффективности HDR и NHEJ для направленного воздействия re-TALEN/ssODN на CCR5 и эффективность NHEL для Cas9-гидРНК. Мы запрограммировали наш анализ в R и рассчитали MI при помощи пакета infotheo.
Таблица 6
участок направленного воздействия
(ReTALEN) (%)
(%)
основе информациионного анализа
(Cas9-гидРНК)
* Группа, в которой предел обнаружения HDR превышает реальное детектируемое значение HDR
Корреляцию между эффективностью редактирования генома и эпигенетическим состоянием урегулировали следующим образом. Коэффициенты корреляции Пирсона рассчитывали для изучения возможных связей между эпигенетическими параметрами (заполненность ДНКазой I HS или нуклеосомами) и эффективностями генной инженерии (HDR, NHEJ). Набор данных по гиперчувствительности к ДНКазе I был загружен из геномного браузера UCSC. ДНКаза I HS из hiPSCs:
/gbdb/hgl9/bbi/wgEncodeOpenChromDnaseIpsnihi7Sig. bigWig
Для вычисления значения р, наблюдаемую корреляцию сравнивали с моделируемым распределением, которая была построена рандомизацией положения эпигенетического параметра (N = 100 000). Наблюдаемые корреляции выше, чем 95-й процентиль, или ниже, чем 5-й процентиль моделируемого распределения, считались потенциальными ассоциациями.
Определяли функцию re-TALEN по сравнению с соответствующими не перекодироваными TALEN в клетках человека. Линию клеток НЕК 293, содержащую репортерную кассету с GFP, и несущую вставку, смещающую рамку считывания, использовали, как описано в источнике 37, включенном в данное описание ссылкой в полном объеме. Смотрите также Фиг. 1а. Доставка TALENs или reTALENs, направленно воздействующих на последовательность вставки, вместе с беспромоторной донорной конструкцией с GFP, приводит к DSB-индуцированному HDR-восстановлению кассеты с GFP, при этом эффективность восстановления GFP может быть использована для оценки эффективности разрезания нуклеазой. См. источник 38, включенный в данный документ ссылкой в полном объеме. Индуцированное reTALENs восстановление GFP в 1,4% трансфецированных клеток, было аналогично полученному с помощью TALENs (1,2%) (см. Фиг. 1b). Активность reTALENs была протестирована в локусе AAVS1 в PGP1 hiPSCs (см. Фиг. 1с), при этом успешно восстановленные клеточные клоны, содержащие специфические вставки (см. Фиг. 1d, e), подтвердили, что reTALENs активны как в соматических, так и в плюрипотентных клетках человека.
Устранение повторов позволяет получить функциональный лентивирирус, нагруженный re-TALE. В частности, лентивирусные частицы, в которые были упакованы фрагменты, кодирующие re-TALE-2A-GFP, были протестированы на активность re-TALE-TF, кодируемых вирусными частицами, путем трансфекции репортера mCherry в пул клеток 293Т, инфецированных lenti-reTALE-2A-GFP. Клетки 293T, трансдуцированные lenti-re-TALE-TF показали 36x активацию экспрессии репортера по сравнению с только отрицательным репортером (см. Фиг. 7a,b,c). Проверяли целостность последовательности re-TALE-TF в лентивирус-инфицированных клетках и обнаружили полноразмерные reTALEs во всех 10 протестированных клонах (см. Фиг. 1d).
Пример XII
Сравнение эффективности ReTALEs и Cas9-гидРНК в hiPSCs с к помощью системы оценки редактирования генома (GEAS)
Для сравнения эффективности редактирования re-TALENs относительно Cas9-гидРНК в hiPSCs, была разработана платформа секвенирования следующего поколения (Система оценки Редактирования Генома) для выявления и количественной оценки как NHEJ, так и HDR событий генного редактирования. Пары re-TALEN и Cas9-гидРНК были спроектированы и сконструированы как направленно воздействующие на область, лежащую выше CCR5 (re-TALEN, Cas9-гидРНК пара # 3 в Таблице 3), вместе с 90 нуклеотидным ssODN-донором, идентичным участку направленного воздействия за исключением 2 п.о. несовпадения (см. Фиг. 2а). Нуклеазные конструкции и донорный ssODN трансфецировали в hiPSCs. Для количественной оценки эффективности генного редактирования, через 3 дня после трансфекции проводили глубокое секвенирование с использованием спаренных концевых фрагментов на целевой геномной области. Эффективность HDR измеряли по проценту «ридов», содержащих точное 2 п.о. несовпадение. Эффективность NHEJ измеряли как процент «ридов», несущих вставки/делеции.
Доставка ssODN отдельно в hiPSCs давала минимальные показатели HDR и NHEJ, в то время как доставка re-TALENs и ssODN давала эффективности 1,7% по HDR и 1,2% по NHEJ (см. Фиг. 2b). Введение Cas9-гидРНК с ssODN давало эффективности 1,2% по HDR и 3,4% по NHEJ. Примечательно, что показатель геномных делеций и вставок достиг своего пика в середине спейсерной области между двумя участками связывания reTALENs, но своего пика достиг на 3-4 п.о. выше последовательности Protospacer Associated Motif (РАМ) участка направленного воздействия Cas9-гидРНК (см. Фиг. 2b), как и следовало ожидать, поскольку двухцепочечные разрывы происходят в этих областях. В случае re-TALENs наблюдали средний геномный размер делеции 6 п.о. и размер вставки 3 п.о., а в случае Cas9-гидРНК средний размер делеции 7 п.о., вставки - 1 п.о. (см. Фиг. 2b), в соответствии с паттернами повреждений ДНК обычно образованных NHEJ (см. источник 4, включенный в данный документ ссылкой в полном объеме). Несколько анализов на платформе секвенирования следующего поколения показало, что GEAS может обнаружить уровень обнаружения HDR до 0,007%, который является одновременно высоко воспроизводимым (коэффициент вариации между повторами = ± 15% * измеренная эффективность) и в 400X более чувствительным, чем наиболее часто используемые тесты с чувствительной к несовпадениям эндонуклеазой (см. Фиг. 8).
Пары re-TALEN и Cas9-гидРНК, нацеленные на пятнадцать участков в геномном локусе CCR5, были созданы для определения эффективности редактирования (см. Фиг. 2с, таблица 3). Эти участки были выбраны для того, чтобы представлять широкий спектр чувствительностей ДНКазы I (см. источник 39, включенный в данный документ ссылкой в полном объеме). Нуклеазные конструкции трансфецировали вместе с соответствующими донорными ssODNs (см. таблицу 3) в PGP1 hiPSCs. Через шесть дней после трансфекции профилировали эффективности редактирования генома в этих участках (таблица 6). Для 13 из 15 пар re-TALEN с донорным ssODN, NHEJ и HDR детектировали на уровнях выше статистического порога обнаружения, со средней эффективностью NHEJ 0,4% и средней эффективностью HDR 0,6% (см. Фиг. 2с). Кроме того, статистически значимую положительную корреляцию (R2 = 0,81) обнаружили между эффективностями HR и NHEJ в одних и тех же целевых локусах (P <1 х 10-4) (см. Фиг. 9а), что предполагает, что образование DSB, общей вышестоящей стадии как для HDR, так и для NHEJ, является скорость-лимитирующей стадией для reTALEN-опосредованного редактирования генома.
В противоположность этому, все 15 пар Cas9-гидРНК показали значительные уровни NHEJ и HR, со средней эффективностью NHEJ 3% и средней эффективностью HDR 1,0% (см. Фиг. 2с). Кроме того, положительная корреляция была также обнаружена между эффективностью NHEJ и HDR, вызванных Cas9-гидРНК (см. Фиг. 9b) (R2 = 0,52, р = 0,003), что согласуется с наблюдениями для reTALENs. Эффективность NHEJ, достигаемая Cas9-гидРНК была значительно выше, чем та, что достигается с помощью reTALENs (t-тест, спаренные концы, P = 0,02). Наблюдалось умеренная, но статистически значимая корреляция между эффективностью NHEJ и температурой плавления целевой последовательности гидРНК (см. Фиг. 9c) (R2 = 0,28, р = 0,04), что позволяет предположить, что сила спаривания оснований между гидРНК и его геномной мишенью может объяснить вплоть до 28% вариации в эффективности Cas9-гидРНК-опосредованного образования DSB. Даже если Cas9-гидРНК продуцируют уровни NHEJ в среднем в 7 раз выше, чем соответствующие reTALEN, Cas9-гидРНК достигает уровней HDR (среднее = 1,0%), схожих с уровнями соответствующих reTALENs (среднее = 0,6%). Без связи с научной теорией, эти результаты позволяют предложить либо то, что концентрация ssODN при DSB является ограничивающим фактором для HDR, либо то, что структура геномного разрыва, образованного Cas9-гидРНК не выгодна для эффективного HDR. Никакой корреляции между ДНКазой I HS и эффективностями направленного воздействия на геном не наблюдали ни для одного из способов (см. Фиг. 10).
Пример XIII
Оптимизация Дизайна донорных ssODN для HDR
Высоко эффективные в hiPSCs ssODNs были разработаны следующим образом. Был разработан набор донорных ssODNs разных длин (50-170 нуклеотидов), которые все несут одинаковое 2 п.о. несовпадение в середине спейсерной области участков направленного воздействия пары re-TALEN #3 для CCR5. Наблюдаемая эффективность HDR варьировала в зависимости от длины ssODN, и оптимальная эффективность HDR -1,8% наблюдалась с 90 нуклеотидным ssODN, тогда как более длинные ssODNs имели пониженную эффективность HDR (см. Фиг. 3а). Поскольку более длинные участки гомологии улучшают показатели HDR, когда донорные дцДНК использовались с нуклеазами (см. источник 40, включенный ссылкой в полном объеме), возможные причины такого результата могут заключаться в том, что ssODNs используются в альтернативном процессе восстановления генома; более длинные ssODNs менее доступны для аппарата восстановления генома; или в том, что более длинные ssODNs привносят отрицательные эффекты, которые нейтрализуют любые улучшения, придаваемые более длинной гомологией, по сравнению с дцДНК-донорами (см. источник 41, включенный в данный документ ссылкой в полном объеме). Тем не менее, если дело было в любой из первых двух причин, то показатели NHEJ должны быть либо неизменными, либо увеличиваться с более длинными ssODNs, потому что репарация NHEJ не включает донорный ssODN. Тем не менее, наблюдали снижение показателей NHEJ вместе с HDR (см. Фиг. 3а), что позволяет предположить, что более длинные ssODNs демонстрируют компенсирующие эффекты. Возможные гипотезы могут заключаться в том, что более длинные ssODNs являются токсичными для клетки (см. источник 42, включенный в данный документ ссылкой в полном объеме), или в том, что трансфекция длинных ssODNs насыщает машинерию процессирования ДНК, тем самым вызывая уменьшение молярного поглощения ДНК и уменьшая емкость клеток поглощать и экспрессировать плазмиды с re-TALEN.
Была проведена проверка вариабельности показателя включения несовпадений, которые несут донорные ssODN, в зависимости от дистанции от двухцепочечного разрыва («DSB»). Для этого разработали серию 90 нуклеотидных ssODNs, которые все обладают одинаковым 2. п.о. несовпадением (А) в центре спейсерной области пары re-TALEN # 3. Каждый ssODN также содержала второе 2 п.о. несовпадение (B) на различных расстояниях от центра (см. Фиг. 3b). ssODN, обладающий лишь одним 2 п.о. несовпадением использовали в качестве контроля. Каждый из этих ssODNs вводили в индивидуальном порядке с парой re-TALEN #3 и анализировали результаты с помощью GEAS. Мы обнаружили, что общий HDR - если измерять по показателю, при котором включение несовпадения А (только А или A + B) - уменьшается по мере того, как несовпадения В располагаются дальше от центра (см. Фиг. 3b, см. Фиг. 11а). Более высокий показатель HDR, наблюдаемый, когда В находится всего лишь в 10 п.о. от А, может отражать меньшую потребность в отжиге ssODN против геномной ДНК в непосредственной близости от разрыва двухцепочечной ДНК.
Для каждого расстояния В от А, часть событий HDR относится к включению только несовпадения А, тогда как другая часть относится к включению как А, так и В несовпадений (см. Фиг. 3b (только A и A + B)). Эти два результата могут быть связаны с трактами генной конверсии (см. источник 43, включенный в данный документ ссылкой в полном объеме) по длине одноцепочечного ДНК-олигонуклеотида, в результате чего включение несовпадений А+В являющегося результатом длинных конверсионных трактов, которые простираются за пределы несовпадения В, а включение только А несовпадения является результатом более коротких путей, которые не достигают В. в соответствии с этой интерпретацией, оценивали распределение трактов генной конверсии в обоих направлениях вдоль ssODN (см. Фиг. 11b). Оцененное распределение подразумевает, что тракты генной конверсии постепенно становятся менее частыми, по мере увеличения их длин, результат, очень похожий на распределения трактов генной конверсии, наблюдаемых с донорными дцДНК, но на сильносжатой шкале дистанций в десятки основания для оцДНК донора относительно сотен оснований для дцДНК доноров. В соответствии с этим результатом, эксперимент с ssODN, включающим три пары 2 п.о. несовпадений с интервалом 10 нуклеотидов в обе стороны от центрального 2 п.о. несовпадения «А», позволил получить паттерн, в котором А отдельно был включен в 85% случаев, с множественными несовпадениями В, включенными в других случаях (см. Фиг. 11с). Хотя количество событий с включением только В было слишком низким для оценки распределения длин путей менее 1 п. о., ясно, что область с коротким путем в пределах 10 п.о. от нуклеазного сайта является преобладающей (см. Фиг. 11,b). Наконец, во всех экспериментах с одиночными несовпадениями В, наблюдалась небольшая часть событий включения только B (0,04% ~ 0,12%), что приблизительно постоянно для всех расстояний от А до В.
Кроме того, был проведен анализ того, как далеко может быть расположен донор ssODN от re-TALEN-индуцированного разрыва двухцепочечной ДНК, при сохранении его включения. Протестировали набор 90-нуклеотидных ssODNs с центральными 2 п.о. несовпадениями, нацеленными на диапазон больших дистанций (-600 п.о. до + 400 п.о.) от re-TALEN-индуцированного участка разрыва дцДНК. Когда ssODNs совпадает с последовательностью в > 40 п. о., мы наблюдали > 30x более низкие эффективности HDR по сравнению с контрольным ssODN, расположенным по центру над областью разрезания (Фиг. 3с). Наблюдавшийся низкий уровень включения может быть результатом процессов, несвязанных с разрезанием дцДНК, как видно в экспериментах, в которых геномы изменены отдельно оцДНК донором, см. источник 42, включенный в данный документ ссылкой в полном объеме. Между тем, низкий уровень HDR, который имеет место, когда ssODN расположен в ~ 40 п. о., может быть связан с комбинацией ослабленной гомологии на содержащей несовпадение стороне разреза дцДНК, вместе с недостаточной длиной оцДНК олигонуклеотида на другой стороне дцДНК разрыва.
Было проведено тестирование дизайна донора ssODNs ДНК для опосредованного Cas9-гидРНК направленного воздействия. Сконструировали Cas9-гидРНК (С2), направленно воздействующий на локус AAVS 1, и ssODN-доноры различных ориентаций (Ос: комплементарная к гидРНК и On: некомплементарная к гидРНК) и длин (30, 50, 70, 90, 110 нуклеотидов). Ос были более эффективны, чем On, а 70-мерный Oc достиг оптимального показателя HDR 1,5% (см. Фиг. 3d.) Такую же тенденциозность цепи ssODN детектировали с помощью никазы из Cas9 (CC: Cas9_D10A), несмотря на тот факт, что эффективности HDR, опосредованные Cc с ssODN были значительно меньше, чем С2 (t-тест, cпаренные концы, Р = 0,02). (см. Фиг. 12).
Пример XIV
Клональное Выделение Скорректированных Клеток hiPSC
GEAS показало, что re-TALEN пара #3 достигла точного редактирования генома в hiPSCsс эффективностью ~ 1%, уровня, при котором правильно отредактированные клетки обычно можно выделить скринингом клонов. HiPSCs имеют плохую жизнеспособность в виде отдельных клеток. Оптимизированные протоколы, описанные в источнике 23, включенном в данный документ ссылкой в полном объеме, вместе с процедурой сортировки одноклеточной FACS использовали для создания надежной платформы сортировки одиночных hiPSCs и их поддержания, где клоны hiPSC могут быть восстановлены с показателями выживания > 25%. Этот способ был объединен с быстрой и эффективной системой генотипирования, для проведения экстракции хромосомной ДНК и целевой амплификации генома в 1 ч реакциях в одной пробирке, что позволяет осуществить генотипирование hiPSCs в большом масштабе. Вместе эти способы представляют собой конвейер для надежного получения hiPSCs с отредактированным геномом без отбора.
Чтобы продемонстрировать эту систему (см. Фиг. 4а), PGP1 hiPSCs трансфецировали парой reTALENs и ssODN, предназначенных для направленного воздействия на CCR5 в участке #3 (таблица 3). GEAS проводили на части трансфецированных клеток, при этом обнаружили частоту HDR 1,7% (см. Фиг. 4b). Эта информация, наряду с 25% выходом отсортированных клонов единичных клеток, позволяют оценить получение, по меньшей мере, одного правильно отредактированного клона из пяти 96-луночных планшетов с пуассоновской вероятностью 98% (при условии, что μ = 0,017 * 0,25 * 96 * 5 * 2). Через шесть дней после трансфекции, hiPSCs сортировали с помощью FACS, а через восемь дней после сортировки, 100 клонов hiPSC подвергли скринингу. Секвенирование по Сенгеру показало, что 2 из этих 100 не подвергнутых отбору колоний hiPSC содержали гетерозиготный генотип, обладающий 2 п.о. мутацией, введенной донорным ssODN (см. Фиг. 4с). Эффективность направленного воздействия 1% (1% = 2/2 * 100, 2 моноаллельных скорректированных клона из 100 клеток, подвергнутых скринингу) была сопоставима с данными, полученными при анализе секвенированием следующего поколения (1,7%) (см. Фиг. 4b). Плюрипотентность полученных hiPSCs подтвердили иммуногистохимическое окрашивание SSEA4 и TRA-1-60 (см. Фиг. 4d). Подвергнутые успешному направленному воздействию клоны hiPSCs были способны образовывать зрелые тератомы с признаками всех трех зародышевых листков (см. Фиг. 4E).
Пример XV
Способ непрерывного редактирования генома клетки
Согласно некоторым аспектам, предлагается способ редактирования генома в клетках, включающий человеческую клетку, например, человеческую стволовую клетку, где клетка генетически модифицирована для включения нуклеиновой кислоты, кодирующей фермент, который образует комплекс колокализации с РНК, комплементарной ДНК-мишени, и который расщепляет ДНК-мишень сайт-специфическим образом. Такой фермент включает направляемый РНК ДНК-связывающий белок, такой как РНК-направляемый ДНК-связывающий белок системы CRISPR II типа. Типичным ферментом является Cas9. Согласно этому аспекту, клетка экспрессирует фермент, а направляющая РНК вносится в клетку из среды, окружающей клетку. Направляющая РНК и фермент образуют комплекс колокализации на ДНК-мишени, где указанный фермент разрезает ДНК. Необязательно, донорная нуклеиновая кислота может присутствовать для вставки в ДНК в месте разреза, например, путем негомологичного соединения концов или гомологичной рекомбинации. Согласно одному аспекту, нуклеиновая кислота, кодирующая фермент, который образует комплекс колокализации с РНК, комплементарной ДНК-мишени и который расщепляет ДНК-мишени сайт-специфическим образом, такой как Cas9, находится под управлением промотора, так что нуклеиновая кислота может быть активирована и подавлена. Такие промоторы, хорошо известны специалистам в данной области техники. Одним примерным промотором является промотор, индуцируемый DOX. Согласно одному аспекту, клетка генетически модифицирована обратимой вставкой в ее геном нуклеиновой кислоты, кодирующей фермент, который образует комплекс колокализации с РНК, комплементарной ДНК-мишени и который расщепляет ДНК-мишень сайт-специфическим образом. После вставки нуклеиновая кислота может быть удалена с помощью реактива, такого как транспозаза. Таким образом, нуклеиновая кислота может быть легко удалена после применения.
Согласно одному аспекту, предлагается система непрерывного редактирования генома человеческих индуцированных плюрипотентных стволовых клеток (hiPSCs) с помощью системы CRISPR. В соответствии с типичным аспектом способ включает применение линии hiPSC с Cas9, обратимо вставленным в геном (Cas9-hiPSCs); и гидРНК, которые были модифицированы из их нативной формы с тем, чтобы позволить им переход из среды, окружающей клетки, в клетки для применения вместе с Cas9. Такие гидРНК обрабатывали фосфатазой, для удаления фосфатных групп. Редактирование генома в клетки осуществляется с помощью Cas9 путем обогащения обработанной фосфатазой гидРНК среды для культивирования тканей. Такой подход позволяет редактировать геном HiPSCs без «шрамов» с эффективностями вплоть до 50% при однодневных обработках, которые в 2-10 раз более эффективны, чем наилучшие эффективности, известные к настоящему времени. Кроме того, способ прост в использовании и имеет значительно меньшую клеточную токсичность. Воплощения настоящего изобретения включают одиночное редактирование hiPSCs для биологических исследований и терапевтических применений, мультиплексное редактирование hiPSCs для биологических исследований и терапевтических применений, направленную эволюцию hiPSCs и скрининг hiPSCs по фенотипу и клеток, производных от них.
В соответствии с некоторыми аспектами, другие клеточные линии и организмы, описанные в данном документе, могут быть использованы в дополнение к стволовым клеткам. Например, описанный в данном документе способ может быть использован для клеток животных, таких как мышиные или крысиные клетки, с получением мышиных и крысиных клеток со стабильной интеграцией Cas9, и может быть проведено тканеспецифичное редактирование генома местным введением обработанной фосфатазой направляющей РНК из среды, окружающей клетки. Более того, другие производные Cas9 могут быть вставлены во множество клеточных линий и микроорганизмов, и могут быть проведены геномные манипуляции направленного воздействия, такие как внесение одноцепочечных разрывов, специфичное к последовательности, активация генов, супрессия и эпигенетическая модификация.
Аспекты настоящего описания направлены на получение стабильных hiPSCs с вставленным в геном Cas9. Аспекты настоящего описания направлены на модификацию РНК, так чтобы позволить ей проникать в клетку через клеточную стенку и колокализоваться с Cas9, при этом избегая иммунного ответа клетки. Такая модифицированная направляющая РНК может достичь оптимальных эффективностей трансфекции с минимальной токсичностью. Аспекты настоящего раскрытия направлены на оптимизированное редактирование генома в Cas9-hiPSCs с использованием гидРНК, обработанных фосфатазой. Аспекты настоящего изобретения включают устранение Cas9 из hiPSCs для достижения редактирования генома без «шрамов», где нуклеиновая кислота, кодирующая Cas9, была обратимо помещена в клеточный геном. Аспекты настоящего изобретения включают биомедицинскую инженерию с использованием hiPSCs с вставленным в геном Cas9 в для создания искомых генетических мутаций. Такие подвергнутые инженерии hiPSCs поддерживают плюрипотентность и могут успешно дифференцироваться в различные типы клеток, в том числе кардиомиоциты, которые полностью воспроизводят фенотип клеточных линий пациента.
Аспекты настоящего изобретения включают библиотеки направляющих РНК, обработанных фосфатазой, для мультиплексного редактирования генома. Аспекты настоящего изобретения включают получение библиотеки клеточных линий PGP, в которых каждая клеточная линия несет несколько обозначенных мутаций в геном, которые служат в качестве ресурса для скрининга лекарственных средств. Аспекты настоящего изобретения включают получение клеточных линий PGP1 со всеми ретроэлементами, подвергнутыми штрихкодированию различными последовательностями, для отслеживания расположений и активности этого элемента.
Пример XVI
Получение стабильных hiPSCs со вставленным в геном Cas9
Конструкт с Cas9, экспрессируемый под DOX-индуцируемым промотором, помещали в вектор PiggyBac, который может быть вставлен в геном и удален из него с помощью транспозазы PiggyBac. Реакция ПЦР подтверждала стабильное введение вектора (см. Фиг 14). Индуцируемую экспрессию Cas9 определяли с помощью количественной ПЦР в реальном времени. Уровень мРНК Cas9 увеличился в 1000x после 8 часов 1 мкг/мл DOX в культуральной среде и упал до нормального уровня через ~ 20 часов после удаления DOX (См. Фиг. 15).
Согласно одному аспекту, редактирование генома на основе системы Cas9-hiPSC обходит процедуру трансфекции плазмиды с Cas9/РНК, большой конструкции обычно с эффективностью трансфекции в hiPSCs <1%. Настоящая система Cas9-hiPSC может служить в качестве платформы для осуществления высоко эффективной геномной инженерии стволовых клеток человека. Кроме того, кассета Cas9, введенная в hiPSCs, с помощью системы PiggyBac, может быть легко удалена из генома при введении транспозазы.
Пример XVII
Направляющая РНК, обработанная фосфатазой
Для того, чтобы сделать возможным непрерывное редактирование генома Cas9-hiPSCs, были получены серии модифицированных РНК, кодирующей направляющую РНК, которые вносились в культуральную среду для Cas9-iPS в комплексе с липосомой. Нативная РНК, обработанная фосфатазой, без какого-либо кэпирования достигает оптимального значения HDR 13%, что более чем в 30X больше, чем значения эффективности, сообщаемые ранее для 5'Cap-Mod РНК (см. Фиг. 16).
Согласно одному аспекту, направляющая РНК физически прикреплена к донорной ДНК. Таким образом, предлагается способ объединения опосредованного Cas9 разрезания в геноме и ssODN-опосредованной HDR, что приводит к стимуляции последовательность-специфического редактирования генома. Направляющая РНК, связанная с донорным ssODN в оптимизированной концентрации, достигает 44% HDR и 2% неспецифического NHEJ (см. Фиг. 17). Следует отметить, что эта процедура не вызывает видимой токсичности, которая наблюдается в случае нуклеофекции и электропорации.
Согласно одному аспекту, в настоящем изобретении предлагается in vitro сконструированная РНК-структура, кодирующая направляющую РНК, которая достигает высокой эффективности трансфекции, эффективности редактирования генома в сочетании со вставленным в геном Сas9. Кроме того, настоящее изобретение обеспечивает химерный конструкт направляющая РНК-ДНК для объединения события разрезания генома с реакцией направляемой гомологией рекомбинации.
Пример XVIII
Удаление из hiPSCs обратимо вставленного Cas9
Для достижения геномного редактирования без «шрамов» согласно некоторым аспектам, кассету с Cas9 вставляли в геном клеток hiPSC с помощью обратимого вектора. Соответственно, кассета Cas9 обратимо встраивается в геном клеток hiPSC с помощью вектора PiggyBac. Кассета с Cas9 удаляли из hiPSCs с отредактированным геномом трансфекцией клетки плазмидой, кодирующей транспозазу. Соответственно, аспекты настоящего изобретения включают применение обратимого вектора, который известен специалистам в данной области техники. Обратимый вектор является вектором, который может быть, например, вставлен в геном, и затем удален с помощью соответствующего фермента для удаления вектора. Такие векторы и соответствующие ферменты для удаления вектора известны специалистам в данной области техники. Проводили скрининг на колонизированных iPS-клетках, и выделяли колонии, лишенные кассеты с Cas9, что было подтверждено реакцией ПЦР. Соответственно, настоящее изобретение обеспечивает способ редактирования генома, который не затрагивает остальную часть генома, при наличии в клетке перманетно вставленной кассеты с Cas9.
Пример XIX
Редактирование генома в клетках iPGP1
Исследование патогенеза кардиомиопатии исторически было затруднено из-за отсутствия подходящих модельных систем. Дифференцировка кардиомиоцитов из индуцированных плюрипотентных стволовых клеток, полученных из пациентов (iPSCs) считается одним из перспективных путей преодоления данного препятствия, и в настоящее время начинают появляться сообщения о моделировании кардиомиопатии на основе iPSCs. Тем не менее, реализация этой перспективы требует подходов, которые преодолевают генетическую гетерогенность линий iPSC, полученных из пациентов.
Клеточные линии Cas9-iPGP1 и обработанную фосфатазой направляющую РНК, связанную с ДНК, использовали для получения трех линий iPSC, которые являются изогенными, за исключением последовательности экзона 6 TAZ, который был идентифицирован как несущий однонуклеотидную делецию у пациентов с синдромом Барта. Однораундная трансфекция РНК дает ~30% эффективность HDR. Модифицированные клетки Cas9-iPGP1 с искомыми мутациями выращивали до уровня колоний (см. Фиг. 18), после чего клеточные линии дифференцировали в кардиомиоциты. Кардиомиоциты полученные из сконструированных Сas9-iPGP1, полностью восстановили кардиолипин, митохондриальный дефицит и дефицит АТФ, наблюдаемые в iPSCs, которые были получены из пациентов, и в неонатальной крысиной модели с нокаутом TAZ (см. Фиг. 19). Соответственно, предлагаются способы коррекции мутаций, вызывающих заболевания, в плюрипотентных клетках с последующей дифференцировкой клеток в искомые типы клеток.
Пример XX
Материалы и методы
1. Получение стабильных клеточных линий iPS/ES с PiggyBacCas9, индуцируемым DOX
1. После достижения клетками 70% конфлюэнтности культуру предварительно обрабатывали в течение ночи ингибитором ROCK Y27632 в конечной концентрации 10 мкМ.
2. На следующий день готовили раствор для нуклеофекции путем объединения 82 мкл раствора для нуклеофекции человеческих стволовых клеток и 18 мкл добавки 1 в стерильной 1,5 мл пробирке Eppendorf. Хорошо перемешивали. Инкубировали раствор при 37°C течение 5 минут.
3. Аспирировали mTeSRl; осторожно промывали клетки 2 мл DPBS на лунку шестилуночного планшета.
4. Аспирировали DPBS, добавляли 2 мл/лунку версена, и оставляли культуру в инкубаторе при температуре 37°C, пока они не сгруппируются вместе и не потеряют адгезию, но до отсоединения. Это требует 3-7 мин.
5. Аккуратно аспирировали версен и добавляли mTeSRl. Добавляли 1 мл mTeSRl и сбивали клетки с помощью 1000 мкл микропипетки медленным потоком mTeSRl.
6. Собирали отсоединившиеся клетки, мягко разбивали их в одноклеточную суспензию, количественно оценивали с помощью гематоцитометра, и корректировали плотность клеток до 1 миллиона клеток на мл.
7. Добавляли 1 мл суспензии клеток в 1,5 мл пробирку Eppendorf и центрифугировали при 1100 оборотов в минуту в течение 5 мин в настольной центрифуге.
8. Ресуспендировали клетки в 100 мкл раствора Nucleofector для нуклеофекции человеческих стволовых клеток из стадии 2.
9. Переносили клетки к кювету Nucleofector с помощью пипетки на 1 мл. Добавляли в суспензию клеток в кювете 1 мкг плазмиды с транспозазой и 5 мкг плазмид PB Cas9. Смешивали клетки и ДНК осторожным втряхиванием.
10. Помещали кювету в Nucleofector. Выбирали программу B-016 и подвергали клетки нуклеофекции нажатием кнопки X.
11. Добавляли 500ul среды mTeSRl с ингибитором ROCK в кювету после нуклеофекции. 12. Асперировали подвергнутые нуклеофекции клетки из кюветы с помощью предоставленной пластиковой пастеровской пипетки. Переносили клетки покапельно в покрытые матригелем лунки 6 луночного планшета со средом mTeSRl и ингибитором ROCK. Инкубировали клетки при 37°С в течение ночи.
13. Заменяли среду в mTesr1 на следующий день и через 72 часа после трансфекции, добавляли пуромицин в конечной концентрации 1 мкг/мл. Линия выводилась в течение 7 дней.
2. Выделение РНК
1. Готовили ДНК-матрицу, гдеТ7-промотор выше последовательности, кодирующей направляющую РНК.
2. Очищали ДНК с помощью Mega Clear Purification и нормализовали ее концентрацию.
3. Готовили пользовательские смеси NTPS для получения различных направляющих РНК.
4. Готовили смесь для транскипции in vitro при комнатной температуре.
Amt (мкл)
об./IVT rxn как указано выше) на льду
5. Инкубировали в течение 4 часов (3-6 часов OK) при 37°C (амплификатор).
6. Добавляли 2мкл Turbo ДНКазы (набор MEGAscript из Ambion) к каждому образцу. Тщательно перемешивали и инкубировали при 37°С в течение 15'.
7. Очищали обработанную ДНКазой реакцию с использованием MegaClear от Ambion в соответствии с инструкциями изготовителя.
8. Очищали РНК с помощью MEGAclear (очищенная РНК может храниться при -80 в течение нескольких месяцев).
9. Удаляли фосфатные группы, с целью избежать иммунной реакции Toll2 в клетке-хозяине.
Аккуратно перемешивали образец и инкубировали при 37 С в течение 30 секунд (30 секунд - 1 ч ок)
3. Трансфекция РНК
1. Рассевали 10K-20K клеток на 48 лунок без антибиотиков. Для трансфекции клетки должны быть на 30-50% конфлюэнтны.
2. Заменяли клеточную среду с B18R (200 нг/мл), DOX (1 мкг/мл), пуромицином (2 мкг/мл), по меньшей мере, за два часа до трансфекции.
3. Готовили реагент для трансфекции, содержащий направляющую РНК (0,5 мкг ~ 2 мкг), донорную ДНК (0,5 мкг ~ 2 мкг) и RNAiMax, инкубировали смесь при температуре rm в течение 15 минут и переносили в камеру к клеткам.
4. Рассеивание одиночных человеческих iPS клеток рассевали и сбор одиночных клонов
1. Через 4 дня индукции DOX и 1 дня отмены DOX, асперировали среду, отмывали осторожно с помощью DPBS, добавляли 2 мл/лунку версена, и помещали культуру обратно в инкубатор при температуре 37°C до тех пор, пока клетки не группировались вместе и становились непрочно прикрепленными, но не отсоединенными. Это требовало 3-7 мин.
2. Аккуратно аспирировали версен и добавляли mTeSRl. Добавляли 1 мл mTeSRl и отсоединяли клетки с помощью 1000 мкл микропипетки медленным потоком mTeSRl.
3. Собирали отсоединенные клетки, мягко разбивали их в одноклеточную суспензию, количественно оценивали с помощью гематоцитометра, и корректировали плотность клеток до 100 тыс. клеток на мл.
4. Рассевали клетки на покрытые матригелем 10 см чашки с mTeSRl плюс ингибитор ROCK при плотности клеток 50К, 100К и 400К на 10 см чашку.
5. Скрининг клонов, образованных из одиночных клеток
1. Через 12 дней культивирования в 10 см чашке, клоны становились достаточно большими, чтобы быть идентифицированными невооруженным глазом, с возможностью мечения цветным маркером. Не давали клонам становиться слишком большими, и слипаться друг с другом.
2. Помещали 10 см чашку в ламинар и с помощью пипетки P20 (установленной на 10 мкл) с наконечниками с фильтрами аспирировали 10 мкл среды из каждой лунки 24 луночных планшетов. Отбирали клоны клон путем соскребания клона и переноса в каждую лунку 24 луночного планшета. Для каждого клона использовали отдельный наконечник с фильтром.
3. Через 4-5 дней клоны внутри одной лунки 24-луночного планшета становились достаточно большими для разделения.
4. Аспририровали среду и промывали 2 мл/лунку DPBS.
5. Аспирировали DPBS, заменяли 250 мкл/лунку диспазы (0,1 Ед/мл) и инкубировали клетки с диспазой при 37°С в течение 7 минут.
6. Заменяли диспазу 2 мл DPBS.
7. Добавляли 250 мкл mTeSRl. С помощью скребка для клеток снимали и собирали клетки.
8. Переносили 125 мкл суспензии клеток в лунку 24-луночного планшета, покрытого матригелем.
9. Переносили 125 мкл суспензии клеток в 1,5 мл пробирку Эппендорф для экстракции геномной ДНК.
6. Скрининг клонов
1. Центрифугировали пробирку из стадии 7.7
2. Аспирировали среду и добавляли 250 мкл буфера для лизиса на лунку (10 мМ + TrispH7. 5 + (или + 8,0), 10 мМ ЭДТА, 10 мМ
3. NaCl + 10% ДСН, 40 мкг/мл протеиназы К + (добавленной свежей перед использованием буфера).
4. Выдерживали при 55 в течение ночи.
5. Высаживали ДНК добавлением 250 мкл изопропанола.
6. Центрифугировали в течение 30 минут на максимальной скорости. Промывали 70% этанолом.
7. Аккуратно удаляли этанол. Сушили на воздухе в течение 5 мин.
8. Ресуспендировали гДНК в 100-200 мкл dH2O.
9. Амплифицировали с помощью ПЦР целевую геномную область с помощью специфических праймеров.
10. Секвенировали по Сенгеру продукт ПЦР с помощью соответствующего праймера.
11. Анализировали данные о последовательностях по Сэнгеру и экспансию целевых клонов.
7. Удаление вектора PiggyBac
1. Повторяли стадии 2.1-2.9
2. Переносили клетки в кювету Nucleofector с помощью 1 мл наконечника для пипетки. Добавляли 2 мкг плазмиды с транспозазой в суспензию клеток в кювете. Смешивали клетки и ДНК осторожным покачиванием.
3. Повторяли стадию 2.10-2.11
4. Асперировали нуклеофицированные клетки из кюветы с помощью предоставленной пастеровской пластиковой пипетки и переносили клетки покапельно в 10 см чашки покрытые матригелеем со средой mTeSR1 и ингибитором ROCK. Инкубировали клетки при 37°С в течение ночи.
5. На следующий день заменяли среду mTesr1 и заменяли среду каждый день в течение 4 последующих дней.
6. После того, как клоны стал достаточно большими забирали 20-50 клонов и рассевали в 24 луночный планшет.
7. Генотипировали клоны с помощью праймеров на вектор PB Cas9 PiggyBac и размножали отрицательные клоны.
Список литературы
Литературные источники обозначены в описании их номером и включены в описание как если бы они были полностью изложены в нем. Каждый из следующих источников включен в данное описание ссылкой в полном объеме.
1. Carroll, D. (2011) Genome engineering with zinc-finger nucleases. Genetics, 188, 773-82.
2. Wood, A. J., Lo, T. -W., Zeitler, B., Pickle, C. S., Ralston, E. J., Lee, A. H., Amora, R., Miller, J. C, Leung, E., Meng, X., et al. (2011) Targeted genome editing across species using ZFNs and TALENs. Science (New York, N. Y.), 333, 307.
3. Perez-Pinera, P., Ousterout, D. G. and Gersbach, C. A. (2012) Advances in targeted genome editing. Current opinion in chemical biology, 16, 268-77.
4. Symington, L. S. and Gautier, J. (2011) Double-strand break end resection and repair pathway choice. Annual review of genetics, 45, 247-71.
5. Urnov, F. D., Miller, J. C, Lee, Y. -L., Beausejour, C. M., Rock, J. M., Augustus, S., Jamieson, A. C, Porteus, M. H., Gregory, P. D. and Holmes, M. C. (2005) Highly efficient endogenous human gene correction using designed zinc-finger nucleases. Nature, 435, 646-51.
6. Boch, J., Scholze, H., Schornack, S., Landgraf, A., Hahn, S., Kay, S., Lahaye, T., Nickstadt, A. and Bonas, U. (2009) Breaking the code of DNA binding specificity of TAL-type III effectors. Science (New York, N. Y.), 326, 1509-12.
7. Cell, P., Replacement, K.S., Talens, A., Type, A., Collection, C, Ccl-, A. and Quickextract, E. Genetic engineering of human pluripotent cells using TALE nucleases.
8. Mussolino, C, Morbitzer, R., Lutge, F., Dannemann, N., Lahaye, T. and Cathomen, T. (2011) A novel TALE nuclease scaffold enables high genome editing activity in combination with low toxicity. Nucleic acids research, 39, 9283-93.
9. Ding, Q., Lee, Y., Schaefer, E. A. K., Peters, D. T., Veres, A., Kim, K., Kuperwasser, N., Motola, D. L., Meissner, T. B., Hendriks, W. T., et al. (2013) Resource A TALEN Genome-Editing System for Generating Human Stem Cell-Based Disease Models.
10. Hockemeyer, D., Wang, H., Kiani, S., Lai, C. S., Gao, Q., Cassady, J. P., Cost, G. J., Zhang, L., Santiago, Y., Miller, J. C, et al. (2011) Genetic engineering of human pluripotent cells using TALE nucleases. Nature biotechnology, 29, 731-4.
11. Bedell, V. M., Wang, Y., Campbell, J. M., Poshusta, T. L., Starker, C. G., Krag Ii, R. G., Tan, W., Penheiter, S. G., Ma, A. C, Leung, A. Y. H., et al. (2012) In vivo genome editing using a high-efficiency TALEN system. Nature, 490, 114-118.
12. Miller, J. C, Tan, S., Qiao, G., Barlow, K. a, Wang, J., Xia, D. F., Meng, X., Paschon, D. E., Leung, E., Hinkley, S. J., et al. (2011) A TALE nuclease architecture for efficient genome editing. Nature biotechnology, 29, 143-8.
13. Holkers, M., Maggio, L, Liu, J., Janssen, J. M., Miselli, F., Mussolino, C, Recchia, A., Cathomen, T. and Goncalves, M. a F. V (2012) Differential integrity of TALE nuclease genes following adenoviral and lentiviral vector gene transfer into human cells. Nucleic acids research, 10. 1093/nar/gksl446.
14. Reyon, D., Tsai, S. Q., Khayter, C, Foden, J. a, Sander, J. D. and Joung, J. K. (2012) FLASH assembly of TALENs for high-throughput genome editing. Nature Biotechnology, 30, 460-465.
15. Qiu, P., Shandilya, H., D'Alessio, J. M., 0'Connor, K., Durocher, J. and Gerard, G. F. (2004) Mutation detection using Surveyor nuclease. BioTechniques, 36, 702-7.
16. Mali, P., Yang, L., Esvelt, K. M., Aach, J., Guell, M., DiCarlo, J. E., Norville, J. E. and Church, G. M. (2013) RNA-guided human genome engineering via Cas9. Science (New York, N. Y.), 339, 823-6.
17. Ding, Q., Regan, S. N., Xia, Y., Oostrom, L. A., Cowan, C. A. and Musunura, K. (2013) Enhanced Efficiency of Human Pluripotent Stem Cell Genome Editing through Replacing TALENs with CRISPRs. Cell Stem Cell, 12, 393-394.
18. Cong, L., Ran, F. A., Cox, D., Lin, S., Barretto, R., Habib, N., Hsu, P. D., Wu, X., Jiang, W., Marraffini, L. a, et al. (2013) Multiplex genome engineering using CRISPR/Cas systems. Science (New York, N. Y.), 339, 819-23.
19. Cho, S. W., Kim, S., Kim, J. M. and Kim, J. -S. (2013) Targeted genome engineering in human cells with the Cas9 RNA-guided endonuclease. Nature biotechnology, 31, 230-232.
20. Hwang, W. Y., Fu, Y., Reyon, D., Maeder, M. L., Tsai, S. Q., Sander, J. D., Peterson, R. T., Yeh, J. -RJ. and Joung, J. K. (2013) Efficient genome editing in zebrafish using a CRISPR-Cas system. Nature biotechnology, 31, 227-229.
21. Chen, F., Praett-Miller, S. M., Huang, Y., Gjoka, M., Duda, K., Taunton, J., Collingwood, T. N., Frodin, M. and Davis, G. D. (2011) High-frequency genome editing using ssDNA oligonucleotides with zinc-finger nucleases. Nature methods, 8, 753-5.
22. Soldner, F., Laganiere, J., Cheng, A. W., Hockemeyer, D., Gao, Q., Alagappan, R., Khurana, V., Golbe, L. L, Myers, R. H., Lindquist, S., et al. (2011) Generation of isogenic pluripotent stem cells differing exclusively at two early onset Parkinson point mutations. Cell, 146, 318-31.
23. Valamehr, B., Abujarour, R., Robinson, M., Le, T., Robbins, D., Shoemaker, D. and Flynn, P. (2012) A novel platform to enable the high-throughput derivation and characterization of feeder-free human iPSCs. Scientific reports, 2, 213.
24. Sanjana, N. E., Cong, L., Zhou, Y., Cunniff, M. M., Feng, G. and Zhang, F. (2012) A transcription activator-like effector toolbox for genome engineering. Nature protocols, 7, 171-92.
25. Gibson, D. G., Young, L., Chuang, R., Venter, J. C., Iii, C. A. H., Smith, H. O. and America, N. (2009) Enzymatic assembly of DNA molecules up to several hundred kilobases. 6, 12-16.
26. Zou, J., Maeder, M. L., Mali, P., Praett-Miller, S. M., Thibodeau-Beganny, S., Chou, B. -K., Chen, G., Ye, Z., Park, I. -H., Daley, G. Q., et al. (2009) Gene targeting of a disease-related gene in human induced pluripotent stem and embryonic stem cells. Cell stem cell, 5, 97-110.
27. Perez, E. E., Wang, J., Miller, J. C, Jouvenot, Y., Kim, K. a, Liu, 0., Wang, N., Lee, G., Bartsevich, V. V, Lee, Y. -L., et al. (2008) Establishment of HIV-1 resistance in CD4+ T cells by genome editing using zinc-finger nucleases. Nature biotechnology, 26, 808-16.
28. Bhakta, M. S., Неnry, I.М., OusteroutD. G., Das, K. T., Lockwood, S. H., Meckler, J. F., Wallen, M. C, Zykovich, A., Yu, Y., Leo, H., et al. (2013) Highly active zinc-finger nucleases by extended modular assembly. Genome research, 10. 1101/gr. 143693. 112.
29. Kim, E., Kim, S., Kim, D. H., Choi, B. -S., Choi, I. -Y. andKim, J. -S. (2012) Precision genome engineering with programmable DNA-nicking enzymes. Genome research, 22, 1327-33.
30. Gupta, A., Meng, X., Zhu, L. J., Lawson, N. D. and Wolfe, S. a (2011) Zinc finger protein-dependent and -independent contributions to the in vivo off-target activity of zinc finger nucleases. Nucleic acids research, 39, 381-92.
31. Park, I. -H., Lerou, P. H., Zhao, R., Huo, H. and Daley, G. Q. (2008) Generation of human-induced pluripotent stem cells. Природа протоколов, 3, 1180-6.
32. Cermak, T., Doyle, E. L., Christian, M., Wang, L., Zhang, Y., Schmidt, C, Baller, J. A., Somia, N. V, Bogdanove, A. J. and Voytas, D. F. (2011) Efficient design and assembly of custom TALEN and other TAL effector-based constructs for DNA targeting. Nucleic acids research, 39, e82.
33. Briggs, A. W., Rios, X., Chari, R., Yang, L., Zhang, F., Mali, P. and Church, G. M. (2012) Iterative capped assembly: rapid and scalable synthesis of repeat-module DNA such as TAL effectors from individual monomers. Nucleic acids research, 10. 1093/nar/gks624.
34. Zhang, F., Cong, L., Lodato, S., Kosuri, S., Church, G. M. and Arlotta, P. (2011) LETTErs Efficient construction of sequence-specific TAL effectors for modulating mammalian transcription. 29, 149-154.
35. Pathak, V. K. and Temin, H. M. (1990) Broad spectrum of in vivo forward mutations, hypermutations, and mutational hotspots in a retroviral shuttle vector after a single replication cycle: substitutions, frameshifts, and hypermutations. Proceedings of the National Academy of Sciences of the United States of America, 87, 6019-23.
36. Tian, J., Ma, K. and Saaem, I. (2009) Advancing high-throughput gene synthesis technology. Molecular bioSystems, 5, 714-22.
37. Zou, J., Mali, P., Huang, X., Dowey, S. N. and Cheng, L. (2011) Site-specific gene correction of a point mutation in human iPS cells derived from an adult patient with sickle cell disease. Blood, 118, 4599-608.
38. Mali, P., Yang, L., Esvelt, K. M., Aach, J., Guell, M., Dicarlo, J. E., Norville, J. E. and Church, G. M. (2013) RNA-Guided Human Genome.
39. Boyle, A. P., Davis, S., Shulha, H. P., Meltzer, P., Margulies, E. H., Weng, Z., Furey, T. S. and Crawford, G. E. (2008) High-resolution mapping and characterization of open chromatin across the genome. Cell, 132, 311-22.
40. Orlando, S. J., Santiago, Y., DeKelver, R. C, Freyvert, Y., Boydston, E. a, Moehle, E. a, Choi, V. M., Gopalan, S. M., Lou, J. F., Li, J., et al. (2010) Zinc-finger nuclease-driven targeted integration into mammalian genomes using donors with limited chromosomal homology. Nucleic acids research, 38, el52.
41. Wang, Z., Zhou, Z. -J., Liu, D. -P. and Huang, J. -D. (2008) Double-stranded break can be repaired by single-stranded oligonucleotides via the ATM/ATR pathway in mammalian cells. Oligonucleotides, 18, 21-32.
42. Rios, X., Briggs, A. W., Christodoulou, D., Gorham, J. M., Seidman, J. G. and Church, G. M. (2012) Stable gene targeting in human cells using single-strand oligonucleotides with modified bases. PloS one, 7, e36697.
43. Elliott, B., Richardson, C, Winderbaum, J., Jac, A., Jasin, M. and Nickoloff, J. A. C. A. (1998) Gene Conversion Tracts from Double-Strand Break Repair in Mammalian Cells Gene Conversion Tracts from Double-Strand Break Repair in Mammalian Cells. 18.
44. Lombardo, A., Genovese, P., Beausejour, C. M., Colleoni, S., Lee, Y. -L., Kim, K. a, Ando, D., Urnov, F. D., Galli, C, Gregory, P. D., et al. (2007) Gene editing in human stem cells using zinc finger nucleases and integrase-defective lentiviral vector delivery. Nature biotechnology, 25, 1298-306.
45. Jinek, M., Chylinski, K., Fonfara, I, Hauer, M., Doudna, J. a and Charpentier, E. (2012) A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science (New York, N. Y.), 337, 816-21.
46. Shrivastav, M., De Haro, L. P. and NickoloffJ. a (2008) Regulation of DNA double-strand break repair pathway choice. Cell research, 18, 134-47.
47. Kim, Y. G., Cha, J. and Chandrasegaran, S. (1996) Hybrid restriction enzymes: zinc finger fusions to Fok I cleavage domain. Proceedings of the National Academy of Sciences of the United States of America, 93, 1156-60.
48. Mimitou, E. P. and Symington, L. S. (2008) Sae2, Exol and Sgsl collaborate in DNA double-strand break processing. Nature, 455, 7701.
49. Doyon, Y., Choi, V. M., Xia, D. F., Vo, T. D., Gregory, P. D. and Holmes, M. C. (2010) Transient cold shock enhances zinc-finger nuclease-mediated gene disruption. Nature methods, 7, 459-60.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Church, George
Yang, Luhan
Cargol, Marc
Yang, Joyce
<120> Genome Engineering
<130> 010498.00517
<140> PCT/US14/048140
<141> 2014-06-30
<150> US 61/858,866
<151> 2013-07-26
<160> 224
<170> PatentIn version 3.5
<210> 1
<211> 15
<212> DNA
<213> Artificial
<220>
<223> Oligonucleotide sequence
<400> 1
tggggcaagc ttctg 15
<210> 2
<211> 102
<212> DNA
<213> Artificial
<220>
<223> TALE template
<220>
<221> misc_feature
<222> (34)..(39)
<223> n is a, c, g, or t
<400> 2
ctaaccccag agcaggtcgt ggcaatcgcc tccnnnnnng gcggaaaaca ggcattggaa 60
acagtacagc ggctgctgcc ggtgctgtgc caagcgcacg ga 102
<210> 3
<211> 102
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<220>
<221> misc_feature
<222> (34)..(39)
<223> n is a, c, g, or t
<400> 3
ctaacccctg aacaggtagt cgctatagct tcannnnnng ggggcaagca agcacttgag 60
accgttcaac gactcctgcc agtgctctgc caagcccatg ga 102
<210> 4
<211> 102
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<220>
<221> misc_feature
<222> (34)..(39)
<223> n is a, c, g, or t
<400> 4
ttgactccgg agcaagtcgt cgcgatcgcg agcnnnnnng gggggaagca ggcgctggaa 60
actgttcaga gactgctgcc tgtactttgt caggcgcatg gt 102
<210> 5
<211> 102
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<220>
<221> misc_feature
<222> (34)..(39)
<223> n is a, c, g, or t
<400> 5
ctcacccccg aacaggttgt cgcaatagca agtnnnnnng gcggtaagca agccctagag 60
actgtgcaac gcctgctccc cgtgctgtgt caggctcacg gt 102
<210> 6
<211> 102
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<220>
<221> misc_feature
<222> (34)..(39)
<223> n is a, c, g, or t
<400> 6
ctgacacctg aacaagttgt cgcgatagcc agtnnnnnng ggggaaaaca agctctagaa 60
acggttcaaa ggttgttgcc cgttctgtgc caagcacatg gg 102
<210> 7
<211> 102
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<220>
<221> misc_feature
<222> (34)..(39)
<223> n is a, c, g, or t
<400> 7
ttaacacccg aacaagtagt agcgatagcg tcannnnnng ggggtaaaca ggctttggag 60
acggtacagc ggttattgcc ggtcctctgc caggcccacg ga 102
<210> 8
<211> 102
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<220>
<221> misc_feature
<222> (34)..(39)
<223> n is a, c, g, or t
<400> 8
cttacgccag aacaggtggt tgcaattgcc tccnnnnnng gcgggaaaca agcgttggaa 60
actgtgcaga gactccttcc tgttttgtgt caagcccacg gc 102
<210> 9
<211> 102
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<220>
<221> misc_feature
<222> (34)..(39)
<223> n is a, c, g, or t
<400> 9
ttgacgcctg agcaggttgt ggccatcgct agcnnnnnng gagggaagca ggctcttgaa 60
accgtacagc gacttctccc agttttgtgc caagctcacg gg 102
<210> 10
<211> 102
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<220>
<221> misc_feature
<222> (34)..(39)
<223> n is a, c, g, or t
<400> 10
ctaacccccg agcaagtagt tgccatagca agcnnnnnng gaggaaaaca ggcattagaa 60
acagttcagc gcttgctccc ggtactctgt caggcacacg gt 102
<210> 11
<211> 102
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<220>
<221> misc_feature
<222> (34)..(39)
<223> n is a, c, g, or t
<400> 11
ctaactccgg aacaggtcgt agccattgct tccnnnnnng gcggcaaaca ggcgctagag 60
acagtccaga ggctcttgcc tgtgttatgc caggcacatg gc 102
<210> 12
<211> 102
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<220>
<221> misc_feature
<222> (34)..(39)
<223> n is a, c, g, or t
<400> 12
ctcaccccgg agcaggtcgt tgccatcgcc agtnnnnnng gcggaaagca agctctcgaa 60
acagtacaac ggctgttgcc agtcctatgt caagctcatg ga 102
<210> 13
<211> 102
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<220>
<221> misc_feature
<222> (34)..(39)
<223> n is a, c, g, or t
<400> 13
ctgacgcccg agcaggtagt ggcaatcgca tctnnnnnng gaggtaaaca agcactcgag 60
actgtccaaa gattgttacc cgtactatgc caagcgcatg gt 102
<210> 14
<211> 102
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<220>
<221> misc_feature
<222> (34)..(39)
<223> n is a, c, g, or t
<400> 14
ttaaccccag agcaagttgt ggctattgca tctnnnnnng gtggcaaaca agccttggag 60
acagtgcaac gattactgcc tgtcttatgt caggcccatg gc 102
<210> 15
<211> 102
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<220>
<221> misc_feature
<222> (34)..(39)
<223> n is a, c, g, or t
<400> 15
cttactcctg agcaagtcgt agctatcgcc agcnnnnnng gtgggaaaca ggccctggaa 60
accgtacaac gtctcctccc agtactttgt caagcacacg gg 102
<210> 16
<211> 102
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<220>
<221> misc_feature
<222> (34)..(39)
<223> n is a, c, g, or t
<400> 16
ttgacaccgg aacaagtggt ggcgattgcg tccnnnnnng gaggcaagca ggcactggag 60
accgtccaac ggcttcttcc ggttctttgc caggctcatg gg 102
<210> 17
<211> 102
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<220>
<221> misc_feature
<222> (34)..(39)
<223> n is a, c, g, or t
<400> 17
ctcacgccag agcaggtggt agcaatagcg tcgnnnnnng gtggtaagca agcgcttgaa 60
acggtccagc gtcttctgcc ggtgttgtgc caggcgcacg ga 102
<210> 18
<211> 102
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<220>
<221> misc_feature
<222> (34)..(39)
<223> n is a, c, g, or t
<400> 18
ctcacaccag aacaagtggt tgctattgct agtnnnnnng gtggaaagca ggccctcgag 60
acggtgcaga ggttacttcc cgtcctctgt caagcgcacg gc 102
<210> 19
<211> 60
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<220>
<221> misc_feature
<222> (34)..(39)
<223> n is a, c, g, or t
<400> 19
ctcactccag agcaagtggt tgcgatcgct tcannnnnng gtggaagacc tgccctggaa 60
<210> 20
<211> 5714
<212> DNA
<213> Artificial
<220>
<223> Oligonucleotide sequence encoding TALEN backbone
<400> 20
atgtcgcgga cccggctccc ttccccaccc gcacccagcc cagcgttttc ggccgactcg 60
ttctcagacc tgcttaggca gttcgacccc tcactgttta acacatcgtt gttcgactcc 120
cttcctccgt ttggggcgca ccatacggag gcggccaccg gggagtggga tgaggtgcag 180
tcgggattga gagctgcgga tgcaccaccc ccaaccatgc gggtggccgt caccgctgcc 240
cgaccgccga gggcgaagcc cgcaccaagg cggagggcag cgcaaccgtc cgacgcaagc 300
cccgcagcgc aagtagattt gagaactttg ggatattcac agcagcagca ggaaaagatc 360
aagcccaaag tgaggtcgac agtcgcgcag catcacgaag cgctggtggg tcatgggttt 420
acacatgccc acatcgtagc cttgtcgcag caccctgcag cccttggcac ggtcgccgtc 480
aagtaccagg acatgattgc ggcgttgccg gaagccacac atgaggcgat cgtcggtgtg 540
gggaaacagt ggagcggagc ccgagcgctt gaggccctgt tgacggtcgc gggagagctg 600
agagggcctc cccttcagct ggacacgggc cagttgctga agatcgcgaa gcggggagga 660
gtcacggcgg tcgaggcggt gcacgcgtgg cgcaatgcgc tcacgggagc acccctcaac 720
agttcacgct gacagagacc gcggccgcat taggcacccc aggctttaca ctttatgctt 780
ccggctcgta taatgtgtgg attttgagtt aggatccgtc gagattttca ggagctaagg 840
aagctaaaat ggagaaaaaa atcactggat ataccaccgt tgatatatcc caatggcatc 900
gtaaagaaca ttttgaggca tttcagtcag ttgctcaatg tacctataac cagaccgttc 960
agctggatat tacggccttt ttaaagaccg taaagaaaaa taagcacaag ttttatccgg
1020
cctttattca cattcttgcc cgcctgatga atgctcatcc ggaattccgt atggcaatga
1080
aagacggtga gctggtgata tgggatagtg ttcacccttg ttacaccgtt ttccatgagc
1140
aaactgaaac gttttcatcg ctctggagtg aataccacga cgatttccgg cagtttctac
1200
acatatattc gcaagatgtg gcgtgttacg gtgaaaacct ggcctatttc cctaaagggt
1260
ttattgagaa tatgtttttc gtctcagcca atccctgggt gagtttcacc agttttgatt
1320
taaacgtggc caatatggac aacttcttcg cccccgtttt caccatgggc aaatattata
1380
cgcaaggcga caaggtgctg atgccgctgg cgattcaggt tcatcatgcc gtttgtgatg
1440
gcttccatgt cggcagaatg cttaatgaat tacaacagta ctgcgatgag tggcagggcg
1500
gggcgtaaag atctggatcc ggcttactaa aagccagata acagtatgcg tatttgcgcg
1560
ctgatttttg cggtataaga atatatactg atatgtatac ccgaagtatg tcaaaaagag
1620
gtatgctatg aagcagcgta ttacagtgac agttgacagc gacagctatc agttgctcaa
1680
ggcatatatg atgtcaatat ctccggtctg gtaagcacaa ccatgcagaa tgaagcccgt
1740
cgtctgcgtg ccgaacgctg gaaagcggaa aatcaggaag ggatggctga ggtcgcccgg
1800
tttattgaaa tgaacggctc ttttgctgac gagaacaggg gctggtgaaa tgcagtttaa
1860
ggtttacacc tataaaagag agagccgtta tcgtctgttt gtggatgtac agagtgatat
1920
tattgacacg cccgggcgac ggatggtgat ccccctggcc agtgcacgtc tgctgtcaga
1980
taaagtctcc cgtgaacttt acccggtggt gcatatcggg gatgaaagct ggcgcatgat
2040
gaccaccgat atggccagtg tgccggtctc cgttatcggg gaagaagtgg ctgatctcag
2100
ccaccgcgaa aatgacatca aaaacgccat taacctgatg ttctggggaa tataaatgtc
2160
aggctccctt atacacagcc agtctgcagg tcgacggtct cgctcttcga aggttacttc
2220
ccgtcctctg tcaagcgcac ggcctcactc cagagcaagt ggttgcgatc gcttcaaaca
2280
acggtggaag acctgccctg gaatcaatcg tggcccagct ttcgaggccg gaccccgcgc
2340
tggccgcact cactaatgat catcttgtag cgctggcctg cctcggcgga cgacccgcct
2400
tggatgcggt gaagaagggg ctcccgcacg cgcctgcatt gattaagcgg accaacagaa
2460
ggattcccga gaggacatca catcgagtgg caggttccca actcgtgaag agtgaacttg
2520
aggagaaaaa gtcggagctg cggcacaaat tgaaatacgt accgcatgaa tacatcgaac
2580
ttatcgaaat tgctaggaac tcgactcaag acagaatcct tgagatgaag gtaatggagt
2640
tctttatgaa ggtttatgga taccgaggga agcatctcgg tggatcacga aaacccgacg
2700
gagcaatcta tacggtgggg agcccgattg attacggagt gatcgtcgac acgaaagcct
2760
acagcggtgg gtacaatctt cccatcgggc aggcagatga gatgcaacgt tatgtcgaag
2820
aaaatcagac caggaacaaa cacatcaatc caaatgagtg gtggaaagtg tatccttcat
2880
cagtgaccga gtttaagttt ttgtttgtct ctgggcattt caaaggcaac tataaggccc
2940
agctcacacg gttgaatcac attacgaact gcaatggtgc ggttttgtcc gtagaggaac
3000
tgctcattgg tggagaaatg atcaaagcgg gaactctgac actggaagaa gtcagacgca
3060
agtttaacaa tggcgagatc aatttccgca agctaaaatg gagaaaaaaa tcactggata
3120
taccaccgtt gatatatccc aatggcatcg taaagaacat tttgaggcat ttcagtcagt
3180
tgctcaatgt acctataacc agaccgttca gctggatatt acggcctttt taaagaccgt
3240
aaagaaaaat aagcacaagt tttatccggc ctttattcac attcttgccc gcctgatgaa
3300
tgctcatccg gaattccgta tggcaatgaa agacggtgag ctggtgatat gggatagtgt
3360
tcacccttgt tacaccgttt tccatgagca aactgaaacg ttttcatcgc tctggagtga
3420
ataccacgac gatttccggc agtttctaca catatattcg caagatgtgg cgtgttacgg
3480
tgaaaacctg gcctatttcc ctaaagggtt tattgagaat atgtttttcg tctcagccaa
3540
tccctgggtg agtttcacca gttttgattt aaacgtggcc aatatggaca acttcttcgc
3600
ccccgttttc accatgggca aatattatac gcaaggcgac aaggtgctga tgccgctggc
3660
gattcaggtt catcatgccg tttgtgatgg cttccatgtc ggcagaatgc ttaatgaatt
3720
acaacagtac tgcgatgagt ggcagggcgg ggcgtaaaga tctggatccg gcttactaaa
3780
agccagataa cagtatgcgt atttgcgcgc tgatttttgc ggtataagaa tatatactga
3840
tatgtatacc cgaagtatgt caaaaagagg tatgctatga agcagcgtat tacagtgaca
3900
gttgacagcg acagctatca gttgctcaag gcatatatga tgtcaatatc tccggtctgg
3960
taagcacaac catgcagaat gaagcccgtc gtctgcgtgc cgaacgctgg aaagcggaaa
4020
atcaggaagg gatggctgag gtcgcccggt ttattgaaat gaacggctct tttgctgacg
4080
agaacagggg ctggtgaaat gcagtttaag gtttacacct ataaaagaga gagccgttat
4140
cgtctgtttg tggatgtaca gagtgatatt attgacacgc ccgggcgacg gatggtgatc
4200
cccctggcca gtgcacgtct gctgtcagat aaagtctccc gtgaacttta cccggtggtg
4260
catatcgggg atgaaagctg gcgcatgatg accaccgata tggccagtgt gccggtctcc
4320
gttatcgggg aagaagtggc tgatctcagc caccgcgaaa atgacatcaa aaacgccatt
4380
aacctgatgt tctggggaat ataaatgtca ggctccctta tacacagcca gtctgcaggt
4440
cgacggtctc gctcttcgaa ggttacttcc cgtcctctgt caagcgcacg gcctcactcc
4500
agagcaagtg gttgcgatcg cttcaaacaa cggtggaaga cctgccctgg aatcaatcgt
4560
ggcccagctt tcgaggccgg accccgcgct ggccgcactc actaatgatc atcttgtagc
4620
gctggcctgc ctcggcggac gacccgcctt ggatgcggtg aagaaggggc tcccgcacgc
4680
gcctgcattg attaagcgga ccaacagaag gattcccgag aggacatagc cccaagaaga
4740
agagaaaggt ggaggccagc ggttccggac gggctgacgc attggacgat tttgatctgg
4800
atatgctggg aagtgacgcc ctcgatgatt ttgaccttga catgcttggt tcggatgccc
4860
ttgatgactt tgacctcgac atgctcggca gtgacgccct tgatgatttc gacctggaca
4920
tgctgattaa ctctagaggc agtggagagg gcagaggaag tctgctaaca tgcggtgacg
4980
tcgaggagaa tcctggccca gtgagcaagg gcgaggagct gttcaccggg gtggtgccca
5040
tcctggtcga gctggacggc gacgtaaacg gccacaagtt cagcgtgtcc ggcgagggcg
5100
agggcgatgc cacctacggc aagctgaccc tgaagttcat ctgcaccacc ggcaagctgc
5160
ccgtgccctg gcccaccctc gtgaccaccc tgacctacgg cgtgcagtgc ttcagccgct
5220
accccgacca catgaagcag cacgacttct tcaagtccgc catgcccgaa ggctacgtcc
5280
aggagcgcac catcttcttc aaggacgacg gcaactacaa gacccgcgcc gaggtgaagt
5340
tcgagggcga caccctggtg aaccgcatcg agctgaaggg catcgacttc aaggaggacg
5400
gcaacatcct ggggcacaag ctggagtaca actacaacag ccacaacgtc tatatcatgg
5460
ccgacaagca gaagaacggc atcaaggtga acttcaagat ccgccacaac atcgaggacg
5520
gcagcgtgca gctcgccgac cactaccagc agaacacccc catcggcgac ggccccgtgc
5580
tgctgcccga caaccactac ctgagcaccc agtccgccct gagcaaagac cccaacgaga
5640
agcgcgatca catggtcctg ctggagttcg tgaccgccgc cgggatcact ctcggcatgg
5700
acgagctgta caag 5714
<210> 21
<211> 3465
<212> DNA
<213> Artificial
<220>
<223> Oligonucleotide sequence encoding TALE backbone sequence
<400> 21
atgtcgcgga cccggctccc ttccccaccc gcacccagcc cagcgttttc ggccgactcg 60
ttctcagacc tgcttaggca gttcgacccc tcactgttta acacatcgtt gttcgactcc 120
cttcctccgt ttggggcgca ccatacggag gcggccaccg gggagtggga tgaggtgcag 180
tcgggattga gagctgcgga tgcaccaccc ccaaccatgc gggtggccgt caccgctgcc 240
cgaccgccga gggcgaagcc cgcaccaagg cggagggcag cgcaaccgtc cgacgcaagc 300
cccgcagcgc aagtagattt gagaactttg ggatattcac agcagcagca ggaaaagatc 360
aagcccaaag tgaggtcgac agtcgcgcag catcacgaag cgctggtggg tcatgggttt 420
acacatgccc acatcgtagc cttgtcgcag caccctgcag cccttggcac ggtcgccgtc 480
aagtaccagg acatgattgc ggcgttgccg gaagccacac atgaggcgat cgtcggtgtg 540
gggaaacagt ggagcggagc ccgagcgctt gaggccctgt tgacggtcgc gggagagctg 600
agagggcctc cccttcagct ggacacgggc cagttgctga agatcgcgaa gcggggagga 660
gtcacggcgg tcgaggcggt gcacgcgtgg cgcaatgcgc tcacgggagc acccctcaac 720
agttcacgct gacagagacc gcggccgcat taggcacccc aggctttaca ctttatgctt 780
ccggctcgta taatgtgtgg attttgagtt aggatccgtc gagattttca ggagctaagg 840
aagctaaaat ggagaaaaaa atcactggat ataccaccgt tgatatatcc caatggcatc 900
gtaaagaaca ttttgaggca tttcagtcag ttgctcaatg tacctataac cagaccgttc 960
agctggatat tacggccttt ttaaagaccg taaagaaaaa taagcacaag ttttatccgg
1020
cctttattca cattcttgcc cgcctgatga atgctcatcc ggaattccgt atggcaatga
1080
aagacggtga gctggtgata tgggatagtg ttcacccttg ttacaccgtt ttccatgagc
1140
aaactgaaac gttttcatcg ctctggagtg aataccacga cgatttccgg cagtttctac
1200
acatatattc gcaagatgtg gcgtgttacg gtgaaaacct ggcctatttc cctaaagggt
1260
ttattgagaa tatgtttttc gtctcagcca atccctgggt gagtttcacc agttttgatt
1320
taaacgtggc caatatggac aacttcttcg cccccgtttt caccatgggc aaatattata
1380
cgcaaggcga caaggtgctg atgccgctgg cgattcaggt tcatcatgcc gtttgtgatg
1440
gcttccatgt cggcagaatg cttaatgaat tacaacagta ctgcgatgag tggcagggcg
1500
gggcgtaaag atctggatcc ggcttactaa aagccagata acagtatgcg tatttgcgcg
1560
ctgatttttg cggtataaga atatatactg atatgtatac ccgaagtatg tcaaaaagag
1620
gtatgctatg aagcagcgta ttacagtgac agttgacagc gacagctatc agttgctcaa
1680
ggcatatatg atgtcaatat ctccggtctg gtaagcacaa ccatgcagaa tgaagcccgt
1740
cgtctgcgtg ccgaacgctg gaaagcggaa aatcaggaag ggatggctga ggtcgcccgg
1800
tttattgaaa tgaacggctc ttttgctgac gagaacaggg gctggtgaaa tgcagtttaa
1860
ggtttacacc tataaaagag agagccgtta tcgtctgttt gtggatgtac agagtgatat
1920
tattgacacg cccgggcgac ggatggtgat ccccctggcc agtgcacgtc tgctgtcaga
1980
taaagtctcc cgtgaacttt acccggtggt gcatatcggg gatgaaagct ggcgcatgat
2040
gaccaccgat atggccagtg tgccggtctc cgttatcggg gaagaagtgg ctgatctcag
2100
ccaccgcgaa aatgacatca aaaacgccat taacctgatg ttctggggaa tataaatgtc
2160
aggctccctt atacacagcc agtctgcagg tcgacggtct cgctcttcga aggttacttc
2220
ccgtcctctg tcaagcgcac ggcctcactc cagagcaagt ggttgcgatc gcttcaaaca
2280
acggtggaag acctgccctg gaatcaatcg tggcccagct ttcgaggccg gaccccgcgc
2340
tggccgcact cactaatgat catcttgtag cgctggcctg cctcggcgga cgacccgcct
2400
tggatgcggt gaagaagggg ctcccgcacg cgcctgcatt gattaagcgg accaacagaa
2460
ggattcccga gaggacatag ccccaagaag aagagaaagg tggaggccag cggttccgga
2520
cgggctgacg cattggacga ttttgatctg gatatgctgg gaagtgacgc cctcgatgat
2580
tttgaccttg acatgcttgg ttcggatgcc cttgatgact ttgacctcga catgctcggc
2640
agtgacgccc ttgatgattt cgacctggac atgctgatta actctagagg cagtggagag
2700
ggcagaggaa gtctgctaac atgcggtgac gtcgaggaga atcctggccc agtgagcaag
2760
ggcgaggagc tgttcaccgg ggtggtgccc atcctggtcg agctggacgg cgacgtaaac
2820
ggccacaagt tcagcgtgtc cggcgagggc gagggcgatg ccacctacgg caagctgacc
2880
ctgaagttca tctgcaccac cggcaagctg cccgtgccct ggcccaccct cgtgaccacc
2940
ctgacctacg gcgtgcagtg cttcagccgc taccccgacc acatgaagca gcacgacttc
3000
ttcaagtccg ccatgcccga aggctacgtc caggagcgca ccatcttctt caaggacgac
3060
ggcaactaca agacccgcgc cgaggtgaag ttcgagggcg acaccctggt gaaccgcatc
3120
gagctgaagg gcatcgactt caaggaggac ggcaacatcc tggggcacaa gctggagtac
3180
aactacaaca gccacaacgt ctatatcatg gccgacaagc agaagaacgg catcaaggtg
3240
aacttcaaga tccgccacaa catcgaggac ggcagcgtgc agctcgccga ccactaccag
3300
cagaacaccc ccatcggcga cggccccgtg ctgctgcccg acaaccacta cctgagcacc
3360
cagtccgccc tgagcaaaga ccccaacgag aagcgcgatc acatggtcct gctggagttc
3420
gtgaccgccg ccgggatcac tctcggcatg gacgagctgt acaag 3465
<210> 22
<211> 1368
<212> PRT
<213> Streptococcus pyogenes
<400> 22
Met Asp Lys Lys Tyr Ser Ile Gly Leu Asp Ile Gly Thr Asn Ser Val
1 5 10 15
Gly Trp Ala Val Ile Thr Asp Glu Tyr Lys Val Pro Ser Lys Lys Phe
20 25 30
Lys Val Leu Gly Asn Thr Asp Arg His Ser Ile Lys Lys Asn Leu Ile
35 40 45
Gly Ala Leu Leu Phe Asp Ser Gly Glu Thr Ala Glu Ala Thr Arg Leu
50 55 60
Lys Arg Thr Ala Arg Arg Arg Tyr Thr Arg Arg Lys Asn Arg Ile Cys
65 70 75 80
Tyr Leu Gln Glu Ile Phe Ser Asn Glu Met Ala Lys Val Asp Asp Ser
85 90 95
Phe Phe His Arg Leu Glu Glu Ser Phe Leu Val Glu Glu Asp Lys Lys
100 105 110
His Glu Arg His Pro Ile Phe Gly Asn Ile Val Asp Glu Val Ala Tyr
115 120 125
His Glu Lys Tyr Pro Thr Ile Tyr His Leu Arg Lys Lys Leu Val Asp
130 135 140
Ser Thr Asp Lys Ala Asp Leu Arg Leu Ile Tyr Leu Ala Leu Ala His
145 150 155 160
Met Ile Lys Phe Arg Gly His Phe Leu Ile Glu Gly Asp Leu Asn Pro
165 170 175
Asp Asn Ser Asp Val Asp Lys Leu Phe Ile Gln Leu Val Gln Thr Tyr
180 185 190
Asn Gln Leu Phe Glu Glu Asn Pro Ile Asn Ala Ser Gly Val Asp Ala
195 200 205
Lys Ala Ile Leu Ser Ala Arg Leu Ser Lys Ser Arg Arg Leu Glu Asn
210 215 220
Leu Ile Ala Gln Leu Pro Gly Glu Lys Lys Asn Gly Leu Phe Gly Asn
225 230 235 240
Leu Ile Ala Leu Ser Leu Gly Leu Thr Pro Asn Phe Lys Ser Asn Phe
245 250 255
Asp Leu Ala Glu Asp Ala Lys Leu Gln Leu Ser Lys Asp Thr Tyr Asp
260 265 270
Asp Asp Leu Asp Asn Leu Leu Ala Gln Ile Gly Asp Gln Tyr Ala Asp
275 280 285
Leu Phe Leu Ala Ala Lys Asn Leu Ser Asp Ala Ile Leu Leu Ser Asp
290 295 300
Ile Leu Arg Val Asn Thr Glu Ile Thr Lys Ala Pro Leu Ser Ala Ser
305 310 315 320
Met Ile Lys Arg Tyr Asp Glu His His Gln Asp Leu Thr Leu Leu Lys
325 330 335
Ala Leu Val Arg Gln Gln Leu Pro Glu Lys Tyr Lys Glu Ile Phe Phe
340 345 350
Asp Gln Ser Lys Asn Gly Tyr Ala Gly Tyr Ile Asp Gly Gly Ala Ser
355 360 365
Gln Glu Glu Phe Tyr Lys Phe Ile Lys Pro Ile Leu Glu Lys Met Asp
370 375 380
Gly Thr Glu Glu Leu Leu Val Lys Leu Asn Arg Glu Asp Leu Leu Arg
385 390 395 400
Lys Gln Arg Thr Phe Asp Asn Gly Ser Ile Pro His Gln Ile His Leu
405 410 415
Gly Glu Leu His Ala Ile Leu Arg Arg Gln Glu Asp Phe Tyr Pro Phe
420 425 430
Leu Lys Asp Asn Arg Glu Lys Ile Glu Lys Ile Leu Thr Phe Arg Ile
435 440 445
Pro Tyr Tyr Val Gly Pro Leu Ala Arg Gly Asn Ser Arg Phe Ala Trp
450 455 460
Met Thr Arg Lys Ser Glu Glu Thr Ile Thr Pro Trp Asn Phe Glu Glu
465 470 475 480
Val Val Asp Lys Gly Ala Ser Ala Gln Ser Phe Ile Glu Arg Met Thr
485 490 495
Asn Phe Asp Lys Asn Leu Pro Asn Glu Lys Val Leu Pro Lys His Ser
500 505 510
Leu Leu Tyr Glu Tyr Phe Thr Val Tyr Asn Glu Leu Thr Lys Val Lys
515 520 525
Tyr Val Thr Glu Gly Met Arg Lys Pro Ala Phe Leu Ser Gly Glu Gln
530 535 540
Lys Lys Ala Ile Val Asp Leu Leu Phe Lys Thr Asn Arg Lys Val Thr
545 550 555 560
Val Lys Gln Leu Lys Glu Asp Tyr Phe Lys Lys Ile Glu Cys Phe Asp
565 570 575
Ser Val Glu Ile Ser Gly Val Glu Asp Arg Phe Asn Ala Ser Leu Gly
580 585 590
Thr Tyr His Asp Leu Leu Lys Ile Ile Lys Asp Lys Asp Phe Leu Asp
595 600 605
Asn Glu Glu Asn Glu Asp Ile Leu Glu Asp Ile Val Leu Thr Leu Thr
610 615 620
Leu Phe Glu Asp Arg Glu Met Ile Glu Glu Arg Leu Lys Thr Tyr Ala
625 630 635 640
His Leu Phe Asp Asp Lys Val Met Lys Gln Leu Lys Arg Arg Arg Tyr
645 650 655
Thr Gly Trp Gly Arg Leu Ser Arg Lys Leu Ile Asn Gly Ile Arg Asp
660 665 670
Lys Gln Ser Gly Lys Thr Ile Leu Asp Phe Leu Lys Ser Asp Gly Phe
675 680 685
Ala Asn Arg Asn Phe Met Gln Leu Ile His Asp Asp Ser Leu Thr Phe
690 695 700
Lys Glu Asp Ile Gln Lys Ala Gln Val Ser Gly Gln Gly Asp Ser Leu
705 710 715 720
His Glu His Ile Ala Asn Leu Ala Gly Ser Pro Ala Ile Lys Lys Gly
725 730 735
Ile Leu Gln Thr Val Lys Val Val Asp Glu Leu Val Lys Val Met Gly
740 745 750
Arg His Lys Pro Glu Asn Ile Val Ile Glu Met Ala Arg Glu Asn Gln
755 760 765
Thr Thr Gln Lys Gly Gln Lys Asn Ser Arg Glu Arg Met Lys Arg Ile
770 775 780
Glu Glu Gly Ile Lys Glu Leu Gly Ser Gln Ile Leu Lys Glu His Pro
785 790 795 800
Val Glu Asn Thr Gln Leu Gln Asn Glu Lys Leu Tyr Leu Tyr Tyr Leu
805 810 815
Gln Asn Gly Arg Asp Met Tyr Val Asp Gln Glu Leu Asp Ile Asn Arg
820 825 830
Leu Ser Asp Tyr Asp Val Asp His Ile Val Pro Gln Ser Phe Leu Lys
835 840 845
Asp Asp Ser Ile Asp Asn Lys Val Leu Thr Arg Ser Asp Lys Asn Arg
850 855 860
Gly Lys Ser Asp Asn Val Pro Ser Glu Glu Val Val Lys Lys Met Lys
865 870 875 880
Asn Tyr Trp Arg Gln Leu Leu Asn Ala Lys Leu Ile Thr Gln Arg Lys
885 890 895
Phe Asp Asn Leu Thr Lys Ala Glu Arg Gly Gly Leu Ser Glu Leu Asp
900 905 910
Lys Ala Gly Phe Ile Lys Arg Gln Leu Val Glu Thr Arg Gln Ile Thr
915 920 925
Lys His Val Ala Gln Ile Leu Asp Ser Arg Met Asn Thr Lys Tyr Asp
930 935 940
Glu Asn Asp Lys Leu Ile Arg Glu Val Lys Val Ile Thr Leu Lys Ser
945 950 955 960
Lys Leu Val Ser Asp Phe Arg Lys Asp Phe Gln Phe Tyr Lys Val Arg
965 970 975
Glu Ile Asn Asn Tyr His His Ala His Asp Ala Tyr Leu Asn Ala Val
980 985 990
Val Gly Thr Ala Leu Ile Lys Lys Tyr Pro Lys Leu Glu Ser Glu Phe
995 1000 1005
Val Tyr Gly Asp Tyr Lys Val Tyr Asp Val Arg Lys Met Ile Ala
1010 1015 1020
Lys Ser Glu Gln Glu Ile Gly Lys Ala Thr Ala Lys Tyr Phe Phe
1025 1030 1035
Tyr Ser Asn Ile Met Asn Phe Phe Lys Thr Glu Ile Thr Leu Ala
1040 1045 1050
Asn Gly Glu Ile Arg Lys Arg Pro Leu Ile Glu Thr Asn Gly Glu
1055 1060 1065
Thr Gly Glu Ile Val Trp Asp Lys Gly Arg Asp Phe Ala Thr Val
1070 1075 1080
Arg Lys Val Leu Ser Met Pro Gln Val Asn Ile Val Lys Lys Thr
1085 1090 1095
Glu Val Gln Thr Gly Gly Phe Ser Lys Glu Ser Ile Leu Pro Lys
1100 1105 1110
Arg Asn Ser Asp Lys Leu Ile Ala Arg Lys Lys Asp Trp Asp Pro
1115 1120 1125
Lys Lys Tyr Gly Gly Phe Asp Ser Pro Thr Val Ala Tyr Ser Val
1130 1135 1140
Leu Val Val Ala Lys Val Glu Lys Gly Lys Ser Lys Lys Leu Lys
1145 1150 1155
Ser Val Lys Glu Leu Leu Gly Ile Thr Ile Met Glu Arg Ser Ser
1160 1165 1170
Phe Glu Lys Asn Pro Ile Asp Phe Leu Glu Ala Lys Gly Tyr Lys
1175 1180 1185
Glu Val Lys Lys Asp Leu Ile Ile Lys Leu Pro Lys Tyr Ser Leu
1190 1195 1200
Phe Glu Leu Glu Asn Gly Arg Lys Arg Met Leu Ala Ser Ala Gly
1205 1210 1215
Glu Leu Gln Lys Gly Asn Glu Leu Ala Leu Pro Ser Lys Tyr Val
1220 1225 1230
Asn Phe Leu Tyr Leu Ala Ser His Tyr Glu Lys Leu Lys Gly Ser
1235 1240 1245
Pro Glu Asp Asn Glu Gln Lys Gln Leu Phe Val Glu Gln His Lys
1250 1255 1260
His Tyr Leu Asp Glu Ile Ile Glu Gln Ile Ser Glu Phe Ser Lys
1265 1270 1275
Arg Val Ile Leu Ala Asp Ala Asn Leu Asp Lys Val Leu Ser Ala
1280 1285 1290
Tyr Asn Lys His Arg Asp Lys Pro Ile Arg Glu Gln Ala Glu Asn
1295 1300 1305
Ile Ile His Leu Phe Thr Leu Thr Asn Leu Gly Ala Pro Ala Ala
1310 1315 1320
Phe Lys Tyr Phe Asp Thr Thr Ile Asp Arg Lys Arg Tyr Thr Ser
1325 1330 1335
Thr Lys Glu Val Leu Asp Ala Thr Leu Ile His Gln Ser Ile Thr
1340 1345 1350
Gly Leu Tyr Glu Thr Arg Ile Asp Leu Ser Gln Leu Gly Gly Asp
1355 1360 1365
<210> 23
<211> 82
<212> DNA
<213> Artificial
<220>
<223> Oligonucleotide sequence
<220>
<221> misc_feature
<222> (41)..(41)
<223> n is a, c, g, or t
<400> 23
ttcttggctt tatatatctt gtggaaagga cgaaacaccg ngttttagag ctagaaatag 60
caagttaaaa taaggctagt cc 82
<210> 24
<211> 1692
<212> DNA
<213> Artificial
<220>
<223> Oligonucleotide sequence encoding re-TALE
<400> 24
ctaacccctg aacaggtagt cgctatagct tcaaatatcg ggggcaagca agcacttgag 60
accgttcaac gactcctgcc agtgctctgc caagcccatg gattgactcc ggagcaagtc 120
gtcgcgatcg cgagcaacgg cggggggaag caggcgctgg aaactgttca gagactgctg 180
cctgtacttt gtcaggcgca tggtctcacc cccgaacagg ttgtcgcaat agcaagtaat 240
ataggcggta agcaagccct agagactgtg caacgcctgc tccccgtgct gtgtcaggct 300
cacggtctga cacctgaaca agttgtcgcg atagccagtc acgacggggg aaaacaagct 360
ctagaaacgg ttcaaaggtt gttgcccgtt ctgtgccaag cacatgggtt aacacccgaa 420
caagtagtag cgatagcgtc aaataacggg ggtaaacagg ctttggagac ggtacagcgg 480
ttattgccgg tcctctgcca ggcccacgga cttacgccag aacaggtggt tgcaattgcc 540
tccaacatcg gcgggaaaca agcgttggaa actgtgcaga gactccttcc tgttttgtgt 600
caagcccacg gcttgacgcc tgagcaggtt gtggccatcg ctagccacga cggagggaag 660
caggctcttg aaaccgtaca gcgacttctc ccagttttgt gccaagctca cgggctaacc 720
cccgagcaag tagttgccat agcaagcaac ggaggaggaa aacaggcatt agaaacagtt 780
cagcgcttgc tcccggtact ctgtcaggca cacggtctaa ctccggaaca ggtcgtagcc 840
attgcttccc atgatggcgg caaacaggcg ctagagacag tccagaggct cttgcctgtg 900
ttatgccagg cacatggcct caccccggag caggtcgttg ccatcgccag taatatcggc 960
ggaaagcaag ctctcgaaac agtacaacgg ctgttgccag tcctatgtca agctcatgga
1020
ctgacgcccg agcaggtagt ggcaatcgca tctcacgatg gaggtaaaca agcactcgag
1080
actgtccaaa gattgttacc cgtactatgc caagcgcatg gtttaacccc agagcaagtt
1140
gtggctattg catctaacgg cggtggcaaa caagccttgg agacagtgca acgattactg
1200
cctgtcttat gtcaggccca tggccttact cctgagcaag tcgtagctat cgccagcaac
1260
ataggtggga aacaggccct ggaaaccgta caacgtctcc tcccagtact ttgtcaagca
1320
cacgggttga caccggaaca agtggtggcg attgcgtcca acggcggagg caagcaggca
1380
ctggagaccg tccaacggct tcttccggtt ctttgccagg ctcatgggct cacgccagag
1440
caggtggtag caatagcgtc gaacatcggt ggtaagcaag cgcttgaaac ggtccagcgt
1500
cttctgccgg tgttgtgcca ggcgcacgga ctcacaccag aacaagtggt tgctattgct
1560
agtaacaacg gtggaaagca ggccctcgag acggtgcaga ggttacttcc cgtcctctgt
1620
caagcgcacg gcctcactcc agagcaagtg gttgcgatcg cttcaaacaa tggtggaaga
1680
cctgccctgg aa 1692
<210> 25
<211> 237
<212> DNA
<213> Artificial
<220>
<223> Template sequence
<220>
<221> misc_feature
<222> (64)..(69)
<223> n is a, c, g, or t
<220>
<221> misc_feature
<222> (166)..(171)
<223> n is a, c, g, or t
<400> 25
cgcaatgcgc tcacgggagc acccctcaac ctaacccctg aacaggtagt cgctatagct 60
tcannnnnng ggggcaagca agcacttgag accgttcaac gactcctgcc agtgctctgc 120
caagcccatg gattgactcc ggagcaagtc gtcgcgatcg cgagcnnnnn nggggggaag 180
caggcgctgg aaactgttca gagactgctg cctgtacttt gtcaggcgca tggtctc 237
<210> 26
<211> 240
<212> DNA
<213> Artificial
<220>
<223> Template sequence
<220>
<221> misc_feature
<222> (67)..(72)
<223> n is a, c, g, or t
<220>
<221> misc_feature
<222> (169)..(174)
<223> n is a, c, g, or t
<400> 26
agactgctgc ctgtactttg tcaggcgcat ggtctcaccc ccgaacaggt tgtcgcaata 60
gcaagtnnnn nnggcggtaa gcaagcccta gagactgtgc aacgcctgct ccccgtgctg 120
tgtcaggctc acggtctgac acctgaacaa gttgtcgcga tagccagtnn nnnnggggga 180
aaacaagctc tagaaacggt tcaaaggttg ttgcccgttc tgtgccaagc acatgggtta 240
<210> 27
<211> 232
<212> DNA
<213> Artificial
<220>
<223> Template sequence
<220>
<221> misc_feature
<222> (59)..(64)
<223> n is a, c, g, or t
<220>
<221> misc_feature
<222> (161)..(166)
<223> n is a, c, g, or t
<400> 27
tgcgctcacg ggagcacccc tcaacctcac ccccgaacag gttgtcgcaa tagcaagtnn 60
nnnnggcggt aagcaagccc tagagactgt gcaacgcctg ctccccgtgc tgtgtcaggc 120
tcacggtctg acacctgaac aagttgtcgc gatagccagt nnnnnngggg gaaaacaagc 180
tctagaaacg gttcaaaggt tgttgcccgt tctgtgccaa gcacatgggt ta 232
<210> 28
<211> 246
<212> DNA
<213> Artificial
<220>
<223> Template sequence
<220>
<221> misc_feature
<222> (67)..(72)
<223> n is a, c, g, or t
<220>
<221> misc_feature
<222> (169)..(174)
<223> n is a, c, g, or t
<400> 28
aggttgttgc ccgttctgtg ccaagcacat gggttaacac ccgaacaagt agtagcgata 60
gcgtcannnn nngggggtaa acaggctttg gagacggtac agcggttatt gccggtcctc 120
tgccaggccc acggacttac gccagaacag gtggttgcaa ttgcctccnn nnnnggcggg 180
aaacaagcgt tggaaactgt gcagagactc cttcctgttt tgtgtcaagc ccacggcttg 240
acgcct 246
<210> 29
<211> 240
<212> DNA
<213> Artificial
<220>
<223> Template sequence
<220>
<221> misc_feature
<222> (67)..(72)
<223> n is a, c, g, or t
<220>
<221> misc_feature
<222> (169)..(174)
<223> n is a, c, g, or t
<400> 29
agactccttc ctgttttgtg tcaagcccac ggcttgacgc ctgagcaggt tgtggccatc 60
gctagcnnnn nnggagggaa gcaggctctt gaaaccgtac agcgacttct cccagttttg 120
tgccaagctc acgggctaac ccccgagcaa gtagttgcca tagcaagcnn nnnnggagga 180
aaacaggcat tagaaacagt tcagcgcttg ctcccggtac tctgtcaggc acacggtcta 240
<210> 30
<211> 240
<212> DNA
<213> Artificial
<220>
<223> Template sequence
<220>
<221> misc_feature
<222> (67)..(72)
<223> n is a, c, g, or t
<220>
<221> misc_feature
<222> (169)..(174)
<223> n is a, c, g, or t
<400> 30
cgcttgctcc cggtactctg tcaggcacac ggtctaactc cggaacaggt cgtagccatt 60
gcttccnnnn nnggcggcaa acaggcgcta gagaccgtcc agaggctctt gcctgtgtta 120
tgccaggcac atggcctcac cccggagcag gtcgttgcca tcgccagtnn nnnnggcgga 180
aagcaagctc tcgaaacagt acaacggctg ttgccagtcc tatgtcaagc tcatggactg 240
<210> 31
<211> 240
<212> DNA
<213> Artificial
<220>
<223> Template sequence
<220>
<221> misc_feature
<222> (67)..(72)
<223> n is a, c, g, or t
<220>
<221> misc_feature
<222> (169)..(174)
<223> n is a, c, g, or t
<400> 31
cggctgttgc cagtcctatg tcaagctcat ggactgacgc ccgagcaggt agtggcaatc 60
gcatctnnnn nnggaggtaa acaagcactc gagactgtcc aaagattgtt acccgtacta 120
tgccaagcgc atggtttaac cccagagcaa gttgtggcta ttgcatctnn nnnnggtggc 180
aaacaagcct tggagaccgt gcaacgatta ctgcctgtct tatgtcaggc ccatggcctt 240
<210> 32
<211> 240
<212> DNA
<213> Artificial
<220>
<223> Template sequence
<220>
<221> misc_feature
<222> (67)..(72)
<223> n is a, c, g, or t
<220>
<221> misc_feature
<222> (169)..(174)
<223> n is a, c, g, or t
<400> 32
cgattactgc ctgtcttatg tcaggcccat ggccttactc ctgagcaggt ggtcgctatc 60
gccagcnnnn nngggggcaa gcaagcactg gaaacagtcc agcgtttgct tccagtactt 120
tgtcaggcgc atggattgac accggaacaa gtggtggcta tagcctcann nnnnggagga 180
aagcaggcgc tggaaaccgt ccaacgtctt ttaccggtgc tttgccaggc gcacgggctc 240
<210> 33
<211> 240
<212> DNA
<213> Artificial
<220>
<223> Template sequence
<220>
<221> misc_feature
<222> (67)..(72)
<223> n is a, c, g, or t
<220>
<221> misc_feature
<222> (169)..(174)
<223> n is a, c, g, or t
<400> 33
cgattactgc ctgtcttatg tcaggcccat ggccttactc ctgagcaagt cgtagctatc 60
gccagcnnnn nnggtgggaa acaggccctg gaaaccgtac aacgtctcct cccagtactt 120
tgtcaagcac acgggttgac accggaacaa gtggtggcga ttgcgtccnn nnnnggaggc 180
aagcaggcac tggagaccgt ccaacggctt cttccggttc tttgccaggc tcatgggctc 240
<210> 34
<211> 240
<212> DNA
<213> Artificial
<220>
<223> Template sequence
<220>
<221> misc_feature
<222> (67)..(72)
<223> n is a, c, g, or t
<220>
<221> misc_feature
<222> (169)..(174)
<223> n is a, c, g, or t
<400> 34
cggcttcttc cggttctttg ccaggctcat gggctcacgc cagagcaggt ggtagcaata 60
gcgtcgnnnn nnggtggtaa gcaagcgctt gaaacggtcc agcgtcttct gccggtgttg 120
tgccaggcgc acggactcac accagaacaa gtggttgcta ttgctagtnn nnnnggtgga 180
aagcaggccc tcgagacggt gcagaggtta cttcccgtcc tctgtcaagc gcacggcctc 240
<210> 35
<211> 49
<212> DNA
<213> Artificial
<220>
<223> Primer sequence
<400> 35
cgcaatgcgc tcacgggagc acccctcaac ctaacccctg aacaggtag 49
<210> 36
<211> 46
<212> DNA
<213> Artificial
<220>
<223> Primer sequence
<400> 36
gagaccatgc gcctgacaaa gtacaggcag cagtctctga acagtt 46
<210> 37
<211> 33
<212> DNA
<213> Artificial
<220>
<223> Primer sequence
<400> 37
tggcgcaatg cgctcacggg agcacccctc aac 33
<210> 38
<211> 49
<212> DNA
<213> Artificial
<220>
<223> Primer sequence
<400> 38
agactgctgc ctgtactttg tcaggcgcat ggtctcaccc ccgaacagg 49
<210> 39
<211> 46
<212> DNA
<213> Artificial
<220>
<223> Primer sequence
<400> 39
taacccatgt gcttggcaca gaacgggcaa caacctttga accgtt 46
<210> 40
<211> 48
<212> DNA
<213> Artificial
<220>
<223> Primer sequence
<400> 40
aggttgttgc ccgttctgtg ccaagcacat gggttaacac ccgaacaa 48
<210> 41
<211> 52
<212> DNA
<213> Artificial
<220>
<223> Primer sequence
<400> 41
aggcgtcaag ccgtgggctt gacacaaaac aggaaggagt ctctgcacag tt 52
<210> 42
<211> 45
<212> DNA
<213> Artificial
<220>
<223> Primer sequence
<400> 42
agactccttc ctgttttgtg tcaagcccac ggcttgacgc ctgag 45
<210> 43
<211> 40
<212> DNA
<213> Artificial
<220>
<223> Primer sequence
<400> 43
tagaccgtgt gcctgacaga gtaccgggag caagcgctga 40
<210> 44
<211> 39
<212> DNA
<213> Artificial
<220>
<223> Primer sequence
<400> 44
cgcttgctcc cggtactctg tcaggcacac ggtctaact 39
<210> 45
<211> 40
<212> DNA
<213> Artificial
<220>
<223> Primer sequence
<400> 45
cagtccatga gcttgacata ggactggcaa cagccgttgt 40
<210> 46
<211> 39
<212> DNA
<213> Artificial
<220>
<223> Primer sequence
<400> 46
cggctgttgc cagtcctatg tcaagctcat ggactgacg 39
<210> 47
<211> 40
<212> DNA
<213> Artificial
<220>
<223> Primer sequence
<400> 47
aaggccatgg gcctgacata agacaggcag taatcgttgc 40
<210> 48
<211> 39
<212> DNA
<213> Artificial
<220>
<223> Primer sequence
<400> 48
cgattactgc ctgtcttatg tcaggcccat ggccttact 39
<210> 49
<211> 43
<212> DNA
<213> Artificial
<220>
<223> Primer sequence
<400> 49
gagcccgtgc gcctggcaaa gcaccggtaa aagacgttgg acg 43
<210> 50
<211> 50
<212> DNA
<213> Artificial
<220>
<223> Primer sequence
<400> 50
cgattactgc ctgtcttatg tcaggcccat ggccttactc ctgagcaagt 50
<210> 51
<211> 40
<212> DNA
<213> Artificial
<220>
<223> Primer sequence
<400> 51
gagcccatga gcctggcaaa gaaccggaag aagccgttgg 40
<210> 52
<211> 51
<212> DNA
<213> Artificial
<220>
<223> Primer sequence
<400> 52
cggcttcttc cggttctttg ccaggctcat gggctcacgc cagagcaggt g 51
<210> 53
<211> 40
<212> DNA
<213> Artificial
<220>
<223> Primer sequence
<400> 53
gaggccgtgc gcttgacaga ggacgggaag taacctctgc 40
<210> 54
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 54
tccccacttt cttgtgaa 18
<210> 55
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 55
taaccactca ggacaggg 18
<210> 56
<211> 19
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 56
cactttcttg tgaatcctt 19
<210> 57
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 57
tcacacagca agtcagca 18
<210> 58
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 58
tagcggagca ggctcgga 18
<210> 59
<211> 19
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 59
tgggctagcg gagcaggct 19
<210> 60
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 60
tacccagacg agaaagct 18
<210> 61
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 61
tcagactgcc aagcttga 18
<210> 62
<211> 19
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 62
acccagacga gaaagctga 19
<210> 63
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 63
tcttgtggct cgggagta 18
<210> 64
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 64
tattgtcagc agagctga 18
<210> 65
<211> 19
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 65
agagggcatc ttgtggctc 19
<210> 66
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 66
ttgagatttt cagatgtc 18
<210> 67
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 67
tatacagtca tatcaagc 18
<210> 68
<211> 19
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 68
atcaagctct cttggcggt 19
<210> 69
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 69
ttcagataga ttatatct 18
<210> 70
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 70
tgccagatac ataggtgg 18
<210> 71
<211> 19
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 71
gcttcagata gattatatc 19
<210> 72
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 72
ttatactgtc tatatgat 18
<210> 73
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 73
tcagctcttc tggccaga 18
<210> 74
<211> 19
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 74
acggatgtct cagctcttc 19
<210> 75
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 75
tggccagaag agctgaga 18
<210> 76
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 76
ttaccgggga gagtttct 18
<210> 77
<211> 19
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 77
ccggggagag tttcttgta 19
<210> 78
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 78
tttgcagaga gatgagtc 18
<210> 79
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 79
ttagcagaag ataagatt 18
<210> 80
<211> 19
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 80
gaaatcttat cttctgcta 19
<210> 81
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 81
tataagacta aactaccc 18
<210> 82
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 82
tcgtctgcca ccacagat 18
<210> 83
<211> 19
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 83
aatgcatgac attcatctg 19
<210> 84
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 84
taaaacagtt tgcattca 18
<210> 85
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 85
tataaagtcc tagaatgt 18
<210> 86
<211> 19
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 86
aacagtttgc attcatgga 19
<210> 87
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 87
tggccatctc tgacctgt 18
<210> 88
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 88
tagtgagccc agaagggg 18
<210> 89
<211> 19
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 89
ccagaagggg acagtaaga 19
<210> 90
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 90
taggtacctg gctgtcgt 18
<210> 91
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 91
tgaccgtcct ggctttta 18
<210> 92
<211> 19
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 92
ctgacaatcg ataggtacc 19
<210> 93
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 93
tgtcatggtc atctgcta 18
<210> 94
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 94
tcgacaccga agcagagt 18
<210> 95
<211> 19
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 95
acaccgaagc agagttttt 19
<210> 96
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 96
tgcccccgcg aggccaca 18
<210> 97
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 97
tctggaagtt gaacaccc 18
<210> 98
<211> 19
<212> DNA
<213> Artificial
<220>
<223> Targeting sequence
<400> 98
ggaagttgaa cacccttgc 19
<210> 99
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 99
ctactgtcat tcagggcaat acccagacga gaaagctgag ggtataacag gtttcaagct 60
tggcagtctg actacagagg ccactggctt 90
<210> 100
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 100
ctactgtcat tcagcccaat accctaacga gaaagctgag ggtataacag gtttcaagct 60
tggcagtctg actacagagg ccactggctt 90
<210> 101
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 101
ctactgtcat tcagcccaat acccagacga gaaaagtgag ggtataacag gtttcaagct 60
tggcagtctg actacagagg ccactggctt 90
<210> 102
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 102
ctactgtcat tcagcccaat acccagacga gaaagctgag ggtataacag gtttcaagct 60
tggcagtctg actacagagg ccactggctt 90
<210> 103
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 103
ctactgtcat tcagcccaat acccagacga gaaagctgag ggtataacag gtttgtagct 60
tggcagtctg actacagagg ccactggctt 90
<210> 104
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 104
ctactgtcat tcagcccaat acccagacga gaaagctgag ggtataacag gtttcaagct 60
tggctctctg actacagagg ccactggctt 90
<210> 105
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 105
ctactgtcat tcagcccaat acccagacga gaaagctgag ggtataacag gtttcaagct 60
tggcagtctg actagtgagg ccactggctt 90
<210> 106
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 106
cactttatat ttccctgctt aaacagtccc ccgagggtgg gtgcggaaaa ggctctacac 60
ttgttatcat tccctctcca ccacaggcat 90
<210> 107
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 107
tttgtatttg ggttttttta aaacctccac tctacagtta agaattctaa ggcacagagc 60
ttcaataatt tggtcagagc caagtagcag 90
<210> 108
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 108
ggaggttaaa cccagcagca tgactgcagt tcttaatcaa tgccccttga attgcacata 60
tgggatgaac tagaacattt tctcgatgat 90
<210> 109
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 109
ctcgatgatt cgctgtcctt gttatgatta tgttactgag ctctactgta gcacagacat 60
atgtccctat atggggcggg ggtgggggtg 90
<210> 110
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Taregt sequence
<400> 110
ggtgtcttga tcgctgggct atttctatac tgttctggct tttcggaagc agtcatttct 60
ttctattctc caagcaccag caattagctt 90
<210> 111
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 111
gcttctagtt tgctgaaact aatctgctat agacagagac tccgacgaac caattttatt 60
aggatttgat caaataaact ctctctgaca 90
<210> 112
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 112
gaaagagtaa ctaagagttt gatgtttact gagtgcatag tatgcactag atgctggccg 60
tggatgcctc atagaatcct cccaacaact 90
<210> 113
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 113
gctagatgct ggccgtggat gcctcataga atcctcccaa caaccgatga aatgactact 60
gtcattcagc ccaataccca gacgagaaag 90
<210> 114
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 114
acaggtttca agcttggcag tctgactaca gaggccactg gctttacccc tgggttagtc 60
tgcctctgta ggattggggg cacgtaattt 90
<210> 115
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 115
ttagtctgcc tctgtaggat tgggggcacg taattttgct gtttaaggtc tcatttgcct 60
tcttagagat cacaagccaa agctttttat 90
<210> 116
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 116
ggaagcccag agggcatctt gtggctcggg agtagctctc tgctaccttc tcagctctgc 60
tgacaatact tgagattttc agatgtcacc 90
<210> 117
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 117
tcagctctgc tgacaatact tgagattttc agatgtcacc aaccagcaag agagcttgat 60
atgactgtat atagtatagt cataaagaac 90
<210> 118
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 118
cataaagaac ctgaacttga ccatatactt atgtcatgtg gaaatcttct catagcttca 60
gatagattat atctggagtg aagaatcctg 90
<210> 119
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 119
gtggaaaatt tctcatagct tcagatagat tatatctgga gtgagcaatc ctgccaccta 60
tgtatctggc atagtgtgag tcctcataaa 90
<210> 120
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 120
ggtttgaagg gcaacaaaat agtgaacaga gtgaaaatcc ccacctagat cctgggtcca 60
gaaaaagatg ggaaacctgt ttagctcacc 90
<210> 121
<211> 30
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 121
ggccactagg gacaaaattg gtgacagaaa 30
<210> 122
<211> 50
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 122
cccacagtgg ggccactagg gacaaaattg gtgacagaaa agccccatcc 50
<210> 123
<211> 70
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 123
tcccctccac cccacagtgg ggccactagg gacaaaattg gtgacagaaa agccccatcc 60
ttaggcctcc 70
<210> 124
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 124
cttttatctg tcccctccac cccacagtgg ggccactagg gacaaaattg gtgacagaaa 60
agccccatcc ttaggcctcc tccttcctag 90
<210> 125
<211> 110
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 125
gttctgggta cttttatctg tcccctccac cccacagtgg ggccactagg gacaaaattg 60
gtgacagaaa agccccatcc ttaggcctcc tccttcctag tctcctgata 110
<210> 126
<211> 30
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 126
tttctgtcac caatggtgtc cctagtggcc 30
<210> 127
<211> 50
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 127
ggatggggct tttctgtcac caatggtgtc cctagtggcc ccactgtggg 50
<210> 128
<211> 70
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 128
ggaggcctaa ggatggggct tttctgtcac caatggtgtc cctagtggcc ccactgtggg 60
gtggagggga 70
<210> 129
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 129
ctaggaagga ggaggcctaa ggatggggct tttctgtcac caatggtgtc cctagtggcc 60
ccactgtggg gtggagggga cagataaaag 90
<210> 130
<211> 110
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 130
tatcaggaga ctaggaagga ggaggcctaa ggatggggct tttctgtcac caatggtgtc 60
cctagtggcc ccactgtggg gtggagggga cagataaaag tacccagaac 110
<210> 131
<211> 70
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 131
ttctagtaac cactcaggac aggggggttc agcccaaaaa ttcacaagaa agtggggacc 60
catgggaaat 70
<210> 132
<211> 70
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 132
cagcaagtca gcagcacagc gtgtgtgact ccgagggtgc tccgctagcc cacattgccc 60
tctgggggtg 70
<210> 133
<211> 70
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 133
gtcagactgc caagcttgaa acctgtctta ccctctactt tctcgtctgg gtattgggct 60
gaatgacagt 70
<210> 134
<211> 70
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 134
cagagctgag aagacagcag agagctactc ccgaagcaca agatgccctc tgggcttccg 60
tgaccttggc 70
<210> 135
<211> 70
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 135
ctgacaatac ttgagatttt cagatgtcac caacgaccaa gagagcttga tatgactgta 60
tatagtatag 70
<210> 136
<211> 70
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 136
cagatacata ggtggcagga ttcttcactc cagacttaat ctatctgaag ctatgagaaa 60
ttttccacat 70
<210> 137
<211> 70
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 137
tatatgattg atttgcacag ctcatctggc cagataagct gagacatccg ttcccctaca 60
agaaactctc 70
<210> 138
<211> 70
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 138
atctggccag aagagctgag acatccgttc cccttgaaga aactctcccc ggtaagtaac 60
ctctcagctg 70
<210> 139
<211> 70
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 139
aggcatctca ctggagaggg tttagttctc cttaagagaa gataagattt caagagggaa 60
gctaagactc 70
<210> 140
<211> 70
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 140
ataatataat aaaaaatgtt tcgtctgcca ccactaatga atgtcatgca ttctgggtag 60
tttagtctta 70
<210> 141
<211> 70
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 141
tttataaagt cctagaatgt atttagttgc cctcgttgaa tgcaaactgt tttatacatc 60
aataggtttt 70
<210> 142
<211> 70
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 142
gctcaacctg gccatctctg acctgttttt ccttcccact gtccccttct gggctcacta 60
tgctgccgcc 70
<210> 143
<211> 70
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 143
ttttaaagca aacacagcat ggacgacagc caggctccta tcgattgtca ggaggatgat 60
gaagaagatt 70
<210> 144
<211> 70
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 144
gcttgtcatg gtcatctgct actcgggaat cctaattact ctgcttcggt gtcgaaatga 60
gaagaagagg 70
<210> 145
<211> 70
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 145
atactgcccc cgcgaggcca cattggcaaa ccagcttggg tgttcaactt ccagacttgg 60
ccatggagaa 70
<210> 146
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 146
ctgaagaatt tcccatgggt ccccactttc ttgtgaatcc ttggagtgaa cccccctgtc 60
ctgagtggtt actagaacac acctctggac 90
<210> 147
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 147
tggaagtatc ttgccgaggt cacacagcaa gtcagcagca cagccagtgt gactccgagc 60
ctgctccgct agcccacatt gccctctggg 90
<210> 148
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 148
ctactgtcat tcagcccaat acccagacga gaaagctgag ggtataacag gtttcaagct 60
tggcagtctg actacagagg ccactggctt 90
<210> 149
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 149
ggaagcccag agggcatctt gtggctcggg agtagctctc tgctaccttc tcagctctgc 60
tgacaatact tgagattttc agatgtcacc 90
<210> 150
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 150
tcagctctgc tgacaatact tgagattttc agatgtcacc aacgcccaag agagcttgat 60
atgactgtat atagtatagt cataaagaac 90
<210> 151
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 151
gtggaaaatt tctcatagct tcagatagat tatatctgga gtgagcaatc ctgccaccta 60
tgtatctggc atagtgtgag tcctcataaa 90
<210> 152
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 152
gaaacagcat ttcctacttt tatactgtct atatgattga tttggtcagc tcatctggcc 60
agaagagctg agacatccgt tcccctacaa 90
<210> 153
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 153
ttgatttgca cagctcatct ggccagaaga gctgagacat ccgtatccct acaagaaact 60
ctccccggta agtaacctct cagctgcttg 90
<210> 154
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 154
ggagagggtt tagttctcct tagcagaaga taagatttca agatgagagc taagactcat 60
ctctctgcaa atctttcttt tgagaggtaa 90
<210> 155
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 155
taatataata aaaaatgttt cgtctgccac cacagatgaa tgtcgagcat tctgggtagt 60
ttagtcttat aaccagctgt cttgcctagt 90
<210> 156
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 156
ttaaaaacct attgatgtat aaaacagttt gcattcatgg agggtgacta aatacattct 60
aggactttat aaaagatcac tttttattta 90
<210> 157
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 157
gacatctacc tgctcaacct ggccatctct gacctgtttt tcctatttac tgtccccttc 60
tgggctcact atgctgccgc ccagtgggac 90
<210> 158
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 158
tcatcctcct gacaatcgat aggtacctgg ctgtcgtcca tgctacgttt gctttaaaag 60
ccaggacggt cacctttggg gtggtgacaa 90
<210> 159
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 159
ggctggtcct gccgctgctt gtcatggtca tctgctactc gggagaccta aaaactctgc 60
ttcggtgtcg aaatgagaag aagaggcaca 90
<210> 160
<211> 90
<212> DNA
<213> Artificial
<220>
<223> Target sequence
<400> 160
ggcaagcctt gggtcatact gcccccgcga ggccacattg gcaagtcagc aagggtgttc 60
aacttccaga cttggccatg gagaagacat 90
<210> 161
<211> 59
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 161
acactctttc cctacacgac gctcttccga tctcgtgatt ttgcagtgtg cgttactcc 59
<210> 162
<211> 59
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 162
acactctttc cctacacgac gctcttccga tctacatcgt ttgcagtgtg cgttactcc 59
<210> 163
<211> 59
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 163
acactctttc cctacacgac gctcttccga tctgcctaat ttgcagtgtg cgttactcc 59
<210> 164
<211> 59
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 164
acactctttc cctacacgac gctcttccga tcttggtcat ttgcagtgtg cgttactcc 59
<210> 165
<211> 54
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 165
ctcggcattc ctgctgaacc gctcttccga tctccaagca actaagtcac agca 54
<210> 166
<211> 58
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 166
acactctttc cctacacgac gctcttccga tctcgtgata tgaggaaatg gaagcttg 58
<210> 167
<211> 58
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 167
acactctttc cctacacgac gctcttccga tctacatcga tgaggaaatg gaagcttg 58
<210> 168
<211> 58
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 168
acactctttc cctacacgac gctcttccga tctgcctaaa tgaggaaatg gaagcttg 58
<210> 169
<211> 58
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 169
acactctttc cctacacgac gctcttccga tcttggtcaa tgaggaaatg gaagcttg 58
<210> 170
<211> 51
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 170
ctcggcattc ctgctgaacc gctcttccga tctcattagg gtattggagg a 51
<210> 171
<211> 58
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 171
acactctttc cctacacgac gctcttccga tctcgtgata atcctcccaa caactcat 58
<210> 172
<211> 58
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 172
acactctttc cctacacgac gctcttccga tctacatcga atcctcccaa caactcat 58
<210> 173
<211> 58
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 173
acactctttc cctacacgac gctcttccga tctgcctaaa atcctcccaa caactcat 58
<210> 174
<211> 58
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 174
acactctttc cctacacgac gctcttccga tcttggtcaa atcctcccaa caactcat 58
<210> 175
<211> 52
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 175
ctcggcattc ctgctgaacc gctcttccga tctcccaatc ctacagaggc ag 52
<210> 176
<211> 58
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 176
acactctttc cctacacgac gctcttccga tctcgtgata agccaaagct ttttattc 58
<210> 177
<211> 58
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 177
acactctttc cctacacgac gctcttccga tctacatcga agccaaagct ttttattc 58
<210> 178
<211> 58
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 178
acactctttc cctacacgac gctcttccga tctgcctaaa agccaaagct ttttattc 58
<210> 179
<211> 58
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 179
acactctttc cctacacgac gctcttccga tcttggtcaa agccaaagct ttttattc 58
<210> 180
<211> 53
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 180
acactctttc cctacacgac gctcttccga tctaagccaa agctttttat tct 53
<210> 181
<211> 59
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 181
acactctttc cctacacgac gctcttccga tctcgtgata tcttgtggct cgggagtag 59
<210> 182
<211> 59
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 182
acactctttc cctacacgac gctcttccga tctacatcga tcttgtggct cgggagtag 59
<210> 183
<211> 53
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 183
ctcggcattc ctgctgaacc gctcttccga tcttggcagg attcttcact cca 53
<210> 184
<211> 59
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 184
acactctttc cctacacgac gctcttccga tctcgtgatc tattttgttg cccttcaaa 59
<210> 185
<211> 59
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 185
acactctttc cctacacgac gctcttccga tctacatcgc tattttgttg cccttcaaa 59
<210> 186
<211> 55
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 186
ctcggcattc ctgctgaacc gctcttccga tctaacctga acttgaccat atact 55
<210> 187
<211> 59
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 187
acactctttc cctacacgac gctcttccga tctcgtgatc agctgagagg ttacttacc 59
<210> 188
<211> 59
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 188
acactctttc cctacacgac gctcttccga tctacatcgc agctgagagg ttacttacc 59
<210> 189
<211> 53
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 189
ctcggcattc ctgctgaacc gctcttccga tctaatgatt taactccacc ctc 53
<210> 190
<211> 60
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 190
acactctttc cctacacgac gctcttccga tctcgtgata ctccaccctc cttcaaaaga 60
<210> 191
<211> 60
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 191
acactctttc cctacacgac gctcttccga tctacatcga ctccaccctc cttcaaaaga 60
<210> 192
<211> 52
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 192
ctcggcattc ctgctgaacc gctcttccga tcttggtgtt tgccaaatgt ct 52
<210> 193
<211> 59
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 193
acactctttc cctacacgac gctcttccga tctcgtgatg ggcacatatt cagaaggca 59
<210> 194
<211> 59
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 194
acactctttc cctacacgac gctcttccga tctacatcgg ggcacatatt cagaaggca 59
<210> 195
<211> 56
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 195
ctcggcattc ctgctgaacc gctcttccga tctagtgaaa gactttaaag ggagca 56
<210> 196
<211> 59
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 196
acactctttc cctacacgac gctcttccga tctcgtgatc acaattaaga gttgtcata 59
<210> 197
<211> 59
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 197
acactctttc cctacacgac gctcttccga tctacatcgc acaattaaga gttgtcata 59
<210> 198
<211> 53
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 198
ctcggcattc ctgctgaacc gctcttccga tctctcagct agagcagctg aac 53
<210> 199
<211> 51
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 199
ctcggcattc ctgctgaacc gctcttccga tctgacactt gataatccat c 51
<210> 200
<211> 60
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 200
acactctttc cctacacgac gctcttccga tctacatcgt caatgtagac atctatgtag 60
<210> 201
<211> 60
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 201
acactctttc cctacacgac gctcttccga tctcgtgatt caatgtagac atctatgtag 60
<210> 202
<211> 59
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 202
acactctttc cctacacgac gctcttccga tctcgtgata ctgcaaaagg ctgaagagc 59
<210> 203
<211> 59
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 203
acactctttc cctacacgac gctcttccga tctacatcga ctgcaaaagg ctgaagagc 59
<210> 204
<211> 59
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 204
acactctttc cctacacgac gctcttccga tctgcctaaa ctgcaaaagg ctgaagagc 59
<210> 205
<211> 59
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 205
acactctttc cctacacgac gctcttccga tcttggtcaa ctgcaaaagg ctgaagagc 59
<210> 206
<211> 57
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 206
ctcggcattc ctgctgaacc gctcttccga tctgcctata aaatagagcc ctgtcaa 57
<210> 207
<211> 60
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 207
acactctttc cctacacgac gctcttccga tctcgtgatc tctattttat aggcttcttc 60
<210> 208
<211> 60
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 208
acactctttc cctacacgac gctcttccga tctacatcgc tctattttat aggcttcttc 60
<210> 209
<211> 52
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 209
ctcggcattc ctgctgaacc gctcttccga tctagccacc acccaagtga tc 52
<210> 210
<211> 60
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 210
acactctttc cctacacgac gctcttccga tctacatcgt tccagacatt aaagatagtc 60
<210> 211
<211> 60
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 211
acactctttc cctacacgac gctcttccga tctcgtgatt tccagacatt aaagatagtc 60
<210> 212
<211> 54
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 212
ctcggcattc ctgctgaacc gctcttccga tctaatcatg atggtgaaga taag 54
<210> 213
<211> 60
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 213
acactctttc cctacacgac gctcttccga tctcgtgatc cggcagagac aaacattaaa 60
<210> 214
<211> 54
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 214
acactctttc cctacacgac gctcttccga tctccggcag agacaaacat taaa 54
<210> 215
<211> 53
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 215
ctcggcattc ctgctgaacc gctcttccga tctagctagg aagccatggc aag 53
<210> 216
<211> 47
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 216
aatgatacgg cgaccaccga gatctacact ctttccctac acgacgc 47
<210> 217
<211> 50
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 217
caagcagaag acggcatacg agatcggtct cggcattcct gctgaaccgc 50
<210> 218
<211> 58
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 218
acactctttc cctacacgac gctcttccga tctagtgcat agtatgtgct agatgctg 58
<210> 219
<211> 59
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 219
gtgactggag ttcagacgtg tgctcttccg atcttgatct ctaagaaggc aaatgagac 59
<210> 220
<211> 64
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<220>
<221> misc_feature
<222> (25)..(30)
<223> n is a, c, g, or t
<400> 220
caagcagaag acggcatacg agatnnnnnn gtgactggag ttcagacgtg tgctcttccg 60
atct 64
<210> 221
<211> 58
<212> DNA
<213> Artificial
<220>
<223> PCR primer
<400> 221
aatgatacgg cgaccaccga gatctacact ctttccctac acgacgctct tccgatct 58
<210> 222
<211> 34
<212> PRT
<213> Artificial
<220>
<223> Deduced TALE template amino acid sequence
<220>
<221> misc_feature
<222> (12)..(13)
<223> Xaa can be any naturally occurring amino acid
<400> 222
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Xaa Xaa Gly Gly Lys
1 5 10 15
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
20 25 30
His Gly
<210> 223
<211> 246
<212> DNA
<213> Artificial
<220>
<223> TALE dimer nucleotide sequence
<400> 223
cgattactgc ctgtcttatg tcaggcccat ggccttactc ctgagcaagt cgtagctatc 60
gccagcaaca taggtgggaa acaggccctg gaaaccgtac aacgtctcct cccagtactt 120
tgtcaagcac acgggttgac accggaacaa gtggtggcga ttgcgtccca cgatggaggc 180
aagcaggcac tggagaccgt ccaacggctt cttccggttc tttgccaggc tcatgggctc 240
acgcca 246
<210> 224
<211> 82
<212> PRT
<213> Artificial
<220>
<223> Deduced TALE dimer amino acid sequence
<400> 224
Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln
1 5 10 15
Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Thr
20 25 30
Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro
35 40 45
Glu Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu
50 55 60
Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu
65 70 75 80
Thr Pro
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕНОМНАЯ ИНЖЕНЕРИЯ | 2014 |
|
RU2764757C2 |
| НАПРАВЛЯЕМАЯ РНК РЕГУЛЯЦИЯ ТРАНСКРИПЦИИ | 2014 |
|
RU2756865C2 |
| ДОСТАВКА, КОНСТРУИРОВАНИЕ И ОПТИМИЗАЦИЯ СИСТЕМ, СПОСОБОВ И КОМПОЗИЦИЙ ДЛЯ МАНИПУЛЯЦИИ С ПОСЛЕДОВАТЕЛЬНОСТЯМИ И ПРИМЕНЕНИЯ В ТЕРАПИИ | 2013 |
|
RU2721275C2 |
| КОМПОНЕНТЫ СИСТЕМЫ CRISPR-CAS, СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ МАНИПУЛЯЦИИ С ПОСЛЕДОВАТЕЛЬНОСТЯМИ | 2013 |
|
RU2796549C2 |
| РНК-НАПРАВЛЯЕМАЯ ИНЖЕНЕРИЯ ГЕНОМА ЧЕЛОВЕКА | 2013 |
|
RU2766685C2 |
| КОНСТРУИРОВАНИЕ СИСТЕМ, СПОСОБЫ И ОПТИМИЗИРОВАННЫЕ НАПРАВЛЯЮЩИЕ КОМПОЗИЦИИ ДЛЯ МАНИПУЛЯЦИИ С ПОСЛЕДОВАТЕЛЬНОСТЯМИ | 2013 |
|
RU2796017C2 |
| НОВЫЕ ФЕРМЕНТЫ И СИСТЕМЫ CRISPR | 2016 |
|
RU2777988C2 |
| ДНК-СОДЕРЖАЩИЕ ПОЛИНУКЛЕОТИДЫ И РУКОВОДЯЩИЕ ПОСЛЕДОВАТЕЛЬНОСТИ ДЛЯ СИСТЕМ CRISPR ТИПА V И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2021 |
|
RU2832314C1 |
| НОВЫЕ ФЕРМЕНТЫ CRISPR И СИСТЕМЫ | 2016 |
|
RU2771826C2 |
| МУТАЦИИ ФЕРМЕНТА CRISPR, УМЕНЬШАЮЩИЕ НЕЦЕЛЕВЫЕ ЭФФЕКТЫ | 2016 |
|
RU2752834C2 |
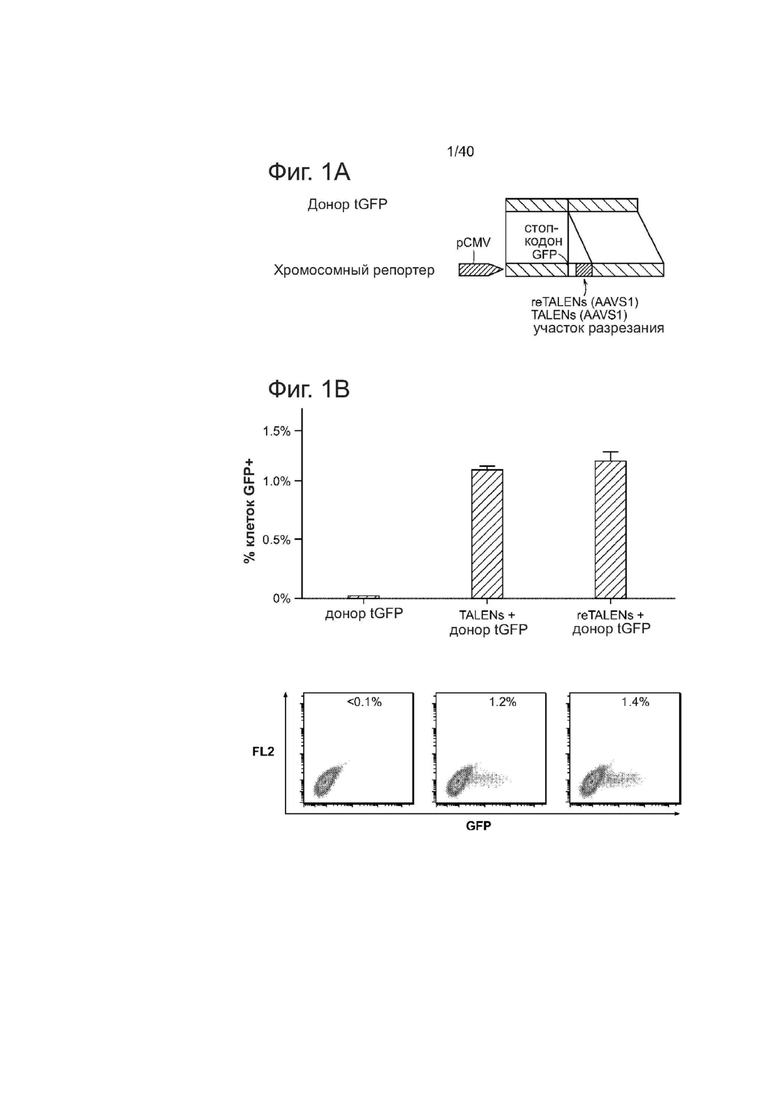

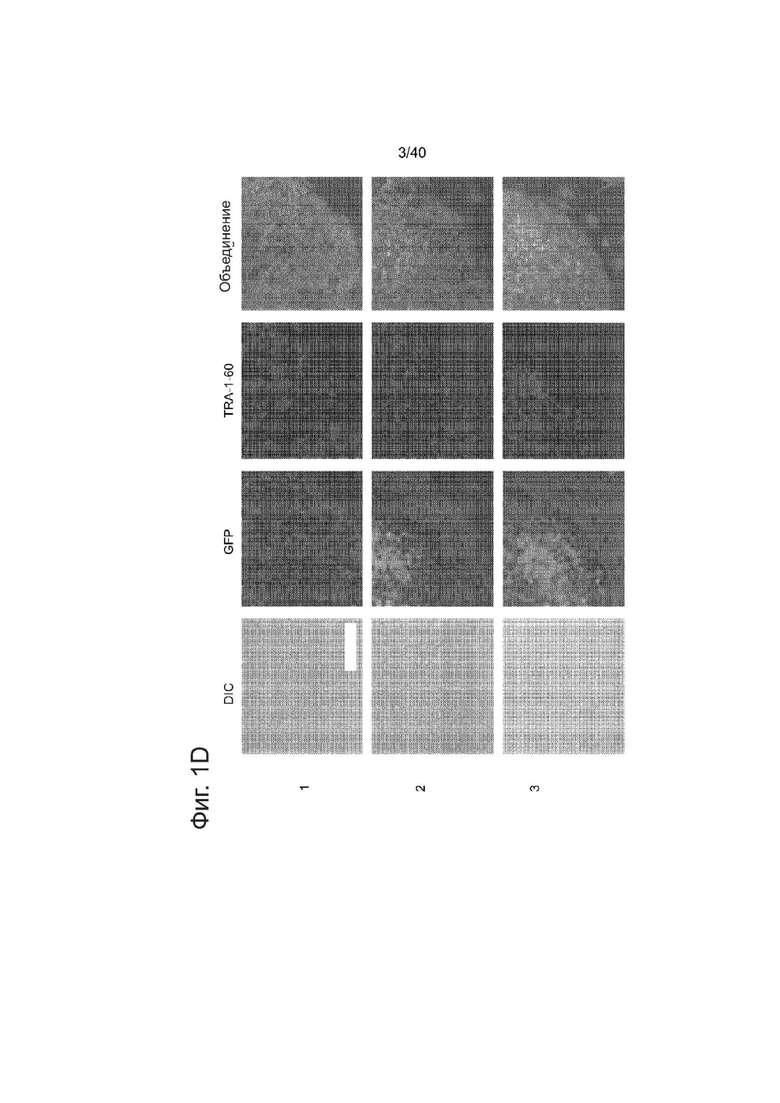
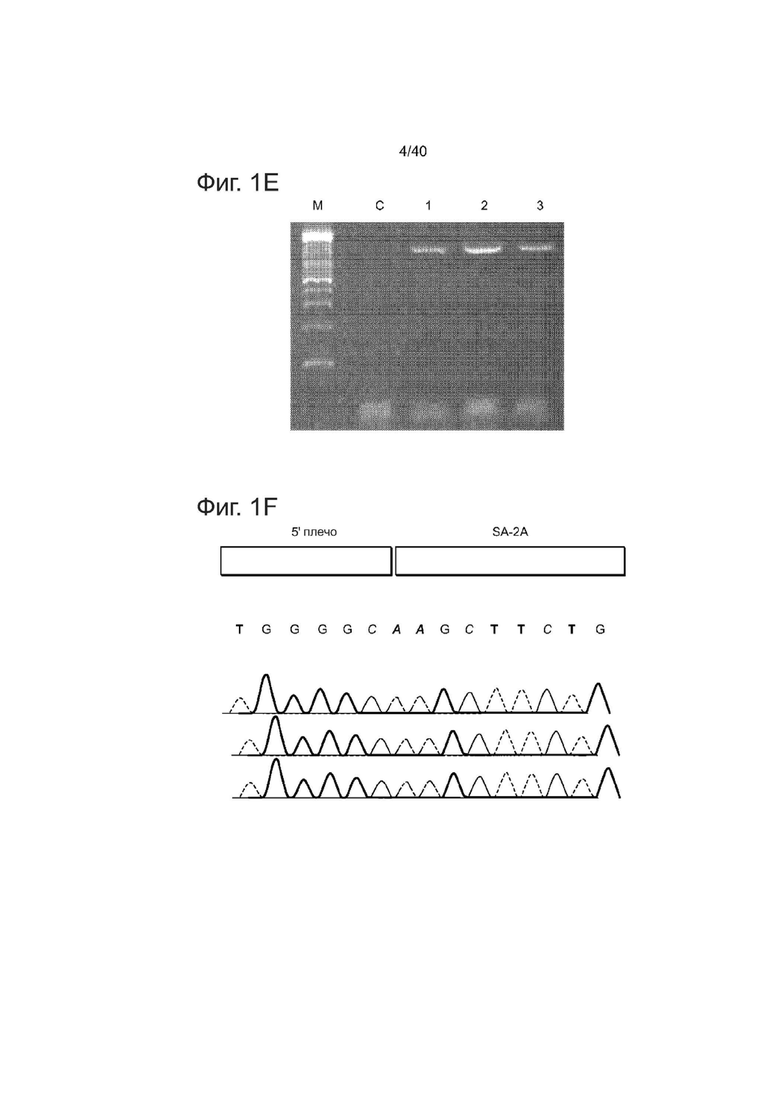
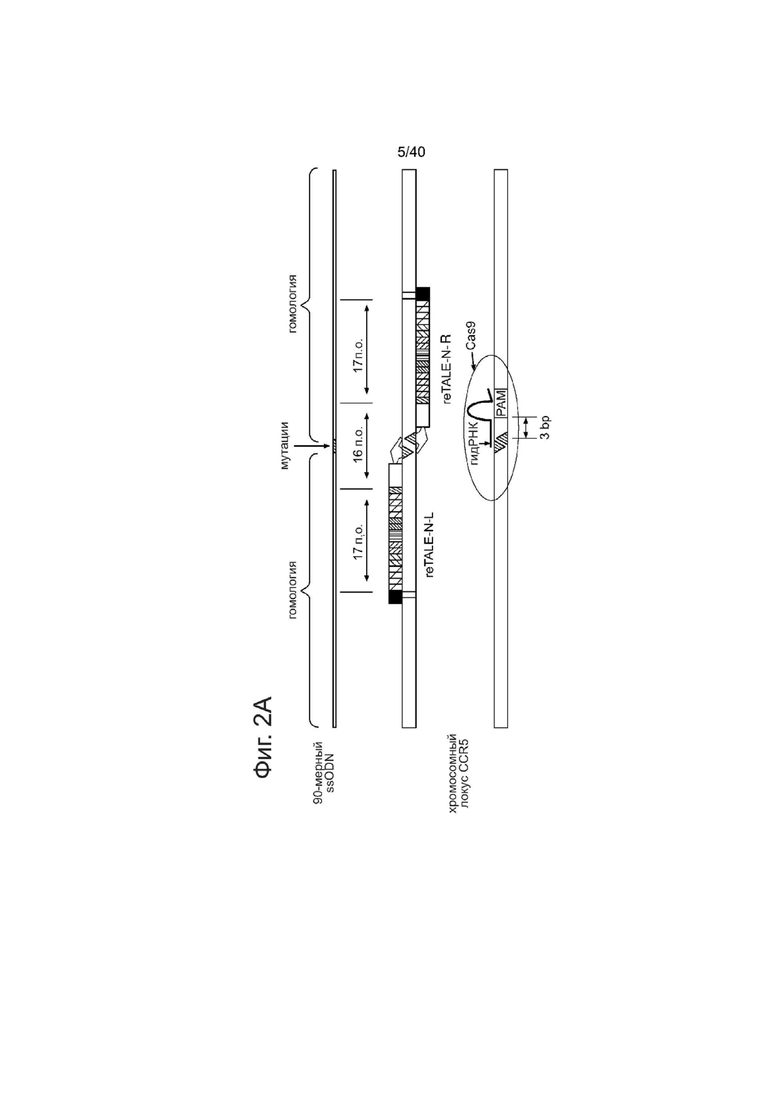
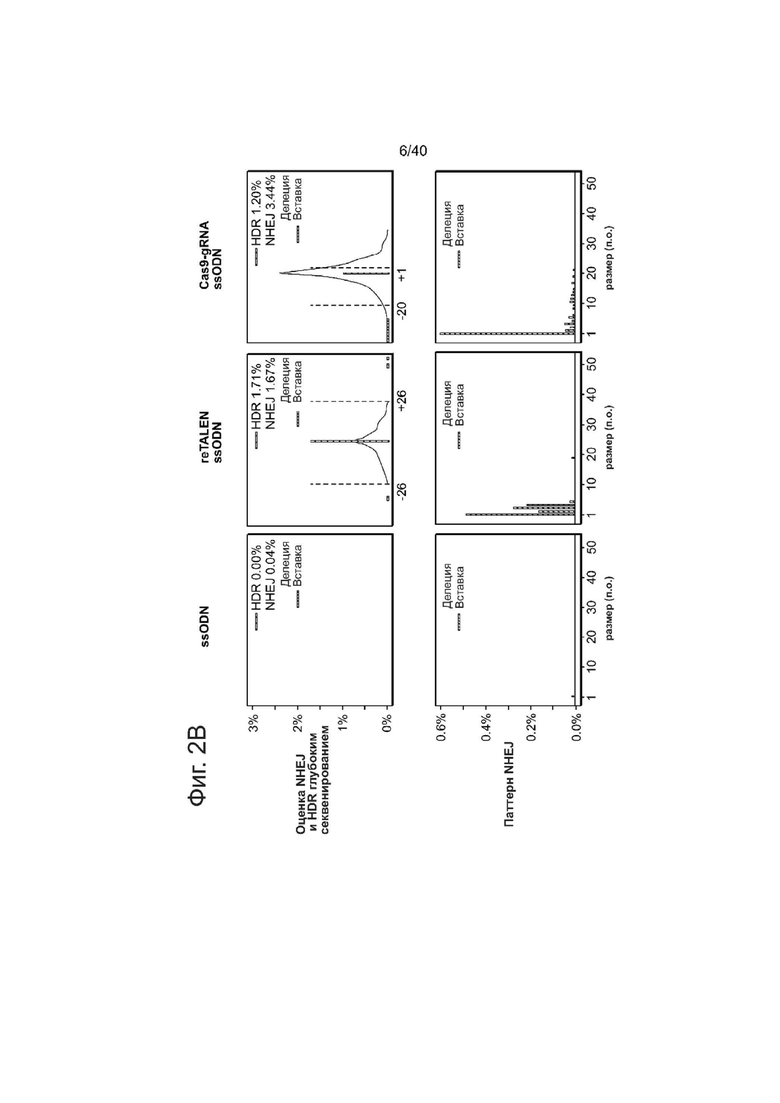
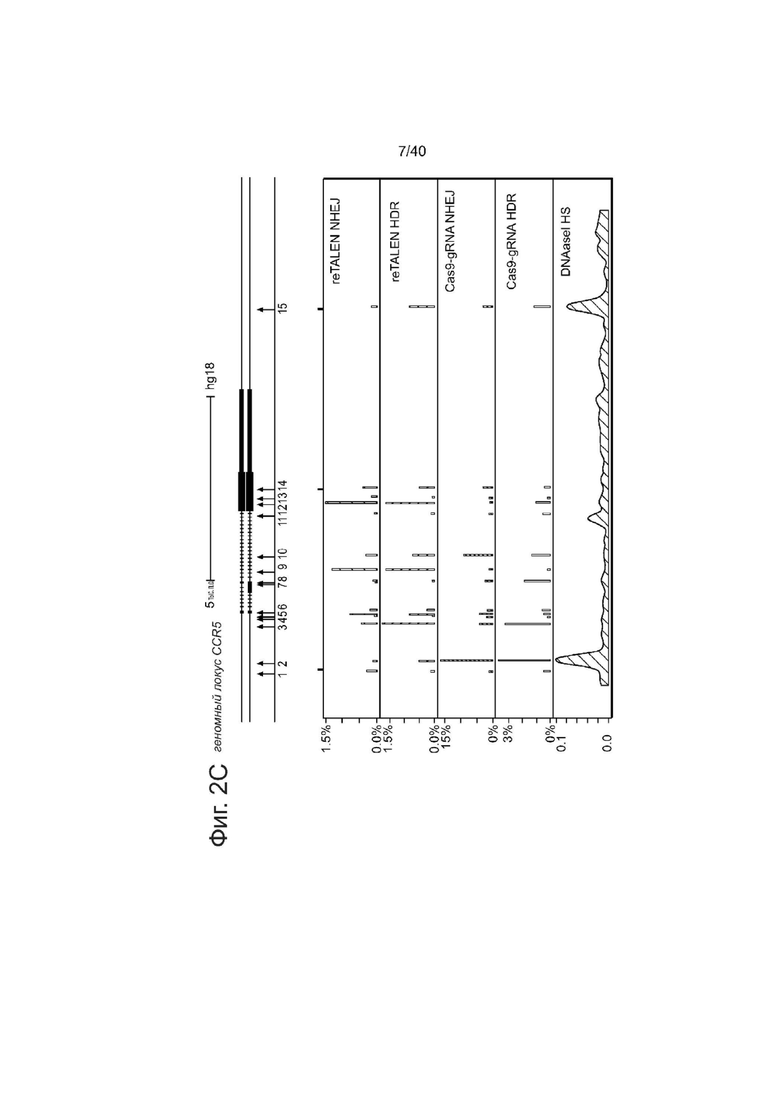
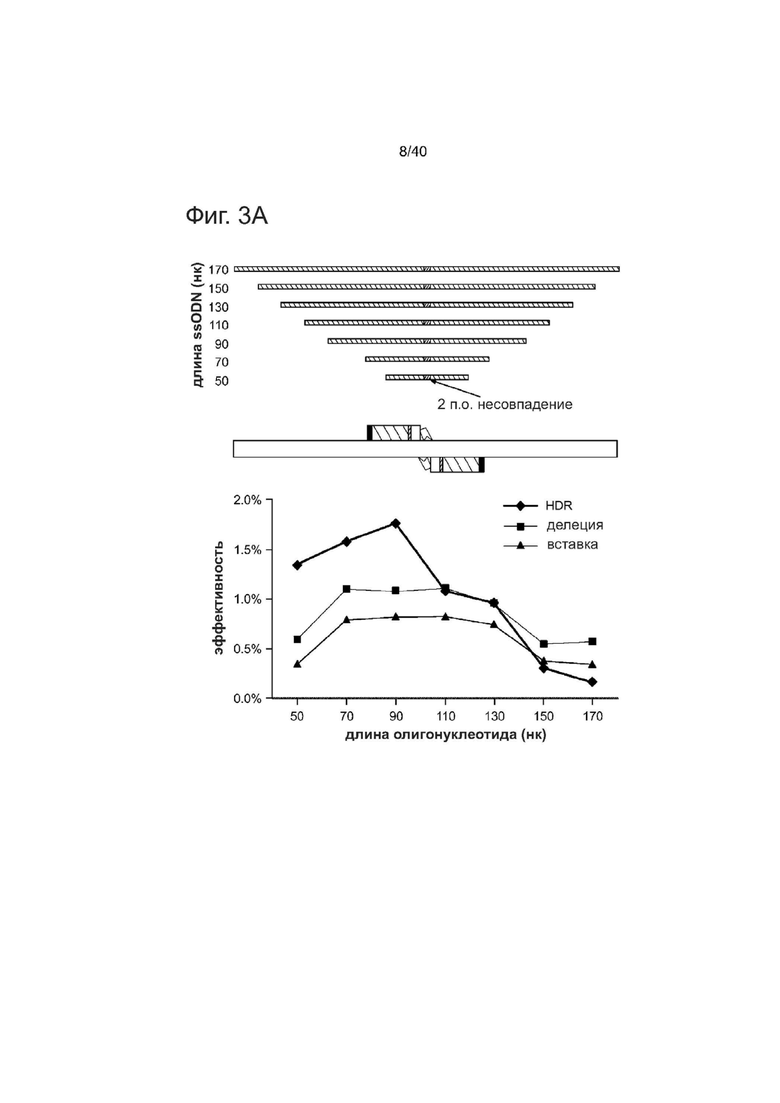
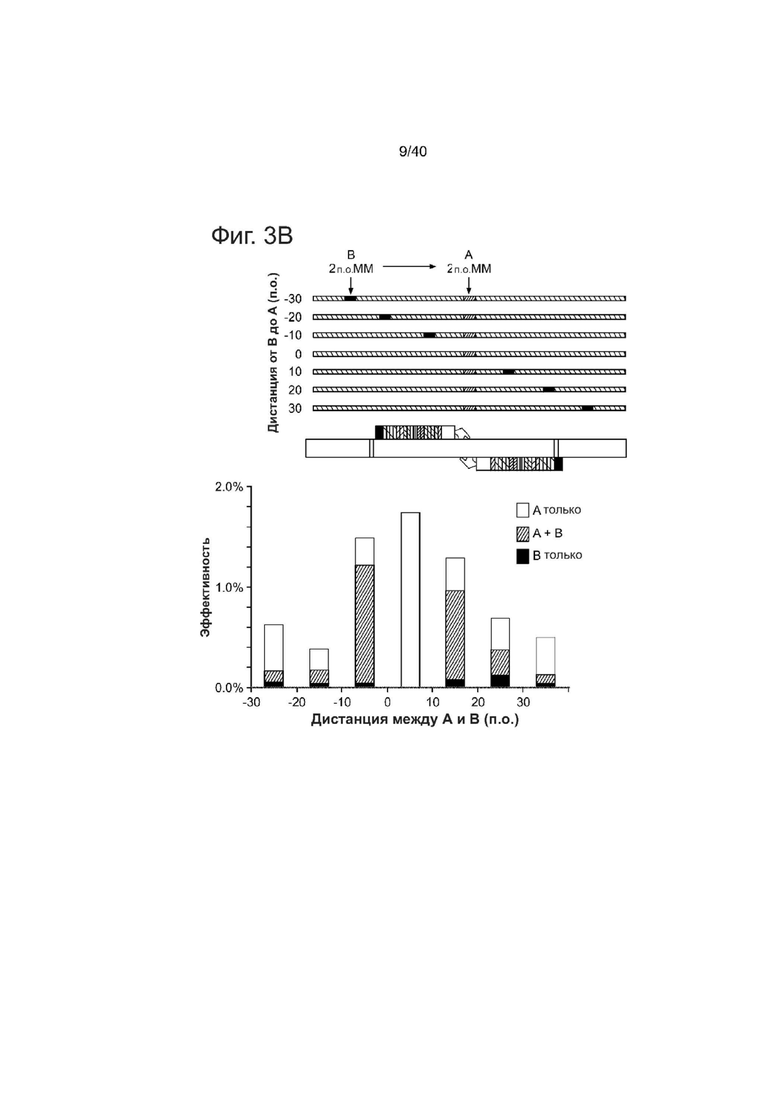
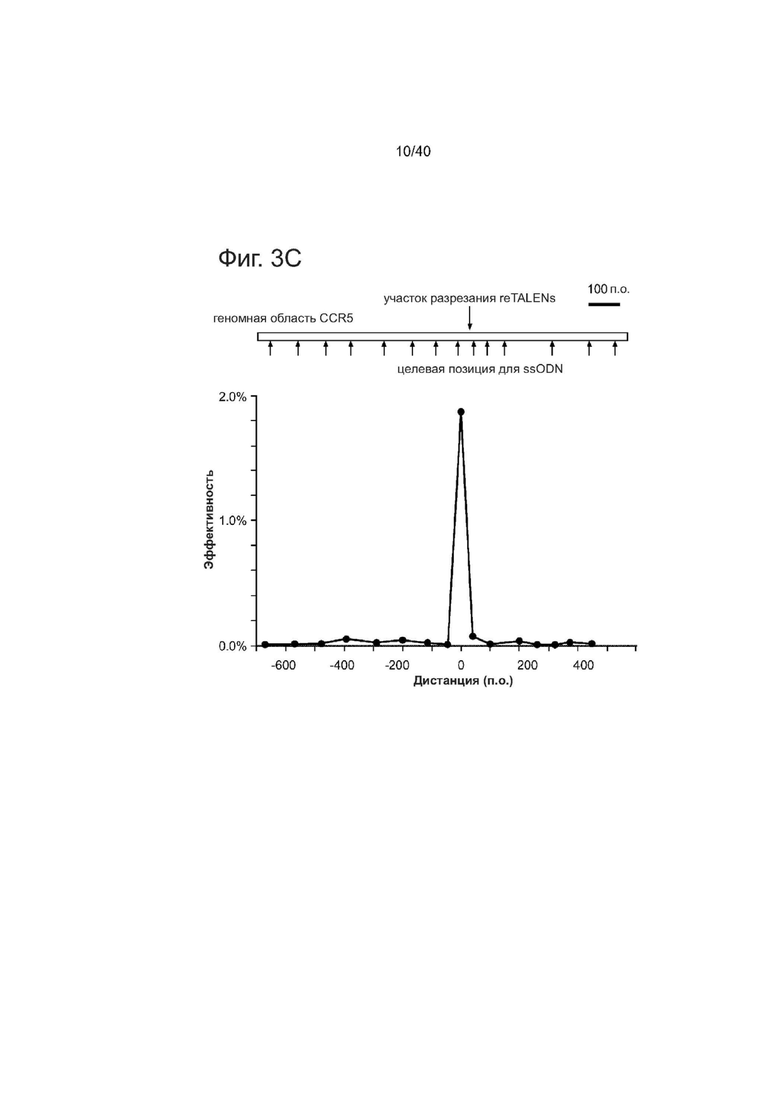
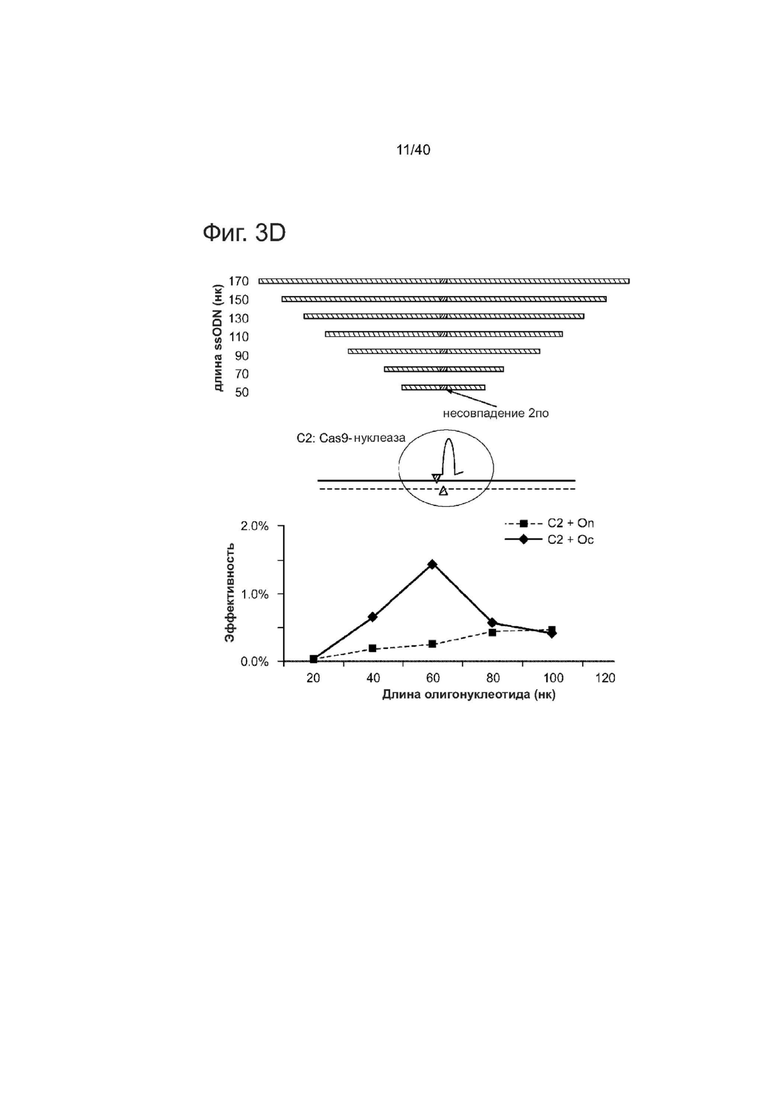
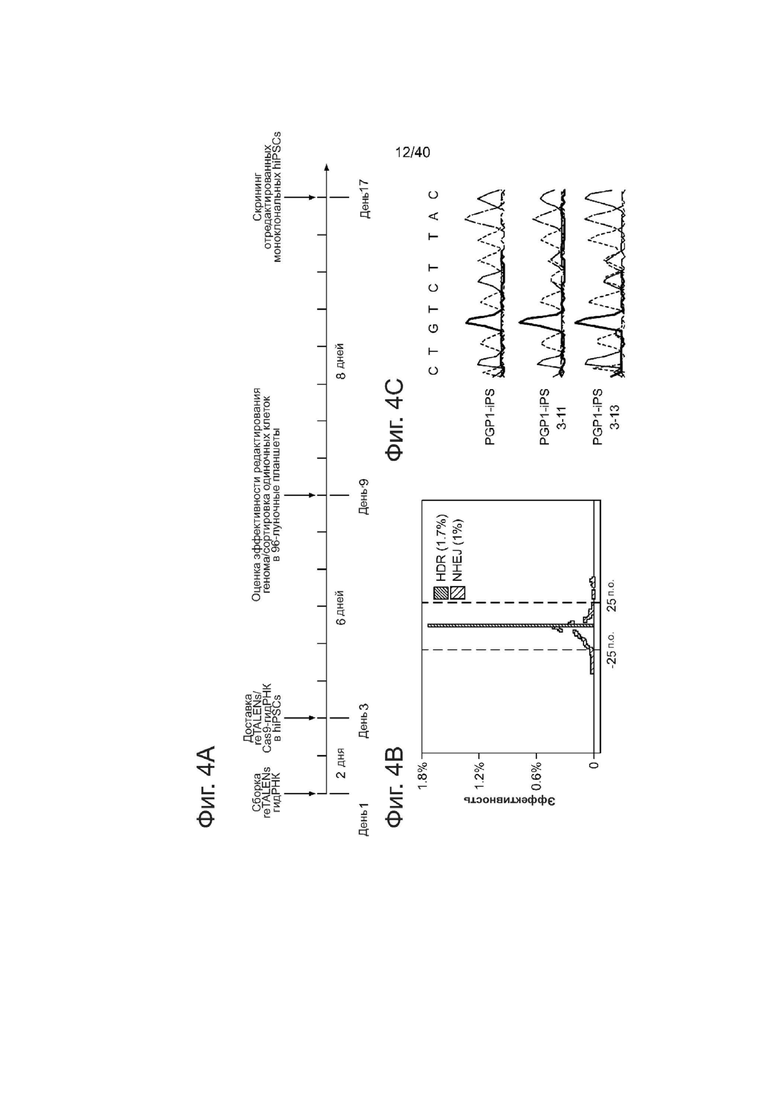
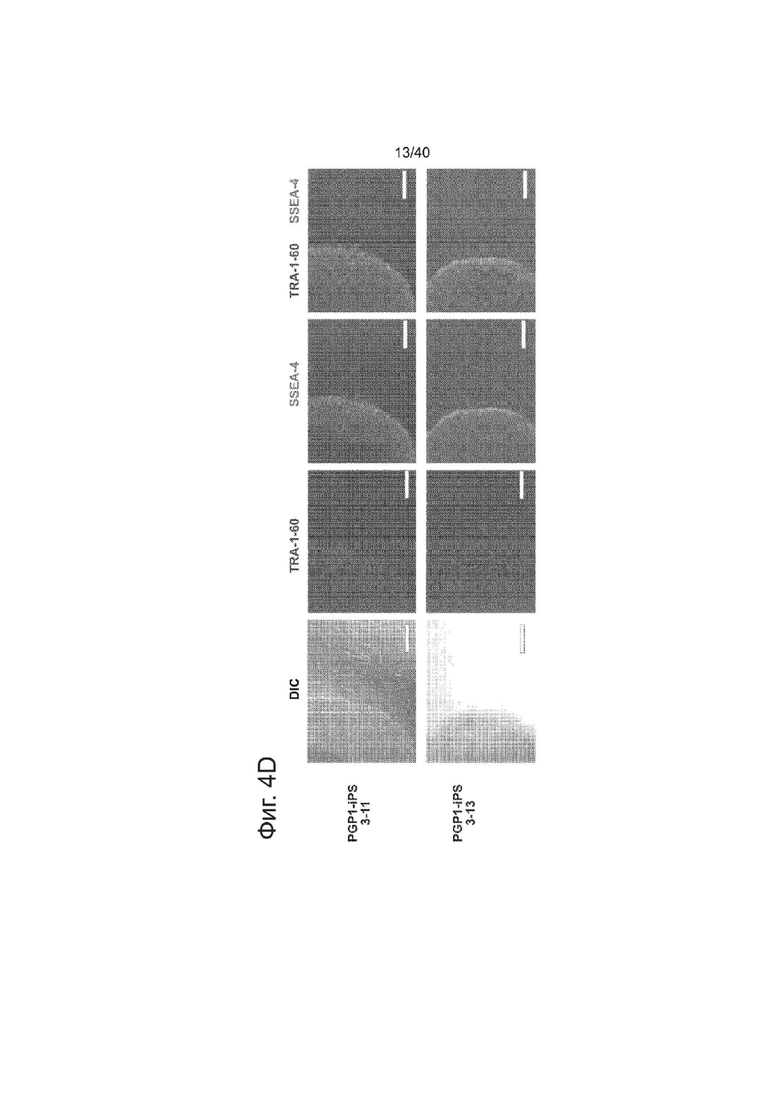

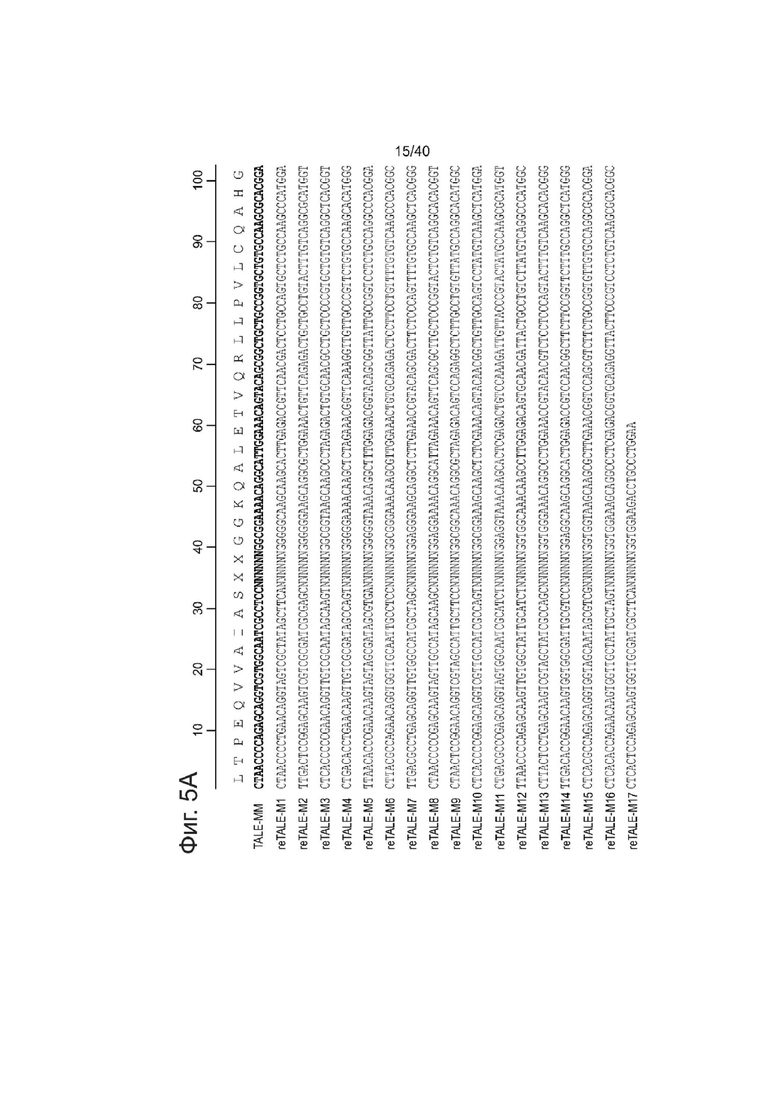

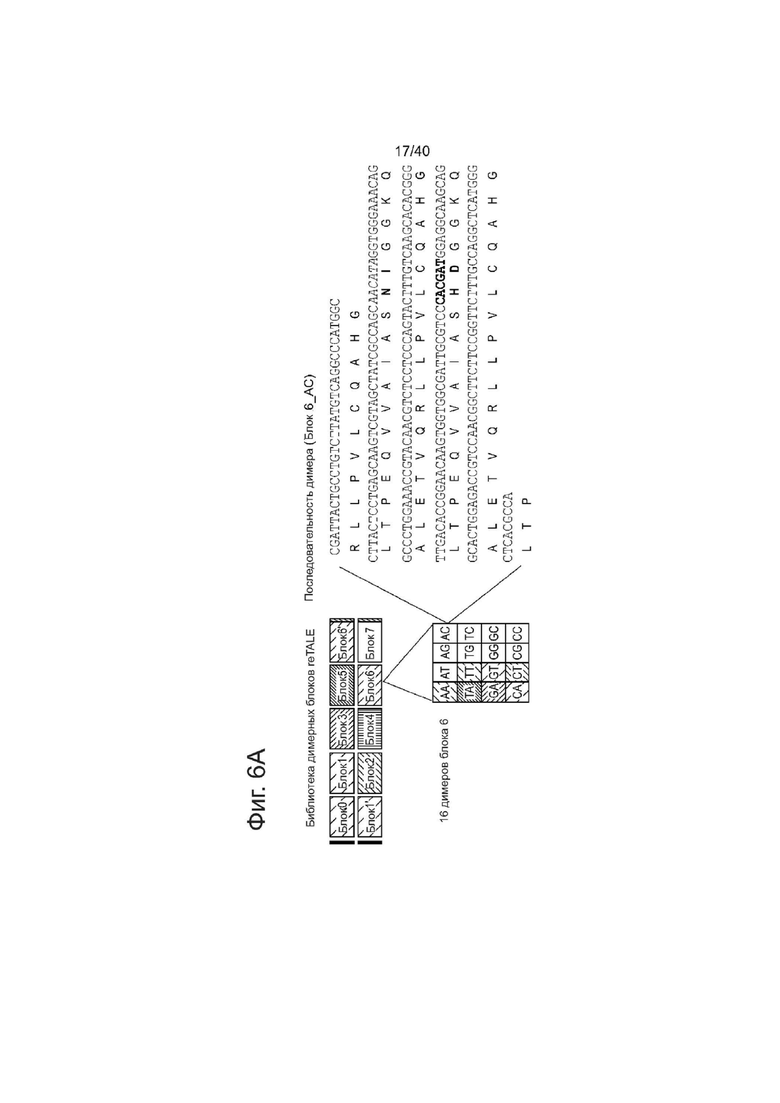
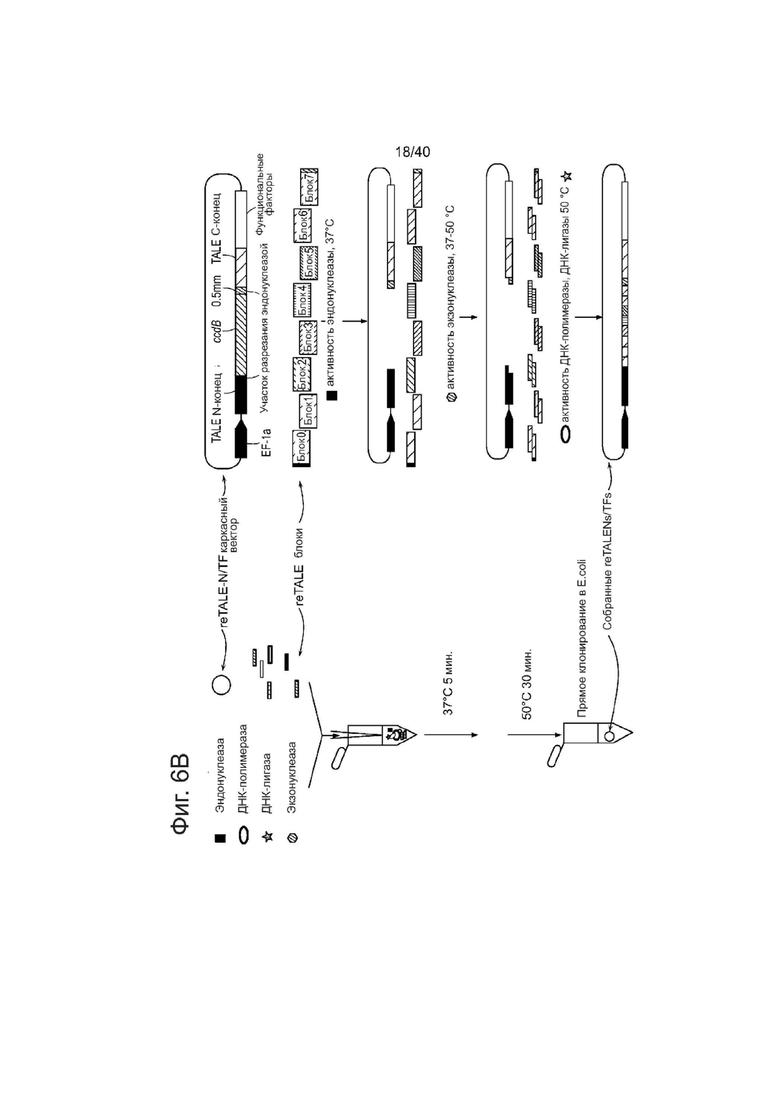
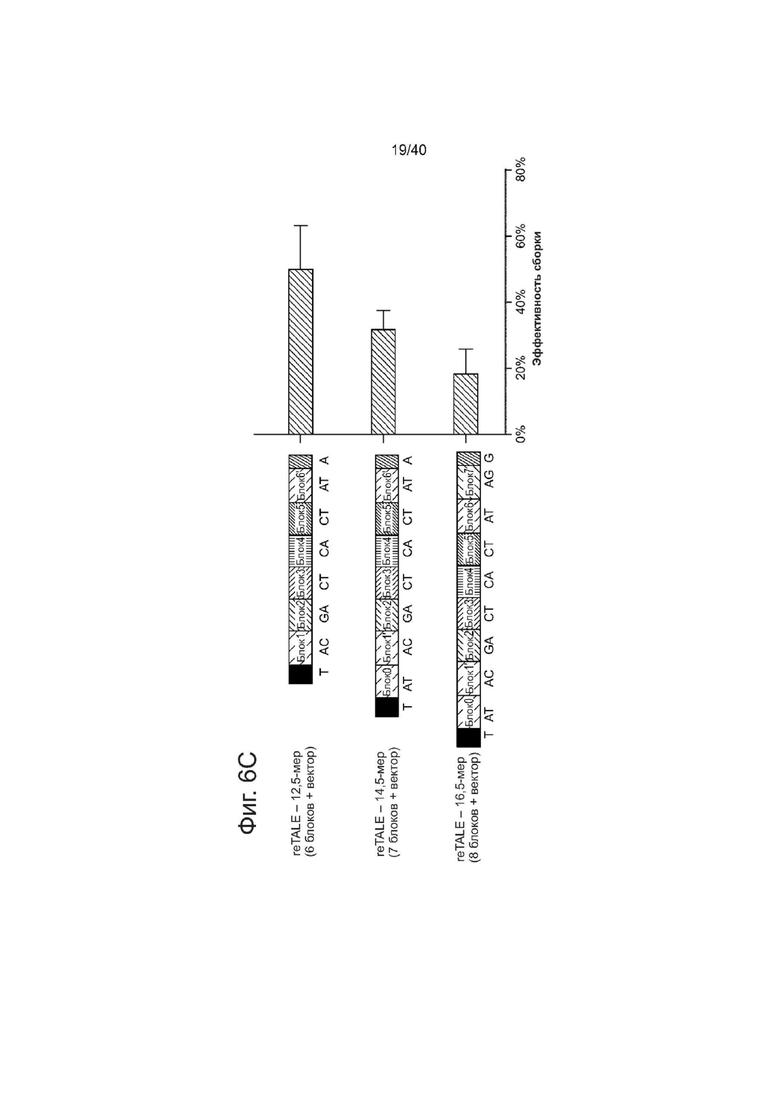
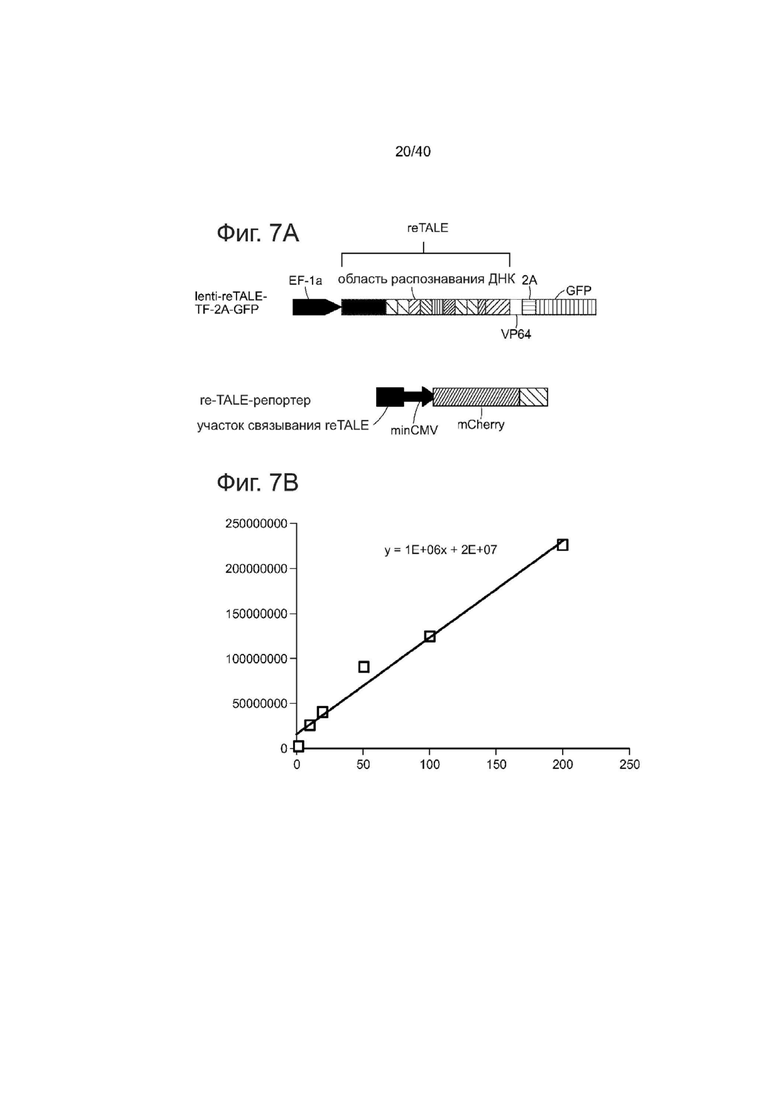
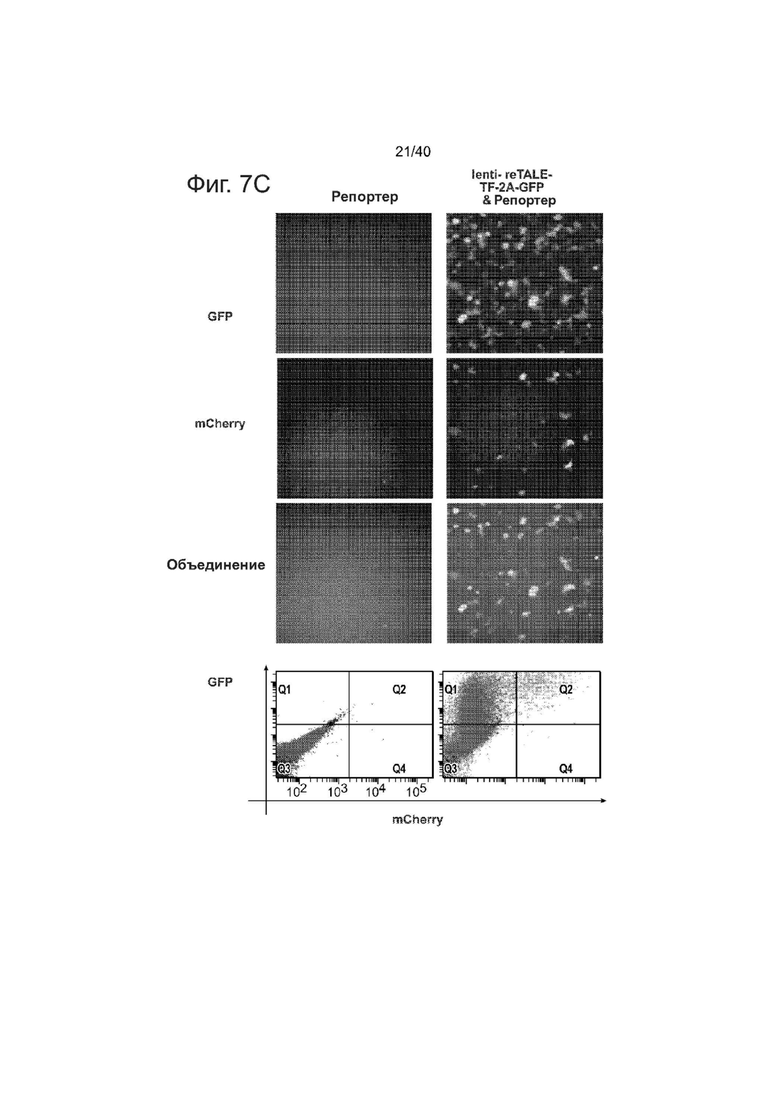
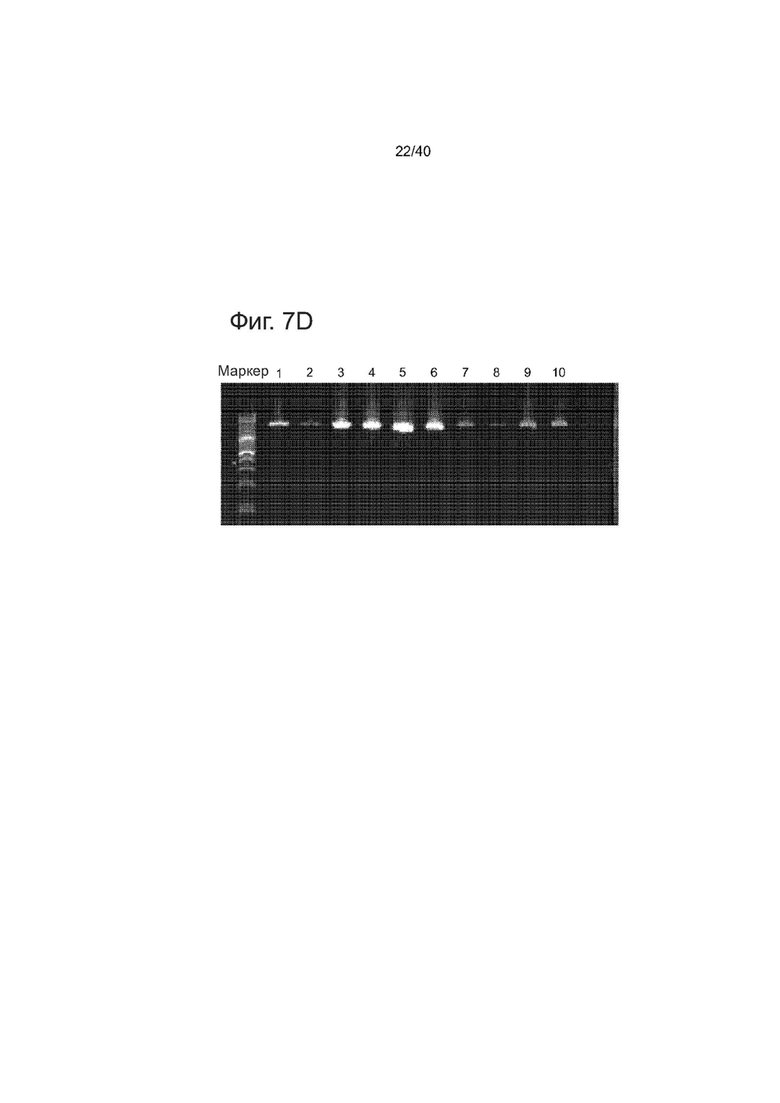
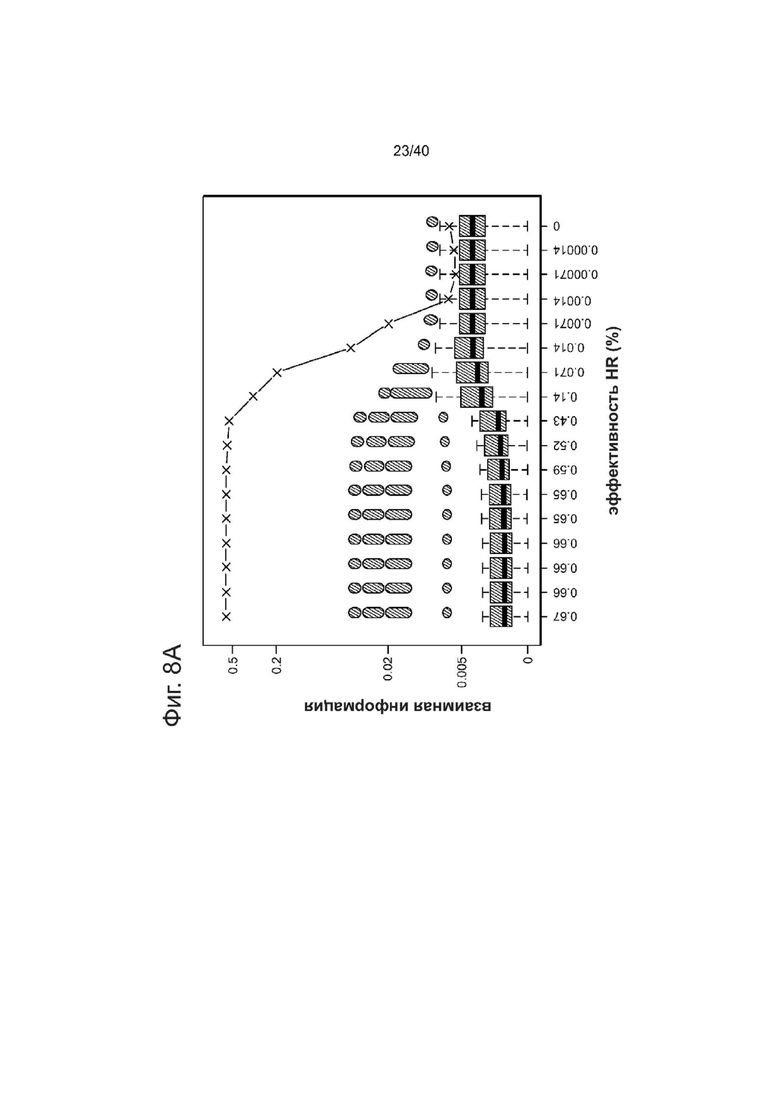
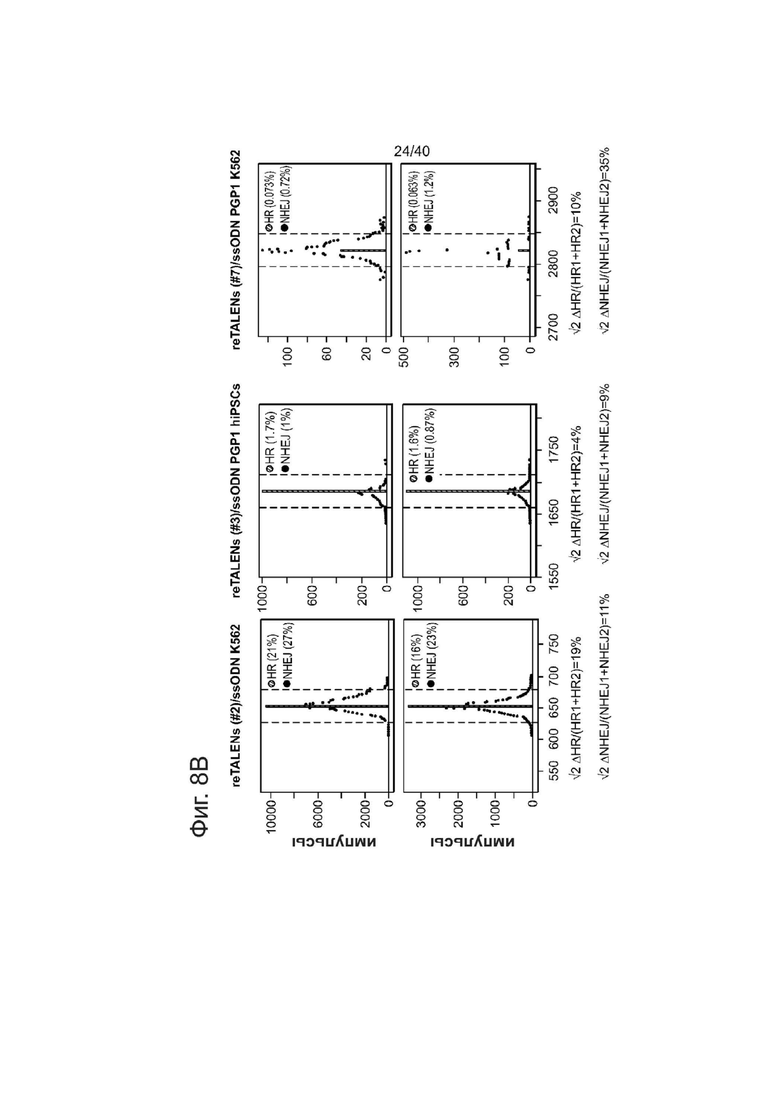
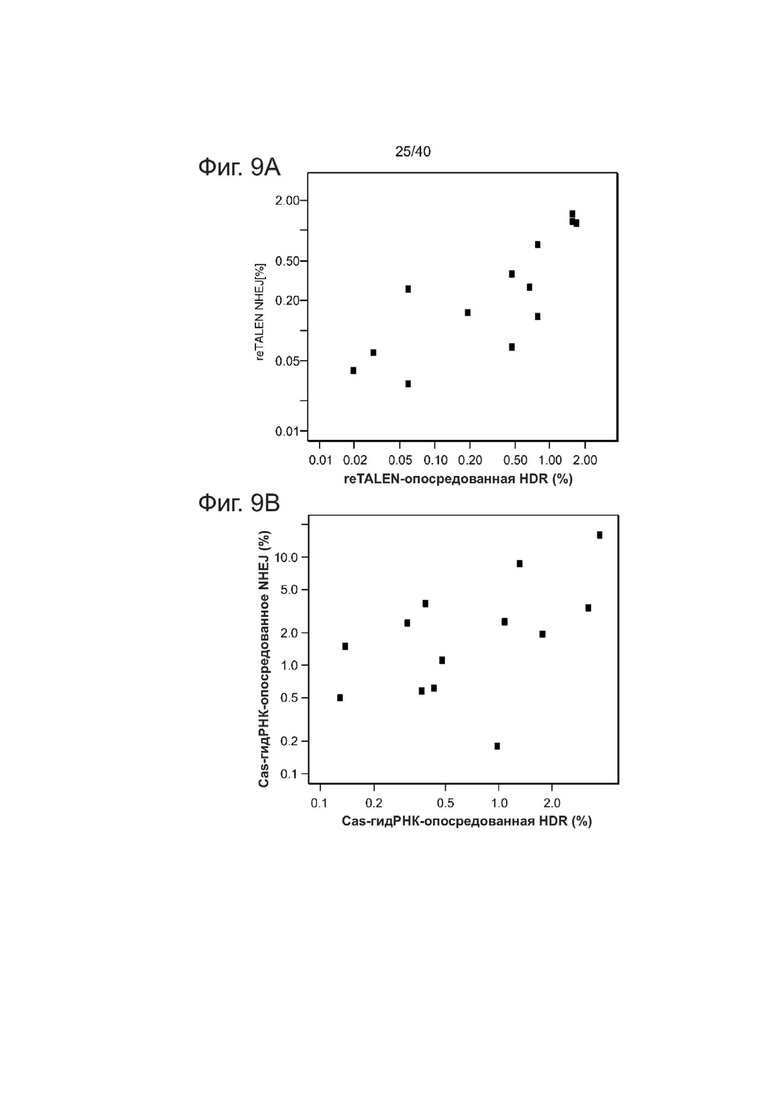
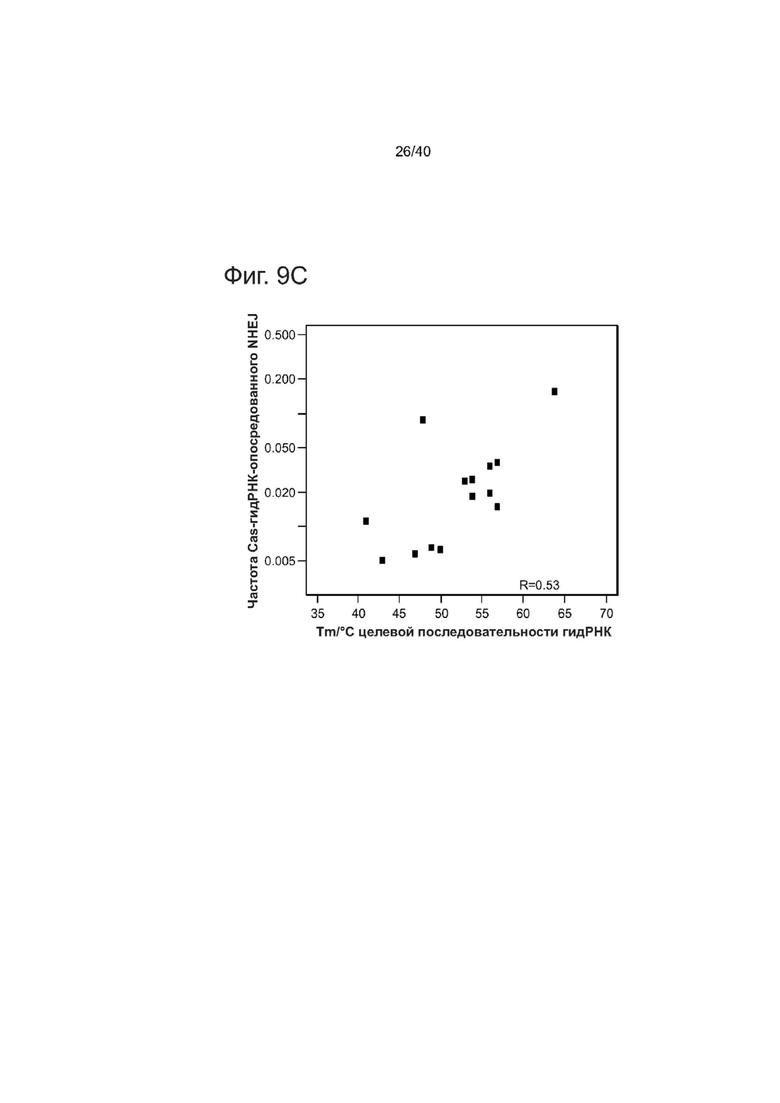
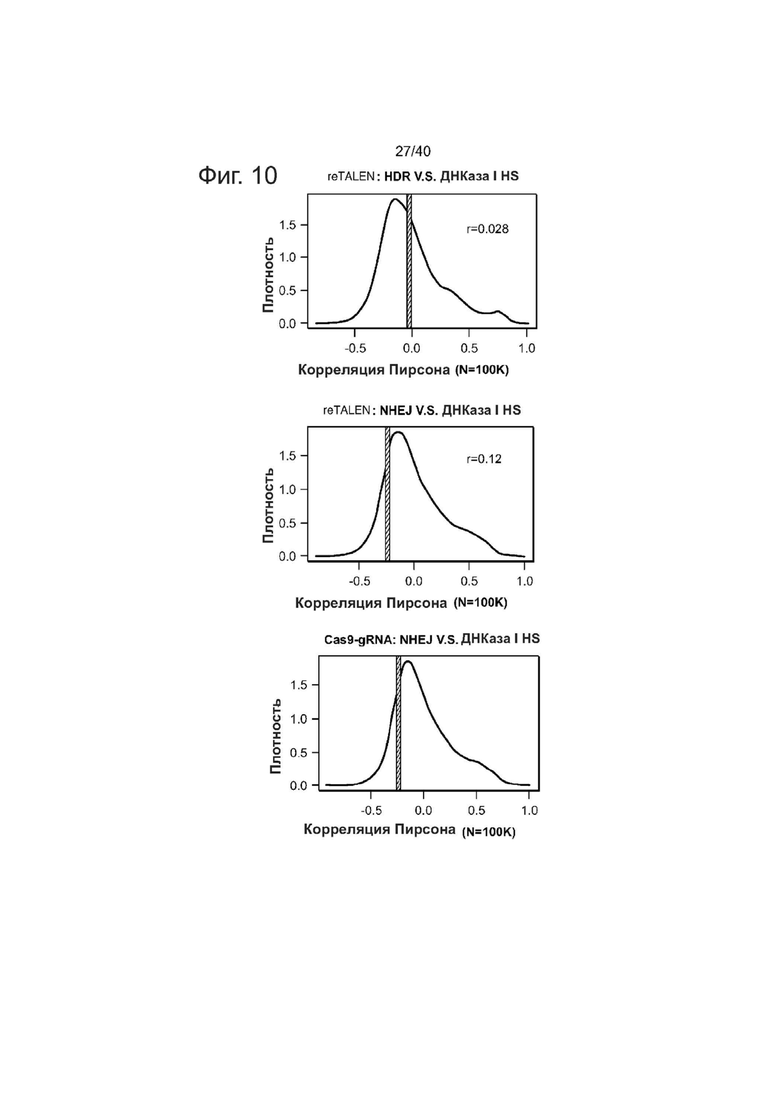
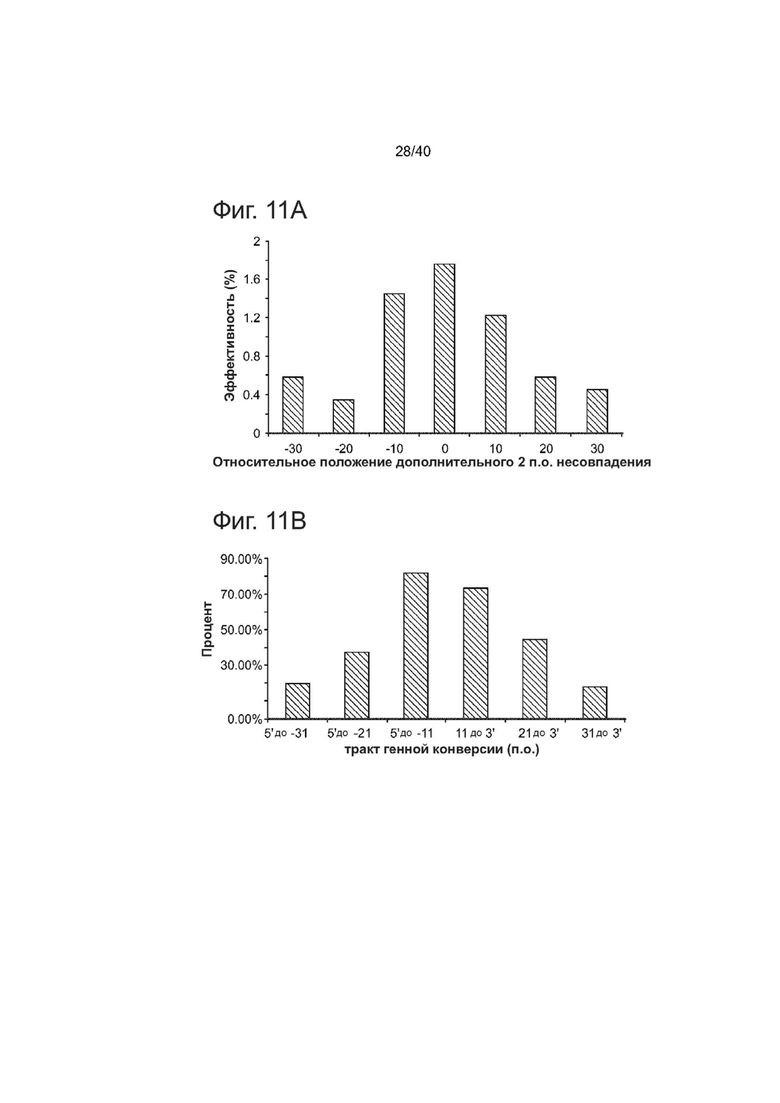
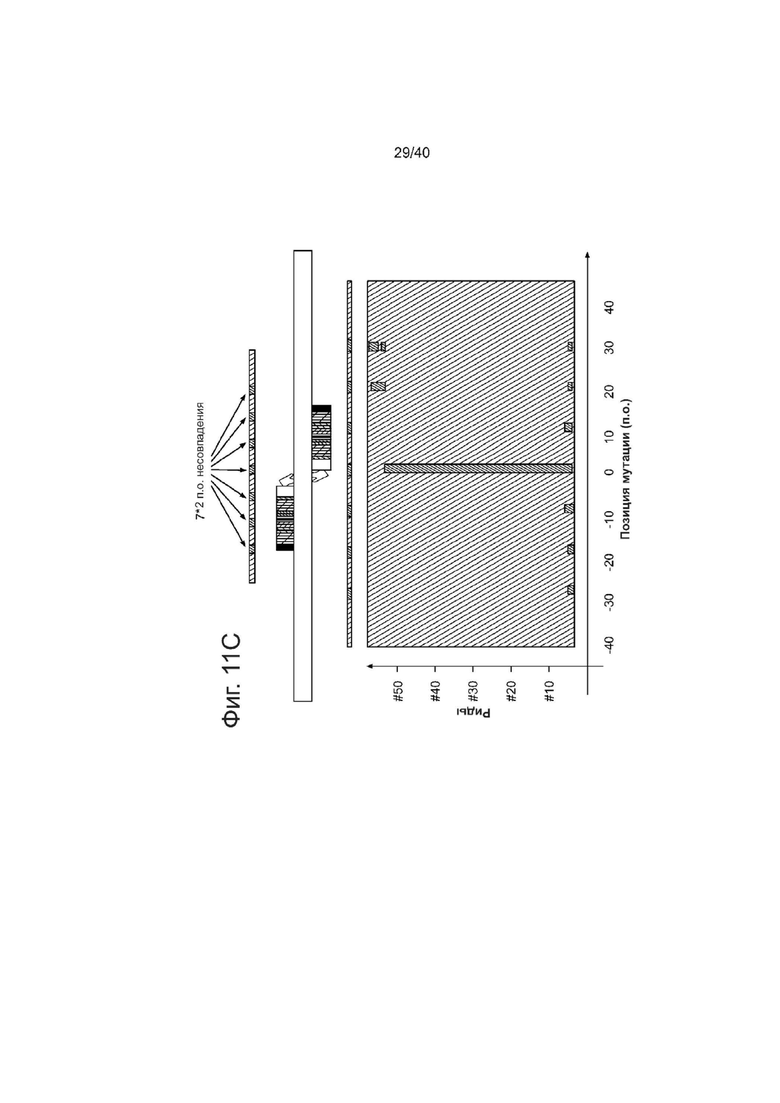
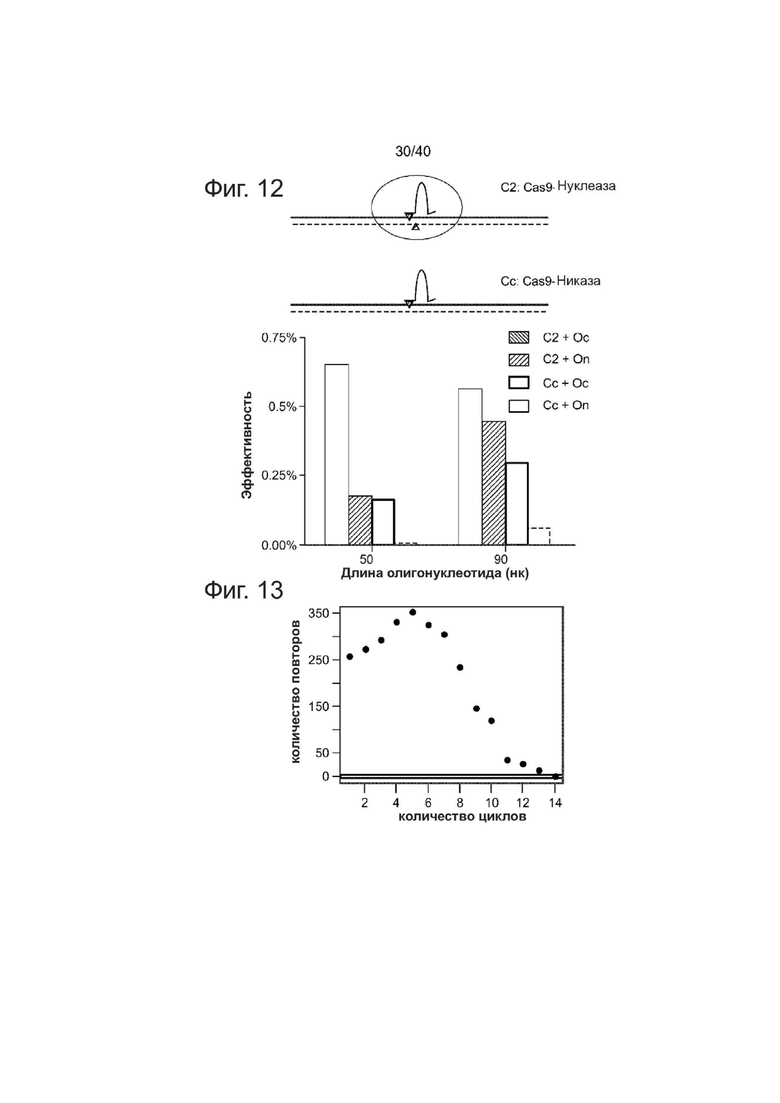
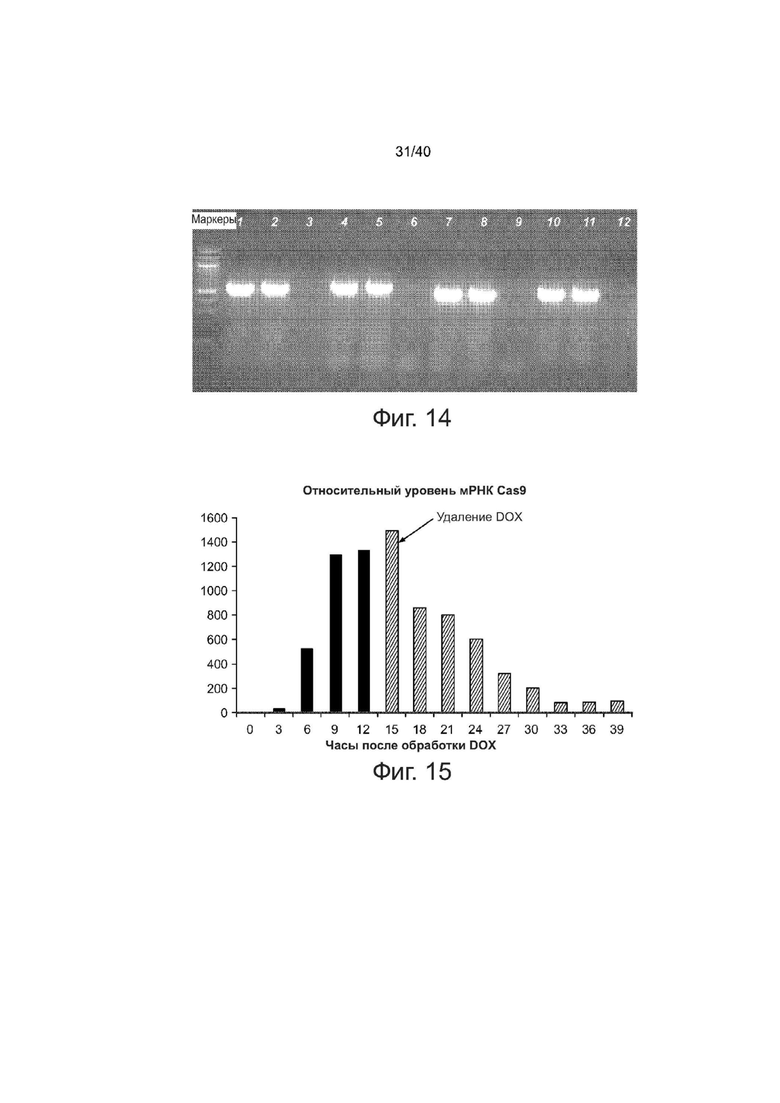
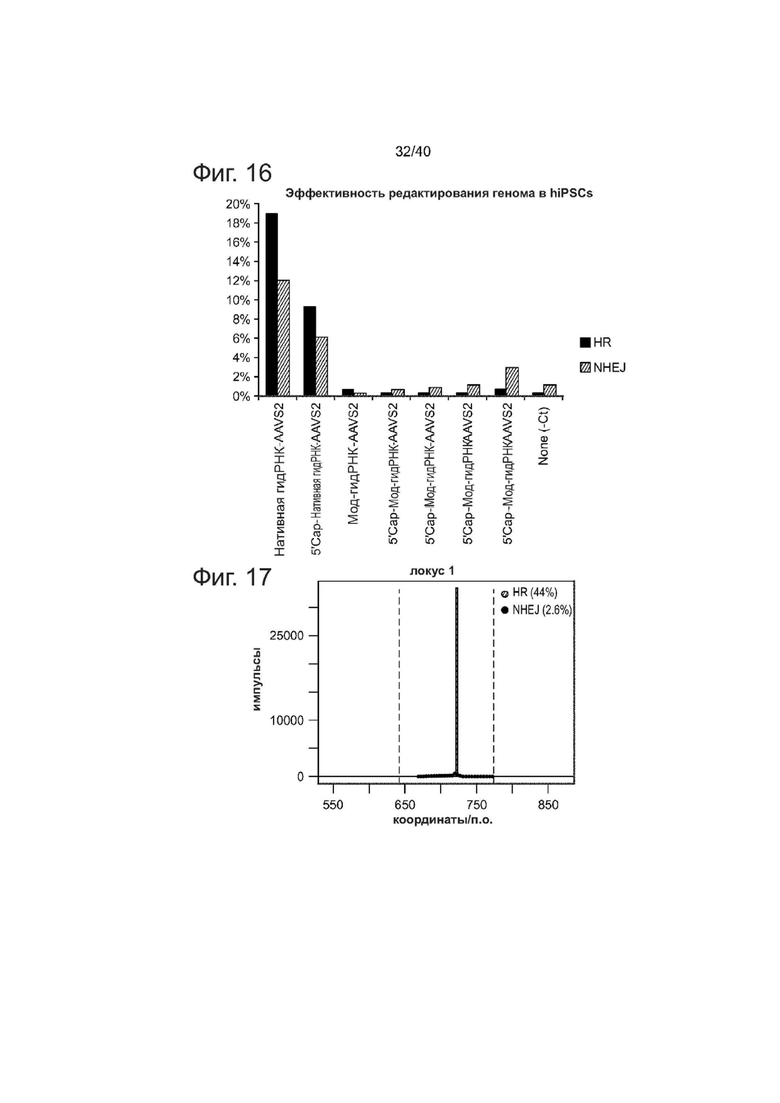

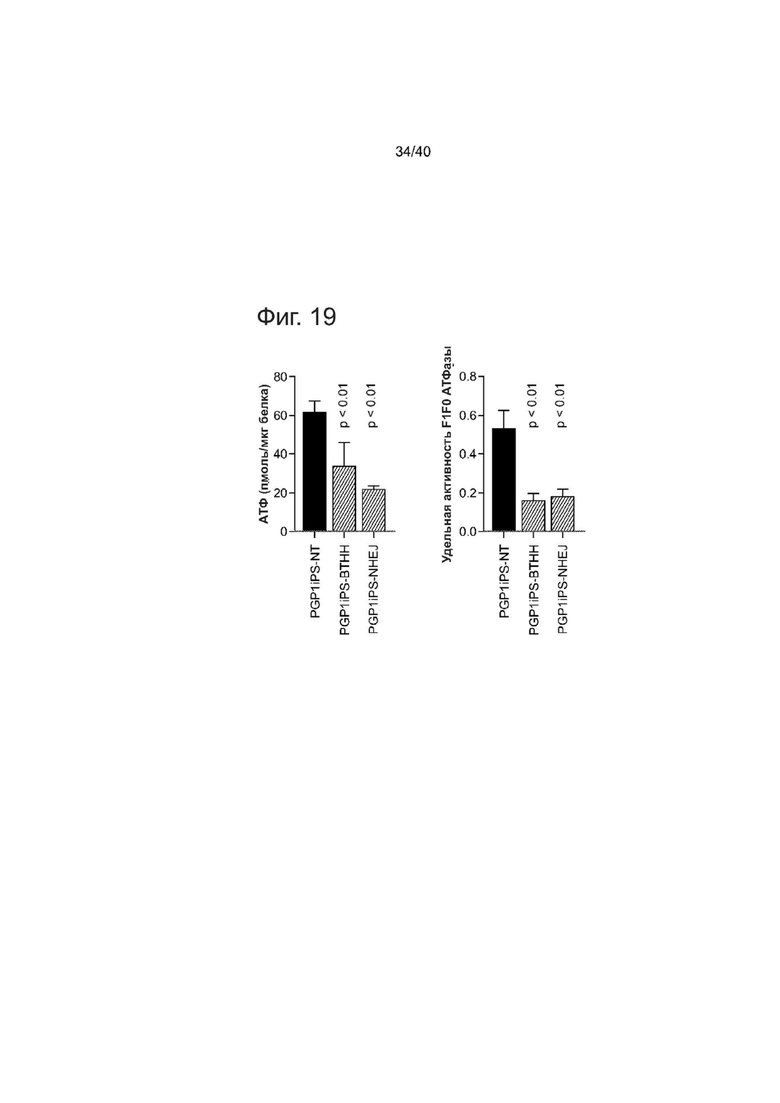






Изобретение относится к области биотехнологии, а именно к способу изменения ДНК-мишени в клетке in vitro. Данный способ предусматривает обеспечение клетки ферментом Cas системы CRISPR II типа, который образует колокализационный комплекс с направляющей РНК, комплементарной ДНК-мишени, и который расщепляет ДНК-мишень сайт-специфичным образом, введение в клетку направляющей РНК, которая комплементарна ДНК-мишени и которая направляет фермент Cas системы CRISPR II типа к ДНК-мишени, где направляющая РНК и фермент Cas системы CRISPR II типа являются членами колокализационного комплекса для ДНК-мишени, и введение в клетку донорной последовательности нуклеиновой кислоты, где направляющая РНК и донорная последовательность нуклеиновой кислоты связаны. Изобретение эффективно для изменения ДНК-мишени в клетке in vitro. 17 з.п. ф-лы, 20 ил., 6 табл., 20 пр.
1. Способ изменения ДНК-мишени в клетке in vitro, включающий
обеспечение клетки ферментом Cas системы CRISPR II типа, который образует колокализационный комплекс с направляющей РНК, комплементарной ДНК-мишени, и который расщепляет ДНК-мишень сайт-специфичным образом,
введение в клетку направляющей РНК, которая комплементарна ДНК-мишени и которая направляет фермент Cas системы CRISPR II типа к ДНК-мишени, где направляющая РНК и фермент Cas системы CRISPR II типа являются членами колокализационного комплекса для ДНК-мишени,
введение в клетку донорной последовательности нуклеиновой кислоты, где направляющая РНК и донорная последовательность нуклеиновой кислоты связаны,
где направляющая РНК и фермент Cas системы CRISPR II типа колокализуются на ДНК-мишени, и фермент Cas системы CRISPR II типа расщепляет ДНК-мишень и донорная последовательность нуклеиновой кислоты встраивается в ДНК-мишень с получением измененной ДНК в клетке, и
где клетка не является человеческой клеткой зародышевой линии или эмбриональной клеткой.
2. Способ по п.1, где направляющая РНК содержит от примерно 10 до примерно 500 нуклеотидов.
3. Способ по п.1, где направляющая РНК содержит от примерно 20 до примерно 100 нуклеотидов.
4. Способ по п.1, где направляющая РНК содержит примерно 100 нуклеотидов.
5. Способ по п.1, где направляющая РНК представляет собой слияние crRNA-tracrRNA.
6. Способ по п.1, где донорная последовательность нуклеиновой кислоты встраивается посредством гомологичной рекомбинации.
7. Способ по п.1, где донорная последовательность нуклеиновой кислоты встраивается посредством негомологичного соединения концов.
8. Способ по п.1, где направляющая РНК встраивается в клетку в виде первой чужеродной нуклеиновой кислоты, которая экспрессируется в клетке.
9. Способ по п.1 дополнительно включающий введение множества донорных нуклеиновых кислот и множества направляющих РНК с получением множества изменений ДНК в клетке.
10. Способ по п.1, где фермент Cas системы CRISPR II типа представляет собой фермент Cas 9.
11. Способ по п.1, где фермент Cas системы CRISPR II типа представляет собой фермент Cas 9 из S. pyogenes.
12. Способ по п.1, где ДНК-мишень представляет собой геномную ДНК, митохондриальную ДНК, вирусную ДНК или экзогенную ДНК.
13. Способ по п.1, где клетка представляет собой эукариотическую клетку.
14. Способ по п.1, где клетка представляет собой клетку дрожжей, клетку растений или клетку животных.
15. Способ по п.1, где клетка представляет собой клетку человека.
16. Способ по п.1, где клетка представляет собой стволовую клетку.
17. Способ по п.1, где клетка представляет собой стволовую клетку человека.
18. Способ по п.1, где клетка представляет собой индуцированную плюрипотентную стволовую клетку человека.
| MALI, PRASHANT et al | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| WOLTJEN, K | |||
| et al | |||
| piggyBac transposition reprograms fibroblasts to induced pluripotent stem cells, Nature, 2009, 458(7239): 766-770 | |||
| CONG LE et al | |||
| Multiplex genome engineering using CRISPR/Cas systems, Science, 03 January 2013, | |||
Авторы
Даты
2024-02-02—Публикация
2021-12-09—Подача