Изобретение относится к микробиологии и может быть использовано в биотехнологии для получения пробиотических препаратов.
В настоящее время пробиотические препараты нашли широкое применение, как в гуманитарной, так и ветеринарной медицине. Это связано с чрезвычайно важной ролью симбионтных микроорганизмов в механизмах обмена веществ и резистентности человека и животных. Поэтому при различных патологиях, особенно связанных с применением антибиотиков, назначаются препараты живых молочнокислых бактерий, в т.ч. лактобактерий. Лактобактерии входят в основной пул симбионтных микроорганизмов кишечного тракта. Они обладают антагонистической активностью к широкому кругу патогенов, способных заселять естественные полости биологических объектов и вызывать воспалительно-дегенеративные процессы. Однако штаммы-пробионты или аутоштаммы лактобактерий могут естественным образом снижать или не проявлять свою антагонистическую активность (АА), что побуждает микробиологов постоянно осуществлять скрининг их активных вариантов или разрабатывать способы повышения у лактобактерий АА. Для повышения АА лактобактерий ранее были использованы различные способы. Так с целью повышения АА лактобактерий зарубежные авторы [Chung Т.С., Axelsson L., Lindgren S.E., Dobrogosz W.J. In vitro studies on reuterin synthesis by Lactobacillus reuteri // Microbial ecology in health and disease, 1989. 2:137-144; DOI: 10.3109/08910608909140211] предложили метод совместного культивирования Lactobacillus reuteri с бактерией-индуктором. Данный метод позволят стимулировать продукцию лактобактерией бактериоцина рейтерина. В качестве бактерии-индуктора авторы использовали представителей энтеробактерий, стафилококков, псевдомонад, клостридий и др. групп бактерий. Было установлено, что продукция лактобактерией бактериоцина была тем выше, чем выше становилась концентрация бактерии-индуцента в культуральной среде. Несмотря на положительный результат, этот способ стимуляции имеет недостатки, заключающиеся в том, что не позволяет контролировать рост бактерий-индукторов, а, следовательно, получать чистый и безопасный пробиотический продукт. Поэтому было предложено использовать в качестве стимуляторов не живых бактерий, а их метаболиты или клеточные компоненты.
В работе Barefoot S.F. с соавторами [Barefoot S.F., Chen Y.R., Hughes Т.А., Bodine A.B., Shearer M.Y., Hughes M.D. Identification and purification of a protein that induces production of the Lactobacillus acidophilus bacteriocin lacta-cin В // Appl. Environ Microbiol., 1994. 60(10):3522-3528; DOI: 10.1128/aem.60.10.3522-3528.] было показано, что выработка Lactobacillus acidophilus лактацина В индуцируется белком клеточной стенки Lactobacillus delbrueckii. Недостатком данного способа является сложность и высокая стоимость получения белка-индуцента, а также то обстоятельство, что продуцируемый бактериоцин подавляет рост близкородственных лактобактерий.
Было установлено влияние метаболитов пробиотических и патогенных бактерий на антагонистическую активность лактобактерий (Вахитов Т.Я., Вербицкая Н.Б., Добролеж О.В., Полевая Е.В., Кобатов А.И. Влияние метаболитов пробиотических и патогенных бактерий на антагонистическую активность Lactobacillus acidophilus Д №75 // Научный журнал КубГАУ, 2013. №92(08); http://ej.kubagro.ru/2013/08/pdf/22.pdf). Данные метаболиты представляют собой водные растворы комплексов различных хелатных солей натрия и монокарбоновых аминокислот. Показано, что эти комплексы метаболитов (Aktoflor и Patogen) стимулировали на плотной питательной среде антагонистическую активность у Lactobacillus acidophilus Д №75 в 2-5 раз, проявляющуюся в виде увеличения зоны задержки роста кишечной палочки, золотистого стафилококка и синегнойной палочки. Однако аналогичного действия в жидкой питательной среде авторы не отметили. Недостатком данного способа стимуляции является искусственный состав метаболитов, не отвечающий естественному (природному) составу и их дороговизна. По своему действию рассматриваемые комплексы метаболитов в большей степени представляют собой дополнительные ростовые компоненты к питательной среде, чем и объясняется стимуляция роста лактобактерий, а также увеличение их АА. Причем, как показывают авторы, с увеличением дозы ввода в питательную среду стимулятора и продолжительностью культивирования лактобактерий повышается АА. Это свидетельствует не столько в пользу стимуляции собственно АА, сколько в пользу накопления в культуральной среде метаболитов лактобактерий, обладающих подавляющим действием на условно патогенные бактерии. Кроме того, данные комплексы метаболитов представляют собой водные растворы, которые авторы предлагают вводить в питательную среду для лактобактерий не из расчета объема (в миллилитрах), а исходя из концентрации в растворе сухого вещества в миллиграммах, что затрудняет расчет дозы ввода стимуляторов в питательную среду.
Близким по технической сущности к заявляемому способу является описанный А.В. Семеновым способ повышения АА бактерий [Семенов А.В. Способ повышения антагонистической активности бактерий // Вестник ОГУ, 2007. №7. С. 100-103; http://vestnik.osu.ru/2007_6/17.pdf]. Данный способ заключается в том, что экзометаболиты и фрагменты клеточной стенки Staphylococcus aureus добавляли в культуральную среду бактерий симбионтов в соотношении 1:2. В качестве экзометаболитов использовался центрифугат суточной бульонной культуры стафилококка обезвреженный хлороформом, а фрагменты клеточной стенки получали вначале путем щелочного, а затем трипсинового протеолиза с последующим осаждением спиртом и ацетоном. Было установлено, что экзометаболиты и фрагменты клеточных стенок могут стимулировать, подавлять или вовсе не оказывать действие на АА различных бактерий в отношении Staphylococcus aureus.
Недостатком данного способа стимуляции АА является узкий спектр действия - только в отношении Staphylococcus aureus, низкая эффективность, высокая доза введения в культуральную среду лактобактерий.
Техническим результатом предлагаемого изобретения является повышение эффективности способа стимуляции антагонистической активности лактобактерий и расширение применения специфического препарата.
Технический результат достигается тем, что в способе стимуляции антагонистической активности лактобактерий предусматривающем добавление в питательную среду для лактобактерий экзометаболита тест-культуры согласно изобретению в качестве экзометаболита используют эшерихиозный анатоксин, взятого относительно питательной среды лактобактерий в соотношении 1:10000-1:100000.
Новизна заявляемого предложения состоит в том, что в качестве стимулятора антагонистической активности лактобактерий используют эшерихиозный анатоксин.
В патентной и научно-технической литературе не обнаружены аналогичные заявляемой совокупности признаков, позволяющие получить технический результат, который ранее не достигался известными средствами, что позволяет судить об изобретательском уровне и новизне заявляемого предложения.
Конкретные примеры, описывающие осуществление способа стимуляции антагонистической активности лактобактерий.
Пример 1. Стимуляция АА лактобактерий на плотной питательной среде. В 99-99,9 мл стерильной растопленной и охлажденной до 40-45°С агаровой среды для культивирования лактобактерий МРС-4 (НИЦФ, Санкт-Петербург) вносили цельный эшерихиозный анатоксин (патент РФ №2432174 от 27.10.2011) в объеме 1 мл, что соответствовало его разведению в питательной среде 1:100 и разведенный 1:10-1:100 стерильным 0,9% раствором хлорида натрия в объеме 0,1-1 мл, что соответствовало разведению анатоксина в среде 1:1000-1:1000000. В предварительных опытах было установлено, что при введении эшерихиозного анатоксина до концентрации 1:10 рост лактобактерий полностью подавлялся из-за содержащегося в препарате консерванта.
Далее среду тщательно размешивали и разливали в чашки Петри диаметром 90 мм в объеме 20 мл. Таким образом, на каждое разведение эшерихиозного анатоксина расходовалось 5 чашек Петри, что соответствовало 5-ти повторностям на каждое разведение. В контроле в питательную среду вносили аналогичный объем стерильного 0,9% хлорида натрия.
После застывания агара в контрольных и опытных чашках на его поверхность вносили 0,1 мл суточной бульонной культуры лактобактерий и распределяли шпателем по всей поверхности для получения сплошного газона. В качестве лактобактерий использовали изолят Lactobacillus plantarum, выделенный из фекалий новорожденного теленка.
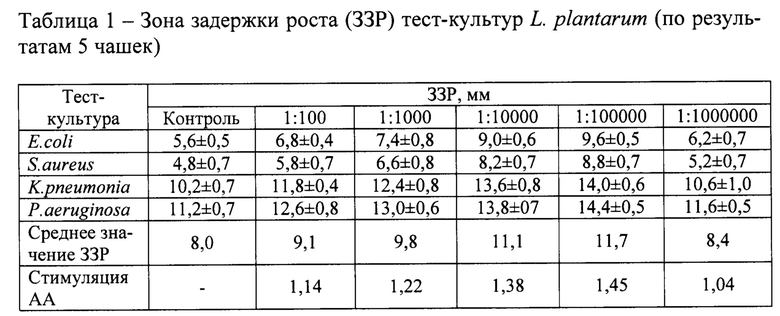
Чашки инкубировали при 37°С в условиях анаэростата или повышенного содержания СО2 с использованием газогенерирующих пакетов в течение 48 ч. По истечении этого времени одну половину агаровой пластины удаляли, а на ее место вносили расплавленный питательный агар для культивирования микроорганизмов (ГРМ-агар, ФБУН ГНЦ ПМБ, Оболенск), после застывания которого перпендикулярными штрихами к агаровой пластинке с выросшими колониями лактобактерий бактериологической петлей диаметром 2 мм засевали тест-культуры (кишечная палочка, золотистый стафилококк, клебсиелла пневмоника, синегнойная палочка) с концентрацией 107 КОЕ/мл и помещали чашки Петри в термостат на 20-24 ч. По истечении времени инкубации чашки вынимали из термостата и линейкой или штангенциркулем производили измерение размера зоны задержки роста тест-культуры в миллиметрах. Величина стимуляции АА L. plantarum равнялась отношению значения среднего показателя величины зоны задержки роста тест-культур в опытных и контрольных чашках Петри. Результаты представлены в таблице 1.
Как видно из материалов таблицы, используемый в опыте изолят лактобактерий обладает достаточно выраженной антагонистической активностью. Средняя величина зоны задержки роста тест-культур была равна 8,0 мм. При добавлении эшерихиозного анатоксина питательную среду для лактобактерий в концентрации от 1:100 до 1:100000 стимулировало АА L. plantarum в 1,14-1,45 раз, но при концентрации 1:1000000 стимулирующее действие практически не проявлялось. Наиболее эффективно стимулировали АА L. plantarum концентрации эшерихиозного анатоксина в диапазоне 1:10000-1:100000, когда индекс стимуляции составлял 1,38-1,45.
Пример 2. Стимуляция АА лактобактерий в жидкой питательной среде. В 99-99,9 мл стерильной жидкой питательной среды для культивирования лактобактерий МРС-1 (НИЦФ, Санкт-Петербург) вносили цельный эшерихиозный анатоксин (патент РФ №2432174 от 27.10.2011) в объеме 1 мл, что соответствовало его разведению в питательной среде 1:100 и разведенный 1:10-1:100 стерильным 0,9% раствором хлорида натрия в объеме 0,1-1 мл, что соответствовало разведению анатоксина в среде 1:1000-1:1000000. В предварительных опытах было установлено, что при введении эшерихиозного анатоксина в питательную среду до концентрации 1:10 рост лактобактерий полностью подавлялся из-за содержащегося в препарате консерванта. В контроле в питательную среду добавляли аналогичный объем стерильного 0,9% хлорида натрия.
Из каждого разведения эшерихиозного анатоксина и контрольной среды отбирали по 10 мл и вносили в пробирки.
Во все опытные пробирки и пробирки контроля №1 (положительный) вначале вносили по 100 тыс. микробных клеток L. plantarum, а через 2 часа такое же количество клеток Е. coli (по 3 пробирки) и S. aureus (по 3 пробирки). Одновременно в пробирки контроля №2 (отрицательный), содержащие только стерильную питательную среду МРС-1, также вносили по 100 тыс. клеток Е. coli и S. aureus. Через 2, 6, 24, 48, 72 ч после посева тест-культур производили посевы из пробирок на дифференциально-диагностические среды. Для индикации кишечной палочки использовали среду Эндо, а стафилококков - солевой агар. Для этого из каждой опытной и контрольных пробирок отбирали по 0,1 мл культуральной среды вносили в пробирки с 9,9 мл стерильного раствора хлорида натрия, из которых также отбирали по 0,1 мл и переносили в чашки Петри с дифференциально-диагностической средой и шпателем жидкость распределяли по всей поверхности агаровой пластинки. Через 24 ч осуществляли подсчет выросших колоний. Результаты отражены в таблице 2 и 3.
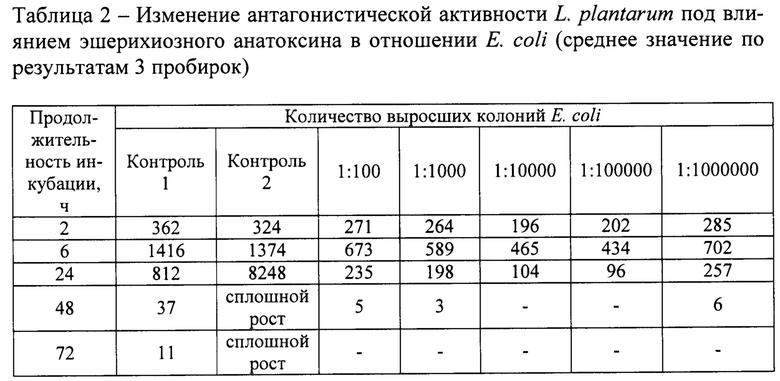
Материалы таблицы 2 и 3 свидетельствуют, что изолят L. plantarum в жидкой питательной среде в отношении Е. coli и S. aureus не сразу проявляет антагонистическую активность. В течение первых 6-ти часов интенсивность
роста тест-культур в пробирках положительного контроля тождественна пробиркам отрицательного контроля. Однако через 24 ч в пробирках положительного контроля количество колониеобразующих единиц Е. coli и S. aureus резко снизилось, а через 48-72 ч достигло несколько десятков. Напротив, в пробирках отрицательного контроля рост кишечной палочки и золотистого стафилококка характеризовался высокой интенсивностью, о чем свидетельствовал сплошной газон колоний при высеве на агаровую среду.
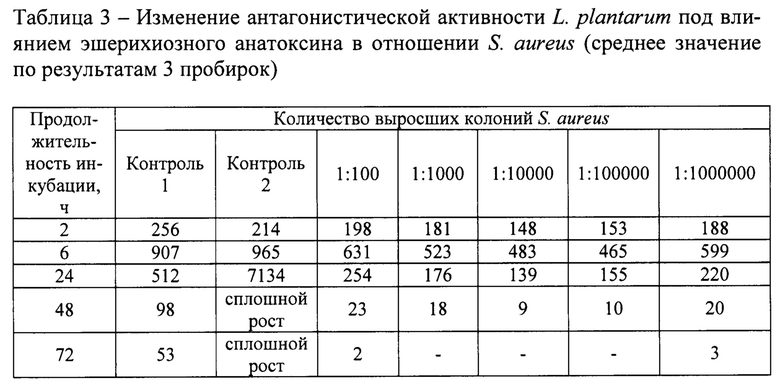
При сравнении роста тест-культуры из опытных пробирок с ростом из пробирок положительного контроля из было установлено, что, несмотря на общую тенденцию тест-культур в течение первых 6-ти часов увеличивать свое количество клеток, интенсивность этого роста была неодинаковой. В посевах из опытных пробирок количество эшерихий и стафилококков было в 1,4-3,2 раза меньшим, чем из пробирок положительного контроля. Это может быть свидетельством того, что анатоксин выступил в качестве сигнального вещества для лактобактерий, активизирующих их еще до встречи с антагонистическими объектами. Через 24 ч разница в количестве выросших колоний тест-культур из опытных и контрольных пробирок стала еще более выраженной. Количество выросших колоний Е. coli из опытных пробирок было 3,4-8,4 раза, а стафилококков в 2-3,6 раза меньшим, чем в пробирках положительного контроля. Через 48 ч в опытных пробирках количество живых клеток эшерихий и стафилококков было в пределах одного-двух десятков, а через 72 ч они полностью подавлялись.
Таким образом, приведенные примеры показывают, что при добавлении в плотную или жидкую культуральную среду эшерихиозного анатоксина стимулирует антагонистическую активность лактобактерий в отношении различных бактерий. В большей степени стимуляция проявляется в отношении грамотрицательных бактерий, в меньшей - грамположительных. Наиболее эффективным стимуляция проявляется при добавлении в питательную среду эшерихиозного анатоксина в концентрации 1:10000-1:100000.
Изобретение относится к биотехнологии. Предложен способ стимуляции антагонистической активности лактобактерий, предусматривающий добавление в питательную среду для лактобактерий экзометаболита тест-культуры, и в качестве экзометаболита используют эшерихиозный анатоксин, взятый относительно питательной среды лактобактерий в соотношении 1:10000-1:100000. Изобретение обеспечивает расширение арсенала способов стимуляции антагонистической активности лактобактерий. 3 табл., 2 пр.
Способ стимуляции антагонистической активности лактобактерий, предусматривающий добавление в питательную среду для лактобактерий экзометаболита тест-культуры, отличающийся тем, что в качестве экзометаболита используют эшерихиозный анатоксин, взятый относительно питательной среды лактобактерий в соотношении 1:10000-1:100000.
| СЕМЕНОВ А.В | |||
| "Способ повышения антагонистической активности бактерий"; Вестник ОГУ, 2007, N 6, с.100-103 | |||
| ЧЕРКАСОВ С.В., СЕМЕНОВ А.В | |||
| "Микробная регуляция антагонистической активности лактобактерий"; Сибирский медицинский журнал, 2012, N 2, с.78-82 | |||
| Способ оценки антагонистической активности лактобактерий толстокишечного биотопа пациента относительно разнообразных бактерий двухэтапным культивированием микроорганизма-антагониста и тестируемой культуры в условиях комбинированной системы | 2018 |
|
RU2670585C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СПОСОБНОСТИ МИКРООРГАНИЗМОВ РЕГУЛИРОВАТЬ АНТАГОНИСТИЧЕСКУЮ АКТИВНОСТЬ БАКТЕРИЙ | 2008 |
|
RU2376381C2 |
Авторы
Даты
2024-02-16—Публикация
2023-03-20—Подача