Изобретение относится к области химической технологии. Данное изобретение может быть использовано в качестве катализатора реакции переэтерификации между триглицеридами карбоновых кислот и спиртом (метанолом) в лабораторных условиях.
Настоящее изобретение относится к способам получения феррит-цинкового феррита методом взаимного химического осаждения, а также использования полученных материалов для реакции переэтерификации (получения биодизеля).
В настоящий момент известно достаточно много материалов, проявляющих каталитическую активность в реакции переэтерификации. Так, изучено большое количество гомогенных катализаторов, использование которых в промышленности достаточно хорошо отработанно. К таковым относят щёлочи, алкоголяты щелочных металлов и серную кислоту [1, 2]. Однако использование гомогенных катализаторов сопряжено с их однократным использованием, сложностью очистки продуктов реакции, требованиям к коррозионной устойчивости оборудования. В то же время, существует альтернатива вышеперечисленным веществам, которые демонстрируют не худшие каталитические свойства - это гетерогенные катализаторы. Их использование решает проблему очистки стоков, однократность применения и не требует использования коррозионностойкого оборудования. В качестве примера гетерогенного катализатора могут выступить CaO [3], цеолиты [4], оксидные композиты [5], ферриты [6].
Известен ряд патентов, в которых для проведения реакции переэтерификации была использована калиевая щёлочь в растворе метанола (RU 2379332, RU 2393006), помимо этого, описано и использование гидроксида натрия в растворе метанола (RU 2453530). Во всех трёх случаях, катализатор (щёлочь) используется для получения метиловых эфиров карбоновых кислот (биодизеля) посредством реакции переэтерификации.
В патенте (RU 2379332) предложенным методом получения биодизеля является технологическая схема, включающая несколько последовательных стадий (отжим масла культуры Jatropha curcas, нейтрализацию свободных жирных кислот, продувка масла сухим воздухом и т.д.) Для проведения реакции переэтерификации был использован раствор гидроксида калия (1,5-2 экв. метанола и 1,5-2% (мас./мас.) KOH в расчете на нейтрализованное масло). Метод получения калиевой щёлочи при этом не уточняется.
В патенте (RU 2393006) исходными сырьевыми компонентами для получения биодизельного топлива являлись растительное рапсовое масло и метанол, взятые в соотношении 9:1. В качестве катализатора использована калиевая щелочь в объеме 1% от общего количества сырьевых компонентов. Метод получения данного гомогенного катализатора переэтерификации также не уточняется.
В патенте (RU 2453530) авторы указывают, что использования в качестве катализатора переэтерификации гидроксида натрия в расчёте 1 масс. % и мольное соотношение масло : спирт = 1:5 оптимально и при проведении реакции в течение 3-х часов даёт выход сложных эфиров в 95-98% от теории при 95% конверсии исходного масла. При этом, метод получения катализатора не уточняется.
Все три вышеописанные свидетельства схожи в том, что требуют большое количество дополнительных технологических стадий обработки и очистки, которые полностью нивелируют экономический эффект дешевизны используемых катализаторов.
Известен метод (RU 2414299) получения катализатора переэтерификации Zn3M2(CN)n(ROH)⋅xZnCl2⋅yH2O. Методика получения включает следующие стадии: а) растворение ZnCl2 в смеси воды и третичного бутанола, b) добавление указанного раствора, полученного на стадии(а), к водному раствору K4Fe(CN)6 при перемешивании, с) добавление тройного блок-сополимера поли(этиленгликоль)-блок-поли(пропиленгликоль)-блок-поли(этиленгликоль) (EO20-PO70-EO20, молекулярная масса примерно 5800), растворенного в смеси трет-бутанола и воды, к указанной выше смеси, полученной на стадии (b), при перемешивании и при температуре в интервале 25-70°С, d) фильтрование реакционной смеси, полученной на стадии (с) для получения твердого продукта с последующим промыванием дистиллированной водой и сушкой при 20-50°С и е) активация указанного высушенного твердого продукта при температуре в интервале 150-200°С для получения целевого катализатора переэтерификации.
В качестве ближайшего аналога-прототипа выбрано следующее техническое решение - способ получения катализаторов переэтерификации на основе метода совместного химического осаждения (RU 2366503). Метод предусматривает получение катализаторов β-MAl12O19 - со структурой магнетоплюмбита или β-Al2O3, где М - Ва2+ или Sr2+, или La3+, или имеющий структуру шпинели - MR2O4, где М - Са2+ или Sr2+, или Ва2+, в качестве R он содержит Y3+ или La3+, или представляющий собой композицию на основе MgO+R2O3+твердый раствор R2-xMgxO3 с гексагональной структурой, в качестве R он содержит Y3+ или La3+, х=0.05-0.12. Финальное спекание осуществляют при 700-1200°С
Недостатком данного решения является использование дорогостоящих прекурсоров Y3+ и La3+, а также необходимость спекания некоторых образцов при повышенных температурах (до 1200°С), что ограничивает потенциал получения данного типа катализатора.
Задачей настоящего изобретения является получение феррит-цинкового катализатора методами взаимного химического осаждения. Полученный феррит-цинковый катализатор может быть использован как катализатор реакции переэтерификации (реакции получения биодизельного топлива) между триглицеридами карбоновых кислот (жирами и маслами) и спиртом (метанолом) в лабораторных условиях.
Техническим результатом является получение катализатора реакции переэтерификации феррита цинка со структурой шпинели ZnFe2O4 в различном кристаллическом состоянии (кристаллическом или полу-аморфном), синтезированного из коммерчески доступных солей цинка Zn2+ (нитратов, хлоридов) и Fe3+ (нитратов, хлоридов) характеризующегося размером кристаллитов 11-25 нм по результатам рентгеновского фазового анализа (РФА), размером частиц около 30-40 нм по результатам сканирующей электронной микроскопии (СЭМ), средним размером агломератов частиц около 100-120 мкм по результатам метода динамического рассеивания света (ДРС) и выходом метиловых эфиров высших карбоновых кислот в реакции переэтерификации между смесью жидких триглицеридов и метанолом до 97,0%.
Технический результат достигается за счет того, что способ получения феррит-цинкового катализатора методом взаимного химического осаждения для реакции переэтерификации между триглицеридами карбоновых кислот и спиртом при производстве биодизельного топлива, при котором, согласно изобретения, заранее рассчитанные количества солей: хлорид цинка и нитрат железа девятиводный или оксид цинка, растворенный в 65% азотной кислоте, и хлорид железа шестиводный, содержащие ионы Zn2+ и Fe3+ , в соотношении 1 к 2 переводят в раствор и инициируют химическую реакцию взаимного осаждения ионов металлов в виде гидроксидов путем добавления натриевой щелочи при перемешивании со скоростью 300-400 об/мин при комнатной температуре и доведении раствора до pH, равного 11, затем полученную суспензию отделяют центрифугированием не менее четырех раз при скорости 8500…9000 об/мин в течение не менее 3-х минут, полученный осадок промывают дистиллированной водой до pH, равного 7 и выпаривают при постоянном перемешивании, температуре 100°С в течение 2…3 часов. Кроме того, полученный феррит-цинковый катализатор после выпаривания дополнительно спекают в муфельной печи при температуре 400…600°С в течение одного часа.
Способ получения феррита цинка методом взаимного химического осаждения заключается в том, что водорастворимые прекурсоры, содержащие ионы Zn2+ (нитрат, хлорид) и Fe3+ (нитрат, хлорид), смешиваются в отношении 1:2 (в пересчёте на ионы) до полного растворения (в случае получения Zn2+ в растворе, возможно использование оксида цинка ZnO путём растворения последнего в 65% азотной кислоте), далее к полученному раствору по каплям и постоянном перемешивании приливается водный раствор реагента для химического осаждения (раствор натриевой или калиевой щёлочи) в результате чего происходит химическая реакция одновременного образования мелкодисперсных гидроксидов Zn(OH)2 и Fe(OH)3, осаждённых друг на друге согласно уравнению (1).
Для полного протекания реакции обеспечивают некоторый избыток осаждающего реагента. Таким образом, проводят реакцию до конечного pH среды равного 11…11.5. Контроль кислотности среды проводится по универсальной индикаторной бумаге. Полученную суспензию отделяют от маточного раствора центрифугированием и многократно промывают дистиллированной водой для удаления вспомогательных ионов до pH промывных вод равного 7. Водную, водно-спиртовую, или водно-ацетоновую суспензию полученных гидроксидов упаривают при постоянном перемешивании в керамической чашке. После окончания упаривания материал представляет из себя аморфный феррит цинка ZnFe2O4. Путём спекания в течение 1 часа при 400…600°С согласно уравнению 2 в атмосфере воздуха получают материал с большей степенью кристалличности.
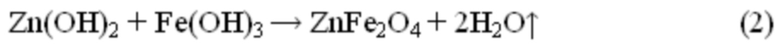
Сущность способа поясняется изображениями на фигурах 1-7, где показано следующее:
фиг. 1 Процесс упаривания суспензии гидроксидов цинка и железа Zn(OH)2 и Fe(OH)3 в керамической чашке;
- фиг. 2 Пример порошковой дифрактограммы для неспечённого и прокалённого при 400, 500 и 600°С феррита цинка ZnFe2O4;
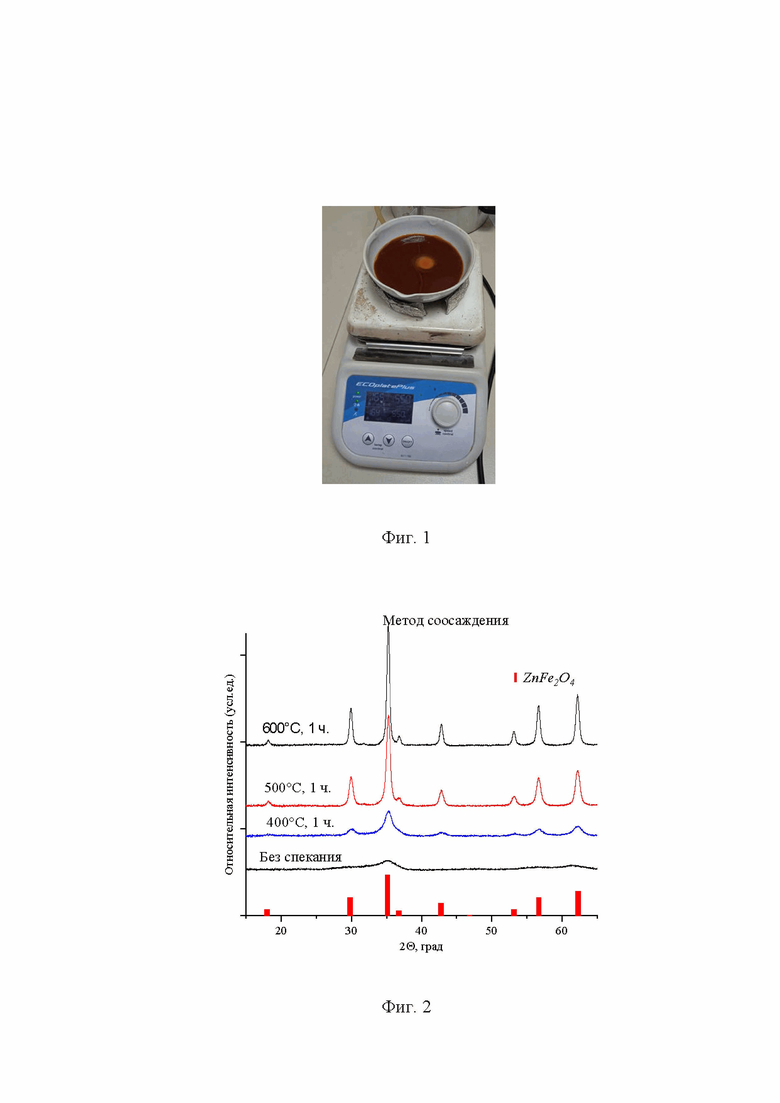
- фиг. 3 Пример электронного изображения, демонстрирующий морфологию и размер частиц полученного феррита цинка ZnFe2O4;
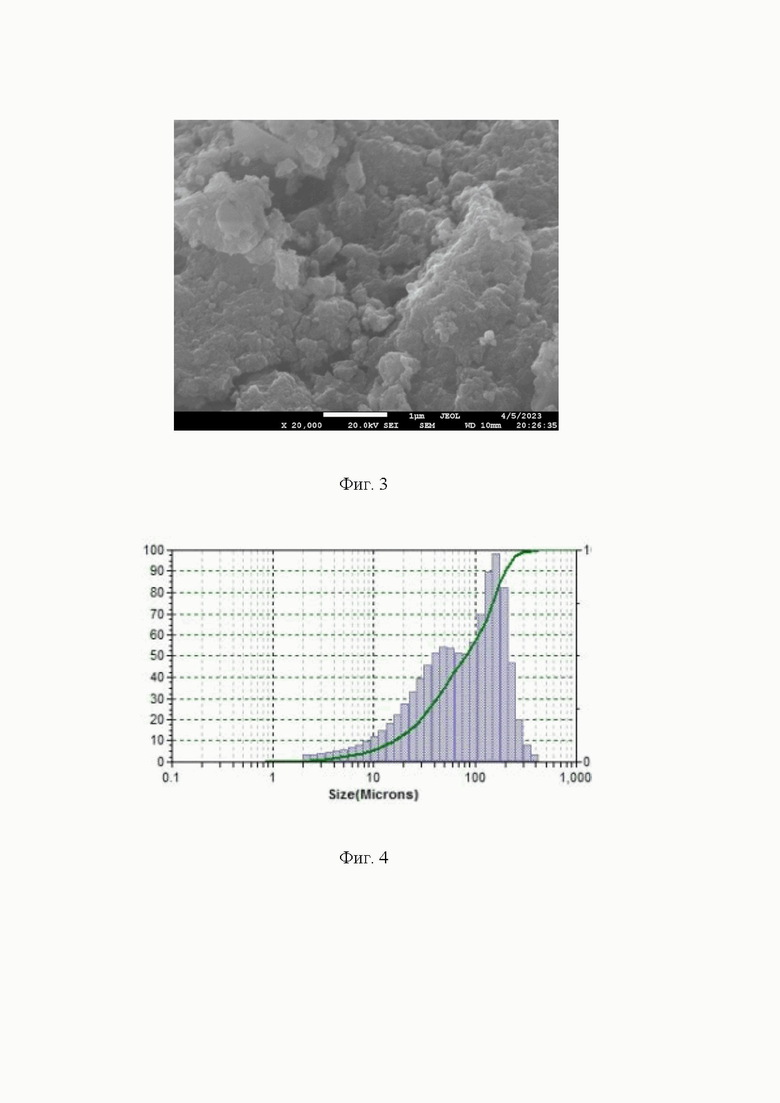
- фиг. 4 Пример гистограммы распределения размера частиц (агломератов) феррита цинка ZnFe2O4 по размеру;
- фиг. 5 Пример каталитического эксперимента с участием растительного масла и метанола (без катализатора);
- фиг. 6 Пример каталитического эксперимента с участием растительного масла, метанола и феррита цинка ZnFe2O4;
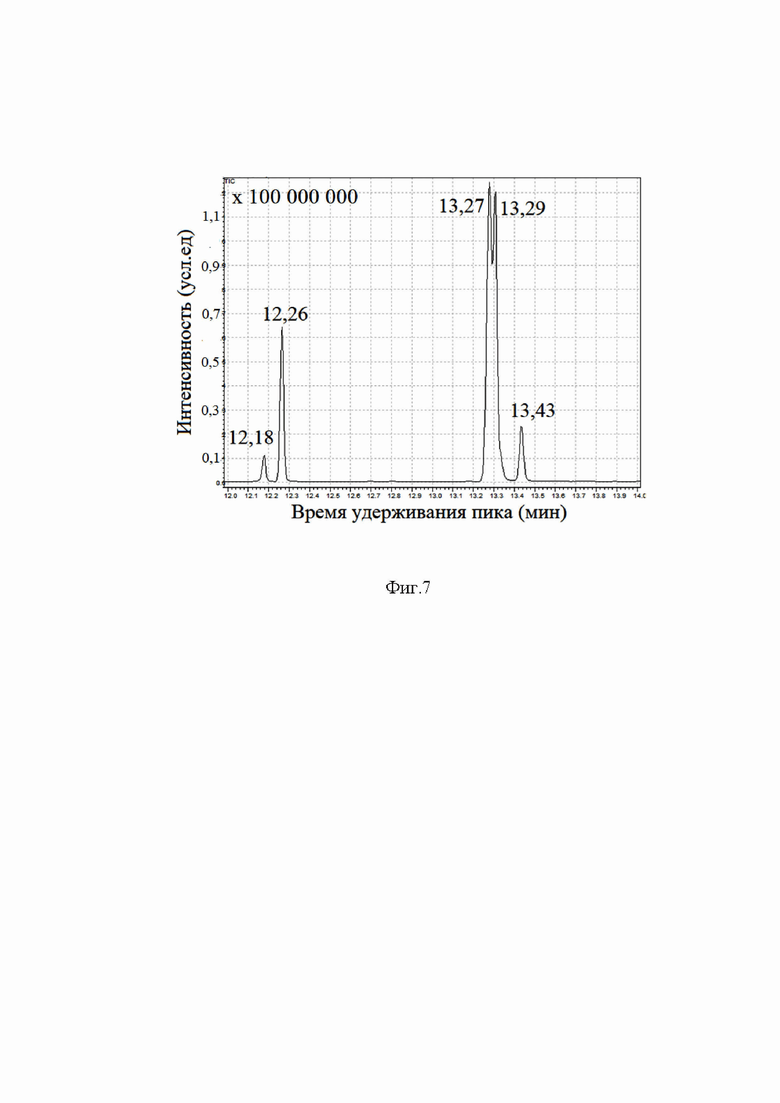
- фиг. 7 Пример хроматограммы анализируемой смеси после реакции подсолнечного масла и метанола в присутствии феррита цинка ZnFe2O4;
Способ осуществляют следующим образом. Берут навески солей, содержащие ионы Zn2+ и Fe3+. Предварительно используемые соли могут быть подвергнуты гравиметрическому анализу. Процесс гравиметрирования сводится к прокаливанию необходимой соли при температуре 1000°C, уточнению массы остатка и путём пересчёта остаточной массы на соотвествующий оксид (ZnO и Fe2O3) корректируется формула гравиметриуемой соли (таким образом, вводится поправка на сорбированную влагу воздуха). Источниками Zn2+ могут выступать ZnCl2, Zn(NO3)2·6H2O, или ZnO, предварительно растворённый в 65% азотной кислоте. Источниками Fe3+ могут выступать FeCl3⋅6H2O, Fe(NO3)3⋅9H2O. В пересчёте на ионы Zn2+ и Fe3+ количество солей берётся в строгом отношении 1 к 2. В качестве осаждающего реагента используют NaOH или KOH. В случае, если используют соли Zn2+ и Fe3+, берётся количество щёлочи несколько больше от теоретического, согласно уравнению 1, общие количество эквивалентов OH- групп в рассматриваемом случае равно 5,5…5,7. Если используется предварительно растворённый в азотной кислоте оксид цинка, количество эквивалентов OH- групп может быть увеличено (то есть увеличена навеска щёлочи), и в таком случае количество эквивалентов гидроксильных групп возрастает до 6,0…11,0.
Навеску необходимых солей прекурсоров полностью растворяют в дистиллированной воде и перемешивают на магнитной мешалке при 300-400 об/мин. Водный раствор солей перемешивают в течение нескольких минут для полной гомогенизации. После этого через капельную воронку со скоростью 0,33-0,5 капля/сек добавляют водный раствор щёлочи. Реакцию проводят при перемешивании 300-400 об/мин и комнатной температуре. После добавления рассчитанного количества щёлочи измеряют кислотность среды полученной суспензии. В случае, если среда раствора pH оказывается меньше, чем 11, добавляют слабо-концентрированный раствор щёлочи небольшими порциями и доводят среду до щелочной (pH = 11) по индикаторной бумаге. Полученную суспензию гидроксидов перемешивают, после чего равными порциями количественно переносят в пробирки для центрифугирования и проводят не менее 4-х циклов центрифугирования с последующей промывкой дистиллированной водой и доведения pH промывных вод до 7. Каждый цикл центрифугирования проводят при 8500…9000 об/мин не менее 3-х минут. Далее смесь гидроксидов количественно переносят из пробирок для центрифугирования в керамическую чашку. Для промывки остатков гидроксидов может использоваться ацетон или этиловый спирт. Смесь упаривают в керамической чашке на открытом «зеркале» плитки или водяной бане в течение 2…3 часов при температуре кипения воды (100°С). Температуру кипения контролируют термометром. После получения сухого остатка, последний перетирают до порошкообразного состояния в агатовой ступке. Полученный материал может быть использован для проведения каталитических реакций.
Применяемые режимы выполнения способа приготовления феррит-цинкового катализатора, а именно: рН растворов, количество циклов центрифугирования, их скорость и время, а также температура и время выпаривания смеси являются наиболее эффективными для осуществления предлагаемого способа, и определены в ходе исследований.
Кроме того, указанный материал может быть дополнительно спечён в муфельной печи в корундовом тигле при 400…600°С в течение 1 часа в воздушной атмосфере. Дополнительный этап спекания применяется для увеличения степени кристалличности полученного катализатора. Увеличение кристалличности в ряде каталитических экспериментов по получению биодизельного топлива приводит к большим выходам по сравнению с неспечённым катализатором. Температурный интервал 400…600°С и выдержка в 1 час были подобраны экспериментально. Установлено, что данный интервал температуры и время выдержки в печи являются оптимальными для получения кристаллической формы феррит-цинкового катализатора. После спекания образец извлекают из печи. Полученный материал - каталитически активный материал, с высокой степенью кристалличности.
Пример 1. Расчёт навесок солей прекурсоров и осаждающего реагента проводят в соответствии с заданными массой готового катализатора в 5 г. по формуле (1 и 2). Для синтеза используют хлорид цинка ZnCl2, нитрат железа девятиводный Fe(NO3)3⋅9H2O и гидроксид натрия NaOH. Хлорид цинка в количестве 1,932 г. и нитрат железа девятиводный в количестве 11,453 г. Растворяли в воде (200 мл.), через капельную воронку к раствору при постоянном перемешивании был прилит раствор щёлочи (50 мл), содержащий 3,00 г гидроксида натрия, при этом рН раствора равен 11. Выпавший осадок перемешивали в течение 5 минут, после чего количественно переносили в пробирки для центрифугирования и подвергали 4-м циклам центрифугирования и промывки от вспомогательных солей путём встряхивания в дистиллированной воде. pH промывных вод после процесса отмывки был равен 7. Осадок из пробирок количественно переносят в керамическую чашку на 150-200 мл и упаривают 2…3 часа до полного испарения жидкости при температуре 100°С (фиг. 1). Полученный образец феррита цинка ZnFe2O4 характеризуется размером кристаллитов около 11 нм (по результатам РФА, фиг. 2), размером частиц около 30 нм (по результатам СЭМ, фиг. 3), средним размером агломератов частиц около 100 мкм (по результатам метода ДРС, фиг. 4). Выход метиловых эфиров высших карбоновых кислот в реакции переэтерификации между смесью жидких триглицеридов и метанолом достигает 92,5…95,5% (фиг. 6 и 7).
Определение размера кристаллитов материала определяли методом порошковой дифрактометрии при помощи многофункционального рентгеновского дифрактометра Rigaku Ultima IV. Размер частиц устанавливали методом электронной сканирующей микроскопии с использованием электронного микроскопа Jeol JSM-7001F. Гистограмма распределения частиц и агломератов частиц по размеру была установлена с использованием метода динамического рассеивания света посредством анализатора размера частиц в суспензии Microtrac S-3500.
Каталитическую активность полученного методом взаимного химического осаждения феррита цинка изучали в соответствии со следующей методикой. В фторопластовый вкладыш (40 мл) помещали подсолнечное масло (2,00 г.), метанол (10 мл.) и полученный катализатор (ZnFe2O4, без спекания, 0,10 г, т.е. 5 масс.% по отношению к маслу). Вкладыш помещали в автоклав и последний плотно герметизировали. В качестве контрольного опыта параллельно проводился аналогичный опыт, но без использования ферритного катализатора. Автоклавы помещали в предварительно разогретый до 160°С сушильный шкаф (важно, чтобы погрешность температуры не превышала 0,1..0,3°С, в противном случае, выходы реакции переэтерификации не воспроизводятся) и выдерживают в течение 12 часов. По истечению отведённого времени автоклавы извлекаются из печи и остужаются на воздухе до комнатной температуры. После реакции во вкладыше без катализатора фиксируется два несмешивающихся между собой слоя (верхний - на основе метанола, нижний - на основе масла, фиг.5), в катализаторе с феррит-цинковых катализатором фиксируется 1 слой (верхний прозрачный слой на основе метанола, и нижний - на основе масла, скрытый под слоем катализатора). Выходы реакции оценивают по количеству остаточно масла. Факт образования метиловых эфиров в реакции переэтерификации при использовании феррит-цинкового катализатора подтверждают методами газовой хроматографии совмещённой с масс-спектрометрией (с использованием аналитический комплекса на базе газового хромато-масс спектрометра Shimadzu GCMS QP2010 Ultra). Объём анализируемой пробы 10 мкл. Программа нагрева хроматографической колонки: 2 минуты при 40°С, далее нагрев от 40°С до 280°С со скоростью 15°/мин, выдержка в течение 25 минут при 280°С. Температура масс-детектора 260°С. Хроматограмма представлена на фиг.7. Каждому из хроматографичеких пиков соответствует метиловый эфир карбоновой кислоты (12,18 мин - метил памитолеиноат, 12,26 мин - метилпальмитат, 13,27 - метил линолеат, 13,29 - метил олеат, 13,43 - метил стеарат). Показано, что полученный методом взаимного химического осаждения без дополнительного спекания феррит-цинка ZnFe2O4 может быть использован в роли катализатора реакции переэтерификации между триглицеридами высших карбоновых кислот и метанолом с получением метиловых эфиров высших карбоновых кислот в качестве основного продукта.
Пример 2. Расчёт навесок солей прекурсоров и осаждающего реагента проводят в соответствии с заданными массой готового катализатора в 5 г. по формуле (1 и 2). Для синтеза используют оксид цинка ZnO, хлорид железа шестиводный FeCl3⋅6H2O и гидроксид натрия NaOH. Оксид цинка в количестве 1,153 г., предварительно растворённый в 3…5 мл 65% азотной кислоте и хлорид железа шестиводный в количестве 7,663 г. растворяли в воде (200 мл.), через капельную воронку к раствору при постоянном перемешивании был прилит раствор щёлочи (50 мл), содержащий 3,70-4,50 г гидроксида натрия. Выпавший осадок перемешивали в течение 5 минут, при этом рН=11, после чего количественно переносили в пробирки для центрифугирования и подвергали 4-м циклам центрифугирования и промывки от вспомогательных солей путём встряхивания в дистиллированной водой, причем pH промывных вод после процесса отмывки был равен 7. Осадок из пробирок количественно переносят в керамическую чашку на 150-200 мл и упаривают 2..3 часа до полного испарения жидкости (фиг.1). Остаток, получившийся после испарения, спекают в корундовом тигли при температуре 400°С при скорости нагрева печи 10°С и изотермической выдержке 1 час. После отведённого времени, образец извлекают из печи и остужают на воздухе. Полученный образец характеризующегося размером кристаллитов около 23 нм (по результатам РФА, фиг.2), размером частиц около 50 нм (по результатам СЭМ), средним размером агломератов частиц около 120 мкм (по результатам метода ДРС). Определение размера кристаллитов, размера частиц, и гистограммы распределения частиц проводились согласно методике, описанной в примере 1. Выход метиловых эфиров высших карбоновых кислот в реакции переэтерификации между смесью жидких триглицеридов и метанолом в данном случае достигает 93…97%. Показано, что полученный методом взаимного химического осаждения и дополнительно спечённый при 400°С в течение 1 часа феррит-цинка ZnFe2O4 может быть использован в роли катализатора реакции переэтерификации между триглицеридами высших карбоновых кислот и метанолом с получением метиловых эфиров высших карбоновых кислот в качестве основного продукта с большим выходом, в сравнении с использованием неспечённого феррита цинка ZnFe2O4.
Таким образом, как показали исследования, (фиг 2,6,7) полученный методом химического осаждения феррит цинка ZnFe2O4 (пример 1,2) является эффективным катализатором и может использоваться для реакции переэтерификации (реакции получения биодизеля).
Список использованной литературы
1. Mandari V., Devarai S.K. Biodiesel Production Using Homogeneous, Heterogeneous, and Enzyme Catalysts via Transesterification and Esterification Reactions: a Critical Review // Bioenergy Res. Springer US, 2022. Vol. 15, № 2. P. 935-961.
2. Bohlouli A., Mahdavian L. Catalysts used in biodiesel production: a review // Biofuels. Taylor & Francis, 2021. Vol. 12, № 8. P. 885-898.
3. Colombo K., Ender L., Barros A.A.C. The study of biodiesel production using CaO as a heterogeneous catalytic reaction // Egypt. J. Pet. 2017. Vol. 26, № 2. P. 341-349.
4. Brito A., Borges M.E., Otero N. Zeolite Y as a heterogeneous catalyst in biodiesel fuel production from used vegetable oil // Energy and Fuels. 2007. Vol. 21, № 6. P. 3280-3283.
5. Zhang P. et al. Magnetic solid base catalyst CaO/CoFe2O4 for biodiesel production: Influence of basicity and wettability of the catalyst in catalytic performance // Appl. Surf. Sci. Elsevier B.V., 2014. Vol. 317. P. 1125-1130.
6. Ali R.M., Elkatory M.R., Hamad H.A. Highly active and stable magnetically recyclable CuFe2O4 as a heterogenous catalyst for efficient conversion of waste frying oil to biodiesel // Fuel. Elsevier, 2020. Vol. 268, № February. P. 117297.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПЕРЕЭТЕРИФИКАЦИИ ЖИРА И/ИЛИ МАСЛА БИОЛОГИЧЕСКОГО ПРОИСХОЖДЕНИЯ ПУТЕМ АЛКОГОЛИЗА | 2000 |
|
RU2263660C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛОВЫХ ЭФИРОВ КАРБОНОВЫХ КИСЛОТ | 2006 |
|
RU2425024C2 |
| Биоцидная добавка из композитных наночастиц и способ ее получения | 2022 |
|
RU2800799C1 |
| КАТАЛИЗАТОР ПЕРЕЭТЕРИФИКАЦИИ И СПОCОБ ЕГО ПРИГОТОВЛЕНИЯ | 2006 |
|
RU2414299C2 |
| КАТАЛИЗАТОР, СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ (ВАРИАНТЫ) И СПОСОБ ПОЛУЧЕНИЯ БИОТОПЛИВА | 2008 |
|
RU2366503C1 |
| СПОСОБ ПОЛУЧЕНИЯ СЛОЖНЫХ ЭФИРОВ ЖИРНЫХ КИСЛОТ И ЭТАНОЛА ИЗ ЖИРОСОДЕРЖАЩИХ ОТХОДОВ | 2019 |
|
RU2720410C1 |
| КОМПЛЕКСНЫЙ СПОСОБ ПРОИЗВОДСТВА МЕТИЛОВОГО ЭФИРА ЯТРОФЫ И СОПУТСТВУЮЩИХ ПРОДУКТОВ | 2010 |
|
RU2528387C2 |
| Способ переработки цинксодержащего гальванического шлама для получения наночастиц оксида цинка | 2022 |
|
RU2799182C1 |
| СПОСОБ ГИДРООБЛАГОРАЖИВАНИЯ ТРИГЛИЦЕРИДОВ ЖИРНЫХ КИСЛОТ В СМЕСИ С НЕФТЯНЫМИ ФРАКЦИЯМИ | 2018 |
|
RU2689416C1 |
| СОРБЕНТ ДЛЯ ИЗВЛЕЧЕНИЯ ИОНОВ ТЯЖЕЛЫХ МЕТАЛЛОВ ИЗ ПИТЬЕВОЙ ВОДЫ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2003 |
|
RU2255801C1 |

Изобретение относится к области каталитической химии. Предложен способ получения феррит-цинкового катализатора методом взаимного химического осаждения для реакции переэтерификации между триглицеридами карбоновых кислот и спиртом при производстве биодизельного топлива, при котором заранее рассчитанные количества солей: хлорид цинка и нитрат железа девятиводный или оксид цинка, растворенный в 65% азотной кислоте, и хлорид железа шестиводный, содержащие ионы Zn2+ и Fe3+ , в соотношении 1 к 2 переводят в раствор и инициируют химическую реакцию взаимного осаждения ионов металлов в виде гидроксидов путем добавления натриевой щелочи при перемешивании со скоростью 300-400 об/мин при комнатной температуре и доведении раствора до pН, равного 11, затем полученную суспензию отделяют центрифугированием не менее четырех раз при скорости 8500-9000 об/мин в течение не менее 3-х минут, полученный осадок промывают дистиллированной водой до pH, равного 7, и выпаривают при постоянном перемешивании, температуре 100°С в течение 2-3 часов. Технический результат - получение катализатора реакции переэтерификации феррита цинка со структурой шпинели ZnFe2O4 в различном кристаллическом состоянии, синтезированного из коммерчески доступных солей цинка Zn2+ и Fe3+. 1 з.п. ф-лы, 7 ил., 2 пр.
1. Способ получения феррит-цинкового катализатора методом взаимного химического осаждения для реакции переэтерификации между триглицеридами карбоновых кислот и спиртом при производстве биодизельного топлива, при котором заранее рассчитанные количества солей: хлорид цинка и нитрат железа девятиводный или оксид цинка, растворенный в 65% азотной кислоте, и хлорид железа шестиводный, содержащие ионы Zn2+ и Fe3+, в соотношении 1 к 2 переводят в раствор и инициируют химическую реакцию взаимного осаждения ионов металлов в виде гидроксидов путем добавления натриевой щелочи при перемешивании со скоростью 300-400 об/мин при комнатной температуре и доведении раствора до pН, равного 11, затем полученную суспензию отделяют центрифугированием не менее четырех раз при скорости 8500-9000 об/мин в течение не менее 3-х минут, полученный осадок промывают дистиллированной водой до pH, равного 7, и выпаривают при постоянном перемешивании, температуре 100°С в течение 2-3 часов.
2. Способ получения феррит-цинкового катализатора по п.1, отличающийся тем, что после выпаривания осадок спекают в муфельной печи при температуре 400-600°С в течение одного часа.
| КАТАЛИЗАТОР, СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ (ВАРИАНТЫ) И СПОСОБ ПОЛУЧЕНИЯ БИОТОПЛИВА | 2008 |
|
RU2366503C1 |
| КАТАЛИЗАТОР ПЕРЕЭТЕРИФИКАЦИИ И СПОCОБ ЕГО ПРИГОТОВЛЕНИЯ | 2006 |
|
RU2414299C2 |
| СПОСОБ ПОЛУЧЕНИЯ СЛОЖНЫХ ЭФИРОВ | 2010 |
|
RU2453530C2 |
| Mandari V., Devarai S.K | |||
| Biodiesel Production Using Homogeneous, Heterogeneous, and Enzyme Catalysts via Transesterification and Esterification Reactions: a Critical Review, Bioenergy Res | |||
| Springer US, 2022 | |||
| Vol | |||
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| p | |||
| Железобетонный фасонный камень, форма для его изготовления и устройство из него стен | 1924 |
|
SU935A1 |
| Bohlouli A., Mahdavian L | |||
Авторы
Даты
2024-02-22—Публикация
2023-06-07—Подача