Область техники
Изобретение относится к области медицины и биотехнологии, а именно к органоидам бронхов и легкого, способам их получения, пассирования, криоконсервации, функционального анализа проводимости CFTR-канала.
Предшествующий уровень техники
Органоиды бронхов (БО) и легкого (ЛО) получают для изучения межклеточных взаимодействий, скрининга лекарственных средств, моделирования заболеваний и применения в регенеративной медицине. БО характеризуются экспрессией маркеров проксимальных эпителиальных клеток легкого (SOX2+, ЕРСАМ+), состоящих из базальных (CK5+, ТР63+), бокаловидных (MUC5AC+) и крупных секреторных клеток (SCGB3A2+), в то время как ЛО, помимо вышеперечисленных маркеров, характеризуются экспрессией маркеров дистальных эпителиальных клеток легкого (SOX9+), включающих в себя альвеолоциты первого (AQP1+, PDPN+, НОРХ+) и второго (SFTPD+, SFTPB+) типа. БО и ЛО могут быть получены из индуцированных плюрипотентных стволовых клеток человека (чИПСК) в несколько этапов дифференцировки, а именно путем последовательной дифференцировки чИПСК в клетки дефинитивной эндодермы (ДЭ), затем дифференцировки в клетки эндодермы передней кишки (ЭПК), дифференцировки в NKX2.1+ легочные прогениторы и, наконец, в БО и ЛО. Известные способы получения БО из чИПСК предполагают последовательное применение коммерческого набора STEMdiff™ Definitive Endoderm Kit, ингибирование путей BMP и TGFb, активацию путей WNT и BMP, клеточную сортировку и ингибирование сигнального пути WNT [1-3].
Известные способы получения ЛО из чИПСК предполагают последовательное применение Активина А, ингибирование путей BMP и TGFb, активацию путей WNT и BMP, клеточную сортировку и активацию сигнального пути WNT [4-5].
За ближайший аналог принят патент "Generation of airway epithelial organoids from human pluripotent stem cells" [пат. 10590392 США], заключающийся в получении БО и ЛО с помощью применения коммерческого набора STEMdiff™ Definitive Endoderm Kit для дифференцировки чИПСК в клетки ДЭ, ингибирования путей BMP и TGFb для получения клеток ЭПК, активации путей WNT и BMP для получения NKX2.1+ легочных прогениторов, с последующей клеточной сортировкой для обогащения популяции NKX2.1+ легочных прогениторов и получением БО и ЛО из отсортированных клеток путем ингибирования или активации сигнального пути WNT, соответственно.
Недостатком данного метода является применение коммерческого набора для дифференцировки чИПСК в клетки ДЭ, в то время как можно применять менее дорогостоящие реактивы согласно ранее опубликованным способам [4-6]. Также в ходе клеточной сортировки NKX2.1+ легочных прогениторов, которая проводится для увеличения популяции NKX2.1+ клеток, происходят потери клеток и снижение их жизнеспособности. Данный этап можно убрать без снижения эффективности получения бронхиальных органоидов, тем самым оптимизировав протокол получения.
Известные способы пассирования БО предполагают пассирование с применением ферментативной диссоциации внеклеточного матрикса и органоидов [1]. Известные способы пассирования ЛО предполагают механическое пассирование с применением шприца с иглой [5] или без его применения. Предлагается способ механического пассирования без шприца с иглой применить к БО.
Известные способы криоконсервации БО предполагают диссоциацию органоидов и криоконсервацию отдельных клеток [пат. 10590392 США]. Способов для криоконсервации легочных органоидов не выявлено. Предлагаемый метод позволяет применять для ЛО криоконсервацию целых органоидов, без их разрушения.
Известные способы проведения форсколин-индуцированного набухания органоидов предполагают проведение анализа на БО [пат. 10590392 США], [3]. Форсколин увеличивает внутриклеточный цАМФ и активирует CFTR-канал, что позволяет исследовать функцию CFTR-канала в органоидах, полученных из чИПСК. Эта система облегчает моделирование заболеваний и скрининг лекарственных средств для лечения различных генетических заболеваний, поражающих эпителий дыхательных путей, например, муковисцидоза. Нами впервые показано, что ЛО, полученные из чИПСК здорового донора (wt/wt), набухают в ответ на форсколин, в то время как ЛО, полученные из чИПСК донора с гомозиготной мутацией CFTR p.F508del (p.F508del/p.F508del), не набухают в ответ на форсколин. Соответственно, БО и ЛО, полученные от пациентов с гомозиготной мутацией p.F508del, можно использовать для оценки функционального восстановления CFTR-канала в ответ на использование лекарственных средств и методик коррекции мутации.
С помощью БО и ЛО можно моделировать заболевания легких, что облегчает персонифицированное лечение моногенных заболеваний дыхательных путей, таких как муковисцидоз. Учитывая высокий уровень интереса к моделям для изучения заболеваний дыхательных путей, способность воспроизводимо получать клинически релевантные типы эпителиальных клеток дыхательных путей из клеток, полученных от пациентов, важна для облегчения клинического применения, включающего моделирование заболеваний дыхательных путей, тестирование новых терапевтических соединений и потенциальную клеточную терапию. В некоторых вариантах осуществления описанная здесь технология позволяет создавать эпителиальные клетки дыхательных путей для использования компаниями и исследовательскими группами, а также для клинического применения и/или в подходах клеточной терапии для получения клинически релевантных эпителиальных клеток дыхательных путей. В некоторых вариантах осуществления способы, раскрытые в данном документе, можно использовать в анализах, например, для поиска соединений для лечения муковисцидоза.
Раскрытие сущности изобретения
Задачей, на решение которой направлено заявленное изобретение, является создание способа получения, пассирования, криоконсервации, функционального анализа проводимости CFTR-канала органоидов бронхов и легкого.
Технический результат, достигаемый при решении поставленной задачи, выражается в: способах получения бронхиальных органоидов; способе получения легочных органоидов; способе пассирования бронхиальных органоидов; способе криоконсервации легочных органоидов; способе проведения форсколин-индуцированного набухания.
Способ получения БО и ЛО из чИПСК, включающему четыре основных этапа.
Первый этап представляет собой получение клеток дефинитивной эндодермы (ДЭ). Существует несколько способов получения клеток ДЭ из чИПСК.
Способ 1 включает в себя культивирование чИПСК, предварительно культивируемых на среде mTESR1, в контакте с внеклеточным матриксом в течение 20-24 ч в присутствии культуральной Среды 1, к которой добавлены рекомбинантный человеческий Активин А и CHIR99021. Затем происходит культивирование с внеклеточным матриксом в течение 48 ч в присутствии культуральной Среды 1, к которой добавлен человеческий Активин А.
Способ 2 включает в себя культивирование чИПСК, предварительно культивируемых на среде mTESR1, в контакте с внеклеточным матриксом в течение 70-72 ч в присутствии среды из коммерческого набора STEMdiff™ Definitive Endoderm Kit (STEMCELL Technologies, Канада).
Клетки ДЭ, полученные этими двумя способами, экспрессируют маркеры ДЭ, а именно/в том числе CD117 и CXCR4 (фиг. 2).
Второй этап представляет собой получение клеток эндодермы передней кишки (ЭПК). Способ получения клеток ЭПК включает в себя: пассирование клеток ДЭ в соотношении 1:2-1:6, при этом клетки ДЭ, полученные Способом 1, предпочтительно пассировать в соотношении 1:3 - 1:4, а клетки ДЭ, полученные Способом 2, предпочтительно пассировать в соотношении 1:4 - 1:5; культивирование клеток ДЭ в контакте с внеклеточным матриксом в течение 72 ч в присутствии культуральной Среды 2, к которой добавлены SB431542 и дорсоморфин. В качестве альтернативы, в другом варианте осуществления изобретения в указанном способе отсутствует пассирование клеток ДЭ, а пассирование клеток ЭПК осуществляют через 72 ч после начала дифференцировки клеток ДЭ в клетки ЭПК.
Третий этап представляет собой получение легочных прогениторов NKX2.1+. Способ получения легочных прогениторов NKX2.1+ из клеток ЭПК включает в себя культивирование клеток ЭПК в контакте с внеклеточным матриксом в течение 8-10 суток в присутствии культуральной Среды 2, к которой добавлены CHIR99021, ВМР4 и ретиноевая кислота.
Четвертый этап представляет собой получение БО и ЛО. Способ получения БО из легочных прогениторов NKX2.1+, выделенных методом клеточной сортировки по наличию маркера CD47 и отсутствию маркера CD26, включает в себя культивирование легочных прогениторов NKX2.1+ CD47+/CD26- в трехмерной структуре внеклеточного матрикса в течение 7 суток и более в присутствии культуральной Среды 2, к которой добавлены FGF2, FGF10, дексаметазон, 3-изобутил-1-метилксантин и 8-бром-цАМФ. Способ получения ЛО из клеток, полученных на этапе 3, включает в себя культивирование клеток в трехмерной структуре внеклеточного матрикса в течение 7 суток и более в присутствии культуральной Среды 2, к которой добавлены F.GF7, FGF10, EGF и CH1R99021.
В другом варианте способ получения БО включает в себя: культивирование легочных прогениторов, полученных на этапе 3, в трехмерной структуре внеклеточного матрикса в течение 7 суток и более в присутствии культуральной Среды 2, к которой добавлены FGF2, FGF10, дексаметазон, 3-изобутил-1-метилксантин и 8-бром-цАМФ. Таким образом продемонстрирована возможность получения БО в отсутствие клеточной сортировки клеток, полученных на 3 этапе, на наличие CD47 и отсутствие CD26.
Для достижения задачи разработки метода пассирования БО предложен способ, включающий в себя: механическое пассирование БО. Способ включает в себя механическое удаление трехмерного внеклеточного матрикса, содержащего БО, центрифугирование и культивирование клеток в трехмерной структуре свежего внеклеточного матрикса. Данный способ позволяет пассировать БО без ферментативной обработки. Способ применим для изменения количества органоидов в капле, изменения объема капли или смены культуральной посуды.
Для достижения задачи разработки метода криоконсервации БО и ЛО с возможностью последующего размораживания предложен способ, включающий с себя криоконсервацию БО или ЛО в среде для криоконсервации. Способ заключается в механическом удалении трехмерного внеклеточного матрикса, содержащего БО или ЛО, центрифугирование и ресуспендирование в среде для криоконсервации.
Для достижения задачи получения метода проведения форсколин-индуцированного набухания ЛО для оценки функциональности CFTR-канала предлагается способ, включающий в себя анализ набухания ЛО в ответ на воздействие форсколина. Способ заключается в себя инкубацию ЛО с раствором кальцеина и форсколина с последующей микроскопией во временные точки 0 и 24 ч от начала инкубации с форсколином, что демонстрирует возможность проведения функциональной оценки CFTR-канала с помощью форсколин-индуцированного набухания на ЛО. В качестве контрольной группы применяли БО, проведение форсколин-индуцированного набухания на которых ранее опубликовано.
Осуществление изобретения
ПРИМЕР 1. Получение бронхиальных и легочных органоидов из чИПСК
1. Подготовительный этап.
чИПСК предварительно культивировали в 6-луночном планшете (кат. номер 3506, Costar), покрытом рекомбинантным витронектином человека (VTN-N) (кат. номер А14700, Thermo Fisher Scientific), в среде mTESR1 (кат. номер 85850, STEMCELL Technologies) в течение 14 и более суток.
В день начала дифференцировки конфлюэнтность чИПСК должна составлять: а) при способе №1 получения клеток ДЭ - 50-70%; б) при способе №2 получения клеток ДЭ - 70-90%.
2. Получение клеток дефинитивной эндодермы.
2а. Получение клеток ДЭ по Способу 1. Для этого производили смену культуральной среды в планшете с чИПСК на Среду 1 (96% RPMI-1640 (кат. номер С330п, ПанЭко), 2% В-27 (кат. номер 17504044, Thermo Fisher Scientific), 100Х GlutaMAX (кат. номер 35050061, Thermo Fisher Scientific) и пенициллин-стрептомицин (кат. номер А063, ПанЭко)) с добавлением 5 мкМ CHIR99021 (кат. номер 4423, Tocris Bioscience) и 100 нг/мл рекомбинантного человеческого активина А (кат. номер 338-АС-010, R&D Systems). Не позднее чем через 24 ч проводили смену среды на Среду 1 с добавлением 100 нг/мл рекомбинантного человеческого активина А. Оценку эффективности образования клеток ДЭ проводили через 70-72 ч от начала дифференцировки (фиг. 1).
2б. Получение клеток ДЭ по Способу 2. Для этого производили смену культуральной среды в планшете с чИПСК на среду коммерческого набора STEMdiff™ Definitive Endoderm Kit (кат. номер 05110, STEMCELL Technologies) по протоколу производителя. Оценку эффективности образования клеток ДЭ проводили через 70-72 ч от начала дифференцировки (фиг. 1).
На данном этапе проводили оценку эффективности образования клеток ДЭ. Оценку эффективности проводили методом измерения уровня экспрессии маркеров CD117 (c-Kit) (кат. номер 11-1178-41, Thermo Fisher Scientific) и CD184 (CXCR4) (кат. номер 12-9999-41, Thermo Fisher Scientific) клетками ДЭ на проточном цитофлуориметре. Для этого лунки с клетками ДЭ трижды промывали раствором DPBS без Са2+ и Mg2+, вносили 1 мл раствора Версена и инкубировали 3 мин при комнатной температуре (25°С). Затем удаляли раствор Версена, вносили 1 мл раствора DPBS без Са2+ и Mg2+ и ресуспендировали клетки до состояния одноклеточной суспензии, после чего центрифугировали при 150g в течение 5 мин и ресуспендировали осадок в 3 мл FACS-буфера (DPBS без Са2+ и Mg2+ с добавлением 1% бычьей фетальной сыворотки (кат. номер 16141079, Thermo Fisher Scientific)). Проводили подсчет клеток на автоматическом счетчике клеток Countess Н (Thermo Fisher Scientific). Переносили по 0,5×106 клеток в 5 пробирок объемом 1,5 мл и центрифугировали при 150g в течение 5 мин. Затем осадки ресуспендировали в 100 мкл FACS-буфера и вносили антитела в соответствии со следующими группами: пробирки №№1, 2 - ничего, пробирка №3-5 мкл антитела против CD117 (c-Kit)), пробирка №4-5 мкл антитела против CD184 (CXCR4), пробирка №5 - оба антитела. Клетки с антителами инкубировали 30 мин на льду в темноте, после чего вносили по 1 мл FACS-буфера в каждую пробирку, центрифугировали при 150g в течение 5 мин и осадки ресуспендировали в 500 мкл FACS-буфера. В пробирки №№2-5 добавляли кальцеин синий (кат. номер С1429, Thermo Fisher Scientific) в финальной концентрации 2 мкМ. Окрашивание оценивали на проточном цитофлуориметре CytoFLEX S (Beckman Coulter). Для этого настраивали прибор на неокрашенных и контрольных клетках: проводили гейтирование по размеру клеток (FSC-A против SSC-A), затем отделяли синглеты (FSC-A против FSC-H), гейтировали по уровням флуоресценции (FL против Count), выделяли популяцию, окрашенную положительно на кальцеин синий, и оценивали уровень экспрессии CD117 и CXCR4 (фиг. 1). Перед оценкой экспрессии маркеров клетки пропускали через фильтр с размером пор 50 мкм (кат. номер 04-0042-2317, Partec); до момента оценки клеток на проточном цитофлуориметре суспензию клеток хранили на +4°С в темноте.
Таким образом, два способа получения клеток ДЭ статистически не отличаются по проценту клеток, экспрессирующих CD117 (c-Kit) и CD184 (CXCR4) (фиг. 2). Процент клеток, экспрессирующих маркеры CD117 (c-Kit) и CD184 (CXCR4), полученных по способам №1 и №2, в среднем составлял 34,7±1,5% и 40,8±7,5%, соответственно.
3. Получение клеток ЭПК. Для этого производили пассирование клеток ДЭ через 70-72 ч от начала дифференцировки. А именно, лунку(и) с клетками ДЭ трижды промывали раствором DPBS без Са2+ и Mg2+, вносили 1 мл раствора Версена и инкубировали 3 мин при комнатной температуре (25°С). Затем удаляли раствор Версена, вносили 1 мл Среды 2 (75% IMDM (кат. номер 21980032, Thermo Fisher Scientific), 25% F12(Ham) (кат. номер 11765054, Thermo Fisher Scientific), 100X B-27 (кат. номер 17504044, Thermo Fisher Scientific), 200X N2 (кат. номер 17502048, Thermo Fisher Scientific), 0,05% бычьего сывороточного альбумина (BSA) (кат. номер А8412-100ML, Sigma Aldrich), 0,45 мМ тиоглицерола (кат. номер M6145-25ML, Sigma Aldrich), 100Х GlutaMAX (кат. номер 35050061, Thermo Fisher Scientinc), 0,05 мг/мл L-аскорбиновой кислоты (кат. номер A4544-25G, Sigma Aldrich) и 100 мкг/мл примоцина (кат. номер ant-pm-2, InvivoGen)) с добавлением 10 мкМ SB431542 (кат. номер 1614, Tocris), 2 мкМ дорсоморфина (кат. номер 3093, Tocris) и 10 мкМ Y-27632 (кат. номер 72302, STEMCELL Technologies) и ресуспендировали клетки до состояния одноклеточной суспензии. После этого переносили суспензию клеток в 6-луночный планшет (кат. номер 3506, Costar), предварительно покрытый раствором VTN-N в DPBS без Са2+ и Mg2+ (финальная концентрация = 5 мкг/мл), в соотношении 1:3 - 1:4 для клеток ДЭ, полученных по Способу 1, и в соотношении 1:4 - 1:5 для клеток ДЭ, полученных по Способу 2. Через 24 ч проводили смену культуральной среды на аналогичную среду без добавления Y-27632. Дифференцировку в клетки ЭПК проводили в течение 72 ч, смену среды производили каждый день.
4. Получение NKX2.1+ легочных прогениторов. Для этого клетки ЭПК культивировали в Среде 2 с добавлением 3 мкМ CH1R99021 (кат. номер 4423, Tocris Bioscience), 10 нг/мл ВМР4 (кат. номер 314-ВР-050, R&D Systems) и 100 нМ ретиноевой кислоты (кат. номер R2625-50MG, Sigma Aldrich). Смену среды проводили через день в течение последующих 8-10 дней, ретиноевую кислоту вносили в среду непосредственно перед сменой среды.
Проводили оценку эффективности дифференцировки клеток ЭПК в NKX2.1+ легочные прогениторы, измеряя экспрессию маркера TTF-1 методом проточной цитофлуориметрии. Для этого на 8 день после начала дифференцировки клеток ЭПК в NKX2.1+ легочные прогениторы клетки трижды промывали раствором DPBS без Са2+ и Mg2+, вносили 1 мл раствора 0,05% трипсин-ЭДТА (кат. номер П043п, ПанЭко) в DPBS без Са2+ и Mg2+. Клетки инкубировали 10-12 мин при 37°С, затем добавляли 1 мл 10% раствора бычьей фетальной сыворотки в DMEM, ресуспендировали клетки, а затем пропускали клеточную суспензию через фильтр 50 мкм для удаления крупных клеточных конгломератов. Клетки центрифугировали при 150g в течение 5 мин, осадок ресуспендировали в 1 мл охлажденного 4% раствора формалина (кат. номер 4979.1, Carl Roth) в DPBS без Са2+ и Mg2+ и инкубировали 15 мин при комнатной температуре (25°С). Затем добавляли 5 мл раствора DPBS без Са2+ и Mg2+ и центрифугировали при 150g в течение 5 мин. Осадок ресуспендировали в 1 мл раствора 0,1% Triton Х100 (кат. номер Am-0694-0.1, VWR (Amresco)) в DPBS без Са2+ и Mg2+ и инкубировали 10 мин при комнатной температуре (25°С). Затем добавляли 5 мл раствора DPBS без Са2+ и Mg2+ и центрифугировали при 150g в течение 5 мин. Осадок ресуспендировали в 1 мл 1% раствора BSA (кат. номер В9000 S, New England Biolabs Inc.) в DPBS без Ca2+ и Mg2+ и инкубировали 10 мин при комнатной температуре (25°С). Затем добавляли 5 мл раствора DPBS без Са2+ и Mg2+ и центрифугировали при 150g в течение 5 мин. Осадок ресуспендировали в 1 мл 1% раствора BSA в DPBS без Са2+ и Mg2+, проводили подсчет клеток на автоматическом счетчике клеток Countess II (кат. номер AMQAF1000, ThermoFisher), переносили по 0,5×106 клеток в 2 пробирки объемом 1,5 мл и центрифугировали при 150g в течение 5 мин. Осадки ресуспендировали в 100 мкл 1% раствора BSA в DPBS без Са2+ и Mg2+ и вносили первичное антитело в соответствии со следующими группами: пробирка №1 - ничего, пробирка №2 - 1 мкл антитела против TTF-1 (кат. номер 180221, Thermo Fisher Scientific). Клетки с антителом и без него инкубировали 40 мин при комнатной температуре (25°С), после чего вносили по 1 мл FACS-буфера в каждую пробирку, центрифугировали при 150g в течение 5 мин, осадки ресуспендировали в 100 мкл 1% раствора BSA в DPBS без Са2+ и Mg2+ и вносили вторичное антитело в соответствии со следующими группами: пробирка №1 - ничего, пробирка №2 - 1 мкл антитела Alexa Fluor 488 (кат. номер А-11029, Thermo Fisher Scientific). Клетки с антителом и без него инкубировали 30 мин при комнатной температуре (25°С), после чего вносили по 1 мл FACS-буфера в каждую пробирку, центрифугировали при 150g в течение 5 мин, осадки ресуспендировали в 500 мкл раствора DPBS без Са2+ и Mg2+. Окрашивание оценивали на проточном цитофлуориметре CytoFLEX S (Beckman Coulter). Для этого настраивали прибор на неокрашенных и контрольных клетках: проводили гейтирование по размеру клеток (FSC-A против SSC-A), затем отделяли синглеты (FSC-A против FSC-H) и гейтировали по уровню флуоресценции (FL против Count), после чего оценивали уровень экспрессии TTF-1. Перед оценкой экспрессии маркеров клетки пропускали через фильтр с размером пор 50 мкм; до момента оценки клеток на проточном цитофлуориметре суспензию клеток хранили на +4°С в темноте.
Средний процент клеток, окрашенных на TTF-1, составлял 6,9±4,2% (n=11).
По завершении дифференцировки в NKX2.1+ легочные прогениторы можно проводить криоконсервацию клеток для последующей разморозки и получения органоидов. Для этого NKX2.1+ легочные прогениторы трижды промывали раствором DPBS без Са2+ и Mg2+, вносили раствора Версена, инкубировали 3 мин при комнатной температуре (25°С), после чего удаляли раствор Версена, снимали клетки с пластика средой для криоконсервации и переносили в криопробирки (кат. номер 430488, Corning-Costar). Криопробирки помещали в штатив CoolCell LX (кат. номер BCS-405G, BioCision) и переносили в низкотемпературный морозильник с температурой -80°С на 1 сутки, а затем переносили в криохранил ище с жидким азотом для длительного хранения.
Среда для криоконсервации, которую используют в способе по изобретению, включает в себя: либо коммерческую среду PSC Cryopreservation Kit (кат. номер А2644601, Thermo Fisher Scientific), либо бычью фетальную сыворотку или Среду 2 с добавлением 10% диметилсульфоксида (кат. номер D2438, Merck) и 10 мкМ Y-27632.
5. Получение бронхиальных и легочных органоидов.
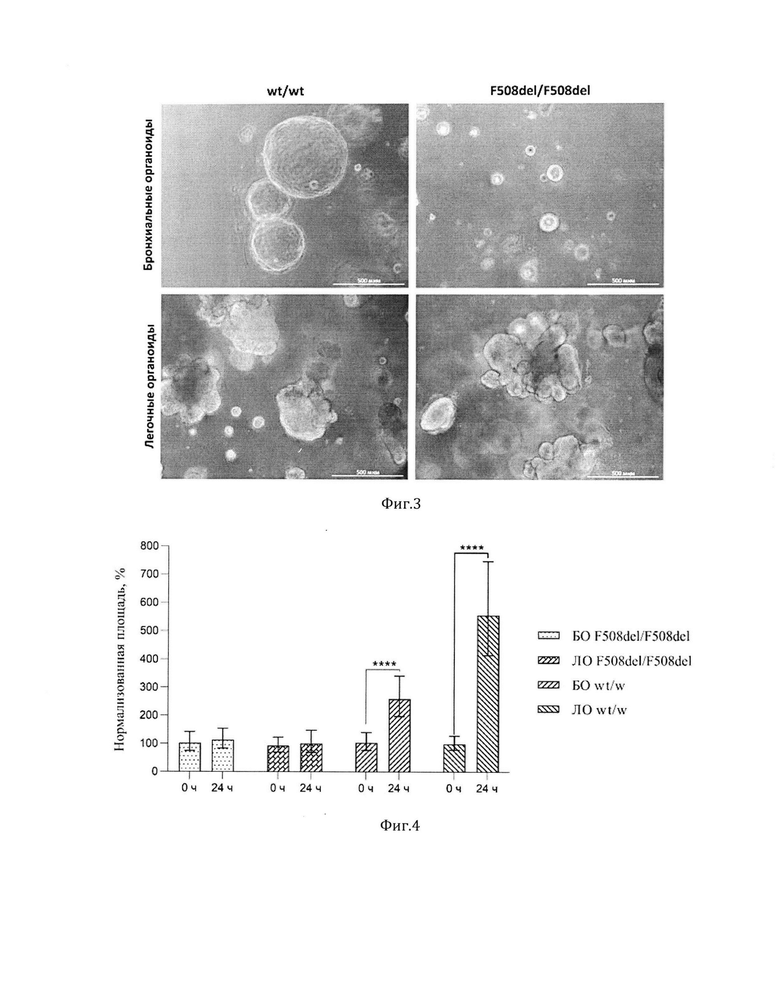
5а. Получение бронхиальных и легочных органоидов в отсутствие клеточной сортировки, проводимой по наличию CD47 и отсутствию CD26, полученных на предыдущем этапе. Для этого клетки, полученные на 8-10 дни дифференцировки ЭПК в NKX2.1+ легочные прогениторы, трижды промывали раствором DPBS без Са2+ и Mg2+, вносили 1 мл 0,05% раствора трипсин-ЭДТА в DPBS без Са2+ и Mg2+ и инкубировали 10-12 мин при 37°С, после чего удаляли раствор трипсин-ЭДТА, вносили 1 мл раствора DPBS без Са2+ и Mg2+ и ресуспендировали клетки. Затем клеточную суспензию пропускали через фильтр с размером пор 50 мкм для удаления крупных клеточных конгломератов и проводили подсчет клеток на автоматическом счетчике клеток Countess II. Суспензию центрифугировали при 150g в течение 5 мин. Осадок ресуспендировали в неразведенном холодном внеклеточном матриксе Matrigel (кат. номер 356234, BD Biosciences) в концентрации 400-1000 клеток в 1 мкл и переносили по каплям объемом 3-50 мкл в лунки 24-луночного планшета (кат. номер 3526, Corning). Давали каплям застыть в течение 10-60 мин, в зависимости от размера капли, в инкубаторе, после чего вносили Среду 2 с добавлением 250 нг/мл FGF2 (кат. номер 233-FB, R&D Systems), 100 нг/мл FGF10 (кат. номер 345-FG, R&D Systems), 50 нм дексаметазона (D4902, Sigma Aldrich), 0,1 мМ 8-бром-цАМФ (кат. номер 15879, Sigma Aldrich), 0,1 мМ 3-изобутил-1-метилксантина (кат. номер В5386, Sigma Aldrich) и Y-27632 для формирования бронхиальных органоидов или Среду 2 с добавлением 10 нг/мл FGF7 (кат. номер 251-KG, R&D Systems), 10 нг/мл FGF10, 10 нг/мл EGF (кат. номер 2028-EG, R&D Systems), 3 мкМ CHIR99021 и Y-27632 для формирования легочных органоидов. Через 24 ч проводили смену культуральных сред на соответствующие среды без Y-27632. Формирование органоидов наблюдали на 1-2 сутки (фиг. 3).
Суспензии клеток во внеклеточном матриксе можно также высевать на 6-, 12-, 48- и 96-луночные планшеты.
5б. Получение бронхиальных органоидов из легочных прогениторов NKX2.1+, выделенных методом клеточной сортировки по наличию маркера CD47 и отсутствию маркера CD26. Для этого клетки, полученные на 8-10 дни дифференцировки ЭПК в NKX2.1+ легочные прогениторы, трижды промывали раствором DPBS без Са2+ и Mg2+, вносили 1 мл раствора 0,05% раствора 0,25% трипсин-ЭДТА в DPBS без Са2+ и Mg2+ и инкубировали 10-12 мин при 37°С, затем удаляли раствор трипсин-ЭДТА, вносили 1 мл раствора DPBS без Са2+ и Mg2+ и ресуспендировали клетки. Затем клеточную суспензию пропускали через фильтр с размером пор 50 мкм для удаления крупных клеточных конгломератов и центрифугировали при 150g в течение 5 мин. Осадок ресуспендировали в 3 мл FACS-буфера и проводили подсчет клеток на автоматическом счетчике клеток Countess II. Переносили по 0,5×106 клеток в пробирки №№1-3 объемом 1,5 мл и 4×106 клеточной суспензии в пробирку №4. Центрифугировали при 150g в течение 5 мин. Осадки ресуспендировали в 100 мкл FACS-буфера и вносили антитела в соответствии со следующими группами: пробирка №1 - ничего, пробирка №2-5 мкл антитела против CD47 (кат. номер 11-0479-42, Thermo Fisher Scientific), пробирка №3-5 мкл антитела против CD26 (кат. номер 302706, Thermo Fisher Scientific), пробирка №4 - оба антитела. Клетки инкубировали 30 мин на льду в темноте, после чего вносили по 1 мл FACS-буфера в каждую пробирку и центрифугировали при 150g в течение 5 мин. Осадок ресуспендировали в 500 мкл FACS-буфера с добавлением 2 мкМ Y-27632. Проводили сортировку клеток на приборе S3e Cell Sorters (Bio-Rad). Перед проведением клеточной сортировки клетки пропускали через фильтр с размером пор 50 мкм. Настраивали прибор на неокрашенных и контрольных клетках: проводили гейтирование по размеру клеток (FSC-A против SSC-A), затем отделяли синглеты (FSC-A против FSC-H) и гейтировали по уровням флуоресценции (FL против Count). Проводили сортировку популяции, экспрессирующей высокий уровень CD47 и низкий уровень CD26, в режиме «Enrich». В пробирку для отсортированных клеток вносили 300 мкл среды с добавлением 1 мкМ Y-27632. Окрашенные клетки до момента сортировки хранили при +4°С в темноте. Средний процент отсортированных клеток составлял 10,9±7,2% (n=18).
Суспензии отсортированных клеток центрифугировали при 150g в течение 5 мин. Осадок ресуспендировали в не разведенном холодном Matrigel в концентрации 400-1000 клеток в 1 мкл и переносили по каплям объемом 3-50 мкл в лунки 24-луночного планшета. Давали каплям застыть в течение 10-60 минут, в зависимости от размера капли, в инкубаторе, после чего вносили Среду 2 с добавлением 250 нг/мл FGF2, 100 нг/мл FGF10, 50 нМ дексаметазона, 0,1 мМ 8-бром-цАМФ, 0,1 мМ 3-изобутил-1-метилксантина и 1 мкМ Y-27632, для формирования бронхиальных органоидов. Через 24 ч проводили смену среды на среду без Y-27632. Формирование органоидов наблюдали на 5 сутки (фиг. 3).
Полученные БО и ЛО окрашивали на маркеры прогениторных клеток проксимального (SOX2, ЕрСАМ) и дистального (только для ЛО) отделов легкого (SOX9), базальных (ТР63, СК5), крупных секреторных (SCGB3A2) и бокаловидных клеток (MUC5AC) по протоколу из статьи Dekkers). F. et al. (2019) [Dekkers J.F. et al. (2019) High-resolution 3D imaging of fixed and cleared organoids. Nature protocols. 14(6), 1756-1771.]
Описание получения, характеризации и культивирования чИПСК, применяемых для получения бронхиальных и легочных органоидов, представлены в статьях [7-8]. ПРИМЕР 2. Пассирование бронхиальных органоидов
1. Из лунки с органоидами отбирали среду и переносили в пробирку на 1,5 мл.
2. Наконечник пипетки смачивали в FACS-буфере, для того чтобы избежать налипания органоидов на наконечник.
3. Механически, с помощью наконечника на пипетки, смещали трехмерный внеклеточный матрикс с органоидами в лунке, после чего вносили часть среды из пробирки обратно в лунку.
4. Отбирали среду с трехмерным внеклеточным матриксом и органоидами из лунки и переносили в пробирку на 1,5 мл.
5. Через шприц с иглой 27-31g пропускали 1-2 раза FACS-буфер, во избежание налипания органоидов.
6. Центрифугировали 5 секунд при 6300g.
7. Осадок ресуспендировали в неразведенном холодном Matrigel, с предварительно смоченным наконечником пипетки в FACS-буфере, и переносили по каплям объемом 3-50 мкл в лунки планшета.
8. Давали каплям застыть в течение 10-60 мин, в зависимости от размера капли, в инкубаторе.
9. Вносили Среду 2 с добавками в зависимости от типа органоидов.
Пассирование органоидов осуществляли раз в 1-2 недели или по мере разрастания и/или "старения" органоидов. В данном протоколе 5 и 6 этапы можно пропустить. ПРИМЕР 3. Криоконсервация бронхиальных и легочных органоидов
1. Из лунки с органоидами отбирали среду и переносили в пробирку на 1,5 мл.
2. Наконечник пипетки смачивали в FACS-буфере, во избежание налипания органоидов на наконечник.
3. Механически, с помощью наконечника на пипетки, смещали трехмерный внеклеточный матрикс с органоидами в лунке, после чего вносили часть среды из пробирки обратно в лунку.
4. Отбирали среду с трехмерным внеклеточным матриксом и органоидами из лунки и переносили в пробирку на 1,5 мл.
5. Центрифугировали 5 секунд при 6300g.
6. Осадок ресуспендировали в среде для криоконсервации предварительно смоченным наконечником пипетки в FACS-буфере, и переносили в криопробирки (кат. номер 430488, Corning-Costar).
Среда для криоконсервации, которую используют в способе по изобретению, включает в себя либо PSC Cryopreservation Kit, либо бычью фетальную сыворотку или Среду 2 с добавками в зависимости от типа органоидов, с добавлением 10% диметилсульфоксида и 1 мкМ Y-27632.
7. Криопробирки с органоидами ставили в штатив CoolCell LX и помещали на -80°С на 1 сутки, а затем переносили в жидкий азот для длительного хранения.
ПРИМЕР 4. Форсколин-индуцированное набухание бронхиальных и легочных органоидов
Форсколин-индуцированное набухание проводили на 22 день от начала дифференцировки.
1. За сутки до проведения анализа проводили пассирование органоидов, как описано в примере 2, на 24-, 48- или 96-луночный планшет с объемом капли 3 мкл. Среды для культивирования органоидов включали в себя среды, описанные в Примере 1, пункт 6, однако в среде для БО отсутствовали 8-бром-цАМФ и 3-изобутил-1-метилксантин минимум в течение суток до начала анализа.
2. В день анализа в лунки с органоидами вносили кальцеин зеленый (кат. номер С34852, Thermo Fisher Scientific) в финальной концентрации 0,01 мкМ для БО и 1 мкМ для ЛО (стоковая концентрация 10 мМ) и инкубировали 40 мин в условиях инкубатора (5% CO2, 37°С).
3. Получали изображение на инвертированном микроскопе ZEISS Axio Vert A1 (ZEISS, Германия).
4. В анализируемые лунки вносили форсколин (кат. номер F6886, Sigma-Aldrich) в финальной концентрации 10 мкМ и инкубировали 24 ч в условиях инкубатора (5% CO2, 37°С).
5. Получали изображение на инвертированном микроскопе ZEISS Axio Vert A1.
6. Полученные изображения анализировали в программном обеспечении ilastik и CellProfiler. Границы органоида определяли при помощи машинного обучения на основе флуоресцентных изображений кальцеина в зеленом канале при помощи программы ilastik. На основе полученных масок вероятности получали бинарную маску границ органоидов в программе CellProfiler. Производили определение первичных объектов и сегментацию, рассчитывали площадь органоида как сумму пикселей в первичном объекте. В программе GraphPad Prism производили нормализацию площадей органоидов, где за 100% принимали среднюю площадь органоидов в группе на 0 ч после добавления форсколина.
7. Статистический анализ проводили в GraphPad Prism версии 8 с применением метода однофакторного дисперсионного анализа (one-way ANOVA) с апостериорным тестом Данна. Нормальность распределения оценивали тестом Шапиро-Вилка. Достоверность различий считали значимыми при р<0,05.
Краткое описание чертежей
Фигура 1. Оценка экспрессии маркеров клеток дефинитивной эндодермы CD117 (с-Kit) и CD184 (CXCR4) методом проточной цитофлуориметрии.
А - точечная диаграмма клеток и выделение популяции по размеру и гранулярности клеток.
Б - точечная диаграмма клеток и выделение клеточных синглетов.
В - точечная диаграмма окрашивания клеток на кальцеин синий.
Г - точечная диаграмма окрашивания клеток на маркер CD117 (c-Kit).
Д - точечная диаграмма окрашивания клеток на маркер CD184 (CXCR4).
Е - точечная диаграмма окрашивания клеток на маркеры CD117 (c-Kit) и CD184 (CXCR4).
Фигура 2. Оценка экспрессии маркеров дефинитивной эндодермы CD117 (c-Kit) и CD184 (CXCR4) клетками, полученными по двум протоколам, методом проточной цитофлуориметрии, n=3 биологических повтора из независимых лунок дифференцировки.
Фигура 3. Фазово-контрастная микроскопия БО и ЛО, полученных из чИПСК wt/wt и чИПСК F508del/F508del, на 20 день от начала дифференцировки.
Фигура 4. Количественная оценка нормализованной (по временной точке 0) площади набухания БО и ЛО, полученных из wt/wt ИПСК и p.F508del/F508del ИПСК, в момент времени = 0 и 24 ч.
Данные представлены как среднее значение ± 95% ДИ, n=2 биологических повтора из независимых экспериментов, количество анализируемых органоидов в каждой группе составляет 30-150 индивидуальных органоидов. **** р<0,0001
Список литературы
1. McCauley K.В. et al. (2018) Derivation of Epithelial-Only Airway Organoids from Human Piuripotent Stem Celis. Current protocois in stem cell bioiogy. 45(1), e51.
2. Wang R. et al. (2020) Differentiation of human airway-organoids from induced pluripotent stem cells (iPSCs). Methods in Cell Biology. 159,95-114.
3. McCauley K.B. et al. (2017) Efficient derivation of functional human airway epithelum from pluripotent stem ceils via temporal regulation of Wnt signaling. Cell stem cell. 20(6), 844-857. e6.
4. Leibel S.L. et al. (2020) Generation of Complete Multi- Cell Type Lung Organoids From Human Embryonic and Patient-Specific Induced Pluripotent Stem Cells for Infectious Disease Modeling and Therapeutics Validation. Current Protocols in Stem Cell Biology. 54(1), e118.
5. Miller A.J. et al. (2019) Generation of lung organoids from human pluripotent stem cells in vitro. Nature protocols. 14(2); 518-540.
6. Jaafarpour Z. et al. (2016) Differentiation of definitive endoderm from human induced pluripotent stem cells on hMSCs feeder in a defined medium. Avicenna journal of medical biotechnology. 8(1), 2.
7. E. Kondrateva et al. (2021) Derivation of iPSC line (RCMGi001-A) from dermal fibroblasts of a cystic fibrosis female patient with homozygous F508del mutation. Stem Cell Research. 102251.
8. Салихова Д.И. и др. (2019) Сравнительный анализ влияния кондиционированных сред, полученных при культивировании нейрональных и глиальных предшественников, на мозжечковые нейроны при глутаматной эксайтотоксичности. Гены и клетки. 14(4).
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения базальных клеток легкого человека из индуцированных плюрипотентных стволовых клеток человека | 2023 |
|
RU2815943C1 |
| КУЛЬТУРАЛЬНАЯ СРЕДА ДЛЯ ЭПИТЕЛИАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК И ОРГАНОИДОВ, СОДЕРЖАЩИХ УКАЗАННЫЕ СТВОЛОВЫЕ КЛЕТКИ | 2010 |
|
RU2555545C2 |
| СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ ЭПИТЕЛИАЛЬНЫХ КЛЕТОК РАКА ЛЁГКОГО, СПОСОБ ИХ КУЛЬТИВИРОВАНИЯ И ПРИМЕНЕНИЕ | 2021 |
|
RU2838489C2 |
| КУЛЬТУРАЛЬНАЯ СРЕДА ДЛЯ ПЕРВИЧНЫХ ЭПИТЕЛИАЛЬНЫХ КЛЕТОК МОЛОЧНОЙ ЖЕЛЕЗЫ, СПОСОБ ИХ КУЛЬТИВИРОВАНИЯ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2819362C1 |
| СПОСОБ СОКУЛЬТИВИРОВАНИЯ КЛЕТОК ДЛЯ ФОРМИРОВАНИЯ IN VITRO МОДЕЛИ ГЕМАТО-ЭНЦЕФАЛИЧЕСКОГО БАРЬЕРА | 2019 |
|
RU2724956C1 |
| КУЛЬТУРАЛЬНАЯ СРЕДА ДЛЯ ЭПИТЕЛИАЛЬНЫХ КЛЕТОК ПЛОСКОКЛЕТОЧНОЙ КАРЦИНОМЫ ПИЩЕВОДА, СПОСОБ КУЛЬТИВИРОВАНИЯ И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2816529C1 |
| ОРГАНОИД ПЕЧЕНИ, ВАРИАНТЫ ЕГО ПРИМЕНЕНИЯ И СПОСОБ КУЛЬТИВИРОВАНИЯ ДЛЯ ЕГО ПОЛУЧЕНИЯ | 2011 |
|
RU2579995C2 |
| Биомедицинский клеточный препарат | 2017 |
|
RU2647429C1 |
| УСТРОЙСТВО И СПОСОБЫ ДЛЯ КУЛЬТИВИРОВАНИЯ КЛЕТОК | 2017 |
|
RU2741806C2 |
| КУЛЬТУРАЛЬНАЯ СРЕДА СТВОЛОВЫХ КЛЕТОК | 2012 |
|
RU2714256C2 |

Изобретение относится к области медицины и биотехнологии, а именно к органоидам бронхов и легкого, способам их получения, пассирования, криоконсервации, функционального анализа проводимости CFTR-канала. Описаны способы получения бронхиальных органоидов, которые включают в себя: (а) применение культуральной среды для получения органоидов, содержащей следующие компоненты, %: IMDM 71,8-72,3; F12(Ham) 23,5-24; В-27 1-2; N2 0,5-1; бычий сывороточный альбумин 0,7; тиоглицерол 0,004; GlutaMAX 1; L-аскорбиновая кислота 0,2 и примоцин 0,2, (b) дифференцировку индуцированных плюрипотентных стволовых клеток человека (чИПСК) в клетки дефинитивной эндодермы с применением Активина А и CHIR99021, (с) отсутствие клеточной сортировки на этапе формирования органоидов из NKX2.1+ легочных прогениторов. 1 з.п. ф-лы, 4 ил., 4 пр.
1. Способ получения и культивирования бронхиальных органоидов (БО) и легочных органоидов (ЛО) из индуцированных плюрипотентных стволовых клеток человека (чИПСК), включающий в себя подготовительный этап и четыре основных этапа, при которых:
на подготовительном этапе выполняют культивирование чИПСК на среде mTESR1 в течение 14 суток и более,
на первом основном этапе осуществляют получение клеток дефинитивной эндодермы (ДЭ), при котором выполняют культивирование чИПСК, полученных на подготовительном этапе, либо конфлюэнтность которых в день начала дифференцировки должна составлять 50-70%, в контакте с внеклеточным матриксом в течение 24 ч в присутствии культуральной Среды 1, содержащей: 96% RPMI-1640, 50X B-27, 100X GlutaMAX и 100X пенициллин-стрептомицин, к которой добавлены 100 нг/мл рекомбинантного человеческого Активина А и 5 мкМ CHIR99021, а затем выполняют культивирование с внеклеточным матриксом в течение 48 ч в присутствии культуральной Среды 1, к которой добавлены 100 нг/мл рекомбинантного человеческого Активина А, либо конфлюэнтность которых в день начала дифференцировки должна составлять 70-90%, в контакте с внеклеточным матриксом в течение 72 ч в присутствии среды из коммерческого набора STEMdiff™ Definitive Endoderm Kit по протоколу производителя,
на втором основном этапе осуществляют получение клеток эндодермы передней кишки (ЭПК), при котором выполняют пассирование клеток ДЭ либо в соотношении количества клеток для пассирования к количеству клеток ДЭ 1:3-1:4, при получении клеток ДЭ с применением рекомбинантного человеческого Активина А, либо в соотношении количества клеток для пассирования к количеству клеток ДЭ 1:4-1:5, при получении клеток ДЭ с применением коммерческого набора STEMdiff™ Definitive Endoderm Kit, а культивирование клеток ДЭ в контакте с внеклеточным матриксом осуществляют в течение 72 ч в присутствии культуральной Среды 2, содержащей: 75% IMDM, 25% F12(Ham), 100X B-27, 200X N2, 0,05% бычий сывороточный альбумин, 0,45 мМ тиоглицерол, 100X GlutaMAX, 0,05 мг/мл L-аскорбиновую кислоту и 100 мкг/мл примоцин, к которой добавляют 10 мкМ SB431542, 2 мкМ дорсоморфин и 10 мкМ Y-27632, через 24 ч проводят смену культуральной среды на аналогичную среду без добавления Y-27632, а смену среды производят каждый день,
на третьем основном этапе осуществляют получение легочных прогениторов NKX2.1+ из клеток ЭПК, который включает в себя культивирование клеток ЭПК в контакте с внеклеточным матриксом в течение 7 суток в присутствии культуральной Среды 2, к которой добавляют 3 мкМ CHIR99021, 10 нг/мл BMP4 и 100 нМ ретиноевой кислоты, при этом смену культуральной среды проводят через день,
на четвертом основном этапе для получения БО из легочных прогениторов NKX2.1+, культивированных на третьем основном этапе, выполняют культивирование легочных прогениторов NKX2.1+ в трехмерной структуре внеклеточного матрикса в присутствии культуральной Среды 2, к которой добавлены 250 нг/мл FGF2, 100 нг/мл FGF10, 50 нм дексаметазона, 0,1 мМ 3-изобутил-1-метилксантина и 0,1 мМ 8-бром-цAМФ, при этом в первые 24 ч после пересева добавлено 10 мкМ Y-27632.
2. Способ получения и культивирования бронхиальных и легочных органоидов из индуцированных плюрипотентных стволовых клеток человека по п.1, отличающийся тем, что на четвертом основном этапе для получения ЛО из легочных прогениторов NKX2.1+, культивированных на третьем основном этапе, выполняют культивирование легочных прогениторов NKX2.1+ в трехмерной структуре внеклеточного матрикса в присутствии культуральной Среды 2, к которой добавлены 10 нг/мл FGF7, 10 нг/мл FGF10, 10 нг/мл EGF и 3 мкМ CHIR99021.
| WANG R | |||
| et al., Chapter 5 - Differentiation of human airway-organoids from induced pluripotent stem cells (iPSCs), Methods in Cell Biology, Vol | |||
| Катодное реле | 1918 |
|
SU159A1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| MCCAULEY K.B | |||
| et al., Efficient Derivation of Functional Human Airway Epithelium from Pluripotent Stem Cells via Temporal Regulation of Wnt Signaling, Cell Stem Cell., 2017, 20(6), | |||
Авторы
Даты
2024-06-25—Публикация
2022-04-14—Подача