Изобретение относится к области биотехнологии, в частности к технологии приготовления питательных сред для культивирования уреолитических микроорганизмов, которые способны к микробной минерализации (биоминерализации).
Микробная минерализация (биоминерализация) - способность бактерий осаждать минералы. Биоминерализующие свойства бактерий выявляют по их уреазной активности. Эта активность обеспечивается за счет фермента уреазы, который катализирует реакцию гидролиза присутствующей в среде мочевины до карбонат-ионов. При наличии в реакционной смеси кальциевых ионов происходит осаждение карбоната кальция.
Использование микробной биоминерализации для решения различных технических задач в настоящее время является перспективным направлением в науке и промышленности: Патент CN 109295108 [1], Патент US 8420362 [2], Патент РФ RU 2764192 [3].
Микробно-индуцированное осаждение кальцита (Microbially induced calcite precipitation - MICP) улучшает физические свойства почв за счет увеличения содержания твердой фазы, уменьшения размера пор и улучшения жесткости контакта между частицами, что приводит к улучшению механических и геотехнических характеристик почвы или других материалов: Oualha, Journal of environmental management vol. 257 (2020): 109965 [4].
Для того чтобы можно было обрабатывать бактериальной суспензией большие объемы почв, подлежащие биоминерализации, необходимо вырастить значительное количество биомассы бактерий, сохраняя их биоминерализующие свойства.
Бактериальные культуры при культивировании чувствительны к компонентам питательной среды. Среда считается сбалансированной, если обеспечивает достаточно быстрый рост и развитие популяции микроорганизмов, (т.е. это определяет эффективность процесса культивирования бактерий, обеспечиваемого данной питательной средой). Уреолитические бактерии при культивировании на питательной среде не должны терять ферментативную (уреазную) активность, чтобы в дальнейшем обеспечить высокий выход минералов.
Известна питательная среда для культивирования уреолитических бактерий со следующим составом: 0,5% коммерческого дрожжевого экстракта, 0,6% фосфата калия, 0,2% цитрата аммония, 4% ацетата натрия, 1% глюкозы, 1% полипептона, 1% мясного экстракта, 0,0575% сульфата магния, 0,012% сульфата марганца, 0,0034% сульфата железа и 0,1% Твин80. Недостатком данной среды является ее многокомпонентность и детектированная низкая уреазная активность (0,1 ЕД/мл): патент US 4970153 [5].
Известна питательная среда для культивирования уреолитических бактерий, содержащая (г/л): коммерческий дрожжевой экстракт - 20, хлорид аммония - 10. Недостатком данной среды является низкая эффективность среды, заключающаяся в низком выходе биомассы (OD600=4) и низкой уреазной активности (10 ЕД/мл): Патент CN 103289919 [6].
Наиболее близким к достигаемому результату является питательная среда для культивирования уреолитических бактерий Bacillus pasteurianus, состоящая из (в г/л): триса - 15,73, сульфата аммония - 10 и коммерческого дрожжевого экстракта - 20. Недостатком среды является высокая стоимость компонентов, при этом получается низкий выход биомассы (OD600=l,8 - 2,5) и невысокая активность уреазы (около 9 ЕД/мл): Патент CN 113585301 [7].
Технический результат заявляемого изобретения состоит в удешевлении питательной среды для культивирования уреолитических бактерий при повышении количества биомассы и эффективности фермента уреазы.
Задача заключаются в нахождении таких компонентов питательной среды, которые обеспечат значительное количество биомассы и высокую уреазную активность.
Для достижения указанного технического результата предложена питательная среда, состоящая из следующих компонентов (г/л): дрожжевой экстракт из отработанных пивных дрожжей - 5, глюкоза 5-10, хлорид натрия - 10 для культивирования уреолитических бактерий.
Удешевление заявляемой питательной среды связано с тем, что в ней отсутствуют дорогостоящие компоненты прототипа: 2-амино-2-гидроксиметил-пропан-1,3-диол(трис) и коммерческий дрожжевой экстракт, а в качестве источника дрожжевого экстракта пивных дрожжей предложено использовать экстракт из отработанных пивных дрожжей.
Для приготовление коммерческого дрожжевого экстракта, дрожжи специально наращивают в больших количествах, затрачивая на это много ресурсов, что делает его дорогостоящим компонентом. Как известно, дрожжи используются в производстве пива для проведения процесса брожения, а после осуществления своей функции отработанные пивные дрожжи должны быть утилизированы. Отработанные пивные дрожжи обычно не находят квалифицированного применения, поэтому чаще всего их выбрасывают, хотя они представляют собой ценный материал, который может быть переработан в продукты с добавленной стоимостью для пищевой и фармацевтической промышленности: Marson, Gabriela Vollet et al. World journal of microbiology & biotechnology vol. 36,7 95. 24 Jun. 2020 [8].
На основании проведенных экспериментальных работ авторами была создана сбалансированная питательная среда для культивирования уреолитических бактерий, которая обеспечивает высокий уровень уреазной активности и значительное количество биомассы, что подтверждает возможность осуществления процесса микробной минерализации (биоминерализации).
На фиг. 1 представлены показатели оптической плотности уреолитических бактерий {Bacillus cereus 4b, Bacillus subtilis DSM 23778, Bacillus subtilis K51, Micrococcus luteus 6) в зависимости от культивирования на питательных средах с различными соотношениями компонентов (1, 2, 3, 4, 5 - номера питательных сред, состав которых дан ниже).
На фиг. 2 представлен сравнительный график зависимости ферментативной (уреазной) активности уреолитических штаммов от времени культивирования для каждой вышеуказанной бактерии, где 1 - контрольная среда, 2 - заявляемая среда.
Предлагаемую питательную среду из отработанных пивных дрожжей готовят следующим образом.
Отработанные пивные дрожжи приобретаются на пивном производстве. Экстракт из отработанных пивных дрожжей получают по модифицированной для лабораторных условий методике на основе, описанной в работе: S. Sacsinchai, М. Suphantharika, С. Verduyn. World J Microbiol Biotechnol 17:307-316 (2001) [9]. Сухие отработанные пивные дрожжи заливают 10-кратным количеством дистиллированной воды и нагревают в течение 10 часов при 50°С с перемешиванием. Затем суспензию нагревают до 85°С и выдерживают в течение 15 мин для инактивации остаточной ферментативной активности и центрифугируют при 3900 об/мин в течение 50 мин. Прозрачный супернатант высушивают на лиофильной сушке. Выход сухого дрожжевого экстракта из отработанных пивных дрожжей составляет 20,0±1,5% от массы сухих дрожжей.
Для приготовления жидкой питательной среды в колбу Эрленмейера (объемом 100 мл) вносят компоненты среды в соотношении (г/л): дрожжевой экстракт из отработанных пивных дрожжей - 5, глюкоза - 5-10, хлорид натрия - 10, дистиллированная вода до 1 л, до рН 6,5-7 доводят 1 М раствором NaOH. Стерилизацию среды проводят при давлении 1,1 атм в течение 15 минут.В остывшую питательную среду асептически вносят посевной материал (5 мл культуры уреолитических бактерий на 100 мл питательной среды). Штаммы культивируют в течение 24 часов при температуре 37°С при постоянном аэрировании.
Примеры конкретной реализации
Пример 1. Получение жидкого дрожжевого экстракта из отработанных пивных дрожжей
Сухие отработанные пивные дрожжи заливают 10-кратным количеством дистиллированной воды и нагревают в течение 10 часов при 50°С с перемешиванием. Затем суспензию нагревают до 85°С и выдерживают в течение 15 мин для инактивации остаточной ферментативной активности и центрифугируют при 3900 об/мин в течение 50 мин. Полученный жидкий экстракт (супернатант) из отработанных пивных дрожжей добавляют в среду из расчета, что выход сухого дрожжевого экстракта составляет 20,0±1,5% от массы сухих дрожжей.
Пример 2. Нахождение параметров сбалансированной среды для культивирования уреолитических бактерий для следующих штаммов: Bacillus cereus 4b, Bacillus subtilis DSM 23778, Bacillus subtilis K51, Micrococcus luteus 6.
С целью установления соотношения компонентов для создания сбалансированной среды для уреолитических бактерий были приготовлены следующие среды.
1) СРЕДА 1: в колбу Эрленмейера (объемом 100 мл) вносят компоненты среды в соотношении (г/л): дрожжевой экстракт из отработанных пивных дрожжей - 5, хлорид натрия - 10, дистиллированная вода до 1 л, до рН 6,5-7 доводят 1 М раствором NaOH. Стерилизацию среды проводят при давлении 1,1 атм в течение 15 минут. В остывшую питательную среду асептически вносят посевной материал (5 мл культуры уреолитических бактерий на 100 мл питательной среды). Штаммы культивируют в течение 24 часов при температуре 37°С при постоянном аэрировании.
2) СРЕДА 2: в колбу Эрленмейера (объемом 100 мл) вносят компоненты среды в соотношении (г/л): дрожжевой экстракт из отработанных пивных дрожжей - 10, хлорид натрия - 10, дистиллированная вода до 1 л, до рН 6,5-7 доводят 1 М раствором NaOH. Далее те же операции, что прописаны для среды 1.
3) СРЕДА 3: в колбу Эрленмейера (объемом 100 мл) вносят компоненты среды в соотношении (г/л): коммерческий дрожжевой экстракт - 5, пептон - 10, хлорид натрия - 10, дистиллированная вода до 1 л, рН=7. Далее те же операции, что прописаны для СРЕДЫ 1. Данная среда - среда LB - является универсальной для выращивания бактериальных культур: Н. Wang, J. Guo, X. Chen, H. He. Metabolites, 2023, 13(8), 958 [10]. Она взята в качестве контроля.
4) СРЕДА 4: в колбу Эрленмейера (объемом 100 мл) вносят компоненты среды в соотношении (г/л): дрожжевой экстракт из отработанных пивных дрожжей - 5, глюкоза - 5, хлорид натрия - 10, дистиллированная вода до 1 л, до рН 6,5-7 доводят 1 М раствором NaOH. Далее те же операции, что прописаны для СРЕДЫ 1.
5) СРЕДА 5: в колбу Эрленмейера (объемом 100 мл) вносят компоненты среды в соотношении (г/л): дрожжевой экстракт из отработанных пивных дрожжей - 5, глюкоза - 10, хлорид натрия - 10, дистиллированная вода до 1 л, до рН 6,5-7 доводят 1 М раствором NaOH. Далее те же операции, что прописаны для СРЕДЫ 1.
Для каждого исследуемого штамма было рассчитано количество биомассы на всех 5 питательных средах путем измерения оптической плотности бактериальной суспензии при длине волны 600 нм.
После культивирования в течение 24 часов отбирали аликвоту (1 мл) каждой бактериальной суспензии и центрифугировали (10 минут, 10000 об/мин). Надосадочную жидкость отбрасывали, а осадок бактерий суспендировали в 1 мл 0,9% NaCl. Оптическую плотность измеряли при длине волны 600 нм на спектрофотометре.
Пример 3. Измерение уреазной активности
Формула 1 определения уреазной активности
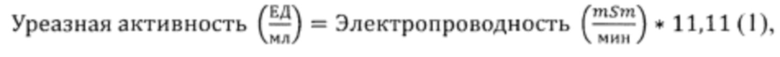 где
где
11,11 - поправочный коэффициент. (1)
Уреазную активность, как было сказано выше, измеряют по электропроводности раствора, содержащего карбонатные ионы: Whiffm, V.S. Microbial СаСО3 Precipitation for the Production of Biocement. Ph.D. Thesis, Murdoch University, Perth, Australia, 2004 [11].
Для приготовления жидкой питательной среды в колбу Эрленмейера (объемом 100 мл) вносят компоненты среды в соотношении (г/л): дрожжевой экстракт из отработанных пивных дрожжей - 5, глюкоза - 10, хлорид натрия - 10, дистиллированная вода до 1 л, до рН 6,5-7 доводят 1 М раствором NaOH. Стерилизацию среды проводят при давлении 1,1 атм в течение 15 минут.В остывшую питательную среду асептически вносят посевной материал (5 мл культуры уреолитических бактерий на 100 мл питательной среды). Штаммы культивируют в течение 24 часов при температуре 37°С при постоянном аэрировании.
Выросшую бактериальную массу каждого штамма отделяют от культуральной жидкости центрифугированием (30 минут, 3900 об/мин) и суспендируют в 0,9% растворе NaCl. Суспензию уреолитических бактерий (5 мл) асептически вносят в колбы Эрленмейера (объемом 100 мл) с аналогичной питательной средой, описанной выше, в которую после стерилизации добавляют фильтрованный раствор мочевины с расчетом, чтобы конечная концентрация мочевины составляла 25 г на 1 л среды. Бактерии культивируют при 37°С и аэрации в течение 72 часов. Для анализа уреазной активности аликвоты (1 мл) бактериальной суспензии были отобраны последовательно в 0, 3, 6, 24, 27, 30, 48, 53 и 72 часа культивирования. Бактерии отделяли центрифугированием (10 мин, 10000 об/мин), затем в надосадочной жидкости измеряли электропроводность на кондуктометре DFRobot DFR0300-H Gravity: Analog Electrical Conductivity Sensor/Meter (K=10), после чего по формуле 1 измеряли уреазную активность раствора.
Таким образом, исходя из фиг. 1 и фиг. 2, биомасса уреолитических бактерий и уреазная активность достигают более высоких значений на СРЕДАХ 4 и 5, т.е., при следующем соотношении компонентов: дрожжевой экстракт из отработанных пивных дрожжей - 5, глюкоза - 5-10, хлорид натрия - 10, дистиллированная вода - до 1 л.
Такое соотношение компонентов приводит к более высокой эффективности, заключающейся в увеличении количества биомассы и высокой уреазной активности по сравнению с контролем и аналогами.
Пример 4. Возможность осуществления биоминерализации (измерение полученного осадка карбоната кальция).
Бактериальный штамм Bacillus cereus 4b (депонирован в коллекции ВКПМ под номером В-14265) культивируют в 100 мл жидкой питательной среды, составом (г/л): дрожжевой экстракт из отработанных пивных дрожжей - 5, глюкоза - 10, хлорид натрия - 10, дистиллированная вода до 1 л, до рН 6,5-7 доводят 1 М раствором NaOH. Стерилизацию среды проводят при давлении 1,1 атм. в течение 15 минут. В качестве контроля использовалась универсальная среда LB, составом (г/л): коммерческий дрожжевой экстракт - 5, пептон - 10, хлорид натрия - 10, дистиллированная вода до 1 л, рН=7. Выросшую бактериальную массу отделяют от культуральной жидкости центрифугированием, суспендируют в 0,9% растворе NaCl. Для получения осадка карбоната кальция бактериальную массу вносят в среду следующего состава (г/л): коммерческий дрожжевой экстракт - 2, глюкоза - 10, мочевина - 25, хлорид кальция - 25. Стерилизацию среды проводят при давлении 1,1 атм в течение 15 минут. В остывшую питательную среду асептически вносят фильтрованный раствор мочевины и хлорида кальция. Бактерии культивируют в течение 7 дней при температуре 37°С. После культивирования осадок, содержащий бактерии и кристаллы карбоната кальция, отделяют от культуральной жидкости центрифугированием (30 минут, 3900 об/мин). Кристаллы карбоната кальция от бактериальной массы отделяют осаждением с промыванием водой. Затем кристаллы сушат и взвешивают. Эксперимент выполнен в 3-х повторностях. В результате были получены следующие данные:

Данные табл. 1 показывают, что бактерии, выращенные на заявляемой среде, способны к биоминерализации.
Таким образом, предлагаемая питательная среда для культивирования уреолитических бактерий содержит недорогое и доступное сырье, что позволяет увеличить биомассу бактерий и уреазную активность относительно контроля, а также не препятствует биоминерализации.
Работа выполнена при финансовой поддержке «Курчатовского геномного центра - ПИЯФ» программой развития центров генетических исследований мирового уровня, Соглашение №075-15-2019-1663.
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм бактерий Bacillus licheniformis BHa 36-R, обладающий уреазной и кальцинирующей активностью и предназначенный для улучшения функциональных свойств строительных материалов на основе цемента или бетона и продукции экзополисахаридов | 2024 |
|
RU2835165C1 |
| Способ получения массовой культуры симбиотических бактерий Xenorhabdus энтомопатогенных нематод Rhabditida: Steinernematidae | 2020 |
|
RU2748023C1 |
| Штамм бактерий Bacillus licheniformis ВКПМ В-13559 для улучшения функциональных свойств строительных материалов | 2020 |
|
RU2764192C1 |
| Питательная среда для культивирования Bacillus subtilis ВКПМ В-12079 | 2017 |
|
RU2680702C1 |
| СПОСОБ ПОЛУЧЕНИЯ СПОРОВОЙ КУЛЬТУРЫ НА ОСНОВЕ БАКТЕРИАЛЬНОГО ШТАММА Bacillus sp. 1839 | 2015 |
|
RU2605543C1 |
| Питательная среда для культивирования Bacillus subtilis | 2018 |
|
RU2668178C1 |
| Питательная среда для культивирования бактерий родов Paenibacillus и Bacillus | 2024 |
|
RU2829228C1 |
| ЖИДКАЯ ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ БАКТЕРИЙ HAEMOPHILUS PLEUROPNEUMONIAE | 1993 |
|
RU2076903C1 |
| Питательная среда для культивирования Bacillus subtilis ВКПМ В-12079 | 2019 |
|
RU2722071C1 |
| ШТАММ Bacillus amyloliquefaciens - ПРОДУЦЕНТ АЛЬФА-АМИЛАЗЫ Bacillus amyloliquefaciens | 2010 |
|
RU2455352C1 |
Изобретение относится к биотехнологии. Предложена питательная среда для культивирования уреолитических микроорганизмов, содержащая дрожжевой экстракт из отработанных пивных дрожжей, глюкозу, хлорид натрия и дистиллированную воду при заданном содержании компонентов. Изобретение обеспечивает повышение количества биомассы и уреазной активности уреолитических микроорганизмов, способных к микробной минерализации - биоминерализации. 2 ил., 1 табл., 4 пр.
Питательная среда для культивирования уреолитических бактерий, содержащая дрожжевой экстракт, хлорид натрия, дистиллированную воду, отличающаяся тем, что дополнительно содержит глюкозу, а в качестве дрожжевого экстракта – дрожжевой экстракт из отработанных пивных дрожжей при следующем соотношении компонентов (г/л):
| ЖУРИШКИНА Е.В | |||
| и др | |||
| "Поиск новых продуктивных штаммов, способных осаждать карбонат кальция"; Актуальная биотехнология, 2020, N 3 (34), с.493-495 | |||
| MOSTAFA SEIFAN et al | |||
| "Induced calcium carbonate precipitation using Bucillus species"; Applied microbiology and biotechnology, 2016, N 100(23), p.9895-9906 | |||
| LIANG MA et al | |||
| "Beneficial factors for |
Авторы
Даты
2024-03-25—Публикация
2023-09-05—Подача