УРОВЕНЬ ТЕХНИКИ
Вирус иммунодефицита человека (ВИЧ) является возбудителем синдрома приобретенного иммунодефицита (СПИД). В отсутствие подавления вируса люди, инфицированные ВИЧ, демонстрируют тяжелый иммунодефицит, что делает их очень восприимчивыми к изнурительным и, в конечном итоге, смертельным условно-патогенным инфекциям. Доступны несколько клинически одобренных антиретровирусных препаратов, которые демонстрируют мульти-логарифмическое уменьшение вирусной нагрузки. Пациенты, проходящие лечение, подвергаются риску приобретения мутаций, которые делают вирус в их организме резистентным к доступным способам лечения, и при прекращении терапии наблюдается быстрое восстановление вирусемии, что указывает на то, что текущие схемы лечения не являются излечивающими.
ВИЧ является ретровирусом, жизненный цикл которого включает обратную транскрипцию генома вирусной РНК в ДНК через фермент, известный как обратная транскриптаза, и последующую интеграцию копии ДНК в хромосомную ДНК хозяина с помощью кодированной вирусом интегразы. Вирусная РНК транскрибируется, и вирусные белки транслируются с использованием клеточного аппарата хозяина в сочетании с вирусными дополнительными белками. Многие вирусные белки содержатся в белках GAG и GAG-POL, при этом GAG содержит структурные белки, а GAG-POL является результатом сдвига рамки считывания рядом с карбокси-концом GAG и содержит вирусные ферменты протеазу (PR), обратную транскриптазу (RT) и интегразу (IN), помимо структурных белков. GAG и GAG-POL расщепляются на отдельные белки в процессе созревания, который происходит во время почкования вирионов из инфицированной клетки. В это время GAG-POL димеризуется, и теперь димерный PR ВИЧ в димере GAG-POL образует активный фермент, который может отщепляться от полипротеина и катализировать дальнейшее расщепление с образованием оставшихся вирусных ферментов и структурных белков.
Доступные антиретровирусные лекарственные средства действуют через блокировку вируса на разных этапах жизненного цикла вируса. Например, ингибиторы обратной транскриптазы таргетируют обратную транскриптазу вируса и предотвращают копирование генома РНК в ДНК, ингибиторы интегразы блокируют способность скопированной ДНК интегрироваться в клетку-хозяин, и ингибиторы протеаз предотвращают созревание вируса, так что вирионы, образующиеся из клетки, обработанные ингибиторами протеаз, являются незрелыми и не инфекционными. После того, как произошла интеграция, клетка инфицируется до тех пор, пока она не умирает либо в результате нормальных путей гибели клеток, либо из-за ускоренной гибели из-за вирусных факторов, либо до тех пор, пока она не станет мишенью иммунной системы. Хотя ожидается, что большинство инфицированных клеток погибнет в течение ~2 дней после заражения, быстрое возобновление вирусемии после прекращения терапии является показателем того, что инфицированные клетки остаются даже после многих лет лечения (см., например, J. B. Dinoso et al., Proc. Natl. Acad. Sci. U.S.A., 2009, 106(23): 9403-9408). Таким образом, новые методы лечения, которые могут избирательно убивать ВИЧ инфицированные клетки, предоставят новые варианты лечения ВИЧ инфекции. Лечение соединениями, которые могут ускорять гибель ВИЧ инфицированных клеток и уменьшать общее количество инфицированных вирусом клеток, которые сохраняются у пациентов, потенциально может снизить невысокую вирусемию у ослабленных пациентов, а также может играть роль в стратегии лечения ВИЧ.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее описание относится к производным пиридинона и их применению в качестве агентов, убивающих клетки, активируемы малыми молекулами (SMACK), которые ускоряют гибель клеток, экспрессирующих GAG-POL ВИЧ, без сопутствующей цитотоксичности по отношению к ВИЧ-наивным клеткам. Соответственно, описанные в настоящем документе соединения полезны для лечения инфекции ВИЧ, или для лечения, профилактики или задержки начала или прогрессирования СПИД или СПИД-ассоциированного комплекса (ARC). Кроме того, соединения полезны для селективного уничтожения ВИЧ инфицированных клеток, экспрессирующих GAG-POL, у субъекта, инфицированного ВИЧ. Также представлены композиции и способы применения, включающие соединения по настоящему описанию.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединениям, производным пиридинона, и их применению для ускорения гибели клеток, экспрессирующих GAG-POL ВИЧ, без сопутствующей цитотоксичности по отношению к не инфицированным ВИЧ клеткам. В отсутствие соединений, таких как соединения по настоящему изобретению, активация PR происходит во время созревания вируса, и концентрация зрелой PR в цитоплазме ограничена. Напротив, настоящие соединения способствуют желаемому фенотипу, катализируя димеризацию GAG-POL внутри инфицированной клетки за счет связывания с незрелым сайтом связывания RT и запуска преждевременной активации фермента PR ВИЧ внутри инфицированной клетки-хозяина до почкования. В результате, PR расщепляет субстраты-хозяева внутри клетки, что приводит к цитотоксичности и гибели клеток. Этот эффект можно заблокировать в присутствии ингибитора ВИЧ протеазы, такого как индинавир или дарунавир, демонстрируя роль ВИЧ протеазы в этом процессе.
Соединения, описанные в настоящем документе, также обладают активностью в качестве не нуклеозидных ингибиторов обратной транскриптазы (NNRTI) из-за гомологии между зрелым и незрелым карманом RT в ВИЧ, что позволяет соединениям связываться со зрелым гидрофобным карманом рядом с активным сайтом вирусного фермента RT. Связывание со зрелой RT приводит к ингибированию ферментативной активности и продукции ДНК провируса, что предотвращает инфицирование наивных CD4+ Т-клеток.
Хотя действие NNRTI на димеризацию RT и GAG-POL было задокументировано (Tachedjian et al. Proc. Natl. Acad. Sci. U.S.A. 2001, 98(13):7188; Tachedjian et al. FEBS Lett. 2005, 579:379; Figueiredo et al. PLOS Path. 2006, 2(11):1051; Sudo et al. J. Virol. 2013, 87(6):3348), о селективном уничтожении ВИЧ инфицированных клеток в результате усиленной димеризации впервые было сообщено Jochmans et al. (Jochmans et al. Retrovirology 2010, 7:89). Авторы получили данные, показывающие эти эффекты в хронически инфицированных клетках MT-4, PBMC и CD4+ клетках. Основываясь на эффективности протестированных молекул, они пришли к выводу, что «Эти данные представляют собой доказательство концепции таргетного лекарственного уничтожения клеток, продуцирующих ВИЧ. Хотя сами по себе NNRTI могут быть недостаточно эффективными для терапевтического применения, результаты служат основой для разработки лекарственных средств, использующих этот механизм действия». Совсем недавно, Zerbato et al. (Zerbato et al. Antimicrob. Agents Chemother. 2017, 61(3)) измерили активность NNRTI на первичной клеточной модели латентного периода ВИЧ. Они увидели значительное сокращение продуцирования вируса для некоторых NNRTI по сравнению с другими классами антиретровирусных препаратов и пришли к выводу, что это произошло из-за способности этих соединений уничтожать клетки, экспрессирующие белки GAG-POL ВИЧ.
Настоящее описание относится к соединению формулы:
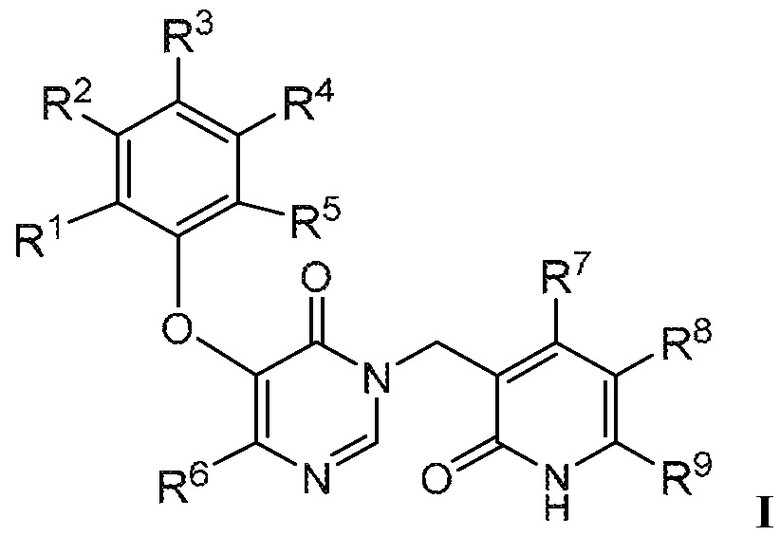
или его фармацевтически приемлемой соли, где:
R1 является Н, галогеном, -NH2, -NH-C1-3алкилом, -N(C1-3алкилом)2, -C3-6циклоалкилом, -C1-3алкилом, замещенным или не замещенным 1-7 F, или -OC1-3алкилом, замещенным или не замещенным 1-7 F;
R2 является CN и R3 является Н; или R2 является Н и R3 является CN;
R4 является -H, галогеном, -NH2, -NH-C1-3алкилом, -N(C1-3алкилом)2, -C3-6циклоалкилом, -C1-3алкилом, замещенным или не замещенным 1-7 F, или -OC1-3алкилом, замещенным или не замещенным 1-7 F;
R5 является -H, галогеном, -NH2, -NH-C1-3алкилом, -N(C1-3алкилом)2, -C3-6циклоалкилом, -C1-3алкилом, замещенным или не замещенным 1-7 F, или -OC1-3алкилом, замещенным или не замещенным 1-7 F;
R6 является галогеном или -C1-6алкилом, замещенным 1-9 -F;
R7 является -H или -C1-3алкилом;
R8 является -H, галогеном или -C1-3алкилом; и
R9 является -H, пиразолилом или -C1-6алкилом, замещенным или не замещенным -OH или -OC1-3алкилом.
В варианте осуществления 1 настоящего описания представлены соединения формулы I, имеющие структурную формулу II (где R2 является CN и R3 является Н):
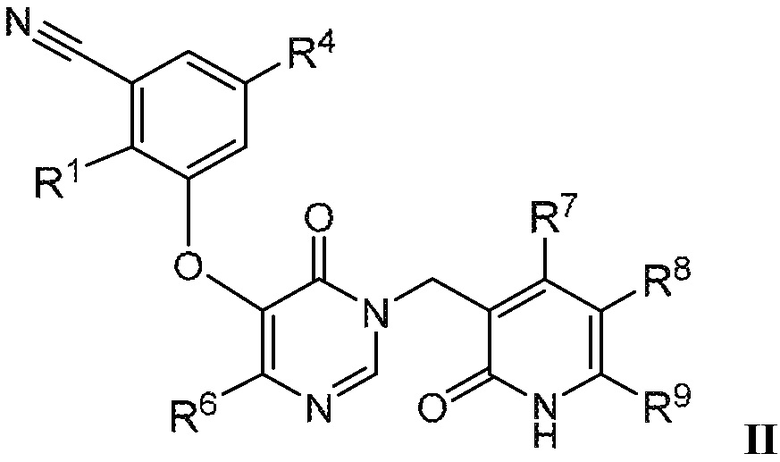
или их фармацевтически приемлемые соли, где R1, R4, R6, R7, R8 и R9 такие, как определены в формуле I.
В варианте осуществления 2 настоящего описания представлены соединения формулы I или формулы II, или фармацевтически приемлемые соли каждого из вышеперечисленных, где:
R4 является галогеном, -NH2, -NH-C1-3алкилом, -N(C1-3алкилом)2, -C3-6циклоалкилом, -C1-3алкилом, замещенным или не замещенным 1-7 F, или -OC1-3алкилом, замещенным или не замещенным 1-7 F. В их классе 1, R4 является галогеном или -C1-3алкилом, замещенным или не замещенным 1-7 F. В их классе 2, R4 является галогеном, -CH3 или -CH3, замещенным 1-3 F.
В варианте осуществления 3A настоящего описания представлены соединения формулы I, формулы II, варианта осуществления 2, или любого их класса, или фармацевтически приемлемые соли каждого из вышеперечисленных, где R1 является -H.
В варианте осуществления 3B настоящего описания представлены соединения формулы I, формулы II, варианта осуществления 2, или любого их класса, или фармацевтически приемлемые соли каждого из вышеперечисленных, где R1 является галогеном, -NH2, -NH-C1-3алкилом, -N(C1-3алкилом)2, -C3-6циклоалкилом, -C1-3алкилом, замещенным или не замещенным 1-7 F, или -OC1-3алкилом, замещенным или не замещенным 1-7 F. В их классе 1, R1 является галогеном или -C1-3алкилом, замещенным или не замещенным 1-7 F. В их классе 2, R1 является галогеном или CH3.
В варианте осуществления 4 настоящего описания представлены соединения формулы I имеющие структурную формулу III (где R2 является Н и R3 является CN):
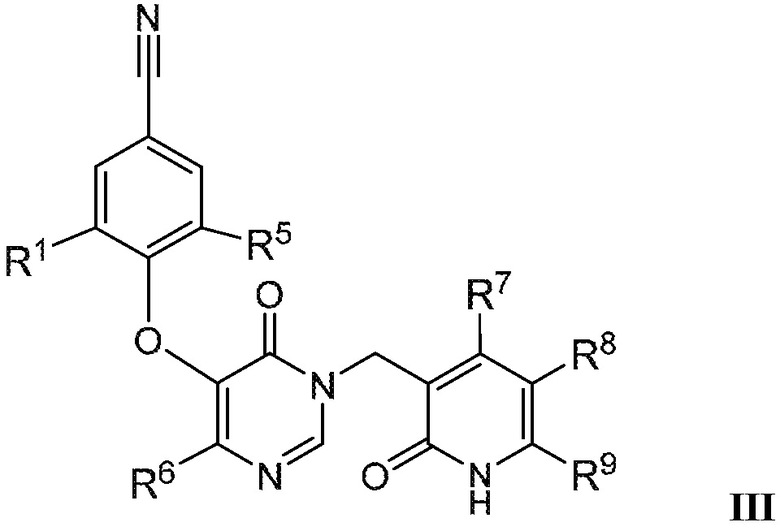
или их фармацевтически приемлемые соли, где R1, R5, R6, R7, R8 и R9 такие, как определены в формуле I.
В варианте осуществления 5A настоящего описания представлены соединения формулы I или формулы III, или фармацевтически приемлемые соли каждого из вышеперечисленных, где:
R1 является галогеном, -NH2, -NH-C1-3алкилом, -N(C1-3алкилом)2, -C3-6циклоалкилом, -C1-3алкилом, замещенным или не замещенным 1-7 F, или -OC1-3алкилом, замещенным или не замещенным 1-7 F. В их классе 1, R1 является галогеном или -C1-3алкилом, замещенным или не замещенным 1-7 F. В их классе 2, R1 является галогеном или CH3.
В варианте осуществления 5B настоящего описания представлены соединения формулы I или формулы III, или фармацевтически приемлемые соли каждого из вышеперечисленных, где:
R5 является галогеном, -NH2, -NH-C1-3алкилом, -N(C1-3алкилом)2, -C3-6циклоалкилом, -C1-3алкилом, замещенным или не замещенным 1-7 F, или -OC1-3алкилом, замещенным или не замещенным 1-7 F. В их классе 1, R5 является галогеном или -C1-3алкилом, замещенным или не замещенным 1-7 F. В их классе 2, R5 является галогеном, -CH3 или -CH3 замещенным 1-3 F.
В варианте осуществления 6 настоящего описания представлены соединения формулы I, формулы II, формулы III или варианта осуществления 2, 3A, 3B, 5A или 5B, или любого их класса, или фармацевтически приемлемые соли каждого из вышеперечисленных, где R6 является галогеном или -C1-4алкилом, замещенным 1-9 -F. В их классе 1, R6 является галогеном или -C1-3алкилом, замещенным 1-7 -F. В их классе 2, R6 является галогеном или -C1-2алкилом, замещенным 1-5 -F.
В варианте осуществления 7 настоящего описания представлены соединения формулы I, формулы II, формулы III или варианта осуществления 2, 3A, 3B, 5A, 5B или 6, или любого их класса, или фармацевтически приемлемые соли каждого из вышеперечисленных, где R7 является Н или -CH3.
В варианте осуществления 8 настоящего описания представлены соединения формулы I, формулы II, формулы III, варианта осуществления 2, 3A, 3B, 5A, 5B, 6 или 7, или любого их класса, или фармацевтически приемлемые соли каждого из вышеперечисленных, где R8 является -H или галогеном.
В варианте осуществления 9 настоящего описания представлены соединения формулы I, формулы II, формулы III, варианта осуществления 2, 3A, 3B, 5A, 5B, 6, 7 или 8, или любого их класса, или фармацевтически приемлемые соли каждого из вышеперечисленных, где R9 является -H, пиразолилом или -C1-4алкилом, замещенным или не замещенным -OH или -OC1-3алкилом. В их классе 1, R9 является -H, пиразолилом или -C1-3алкилом, замещенным или не замещенным -OH или -OC1-3алкилом. В их классе 2, R9 является -H, пиразолилом или -C1-3алкилом, замещенным или не замещенным -OH или -OCH3.
В варианте осуществления 10 настоящего описания представлены соединения формулы I или II или их фармацевтически приемлемые соли, где
R1 является Н, галогеном или -C1-3алкилом, замещенным или не замещенным 1-7 F; например, R1 является Н, галогеном или CH3;
R4 является галогеном, -CH3 или -CH3, замещенным 1-3 F;
R6 является галогеном или -C1-3алкилом, замещенным 1-7 -F, например, R6 является -C1-2алкилом, замещенным 1-5 -F;
R7 является -H или -C1-3алкилом, например, R7 является Н или -CH3;
R8 является -H, галогеном или -C1-3алкилом, например, R8 является -H или галогеном; и
R9 является -H, пиразолилом или -C1-6алкилом, замещенным или не замещенным -OH или -OC1-3алкилом, например, R9 является -H, пиразолилом, или -C1-3алкилом, замещенным или не замещенным -OH или -OCH3.
В варианте осуществления 11 настоящего описания представлены соединения формулы I или III, или их фармацевтически приемлемые соли, где
R1 является галогеном или -C1-3алкилом, замещенным или не замещенным 1-7 F, например, R1 является галогеном или CH3;
R5 является галогеном или -C1-3алкилом, замещенным или не замещенным 1-7 F, например, R5 является галогеном, -CH3 или -CH3, замещенным 1-3 F, например, R5 является -CH3;
R6 является галогеном или -C1-3алкилом, замещенным 1-7 -F, например, R6 является -C1-2алкилом, замещенным 1-5 -F;
R7 является -H или -C1-3алкилом, например, R7 является Н или -CH3;
R8 является -H, галогеном или -C1-3алкилом, например, R8 является -H или галогеном; и
R9 является -H, пиразолилом или -C1-6алкилом, замещенным или не замещенным -OH или -OC1-3алкилом, например, R9 является -H, пиразолилом, или -C1-3алкилом, замещенным или не замещенным -OH или -OCH3.
Ссылка на соединения формулы I в настоящем документе охватывает соединения формулы I, II и III, а также их варианты осуществления и классы. Соединения формулы I могут быть нейтральными соединениями или в форме соли, если такие соли возможны, включая фармацевтически приемлемые соли.
Термин «например» означает «например». Когда в настоящем документе используются термины «например» или «например», приведенные примеры предназначены для иллюстрации и не предназначены для того, чтобы быть исчерпывающим списком всех соответствующих примеров.
Используемый в настоящем документе термин «алкил» относится к насыщенным алифатическим углеводородным группам как с разветвленной, так и с прямой цепью, имеющим определенное количество атомов углерода в определенном диапазоне.
Например, термин «C1-6алкил» означает алкильные группы с линейной или разветвленной цепью, включая все возможные изомеры, имеющие 1, 2, 3, 4, 5 или 6 атомов углерода, а также включает каждый из гексильных и пентильных изомеров, а также н-, изо-, втор- и трет-бутил (бутил, и-бутил, в-бутил, т-бутил, вместе «C4алкил», Bu=бутил), н- и изо-пропил (изопропил, и-пропил вместе «C3алкил»; Pr=пропил), этил (Et) и метил (Me). «C1-4алкил» имеет 1, 2, 3 или 4 атома углерода и включает каждый из н-, и-, в- и т-бутил, н- и и-пропил, этил и метил. «C1-3алкил» имеет 1, 2 или 3 атома углерода, и включает в себя каждый из н-пропила, и-пропила, этила и метила.
«Циклоалкил» относится к циклизованному алкильному кольцу, имеющему указанное число атомов углерода в указанном диапазоне. Таким образом, например «С3-6циклоалкил» включает в себя каждый из циклопропила, циклобутила, циклопентила и циклогексила, и «С3-4циклоалкил» включает в себя каждый из циклопропила и циклобутила.
«Гало» или «галоген» означает хлор, фтор, бром или йод. Хлор, фтор и бром представляют собой класс представляющих интерес галогенов, в частности хлор и фтор.
«ВИЧ-наивными клетками» являются клетки, не инфицированные ВИЧ.
«Совместимыми анти-ВИЧ агентами» являются агенты против ВИЧ, за исключением ингибиторов протеазы ВИЧ.
«Стабильным» соединением является соединение, которое может быть получено и выделено, и чья структура и свойства остаются или могут оставаться практически неизменными в течение периода времени, достаточного для использования соединения для целей, описанных в настоящем документе (например, терапевтического или профилактического введения субъекту). Соединения по настоящему изобретению ограничены стабильными соединениями, охватываемыми формулой I и ее вариантами. Например, определенные фрагменты, как определено в формуле I, могут быть не замещенными или замещенными, и последний термин предназначен для охвата схем замещения (т.е. числа и типа заместителей), которые химически возможны для группы и которые приводят к стабильному соединению.
Настоящее описание включает индивидуальные диастереомеры, в частности эпимеры, т.е. соединения, имеющие одинаковую химическую формулу, но различающиеся пространственным расположением вокруг одного атома. Настоящее описание также включает смеси диастереомеров, особенно смеси эпимеров, во всех соотношениях. Настоящее описание охватывает соединения формулы I, имеющие либо (R), либо (S) стереоконфигурацию в асимметричном центре и в любых дополнительных асимметричных центрах, которые могут присутствовать в соединении формулы I, а также их стереоизомерных смесях. Варианты осуществления настоящего описания также включают смесь энантиомеров, обогащенную 51% или более одного из энантиомеров, включая, например, 60% или более, 70% или более, 80% или более, или 90% или более одного энантиомера. Единственный эпимер является предпочтительным. Индивидуальные или единственные энантиомеры относятся к энантиомерам, полученным хиральным синтезом и/или с использованием общеизвестных методик разделения и очистки, и которые могут составлять 100% одного энантиомера, или могут содержать небольшие количества (например, 10% или меньше) противоположных энантиомеров. Таким образом, индивидуальные энантиомеры являются предметом настоящего описания в чистой форме, как левовращающие, так и правовращающие антиподы, в форме рацематов и в виде смесей двух энантиомеров во всех соотношениях. В случае цис/транс-изомерии это описание включает как цис-форму, так и транс-форму, а также смеси этих форм во всех соотношениях.
При желании, получение индивидуальных стереоизомеров можно осуществлять путем разделения смеси обычными способами, например, хроматографией или кристаллизацией, использованием стереохимически однородных исходных материалов для синтеза или стереоселективным синтезом. Необязательно дериватизацию можно проводить перед разделением стереоизомеров. Разделение смеси стереоизомеров можно проводить на промежуточной стадии во время синтеза соединения формулы I, или его можно проводить на конечном рацемическом продукте. Абсолютная стереохимия может быть определена с помощью рентгеновской кристаллографии кристаллических продуктов или кристаллических промежуточных продуктов, которые при необходимости дериватизируются с помощью реагента, содержащего стереогенный центр известной конфигурации. Альтернативно, абсолютная стереохимия может быть определена спектроскопическим анализом вибрационного кругового дихроизма (VCD). Настоящее описание включает все такие изомеры, а также соли, сольваты (включая гидраты) и сольватированные соли таких рацематов, энантиомеров, диастереомеров и таутомеров и их смесей.
Как будет понятно специалисту в данной области техники, некоторые соединения настоящего описания могут существовать в виде таутомеров. Все таутомерные формы таких соединений, независимо от того, выделены ли они по отдельности или в смесях, входят в объем настоящего описания. Например, в случаях, когда в гетероароматическом кольце разрешен оксо (= O) заместитель и возможна кето-енольная таутомерия, понятно, что заместитель может фактически присутствовать, полностью или частично, в форме -OH.
Атомы в соединении формулы I могут проявлять свое естественное изотопное содержание, или один или несколько атомов могут быть искусственно обогащены конкретным изотопом, имеющим тот же атомный номер, но атомную массу или массовое число, отличное от атомной массы или массового число, преимущественно встречающегося в природе. Подразумевается, что настоящее описание включает все подходящие изотопные варианты соединений формулы I; например, различные изотопные формы водорода (H) включают протий (1H) и дейтерий (2H). Протий является преобладающим изотопом водорода, встречающимся в природе. Обогащение дейтерием может дать определенные терапевтические преимущества, такие как увеличение периода полужизни in vivo или снижение требований к дозировке, или может дать соединение, используемое в качестве стандарта для характеризации биологических образцов. Обогащенные изотопами соединения формулы I могут быть получены без чрезмерного экспериментирования обычными методами, хорошо известными специалистам в данной области техники, или способами, аналогичными тем, которые описаны в схемах и примерах в настоящем документе, с использованием подходящих реагентов и/или промежуточных соединений, обогащенных изотопами.
Соединения можно вводить в форме фармацевтически приемлемых солей. Термин «фармацевтически приемлемая соль» относится к соли, которая обладает эффективностью исходного соединения и которая не является нежелательной с биологической или иной точки зрения (например, не является токсичной или вредной для ее реципиента). Когда соединения формулы I содержат одну или несколько кислотных групп или основных групп, изобретение включает соответствующие фармацевтически приемлемые соли.
Таким образом, соединение формулы I, которые содержат кислотные группы (например, -COOH) может быть использовано в соответствии с изобретением в виде, например, но не ограничиваясь ими, соли щелочных металлов, соли щелочноземельных металлов или в виде аммониевых солей. Примеры таких солей включают, но не ограничиваются ими, соли натрия, соли калия, соли кальция, соли магния или соли с аммиаком или органическими аминами, такими как, например, этиламин, этаноламин, триэтаноламин или аминокислоты. Соединения формулы I, которые содержат одну или несколько основных групп, то есть групп, которые могут быть протонированы, могут использоваться согласно изобретению в форме их кислотно-аддитивных солей с неорганическими или органическими кислотами, таких как, но не ограничиваясь ими, гидрохлорида, гидробромида, солей с фосфорной кислотой, серной кислотой, азотной кислотой, бензолсульфоновой кислотой, метансульфоновой кислотой, п-толуолсульфоновой кислотой, нафталиндисульфоновыми кислотами, щавелевой кислотой, уксусной кислотой, трифторуксусной кислотой, винной кислотой, молочной кислотой, салициловой кислотой, бензойной кислотой, муравьиной кислотой, пропионовой кислотой, пиваловой кислотой, диэтилуксусной кислотой, малоновой кислотой, янтарной кислотой, пимелиновой кислотой, фумаровой кислотой, малеиновой кислотой, яблочной кислотой, сульфаминовой кислотой, фенилпропионовой кислотой, глюконовой кислотой, аскорбиновой кислотой, изоникотиновой кислотой, лимонной кислотой, адипиновой кислотой и т. д. Если соединения формулы I одновременно содержат кислотные и основные группы в молекуле, изобретение также включает, в дополнение к упомянутым солевым формам, внутренние соли или бетаины (цвиттерионы). Соли могут быть получены из соединений формулы I обычными способами, которые известны специалисту в данной области техники, например, путем комбинации с органической или неорганической кислотой или основанием в растворителе или диспергаторе, или путем анионного обмена или катионного обмена из других солей. Настоящее изобретение также включает все соли соединений формулы I, которые, из-за низкой физиологической совместимости, не подходят напрямую для использования в фармацевтических препаратах, но могут использоваться, например, в качестве промежуточных продуктов для химических реакций или для получения фармацевтически приемлемых солей.
Настоящее описание охватывает любую композицию, состоящую из соединения формулы I или соединения, которое является его солью, включая, например, но не ограничиваясь этим, композицию, состоящую из указанного соединения, связанного вместе с одним или несколькими дополнительными молекулярными и/или ионными компонентами, которые могут называться «сокристалл». Используемый в настоящем документе термин «сокристалл» относится к твердой фазе (которая может быть или не быть кристаллической), где два или несколько различных молекулярных и/или ионных компонентов (обычно в стехиометрическом соотношении) удерживаются вместе за счет неионных взаимодействий, включая, но не ограничиваясь ими, водородные связи, диполь-дипольные взаимодействия, диполь-квадрупольные взаимодействия или дисперсионные силы (Ван-дер-Ваальса). Передача протона между разнородными компонентами отсутствует, и твердая фаза не является ни простой солью, ни сольватом. Обсуждение сокристаллов можно найти, например, в S. Aitipamula et al., Crystal Growth and Design, 2012, 12 (5), pp. 2147-2152.
Кроме того, соединения по настоящему изобретению могут существовать в аморфной форме и/или в одной или нескольких кристаллических формах, и как таковые все аморфные и кристаллические формы и их смеси соединений формулы I и их солей предназначены для включения в объем настоящего описания. Кроме того, некоторые из соединений настоящего описания могут образовывать сольваты с водой (т.е. гидраты) или обычными органическими растворителями. Такие сольваты и гидраты, особенно фармацевтически приемлемые сольваты и гидраты соединений по настоящему описанию, также входят в объем соединений, определенных формулой I, и их фармацевтически приемлемыми солями, наряду с не сольватированными и безводными формами таких соединений.
Соответственно, соединения формулы I или их соли, включая их фармацевтически приемлемые соли, варианты их реализации и конкретные соединения, описанные и заявленные в настоящем документе, охватывают все возможные стереоизомеры, таутомеры, физические формы (например, аморфные и кристаллические формы), сокристаллические формы, сольватные и гидратные формы, и любые комбинации вышеуказанных форм, где такие формы возможны.
Другой вариант осуществления настоящего описания представляет соединение формулы I, где соединение или его соль находится по существу в чистой форме. Используемый в настоящем документе термин «по существу чистая» означает, по меньшей мере, примерно 60% масс., обычно, по меньшей мере, примерно 70% масс., предпочтительно, по меньшей мере, примерно 80% масс., более предпочтительно, по меньшей мере, примерно 90% масс. (например, от примерно 90% масс. до примерно 99% масс.), даже более предпочтительно, по меньшей мере, примерно 95% масс. (например, от примерно 95% масс. до примерно 99% масс. или от примерно 98% масс. до 100% масс.), и наиболее предпочтительно, по меньшей мере около 99% масс. (например, 100% масс.) продукта, содержащего соединение формулы I или его соль (например, продукта, выделенного из реакционной смеси, дающей соединение или соль) составляет соединение или соль. Уровень чистоты соединений и солей может быть определен с использованием стандартного способа анализа, такого как высокоэффективная жидкостная хроматография и/или масс-спектрометрия или способы ЯМР. Если используется более одного способа анализа, и эти способы обеспечивают экспериментально значимые различия в определенном уровне чистоты, то приоритетным является способ, обеспечивающий наивысший уровень чистоты. Соединением или солью со 100% чистотой является соединение или соль, не содержащая обнаруживаемых примесей, определяемых стандартным способом анализа. Что касается соединения по изобретению, которое имеет один или несколько асимметричных центров и может встречаться в виде смесей стереоизомеров, по существу чистое соединение может быть либо по существу чистой смесью стереоизомеров, либо по существу чистым индивидуальным стереоизомером.
Соединения формулы I в настоящем документе и их фармацевтически приемлемые соли применимы для вызова димеризации GAG-POL в ВИЧ инфицированных клетках и, таким образом, селективного уничтожения ВИЧ инфицированных клеток, экспрессирующих GAG-POL, без сопутствующей цитотоксичности по отношению к ВИЧ-наивным клеткам, именуемой в настоящем документе активностью по уничтожению клеток, активируемой малыми молекулами (SMACK). Таким образом, соединения формулы I и их фармацевтически приемлемые соли полезны для:
(i) Способ лечения инфекции ВИЧ или лечения, профилактики или задержки начала или прогрессирования СПИД или ARC у человека, нуждающегося в этом, который включает введение человеку эффективного количества соединения в соответствии с п.1 или его фармацевтически приемлемой соли;
(ii) Способ вызова димеризации GAG-POL в ВИЧ инфицированных клетках у человека, нуждающегося в этом, который включает введение человеку эффективного количества соединения по п.1 или его фармацевтически приемлемой соли; и/или
(iii) Способ селективного уничтожения ВИЧ инфицированных клеток, экспрессирующих GAG-POL, без сопутствующей цитотоксичности по отношению к ВИЧ-наивным клеткам у человека, который включает введение человеку эффективного количества соединения по п.1 или его фармацевтически приемлемой соли.
Кроме того, соединения формулы I и их фармацевтически приемлемые соли применимы для любого из способов (i), (ii) или (iii), указанных выше, дополнительно включающих введение человеку эффективного количества одного или нескольких совместимых антивирусных агентов ВИЧ, выбранных из нуклеозидных или нуклеотидных ингибиторов обратной транскриптазы ВИЧ, ингибиторов транслокации нуклеозидной обратной транскриптазы, не-нуклеозидных ингибиторов обратной транскриптазы ВИЧ, ингибиторов интегразы ВИЧ, ингибиторов слияния ВИЧ, ингибиторов проникновения ВИЧ и ингибиторов созревания ВИЧ. В способах (i), (ii) и (iii) непосредственно выше, человека лечат соединением формулы I или его фармацевтически приемлемой солью в дополнение к лечению одним или несколькими совместимыми противовирусными агентами ВИЧ.
Соединения формулы I и их фармацевтически приемлемые соли также полезны для способа усиления подавления вирусемии ВИЧ у человека, чья вирусемия подавляется введением одного или нескольких совместимых антивирусных агентов ВИЧ, который включает дополнительное введение человеку эффективного количества соединения по п.1 или его фармацевтически приемлемой соли.
Другие варианты осуществления настоящего описания включают следующее:
(а) Фармацевтическая композиция, содержащая эффективное количество соединения формулы I или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель.
(b) Фармацевтическая композиция, которая содержит продукт, полученный путем объединения (например, смешивания) эффективного количества соединения формулы I или его фармацевтически приемлемой соли и фармацевтически приемлемого носителя.
(с) Фармацевтическая композиция по пунктам (a) или (b), дополнительно содержащая эффективное количество одного или нескольких совместимых анти-ВИЧ агентов, выбранных из группы, состоящей из противовирусных агентов ВИЧ, иммуномодуляторов и противоинфекционных агентов.
(d) Фармацевтическая композиция по пункту (c), где совместимый анти-ВИЧ агент выбран из одного или нескольких противовирусных препаратов, выбранных из группы, состоящей из нуклеозидных или нуклеотидных ингибиторов обратной транскриптазы ВИЧ, нуклеозидных ингибиторов транслокации обратной транскриптазы ВИЧ, не нуклеозидных ингибиторов обратной транскриптазы ВИЧ, ингибиторов интегразы ВИЧ, ингибиторов слияния ВИЧ, ингибиторов проникновения ВИЧ и ингибиторов созревания ВИЧ.
(е) Комбинация, которая представляет собой (i) соединение формулы I или его фармацевтически приемлемую соль и (ii) один или несколько совместимых анти-ВИЧ агентов, выбранных из группы, состоящей из противовирусных агентов ВИЧ, иммуномодуляторов и противоинфекционных агентов; где соединение и совместимый анти-ВИЧ агент, каждый, используются в количестве, которое делает комбинацию эффективной для лечения инфекции ВИЧ, или для лечения, профилактики или задержки начала или прогрессирования СПИД или ARC.
(f) Комбинация (е), где совместимым анти-ВИЧ агентом является противовирусный препарат, выбранный из группы, состоящей из нуклеозидных или нуклеотидных ингибиторов обратной транскриптазы ВИЧ, нуклеозидных ингибиторов транслокации обратной транскриптазы, не нуклеозидных ингибиторов обратной транскриптазы ВИЧ, ингибиторов интегразы ВИЧ, ингибиторов слияния ВИЧ, ингибиторов проникновения ВИЧ и ингибиторов созревания ВИЧ.
(g) Способ вызова димеризации GAG-POL в ВИЧ инфицированных клетках, способ избирательного уничтожения ВИЧ инфицированных клеток, экспрессирующих GAG-POL без сопутствующей цитотоксичности по отношению к ВИЧ-наивным клеткам, и/или способ лечения инфекции ВИЧ, или лечения, профилактики или задержки начала или прогрессирования СПИД или ARC, включающие введение эффективного количества соединения формулы I или его фармацевтически приемлемой соли субъекту, нуждающемуся в таком лечении.
(h) Способ по (g), где соединение формулы I или его фармацевтически приемлемую соль вводят в комбинации с эффективным количеством, по меньшей мере, одного другого совместимого антивирусного агента ВИЧ, выбранного из нуклеозидных или нуклеотидных ингибиторов обратной транскриптазы ВИЧ, ингибиторов транслокации нуклеозидной обратной транскриптазы, не нуклеозидных ингибиторов обратной транскриптазы ВИЧ, ингибиторов интегразы ВИЧ, ингибиторов слияния ВИЧ, ингибиторов проникновения ВИЧ и ингибиторов созревания ВИЧ.
(i) Способ (g) или (h), включающий введение субъекту фармацевтической композиции (а), (b), (c) или (d) или комбинации (е) или (f).
(j) Применение соединения формулы I или его фармацевтически приемлемой соли в производстве лекарственного средства для (1) вызова димеризации GAG-POL в ВИЧ инфицированных клетках у субъекта; (2) селективного уничтожения ВИЧ инфицированных клеток, экспрессирующих GAG-POL, без сопутствующей цитотоксичности по отношению к ВИЧ-наивным клеткам у субъекта; (3) лечения заражения ВИЧ у субъекта; (4) лечения, профилактики или задержки начала или прогрессирования СПИД или ARC у субъекта; и/или (5) усиления подавления ВИЧ вирусемии у субъекта, проходящего лечение совместимым анти-ВИЧ агентом.
(k) Соединение формулы I или его фармацевтически приемлемая соль для применения в (1) вызове димеризации GAG-POL в ВИЧ инфицированных клетках; (2) селективного уничтожения ВИЧ инфицированных клеток, экспрессирующих GAG-POL, без сопутствующей цитотоксичности по отношению к ВИЧ-наивным клеткам; (3) лечения инфекции ВИЧ; (4) лечения, профилактики или задержки начала или прогрессирования СПИД или ARC; и/или (5) усиления подавления ВИЧ вирусемии у субъекта, проходящего лечение совместимым анти-ВИЧ агентом.
Дополнительные варианты осуществления настоящего изобретения включают каждую из фармацевтических композиций, способов и применений, изложенных в предыдущих абзацах, где соединение формулы I или его соль, используемые в них, находится в по существу чистой форме. Что касается фармацевтической композиции, содержащей соединение формулы I или его соль и фармацевтически приемлемый носитель и, необязательно, один или несколько эксципиентов, следует понимать, что термин «по существу чистое» относится к соединению формулы I или его соли как таковому.
Другим вариантом осуществления настоящего описания являются фармацевтические композиции, способы и применения, изложенные выше, где представляющим интерес ВИЧ является ВИЧ-1. Термин «введение» и его варианты (например, «введение» соединения) по отношению к соединению формулы I означает предоставление соединения индивиду, нуждающемуся в лечении или профилактике, и включает как самостоятельное введение, так и введение пациенту другим человеком. Когда соединение представлено в комбинации с одним или несколькими другими активными агентами (например, противовирусными агентами, полезными для лечения или профилактики ВИЧ инфекции или СПИД), «введение» и его варианты, каждый понимается как включающие предоставление соединения и других агентов в одно и то же время или в разное время. Когда агенты комбинации вводят одновременно, их можно вводить вместе в одной композиции или их можно вводить по отдельности.
Используемый в настоящем документе термин «композиция» предназначен для охвата продукта, содержащего указанные ингредиенты, а также любого продукта, который является результатом объединения указанных ингредиентов. Ингредиенты, подходящие для включения в фармацевтическую композицию, являются фармацевтически приемлемыми ингредиентами, что означает, что ингредиенты должны быть совместимы друг с другом и не вредны для их реципиента.
Термин «субъект» или «пациент» в контексте настоящего описания относится к животному, предпочтительно млекопитающему, наиболее предпочтительно, человеку, которое является объектом лечения, наблюдения или эксперимента.
Используемый в настоящем документе термин «эффективное количество» означает количество соединения, достаточное для того, чтобы вызвать димеризацию GAG-POL в ВИЧ инфицированных клетках и избирательно убивать ВИЧ инфицированные клетки, экспрессирующие GAG-POL, без сопутствующей цитотоксичности по отношению к ВИЧ-наивным клеткам; и/или оказывать терапевтический эффект, и/или оказывать профилактический эффект после введения. Одним из вариантов осуществления «эффективного количества» является «терапевтически эффективное количество», которое представляет собой количество соединения, которое эффективно для селективного уничтожения ВИЧ инфицированных клеток, экспрессирующих GAG-POL, лечения ВИЧ инфекции, или эффективного для лечения или отсрочки начала или прогрессирования СПИД или ARC у пациента, инфицированного ВИЧ. Другим вариантом осуществления «эффективного количества» является «профилактически эффективное количество», которое представляет собой количество соединения, эффективное для профилактики СПИД или ARC у ВИЧ инфицированного пациента. Понятно, что эффективное количество может одновременно быть как терапевтически эффективным количеством, например, для лечения ВИЧ инфекции, так и профилактически эффективным количеством, например, для предотвращения или снижения риска развития СПИД или ARC у субъекта, инфицированного ВИЧ. Используемый в настоящем документе термин «профилактика» относится к снижению вероятности или тяжести СПИД после инфицирования ВИЧ.
В комбинированных терапиях по настоящему изобретению эффективное количество может относиться к каждому индивидуальному агенту или к комбинации в целом, где количества всех агентов, вводимых в комбинации, вместе эффективны, но где компонентный агент комбинации может или не может присутствовать индивидуально в эффективном количестве относительно того, что считается эффективным для данного компонента агента, если его вводили отдельно.
В способах по настоящему изобретению (т.е. селективное уничтожение ВИЧ инфицированных клеток, экспрессирующих GAG-POL, лечение инфекции ВИЧ или лечение, профилактика или задержка начала или прогрессирования СПИД или ARC), соединения по данному изобретению или их соли можно вводить с помощью средств, обеспечивающих контакт активного агента с местом действия агента. Их можно вводить обычными способами, доступными для использования в сочетании с фармацевтическими препаратами, либо в виде отдельных терапевтических агентов, либо в комбинации терапевтических агентов. Соединение можно вводить самостоятельно, но обычно его вводят с фармацевтическим носителем, выбранным на основе выбранного пути введения и стандартной фармацевтической практики. Соединения по настоящему изобретению можно, например, вводить перорально (например, в виде таблетки или капсулы), парентерально (включая, например, подкожные инъекции, внутривенные, внутримышечные или внутригрудинные инъекции или методы инфузии), с помощью ингаляционного спрея или ректально, в стандартной дозированной форме фармацевтической композиции, содержащей эффективное количество соединения и обычные не токсичные фармацевтически приемлемые носители, адъюванты и средства доставки. Соединение также можно вводить с помощью имплантируемого устройства для доставки лекарственного средства, адаптированного для обеспечения эффективного количества соединения или фармацевтической композиции соединения в течение продолжительного периода времени.
СОСТАВЫ
Твердые препараты, подходящие для перорального введения (например, порошки, пилюли, капсулы и таблетки), могут быть приготовлены согласно методикам, известным в данной области техники, и могут использовать такие твердые эксципиенты, как крахмалы, сахара, каолин, лубриканты, связующие, разрыхлители и подобные. Жидкие препараты, подходящие для перорального введения (например, суспензии, сиропы, эликсиры и подобные), могут быть приготовлены согласно методикам, известным в данной области техники, и могут использовать любую из обычных сред, таких как вода, гликоли, масла, спирты и подобные. Композиции для парентерального введения могут быть приготовлены согласно методикам, известным в данной области техники, и обычно используют стерильную воду в качестве носителя и, возможно, другие ингредиенты, такие как добавки, способствующие растворимости. Растворы для инъекций могут быть приготовлены способами, известными в данной области техники, где носитель включает солевой раствор, раствор глюкозы или раствор, содержащий смесь солевого раствора и глюкозы. Имплантируемые композиции могут быть получены способами, известными в данной области техники, где носитель включает активный химический ингредиент с полимерами в качестве подходящих эксципиентов, или с использованием имплантируемого устройства для доставки лекарственного средства. Дополнительное описание способов, подходящих для использования при приготовлении фармацевтических композиций для использования в настоящем изобретении, и ингредиентов, подходящих для использования в указанных композициях, представлено в Remington - The Science and Practice of Pharmacy, 22nd Edition, published by Pharmaceutical Press and Philadelphia College of Pharmacy at University of the Sciences, 2012, ISBN 978 0 85711-062-6 и предыдущих изданиях.
Составы соединений формулы I, которые приводят к перенасыщению и/или быстрому растворению лекарственного средства, могут быть использованы для облегчения всасывания лекарственного средства при пероральном введении. Подходы к составлению препаратов, вызывающие перенасыщение и/или быстрое растворение лекарственного средства, включают, но не ограничиваются ими, системы наночастиц, аморфные системы, твердые растворы, твердые дисперсии и липидные системы. Такие подходы к составлению и методики их приготовления известны в данной области техники. Например, твердые дисперсии могут быть приготовлены с использованием эксципиентов и способов, как описано в обзорах (например, A.T.M. Serajuddin, J Pharm Sci, 88:10, pp. 1058-1066 (1999)). Системы наночастиц, основанные как на истощении, так и на прямом синтезе, также описаны в обзорах, таких как Wu et al (F. Kesisoglou, S. Panmai, Y. Wu, Advanced Drug Delivery Reviews, 59:7 pp. 631-644 (2007)).
Соединения формулы I можно вводить в интервале дозировок, например, от 1 до 20 мг/кг, или от 1 до 10 мг/кг, или примерно 5 мг/кг массы тела млекопитающего (например, человека) в сутки, или через другие временные интервалы, в зависимости от ситуации, однократно или в несколько приемов. Соединения формулы I можно вводить в диапазоне доз от 0,001 до 2000 мг в сутки однократно или в несколько приемов. Примеры диапазонов доз составляют от 0,01 до 1500 мг в сутки или от 0,1 до 1000 мг в сутки, вводимых перорально или другими путями введения в виде разовой дозы или разделенных доз.
Для перорального (например, таблеток или капсул) или других путей введения дозированные единицы могут содержать от 100 мг до 1500 мг активного ингредиента, например, но не ограничиваясь этим, 100, 150, 200, 250, 300, 350, 400, 450, 500, 600, 700, 800, 900, 1000, 1100, 1200, 1300, 1400 или 1500 миллиграммов активного ингредиента для симптоматической корректировки дозировки для пациента, подлежащего лечению. Кроме того, соединение может быть составлено в виде пероральных составов для немедленного или модифицированного высвобождения, такого как пролонгированное или контролируемое высвобождение. Когда соединение формулы I вводят в виде соли, ссылка на количество соединения в миллиграммах или граммах основывается на свободной форме (т.е. не солевой форме) соединения.
Ежедневное введение может осуществляться любым подходящим путем введения, но предпочтительно путем перорального введения, и может представлять собой разовую дозу или более одной дозы в разное время (разделенные суточные дозы) в течение каждых 24 часов. Каждую дозу можно вводить с использованием одной или нескольких дозированных единиц, в зависимости от ситуации.
Конкретный уровень дозы и частота дозирования для любого конкретного пациента могут варьироваться и будут зависеть от множества факторов, включая активность конкретного применяемого соединения, метаболическую стабильность и продолжительность действия этого соединения, возраст, массу тела, общее состояние здоровье, пол, диету, способ и время введения, скорость выведения, комбинацию лекарственных средств, тяжесть конкретного состояния и хозяина, проходящего терапию. В некоторых случаях, в зависимости от эффективности соединения или индивидуального ответа, может потребоваться отклонение в сторону увеличения или уменьшения от данной дозы. Количество и частота введения будут регулироваться в соответствии с заключением лечащего врача с учетом таких факторов.
«Анти-ВИЧ агентом» является любой агент, который прямо или косвенно эффективен в подавлении ВИЧ, лечении или профилактике ВИЧ инфекции и/или лечении, профилактике или задержке начала или прогрессирования СПИД или ARC. Понятно, что анти-ВИЧ агент эффективен для лечения, профилактики или задержки начала или прогрессирования ВИЧ инфекции или СПИД и/или заболеваний или состояний, возникающих в результате или ассоциированных с ними. Настоящее описание дополнительно направлено на использование соединения формулы I с одним или несколькими совместимыми анти-ВИЧ агентами, то есть с анти-ВИЧ агентами, за исключением ингибиторов протеазы ВИЧ. Например, соединения формулы I можно вводить в комбинации с эффективными количествами одного или нескольких совместимых анти-ВИЧ агентов, выбранных из антивирусных агентов ВИЧ, иммуномодуляторов, противоинфекционных средств или вакцин, полезных для лечения ВИЧ инфекции или СПИД. Подходящие совместимые противовирусные препараты ВИЧ для использования в комбинации с соединениями по настоящему описанию включают, но не ограничиваются ими, перечисленные в Таблице А, а именно:
Таблица A: Противовирусные агенты для лечения ВИЧ инфекции или СПИД
EI=ингибитор входа; FI=ингибитор слияния; InSTI=ингибитор интегразы; NRTI=нуклеозидный или нуклеотидный ингибитор обратной транскриптазы; NNRTI=не нуклеозидный ингибитор обратной транскриптазы; NRTTI=нуклеозидный ингибитор транслокации обратной транскриптазы. Некоторые из лекарственных средств, перечисленных в таблице, используют в форме соли, например, сульфат абакавира, мезилат делавирдина.
Понятно, что объем комбинаций соединений по настоящему изобретению с совместимыми анти-ВИЧ агентами не ограничивается противовирусными препаратами ВИЧ, перечисленными в таблице А, но в принципе включает любую комбинацию с любой фармацевтической композицией, полезной для лечения или профилактики ВИЧ. СПИД или ARC, за исключением ингибиторов протеазы ВИЧ. Совместимые противовирусные агенты ВИЧ и другие активные агенты обычно будут использоваться в этих комбинациях в их обычных диапазонах доз и схемах, как сообщается в данной области техники, включая, например, дозировки, описанные в текущем Physicians' Desk Reference, Thomson PDR, 70th edition (2016), Montvale, NJ: PDR Network, или в его предыдущих выпусках. Диапазоны дозировки соединения по настоящему изобретению в этих комбинациях могут быть такими же, как указано выше.
Соединения по настоящему изобретению также полезны при подготовке и проведении скрининговых анализов на антивирусные соединения. Например, соединения данного изобретения полезны для выделения мутантов ферментов, которые являются отличными инструментами скрининга для более мощных противовирусных соединений. Кроме того, соединения по настоящему изобретению полезны для установления или определения сайта связывания других противовирусных средств с областью обратной транскриптазы в GAG-POL, например, путем конкурентного ингибирования.
Следующие акронимы и сокращения имеют указанные значения:
Несколько способов получения соединений по настоящему изобретению описаны в следующих схемах и примерах. Исходные материалы и промежуточные продукты приобретают или получают с использованием известных процедур, или как иначе проиллюстрировано в пяти разделах «Промежуточное соединение» (A, B, C, AB и BC), которые следуют ниже. Часто применяемый способ получения соединений формулы I описан на следующих схемах.
СХЕМА 1
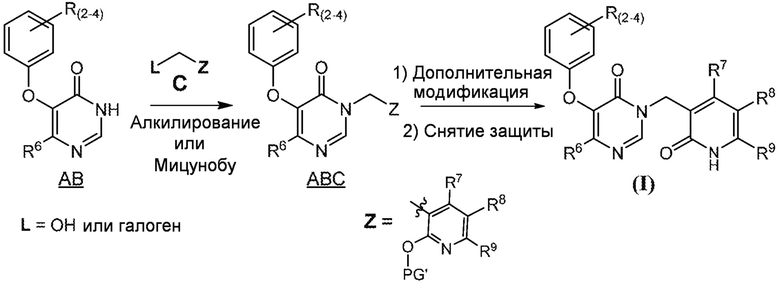
На схеме 1 изображен способ получения соединений формулы I. Промежуточное соединение AB получают методиками, проиллюстрированными в разделе «Промежуточное соединение AB». Реакция Мицунобу или алкилирование с использованием подходящего бензилового спирта или галогенида пиридинона (промежуточное соединение C) дает промежуточное соединение ABC. Промежуточное соединение C обычно имеет защищенную (PG’) пиридиноновую группу, обозначенную буквой Z на схеме 1. Синтез C проиллюстрирован в разделе «Промежуточное соединение C». Полученное промежуточное соединение ABC может необязательно подвергаться дополнительной модификации с последующей стадией снятия защиты с получением соединений формулы I.
СХЕМА 2
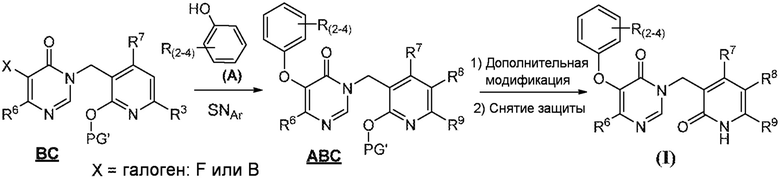
Схема 2 иллюстрирует другой способ получения соединений формулы I. Реакция SNAr между промежуточным соединением A (коммерчески доступным или полученным с использованием процедур, описанных в разделе «Промежуточное соединение A») и промежуточным соединением BC (полученным с помощью процедур, проиллюстрированных в разделе «Промежуточное соединение BC»). используется для создания промежуточного соединения АВС. Кольцо С пиридинона обычно защищено защитной группой (PG'), такой как метил или группа PMB. Полученное промежуточное соединение ABC может затем необязательно подвергаться дополнительной модификации с последующей стадией снятия защиты с получением соединений формулы I.
Реакции, чувствительные к влаге или воздуху, проводят в атмосфере азота или аргона с использованием безводных растворителей и реагентов. Реакции, проводимые с использованием микроволнового излучения, обычно проводят с использованием Emrys Optimizer производства Personal Chemistry или Initiator производства Biotage. Концентрацию растворов проводят на роторном испарителе при пониженном давлении.
Ход реакций определяют либо аналитической тонкослойной хроматографией (ТСХ), обычно проводимой с пластинами ТСХ с предварительно нанесенным покрытием E. Merck, силикагель 60F-254, толщина слоя 0,25 мм, либо аналитической жидкостной хроматографией-масс-спектрометрией (ЖХ-МС). Как правило, используемая аналитическая система ЖХ-МС состоит из платформы Waters ZQ™ с ионизацией электрораспылением в режиме определения положительных ионов с помощью ВЭЖХ Agilent 1100 серии с автопробоотборником. Колонкой обычно является Waters Xterra МС C18, 3,0 × 50 мм, 5 мкм или Waters Acquity UPLC® BEH C18, 1,0 × 50 мм, 1,7 мкм. Скорость потока составляет 1 мл/мин, и объем впрыска составляет 10 мкл. УФ-определение проводят в диапазоне 210-400 нм. Подвижная фаза состоит из растворителя A (вода плюс 0,05% ТФК) и растворителя B (ацетонитрил плюс 0,05% ТФК) с градиентом 100% растворителя A в течение 0,7 мин, переходящего на 100% растворитель B в течение 3,75 мин, выдерживаемого в течение 1,1 мин, затем переходящего на 100% растворитель А в течение 0,2 мин. Определение ЖХ/МС проводят на системе Waters Classing Aquity, оснащенной детекторами TUV и МС и масс-спектрометром Waters SQD, Shimadzu 20 UV 254 и 220 нм с масс-спектрометром Shimadzu 2010 или 2020 или Agilent 1200 ВЭЖХ с DAD/ELSD и G6110 MSD с использованием одного из следующих условий: 1) Ascentis Express C18 (3×50 мм) 2,7 мкм колонка с использованием подвижной фазы, содержащей A: 0,05% трифторуксусной кислоты в воде и B: 0,05% трифторуксусной кислоты в ацетонитриле с градиентом от 90:10 (A:B) до 5:95 (A:B) в течение 6 минут при скорости потока 1,8 мл/мин, УФ-определение при 210 нм; 2) Aquity BEH C18, (1,0×50 мм) 1,7 мкм колонка с использованием подвижной фазы, содержащей A: 0,05% трифторуксусной кислоты в воде и B: 0,05% трифторуксусной кислоты в ацетонитриле с градиентом от 90:10 (A:B) до 5:95 (A:B) в течение 2 минут при скорости потока 0,3 мл/мин, УФ-определение при 215 нм; 3) Agilent YMC J'Sphere H-80 (3×50 мм) 5 мкм колонка с использованием подвижной фазы, содержащей A: 0,1% трифторуксусной кислоты в воде и B: ацетонитрил с градиентом от 95:5 (A:B) до 0:100. (A:B) в течение 3,6 мин и 0:100 (A:B) в течение 0,4 мин при скорости потока 1,4 мл/мин, УФ-определение при 254 и 220 нм и квадрупольный масс-спектрометр Agilent 1100; 4) Agilent TC-C18 (2,1×50 мм) 5 мкм колонка с использованием подвижной фазы, содержащей A: 0,0375% трифторуксусной кислоты в воде и B: 0,01875% трифторуксусной кислоты в ацетонитриле с градиентом от 90:10 (A:B) в течение 0,4 мин до 90:10 до 0:100 (A:B) в течение 3 минут и 10:90 (A:B) в течение 0,6 мин при скорости потока 0,8 мл/мин, УФ-определение при 254 и 220 нм и квадрупольный масс-спектрометр Agilent 6110.
Препаративную очистку ВЭЖХ обычно проводят либо с использованием системы, направляемой масс-спектрометрией, либо системы без масс-управления. Обычно ее проводят на Waters Chromatography Workstation, сконфигурированной с системой ЖХ-МС, состоящей из: одноквадрупольной МС системы Waters ZQ™ с ионизацией электрораспылением, градиентного насоса Waters 2525, инжектора/коллектора Waters 2767, детектора Waters 996 PDA, условий МС: 150-750 а.е.м., положительное электрораспыление, сборка, запускаемая МС и колонка Waters SUNFIRE® с-18 5 микрон, 30 мм (ID) х 100 мм. Подвижные фазы состоят из смесей ацетонитрила (10-100%) в воде, содержащей 0,1% ТФК. Скорость потока поддерживают на уровне 50 мл/мин, объем впрыска составляет 1800 мкл, и диапазон УФ-определения составляет 210-400 нм. В качестве альтернативы используют систему препаративной ВЭЖХ с Gilson Workstation, состоящую из: инжектора/коллектора Gilson GX-281, датчика Gilson UV/VIS-155, насосов Gilson 333 и 334 и оснащенную колонкой, выбранной из следующих: Phenomenexd Synergi C18 (150 мм x 30 мм x 4 микрона), YMC-Actus Pro C18 (150 мм x 30 мм x 5 микрон), Xtimate C18 (150 мм x 25 мм x 5 микрон), Boston Green ODS (150 мм x 30 мм x 5 микрон), XSELECT C18 (150 мм x 30 мм x 5 микрон) и Waters XSELECT C18 (150×30 x 5 микрон). Условия включали либо высокий pH (0-100% элюент ацетонитрил/вода, содержащий 0,1% об./об. 10 мМ NH4HCO3 или 0,05% NH4OH), либо низкий pH (0-95% элюент ацетонитрил/вода, содержащий 0,1% об./об. ТФК). Объем впрыска составляет от 1000 до 8000 мкл, и диапазон УФ определения составляет 210-400 нм. Градиенты подвижной фазы оптимизируют для отдельных соединений.
Флэш-хроматографию, как правило, выполняют с использованием или аппарата Biotage® Flash Chromatography (Dyax Corp.), или аппарата устройство ISCO CombiFlash® Rf, или с ISCO CombiFlash® Companion XL на силикагеле (32-63 мкм, 60 Å размер пор) в предварительно-упакованных картриджах указанного размера.
Хиральное разделение СЖХ проводят на Sepiate Prep SFC 100, Multigram II (MG II), THAR80 Prep SFC или Waters SFC (80, 200 или 350) с использованием условий, описанных в экспериментальном разделе.
Протон или 1H ЯМР регистрируют с помощью ЯМР спектрометра Varian Unity-Inova 400 МГц, оснащенного Varian 400 ATB PFG 5 мм, Nalorac DBG 400-5 или Nalorac IDG 400-5, МР спектрометра Varian-400MHz, оборудованного Auto X ID PFG Probe 5 мм, спектрометр Varian 400MHz VЯМРS, оснащенного PFG 4Nuc Probe 5 мм, или спектрометра Bruker AvanceIII 500MHz, оборудованного PABBO Probe 5 мм, в соответствии со стандартными аналитическими методами, если не указано иное, и представляют результаты спектрального анализа. Спектры 1H ЯМР снимают в растворах CDCl3, если не указано иное. Химические сдвиги указывают в частях на миллион (ч./млн.). Тетраметилсилан (ТМС) используют в качестве внутреннего стандарта в растворах CD3Cl, и остаточный пик CH3OH или ТМС используют в качестве внутреннего стандарта в растворах CD3OD. Константы сочетания (J) представлены в герцах (Гц).
Понятно, что хиральный центр в соединении может существовать в стереоконфигурации «S» или «R» или в виде их смеси. Внутри молекулы каждая связь, проведенная как прямая линия от хирального центра, охватывает каждый из (R) и (S) стереоизомеров, а также их смеси, если не указано иное. Соединения в примерах 32, 33 и 34 содержат хиральный центр. Смесь изомеров, полученную, как описано в каждом из экспериментов для этих соединений, разделяют с получением одного или обоих из изомера A (изомер с более быстрым элюированием) и изомера B (изомер с более медленным элюированием) на основе их наблюдаемого порядка элюирования, полученного в результате разделения, как выполнено в Примере. Время элюирования и/или порядок разделенных изомеров могут отличаться, если они выполняются в условиях, отличных от используемых здесь. Абсолютная стереохимия (R или S) хирального центра в каждом из разделенных «A» и/или «B» стереоизомерах в примерах 32, 33 и 34 не определяют, и «A» и «B» относятся только к порядку элюирования в результате выполненных условий очистки. Звездочка (*) может использоваться на соответствующих чертежах химической структуры примеров соединений для обозначения хирального центра.
Раздел «промежуточное соединение A»
Промежуточное соединение A01
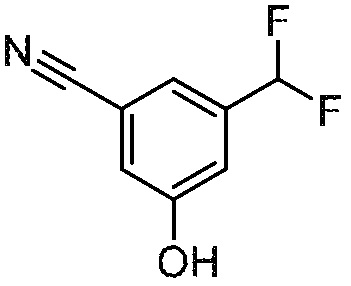
3-(дифторметил)-5-гидроксибензонитрил
Стадия 1: 3-хлор-5-((4-метоксибензил)окси)бензонитрил
К раствору 3-хлор-5-гидроксибензонитрила (30 г, 0,20 моль) в АЦН (300 мл) добавляют PMBCl (34 г, 0,21 моль) и K2CO3 (55 г, 0,4 ммоль), затем смесь перемешивают при 70°С в течение 4 ч. Реакционную смесь фильтруют и концентрируют в вакууме. Остаток очищают флэш-хроматографией на диоксиде кремния (2% EtOAc/петролейный эфир) с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, CDCl3): δ 7,33 (д, J= 8,0 Гц, 2H), 7,23 (с, 1H), 7,19 (с, 1H), 7,11 (с, 1H), 6,94 (д, J= 8,0 Гц, 2H), 5,00 (с, 2H), 3,83(с, 3H).
Стадия 2: 3-((4-метоксибензил)окси)-5-винилбензонитрил
К раствору 3-хлор-5-((4-метоксибензил)окси)бензонитрила, (50 г, 0,18 моль) в диоксане/H2O (400 мл/80 мл) добавляют винилтрифторборат калия (25 г, 0,18 моль), K2CO3 (50 г, 0,36 моль), X-phos (17 г, 36 ммоль) и Pd(OAc)2 (4,1 г, 18 ммоль) под N2 атмосферой, смесь перемешивают при 80°С в течение 2 ч. После охлаждения до КТ, полученную смесь фильтруют и экстрагируют EtOAc (3 × 400 мл). Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на диоксиде кремния (1-2% EtOAc/петролейный эфир) с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, CDCl3): δ 7,34 (д, J= 8,4 Гц, 2H), 7,28 (с, 1H), 7,20 (с, 1H), 7,09 (с, 1H), 6,93 (д, J= 8,4 Гц, 2H), 6,63 (дд, J= 17,6, 12,0 Гц, 1H), 5,78 (д, J= 17,6 Гц, 1H), 5,38 (д, J= 12,0 Гц, 1H), 5,01 (с, 2H), 3,82 (с, 3H).
Стадия 3: 3-формил-5-((4-метоксибензил)окси)бензонитрил
К перемешиваемому раствору соединения 3-((4-метоксибензил)окси)-5-винилбензонитрил, (28 г, 0,1 моль) в диоксане/H2O (180 мл/60 мл) добавляют 2,6-лутидин (22 г, 0,2 моль), OsO4 (1,3 г, 5 ммоль) и NaIO4 (43 г, 0,2 моль), смесь перемешивают при КТ в течение 3 ч. После завершения реакции, смесь разбавляют водой, экстрагируют EtOAc (3×200 мл). Органический слой промывают водой и насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на диоксиде кремния (2-10% EtOAc/петролейный эфир) с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6): δ 9,95 (с, 1H), 7,90 (с, 1H), 7,82 (с, 1H), 7,76 (с, 1H), 7,37 (д, J= 8,4 Гц, 2H), 6,93 (д, J= 8,4 Гц, 2H), 5,14 (с, 2H), 3,73 (с, 3H).
Стадия 4: 3-(дифторметил)-5-((4-метоксибензил)окси)бензонитрил
К перемешиваемому раствору 3-формил-5-((4-метоксибензил)окси)бензонитрил, (22 г, 82 ммоль) в ДХМ (250 мл) добавляют ТДАС (106 г, 0,6 моль) при 0°С под N2 атмосферой, затем смесь перемешивают в течение 3 ч при КТ. После завершения реакции, смесь гасят водой, экстрагируют ДХМ (3 × 200 мл). Органический слой промывают водой и насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения.
Стадия 5: 3-(дифторметил)-5-гидроксибензонитрил
Раствор 3-(дифторметил)-5-((4-метоксибензил)окси)бензонитрила (23,7 г, 82 ммоль) в ТФК/ТФУА (100 мл/ 50 мл) перемешивают при 110°С в течение 3 ч. После завершения реакции, полученную смесь гасят насыщ. водн. NaHCO3 (100 мл) и экстрагируют EtOAc (3 × 150 мл). Объединенные органические слои промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6): δ 10,66 (с, 1H), 7,41 (с, 1H), 7,28 (с, 1H), 7,23 (с, 1H), 6,97 (т, J= 56,0 Гц, 1H).
Промежуточное соединение A02
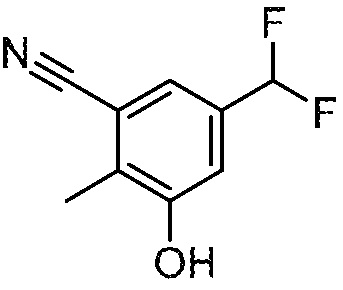
5-(дифторметил)-3-гидрокси-2-метилбензонитрил
Стадия 1: 5-формил-2-метилбензонитрил
В 20 л 4-горлую круглодонную колбу, продутую и выдержанную в инертной атмосфере азота, помещают раствор 5-бром-2-метилбензонитрила (750 г, 38,26 моль) в тетрагидрофуране (6 л), n-BuLi (1,54 л, 38,26 моль) добавляют по каплям при -78°С, полученный раствор перемешивают в течение 30 мин, N, N-диметилформамид (295 г, 4,04 моль, 1,05 эквив.) добавляют по каплям. И реакционную смесь перемешивают при -78°C в течение 30 мин на бане с жидким азотом, и затем гасят добавлением 5 л насыщ. NH4Cl водн. полученный раствор экстрагируют EtOAc (3 × 5 л). Органический слой промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения.
Стадия 2: 3-бром-5-формил-2-метилбензамид
В 3-л 4-горлую круглодонную колбу, продутую и выдержанную в инертной атмосфере азота, помещают раствор 5-формил-2-метилбензонитрила (245 г, 1,69 моль) в серной кислоте (980 мл), реакционную смесь перемешивают при 60°С, 1-бромпирролидин-2,5-дион (300 г, 1,69 моль) добавляют 3 партиями. Полученный раствор перемешивают при 60°С в течение 30 мин. Реакционную смесь затем гасят добавлением 5 л воды/льда и перемешивают в течение 1 ч. Твердые вещества собирают фильтрацией и сушат под вакуумом с получением указанного в заголовке соединения и применяют как есть на следующей стадии.
Стадия 3: 3-бром-5-формил-2-метилбензонитрил
В 20-л 4-горлую круглодонную колбу, продутую и выдержанную в инертной атмосфере азота, помещают раствор 3-бром-5-формил-2-метилбензамида (500 г (неочищенный продукт со стадии 2, 2,07 моль) в дихлорметане (10 л), пиридине (524,5 г, 6,63 моль). Пока полученный раствор перемешивают при 0°С, 2,2,2-трифторацетат (1305 г, 6,21 моль) добавляют по каплям. Полученный раствор перемешивают в течение 30 мин при КТ, затем гасят водой/льдом (5 л) и экстрагируют ДХМ (3 × 5 л). Органические слои объединяют и сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на диоксиде кремния (20% EtOAc/гексан) с получением указанного в заголовке соединения.
Стадия 4: 3-бром-5-(дифторметил)-2-метилбензонитрил
К раствору 3-бром-5-формил-2-метилбензонитрила (360 г, 1,61 моль) в дихлорметане (5,4 л), ТДАС (260 г, 1,61 моль, 1,00 эквив.) добавляют по каплям при КТ. Полученный раствор перемешивают при КТ в течение 1 ч, и затем гасят водой/льдом (3 л). Полученный раствор экстрагируют ДХМ (3 × 5 л). Органические слои объединяют и сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения и используют как есть на следующей стадии.
Стадия 5: 5-(дифторметил)-3-гидрокси-2-метилбензонитрил
К раствору 3-бром-5-(дифторметил)-2-метилбензонитрила (320 г, 1,30 моль) в 1,4-диоксане (1,6 л), добавляют раствор KOH (146 г, 2,60 моль) в воде (1,6 л), Pd2(dba)3 (67 г, 64,92 ммоль), и 2-ди-трет-бутилфосфино-2′,4′,6′-триизопропилбифенил (55 г, 129,53 ммоль). Полученную смесь продувают азотом (3×) и перемешивают при 90°С в течение 1 ч, и затем разделяют между ледяной водой (4 л) и EtOAc (3 × 2 л). Объединенные органические слои промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на диоксиде кремния (33% EtOAc/гексан) с получением указанного в заголовке соединения. МС: 182 (M+1). 1H ЯМР (400 МГц, ДМСО-d6): δ 10,65 (с, 1H), 7,42 (д, J=1,6 Гц, 1H), 7,26 (д, J=1,5 Гц, 1H), 6,99 (с, 1H), 2,34 (д, J=1,3 Гц, 3H).
Промежуточное соединение A03
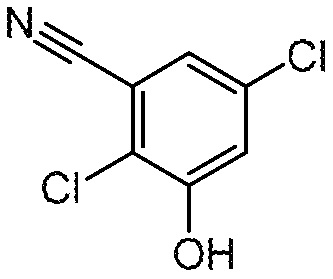
2,5-дихлор-3-гидроксибензонитрил
Стадия 1: 2-амино-5-бром-3-фторбензонитрил
К перемешиваемому раствору 2-амино-3-фторбензонитрила (5 г, 36,7 ммоль) в ДМФ (50 мл) добавляют 1-хлорпирролидин-2,5-дион (5,15 г, 38,6 ммоль), и полученную смесь перемешивают при 60°С в течение 6 ч. Смесь разделяют между водой (200 мл) и EtOAc (2×150 мл). Объединенные органические слои промывают насыщенным раствором соли (3×300 мл), сушат с безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения, которое применяют на следующей стадии без очистки. МС: 171,1 (M+1).
Стадия 2: 2,5-дихлор-3-фторбензонитрил
К смеси 2-амино-5-хлор-3-фторбензонитрила (6,217 г, 36,4 ммоль), хлорида меди(I) (10,82 г, 109 ммоль) и хлорида меди(II) (17,15 г, 128 ммоль) в АЦН (60 мл), добавляют трет-бутилнитрит (17,34 мл, 146 ммоль) при 25°C в течение 1 ч. Реакционную смесь разбавляют водой (180 мл) и экстрагируют EtOAc (3 × 120 мл). Органический слой промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на диоксиде кремния (10-100% EtOAc/петролейный эфир) с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, хлороформ-d): δ ч./млн. 7,51 (дд, J=2,26, 1,65 Гц, 1 H), 7,44-7,47 (м, 1 H).
Стадия 3: 2,5-дихлор-3-((4-метоксибензил)окси)бензонитрил
К перемешиваемому раствору (4-метоксифенил)метанола (2,75 г, 19,89 ммоль) в ДМФ (40 мл) добавляют NaH (1,034 г, 25,9 ммоль) при 0°С. Смесь перемешивают при 0°С в течение 30 мин, затем добавляют 2,5-дихлор-3-фторбензонитрил (3,78 г, 19,89 ммоль), и затем перемешивают при 25°С в течение 2 ч. Реакционную смесь разбавляют водой (200 мл) и экстрагируют EtOAc (3 × 150 мл). Органический слой промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют с получением указанного в заголовке соединения. МС: 308,1 (M+1).
Стадия 4: 2,5-дихлор-3-гидроксибензонитрил
К перемешиваемому раствору 2,5-дихлор-3-((4-метоксибензил)окси)бензонитрила (6,13 г, 19,89 ммоль) в ДХМ (60 мл), ТФК (20 мл) и затем перемешивают при 25°С в течение 1 ч. После завершения, реакционную смесь выливают в насыщ. водн. NaHCO3 (30 мл), экстрагируют ДХМ (3 × 60 мл). Объединенные органические слои промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения, которое применяют непосредственно без дальнейшей очистки. МС: 187,9 (M-1).
Промежуточное соединение A04
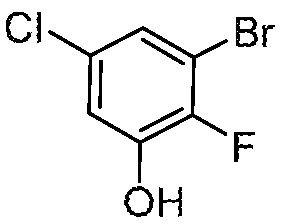
3-бром-5-хлор-2-фторфенол
Стадия 1: 2-(3-бром-5-хлор-2-фторфенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
К раствору 2-бром-4-хлор-1-фторбензола (300 г, 1,43 моль) в гексане (4,5 л), добавляют B2Pin2 (363,7 г, 1,43 моль), Ir [(Ome) (1,5-COD)]2 (14,2 г, 21,42 ммоль), 4-трет-бутил-2-(4-трет-бутилпиридин-2-ил)пиридин (11,5 г, 42,85 ммоль), затем продувают азотом три раза. Полученный раствор перемешивают при КТ в течение ночи и затем концентрируют под вакуумом. Остаток очищают флэш-хроматографией на диоксиде кремния (0-100% EtOAc/петролейный эфир) с получением указанного в заголовке соединения.
Стадия 2: 3-бром-5-хлор-2-фторфенол
К раствору 2-(3-бром-5-хлор-2-фторфенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (385 г, 1,15 моль) в ТГФ (3,85 л), добавляют раствор гидроксида натрия (138 г, 3,45 моль) в воде (3 л), 35% водн. перекись водорода (390 г, 3,44 моль) при 0°С. полученный раствор перемешивают при 0°С в течение 2 ч, и гасят насыщ. водным раствором Na2SO3. После доведения рН раствора до 3-4 с HCl (1 M), полученный раствор экстрагируют EtOAc (3 × 3 л). Объединенные органические слои промывают насыщенным раствором соли, затем концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на диоксиде кремния (0-90% EtOAc/петролейный эфир) с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, CDCl3): δ 11,31 (шс, 1H), 7,47 (дд, J=2,4, 4,4 Гц, 1H), 7,30 (дд, J=2,4, 7,6 Гц, 1H).
Промежуточное соединение A05
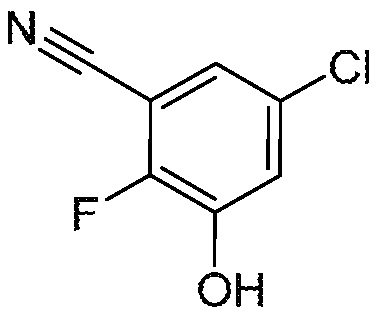
5-хлор-2-фтор-3-гидроксибензонитрил
К раствору 3-бром-5-хлор-2-фторфенола (86 г, 343 ммоль) в NMP (860 мл), добавляют CuCN (154 г, 1,72 моль) одной порцией. Полученную реакционную смесь перемешивают при 180°С в течение 2 ч, затем разделяют между ледяной водой (1 л) и EtOAc (3 × 800 мл). Объединенные органические слои промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на диоксиде кремния (2-33% EtOAc/петролейный эфир) с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6): δ 11,33 (шс, 1H), 7,49 (дд, J=2,5, 4,5 Гц, 1H), 7,30 (дд, J=2,5, 7,6 Гц, 1H).
Промежуточное соединение A06
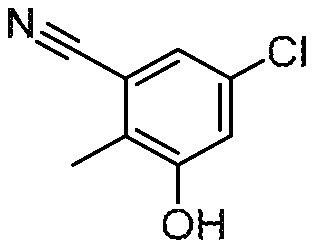
5-хлор-3-гидрокси-2-метилбензонитрил
Стадия 1: 2,3-дифторбензальдегид
К раствору 1,2-дифторбензола (1668 г, 14,62 моль) в ТГФ (16,7 л) охлажденного при -78°С, добавляют ТГФ раствор n-BuLi (6,44 л, 16,08 моль) по каплям при перемешивании в течение 60 мин. Затем к этой смеси добавляют ДМФ (5340 г, 73,06 моль) по каплям при перемешивании при -78°С over 60 мин. Полученный раствор перемешивают при -78°С в течение 1 ч. Реакционную смесь затем гасят насыщ. водн. NH4Cl (10 л), затем экстрагируют EtOAc (3 ×10 л). Объединенные органические слои промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на диоксиде кремния (2% EtOAc/петролейный эфир) с получением указанного в заголовке соединения.
Стадия 2: ( E )-N-[(2,3-дифторфенил)метилиден]гидроксиламин
Смесь 2,3-дифторбензальдегида (2410 г, 16,96 моль) в 70% растворе NH2OH (672 г, 20,35 моль) в ДМФ (10 л) перемешивают при 20°С в течение 3 ч, затем разделяют между (6 л) и EtOAc (3 × 8 л). Объединенные органические слои промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на диоксиде кремния (2% EtOAc/петролейный эфир) с получением указанного в заголовке соединения.
Стадия 3: 2,3-дифторбензонитрил
Раствор (E)-N-[(2,3-дифторфенил)метилиден]гидроксиламина (2025 г, 12,89 моль) в ДМФ (11 л) обрабатывают POCl3 (5688 г, 37,10 моль). Полученный раствор перемешивают при 25°С в течение 3 ч, затем разделяют между (6 л) и EtOAc (3 × 6 л). Объединенные органические слои промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на диоксиде кремния (2% EtOAc/петролейный эфир) с получением указанного в заголовке соединения.
Стадия 4: 2-амино-3-фторбензонитрил
В герметично закрытом реакторе, раствор 2,3-дифторбензонитрила (1273 г, 9,15 моль) в EtOH (13 л) барботируют в NH3(газ). Полученный раствор перемешивают при 140°С в течение 8 ч, охлаждают до КТ, затем концентрируют при пониженном давлении. Остаток разделяют между (5 л) и МТБЭ (3 × 8 л). Объединенные органические слои промывают водой, насыщенным раствором соли и сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения.
Стадия 5: 2-амино-5-хлор-3-фторбензонитрил
Раствор 2-амино-3-фторбензонитрил (934 г, 6,86 моль) в ДМФ (14 л) обрабатывают NCS (1008 г, 7,55 моль). Полученный раствор перемешивают при 45°С в течение 2 ч, затем разделяют между ледяной водой (20 л) и EtOAc (3 ×12 л). Органический слой промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на диоксиде кремния (3% EtOAc/петролейный эфир) с получением указанного в заголовке соединения.
Стадия 6: 2-бром-5-хлор-3-фторбензонитрил
К смеси t-BuONO (815 г, 7,88 моль) и CuBr2 (1365 г, 6,13 моль) в АЦН (8 л), добавляют раствор 2-амино-5-хлор-3-фторбензонитрила (747 г, 4,38 моль) в АЦН (7 л) по каплям при перемешивании в течение 90 мин. Полученную смесь перемешивают при КТ в течение 10 ч, и разбавляют водой (15 л), и затем экстрагируют EtOAc (3 × 10 л). Органический слой промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на диоксиде кремния (3% EtOAc/петролейный эфир) с получением указанного в заголовке соединения.
Стадия 7: 5-хлор-3-фтор-2-метилбензонитрил
Смесь 2-бром-5-хлор-3-фторбензонитрил (768 г, 3,28 моль), 1,4-метилбороновой кислоты (297 г, 4,96 моль), карбоната калия (913 г, 6,61 моль) и PdCl2(dppf) (213 г, 0,33 моль) в дегазированном 1,4-диоксане (4500 мл) и воде (450 мл) перемешивают при 100°С в течение 60 мин и затем разбавляют водой (4 л), и экстрагируют EtOAc (3 × 6 л). Органический слой промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на диоксиде кремния (3% EtOAc/петролейный эфир) с получением указанного в заголовке соединения.
Стадия 8: 5-хлор-3-[(4-метоксифенил)метокси]-2-метилбензонитрил
Под атмосферой азота, к раствору 4-Метоксибензилового спирта (410 г, 2,97 моль) в ДМФ (3200 мл), добавляют гидрид натрия (128 г, 5,33 моль), затем добавляют раствор 5-хлор-3-фтор-2-метилбензонитрила (418 г, 2,46 моль) в ДМФ (800 мл) по каплям. Полученный раствор перемешивают при 25°С в течение 12 ч, затем разбавляют ледяной водой (2 л), и экстрагируют EtOAc (3 × 3 л). Органический слой промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученное твердое вещество промывают петролейным эфиром и собирают в верхней части фильтра с получением указанного в заголовке соединения.
Стадия 9: 5-хлор-3-гидрокси-2-метилбензонитрил
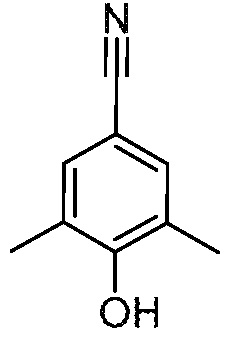
Раствор 5-хлор-3-[(4-метоксифенил)метокси]-2-метилбензонитрил (518 г, 1,80 моль) в ДХМ (1500 мл) обрабатывают ТФК (500 мл). Полученный раствор перемешивают при 25°С в течение 1 ч. Твердые вещества собирают в верхней части фильтра с получением указанного в заголовке соединения. МС: 166 (M-1). 1H ЯМР (400 МГц, ДМСО-d6): 10,67 (с, 1H), 7,32-7,33 (д, 1H), 7,07-7,08 (д, 1H), 2,24 (с, 3H).
Промежуточное соединение A07
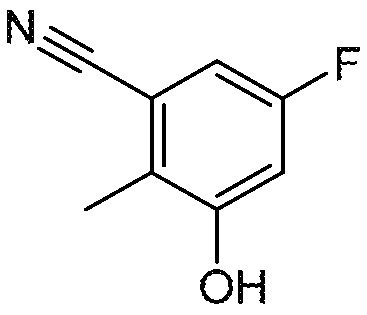
5-фтор-3-гидрокси-2-метилбензонитрил
Стадия1: 3-бром-5-фтор-2-метиланилин
К раствору 1-бром-5-фтор-2-метил-3-нитробензола (23 г, 98 ммоль) в этаноле (390 мл), добавляют гидрохлорид аммония (26,3 г, 491 ммоль) и воду (38,3 мл, 2126 ммоль) затем добавляют раствор железа (27,4 г, 491 ммоль). Полученную смесь перемешивают при 90°С в течение 6 ч. После завершения реакции, отслеживаемого ТСХ, реакционную смесь фильтруют через спеченную воронку. Фильтрат выпаривают при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (5% EtOAc/петролейный эфир) с получением указанного в заголовке соединения. МС: 204,2 и 206,2 (M+1).
Стадия2: 3-бром-5-фтор-2-метилфенол
К раствору серной кислоты (145 мл, 2729 ммоль) в воде (21,73 мл, 1206 ммоль) добавляют 3-бром-5-фтор-2-метилфенол (7 г, 31,1 ммоль). Полученную смесь охлаждают на ледяной бане до 0°C. Затем раствор нитрата натрия (6,66 г, 78 ммоль) в воде добавляют по каплям. После перемешивания при этой температуре в течение 30 минут, реакционную смесь нагревают при 100°C в течение 30 минут, и затем разбавляют водой и экстрагируют EtOAc. Объединенные органические слои промывают насыщенным раствором соли и сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (4-10% EtOAc/петролейный эфир) с получением указанного в заголовке соединения. МС: 203,2 и 205,2 (M-1).
Стадия3: 5-фтор-3-гидрокси-2-метилбензонитрил
К перемешиваемому раствору 3-бром-5-фтор-2-метилфенола (7 г, 34,1 ммоль) в ДМА (140 мл), добавляют цинковый порошок (4,46 г, 68,3 ммоль) и dppf (3,79 г, 6,83 ммоль). Полученную смесь дегазируют азотом в течение 10 минут, и затем добавляют Pd2(dba)3 (1,563 г, 1,707 ммоль) и цианид цинка (8,02 г, 68,3 ммоль). Реакционный сосуд герметично закрывают. И полученную смесь нагревают до 140°C в течение 6 ч, и затем разбавляют водой (200 мл), и фильтруют через слой CELITE®. Фильтровальную лепешку промывают EtOAc (400 мл). Слои фильтрата разделяют. Водный слой затем экстрагируют EtOAc (2×200 мл). Объединенные органические слои промывают насыщенным раствором соли (2×200 мл) и сушат над фильтратом натрия, фильтруют, и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией над диоксидом кремния (5-15% EtOAc/петролейный эфир) с получением указанного в заголовке соединения. МС: 150,2 (M-1).
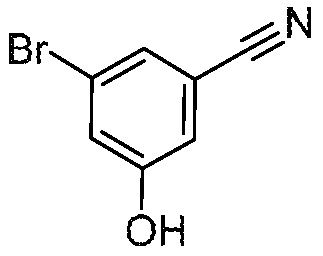
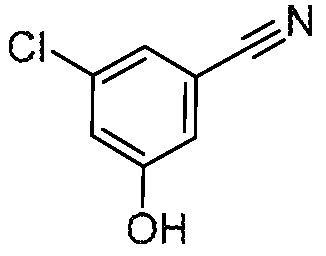
Следующие промежуточные соединения в таблице 1 покупают из коммерческих источников.
ТАБЛИЦА 1
Раздел «Промежуточное соединение B»
Промежуточное соединение B01
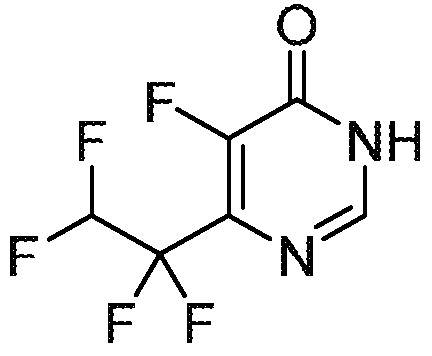
5-фтор-6-(1,1,2,2-тетрафторэтил)-3,4-дигидропиримидин-4-он
Стадия 1: 2,2,3,3-тетрафторпропановая кислота
К раствору гептаоксодихрома калия (1782 г, 6,06 моль) в серной кислоте (2097 г, 21,38 моль) и воде (2400 мл), добавляют 2,2,3,3-тетрафторпропан-1-ол (800 г, 6,06 моль) по каплям при перемешивании при 100°С. Полученный раствор перемешивают при 100°С в течение 5 ч при кипении с обратным холодильником, и затем экстрагируют МТБЭ (4×2L). Органический слой сушат безводным фильтратом натрия и концентрируют при пониженном давлении с получением указанного в заголовке соединения и используют как есть на следующей стадии.
Стадия 2: 2,2,3,3-тетрафтор-N-метокси-N-метилпропанамид
К раствору 2,2,3,3-тетрафторпропановой кислоты (неочищенный продукт с предыдущей стадии, 45% чистота, 1007 г, 3,15 моль) в ТГФ (4600 мл), добавляют сульфурооил дихлорид (787,2 г, 6,62 моль) по каплям при 0°С, затем по каплям добавляют ДМФ (753,4 г, 10,31 моль). После перемешивания при КТ в течение 45 мин, реакционную смесь охлаждают до 0°С, и затем обрабатывают гидрохлорида метокси(метил)амина (1222,5 г, 12,53 моль), и ТЭА (1913 г, 18,91 моль) по каплям. Полученную смесь перемешивают при КТ в течение 5 ч, и затем гасят ледяной водой (2 л), и экстрагируют МТБЭ (3 л). Органический слой промывают насыщ. водн. NaHCO3, насыщенным раствором соли, сушат над безводным фильтратом натрия, фильтруют и дистиллируют с получением указанного в заголовке соединения.
Стадия 3: Этил 2,4,4,5,5-пентафтор-3-оксопентаноат
К раствору 2,2,3,3-тетрафтор-N-метокси-N-метилпропанамида (470 г, 2,49 моль) в ТГФ (4700 мл), добавляют этил 2-фторацетат (316,2 г, 2,98 моль), 1M раствор LiHMDS в ТГФ (3729 мл, 3,73 моль) при -78°С. Полученную смесь перемешивают при -78°С в течение 2 ч, и затем гасят насыщ. водн. NH4Cl (1 л). После доведения рН значения раствора до 3 с HCl (1M), реакционную смесь экстрагируют МТБЭ (3×2L). Органический слой промывают насыщенным раствором соли, сушат над безводным фильтратом натрия, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения, которое применяют непосредственно на следующей стадии.
Стадия 4: 5-фтор-6-(1,1,2,2-тетрафторэтил)-3,4-дигидропиримидин-4-он
К раствору этил 2,4,4,5,5-пентафтор-3-оксопентаноата (533 г, 2,28 моль) в метаноле (5330 мл), добавляют ацетат формамидина (1185,1 г, 11,38 моль), и метоксид натрия (492 г, 9,11 моль). Полученную смесь перемешивают при КТ в течение 2 ч, затем гасят ледяной водой (1,5 л). После доведения рН значения раствора до 3 с HCl(2M), полученную смесь экстрагируют МТБЭ (3 × 1 л). Объединенные органические слои сушат над безводным фильтратом натрия, фильтруют и концентрируют при пониженном давлении. Остаток очищают перекристаллизацией из МТБЭ/ПЭ (1:5) с получением указанного в заголовке соединения. МС: 212,9 (M-1). 1H ЯМР: (300 МГц, CD3OD): δ 8,10 (1H, с), 6,67~6,38(1H, м).
Следующие промежуточные соединения в таблице 2 получают согласно схеме C с использованием методике, описанной для синтеза промежуточного соединения B01 с применением известного фторированного алкилового спирта или его соответствующей кислоты или метилового эфира.
ТАБЛИЦА 2
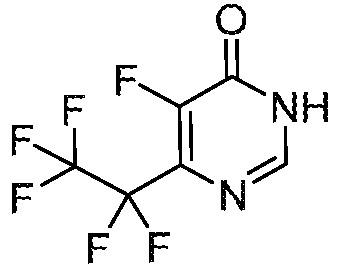
Промежуточное соединение B05
4-хлор-5-фтор-6-метоксипирмидин
К раствору 4,6-дихлор-5-фторпирмидина (8,0 г, 47,9 ммоль) в MeOH (80 мл) добавляют метоксид натрия (3,05 г, 56,5 ммоль) при 0°C. Полученную реакционную смесь перемешивают при 20°C в течение 2 ч, затем гасят водой (20 мл) и затем экстрагируют EA (3×20 мл). Органический слой промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения. МС: 163,1 (M+1). 1H ЯМР (400 МГц, ДМСО-d6): δ 8,45 (с, 1H), 4,03 (с, 1H).
Промежуточное соединение B06
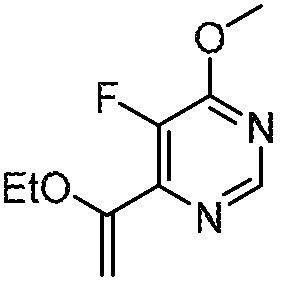
4-(1-этоксивинил)-5-фтор-6-метоксипирмидин
К раствору 4-хлор-5-фтор-6-метоксипирмидин (5,2 г, 28,8 ммоль), трибутил (1-этоксивинил) станнан (12,48 г, 34,5 ммоль) в ДМФ (50 мл) добавляют Pd(Ph3P)4 (0,5 г, 0,433 ммоль). Полученную реакционную смесь перемешивают при 100°C в течение 4 ч под N2 атмосферой. После завершения, реакционную смесь разбавляют водой (30 мл), экстрагируют EtOAc (3×100 мл). Объединенные органические слои обрабатывают насыщ. водн. KF (80 мл) и перемешивают при КТ в течение 0,5 ч, затем пропускают через слой фильтра CELITE®. Фильтрат промывают водой, насыщенным раствором соли, и сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (10-90% EtOAc/ПЭ) to с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, CDCl3): δ 8,49 (с, 1H), 5,08 (д, J=2,8 Гц, 1H), 4,64 (д, J=3,2 Гц, 1H), 4,06(с, 3H), 3,93 (м, 2H),1,42(м, 3H).
Промежуточное соединение B07
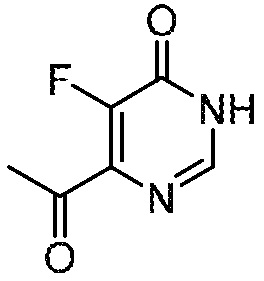
6-ацетил-5-фторпирмидин-4(3H)-он
К раствору 4-(1-этоксивинил)-5-фтор-6-метоксипирмидина (4,5 г, 20,43 ммоль) в ТГФ (30 мл) добавляют 6M водн. HCl (20 мл, 120 ммоль) по каплям при 0°C. Полученный реакционный раствор перемешивают при 20°C в течение 18 ч, и затем концентрируют при пониженном давлении, сохраняя температуру бани 40°C до получения указанного в заголовке соединения. 1H ЯМР (400 МГц, d6-ДМСО): δ 8,15(с, 1H), 2,50(с, 3H).
Промежуточное соединение B08
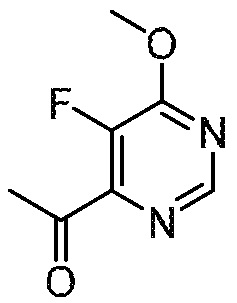
1-(5-фтор-6-метоксипирмидин-4-ил)этанон
К перемешиваемому раствору 4-(1-этоксивинил)-5-фтор-6-метоксипирмидина, B06 (12 г, 60,5 ммоль) в АЦН (100 мл) при 0°C, по каплям добавляют 4M раствор хлористоводородной кислоты в 1,4-диоксане (30 мл, 120 ммоль). Полученный раствор перемешивают при комнатной температуре в течение 1 ч, и затем осторожно гасят ледяной водой (200 мл) и экстрагируют EtOAc. Объединенные органические слои сушат над безводным фильтратом натрия, фильтруют и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (0-20% EtOAc/петролейный эфир) с получением указанного в заголовке соединения. МС: 171,4 (M+1).
Промежуточное соединение B09
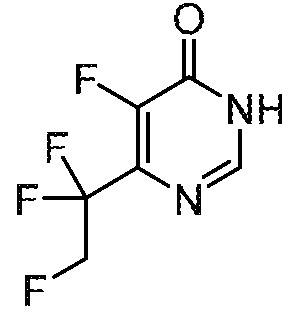
5-фтор-6-(1,1,2-трифторэтил)пирмидин-4(3H)-он
Стадия 1: 2-фтор-1-(5-фтор-6-метоксипирмидин-4-ил)этанон
Раствор 4-(1-этоксивинил)-5-фтор-6-метоксипирмидина, B06 (0,2 г, 0,86 ммоль) в АЦН (3 мл) добавляют по каплям к суспензии бис(тетрафторбората) 1-хлорметил-4-фтор-1,4-диазониабицикло[2,2,2]октан (0,456 г, 1,29 ммоль) в АЦН (2 мл) и воде (1 мл) over 4 ч, поддерживая температуру ниже 15°C. Реакционную смесь затем гасят насыщ. водн. NaHCO3 (10 мл) и перемешивают в течение 10 мин. После завершения, смесь экстрагируют ЭА (3×10 мл). Объединенные органические слои промывают насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения. МС: 189,1 (M+1).
Стадия 2: 5-фтор-4-метокси-6-(1,1,2-трифторэтил)пирмидин
К раствору 2-фтор-1-(5-фтор-6-метоксипирмидин-4-ил)этанона (0,15 г, 0,60 ммоль) в ДХМ (2 мл) добавляют трифторид диэтиламиносеры (0,578 г, 3,59 ммоль). Полученную реакционную смесь перемешивают при 20°C в течение 4 ч, и затем разбавляют водой и экстрагируют EtOAc (3×50 мл). Объединенные органические слои концентрируют при пониженном давлении. Остаток очищают препаративной ТСХ (20% EtOAc/П.Э.) с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, CDCl3) δ 8,56 (с, 1H), 4,99 (т, J=12,0 Гц, 1H), 4,88 (т, J=12,0 Гц, 1H), 4,12 (с, 3H).
Стадия 3: 5-фтор-6-(1,1,2-трифторэтил)пирмидин-4(3H)-он
К смеси 5-фтор-4-метокси-6-(1,1,2-трифторэтил)пирмидина (0,05 г, 0,238 ммоль) и KI (0,119 г, 0,714 ммоль) в АЦН (15 мл), добавляют хлортриметилсилан (0,078 г, 0,714 ммоль) при КТ. Полученную смесь перемешивают при 80°C в течение 4 ч, и затем разбавляют EtOAc, промывают водн. Na2S2O3 и насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения. МС: 197,1 (M+1).
Промежуточное соединение B10
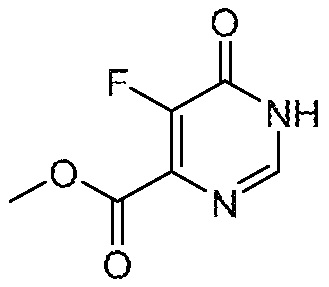
5-фтор-6-метоксипирмидин-4-карбоксилат
В 20 л герметично закрытую пробирку, продутую N2, помещают раствор 4-хлор-5-фтор-6-метоксипирмидина, B05 (410 г, 2,52 моль) в MeOH (8,2 л), триэтиламин (1,247 кг, 12,32 моль), PdCl2(dppf) (201 г, 246,32 ммоль). Затем помещают для карбонилирования баллон с CO при 2 бар и нагревают при 50°C в течение 16 ч. Твердые вещества отфильтровывают. Фильтрат концентрируют при пониженном давлении для удаления MeOH, и затем разбавляют EtOAc (4 л). Твердые вещества отфильтровывают. Фильтрат снова концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (10% EtOAc/гексан) и затем перекристаллизовывают (пропан-2-ол:H2O=2:7) с получением указанного в заголовке соединения МС: 187 (M+1). 1H ЯМР (400 МГц, CDCl3): δ 5,587 (с, 1H), 4,109-4,075 (с, 3H), 4,003-3,935 (с, 3H).
Промежуточное соединение B11
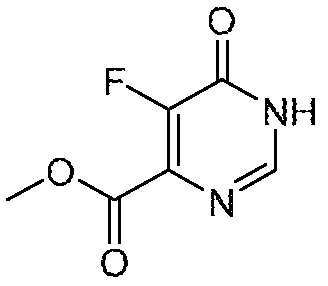
Метил 5-фтор-6-гидроксипирмидинe-4-карбоксилат
Триметилсилилхлорид (25,7 мл, 201 ммоль) медленно добавляют к перемешиваемой суспензии метил 5-фтор-6-метоксипирмидин-4-карбоксилата, B09 (25 г, 134 ммоль) и йодида калия (33,4 г, 201 ммоль) в АЦН (300 мл) при 25°C. Полученную смесь перемешивают при 25°C в течение 2 ч. ЖХМС показывает завершение реакции. Реакционную смесь гасят метанолом (100 мл) и концентрируют с получением указанного в заголовке соединения, которое применяют на следующей стадии без дальнейшей очистки. МС: 173,0 (M+1). 1H ЯМР (400 МГц, ДМСО-d6) 8,12 (с, 1H), 2,59 (с, 3H).
Промежуточное соединение B12
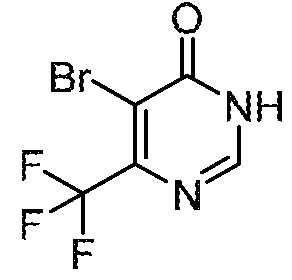
5-бром-6-(трифторметил)пирмидин-4(3H)-он
Это промежуточное соединение получают бромированием 6-(трифторметил)пирмидин-4(3H)-она с применением методик, описанных в US20140100231(A1).
Промежуточное соединение B13
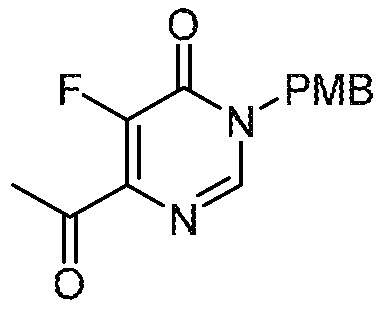
6-ацетил-5-фтор-3-(4-метоксибензил)пирмидин-4(3H)-он
К раствору 6-ацетил-5-фторпирмидин-4(3H)-она, B07 (1,0 г, 5,44 ммоль) в ДМФ (10 мл) добавляют K2CO3 (2,257 г, 16,33 ммоль). Полученную реакционную смесь перемешивают при 20°C в течение 10 мин, затем добавляют 1-(хлорметил)-4-метоксибензол (1,023 г, 6,53 ммоль). Реакционную смесь перемешивают при 20°C в течение еще 6 ч, и затем разбавляют водой (50 мл) и экстрагируют EtOAc (3×50 мл). Объединенные органические слои промывают водой, насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (50% EtOAc/ПЭ) с получением указанного в заголовке соединения. МС: 277,1 (M+1). 1H ЯМР (400 МГц, CDCl3): δ 8,01 (с, 1H), 7,29 (м, 2H), 6,89 (д, J =8,8, 2H), 5,09 (с, 2H), 3,81 (с, 2H), 2,58 (д, J =8,8, 3H).
Следующие промежуточные соединения в ТАБЛИЦЕ 3 получают в аналогичных условиях, что и в вышеуказанной методике синтеза, описанной для синтеза промежуточного соединения B13 с применением соответствующего промежуточного соединения B.
ТАБЛИЦА 3
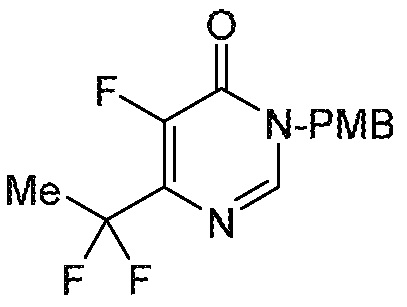
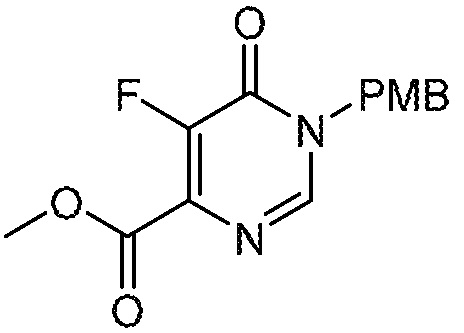
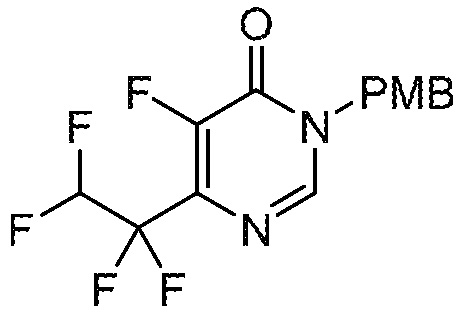
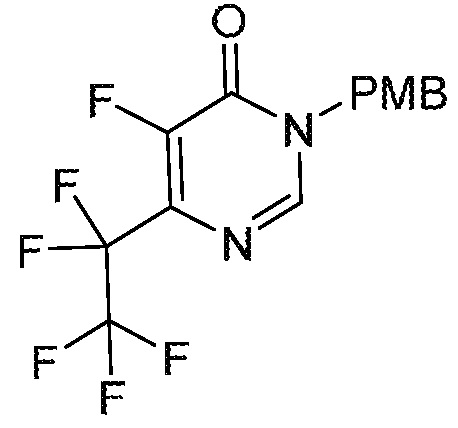
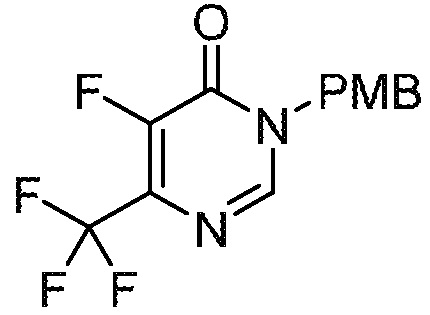
Промежуточное соединение B19
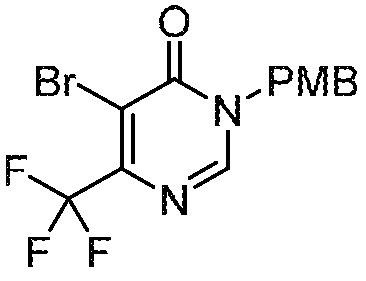
5-бром-3-(4-метоксибензил)-6-(трифторметил)пирмидин-4(3H)-он
Это промежуточное соединение получают с применением методик, описанных в US20140100231(A1).
Промежуточное соединение B20
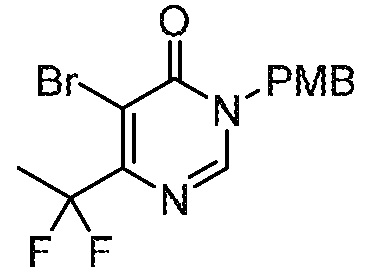
5-бром-6-(1,1-дифторэтил)-3-(4-метоксибензил)пирмидин-4(3H)-он
Это промежуточное соединение получают с применением методик, описанных в US20140100231(A1).
Раздел «Промежуточное соединение C»
Промежуточное соединение C01
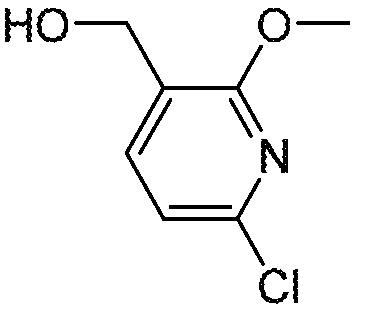
(6-хлор-2-метоксипиридин-3-ил)метанол
Стадия 1: 6-хлор-2-метоксиникотинальдегид
К перемешиваемой смеси t-BuLi (23,94 мл, 38,3 ммоль) в ТГФ (100 мл) при -78°C, добавляют 2-хлор-6-метоксипиридин (5 г, 34,8 ммоль). Полученную смесь перемешивают при -78°C в течение 1 часа, и затем ДМФ (3,51 мл, 45,3 ммоль) добавляют и реакционную смесь перемешивают при -78°C в течение 1,5 ч, и затем гасят уксусной кислотой (3,99 мл, 69,7 ммоль) при -78°C. Затем смесь нагревают до 20°C в течение 30 минут. Смесь нейтрализуют насыщенным водным раствором NaHCO3 (200 мл) и экстрагируют EtOAc (3×50 мл). Объединенные органические фракции промывают насыщенным раствором соли (3× 50 мл), сушат над безводным Na₂SO₄, фильтруют и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (1-2% EtOAc/изогексан) с получением указанного в заголовке соединения.
Стадия 2: (6-хлор-2-метоксипиридин-3-ил)метанол
К суспензии 6-хлор-2-метоксиникотинальдегида (1 г, 5,83 ммоль) в MeOH (12 мл) при 0°C, добавляют боргидрид натрия (0,140 г, 3,70 ммоль) порциями в течение 20 минут. Полученную смесь перемешивают при 0°C в течение 40 минут, затем гасят водой и экстрагируют ДХМ (3×5 мл). Объединенные органические слои промывают насыщенным раствором соли, сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения, которое применяют на следующей стадии как есть. МС: 174,1 (M+1).
Промежуточное соединение C02
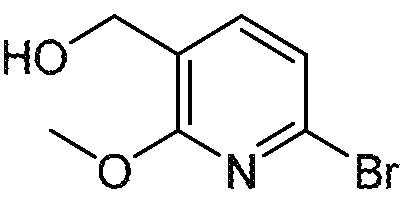
(6-бром-2-метоксипиридин-3-ил)метанол
Стадия 1: 6-бром-2-метоксиникотиновая кислота
К перемешиваемому раствору 2,2,6,6-тетраметилпиперидина (3,76 г, 26,6 ммоль) в ТГФ (50 мл) при -78°C, добавляют 2,5 M раствор n-BuLi в ТГФ (10,64 мл, 26,6 ммоль) по каплям. Полученную смесь перемешивают при той же температуре в течение 60 минут, затем раствор 2-бром-6-метоксипиридина (5 г, 26,6 ммоль) в ТГФ добавляют по каплям. Реакционную смесь перемешивают при той же температуре в течение 60 минут и обрабатывают измельченным сухим льдом добавляют и перемешивают в течение 3 часов при -78°C, и затем медленно нагревают до комнатной температуры и разбавляют водой. И затем pH смеси доводят до 3-4 с использованием конц. HCl. Смесь экстрагируют EtOAc (2×250 мл). Объединенные органические слои промывают насыщенным раствором соли, сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (50% EtOAc/петролейный эфир) с получением указанного в заголовке соединения. МС: 230,2 и 232,0 (M-1).
Стадия 2: (6-бром-2-метоксипиридин-3-ил)метанол
К перемешиваемому раствору 6-бром-2-метоксиникотиновой кислоты (2,3 г, 9,91 ммоль) в ТГФ (20 мл), добавляют 1M раствор АГЛ в ТГФ (19,82 мл, 19,82 ммоль) по каплям при -20°C. Полученную смесь перемешивают при комнатной температуре в течение 60 минут, и затем гасят водой (0,5 мл), 10% NaOH водным раствором и водой. Полученную смесь перемешивают в течение 30 минут и фильтруют через слой CELITE®. Фильтровальную лепешку промывают EtOAc. Фильтрат концентрируют при пониженном давлении. Остаток очищают сначала колоночной хроматографией на диоксиде кремния (30% EtOAc/петролейный эфир), затем с применением ВЭЖХ с обращенной фазой (АЦН/вода с 0,1% ТФК модификатором) с получением указанного в заголовке соединения. МС: 217,4 и 219,4 (M+1).
Промежуточное соединение C03
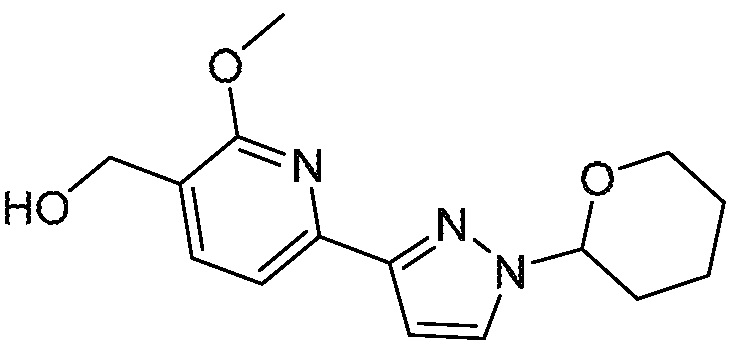
(2-метокси-6-(1-(тетрагидро-2H-пиран-2-ил)-1H-пиразол-3-ил)пиридин-3-ил)метанол
Смесь 1-(тетрагидро-2h-пиран-2-ил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1h-пиразола (113 мг, 0,406 ммоль), (6-хлор-2-метоксипиридин-3-ил)метанола, C01 (47 мг, 0,271 ммоль), и трехосновного фосфата калия (172 мг, 0,812 ммоль) в 1,4-диоксане (2 мл) и воде (1,0 мл) продувают азотом в течение 5 минут и затем добавляют [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (19,81 мг, 0,027 ммоль). Полученную смесь перемешивают при 80°C в течение 15 ч, и затем пропускают через фильтр. Фильтрат концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (0-100% EtOAc/гексан) с получением указанного в заголовке соединения. МС: 290,1 (M+1).
Следующие промежуточные соединения в ТАБЛИЦЕ 4 получают с применением методики, аналогичной описанной для синтеза промежуточного соединения C03 с применением соответствующей коммерчески доступной бороновой кислоты или бороната.
ТАБЛИЦА 4
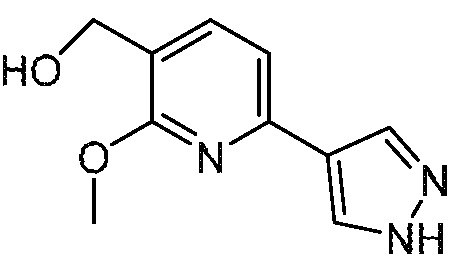
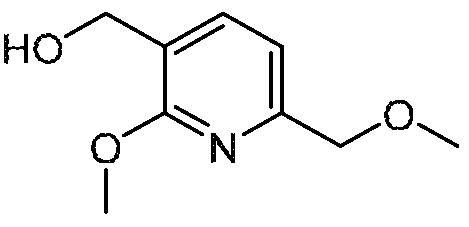
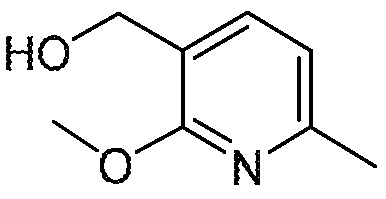
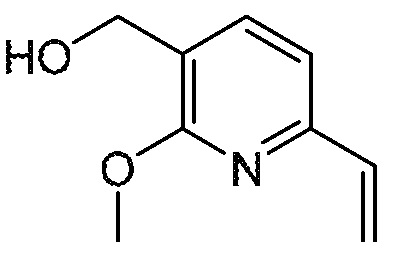
Промежуточное соединение C08
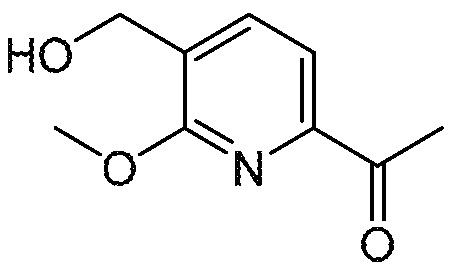
1-(5-(хлорметил)-6-метоксипиридин-2-ил)этанон
Стадия 1: (6-(1-этоксивинил)-2-метоксипиридин-3-ил)метанол и 1-(5-(гидроксиметил)-6-метоксипиридин-2-ил)этанон
К раствору (6-хлор-2-метоксипиридин-3-ил)метанола, C01 (1 г, 5,76 ммоль) и трибутил(1-этоксивинил)станнана (4,16 г, 11,52 ммоль) в ДМФ (5 мл) добавляют Pd(Ph3P)4 (0,200 г, 0,173 ммоль). Полученную смесь перемешивают при 100°C в течение 4 ч под N2 атмосферой, и затем охлаждают до комнатной температуры и разбавляют водой (20 мл), и экстрагируют EtOAc (3×30 мл). Объединенные органические слои обрабатывают насыщенным водным раствором KF (45 мл) и 4M HCl водным раствором, перемешивают при 20°C в течение 0,5 ч, затем промывают насыщенным раствором соли (2×75 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (1-25% EtOAc/петролейный эфир) с получением указанного в заголовке соединения. МС: 182,1 (M+1).
Промежуточное соединение C09
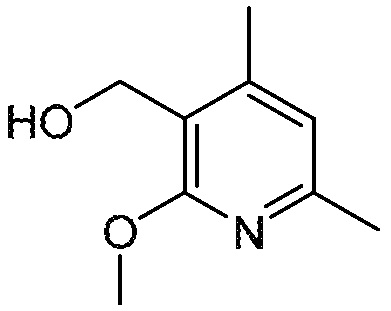
(4-хлор-6-метокси-2-метилпирмидин-5-ил)метанол
Стадия 1: метил 2-хлор-4,6-диметилникотинат
К 2-хлор-4,6-диметилникотиновой кислоте (2 г, 10,78 ммоль) медленно добавляют тионилхлорид (20 мл, 275 ммоль). Полученную смесь перемешивают при 80°C в течение 2 ч и затем концентрируют при пониженном давлении. Остаток обрабатывают MeOH (20 мл) при 0°C, и затем реакционную смесь перемешивают при 20°C в течение 16 ч и концентрируют при пониженном давлении с получением указанного в заголовке соединения, которое применяют на следующей стадии без дальнейшей очистки. МС: 200,1 (M+).
Стадия 2: метил 2-метокси-4,6-диметилникотинат
К раствору метил 2-хлор-4,6-диметилникотината (2,206 г, 11,05 ммоль) в MeOH (20 мл) добавляют метанолат натрия (3,58 г, 66,3 ммоль) при 0°C. Полученную смесь перемешивают при 60°C в течение 24 ч, и затем гасят водой (20 мл) и затем экстрагируют ДХМ (3×20 мл). Объединенные органические слои промывают насыщенным раствором соли (3×10 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения, которое применяют на следующей стадии без дальнейшей очистки. МС: 196,1 (M+1).
Стадия 3: 2-метокси-4,6-диметилпиридин-3-ил)метанол
К раствору метил 2-метокси-4,6-диметилникотината (500 мг, 2,56 ммоль) в ТГФ (5 мл) добавляют АГЛ (97 мг, 2,56 ммоль) при 0°C. Полученную смесь перемешивают при 20°C в течение 1 часа, и затем гасят насыщенным раствором хлорида аммония и экстрагируют ДХМ (3×10 мл). Объединенные органические слои промывают насыщенным раствором соли (20 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают препаративной ТСХ (25% EtOAc/петролейный эфир) с получением указанного в заголовке соединения. МС: 168,3 (M+1).
Промежуточное соединение C10
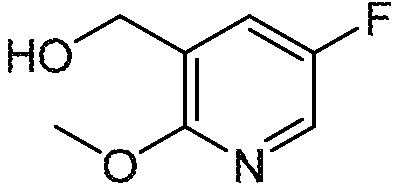
(5-фтор-2-метоксипиридин-3-ил)метил метансульфонат
Стадия 1: 5-фтор-2-метоксиникотиновая кислота
Смесь метоксида натрия (5,70 г, 106 ммоль) и метил 2-хлор-5-фторникотината (2 г, 10,55 ммоль) в ТГФ (15 мл) перемешивают при 100°C в течение 48 ч, и затем разбавляют H2O (30 мл) и подкисляют HCl (1 M) до pH=3-4, и затем экстрагируют EtOAc (3×20 мл). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения, которое применяют непосредственно на следующей стадии без дальнейшей очистки. МС: 170 (M-1).
Стадия 2: (5-фтор-2-метоксипиридин-3-ил)метанол
К раствору 5-фтор-2-метоксиникотиновая кислота (800 мг, 4,67 ммоль) в ТГФ (10 мл) добавляют АГЛ (266 мг, 7,01 ммоль). Полученную смесь перемешивают при 25°C в течение 5 минут, затем гасят водой (0,27 мл) и водным раствором NaOH (0,27 мл). Смесь фильтруют. Фильтрат экстрагируют EtOAc (3×30 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения, которое применяют на следующей стадии без очистки. МС: 158 (M+1).
Промежуточное соединение C11
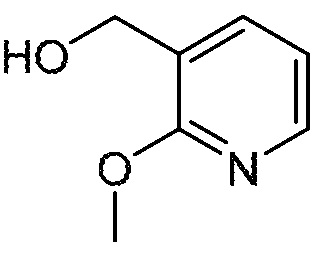
(2-метоксипиридин-3-ил)метанол
Стадия 1: метил 2-метоксиникотинат
К перемешиваемому раствору 2-метоксиникотиновой кислоты (1 г, 6,53 ммоль) в метанол (10 мл), добавляют H2SO4 (0,696 мл, 13,06 ммоль) при 0°C. Полученную смесь перемешивают при 65°C в течение 6 ч, и затем концентрируют при пониженном давлении с получением указанного в заголовке соединения. МС: 168,4 (M+1).
Стадия 2: (2-метоксипиридин-3-ил)метанол
К перемешиваемому раствору метил 2-метоксиникотината (500 мг, 2,99 ммоль) в ТГФ (6 мл) медленно добавляют 1M раствор АГЛ в ТГФ (5,98 мл, 5,98 ммоль) при 0°C. Полученную смесь нагревают до комнатной температуры и перемешивают в течение 6 ч, и затем охлаждают и гасят насыщенным водным раствором Na2SO4 и EtOAc. Реакционную смесь фильтруют через слой CELITE®. Фильтровальную лепешку промывают избытком EtOAc. Фильтрат отделяют. Органический слой концентрируют при пониженном давлении с получением указанного в заголовке соединения. МС: 140,4 (M+1).
Промежуточное соединение C12
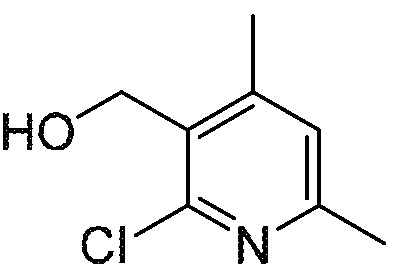
(2-хлор-4,6-диметилпиридин-3-ил)метанол
К раствору 2-хлор-4,6-диметилникотиновой кислоты (300 мг, 1,616 ммоль) растворяют в ТГФ (3 мл), добавляют 1M АГЛ раствор в ТГФ (1,616 мл, 1,616 ммоль) по каплям в течение 10 минут при 0°C. Полученную смесь перемешивают при 0°C в течение 2 ч, и затем нагревают до температуры окружающей среды и перемешивают в течение выходных. ЖХМС показала полное превращение в желаемый продукт. Реакционную смесь разбавляют водой (~1 мл) очень медленно, и выпаривают органический растворитель при пониженном давлении, и затем разделяют между EtOAc (10 мл) и водой (5 мл). Водный слой затем экстрагируют EtOAc (2×10 мл). Объединенные органические слои сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (0-100% EtOAc/гексан) с получением указанного в заголовке соединения. МС: 172,0 (M+1).
Промежуточное соединение C13
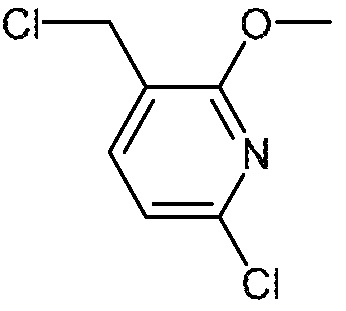
6-хлор-3-(хлорметил)-2-метоксипиридин
Раствор (6-хлор-2-метоксипиридин-3-ил)метанола, C01 (500 мг, 2,88 ммоль) в ДХМ (14 мл) обрабатывают триэтиламином (0,803 мл, 5,76 ммоль) и затем Mesyl-Cl (0,247 мл, 3,17 ммоль) по каплям. Полученную реакционную смесь перемешивают при 23°C в течение ночи, и затем разделяют между ДХМ и насыщенным водным раствором NaHCO3. Органические слои разделяют и сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (0-20% EtOAc/Гексан) с получением указанного в заголовке соединения. МС: 192,0 (M+1). 1H ЯМР (600 МГц, Хлороформ-d) δ 7,58 (д, J=7,7 Гц, 1H), 6,90 (д, J=7,7 Гц, 1H), 4,53 (с, 2H), 3,99 (с, 3H).
Следующие промежуточные соединения в ТАБЛИЦЕ 5 получают с применением методики, аналогичной описанной для синтеза промежуточного соединения C12 с подходящим промежуточным (6-метоксипирмидин-5-ил)метанолом C в качестве исходного материала, описанного в таблице C12.
ТАБЛИЦА 5
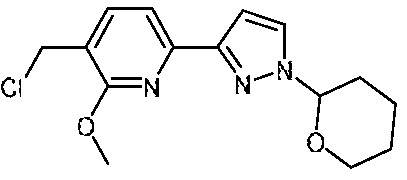
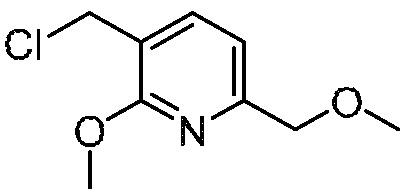
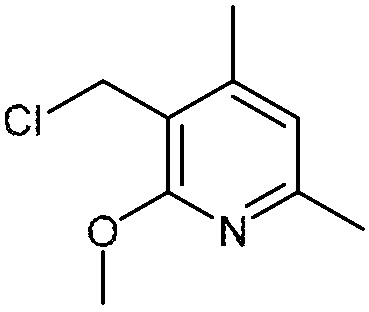
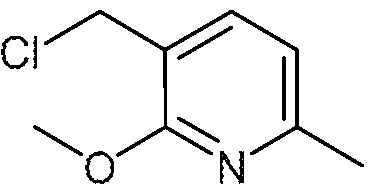
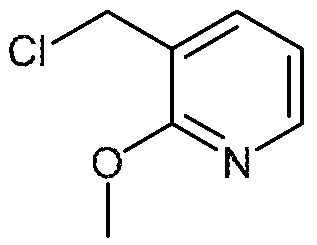
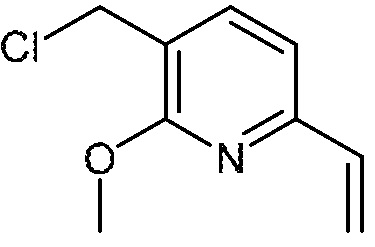
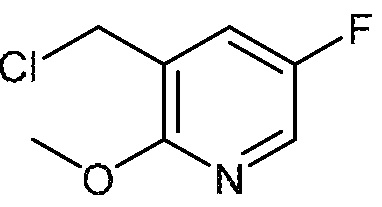
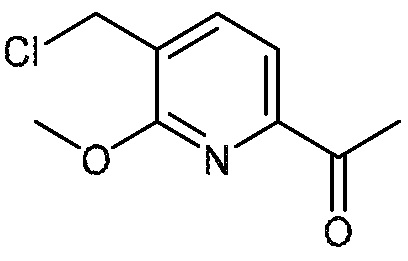
Промежуточное соединение C24
5-бром-3-(хлорметил)-2-метоксипиридин
Промежуточное соединение C24 синтезируют с применением методики, аналогичной промежуточному соединению C12 через замену промежуточного соединения C01 коммерчески доступным (5-бром-2-метоксипиридин-3-ил)метанол.
Раздел «Промежуточное соединение AB»
Промежуточное соединение AB01
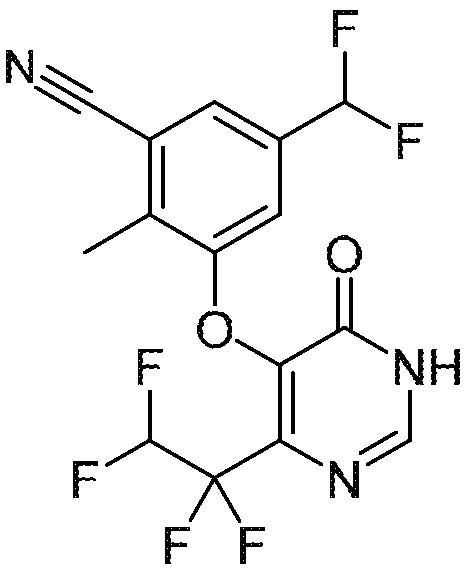
5-(дифторметил)-2-метил-3-((6-oxo-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
Стадия 1: 5-(дифторметил)-3-((1-(4-метоксибензил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил
К раствору 5-фтор-3-(4-метоксибензил)-6-(1,1,2,2-тетрафторэтил)пирмидин-4(3H)-она, B16 (7 г, 20,94 ммоль) в NMP (46,5 мл) добавляют 5-(дифторметил)-3-гидрокси-2-метилбензонитрил, A02 (4,22 г, 23,04 ммоль) и K2CO3 (8,68 г, 62,8 ммоль). Полученную смесь перемешивают при 80°C в течение ночи. ЖХМС показала полное превращение. Реакционную смесь охлаждают до комнатной температуры, затем разбавляют водой. Осадок собирают в верхней части фильтра и промывают водой (3×), затем сушат на воздухе с получением указанного в заголовке соединения. МС: 498,1 (M+1).
Стадия 2: 5-(дифторметил)-2-метил-3-((6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
Раствор 5-(дифторметил)-3-((1-(4-метоксибензил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрила (9,89 г, 19,88 ммоль) в ТФК (66,3 мл) и ТФУА (33,1 мл) перемешивают при 50°C в течение ночи. ЖХМС показала полное превращение. Реакционную смесь концентрируют при пониженном давлении. Остаток растирают с гексаном, и твердое вещество собирают в верхней части фильтра, промывают гексаном, затем сушат на воздухе с получением указанного в заголовке соединения, которое применяют непосредственно на следующей стадии без дальнейшей очистки. МС: 378,3 (M+1).
Следующие промежуточные соединения в ТАБЛИЦЕ 6 получают по методике, аналогично получению промежуточного соединения AB01, которая описана выше: SNAr реакция с применением соответствующего промежуточного соединения A и промежуточного соединения B, затем снимают защиту для удаления PMB группы с применением ТФК/ТФУА.
ТАБЛИЦА 6
(A №, B №)
(A02, B18)
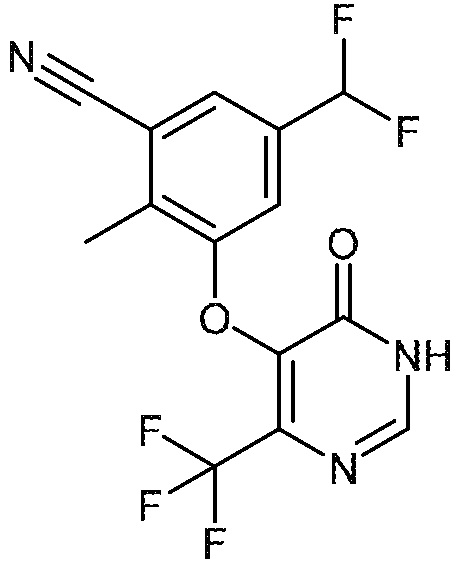
(A02, B17)
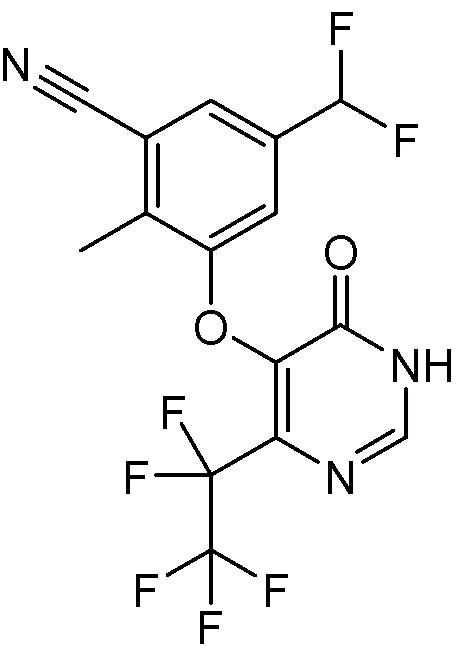
(A06, B16)
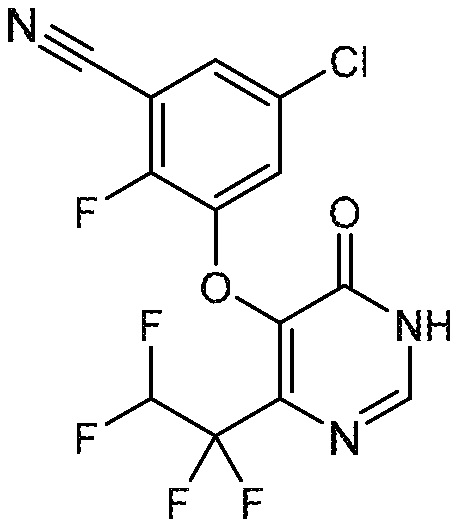
(A08, B16)
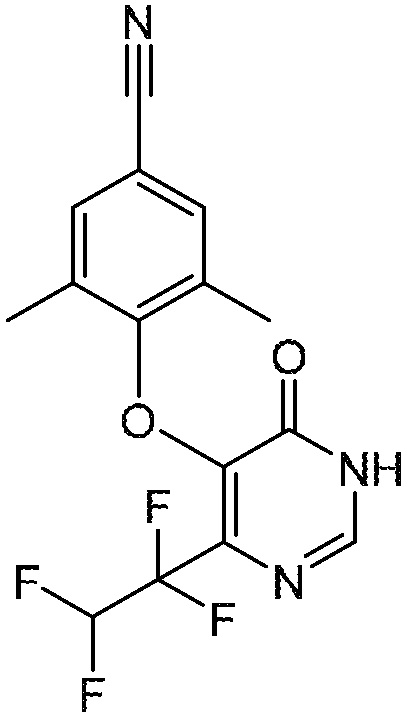
(A05, B17)
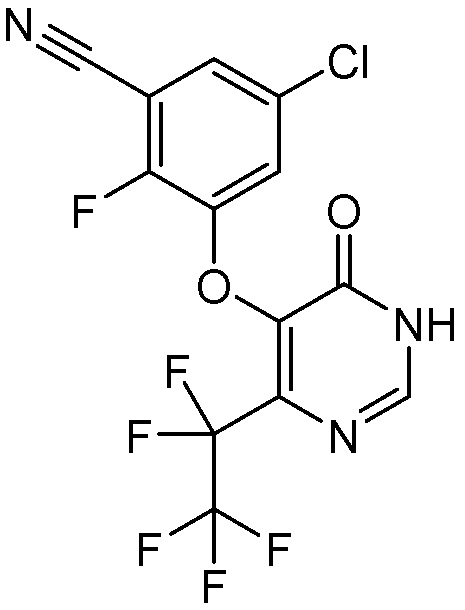
(A09, B16)
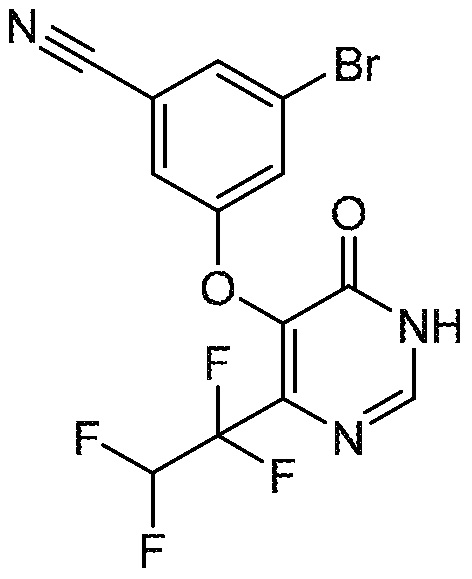
(A10, B16)
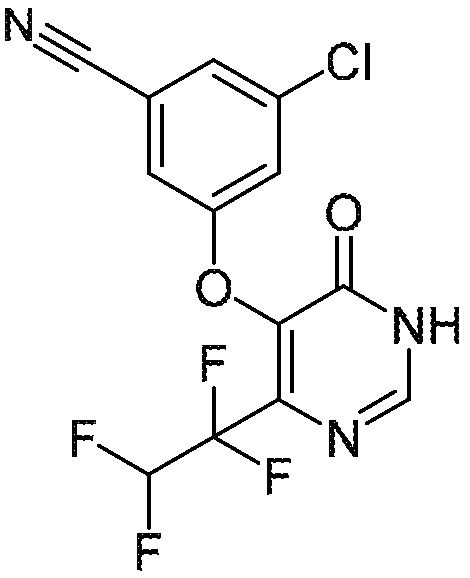
(M-1)
(A06, B16)
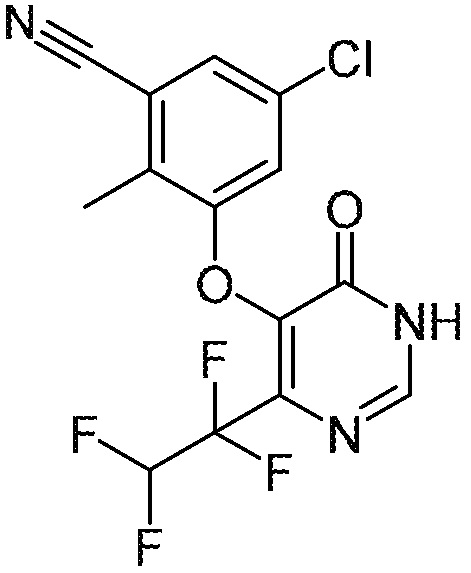
(A03, B16)
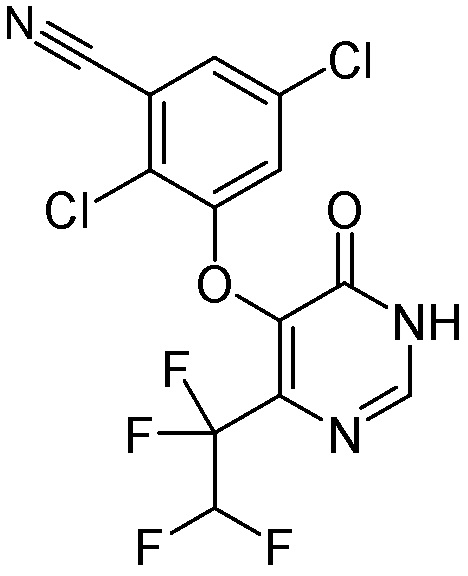
(A07, B16)
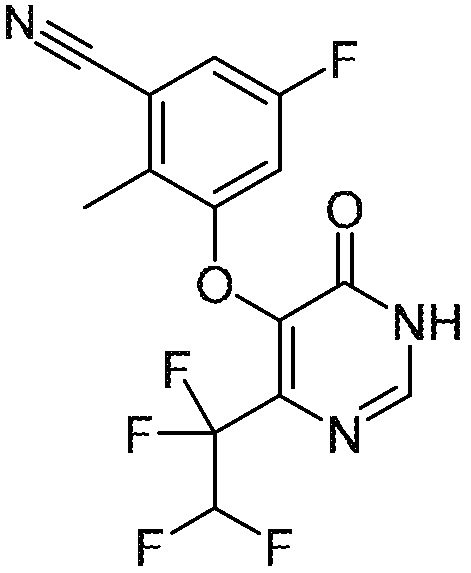
Промежуточное соединение AB12
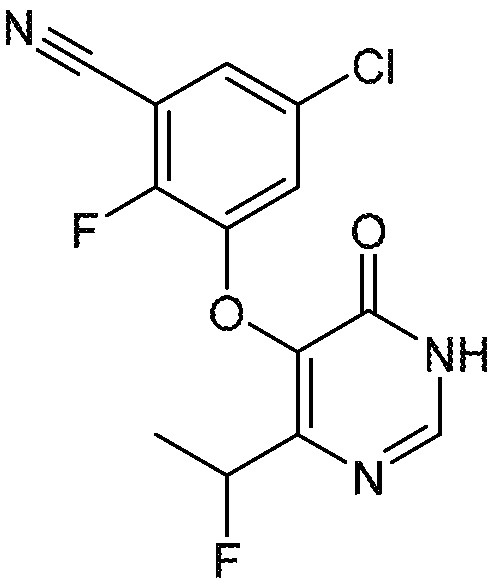
5-хлор-2-фтор-3-((4-(1-фторэтил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)бензонитрил
Стадия 1: 6-ацетил-5-(3-бром-5-хлор-2-фторфенокси)-3-(4-метоксибензил)пирмидин-4(3H)-он
К раствору 6-ацетил-5-фтор-3-(4-метоксибензил)пирмидин-4(3H)-она, B13 (2 г, 7,24 ммоль) в ДМФ (10 мл) добавляют 3-бром-5-хлор-2-фторфенол, A04 (1,959 г, 8,69 ммоль) и K2CO3 (2,001 г, 14,48 ммоль). Полученную смесь перемешивают при 60°C в течение 4 ч, и затем выливают в H2O (100 мл), экстрагируют EtOAc (3×50 мл). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (2-3,3% MeOH/ДХМ) с получением указанного в заголовке соединения.
Стадия 2: 5-(3-бром-5-хлор-2-фторфенокси)-6-(1-гидроксиэтил)-3-(4-метоксибензил)пирмидин-4(3H)-он
К раствору 6-ацетил-5-(3-бром-5-хлор-2-фторфенокси)-3-(4-метоксибензил)пирмидин-4(3H)-она (300 мг, 0,623 ммоль) в ТГФ (2 мл) добавляют 0,1 M раствор Zn(BH4)2 в ТГФ (0,934 мл, 0,093 ммоль) при -30°C и смесь перемешивают в течение 10 мин. В реакционную смесь добавляют воду (1 капля) и затем концентрируют при пониженном давлении с получением указанного в заголовке соединения.
Стадия 3: 5-(3-бром-5-хлор-2-фторфенокси)-6-(1-фторэтил)-3-(4-метоксибензил)пирмидин-4(3H)-он
К раствору 5-(3-бром-5-хлор-2-фторфенокси)-6-(1-гидроксиэтил)-3-(4-метоксибензил)пирмидин-4(3H)-она (680 мг, 1,406 ммоль) в ДХМ (10 мл) добавляют ТДАС (0,427 мл, 3,23 ммоль) при 0°C. Полученную реакционную смесь перемешивают при 0°C в течение 1 ч, и затем разбавляют водой (5 мл), экстрагируют ДХМ (3×10 мл). Объединенные органические слои промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения.
Стадия 4: 5-хлор-2-фтор-3-((4-(1-фторэтил)-1-(4-метоксибензил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)бензонитрил
К перемешиваемому раствору 5-(3-бром-5-хлор-2-фторфенокси)-6-(1-фторэтил)-3-(4-метоксибензил)пирмидин-4(3H)-она (340 мг, 0,700 ммоль) в NMP (3 мл) добавляют цианомедь (217 мг, 2,423 ммоль) под N2. Полученную смесь перемешивают при 170°C в течение 12 ч, и затем разбавляют H2O (30 мл) и EtOAc (30 мл). Смесь фильтруют через воронку CELITE®. Фильтрат экстрагируют ЭА (3×30 мл). Объединенные органические слои промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток растирают с MeOH (20 мл) с получением указанного в заголовке соединения.
Стадия 5: 5-хлор-2-фтор-3-((4-(1-фторэтил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)бензонитрил
К раствору 5-хлор-2-фтор-3-((4-(1-фторэтил)-1-(4-метоксибензил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)бензонитрила (0,217 г, 0,503 ммоль) в ТФК (1,5 мл) добавляют ТФУА (0,75 мл). Полученную смесь перемешивают при 100°C в течение 6 ч, и затем разбавляют ДХМ (10 мл), и концентрируют при пониженном давлении с получением указанного в заголовке соединения.
Промежуточное соединение AB13
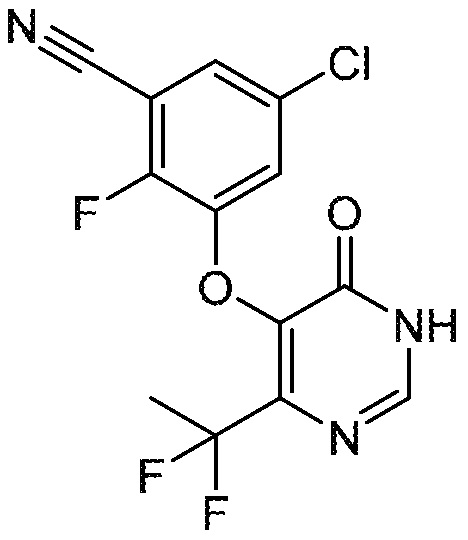
5-Хлор-3-((4-(1,1-дифторэтил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)-2-фторбензонитрил
Стадия 1: Метил 5-фтор-1-(4-метоксибензил)-6-оксо-1,6-дигидропиримидин-4-карбоксилат
Карбонат калия (16,11 г, 117 ммоль) добавляют к смеси метил 5-фтор-1-(4-метоксибензил)-6-оксо-1,6-дигидропиримидин-4-карбоксилата, B15 (21,29 г, 72,9 ммоль) и 5-хлор-2-фтор-3-гидроксибензонитрила, A05 (10 г, 58,3 ммоль) в диметилацетамиде (350 мл) при 25°C. Полученную смесь перемешивают при 90°C в течение ночи. ЖХМС показала желаемый продукт и чистую реакционную смесь. Воду (500 мл) добавляют и образуется осадок. Смесь фильтруют, и твердое вещество промывают водой (100 мл) и гексаном (200 мл) и сушат в течение ночи под высоким вакуумом с получением указанного в заголовке соединения. МС: 444 (M+1).
Стадия 2: 5-(5-Хлор-3-циано-2-фторфенокси)-1-(4-метоксибензил)-6-оксо-1,6-дигидропиримидин-4-карбоновая кислота
Триметилсиланолат калия (9,97 г, 78 ммоль) добавляют к перемешиваемой смеси метил 5-(5-хлор-3-циано-2-фторфенокси)-1-(4-метоксибензил)-6-оксо-1,6-дигидропиримидин-4-карбоксилата (23 г, 51,8 ммоль) в ТГФ (345 мл). Полученную смесь перемешивают при 25°C в течение 1 часа. ЖХМС показала только желаемый продукт. Медленно добавляют HCl (1N водн., 300 мл), и образуется белое вещество. Смесь концентрируют при пониженном давлении для удаления ТГФ. Смесь фильтруют, и белое твердое вещество промывают водой и сушат под вакуумом с получением указанного в заголовке соединения. МС: 430,0 (M+1).
Стадия 3: 5-(5-Хлор-3-циано-2-фторфенокси)- N -метокси-1-(4-метоксибензил)- N -метил-6-оксо-1,6-дигидропиримидин-4-карбоксамид
В колбу, содержащую 5-(5-хлор-3-циано-2-фторфенокси)-1-(4-метоксибензил)-6-оксо-1,6-дигидропиримидинe-4-карбоновую кислоту (20 г, 46,5 ммоль) и N, O-диметилгидроксиламина гидрохлорид (4,99 г, 51,2 ммоль) в ДМФ (200 мл), добавляют триэтиламин (25,9 мл, 186 ммоль), затем ЭДК (9,81 г, 51,2 ммоль) и HOBt (7,84 г, 51,2 ммоль) при 25°C. Полученную смесь перемешивают при 25°C в течение ночи. ЖХМС показывает завершение реакции. Добавляют воду (300 мл), и полученный осадок фильтруют и промывают водой, сушат под вакуумом с получением указанного в заголовке соединения. МС: 473,1 (M+1).
Стадия 4: 3-((4-Ацетил-1-(4-метоксибензил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)-5-хлор-2-фторбензонитрил
Бромид метилмагния (3M в ТГФ, 40 мл, 120 ммоль) добавляют по каплям к охлажденной (-78°C) смеси 5-(5-хлор-3-циано-2-фторфенокси)-N-метокси-1-(4-метоксибензил)-N-метил-6-оксо-1,6-дигидропиримидин-4-карбоксамида (16,5 г, 34,9 ммоль) в ТГФ (350 мл). Полученную смесь перемешивают при -78°C в течение 3 ч. ЖХМС показала желаемый продукт, но также исходный материал. Реакционную смесь затем нагревают до 0°C и перемешивают в течение 30 мин. ЖХМС показывают завершение реакции. Реакционную смесь гасят насыщенным водным раствором NH4Cl (500 мл) и разбавляют EtOAc (200 мл). Органический слой разделяют и водный слой экстрагируют EtOAc (2×200 мл). Объединенные органические слои промывают насыщенным раствором соли (500 мл), сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (0-100% EtOAc/гексан) с получением указанного в заголовке соединения. МС: 428,0 (M+1).
Стадия 5: 5-Хлор-3-((4-(1,1-дифторэтил)-1-(4-метоксибензил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)-2-фторбензонитрил
Deoxofluor® (15,08 мл, 82 ммоль) добавляют во флакон, содержащий 3-((4-ацетил-1-(4-метоксибензил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)-5-хлор-2-фторбензонитрил (7 г, 16,36 ммоль) и дихлорэтан (9,35 мл) при 25°C. Полученный флакон герметично закрывают и перемешивают при 70°C в течение 3 ч. ЖХМС показала желаемый продукт. Реакционную смесь охлаждают до комнатной температуры и выливают в насыщенный раствор NaHCO3 очень медленно и осторожно. Затем, органический слой разделяют и водный слой экстрагируют дихлорметаном (2×100 мл). Объединенные органические слои сушат над MgSO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией на диоксиде кремния (0-100% EtOAc/гексан) с получением указанного в заголовке соединения. МС: 450,0 (M+1).
Стадия 6: 5-Хлор-3-((4-(1,1-дифторэтил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)-2-фторбензонитрил
Колбу, содержащую смесь 5-хлор-3-((4-(1,1-дифторэтил)-1-(4-метоксибензил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)-2-фторбензонитрила (7 г, 15,56 ммоль) в трифторуксусной кислоте (58,4 мл) и трифторуксусном ангидриде (19,45 мл) перемешивают при 80°C в течение 4 ч. После охлаждения до комнатной температуры, смесь концентрируют при пониженном давлении. Остаток растворяют в дихлорметане (50 мл) и медленно добавляют гексан (100 мл) до образование белого твердого вещества. После перемешивания в течение 30 мин, белое твердое вещество собирают в верхней части фильтра, и сушат под вакуумом с получением указанного в заголовке соединения. МС: 330,0 (M+1).
Промежуточное соединение AB14
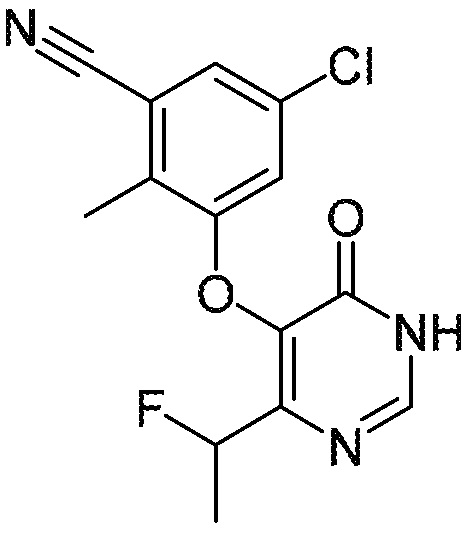
5-хлор-3-((4-(1-фторэтил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил
Стадия 1: 3-((4-ацетил-6-метоксипирмидин-5-ил)окси)-5-хлор-2-метилбензонитрил
К раствору 1-(5-фтор-6-метоксипирмидин-4-ил)этанона, B08 (2,8 г, 16,46 ммоль) в ДМФ (20 мл), добавляют карбонат калия (6,82 г, 49,4 ммоль) и 5-хлор-3-гидрокси-2-метилбензонитрил, A06 (3,31 г, 19,75 ммоль) под азотом. Полученную смесь нагревают при 40°C в течение 2 ч, и затем разбавляют водой, и экстрагируют EtOAc. Объединенные органические слои промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (20-60% EtOAc/петролейный эфир) с получением указанного в заголовке соединения. МС: 318,4 (M+1).
Стадия 2: 5-хлор-3-((4-(1-гидроксиэтил)-6-метоксипирмидин-5-ил)окси)-2-метилбензонитрил
К перемешиваемому раствору 3-((4-ацетил-6-метоксипирмидин-5-ил)окси)-5-хлор-2-метилбензонитрила (1,8 г, 5,67 ммоль) в метаноле (50 мл), добавляют гептагидрат хлорида церия(iii) (3,17 г, 8,50 ммоль), затем медленно добавляют боргидрид натрия (0,214 г, 5,67 ммоль). Полученную суспензию перемешивают при 0°C в течение 1 часа и затем гасят ледяной водой и экстрагируют EtOAc. Объединенные органические слои промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (40-80% EtOAc/петролейный эфир) с получением указанного в заголовке соединения. МС: 320,0 (M+1).
Стадия 3: 5-хлор-3-((4-(1-фторэтил)-6-метоксипирмидин-5-ил)окси)-2-метилбензонитрил
К перемешиваемому раствору 5-хлор-3-((4-(1-гидроксиэтил)-6-метоксипирмидин-5-ил)окси)-2-метилбензонитрила (1,4 г, 4,38 ммоль) в ДХМ (5 мл), добавляют Deoxofluor (1,615 мл, 8,76 ммоль) при 0°C. Полученную смесь перемешивают при комнатной температуре в течение 3 ч, и затем разбавляют ДХМ и промывают насыщенным водным раствором NaHCO3 и насыщенным раствором соли. Органический слой сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (10 40% EtOAc/петролейный эфир) с получением указанного в заголовке соединения. МС: 322,4 (M+1).
Стадия 4: 5-хлор-3-((4-(1-фторэтил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил
К перемешиваемому раствору 5-хлор-3-((4-(1-фторэтил)-6-метоксипирмидин-5-ил)окси)-2-метилбензонитрила (1,2 г, 3,73 ммоль) вАЦН (20 мл) добавляют йодид натрия (1,118 г, 7,46 ммоль) и ТМС-Cl (0,953 мл, 7,46 ммоль) под азотом. Полученную смесь нагревают при 80°С в течение 2 ч, и затем концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (40-80% EtOAc/петролейный эфир) с получением указанного в заголовке соединения. МС: 306,4 (M-1).
Промежуточное соединение AB15
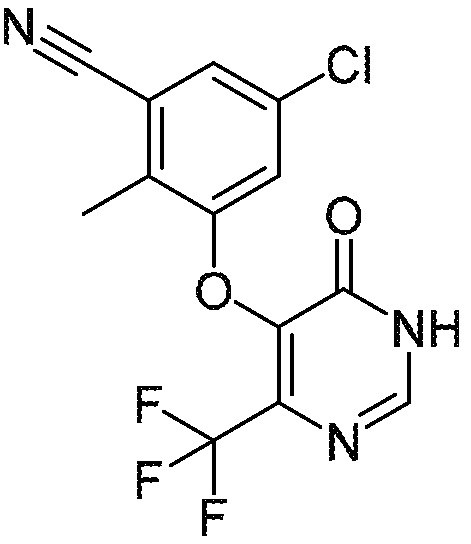
5-хлор-2-метил-3-((6-оксо-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
Стадия 1: 5-хлор-3-((1-(4-метоксибензил)-6-оксо-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил
К раствору 5-фтор-3-(4-метоксибензил)-6-(трифторметил)пирмидин-4(3H)-она, B18 (9,0 г, 29,8 ммоль), 5-хлор-3-гидрокси-2-метилбензонитрила, A06 (4,99 г, 29,8 ммоль) в ДМФ (60 мл), добавляют карбонат калия (8,23 г, 59,6 ммоль). Реакционную смесь перемешивают при 100°C в течение 16 ч и затем разбавляют водой (85 мл), и экстрагируют EtOAc (100 мл). Органический слой промывают насыщенным раствором соли (40 мл), сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (0-35% EtOAc/петролейный эфир) с получением указанного в заголовке соединения. МС: 450,8 (M+1).
Стадия 2: 5-хлор-2-метил-3-((6-оксо-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
К раствору 5-хлор-3-((1-(4-метоксибензил)-6-оксо-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрила (3 г, 6,67 ммоль) в АЦН (70 мл) и воде (5 мл), добавляют цериевый нитрат аммония (18,28 г, 33,3 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 24 ч, и затем разбавляют водой (10 мл), и экстрагируют EtOAc (200 мл). Органический слой промывают насыщенным раствором соли (70 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (0-35% EtOAc/петролейный эфир) с получением указанного в заголовке соединения. МС: 328,0 (M-1).
Промежуточное соединение AB16
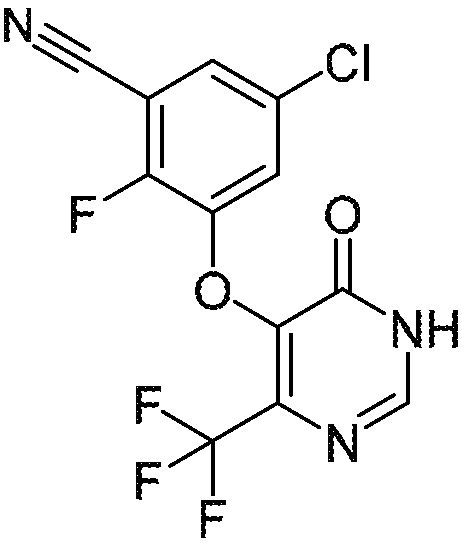
5-хлор-2-фтор-3-((6-оксо-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
Стадия 1: 5-(3-бром-5-хлор-2-фторфенокси)-3-(4-метоксибензил)-6-(трифторметил)пирмидин-4(3H)-он
К раствору 5-фтор-3-(4-метоксибензил)-6-(трифторметил)пирмидин-4(3H)-она, B18 (1 г, 3,31 ммоль) в ДМФ (10 мл), добавляют 3-бром-5-хлор-2-фторфенол, A04 (0,821 г, 3,64 ммоль) и K2CO3 (16,54 мг, 0,120ммоль) при 25°C. Реакционную смесь перемешивают при 80°C в течение 1 ч, и затем разбавляют водой (3 мл), и экстрагируют EtOAc (3×2 мл). Объединенные органические слои промывают насыщенным раствором соли (3 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают препаративной ТСХ (25% EtOAc/петролейный эфир) с получением указанного в заголовке соединения. МС: 507,2 (M+1). 1H ЯМР (400 МГц, Хлороформ-d) δ=8,03 (д, J=4,4 Гц, 1H), 7,34-7,24 (м, 3H), 7,04-6,89 (м, 2H), 6,86 (дд, J=2,4, 6,6 Гц, 1H), 5,07 (с, 2H), 3,81 (с, 3H).
Стадия 2: 5-хлор-2-фтор-3-((1-(4-метоксибензил)-6-оксо-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
Перемешиваемый раствор смеси 5-(3-бром-5-хлор-2-фторфенокси)-3-(4-метоксибензил)-6-(трифторметил)пирмидин-4(3H)-она (300 мг, 0,591 ммоль) и цианида меди(I) (265 мг, 2,95 ммоль) в NMP (3 мл) перемешивают при 170°C в течение 7 ч, затем разбавляют водой (30 мл), и затем экстрагируют EtOAc (3×5 мл). Осадок твердого вещества промывают смешанным растворителем ДХМ:MeOH:MeCN=1:1:1 (5 мл). Объединенные органические слои промывают насыщенным раствором соли (2×10 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают препаративной ТСХ (50% EtOAc/петролейный эфир) с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, Хлороформ-d) δ=8,17 (с, 1H), 7,35-7,30 (м, 1H), 7,25 (д, J=8,7 Гц, 2H), 7,14 (дд, J=2,4, 7,0 Гц, 1H), 6,98-6,86 (м, 2H), 5,06 (с, 2H), 3,79 (с, 3H).
Стадия 3: 5-хлор-2-фтор-3-((6-оксо-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
К раствору 5-хлор-2-фтор-3-((1-(4-метоксибензил)-6-оксо-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)бензонитрила (200 мг, 0,176 ммоль) в ТФК (2 мл), добавляют ТФУА (1 мл). Полученную смесь перемешивают при 110°C в течение 2 ч, затем гасят добавлением насыщенного водного раствора NaHCO3 (5 мл) и экстрагируют EtOAc (3×5 мл). Объединенные органические слои промывают насыщенным раствором соли (10 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения, которое применяют непосредственно на следующей стадии. МС: 375,0 (M+АЦН+1).
Промежуточное соединение AB17
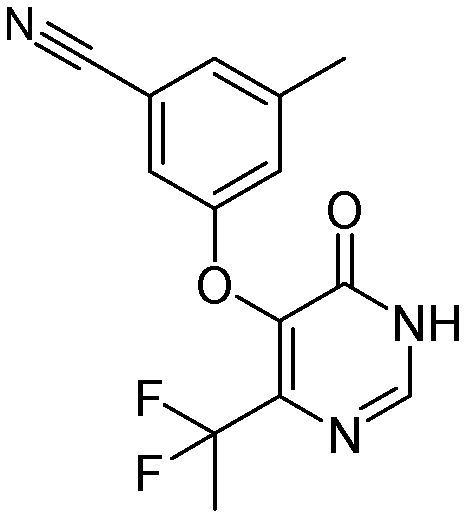
3-((4-(1,1-дифторэтил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)-5-метилбензонитрил
Стадия 1: 3-хлор-5-((4-(1,1-дифторэтил)-1-(4-метоксибензил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)бензонитрил
К смеси соединения 5-бром-6-(1,1-дифторэтил)-3-(4-метоксибензил)пирмидин-4(3H)-она, B20 (20 г, 55,7 ммоль), 3-хлор-5-гидроксибензонитрила, A10 (17,10 г, 111 ммоль) в NMP (140 мл), добавляют K2CO3 (15,39 г, 111 ммоль). Полученную смесь перемешивают при 140°C в течение 24 ч. К смеси добавляют 3-хлор-5-гидроксибензонитрил (17,10 г, 111 ммоль). Полученную смесь перемешивают при 140°C в течение еще 16 ч, затем разбавляют водой, экстрагируют EtOAc. Органический слой промывают водой и насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (6,25-50% EtOAc/петролейный эфир) с получением указанного в заголовке соединения. МС: 432,1 (M+1).
Стадия 2: 3-((4-(1,1-дифторэтил)-1-(4-метоксибензил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)-5-метилбензонитрил
Смесь 3-хлор-5-((4-(1,1-дифторэтил)-1-(4-метоксибензил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)бензонитрила (1,0 г, 2,316 ммоль), хлор[(ди(1-адамантил)-н-бутилфосфин)-2-(2-аминобифенил)]палладия(II) (155 мг, 0,232 ммоль), метилтрифторбората калия (424 мг, 3,47 ммоль) и Cs2CO3 (2264 мг, 6,95 ммоль)) в воде (5,79 мл) и 1,4-диоксане (17,4 мл) продувают N2, и затем нагревают до 130°C. Через 30 минут, смесь пропускают через слой фильтра CELITE®. Фильтрат разбавляют EtOAc (10 мл) и промывают водой. Органический слой сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (0-70% EtOAc/Гексан) с получением указанного в заголовке соединения. МС: 412,1 (M+1). 1H ЯМР (600 МГц, Хлороформ-d) δ 8,13 (с, 1H), 7,28 (д, J=8,6 Гц, 2H), 7,17 (с, 1H), 7,01 (с, 1H), 6,89 (д, J=8,6 Гц, 3H), 5,05 (с, 2H), 3,80 (с, 3H), 2,35 (с, 3H), 1,93 (т, J=18,8 Гц, 3H).
Стадия 3: 3-((4-(1,1-дифторэтил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)-5-метилбензонитрил
К раствору 3-((4-(1,1-дифторэтил)-1-(4-метоксибензил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)-5-метилбензонитрила (841,5 мг, 2,045 ммоль) в ТФК (9297 мкл) добавляют анизол (223 мкл, 2,045 ммоль) и ТФУА (930 мкл). Полученную смесь нагревают до 110°C в течение 15 минут, и концентрируют при пониженном давлении. Остаток помещают в ДХМ (20 мл) и промывают насыщенным водным раствором NaHCO3 (2×5 мл) и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (0-10% MeOH/ДХМ) с получением указанного в заголовке соединения. МС: 292,1 (M+1). 1H ЯМР (600 МГц, Хлороформ-d) δ 8,08 (с, 1H), 7,20 (с, 1H), 7,02 (с, 1H), 6,93 (с, 1H), 2,38 (с, 3H), 1,96 (т, J=18,8 Гц, 3H).
Раздел «Промежуточное соединение BC»
Промежуточное соединение BC01
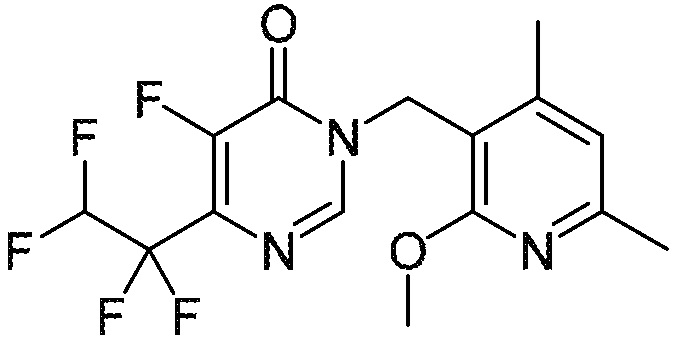
5-фтор-3-((2-метокси-4,6-диметилпиридин-3-ил)метил)-6-(1,1,2,2-тетрафторэтил)пирмидин-4(3H)-он
К смеси 5-фтор-6-(1,1,2,2-тетрафторэтил)пирмидин-4(3H)-он, B01 (48 мг, 0,224 ммоль), бромида лития (19,47 мг, 0,224 ммоль) и K2CO3 (77 мг, 0,561 ммоль) в ДМФ (2242 мкл), добавляют 3-(хлорметил)-2-метокси-4,6-диметилпиридин, C16 (41,6 мг, 0,224 ммоль). Полученную смесь нагревают до 50°C в течение ночи, и затем фильтруют и очищают ВЭЖХ с обращенной фазой (АЦН/вода с 0,1% ТФК в качестве модификатора) для выделения указанного в заголовке соединения. МС: 363,9 (M+1). 1H ЯМР (500 МГц, Хлороформ-d) δ 8,18 (с, 1H), 6,65 (с, 1H), 5,08 (с, 2H), 3,94 (с, 3H), 2,46 (с, 3H), 2,40 (с, 3H).
Следующие промежуточные соединения в ТАБЛИЦЕ 7 получают в условиях, таких как описаны выше в методике синтеза промежуточного соединения BC01 с применением соответствующего промежуточного соединения B и промежуточного соединения C.
ТАБЛИЦА 7
(B №, C №)
(B04, C23)
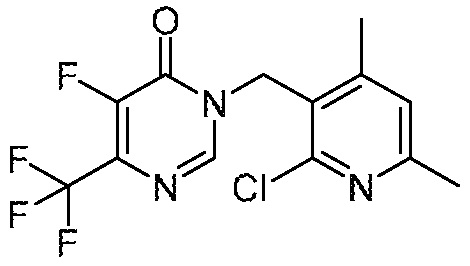
(B01, C17)
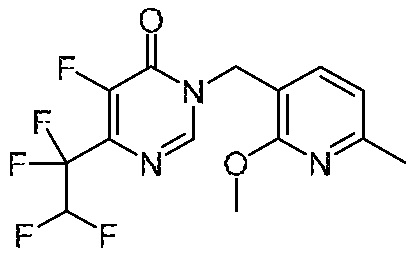
Промежуточное соединение BC04
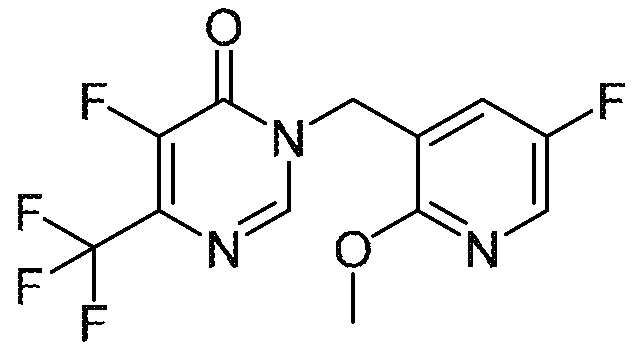
5-фтор-3-((5-фтор-2-метоксипиридин-3-ил)метил)-6-(трифторметил)пирмидин-4(3H)-он
К перемешиваемому раствору 5-фтор-6-(трифторметил)пирмидин-4(3H)-она, B04 (0,207 г, 1,139 ммоль) и 3-(хлорметил)-5-фтор-2-метоксипиридина, C20 (0,2 г, 1,139 ммоль) в NMP (5,70 мл) при комнатной температуре, добавляют карбонат калия (0,315 г, 2,278 ммоль). Полученную смесь перемешивают при комнатной температуре в течение ночи, и разбавляют водой (3 мл) и EtOAc (3 мл). Органический слой разделяют и концентрируют при пониженном давлении с получением указанного в заголовке соединения, которое применяют на следующей стадии без дальнейшей очистки. МС: 322,1 (M+1).
Следующие промежуточные соединения в ТАБЛИЦЕ 8 получают в условиях, таких как описаны выше в методике синтеза промежуточного соединения BC04 с применением соответствующего промежуточного соединения B и промежуточного соединения C.
ТАБЛИЦА 8
(B №, C №)
(B02, C20)
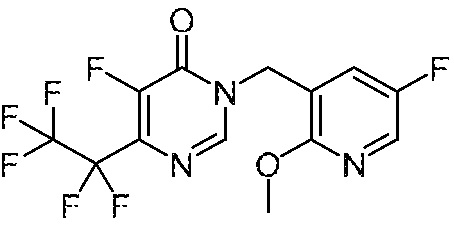
(B08, C16)
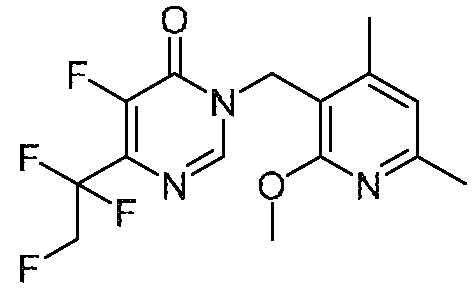
ПРИМЕР 1
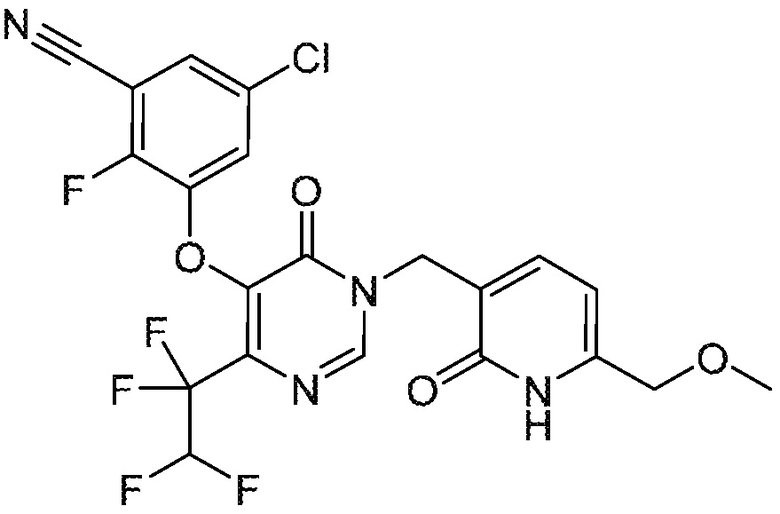
5-хлор-2-фтор-3-((1-((6-(метоксиметил)-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
Стадия 1: 5-хлор-2-фтор-3-((1-((2-метокси-6-(метоксиметил)пиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
К перемешиваемому раствору 3-(хлорметил)-2-метокси-6-(метоксиметил)пиридина, C15 (30 мг, 0,149 ммоль), 5-хлор-2 -фтор-3-((6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрила, AB04 (35 мг, 0,086 ммоль) в ДМФ (1 мл), добавляют K2CO3 (23,81 мг, 0,172 ммоль) и бромид лития (11,22 мг, 0,129 ммоль). Полученную смесь перемешивают при 15°C в течение 1 ч. ТСХ показала завершение реакции и смесь разбавляют H2O (10 мл) и экстрагируют EtOAc (3×10 мл). Объединенные органические слои промывают насыщенным раствором соли (10 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают препаративной ТСХ (50% EtOAc/петролейный эфир) с получением указанного в заголовке соединения. МС: 531 (M+1).
Стадия 2: 5-хлор-2-фтор-3-((1-((6-(метоксиметил)-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
К перемешиваемому раствору 5-хлор-2-фтор-3-((1-((2-метокси-6-(метоксиметил)пиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрила (25 мг, 0,047 ммоль) в АЦН (0,5 мл), добавляют KI (23,45 мг, 0,141 ммоль) и ТМС-Cl (0,018 мл, 0,141 ммоль) под N2. Полученную смесь перемешивают при 70°C в течение 1 часа. ТСХ показала завершение реакции. Смесь очищают ВЭЖХ с обращенной фазой (АЦН/вода с 0,1% ТФК в качестве модификатора) для выделения указанного в заголовке соединения. МС: 517 (M+1). 1H ЯМР (400 МГц, CDCl3): δ 9,79 (с, 1 H) 8,78 (с, 1 H) 7,69 (д, J=6,84 Гц, 1 H) 7,31 (м, J=4,41, 2,43 Гц, 1 H) 7,07 (дд, J=6,84, 2,43 Гц, 1 H) 6,15-6,45 (м, 1 H) 6,10 (д, J=6,84 Гц, 1 H) 4,94 (с, 2 H) 4,36 (с, 2 H) 3,45 (с, 3 H).
Следующие примеры в ТАБЛИЦЕ 9 получают по методтке, описанной выше для синтеза примера 1 с применением подходящего промежуточного соединения AB и промежуточного соединения C.
ТАБЛИЦА 9
(AB №, C №)
(AB13, C16)
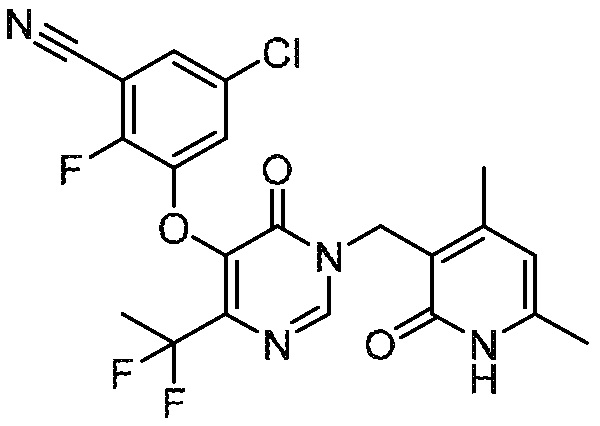
(AB13, C17)
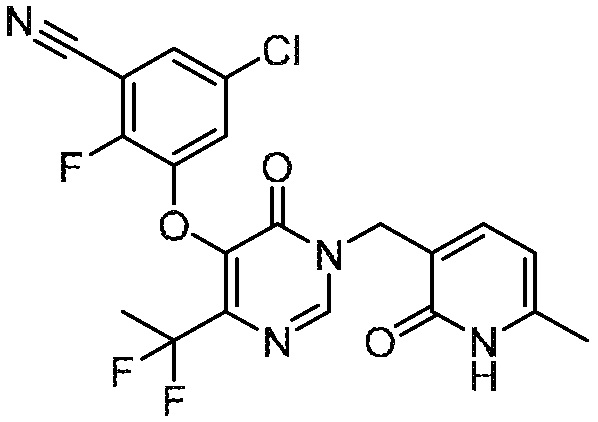
(AB16, C17)
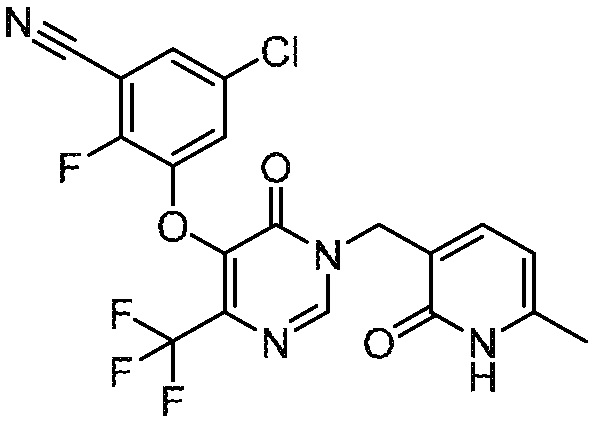
(AB01, C16)
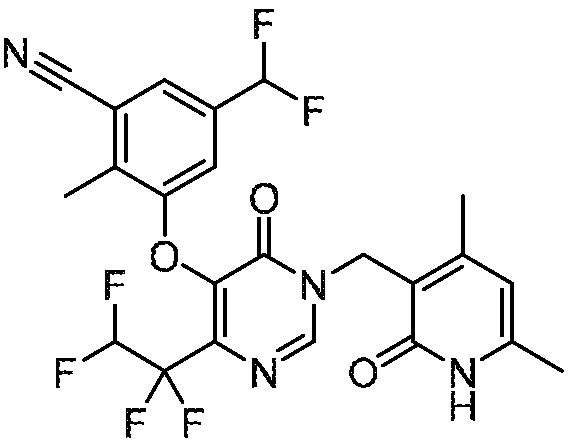
(AB08, C16)
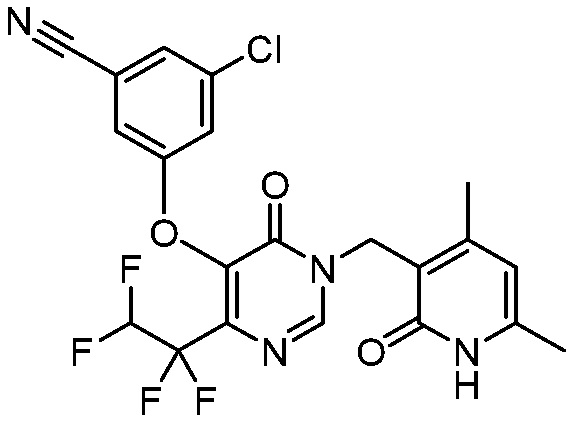
(AB07, C16)
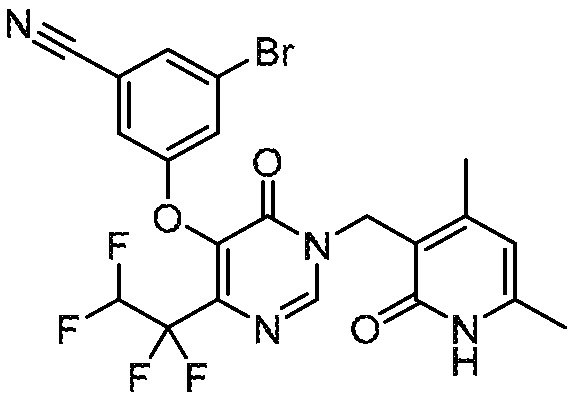
и
529,0
(AB10, C18)
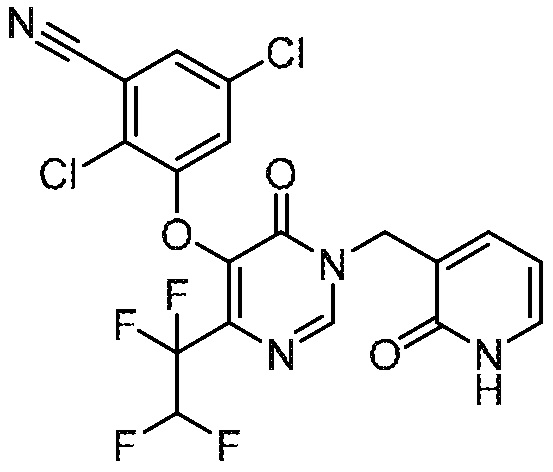
(AB11, C17)
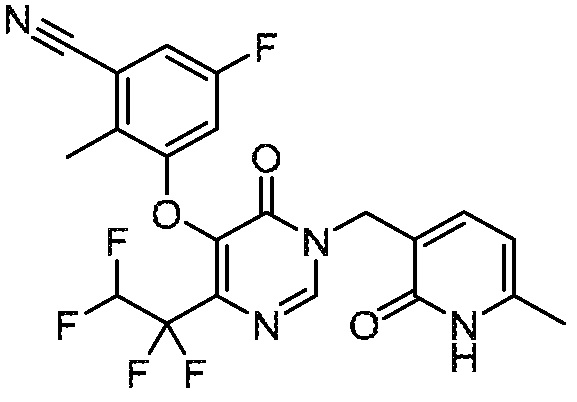
(AB05, C16)
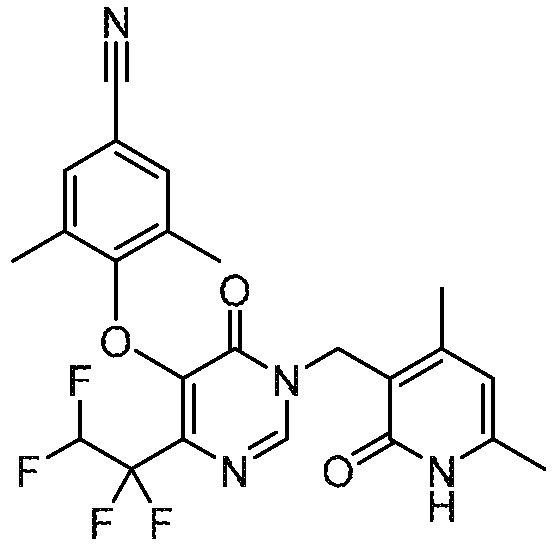
(AB01, C24)
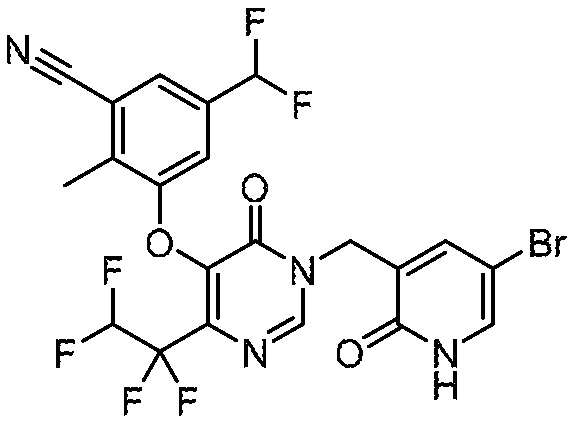
и
567,2
(AB14, C14)
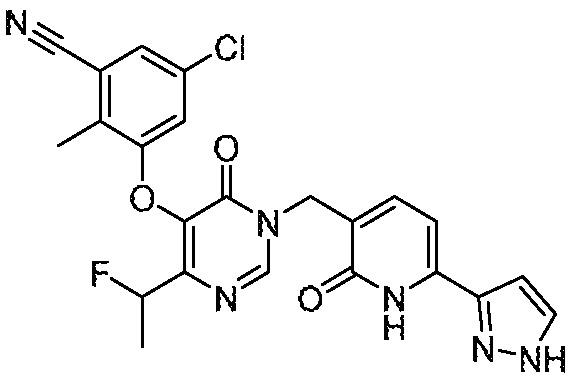
(AB15, C14)
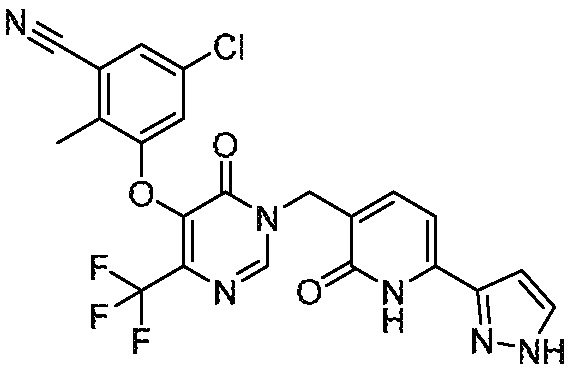
ПРИМЕР 14
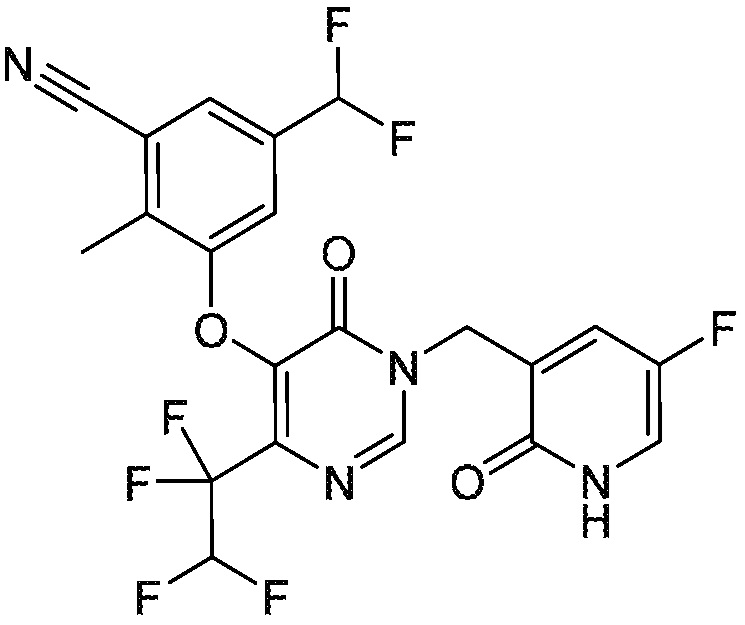
5-(дифторметил)-3-((1-((5-фтор-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил
Стадия 1: 5-(дифторметил)-3-((1-((5-фтор-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил
К перемешиваемому раствору 5-(дифторметил)-2-метил-3-((6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрила, AB01 (30 мг, 0,080 ммоль) и 3-(хлорметил)-5-фтор-2-метоксипиридина, C20 (15,36 мг, 0,087 ммоль) в NMP (795 мкл) при комнатной температуре, добавляют карбонат калия (21,98 мг, 0,159 ммоль). Полученную смесь перемешивают при комнатной температуре в течение ночи, и затем разбавляют водой (3 мл) и экстрагируют EtOAc (3 мл). Органический слой концентрируют при пониженном давлении с получением указанного в заголовке соединения, которое применяют на следующей стадии без дальнейшей очистки. МС: 517,1 (M+1).
Стадия 2: 5-(дифторметил)-3-((1-((5-фтор-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил
К раствору 5-(дифторметил)-3-((1-((5-фтор-2-метоксипиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрила (40 мг, 0,077 ммоль) в АЦН (775 мкл), добавляют ТМС-I (10,54 мкл, 0,077 ммоль) при комнатной температуре по каплям. После добавления, полученную смесь нагревают до 60°C в течение 1 часа, и затем разбавляют EtOAc (2 мл) и гасят насыщенным водным раствором NaHCO3 (1 мл) и насыщенным водным раствором Na2S2O3 (1 мл). Органический слой разделяют и концентрируют при пониженном давлении. Остаток очищают ВЭЖХ с обращенной фазой (АЦН/вода с 0,1% ТФК в качестве модификатора) для выделения указанного в заголовке соединения. МС: 503,1 (M+1). 1H ЯМР (600 МГц, ДМСО-d6) δ 8,73 (с, 1H), 7,73 (с, 1H), 7,61-7,56 (м, 2H), 7,31 (с, 1H), 6,94 (д, J=16,0 Гц, 1H), 6,86 (с, 1H), 6,77 (с, 1H), 4,87 (с, 2H), 2,47 (с, 3H).
Следующие примеры в ТАБЛИЦЕ 10 получают по методтке, описанной выше для синтеза примера 14 с применением подходящего промежуточного соединения AB и промежуточного соединения C.
ТАБЛИЦА 10
(AB №, C №)
(AB17, C16)
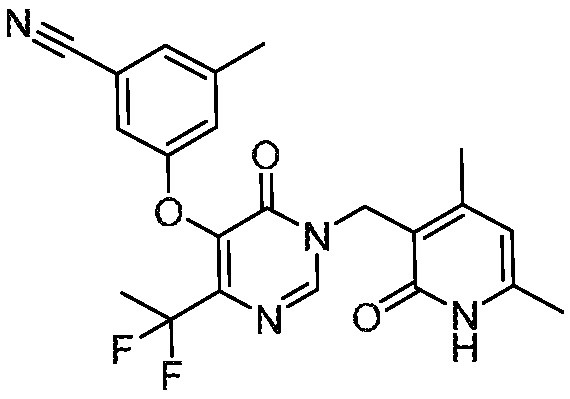
(AB02, C18)
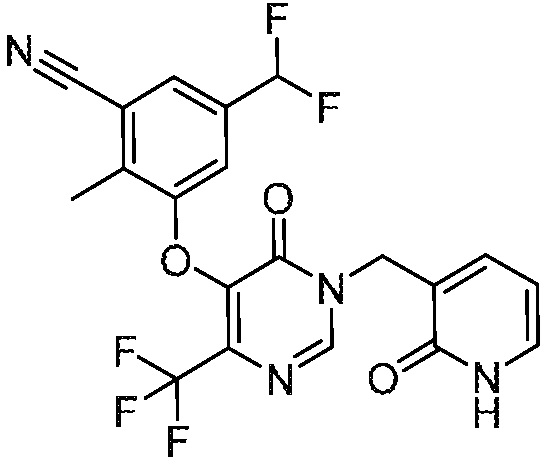
(AB01, C18)
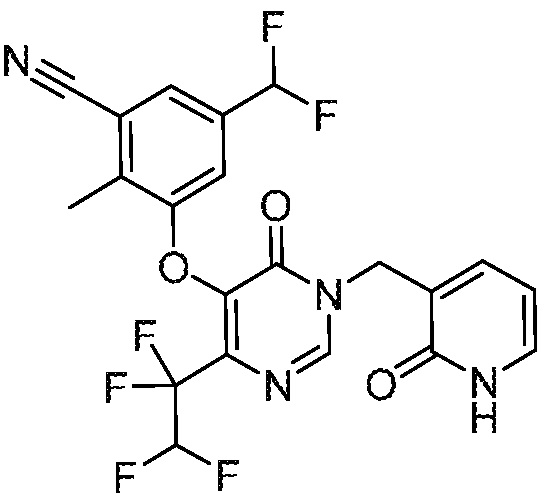
(AB02, C20)
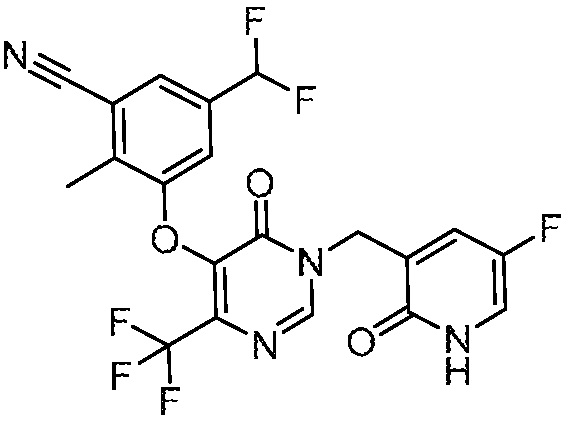
(AB15, C20)
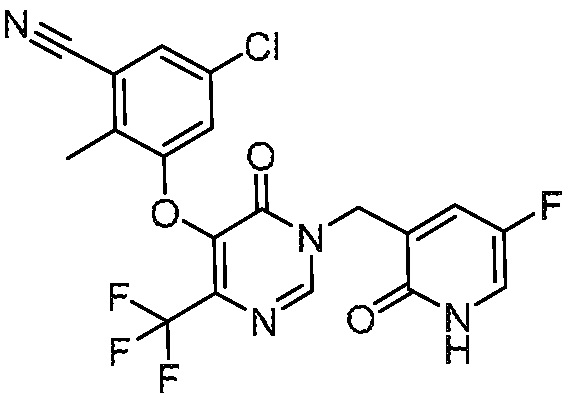
(AB06, C20)
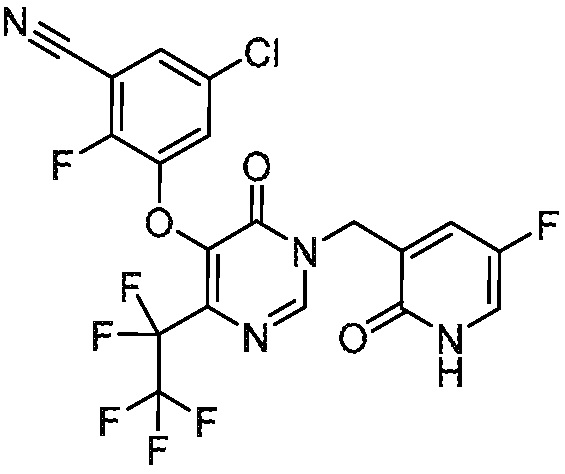
ПРИМЕР 21
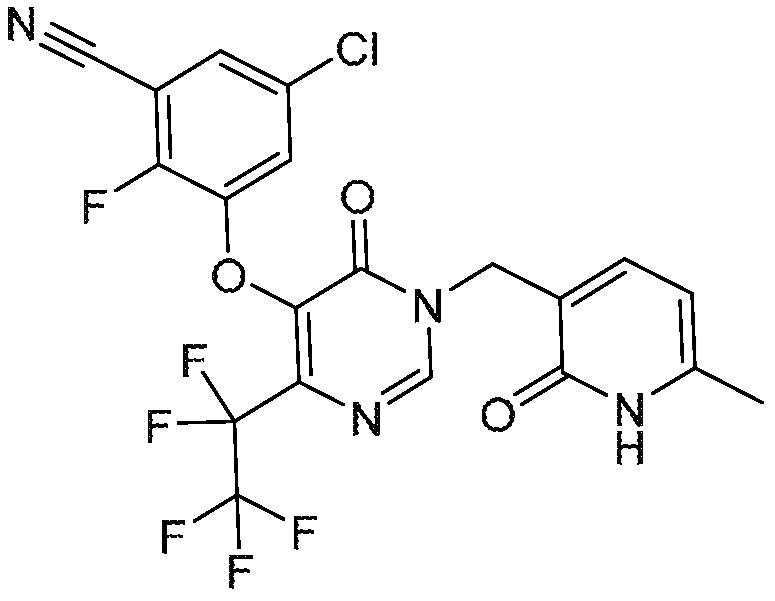
5-хлор-2-фтор-3-((1-((6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(перфторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
Стадия 1: 5-хлор-2-фтор-3-((1-((2-метокси-6-метилпиридин-3-ил)метил)-6-оксо-4-(перфторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
К ледяному раствору 5-хлор-2-фтор-3-((6-оксо-4-(перфторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрила, AB06 (50 мг, 0,130 ммоль) и (2-метокси-6-метилпиридин-3-ил)метанола, C17 (20,0 мг, 0,13 ммоль) в ДХМ (1303 мкл) по каплям добавляют ДИАД (25,3 мкл, 0,130 ммоль). Полученную смесь нагревают до комнатной температуры и затем разбавляют насыщенным водным раствором NaHCO3 и экстрагируют ДХМ. Органический слой сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (0-100% EtOAc/гексан) с получением указанного в заголовке соединения. МС: 519,1 (M+1).
Стадия 2: 5-хлор-2-фтор-3-((1-((6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(перфторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
К раствору 5-хлор-2-фтор-3-((1-((2-метокси-6-метилпиридин-3-ил)метил)-6-оксо-4-(перфторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрила (39 мг, 0,075 ммоль) и йодида калия (37,4 мг, 0,226 ммоль) в АЦН (752 мкл), добавляют ТМС-Cl (28,8 мкл, 0,226 ммоль). Полученную смесь нагревают до 50°C в течение 1 часа и затем охлаждают до комнатной температуры, затем разбавляют MeOH (1 мл) и концентрируют при пониженном давлении. Остаток очищают ВЭЖХ с обращенной фазой (АЦН/вода с 0,1% ТФК в качестве модификатора) для выделения указанного в заголовке соединения. МС: 505,0 (M+1). 1H ЯМР (500 МГц, Хлороформ-d) δ 8,78 (с, 1H), 7,68 (д, J=6,9 Гц, 1H), 7,33 (с, 1H), 7,10 (д, J=6,8 Гц, 1H), 6,12 (д, J=7,5 Гц, 1H), 4,94 (с, 2H), 2,36 (с, 3H).
Следующий пример пример 22 в ТАБЛИЦЕ 11 получают по методике, аналогичной той, которая описана выше для синтеза примера 21 с применением подходящего промежуточного соединения AB и промежуточного соединения C.
ТАБЛИЦА 11
(AB №, C №)
(AB01, C17)
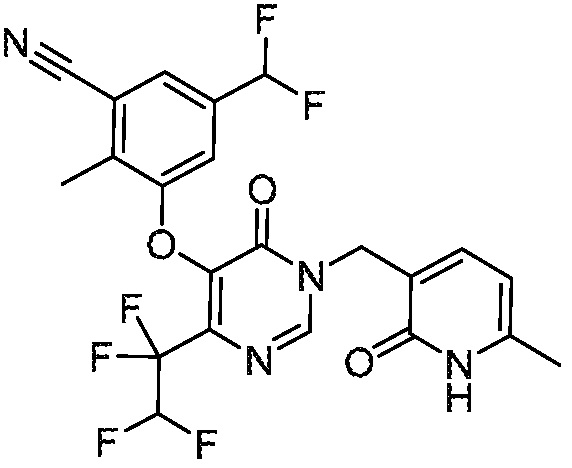
ПРИМЕР 23
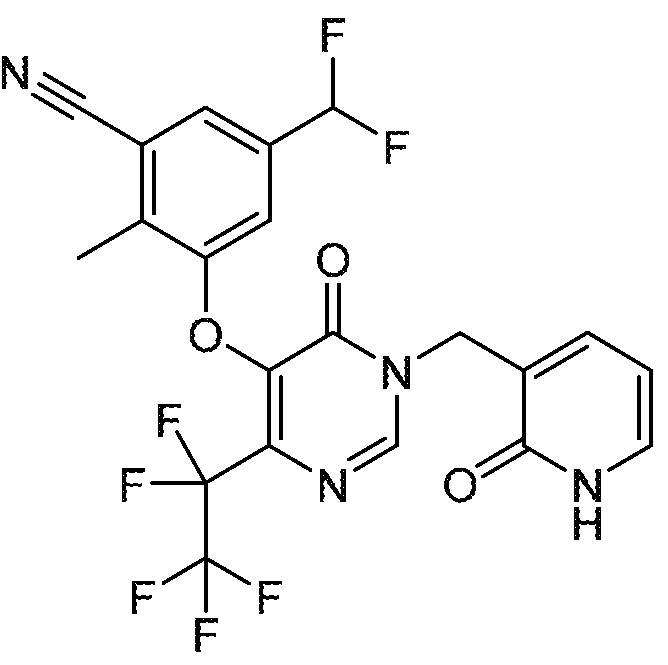
5-(дифторметил)-2-метил-3-((6-оксо-1-((2-оксо-1,2-дигидропиридин-3-ил)метил)-4-(перфторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
Стадия 1: 5-(дифторметил)-3-((1-((2-метоксипиридин-3-ил)метил)-6-оксо-4-(перфторэтил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил
К раствору 5-(дифторметил)-2-метил-3-((6-оксо-4-(перфторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрила, AB03 (50 мг, 0,127 ммоль) в ТГФ (633 мкл), добавляют (2-метоксипиридин-3-ил)метанол, C18 (19,36 мг, 0,139 ммоль) и трифенилфосфин (127 мг, 0,380 ммоль), затем добавляют (E)-ди-трет-бутил диазен-1,2-дикарбоксилат (64,1 мг, 0,278 ммоль). Полученную смесь перемешивают в течение ночи, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения. МС: 517,1 (M+1).
Стадия 2: 5-(дифторметил)-2-метил-3-((6-оксо-1-((2-оксо-1,2-дигидропиридин-3-ил)метил)-4-(перфторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
К раствору 5-(дифторметил)-3-((1-((2-метоксипиридин-3-ил)метил)-6-оксо-4-(перфторэтил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрила (65 мг, 0,126 ммоль) в ДМА (629 мкл), добавляют пиридина гидрохлорид (43,6 мг, 0,378 ммоль). Полученную смесь перемешивают при 120°C в течение 60 минут, и затем очищают ВЭЖХ с обращенной фазой (АЦН/вода с 0,1% ТФК в качестве модификатора) для выделения указанного в заголовке соединения. МС: 503,1 (M+1). 1H ЯМР (500 МГц, ДМСО-d6) δ 11,80 (с, 1H), 8,77 (с, 1H), 7,73 (с, 1H), 7,42 (д, J=6,8 Гц, 1H), 7,37 (с, 2H), 6,12 (т, J=6,7 Гц, 1H), 4,85 (с, 2H), 2,44 (с, 3H).
ПРИМЕР 24
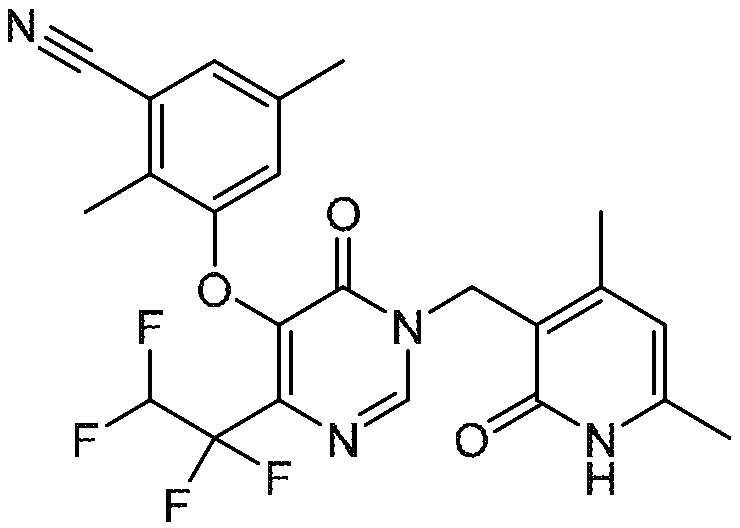
3-((1-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-2,5-диметилбензонитрил
Стадия 1: 5-хлор-3-((1-((2-метокси-4,6-диметилпиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил
К перемешиваемому раствору 5-хлор-2-метил-3-((6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрила, AB09 (90 мг, 0,249 ммоль) и 3-(хлорметил)-2-метокси-4,6-диметилпиридина, C16 (46,2 мг, 0,249 ммоль) в ДМФ (3 мл) затем добавляют раствор карбоната калия (68,8 мг, 0,498 ммоль). Полученную смесь перемешивают при КТ в течение 5 ч, и затем разбавляют водой (30 мл) и экстрагируют EtOAc (2×30 мл). Объединенные органические слои промывают насыщенным раствором соли (20 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на диоксиде кремния (0-60% EtOAc/П.Э.) с получением указанного в заголовке соединения. МС: 510,8 (M+1).
Стадия 2: 3-((1-((2-метокси-4,6-диметилпиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-2,5-диметилбензонитрил
К перемешиваемому раствору 5-хлор-3-((1-((2-метокси-4,6-диметилпиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрила (70 мг, 0,137 ммоль) в ТГФ (3 мл) добавляют карбонат цезия (134 мг, 0,411 ммоль) и PdCl2(dppf) (22,38 мг, 0,027 ммоль) и триметилбороксин (25,8 мг, 0,206 ммоль). Полученную смесь нагревают до 100°C в течение ночи, и затем гасят водой (10 мл) и экстрагируют EtOAc (2×20 мл). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на диоксиде кремния (0-40% EtOAc/П.Э.) с получением указанного в заголовке соединения. МС: 490,8 (M+1).
Стадия 3: 3-((1-((2-гидрокси-4,6-диметилпиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-2,5-диметилбензонитрил
К перемешиваемому ледяному раствору 3-((1-((2-метокси-4,6-диметилпиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-2,5-диметилбензонитрила (60 мг, 0,122 ммоль) в АЦН (3 мл) добавляют йодид натрия (36,7 мг, 0,245 ммоль) и ТМС-Cl (0,031 мл, 0,245 ммоль). Полученную смесь нагревают до 80°C в течение 1 ч, и затем гасят водой (10 мл) и экстрагируют EtOAc (2×20 мл). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают ВЭЖХ с обращенной фазой (АЦН/вода с 0,1% ТФК в качестве модификатора) для выделения указанного в заголовке соединения. МС: 477,2 (M+1).
ПРИМЕР 25
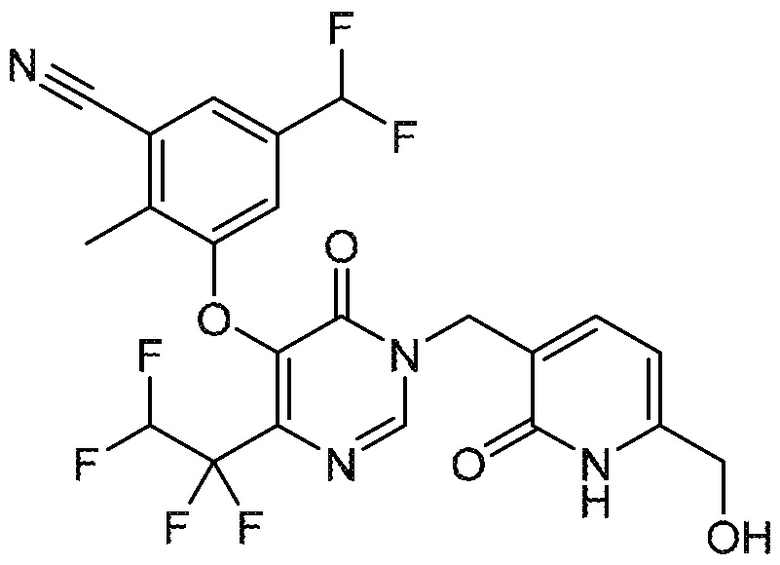
5-(дифторметил)-3-((1-((6-(гидроксиметил)-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил
Стадия 1: 3-((1-((6-хлор-2-метоксипиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-5-(дифторметил)-2-метилбензонитрил
К перемешиваемому раствору 6-хлор-3-(хлорметил)-2-метоксипиридина, C13 (244 мг, 1,272 ммоль) и 5-(дифторметил)-2-метил-3-((6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрила, AB01 (480 мг, 1,272 ммоль) в NMP (3181 мкл) при комнатной температуре, добавляют K2CO3 (352 мг, 2,54 ммоль). Полученную смесь перемешивают при 25°C в течение ночи и затем разбавляют водой (50 мл), и перемешивают при комнатной температуре в течение 30 минут. Осадок собирают в верхней части фильтра, промывают водой (3×), затем сушат на воздухе с получением указанного в заголовке соединения. МС: 533,3 (M+1).
Стадия 2: 5-(дифторметил)-3-((1-((6-(гидроксиметил)-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил
К продутой N2 смеси 3-((1-((6-хлор-2-метоксипиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-5-(дифторметил)-2-метилбензонитрила (20 мг, 0,038 ммоль), трифтор(((4-метоксибензил)окси)метил)бората калия (14,53 мг, 0,056 ммоль) и cataCXium® A Pd G2 (5,02 мг, 7,51 мкмоль) в 1,4-диоксане (1 мл), добавляют 2 M водный раствор карбоната цезия (0,5 мл, 1,0 ммоль). Полученную смесь нагревают при 150°C в микроволновой печи в течение 15 минут, и затем экстрагируют EtOAc. Органический слой сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток берут с АЦН (1 мл), и обрабатывают KI (6,23 мг, 0,038 ммоль) и ТМС-Cl (40 мкл, 0,313 ммоль). Полученную смесь нагревают при 100°C в микроволновой печи в течение 10 минут, и затем очищают ВЭЖХ с обращенной фазой (АЦН/вода с 0,1% ТФК в качестве модификатора) для выделения указанного в заголовке соединения. МС: 515,2 (M+1).
Следующие примеры в ТАБЛИЦЕ 12 получают по методтке, описанной выше для синтеза примера 25 с применением промежуточного соединения со стадии 1 в синтезе примера 25 с подходящим гетероарилом или алкилборонатом во второй колонке.
ТАБЛИЦА 12
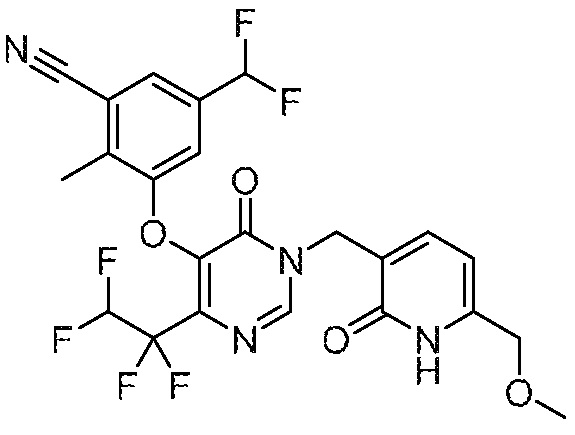
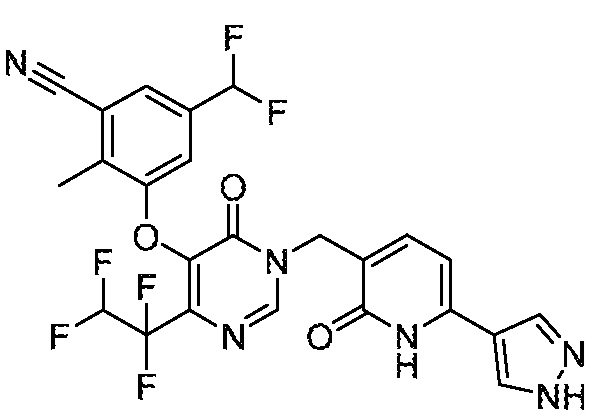
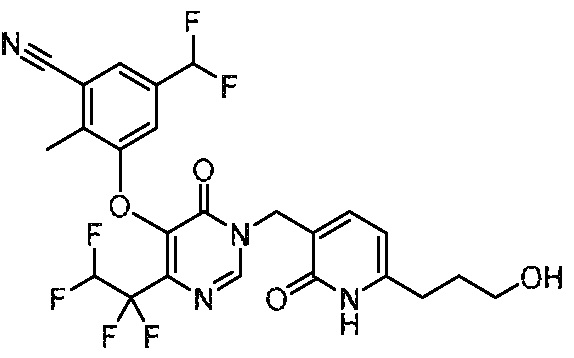
ПРИМЕР 29
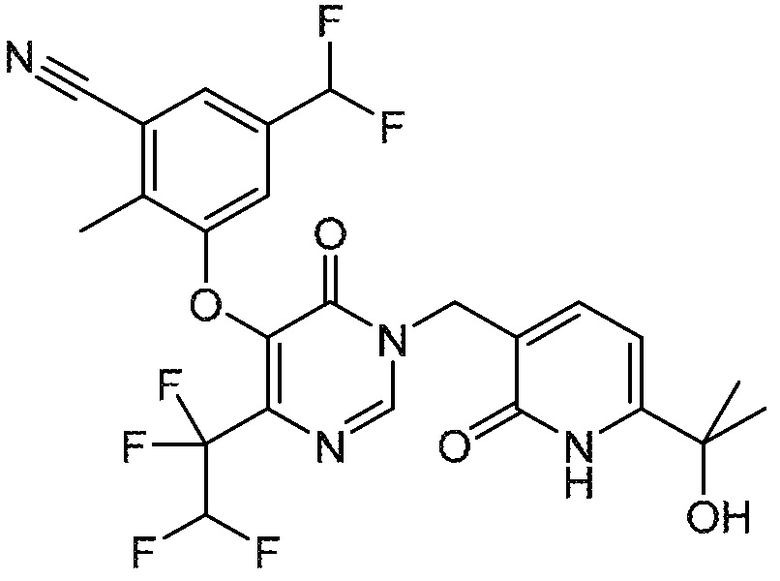
5-(дифторметил)-3-((1-((6-(2-гидроксипропан-2-ил)-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил
Стадия 1: 3-((1-((6-ацетил-2-метоксипиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-5-(дифторметил)-2-метилбензонитрил
Смесь 3-((1-((6-хлор-2-метоксипиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-5-(дифторметил)-2-метилбензонитрила (промежуточного соединения со Стадии 1 из Примера 25) (100 мг, 0,188 ммоль), дихлорида бис(трифенилфосфин)палладия(II) (26,3 мг, 0,038 ммоль), и трибутил(1-этоксивинил)олова (127 мкл, 0,375 ммоль) в толуоле (1877 мкл) перемешивают при 100°C в течение ночи, и затем разбавляют EtOAc и насыщенным водным раствором KF, и обрабатывают концентрированной HCl (1 мл). Смесь перемешивают при к.т. в течение ночи, и пропускают через CELITE® в воронке. Фильтрат экстрагируют EtOAc (2X). Объединенные органические слои концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (0-100% EtOAc/гексан) с получением указанного в заголовке соединения. МС: 541,4 (M+1).
Стадия 2: 5-(дифторметил)-3-((1-((6-(2-гидроксипропан-2-ил)-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил
К раствору 3-((1-((6-ацетил-2-метоксипиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-5-(дифторметил)-2-метилбензонитрила (30 мг, 0,056 ммоль) в ТГФ (278 мкл) при -78°C, добавляют 3 M раствор бромида метилмагния в Et2O (37,0 мкл, 0,111 ммоль) по каплям. Как только ЖХМС показала полное превращение, смесь гасят MeOH и водой, и затем разделяют между EtOAc и насыщенным водным раствором NaHCO3. Органический слой сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток берут с АЦН (2 мл), и обрабатывают KI (9,22 мг, 0,056 ммоль) и ТМС-Cl (20 мкл, 0,156 ммоль). Полученную смесь нагревают при 100°C в микроволновой печи в течение 10 минут. Смесь очищают ВЭЖХ с обращенной фазой (АЦН/вода с 0,1% ТФК в качестве модификатора) для выделения указанного в заголовке соединения. МС: 543,4 (M+1). 1H ЯМР (600 МГц, Ацетон-d6) δ 8,77 (с, 1H), 7,67-7,54 (м, 2H), 7,22 (с, 1H), 6,77 (д, J=11,9 Гц, 1H), 6,70-6,65 (м, 1H), 6,26 (д, J=7,2 Гц, 1H), 4,94 (с, 2H), 2,03 (с, 3H), 1,62 (с, 1H), 1,53 (с, 6H).
ПРИМЕР 30
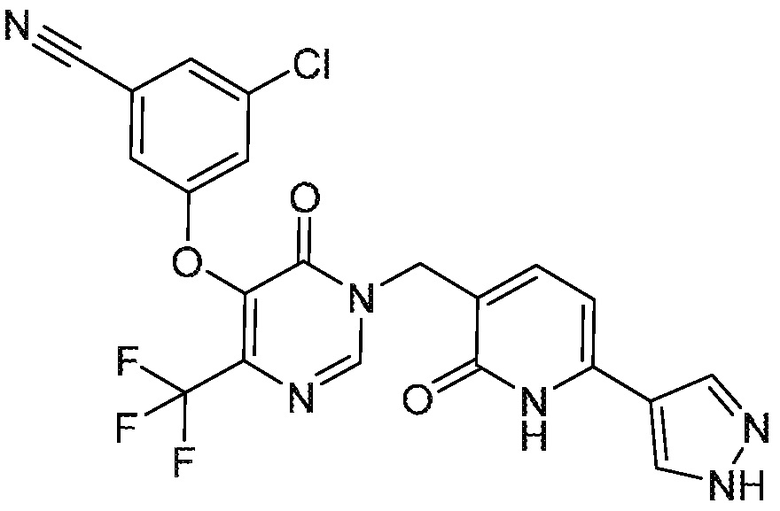
3-хлор-5-((6-оксо-1-((2-оксо-6-(1H-пиразол-4-ил)-1,2-дигидропиридин-3-ил)метил)-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
Стадия 1: 3-((1-((6-бром-2-метоксипиридин-3-ил)метил)-6-оксо-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)-5-хлорбензонитрил
К перемешиваемому раствору 3-хлор-5-((6-оксо-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)бензонитрила (2,27 г, 7,19 ммоль) в толуоле (30 мл), добавляют (6-бром-2-метоксипиридин-3-ил)метанол C02 (1,3 г, 5,96 ммоль), трифенилфосфин (3,15 г, 12,01 ммоль) и ДИАД (2,337 мл, 12,02 ммоль). Полученную смесь перемешивают при комнатной температуре в течение ночи и затем разбавляют EtOAc. Органический слой промывают водой и насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (30% EtOAc/П.Э.) с получением указанного в заголовке соединения.
Стадия 2: 3-((1-((6-бром-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)-5-хлорбензонитрил
К перемешиваемому раствору 3-((1-((6-бром-2-метоксипиридин-3-ил)метил)-6-оксо-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)-5-хлорбензонитрила (1,8 г, 3,49 ммоль) в АЦН (20 мл) добавляют йодид натрия (1,046 г, 6,98 ммоль) и ТМС-Cl (0,892 мл, 6,98 ммоль). Реакционную смесь перемешивают при 80°C в течение ночи, затем охлаждают до комнатной температуры и добавляют еще АЦН, перемешивают и фильтруют. Фильтровальную лепешку промывают АЦН. Фильтрат концентрируют при пониженном давлении с получением указанного в заголовке соединения. МС: 501,2 и 503,2 (M+1).
Стадия 3: 3-хлор-5-((6-оксо-1-((2-оксо-6-(1H-пиразол-4-ил)-1,2-дигидропиридин-3-ил)метил)-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
Смесь 3-((1-((6-бром-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)-5-хлорбензонитрила (20 мг, 0,040 ммоль), 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола (9,28 мг, 0,048 ммоль), аддукта PdCl2(dppf)-CH2Cl2 (3,26 мг, 3,99 мкмоль), трехосновного фосфата калия (22,85 мг, 0,108 ммоль) в 1,4-диоксане (53,2 мкл) и воде (26,6 мкл) дегазируют и продувают N2. Полученную смесь перемешивают при 80°C в течение 3 ч. ЖХМС показала, что реакционная смес полная. Растворитель выпаривают при пониженном давлении. Остаток очищают ВЭЖХ с обращенной фазой (АЦН/вода с 0,1% ТФК в качестве модификатора) для выделения указанного в заголовке соединения. МС: 489,0 (M+1).
ПРИМЕР 31
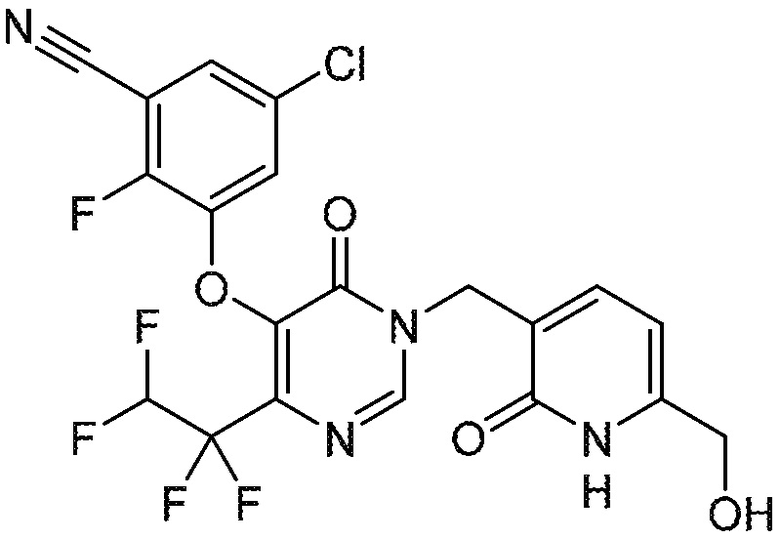
5-хлор-2-фтор-3-((1-((6-(гидроксиметил)-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
Стадия 1: 5-хлор-2-фтор-3-((1-((2-метокси-6-винилпиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
К раствору 5-хлор-2-фтор-3-((6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрила, AB04 (150 мг, 0,410 ммоль) и K2CO3 (283 мг, 2,051 ммоль) в ДМФ (2 мл), добавляют 3-(хлорметил)-2-метокси-6-винилпиридин, C19 (75 мг, 0,410 ммоль) и бромида лития (42,8 мг, 0,492 ммоль). Полученную смесь перемешивают при 20°C в течение 20 ч, и затем гасят H2O (5 мл), экстрагируют EtOAc (3×5 мл). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают препаративной ТСХ (25% EtOAc/П.Э.) с получением указанного в заголовке соединения. МС: 513,1 (M+1).
Стадия 2: 5-хлор-2-фтор-3-((1-((6-формил-2-метоксипиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
К смеси 5-хлор-2-фтор-3-((1-((2-метокси-6-винилпиридин-3-ил) метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрила (80 мг, 0,156 ммоль) и 2,6-лутидина (0,051 мл, 0,438 ммоль) в 1,4-диоксане (3 мл) и H2O (1 мл), добавляют тетроксид осмия (1,224 мкл, 3,90 мкмоль) растворяют в t-BuOH (0,1 мл). Полученную смесь перемешивают при 20°C в течение 30 минут, и к смеси добавляют периодат натрия (122 мг, 0,571 ммоль). Полученную смесь перемешивают при 20°C в течение 1,5 ч, и затем разбавляют EtOAc (10 мл) и осторожно выливают в воду (10 мл). Органический слой промывают насыщенным водным раствором Na2S2O3 (10 мл) и насыщенным раствором соли (10 мл), сушат над безводным Na2SO4 и концентрируют при пониженном давлении с получением указанного в заголовке соединения. МС: 515,1 (M+1).
Стадия 3: 5-хлор-2-фтор-3-((1-((6-(гидроксиметил)-2-метоксипиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
К раствору 5-хлор-2-фтор-3-((1-((6-формил-2-метоксипиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрила (70 мг, 0,136 ммоль) в EtOAc (1 мл) и MeOH (3 мл), добавляют Zn(BH4)2 (0,136 мл, 0,136 ммоль). Полученную смесь перемешивают при 20°C в течение 0,25 ч, и затем гасят 1N HCl (10 мл), экстрагируют EtOAc (3×10 мл). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения, которое применяют непосредственно на следующей стадии. МС: 517,1 (M+1).
Стадия 4: 5-хлор-2-фтор-3-((1-((6-(гидроксиметил)-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
К раствору 5-хлор-2-фтор-3-((1-((6-(гидроксиметил)-2-метоксипиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрила (60 мг, 0,116 ммоль) в АЦН (3,00 мл) добавляют KI (57,8 мг, 0,348 ммоль) и ТМС-Cl (0,045 мл, 0,348 ммоль). Полученную смесь перемешивают при 70°C в течение 1 часа и затем концентрируют при пониженном давлении. Остаток очищают ВЭЖХ с обращенной фазой (АЦН/вода с 0,1% ТФК в качестве модификатора) для выделения указанного в заголовке соединения. МС: 503,0 (M+1). 1H ЯМР (400 МГц, ДМСО- d6): δ11,75 (с, 1H), 8,79 (с, 1H), 7,86-7,84 (м, 1 H), 7,69-7,50 (м, 1H), 7,48-7,46 (д, 1H), 6,87-6,74(м, 1H), 6,17-6,15 (м, 1 H), 5,42 (с, 1H), 4,86(с, 2H), 4,27 (с, 2H).
ПРИМЕР 32 (изомер A) и 33 (изомер B)
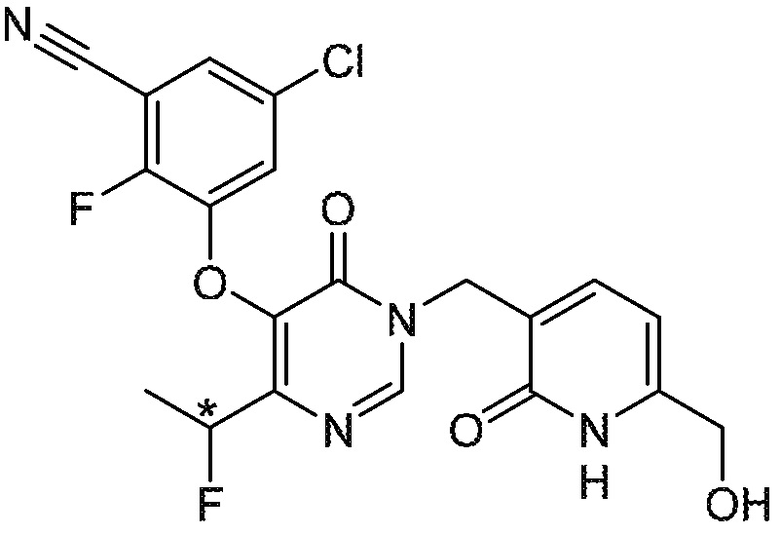
( S )-5-хлор-2-фтор-3-((4-(1-фторэтил)-1-((6-(гидроксиметил)-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)бензонитрил и
( R )-5-хлор-2-фтор-3-((4-(1-фторэтил)-1-((6-(гидроксиметил)-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)бензонитрил
Стадия 1: 5-хлор-2-фтор-3-((4-(1-фторэтил)-1-((2-метокси-6-винилпиридин-3-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)бензонитрил
К раствору 5-хлор-2-фтор-3-((4-(1-фторэтил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)бензонитрила, AB12 (0,3 г, 0,963 ммоль) в ДМФ (5 мл) добавляют 3-(хлорметил)-2-метокси-6-винилпиридин, C19 (0,177 г, 0,963 ммоль), K2CO3 (0,399 г, 2,89 ммоль) и бромид лития (0,167 г, 1,925 ммоль). Полученную смесь перемешивают при 20°C в течение 1 часа и затем экстрагируют EtOAc (3×15 мл). Объединенные органические слои промывают насыщенным раствором соли, сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток растирают с MeOH с получением указанного в заголовке соединения, и применяют непосредственно без дальнейшей очистки.
Стадия 2: 5-хлор-2-фтор-3-((4-(1-фторэтил)-1-((6-формил-2-метоксипиридин-3-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)бензонитрил
К смеси 5-хлор-2-фтор-3-((4-(1-фторэтил)-1-((2-метокси-6-винилпиридин-3-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)бензонитрила (200 мг, 0,436 ммоль) в 1,4-диоксане (1,5 мл) и воде (0,5 мл), добавляют 2,6-диметилпиридин (131 мг, 1,220 ммоль) и раствор тетроксида осмия (0,1 мл, 0,436 ммоль) в t-BuOH (0,1 мл). Полученную смесь перемешивают при 20°C в течение 15 минут. Затем добавляют периодат натрия (336 мг, 1,569 ммоль). Реакционную смесь перемешивают при 20°C в течение 1,5 ч и затем разбавляют водой (15 мл) и экстрагируют EtOAc (3×15 мл). Объединенные органические слои сушат над безводным Na2SO4 и концентрируют. Остаток очищают колоночной хроматографией на диоксиде кремния (0-20% EtOAc/петролейный эфир) с получением указанного в заголовке соединения. МС: 461,1 (M+1).
Стадия 3: 5-хлор-2-фтор-3-((4-(1-фторэтил)-1-((6-(гидроксиметил)-2-метоксипиридин-3-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)бензонитрил
К раствору 5-хлор-2-фтор-3-((4-(1-фторэтил)-1-((6-формил-2-метоксипиридин-3-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)бензонитрила (55 мг, 0,107 ммоль) в ТГФ (3 мл) и EtOAc (2 мл), добавляют 1M Zn(BH4)2 раствор в ТГФ (0,021 мл, 0,021 ммоль) при -30°C. Полученную смесь перемешивают при -30°C в течение 0,5 ч. Реакционную смесь гасят водой (1 капля) и затем концентрируют при пониженном давлении с получением указанного в заголовке соединения. МС: 463,1 (M+1).
Стадия 4: 5-хлор-2-фтор-3-((4-(1-фторэтил)-1-((6-(гидроксиметил)-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)бензонитрил;
(S)-5-хлор-2-фтор-3-((4-(1-фторэтил)-1-((6-(гидроксиметил)-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)бензонитрил; и
(R)-5-хлор-2-фтор-3-((4-(1-фторэтил)-1-((6-(гидроксиметил)-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)бензонитрил
К раствору 5-хлор-2-фтор-3-((4-(1-фторэтил)-1-((6-(гидроксиметил)-2-метоксипиридин-3-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)бензонитрилв (49 мг, 0,106 ммоль) в АЦН (3 мл) добавляют KI (22,14 мг, 0,133 ммоль). ТМС-Cl (0,044 мл, 0,347 ммоль). Полученную смесь перемешивают при 70°C в течение 5 ч и концентрируют при пониженном давлении. Остаток очищают ВЭЖХ с обращенной фазой (АЦН/вода с 0,1% ТФК в качестве модификатора) для выделения рацемического указанного в заголовке соединения. МС: 449 (M+1). 1H ЯМР (400 МГц, ДМСО-d6) δ ч./млн. 4,27 (шд, J=4,63 Гц, 2 H) 4,83 (с, 2 H) 5,46 (с, 1 H) 5,63-5,88 (м, 1 H) 6,15 (шд, J=7,28 Гц, 1 H) 7,42 (д, J=7,06 Гц, 1 H) 7,58 (шд, J=5,73 Гц, 1 H) 7,82 (шс, 1 H) 8,68 (с, 1 H). Рцемическую смесь очищают хиральной СЖХ (колонка Chiralpak IC-H, 250 ×30 мм вд, 5 мкм, ИПС/CO2=35%) с получением Примера 32 изомера A (более быстрое элюирование) и Примера 33 изомера B (более медленное элюирование).
ПРИМЕР 34 (изомер A)
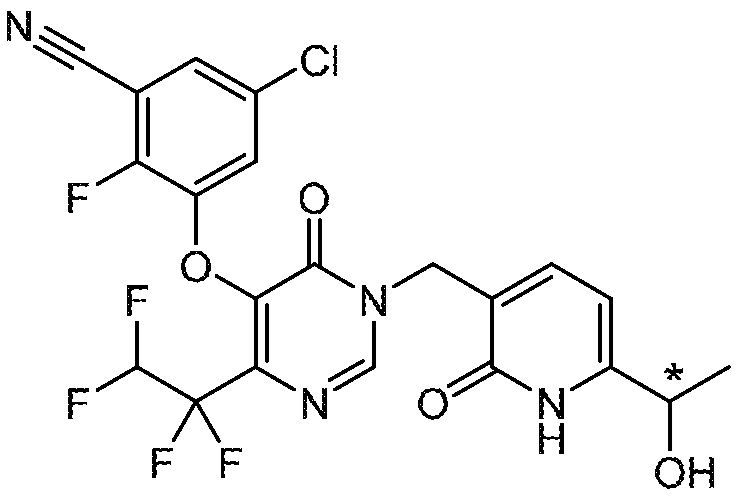
( S ) или ( R )-5-хлор-2-фтор-3-((1-((6-(1-гидроксиэтил)-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
Стадия 1: 3-((1-((6-ацетил-2-метоксипиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-5-хлор-2-фторбензонитрил
К раствору 5-хлор-2-фтор-3-((6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрила, AB04 (247 мг, 0,676 ммоль) в ДМФ (4 мл), добавляют 1-(5-(хлорметил)-6-метоксипиридин-2-ил)этанон, C21 (135 мг, 0,676 ммоль) и K2CO3 (187 мг, 1,352 ммоль) и бромид лития (88 мг, 1,014 ммоль). Полученную смесь перемешивают при 30°C в течение 5 ч, и разбавляют H2O (15 мл) и экстрагируют EtOAc (3×30 мл). Объединенные органические слои промывают насыщенным раствором соли (40 мл) и сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (50% EtOAc/П.Э.) с получением указанного в заголовке соединения. МС: 529,2 (M+1).
Стадия 2: 5-хлор-2-фтор-3-((1-((6-(1-гидроксиэтил)-2-метоксипиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
К раствору 3-((1-((6-ацетил-2-метоксипиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-5-хлор-2-фторбензонитрила (144 мг, 0,272 ммоль) в EtOAc (21 мл) добавляют 1M Zn(BH4)2 раствора в ТГФ (0,272 мл, 0,272 ммоль) при 20°C. Полученный раствор перемешивают при 15-20°C в течение 0,5 ч, и затем гасят 4N HCl водным раствором (5 мл), и разбавляют H2O (15 мл) и экстрагируют EtOAc (3×30 мл). Объединенные органические слои промывают насыщенным раствором соли (40 мл) и сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения. МС: 531,2 (M+1).
Стадия 3: ( S ) или ( R )-5-хлор-2-фтор-3-((1-((6-(1-гидроксиэтил)-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
К раствору 5-хлор-2-фтор-3-((1-((6-(1-гидроксиэтил)-2-метоксипиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрила (185 мг, 0,349 ммоль) в АЦН (32 мл) добавляют KI (174 мг, 1,046 ммоль) и ТМС-Cl (0,134 мл, 1,046 ммоль). Полученную смесь перемешивают при 70°C в течение 2 ч и затем разбавляют водой (15 мл), и экстрагируют EtOAc (3×30 мл). Объединенные органические слои промывают насыщенным раствором соли (30 мл), сушат над безводным Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают ВЭЖХ с обращенной фазой (АЦН/вода с 0,1% ТФК в качестве модификатора) для выделения рацемического указанного в заголовке соединения. Рацемическую смесь очищают хиральной СЖХ (колонка ChiralPak AD-H, 250 ×30 мм вд, 5 мкм, 25% ИПС/CO2 с 0,1% NH4OH в качестве модификатора) с получением Примера 34 (изомер A, более быстрое элюирование). МС: 517,0 (M+1). 1H ЯМР (400 МГц, ДМСО-d6) δ ч./млн. 1,29 (д, J=6,58 Гц, 3 H) 4,49 (шд, J=4,39 Гц, 1 H) 4,86 (с, 2 H) 5,49 (шд, J =3,51 Гц, 1 H) 6,17 (д, J=7,45 Гц, 1 H) 6,68-7,07 (м, 1 H) 7,47 (д, J=7,02 Гц, 1 H) 7,76 (дд, J=7,24, 2,41 Гц, 1 H) 7,85 (дд, J=4,38, 2,63 Гц, 1 H) 8,80 (с, 1 H).
ПРИМЕР 35
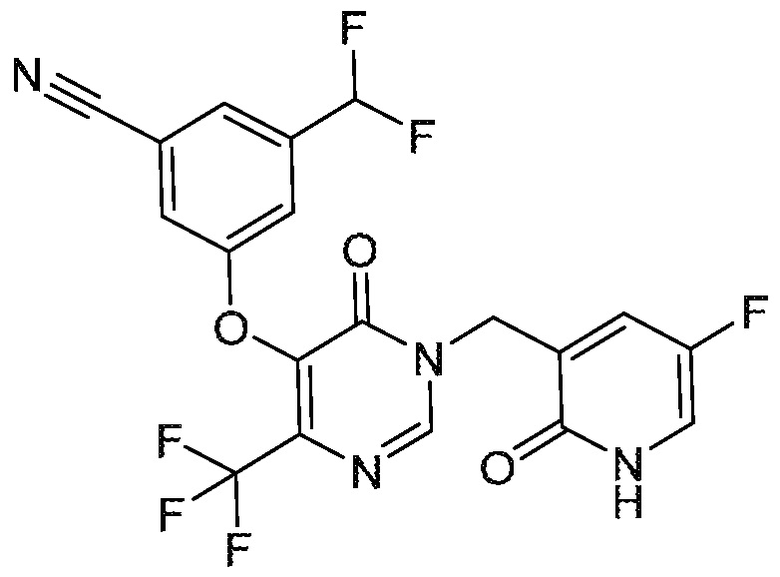
3-(дифторметил)-5-((1-((5-фтор-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
Карбонат калия (34,4 мг, 0,249 ммоль) добавляют к перемешиваемому раствору 5-фтор-3-((5-фтор-2-метоксипиридин-3-ил)метил)-6-(трифторметил)пирмидин-4(3H)-она, BC04 (40 мг, 0,125 ммоль) и 3-(дифторметил)-5-гидроксибензонитрила, A01 (25,3 мг, 0,149 ммоль) в ДМФ (623 мкл) при комнатной температуре. Полученную смесь перемешивают при 100°C в течение ночи, и затем разбавляют водой (2 мл) и EtOAc (2 мл). Органический слой разделяют и концентрируют при пониженном давлении. Остаток растворяют в АЦН (2 мл) и ТМС-I (85 мкл, 0,623 ммоль) добавляют при комнатной температуре по каплям. После добавления, полученную смесь нагревают до 60°C в течение 2 ч. Реакционную смесь разбавляют EtOAc (2 мл) и гасят насыщенным водным раствором NaHCO3 (1 мл) и насыщенным водным раствором Na2S2O3 (1 мл). Органический слой разделяют и концентрируют при пониженном давлении. Остаток очищают ВЭЖХ с обращенной фазой (АЦН/вода с 0,1% ТФК в качестве модификатора) для выделения указанного в заголовке соединения. МС: 457,1 (M+1). 1H ЯМР (600 МГц, ДМСО-d6) δ 8,75 (с, 1H), 7,88 (с, 1H), 7,79 (с, 1H), 7,66 (с, 1H), 7,62-7,55 (м, 2H), 7,00 (т, J=55,2 Гц, 1H), 4,88 (с, 2H).
Следующие примеры в ТАБЛИЦЕ 13 получают по методтке, описанной выше для синтеза примера 35 с применением подходящего промежуточного соединения A и промежуточного соединения BC.
ТАБЛИЦА 13
(A №, BC №)
(A03,BC04)
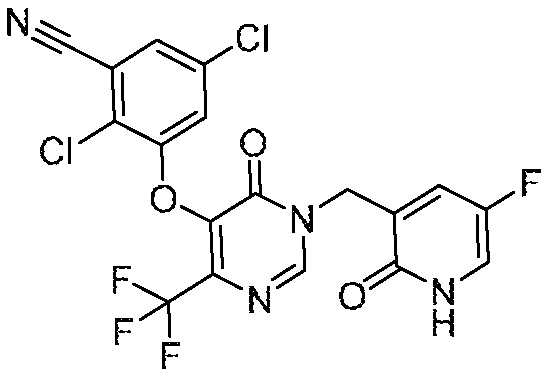
(A05,BC04)
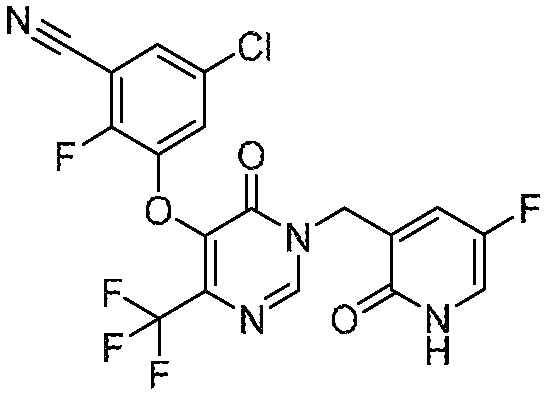
(A02,BC05)
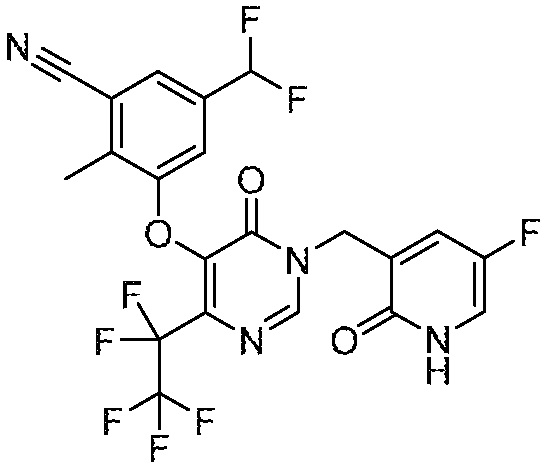
ПРИМЕР 39
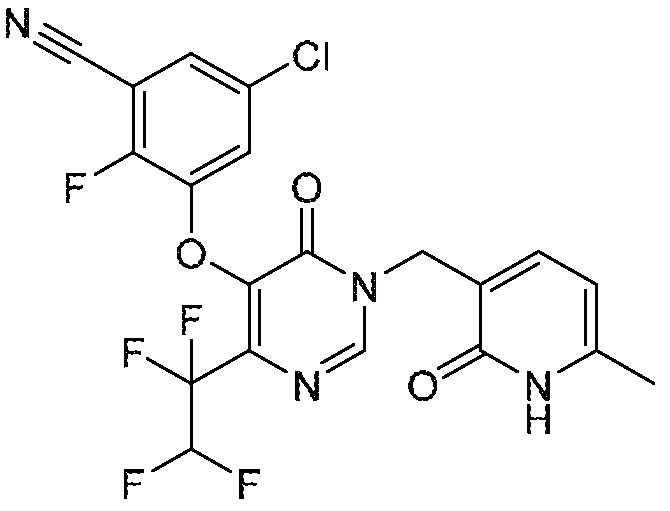
5-хлор-2-фтор-3-((1-((6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
Стадия 1: 5-хлор-2-фтор-3-((1-((2-метокси-6-метилпиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
Смесь 5-фтор-3-((2-метокси-6-метилпиридин-3-ил)метил)-6-(1,1,2,2-тетрафторэтил)пирмидин-4(3H)-она, BC03 (60 мг, 0,172 ммоль), 5-хлор-2-фтор-3-гидроксибензонитрила, A05 (30,9 мг, 0,180 ммоль), карбоната калия (47,5 мг, 0,344 ммоль) в ДМФ (859 мкл) нагревают до 80°C в течение ночи и затем при 100°C в течение второй ночи. Неочищенный продукт очищают ВЭЖХ с обращенной фазой (АЦН/вода с 0,1% ТФК в качестве модификатора) для выделения указанного в заголовке соединения. МС: 501,2 (M+1).
Стадия 2: 5-хлор-2-фтор-3-((1-((6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил
К раствору 5-хлор-2-фтор-3-((1-((2-метокси-6-метилпиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрила (11,5 мг, 0,023 ммоль) и йодида калия (11,44 мг, 0,069 ммоль) в АЦН (230 мкл), добавляют ТМС-Cl (8,80 мкл, 0,069 ммоль). Полученную смесь нагревают до 50°C в течение 4 ч и затем гасят MeOH (1 мл). Неочищенный продукт очищают ВЭЖХ с обращенной фазой (АЦН/вода с 0,1% ТФК в качестве модификатора) для выделения указанного в заголовке соединения. МС: 487,2 (M+1).
Следующие примеры в ТАБЛИЦЕ 14 получают по методтке, описанной выше для синтеза примера 39 с применением подходящего промежуточного соединения A и промежуточного соединения BC.
ТАБЛИЦА 14
A №, BC №
(A01,BC01)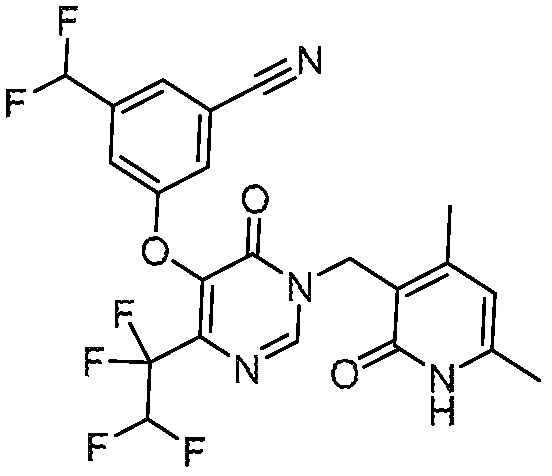
(A02,BC06)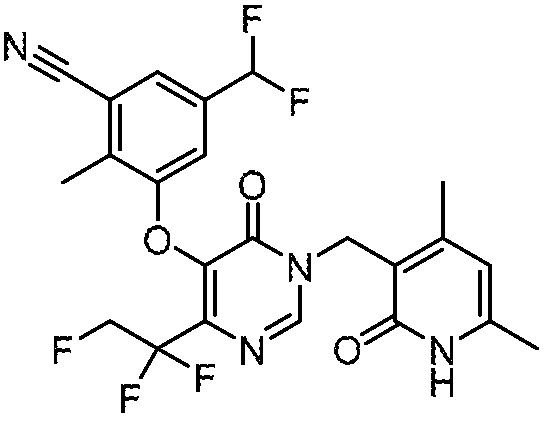
ПРИМЕР 42
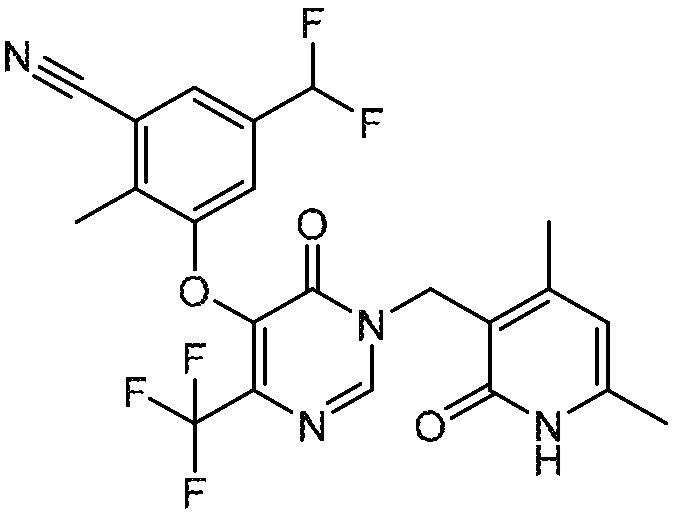
5-(дифторметил)-3-((1-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил
Стадия 1: 3-((1-((2-хлор-4,6-диметилпиридин-3-ил)метил)-6-оксо-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)-5-(дифторметил)-2-метилбензонитрил
Смесь 5-(дифторметил)-3-гидрокси-2-метилбензонитрила, A02 (118 мг, 0,643 ммоль), ((2-хлор-4,6-диметилпиридин-3-ил)метил)-5-фтор-6-(трифторметил)пирмидин-4(3H)-она, BC02 (180 мг, 0,536 ммоль), карбоната калия (148 мг, 1,072 ммоль) в ДМФ (2 мл) перемешивают при 80°C в течение 15 ч, пропускают через слой фильтра. Фильтровальную лепешку промывают EtOAc (10 мл). Фильтрат разделяют между EtOAc и водой. Слои разделяют. И водный слой далее экстрагируют EtOAc (3×10 мл). Объединенные органические слои сушат над безводным MgSO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией на диоксиде кремния (0-100% EtOAc/ гексан) с получением указанного в заголовке соединения. МС: 499,1 (M+1).
Стадия 2: 5-(дифторметил)-3-((1-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил
Раствор 3-((1-((2-хлор-4,6-диметилпиридин-3-ил)метил)-6-оксо-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)-5-(дифторметил)-2-метилбензонитрила (140 мг, 0,281 ммоль) в AcOH (32,100 мл, 561 ммоль) нагревают при 100°C в течение 4 ночей до тех пор, пока ЖХМС не покажет полное превращение. Смесь концентрируют при пониженном давлении. Остаток очищают ВЭЖХ с обращенной фазой (АЦН/вода с 0,1% ТФК в качестве модификатора) для выделения указанного в заголовке соединения. МС: 481,1 (M+1). 1H ЯМР (500 МГц, Хлороформ-d) δ 8,77 (с, 1H), 7,45 (с, 1H), 7,26 (д, J=1,8 Гц, 3H), 6,73 (с, 1H), 6,51 (т, J=55,9 Гц, 1H), 6,16 (с, 1H), 5,02 (с, 2H), 2,64 (с, 1H), 2,59 (с, 3H), 2,43 (д, J=1,4 Гц, 3H), 2,35 (с, 3H).
ПРИМЕР 43: определение активности по уничтожению клеток (SMACK):
PBMC, полученные у здоровых доноров, выращивают в полной среде (RPMI 1640 с L-глутамином; 10% инактивированной нагреванием фетальной бычьей сыворотки; 100 Ед/мл пенициллина-стрептомицина), содержащей 5 мкг/мл фитогемагглютинина при примерно 2,5×106 клеток/мл в течение 3 дней при 5% CO2, 37°C и 90% влажности. На 4 день, ФГА-стимулированные клетки промывают и ресуспендируют при примерно 20×106 клеток/мл в полной среде с IL-2 (10 Ед/мл) с исходным VSV-G псевдотипированным ВИЧ вирусом (VSV-G/pNLG1-P2A-∆Env-20 мкг/мл p24) и инкубируют в течение 4 часов при 37°C, 5% CO2 и 90% влажности. VSV-G/pNLG1-P2A-∆Env является VSV-G псевдотипированным вирусом, полученным из pNL43 с egfp вставкой 5’ nef и eGFP экспрессией, управляемой нормальными сплайсированными РНК транскриптами. Вирус, содержащий Vif, усеченный на 50 аминокислот из-за делеции одного нуклеотида, вызывающего сдвиг рамки, не экспрессирует Nef из-за стоп-кодона после gfp. ВИЧ Env не экспрессируется из-за сдвига рамки, что дает множество стоп-кодонов. инфицированные клетки затем промывают полной средой плюс 10 Ед/мл IL-2 3 раза с центрифугированием при 200 x г в течение 3 минут при 22°C. Клетки ресуспендируют при 5×106 клеток/мл в полной среде плюс 10 Ед/мл IL-2 и инкубируют в течение ночи при 37°C, 5% CO2 и 90% влажности. Для обработки соединения, инфицированные PBMC разводят до 4×105 клеток/мл RPMI 1640 с L-глутамином, 50% сывороткой здорового человека(СЗЧ), 100 Ед/мл пенициллина-стрептомицина плюс IL-2 (10 Ед/мл), и 20000 клеток переносят в каждую лунку 384-луночного покрытого поли-D-лизином планшета, содержащего соединения с конечным ДМСО <0,5%. Соединения тестируют с 10-точечным 3-кратным титрованием. Планшеты анализируют на аппарате для визуализации Acumen ex3 с применением Blue Laser 488 нм, и количество GFP-положительных объектов собирают с потерей GFP репрезентирующей смерти зараженных клеток. Кривые титрования и значения EC50 рассчитывают с применением четырехпараметрической логистической модели подгонки. Результаты показаны в Таблице 15.
ТАБЛИЦА 15
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОЛЕКАРСТВЕННЫЕ СРЕДСТВА ИНГИБИТОРОВ ОБРАТНОЙ ТРАНСКРИПТАЗЫ ВИЧ | 2015 |
|
RU2693622C2 |
| СОЕДИНЕНИЯ 2,3-ДИГИДРОХИНАЗОЛИНА В КАЧЕСТВЕ ИНГИБИТОРОВ NaV1.8 | 2020 |
|
RU2833870C2 |
| НЕНУКЛЕОЗИДНЫЕ ИНГИБИТОРЫ ОБРАТНОЙ ТРАНСКРИПТАЗЫ | 2007 |
|
RU2451676C2 |
| ИНГИБИТОРЫ ТРАНСГЛУТАМИНАЗЫ 2 (TG2) | 2019 |
|
RU2781370C2 |
| ТРИАРИЛЬНЫЕ СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ PD-L1 ЗАБОЛЕВАНИЙ | 2020 |
|
RU2840345C2 |
| СОЕДИНЕНИЯ N-ПИРРОЛИДИНИЛМОЧЕВИНЫ, N'-ПИРАЗОЛИЛМОЧЕВИНЫ, ТИОМОЧЕВИНЫ, ГУАНИДИНА И ЦИАНОГУАНИДИНА КАК ИНГИБИТОРЫ КИНАЗЫ TRKA | 2013 |
|
RU2677667C2 |
| ПРОИЗВОДНЫЕ ДИАМИНОПИРИМИДИНА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2587981C2 |
| АЗОТСОДЕРЖАЩИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ В ЛЕКАРСТВЕННЫХ ПРЕПАРАТАХ | 2014 |
|
RU2694254C1 |
| ФЕНОКСИМЕТИЛЬНЫЕ ПРОИЗВОДНЫЕ | 2016 |
|
RU2746481C1 |
| 1-ГИДРОКСИИМИНО-3-ФЕНИЛ-ПРОПАНЫ | 2011 |
|
RU2579114C9 |
Изобретение относится к производным пиридинона формулы I или его фармацевтически приемлемой соли и фармацевтическим композициям на их основе, обладающим активностью по уничтожению клеток, активируемых малыми молекулами (SMACK), и обладающим активностью по селективному уничтожению ВИЧ-инфицированных клеток, экспрессирующих GAG-POL. Использование изобретения позволяет лечить инфекции ВИЧ, а также проводить лечение и профилактику или задержку начала или прогрессирования СПИД или СПИД-ассоциированного комплекса (ARC). 3 н. и 13 з.п. ф-лы, 16 табл., 43 пр.
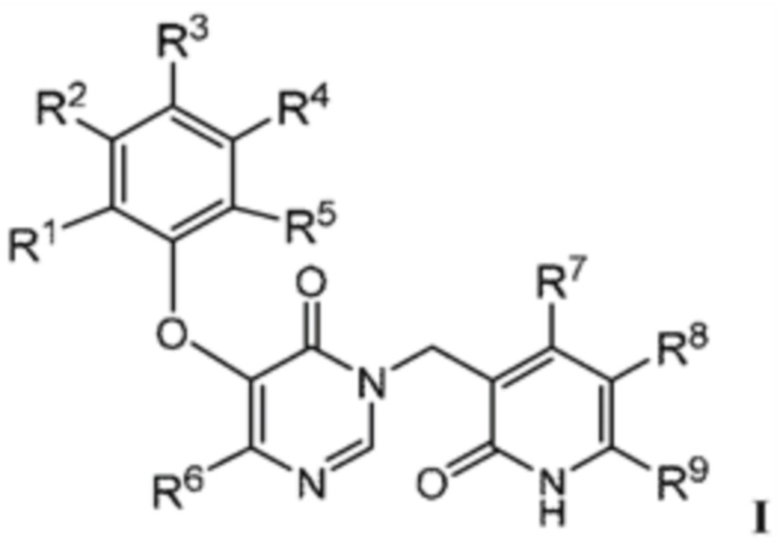

1. Соединение формулы I
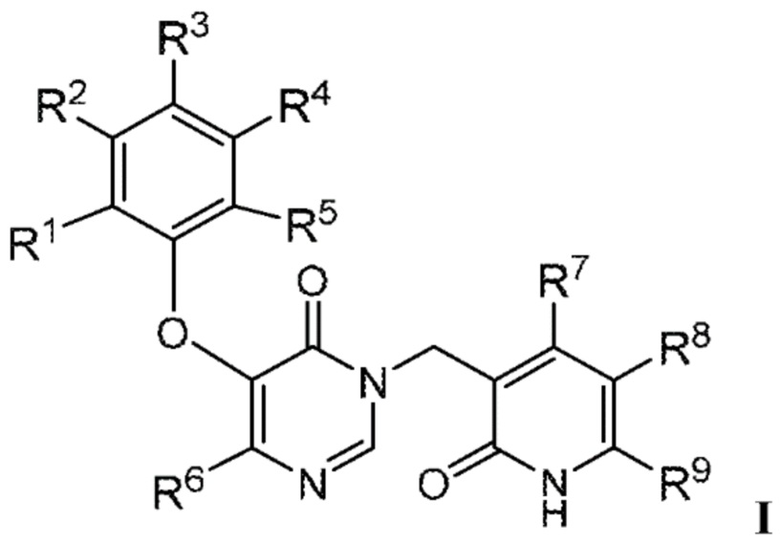
или его фармацевтически приемлемая соль,
где R1 является Н, галогеном или -C1-3алкилом, незамещенным или замещенным 1-7 F;
R2 является CN и R3 является Н; или R2 является Н и R3 является CN, или R2 является -C1-3алкилом, незамещенным или замещенным 1-7 F, и R3 является H;
R4 является -H, галогеном, -C1-3алкилом, незамещенным или замещенным 1-7 F, -OC1-3алкилом, незамещенным или замещенным 1-7 F, или CN;
R5 является –H или -C1-3алкилом, незамещенным или замещенным 1-7 F;
R6 является галогеном или -C1-6алкилом, замещенным 1-9 -F;
R7 является -H или -C1-3алкилом;
R8 является -H, галогеном или -C1-3алкилом; и
R9 является -H, пиразолилом или -C1-6алкилом, незамещенным или замещенным -OH или -OC1-3алкилом.
2. Соединение по п. 1 или его фармацевтически приемлемая соль, отличающееся тем, что R6 является галогеном или -C1-3алкилом, замещенным 1-7 -F.
3. Соединение по п. 2 или его фармацевтически приемлемая соль, отличающееся тем, что R7 является Н или -CH3.
4. Соединение по п. 3 или его фармацевтически приемлемая соль, отличающееся тем, что R8 является -H или галогеном.
5. Соединение по любому из пп. 1-4, имеющее структурную формулу II
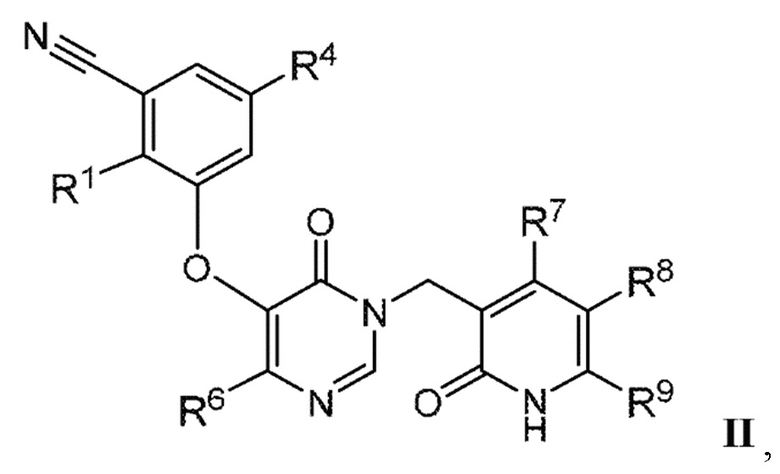
или его фармацевтически приемлемая соль.
6. Соединение по п. 5 или его фармацевтически приемлемая соль, отличающееся тем, что R1 является -H.
7. Соединение по п. 5 или его фармацевтически приемлемая соль, отличающееся тем, что R1 является галогеном или -C1-3алкилом, незамещенным или замещенным 1-7 F.
8. Соединение по любому из пп. 1-4, имеющее структурную формулу III
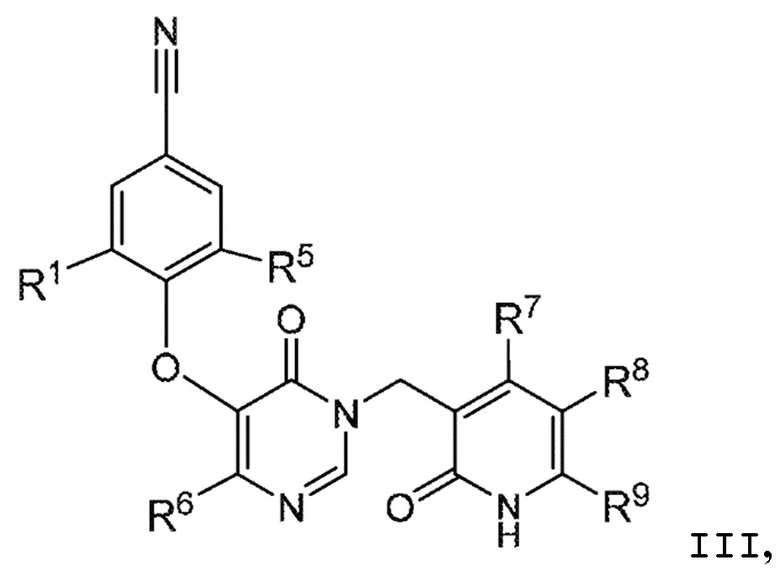
или его фармацевтически приемлемая соль.
9. Соединение по п. 8 или его фармацевтически приемлемая соль, отличающееся тем, что R1 является галогеном или -C1-3алкилом, незамещенным или замещенным 1-7 F.
10. Соединение по п. 9 или его фармацевтически приемлемая соль, отличающееся тем, что R5 является галогеном или -C1-3алкилом, незамещенным или замещенным 1-7 F.
11. Соединение по п. 1, которым является:
5-хлор-2-фтор-3-((1-((6-(метоксиметил)-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил;
5-хлор-3-((4-(1,1-дифторэтил)-1-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)-2-фторбензонитрил;
5-хлор-3-((4-(1,1-дифторэтил)-1-((6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)-2-фторбензонитрил;
5-хлор-2-фтор-3-((1-((6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил;
5-(дифторметил)-3-((1-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил;
3-хлор-5-((1-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил;
3-бром-5-((1-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил;
2,5-дихлор-3-((6-оксо-1-((2-оксо-1,2-дигидропиридин-3-ил)метил)-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил;
5-фтор-2-метил-3-((1-((6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил;
4-((1-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-3,5-диметилбензонитрил;
3-((1-((5-бром-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-5-(дифторметил)-2-метилбензонитрил;
5-хлор-3-((4-(1-фторэтил)-6-оксо-1-((2-оксо-6-(1H-пиразол-3-ил)-1,2-дигидропиридин-3-ил)метил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил;
5-хлор-2-метил-3-((6-оксо-1-((2-оксо-6-(1H-пиразол-3-ил)-1,2-дигидропиридин-3-ил)метил)-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил;
5-(дифторметил)-3-((1-((5-фтор-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил;
3-((4-(1,1-дифторэтил)-1-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)-5-метилбензонитрил;
5-(дифторметил)-2-метил-3-((6-оксо-1-((2-оксо-1,2-дигидропиридин-3-ил)метил)-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил;
5-(дифторметил)-2-метил-3-((6-оксо-1-((2-оксо-1,2-дигидропиридин-3-ил)метил)-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил;
5-(дифторметил)-3-((1-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил;
5-хлор-3-((1-((5-фтор-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил;
5-хлор-2-фтор-3-((1-((5-фтор-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(перфторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил;
5-хлор-2-фтор-3-((1-((6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(перфторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил;
5-(дифторметил)-2-метил-3-((1-((6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил;
5-(дифторметил)-2-метил-3-((6-оксо-1-((2-оксо-1,2-дигидропиридин-3-ил)метил)-4-(перфторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил;
3-((1-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-2,5-диметилбензонитрил;
5-(дифторметил)-3-((1-((6-(гидроксиметил)-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил;
5-(дифторметил)-3-((1-((6-(метоксиметил)-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил;
5-(дифторметил)-3-((1-((2-гидрокси-6-(1H-пиразол-4-ил)пиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил;
5-(дифторметил)-3-((1-((6-(3-гидроксипропил)-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил;
5-(дифторметил)-3-((1-((6-(2-гидроксипропан-2-ил)-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил;
3-хлор-5-((6-оксо-1-((2-оксо-6-(1H-пиразол-4-ил)-1,2-дигидропиридин-3-ил)метил)-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил;
5-хлор-2-фтор-3-((1-((6-(гидроксиметил)-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил;
(S) 5-хлор-2-фтор-3-((4-(1-фторэтил)-1-((6-(гидроксиметил)-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)бензонитрил;
(R)-5-хлор-2-фтор-3-((4-(1-фторэтил)-1-((6-(гидроксиметил)-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-1,6-дигидропиримидин-5-ил)окси)бензонитрил;
5-хлор-2-фтор-3-((1-((6-(1-гидроксиэтил)-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил, изомер A;
3-(дифторметил)-5-((1-((5-фтор-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил;
2,5-дихлор-3-((1-((5-фтор-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил;
5-хлор-2-фтор-3-((1-((5-фтор-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил;
5-(дифторметил)-3-((1-((5-фтор-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(перфторэтил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил;
5-хлор-2-фтор-3-((1-((6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил;
3-(дифторметил)-5-((1-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2,2-тетрафторэтил)-1,6-дигидропиримидин-5-ил)окси)бензонитрил;
5-(дифторметил)-3-((1-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(1,1,2-трифторэтил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил; или
5-(дифторметил)-3-((1-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-6-оксо-4-(трифторметил)-1,6-дигидропиримидин-5-ил)окси)-2-метилбензонитрил;
или его фармацевтически приемлемая соль.
12. Соединение по п. 1, которым является
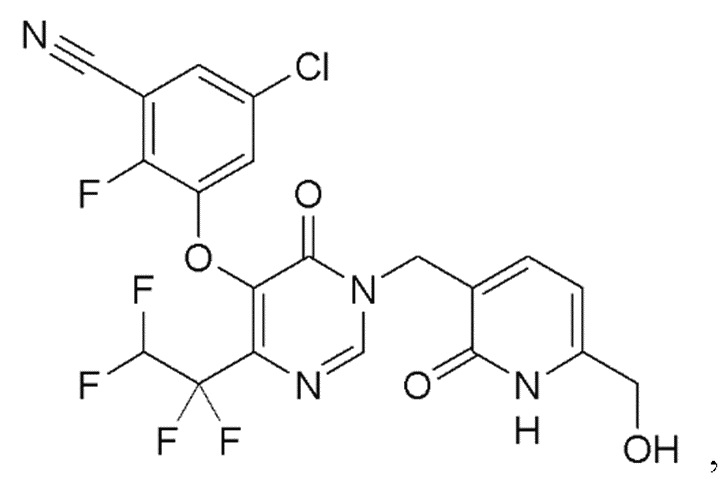
или его фармацевтически приемлемая соль.
13. Фармацевтическая композиция, обладающая активностью по уничтожению клеток, активируемых малыми молекулами (SMACK), содержащая эффективное количество соединения по любому из пп. 1-12 или его фармацевтически приемлемую соль, и фармацевтически приемлемый носитель.
14. Фармацевтическая композиция по п. 13, дополнительно содержащая эффективное количество одного или нескольких дополнительных нуклеозидных или нуклеотидных ингибиторов обратной транскриптазы ВИЧ, нуклеозидных или нуклеотидных ингибиторов трансляции обратной транскриптазы, не нуклеозидных ингибиторов обратной транскриптазы ВИЧ, ингибиторов интегразы ВИЧ, ингибиторов слияния ВИЧ, ингибиторов проникновения ВИЧ и ингибиторов созревания ВИЧ.
15. Соединение по любому из пп. 1-12 для терапии.
16. Фармацевтическая композиция, обладающая активностью по селективному уничтожению ВИЧ-инфицированных клеток, экспрессирующих GAG-POL, содержащая эффективное количество соединения по любому из пп. 1-12 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель.
| WO 2014058747 A1, 17.04.2014 | |||
| US 6683079 B2, 27.01.2004 | |||
| US 20100056535 A1, 04.03.2010 | |||
| US 20100256181 A1, 07.10.2010 | |||
| ПРОИЗВОДНОЕ 6-(ГЕТЕРОЦИКЛЗАМЕЩЕННЫЙ БЕНЗИЛ)-4-ОКСОХИНОЛИНА И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРА ИНТЕГРАЗЫ ВИЧ | 2007 |
|
RU2399616C1 |
Авторы
Даты
2024-03-26—Публикация
2020-05-18—Подача