Область техники
Изобретение относится к медицине, а именно к области диагностики онкогематологических заболеваний.
Существующий уровень техники
Диагностика острых лейкозов состоит из двух этапов. Первый из них (этап 1) - определение в пунктате костного мозга незрелых (бластных) клеток. Если их количество превышает 20% от всех ядерных клеток в образце, у пациента острый лейкоз, в противном случае диагноз «острый лейкоз» исключается. Второй этап (этап 2) - определение принадлежности обнаруженных бластных клеток к тому или иному подтипу лейкоцитов и определение степени их созревания. В зависимости от природы бластных клеток острые лейкозы разделяют на лимфобластные (ОЛЛ) и миелоидные (ОМЛ), и каждый из указанных типов делится на подгруппы в зависимости от стадии созревания бластных клеток (Т-ОЛЛ 1-4, В-ОЛЛ 1-4, ОМЛ М0-М7). Данная подгруппа фактически является диагнозом по т.н. франко-американско-британской (FAB) классификации. Несмотря на то, что современная классификация лейкозов (Swerdlow, S., Campo, Е., Harris, N. L, Jaffe, E. S., Pileri, S. A., Stein, H., … & Vardiman, J. W. (2008). WHO Classification of Tumors of Hematopoietic and Lymphoid Tissues 4th Ed.) учитывает присутствие различных мутаций, в случае невозможности проведения соответствующих исследований диагноз по FAB-классификации позволяет в случае необходимости назначить лечение.
Существует метод диагностики острых лейкозов с помощью проточной цитометрии. В основе метода лежит инкубация клеток пунктата костного мозга с антителами к поверхностным или внутриклеточным дифференцировочным антигенам лейкоцитов человека (cluster-of-differentiation, CD) с последующим определением количества клеток, несущих те или иные CD-антигены, с помощью проточного цитометра (патент «Method for the classification and monitoring of leukemias», US 5234816 А). В данном методе бластные клетки определяются по уровню бокового светорассеяния и экспрессии пан-лейкоцитарного антигена CD45 (этап 1), а дальнейшее определение природы обнаруженных бластов (этап 2) производится на основании набора CD-антигенов, обнаруженных на этой популяции клеток. В настоящий момент в литературе и медицинской практике параллельно существует несколько схем диагностики лейкозов методом проточной цитометрии, отличающихся последовательностью применения антител к различным антигенам, их набором и методами их сочетания, а также клонами используемых антител и выбором флуоресцентных меток на них (Van Dongen, J. J. M., Lhermitte, L, Bottcher, S., Almeida, J., Van der Velden, V. H. J., Flores-Montero, J., & Mejstrikova, E. (2012). EuroFlow antibody panels for standardized n-dimensional flow cytometric immunophenotyping of normal, reactive and malignant leukocytes. Leukemia, 26(9), 1908; Bene, M. C, Nebe, Т., Bettelheim, P., Buldini, В., Bumbea, H., Kern, W., & Maynadie, M. (2011). Immunophenotyping of acute leukemia and lymphoproliferative disorders: a consensus proposal of the European LeukemiaNet Work Package 10. Leukemia, 25(4), 567).
Основным недостатком данного метода является затруднительность разделения различных подвидов ОМЛ, за исключением ОМЛ М7, имеющего характерный иммунофенотип опухолевых клеток. Кроме того, данный метод требует использования дорогостоящего оборудования и реактивов (проточного цитометра и флуоресцентно меченых моноклональных антител).
Существует способ диагностики острых лейкозов с помощью подложки из нитроцеллюлозы с иммобилизованными на ней антителами (патент «Ап assay to detect a binding partner» ЕР 1151300 A4; Christopherson, R. I., Stoner, K., Barber, N., Belov, L, Woolfson, A., Scott, M., … & Mulligan, S. P. (2006). Classification of AML using a monoclonal antibody microarray. Myeloid Leukemia: Methods and Protocols, 241-251)
Основу метода составляет исследование «расширенного иммунофенотипа» мононуклеаров, выделенных из периферической крови или пунктата костного мозга методом центрифугирования в градиенте плотности Histopaque 1077. Расширенный иммунофенотип определяется как набор плотностей связывания клеток с каждым из 96 антител к CD (cluster of differentiation)-антигенам после инкубации суспензии клеток с биочипом без перемешивания. Авторами метода выделены расширенные иммунофенотипы, в большей степени характерные для разных подтипов ОМЛ. Поскольку в этом способе нет разделения на этап 1 и этап 2, основной проблемой при использовании данного способа является его недостаточная точность, особенно при небольших бластных популяциях, и затруднения в отделении острых лейкозов с небольшой бластной популяцией от хронических лейкозов с повышенной концентрацией бластов. Кроме того, недостатком данного способа является необходимость использования специального оборудования для сканирования биочипов с связавшимися клетками, а также невозможность его применения в случае бифенотипических или билинейных лейкозов.
Существует способ диагностики с использованием морфологии и проточной цитометрии. При этом исследования пунктата костного мозга пациента проводятся параллельно в мазках методами морфологии и цитохимии.
Этап 1 проводится параллельно в мазках с использованием морфологического способа подсчета бластных клеток, и методом проточной цитометрии, с определением бластной популяции по боковому светорассеянию и уровню экспрессии CD45.
Этап 2 также проводится параллельно в мазках с определением линейной принадлежности бластных клеток на основании их морфологии и активности линиеспецифичных ферментов в лейкоцитах костного мозга и методом проточной цитометрии на основании экспрессируемых на бластных клетках дифференцировочных антигенов. Данные морфологии и цитохимии с одной стороны и цитометрии с другой стороны комбинируются для формулировки диагноза. Этот метод является наиболее точным из описанных, закреплен в медицинских стандартах и рекомендуется Всемирной организацией здравоохранения (Swerdlow, S., Campo, Е., Harris, N. L, Jaffe, E. S., Pileri, S. A., Stein, H., & Vardiman, J. W. (2008). WHO Classification of Tumors of Hematopoietic and Lymphoid Tissues 4th Ed., c. 110-139, c. 168-178).
Основным недостатком данного способа является невозможность его использования в учреждениях, не оснащенных проточной цитометрией и не имеющих специалистов для проведения данного типа анализа. Кроме того, при работе по данному способу требуется сравнивать данные, полученные с помощью двух диагностических методов, причем бластная популяция в них определяется по-разному. Это может приводить к затруднению в сопоставлении данных и постановке диагноза.
Существует способ диагностики острых лейкозов с определением подгруппы по FAB-классификации на основании морфологии и цитохимических реакций на миелопероксидазу, Судан черный, неспецифическую эстеразу с подавлением NaF, а также кислую фосфатазу и реакцию на определение гликогена с помощью Шиффовых оснований (по методу йодная кислота -реактив Шиффа, ШИК-реакция) (Р. В. Neame, P. Soamboonsrup, G. Р Browman, R. М. Meyer, A. Benger, W. Е. Wilson, &, J. А. McBride (1986). Classifying acute leukemia by immunophenotyping: a combined FAB-immunologic classification of AML. Blood, 68(6), 1355-1362; Dacie and Lewis Practical Hematology, ed. B.J. Bain, I. Bates, M.A. Laffan, A.M. Lewis (2011) 11th ed., Elsevier Churchill Livingstone). При этом количество бластных клеток определяется морфологически (по характерной «бластной» структуре хроматина, этап 1), а диагноз ставится на основании морфологических особенностей бластов (формы ядра, наличия гранул или их конгломератов, т.н. палочек Ауэра) и цитохимических реакций (этап 2). Соотношение клеток, положительных по миелопероксидазе, присутствующей в созревающих гранулоцитах, и неспецифической эстеразе, подавляемой NaF, характерной для монобластов, позволяет различить различные подтипы ОМЛ (Dacie and Lewis Practical Hematology, ed. B.J. Bain, I. Bates, M.A. Laffan, A.M. Lewis (2011) 11th ed., Elsevier Churchill Livingstone). Учитывается также, что опухолевые клетки при лимфобластных лейкозах отрицательны по миелопероксидазе, Судану черному и неспецифической эстеразе и в различной степени положительны по ШИК-реакции, а Т-лимфобластные лейкозы часто положительны по кислой фосфатазе. Основными недостатками данного метода являются сложности в дифференциальной диагностике лимфобластного лейкоза, поскольку данный метод не позволяет уверенно различать Т-лимфобластные и В-лимфобластные лейкозы и разделять различные подвиды В-лимфобластного лейкоза. Главным достоинством способа является его дешевизна и нетребовательность к оборудованию (достаточно светового микроскопа). Данный способ выбирается в качестве ближайшего аналога.
Раскрытие изобретения
Задачей при создании описываемого способа является разработка способа диагностики острых лейкозов до подгруппы острого лейкоза по FAB-классификации, осуществимого при помощи светового микроскопа, при котором этап 1, определение количества бластных клеток, осуществлялся бы на основании анализа морфологических характеристик, а определение принадлежности обнаруженных бластных клеток к тому или иному подтипу лейкоцитов и определение степени их созревания (этап 2) осуществлялся бы как на основании их морфологии и цитохимической активности, так и на основании экспрессируемых на бластных клетках дифференцировочных антигенов.
Указанная задача решается за счет того, что создан способ дифференциальной диагностики острых лейкозов на основании исследования морфологии и цитохимической активности лейкоцитов пунктата костного мозга, при этом для анализа выделяют мононуклеарную фракцию лейкоцитов и сортируют выделенные клетки по их поверхностным антигенам путем инкубации на трех клеточных биочипах с иммобилизованными на прозрачной подложке антителами, затем биочипы отмывают от несвязавшихся лейкоцитов и высушивают, после чего биочип 1 окрашивают для морфологического исследования, биочип 2 используют для определения внутриклеточных маркеров, а биочип 3 - для анализа на цитохимическую активность, наличие острого лейкоза устанавливают, если при морфологическом анализе лейкоцитов, связавшихся с анти-CD45RA на биочипе 1, доля бластных клеток среди них превышает пороговое значение, а линейная принадлежность бластных клеток определяют на основании набора антител, с которыми связываются бластные клетки, определяемого по биочипу 1, анализа на внутриклеточные линиеспецифичные антигены на биочипе 2 и анализа цитохимической активности лейкоцитов на биочипе 3. В заявленном способе на биочип наносят антитела ко всем или части из следующего списка антигенов: CD1a, CD2, CD3, CD4, CD5, CD7, CD8, CD10, CD11b, CD11c, CD13, CD14, CD15, CD16, CD19, CD20, CD22, CD23, CD25, CD27, CD28, CD33, CD34, CD38, CD41, CD42, CD43, CD45, CD45RA, CD45R0, CD56, CD61, CD64, CD103, CD117, CD123, CD200, CD235, HLA-DR, IgM, к и λ легкие цепи иммуноглобулинов, CD133, отрицательный контроль (смесь иммуноглобулинов). При этом после отмывки биочипов от неспецифически связавшихся лейкоцитов для подготовки к окраске для морфологического исследования биочипы заливают фетальной телячьей сывороткой или инактивированной человеческой плазмой и высушивают с помощью вращения вокруг оси, перпендикулярной его плоскости и проходящей через его центр. Пороговое значение для доли бластных клеток среди всех клеток, связавшихся с анти-CD45RA, при превышении которого устанавливают диагноз «острый лейкоз», составляет 25%. Если доля бластных клеток среди всех клеток, связавшихся с антителом к CD45RA, превышает пороговое значение, то на основании наличия связывания бластных клеток с антителами к набору CD антигенов, характерных для миелоидных, моноцитарных и лимфоидных клеток, определяют миеломоноцитарный и В-лимфоцитарный баллы. По заявленному способу миеломоноцитарный балл вычисляют по формуле ММ=p(CD13)+p(CD33)+p(CD117)+p(CD14)+p(CD64)+0.5*p (CD11b)+0.5*p(CD15), причем при наличии связывания бластных клеток с антителом к CDi p(CDi)=1, а при отсутствии связывания бластных клеток с антителом к CDi p(CDi)=0. В-лимфоцитарный балл вычисляют по формуле В=p(CD10)+p(CD19)+(CD22), где при наличии связывания бластных клеток с антителом к CDi p(CDi)=1, а при отсутствии связывания бластных клеток с антителом к CDi p(CDi)=0. Пороговые значения для В-лимфоцитарного и миеломоноцитарного баллов составляют 2.
Если миеломоноцитарный балл ниже его порогового значения, а В-лимфоцитарный балл больше либо равен его пороговому значению, ставят диагноз «В-лимфобластный лейкоз» и определяют подвид В-ОЛЛ (В1, В2-В3, В4). Для уточнения подвида В-ОЛЛ в случае связывания бластных клеток с антителами к CD10 и CD19 и отсутствия связывания с анти-IgM, устанавливают диагноз ОЛЛ В2-В3, а если бластные клетки отрицательны и по CD10, и по IgM, устанавливают диагноз ОЛЛ В1.
Для миеломоноцитарного балла большего либо равного его пороговому значению, устанавливают диагноз «острый миелобластный лейкоз подварианты М2, М3, М4 или М5» и далее производят анализ биочипа 3 на активность α-нафтилбутират эстеразы и нафтол AS-D-хлорацетат эстеразы. При доле клеток, положительных по α-нафтилбутират эстеразе среди всех клеток, связавшихся с антителом к CD45RA, не ниже порога 1, устанавливают диагноз ОМЛ М5, а при доле клеток, положительных по α-нафтилбутират эстеразе среди всех клеток, связавшихся с антителом к CD45RA, ниже порога 2, и доле клеток, положительных по нафтол AS-D-хлорацетат эстеразе, не ниже порога 3, устанавливают диагноз ОМЛ М2 или ОМЛ М3, причем ОМЛ М3 определяют по характерной морфологии патологических промиелоцитов. Причем порог 1 составляет 40%, порог 2 - 2%, а порог 3 - 20%.
При миеломоноцитарном балле ниже его порогового значения и В-лимфоцитарном балле ниже его порогового значения, ставят диагноз «острый миелобластный лейкоз М0, М1, М7 или Т-лимфобластный лейкоз», при этом если бластные клетки присутствуют на антителах к CD41 и/или CD61, устанавливают диагноз «острый миелобластный лейкоз, М7». Для дифференциальной диагностики ОМЛ М0-М1 от Т-ОЛЛ используют анализ клеток, связавшихся с биочипом 2, на наличие внутриклеточного CD3, и при наличии внутриклеточного CD3 в бластных клетках устанавливают диагноз Т-ОЛЛ. При этом биочип 2 со связавшимися клетками фиксируют, промывают, сушат, инкубируют в забивочном растворе, затем с раствором антитела к CD3, конъюгированного с антигенной детерминантой (первичного антитела), затем с раствором антитела к антигенной детерминанте, конъюгированным с ферментом (вторичного антитела) и затем с колориметрическим субстратом для используемого фермента, дающим при реакции с ферментом цветной нерастворимый осадок. Для фиксации используют смесь формалина (40%) с чистым этанолом 1:10. При этом антигенной детерминантой является FITC, а ферментом, конъюгированным с вторичным антителом, выступает щелочная фосфатаза или пероксидаза хрена.
Краткое описание фигур
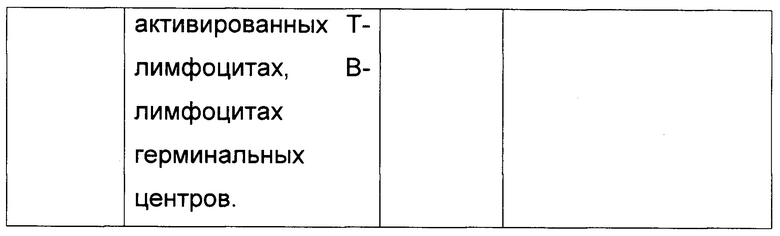
Фиг. 1.
Зависимость чувствительности и специфичности определения наличия (N=91) или отсутствия (N=60) острого лейкоза от порога процентной доли бластных клеток среди всех, связавшихся с антителом к CD45RA. Для определения чувствительности и специфичности у пациентов с долей бластных клеток выше порогового значения предполагали острый лейкоз, затем результат сравнивали с диагнозом, установленным стандартными диагностическими методами.
Фиг. 2.
ROC кривая для определения наличия (N=91) или отсутствия (N=60) острого лейкоза на основании порога процентной доли бластных клеток среди всех, связавшихся с антителом к CD45RA. Для определения чувствительности и специфичности у пациентов с долей бластных клеток выше порогового значения предполагали острый лейкоз, затем результат сравнивали с диагнозом, установленным стандартными диагностическими методами.
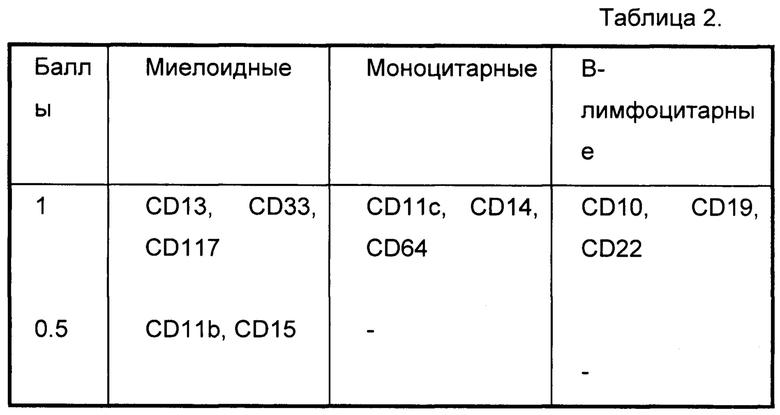
Фиг. 3.
Зависимость чувствительности и специфичности установления диагноза ОМЛ для пациентов, имеющих долю бластных клеток, связавшихся с анти-CD45RA на биочипе, более 25%, от порога миеломоноцитарного балла на основе данных 69 пациентов с ОМЛ и 29 пациентов с ОЛЛ. Для определения чувствительности и специфичности у пациентов с миеломоноцитарным баллом выше порога предполагался диагноз ОМЛ, и полученный результат сравнивался с диагнозом, поставленным стандартными диагностическими методами.
Фиг. 4.
ROC кривая для установления диагноза ОМЛ для пациентов с уровнем бластов, связавшихся с анти-CD45RA на биочипе выше 25%, на основании значения миеломоноцитарного балла. Для определения чувствительности и специфичности у пациентов с миеломоноцитарным баллом выше порога предполагался диагноз ОМЛ, и полученный результат сравнивался с диагнозом, поставленным стандартными диагностическими методами.
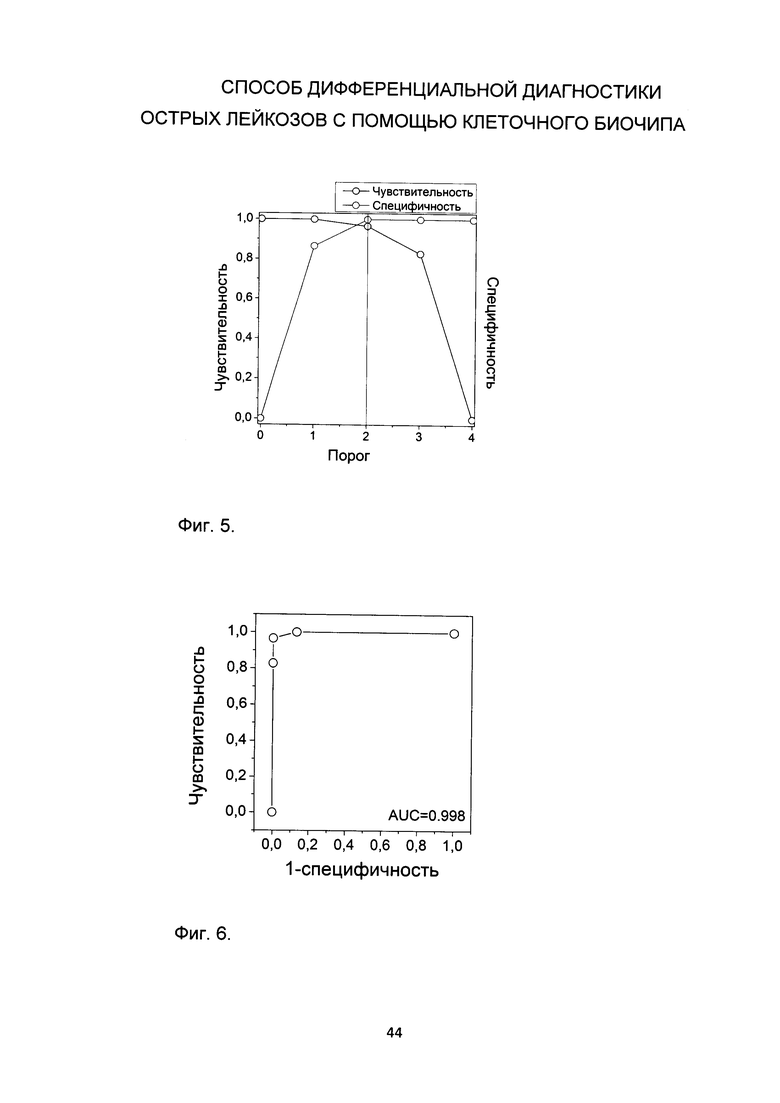
Фиг. 5.
Зависимость чувствительности и специфичности установления диагноза В-ОЛЛ для пациентов с уровнем бластов, связавшихся с анти-CD45RA на биочипе, выше 25% от порога В-лимфоцитарного балла на основе данных 60 пациентов с ОМЛ и 29 пациентов с ОЛЛ. Для определения чувствительности и специфичности у пациентов с В-лимфоцитарным баллом выше порога предполагался диагноз В-ОЛЛ, и полученный результат сравнивался с диагнозом, поставленным стандартными диагностическими методами.
Фиг.
6. ROC кривая для установления диагноза В-ОЛЛ для пациентов с уровнем бластов, связавшихся с анти-CD45RA на биочипе, выше 25% от порога В-лимфоцитарного балла на основании данных 69 пациентов с ОМЛ и 29 пациентов с ОЛЛ. Для определения чувствительности и специфичности у пациентов с В-лимфоцитарным баллом выше порога предполагался диагноз В-ОЛЛ, и полученный результат сравнивался с диагнозом, поставленным стандартными диагностическими методами.
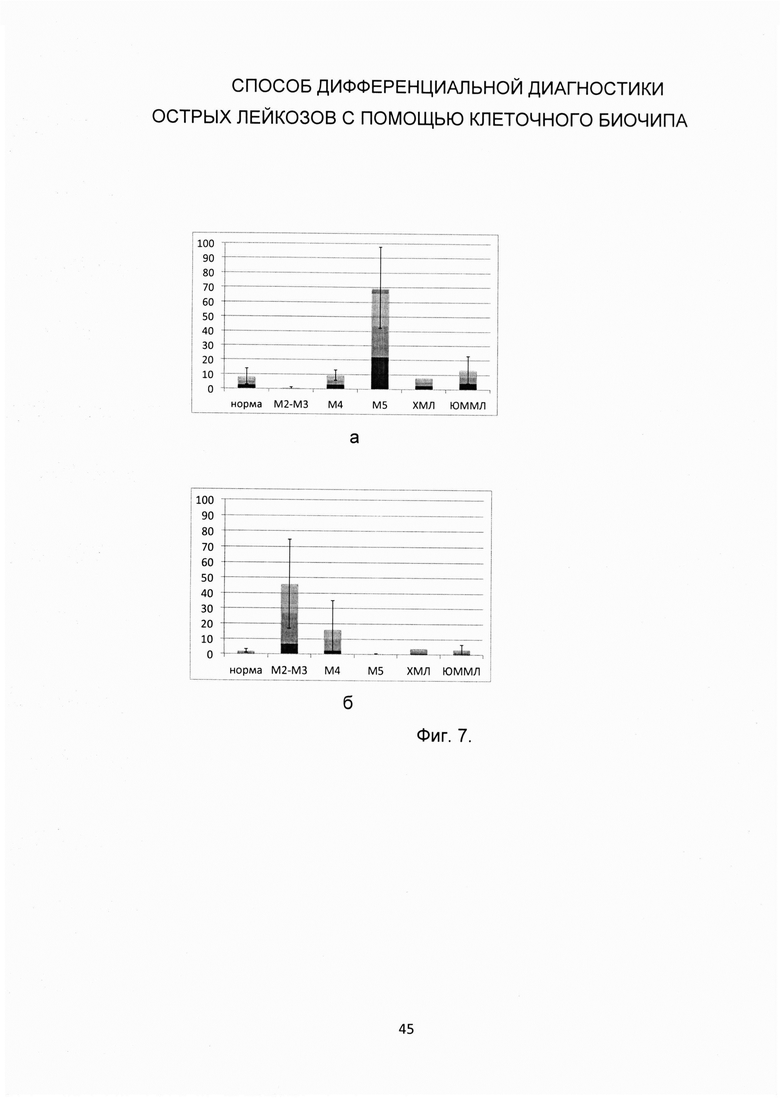
Фиг. 7.
а) Доля клеток, положительных по α-нафтил бутират эстеразе, от всех клеток, связавшихся на биочипе с анти-CD45RA, для здорового контроля и различных острых и хронических миелоидных лейкозов; б) Доля клеток, положительных по нафтол AS-D хлорацетат эстеразе, от всех клеток, связавшихся на биочипе с анти-CD45RA, для здорового контроля и различных острых и хронических миелоидных лейкозов.
Фиг. 8.
Властные клетки пациента с ОМЛ М3, связавшиеся на биочипе с антителами к CD38. Окраска по Паппенгейму, увеличение x1000.
Реализация изобретения
Подробное описание проведения диагностики ОЛ по предлагаемому способу:
1. Изготовление биочипа
- На прозрачные пластиковые подложки, например, из пластифицированного поливинилхлорида или полистирола с или без предварительной обработки наносят капли раствора моноклональных анти-CD антител в карбонат-бикарбонатном буфере рН 9.2-9.4, концентрация антител 0.25-0.75 мкг/мл; все описанные далее в методике и примерах результаты получены с использованием поливинилхлоридных покровных стекол производства Fisher Scientific размером 22×22 мм без предварительной обработки;
- Подложка с нанесенным каплями антител инкубируют во влажной камере при 4°С не менее 10 часов;
- Подложки вынимают из влажной камеры и высушивают при 4°С не менее 2 часов (до полного высыхания);
- Подложки с высохшими антителами заливают забивочным раствором, например 5% раствором бычьего сывороточного альбумина (BSA) на фосфатном буфере рН 7.2-7.4 (phosphate buffered saline, PBS) или 1% раствором полоксамера на фосфатном буфере рН 7.2-7.4 (phosphate buffered saline, PBS) и инкубируют при комнатной температуре 1 час;
- Подложки ополаскивают дистиллированной водой, заливают 0.1% раствором глютатиона в воде, инкубируют 10 минут с покачиванием и затем высушивают;
- Высушенные подложки запаковывают в герметичные контейнеры с осушителем и хранят при 4°С до использования;
- Перед использованием (до нанесения суспензии клеток) подложки инкубируют в 1% растворе BSA на PBS не менее 10 минут.
Высушивание антител при температуре 4°С является оптимальным протоколом иммобилизации антител по сравнению с отсутствием высушивания и высушиванием при комнатной температуре. Наши данные показывают, что при отсутствии высушивания плотность связывания клеток с иммобилизованными таким образом антителами ниже, чем при высушивании при температуре 4°С, а высушивание при комнатной температуре приводит к неравномерному распределению связывающихся клеток по площади пятна иммобилизованных антител.
2. Панель антител.
На биочипе для диагностики ОЛ по предлагаемому способу иммобилизуются антитела к следующим CD антигенам В таблице 1 представлены CD антигены, входящие в панель биочипа, и нормальные лейкоциты, на которых они экспрессируются..
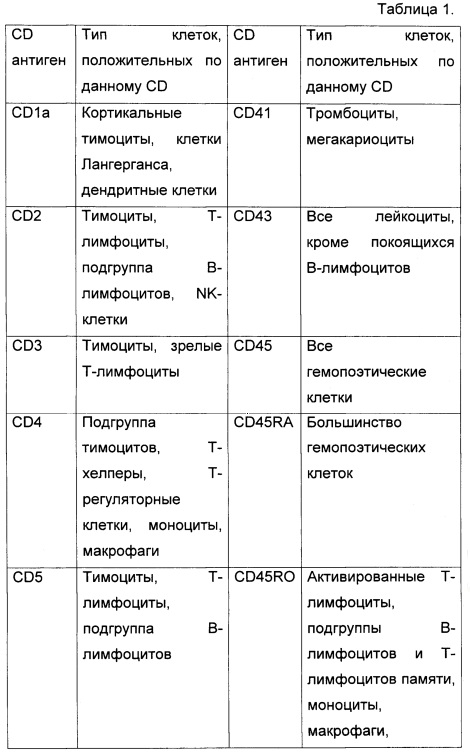
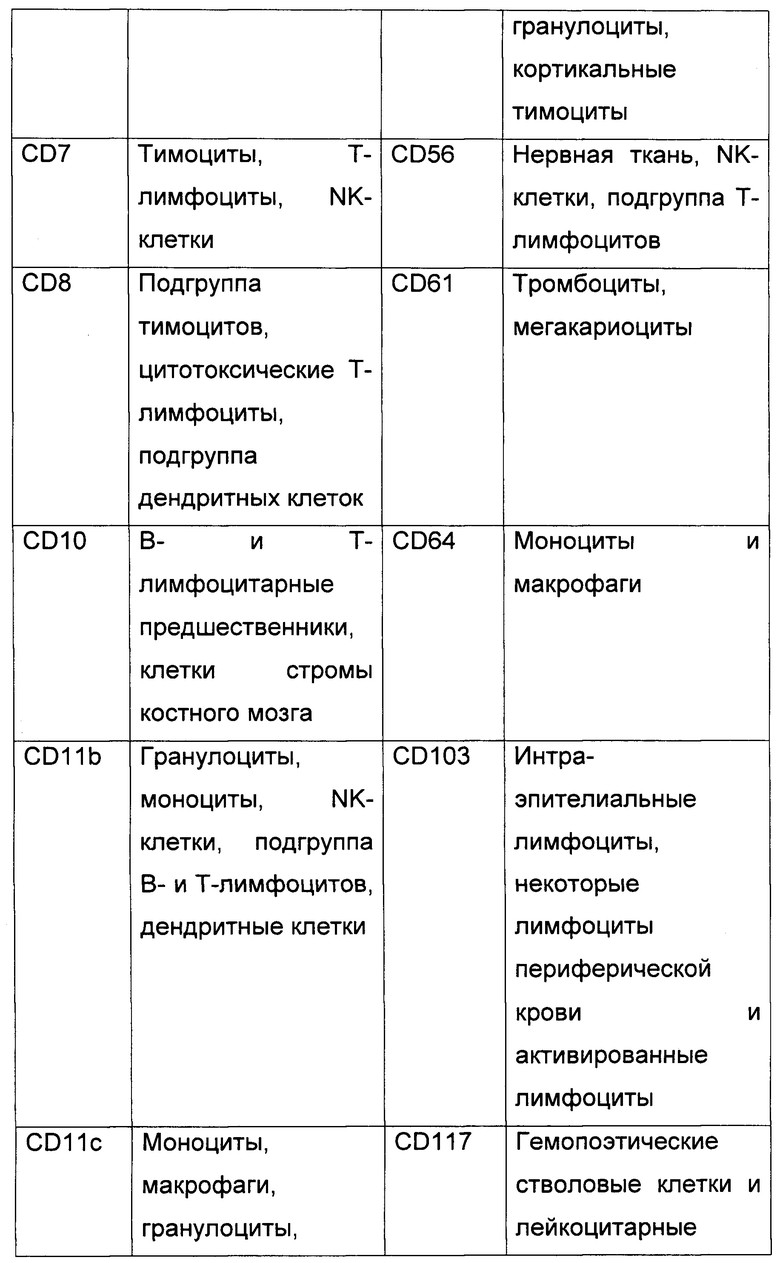
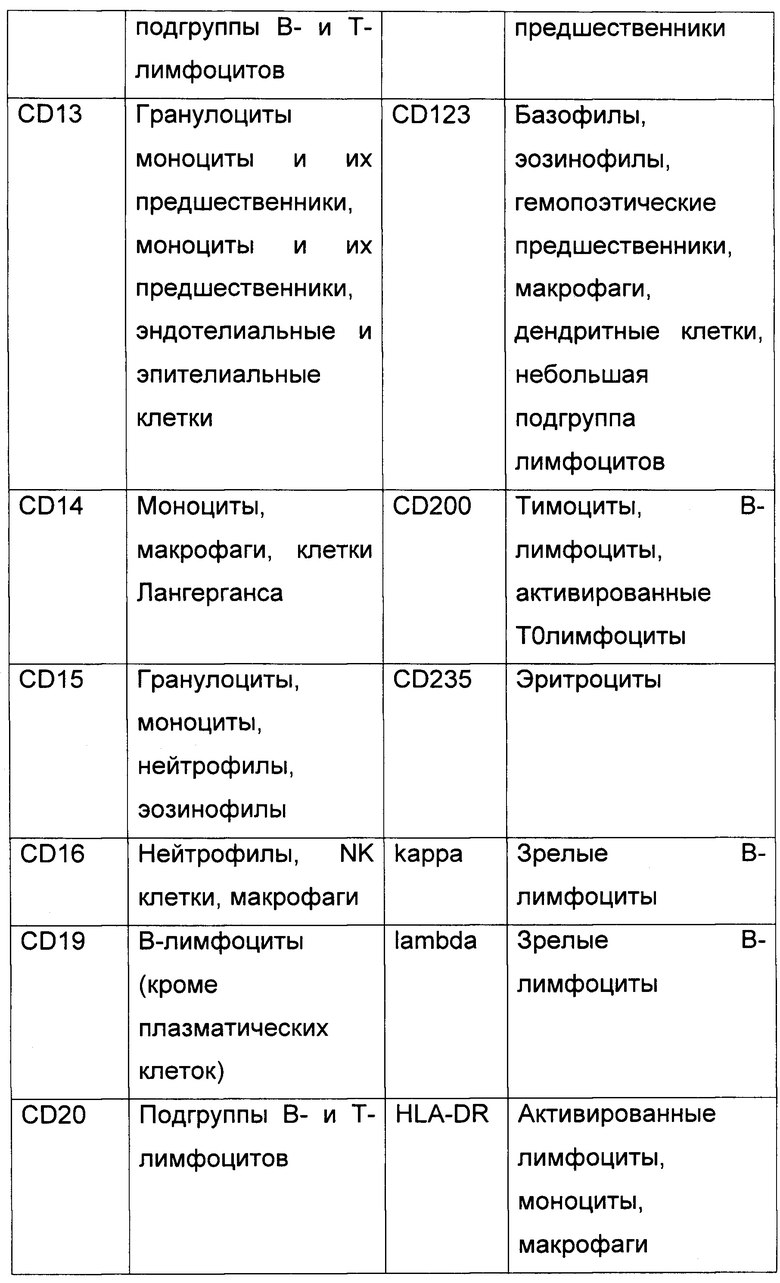
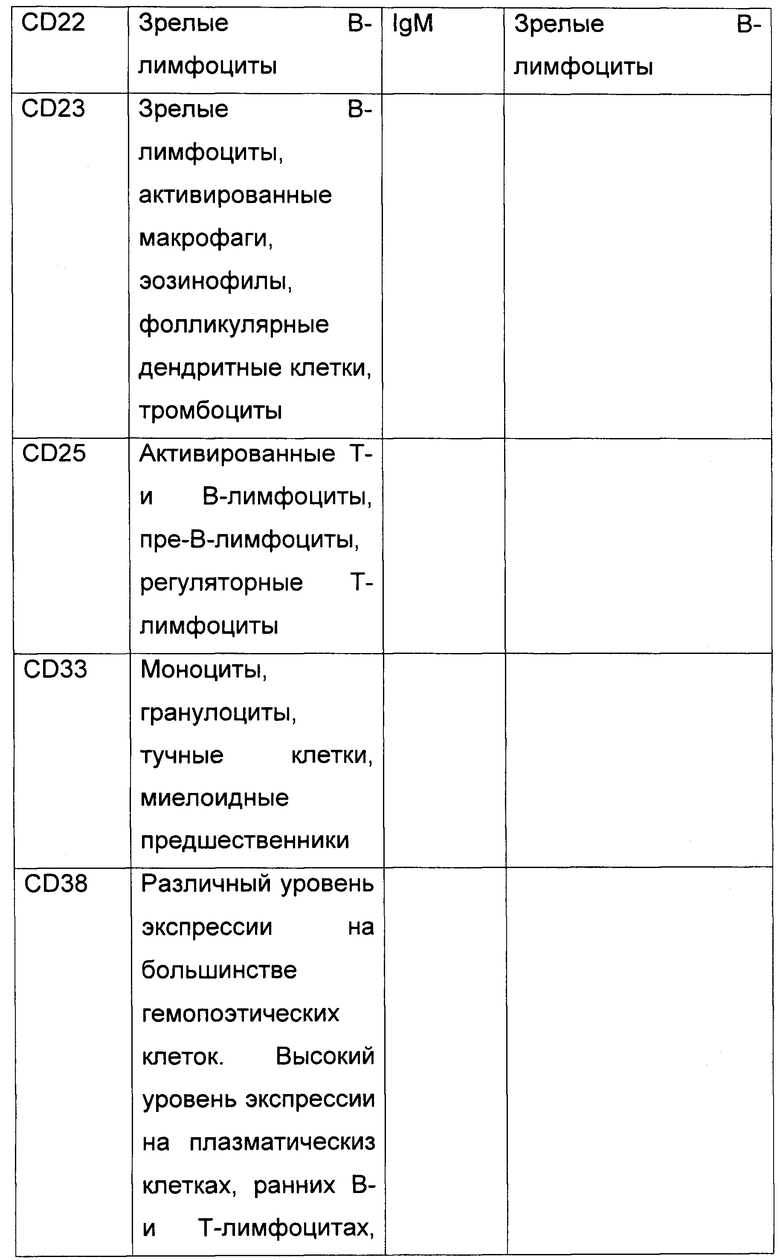
3. Сортировка клеток с помощью клеточного биочипа.
- Из пунктата костного мозга, взятого на ЭДТА, выделяют мононуклеарную фракцию с помощью центрифугирования в градиенте плотности Histopaque 1077 в соответствии с инструкцией производителя;
- Полученную суспензию мононуклеарных клеток ресуспендируют в растворе, содержащем более 50% фетальной телячей сыворотки или инактивированной человеческой плазмы в 1% растворе BSA на PBS. Целевое количество клеток в области над биочипом от 5 до 8⋅106.
- Полученную суспензию наносят на три биочипа (биочипы 1, 2 и 3) и инкубируют на охлаждающем элементе с температурой +7°С без перемешивания в течение 45 минут.
- Биочипы со связавшимися клетками ополаскивают в стакане с 1% BSA на PBS, остаток жидкости стряхивают, затем биочипы заливают чистой фетальной телячьей сывороткой или инактивированной человеческой плазмой и инкубируют несколько минут.
- Фетальную телячью сыворотку или инактивированную человеческую плазму сливают с биочипов, затем биочипы по очереди помещают в пазы специальной цитоцентрифуги, обеспечивающей вращение подложки в горизонтальной плоскости вокруг вертикальной оси, проходящей через ее центр, со скоростью от 4 до 7 тысяч об/мин в течение 10-30 секунд. Данная процедура обеспечивает быстрое высушивание клеток без нарушений осмотичности окружающего раствора и распластывание клеток по поверхности подложки. Распластывание клеток с помощью центрифугирования обеспечивает максимальное морфологическое сходство клеток с клетками в мазке, поскольку при приготовлении мазка клетки также распластываются по поверхности стекла за счет сил поверхностного натяжения.
4. Биочип 1 со связавшимися клетками окрашивают для морфологического исследования по Паппенгейму в соответствии со стандартными протоколами. Второй биочип (биочип 2) в случае попадания образца пациента в «серую зону» (см. ниже) может быть окрашен на внутриклеточный маркер CD3 по описанному ниже протоколу. Третий биочип (биочип 3) окрашивают для определения активности специфической и неспецифической эстераз по протоколу, описанному в работе (Dacie and Lewis Practical Hematology, ed. BJ Bain, I. Bates, MA Laffan, AM Lewis (2011) 11th ed., Elsevier Churchill Livingstone) с небольшими модификациями (см. ниже).
5. Анализ активности нафтол AS-D-хлорацетат эстеразы и а-нафтил бутират эстеразы.
Биочип 3 со связавшимися клетками фиксируется 30 с в охлажденном до 4°С формол-ацетоновом фиксаторе, отмывается проточной водой и высушивается. Для приготовления рабочего раствора 1 в 20 мл фосфатного буфера 100 мМ, рН 8.0 растворяют 18 мг соли прочного синего ВВ, затем добавляют 0.4 мл раствора (4 мг/мл) α-нафтил бутирата в ацетоне. Биочип 3 с зафиксированными клетками инкубируется в рабочем растворе 1 45 минут в темноте при комнатной температуре, затем отмывается проточной водой. Для приготовления рабочего раствора 2 10 мг соли прочного синего ВВ растворяют в 19 мл фосфатного буфера 66 мМ, рН 7.4, добавляют 1 мл раствора (2.5 мг/мл) нафтол AS-D-хлорацетата в N-диметилформамиде. Тот же биочип 3 заливают рабочим раствором 2, инкубируют 30 минут в темноте при комнатной температуре, затем отмывают проточной водой и высушивают (Dacie and Lewis Practical Hematology, ed. BJ Bain, I. Bates, MA Laffan, AM Lewis (2011) 11th ed., Elsevier Churchill Livingstone). Продукт реакции неспецифических эстераз с α-нафтил бутиратом выпадает в виде бурого осадка, продукт реакции специфических эстераз с нафтол AS-D-хлорацетатом - в виде синего или фиолетового осадка (Федянина, О.С, Закирова, А.О., Задорожная, А.Е., Капранов, Н.М., Хвастунова, А.Н., Ядгарова, П.А., … & Кузнецова, С.А. (2016) Исследование морфологии и распределения α-нафтилбутиратэстеразы и нафтол-АБ-О-хлор ацетат-эстеразы в нормальных предшественниках лейкоцитов миелоидного ростка с помощью клеточного биочипа. Онкогематология, 4, 74-79.).
6. Исследование наличия внутриклеточных маркеров Биочип 2 со связавшимися клетками после сушки в цитоцентрифуге фиксируют 10 сек в смеси формалина (40%) с чистым этанолом 1:10, промывают фосфатно-солевым буфером (PBS, рН 7.2-7.4) и высушивают на воздухе. Высушенный биочип 2 инкубируют в забивочном растворе, 1% растворе бычьего сывороточного альбумина (BSA) на PBS 30 мин при комнатной температуре. Забивочный раствор сливают, заливают биочип 2 с клетками раствором первичного антитела (моноклонального антитела к определяемому антигену, конъюгированного с FITC), в FACS буфере (5% телячей сыворотки в PBS) и инкубируют 30 минут при комнатной температуре. Затем биочип 2 отмывают от несвязавшихся антител отмывочным буфером (0.05% Tween 20 в PBS), заливают биочип 2 раствором вторичных антител (анти-FITC, конъюгированных с щелочной фосфатазой), инкубируют 30 минут при комнатной температуре, отмывают дважды отмывочным раствором, затем деионизованной водой. После этого биочип 2 инкубируют с готовым раствором колориметрического субстрата для щелочной фосфатазы в соответствии с рекомендациями производителя.
7. Определение бластоза (доли бластных клеток) для дифференцировки острых лейкозов от других заболеваний (этап 1).
На биочипе 1, окрашенном по Паппенгейму, с помощью световой микроскопии в светлом поле при увеличении х1000 производят подсчет клеток с бластной морфологией (бластной структурой хроматина), связавшихся на биочипе с антителом к CD45RA. В случае если доля бластных клеток от всех мононуклеаров, связавшихся с анти-CD45RA, составляет более 25%, у пациента предполагают острый лейкоз.
Пороговое значение доли бластных клеток среди всех связавшихся с антителом к CD45RA на биочипе 1, выше которого у пациента следует предполагать острый лейкоз, получено из зависимости чувствительности и специфичности от порогового значения при предположении наличия острого лейкоза у пациентов с долей бластных клеток выше порога для 40 пунктатов нормального костного мозга, и образцы пунктатов костного мозга 17 пациентов с хроническими лейкозами, 3 пациентов с ОЛ в ремиссии, поступивших с подозрением на рецидив и 91 пациентов с острыми лейкозами (Фиг. 1). На фиг. 2 представлена ROC - кривая для использования процентной доли бластных клеток среди всех, связавшихся с антителом к CD45RA, для выделения пациентов с острым лейкозом. Площадь под ROC-кривой составляет 0.976, что свидетельствует о высокой надежности использования данного критерия выделения острых лейкозов.
8. Определение природы бластных клеток (этап 2).
- Для определения природы бластных клеток на биочипе 1, окрашенном по Паппенгейму, с помощью световой микроскопии в светлом поле при увеличении х1000 производят морфологический анализ не менее 100 клеток на каждом из пятен антител, присутствующих на биочипе, и определяют среди них долю клеток с бластной морфологией.
- В случае, если доля бластов среди клеток, связавшихся с анти-CDx, больше либо равна 2%, бластные клетки в образце пациента считают положительными по CDx.
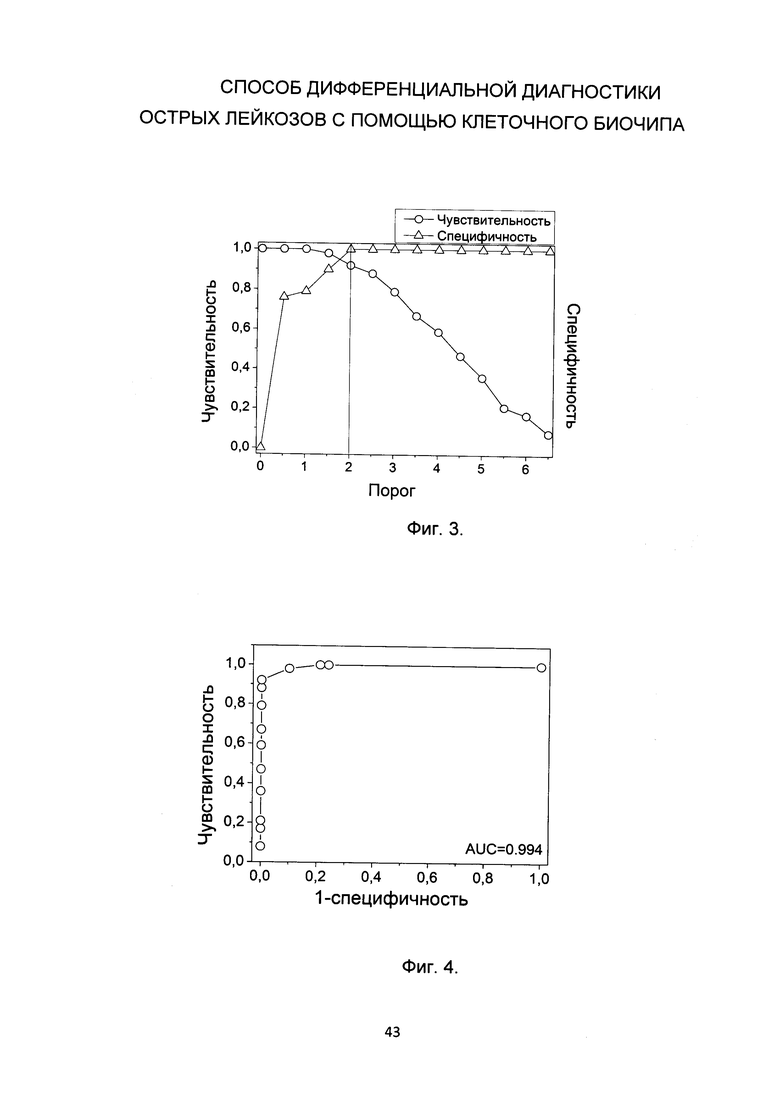
- После определения набора CD-антигенов из панели биочипа, по которым положительны бластные клетки, производят подсчет В-лимфоцитарного и миело-моноцитарного баллов в соответствии с таблицей 2. В таблице 2 представлен пособ расчета миеломоноцитарного и В-лимфоцитарного баллов на основании связывания бластных клеток с антителами к различным CD-антигенам на биочипе. Миеломоноцитарный балл вычисляется как сумма моноцитарных и миелоидных баллов.
В основе таблицы 2 лежит балльная система, предложенная Европейской группой по иммунологической характеризации лейкозов (Bene, М.С, Castoldi, G., Knapp, W., Ludwig, W.D., Matutes, E., Orfao, A., & Van't Veer, M. B. (1995). Proposals for the immunological classification of acute leukemias. European Group for the Immunological Characterization of Leukemias (EGIL). Leukemia, 9(10), 1783-1786) с добавлением маркера CD117 (Bene, M.С, Bernier, М., Casasnovas, R.О., Castoldi, G., Knapp, W., Lanza, F., … & Van't Veer, M. B. (1998). The reliability and specificity of c-kit for the diagnosis of acute myeloid leukemias and undifferentiated leukemias. Blood, 92(2), 596-599). Балл 0.5 характеризует миелоидные маркеры с частой аберрантной экспрессией на опухолевых клетках лимфобластных лейкозов (Bene, М.С, Castoldi, G., Knapp, W., Ludwig, W.D., Matutes, E., Orfao, A., & Van't Veer, M. B. (1995). Proposals for the immunological classification of acute leukemias. European Group for the Immunological Characterization of Leukemias (EGIL). Leukemia, 9(10), 1783-1786; Orfao, A., Ortuno, F., de Santiago, M., Lopez, A., & San Miguel, J. (2004). Immunophenotyping of acute leukemias and myelodysplastic syndromes. Cytometry Part A, 58(1), 62-71)
- В случае, если миеломоноцитарный балл больше либо равен 2, устанавливают диагноз ОМЛ. Определение порога миеломоноцитарного балла, выше которого у пациента предполагают ОМЛ, полученный на основе данных 69 пациентов с ОМЛ и 29 пациентов с ОЛЛ, представлен на Фиг. 3. На Фиг. 4 представлена ROC - кривая для использования значения миеломоноцитарного балла для выделения пациентов с ОМЛ из пациентов с острыми лейкозами. Площадь под ROC-кривой составляет 0.994, что свидетельствует о высокой надежности использования данного критерия выделения ОМЛ из всех острых лейкозов.
- В случае, если миеломоноцитарный балл меньше 2, а В-лимфоцитарный балл больше, либо равен 2, устанавливают диагноз В-ОЛЛ. Определение порога В-лимфоцитарного балла, выше которого у пациента предполагают В-ОЛЛ, полученный на основе данных 69 пациентов с ОМЛ и 29 пациентов с ОЛЛ, представлен на Фиг. 5. На Фиг. 6 представлена ROC - кривая для использования значения В-лимфоцитарного балла для выделения пациентов с В-ОЛЛ из пациентов с острыми лейкозами. Площадь под ROC-кривой составляет 0.998, что свидетельствует о высокой надежности использования данного критерия выделения ОМЛ из всех острых лейкозов.
- В случае, если миеломоноцитарный балл менее 2 и В-лимфоцитарный балл менее 2, пациентов относят к так называемой «серой зоне», включающей ОМЛ-М0, ОМЛ-М1, ОМЛ-М7 и Т-ОЛЛ. Если бластные клетки связываются на биочипе с антителами к CD41 и CD61, у пациента предполагают диагноз ОМЛ-М7. Подтверждением диагноза ОМЛ М7 может также служить характерная морфология опухолевых клеток при мегакариобластном лейкозе (ОМЛ М7).
- Для образцов пациентов, отнесенных на основании описанного алгоритма к «серой зоне», в которых на поверхности бластных клеток присутствует более одного Т-лимфоцитарного маркера (CD1a, CD2, CD5, CD7), на биочипе 2 проводят реакцию на цитоплазматический CD3 по протоколу исследования на наличие внутриклеточных маркеров, описанному выше. В случае положительности бластных клеток по цитоплазматическому CD3 пациенту устанавливают диагноз «Т-лимфобластный лейкоз», поскольку наличие цитоплазматического CD3 является наиболее специфичным маркером Т-клеточной принадлежности, наличия которого достаточно для отнесения клеток к Т-лимфоцитам (Orfao, A., Ortuno, F., de Santiago, М., Lopez, А., & San Miguel, J. (2004). Immunophenotyping of acute leukemias and myelodysplastic syndromes. Cytometry Part A, 58(1), 62-71). Для определения подвида Т-ОЛЛ используют данные о более подробном иммунофенотипе опухолевых клеток: бластные клетки при ОЛЛ Т1 положительны по CD7 и отрицательны по другим Т-клеточным маркерам, при ОЛЛ Т2 могут экспрессировать также CD2 и/или CD5, но не CD1a или поверхностный CD3, при ОЛЛ Т3-положительны по CD1a, но не поверхностному CD3, при ОЛЛ Т4 - отрицательны по CD1a, положительны по поверхностным CD3, CD4 или CD8 (Orfao, A., Ortuno, F., de Santiago, М., Lopez, А., & San Miguel, J. (2004). Immunophenotyping of acute leukemias and myelodysplastic syndromes. Cytometry Part A, 58(1), 62-71).
- В случае, если пациенты отнесены к группе В-ОЛЛ на основании значений миеломоноцитарного и В-лимфоцитарного баллов, для уточнения подгруппы по FAB классификации используют следующие данные. Если бластные клетки пациента положительны по поверхностным IgM и имеют морфологию типа L3 (Hann, I.М., Evans, D. I. К., Palmer, М.К., Jones, Р.М., & Haworth, С. (1979). The prognostic significance of morphological features in childhood acute lymphoblastic leukaemia. International Journal of Laboratory Hematology, 1(3), 215-226), устанавливают диагноз ОЛЛ B4. Если бластные клетки положительны по CD10, отрицательны по IgM и не имеют L3 морфологии, то устанавливают диагноз ОЛЛ В2-В3. Если бластные клетки отрицательны и по CD10, и по IgM, устанавливается диагноз ОЛЛ В1. Подтип В ОЛЛ В1 является редким (10% от всех случаев В-ОЛЛ) и в исследованной нами выборке 94 пациентов, поступивших с подозрением на острый лейкоз не встречался.
- В случае, если пациенты отнесены к группе ОМЛ на основании значения миеломоноцитарного балла, то для определения подвида ОМЛ используют данные анализа на специфическую и неспецифическую эстеразы по описанному выше протоколу. При этом оценивают долю клеток, положительных по α-нафтил бутират эстеразе и нафтол AS-D-хлорацетат эстеразе, среди всех лейкоцитов, связавшихся на биочипе с антителом к CD45RA.
- Если доля клеток, положительных по α-нафтил бутират эстеразе, составляет более 40% среди всех клеток, связавшихся с анти-CD45RA, то устанавливают диагноз ОМЛ М5 (острый монобластный лейкоз) (см. Фиг. 7а).
- Если доля клеток, положительных по α-нафтил бутират эстеразе, среди клеток, связавшихся с анти-CD45RA, составляет менее 2%, а доля клеток, положительных по нафтол AS-D-хлорацетат эстеразе, среди клеток, связавшихся с анти-CD45RA, составляет более 20%, то у пациента предполагают диагноз ОМЛ М2 или ОМЛ М3 (см. Фиг. 76). При этом ОМЛ М3 определяют по характерной морфологии бластных клеток -промиелоцитам, часто с палочками Ауэра, представленной на Фиг. 8.
Пример 1.
В ходе работы нами были исследованы пунктаты костного мозга 66 пациентов с известными острыми лейкозами (обучающая выборка). На основании полученных данных были сформулированы основные принципы описываемого способа диагностики. Для определения пороговых значений доли бластных клеток, миеломоноцитарного и В-лимфоцитарного балла были использованы данные 105 исследованных нами пациентов, поступивших с подозрением на первичный ОЛ или рецидив, из них у 58 пациентов был обнаружен ОМЛ М2-М5 (М2 15 пациентов, М3 6 пациентов, М4 13 пациентов, М5 24 пациента), у 28 пациентов - В-ОЛЛ (В1 2 пациента, В2-В3 26 пациента), к «серой зоне» были отнесены 19 пациентов, из них у 9 на основании алгоритма, изложенного выше, мы предположили диагноз ОМЛ М7, у 5 был предположен диагноз Т-ОЛЛ, у 5 был предположен диагноз М0-М1, которые во всех случаях были подтверждены стандартными методами диагностики.
Пример 2.
Пациентка 9 месяцев, поступила в ФНКЦ ДГОИ им. Рогачева с подозрением на острый лейкоз. По данным анализа клеток пунктата костного мозга на биочипе 1 доля бластов среди всех лейкоцитов, связавшихся с антителом к CD45RA, составляет 51%, то есть по предлагаемому способу можно предполагать у пациента острый лейкоз. При анализе связывания бластных клеток с антителами к различным CD антигенам на биочипе 1 было определено значение миеломоноцитарного балла 0 (бласты положительны по CD13 и отрицательны по остальным антигенам, используемым при расчете миеломоноцитарного балла), что ниже используемого нами порога. Значение В-лимфоцитарного балла равно 0, что ниже используемого нами порога 2. Поскольку бластные клетки были обнаружены на биочипе 1 на антителах к CD41 и CD61, пациентке был установлен диагноз ОМЛ М7. Данный диагноз подтвержден стандартными диагностическими методами (морфологией и проточной цитометрией).
Пример 3.
Пациент с хроническим миелоидным лейкозом в анамнезе госпитализирован в ФНКЦ ДГОИ им. Дм. Рогачева. По данным анализа клеток пунктата костного мозга на биочипе 1 доля бластов среди всех лейкоцитов, связавшихся с антителом к CD45RA, составляет 42%, то есть по предлагаемому способу можно предполагать у пациента острый лейкоз. При анализе связывания бластных клеток с антителами к различным CD антигенам на биочипе 1 было определено значение миеломоноцитарного балла 1 (бласты положительны по CD13 и отрицательны по остальным антигенам, используемым при расчете миеломоноцитарного балла), что ниже используемого нами порога. Значение В-лимфоцитарного балла равно 2 (CD10+CD19+CD22-), что выше используемого нами порога (В≥2). В соответствии с предлагаемым способом пациенту был установлен диагноз В-ОЛЛ В2/В3. Данный диагноз подтвержден стандартными диагностическими методами (морфологией и проточной цитометрией).
Пример 4.
Пациент с ОМЛ М3 в анамнезе после рецидива во второй клинико-гематологической ремиссии, поступил с подозрением на второй рецидив. По данным анализа клеток пунктата костного мозга на биочипе 1 доля бластов среди всех лейкоцитов, связавшихся с антителом к CD45RA, составляет 14%, то есть по предлагаемому способу острого лейкоза у пациента нет. Отсутствие рецидива подтверждено стандартными диагностическими методами (морфологией и проточной цитометрией).
Пример 5.
Пациент поступил первично с подозрением на острый лейкоз. По данным анализа клеток пунктата костного мозга на биочипе 1 доля бластов среди всех лейкоцитов, связавшихся с антителом к CD45RA, составляет 90%, то есть по предлагаемому способу можно предполагать у пациента острый лейкоз. При анализе связывания бластных клеток с антителами к различным CD антигенам на биочипе 1 было определено значение миеломоноцитарного балла 4,5 (бласты положительны по CD11b, CD11c, CD13, CD33, CD64), что выше используемого нами порога (ММ≥2), то есть при диагностике по предлагаемому способу предполагаемый диагноз пациента острый миелобластный лейкоз (ОМЛ) М2, М3, М4 или М5. Для уточнения подвида ОМЛ в соответствии с описанным способом было проведено исследование биочипа 3 на активность α-нафтилбутират эстеразы и нафтол AS-D-хлорацетат эстеразы. Доля клеток с активной α-нафтилбутират эстеразой среди всех клеток, связавшихся на биочипе 3 с анти-CD45RA, составляет 80%, что выше используемого нами порога 40%. В соответствии с предлагаемым способом у пациента предполагается диагноз ОМЛ М5. Данный диагноз подтвержден стандартными диагностическими методами (морфологией и проточной цитометрией).
Все вышеприведенные примеры подтверждают выполнение поставленной задачи и промышленную применимость изобретения.
Список сокращений
ОЛ - острый лейкоз;
ОЛЛ - острый лимфобластный лейкоз;
В-ОЛЛ - острый В-лимфобластный лейкоз;
Т-ОЛЛ - острый Т-лимфобластный лейкоз;
ОМЛ - острый миелоидный лейкоз;
ХМЛ - хронический миелоидный лейкоз;
ЮММЛ - ювенильный миеломоноцитарный лейкоз;
FAB-классификация - франко-америко-британская классификация, классификация острых лейкозов по морфологическим и иммунофенотипическим характеристикам;
CD - cluster of differentiation, дифференцировочные антигены лейкоцитов человека;
BSA - bovine serum albumin, бычий сывороточный альбумин;
PBS - phosphate buffered saline, тип фосфатного буфера;
ROC-кривая - receiver operating characteristic, кривая, позволяющая оценить качество бинарной классификации.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ ЭТИОЛОГИИ ЛИХОРАДКИ НЕЯСНОГО ГЕНЕЗА У ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ | 2017 |
|
RU2647456C1 |
| Способ прогнозирования эффективности лечения больных острыми миелобластными лейкозами противоопухолевыми препаратами даунорубицином и цитозин-арабинозидом | 2019 |
|
RU2702657C1 |
| СПОСОБ ДИАГНОСТИКИ ИНФЕКЦИИ У БОЛЬНЫХ ОСТРЫМ ЛИМФОБЛАСТНЫМ ЛЕЙКОЗОМ В ПЕРИОД МАНИФЕСТАЦИИ ЗАБОЛЕВАНИЯ | 2013 |
|
RU2535057C1 |
| СПОСОБЫ ЛЕЧЕНИЯ С ИСПОЛЬЗОВАНИЕМ АНТИ-CD123 ИММУНОКОНЪЮГАТОВ | 2019 |
|
RU2816847C2 |
| СПОСОБ ИССЛЕДОВАНИЯ КЛЕТОК С ПОМОЩЬЮ ИММУНОЛОГИЧЕСКОГО БИОЧИПА | 2008 |
|
RU2389024C1 |
| Способ прогнозирования рецидивов острого лимфобластного лейкоза | 1987 |
|
SU1589215A1 |
| СПОСОБЫ ЛЕЧЕНИЯ, ДИАГНОСТИКИ И ПРОГНОЗИРОВАНИЯ ГЕМАТОЛОГИЧЕСКОГО ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ | 2015 |
|
RU2727418C2 |
| Способ диагностики онкологического заболевания крови | 2022 |
|
RU2803281C1 |
| Способ оценки минимальной остаточной болезни (МОБ) методом многоцветной проточной цитофлуориметрии у больных острым миелоидным лейкозом (ОМЛ) в постиндукционной фазе лечения | 2022 |
|
RU2802131C1 |
| Штамм гибридных культивируемых клеток животных MUS мUSсULUS L-продуцент моноклональных антител против общего антигена клеток острого лимфобластного лейкоза | 1988 |
|
SU1638160A1 |

Изобретение относится к медицине, а именно к области диагностики онкогематологических заболеваний, и может быть использовано для дифференциальной диагностики острых лейкозов. Способ включает сортировку выделенной мононуклеарной фракции лейкоцитов по их поверхностным антигенам путем инкубации на трех клеточных биочипах с иммобилизованными на прозрачной подложке антителами. Затем биочипы отмывают от несвязавшихся лейкоцитов и высушивают, после чего биочип 1 окрашивают для морфологического исследования, биочип 2 используют для определения внутриклеточных маркеров, а биочип 3 - для анализа на цитохимическую активность. Наличие острого лейкоза устанавливают, если при морфологическом анализе лейкоцитов, связавшихся с анти-CD45RA на биочипе 1, доля бластных клеток среди них превышает 25%, в этом случае на основании наличия связывания бластных клеток с антителами к набору CD антигенов, характерных для миелоидных, моноцитарных и лимфоидных клеток, определяют миеломоноцитарный балл ММ по формуле ММ=p(CD13)+p(CD33)+p(CD117)+p(CD14)+p(CD64)+0.5*p(CD11b)+0.5*p(CD15) и В-лимфоцитарный балл В по формуле В=p(CD10)+p(CD19)+(CD22), где при наличии связывания бластных клеток с антителом к CDi p(CDi)=1, а при отсутствии связывания бластных клеток с антителом к CDi p(CDi)=0. При этом если миеломоноцитарный балл <2, а В-лимфоцитарный балл ≥2, устанавливают диагноз В-лимфобластный лейкоз (В-ОЛЛ), если миеломоноцитарный балл ≥2, устанавливают диагноз острый миелобластный лейкоз (ОМЛ) М2, М3, M4 или М5, если миеломоноцитарный балл <2 и В-лимфоцитарный балл <2, устанавливают диагноз острый миелобластный лейкоз М0, М1, М7 или Т-лимфобластный лейкоз (Т-ОЛЛ), при этом если бластные клетки присутствуют на антителах к CD41 и/или CD61, устанавливают диагноз острый миелобластный лейкоз, М7, а при наличии внутриклеточного CD3 в бластных клетках устанавливают диагноз Т-ОЛЛ. Использование изобретения позволяет повысить точность дифференциальной диагностики ОМЛ и ОЛЛ. 8 з.п. ф-лы, 2 табл., 8 ил., 5 пр.
1. Способ дифференциальной диагностики острых лейкозов на основании исследования морфологии и цитохимической активности лейкоцитов пунктата костного мозга, при котором выделенную мононуклеарную фракцию лейкоцитов сортируют по их поверхностным антигенам путем инкубации на трех клеточных биочипах с иммобилизованными на прозрачной подложке антителами, затем биочипы отмывают от несвязавшихся лейкоцитов и высушивают, после чего биочип 1 окрашивают для морфологического исследования, биочип 2 используют для определения внутриклеточных маркеров, а биочип 3 - для анализа на цитохимическую активность, отличающийся тем, что наличие острого лейкоза устанавливают, если при морфологическом анализе лейкоцитов, связавшихся с анти-CD45RA на биочипе 1, доля бластных клеток среди них превышает 25%, в этом случае на основании наличия связывания бластных клеток с антителами к набору CD антигенов, характерных для миелоидных, моноцитарных и лимфоидных клеток, определяют миеломоноцитарный балл ММ по формуле ММ=p(CD13)+p(CD33)+p(CD117)+p(CD14)+p(CD64)+0.5*p(CD11b)+0.5*p(CD15) и В-лимфоцитарный балл В по формуле В=p(CD10)+p(CD19)+(CD22), где при наличии связывания бластных клеток с антителом к CDi p(CDi)=1, а при отсутствии связывания бластных клеток с антителом к CDi p(CDi)=0, при этом если миеломоноцитарный балл <2, а В-лимфоцитарный балл ≥2, устанавливают диагноз В-лимфобластный лейкоз (В-ОЛЛ), если миеломоноцитарный балл ≥2, устанавливают диагноз острый миелобластный лейкоз (ОМЛ) М2, М3, M4 или М5, если миеломоноцитарный балл <2 и В-лимфоцитарный балл <2, устанавливают диагноз острый миелобластный лейкоз М0, М1, М7 или Т-лимфобластный лейкоз (Т-ОЛЛ), при этом если бластные клетки присутствуют на антителах к CD41 и/или CD61, устанавливают диагноз острый миелобластный лейкоз, М7, а при наличии внутриклеточного CD3 в бластных клетках устанавливают диагноз Т-ОЛЛ.
2. Способ по п. 1, при котором на биочип наносят антитела ко всем или части из следующего списка антигенов: CD1a, CD2, CD3, CD4, CD5, CD7, CD8, CD10, CD11b, CD11c, CD13, CD14, CD15, CD16, CD19, CD20, CD22, CD23, CD25, CD27, CD28, CD33, CD34, CD38, CD41, CD42, CD43, CD45, CD45RA, CD45R0, CD56, CD61, CD64, CD103, CD117, CD123, CD200, CD235, HLA-DR, IgM, κ и λ легкие цепи иммуноглобулинов, CD133, отрицательный контроль (смесь иммуноглобулинов).
3. Способ по п. 1, при котором после отмывки биочипов от неспецифически связавшихся лейкоцитов для подготовки к окраске для морфологического исследования биочипы заливают фетальной телячьей сывороткой или инактивированной человеческой плазмой и высушивают с помощью вращения вокруг оси, перпендикулярной его плоскости и проходящей через его центр.
4. Способ по любому из пп. 1-3, при котором для пациентов с В-ОЛЛ в случае связывания бластных клеток с антителами к CD10 и CD19 и отсутствия связывания с анти-IgM устанавливают диагноз ОЛЛ В2-В3, если бластные клетки отрицательны и по CD10, и по IgM, устанавливают диагноз ОЛЛ В1, а если бластные клетки отрицательны по CD10 и положительны по IgM, устанавливают диагноз ОЛЛ В4.
5. Способ по любому из пп. 1-3, при котором при доле клеток, положительных по α-нафтилбутират эстеразе среди всех клеток, связавшихся с антителом к CD45RA, не ниже 40% устанавливают диагноз ОМЛ М5, а при доле клеток, положительных по α-нафтилбутират эстеразе среди всех клеток, связавшихся с антителом к CD45RA, ниже 2% и доле клеток, положительных по нафтол AS-D-хлорацетат эстеразе, не ниже 20% устанавливают диагноз ОМЛ М2 или ОМЛ М3, причем ОМЛ М3 определяют по характерной морфологии патологических промиелоцитов.
6. Способ по любому из пп. 1-3, при котором для определения внутриклеточного CD3 биочип 2 со связавшимися клетками фиксируют, промывают, сушат, инкубируют в забивочном растворе, затем с раствором антитела к CD3, конъюгированного с антигенной детерминантой (первичного антитела), затем с раствором антитела к антигенной детерминанте, конъюгированным с ферментом (вторичного антитела) и затем с колориметрическим субстратом для используемого фермента, дающим при реакции с ферментом цветной нерастворимый осадок.
7. Способ по п. 6, при котором для фиксации используют смесь формалина (40%) с чистым этанолом 1:10.
8. Способ по п. 6, при котором антигенной детерминантой является FITC.
9. Способ по п. 6, при котором ферментом, конъюгированным с вторичным антителом, выступает щелочная фосфатаза или пероксидаза хрена.
| КУЗНЕЦОВА С.А | |||
| и др | |||
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| СПОСОБ ИДЕНТИФИКАЦИИ ХРОМОСОМНЫХ ТРАНСЛОКАЦИЙ, ПРИВОДЯЩИХ К РАЗВИТИЮ ЗЛОКАЧЕСТВЕННЫХ ЗАБОЛЕВАНИЙ КРОВИ (ЛЕЙКОЗОВ), С ИСПОЛЬЗОВАНИЕМ ОЛИГОНУКЛЕОТИДНОГО БИОЛОГИЧЕСКОГО МИКРОЧИПА (БИОЧИПА) | 2004 |
|
RU2286798C2 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| ФЕДЯНИНА О.С | |||
| и др | |||
| Исследование морфологии и распределения α-нафтилбутиратэстеразы и нафтол-as-d-хлор ацетатэстеразы в нормальных предшественниках лейкоцитов миелоидного ростка с помощью клеточного биочипа//Онкогематология, 2016 | |||
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| ХВАСТУНОВА А.Н | |||
| Параллельное исследование морфологии и иммунофенотипа нормальных и патологических лимфоцитов с помощью клеточного биочипа | |||
| Дисс.к.б.н., Москва, 2016. | |||
Авторы
Даты
2019-03-12—Публикация
2017-12-18—Подача