Область техники, к которой относится изобретение
Настоящее изобретение относится к производным пиразоло[1,5-a][1,3,5]триазина и пиразоло[1,5-a]пиримидина и/или их фармацевтически приемлемым солям, применению этих производных в качестве фармацевтически активных агентов, особенно для профилактики и/или лечения клеточно-пролиферативных заболеваний, воспалительных заболеваний, иммунологических заболеваний, сердечно-сосудистых заболеваний и инфекционных заболеваний. Кроме того, настоящее изобретение относится к фармацевтическим композициям, содержащим по меньшей мере одно из производных пиразоло[1,5-a][1,3,5]триазина и пиразоло[1,5-a]пиримидина и/или их фармацевтически приемлемые соли.
Уровень техники
Элементы семейства циклин-зависимых киназ (CDK), которые запускают прохождение клеточного цикла, рассматриваются как перспективные терапевтические мишени, особенно при раке. Элементы семейства CDK, которые контролируют другие процессы, такие как транскрипция и процессинг РНК, до сих пор привлекали меньше внимания, хотя появляются экспериментальные доказательства их участия в различных патологических процессах. Также было установлено, что комплексы CDK / циклиновые комплексы, наряду с контролем клеточного цикла, являются сохраненными компонентами транскрипционного аппарата РНК-полимеразы II (Pol II) (Bregman et al., 2000, Front Biosci. 5:244-257). В настоящее время известно 20 CDK млекопитающих. При том, что CDK7-13 были связаны с транскрипцией, только CDK 1, 2, 4 и 6 проявляют очевидную связь с клеточным циклом. Уникальная среди CDK млекопитающих, CDK7 обладает консолидированными киназными активностями, регулируя как прохождение клеточного цикла, так и транскрипцию (Desai et al., 1995, Mol. Cell Biol. 15, 345-350).
Общий фактор транскрипции TFIIH, очищенный от клеток млекопитающих, состоит из десяти субъединиц, семь из которых (p62, p52, p44, p34, XPD, XPB и TTDA) образуют основной комплекс. Три субъединицы (циклин H, MAT1 и CDK7) из CDK-активирующей киназы (CAK), которая связана с ядром TFIIH через субъединицу комплекса XPD (АТФ-зависимая геликаза). Во время процесса инициации транскрипции активность хеликазы TFIIH открывает ДНК основного промотора, при этом CDK7 фосфорилирует C-концевой домен (CTD) Pol II в серинах 5 и 7 (Akhtar et al., 2009, Mol. Cell 34, 387-393), а также другие факторы транскрипции, контролирующие переход от инициации к элонгации (Larochelle et al., 2012, Nat. Strut. Mol. Biol. 19, 1108-1115). Таким образом, CDK7 является важным фактором процесса транскрипции, что позволяет предположить, что CDK7 является мишенью для лечения рака, особенно рака, зависимого от транскрипции.
Уже давно утверждается, что CDK7 играет важную роль в метаболизме и жизнеспособности клеток. Ингибиторы транскрипции CDK снижают активность большого количества короткоживущих антиапоптотических белков, таких как антиапоптотические белки миелоидного клеточного лейкоза-1 (Mcl-1), сверхдлинные молекулы лимфомы B-клеток (Bcl-xL) и XIAP (Х-связанный ингибитор белка апоптоза), D-циклины, c-Myc, Mdm-2 (обеспечивающие стабилизацию p53), белки p21waf1, транскрипция которых опосредована транскрипционным фактором (NF-kB), и индуцированный гипоксией VEGF (Shapiro GI. 2006, J Clin Oncol; 24(11):1770-83). Транскрипционный неселективный ингибитор циклин-зависимой киназы флавопиридол индуцирует апоптоз в клетках множественной миеломы за счет транскрипционной репрессии и понижающей регуляции Mcl-1. Эти выводы подтвердили предыдущие предположения, что CDK7 может быть ценной мишенью для лекарств, направленных на лечение злокачественных новообразований и заболеваний, связанных с клеточным циклом (Lolli G and Johnson LN. 2005. Cell Cycle 4:572-577).
Функция CDK7 как регулятора общей транскрипции и использование CDK7 в качестве терапевтической мишени для лечения многих заболеваний и синдромов связаны с мутациями в регуляторных областях и факторах транскрипции, кофакторах, регуляторах хроматина и некодирующих РНК. Эти мутации могут, помимо прочего, способствовать развитию рака, аутоиммунитета, неврологических расстройств, синдромов развития, диабета, сердечнососудистых заболеваний и ожирения. Некоторые факторы транскрипции контролируют запуск паузы и элонгацию РНК-полимеразы II и, при изменении их экспрессии или функции, могут продуцировать агрессивные опухолевые клетки (c-Myc) или некоторые формы аутоиммунитета (AIRE) (Tong Ihn Lee and Richard A. Young, Cell, 2013, 152:1237-1251). Таким образом, ингибирование активности киназы CDK7 человека, по всей вероятности, приведет к подавлению пролиферации за счет функции развития клеточного цикла и транскрипционной регуляции за счет ингибирования некоторых факторов транскрипции, связанных с онкогеном, за счет ингибирования общего процесса транскрипции. Что более важно, было показано, что CDK7 регулирует экспоненциальную экспрессию онкогенных факторов транскрипции более значительно, чем она это делает для других конститутивных генов в раковых клетках. Таким образом, ингибирование CDK7 может по-разному влиять на транскрипцию определенных онкогенов и конститутивного гена, следовательно, может быть обеспечено терапевтическое окно. По этой причине для лечения пролиферативного расстройства, включая рак, можно применять регуляцию транскрипции и фармакологическое ингибирование посредством соответствующего общего ингибирования транскрипции с помощью CDK7. Являясь общим регулятором транскрипции, CDK7 представляет собой терапевтическую мишень для лечения таких заболеваний, как воспаление, репликация вирусов, например, ВИЧ, вируса Эпштейна-Барр, рак и гипертрофия сердца.
Экспрессия гена ВИЧ-1 регулируется белком вирусного трансактиватора (Tat), который индуцирует транскрипционную элонгацию длинного тандемного повтора ВИЧ-1. Для такой индукции необходимо гиперфосфорилирование повтора С-концевого домена РНК-полимеразы II. Для архивирования указанного гиперфосфорилирования Tat стимулирует киназы CTD, связанные с общими факторами транскрипции промоторного комплекса, в частности, TFIIH-ассоциированные CDK7 (Nekhai et al.; Biochem J. (2002) 364, 649-657). Авторы US 615968 также описали, что Tat связывается с CDK7 и это взаимодействие увеличивает способность CAK фосфорилировать CTD. Кроме того, авторы US 615968 описывают, что активация транскрипции Tat зависит от киназной активности CDK7. Кроме того, Young Kyeung Kim с соавторами пришел к выводу, что рекрутинг и активация TFIIH представляет собой скорость-лимитирующий этап для эмергенции ВИЧ из латентного состояния (Young Kyeung Kim, EMBO (2006) 25, 3596-3604).
Уровни CDK7 и CDK9, а также других компонентов комплексов киназ, MAT-1/ циклин H, регулируются на повышение при инфицировании цитомегаловирусом человека. Кроме того, наблюдается усиление киназной активности CDK7 и CDK9 (Tamrakar et al., Journal of Virology, 2005, 79; 15477-15493).
Мишенями многих противовирусных препаратов являются вирусные белки. Недостаток таких противовирусных препаратов заключается в том, что у вирусов часто развивается устойчивость к этим препаратам. Противовирусные препараты, мишенями которых являются клеточные белки, необходимые для вирусного процесса, такие как CDK7, могут обходить этот недостаток. Эти препараты также могут быть эффективны при лечении нескольких неродственных вирусов, и их действие должно дополнять традиционные противовирусные средства. Ингибиторы CDK7, которая выполняет двойную функцию: функцию активирующей CDK киназы и регуляцию транскрипции, очень эффективны при лечении нескольких вирусов.
Раскрытие изобретения
Объектом настоящего изобретения является предложение соединений и/или их фармацевтически приемлемых солей, которые можно использовать в качестве фармацевтически активных агентов, особенно для профилактики и/или лечения клеточно-пролиферативных заболеваний, воспалительных заболеваний, иммунологических заболеваний, сердечнососудистых заболеваний и инфекционных заболеваний, а также композиций, содержащих по меньшей мере одно из этих соединений и/или их фармацевтически приемлемые соли в качестве фармацевтически активных ингредиентов.
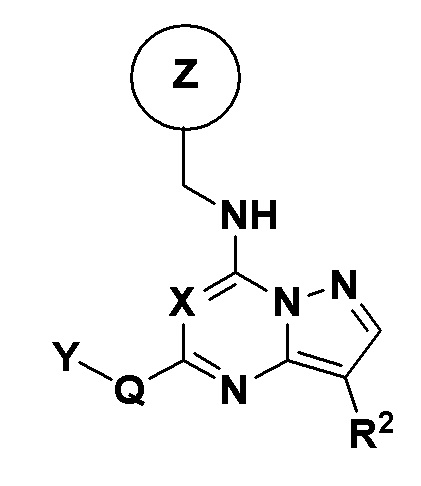
В одном аспекте настоящее изобретение относится к соединениям пиразолотриазина или пиразолопиримидина, которые определены общей формулой I
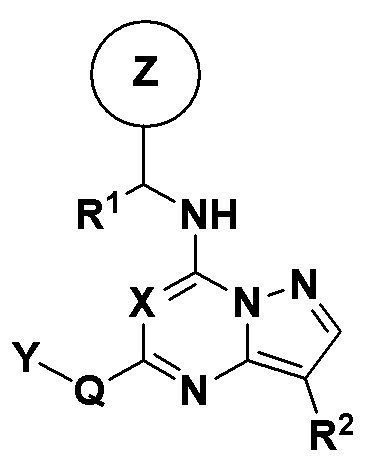
Формула I
где
X независимо в каждом случае выбран из CH и N;
Q либо отсутствует, либо независимо в каждом случае выбран из группы, состоящей из -NH-, -NH(CH2)-, -NH(CH2)2-, -NH(C=O)-, -NHSO2-, -O-, -O(CH2)-, -(C=O)-, -(C=O)NH- и -(C=O)(CH2)-;
Y независимо в каждом случае выбран из группы, состоящей из C3-C8 циклоалкила, арила, гетероарила, гетероциклила и C1-C6 алкила, где C1-C6 алкил замещен одним или двумя -OR5, -N(R5)R5, арилом, гетероарилом и гетероциклилом,
C3-C8-циклоалкил может быть замещен одним или двумя R3, R4 и -(C=O)R5,
гетероциклил может быть замещен одним или двумя R3, R4 и -(C=O)R5, а
арил или гетероарил могут быть замещены одним или двумя R3, C1-C6 алкилом, -OR5, -N(R5)R5, -(C=O)R5, галогеном, гетероарилом и гетероциклилом,
R1 независимо в каждом случае выбран из группы, состоящей из водорода и метила;
R2 независимо в каждом случае выбран из группы, состоящей из галогена, C1-C6 алкила, C3-C10 циклоалкила, -CN, -(C=O)CH3 и C1-C3 галогеналкила, любой из которых необязательно замещен;
R3 либо отсутствует, либо независимо в каждом случае выбран из группы, состоящей из водорода, -OR5, галогена, -N(R5)R5, -NH(C=O)R5, -(C=O)NH2, арила, гетероарила, гетероциклила, C1-C6 алкила и C1-C6 алкила, замещенного -ОН или -NH2;
R4 независимо в каждом случае выбран из группы, состоящей из водорода, галогена, -OR5, -N(R5)R5, (=O), арила, гетероарила, гетероциклила, C1-C6 алкила и C1-C6 алкила, замещенного -ОН или -NH2;
R5 в каждом случае независимо выбран из группы, состоящей из водорода, C1-C6 алкила, C3-C6 циклоалкила, C1-C3 галогеналкила, гетероарила, гетероциклила, гетероарила, замещенного одним или двумя галогенами, -OR11, -N(R11)R11, C1-C6 алкилом, и C1-C6 алкила, замещенного -OH, -NH2, гетероциклила, замещенного одним или двумя галогенами, -OR11, -N(R11)R11, C1-C6 алкилом и C1-C6 алкилом, замещенным -ОН или -NH2;
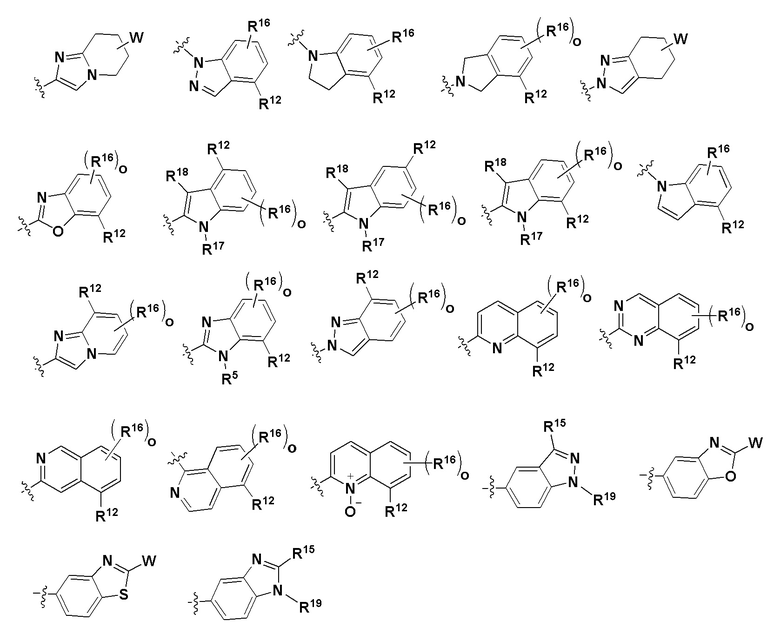
Z - любая структура следующей группы A;
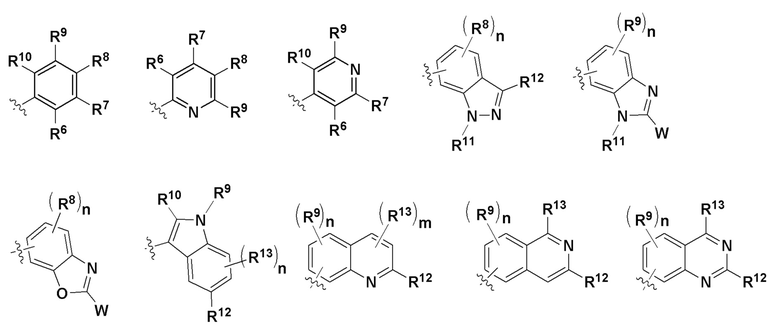
Группа A
где n = 1, 2 или 3; m = 1 или 2;
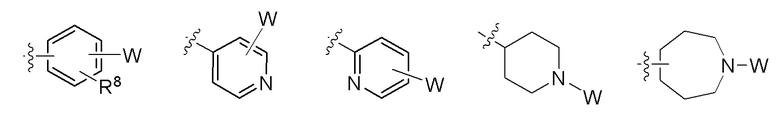
R6 и R7 в каждом случае независимо выбраны из группы, состоящей из водорода, -NH(C=O)R14, -NHR14, -OR14 и любой структуры следующей группы B, при условии, что когда Z представляет собой 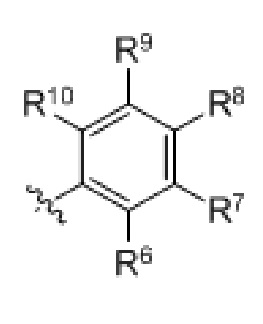 , один из R6 и R7 не является H;
, один из R6 и R7 не является H;
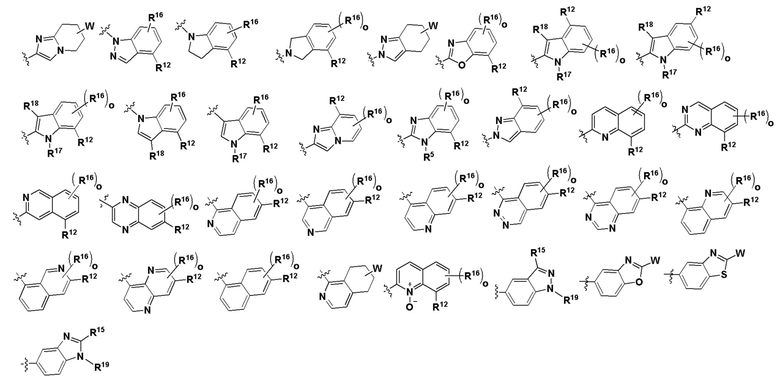
Группа B
где о независимо в каждом случае выбран из 1, 2 и 3;
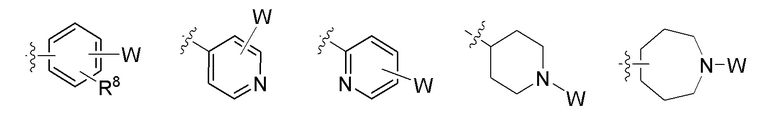
W - любая структура следующей группы С;
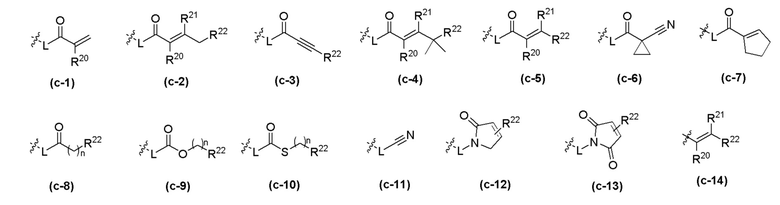
Группа C
L отсутствует или независимо в каждом случае выбран из группы, состоящей из -O- и -NH-;
где n независимо в каждом случае выбран из 1, 2 и 3;
R8, R9 и R10 независимо в каждом случае выбраны из группы, состоящей из водорода, галогена, C1-C6 алкила, C1-C3 галогеналкила, -OR5, -CN и C1-C6 алкила, замещенного -OH, -OR5 или -NHR5;
R11 независимо в каждом случае выбран из группы, состоящей из водорода, C1-C6 алкила, C3-C10 циклоалкила и W, определенного выше;
R12 независимо в каждом случае выбран из группы, состоящей из водорода и W, определенного выше;
при этом если R11 представляет собой W, R12 представляет собой водород;
R13 независимо в каждом случае выбран из группы, состоящей из водорода, галогена, C1-C6 алкила, C1-C3 галогеналкила, -NH2, -OR5, -CN и W, определенного выше;
при этом если R13 представляет собой W, R12 представляет собой водород;
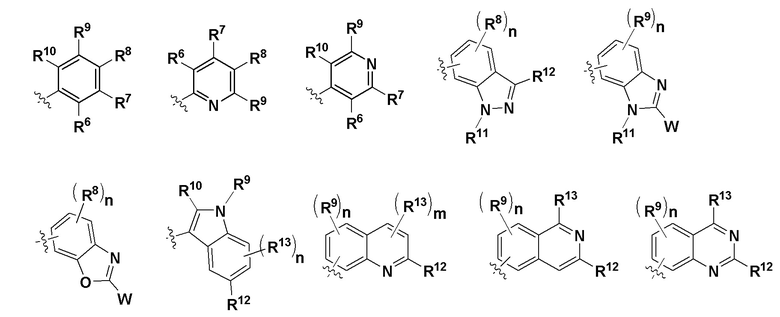
R14 - любая структура группы D;
Группа D
R15 независимо в каждом случае выбран из группы, состоящей из водорода и W, определенного выше;
R16 независимо в каждом случае выбран из группы, состоящей из водорода, галогена, C1-C6 алкила, C1-C3 галогеналкила, -NH2, -OR5, -CN и W, определенного выше;
при этом если R16 представляет собой W, R12 представляет собой водород;
R17 независимо в каждом случае выбран из группы, состоящей из водорода, C1-C6 алкила и C1-C3 галогеналкила;
R18 независимо в каждом случае выбран из группы, состоящей из водорода, галогена, C1-C6 алкила, C1-C3 галогеналкила, -NH2, -OR5 и -CN;
R19 независимо в каждом случае выбран из группы, состоящей из водорода, C1-C6 алкила, C3-C10 циклоалкила и W, определенного выше;
при этом если R19 представляет собой W, R15 представляет собой водород;
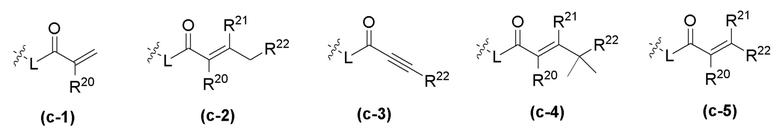
R20 и R21 независимо в каждом случае выбраны из группы, состоящей из водорода, галогена, C1-C6 алкила, C1-C3 галогеналкила, -OR5, гетероциклила и -CN;
R22 независимо в каждом случае выбран из группы, состоящей из водорода, галогена, C1-C6 алкила, C3-C10 циклоалкила, -N(R5)2, -NR19R20, -NR19CH2(CO)NH2, гетероциклила, -OR5 и -CN;
или энантиомер, стереоизомерная форма, смесь энантиомеров, диастереомер, смесь диастереомеров, рацемат вышеуказанных соединений или их фармацевтически приемлемая соль.
Настоящее изобретение также относится к энантиомерам, стереоизомерным формам, смесям энантиомеров, диастереомеров, смесям диастереомеров, рацематам вышеуказанных соединений и к их фармацевтически приемлемым солям.
В одном варианте соединений общей формулы I, приведенной выше, соединения имеют общую формулу Ia

Формула Ia
где
X независимо в каждом случае выбран из CH и N;
Y1 независимо в каждом случае выбран из CH, C(OH) и N;
Y2 независимо в каждом случае выбран из CH, C(OH) и N;
Q либо отсутствует, либо независимо в каждом случае выбран из группы, состоящей из -NH-, -NH(CH2)-, -NH(C=O)-, -NHSO2-, -O-, -O(CH2)-, -(C=O)- и -(C=O)(CH2)-;
R1 независимо в каждом случае выбран из группы, состоящей из водорода и метила;
R2 независимо в каждом случае выбран из группы, состоящей из галогена, C1-C6 алкила, C3-C10 циклоалкила, -CN, -(C=O)CH3 и C1-C3 галогеналкила, любой из которых необязательно замещен;
R3 независимо в каждом случае выбран из группы, состоящей из водорода, -OH, галогена, -N(R5)2, -NH(C=O)R5, -(C=O)NH2, C1-C6 алкила и C1-C6 алкила, замещенного -ОН или -NH2;
R4 в каждом случае отсутствует или независимо выбран из группы, состоящей из водорода, галогена, -OH, -OR5, -NH2, C1-C6 алкила и C1-C6 алкила, замещенного -ОН или -NH2;
R5 независимо в каждом случае выбран из группы, состоящей из водорода, C1-C6 алкила и C1-C3 галогеналкила;
Z - любая структура следующей группы A;
Группа A
где n = 1, 2 или 3; m = 1 или 2;
R6 и R7 в каждом случае независимо выбраны из группы, состоящей из водорода, -NH(C=O)R14, -NHR14, -OR14 и любой структуры следующей группы B, при условии, что когда Z представляет собой  , один из R6 и R7 не является H;
, один из R6 и R7 не является H;
Группа B
где о = 1, 2 или 3;
W - любая структура следующей группы С;
Группа C
L отсутствует или независимо в каждом случае выбран из группы, состоящей из -O- и -NH-;
R8, R9 и R10 независимо в каждом случае выбраны из группы, состоящей из водорода, галогена, C1-C6 алкила, C1-C3 галогеналкила, -OR5, -CN и C1-C6 алкила, замещенного -OH, -OR5 или -NHR5;
R11 независимо в каждом случае выбран из группы, состоящей из водорода, C1-C6 алкила, C3-C10 циклоалкила и W, определенного выше;
R12 независимо в каждом случае выбран из группы, состоящей из водорода и W, определенного выше;
при этом если R11 представляет собой W, то R12 представляет собой водород;
R13 независимо в каждом случае выбран из группы, состоящей из водорода, галогена, C1-C6 алкила, C1-C3 галогеналкила, -NH2, -OR5, -CN и W, определенного выше;
при этом если R13 представляет собой W, R12 представляет собой водород;
R14 - любая структура группы D;
Группа D
R15 независимо в каждом случае выбран из группы, состоящей из водорода и W, определенного выше;
R16 независимо в каждом случае выбран из группы, состоящей из водорода, галогена, C1-C6 алкила, C1-C3 галогеналкила, -NH2, -OR5, -CN и W, определенного выше;
при этом если R16 представляет собой W, то R12 представляет собой водород;
R17 независимо в каждом случае выбран из группы, состоящей из водорода, C1-C6 алкила и C1-C3 галогеналкила;
R18 независимо в каждом случае выбран из группы, состоящей из водорода, галогена, C1-C6 алкила, C1-C3 галогеналкила, -NH2, -OR5 и -CN;
R19 независимо в каждом случае выбран из группы, состоящей из водорода, C1-C6 алкила, C3-C10 циклоалкила и W, определение которого указано выше;
при этом если R19 представляет собой W, то R15 представляет собой водород;
R20 и R21 независимо в каждом случае выбраны из группы, состоящей из водорода, галогена, C1-C6 алкила, C1-C3 галогеналкила, -OR5, гетероциклила и -CN;
R22 независимо в каждом случае выбран из группы, состоящей из водорода, галогена, C1-C6 алкила, C3-C10 циклоалкила, -N(R5)2, -NR19R20, гетероциклила, -OR5 и -CN.
В одном варианте соединений общей формулы I или формулы Ia, указанных выше, по меньшей мере один из Z, R6, R7, R11, R12, R13, R15, R16 и R19 представляет собой W, определенный выше для общей формулы I, или представляет собой структуру, содержащую W, определенный выше для общей формулы I.
В одном варианте соединений общей формулы I или формулы Ia, указанной выше, только один из Z, R6, R7, R11, R12, R13, R15, R16 и R19 представляет собой W, определенный выше для общей формулы I, или представляет собой структуру, содержащую W, определенный выше для общей формулы I.
В одном варианте по меньшей мере один из Z, R6, R7, R11, R12, R13, R15, R16 и R19 представляет собой W, определенный выше, или представляет собой структуру, содержащую W, определенный выше для общей формулы Ia.
В одном варианте только один из Z, R6, R7, R11, R12, R13, R15, R16 и R19 представляет собой W, определенный выше, или представляет собой структуру, содержащую W, определенный выше для общей формулы Ia.
В одном варианте соединений общей формулы I, приведенной выше, R1 представляет собой водород, а соединение имеет общую формулу II
Формула II
где X, Y, Z, R2 и Q имеют значения, приведенные выше для общей формулы I.
В одном варианте соединений общей формулы I, указанной выше, соединения имеют общую формулу III
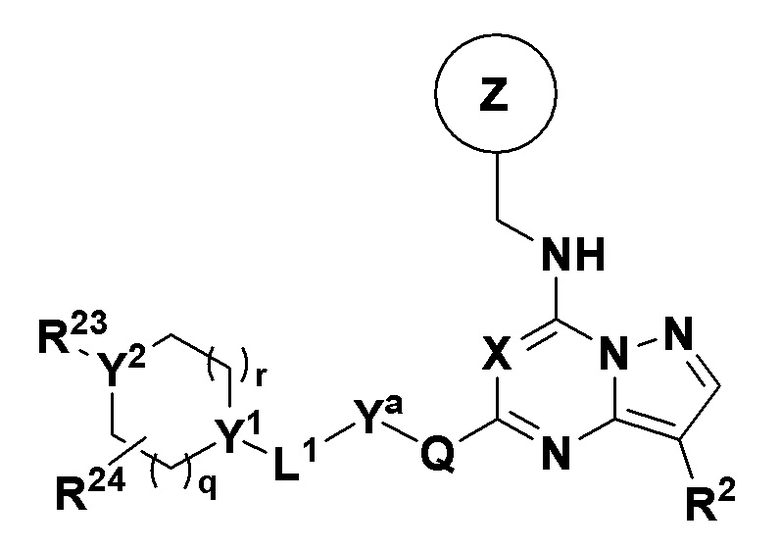
Формула III
где X, Y, Z, R2 и Q имеют значения, приведенные выше для общей формулы I, и
Ya либо отсутствует, либо в каждом случае независимо выбран из группы, состоящей из арила, гетероарила, гетероциклила, арила, замещенного одним или двумя из C1-C6 алкила, -OR5, -N(R5)R5, и галогена, гетероарила, замещенного одним или двумя из C1-C6 алкила, OR5, -N(R5)R5 и галогена, гетероциклила, замещенного одним или двумя из R23 и R24;
R23 либо отсутствует, либо независимо в каждом случае выбран из группы, состоящей из водорода, -OR5, галогена, -N(R5)R5, -NH(C=O)R5, -(C=O)NH2, арила, гетероарила, гетероциклила, C1-C6 алкила и C1-C6 алкила, замещенного -ОН или -NH2;
R24 независимо в каждом случае выбран из группы, состоящей из водорода, галогена, -OR5, -N(R5)R5, (=O), арила, гетероарила, гетероциклила, C1-C6 алкила и C1-C6 алкила, замещенного -ОН или -NH2;
где R5 имеет значение, определенное в п.1 формулы изобретения;
L1 либо отсутствует, либо независимо в каждом случае выбран из группы, состоящей из -NH-, -NH(CH2)-, -NH(C=O)-, -NHSO2-, -O-, -O(CH2)-, -(C=O)-, -(C=O)NH- и -(C=O)(CH2)-;
Y1 независимо в каждом случае выбран из CH, C(OH) и N;
Y2 независимо в каждом случае выбран из CH, C(OH), О и N;
q независимо в каждом случае выбран из 0, 1 и 2;
r независимо в каждом случае выбран из 0, 1, 2 и 3;
В одном варианте соединений общей формулы I или общей формулы Ia, указанной выше,
Z представляет собой Z1, где Z1 представляет собой любую структуру следующей группы Е;
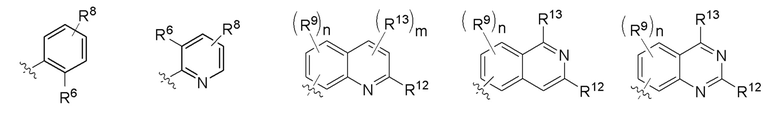
ГруппаЕ
где m независимо в каждом случае выбран из 1 и 2; и
n имеет значение, приведенное выше для общей формулы I;
R8, R9, R12 и R13 имеют значения, определенные выше для общей формулы I;
R6 представляет собой любую структуру группы B, определенной выше для общей формулы I.
В одном варианте соединений общей формулы Ia, указанной выше,
Z представляет собой Z1, где Z1 представляет собой любую структуру следующей группы Е;
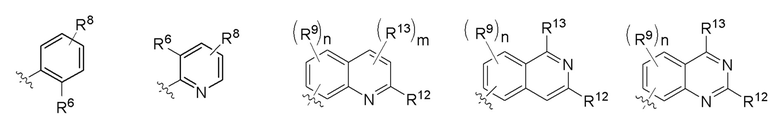
Группа E
где n = 1, 2 или 3; m = 1 или 2;
R8, R9, R12 и R13 имеют значения, определенные выше; а
R6 представляет собой любую структуру группы B, определенной выше.
В одном варианте соединений общей формулы I или общей формулы Ia, указанной выше,
Z представляет собой 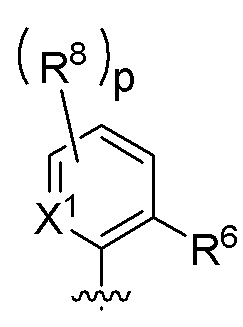
p независимо в каждом случае выбран из 0, 1, 2 и 3;
X1 независимо в каждом случае выбран из CR8 и N;
R6 представляет собой любую структуру группы B, определенной выше для общей формулы I; и
R8 имеет значение, определенное выше для общей формулы I.
В одном варианте соединений общей формулы Ia, указанной выше,
Z представляет собой 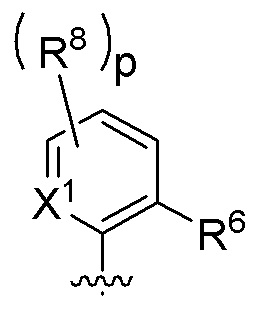
р равно 0, 1, 2 или 3
X1 независимо в каждом случае выбран из CR8 и N;
R6 представляет собой любую структуру группы B, определенной выше; и
R8 имеет значение, определенное выше.
В одном варианте соединений общей формулы I или общей формулы Ia, указанной выше,
Z представляет собой  или Z представляет собой
или Z представляет собой 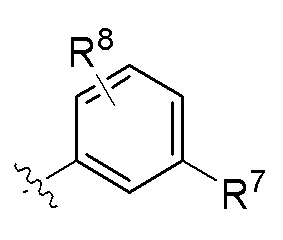
где R6 - R8 имеют значения, определенные выше для общей формулы I.
В одном варианте соединений общей формулы Ia, указанной выше,
Z представляет собой 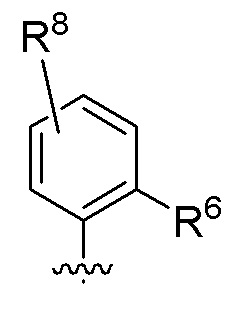 или Z представляет собой
или Z представляет собой 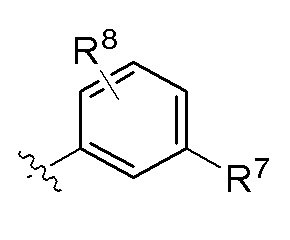
где R6 - R8 имеют значения, определенные выше.
В одном варианте соединений общей формулы I, указанной выше,
Z представляет собой 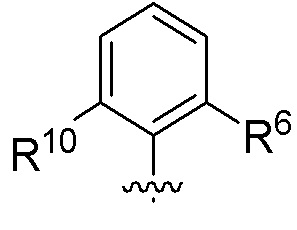
где R6 и R10 имеют значения, определенные выше для общей формулы I.
В одном варианте соединений общей формулы I, указанной выше, соединения имеют общую формулу IV
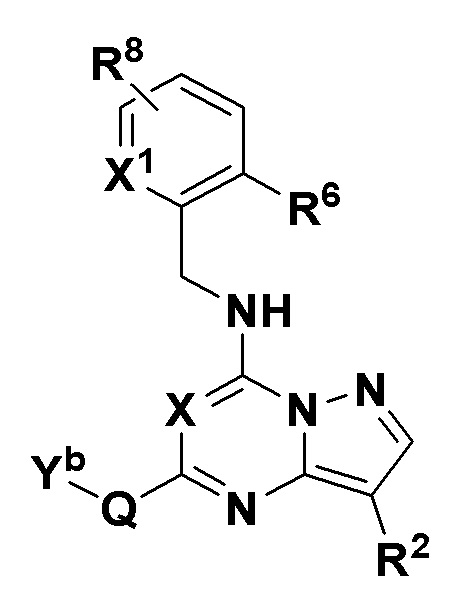
Формула IV
где X, X1, R6, R8 и Q имеют значения, указанные выше для общей формулы I, и
X1 имеет значение, определенное выше;
где Yb - любая структура следующей группы F;
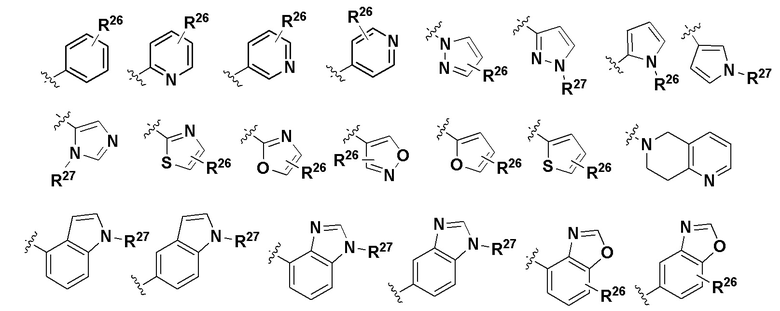
Группа F
R26 и R27 либо отсутствуют, либо независимо в каждом случае выбраны из группы, состоящей из водорода, -OR5, галогена, -N(R5)R5, -NH(C=O)R5, -(C=O)NH2, арила, гетероарила, гетероциклила, C1-C6 алкила и C1-C6 алкила, замещенного -ОН или -NH2;
где R5 имеет значение, определенное выше для общей формулы I.
В одном варианте соединений общей формулы I, указанной выше,
R2 представляет собой C1 -C6 алкил.
В одном варианте соединений общей формулы Ia, указанной выше,
R2 представляет собой C1-C6 алкил.
В одном варианте соединений общей формулы I или общей формулы Ia, указанных выше,
R6 и R7 в каждом случае независимо выбраны из группы, состоящей из -NH(C=O)R14, -NHR14, -OR14, любой структуры следующей группы B'
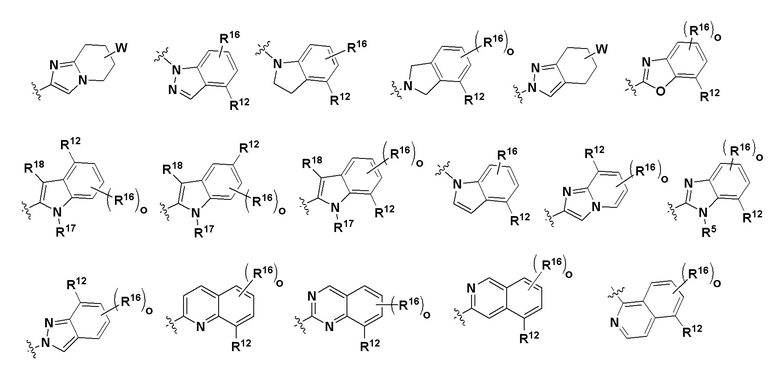
Группа B'
где R14 выбран из группы, состоящей из 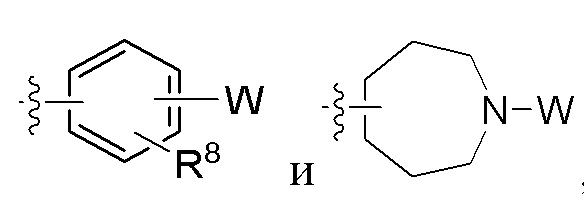 , где R5, R8, R12, R16, R17, R18 и W имеют значения, определенные выше.
, где R5, R8, R12, R16, R17, R18 и W имеют значения, определенные выше.
В одном варианте соединений общей формулы I или общей формулы Ia, указанных выше,
W выбран из группы, состоящей из 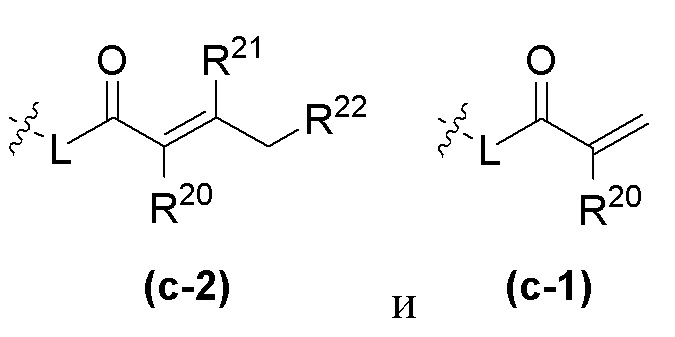
R20 - R22 и L имеют значения, определенные выше.
В одном варианте соединений общей формулы Ia или общей формулы III, указанных выше,
Y1 представляет собой N, Y2 представляет собой CH, и R3 представляет собой -N(R5)2, где R5 имеет значение, определенное выше.
В одном варианте настоящее изобретение также относится к фармацевтически приемлемым солям соединений по настоящему изобретению, определение которых указано выше.
В одном варианте соединение по настоящему изобретению представляет собой соединение, выбранное из структур 1-88, которые приведены далее в таблице 7.
В дополнительном аспекте настоящее изобретение также относится к фармацевтической композиции, содержащей соединение по настоящему изобретению, определение которого приведено в настоящем описании, в качестве активного ингредиента вместе с по меньшей мере одним фармацевтически приемлемым носителем, наполнителем и/или разбавителем.
В одном аспекте настоящее изобретение также относится к соединению по настоящему изобретению, определение которого приведено в настоящем описании, для применения в качестве фармацевтического или фармацевтически активного агента, при этом указанный фармацевтический или фармацевтически активный агент предпочтительно обладает активностью подавления циклин-зависимой киназы 7 (CDK7).
В одном аспекте настоящее изобретение также относится к соединению по настоящему изобретению, определение которого приведено в настоящем описании, для использования в способе профилактики и/или лечения заболевания, которое связано с ингибированием апоптоза, аномальной транскрипционной активности и/или арестом клеточного цикла за счет аномальной активности и/или сверхэкспрессии одной или нескольких циклин-зависимых киназ (CDK), в частности, циклин-зависимой киназы 7 (CDK7), при этом заболевание выбрано из пролиферативных заболеваний, инфекционных заболеваний, включая оппортунистические заболевания, иммунологических заболеваний, аутоиммунных заболеваний и воспалительных заболеваний.
В одном варианте заболеванием, связанным с ингибированием апоптоза, аномальной транскрипционной активности и/или арестом клеточного цикла вследствие аномальной активности и/или сверхэкспрессии одной или нескольких циклин-зависимых киназ (CDK), в частности, циклин-зависимой киназы 7 (CDK7), является заболевание, связанное, сопровождающееся, вызванное и/или спровоцированное дисфункцией и/или гиперфункцией CDK7. В одном варианте заболеванием, связанным с ингибированием апоптоза, аномальной транскрипционной активности и/или арестом клеточного цикла вследствие аномальной активности и/или сверхэкспрессии одной или нескольких циклин-зависимых киназ (CDK), в частности, циклин-зависимой киназы 7 (CDK7), является пролиферативное заболевание. В одном варианте указанным пролиферативным заболеванием является рак.
В одном варианте указанным раком является один из следующих: аденокарцинома, хориоидальная меланома, острый лейкоз, неврилеммома слухового нерва, карцинома амплулярного отдела толстой кишки, анальная карцинома, астроцитома, базальноклеточная карцинома, рак поджелудочной железы, десмоидная опухоль, рак мочевого пузыря, бронхиальная карцинома, эстроген-зависимый и эстроген-независимый рак молочной железы, лимфома Беркитта, рак тела, опухоль неизвестной первичной локализации карциномы (CUP-синдром), колоректальный рак, рак тонкого кишечника, опухоли тонкого кишечника, рак яичников, карцинома эндометрия, эпендимома, эпителиальные типы рака, опухоли Юинга, опухоли желудочно-кишечного тракта, рак желудка, рак желчного пузыря, карциномы желчного пузыря, рак матки, рак шейки матки, глиобластомы шейки матки, гинекологические опухоли, опухоли уха, носа и горла, гематологическая опухоль, волосатоклеточный лейкоз, рак уретры, рак кожи, рак кожи яичек, опухоли головного мозга (глиомы), метастазы в мозг, рак яичка, опухоль гипофиза, карциноиды, саркома Капоши, рак гортани, эмбрионально-клеточная опухоль, рак костей, колоректальная карцинома, опухоли головы и шеи (опухоли области уха, носа и горла), карцинома толстой кишки, краниофарингиомы, рак ротовой полости (рак в области рта и на губах), рак центральной нервной системы, рак печени, метастазы в печень, лейкемия, опухоль века, рак легких, лимфомы, рак желудка, злокачественная меланома, злокачественное новообразование, злокачественные новообразования желудочно-кишечного тракта, карцинома молочной железы, рак прямой кишки, медуллобластомы, меланома, менингиомы, лимфома Ходжкина / неходжкинская лимфома, фунгоидная гранулема, рак носа, невринома, нейробластома, рак почки, почечно-клеточные карциномы, олигодендроглиома, карцинома пищевода, остеолитические карциномы и остеопластические карциномы, остеосаркомы, карцинома яичника, карцинома поджелудочной железы, рак полового члена, плазмоцитома, рак предстательной железы, фарингеальный рак, карцинома прямой кишки, ретинобластома, рак влагалища, карцинома щитовидной железы, рак пищевода, Т-клеточная лимфома, тимома, карцинома труб, опухоли глаза, рак уретры, урологические опухоли, уротелиальная карцинома, рак вульвы, появление бородавок, опухоли мягких тканей, саркома мягких тканей, нефробластома, карцинома шейки матки, рак языка, инвазивная протоковая карцинома молочной железы, инвазивная дольковая карцинома, протоковая карцинома in situ, дольковая карцинома in situ, мелкоклеточная карцинома легких, немелкоклеточная карцинома легких, аденома бронха, плевролегочная бластома, мезотелиома, глиома ствола головного мозга, гипоталамическая глиома, астроцитома мозжечка, астроцитома головного мозга, нейроэктодермальная опухоль, опухоли шишковидной железы, саркома матки, раки слюнных желез, аденокарциномы анальной железы, мастоцитомы, опухоль почечной лоханки, опухоль мочеточника, наследственные папиллярные раки почек, спорадические папиллярные раки почек, внутриглазная меланома, гепатоцеллюлярная карцинома, холангиокарцинома, смешанная гепатоцеллюлярная холангиокарцинома, плоскоклеточная карцинома, злокачественная меланома, рак кожи из клеток Меркеля, немеланомный рак кожи, подглоточный рак, рак носоглотки, рак ротоглотки, рак полости рта, плоскоклеточный рак, меланома полости рта, СПИД-ассоциированная лимфома, кожная Т-клеточная лимфома, лимфома центральной нервной системы, злокачественная фиброзная гистиоцитома, саркома лимфатических узлов, рабдомиосаркома, злокачественный гистиоцитоз, фибробластическая саркома, гемангиосаркома, гемангиоперицитома, лейомиосаркома (ЛМС), карцинома молочной железы собак и карцинома молочной железы кошек.
В одном варианте указанное инфекционное заболевание, включая оппортунистические заболевания, выбрано из следующих заболеваний: СПИД, аденовирусная инфекция, альвеолярный гидатидный эхинококкоз (AHD), амебиаз, ангиостронгилиоз, анизакиаз, сибирская язва, бабезиоз, балантидиаз, заражение нематодами Baylisascaris, бильгарция (шистосомоз), бластоцитоз, боррелиоз Лайма, ботулизм, диарея Брайнерда, бруцеллез, губчатая энцефалопатия крупного рогатого скота (ГЭКРС), кандидоз, капилляриоз, синдром хронической усталости (СХУ), болезнь Шагаса, ветряная оспа, инфицирование хламидией пневмонии, холера, синдром хронической усталости, болезнь Крейтцфельда-Якоба (CJD), клонорхоз, кожная мигрирующая личинка (CLM), кокцидиридомикоз, конъюнктивит, инфекция коксаки (Cox A16), криптококковое заболевание, криптоспоридиоз, лихорадка Западного Нила, циклоспориаз, нейроцистицеркоз, цитомегаловирусная инфекция, лихорадка денге, инфицирование Dipylidium caninum, геморрагическая лихорадка Эбола (EHF), альвеолярный эхинококкоз (AE), энцефалит, инфицирование кишечной амебой, инфицирование Entamoeba dispar, инфицирование Entamoeba hartmanni, инфицирование Entamoeba polecki, энтеробиоз, энтеровирусная инфекция (полио/неполио), инфицирование вирусом Эпштейна-Барр, инфицирование кишечной палочкой, пищевая инфекция, ящур, грибковый дерматит, грибковые инфекции, гастроэнтерит, стрептококковая болезнь группы А, стрептококковая болезнь группы В, болезнь Хансена (проказа), хантавирусный легочный синдром, вшивость (педикулез), инфекция Helicobacter pylori, гематологическая болезнь, инфицирование вирусом Вирус Хендра, гепатит (HCV, HBV), опоясывающий герпес (лищай), ВИЧ, эрлихиоз человека, инфицирование вирусом парагриппа, грипп, изоспориаз, лихорадка Ласса, лейшманиоз, висцеральный лейшманиоз (ВЛ), малярия, геморрагическая лихорадка Марбург, корь, менингит, инфекция комплекса Микобактериум авиум (MAC), инфицирование амебой Неглерия Фоулера, нозокомиальная инфекция, инфицирование непатогенными кишечными амебами, онхоцеркоз, описторхоз, инфицирование вирусом папилломы, парвовирусная инфекция, чума, пневмоцистная пневмония (PCP), инфицирование полиомавирусом, Ку-лихорадка, бешенство, инфицирование респираторно-синцитиальным вирусом, ревматический полиартрит, лихорадка долины Рифт, ротавирусная инфекция, инфицирование круглыми червями, сальмонеллез, чесотка, шигеллиоз, опоясывающий лишай, летаргический энцефалит, натуральная оспа, стрептококковая инфекция, инфицирование ленточными червями, столбняк, синдром токсического шока, туберкулез, дуоденит, инфицирование парагемолитическим вибрионом, вибрион общей гнойной инфекции, вирусная геморрагическая лихорадка, бородавки, инфекционные заболевания, передающиеся через воду, инфицирование вирусом ветряной оспы, коклюш и амарилльная лихорадка.
В одном варианте иммунологическое заболевание и/или аутоиммунное заболевание выбрано из следующих заболеваний: астма, диабет, ревматические заболевания, отторжение трансплантированных органов и тканей, ринит, хронические обструктивные заболевания легких, остеопороз, язвенный колит, синусит, красная волчанка, рецидивирующие инфекции, атопический дерматит/ экзема и профессиональные аллергии, пищевые аллергии, лекарственные аллергии, тяжелые анафилактические реакции, анафилаксия, проявления аллергических заболеваний, первичные иммунодефициты, состояния дефицита антител, клеточно-опосредованные иммунодефициты, тяжелый комбинированный иммунодефицит, синдром ДиДжорджи, синдром гиперпродукции IgE (HIES), синдром Вискотта-Олдрича (WAS), атаксия-телеангиэктазия, иммуноопосредованные раки, дефекты лейкоцитов, аутоиммунные заболевания, системная красная волчанка (СКВ), ревматоидный артрит (РА), рассеянный склероз (РС), иммуноопосредованный диабет или сахарный диабет 1 типа, иммуноопосредованный гломерулонефрит, склеродермия, пернициозная анемия, алопеция, пузырчатка, обыкновенная пузырчатка, тяжелая миастения, воспалительные заболевания кишечника, болезнь Крона, псориаз, аутоиммунные заболевания щитовидной железы, тиреоидит Хашимото, дерматомиозит, синдром Гудпасчера (GPS), тяжелая миастения (MG), симпатическая офтальмия, факогенный увеит, хронический агрессивный гепатит, первичный билиарный цирроз, аутоиммунная гемолитическая анемия и болезнь Верльгофа.
В одном варианте воспалительное заболевание вызывается, индуцируется, инициируется и/или усиливается бактериями, вирусами, прионами, паразитами, грибами и/или вызывается раздражающими, травматическими, метаболическими, аллергическими, аутоиммунными или идиопатическими агентами.
В одном варианте воспалительное заболевание выбрано из следующих заболеваний: воспалительные заболевания центральной нервной системы (ЦНС), воспалительные ревматические заболевания, воспалительные заболевания кровеносных сосудов, воспалительные заболевания среднего уха, воспалительные заболевания кишечника, воспалительные заболевания кожи, воспалительное заболевание увеит и воспалительные заболевания гортани.
В одном варианте указанное воспалительное заболевание выбрано из следующих заболеваний: воспалительные заболевания центральной нервной системы (ЦНС), воспалительные ревматические заболевания, воспалительные заболевания кровеносных сосудов, воспалительные заболевания среднего уха, воспалительные заболевания кишечника, воспалительные заболевания кожи, воспалительное заболевание увеит, воспалительные заболевания гортани, при этом указанными воспалительными заболеваниями предпочтительно являются заболевания из группы, в которую входят: абсцесс, инфицирование акантамебой, юношеские угри, актиномикоз, острые воспалительные дерматозы, острые инфекции гортани у взрослых, острая мультифокальная плакоидная пигментная эпителиопатия, острая (термическая) травма, острый некроз сетчатки, острый гнойный средний отит, заболевания, вызываемые водорослями, аллергический контактный дерматит, амилоидоз, ангионевротический отек, анкилозирующий спондилит, аспергиллез, атопический дерматит, псевдобешенство, аутоантитела при васкулите, бактериальные заболевания, бактериальный ларингит, бактериальный менингит, болезнь Бехчета (BD), дробьевидная хориоидопатия, бластомикоз Гилкриста, болезнь Борна, бруцеллез, буллезный мирингит, бурсит, кандидоз, вызванный чумой собак энцефаломиелит, вызванный чумой собак энцефаломиелит у неполовозрелых животных, геморрагическая лихорадка собак, вызванный вирусом герпеса собак энцефаломиелит, холестеатома, хронические гранулематозные заболевания (CGD), хронические воспалительные дерматозы, хронический рецидивирующий энцефаломиелит, хронический гнойный средний отит, рубцевой пемфигоид глаз (OCP), общая инфекция верхних дыхательных путей, гранулема, болезнь Крона, криптококковое заболевание, дерматомиозит, дифтерия, дискоидная красная волчанка (DLE), лекарственный васкулит, лекарственная реакция или реакция гиперчувствительности, энцефалитный зооноз, эозинофильный менингоэнцефалит, полиморфная эритема (EM), вирус лейкемии кошек, вирус иммунодефицита кошек, инфекционный перитонит кошек, полиоэнцефалит кошек, губчатая энцефалопатия кошек, фибромиалгия, гетерохромный увеит Фукса, гастроэзофагеальная (гортанно-глоточная) рефлюксная болезнь гигантоклеточный артериит, сап, глаукоматоциклический кризис, гонорейный гранулярный мирингит, гранулематозный менингоэнцефалит (GME), простой герпес, гистоплазмоз, идиопатические заболевания, идиопатические воспалительные расстройства, иммунные и идиопатические расстройства, инфекции иммунодефицитного хозяина, инфекционный гепатит собак, ингаляционный ларингит, интерстициальный нефрит, ирритантный контактный дерматит, ювенильный ревматоидный артрит, синдром Кавасаки, вирусный энцефалит Ла-Кросс, абсцесс гортани, ларинготрахеобронхит, лейшманиоз, факогенный увеит, проказа, лептоспироз, лейкемия, красный плоский лишай, волчанка, лимфома, менингит, менингоэнцефалит борзых, прочий менингит/ менингоэнцефалит, микроскопический полиангиит, многоочаговый хороидит, вызванный чумой собак многоочаговый энцефаломиелит у половозрелых животных, рассеянный склероз, дисфония мышечного напряжения (MTD), микотические (грибковые) заболевания, микотические заболевания ЦНС, некротизирующий энцефалит, неоспороз, энцефалит старых собак, онхоцеркоз, паразитарный энцефаломиелит, паразитарные инфекции, парспланит, парвовирусный энцефалит, детский ларингит, аллергия на загрязнение окружающей среды и ингаляционная аллергия, полимиозит, поствакцинальный вызванный чумой энцефалит собак, заболевания, индуцированные прионным белком, прототекоз, протозойный энцефалит-энцефаломиелит, псориаз, псориатический артрит, энцефалит мопсов, лучевое поражение, лучевой ларингит, лучевой некроз, рецидивирующий полихондрит, синдром Рейтера, пигментная дегенерация сетчатки, ретинобластома, ревматоидный артрит, риккетсиозы, пятнистая лихорадка Скалистых гор, болезнь отравления лососевыми (SPD), саркоцистоз, саркоидоз, шистозоматоз, склеродермия, риносклерома, ползучий хороидит, идиопатический церебеллит, синдром Шегрена, спазматический круп, спирохетозные (сифилисные) заболевания, спонгиотический дерматит, споротрихоз, стероид-реагирующий менингит-артериит, синдром Стивенса-Джонсона (SJS, обширная полиморфная эритема), эпиглоттит, симпатическая офтальмия, сингамоз, сифилис, системный васкулит при саркоидозе, синдром Такаясу, тендинит (тендонит), облитерирующий тромбангиит (болезнь Бюргера), клещевой вирусный энцефалит собак, токсический эпидермальный некролиз (TEN), токсокариаз, токсоплазмоз, травма, травматический ларингит, трихинеллез, трипаносомоз, туберкулез, туляремия, язвенный колит, аллергическая сыпь (крапивница), васкулит, васкулит и злокачественные новообразования, васкулит и ревматоидный артрит, васкулит при идиопатических воспалительных миопатиях, васкулит центральной нервной системы, васкулит, вторичный по отношению к бактериальному, грибковые и паразитарные инфекции, вирусные заболевания, вирусный ларингит, витилиго, злоупотребление голосом, кровоизлияние в голосовые связки, синдром Фогта-Коянаги-Харады (VKH), гранулематоз Вегенера и болезнь Уиппла.
В одном аспекте настоящее изобретение также относится к лечению и/или профилактике заболевания, которое связано с ингибированием апоптоза, аномальной транскрипционной активностью и/или арестом клеточного цикла за счет аномальной активности и/или сверхэкспрессии одной или нескольких циклин-зависимых киназ (CDK), в частности, циклин-зависимой киназы 7 (CDK7), при этом заболевание выбрано из пролиферативных заболеваний, инфекционных заболеваний, включая оппортунистические заболевания, иммунологических заболеваний, аутоиммунных заболеваний и воспалительных заболеваний, при этом указанный способ лечения и/или профилактики включает в себя введение соединения по настоящему изобретению, определение которого указано в настоящем описании, пациенту, который нуждается в таком лечении и/или профилактике.
В еще одном варианте пациентом, нуждающимся в таком лечении и/или профилактике, является млекопитающее. В одном варианте пациентом, нуждающимся в таком лечении и/или профилактике, является человек. В еще одном варианте пациентом, нуждающимся в таком лечении, является животное, не являющееся человеком.
В одном варианте заболеванием, которое предотвращают или лечат указанным способом, является заболевание, определенное в настоящем описании.
В одном аспекте настоящее изобретение также относится к применению соединения по настоящему изобретению, определение которого приведено в настоящем описании, для изготовлении лекарственного средства для профилактики и/или лечения заболевания, связанного с ингибированием апоптоза, аномальной транскрипционной активности и/или арестом клеточного цикла за счет аномальной активности и/или сверхэкспрессии одной или нескольких циклин-зависимых киназ (CDK), в частности, циклин-зависимой киназы 7 (CDK7), при этом заболевание выбрано из пролиферативных заболеваний, инфекционных заболеваний, включая оппортунистические заболевания, иммунологических заболеваний, аутоиммунных заболеваний и воспалительных заболеваний, определение которых приведено в настоящем описании.
Осуществление изобретения
Дополнительные полезные признаки, аспекты и детали изобретения очевидны из зависимых пунктов формулы изобретения, описания, примеров и чертежей.
Соединения по настоящему изобретению представляют собой высокоэффективные ингибиторы треонин- / серинкиназы CDK7 и/или ее комплекса, CDK7/MAT1/CycH. Соединения по изобретению подходят для применения в качестве фармацевтически активного агента. Соединения по изобретению подходят для лечения расстройств, связанных, сопровождаемых, вызываемых и/или индуцированных CDK7 и ее комплексом, в частности, ее гиперфункцией или дисфункцией. Таким образом, соединения по изобретению подходят для лечения заболеваний или нарушений, связанных с CDK7, и нарушений, индуцированных комплексом CDK7.
Соединения по изобретению также могут применяться для изготовления лекарственного средства или фармацевтической композиции для лечения расстройств, связанных, сопровождаемых, вызываемых и/или индуцированных CDK7 и ее комплексом, в частности, ее гиперфункцией или дисфункцией. Соединения по изобретению дополнительно применяют для производства лекарственного средства или фармацевтической композиции для лечения и/или профилактики расстройств, индуцированных CDK7 и ее комплексом.
Авторы настоящего изобретения установили, что, в частности, в тех вариантах настоящего изобретения, в которых соединения по изобретению содержат группу W, определеную выше, они могут ковалентно связываться с -SH-группами остатков цистеина в циклин-зависимой киназе (киназах), в частности, CDK7, таким образом образуя ковалентную связь и аддукт между соединением и киназой и таким образом ингибируя киназу (киназы). Это касается, в частности, тех вариантов, в которых по меньшей мере один из Z, R6, R7, R11, R12, R13, R15, R16 и R19 представляет собой W, определенный выше, или представляет собой структуру, содержащую W, определенный выше.
Кроме того, это касается тех вариантов, в которых только один из Z, R6, R7, R11, R12, R13, R15, R16 и R19 представляет собой W, определенный выше, или представляет собой структуру, содержащую W, определенный выше. Это связано с тем, что все структуры W, определенные выше, содержат двойную или тройную связь, обеспечивающую возможность осуществления реакции с сульфгидрильной группой в киназе и образования аддукта между соединением и киназой. Ингибирование киназы происходит за счет ковалентного связывания соединения по изобретению. При использовании в данном контексте термин «только один» означает, что только одна (и не более) из перечисленных групп/остатков представляет собой W или структуру, содержащую W, определенный выше.
При использовании в настоящем описании термин «необязательно замещенный» означает, что атом водорода, если он присутствует и присоединен к атому-элементу в группе, или несколько таких атомов водорода могут быть заменены подходящей группой, такой как галоген, включая фтор, C1-C3 алкил, C1-C3 галогеналкил, метилгидроксил, COOMe, C(O)H, COOH, OMe или OCF3;
Термин «алкил» относится к одновалентному насыщенному алифатическому углеводородному радикалу с прямой, разветвленной или циклической цепью, с количеством атомов углерода в указанном диапазоне. Таким образом, например, «C1-C6-алкил» означает любой из гексилалкильных и пентилалкильных изомеров, а также н-, изо-, втор- и трет-бутил, н- и изопропил, циклический пропил, этил и метил.
Термин «алкенил» означает одновалентный алифатический углеводородный радикал с прямой или разветвленной цепью, с одной или несколькими двойными связями углерод-углерод и с количеством атомов углерода в указанном диапазоне. Таким образом, например, «С2-С6-алкенил» означает все гексенильные и пентенильные изомеры, а также 1-бутенил, 2-бутенил, 3-бутенил, изобутенил, 1-пропенил, 2-пропенил и этенил (или винил).
Термин «циклоалкил», сам по себе или в сочетании с любым другим термином, означает такую группу, как, например, необязательно замещенный или незамещенный циклический углеводород, имеющий от трех до восьми атомов углерода, если не определено иное. Таким образом, например, «C3-C8 циклоалкил» означает циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил.
Термин «галогеналкил» означает алкильную группу, определенную в настоящем описании, которая замещена по меньшей мере одним галогеном. Примеры «галогеналкильных» групп с прямой или разветвленной цепью, используемых в настоящем изобретении, включают, помимо прочего, метил, этил, пропил, изопропил, н-бутил и трет-бутил, независимо замещенные одним или несколькими галогенами. Следует понимать, что термин «галогеналкил» включает в себя такие заместители, как -CHF2, -CF3, -CH2-CH2-F, -CH2-CF3 и т.п.
Термин «гетероалкил» означает алкильную группу, в которой один или несколько атомов углерода заменены гетероатомом, например, O, N или S. Например, если атом углерода алкильной группы, которая присоединена к исходной молекуле, заменен гетероатомом (например, O, N или S), полученные гетероалкильные группы представляют собой, соответственно, алкоксигруппу (например, -OCH3 и т.д.), амин (например, -NHCH3, -N(CH3)2 и т.д.) или тиоалкильную группу (например, -SCH3 и т. д.). Если неконцевой атом углерода алкильной группы, которая не присоединена к исходной молекуле, заменен гетероатомом (например, O, N или S) и полученные гетероалкильные группы представляют собой, соответственно, алкиловый эфир (например, -CH2CH2-O-CH3 и т.д.), алкиловый амин (например, -CH2NHCH3, -CH2N(CH3)2 и т.д.) или тиоалкиловый эфир (например, -CH2-S-CH3).
Термин «галоген» означает фтор, хлор, бром или йод.
При использовании в настоящем описании термин «фенил» означает необязательно замещенную или незамещенную фенильную группу.
При использовании в настоящем описании термин «бензил» означает необязательно замещенную или незамещенную бензильную группу.
Термин «гетероарил» означает (i) необязательно замещенные 5- и 6-членные гетероароматические кольца и (ii) необязательно замещенные 9- и 10-членные системы бициклических конденсированных колец, в которых по меньшей мере одно кольцо является ароматическим, при этом гетероароматическое кольцо или система бициклических конденсированных колец содержит от 1 до 4 гетероатомов, независимо выбранных из N, O и S, при этом каждый N необязательно имеет форму оксида, а каждый S в неароматическом кольце необязательно представляет собой S(O) или S(O)2. К подходящим 5- и 6-членным гетероароматическим кольцам относятся, например, пиридил, пирролил, пиразинил, пиримидинил, пиридазинил, триазинил, тиенил, фуранил, имидазолил, пиразолил, триазолил, тетразолил, оксазолил, изооксазолил, оксадиазолил, тиазолил, изотиазолил и тиадиазолил. К подходящим 9- и 10-членным системам гетеробициклических конденсированных колец относятся, например, бензофуранил, индолил, индазолил, нафтиридинил, изобензофуранил, бензопиперидинил, бензизоксазолил, бензоксазолил, хроменил, хинолинил, изохинолинил, циннолинил, хиназолинил, тетрагидрохинолинил, тетрагидроизохинолинил, изоиндолил, бензодиоксолил, бензофурил, имидазо [1,2-a] пиридинил, бензотриазолил, дигидроиндолил, дигидроизоиндолил, индазолил, индолинил, изоиндолинил, хиноксалинил, хиназолинил, 2,3-дигидробензофуранил и 2,3-дигидробензо-1,4-диоксинил.
Термин «гетероциклил» означает (i) необязательно замещенные 4-8-членные, насыщенные и ненасыщенные, но неароматические моноциклические кольца, содержащие по меньшей мере один атом углерода и от 1 до 4 гетероатомов, (ii) необязательно замещенные системы бициклических колец, содержащие от 1 до 6 гетероатомов, и (iii) необязательно замещенные системы трициклических колец, при этом каждое кольцо в (ii) или (iii) независимо слито или соединено мостиком с другим кольцом или кольцами, и каждое кольцо является насыщенным или ненасыщенным, но неароматическим, и при этом каждый гетероатом в (i), (ii) и (iii) независимо выбран из N, O и S, при этом каждый N необязательно имеет форму оксида, а каждый S необязательно окислен до S(O) или S(O)2. К подходящим 4-8-членным насыщенным гетероциклилам относятся, например, азетидинил, пиперидинил, морфолинил, тиоморфолинил, тиазолидинил, изотиазолидинил, оксазолидинил, изоксазолидинил, пирролидинил, имидазолидинил, пиперазинил, тетрагидрофуранил, тетрагидротиенил, пиразолидинил, гексагидропиримидинил, тиазинанил, тиазипанил, тиазепанил, азепанил, диазепанил, тетрагидропиранил, тетрагидротиопиранил, диоксанил и азациклооктил. Подходящие ненасыщенные гетероциклические кольца включают в себя кольца, которые соответствуют насыщенным гетероциклическим кольцам, перечисленным в предложении выше, в которых одинарная связь заменена двойной связью. Следует понимать, что указанные кольца и системы колец, подходящие для использования в настоящем изобретении, не ограничиваются перечисленными в этом и предыдущих абзацах. Эти кольца и системы колец приведены исключительно в качестве примеров.
Фармацевтически приемлемые соли
Примерами фармацевтически приемлемых аддитивных солей являются, помимо прочего, нетоксичные аддитивные соли неорганических и органических кислот, например, ацетат, полученный из уксусной кислоты, аконат, полученный из аконитовой кислоты, аскорбат, полученный из аскорбиновой кислоты, бензолсульфонат, полученный из бензолсульфоновой кислоты, бензоат, полученный из бензойной кислоты, циннамат, полученный из коричной кислоты, цитрат, полученный из лимонной кислоты, эмбонат, полученный из эмбоновой кислоты, энантат, полученный из энантовой кислоты, формиат, полученный из муравьиной кислоты, фумарат, полученный из фумаровой кислоты, глутамат, полученный из глутаминовой кислоты, гликолат, полученный из гликолевой кислоты, гидрохлорид, полученный из соляной кислоты, гидробромид, полученный из бромистоводородной кислоты, лактат, полученный из молочной кислоты, малеат, полученный из малеиновой кислоты, малонат, полученный из малоновой кислоты, соль миндальной кислоты, метансульфонат, полученный из метансульфоновой кислоты, нафталин-2-сульфонат, полученный из нафталин-2-сульфоновой кислоты, нитрат, полученный из азотной кислоты, перхлорат, полученный из перхлорной кислоты, фосфат, полученный из фосфорной кислоты, фталат, полученный из фталевой кислоты, салицилат, полученный из салициловой кислоты, сорбат, полученный из сорбиновой кислоты, стеарат, полученный из стеариновой кислоты, сукцинат, полученный из янтарной кислоты, сульфат, полученный из серной кислоты, тартрат, полученный из винной кислоты, толуол-п-сульфонат, полученный из п-толуолсульфоновой кислоты, и т.п. Такие соли могут быть получены способами, хорошо известными и описанными в данной области техники.
Другие кислоты, такие как щавелевая кислота, хотя сами по себе и не являются фармацевтически приемлемыми, могут быть полезны в получении солей как промежуточные продукты при получении химического соединения по изобретению и его фармацевтически приемлемой соли.
В еще одном варианте соединения по изобретению используют в их соответствующей форме свободного основания по настоящему изобретению.
Соли металлов химического соединения по изобретению включают в себя соли щелочных металлов, такие как натриевая соль химического соединения по изобретению, содержащая карбоксильную группу.
Химические соединения по изобретению могут быть представлены в несольватированной или сольватированной формах вместе с фармацевтически приемлемым растворителем (растворителями), таким как вода, этанол и т.п. Сольватированные формы также могут включать в себя такие гидратированные формы, как моногидрат, дигидрат, полугидрат, тригидрат, тетрагидрат и т.д. В общем, для целей настоящего изобретения сольватированные формы считаются эквивалентными несольватированным формам.
Дополнительные аспекты настоящего изобретения показаны и объяснены на примерах следующих схем, примеров, таблиц и описаний процедур, которые приведены исключительно в качестве иллюстрации, а не для ограничения настоящего изобретения. Объем защиты настоящего изобретения ограничен только прилагаемой формулой изобретения.
Таблицы
Далее приведены ссылки на прилагаемые таблицы, где
В Таблице 1 показаны данные об активности в ферментативном анализе CDK1, CDK2, CDK5 и CDK7 для выбранных соединений по изобретению. Ингибирование приведено в виде IC50 со следующими условными обозначениями: A = IC50 менее 100 нМ; B = IC50 более 100 нМ, но менее 1000 нМ; C = IC50 более 1000 нМ. Также в Таблице 1 приведены данные о селективности в CDK1/CDK7, CDK2/CDK7 и CDK5/CDK7 для выбранных соединений по изобретению. Селективность указана как CDK1/CDK7*, CDK2/CDK7** и CDK5/CDK7*** со следующими условными обозначениями: A = более чем в 500 раз; B = менее 500 раз, но более 50 раз; C = менее 50 раз.
В Таблице 2 приведены данные об активности в анализе клеточной жизнеспособности H460 для выбранных соединений по изобретению. Ингибирование приведено в виде IC50 со следующими условными обозначениями: A = IC50 менее 1 мкМ; B = IC50 более 1 мкМ, но менее 10 мкМ; C = IC50 более 10 мкМ.
В Таблице 3 приведены данные об активности в анализе клеточной жизнеспособности MV4-11 для выбранных соединений по изобретению. Ингибирование приведено в виде IC50 со следующими условными обозначениями: A = IC50 менее 1 мкМ; B = IC50 более 1 мкМ, но менее 10 мкМ; C = IC50 более 10 мкМ.
В Таблице 4 приведены данные об активности в анализе жизнеспособности A2780 для выбранных соединений по изобретению. Ингибирование приведено в виде IC50 со следующими условными обозначениями: A = IC50 менее 1 мкМ; B = IC50 более 1 мкМ, но менее 10 мкМ; C = IC50 более 10 мкМ.
В Таблице 5 приведены данные об активности в анализе жизнеспособности OVCAR-3 для выбранных соединений по изобретению. Ингибирование приведено в виде IC50 со следующими условными обозначениями: A = IC50 менее 1 мкМ; B = IC50 более 1 мкМ, но менее 10 мкМ; C = IC50 более 10 мкМ.
В Таблице 6 приведены соединения 1-88 с точки зрения их структур и соответствующих характеристик.
Примеры
Далее изобретение будет дополнительно описано при помощи следующих примеров, которые приведены для иллюстрации, а не для ограничения настоящего изобретения.
Пример 1: Ферментативный анализ CDK1, CDK2, CDK5 и CDK7
Протокол анализа ферментативного связывания CDK1, CDK2, CDK5 и CDK7
Ингибирующая активность соответствующего соединения в отношении киназы CDK при значении Km для АТФ была протестирована при помощи анализа киназы с помощью LANCE® Ultra на основе метода резонансного переноса энергии флуоресценции (Perkin Elmer), в котором используется пептидный субстрат, меченный ULight™, и соответствующее меченное европием антифосфолипидное антитело. Тестируемые соединения приготовили в растворах ДМСО, а затем приготовили 4-кратные последовательные разведения для 8 доз с использованием автоматического устройства для манипуляций с жидкостями (POD™ 810, Labcyte), и разбавленные растворы соединений поместили в 384-луночные планшеты в объеме 80 нл/лунку (Greiner, № по каталогу 784075). Затем в планшет добавили 68 нМ пептида ULight-MBP (Perkin Elmer, № по каталогу TRF0109-M) и АТФ в объеме 5 мкл/лунку (Sigma, № по каталогу A7699). После центрифугирования в течение 1 мин на скорости 1000 об/мин добавили очищенные CDK/ комплекс циклина со следующими концентрациями соответственно. В каждый соответствующий планшет для CDK1, CDK2, CDK5 и CDK7 добавили 24 мкМ для CDK1/ циклина B (Invitrogen, № по каталогу PR4768C), 22 мкМ для CDK2/ циклина A (Invitrogen, № по каталогу PV6290), 10 мкМ для CDK5/ p25 (Invitrogen, № по каталогу PR8543B) и 400 мкМ для CDK7/ циклина H/ MNAT1 (Invitrogen, № по каталогу PR6749B). Инкубировали при 23°С в течение 60 минут, затем в каждую лунку добавили смесь меченного европием антифосфолипидного основного белка миелина (PE, № по каталогу TRF0201-M) и ЭДТК (Invitrogen, № по каталогу 15575038) в буфере Lance Detection Buffer (Perkin Elmer, № по каталогу CR97100). После дополнительной инкубации при 23°С в течение 60 минут у испытуемых образцов измеряли флуоресценцию при помощи Envision leader (Perkin Elmer, США) [лазер в качестве возбуждающего света; APC 615 нм и европий 665 в качестве первого и второго фильтров излучения]. Данные анализировали с помощью программного обеспечения XLfit.
Пример 2: Анализ жизнеспособности клеток H460, MV4-11, A2780 и OVCAR-3
Клеточная культура
Из Американской коллекции типовых культур (ATCC) получили клеточную линию острого лимфобластного лейкоза Т-лимфоцитов человека MV4-11 (АТСС, № по каталогу CRL-9591), клеточную линию НМРЛ (немелкоклеточного рака легкого) H460 (АТСС, № по каталогу HTB-177), A2780 (ECACC, № по каталогу 93112519) и OVCAR-3 (ATCC, № по каталогу HTB-161). Клетки выращивали в среде RPMI-1640 (Invitrogen, № по каталогу 22400-089) с добавлением 10% эмбриональной бычьей сыворотки (Invitrogen, № по каталогу 10099141) и 1% пенициллина/ стрептомицина (Invitrogen, № по каталогу 15070063) и культивировали при 37°С, 5% CO2 в увлажнительной камере. Все клеточные линии регулярно тестировали на микоплазму.
Протокол анализа жизнеспособности клеток H460, MV4-11, A2780 и OVCAR-3
Для обеспечения ингибирования роста раковых клеток-мишеней ингибитором CDK7 анализ жизнеспособности проводили в течение 72 часов. Схематически, кандидатную линию клеток высеяли в 96-луночный планшет при следующей плотности клеток, соответственно. 1 X 104 клеток/лунку для MV4-11, 5 X 103 для H460 и OVCAR-3 и 1 X 103 для A2780. Через 24 часа клетки обработали различными концентрациями соединения (от 0,0015 мкМ до 10 мкМ). Растворитель ДМСО без соединения использовали как контроль при конечной концентрации ДМСО менее 0,1%. Через 72 часа инкубации при 37°C в инкубаторе с 5% CO2 анализировали жизнеспособность клеток с помощью люминесцентного анализа жизнеспособности клеток CellTiter-Glo (Promega, № по каталогу G7570). Все анализы жизнеспособности провели в двух повторениях, значение люминесценции получили с помощью Envision (Perkin Elmer, США). Данные анализировали с помощью программного обеспечения XLfit.
Пример 3: Получение производных пиразоло-триазинового общего каркаса
Получили производные от представленных соединений при помощи способов, описанных ниже (Схема 1-37). Полученные производные исследовали на ферментативное связывание и клеточную активность (H460, MV4-11, A2780 и OVCAR-3) с использованием анализов, описанных выше (примеры 1 и 2), и результаты кратко описаны в Таблицах 1-5. Синтезированные соединения 1-88 приведены в Таблице 6.
Схема 1: Общий механизм синтеза 1
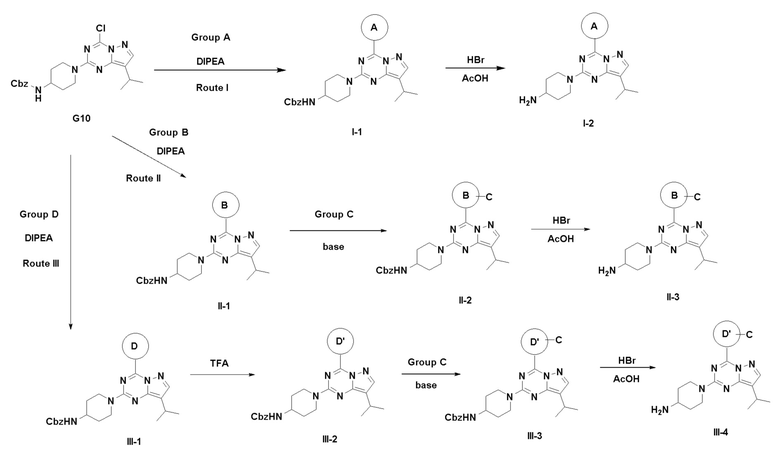
Способ получения соединений формулы I-2, II-3 и III-4 показан на схеме 1.
Путь I: Соединение G10 можно обработать группой A в присутствии диизопропилэтиламина с получением соединений I-1. Соединения I-2 можно обработать HBr/AcOH для получения соединений формулы I-2.
Путь II: Соединение G10 можно обработать группой В в присутствии диизопропилэтиламина с получением соединений II-1. Соединение II-1 можно обработать группой С, описанной в пункте 1 формулы, в присутствии диизопропилэтиламина и ацилхлорида с получением соединений II-2. Соединения II-2 можно обработать HBr/AcOH для получения соединений формулы II-3.
Путь III: Соединение G10 можно обработать группой D в присутствии диизопропилэтиламина с получением соединений III-1. Соединение III-1 можно обработать трифторуксусной кислотой с получением соединения III-2. Соединение III-2 можно обработать группой С, описанной в пункте 1 формулы, в присутствии диизопропилэтиламина и ацилхлорида с получением соединений III-3. Соединения III-3 можно обработать HBr/AcOH для получения соединений формулы III-4.
Общие схемы группы А
Схема 2: Механизм синтеза для A7

Процедура синтеза A3
К раствору соединения A2 (2,64 г), диизопропилэтиламина (3,07 г, 23,7 ммоль) в ДХМ (40,0 мл) добавили 3-нитробензоилхлорид A1 (2,20 г, неочищенный) при 0°C. Реакционную смесь перемешивали при температуре 10°С в течение 16 часов в атмосфере N2. ТСХ показала, что образовалось новое пятно. Реакционный раствор промыли водой (100 мл), высушили над безводным Na2SO4, отфильтровали, выпарили при пониженном давлении. Остаток очистили с помощью системы Combi flash с получением соединения A3 (1,96 г) в виде грязно-белого порошка.
Процедура синтеза A4
К раствору соединения A3 (1,76 г) в метаноле (40,0 мл) добавили порошок Zn (3,10 г, 47,40 ммоль) и NH4Cl (2,54 г, 47,4 ммоль). Реакционную смесь перемешивали при температуре 10°С в течение 1 часа. ТСХ показала, что реакция завершилась. Реакционную смесь влили в насыщенный водный раствор NaHCO3 (20 мл) и экстрагировали этилацетатом (10 мл × 2). Объединенный экстракт промыли рассолом (10 мл), высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением неочищенного продукта. Неочищенный продукт очистили с помощью системы Combi flash с получением соединения А4 (875 мг) в виде коричневого смолянистого вещества.
Процедура синтеза A6
К раствору соединения A4 (775 мг, 2,27 ммоль) и диизопропилэтиламина (601 мг, 4,65 ммоль) в безводном ТГФ (10 мл) добавили раствор соединения A5 (500 мг, 2,72 ммоль) в безводном ТГФ (1,0 мл) по каплям при 15°C. После перемешивания при 15°C в течение 10 минут добавили диметиламин (2М в ТГФ, 7,57 мл). Реакционную смесь перемешивали при температуре 15°С в течение 20 минут. ТСХ показала, что реакция завершилась. Реакционную смесь влили в воду (10 мл) и затем экстрагировали этилацетатом (10 мл x 2). Органический экстракт промыли водой (10 мл) и рассолом (10 мл), высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением неочищенного продукта в виде коричневого смолянистого вещества. Неочищенный продукт очистили с помощью системы Combi flash с получением соединения А6 (337 мг) в виде светло-коричневого смолянистого вещества.
Процедура синтеза A7
К раствору соединения А6 (168 мг) в ДХМ (2 мл) добавили трифторуксусную кислоту (500 мкл). Реакционный раствор перемешивали при температуре 10°С в течение 2 часов. ТСХ показала, что реакция завершилась. Смесь выпарили при пониженном давлении. Остаток распределили между ДХМ (10 мл) и насыщенным водным раствором NaHCO3 (10 мл). Органический и водный слой выпарили при пониженном давлении с получением 130 мг неочищенного соединения A7. Неочищенный продукт использовали напрямую на следующем этапе без дополнительной очистки.
Схема 3: Механизм синтеза А16 и А18
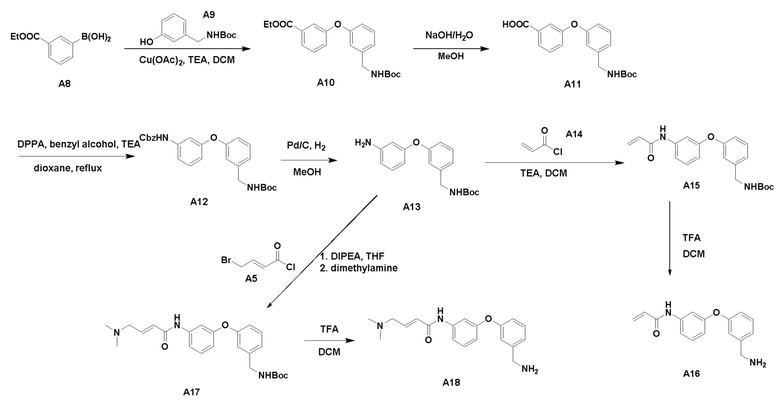
Процедура синтеза A10
К раствору соединения A8 (2,80 г, 12,5 ммоль) в безводном ДХМ (100 мл) добавили соединение А9 (3,65 г, 18,8 ммоль), Cu(OAc)2 (3,42 г, 18,8 ммоль) и ТЭА (3,81 г, 37,6 ммоль, 5,22 мл). Реакционную смесь перемешивали при температуре 15°С в течение 1 дня. ТСХ показала, что соединение А13 было израсходовано. Реакционную смесь отфильтровали. Фильтрат промыли водой (20 мл) и выпарили при пониженном давлении с получением светло-коричневого смолянистого вещества. Неочищенное смолянистое вещество очистили с помощью системы Combi flash с получением соединения А10 (629 мг) в виде белого порошка.
Процедура синтеза A11
К раствору соединения А10 (625 мг, 1,68 ммоль) в метаноле (6 мл) добавили NaOH (1 М, 3,36 мл). Реакционную смесь перемешивали при температуре 15°С в течение 17 часов. ТСХ показала, что реакция завершилась. Реакционную смесь выпарили при пониженном давлении. Остаток растворили в воде (5 мл) и нейтрализовали водным раствором HCl (1 M, 3,40 мл), затем экстрагировали при помощи ДХМ (10 мл × 2). Органический слой промыли водой (10 мл), высушили над безводным Na2SO4, отфильтровали, выпарили при пониженном давлении с получением соединения А11 (483 мг) в виде белого порошка.
Процедура синтеза A12
К раствору соединения A11 (383 мг, 1,12 ммоль), бензилового спирта (969 мг, 8,96 ммоль, 931,67 мкл), ТЭА (453 мг, 4,48 ммоль, 621 мкл) в диоксане (10 мл) добавили дифенилфосфорилазид (339 мг, 1,23 ммоль, 267 мкл). Реакционный раствор кипятили с обратным холодильником в течение 2 часов. ТСХ показала, что реакция завершилась. Реакционную смесь распределили между водой (30 мл) и ДХМ (30 мл). Органический экстракт промыли водой (10 мл × 2), рассолом (10 мл), высушили над безводным Na2SO4 и выпарили при пониженном давлении с получением остатка. Неочищенный продукт очистили с помощью системы Combi flash с получением соединения А12 (1,20 г, неочищенного) в виде бесцветного маслянистого вещества. Неочищенный продукт использовали напрямую на следующем этапе без дополнительной очистки.
Процедура синтеза A13
К раствору соединения А12 (1,10 г, неочищенного) в метаноле (50 мл) добавили Pd/C (100 мг, 50% влажности, 10% Pd). Реакционную смесь дегазировали под вакуумом и 3 раза продули H2, затем перемешивали при 15°C в течение 16 часов в атмосфере H2 (15 фунтов на кв. дюйм). ТСХ показала, что реакция завершилась. Реакционную смесь отфильтровали через целитовую прокладку. Фильтрат выпарили при пониженном давлении. Остаток очистили с помощью системы Combi flash с получением соединения А13 (210 мг) в виде бесцветного маслянистого вещества.
Процедура синтеза A15
К раствору соединения A13 (140 мг, 0,445 ммоль), ТЭА (64 мг, 0,63 ммоль) в ДХМ (2 мл) добавили акрил хлорид A14 (61,0 мг, 0,674 ммоль) по каплям при 20°C. Реакционный раствор перемешивали при температуре 20°С в течение 2 часов в атмосфере N2. ТСХ показала, что реакция завершилась. Реакцию погасили водой (5 мл) и затем экстрагировали ДХМ (10 мл × 2). Объединенный экстракт промыли водой (5 мл), высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением неочищенного продукта в виде коричневого смолянистого вещества. Неочищенный продукт очистили с помощью системы Combi flash с получением соединения А15 (131 мг) в виде коричневого смолянистого вещества.
Процедура синтеза A16
Соединение A15 (130 мг) обработали тем же способом, что и A7, с получением 90 мг соединения A16 в виде коричневого смолянистого вещества.
Процедура синтеза A17
К раствору соединения A13 (210 мг, 0,668 ммоль) и диизопропилэтиламина (177 мг, 1,37 ммоль) в безводном ТГФ (5 мл) добавили раствор соединения A5 (147 мг, 0,801 ммоль) в безводном ТГФ (1,0 мл) по каплям при 15°C. После перемешивания при 15°C в течение 30 минут ЖХМС показала желаемый продукт. Реакционную смесь влили в воду (10 мл) и затем экстрагировали ДХМ (10 мл × 2). Органический экстракт промыли водой (10 мл) и рассолом (10 мл), высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением неочищенного продукта в виде коричневого смолянистого вещества. Неочищенный продукт очистили с помощью системы Combi flash с получением соединения А17 (183 мг) в виде светло-коричневого смолянистого вещества.
Процедура синтеза A18
Соединение A17 (180 мг) обработали тем же способом, что и A7, с получением 133 мг соединения A18 в виде коричневого смолянистого вещества.
Схема 4: Путь синтеза для A23
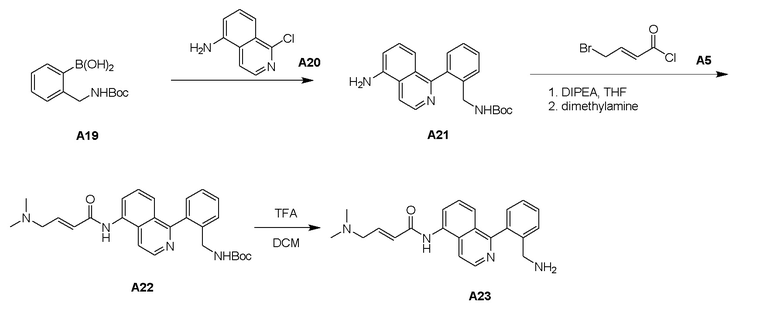
Процедура синтеза А21
К раствору соединения A20 (300 мг, 1,68 ммоль) и соединения A19 (506 мг, 2,02 ммоль) в диоксане (5 мл) и H2O (1 мл) добавили Cs2CO3 (547 мг, 1,68 ммоль), Pd(dppf)Cl2 (123 мг, 0,168 ммоль) в атмосфере N2. Полученную смесь нагревали при 100°C и перемешивали в течение 1,5 часов с получением черной суспензии. ЖХМС и ТСХ показали, что реакция завершилась. Реакцию погасили добавлением H2O (50 мл) и экстрагировали этилацетатом (50 мл × 2). Объединенные органические слои промыли рассолом (20 мл × 2), высушили над Na2SO4, отфильтровали и выпарили при пониженном давлении с получением остатка. Остаток очистили с помощью системы Combi flash с получением соединения А21 (240 мг) в виде желтого твердого вещества.
Процедура синтеза A22
Соединение A21 (408 мг) обработали тем же способом, что и A6, с получением 184 мг соединения A22 в виде желтого маслянистого вещества.
Процедура синтеза A23
Соединение A22 (184 мг) обработали тем же способом, что и A7, с получением 160 мг соединения A23 в виде желтого маслянистого вещества.
Общие схемы группы В
Схема 5: Общий путь синтеза для B4
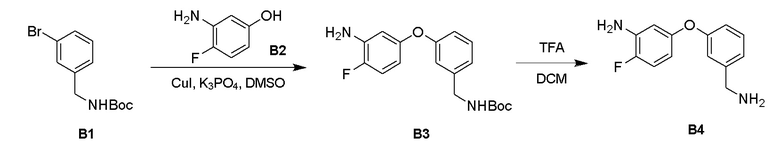
Процедура синтеза B3
К раствору соединения B1 (2,48 г, 8,66 ммоль), соединения B2 (1,00 г, 7,87 ммоль), пиридин-2-карбоновой кислоты (194 мг, 1,57 ммоль) и K3PO4 (3,34 г, 15,7 ммоль) в ДМСО (15 мл) добавили CuI (150 мг, 0,787 ммоль), смесь трижды продули N2 и перемешивали при 90°C в течение 17 часов с получением темного раствора. ЖХМС показала, что реакция завершилась. ТСХ показала, что реакция завершилась. Реакционную смесь влили в воду (100 мл), экстрагировали этилацетатом (100 мл × 2), объединенные экстракты промыли рассолом (30 мл x 2), высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением остатка. Остаток очистили с помощью системы Combi flash с получением соединения В3 (860 мг) в виде светло-желтого маслянистого вещества.
Процедура синтеза B4
К раствору соединения B3 (860 мг, 2,59 ммоль) в ДХМ (7 мл) добавили ТФУК (3 мл), реакционную смесь перемешивали при 25°C в атмосфере N2 в течение 1 часа с получением коричневого раствора. ТСХ показала, что реакция завершилась. Реакционную смесь выпарили при пониженном давлении с получением соединения B4 (800 мг) в виде коричневого смолянистого вещества.
Схема 6: Общий путь синтеза для B7
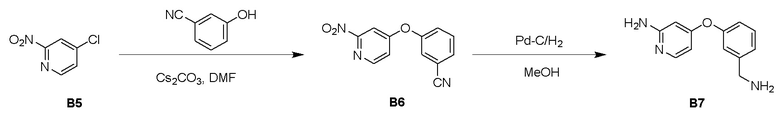
Процедура синтеза B6
К суспензии соединения B5 (4,00 г, 25,2 ммоль) и Cs2CO3 (16,4 г, 50,5 ммоль) в ДМФ (50 мл) добавили 3-цианофенол (3,16 г, 26,5 ммоль), смесь перемешивали при 60°C в течение 17 часов с получением коричневой суспензии. ЖХМС неочищенного вещества (время удержания: 1,384 мин) показала, что реакция завершилась. Смесь влили в воду (400 мл), образовалось много белого твердого вещества, его отфильтровали, осадок на фильтре промыли водой (30 мл × 3) с получением неочищенного продукта. Неочищенный продукт очистили с помощью системы Combi flash с получением 1,00 г B6 в виде желтого порошка.
Процедура синтеза B7
К раствору соединения B6 (850 мг, 3,52 ммоль) и Pd/C (170 мг, 10% Pd) в метаноле (10 мл) добавили NH3.H2O (1,83 г, 5,21 ммоль), смесь продули N2 три раза и перемешивали при 20°C в баллоне с H2 (15 фунтов на кв. дюйм) в течение 1 часа с получением коричневой суспензии. ЖХМС неочищенного продукта показала, что реакция завершилась. Смесь отфильтровали, фильтрат выпарили при пониженном давлении с получением 700 мг соединения B7 в виде желтого смолянистого вещества.
Схема 7: Общий механизм синтеза для B11
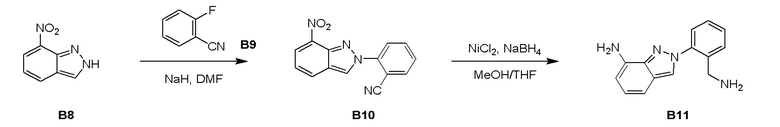
Процедура синтеза B10
К раствору NaH (1,73 г, 43,4 ммоль) в ДМФ (100 мл) добавили 7-нитро-2H-индазол B8 (5,19 г, 31,8 ммоль) несколькими порциями при 20°C, полученную смесь перемешивали в течение 1 часа при 20°C, затем к смеси добавили 2-фторбензонитрил B9 (3,50 г, 28,9 ммоль), реакционную смесь перемешивали еще 12 часов при 130°C с получением черной суспензии. ТСХ показала, что реакция завершилась. Реакцию погасили добавлением H2O (500 мл) и экстрагировали этилацетатом (500 мл × 2). Объединенные органические слои промыли рассолом (100 мл × 2), высушили над Na2SO4, отфильтровали и выпарили при пониженном давлении с получением остатка. Остаток очистили, измельчили в порошок с получением соединения В10 (1,80 г) в виде черного твердого вещества.
Процедура синтеза B11
К раствору соединения B10 (200 мг, 0,8 ммоль) в метаноле (20 мл) и NH3.H2O (1,00 мл, 25%) добавляли никель Ренея (64,8 мг, 0,8 ммоль) в атмосфере N2. Суспензию дегазировали под вакуумом и несколько раз продули H2. Смесь перемешивали в атмосфере H2 (40 фунтов на кв. дюйм) при 20°C в течение 2 часов с получением черной суспензии. ТСХ и ЖХМС показали, что реакция завершилась. Реакционную смесь отфильтровали через целитовую прокладку и выпарили при пониженном давлении с получением остатка. Остаток очистили с помощью системы Combi flash с получением соединения В11 (50 мг) в виде желтого маслянистого вещества.
Схема 8: Общий путь синтеза для B17
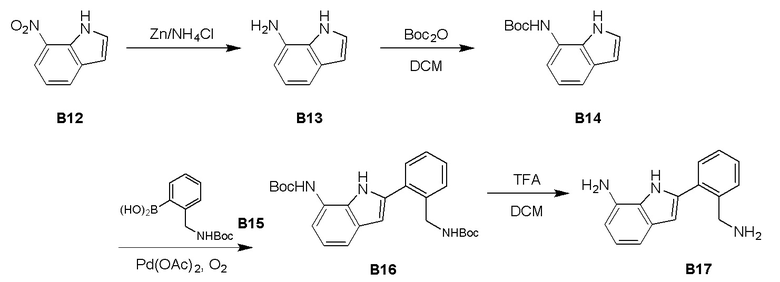
Процедура синтеза B13
К раствору соединения В12 (1,50 г, 9,25 ммоль) в метаноле (50 мл) добавили Zn (6,05 г, 92,5 ммоль) и NH4Cl (4,95 г, 92,5 ммоль). Полученную смесь перемешивали при 20°C в течение 12 часов с получением черной суспензии. ТСХ показала, что реакция завершилась, образовалось одно новое пятно. Реакционную смесь отфильтровали и выпарили при пониженном давлении с получением остатка с получением 1,80 г соединения B13 в виде черного твердого вещества, которое использовали на следующем этапе без очистки.
Процедура синтеза B14
К раствору неочищенного продукта соединения В13 (1,80 г, 6,81 ммоль) в метаноле (50 мл) добавили триэтиламин (689 мг, 6,81 ммоль) и Boc2O (2,23 г, 10,2 ммоль). Полученную смесь перемешивали при 20°C в течение 12 часов с получением черного раствора. ТСХ показала, что образовалось одно новое пятно. Реакционную смесь отфильтровали при пониженном давлении с получением остатка. Остаток очистили с помощью системы Combi flash с получением соединения В14 (781 мг) в виде белого твердого вещества.
Процедура синтеза B16
К смеси соединения B14 (810 мг, 3,23 ммоль), соединения B15 (500 мг, 2,15 ммоль) в уксусной кислоте (20 мл) добавили Pd(OAc)2 (241 мг, 1,08 ммоль), смесь перемешивали при 40-50°C в атмосфере O2 (15 фунтов на кв. дюйм) в течение 12 часов с получением черно-коричневой суспензии. ЖХМС (время удержания = 1,436 минуты) показала, что реакция завершилась. Уксусную кислоту удалили при пониженном давлении, остаток растворили в ДХМ (150 мл) и промыли насыщенным водным раствором NaHCO3 (100 мл × 3). Органический слой высушили над Na2SO4, отфильтровали, выпарили при пониженном давлении с получением черно-коричневого маслянистого вещества. Смесь очистили с помощью системы Combi flash с получением соединения В16 (380 мг) в виде желтого смолянистого вещества.
Процедура синтеза B17
К смеси соединения В16 (380 г, 0,869 ммоль) в ДХМ (30 мл) добавили трифторуксусную кислоту (8 мл). Смесь перемешивали при 15°C в течение 0,5 часа с получением желтой смеси. ЖХМС показала, что реакция завершилась. Смесь объединили и выпарили при пониженном давлении с получением соединения B17 (350 мг) в виде желтого маслянистого вещества.
Схема 9: Общий путь синтеза для B23
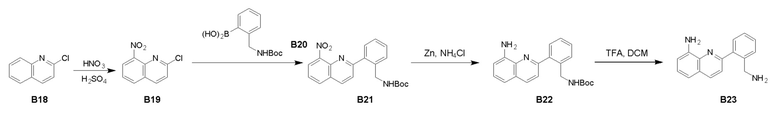
Процедура синтеза B19
Раствор 2-хлорхинолина B18 (2,00 г, 12,2 ммоль) в H2SO4 (20 мл) охладили до 0°C. По каплям добавили HNO3 (3,55 г, 36,7 ммоль). Реакционный раствор перемешивали при 25°C в течение 1 часа с получением черно-коричневого раствора. ТСХ показала, что реакция завершилась. Реакционную смесь влили в воду (50 мл), нейтрализовали до рН = 7-8 насыщенным Na2CO3. Полученную смесь экстрагировали ДХМ (200 мл × 2). Объединенный органический слой промыли рассолом (100 мл), высушили над безводным Na2SO4 и выпарили при пониженном давлении. Остаток очистили с помощью системы Combi flash с получением соединения В19 (1,30 г) в виде желтого твердого вещества.
Процедура синтеза B21
К раствору соединения B19 (560 мг, 2,68 ммоль) и соединения B20 (2,02 г, 8,04 ммоль) в диоксане (10 мл) / H2O (3 мл) добавили Cs2CO3 (1,75 г, 5,36 ммоль) и Pd(dppf)Cl2 (98,1 мг, 0,134 ммоль) в атмосфере N2. Реакционную смесь нагрели до 100°C и перемешивали в течение 16 часов в атмосфере N2 с получением черной смеси. ТСХ показала, что реакция завершилась. Реакционную смесь разбавили водой (100 мл) и экстрагировали этилацетатом (200 мл × 2). Объединенные экстракты высушили над безводным Na2SO4 и выпарили при пониженном давлении. Остаток очистили с помощью системы Combi flash с получением соединения В21 (1,00 г) в виде коричневого твердого вещества.
Процедура синтеза B22
К раствору соединения В21 (500 мг, 1,32 ммоль) и NH4Cl (706 мг, 13,2 ммоль) в метаноле (10 мл) добавили Zn (863 мг, 13,2 ммоль). Реакционную смесь перемешивали при 25°C в течение 16 часов с получением черно-коричневой смеси. ТСХ показала, что реакция завершилась. Реакционную смесь разбавили метанолом (50 мл) и отфильтровали. Фильтрат выпарили при пониженном давлении. Остаток очистили с помощью системы Combi flash с получением соединения В22 (500 мг) в виде желтого твердого вещества.
Процедура синтеза B23
К смеси соединения В22 (500 мг, 1,43 ммоль) в ДХМ (7 мл) добавили трифторуксусную кислоту (3 мл). Реакционный раствор перемешивали при 25°C в течение 1 часа с получением красного раствора. ЖХМС показала, что реакция завершилась. Реакционную смесь разбавили ДХМ (10 мл) и выпарили при пониженном давлении с получением соединения B23 (300 мг) в виде черно-коричневого маслянистого вещества.
Схема 10: Общий путь синтеза для B31
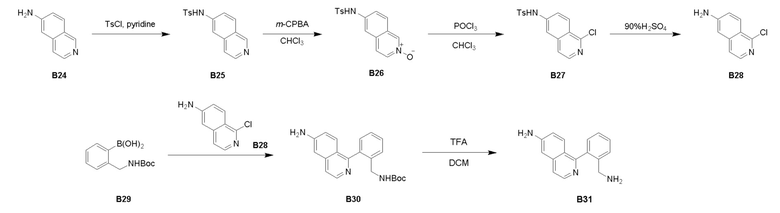
Процедура синтеза B25
Изохинолин-6-амин В24 (2,00 г, 13,87 ммоль) растворили в пиридине (20 мл) и добавили метилбензолсульфонилхлорид (3,17 г, 16,64 ммоль). Реакционную смесь перемешивали при температуре 20°С в течение 12 часов. ЖХМС показала, что реакция завершилась. К реакционной смеси добавили воду (30 мл) при хорошем перемешивании, смесь перемешивали при 20°C в течение 0,5 часа, выпал осадок в виде твердого вещества бледно-желтого цвета. Смесь отфильтровали, твердое вещество собрали и промыли водой (5 мл) с получением соединения B25 (2,2 г) в виде желтого твердого вещества.
Процедура синтеза B26
Соединение B25 (2,00 г, 6,70 ммоль) растворили в CHCl3 (30,00 мл). При охлаждении льдом (0°C) к нему добавили мета-хлорпероксибензойную кислоту (1,71 г, 7,91 ммоль) с последующим перемешиванием при 20°C в течение 12 часов. ТСХ показала, что реакция завершилась. Растворитель выпарили и полученное твердое вещество промыли МТБЭ (50 мл). Осадок на фильтре собрали и высушили в высоком вакууме с получением соединения B26 (1,96 г) в виде светло-желтого твердого вещества.
Процедура синтеза B27
К смеси соединения B26 (4,20 г, 13,4 ммоль) в CHCl3 (120 мл) добавили POCl3 (45,1 г, 293,9 ммоль). Реакционную смесь нагрели до 61°C и перемешивали в течение 16 часов с получением черно-коричневого раствора. ТСХ показала, что реакция завершилась. Реакционную смесь охладили до 20°С и выпарили при пониженном давлении. Остаток влили в воду (200 мл) и нейтрализовали до рН = 8-9 насыщенным Na2CO3. Добавили 300 мл этилацетата и смесь отфильтровали. Фильтрат собрали, отделили и водную фазу экстрагировали этилацетатом (200 мл × 2). Объединенные экстракты собрали, высушили над безводным Na2SO4 и выпарили при пониженном давлении с получением соединения B27 (4,00 г) в виде желтого твердого вещества.
Процедура синтеза B28
Раствор соединения B27 (4,00 г, 12,0 ммоль) в H2SO4 (50 мл) (90%) перемешивали при 20°C в течение 16 часов с получением черно-коричневого раствора. ЖХМС показала, что реакция завершилась. Реакционный раствор охладили до 0-10°C ледяной водой (100 мл), нейтрализовали до pH = 7-8 с помощью Na2CO3 (твердого) и экстрагировали этилацетатом (300 мл × 2). Объединенные экстракты собрали, высушили над безводным Na2SO4 и выпарили при пониженном давлении с получением соединения B28 (1,80 г) в виде красного твердого вещества.
Процедура синтеза B30
К раствору соединения B28 (1,00 г, 5,60 ммоль) и соединения B29 (4,22 г, 16,8 ммоль) в диоксане (15 мл) / H2O (5 мл) добавили Cs2CO3 (3,65 г, 11,2 ммоль) и Pd(dppf)Cl2 (205 мг, 0,280 ммоль) в атмосфере N2. Реакционную смесь нагрели до 100°C и перемешивали в течение 4 часов в атмосфере N2 с получением черной смеси. ТСХ показала, что реакция завершилась. Реакционную смесь разбавили водой (100 мл) и экстрагировали этилацетатом (200 мл × 2). Объединенные экстракты высушили над безводным Na2SO4 и выпарили при пониженном давлении. Остаток очистили с помощью системы Combi flash с получением соединения В30 (1,00 г) в виде черно-коричневого маслянистого вещества.
Процедура синтеза B31
К раствору соединения В30 (1,00 г, 2,86 ммоль) в ДХМ (14 мл) медленно добавили трифторуксусную кислоту (6 мл). Реакционный раствор перемешивали при 25°C в течение 1 часа с получением красного раствора. ЖХМС показала, что реакция завершилась. Реакционный раствор выпарили при пониженном давлении с получением соединения B31 (1,00 г) в виде черно-коричневого маслянистого вещества, которое использовали на следующем этапе без дополнительной очистки.
Схема 11: Общий путь синтеза для B35
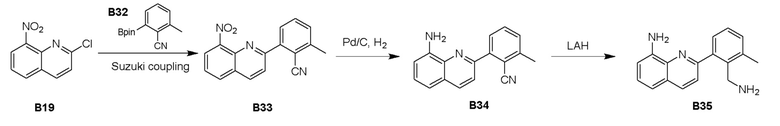
Процедура синтеза B33
К раствору соединения B19 (2,7 г, 12,9 ммоль, 1 экв.) и соединения 32 (3,15 г, 12,9 ммоль, 1,0 экв.) в диоксане (50 мл) и H2O (10 мл) добавили Na2CO3 (2,74 г, 25,9 ммоль, 2 экв.) и Pd(PPh3)4 (748 мг, 0,65 ммоль, 0,005 экв.) в атмосфере N2. Полученную смесь нагрели при 80°C и перемешивали в течение 12 часов с получением желтой суспензии. ТСХ показала, что реакция завершилась. Реакционную смесь отфильтровали с получением остатка в виде светло-желтого твердого вещества. Затем остаток растворяли в ДХМ (200 мл) и H2O (200 мл) и экстрагировали ДХМ (200 мл). Объединенные органические слои промыли рассолом (100 мл), высушили над Na2SO4, отфильтровали и выпарили при пониженном давлении с получением соединения B33 (3,25 г) в виде светло-желтого твердого вещества.
Процедура синтеза B34
К раствору соединения В33 (2,5 г, 8,64 ммоль, 1 экв.) в ДХМ (100 мл) добавили Pd/C (1,5 г, 1,75 ммоль) в атмосфере N2. Суспензию дегазировали в вакууме и несколько раз продули H2. Смесь перемешивали в атмосфере H2 (15 фунтов на кв. дюйм) при 15°C в течение 12 часов с получением черного раствора. ЖХМС показала, что реакция завершилась. Реакционную смесь отфильтровали и выпарили при пониженном давлении с получением соединения В34 (1,96 г) в виде желтого твердого вещества.
Процедура синтеза B35
К суспензии LiAlH4 (673 мг, 17,7 ммоль, 2 экв.) в ТГФ (20 мл) добавили раствор соединения В34 (2,3 г, 8,87 ммоль, 1 экв.) в ТГФ (10 мл) при 0°С. Реакционную смесь перемешивали при 15°C в течение 1 часа с получением красного раствора. ЖХМС показала, что реакция завершилась. Смесь погасили насыщенным раствором NH4Cl. Смесь распределили между этилацетатом и H2O. Водную фазу экстрагировали этилацетатом. Объединенные органические слои промыли рассолом (200 мл), высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением соединения B35 (1,53 г, неочищенного) в виде коричневого твердого вещества. Неочищенный продукт использовали напрямую на следующем этапе.
Общие схемы группы D
Схема 12: Общий путь синтеза для D3
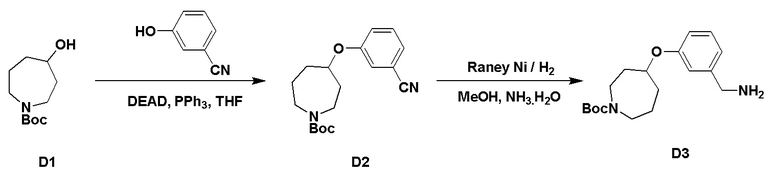
Процедура синтеза D2
К раствору соединения D1 (500 мг, 2,32 ммоль) и 3-гидроксибензонитрила (276 мг, 2,32 ммоль) в ТГФ (20 мл) добавили PPh3 (730 мг, 2,78 ммоль) и диэтилазодикарбоксилат (485 мг, 2,78 ммоль). Полученную смесь перемешивали при 20°C в течение 12 часов с получением желтого раствора. ЖХМС и ТСХ показали, что реакция завершилась. Реакционную смесь погасили добавлением H2O (50 мл) и экстрагировали этилацетатом (50 мл × 2). Объединенные органические слои промыли рассолом (30 мл × 2), высушили над Na2SO4, отфильтровали и выпарили при пониженном давлении с получением остатка. Остаток очистили с помощью системы Combi flash с получением соединения D2 (587 мг) в виде желтого маслянистого вещества.
Процедура синтеза D3
К раствору соединения D2 (587 мг, 1,86 ммоль) в метаноле (20 мл) и NH3.H2O (1 мл) (28%) добавляли никель Ренея (159 мг, 1,86 ммоль) в атмосфере N2. Суспензию дегазировали в вакууме и несколько раз продули H2. Смесь перемешивали в атмосфере H2 (15 фунтов на кв. дюйм) при 20°C в течение 2 часов с получением черной суспензии. ЖХМС показала, что реакция завершилась. Реакционную смесь отфильтровали через целитовую прокладку и выпарили при пониженном давлении с получением соединения D3 (600 мг) в виде желтого маслянистого вещества.
Схема 13: Общий путь синтеза для D6
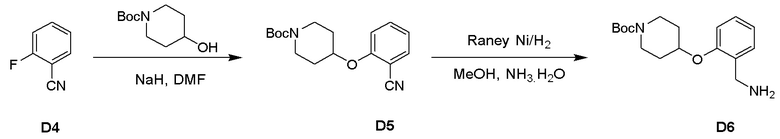
Процедура синтеза D5
К трет-бутил-4-гидроксипиперидин-1-карбоксилату (4,82 г, 23,95 ммоль) в ДМФ (50 мл) добавили порциями NaH (1,44 г, 35,92 ммоль) при 0 °C. Реакционную смесь перемешивали при температуре 20°С в течение 2 часов. Затем к вышеуказанной смеси добавили 2-фторбензонитрил D4 (2,90 г, 23,95 ммоль) и реакционную смесь нагревали до 50°C в течение 1 часа. ТСХ показала, что реакция завершилась. В реакционную смесь по каплям осторожно добавили насыщенный NH4Cl (100 мл) при 0°C для погашения реакции. Смесь экстрагировали этилацетатом (100 мл × 2). Объединенные экстракты промыли водой (50 мл × 3), рассолом (100 мл), высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением соединения D5 (9,10 г, неочищенного) в виде светло-желтого маслянистого вещества.
Процедура синтеза D6
К раствору никеля Ренея (425 мг, 4,96 ммоль) и соединения D5 (3,00 г, 9,92 ммоль) в метаноле (90 мл) добавили NH3.H2O (6 мл) в атмосфере N2. Суспензию дегазировали в вакууме и три раза продули H2. Смесь перемешивали в атмосфере H2 (15 фунтов на кв. дюйм) при 20°C в течение 4 часов. ЖХМС показала, что реакция завершилась. Реакционную смесь отфильтровали, фильтрат выпарили для удаления большей части метанола. Остаток разбавили ДХМ (100 мл), промыли рассолом (80 мл × 2), высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением соединения D6 (2,90 г) в виде светло-желтого маслянистого вещества.
Схема 14: Общий механизм синтеза 2
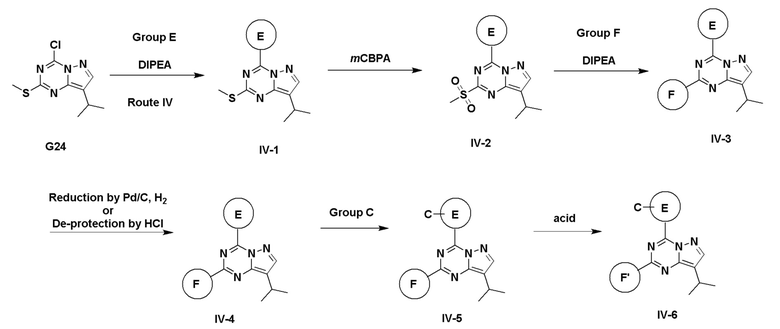
Способ получения соединений формулы IV-5 и IV-6 показан на схеме 14.
Путь IV: Соединение G24 можно обработать группой Е в присутствии диизопропилэтиламина с получением соединений IV-1. Соединение IV-1 можно обработать м-ХПБК с получением соединения IV-2. Соединение IV-2 можно обработать группой F в присутствии диизопропилэтиламина с получением соединений IV-3. Соединение IV-3 можно обработать Pd/C и H2, или HCl с получением соединения IV-4. Соединение IV-4 можно обработать группой С, определение которой указано в пункте 1 формулы изобретения, с получением соединений IV-5. Соединения IV-5 можно обработать кислотой, например, HCl, для получения соединений формулы IV-6.
Общие схемы группы Е
Схема 15: Путь синтеза для E10
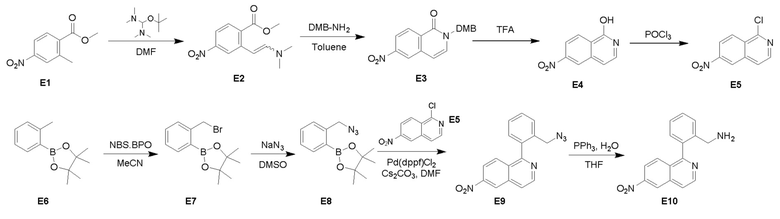
Процедура синтеза E2
К раствору соединения Е1 (93 г, 476 ммоль) в ДМФ (45 мл) добавили 1-трет-бутокси-N,N,N',N'-тетраметил-метандиамин (249 г, 1,43 ммоль, 295 мл). Реакционную смесь перемешивали при 140°C в течение 3 часов с получением коричневой смеси. ТСХ показала наличие нового пятна. Смесь охладили до комнатной температуры и перемешивали при 0°C в течение 30 минут. Твердое вещество выпало в осадок. После фильтрации осадок на фильтре промыли этилацетатом/ПЭ и высушили при пониженном давлении с получением соединения Е2 (69 г) в виде фиолетового порошка.
Процедура синтеза E3
Раствор Е2 (63 г, 252 ммоль), (2,4-диметоксифенил)метанамина (63 г, 378 ммоль, 57 мл) в толуоле (150 мл) перемешивали при 35°C в течение 2 часов с получением желтой смеси. Затем реакционную смесь перемешивали при 65°C в течение 2 часов с получением желтой смеси. Затем реакционную смесь перемешивали при 110°C в течение 3 часов с получением желтой смеси. ТСХ показала наличие нового пятна. Смесь охладили до 20°C. Желтое твердое вещество выпало в осадок. Смесь отфильтровали. Осадок на фильтре дважды промыли ПЭ (50 мл) и высушили под высоким вакуумом с получением соединения Е3 (50 г) в виде желтого твердого вещества.
Процедура синтеза E4
Раствор Е3 (55 г, 162 ммоль) в ТФУК (330 мл) перемешивали при 70°C в течение 16 часов с получением пурпурной смеси. ТСХ показала наличие нового пятна. Реакционную смесь выпарили при пониженном давлении с получением остатка. К остатку добавили ПЭ (60 мл) и перемешивали при 25°C в течение 2 часов с получением пурпурной смеси. После фильтрации осадок на фильтре промыли ПЭ (50 мл), высушили при пониженном давлении с получением соединения Е4 (80 г, неочищенного) в виде пурпурного твердого вещества.
Процедура синтеза E5
Раствор Е4 (80 г, 421 ммоль) в POCl3 (341 мл) перемешивали при 100°C в течение 2 часов с получением коричневой смеси. ТСХ показала наличие нового пятна. Реакционную смесь выпарили при пониженном давлении с получением остатка. Остаток растворили в ДХМ (1000 мл). Органический слой промыли насыщенным раствором NaHCO3 (1000 мл), твердое вещество выпало в осадок. После фильтрации осадок на фильтре промыли ДХМ (300 мл × 2). Органический слой высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением неочищенного продукта. Остаток очистили с помощью колоночной хроматографии с получением соединения Е5 (35 г) в виде светло-желтого твердого вещества.
Процедура синтеза E7
К раствору соединения Е6 (40 г, 183 ммоль) в ацетонитриле (400 мл) добавили N-бромсукцинимид (35,9 г, 202 ммоль), бензоил-пероксид (444 мг, 1,83 ммоль). Реакционную смесь перемешивали при 90°C в течение 4 часов с получением коричневой смеси. ЖХМС показала желаемый МС. Реакционную смесь разбавили водой (200 мл) и экстрагировали этилацетатом (100 мл × 2). Органический слой промыли водой (100 мл × 4), рассолом (100 мл × 3), высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением E7 (57 г, неочищенного) в виде коричневого маслянистого вещества.
Процедура синтеза E8
Смесь Е7 (57 г, 192 ммоль) и NaN3 (18,8 г, 290 ммоль) в ДМСО (290 мл) перемешивали при 25°C в течение 16 часов с получением коричневой смеси. ЖХМС показала желаемый МС. Реакционную смесь погасили NaHCO3 (500 мл) и экстрагировали этилацетатом (200 мл × 2). Органический слой промыли водой (300 мл × 4), рассолом (300 мл × 4), высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением E8 (42 г, неочищенного) в виде коричневого маслянистого вещества.
Процедура синтеза E9
К раствору соединения Е8 (12 г, 46,3 ммоль) в диоксане (60 мл) и H2O (15 мл) добавили Е5 (9,66 г, 46,3 ммоль), Cs2CO3 (30,2 г, 92,6 ммоль, 2 экв.) и Pd(dppf)Cl2 (1,69 г, 2,32 ммоль, 0,05 экв.). Реакционную смесь перемешивали при 80°C в защитной атмосфере N2 в течение 5 часов с получением черной смеси. ТСХ показала наличие нового пятна. Реакционную смесь разбавили водой (300 мл) и экстрагировали этилацетатом (200 мл × 2). Органический слой промыли водой (100 мл × 4), рассолом (100 мл × 2), высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением остатка. Остаток очистили с помощью колоночной хроматографии с получением соединения Е9 (8 г) в виде коричневого твердого вещества.
Процедура синтеза E10
К раствору соединения Е9 (8 г, 26,2 ммоль, 1 экв.) в ТГФ (80 мл)/H2O (40 мл) добавили PPh3 (10,3 г, 39,3 ммоль, 1,5 экв.). Реакционную смесь перемешивали при 60°C в течение 16 часов с получением коричневой смеси. ТСХ показала, что реакция завершилась. Реакционную смесь разбавили водой (100 мл) и экстрагировали этилацетатом (100 мл × 2). Органический слой промыли рассолом (100 мл), высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением соединения Е10 (7,32 г, неочищенного) в виде коричневого смолянистого вещества.
Схема 16: Путь синтеза для E15
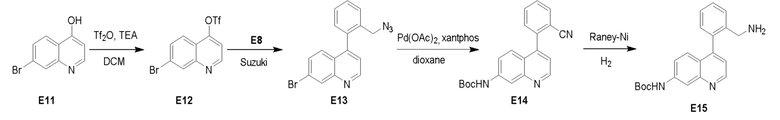
Процедура синтеза E12
К смеси Е11 (2 г, 8,93 ммоль) в пиридине (20 мл) добавили Tf2O (3,02 г, 10,71 ммоль, 1,77 мкл, 1,2 экв.) и при 0°С, смесь перемешивали при 0°C в течение 2 часов с получением коричневой смеси. ЖХМС показала, что реакция завершилась. Реакционную смесь погасили водой (20 мл) и экстрагировали этилацетатом (20 мл x 2). Органический слой промыли водой (20 мл × 2), рассолом (30 мл × 4), высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением неочищенного продукта. Неочищенный продукт очистили с помощью системы Combi flash с получением Е12 (2,2 г) в виде белого твердого вещества.
Процедура синтеза E13
Соединение Е13 (2,2 г) обрабатывали тем же способом, что и В33, с получением 1,3 г соединения Е13 в виде желтого порошка.
Процедура синтеза E14
К смеси E13 (600 мг, 1,77 ммоль) и NH2Boc (248 мг, 2,12 ммоль) в диоксане (10 мл) добавили Pd(OAc)2 (39,71 мг, 176,89 ммоль) и ксантфос (204 мг, 353,79 мкмоль) и Cs2CO3 (1,15 г, 3,54 ммоль), смесь перемешивали при 100°C в течение 16 часов с получением черной смеси. ТСХ показала, что реагент был израсходован. Реакционную смесь погасили водой (20 мл) и экстрагировали этилацетатом (20 мл × 2). Органический слой промыли водой (20 мл × 2), рассолом (30 мл × 4), высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением неочищенного продукта. Неочищенный продукт очистили с помощью системы Combi flash с получением соединения Е14 (190 мг) в виде желтого твердого вещества.
Процедура синтеза E15
Соединение Е14 (400 мг) обрабатывали тем же способом, что и В11, с получением 385 мг соединения Е15 в виде желтого смолянистого вещества.
Схема 17: Путь синтеза для E22

Процедура синтеза E16
Соединение В12 (10,2 г) обрабатывали тем же способом, что и В14, с получением 15,2 г соединения Е16 в виде желтого порошка.
Процедура синтеза E17
К раствору соединения Е16 (7 г, 26,7 ммоль) в ТГФ (45 мл) добавили диизопропиламид лития (2 М, 20 мл) при -78°С в атмосфере N2. Реакционную смесь перемешивали при температуре -78°С в течение 30 минут. В реакционную смесь добавили трибутил(хлор)станнан (10,4 г, 32 ммоль, 1,2 экв.) при -78°C. Реакционную смесь перемешивали при -78°C в течение 30 минут и реакционную смесь перемешивали при 15°C в течение 17 часов с получением желтой смеси. ТСХ показала, что исходный материал не был израсходован полностью. К реакционной смеси добавили насыщенный раствор NH4Cl (20 мл). Смесь распределили между этилацетатом (300 мл) и H2O (300 мл). Органический экстракт промыли насыщенным раствором NH4Cl (300 мл), рассолом (300 мл), высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением желтого смолянистого вещества. Неочищенный продукт очистили с помощью системы Combi flash с получением соединения Е17 (9,8 г) в виде желтого маслянистого вещества.
Процедура синтеза E19
К суспензии соединения Е18 (1 г, 5,10 ммоль) в ТГФ (10 мл) добавили BH3•ТГФ (1 М, 15,3 мл) при 0°С в атмосфере N2. Реакционную смесь перемешивали при 15°C в течение 30 минут с получением желтой смеси. ЖХМС показала, что исходный материал не был израсходован полностью. Реакционную смесь перемешивали при 15°C в течение 17 часов с получением желтой смеси. ЖХМС показала, что исходный материал был израсходован полностью. Небольшое количество смеси очистили с помощью препаративной ТСХ с получением образца. Реакцию погасили метанолом (4 мл). Реакционную смесь выпарили при пониженном давлении с получением Е19 (1,1 г, неочищенного) в виде желтого смолянистого вещества.
Процедура синтеза E20
Соединение Е19 (1,1 г) обрабатывали тем же способом, что и В14, с получением 890 мг соединения Е20 в виде бесцветного маслянистого вещества.
Процедура синтеза E21
Соединения Е20 (800 мг) и Е17 (1,91 г) обрабатывали тем же способом, что и В33, с получением 385 мг соединения Е21 в виде желтого маслянистого вещества.
Процедура синтеза E22
Соединение Е21 (600 мг) обрабатывали тем же способом, что и А7, с получением 450 мг соединения Е22 в виде желтого порошка.
Общие схемы группы F
Схема 18: Путь синтеза для F5
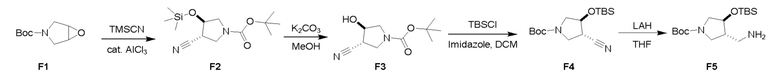
Процедура синтеза F2
К смеси соединения F1 (3 г, 16,20 ммоль) и триметилсилилформонитрила (1,61 г, 16,20 ммоль, 2,03 мл) добавили AlCl3 (60 мг, 449,97 мкмоль, 24,59 мкл, 2,78e-2 экв.), и смесь нагрели до 50°C в течение 20 часов. ТСХ показала, что реакция завершилась. Реакцию погасили водой (10 мл) и затем экстрагировали этилацетатом (10 мл × 2). Объединенную органическую фазу высушили над безводным Na2SO4, отфильтровали и выпарили в вакууме с получением соединения F2 (4,6 г) в виде желтого твердого вещества.
Процедура синтеза F3
К раствору соединения F2 (1 г, 3,52 ммоль) в метаноле (10 мл) добавили K2CO3 (52,48 мг, 379,71 мкмоль). Смесь перемешивали при температуре 20°С в течение 2 часов. ТСХ показала, что материал исчез, и было обнаружено одно крупное новое пятно с большей полярностью. К реакционной смеси добавили 8,75 мл HCl (0,1 М), затем экстрагировали этилацетатом (2×20 мл). Объединенный органический слой высушили над (Na2SO4) и выпарили до сухости с получением соединения F3 (0,74 г) в виде желтого маслянистого вещества.
Процедура синтеза F4
Смесь соединения F3 (2,42 г, 11,40 ммоль), имидазола (993,59 мг, 14,59 ммоль) и трет-бутилхлор-диметилсилана (2,06 г, 13,68 ммоль, 1,68 мл) в ДМФ (10 мл) перемешивали при 20°C в течение 14 часов. ТСХ показала, что материал полностью израсходован и образовались новые пятна. Реакционную смесь разбавили водой (50 мл) и затем экстрагировали этилацетатом 100 мл (50 мл × 2). Объединенные органические слои промыли 100 мл водного раствора NaCl (50 мл × 2), высушили над Na2SO4, отфильтровали и выпарили при пониженном давлении с получением остатка. Остаток очистили при помощи хроматографии на силикагеле с элюированием (ПЭ: этилацетат = 5:1) с получением соединения F4 (2,44 г) в виде бесцветного маслянистого вещества.
Процедура синтеза F5
К раствору соединения F4 (1 г, 3,06 ммоль) в ТГФ (12 мл) добавили алюмогидрид лития (200 мг, 5,27 ммоль) при 0°C, его перемешивали при 0°C в течение 0,5 часа с получением белой суспензии. ТСХ показала, что материал исчез. Реакционную смесь разбавили ТГФ (20 мл) и затем погасили водой (0,2 мл) 15% водным раствором NaOH (0,2 мл) и водой (0,6 мл) при 0°С. Затем смесь перемешивали при температуре 0°С в течение 0,5 часа. Смесь высушили над безводным Na2SO4, затем отфильтровали и осадок на фильтре промыли этилацетатом (20 мл). Объединенный фильтрат выпарили при пониженном давлении с получением соединения F5 (870 мг, смесь 2 трансизомеров) в виде бесцветного маслянистого вещества.
Схема 19: Путь синтеза для F9

Процедура синтеза F7
К смеси F6 (1,7 г, 7,82 ммоль), ТЭА (1,03 г, 10,2 ммоль) в ДХМ (10 мл) добавили тозилхлорид (1,57 г, 8,21 ммоль, 1,05) при 0°C. Реакционную смесь перемешивали при 20°C в течение 17 часов с получением желтого раствора. ЖХМС показала, что наблюдается желаемое значение МС. Реакционную смесь выпарили при пониженном давлении. Концентрат разбавили этилацетатом (150 мл) и полученный раствор промыли водным раствором HCl (100 мл, pH = 4), водным раствором NaOH (1 Н, 100 мл), рассолом (150 мл), высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением соединения F7 (2,49 г) в виде желтого маслянистого вещества.
Процедура синтеза F8
К смеси F7 (2,3 г, 6,19 ммоль) в ДМСО (20 мл) добавили цианид калия (443 мг, 6,81 ммоль, 291 мкл) и KI (1,54 г, 9,29 ммоль), смесь перемешивали при 80°C в течение 3 часов и при 100°C в течение 2 часов с получением черной смеси. ТСХ показала, что реагент был израсходован. Реакционную смесь погасили водой (50 мл) и экстрагировали этилацетатом (50 мл × 2). Органический слой промыли водой (50 мл × 2), рассолом (30 мл × 4), высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением неочищенного продукта. Неочищенный продукт очистили с помощью системы Combi flash с получением F8 (1,19 г) в виде желтого маслянистого вещества.
Процедура синтеза F9
К раствору F8 (600 мг, 2,65 ммоль) в метаноле (20 мл) добавили никель Ренея (227 мг, 2,65 ммоль), суспензию дегазировали под вакуумом и несколько раз продули H2, смесь перемешивали при 25°C в атмосфере H2 (15 фунтов на кв. дюйм) в течение 16 часов с получением черной смеси. ТСХ (ПЭ/ЭА = 1/1) показала, что реакция завершилась. Смесь отфильтровали и выпарили при пониженном давлении с получением F9 (530 мг, неочищенного) в виде желтого маслянистого вещества.
Для группы E использовали такие коммерчески доступные реагенты, как бензилпиперидин-4-илкарбамат, трет-бутилпиперидин-4-илкарбамат, трет-бутилпиперазин-1-карбоксилат, трет-бутил-2-(аминометил)морфолин-4-карбоксилат, трет-бутил-2-(гидроксиметил)морфолин-4-карбоксилат, трет-бутил-4-аминопиперидин-1-карбоксилат, 4-метоксипиперидин, пиперидин-4-илметанамин, 4-метоксициклогексан-1-амин, (тетрагидро-2H-пиран-4 -ил)метанамин, морфолин, азепан-4-ол, пирролидин-3-ол, 4-аминоциклогексан-1-ол, N-метилпиперидин-4-амин, (1R,4R)-4-(аминометил) циклогексан-1-ол, (1S,3S)-3-аминоциклопентан-1-ол, пиперидин-4-ол, 4-(аминометил)пиперидин-2-он, пиперидин-4-илметанол, 4-(трифторметокси)пиперидин, 4-этоксипиперидин, 4-изопропоксипиперидин, 4-этоксициклогексан-1-амин, 4-метоксициклогексан-1-амин, 4-изопропоксициклогексан-1-амин и 3-аминопропан-1-ол.
Схема 20: Общий путь синтеза 3
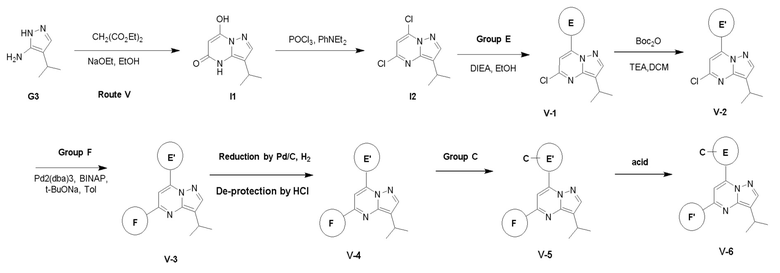
Способ получения соединений формул V-5 и V-6 показан на схеме 20.
Путь V: Соединение G3 можно обработать NaOEt с получением соединения I1. Соединение I1 можно обработать POCl3 с получением соединения I2. Соединение I2 можно обработать группой Е в присутствии диизопропилэтиламина с получением соединений V-1. Соединение V-1 можно обработать Boc2O с получением соединений V-2. Соединение V-2 можно обработать группой F в присутствии трис (дибензилиденацетон)дипалладия (0) с получением соединений V-3. Соединение V-3 можно обработать Pd/C и H2, или HCl с получением соединения V-4. Соединение V-4 можно обработать группой С, определение которой указано в пункте 1 формулы изобретения, с получением соединений V-5. Соединения V-5 можно обработать кислотой, например, HCl, для получения соединений формулы V-6.
Процедура синтеза I1
К безводному EtOH (125 мл) добавили Na (790 мг, 34,3 ммоль), смесь перемешивали при 10°C в течение часа. В этот раствор добавили соединение G3 (3,50 г, 27,9 ммоль) и диэтилпропандиоат (5,42 г, 33,8 ммоль). Смесь перемешивали при температуре 78°С в течение 16 часов в атмосфере N2 с получением желтого раствора. ТСХ показала, что реакция завершилась. Смесь выпарили при пониженном давлении. Остаток растворили в воде (60 мл) и подкислили до pH=3 с помощью 3М HCl, затем отфильтровали с получением соединения I1 (3,70 г) в виде белого порошка.
Процедура синтеза I2
К смеси соединения I1 (1,30 г, 6,73 ммоль) в POCl3 (20,6 г, 134 ммоль) добавили N,N-диэтиланилин (672 мг, 4,51 ммоль). Смесь перемешивали при температуре 100°С в течение 16 часов в атмосфере N2. ТСХ показала наличие нового пятна. Большую часть POCl3 удалили при пониженном давлении. Затем смесь влили в H2O (40 мл), экстрагировали ДХМ (50 мл × 3). Органический слой промыли рассолом (50 мл × 2), высушили над безводным Na2SO4, затем отфильтровали и выпарили при пониженном давлении с получением соединения I2 (3,11 г, неочищенного) в виде желтого маслянистого вещества, для использования без дополнительной очистки на следующем этапе.
Схема 21: Механизм синтеза соединения 1 через Путь I в общем механизме синтеза 1
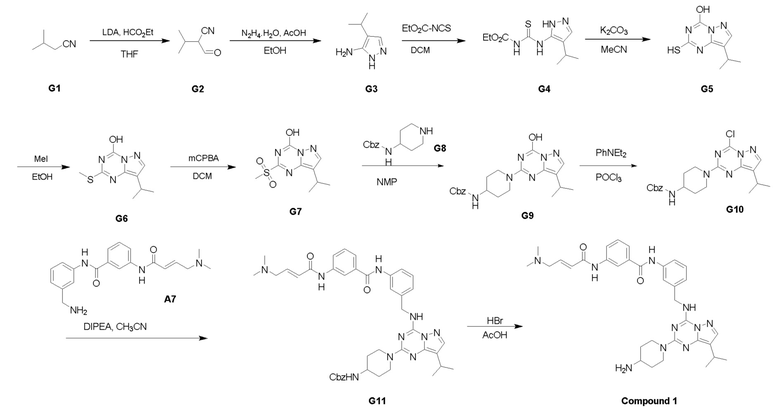
Процедура синтеза G2
К смеси диизопропиламина (6,69 г, 66,2 ммоль) в безводном ТГФ (20 мл) добавили н-BuLi (2,5 M, 27,7 мл) при 0°C и перемешивали при 0°C в течение 0,5 часа, затем смесь охладили до -70°C и добавили G1 (5,00 г, 60,2 ммоль) в ТГФ (20 мл) к смеси при -70°C и перемешивали при -70°C в течение 0,5 часа, затем смесь влили в смесь этилформиата (4,90 г, 66,2 ммоль) в ТГФ (20 мл) при -70°C в атмосфере N2 и полученную смесь перемешивали при -70°C в течение 0,5 часа, затем нагрели до 15°C и перемешивали при 15°C в течение 17 часов. ТСХ (силикагель, ПЭ/ этилацетат = 2/1) показала, что реакция завершилась. Реакционную смесь влили в водный раствор HCl (150 мл, 1M) при 0°C и перемешивали при 0°C в течение 0,5 часа, затем смесь экстрагировали этилацетатом (150 мл × 3). Органический слой промыли рассолом (250 мл), высушили над безводным Na2SO4, отфильтровали, фильтрат выпарили при пониженном давлении с получением соединения G2 (5,0 г) в виде желтого маслянистого вещества. Неочищенный продукт использовали напрямую на следующем этапе без дополнительной очистки.
Процедура синтеза G3
К раствору соединения G2 (8,82 г, 67,5 ммоль) и уксусной кислоты (7,09 г, 118 ммоль) в этаноле (5 мл) добавили NH2-NH2.H2O (4,39 г, 87,7 ммоль), полученную смесь перемешивали при 78°C в течение 17 часов с получением бледно-желтого раствора. ТСХ показала, что реакция завершилась. Реакционную смесь выпарили при пониженном давлении с получением остатка, затем значение pH остатка доводили до 9 водным раствором NaOH (1 М), разбавили водой (50 мл) и экстрагировали этилацетатом (100 мл × 3). Органический слой промыли рассолом (150 мл), высушили над безводным Na2SO4, отфильтровали и фильтрат выпарили при пониженном давлении с получением соединения G3 (10,0 г, неочищенного) в виде желтого смолянистого вещества. Неочищенный продукт использовали напрямую на следующем этапе без дополнительной очистки.
Процедура синтеза G4
К смеси соединения G3 (5,00 г, 40,0 ммоль) в безводном ДХМ (25 мл) добавили смесь этоксикарбонилизотиоцианата (4,72 г, 36,0 ммоль) в безводном ДХМ (25 мл) при -70°C и перемешивали при -70°C в течение 1 часа, образовалось большое количество белого твердого вещества. ТСХ показала, что реакция завершилась. Затем смесь оставили нагреться до -10°C и отфильтровали, и осадок на фильтре промыли ДХМ (15 мл) с получением 4,50 г желаемого соединения в виде белого твердого вещества, структуру подтвердили протонным магнитным резонансом. Фильтрат очистили с помощью колоночной хроматографии с силикагелем с получением соединения G4 (1,80 г) в виде белого твердого вещества.
Процедура синтеза G5
К смеси соединения G4 (6,30 г, 24,6 ммоль) в MeCN (50 мл) добавили K2CO3 (6,79 г, 49,2 ммоль), смесь перемешивали при 80°С в течение 8 часов. ЖХМС неочищенного продукта показала, что реакция завершилась. Смесь охладили до комнатной температуры, затем к смеси добавили уксусную кислоту (15 мл) и перемешивали при 15°C в течение 20 минут, затем полученную смесь выпарили при пониженном давлении с получением остатка, который промыли водой (50 мл x 3) с получением соединения G5 (4,20 г) в виде белого твердого вещества.
Процедура синтеза G6
К смеси соединения G5 (4,20 г, 20,0 ммоль) в этаноле (40 мл) добавили NaOH (2,00 г, 50,0 ммоль) в H2O (20 мл) при 15°C, затем к вышеуказанной смеси добавили иодметан (2,84 г, 20,0 ммоль) и полученную смесь перемешивали при 15°C в течение 2 часов. ЖХМС неочищенного продукта показала, что реакция завершилась. Смесь выпарили при пониженном давлении с получением остатка, который обрабатывали ледяной водой (50 мл) и водным раствором HCl (20 мл, 6 M) в течение 30 минут, образовалось много белого твердого вещества, которое отфильтровали с получением неочищенного продукта. Неочищенный продукт влили в ацетонитрил (50 мл) с получением суспензии, затем суспензию выпарили при пониженном давлении с получением соединения G6 (3,60 г) в виде белого твердого вещества.
Процедура синтеза G7
К смеси соединения G6 (1,00 г, 4,46 ммоль) в ДХМ (30 мл) добавили мета-хлорпероксибензойную кислоту (3,07 г, 14,2 ммоль) порциями при 20°С. Реакционную смесь перемешивали при 20°С в течение 2 часов. ЖХМС показала, что реакция завершилась. Реакционную смесь разбавили раствором смеси рассола (20 мл) и NaOH/H2O (3M, 10 мл). Водный слой отделили и довели рН до 1 при помощи HCl (3М). В осадок выпало большое количество белого порошка. Затем смесь экстрагировали этилацетатом (50 мл × 2). Органический слой промыли рассолом (20 мл), высушили над безводным Na2SO4, отфильтровали, выпарили при пониженном давлении с получением остатка. Остаток очистили с помощью системы Combi flash с получением соединения G7 (1,03 г) в виде светло-коричневого смолянистого вещества.
Процедура синтеза G9
К раствору соединения G7 (6,62 г, 25,83 ммоль) в н-метил-2-пирролидоне (100 мл) добавили соединение G8 (18,15 г, 77,5 ммоль). Реакционную смесь перемешивали при 140°С в течение 16 часов. ТСХ показала, что реакция завершилась. Реакционную смесь распределили между рассолом (500 мл) и этилацетатом (400 мл). Органический слой промыли водой (100 мл × 2), рассолом (100 мл), высушили над безводным Na2SO4 и выпарили при пониженном давлении с получением остатка. Остаток очистили с помощью системы Combi flash с получением коричневого смолянистого вещества, которое истерли в порошок с CH3CN (50 мл) с получением соединения G9 (2,06 г) в виде не чисто-белого порошка.
Процедура синтеза G10
К смеси соединения G9 (89 мг, 0,22 ммоль) в POCl3 (4,41 г, 28,7 ммоль) добавили N,N-диэтиланилин (97 мг, 0,65 ммоль) при 20°С. Реакционную смесь перемешивали при 80°С в течение 2 часов. Реакционную смесь выпарили при пониженном давлении с получением G10 (93 мг) в виде коричневого смолянистого вещества в качестве неочищенного продукта. Неочищенный продукт использовали напрямую на следующем этапе без дополнительной очистки.
Процедура синтеза G11
К раствору соединения G10 (127 мг, 0,297 ммоль), диизопропилэтиламина (95,9 мг, 0,742 ммоль) в ДМФ (2 мл) добавили соединение А7 (131 мг, 0,371 ммоль). Реакционный раствор перемешивали при температуре 10°С в течение 1 часа. ЖХМС показала желаемое значение МС. Реакционную смесь распределили между этилацетатом (20 мл) и насыщенным водным раствором NaHCO3 (20 мл). Органический слой промыли рассолом (100 мл), высушили над безводным Na2SO4, отфильтровали, выпарили при пониженном давлении. Остаток очистили с помощью системы Combi flash с получением соединения G11 (103 мг) в виде коричневого смолянистого вещества.
Процедура синтеза соединения 1
К раствору соединения G11 (70 мг, 0,094 ммоль) в AcOH (0,5 мл) добавили HBr/AcOH (0,5 мл, чистота 35%) при 15°С. Этот реакционный раствор перемешивали при 15°C в течение 1 часа с получением светло-коричневого раствора. ЖХМС показала, что реакция завершилась. Реакционную смесь разбавили 5 мл МТБЭ с осаждением серого порошка, который собрали фильтрацией. Твердое вещество растворили в метаноле (4 мл), затем добавили каплю водного раствора аммиака (28%) для подщелачивания раствора. Неочищенный продукт, растворенный в метаноле, очистили препаративной ВЭЖХ. Элюент, содержащий желаемый продукт, выпарили при пониженном давлении и раствор остатка лиофилизировали с получением соединения 1 (9,9 мг) в виде белого порошка.
Схема 22: Механизм синтеза соединения 9 через Путь I в общем механизме синтеза 1
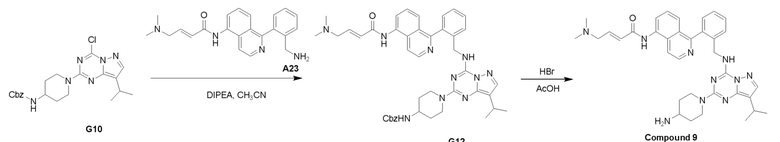
Процедура синтеза G12
К раствору соединения А23 (183 мг, 0,385 ммоль) в CH3CN (10 мл) добавили диизопропилэтиламин (226 мг, 1,75 ммоль) и соединение G10 (150 мг, 0,35 ммоль). Полученную смесь перемешивали при 20°C в течение 1 часа с получением белой суспензии. ТСХ показала, что реакция завершилась. Реакционную смесь погасили добавлением H2O (50 мл) и экстрагировали этилацетатом (50 мл × 2). Объединенные органические слои промыли рассолом (10 мл × 2), высушили над Na2SO4, отфильтровали и выпарили при пониженном давлении с получением остатка. Остаток очистили с помощью системы Combi flash с получением соединения G12 (75 мг) в виде не чисто-белого твердого вещества.
Процедура синтеза соединения 9
Раствор соединения G12 (30 мг, 0,4 ммоль) в HBr/уксусной кислоте 35% (1 мл) перемешивали при 20°C в течение 1 часа с получением желтого раствора. ТСХ показала, что реакция завершилась. В реакционную смесь добавляли МТБЭ (50 мл), и большое количество твердого вещества выпало в осадок, смесь отфильтровали при пониженном давлении с получением осадка на фильтре в виде не чисто-белого твердого вещества. Осадок на фильтре очистили препаративной ВЭЖХ. Из остатка выпарили большую часть растворителя, остаток лиофилизировали с получением соединения 9 (7,8 мг) в виде белого порошка.
Схема 23: Механизм синтеза соединения 16 через Путь II в общем механизме синтеза 1
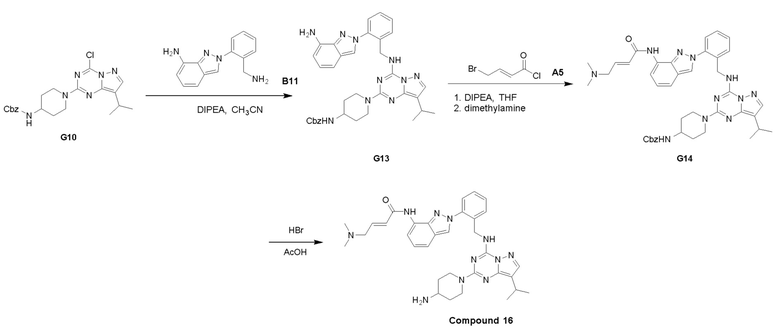
Процедура синтеза G13
К раствору соединения В11 (50 мг, 0,2 ммоль) и соединения G10 (90 мг, 0,2 ммоль) в CH3CN (5 мл) добавили диизопропилэтиламин (27,1 мг, 0,2 ммоль). Полученную смесь перемешивали при 0°C в течение 30 минут с получением красного раствора. ТСХ показала, что реакция завершилась. Реакционную смесь выпарили при пониженном давлении с получением остатка. Остаток очистили с помощью системы Combi flash с получением соединения G13 (100 мг) в виде желтоватого твердого вещества.
Процедура синтеза G14
К раствору соединения G13 (100 мг, 0,158 ммоль) в ТГФ (5 мл) добавили соединение А5 (58,2 мг, 0,317 ммоль) и диизопропилэтиламин (82 мг, 0,634 ммоль), полученную смесь перемешивали при 20°C в течение 1 часа с получением красного раствора. ЖХМС показала, что реакция завершилась. К смеси добавляли диметиламин (71,5 мг, 1,59 ммоль), затем перемешивали еще 3 часа при 20°C с получением красного раствора. ТСХ показала, что реакция завершилась. Реакционную смесь погасили добавлением H2O (50 мл) и экстрагировали этилацетатом (50 мл × 2). Объединенные органические слои промыли рассолом (20 мл × 2), высушили над Na2SO4, отфильтровали и выпарили при пониженном давлении с получением остатка. Остаток очистили с помощью Combi flash с получением 100 мг вещества (неочищенного), которое очистили с получением соединения G14 (50 мг) в виде желтого твердого вещества.
Процедура синтеза соединения 16
Раствор соединения G14 (50 мг, 67,4 мкмоль) в HBr/HOAc (35%) (1 мл) перемешивали при 20°C в течение 30 минут с получением красного раствора. ЖХМС показала, что реакция завершилась. К реакционной смеси добавили МТБЭ (3 мл) с осаждением желтого смолянистого вещества. Желтое смолянистое вещество собрали фильтрацией и промыли МТБЭ (3 мл × 2). Желтое смолянистое вещество растворили в метаноле (2 мл) и очистили катионообменной смолой с элюированием с 5% NH3.H2O/метанола, затем лиофилизировали с получением соединения 16 (29,9 мг) в виде желтого твердого вещества.
Схема 24: Механизм синтеза соединения 25 через Путь II в общем механизме синтеза 1
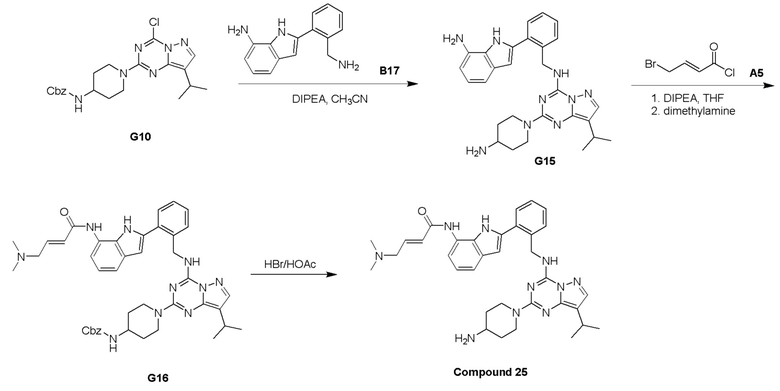
Процедура синтеза G15
К раствору соединения В17 (403 мг, 0,866 ммоль) в MeCN (5 мл) добавили диизопропилэтиламин (976 мкл), соединение G10 (338 мг, 0,787 ммоль). Смесь перемешивали при 15°C в течение 0,5 часа с получением желтой смеси. ТСХ показала, что реакция завершилась. Смесь разделили между ДХМ (50 мл × 2) и водой (50 мл), смесь экстрагировали ДХМ (50 мл х 2), объединенный экстракт промыли рассолом (50 мл), высушили над Na2SO4, отфильтровали, выпарили при пониженном давлении с получением желтого маслянистого вещества, которое очистили системой Combi flash с получением соединения G15 (250 мг) в виде коричневого маслянистого вещества.
Процедура синтеза G16
К раствору соединения G15 (250 мг, 0,397 ммоль) в ТГФ (5 мл) добавили диизопропилэтиламин (0,257 мг, 1,98 ммоль) и соединение А5 (218 мг, 1,19 ммоль). Желтую смесь перемешивали при 15°С в течение 1 часа. Цвет смеси сменился на черный. ЖХМС показала, что реакция завершилась. К смеси добавили диметиламин (2 M, 992 мкл) и перемешивали при 15°C в течение 1 часа с получением черно-коричневой смеси. ЖХМС показала, что реакция завершилась. Смесь распределили между ДХМ (50 мл) и водой (30 мл). Водный раствор экстрагировали ДХМ (50 мл × 2), объединенную экстрагированную фазу промыли рассолом (30 мл), высушили над безводным Na2SO4, отфильтровали, выпарили при пониженном давлении с получением коричневого маслянистого вещества, которое очистили системой Combi flash с получением соединения G16 (250 мг) в виде коричневого смолянистого вещества.
Процедура синтеза соединения 25
Смесь соединения G16 (250 мг, 0,337 ммоль) в HBr/HOAc (3 мл) перемешивали при 15°C в течение 0,5 часа с получением желтой смеси. ЖХМС показала, что реакция завершилась. К реакционной смеси добавили МТБЭ (10 мл) для осаждения желтого порошка. Белый порошок собрали фильтрованием и промыли МТБЭ (5 мл × 2), подщелачивали насыщенным раствором Na2CO3 до pH = 9-10 и экстрагировали ДХМ (50 мл × 2), объединенную органическую фазу промыли водой (50 мл), высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением желтого маслянистого вещества, которое очистили препаративной ВЭЖХ (0,1% ТФУК), подщелачивали насыщенным раствором Na2CO3 до pH = 9-10 и экстрагировали ДХМ (50 мл × 3), высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением соединения 25 (30 мг) в виде белого порошка.
Схема 25: Механизм синтеза соединения 20 через Путь II в общем механизме синтеза 1
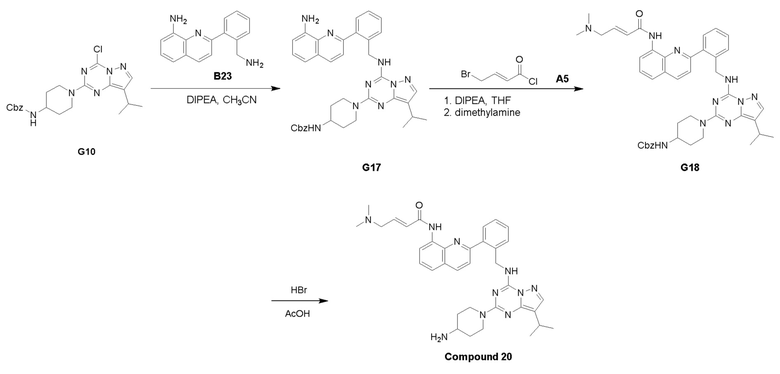
Процедура синтеза G17
К раствору соединения В23 (230 мг, 0,633 ммоль) в CH3CN (5 мл) добавили диизопропилэтиламин (818 мг, 6,33 ммоль) и соединение G10 (299 мг, 0,696 ммоль) при 0-5°С. Реакционный раствор перемешивали при 25°C в течение 1 часа с получением черно-коричневого раствора. ЖХМС показала желаемое значение МС. Реакционную смесь разбавили ДХМ (30 мл) и выпарили при пониженном давлении. Остаток распределили между водой (50 мл) и ДХМ (100 мл). Отделенный органический слой промыли водой (80 мл), рассолом (80 мл), высушили над безводным Na2SO4 и выпарили при пониженном давлении. Остаток очистили с помощью системы Combi flash с получением соединения G17 (150 мг) в виде желтого маслянистого вещества.
Процедура синтеза G18
К раствору соединения G17 (200 мг, 0,312 ммоль) в ТГФ (5 мл) добавили диизопропилэтиламин (201 мг, 1,56 ммоль) и соединение А5 (172 мг, 0,935 ммоль). Реакционный раствор перемешивали при 25°C в течение 30 минут с получением черно-коричневого раствора. Затем добавили диметиламин (2M, 1,56 мкл) и перемешивали в течение еще 16 часов с получением черно-коричневого раствора. ЖХМС и ТСХ показали, что реакция завершилась. Реакционную смесь выпарили при пониженном давлении. Остаток распределили между ДХМ (150 мл) и водой (100 мл). Органический слой промыли водой (100 мл), рассолом (100 мл) и выпарили при пониженном давлении. Остаток очистили с помощью системы Combi flash с получением соединения G18 (100 мг) в виде желтого маслянистого вещества.
Процедура синтеза соединения 20
Раствор соединения G18 (150 мг, 0,199 ммоль) в HBr/HOAc (2 мл, 35%) перемешивали при 25°C в течение 0,5 часа с получением красного раствора. ЖХМС показала, что реакция завершилась. Добавили 10 мл МТБЭ и полученную белую смесь отфильтровали. Осадок на фильтре собрали, промыли МТБЭ (20 мл), растворили в метаноле (3 мл) и подщелачивали катионообменной смолой с получением соединения 20 (46,6 мг) в виде желтого порошка.
Схема 26: Механизм синтеза соединения 11 через Путь II в общем механизме синтеза 1
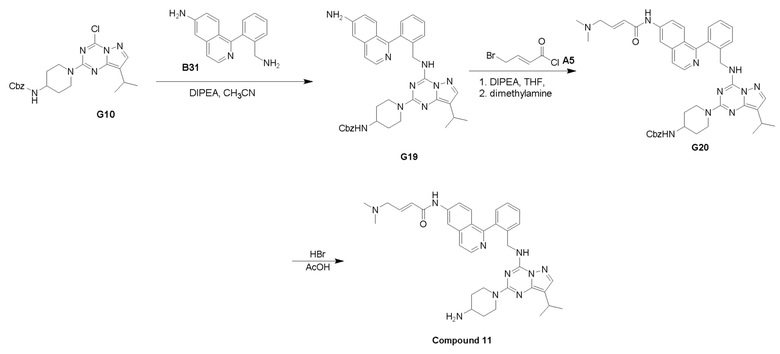
Процедура синтеза G19
К раствору соединения В31 (400 мг, 0,933 ммоль) в CH3CN (10 мл) добавили диизопропилэтиламин (362 мг, 2,80 ммоль) и соединение G10 (500 мг, 1,38 ммоль) при 0-10°С. Реакционный раствор перемешивали при 25°C в течение 1 часа с получением коричневого раствора. ЖХМС неочищенного продукта показала, что реакция завершилась. ТСХ показала образование нового пятна. Реакционный раствор выпарили при пониженном давлении. Остаток очистили с помощью системы Combi flash с получением соединения F19 (380 мг) в виде желтого смолянистого вещества.
Процедура синтеза G20
К раствору соединения G19 (380 мг, 0,600 ммоль) в ТГФ (5 мл) добавили раствор соединения А5 (330 мг, 1,80 ммоль) в ТГФ (2 мл) при 0-5°С на ледяной бане. Реакционный раствор перемешивали при температуре 0-25°С в течение 0,5 часа. Добавили диметиламин (2M, 3 мкл, 10 экв.) и перемешивали в течение еще 2 часов с получением черно-коричневого раствора. ЖХМС неочищенного продукта показала, что реакция завершилась. ТСХ показала, что реакция завершилась. Реакционный раствор выпарили при пониженном давлении. Остаток растворили в ДХМ (200 мл), промыли насыщенным раствором NH4Cl (100 мл), водой (100 мл) и рассолом (100 мл), органический слой высушили над безводным Na2SO4 и выпарили при пониженном давлении. Остаток очистили с помощью системы Combi flash с получением соединения G20 (130 мг) в виде желтого твердого вещества.
Процедура синтеза соединения 11
Раствор соединения G20 (70 мг, 0,093 ммоль) в HBr/HOAc (1 мл, 35%) перемешивали при 25°C в течение 0,5 часа с получением желтого раствора. ЖХМС показала желаемое значение МС. Добавили 10 мл МТБЭ и полученную смесь отфильтровали с получением белого твердого вещества. Твердое вещество растворили в метаноле (2 мл), очистили катионообменной смолой и лиофилизировали с получением белого порошка, который дополнительно очистили препаративной ВЭЖХ. Фракцию выпарили при пониженном давлении. Остаток нейтрализовали до pH 7-8 с помощью K2CO3 (твердого вещества). Полученную белую смесь экстрагировали этилацетатом (50 мл × 2). Органический слой высушили над безводным Na2SO4, выпарили и лиофилизировали с получением соединения 11 (23,1 мг) в виде белого порошка.
Схема 27: Механизм синтеза соединения 18 через Путь III в общем механизме синтеза 1
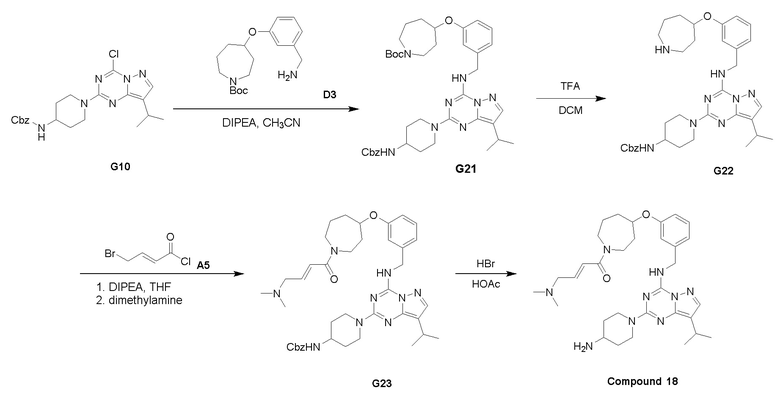
Процедура синтеза G21
К раствору соединения D3 (300 мг, 0,7 ммоль) и соединения G10 (448 мг, 1,40 ммоль) в CH3CN (20 мл) добавили диизопропилэтиламин (181 мг, 1,40 ммоль). Полученную смесь перемешивали при 20°C в течение 1 часа с получением желтого раствора. ЖХМС показала, что реакция завершилась. Реакционную смесь выпарили при пониженном давлении с получением остатка, ТСХ. Остаток очистили с помощью системы Combi flash с получением соединения G21 (240 мг) в виде желтого маслянистого вещества.
Процедура синтеза G22
К смеси соединения G21 (240 мг, 0,34 ммоль) в ДХМ (7 мл) добавили трифторуксусную кислоту (4,62 г, 40,5 ммоль). Полученную смесь перемешивали при 20°C в течение 1 часа с получением желтого раствора. ТСХ и ЖХМС показали, что реакция завершилась. Реакционную смесь выпарили при пониженном давлении с получением соединения G22 (268 мг) в виде желтого маслянистого вещества.
Процедура синтеза G23
К раствору соединения G22 (268 мг, 0,37 ммоль) в ТГФ (20 мл) добавили диизопропилэтиламин (143 мг) и соединение A5 (67,6 мг, 0,37 ммоль), полученную смесь перемешивали при 20°C в течение 1 часа. ЖХМС показала, что реакция завершилась. Затем к смеси добавляли диметиламин (83,1 мг, 1,84 ммоль) и перемешивали еще 2 часа с получением желтой суспензии. ТСХ показала, что реакция завершилась. Реакционную смесь погасили добавлением H2O (50 мл) и экстрагировали этилацетатом (50 мл). Органические слои промыли рассолом (20 мл), высушили над Na2SO4, отфильтровали и выпарили при пониженном давлении с получением остатка. Остаток очистили с помощью системы Combi flash с получением соединения G23 (74 мг) в виде желтого маслянистого вещества.
Процедура синтеза соединения 18
Раствор соединения G23 (74,0 мг, 0,1 ммоль) в HBr/HOAc 35% (1 мл) перемешивали при 20°C в течение 1 часа с получением желтого раствора. ЖХМС показала, что реакция завершилась. К реакционной смеси добавили МТБЭ (3 мл) с осаждением белого смолянистого вещества. Смолянистое твердое вещество собрали фильтрацией и промыли МТБЭ (3 мл х 2). Белое смолянистое вещество растворили в метаноле (2 мл) и очистили катионообменной смолой (PCX-SPE (твердофазной экстракцией с дезоксигуанидинопроклаваминовой кислотой)) с элюированием с 5% NH3.H2O/метанола, потоки выпарили и лиофилизировали с получением соединения 18 (42,9 мг) в виде белого порошка.
Схема 28: Механизм синтеза соединения 44 через Путь IV в общем механизме синтеза 2
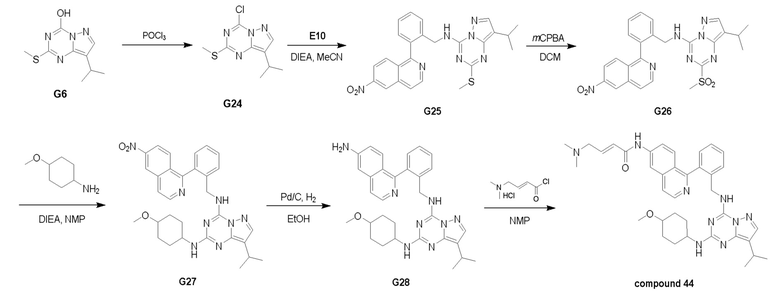
Процедура синтеза G24
К смеси соединения G6 (1,00 г, 4,46 ммоль) в POCl3 (14 мл) добавили N,N-диэтиланилин (2,00 г, 13,4 ммоль) при 15°С, смесь перемешивали при 90°С в течение 3 часов. Смесь выпарили при пониженном давлении с получением соединения G24 (3,20 г, неочищенного) в виде коричневого смолянистого вещества, которое использовали на следующем этапе без дополнительной очистки.
Процедура синтеза G25
К раствору Е10 (7,32 г, 26,2 ммоль) в MeCN (70 мл) добавили диизопропилэтиламин (6,77 г, 52,4 ммоль, 9,13 мл), G24 (6,36 г, 26,2 ммоль). Реакционную смесь перемешивали при 25°C в течение 16 часов с получением коричневой смеси. ТСХ показала наличие нового пятна. Реакционную смесь разбавили водой (100 мл) и экстрагировали этилацетатом (100 мл x 2). Органический слой высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением остатка. Остаток очистили с помощью колоночной хроматографии с получением G25 (11,3 г) в виде желтого твердого вещества.
Процедура синтеза G26
К смеси соединения G25 (11,3 г, 23,2 ммоль) в ДХМ (110 мл) добавили мета-хлорпербензойную кислоту (10,0 г, 46,5 ммоль, чистота: 80%) при 0-10°С, смесь перемешивали при 0-10°С в течение 2 часов с получением желтой смеси. ЖХМС показала, что реакция не завершилась. Смесь перемешивали при 0-10°C в течение еще 1 часа с получением желтой смеси. ЖХМС показала, что наблюдается желаемый продукт. Смесь распределили между ДХМ (100 мл) и насыщенным водным раствором Na2SO3 (100 мл). Водную фазу экстрагировали ДХМ (100 мл × 2). Объединенный органический экстракт высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением неочищенного продукта. Неочищенный продукт очистили с помощью системы Combi flash с получением G26 (6,6 г) в виде желтого твердого вещества.
Процедура синтеза G27
К раствору 4-метоксициклогексанамина (71,9 мг, 0,556 ммоль) и G26 (180 мг, 0,348 ммоль) в н-метил-2-пирролидоне (1 мл) добавили диизопропилэтиламин (135 мг, 1,04 ммоль). Полученную смесь нагрели при 110°C и перемешивали в течение 12 часов с получением коричневого раствора. ЖХМС и ТСХ показали, что реакция завершилась. Реакционную смесь погасили добавлением H2O (50 мл) и экстрагировали этилацетатом (50 мл × 2). Объединенные органические слои промыли рассолом (30 мл × 2), высушили над Na2SO4, отфильтровали и выпарили при пониженном давлении с получением остатка. Остаток очистили с помощью колоночной хроматографии (SiO2, петролейный эфир/ этилацетат = 1:1) с получением соединения G27 (105 мг) в виде оранжево-желтого твердого вещества.
Процедура синтеза G28
Соединение G27 (105 мг) обрабатывали тем же способом, что и В7, с получением 110 мг соединения G28 в виде желтого твердого вещества.
Процедура синтеза соединения 44
К раствору G28 (110 мг, 0,172 ммоль) в н-метил-2-пирролидоне (2 мл) добавили (E)-4-(диметиламино)бут-2-еноилхлорид (3 М, 172 мкл) при 0°С, полученную смесь перемешивали при 15°C в течение 12 часов с получением желтого раствора. ЖХМС показала, что большая часть исходного материала была израсходована. Реакционную смесь погасили добавлением H2O (50 мл) и экстрагировали этилацетатом (50 мл × 2). Объединенные органические слои промыли рассолом (20 мл × 2), высушили над Na2SO4, отфильтровали и выпарили при пониженном давлении с получением остатка. Остаток очистили с помощью препаративной ВЭЖХ, затем выпарили с получением соединения 44 (21 мг) в виде светло-желтого твердого вещества.
Схема 29: Механизм синтеза соединения 79 через Путь IV в общем механизме синтеза 2
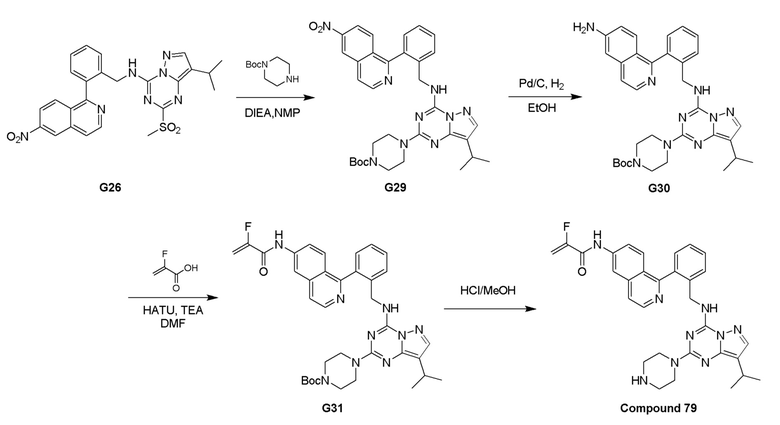
Процедура синтеза G29
К раствору соединения G26 (300 мг, 0,58 ммоль) и трет-бутилпиперазин-1-карбоксилата (323,88 мг, 1,74 ммоль) в н-метил-2-пирролидоне (3 мл) добавили диизопропилэтиламин (149,83 мг, 1,16 ммоль, 201,93 мкл). Полученную смесь нагрели при 110°C и перемешивали в течение 2 часов с получением желтого раствора. ЖХМС и ТСХ показали, что реакция завершилась. Реакционную смесь погасили добавлением H2O (50 мл) и экстрагировали этилацетатом (50 мл × 2). Объединенные органические слои промыли рассолом (30 мл × 3), высушили над Na2SO4, отфильтровали и выпарили при пониженном давлении с получением остатка. Остаток очистили с помощью колоночной хроматографии с получением соединения G29 (285 мг) в виде желтого твердого вещества.
Процедура синтеза G30
Соединение G29 (285 мг) обрабатывали тем же способом, что и В7, с получением 258 мг соединения G30 в виде желтого твердого вещества.
Процедура синтеза G31
К раствору 2-фторпроп-2-еновой кислоты (16,38 мг, 181,90 мкмоль) в ДМФ (2 мл) добавили ТЭА (46,02 мг, 454,76 мкмоль, 63,30 мкл) и HATU (1-[бис(диметиламино)метилен]-1Н-1,2.3-триазоло[4,5-b]пиридиний-3-оксид-гексафторфосфат) (69,17 мг, 181,90 мкмоль), затем к смеси добавили соединение G30 (90 мг, 151,59 мкмоль) и перемешивали при 15°C в течение 2 часов с получением коричневого раствора. ЖХМС показала, что осталась часть исходного материала, реакционную смесь перемешивали при 15°C в течение еще 2 часов с получением коричневого раствора. ЖХМС показала, что реакция почти завершилась. Реакционную смесь влили в воду (15 мл) и желтую суспензию отфильтровали. Осадок на фильтре промыли ПЭ (10 мл) и высушили с получением соединения G31 (100 мг) в виде желтого твердого вещества.
Процедура синтеза соединения 79
Смесь соединения G31 (100 мг) в 4 М HCl/ метанола (2 мл) перемешивали при 15°C в течение 1 часа с получением желтого раствора. ЖХМС и ТСХ показали, что реакция проходила успешно. Растворитель удалили при пониженном давлении с получением неочищенного продукта. Его очистили препаративной ВЭЖХ, большую часть растворителя удалили при пониженном давлении, и оставшийся растворитель удалили лиофилизацией с получением соединения 79 (34,7 мг) в виде желтого твердого вещества.
Схема 30: Механизм синтеза соединения 58 через Путь IV в общем механизме синтеза 2
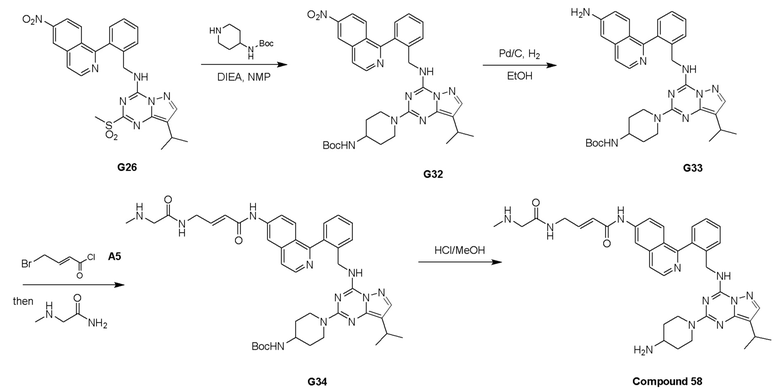
Процедура синтеза G32
К раствору соединения G26 (500 мг, 0,96 ммоль) и трет-бутил N-(4-пиперидил)карбамата (386 мг, 1,93 ммоль) в н-метил-2-пирролидоне (5 мл) добавили диизопропилэтиламин (249 мг, 1,93 ммоль, 336 мкл) и смесь перемешивали при 110°С в течение 16 часов с получением коричневой смеси. ЖХМС показала, что реакция завершилась. Реакционную смесь погасили водой (20 мл) и экстрагировали этилацетатом (20 мл × 2). Органический слой промыли водой (20 мл × 2), рассолом (30 мл × 4), высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением неочищенного продукта. Неочищенный продукт очистили с помощью системы Combi flash с получением соединения G32 (520 мг) в виде красного твердого вещества.
Процедура синтеза G33
Соединение G32 (520 мг) обрабатывали тем же способом, что и В7, с получением 450 мг соединения G33 в виде желтого твердого вещества.
Процедура синтеза G34
К раствору соединения G33 (50 мг, 82 мкмоль, 1 экв.) в ТГФ (2 мл) добавили раствор соединения А5 (330 мг, 164 мкмоль, 2 экв.) в ТГФ (2 мл) при 0-5°С на ледяной бане. Реакционный раствор перемешивали при температуре 0-25°С в течение 1,5 часов. Добавили 2-(метиламино)ацетамид (21 мг, 246 мкмоль, 3 экв.) и диизопропилэтиламин (10 мг, 82 мкмоль, 14 мкл, 1 экв.) и перемешивали еще 16 часов с получением черно-коричневого раствора. ЖХМС показала, что наблюдается желаемый продукт. Реакционную смесь погасили водой (20 мл) и экстрагировали этилацетатом (20 мл × 2). Органический слой промыли водой (20 мл × 2), рассолом (30 мл × 4), высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением неочищенного продукта. Неочищенный продукт очистили с помощью препаративной ТСХ с получением соединения G34 (22 мг) в виде белого порошка.
Процедура синтеза соединения 58
Соединение G34 (22 мг) обрабатывали тем же способом, что и соединение 79, с получением 3 мг соединения 58 в виде желтого твердого вещества.
Схема 31: Механизм синтеза соединения 81 через Путь V в общем механизме синтеза 3
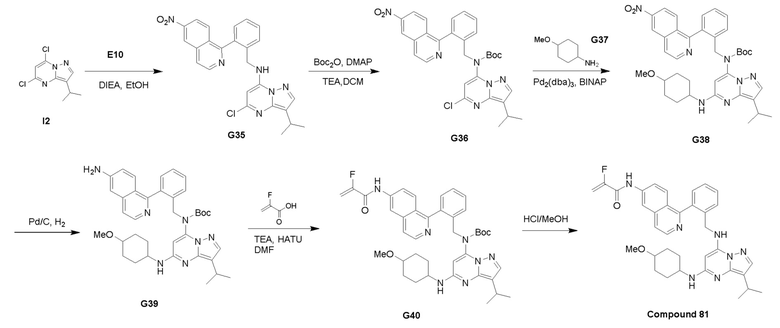
Процедура синтеза G35
К раствору соединения Е10 (728 мг, 2,61 ммоль) и соединения I2 (500 мг, 2,17 ммоль) в этаноле (10 мл) добавили диизопропилэтиламин (561 мг, 4,35 ммоль, 0,757 мл, 2 экв.). Полученную смесь перемешивали при 75°C в течение 12 часов с получением коричневого раствора. ТСХ показала, что реакция завершилась. Реакционную смесь выпарили при пониженном давлении с получением остатка. Реакционную смесь разбавили H2O (50 мл) и экстрагировали этилацетатом (50 мл × 2). Объединенные органические слои промыли рассолом (20 мл × 2), высушили над Na2SO4, отфильтровали и выпарили при пониженном давлении с получением остатка. Остаток очистили с помощью колоночной хроматографии с получением соединения G35 (948 мг) в виде коричневого смолянистого вещества.
Процедура синтеза G36
Соединение G35 (948 мг) обрабатывали тем же способом, что и В14, с получением 930 мг соединения G36 в виде желтого твердого вещества.
Процедура синтеза G38
К смеси соединения G36 (200 мг, 349 мкмоль) и соединения G37 (90,19 мг, 698 мкмоль) в толуоле (5 мл) добавили Pd2(dba)3 (31,9 мг, 34,9 мкмоль), t-BuONa (50,3 мг, 523 мкмоль, 1,5 экв.) и BINAP (2,2'-бис(дифенилфосфино)-1,1'-бинафтил) (21,7 мг, 34,9 мкмоль), и смесь перемешивали при 95°C в течение 4 часов с получением желтой смеси. ЖХМС показала, что реакция не завершилась. Смесь перемешивали при 95°C в течение 6 часов с получением красной смеси. ТСХ показала, что реакция завершилась. Смесь распределили между этилацетатом (15 мл) и водой (10 мл). Водную фазу экстрагировали этилацетатом (10 мл × 2). Объединенный органический экстракт промыли рассолом (130 мл), высушили над Na2SO4, отфильтровали, выпарили при пониженном давлении с получением неочищенного продукта. Неочищенный продукт очистили с помощью системы Combi flash с получением соединения G38 (130 мг) в виде желтого твердого вещества.
Процедура синтеза G39
Соединение G38 (130 мг) обрабатывали тем же способом, что и В7, с получением 110 мг соединения G39 в виде желтого твердого вещества.
Процедура синтеза G40
Соединение G39 (100 мг) обрабатывали тем же способом, что и G31, с получением 70 мг соединения G40 в виде желтого твердого вещества.
Процедура синтеза соединения 81
Соединение G40 (70 мг) обрабатывали тем же способом, что и соединение 79, с получением 18 мг соединения 81 в виде желтого твердого вещества.
Исключительный механизм синтеза
Схема 32: Механизм синтеза для соединения 22
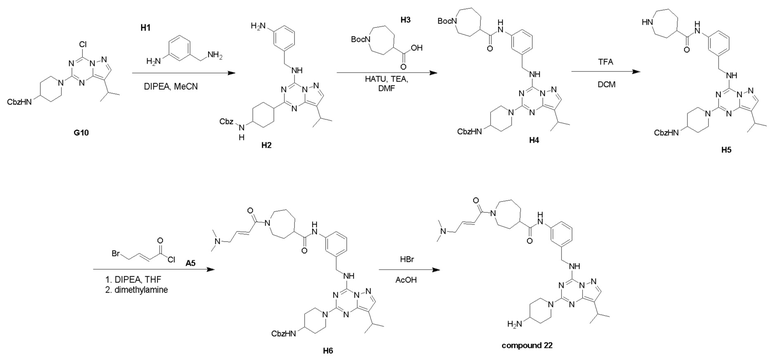
Процедура синтеза H2
К смеси соединения Н1 (214 мг, 1,75 ммоль), диизопропилэтиламин (1 мл) в MeCN (10 мл) добавили соединение G10 (500 мг, 1,17 ммоль). Реакционный раствор перемешивали при 20°C в течение 1 часа с получением желтой смеси. ЖХМС показала, что реакция завершилась. Реакционную смесь распределили между ДХМ (100 мл) и водой (80 мл). Водную фазу экстрагировали ДХМ (80 мл × 2). Объединенный экстракт промыли рассолом (80 мл × 2), высушили над безводным Na2SO4 и отфильтровали, затем выпарили при пониженном давлении с получением неочищенного продукта в виде желтого маслянистого вещества, которое очистили системой Combi flash с получением соединения Н2 (500 г) в виде желтого смолянистого вещества.
Процедура синтеза H4
К смеси соединения Н2 (200 мг, 0,822 ммоль) в ДМФ (5 мл) добавили HATU (391 мг, 1,03 ммоль), ТЭА (139 мг, 1,37 ммоль) и перемешивали при 20°С в течение 30 минут. Затем к смеси добавляли соединение H3 (352 мг, 0,685 ммоль) и перемешивали при 60°C в атмосфере N2 в течение 5 часов с получением желтой смеси. ЖХМС показала, что реакция завершилась. Смесь охладили до температуры и вливали в воду (50 мл). Желтое твердое вещество выпало в осадок из смеси. Смесь отфильтровали и осадок на фильтре промыли водой (50 мл) с получением неочищенного продукта в виде желтого порошка, который очистили с помощью системы Combi flash с получением соединения H4 (302 мг) в виде желтого смолянистого вещества.
Процедура синтеза H5
Соединение Н2 (300 мг) обрабатывали тем же способом, что и A7, с получением 290 мг соединения Н5 в виде желтого смолянистого вещества.
Процедура синтеза H6
Соединение Н5 (200 мг) обрабатывали тем же способом, что и A6, с получением 101 мг соединения Н6 в виде желтого маслянистого вещества.
Процедура синтеза соединения 22
Смесь соединения Н6 (100 мг, 0,133 ммоль) в HBr/HOAc (2 мл, 35%) перемешивали при 20°C в течение 1 часа с получением желтой смеси. ЖХМС показала, что реакция завершилась. К реакционной смеси добавили МТБЭ (10 мл) для осаждения не чисто-белого порошка. Белый порошок собрали фильтрованием и промыли МТБЭ (5 мл × 2), затем его очистили препаративной ВЭЖХ (0,1% ТФУК), затем подщелачили катионообменной смолой с элюированием 5% NH3.H2O/метанола, с получением соединения 22 (15 мг) в виде белого порошка.
Схема 33: Механизм синтеза для соединения 21
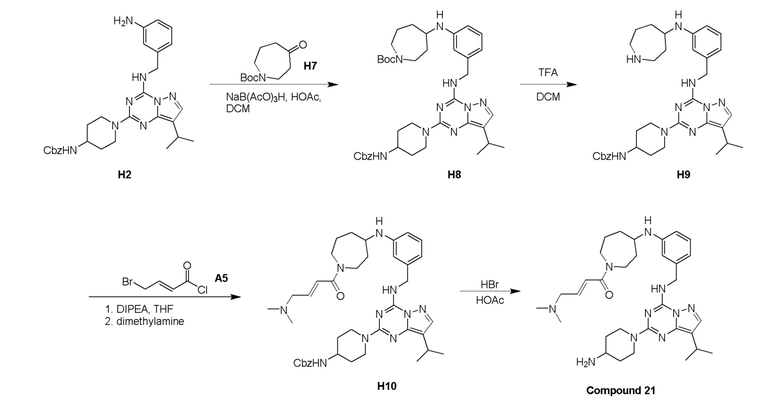
Процедура синтеза H8
К смеси соединения Н2 (207 мг, 0,972 ммоль), соединения Н7 (500 мг, 0,972 ммоль) в ДХМ (8 мл) добавили AcOH (58,3 мг, 0,972 ммоль). Смесь перемешивали при 20°C в течение 1 часа, затем к смеси добавили NaBH(OAc)3 (309 мг, 1,46 ммоль) и перемешивали при 20°C в течение 24 часов. ЖХМС показала желаемое значение МС. Смесь распределили между ДХМ (50 мл) и насыщенным раствором NaHCO3 (50 мл). Фазу ДХМ промыли NaHCO3 (50 мл × 2) и высушили над безводным Na2SO4, отфильтровали, выпарили при пониженном давлении с получением желтого маслянистого вещества, которое очистили системой Combi flash с получением соединения Н8 (200 г) в виде желтого маслянистого вещества.
Процедура синтеза H9
К смеси соединения Н8 (200 мг, 0,281 ммоль) в ДХМ (5 мл) добавили трифторуксусную кислоту (1 мл). Смесь перемешивали при 20°C в течение 2 часов с получением желтой смеси. ЖХМС показала, что реакция завершилась. Смесь объединили и выпарили при пониженном давлении с получением соединения Н9 (200 мг) в виде желтого маслянистого вещества.
Процедура синтеза H10
К раствору соединения Н9 (200 мг, 0,276 ммоль) в ТГФ (5 мл) добавили диизопропилэтиламин (178 мг, 1,38 ммоль), соединение А5 (152 мг, 0,827 ммоль). Желтую смесь перемешивали при 25°C в течение 1 часа, после чего она стала черной. ЖХМС показала, что реакция завершилась. К смеси добавили диметиламин (2 M, 689 мкл) и перемешивали при 25°C в течение 1 часа с получением коричневой смеси. ЖХМС показала желаемое значение МС. Смесь распределили между ДХМ (50 мл) и водой (30 мл). Водную фазу экстрагировали ДХМ (50 мл × 2). Объединенную экстрагированную фазу промыли рассолом (30 мл), высушили над безводным Na2SO4, отфильтровали, выпарили при пониженном давлении с получением коричневого маслянистого вещества, которое очистили системой Combi flash с получением соединения Н10 (180 г) в виде коричневого маслянистого вещества.
Процедура синтеза соединения 21
Смесь соединения Н10 (180 мг, 0,249 ммоль) в HBr/HOAc (2,00 мл, чистота: 35%) перемешивали при 20°C в течение 1 часа с получением желтой смеси. ТСХ показала, что реакция завершилась. К реакционной смеси добавили МТБЭ (10 мл) для осаждения не чисто-белого порошка. Белый порошок собрали фильтрацией и промыли МТБЭ (5 мл × 2). Неочищенный продукт очистили с помощью препаративной ВЭЖХ с получением соединения 21 (16,2 мг) в виде белого порошка.
Схема 34: Механизм синтеза для соединения 12
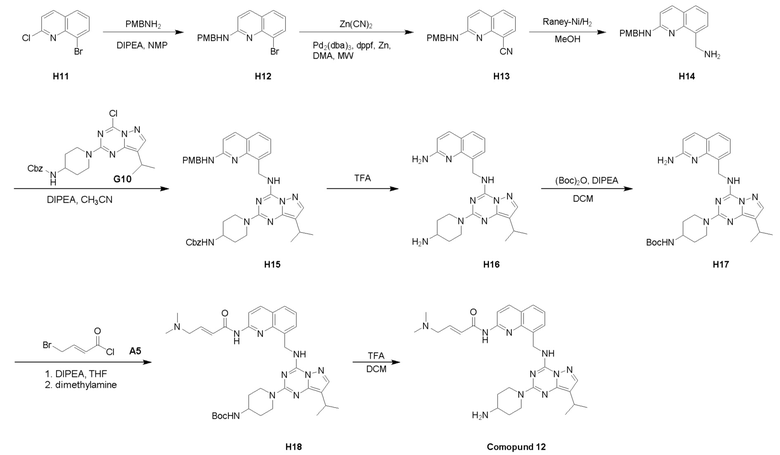
Процедура синтеза H12
К смеси соединения Н11 (500 мг, 2,06 ммоль) и диизопропилэтиламина (400 мг, 3,09 ммоль) в н-метил-2-пирролидоне (5 мл) добавили (4-метоксифенил)метанамин (475 мг, 3,46 ммоль). Реакционную смесь перемешивали при температуре 135°С в течение 24 часов в атмосфере N2. Смесь охладили до комнатной температуры, к реакционной смеси добавили воду (50 мл) и экстрагировали МТБЭ (30 мл х 3), объединенную органическую фазу промыли водой (20 мл) и рассолом (20 мл), высушили над безводным Na2SO4 и выпарили при пониженном давлении с получением остатка. Остаток очистили с помощью колоночной хроматографии с силикагелем с получением соединения Н12 (910 г) в виде красного твердого вещества.
Процедура синтеза H13
К раствору соединения H12 (500 мг, 1,46 ммоль) в ДМА (5 мл) добавили Zn(CN)2 (103 мг, 0,876 ммоль), Pd2(dba)3 (134 мг, 0,146 ммоль), DPPF (1,1'-бис(дифенилфосфино) ферроцен) (162 мг, 0,292 ммоль) и Zn (15,28 мг, 0,234 ммоль). Реакционную смесь перемешивали при температуре 150°С в микроволновой печи в течение 0,5 часа в атмосфере N2. ЖХМС показала, что реакция завершилась. Смесь распределили между водой (30 мл) и этилацетатом (30 мл). Водную фазу экстрагировали этилацетатом (20 мл). Объединенные экстракты промыли рассолом (50 мл), высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением соединения, которое очистили системой Combi flash с получением соединения Н13 (300 г) в виде красного смолянистого вещества.
Процедура синтеза H14
К смеси никеля Ренея (100 мг) в MeOH (30 мл) добавили соединение Н13 (500 мг, 1,73 ммоль) и NH3.H2O (2,5 мл, 25%). Суспензию дегазировали под вакуумом и несколько раз продули H2, смесь перемешивали при 25°C в атмосфере H2 (15 фунтов на кв. дюйм) в течение 3 часов с получением черной смеси. ТСХ показала, что реакция завершилась. Смесь отфильтровали, фильтрат выпарили при пониженном давлении с получением соединения Н14 (400 мг) в виде желтого смолянистого вещества.
Процедура синтеза H15
К раствору соединения Н14 (90,0 мг, 0,307 ммоль), диизопропилэтиламина (165 мг, 1,28 ммоль) в ацетонитриле (1 мл) добавили соединение G10 (110 мг, 256 ммоль). Реакционный раствор перемешивали при 25°C в течение 1 часа с получением желтой смеси. ЖХМС показала, что реакция завершилась. Смесь распределили между ДХМ (30 мл) и водой (20 мл). Водную фазу экстрагировали ДХМ (30 мл × 2). Объединенный экстракт промыли рассолом (30 мл × 2), высушили над безводным Na2SO4 и отфильтровали, затем выпарили при пониженном давлении с получением неочищенного продукта в виде желтого маслянистого вещества. Неочищенный продукт очистили с помощью системы Combi flash с получением соединения Н15 (100 мг) в виде желтого смолянистого вещества.
Процедура синтеза H16
Смесь соединения H15 (100 мг, 0,146 ммоль) в ТФУК (1 мл) перемешивали при 25°C в течение 3 часов, ЖХМС показала, что все еще оставалось большое количество исходного материала; смесь нагревали до 60°C в течение 12 часов. ЖХМС показала желаемое значение МС, затем смесь нагревали до 80°C в течение 14 часов с получением желтой смеси. ЖХМС показала, что реакция завершилась. Смесь распределили между ДХМ (50 мл) и насыщенным раствором NaHCO3 (30 мл). Водную фазу экстрагировали ДХМ (50 мл × 2). Объединенный экстракт промыли рассолом (30 мл × 2), высушили над безводным Na2SO4 и отфильтровали, затем выпарили при пониженном давлении с получением соединения Н16 (100 мг) в виде желтого смолянистого вещества.
Процедура синтеза H17
К раствору соединения Н16 (100 мг, неочищенного) и ди-трет-бутилдикарбоната (55,6 мг, 0,255 ммоль) в ДХМ (1 мл) добавили диизопропилэтиламин (32,9 г, 0,255 ммоль). Полученную смесь перемешивали при 25°C в течение 2 часов с получением бесцветного раствора. ЖХМС показала, что реакция завершилась. Смесь выпарили при пониженном давлении с получением соединения Н17 (102 мг) в виде желтого смолянистого вещества.
Процедура синтеза H18
К смеси соединения H17 (102 мг) в ТГФ (2 мл) добавили диизопропилэтиламин (248 мг, 1,92 ммоль) и соединение A5 (106 мг, 0,576 ммоль), смесь перемешивали при 25°C в течение 1 часа. ЖХМС показала, что реакция завершилась. К смеси добавили диметиламин (2 M, 383 мкл). Смесь перемешивали при 25°C в течение 30 часов с получением коричневой смеси. ЖХМС показала, что реакция завершилась. Смесь распределили между ДХМ (50 мл) и водой (30 мл). Водный раствор экстрагировали ДХМ (50 мл × 2), объединенную экстрагированную фазу промыли рассолом (30 мл), высушили над безводным Na2SO4, отфильтровали, выпарили при пониженном давлении с получением коричневого маслянистого вещества, которое очистили системой Combi flash с получением соединения Н18 (80 мг) в виде желтого маслянистого вещества.
Процедура синтеза соединения 12
К смеси соединения Н18 (80 мг, 0,083 ммоль) в ДХМ (2 мл) добавили ТФУК (770 мл, 0,5 мл), смесь перемешивали при 25°C в течение 1 часа с получением желтой смеси. ЖХМС показала, что реакция завершилась. Смесь выпарили при пониженном давлении с получением желтого маслянистого вещества, которое очистили препаративной ВЭЖХ с получением соединения 12 (6,4 мг) в виде белого порошка.
Схема 35: Механизм синтеза для соединения 14
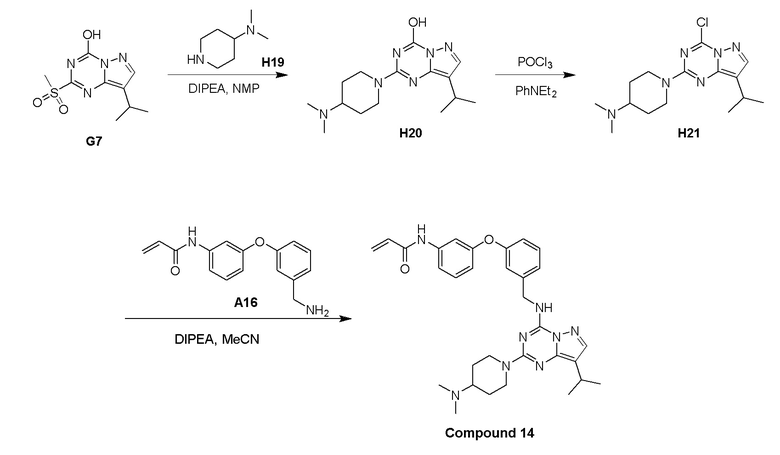
Процедура синтеза H20
К раствору соединения G7 (650 мг, 2,54 ммоль) и диизопропилэтиламина (1,64 г, 12,7 ммоль) в ацетонитриле (12 мл) добавили соединение Н19 (488 мг, 3,80 ммоль). Реакционную смесь перемешивали при 140°C в течение 28 часов в атмосфере N2 с получением коричневого раствора. ЖХМС показала, что реакция завершилась. Реакцию проводили одновременно в двух сосудах. Реакционную смесь объединили и выпарили при пониженном давлении с получением неочищенного продукта в виде коричневого смолянистого вещества, которое промыли метанолом (15 мл) с получением соединения H20 (1,09 мг) в виде желтого порошка.
Процедура синтеза H21
К смеси соединения Н20 (400 мг, 1,31 ммоль) в POCl3 (5 мл) добавили N, N-диэтиланилин (588 мг, 3,94 ммоль). Смесь перемешивали при 90°C в течение 1 часа с получением желтой смеси. Смесь выпарили при пониженном давлении с получением соединения Н21 (420 мг) в виде коричневого маслянистого вещества.
Процедура синтеза соединения 14
К смеси соединения Н21 (300 мг, 0,929 ммоль), диизопропилэтиламина (2,40 г, 18,6 ммоль) в CH3CN (5 мл) добавили соединение А16 (533 мг, 1,39 ммоль). Реакционный раствор перемешивали при 25°C в течение 1 часа с получением желтой смеси. ЖХМС показала, что реакция завершилась. Смесь влили разделили между ДХМ (80 мл) и водой (50 мл), водную фазу экстрагировали ДХМ (80 мл × 2), объединенную экстрагированную фазу промыли рассолом (80 мл × 2), высушили над безводным Na2SO4, отфильтровали, выпарили при пониженном давлении с получением желтого маслянистого вещества. Неочищенный продукт очистили с помощью системы Combi flash, затем с помощью препаративной ТСХ. Продукт лиофилизировали с получением соединения 14 (45,5 мг) в виде желтого порошка.
Схема 36: Механизм синтеза для соединения 41
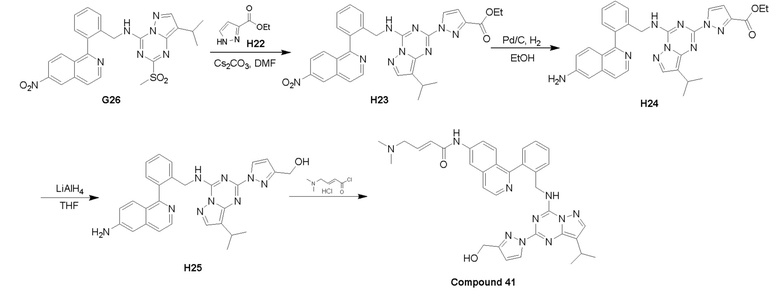
Процедура синтеза H23
К раствору соединения G26 (500 мг, 966,07 мкмоль) и соединения Н22 (271 мг, 1,93 ммоль) в ДМФ (10 мл) добавили Cs2CO3 (630 мг, 1,93 ммоль). Полученную смесь нагрели при 30-40°C и перемешивали в течение 16 часов с получением желтого раствора. ЖХМС показала, что реакция завершилась. Смесь отфильтровали и распределили между этилацетатом (50 мл). Водный слой экстрагировали этилацетатом (50 мл × 3). Органический слой промыли насыщенным рассолом (50 мл), высушили над безводным Na2SO4, отфильтровали и выпарили при пониженном давлении с получением неочищенного продукта в виде желтого маслянистого вещества. Неочищенный продукт очистили с помощью системы Combi flash с получением соединения Н23 (490 мг) в виде желтого маслянистого вещества.
Процедура синтеза H24
Соединение Н23 (490 мг) обрабатывали тем же способом, что и В7, с получением 440 мг соединения Н24 в виде желтого порошка.
Процедура синтеза H25
Соединение Н24 (390 мг) обрабатывали тем же способом, что и Е3, с получением 310 мг соединения Н25 в виде желтого порошка.
Процедура синтеза соединения 41
Соединение Н25 (150 мг) обрабатывали тем же способом, что и соединение 44, с получением 23 мг соединения 41 в виде желтого порошка.
Схема 37: Механизм синтеза для соединения 41
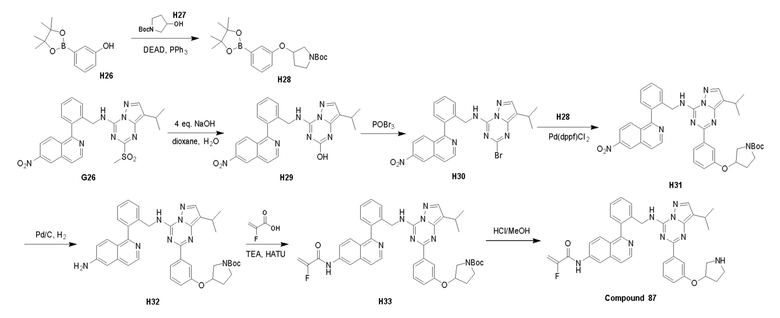
Процедура синтеза H28
К раствору соединения Н26 (500 мг, 2,27 ммоль), соединения Н27 (638 мг, 3,41 ммоль) и PPh3 (893 мг, 3,41 ммоль) в ТГФ (10 мл) добавили диизопропилазодикарбоксилат (689 мг, 3,41 ммоль, 662 мк) при 0°С. Полученную смесь перемешивали при 15°C в течение 24 часов с получением желтого раствора. ТСХ показала, что большая часть исходного материала была израсходована. Реакционную смесь погасили добавлением H2O (30 мл) и экстрагировали этилацетатом (30 мл × 2). Объединенные органические слои промыли рассолом (10 мл × 2), высушили над Na2SO4, отфильтровали и выпарили при пониженном давлении с получением остатка. Остаток очистили с помощью колоночной хроматографии с получением соединения Н28 (570 мг) в виде желтого маслянистого вещества.
Процедура синтеза H29
К смеси соединения G26 (1 г, 1,93 ммоль) в диоксане (10 мл) и H2O (10 мл) добавили NaOH (309 мг, 7,73 ммоль) и смесь перемешивали при 50°C в течение 12 часа с получением желтой смеси. ЖХМС показала, что наблюдается желаемый продукт. Смесь выпарили при пониженном давлении и доводили до pH = 3~4, смесь отфильтровали и собрали белое твердое вещество с получением соединения H29 (620 мг) в виде желтого твердого вещества.
Процедура синтеза H30
К смеси соединения Н29 (500 мг, 1,10 ммоль) в толуоле (10 мл) добавили POBr3 (944 мг, 3,29 ммоль, 334 мкл) и N, N-диэтиланилин (16,3 мг, 109 мкмоль, 17,56 мкл) при 15°С, смесь перемешивали при 100°C в течение 3 часов с получением желтой смеси. ЖХМС показала, что наблюдается желаемый продукт. Смесь выпарили при пониженном давлении с получением неочищенного продукта. Неочищенный продукт измельчили в порошок с (ПЭ/ЭА = 3/1) при 15°C в течение 30 минут с получением соединения H30 (330 мг) в виде черно-коричневого твердого вещества.
Процедура синтеза H31
К смеси соединения Н30 (330 мг, 636 мкмоль) и соединения Н28 (247 мг, 636 мкмоль) в диоксане (5 мл) и H2O (2 мл) добавили Na2CO3 (134 мг, 1,27 ммоль, 2 экв.) и Pd(dppf)Cl2 (46,58 мг, 63,66 мкмоль) и смесь перемешивали при 80°C в течение 16 часа в атмосфере N2 с получением черной смеси. ЖХМС показала, что наблюдается желаемый продукт. Смесь распределили между этилацетатом (15 мл) и водой (10 мл). Водную фазу экстрагировали этилацетатом (10 мл × 2). Объединенный органический экстракт промыли рассолом (10 мл), высушили над Na2SO4, отфильтровали, выпарили при пониженном давлении с получением неочищенного продукта. Неочищенный продукт очистили с помощью системы Combi flash (ПЭ/ЭА=1/1) с получением соединения Н31 (50 мг) в виде красного твердого вещества.
Процедура синтеза H32
Соединение Н31 (50 мг) обрабатывали тем же способом, что и соединение В7, с получением 43 мг соединения Н32 в виде желтого порошка.
Процедура синтеза H33
Соединение Н32 (11,5 мг) обрабатывали тем же способом, что и соединение G31, с получением 10 мг соединения Н33 в виде желтого порошка.
Процедура синтеза соединения 87
Соединение Н32 (10 мг) обрабатывали тем же способом, что и соединение А7, с получением 3 мг соединения 87 в виде желтого порошка.
Список литературы
D.B. Bregman, R.G. Pestell and V.J. Kidd. Cell cycle regulation and RNA polymerase II. Front Biosci. 2000 Feb; 1(5): D244-57.
D. Desai, H.C. Wessling, R.P. Fisher, and D.O. Morgan. Effects of phosphorylation by CAK on cyclin binding by CDC2 and CDK2. Mol. Cell Biol. 1995 Jan; 15(1): 345-350.
S. Akhtar, M. Heidemann, J.R. Tietjen, D.W. Zhang, R.D. Chapman, D. Eick, and A.Z. Ansari. TFIIH Kinase Places Bivalent Marks on the Carboxy-Terminal Domain of RNA Polymerase II. Mol. Cell. 2009 May; 15; 34(3):387-93.
S. Larochelle, R. Amat, K.G. Cutter, M. Sansó, C. Zhang, J.J. Allen, K.M. Shokat, D.L. Bentley and R.P. Fisher. Cyclin-dependent kinase control of the initiation-to-elongation switch of RNA polymerase II. Nat. Struct. Mol. Biol. 2012 Nov; 19(11):1108-15.
G.I. Shapiro. Cyclin-Dependent Kinase Pathways as Targets for Cancer Treatment. J. Clin. Oncol. 2006 Apr; 10; 24(11):1770-83.
G. Lolli and L.N. Johnson. CAK-Cyclin-dependent Activating Kinase: a key kinase in cell cycle control and a target for drugs? Cell Cycle. 2005 Apr; 4(4):572-7.
T.I. Lee and R.A. Young. Transcriptional Regulation and its misregulation in Disease. Cell. 2013 Mar; 14; 152(6):1237-51.
S. Nekhai, M. Zhou, A. Fernandez, W.S. Lane, Ned J.C. Lamb, J. Brady, A. Kumar. Biochem. J. 2002 Jun; 15; 364(Pt 3):649-57.
Y.K. Kim, C.F. Bourgeois, R. Pearson, M. Tyagi, M.J. West, J. Wong, S.Y. Wu, C.M. Chiang, and J. Karn. Recruitment of TFIIH to the HIV LTR is a rate-limiting step in the emergence of HIV from latency. EMBO. J. 2006 Aug; 9; 25(15): 3596-3604.
A. J. Kapasi and D. H. Spector. Inhibition of the Cyclin-Dependent Kinases at the Beginning of Human Cytomegalovirus Infection Specifically Alters the Levels and Localization of the RNA Polymerase II Carboxyl-Terminal Domain Kinases cdk9 and cdk7 at the Viral Transcriptosome. J. Virol. 2008 Jan; 82(1): 394-407.
Eickhoff et al. Pyrazolo-triazine derivatives as selective cyclin-dependent kinase inhibitors. PCT WO2013/128028A1.
Таблица 1. Ферментативная активность CDK (1, 2, 5 и 7) и селективность CDK7
/CDK7*
* CDK1/CDK7: Селективность ингибирования CDK7 по сравнению с ингибированием CDK1 [раз]
** CDK2/CDK7: Селективность ингибирования CDK7 по сравнению с ингибированием CDK2 [раз]
*** CDK5/CDK7: Селективность ингибирования CDK7 по сравнению с ингибированием CDK5 [раз]
Диапазон активности: A обозн. [раз] > 500 , B обозн. 50 < [раз] ≤ 500, C обозн.[раз] ≤ 50
Таблица 1 (продолжение)
* CDK1/CDK7: Селективность ингибирования CDK7 по сравнению с ингибированием CDK1 [раз]
** CDK2/CDK7: Селективность ингибирования CDK7 по сравнению с ингибированием CDK2 [раз]
*** CDK5/CDK7: Селективность ингибирования CDK7 по сравнению с ингибированием CDK5 [раз]
Диапазон активности: A обозн. [раз] > 500 , B обозн. 50 < [раз] ≤ 500, C обозн.[раз] ≤ 50
Таблица 1 (продолжение)
* CDK1/CDK7: Селективность ингибирования CDK7 по сравнению с ингибированием CDK1 [раз]
** CDK2/CDK7: Селективность ингибирования CDK7 по сравнению с ингибированием CDK2 [раз]
*** CDK5/CDK7: Селективность ингибирования CDK7 по сравнению с ингибированием CDK5 [раз]
Диапазон активности: A обозн. [раз] > 500 , B обозн. 50 < [раз] ≤ 500, C обозн.[раз] ≤ 50
Таблица 2. Анализ клеточной жизнеспособности H460
A обозначает IC50 ≤ 1 мкМ, B обозначает 1 < IC50 ≤ 10 мкМ, C обозначает IC50 ⋅ 10 мкМ
Таблица 4. Анализ жизнеспособности A2780
A обозначает IC50 ≤ 1 мкМ, B обозначает 1 < IC50 ≤ 10 мкМ, C обозначает IC50 ⋅ 10 мкМ
A обозначает IC50 ≤ 1 мкМ, B обозначает 1 < IC50 ≤ 10 мкМ, C обозначает IC50 ⋅ 10 мкМ
Таблица 6. Обобщенные сведения о соединениях 1-88 в отношении их структур и соответствующих характеристик
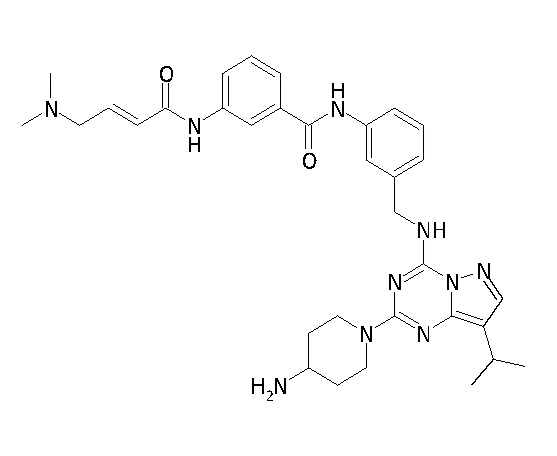
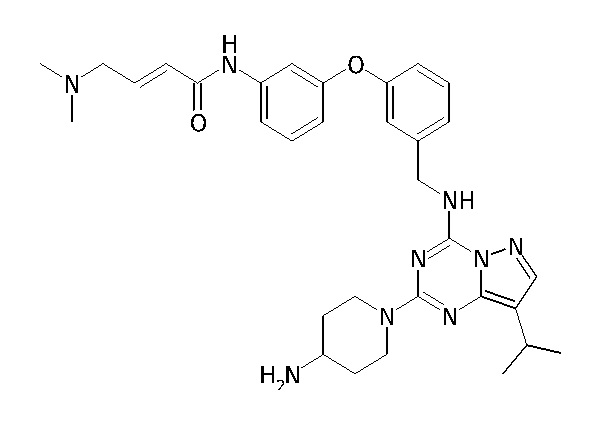
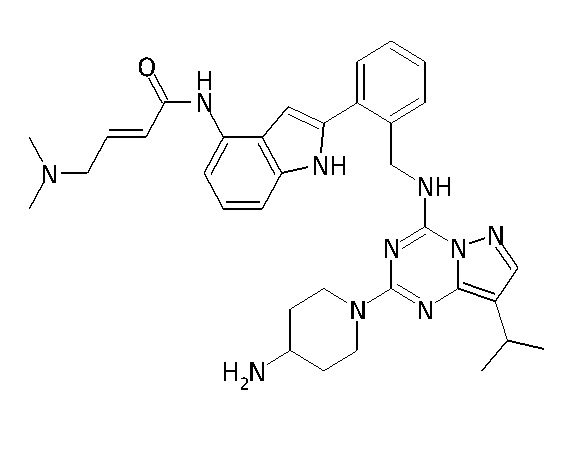
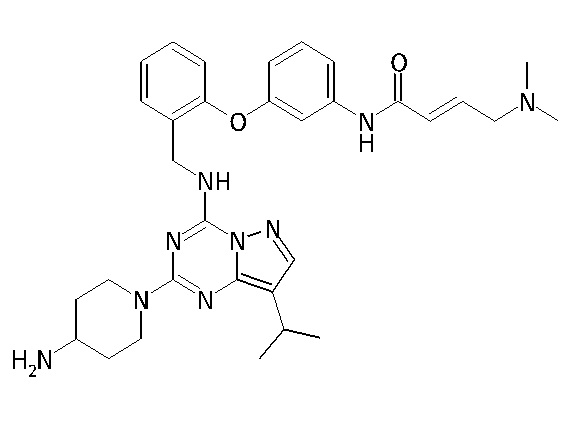
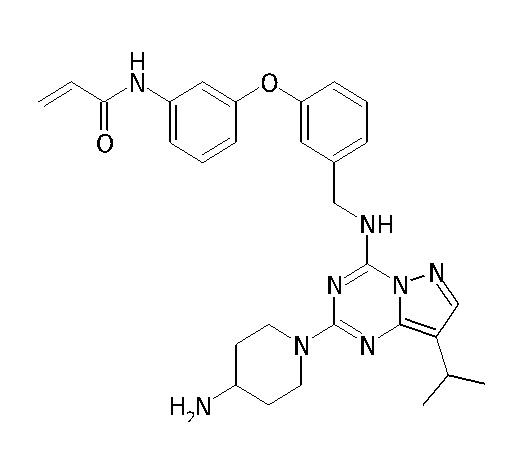
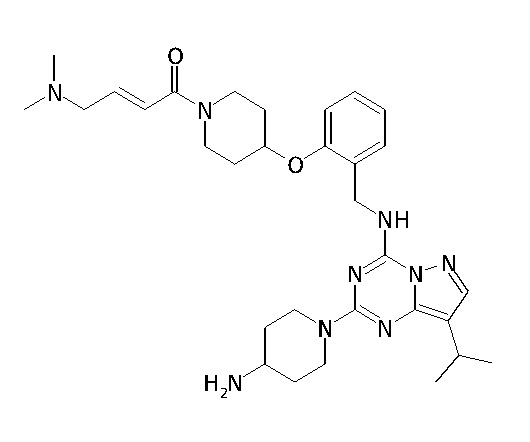
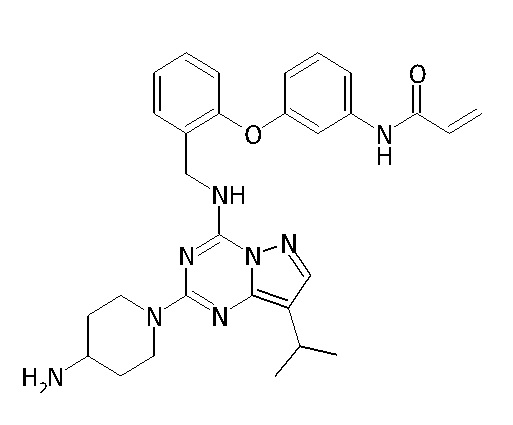
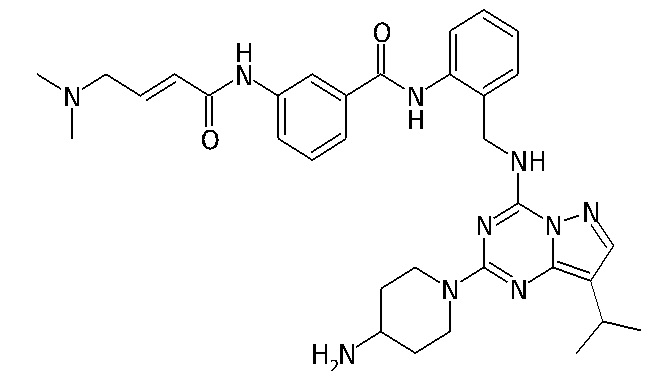
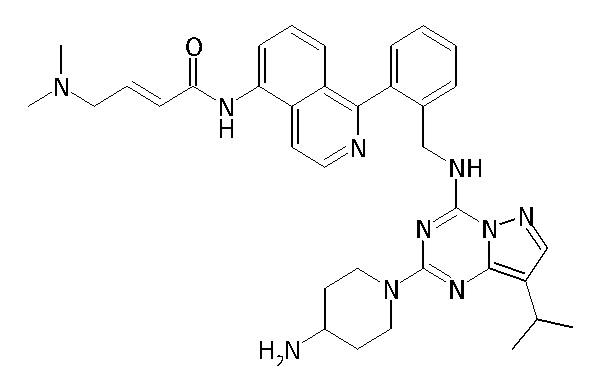
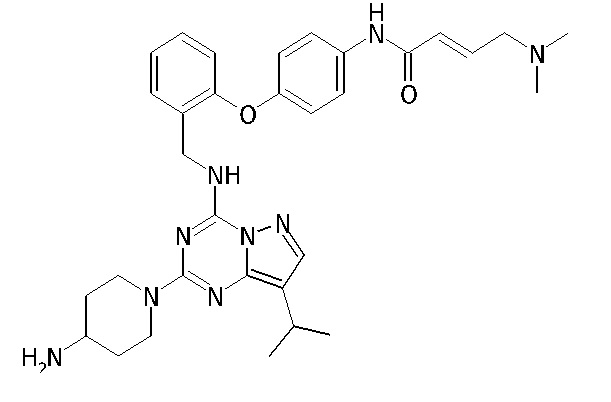
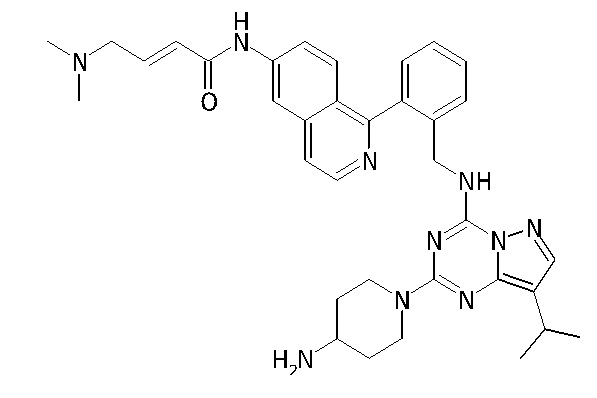
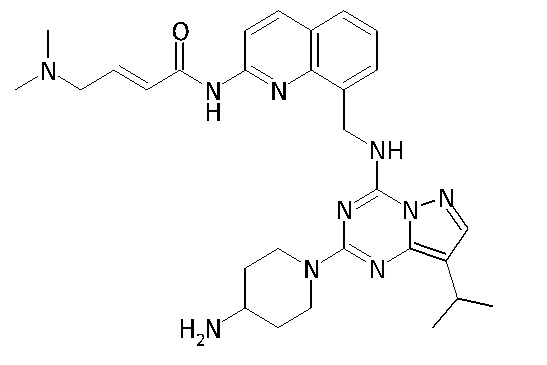
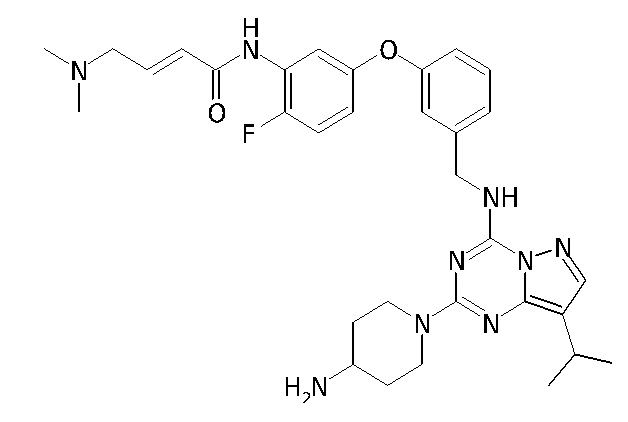
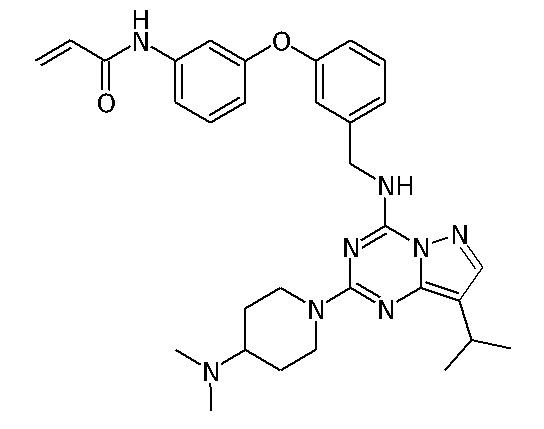
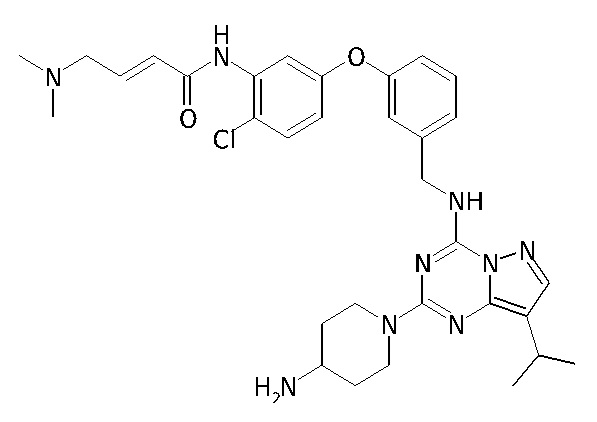
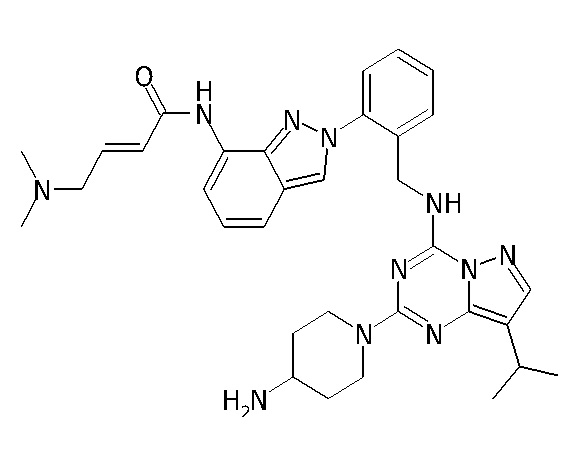
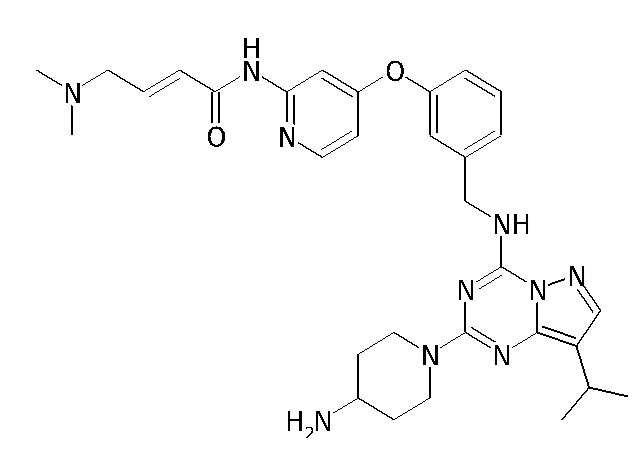
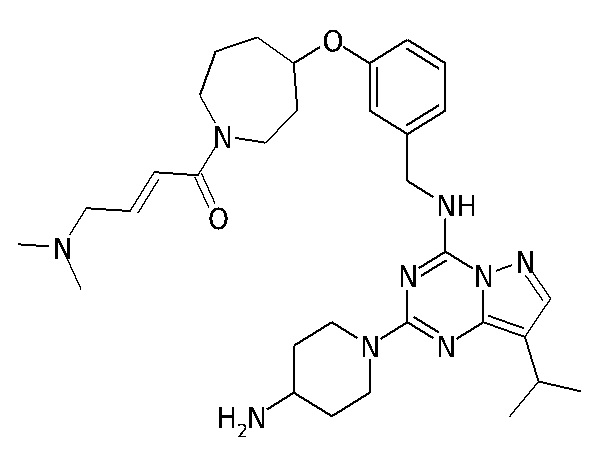
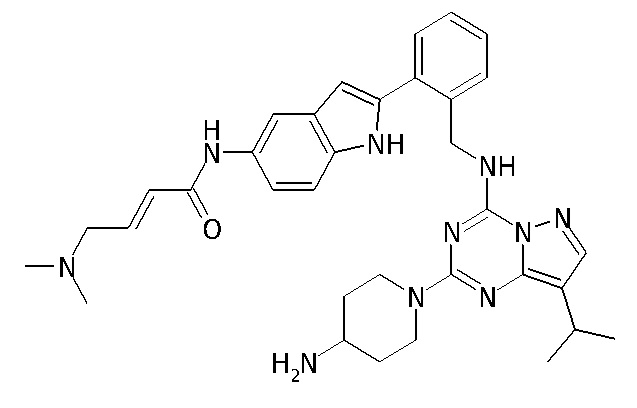
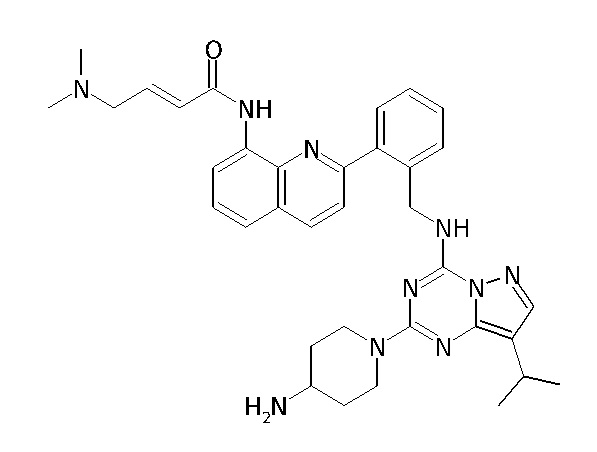
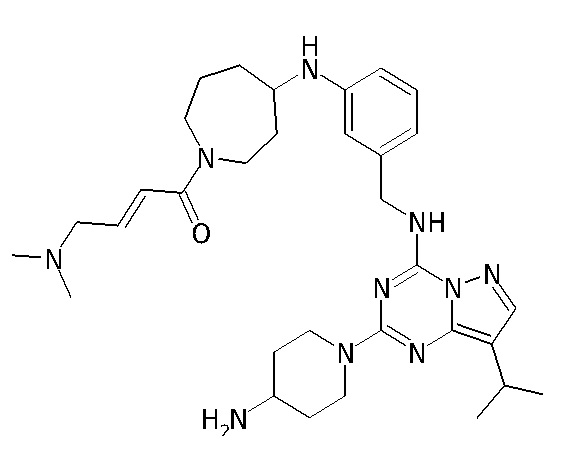
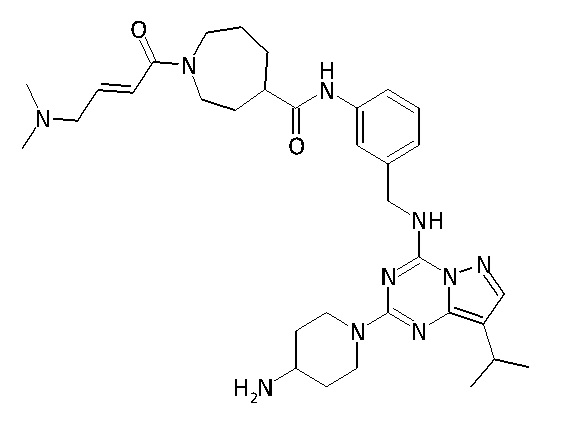
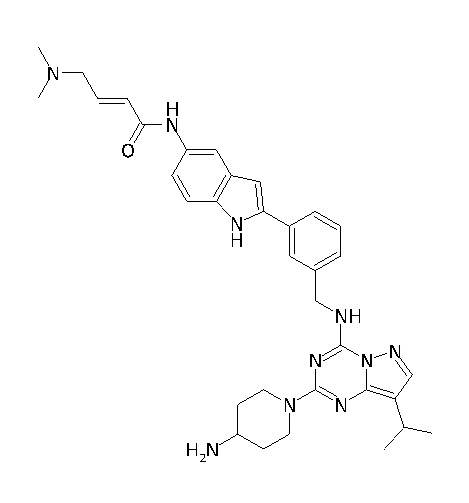
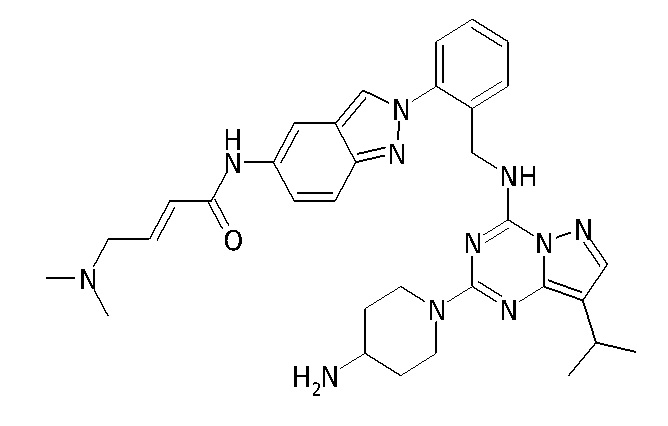
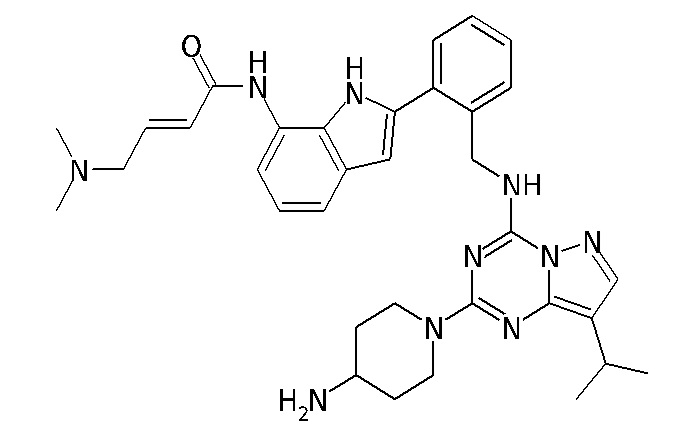
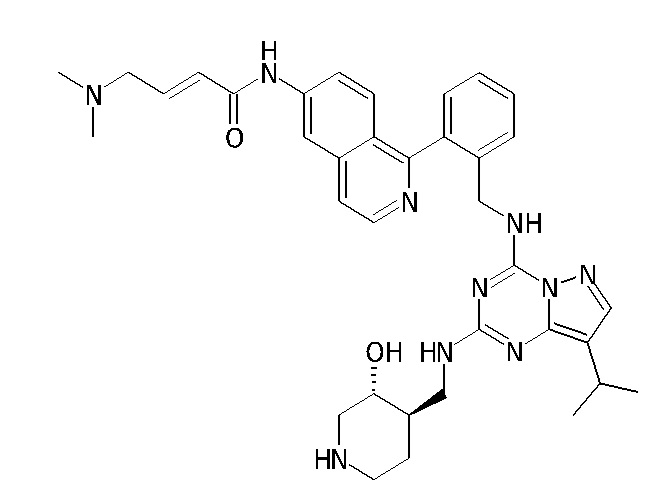
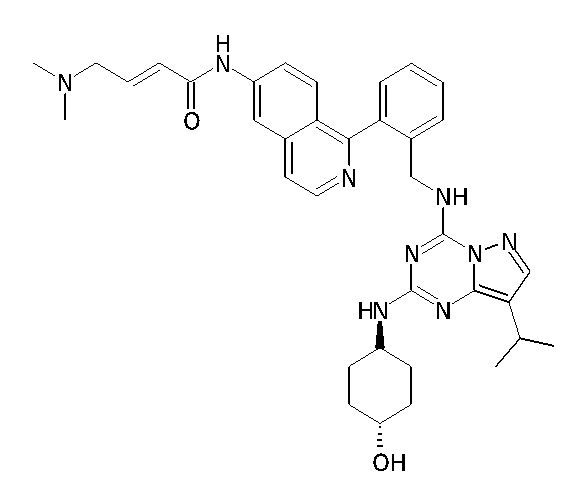
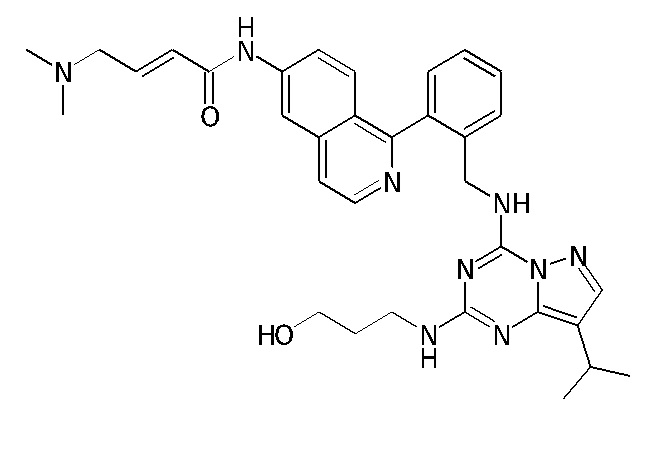
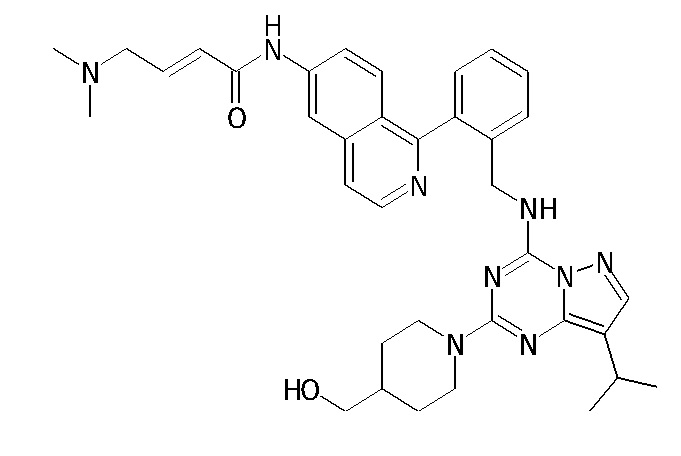
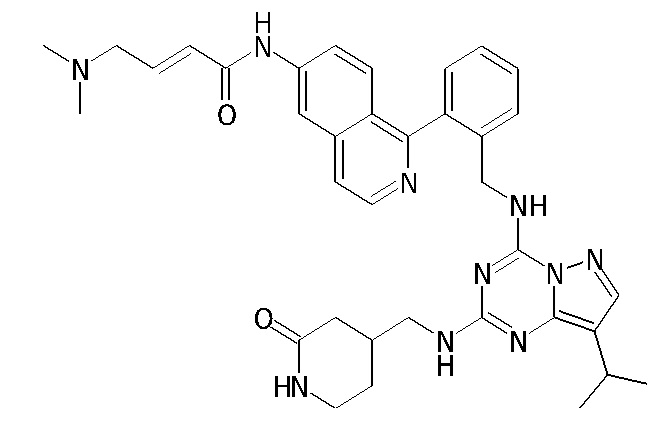
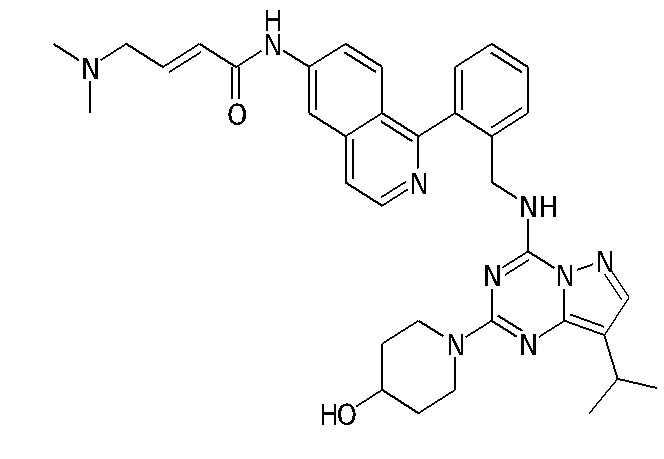
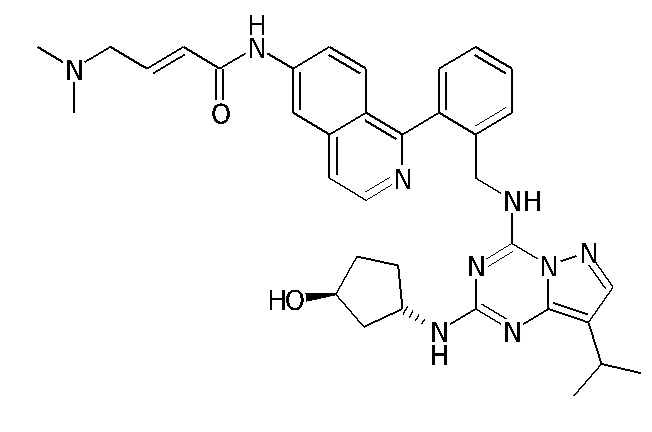
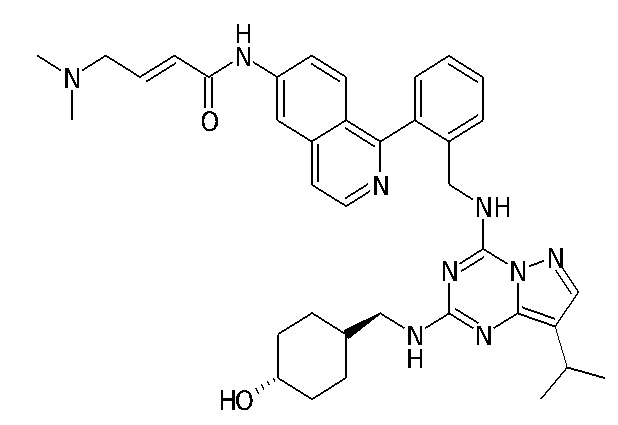

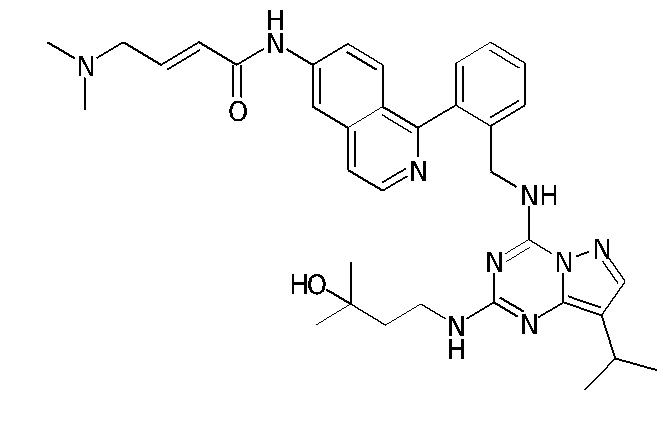
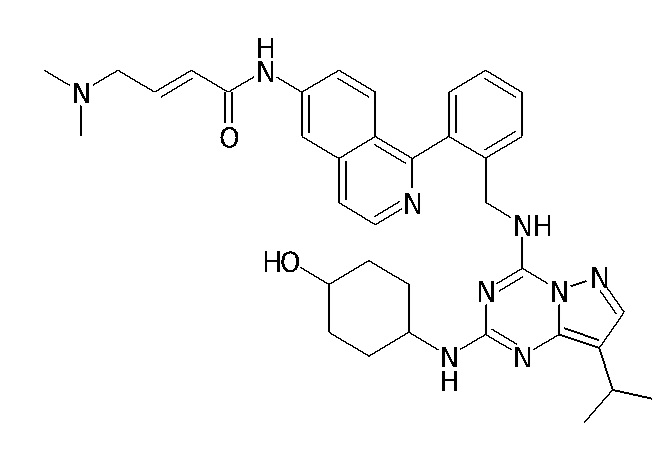


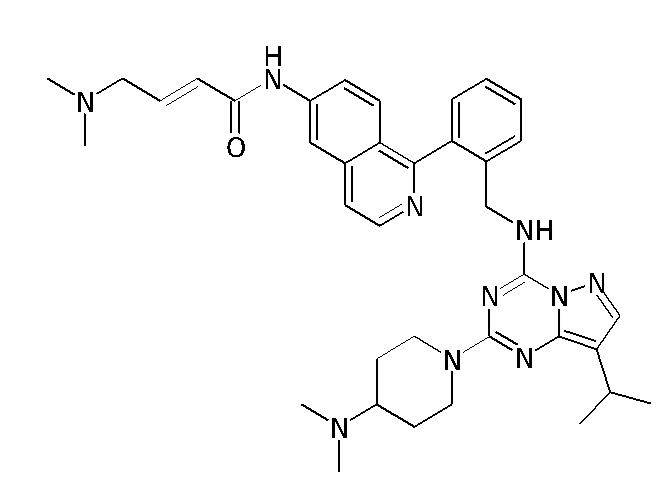
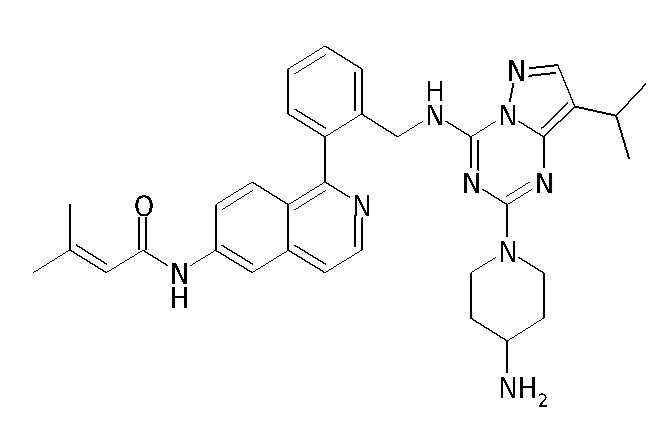
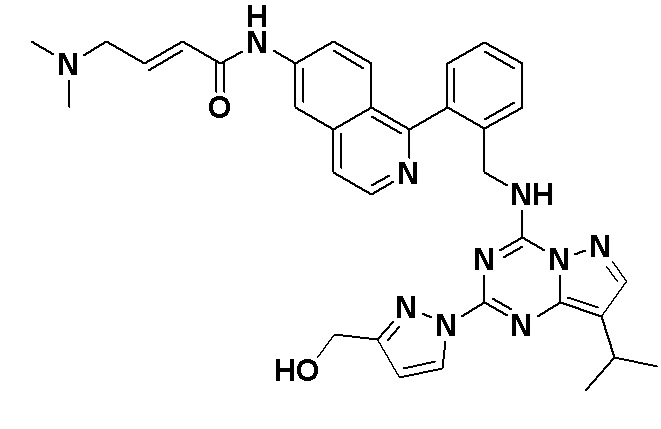
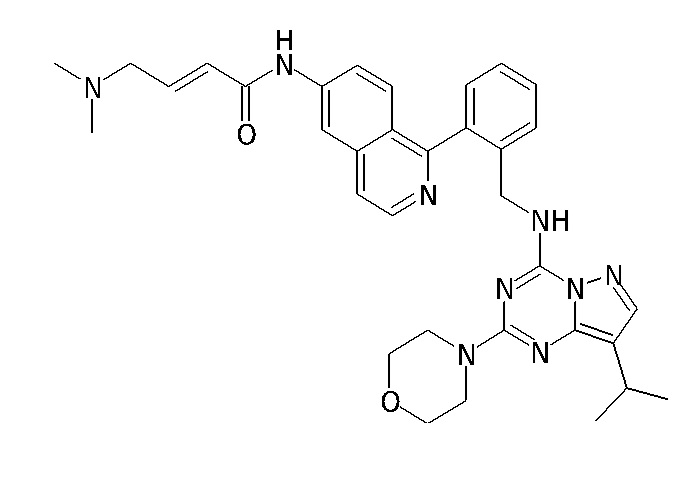
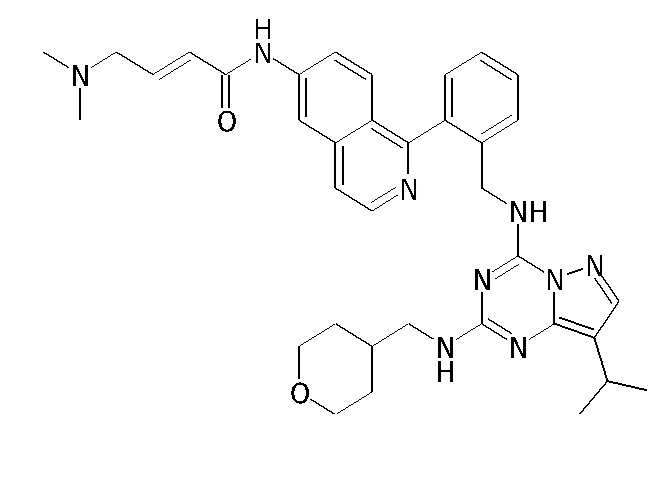
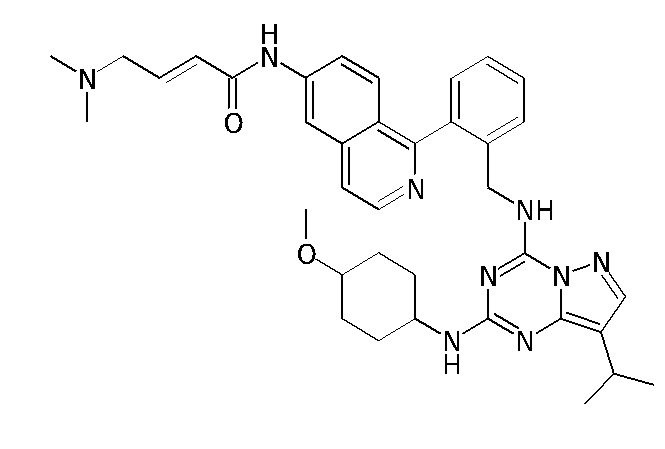
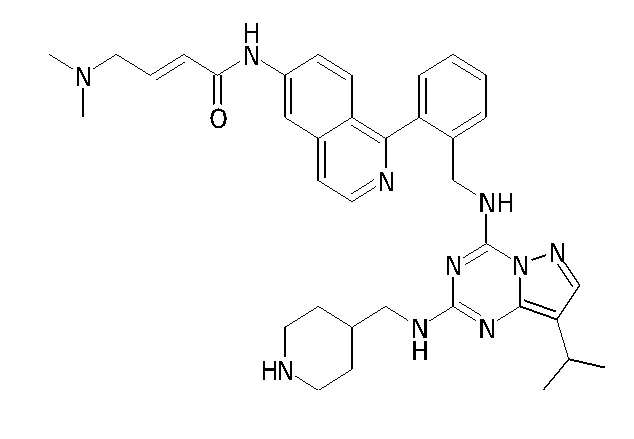
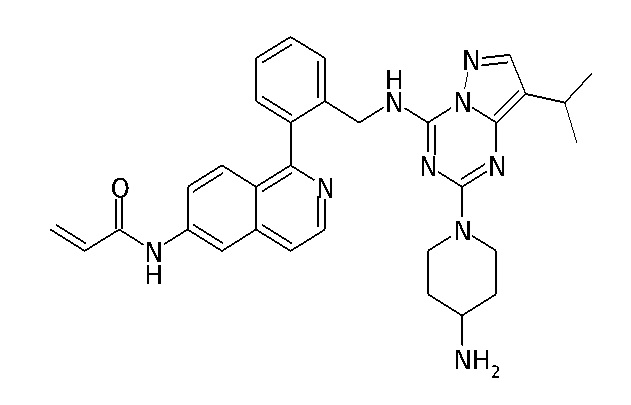
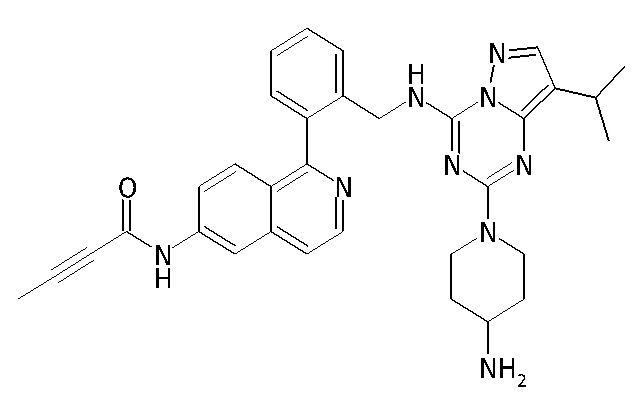
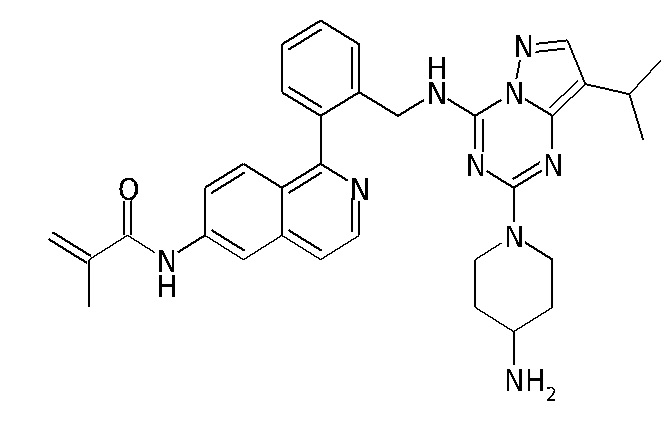

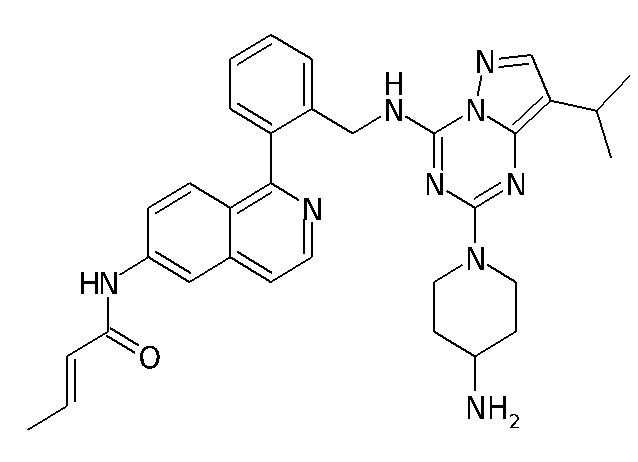
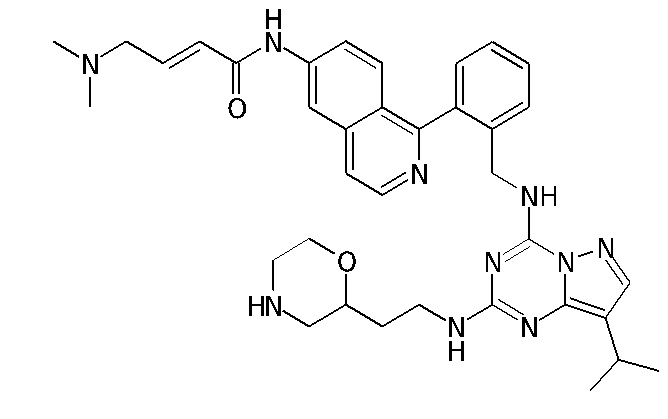
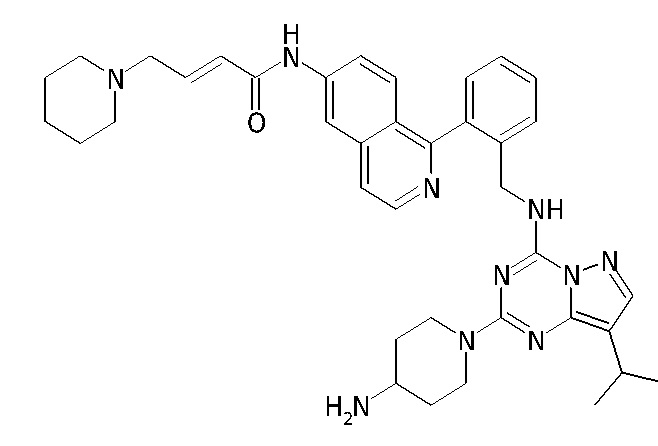
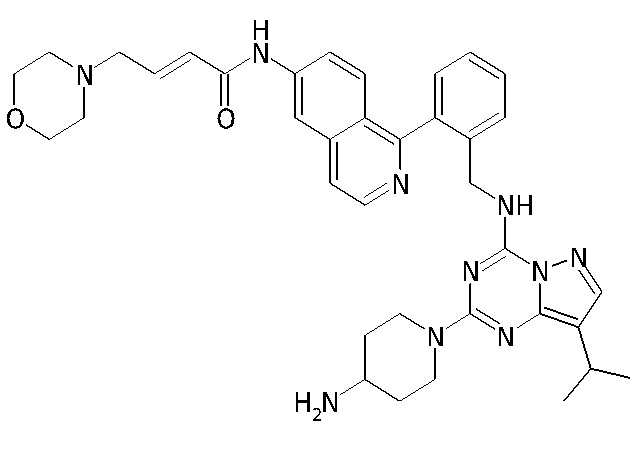
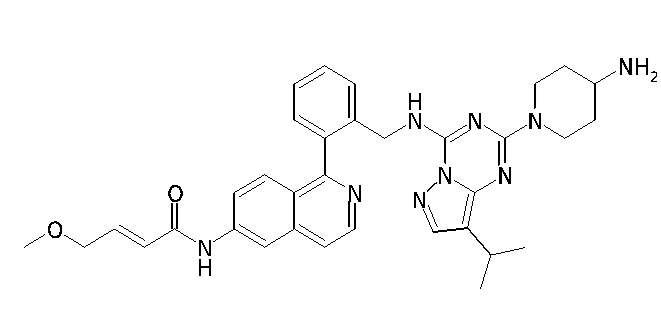
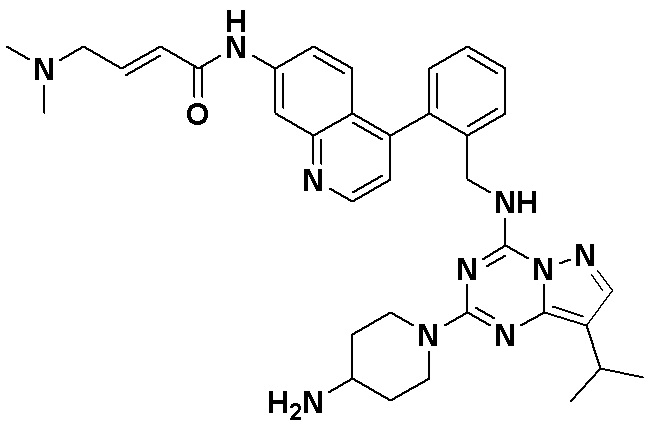
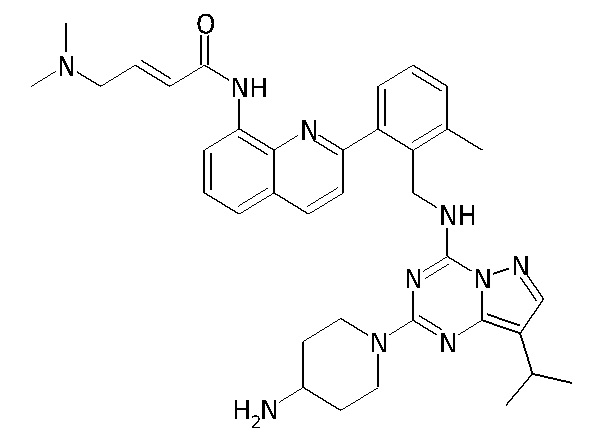
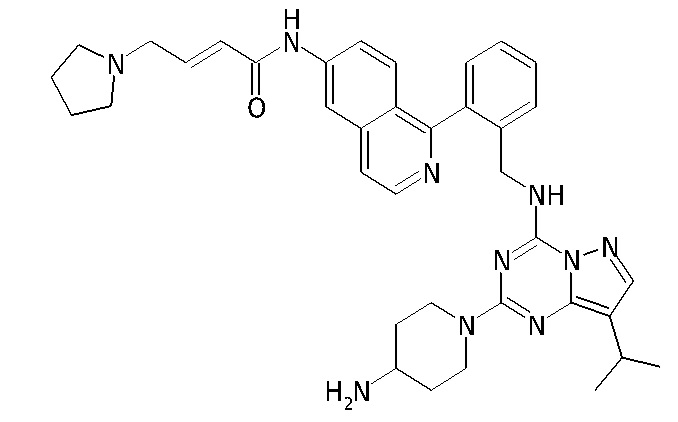
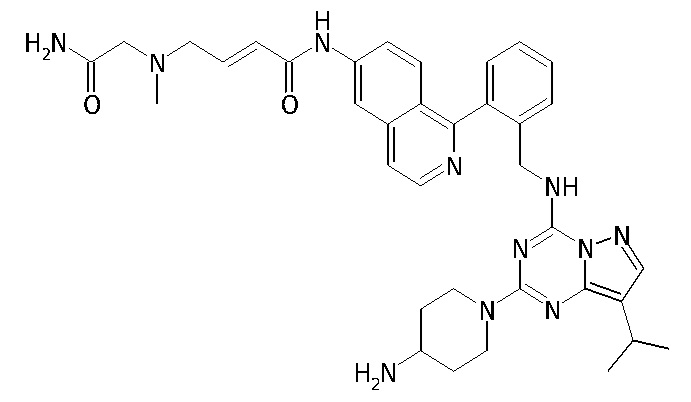
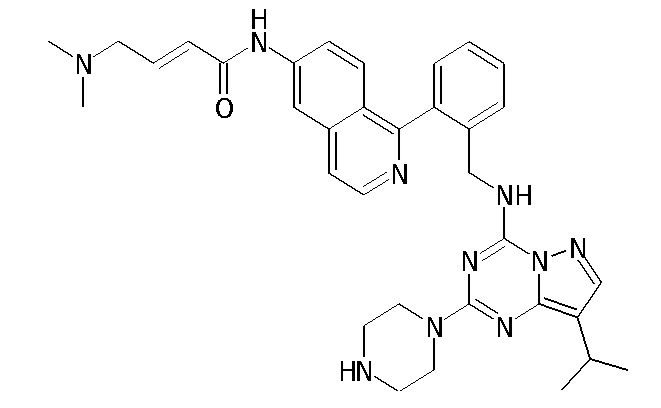
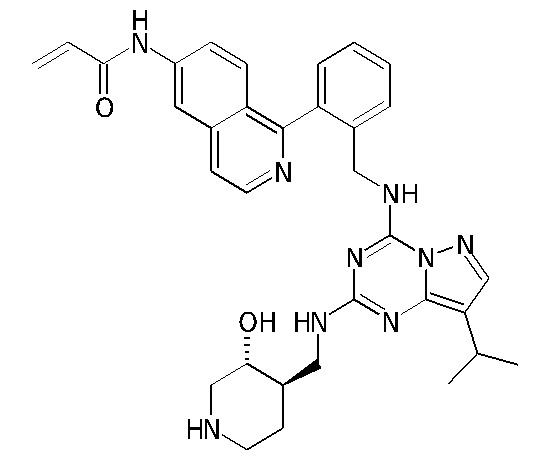
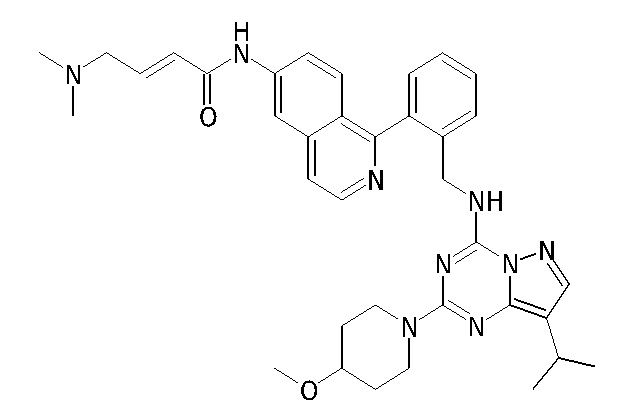
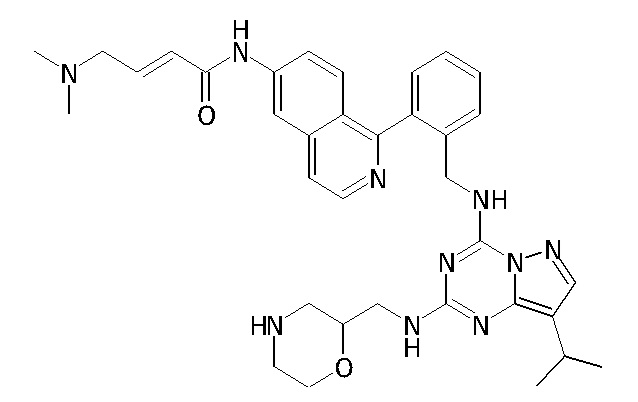
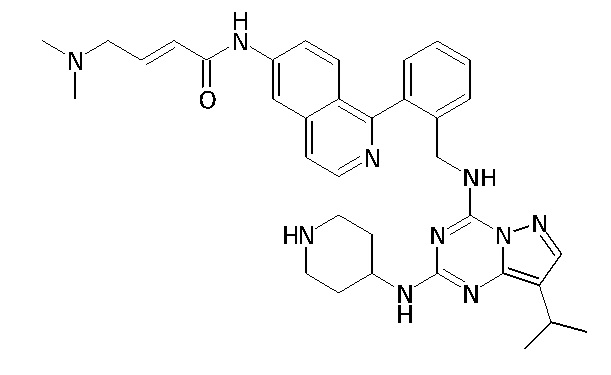
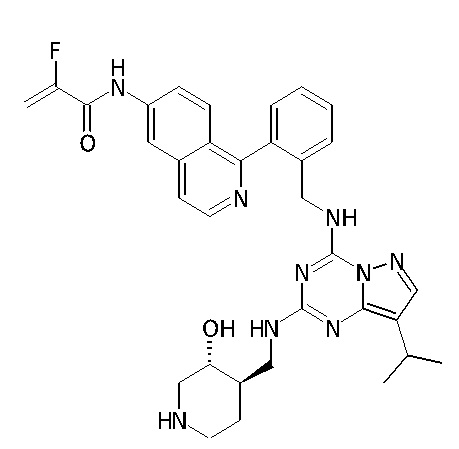
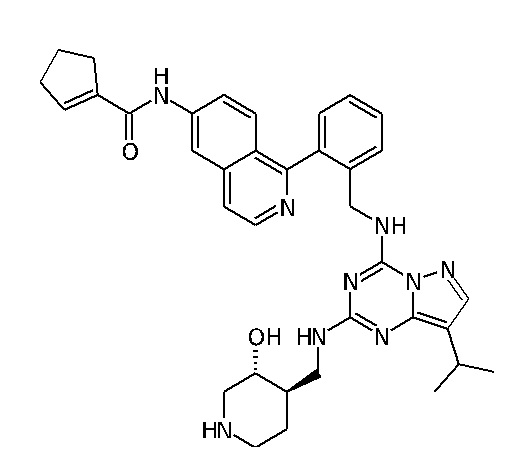
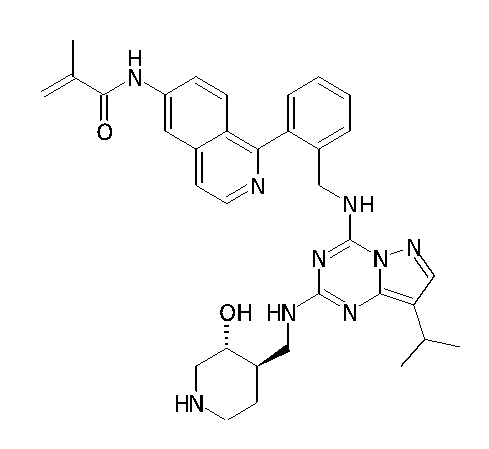
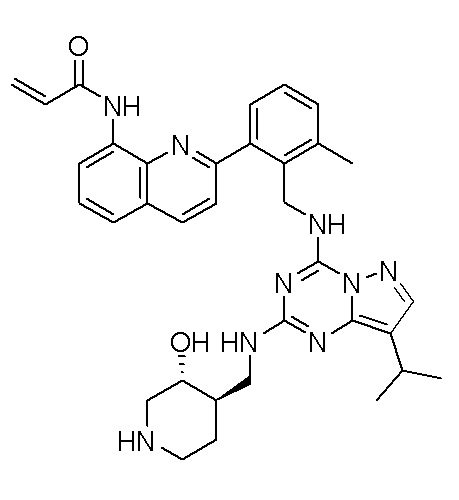
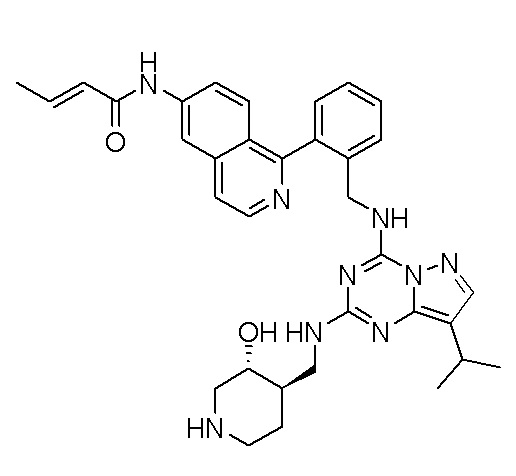

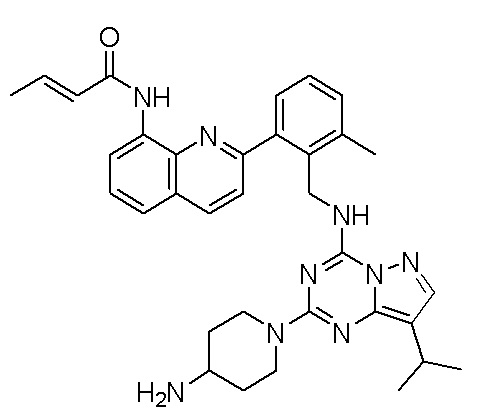
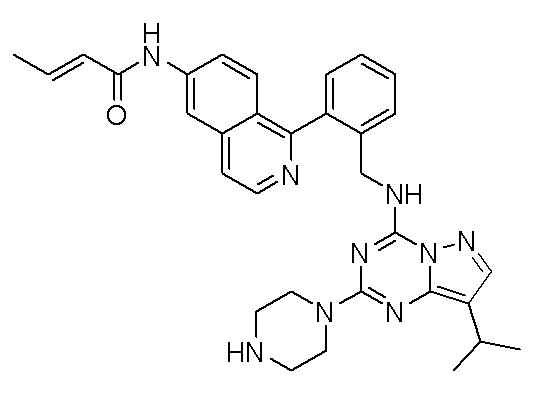
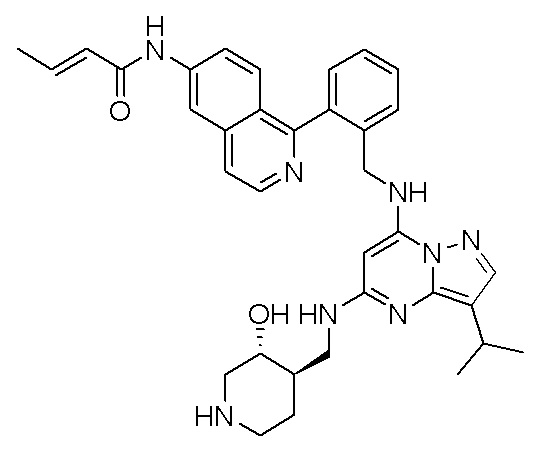
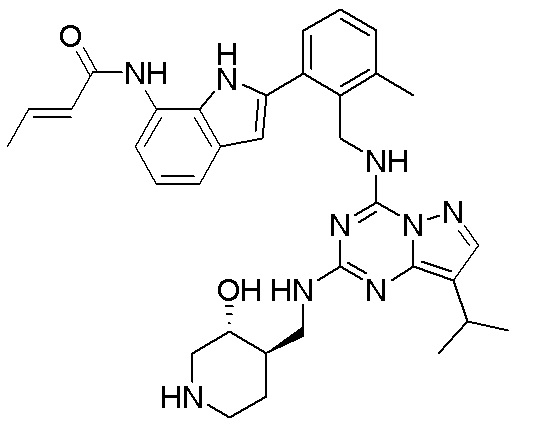
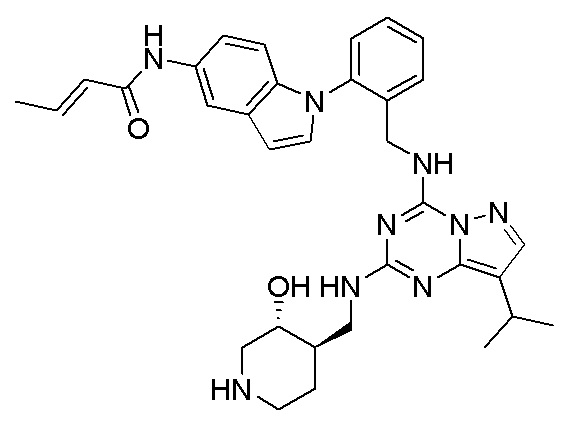
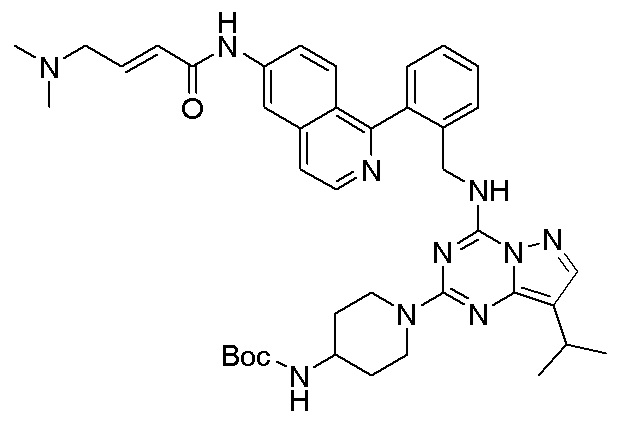
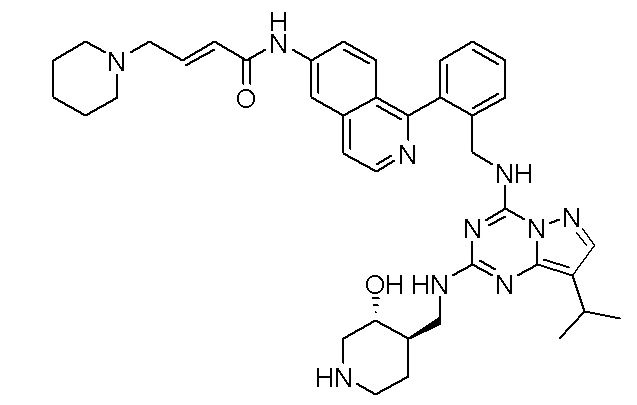
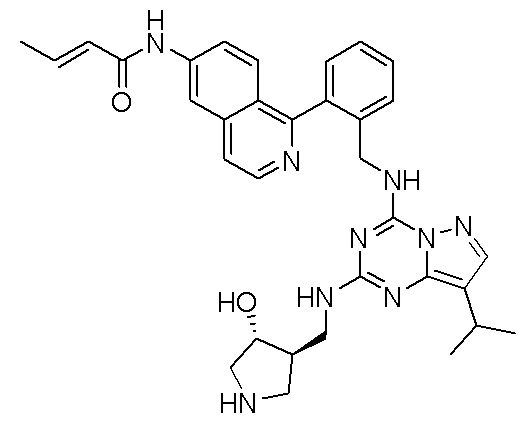
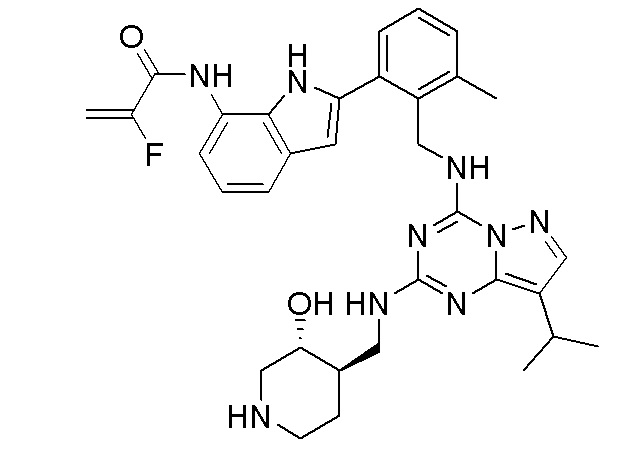
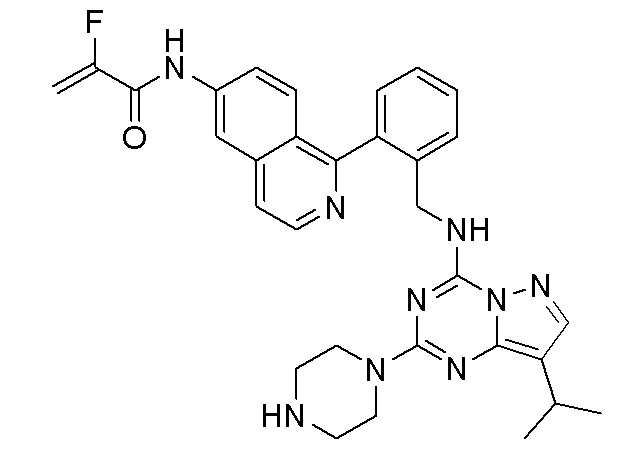
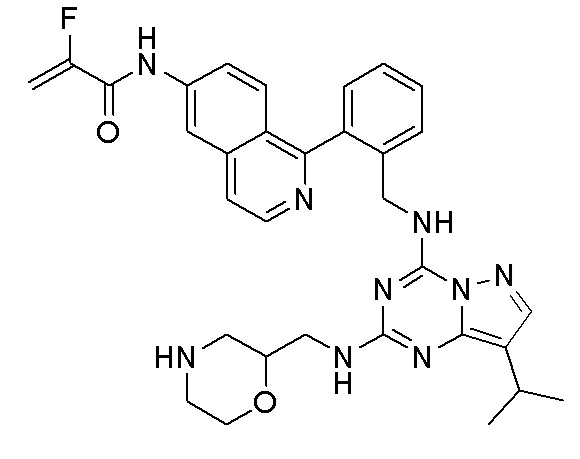
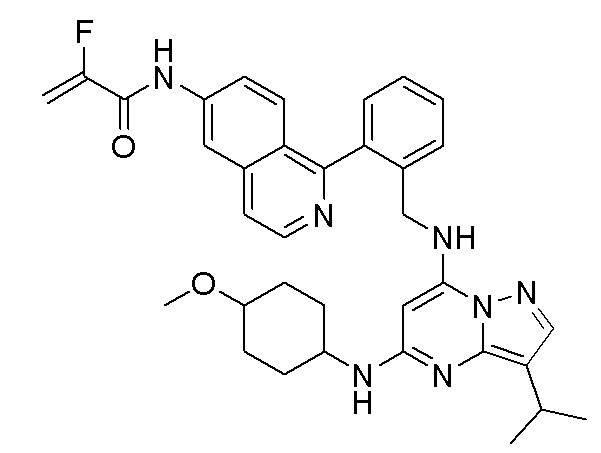
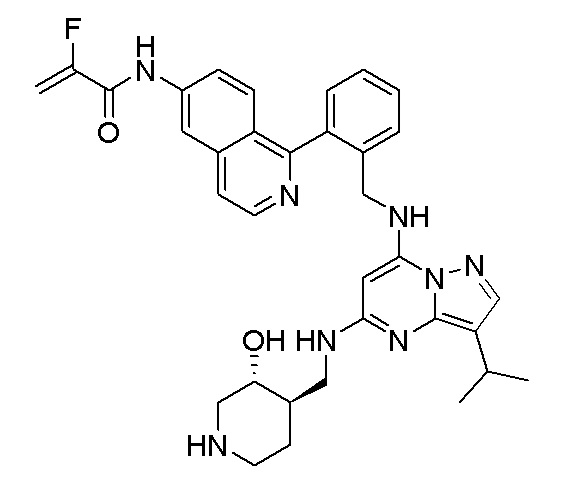
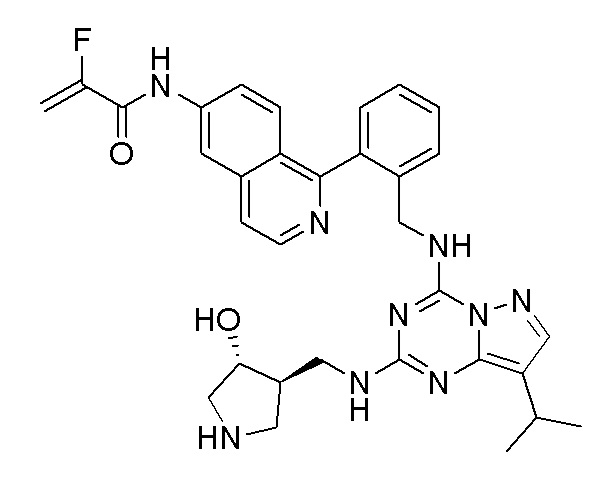
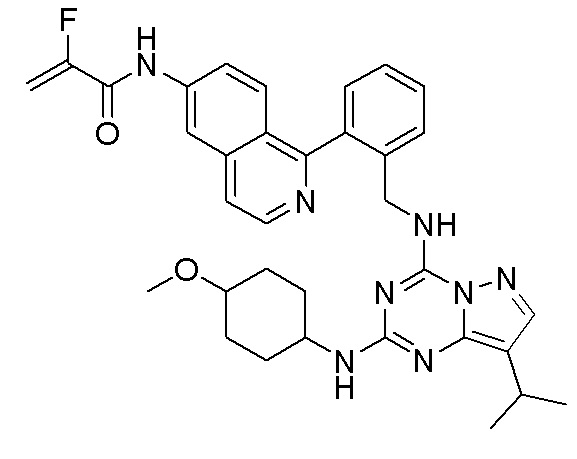
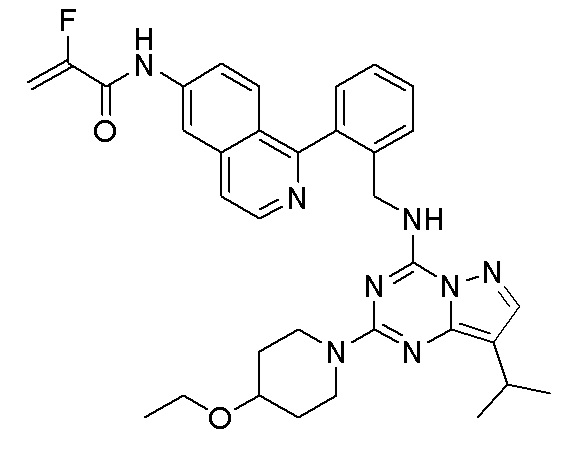
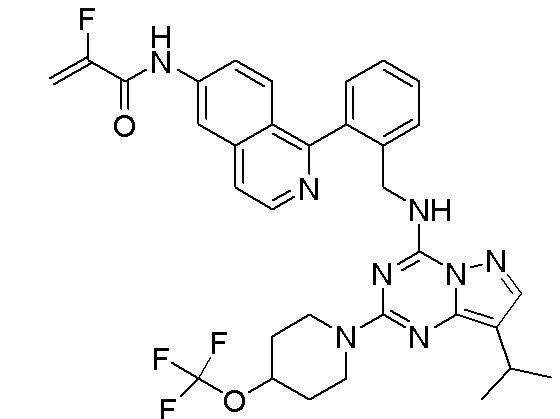
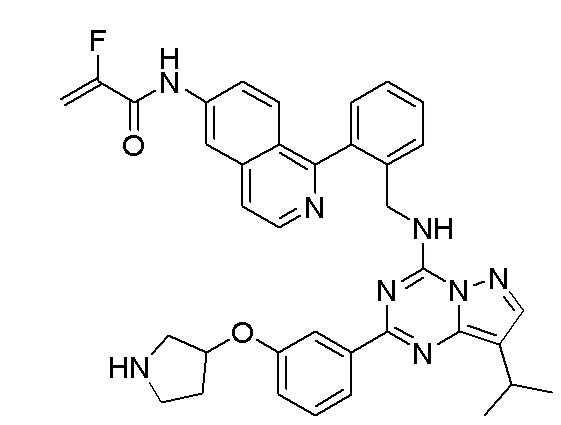
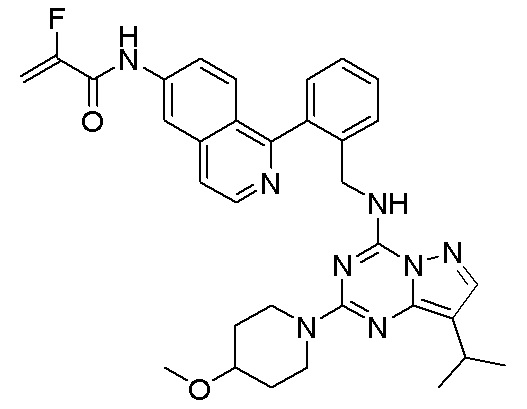
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ПИРАЗОЛОТРИАЗИНА И/ИЛИ ПИРАЗОЛОПИРИМИДИНА В КАЧЕСТВЕ СЕЛЕКТИВНОГО ИНГИБИТОРА ЦИКЛИНЗАВИСИМОЙ КИНАЗЫ | 2019 |
|
RU2809779C2 |
| ОКСИСТЕРОЛЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2742333C2 |
| ПРОИЗВОДНЫЕ ХИНОЛИНА В КАЧЕСТВЕ ИНГИБИТОРОВ РЕЦЕПТОРНОЙ ТИРОЗИНКИНАЗЫ AXL/MER И CSF1R | 2019 |
|
RU2812631C2 |
| 3,6-ДИАМИНОПИРИДАЗИН-3-ИЛЬНЫЕ ПРОИЗВОДНЫЕ, СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОАПОПТОТИЧЕСКИХ СРЕДСТВ | 2020 |
|
RU2830186C2 |
| 6,7-ДИГИДРО-5H-ПИРИДО[2,3-C]ПИРИДАЗИНОВЫЕ ПРОИЗВОДНЫЕ И РОДСТВЕННЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ БЕЛКОВ BCLXL И ПРОАПОПТОТИЧЕСКИХ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2020 |
|
RU2832191C2 |
| МОДУЛЯТОРЫ РЕЦЕПТОРА НМДА И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2621049C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ ЦНС | 2015 |
|
RU2733756C2 |
| КОМПОЗИЦИИ, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ, СВЯЗАННЫХ С KIT | 2014 |
|
RU2706235C2 |
| ПИРИМИДИНЫ, ИХ ВАРИАНТЫ И ПРИМЕНЕНИЕ | 2017 |
|
RU2761439C2 |
| ИНГИБИТОРЫ РЕЦЕПТОРА ФАКТОРА РОСТА ФИБРОБЛАСТОВ | 2014 |
|
RU2704112C2 |
Изобретение относится к производным пиразоло[1,5-a][1,3,5]триазина и пиразоло[1,5-a]пиримидина и/или их фармацевтически приемлемым солям, применению этих производных в качестве фармацевтически активных агентов, особенно для профилактики и/или лечения клеточно-пролиферативных заболеваний, воспалительных заболеваний, иммунологических заболеваний, сердечно-сосудистых заболеваний и инфекционных заболеваний. Кроме того, настоящее изобретение относится к фармацевтическим композициям, содержащим по меньшей мере одно из производных пиразоло[1,5-a][1,3,5]триазина и пиразоло[1,5-a]пиримидина и/или их фармацевтически приемлемые соли. 4 н. и 6 з.п. ф-лы, 6 табл., 3 пр.
1. Соединение, имеющее структуру, выбранную из структур 11, 26, 27, 31, 32, 34-36, 39-41, 44-73, 76-80, 82, 83 и 87 в соответствии с определением в таблице:
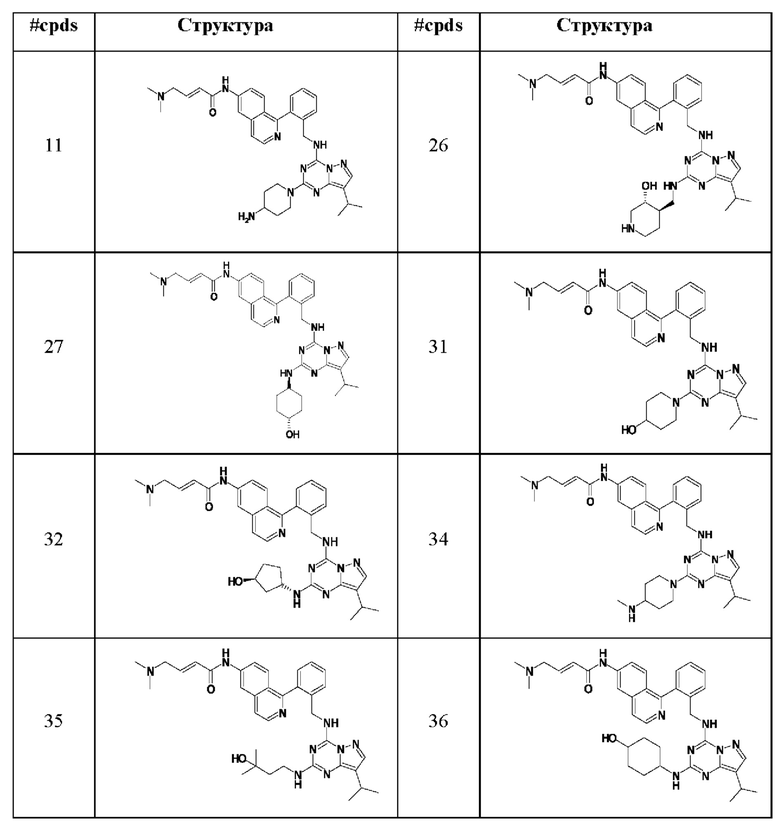
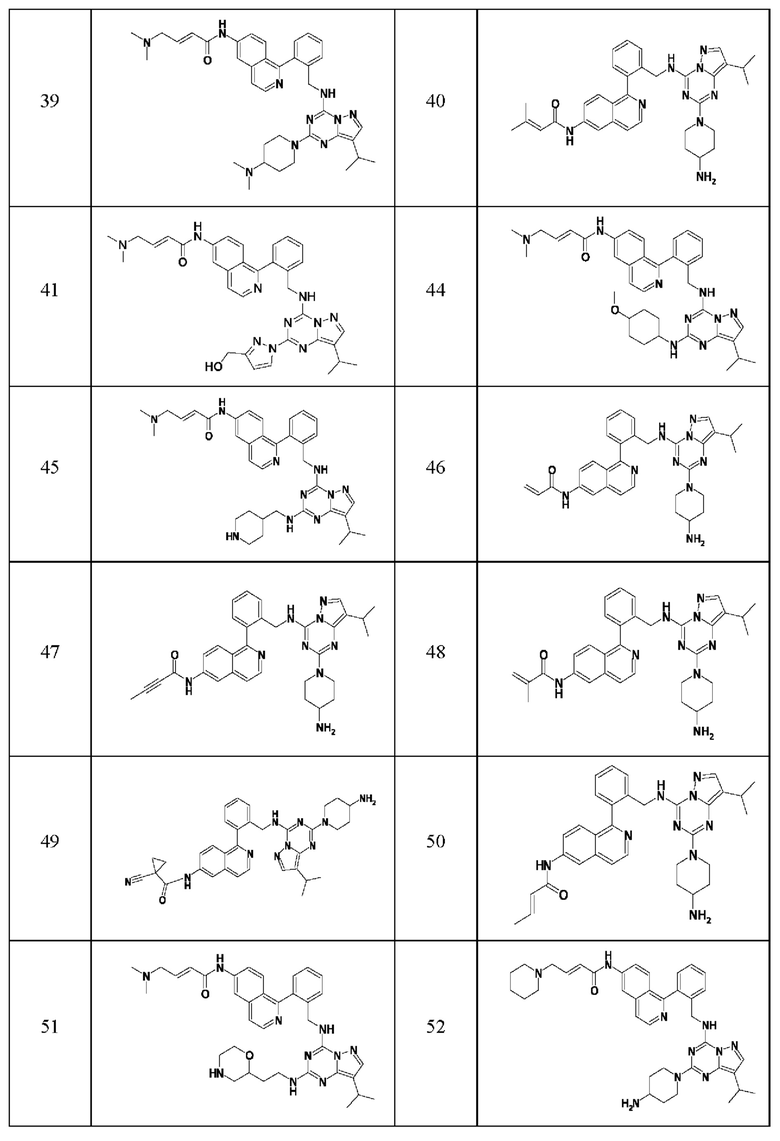
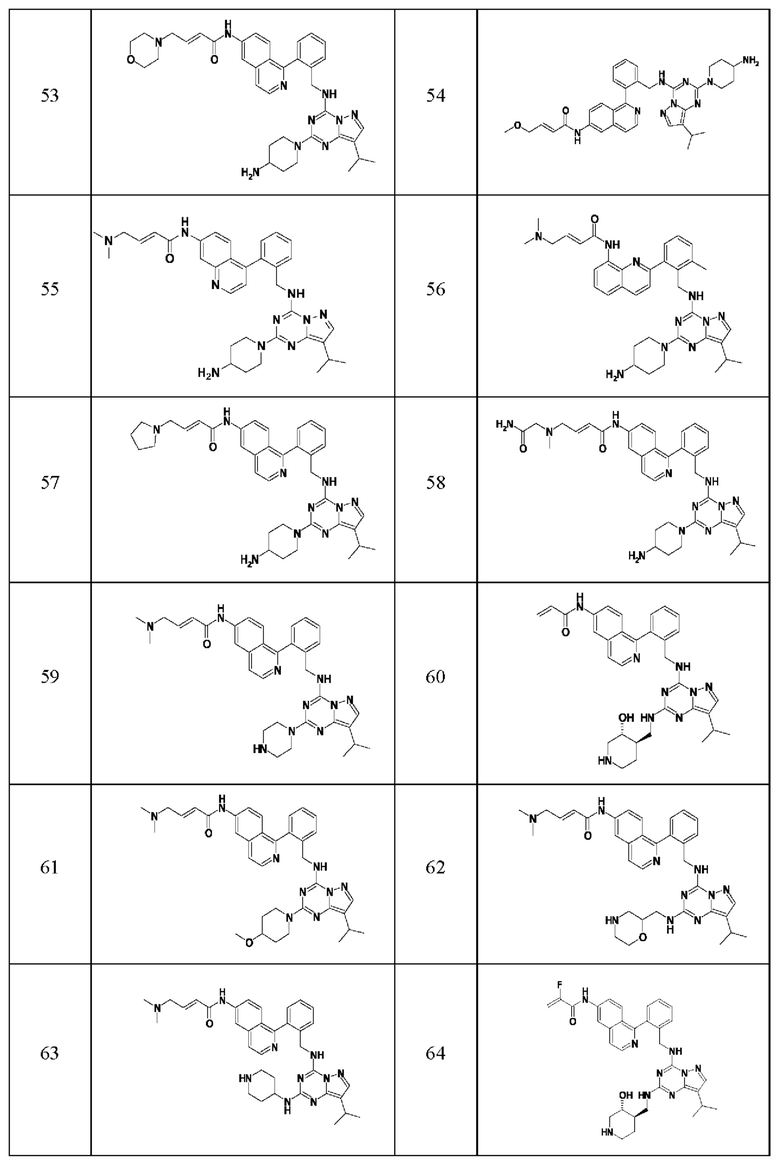
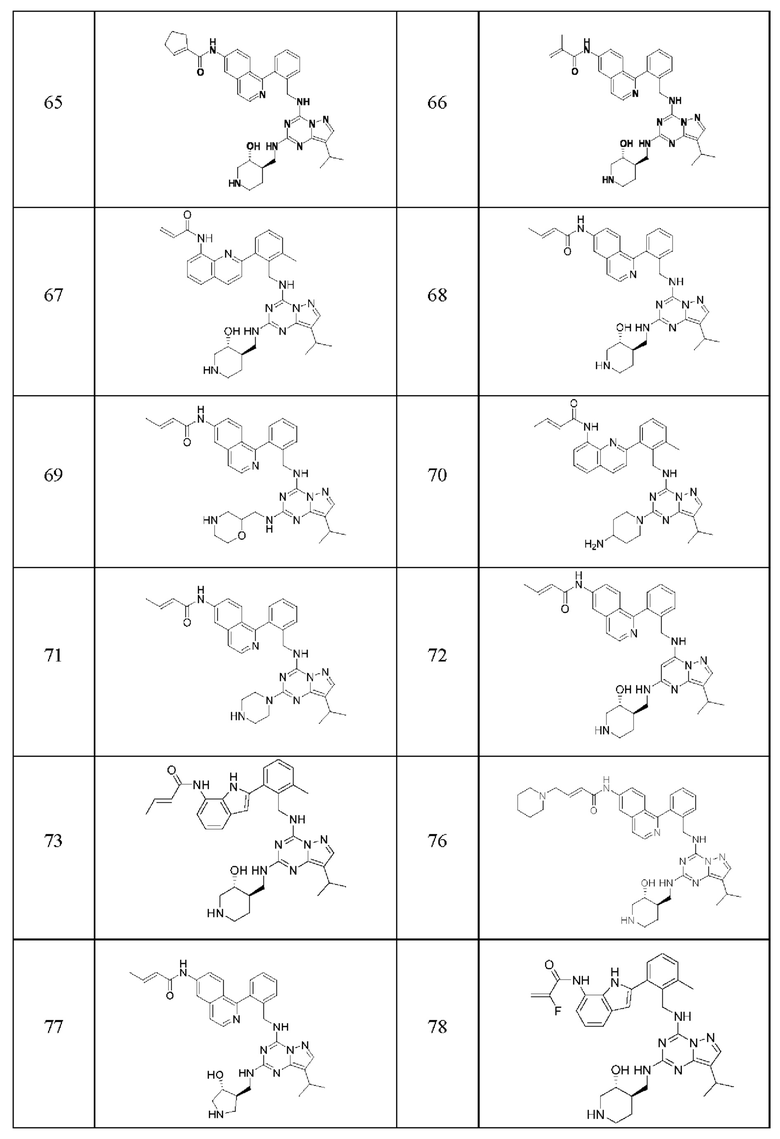
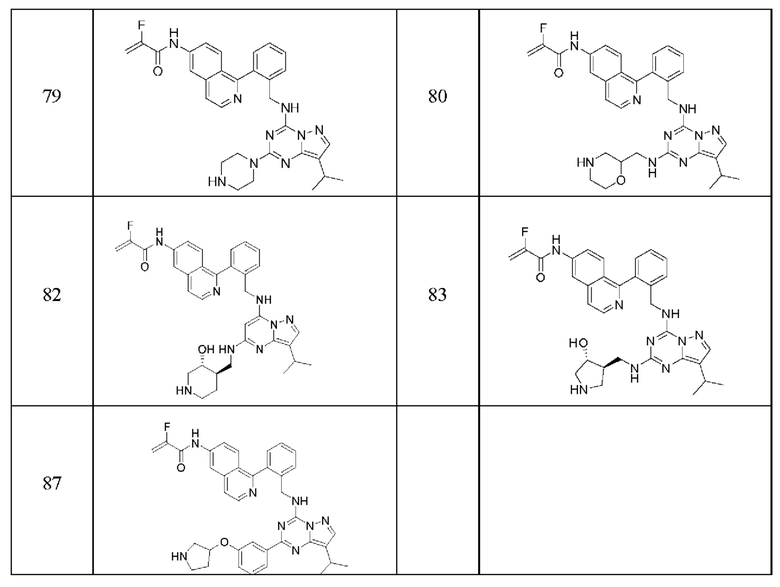
2. Фармацевтическая композиция для профилактики и/или лечения клеточно-пролиферативных заболеваний, воспалительных заболеваний, иммунологических заболеваний, сердечно-сосудистых заболеваний и инфекционных заболеваний, содержащая соединение по п. 1 в качестве действующего вещества, имеющего ингибирующую активность в отношении циклин-зависимой киназы (CDK), вместе с по меньшей мере одним фармацевтически приемлемым носителем, вспомогательным веществом и/или разбавителем.
3. Применение соединения по п. 1 в качестве фармацевтически активного агента, который обладает ингибирующей активностью в отношении циклин-зависимой киназы 7 (CDK7).
4. Применение соединения по п. 1 для профилактики и/или лечения заболевания, связанного с ингибированием апоптоза, аномальной транскрипционной активностью и/или арестом клеточного цикла за счет аномальной активности и/или сверхэкспрессии одной или нескольких циклин-зависимых киназ (CDK), в частности, циклин-зависимой киназы 7 (CDK7), где заболевание выбрано из пролиферативных заболеваний, инфекционных заболеваний, включая оппортунистические заболевания, иммунологических заболеваний, аутоиммунных заболеваний и воспалительных заболеваний.
5. Применение по п. 4, в котором пролиферативным заболеванием является рак, предпочтительно рак, выбранный из группы, включающей в себя или состоящей из следующих заболеваний: аденокарцинома, хориоидальная меланома, острый лейкоз, неврилеммома слухового нерва, карцинома амплулярного отдела толстой кишки, анальная карцинома, астроцитома, базальноклеточная карцинома, рак поджелудочной железы, десмоидная опухоль, рак мочевого пузыря, бронхиальная карцинома, эстроген-зависимый и эстроген-независимый рак молочной железы, лимфома Беркитта, рак тела, опухоль неизвестной первичной локализации, карцинома (CUP-синдром), колоректальный рак, рак тонкого кишечника, опухоли тонкого кишечника, рак яичников, карцинома эндометрия, эпендимома, эпителиальные типы рака, опухоли Юинга, опухоли желудочно-кишечного тракта, рак желудка, рак желчного пузыря, карциномы желчного пузыря, рак матки, рак шейки матки, глиобластомы, гинекологические опухоли, опухоли уха, носа и горла, гематологическая опухоль, волосатоклеточный лейкоз, рак уретры, рак кожи, рак яичек, опухоли головного мозга (глиомы), метастазы в мозг, рак яичка, опухоль гипофиза, карциноиды, саркома Капоши, рак гортани, эмбрионально-клеточная опухоль, рак костей, колоректальная карцинома, опухоли головы и шеи (опухоли области уха, носа и горла), карцинома толстой кишки, краниофарингиомы, рак ротовой полости (рак в области рта и на губах), рак центральной нервной системы, рак печени, метастазы в печень, лейкемия, опухоль века, рак легких, лимфомы, рак желудка, злокачественная меланома, злокачественное новообразование, злокачественные новообразования желудочно-кишечного тракта, карцинома молочной железы, рак прямой кишки, медуллобластомы, меланома, менингиомы, лимфома Ходжкина / неходжкинская лимфома, фунгоидная гранулема, рак носа, невринома, нейробластома, рак почки, почечно-клеточные карциномы, олигодендроглиома, карцинома пищевода, остеолитические карциномы и остеопластические карциномы, остеосаркомы, карцинома яичника, карцинома поджелудочной железы, рак полового члена, плазмоцитома, рак предстательной железы, фарингеальный рак, карцинома прямой кишки, ретинобластома, рак влагалища, карцинома щитовидной железы, рак пищевода, Т-клеточная лимфома, тимома, карцинома труб, опухоли глаза, рак уретры, урологические опухоли, уротелиальная карцинома, рак вульвы, появление бородавок, опухоли мягких тканей, саркома мягких тканей, нефробластома, карцинома шейки матки, рак языка, инвазивная протоковая карцинома молочной железы, инвазивная дольковая карцинома, протоковая карцинома in situ, дольковая карцинома in situ, мелкоклеточная карцинома легких, немелко клеточная карцинома легких, аденома бронха, плевролегочная бластома, мезотелиома, глиома ствола головного мозга, гипоталамическая глиома, астропитома мозжечка, астроцитома головного мозга, нейроэктодермальная опухоль, опухоли шишковидной железы, саркома матки, раки слюнных желез, аденокарциномы анальной железы, мастоцитомы, опухоль почечной лоханки, опухоль мочеточника, наследственные папиллярные раки почек, спорадические папиллярные раки почек, внутриглазная меланома, гепатоцеллюлярная карцинома, холангиокарцинома, смешанная гепатоцеллюлярная холангиокарцинома, плоскоклеточная карцинома, злокачественная меланома, рак кожи из клеток Меркеля, немеланомный рак кожи, подглоточный рак, рак носоглотки, рак ротоглотки, рак полости рта, плоскоклеточный рак, меланома полости рта, СПИД-ассоциированная лимфома, кожная Т-клеточная лимфома, лимфома центральной нервной системы, злокачественная фиброзная гистиоцитома, саркома лимфатических узлов, рабдомиосаркома, злокачественный гистиоцитоз, фибробластическая саркома, гемангиосаркома, гемангиоперицитома, лейомиосаркома (ЛМС), карцинома молочной железы собак, и карцинома молочной железы кошек.
6. Применение по п. 4, в котором инфекционным заболеванием, включая оппортунистические заболевания, является заболевание, выбранное из группы, включающей в себя или состоящей из следующих заболеваний: СПИД, аденовирусная инфекция, альвеолярный гидатидный эхинококкоз (AHD), амебиаз, ангиостронгилиоз, анизакиаз, сибирская язва, бабезиоз, балантидиаз, заражение нематодами Baylisascaris, бильгарция (шистосомоз), бластоцитоз, боррелиоз Лайма, ботулизм, диарея Брайнерда, бруцеллез, губчатая энцефалопатия крупного рогатого скота (ГЭКРС), кандидоз, капилляриоз, синдром хронической усталости (СХУ), болезнь Шагаса, ветряная оспа, инфицирование хламидией пневмонии, холера, синдром хронической усталости, болезнь Крейтцфельда-Якоба (CJD), клонорхоз, кожная мигрирующая личинка (CLM), кокцидиридомикоз, конъюнктивит, инфекция коксаки (Сох А16), криптококковое заболевание, криптоспоридиоз, лихорадка Западного Нила, циклоспориаз, нейроцистицеркоз, цитомегаловирусная инфекция, лихорадка денге, инфицирование Dipylidium caninum, геморрагическая лихорадка Эбола (EHF), альвеолярный эхинококкоз (АЕ), энцефалит, инфицирование кишечной амебой, инфицирование Entamoeba dispar, инфицирование Entamoeba hartmanni, инфицирование Entamoeba polecki, энтеробиоз, энтеровирусная инфекция (полио/неполио), инфицирование вирусом Эпштейна-Барр, инфицирование кишечной палочкой, пищевая инфекция, ящур, грибковый дерматит, грибковые инфекции, гастроэнтерит, стрептококковая болезнь группы А, стрептококковая болезнь группы В, болезнь Хансена (проказа), хантавирусный легочный синдром, вшивость (педикулез), инфекция Helicobacter pylori, гематологическая болезнь, инфицирование вирусом Вирус Хендра, гепатит (HCV, HBV), опоясывающий герпес (лишай), ВИЧ, эрлихиоз человека, инфицирование вирусом парагриппа, грипп, изоспориаз, лихорадка Ласса, лейшманиоз, висцеральный лейшманиоз (ВЛ), малярия, геморрагическая лихорадка Марбург, корь, менингит, инфекция комплекса Микобактериум авиум (MAC), инфицирование амебой Неглерия Фоулера, нозокомиальная инфекция, инфицирование непатогенными кишечными амебами, онхоцеркоз, описторхоз, инфицирование вирусом папилломы, парвовирусная инфекция, чума, пневмоцистная пневмония (РСР), инфицирование полиомавирусом, Ку-лихорадка, бешенство, инфицирование респираторно-синцитиальным вирусом, ревматический полиартрит, лихорадка долины Рифт, ротавирусная инфекция, инфицирование круглыми червями, сальмонеллез, чесотка, шигеллиоз, опоясывающий лишай, летаргический энцефалит, натуральная оспа, стрептококковая инфекция, инфицирование ленточными червями, столбняк, синдром токсического шока, туберкулез, дуоденит, инфицирование парагемолитическим вибрионом, вибрион общей гнойной инфекции, вирусная геморрагическая лихорадка, бородавки, инфекционные заболевания, передающиеся через воду, инфицирование вирусом ветряной оспы, коклюш и амарилльная лихорадка.
7. Применение по п. 4, в котором иммунологическим заболеванием и/или аутоиммунным заболеванием является заболевание, выбранное из группы, включающей в себя или состоящей из следующих заболеваний: астма, диабет, ревматические заболевания, отторжение трансплантированных органов и тканей, ринит, хронические обструктивные заболевания легких, остеопороз, язвенный колит, синусит, красная волчанка, рецидивирующие инфекции, атопический дерматит/ экзема и профессиональные аллергии, пищевые аллергии, лекарственные аллергии, тяжелые анафилактические реакции, анафилаксия, проявления аллергических заболеваний, первичные иммунодефициты, состояния дефицита антител, клеточно-опосредованные иммунодефициты, тяжелый комбинированный иммунодефицит, синдром ДиДжорджи, синдром гиперпродукции IgE (HIES), синдром Вискотта-Олдрича (WAS), атаксия-телеангиэктазия, иммуноопосредованные раковые заболевания, дефекты лейкоцитов, аутоиммунные заболевания, системная красная волчанка (СКВ), ревматоидный артрит (РА), рассеянный склероз (PC), иммуноопосредованный диабет или сахарный диабет 1 типа, иммуноопосредованный гломерулонефрит, склеродермия, пернициозная анемия, алопеция, пузырчатка, обыкновенная пузырчатка, тяжелая миастения, воспалительные заболевания кишечника, болезнь Крона, псориаз, аутоиммунные заболевания щитовидной железы, тиреоидит Хашимото, дерматомиозит, синдром Гудпасчера (GPS), тяжелая миастения (MG), симпатическая офтальмия, факогенный увеит, хронический агрессивный гепатит, первичный билиарный цирроз, аутоиммунная гемолитическая анемия и болезнь Верльгофа.
8. Применение по п. 4, в котором воспалительное заболевание вызывается, индуцируется, инициируется и/или усиливается бактериями, вирусами, прионами, паразитами, грибами и/или вызывается раздражающими, травматическими, метаболическими, аллергическими, аутоиммунными или идиопатическими агентами.
9. Применение по п. 4 или 8, в котором воспалительное заболевание выбрано из группы, содержащей или состоящей из воспалительных заболеваний центральной нервной системы (ЦНС), воспалительных ревматических заболеваний, воспалительных заболеваний кровеносных сосудов, воспалительных заболеваний среднего уха, воспалительных заболеваний кишечника, воспалительных заболеваний кожи, воспалительного заболевания увеит и воспалительных заболеваний гортани.
10. Применение по пп. 4, 8 или 9, в котором воспалительное заболевание выбрано из следующих заболеваний: воспалительные заболевания центральной нервной системы (ЦНС), воспалительные ревматические заболевания, воспалительные заболевания кровеносных сосудов, воспалительные заболевания среднего уха, воспалительные заболевания кишечника, воспалительные заболевания кожи, воспалительное заболевание увеит, воспалительные заболевания гортани, при этом указанные воспалительные заболевания предпочтительно выбраны из группы, в которую входят абсцесс, инфицирование акантамебой, юношеские угри, актиномикоз, острые воспалительные дерматозы, острые инфекции гортани у взрослых, острая мультифокальная плакоидная пигментная эпителиопатия, острая (термическая) травма, острый некроз сетчатки, острый гнойный средний отит, заболевания, вызываемые водорослями, аллергический контактный дерматит, амилоидоз, ангионевротический отек, анкилозирующий спондилит, аспергиллез, атопический дерматит, псевдобешенство, аутоантитела при васкулите, бактериальные заболевания, бактериальный ларингит, бактериальный менингит, болезнь Бехчета (BD), дробьевидная хориоидопатия, бластомикоз Гилкриста, болезнь Борна, бруцеллез, буллезный мирингит, бурсит, кандидоз, вызванный чумой собак энцефаломиелит, вызванный чумой собак энцефаломиелит у неполовозрелых животных, геморрагическая лихорадка собак, вызванный вирусом герпеса собак энцефаломиелит, холестеатома, хронические гранулематозные заболевания (CGD), хронические воспалительные дерматозы, хронический рецидивирующий энцефаломиелит, хронический гнойный средний отит, рубцевой пемфигоид глаз (ОСР), общая инфекция верхних дыхательных путей, гранулема, болезнь Крона, криптококковое заболевание, дерматомиозит, дифтерия, дискоидная красная волчанка (DLE), лекарственный васкулит, лекарственная реакция или гиперчувствительность к лекарствам, энцефалитный зооноз, эозинофильный менингоэнцефалит, полиморфная эритема (ЕМ), вирус лейкемии кошек, вирус иммунодефицита кошек, инфекционный перитонит кошек, полиоэнцефалит кошек, губчатая энцефалопатия кошек, фибромиалгия, гетерохромный увеит Фукса, гастроэзофагеальная (гортанно-глоточная) рефлюксная болезнь гигантоклеточный артериит, сап, глаукоматоциклический кризис, гонорейный гранулярный мирингит, гранулематозный менингоэнцефалит (GME), простой герпес, гистоплазмоз, идиопатические заболевания, идиопатические воспалительные расстройства, иммунные и идиопатические расстройства, инфекции иммунодефицитного хозяина, инфекционный гепатит собак, ингаляционный ларингит, интерстициальный нефрит, ирритантный контактный дерматит, ювенильный ревматоидный артрит, синдром Кавасаки, вирусный энцефалит Ла-Кросс, абсцесс гортани, ларинготрахеобронхит, лейшманиоз, факогенный увеит, проказа, лептоспироз, лейкемия, красный плоский лишай, волчанка, лимфома, менингит, менингоэнцефалит борзых, прочий менингит/ менингоэнцефалит, микроскопический полиангиит, многоочаговый хороидит, вызванный чумой собак многоочаговый энцефаломиелит у половозрелых животных, рассеянный склероз, дисфония мышечного напряжения (MTD), микотические (грибковые) заболевания, микотические заболевания ЦНС, некротизирующий энцефалит, неоспороз, энцефалит старых собак, онхоцеркоз, паразитарный энцефаломиелит, паразитарные инфекции, парспланит, парвовирусный энцефалит, детский ларингит, аллергия на загрязнение окружающей среды и ингаляционная аллергия, полимиозит, поствакцинальный вызванный чумой энцефалит собак, заболевания, индуцированные прионным белком, прототекоз, протозойный энцефалит-энцефаломиелит, псориаз, псориатический артрит, энцефалит мопсов, лучевое поражение, лучевой ларингит, лучевой некроз, рецидивирующий полихондрит, синдром Рейтера, пигментная дегенерация сетчатки, ретинобластома, ревматоидный артрит, риккетсиозы, пятнистая лихорадка Скалистых гор, болезнь отравления лососевыми (SPD), саркоцистоз, саркоидоз, шистозоматоз, склеродермия, риносклерома, ползучий хороидит, идиопатический церебеллит, синдром Шегрена, спазматический круп, спирохетозные (сифилисные) заболевания, спонгиотический дерматит, споротрихоз, стероид-реагирующий менингит-артериит, синдром Стивенса-Джонсона (SJS, обширная полиморфная эритема), эпиглоттит, симпатическая офтальмия, сингамоз, сифилис, системный васкулит при саркоидозе, синдром Такаясу, тендинит (тендонит), облитерирующий тромбангиит (болезнь Бюргера), клещевой вирусный энцефалит собак, токсический эпидермальный некролиз (TEN), токсокариаз, токсоплазмоз, травма, травматический ларингит, трихинеллез, трипаносомоз, туберкулез, туляремия, язвенный колит, аллергическая сыпь (крапивница), васкулит, васкулит и злокачественные новообразования, васкулит и ревматоидный артрит, васкулит при идиопатических воспалительных миопатиях, васкулит центральной нервной системы, васкулит, вторичный по отношению к бактериальному, грибковые и паразитарные инфекции, вирусные заболевания, вирусный ларингит, витилиго, злоупотребление голосом, кровоизлияние в голосовые связки, синдром Фогта-Коянаги-Харады (VKH), гранулематоз Вегенера и болезнь Уиппла.
| WO 2016142855 A2, 15.09.2016 | |||
| WO 2013128028 A1, 06.09.2013 | |||
| WO 2015154022 A1, 08.10.2015 | |||
| WO 2013128029 A1, 06.09.2013. |
Авторы
Даты
2024-05-02—Публикация
2019-04-11—Подача