Изобретение относится к области медицины, а именно к кардиологии и представляет собой способ оценки риска развития неблагоприятных сердечнососудистых событий в отдаленном периоде (в течение 4-х лет наблюдения) у пациентов с сердечной недостаточностью (СН) после имплантации кардиовертера-дефибриллятора (ИКД), что является очень важной задачей, поскольку позволяет персонифицировать отбор пациентов на имплантацию кардиовертера-дефибриллятора и план их дальнейшего наблюдения после его установки, и тем самым снизить число развития неблагоприятных сердечнососудистых событий и смерти на отдаленном этапе у этой тяжелой категории пациентов.
Проблемы внезапной сердечной смерти (ВСС) и СН тесно взаимосвязаны. Во всех рандомизированных клинических исследованиях (РКИ) по изучению эффективности ИКД для первичной профилактики ВСС в качестве единственного определяющего критерия высокого риска выступала низкая фракция выброса левого желудочка (ФВ ЛЖ). Это связано с тем, что ранее во всех исследованиях было убедительно продемонстрировано решающее значение нарушения сократительной функции миокарда, а не индуцируемых или предшествующих желудочковых нарушений ритма (ЖНР) [Israel, С.W. Mechanisms of sudden cardiac death / С.W. Israel // Indian. Heart J. - 2014. - Vol. 66, Suppl 1 (Suppl 1). - P. S10-S17; Predictors of sudden cardiac death change with time after myocardial infarction: results from the VALIANT trial / J.P. Piccini, M. Zhang, K. Pieper [et al.] // Eur. Heart J. - 2010. - Vol. 31, №2. - P. 211-222]. Таким образом, в настоящее время ФВ ЛЖ менее 35% является единственным предиктором высокого риска ВСС, на котором основаны показания для имплантации кардиовертера-дефибриллятора в качестве метода первичной профилактики ВСС во всех существующих рекомендациях, в том числе, и обновленных рекомендациях по СН [Хроническая сердечная недостаточность в Российской Федерации: что изменилось за 20 лет наблюдения? Результаты исследования ЭПОХА - ХСН / Д.С. Поляков, И.В. Фомин, Ю.Н. Беленков [и др.] // Кардиология. - 2021. - Т. 61, №4. - С. 4-14]. Кроме того, даже в группе вторичной профилактики ВСС наибольшую пользу ИКД-терапия приносит в группе с низкой ФВ ЛЖ [Borne, R.Т. Implantable cardibverter-defibrillator shocks: epidemiology, outcomes, and therapeutic approaches / R.T. Borne, P.D. Varosy, F.A. Masoudi // JAMA Intern. Med. - 2013. - Vol. 173, №10. - P. 859-865].
Однако в настоящее время становится все более очевидным, что существующая стратегия долгосрочной профилактики ВСС на основе ФВ ЛЖ как ключевого критерия стратификации риска несовершенна. Причина заключается в том, что с одной стороны самые большие абсолютные числа ВСС встречаются в общей популяции, а с другой стороны - развитие новых подходов к фармакотерапии СН привело к снижению частоты ВСС у этой категории пациентов и, соответственно, к снижению вклада низкой ФВ ЛЖ как предиктора ВСС [Predictors of sudden cardiac death change with time after myocardial infarction: results from the VALIANT trial / J.P. Piccini, M. Zhang, K. Pieper [et al.] // Eur. Heart J. - 2010. - Vol. 31, №2. - P. 211-221; Single vs. dual chamber implantable cardioverter-defibrillators or programming of implantable cardioverter-defibrillators in patients without a bradycardia pacing indication: systematic review and meta-analysis. / E.P. Zeitler, G.D. Sanders, K. Singh [et al.] // Europace. - 2018. - Vol. 20, №10. - P. 1621-1629]. Вопросы прогнозирования неблагоприятных исходов после установки ИКД приобретают особую актуальность, поскольку, несмотря на кажущуюся успешность ИКД-терапии в профилактике риска ВСС, смертность в группе пациентов с ИКД остается высокой, что связано не только с неадекватным срабатыванием самого устройства, но и с высокой неаримтической смертностью в этой группе [Sudden cardiac death protocol analyses of postmortem autopsies / S.I. Mikhaylichenko, V.V. Gorbunov, E.V. Bogaticov [et al.] // J. Interv. Card. Electrophysiol. - 2015. - Vol. 42, №3. - P. 173-326; Long-term clinical course of patients after termination of ventricular tachyarrhythmia by an implanted defibrillator / A.J. Moss, H. Greenberg, R.B. Case [et al.] // Circulation. - 2004. - Vol. 110, №25. - P. 3760-3765]. Кроме того, реальной проблемой становится и отсутствие востребованности ИКД-терапии, которое выражается в отсутствии срабатываний устройств у 30-65%, ставя под сомнение экономическую целесообразность столь дорогостоящего высокотехнологичного метода медицинской помощи [Development and external validation of predictionmodels to predict implantable cardioverter-defibrillator efficacy in primary prevention of sudden cardiac death / Т.E. Verstraelen, M. van Barreveld, PHFM van Dessel [et al.] // Europace. - 2021. - Vol. 23, №6. - P. 887-897]. Таким образом, вопрос о том, какие инструменты могут помочь практическому врачу оценить относительную ценность ИКД для улучшения прогноза пациента в каждом конкретном случае приобретает особую актуальность.
Поиск по научно-медицинской и патентной литературе позволил выявить существующие способы прогнозирования исходов отдельно у пациентов с СН и ИКД. Так, по результатам масштабных РКИ для клинической стратификации выгоды ИКД-терапии была предложена щкала MADIT-II risk score [Naksuk, N. Application of the Multicenter Automatic Defibrillator Implanta-tion Trial II risk score in a nontrial setting / N. Naksuk, M. Akkaya, S. Adabag // Am. J. Cardiol. - 2013. - Vol. 112, №4. - P. 530-532].
Авторы определили восемь предикторов развития жизнеугрожающих ЖНР: мужской пол, возраст <75 лет, неустойчивая желудочковая тахикардия в анамнезе, частота сердечных сокращений (ЧСС)>75 уд/мин, систолическое артериальное давление (САД)<140 мм рт.ст., ФВ ЛЖ≤25%, инфаркт миокарда в анамнезе и предсердная аритмия. Также авторы определили семь предикторов неаритмической смертности: возраст ≥75 лет, сахарный диабет, индекс массы тела <23 кг/м2, ФВ≤25%, класс ≥II по NYHA, ИКД вместо кардиоресинхронизирующей терапии, фибрилляция предсердий, уровень мозгового натрийуретического пептида (МНУП) и продолжительность комплекса QRS. На основании оценки предикторов была разработана прогностическая модель для индивидуальной оценки риска развития жизнеугрожающих ЖНР по сравнению неаримической смертью. Согласно шкале MADIT-II в существует U-образная зависимость: выгода выживания ИКД против не-ИКД терапии наблюдалась у пациентов, имеющих хотя бы один из пяти клинических факторов риска (класс NYHA>2, возраст>70 лет, НУП>26 мг/дл, продолжительность QRS>0,12 с и мерцательная аритмия); тогда как польза также отсутствовала у пациентов ни с одним из пяти клинических факторов риска (0 баллов), описанных выше, или в группе очень высокого риска (5 баллов). В группе с наивысшей эффективностью ИКД-терапии 3-летний прогнозируемый риск ЖТ/ФЖ был в три раза выше, чем риск неаритмической смертности (20% против 7%, р<0,001). В группе со средней эффективностью разница в соответствующих прогнозируемых рисках была ослаблена (15% против 9%, р<0,01). В группе с самой низкой эффективностью 3-летний прогнозируемый риск ЖТ/ФЖ был аналогичен риску неаритмической смертности (11% против 12%, р=0,41). Недостатком шкалы MADIT-II является ее давность, шкала основана ни результатах РКИ 2002 г., и хотя приверженность к терапии СН была высокой (70%), пациенты получали ингибиторы ангиотензин-превращающего фермента и бета-адреноблокаторы, но не рекомендуемую сейчас трех- и четырехкомпонентную терапию. Шкала ограничена пациентами с ишемической кардиомиопатией, не валидизирована на российской популяции и не нашла широкого применения.
Тем не менее, данная шкала показала, что путем простой оценки клинического риска возможно определить группы пациентов, у которых первичная ИКД-профилактика даст или не даст выгоду по выживаемости.
Для оценки риска смерти у пациентов с СН так же существуют шкалы, основанные на результатах РКИ. Наиболее популярной и прогностически точной является модель сердечной недостаточности SHFM (Seattle Heart Failure Model), используемая для оценки продолжительности жизни пациентов с СН на амбулаторном этапе. Она была создана на основании исследования PRAISE1 и апробирована на жителях США и Италии [Levy W.С., Mozaffarian D., Linker D.Т. et al. The Seattle Heart Failure Model: prediction of survival in heart failure. Circulation. 2006; 113 (11): 1424-33]. Однако эта шкала имеет ряд существенных недостатков: она не может применяться у пациентов с коморбидностью, не может применяться на стационарном этапе, не оценивает частоту госпитализаций, кроме того, недооценивает или переоценивает риски у пациентов с имплантированными устройствами, в частности, с ИКД. Тем не менее, данная шкала демонстрирует неэффективность ИКД-терапии для улучшения прогнозу в группе пациентов с высоким риском общей смерти.
Шкала риска MAGGIC (Meta-Analysis Global Group in Chronic Heart Failure) включает в себя 13 параметров: возраст, пол, индекс массы тела, ФВ ЛЖ, класс NYHA, креатинин плазмы, диабет, прием бета-блокаторов, ингибиторов ангиотензинпревращающего фермента или блокаторов рецепторов ангиотензина, САД, курение, хроническую обструктивную болезнь легких. Ограничение данной шкалы - завышение риска смерти у пациентов с низкой ФВ ЛЖ, невозможность применения у пациентов с ИКД. Достоверность прогноза, высчитанного по шкале MAGGIC, составляет 0,74 [Khanam S.S., Choi Е., Son J.W., Lee J.W. et al, Validation of the MAGGIC (Meta-Analysis Global Group in Chronic Heart Failure) heart failure risk score and the effect of adding natriuretic peptide for predicting mortality after discharge in hospitalized patients with heart failure. PLoS One. 2018 Nov 28; 13(11): e0206380. doi: 10.1371/journal.pone.0206380].
Следует также учитывать тот факт, что обе упомянутые шкалы также основаны на результатах достаточно давних РКИ, не отражающих современных реалий, не прошли валидизацию на российской популяции, поэтому не могут быть рекомендованы для практического применения.
Хазова Е.В. с соавторами, 2014 г. предложили новые подходы к прогнозированию исходов при СН с использованием совокупности клинических и генетических маркеров и показали, что наиболее значимыми редакторами наступления несмертельного сердечно-сосудистого события у больных с СН являются объем правого предсердия и размер правого желудочка; отягощенная наследственность, курение, женский пол. Предикторами смертельного события являлись генотип II по гену АСЕ и аллель М по гену ATG, перенесенный ИМ, результаты ШОКС и теста ходьбы, уровень креатинина и общего холестерина крови, и размер левого предсердия [Е.В. Хазова, О.В. Булашова, М.И. Малкова, В.Н. Ослопов. Новый подход к прогнозированию исходов хронической сердечной недостаточности. Практическая Медицина. 20014: 6; 101-104]. Недостаток предложенного метода - его сложность и невозможность проведения рутинного генетического тестирования.
Известен «Способ прогнозирования исхода заболевания у больных пожилого и старческого возраста с сердечной недостаточностью» (патент РФ 2353933), который предполагает определение в сыворотке крови больных содержания тканевого ингибитора матриксных металлопротеиназ 1 типа. При этом при величине содержания тканевого ингибитора матриксных металлопротеиназ 1 типа менее 710 нг/мл прогнозируют благоприятный исход заболевания, а при значении более 710 нг/мл - прогнозируют летальный исход заболевания в течение трех месяцев. Очевидные недостатки способа - невозможность использования в клинической практике, прогнозирование только риска летального исхода, применение только у лиц старше 65 лет.
«Способ прогнозирования риска смерти у больных с хронической сердечной недостаточностью с использованием эндогенного эритропоэтина сыворотки крови» (патент РФ 2766252 С1) основан на определении иммуноферментным методом содержания в сыворотке крови эндогенного эритропоэтина, что экономически необоснованно и недоступно в рутинной практике.
«Способ прогнозирования выживаемости пациентов старческого возраста с хронической сердечной недостаточностью» (патент РФ 2355316), предполагает оценку объективных и лабораторно-инструментальных данных, с дополнительным измерением концентрации МНУП и использование специального алгоритма. Способ ограничен возрастом пациентов, а также обязательным определением МНУП, что не всегда возможно на первичном этапе обследования, кроме того, концентрация МНУП весьма вариабельна и зависит от многих сопутствующих факторов. Кроме того, способ ограничен 28 месяцами наблюдения.
Существует «Способ прогнозирования риска сердечно-сосудистой летальности у больных с хронической сердечной недостаточностью ишемической этиологии, сочетающейся с сахарным диабетом 2 типа» (патент РФ 2531947 С1), основанный на определении количества прогениторных клеток иммунофенотипа CD34+, CD 133 dim, CD45- в периферической крови. Метод не применим на практике, а также ограничен пациентами с ишемической болезнью сердца и сахарным диабетом.
Известен «Способ прогнозирования риска смерти больных с хронической сердечной недостаточностью» (патент RU 2706975), предполагающий бальную оценку патологии почек согласно индексу Чарлсона. Недостатки способа - прогнозирование только годовой летальности, но не других нежелательных событий, а также отсутствие стратификации СН по величине фракции выброса левого желудочка.
«Способ прогнозирования выживаемости больных с хронической сердечной недостаточностью» (патент RU 2480749) основан на математических вычислениях по определенной формуле, включающей возраст пациента, концентрацию галектина-3 и цистатина С в плазме крови. К недостаткам данного метода следует отнести малый объем выборки, а также тот факт, что он применима только к пациентам, перенесшим ИМ, а применение метода невозможно в реальной клинической практике, так как требуемые биомаркеры не входят в стандарт обследования.
Существует «Способ прогнозирования выживаемости больного хронической сердечной недостаточностью с низкой фракцией выброса левого желудочка в течение 1 года» (патент RU 2646750), в основе которого лежит определение частоты дыхания и сердечных сокращений, уровня САД, концентрации МНУП в сыворотке крови. В отличие от предыдущих моделей, все определяемые параметры доступны в клинике, однако к недостаткам способа можно отнести то, что возможно прогнозирование только выживаемости в течение ограниченного периода времени (год), но не других неблагоприятных сердечно-сосудистых событий, кроме того, когорта пациентов ограничена возрастом - до 70 лет. Кроме того, данный способ не применим для пациентов с ИКД.
Итак, известно довольно много современных способов прогнозирования отдаленных исходов у пациентов с СН, валидизированных на российской популяции, но ни один из них не создавался на группе пациентов с ИКД, который вносит свой существенный вклад в прогноз пациентов с СН, снижая риск ВСС. Таким образов, все проведенные выше методы оценки прогноза неприменимы для пациентов с СН и ИКД.
С другой стороны, существующие способы оценки риска неблагоприятных исходов у пациентов с ИКД в основном нацелены на определение риска развития ЖНР, вероятности развития мотивированных или немотивированных шоков и не учитывают вклад существующей СН и риск неаримической смерти. Большинство исследований, нацелены на определение риска развития ЖНР у пациентов с СН, как дополнительного показания для имплантации кардиовертера-дефибриллятора. Так, например, было выявлено, что индекс дисперсии ≥101 мс и индекс диссинергии ≥6,1% у пациентов с СН являются предикторами фатальных желудочковых аритмий (р=0,004 и р=0,0001, соответственно), с чувствительностью 77%, и специфичностью 79% [Koji Fukuzawa, Akihiro Yoshida, Ken-ichi Hirata. Left ventricular dyssynergy and dispersion as determinant factors of fatal ventricular arrhythmias in patients with mildly reduced ejection fraction Eur Heart J Cardiovasc Imaging. 2015 Jul 9. pii: jev172].
Далее, в исследовании Атабекова Т.А. были изучены клинико-инструментальные показатели у пациентов с ишемической болезнью сердца, проведен многофакторный регрессионный анализ, по результатам которого определены независимые предикторы развития ЖНР и разработана прогностическая модель, которая позволяет выявить группу пациентов с высоким риском развития пароксизмальных ЖНР сердца у пациентов после ИМ, что должно послужить дополнительным показанием для установки ИКД (патент RU 2722656 С1).
Известен метод прогнозирования жизнеугрожающих ЖНР, основанный на создании персонализированной модели у пациентов с хронической СН, не имеющих имплантированных устройств с функцией дефибрилляции [Frolov A.V., Vaikhanskaya T.G., Melnikova О.Р., Vorobiev A.P., Guel L.M. Risk stratification personalised model for prediction of life-threatening ventricular tachyarrhythmias in patients with chronic heart failure. Kardiologia Polska 2017; 75,7: 682-688]. Недостаток метода - он неприменим для категории пациентов с ИКД, валидизирован на очень неоднородной категории пациентов с различной ФВ ЛЖ.
Если рассматривать когорту пациентов с уже имплантированным кардиовертером-дефибриллятором, то существующих моделей прогнозирования значительно меньше.
Известен «Способ прогнозирования вероятности детекции истинной желудочковой тахиаритмии у пациентов с имплантированными устройствами для первичной профилактики внезапной сердечной смерти» (патент № RU 2707141), который также используется для прогнозирования возникновения желудочковой тахиаритмии и основан на учете наличия различных форм предсердных тахиаритмий уже после имплантации ИКД. Недостатки способа - невозможность прогнозирования непосредственно исхода, малое количество учитываемых факторов.
Существует также «Способ прогнозирования развития жизнеугрожающих желудочковых нарушений ритма сердца и внезапной сердечной смерти у пациентов с ишемической болезнью сердца и сердечной недостаточностью со сниженной фракцией выброса в течение 12 месяцев после имплантации кардиовертера-дефибриллятора» (патент RU 2758120), основанный на определении галектина-3, являющегося маркером фиброза, до имплантации ИКД. Недостатки метода - прогнозирует только внезапную смерть, связанную с развитием ЖНР и неэффективностью ИКД, не учитывая другие механизмы смерти, период прогнозирования ограничен 12 месяцами, применим только для пациентов с ишемической этиологией СН.
Изучение предикторов смертности у пациентов с ИКД проводилось в исследовании PROSe-ICD (Prospective Observational Study of Implantable Cardioverter Defibrillators). Оно включало 1189 пациентов с систолической СН, которым для первичной профилактики ВСС был установлен ИКД. В среднем через 4,0 года периода наблюдения 343 пациента умерли и у 137 имела место адекватная генерация электрического импульса ИКД. Было показано, что высокий уровень интерлейкина-6 повышал риск развития адекватной генерации импульса (ОР=2.,23; р=0,02). Повышенный уровень С-реактивного белка, фактора некроза опухоли-альфа, МНУП, тропонина Т и иинтерлейкина-6 повышали риск смерти (р<0,001 для всех показателей) [Alan Cheng, Yiyi Zhang, Elena Blasco-Colmenares, Darshan Dalai, Barbara Butcher, Sanaz Norgard, Zayd Eldadah, Kenneth A. Ellenbogen, Timm Dickfeld, David D. Spragg, Joseph E. Marine, Eliseo Guallar, Gordon F. Tomaselli. Protein Biomarkers Identify Patients Unlikely to Benefit from Primary Prevention ICDs: Findings from the PROSE-ICD Study. CircArrhythm Electrophysiol. 2014: 10]. Недостатком этого метода является то, что он полностью основан на определении биохимических маркеров, большинство из которых рутинно не применяется в реальной клинической практике Кроме того, этот метод также не был валидизирован на российской популяции.
Таким образом, очевидно, что в настоящее время не существует адекватных способов оценки отдаленного неблагоприятного прогноза у пациентов с СН после имплантации кардиовертера-дефибриллятора для практического применения.
Предложенный способ оценки риска отдаленных неблагоприятных исходов у пациентов с сердечной недостаточностью и имплантированным кардиовертером-дефибриллятором отличается от существующих тем, что 1) при определении прогноза учитывается наличие обоих факторов (СН и ИКД); 2) прогностический период длительный - 4 года; 3) прогнозируется не только риск летального исхода, но риск всех неблагоприятных сердечно-сосудистых событий: инфаркт миокарда, инсульт, нестабильная стенокардию, внеплановая коронарная реваскуляризация, острая декомпенсация сердечной недостаточности; 4) способ основан на определении рутинных показателей, входящих в стандарт обследования пациента с СН и не требует дополнительных экономических затрат; 5) способ может применяться до имплантации ИКД и тем самым выявить тех пациентов, у которых имплантация кардиовертера-дефибриллятора способна реально улучшить отдаленный прогноз; 6) применение данного способа позволит снизить необоснованные экономические затраты на высокотехнологичную медицинскую помощь.
Для расчета прогноза необходимо знать следующие рутинные параметры: социальное положение пациента (работает/не работает), гипертрофию левого желудочка (толщина межжелудочковой перегородки (МЖП)) в см, ФВ ЛЖ в % и систолическое давление в легочной артерии (р(ЛА) в мм.рт.ст. по данным эхокардиографии, наличие ХОБЛ в анамнезе, принимает или не принимает пациент блокаторы ренин-ангиотензиновой системы (РААС).
Формула прогностической вероятности развития неблагоприятного сердечно-сосудистого события имеет следующий вид:
Р=1/(1+2,718(-0,635-3.515xX1+0,051хХ2+1,11хХ3+2,108хХ4+1,405хХ5-2,418хХ6)x100%
где,
X1 - толщина МЖП, указывается в см.;
Х2 - систолическое давление в легочной артерии, указывается в мм.рт.ст.;
Х3 - социальное положение, Х3=0, если пациент работает, Х3=1, если пациент не работает;
Х4 - наличие ХОБЛ, Х4=0, если ХОБЛ нет, Х4=1, если ХОБЛ есть;
Х5 - ФВ ЛЖ, Х5=0, если ФВ ЛЖ>40%, Х5=1, если ФВ ЛЖ<40%;
Х6 - прием блокатора РААС, Х6=0, если пациент не принимает, Х6=1, если пациент принимает;
P выше 50% свидетельствует о высокой вероятности развития неблагоприятного сердечно-сосудистого события.
Критерий согласия Хосмера-Лемешова для данной прогностической модели составил: χ2=3,624, р=0,889.
При проведении ROC-анализа площадь под ROC-кривой (AUC) созданной модели составила 0,8, что свидетельствует о высокой прогностической способности. Чувствительность модели равна 70%, специфичность - 75,9%.
Техническим результатом заявленного изобретения является разработка способа прогнозирования, учитывающего шесть факторов (социальное положение, величину ФВ ЛЖ, ГЛЖ, р (ЛА), ХОБЛ в анамнезе, прием блокатора РААС) в результате регистрового ретроспективно-проспективного исследования на российской популяции пациентов с СН и ИКД. Комплекс используемых прогностических факторов не учитывается ни в одной известной модели. Данные факторы были отобраны из нескольких исследованных показателей, как наиболее значимые путем проведения последовательно однофакторной и многофакторной логистической регрессии по Коксу.
В качестве неблагоприятных исходов предлагаемый способ прогнозирует не только смерть, но и другие неблагоприятные сердечнососудистые события (инфаркт миокарда, инсульт, нестабильную стенокардию, внеплановую коронарную реваскуляризацию, острую декомпенсацию сердечной недостаточности). Заявленный способ позволяет прогнозировать неблагоприятные события в течение 4-лет после имплантации кардиовертера-дефибриллятора у пациентов с СН со сниженной ФВ ЛЖ, а предлагаемая формула расчета вероятности неблагоприятного исхода показывает удельный вклад того или иного фактора в повышение риска, что поможет сконцентрировать внимание на наиболее значимых показателях.
Обоснование предлагаемого способа.
В исследование было включено 260 больных с СН и ИКД, как мужчин, так и женщин. Возраст больных составил 59 (53; 66) лет.
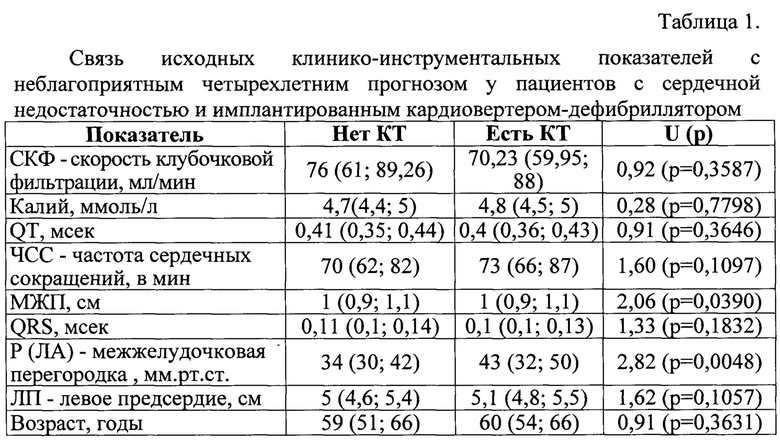
Кардиовертер-дефибриллятор имплантировался по стандартной методике для первичной и вторичной профилактики ВСС согласно рекомендациям Всероссийского научного общества специалистов по клинической электрофизиологии, аритмологии и кардиостимуляции (ВНОА) на 2-3 сутки от поступления. У больных в качестве предполагаемых предикторов неблагоприятного прогноза определяли следующие показатели: 1) количественные: возраст, годы; скорость югу бочковой фильтрации, мл/мин; уровень калия, ммоль/л; интервал QT, мсек; частота сердечный сокращений, толщина МЖП, см; комплекс QRS, мсек; р (ЛА), мм.рт.ст.; ЛП, см; 2) качественные: пол, социальное положение, данные анамнеза (артериальная гипертония, сахарный диабет, ХОБЛ, хроническая ишемия головного мозга, хроническая болезнь почек, ИБС, реваскуялризация, инфаркт миокарда, фибрилляция предсердий), ФВ ЛЖ менее 40%, степень и стадию СН, прием блокатора РААС).
Для построения математической модели, определяющей зависимость вероятности неблагоприятного годового прогноза от значений, перечисленных выше предикторов, использовали однофакторный и многофакторный линейный регрессионный анализ. Для количественных переменных был проведен линейный регрессионный анализ с использованием непараметрического U-критерия Манна-Уитни, для качественных признаков был проведен логистический регрессионный анализ с использованием хи-квадрата Пирсона и отношения шансов (ОШ) (с расчетом 95% доверительных интервалов (ДИ)). При однофакторном анализе были отобраны факторы, способные оказать влияние на прогноз (таблицы 1-2). Далее методом пошагового включения выполняли многофакторный регрессионный анализ по Коксу, который позволил включить в модель только наиболее значимые, высоко достоверные предикторы. При моделировании применялось регрессивное уравнение: где у - зависимая переменная, принимающая два значения: 0 - нет события, 1 - есть событие; а - константа; bi - коэффициенты регрессии; Xi - переменные. Рассчитывалась вероятность возникновения события Р, где Р - прогностическая вероятность, е - экспонента.
Вероятность Р неблагоприятного годового исхода инфаркта миокарда, осложненного систолической дисфункцией у пациентов с церебральным атеросклерозом вычисляется по формуле логистической регрессии:
Р=1/(1+2,718(-0,635-3,515xX1+0,051хХ2+1,11хХ3+2,108хХ4+1,405хХ5-2,418хХ6)x100%
где,
р - вероятность наступления нежелательного события в течение года после ИМ;
С применением ROC-анализа выносилось суждение об уровне качества созданной модели, при этом использовалось значение величины площади под ROC-кривой (AUC, area under the curve). Валидность модели оценивалась на основании процента верно переклассифицированных случаев и критерия Somers'D. Проверка общей согласованности прогностической модели с реальными данными осуществлена по критерию согласия Хосмера-Лемешова. Граница критического уровня значимости р соответствовала 0,05 (доверительная вероятность 0,95).
Важно, что предложенная формула прогнозирования проста для практического применения и не требует проведения дополнительных затратных методов дополнительной диагностики.
Примеры осуществления предлагаемого способа
Пример 1. Пациент А., 65 лет, мужчина, работающий, поступил для имплантации ИКД с диагнозом: Миокардит неуточненной этиологии с исходом в кардиосклероз. Вторичная ДКМП. Персистирующая форма фибрилляции предсердий. Пароксизмальная неустойчивая желудочковая тахикардия. Тромбоз ушка левого предсердия. Относительная недостаточность МК, ТК XCH II Б. ФК II.
По данным эхокардиографии припоступлении, ФВ ЛЖ составляет 28%, р (ЛА) 41 мм.рт.ст, МЖП 1,0 см. Принимает блокатор РААС периндоприл. ХОБЛ в анамнезе нет.
Для определения прогноза наступления неблагоприятного события у данного пациента в течение 4-х лет после имплантации ИКД учитываем толщину МЖП (1,0 см), р (ЛА) 41 мм.рт.ст., социальное положение (работает), отсутствие ХОБЛ в анамнезе, в анамнезе, ФВ ЛЖ менее 40%, прием блокатора РААС.
Значения переменных XI-Х6 подставляем в формулу расчета:
Р=1/(1+2,718(-0,635-3.515xX1+0,051хХ2+1,11хХ3+2,108хХ4+1,405хХ5-2,418хХ6)x100%
Х1=1;
Х2=41;
Х3=0;
Х4=0,
Х5=1
Х6=1
и рассчитываем Р
1/(1+2,718(-0,635-3.515x1+0,051х41+1,11х0+2,108х0+1,405х1-2,418хХ6)x100%=33%
Согласно проведенным расчетам, отдаленный прогноз у пациента при имплантации ИКД - относительно благоприятный (Р менее 50%), таким образом, имплантация ИКД целесообразна.
Пример 2. Пациент Б., 69 лет, неработающий, поступил в стационарс диагнозом: ИБС. Стенокардия ФК II Постинфарктный кардиосклероз неуточненной давности. Пароксизмальная неустойчивая желудочковая тахикардия. Ишемическая кардиомиопатия Имлантированный ИКД. ХСН II Б. ФК II. ХОБЛ средней степени тяжести.
По данным эхокардиографии при поступлении, ФВ ЛЖ составляет 29%, р (ЛА) 36 мм. рт.ст, МЖП 1,1 см. Блокатор РААС не принимает, ХОБЛ в анамнезе.
Для определения прогноза наступления неблагоприятного события у данного пациента в течение 4-х лет после имплантации ИКД учитываем толщину МЖП (1,1 см), р (ЛА) 36 мм.рт.ст., социальное положение (не работает), ХОБЛ в анамнезе, в анамнезе, ФВ ЛЖ менее 40%, отсутствие приема 6 локатора РААС.
Значения переменных X1-Х6 подставляем в формулу расчета:
Р=1/(1+2,718(-0,635-3.515xX1+0,051хХ2+1,11хХ3+2,108хХ4+1,405хХ5-2,418хХ6)x100%
Х1=1,1;
Х2=36;
Х3=1;
Х4=1,
Х5=1
Х6=0
и рассчитываем Р
1/(1+2,718(-0,635-3,515x1+0,051х41+1,11х0+2,108х0+1,405х1-2,418х1)x100%=67%
Согласно проведенным расчетам, отдаленный прогноз у пациента, не смотря на наличие ИКД, прогноз - неблагоприятный (Р более 50%). Таким образом, данному пациенту следует усилить медикаментозную терапию – назначить и блокатор РААС, титровать дозы медикаментозной терапии согласно существующим рекомендациям, активно проводить амбулаторное наблюдение у кардиолога.

Изобретение относится к медицине, а именно к кардиологии и может быть использовано для прогнозирования отдаленных неблагоприятных исходов у пациентов с сердечной недостаточностью и имплантированным кардиовертером-дефибриллятором. Для этого оценивают параметры: социальное положение пациента, работает или не работает; толщину межжелудочковой перегородки (МЖП)) в см; фракцию выброса левого желудочка (ФВ ЛЖ) в %; систолическое давление в легочной артерии (р(ЛА) в мм.рт.ст., по данным эхокардиографии; наличие хронической обструктивной болезни легких (ХОБЛ) в анамнезе; принимает или не принимает пациент ингибиторы блокаторов ренин-ангиотензиновой системы (РААС) и рассчитывают вероятность развития неблагоприятных сердечно-сосудистых событий P по разработанной математической формуле. Рассчитанное значение Р выше 50% свидетельствует о высокой вероятности развития неблагоприятного сердечно-сосудистого события. Изобретение позволяет с высокой точностью прогнозировать неблагоприятные исходы у данной категории пациентов в отделенном периоде после имплантации устройства, что, в свою очередь, позволяет оптимизировать план дальнейшего наблюдения пациентов при наличии высокого риска неблагоприятного исхода. 2 табл., 2 пр.
Способ прогнозирования отдаленных неблагоприятных исходов у пациентов с сердечной недостаточностью и имплантированным кардиовертером-дефибриллятором, отличается тем, что оценивают параметры: социальное положение пациента, толщину межжелудочковой перегородки (МЖП) в см, фракцию выброса левого желудочка (ФВ ЛЖ) в %, систолическое давление в легочной артерии (р(ЛА) в мм.рт.ст., по данным эхокардиографии, наличие хронической обструктивной болезни легких (ХОБЛ) в анамнезе, принимает или не принимает пациент ингибиторы блокаторов ренин-ангиотензиновой системы (РААС) и рассчитывают вероятность развития неблагоприятных сердечно-сосудистых событий:
P=1/(1+2,718(-0,635-3.515хХ1+0,051xX2+1,11хХ3+2,108хХ4+1,405хХ5-2,418хХ6)x100% где,
р - вероятность развития события,
X1 - толщина МЖП, см;
Х2 - систолическое давление в легочной артерии, мм.рт.ст.;
Х3 - социальное положение, Х3=0, если пациент работает, Х3=1, если пациент не работает;
Х4 - наличие ХОБЛ, Х4=0, если ХОБЛ нет, Х4=1, если ХОБЛ есть;
Х5 - ФВ ЛЖ, Х5=0, если ФВ ЛЖ>40%, Х5=1, если ФВ ЛЖ<40%;
Х6 - прием блокатора РААС, Х6=0, если пациент не принимает, Х6=1, если пациент принимает;
Р выше 50% свидетельствует о высокой вероятности развития неблагоприятного сердечно-сосудистого события.
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ НЕБЛАГОПРИЯТНЫХ СЕРДЕЧНО-СОСУДИСТЫХ СОБЫТИЙ У БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА В ТЕЧЕНИЕ 12 МЕСЯЦЕВ ПОСЛЕ ДЕКОМПЕНСАЦИИ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ | 2020 |
|
RU2756391C1 |
| Способ прогнозирования прогрессирования хронической сердечной недостаточности в течение года после перенесенного инфаркта миокарда | 2019 |
|
RU2716749C1 |
| JP 0005945063 B2, 05.07.2016 | |||
| Совок для отмеривания определенных порций сыпучего продукта | 1929 |
|
SU20349A1 |
| ТЕПЛЯКОВ А.Т | |||
| и др | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2024-05-16—Публикация
2023-03-01—Подача