ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к области медицины, и, в частности, относится к трициклическому пиримидиноновому соединению, способу его получения, его лекарственной композиции и его применению в медицине.
УРОВЕНЬ ТЕХНИКИ
Липопротеин-ассоциированная фосфолипаза А2 (Lp-PLA2) является членом суперсемейства фосфолипаз А2 (Dennis ЕА, Cao J, Hsu YH, Magrioti V, Kokotos G. Chem Rev. 2011, 111, 6130-6185). Она в основном секретируется моноцитами, макрофагами, Т-лимфоцитами и главными клетками (StafForini DM, Elstad MR, Mcliterrre TM, Zimmerman GA, Prescott SM. J Biol Chem. 1990, 265: 9682-9687; Nakajima K, Murakami M, Yanoshita R, Samejima Y, Karasawa K, Setaka M, Nojima S Kudo I. J Biol Chem. 1997, 272, 19708-19713). Эфиры фосфатидилхолина sn-2 образуются во время окисления липопротеина низкой плотности (ЛПНП). Lp-PLA2 отвечает за гидролиз окисленного эфира фосфатидилхолина sn-2, который затем продуцирует окисленные жирные кислоты и лизофосфатидилхолин (LysoPC) (Caslake MJ, Packard CJ, Suckling KE, Holmes SD, Chamberlain P, Macphee CH. Atherosclerosis. 2000, 150, 413-419; MacPhee CH, Moores KE, Boyd HF, Dhanak D, 1fe RJ, Leach СA, Leake DS, Milliner KJ, Patterson RA, Suckling KE, Tew DG, Hickey DM. Biochem J. 1999, 338, 479-487). Как окисленные жирные кислоты, так и LysoPC играют роль в активации макрофагов, увеличивая окислительный стресс, оказывая влияние на функцию Т-лимфоцитов и индуцируя воспалительные реакции (Quinn МТ, Parthasarathy S, Steinberg D.Proc Natl Acad Sci USA. 1988, 85, 2805-2809). Как сообщалось, LysoPC индуцируют высвобождение множественных цитотоксических воспалительных цитокинов (Shi, et al., Atherosclerosis, 2007, 191, 54-62). Кроме того, LysoPC также участвовали в активации лейкоцитов, индукции апоптоза и опосредовании эндотелиальной дисфункции (Wilensky et al., Current Opinion in Lipidology, 2009, 20, 415-420).
Как сообщалось, уровень Lp-PLA2 в плазме связан с сердечно-сосудистыми заболеваниями (Fitzpatrick AL, Irizarry МС, Cushman М, Jenny NS, CHI GC, Kоrо С. Atherosclerosis. 2014, 235, 384-391), диабетическим макулярным отеком (DME) (Staurenghi G, Ye L, Magee MH, Danis RP, Wurzelmann J, Adamson P, McLaughlin MM, Darapladib DMES G. Ophthalmology. 2015, 122, 990-996) и раком предстательной железы (Bertilsson Н, Tessem MB, Flatberg A, Viset Tribbestad I, Angelsen A, Halgunset J. Clin Cancer Res. 2012, 18, 3261-3269).
Болезнь Альцгеймера (БА) представляет собой хроническое нейродегенеративное заболевание, которое приводит к снижению когнитивных способностей, перепадам настроения, необратимой потере памяти, дезориентации, нарушению речи и потере самосохранения (Hardy J, et al. Science 2002, 297, 353-356). Болезнь Альцгеймера обычно начинается медленно, состояние ухудшается с течением времени, что является причиной от 60% до 70% случаев деменции и затрагивает около 6% населения в возрасте старше 65 лет. Пациенты с БА постепенно отдаляются от семьи и общества, все больше и больше полагаются на помощь и в конечном итоге умирают. БА является одним из наиболее дорогостоящих заболеваний в развитых странах, а также требует высоких затрат в других странах. Эти затраты будут расти, особенно учитывая, что старение становится серьезной социальной проблемой. Нет необходимости говорить о том, что БА - это сложное заболевание, включающее множество факторов. Хоть и этиология БА не до конца установлена, очевидно, что в возникновении и прогрессировании заболевания участвует несколько факторов, включая агрегированный тау-белок и пептид Аβ, окислительный стресс и нейровоспаление (Echeverria V, Yarkov A, Aliev G. Prog Neurobiol. 2016, 144, 142-157). Современные исследования и разработки лекарственного средства от БА сосредоточены на мишенях Аβ-амилоидоза и тау (Chiang K, Коо EH. Аппи Rev Pharmacol Toxicol. 2014, 54, 381-405; Awasthi M, Singh S, Pandey VP, Dwivedi UN. J Neurol Sci. 2016, 361, 256-271). Однако, несмотря на достоверные данные доклинических исследований, результаты клинических исследований на поздней стадии до сих пор не продемонстрировали клинической эффективности. Эти разочаровывающие результаты дают основание предположить, что для терапии БА возможно придеться изучить другие механизмы нейропатологии, такие как окислительный стресс и нейровоспаление.
Повышенные уровни Lp-PLA2 в плазме повышают риск деменции, включая БА (Van Oijen, et al. Annals of Neurology, 2006, 59, 139). Помимо сосудистой деменции и смешанной деменции, у пациентов с БА были обнаружены высокие уровни окисленных ЛПНП (Maher-Edwards G, De'Ath J, Barnett С, Lavrov A, Lockhart A, Alzheimer's & Dementia: Translational Research & Clinical Interventions. 2015, 1, 131-140; Kassner et al. Current Alzheimer Research, 2008, 5, 358-366; Dildar, et al., Alzheimer Dis Assoc Disord, 24, April-June (2010); Sinem, et al. Current Alzheimer Research, 2010, 7, 463-469). У пациентов с БА также было обнаружено неировоспаление и повышение уровня экспрессии множественных воспалительных цитокинов (Colangelo, et al., Journal of Neuroscience Research, 2002, 70, 462-473; Wyss-Coray, Nature Medicine, 2006, 12, Sept.).
На основании всех этих результатов Lp-PLA2 является потенциальной мишенью для лечения БА, и это дополнительно подтверждается клиническими результатами применения ингибитора Lp-PLA2 рилапладиба для пациентов с БА (Maher-Edwards G, De'Ath J, Barnett С, Lavrov A, Lockhart A, Alzheimer's & Dementia: Translational Research & Clinical Interventions. 2015, 1, 131-140).
Глаукома и возрастная макулярная дегенерация (ВМД) являются нейродегенеративными заболеваниями сетчатки. Buschini et al. сообщали, что воспаление, включая передачу сигналов ФНО-α, может играть важную роль в патогенезе глаукомы и ВМД (Buschini et al, Progress in Neurobology, 2011, 95, 14-25; Tezel, Progress in Brain Research, vol. 173, ISSN0079-6123, Chapter 28). Кроме того, Shi с соавторами продемонстрировали, что ингибиторы Lp-PLA2 могут блокировать высвобождение воспалительных цитокинов (Shi, et al., Atherosclerosis, 2007, 191, 54-62). Ингибирование Lp-PLA2 является потенциальным лечением глаукомы и AMD.
Также сообщалось о ряде ингибиторов Lp-PLA2, включая β-лактамы (Tew DG, Boyd HF, Ashman S, Theobald C, Leach CA. Biochemistry. 1998, 37, 10087-10093), оксимы (Jeong TS, Kim MJ, Yu H, Kim HS, Choi JK, Kim SS, Lee WS. Bioorg Med Chem Lett. 2005, 15, 1525-1527; Jeong HJ, Park YD, Park HY, Jeong IY, Jeong TS, Lee WS. Bioorg Med Chem Lett. 2006, 16, 5576-5579), амиды ксантуровой кислоты (Lin EC, Hu Y, Amantea CM, Pham LM, Cajica J, Okerberg E, Brown HE, Fraser A, Du L, Kohno Y, Ishiyama J, Kozarich JW, Shreder KR. Bioorg Med Chem Lett. 2012, 22, 868-871; Hu Y, Lin EC, Pham LM, Cajica J, Amantea CM, Okerberg E, Brown HE, Fraser A, Du L, Kohno Y, Ishiyama J, Kozarich JW, Shreder KR. Bioorg Med Chem Lett. 2013, 23, 1553-1556) и карбаматы (Nagano JM, Hsu KL, Whitby LR, Niphakis MJ, Speers AE, Brown SJ, Spicer T, Fernandez-Vega V, Ferguson J, Hodder P, Srinivasan P, Gonzalez TD, Rosen H, Bahnson В J, Cravatt BE Bioorg Med Chem Lett. 2013, 23, 839-843).
Сообщалось, что ингибитор Lp-PLA2 дарапладиб является потенциальной терапией против атеросклероза и диабетического макулярного отека (ДМО) (Magrioti V, Kokotos CExpert Opin TherPat. 2013; 23: 333-344).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения обнаружили, что ингибиторы Lp-PLA2 играют важную роль в лечении нейродегенеративных связанных заболеваний, таких как болезнь Альцгеймера (БА), глаукома и возрастная макулярная дегенерация (ВМД), или сердечнососудистых заболеваний, включая атеросклероз. По этой причине авторы настоящего изобретения разработали новый тип ингибитора Lp-PLA2, трициклического пиримидинонового соединения.
Указанное три циклическое пиримидинононовое соединение представляет собой соединение, имеющее структуру, представленную формулой (I), или его фармацевтически приемлемую соль:

где
каждый n1, n2 и n3 независимо равен 0, 1 или 2;
каждый R1 и R2 независимо выбран из -Н, гидроксила, циано, галогена, алкила, дейтерированного алкила, гидроксиалкила, галoгeналкила, циклоалкила, алкокси, галогеналкокси, дейтерированного алкокси;
каждый X1 и Х2 независимо выбран из алкилена, -О-, -S- или -NR'-,
R' выбран из -Н, алкила, дейтерированного алкила или циклоалкила;
Аr представляет собой ариленовую группу или гетероариленовую группу, где атомы водорода в арилене или гетероарилене необязательно замещены 0, 1 или более заместителями, и каждый из заместителей независимо выбран из галогена, алкила, дейтероалкила, галогеналкила, алкокси, дейтероалкокси, галогеналкокси, гидрокси, гидроксиалкила, циано, амино, моноалкил- или диалкилзамещенного амино, нитро, карбоксила, альдегида, циклоалкила, гетероциклила, арила или гетероарила;
Y представляет собой -Н, галоген, алкил, галогеналкил, галогеналкокси, циклоалкил, алкокси, дейтерированный алкил, дейтерированный алкокси, -ОАr', -SAr', -NH-Ar', NMe-Ar' -NR'' или -R'''-Ar';
Ar' выбран из арила или гетероарила, где атомы водорода в ариле или гетероариле необязательно замещены одним или более заместителями, каждый из которых независимо выбран из галогена, алкила, дейтерированного алкила, галогеналкила, алкокси, дейтерированного алкокси, гидрокси, гидроксиалкила, галогеналкокси, циано, амино, нитро, карбоксила, альдегида, циклоалкила, гетероциклила, арила или гетероарила;
R'' представляет собой алкил;
R''' представляет собой алкилен;
Z представляет собой О или S.
Необязательно, каждый галоген в «галогене», «галогеналкиле» и «галогеналкокси» независимо выбран из F, Cl, Вr или I;
необязательно, каждый алкил в «алкиле», «дейтерированном алкиле», «гидроксиалкиле», «галогеналкокси», «алкокси» и «моно- или диалкилзамещенном амино» независимо представляет собой C1-С10 линейный или разветвленный алкил;
необязательно каждый независимо представляет собой С1-С7 линейный или разветвленный алкил; необязательно каждый независимо представляет собой С1-С4 линейный или разветвленный алкил; и необязательно выбран из метила, этила, н-пропила, изопропила, н-бутила, изобутила, трет-бутила, втор-бутила, н-пентила, 1-метилбутила, 2-метилбутила, 3-метилбутила, изопентила, 1-этилпропила, неопентила, н-гексила, 1-метилпентила, 2-метилпентила, 3-метилпентила, изогексила, 1,1-диметилбутила, 2,2-диметилбутила, 3,3-диметилбутила, 1,2-диметилбутила, 1,3-диметилбутила, 2,3-диметилбутила, 2-этилбутила, н-гептила, 2-метилгексила, 3-метилгексила, 2,2-диметилпентила, 3,3-диметилпентила, 2,3-диметилпентила, 2,4-диметилпентила, 3-этилпентила или 2,2,3-триметилбутила;
необязательно, каждый «алкилен» независимо представляет собой C1-С10 линейный или разветвленный алкилен; необязательно выбран из С1-С7 линейного или разветвленного алкилена; необязательно выбран из С1-С5 линейного или разветвленного алкилена; и, необязательно, каждый алкилен, выбранный из метилена, этилена, н-пропилена, изопропилена, н-бутилена, изобутилена, трет-бутилена, втор-бутилена, н-пентилена, 1-метилбутилена, 2-метилбутилена, 3-метилбутилена, изопентилена, 1-этилпропилена, неопентилена, н-гексилена, 1-метилпентилена, 2-метилпентилена, 3-метилпентилена, изогексилена, 1,1-диметилбутилена, 2,2-диметилбутилена, 3,3-диметил бутиле на, 1,2-диметилбутилена, 1,3-диметилбутилена, 2,3-диметилбутилена, 2-этилбутилена, н-гептилена, 2-метилгексилена, 3-метилгексилена, 2,2-диметилпентилена, 3,3-диметилпентилена, 2,3-диметилпентилена, 2,4-диметилпентилена, 3-этилпентилена или 2,2,3-триметилбутилена;
необязательно, «циклоалкил» представляет собой С3-С10 моноциклический или бициклический циклоалкил, необязательно С3-С7 моноциклический циклоалкил и необязательно циклопропил, циклобутил, циклопентил, циклогексил или циклогептил;
необязательно, «гетероциклил» представляет собой 3-10-членное неароматическое гетероциклическое кольцо, содержащее 1, 2 или 3 гетероатома, выбранных из N, О и S; необязательно, 3-10-членное неароматическое кольцо, содержащее 1 или 2 гетероатома, выбранных из N и О; необязательно, 3-6-членное неароматическое кольцо, содержащее 1 или 2 гетероатома, выбранных из N и О; необязательно, 3-10-членное неароматическое кольцо, содержащее 1 или 2 гетероатома, выбранных из N и S; и, необязательно, 3-6-членное неароматическое кольцо, содержащее 1 или 2 гетероатома, выбранных из N и S;
необязательно, «арил» представляет собой 6-10-членный арил; необязательно фенил или нафтил, и необязательно фенил, 1-нафтил или 2-нафтил;
необязательно, «арилен» представляет собой 6-10-членный арилен; и необязательно фенилен или нафтилен;
необязательно, «гетероарильное кольцо» представляет собой 5-10-членное гетероарильное кольцо, содержащее 1-3 гетероатома, выбранных из N, О и S; необязательно 5-10-членное гетероарильное кольцо, содержащее 1-2 гетероатома, выбранных из N, О и S; необязательно, гетероарильное кольцо выбрано из пиридинового кольца, пиррольного кольца, пиразольного кольца, пиримидинового кольца, пиразинового кольца, пиридазинового кольца, тиофенового кольца и фуранового кольца; необязательно выбрано из пиридин-2-ила, пиридин-3-ила, пиридин-4-ила, пиридазин-3-ила, пиридазин-4-ила, пиримидин-2-ила, пиримидин-4-ила, пиримидин-5-ила, пиразин-2-ила, пиразин-3-ила, индолила, изоиндолила, индазолила, индолизинила, пуринила, хинолизинила, хинолинила, изохинолинила, циннолинила, фталазинила, нафтиридинила, хиназолинила, хиноксалинила, тиено[2,3-b]фуранила, фуро[3,2-b]-пиранила, пиридо[2,3-d]оксазинила, пиразоло[4,3-d]окcазолила, имидазо[4,5-d]тиазолила, пиразино[2,3-d]пиридазинила, имидазо[2,1-b]тиазолила, имидазо[1,2-b][1,2,4]триазинила, бензотиенила, бензоксазолила, бензимидазолила, бензотиазолила, бензоксепинила, бензоксазинила, бензофуранила, бензотриазолила, пирроло[2,3-b]пиридила, пирроло[3,2-с]пиридинила, пирроло[3,2-b]пиридила, имидазо[4,5-b]пиридила, имидазо[4,5-с]пиридила, пиразоло[4,3-d]пиридила, пиразоло[4,3-с]пиридила, пиразоло[3,4-с]пиридинила, пиpaзoлo[3,4-d]пиpидилa, пиразоло[3,4-b]пиридинила, имидазо [1,2-а]пиридинила, пиразоло[1,5-а]пиридинила, пирроло[1,2-b]пиридазинила, имидазо[1,2-с]пиримидинила, пиридо[3,2-d]пиримидинила, пиридо[4,3-d]пиримидинила, пиpидo[3,4-d]пиpимидинилa, пиpидo[2,3-d]пиpимидинилa, пиридо[2,3-b]пиразинила, пиридо[3,4-b]пиразинила, пиpимидo[5,4-d]пиpимидинилa, пиразоло[2,3-b]пиразинила или пиpимидo[4,5-d]пиpимидинилa; и необязательно выбран из пиридин-2-ила, пиридин-3-ила, пиридин-4-ила, пиримидин-2-ила, пиримидин-4-ила или пиримидин-5-ила;
необязательно «гетероарилен» представляет собой 5-10-членное гетероариленовое кольцо, содержащее 1-3 гетероатома, выбранных из N, О и S; необязательно 5-10-членное гетероароматическое кольцо, содержащее 1-2 гетероатома, выбранных из N, О и S; и необязательно гетероариленовое кольцо выбрано из пиридинового кольца, пиррольного кольца, пиразольного кольца, пиримидинового кольца, пиразинового кольца, пиридазинового кольца, тиофенового кольца, фуранового кольца.
Необязательно, каждый n1, n2 и n3 независимо равен 0, 1 или 2.
Необязательно, n1 равен 0 или 1.
Необязательно, n1 равен 0.
Необязательно, n2 равен 0 или 1.
Необязательно, n2 равен 1.
Необязательно, n3 равен 1.
Необязательно, каждый R1 и R2 независимо выбран из -Н, фтора, хлора, брома, гидроксила, циано, С1-С7 алкила (такого как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, втор-бутил, н-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, изопентил, 1-этилпропил, неопентил, н-гексил, 1-метилпентил, 2-метилпентил, 3-метилпентил, изогексил, 1,1-диметилбутил, 2,2-диметилбутил, 3,3-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,3-диметилбутил, 2-этилбутил, н-гептил, 2-метилгексил, 3-метилгексил, 2,2-диметилпентил, 3,3-диметилпентил, 2,3-диметилпентил, 2,4-диметилпентил, 3-этилпентил или 2,2,3-триметилбутил), С1-С3 дейтероалкила (такого как -CD3, -C2D5 или -C3D7), С1-С3 дейтероалкоксила (такого как -OCD3, -OC2D5 или -OC3D7), галогеналкила, гало ген ал кокс ила, циклопропанила, циклобутанила, циклопентанила; необязательно, R1 представляет собой -Н или -СН3; и необязательно, R1 представляет собой-Н, R2 представляет собой-Н;
необязательно, каждый X1 и Х2 независимо выбран из С1-С7 алкилена (необязательно, -СН2-, этилена, н-пропилена, изопропилена, н-бутилена или изобутилена), -О-, -S- или -NR'-; необязательно, X1 представляет собой -СН2- или -О-; необязательно, X1 представляет собой -О-; необязательно, Х2 представляет собой -О-;
необязательно, R' выбран из -Н, С1-С7 алкила (необязательно, метила, этила, н-пропила, изопропила, н-бутила, изобутила, трет-бутила, втор-бутила, н-пентила, 1-метилбутила, 2-метил бутила, 3-метилбутила, изопентила, 1-этилпропила, неопентила, н-гексила, 1-метилпентила, 2-метилпентила, 3-метилпентила, изогексила, 1,1-диметилбутила, 2,2-диметилбутила, 3,3-диметилбутила, 1,2-диметилбутила, 1,3-диметилбутила, 2,3-диметил бутила, 2-этилбутила, н-гептила, 2-метилгексила, 3-метилгексила, 2,2-диметилпентила, 3,3-диметилпентила, 2,3-диметилпентила, 2,4-диметилпентила, 3-этилпентила или 2,2,3-триметилбутила), дейтерированного алкила (необязательно, -CD3, -C2D5 или -C3D7) или С3-С6 циклоалкила (необязательно, циклопропанила, циклобутанила, циклопентанила или циклогексанила);
необязательно, Аr представляет собой фенилен или пиридил, где атомы водорода в указанном фенилене или пиридиле необязательно замещены 0, 1, 2 или 3 заместителями, каждый из которых независимо выбран из F, Cl, Br, I, -CN, -Me, -С2Н5, циклопропила, -CD3, -ОМе, -OCD3, -CF3 или -OCF3; необязательно, Аr представляет собой фенилен, где атом водорода в указанном фенилене необязательно замещен 2 заместителями, и указанный заместитель представляет собой F;
необязательно, Y представляет собой -Н, -F, -О, -Вr, метил, этил, н-пропил, изопропил, -CD3, -CF3, -CH2CF3, -OCF3, -OCHF2, -OCH2F, циклопропил, циклобутил, циклопентил, -ОСН3, -OCD3, -ОС2Н5, -ОС3Н7 или -ОАr';
необязательно, Y представляет собой Н, галоген или -ОАr'; и необязательно, Y представляет собой Н, -F или -ОАr';
Аr' выбран из фенила, пиридила, пиримидила, пирролила, пиразолила, тиенила или хинолинила и фенила, пиридила, пиримидила, пирролила, пирролила, пиразолила, тиенила или хинолина;
необязательно, Аr' выбран из фенила, пиридила, пиримидила, пирролила, пиразолила, тиенила или хинолинила, где каждый из атомов водорода в фениле, пиридиле, пиримидиле, пирролиле, пиразолиле, тиениле или хинолинильном кольце независимо необязательно замещен 1, 2 или 3 заместителями, при этом каждый из заместителей независимо выбран из F, Cl, Br, -CN, C1-C7 алкила (необязательно, метила, этила, н-пропила, изопропила, н-бутила, изобутила, трет-бутила, втор-бутила, н-пентила, 1-метил бутила, 2-метилбутила, 3-метилбутила, изопентила, 1-этилпропила, неопентила, н-гексила, 1-метилпентила, 2-метилпентила, 3-метилпентила, изогексила, 1,1-диметилбутила, 2,2-диметилбутила, 3,3-диметилбутила, 1,2-диметилбутила, 1,3-диметилбутила, 2,3-диметилбутила, 2-этилбутила, н-гептила, 2-метилгексила, 3-метилгексила, 2,2-диметилпентила, 3,3-диметилпентила, 2,3-диметилпентила, 2,4-диметилпентила, 3-этилпентила или 2,2,3-триметилбутила), -CD3, C1-C6 галогеналкила, -ОСН3, -OCD3, -ОС2Н7, -ОС3Н7, C1-С6 галогеналкоксила или С3-С6 циклоалкила (необязательно, циклопропанила, циклобутанила, циклопентанила или циклогексанила);
необязательно, Аr' выбран из фенила, пиридин-3-ила, пиридин-4-ила или пиримидин-5-ила и необязательно замещен 1 или 2 заместителями, где указанные заместители выбраны из F, Сl, -СН3, -CF3 или -OCF3;
необязательно, Z представляет собой О.
Необязательно, соединение формулы (I) или его фармацевтически приемлемая соль включают соединение формулы (I), выбранное из следующих соединений:
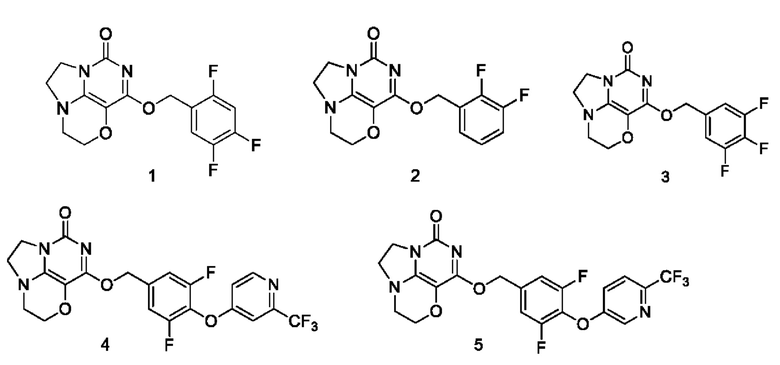
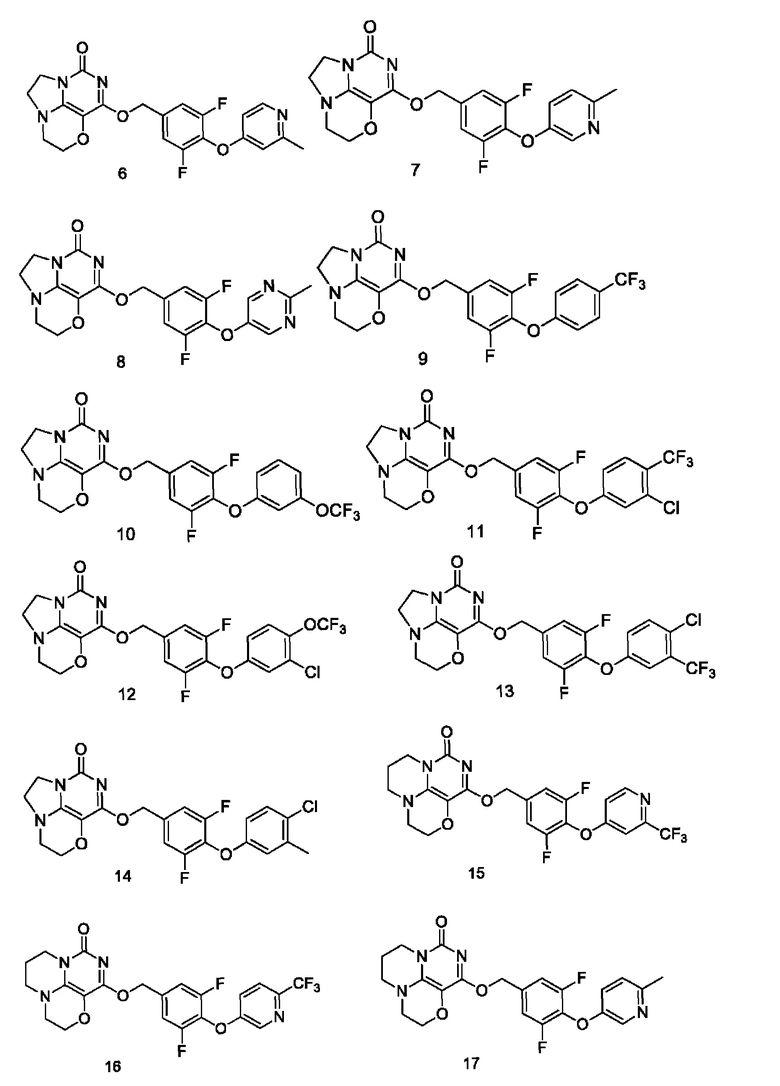
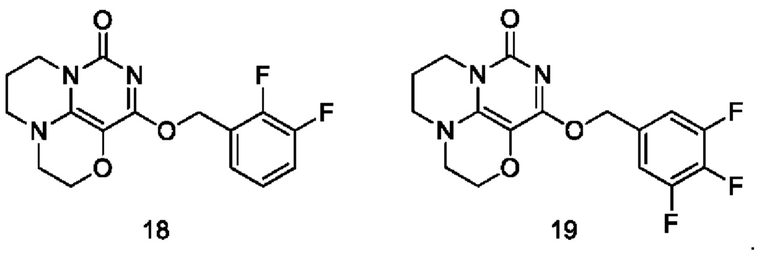
Необязательно, соединение формулы (I) или его таутомеры, мезоформы, рацематы, энантиомеры, диастереоизомеры или их смеси или фармацевтически приемлемые соли включают анионные соли и катионные соли соединений формулы (I);
необязательно, фармацевтически приемлемая соль включает соль щелочного металла, соль щелочноземельного металла или аммонийную соль соединения формулы (I); необязательно, указанный щелочной металл включает натрий, калий, литий или цезий, и указанный щелочноземельный металл включает магний, кальций или стронций;
необязательно, фармацевтически приемлемая соль содержит соединение формулы I или его таутомер, мезоформ, рацемат, энантиомер, диастереоизомер или смесь с органическим основанием;
необязательно, органическое основание включает триалкиламин, пиридин, хинолин, пиперидин, имидазол, пиколин, диметиламинопиридин, диметиланилин, N-алкилморфолин, 1,5-диазабицикло[4.3.0]нонен-5,8-диазабицикло[5.4.0]ундецен-7, 1,4-диазабицикло[2.2.2]октан; в качестве альтернативы, все описанные триалкиламины включают триметиламин, триэтиламин, N-этилдиизопропиламин; необязательно, описанный N-алкилморфолин включает N-метилморфолин;
необязательно, фармацевтически приемлемая соль содержит соединение формулы I или его таутомер, мезоформ, рацемат, энантиомер, диастереоизомер или смесь с кислотой;
необязательно, указанная кислота включает неорганическую кислоту или органическую кислоту; при этом, необязательно, указанная неорганическая кислота включает хлористоводородную кислоту, бромистоводородную кислоту, йодистоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту или угольную кислоту; необязательно, указанная органическая кислота включает муравьиную кислоту, уксусную кислоту, пропионовую кислоту, щавелевую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, малеиновую кислоту, молочную кислоту, яблочную кислоту, лимонную кислоту, лимонную кислоту, винную кислоту, угольную кислоту, пикриновую кислоту, метансульфоновую кислоту, этансульфоновую кислоту, п-толуолсульфоновую кислоту, глутаминовую кислоту или памовую кислоту.
В другом аспекте предложен способ получения соединения формулы (I) или его фармацевтически приемлемой соли, включающий стадию взаимодействия соединения формулы (II) с соединением формулы (III) с получением соединения формулы (I):
В другом аспекте предложен способ получения соединения формулы (I) или его таутомера, мезомера, рацемата, энантиомера, диастереоизомер а или их смеси или фармацевтически приемлемой соли. Указанный способ представлен в виде приведенной ниже схемы реакции:
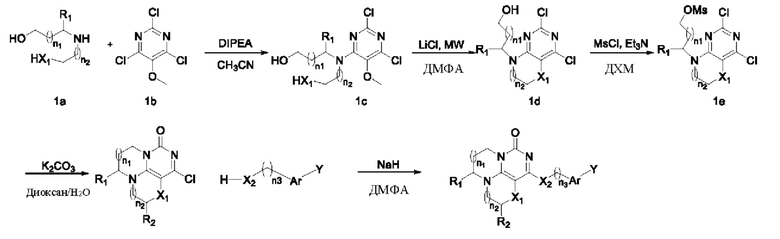
В каждой из формул в способе получения, описанном выше, n1, n2, n3, R1, R2, X1, Х2, Аr и Y являются такими, как определено выше.
Конкретных ограничений для вышеуказанных условий реакции нет. Все реакции могут быть осуществлены в обычных условиях.
В другом аспекте предложена фармацевтическая композиция, содержащая терапевтически эффективное количество одного или более из соединения формулы (I) или его фармацевтически приемлемой соли и, необязательно, фармацевтически приемлемое вспомогательное вещество(-а).
В другом аспекте предложена фармацевтическая композиция, содержащая терапевтически эффективное количество вышеупомянутого соединения формулы (I) или его таутомера, мезоформы, рацемата, энантиомера, диастереомера, одного или более изомеров или их смесь или их фармацевтически приемлемой соли и, необязательно, фармацевтически приемлемый носитель.
Необязательно, лекарственная форма фармацевтической композиции включает пероральный, ректальный или парентеральный состав;
необязательно, пероральный состав включает твердый или жидкий состав;
необязательно, твердый состав включает таблетку, порошок, гранулу или капсулу;
необязательно, жидкий состав включает водную или масляную суспензию или сироп;
необязательно, парентеральный состав включает раствор для инъекций или водную или масляную суспензию.
В другом аспекте предложено вышеупомянутое соединение формулы (I) или его таутомер, мезомер, рацемат, энантиомер, диастереоизомер или их смесь или его фармацевтически приемлемая соль или вышеупомянутая фармацевтическая композиция для получения ингибитора Lp-PLA2.
В другом аспекте предложено вышеупомянутое соединение формулы (I) или его таутомер, мезомер, рацемат, энантиомер, диастереоизомер или их смесь или его фармацевтически приемлемая соль или вышеупомянутая фармацевтическая композиция для получения лекарственного средства для лечения заболеваний, связанных с нейродегенерацией.
Необязательно, связанные с нейродегенерацией заболевания включают болезнь Альцгеймера (БА), глаукому и возрастную макулярную дегенерацию (AMD).
В другом аспекте предложено вышеупомянутое соединение формулы (I) или его таутомер, мезомер, рацемат, энантиомер, диастереоизомер или их смесь или его фармацевтически приемлемая соль или вышеупомянутая фармацевтическая композиция для получения лекарственного средства для лечения сердечно-сосудистых заболеваний, диабетического макулярного отека (ДМО) или заболеваний предстательной железы.
Необязательно, указанные сердечно-сосудистые заболевания включают атеросклероз.
Благоприятные эффекты настоящего изобретения заключаются в следующем:
соединение формулы (I) представляет собой трициклическое пиримидиноновое соединение в качестве нового ингибитора Lp-PLA2. Он может быть использован для лечения нейродегенеративных заболеваний, таких как болезнь Альцгеймера (БА), глаукома и возрастная дегенерация желтого пятна (ВМД), или сердечно-сосудистых заболеваний, включая атеросклероз.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение дополнительно проиллюстрировано следующими примерами. Следует понимать, что варианты реализации в настоящем документе используются только для иллюстрации настоящего изобретения и никоим образом не ограничивают объем настоящего изобретения.
Исходные вещества для настоящего изобретения могут быть синтезированы способом, известным в данной области техники, или могут быть приобретены в компаниях ABCR GmbH & Co.KG, Acros Organics, Aldrich Chemical Company, Accela ChemBio Inc., Dairy Chemicals и других.
Если не указано иное, раствор в примерах относится к водному раствору.
Если не указано иное, температура, при которой в примерах проводится реакция, равна комнатной температуре, и составляет, например, от 20°С до 30°С.
Пример 1
Получение соединения 1

Стадия I: Получение соединения 1с
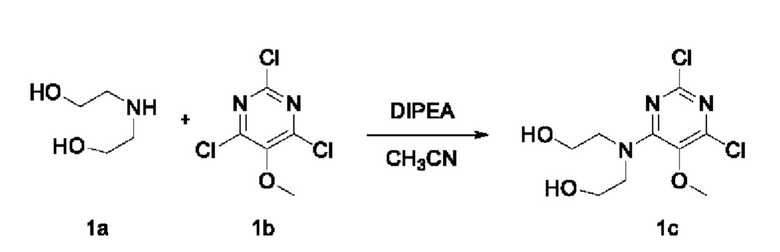
При комнатной температуре 2,4,6-трихлор-5-метоксипиримидин 1b (1,5 г, 7,03 ммоль), диэтаноламин 1а (1,1 г, 10,5 ммоль) и диизопропилэтиламин (1,36 г, 10,54 ммоль) растворяли в ацетонитриле (50 мл), перемешивали и проводили реакцию в течение 3 ч, концентрировали при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол = 20/1) получали указанное в заголовке соединение 1 с (1,6 г, выход: 81,0%) в виде твердого вещества белого цвета.
1Н ЯМР (400 МГц, CDCl3) δ 3,94-3,89 (m, 4Н), 3,88-3,83 (m, 4Н), 3,77 (s, 3Н), 3,17 (s, 2Н).
Стадия II: Получение соединения Id
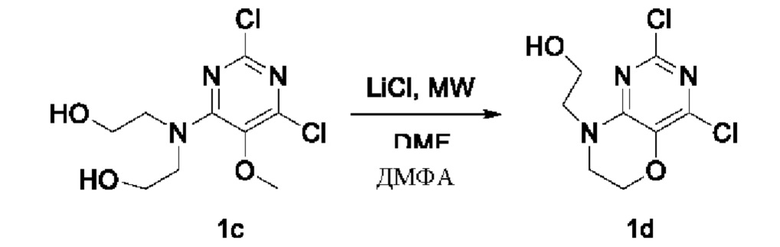
При комнатной температуре 2,2'-((2,6-дихлор-5-метоксипиримидин-4-ил)азандиил)диэтанол 1 с (1,0 г, 3,54 ммоль) и хлорид лития (0,75 г, 17,73 ммоль) растворяли в N,N-диметилформамиде (5 мл), нагревали в микроволновой печи при 130°С в течение 1 ч, концентрировали при пониженном давлении, проводили экстракцию этилацетатом (60 мл×3). Объединенные органические фазы промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия, фильтровали для удаления осушителя, концентрировали при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол = 20/1) получали указанное в заголовке соединение Id (0,39 г, выход: 44,0%) в виде твердого вещества белого цвета.
1Н ЯМР (400 МГц, CDCl3) δ 4,32-4,27 (m, 2Н), 3,92 (m, 2Н), 3,83-3,76 (m, 2Н), 3,76-3,69 (m, 2Н).
Стадии III и IV: Получение соединения 1f
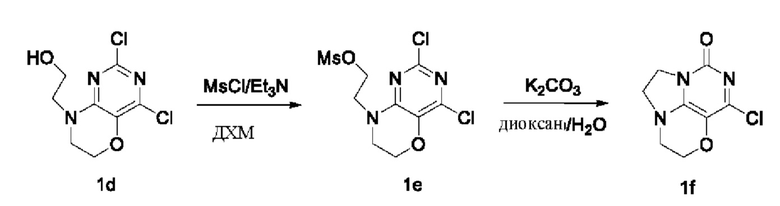
При комнатной температуре 2-(2,4-дихлор-6-гидро-пиримидо[5,4-b][1,4]оксазин-8(7Н)-ил)этанол 1d (0,77 г, 3,1 ммоль) и триэтиламин (0,94 г, 9,3 ммоль) растворяли в дихлорметане (30 мл), затем по каплям добавляли метансульфонилхлорид (0,39 г, 3,4 ммоль) при 0°С. Реакционную смесь перемешивали и проводили реакцию при 0°С в течение 1 ч, концентрировали и направляли непосредственно на следующую реакцию. Неочищенный продукт растворяли в смешанном растворителе 1/1 диоксан/вода (60 мл), затем добавляли карбонат калия (1,3 г, 9,3 ммоль) при комнатной температуре. Реакционную смесь перемешивали при 90°С в течение ночи, концентрировали при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол = 10/1) получали указанное в заголовке соединение 1f (0,38 г, выход: 57,4%) в виде твердого вещества белого цвета.
1Н ЯМР (400 МГц, MeOD) δ 4,32-4,25 (m, 2Н), 4,25-4,17 (m, 2Н), 3,99 (m, 2Н), 3,60-3,52 (m, 2Н).
Стадия V: Получение соединения 1
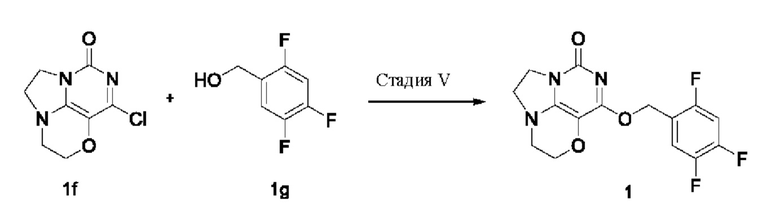
К раствору (2,4,5-трифторфенокси)метанола 1g (39 мг, 0,24 ммоль) в сухом N,N-диметилформамиде (5 мл) добавляли гидрид натрия (60% в минеральном масле, 16 мг, 0,4 ммоль) при 0°С и перемешивали при комнатной температуре в течение 5 мин. Затем добавляли соединение 1f (43 мг, 0,20 ммоль) и перемешивали в течение 1 ч, гасили небольшим количеством воды. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол = 10/1) получали указанное в заголовке соединение 1 (13,6 мг, 20%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3) δ 7,30 (m, 1H), 6,96 (m, 1Н), 5,43 (s, 2H), 4,32-4,22 (m, 2H), 4,20 (m, 2H), 3,78 (m, 2H), 3,48-3,39 (m, 2H). MC (ИЭР): m/z 340,1 [М+Н]+.
Пример 2
Получение соединения 2
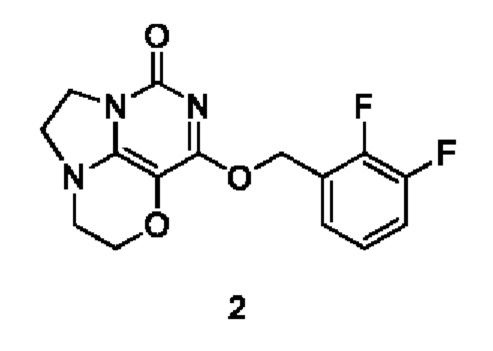
К раствору (2,3-дифторфенил)метанола (35 мг, 0,24 ммоль) в сухом N,N-диметилформамиде (5 мл) добавляли гидрид натрия (60% в минеральном масле, 16 мг, 0,4 ммоль) при 0°С и перемешивали при комнатной температуре в течение 5 мин. Затем добавляли соединение 1f (43 мг, 0,20 ммоль) и перемешивали в течение 1 ч, гасили небольшим количеством воды. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол = 10/1) получали указанное в заголовке соединение 2 (15 мг, 23,3%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3) δ 7,45 (m, 1H), 6,96-6,82 (m, 2Н), 5,43 (s, 2Н), 4,33-4,22 (m, 2Н), 4,19 (m, 2Н), 3,77 (m, 2Н), 3,46-3,39 (m, 2Н). МС (ИЭР): m/z 322,1 [М+Н]+.
Пример 3
Получение соединения 3
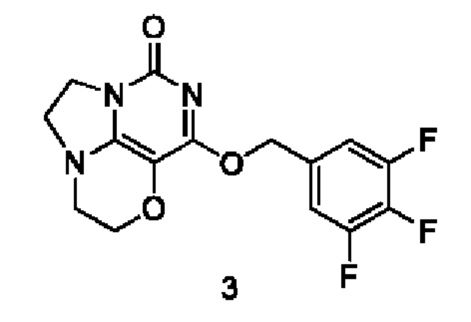
К раствору (3,4,5-трифторфенил)метанола (39 мг, 0,24 ммоль) в сухом N,N-диметилформамиде (5 мл) добавляли гидрид натрия (60% в минеральном масле, 16 мг, 0,4 ммоль) при 0°С и перемешивали при комнатной температуре в течение 5 мин. Затем добавляли соединение 1f (43 мг, 0,20 ммоль) и перемешивали в течение 1 ч, гасили небольшим количеством воды. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол = 10/1) получали указанное в заголовке соединение 3 (11,5 мг, 17%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3) δ 7,31 (m, 2Н), 5,42 (s, 2Н), 4,31-4,22 (m, 2Н), 4,20 (m, 2Н), 3,78 (m, 2Н), 3,46-3,38 (m, 2Н). МС (ИЭР): m/z 340,1 [М+Н]+.
Пример 4
Получение соединения 4
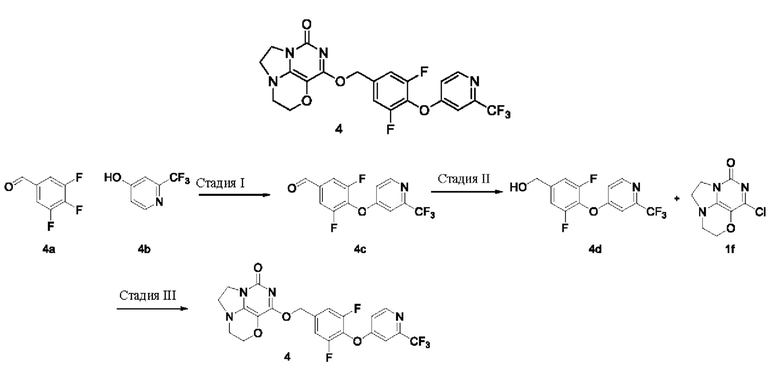
Стадия I: Получение соединения 4с
2-(Трифторметил)пиридин-4-ол 4b (0,85 г, 5,2 ммоль), 3,4,5-трифторбензальдегид 4а (1 г, 6,2 ммоль) и карбонат калия (0,93 г, 6,76 ммоль) растворяли в N,N-диметилформамиде (ДМФА) (30 мл) при комнатной температуре. Реакционную смесь перемешивали при 90°С в течение 1 часа, охлаждали до комнатной температуры, затем добавляли ледяную воду (100 мл), проводили экстракцию этилацетатом (50 мл×3). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом натрия, фильтровали с удалением осушителя. Фильтрат концентрировали при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (петролейный эфир/этилацетат = 5/1) получали указанное в заголовке соединение 4 с (1,47 г, выход: 93,2%) в виде желтого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 9,97 (s, 1H), 8,65 (m, 1H), 7,63 (m, 2Н), 7,27 (m, 1H), 7,01 (m, 1H).
Стадия II: Получение соединения 4d
При комнатной температуре 3,5-дифтор-4-((2-(трифторметил)пиридин-4-ил)окси)бензальдегид 4 с (1,47 г, 4,85 ммоль) растворяли в этаноле (50 мл), затем добавляли NaBH4 (184 мг, 4,84 ммоль) при 0°С. Реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч, концентрировали при пониженном давлении, с последующим добавлением воды, проводили экстракцию этилацетатом (100 мл×2). Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия, фильтровали с удалением осушителя. Фильтрат концентрировали при пониженном давлении. В результате очистки посредством колоночной хроматографии на силикагеле с элюентной системой (петролейный эфир/этилацетат = 2/1) получали указанное в заголовке соединение 4d (1,04 г, выход: 70,3%) в виде твердого вещества белого цвета.
1Н ЯМР (400 МГц, CDCl3) δ 8,59 (m, 1Н), 7,24 (m, 1H), 7,11 (m, 2H), 6,99 (m, 1H), 4,75 (m, 2H), 2,19 (m, 1H).
Стадия III: Получение соединения 4
К раствору (3,5-дифтор-4-((2-(трифторметил)пиридин-4-ил)окси)фенил)метанола 4d (68 мг, 0,22 ммоль) в сухом N,N-диметил форм амиде (5 мл) добавляли гидрид натрия (60% в минеральном масле, 16 мг, 0,4 ммоль) при 0°С и перемешивали при комнатной температуре в течение 5 мин. Затем добавляли соединение 1f (43 мг, 0,20 ммоль) и перемешивали в течение 1 ч, гасили небольшим количеством воды. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол = 10/1) получали указанное в заголовке соединение 4 (31 мг, 32,1%) в виде твердого вещества белого цвета.
1Н ЯМР (400 МГц, CDCl3) δ 8,58 (m, 1H), 7,24 (m, 1H), 7,16 (m, 2Н), 6,96 (m, 1H), 5,45 (s, 2H), 4,32-4,23 (m, 2H), 4,19 (m, 2H), 3,78 (m, 2H), 3,46-3,37 (m, 2H). MC (ИЭР): m/z 482,9 [М+Н]+.
Пример 5
Получение соединения 5

Стадия I: Получение соединения 5b
6-(Трифторметил)пиридин-3-ол 5а (0,85 г, 5,2 ммоль), 3,4,5-трифторбензальдегид 4а (1 г, 6,2 ммоль) и карбонат калия (0,93 г, 6,76 ммоль) растворяли в N,N-диметилформамиде (ДМФА) (30 мл) при комнатной температуре. Реакционную смесь перемешивали при 90°С в течение 1 часа, охлаждали до комнатной температуры, затем добавляли ледяную воду (100 мл), проводили экстракцию этилацетатом (50 мл×3). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом натрия, фильтровали с удалением осушителя. Фильтрат концентрировали при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (петролейный эфир/этилацетат = 5/1) получали указанное в заголовке соединение 5b (1,34 г, выход: 85,0%) в виде желтого твердого вещества.
Стадия II: Получение соединения 5с
При комнатной температуре 3,5-дифтор-4-((6-(трифторметил)пиридин-3-ил)окси)бензальдегид 5b (1,34 г, 4,4 ммоль) растворяли в этаноле (50 мл), затем добавляли NaBH4 (167 мг, 4,4 ммоль) при 0°С. Реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч, концентрировали при пониженном давлении, с последующим добавлением воды, проводили экстракцию этилацетатом (100 мл×2). Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия, фильтровали с удалением осушителя. Фильтрат концентрировали при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (петролейный эфир/этилацетат = 2/1) получали указанное в заголовке соединение 5с (0,77 г, выход: 57,3%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3) δ 8,46 (m, 1H), 7,63 (m, m 1H), 7,30 (m, 1H), 7,09 (m, 2Н), 4,73 (m, 2Н), 2,40 (m, 1H).
Стадия III: Получение соединения 5
К раствору (3,5-дифтор-4- ((6-(трифторметил)пиридин-3-ил)окси)фенил)метанола 5с (43 мг, 0,14 ммоль) в сухом N,N-диметилформамиде (5 мл) добавляли гидрид натрия (60% в минеральном масле, 11 мг, 0,28 ммоль) при 0°С и перемешивали при комнатной температуре в течение 5 мин. Затем добавляли соединение 1f (30 мг, 0,14 ммоль) и перемешивали в течение 1 ч, гасили небольшим количеством воды. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол = 10/1) получали указанное в заголовке соединение 5 (11 мг, 16,3%) в виде твердого вещества белого цвета.
1Н ЯМР (400 МГц, CDCl3) δ 8,50 (m, 1H), 7,63 (m, 1H), 7,28 (m, 1H), 7,15 (m, 2Н), 5,45 (s, 2Н), 4,33-4,27 (m, 2Н), 4,20 (m, 2Н), 3,78 (m, 2Н), 3,46-3,39 (m, 2Н). МС (ИЭР): m/z 482,9 [М+Н]+.
Пример 6
Получение соединения 6
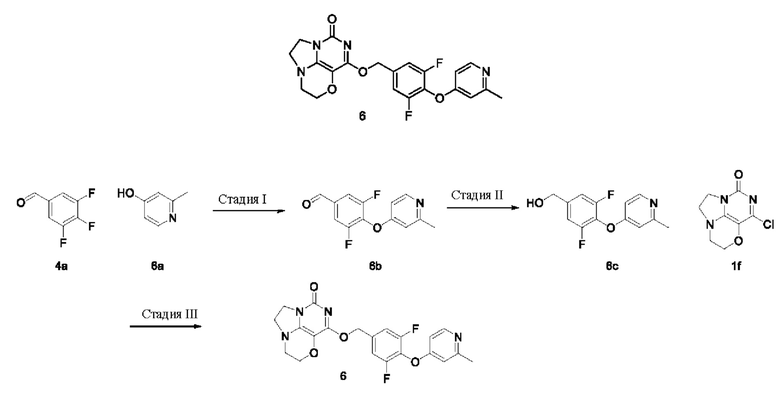
Стадия I: Получение соединения 6b
6-Метилпиридин-4-ол 6а (0,5 г,4,6 ммоль), 3,4,5-трифторбензальдегид 4а (0,88 г, 5,5 ммоль) и карбонат калия (0,82 г, 5,95 ммоль) растворяли в N,N-диметилформамиде (ДМФА) (30 мл) при комнатной температуре. Реакционную смесь перемешивали при 90°С в течение 2 часов, охлаждали до комнатной температуры, затем добавляли ледяную воду (100 мл), проводили экстракцию этилацетатом (50 мл×3). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом натрия, фильтровали с удалением осушителя. Фильтрат концентрировали при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (петролейный эфир/этилацетат = 10/1) получали указанное в заголовке соединение 6b (0,4 г, выход: 34,8%) в виде желтого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 9,94 (m, 1H), 8,39 (m, 1H), 7,63-7,55 (m, 2Н), 6,72 -6,64 (m, 2Н), 2,50 (s, 3Н).
Стадия II: Получение соединения 6с
При комнатной температуре 3,5-дифтор-4-((2-метилпиридин-4-ил)окси)бензальдегид 6b (0,4 г, 1,6 ммоль) растворяли в этаноле (50 мл), затем добавляли NaBH4 (71 мг, 1,87 ммоль) при 0°С. Реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч, концентрировали при пониженном давлении, с последующим добавлением воды, проводили экстракцию этилацетатом (100 мл×2). Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия, фильтровали с удалением осушителя. Фильтрат концентрировали при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (петролейный эфир/этилацетат = 4/1) получали указанное в заголовке соединение 6с (0,34 г, выход: 85,7%) в виде бесцветного масла.
1Н ЯМР (400 МГц, CDCl3) δ 8,29 (m, 1H), 7,07 (m, 2Н), 6,70 (m, 1H), 6,65 (m, 1H), 4,73 (s, 2Н), 3,20 (m, 1H), 2,50 (s, 3Н).
Стадия III: Получение соединения 6
К раствору (3,5-дифтор-4-((2-метилпиридин-4-ил)окси)фенил)метанола 6с (35 мг, 0,14 ммоль) в сухом N,N-диметилформамиде (5 мл) добавляли гидрид натрия (60% в минеральном масле, 11 мг, 0,28 ммоль) при 0°С и перемешивали при комнатной температуре в течение 5 мин. Затем добавляли соединение 1f (30 мг, 0,14 ммоль) и перемешивали в течение 1 ч, гасили небольшим количеством воды. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол = 10/1) получали указанное в заголовке соединение 6 (6 мг, 10%) в виде твердого вещества белого цвета.
1Н ЯМР (400 МГц, CDCl3) δ 8,35 (m, 1H), 7,12 (m, 2Н), 6,67 (m, 2Н), 5,44 (s, 2Н), 4,33-4,27 (m, 2Н), 4,19 (m, 2Н), 3,78 (m, 2Н), 3,45-3,38 (m, 2Н), 2,50 (s, 3H). МС (ИЭР): m/z 429,0 [М+Н]+.
Пример 7
Получение соединения 7
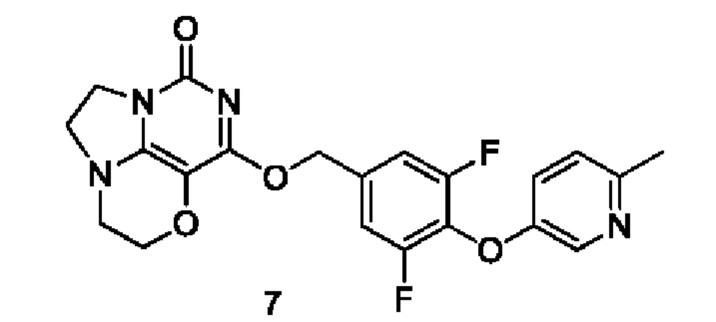
Стадия I: Получение соединения 7b
6-Метилпиридин-3-ол 7а (0,57 г,5,2 ммоль), 3,4,5-трифторбензальдегид 4а (1 г, 6,2 ммоль) и карбонат калия (0,93 г, 6,76 ммоль) растворяли в N,N-диметилформамиде (ДМФА) (30 мл) при комнатной температуре. Реакционную смесь перемешивали при 90°С в течение 1 часа, охлаждали до комнатной температуры, затем добавляли ледяную воду (100 мл), проводили экстракцию этилацетатом (50 мл×3). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом натрия, фильтровали с удалением осушителя. Фильтрат концентрировали при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (петролейный эфир/этилацетат = 10/1) получали указанное в заголовке соединение 7b (0,91 г, выход: 70,2%) в виде желтого твердого вещества.
1Н ЯМР (400 МГц, CDCl3) δ 9,92 (s, 1H), 8,28 (s, 1H), 7,62-7,49 (m, 2Н), 7,18-7,10 (m, 2Н), 2,54 (s, 3H).
Стадия II: Получение соединения 7с
При комнатной температуре 3,5-дифтор-4-((6-метилпиридин-3-ил)окси)бензальдегид 7b (0,91 г, 3,6 ммоль) растворяли в метаноле (50 мл), затем добавляли NaBH4 (161 мг, 4,2 ммоль) при 0°С. Реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч, концентрировали при пониженном давлении, с последующим добавлением воды, проводили экстракцию этилацетатом (100 мл×2). Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия, фильтровали с удалением осушителя.
Фильтрат концентрировали при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (петролейный эфир/этилацетат = 4/1) получали указанное в заголовке соединение 7с (0,89 г, выход: 98,4%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3) δ 8,20 (m, 1H), 7,16-6,98 (m, 4Н), 4,69 (m, 2Н), 2,88 (m, 1H), 2,50 (s, 3H).
Стадия III: Получение соединения 7
К раствору (3,5-дифтор-4-((6-метилпиридин-3-ил)окси)фенил)метанола 7с (35 мг, 0,14 ммоль) в сухом N,N-диметилформамиде (5 мл) добавляли гидрид натрия (60% в минеральном масле, 11 мг, 0,28 ммоль) при 0°С и перемешивали при комнатной температуре в течение 5 мин. Затем добавляли соединение 1f (30 мг, 0,14 ммоль) и перемешивали в течение 1 ч, гасили небольшим количеством воды. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол = 10/1) получали указанное в заголовке соединение 7 (12 мг, 20%) в виде твердого вещества белого цвета.
1Н ЯМР (400 МГц, CDCl3) δ 8,27 (m, 1H), 7,14-7,02 (m, 4Н), 5,42 (s, 2Н), 4,32-4,25 (m, 2Н), 4,19 (m, 2Н), 3,77 (m, 2Н), 3,45-3,36 (m, 2Н), 2,51 (s, 3H). МС (ИЭР): m/z 429,0 [М+Н]+.
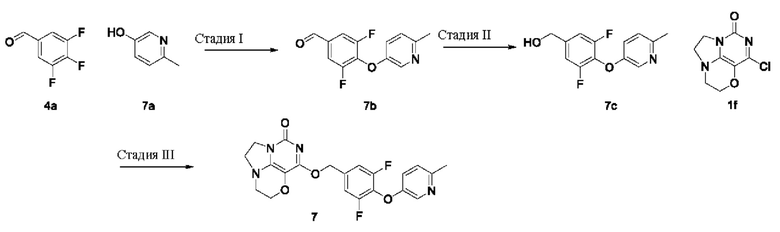
Пример 8
Получение соединения 8

Стадия I: Получение соединения 8b
2-Метилпиримидин-5-ол 8а (0,25 г,2,3 ммоль), 3,4,5-трифторбензальдегид 4а (0,44 г, 2,7 ммоль) и карбонат калия (0,41 г, 2,9 ммоль) растворяли в N,N-диметилформамиде (ДМФА) (30 мл) при комнатной температуре. Реакционную смесь перемешивали при 90°С в течение 2 часов, охлаждали до комнатной температуры, затем добавляли ледяную воду (100 мл), проводили экстракцию этилацетатом (50 мл×3). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом натрия, фильтровали с удалением осушителя. Фильтрат концентрировали при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (петролейный эфир/этилацетат=10/1) получали указанное в заголовке соединение 8b (0,24 г, выход: 41,7%) в виде желтого твердого вещества.
1Н ЯМР (400 МГц, CDCl3) δ 9,93 (s, 1H), 8,39 (s, 2Н), 7,64-7,54 (m, 2Н), 2,72 (s, 3H).
Стадия II: Получение соединения 8с
При комнатной температуре 3,5-дифтор-4- ((2-метилпиримидин-5-ил)окси)бензальдегид 8b (0,24 г, 0,96 ммоль) растворяли в метаноле (50 мл), затем добавляли NaBH4 (30 мг, 0,79 ммоль) при 0°С. Реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч, концентрировали при пониженном давлении, с последующим добавлением воды, проводили экстракцию этилацетатом (100 мл×2). Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия, фильтровали с удалением осушителя. Фильтрат концентрировали при пониженном давлении. В результате очистки с помощью
колоночной хроматографии на силикагеле с элюентной системой (петролейный эфир/этилацетат=4/1) получали указанное в заголовке соединение 8 с (0,17 г, выход: 70,2%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3) δ 8,33 (s, 2Н), 7,04 (m, 2Н), 4,71 (m, 2Н), 2,70 (s, 3H).
Стадия III: Получение соединения 8
К раствору (3,5-дифтор-4- ((2-метилпиримидин-5-ил)окси)фенил)метанола 8 с (35 мг, 0,14 ммоль) в сухом N,N-диметилформамиде (5 мл) добавляли гидрид натрия (60% в минеральном масле, 11 мг, 0,28 ммоль) при 0°С и перемешивали при комнатной температуре в течение 5 мин. Затем добавляли соединение 1f (30 мг, 0,14 ммоль) и перемешивали в течение 1 ч, гасили небольшим количеством воды. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол=10/1) получали указанное в заголовке соединение 8 (8 мг, 13,3%) в виде твердого вещества белого цвета.
1Н ЯМР (400 МГц, CDCl3) δ 8,34 (s, 2Н), 7,13 (m, 2Н), 5,43 (s, 2Н), 4,32-4,24 (m, 2Н), 4,19 (m, 2Н), 3,77 (m, 2Н), 3,42 (m, 2Н), 2,69 (s, 3H). МС (ИЭР): m/z 429,9 [М+Н]+.
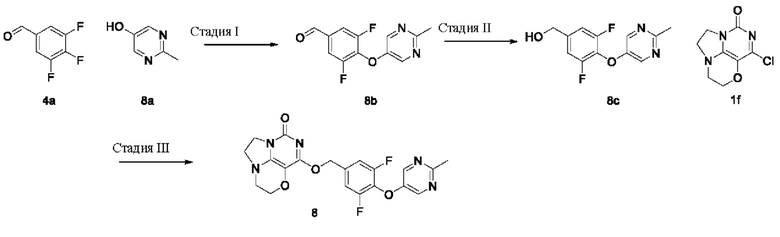
Пример 9
Получение соединения 9
Стадия I: Получение соединения 9b
4-(Трифторметил)фенол 9а (0,84 г, 5,2 ммоль), 3,4,5-трифторбензальдегид 4а (1 г, 6,2 ммоль) и карбонат калия (0,93 г, 6,76 ммоль) растворяли в N,N-диметилформамиде (ДМФА) (30 мл) при комнатной температуре. Реакционную смесь перемешивали при 90°С в течение 1 часа, охлаждали до комнатной температуры, затем добавляли ледяную воду (100 мл), проводили экстракцию этилацетатом (50 мл×3). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом натрия, фильтровали с удалением осушителя. Фильтрат концентрировали при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (петролейный эфир/этилацетат=5/1) получали указанное в заголовке соединение 9b (1,33 г, выход: 84,6%) в виде желтого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 9,94 (m, 1H), 7,59 (m, 4Н), 7,04 (m, 2Н).
Стадия II: Получение соединения 9с
При комнатной температуре 3,5-Дифтор-4- (4-(трифторметил)фенокси)бензальдегид 9b (1,33 г, 4,4 ммоль) растворяли в метаноле (50 мл), затем добавляли NaBH4 (166 мг, 4,4 ммоль) при 0°С. Реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч, концентрировали при пониженном давлении, с последующим добавлением воды, проводили экстракцию этилацетатом (100 млх2). Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия, фильтровали с удалением осушителя. Фильтрат концентрировали при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (петролейный эфир/этилацетат=2/1) получали указанное в заголовке соединение 9 с (0,85 г, выход: 63,4%) в виде бесцветного масла.
1Н ЯМР (400 МГц, CDCl3) δ 7,57 (m, 2Н), 7,09-7,00 (m, 4Н), 4,72 (m, 2Н), 2,03 (m,
1H).
Стадия III: Получение соединения 9
К раствору 3,5-дифтор-4- (4-(трифторметил)фенокси) фенил)метанола 9 с (43 мг, 0,14
ммоль) в сухом N,N-диметилформамиде (5 мл) добавляли гидрид натрия (60% в минеральном масле, 11 мг, 0,28 ммоль) при 0°С и перемешивали при комнатной температуре в течение 5 мин. Затем добавляли соединение 1f (30 мг, 0,14 ммоль) и перемешивали в течение 1 ч, гасили небольшим количеством воды. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол=10/1) получали указанное в заголовке соединение 9 (9 мг, 13,4%) в виде твердого вещества белого цвета.
1ЯМР (400 МГц, CDCl3) δ 7,56 (m, 2Н), 7,16-7,09 (m, 2Н), 7,00 (m, 2Н), 5,44 (s, 2Н), 4,30 (m, 2Н), 4,20 (m, 2Н), 3,78 (m, 2Н), 3,46-3,35 (m, 2Н). МС (ИЭР): m/z 481,9 [М+Н]+.
Пример 10
Получение соединения 10 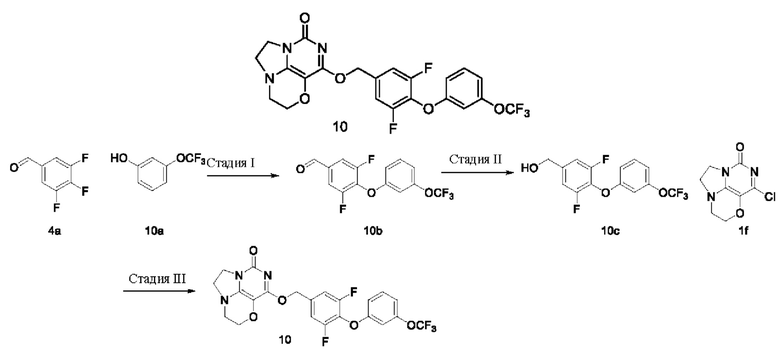 Стадия I: Получение соединения 10b
Стадия I: Получение соединения 10b
3-(Трифторметокси)фенол 10а (0,50 г,2,8 ммоль), 3,4,5-трифторбензальдегид 4а (0,5 г, 3,1 ммоль) и карбонат калия (0,5 г, 3,64 ммоль) растворяли в N,N-диметилформамиде (ДМФА) (30 мл) при комнатной температуре. Реакционную смесь перемешивали при 90°С в течение 2 часов, охлаждали до комнатной температуры, затем добавляли ледяную воду (100 мл), проводили экстракцию этилацетатом (50 мл×3). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом натрия, фильтровали с удалением осушителя. Фильтрат концентрировали при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (петролейный эфир/этилацетат=10/1) получали указанное в заголовке соединение 10b (0,73 г, выход: 81,9%) в виде желтого твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ 9,94 (s, 1H), 7,64-7,54 (m, 2Н), 7,34 (m, 1H), 7,00 (m, 1H), 6,87 (m, 2Н).
Стадия II: Получение соединения 10с
При комнатной температуре 4-(3-(трифторметокси)фенокси)-3,5-
дифторбензальдегид 10b (0,73 г,2,3 ммоль) растворяли в метаноле (50 мл), затем добавляли NaBH4 (86 мг,2,26 ммоль) при 0°С. Реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч, концентрировали при пониженном давлении, с последующим добавлением воды, проводили экстракцию этилацетатом (100 мл×2). Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия, фильтровали с удалением осушителя. Фильтрат концентрировали при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (петролейный эфир/этилацетат=4/1) получали указанное в заголовке соединение 10 с (0,57 г, выход: 77,4%) в виде бесцветного масла.
1Н ЯМР (400 МГц, CDCl3) δ 7,30 (m, 1H), 7,06 (m, 2Н), 6,94 (m, 1H), 6,85 (m, 1H), 6,81 (s, 1H), 4,72 (m, 2Н), 1,94 (m, 1H).
Стадия III: Получение соединения 10
К раствору 4-(3-(трифторметокси)фенокси)-3,5-дифторфенил)метанола 10c (48 мг, 0,15 ммоль) в сухом N,N-диметилформамиде (5 мл) добавляли гидрид натрия (60% в минеральном масле, 11 мг, 0,28 ммоль) при 0°С и перемешивали при комнатной температуре в течение 5 мин. Затем добавляли соединение 1f (30 мг, 0,14 ммоль) и перемешивали в течение 1 ч, гасили небольшим количеством воды. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол=10/1) получали указанное в заголовке соединение 10 (18 мг, 25,8%)
в виде твердого вещества белого цвета.
1Н ЯМР (400 МГц, CDC13) δ 7,30 (m, 1H), 7,11 (m, 2Н), 6,93 (m, 1Н), 6,83 (m, 2H), 5,44 (s, 2H), 4,34-4,27 (m, 2H), 4,20 (m, 2H), 3,78 (m, 2H), 3,46-3,38 (m, 2H). MC (ИЭР): m/z 497,9 [М+Н]+.
Пример 11
Получение соединения 11 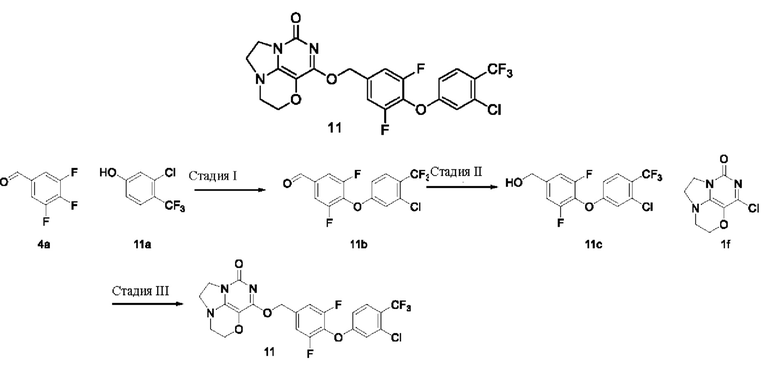 Стадия I: Получение соединения 11b
Стадия I: Получение соединения 11b
3-Хлор-4-(трифторметил)фенол 11а (0,25 г, 1,27 ммоль), 3,4,5-трифторбензальдегид 4а (0,22 г, 1,4 ммоль) и карбонат калия (0,23 г, 1,65 ммоль) растворяли в N,N-диметилформамиде (ДМФА) (20 мл) при комнатной температуре. Реакционную смесь перемешивали при 90°С в течение 2 часов, охлаждали до комнатной температуры, затем добавляли ледяную воду (100 мл), проводили экстракцию этилацетатом (50 мл×3). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом натрия, фильтровали с удалением осушителя. Фильтрат концентрировали при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (петролейный эфир/этилацетат=10/1) получали указанное в заголовке соединение 11b (0,32 г, выход: 74,8%) в виде желтого твердого вещества.
1Н ЯМР (400 МГц, CDCl3) δ 9,95 (s, 1H), 7,69-7,56 (m, 3Н), 7,10 (m, 1H), 6,92 (m, 1H).
Стадия II: Получение соединения 11с
При комнатной температуре 4-(3-хлор-4- (трифторметил)фенокси)-3,5-дифторбензальдегид 11b (0,32 г, 0,95 ммоль) растворяли в метаноле (50 мл), затем добавляли NaBH4 (36 мг, 0,95 ммоль) при 0°С. Реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч, концентрировали при пониженном давлении, с последующим добавлением воды, проводили экстракцию этилацетатом (100 мл×2). Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия, фильтровали с удалением осушителя. Фильтрат концентрировали при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (петролейный эфир/этилацетат=4/1) получали указанное в заголовке соединение 11с (0,15 г, выход: 46,6%) в виде белого твердого вещества.
1Н ЯМР (400 МГц, CDCl3) δ 7,62 (m, 1H), 7,13-7,00 (m, 3Н), 6,90 (m, 1H), 4,74 (m, 2H), 1,88 (m, 1H).
Стадия III: Получение соединения 11
К раствору (4- (3-хлор-4-(трифторметил)фенокси)-3,5-дифторфенил)метанола 11с (67 мг, 0,20 ммоль) в сухом N,N-диметилформамиде (5 мл) добавляли гидрид натрия (60% в минеральном масле, 15 мг, 0,38 ммоль) при 0°С и перемешивали при комнатной температуре в течение 5 мин. Затем добавляли соединение 1f (40 мг, 0,19 ммоль) и перемешивали в течение 1 ч, гасили небольшим количеством воды. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол=10/1) получали указанное в заголовке соединение 11 (21 мг, 21,4%) в виде твердого вещества белого цвета.
1Н ЯМР (400 МГц, CDCl3) δ 7,62 (m, 1H), 7,14 (m, 2Н), 7,06 (m, 1H), 6,89 (m, 1H), 5,45 (s, 2Н), 4,34-4,26 (m, 2Н), 4,21 (m, 2Н), 3,78 (m, 2Н), 3,52-3,37 (m, 2Н). МС (ИЭР): m/z 515,9 [М+Н]+.
Пример 12
Получение соединения 12
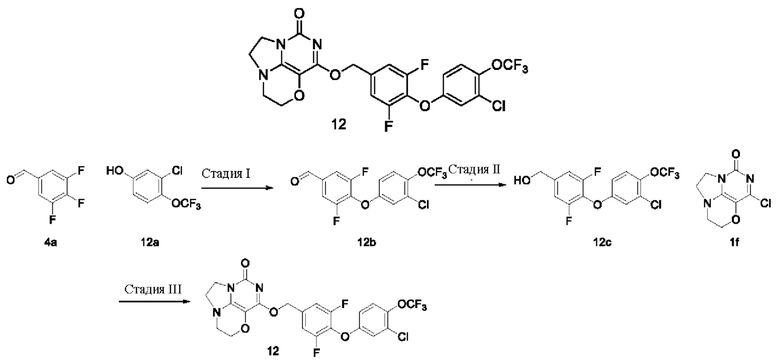
Стадия I: Получение соединения 12b
3-Хлор-4-(трифторметокси)фенол 12а (0,5 г, 2,4 ммоль), 3,4,5-трифторбензальдегид 4а (0,41 г, 2,6 ммоль) и карбонат калия (0,42 г, 3,04 ммоль) растворяли в N,N-диметилформамиде (ДМФА) (20 мл) при комнатной температуре. Реакционную смесь перемешивали при 90°С в течение 2 часов, охлаждали до комнатной температуры, затем добавляли ледяную воду (100 мл), проводили экстракцию этилацетатом (50 мл×3). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом натрия, фильтровали с удалением осушителя. Фильтрат концентрировали при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (петролейный эфир/этилацетат=10/1) получали указанное в заголовке соединение 12b (0,62 г, выход: 73,2%) в виде желтого твердого вещества.
1Н ЯМР (400 МГц, CDCl3) δ 9,94 (s, 1H), 7,63-7,54 (m, 2Н), 7,29 (m, 1H), 7,07 (m, 1H), 6,90 (m, 1H).
Стадия II: Получение соединения 12с
При комнатной температуре 4-(3-хлор-4- (трифторметокси)фенокси)-3,5-дифторбензальдегид 12b (0,62 г, 1,8 ммоль) растворяли в метаноле (50 мл), затем добавляли NaBH4: (62 мг,1,63 ммоль) при 0°С. Реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч, концентрировали при пониженном давлении, с последующим добавлением воды, проводили экстракцию этилацетатом (100 мл×2). Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия, фильтровали с удалением осушителя. Фильтрат концентрировали при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (петролейный эфир/этилацетат=4/1) получали указанное в заголовке соединение 12с (0,53 г, выход: 83,0%) в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3) δ 7,25 (m, 1Н), 7,06 (m, 2H), 7,01 (m, 1H), 6,87 (m, 1H), 4,72 (s, 2H), 2,04 (m, 1H).
Стадия III: Получение соединения 12
К раствору (4- (3-хлор-4-(трифторметокси)фенокси)-3,5-дифторфенил)метанола 12с (67 мг, 0,19 ммоль) в сухом N,N-диметилформамиде (5 мл) добавляли гидрид натрия (60% в минеральном масле, 15 мг, 0,38 ммоль) при 0°С и перемешивали при комнатной температуре в течение 5 мин. Затем добавляли соединение 1f (40 мг, 0,19 ммоль) и перемешивали в течение 1 ч, гасили небольшим количеством воды. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол=10/1) получали указанное в заголовке соединение 12 (19 мг, 18,8%) в виде твердого вещества белого цвета.
1Н ЯМР (400 МГц, CDCl3) δ 7,23 (m, 1H), 7,16-7,08 (m, 2Н), 7,03 (m, 1H), 6,86 (m, 1H), 5,44 (s, 2Н), 4,30 (m, 2Н), 4,20 (m, 2Н), 3,78 (m, 2Н), 3,46-3,39 (m, 2Н). МС (ИЭР): m/z 531,8 [М+Н]+.
Пример 13
Получение соединения 13
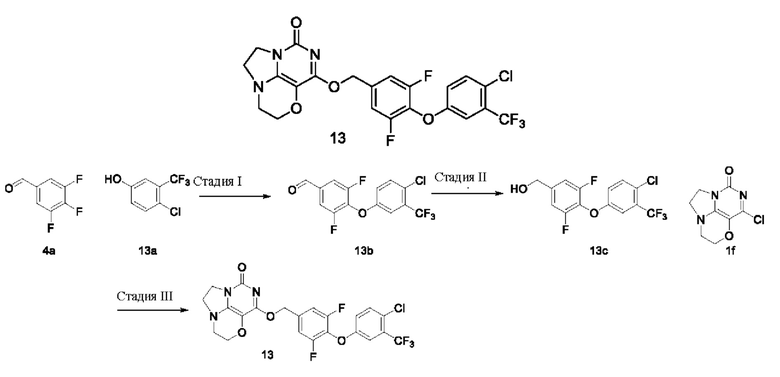
Стадия I: Получение соединения 13b
4-Хлор-3-(трифторметил)фенол 13а (0,5 г, 2,5 ммоль), 3,4,5-трифторбензальдегид 4а (0,41 г, 2,8 ммоль) и карбонат калия (0,46 г, 3,3 ммоль) растворяли в N,N-диметилформамиде (ДМФА) (30 мл) при комнатной температуре. Реакционную смесь перемешивали при 90°С в течение 2 часов, охлаждали до комнатной температуры, затем добавляли ледяную воду (100 мл), проводили экстракцию этилацетатом (50 мл×3). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом натрия, фильтровали с удалением осушителя. Фильтрат концентрировали при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (петролейный эфир/этилацетат=10/1) получали указанное в заголовке соединение 13b (0,6 г, выход: 71,3%) в виде желтого твердого вещества.
1ЯМР (400 МГц, CDC13) δ 9,94 (s, 1H), 7,64-7,55 (m, 2Н), 7,45 (m, 1H), 7,31 (m, 1H), 7,05 (m, 1H).
Стадия II: Получение соединения 13с
При комнатной температуре 4-(4-хлор-3-(трифторметил)фенокси)-3,5-дифторбензальдегид 13b (0,6 г, 1,78 ммоль) растворяли в метаноле (50 мл), затем добавляли NaBH4 (67 мг, 1,76 ммоль) при 0°С. Реакционную смесь перемешивали при
комнатной температуре в течение 0,5 ч, концентрировали при пониженном давлении, с последующим добавлением воды, проводили экстракцию этилацетатом (100 мл×2). Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия, фильтровали с удалением осушителя. Фильтрат концентрировали при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (петролейный эфир/этилацетат=4/1) получали указанное в заголовке соединение 13с (0,28 г, выход: 46,4%) в виде твердого вещества белого цвета.
1Н ЯМР (400 МГц, CDCl3) 6 7,41 (m, 1H), 7,28 (m, 1H), 7,08-7,00 (m, 3Н), 4,73 (m, 2Н), 1,94 (m, 1Н).
Стадия III: Получение соединения 13
К раствору (4- (4-хлор-3-(трифторметил)фенокси)-3,5-дифторфенил)метанола 13с (64 мг, 0,19 ммоль) в сухом N,N-диметилформамиде (5 мл) добавляли гидрид натрия (60% в минеральном масле, 15 мг, 0,38 ммоль) при 0°С и перемешивали при комнатной температуре в течение 5 мин. Затем добавляли соединение 1f (40 мг, 0,19 ммоль) и перемешивали в течение 1 ч, гасили небольшим количеством воды. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол=10/1) получали указанное в заголовке соединение 13 (29 мг, 29,6%) в виде твердого вещества белого цвета.
1Н ЯМР (400 МГц, CDCl3) 6 7,41 (m, 1H), 7,30 (m, 1H), 7,13 (m, 2Н), 6,99 (m, 1H), 5,44 (s, 2Н), 4,30 (m, 2Н), 4,20 (m, 2Н), 3,78 (m, 2Н), 3,57-3,35 (m, 2Н). МС (ИЭР): m/z 515,9 [М+Н]+.
Пример 14
Получение соединения 14 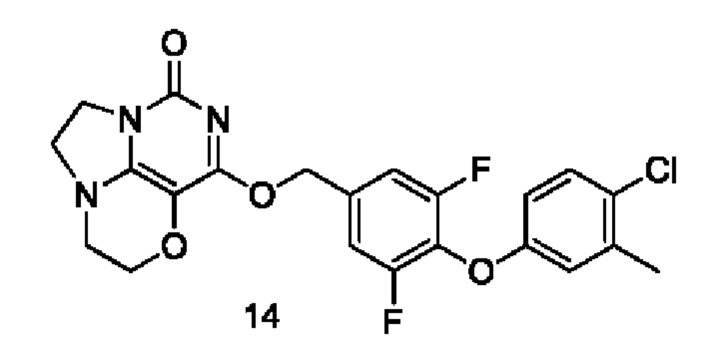

Стадия I: Получение соединения 14b
4-Хлор-3-метилфенол 14а (1 г, 7,0 ммоль), 3,4,5-трифторбензальдегид 4а (1,2 г, 7,5 ммоль) и карбонат калия (1,3 г, 9,1 ммоль) растворяли в N,N-диметилформамиде (ДМФА) (30 мл) при комнатной температуре. Реакционную смесь перемешивали при 90°С в течение 2 часов, охлаждали до комнатной температуры, затем добавляли ледяную воду (100 мл), проводили экстракцию этилацетатом (50 мл×3). Объединенные органические фазы промывали насыщенным водным хлоридом натрия, сушили над безводным сульфатом натрия, фильтровали с удалением осушителя. Фильтрат концентрировали при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (петролейный эфир/этилацетат=10/1) получали указанное в заголовке соединение 14b (1,2 г, выход: 60,6%) в виде желтого твердого вещества.
1Н ЯМР (400 МГц, CDCl3) δ 9,92 (s, 1H), 7,61-7,51 (m, 2Н), 7,30-7,23 (m, 1H), 6,85 (m, 1H), 6,73 (m, 1H), 2,34 (s, 3H).
Стадия II: Получение соединения 14с
При комнатной температуре 4-(4-хлор-3-метилфенокси)-3,5-дифторбензальдегид 14b (1,2 г, 4,24 ммоль) растворяли в метаноле (50 мл), затем добавляли NaBH4 (161 мг, 4,2 ммоль) при 0°С. Реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч, концентрировали при пониженном давлении, с последующим добавлением воды, проводили экстракцию этилацетатом (100 мл×2). Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия, фильтровали с удалением осушителя. Фильтрат концентрировали при
пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (петролейный эфир/этилацетат=4/1) получали указанное в заголовке соединение 14 с (0,89 г, выход: 73,7%) в виде бесцветного масла.
Стадия III: Получение соединения 14
К раствору (3,5-дифтор-4-((2-(трифторметил)пиридин-4-ил)окси)фенил)метанола 14 с (40 мг, 0,14 ммоль) в сухом N,N-диметилформамиде (5 мл) добавляли гидрид натрия (60% в минеральном масле, 11 мг, 0,28 ммоль) при 0°С и перемешивали при комнатной температуре в течение 5 мин. Затем добавляли соединение 1f (30 мг, 0,14 ммоль) и перемешивали в течение 1 ч, гасили небольшим количеством воды. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол=10/1) получали указанное в заголовке соединение 14 (16 мг, 24,7%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3) δ 7,23 (m, га 1H), 7,13-7,05 (m, 2Н), 6,80 (m, 1H), 6,70 (m, 1H), 5,43 (s, 2Н), 4,33-4,25 (m, 2Н), 4,20 (m, 2Н), 3,77 (m, 2Н), 3,46-3,36 (m, 2Н), 2,32 (s, 3H). МС (ИЭР): m/z 461,9 [М+Н]+.
Пример 15
Получение соединения 15  Стадия I: Получение соединения 15b
Стадия I: Получение соединения 15b

При комнатной температуре 2,4,6-трихлор-5-метоксипиримидин 1b (1,5 г, 7,03 ммоль), этаноламин 15а (0,64 г, 10,48 ммоль) и диизопропилэтиламин (1,36 г, 10,54 ммоль) растворяли в ацетонитриле (70 мл), перемешивали и проводили реакцию в течение 3 ч, концентрируя при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол=20/1) получали указанное в заголовке соединение 15b (1,35 г, выход: 80,6%) в виде масла.
1H ЯМР (400 МГц, ДМСО) δ 7,99 (m, 1H), 4,77 (m, 1H), 3,73 (s, 3Н), 3,52 (m, 2Н), 3,39 (m, 2Н).
Стадия II: Получение соединения 15с

Под защитой аргона 15b (1,35 г, 5,7 ммоль) растворяли в безводном дихлорметане (50 мл), затем медленно по каплям добавляли трибромид бора (28,5 мл, 1 М), и реакционную смесь перемешивали при 0°С в течение 4 ч. Реакцию гасили добавлением метанола, концентрированного при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол=10/1) получали указанное в заголовке соединение 15с (1,09 г, выход: 85,4%) в виде твердого вещества белого цвета.
Стадия III: Получение соединения 15d
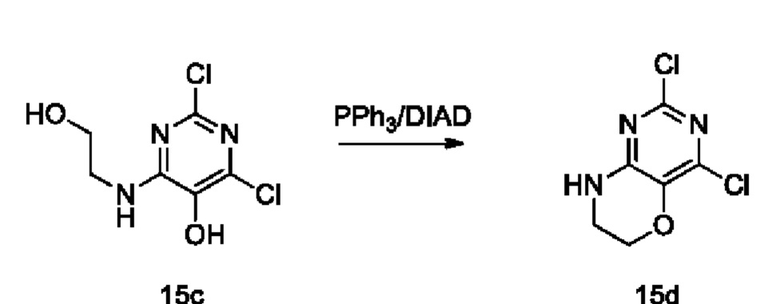
В защитной атмосфере азота трифенилфосфин (3,8 г, 14,5 ммоль) растворяли в безводном ТГФ (50 мл), затем медленно по каплям добавляли DIAD (2,87 мл, 14,6 ммоль). Реакционную смесь перемешивали при 0°С в течение 15 мин и по каплям добавляли 15 с (1,09 г, 4,87 ммоль) в растворе ТГФ/ДМФА (30 мл/5 мл), затем перемешивали при 0°С в течение 4 ч, гасили реакцию путем добавления воды по каплям, проводили экстракцию этилацетатом. Объединенные органические слои сушили над безводным сульфатом натрия, концентрировали при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол=40/1) получали указанное в заголовке соединение 15d (1,0 г, выход: 99,6%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3) δ 7,14 (s, 1H), 4,30 (m, 2Н), 3,75-3,66 (m, 2Н).
Стадия IV: Получение соединения 15f
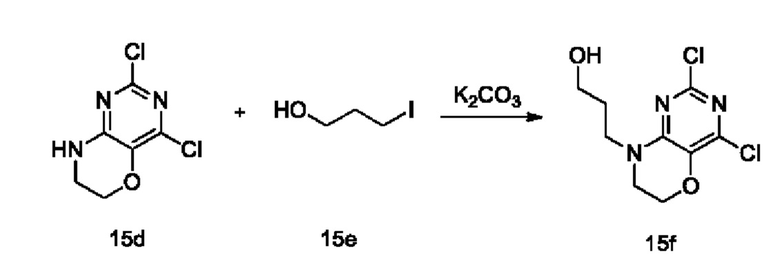
При комнатной температуре 15d (1,0 г, 4,85 ммоль) растворяли в ДМ ФА (40 мл), затем добавляли карбонат калия (0,92 г, 6,64 ммоль) и 3-иодпропанол (1,23 г, 6,61 ммоль). Реакционную смесь перемешивали при 80°С в течение 2 ч, гасили добавлением воды в реакционную смесь, проводили экстракцию этилацетатом. Объединенные органические слои сушили над безводным сульфатом натрия, концентрировали при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол=20/1) получали указанное в заголовке соединение 15f (0,58 г, выход: 45,3%) в виде твердого вещества белого цвета.
1Н ЯМР (400 МГц, CDCl3) δ 4,26 (m, 2Н), 3,77-3,70 (m, 2Н), 3,61-3,54 (m, 3Н), 3,30
(m, 1H), 1,84 (m, 2H).
Стадии V и VI: Получение соединения 15h
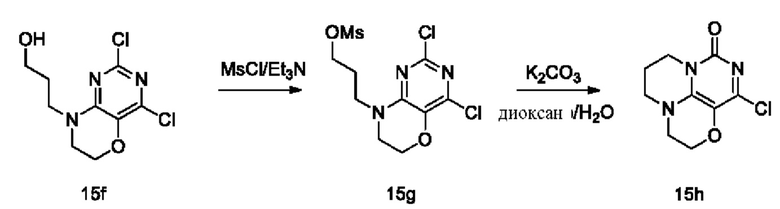
При комнатной температуре 15f (0,58 г, 2,2 ммоль) и триэтиламин (0,67 г, 6,6 ммоль) растворяли в сухом дихлорметане (30 мл), затем по каплям добавляли метансульфонилхлорид (0,30 г, 2,6 ммоль) при 0°С. Реакционную смесь перемешивали при 0°С в течение 1 ч, концентрировали при пониженном давлении. Неочищенный продукт предыдущей стадии растворяли в смешанном растворителе диоксан/вода (60 мл, 1/1), после чего добавляли карбонат калия (0,9 г, 6,6 ммоль) при комнатной температуре. Реакционную смесь перемешивали при 90°С в течение ночи, концентрировали при пониженном давлении. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол=10/1) получали указанное в заголовке соединение 15h (85 мг, выход: 16,8%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3) δ 4,19-4,14 (m, 2Н), 3,97-3,90 (m, 2Н), 3,56 (m, 2Н), 3,44 (m, 2Н), 2,14(m, 2Н).
Стадия VII: Получение соединения 15
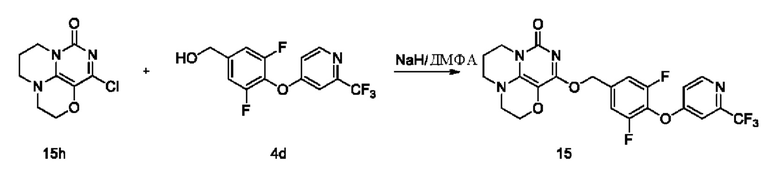
К раствору (3,5-дифтор-4-((2-(трифторметил)пиридин-4-ил)окси)фенил)метанола 4d (79 мг, 0,26 ммоль) в сухом N,N-диметилформамиде (5 мл) добавляли гидрид натрия (60% в минеральном масле, 11 мг, 0,28 ммоль) при 0°С и перемешивали при комнатной температуре в течение 5 мин. Затем добавляли соединение 15h (40 мг, 0,18 ммоль) и
перемешивали в течение 1 ч, гасили небольшим количеством воды. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол=10/1) получали указанное в заголовке соединение 15 (12 мг, 13,4%) в виде твердого вещества белого цвета.
1Н ЯМР (400 МГц, CDCl3) δ 8,61 (m, 1H), 7,20 (m, 3Н), 6,99 (m, 1H), 5,47 (m, 2Н), 4,19 (m, 2Н), 4,05-3,97 (m, 2Н), 3,58-3,50 (m, 2Н), 3,40 (m, 2Н), 2,17 (m, 2Н). МС (ИЭР): m/z 497,1 [М+Н]+.
Пример 16
Получение соединения 16
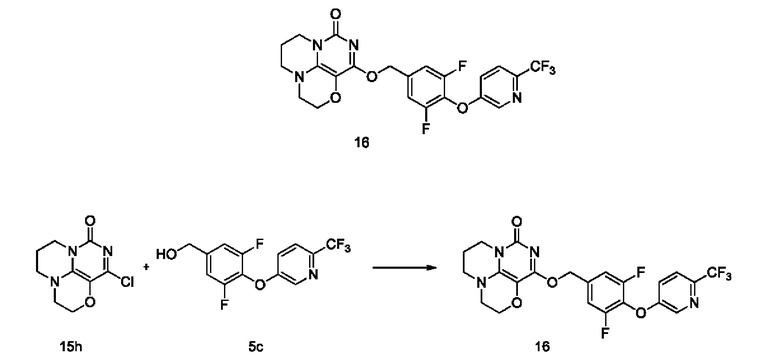
К раствору (3,5-дифтор-4- ((6-(трифторметил)пиридин-3-ил)окси)фенил)метанола 5с (61 мг, 0,2 ммоль) в сухом N,N-диметилформамиде (5 мл) добавляли гидрид натрия (60% в минеральном масле, 8 мг, 0,2 ммоль) при 0°С и перемешивали при комнатной температуре в течение 5 мин. Затем добавляли соединение 15h (30 мг, 0,13 ммоль) и перемешивали в течение 1 ч, гасили небольшим количеством воды. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол=10/1) получали указанное в заголовке соединение 16 (11 мг, 17,0%) в виде твердого вещества белого цвета.
1Н ЯМР (400 МГц, CDCl3) δ 8,49 (m, 1H), 7,62 (m, 1H), 7,28 (m, т 1H), 7,17 (m, 2Н), 5,43 (s, 2Н), 4,17 (m, 2Н), 4,03 -3,95 (m, 2Н), 3,55 -3,49 (m, 2Н), 3,37 (m, 2Н), 2,15 (m, 2Н). МС (ИЭР): m/z 497,1 [М+Н]+.
Пример 17
Получение соединения 17

К раствору (3,5-дифтор-4- ((6-метилпиридин-3-ил)окси)фенил)метанола 7с (50 мг, 0,2 ммоль) в сухом N,N-диметилформамиде (5 мл) добавляли гидрид натрия (60% в минеральном масле, 8 мг, 0,2 ммоль) при 0°С и перемешивали при комнатной температуре в течение 5 мин. Затем добавляли соединение 15h (30 мг, 0,13 ммоль) и перемешивали в течение 1 ч, гасили небольшим количеством воды. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол=10/1) получали указанное в заголовке соединение 17 (18 мг, 31,3%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3) δ 8,26 (s, 1H), 7,09 (m, 4Н), 5,42 (s, 2Н), 4,16 (m, 2Н), 3,99 (m, 2Н), 3,51 (m, 2Н), 3,36 (m, 2Н), 2,51 (s, 3Н), 2,14 (m, 2Н). МС (ИЭР): m/z 443,1 [М+Н]+.
Пример 18
Получение соединения 18
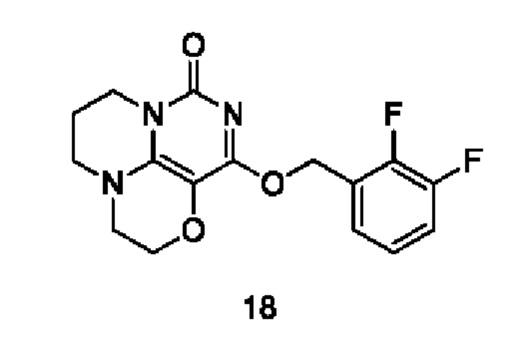
К раствору (2,3-дифторфенил)метанола (38 мг, 0,26 ммоль) в сухом N,N-диметилформамиде (5 мл) добавляли гидрид натрия (60% в минеральном масле, 11 мг, 0,28 ммоль) при 0°С и перемешивали при комнатной температуре в течение 5 мин. Затем добавляли соединение 15h (40 мг, 0,18 ммоль) и перемешивали в течение 1 ч, гасили небольшим количеством воды. В результате очистки с помощью колоночной
хроматографии на силикагеле с элюентной системой (дихлорметан/метанол=10/1) получали указанное в заголовке соединение 18 (16 мг, 26,5%) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, CDCl3) δ 7,45 (m, 1H), 6,95-6,83 (m, 2Н), 5,42 (s, 2Н), 4,20 (m, 2Н), 4,04-3,95 (m, 2Н), 3,56-3,49 (m, 2Н), 3,40 (m, 2Н), 2,16 (m, 2Н). МС (ИЭР): m/z 336,1 [М+Н]+.
Пример 19
Получение соединения 19
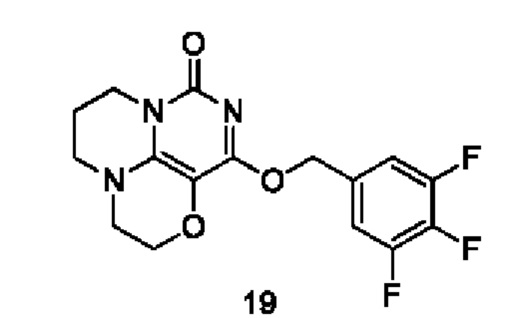
К раствору (3,4,5-трифторфенил)метанола (42 мг, 0,26 ммоль) в сухом N,N-диметилформамиде (5 мл) добавляли гидрид натрия (60% в минеральном масле, 11 мг, 0,28 ммоль) при 0°С и перемешивали при комнатной температуре в течение 5 мин. Затем добавляли соединение 15h (40 мг, 0,18 ммоль) и перемешивали в течение 1 ч, гасили небольшим количеством воды. В результате очистки с помощью колоночной хроматографии на силикагеле с элюентной системой (дихлорметан/метанол=10/1) получали указанное в заголовке соединение 19 (15 мг, 23,6%) в виде твердого вещества белого цвета.
1Н ЯМР (400 МГц, CDCl3) δ 7,33 (m, 2Н), 5,43 (s, 2Н), 4,20 (m, 2Н), 4,06-3,96 (m, 2Н), 3,57-3,49 (m, 2Н), 3,41 (m, 2Н), 2,18 (m, 2Н). МС (ИЭР): m/z 354,1 [М+Н]+.
Биологическая оценка
Биологическая активность соединений может быть определена с использованием любого подходящего анализа и моделей в ткани и in vivo для определения активности соединений в качестве ингибиторов LpPLA2.
(1) Рекомбинантный анализ Lp-PLA2 человека (rhLp-PLA2) (также известный как анализ PED6)
PED6 представляет собой флуоресцентно-меченный фосфолипид, который может быть приобретен непосредственно в Invitogene или Molecular Probes. Существует гасящая флуоресценцию п-нитрофенильная группа в положении Sn3 и группа флуоресцеина Bodipy (FL) в положении sn2. После того, как он расщепляется ферментом Lp-PLA2, группа FL высвобождается, что приводит к усилению флуоресценции. Однако ингибиторы Lp-PLA2 могут предотвращать это расщепление таким образом, что не наблюдается усиления флуоресценции.
Методика анализа: испытуемое соединение (представленное в таблице 1) смешивали с раствором ДМСО в объемном отношении 1:3, разбавляли с получением исходного планшета из 384-луночного микропланшета. Затем 0,01 мкл соединения переносили через дозатор жидкости ECHO из исходного планшета в 384-луночный планшет Greiner 784076 и в каждую лунку на планшете добавляли 5 микролитров буфера, состоящего из 50 мМ HEPES, рН 7,4, 150 мМ NaCl, 1 мМ CHAPS (буферный раствор содержит рекомбинантный фермент Lp-PLA2 человека в концентрации 4 нМ или ПО пМ). Планшет центрифугировали при 500 об/мин в течение 10 секунд. После 30 минут предварительной инкубации 5 микролитров вышеупомянутого буферного раствора добавляли в 384-луночный планшет Greiner784076 и планшет центрифугировали при 500 об/мин в течение 10 секунд. После того, как планшет инкубировали при комнатной температуре в течение 20 мин в темноте, определяли интенсивность флуоресценции при возбуждении 480/эмиссии 540 с помощью визуализатора планшета ViewLux, и использовали модель аппроксимации XL Excel для выполнения кривой и анализа КК для расчета рIС50. Результаты приведены в таблице 1.
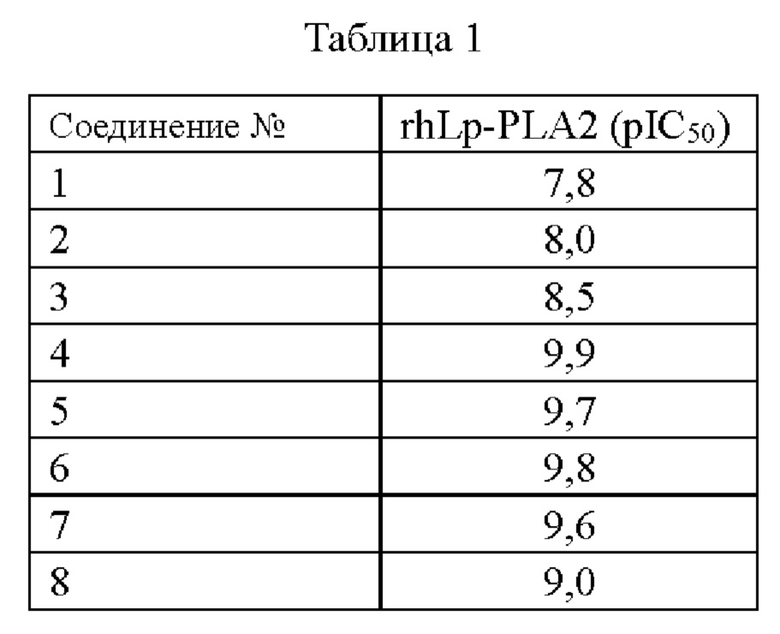

(2) Анализ плазмы человека Lp-PLA2 (также известный как анализ Thio-PAF)
Анализ плазмы человека проводили с использованием сульфатидного аналога PAF (фосфатидилхолина), который гидролизовали для получения фосфолипидов, содержащих свободные сульфгидрильные группы, подвергали присоединению по Михаэлю с помощью СРМ для получения малеимида, усиливающего флуоресценцию.
Непрерывный количественный анализ тиола может быть проведен путем определения интенсивности флуоресценции.
Этот анализ может быть использован для обнаружения ингибирующей активности ингибитора Lp-PLA2 в отношении фермента Lp-PLA2 в плазме человека.
Методика анализа: испытуемое соединение (представленное в таблице 2) смешивали с раствором ДМСО в объемном отношении (1:3) и разбавляли с получением исходного планшета из 384-луночного микро планшета. Затем 0,01 мкл соединения переносили через дозатор жидкости ECHO из исходного планшета в 384-луночный планшет небольшого объема Greiner 784076 и добавляли 8 мкл предварительно аликвотированной и замороженной смешанной человеческой плазмы. Планшет центрифугировали при 500 об/мин в течение 10 секунд. После 30 мин предварительной инкубации 2 мкл раствора субстрата, содержащего 2,5 мМ 2-тио-PAF (раствор в этаноле), 32 мкМ СРМ (раствор в ДМСО) и буфер 3,2 мМ N-этилмалеимида (NEM) (буферный раствор, состоящий из 50 мМ
HEPES, рН 7,4, 150 мМ NaCl, 1 мМ CHAPS), вносили с помощью станции для обработки жидкости BRAVO в 384-луночный планшет Greiner 784076 малого объема. Через 2 мин реакционную смесь гасили 5 мкл 5% трифтоуксусной кислоты. После того как планшет инкубировали при комнатной температуре в течение 40 мин в темном месте, интенсивность флуоресценции считывали при возбуждении 380 нм/ эмиссии 485 нм с помощью считывателя планшетов Envision, и для анализа кривой и анализа QC для расчета рIС50 использовали модель аппроксимации XL в Excel. Результаты представлены в таблице 2. 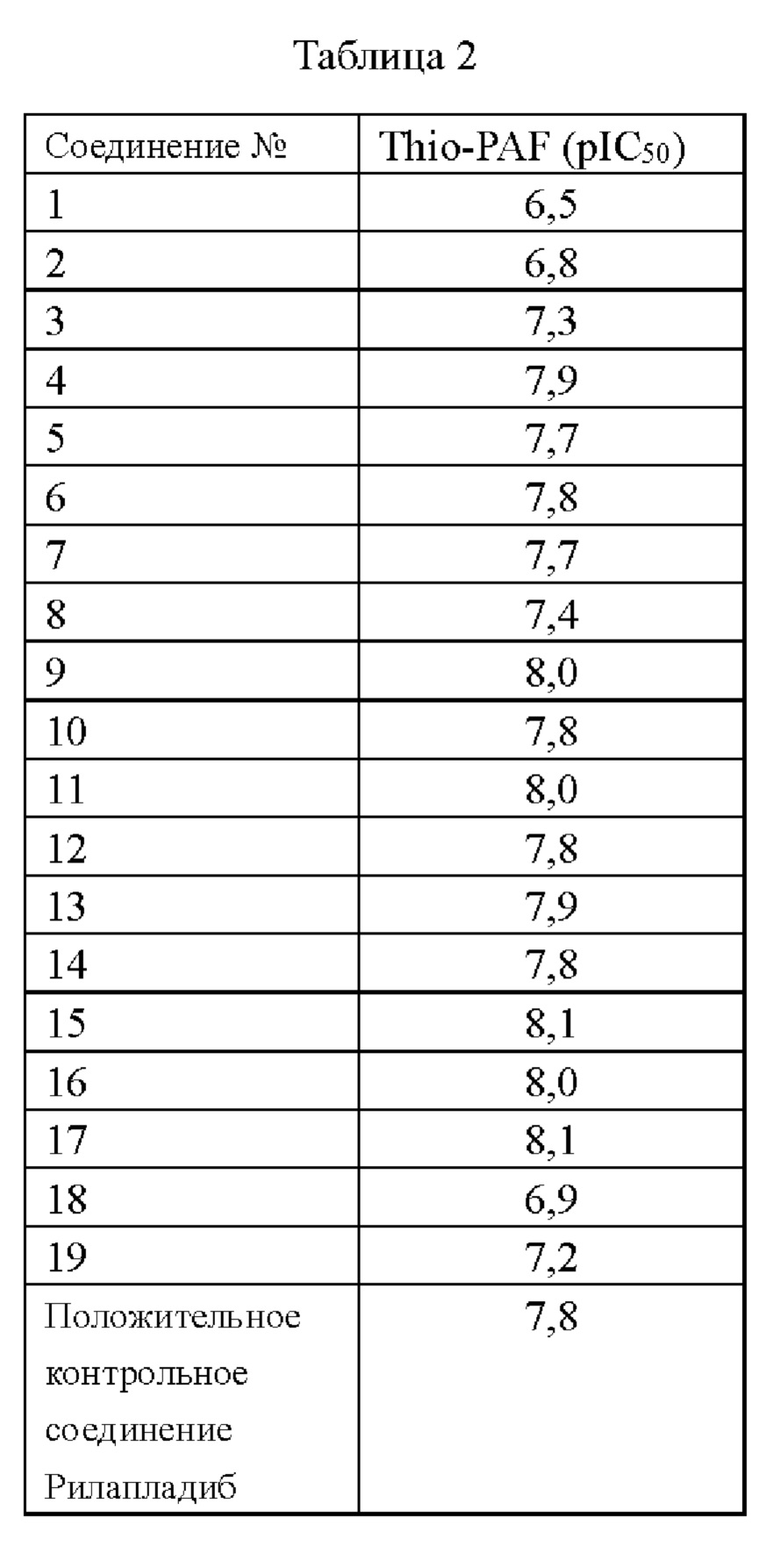
Группа изобретений относится к органической химии и включает соединение формулы (I) или его фармацевтически приемлемую соль, способ его получения, фармацевтическую композицию, его содержащую, и применение. В формуле (I) каждый n1, n2 и n3 независимо равен 0, 1 или 2; каждый R1 и R2 независимо выбран из -H, алкила, дейтерированного алкила, галогеналкила; каждый X1 и X2 независимо представляет собой -O-; Ar представляет собой ариленовую группу, где атомы водорода в арилене замещены 0, 1, 2 или 3 заместителями, и каждый из заместителей независимо выбран из галогена, алкила, дейтероалкила, галогеналкила; Y представляет собой -H, галоген, -OAr'; Ar' выбран из 6-10-членного арила или 5-6-членного гетероарила, содержащего 1-2 атома N, где атомы водорода в ариле или гетероариле замещены 1 или 2 заместителями, каждый из которых независимо выбран из галогена, алкила, дейтерированного алкила, галогеналкила, алкокси, дейтерированного алкокси, галогеналкокси; Z представляет собой O или S; каждый галоген в «галогене», «галогеналкиле» и «галогеналкокси» независимо выбран из F, Cl, Br или I; каждый алкил в «алкиле», «дейтерированном алкиле», «галогеналкиле», «галогеналкокси», «дейтерированном алкокси», «алкокси» независимо представляет собой C1-C7 линейный или разветвленный алкил; каждый «алкилен» независимо представляет собой C1-C7 линейный или разветвленный алкилен; «арилен» представляет собой 6-10-членный арилен. Технический результат - соединение формулы (I) в качестве ингибитора Lp-PLA2. 6 н. и 38 з.п. ф-лы, 2 табл., 19 пр.
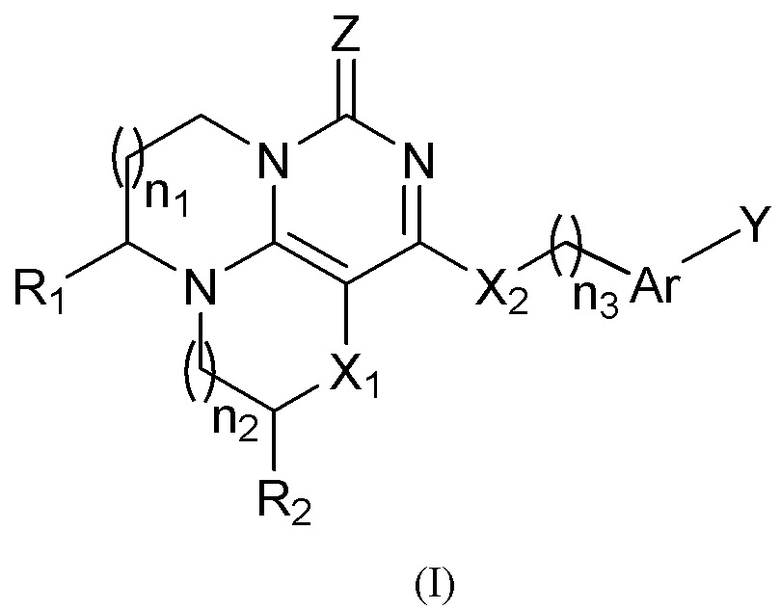
1. Соединение формулы I или его фармацевтически приемлемая соль:
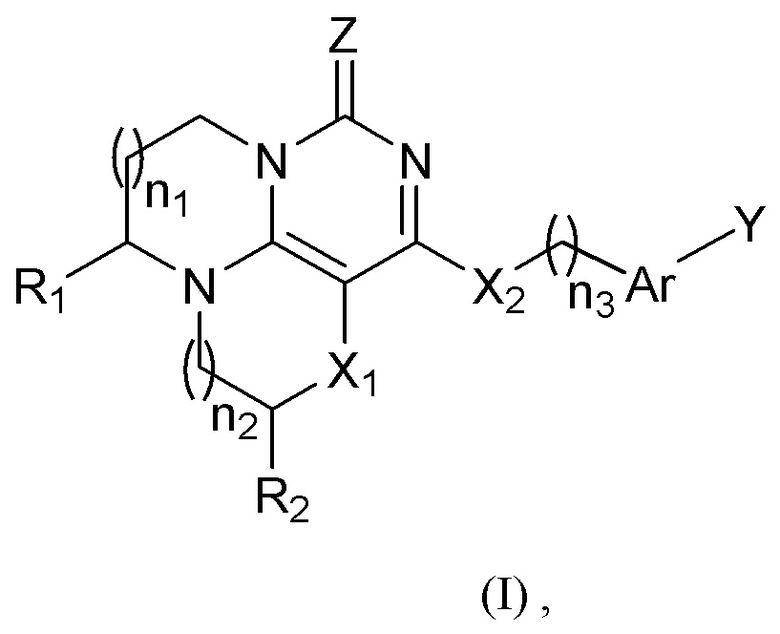
где
каждый n1, n2 и n3 независимо равен 0, 1 или 2;
каждый R1 и R2 независимо выбран из -H, алкила, дейтерированного алкила, галогеналкила;
каждый X1 и X2 независимо представляет собой -O-;
Ar представляет собой ариленовую группу, где атомы водорода в арилене замещены 0, 1, 2 или 3 заместителями, и каждый из заместителей независимо выбран из галогена, алкила, дейтероалкила, галогеналкила;
Y представляет собой -H, галоген, -OAr';
Ar' выбран из 6-10-членного арила или 5-6-членного гетероарила, содержащего 1-2 атома N, где атомы водорода в ариле или гетероариле замещены 1 или 2 заместителями, каждый из которых независимо выбран из галогена, алкила, дейтерированного алкила, галогеналкила, алкокси, дейтерированного алкокси, галогеналкокси;
Z представляет собой O или S;
каждый галоген в «галогене», «галогеналкиле» и «галогеналкокси» независимо выбран из F, Cl, Br или I;
каждый алкил в «алкиле», «дейтерированном алкиле», «галогеналкиле», «галогеналкокси», «дейтерированном алкокси», «алкокси» независимо представляет собой C1-C7 линейный или разветвленный алкил;
каждый «алкилен» независимо представляет собой C1-C7 линейный или разветвленный алкилен;
«арилен» представляет собой 6-10-членный арилен.
2. Соединение формулы (I) или его фармацевтически приемлемая соль по п. 1, где каждый алкил в «алкиле», «дейтерированном алкиле», «галогеналкиле», «галогеналкокси», «дейтерированном алкокси» и «алкокси» независимо представляет собой C1-C4 линейный или разветвленный алкил.
3. Соединение формулы (I) или его фармацевтически приемлемая соль по п. 1, где каждый алкил в «алкиле», «дейтерированном алкиле», «галогеналкиле», «галогеналкокси», «дейтерированном алкокси» и «алкокси» независимо выбран из метила, этила, н-пропила, изопропила, н-бутила, изобутила, трет-бутила, втор-бутила, н-пентила, 1-метилбутила, 2-метилбутила, 3-метилбутила, изопентила, 1-этилпропила, неопентила, н-гексила, 1-метилпентила, 2-метилпентила, 3-метилпентила, изогексила, 1,1-диметилбутила, 2,2-диметилбутила, 3,3-диметилбутила, 1,2-диметилбутила, 1,3-диметилбутила, 2,3-диметилбутила, 2-этилбутила, н-гептила, 2-метилгексила, 3-метилгексила, 2,2-диметилпентила, 3,3-диметилпентила, 2,3-диметилпентила, 2,4-диметилпентила, 3-этилпентила или 2,2,3-триметилбутила.
4. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-3, где каждый «алкилен» независимо представляет собой C1-C5 линейный или разветвленный алкилен.
5. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-3, где каждый «алкилен» выбран из метилена, этилена, н-пропилена, изопропилена, н-бутилена, изобутилена, трет-бутилена, втор-бутилена, н-пентилена, 1-метилбутилена, 2-метилбутилена, 3-метилбутилена, изопентилена, 1-этилпропилена, неопентилена, н-гексилена, 1-метилпентилена, 2-метилпентилена, 3-метилпентилена, изогексилена, 1,1-диметилбутилена, 2,2-диметилбутилена, 3,3-диметилбутилена, 1,2-диметилбутилена, 1,3-диметилбутилена, 2,3-диметилбутилена, 2-этилбутилена, н-гептилена, 2-метилгексилена, 3-метилгексилена, 2,2-диметилпентилена, 3,3-диметилпентилена, 2,3-диметилпентилена, 2,4-диметилпентилена, 3-этилпентилена или 2,2,3-триметилбутилена.
6. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-5, где «арил» представляет собой фенил или нафтил.
7. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-5, где «арил» представляет собой фенил, 1-нафтил или 2-нафтил.
8. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-7, где «арилен» представляет собой фенилен или нафтилен.
9. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-8, где «гетероарил» выбран из пиридинового кольца, пиррольного кольца, пиримидинового кольца, пиразинового кольца или пиридазинового кольца.
10. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-8, где «гетероарил» выбран из пиридин-2-ила, пиридин-3-ила, пиридин-4-ила, пиридазин-3-ила, пиридазин-4-ила, пиримидин-2-ила, пиримидин-4-ила, пиримидин-5-ила, пиразин-2-ила, пиразин-3-ила.
11. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-10, где n1 равен 0 или 1.
12. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-11, где n2 равен 1.
13. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-12, где n3 равен 1.
14. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-13, где каждый из R1 и R2 независимо выбран из -H, метила, этила, н-пропила, изопропила, н-бутила, изобутила, трет-бутила, втор-бутила, н-пентила, 1-метилбутила, 2-метилбутила, 3-метилбутила, изопентила, 1-этилпропила, неопентила, н-гексила, 1-метилпентила, 2-метилпентила, 3-метилпентила, изогексила, 1,1-диметилбутила, 2,2-диметилбутила, 3,3-диметилбутила, 1,2-диметилбутила, 1,3-диметилбутила, 2,3-диметилбутила, 2-этилбутила, н-гептила, 2-метилгексила, 3-метилгексила, 2,2-диметилпентила, 3,3-диметилпентила, 2,3-диметилпентила, 2,4-диметилпентила, 3-этилпентила, 2,2,3-триметилбутила, -CD3, -C2D5, -C3D7, галогеналкила.
15. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-14, где R1 представляет собой -H или -CH3.
16. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-14, где R1 представляет собой -H, R2 представляет собой -H.
17. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-16, где Ar представляет собой фенилен, где атомы водорода в указанном фенилене замещены 0, 1, 2 или 3 заместителями, каждый из которых независимо выбран из F, Cl, Br, I, -Me, -C2H5, -CD3 или -CF3.
18. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-16, где Ar представляет собой фенилен, где атом водорода в указанном фенилене замещен 2 заместителями, и указанный заместитель представляет собой F.
19. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-18, где Y представляет собой -H, -F, -Cl, -Br или -OAr'.
20. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-18, где Y представляет собой H, -F или -OAr'.
21. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-20, где Ar' выбран из фенила, пиридила, пиримидила, пирролила, или пиразолила, где каждый из атомов водорода в фениле, пиридиле, пиримидиле, пирролиле или пиразолиле независимо замещен 1 или 2 заместителями, при этом каждый из заместителей независимо выбран из F, Cl, Br, метила, этила, н-пропила, изопропила, н-бутила, изобутила, трет-бутила, втор-бутила, н-пентила, 1-метилбутила, 2-метилбутила, 3-метилбутила, изопентила, 1-этилпропила, неопентила, н-гексила, 1-метилпентила, 2-метилпентила, 3-метилпентила, изогексила, 1,1-диметилбутила, 2,2-диметилбутила, 3,3-диметилбутила, 1,2-диметилбутила, 1,3-диметилбутила, 2,3-диметилбутила, 2-этилбутила, н-гептила, 2-метилгексила, 3-метилгексила, 2,2-диметилпентила, 3,3-диметилпентила, 2,3-диметилпентила, 2,4-диметилпентила, 3-этилпентила, 2,2,3-триметилбутила, -CD3, C1-C6 галогеналкила, -OCH3, -OCD3, -OC2H7, -OC3H7, C1-C6 галогеналкоксила.
22. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-20, где Ar' выбран из фенила, пиридин-3-ила, пиридин-4-ила или пиримидин-5-ила и замещен 1 или 2 заместителями, где указанные заместители выбраны из F, Cl, -CH3, -CF3 или -OCF3.
23. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-22, где Z представляет собой O.
24. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-23, где соединение формулы (I) выбрано из следующих соединений:
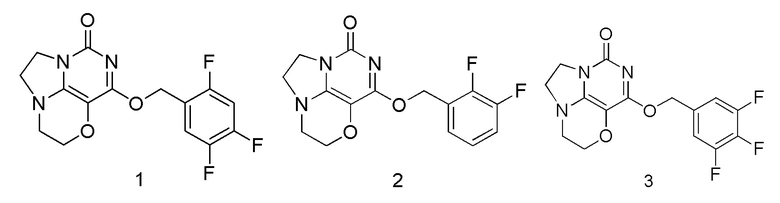
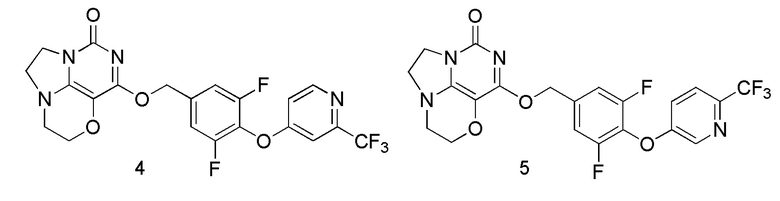
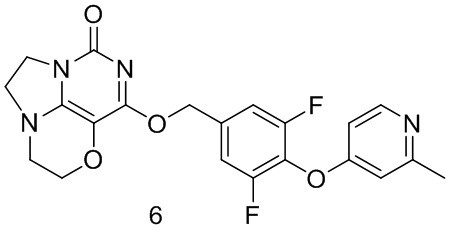


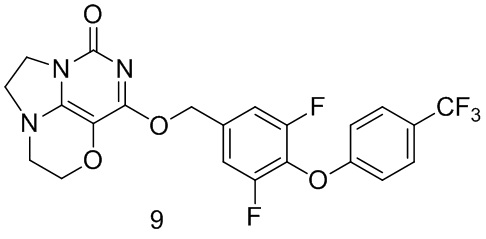
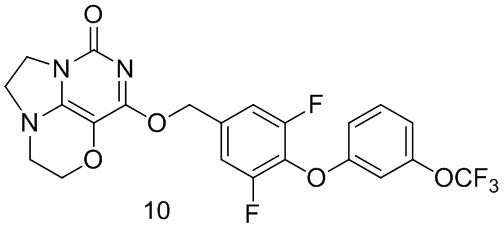
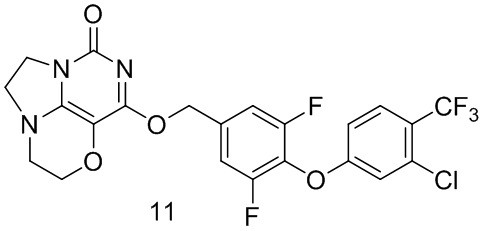

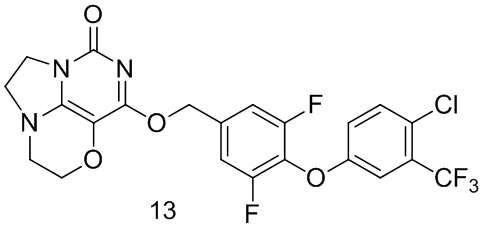
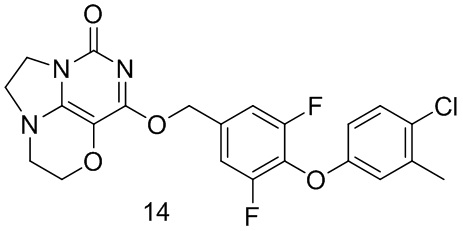

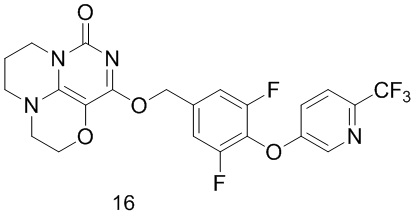
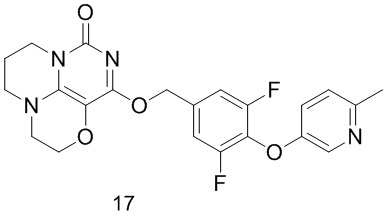
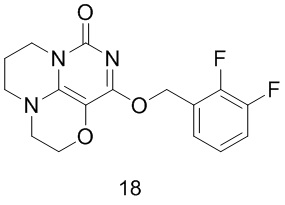
 .
.
25. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-24, где указанная фармацевтически приемлемая соль включает анионную соль или катионную соль соединения формулы (I).
26. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-24, где фармацевтически приемлемая соль включает соль щелочного металла, соль щелочноземельного металла или аммонийную соль соединения формулы (I).
27. Соединение формулы (I) или его фармацевтически приемлемая соль по п. 26, где указанный щелочной металл включает натрий, калий, литий или цезий, и указанный щелочноземельный металл включает магний, кальций или стронций.
28. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-24, где фармацевтически приемлемая соль включает соль, образуемую соединением Формулы (I) и органическим основанием.
29. Соединение формулы (I) или его фармацевтически приемлемая соль по п. 28, где органическое основание включает триалкиламин, пиридин, хинолин, пиперидин, имидазол, пиколин, диметиламинопиридин, диметиланилин, N-алкилморфолин, 1,5-диазабицикло[4.3.0]нонен-5, 1,8-диазабицикло[5.4.0]ундецен-7, 1,4-диазабицикло[2.2.2]октан.
30. Соединение формулы (I) или его фармацевтически приемлемая соль по п. 29, где указанный триалкиламин включает триметиламин, триэтиламин или N-этилдиизопропиламин; указанный N-алкилморфолин включает N-метилморфолин.
31. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-24, где фармацевтически приемлемая соль включает соль, образуемую соединением формулы (I) и кислотой.
32. Соединение формулы (I) или его фармацевтически приемлемая соль по любому из пп. 1-24, где указанная кислота включает неорганическую кислоту или органическую кислоту.
33. Соединение формулы (I) или его фармацевтически приемлемая соль по п. 32, где указанная неорганическая кислота включает хлористоводородную кислоту, бромистоводородную кислоту, йодистоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту или угольную кислоту; указанная органическая кислота включает муравьиную кислоту, уксусную кислоту, пропионовую кислоту, щавелевую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, малеиновую кислоту, молочную кислоту, яблочную кислоту, лимонную кислоту, винную кислоту, угольную кислоту, пикриновую кислоту, метансульфоновую кислоту, этансульфоновую кислоту, п-толуолсульфоновую кислоту, глутаминовую кислоту или памовую кислоту.
34. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли по любому из пп. 1-33, включающий следующий путь синтеза:
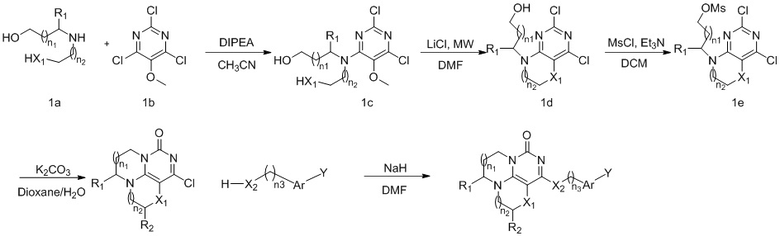
при этом в каждой из формул в способе получения, описанном выше, n1, n2, n3, R1, R2, X1, X2, Ar и Y принимают значения, определенные в любом из пп. 1-33.
35. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении Lp-PLA2, содержащая терапевтически эффективное количество соединения формулы (I) по любому из пп. 1-33 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель.
36. Фармацевтическая композиция по п. 35, отличающаяся тем, что лекарственная форма фармацевтической композиции включает пероральный, ректальный или парентеральный состав.
37. Фармацевтическая композиция по п. 36, отличающаяся тем, что пероральный состав фармацевтической композиции включает твердый или жидкий состав.
38. Фармацевтическая композиция по п. 37, отличающаяся тем, что твердый состав включает таблетку, порошок, гранулу или капсулу;
жидкий состав включает водную или масляную суспензию или сироп.
39. Фармацевтическая композиция по п. 36, отличающаяся тем, что парентеральный состав включает раствор для инъекций или водную или масляную суспензию.
40. Применение соединения формулы (I) или его фармацевтически приемлемой соли по любому из пп. 1-33 или фармацевтической композиции по любому из пп. 35-39 для получения ингибитора Lp-PLA2.
41. Применение соединения формулы (I) или его фармацевтически приемлемой соли по любому из пп. 1-33 или фармацевтической композиции по любому из пп. 35-39 в качестве ингибитора Lp-PLA2 для получения лекарственного средства для лечения заболеваний, связанных с нейродегенерацией.
42. Применение по п. 41, отличающееся тем, что указанные связанные с нейродегенерацией заболевания включают болезнь Альцгеймера (БА), глаукому или возрастную макулярную дегенерацию (AMD).
43. Применение соединения формулы (I) или его фармацевтически приемлемой соли по любому из пп. 1-33 или фармацевтической композиции по любому из пп. 35-39 в качестве ингибитора Lp-PLA2 для получения лекарственного средства для лечения сердечно-сосудистых заболеваний, диабетического макулярного отека (ДМО) или заболеваний предстательной железы.
44. Применение по п. 43, отличающееся тем, что указанные сердечно-сосудистые заболевания включают атеросклероз.
| CN 103827116 A, 28.05.2014 | |||
| CN 105008368 A, 28.10.2015 | |||
| CN 106536525 A, 22.03.2017 | |||
| WO 2016012916 A1, 28.01.2016 | |||
| RU 2015135806 A, 03.03.2017. |
Авторы
Даты
2024-06-11—Публикация
2021-06-25—Подача