ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение принадлежит к области медицины и относится к производному индола и формамида, способу его получения и применению в медицине. В частности, настоящее изобретение относится к производному индола и формамида формулы (I), способу его получения, содержащей его фармацевтической композиции, применению их в качестве агониста ROR, а также к применению их для получения лекарственного средства для предупреждения и/или лечения опухоли или раковой опухоли.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Орфанный (сиротский) рецептор ретиноидов (англ. ROR, Retinoid-related orphan receptor) принадлежит к семейству ядерных рецепторов и является представителем класса лиганд-зависимых факторов транскрипции. Он может регулировать различные физиологические и биохимические процессы, в том числе репродуктивное развитие, метаболизм, регуляцию иммунной системы и тому подобное (Mech Dev. 1998 Jan, 70 (1-2: 147-53; EMBO J. 1998 Jul 15, 17(14):3867-77). Семейство ROR включает в себя три типа: RORα, RORβ и RORγ (Curr Drug Targets Inflamm Allergy. 2004 Dec, 3(4):395-412), из которых RORγ может экспрессироваться во многих тканях, включая тимус, печень, почки, жировую ткань, скелетные мышцы и т.д. (Immunity. 1998 Dec, 9(6):797-806).
RORγ бывает двух подтипов: RORγ1 и RORγt (RORγ2), при этом RORγ1 экспрессируется во многих тканях, таких как тимус, мышцы, почки и печень, тогда как RORγt экспрессируется исключительно в клетках иммунной системы (Eur J Immunol. 1999 Dec, 29(12):4072-80). В литературе сообщалось, что RORγt может регулировать выживание Т-клеток во время дифференцировки иммунных клеток и может активировать и стимулировать дифференцировку клеток CD4+ и CD8+ в Т-хелпер-17 (Th17) и цитотоксичные Т-клетки (Тс17) (J Immunol. 2014 Mar 15, 192(6):2564-75). Клетки ТН17 и Тс17 относятся к классу эффекторных клеток, которые стимулируют воспалительный ответ, усиливают приобретенный иммунный ответ и аутоиммунный ответ путем секреции интерлейкина-17 (IL-17) и других воспалительных факторов, таких как IL-21. Кроме того, существующие исследования показали, что рост трансплантированной опухоли может быть в значительной степени ингибирован путем трансплантации мышам-опухоленосителям клеток Th17 и Тс17 (J Immunol. 2010 Apr 15, 184(8):4215-27). Th17 могут также рекрутировать цитотоксические CD8+ Т-клетки и естественные клетки-киллеры для проникновения в микроокружение опухоли, убивая тем самым опухолевые клетки и достигая противоопухолевых целей (Blood. 2009 Aug 6, 114(6):1141-9; Clin Cancer Res. 2008 Jun 1, 14(11):3254-61). Таким образом, активация RORγt, вероятно, может стать новым направлением в противоопухолевой терапии.
На настоящий момент фармацевтическими компаниями разработаны агонисты RORγt, такие как низкомолекулярное лекарственное средство LYC-55716, созданное компанией Lycera Corp. Доклинические исследования показали, что его аналог LYC-54143 ингибирует рост опухоли двумя различными путями, проявляя при этом достаточно высокую противоопухолевую активность. Во-первых, LYC-54143 активирует RORγt для регуляции дифференцировки клеток Th17 и Тс17 посредством традиционных путей, стимуляции экспрессии других цитокинов, таких как IL-17, и повышения активности Т-клеток. Кроме того, активированный RORγt может регулировать экспрессию целого ряда генов в иммунной системе, ингибировать экспрессию PD-1 в клеточных рецепторах контрольных точек, тем самым снижая иммуносупрессию и повышая противоопухолевую активность (Oncoimmunology. 2016 Nov 4, 5(12): е1254854; ACS Chem Biol. 2016 Apr 15, 11(4):1012-8). И хотя в настоящее время LYC-55716 вступил в клиническую фазу II, на сегодняшний день имеется недостаточно лекарственных средств, связанных с этой мишенью, причем такие лекарственные средства отсутствуют в продаже. Раскрытые заявки на патенты включают, например, WO 2015171558, WO 2008152260, WO 2007068580, WO 2007068579, WO 2005056516, WO 2005056510, WO 2005066116 и WO 00228810. По-прежнему существует необходимость в продолжении разработки новых и более эффективных агонистов RORγt для обеспечения пациентов новыми и эффективными противоопухолевыми препаратами.
Авторы настоящего изобретения разработали соединение индола и формамида, имеющее структуру, представленную формулой (I), проявляющее значительный агонистический эффект в отношении ROR. Входе изучения агонистов ROR авторы изобретения также установили, что изменения орто-группы в кольце А соединения формулы (I) по настоящему изобретению могут изменять его регулирующее действие. В случае, когда орто-группа в кольце А представляет собой группу, имеющую небольшое стерическое затруднение (такую как Н), соединение формулы (I) является обратным агонистом. Когда орто-группа в кольце А представляет собой группу, обладающую значительным стерическим затруднением, как, например, галогеналкил (такой как трифторметил), алкил (такой как этил) и галогеналкокси (такой как трифторметокси), соединение формулы (I) является агонистом ROR. Настоящее изобретение также предлагает фармакодинамическое исследование, в котором соединение по настоящему изобретению показывает высокую противоопухолевую активность при монокомпонентном введении. Кроме того, соединение по настоящему изобретению проявляет синергическое действие при введении в комбинации с антителом к PD-1, что открывает новые возможности для повышения эффективности иммунотерапии.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является получение соединения формулы (I):
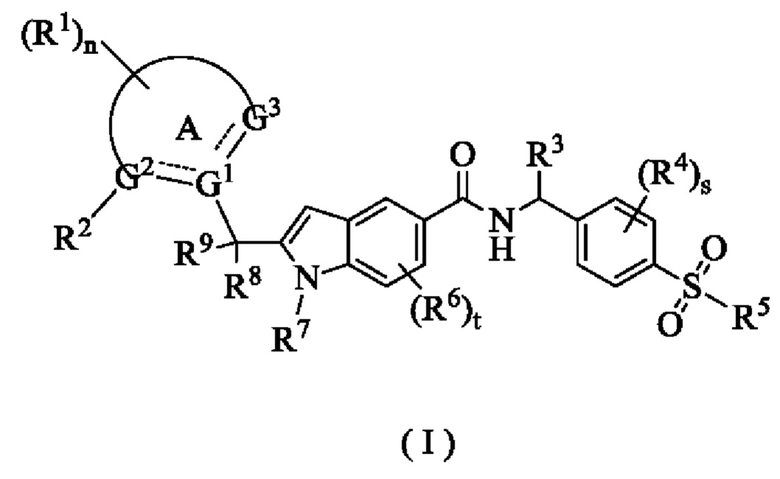
или его таутомера, мезомера, рацемата, энантиомера, диастереомера или их смеси, или его фармацевтически приемлемой соли,
где:
 означает двойную или одинарную связь;
означает двойную или одинарную связь;
G1, G2 и G3 являются одинаковыми или разными, при этом каждый независимо выбран из группы, состоящей из С, СН, СН2 и N;
кольцо А выбрано из группы, состоящей из арила, гетероарила, циклоалкила и гетероциклила;
каждый из R1 является одинаковым или различным, при этом каждый независимо выбран из группы, состоящей из водорода, галогена, алкила, галогеналкила, алкокси, галогеналкокси, циано, амино, нитро, гидрокси и гидроксиалкила;
R2 представляет собой галогеналкил;
R3 выбран из группы, состоящей из алкила, галогеналкила, алкокси, галогеналкокси, гидроксиалкила, галогена, циано, амино, нитро, гидрокси, циклоалкила, гетероциклила, арила и гетероарила, где каждый из алкила, галогеналкила, циклоалкила, гетероциклила, арила и гетероарила независимо факультативно замещен одним или более заместителями, выбранными из группы, состоящей из гидрокси, галогена, алкила, алкокси и амино;
каждый из R4 является одинаковым или различным, при этом каждый независимо выбран из группы, состоящей из водорода, галогена, алкила, галогеналкила, алкокси, галогеналкокси, циано, амино, нитро, гидрокси, гидроксиалкила, циклоалкила, гетероциклила, арила и гетероарила;
R5 выбран из группы, состоящей из водорода, алкила, галогеналкила, амино, гидрокси, гидроксиалкила, циклоалкила, гетероциклила, NR10R11, арила и гетероарила, где каждый из алкила, циклоалкила, гетероциклила, арила и гетероарила независимо факультативно замещен одним или более заместителями, выбранными из группы, состоящей из гидрокси, галогена, алкила, амино, циклоалкила и гетероциклила;
каждый из R6 является одинаковым или различным, при этом каждый независимо выбран из группы, состоящей из водорода, галогена, алкила, галогеналкила, алкокси, галогеналкокси, циано, амино, нитро, гидрокси, гидроксиалкила, циклоалкила, гетероциклила, арила и гетероарила;
R7 выбран из группы, состоящей из водорода, алкила, галогеналкила, циклоалкила и гетероциклила, где алкил факультативно замещен одним или более заместителями, выбранными из группы, состоящей из галогена, нитро, циклоалкила и гетероциклила;
R8 и R9 являются одинаковыми или разными, при этом каждый независимо выбран из группы, состоящей из водорода, галогена, алкила, галогеналкила, алкокси, циано, амино, нитро, гидрокси и гидроксиалкила;
R10 и R11 являются одинаковыми или разными, при этом каждый независимо выбран из группы, состоящей из водорода, алкила, галогеналкила, амино, гидрокси, гидроксиалкила, циклоалкила, гетероциклила, арила и гетероарила;
n равно 0, 1, 2, 3 или 4;
s равно 0, 1, 2 или 3; а
t равно 0, 1, 2 или 3.
Согласно предпочтительному варианту осуществления настоящего изобретения, соединение формулы (I) представляет собой соединение формулы (IA):
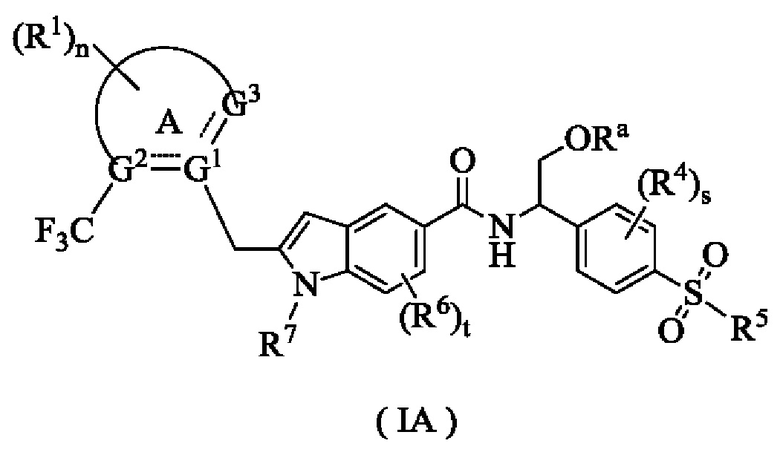
где:
Ra представляет собой водород или алкил;
 кольцо A, G1~G3, R1, R4~R7, n, s и t являются такими, как определены для формулы (I).
кольцо A, G1~G3, R1, R4~R7, n, s и t являются такими, как определены для формулы (I).
Согласно предпочтительному варианту осуществления настоящего изобретения, соединение формулы (I) представляет собой соединение формулы (II):

где:
 кольцо A, G1~G3, R1, R4~R7, n, s и t являются такими, как определено для формулы (I).
кольцо A, G1~G3, R1, R4~R7, n, s и t являются такими, как определено для формулы (I).
Согласно предпочтительному варианту осуществления настоящего изобретения, соединение формулы (I) представляет собой соединение формулы (I') ниже:

где кольцо A, R1~R9, n, s и t являются такими, как определено для формулы (I).
Согласно другому предпочтительному варианту осуществления настоящего изобретения, соединение формулы (II) представляет собой соединение формулы (II') ниже:

где кольцо A, R1, R4~R7, n, s и t являются такими, как определено для формулы (II).
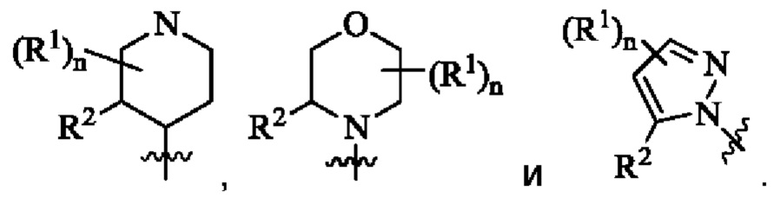
Согласно предпочтительному варианту осуществления настоящего изобретения, в соединении формулы (I) кольцо А выбрано из группы, состоящей из фенила, пиридила, имидазолила, пиразолила и морфолинила.
Согласно предпочтительному варианту осуществления настоящего изобретения, в соединении формулы (I) 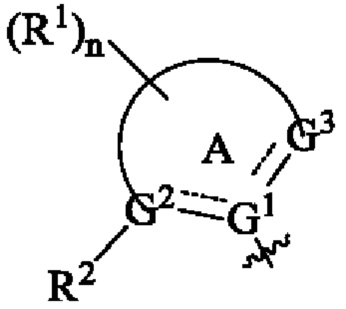 выбрано из группы, состоящей из
выбрано из группы, состоящей из 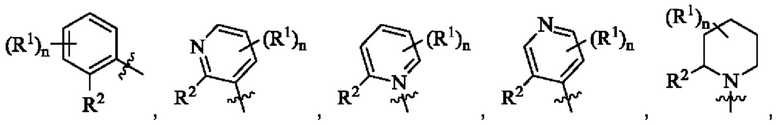
Согласно предпочтительному варианту осуществления настоящего изобретения, соединение формулы (I) представляет собой соединение формулы (III):

где:
R1, R5~R7, n и t являются такими, как определено для формулы (I).
Согласно предпочтительному варианту осуществления настоящего изобретения, соединение формулы (I) представляет собой соединение формулы (IV):

где:
R1, R5~R7, n и t являются такими, как определено для формулы (I).
Согласно предпочтительному варианту осуществления настоящего изобретения, в соединении формулы (I) R1 выбран из группы, состоящей из водорода, галогена и алкила.
Согласно предпочтительному варианту осуществления настоящего изобретения, в соединении формулы (I) R5 выбран из группы, состоящей из алкила, NR10R11 и циклоалкила, где каждый из алкила и циклоалкила независимо факультативно замещен одним или более заместителями, выбранными из группы, состоящей из гидрокси, галогена, алкила, амино, циклоалкила и гетероциклила; R10 и R11 являются такими, как определены для формулы (I).
Согласно предпочтительному варианту осуществления настоящего изобретения, в соединении формулы (I) R5 выбран из группы, состоящей из этила, циклопропила, циклопропилметила и -NH-циклопропила.
Согласно предпочтительному варианту осуществления настоящего изобретения, в соединении формулы (I) R6 является водородом или галогеном.
Согласно предпочтительному варианту осуществления настоящего изобретения, в соединении формулы (I) R7 выбран из группы, состоящей из алкила, циклоалкила и галогеналкила.
Типичные соединения формулы (I) включают, не исчерпываясь перечнем:


или его таутомер, мезомер, рацемат, энантиомер, диастереомер или их смесь, или его фармацевтически приемлемую соль.
Согласно другому аспекту, настоящее изобретение относится к фармацевтической композиции, включающей в себя терапевтически эффективное количество соединения формулы (I) или его таутомера, мезомера, рацемата, энантиомера, диастереомера или их смеси, или его фармацевтически приемлемой соли и один или более фармацевтически приемлемых носителей, разбавителей или наполнителей. Настоящее изобретение также относится к способу получения фармацевтической композиции, включающему стадию смешивания соединения формулы (I) или его таутомера, мезомера, рацемата, энантиомера, диастереомера или их смеси, или его фармацевтически приемлемой соли с фармацевтически приемлемым носителем (носителями), разбавителем (разбавителями) или наполнителем (наполнителями). Согласно одному из вариантов осуществления настоящего изобретения, фармацевтическая композиция также включает в себя антитело против PD-1 (анти-PD-1-антитело), предпочтительно, антитело против мышиного PD-1.
Настоящее изобретение также относится к применению соединения формулы (I) или его таутомера, мезомера, рацемата, энантиомера, диастереомера или их смеси, или его фармацевтически приемлемой соли, или содержащей их фармацевтической композиции для получения агониста ROR.
Настоящее изобретение также относится к применению соединения формулы (I) или его таутомера, мезомера, рацемата, энантиомера, диастереомера или их смеси, или его фармацевтически приемлемой соли, или содержащей их фармацевтической композиции в качестве агониста ROR для получения лекарственного средства для предупреждения и/или лечения опухоли или рака.
Настоящее изобретение также относится к применению соединения формулы (I) или его таутомера, мезомера, рацемата, энантиомера, диастереомера или их смеси, или его фармацевтически приемлемой соли (в качестве агониста ROR), или содержащей их фармацевтической композиции в комбинации с анти-PD-1-антителом для получения лекарственного средства для предупреждения и/или лечения опухоли или рака.
Настоящее изобретение также относится к соединению формулы (I) или его таутомеру, мезомеру, рацемату, энантиомеру, диастереомеру или их смеси, или его фармацевтически приемлемой соли или содержащей их фармацевтической композиции для применения в качестве лекарственного средства.
Настоящее изобретение также относится к соединению формулы (I) или его таутомеру, мезомеру, рацемату, энантиомеру, диастереомеру или их смеси, или его фармацевтически приемлемой соли, или содержащей их фармацевтической композиции для применения в качестве агониста ROR.
Настоящее изобретение также относится к соединению формулы (I) или его таутомеру, мезомеру, рацемату, энантиомеру, диастереомеру или их смеси, или его фармацевтически приемлемой соли, или содержащей их фармацевтической композиции для применения в качестве агониста ROR для предупреждения и/или лечения опухоли или рака.
Настоящее изобретение также относится к комбинации соединения формулы (I) или его таутомера, мезомера, рацемата, энантиомера, диастереомера или их смеси, или его фармацевтически приемлемой соли, или содержащей их фармацевтической композиции и анти-PD-1-антитела для применения для предупреждения и/или лечения опухоли или рака.
Настоящее изобретение также относится к способу предупреждения и/или лечения опухоли или рака, включающему стадию введения пациенту, нуждающемуся в этом, терапевтически эффективной дозы соединения формулы (I) или его таутомера, мезомера, рацемата, энантиомера, диастереомера или их смеси, или его фармацевтически приемлемой соли, или содержащей их фармацевтической композиции в качестве агониста ROR.
Настоящее изобретение также относится к способу предупреждения и/или лечения опухоли или раковой опухоли, включающему в себя стадию введения пациенту, нуждающемуся в этом, терапевтически эффективной дозы соединения формулы (I) или его таутомера, мезомера, рацемата, энантиомера, диастереомера или их смеси, или его фармацевтически приемлемой соли, или содержащей их фармацевтической композиции и анти-PD-1-антитела.
Фармацевтическая композиция, содержащая активный ингредиент, может иметь форму, подходящую для перорального способа введения, например, это может быть таблетка, лепешка, пастилка, водная или масляная суспензия, диспергируемые порошок или гранулы, эмульсия, твердая или мягкая капсула, сироп или эликсир. Композиция для перорального применения может быть приготовлена при помощи любого известного в данной области техники способа приготовления фармацевтической композиции. Для получения привлекательной и приятной на вкус фармацевтической композиции такая композиция может содержать один или более ингредиентов, выбранных из группы, состоящей из подсластителей, вкусо-ароматических добавок, красителей и консервантов. Таблетка содержит активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми наполнителями, подходящими для изготовления таблеток. Такими наполнителями могут быть инертные наполнители, гранулирующие агенты, разрыхлители, связующие и смазывающие вещества. Таблетка может быть без покрытия либо может иметь покрытие, нанесенное с помощью известных способов, для маскировки вкуса лекарственного средства или замедления распада и абсорбции активного ингредиента в желудочно-кишечном тракте, что обеспечивает замедленное высвобождение в течение длительного времени.
Состав для перорального применения также может быть представлен в виде мягких желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, либо активный ингредиент смешан с водорастворимым носителем или масляной средой.
Водная суспензия содержит активный ингредиент в смеси с наполнителями, подходящими для приготовления водной суспензии. Такими наполнителями являются суспендирующие агенты, диспергирующие вещества или увлажняющие агенты. Водная суспензия может также содержать один или более консервантов, один или более красителей, одну или более вкусо-ароматических добавок, один или более подсластителей.
Масляная суспензия может быть приготовлена путем суспендирования активного ингредиента в растительном или минеральном масле. Масляная суспензия может содержать загуститель. Для получения приятного на вкус состава могут быть добавлены упоминавшиеся выше подсластители и вкусо-ароматические добавки. Такие композиции могут быть сохранены при помощи добавления антиокислителя.
Фармацевтическая композиция по настоящему изобретению также может иметь форму эмульсии типа "масло в воде". Масляная фаза может быть растительным маслом, или минеральным маслом, или их смесью. Приемлемыми эмульгирующими агентами могут быть фосфолипиды природного происхождения. Кроме того, эмульсия может содержать подсластитель, вкусо-ароматическую добавку, консервант и антиокислитель. Такой состав может также содержать средство, уменьшающее раздражение, консервант, краситель и антиокислитель.
Фармацевтическая композиция по настоящему изобретению может иметь форму стерильного водного раствора для инъекций. Приемлемыми носителями или растворителями, которые можно использовать, являются вода, раствор Рингера или изотонический раствор хлорида натрия. Стерильный состав для инъекций может представлять собой стерильную микроэмульсию типа "масло в воде" для инъекций, в которой активный ингредиент растворен в масляной фазе. Раствор или микроэмульсия для инъекций могут быть введены в кровоток пациента при помощи локальной болюсной инъекции. В качестве альтернативы, раствор и микроэмульсию предпочтительно вводят таким образом, чтобы поддерживать постоянную циркулирующую концентрацию соединения по настоящему изобретению. Для поддержания такой постоянной концентрации можно использовать устройство для непрерывной внутривенной доставки. Примером такого устройства является насос для внутривенных инъекций Deltec CADD-PLUS. ТМ. 5400.
Фармацевтическая композиция по настоящему изобретению может иметь форму стерильной водной или масляной суспензии для инъекций, подходящей для внутримышечного и подкожного введения. Такая суспензия может быть приготовлена с использованием подходящих диспергирующих веществ или увлажняющих агентов и суспендирующих агентов, как описаны выше, в соответствии с известными способами. Стерильный состав для инъекций может также представлять собой стерильный раствор или суспензию для инъекций, приготовленные в нетоксичном, подходящем для парентерального введения разбавителе или растворителе. Кроме того, в качестве растворителя или суспендирующей среды можно использовать стерильные нелетучие масла. Для этой цели можно использовать любое смешанное нелетучее масло. Кроме того, для приготовления инъекций можно также использовать жирные кислоты.
Соединение по настоящему изобретению можно вводить в форме суппозитория для ректального введения. Такие фармацевтические композиции могут быть приготовлены путем смешивания лекарственного средства с подходящим не вызывающим раздражения наполнителем, которое является твердым при обычных температурах, но становится жидким в прямой кишке и, следовательно, расплавляется в прямой кишке с высвобождением лекарственного средства.
Специалистам в данной области техники хорошо известно, что дозировка лекарственного средства зависит от множества факторов, включая, но не ограничиваясь перечнем, следующие: активность конкретного соединения, возраст пациента, вес пациента, общее состояние здоровья пациента, поведение пациента, питание пациента, время введения, способ введения, скорость выведения, комбинация лекарственных средств и тому подобное. Кроме того, оптимальное лечение, такое как режим лечения, суточная доза соединения формулы (I) или тип его фармацевтически приемлемой соли, может быть проверено с помощью традиционных схем лечения.
ОПРЕДЕЛЕНИЯ
Если не указано иное, термины, используемые в описании и формуле изобретения, имеют значения, описанные ниже.
Термин "алкил" относится к насыщенной алифатической углеводородной группе, представляющей собой группу с прямой или разветвленной цепью, содержащую от 1 до 20 атомов углерода, предпочтительно, алкильную группу, содержащую от 1 до 12 атомов углерода и, более предпочтительно, алкильную группу, содержащую от 1 до 6 атомов углерода. Неограничивающие примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, втор-бутил, н-пентил, 1,1-диметилпропил, 1,2-диметилпропил, 2,2-диметилпропил, 1-этилпропил, 2-метилбутил, 3-метилбутил, н-гексил, 1-этил-2-метилпропил, 1,1,2-триметилпропил, 1,1-диметилбутил, 1,2-диметилбутил, 2,2-диметилбутил, 1,3-диметилбутил, 2-этилбутил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2,3-диметилбутил, н-гептил, 2-метилгексил, 3-метилгексил, 4-метилгексил, 5-метилгексил, 2,3-диметилпентил, 2,4-диметилпентил, 2,2-диметилпентил, 3,3-диметилпентил, 2-этилпентил, 3-этилпентил, н-октил, 2,3-диметилгексил, 2,4-диметилгексил, 2,5-диметилгексил, 2,2-диметилгексил, 3,3-диметилгексил, 4,4-диметилгексил, 2-этилгексил, 3-этилгексил, 4-этилгексил, 2-метил-2-этилпентил, 2-метил-3-этилпентил, н-нонил, 2-метил-2-этилгексил, 2-метил-3-этилгексил, 2,2-диэтилпентил, н-децил, 3,3-диэтилгексил, 2,2-диэтилгексил и их различные разветвленные изомеры. Более предпочтительно, алкильная группа является низшим алкилом, содержащим от 1 до 6 атомов углерода, при этом неограничивающие примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, втор-бутил, н-пентил, 1,1-диметилпропил, 1,2-диметилпропил, 2,2-диметилпропил, 1-этилпропил, 2-метилбутил, 3-метилбутил, н-гексил, 1-этил-2-метилпропил, 1,1,2-триметилпропил, 1,1-диметилбутил, 1,2-диметилбутил, 2,2-диметилбутил, 1,3-диметилбутил, 2-этилбутил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2,3-диметилбутил и тому подобное. Алкильная группа может быть замещенной или незамещенной. При наличии замещения заместитель (заместители) может находиться в любом доступном для присоединения месте. Предпочтительно, заместитель (заместители) представляет собой одну или более групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси, циклоалкилтио, гетероциклилтио, оксо, карбокси и алкоксикарбонила.
Термин "алкокси" относится к группе -О-(алкил) или -O-(незамещенный циклоалкил), где алкил и циклоалкил такие, как определены выше. Неограничивающие примеры алкоксильных групп включают метокси, этокси, пропокси, бутокси, циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси. Алкоксильная группа может быть факультативно замещенной или незамещенной. При наличии замещения заместитель (заместители) предпочтительно представляет собой одну или более групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси, циклоалкилтио, гетероциклилтио, карбокси и алкоксикарбонила.
Термин "циклоалкил" относится к насыщенному или частично ненасыщенному моноциклическому или полициклическому углеводородному заместителю, содержащему от 3 до 20 атомов углерода, предпочтительно, от 3 до 12 атомов углерода и, более предпочтительно, от 3 до 6 атомов углерода. Неограничивающие примеры моноциклического циклоалкила включают циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогексадиенил, циклогептил, циклогетатриенил, циклооктил и тому подобное. Полициклический циклоалкил включает циклоалкил, содержащий спирокольцо, конденсированное кольцо или кольцо с внутренним мостиком.
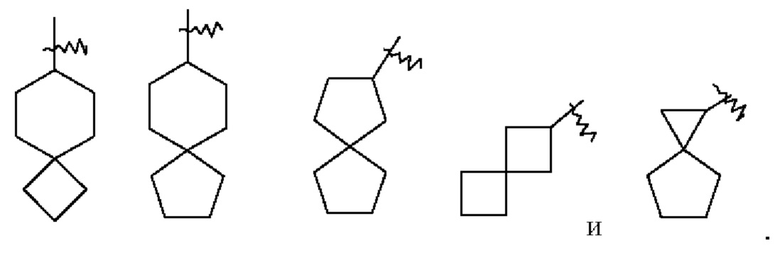
Термин "спироциклоалкил" относится к от 5 до 20-членной полициклической группе с отдельными кольцами, соединенными через один общий атом углерода (называемый спироатомом), где кольца могут содержать одну или более двойных связей, но ни одно из колец не имеет полностью сопряженной  системы. Спироциклоалкил предпочтительно представляет собой от 6 до 14-членный спироциклоалкил и, более предпочтительно, от 7 до 10-членный спироциклоалкил. В зависимости от числа спироатомов, общих для колец, спироциклоалкил можно подразделить на моноспироциклоалкил, диспироциклоалкил или полисписроциклоалкил, при этом спироциклоалкил предпочтительно представляет собой моноспироциклоалкил или диспироциклоалкил и, более предпочтительно, 4-членный/4-членный, 4-членный/5-членный, 4-членный/6-членный, 5-членный/5-членный или 5-членный/6-членный моноспироциклоалкил. Неограничивающие примеры спироциклоалкила включают:
системы. Спироциклоалкил предпочтительно представляет собой от 6 до 14-членный спироциклоалкил и, более предпочтительно, от 7 до 10-членный спироциклоалкил. В зависимости от числа спироатомов, общих для колец, спироциклоалкил можно подразделить на моноспироциклоалкил, диспироциклоалкил или полисписроциклоалкил, при этом спироциклоалкил предпочтительно представляет собой моноспироциклоалкил или диспироциклоалкил и, более предпочтительно, 4-членный/4-членный, 4-членный/5-членный, 4-членный/6-членный, 5-членный/5-членный или 5-членный/6-членный моноспироциклоалкил. Неограничивающие примеры спироциклоалкила включают:
Термин "конденсированный циклоалкил" относится к от 5 до 20-членной полностью углеродной полициклической группе, где каждое кольцо в системе имеет общую смежную пару атомов углерода с другим кольцом, где одно или более колец могут содержать одну или более двойных связей, но ни одно из колец не имеет полностью сопряженной 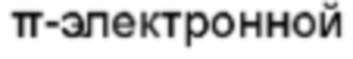 системы. Конденсированный циклоалкил предпочтительно представляет собой от 6 до 14-членный конденсированный циклоалкил и, более предпочтительно, от 7 до 10-членный конденсированный циклоалкил. В зависимости от числа членных колец конденсированный циклоалкил можно подразделить на бициклический, трициклический, тетрациклический или полициклический конденсированный циклоалкил, при этом конденсированный циклоалкил предпочтительно представляет собой бициклический или трициклический конденсированный циклоалкил и, более предпочтительно, 5-членный/5-членный или 5-членный/6-членный бициклический конденсированный циклоалкил. Неограничивающие примеры конденсированного циклоалкила включают:
системы. Конденсированный циклоалкил предпочтительно представляет собой от 6 до 14-членный конденсированный циклоалкил и, более предпочтительно, от 7 до 10-членный конденсированный циклоалкил. В зависимости от числа членных колец конденсированный циклоалкил можно подразделить на бициклический, трициклический, тетрациклический или полициклический конденсированный циклоалкил, при этом конденсированный циклоалкил предпочтительно представляет собой бициклический или трициклический конденсированный циклоалкил и, более предпочтительно, 5-членный/5-членный или 5-членный/6-членный бициклический конденсированный циклоалкил. Неограничивающие примеры конденсированного циклоалкила включают:

Термин "мостиковый циклоалкил" относится к от 5 до 20-членной полностью углеродной полициклической группе, где каждые два кольца в системе имеют два несвязанных атома углерода, причем кольца могут содержать одну или более двойных связей, но ни одно из колец не имеет полностью сопряженной 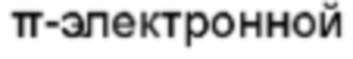 системы. Мостиковый циклоалкил предпочтительно представляет собой от 6 до 14-членный мостиковый циклоалкил и, более предпочтительно, от 7 до 10-членный мостиковый циклоалкил. В зависимости от числа членных колец мостиковый циклоалкил можно подразделить на бициклический, трициклический, тетрациклический или полициклический мостиковый циклоалкил, при этом мостиковый циклоалкил предпочтительно представляет собой бициклический, трициклический или тетрациклический мостиковый циклоалкил и, более предпочтительно, бициклический или трициклический мостиковый циклоалкил. Неограничивающие примеры мостикового циклоалкила включают:
системы. Мостиковый циклоалкил предпочтительно представляет собой от 6 до 14-членный мостиковый циклоалкил и, более предпочтительно, от 7 до 10-членный мостиковый циклоалкил. В зависимости от числа членных колец мостиковый циклоалкил можно подразделить на бициклический, трициклический, тетрациклический или полициклический мостиковый циклоалкил, при этом мостиковый циклоалкил предпочтительно представляет собой бициклический, трициклический или тетрациклический мостиковый циклоалкил и, более предпочтительно, бициклический или трициклический мостиковый циклоалкил. Неограничивающие примеры мостикового циклоалкила включают:


Циклоалкильное кольцо может быть сконденсировано с арильным, гетероарильным или гетероциклильным кольцом, где кольцо, связанное с исходной структурой, представляет собой циклоалкил. Неограничивающие примеры включают инданил, тетрагидронафтил, бензоциклогептил и тому подобное. Циклоалкил может быть факультативно замещенным или незамещенным. При наличии замещения заместитель (заместители) предпочтительно представляет собой одну или более групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси, циклоалкилтио, гетероциклилтио, оксо, карбокси и алкоксикарбонила.
Термин "гетероциклил" относится к от 3 до 20-членной насыщенной или частично ненасыщенной моноциклической или полициклической углеводородной группе, где один или более атомов кольца являются гетероатомами, выбранными из группы, состоящей из N, О и S(O)m (где m - целое число от 0 до 2), но без -О-О-, -О-S- или -S-S- в кольце, а остальные атомы в кольце являются атомами углерода. Предпочтительно, гетероциклил содержит от 3 до 12 атомов в кольце, где от 1 до 4 атомов являются гетероатомами; более предпочтительно, от 3 до 8 атомов в кольце, где от 1 до 3 атомов являются гетероатомами; наиболее предпочтительно, от 3 до 6 атомов в кольце, где от 1 до 2 атомов являются гетероатомами. Неограничивающие примеры моноциклического гетероциклила включают пирролидинил, имидазолидинил, тетрагидрофуранил, тетрагидротиенил, дигидроимидазолил, дигидрофуранил, дигидропиразолил, дигидропирролил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, гомопиперазинил, пиранил и тому подобное, и предпочтительно, пиперидинил, пиперазинил или морфолинил. Полициклический гетероциклил включает гетероциклил, имеющий спирокольцо, конденсированное кольцо или кольцо с внутренним мостиком.
Термин "спирогетероциклил" относится к от 5 до 20-членной полициклической гетероциклильной группе с отдельными кольцами, соединенными через один общий атом (называемый спироатомом), где один или более атомов кольца являются гетероатомами, выбранными из группы, состоящей из N, О и S(O)m (где m - целое число от 0 до 2), а остальные атомы кольца являются атомами углерода, где кольца могут содержать одну или более двойных связей, но ни одно из колец не имеет полностью сопряженной 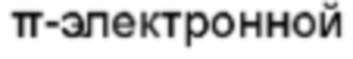 системы. Спирогетероциклил предпочтительно представляет собой от 6 до 14-членный спирогетероциклил и, более предпочтительно, от 7 до 10-членный спирогетероциклил. В зависимости от числа спироатомов, общих для колец, спирогетероциклил можно подразделить на моноспирогетероциклил, диспирогетероциклил или полиспирогетероциклил, при этом спирогетероциклил предпочтительно представляет собой моноспирогетероциклил или диспирогетероциклил и, более предпочтительно, 3-членный/6-членный, 4-членный/4-членный, 4-членный/5-членный, 4-членный/6-членный, 5-членный/5-членный или 5-членный/6-членный моноспирогетероциклил. Неограничивающие примеры спирогетероциклила включают:
системы. Спирогетероциклил предпочтительно представляет собой от 6 до 14-членный спирогетероциклил и, более предпочтительно, от 7 до 10-членный спирогетероциклил. В зависимости от числа спироатомов, общих для колец, спирогетероциклил можно подразделить на моноспирогетероциклил, диспирогетероциклил или полиспирогетероциклил, при этом спирогетероциклил предпочтительно представляет собой моноспирогетероциклил или диспирогетероциклил и, более предпочтительно, 3-членный/6-членный, 4-членный/4-членный, 4-членный/5-членный, 4-членный/6-членный, 5-членный/5-членный или 5-членный/6-членный моноспирогетероциклил. Неограничивающие примеры спирогетероциклила включают:

Термин "конденсированный гетероциклил" относится к от 5 до 20-членной полициклической гетеро цикл ильной группе, где каждое кольцо в системе имеет общую смежную пару атомов с другим кольцом, причем одно или более колец могут содержать одну или более двойных связей, но ни одно из колец не имеет полностью сопряженной 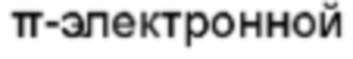 системы, и где один или более атомов кольца являются гетероатомами, выбранными из группы, состоящей из N, О и S(O)m (где m - целое число от 0 до 2), а остальные атомы кольца представляют собой атомы углерода. Конденсированный гетероциклил предпочтительно представляет собой от 6 до 14-членный конденсированный гетероциклил и, более предпочтительно, от 7 до 10-членный конденсированный гетероциклил. В зависимости от числа членных колец конденсированный гетероциклил можно подразделить на бициклический, трициклический, тетрациклический или полициклический конденсированный гетероциклил, при этом конденсированный гетероциклил предпочтительно представляет собой бициклический или трициклический конденсированный гетероциклил и, более предпочтительно, 5-членный/5-членный или 5-членный/6-членный бициклический конденсированный гетероциклил. Неограничивающие примеры конденсированного гетероциклила включают:
системы, и где один или более атомов кольца являются гетероатомами, выбранными из группы, состоящей из N, О и S(O)m (где m - целое число от 0 до 2), а остальные атомы кольца представляют собой атомы углерода. Конденсированный гетероциклил предпочтительно представляет собой от 6 до 14-членный конденсированный гетероциклил и, более предпочтительно, от 7 до 10-членный конденсированный гетероциклил. В зависимости от числа членных колец конденсированный гетероциклил можно подразделить на бициклический, трициклический, тетрациклический или полициклический конденсированный гетероциклил, при этом конденсированный гетероциклил предпочтительно представляет собой бициклический или трициклический конденсированный гетероциклил и, более предпочтительно, 5-членный/5-членный или 5-членный/6-членный бициклический конденсированный гетероциклил. Неограничивающие примеры конденсированного гетероциклила включают:
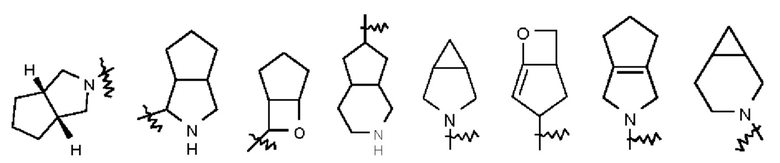

Термин "мостиковый гетероциклил" относится к от 5 до 14-членной полициклической гетеро цикл ильной группе, где каждые два кольца в системе имеют два общих несвязанных атома, причем кольца могут иметь одну или более двойных связей, но ни одно из колец не имеет полностью сопряженной 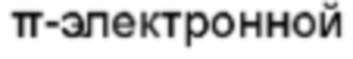 системы, и где один или более атомов кольца являются гетероатомами, выбранными из группы, состоящей из N, О и S(O)m (где m - целое число от 0 до 2), а остальные атомы кольца представляют собой атомы углерода. Мостиковый гетероциклил предпочтительно представляет собой от 6 до 14-членный мостиковый гетероциклил и, более предпочтительно, от 7 до 10-членный мостиковый гетероциклил. В соответствии с числом членных колец мостиковый гетероциклил можно подразделить на бициклический, трициклический, тетрациклический или полициклический мостиковый гетероциклил, при этом мостиковый гетероциклил предпочтительно представляет собой бициклический, трициклический или тетрациклический мостиковый гетероциклил и, более предпочтительно, бициклический или трициклический мостиковый гетероциклил. Неограничивающие примеры мостикового гетероциклила включают:
системы, и где один или более атомов кольца являются гетероатомами, выбранными из группы, состоящей из N, О и S(O)m (где m - целое число от 0 до 2), а остальные атомы кольца представляют собой атомы углерода. Мостиковый гетероциклил предпочтительно представляет собой от 6 до 14-членный мостиковый гетероциклил и, более предпочтительно, от 7 до 10-членный мостиковый гетероциклил. В соответствии с числом членных колец мостиковый гетероциклил можно подразделить на бициклический, трициклический, тетрациклический или полициклический мостиковый гетероциклил, при этом мостиковый гетероциклил предпочтительно представляет собой бициклический, трициклический или тетрациклический мостиковый гетероциклил и, более предпочтительно, бициклический или трициклический мостиковый гетероциклил. Неограничивающие примеры мостикового гетероциклила включают:


Гетероциклильное кольцо может быть сконденсировано с арильным, гетероарильным или циклоалкильным кольцом, где кольцо, связанное с исходной структурой, является гетероциклилом. Неограничивающие примеры этого включают:
 и тому подобное.
и тому подобное.
Гетероциклил может быть факультативно замещенным или незамещенным. При наличии замещения заместитель (заместители) предпочтительно представляет собой одну или более групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси, циклоалкилтио, гетероциклилтио, оксо, карбокси и алкоксикарбонила.
Термин "арил" относится к от 6 до 14-членному полностью углеродному моноциклическому кольцу или полициклическому конденсированному кольцу (то есть каждое кольцо в системе имеет общую смежную пару атомов углерода с другим кольцом в системе), имеющему сопряженную  систему, предпочтителен от 6 до 10-членный арил, например, фенил и нафтил. Более предпочтительно, арил является фенилом. Арильное кольцо может быть сконденсировано с гетероарильным, гетероциклильным или циклоалкильным кольцом, где кольцо, связанное с исходной структурой, является арильным кольцом. Неограничивающие примеры этого включают:
систему, предпочтителен от 6 до 10-членный арил, например, фенил и нафтил. Более предпочтительно, арил является фенилом. Арильное кольцо может быть сконденсировано с гетероарильным, гетероциклильным или циклоалкильным кольцом, где кольцо, связанное с исходной структурой, является арильным кольцом. Неограничивающие примеры этого включают:


Арил может быть замещенным или незамещенным. При наличии замещения заместитель (заместители) предпочтительно представляет собой одну или более групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси, циклоалкилтио, гетероциклилтио, карбокси и алкоксикарбонила.
Термин "гетероарил" относится к от 5 до 14-членной гетероароматической системе, содержащей от 1 до 4 гетероатомов, выбранных из группы, состоящей из О, S и N. Гетероарил предпочтительно представляет собой от 5 до 10-членный гетероарил, содержащий от 1 до 3 гетероатомов, более предпочтительно, 5 или 6-членный гетероарил, содержащий от 1 до 2 гетероатомов; предпочтительно, является, например, имидазолилом, фурилом, тиенилом, тиазолилом, пиразолилом, оксазолилом, пирролилом, тетразолилом, пиридилом, пиримидинилом, тиадиазолилом, пиразинилом и тому подобным, предпочтительны имидазолил, тетразолил, пиридил, тиенил, пиразолил, пиримидинил, тиазолил и более предпочтителен - пиридил. Гетероарильное кольцо может быть сконденсировано с арильным, гетероциклильным или циклоалкильным кольцом, где кольцо, связанное с исходной структурой, является гетероарильным кольцом. Неограничивающие примеры этого включают:
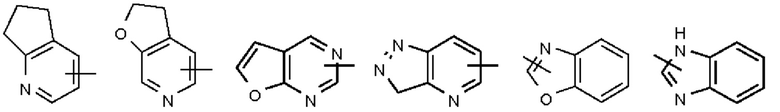
Гетероарил может быть факультативно замещенным или незамещенным. При наличии замещения заместитель (заместители) предпочтительно представляет собой одну или более групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси, циклоалкилтио, гетероциклилтио, карбокси и алкоксикарбонила.
Термин "галогеналкил" относится к алкильной группе, замещенной одним или более галогенами, где алкил такой, как определен выше.
Термин "галогеналкокси" относится к алкоксильной группе, замещенной одним или более галогенами, где алкоксильная группа такая, как определена выше.
Термин "гидроксиалкил" относится к алкильной группе, замещенной гидроксилом (гидроксилами), где алкил такой, как определен выше.
Термин "гидрокси" относится к группе -ОН.
Термин "галоген" относится к фтору, хлору, брому или йоду.
Термин "амино" относится к группе -NH2.
Термин "циано" относится к группе -CN.
Термин "нитро" относится к группе -NO2.
Термин "оксо" относится к группе =O.
Термин "карбонил" относится к группе С=O.
Термин "карбокси" относится к группе -С(O)ОН.
Термин "алкоксикарбонил" относится к группе -С(O)O(алкил) или -С(O)O(циклоалкил), где алкил и циклоалкил такие, как определены выше.
Термин "ацилгалогенид" относится к соединению, содержащему группу -С(О)-галоген.
"Факультативный" или "факультативно" означает, что описанное далее событие или обстоятельство может, но не обязательно должно, происходить, и такое описание включает ситуацию, в которой событие или обстоятельство происходит или не происходит. Например, "гетероциклил, факультативно замещенный алкилом" означает, что алкильная группа может, но не обязательно должна, присутствовать, и такое описание включает ситуации, когда гетероциклил замещен алкилом и когда гетероциклил не замещен алкилом.
"Замещенный" относится к одному или более атомам водорода, предпочтительно, до 5 атомов водорода и, более предпочтительно, от 1 до 3 атомов водорода, в группе, независимо замещенным соответствующим числом заместителей. Само собой разумеется, что заместители присутствуют только в их возможном с химической точки зрения положении. Специалист в данной области техники без чрезмерных усилий сможет экспериментально или теоретически определить, возможно или нет такое замещение. Например, аминогруппа или гидроксильная группа, имеющие свободный атом водорода, могут быть нестабильными в сочетании с атомами углерода, имеющими ненасыщенные (например, олефиновые) связи.
"Фармацевтическая композиция" относится к смеси одного или более соединений в соответствии с настоящим изобретением или его физиологически/фармацевтически приемлемых солей или пролекарств с другими химическими компонентами и другими компонентами, такими как физиологически/фармацевтически приемлемые носители и наполнители. Назначением фармацевтической композиции является облегчение введения соединения в организм, что способствует абсорбции активного ингредиента, обеспечивая проявление его биологической активности.
"Фармацевтически приемлемая соль" относится к соли соединения по настоящему изобретению, которая является безопасной и эффективной для млекопитающих и обладает требуемой биологической активностью.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 показано влияние соединения Примера 4 при введении самостоятельно или в комбинации с антителом против мышиного PD-1 на рост колоректальной опухоли МС38 у мышей линии C57BL/6.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение будет дополнительно описано со ссылкой на следующие примеры, однако эти примеры не следует рассматривать, как ограничивающие объем настоящего изобретения.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Структуру соединений идентифицировали методом ядерно-магнитного резонанса (ЯМР, англ. NMR) и/или масс-спектрометрии (МС, англ. MS). Химические сдвиги ЯМР (δ) приведены в 10-6 (м.д.). Спектры ЯМР снимали на приборе Bruker AVANCE-400. В качестве растворителей для снятия спектров использовали дейтерированный диметилсульфоксид (ДМСО-d6, англ. DMSO-d6), дейтерированный хлороформ (CDCl3) и дейтерированный метанол (CD3OD), в качестве внутреннего стандарта - тетраметилсилан (ТМС, англ. TMS).
МС определяли при помощи масс-спектрометра FINNIGAN LCQAd (ESI) (производитель: Thermo, тип: Finnigan LCQ advantage MAX).
Высокоэффективную жидкостную хроматографию (ВЭЖХ, англ. HPLC) выполняли на жидкостном хроматографе высокого давления Agilent 1200DAD (хроматографическая колонка Sunfire С18 150×4,6 мм) и жидкостном хроматографе высокого давления Waters 2695-2996 (хроматографическая колонка Gimini С18 150×4,6 мм).
Анализ методом хиральной ВЭЖХ выполняли при помощи приборов LC-10A vp (Shimadzu) или SFC-analytical (Berger Instruments Inc.).
В качестве пластины для тонкослойной хроматографии на силикагеле (ТСХ, англ. TLC) использовали силикагелевую пластину Yantai Huanghai HSGF254 или Qingdao GF254. Толщина слоя силикагеля пластины, используемой для ТСХ, составляла от 0,15 мм до 0,2 мм, а толщина слоя силикагеля пластины, используемой для очистки продукта - от 0,4 мм до 0,5 мм.
В качестве носителя для колоночной хроматографии использовали силикагель Yantai Huanghai, 200-300 меш.
Для хиральной препаративной колоночной хроматографии использовали систему Prep Star SD-1 (Varian Instruments Inc.) или SFC-multigram (Berger Instruments Inc.).
В качестве прибора для флэш-хроматографии использовали Combiflash Rf200 (TELEDYNE ISCO).
Средние скорости ингибирования киназы и величины IC50 определяли при помощи NovoStar ELISA (BMG Co., Germany).
Известные исходные материалы по настоящему изобретению могут быть синтезированы известными способами или приобретены у компаний ABCR GmbH & Co. KG, Acros Organnics, Aldrich Chemical Company, Accela ChemBio Inc., Dari chemical Company или Shanghai Bide Pharmatech Ltd. etc.
Если не указано иное, реакции проводили в атмосфере аргона или атмосфере азота.
"Атмосфера аргона" или "атмосфера азота" означает, что реакционная колба соединена с баллоном с аргоном или азотом (емкостью приблизительно 1 л).
"Атмосфера водорода" означает, что реакционная колба соединена с баллоном с водородом (емкостью приблизительно 1 л).
Реакции гидрирования под давлением проводили с использованием установки для гидрирования Parr 3916EKX и генератора водорода Qinglan QL-500 или установки для гидрирования HC2-SS.
В реакциях гидрирования реакционную систему обычно вакуумировали и заполняли водородом, указанную операцию повторяли трижды.
Для микроволновых реакций использовали микроволновый реактор типа СЕМ Discover-S 908860.
Если не указано иное, раствор относится к водному раствору.
Если не указано иное, температура реакции соответствует комнатной температуре от 20°С до 30°С.
Ход реакции в примерах контролировали методом тонкослойной хроматографии (ТСХ). Проявляющий растворитель, используемый в реакциях, элюент для колоночной хроматографии и система проявляющих растворителей, используемая в тонкослойной хроматографии для очистки соединений, включали: А: систему дихлорметан/метанол, и В: систему н-гексан/этилацетат. Объемное соотношение растворителей регулировали в зависимости от полярности соединений, при этом для регулирования также может быть добавлено небольшое количество щелочного реагента, такого как триэтиламин, или кислого реагента, такого как уксусная кислота.
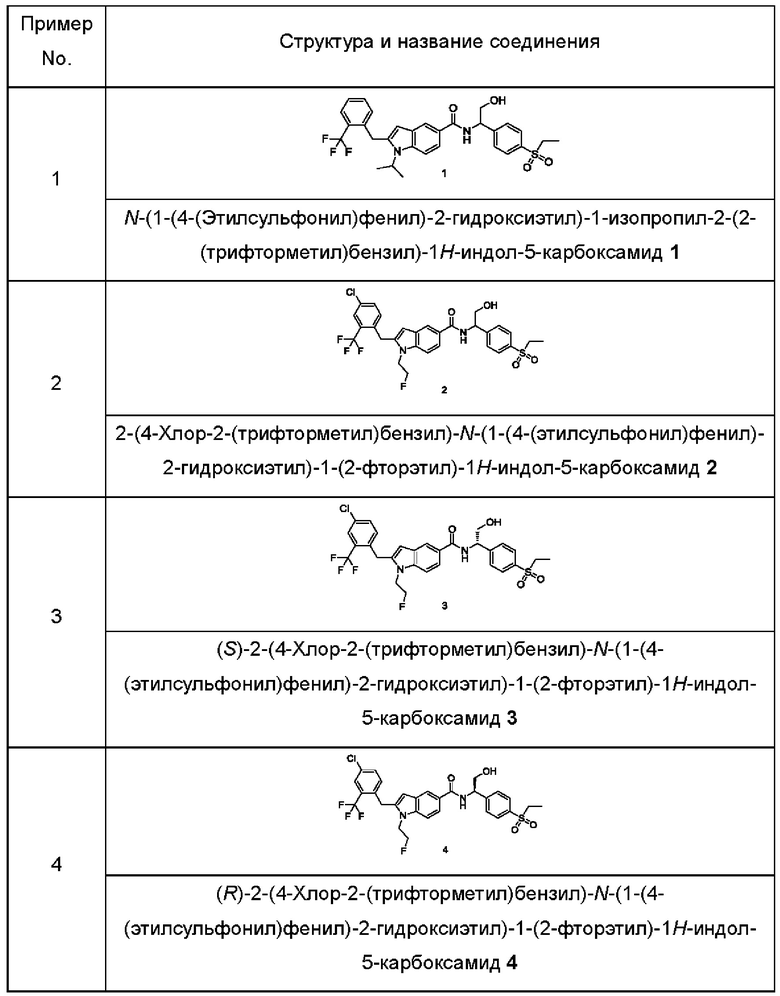
Пример 1
N-(1-(4-(Этилсульфонил)фенил)-2-гидроксиэтил)-1-изопропил-2-(2-(трифторметил)бензил)-1Н-индол-5-карбоксамид 1

Стадия 1
Метил-2-(2-(трифторметил)бензил)-1Н-индол-5-карбоксилат 1с
Метил-1Н-индол-5-карбоксилат 1b (400 мг, 2,29 ммоль), 1-(бромметил)-2-(трифторметил)бензол 1а (574 мг, 2,4 ммоль), хлорид бис(ацетонитрил)палладия(II) (118 мг, 0,46 ммоль), бицикло[2,2,1]-2-гептен (429 мг, 4,6 ммоль) и бикарбонат натрия (384 мг, 4,6 ммоль) добавляли к 10 мл N,N-диметилацетамида. Реакционный раствор нагревали до температуры 70°С и перемешивали в течение 16 часов в атмосфере аргона. После завершения реакции реакционный раствор выливали в воду и трижды экстрагировали этилацетатом. Органические фракции объединяли, последовательно промывали водой и насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали указанное в заголовке соединение 1с (570 мг, выход: 74,9%).
Стадия 2
Метил-1-изопропил-2-(2-(трифторметил)бензил)-1Н-индол-5-карбоксилат 1d
Соединение 1с (500 мг, 1,5 ммоль) растворяли в 15 мл N,N-диметилформамида. В раствор добавляли 60% раствор гидрида натрия (120 мг, 3,0 ммоль) и перемешивали при комнатной температуре в течение 30 минут. Затем в реакционный раствор добавляли 2-йодпропан (1,02 г, 6,0 ммоль), и проводили реакцию в запаянной реакционной трубке при температуре 70°С в течение 16 часов. Реакционный раствор охлаждали до комнатной температуры, выливали в воду и трижды экстрагировали этилацетатом. Органические фракции объединяли, однократно промывали водой, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи тонкослойной хроматографии в проявляющей системе растворителей В, в результате получали указанное в заголовке соединение 1d (80 мг, выход: 14,2%).
Стадия 3
1-Изопропил-2-(2-(трифторметил)бензил)-1Н-индол-5-карбоновая кислота 1е
Соединение 1d (80 мг, 0,21 ммоль) растворяли в смешанном растворителе, состоящем из 5 мл метанола и 2 мл тетрагидрофурана. В раствор добавляли 3 мл 4N раствора гидроксида натрия и перемешивали при температуре 60°С в течение 1 часа. Реакционный раствор нейтрализовали концентрированной соляной кислотой, добавляли в него воду и трижды экстрагировали этилацетатом. Органические фракции объединяли, промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением технического указанного в заголовке соединения 1е (70 мг), которое использовали непосредственно на следующей стадии без очистки.
Стадия 4
N-(1-(4-(Этилсульфонил)фенил)-2-гидроксиэтил)-1-изопропил-2-(2-(трифторметил)бензил)-1Н-индол-5-карбоксамид 1
2-Амино-2-(4-этилсульфонилфенил)этанол 1f (67 мг, 0,29 ммоль, полученный в соответствии со способом, раскрытым в заявке на патент WO 2016061160), техническое соединение 1е (70 мг, 0,193 ммоль), гидрохлорид 1-этил-(3-диметиламинопропил)карбонилдиимида (56 мг, 0,29 ммоль), 1-гидроксибензотриазол (40 мг, 0,29 ммоль) и триэтиламин (101 мг, 1 ммоль) добавляли к 10 мл дихлорметана. Реакционный раствор перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента А, в результате получали титульное соединение 1 (40 мг, выход: 36,0%).
МС m/z (ESI): 573,5 [М+1].
1Н ЯМР (400 МГц, CDCl3): δ 8,12 (д, 1Н), 7,92 (д, 2Н), 7,76 (д, 1Н), 7,69 (дд, 1Н), 7,64 (д, 2Н), 7,59 (д, 1Н), 7,47-7,38 (м, 2Н), 7,14-7,09 (м, 2Н), 6,35 (с, 1Н), 5,41-5,37 (м, 1Н), 4,49-4,42 (м, 1Н), 4,35 (с, 2Н), 4,12-4,08 (м, 2Н), 3,14 (кв, 2Н), 2,37 (ушир.с, 1Н), 1,52 (д, 6Н), 1,32 (т, 3Н).
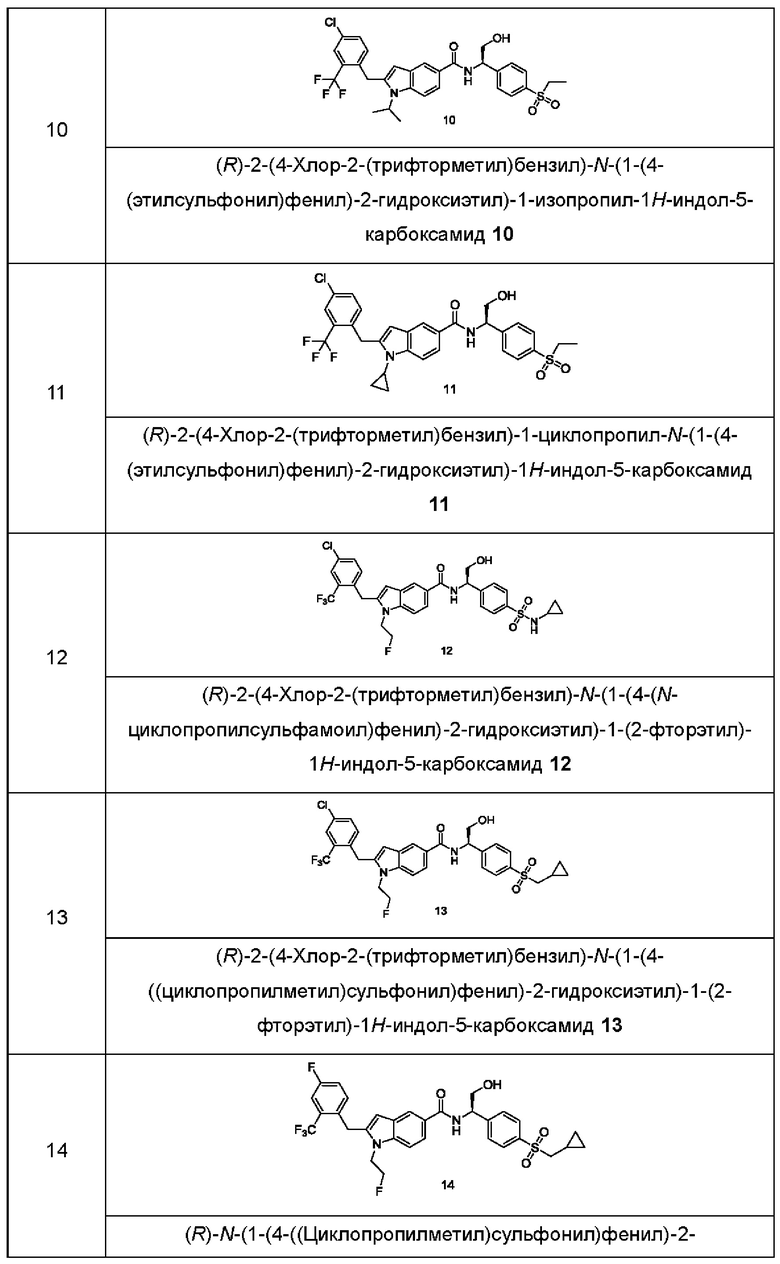
Пример 2
2-(4-Хлор-2-(трифторметил)бензил)-N-(1-(4-(этилсульфонил)фенил)-2-гидроксиэтил)-1-(2-фторэтил)-1Н-индол-5-карбоксамид 2

Стадия 1
Метил-2-(4-хлор-2-(трифторметил)бензил)-1Н-индол-5-карбоксилат 2b
Соединение 1b (7 г, 39,96 ммоль) и 1-(бромметил)-4-хлор-2-(трифторметил)бензол 2а (13,11 г, 47,95 ммоль) растворяли в 200 мл N,N-диметилацетамида. Затем добавляли хлорид бис(ацетонитрил)палладия(II) (2,07 г, 7,99 ммоль), бицикло[2,2,1]-2-гептен (3,76 г, 39,96 ммоль) и карбонат натрия (8,47 г, 79,92 ммоль). Реакционный раствор нагревали до температуры 80°С и перемешивали в течение 17 часов в атмосфере аргона. Реакционный раствор охлаждали и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали указанное в заголовке соединение 2b (13 г, выход: 88,47%).
МС m/z (ESI): 368,1 [М+1].
Стадия 2
Метил-2-(4-хлор-2-(трифторметил)бензил)-1-(2-фторэтил)-1Н-индол-5-кар6оксилат 2с
Соединение 2b (0,3 г, 815,77 мкмоль), 1-бром-2-фторэтан (310,7 мг, 2,45 ммоль) растворяли в 10 мл N,N-диметилформамида. В реакционный раствор добавляли карбонат цезия (797,38 мг, 2,45 ммоль), и проводили реакцию под воздействием микроволнового излучения при температуре 100°С в течение 1 часа. Реакционный раствор охлаждали и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали указанное в заголовке соединение 2с (0,25 г, выход: 74,06%).
МС m/z (ESI): 414,1 [М+1].
Стадия 3
2-(4-Хлор-2-(трифторметил)бензил)-1-(2-фторэтил)-1Н-индол-5-карбоновая кислота 2d
Соединение 2с (0,25 г, 604,17 мкмоль) растворяли в 20 мл метанола. В раствор добавляли 1,5 мл 4N раствора гидроксида натрия и перемешивали при кипении с обратным холодильником в течение 1 часа. Реакционный раствор охлаждали до комнатной температуры, и прибавляли по каплям 1М раствор соляной кислоты для регулирования величины рН на уровне 3~4. В реакционный раствор добавляли 20 мл воды и 20 мл этилацетата и экстрагировали этилацетатом (20 мл×2). Органические фракции объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента А, в результате получали указанное в заголовке соединение 2d (0,24 г, выход: 99,4%).
МС m/z (ESI): 400,1 [М+1].
Стадия 4
2-(4-Хлор-2-(трифторметил)бензил)-N-(1-(4-(этилсульфонил)фенил)-2-гидроксиэтил)-1-(2-фторэтил)-1Н-индол-5-карбоксамид 2
Соединение 2d (10 мг, 25,01 мкмоль) растворяли в 2 мл N,N-диметилформамида. Добавляли соединение 1f (8,67 мг, 37,83 мкмоль) и N,N-диизопропилэтиламин (6,47 мг, 50,03 мкмоль), затем гексафторфосфат 2-(7-азобензотриазол)-N,N,N',N'-тетраметилурония (11,77 мг, 50,03 мкмоль). Реакционный раствор перемешивали при комнатной температуре в течение 2 часов, концентрировали при пониженном давлении, полученный остаток очищали при помощи высокоэффективной жидкостной хроматографии, в результате получали указанное в заголовке соединение 2 (7,9 мг, выход: 51,7%).
МС m/z (ESI): 611,5 [М+1].
1Н ЯМР (400 МГц, CDCl3): δ 8,13 (с, 1Н), 7,93-7,90 (м, 2Н), 7,77-7,75 (м, 2Н), 7,64-7,62 (м, 2Н), 7,47-7,45 (м, 1Н), 7,37-7,35 (м, 1Н), 7,16-7,14 (м, 1Н), 7,13-7,11 (м, 1Н), 6,33 (с, 1Н), 5,40-5,38 (м, 1Н), 4,70-4,68 (м, 1Н), 4,57-4,56 (м, 1Н), 4,37-4,35 (м, 1Н), 4,35 (с, 2Н), 4,30-4,31 (м, 1Н), 4,11-4,06 (м, 2Н), 3,16-3,11 (м, 2Н), 1,33-1,29 (м, 3Н).
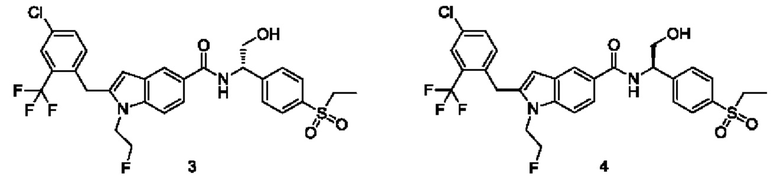
Пример 3, 4
(S)-2-(4-Хлор-2-(трифторметил)бензил)-N-(1-(4-(этилсульфонил)фенил)-2-гидроксиэтил)-1-(2-фторэтил)-1Н-индол-5-карбоксамид 3
(R)-2-(4-хлор-2-(трифторметил)бензил)-N-(1-(4-(этилсульфонил)фенил)-2-гидроксиэтил)-1-(2-фторэтил)-1Н-индол-5-карбоксамид 4
Проводили хиральное разделение соединения 2 (120 мг, 0,197 ммоль) (условия разделения: Superchiral S-AD (Chiralway), 2 см в.д. × 25 см длина, 5 мкм, подвижная фаза: диоксид углерода/этанол/диэтиламин = 60/40/0,05 (об./об./об.), расход: 50 г/мин). Собирали соответствующие фракции и концентрировали при пониженном давлении, в результате получали указанное в заголовке соединение 3 (52 мг) и титульное соединение 4 (52 мг).
Соединение 3:
МС m/z (ESI): 610,9 [М+1].
Анализ методом хиральной ВЭЖХ: время удерживания 7,882 минут, хиральная чистота: 100% (хроматографическая колонка: Lux Amylose-1 (AD) 4,6×150 мм 5 мкм (оснащена защитной колонкой); подвижная фаза: н-гексан/этанол (содержащий 0,1% диэтиламина) = 60/40 (об./об.)).
1Н ЯМР (400 МГц, CDCl3): δ 8,13 (с, 1Н), 7,93-7,90 (м, 2Н), 7,77-7,75 (м, 2Н), 7.64-7,62 (м, 2Н), 7,47-7,45 (м, 1Н), 7,37-7,35 (м, 1Н), 7,16-7,14 (м, 1Н), 7,13-7,11 (м, 1Н), 6,33 (с, 1Н), 5,40-5,38 (м, 1Н), 4,70-4,68 (м, 1Н), 4,57-4,56 (м, 1Н), 4,37-4,35 (м, 1Н), 4,35 (с, 2Н), 4,31-4,30 (м, 1Н), 4,11-4,06 (м, 2Н), 3,16-3,11 (м, 2Н), 1,33-1,29 (м, 3Н).
Соединение 4:
МС m/z (ESI): 611,0 [М+1].
Анализ методом хиральной ВЭЖХ: время удерживания 11,747 минут, хиральная чистота: 100% (хроматографическая колонка: Lux Amylose-1 (AD) 4,6×150 мм 5 мкм (оснащена защитной колонкой); подвижная фаза: н-гексан/этанол (содержащий 0,1% диэтиламина) = 60/40 (об./об.)).
1Н ЯМР (400 МГц, CDCl3): δ 8,12 (с, 1Н), 7,93-7,91 (м, 2Н), 7,76-7,74 (м, 2Н), 7.65-7,63 (м, 2Н), 7,47-7,45 (м, 1Н), 7,37-7,35 (м, 1Н), 7,15-7,11 (м, 2Н), 6,33 (с, 1Н), 5,39-5,38 (м, 1Н), 4,70-4,69 (м, 1Н), 4,59-4,56 (м, 1Н), 4,37-4,36 (м, 1Н), 4,35 (с, 2Н), 4,31-4,30 (м, 1Н), 4,11-4,06 (м, 2Н), 3,17-3,11 (м, 2Н), 2,33 (ушир.с, 1Н), 1,34-1,30 (м, 3Н).
Пример 5
(R)-2-(4-Хлор-2-(трифторметил)бензил)-N-(1-(4-(этилсульфонил)фенил)-2-гидроксиэтил)-6-фтор-1-(2-фторэтил)-1Н-индол-5-карбоксамид 5

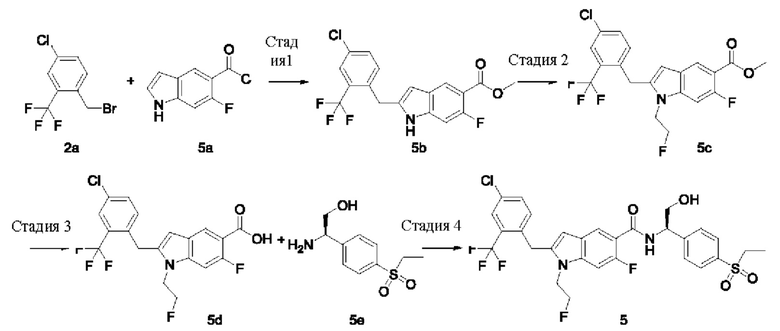
Стадия 1
Метил-2-(4-хлор-2-(трифторметил)бензил)-6-фтор-1Н-индол-5-карбоксилат 5b
Метил-6-фтор-1Н-индол-5-карбоксилат 5а (500 мг, 2,59 ммоль), соединение 2а (1,06 г, 88 ммоль), хлорид бис(ацетонитрил)палладия(II) (67,15 мг, 258,83 мкмоль), бицикло[2,2,1]-2-гептен (487,40 мг, 5,18 ммоль) и карбонат калия (714,38 мг, 5,18 ммоль) добавляли к 20 мл N,N-диметилацетамида. Реакционный раствор нагревали до температуры 80°С и перемешивали в течение 16 часов в атмосфере аргона. Реакционный раствор охлаждали до комнатной температуры и фильтровали. Фильтрат выливали в воду и экстрагировали этилацетатом. Органические фракции объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали указанное в заголовке соединение 5b (600 мг, выход: 60,1%).
МС m/z (ESI): 386,1 [М+1].
Стадия 2
Метил-2-(4-хлор-2-(трифторметил)бензил)-6-фтор-1-(2-фторэтил)-1Н-индол-5-карбоксилат 5с
Соединение 5b (100 мг, 259,24 мкмоль), 1-фтор-2-йодэтан (67,64 мг, 388,86 мкмоль) и карбонат цезия (254,32 мг, 777,72 мкмоль) добавляли к 5 мл ацетонитрила. Проводили реакцию в реакционном растворе под воздействием микроволнового излучения при температуре 100°С в течение 1 часа. Реакционный раствор выливали в воду и экстрагировали этилацетатом. Органические фракции объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали титульное соединение 5с (80 мг, выход: 71,5%).
МС m/z (ESI): 432,1 [М+1].
Стадия 3
2-(4-Хлор-2-(трифторметил)бензил)-6-фтор-1-(2-фторэтил)-1Н-индол-5-карбоновая кислота 5d
Соединение 5с (80 мг, 185,28 мкмоль) и гидроксид натрия (37,05 мг, 926,39 мкмоль) добавляли в смешанный растворитель, состоящий из 6 мл метанола и 0,5 мл воды. Реакционный раствор перемешивали при температуре 60°С в течение 2 часов. Метанол удаляли при пониженном давлении, и к полученному остатку по каплям прибавляли разбавленную 1М соляную кислоту для регулирования величины рН на уровне ~3. Реакционный раствор экстрагировали этилацетатом, органическую фракцию сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением технического титульного соединения 5d (50 мг), которое использовали непосредственно на следующей стадии без очистки.
МС m/z (ESI): 418,0 [М+1].
Стадия 4
(R)-2-(4-Хлор-2-(трифторметил)бензил)-N-(1-(4-(этилсульфонил)фенил)-2-гидроксиэтил)-6-фтор-1-(2-фторэтил)-1Н-индол-5-карбоксамид 5
(R)-2-Амино-2-(4-(этилсульфонил)фенил)этанол 5е (16,47 мг, 71,81 мкмоль, полученный в соответствии со способом, раскрытым в заявке на патент WO 2016061160), техническое соединение 5d (30 мг, 71,81 мкмоль), гидрохлорид 1-этил-(3-диметиламинопропил)карбонилдиимида (20,57 мг, 107,72 мкмоль), 1-гидроксибензотриазол (16,39 мг, 107,72 мкмоль) и N,N-диизопропилэтиламин (27,84 мг, 215,43 мкмоль) добавляли к 3 мл N,N-диметилформамида. Реакционный раствор перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор экстрагировали этилацетатом, органические фракции объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали титульное соединение 5 (19 мг, выход: 42,1%).
МС m/z (ESI): 629,5 [М+1].
1Н ЯМР (400 МГц, CDCl3): δ 8,26 (д, 1Н), 7,89 (д, 2Н), 7,72-7,60 (м, 4Н), 7,42 (д, 1Н), 7,11-7,03 (м, 2Н), 6,27 (с, 1Н), 5,41-5,39 (м, 1Н), 4,63-4,51 (м, 2Н), 4,27-4,19 (м, 4Н), 4,06-4,01 (м, 2Н), 3,12-3,07 (м, 2Н), 2,35 (ушир.с, 1Н), 1,30-1,27 (м, 3Н).
Пример 6
(R)-2-(4-Хлор-2-(трифторметил)бензил)-1-циклопропил-N-(1-(4-(этилсульфонил)фенил)-2-гидроксиэтил)-6-фтор-1Н-индол-5-карбоксамид 6
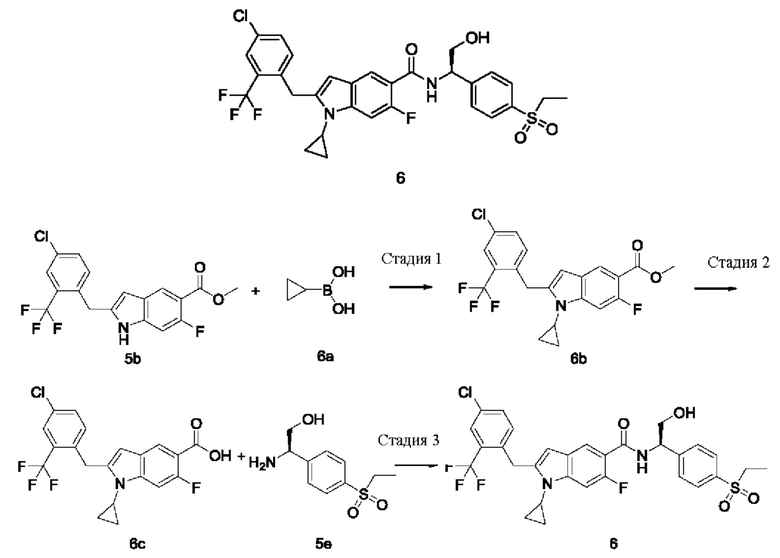
Стадия 1
Метил-2-(4-хлор-2-(трифторметил)бензил)-1-циклопропил-6-фтор-1Н-индол-5-карбоксилат 6b
Соединение 5b (100 мг, 259,24 мкмоль), циклопропилбороновую кислоту 6а (44,54 мг, 518,48 мкмоль), 2,2'-бипиридин (48,59 мг, 311,09 мкмоль), ацетат меди (56,50 мг, 311,09 мкмоль) и карбонат натрия (54,95 мг, 518,48 мкмоль) добавляли к 20 мл тетрагидрофурана. Реакционный раствор перемешивали при температуре 60°С в течение 16 часов в атмосфере аргона. Реакционный раствор фильтровали, фильтрат экстрагировали этилацетатом, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали титульное соединение 6b (80 мг, выход: 72,47%).
МС m/z (ESI): 426,1 [М+1].
Стадия 2
2-(4-Хлор-2-(трифторметил)бензил)-1-циклопропил-6-фтор-1Н-индол-5-кар6оновая кислота 6с
Соединение 6b (90 мг, 211,37 мкмоль) и гидроксид натрия (42,27 мг, 1,06 ммоль) добавляли в смешанный растворитель, состоящий из 6 мл метанола и 0,5 мл воды. Раствор перемешивали при температуре 60°С в течение 2 часов. Метанол удаляли при пониженном давлении, и к полученному остатку по каплям прибавляли 1М раствор соляной кислоты для регулирования величины рН на уровне ~3. Раствор экстрагировали этилацетатом, органическую фракцию сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением технического титульного соединения 6с (60 мг), которое использовали непосредственно на следующей стадии без очистки.
МС m/z (ESI):412,0 [М+1].
Стадия 3
(R)-2-(4-Хлор-2-(трифторметил)бензил)-1-циклопропил-N-(1-(4-(этилсульфонил)фенил)-2-гидроксиэтил)-6-фтор-1Н-индол-5-карбоксамид 6
Соединение 5е (16,71 мг, 72,86 мкмоль), техническое соединение 6с (30 мг, 72,86 мкмоль), гидрохлорид 1-этил-(3-диметиламинопропил)карбонилдиимида (20,87 мг, 109,28 мкмоль), 1-гидроксибензотриазол (16,63 мг, 109,28 мкмоль) и N,N-диизопропилэтиламин (28,25 мг, 218,57 мкмоль) добавляли к 3 мл N,N-диметилформамида. Реакционный раствор перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор экстрагировали этилацетатом, органические фракции объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали титульное соединение 6 (15 мг, выход: 33,0%).
МС m/z (ESI): 623,5 [М+1].
1Н ЯМР (400 МГц, CDCl3): δ 8,23 (д, 1Н), 7,91 (д, 2Н), 7,71 (д, 2Н), 7,62 (д, 2Н), 7,42 (д, 1Н), 7,28 (д, 1Н), 7,03 (д, 1Н), 6,17 (с, 1Н), 5,40 (с, 1Н), 4,37 (с, 2Н), 4,08-4,04 (м, 2Н), 3,14-3,10 (м, 2Н), 2,98-2,90 (м, 1Н), 2,21 (ушир.с, 1Н),1,31-1,27 (м, 3Н), 1,14-1,12 (м, 2Н), 0,98-0,89 (м, 2Н).
Пример 7
N-((R)-1-(4-(Этилсульфонил)фенил)-2-гидроксиэтил)-1-(2-фторэтил)-2-((3-(трифторметил)морфолино)метил)-1H-индол-5-карбоксамид 7

Стадия 1
4-((5-Бром-1Н-индол-2-ил)метил)-3-(трифторметил)морфолин 7с
5-Бром-1Н-индол-2-карбальдегид 7а (120 мг, 0,54 ммоль, полученный в соответствии с известным способом, раскрытым в журнале "Journal of Medicinal Chemistry, 2014, 57(2), 364-377") растворяли в 10 мл 1,2-дихлорэтана. В раствор добавляли гидрохлорид 3-(трифторметил)морфолина 7b (120 мг, 0,63 ммоль) и 5 капель уксусной кислоты и перемешивали в течение 1,5 часов. В реакционный раствор добавляли триацетилборгидрид натрия (240 мг, 1,1 ммоль) и перемешивали в течение 16 часов. После этого в реакционный раствор добавляли насыщенный раствор бикарбоната натрия и трижды экстрагировали этилацетатом. Органические фракции объединяли, промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и очищали при помощи устройства для флэш-хроматографии CombiFlash, используя элюент В, в результате получали титульное соединение 7с (150 мг, выход: 76,5%).
МС m/z (ESI): 363 [М+1].
Стадия 2
4-((5-Бром-1-(2-фторэтил)-1Н-индол-2-ил)метил)-3-(трифторметил)морфолин 7d
Соединение 7с (80 мг, 0,22 ммоль), 1-фтор-2-йодэтан (60 мкл), карбонат цезия (200 мг, 0,61 ммоль) и 10 мл N,N-диметилформамида помещали в пробирку для микроволновой реакции. Проводили реакцию в реакционном растворе под воздействием микроволнового излучения при температуре 100°С в течение 1 часа. Реакционный раствор разбавляли водой и экстрагировали этилацетатом. Органические фракции объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали с помощью устройства для флэш-хроматографии CombiFlash при использовании элюента В, в результате получали указанное в заголовке соединение 7d (92 мг, выход: 100%).
МС m/z (ESI): 409 [М+1].
Стадия 3
1-(2-Фторэтил)-2-((3-(трифторметил)морфолино)метил)-1Н-индол-5-карбоновая кислота 7е
Соединение 7d (28 мг, 68 мкмоль), гексакарбонил молибдена (35 мг, 133 мкмоль), транс-бис(ацетато)бис[о-(ди-о-толилфосфино)бензил]дипалладий(II) (14 мг, 15 мкмоль), три-трет-бутилфосфинтетрафторборат (14 мг, 48 мкмоль), 1,8-диазабициклоундец-7-ен (50 мкл) добавляли в смешанный растворитель, состоящий из воды (50 мкл) и 1,4-диоксана (0,5 мл). Проводили реакцию в реакционном растворе под воздействием микроволнового излучения при температуре 150°С в течение 15 минут. Реакционный раствор очищали с помощью устройства для флэш-хроматографии CombiFlash при использовании элюента А, в результате получали указанное в заголовке соединение 7е (15 мг, выход: 58%).
МС m/z (ESI): 375 [М+1].
Стадия 4
N-((R)-1-(4-(Этилсульфонил)фенил)-2-гидроксиэтил)-1-(2-фторэтил)-2-((3-(трифторметил)морфолино)метил)-1Н-индол-5-карбоксамид 7
Соединение 7е (18 мг, 48 мкмоль) растворяли в 0,8 мл N,N-диметилформамида, после чего добавляли соединение 5е (12 мг, 52 мкмоль), N,N-диизопропилэтиламин (40 мкл) и гексафторфосфат 2-(7-азобензотриазол)-N,N,N',N'-тетраметилурония (30 мг, 78 мкмоль). Реакционный раствор перемешивали в течение 2 часов и затем очищали при помощи высокоэффективной жидкостной хроматографии, в результате получали титульное соединение 7 (6 мг, выход: 21,4%).
МС m/z (ESI): 586 [М+1].
1Н ЯМР (400 МГц, CDCl3): δ 8,03 (с, 1Н), 7,79 (д, 2Н), 7,64 (д, 1Н), 7,51 (д, 2Н), 7,30 (д, 1Н), 7,11 (д, 1Н), 6,47 (с, 1Н), 5,24 (ушир.с, 1Н), 4,75-4,73 (м, 1Н), 4,62-4,37 (м, 3Н), 4,12 (д, 1Н), 4,05-3,81 (м, 4Н), 3,81-3,51 (м, 3Н), 3,08-2,87 (м, 4Н), 2,38 (д, 1Н), 1,20 (т, 3Н).
Пример 8
(R)-1-Циклопропил-N-(1-(4-(этилсульфонил)фенил)-2-гидроксиэтил)-6-фтор-2-((3-метил-5-(трифторметил)-1Н-пиразол-1-ил)метил)-1Н-индол-5-карбоксамид 8

Стадия 1
Метил-4-амино-2-фтор-5-йодбензоат 8b
Метил-4-амино-2-фторбензоат (3,4 г, 20,2 ммоль, полученный в соответствии со способом, раскрытым в заявке на патент WO 2013068467) растворяли в 30 мл смешанного растворителя, состоящего из дихлорметана и метанола (V:V=2:1). В раствор добавляли хлористый йод (3,6 г, 22,2 ммоль) и карбонат кальция (4,03 г, 40,4 ммоль) при комнатной температуре и перемешивали в течение 2 часов. Реакционный раствор фильтровали. Фильтрат промывали насыщенным раствором тиосульфата натрия (50 мл×1), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали указанное в заголовке соединение 8b (6,5 г, выход: 100%).
МС m/z (ESI): 296 [М+1].
Стадия 2
Метил-2-фтор-5-йод-4-(2,2,2-трифторацетамидо)бензоат 8с
Соединение 8b (6,5 г, 20,2 ммоль) растворяли в 100 мл дихлорметана. При охлаждении на ледяной бане в раствор добавляли трифторуксусный ангидрид (3,6 г, 22,2 ммоль) и перемешивали в течение 1 часа. Реакционный раствор концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали титульное соединение 8с (5,4 г, выход: 69%).
МС m/z (ESI): 392 [М+1].
Стадия 3
Метил-2-(((трет-бутилдиметилсилил)окси)метил)-6-фтор-1Н-индол-5-карбоксилат 8е
Соединение 8с (2,28 г, 5,8 ммоль) и трет-бутилдиметил-(2-пропин-1-илокси)силан 8d (1,49 г, 8,74 ммоль, полученный в соответствии с известным способом, раскрытым в журнале "Journal of the American Chemical Society, 2016, 138(24), 7532-7535") растворяли в 10 мл N,N-диметилформамида. В раствор добавляли хлорид бис(трифенилфосфин)палладия (0,61 г, 0,88 ммоль), йодид меди (0,222 г, 1,17 ммоль) и триэтиламин (4,07 мл, 29,2 ммоль) и перемешивали при температуре 70°С в течение 4 часов. В реакционный раствор добавляли 40 мл воды и экстрагировали этилацетатом (30 мл×3). Органические фракции объединяли, промывали насыщенным раствором хлорида натрия (30 мл×1), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали титульное соединение 8е (1,29 г, выход: 65%).
МС m/z (ESI): 338 [М+1].
Стадия 4
Метил-2-(((трет-бутилдиметилсилил)окси)метил)-1-циклопропил-6-фтор-1H-индол-5-карбоксилат 8f
Соединение 8е (0,633 г, 1,88 ммоль) и циклопропилбороновую кислоту (1,61 г, 18,8 ммоль) растворяли в 5 мл 1,2-дихлорэтана. В раствор добавляли ацетат меди (1,43 г, 7,88 ммоль), 2,2-бипиридин (1,23 г, 7,88 ммоль) и карбонат натрия (0,84 г, 7,88 ммоль) и перемешивали при температуре 80°С в течение 16 часов. Реакционный раствор фильтровали, осадок на фильтре промывали дихлорметаном. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали указанное в заголовке соединение 8f (350 мг, выход: 50%).
МС m/z (ESI): 378 [М+1].
Стадия 5
Метил-1-циклопропил-6-фтор-2-(гидроксиметил)-1Н-индол-5-карбоксилат 8q
Соединение 8f (350 мг, 0,927 ммоль) растворяли в 10 мл тетрагидрофурана. В раствор добавляли раствор фторида тетрабутиламмония в тетрагидрофуране (1,85 мл, 1,85 ммоль) при охлаждении на ледяной бане и перемешивали при температуре 0°С в течение 2 часов. В реакционный раствор добавляли 10 мл воды и экстрагировали этилацетатом (10 мл×3). Органические фракции объединяли, промывали насыщенным раствором хлорида натрия (10 мл×1), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали указанное в заголовке соединение 8g (230 мг, выход: 68%).
МС m/z (ESI): 264 [М+1].
Стадия 6
Метил-1-циклопропил-6-фтор-2-((3-метил-5-(трифторметил)-1Н-пиразол-1-ил)метил)-1Н-индол-5-карбоксилат 8i
Соединение 8g (84 мг, 0,32 ммоль) и 3-метил-5-трифторметилпиразол 8h (192 мг, 1,28 ммоль, полученный в соответствии с известным способом, раскрытым в журнале "Tempahedron Letters, 2016, 57(14), 1555-1559") растворяли в 10 мл тетрагидрофурана. В раствор добавляли трифенилфосфин (336 мг, 1,85 ммоль) и диэтилазодикарбоксилат (200 мкл, 1,28 ммоль) при комнатной температуре и перемешивали в течение 16 часов. В реакционный раствор добавляли 30 мл этилацетата, последовательно промывали водой (10 мл) и насыщенным раствором хлорида натрия (10 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали указанное в заголовке соединение 8i (49 мг, выход: 39%).
МС m/z (ESI): 396 [М+1].
Стадия 7
1-Циклопропил-6-фтор-2-((3-метил-5-(трифторметил)-1Н-пиразол-1-ил)метил)-1Н-индол-5-карбоновая кислота 8i
Соединение 8i (50 мг, 0,124 ммоль) растворяли в 1 мл метанола. В раствор добавляли 2 М раствор гидроксида калия (1 мл, 2 ммоль) при комнатной температуре и перемешивали при комнатной температуре в течение 16 часов. В реакционный раствор добавляли 6 М соляную кислоту для регулирования величины рН на уровне 1~2, разбавляли 10 мл воды и экстрагировали этилацетатом (10 мл×3). Органические фракции объединяли, промывали насыщенным раствором хлорида натрия (10 мл×1), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением неочищенного указанного в заголовке соединения 8j (50 мг), которое использовали непосредственно на следующей стадии без очистки.
МС m/z (ESI): 382 [М+1].
Стадия 8
(R)-1-Цикпопропил-N-(1-(4-(этилсульфонил)фенил)-2-гидроксиэтил)-6-фтор-2-((3-метил-5-(трифторметил)-1Н-пиразол-1-ил)метил)-1Н-индол-5-карбоксамид 8
Соединение 8j (3,9 мг, 0,01 ммоль) и соединение 5е (4 мг, 0,015 ммоль) растворяли в 1 мл дихлорметана. В раствор добавляли гидрохлорид 1-этил-(3-диметиламинопропил)карбодиимида (3,9 мг, 0,02 ммоль), 1-гидроксибензотриазол (2,7 мг, 0,02 ммоль) и триэтиламин (7 мкл, 0,05 ммоль) при комнатной температуре и перемешивали при комнатной температуре в течение 4 часов. Реакционный раствор концентрировали при пониженном давлении, полученный остаток очищали при помощи высокоэффективной жидкостной хроматографии, в результате получали указанное в заголовке соединение 8 (3 мг, выход: 50%).
МС m/z (ESI): 593 [М+1].
Пример 9
(R)-N-(1-(4-(Этилсульфонил)фенил)-2-гидроксиэтил)-6-фтор-1-(2-фторэтил)-2-((3-метил-5-(трифторметил)-1Н-пиразол-1-ил)метил)-1Н-индол-5-карбоксамид 9

Стадия 1
Метил-2-(((трет-бутилдиметилсилил)окси)метил)-6-фтор-1-(2-фторэтил)-1Н-индол-5-карбоксилат 9а
Соединение 8е (0,6 г, 1,78 ммоль) растворяли в 5 мл N,N-диметилформамида. В раствор добавляли 2-фторйодэтан (0,775 г, 4,45 ммоль) и карбонат калия (0,862 г, 6,24 ммоль) и перемешивали при температуре 80°С в течение 4 часов. В реакционный раствор добавляли 40 мл воды и экстрагировали этилацетатом (20 мл×3). Органические фракции объединяли, промывали насыщенным раствором хлорида натрия (30 мл×1), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали указанное в заголовке соединение 9а (610 мг, выход: 90%).
МС m/z (ESI): 384 [М+1].
Стадия 2
Метил-6-фтор-1-(2-фторэтил)-2-(гидроксиметил)-1Н-индол-5-карбоксилат 9b
руководствуясь схемой синтеза соединения 8g на стадии 5 Примера 8, заменяли исходное соединение 8f соединением 9а, соответственно, и получали указанное в заголовке соединение 9b (340 мг, выход: 80%).
МС m/z (ESI): 270 [М+1].
Стадия 3
Метил-6-фтор-1-(2-фторэтил)-2-((3-метил-5-(трифторметил)-1Н-пиразол-1-ил)метил)-1Н-индол-5-карбоксилат 9с
Руководствуясь схемой синтеза соединения 8i на стадии 6 Примера 8, заменяли исходное соединение 8g соединением 9b, соответственно, и получали указанное в заголовке соединение 9с (170 мг, выход: 73%).
МС m/z (ESI): 402 [М+1].
Стадия 4
6-Фтор-1-(2-фторэтил)-2-((3-метил-5-(трифторметил)-1Н-пиразол-1-ил)метил)-1Н-индол-5-карбоновая кислота 9d
Руководствуясь схемой синтеза соединения 8j на стадии 7 Примера 8, заменяли исходное соединение 8i соединением 9с, соответственно, и получали неочищенное указанное в заголовке соединение 9d (150 мг, выход: 90%), которое использовали непосредственно на следующей стадии без очистки.
МС m/z (ESI): 388 [М+1].
Стадия 5
(R)-N-(1-(4-(Этилсульфонил)фенил)-2-гидроксиэтил)-6-фтор-1-(2-фторэтил)-2-((3-метил-5-(трифторэтил)-1Н-пиразол-1-ил)метил)-1Н-индол-5-карбоксамид 9
Руководствуясь схемой синтеза соединения 8 на стадии 8 Примера 8, заменяли исходное соединение 8j соединением 9d, соответственно, и получали указанное в заголовке соединение 9 (1,4 мг, выход: 20%).
МС m/z (ESI): 599 [М+1].
Пример 10
(R)-2-(4-Хлор-2-(трифторметил)бензил)-N-(1-(4-(этилсульфонил)фенил)-2-гидроксиэтил)-1-изопропил-1Н-индол-5-карбоксамид 10

Стадия 1
Метил-2-(4-хлор-2-(трифторметил)бензил)-1-изопропил-1Н-индол-5-карбоксилат 10а
Соединение 2b (47,5 мг, 0,13 ммоль) растворяли в 1,5 мл N,N-диметилформамида. В раствор добавляли 60% раствор гидрида натрия (32 мг, 0,774 ммоль), затем 2-йодпропан (77,4 мкл, 0,774 ммоль) и проводили реакцию при температуре 75°С в течение 16 часов. Реакционный раствор охлаждали до комнатной температуры, разбавляли 15 мл воды и экстрагировали этилацетатом (10 мл×3). Органические фракции объединяли, промывали насыщенным раствором хлорида натрия (10 мл×3), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле в проявляющей системе растворителей В, в результате получали указанное в заголовке соединение 10а (20 мг, выход: 40%).
МС m/z (ESI): 410 [М+1].
Стадия 2
2-(4-Хлор-2-(трифторметил)бензил)-1-изопропил-1H-индол-5-карбоновая кислота 10b
Руководствуясь схемой синтеза стадии 4 Примера 9, заменяли исходное соединение 9с соединением 10а, соответственно, и получали неочищенное указанное в заголовке соединение 10b (21 мг, выход: 100%), которое использовали непосредственно на следующей стадии без очистки.
МС m/z (ESI): 396 [М+1].
Стадия 3
(R)-2-(4-Хлор-2-(трифторметил)бензил)-N-(1-(4-(этилсульфонил)фенил)-2-гидроксиэтил)-1-изопропил-1Н-индол-5-карбоксамид 10
Руководствуясь схемой синтеза стадии 5 Примера 9, заменяли исходное соединение 9d соединением 10b, соответственно, и получали указанное в заголовке соединение 10 (25,2 мг).
МС m/z (ESI): 607 [М+1].
1Н ЯМР (300 МГц, CDCl3): δ 8,01 (с, 1Н), 7,82 (д, 2Н), 7,68-7,43 (м, 4Н), 7,32 (д, 1Н), 7,02 (с, 1Н), 6,94 (д, 1Н), 6,24 (с, 1Н), 5,29 (с, 1Н), 4,31 (кв, 1Н), 4,22 (с, 2Н), 4,00 (д, 2Н), 3,03 (кв, 2Н), 1,43 (д, 6Н), 1,22 (т, 3Н).
Пример 11
(R)-2-(4-Хлор-2-(трифторметил)бензил)-1-циклопропил-N-(1-(4-(этилсульфонил)фенил)-2-гидроксиэтил)-1Н-индол-5-карбоксамид 11
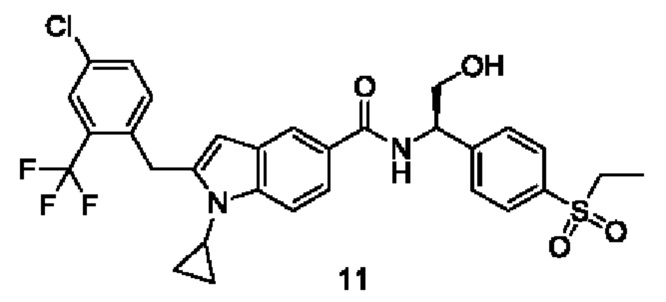
Руководствуясь схемой синтеза Примера 6, заменяли исходное соединение 5b соединением 2b, соответственно, и получали указанное в заголовке соединение 11 (23,8 мг).
МС m/z (ESI): 623 [М+1].
1Н ЯМР (300 МГц, CDCl3): δ 7,95 (с, 1Н), 7,81 (д, 2Н), 7,67-7,58 (м, 2Н), 7,53 (д, 3Н), 7,34 (д, 1Н), 7,04 (ушир.с, 1Н), 6,95 (д, 1Н), 6,13 (с, 1Н), 5,25 (м, 1Н), 4,34 (с, 2Н), 4,12-3,93 (м, 3Н), 3,02 (кв, 2Н), 2,89 (b, 1Н), 1,27-1,13 (м, 3Н), 1,09-0,88 (м, 4Н).
Пример 12
(R)-2-(4-Хлор-2-(трифторметил)бензил)-N-(1-(4-(N-циклопропилсульфамоил)фенил)-2-гидроксиэтил)-1-(2-фторэтил)-1Н-индол-5-карбоксамид 12

Стадия 1
N-Циклопропил-4-винилбензолсульфонамид 12b
п-Стиролсульфонат натрия 12а растворяли в 40 мл толуола. В раствор добавляли тионилхлорид (11,54 г, 97,00 ммоль) и N,N-диметилформамид (0,5 мл) при комнатной температуре, затем нагревали до температуры 100°С и перемешивали в течение 2 часов. Реакционный раствор охлаждали и концентрировали при пониженном давлении. В реакционный раствор добавляли дихлорметан (100 мл) и по каплям прибавляли циклопропиламин (2,22 г, 38,80 ммоль). По окончании прибавления реакционный раствор перемешивали при комнатной температуре в течение 1 часа и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали указанное в заголовке соединение 12b (2,0 г, выход: 46,2%).
МС m/z (ESI): 224 [М+1].
Стадия 2
трет-Бутил (R)-(1-(4-(N-циклопропилсульфамоил)фенил)-2-гидроксиэтил)карбамат 12с
Гидроксид натрия (1,07 г, 26,87 ммоль) растворяли в 15 мл воды, после чего в 5 мл полученного раствора растворяли дигидрат осмата калия (132,00 мг, 358,28 мкмоль). трет-Бутилкарбамат (3,67 г, 31,35 ммоль) растворяли в 100 мл н-пропанола при комнатной температуре и смешивали с указанным выше водным раствором гидроксида натрия. К реакционному раствору по каплям прибавляли трет-бутилгипохлорит (2,92 г, 26,87 ммоль) при комнатной температуре и по окончании прибавления перемешивали в течение 5 минут. В реакционный раствор добавляли 1,4-фталазиндииловый эфир гидрохинидина (418,64 мг, 537,42 мкмоль) и перемешивали при комнатной температуре в течение 10 минут. К реакционному раствору по каплям прибавляли 20 мл приготовленного заранее соединения 12b (2,0 г, 8,96 ммоль) в н-пропаноле и 5 мл раствора дигидрата осмата калия в гидроксиде натрия и по окончании прибавления перемешивали в течение 5 часов при комнатной температуре. Реакцию гасили насыщенным раствором тиосульфата натрия, реакционный раствор экстрагировали этилацетатом (1000 мл×2). Органические фракции объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали указанное в заголовке соединение 12с (0,3 г, выход: 9,4%).
МС m/z (ESI): 357 [М+1].
Стадия 3
(R)-4-(1-Амино-2-гидроксиэтил)-N-циклопропилбензолсульфонамид 12d
Соединение 12с (300 мг, 841,67 мкмоль) растворяли в 10 мл метанола. В раствор добавляли 4 мл концентрированной соляной кислоты и перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении, в результате получали указанное в заголовке соединение 12d (215 мг, выход: 99,6%).
МС m/z (ESI): 257,4 [М+1].
Стадия 4
(R)-2-(4-Хлор-2-(трифторметил)бензил)-N-(1-(4-(N-циклопропилсульфамоил)фенил)-2-гидроксиэтил)-1-(2-фторэтил)-1Н-индол-5-карбоксамид 12
Соединение 2d (100 мг, 250,15 мкмоль) растворяли в 2 мл N,N-диметилформамида. В раствор добавляли соединение 12d (87,89 мг, 300,2 мкмоль) и N,N-диизопропилэтиламин (64,66 мг, 500,3 мкмоль), затем гексафторфосфат 2-(7-азобензотриазол)-N,N,N',N'-тетраметилурония (190 мг, 500,3 мкмоль) и перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении, полученный остаток очищали при помощи высокоэффективной жидкостной хроматографии, в результате получали титульное соединение 12 (50 мг, выход: 30,3%).
МС m/z (ESI): 638 [М+1].
1Н ЯМР (400 МГц, CD3OD): δ 8,69-8,67 (д, 1Н), 8,12 (с, 1Н), 7,89-7,87 (м, 2Н), 7,80 (с, 1Н), 7,76-7,73 (д, 1Н), 7,68-7,66 (м, 2Н), 7,61-7,59 (м, 1Н), 7,49-7,47 (м, 1Н), 7,28-7,26 (м, 1Н), 6,17 (с, 1Н), 5,32-5,30 (м, 1Н), 4,73 (с, 1Н), 4,61 (с, 1Н), 4,48 (с, 1Н), 4,41-4,40 (м, 3Н), 3,95-3,93 (м, 2Н), 2,15-2,14 (м, 1Н), 1,36-1,31 (м, 1Н), 0,55-0,53 (м, 4Н).
Пример 13
(R)-2-(4-Хлор-2-(трифторметил)бензил)-N-(1-(4-((циклопропилметил)сульфонил)фенил)-2-гидроксиэтил)-1-(2-фторэтил)-1Н-индол-5-карбоксамид 13

Стадия 1
(4-Бромфенил)(циклопропилметил)сульфан 13с
4-Бромбензолтиол 13а (2,00 г, 10,58 ммоль) растворяли в 15 мл N,N-диметилформамида. В раствор добавляли карбонат калия (1,61 г, 11,64 ммоль) и бромметилциклопропан 13b (1,57 г, 11,64 ммоль) и перемешивали в атмосфере аргона при комнатной температуре в течение 16 часов. Реакционный раствор фильтровали, фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали указанное в заголовке соединение 13с (2,5 г, выход: 97,2%).
Стадия 2
1-Бром-4-((циклопропилметил)сульфонил)бензол 13d
Соединение 13с (2,57 г, 10,58 ммоль) растворяли в 50 мл дихлорметана. Раствор охлаждали на ледяной бане, затем добавляли в него м-хлорпероксибензойную кислоту (4,60 г, 26,42 ммоль) и перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор фильтровали, фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали указанное в заголовке соединение 13с (2,9 г, выход: 88,3%).
МС m/z (ESI): 292 [М+18].
Стадия 3
1-((Циклопропилметил)сульфонил)-4-винилбензол 13f
4-(Циклопропилметил)сульфонилбромбензол 13d (2,48 г, 9,01 ммоль) растворяли в 80 мл 1,4-диоксана. Добавляли 10 мл воды, пинаколовый эфир винилбороновой кислоты 13е (2,78 г, 18,03 ммоль) и тетракис(трифенилфосфин)палладий (520,49 мг, 450,64 мкмоль), затем - карбонат цезия (5,88 г, 18,03 ммоль). Реакционный раствор нагревали до температуры 80°С в атмосфере аргона и перемешивали в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении, полученный остаток очищали при помощи высокоэффективной жидкостной хроматографии, в результате получали указанное в заголовке соединение 13f (1,83 г, 91,3%).
МС m/z (ESI): 240 [М+18].
Стадия 4
трет-Бутил (R)-(1-(4-(циклопропилметилсульфонил)фенил)-2-гидроксиэтил)карбамат 13q
Гидроксид натрия (1,00 г, 24,70 ммоль) растворяли в 15 мл воды, в 5 мл полученного раствора растворяли дигидрат осмата калия (121,18 мг, 329,28 мкмоль). трет-Бутилкарбамат (3,38 г, 28,81 ммоль) растворяли в 100 мл н-пропанола при комнатной температуре и смешивали с указанным выше водным раствором гидроксида натрия. В раствор по каплям прибавляли трет-бутилгипохлорит (2,68 г, 24,70 ммоль) при комнатной температуре и по окончании прибавления перемешивали в течение 5 минут. В реакционный раствор добавляли 1,4-фталазиндииловый эфир гидрохинидина (384,64 мг, 493,92 мкмоль) и перемешивали при комнатной температуре в течение 10 минут. К реакционному раствору по каплям прибавляли 20 мл приготовленного заранее раствора 4-циклопропилметилсульфонилстирола 13f (1,83 г, 8,23 ммоль) в н-пропаноле и 5 мл раствора дигидрата осмата калия в гидроксиде натрия и по окончании прибавления перемешивали в течение 5 часов при комнатной температуре. Реакцию гасили насыщенным раствором тиосульфата натрия, реакционный раствор экстрагировали этилацетатом (1000 мл×2). Органические фракции объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали указанное в заголовке соединение 13g (1,3 г, выход: 44,43%).
МС m/z (ESI): 256 [М-100+1].
Стадия 5
(R)-2-Амино-2-(4-((циклопропилметил)сульфонил)фенил)этанол 13h
Соединение 13g (1,30 г, 3,66 ммоль) растворяли в 10 мл метанола. В раствор добавляли 4 мл концентрированной соляной кислоты и перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении, в результате получали указанное в заголовке соединение 13h (0,9 г, 96,4%).
Стадия 6
(R)-2-(4-Хлор-2-(трифторметил)бензил)-N-(1-(4-((циклопропилметил)сульфонил)фенил)-2-гидроксиэтил)-1-(2-фторэтил)-1Н-индол-5-карбоксамид 13
Соединение 2d (200 мг, 500,29 мкмоль) растворяли в 5 мл N,N-диметилформамида. Добавляли соединение 13h (218,97 мг, 750,44 мкмоль) и N,N-диизопропилэтиламин (129,32 мг, 1,00 ммоль), затем гексафторфосфат 2-(7-азобензотриазол)-N,N,N',N'-тетраметилурония (235,41 мг, 1,00 ммоль). Реакционный раствор перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении, полученный остаток очищали при помощи высокоэффективной жидкостной хроматографии, в результате получали титульное соединение 13 (41 мг, 12,8%).
МС m/z (ESI): 637 [М+1].
1Н ЯМР (400 МГц, CDCl3): δ 8,13-8,12 (д, 1Н), 7,97-7,95 (м, 2Н), 7,76-7,75 (м, 1Н), 7,65-7,63 (м, 2Н), 7,47-7,45 (м, 1Н), 7,39-7,38 (д, 1Н), 7,20-7,16 (м, 1Н), 7,13-7,11 (м, 1Н), 6,30 (с, 1Н), 5,39-5,35 (м, 1Н), 4,70-4,68 (т, 1Н), 4,59-4,56 (т, 1Н), 4,38-4,35 (м, 3Н), 4,31-4,29 (м, 1Н), 4,15-4,11 (дд, 1Н), 4,08-4,04 (дд, 1Н), 3,05-3,04 (д, 2Н), 1,09-1,05 (м, 1Н), 0,64-0,59 (м, 2Н), 0,24-0,20 (м, 2Н).
Пример 14
(R)-N-(1-(4-((Циклопропилметил)сульфонил)фенил)-2-гидроксиэтил)-2-(4-фтор-2-(трифторметил)бензил)-1-(2-фторэтил)-1Н-индол-5-карбоксамид 14
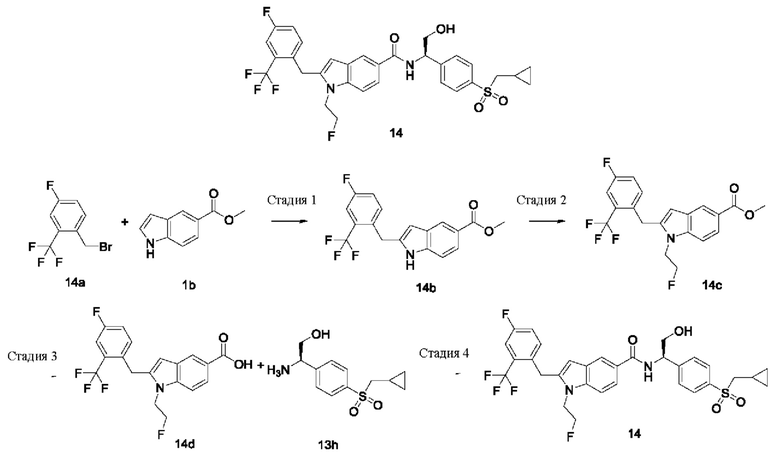
Стадия 1
Метил-2-(4-фтор-2-(трифторметил)бензил)-1Н-индол-5-карбоксилат 14b
4-Фтор-2-трифторметилбензилбромид 14а (2,29 г, 8,90 ммоль), соединение 1b (1,30 г, 7,42 ммоль), хлорид бис(ацетонитрил)палладия(II) (385,05 мг, 1,48 ммоль), бицикло[2,2,1]-2-гептен (698,67 мг, 7,42 ммоль) и карбонат калия (1,57 г, 14,84 ммоль) добавляли к 20 мл N,N-диметилацетамида. Реакционный раствор нагревали до температуры 80°С и перемешивали в течение 16 часов в атмосфере аргона. Реакционный раствор охлаждали до комнатной температуры и фильтровали. Фильтрат выливали в воду и экстрагировали этилацетатом. Органические фракции объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали указанное в заголовке соединение 14b (2,0 г, выход: 76,7%).
МС m/z (ESI): 350 [М-1].
Стадия 2
Метил-2-(4-фтор-2-(трифторметил)бензил)-1-(2-фторэтил)-1Н-индол-5-карбоксилат 14с
Соединение 14b (140 мг, 398,53 мкмоль), 1-фтор-2-йодэтан (151,2 мг, 1,20 ммоль) и карбонат цезия (389,54 мг, 1,20 ммоль) добавляли к 15 мл ацетонитрила. Проводили реакцию в реакционном растворе под воздействием микроволнового излучения при температуре 100°С в течение 1 часа. Реакционный раствор выливали в воду и экстрагировали этилацетатом. Органические фракции объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали указанное в заголовке соединение 14с (135 мг, выход: 85,25%).
МС m/z (ESI): 396 [М-1].
Стадия 3
2-(4-Фтор-2-(трифторметил)бензил)-1-(2-фторэтил)-1Н-индол-5-карбоновая кислота 14d
Соединение 14с (135 мг, 339,76 мкмоль) и гидроксид натрия (37,05 мг, 926,39 мкмоль) добавляли в смешанный растворитель, состоящий из 6 мл метанола и 0,5 мл воды. Реакционный раствор перемешивали при температуре 60°С в течение 2 часов. Метанол удаляли при пониженном давлении, к полученному остатку по каплям прибавляли разбавленную 1М соляную кислоту для регулирования величины рН на уровне ~3. Реакционный раствор экстрагировали этилацетатом, органическую фракцию сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением неочищенного указанного в заголовке соединения 14d (130 мг), которое использовали непосредственно на следующей стадии без очистки.
МС m/z (ESI): 382 [М-1].
Стадия 4
(R)-N-(1-(4-((Циклопропилметил)сульфонил)фенил)-2-гидроксиэтил)-2-(4-фтор-2-(трифторметил)бензил)-1-(2-фторэтил)-1Н-индол-5-карбоксамид 14
Соединение 14d (300 мг, 782,65 мкмоль) растворяли в 5 мл N,N-диметилформамида. Добавляли соединение 13h (342,56 мг, 1,17 ммоль) и N,N-диизопропилэтиламин (202,3 мг, 1,57 ммоль), затем - фторфосфат 2-(7-азобензотриазол)-N,N,N',N'-тетраметилурония (594,82 мг, 1,57 ммоль). Реакционный раствор перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении, полученный остаток очищали при помощи высокоэффективной жидкостной хроматографии, в результате получали указанное в заголовке соединение 14 (200 мг, 41,2%).
МС m/z (ESI): 621 [М+1].
1Н ЯМР (400 МГц, CDCl3): δ 8,13-8,12 (д, 1Н), 7,94-7,92 (м, 2Н), 7,77-7,74 (м, 1Н), 7,63-7,61 (м, 2Н), 7,50-7,47 (м, 1Н), 7,36-7,34 (д, 1Н), 7,25-7,23 (м, 1Н), 7,20-7,14 (м, 1Н), 6,30 (с, 1Н), 5,39-5,35 (м, 1Н), 4,69-4,67 (т, 1Н), 4,58-4,55 (т, 1Н), 4,38-4,35 (м, 3Н), 4,32-4,29 (м, 1Н), 4,12-4,08 (дд, 1Н), 4,05-4,01 (дд, 1Н), 3,05-3,02 (д, 2Н), 1,05-0,98 (м, 1Н), 0,64-0,59 (м, 2Н), 0,24-0,20 (м, 2Н).
Пример 15
(R)-2-(4-Хлор-2-(трифторметил)бензил)-N-(1-(4-(циклопропилсульфонил)фенил)-2-гидроксиэтил)-1-(2-фторэтил)-1Н-индол-5-карбоксамид 15
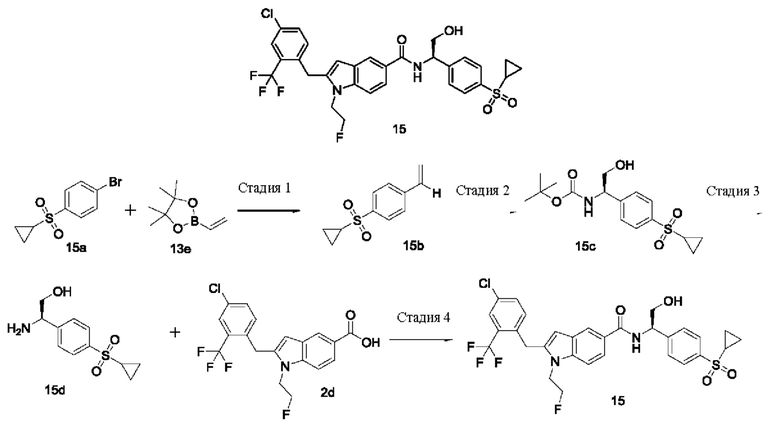
Стадия 1
1-((Циклопропил)сульфонил)-4-винилбензол 15b
4-Цикпопропилсульфонилбромбензол 15а (315 мг, 1,21 ммоль) растворяли в 20 мл 1,4-диоксана. Добавляли 5 мл воды, соединение 13е (223 мг, 1,45 ммоль) и тетракис(трифенилфосфин)палладий (55,8 мг, 48,25 мкмоль), затем - карбонат цезия (786,5 мг, 2,41 ммоль). Реакционный раствор нагревали до температуры 80°С в атмосфере аргона и перемешивали в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении, полученный остаток очищали при помощи высокоэффективной жидкостной хроматографии, в результате получали указанное в заголовке соединение 15b (210 мг, 83,6%).
МС m/z (ESI): 226 [М+18].
Стадия 2
трет-Бутил (R)-(1-(4-(циклопропилсульфонил)фенил)-2-гидроксиэтил)карбамат 15с
Гидроксид натрия (121 мг, 3,02 ммоль) растворяли в 15 мл воды, в 5 мл полученного раствора растворяли дигидрат осмата калия (14,84 мг, 40,33 мкмоль). трет-Бутилкарбамат (413,3 мг, 3,53 ммоль) растворяли в 10 мл н-пропанола при комнатной температуре и смешивали с указанным выше водным раствором гидроксида натрия. К реакционному раствору по каплям прибавляли трет-бутилгипохлорит (328,4 мг, 3,02 ммоль) при комнатной температуре и по окончании прибавления перемешивали в течение 5 минут. В реакционный раствор добавляли 1,4-фталазиндииловый эфир гидрохинидина (47,13 мг, 60,5 мкмоль) и перемешивали при комнатной температуре в течение 10 минут. К реакционному раствору по каплям прибавляли 10 мл раствора соединения 15b (0,21 г, 1,01 ммоль) в н-пропаноле и 5 мл раствора дигидрата осмата калия в гидроксиде натрия и по окончании прибавления перемешивали в течение 5 часов при комнатной температуре. Реакцию гасили насыщенным раствором тиосульфата натрия, реакционный раствор экстрагировали этилацетатом (50 мл×2). Органические фракции объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали указанное в заголовке соединение 15с (133 мг, выход: 38,6%).
МС m/z (ESI): 242 [М-100+1].
Стадия 3
(R)-2-Амино-2-(4-((циклопропил)сульфонил)фенил)этанол 15d
Соединение 15с (133 мг, 389,56 мкмоль) растворяли в 10 мл метанола. В раствор добавляли 4 мл концентрированной соляной кислоты и перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении, в результате получали титульное соединение 15d (90 мг, 96,4%).
Стадия 4
(R)-2-(4-Хлор-2-(трифторметил)бензил)-N-(1-(4-(циклопропилсульфонил)фенил)-2-гидроксиэтил)-1-(2-фторэтил)-1Н-индол-5-карбоксамид 15
Соединение 2d (150 мг, 375,22 мкмоль) растворяли в 5 мл N,N-диметилформамида. Добавляли соединение 15d (90,54 мг, 375,22 мкмоль) и N,N-диизопропилэтиламин (97,00 мг, 750,44 мкмоль), затем - фторфосфат 2-(7-азобензотриазол)-N,N,N',N'-тетраметилурония (285,41 мг, 750,44 мкмоль). Реакционный раствор перемешивали при комнатной температуре в течение 2 часов. Затем реакционный раствор концентрировали при пониженном давлении, полученный остаток очищали при помощи высокоэффективной жидкостной хроматографии, в результате получали указанное в заголовке соединение 15 (100 мг, 42,8%).
МС m/z (ESI): 621 [М-1].
1Н ЯМР (400 МГц, CDCl3): δ 8,13 (с, 1Н), 7,94-7,92 (м, 2Н), 7,77-7,75 (м, 2Н), 7,64-7,62 (м, 2Н), 7,48-7,45 (м, 1Н), 7,38-7,36 (м, 1Н), 7,15-7,12 (м, 2Н), 6,34 (с, 1Н), 5,41-5,38 (м, 1Н), 4,70-4,68 (т, 1Н), 4,60-4,56 (т, 1Н), 4,38-4,36 (м, 3Н), 4,31-4,29 (м, 1Н), 4,16-4,12 (дд, 1Н), 4,09-4,05 (дд, 1Н), 2,51-2,46 (м, 1Н), 1,41-1,37 (м, 2Н), 1,09-1,05 (м, 2Н).
Пример 16
(R)-2-(4-Хлор-2-(трифторметил)бензил)-N-(1-(4-(этилсульфонил)фенил)-2-метоксиэтил)-1-(2-фторэтил)-1Н-индол-5-карбоксамид 16

Стадия 1
трет-Бутил (R)-(1-(4-(этилсульфонил)фенил)-2-гидроксиэтил)карбамат 16а
Соединение 5е (50 мг, 218,06 мкмоль) растворяли в 6 мл дихлорметана. В раствор добавляли триэтиламин (44,63 мг, 436,12 мкмоль) и ди-трет-бутилдикарбонат (95,07 мг, 436,12 мкмоль) при температуре 0°С и перемешивали в течение 1 часа. Реакцию гасили добавлением ледяной воды. Реакционный раствор экстрагировали этилацетатом, органическую фракцию сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, неочищенный продукт очищали при помощи тонкослойной хроматографии с использованием элюента В, в результате получали соединение 16b (45 мг, выход: 62,6%).
МС m/z (ESI): 230,2 [М-100+1].
Стадия 2
трет-Бутил (R)-(1-(4-(этилсульфонил)фенил)-2-метоксиэтил)карбамат 16b
Соединение 16а (50 мг, 151,79 мкмоль) растворяли в 6 мл тетрагидрофурана. В раствор добавляли гидрид натрия (11,63 мг, 303,57 мкмоль) при температуре 0°С и перемешивали в течение 10 минут. В реакционный раствор добавляли метилйодид (23,70 мг, 166,96 мкмоль) и перемешивали в течение 2 часов. Реакцию гасили добавлением ледяной воды. Реакционный раствор экстрагировали этилацетатом, органическую фракцию сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, неочищенный продукт очищали при помощи тонкослойной хроматографии с использованием элюента В, в результате получали соединение 16b (45 мг, выход: 86,32%).
Стадия 3
(R)-1-(4-(Этилсульфонил)фенил)-2-метоксиэтиламин 16с
Соединение 16b (45 мг, 131,03 мкмоль) растворяли в 10 мл дихлорметана. В раствор добавляли трифторуксусную кислоту (298,80 мг, 2,62 ммоль) и перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор концентрировали при пониженном давлении с получением неочищенного указанного в заголовке соединения 16 с (40 мг), которое использовали непосредственно на следующей стадии без очистки.
Стадия 4
(R)-2-(4-Хлор-2-(трифторметил)бензил)-N-(1-(4-(этилсульфонил)фенил)-2-метоксиэтил)-1-(2-фторэтил)-1Н-индол-5-карбоксамид 16
Соединение 2d (44,75 мг, 111,94 мкмоль) и неочищенное соединение 16с (40,00 мг, 111,94 мкмоль) растворяли в 20 мл N,N-диметилформамида. В раствор добавляли гексафторфосфат 2-(7-азобензотриазол)-N,N,N',N'-тетраметилурония (31,60 мг, 134,32 мкмоль) и N,N-диизопропилэтиламин (43,40 мг, 335,81 мкмоль) и перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор разбавляли водой и экстрагировали этилацетатом. Органические фракции объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали указанное в заголовке соединение 16 (25 мг, выход: 35,73%).
МС m/z (ESI): 625,6 [М+1].
1Н ЯМР (400 МГц, CDCl3): δ 8,07 (с, 1Н), 7,87-7,85 (д, 2Н), 7,73-7,71 (м, 2Н), 7,62-7,60 (м, 2Н), 7,43-7,41 (м, 1Н), 7,34-7,31 (м, 1Н), 7,15-7,08 (м, 2Н), 6,28 (с, 1Н), 5,44-5,40 (м, 1Н), 4,66-4,64 (м, 1Н), 4,55-4,52 (м, 1Н), 4,34-4,29 (м, 3Н), 4,28-4,25 (м, 1Н), 3,83-3,74 (м, 2Н), 3,39 (с, 3Н), 3,12-3,06 (м, 2Н), 1,29-1,26 (м, 3Н).
Пример 17 (Сравнительный пример)
(R)-2-(4-(Трифторметил)бензил)-N-(1-(4-(этилсульфонил)фенил)-2-гидроксиэтил)-1-(2-фторэтил)-1H-индол-5-карбоксамид 17

Стадия 1
Метил-2-(4-(трифторметил)бензил)-1H-индол-5-карбоксилат 17b
Соединение 1b (1,00 г, 5,71 ммоль) и 4-(трифторметил)бензилбромид 17а (16,40 г, 6,86 ммоль) растворяли в 15 мл N,N-диметилацетамида. Добавляли хлорид бис(ацетонитрил)палладия(II) (296,17 мг, 1,14 ммоль), бицикло[2,2,1]-2-гептен (1,1 г, 11,68 ммоль) и карбонат натрия (1,22 г, 11,51 ммоль). Реакционный раствор нагревали до температуры 80°С и перемешивали в течение 17 часов в атмосфере аргона. После этого реакционный раствор охлаждали и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали указанное в заголовке соединение 17b (1,60 г, выход: 84,10%).
МС m/z (ESI): 334,1 [М+1].
Стадия 2
Метил-2-(4-(трифторметил)бензил)-1-(2-фторэтил)-1Н-индол-5-карбоксилат 17с
Соединение 17b (500 мг, 1,50 ммоль), 1-фтор-2-йодэтан (381,0 мг, 3,0 ммоль) и карбонат цезия (976 мг, 2,0 ммоль) добавляли к 10 мл ацетонитрила. Проводили реакцию в реакционном растворе под воздействием микроволнового излучения при температуре 100°С в течение 1 часа. Реакционный раствор выливали в воду и экстрагировали этилацетатом. Органические фракции объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали указанное в заголовке соединение 17с (500 мг, выход: 87,86%).
МС m/z (ESI): 380,1 [М+1].
Стадия 3
2-(4-(Трифторметил)бензил)-1-(2-фторэтил)-1Н-индол-5-карбоновая кислота 17d
Соединение 17с (500 мг, 1,32 ммоль) и гидроксид натрия (527,2 мг, 13,18 ммоль) добавляли в смешанный растворитель, состоящий из 10 мл метанола и 2 мл воды. Раствор перемешивали при температуре 60°С в течение 2 часов. Метанол удаляли при пониженном давлении, к полученному остатку по каплям прибавляли разбавленную 1М соляную кислоту для регулирования величины рН на уровне ~3. Раствор экстрагировали этилацетатом, органическую фракцию сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением неочищенного указанного в заголовке соединения 17d (500 мг), которое использовали непосредственно на следующей стадии без очистки.
МС m/z (ESI): 366,1 [М+1].
Стадия 4
(R)-2-(4-(Трифторметил)бензил)-N-(1-(4-(этилсульфонил)фенил)-2-гидроксиэтил)-1-(2-фторэтил)-1Н-индол-5-карбоксамид 17
(R)-2-Амино-2-(4-(этилсульфонил)фенил)этанол 5е (76 мг, 0,33 ммоль), неочищенное соединение 17d (100 мг, 0,27 ммоль), гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (125 мг, 0,33 ммоль) и N,N-диизопропилэтиламин (54 мг, 0,42 ммоль) добавляли к 5 мл N,N-диметилформамида. Реакционный раствор перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор экстрагировали этилацетатом, органические фракции объединяли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, полученный остаток очищали при помощи колоночной хроматографии на силикагеле с использованием элюента В, в результате получали указанное в заголовке соединение 17 (46 мг, выход: 29,14%).
МС m/z (ESI): 577,1 [М+1].
1Н ЯМР (400 МГц, CD3OD): δ 8,65 (д, 1Н), 8,12 (с, 1Н), 7,88 (д, 2Н), 7,86 (д, 3Н), 7,63 (д, 2Н), 7,46-7,43 (м, 3Н), 6,3 (с, 1Н), 5,3 (д, 1Н), 4,64-4,62 (т, 1Н), 4,52-4,5 (т, 1Н), 4,47-4,45 (т, 1Н), 4,41-4,38 (т, 1Н), 4,10 (д, 2Н), 3,92 (д, 2Н), 3,22-3,16 (м, 2Н), 1,26-1,19 (м, 3Н).
Биологический анализ
Настоящее изобретение будет дополнительно описано со ссылкой на следующие тестовые примеры, которые, однако, не следует рассматривать, как ограничивающие объем настоящего изобретения.
Тестовый пример 1
Определение влияния соединений по настоящему изобретению на in vitro активность RORγ
I. Экспериментальные материалы и инструменты
1. Система коактивации RORγ LanthaScreen® TR-FRET (Life Technologies)
2. RORγ LBD (англ. LBD, Ligand Binding Domain - лигандсвязывающий домен) (AB Vector)
3. ДМСО (SigmaAldrich)
4. Считывающее устройство для микропланшетов (Tecan)
II. Экспериментальная часть
Скрининг соединений по настоящему изобретению на регуляцию активности RORγ осуществляли с помощью системы коактивации RORγ LanthaScreen TR-FRET (англ. Time Resolved Fluorescence Resonance Energy Transfer - времяразрешенный флуоресцентный индуктивно-резонансный перенос энергии).
Сначала готовили полный буфер D (полный TR-FRET Coregulator) (Life Technologies) с конечной концентрацией DTT (англ. dithiothreitol - дитиотреитол) 5 мМ. Конечная концентрация ДМСО составляла 2%. Испытываемое соединение последовательно разбавляли в полном буфере D, содержащем 2% ДМСО, до конечной концентрации 2x, при этом максимальная доза составляла 60 мкМ. Испытываемое соединение добавляли в тестовые лунки 384-луночного планшета (PerkinElmer) по 10 мкл/лунку. Для каждого испытываемого соединения были предусмотрены по две параллельные контрольные лунки с такой же концентрацией. Готовили 4Х RORγ LBD (АВ Vector). RORγ LBD разбавляли полным буфером D до концентрации 1 нг/мкл и добавляли в тестовые лунки 384-луночного планшета по 5 мкл/лунку. В лунке с негативным контролем содержалось 5 мкл полного буфера D без RORγ LBD. Готовили смешанный раствор, содержащий 0,6 мкМ флуоресцеина-D22 (4Х) и 8 нМ меченого тербием (Tb) анти-GST антитела (4Х) (Life Technologies), в полном буфере D и добавляли 5 мкл смешанного раствора в 384-луночный планшет. Общий объем реакционной системы составлял 20 мкл. 384-луночный планшет осторожно встряхивали на шейкере и инкубировали при комнатной температуре в темноте в течение от 2 до 4 часов.
Показания флуоресценции определяли при помощи Tecan Infinite М1000. Логарифмическую кривую отношения длины волны излучения 520 нм/495 нм к концентрации соединения строили при помощи программного обеспечения GraphPad Prism 6.0. Вычисляли величину EC50/IC50 испытываемого соединения.
Влияние соединений по настоящему изобретению на in vitro активность RORγ определяли при помощи указанного выше теста, полученные значения ЕС50 представлены в Таблице 1.


Заключение: Соединения по настоящему изобретению оказывают сильное агонистическое действие на in vitro активность RORγ. Вместе с тем, заявитель обнаружил, что изменения орто-группы в кольце А могут менять регулирующее действие соединения, при этом соединение Примера 17, в котором орто-группа в кольце А представляет собой группу, имеющую небольшое стерическое затруднение (такую как Н), является обратным агонистом.
Тестовый пример 2
Определение активности соединений по настоящему изобретению в отношении IL-17А с помощью иммуноферментного количественного анализа
I. Экспериментальные материалы и инструменты
1. Мононуклеарные клетки периферической крови человека (англ. РВМС, Human peripheral blood mononuclear cells) (Zenbio)
2. Среда для культивирования лимфоцитов (Zenbio)
3. TexMACS (Miltenyi Biotec)
4. Цитостим человека (Miltenyi Biotec)
5. Набор для иммуноферментного анализа Human IL 17 ELISA kit (R&D System)
6. Инкубатор с CO2 (Fisher Scientific)
7. Центрифуга (Fisher Scientific)
8. 96-луночный планшет для культивирования клеток (Fisher Scientific)
9. Считывающее устройство для микропланшетов (Tecan)
II. Экспериментальная часть
Замороженные мононуклеарные клетки периферической крови человека (РВМС) быстро реанимировали в предварительно нагретой среде для культивирования лимфоцитов и центрифугировали при 1000 об/мин в течение 10 мин. Супернатант клеточной культуры удаляли. Клетки осторожно суспендировали в среде TexMACS и подсчитывали. В клеточную суспензию пропорционально добавляли реагент цитостим для активации Т-клеток (10 мкл/мл). Затем клетки высевали в 96-луночный планшет для культивирования клеток с плотностью 1×105 мононуклеарных клеток периферической крови/лунку. Испытываемые соединения градиентно разбавляли средой TexMACS и добавляли соответственно в тестовые лунки, используя по 2-3 параллельные лунки на каждую группу. Для получения фонового считывания использовали лунку с негативным контролем, содержащую только клетки без цитостима. Планшет для культивирования клеток помещали в инкубатор, содержащий 5% диоксида углерода, и инкубировали при температуре 37°С в течение 3 суток. Через трое суток после обработки лекарственным средством собирали супернатант клеточной культуры и центрифугировали его для удаления суспензии. После этого в супернатанте определяли количество IL-17А с помощью набора для иммуноферментного анализа IL-17A. Значения ЕС50 испытываемых соединений рассчитывали при помощи GraphPad Prism 6.0.
С помощью указанного выше теста определяли влияние соединений по настоящему изобретению на IL-17A при иммуноферментном количественном анализе, полученные значения ЕС50 представлены в Таблице 2.


Заключение: Соединения по настоящему изобретению оказывают значительное регулирующее действие на IL-17A при иммуноферментном количественном анализе.
Оценка фармакокинетических характеристик
Тестовый пример 3
Фармакокинетический анализ соединения по настоящему изобретению у мышей
1. Краткое описание
В качестве подопытных животных использовали мышей. Концентрацию лекарственного средства в плазме в различные моменты времени определяли методом ЖХ/МС/МС после внутрижелудочного введения мышам соединения Примера 4. У мышей изучали и оценивали фармакокинетические характеристики соединения по настоящему изобретению.
2. Протокол испытаний
2.1. Испытываемое соединение
Соединение Примера 4.
2.2. Подопытные животные
Группа из девяти мышей линии С57 (самок) была приобретена в компании Shanghai Jiesijie Laboratory Animal Co., LTD, Сертификат No.: SCXK (Shanghai) 2013-0006.
2.3. Приготовление испытываемого соединения
Взвешивали определенное количество испытываемого соединения, добавляли 5 об. % ДМСО, 5 об. % Твин 80 и 90 об. % физиологического раствора, в результате получали бесцветный чистый и прозрачный раствор с концентрацией 0,1 мг/мл.
2.4. Введение
Испытываемое соединение вводили мышам линии С57 утром натощак внутрижелудочно при дозе введения 2,0 мг/кг и объеме введения 0,2 мл/10 г.
3. Способ
Мышам внутрижелудочно вводили соединение Примера 4. Отбирали по 0,1 мл крови (у 3 животных в каждый момент времени) перед введением и через 0,25, 0,5, 1,0, 2,0, 4,0, 6,0, 8,0, 11,0 и 24,0 часа после введения. Образцы хранили в гепаринизированных пробирках и центрифугировали в течение 10 минут при 3500 об/мин для отделения плазмы крови. Образцы плазмы хранили при температуре -20°С.
Определяли содержание испытываемого соединения в плазме мышей после его внутрижелудочного введения в различных концентрациях: каждый раз после введения отбирали по 25 мкл мышиной плазмы, добавляли 80 мкл раствора внутреннего стандарта камптотецина (100 нг/мл) и 200 мкл ацетонитрила, перемешивали на вортексе в течение 5 минут и центрифугировали в течение 10 минут (при 3600 об/мин). Из образцов плазмы отбирали по 1 мкл супернатанта для анализа мотодом ЖХ/МС/МС.
4. Результаты определения фармакокинетических параметров
Фармакокинетические параметры соединения по настоящему изобретению представлены ниже:

Заключение: Соединение по настоящему изобретению хорошо абсорбируется и обладает фармакокинетическим преимуществом.
Оценка фармакодинамических характеристик
Тестовый пример 4
Эффективность агониста RORγ на мышиной модели опухоли колоректального рака МС38
1. Цель эксперимента
Ингибирующее действие соединения Примера 4 на рост опухоли МС38 оценивали на мышиной модели МС38.
2. Экспериментальный метод и экспериментальные материалы
2.1. Подопытные животные и условия кормления
Самки мышей линии C57BL/6 для эксперимента были приобретены в компании Charles River Lab (U.S.A.). На момент приобретения вес мышей составлял от 20 до 25 г, возраст - от 7 до 9 недель. Мышей содержали (по 10 животных в клетке) при постоянной температуре 23±1°С и влажности 50-60% со свободным доступом к пище и воде. Мышей лечили и использовали в соответствии с требованиями Институционального комитета по содержанию и использованию животных (утвержденные нормы IACUC). После приобретения животных эксперимент начинали по истечении 7 суток адаптивного кормления.
2.2. Экспериментальные лекарственные средства
Соединение Примера 4;
антитело против мышиного PD-1 (CD279), приобретенное в компании BioXcell (клон RMP1-14; номер по каталогу ВР0146);
антитело изотипического контроля IgG2a, приобретенное в компании BioXcell (клон 2А3; номер по каталогу ВЕ0089).
2.3. План исследования и метод исследования
2.3.1. Распределение животных по группам
После адаптивного кормления мышей группировали следующим образом:


2.3.2. Метод исследования
В эксперименте использовали самок мышей линии C57BL/6 (20-25 г, возраст 7-9 недель). Противоопухолевую активность in vivo соединения Примера 4, вводимого отдельно, или соединения Примера 4, вводимого в комбинации с антителом против мышиного PD-1, оценивали путем выявления роста кол о ректальной опухоли МС38 (Synta Pharmaceuticals) у инбредных мышей C57BL/6. В правую часть брюшной полости каждой мыши были подкожно имплантированы 500000 (5×105) клеток МС38. Через 5 суток, когда опухоль выросла до 40-80 мм3, мышей случайным образом разделяли на группы. Соединение Примера 4 (30 мг/кг) вводили два раза в сутки в течение 21 суток подряд. Во время лечебного эксперимента, в ходе которого антитело вводили по отдельности или в комбинации с соединением Примера 4, мышам, несущим опухоль МС38, внутрибрюшинно (i.p.) инъецировали антитело против мышиного PD-1 (CD279) (BioXcell) (5 мг/кг) строго в 5, 8, 11 и 14 сутки. Контрольной группе вводили лекарственную композицию CMC-Na и антитело изотипического контроля IgG2a.
2.4. Представление данных
Объем опухоли определяли при помощи штангенциркуля в трех измерениях и затем вычисляли по следующей формуле: объем опухоли (мм3)=l×w×h×0,5236, где l - длина опухоли, w - ширина опухоли, a h - высота опухоли, в миллиметрах. Скорость ингибирования роста опухоли TGI%=100×(TVcontrol-TVtumor)/(TVcontrol-TVinitial), где TVcontrol=объем опухоли в контрольной группе; TVtumor=объем опухоли в лечебной группе; a TVinitial=исходный объем опухоли на 5 сутки.
3. Результаты и обсуждение:
Как показано на Фиг. 1, при введении 30 мг/кг только лишь соединения Примера 4 величина TGI составляла 40%. При введении только антитела против мышиного PD-1 (CD279) (5 мг/кг) величина TGI составляла 51%. При введении соединения Примера 4 (30 мг/кг) в комбинации с моноклональным антителом против мышиного PD-1 (5 мг/кг) проявлялось синергическое действие (TGI=63%). Эти данные указывают на то, что на модели изогенной колоректальной опухоли МС38 соединение Примера 4, вводимое в виде монотерапии, проявляет противоопухолевую активность, а введение соединения Примера 4 в комбинации с антителом к PD-1 приводит к синергическому действию. Эти данные также указывают на то, что соединение Примера 4 обладает биологической активностью, согласующейся с активацией RORγ (а не ингибированием), что открывает новый способ повышения эффективности иммунотерапии.

Изобретение относится к соединению формулы (I) или его фармацевтически приемлемым солям, где  означает двойную или одинарную связь, G1, G2 и G3 являются одинаковыми или разными, при этом каждый независимо выбран из группы, состоящей из C, CH, CH2 и N, кольцо A выбрано из группы, состоящей из фенила, пиридила, имидазолила, пиразолила и морфолинила, каждый из R1 является одинаковым или различным, при этом каждый независимо выбран из группы, состоящей из водорода, галогена, C1-6 алкила, C1-6 галогеналкила, C1-6 алкокси, C1-6 галогеналкокси, циано, амино, нитро, гидрокси и C1-6 гидроксиалкила, R2 представляет собой C1-6 галогеналкил, R3 выбран из группы, состоящей из C1-6 алкила, C1-6 галогеналкила, C1-6 алкокси, C1-6 галогеналкокси, C1-6 гидроксиалкила, галогена и гидрокси, каждый из R4 является одинаковым или различным, при этом каждый независимо выбран из группы, состоящей из водорода, галогена, C1-6 алкила, C1-6 галогеналкила, C1-6 алкокси, C1-6 галогеналкокси, циано, амино, нитро, гидрокси и C1-6 гидроксиалкила, R5 выбран из группы, состоящей из водорода, C1-6 алкила, C1-6 галогеналкила, амино, гидрокси, C1-6 гидроксиалкила, 3-6-членного циклоалкила и NR10R11, где каждый из C1-6 алкила и 3-6-членного циклоалкила независимо необязательно замещен одним или более заместителями, выбранными из группы, состоящей из гидрокси, галогена, C1-6 алкила, амино, 3-6-членного циклоалкила и 3-6-членного гетероциклила, каждый из R6 является одинаковым или различным, при этом каждый независимо выбран из группы, состоящей из водорода, галогена, C1-6 алкила, C1-6 галогеналкила, C1-6 алкокси, C1-6 галогеналкокси, циано, амино, нитро, гидрокси и C1-6 гидроксиалкила, R7 выбран из группы, состоящей из водорода, C1-6 алкила, C1-6 галогеналкила и 3-6-членного циклоалкила, где C1-6 алкил необязательно замещен одним или более заместителями, выбранными из группы, состоящей из галогена, нитро и 3-6-членного циклоалкила, R8 и R9 являются одинаковыми или разными, при этом каждый независимо выбран из группы, состоящей из водорода, галогена, C1-6 алкила, C1-6 галогеналкила, C1-6 алкокси, циано, амино, нитро, гидрокси и C1-6 гидроксиалкила, R10 и R11 являются одинаковыми или разными, при этом каждый независимо выбран из группы, состоящей из водорода, C1-6 алкила, C1-6 галогеналкила, амино, гидрокси, C1-6 гидроксиалкила и 3-6-членного циклоалкила, n равно 0 или 1, s равно 0 или 1, и t равно 0 или 1. Технический результат - получены новые соединения формулы (I), которые могут найти свое применение в медицине для лечения опухолевых заболеваний, опосредованных RORγ. 4 н. и 9 з.п. ф-лы, 2 табл., 1 ил., 17 пр.
означает двойную или одинарную связь, G1, G2 и G3 являются одинаковыми или разными, при этом каждый независимо выбран из группы, состоящей из C, CH, CH2 и N, кольцо A выбрано из группы, состоящей из фенила, пиридила, имидазолила, пиразолила и морфолинила, каждый из R1 является одинаковым или различным, при этом каждый независимо выбран из группы, состоящей из водорода, галогена, C1-6 алкила, C1-6 галогеналкила, C1-6 алкокси, C1-6 галогеналкокси, циано, амино, нитро, гидрокси и C1-6 гидроксиалкила, R2 представляет собой C1-6 галогеналкил, R3 выбран из группы, состоящей из C1-6 алкила, C1-6 галогеналкила, C1-6 алкокси, C1-6 галогеналкокси, C1-6 гидроксиалкила, галогена и гидрокси, каждый из R4 является одинаковым или различным, при этом каждый независимо выбран из группы, состоящей из водорода, галогена, C1-6 алкила, C1-6 галогеналкила, C1-6 алкокси, C1-6 галогеналкокси, циано, амино, нитро, гидрокси и C1-6 гидроксиалкила, R5 выбран из группы, состоящей из водорода, C1-6 алкила, C1-6 галогеналкила, амино, гидрокси, C1-6 гидроксиалкила, 3-6-членного циклоалкила и NR10R11, где каждый из C1-6 алкила и 3-6-членного циклоалкила независимо необязательно замещен одним или более заместителями, выбранными из группы, состоящей из гидрокси, галогена, C1-6 алкила, амино, 3-6-членного циклоалкила и 3-6-членного гетероциклила, каждый из R6 является одинаковым или различным, при этом каждый независимо выбран из группы, состоящей из водорода, галогена, C1-6 алкила, C1-6 галогеналкила, C1-6 алкокси, C1-6 галогеналкокси, циано, амино, нитро, гидрокси и C1-6 гидроксиалкила, R7 выбран из группы, состоящей из водорода, C1-6 алкила, C1-6 галогеналкила и 3-6-членного циклоалкила, где C1-6 алкил необязательно замещен одним или более заместителями, выбранными из группы, состоящей из галогена, нитро и 3-6-членного циклоалкила, R8 и R9 являются одинаковыми или разными, при этом каждый независимо выбран из группы, состоящей из водорода, галогена, C1-6 алкила, C1-6 галогеналкила, C1-6 алкокси, циано, амино, нитро, гидрокси и C1-6 гидроксиалкила, R10 и R11 являются одинаковыми или разными, при этом каждый независимо выбран из группы, состоящей из водорода, C1-6 алкила, C1-6 галогеналкила, амино, гидрокси, C1-6 гидроксиалкила и 3-6-членного циклоалкила, n равно 0 или 1, s равно 0 или 1, и t равно 0 или 1. Технический результат - получены новые соединения формулы (I), которые могут найти свое применение в медицине для лечения опухолевых заболеваний, опосредованных RORγ. 4 н. и 9 з.п. ф-лы, 2 табл., 1 ил., 17 пр.

1. Соединение формулы (I)
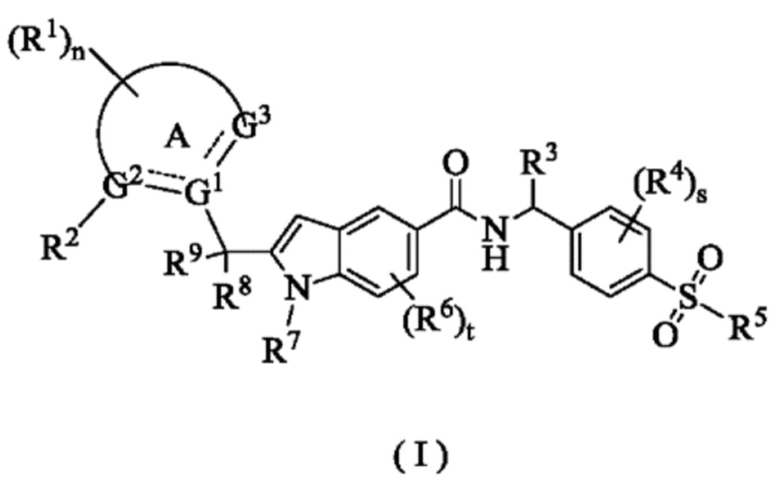
или его фармацевтически приемлемая соль,
где
 означает двойную или одинарную связь;
означает двойную или одинарную связь;
G1, G2 и G3 являются одинаковыми или разными, при этом каждый независимо выбран из группы, состоящей из C, CH, CH2 и N;
кольцо A выбрано из группы, состоящей из фенила, пиридила, имидазолила, пиразолила и морфолинила;
каждый из R1 является одинаковым или различным, при этом каждый независимо выбран из группы, состоящей из водорода, галогена, C1-6 алкила, C1-6 галогеналкила, C1-6 алкокси, C1-6 галогеналкокси, циано, амино, нитро, гидрокси и C1-6 гидроксиалкила;
R2 представляет собой C1-6 галогеналкил;
R3 выбран из группы, состоящей из C1-6 алкила, C1-6 галогеналкила, C1-6 алкокси, C1-6 галогеналкокси, C1-6 гидроксиалкила, галогена и гидрокси;
каждый из R4 является одинаковым или различным, при этом каждый независимо выбран из группы, состоящей из водорода, галогена, C1-6 алкила, C1-6 галогеналкила, C1-6 алкокси, C1-6 галогеналкокси, циано, амино, нитро, гидрокси и C1-6 гидроксиалкила;
R5 выбран из группы, состоящей из водорода, C1-6 алкила, C1-6 галогеналкила, амино, гидрокси, C1-6 гидроксиалкила, 3-6-членного циклоалкила и NR10R11, где каждый из C1-6 алкила и 3-6-членного циклоалкила независимо необязательно замещен одним или более заместителями, выбранными из группы, состоящей из гидрокси, галогена, C1-6 алкила, амино, 3-6-членного циклоалкила и 3-6-членного гетероциклила;
каждый из R6 является одинаковым или различным, при этом каждый независимо выбран из группы, состоящей из водорода, галогена, C1-6 алкила, C1-6 галогеналкила, C1-6 алкокси, C1-6 галогеналкокси, циано, амино, нитро, гидрокси и C1-6 гидроксиалкила;
R7 выбран из группы, состоящей из водорода, C1-6 алкила, C1-6 галогеналкила и 3-6-членного циклоалкила, где C1-6 алкил необязательно замещен одним или более заместителями, выбранными из группы, состоящей из галогена, нитро и 3-6-членного циклоалкила;
R8 и R9 являются одинаковыми или разными, при этом каждый независимо выбран из группы, состоящей из водорода, галогена, C1-6 алкила, C1-6 галогеналкила, C1-6 алкокси, циано, амино, нитро, гидрокси и C1-6 гидроксиалкила;
R10 и R11 являются одинаковыми или разными, при этом каждый независимо выбран из группы, состоящей из водорода, C1-6 алкила, C1-6 галогеналкила, амино, гидрокси, C1-6 гидроксиалкила и 3-6-членного циклоалкила;
n равно 0 или 1;
s равно 0 или 1; и
t равно 0 или 1.
2. Соединение формулы (I) по п. 1, представляющее собой соединение формулы (IA)
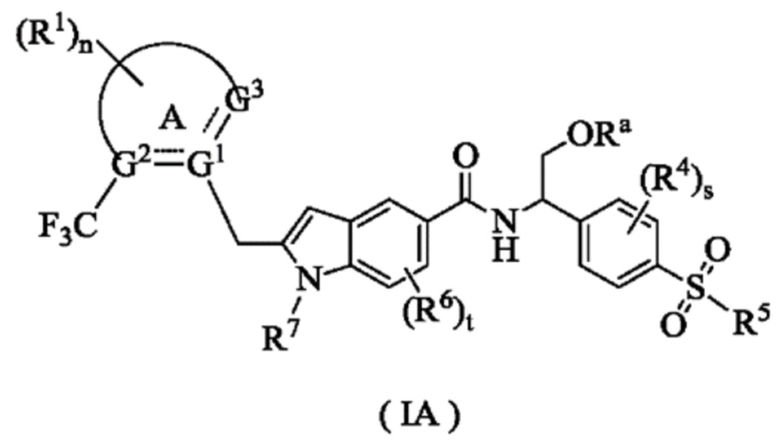
где
Ra представляет собой водород или C1-6 алкил;
 , кольцо A, G1-G3, R1, R4-R7, n, s и t являются такими, как определено в п. 1.
, кольцо A, G1-G3, R1, R4-R7, n, s и t являются такими, как определено в п. 1.
3. Соединение формулы (I) по п. 1 или 2, представляющее собой соединение формулы (II)

где
 , кольцо A, G1-G3, R1, R4-R7, n, s и t являются такими, как определено в п. 1.
, кольцо A, G1-G3, R1, R4-R7, n, s и t являются такими, как определено в п. 1.
4. Соединение формулы (I) по любому из пп. 1-3, представляющее собой соединение формулы (III)

где
R1, R5-R7, n и t являются такими, как определено в п. 1.
5. Соединение формулы (I) по любому из пп. 1-4, представляющее собой соединение формулы (IV)

где
R1, R5-R7, n и t являются такими, как определено в п. 1.
6. Соединение формулы (I) по любому из пп. 1-5, где R1 выбран из группы, состоящей из водорода, галогена и C1-6 алкила.
7. Соединение формулы (I) по любому из пп. 1-6, где R5 выбран из группы, состоящей из C1-6 алкила, NR10R11 и 3-6-членного циклоалкила, где каждый из C1-6 алкила и 3-6-членного циклоалкила независимо необязательно замещен одним или более заместителями, выбранными из группы, состоящей из гидрокси, галогена, C1-6 алкила, амино, 3-6-членного циклоалкила и 3-6-членного гетероциклила, при этом R10 и R11 являются такими, как определено в п. 1.
8. Соединение формулы (I) по любому из пп. 1-7, где R6 представляет собой водород или галоген.
9. Соединение формулы (I) по любому из пп. 1-8, где R7 выбран из группы, состоящей из C1-6 алкила, 3-6-членного циклоалкила и C1-6 галогеналкила.
10. Соединение формулы (I) по любому из пп. 1-9, выбранное из группы, состоящей из
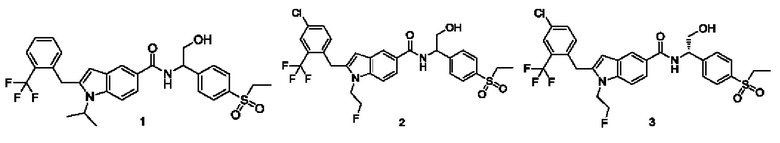



и

11. Применение соединения формулы (I) по любому из пп. 1-10 для получения агониста ретиноидного орфанного рецептора (ROR).
12. Применение соединения формулы (I) по любому из пп. 1-10 в качестве агониста ретиноидного орфанного рецептора (ROR) в получении лекарственного средства для предупреждения и/или лечения опухоли или рака.
13. Применение соединения формулы (I) по любому из пп. 1-10 в комбинации с анти-PD-1-антителом в получении лекарственного средства для предупреждения и/или лечения опухоли или рака.
| WO 2017024018 A1, 09.02.2017 | |||
| WO 2015159233 A1, 22.10.2015 | |||
| RU 2015108898 A, 10.10.2016 | |||
| RU 2015114772 A, 10.11.2016. |
Авторы
Даты
2021-02-10—Публикация
2018-07-05—Подача