РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка заявляет приоритет предварительной заявки США №62/671225, поданной 14 мая 2018 г., предварительной заявки США №62/756504, поданной 6 ноября 2018 г., и предварительной заявки США №62/756515, поданной 6 ноября 2018 г. Полное описание вышеуказанных заявок включено в данный документ посредством ссылки.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Данная заявка содержит Перечень последовательностей, который был подан в электронной форме в формате ASCII и в полном объеме включен в данный документ посредством ссылки. Указанная копия ASCII, созданная 14 мая 2019 г., называется 105365-0022_SL.txt и имеет размер 232520 байт.
УРОВЕНЬ ТЕХНИКИ
[1] Развитие зрелых иммунокомпетентных лимфоидных клеток из менее ко имитированных предшественников, их последующие антиген-обусловленные иммунные ответы и супрессия этих и нежелательных аутореактивных ответов сильно зависят от цитокинов и регулируются цитокинами (включая интерлейкин-2 [IL-2], IL-4, IL-7, IL-9, IL-15 и IL-21), которые используют рецепторы в общем семействе γ-цепей (γс) (Rochman et al., 2009), и представителями семейства, включающего IL-12, 18 и 23. IL-2 важен для развития клеток Treg в вилочковой железе и в значительной мере регулирует несколько ключевых аспектов зрелых периферических Treg и антиген-активируемых традиционных Т-клеток. Из-за его выраженной активности в качестве фактора роста Т-клеток in vitro, IL-2 широко изучают, частично вследствие этой активности, предоставляющей потенциальные средства для прямого повышения иммунитета, например, у пациентов со СПИД/ВИЧ, или мишень для антагонизации нежелательных ответов, например, отторжение трансплантата и аутоиммунные заболевания. Хотя in vitro исследования с IL-2 обеспечивают сильное обоснование для этих исследований, понятно, что функция IL-2 in vivo является намного сложнее, как было впервые продемонстрировано на мышах с дефицитом IL-2, у которых наблюдали быстрый летальный аутоиммунный синдром, а не отсутствие иммунитета (Sadlacket al., 1993, 1995). Сходные наблюдения были сделаны позже при индивидуальной абляции гена, кодирующего IL-2Rα (Il2ra) и IL-2Rp (Il2rb) (Suzuki et al., 1995; Willerford et al., 1995).
[2] Данное изобретение относится к кондиционально активным и/или нацеленным цитокинам для применения в лечении рака и других заболеваний, зависимых от повышающей или понижающей регуляции иммунитета. Например, противоопухолевая активность некоторых цитокинов хорошо известна и описана, а некоторые цитокины уже используются в терапевтических целях для лечения людей. Такие цитокины, как интерлейкин-2 (IL-2) и интерферон α (IFNα), продемонстрировали положительную противоопухолевую активность у пациентов с разными типами опухолей, такими как метастатическая карцинома почки, волосатоклеточный лейкоз, саркома Капоши, меланома, множественная миелома и т.п. Другие цитокины, такие как IFNβ, фактор некроза опухоли (TNF)α, TNFβ, IL-1, 4, 6, 12, 15 и CSF демонстрировали определенную противоопухолевую активность в случае некоторых типов опухолей и, следовательно, являются предметом дополнительных исследований.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[3] В данном изобретении предложены терапевтические белки, нуклеиновые кислоты, которые кодируют белки, а также композиции и способы применения таких белков и нуклеиновых кислот для лечения заболевания или нарушения, такого как пролиферативное заболевание, опухолевое заболевание, воспалительное заболевание, иммунологическое нарушение, аутоиммунное заболевание, инфекционное заболевание, вирусное заболевание, аллергическая реакция, паразитарная реакция, болезнь «трансплантат против хозяина» и т.п.
[4] Данное изобретение относится к слитым белкам, которые являются кондиционально активными вариантами IL-12. В одном аспекте полноразмерные полипептиды по данному изобретению обладают сниженной или минимальной активностью активации рецептора IL-12 даже если они содержат функциональный полипептид IL-12. После активации, например, посредством расщепления линкера, который соединяет блокирующий фрагмент, например, стерически блокирующий полипептид, в последовательности с активным цитокином, IL-12 или его функциональным фрагментом или мутеином, может связывать свой рецептор и осуществлять сигнализацию. При необходимости полноразмерные полипептиды могут содержать блокирующий полипептидный фрагмент, который также обеспечивает дополнительные преимущественные свойства. Например, полноразмерный полипептид может блокирующий полипептидный фрагмент, который также продлевает сывороточное время полужизни и/или нацеливает полноразмерный полипептид на необходимый сайт цитокиновой активности. В альтернативном варианте полноразмерные слитые полипептиды могут содержать элемент продления сывороточного времени полужизни и/или нацеливающий домен, которые отличаются от блокирующего полипептидного фрагмента. Предпочтительно слитый белок содержит по меньшей мере один элемент, способный продлевать время полужизни в циркуляции in vivo. Предпочтительно этот элемент ферментативно удаляется в необходимом месте организма (например, за счет расщепления протеазой в микроокружении опухоли) с восстановлением фармакокинетических свойств нагрузочной молекулы (например, IL2 или IFNα), по существу сходных с нагрузочной молекулой природного происхождения. Слитые белки нацелены на необходимые клетку или ткань. Как описано в данном документе, нацеливание осуществляется посредством действия блокирующего полипептидного фрагмента, который также связывается с необходимой мишенью, или посредством нацеливающего домена. Домен, который распознает целевой антиген на предпочтительной мишени (например, опухолеспецифический антиген), может быть присоединен к цитокину посредством расщепляемого или нерасщепляемого линкера. При присоединении посредством нерасщепляемого линкера нацеливающий домен может дополнительно способствовать удержанию цитокина в опухоли и может считаться удерживающим доменом. Нацеливающий домен не обязательно должен быть напрямую связан с нагрузочной молекулой и может быть напрямую связан с другим элементом слитого белка. В особенности это справедливо для случаев, когда нацеливающий домен присоединен посредством расщепляемого линкера.
[5] В одном аспекте предложен слитый белок, содержащий полипептид IL-12 или его функциональный фрагмент или мутеин и блокирующий фрагмент, например, стерически блокирующий домен. Блокирующий фрагмент слит с полипептидом IL-12 напрямую или посредством линкера и может быть отделен от полипептида IL-12 путем расщепления (например, опосредованного протеазой расщепления) слитого полипептида в или вблизи сайта слияния, или линкера, или в блокирующем фрагменте. Например, если полипептид IL-12 слит с блокирующим фрагментом посредством линкера, который содержит сайт расщепления протеазой, полипептид IL-12 отделяется от блокирующего фрагмента и может связывать свой рецептор после опосредованного протеазой расщепления линкера. Линкер сконструирован с возможностью расщепления в сайте необходимой цитокиновой активности, например, в микроокружении опухоли, с избежанием нецелевой цитокиновой активности и снижением общей токсичности цитокиновой терапии.
[6] Блокирующий фрагмент также может выполнять функцию элемента продления сывороточного времени полужизни. В некоторых вариантах осуществления слитый полипептид дополнительно содержит отдельный элемент продления сывороточного времени полужизни. В некоторых вариантах осуществления слитый полипептид дополнительно содержит нацеливающий домен. В различных вариантах осуществления элемент продления сывороточного времени полужизни представляет собой водорастворимый полипептид, такой как необязательно разветвленный или многозвеньевой полиэтиленгликоль (ПЭГ), полноразмерный человеческий сывороточный альбумин (ЧСА) или фрагмент, который сохраняет связывание с FcRn, Fc-фрагмент или нанотело, которое напрямую связывается с FcRn или с человеческим сывороточным альбумином.
[7] Помимо элементов продления сывороточного времени полужизни описанные в данном документе фармацевтические композиции предпочтительно содержат по меньшей мере один или более нацеливающих доменов, которые связываются с одним или более целевыми антигенами или одной или более областями на одном целевом антигене. В данном документе подразумевается, что полипептидная конструкция по изобретению расщепляется, например в патологическом микроокружении или в крови субъекта в сайте расщепления протеазой и что нацеливающий(ие) домен(ы) будет(ут) связываться с целевым антигеном на целевой клетке. По меньшей мере один целевой антиген вовлечен в процесс заболевания, нарушения или патологического состояния и/или связан с ним. Типовые антигены включают связанные с пролиферативным заболеванием, опухолевым заболеванием, воспалительным заболеванием, иммунологическим нарушением, аутоиммунным заболеванием, инфекционным заболеванием, вирусным заболеванием, аллергической реакцией, паразитарной реакцией, болезнью «трансплантат против хозяина» или болезнью «хозяин против трансплантата».
[8] В некоторых вариантах осуществления целевой антиген представляет собой молекулу клеточной поверхности, такую как белок, липид или полисахарид. В некоторых вариантах осуществления целевой антиген находится на опухолевой клетке, вирусно инфицированной клетке, бактериально инфицированной клетке, поврежденной красной кровяной клетке, клетке артериального тромбоцита или клетке фиброзной ткани. [9] В некоторых случаях целевые антигены экспрессируются на поверхности патологической клетки или ткани, например, опухолевой или раковой клетки. Целевый антигены в случае опухолей включают, но не ограничиваются этим, белок активации фибробластов альфа (FAPa), гликопротеин трофобластов (5Т4), опухолеассоциированный трансдуктор кальциевого сигнала 2 (Trop2), EDB фибронектина (EDB-FN), домен ЕШВ фибронектина, CGS-2, ЕрСАМ, EGFR, HER-2, HER-3, c-Met, FOLR1 и СЕА. Описанные в данном документе фармацевтические композиции также содержат белки, содержащие два антигенсвязывающих домена, которые связываются с двумя разными целевыми антигенами, которые, согласно известным данным, экспрессируются в патологической клетке или ткани. Примеры пар антигенсвязывающих доменов включают, но не ограничиваются этим, EGFR/CEA, ЕрСАМ/СЕА и HER-2/HER-3.
[10] В некоторых вариантах осуществления нацеливающие полипептиды независимо содержат scFv, VH-домен, VL-домен, не принадлежащий Ig домен или лиганд, который специфически связывается с целевым антигеном. В некоторых вариантах осуществления нацеливающие полипептиды специфически связываются с молекулой клеточной поверхности. В некоторых вариантах осуществления нацеливающие полипептиды специфически связываются с опухолевым антигеном. В некоторых вариантах осуществления нацеливающие полипептиды специфически и независимо связываются с опухолевым антигеном, выбранным по меньшей мере из одного из ЕрСАМ, EGFR, HER-2, HER-3, cMet, СЕА и FOLR1. В некоторых вариантах осуществления нацеливающие полипептиды специфически и независимо связываются с двумя разными антигенами, причем по меньшей мере один из антигенов представляет собой опухолевый антиген, выбранный из ЕрСАМ, EGFR, HER-2, HER-3, cMet, СЕА и FOLR1. В некоторых вариантах осуществления нацеливающий полипептид служит в качестве удерживающего домена и присоединен к цитокину посредством нерасщепляемого линкера.
[11] Как описано в данном документе, цитокин-блокирующий фрагмент может связываться с цитокином и тем самым блокировать активацию когнатного рецептора цитокина.
[12] Данное описание также относится к нуклеиновым кислотам, например, ДНК, РНК, мРНК, которые кодируют описанные в данном документе кондиционально активные белки, а также векторам и клеткам-хозяевам, которые содержат такие нуклеиновые кислоты.
[13] Данное описание также относится к фармацевтическим композициям, которые содержат кондиционально активный белок, нуклеиновую кислоту, которая кодирует кондиционально активный белок, и векторы и клетки-хозяев, которые содержат такие нуклеиновые кислоты. Как правило, фармацевтическая композиция содержит один или более физиологически приемлемых носителей и/или эксципиентов.
[14] Данное описание также относится к терапевтическим способам, которые включают введение нуждающемуся в этом субъекту эффективного количества кондиционально активного белка, нуклеиновой кислоты, которая кодирует кондиционально активный белок, векторов или клеток-хозяев, которые содержат такую нуклеиновую кислоту, и фармацевтических композиций любых вышеприведенных компонентов. Как правило, субъект имеет или подвержен риску развития пролиферативного заболевания, опухолевого заболевания, воспалительного заболевания, иммунологического нарушения, аутоиммунного заболевания, инфекционного заболевания, вирусного заболевания, аллергической реакции, паразитарной реакции, болезни «трансплантат против хозяина» или болезни «хозяин против трансплантата».
[15] Данное описание также относится к применению кондиционально активного белка, нуклеиновой кислоты, которая кодирует кондиционально активный белок, векторов или клеток-хозяев, которые содержат такую нуклеиновую кислоту, и фармацевтических композиций любых вышеприведенных компонентов для лечения нуждающегося в этом субъекта. Как правило, субъект имеет или подвержен риску развития пролиферативного заболевания, опухолевого заболевания, воспалительного заболевания, иммунологического нарушения, аутоиммунного заболевания, инфекционного заболевания, вирусного заболевания, аллергической реакции, паразитарной реакции, болезни «трансплантат против хозяина» или болезни «хозяин против трансплантата».
[16] Данное описание также относится к применению кондиционально активного белка, нуклеиновой кислоты, которая кодирует кондиционально активный белок, векторов или клеток-хозяев, которые содержат такую нуклеиновую кислоту, для производства лекарственного средства для лечения заболевания, такого как пролиферативное заболевание, опухолевое заболевание, воспалительное заболевание, иммунологическое нарушение, аутоиммунное заболевание, инфекционное заболевание, вирусное заболевание, аллергическая реакция, паразитарная реакция, болезнь «трансплантат против хозяина» или болезнь «хозяин против трансплантата».
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[17] Фиг. 1а схематически иллюстрирует активируемый протеазой цитокин или хемокин, который содержит блокирующий фрагмент. Блокирующий фрагмент необязательно может выполнять функцию домена продления сывороточного времени полужизни. С левой стороны стрелки на изображении показано, что цитокин связан с блокирующим фрагментом посредством расщепляемого протеазой линкера, что блокирует его возможность связываться с рецептором. С правой стороны стрелки на изображении показано, что в воспалительном или опухолевом окружении расщепление протеазой происходит в сайте расщепления протеазой на линкере с высвобождением блокирующего фрагмента и обеспечением возможности цитокина связываться с рецептором.
[18] Фиг. 1b схематически иллюстрирует активируемый протеазой цитокин или хемокин, в котором ЧСА (блокирующий фрагмент) напрямую связан с представляющим интерес цитокином или хемокином, а сайт расщепления протеазой находится между ЧСА и представляющим интерес цитокином или хемокином. С левой стороны стрелки на изображении показано, что цитокин связан с блокирующим фрагментом посредством расщепляемого протеазой линкера, что блокирует его возможность связываться с рецептором. С правой стороны стрелки на изображении показано, что в воспалительном или опухолевом окружении расщепление протеазой происходит в сайте расщепления протеазой на линкере с высвобождением блокирующего фрагмента и обеспечением возможности цитокина связываться с рецептором.
[19] Фиг. 1 с схематически иллюстрирует активируемый протеазой цитокин или хемокин, в котором более одного ЧСА (блокирующий фрагмент) напрямую связано с представляющей интерес молекулой. При необходимости один или более ЧСА могут быть связаны с цитокином или хемокином посредством линкера, такого как линкер, который содержит сайт расщепления протеазой. С левой стороны стрелки на изображении показано, что цитокин связан с блокирующим фрагментом посредством расщепляемого протеазой линкера, что блокирует его возможность связываться с рецептором. С правой стороны стрелки на изображении показано, что в воспалительном или опухолевом окружении расщепление протеазой происходит в сайте расщепления протеазой на линкере с высвобождением блокирующего фрагмента и обеспечением возможности цитокина связываться с рецептором. Теперь цитокин имеет аналогичные ФК-свойства по сравнению с нативным цитокином (например, имеет короткое время полужизни).
[20] Фиг. 1d схематически иллюстрирует активируемый протеазой цитокин или хемокин, содержащий более одного цитокина, одного типа или разного типа, каждый из которых связан со связывающим доменом посредством расщепляемого протеазой линкера. С левой стороны стрелки на изображении показано, что цитокин связан с блокирующим фрагментом посредством расщепляемого протеазой линкера, что блокирует его возможность связываться с рецептором. С правой стороны стрелки на изображении показано, что в воспалительном или опухолевом окружении расщепление протеазой происходит в сайте расщепления протеазой на линкере с высвобождением блокирующего фрагмента и обеспечением возможности цитокина связываться с рецептором.
[21] Фиг. 2 схематически иллюстрирует активируемый протеазой цитокин или хемокин, содержащий полипептид цитокина или хемокина, блокирующий фрагмент и домен для продления сывороточного времени полужизни, связанный посредством по меньшей мере одного расщепляемого протеазой линкера. С левой стороны стрелки на изображении показано, что цитокин связан с блокирующим фрагментом посредством расщепляемых протеазой линкеров, что блокирует его возможность связываться с рецептором. Также он связан с отдельным элементом для продления времени полужизни, который продлевает время полужизни в сыворотке. С правой стороны стрелки на изображении показано, что в воспалительном или опухолевом окружении расщепление протеазой происходит в сайте расщепления протеазой на линкере с высвобождением элемента для продления времени полужизни и блокирующего фрагмента и обеспечением возможности цитокина связываться с рецептором. Теперь цитокин имеет аналогичные ФК-свойства по сравнению с нативным цитокином (например, короткое время полужизни).
[22] Фиг. 3 схематически иллюстрирует активируемый протеазой цитокин или хемокин, содержащий полипептид цитокина или хемокина, блокирующий фрагмент и нацеливающий домен, связанный посредством по меньшей мере одного расщепляемого протеазой линкера. С левой стороны стрелки на изображении показано, что цитокин связан с блокирующим фрагментом и нацеливающим доменом посредством расщепляемого протеазой линкера, что блокирует его возможность связываться с рецептором. С правой стороны стрелки на изображении показано, что в воспалительном или опухолевом окружении расщепление протеазой происходит в сайте расщепления протеазой на линкере с высвобождением нацеливающего домена и блокирующего фрагмента и обеспечением возможности цитокина связываться с рецептором.
[23] Фиг. 4а схематически иллюстрирует активируемый протеазой цитокин или хемокин, содержащий полипептид цитокина или хемокина, блокирующий фрагмент, нацеливающий домен и домен для продления сывороточного времени полужизни, связанный посредством по меньшей мере одного расщепляемого протеазой линкера, причем полипептид цитокина и нацеливающий домен связаны посредством расщепляемого протеазой линкера. С левой стороны стрелки на изображении показано, что цитокин связан с нацеливающим доменом, блокирующим фрагментом и элементом для продления времени полужизни посредством расщепляемого(ых) протеазой линкера(ов), что блокирует его возможность связываться с рецептором. С правой стороны стрелки на изображении показано, что в воспалительном или опухолевом окружении расщепление протеазой происходит в сайте расщепления протеазой на линкере(ах) с высвобождением элемента для продления времени полужизни, нацеливающего домена и блокирующего фрагмента и обеспечением возможности цитокина связываться с рецептором. Теперь цитокин имеет аналогичные ФК-свойства по сравнению с нативным цитокином (например, короткое время полужизни).
[24] Фиг. 4b схематически иллюстрирует активируемый протеазой цитокин или хемокин, содержащий полипептид цитокина или хемокина, блокирующий фрагмент, нацеливающий домен и домен для продления сывороточного времени полужизни, связанный посредством по меньшей мере одного расщепляемого протеазой линкера. С левой стороны стрелки на изображении показано, что цитокин связан с нацеливающим доменом, блокирующим фрагментом и элементом для продления времени полужизни посредством расщепляемого(ых) протеазой линкера(ов), что блокирует его возможность связываться со своим рецептором. С правой стороны стрелки на изображении показано, что в воспалительном или опухолевом окружении расщепление протеазой происходит в сайте расщепления протеазой на линкере(ах) с высвобождением элемента для продления времени полужизни и блокирующего фрагмента и обеспечением возможности цитокина связываться с рецептором. Нацеливающий фрагмент остается связанным, удерживая цитокин в микроокружении опухоли. Теперь цитокин имеет аналогичные ФК-свойства по сравнению с нативным цитокином (например, короткое время полужизни).
[25] Фиг. 5 схематически иллюстрирует структуру вариабельного домена молекулы иммуноглобулина. Вариабельные домены как легкой, так и тяжелой цепей иммуноглобулина содержат гипервариабельные петли или определяющие комплементарность области (CDR). Три CDR V-домена (CDR1, CDR2, CDR3) образуют кластер в одном конце бета-бочки. CDR представляют собой петли, которые соединяют бета-цепи В-С, С'-С'' и F-G укладки цепи иммуноглобулина, причем нижние петли, которые соединяют бета-цепи АВ, СС', С'-D и E-F укладки цепи иммуноглобулина, и верхняя петля, которая соединяет цепи D-E укладки цепи иммуноглобулина, представляют собой отличные от CDR петли.
[26] Фиг. 6 схематически иллюстрирует активируемый протеазой цитокин или хемокин, содержащий полипептид цитокина или хемокина, блокирующий фрагмент, который представляет собой домен, связывающий сывороточный альбумин (например, dAb), и расщепляемый протеазой линкер. В проиллюстрированном примере отличные от CDR петли в домене, связывающем сывороточный альбумин (например, sdAb), могут образовывать сайт связывания для цитокина IL-12. В этом примере сайт связывания для сывороточного альбумина может быть образован CDR домена, связывающего сывороточный альбумин.
[27] На Фиг. 7 представлен график, иллюстрирующий результаты анализа IL-12 с репортером HEK-Blue, проведенного для слитых белков IL-12 р40 человека/р35 мыши до и после расщепления протеазой. Анализ проводили на основании количественной оценки активности секретируемой щелочной фосфатазы (SEAP), используя реагент QUANTI-Blue® (InvivoGen). Результаты подтверждают, что слитые белки IL12 являются активными.
[28] На Фиг. 8a-8f представлен ряд графиков, иллюстрирующих результаты анализа с HEK-Blue для четырех слитых белков IL-12 до и после расщепления ММР9. Анализ проводили на основании количественной оценки активности секретируемой щелочной фосфатазы (SEAP), используя реагент QUANTI-Blue (InvivoGen). Данные показывают большую активность для расщепленного IL12, чем для полного слитого белка. Исследуемыми конструкциями были АСР06 (Фиг. 8а), АСР07 (Фиг. 8 с), АСР08 (Фиг. 8b), АСР09 (Фиг. 8d), ACP10 (Фиг. 8е), АСР11 (Фиг. 8f).
[29] На Фиг. 9 проиллюстрированы результаты анализа расщепления белка. Каждый белок АСР11 разделяли в геле ДСН-ПААГ в расщепленной и нерасщепленной форме. Как можно видеть в геле, расщепление было полным.
[30] На Фиг. 10 приведена схема, которая схематически иллюстрирует неограничивающий пример индуцибельного белка цитокина, на которой конструкция активируется после расщепления протеазой линкера, подсоединенного между двумя субъединицами цитокина.
[31] На Фиг. 11a-11d представлены графики, иллюстрирующие результаты анализа с HEK-Blue, проведенного для слитых белков IL-12 р40 человека/р35 мыши до и после расщепления протеазой. Анализ проводили. Результаты подтверждают, что слитые белки IL12 являются активными. Каждый анализ пролиферации проводили с ЧСА или без ЧСА. На Фиг. 12 приведены два графика, иллюстрирующие активность типовых слитых белков IFNγ (АСР51 и АСР52), расщепленных протеазой ММР9, в сравнении с активностью нерасщепленных слитых белков, с использованием анализа с репортером В16. Каждый слитый белок содержит ЧСА-связывающую часть и нацеливающий на опухоль домен.
[32] На Фиг. 13 приведен ряд графиков, иллюстрирующих, что расщепленные полипептиды IL-12 являются активными в анализе с репортером HEKBlue. На верхней левой панели показано, что мышиный IL-12 является активным в этом анализе (положительный контроль). На нижней левой панели и нижней правой панели показана активность нерасщепленных (квадраты) и расщепленных (треугольники) белков соответственно. Значения ЕС50 для каждого из них приведены во вставленной таблице на верхней правой панели.
[33] На Фиг. 14 проиллюстрирован объем опухолей в динамике по времени у мышей, обработанных 17,5 мкг АСР11 (квадраты), 175 мкг АСР11 (треугольники), 525 мкг АСР11 (круги) и 2 мкг АСР04 в качестве контроля (пунктирная линия, квадраты) и 10 мкг АСР04 (пунктирная линия, ромбы). Один носитель показан большими незакрашенными кругами. Данные показывают, что у мышей, обработанных как АСР11, так и АСР04 (слитый белок IL12 р40 человека/р35 мыши), объем опухолей снижался со временем дозозависимым образом.
[34] На Фиг. 15 приведен ряд «спагетти»-графиков, иллюстрирующих объем опухолей в динамике по времени в мышиной модели с ксенотрансплантатом опухоли у мышей, обработанных одним носителем (вверху слева), 2 мкг АСР04 (вверху посередине), 10 мкг АСР04 (вверху справа), 17,5 мкг АСР11 (внизу слева), 175 мкг АСР11 (внизу посередине) и 525 мкг АСР11 (внизу справа). Каждая линия представляет одну мышь.
[35] Фиг. 16-21 иллюстрируют свойства полипептидов TriTac, которые служат примерами расщепляемых протеазами слитых белков.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[36] В данном документе раскрыты способы и композиции для создания и применения конструкций, содержащих индуцибельные IL-12. IL-12 является сильным иммунным агонистом, что позволяет рассматривать его в качестве перспективного терапевтического агента для онкологии. Однако было доказано, что IL-12 и другие цитокины имеют очень узкое терапевтическое окно. Цитокины, такие как IL-12, имеют короткое сывороточное время полужизни и также считаются очень сильнодействующими. Следовательно, терапевтическое введение цитокинов приводит к нежелательным системным эффектами и токсичности. Это усугублялось необходимостью введения больших количеств цитокинов с целью достижения необходимых уровней цитокинов в предполагаемом месте действия цитокинов (например, опухоли). К сожалению, вследствие биологии цитокинов и невозможности эффективно направлять и контролировать их активность, цитокины не оправдали надежд в отношении клинических преимуществ в лечении опухолей.
[37] В данном документе описаны слитые белки, для которых разрешены проблемы токсичности и короткого времени полужизни, которые сильно ограничивали клиническое применение IL-12 в онкологии. Эти слитые белки содержат полипептиды IL-12, которые обладают активностью агонистов рецепторов. Но в контексте слитого белка активность агониста рецептора IL-12 ослаблена и продлено время полужизни в циркуляции. Эти слитые белки содержат сайты расщепления протеазами, которые расщепляются протеазами, ассоциированными с необходимым сайтом активности IL-12 (например, опухолью), и как правило, обогащенными или избирательно присутствующими в сайте необходимой активности. Таким образом, слитые белки преимущественно (или избирательно) и эффективно расщепляются в необходимом сайте активности с ограничением активности цитокина по существу необходимым сайтом активности, таким как микроокружение опухоли. Расщепление протеазой в необходимом сайте активности, таком как микроокружение опухоли, приводит к высвобождению такой формы IL-12 из слитого белка, которая является намного более активной в качестве агониста рецептора IL-12, чем слитый белок (как правило, по меньшей мере в около 100 раз более активной, чем слитый белок). Форма IL-12, которая высвобождается после расщепления слитого белка, как правило, имеет короткое время полужизни, которое часто по существу сходно со временем полужизни IL-12 природного происхождения, дополнительно ограничивая активность IL-12 микроокружением опухоли. Даже несмотря на то, что время полужизни слитого белка увеличено, токсичность сильно снижена или устранена, поскольку находящийся в циркуляции слитый белок ослаблен, а активный цитокин нацелен на микроокружение опухоли. Описанные в данном документе слитые белки впервые делают возможным введение эффективной терапевтической дозы цитокина для лечения опухолей, при этом активность цитокина по существу ограничена микроокружением опухоли, а нежелательные системные эффекты и токсичность цитокина сильно снижены или устранены.
[38] Если не указано иное, подразумевается, что все термины, присущие данной области техники, сокращения и другая научная терминология, используемые в данном документе, имеют значения, известные специалистам в области техники, к которой относится это изобретение. В некоторых случаях в данном документе приведены определения терминов, имеющих известное значение, в целях ясности и/или для удобства приведения ссылок, причем включение в данный документ таких определений не обязательно следует воспринимать, как представляющее разницу с тем, что в целом известно в данной области техники. Способы и процедуры, описанные или на которые приведены ссылки в данном документе, в целом хорошо известны и применимы специалистами в данной области техники с использованием традиционных методик, например таких, как широко используемые методики молекулярного клонирования, описанные в Sambrook et al., Molecular Cloning: A Laboratory Manual 4th ed. (2012) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY. В соответствующих случаях процедуры, включающие применение коммерчески доступных наборов и реагентов, в целом проводят в соответствии с определенными производителями протоколами и условиями, если не указано иное.
[39] «Цитокин» является хорошо известным термином в данной области техники, который относится к любому из класса иммунорегуляторных белков (таких как интерлейкины или интерфероны), которые секретируются клетками, в особенности иммунной системы, и которые являются модуляторами иммунной системы. Полипептиды цитокинов, которые можно использовать в описанных в данном документе слитых белках, включают, но не ограничиваются этим, трансформирующие факторы роста, такие как TGF-α и TGF-β (например, TGF-бета1, TGF-бета2, TGF-бета3); интерфероны, такие как интерферон-α, интерферон-β, интерферон-у, интерферон-каппа и интерферон-омега; интерлейкины, такие как IL-1, IL-1α, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, IL-21 и IL-25; факторы некроза опухолей, такие как фактор некроза опухолей альфа и лимфотоксин; хемокины (например, хемокин с мотивом С-Х-С 10 (CXCL10), CCL19, CCL20, CCL21) и гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CS), а также фрагменты таких полипептидов, которые активируют когнатные рецепторы для цитокина (т.е. функциональные фрагменты вышеприведенных молекул). «Хемокин» является термином в данной области техники, который относится к любому из семейства малых цитокинов со способностью индуцировать направленный хемотаксис в находящихся по близости чувствительных клетках.
[40] Хорошо известно, что хемокины имеют короткое время полужизни, которое часто составляет всего несколько минут или часов. Даже формы цитокинов, которые имеют измененные аминокислотные последовательности, предназначенные для продления сывороточного времени полужизни с сохранением активности агонистов рецепторов, как правило, также имеют короткое сывороточное время полужизни. В контексте данного документа «цитокин с коротким временем полужизни» относится к цитокину, который характеризуется по существу краткой циркуляцией в сыворотке субъекта, например, сывороточным временем полужизни, которое составляет менее 10, менее 15, менее 30, менее 60, менее 90, менее 120, менее 240 или менее 480 минут В контексте данного документа цитокин с коротким временем полужизни включает цитокины, последовательности которых не были модифицированы с целью достижения большего чем обычно времени полужизни в организме субъекта, и полипептиды, которые имеют измененные аминокислотные последовательности, предназначенные для продления сывороточного времени полужизни с сохранением активности агонистов рецепторов. Это последний случай не подразумевает добавление гетерологичных белковых доменов, таких как истинный элемент для продления времени полужизни, такой как сывороточный альбумин. Как правило, полипептид цитокина с коротким временем полужизни, такой как полипептид IL-12, имеет сывороточное время полужизни, сравнимое с IL-12 природного происхождения, например, в пределах 5-кратного, 4-кратного, 3-кратного или 2-кратного превышения времени IL-12 природного происхождения.
[41] «Сортазы» представляют собой транспозазы, которые модифицируют белки путем распознавания и расщепления карбокси-концевого сигнала сортировки, включенного в целевой белок или пептид или присоединенного в его конце. Сортаза А катализирует расщепление мотива LPXTG (SEQ ID NO: 80) (где X представляет собой любую стандартную аминокислоту) между остатками Thr и Gly в целевом белке с временным присоединением остатка Thr к активному сайту остатка Cys в ферменте с образованием промежуточного соединения фермент-тиоацил. Для завершения транспептидации и создания конъюгата пептид-мономер биомолекула с N-концевой нуклеофильной группой, как правило, олигоглициновым мотивом, атакует промежуточное соединение, вытесняя сортазу А и соединяя две молекулы.
[42] В контексте данного документа «стерический блокатор» относится полипептиду или полипептидному фрагменту, который может быть ковалентно связан с полипептидом цитокина, напрямую или ненапрямую посредством других фрагментов, таких как линкеры, например, в форме химерного полипептида (слитого белка), но никаким иным образом ковалентно не связывается с полипептидом цитокина. Стерический блокатор может связываться с полипептидом цитокина нековалентно, например, посредством электростатического, гидрофобного, ионного или водородного связывания. Стерический блокатор, как правило, ингибирует или блокирует активность цитокинового фрагмента вследствие своей близости к цитокиновому фрагменту и сопоставимого размера.
[43] В контексте данного документа и описания «элемент для продления времени полужизни» является частью химерного полипептида, которая повышает сывороточное время полужизни и улучшает ФК, например, путем изменения его размера (например, чтобы превышать порог почечной фильтрации), формы, гидродинамического радиуса, заряда или параметров всасывания, биораспределения, метаболизма и элиминации.
[44] В контексте данного документа термины «активируемый», «активировать», «индуцировать» и «индуцибельный» относятся к способности белка, т.е. цитокина, который является частью слитого белка, связывать его рецептор и осуществлять активность после расщепления дополнительных элементов из слитого белка.
[45] В контексте данного документа «плазмиды» или «вирусные векторы» представляют собой агенты, которые переносят описанные нуклеиновые кислоты в клетку, не разрушая ее, и содержат промотор, обеспечивающий экспрессию молекулы нуклеиновой кислоты и/или полипептида в клетках, в которые они были доставлены.
[46] В контексте данного документа термины «пептид», «полипептид» или «белок» используются в широком смысле для обозначения двух или более аминокислот, связанных пептидной связью. Белок, пептид и полипептид также взаимозаменяемо используются в данном документе для обозначения аминокислотных последовательностей. Следует понимать, что термин полипептид в контексте данного документа не предполагает конкретные размер или число аминокислот, составляющих молекулу, и что пептид по изобретению может содержать до нескольких аминокислотных остатков или более.
[47] В контексте данного документа «субъект» может представлять собой позвоночное, конкретнее млекопитающее (например, человека, лошадь, кошку, собаку, корову, свинью, овцу, козу, мышь, кролика, крысу и морскую свинку), птиц, рептилий, амфибий, рыб и любое другое животное. Этот термин не предполагает конкретный возрастили пол. Такими образом, подразумевается, что охвачены взрослые и новорожденные субъекты мужского и женского пола.
[48] В контексте данного документа термины «пациент» или «субъект» могут использоваться взаимозаменяемо и могут относиться к субъекту с заболеванием или нарушением (например, раком). Термин пациент или субъект включает людей и ветеринарных субъектов.
[49] В контексте данного документа термины «лечение» или «лечить» относятся к способу снижения действия заболевания или патологического состояния или симптома заболевания или патологического состояния. Таким образом, в описанном способе лечение может относиться к по меньшей мере около 10%, по меньшей мере около 20%, по меньшей мере около 30%, по меньшей мере около 40%, по меньшей мере около 50%, по меньшей мере около 60%, по меньшей мере около 70%, по меньшей мере около 80%, по меньшей мере около 90% или по существу полному снижению тяжести установленного заболевания или патологического состояния или симптома заболевания или патологического состояния. Например, способ лечения заболевания считается лечением, если наблюдается 10% снижение одного или более симптомов заболевания у субъекта по сравнению с контролем. Таким образом, снижение может составлять 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100% или любой процент снижения между 10% и 100% по сравнению с нативными или контрольными уровнями. Следует понимать, что лечение не обязательно относится к излечению или полному устранению заболевания, патологического состояния или симптомов заболевания или патологического состояния.
[50] В контексте данного документа термины «предотвращать» и «предотвращение» заболевания или нарушения относятся к действию, например, введению химерного полипептида или последовательности нуклеиновой кислоты, кодирующей химерный полипептид, которое происходит до или приблизительно в то же время, когда субъект начинает демонстрировать один или более симптомов заболевания или нарушения, которое ингибирует или замедляет начало или усугубление одного или более симптомов заболевания или нарушения.
[51] В контексте данного документа употребление терминов «снижение», «уменьшение» или «ингибирование» включает изменение, составляющее по меньшей мере около 10%, по меньшей мере около 20%, по меньшей мере около 30%, по меньшей мере около 40%, по меньшей мере около 50%, по меньшей мере около 60%, по меньшей мере около 70%, по меньшей мере около 80%, по меньшей мере около 90% или более по сравнению с подходящим контрольным уровнем. Такие термины могут включать, но необязательно включают полное устранение функции или свойства, такого как активность агониста.
[52] «Ослабленный агонист рецептора цитокина» относится к агонисту рецептора цитокина, который обладает сниженной активностью агониста рецептора по сравнению с агонистом рецептора цитокина природного происхождения. Ослабленный агонист рецептора цитокина может обладать по меньшей мере в около 10Х, по меньшей мере в около 50Х, по меньшей мере в около 100Х, по меньшей мере в около 250Х, по меньшей мере в около 500Х, по меньшей мере в около 1000Х или еще меньшей активностью агониста по сравнению с агонистом рецептора природного происхождения. Если слитый белок, который содержит полипептид цитокина, описанный в данном документе, описан как «ослабленный» или имеющий «ослабленную активность», это означает, что слитый белок представляет собой ослабленный агонист рецептора цитокина.
[53] «Интактный слитый белок» представляет собой слитый белок, в котором не было удалено ни одного домена, например, путем расщепления протеазой. Домен может быть удален расщеплением протеазой или посредством другой ферментативной активности, но когда слитый белок является «интактным», это еще не произошло.
[54] В контексте данного документа «фрагмент» относится к части молекулы, которая имеет отличную функцию в этой молекуле, и эта функция может осуществляться этим фрагментом в контексте другой молекулы. Фрагмент может представлять собой химическое соединение с конкретной функцией или часть биологической молекулы с конкретной функцией. Например, «блокирующий фрагмент» в слитом белке представляет собой часть слитого белка, которая способна блокировать активность некоторой части или всего слитого белка. Это может быть белковый домен, такой как сывороточный альбумин.
[55] В целом, терапевтическое применение цитокинов сильно ограничено их системной токсичностью. Например, TNF изначально изучали вследствие его способности индуцировать геморрагический некроз некоторых опухолей и вследствие его in vitro цитотоксического эффекта на разные опухолевые линии, но впоследствии было доказано, что он обладает сильной противовоспалительной активностью, что может, в случае патологической сверхвыработки, представлять опасность для человеческого организма. Поскольку системная токсичность является фундаментальной проблемой для применения фармакологически активных количеств цитокинов людьми, на сегодня на апробации находятся новые производные и терапевтические стратегии, целью которых является снижение токсических эффектов этого класса биологических эффекторов с сохранением их терапевтической эффективности.
[56] Интерлейкин-12 (IL-12) представляет собой дисульфид-связанный гетеродимер из двух отдельно кодируемых субъединиц (р35 и р40), которые ковалентно связаны с образованием так называемой биоактивной гетеродимерной (р70) молекулы (Lieschke et al., 1997; Jana et al., 2014). Отдельно от образования гетеродимеров (IL-12 и IL-23), субъединица р40 также секретируется в виде мономера (р40) и гомодимера (р402). В данной области техники известно, что синтез гетеродимера в виде одной цепи с линкером, соединяющим субъединицу р35 с р40 сохраняет полную биологическую активность гетеродимера. IL-12 играет важную роль в раннем воспалительном ответе на инфекцию и в генерации клеток Th1, которые поддерживают клеточноопосредованный иммунитет. Было обнаружено, что сверхвыработка IL-12 может быть опасной для хозяина, поскольку она связана с патогенезом ряда аутоиммунных воспалительных заболеваний (например, МС, артрит, диабет 1 типа).
[57] Рецептор IL-12 (IL-12R) представляет собой гетер од имерный комплекс, состоящий из цепей IL-12Rβ1 и IL-12Rβ2, экспрессируемых на поверхности активированных Т-клеток и естественных клеток-киллеров (Trinchieri et al., 2003). Цепь IL-12Rβ1 связывается с субъединицей IL-12p40, тогда как IL-12p35 вместе с IL-12Rβ32 обеспечивает возможность внутриклеточной сигнализации (Benson et al., 2011). Передача сигнала через IL-12R индуцирует фосфорилирование киназы Janus (Jak2) и тирозинкиназы (Tyk2), которые фосфорилируют и активируют переносчик сигнала и активатор транскрипции (STAT)1, STAT3, STAT4 и STAT5. Специфические клеточные эффекты IL-12 связаны, главным образом, с активацией STAT4. IL-12 индуцирует выработку естественными клетками-киллерами и Т-клетками цитокинов, в частности, интерферона (IFN)γ, которые опосредуют многие виды провоспалительной активности IL-12, включая дифференцировку CD4+ Т-клеток в направлении фенотипа Th1 (Montepaone et al., 2014).
[58] IL-12 представляет собой плейотропный цитокин, действие которого создает взаимосвязь между врожденным и адаптивным иммунитетом. IL-12 впервые был описан как фактор, секретируемый из РМА-индуцированных EBV-трансформированных линий В-клеток. На основании своего действия IL-12 был определен как фактор созревания цитотоксических лимфоцитов и стимулирующий фактор естественных клеток-киллеров. Благодаря соединению врожденного и адаптивного иммунитета и сильной стимуляции выработки IFNγ цитокин, координирующий природных механизмы противораковой защиты, IL-12 казался идеальным кандидатом для иммунотерапии опухолей у людей. Однако тяжелые побочные эффекты, связанные с системным введением IL-12 в клинических исследованиях, и очень узкий терапевтический индекс этого цитокина существенно умерили энтузиазм в отношении применения этого цитокина раковыми пациентами (Lasek et. al., 2014). Подходы к терапии IL-12, в которых доставка этого цитокина нацелена на опухоль, что может уменьшить некоторые из предшествующих проблем терапии IL-12, на данный момент находятся на стадии клинических исследований для лечения рака.
[59] Данное изобретение разработано для разрешения недостатков прямой терапии IL-12 и терапии с применением других цитокинов, например, за счет применения блокирующих цитокины фрагментов, например, стерических блокирующих полипептидов, полипептидов для продления сывороточного времени полужизни, нацеливающих полипептидов, соединительных полипептидов, содержащих расщепляемые протеазами линкеры, и их комбинаций. Цитокины, включая интерлейкины (например, IL-2, IL-7, IL-12, IL-15, IL-18, IL-21 IL-23), интерфероны (IFN, включая IFN-альфа, IFN-бета и IFN-гамма), факторы некроза опухолей (например, TNF-альфа, лимфотоксин), трансформирующие факторы роста (например, TGF-бета1, TGF-бета2, TGF-бета3), хемокины (хемокин с мотивом С-Х-С 10 (CXCL10), CCL19, CCL20, CCL21) и гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CS) являются очень эффективными при введении пациентам. В контексте данного документа «хемокин» означает семейство малых цитокинов со способностью индуцировать направленный хемотаксис в находящихся по близости чувствительных клетках. Цитокины могут обеспечить мощную терапию, но она сопровождается нежелательными явлениями, которые трудно контролировать клинически и которые ограничивали клиническое применение цитокинов. Данное изобретение относится к новым формам цитокинов, которые можно применять на пациентах, со сниженными или устраненными нежелательными явлениями. В частности, данное изобретение относится к фармацевтическим композициям, содержащим химерные полипептиды (слитые белки), нуклеиновые кислоты, кодирующие слитые белки, и фармацевтическим составам вышеприведенного, которые содержат цитокины или активные фрагменты или мутеины цитокинов, которые имеют сниженную активность активации рецептора цитокина по сравнению с соответствующими цитокином. При этом в выбранных условиях или в выбранном биологическом окружении химерные полипептиды активируют свои когнатные рецепторы, часто с такой же или большей эффективностью, чем соответствующий цитокин природного происхождения. Как описано в данном документе, этого, как правило, достигают, используя блокирующий цитокин фрагмент, который блокирует или ингибирует рецептор-активирующую функцию цитокина, его активный фрагмент или мутеин, в общих условиях, но не в выбранных условиях, таких как существуют в необходимом сайте цитокиновой активности (например, сайте воспаления или опухоли).
[60] Химерные полипептиды и нуклеиновые кислоты, кодирующие химерные полипептиды, можно создавать, используя любой подходящий способ. Например, нуклеиновые кислоты, кодирующие химерный полипептид, можно создавать, используя технологии рекомбинантных ДНК, синтетической химии или комбинации этих способов, и экспрессировать в подходящей экспрессионной системе, например, в клетках СНО. Аналогично, химерные полипептиды можно создавать, например, путем экспрессии подходящей нуклеиновой кислоты, используя синтетические или полусинтетические химические способы и т.п. В некоторых вариантах осуществления блокирующий фрагмент может быть присоединен к полипептиду цитокина посредством опосредованной сортазой конъюгации. «Сортазы» представляют собой транспозазы, которые модифицируют белки путем распознавания и расщепления карбокси-концевого сигнала сортировки, включенного в целевой белок или пептид или присоединенного в его конце. Сортаза А катализирует расщепление мотива LPXTG (SEQ ID NO: 80) (где X представляет собой любую стандартную аминокислоту) между остатками Thr и Gly в целевом белке с временным присоединением остатка Thr к активному сайту остатка Cys в ферменте с образованием промежуточного соединения фермент-тиоацил. Для завершения транспептидации и создания конъюгата пептид-мономер биомолекула с N-концевой нуклеофильной группой, как правило, олигоглициновым мотивом, атакует промежуточное соединение, вытесняя сортазу А и соединяя две молекулы.
[61] Для образования слитого белка цитокин-блокирующий фрагмент полипептид цитокина сначала метят в N-конце полиглициновой последовательностью или, в альтернативном варианте, в С-конце мотивом LPXTG (SEQ ID NO: 80). Блокирующий фрагмент или другой элемент содержит соответствующие присоединенные пептиды, которые служат акцепторными сайтами для меченных полипептидов. Для конъюгации с доменами, несущими акцепторный пептид LPXTG (SEQ ID NO: 80), присоединенный в N-конце, полипептид метят N-концевым полиглициновым участком. Для конъюгации с доменом, несущим полиглициновый пептид, присоединенный в С-конце, полипептид метят в С-конце последовательностью распознавания сортазы LPXTG (SEQ ID NO: 80). Распознавая полиглициновую последовательность и LPXTG (SEQ ID NO: 80), сортаза образует пептидную связь между полимером-пептидом и меченными полипептидами. Реакция с участием сортазы отщепляет остаток глицина в виде промежуточного соединения и происходит при комнатной температуре.
[62] Для устранения или снижения ингибирования, обусловленного блокирующим фрагментом, можно использовать ряд механизмов. Например, фармацевтические композиции могут содержать полипептид IL-12 и блокирующий фрагмент, например, стерический блокирующий фрагмент, причем между полипептидом IL-12 и блокирующим цитокин фрагментом или в пределах блокирующего цитокин фрагмента расположен расщепляемый протеазой линкер, содержащий сайт расщепления протеазой. Если сайт расщепления протеазой расщеплен блокирующий фрагмент может диссоциировать от цитокина, а цитокин после этого может активировать рецептор цитокина. Цитокиновый фрагмент также можно блокировать специфическим блокирующим фрагментом, таким как антитело, которое связывает эпитоп, находящийся на соответствующем цитокине.
[63] Можно использовать любой подходящий линкер. Например, линкер может содержать глицин-глицин, мотив распознавания сортазы или мотив распознавания сортазы и пептидную последовательность (Gly4Ser)n (SEQ ID NO: 81) или (Gly3Ser)n, (SEQ ID NO: 82), где n равно 1, 2, 3, 4 или 5. Как правило, мотив распознавания сортазы содержит пептидную последовательность LPXTG (SEQ ID NO: 80), где X представляет собой любую аминокислоту. В некоторых вариантах осуществления ковалентная связь находится между реактивным остатком лизина, присоединенным к С-концу полипептида цитокина, и реактивным остатком аспарагиновой кислоты, присоединенным к N-концу блокатора или другого домена. В других вариантах осуществления ковалентная связь находится между реактивным остатком аспарагиновой кислоты, присоединенным к N-концу полипептида цитокина, и реактивным остатком лизина, присоединенным к С-концу указанного блокатора или другого домена.
[64] Соответственно, как подробно описано в данном документе, применяемые блокирующие цитокины фрагменты (блокирующие IL-12 фрагменты) могут быть стерическими блокаторами. В контексте данного документа «стерический блокатор» относится полипептиду или полипептидному фрагменту, который может быть ковалентно связан с полипептидом цитокина, напрямую или ненапрямую посредством других фрагментов, таких как линкеры, например, в форме химерного полипептида (слитого белка), но никаким иным образом ковалентно не связывается с полипептидом цитокина. Стерический блокатор может связываться с полипептидом цитокина нековалентно, например, посредством электростатического, гидрофобного, ионного или водородного связывания. Стерический блокатор, как правило, ингибирует или блокирует активность цитокинового фрагмента вследствие своей близости к цитокиновому фрагменту и сопоставимого размера. Стерическое ингибирование цитокина можно устранить путем пространственного отделения цитокинового фрагмента от стерического блокатора, например, путем ферментативного расщепления слитого белка, который содержит стерический блокатор и полипептид цитокина, в сайте между стерическим блокатором и полипептидом цитокина.
[65] Как более подробно описано в данном документе, функция блокирования может быть скомбинирована или обусловлена наличием дополнительных функциональных компонентов в фармацевтической композиции, таких как нацеливающий домен, элемент для продления сывороточного времени полужизни и расщепляемые протеазами связывающие полипептиды. Например, полипептид для продления сывороточного времени полужизни также может быть стерическим блокатором.
[66] Различные элементы гарантируют доставку и активность IL-12 преимущественно в сайте необходимой активности IL-12 и строгое ограничение системного воздействия интерлейкина посредством стратегии блокирования и/или нацеливания, преимущественно в связи со стратегией продления сывороточного времени полужизни. В этой стратегии продления сывороточного времени полужизни блокированная версия интерлейкина циркулирует в течение продленного времени (преимущественно 1-2 или более недель), но активированная версия имеет типичное сывороточное время полужизни интерлейкина.
[67] В некоторых вариантах осуществления этого изобретения элемент для продления времени полужизни связан с интерлейкином посредством линкера, который расщепляется в сайте действия (например, специфическими для воспаления или опухолеспецифическими протеазами) с высвобождением полной активности интерлейкина в необходимом сайте и также отделением его от элемента продления времени полужизни нерасщепленной версии. В таких вариантах осуществления полностью активный и свободный интерлейкин будет иметь очень отличные фармакокинетические (ФК) свойства - время полужизни, составляющее часы, вместо недель. Кроме того, воздействие активного цитокина ограничено местом необходимой цитокиновой активности (например, местом воспаления или опухолью), а системное воздействие активного цитокина и связанные с ним токсичность и побочные эффекты снижены.
[68] Блокирующие фрагменты, дополнительно подробно описанные ниже, также можно использовать, чтобы способствовать связыванию или активации одного или более рецепторов. Это блокирование можно снимать путем удаления блокирующих фрагментов в конкретном окружении, например, за счет протеолитического расщепления линкеры, связывающего один или более блокирующих фрагментов с цитокином.
[69] В другом аспекте можно применять сзходный подход для усовершенствования других цитокинов, в частности, для их применения в качества иммуностимулирующих агентов, например, для лечения рака. Например, в этом аспекте фармакокинетику и/или фармакодинамику цитокина (например, IL-2, IL-7, IL-12, IL-15, IL-18, IL-21 IL-23, IFN-альфа, IFN-бета, IFN-гамма, TNF-альфа, лимфотоксина, TGF-бета1, TGF-бета2, TGF-бета3, GM-CSF, CXCL10, CCL19, CCL20 и CCL21) можно подбирать в расчете на максимальную активацию эффекторных клеток (например, воздействие на Т-клетки, NK-клетки) и/или цитотоксических клеток, стимулирующих иммунный ответ (например, индукция созревания дендритных клеток) в месте необходимой активности, таком как опухоль, но предпочтительно не систематически.
[70] Таким образом, в данном документе предложены фармацевтические композиции, содержащие по меньшей мере один полипептид цитокина, такой как интерлейкины (например, IL-2, IL-7, IL-12, IL-15, IL-18, IL-21, IL-23), интерфероны (IFN, включая IFN-альфа, IFN-бета и IFN-гамма), факторы некроза опухолей (например, TNF-альфа, лимфотоксин), трансформирующие факторы роста (например, TGF-бета1, TGF-бета2, TGF-бета3), хемокины (например, CXCL10, CCL19, CCL20, CCL21) и гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CS) или функциональный фрагмент или мутеин любого из вышеприведенного. Полипептид, как правило, также содержит по меньшей мере одну линкерную аминокислотную последовательность, причем аминокислотная последовательность, в определенных вариантах осуществления, может расщепляться эндогенной протеазой. В одном варианте осуществления линкер содержит аминокислотную последовательность HSSKLQ (SEQ ID NO: 24), GPLGVRG (SEQ ID NO: 83), IPVSLRSG (SEQ ID NO: 84), VPLSLYSG (SEQ ID NO. 85) или SGESPAYYTA (SEQ ID NO: 86). В других вариантах осуществления химерный полипептид дополнительно содержит блокирующий фрагмент, например, стерический блокирующий полипептидный фрагмент, способный блокировать активность полипептида интерлейкина. Блокирующий фрагмент, например, может содержать связывающий домен человеческого сывороточного альбумина (ЧСА) или необязательно разветвленный или многозвеньевой полиэтиленгликоль (ПЭГ). В альтернативном варианте фармацевтическая композиция содержит первый полипептид цитокина или его фрагмент и блокирующий фрагмент, например, стерический блокирующий полипептидный фрагмент, причем блокирующий фрагмент блокирует активность полипептида цитокина или рецептора цитокина и при этом, в определенных вариантах осуществления, блокирующий фрагмент содержит расщепляемый протеазой домен. В некоторых вариантах осуществления блокирование и снижение активности цитокина достигается просто за счет присоединения дополнительных доменов с очень короткими линкерами к N- или С-концу домена интерлейкина. В таких вариантах осуществления предполагается, что блокирование снимается расщеплением протеазой блокирующего фрагмента или короткого линкера, который связывает блокатор с интерлейкином. После отсечения или освобождения домена он более не способен блокировать активность цитокина.
[71] Фармацевтическая композиция, например, химерный полипептид, может содержать два или более цитокинов, которые могут представлять собой полипептид одного и того же цитокина или полипептиды разных цитокинов. Например, два или более типов цитокинов имеют взаимодополняющие функции. В некоторых примерах первым цитокином является IL-12, а вторым цитокином является IL-2. В некоторых вариантах осуществления каждый из полипептидов двух или более разных типов цитокинов обладает активностью, которая модулирует активность полипептидов других цитокинов. В некоторых примерах химерных полипептидов, которые содержат полипептиды двух цитокинов, полипептид первого цитокина активирует Т-клетки, а полипептид второго цитокина не активирует Т-клетки. В некоторых примерах химерных полипептидов, которые содержат полипептиды двух цитокинов, первый цитокин является хемоатрактантом, например, CXCL10, а второй цитокин является активатором иммунных клеток.
[72] Предпочтительно полипептиды IL-12 (включая их функциональные фрагменты), которые входят в состав описанных в данном документе слитых белков, не мутированы и не сконструированы так, чтобы изменять свойства цитокина природного происхождения, включая аффинность и специфичность связывания рецептора или сывороточное время полужизни. При этом изменения в аминокислотной последовательности относительно цитокина природного происхождения (включая дикий тип) являются приемлемыми, например, для облегчения клонирования и обеспечения необходимых уровней экспрессии.
Блокирующий фрагмент
[73] Блокирующий фрагмент может представлять собой любой фрагмент, который ингибирует способность цитокина связывать и/или активировать его рецептор. Блокирующий фрагмент может ингибировать способность цитокина связывать и/или активировать его рецептор за счет стерического блокирования и/или нековалентного связывания цитокина. Примеры подходящих блокирующих фрагментов включают полноразмерный или цитокин-связывающий фрагмент или мутеин когнатного рецептора цитокина. Также можно использовать антитела и их фрагменты, включая поликлональное антитело, рекомбинантное антитело, человеческое антитело, гуманизированное антитело, одноцепочечный вариабельный фрагмент (scFv), однодоменное антитело, такое как вариабельный домен тяжелой цепи (VH), вариабельный домен легкой цепи (VL) и вариабельный домен нанотела верблюжьих (VHH), dAb и т.п., которые связывают цитокин. Другие антигенсвязывающие домены, которые связывают цитокин и которые можно использовать, включают отличные от иммуноглобулинов белки, которые имитируют связывание и/или структуру антитела, такие как антикалины, аффилины, молекулы аффител, аффимеры, аффитины, альфатела, авимеры, дарпины, финомеры, пептиды доменов Куница, монотела и связывающие домены на основе других сконструированных остовов, таких как остовы SpA, GroEL, фибронектина, липокалина и CTLA4. дополнительные примеры подходящих блокирующих полипептидов включают полипептиды, которые стерически ингибируют или блокируют связывание цитокина с его когнатным рецептором. Преимущественно такие фрагменты могут также выполнять функцию элементов продления времени полужизни. Например, пептид, модифицированный путем конъюгации с водорастворимым полимером, таким как ПЭГ, может стерически ингибировать или предотвращать связывание цитокина с его рецептором. Также можно использовать полипептиды или их фрагменты, которые имеют длительное сывороточное время полужизни, такие как сывороточный альбумин (человеческий сывороточный альбумин), Fc иммуноглобулина, трансферрин и т.п., а также фрагменты и мутеины таких полипептидов.
Антитела и антигенсвязывающие домены, которые связываются, например, с белком с длительным сывороточным временем полужизни, таким как ЧСА, иммуноглобулин или трансферрин, или с рецептором, который возвращается на плазматическую мембрану, таким как FcRn или рецептор трансферрина, также могут ингибировать цитокин, в частности при связывании с антигеном. Примеры таких антигенсвязывающих полипептидов включают одноцепочечный вариабельный фрагмент (scFv), однодоменное антитело, такое как вариабельный домен тяжелой цепи (VH), вариабельный домен легкой цепи (VL) и вариабельный домен нанотела верблюжьих (VHH), dAb и т.п. Другие подходящие антигенсвязывающие домены, которые связывают цитокин и которые также можно использовать, включают отличные от иммуноглобулинов белки, которые имитируют связывание и/или структуру антитела, такие как антикалины, аффилины, молекулы аффител, аффимеры, аффитины, альфатела, авимеры, дарпины, финомеры, пептиды доменов Куница, монотела и связывающие домены на основе других сконструированных остовов, таких как остовы SpA, GroEL, фибронектина, липокалина и CTLA4.
[74] В иллюстративных примерах, если IL-12 является цитокином в химерном полипептиде, блокирующий фрагмент может быть полноразмерным рецептором или фрагментом или мутеином первой молекулы рецептора IL-12 (IL-12Rβ1) или бета (IL-12Rβ2), однодоменным анти-1L-2 антителом (dAb) или scFv, анти-IL-12Rβ1 антителом или его фрагментом, анти-IL-12Rβ2 антителом или его фрагментом и анти-HAS dAb или scFv, и т.п.
Дополнительные аспекты данного изобретения
1. Слитый белок, содержащий цитокиновый фрагмент, который функционально связан со связывающим фрагментом, причем связывающий фрагмент содержит отличную от CDR петлю и расщепляемый линкер, при этом связывающий фрагмент способен маскировать связывание цитокина с его рецептором и/или активацию рецептора цитокином.
2. Слитый белок по аспекту 1, отличающийся тем, что связывающий фрагмент представляет собой природный пептид, синтетический пептид, сконструированный остов или сконструированный общий сывороточный белок.
3. Слитый белок по аспекту 1 или 2, отличающийся тем, что сконструированный остов содержит sdAb, scFv, Fab, VHH, домен фибронектина типа III, иммуноглобулин-подобный остов, дарпин, пептид цистинового узла, липокалин, трехспиральный остов, родственный протеину G альбумин-связывающий модуль или остов ДНК-или РНК-аптамера.
4. Слитый белок по любому из аспектов 12, отличающийся тем, что связывающий фрагмент способен связываться с общим сывороточным белком.
5. Слитый белок по любому из аспектов 13, отличающийся тем, что отличная от CDR петля получена из вариабельного домена, константного домена, домена С1-типа, домена С2-типа, I-домена или любых их комбинаций.
6. Слитый белок по любому из аспектов 14, отличающийся тем, что связывающий фрагмент дополнительно содержит определяющие комплементарность области (CDR).
7. Слитый белок по аспекту 5, отличающийся тем, что связывающий фрагмент способен связываться с общим сывороточным белком.
8. Слитый белок по аспекту 6, отличающийся тем, что общий сывороточный белок представляет собой белок, продлевающий время полужизни.
9. Слитый белок по аспекту 6 или 7, отличающийся тем, что общий сывороточный белок представляет собой альбумин, трансферрин, фактор XIII или фибриноген.
10. Слитый белок по любому из аспектов 5-8, отличающийся тем, что петля CDR обеспечивает сайт связывания, специфический в отношении общего сывороточного белка или легкой цепи иммуноглобулина, или любой их комбинации.
11. Слитый белок по любому из аспектов 1-9, отличающийся тем, что расщепляемый линкер содержит сайт расщепления.
12. Слитый белок по аспекту 10, отличающийся тем, что сайт расщепления распознается протеазой.
13. Слитый белок по аспекту 11, отличающийся тем, что связывающий фрагмент связан с цитокином.
14. Слитый белок по аспекту 11, отличающийся тем, что связывающий фрагмент ковалентно связан с цитокином.
15. Слитый белок по аспекту 11 или 14, отличающийся тем, что связывающий фрагмент способен маскировать связывание цитокина с его мишенью посредством специфических межмолекулярных взаимодействий между связывающим фрагментом и цитокином.
16. Слитый белок по любому из аспектов 11-14, отличающийся тем, что отличная от CDR петля обеспечивает сайт связывания, специфический в отношении связывания фрагмента с цитокином.
17. Слитый белок по любому из аспектов 11-15, отличающийся тем, что после расщепления расщепляемого линкера происходит отделение связывающего фрагмента от цитокина, а цитокин связывается со своей мишенью.
18. Слитый белок по любому из аспектов 1-16, отличающийся тем, что цитокин связывается с рецептором цитокина.
19. Слитый белок по аспекту 17, отличающийся тем, что рецептор цитокина включает рецептор цитокина типа I, рецептор IL типа I, рецептор IL типа II, рецептор хемокина или рецептор суперсемейства факторов некроза опухолей.
20. Слитый белок по любому из аспектов 118, отличающийся тем, что расщепляемый линкер содержит сайт расщепления.
21. Слитый белок по аспекту 20, отличающийся тем, что сайт расщепления распознается протеазой.
22. Слитый белок по аспекту 21, отличающийся тем, что сайт расщепления протеазой распознается сериновой протеазой, цистеиновой протеазой, аспартатной протеазой, треониновой протеазой, глутаминовой кислой протеазой, металлопротеиназой, желатиназой или аспарагиновой пептид-лиазой.
23. Слитый белок по аспекту 21, отличающийся тем, что сайт расщепления протеазой распознается катепсином В, катепсином С, катепсином D, катепсином Е, катепсином К, катепсином L, калликреином, hK1, hK10, hK15, плазмином, коллагеназой, коллагеназой типа IV, стромелизином, фактором Ха, химотрипсин-подобной протеазой, трипсин-подобной протеазой, эластазо-подобной протеазой, субтилизин-подобной протеазой, актинидаином, бромелаином, кальпаином, каспазой, каспазой-3, Mir1-CP, папаином, ВИЧ-1-протеазой, ВПГ-протеазой, ЦМВ-протеазой, химозином, ренином, пепсином, матриптазой, легумаином, плазмепсином, непентезином, металлоэкзо пептид аз ой, металлоэндопептидазой, матриксной металлопротеиназой (ММР), ММР1, ММР2, ММР3, ММР8, ММР9, ММР10, ММР11, ММР 12, ММР13, ММР14, ADAM10, ADAM17, ADAM12, активатором плазминогена урокиназного типа (uPA), энтерокиназой, простат-специфической мишенью (PSA, hK3), интерлейкин-1β-конвертирующим ферментом, тромбином, FAP (FAP-α), дипептидилпептидазой или дипептидилпептидазой IV (DPPIV/CD26), трансмембранной сериновой протеазой типа II (TTSP), эластазой нейтрофилов, катепсином G, протеиназой 3, сериновой протеазой нейтрофилов 4, химазой тучных клеток, триптазой тучных клеток, дипептидилпептидазой и дипептидилпептидазой IV (DPPIV/CD26).
24. Кондиционально активный связывающий белок, содержащий связывающий фрагмент (М), который содержит отличную от CDR петлю, цитокин и расщепляемый линкер (L), причем отличная от CDR петля способна связываться с цитокином, а связывающий фрагмент способен ингибировать связыванием цитокина с его рецептором и/или ингибировать активацию рецептора цитокином.
25. Кондиционально активный связывающий белок по аспекту 24, отличающийся тем, что связывающий фрагмент способен связываться с белком, продлевающим время полужизни.
26. Кондиционально активный связывающий белок по аспекту 24 или 25, отличающийся тем, что связывающий фрагмент представляет собой природный пептид, синтетический пептид, сконструированный остов или сконструированный общий сывороточный белок.
27. Кондиционально активный связывающий белок по аспекту 26, отличающийся тем, что сконструированный остов содержит sdAb, scFv, Fab, VHH, домен фибронектина типа III, иммуноглобулин-подобный остов, дарпин, пептид цистинового узла, липокалин, трехспиральный остов, родственный протеину G альбумин-связывающий модуль или остов ДНК- или РНК-аптамера.
28. Кондиционально активный связывающий по любому из аспектов 24-27, отличающийся тем, что отличная от CDR петля получена из вариабельного домена, константного домена, домена С1-типа, домена С2-типа, I-домена или любых их комбинаций.
29. Кондиционально активный связывающий белок по любому из аспектов 24-28, отличающийся тем, что связывающий фрагмент дополнительно содержит определяющие комплементарность области (CDR).
30. Кондиционально активный связывающий белок по любому из аспектов 24-29, отличающийся тем, что связывающий фрагмент содержит сайт связывания, специфический в отношении общего сывороточного белка.
31. Кондиционально активный связывающий белок по аспекту 30, отличающийся тем, что общий сывороточный белок представляет собой альбумин, трансферрин, фактор XIII или фибриноген.
32. Кондиционально активный связывающий белок по любому из аспектов 29-31, отличающийся тем, что CDR обеспечивают сайт связывания, специфический в отношении общего сывороточного белка или легкой цепи иммуноглобулина, или любой их комбинации.
33. Кондиционально активный связывающий белок по любому из аспектов 29-32, отличающийся тем, что связывающий фрагмент способен маскировать связывание цитокина с его мишенью посредством специфических межмолекулярных взаимодействий между связывающим фрагментом и цитокином.
34. Кондиционально активный связывающий белок по любому из аспектов 29-33, отличающийся тем, что отличная от CDR петля обеспечивает сайт связывания, специфический в отношении связывания связывающего фрагмента с цитокином.
35. Кондиционально активный связывающий белок по любому из аспектов 24-34, отличающийся тем, что цитокин связывается с рецептором цитокина.
36. Кондиционально активный связывающий белок по аспекту 35, отличающийся тем, что рецептор цитокина включает рецептор цитокина типа I, рецептор IL типа I, рецептор IL типа II, рецептор хемокина или рецептор суперсемейства факторов некроза опухолей.
37. Кондиционально активный связывающий белок по любому из аспектов 24-36, отличающийся тем, что расщепляемый линкер содержит сайт расщепления.
38. Кондиционально активный связывающий белок по аспекту 37, отличающийся тем, что сайт расщепления распознается протеазой.
39. Кондиционально активный связывающий белок по аспекту 38, отличающийся тем, что сайт расщепления протеазой распознается сериновой протеазой, цистеиновой протеазой, аспартатной протеазой, треониновой протеазой, глутаминовой кислой протеазой, металлопротеиназой, желатиназой или аспарагиновой пептид-лиазой.
40. Кондиционально активный связывающий белок по аспекту 38, отличающийся тем, что сайт расщепления протеазой распознается катепсином В, катепсином С, катепсином D, катепсином Е, катепсином K, катепсином L, калликреином, hK1, hK10, hK15, плазмином, коллагеназой, коллагеназой типа IV, стромелизином, фактором Ха, химотрипсин-подобной протеазой, трипсин-подобной протеазой, эластазо-подобной протеазой, субтилизин-подобной протеазой, актинидаином, бромелаином, кальпаином, каспазой, каспазой-3, Mir1-CP, папаином, ВИЧ-1-протеазой, ВПГ-протеазой, ЦМВ-протеазой, химозином, ренином, пепсином, матриптазой, легумаином, плазмепсином, непентезином, металлоэкзопептидазой, металлоэндопептидазой, матриксной металлопротеиназой (ММР), ММР1, ММР2, ММР3, ММР8, ММР9, ММР10, ММР11, ММР12, ММР13, ММР14, ADAM10, ADAM17, ADAM12, активатором плазминогена урокиназного типа (uPA), энтерокиназой, простат-специфической мишенью (PSA, hK3), интерлейкин-1β-конвертирующим ферментом, тромбином, FAP (FAP-α), дипептидилпептидазой или дипептидилпептидазой IV (DPPIV/CD26), трансмембранной сериновой протеазой типа II (TTSP), эластазой нейтрофилов, катепсином G, протеиназой 3, сериновой протеазой нейтрофилов 4, химазой тучных клеток, триптазой тучных клеток, дипептидилпептидазой и дипептидилпептидазой IV (DPPIV/CD26).
41. Кондиционально активный связывающий белок по аспекту 24, дополнительно содержащий домен для продления времени полужизни, связанный со связывающим фрагментом, причем домен для продления времени полужизни обеспечивает связывающий белок переключателем безопасности, и при этом после расщепления линкера происходит активация связывающего белка путем отделения связывающего фрагмента и домена для продления времени полужизни от цитокина и, таким образом, происходит отделение связывающего белка от переключателя безопасности.
42. Кондиционально активный связывающий белок по аспекту 41, отличающийся тем, расщепление линкера происходит в микроокружении опухоли.
43. Кондиционально активный связывающий белок, содержащий связывающий фрагмент, который связывает цитокин посредством отличной от CDR петли в связывающем фрагменте, причем связывающий фрагмент дополнительно связан с доменом для продления времени полужизни и содержит расщепляемый линкер, причем связывающий фрагмент имеет продленное время полужизни до его активации путем расщепления линкера, а после активации происходит отделение связывающего фрагмента и домена для продления времени полужизни от цитокина, и связывающий белок в активированном состоянии не обладает продленным временем полужизни.
44. Кондиционально активный связывающий белок по аспекту 43, отличающийся тем, расщепление линкера происходит в микроокружении опухоли.
Элементы для продления времени полужизни in vivo
[75] Предпочтительно химерные полипептиды содержат элемент для продления времени полужизни in vivo. Повышение времени полужизни терапевтических молекул in vivo с природно короткими временами полужизни позволяет реализовывать более приемлемые и поддающиеся коррекции схемы введения доз, не жертвуя эффективностью. В контексте данного документа «элемент для продления времени полужизни» является частью химерного полипептида, которая повышает время полужизни in vivo и улучшает ФК, например, путем изменения его размера (например, чтобы превышать порог почечной фильтрации), формы, гидродинамического радиуса, заряда или параметров всасывания, биораспределения, метаболизма и элиминации. Типовым способом улучшения ФК полипептида является экспрессия в полипептидной цепи элемента, который связывается с рецепторами, которые подвергаются рециклингу в плазматическую мембрану клеток, а не деградации в лизосомах, такими как FcRn-рецептор на эндотелиальных клетках и рецептор трансферрина. Три типа белков, например, человеческие IgG, ЧСА (или его фрагменты) и трансферрин присутствуют в человеческой сыворотке в течение намного большего времени, чем можно было спрогнозировать по их размеру, что является функцией их способности связываться с рецепторами, которые подвергаются рециклингу, а не деградации в лизосоме. Эти белки или их фрагменты, которые сохраняют свойство связывания FcRn, обычно связывают с другими полипептидами для продления их сывороточного времени полужизни. В одном варианте осуществления элементом для продления времени полужизни является связывающий домен человеческого сывороточного альбумина (ЧСА). ЧАС (SEQ ID NO: 2) также может быть напрямую связан с фармацевтическими композициями или связан посредством короткого линкера. Также можно использовать фрагменты ЧСА. ЧСА и его фрагменту могут осуществлять функцию как блокирующего фрагмента, так и элемента для продления времени полужизни. Человеческие IgG также могут осуществлять сходную функцию.
[76] Элементом продления сывороточного времени полужизни также может быть антигенсвязывающий полипептид, который связывается с белком с большим сывороточным временем полужизни, таким как сывороточный альбумин, трансферрин и т.п. Примеры таких полипептидов включают антитела и их фрагменты, включая поликлональное антитело, рекомбинантное антитело, человеческое антитело, гуманизированное антитело, одноцепочечный вариабельный фрагмент (scFv), однодоменное антитело, такое как вариабельный домен тяжелой цепи (VH), вариабельный домен легкой цепи (VL) и вариабельный домен нанотела верблюжьих (VHH), dAb и т.п. Другие подходящие антигенсвязывающие домены включают отличные от иммуноглобулинов белки, которые имитируют связывание и/или структуру антитела, такие как антикалины, аффилины, молекулы аффител, аффимеры, аффитины, альфатела, авимеры, дарпины, финомеры, пептиды доменов Куница, монотела и связывающие домены на основе других сконструированных остовов, таких как остовы SpA, GroEL, фибронектина, липокалина и CTLA4. Дополнительные примеры антигенсвязывающих полипептидов включают лиганд для необходимого рецептора, лиганд-связывающую часть рецептора, лектин и пептиды, которые связываются или ассоциируют с одним или более целевыми антигенами.
[77] Некоторые предпочтительные элементы для продления сывороточного времени полужизни представляют собой полипептиды, которые содержат определяющие комплементарность области (CDR) и, необязательно, отличные от CDR петли. Преимущественно такие элементы для продления сывороточного времени полужизни могут продлевать сывороточное время полужизни цитокина, а также осуществлять функцию ингибиторов цитокина (например, посредством стерического блокирования, нековалентного взаимодействия или их комбинации) и/или нацеливающих доменов. В некоторых случаях элементы для продления сывороточного времени полужизни представляют собой домены, полученные из молекулы иммуноглобулина (Ig-молекулы) или сконструированные белковые каркасы, которые имитируют структуру и/или активность связывания антитела. Ig может принадлежать любому классу или подклассу (IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM и т.д.). Полипептидная цепь Ig-молекулы свернута в ряд параллельных бета-цепей, соединенных петлями. В вариабельной области три петли составляют «определяющие комплементарность области» (CDR), которые определяют антигенсвязывающую специфичность молекулы. Молекула IgG содержит по меньшей мере две тяжелые (Н) цепи и две легкие (L) цепи, связанные между собой дисульфидными связями, или их антигенсвязывающий фрагмент. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно называемой в данном документе VH) и константной области тяжелой цепи. Константная область тяжелой цепи содержит три домена - CH1, СН2 и СН3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно называемой в данном документе VL) и константной области легкой цепи. Константная область легкой цепи содержит один домен - CL. VH- и VL-области можно дополнительно разделить на области гипервариабельности, называемые определяющими комплементарность областями (CDR), которые являются гипервариабельными по последовательности и/или участвуют в распознавании антигена, и/или обычно образуют структурно определенные петли, которые перемежаются более консервативными областями, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. В некоторых вариантах осуществления этого изобретения по меньшей мере некоторые или все аминокислотные последовательности FR1, FR2, FR3 и FR4 являются частью «отличной от CDR петли» связывающих фрагментов, описанных в данном документе. Как проиллюстрировано на Фиг. 5, вариабельный домен молекулы иммуноглобулина имеет несколько бета-цепей, которые расположены двумя складками. Вариабельные домены как легкой, так и тяжелой цепей иммуноглобулина содержат гипервариабельные петли или определяющие комплементарность области (CDR). Три CDR V-домена (CDR1, CDR2, CDR3) образуют кластер в одном конце бета-бочки. CDR представляют собой петли, которые соединяют бета-цепи В-С, С'-С'' и F-G укладки цепи иммуноглобулина, причем нижние петли, которые соединяют бета-цепи АВ, СС', С''-D и Е-F укладки цепи иммуноглобулина, и верхняя петля, которая соединяет цепи D-E укладки цепи иммуноглобулина, представляют собой отличные от CDR петли. В некоторых вариантах осуществления этого изобретения по меньшей мере некоторые аминокислотные остатки константного домена, CH1, СН2 и СН3, являются частью «отличной от CDR петли» связывающих фрагментов, описанных в данном документе. Отличные от CDR петли, в некоторых вариантах осуществления, включают одну или более из петель АВ, CD, EF и DE домена С1-типа Ig или Ig-подобной молекулы; петель АВ, СС, EF, FG, ВС и ЕС домена С2-типа Ig или Ig-подобной молекулы; петель DE, BD, GF, А(А1А2)В и EF домена 1(промежуточного)-типа Ig или Ig-подобной молекулы.
[78] В пределах вариабельного домена считается, что CDR отвечают за распознавание и связывание антигена, тогда как остатки FR считаются каркасом для CDR. Однако в определенных случаях некоторые из остатков FR играют важную роль в распознавании и связывании антигена. Каркасные области, которые влияют на связывание антигена, делятся на две категории. К первой относятся остатки FR, которые контактируют с антигеном и, таким образом, являются частью сайта связывания, а некоторые из этих остатков в последовательности расположены близко к CDR. Другими остатками являются те, которые расположены далеко от CDR в последовательности, но находятся в непосредственной близости к ним в 3-D структуре молекулы, например, в петле в тяжелой цепи. Домен для продления сывороточного времени полужизни (например, домен, который содержит CDR) может содержать по меньшей мере одну отличную от CDR петлю. В некоторых вариантах осуществления отличная от CDR петля обеспечивает сайт связывания для связывания с цитокином, общим сывороточным белком или другим целевым антигеном.
[79] Элемент для продления сывороточного времени полужизни помимо того, что содержит CDR, дополнительно или в качестве альтернативы содержит отличную от CDR петлю. В некоторых вариантах осуществления отличная от CDR петля модифицирована с целью создания антигенсвязывающего сайте, специфического в отношении необходимого целевого антигена, такого как общий сывороточный белок, такой как альбумин, или в отношении цитокинового фрагмента или другого целевого антигена. Подразумевается, что для модификации отличной от CDR петли можно использовать различные способы, например, сайт-направленный мутагенез, случайный мутагенез, вставку по меньшей мере одной кислоты, которая является чужеродной для аминокислотной последовательности отличной от CDR петли, аминокислотную замену. В некоторых примерах пептид антигена вставлен в отличную от CDR петлю. В некоторых примерах антигенный пептид замещает отличную от CDR петлю. Модификацией для создания антигенсвязывающего сайта в некоторых случаях является только одна отличная от CDR петля. В других случаях модифицировано более одной отличной от CDR петли. Например, модификация может присутствовать в любой из отличных от CDR петель, проиллюстрированных на Фиг. 5, т.е. АВ, СС', С''D, EF и D-E. В некоторых случаях модификация находится в петле DE. В других случаях модификации находятся во всех четырех петлях из АВ, СС', С''-D, E-F.
[80] В некоторых примерах элемент для продления сывороточного времени полужизни имеет двойную специфичность связывания и содержит CDR, которые специфически связывают общие сывороточные белки, такие как сывороточный альбумин, и отличные от CDR петли, которые специфически связывают и блокируют цитокиновый домен. В других примерах элемент для продления сывороточного времени полужизни содержит CDR, которые специфически связывают целевой антиген, такой как цитокиновый домен или другой целевой антиген, и отличные от CDR петли, которые специфически связывают общий сывороточный белок, такой как сывороточный альбумин. Предпочтительно элемент для продления сывороточного времени полужизни ингибирует связывание цитокинового домена с когнатным рецептором цитокина, например, посредством стерического затруднения, посредством специфических межмолекулярных взаимодействий или их комбинации.
[81] В некоторых вариантах осуществления элемент для продления сывороточного времени полужизни напрямую нековалентно связывается с цитокином и ингибирует его активность.
[82] В определенных примерах связывающий фрагмент связывается с цитокином посредством одной или более из петель АВ, СС', С'' D и E-F и связывается с общим сывороточным белком, таким как альбумин, посредством одной или более из петель ВС, С'С'' и FG. В определенных примерах связывающий фрагмент связывается с общим сывороточным белком, таким как альбумин, посредством петли АВ, СС', С'' D или EF и связывается с цитокином посредством петли ВС, С'С'' или FG. В определенных примерах связывающий фрагмент связывается с общим сывороточным белком, таким как альбумин, посредством петли АВ, СС', С'' D и EF и связан с цитокином посредством петли ВС, СС" и FG. В определенных примерах связывающий фрагмент связывается с общим сывороточным белком, таким как альбумин, посредством одной или более из петель АВ, СС', С''D и E-F и связывается с цитокином посредством одной или более из петель ВС, С'С'' и FG.
[83] Связывающие фрагменты представляют собой любые виды полипептидов. Например, в определенных случаях связывающие фрагменты представляют собой природные пептиды, синтетические пептиды или фибронектиновые остовы, или сконструированные общие сывороточные белки. Общие сывороточные белки включают, например, альбумин, фибриноген или глобулин. В некоторых вариантах осуществления связывающие фрагменты представляют собой сконструированные остовы. Сконструированные остовы включают, например, sdAb, scFv, Fab, VHH, домен фибронектина типа III, иммуноглобулин-подобный остов (предложенный в Halaby et al., 1999. Prot Eng 12(7):563-571), дарпин, пептид цистинового узла, липокалин, трехспиральный остов, родственный протеину G альбумин-связывающий модуль или остов ДНК-или РНК-аптамера.
[84] В некоторых случаях элемент для продления сывороточного времени полужизни связывается с цитокиновым доменом посредством отличных от CDR петель, а цитокиновый домен дополнительно соединен с нацеливающим доменом, как описано в данном документе. В некоторых случаях элемент для продления сывороточного времени полужизни содержит сайт связывания для общего сывороточного белка. В некоторых вариантах осуществления CDR обеспечивают сайт связывания для общего сывороточного белка. В некоторых примерах общий сывороточный белок представляет собой глобулин, альбумин, трансферрин, IgG1, IgG2, IgG4, IgG3, мономер IgA, фактор XIII, фибриноген, IgE или пентамерный IgM. В некоторых вариантах осуществления CDR образует сайт связывания для легкой цепи иммуноглобулина, такой как свободная легкая цепь IgK или свободная легкая цепь Igλ.
[85] Один типовой кондиционально активный белок представлен на Фиг. 6. В проиллюстрированном примере отличные от CDR петли в домене, связывающем сывороточный альбумин (например, dAb), могут образовывать сайт для цитокина IL-12. В этом примере сайт связывания для сывороточного альбумина может быть образован CDR домена, связывающего сывороточный альбумин.
[86] Элемент для продления сывороточного времени полужизни может представлять собой любой тип связывающего домена, включая, но не ограничиваясь этим, домены из моноклонального антитела, поликлонального антитела, рекомбинантного антитела, человеческого антитела, гуманизированного антитела. В некоторых вариантах осуществления связывающий фрагмент представляет собой одноцепочечный вариабельный фрагмент (scFv), однодоменное антитело, такое как вариабельный домен тяжелой цепи (VH), вариабельный домен легкой цепи (VL) и вариабельный домен нанотела верблюжьих (VHH). В других вариантах осуществления связывающие фрагменты представляют собой отличные от Ig связывающие домены, т.е. миметики антител, такие как антикалины, аффилины, молекулы аффител, аффимеры, аффитины, альфатела, авимеры, дарпины, финомеры, пептиды доменов Куница и монотела.
[87] В других вариантах осуществления элемент для продления сывороточного времени полужизни может представлять собой водорастворимый полимер или пептид, который конъюгирован к водорастворимому полимеру, такому как ПЭГ. В контексте данного документе «ПЭГ», «полиэтиленгликоль» и «поли(этиленгликоль» являются взаимозаменяемыми терминами и охватывают любой непептидный водорастворимый поли(этиленоксид). Термин «ПЭГ» также обозначает полимер, который содержит большинство, то есть более 50%, повторяющихся субъединиц -ОСН2СН2-. Что до конкретных форм, то ПЭГ может иметь любое число или любой ряд значений молекулярной массы, а также структур или геометрий, например, «разветвленную», «линейную», «раздвоенную», «многофункциональную» и т.п., что более подробно описано ниже. ПЭГ не ограничен конкретной структурой и может быть линейным (например, кэпированным в конце, например, алкокси-ПЭГ или бифункциональный ПЭГ), разветвленным или многозвеньевым (например, раздвоенный ПЭГ или ПЭГ, присоединенный к полиоловой сердцевине), иметь дендритную (или в форме звезды) архитектуру, в каждом случае с одной или более разлагаемыми связями или без них. Кроме того, внутренняя структура ПЭГ может иметь организацию, соответствующую любому числу повторяющихся схем, и может быть выбрана из группы, состоящей из гомополимера, чередующегося сополимера, случайного сополимера, блок-сополимера, чередующегося триполимера, случайного триполимера и блок-триполимера. ПЭГ можно конъюгировать к полипептидам и пептидам любым подходящим способом. Как правило, реакционноспособное производное ПЭГ, такое как N-гидроксисукцинимидиловый сложный эфир ПЭГ, приводят в реакцию с пептидом или полипептидом, который содержит аминокислоты с боковой цепью, которая содержит функциональную группу амина, сульфгидрила, карбоновой кислоты или гидроксила, такие как цистеин, лизин, аспарагин, глутамин, треонин, тирозин, серии, аспарагиновая кислота и глутаминовая кислота.
Нацеливающие домены и домены удержания
[88] В определенных применениях может существовать необходимость минимизировать количество времени нахождения конструкции в необходимом месте в организме. Это можно обеспечить путем включения в химерный полипептид (слитый белок) одного дополнительного домена, который влиял бы на его перемещение в организме. Например, химерные нуклеиновые кислоты могут кодировать домен, который направляет полипептид к месту в организме, например, к опухолевым клеткам или месту воспаления; этот домен называется «нацеливающим доменом», и/или кодировать домен, который удерживает полипептид в определенном месте в организме, например, в опухолевых клетках или месте воспаления; этот домен называется «доменом удержания». В некоторых вариантах осуществления домен может функционировать сразу как нацеливающий домен и домен удержания. В некоторых вариантах осуществления нацеливающий домен и/или домен удержания специфичны к богатому протеазами окружению. В некоторых вариантах осуществления кодируемые нацеливающий домен и/или домен удержания специфичны в отношении регуляторных Т-клеток (Treg), например, нацелены на рецепторы CCR4 или CD39. Другие подходящие нацеливающий домен и/или домен удержания включают те, которые имеют когнатный лиганд, характеризующийся сверхэкспрессией в воспаленной ткани, например, рецептор IL-1 или рецептор IL-6. В других вариантах осуществления подходящие нацеливающий домен и/или домен удержания включают те, которые имеют когнатный лиганд, характеризующийся сверхэкспрессией в опухолевой ткани, например, Epcam, СЕА или мезотелин. В некоторых вариантах осуществления нацеливающий домен связан с интерлейкином посредством линкера, который расщепляется в месте действия (например, воспалительными или специфическими для рака протеазами) с высвобождением полной активности интерлейкина в необходимом месте. В некоторых вариантах осуществления нацеливающий домен и/или домен удержания связаны с интерлейкином посредством линкера, который не расщепляется в месте действия (например, воспалительными или специфическими для рака протеазами), что приводит к удержанию цитокина в необходимом месте.
[89] Предпочтительные антигены в некоторых случаях экспрессируются на поверхности патологической клетки или ткани, например, опухолевой или раковой клетки. Антигены, применимые для нацеливания на опухоль и удержания в ней, включают, но не ограничиваются этим, активирующий фибробласты белок альфа (FAPa), гликопротеин трофобластов (5Т4), опухолеассоциированный трансдуктор кальциевого сигнала 2 (Trop2), EDB фибронектина (EDB-FN), FOLR1, домен EIIIB фибронектина, ЕрСАМ, EGFR, HER-2, HER-3, c-Met, FOLR1 и СЕА. Описанные в данном документе фармацевтические композиции также содержат белки, содержащие два нацеливающих домена и/или домена удержания, которые связываются с двумя разными целевыми антигенами, которые, согласно известным данным, экспрессируются в патологической клетке или ткани. Примеры пар антигенсвязывающих доменов включают, но не ограничиваются этим, EGFR/CEA, ЕрСАМ/СЕА и HER-2/HER-3.
[90] Подходящие нацеливающие домены и/или домены удержания включают антигенсвязывающие домены, такие как антитела и их фрагменты, включая поликлональное антитело, рекомбинантное антитело, человеческое антитело, гуманизированное антитело, одноцепочечный вариабельный фрагмент (scFv), однодоменное антитело, такое как вариабельный домен тяжелой цепи (VH), вариабельный домен легкой цепи (VL) и вариабельный домен нанотела верблюжьих (VHH), dAb и т.п. Другие подходящие антигенсвязывающие домены включают отличные от иммуноглобулинов белки, которые имитируют связывание и/или структуру антитела, такие как антикалины, аффилины, молекулы аффител, аффимеры, аффитины, альфатела, авимеры, дарпины, финомеры, пептиды доменов Куница, монотела и связывающие домены на основе других сконструированных остовов, таких как остовы SpA, GroEL, фибронектина, липокалина и CTLA4. Дополнительные примеры антигенсвязывающих полипептидов включают лиганд для необходимого рецептора, лиганд-связывающую часть рецептора, лектин и пептиды, которые связываются или ассоциируют с одним или более целевыми антигенами.
[91] В некоторых вариантах осуществления нацеливающие домены и/или домены удержания специфически связываются с молекулой клеточной поверхности. В некоторых вариантах осуществления нацеливающие домены и/или домены удержания специфически связываются с опухолевым антигеном. В некоторых вариантах осуществления нацеливающие полипептиды специфически и независимо связываются с опухолевым антигеном, выбранным из по меньшей мере одного из активирующего фибробласты белка альфа (FAPa), гликопротеина трофобластов (5Т4), опухолеассоциированного трансдуктора кальциевого сигнала 2 (Trop2), EDB фибронектина (EDB-FN), FOLR1 домена ЕШВ фибронектина, ЕрСАМ, EGFR, HER-2, HER-3, cMet, СЕА и FOLR1. В некоторых вариантах осуществления нацеливающие полипептиды специфически и независимо связываются с двумя разными антигенами, причем по меньшей мере один из антигенов представляет собой опухолевый антиген, выбранный из активирующего фибробласты белка альфа (FAPa), гликопротеина трофобластов (5Т4), опухолеассоциированного трансдуктора кальциевого сигнала 2 (Trop2), EDB фибронектина (EDB-FN), FOLR1 домена EIIIB фибронектина, ЕрСАМ, EGFR, HER-2, HER-3, cMet, СЕА и FOLR1.
[92] Нацеливающий антиген и/или антиген удержания могут представлять собой опухолевый антиген, экспрессируемый на опухолевой клетке. Опухолевые антигены хорошо известны в данной области техники и включают, например, активирующий фибробласты белок альфа (FAPa), гликопротеин трофобластов (5Т4), опухолеассоциированный трансдуктор кальциевого сигнала 2 (Trop2), EDB фибронектина (EDB-FN), FOLR1, домен EIIIB фибронектина, ЕрСАМ, EGFR, HER-2, HER-3, c-Met, FOLR1, PSMA, CD38, ВСМА и СЕА. 5T4, AFP, B7-H3, кадгерин-6, CALX, CD117, CD123, CD138, CD166, CD19, CD20, CD205, CD22, CD30, CD33, CD352, CD37, CD44, CD52, CD56, CD70, CD71, CD74, CD79b, DLL3, EphA2, FAP, FGFR2, FGFR3, GPC3, gpA33, FLT-3, gpNMB, HPV-16 E6, HPV-16 E7, ITGA2, ITGA3, SLC39A6, MAGE, мезотелин, Muc1, Muc16, NaPi2b, нектин-4, Р-кадгерин, NY-ESO-1, PRLR, PSCA, PTK7, ROR1, SLC44A4, SLTRK5, SLTRK6, STEAP1, TIM1, Trop2, WT1.
[93] Нацеливающий антиген и/или антиген удержания могут представлять собой белок иммунной контрольной точки. Примеры белков иммунных контрольных точек включают, но не ограничиваются этим, CD27, CD137, 2 В4, TIGIT, CD155, ICOS, HVEM, CD40L, LIGHT, TIM-1, ОХ40, DNAM-1, PD-L1, PD1, PD-L2, CTLA-4, CD8, CD40, СЕАСАМ1, CD48, CD70, A2AR, CD39, CD73, В7-Н3, В7-Н4, BTLA, IDO1, IDO2, TDO, KIR, LAG-3, TIM-3 или VISTA.
[94] Нацеливающий антиген и/или антиген удержания могут представлять собой молекулу клеточной поверхности, такую как белок, липид или полисахарид. В некоторых вариантах осуществления нацеливающий антиген и/или антиген удержания находятся на опухолевой клетке, вирусно инфицированной клетке, бактериально инфицированной клетке, поврежденной красной кровяной клетке, клетке артериального тромбоцита, клетке воспаленной или фиброзной ткани. Нацеливающий антиген и/или антиген удержания могут включать модулятор иммунного ответа. Примеры модуляторов иммунного ответа включают, но не ограничиваются этим, гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), макрофагальный колониестимулирующий фактор (M-CSF), гранулоцитарный колониестимулирующий фактор (G-CSF), интерлейкин 2 (IL-2), интерлейкин 3 (IL-3), интерлейкин 12 (IL-12), интерлейкин 15 (IL-15), В7-1 (CD80), В7-2 (CD86), GITRL, CD3 или GITR.
[95] Нацеливающий антиген и/или антиген удержания могут представлять собой рецептор цитокина. Примеры рецепторов цитокинов включают, но не ограничиваются этим, рецепторы цитокинов типа I, такие как рецептор GM-CSF, рецептор G-CSF, рецепторы IL типа I, рецептор Еро, рецептор LIF, рецептор CNTF, рецептор ТРО; рецепторы цитокинов типа II, такие как рецептор IFN-альфа (IFNAR1, IFNAR2), рецептор IFB-бета, рецептор IFN-гамма (IFNGR1, IFNGR2), рецепторы IL типа II; рецепторы хемокинов, такие как рецепторы хемокинов СС, рецепторы хемокинов СХС, рецепторы хемокинов СХ3С, рецепторы хемокинов ХС; рецепторы суперсемейства факторов некроза опухолей, такие как TNFRSF5/CD40, TNFRSF8/CD30, TNFRSF7/CD27, TNFRSF1A/TNFR1/CD120a, TNFRSF1B/TNFR2/CD120b; рецепторы TGF-бета, такие как рецептор TGF-бета 1, рецептор TGF-бета 2; рецепторы суперсемейства Ig, такие как рецепторы IL-1, CSF-1R, PDGFR (PDGFRA, PDGFRB), SCFR.
Линкеры
[96] Как указано выше, фармацевтические композиции содержат одну или более линкерных последовательностей. Линкерная последовательность служит для обеспечения гибкости между полипептидами так, чтобы, например, блокирующий фрагмент был способен ингибировать активность полипептида цитокина. Линкерная последовательность может быть расположена между любыми или всеми компонентами из полипептида цитокина, элемента для продления сывороточного времени полужизни и/или блокирующего фрагмента. Как описано в данном документе, по меньшей мере один из линкеров расщепляется протеазой и содержит (один или более) сайты расщепления для (одной или более) необходимых протеаз. Предпочтительно необходимая протеаза обогащена или избирательно присутствует в необходимом сайте цитокиновой активности (например, микроокружении опухоли). Таким образом, слитый белок преимущественно или избирательно расщепляется в сайте необходимой цитокиновой активности.
[97] Ориентация компонентов фармацевтической композиции по большому счету зависит от выбора дизайна и понятно, что возможны многие варианты ориентации и предполагается, что они все охвачены этим изобретением. Например, блокирующий фрагмент может быть расположен со стороны С-конца или N-конца полипептида цитокина.
[98] Протеазы, которые, как известно, ассоциированы с патологическими клетками или тканями, включают, но не ограничиваются этим, сериновые протеазы, цистеиновые протеазы, аспартатные протеазы, треониновые протеазы, глутаминовые кислые протеазы, металлопротеиназы, аспарагиновые пептид-лиазы, сывороточные протеазы, катепсины, катепсин В, катепсин С, катепсин D, катепсин Е, катепсин K, катепсин L, калликреины, hK1, hK10, hK15, плазмин, коллагеназу, коллагеназу типа IV, стромелизин, фактор Ха, химотрипсин-подобную протеазу, трипсин-подобную протеазу, эластазо-подобную протеазу, субтилизин-подобную протеазу, актинидаин, бромелаин, кальпаин, каспазу, каспазу-3, Mir1-CP, папаин, ВИЧ-1-протеазу, ВПГ-протеазу, ЦМВ-протеазу, химозин, ренин, пепсин, матриптазу, легумаин, плазмепсин, непентезин, металлоэкзопептидазы, металлоэндопептидазы, матриксные металлопротеиназы (ММР), ММР1, ММР2, ММР3, ММР8, ММР9, ММР13, ММР11, ММР14, активатор плазминогена урокиназного типа (uPA), энтерокиназу, простат-специфический антиген (PSA, hK3), интерлейкин-1β-конвертирующий фермент, тромбин, FAP (FAP-α), дипептидилпептидазу, меприны, гранзимы и дипептидилпептидазу IV (DPPIV/CD26). Протеазы, способные расщеплять аминокислотные последовательности, кодируемые химерными последовательностями нуклеиновых кислот, предложенными в данном документе, могут, например, быть выбраны из группы, состоящей из простат-специфического антигена (PSA), матриксной металлопротеиназы (ММР), дизинтегрина и металлопротеиназы (ADAM), активатора плазминогена, катепсина, каспазы, поверхностной протеазы опухолевых клеток и эластазы. ММР может, например, представлять собой матриксную металлопротеиназу 2 (ММР2) или матриксную металлопротеиназу 9 (ММР9).
[99] Протеазы, применимые в описанных в данном документе способах, представлены в таблице 1, а типовые протеазы и их сайты расщепления представлены в таблице 1а:

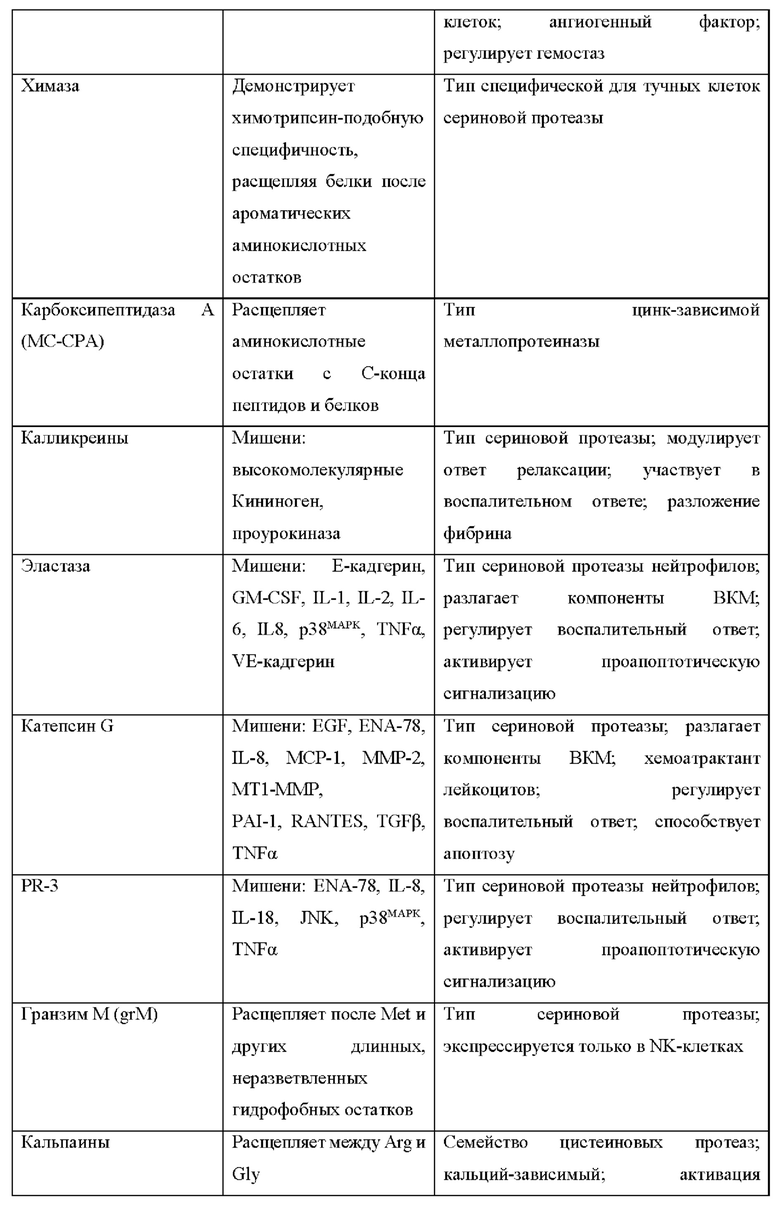

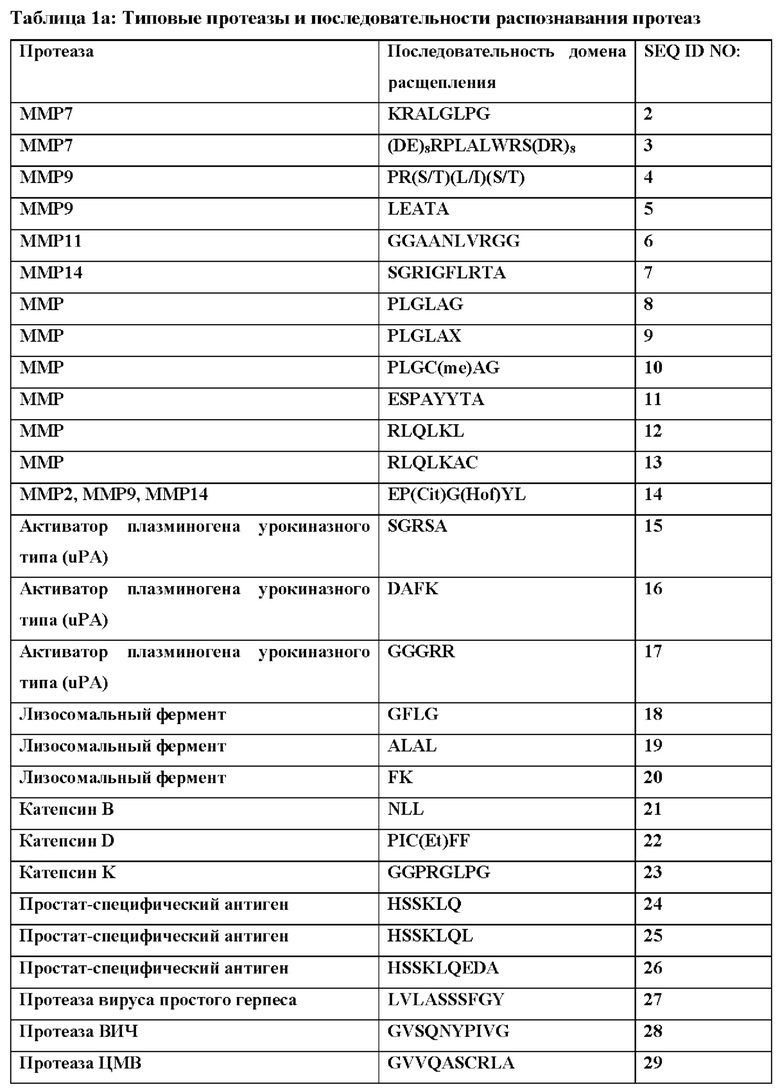
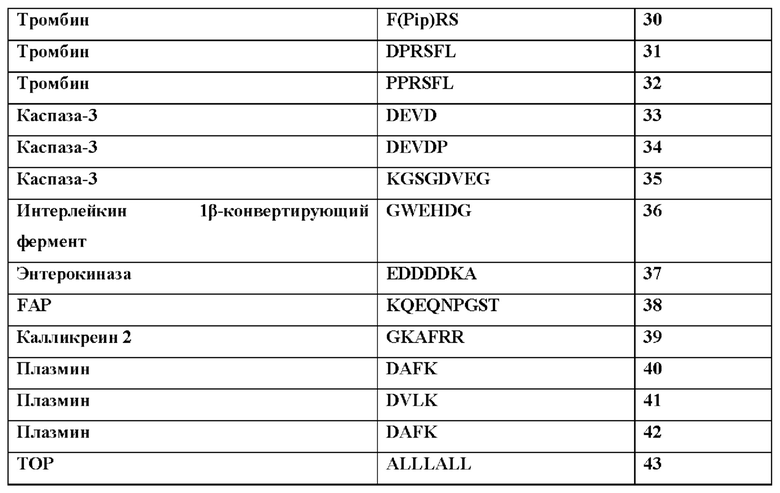
[100] В данном документе предложены фармацевтические композиции, содержащие полипептидные последовательности. Как и в случае всех пептидов, полипептидов и белков, включая их фрагменты, понятно, что могут присутствовать дополнительные модификации аминокислотной последовательности химерных полипептидов (варианты аминокислотной последовательности), которые не меняют природу или функцию пептидов, полипептидов или белков. Такие модификации включают консервативные аминокислотные замены и более подробно обсуждаются ниже.
[101] Предложенные в данном документе композиции имеют необходимую функуию. Указанные композиции состоят из по меньшей мере полипептида цитокина IL-12, блокирующего фрагмента, например, стерического блокирующего полипептида, и необязательного элемента для продления сывороточного времени полужизни и необязательного нацеливающего полипептида, причем каждый полипептид в композиции соединяют один или более линкеров. Первый полипептид, например, полипептид IL-12, предложен в качестве активного агента. Блокирующий фрагмент предложен с целью блокирования активности интерлейкина. Линкерный полипептид, например, расщепляемый протеазой полипептид, предложен с целью расщепления протеазой, которая специфически экспрессируется в предполагаемой мишени активного агента. Необязательно, блокирующий фрагмент блокирует активность первого полипептида путем связывания полипептида интерлейкина. В некоторых вариантах осуществления блокирующий фрагмент, например, стерический блокирующий пептид, связан с интерлейкином посредством расщепляемого протеазой линкера, который расщепляется в месте действия (например, воспалительными или опухолеспецифическими протеазами) с высвобождением полной активности цитокина в необходимом месте.
[102] Сайт расщепления протеазой может представлять собой сайт расщепления протеазой природного происхождения или искусственно сконструированный сайт расщепления протеазой. Искусственно сконструированный сайт расщепления протеазой может расщепляться более чем одной протеазой, специфической для необходимого окружения, в котором будет происходить расщепление, например, для опухоли. Сайт расщепления протеазой может расщепляться по меньшей мере одной протеазой, по меньшей мере двумя протеазами, по меньшей мере тремя протеазами или по меньшей мере четырьмя протеазами.
[103] В некоторых вариантах осуществления линкер содержит глицин-глицин, мотив распознавания сортазы или мотив распознавания сортазы и пептидную последовательность (Gly4Ser)n (SEQ ID NO: 81) или (Gly3Ser)n, (SEQ ID NO: 82), где n равно 1, 2, 3, 4 или 5. В одном варианте осуществления мотив распознавания сортазы содержит пептидную последовательность LPXTG (SEQ ID NO: 80), где X представляет собой любую аминокислоту. В одном варианте осуществления ковалентная связь находится между реактивным остатком лизина, присоединенным к С-концу полипептида цитокина, и реактивным остатком аспарагиновой кислоты, присоединенным к N-концу блокирующего или другого фрагмента. В одном варианте осуществления ковалентная связь находится между реактивным остатком аспарагиновой кислоты, присоединенным к N-концу полипептида цитокина, и реактивным остатком лизина, присоединенным к С-концу блокирующего или другого фрагмента. Расщепление и индуцибельность
[104] Как описано в данном документе, активность полипептида цитокина в контексте слитого белка ослаблена, а расщепление протеазой в необходимом месте активности, таком как микроокружение опухоли, приводит к высвобождению из слитого белка формы цитокина, которая является намного более активной в качестве агониста рецептора цитокина, чем слитый белок. Например, активирующая (агонистическая) рецептор цитокина активность слитого полипептида может быть по меньшей мере в около 10 раз, по меньшей мере в около 50 раз, по меньшей мере в около 100 раз, по меньшей мере в около 250 раз, по меньшей мере в около 500 раз или по меньшей мере в около 1000 раз меньшей, чем активирующая рецептор цитокина активность полипептида цитокина в виде отдельной молекулы. Полипептид цитокина, который является частью слитого белка, существует в виде отдельной молекулы, когда он содержит аминокислоты, которые по существу идентичны полипептиду цитокина, и практически не содержит дополнительные аминокислоты и не связан (ковалентными или нековалентными связями) с другими молекулами. При необходимости полипептид цитокина в виде отдельной молекулы может содержать некоторые дополнительные аминокислотные последовательности, такие как метки или короткие последовательности, которые способствуют экспрессии и/или очистке.
[105] В других примерах активирующая (агонистическая) рецептор цитокина активность слитого полипептида является по меньшей мере в около 10 раз, по меньшей мере в около 50 раз, по меньшей мере в около 100 раз, по меньшей мере в около 250 раз, по меньшей мере в около 500 раз или в около 1000 раз меньшей, чем активирующая рецептор цитокина активность полипептида, который содержит полипептид цитокина, образованный вследствие расщепления расщепляемым протеазой линкером в слитом белке. Другими словами, активирующая (агонистическая) рецептор цитокина активность полипептида, который содержит полипептид цитокина, образованный вследствие расщепления расщепляемым протеазой линкером в слитом белке, является по меньшей мере в около 10 раз, по меньшей мере в около 50 раз, по меньшей мере в около 100 раз, по меньшей мере в около 250 раз, по меньшей мере в около 500 раз или по меньшей мере в около 1000 раз большей, чем активирующая рецептор цитокина активность слитого белка. Полипептидные замены
[106] Описанные в данном документе полипептиды могут содержать компоненты (например, цитокин, блокирующий фрагмент), которые имеют такую же аминокислотную последовательность, что и соответствующий белок природного происхождения (например, IL-2, IL-15, ЧСА), или могут иметь аминокислотную последовательность, которая отличается от белка природного происхождения, при условии сохранения необходимой функции. Понятно, что один из способов определения любых модификаций и производных описанных белков и кодирующих их нуклеиновых кислот, известных или тех, которые могут возникнуть, состоит в определении вариантов последовательности в терминах идентичности с конкретными известными референсными последовательностями. В частности, описаны полипептиды и нуклеиновые кислоты, которые имеют по меньшей мере 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 процентов идентичности с предложенными в данном документе химерными полипептидами. Например, предложены полипептиды или нуклеиновые кислоты, которые имеют по меньшей мере 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 процентов идентичности с последовательностью любой из нуклеиновых кислот или любого из полипептидов, описанных в данном документе. Специалистам в данной области техники известно, как определять идентичность двух полипептидов или двух нуклеиновых кислот.Например, идентичность можно рассчитать после выравнивания двух последовательностей так, чтобы идентичность была на самом высоком уровне.
[107] другой способ расчета идентичности может быть осуществлен по опубликованным в литературе алгоритмам. Оптимальное выравнивание последовательностей для сравнения можно проводить с помощью алгоритма локальной идентичности Смита и Уотермана (Smith and Waterman Adv. Appl. Math. 2:482 (1981)), с помощью алгоритма выравнивания Нидлмана и Вунша (Needleman and Wunsch, J. Mol. Biol. 48:443 (1970)), с помощью способа поиска сходства Пирсона и Липмана (Proc. Natl. Acad. Sci. USA 85:2444 (1988)), с помощью компьютеризованных версий этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в пакете программного обеспечения Wisconsin Genetics, Genetics Computer Group, 575 Science Dr., Madison, Wis.) или путем визуальной оценки.
[108] Те же типы идентичности можно получить для нуклеиновых кислот, например, с помощью алгоритмов, описанных в Zuker, Science 244:48-52 (1989); Jaeger et al., Proc. Natl. Acad. Sci. USA 86:7706-7710 (1989); Jaeger et al., Methods Enzymol. 183:281-306 (1989), которые включены посредством ссылки в отношении по меньшей мере материала, относящегося к выравниванию нуклеиновых кислот.Понятно, что обычно можно использовать любые из способов и что в определенных случаях результаты этих различных способов могут отличаться, но специалисту в данной области техники понятно, что в случае обнаружения идентичности по меньшей мере одним из этих способов будет считаться, что последовательности имеют указанную идентичности и описаны в данном документе.
[109] Белковые модификации включают модификации аминокислотной последовательности. Модификации в аминокислотной последовательности могут возникать естественным образом в виде аллельных вариаций (например, вследствие генетического полиморфизма), могут возникать вследствие влияния окружающей среды (например, за счет воздействия ультрафиолетового света) или могут быть созданы вследствие вмешательства человека (например, с помощью мутагенеза клонированных последовательностей ДНК), например, индуцированные точечные, делеционные, инсерционные и заместительные мутанты. Эти модификации могут приводить к изменениям в аминокислотной последовательности, обеспечивать молчащие мутации, модифицировать сайт рестрикции или обеспечивать другие специфические мутации. Модификации аминокислотной последовательности, как правило, относятся к одному или более из трех классов: заместительные, инсерционные или делеционные модификации. Вставки (инсерции) включают амино- и/или карбокси-концевые слияния, а также вставки внутри последовательности одного или нескольких аминокислотных остатков. Вставки обычно являются меньшими вставками, чем в случае амино- или карбокси-концевых слияний, например, порядка от одного до четырех остатков. Делеции характеризуются удалением одного или более аминокислотных остатков из белковой последовательности. Как правило, в любом сайте в белковой молекуле удаляют не более чем около 2-6 остатков. Аминокислотные замены, как правило, относятся к единичным остаткам, но могут быть внесены сразу в ряд разных локаций; вставки обычно имеют порядок от 1 до 10 аминокислотных остатков; а делеции имеют диапазон от 1 до 30 остатков. Делеции и вставки предпочтительно проводят в соседних парах, т.е. делецию 2 остатков или вставку 2 остатков. Замены, делеции, вставки или любые их комбинации можно комбинировать, чтобы получить конечную конструкцию. Мутации не должны вытеснять последовательность из рамки считывания и предпочтительно не создают комплементарные области, которые могут привести к образованию вторичной структуры мРНК. Заместительными модификациями являются те, в которых по меньшей мере один остаток был удален и на его место вставлен другой остаток. Такие замены в целом проводят в соответствии с нижеприведенной таблицей 2 и считаются консервативными заменами.


[110] Модификации, включая конкретные аминокислотные замены, осуществляют известными способами. Например, модификации можно осуществлять с помощью сайт-специфического мутагенеза нуклеотидов в ДНК, кодирующей полипептид, с получением, таким образом, ДНК, кодирующей модификацию, и экспрессии после этого ДНК в рекомбинантной клеточной культуре. Способы создания заместительных мутаций в заданных сайтах в ДНК, имеющих известную последовательность, хорошо известны, например, это мутагенез с праймерами М13 и ПЦР-мутагенез.
[111] Модификации можно выбирать, чтобы оптимизировать связывание. Например, можно использовать методы созревания аффинности для изменения связывания scFv путем внесения случайных мутаций в определяющие комплементарность области (CDR). Такие случайные мутации можно вносить с помощью ряда способов, включая облучение, химические мутагены или ПЦР с внесением ошибок. Множественные раунды мутации и отбора можно проводить, используя, например, фаговый дисплей.
[112] Данное изобретение также относится к нуклеиновым кислотам, которые кодируют описанные в данном документе химерные полипептиды, и к применению таких нуклеиновых кислот для получения химерных полипептидов в терапевтических целях. Например, данное изобретение включает молекулы ДНК и РНК (например, мРНК, самореплицирующаяся РНК), которые кодируют химерный полипептид, и к терапевтическому применению таких молекул ДНК и РНК.
Типовые композиции
[113] В типовых слитых белках по данному изобретению вышеописанные элементы скомбинированы в ряде вариаций. Описанные в данном разделе вариации подразумеваются как примеры и не считаются ограничивающими.
[114] В некоторых вариантах осуществления слитый белок содержит полипептид IL-12, блокирующий фрагмент и элемент для продления времени полужизни. В некоторых вариантах осуществления полипептид IL-12 расположен между элементом для продления времени полужизни и блокирующим фрагментом. В некоторых вариантах осуществления полипептид IL-12 расположен со стороны N-конца относительно блокирующего фрагмента и элемента для продления времени полужизни. В некоторых таких вариантах осуществления полипептид IL-12 расположен вблизи блокирующего фрагмента; в некоторых таких вариантах осуществления полипептид IL-12 расположен вблизи элемента для продления времени полужизни. По меньшей мере один расщепляемый протеазой линкер должен быть включен во всех вариантах осуществления, чтобы полипептид IL-12 мог становиться активным после расщепления. В некоторых вариантах осуществления полипептид IL-12 расположен со стороны С-конца относительно блокирующего фрагмента и элемента для продления времени полужизни. Дополнительные элементы могут быть присоединены один к другому посредством расщепляемого линкера, нерасщепляемого линкера или путем прямого слияния.
[115] В некоторых вариантах осуществления используемые блокирующие домены способны продлевать время полужизни, а полипептид IL-12 расположен между двумя такими блокирующими доменами. В некоторых вариантах осуществления полипептид IL-12 расположен между двумя блокирующими доменами, один из которых способен продлевать время полужизни.
[116] В некоторых вариантах осуществления в одну конструкцию включены два цитокина. В некоторых вариантах осуществления каждый из цитокинов соединен с двумя блокирующими доменами (всего три в одной молекуле) с блокирующим доменом между двумя цитокинами. В некоторых вариантах осуществления могут быть включены один или более дополнительных доменов для продления времени полужизни, чтобы оптимизировать фармакокинетические свойства.
[117] В некоторых вариантах осуществления в одну конструкцию включены три цитокина. В некоторых вариантах осуществления третий цитокин может иметь функцию блокирования двух других вместо блокирующего домена между двумя цитокинами.
[118] Предпочтительными элементами для продления времени полужизни для применения в слитых белках являются человеческий сывороточный альбумин (ЧСА), антитело или фрагмент антитела (например, scFV, dAb), которые связывают сывороточный альбумин, человеческий или гуманизированный IgG или фрагмент любого из вышеприведенного. В некоторых предпочтительных вариантах осуществления блокирующим фрагментом является человеческий сывороточный альбумин (ЧСА) или антитело или фрагмент антитела, которые связывают сывороточный альбумин, антитело, которое связывает цитокин и предотвращает активацию связывания или активацию рецептора цитокина, другой цитокин или фрагмент любого из вышеприведенного. В предпочтительных вариантах осуществления, включающий применение дополнительного нацеливающего домена, нацеливающий домен представляет собой антитело, которое связывается с белком клеточной поверхности, который обогащен на поверхности раковых клеток, таким как ЕрСАМ, FOLR1 и фибронектин. Способы лечения и фармацевтические композиции.
[119] Дополнительно предложены способы лечения субъекта, который имеет или подвержен риску развития заболевания или нарушения, такого как пролиферативное заболевание, опухолевое заболевание, воспалительное заболевание, иммунологическое нарушение, аутоиммунное заболевание, инфекционное заболевание, вирусное заболевание, аллергическая реакция, паразитарная реакция или болезнь «трансплантат против хозяина». Способы введения нуждающемуся в этом субъекту эффективного количества описанного в данном документе слитого белка, который, как правило, вводят в виде фармацевтической композиции. В некоторых вариантах осуществления способ дополнительно включает отбор субъекта, который имеет или подвержен риску развития такого заболевания или нарушения. Фармацевтическая композиция предпочтительно содержит заблокированный полипептид IL-12, его фрагмент или мутеин, который активируется в месте воспаления. В одном варианте осуществления химерный полипептид содержит полипептид IL-12, его фрагмент или мутеин и элемент для продления сывороточного времени полужизни. В другом варианте осуществления химерный полипептид содержит полипептид IL-12, его фрагмент или мутеин и блокирующий фрагмент, например, стерический блокирующий полипептид, причем стерический блокирующий полипептид способен стерически блокировать активность полипептида IL-12, его фрагмента или мутеина. В другом варианте осуществления химерный полипептид содержит полипептид IL-12, его фрагмент или мутеин, блокирующий фрагмент и элемент для продления сывороточного времени полужизни.
[120] Воспаление является частью комплексного биологического ответа тканей организма на вредоносные стимулы, такие как патогены, поврежденные клетки или раздражители, я является защитным ответом, в котором участвуют иммунные клетки, кровяные сосуды и молекулярные медиаторы. Функцией воспаления является устранение изначальной причины повреждения клеток, выведение некротических клеток и тканей, поврежденных вследствие исходного воздействия и воспалительного процесса, и инициация восстановления тканей. Воспаление может возникать из-за инфекции, как симптом заболевания, например, рака, атеросклероза, аллергий, миопатий, ВИЧ, ожирения или аутоиммунного заболевания. Аутоиммунное заболевание представляет собой хроническое патологическое состояние, возникающее из-за аномального иммунного ответа на собственные антигены. Аутоиммунные заболевания, которые можно лечить описанными в данном документе полипептидами, включают, но не ограничиваются этим, волчанку, глютеновую болезнь, сахарный диабет 1 типа, болезнь Грейвса, воспалительное заболевание кишечника, множественный склероз, псориаз, ревматоидный артрит и системную красную волчанку.
[121] Фармацевтическая композиция может содержать одну или более расщепляемых протеазами последовательностей. Линкерная последовательность служит для обеспечения гибкости между полипептидами так, чтобы каждый полипептид был способен ингибировать активность первого полипептида. Линкерная последовательность может быть расположена между любыми или всеми из полипептида цитокина, его фрагмента или мутеина, блокирующего фрагмента и элемента для продления сывороточного времени полужизни. Необязательно, композиция содержит две, три, четыре или пять линкерных последовательностей. Линкерная последовательность, две, три или четыре линкерные последовательности могут быть одинаковыми или разными линкерными последовательностями. В одном варианте осуществления линкерная последовательность содержит GGGGS (SEQ ID NO: 87), GSGSGS (SEQ ID NO: 88) или G(SGGG)2SGGT (SEQ ID NO: 89). В другом варианте осуществления линкер содержит расщепляемую протеазой последовательность, выбранную из группы, состоящей из HSSKLQ (SEQ ID NO: 24), GPLGVRG (SEQ ID NO: 83), IPVSLRSG (SEQ ID NO: 84), VPLSLYSG (SEQ ID NO: 85) и SGESPAYYTA (SEQ ID NO: 86).
[122] Подходящие линкеры могут иметь любую длину, такую как от 1 аминокислоты (например, Gly) до 20 аминокислот, от 2 аминокислот до 15 аминокислот, от 3 аминокислот до 12 аминокислот, в том числе от 4 аминокислот до 10 аминокислот, аминокислот до 9 аминокислот, от 6 аминокислот до 8 аминокислот или от 7 аминокислот до 8 аминокислот, и могут составлять 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59 или 60 аминокислот.
[123] В некоторых вариантах осуществления линкер расщепляется протеазой, выбранной из группы, состоящей из калликреина, тромбина, химазы, карбоксипептидазы А, катепсина G, эластазы, PR-3, гранзима М, кальпаина, матриксной металлопротеиназы (ММР), активатора плазминогена, катепсина, каспазы, триптазы или поверхностной протеазы опухолевых клеток.
[124] Дополнительно предложены способы лечение субъекта, которые имеет или подвержен риску развития рака. Указанные способы включают введение нуждающемуся в этом субъекту эффективного количества описанного в данном документе химерного полипептида (слитого белка), который, как правило, вводят в виде фармацевтической композиции. В некоторых вариантах осуществления способ дополнительно включает отбор субъекта, который имеет или подвержен риску развития рака. Фармацевтическая композиция предпочтительно содержит заблокированный цитокин, его фрагмент или мутеин, который активируется в месте опухоли. Предпочтительно опухоль является солидной опухолью. Рак может представлять собой рак толстой кишки, рак легкого, меланому, саркому, почечно-клеточную карциному, рак молочной железы…
[125] Указанный способ может дополнительно включать введение одного или более дополнительных агентов для лечения рака, таких как химиотерапевтические агенты (например, адриамицин, церубидин, блеомицин, алкеран, велбан, онковин, фторурацил, тиотепа, метотрексат, бисантрен, ноантрон, тиогуанин, цитарабин, прокарбазин), иммуноонкологические агенты (например, анти-PD-L1, анти-CTLA4, анти-PD-1, анти-CD47, анти-GD2), клеточная терапия (например, CAR-T, Т-клеточная терапия), онколитические вирусы и т.п.
[126] В данном документе предложены фармацевтические составы или композиции, содержащие химерные полипептиды и фармацевтически приемлемый носитель. Предложенные в данном документе композиции подходят для введения in vitro или in vivo. Под фармацевтически приемлемым носителем подразумевается материал, который не является биологически или иным образом нежелательным, т.е. материал, вводимый субъекту, не вызывает нежелательных биологических эффектов или не взаимодействует вредоносным образом с другими компонентами фармацевтического состава или композиции, в которой он находится. Носитель выбирают так, чтобы минимизировать деградацию активного ингредиента и минимизировать нежелательные побочные эффекты у субъекта.
[127] Подходящие носители и их составы описаны в Remington: The Science and Practice of Pharmacy, 21st Edition, David B. Troy, ed., Lippicott Williams & Wilkins (2005). Как правило, в составе используют соответствующее количество фармацевтически приемлемой соли, чтобы сделать состав изотоническим, хотя состав может быть гипертоническим или гипотоническим при необходимости. Примеры фармацевтически приемлемых носителей включают, но не ограничиваются этим, стерильную воду, солевой раствор, забуференные растворы, такие как раствор Рингера и раствор декстрозы. рН раствора в общем случае составляет от около 5 до около 8 или от около 7 до 7,5. Другие носители включают препараты для замедленного высвобождения, такие как полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие иммуногенные полипептиды. Матрицы имеют вид формованных изделий, например, пленок, липосом или микрочастиц. Определенные носители могут быть более предпочтительными в зависимости от, например, пути введения и концентрации вводимой композиции. Носители подходят для введения химерных полипептидов иди последовательностей нуклеиновых кислот, кодирующих химерные полипептиды, людям или другим субъектам.
[128] Фармацевтические составы или композиции вводят рядом способов в зависимости от того, необходимо местное или системное лечение, и от подлежащего лечению участка. Композиции вводят любым из нескольких путей введения, включая местный, пероральный, парентеральный, внутривенный, внутрисуставной, внутрибрюшинный, внутримышечный, подкожный, внутриполостной, трансдермальный, внутрипеченочный, внутричерепной, путем распыления/ингаляции или с помощью бронхоскопии. В некоторых вариантах осуществления композиции вводят местно (не систематически), в том числе интратуморально, внутрисуставно, интратекально и т.д.
[129] Препараты для парентерального введения включают стерильные водные или неводные растворы, суспензии и эмульсии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъекционные органические сложные эфиры, такие как этилолеат.Водные носители включают воду, спиртово-водные растворы, эмульсии или суспензии, включая солевой раствор и забуференную среду. Парентеральные носители включают раствор хлорида натрия, декстрозу Рингера, декстрозу и хлорид натрия, лактат Рингера или жирные масла. Внутривенные носители включают пополнители жидкости и питательных веществ, пополнители электролитов (например, на основе декстрозы Рингера) и т.п. Необязательно присутствуют консерванты и другие добавки, такие как, например, противомикробные препараты, антиоксиданты, хелатирующие агенты и инертные газы и т.п.
[130] Составы для местного введения включают мази, лосьоны, кремы, гели, капли, суппозитории, спреи, жидкости и порошки. Традиционные фармацевтические носители, водные, порошковые или масляные основы, загустители и т.п. являются необязательными или необходимыми.
[131] Композиции для перорального введения включают порошки или гранулы, суспензии или растворы в воде или неводных средах, капсулы, саше или таблетки. Необязательно, необходимы загустители, ароматизаторы, разбавители, эмульгаторы, диспергирующие агенты или связующие вещества.
[132] Необязательно, химерные полипептиды или последовательности нуклеиновых кислот, кодирующие химерные полипептиды, вводят с помощью вектора. Существует ряд композиций и способов, которые можно использовать для доставки молекул нуклеиновых кислот и/или полипептидов в клетки, как in vitro, так и in vivo, например, экспрессионные векторы. Эти способы и композиции можно в целом поделить на два класса: системы на основе вирусной доставки и системы на основе невирусной доставки. Такие способы хорошо известны в данной области техники и легко адаптируются для применения с описанными в данном документе способами и композициями. Такие композиции и способы можно использовать для трансфекции или трансдукции клеток in vitro или in vivo, например, для получения линий клеток, которые экспрессируют и, предпочтительно, секретируют кодируемый химерный полипептид, или для терапевтической доставки нуклеиновых кислот субъекту. Компоненты описанных в данном документе нуклеиновых кислот, как правило, функционально связаны в рамке считывания, чтобы кодировать слитый белок.
[133] В контексте данного документа плазмиды или вирусные векторы представляют собой агенты, которые переносят описанные нуклеиновые кислоты в клетку, не разрушая ее, и содержат промотор, обеспечивающий экспрессию молекулы нуклеиновой кислоты и/или полипептида в клетках, в которые они были доставлены. Вирусными векторам являются, например, аденовирус, аденоассоциированный вирус, вирус герпеса, вирус осповакцины, полиовирус, вирус Синдбис и другие РНК-вирусы, включая вирусы с остовом ВИЧ. Также предпочтительными являются любые семейства вирусов, которые имеют свойства тех вирусов, которые делают их подходящими для применения в качестве векторов. Ретровирусные векторы в целом описаны в Coffin et al., Retroviruses, Cold Spring Harbor Laboratory Press (1997), которая включена в данный документ посредством ссылки в отношении векторов и способов их создания. Было описано конструирование дефективных по репликации аденовирусов (Berkner et al., J. Virol. 61:1213-20 (1987); Massie et al., Mol. Cell. Biol. 6:2872-83 (1986); Haj-Ahmad et al., J. Virol. 57:267-74 (1986); Davidson et al., J. Virol. 61:1226-39 (1987); Zhang et al., BioTechniques 15:868-72 (1993)). Преимуществом применения этих вирусов в качестве векторов является то, что они ограничены по степени, в которой они могут распространяться по другим типам клеток, то есть, они могут реплицироваться в исходной инфицированной клетке, но не способны образовывать новые инфекционные вирусные частицы. Было показано, что рекомбинантные вирусы обеспечивают высокую эффективность после прямой in vivo доставки в эпителий дыхательных путей, гепатоциты, сосудистый эндотелий, паренхиму ЦНС и ряд других тканевых сайтов. Другие применимые системы включают, например, векторы на основе реплицирующегося и ограниченного по организму-хозяину нереплицирующегося вируса осповакцины.
[134] Предложенные полипептиды и/или молекулы нуклеиновых кислот можно доставлять посредством вирусоподобных частиц. Вирусоподобные частицы (ВПЧ) состоят из вирусных белков, полученных из структурных белков вируса. Способы создания и применения вирусоподобных частиц описаны, например, в Garcea and Gissmann, Current Opinion in Biotechnology 15:513-7 (2004).
[135] Предложенные полипептиды можно доставлять с помощью субвирусных плотных телец (ПТ). ПТ переносят белки в целевые клетки посредством мембранного слияния.
Способы создания и применения ПТ описаны, например, в Pepperl-Klindworth et al., Gene Therapy 10:278-84 (2003).
[136] Предложенные полипептиды можно доставлять посредством тегументных агрегатов. Способы создания и применения тегументных агрегатов описаны в международной публикации № WO 2006/110728.
[137] Способы на основе невирусной доставки могут включать применение экспрессионных векторов, содержащих молекулы нуклеиновых кислот и последовательности нуклеиновых кислот, кодирующие полипептиды, причем нуклеиновые кислоты функционально связаны с экспрессионной регуляторной последовательностью. Подходящие векторные остовы включают, например, те, которые обычно используют в данной области техники, такие как плазмиды, искусственные хромосомы, ВАС, YAC или РАС. Ряд векторов и экспрессионных систем коммерчески доступны от таких корпораций, какв Novagen (Madison, Wis.), Clonetech (Pal Alto, Calif.), Stratagene (La Jolla, Calif.) и Invitrogen/Life Technologies (Carlsbad, Calif.), векторы, как правило, содержат одну или более регуляторных областей. Регуляторные области включают, без ограничения, промоторные последовательности, энхансерные последовательности, элементы ответа, белок-распознающие сайты, индуцибельные элементы, белок-связывающие последовательности, 5' и 3' нетранслируемые области (НТО), сайты инициации транскрипции, последовательности терминации, последовательности полиаденилирования и интроны. Такие векторы также можно использовать для создания химерных полипептидов путем экспрессии в подходящей клетке-хозяине, такой как клетки СНО.
[138] Предпочтительные промоторы, регулирующие транскрипцию из векторов в клетках-хозяевах млекопитающих, можно получать из различных источников, например, геномов вирусов, таких как вирус полиомы, вирус обезьян 40 (SV40), аденовирус, ретровирус, вирус гепатита В и, наиболее предпочтительно, цитомегаловирус (ЦМВ), или из гетерологичных промоторов млекопитающих, например, промотора β-актина или промотора EF1α, или из гибридных химерных промоторов (например, промотора ЦМВ, слитого с промотором β-актина). Конечно, в контексте данного документа также применимы промоторы из клетки-хозяина или родственных видов.
[139] Энхансер в общем случае относится к последовательности ДНК, которая не функционирует на каком-либо фиксированном расстоянии от сайта инициации транскрипции и может находиться как 5', так и 3' относительно транскрипционной единицы. Кроме того, энхансеры могут находиться в интроне, а также в самой кодирующей последовательности. Обычно их длина составляет от 10 до 300 пар оснований (п.о.), и они функционируют в цис-форме. Функцией энхансера обычно является повышение транскрипции из расположенных рядом промоторов. Энхансеры также могут содержать элементы ответа, которые опосредуют регуляцию транскрипции. Хотя известны последовательности многих энхансеров из генов млекопитающих (глобина, эластазы, альбумина, фетопротеина и инсулина), как правило, для общей экспрессии используют энхансер из вируса эукариотической клетки. Предпочтительными примерами являются энхансер SV40 на поздней стороне точки начала репликации, энхансер раннего промотора цитомегаловируса, энхансер вируса полиомы на поздней стороне точки начала репликации и энхансеры аденовирусов.
[140] Промотор и/или энхансер может быть индуцибельным (например, регулироваться химически или физически). Химически регулируемый промотор и/или энхансер может, например, регулироваться наличием спирта, тетрациклина, стероида или металла. Физически регулируемый промотор и/или энхансер может, например, регулироваться факторами окружающей среды, такими как температура и освещение. Необязательно, область промотора и/или энхансера может действовать как конститутивный промотор и/или энхансер, чтобы максимизировать экспрессию области транскрипционной единицы, предназначенной для транскрипции. В определенных векторах область промотора и/или энхансера может быть активной образом, специфическим в отношении типа клеток. Необязательно, в определенных векторах область промотора и/или энхансера может быть активной в эукариотических клетках, независимо от типа клеток. Предпочтительными промоторами этого типа являются промотор ЦМВ, промотор SV40, промотор β-актина, промотор EF1α и ретровирусный длинный концевой повтор (ДКП).
[141] Векторы также могут содержать, например, точки начала репликации и/или маркеры. Маркерный ген может придавать клетке селективный фенотип, например, устойчивость к антибиотику. Маркерный продукт использую для определения, был ли вектор доставлен в клетку и экспрессируется ли он после доставки. Примерами селективных маркером для клеток млекопитающих являются дигидрофолатредуктаза (DHFR), тимидинкиназа, неомицин, аналог неомицина G418, гигромицин, пуромицин и бластицидин. В случае успешного переноса таких селективных маркеров в клетку-хозяина млекопитающего, трансформированная клетка-хозяин млекопитающего способна выжить при помещении в условия селективного давления. Примеры других маркеров включают, например, ген lacZ Е. coli, зеленый флуоресцентный белок (ЗФБ) и люциферазу. Кроме того, экспрессионный вектор может содержать последовательность метки, предназначенную для облегчения обнаружения (например, очистки или локализации) экспрессируемого полипептида. Последовательности меток, такие как последовательности ЗФБ, глутатион S-трансферазы (GST), полигистидина, с-тус, гемагглютинина или метки FLAG™ (Kodak; New Haven, Conn.), как правило, экспрессируются в виде слияния с кодируемым полипептидом. Такие метки могут быть вставлены в любом месте в полипептиде, в том числе в карбокси- или амино-конце.
[142] В контексте данного документа термины пептид, полипептид или белок используются в широком смысле для обозначения двух или более аминокислот, связанных пептидной связью. Белок, пептид и полипептид также взаимозаменяемо используются в данном документе для обозначения аминокислотных последовательностей. Следует понимать, что термин полипептид в контексте данного документа не предполагает конкретные размер или число аминокислот, составляющих молекулу, и что пептид по изобретению может содержать до нескольких аминокислотных остатков или более. В контексте данного документа субъект может представлять собой позвоночное, конкретнее млекопитающее (например, человека, лошадь, кошку, собаку, корову, свинью, овцу, козу, мышь, кролика, крысу и морскую свинку), птиц, рептилий, амфибий, рыб и любое другое животное. Этот термин не предполагает конкретный возраст или пол. Такими образом, подразумевается, что охвачены взрослые и новорожденные субъекты мужского и женского пола. В контексте данного документа термины пациент или субъект могут использоваться взаимозаменяемо и могут относиться к субъекту с заболеванием или нарушением (например, раком). Термин пациент или субъект включает людей и ветеринарных субъектов.
[143] Субъект, подверженный риску развития заболевания или нарушения, может быть генетически предрасположен к заболеванию или нарушению, например, иметь семейный анамнез или иметь мутацию в гене, которая вызывает заболевание или нарушение, или демонстрировать ранние признаки или симптомы заболевания или нарушения. Субъект, который на данный момент имеет заболевание или нарушение, имеет один или более одного симптомы заболевания или нарушения, и у него может быть диагностировано заболевание или нарушение.
[144] Описанные в данном документе способы и агенты применимы в качестве как профилактического, так и терапевтического лечения. В случае профилактического применения терапевтически эффективное количество химерных полипептидов или последовательностей химерных нуклеиновых кислот, кодирующих химерные полипептиды, описанных в данном документе, вводят субъекту до начала (например, до появления очевидных симптомов рака или воспаления) или во время раннего начала (например, после появления начальных симптомов и симптомов рака или воспаления). Профилактическое введение может продолжаться в течение времени от нескольких суток до нескольких лет до проявления симптомов рака или воспаления. Профилактическое лечение можно применять, например, при превентивном лечении субъектов, у которых была диагностирована генетическая предрасположенность к раку. Терапевтическое лечение включает введение субъекту терапевтически эффективного количества химерных полипептидов или последовательностей химерных нуклеиновых кислот, кодирующих химерные полипептиды, описанных в данном документе, после диагностирования или развития рака или воспаления (например, аутоиммунного заболевания). Профилактическое применение также можно использовать, когда пациент проходит лечение, например, химиотерапию, при котором ожидаемо воспаление.
[145] В соответствии с описанными в данном документе способами субъекту вводят эффективное количество агента (например, химерного полипептида). Термины эффективное количество и эффективная дозировка используются взаимозаменяемо. Термин эффективное количество определяется как любое количество, необходимое для получения желаемого физиологического ответа. Эффективные количества и режимы введения агента можно определять эмпирически, и такие определения находятся в компетенции специалиста в данной области техники. Диапазоны дозировок для введения являются достаточно большими, чтобы привести к необходимому эффекту, при котором один или более симптомов заболевания или нарушения подвергаются изменению (например, снижаются или замедляются). Дозировка не должна быть настолько большой, чтобы вызвать существенные нежелательные побочные эффекты, такие как нежелательные перекрестные реакции, анафилактические реакции и т.п. В общем случае дозировка будет варьироваться в зависимости от возраста, патологического состояния, пола, типа заболевания, степени заболевания или нарушения, пути введения или того, включены ли в схему другие лекарственные препараты, и может быть определена специалистом в данной области техники. Дозировка может корректироваться индивидуальным лечащим врачом в случае любых противопоказаний. Дозировки могут варьироваться, и их можно вводить за одно или более введений дозы ежесуточно в течение одних или нескольких суток. Руководство в отношении соответствующих дозировок для заданных классов фармацевтических продуктов можно найти в литературе.
[146] В контексте данного документа термины лечение или лечить относятся к способу снижения действия заболевания или патологического состояния или симптома заболевания или патологического состояния. Таким образом, в описанном способе лечение может относиться к 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% снижению тяжести установленного заболевания или патологического состояния или симптома заболевания или патологического состояния. Например, способ лечения заболевания считается лечением, если наблюдается 10% снижение одного или более симптомов заболевания у субъекта по сравнению с контролем. Таким образом, снижение может составлять 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100% или любой процент снижения между 10% и 100% по сравнению с нативными или контрольными уровнями. Следует понимать, что лечение не обязательно относится к излечению или полному устранению заболевания, патологического состояния или симптомов заболевания или патологического состояния.
[147] В контексте данного документа термины предотвращать и предотвращение заболевания или нарушения относятся к действию, например, введению химерного полипептида или последовательности нуклеиновой кислоты, кодирующей химерный полипептид, которое происходит до или приблизительно в то же время, когда субъект начинает демонстрировать один или более симптомов заболевания или нарушения, которое ингибирует или замедляет начало или усугубление одного или более симптомов заболевания или нарушения. В контексте данного документа употребление терминов снижение, уменьшение или ингибирование включает изменение, составляющее 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или более по сравнению с контрольным уровнем. Такие термины могут включать, но не обязательно включают полное устранение.
[148] Описаны материалы, композиции и компоненты, которые можно использовать для, можно использовать в сочетании, можно использовать при приготовлении или которые являются продуктами описанных способов и композиций. Эти и другие материалы описаны в данном документе; понятно, что если описаны комбинации, подгруппы, взаимодействия, группы и т.д. этих материалов, несмотря на то, что конкретная ссылка на каждую из различных индивидуальных и коллективных комбинаций и перестановок этих соединений может быть явным образом не описана, каждая отдельно предусмотрена и описана в данном документе. Например, если описан и обсуждается способ и обсуждается ряд модификаций, которые могут быть осуществлены в отношении ряда молекул, включая способ, каждая и любая комбинация и перестановка способа и модификации, которые возможны, явным образом предусмотрены, если явным образом не указано иное. Аналогично, любая их подгруппа или комбинация также явным образом предусмотрена и описана. Эта концепция относится ко всем аспектам изобретения, включая, но не ограничиваясь этим, этапы в способах с применением описанных композиций. Таким образом, при наличии ряда дополнительных этапов, которые можно проводить, следует понимать, что каждый из этих дополнительных этапов можно проводить, используя любые конкретные этапы способа или комбинацию этапов способа описанных способов, и что каждая такая комбинация или подгруппа комбинаций явным образом предусмотрена и считается описанной.
[149] Цитируемые в данном документе публикации и материалы, в отношении которых они цитируются, в полном объеме и явным образом включены в данный документ посредством ссылки.
ПРИМЕРЫ
[150] Ниже приведены примеры способов и композиций по данному изобретению. Следует понимать, что на практике можно реализовать различные другие варианта осуществления с учетом описания, предложенного в данном документе.
Пример 1: Расщепление слитого белка протеазой ММР9
[151] Специалисту в данной области техники должны быть известны способы проведения анализа расщепления белка. 100 мкг белка в 1хФСБ, рН 7,4, расщепляли 1 мкг активной ММР9 (каталог Sigma, № SAE0078-50 или каталог Enzo, BML-SE360) и инкубировали при комнатной температуре в течение до 16 часов. После этого расщепленный белок можно использовать в функциональном анализе или хранили при -80°С до исследования. Степень расщепления отслеживали с помощью ДСН-ПААГ, используя методы, известные в данной области техники. Как проиллюстрировано на Фиг. 9.
Пример 2: Анализ HEK Blue
[152] Клетки HEK-Blue IL12 (InvivoGen) высевали в суспензию в концентрации 250000 клеток/лунка в культуральную среду с 40 мг/мл человеческого сывороточного альбумина (ЧСА) или без него и стимулировали серией разведений рекомбинантного hIL12, химерного IL12 (р35 мыши/р40 человека) или активируемого hIL12 в течение 24 часов при 37°С и 5% СО2. Исследовали активность нерасщепленного и расщепленного активируемого hIL12. Расщепленный индуцибельный hIL12 получали путем инкубации с активной ММР9. Активность IL12 оценивали на основании количественной оценки активности секретируемой щелочной фосфатазы (SEAP), используя реагент QUANTI-Blue (InvivoGen), колориметрический анализ. Как проиллюстрировано на Фиг. 7, 8, 11 и 13.
Пример 3: Анализ спленоцитов Т-бластов
[153] Т-бласты индуцировали из мышиных спленоцитов с 6-суточной инкубацией с РНА и 24-часовой инкубацией с рекомбинантным hIL12. Затем Т-бласты высевали в суспензию в концентрации 200000 клеток/лунка в культуральную среду с 40 мг/мл человеческого сывороточного альбумина (ЧСА) или без него и стимулировали серией разведений рекомбинантного hIL12, химерного IL12 (р35 мыши/р40 человека) или мышиного IL12 в течение 72 часов при 37°С и 5% СО2. Исследовали активность нерасщепленного и расщепленного активируемого IL12. Расщепленный индуцибельный hIL12 получали путем инкубации с активной ММР9. Активность IL12 оценивали по последующему количественному определению выработки IFNγ, используя ИФА для mIFNγ альфа.
Пример 4: In vivo доставка активированного протеазой слитого белка приводит к снижению роста опухоли
[154] Химерные полипептиды исследовали, чтобы определить, могут ли они оказывать биологические эффекты in vivo. В этих экспериментах используют систему, в которой опухолевые клетки, вводимые внутрибрюшинно, быстро и преимущественно присоединяются и растут изначально на молочных пятнах, ряде организованных иммунных агрегатов, встречающихся в сальниках (Gerber et al., Am. J. Pathol. 169:1739-52 (2006)). Эта система предлагает удобный способ для изучения эффектов обработки слитым белком на рост опухоли, поскольку слитые белки можно многократно доставлять внутрибрюшинно, а рост опухоли можно анализировать, изучая диссоциированные клетки сальника. Для этих экспериментов можно использовать линию клеток толстой кишки 38, быстро растущую опухолевую линию клеток, которая экспрессирует как ММР2, так и ММР9 in vitro. Ткань сальника обычно экспрессирует относительно небольшое количество ММР2 и ММР9, но когда опухоль толстой кишки 38 присутствует на сальнике, уровни ММР повышаются. Используя эту опухолевую модель, исследуют способность слитых белков мутеина IL-2 влиять на рост опухоли. Клетки толстой кишки 38 инъецируют внутрибрюшинно, позволяют им присоединиться и расти в течение 1 суток, а затем ежесуточно внутрибрюшинно обрабатывают слитым белком. На 7 сутки животных умерщвляют и исследуют сальники в отношении роста опухоли, используя проточную цитометрию и с помощью анализа образования колоний.
Пример 5: Конструирование типового активируемого белка интерлейкина, нацеленного на CD20
Создание активируемого домена интерлейкина
[155] Каноническая последовательность цепи IL-12p35 человека имеет номер доступа Uniprot №Р29459. Каноническая последовательность цепи IL-12p40 человека имеет номер доступа Uniprot №Р29460. IL-12p35 и IL-12p40 клонируют в экспрессионную конструкцию. Сайт расщепления протеазой включен между доменами IL-12р35 и IL-12р40. Полипептид IL-12, способный связываться с полипептидом CD20, присутствующим в опухоли или на опухолевой клетке, получают следующим образом. Получают нуклеиновую кислоту, которая содержит последовательности нуклеиновой кислоты: (1) кодирующие последовательность полипептида IFNg и (2) один или более полипептидных линкеров. Плазмидные конструкции активируемого интерлейкина могут иметь необязательные Flag, His или другие аффинные метки, их электропорируют в HEK293 или другие подходящие линии клеток человека или млекопитающих и очищают.Валидационный анализ включает анализ активации Т-клеток с использованием Т-клеток, восприимчивых к стимуляции IL-12 в присутствии протеазы.
Создание CD20-связывающего домена scFv
[156] CD20 является одним из белков клеточной поверхности, присутствующих на В-лимфоцитах. Антиген CD20 встречается в нормальных и злокачественных пре-В и зрелых В-лимфоцитах, в том числе в более 90% В-клеток неходжкинских лимфом (НХЛ). Этот антиген отсутствует в гемопоэтических стволовых клетках, активированных В-лимфоцитах (плазматических клетках) и нормальной ткани. В связи с этим было описано несколько антител, преимущественно мышиного происхождения: 1F5, 2 В8/С2 В8, 2Н7 и 1Н4.
[157] Следовательно, человеческие или гуманизированные анти-CD20 антитела используют для создания последовательностей scFv для доменов связывания CD20 активируемого белка интерлейкина. Получают последовательности ДНК, кодирующие человеческие или гуманизированные VL- и VH-домены, а кодоны конструкций, необязательно, оптимизируют для экспрессии в клетках от Homo sapiens. Порядок, в котором VL- и VH-домены расположены в scFv, варьируется (т.е. ориентация VL-VH или VH-VL), а три копии «G4S» (SEQ ID NO: 87) или «G4S» (SEQ ID NO: 87) субъединицы (G4S)3 (SEQ ID NO: 90) соединяют вариабельные домены с созданием домена scFv. Плазмидные конструкции анти-CD20 scFv могут иметь необязательные Flag, His или другие аффинные метки, их электропорируют в HEK293 или другие подходящие линии клеток человека или млекопитающих и очищают. Валидационный анализ включает анализ связывания методом FACS, кинетический анализ с помощью Proteon и окрашивание CD20-экспрессирующих клеток.
Клонирование экспрессионных конструкций ДНК, кодирующих активируемый белок интерлейкина
[158] Активируемую конструкцию интерлейкина с доменами сайта расщепления протеазой используют для конструирования активируемого белка интерлейкина в комбинации с анти-CD20 scFv-доменом и элементом для продления сывороточного времени полужизни (например, ЧСА-связывающим пептидом или VH-доменом), как проиллюстрировано на Фиг. 10. Для экспрессии активируемого белка интерлейкина в клетках СНО кодирующие последовательности всех белковых доменов клонируют в экспрессионную векторную систему млекопитающих. Вкратце, генные
последовательности, кодирующие домен активируемого белка интерлейкина, элемент для продления сывороточного времени полужизни и CD20-связывающий домен наряду с пептидными линкерами L1 и L2, синтезируют отдельно и субклонируют.Полученные в результате конструкции лигируют вместе в порядке СВ20-связывающий домен - L1 - IL - 12р35 - L2 - домен расщепления протеазой - L3 - IL - 12p40 - L4 анти-CD20 scFv - L5 - элемент для продления сывороточного времени полужизни для получения конечной конструкции. Все экспрессионные конструкции содержат кодирующие последовательности для N-концевого сигнального пептида и С-концевой гексагистидиновой (6xHis)-метки (SEQ ID NO: 91) для облегчения секреции и очистки белка, соответственно.
Экспрессия активируемых белков интерлейкина в стабильно трансфицированных клетках СНО
[159] Используют экспрессионную систему на основе клеток СНО (Flp-In®, Life Technologies), производное клеток яичника китайского хомяка СНО-K1 (АТСС, CCL-61) (Kao and Puck, Proc. Natl. Acad Sci USA 1968; 60(4):1275-81). Адгезивные клетки субкультивируют в соответствии со стандартными протоколами клеточного культивирования, предоставленными Life Technologies.
[160] Для адаптации для роста в суспензии клетки отделяют от пробирок для тканевых культур и помещают в бессывороточную среду. Адаптированные к суспензии клетки криоконсервируют в среде с 10% ДМСО.
[161] Рекомбинантные линии клеток СНО, стабильно экспрессирующие секретируемые активируемые белки интерлейкина, создают путем трансфекции адаптированных к суспензии клеток. Во время селекции с использованием антибиотика гигромицина В плотность жизнеспособных клеток измеряют дважды в неделю, клетки центрифугируют и ресуспендируют в свежей селекционной среде при максимальной плотности 0,1×106 жизнеспособных клеток/мл. Пулы клеток, стабильно экспрессирующих активируемые белки интерлейкина, восстанавливают через 2-3 недели селекции и в этот момент времени клетки переносят в стандартную культуральную среду во встряхиваемые пробирки. Экспрессию рекомбинантных секретируемых белков подтверждают путем проведения гель-электрофореза или проточной цитометрии. Стабильные пулы клеток криоконсервируют в среде, содержащей ДМСО.
[162] Активируемые белки интерлейкина получают в 10-суточных подпитываемых культурах стабильно трансфицированных линий клеток СНО путем секреции в клеточный культуральный супернатант.Клеточные культуральные супернатанты собирают через 10 суток при жизнеспособности культур обычно >75%. Образцы отбирают из вырабатывающих культур через сутки и оценивают жизнеспособность и плотность клеток. В день сбора клеточные культуральные супернатанты осветляют путем центрифугирования и вакуумной фильтрации перед дальнейшим использованием.
[163] Титры белковой экспрессии и целостность продуктов в клеточных культуральных супернатантах анализируют методом ДСН-ПААГ.
Очистка активируемых белков интерлейкина
[164] Активируемые белки интерлейкина очищают из клеточных культуральных супернатантов СНО с помощью двухэтапной процедуры. На первом этапе конструкции подвергают аффинной хроматографии, за которой следуют эксклюзионная хроматография (ЭХ) на Superdex 200 на втором этапе. В образцах проводят замену буфера и концентрируют их путем ультрафильтрации до типичной концентрации >1 мг/мл. Чистоту и гомогенность (обычно >90%) конечных образцов оценивают методом ДСН-ПААГ в восстанавливающих и невосстанавливающих условиях с последующим иммуноблоттингом с использованием анти-ЧСА или анти-идиотипического антитела, а также методом аналитической ЭХ, соответственно. Очищенные белки хранят в аликвотах при -80°С до использования.
Пример 6: Определение аффинности к антигену методом проточной цитометрии
[165] Активируемые белки интерлейкина из предыдущих примеров исследуют в отношении аффинности связывания с CD20+ клетками человека и CD20+ клетками яванского макака.
[166] Клетки CD20+ инкубируют со 100 мкл серийных разведений активируемых белков интерлейкина из предыдущих примеров и по меньшей мере одной протеазой. После промывки три раза буфером FACS клетки инкубируют с 0,1 мл 10 мкг/мл мышиного моноклонального анти-идиотипического антитела в том же самом буфере в течение 45 мин на льду. После второго цикла промывки клетки инкубируют с 0,1 мл 15 мкг/мл ФИТЦ-конъюгированных козьих антимышиных антител IgG в тех же условиях, что и ранее. В качестве контроля клетки инкубируют с анти-His IgG, после этого - с ФИТЦ-конъюгированными козьими антимышиными антителами IgG без активируемых белков интерлейкина. Клетки снова промывали и ресуспендировали в 0,2 мл буфера FACS, содержащего 2 мкг/мл пропидий йодида (ПИ), чтобы исключить мертвые клетки. Флуоресценцию 1×104 живых клеток измеряли, используя проточный цитометр Beckman-Coulter FC500 MPL и программное обеспечение МХР (Beckman-Coulter, Krefeld, Germany) или проточный цитометр Millipore Guava EasyCyte и программное обеспечение Incyte (Merck Millipore, Schwalbach, Germany). Среднюю интенсивность флуоресценции образцов клеток рассчитывали, используя программное обеспечение СХР (Beckman-Coulter, Krefeld, Germany) или программное обеспечение Incyte (Merck Millipore, Schwalbach, Germany). После вычитания значений интенсивности флуоресценции клеток, окрашенных только вторичными и третичными реагентами, эти значения затем используют для расчета значений KD с помощью уравнения для односайтового связывания (гипербола) в GraphPad Prism (версия 6.00 для Windows, GraphPad Software, La Jolla California USA).
[167] Связывание CD20 и перекрестную реактивность оценивают на линиях опухолевых клеток CD20+ человека. Отношение KD перекрестной реактивности рассчитывают, используя значения KD, определенные в линиях клеток СНО, экспрессирующих рекомбинантные антигены человека или рекомбинантные антигены яванского макака.
Пример 7: Анализ цитотоксичности
[168] Активируемый белок интерлейкина из предыдущих примеров оценивают in vitro в отношении его опосредования иммунного ответа на целевые клетки CD20+.
[169] Флуоресцентно меченные клетки CD20+ REC-1 (линия клеток мантийноклеточной лимфомы, АТСС CRL-3004) инкубируют с выделенными МКПК от случайных доноров или СВ15 Т-клетками (стандартизированная линия Т-клеток) в качестве эффекторных клеток в присутствии активируемого белка интерлейкина из предыдущих примеров и по меньшей мере одной протеазы. После инкубации в течение 4 ч при 37°С в увлажненном инкубаторе определяют высвобождение флуоресцентного красителя из целевых клеток в супернатант в спектрофлуориметре. Целевые клетки, которые инкубировали без активируемого белка интерлейкина из предыдущих примеров, и целевые клетки, полностью лизированные путем добавления сапонина в конце инкубации, служат в качестве отрицательного и положительного контролей, соответственно.
[170] На основании измеренных оставшихся живых целевых клеток рассчитывают процент специфического клеточного лизиса в соответствии со следующей формулой: [1-(число живых мишеней(образец)/число живых мишеней(спонтанных))] × 100%. Сигмоидальные кривые доза-ответ и значения ЕС50 рассчитывают с помощью нелинейной регрессионной/4-параметрической логистической аппроксимации, используя программное обеспечение GraphPad. Значения лизиса, полученные для заданной концентрации антитела используют для расчета сигмоидальных кривых доза-ответ с помощью анализа 4-параметрической логистической аппроксимации, используя программное обеспечение Prism.
Пример 8: Фармакокинетика активируемых белков интерлейкина
[171] Активируемый белок интерлейкина из предыдущих примеров оценивают в отношении периода полувыведения в исследованиях на животных.
[172] Активируемый белок интерлейкина вводят яванским макакам в виде 0,5 мг/кг болюсной инъекции в подкожную вену. Другая группа яванских макаков получает сравнимый по размеру цитокин, но в котором отсутствует элемент продления сывороточного времени полужизни. Третья и четвертая группы получают цитокин с элементами для продления сывороточного времени полужизни и цитокин с CD20 и элементами для продления сывороточного времени полужизни, соответственно, оба сравнимые по размеру с активируемым белком интерлейкина. Каждая исследуемая группа состоит из 5 обезьян. Образцы сыворотки получают в указанные моменты времени, проводят серийное разведение и определяют концентрацию белков, используя ИФА связывания с CD20.
[173] Анализ фармакокинетики проводят, используя плазменные концентрации исследуемого препарата. Средние по группе плазменные данные для каждого исследуемого препарата соответствуют мультиэкспоненциальному профилю при построении зависимости от времени после введения дозы. Данные аппроксимируют стандартной двухкомпартментной моделью с болюсным вводом и константами скорости первого порядка для фаз распределения и выведения. Общим уравнением для наилучшей аппроксимации данных для в/в введения является: c(t)=Ae-αt+Be-βt, где c(t) - плазменная концентрация в момент времени t, А и В - пересечения с осью Y, а α и β - кажущиеся константы скорости первого порядка для фаз распределения и выведения, соответственно.
α-фаза представляет собой начальную фазу выведения и отображает распределение белка во всей внеклеточной жидкости животного, тогда как вторая часть или р-фаза спадающей кривой представляет истинное плазменное выведение. Способы аппроксимации таких уравнений хорошо известны в данной области техники. Например, A=D/V(α-k21)/(α-β), B=D/V(β-k21)/(α-β), а α и β (для α>β) являются корнями квадратного уравнения: r2+(k12+k21+k10)r+k21k10=0 с использованием оценочных параметров V=объем распределения, k10=скорость выведения, k12=скорость переноса из компартмента 1 в компартмент 2, а k21=скорость переноса из компартмента 2 в компартмент 1, и D=вводимая доза.
[174] Анализ данных: Графики зависимости концентрации от временного профиля строят, используя KaleidaGraph (KaleidaGraph™ V. 3.09 Copyright 1986-1997. Synergy Software. Reading, Pa.). Значения, представленные как «меньше подлежащего представлению» (МПП) не включены в анализ ФК и не представлены графически. Фармакокинетические параметры определяют с помощью компартментного анализа, используя программное обеспечение WinNonlin (WinNonlin® Professional V. 3.1 WinNonlin™ Copyright 1998-1999. Pharsight Corporation. Mountain View, Calif). Фармакокинетические параметры рассчитывают, как описано в Ritschel WA and Kearns GL, 1999, IN: Handbook Of Basic Pharmacokinetics Including Clinical Applications, 5th edition, American Pharmaceutical Assoc., Washington, D.C.
[175] Ожидается, что активируемый белок интерлейкина из предыдущих примеров имеет улучшенные фармакокинетические параметры, такие как повышение времени полувыведения, по сравнению с белками, в которых отсутствует элемент для продления сывороточного времени полужизни.
Пример 9: Модель с ксенотрансплантатом опухоли
[176] Активируемый белок интерлейкина из предыдущих примеров оценивают в модели с ксенотрансплантатом.
[177] Самок иммунодефицитных мышей NOD/scid облучают сублетальной дозой (2 грэй) и подкожно инокулируют 4×106 клеток Ramos RA1 в верхнюю часть правого бока. Когда опухоли достигают 100-200 мм3, животных распределяют по 3 группам обработки. Группам 2 и 3 (по 8 животных в каждой) внутрибрюшинно инъецируют 1,5×107 активированных человеческих Т-клеток. Через трое суток животных из группы 3 последовательно обрабатывают в целом 9 внутривенными дозами 50 мкг активируемого белка интерлейкина из предыдущих примеров (один раз в сутки × 9с). Группы 1 и 2 обрабатывают только носителем. Массу тела и объем опухолей определяют в течение 30 суток.
[178] Ожидается, что животные, обработанные активируемым белком интерлейкина из предыдущих примеров, имеют статически значимое замедление роста опухоли по сравнению с соответствующей обработанной носителем контрольно группой.
[179] Хотя предпочтительные варианты осуществления данного изобретения были проиллюстрированы и описаны в данном документе, для специалистов в данной области техники очевидно, что такие варианты осуществления приведены исключительно в качестве примера. Теперь специалистам в данной области техники станут понятны многочисленные вариации, изменения и замещения, не выходящие за пределы объема изобретения. Следует понимать, что при практической реализации изобретения можно применять различные альтернативы вариантам осуществления изобретения, описанным в данном документе. Предполагается, что нижеприведенная формула изобретения определяет объем изобретения и что она охватывает способы и структуры в пределах объема этой формулы изобретения, а также их эквиваленты.
Пример 10: Эксперименты МС38
Использовали линию клеток МС38, быстро растущую линию клеток аденокарциномы толстой кишки, которая экспрессирует ММР9 in vitro. Используя эту опухолевую модель, исследовали способность слитых белков влиять на рост опухоли.

Процедуры:
Мышей анестезировали изофлураном для имплантации клеток для снижения изъязвлений. CR самкам мышей линии C57BL/6 п/к вводили 5×105 МС38 опухолевых клеток в 0% матригеле в бок. Объем инъекции клеток составлял 0,1 мл/мышь. Возраст мышей на дату начала составлял 8-12 недель. Проводили совмещение пар, когда опухоли достигали среднего объема 100-150 мм3, и начинали обработку. Массу тела измеряли на момент начала, и после этого - два раза в неделю до конца. Измерения кронциркулем проводили два раза в неделю до конца. О любых нежелательных реакциях следовало незамедлительно сообщать. Любое отдельное животное с одним наблюдением >30% потери массы тела или тремя последовательными измерениями >25% потери массы тела умерщвляли. В любой группе со средней потерей массы тела >20% или >10% введение доз прекращали; группу не умерщвляли и оставляли восстанавливаться. В группах с потерей массы>20% умерщвляли животных, достигших индивидуального конечного показателя потери массы тела. Если связанная с обработкой потеря массы тела в группе восстанавливалась до 10% от исходных значений массы, введение доз возобновляли в меньшей дозе или по схеме с менее частым введением. Исключения для не обусловленного лечением восстановления % массы тела допускались в зависимости от конкретного случая. Конечным результатом было замедление роста опухоли (ЗРО). За животными наблюдали индивидуально. Конечным результатом эксперимента был объем опухоли 1500 мм3 или 45 суток, в зависимости от того, что произойдет быстрее. За демонстрирующими ответ животными наблюдали дольше. При достижении конечного результата животных необходимо умертвить.
Пример 11: Кондиционально активные слитые белки, которые содержат блокирующий фрагмент, который представляет собой связывающий сывороточный альбумин фрагмент
[180] В этом примере описаны получение и активность слитых белков, предпочтительно цитокинов, которые обладают индуцибельной активностью, т.е. они неактивны до индукции, как правило, за счет отделения блокирующего фрагмента от активного фрагмента после расщепления линкера между блокирующим фрагментом и активным фрагментом. Слитые белки содержат один вариабельный домен антитела (dAb), который связывает сывороточный альбумин посредством петель CDR, и связывается с активным фрагментом (в данном случае анти-СО3 scFV) посредством одной или более отличных от CDR петель (например, петли С). Связывающий сывороточный альбумин блокирующий фрагмент функционально связан с активным фрагментом посредством расщепляемого протеазой линкера, а активный фрагмент функционально связан с нацеливающим доменом (в данном случае dAb против рецептора эпидермального фактора роста (EGFR) или dAb против простат-специфического мембранного антигена (PSMA)) посредством линкера, которые не расщепляется протеазой. Эти слитые белки можно вводить в виде неактивных белков, которые активируются после расщепления расщепляемого протеазой линкера и последующего высвобождения ингибирующего альбумин-связывающего домена. Анти-CD3 scFV в слитых белках является суррогатом необходимого цитокина в слитых белках, описанных в этом изобретении. Аналогичные слитые белки, которые содержат необходимый цитокин (например, IL-2, IL-12, интерферон) или его функциональный фрагмент или мутеин, нацеливающий домен и альбумин-связывающий dAb, который также связывает и ингибирует цитокин или его функциональный фрагмент или мутеин, можно получать, используя способы, описанные и проиллюстрированные в данном документе. dAb против сывороточного альбумина, который связывает и ингибирует активность необходимого цитокина или его функционального фрагмента или мутеина, может обеспечить как стерическую маскировку цитокина (за счет близости цитокина к связанному сывороточному альбумину), так и специфическую маскировку цитокина (за счет связывания с цитокином посредством отличной от CDR петли (например, петли С)). dAb против сывороточного альбумина, который связывает и ингибирует активность необходимого цитокина или его функционального фрагмента или мутеина, можно получать, используя подходящие способы, например, путем внесения разнообразия аминокислотной последовательности в отличные от CDR петли (например, петлю С) связывающего dAb против сывороточного альбумина, и проведения скрининга в отношении связывания с необходимым цитокином. Для проведения отбора можно использовать любые подходящие способы, такие как фаговый дисплей. Например, типовой dAb против сывороточного альбумина, который можно использовать, имеет следующую последовательность, а аминокислотную последовательность петли С (выделена жирным и подчеркиванием) можно диверсифицировать (например, рандомизировать), и провести скрининг полученных в результате dAb в отношении связывания с сывороточным альбумином посредством взаимодействия CDR и с цитокином посредством взаимодействия отличной от CDR петли. При необходимости аминокислотную последовательность известного цитокин-связывающего пептида можно привить в петлю С.
EVQLVESGGGLVOPGNSLRLSCAASGFTFSKFGMSWVRQGGGGGLDGNEEPGGLEWVSSISGSGRDTLYADSVKGRFTISRDNAKTTLYLQMNSLRPEDTAVYYCTIGGSLSVSSQGTLVTVSS (SEQ ID NO: 92)
А. Активация протеазой ProTriTAC приводит к существенно повышенной активности in vitro
[181] Очищенный ProTriTAC (пролекарство), нерасщепляемый ProTriTAC [пролекарство (нерасщепляемый)] и рекомбинантный активный лекарственный фрагмент, имитирующий активность активированного протеазой ProTriTAC (активное лекарство) исследовали в отношении связывания с рекомбинантным человеческим CD3 в анализе ИФА, связывания с очищенными человеческими первичными Т-клетками в анализе проточной цитометрии и функциональной эффективности в Т-клеточно-зависимом анализе клеточной цитотоксично сти.
[182] Для ИФА растворимые белки ProTriTAC в указанных концентрациях инкубировали с иммобилизованным рекомбинантным человеческим CD3e (R&D Systems) в течение 1 ч при комнатной температуре в ФСБ, дополненном 15 мг/мл человеческого сывороточного альбумина. Планшеты блокировали, используя SuperBlock (Thermo Fisher), промывали, используя ФСБ с 0,05% Твин-20, и проводили обнаружение, используя неконкурентное анти-СО3 идиотипическое моноклональное антитело 11D3, а после него - меченное пероксидазой вторичное антитело и раствор субстрата ТМБ-ИФА (Thermo Fisher).
[183] Для проточной цитометрии растворимые белки ProTriTAC в указанных концентрациях инкубировали с очищенными человеческими первичными Т-клетками в течение 1 ч при 4°С в присутствии ФСБ с 2% фетальной бычьей сыворотки и 15 мг/мл человеческого сывороточного альбумина. Планшеты промывали ФСБ с 2% фетальной бычьей сыворотки, проводили обнаружение, используя AlexaFluor 647-меченное неконкурентное анти-СО3 идиотипическое моноклональное антитело 11D3, а данные анализировали, используя FlowJo 10 (Flow Jo, LLC).
[184] Для определения функциональной эффективности в Т-клеточно-зависимом анализе клеточной цитотоксичности растворимые белки ProTriTAC в указанных концентрациях инкубировали с очищенными покоящимися человеческими Т-клетками (эффекторные клетки) и раковыми клетками НСТ116 (целевые клетки) в соотношении 10:1 эффекторныещелевые клетки в течение 48 ч при 37°С. Линию целевых клеток НСТ116 стабильно трансфицировали репортерным геном люциферазы, чтобы провести измерение опосредованного Т-клетками уничтожения клеток с помощью ONE-Glo (Promega).
B. ProTriTAC демонстрирует сильную, протеазо-зависимую противоопухолевую активность в модели с ксенотрансплантатом опухоли у грызунов
[185] ProTriTAC оценивали в отношении их противоопухолевой активности in vivo в подкожной ксенотрансплантатной опухоли НСТ116 с добавленными размноженными человеческими Т-клетками у иммунодефицитных мышей NCG. В частности, 5×106 клеток НСТ116 смешивали с 2,5×106 размноженных Т-клеток на мышь на сутки 0. Введение доз ProTriTAC проводили, начиная со следующих суток по схеме каждые сутки × 10 посредством внутрибрюшинной инъекции. Объем опухолей определяли, используя проводимые с помощью кронциркуля измерения, и рассчитывали, используя формулу V=(длина × ширина × ширина)/2 в указанные моменты времени.
C. Экспрессия, очистка и стабильность типовых триспецифических молекул ProTriTAC
Выработка белка
[186] Последовательности, кодирующие молекулы индуцибельного слитого белка, клонировали в экспрессионный вектор млекопитающих pcDNA 3.4 (Inviitrogen), перед ними находилась лидерная последовательность, а за ними - 6х гистидиновая метка (SEQ ID NO: 91). Клетки Expi293F (Life Technologies A14527) поддерживали в суспензии в пробирках для оптимального роста (Thomson) от 0,2 до 8 × 1е6 клеток/мл в среде Expi 293. Очищенную плазмидную ДНК трансфицировали в клетки Expi293 в соответствии с протоколами набора с экспрессионной системой для Expi293 (Life Technologies, А14635) и поддерживали в течение 4 6 суток после трансфекции. В альтернативном варианте последовательности, кодирующие молекулы слитого белка, клонировали в экспрессионный вектор млекопитающих pDEF38 (CMC ICOS), трансфицировали в клетки CHO-DG44 dhfr-, создавали стабильные пулы и культивировали в среде для выработки в течение до 12 суток перед очисткой. Количество типовых слитых белков в кондиционированной среде оценивали, используя прибор Octet RED 96 с наконечниками с протеином A (ForteBio/Pall), используя контрольный слитый белок для стандартной кривой. Кондиционированную среду из любых клеток-хозяев фильтровали и частично очищали с помощью аффинной и обессоливающей хроматографии. После этого слитые белки полировали с помощью ионообменной хроматографии и после объединения фракций вмешивали в нейтральный буфер, содержащий вспомогательный вещества. Конечную степень чистоты оценивали с помощью ДСН-ПААГ и аналитической ЭХ, используя колонку Acquity ВЕН SEC 200 1,7 мкм 4,6×150 мм (Waters Corporation), разрешали в водной/органической подвижной фазе со вспомогательными веществами при нейтральном рН на системе 1290 LC и интегрировали пики с помощью программного обеспечения Chemstation CDS (Agilent). Слитые белки, очищенные из клеток СНО, приведены на ДСН-ПААГ, проиллюстрированном ниже.
Оценка стабильности
[187] Очищенные слитые белки в двух составах субаликвотировали в стерильные пробирки и подвергали стрессовым условиями посредством пяти циклов замораживания-размораживания, каждый из которых включал более 1 часа при -80°С и комнатной температуре, или посредством инкубации при 37°С в течение 1 недели. Подвергнутые стрессу образцы оценивали в отношении концентрации и мутности с помощью УФОспектрометрии, используя УФ-прозрачные 96-луночные планшеты (Corning 3635), с помощью программного обеспечения SpectraMax М2 и SoftMaxPro (Molecular Devices), ДСН-ПААГ и аналитической ЭХ, и сравнивали с таким же анализом контрольных не подвергнутых стрессу образцов. Наложение хроматограмм аналитической ЭХ контрольных и подвергнутых стрессу образцов для одной типовой молекулы ProTriTAC, очищенной из клеток-хозяев 293, проиллюстрировано ниже.
[188] Результаты показывают, что ProTriTAC вырабатывались на сравнимом уровне с регулярными TriTAC из стабильных пулов СНО; и что свойства белков были стабильными после повторяемых циклов замораживания-размораживания и 37°С в течение 1 недели.
D. Демонстрация функциональной маскировки и стабильности ProTriTAC in vivo в трехнедельном исследовании фармакокинетики на яванских макаках
[189] Одну дозу нацеленного на PSMA ProTriTAC (SEQ ID NO: 74), нерасщепляемого ProTriTAC (SEQ ID NO: 75), немаскированного/нерасщепляемого TriTAC (SEQ ID NO: 78) и активного лекарства, имитирующего активированный протеазой ProTriTAC (SEQ ID NO: 76) вводили яванским макакам в дозе 0,1 мг/кг путем внутривенной инъекции. Образцы плазмы получали в указанные моменты времени. Концентрации ProTriTAC определяли, используя анализ связывания лиганда с биотинилиро ванным рекомбинантным человеческим PSMA (R&D systems) и сульфо-меченным анти-СО3 идиотипическим антителом 11D3 в анализе MSD (Meso Scale Diagnostic, LLC). Фармакокинетические параметры оценивали, используя программное обеспечение для фармакокинетики Phoenix WinNonlin и некомпартментный подход, согласующийся с внутривенным болюсным путем введения.
[190] Чтобы рассчитать скорость in vivo превращения пролекарства, оценивали концентрацию активного лекарства в циркуляции путем решения следующей системы дифференциальных уравнений, где Р - концентрация пролекарства, А - концентрация активного лекарства, ka - скорость активации пролекарства в циркуляции, kc,P - скорость выведения пролекарства, а kc,А- скорость выведения активного лекарства.
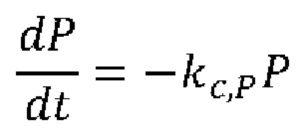
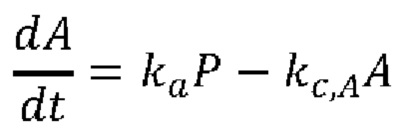
[191] Скорость выведения пролекарства, активного лекарства и нерасщепляемого контрольного пролекарства (kc,NCLV) определяли эмпирически у яванских макаков. Чтобы оценить скорость активации пролекарства в циркуляции, мы предположили, что разница между скоростью выведения расщепляемого пролекарства и нерасщепляемого пролекарства возникает исключительно вследствие неспецифической активации в циркуляции. Следовательно, скорость превращения пролекарства в активное лекарство в циркуляции оценивали путем вычитания скорости выведения расщепляемого пролекарства из нерасщепляемого пролекарства.

[192] Исходную концентрацию пролекарства в циркуляции определяли эмпирически, а исходную концентрацию активного лекарства приняли за ноль.
Результаты и обсуждение
[193] Результаты примера 11 показывают, что можно получать слитые белки, которые содержат полипептид с необходимой терапевтической активностью, такой как цитокин или его функциональный фрагмент или мутеин, или анти-СО3 scFV, в которых терапевтическая активность маскируется маскирующим доменом, который связывается как с сывороточным альбумином, так и с активным полипептидом. Маскирующий домен функционально связан с активным доменом посредство расщепляемого протеазой линкера. Результаты показывают, что этот тип слитого белка можно вводить в виде неактивного белка, который активируется после расщепления протеазой в необходимом месте терапевтической активности, таком как опухоль.
[194] Аминокислотные последовательности слитых белков из примера 11 приведены как SEQ ID NO: 71-78.
[195] Примеры конструкций слитых белков подробно описаны в таблице 3. В таблице 3 «L» является сокращением «линкера», а «расщепл. линк.» является сокращением «расщепляемого линкера». Другие сокращения: «mIFNg» обозначает мышиный интерферон гамма (IFNg); «hAlbumin» обозначает человеческий сывороточный альбумин (ЧСА); «mAlbumin» обозначает мышиный сывороточный альбумин.
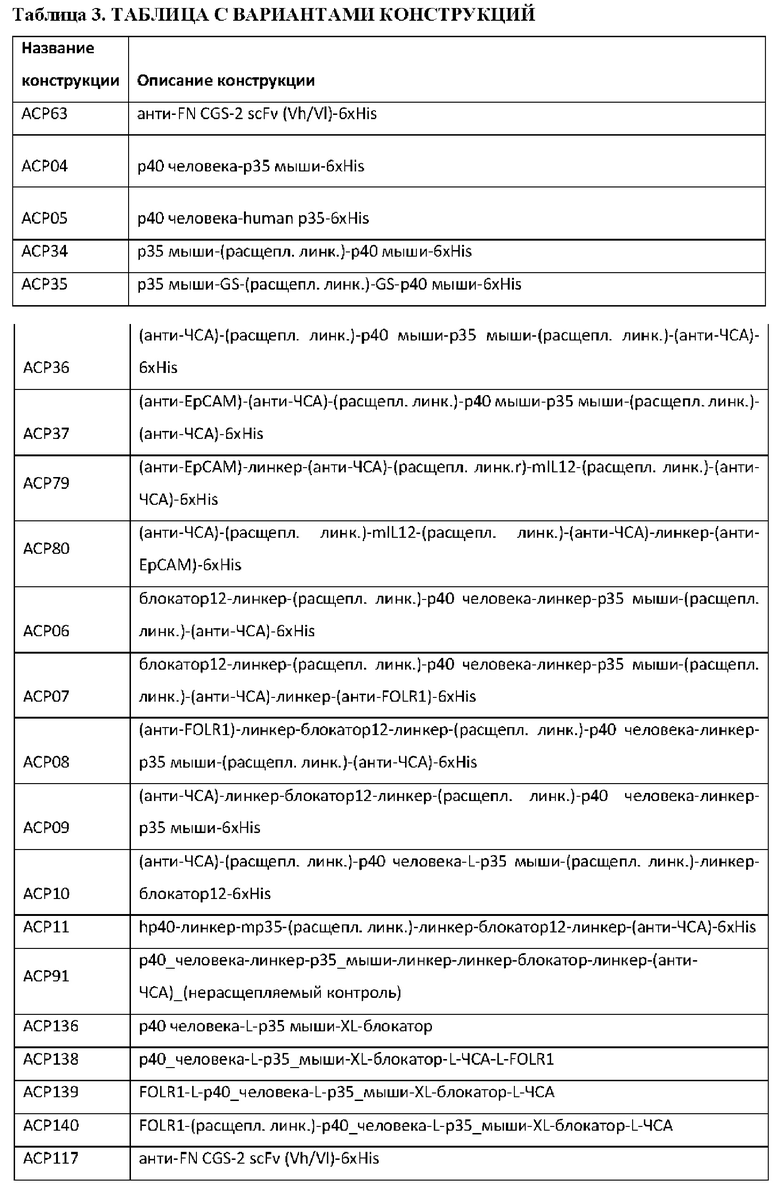






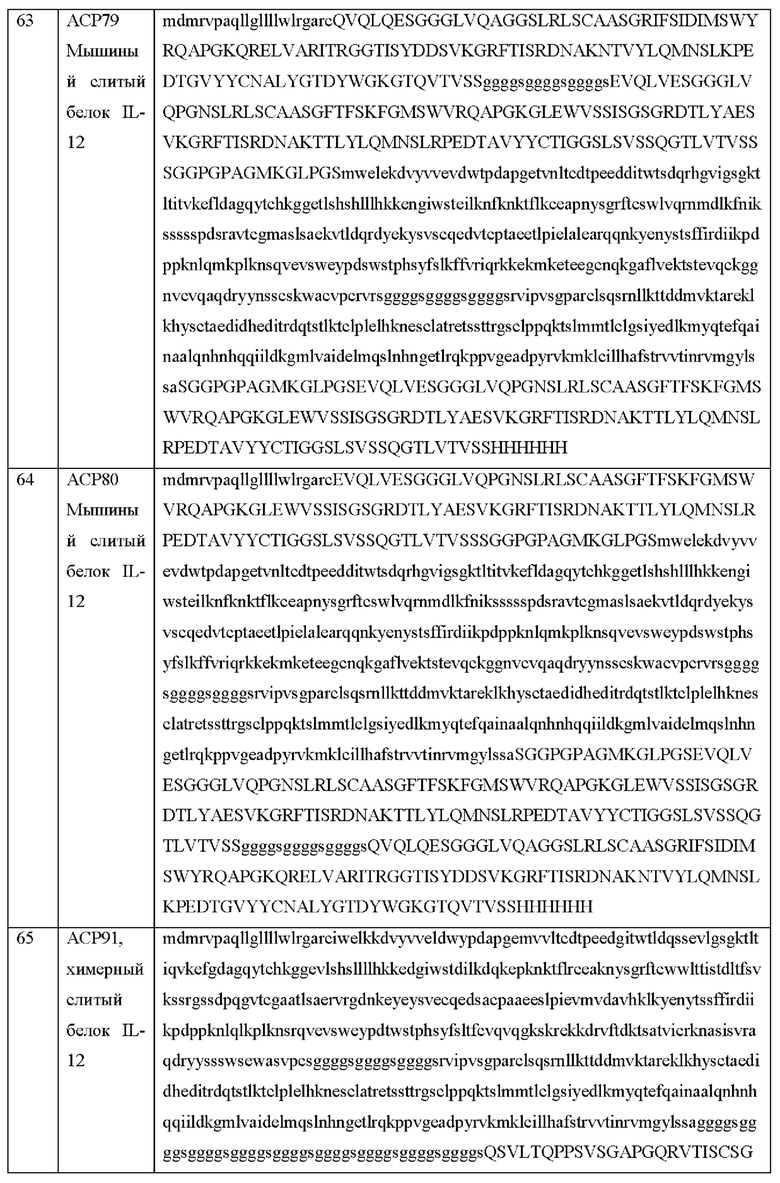

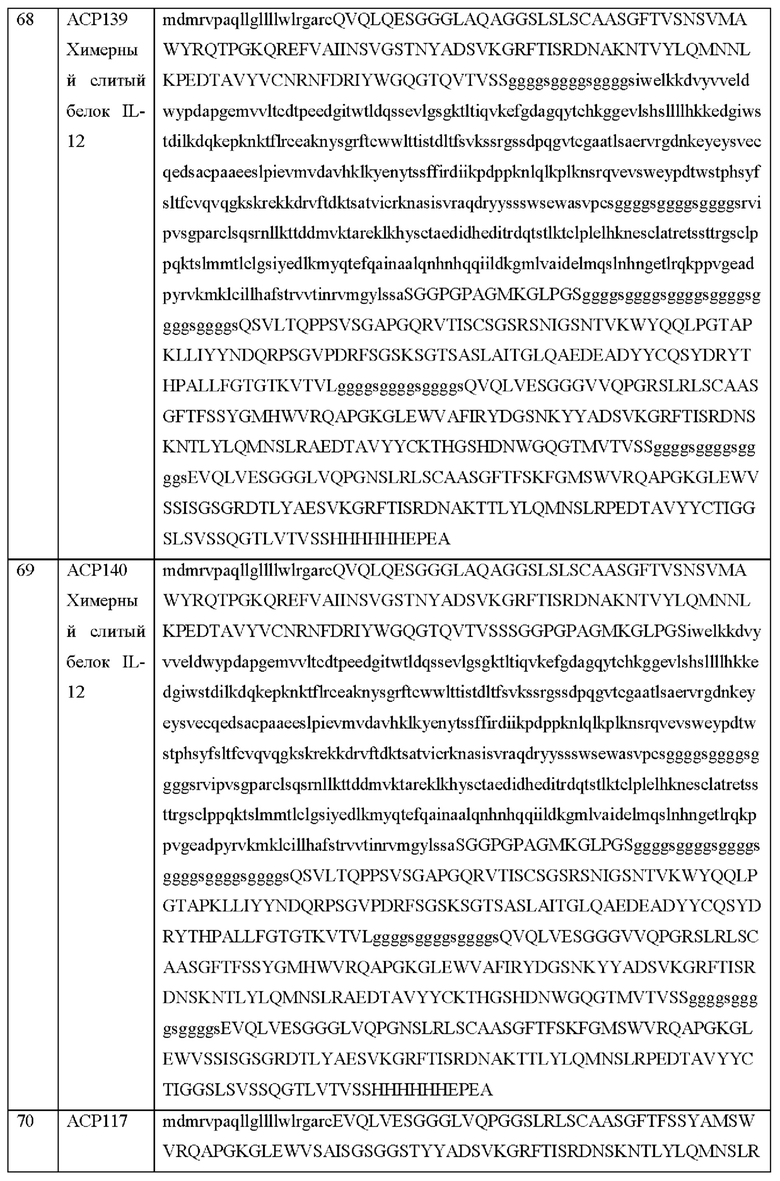



ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
[196] Полное содержание всех патентных и непатентных публикаций, цитируемых в данном документе, включено посредством ссылки в полном объеме и во всех целях.
ДРУГИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
[197] Вышеприведенное описание может охватывать многие отличные изобретения с независимым применением. Хотя каждое из этих изобретений было описано в предпочтительной(ых) форме(ах), конкретные варианты их осуществления, описанные и проиллюстрированные в данном документе, не следует воспринимать в ограничительном смысле, поскольку возможны много численные вариации. Предмет данного изобретения включает все новые и неочевидные комбинации и подкомбинации различных элементов, признаков, функций и/или свойств, описанных в данном документе. В частности, в нижеприведенной формуле изобретения указаны определенные комбинации и подкомбинации, считающиеся новыми и неочевидными. Изобретения, осуществленные в других комбинациях и подкомбинациях признаков, функций, элементов и/или свойств, могут быть заявлены в данной заявке, в заявках, заявляющих приоритет по данной заявке, или в родственных заявках. Такие заявляемые пункты, относящиеся к другому изобретению или к одному и тому же изобретению, и имеющий более широкий, более узкий, эквивалентный или отличный объем по сравнению с оригинальными заявляемыми пунктами, также считаются включенными в предмет изобретение данного описания.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ВЕРВУЛФ ТЕРАПЬЮТИКС, ИНК.
<120> АКТИВИРУЕМЫЕ ПОЛИПЕПТИДЫ ИНТЕРЛЕЙКИНА 12 И СПОСОБЫ ИХ
ПРИМЕНЕНИЯ
<130>105365-0022
<140>
<141>
<150> 62/756515
<151> 2018-11-06
<150> 62/756504
<151> 2018-11-06
<150> 62/671225
<151> 2018-05-14
<160> 92
<170>PatentIn, версия 3.5
<210> 1
<211> 609
<212> Белок
<213> Homo sapiens
<400> 1
Met Lys Trp Val ThrPhe Ile Ser Leu LeuPhe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Arg Gly Val Phe Arg Arg Asp Ala His Lys Ser Glu Val Ala
20 25 30
His Arg Phe Lys Asp Leu Gly Glu GluAsnPhe Lys Ala Leu Val Leu
35 40 45
Ile Ala Phe Ala Gln Tyr Leu Gln GlnCys Pro Phe Glu Asp His Val
50 55 60
Lys Leu Val Asn Glu Val Thr Glu Phe Ala Lys ThrCys Val Ala Asp
65 70 75 80
Glu Ser Ala Glu AsnCys Asp Lys Ser Leu His Thr Leu PheGly Asp
85 90 95
Lys Leu CysThr Val Ala Thr Leu Arg Glu Thr Tyr Gly Glu Met Ala
100 105 110
Asp CysCys Ala Lys Gln Glu Pro Glu Arg Asn Glu CysPhe Leu Gln
115 120 125
His Lys Asp AspAsn Pro Asn Leu Pro Arg Leu Val Arg Pro Glu Val
130 135 140
Asp Val Met CysThr Ala Phe His Asp Asn Glu GluThrPhe Leu Lys
145 150 155 160
Lys Tyr Leu Tyr Glu Ile Ala Arg Arg His Pro Tyr Phe Tyr Ala Pro
165 170 175
Glu Leu LeuPhePhe Ala Lys Arg Tyr Lys Ala AlaPheThr Glu Cys
180 185 190
Cys Gln Ala Ala Asp Lys Ala AlaCys Leu Leu Pro Lys Leu Asp Glu
195 200 205
Leu Arg Asp Glu Gly Lys Ala Ser Ser Ala Lys Gln Gly Leu Lys Cys
210 215 220
Ala Ser Leu Gln Lys PheGly Glu Arg Ala Phe Lys Ala Trp Ala Val
225 230 235 240
Ala Arg Leu Ser Gln Arg Phe Pro Lys Ala Glu Phe Ala Glu Val Ser
245 250 255
Lys Leu Val Thr Asp Leu Thr Lys Val His Thr Glu CysCys His Gly
260 265 270
Asp Leu Leu Glu Cys Ala Asp Asp Arg Ala Asp Leu Ala Lys Tyr Ile
275 280 285
Cys Glu Asn Gln Asp Ser Ile Ser Ser Lys Leu Lys Glu CysCys Glu
290 295 300
Lys Pro Leu Leu Glu Lys Ser His Cys Ile Ala Glu Val Glu Asn Asp
305 310 315 320
Glu Met Pro Ala Asp Leu Pro Ser Leu Ala Ala Asp Phe Val Gly Ser
325 330 335
Lys Asp Val Cys Lys Asn Tyr Ala Glu Ala Lys Asp Val Phe Leu Gly
340 345 350
Met Phe Leu Tyr Glu Tyr Ala Arg Arg His Pro Asp Tyr Ser Val Val
355 360 365
Leu LeuLeu Arg Leu Ala Lys Thr Tyr Glu ThrThr Leu Glu Lys Cys
370 375 380
Cys Ala AlaAla Asp Pro His Glu Cys Tyr Ala Lys Val Phe Asp Glu
385 390 395 400
Phe Lys Pro Leu Val Glu Glu Pro Gln Asn Leu Ile Lys Gln AsnCys
405 410 415
Glu Leu Phe Glu Gln Leu Gly Glu Tyr Lys Phe Gln Asn Ala Leu Leu
420 425 430
Val Arg Tyr Thr Lys Lys Val Pro Gln Val Ser Thr Pro Thr Leu Val
435 440 445
Glu Val Ser Arg Asn Leu Gly Lys Val Gly Ser Lys CysCys Lys His
450 455 460
Pro Glu Ala Lys Arg Met Pro Cys Ala Glu Asp Cys Leu Ser Val Phe
465 470 475 480
Leu Asn Gln Leu Cys Val Leu His Glu Lys Thr Pro Val Ser Asp Arg
485 490 495
Val Thr Lys CysCysThr Glu Ser Leu Val AsnGly Arg Pro CysPhe
500 505 510
Ser Ala Leu Glu Val Asp Glu Thr Tyr Val Pro Lys Glu PheAsn Ala
515 520 525
Glu ThrPheThrPhe His Ala Asp Ile CysThr Leu Ser Glu Lys Glu
530 535 540
Arg Gln Ile Lys Lys Gln Thr Ala Leu Val Glu Leu Val Lys His Lys
545 550 555 560
Pro Lys Ala Thr Lys Glu Gln Leu Lys Ala Val Met Asp AspPhe Ala
565 570 575
Ala Phe Val Glu Lys CysCys Lys Ala Asp Asp Lys Glu ThrCysPhe
580 585 590
Ala Glu GluGly Lys Lys Leu Val Ala Ala Ser Gln Ala Ala Leu Gly
595 600 605
Leu
<210> 2
<211> 8
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
последовательность домена расщепления MMP7"
<400> 2
LysArgAlaLeuGlyLeu Pro Gly
1 5
<210> 3
<211> 40
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
последовательность домена расщепления MMP7"
<400> 3
AspGluAspGluAspGluAspGluAspGluAspGluAspGluAspGlu
1 5 10 15
Arg Pro Leu Ala Leu Trp Arg Ser Asp Arg Asp Arg Asp Arg Asp Arg
20 25 30
Asp Arg Asp Arg Asp Arg Asp Arg
35 40
<210> 4
<211> 5
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
последовательность домена расщепления MMP9"
<220>
<221> ВАРИАНТ
<222> (3)..(3)
<223> /замена="Thr"
<220>
<221> ВАРИАНТ
<222> (4)..(4)
<223> /замена="Ile"
<220>
<221> ВАРИАНТ
<222> (5)..(5)
<223> /замена="Thr"
<220>
<221> SITE
<222> (1)..(5)
<223> /примечание="Вариантные остатки, приведенные в последовательности,
не имеют преимущества относительно находящихся в
обозначениях для вариантных позиций"
<400> 4
Pro ArgSerLeuSer
1 5
<210> 5
<211> 5
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
последовательность домена расщепления MMP9"
<400> 5
LeuGluAlaThrAla
1 5
<210> 6
<211> 10
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
последовательность домена расщепления MMP11"
<400> 6
GlyGlyAlaAlaAsnLeuValArgGlyGly
1 5 10
<210> 7
<211> 10
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
последовательность домена расщепления MMP14"
<400> 7
SerGlyArgIleGlyPheLeuArgThrAla
1 5 10
<210> 8
<211> 6
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
последовательность домена расщепления MMP"
<400> 8
Pro LeuGlyLeuAlaGly
1 5
<210> 9
<211> 6
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
последовательность домена расщепления MMP"
<220>
<221> МОД_ОСТ
<222> (6)..(6)
<223> Любая аминокислота
<400> 9
Pro LeuGlyLeuAlaXaa
1 5
<210> 10
<211> 6
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
последовательность домена расщепления MMP"
<220>
<221> МОД_ОСТ
<222> (4)..(4)
<223>Cys(me)
<400> 10
Pro Leu GlyXaa Ala Gly
1 5
<210> 11
<211> 8
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
последовательность домена расщепления MMP"
<400> 11
GluSer Pro AlaTyrTyrThrAla
1 5
<210> 12
<211> 6
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
последовательность домена расщепления MMP"
<400> 12
ArgLeuGlnLeuLysLeu
1 5
<210> 13
<211> 7
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
последовательность домена расщепления MMP"
<400> 13
ArgLeuGlnLeuLysAlaCys
1 5
<210> 14
<211> 7
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
MMP2, MMP9, последовательность домена расщепления MMP14"
<220>
<221> МОД_ОСТ
<222> (3)..(3)
<223>Cit
<220>
<221> МОД_ОСТ
<222> (5)..(5)
<223> Hof
<400> 14
Glu Pro Xaa Gly Xaa Tyr Leu
1 5
<210> 15
<211> 5
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления активатора
плазминогенаурокиназного типа (uPA)"
<400> 15
Ser Gly Arg Ser Ala
1 5
<210> 16
<211> 4
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления активатора
плазминогенаурокиназного типа (uPA)"
<400> 16
AspAlaPheLys
1
<210> 17
<211> 5
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления активатора
плазминогенаурокиназного типа (uPA)"
<400> 17
Gly Gly Gly Arg Arg
1 5
<210> 18
<211> 4
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления лизосомального фермента"
<400> 18
GlyPheLeuGly
1
<210> 19
<211> 4
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления лизосомального фермента"
<400> 19
AlaLeuAlaLeu
1
<210> 20
<211> 2
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления лизосомального фермента"
<400> 20
PheLys
1
<210> 21
<211> 3
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления катепсина B"
<400> 21
AsnLeuLeu
1
<210> 22
<211> 5
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления катепсина D"
<220>
<221>МОД_ОСТ
<222> (3)..(3)
<223> Cys(Et)
<400> 22
Pro Ile Xaa Phe Phe
1 5
<210> 23
<211> 8
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления катепсина K"
<400> 23
Gly Gly Pro Arg Gly Leu Pro Gly
1 5
<210> 24
<211> 6
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления простат-специфического антигена"
<400> 24
His Ser Ser Lys Leu Gln
1 5
<210> 25
<211> 7
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления простат-специфического антигена"
<400> 25
His Ser Ser Lys Leu Gln Leu
1 5
<210> 26
<211> 9
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления простат-специфического антигена"
<400> 26
His Ser Ser Lys Leu Gln Glu Asp Ala
1 5
<210> 27
<211> 10
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления протеазой вируса простого герпеса"
<400> 27
Leu Val Leu Ala Ser Ser Ser Phe Gly Tyr
1 5 10
<210> 28
<211> 10
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления протеазой ВИЧ"
<400> 28
Gly Val Ser Gln Asn Tyr Pro Ile Val Gly
1 5 10
<210> 29
<211> 10
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления протеазой ЦМВ"
<400> 29
Gly Val Val Gln Ala Ser Cys Arg Leu Ala
1 5 10
<210> 30
<211> 4
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления тромбина"
<220>
<221> МОД_ОСТ
<222> (2)..(2)
<223> 2-карбоксипиперидин
<400> 30
PheXaaArgSer
1
<210> 31
<211> 6
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления тромбина"
<400> 31
Asp Pro ArgSerPheLeu
1 5
<210> 32
<211> 6
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления тромбина"
<400> 32
Pro ProArgSerPheLeu
1 5
<210> 33
<211> 4
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления каспазы-3"
<400> 33
AspGluValAsp
1
<210> 34
<211> 5
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления каспазы-3"
<400> 34
AspGluValAsp Pro
1 5
<210> 35
<211> 8
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления каспазы-3"
<400> 35
LysGlySerGlyAspValGluGly
1 5
<210> 36
<211> 6
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления
интерлейкин 1-бета-конвертирующего фермента"
<400> 36
Gly Trp Glu His Asp Gly
1 5
<210> 37
<211> 7
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления энтерокиназы"
<400> 37
GluAspAspAspAspLysAla
1 5
<210> 38
<211> 9
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления FAP"
<400> 38
LysGlnGluGlnAsn Pro GlySerThr
1 5
<210> 39
<211> 6
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления калликреина 2"
<400> 39
GlyLysAlaPheArgArg
1 5
<210> 40
<211> 4
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления плазмина"
<400> 40
AspAlaPheLys
1
<210> 41
<211> 4
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления плазмина"
<400> 41
AspValLeuLys
1
<210> 42
<211> 4
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления плазмина"
<400> 42
AspAlaPheLys
1
<210> 43
<211> 7
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность домена расщепления TOP"
<400> 43
AlaLeuLeuLeuAlaLeuLeu
1 5
<210> 44
<211> 520
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 44
Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr
1 5 10 15
Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu
20 25 30
Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly
35 40 45
Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Glu Phe Gly Asp Ala Gly
50 55 60
Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu
65 70 75 80
Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys
85 90 95
Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys
100 105 110
Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr
115 120 125
Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln
130 135 140
Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly
145 150 155 160
Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala
165 170 175
Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala
180 185 190
Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg
195 200 205
Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu
210 215 220
Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp
225 230 235 240
Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln
245 250 255
Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr
260 265 270
Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala
275 280 285
Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro
290 295 300
Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
305 310 315 320
Ser Arg Val Ile Pro Val Ser Gly Pro Ala Arg Cys Leu Ser Gln Ser
325 330 335
Arg Asn Leu Leu Lys Thr Thr Asp Asp Met Val Lys Thr Ala Arg Glu
340 345 350
Lys Leu Lys His Tyr Ser Cys Thr Ala Glu Asp Ile Asp His Glu Asp
355 360 365
Ile Thr Arg Asp Gln Thr Ser Thr Leu Lys Thr Cys Leu Pro Leu Glu
370 375 380
Leu His Lys Asn Glu Ser Cys Leu Ala Thr Arg Glu Thr Ser Ser Thr
385 390 395 400
Thr Arg Gly Ser Cys Leu Pro Pro Gln Lys Thr Ser Leu Met Met Thr
405 410 415
Leu Cys Leu Gly Ser Ile Tyr Glu Asp Leu Lys Met Tyr Gln Thr Glu
420 425 430
Phe Gln Ala Ile Asn Ala Ala Leu Gln Asn His Asn His Gln Gln Ile
435 440 445
Ile Leu Asp Lys Gly Met Leu Val Ala Ile Asp Glu Leu Met Gln Ser
450 455 460
Leu Asn His Asn Gly Glu Thr Leu Arg Gln Lys Pro Pro Val Gly Glu
465 470 475 480
Ala Asp Pro Tyr Arg Val Lys Met Lys Leu Cys Ile Leu Leu His Ala
485 490 495
Phe Ser Thr Arg Val Val Thr Ile Asn Arg Val Met Gly Tyr Leu Ser
500 505 510
Ser Ala His His His His His His
515 520
<210> 45
<211> 524
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 45
Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr
1 5 10 15
Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu
20 25 30
Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly
35 40 45
Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Glu Phe Gly Asp Ala Gly
50 55 60
Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu
65 70 75 80
Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys
85 90 95
Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys
100 105 110
Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr
115 120 125
Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln
130 135 140
Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly
145 150 155 160
Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala
165 170 175
Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala
180 185 190
Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg
195 200 205
Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu
210 215 220
Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp
225 230 235 240
Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln
245 250 255
Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr
260 265 270
Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala
275 280 285
Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro
290 295 300
Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
305 310 315 320
Ser Arg Asn Leu Pro Val Ala Thr Pro Asp Pro Gly Met Phe Pro Cys
325 330 335
Leu His His Ser Gln Asn Leu Leu Arg Ala Val Ser Asn Met Leu Gln
340 345 350
Lys Ala Arg Gln Thr Leu Glu Phe Tyr Pro Cys Thr Ser Glu Glu Ile
355 360 365
Asp His Glu Asp Ile Thr Lys Asp Lys Thr Ser Thr Val Glu Ala Cys
370 375 380
Leu Pro Leu Glu Leu Thr Lys Asn Glu Ser Cys Leu Asn Ser Arg Glu
385 390 395 400
Thr Ser Phe Ile Thr Asn Gly Ser Cys Leu Ala Ser Arg Lys Thr Ser
405 410 415
Phe Met Met Ala Leu Cys Leu Ser Ser Ile Tyr Glu Asp Leu Lys Met
420 425 430
Tyr Gln Val Glu Phe Lys Thr Met Asn Ala Lys Leu Leu Met Asp Pro
435 440 445
Lys Arg Gln Ile Phe Leu Asp Gln Asn Met Leu Ala Val Ile Asp Glu
450 455 460
Leu Met Gln Ala Leu Asn Phe Asn Ser Glu Thr Val Pro Gln Lys Ser
465 470 475 480
Ser Leu Glu Glu Pro Asp Phe Tyr Lys Thr Lys Ile Lys Leu Cys Ile
485 490 495
Leu Leu His Ala Phe Arg Ile Arg Ala Val Thr Ile Asp Arg Val Met
500 505 510
Ser Tyr Leu Asn Ala Ser His His His His His His
515 520
<210> 46
<211> 940
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 46
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Arg Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Tyr Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Arg Tyr Thr
85 90 95
His Pro Ala Leu Leu Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Val
115 120 125
Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu
130 135 140
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr Gly Met
145 150 155 160
His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Phe
165 170 175
Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys Gly
180 185 190
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
195 200 205
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Lys Thr
210 215 220
His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr Val Ser
225 230 235 240
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
245 250 255
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser
260 265 270
Gly Gly Pro Gly Pro Ala Gly Met Lys Gly Leu Pro Gly Ser Ile Trp
275 280 285
Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr Pro Asp
290 295 300
Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu Glu Asp
305 310 315 320
Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly Ser Gly
325 330 335
Lys Thr Leu Thr Ile Gln Val Lys Glu Phe Gly Asp Ala Gly Gln Tyr
340 345 350
Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu Leu Leu
355 360 365
His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys Asp Gln
370 375 380
Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys Asn Tyr
385 390 395 400
Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr Asp Leu
405 410 415
Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln Gly Val
420 425 430
Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly Asp Asn
435 440 445
Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala Cys Pro
450 455 460
Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala Val His
465 470 475 480
Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg Asp Ile
485 490 495
Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu Lys Asn
500 505 510
Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp Ser Thr
515 520 525
Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln Gly Lys
530 535 540
Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr Ser Ala
545 550 555 560
Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala Gln Asp
565 570 575
Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro Cys Ser
580 585 590
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Arg
595 600 605
Val Ile Pro Val Ser Gly Pro Ala Arg Cys Leu Ser Gln Ser Arg Asn
610 615 620
Leu Leu Lys Thr Thr Asp Asp Met Val Lys Thr Ala Arg Glu Lys Leu
625 630 635 640
Lys His Tyr Ser Cys Thr Ala Glu Asp Ile Asp His Glu Asp Ile Thr
645 650 655
Arg Asp Gln Thr Ser Thr Leu Lys Thr Cys Leu Pro Leu Glu Leu His
660 665 670
Lys Asn Glu Ser Cys Leu Ala Thr Arg Glu Thr Ser Ser Thr Thr Arg
675 680 685
Gly Ser Cys Leu Pro Pro Gln Lys Thr Ser Leu Met Met Thr Leu Cys
690 695 700
Leu Gly Ser Ile Tyr Glu Asp Leu Lys Met Tyr Gln Thr Glu Phe Gln
705 710 715 720
Ala Ile Asn Ala Ala Leu Gln Asn His Asn His Gln Gln Ile Ile Leu
725 730 735
Asp Lys Gly Met Leu Val Ala Ile Asp Glu Leu Met Gln Ser Leu Asn
740 745 750
His Asn Gly Glu Thr Leu Arg Gln Lys Pro Pro Val Gly Glu Ala Asp
755 760 765
Pro Tyr Arg Val Lys Met Lys Leu Cys Ile Leu Leu His Ala Phe Ser
770 775 780
Thr Arg Val Val Thr Ile Asn Arg Val Met Gly Tyr Leu Ser Ser Ala
785 790 795 800
Ser Gly Gly Pro Gly Pro Ala Gly Met Lys Gly Leu Pro Gly Ser Glu
805 810 815
Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn Ser
820 825 830
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Lys Phe Gly
835 840 845
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser
850 855 860
Ser Ile Ser Gly Ser Gly Arg Asp Thr Leu Tyr Ala Glu Ser Val Lys
865 870 875 880
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr Leu
885 890 895
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys Thr
900 905 910
Ile Gly Gly Ser Leu Ser Val Ser Ser Gln Gly Thr Leu Val Thr Val
915 920 925
Ser Ser His His His His His His Glu Pro Glu Ala
930 935 940
<210> 47
<211> 1069
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 47
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Arg Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Tyr Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu Gln
65 70 75 80
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Arg Tyr Thr
85 90 95
His Pro Ala Leu Leu Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105 110
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Val
115 120 125
Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu
130 135 140
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr Gly Met
145 150 155 160
His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Phe
165 170 175
Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys Gly
180 185 190
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
195 200 205
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Lys Thr
210 215 220
His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr Val Ser
225 230 235 240
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
245 250 255
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser
260 265 270
Gly Gly Pro Gly Pro Ala Gly Met Lys Gly Leu Pro Gly Ser Ile Trp
275 280 285
Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr Pro Asp
290 295 300
Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu Glu Asp
305 310 315 320
Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly Ser Gly
325 330 335
Lys Thr Leu Thr Ile Gln Val Lys Glu Phe Gly Asp Ala Gly Gln Tyr
340 345 350
Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu Leu Leu
355 360 365
His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys Asp Gln
370 375 380
Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys Asn Tyr
385 390 395 400
Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr Asp Leu
405 410 415
Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln Gly Val
420 425 430
Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly Asp Asn
435 440 445
Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala Cys Pro
450 455 460
Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala Val His
465 470 475 480
Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg Asp Ile
485 490 495
Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu Lys Asn
500 505 510
Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp Ser Thr
515 520 525
Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln Gly Lys
530 535 540
Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr Ser Ala
545 550 555 560
Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala Gln Asp
565 570 575
Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro Cys Ser
580 585 590
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Arg
595 600 605
Val Ile Pro Val Ser Gly Pro Ala Arg Cys Leu Ser Gln Ser Arg Asn
610 615 620
Leu Leu Lys Thr Thr Asp Asp Met Val Lys Thr Ala Arg Glu Lys Leu
625 630 635 640
Lys His Tyr Ser Cys Thr Ala Glu Asp Ile Asp His Glu Asp Ile Thr
645 650 655
Arg Asp Gln Thr Ser Thr Leu Lys Thr Cys Leu Pro Leu Glu Leu His
660 665 670
Lys Asn Glu Ser Cys Leu Ala Thr Arg Glu Thr Ser Ser Thr Thr Arg
675 680 685
Gly Ser Cys Leu Pro Pro Gln Lys Thr Ser Leu Met Met Thr Leu Cys
690 695 700
Leu Gly Ser Ile Tyr Glu Asp Leu Lys Met Tyr Gln Thr Glu Phe Gln
705 710 715 720
Ala Ile Asn Ala Ala Leu Gln Asn His Asn His Gln Gln Ile Ile Leu
725 730 735
Asp Lys Gly Met Leu Val Ala Ile Asp Glu Leu Met Gln Ser Leu Asn
740 745 750
His Asn Gly Glu Thr Leu Arg Gln Lys Pro Pro Val Gly Glu Ala Asp
755 760 765
Pro Tyr Arg Val Lys Met Lys Leu Cys Ile Leu Leu His Ala Phe Ser
770 775 780
Thr Arg Val Val Thr Ile Asn Arg Val Met Gly Tyr Leu Ser Ser Ala
785 790 795 800
Ser Gly Gly Pro Gly Pro Ala Gly Met Lys Gly Leu Pro Gly Ser Glu
805 810 815
Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn Ser
820 825 830
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Lys Phe Gly
835 840 845
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser
850 855 860
Ser Ile Ser Gly Ser Gly Arg Asp Thr Leu Tyr Ala Glu Ser Val Lys
865 870 875 880
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr Leu
885 890 895
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys Thr
900 905 910
Ile Gly Gly Ser Leu Ser Val Ser Ser Gln Gly Thr Leu Val Thr Val
915 920 925
Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
930 935 940
Ser Gln Val Gln Leu Gln Glu Ser Gly Gly Gly Leu Ala Gln Ala Gly
945 950 955 960
Gly Ser Leu Ser Leu Ser Cys Ala Ala Ser Gly Phe Thr Val Ser Asn
965 970 975
Ser Val Met Ala Trp Tyr Arg Gln Thr Pro Gly Lys Gln Arg Glu Phe
980 985 990
Val Ala Ile Ile Asn Ser Val Gly Ser Thr Asn Tyr Ala Asp Ser Val
995 1000 1005
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val
1010 1015 1020
Tyr Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Val Tyr
1025 1030 1035
Val Cys Asn Arg Asn Phe Asp Arg Ile Tyr Trp Gly Gln Gly Thr
1040 1045 1050
Gln Val Thr Val Ser Ser His His His His His His Glu Pro Glu
1055 1060 1065
Ala
<210> 48
<211> 1069
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 48
Gln Val Gln Leu Gln Glu Ser Gly Gly Gly Leu Ala Gln Ala Gly Gly
1 5 10 15
Ser Leu Ser Leu Ser Cys Ala Ala Ser Gly Phe Thr Val Ser Asn Ser
20 25 30
Val Met Ala Trp Tyr Arg Gln Thr Pro Gly Lys Gln Arg Glu Phe Val
35 40 45
Ala Ile Ile Asn Ser Val Gly Ser Thr Asn Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Val Tyr Val Cys Asn
85 90 95
Arg Asn Phe Asp Arg Ile Tyr Trp Gly Gln Gly Thr Gln Val Thr Val
100 105 110
Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly
130 135 140
Gln Arg Val Thr Ile Ser Cys Ser Gly Ser Arg Ser Asn Ile Gly Ser
145 150 155 160
Asn Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu
165 170 175
Leu Ile Tyr Tyr Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe
180 185 190
Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu
195 200 205
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Arg Tyr
210 215 220
Thr His Pro Ala Leu Leu Phe Gly Thr Gly Thr Lys Val Thr Val Leu
225 230 235 240
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
245 250 255
Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser
260 265 270
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr Gly
275 280 285
Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala
290 295 300
Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
305 310 315 320
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
325 330 335
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Lys
340 345 350
Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr Val
355 360 365
Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
370 375 380
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
385 390 395 400
Ser Gly Gly Pro Gly Pro Ala Gly Met Lys Gly Leu Pro Gly Ser Ile
405 410 415
Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr Pro
420 425 430
Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu Glu
435 440 445
Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly Ser
450 455 460
Gly Lys Thr Leu Thr Ile Gln Val Lys Glu Phe Gly Asp Ala Gly Gln
465 470 475 480
Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu Leu
485 490 495
Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys Asp
500 505 510
Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys Asn
515 520 525
Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr Asp
530 535 540
Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln Gly
545 550 555 560
Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly Asp
565 570 575
Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala Cys
580 585 590
Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala Val
595 600 605
His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg Asp
610 615 620
Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu Lys
625 630 635 640
Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp Ser
645 650 655
Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln Gly
660 665 670
Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr Ser
675 680 685
Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala Gln
690 695 700
Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro Cys
705 710 715 720
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
725 730 735
Arg Val Ile Pro Val Ser Gly Pro Ala Arg Cys Leu Ser Gln Ser Arg
740 745 750
Asn Leu Leu Lys Thr Thr Asp Asp Met Val Lys Thr Ala Arg Glu Lys
755 760 765
Leu Lys His Tyr Ser Cys Thr Ala Glu Asp Ile Asp His Glu Asp Ile
770 775 780
Thr Arg Asp Gln Thr Ser Thr Leu Lys Thr Cys Leu Pro Leu Glu Leu
785 790 795 800
His Lys Asn Glu Ser Cys Leu Ala Thr Arg Glu Thr Ser Ser Thr Thr
805 810 815
Arg Gly Ser Cys Leu Pro Pro Gln Lys Thr Ser Leu Met Met Thr Leu
820 825 830
Cys Leu Gly Ser Ile Tyr Glu Asp Leu Lys Met Tyr Gln Thr Glu Phe
835 840 845
Gln Ala Ile Asn Ala Ala Leu Gln Asn His Asn His Gln Gln Ile Ile
850 855 860
Leu Asp Lys Gly Met Leu Val Ala Ile Asp Glu Leu Met Gln Ser Leu
865 870 875 880
Asn His Asn Gly Glu Thr Leu Arg Gln Lys Pro Pro Val Gly Glu Ala
885 890 895
Asp Pro Tyr Arg Val Lys Met Lys Leu Cys Ile Leu Leu His Ala Phe
900 905 910
Ser Thr Arg Val Val Thr Ile Asn Arg Val Met Gly Tyr Leu Ser Ser
915 920 925
Ala Ser Gly Gly Pro Gly Pro Ala Gly Met Lys Gly Leu Pro Gly Ser
930 935 940
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn
945 950 955 960
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Lys Phe
965 970 975
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
980 985 990
Ser Ser Ile Ser Gly Ser Gly Arg Asp Thr Leu Tyr Ala Glu Ser Val
995 1000 1005
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu
1010 1015 1020
Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr
1025 1030 1035
Tyr Cys Thr Ile Gly Gly Ser Leu Ser Val Ser Ser Gln Gly Thr
1040 1045 1050
Leu Val Thr Val Ser Ser His His His His His His Glu Pro Glu
1055 1060 1065
Ala
<210> 49
<211> 940
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 49
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Lys Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Gly Arg Asp Thr Leu Tyr Ala Glu Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Gly Ser Leu Ser Val Ser Ser Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro
130 135 140
Gly Gln Arg Val Thr Ile Ser Cys Ser Gly Ser Arg Ser Asn Ile Gly
145 150 155 160
Ser Asn Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys
165 170 175
Leu Leu Ile Tyr Tyr Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg
180 185 190
Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly
195 200 205
Leu Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Arg
210 215 220
Tyr Thr His Pro Ala Leu Leu Phe Gly Thr Gly Thr Lys Val Thr Val
225 230 235 240
Leu Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
245 250 255
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
260 265 270
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
275 280 285
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
290 295 300
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
305 310 315 320
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
325 330 335
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
340 345 350
Lys Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr
355 360 365
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
370 375 380
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
385 390 395 400
Ser Ser Gly Gly Pro Gly Pro Ala Gly Met Lys Gly Leu Pro Gly Ser
405 410 415
Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr
420 425 430
Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu
435 440 445
Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly
450 455 460
Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Glu Phe Gly Asp Ala Gly
465 470 475 480
Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu
485 490 495
Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys
500 505 510
Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys
515 520 525
Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr
530 535 540
Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln
545 550 555 560
Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly
565 570 575
Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala
580 585 590
Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala
595 600 605
Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg
610 615 620
Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu
625 630 635 640
Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp
645 650 655
Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln
660 665 670
Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr
675 680 685
Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala
690 695 700
Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro
705 710 715 720
Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
725 730 735
Ser Arg Val Ile Pro Val Ser Gly Pro Ala Arg Cys Leu Ser Gln Ser
740 745 750
Arg Asn Leu Leu Lys Thr Thr Asp Asp Met Val Lys Thr Ala Arg Glu
755 760 765
Lys Leu Lys His Tyr Ser Cys Thr Ala Glu Asp Ile Asp His Glu Asp
770 775 780
Ile Thr Arg Asp Gln Thr Ser Thr Leu Lys Thr Cys Leu Pro Leu Glu
785 790 795 800
Leu His Lys Asn Glu Ser Cys Leu Ala Thr Arg Glu Thr Ser Ser Thr
805 810 815
Thr Arg Gly Ser Cys Leu Pro Pro Gln Lys Thr Ser Leu Met Met Thr
820 825 830
Leu Cys Leu Gly Ser Ile Tyr Glu Asp Leu Lys Met Tyr Gln Thr Glu
835 840 845
Phe Gln Ala Ile Asn Ala Ala Leu Gln Asn His Asn His Gln Gln Ile
850 855 860
Ile Leu Asp Lys Gly Met Leu Val Ala Ile Asp Glu Leu Met Gln Ser
865 870 875 880
Leu Asn His Asn Gly Glu Thr Leu Arg Gln Lys Pro Pro Val Gly Glu
885 890 895
Ala Asp Pro Tyr Arg Val Lys Met Lys Leu Cys Ile Leu Leu His Ala
900 905 910
Phe Ser Thr Arg Val Val Thr Ile Asn Arg Val Met Gly Tyr Leu Ser
915 920 925
Ser Ala His His His His His His Glu Pro Glu Ala
930 935 940
<210> 50
<211> 940
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 50
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Lys Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Gly Arg Asp Thr Leu Tyr Ala Glu Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Gly Ser Leu Ser Val Ser Ser Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ser Gly Gly Pro Gly Pro Ala Gly Met Lys Gly Leu Pro
115 120 125
Gly Ser Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp
130 135 140
Trp Tyr Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr
145 150 155 160
Pro Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val
165 170 175
Leu Gly Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Glu Phe Gly Asp
180 185 190
Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser
195 200 205
Leu Leu Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile
210 215 220
Leu Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu
225 230 235 240
Ala Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile
245 250 255
Ser Thr Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp
260 265 270
Pro Gln Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val
275 280 285
Arg Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp
290 295 300
Ser Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val
305 310 315 320
Asp Ala Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe
325 330 335
Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys
340 345 350
Pro Leu Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp
355 360 365
Thr Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln
370 375 380
Val Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp
385 390 395 400
Lys Thr Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val
405 410 415
Arg Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser
420 425 430
Val Pro Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
435 440 445
Gly Gly Ser Arg Val Ile Pro Val Ser Gly Pro Ala Arg Cys Leu Ser
450 455 460
Gln Ser Arg Asn Leu Leu Lys Thr Thr Asp Asp Met Val Lys Thr Ala
465 470 475 480
Arg Glu Lys Leu Lys His Tyr Ser Cys Thr Ala Glu Asp Ile Asp His
485 490 495
Glu Asp Ile Thr Arg Asp Gln Thr Ser Thr Leu Lys Thr Cys Leu Pro
500 505 510
Leu Glu Leu His Lys Asn Glu Ser Cys Leu Ala Thr Arg Glu Thr Ser
515 520 525
Ser Thr Thr Arg Gly Ser Cys Leu Pro Pro Gln Lys Thr Ser Leu Met
530 535 540
Met Thr Leu Cys Leu Gly Ser Ile Tyr Glu Asp Leu Lys Met Tyr Gln
545 550 555 560
Thr Glu Phe Gln Ala Ile Asn Ala Ala Leu Gln Asn His Asn His Gln
565 570 575
Gln Ile Ile Leu Asp Lys Gly Met Leu Val Ala Ile Asp Glu Leu Met
580 585 590
Gln Ser Leu Asn His Asn Gly Glu Thr Leu Arg Gln Lys Pro Pro Val
595 600 605
Gly Glu Ala Asp Pro Tyr Arg Val Lys Met Lys Leu Cys Ile Leu Leu
610 615 620
His Ala Phe Ser Thr Arg Val Val Thr Ile Asn Arg Val Met Gly Tyr
625 630 635 640
Leu Ser Ser Ala Ser Gly Gly Pro Gly Pro Ala Gly Met Lys Gly Leu
645 650 655
Pro Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
660 665 670
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
675 680 685
Ser Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly
690 695 700
Gln Arg Val Thr Ile Ser Cys Ser Gly Ser Arg Ser Asn Ile Gly Ser
705 710 715 720
Asn Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu
725 730 735
Leu Ile Tyr Tyr Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe
740 745 750
Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu
755 760 765
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Arg Tyr
770 775 780
Thr His Pro Ala Leu Leu Phe Gly Thr Gly Thr Lys Val Thr Val Leu
785 790 795 800
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
805 810 815
Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser
820 825 830
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr Gly
835 840 845
Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala
850 855 860
Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
865 870 875 880
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
885 890 895
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Lys
900 905 910
Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr Val
915 920 925
Ser Ser His His His His His His Glu Pro Glu Ala
930 935 940
<210> 51
<211> 940
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 51
Ile Trp Glu Leu Lys Lys Asp Val Tyr Val Val Glu Leu Asp Trp Tyr
1 5 10 15
Pro Asp Ala Pro Gly Glu Met Val Val Leu Thr Cys Asp Thr Pro Glu
20 25 30
Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln Ser Ser Glu Val Leu Gly
35 40 45
Ser Gly Lys Thr Leu Thr Ile Gln Val Lys Glu Phe Gly Asp Ala Gly
50 55 60
Gln Tyr Thr Cys His Lys Gly Gly Glu Val Leu Ser His Ser Leu Leu
65 70 75 80
Leu Leu His Lys Lys Glu Asp Gly Ile Trp Ser Thr Asp Ile Leu Lys
85 90 95
Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe Leu Arg Cys Glu Ala Lys
100 105 110
Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp Leu Thr Thr Ile Ser Thr
115 120 125
Asp Leu Thr Phe Ser Val Lys Ser Ser Arg Gly Ser Ser Asp Pro Gln
130 135 140
Gly Val Thr Cys Gly Ala Ala Thr Leu Ser Ala Glu Arg Val Arg Gly
145 150 155 160
Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu Cys Gln Glu Asp Ser Ala
165 170 175
Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile Glu Val Met Val Asp Ala
180 185 190
Val His Lys Leu Lys Tyr Glu Asn Tyr Thr Ser Ser Phe Phe Ile Arg
195 200 205
Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Leu Lys Pro Leu
210 215 220
Lys Asn Ser Arg Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Thr Trp
225 230 235 240
Ser Thr Pro His Ser Tyr Phe Ser Leu Thr Phe Cys Val Gln Val Gln
245 250 255
Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg Val Phe Thr Asp Lys Thr
260 265 270
Ser Ala Thr Val Ile Cys Arg Lys Asn Ala Ser Ile Ser Val Arg Ala
275 280 285
Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser Glu Trp Ala Ser Val Pro
290 295 300
Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
305 310 315 320
Ser Arg Val Ile Pro Val Ser Gly Pro Ala Arg Cys Leu Ser Gln Ser
325 330 335
Arg Asn Leu Leu Lys Thr Thr Asp Asp Met Val Lys Thr Ala Arg Glu
340 345 350
Lys Leu Lys His Tyr Ser Cys Thr Ala Glu Asp Ile Asp His Glu Asp
355 360 365
Ile Thr Arg Asp Gln Thr Ser Thr Leu Lys Thr Cys Leu Pro Leu Glu
370 375 380
Leu His Lys Asn Glu Ser Cys Leu Ala Thr Arg Glu Thr Ser Ser Thr
385 390 395 400
Thr Arg Gly Ser Cys Leu Pro Pro Gln Lys Thr Ser Leu Met Met Thr
405 410 415
Leu Cys Leu Gly Ser Ile Tyr Glu Asp Leu Lys Met Tyr Gln Thr Glu
420 425 430
Phe Gln Ala Ile Asn Ala Ala Leu Gln Asn His Asn His Gln Gln Ile
435 440 445
Ile Leu Asp Lys Gly Met Leu Val Ala Ile Asp Glu Leu Met Gln Ser
450 455 460
Leu Asn His Asn Gly Glu Thr Leu Arg Gln Lys Pro Pro Val Gly Glu
465 470 475 480
Ala Asp Pro Tyr Arg Val Lys Met Lys Leu Cys Ile Leu Leu His Ala
485 490 495
Phe Ser Thr Arg Val Val Thr Ile Asn Arg Val Met Gly Tyr Leu Ser
500 505 510
Ser Ala Ser Gly Gly Pro Gly Pro Ala Gly Met Lys Gly Leu Pro Gly
515 520 525
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
530 535 540
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
545 550 555 560
Ser Val Leu Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln Arg
565 570 575
Val Thr Ile Ser Cys Ser Gly Ser Arg Ser Asn Ile Gly Ser Asn Thr
580 585 590
Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu Ile
595 600 605
Tyr Tyr Asn Asp Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser Gly
610 615 620
Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu Gln Ala
625 630 635 640
Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Arg Tyr Thr His
645 650 655
Pro Ala Leu Leu Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly Gly
660 665 670
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln
675 680 685
Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg
690 695 700
Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr Gly Met His
705 710 715 720
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Phe Ile
725 730 735
Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys Gly Arg
740 745 750
Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met
755 760 765
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Lys Thr His
770 775 780
Gly Ser His Asp Asn Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
785 790 795 800
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
805 810 815
Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn Ser
820 825 830
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Lys Phe Gly
835 840 845
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser
850 855 860
Ser Ile Ser Gly Ser Gly Arg Asp Thr Leu Tyr Ala Glu Ser Val Lys
865 870 875 880
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr Leu
885 890 895
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys Thr
900 905 910
Ile Gly Gly Ser Leu Ser Val Ser Ser Gln Gly Thr Leu Val Thr Val
915 920 925
Ser Ser His His His His His His Glu Pro Glu Ala
930 935 940
<210> 52
<211> 328
<212>Белок
<213> Homo sapiens
<400> 52
Met Cys His Gln Gln Leu Val Ile Ser Trp Phe Ser Leu Val Phe Leu
1 5 10 15
Ala Ser Pro Leu Val Ala Ile Trp Glu Leu Lys Lys Asp Val Tyr Val
20 25 30
Val Glu Leu Asp Trp Tyr Pro Asp Ala Pro Gly Glu Met Val Val Leu
35 40 45
Thr Cys Asp Thr Pro Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln
50 55 60
Ser Ser Glu Val Leu Gly Ser Gly Lys Thr Leu Thr Ile Gln Val Lys
65 70 75 80
Glu Phe Gly Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Val
85 90 95
Leu Ser His Ser Leu Leu Leu Leu His Lys Lys Glu Asp Gly Ile Trp
100 105 110
Ser Thr Asp Ile Leu Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe
115 120 125
Leu Arg Cys Glu Ala Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp
130 135 140
Leu Thr Thr Ile Ser Thr Asp Leu Thr Phe Ser Val Lys Ser Ser Arg
145 150 155 160
Gly Ser Ser Asp Pro Gln Gly Val Thr Cys Gly Ala Ala Thr Leu Ser
165 170 175
Ala Glu Arg Val Arg Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu
180 185 190
Cys Gln Glu Asp Ser Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile
195 200 205
Glu Val Met Val Asp Ala Val His Lys Leu Lys Tyr Glu Asn Tyr Thr
210 215 220
Ser Ser Phe Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn
225 230 235 240
Leu Gln Leu Lys Pro Leu Lys Asn Ser Arg Gln Val Glu Val Ser Trp
245 250 255
Glu Tyr Pro Asp Thr Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Thr
260 265 270
Phe Cys Val Gln Val Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg
275 280 285
Val Phe Thr Asp Lys Thr Ser Ala Thr Val Ile Cys Arg Lys Asn Ala
290 295 300
Ser Ile Ser Val Arg Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser
305 310 315 320
Glu Trp Ala Ser Val Pro Cys Ser
325
<210> 53
<211> 215
<212>Белок
<213> Mus musculus
<400> 53
Met Cys Gln Ser Arg Tyr Leu Leu Phe Leu Ala Thr Leu Ala Leu Leu
1 5 10 15
Asn His Leu Ser Leu Ala Arg Val Ile Pro Val Ser Gly Pro Ala Arg
20 25 30
Cys Leu Ser Gln Ser Arg Asn Leu Leu Lys Thr Thr Asp Asp Met Val
35 40 45
Lys Thr Ala Arg Glu Lys Leu Lys His Tyr Ser Cys Thr Ala Glu Asp
50 55 60
Ile Asp His Glu Asp Ile Thr Arg Asp Gln Thr Ser Thr Leu Lys Thr
65 70 75 80
Cys Leu Pro Leu Glu Leu His Lys Asn Glu Ser Cys Leu Ala Thr Arg
85 90 95
Glu Thr Ser Ser Thr Thr Arg Gly Ser Cys Leu Pro Pro Gln Lys Thr
100 105 110
Ser Leu Met Met Thr Leu Cys Leu Gly Ser Ile Tyr Glu Asp Leu Lys
115 120 125
Met Tyr Gln Thr Glu Phe Gln Ala Ile Asn Ala Ala Leu Gln Asn His
130 135 140
Asn His Gln Gln Ile Ile Leu Asp Lys Gly Met Leu Val Ala Ile Asp
145 150 155 160
Glu Leu Met Gln Ser Leu Asn His Asn Gly Glu Thr Leu Arg Gln Lys
165 170 175
Pro Pro Val Gly Glu Ala Asp Pro Tyr Arg Val Lys Met Lys Leu Cys
180 185 190
Ile Leu Leu His Ala Phe Ser Thr Arg Val Val Thr Ile Asn Arg Val
195 200 205
Met Gly Tyr Leu Ser Ser Ala
210 215
<210> 54
<211> 862
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность IL12Rb-2"
<400> 54
Met Ala His Thr Phe Arg Gly Cys Ser Leu Ala Phe Met Phe Ile Ile
1 5 10 15
Thr Trp Leu Leu Ile Lys Ala Lys Ile Asp Ala Cys Lys Arg Gly Asp
20 25 30
Val Thr Val Lys Pro Ser His Val Ile Leu Leu Gly Ser Thr Val Asn
35 40 45
Ile Thr Cys Ser Leu Lys Pro Arg Gln Gly Cys Phe His Tyr Ser Arg
50 55 60
Arg Asn Lys Leu Ile Leu Tyr Lys Phe Asp Arg Arg Ile Asn Phe His
65 70 75 80
His Gly His Ser Leu Asn Ser Gln Val Thr Gly Leu Pro Leu Gly Thr
85 90 95
Thr Leu Phe Val Cys Lys Leu Ala Cys Ile Asn Ser Asp Glu Ile Gln
100 105 110
Ile Cys Gly Ala Glu Ile Phe Val Gly Val Ala Pro Glu Gln Pro Gln
115 120 125
Asn Leu Ser Cys Ile Gln Lys Gly Glu Gln Gly Thr Val Ala Cys Thr
130 135 140
Trp Glu Arg Gly Arg Asp Thr His Leu Tyr Thr Glu Tyr Thr Leu Gln
145 150 155 160
Leu Ser Gly Pro Lys Asn Leu Thr Trp Gln Lys Gln Cys Lys Asp Ile
165 170 175
Tyr Cys Asp Tyr Leu Asp Phe Gly Ile Asn Leu Thr Pro Glu Ser Pro
180 185 190
Glu Ser Asn Phe Thr Ala Lys Val Thr Ala Val Asn Ser Leu Gly Ser
195 200 205
Ser Ser Ser Leu Pro Ser Thr Phe Thr Phe Leu Asp Ile Val Arg Pro
210 215 220
Leu Pro Pro Trp Asp Ile Arg Ile Lys Phe Gln Lys Ala Ser Val Ser
225 230 235 240
Arg Cys Thr Leu Tyr Trp Arg Asp Glu Gly Leu Val Leu Leu Asn Arg
245 250 255
Leu Arg Tyr Arg Pro Ser Asn Ser Arg Leu Trp Asn Met Val Asn Val
260 265 270
Thr Lys Ala Lys Gly Arg His Asp Leu Leu Asp Leu Lys Pro Phe Thr
275 280 285
Glu Tyr Glu Phe Gln Ile Ser Ser Lys Leu His Leu Tyr Lys Gly Ser
290 295 300
Trp Ser Asp Trp Ser Glu Ser Leu Arg Ala Gln Thr Pro Glu Glu Glu
305 310 315 320
Pro Thr Gly Met Leu Asp Val Trp Tyr Met Lys Arg His Ile Asp Tyr
325 330 335
Ser Arg Gln Gln Ile Ser Leu Phe Trp Lys Asn Leu Ser Val Ser Glu
340 345 350
Ala Arg Gly Lys Ile Leu His Tyr Gln Val Thr Leu Gln Glu Leu Thr
355 360 365
Gly Gly Lys Ala Met Thr Gln Asn Ile Thr Gly His Thr Ser Trp Thr
370 375 380
Thr Val Ile Pro Arg Thr Gly Asn Trp Ala Val Ala Val Ser Ala Ala
385 390 395 400
Asn Ser Lys Gly Ser Ser Leu Pro Thr Arg Ile Asn Ile Met Asn Leu
405 410 415
Cys Glu Ala Gly Leu Leu Ala Pro Arg Gln Val Ser Ala Asn Ser Glu
420 425 430
Gly Met Asp Asn Ile Leu Val Thr Trp Gln Pro Pro Arg Lys Asp Pro
435 440 445
Ser Ala Val Gln Glu Tyr Val Val Glu Trp Arg Glu Leu His Pro Gly
450 455 460
Gly Asp Thr Gln Val Pro Leu Asn Trp Leu Arg Ser Arg Pro Tyr Asn
465 470 475 480
Val Ser Ala Leu Ile Ser Glu Asn Ile Lys Ser Tyr Ile Cys Tyr Glu
485 490 495
Ile Arg Val Tyr Ala Leu Ser Gly Asp Gln Gly Gly Cys Ser Ser Ile
500 505 510
Leu Gly Asn Ser Lys His Lys Ala Pro Leu Ser Gly Pro His Ile Asn
515 520 525
Ala Ile Thr Glu Glu Lys Gly Ser Ile Leu Ile Ser Trp Asn Ser Ile
530 535 540
Pro Val Gln Glu Gln Met Gly Cys Leu Leu His Tyr Arg Ile Tyr Trp
545 550 555 560
Lys Glu Arg Asp Ser Asn Ser Gln Pro Gln Leu Cys Glu Ile Pro Tyr
565 570 575
Arg Val Ser Gln Asn Ser His Pro Ile Asn Ser Leu Gln Pro Arg Val
580 585 590
Thr Tyr Val Leu Trp Met Thr Ala Leu Thr Ala Ala Gly Glu Ser Ser
595 600 605
His Gly Asn Glu Arg Glu Phe Cys Leu Gln Gly Lys Ala Asn Trp Met
610 615 620
Ala Phe Val Ala Pro Ser Ile Cys Ile Ala Ile Ile Met Val Gly Ile
625 630 635 640
Phe Ser Thr His Tyr Phe Gln Gln Lys Val Phe Val Leu Leu Ala Ala
645 650 655
Leu Arg Pro Gln Trp Cys Ser Arg Glu Ile Pro Asp Pro Ala Asn Ser
660 665 670
Thr Cys Ala Lys Lys Tyr Pro Ile Ala Glu Glu Lys Thr Gln Leu Pro
675 680 685
Leu Asp Arg Leu Leu Ile Asp Trp Pro Thr Pro Glu Asp Pro Glu Pro
690 695 700
Leu Val Ile Ser Glu Val Leu His Gln Val Thr Pro Val Phe Arg His
705 710 715 720
Pro Pro Cys Ser Asn Trp Pro Gln Arg Glu Lys Gly Ile Gln Gly His
725 730 735
Gln Ala Ser Glu Lys Asp Met Met His Ser Ala Ser Ser Pro Pro Pro
740 745 750
Pro Arg Ala Leu Gln Ala Glu Ser Arg Gln Leu Val Asp Leu Tyr Lys
755 760 765
Val Leu Glu Ser Arg Gly Ser Asp Pro Lys Pro Glu Asn Pro Ala Cys
770 775 780
Pro Trp Thr Val Leu Pro Ala Gly Asp Leu Pro Thr His Asp Gly Tyr
785 790 795 800
Leu Pro Ser Asn Ile Asp Asp Leu Pro Ser His Glu Ala Pro Leu Ala
805 810 815
Asp Ser Leu Glu Glu Leu Glu Pro Gln His Ile Ser Leu Ser Val Phe
820 825 830
Pro Ser Ser Ser Leu His Pro Leu Thr Phe Ser Cys Gly Asp Lys Leu
835 840 845
Thr Leu Asp Gln Leu Lys Met Arg Cys Asp Ser Leu Met Leu
850 855 860
<210> 55
<211> 662
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Последовательность IL12Rb-1"
<400> 55
Met Glu Pro Leu Val Thr Trp Val Val Pro Leu Leu Phe Leu Phe Leu
1 5 10 15
Leu Ser Arg Gln Gly Ala Ala Cys Arg Thr Ser Glu Cys Cys Phe Gln
20 25 30
Asp Pro Pro Tyr Pro Asp Ala Asp Ser Gly Ser Ala Ser Gly Pro Arg
35 40 45
Asp Leu Arg Cys Tyr Arg Ile Ser Ser Asp Arg Tyr Glu Cys Ser Trp
50 55 60
Gln Tyr Glu Gly Pro Thr Ala Gly Val Ser His Phe Leu Arg Cys Cys
65 70 75 80
Leu Ser Ser Gly Arg Cys Cys Tyr Phe Ala Ala Gly Ser Ala Thr Arg
85 90 95
Leu Gln Phe Ser Asp Gln Ala Gly Val Ser Val Leu Tyr Thr Val Thr
100 105 110
Leu Trp Val Glu Ser Trp Ala Arg Asn Gln Thr Glu Lys Ser Pro Glu
115 120 125
Val Thr Leu Gln Leu Tyr Asn Ser Val Lys Tyr Glu Pro Pro Leu Gly
130 135 140
Asp Ile Lys Val Ser Lys Leu Ala Gly Gln Leu Arg Met Glu Trp Glu
145 150 155 160
Thr Pro Asp Asn Gln Val Gly Ala Glu Val Gln Phe Arg His Arg Thr
165 170 175
Pro Ser Ser Pro Trp Lys Leu Gly Asp Cys Gly Pro Gln Asp Asp Asp
180 185 190
Thr Glu Ser Cys Leu Cys Pro Leu Glu Met Asn Val Ala Gln Glu Phe
195 200 205
Gln Leu Arg Arg Arg Gln Leu Gly Ser Gln Gly Ser Ser Trp Ser Lys
210 215 220
Trp Ser Ser Pro Val Cys Val Pro Pro Glu Asn Pro Pro Gln Pro Gln
225 230 235 240
Val Arg Phe Ser Val Glu Gln Leu Gly Gln Asp Gly Arg Arg Arg Leu
245 250 255
Thr Leu Lys Glu Gln Pro Thr Gln Leu Glu Leu Pro Glu Gly Cys Gln
260 265 270
Gly Leu Ala Pro Gly Thr Glu Val Thr Tyr Arg Leu Gln Leu His Met
275 280 285
Leu Ser Cys Pro Cys Lys Ala Lys Ala Thr Arg Thr Leu His Leu Gly
290 295 300
Lys Met Pro Tyr Leu Ser Gly Ala Ala Tyr Asn Val Ala Val Ile Ser
305 310 315 320
Ser Asn Gln Phe Gly Pro Gly Leu Asn Gln Thr Trp His Ile Pro Ala
325 330 335
Asp Thr His Thr Glu Pro Val Ala Leu Asn Ile Ser Val Gly Thr Asn
340 345 350
Gly Thr Thr Met Tyr Trp Pro Ala Arg Ala Gln Ser Met Thr Tyr Cys
355 360 365
Ile Glu Trp Gln Pro Val Gly Gln Asp Gly Gly Leu Ala Thr Cys Ser
370 375 380
Leu Thr Ala Pro Gln Asp Pro Asp Pro Ala Gly Met Ala Thr Tyr Ser
385 390 395 400
Trp Ser Arg Glu Ser Gly Ala Met Gly Gln Glu Lys Cys Tyr Tyr Ile
405 410 415
Thr Ile Phe Ala Ser Ala His Pro Glu Lys Leu Thr Leu Trp Ser Thr
420 425 430
Val Leu Ser Thr Tyr His Phe Gly Gly Asn Ala Ser Ala Ala Gly Thr
435 440 445
Pro His His Val Ser Val Lys Asn His Ser Leu Asp Ser Val Ser Val
450 455 460
Asp Trp Ala Pro Ser Leu Leu Ser Thr Cys Pro Gly Val Leu Lys Glu
465 470 475 480
Tyr Val Val Arg Cys Arg Asp Glu Asp Ser Lys Gln Val Ser Glu His
485 490 495
Pro Val Gln Pro Thr Glu Thr Gln Val Thr Leu Ser Gly Leu Arg Ala
500 505 510
Gly Val Ala Tyr Thr Val Gln Val Arg Ala Asp Thr Ala Trp Leu Arg
515 520 525
Gly Val Trp Ser Gln Pro Gln Arg Phe Ser Ile Glu Val Gln Val Ser
530 535 540
Asp Trp Leu Ile Phe Phe Ala Ser Leu Gly Ser Phe Leu Ser Ile Leu
545 550 555 560
Leu Val Gly Val Leu Gly Tyr Leu Gly Leu Asn Arg Ala Ala Arg His
565 570 575
Leu Cys Pro Pro Leu Pro Thr Pro Cys Ala Ser Ser Ala Ile Glu Phe
580 585 590
Pro Gly Gly Lys Glu Thr Trp Gln Trp Ile Asn Pro Val Asp Phe Gln
595 600 605
Glu Glu Ala Ser Leu Gln Glu Ala Leu Val Val Glu Met Ser Trp Asp
610 615 620
Lys Gly Glu Arg Thr Glu Pro Leu Glu Lys Thr Glu Leu Pro Glu Gly
625 630 635 640
Ala Pro Glu Leu Ala Leu Asp Thr Glu Leu Ser Leu Glu Asp Gly Asp
645 650 655
Arg Cys Lys Ala Lys Met
660
<210> 56
<211> 328
<212>Белок
<213> Homo sapiens
<400> 56
Met Cys His Gln Gln Leu Val Ile Ser Trp Phe Ser Leu Val Phe Leu
1 5 10 15
Ala Ser Pro Leu Val Ala Ile Trp Glu Leu Lys Lys Asp Val Tyr Val
20 25 30
Val Glu Leu Asp Trp Tyr Pro Asp Ala Pro Gly Glu Met Val Val Leu
35 40 45
Thr Cys Asp Thr Pro Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln
50 55 60
Ser Ser Glu Val Leu Gly Ser Gly Lys Thr Leu Thr Ile Gln Val Lys
65 70 75 80
Glu Phe Gly Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Val
85 90 95
Leu Ser His Ser Leu Leu Leu Leu His Lys Lys Glu Asp Gly Ile Trp
100 105 110
Ser Thr Asp Ile Leu Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe
115 120 125
Leu Arg Cys Glu Ala Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp
130 135 140
Leu Thr Thr Ile Ser Thr Asp Leu Thr Phe Ser Val Lys Ser Ser Arg
145 150 155 160
Gly Ser Ser Asp Pro Gln Gly Val Thr Cys Gly Ala Ala Thr Leu Ser
165 170 175
Ala Glu Arg Val Arg Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu
180 185 190
Cys Gln Glu Asp Ser Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile
195 200 205
Glu Val Met Val Asp Ala Val His Lys Leu Lys Tyr Glu Asn Tyr Thr
210 215 220
Ser Ser Phe Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn
225 230 235 240
Leu Gln Leu Lys Pro Leu Lys Asn Ser Arg Gln Val Glu Val Ser Trp
245 250 255
Glu Tyr Pro Asp Thr Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Thr
260 265 270
Phe Cys Val Gln Val Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg
275 280 285
Val Phe Thr Asp Lys Thr Ser Ala Thr Val Ile Cys Arg Lys Asn Ala
290 295 300
Ser Ile Ser Val Arg Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser
305 310 315 320
Glu Trp Ala Ser Val Pro Cys Ser
325
<210> 57
<211> 335
<212>Белок
<213> Mus musculus
<400> 57
Met Cys Pro Gln Lys Leu Thr Ile Ser Trp Phe Ala Ile Val Leu Leu
1 5 10 15
Val Ser Pro Leu Met Ala Met Trp Glu Leu Glu Lys Asp Val Tyr Val
20 25 30
Val Glu Val Asp Trp Thr Pro Asp Ala Pro Gly Glu Thr Val Asn Leu
35 40 45
Thr Cys Asp Thr Pro Glu Glu Asp Asp Ile Thr Trp Thr Ser Asp Gln
50 55 60
Arg His Gly Val Ile Gly Ser Gly Lys Thr Leu Thr Ile Thr Val Lys
65 70 75 80
Glu Phe Leu Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Thr
85 90 95
Leu Ser His Ser His Leu Leu Leu His Lys Lys Glu Asn Gly Ile Trp
100 105 110
Ser Thr Glu Ile Leu Lys Asn Phe Lys Asn Lys Thr Phe Leu Lys Cys
115 120 125
Glu Ala Pro Asn Tyr Ser Gly Arg Phe Thr Cys Ser Trp Leu Val Gln
130 135 140
Arg Asn Met Asp Leu Lys Phe Asn Ile Lys Ser Ser Ser Ser Ser Pro
145 150 155 160
Asp Ser Arg Ala Val Thr Cys Gly Met Ala Ser Leu Ser Ala Glu Lys
165 170 175
Val Thr Leu Asp Gln Arg Asp Tyr Glu Lys Tyr Ser Val Ser Cys Gln
180 185 190
Glu Asp Val Thr Cys Pro Thr Ala Glu Glu Thr Leu Pro Ile Glu Leu
195 200 205
Ala Leu Glu Ala Arg Gln Gln Asn Lys Tyr Glu Asn Tyr Ser Thr Ser
210 215 220
Phe Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln
225 230 235 240
Met Lys Pro Leu Lys Asn Ser Gln Val Glu Val Ser Trp Glu Tyr Pro
245 250 255
Asp Ser Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Lys Phe Phe Val
260 265 270
Arg Ile Gln Arg Lys Lys Glu Lys Met Lys Glu Thr Glu Glu Gly Cys
275 280 285
Asn Gln Lys Gly Ala Phe Leu Val Glu Lys Thr Ser Thr Glu Val Gln
290 295 300
Cys Lys Gly Gly Asn Val Cys Val Gln Ala Gln Asp Arg Tyr Tyr Asn
305 310 315 320
Ser Ser Cys Ser Lys Trp Ala Cys Val Pro Cys Arg Val Arg Ser
325 330 335
<210> 58
<211> 276
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 58
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1 5 10 15
Leu Arg Gly Ala Arg Cys Glu Val Gln Leu Val Glu Ser Gly Gly Gly
20 25 30
Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly
35 40 45
Phe Thr Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly
50 55 60
Lys Gly Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr
65 70 75 80
Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn
85 90 95
Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp
100 105 110
Thr Ala Val Tyr Tyr Cys Ala Arg Gly Val Gly Ala Phe Arg Pro Tyr
115 120 125
Arg Lys His Glu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Arg Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Ser
145 150 155 160
Glu Leu Thr Gln Asp Pro Ala Val Ser Val Ala Leu Gly Gln Thr Val
165 170 175
Arg Ile Thr Cys Gln Gly Asp Ser Leu Arg Ser Tyr Tyr Ala Ser Trp
180 185 190
Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr Gly Lys
195 200 205
Asn Asn Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser Ser Ser
210 215 220
Gly Asn Thr Ala Ser Leu Thr Thr Thr Gly Ala Gln Ala Glu Asp Glu
225 230 235 240
Ala Asp Tyr Tyr Cys Asn Ser Ser Pro Phe Glu His Asn Leu Val Val
245 250 255
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu His His His His His His
260 265 270
Glu Pro GluAla
275
<210> 59
<211> 549
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 59
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1 5 10 15
Leu Arg Gly Ala Arg Cys Arg Val Ile Pro Val Ser Gly Pro Ala Arg
20 25 30
Cys Leu Ser Gln Ser Arg Asn Leu Leu Lys Thr Thr Asp Asp Met Val
35 40 45
Lys Thr Ala Arg Glu Lys Leu Lys His Tyr Ser Cys Thr Ala Glu Asp
50 55 60
Ile Asp His Glu Asp Ile Thr Arg Asp Gln Thr Ser Thr Leu Lys Thr
65 70 75 80
Cys Leu Pro Leu Glu Leu His Lys Asn Glu Ser Cys Leu Ala Thr Arg
85 90 95
Glu Thr Ser Ser Thr Thr Arg Gly Ser Cys Leu Pro Pro Gln Lys Thr
100 105 110
Ser Leu Met Met Thr Leu Cys Leu Gly Ser Ile Tyr Glu Asp Leu Lys
115 120 125
Met Tyr Gln Thr Glu Phe Gln Ala Ile Asn Ala Ala Leu Gln Asn His
130 135 140
Asn His Gln Gln Ile Ile Leu Asp Lys Gly Met Leu Val Ala Ile Asp
145 150 155 160
Glu Leu Met Gln Ser Leu Asn His Asn Gly Glu Thr Leu Arg Gln Lys
165 170 175
Pro Pro Val Gly Glu Ala Asp Pro Tyr Arg Val Lys Met Lys Leu Cys
180 185 190
Ile Leu Leu His Ala Phe Ser Thr Arg Val Val Thr Ile Asn Arg Val
195 200 205
Met Gly Tyr Leu Ser Ser Ala Ser Gly Gly Pro Gly Pro Ala Gly Met
210 215 220
Lys Gly Leu Pro Gly Ser Met Trp Glu Leu Glu Lys Asp Val Tyr Val
225 230 235 240
Val Glu Val Asp Trp Thr Pro Asp Ala Pro Gly Glu Thr Val Asn Leu
245 250 255
Thr Cys Asp Thr Pro Glu Glu Asp Asp Ile Thr Trp Thr Ser Asp Gln
260 265 270
Arg His Gly Val Ile Gly Ser Gly Lys Thr Leu Thr Ile Thr Val Lys
275 280 285
Glu Phe Leu Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Thr
290 295 300
Leu Ser His Ser His Leu Leu Leu His Lys Lys Glu Asn Gly Ile Trp
305 310 315 320
Ser Thr Glu Ile Leu Lys Asn Phe Lys Asn Lys Thr Phe Leu Lys Cys
325 330 335
Glu Ala Pro Asn Tyr Ser Gly Arg Phe Thr Cys Ser Trp Leu Val Gln
340 345 350
Arg Asn Met Asp Leu Lys Phe Asn Ile Lys Ser Ser Ser Ser Ser Pro
355 360 365
Asp Ser Arg Ala Val Thr Cys Gly Met Ala Ser Leu Ser Ala Glu Lys
370 375 380
Val Thr Leu Asp Gln Arg Asp Tyr Glu Lys Tyr Ser Val Ser Cys Gln
385 390 395 400
Glu Asp Val Thr Cys Pro Thr Ala Glu Glu Thr Leu Pro Ile Glu Leu
405 410 415
Ala Leu Glu Ala Arg Gln Gln Asn Lys Tyr Glu Asn Tyr Ser Thr Ser
420 425 430
Phe Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln
435 440 445
Met Lys Pro Leu Lys Asn Ser Gln Val Glu Val Ser Trp Glu Tyr Pro
450 455 460
Asp Ser Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Lys Phe Phe Val
465 470 475 480
Arg Ile Gln Arg Lys Lys Glu Lys Met Lys Glu Thr Glu Glu Gly Cys
485 490 495
Asn Gln Lys Gly Ala Phe Leu Val Glu Lys Thr Ser Thr Glu Val Gln
500 505 510
Cys Lys Gly Gly Asn Val Cys Val Gln Ala Gln Asp Arg Tyr Tyr Asn
515 520 525
Ser Ser Cys Ser Lys Trp Ala Cys Val Pro Cys Arg Val Arg Ser His
530 535 540
His His His His His
545
<210> 60
<211> 579
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 60
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1 5 10 15
Leu Arg Gly Ala Arg Cys Arg Val Ile Pro Val Ser Gly Pro Ala Arg
20 25 30
Cys Leu Ser Gln Ser Arg Asn Leu Leu Lys Thr Thr Asp Asp Met Val
35 40 45
Lys Thr Ala Arg Glu Lys Leu Lys His Tyr Ser Cys Thr Ala Glu Asp
50 55 60
Ile Asp His Glu Asp Ile Thr Arg Asp Gln Thr Ser Thr Leu Lys Thr
65 70 75 80
Cys Leu Pro Leu Glu Leu His Lys Asn Glu Ser Cys Leu Ala Thr Arg
85 90 95
Glu Thr Ser Ser Thr Thr Arg Gly Ser Cys Leu Pro Pro Gln Lys Thr
100 105 110
Ser Leu Met Met Thr Leu Cys Leu Gly Ser Ile Tyr Glu Asp Leu Lys
115 120 125
Met Tyr Gln Thr Glu Phe Gln Ala Ile Asn Ala Ala Leu Gln Asn His
130 135 140
Asn His Gln Gln Ile Ile Leu Asp Lys Gly Met Leu Val Ala Ile Asp
145 150 155 160
Glu Leu Met Gln Ser Leu Asn His Asn Gly Glu Thr Leu Arg Gln Lys
165 170 175
Pro Pro Val Gly Glu Ala Asp Pro Tyr Arg Val Lys Met Lys Leu Cys
180 185 190
Ile Leu Leu His Ala Phe Ser Thr Arg Val Val Thr Ile Asn Arg Val
195 200 205
Met Gly Tyr Leu Ser Ser Ala Gly Gly Gly Gly Ser Gly Gly Gly Gly
210 215 220
Ser Gly Gly Gly Gly Ser Ser Gly Gly Pro Gly Pro Ala Gly Met Lys
225 230 235 240
Gly Leu Pro Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
245 250 255
Gly Gly Gly Ser Met Trp Glu Leu Glu Lys Asp Val Tyr Val Val Glu
260 265 270
Val Asp Trp Thr Pro Asp Ala Pro Gly Glu Thr Val Asn Leu Thr Cys
275 280 285
Asp Thr Pro Glu Glu Asp Asp Ile Thr Trp Thr Ser Asp Gln Arg His
290 295 300
Gly Val Ile Gly Ser Gly Lys Thr Leu Thr Ile Thr Val Lys Glu Phe
305 310 315 320
Leu Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Thr Leu Ser
325 330 335
His Ser His Leu Leu Leu His Lys Lys Glu Asn Gly Ile Trp Ser Thr
340 345 350
Glu Ile Leu Lys Asn Phe Lys Asn Lys Thr Phe Leu Lys Cys Glu Ala
355 360 365
Pro Asn Tyr Ser Gly Arg Phe Thr Cys Ser Trp Leu Val Gln Arg Asn
370 375 380
Met Asp Leu Lys Phe Asn Ile Lys Ser Ser Ser Ser Ser Pro Asp Ser
385 390 395 400
Arg Ala Val Thr Cys Gly Met Ala Ser Leu Ser Ala Glu Lys Val Thr
405 410 415
Leu Asp Gln Arg Asp Tyr Glu Lys Tyr Ser Val Ser Cys Gln Glu Asp
420 425 430
Val Thr Cys Pro Thr Ala Glu Glu Thr Leu Pro Ile Glu Leu Ala Leu
435 440 445
Glu Ala Arg Gln Gln Asn Lys Tyr Glu Asn Tyr Ser Thr Ser Phe Phe
450 455 460
Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln Met Lys
465 470 475 480
Pro Leu Lys Asn Ser Gln Val Glu Val Ser Trp Glu Tyr Pro Asp Ser
485 490 495
Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Lys Phe Phe Val Arg Ile
500 505 510
Gln Arg Lys Lys Glu Lys Met Lys Glu Thr Glu Glu Gly Cys Asn Gln
515 520 525
Lys Gly Ala Phe Leu Val Glu Lys Thr Ser Thr Glu Val Gln Cys Lys
530 535 540
Gly Gly Asn Val Cys Val Gln Ala Gln Asp Arg Tyr Tyr Asn Ser Ser
545 550 555 560
Cys Ser Lys Trp Ala Cys Val Pro Cys Arg Val Arg Ser His His His
565 570 575
HisHisHis
<210> 61
<211> 809
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 61
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1 5 10 15
Leu Arg Gly Ala Arg Cys Glu Val Gln Leu Val Glu Ser Gly Gly Gly
20 25 30
Leu Val Gln Pro Gly Asn Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly
35 40 45
Phe Thr Phe Ser Lys Phe Gly Met Ser Trp Val Arg Gln Ala Pro Gly
50 55 60
Lys Gly Leu Glu Trp Val Ser Ser Ile Ser Gly Ser Gly Arg Asp Thr
65 70 75 80
Leu Tyr Ala Glu Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn
85 90 95
Ala Lys Thr Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp
100 105 110
Thr Ala Val Tyr Tyr Cys Thr Ile Gly Gly Ser Leu Ser Val Ser Ser
115 120 125
Gln Gly Thr Leu Val Thr Val Ser Ser Ser Gly Gly Pro Gly Pro Ala
130 135 140
Gly Met Lys Gly Leu Pro Gly Ser Met Trp Glu Leu Glu Lys Asp Val
145 150 155 160
Tyr Val Val Glu Val Asp Trp Thr Pro Asp Ala Pro Gly Glu Thr Val
165 170 175
Asn Leu Thr Cys Asp Thr Pro Glu Glu Asp Asp Ile Thr Trp Thr Ser
180 185 190
Asp Gln Arg His Gly Val Ile Gly Ser Gly Lys Thr Leu Thr Ile Thr
195 200 205
Val Lys Glu Phe Leu Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly
210 215 220
Glu Thr Leu Ser His Ser His Leu Leu Leu His Lys Lys Glu Asn Gly
225 230 235 240
Ile Trp Ser Thr Glu Ile Leu Lys Asn Phe Lys Asn Lys Thr Phe Leu
245 250 255
Lys Cys Glu Ala Pro Asn Tyr Ser Gly Arg Phe Thr Cys Ser Trp Leu
260 265 270
Val Gln Arg Asn Met Asp Leu Lys Phe Asn Ile Lys Ser Ser Ser Ser
275 280 285
Ser Pro Asp Ser Arg Ala Val Thr Cys Gly Met Ala Ser Leu Ser Ala
290 295 300
Glu Lys Val Thr Leu Asp Gln Arg Asp Tyr Glu Lys Tyr Ser Val Ser
305 310 315 320
Cys Gln Glu Asp Val Thr Cys Pro Thr Ala Glu Glu Thr Leu Pro Ile
325 330 335
Glu Leu Ala Leu Glu Ala Arg Gln Gln Asn Lys Tyr Glu Asn Tyr Ser
340 345 350
Thr Ser Phe Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn
355 360 365
Leu Gln Met Lys Pro Leu Lys Asn Ser Gln Val Glu Val Ser Trp Glu
370 375 380
Tyr Pro Asp Ser Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Lys Phe
385 390 395 400
Phe Val Arg Ile Gln Arg Lys Lys Glu Lys Met Lys Glu Thr Glu Glu
405 410 415
Gly Cys Asn Gln Lys Gly Ala Phe Leu Val Glu Lys Thr Ser Thr Glu
420 425 430
Val Gln Cys Lys Gly Gly Asn Val Cys Val Gln Ala Gln Asp Arg Tyr
435 440 445
Tyr Asn Ser Ser Cys Ser Lys Trp Ala Cys Val Pro Cys Arg Val Arg
450 455 460
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
465 470 475 480
Arg Val Ile Pro Val Ser Gly Pro Ala Arg Cys Leu Ser Gln Ser Arg
485 490 495
Asn Leu Leu Lys Thr Thr Asp Asp Met Val Lys Thr Ala Arg Glu Lys
500 505 510
Leu Lys His Tyr Ser Cys Thr Ala Glu Asp Ile Asp His Glu Asp Ile
515 520 525
Thr Arg Asp Gln Thr Ser Thr Leu Lys Thr Cys Leu Pro Leu Glu Leu
530 535 540
His Lys Asn Glu Ser Cys Leu Ala Thr Arg Glu Thr Ser Ser Thr Thr
545 550 555 560
Arg Gly Ser Cys Leu Pro Pro Gln Lys Thr Ser Leu Met Met Thr Leu
565 570 575
Cys Leu Gly Ser Ile Tyr Glu Asp Leu Lys Met Tyr Gln Thr Glu Phe
580 585 590
Gln Ala Ile Asn Ala Ala Leu Gln Asn His Asn His Gln Gln Ile Ile
595 600 605
Leu Asp Lys Gly Met Leu Val Ala Ile Asp Glu Leu Met Gln Ser Leu
610 615 620
Asn His Asn Gly Glu Thr Leu Arg Gln Lys Pro Pro Val Gly Glu Ala
625 630 635 640
Asp Pro Tyr Arg Val Lys Met Lys Leu Cys Ile Leu Leu His Ala Phe
645 650 655
Ser Thr Arg Val Val Thr Ile Asn Arg Val Met Gly Tyr Leu Ser Ser
660 665 670
Ala Ser Gly Gly Pro Gly Pro Ala Gly Met Lys Gly Leu Pro Gly Ser
675 680 685
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn
690 695 700
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Lys Phe
705 710 715 720
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
725 730 735
Ser Ser Ile Ser Gly Ser Gly Arg Asp Thr Leu Tyr Ala Glu Ser Val
740 745 750
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr
755 760 765
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys
770 775 780
Thr Ile Gly Gly Ser Leu Ser Val Ser Ser Gln Gly Thr Leu Val Thr
785 790 795 800
Val Ser Ser His His His His His His
805
<210> 62
<211> 938
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 62
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1 5 10 15
Leu Arg Gly Ala Arg Cys Gln Val Gln Leu Gln Glu Ser Gly Gly Gly
20 25 30
Leu Val Gln Ala Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly
35 40 45
Arg Ile Phe Ser Ile Asp Ile Met Ser Trp Tyr Arg Gln Ala Pro Gly
50 55 60
Lys Gln Arg Glu Leu Val Ala Arg Ile Thr Arg Gly Gly Thr Ile Ser
65 70 75 80
Tyr Asp Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr
100 105 110
Gly Val Tyr Tyr Cys Asn Ala Leu Tyr Gly Thr Asp Tyr Trp Gly Lys
115 120 125
Gly Thr Gln Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly
145 150 155 160
Gly Leu Val Gln Pro Gly Asn Ser Leu Arg Leu Ser Cys Ala Ala Ser
165 170 175
Gly Phe Thr Phe Ser Lys Phe Gly Met Ser Trp Val Arg Gln Ala Pro
180 185 190
Gly Lys Gly Leu Glu Trp Val Ser Ser Ile Ser Gly Ser Gly Arg Asp
195 200 205
Thr Leu Tyr Ala Glu Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp
210 215 220
Asn Ala Lys Thr Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu
225 230 235 240
Asp Thr Ala Val Tyr Tyr Cys Thr Ile Gly Gly Ser Leu Ser Val Ser
245 250 255
Ser Gln Gly Thr Leu Val Thr Val Ser Ser Ser Gly Gly Pro Gly Pro
260 265 270
Ala Gly Met Lys Gly Leu Pro Gly Ser Met Trp Glu Leu Glu Lys Asp
275 280 285
Val Tyr Val Val Glu Val Asp Trp Thr Pro Asp Ala Pro Gly Glu Thr
290 295 300
Val Asn Leu Thr Cys Asp Thr Pro Glu Glu Asp Asp Ile Thr Trp Thr
305 310 315 320
Ser Asp Gln Arg His Gly Val Ile Gly Ser Gly Lys Thr Leu Thr Ile
325 330 335
Thr Val Lys Glu Phe Leu Asp Ala Gly Gln Tyr Thr Cys His Lys Gly
340 345 350
Gly Glu Thr Leu Ser His Ser His Leu Leu Leu His Lys Lys Glu Asn
355 360 365
Gly Ile Trp Ser Thr Glu Ile Leu Lys Asn Phe Lys Asn Lys Thr Phe
370 375 380
Leu Lys Cys Glu Ala Pro Asn Tyr Ser Gly Arg Phe Thr Cys Ser Trp
385 390 395 400
Leu Val Gln Arg Asn Met Asp Leu Lys Phe Asn Ile Lys Ser Ser Ser
405 410 415
Ser Ser Pro Asp Ser Arg Ala Val Thr Cys Gly Met Ala Ser Leu Ser
420 425 430
Ala Glu Lys Val Thr Leu Asp Gln Arg Asp Tyr Glu Lys Tyr Ser Val
435 440 445
Ser Cys Gln Glu Asp Val Thr Cys Pro Thr Ala Glu Glu Thr Leu Pro
450 455 460
Ile Glu Leu Ala Leu Glu Ala Arg Gln Gln Asn Lys Tyr Glu Asn Tyr
465 470 475 480
Ser Thr Ser Phe Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys
485 490 495
Asn Leu Gln Met Lys Pro Leu Lys Asn Ser Gln Val Glu Val Ser Trp
500 505 510
Glu Tyr Pro Asp Ser Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Lys
515 520 525
Phe Phe Val Arg Ile Gln Arg Lys Lys Glu Lys Met Lys Glu Thr Glu
530 535 540
Glu Gly Cys Asn Gln Lys Gly Ala Phe Leu Val Glu Lys Thr Ser Thr
545 550 555 560
Glu Val Gln Cys Lys Gly Gly Asn Val Cys Val Gln Ala Gln Asp Arg
565 570 575
Tyr Tyr Asn Ser Ser Cys Ser Lys Trp Ala Cys Val Pro Cys Arg Val
580 585 590
Arg Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
595 600 605
Ser Arg Val Ile Pro Val Ser Gly Pro Ala Arg Cys Leu Ser Gln Ser
610 615 620
Arg Asn Leu Leu Lys Thr Thr Asp Asp Met Val Lys Thr Ala Arg Glu
625 630 635 640
Lys Leu Lys His Tyr Ser Cys Thr Ala Glu Asp Ile Asp His Glu Asp
645 650 655
Ile Thr Arg Asp Gln Thr Ser Thr Leu Lys Thr Cys Leu Pro Leu Glu
660 665 670
Leu His Lys Asn Glu Ser Cys Leu Ala Thr Arg Glu Thr Ser Ser Thr
675 680 685
Thr Arg Gly Ser Cys Leu Pro Pro Gln Lys Thr Ser Leu Met Met Thr
690 695 700
Leu Cys Leu Gly Ser Ile Tyr Glu Asp Leu Lys Met Tyr Gln Thr Glu
705 710 715 720
Phe Gln Ala Ile Asn Ala Ala Leu Gln Asn His Asn His Gln Gln Ile
725 730 735
Ile Leu Asp Lys Gly Met Leu Val Ala Ile Asp Glu Leu Met Gln Ser
740 745 750
Leu Asn His Asn Gly Glu Thr Leu Arg Gln Lys Pro Pro Val Gly Glu
755 760 765
Ala Asp Pro Tyr Arg Val Lys Met Lys Leu Cys Ile Leu Leu His Ala
770 775 780
Phe Ser Thr Arg Val Val Thr Ile Asn Arg Val Met Gly Tyr Leu Ser
785 790 795 800
Ser Ala Ser Gly Gly Pro Gly Pro Ala Gly Met Lys Gly Leu Pro Gly
805 810 815
Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
820 825 830
Asn Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Lys
835 840 845
Phe Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
850 855 860
Val Ser Ser Ile Ser Gly Ser Gly Arg Asp Thr Leu Tyr Ala Glu Ser
865 870 875 880
Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu
885 890 895
Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr
900 905 910
Cys Thr Ile Gly Gly Ser Leu Ser Val Ser Ser Gln Gly Thr Leu Val
915 920 925
Thr Val Ser Ser His His His His His His
930 935
<210> 63
<211> 938
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 63
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1 5 10 15
Leu Arg Gly Ala Arg Cys Gln Val Gln Leu Gln Glu Ser Gly Gly Gly
20 25 30
Leu Val Gln Ala Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly
35 40 45
Arg Ile Phe Ser Ile Asp Ile Met Ser Trp Tyr Arg Gln Ala Pro Gly
50 55 60
Lys Gln Arg Glu Leu Val Ala Arg Ile Thr Arg Gly Gly Thr Ile Ser
65 70 75 80
Tyr Asp Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr
100 105 110
Gly Val Tyr Tyr Cys Asn Ala Leu Tyr Gly Thr Asp Tyr Trp Gly Lys
115 120 125
Gly Thr Gln Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly
145 150 155 160
Gly Leu Val Gln Pro Gly Asn Ser Leu Arg Leu Ser Cys Ala Ala Ser
165 170 175
Gly Phe Thr Phe Ser Lys Phe Gly Met Ser Trp Val Arg Gln Ala Pro
180 185 190
Gly Lys Gly Leu Glu Trp Val Ser Ser Ile Ser Gly Ser Gly Arg Asp
195 200 205
Thr Leu Tyr Ala Glu Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp
210 215 220
Asn Ala Lys Thr Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu
225 230 235 240
Asp Thr Ala Val Tyr Tyr Cys Thr Ile Gly Gly Ser Leu Ser Val Ser
245 250 255
Ser Gln Gly Thr Leu Val Thr Val Ser Ser Ser Gly Gly Pro Gly Pro
260 265 270
Ala Gly Met Lys Gly Leu Pro Gly Ser Met Trp Glu Leu Glu Lys Asp
275 280 285
Val Tyr Val Val Glu Val Asp Trp Thr Pro Asp Ala Pro Gly Glu Thr
290 295 300
Val Asn Leu Thr Cys Asp Thr Pro Glu Glu Asp Asp Ile Thr Trp Thr
305 310 315 320
Ser Asp Gln Arg His Gly Val Ile Gly Ser Gly Lys Thr Leu Thr Ile
325 330 335
Thr Val Lys Glu Phe Leu Asp Ala Gly Gln Tyr Thr Cys His Lys Gly
340 345 350
Gly Glu Thr Leu Ser His Ser His Leu Leu Leu His Lys Lys Glu Asn
355 360 365
Gly Ile Trp Ser Thr Glu Ile Leu Lys Asn Phe Lys Asn Lys Thr Phe
370 375 380
Leu Lys Cys Glu Ala Pro Asn Tyr Ser Gly Arg Phe Thr Cys Ser Trp
385 390 395 400
Leu Val Gln Arg Asn Met Asp Leu Lys Phe Asn Ile Lys Ser Ser Ser
405 410 415
Ser Ser Pro Asp Ser Arg Ala Val Thr Cys Gly Met Ala Ser Leu Ser
420 425 430
Ala Glu Lys Val Thr Leu Asp Gln Arg Asp Tyr Glu Lys Tyr Ser Val
435 440 445
Ser Cys Gln Glu Asp Val Thr Cys Pro Thr Ala Glu Glu Thr Leu Pro
450 455 460
Ile Glu Leu Ala Leu Glu Ala Arg Gln Gln Asn Lys Tyr Glu Asn Tyr
465 470 475 480
Ser Thr Ser Phe Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys
485 490 495
Asn Leu Gln Met Lys Pro Leu Lys Asn Ser Gln Val Glu Val Ser Trp
500 505 510
Glu Tyr Pro Asp Ser Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Lys
515 520 525
Phe Phe Val Arg Ile Gln Arg Lys Lys Glu Lys Met Lys Glu Thr Glu
530 535 540
Glu Gly Cys Asn Gln Lys Gly Ala Phe Leu Val Glu Lys Thr Ser Thr
545 550 555 560
Glu Val Gln Cys Lys Gly Gly Asn Val Cys Val Gln Ala Gln Asp Arg
565 570 575
Tyr Tyr Asn Ser Ser Cys Ser Lys Trp Ala Cys Val Pro Cys Arg Val
580 585 590
Arg Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
595 600 605
Ser Arg Val Ile Pro Val Ser Gly Pro Ala Arg Cys Leu Ser Gln Ser
610 615 620
Arg Asn Leu Leu Lys Thr Thr Asp Asp Met Val Lys Thr Ala Arg Glu
625 630 635 640
Lys Leu Lys His Tyr Ser Cys Thr Ala Glu Asp Ile Asp His Glu Asp
645 650 655
Ile Thr Arg Asp Gln Thr Ser Thr Leu Lys Thr Cys Leu Pro Leu Glu
660 665 670
Leu His Lys Asn Glu Ser Cys Leu Ala Thr Arg Glu Thr Ser Ser Thr
675 680 685
Thr Arg Gly Ser Cys Leu Pro Pro Gln Lys Thr Ser Leu Met Met Thr
690 695 700
Leu Cys Leu Gly Ser Ile Tyr Glu Asp Leu Lys Met Tyr Gln Thr Glu
705 710 715 720
Phe Gln Ala Ile Asn Ala Ala Leu Gln Asn His Asn His Gln Gln Ile
725 730 735
Ile Leu Asp Lys Gly Met Leu Val Ala Ile Asp Glu Leu Met Gln Ser
740 745 750
Leu Asn His Asn Gly Glu Thr Leu Arg Gln Lys Pro Pro Val Gly Glu
755 760 765
Ala Asp Pro Tyr Arg Val Lys Met Lys Leu Cys Ile Leu Leu His Ala
770 775 780
Phe Ser Thr Arg Val Val Thr Ile Asn Arg Val Met Gly Tyr Leu Ser
785 790 795 800
Ser Ala Ser Gly Gly Pro Gly Pro Ala Gly Met Lys Gly Leu Pro Gly
805 810 815
Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
820 825 830
Asn Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Lys
835 840 845
Phe Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
850 855 860
Val Ser Ser Ile Ser Gly Ser Gly Arg Asp Thr Leu Tyr Ala Glu Ser
865 870 875 880
Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu
885 890 895
Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr
900 905 910
Cys Thr Ile Gly Gly Ser Leu Ser Val Ser Ser Gln Gly Thr Leu Val
915 920 925
Thr Val Ser Ser His His His His His His
930 935
<210> 64
<211> 938
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 64
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1 5 10 15
Leu Arg Gly Ala Arg Cys Glu Val Gln Leu Val Glu Ser Gly Gly Gly
20 25 30
Leu Val Gln Pro Gly Asn Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly
35 40 45
Phe Thr Phe Ser Lys Phe Gly Met Ser Trp Val Arg Gln Ala Pro Gly
50 55 60
Lys Gly Leu Glu Trp Val Ser Ser Ile Ser Gly Ser Gly Arg Asp Thr
65 70 75 80
Leu Tyr Ala Glu Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn
85 90 95
Ala Lys Thr Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp
100 105 110
Thr Ala Val Tyr Tyr Cys Thr Ile Gly Gly Ser Leu Ser Val Ser Ser
115 120 125
Gln Gly Thr Leu Val Thr Val Ser Ser Ser Gly Gly Pro Gly Pro Ala
130 135 140
Gly Met Lys Gly Leu Pro Gly Ser Met Trp Glu Leu Glu Lys Asp Val
145 150 155 160
Tyr Val Val Glu Val Asp Trp Thr Pro Asp Ala Pro Gly Glu Thr Val
165 170 175
Asn Leu Thr Cys Asp Thr Pro Glu Glu Asp Asp Ile Thr Trp Thr Ser
180 185 190
Asp Gln Arg His Gly Val Ile Gly Ser Gly Lys Thr Leu Thr Ile Thr
195 200 205
Val Lys Glu Phe Leu Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly
210 215 220
Glu Thr Leu Ser His Ser His Leu Leu Leu His Lys Lys Glu Asn Gly
225 230 235 240
Ile Trp Ser Thr Glu Ile Leu Lys Asn Phe Lys Asn Lys Thr Phe Leu
245 250 255
Lys Cys Glu Ala Pro Asn Tyr Ser Gly Arg Phe Thr Cys Ser Trp Leu
260 265 270
Val Gln Arg Asn Met Asp Leu Lys Phe Asn Ile Lys Ser Ser Ser Ser
275 280 285
Ser Pro Asp Ser Arg Ala Val Thr Cys Gly Met Ala Ser Leu Ser Ala
290 295 300
Glu Lys Val Thr Leu Asp Gln Arg Asp Tyr Glu Lys Tyr Ser Val Ser
305 310 315 320
Cys Gln Glu Asp Val Thr Cys Pro Thr Ala Glu Glu Thr Leu Pro Ile
325 330 335
Glu Leu Ala Leu Glu Ala Arg Gln Gln Asn Lys Tyr Glu Asn Tyr Ser
340 345 350
Thr Ser Phe Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn
355 360 365
Leu Gln Met Lys Pro Leu Lys Asn Ser Gln Val Glu Val Ser Trp Glu
370 375 380
Tyr Pro Asp Ser Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Lys Phe
385 390 395 400
Phe Val Arg Ile Gln Arg Lys Lys Glu Lys Met Lys Glu Thr Glu Glu
405 410 415
Gly Cys Asn Gln Lys Gly Ala Phe Leu Val Glu Lys Thr Ser Thr Glu
420 425 430
Val Gln Cys Lys Gly Gly Asn Val Cys Val Gln Ala Gln Asp Arg Tyr
435 440 445
Tyr Asn Ser Ser Cys Ser Lys Trp Ala Cys Val Pro Cys Arg Val Arg
450 455 460
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
465 470 475 480
Arg Val Ile Pro Val Ser Gly Pro Ala Arg Cys Leu Ser Gln Ser Arg
485 490 495
Asn Leu Leu Lys Thr Thr Asp Asp Met Val Lys Thr Ala Arg Glu Lys
500 505 510
Leu Lys His Tyr Ser Cys Thr Ala Glu Asp Ile Asp His Glu Asp Ile
515 520 525
Thr Arg Asp Gln Thr Ser Thr Leu Lys Thr Cys Leu Pro Leu Glu Leu
530 535 540
His Lys Asn Glu Ser Cys Leu Ala Thr Arg Glu Thr Ser Ser Thr Thr
545 550 555 560
Arg Gly Ser Cys Leu Pro Pro Gln Lys Thr Ser Leu Met Met Thr Leu
565 570 575
Cys Leu Gly Ser Ile Tyr Glu Asp Leu Lys Met Tyr Gln Thr Glu Phe
580 585 590
Gln Ala Ile Asn Ala Ala Leu Gln Asn His Asn His Gln Gln Ile Ile
595 600 605
Leu Asp Lys Gly Met Leu Val Ala Ile Asp Glu Leu Met Gln Ser Leu
610 615 620
Asn His Asn Gly Glu Thr Leu Arg Gln Lys Pro Pro Val Gly Glu Ala
625 630 635 640
Asp Pro Tyr Arg Val Lys Met Lys Leu Cys Ile Leu Leu His Ala Phe
645 650 655
Ser Thr Arg Val Val Thr Ile Asn Arg Val Met Gly Tyr Leu Ser Ser
660 665 670
Ala Ser Gly Gly Pro Gly Pro Ala Gly Met Lys Gly Leu Pro Gly Ser
675 680 685
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn
690 695 700
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Lys Phe
705 710 715 720
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
725 730 735
Ser Ser Ile Ser Gly Ser Gly Arg Asp Thr Leu Tyr Ala Glu Ser Val
740 745 750
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr
755 760 765
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys
770 775 780
Thr Ile Gly Gly Ser Leu Ser Val Ser Ser Gln Gly Thr Leu Val Thr
785 790 795 800
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
805 810 815
Gly Ser Gln Val Gln Leu Gln Glu Ser Gly Gly Gly Leu Val Gln Ala
820 825 830
Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Ile Phe Ser
835 840 845
Ile Asp Ile Met Ser Trp Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu
850 855 860
Leu Val Ala Arg Ile Thr Arg Gly Gly Thr Ile Ser Tyr Asp Asp Ser
865 870 875 880
Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val
885 890 895
Tyr Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Gly Val Tyr Tyr
900 905 910
Cys Asn Ala Leu Tyr Gly Thr Asp Tyr Trp Gly Lys Gly Thr Gln Val
915 920 925
Thr Val Ser Ser His His His His His His
930 935
<210> 65
<211> 962
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 65
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1 5 10 15
Leu Arg Gly Ala Arg Cys Ile Trp Glu Leu Lys Lys Asp Val Tyr Val
20 25 30
Val Glu Leu Asp Trp Tyr Pro Asp Ala Pro Gly Glu Met Val Val Leu
35 40 45
Thr Cys Asp Thr Pro Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln
50 55 60
Ser Ser Glu Val Leu Gly Ser Gly Lys Thr Leu Thr Ile Gln Val Lys
65 70 75 80
Glu Phe Gly Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Val
85 90 95
Leu Ser His Ser Leu Leu Leu Leu His Lys Lys Glu Asp Gly Ile Trp
100 105 110
Ser Thr Asp Ile Leu Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe
115 120 125
Leu Arg Cys Glu Ala Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp
130 135 140
Leu Thr Thr Ile Ser Thr Asp Leu Thr Phe Ser Val Lys Ser Ser Arg
145 150 155 160
Gly Ser Ser Asp Pro Gln Gly Val Thr Cys Gly Ala Ala Thr Leu Ser
165 170 175
Ala Glu Arg Val Arg Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu
180 185 190
Cys Gln Glu Asp Ser Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile
195 200 205
Glu Val Met Val Asp Ala Val His Lys Leu Lys Tyr Glu Asn Tyr Thr
210 215 220
Ser Ser Phe Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn
225 230 235 240
Leu Gln Leu Lys Pro Leu Lys Asn Ser Arg Gln Val Glu Val Ser Trp
245 250 255
Glu Tyr Pro Asp Thr Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Thr
260 265 270
Phe Cys Val Gln Val Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg
275 280 285
Val Phe Thr Asp Lys Thr Ser Ala Thr Val Ile Cys Arg Lys Asn Ala
290 295 300
Ser Ile Ser Val Arg Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser
305 310 315 320
Glu Trp Ala Ser Val Pro Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly
325 330 335
Gly Ser Gly Gly Gly Gly Ser Arg Val Ile Pro Val Ser Gly Pro Ala
340 345 350
Arg Cys Leu Ser Gln Ser Arg Asn Leu Leu Lys Thr Thr Asp Asp Met
355 360 365
Val Lys Thr Ala Arg Glu Lys Leu Lys His Tyr Ser Cys Thr Ala Glu
370 375 380
Asp Ile Asp His Glu Asp Ile Thr Arg Asp Gln Thr Ser Thr Leu Lys
385 390 395 400
Thr Cys Leu Pro Leu Glu Leu His Lys Asn Glu Ser Cys Leu Ala Thr
405 410 415
Arg Glu Thr Ser Ser Thr Thr Arg Gly Ser Cys Leu Pro Pro Gln Lys
420 425 430
Thr Ser Leu Met Met Thr Leu Cys Leu Gly Ser Ile Tyr Glu Asp Leu
435 440 445
Lys Met Tyr Gln Thr Glu Phe Gln Ala Ile Asn Ala Ala Leu Gln Asn
450 455 460
His Asn His Gln Gln Ile Ile Leu Asp Lys Gly Met Leu Val Ala Ile
465 470 475 480
Asp Glu Leu Met Gln Ser Leu Asn His Asn Gly Glu Thr Leu Arg Gln
485 490 495
Lys Pro Pro Val Gly Glu Ala Asp Pro Tyr Arg Val Lys Met Lys Leu
500 505 510
Cys Ile Leu Leu His Ala Phe Ser Thr Arg Val Val Thr Ile Asn Arg
515 520 525
Val Met Gly Tyr Leu Ser Ser Ala Gly Gly Gly Gly Ser Gly Gly Gly
530 535 540
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
545 550 555 560
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
565 570 575
Gly Gly Gly Gly Ser Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser
580 585 590
Gly Ala Pro Gly Gln Arg Val Thr Ile Ser Cys Ser Gly Ser Arg Ser
595 600 605
Asn Ile Gly Ser Asn Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr
610 615 620
Ala Pro Lys Leu Leu Ile Tyr Tyr Asn Asp Gln Arg Pro Ser Gly Val
625 630 635 640
Pro Asp Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala
645 650 655
Ile Thr Gly Leu Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser
660 665 670
Tyr Asp Arg Tyr Thr His Pro Ala Leu Leu Phe Gly Thr Gly Thr Lys
675 680 685
Val Thr Val Leu Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
690 695 700
Gly Gly Ser Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln
705 710 715 720
Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
725 730 735
Ser Ser Tyr Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
740 745 750
Glu Trp Val Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala
755 760 765
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn
770 775 780
Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
785 790 795 800
Tyr Tyr Cys Lys Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr
805 810 815
Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
820 825 830
Gly Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
835 840 845
Val Gln Pro Gly Asn Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
850 855 860
Thr Phe Ser Lys Phe Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys
865 870 875 880
Gly Leu Glu Trp Val Ser Ser Ile Ser Gly Ser Gly Arg Asp Thr Leu
885 890 895
Tyr Ala Glu Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
900 905 910
Lys Thr Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr
915 920 925
Ala Val Tyr Tyr Cys Thr Ile Gly Gly Ser Leu Ser Val Ser Ser Gln
930 935 940
Gly Thr Leu Val Thr Val Ser Ser His His His His His His Glu Pro
945 950 955 960
GluAla
<210> 66
<211> 832
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 66
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1 5 10 15
Leu Arg Gly Ala Arg Cys Ile Trp Glu Leu Lys Lys Asp Val Tyr Val
20 25 30
Val Glu Leu Asp Trp Tyr Pro Asp Ala Pro Gly Glu Met Val Val Leu
35 40 45
Thr Cys Asp Thr Pro Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln
50 55 60
Ser Ser Glu Val Leu Gly Ser Gly Lys Thr Leu Thr Ile Gln Val Lys
65 70 75 80
Glu Phe Gly Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Val
85 90 95
Leu Ser His Ser Leu Leu Leu Leu His Lys Lys Glu Asp Gly Ile Trp
100 105 110
Ser Thr Asp Ile Leu Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe
115 120 125
Leu Arg Cys Glu Ala Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp
130 135 140
Leu Thr Thr Ile Ser Thr Asp Leu Thr Phe Ser Val Lys Ser Ser Arg
145 150 155 160
Gly Ser Ser Asp Pro Gln Gly Val Thr Cys Gly Ala Ala Thr Leu Ser
165 170 175
Ala Glu Arg Val Arg Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu
180 185 190
Cys Gln Glu Asp Ser Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile
195 200 205
Glu Val Met Val Asp Ala Val His Lys Leu Lys Tyr Glu Asn Tyr Thr
210 215 220
Ser Ser Phe Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn
225 230 235 240
Leu Gln Leu Lys Pro Leu Lys Asn Ser Arg Gln Val Glu Val Ser Trp
245 250 255
Glu Tyr Pro Asp Thr Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Thr
260 265 270
Phe Cys Val Gln Val Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg
275 280 285
Val Phe Thr Asp Lys Thr Ser Ala Thr Val Ile Cys Arg Lys Asn Ala
290 295 300
Ser Ile Ser Val Arg Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser
305 310 315 320
Glu Trp Ala Ser Val Pro Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly
325 330 335
Gly Ser Gly Gly Gly Gly Ser Arg Val Ile Pro Val Ser Gly Pro Ala
340 345 350
Arg Cys Leu Ser Gln Ser Arg Asn Leu Leu Lys Thr Thr Asp Asp Met
355 360 365
Val Lys Thr Ala Arg Glu Lys Leu Lys His Tyr Ser Cys Thr Ala Glu
370 375 380
Asp Ile Asp His Glu Asp Ile Thr Arg Asp Gln Thr Ser Thr Leu Lys
385 390 395 400
Thr Cys Leu Pro Leu Glu Leu His Lys Asn Glu Ser Cys Leu Ala Thr
405 410 415
Arg Glu Thr Ser Ser Thr Thr Arg Gly Ser Cys Leu Pro Pro Gln Lys
420 425 430
Thr Ser Leu Met Met Thr Leu Cys Leu Gly Ser Ile Tyr Glu Asp Leu
435 440 445
Lys Met Tyr Gln Thr Glu Phe Gln Ala Ile Asn Ala Ala Leu Gln Asn
450 455 460
His Asn His Gln Gln Ile Ile Leu Asp Lys Gly Met Leu Val Ala Ile
465 470 475 480
Asp Glu Leu Met Gln Ser Leu Asn His Asn Gly Glu Thr Leu Arg Gln
485 490 495
Lys Pro Pro Val Gly Glu Ala Asp Pro Tyr Arg Val Lys Met Lys Leu
500 505 510
Cys Ile Leu Leu His Ala Phe Ser Thr Arg Val Val Thr Ile Asn Arg
515 520 525
Val Met Gly Tyr Leu Ser Ser Ala Ser Gly Gly Pro Gly Pro Ala Gly
530 535 540
Met Lys Gly Leu Pro Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
545 550 555 560
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
565 570 575
Gly Gly Gly Gly Ser Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser
580 585 590
Gly Ala Pro Gly Gln Arg Val Thr Ile Ser Cys Ser Gly Ser Arg Ser
595 600 605
Asn Ile Gly Ser Asn Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr
610 615 620
Ala Pro Lys Leu Leu Ile Tyr Tyr Asn Asp Gln Arg Pro Ser Gly Val
625 630 635 640
Pro Asp Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala
645 650 655
Ile Thr Gly Leu Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser
660 665 670
Tyr Asp Arg Tyr Thr His Pro Ala Leu Leu Phe Gly Thr Gly Thr Lys
675 680 685
Val Thr Val Leu Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
690 695 700
Gly Gly Ser Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln
705 710 715 720
Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
725 730 735
Ser Ser Tyr Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
740 745 750
Glu Trp Val Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala
755 760 765
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn
770 775 780
Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
785 790 795 800
Tyr Tyr Cys Lys Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr
805 810 815
Met Val Thr Val Ser Ser His His His His His His Glu Pro Glu Ala
820 825 830
<210> 67
<211> 1091
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 67
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1 5 10 15
Leu Arg Gly Ala Arg Cys Ile Trp Glu Leu Lys Lys Asp Val Tyr Val
20 25 30
Val Glu Leu Asp Trp Tyr Pro Asp Ala Pro Gly Glu Met Val Val Leu
35 40 45
Thr Cys Asp Thr Pro Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln
50 55 60
Ser Ser Glu Val Leu Gly Ser Gly Lys Thr Leu Thr Ile Gln Val Lys
65 70 75 80
Glu Phe Gly Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Val
85 90 95
Leu Ser His Ser Leu Leu Leu Leu His Lys Lys Glu Asp Gly Ile Trp
100 105 110
Ser Thr Asp Ile Leu Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe
115 120 125
Leu Arg Cys Glu Ala Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp
130 135 140
Leu Thr Thr Ile Ser Thr Asp Leu Thr Phe Ser Val Lys Ser Ser Arg
145 150 155 160
Gly Ser Ser Asp Pro Gln Gly Val Thr Cys Gly Ala Ala Thr Leu Ser
165 170 175
Ala Glu Arg Val Arg Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu
180 185 190
Cys Gln Glu Asp Ser Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile
195 200 205
Glu Val Met Val Asp Ala Val His Lys Leu Lys Tyr Glu Asn Tyr Thr
210 215 220
Ser Ser Phe Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn
225 230 235 240
Leu Gln Leu Lys Pro Leu Lys Asn Ser Arg Gln Val Glu Val Ser Trp
245 250 255
Glu Tyr Pro Asp Thr Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Thr
260 265 270
Phe Cys Val Gln Val Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg
275 280 285
Val Phe Thr Asp Lys Thr Ser Ala Thr Val Ile Cys Arg Lys Asn Ala
290 295 300
Ser Ile Ser Val Arg Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser
305 310 315 320
Glu Trp Ala Ser Val Pro Cys Ser Gly Gly Gly Gly Ser Gly Gly Gly
325 330 335
Gly Ser Gly Gly Gly Gly Ser Arg Val Ile Pro Val Ser Gly Pro Ala
340 345 350
Arg Cys Leu Ser Gln Ser Arg Asn Leu Leu Lys Thr Thr Asp Asp Met
355 360 365
Val Lys Thr Ala Arg Glu Lys Leu Lys His Tyr Ser Cys Thr Ala Glu
370 375 380
Asp Ile Asp His Glu Asp Ile Thr Arg Asp Gln Thr Ser Thr Leu Lys
385 390 395 400
Thr Cys Leu Pro Leu Glu Leu His Lys Asn Glu Ser Cys Leu Ala Thr
405 410 415
Arg Glu Thr Ser Ser Thr Thr Arg Gly Ser Cys Leu Pro Pro Gln Lys
420 425 430
Thr Ser Leu Met Met Thr Leu Cys Leu Gly Ser Ile Tyr Glu Asp Leu
435 440 445
Lys Met Tyr Gln Thr Glu Phe Gln Ala Ile Asn Ala Ala Leu Gln Asn
450 455 460
His Asn His Gln Gln Ile Ile Leu Asp Lys Gly Met Leu Val Ala Ile
465 470 475 480
Asp Glu Leu Met Gln Ser Leu Asn His Asn Gly Glu Thr Leu Arg Gln
485 490 495
Lys Pro Pro Val Gly Glu Ala Asp Pro Tyr Arg Val Lys Met Lys Leu
500 505 510
Cys Ile Leu Leu His Ala Phe Ser Thr Arg Val Val Thr Ile Asn Arg
515 520 525
Val Met Gly Tyr Leu Ser Ser Ala Ser Gly Gly Pro Gly Pro Ala Gly
530 535 540
Met Lys Gly Leu Pro Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
545 550 555 560
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
565 570 575
Gly Gly Gly Gly Ser Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser
580 585 590
Gly Ala Pro Gly Gln Arg Val Thr Ile Ser Cys Ser Gly Ser Arg Ser
595 600 605
Asn Ile Gly Ser Asn Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly Thr
610 615 620
Ala Pro Lys Leu Leu Ile Tyr Tyr Asn Asp Gln Arg Pro Ser Gly Val
625 630 635 640
Pro Asp Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala
645 650 655
Ile Thr Gly Leu Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser
660 665 670
Tyr Asp Arg Tyr Thr His Pro Ala Leu Leu Phe Gly Thr Gly Thr Lys
675 680 685
Val Thr Val Leu Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
690 695 700
Gly Gly Ser Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln
705 710 715 720
Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
725 730 735
Ser Ser Tyr Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
740 745 750
Glu Trp Val Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala
755 760 765
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn
770 775 780
Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
785 790 795 800
Tyr Tyr Cys Lys Thr His Gly Ser His Asp Asn Trp Gly Gln Gly Thr
805 810 815
Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
820 825 830
Gly Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
835 840 845
Val Gln Pro Gly Asn Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe
850 855 860
Thr Phe Ser Lys Phe Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys
865 870 875 880
Gly Leu Glu Trp Val Ser Ser Ile Ser Gly Ser Gly Arg Asp Thr Leu
885 890 895
Tyr Ala Glu Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
900 905 910
Lys Thr Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr
915 920 925
Ala Val Tyr Tyr Cys Thr Ile Gly Gly Ser Leu Ser Val Ser Ser Gln
930 935 940
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
945 950 955 960
Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Gln Glu Ser Gly Gly
965 970 975
Gly Leu Ala Gln Ala Gly Gly Ser Leu Ser Leu Ser Cys Ala Ala Ser
980 985 990
Gly Phe Thr Val Ser Asn Ser Val Met Ala Trp Tyr Arg Gln Thr Pro
995 1000 1005
Gly Lys Gln Arg Glu Phe Val Ala Ile Ile Asn Ser Val Gly Ser
1010 1015 1020
Thr Asn Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg
1025 1030 1035
Asp Asn Ala Lys Asn Thr Val Tyr Leu Gln Met Asn Asn Leu Lys
1040 1045 1050
Pro Glu Asp Thr Ala Val Tyr Val Cys Asn Arg Asn Phe Asp Arg
1055 1060 1065
Ile Tyr Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser His His
1070 1075 1080
His His His His Glu Pro Glu Ala
1085 1090
<210> 68
<211> 1091
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 68
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1 5 10 15
Leu Arg Gly Ala Arg Cys Gln Val Gln Leu Gln Glu Ser Gly Gly Gly
20 25 30
Leu Ala Gln Ala Gly Gly Ser Leu Ser Leu Ser Cys Ala Ala Ser Gly
35 40 45
Phe Thr Val Ser Asn Ser Val Met Ala Trp Tyr Arg Gln Thr Pro Gly
50 55 60
Lys Gln Arg Glu Phe Val Ala Ile Ile Asn Ser Val Gly Ser Thr Asn
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Thr Val Tyr Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr
100 105 110
Ala Val Tyr Val Cys Asn Arg Asn Phe Asp Arg Ile Tyr Trp Gly Gln
115 120 125
Gly Thr Gln Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Ile Trp Glu Leu Lys Lys Asp Val Tyr
145 150 155 160
Val Val Glu Leu Asp Trp Tyr Pro Asp Ala Pro Gly Glu Met Val Val
165 170 175
Leu Thr Cys Asp Thr Pro Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp
180 185 190
Gln Ser Ser Glu Val Leu Gly Ser Gly Lys Thr Leu Thr Ile Gln Val
195 200 205
Lys Glu Phe Gly Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu
210 215 220
Val Leu Ser His Ser Leu Leu Leu Leu His Lys Lys Glu Asp Gly Ile
225 230 235 240
Trp Ser Thr Asp Ile Leu Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr
245 250 255
Phe Leu Arg Cys Glu Ala Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp
260 265 270
Trp Leu Thr Thr Ile Ser Thr Asp Leu Thr Phe Ser Val Lys Ser Ser
275 280 285
Arg Gly Ser Ser Asp Pro Gln Gly Val Thr Cys Gly Ala Ala Thr Leu
290 295 300
Ser Ala Glu Arg Val Arg Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val
305 310 315 320
Glu Cys Gln Glu Asp Ser Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro
325 330 335
Ile Glu Val Met Val Asp Ala Val His Lys Leu Lys Tyr Glu Asn Tyr
340 345 350
Thr Ser Ser Phe Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys
355 360 365
Asn Leu Gln Leu Lys Pro Leu Lys Asn Ser Arg Gln Val Glu Val Ser
370 375 380
Trp Glu Tyr Pro Asp Thr Trp Ser Thr Pro His Ser Tyr Phe Ser Leu
385 390 395 400
Thr Phe Cys Val Gln Val Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp
405 410 415
Arg Val Phe Thr Asp Lys Thr Ser Ala Thr Val Ile Cys Arg Lys Asn
420 425 430
Ala Ser Ile Ser Val Arg Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp
435 440 445
Ser Glu Trp Ala Ser Val Pro Cys Ser Gly Gly Gly Gly Ser Gly Gly
450 455 460
Gly Gly Ser Gly Gly Gly Gly Ser Arg Val Ile Pro Val Ser Gly Pro
465 470 475 480
Ala Arg Cys Leu Ser Gln Ser Arg Asn Leu Leu Lys Thr Thr Asp Asp
485 490 495
Met Val Lys Thr Ala Arg Glu Lys Leu Lys His Tyr Ser Cys Thr Ala
500 505 510
Glu Asp Ile Asp His Glu Asp Ile Thr Arg Asp Gln Thr Ser Thr Leu
515 520 525
Lys Thr Cys Leu Pro Leu Glu Leu His Lys Asn Glu Ser Cys Leu Ala
530 535 540
Thr Arg Glu Thr Ser Ser Thr Thr Arg Gly Ser Cys Leu Pro Pro Gln
545 550 555 560
Lys Thr Ser Leu Met Met Thr Leu Cys Leu Gly Ser Ile Tyr Glu Asp
565 570 575
Leu Lys Met Tyr Gln Thr Glu Phe Gln Ala Ile Asn Ala Ala Leu Gln
580 585 590
Asn His Asn His Gln Gln Ile Ile Leu Asp Lys Gly Met Leu Val Ala
595 600 605
Ile Asp Glu Leu Met Gln Ser Leu Asn His Asn Gly Glu Thr Leu Arg
610 615 620
Gln Lys Pro Pro Val Gly Glu Ala Asp Pro Tyr Arg Val Lys Met Lys
625 630 635 640
Leu Cys Ile Leu Leu His Ala Phe Ser Thr Arg Val Val Thr Ile Asn
645 650 655
Arg Val Met Gly Tyr Leu Ser Ser Ala Ser Gly Gly Pro Gly Pro Ala
660 665 670
Gly Met Lys Gly Leu Pro Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
675 680 685
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
690 695 700
Ser Gly Gly Gly Gly Ser Gln Ser Val Leu Thr Gln Pro Pro Ser Val
705 710 715 720
Ser Gly Ala Pro Gly Gln Arg Val Thr Ile Ser Cys Ser Gly Ser Arg
725 730 735
Ser Asn Ile Gly Ser Asn Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly
740 745 750
Thr Ala Pro Lys Leu Leu Ile Tyr Tyr Asn Asp Gln Arg Pro Ser Gly
755 760 765
Val Pro Asp Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu
770 775 780
Ala Ile Thr Gly Leu Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln
785 790 795 800
Ser Tyr Asp Arg Tyr Thr His Pro Ala Leu Leu Phe Gly Thr Gly Thr
805 810 815
Lys Val Thr Val Leu Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
820 825 830
Gly Gly Gly Ser Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val
835 840 845
Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr
850 855 860
Phe Ser Ser Tyr Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly
865 870 875 880
Leu Glu Trp Val Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr
885 890 895
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
900 905 910
Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
915 920 925
Val Tyr Tyr Cys Lys Thr His Gly Ser His Asp Asn Trp Gly Gln Gly
930 935 940
Thr Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
945 950 955 960
Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly
965 970 975
Leu Val Gln Pro Gly Asn Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly
980 985 990
Phe Thr Phe Ser Lys Phe Gly Met Ser Trp Val Arg Gln Ala Pro Gly
995 1000 1005
Lys Gly Leu Glu Trp Val Ser Ser Ile Ser Gly Ser Gly Arg Asp
1010 1015 1020
Thr Leu Tyr Ala Glu Ser Val Lys Gly Arg Phe Thr Ile Ser Arg
1025 1030 1035
Asp Asn Ala Lys Thr Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg
1040 1045 1050
Pro Glu Asp Thr Ala Val Tyr Tyr Cys Thr Ile Gly Gly Ser Leu
1055 1060 1065
Ser Val Ser Ser Gln Gly Thr Leu Val Thr Val Ser Ser His His
1070 1075 1080
His His His His Glu Pro Glu Ala
1085 1090
<210> 69
<211> 1091
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 69
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1 5 10 15
Leu Arg Gly Ala Arg Cys Gln Val Gln Leu Gln Glu Ser Gly Gly Gly
20 25 30
Leu Ala Gln Ala Gly Gly Ser Leu Ser Leu Ser Cys Ala Ala Ser Gly
35 40 45
Phe Thr Val Ser Asn Ser Val Met Ala Trp Tyr Arg Gln Thr Pro Gly
50 55 60
Lys Gln Arg Glu Phe Val Ala Ile Ile Asn Ser Val Gly Ser Thr Asn
65 70 75 80
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
85 90 95
Lys Asn Thr Val Tyr Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr
100 105 110
Ala Val Tyr Val Cys Asn Arg Asn Phe Asp Arg Ile Tyr Trp Gly Gln
115 120 125
Gly Thr Gln Val Thr Val Ser Ser Ser Gly Gly Pro Gly Pro Ala Gly
130 135 140
Met Lys Gly Leu Pro Gly Ser Ile Trp Glu Leu Lys Lys Asp Val Tyr
145 150 155 160
Val Val Glu Leu Asp Trp Tyr Pro Asp Ala Pro Gly Glu Met Val Val
165 170 175
Leu Thr Cys Asp Thr Pro Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp
180 185 190
Gln Ser Ser Glu Val Leu Gly Ser Gly Lys Thr Leu Thr Ile Gln Val
195 200 205
Lys Glu Phe Gly Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu
210 215 220
Val Leu Ser His Ser Leu Leu Leu Leu His Lys Lys Glu Asp Gly Ile
225 230 235 240
Trp Ser Thr Asp Ile Leu Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr
245 250 255
Phe Leu Arg Cys Glu Ala Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp
260 265 270
Trp Leu Thr Thr Ile Ser Thr Asp Leu Thr Phe Ser Val Lys Ser Ser
275 280 285
Arg Gly Ser Ser Asp Pro Gln Gly Val Thr Cys Gly Ala Ala Thr Leu
290 295 300
Ser Ala Glu Arg Val Arg Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val
305 310 315 320
Glu Cys Gln Glu Asp Ser Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro
325 330 335
Ile Glu Val Met Val Asp Ala Val His Lys Leu Lys Tyr Glu Asn Tyr
340 345 350
Thr Ser Ser Phe Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys
355 360 365
Asn Leu Gln Leu Lys Pro Leu Lys Asn Ser Arg Gln Val Glu Val Ser
370 375 380
Trp Glu Tyr Pro Asp Thr Trp Ser Thr Pro His Ser Tyr Phe Ser Leu
385 390 395 400
Thr Phe Cys Val Gln Val Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp
405 410 415
Arg Val Phe Thr Asp Lys Thr Ser Ala Thr Val Ile Cys Arg Lys Asn
420 425 430
Ala Ser Ile Ser Val Arg Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp
435 440 445
Ser Glu Trp Ala Ser Val Pro Cys Ser Gly Gly Gly Gly Ser Gly Gly
450 455 460
Gly Gly Ser Gly Gly Gly Gly Ser Arg Val Ile Pro Val Ser Gly Pro
465 470 475 480
Ala Arg Cys Leu Ser Gln Ser Arg Asn Leu Leu Lys Thr Thr Asp Asp
485 490 495
Met Val Lys Thr Ala Arg Glu Lys Leu Lys His Tyr Ser Cys Thr Ala
500 505 510
Glu Asp Ile Asp His Glu Asp Ile Thr Arg Asp Gln Thr Ser Thr Leu
515 520 525
Lys Thr Cys Leu Pro Leu Glu Leu His Lys Asn Glu Ser Cys Leu Ala
530 535 540
Thr Arg Glu Thr Ser Ser Thr Thr Arg Gly Ser Cys Leu Pro Pro Gln
545 550 555 560
Lys Thr Ser Leu Met Met Thr Leu Cys Leu Gly Ser Ile Tyr Glu Asp
565 570 575
Leu Lys Met Tyr Gln Thr Glu Phe Gln Ala Ile Asn Ala Ala Leu Gln
580 585 590
Asn His Asn His Gln Gln Ile Ile Leu Asp Lys Gly Met Leu Val Ala
595 600 605
Ile Asp Glu Leu Met Gln Ser Leu Asn His Asn Gly Glu Thr Leu Arg
610 615 620
Gln Lys Pro Pro Val Gly Glu Ala Asp Pro Tyr Arg Val Lys Met Lys
625 630 635 640
Leu Cys Ile Leu Leu His Ala Phe Ser Thr Arg Val Val Thr Ile Asn
645 650 655
Arg Val Met Gly Tyr Leu Ser Ser Ala Ser Gly Gly Pro Gly Pro Ala
660 665 670
Gly Met Lys Gly Leu Pro Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
675 680 685
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
690 695 700
Ser Gly Gly Gly Gly Ser Gln Ser Val Leu Thr Gln Pro Pro Ser Val
705 710 715 720
Ser Gly Ala Pro Gly Gln Arg Val Thr Ile Ser Cys Ser Gly Ser Arg
725 730 735
Ser Asn Ile Gly Ser Asn Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly
740 745 750
Thr Ala Pro Lys Leu Leu Ile Tyr Tyr Asn Asp Gln Arg Pro Ser Gly
755 760 765
Val Pro Asp Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu
770 775 780
Ala Ile Thr Gly Leu Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln
785 790 795 800
Ser Tyr Asp Arg Tyr Thr His Pro Ala Leu Leu Phe Gly Thr Gly Thr
805 810 815
Lys Val Thr Val Leu Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
820 825 830
Gly Gly Gly Ser Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val
835 840 845
Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr
850 855 860
Phe Ser Ser Tyr Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly
865 870 875 880
Leu Glu Trp Val Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr
885 890 895
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
900 905 910
Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
915 920 925
Val Tyr Tyr Cys Lys Thr His Gly Ser His Asp Asn Trp Gly Gln Gly
930 935 940
Thr Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
945 950 955 960
Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly
965 970 975
Leu Val Gln Pro Gly Asn Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly
980 985 990
Phe Thr Phe Ser Lys Phe Gly Met Ser Trp Val Arg Gln Ala Pro Gly
995 1000 1005
Lys Gly Leu Glu Trp Val Ser Ser Ile Ser Gly Ser Gly Arg Asp
1010 1015 1020
Thr Leu Tyr Ala Glu Ser Val Lys Gly Arg Phe Thr Ile Ser Arg
1025 1030 1035
Asp Asn Ala Lys Thr Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg
1040 1045 1050
Pro Glu Asp Thr Ala Val Tyr Tyr Cys Thr Ile Gly Gly Ser Leu
1055 1060 1065
Ser Val Ser Ser Gln Gly Thr Leu Val Thr Val Ser Ser His His
1070 1075 1080
His His His His Glu Pro Glu Ala
1085 1090
<210> 70
<211> 276
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 70
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1 5 10 15
Leu Arg Gly Ala Arg Cys Glu Val Gln Leu Val Glu Ser Gly Gly Gly
20 25 30
Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly
35 40 45
Phe Thr Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly
50 55 60
Lys Gly Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr
65 70 75 80
Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn
85 90 95
Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp
100 105 110
Thr Ala Val Tyr Tyr Cys Ala Arg Gly Val Gly Ala Phe Arg Pro Tyr
115 120 125
Arg Lys His Glu Trp Gly Gln Gly Thr Leu Val Thr Val Ser Arg Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Ser
145 150 155 160
Glu Leu Thr Gln Asp Pro Ala Val Ser Val Ala Leu Gly Gln Thr Val
165 170 175
Arg Ile Thr Cys Gln Gly Asp Ser Leu Arg Ser Tyr Tyr Ala Ser Trp
180 185 190
Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr Gly Lys
195 200 205
Asn Asn Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser Ser Ser
210 215 220
Gly Asn Thr Ala Ser Leu Thr Thr Thr Gly Ala Gln Ala Glu Asp Glu
225 230 235 240
Ala Asp Tyr Tyr Cys Asn Ser Ser Pro Phe Glu His Asn Leu Val Val
245 250 255
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu His His His His His His
260 265 270
Glu Pro GluAla
275
<210> 71
<211> 534
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 71
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Lys Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Gly Gly Gly Gly Gly Leu Asp Gly Asn
35 40 45
Glu Glu Pro Gly Gly Leu Glu Trp Val Ser Ser Ile Ser Gly Ser Gly
50 55 60
Arg Asp Thr Leu Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser
65 70 75 80
Arg Asp Asn Ala Lys Thr Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg
85 90 95
Pro Glu Asp Thr Ala Val Tyr Tyr Cys Thr Ile Gly Gly Ser Leu Ser
100 105 110
Val Ser Ser Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly
115 120 125
Lys Pro Leu Gly Leu Gln Ala Arg Val Val Gly Gly Gly Gly Thr Gln
130 135 140
Thr Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly Thr
145 150 155 160
Val Thr Leu Thr Cys Ala Ser Ser Thr Gly Ala Val Thr Ser Gly Asn
165 170 175
Tyr Pro Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly Leu
180 185 190
Ile Gly Gly Thr Lys Phe Leu Val Pro Gly Thr Pro Ala Arg Phe Ser
195 200 205
Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Leu Ser Gly Val Gln
210 215 220
Pro Glu Asp Glu Ala Glu Tyr Tyr Cys Thr Leu Trp Tyr Ser Asn Arg
225 230 235 240
Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gly Gly Gly
245 250 255
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Val
260 265 270
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Lys Leu Ser
275 280 285
Cys Ala Ala Ser Gly Phe Thr Phe Asn Lys Tyr Ala Ile Asn Trp Val
290 295 300
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Arg Ser
305 310 315 320
Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Gln Val Lys Asp Arg
325 330 335
Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr Ala Tyr Leu Gln Met
340 345 350
Asn Asn Leu Lys Thr Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His
355 360 365
Ala Asn Phe Gly Asn Ser Tyr Ile Ser Tyr Trp Ala Tyr Trp Gly Gln
370 375 380
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
385 390 395 400
Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
405 410 415
Gly Ser Leu Thr Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Ser
420 425 430
Tyr Ala Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe
435 440 445
Val Val Ala Ile Asn Trp Ala Ser Gly Ser Thr Tyr Tyr Ala Asp Ser
450 455 460
Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu
465 470 475 480
Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr
485 490 495
Cys Ala Ala Gly Tyr Gln Ile Asn Ser Gly Asn Tyr Asn Phe Lys Asp
500 505 510
Tyr Glu Tyr Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
515 520 525
His His His His His His
530
<210> 72
<211> 534
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 72
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Lys Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Gly Gly Gly Gly Gly Leu Asp Gly Asn
35 40 45
Glu Glu Pro Gly Gly Leu Glu Trp Val Ser Ser Ile Ser Gly Ser Gly
50 55 60
Arg Asp Thr Leu Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser
65 70 75 80
Arg Asp Asn Ala Lys Thr Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg
85 90 95
Pro Glu Asp Thr Ala Val Tyr Tyr Cys Thr Ile Gly Gly Ser Leu Ser
100 105 110
Val Ser Ser Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Gly Gly Val Val Gly Gly Gly Gly Thr Gln
130 135 140
Thr Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly Thr
145 150 155 160
Val Thr Leu Thr Cys Ala Ser Ser Thr Gly Ala Val Thr Ser Gly Asn
165 170 175
Tyr Pro Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly Leu
180 185 190
Ile Gly Gly Thr Lys Phe Leu Val Pro Gly Thr Pro Ala Arg Phe Ser
195 200 205
Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Leu Ser Gly Val Gln
210 215 220
Pro Glu Asp Glu Ala Glu Tyr Tyr Cys Thr Leu Trp Tyr Ser Asn Arg
225 230 235 240
Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gly Gly Gly
245 250 255
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Val
260 265 270
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Lys Leu Ser
275 280 285
Cys Ala Ala Ser Gly Phe Thr Phe Asn Lys Tyr Ala Ile Asn Trp Val
290 295 300
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Arg Ser
305 310 315 320
Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Gln Val Lys Asp Arg
325 330 335
Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr Ala Tyr Leu Gln Met
340 345 350
Asn Asn Leu Lys Thr Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His
355 360 365
Ala Asn Phe Gly Asn Ser Tyr Ile Ser Tyr Trp Ala Tyr Trp Gly Gln
370 375 380
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
385 390 395 400
Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
405 410 415
Gly Ser Leu Thr Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Ser
420 425 430
Tyr Ala Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe
435 440 445
Val Val Ala Ile Asn Trp Ala Ser Gly Ser Thr Tyr Tyr Ala Asp Ser
450 455 460
Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu
465 470 475 480
Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr
485 490 495
Cys Ala Ala Gly Tyr Gln Ile Asn Ser Gly Asn Tyr Asn Phe Lys Asp
500 505 510
Tyr Glu Tyr Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
515 520 525
His His His His His His
530
<210> 73
<211> 398
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 73
Val Val Gly Gly Gly Gly Thr Gln Thr Val Val Thr Gln Glu Pro Ser
1 5 10 15
Leu Thr Val Ser Pro Gly Gly Thr Val Thr Leu Thr Cys Ala Ser Ser
20 25 30
Thr Gly Ala Val Thr Ser Gly Asn Tyr Pro Asn Trp Val Gln Gln Lys
35 40 45
Pro Gly Gln Ala Pro Arg Gly Leu Ile Gly Gly Thr Lys Phe Leu Val
50 55 60
Pro Gly Thr Pro Ala Arg Phe Ser Gly Ser Leu Leu Gly Gly Lys Ala
65 70 75 80
Ala Leu Thr Leu Ser Gly Val Gln Pro Glu Asp Glu Ala Glu Tyr Tyr
85 90 95
Cys Thr Leu Trp Tyr Ser Asn Arg Trp Val Phe Gly Gly Gly Thr Lys
100 105 110
Leu Thr Val Leu Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Pro Gly Gly Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
145 150 155 160
Asn Lys Tyr Ala Ile Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
165 170 175
Glu Trp Val Ala Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr
180 185 190
Tyr Ala Asp Gln Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser
195 200 205
Lys Asn Thr Ala Tyr Leu Gln Met Asn Asn Leu Lys Thr Glu Asp Thr
210 215 220
Ala Val Tyr Tyr Cys Val Arg His Ala Asn Phe Gly Asn Ser Tyr Ile
225 230 235 240
Ser Tyr Trp Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
245 250 255
Gly Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser
260 265 270
Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Thr Leu Ser Cys Ala
275 280 285
Ala Ser Gly Arg Thr Phe Ser Ser Tyr Ala Met Gly Trp Phe Arg Gln
290 295 300
Ala Pro Gly Lys Glu Arg Glu Phe Val Val Ala Ile Asn Trp Ala Ser
305 310 315 320
Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser
325 330 335
Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg
340 345 350
Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ala Gly Tyr Gln Ile Asn
355 360 365
Ser Gly Asn Tyr Asn Phe Lys Asp Tyr Glu Tyr Asp Tyr Trp Gly Gln
370 375 380
Gly Thr Leu Val Thr Val Ser Ser His His His His His His
385 390 395
<210> 74
<211> 518
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 74
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Lys Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Gly Gly Gly Gly Gly Leu Asp Gly Asn
35 40 45
Glu Glu Pro Gly Gly Leu Glu Trp Val Ser Ser Ile Ser Gly Ser Gly
50 55 60
Arg Asp Thr Leu Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser
65 70 75 80
Arg Asp Asn Ala Lys Thr Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg
85 90 95
Pro Glu Asp Thr Ala Val Tyr Tyr Cys Thr Ile Gly Gly Ser Leu Ser
100 105 110
Val Ser Ser Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly
115 120 125
Lys Pro Leu Gly Leu Gln Ala Arg Val Val Gly Gly Gly Gly Thr Gln
130 135 140
Thr Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly Thr
145 150 155 160
Val Thr Leu Thr Cys Ala Ser Ser Thr Gly Ala Val Thr Ser Gly Asn
165 170 175
Tyr Pro Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly Leu
180 185 190
Ile Gly Gly Thr Lys Phe Leu Val Pro Gly Thr Pro Ala Arg Phe Ser
195 200 205
Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Leu Ser Gly Val Gln
210 215 220
Pro Glu Asp Glu Ala Glu Tyr Tyr Cys Thr Leu Trp Tyr Ser Asn Arg
225 230 235 240
Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gly Gly Gly
245 250 255
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Val
260 265 270
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Lys Leu Ser
275 280 285
Cys Ala Ala Ser Gly Phe Thr Phe Asn Lys Tyr Ala Ile Asn Trp Val
290 295 300
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Arg Ser
305 310 315 320
Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Gln Val Lys Asp Arg
325 330 335
Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr Ala Tyr Leu Gln Met
340 345 350
Asn Asn Leu Lys Thr Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His
355 360 365
Ala Asn Phe Gly Asn Ser Tyr Ile Ser Tyr Trp Ala Tyr Trp Gly Gln
370 375 380
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
385 390 395 400
Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
405 410 415
Gly Ser Leu Thr Leu Ser Cys Ala Ala Ser Arg Phe Met Ile Ser Glu
420 425 430
Tyr His Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
435 440 445
Val Ser Thr Ile Asn Pro Ala Gly Thr Thr Asp Tyr Ala Glu Ser Val
450 455 460
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
465 470 475 480
Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
485 490 495
Asp Ser Tyr Gly Tyr Arg Gly Gln Gly Thr Gln Val Thr Val Ser Ser
500 505 510
His His His His His His
515
<210> 75
<211> 518
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 75
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Lys Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Gly Gly Gly Gly Gly Leu Asp Gly Asn
35 40 45
Glu Glu Pro Gly Gly Leu Glu Trp Val Ser Ser Ile Ser Gly Ser Gly
50 55 60
Arg Asp Thr Leu Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser
65 70 75 80
Arg Asp Asn Ala Lys Thr Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg
85 90 95
Pro Glu Asp Thr Ala Val Tyr Tyr Cys Thr Ile Gly Gly Ser Leu Ser
100 105 110
Val Ser Ser Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Gly Gly Val Val Gly Gly Gly Gly Thr Gln
130 135 140
Thr Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly Thr
145 150 155 160
Val Thr Leu Thr Cys Ala Ser Ser Thr Gly Ala Val Thr Ser Gly Asn
165 170 175
Tyr Pro Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly Leu
180 185 190
Ile Gly Gly Thr Lys Phe Leu Val Pro Gly Thr Pro Ala Arg Phe Ser
195 200 205
Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Leu Ser Gly Val Gln
210 215 220
Pro Glu Asp Glu Ala Glu Tyr Tyr Cys Thr Leu Trp Tyr Ser Asn Arg
225 230 235 240
Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gly Gly Gly
245 250 255
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Val
260 265 270
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Lys Leu Ser
275 280 285
Cys Ala Ala Ser Gly Phe Thr Phe Asn Lys Tyr Ala Ile Asn Trp Val
290 295 300
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Arg Ser
305 310 315 320
Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Gln Val Lys Asp Arg
325 330 335
Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr Ala Tyr Leu Gln Met
340 345 350
Asn Asn Leu Lys Thr Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His
355 360 365
Ala Asn Phe Gly Asn Ser Tyr Ile Ser Tyr Trp Ala Tyr Trp Gly Gln
370 375 380
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
385 390 395 400
Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
405 410 415
Gly Ser Leu Thr Leu Ser Cys Ala Ala Ser Arg Phe Met Ile Ser Glu
420 425 430
Tyr His Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
435 440 445
Val Ser Thr Ile Asn Pro Ala Gly Thr Thr Asp Tyr Ala Glu Ser Val
450 455 460
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
465 470 475 480
Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
485 490 495
Asp Ser Tyr Gly Tyr Arg Gly Gln Gly Thr Gln Val Thr Val Ser Ser
500 505 510
His His His His His His
515
<210> 76
<211> 382
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 76
Val Val Gly Gly Gly Gly Thr Gln Thr Val Val Thr Gln Glu Pro Ser
1 5 10 15
Leu Thr Val Ser Pro Gly Gly Thr Val Thr Leu Thr Cys Ala Ser Ser
20 25 30
Thr Gly Ala Val Thr Ser Gly Asn Tyr Pro Asn Trp Val Gln Gln Lys
35 40 45
Pro Gly Gln Ala Pro Arg Gly Leu Ile Gly Gly Thr Lys Phe Leu Val
50 55 60
Pro Gly Thr Pro Ala Arg Phe Ser Gly Ser Leu Leu Gly Gly Lys Ala
65 70 75 80
Ala Leu Thr Leu Ser Gly Val Gln Pro Glu Asp Glu Ala Glu Tyr Tyr
85 90 95
Cys Thr Leu Trp Tyr Ser Asn Arg Trp Val Phe Gly Gly Gly Thr Lys
100 105 110
Leu Thr Val Leu Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Pro Gly Gly Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
145 150 155 160
Asn Lys Tyr Ala Ile Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
165 170 175
Glu Trp Val Ala Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr
180 185 190
Tyr Ala Asp Gln Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser
195 200 205
Lys Asn Thr Ala Tyr Leu Gln Met Asn Asn Leu Lys Thr Glu Asp Thr
210 215 220
Ala Val Tyr Tyr Cys Val Arg His Ala Asn Phe Gly Asn Ser Tyr Ile
225 230 235 240
Ser Tyr Trp Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
245 250 255
Gly Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser
260 265 270
Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Thr Leu Ser Cys Ala
275 280 285
Ala Ser Arg Phe Met Ile Ser Glu Tyr His Met His Trp Val Arg Gln
290 295 300
Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Thr Ile Asn Pro Ala Gly
305 310 315 320
Thr Thr Asp Tyr Ala Glu Ser Val Lys Gly Arg Phe Thr Ile Ser Arg
325 330 335
Asp Asn Ala Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Lys Pro
340 345 350
Glu Asp Thr Ala Val Tyr Tyr Cys Asp Ser Tyr Gly Tyr Arg Gly Gln
355 360 365
Gly Thr Gln Val Thr Val Ser Ser His His His His His His
370 375 380
<210> 77
<211> 503
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 77
Gln Val Gln Leu Val Glu Ser Gly Gly Ala Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Pro Val Asn Arg Tyr
20 25 30
Ser Met Arg Trp Tyr Arg Gln Ala Pro Gly Lys Glu Arg Glu Trp Val
35 40 45
Ala Gly Met Ser Ser Ala Gly Asp Arg Ser Ser Tyr Glu Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ala Arg Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Asn Val Asn Val Gly Phe Glu Tyr Trp Gly Gln Gly Thr Gln Val Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu
115 120 125
Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn Ser Leu Arg Leu
130 135 140
Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Lys Phe Gly Met Ser Trp
145 150 155 160
Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ser Ile Ser
165 170 175
Gly Ser Gly Arg Asp Thr Leu Tyr Ala Asp Ser Val Lys Gly Arg Phe
180 185 190
Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr Leu Gln Met Asn
195 200 205
Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys Thr Ile Gly Gly
210 215 220
Ser Leu Ser Val Ser Ser Gln Gly Thr Leu Val Thr Val Ser Ser Gly
225 230 235 240
Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly
245 250 255
Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Lys Leu Ser Cys Ala Ala
260 265 270
Ser Gly Phe Thr Phe Asn Lys Tyr Ala Ile Asn Trp Val Arg Gln Ala
275 280 285
Pro Gly Lys Gly Leu Glu Trp Val Ala Arg Ile Arg Ser Lys Tyr Asn
290 295 300
Asn Tyr Ala Thr Tyr Tyr Ala Asp Gln Val Lys Asp Arg Phe Thr Ile
305 310 315 320
Ser Arg Asp Asp Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Asn Leu
325 330 335
Lys Thr Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg His Ala Asn Phe
340 345 350
Gly Asn Ser Tyr Ile Ser Tyr Trp Ala Tyr Trp Gly Gln Gly Thr Leu
355 360 365
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
370 375 380
Gly Gly Gly Ser Gln Thr Val Val Thr Gln Glu Pro Ser Leu Thr Val
385 390 395 400
Ser Pro Gly Gly Thr Val Thr Leu Thr Cys Ala Ser Ser Thr Gly Ala
405 410 415
Val Thr Ser Gly Asn Tyr Pro Asn Trp Val Gln Gln Lys Pro Gly Gln
420 425 430
Ala Pro Arg Gly Leu Ile Gly Gly Thr Lys Phe Leu Val Pro Gly Thr
435 440 445
Pro Ala Arg Phe Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr
450 455 460
Leu Ser Gly Val Gln Pro Glu Asp Glu Ala Glu Tyr Tyr Cys Thr Leu
465 470 475 480
Trp Tyr Ser Asn Arg Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val
485 490 495
Leu His His His His His His
500
<210> 78
<211> 509
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 78
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Lys Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Gly Arg Asp Thr Leu Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Gly Ser Leu Ser Val Ser Ser Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Val
115 120 125
Val Gly Gly Gly Gly Thr Gln Thr Val Val Thr Gln Glu Pro Ser Leu
130 135 140
Thr Val Ser Pro Gly Gly Thr Val Thr Leu Thr Cys Ala Ser Ser Thr
145 150 155 160
Gly Ala Val Thr Ser Gly Asn Tyr Pro Asn Trp Val Gln Gln Lys Pro
165 170 175
Gly Gln Ala Pro Arg Gly Leu Ile Gly Gly Thr Lys Phe Leu Val Pro
180 185 190
Gly Thr Pro Ala Arg Phe Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala
195 200 205
Leu Thr Leu Ser Gly Val Gln Pro Glu Asp Glu Ala Glu Tyr Tyr Cys
210 215 220
Thr Leu Trp Tyr Ser Asn Arg Trp Val Phe Gly Gly Gly Thr Lys Leu
225 230 235 240
Thr Val Leu Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
245 250 255
Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro
260 265 270
Gly Gly Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn
275 280 285
Lys Tyr Ala Ile Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
290 295 300
Trp Val Ala Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr
305 310 315 320
Ala Asp Gln Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys
325 330 335
Asn Thr Ala Tyr Leu Gln Met Asn Asn Leu Lys Thr Glu Asp Thr Ala
340 345 350
Val Tyr Tyr Cys Val Arg His Ala Asn Phe Gly Asn Ser Tyr Ile Ser
355 360 365
Tyr Trp Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly
370 375 380
Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly
385 390 395 400
Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Thr Leu Ser Cys Ala Ala
405 410 415
Ser Arg Phe Met Ile Ser Glu Tyr His Met His Trp Val Arg Gln Ala
420 425 430
Pro Gly Lys Gly Leu Glu Trp Val Ser Thr Ile Asn Pro Ala Gly Thr
435 440 445
Thr Asp Tyr Ala Glu Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp
450 455 460
Asn Ala Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Lys Pro Glu
465 470 475 480
Asp Thr Ala Val Tyr Tyr Cys Asp Ser Tyr Gly Tyr Arg Gly Gln Gly
485 490 495
Thr Gln Val Thr Val Ser Ser His His His His His His
500 505
<210> 79
<211> 269
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 79
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1 5 10 15
Leu Arg Gly Ala Arg Cys Gln Ser Val Leu Thr Gln Pro Pro Ser Val
20 25 30
Ser Gly Ala Pro Gly Gln Arg Val Thr Ile Ser Cys Ser Gly Ser Arg
35 40 45
Ser Asn Ile Gly Ser Asn Thr Val Lys Trp Tyr Gln Gln Leu Pro Gly
50 55 60
Thr Ala Pro Lys Leu Leu Ile Tyr Tyr Asn Asp Gln Arg Pro Ser Gly
65 70 75 80
Val Pro Asp Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu
85 90 95
Ala Ile Thr Gly Leu Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Gln
100 105 110
Ser Tyr Asp Arg Tyr Thr His Pro Ala Leu Leu Phe Gly Thr Gly Thr
115 120 125
Lys Val Thr Val Leu Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val
145 150 155 160
Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr
165 170 175
Phe Ser Ser Tyr Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly
180 185 190
Leu Glu Trp Val Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr
195 200 205
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
210 215 220
Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Lys Thr His Gly Ser His Asp Asn Trp Gly Gln Gly
245 250 255
Thr Met Val Thr Val Ser Ser His His His His His His
260 265
<210> 80
<211> 5
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
Сайт расщепления сортазой A"
<220>
<221> МОД_ОСТ
<222> (3)..(3)
<223> Любая аминокислота
<400> 80
Leu Pro XaaThrGly
1 5
<210> 81
<211> 25
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<220>
<221> SITE
<222> (1)..(25)
<223> /примечание="Эта последовательность может содержать 1-5 повторяющихся
звеньев 'Gly Gly Gly Gly Ser'"
<400> 81
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25
<210> 82
<211> 20
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<220>
<221> SITE
<222> (1)..(20)
<223> /примечание="Эта последовательность может содержать 1-5 повторяющихся
звеньев 'Gly Gly Gly Ser'"
<400> 82
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10 15
GlyGlyGlySer
20
<210> 83
<211> 7
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
расщепляемая протеазой последовательность"
<400> 83
Gly Pro LeuGlyValArgGly
1 5
<210> 84
<211> 8
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
расщепляемая протеазой последовательность"
<400> 84
Ile Pro ValSerLeuArgSerGly
1 5
<210> 85
<211> 8
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
расщепляемая протеазой последовательность"
<400> 85
Val Pro LeuSerLeuTyrSerGly
1 5
<210> 86
<211> 10
<212> Белок
<213> Неизвестная последовательность
<220>
<221> источник
<223> /примечание="Описание неизвестной последовательности:
расщепляемая протеазой последовательность"
<400> 86
SerGlyGluSer Pro AlaTyrTyrThrAla
1 5 10
<210> 87
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 87
Gly Gly Gly Gly Ser
1 5
<210> 88
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 88
Gly Ser Gly Ser Gly Ser
1 5
<210> 89
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 89
Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Thr
1 5 10
<210> 90
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 90
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 91
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетическая
метка 6xHis"
<400> 91
His His His His His His
1 5
<210> 92
<211> 124
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 92
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Lys Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Gly Gly Gly Gly Gly Leu Asp Gly Asn
35 40 45
Glu Glu Pro GlyGly Leu Glu Trp Val Ser Ser Ile Ser Gly Ser Gly
50 55 60
Arg Asp Thr Leu Tyr Ala Asp Ser Val Lys Gly Arg PheThr Ile Ser
65 70 75 80
Arg Asp Asn Ala Lys ThrThr Leu Tyr Leu Gln Met Asn Ser Leu Arg
85 90 95
Pro Glu Asp Thr Ala Val Tyr TyrCysThr Ile GlyGly Ser Leu Ser
100 105 110
Val Ser Ser Gln GlyThr Leu Val Thr Val Ser Ser
115 120
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АКТИВИРУЕМЫЕ ПОЛИПЕПТИДЫ ИНТЕРЛЕЙКИНА-2 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2826454C2 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2728861C1 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2698655C2 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2746550C2 |
| ИММУНОЦИТОКИНЫ И ИХ ПРИМЕНЕНИЕ | 2021 |
|
RU2818371C1 |
| ХИМЕРНЫЙ ЦИТОКИНОВЫЙ РЕЦЕПТОР | 2016 |
|
RU2826122C1 |
| ЛИГАНДСВЯЗЫВАЮЩАЯ МОЛЕКУЛА С РЕГУЛИРУЕМОЙ ЛИГАНДСВЯЗЫВАЮЩЕЙ АКТИВНОСТЬЮ | 2017 |
|
RU2803067C2 |
| ВАРИАНТНЫЕ МОЛЕКУЛЫ IL-10 И СПОСОБ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2020 |
|
RU2836849C2 |
| СЛИТЫЕ БЕЛКИ С АЛЬБУМИН-СВЯЗЫВАЮЩИМИ ДОМЕНАМИ | 2018 |
|
RU2786444C2 |
| АНТИТЕЛА, СОДЕРЖАЩИЕ ПОЛИПЕПТИД, ВСТРОЕННЫЙ В УЧАСТОК КАРКАСНОЙ ОБЛАСТИ 3 | 2019 |
|
RU2796254C2 |



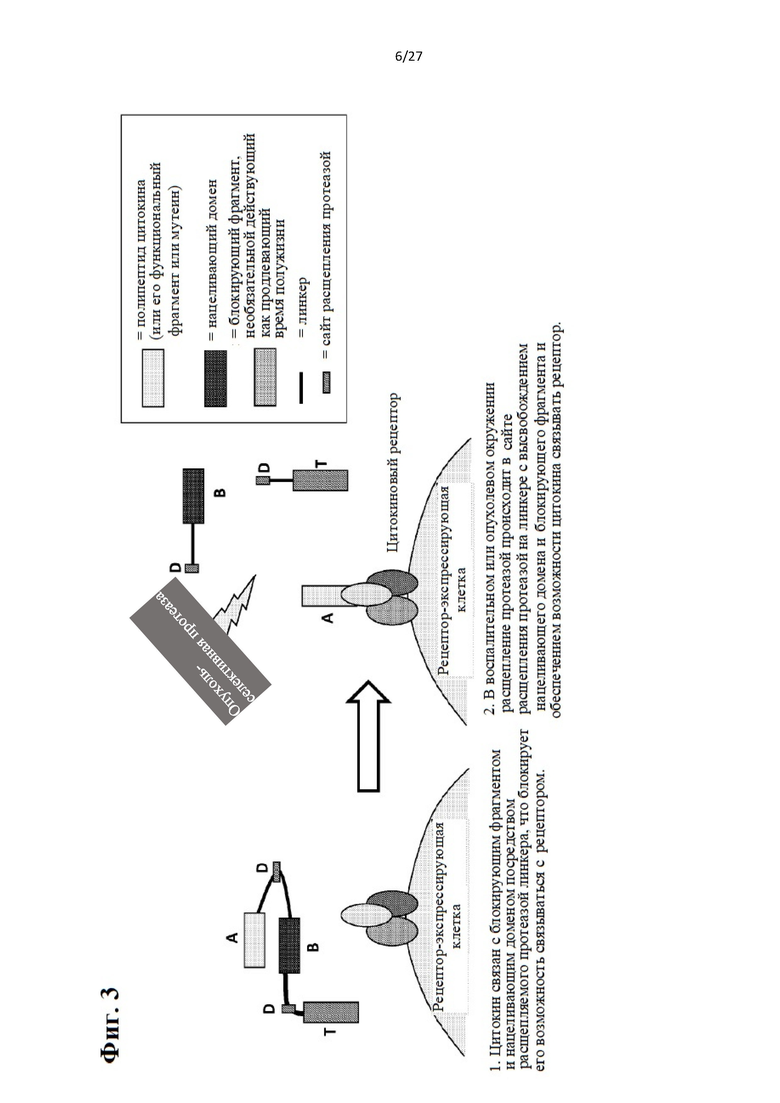


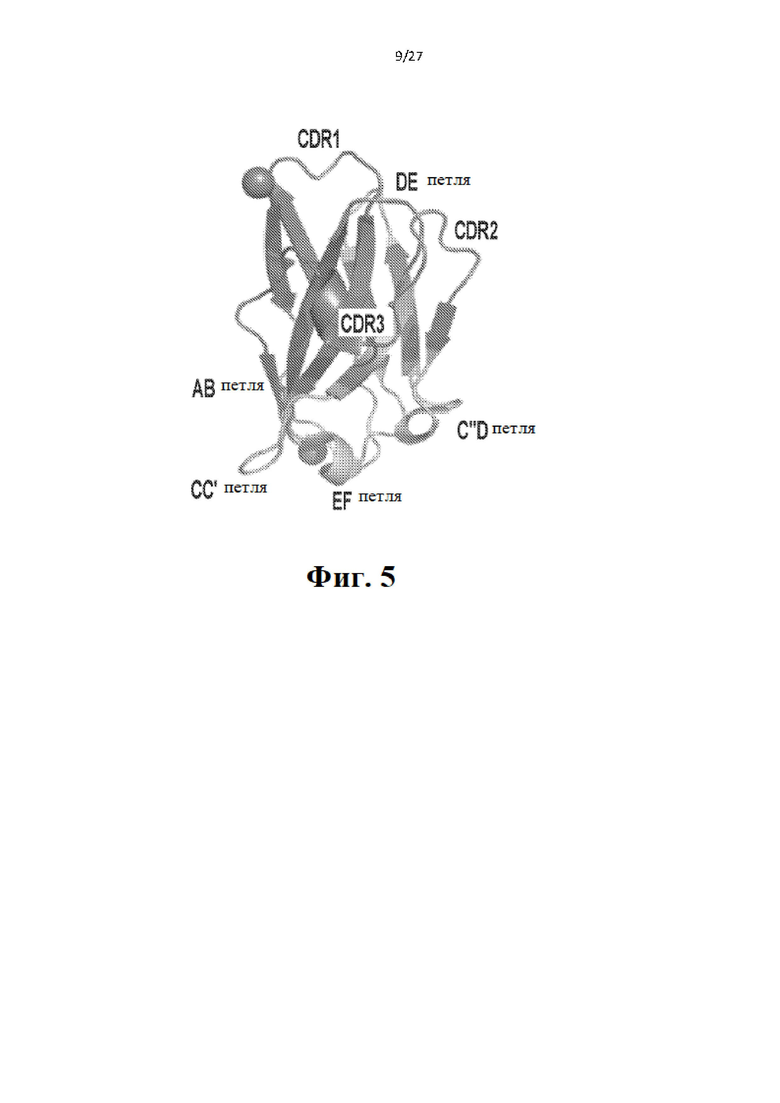


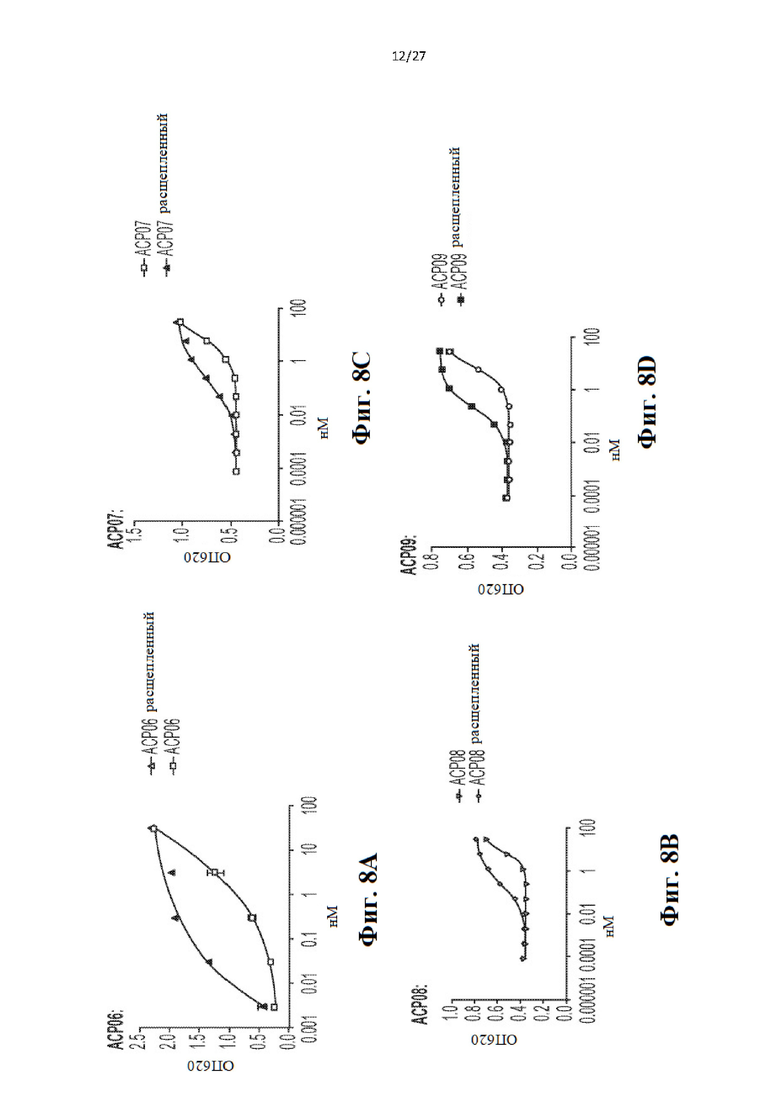
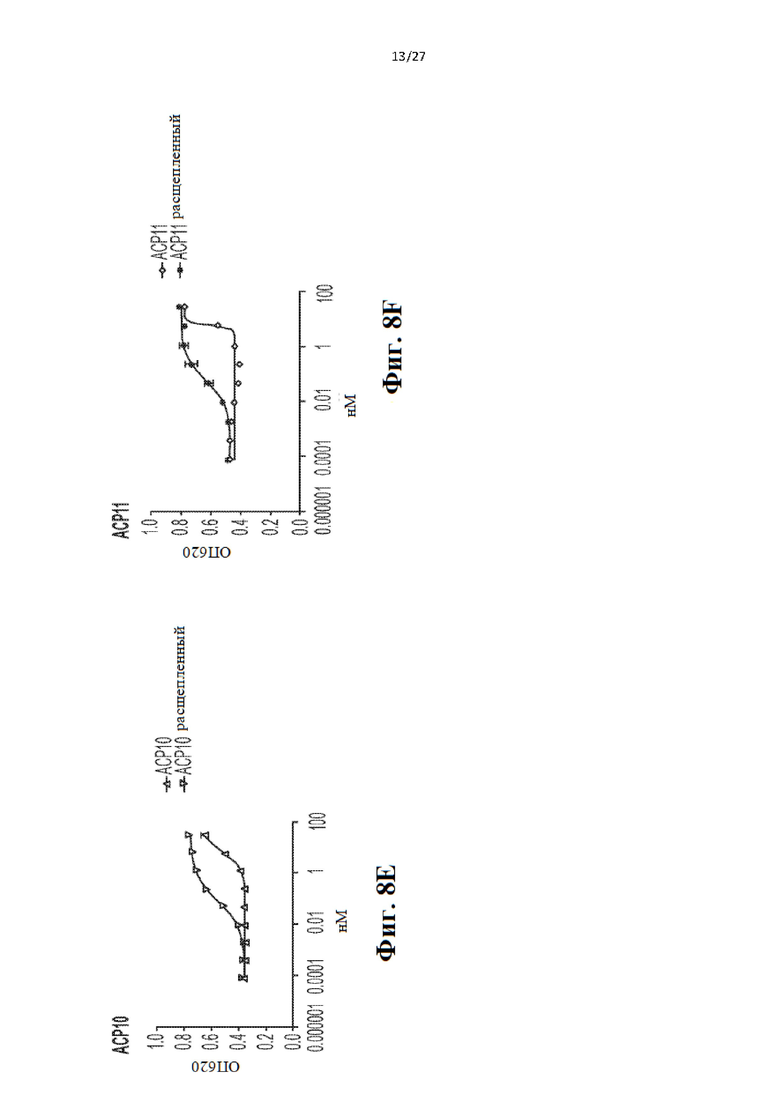
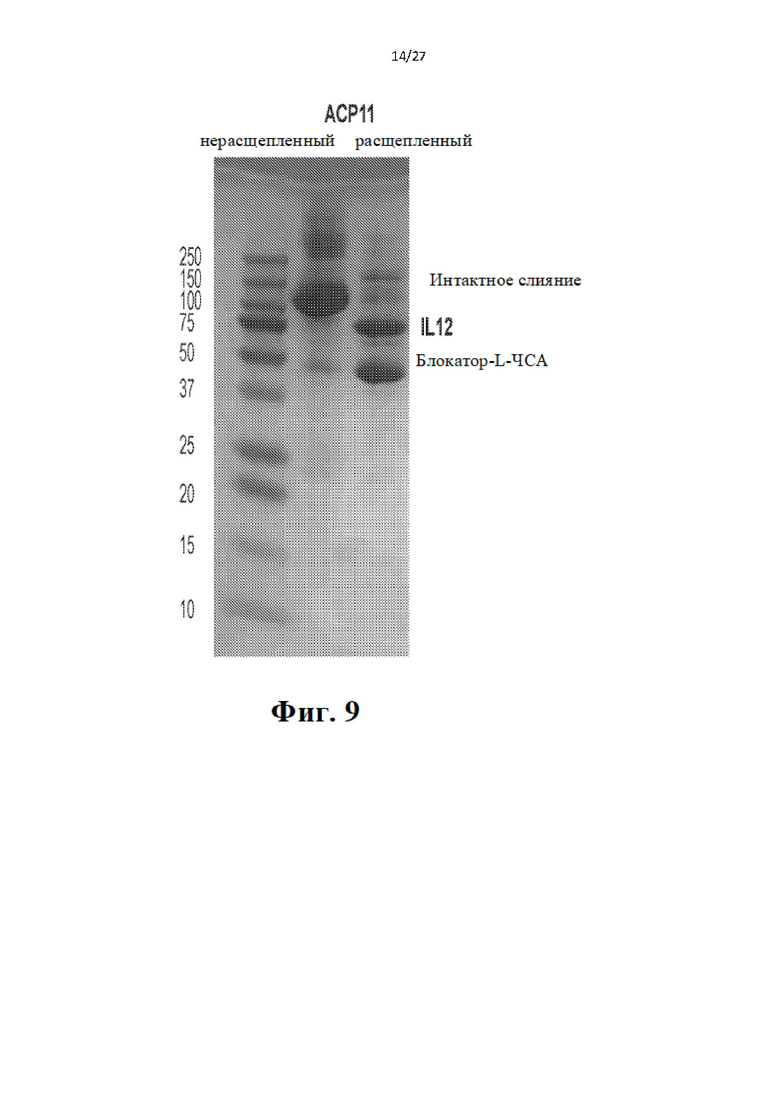

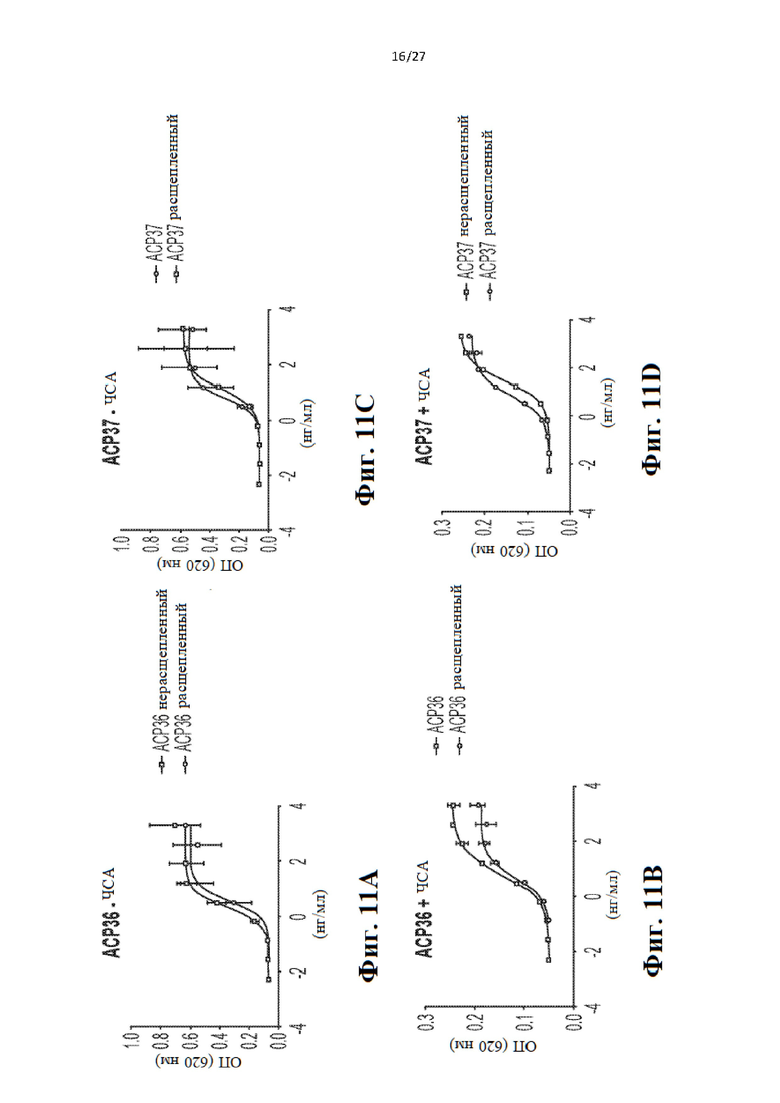




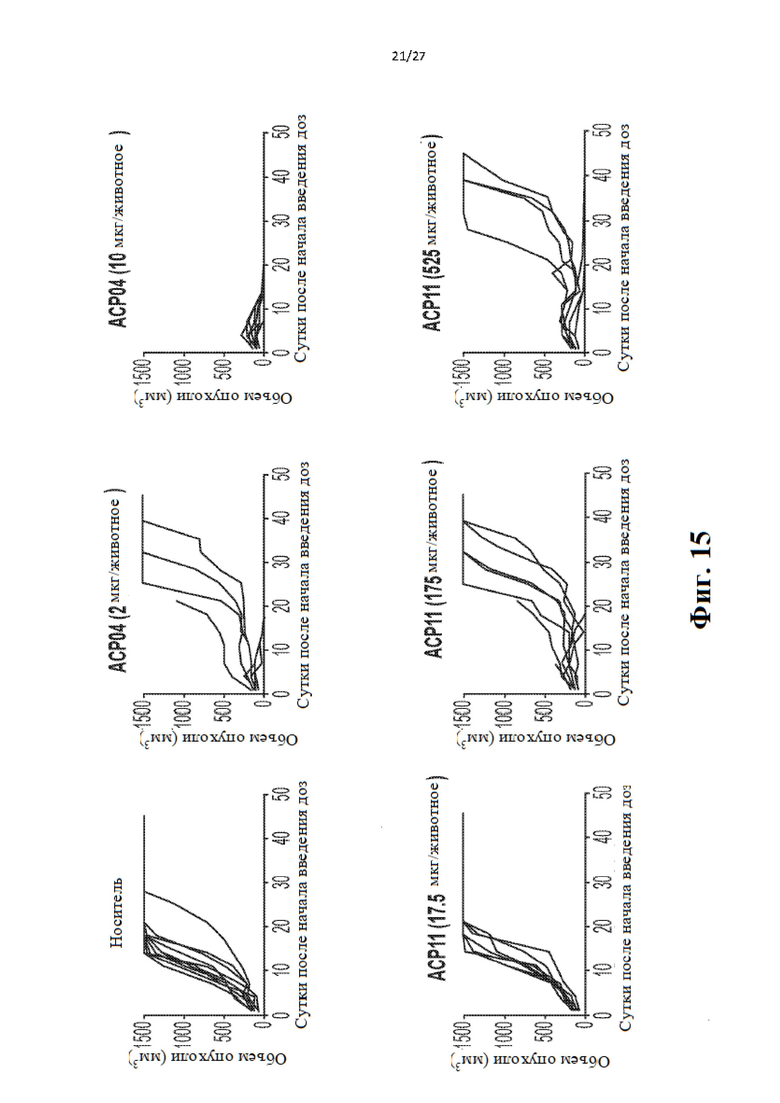
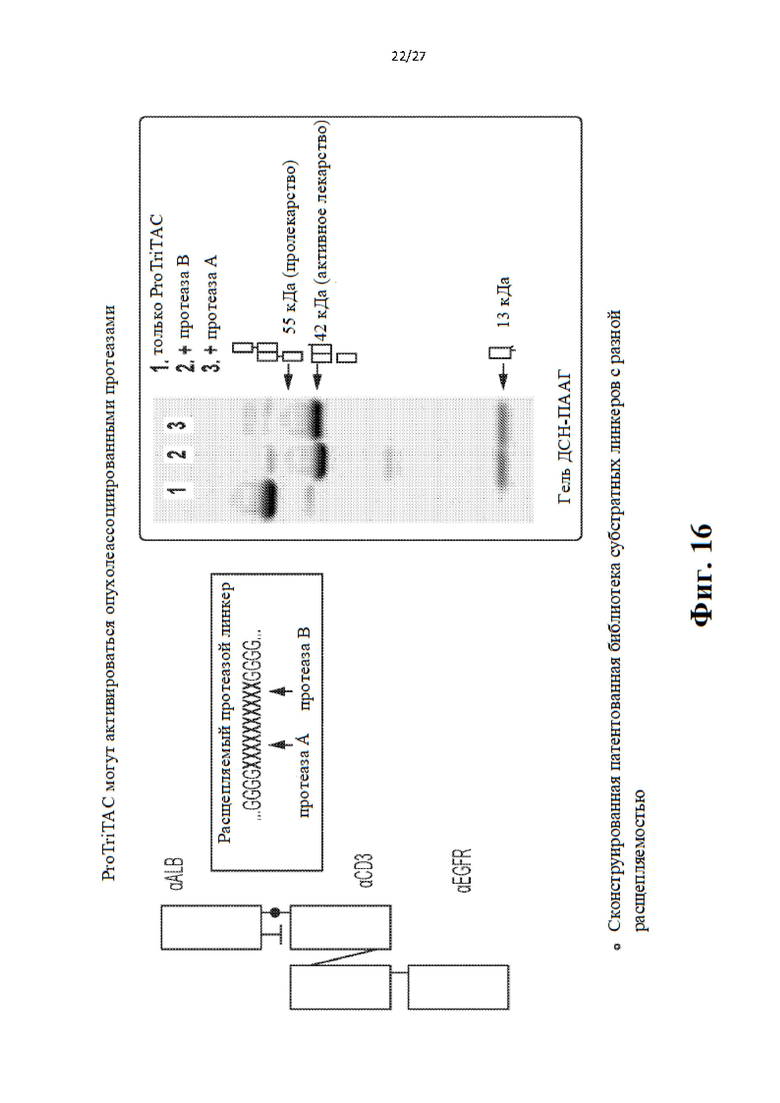
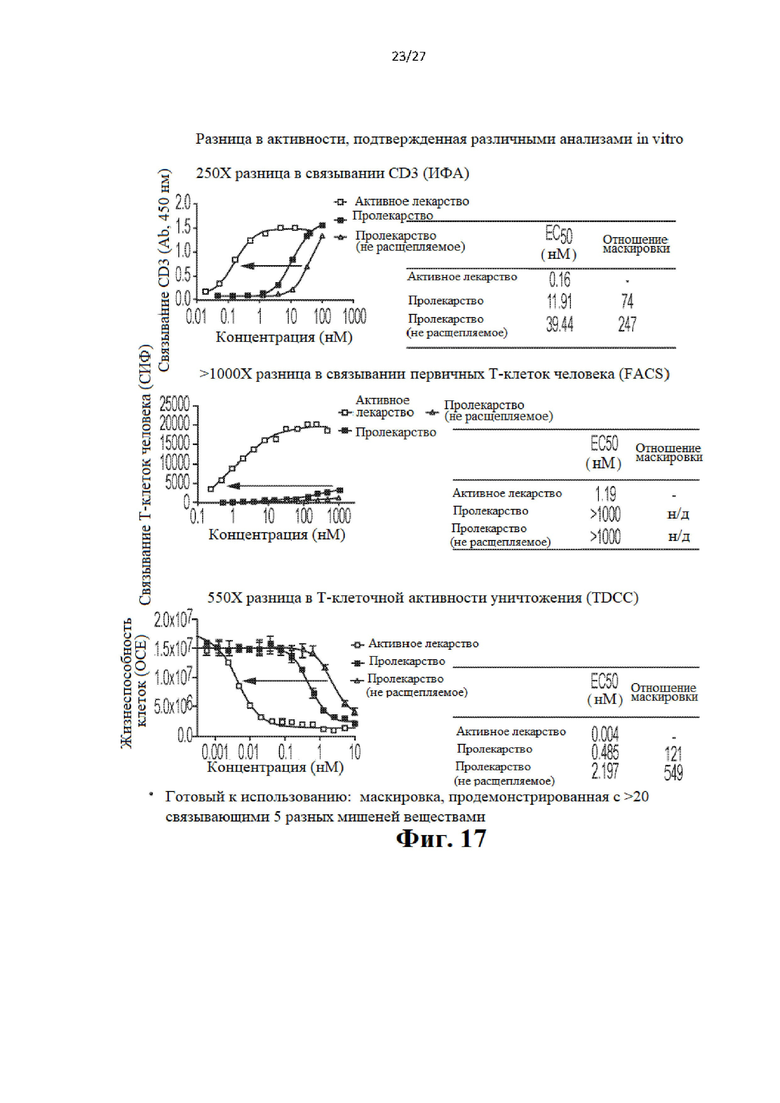
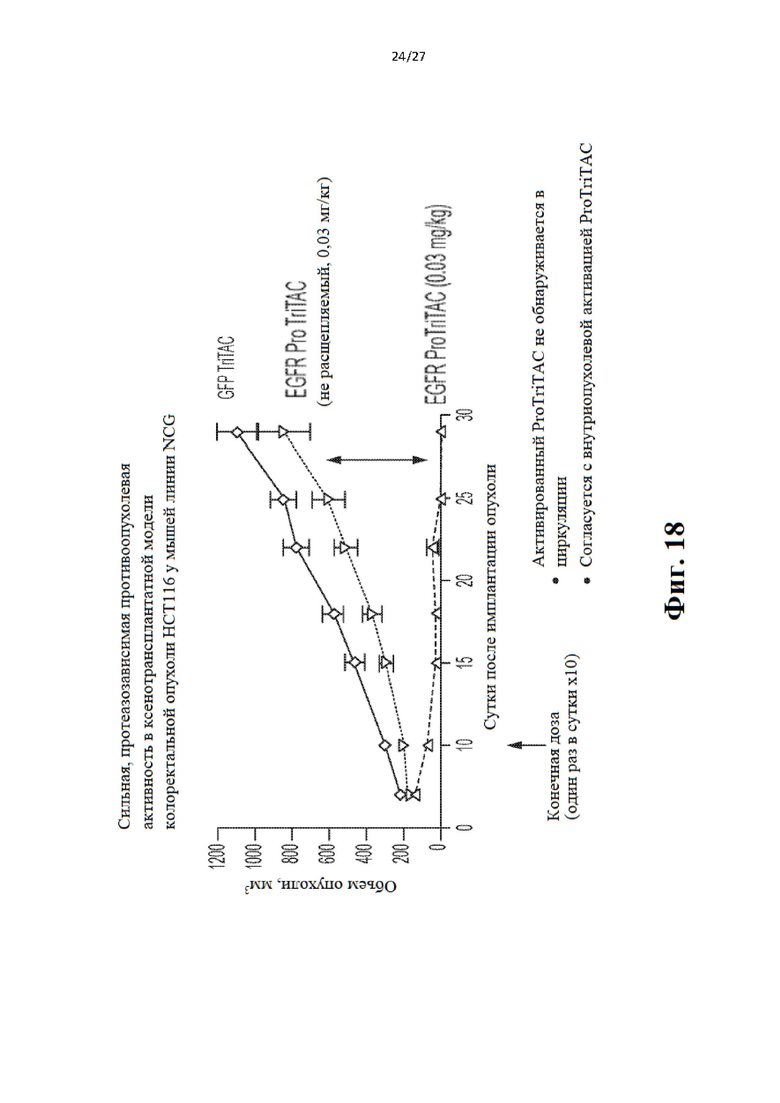

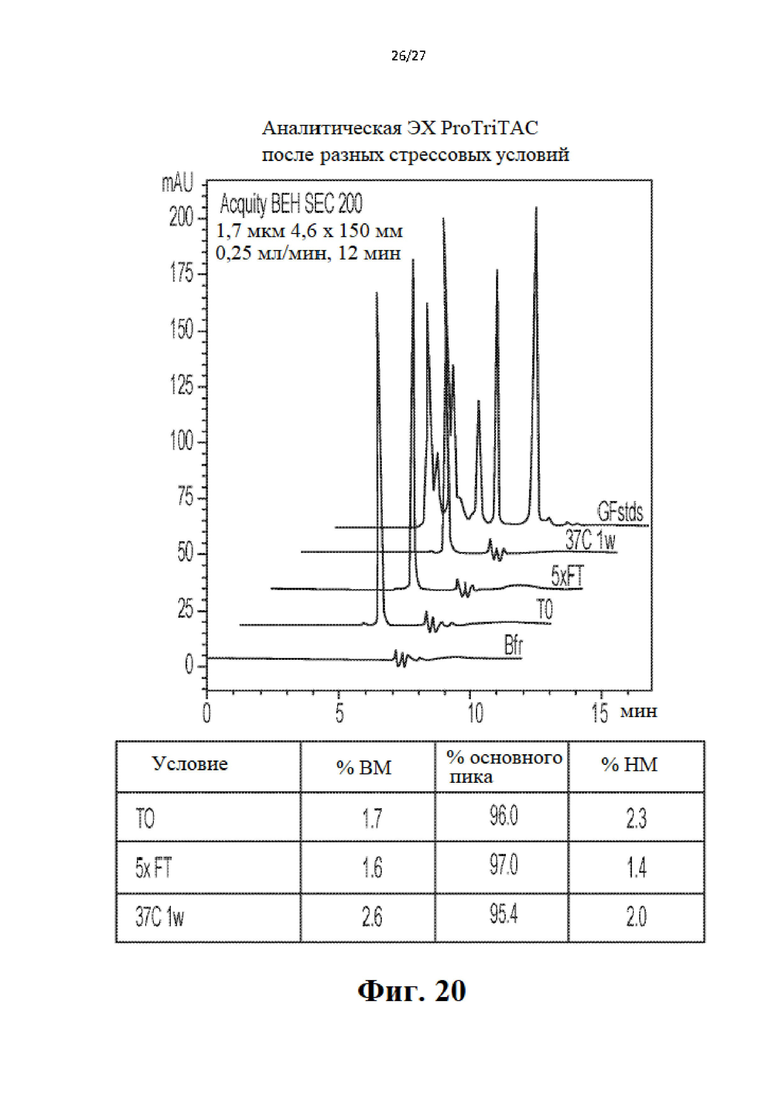

Изобретение относится к области биотехнологии, конкретно к получению слитых белков, которые являются кондиционально активными вариантами интерлейкина 2 (IL-12), и может быть использовано в медицине для лечения опухоли. Предложен кондиционально активный IL-12, содержащий слитый полипептид, в состав которого входит полипептид IL-12, элемент для продления времени полужизни и блокирующий IL-12 фрагмент, соединенные линкерами. Изобретение обеспечивает получение кондиционально активного пролекарства IL-12, имеющего увеличенное время полужизни, которое доставляет активный IL-12 при расщеплении протеазой, особенно в желаемые места активности, такие как микроокружение опухоли. 4 н. и 21 з.п. ф-лы, 21 ил., 3 табл., 11 пр.
1. Кондиционально активный IL-12, содержащий слитый полипептид формулы:
[A]-[L1]-[D]-[L2]-[B] или [B]-[L1]-[A]-[L1]-[D], где
[A] представляет собой полипептид интерлейкина 12 (IL-12);
[B] представляет собой элемент для продления времени полужизни, причем элемент для продления времени полужизни представляет собой человеческий сывороточный альбумин или антигенсвязывающий полипептид, который связывается с сывороточным альбумином, или Fc иммуноглобулина;
[L1] представляет собой расщепляемый протеазой полипептидный линкер и [L2] представляет собой полипептидный линкер, который необязательно является расщепляемым протеазой, и где расщепляемый протеазой линкер [L2] содержит по меньшей мере одну последовательность, которая является расщепляемой протеазой, причем для каждого из [L1] и [L2] независимо протеаза выбрана из группы, состоящей из калликреина, тромбина, химазы, карбоксипептидазы A, эластазы, PR-3, гранзима M, кальпаина, матриксной металлопротеиназы (MMP), белка активации фибробластов (FAP), металлопротеиназы ADAM, активатора плазминогена, катепсина, каспазы, триптазы и поверхностной протеазы опухолевых клеток; и
[D] представляет собой блокирующий IL-12 фрагмент; причем блокирующий IL-12 фрагмент представляет собой антитело, которое связывается с IL-12, антигенсвязывающий фрагмент антитела, который связывается с полипептидом IL-12, или лигандсвязывающий домен, или фрагмент когнатного рецептора для полипептида IL-12; и
кондиционально активный IL-12 имеет ослабленную активирующую рецептор IL-12 активность, причем активирующая рецептор IL-12 активность слитого полипептида является по меньшей мере в около 10 раз меньшей, чем активирующая рецептор IL-12 активность полипептида, который содержит полипептид IL-12, который образуется вследствие расщепления расщепляемого протеазой полипептидного линкера L1 или, когда L2 является расщепляемым протеазой, вследствие расщепления как L1, так и L2, и причем активирующая рецептор IL-12 активность оценивается с использованием клеточного анализа с репортером HEK Blue, с эквивалентными молярными количествами полипептида IL-12 и слитого полипептида.
2. Кондиционально активный IL-12 по п. 1, отличающийся тем, что [A] имеет формулу:
[A1]-[L3]-[A2]или [A2]-[L3]-[A1], где
[A1] представляет собой полипептид субъединицы p40 IL-12;
[A2] представляет собой полипептид субъединицы p35 IL-12; и
[L3] представляет собой полипептидный линкер, который необязательно расщепляется протеазой.
3. Кондиционально активный IL-12 по п. 2, отличающийся тем, что [A] имеет формулу [A1]- [L3]-[A2], а [L3] является не расщепляемым протеазой.
4. Кондиционально активный IL-12 по п. 1, причем [L2] является расщепляемым протеазой линкером.
5. Кондиционально активный IL-12 по п. 1, причем [L1] является субстратом для первой протеазы, а [L2] является субстратом для второй протеазы.
6. Кондиционально активный IL-12 по п. 5, отличающийся тем, что каждый расщепляемый протеазой полипептид независимо содержит два или более сайтов расщепления для одной протеазы или два или более сайтов расщепления, которые расщепляются разными протеазами, или по меньшей мере один из расщепляемых протеазой полипептидов содержит сайт расщепления для двух или более разных протеаз.
7. Кондиционально активный IL-12 по п. 1, отличающийся тем, что блокирующий IL-12 фрагмент ингибирует активацию рецептора IL-12 слитым полипептидом.
8. Кондиционально активный IL-12 по п. 7, отличающийся тем, что блокирующий IL-12 фрагмент нековалентно связывается с полипептидом IL-12.
9. Кондиционально активный IL-12 по п. 7, отличающийся тем, что блокирующий IL-12 фрагмент связывает полипептид субъединицы p40 IL-12.
10. Кондиционально активный IL-12 по п. 7, отличающийся тем, что блокирующий IL-12 фрагмент связывает полипептид субъединицы p35 IL-12.
11. Кондиционально активный IL-12 по п. 7, отличающийся тем, что блокирующий IL-12 фрагмент содержит однодоменное антитело, Fab или scFv, которые связывают полипептид IL-12.
12. Кондиционально активный IL-12 по п. 6, причем IL-12 может свободно диссоциировать от блокирующего IL-12 фрагмента после расщепления расщепляемого протеазой полипептидного линкера протеазой.
13. Кондиционально активный IL-12 по п. 1, дополнительно содержащий опухолеспецифический антигенсвязывающий пептид.
14. Кондиционально активный IL-12 по п. 13, причем опухолеспецифический антигенсвязывающий пептид связан с полипептидом IL-12 нерасщепляемым линкером.
15. Кондиционально активный IL-12 по п. 13, причем опухолеспецифический антигенсвязывающий пептид связан расщепляемым линкером с полипептидом IL-12, элементом для продления времени полужизни или блокирующим IL-12 фрагментом.
16. Кондиционально активный IL-12 по п. 1, причем катепсин представляет собой катепсин B, катепсин C, катепсин D, катепсин E, катепсин K, катепсин L или катепсин G.
17. Кондиционально активный IL-12 по п. 1, причем матриксная металлопротеиназа (MMP) представляет собой MMP1, MMP2, MMP3, MMP8, MMP9, MMP10, MMP11, MMP12, MMP13 или MMP14.
18. Кондиционально активный IL-12 по п. 2, причем элемент для продления времени полужизни функционально связан с IL-12p35.
19. Кондиционально активный IL-12 по п. 2, причем элемент для продления времени полужизни функционально связан с IL-12p40.
20. Кондиционально активный IL-12 по п. 9, причем IL-12p40 связан с IL-12p35 с образованием гетеродимера.
21. Кондиционально активный IL-12 по п. 10, причем IL-12p35 связан с IL-12p40 с образованием гетеродимера.
22. Кондиционально активный IL-12 по п. 1, причем когнантный рецептора для IL-12 представляет собой IL-12R бета 1 (IL-12Rβ1) или IL12R бета 2 (IL-12Rβ2).
23. Способ лечения опухоли, включающий введение нуждающемуся в этом субъекту эффективного количества кондициально активного IL-12 по любому из пп. 1-22.
24. Применение кондициально активного IL-12 по любому из пп. 1-22 для лечения опухоли у нуждающегося в этом субъекта.
25. Фармацевтическая композиция для лечения опухоли у нуждающегося в этом субъекта, содержащая в качестве активного ингредиента кондициально активный IL-12 по любому из пп. 1-22.
| НУКЛЕИНОВО-КИСЛОТНЫЙ КОНСТРУКТ ДЛЯ ЭКСПРЕССИИ АКТИВНЫХ ВЕЩЕСТВ, КОТОРЫЕ МОГУТ БЫТЬ АКТИВИРОВАНЫ ПРОТЕАЗАМИ, ПОЛУЧЕНИЕ И ИСПОЛЬЗОВАНИЕ | 1998 |
|
RU2204414C2 |
| PUSKAS J | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| SKROMBOLAS D | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2024-09-05—Публикация
2019-05-14—Подача