Изобретение относится к области молекулярной биологии и биотехнологии, в частности, к экспрессионным векторам на основе аденоассоциированных вирусов (ААВ), и может быть использовано в медицине для лечения пациентов с множественной эпифизарной дисплазией (МЭД), обусловленной мутациями в гене транспортера ионов сульфата SLC26A2.
МЭД - группа генетически гетерогенных врожденных заболеваний, поражающих преимущественно концы длинных трубчатых костей рук и ног (эпифизы). Существует два типа МЭД, которые различаются по типу наследования. Рецессивная МЭД отличается от доминантного типа пороками развития кистей, стоп, коленей и аномальным искривлением позвоночника [Unger S., Superti-Furga A. SLC26A2-Related Multiple Epiphyseal Dysplasia // GeneReviews. - URL: https://www.ncbi.nlm.nih.gov/books/NBK1306/]. Примерно у 50% больных при рождении наблюдаются такие аномалии, как косолапость, клинодактилия или кистозный отек уха.
Среди рецессивных форм МЭД около 25% случаев связано с мутациями в гене SLC26A2 [Unger S., Superti-Furga A. SLC26A2-Related Multiple Epiphyseal Dysplasia // GeneReviews. - URL: https://www.ncbi.nlm.nih.gov/books/NBK1306/]. Эти формы заболевания объединяют в группу SLC26A2-связанных МЭД или МЭД 4 типа (№226900 в базе данных OMIM). Мутации в SLC26A2 в гомозиготном состоянии приводят к нехватке или полному отсутствию белка SLC26A2 - транспортера ионов сульфата. Ионы сульфата необходимы для синтеза протеогликанов межклеточного вещества хряща и синовиальной жидкости, поэтому при дефиците белка SLC26A2 нарушается формирование хрящевых выстилок суставных поверхностей [Kausar М., Mäkitie R.Е. et al. Recessive multiple epiphyseal dysplasia - Clinical characteristics caused by rare compound heterozygous SLC26A2 genotypes // Eur J Med Genet. - 2019. - Vol. 62, №11 P 103573; Haila S. et al. SLC26A2 (diastrophic dysplasia sulfate transporter) is expressed in developing and mature cartilage but also in other tissues and cell types // Histochem Cytochem. - 2001. - Vol. 49, №8 P 973-82]. В результате развиваются множественные диспластические аномалии позвоночника и суставов, прежде всего - тазобедренных и коленных, что приводит к ранней инвалидизации больных. В настоящее время этиотропная и патогенетическая терапия МЭД отсутствуют. Симптоматическое лечение МЭД направлено на облегчение тяжести протекания заболевания и предотвращение ранней инвалидизации пациентов.
Одним из наиболее перспективных и активно развивающихся сегментов генотерапевтических средств являются препараты на основе аденоассоциированнных вирусов (ААВ). Эффективность и безопасность векторов на основе ААВ подтверждается их активным внедрением в клиническую практику. Однако на данный момент не предложено разработок для генной терапии на основе ААВ-векторов для лечения пациентов с МЭД.
Обнадеживающими можно считать предварительные результаты применения ААВ для лечения других заболеваний опорно-двигательного аппарата - остеоартрита и ревматоидного артрита. После внутрисуставного введения ААВ серотипа 5, несущего ген бета-интерферона, модельным животным - мышам [Aalbers C.J. et al. Preclinical potency and biodistribution studies of an AAV5 vector expressing human interferon- (ART-102) for local treatment of patients with rheumatoid arthritis // PLoS ONE. - 2014. - Vol. 10, №6] и крысам [Adriaansen et al. Local delivery of beta-interferon using an adeno-assosiated virus type 5 effectively inhibits adjuvant arthritis in rats // J Gen Virol. - 2007. - Vol. 8, №6 P 1717-1721], было показано что более 93% AAV5 остается внутри сустава, с незначительным количеством вирусных частиц, попадающих в прилежащие лимфатические узлы, при этом наблюдался противовоспалительный эффект и синтез трансгена в обрасти сустава.
В экспериментах на модельных макаках резус [Bevaart L. et al. Safety, biodistribution, and efficacy of an AAV-5 vector encoding human interferon-beta (ART-102) delivered via intra-articular injection in rhesus monkeys with collagen-induced arthritis // Hum Gene Ther Clin Dev. - 2015. - Vol. 26, №2 P 103-12] после инъекции AAV5 был продемонстрирован терапевтический эффект в целевом суставе, а также в прилегающих костных и хрящевых тканях, при хорошей переносимости процедуры и отсутствии нежелательных эффектов. Предварительные результаты клинических исследований на группе пациентов с острым воспалительным артритом после введения в суставы рук не выявили серьезных побочных или системных явлений у всех пациентов, однако выраженный терапевтический эффект не был достигнут, при вероятности развития местных побочных реакций [Vrouwe J.P.M. et al. Administration of an adeno-assosiated viral vector expressing interferon-gamma in patients with inflammatory hand arthritis, results of a phase I/II study // Osteoarthritis and Cartilage. - 2022. - Vol. 30, 31 P 52-60].
Известны рекомбинантные ААВ-векторы, экспрессирующие остеопротективные гены, включая гиалуронсинтазу-2 (HAS-2) и лубрицин, пригодные при лечении остеоартрита (OA) и сходных заболеваний суставов у млекопитающих (RU 2771490, С2). Результаты исследований подтвердили устойчивый опосредованный rAAV5 перенос терапевтических генов в синовиальную и хрящевую ткань суставов собак с OA и продемонстрировали длительную экспрессию, обусловленную вектором, по меньшей мере, в течение шести месяцев. Гистологический анализ показал уменьшенную патологию хряща и задержку прогрессирования болезни в большинстве суставов, обработанных HAS-2, наряду с тем, что наблюдались небольшие различия в общих уровнях гиалуроновой кислоты (НА) в синовиальной жидкости. Последнее может указывать на то, что локальная экспрессия НА в хрящевой и синовиальной ткани обладает некоторыми терапевтическими свойствами при отсутствии повышения общих уровней НА в синовиальной жидкости. Указанный способ использует ААВ серотипа 5 как средство доставки терапевтических генов в область пораженных суставов при остеоартрите и сходных с ним заболеваниях опорно-двигательного аппарата воспалительного характера.
МЭД относится к врожденным моногенным заболеваниям. Воспалительные процессы могут сопутствовать патологическим процессам в суставах при МЭД, но обусловлены нарушением формирования хрящевой ткани и синовиальной жидкости при врожденных мутациях в гене SLC26A2 и носят вторичный характер по отношению к недостаточности белка-транспортера сульфат-ионов - продукта гена SLC26A2, что не позволяет использовать указанные выше предложения для патогенетической коррекции МЭД.
Из данных отечественной и зарубежной литературы, патентов и патентных заявок не известно использование векторов на основе ААВ для лечения множественной эпифизарной дисплазии.
Конкретная задача требует конкретных решений, поэтому под каждую задачу приходится создавать свою оптимальную генетическую конструкцию. Нами была поставлена задача сконструировать экспрессионный вектор на основе ААВ, несущий функциональную копию гена SLC26A2 под контролем универсального промотора, который может быть использован для местных внутрисуставных инъекций при лечении пациентов с МЭД, вызванной мутациями в гене SLC26A2. Доставка функциональной копии гена должна восполнить недостаток белка-транспортера сульфат-ионов в пораженных тканях сустава и тем самым улучшить качество жизни пациентов с МЭД.
Технический результат, достигаемый при осуществлении изобретения, заключается в разработке этиопатогенетического средства для лечения МЭД, обусловленной мутациями в гене транспортера ионов сульфата SLC26A2, за счет использования оригинального экспрессионного вектора, обеспечивающего увеличение экспрессии гена SLC26A2, путем его внутрисуставного введения.
Упомянутый вектор в виде дезоксирибонуклеиновой кислоты, упакованной в вирусные частицы ААВ серотипа 5 с помощью известных из уровня техники способов, может быть использован в качестве средства доставки терапевтического гена в пораженные суставы методом внутрисуставных инъекций.
Сущность изобретения заключается в следующем.
Предложен экспрессионный вектор для увеличения экспрессии гена SLC26A2 в клетках млекопитающего, представляющий собой вирусную частицу ААВ, имеющую капсидные белки ААВ серотипа 5. В указанную частицу упакована в качестве генома одноцепочечная молекула ДНК, на концах которой расположены последовательности ITR (inverted terminal repeats, инвертированные концевые повторы) ААВ серотипа 2. Внутри ITR ААВ серотипа 2 последовательно расположены последовательность раннего промотора цитомегаловируса человека, интрон из гена бета-глобина человека, последовательность гена SLC26A2 человека и сигнал полиаденилирования из гена гормона роста человека.
В частном случае в качестве генома выбрана нуклеотидная последовательность SEQ ID NO: 1.
Предлагаемый экспрессионный вектор создан на основе вирусных частиц аденоассоциированного вируса (ААВ) и содержит белки капсида серотипа 5. В качестве генома в вирусные частицы упакована одноцепочечная молекула ДНК, на концах которой расположены концевые повторы ITRs аденоассоциированного вируса серотипа 2. Внутри ITRs в следующей последовательности (в направлении от 5'- к 3'-концу молекулы ДНК) расположены необходимые функциональные элементы:
- ранний промотор цитомегаловируса человека (CMV);
- интрон из гена бета-глобина человека;
- ген SLC26A2 человека;
- сигнал полиаденилирования из гена гормона роста человека.
Ранний промотор CMV был выбран на основании ряда ранее проведенных экспериментов, которые показали, что он обеспечивает более высокий уровень экспрессии трансгена в человеческих клетках различного тканевого происхождения по сравнению с другими промоторами, широко применяющимися в генотерапевтических конструкциях на основе ААВ, и, в частности, с промотором CAG.
Кроме того, промотор CMV является универсальным, то есть обеспечивает постоянный уровень экспрессии в различных типах клеток и тканей.
После упомянутого промотора в геноме вектора содержится интрон из гена бета-глобина человека, обеспечивающий повышенный уровень экспрессии трансгена в составе векторного генома.
После участка интрона следует нуклеотидная последовательность гена SLC26A2 человека согласно референсной последовательности NM_000112.4 базы данных NCBI, которая должна обеспечивать экспрессию и синтез нормального белка-транспортера в клетках с мутантным геном SLC26A2.
В качестве терминатора транскрипции использован сигнал полиаденилирования из гена гормона роста человека.
В качестве источника гена SLC26A2 использовали геномную ДНК здорового донора с известной нуклеотидной последовательностью, подтвержденной методом высокопроизводительного секвенирования независимо на платформах Illumina HiSeq (Illumina Inc., США), MGISEQ-2000 (MGI Tech Co., Ltd, КНР) и Oxford Nanopore (Oxford Nanopore Technologies, Великобритания).
Для создания рекомбинантного экспрессионного ААВ вектора использовали доступные для заказа плазмидные векторы pCMV.MCS и pAAV.CMV.LacZ (№105531, Addgene, США). В работе применяли стандартные методы молекулярного клонирования, известные специалистам в данной области техники (например, M.R. Green and Sambrook J., Molecular Cloning: a Laboratory Manual, 4th Edition, Cold Spring Harbor Lab. Press, New York 2012). Кодирующую последовательность гена SLC26A2 амплифицировали в реакции полимеразной цепной реакции (ПЦР) с помощью высокоточной ДНК-полимеразы и праймеров, содержащих подходящие для клонирования сайты рестрикции. Продукт реакции амплификации, целевой фрагмент длиной 2220 п. н., очищали в ходе электрофореза в агарозном геле, выделяли из геля и клонировали в вектор pCMV-MCS (в полилинкер MCS, multiple cloning site) по сайтам рестрикции EcoRI и BglII, в результате чего был получена промежуточная векторная конструкция, содержащая кодирующую область гена SLC26A2. На следующем этапе на матрице промежуточной конструкции амплифицировали фрагмент около 3180 п. н., включающий интрон гена бета-глобина человека, ген SLC26A2 и сигнал полиаденилирования гена гормона роста человека, также с помощью высокоточной ДНК-полимеразы, и клонировали в аденоассоциированный вектор pAAV.CMV.LacZ по сайтам рестрикции PstI и XhoI вместо участка, содержащего последовательность гена LacZ. В результате был получен рекомбинантный аденоассоциированный вектор pAAV-SLC26A2. Нуклеотидную последовательность полученного вектора верифицировали с помощью секвенирования на платформе MGISEQ-2000 (MGI Tech Co., Ltd, КНР).
На основе данного вектора получали частицы ААВ в культуре клеток человека HEK293T в ходе ко-трансфекции тремя плазмидами: pAAV-SLC26A2, pRepCap (кодирует капсидные белки rAAV) и pHelper (содержит участки генома аденовируса-помощника). Метод тройной трансфекции для продукции рекомбинантных ААВ широко известен (например, Zolotukhin S., Byrne В.J., Mason Е., Zolotukhin I., Potter M., Chesnut K., Summerford C, Samulski R.J., Muzyczka N. Recombinant adeno-associated virus purification using novel methods improves infectious titer and yield // Gene Ther. 1999. Vol. 6. P.973-985).
Смесь трех плазмид вводили в культуру клеток HEK293T в эквимолярных количествах при помощи трансфецирующего реагента (например, линейного полиэтиленимина). Через три дня после трансфекции клетки собирали, лизировали, вирусные частицы очищали из клеточного лизата с помощью центрифугирования в градиенте плотности йодиксанола. Финальный препарат вирусных частиц получали в результате диализа против фосфатно-солевого буфера, содержащего 213 мМ NaCl и 0,001% Pluronic F-68. Оценку титра полученных вирусных частиц проводили методом количественной ПЦР в реальном времени.
Примером осуществления изобретения может служить Seq ID No: 1.
Пример 1.
Для конструирования экспрессионного вектора использовали стандартные методы молекулярного клонирования. Для получения нуклеотидной последовательности, кодирующей белок SLC26A2, использовали человеческую кДНК здорового донора и синтетические олигонуклеотидные праймеры, специфические к последовательности гена SLC26A2 и содержащие сайты рестрикции. Химический синтез праймеров заказывали в компании Евроген (Россия). Амплификацию последовательности гена SLC26A2 проводили с помощью высокоточной ДНК-полимеразы KAPA (Roche), полученный ПЦР-продукт длиной около 2220 п.н. очищали в ходе электрофореза в агарозном геле, выделяли из геля с использованием набора реагентов Cleanup (Евроген, Россия) по протоколу производителя и лигировали в промежуточный экспрессионный вектор pCMV-MCS в участок полилинкера с соответствующими сайтами рестрикции. Затем на матрице полученной промежуточной конструкции с помощью высокоточной ДНК-полимеразы амплифицировали фрагмент около 3180 п. н., включающий интрон гена бета-глобина человека, ген SLC26A2 и сигнал полиаденилирования гена гормона роста человека, и клонировали в аденоассоциированный вектор pAAV.CMV.LacZ по сайтам рестрикции PstI и XhoI вместо участка, содержащего последовательность гена LacZ. В результате был получен рекомбинантный аденоассоциированный вектор pAAV-SLC26A2, геном которого соответствует Seq ID No: 1.
Последовательность полученного таким образом вектора pAAV-SLC26A2 верифицировали методом высокопроизводительного секвенирования на платформе MGISEQ-2000 (MGI Tech Co., Ltd, КНР).
Затем на основе данного вектора получали частицы ААВ в культуре клеток HEK293T в ходе ко-трансфекции тремя плазмидами: pAAV-SLC26A2, pRepCap (кодирует капсидные белки rAAV) и pHelper (содержит участки генома аденовируса-помощника). Смесь трех плазмид вводили в культуру клеток HEK293T в эквимолярных количествах при помощи трансфецирующего реагента полиэтиленимина PEI (PolySciences, США). Через три дня после трансфекции клетки собирали, лизировали в присутствии 0,1% детергента Triton Х-100, и вирусные частицы очищали из клеточного лизата с помощью центрифугирования в градиенте плотности йодиксанола, как ранее описано [Zolotukhin S., Byrne B.J., Mason Е., Zolotukhin I., Potter M., Chesnut K., Summerford C, Samulski R.J., Muzyczka N. Recombinant adeno-associated virus purification using novel methods improves infectious titer and yield // Gene Ther. 1999. Vol.6. P.973-985]. Финальный препарат вирусных частиц получали в результате диализа против фосфатно-солевого буфера, содержащего 213 mM NaCl и 0,001% Pluronic F-68. Оценку титра полученных вирусных частиц проводили методом количественной ПЦР в реальном времени.
Пример 2.
Для подтверждения функциональности вектора pAAV-SLC26A2 проводили трансдукцию культуры человеческих клеток HeLa полученными на основе данного вектора вирусными частицами. Вирусные частицы содержали белки капсида ААВ серотипа 5 и вирусный геном, соответствующий Seq ID No: 1. Экспрессию гена SLC26A2 в составе рекомбинантного вектора выявляли через 4 дня после трансдукции в ходе анализа РНК трансдуцированных клеток. В качестве контроля использовали клетки исходной, нетрансдуцированной, линии. РНК выделяли из клеток стандартными методами и анализировали в реакции ПЦР с обратной транскрипцией с использованием прямых праймеров, подобранных на разные экзоны гена SLC26A2, и обратный праймер - на 3' конен, гена SLC26A2.
Результаты реакции амплификации в образце AAV(-) (нетрансдуцированные клетки) должны показать эндогенный уровень экспрессии хромосомной копии гена SLC26A2 в клетках Hela. В образце AAV-SLC26A2 результаты амплификации должны складываться из эндогенной экспрессии и экспрессии аденоассоциированного вектора, кодирующего ген SLC26A2.
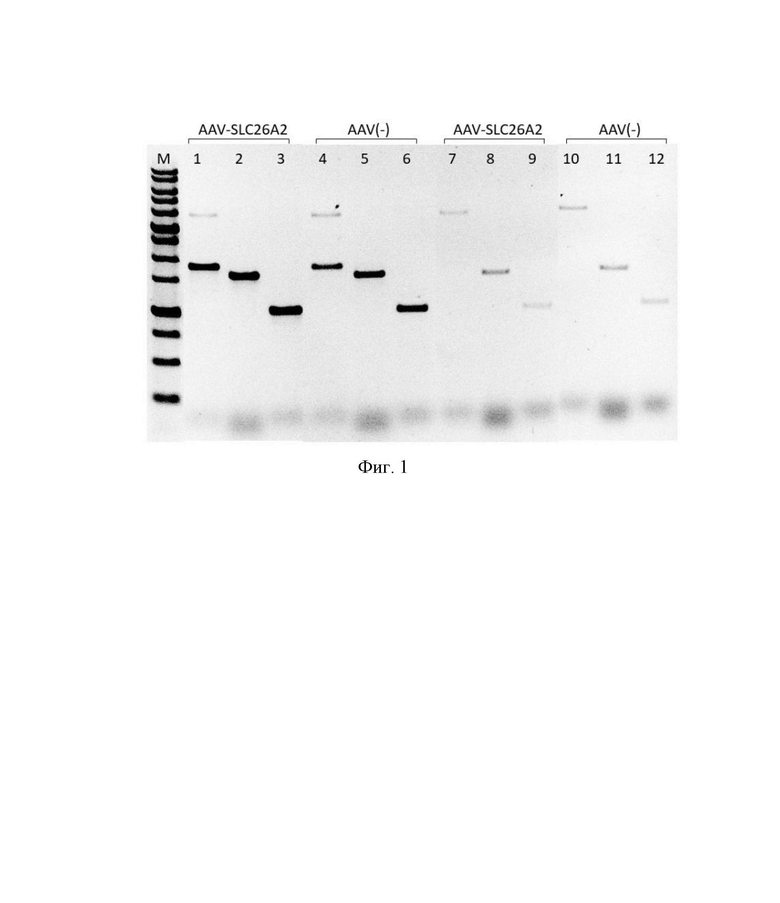
На фиг. 1 представлены результаты ПЦР с тремя комбинациями праймеров на разные участки гена SLC26A2: результаты ПЦР с обратной транскрипцией образцов РНК, выделенных из трансдуцированных AAV-SLC26A2 и нетрансдуцированных клеток AAV(-) (подписи над линиями). 1-6 - реакции с добавлением обратной транскриптазы, 7-12 - реакции без обратной транскриптазы.
Как видно из фиг. 1, количество ПЦР-продукта в реакциях с образцами трансдуцированных клеток (дорожки 1-3) превышает количество ПЦР-продукта в реакциях с нетрансдуцированными клетками (дорожки 4-6), что свидетельствует о повышении экспрессии гена SLC26A2 после трансдукции аденоассоциированным вектором AAV-SLC26A2. Размеры ПЦР-продуктов в реакциях с образцом AAV-SLC26A2 (дорожки 1-3) соответствуют ожидаемым и совпадают с размерами ПЦР-продуктов в реакциях с образцом AAV(-) (дорожки 4-6). Минорные продукты амплификации, полученные в реакциях без добавления обратной транскриптазы (дорожки 7-12) являются результатом ПЦР с остаточной геномной ДНК.
Результаты сравнения дорожек 1-3 и 4-6 позволяют заключить, что экспрессия гена SLC26A2 в составе рекомбинантного вектора проходит с образованием полноразмерной функциональной мРНК, без альтернативного сплайсинга и формирования укороченных форм мРНК.
Пример 3.
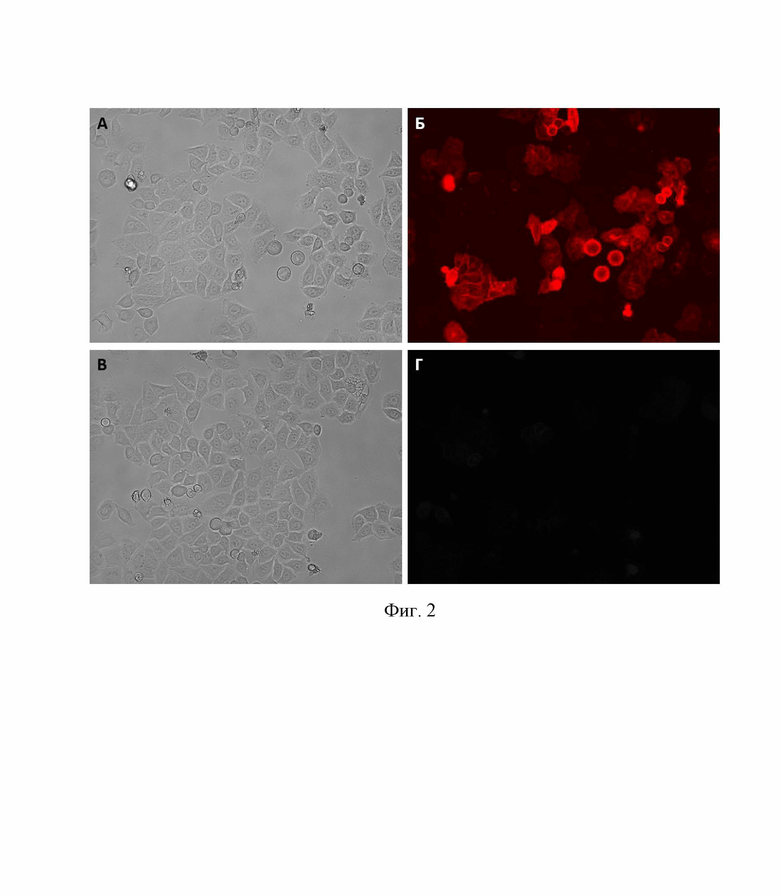
Для подтверждения функциональности копии гена SLC26A2 и визуализации экспрессии белка мы получили производную конструкцию, в которой последовательность гена SLC26A2 соединялась с геном красного флуоресцентного белка mKate2 (Евроген, Россия) через нуклеотидную последовательность, кодирующую гибкий спейсер из 17 аминокислотных остатков. Полученный вектор был нами обозначен pAAV-SLC26A2-mKate2. Вирусные частицы на основе вектора pAAV-SLC26A2-mKate2 были получены в культуре клеток HEK283T, как описано выше, и использованы для трансдукции клеток HeLa. Через 48 ч после трансдукции клетки исследовали при помощи флуоресцентной микроскопии (фиг. 2). На фиг. 2 представлена микроскопия клеток HeLa через 48 ч после трансдукции вирусными частицами AAV-SLC26A2-mKate2 (А, Б) и нетрансдуцированных клеткок HeLa (В, Г). А, В - проходящий свет, Б, Г - флуоресценция с длиной волны 586/15 нм.
Как видно на фиг. 2, флуоресцентный маркер хорошо визуализируется в трансдуцированных клетках и демонстрирует преимущественно мембранный характер локализации (Б). При этом в нетрансдуцированных клетках, использованных в качестве отрицательного контроля, флуоресцентный сигнал отсутствовал (Г). Известно, что белок-транспортер SLC26A2 имеет цитоплазматический, мембранный и трансмембранные домены, обеспечивающие его правильную локализацию в плазматической мембране клеток [Ohana Е., Shcheynikov N., Park М. et al. Solute carrier family 26 member a2 (Slc26a2) protein functions as an electroneutral SO42-/OH-/Cl- exchanger regulated by extracellular Cl- // J Biol Chem. - 2011. - Vol. 287, №7. P. 5122-5132].
Таким образом, выявленный в ходе микроскопии мембранный паттерн локализации белка SLC26A2, соединенного с флуоресцентным маркером mKate2, свидетельствует, что ген SLC26A2 в составе рекомбинантного вектора обеспечивает корректную экспрессию и локализацию белка-транспортера сульфат-ионов SLC26A2 в трансдуцированных клетках.
Генная терапия, основанная на доставке действующей копии гена SLC26A2 в организм пациента, может стать альтернативным способом лечения МЭД, вызванной мутациями в гене SLC26A2. Привнесение функциональной копии гена SLC26A2 в клетки пораженных суставных поверхностей приведет к восстановлению синтеза белка-переносчика сульфат-ионов, что, в свою очередь, обеспечит нормализацию формирования внеклеточного матрикса хряща и, таким образом, будет способствовать облегчению симптомов и терапевтическому эффекту у пациентов с множественной эпифизарной дисплазией.
Настоящее изобретение не предназначено для модификации генетической целостности клеток зародышевой линии человека, не предполагает использование человеческих эмбрионов.
В настоящее изобретение могут быть внесены различные изменения и модификации процедуры, понятные специалисту в данной области техники, не влияющие на объем притязаний.
--->
<ST26SequenceListing dtdVersion="V1_3"
fileName="pAAV-CMV-SLC26A2-v105531.xml" softwareName="WIPO Sequence"
softwareVersion="2.3.0" productionDate="2024-03-22">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText/>
<FilingDate>2024-03-19</FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>190324</ApplicantFileReference>
<ApplicantName languageCode="ru">Федеральное государственное
автономное образовательное учреждение высшего образования "Российский
национальный исследовательский медицинский университет имени Н.И.
Пирогова" Министерства здравоохранения Российской
Федерации</ApplicantName>
<ApplicantNameLatin>Federalnoe gosudarstvennoe autonomnoe
obrazovatelnoe uchrezhdenie vysshego obrazovaniya "Rossijskij
natsionalnyj issledovatelskij meditsinskij universitet imeni N.I.
Pirogova" Ministerstva zdravookhraneniya Rossijskoj
Federatsii</ApplicantNameLatin>
<InventorName languageCode="ru">Denis Rebrikov</InventorName>
<InventionTitle languageCode="ru">Экспрессионный вектор для лечения
множественной эпифизарной дисплазии, вызванной мутациями в гене
SLC26A2</InventionTitle>
<SequenceTotalQuantity>1</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>4230</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1.4230</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q1">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>ctgcgcgctcgctcgctcactgaggccgcccgggcaaagcccgggcgtcggg
cgacctttggtcgcccggcctcagtgagcgagcgagcgcgcagagagggagtggccaactccatcactag
gggttccttgtagttaatgattaacccgccatgctacttatctacgtagccatgctctaggaagatcgga
attcgcccttaagctagctagttattaatagtaatcaattacggggtcattagttcatagcccatatatg
gagttccgcgttacataacttacggtaaatggcccgcctggctgaccgcccaacgacccccgcccattga
cgtcaataatgacgtatgttcccatagtaacgccaatagggactttccattgacgtcaatgggtggagta
tttacggtaaactgcccacttggcagtacatcaagtgtatcatatgccaagtacgccccctattgacgtc
aatgacggtaaatggcccgcctggcattatgcccagtacatgaccttatgggactttcctacttggcagt
acatctacgtattagtcatcgctattaccatggtgatgcggttttggcagtacatcaatgggcgtggata
gcggtttgactcacggggatttccaagtctccaccccattgacgtcaatgggagtttgttttggcaccaa
aatcaacgggactttccaaaatgtcgtaacaactccgccccattgacgcaaatgggcggtaggcgtgtac
ggtgggaggtctatataagcagagctggtttagtgaaccgtcagatcccgaatcccggccgggaacggtg
cattggaacgcggattccccgtgccaagagtgacgtaagtaccgcctatagagtctataggcccacaaaa
aatgctttcttcttttaatatacttttttgtttatcttatttctaatactttccctaatctctttctttc
agggcaataatgatacaatgtatcatgcctctttgcaccattctaaagaataacagtgataatttctggg
ttaaggcaatagcaatatttctgcatataaatatttctgcatataaattgtaactgatgtaagaggtttc
atattgctaatagcagctacaatccagctaccattctgcttttattttatggttgggataaggctggatt
attctgagtccaagctaggcccttttgctaatcatgttcatacctcttatcttcctcccacagctcctgg
gcaacgtgctggtctgtgtgctggcccatcactttggcaaagaattgggattcgaacatcgattgatgtc
ttcagaaagtaaagagcaacataacgtttcacccagagactcagctgaaggaaatgacagttatccatct
gggatccatctggaacttcaaagggaatcaagtactgacttcaagcaatttgagaccaatgatcaatgca
gaccttatcataggatccttattgagcgtcaagagaaatcagatacaaacttcaaggagtttgttattaa
aaagctgcagaagaattgccagtgcagtccagccaaagccaaaaatatgattttaggtttccttcctgtt
ttgcagtggctcccaaaatacgacctaaagaaaaacattttaggggatgtgatgtcaggcttgattgtgg
gcatattattggtgccccagtccattgcttattccctgctggctggccaagaacctgtctatggtctgta
cacatctttttttgccagcatcatttattttctcttgggtacctcccgtcacatctctgtgggcattttt
ggagtactgtgccttatgattggtgagacagttgaccgagaactacagaaagctggctatgacaatgccc
atagtgctccttccttaggaatggtttcaaatgggagcacattattaaatcatacatcagacaggatatg
tgacaaaagttgctatgcaattatggttggcagcactgtaacctttatagctggagtttatcaggtagcg
atgggcttctttcaagtgggttttgtttctgtctacctctcagatgccttgctgagtggatttgtcactg
gtgcctccttcactattcttacatctcaggccaagtatcttcttgggctcaaccttcctcggactaatgg
tgtgggctcactcatcactacctggatacatgtcttcagaaacatccataagaccaatctctgtgatctt
atcaccagccttttgtgccttttggttcttttgccaaccaaagaactcaatgaacacttcaaatccaagc
ttaaggcaccgattcctattgaacttgttgttgttgtagcagccacattagcctctcattttggaaaact
acatgaaaattataattctagtattgctggacatattcccactgggtttatgccacccaaagtaccagaa
tggaacctaattcctagtgtggctgtagatgcaatagctatttccatcattggttttgctatcactgtat
cactttctgagatgtttgccaagaaacatggttacacagtcaaagcaaaccaggaaatgtatgccattgg
cttttgtaatatcatcccttccttcttccactgttttactactagtgcagctcttgcaaagacattggtt
aaagaatcaacaggctgccatactcagctttctggtgtggtaacagccctggttcttttgttggtcctcc
tagtaatagctcctttgttctattcccttcaaaaaagtgtccttggtgtgatcacaattgtaaatctacg
gggagcccttcgtaaatttagggatcttcccaaaatgtggagtattagtagaatggatacagttatctgg
tttgttactatgctgtcctctgcactgctaagtactgaaataggcctacttgttggggtttgtttttcta
tattttgtgtcatcctccgcactcagaagccaaagagttcactgcttggcttggtggaagagtctgaggt
ctttgaatctgtgtctgcttacaagaaccttcagactaagccaggcatcaagattttccgctttgtagcc
cctctctactacataaacaaagaatgctttaaatctgctttatacaaacaaactgtcaacccaatcttaa
taaaggtggcttggaagaaggcagcaaagagaaagatcaaagaaaaagtagtgactcttggtggaatcca
ggatgaaatgtcagtgcaactttcccatgatcccttggagctgcatactatagtgattgactgcagtgca
attcaatttttagatacagcagggatccacacactgaaagaagttcgcagagattatgaagccattggaa
tccaggttctgctggctcagtgcaatccctctgtgagggattccctaaccaacggagaatattgcaaaaa
ggaagaagaaaaccttctcttctatagtgtgtatgaagcgatggcttttgcagaagtatctaaaaatcag
aaaggagtatgtgttcccaatggtctgagtcttagtagtgattaatacgggtggcatccctgtgacccct
ccccagtgcctctcctggccctggaagttgccactccagtgcccaccagccttgtcctaataaaattaag
ttgcatcattttgtctgactaggtgtccttctataatattatggggtggaggggggtggtatggagcaag
gggcaagttgggaagacaacctgtagggcctgcggggtctattgggaaccaagctggagtgcagtggcac
aatcttggctcactgcaatctccgcctcctgggttcaagcgattctcctgcctcagcctcccgagttgtt
gggattccaggcatgcatgaccaggctcagctaatttttgtttttttggtagagacggggtttcaccata
ttggccaggctggtctccaactcctaatctcaggtgatctacccaccttggcctcccaaattgctgggat
tacaggcgtgaaccactgctcccttccctgtccttctgattttgtagttaagggcgaattcccgataagg
atcttcctagagcatggctacgtagataagtagcatggcgggttaatcattaactacaaggaacccctag
tgatggagttggccactccctctctgcgcgctcgctcgctcactgaggccgggcgaccaaaggtcgcccg
acgcccgggctttgcccgggcggcctcagtgagcgagcgagcgcgcag</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Пептид митохондриальной локализации, нуклеиновая кислота для аллотопической экспрессии гена MT-ND4, содержащий ее экспрессионный вектор и его применение | 2023 |
|
RU2817420C1 |
| Нуклеиновая кислота для аллотопической экспрессии гена MT-ND4 | 2023 |
|
RU2809065C1 |
| МИНИ-БЕЛОК USH2A, НУКЛЕИНОВАЯ КИСЛОТА, КОДИРУЮЩАЯ МИНИБЕЛОК USH2A, И СОДЕРЖАЩИЙ ЕЕ ЭКСПРЕССИОННЫЙ ВЕКТОР ДЛЯ ГЕННОЙ ТЕРАПИИ | 2023 |
|
RU2822884C1 |
| Нуклеиновая кислота, предназначенная для снижения массы тела млекопитающего, экспрессионный вектор для экспрессии в клетках млекопитающего, способ его доставки и способ снижения массы тела млекопитающего | 2023 |
|
RU2810191C1 |
| Кодон-оптимизированная последовательность нуклеотидов, кодирующая hAIPL1, и её содержащий экспрессионный вектор | 2021 |
|
RU2785621C1 |
| Нуклеиновая кислота, содержащая последовательность гена PRDM16, предназначенная для снижения массы тела млекопитающего, экспрессионный вектор для экспрессии в клетках млекопитающего, способ его доставки и способ снижения массы тела млекопитающего | 2024 |
|
RU2834035C1 |
| ВЕКТОРЫ И ПОСЛЕДОВАТЕЛЬНОСТИ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ | 2011 |
|
RU2588667C2 |
| АДЕНОАССОЦИИРОВАННЫЕ ВИРУСНЫЕ ВЕКТОРЫ ДЛЯ ЛЕЧЕНИЯ МУКОПОЛИСАХАРИДОЗОВ ТИПА IV A | 2019 |
|
RU2794960C2 |
| Применение вектора для снижения иммунного ответа при вирусной доставке AIPL1 | 2023 |
|
RU2818342C1 |
| Кодон-оптимизированная нуклеиновая кислота, которая кодирует белок фактора свёртывания крови IX, и ее применение | 2021 |
|
RU2831751C2 |
Изобретение относится к области молекулярной биологии и биотехнологии, в частности к экспрессионным векторам на основе аденоассоциированных вирусов (ААВ), и может быть использовано в медицине для лечения пациентов с множественной эпифизарной дисплазией (МЭД), обусловленной мутациями в гене транспортера ионов сульфата SLC26A2. Экспрессионный вектор для увеличения экспрессии гена SLC26A2 в клетках млекопитающего представляет собой вирусную частицу аденоассоциированного вируса (ААВ), имеющую капсидные белки ААВ серотипа 5, в которую упакована в качестве генома одноцепочечная молекула ДНК, на концах которой расположены последовательности ITR AAВ серотипа 2. Внутри ITR AAВ серотипа 2 последовательно расположены последовательность раннего промотора цитомегаловируса человека, интрон из гена бета-глобина человека, последовательность гена SLC26A2 человека, сигнал полиаденилирования из гена гормона роста человека. Использование изобретения обеспечивает увеличение экспрессии гена SLC26A2, путем его внутрисуставного введения, восполняя недостаток белка-транспортера сульфат-ионов в пораженных тканях сустава и тем самым улучшая качество жизни пациентов с МЭД. 1 з.п. ф-лы, 2 ил., 3 пр.
1. Экспрессионный вектор для увеличения экспрессии гена SLC26A2 в клетках млекопитающего, представляющий собой вирусную частицу аденоассоциированного вируса (ААВ), имеющую капсидные белки ААВ серотипа 5, в которую упакована в качестве генома одноцепочечная молекула ДНК, на концах которой расположены последовательности ITR AAВ серотипа 2, внутри ITR AAВ серотипа 2 последовательно расположены последовательность раннего промотора цитомегаловируса человека, интрон из гена бета-глобина человека, последовательность гена SLC26A2 человека, сигнал полиаденилирования из гена гормона роста человека.
2. Экспрессионный вектор по п. 1, имеющий в качестве генома нуклеотидную последовательность SEQ ID NO: 1.
| РЕКОМБИНАНТНЫЕ AAV ВЕКТОРЫ, ЭКСПРЕССИРУЮЩИЕ ОСТЕОПРОТЕКТИВНЫЕ ГЕНЫ, ВКЛЮЧАЯ HAS2 И ЛУБРИЦИН, ПРИГОДНЫЕ ПРИ ЛЕЧЕНИИ ОСТЕОАРТРИТА И СХОДНЫХ ЗАБОЛЕВАНИЙ СУСТАВОВ У МЛЕКОПИТАЮЩИХ | 2017 |
|
RU2771490C2 |
| CN 114366742 A, 19.04.2022 | |||
| Микропроцессор | 1984 |
|
SU1257657A1 |
Авторы
Даты
2025-03-17—Публикация
2024-03-27—Подача