Область техники
Изобретение относится к области биотехнологии и молекулярной биологии, в частности генной инженерии, а именно к кодон-оптимизированной последовательности гена hAIPL1.
Уровень техники
Моногенные заболевания сетчатки представляют собой группу из порядка 300 разнородных по клиническим проявлениям изолированных или синдромальных заболеваний, которые объединены схожими механизмами развития - повреждением одного из звеньев фототрансдукции или целостности клеток фоторецепторов/вспомогательных клеток. Частота встречаемости моногенных заболеваний сетчатки колеблется от 1:5000 (болезнь Штаргардта) до 1:100000 (синдром Ашера, ахроматопсия). На сегодняшний день в широкой клинической практике отсутствует патогенетически направленное эффективное лечение данной группы заболеваний, однако на разных стадиях клинических и доклинических исследований находятся перспективные методы лечения.
Амавроз Лебера (Leber Congenital Amaurosis - LCA), самая быстрая и тяжелая форма наследственной дистрофии сетчатки, обычно наследуется по аутосомно-рецессивному типу и характеризуется ранней потерей зрения, нистагмом и отсутствующей или существенно сниженной электроретинограммой (ЭРГ) [den Hollander AI, Roepman R, Koenekoop RK, Cremers FP. Leber congenital amaurosis: genes, proteins and disease mechanisms. Prog Retin Eye Res. 2008 Jul; 27(4):391-419]. Встречается с частотой приблизительно 1:200000 человек. На сегодняшний день мутации в 26 различных генах, кодирующих белки, играющие важную роль в развитии и физиологической функции сетчатки, вызывают клинически различные типы LCA [RetNet https://sph.uth.edu/retnet, дата обращения 17.06.2021]. Среди них мутации в гене белка-подобного 1, взаимодействующего с арилуглеводородными рецепторами (aryl hydrocarbon receptor interacting protein like 1 - AIPL1), связаны с LCA типа IV (LCA4). Несмотря на то, что на него приходится всего 5 10% случаев LCA, клинический фенотип, вызванный дефицитом AIPL1, находится в спектре LCA с тяжелым течением. Такие серьезные симптомы вызваны обширной и необратимой дегенерацией фоторецепторов палочек и колбочек, критических для зрительной фототрансдукции, в которой AIPL1 играет косвенную, но важную роль для поддержания функциональной целостности [Yadav RP, Artemyev NO. AIPL1: A specialized chaperone for the phototransduction effector. Cell Signal. 2017 Dec; 40:183-189].
Экспрессия AIPL1 происходит исключительно в фоторецепторах сетчатки и эпифизе [van der Spuy J, Chappie JP, Clark BJ, Luthert PJ, Sethi CS, Cheetham ME. The Leber congenital amaurosis gene product AIPL1 is localized exclusively in rod photoreceptors of the adult human retina. Hum Mol Genet. 2002 Apr 1; 11(7):823-31]. В сетчатке AIPL1 действует как специализированный ко-шаперон циклической нуклеотидной фосфодиэстеразы шестого семейства (PDE6), важного эффектора фермента в пути фототрансдукции [Sacristan-Reviriego A, van der Spuy J. The Leber Congenital Amaurosis-Linked Protein AIPL1 and Its Critical Role in Photoreceptors. Adv Exp Med Biol. 2018; 1074:381-386]. После стимуляции светом активированный PDE6 гидролизует циклический ГМФ (цГМФ), запуская закрытие цГМФ-зависимых ионных каналов Са2+ и распространение «светового» электрического сигнала за счет гиперполяризации плазматической мембраны [Yadav RP, Artemyev NO. AIPL1: A specialized chaperone for the phototransduction effector. Cell Signal. 2017 Dec; 40:183-189]. Стабилизация PDE6 обеспечивается шаперонным гетерокомплексом, включающим HSP90 и родственный PDE6-специфический ко-шаперон AIPL1 [Hidalgo-de-Quintana J, Evans RJ, Cheetham ME, van der Spuy J. The Leber congenital amaurosis protein AIPL1 functions as part of a chaperone heterocomplex. Invest Ophthalmol Vis Sci. 2008 Jul; 49(7):2878-87], которые необходимы для стабильной сборки холофермента PDE6 [Kolandaivelu S, Huang J, Hurley JB, Ramamurthy V. AIPL1, a protein associated with childhood blindness, interacts with alpha-subunit of rod phosphodiesterase (PDE6) and is essential for its proper assembly. J Biol Chem. 2009 Nov 6; 284(45):30853-61].
Мутации AIPL1 влияют на функциональные домены транслируемого белка, нарушая взаимодействие AIPL1 с изопренилированным PDE6 или HSP90, что предотвращает сборку гетерокомплекса шаперона PDE6 [Sacristan-Reviriego A, van der Spuy J. The Leber Congenital Amaurosis-Linked Protein AIPL1 and Its Critical Role in Photoreceptors. Adv Exp Med Biol. 2018; 1074:381-386]. У мышей с нокаутом Aipl1 и у гипоморфных мышей потеря функции AIPL1 вызывает неправильную сборку холофермента PDE6, вызывая дестабилизацию и быструю протеасомную деградацию субъединиц PDE6. Следовательно, происходит быстрая дегенерация палочковых фоторецепторов из-за увеличения внутриклеточного цГМФ, что приводит к длительному открытию циклических нуклеотид-управляемых каналов и избыточному притоку Са2+ [Wang T, Tsang SH, Chen J. Two pathways of rod photoreceptor cell death induced by elevated cGMP. Hum Mol Genet. 2017 Jun 15; 26(12):2299-2306].
Учитывая уникальные особенности глаза (доступное расположение, небольшая по размеру изолированная структура, иммуннопривилегированность), наследственные дистрофии сетчатки являются одной из самых привлекательных мишеней для генной терапии. За последние годы количество клинических испытаний генной терапии наследственных дистрофий сетчатки увеличилось, и кульминацией стало регистрация первой генной терапии для лечения - voretigene neparvovec-rzyl (Luxturna) - рекомбинантного аденоассоциированного вируса (AAV), экспрессирующего ген RPE65 для лечения Амавроза Лебера II типа (LCA II) [Auricchio F, Scavone С, Cimmaruta D, Di Mauro G, Capuano A, Sportiello L, Rafaniello C. Drugs approved for the treatment of multiple sclerosis: review of their safety profile. Expert Opin Drug Saf. 2017 Dec; 16(12): 1359-1371]. AAV являются перспективными и наиболее успешными векторами для доставки терапевтических генов и стандартным выбором для трансдукции фоторецепторов. Было показано, что несколько природных или созданных серотипов AAV эффективно трансдуцируют фоторецепторы в моделях на животных [Day TP, Byrne LC, Schaffer DV, Flannery JG. Advances in AAV vector development for gene therapy in the retina. Adv Exp Med Biol. 2014;801:687-93].
В заявке на патент US 20030022165 A1 раскрывается нормальный и мутантный ген AIPL1 и его роль в развитии LCA4, а также способ лечения заболевания сетчатки, включающий, в частности, введение животному эффективного количества полинуклеотидной последовательности гена AIPL1 дикого типа.
В статье: Tan MH, Smith AJ, Pawlyk В, et al. Gene therapy for retinitis pigmentosa and Leber congenital amaurosis caused by defects in AIPL1: effective rescue of mouse models of partial and complete Aipl1 deficiency using AAV2/2 and AAV2/8 vectors. Hum Mol Genet. 2009; 18(12):2099-2114 раскрываются рекомбинантные аденоассоциированные вирусы AAV2/2 и AAV2/8, содержащие последовательности ДНК, кодирующие мышиный Aipl1 (mAipl1) под управлением промотора цитомегаловируса (CMV). В результате генной терапии с помощью субретинальной инъекции AAV2/2-CMV-mAIPL1 и AAV2/8-CMV-mAIPL1 снижается дегенерация фоторецепторов у гипоморфных мышей AIPL11 (гипо/гипо) с более медленной дегенерацией сетчатки, уровень PDE6 повышается, и его локализация восстанавливается во внешних сегментах фоторецепторов (OS). Субретинальная инъекция AAV2/8-CMV-mAipl1 на 12-й день постнатального развития (Р12) приводит к предотвращению дегенерации фоторецепторов в наиболее тяжелой модели нокаута AIPL1-/-, при этом сохраняется толщина внешнего ядерного слоя сетчатки (ONL) через 3 месяца после инъекции. В работе был использован мышиный ген AIPL11 дикого типа.
В работе: Sun X, Pawlyk В, Xu X, Liu X, Bulgakov OV, Adamian M, Sandberg MA, Khani SC, Tan MH, Smith AJ, Ali RR, Li T. Gene therapy with a promoter targeting both rods and cones rescues retinal degeneration caused by AIPL1 mutations. Gene Ther. 2010 Jan; 17(1):117-31 раскрывается аденоассоциированный вирус AAV8, содержащий последовательность ДНК, кодирующую человеческий Aipl1 (hAipl1) под управлением промотора фоторецептор-специфической родопсинкиназы (RK). Инъекция AAV8-RK-hAIPL1 мышам Aipl1-/- на 9-й день постнатального развития (Р9) вызывает значительное накопление палочко-колбочковой PDE6 во внешних сегментах фоторецепторов, задерживая дегенерацию фоторецепторов по крайней мере на 5 месяцев после лечения. В настоящее время препарат, содержащий AAV8-RK-hAIPL1 производится компанией MeiraGTx для сострадательного использования по лицензии MHRA Specials в Великобритании. В работе использован мышиный и человеческий ген Aipl1 дикого типа, а также тканеспецифичный промотор RK, активность которого контролируется транскрипционными факторами клетки и может значительно варьировать в зависимости от физиологического состояния клетки.
В работе: Ku СА, Chiodo VA, Boye SL, Goldberg AF, Li T, Hauswirth WW, Ramamurthy V. Gene therapy using self-complementary Y733F capsid mutant AAV2/8 restores vision in a model of early onset Leber congenital amaurosis. Hum Mol Genet. 2011 Dec 1; 20(23):4569-81 раскрыт сконструированный scAAV2/8 с мутацией Y733F (scAAV-Y733), содержащий последовательность hAIPL1, который запускает раннюю экспрессию и повышает уровни экспрессии hAIPL1, приводя к улучшению сохранения фоторецепторов и функции сетчатки у мышей Aipl1-/-. Субретинальная инъекция мышей Aipl1-/- на второй день постнатального развития (Р2) конструкцией scAAV-Y733-RKhAIPL1 восстанавливает экспрессию PDE6 в палочках и колбочках в течение 2 месяцев после лечения, улучшая ультраструктуру фоторецепторов. В работе использован человеческий ген Aipl1 дикого типа, а также тканеспецифичный промотор RK, активность которого контролируется транскрипционными факторами клетки и может быть значительно варьировать от физиологического состояния клетки. Авторы в работе используют самокомплементарный формат генома AAV, который может иметь преимущество перед одноцепочечным геномом AAV по уровню экспрессии, однако накладывает ограничения на возможность включения в экспрессионную кассету AAV дополнительных регуляторных элементов, промоторов, если такая необходимость возникнет после получения результатов испытаний препарата на клеточных и животных моделях.
Технической задачей, на решение которой направлено настоящее изобретение, является решение как минимум одной из вышеуказанных в уровне техники проблем.
Сущность изобретения
Технической решением является использование описанного признаками в пунктах формулы изобретения.
Одной из возможных технических задач, на решение которой может быть направлено настоящее изобретение, являлось создание рекомбинантного гена hAIPL1, позволяющего увеличить экспрессию гена и повысить уровень белка aipl1 в клетках при введении его в экспрессионном векторе. Изобретение может быть использовано при генной терапии офтальмологических заболеваний.
Задача может решаться путем оптимизации кодонов, направленной на увеличение стабильности матричной РНК и повышение уровня белка aipl1 в клетках после введения гена в экспрессионном векторе. Технический результат может достигаться созданием кодон-оптимизированной последовательности гена hAIPL1opt, представленной в Seq Id No: 2.
В одном из вариантов осуществления настоящего изобретения предлагается последовательность нуклеотидов Seq Id No.: 2, кодирующая белок aipl1 человека, кодонно оптимизированная на основе последовательности гена hAIPL1 дикого типа (NP_055151.3, Gene ID: 23746, Seq Id No.: 1).
Термин «кодонно оптимизированный» обозначает последовательность нуклеотидов, в которой была произведена замена одного или более кодонов на синонимичные без изменения последовательности белка, синтезированного с матрицы этой последовательности.
В другом варианте осуществления изобретения предлагается экспрессионный вектор, содержащий последовательность нуклеотидов Seq Id No.:2. Термин «вектор» обозначает молекулу нуклеиновой кислоты, используемую для передачи генетического материала внутрь клетки. Термин «экспрессионный вектор» обозначает вектор, содержащий промоторную и другие регуляторные последовательности, обеспечивающие эффективную транскрипцию рекомбинантного гена с последующей трансляцией мРНК и образованием рекомбинантного белка. Используемые плазмидные и экспрессионные векторы, приведенные ниже, используются для примера и не ограничивают объем прав настоящего изобретения. Термин «экспрессия гена» обозначает преобразование наследственной информации, зашифрованной в последовательности нуклеотидов гена, в функциональный продукт РНК или белок.
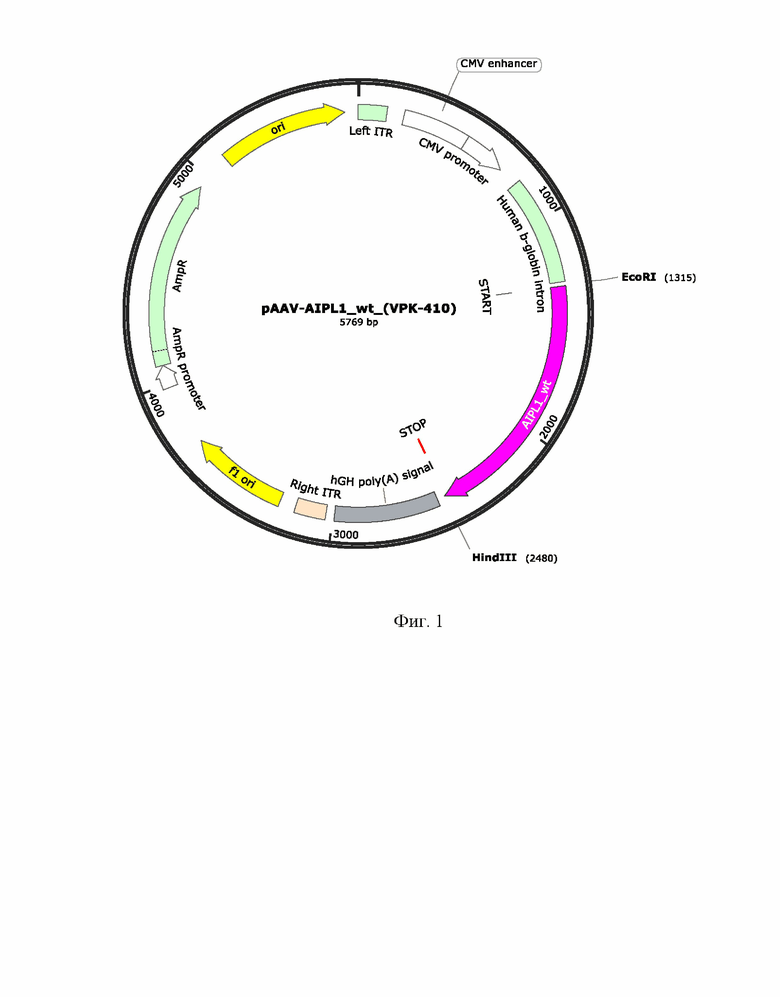
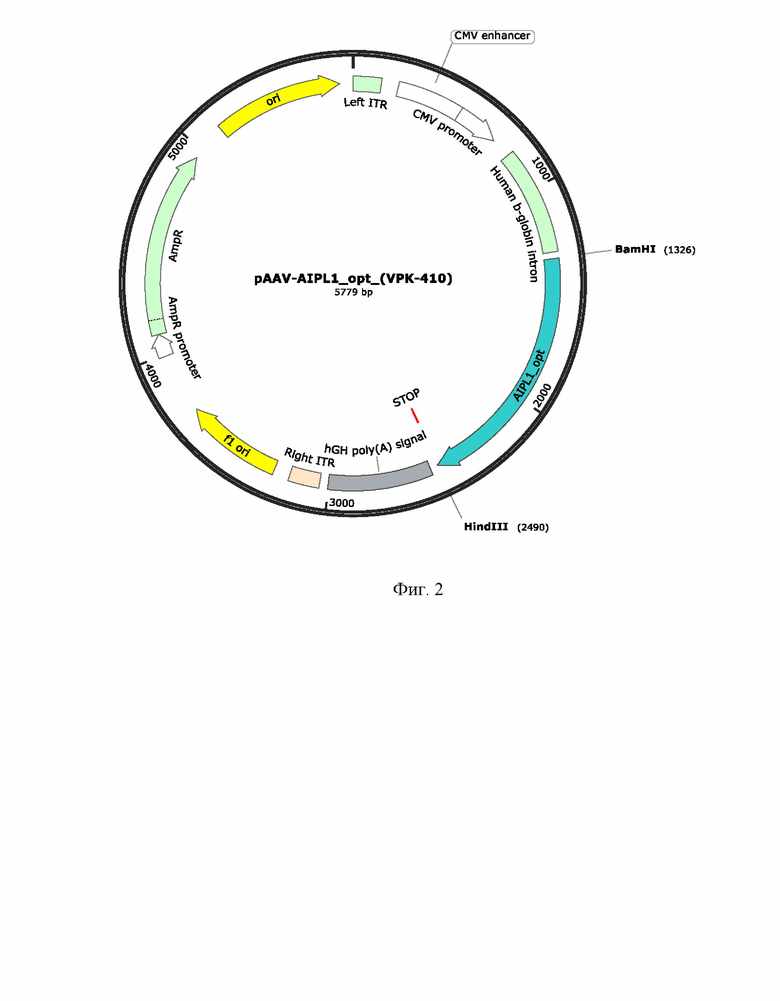
В другом варианте осуществления изобретения предлагается плазмидный экспрессионный вектор, содержащий в соответствии с физической и генетической картой, представленной на Фиг. 2, следующие элементы:
- участок начала репликации ori;
- левый инвертированный концевой повтор ITR;
- CMV энхансер цитомегаловирусного промотора;
- цитомегаловирусный промотор CMV promoter;
- последовательность интрона гена b-глобина человека;
- последовательность по п. 1 Seq Id No.:2;
- последовательность сигнала полиаденилирования hGH poly(A) signal;
- правый инвертированный концевой повтор ITR;
- f1 ori;
- промотор гена устойчивости к ампициллину AmpR promoter;
- ген устойчивости к антибиотику ампициллину AmpR.
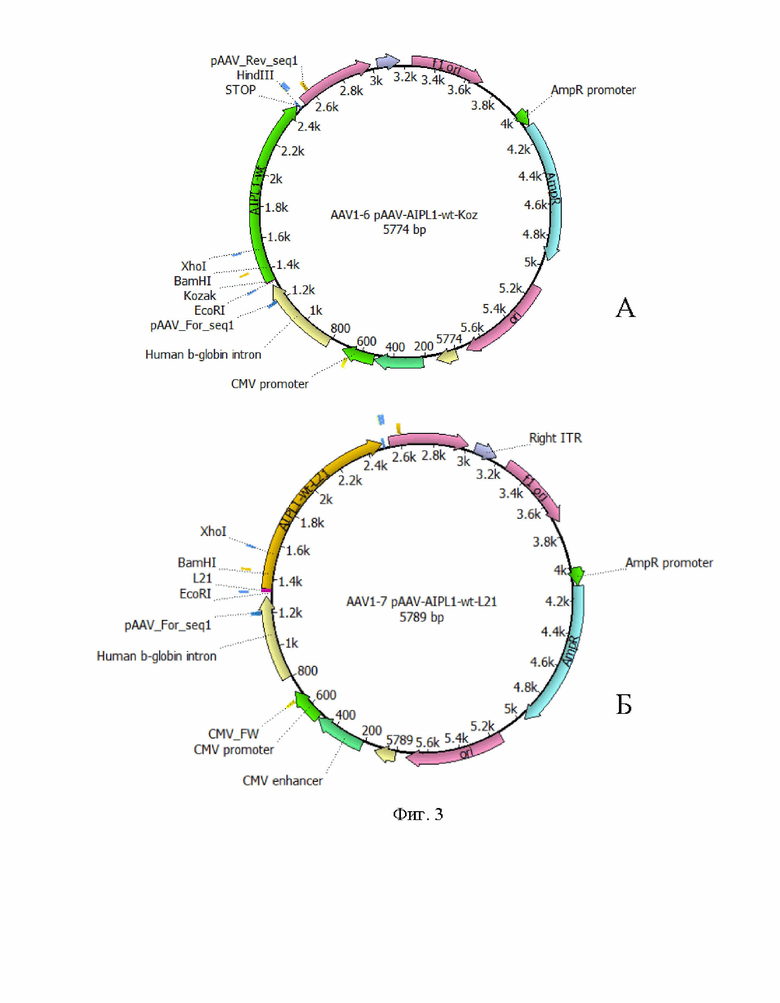
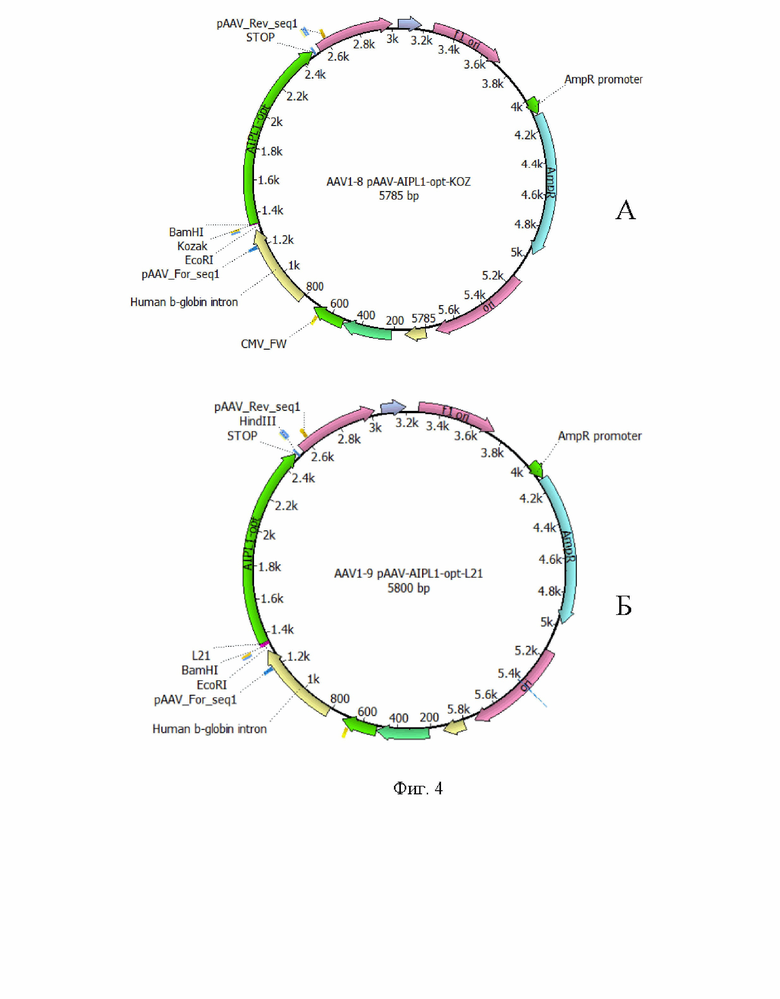
В еще одном варианте осуществления изобретения предлагается плазмидный экспрессионный вектор, содержащий в соответствии с физической и генетической картой, представленной на Фиг. 4А, следующие элементы:
- участок начала репликации ori;
- левый инвертированный концевой повтор ITR;
- CMV энхансер цитомегаловирусного промотора;
- цитомегаловирусный промотор CMV promoter;
- последовательность интрона гена b-глобина человека;
- консенсусную последовательность Kozak;
- последовательность по п. 1 Seq Id No.:2;
- последовательность сигнала полиаденилирования hGH poly(A) signal;
- правый инвертированный концевой повтор ITR;
- f1 ori;
- промотор гена устойчивости к ампициллину AmpR promoter;
- ген устойчивости к антибиотику ампициллину AmpR.
В другом варианте осуществления изобретения предлагается плазмидный экспрессионный вектор, содержащий в соответствии с физической и генетической картой, представленной на Фиг. 4Б, следующие элементы:
- участок начала репликации ori;
- левый инвертированный концевой повтор ITR;
- CMV энхансер цитомегаловирусного промотора;
- цитомегаловирусный промотор CMV promotor;
- последовательность интрона гена b-глобина человека;
- лидерную последовательность L21;
- последовательность по п. 1 Seq Id No.:2;
- последовательность сигнала полиаденилирования hGH poly(A) signal;
- правый инвертированный концевой повтор ITR;
- f1 ori;
- промотор гена устойчивости к ампициллину AmpR promotor;
- ген устойчивости к антибиотику ампициллину AmpR.
В другом варианте осуществления изобретения предлагается вирусный экспрессионный вектор, содержащий последовательность нуклеотидов Seq Id No.:2.
В другом варианте осуществления изобретения предлагается аденоассоциированный вирус, содержащий последовательность нуклеотидов Seq Id No.:2, в качестве вирусного экспрессионного вектора.
В другом варианте осуществления изобретения предлагается аденоассоциированный вирус 2, 8 или 9 серотипа, содержащий последовательность нуклеотидов Seq Id No.:2, в качестве вирусного экспрессионного вектора.
В другом варианте осуществления изобретения в качестве вирусного экспрессионного вектора предлагается аденоассоциированный вирус 2, 8 или 9 серотипа, содержащий последовательность нуклеотидов Seq Id No.:2, нарабатываемый в суспензионных клеточных культурах HEK293.
В другом варианте осуществления изобретения предлагается применение экспрессионного вектора, содержащего последовательность нуклеотидов Seq Id No.:2, для лечения амавроза Лебера 4 типа.
Таким образом одна из технических задач настоящего изобретения, например, создание рекомбинантного гена hAIPL1, позволяющего увеличить экспрессию гена и повысить уровень белка aipl1 в клетках при введении его в экспрессионном векторе, может быть решена с помощью кодонно оптимизированной последовательности нуклеотидов по настоящему изобретению.
Повышение экспрессии гена hAIPL1 может приводить к повышению эффективности генной терапии с помощью ДНК с последовательностью нуклеотидов по настоящему изобретению и вследствие этого к снижению терапевтической дозы препарата, содержащего ДНК с последовательностью нуклеотидов по настоящему изобретению, и к уменьшению нежелательных побочных эффектов.
Фигуры
Изобретение иллюстрируются следующими графическими материалами:
На Фиг. 1 представлен рекомбинантный плазмидный экспрессионный вектор pAAV-AIPL1_wt экспрессирующий ген hAIPl1 дикого типа. Ген hAIPLh1 был синтезирован и клонирован в плазмиду pAAV-MCS по сайтам рестрикции (EcoRI-HindIII) под контролем CMV промотора.
На Фиг. 2 представлен рекомбинантный плазмидный экспрессионный вектор pAAV-AIPL1_opt экспрессирующий кодонно оптимизированный вариант гена hAIPl1. Ген hAIPLh1_opt был синтезирован и клонирован в плазмиду pAAV-MCS по сайтам рестрикции (EcoRI-HindIII) под контролем CMV промотора.
На Фиг. 3 представлен рекомбинантный плазмидный экспрессионный вектор pAAV-AIPL1_wt экспрессирующий ген hAIPl1 дикого типа, дополнительно содержащая регуляторный элемент Kozak (А) и L21 (Б).
На Фиг. 4 представлен рекомбинантный плазмидный экспрессионный вектор pAAV-AIPL1_opt экспрессирующий кодонно оптимизированный вариант гена hAIPl1, дополнительно содержащая регуляторный элемент Kozak (А) и L21 (Б).
На Фиг. 5 представлены изображения AAV капсидов, полученные с помощью трансмиссионной электронной микроскопии. Сконцентрированный образец AAV9-hAIPL1_wt (А) или AAV9-hAIPL1_opt (Б) после аффинной хроматографии фиксировали и окрашивали 1% ФВК и наносили на медные сеточки покрытые формваром. Увеличение ×100000.
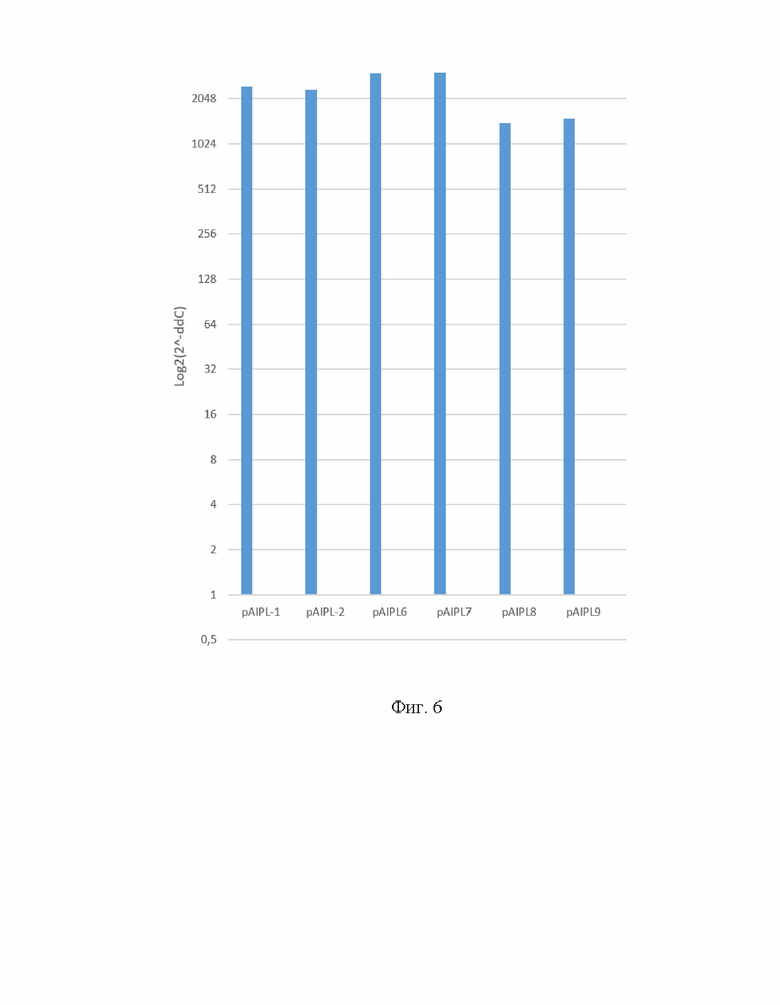
На Фиг. 6 представлен результат дифференциального анализа относительной экспрессии вариантов гена hAIPL1 в культуре клеток HEK293T. Плазмидные экспрессионные векторы, содержащие ген hAIPL1 дикого типа или ДНК с последовательностью нуклеотидов Seq Id No.: 2 были использованы для трансфекции клеточной линии HEK293T. Оценку уровня экспрессии проводили с помощью ОТ-ПЦР относительно уровня мРНК гена GAPDH и PPIA человека с использованием интеркалирующего красителя SybrGreen.
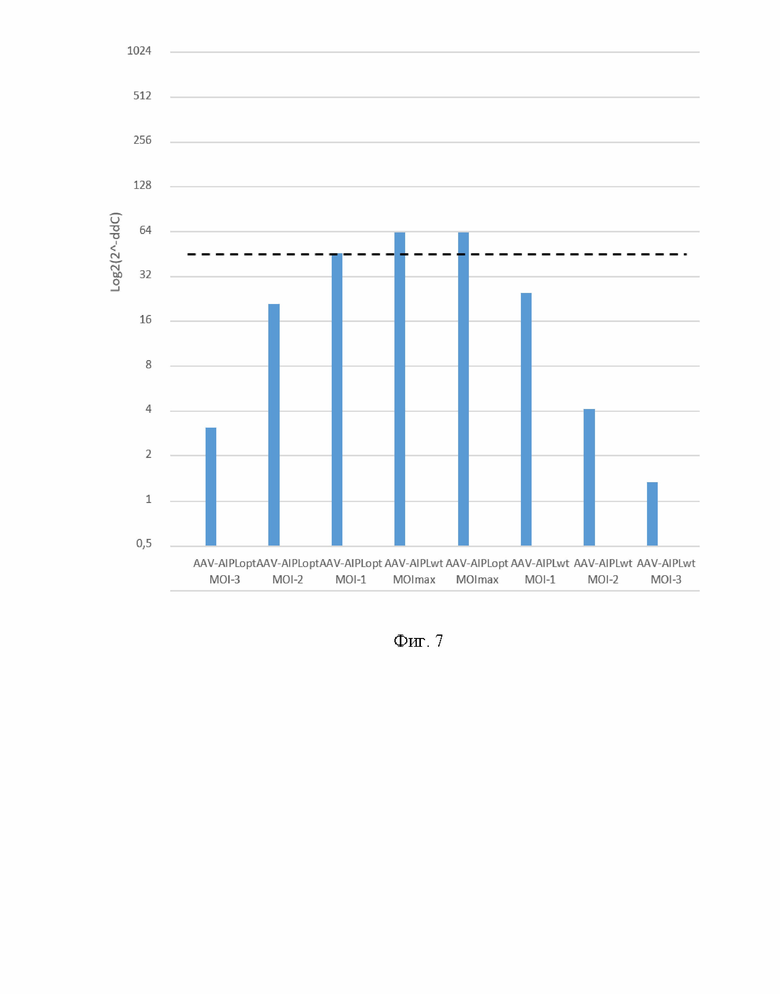
На Фиг. 7 представлены результаты оценки уровня мРНК hAIPL1_wt и hAIPL1_opt после трансдукции клеточной линии HEK293TN рекомбинантным вирусом AAV9. MOI МАХ - максимальная множественность заражения, 100000; MOI-1, MOI-2, MOI-3 - десятикратные разведения AAV9.
На Фиг. 8 демонстрируются результаты иммуноблоттинга по выявлению белка hAIPL1 после трансфекции клеточной линии HEK293T плазмидными экспрессионными векторами, экспрессирующими hAIPL_wt и hAIPL-opt (на фигуре обозначена как hAIPL-СО). Антитела к hAIPL-1 Mouse monoclonal antibody raised against a full-length recombinant AIPL1 (H00023746-M04) (1:1000). А) Иммуноблоттинг; Б) SDS-PAGE электрофорез лизатов клеток HEK293T после трансфекции.
На Фиг. 9 демонстрируются результаты иммуноблоттинга по выявлению белка hAIPL1 после трансфекции клеточной линии HEK293 плазмидными экспрессионными векторами, экспрессирующими hAIPL_wt-6xHIS и hAIPL-CO-6xHIS. Антитела к His-метке HRP Anti-6x His tag antibody (ab1187) (1:5000).
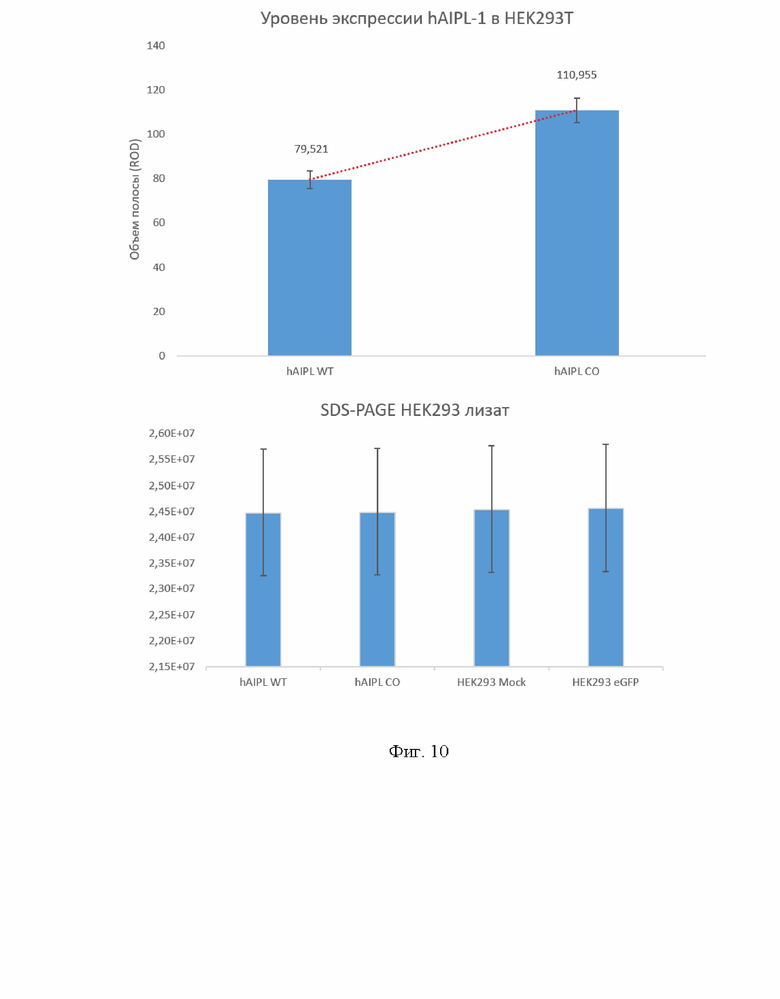
На Фиг. 10 представлен анализ денситометрического измерения результатов обнаружения hAIPl1 методом иммуноблоттинга. А) Иммуноблоттинг hAIPL1 с антителами к His-метке HRP Anti-6x His tag antibody (ab1187) (1:5000); Б) Нормализация по количеству белка SDS-PAGE.
Детальное описание изобретения
Если не указано иначе, предполагается, что все термины, обозначения и другие научные термины, используемые в данной заявке, имеют значения, которые обычно понимают специалисты в области, к которой относится настоящее изобретение. В некоторых случаях определения терминов с общепринятыми значениями приведены в данной заявке для ясности и/или для быстрой справки и понимания, и включение таких определений в настоящее описание не должно истолковываться как наличие существенного отличия значения термина от обычно подразумеваемого в данной области.
Кроме того, если по контексту не требуется иное, термины в единственном числе включают в себя термины во множественном числе, и термины во множественном числе включают в себя термины в единственном числе. Как правило, используемая классификация и методы культивирования клеток, молекулярной биологии, иммунологии, микробиологии, генетики, аналитической химии, химии органического синтеза, медицинской и фармацевтической химии, а также гибридизации и химии белка и нуклеиновых кислот, описанные в настоящем документе, хорошо известны специалистам и широко применяются в данной области. Ферментативные реакции и способы очистки осуществляют в соответствии с инструкциями производителя, как это обычно осуществляется в данной области, или как описано в настоящем документе.
В одном из вариантов осуществления настоящего изобретения предлагается последовательность нуклеотидов Seq Id No.: 2, кодирующая aipl1 человека. На основе последовательности гена hAIPL1 дикого типа (NP_055151.3, Gene ID: 23746, Seq Id No.: 1) была проведена оптимизация кодонов для того, чтобы увеличить стабильность синтезируемой на основе этого гена матричной РНК и уровень экспрессии гетерологичного гена AIPL1 при введении в клетки в составе плазмидного и/или вирусного экспрессионного вектора.
Термин «оптимизация кодонов» означает экспериментальный подход для улучшения кодонного состава рекомбинантного гена на основе различных критериев без изменения аминокислотной последовательности. Оптимизация кодонов возможна благодаря вырожденному генетическому коду, означающему, что большинство аминокислот кодируется более чем одним кодоном. Большинство подходов к оптимизации кодонов заключается в избегании использования редких кодонов. Также направлением оптимизации кодонов может быть выявление элементов нестабильности мРНК, вторичных структур мРНК, повторов последовательностей, внутренних сайтов входа в рибосому, промоторных последовательностей, предполагаемых сайтов сплайсинга и пр. примеры технологий такой оптимизации писаны в статье [Gao, W. et al. (2004) UpGene: Application of a web-based DNA codon optimization algorithm. Biotechnol. Prog. 20, 443-448; Raab, D. et al. (2010) The GeneOptimizer Algorithm: using a sliding window approach to cope with the vast sequence space in multiparameter DNA sequence optimization. Syst. Synth. Biol. 4, 215-225; Gaspar, P. et al. (2012) EuGene: maximizing synthetic gene design for heterologous expression. Bioinformatics 28, 2683-2684; Fath, S. et al. (2011) Multiparameter RNA and codon optimization: a standardized tool to assess and enhance autologous mammalian gene expression. PLoS ONE 6, e17596], текст которой инкорпорирован в настоящее описание посредством ссылки. Частоты встречаемости синонимических кодонов различаются у разных организмов и даже в разных клетках одного и того же организма. Они декодируются рибосомами с разной скоростью, так как соответствующие им тРНК также присутствуют в разных клетках в разных количествах, как показано в статье [Dana A., Tuller Т. (2014) The effect of tRNA levels on decoding times of mRNA codons. Nucl. Acids Res. 42, 9171-9181], текст которой инкорпорирован в настоящее описание посредством ссылки. Поэтому уровень трансляции рекомбинантного белка можно значительно повысить, заменив редкие кодоны на предпочитаемые данной клеточной линией или клетками тканей-мишеней.
Уровень экспрессии гена можно приблизительно предсказать исходя из частоты использования кодонов с помощью различных методик и компьютерных программ, примеры таких программ приведены в статье [Harraghy N., Gaussin A., Mermod N. (2008) Sustained transgene expression using MAR elements. Curr. Gene Ther. 8, 353-366]. База Codon usage database [http://www.kazusa.or.jp/codon/, дата обращения 25.11.2021] предоставляет возможность узнать частоты использования синонимических кодонов и процент встречаемости GC в генетическом коде более чему 35000 организмов. Подходы, включающие замену редких кодонов на частые, в сочетании с уменьшением общего количества GC, приводящего к формированию стабильной вторичной структуры мРНК, часто используются биотехнологическими компаниями и исследовательскими группами для оптимизации экспрессии гетерологичных белков, в некоторых случаях оптимизация использования кодонов способна существенно увеличить выход белка (до 1000 раз). Оптимизацию кодонов можно проводить с помощью биоинформатического программного обеспечения различных производителей (IDT Codon Optimization Tool, GenSmart™ Codon Optimization, ExpOptimizer, OptimumGene™ и множество других биоинформатических инструментов).
Оптимизация кодонов при создании настоящего изобретения была выполнена с учетом вторичной структуры РНК и стабильности шпилек молекулы РНК, также при проведении оптимизации учитывали структурные особенности белка aipl1, в частности тот факт, что N-конец белка aipl1 формирует глобулярную структуру, в то время как С-конец молекулы белка сформирован из неструктурированных элементов. При создании последовательности нуклеотидов по настоящему изобретению был использован программный продукт EMBOSS Backtranseq (EMBL-EBI, Великобритания).
В результате оптимизации кодонов было получено несколько вариантов последовательности нуклеотидов, кодирующих aipl1, из которых была выбрана последовательность нуклеотидов Seq Id No.: 2 с оптимальными свойствами, предсказанными in silico. ДНК с последовательностью нуклеотидов по настоящему изобретению успешно синтезирована и введена в плазмидный экспрессионный вектор на основе pAAV и вирусный экспрессионный вектор на основе аденоассоциированного вируса. ДНК с последовательностью нуклеотидов по настоящему изобретению стабильно экспрессируется как в клетках адгезионной культуры, так и в клетках суспензионной культуры на достоверно более высоком уровне, чем гетерологичный ген hAIPL1 дикого типа, введенный в клетки в аналогичном экспрессионном векторе.
В результате отбора in silico из 9 спроектированных вариантов была получена последовательность нуклеотидов hAIPL1opt (Seq Id No.: 2). ДНК с заявленной последовательностью может быть получена любым известным из уровня техники способом, включая, в качестве неограничивающих примеров, рекомбинантные способы, такие как клонирование последовательностей нуклеиновой кислоты из рекомбинантной библиотеки или генома клетки, использование обычной технологии клонирования и ПЦР и другими, а также способами химического синтеза.
Ген с кодон-оптимизированной последовательностью нуклеотидов по настоящему изобретению может быть введен в плазмидный экспрессионный вектор, например, на основе pAAV. Введение плазмидного экспрессионного вектора, содержащего ген с последовательностью нуклеотидов по настоящему изобретению, в клетки HEK293T путем трансфекции приводит к экспрессии гетерологичного гена hAIPL1opt, при этом количество целевого белка по меньшей мере на 29% выше, чем при введении гена hAIPL1 дикого типа в аналогичном экспрессионном векторе, различие статистически достоверно. Введение плазмидного экспрессионного вектора, содержащего ген с последовательностью нуклеотидов по настоящему изобретению, совместно с вектором pHelper и вектором, выбранным из векторов pRC2/2, pRC2/8, pRC2/9 в клетки HEK293T приводит к продукции вирусного экспрессионного вектора. Введение полученного вирусного экспрессионного вектора в клетки HEK293T путем трансдукции приводит к экспрессии гетерологичного гена hAIPL1opt, при этом количество мРНК hAIPL1opt на 15% выше, чем при введении гена hAIPL1 дикого типа в аналогичном экспрессионном векторе, различие статистически достоверно.
В одном из вариантов осуществления изобретения предлагается экспрессионный вектор, содержащий последовательность нуклеотидов Seq Id No.:2. ДНК с последовательностью нуклеотидов по настоящему изобретению может быть введена в любой известный из уровня техники вектор, в том числе в плазмидный, вирусный, в том числе на основе вируса SV40, аденовирусов, герпесвирусов, ретровирусов, лентивирусов, аденоассоциированного и других вирусов. Векторы, в которые может быть введена ДНК с последовательностью нуклеотидов по настоящему изобретению не ограничивается этим списком. Выбор экспрессионного вектора определяется задачами, для которых вектор будет в дальнейшем использован и не ограничивает объем настоящего изобретения, способы получения векторов известны из уровня техники, векторы, содержащие ДНК с последовательностью нуклеотидов по настоящему изобретению могут быть получены специалистами в области генетической инженерии. Использование плазмидных экспрессионных векторов, содержащих различные дополнительные регуляторные последовательности, такие как консенсусная последовательность Kozak или лидерная последовательность L21, показало, что они могут быть полезны для решения определенных технических задач, при этом могут использоваться другие регуляторные последовательности плазмидного экспрессионного вектора.
В некоторых вариантах осуществления изобретения предлагаются плазмидные экспрессионные векторы, содержащие элементы в соответствии с физической и генетической картой, представленной на Фиг. 2, Фиг. 4А, Фиг. 4Б. Термин «промотор», используемый в настоящем документе, в частности, относится к последовательности нуклеотидов ДНК, узнаваемой РНК-полимеразой, на которой происходит инициация транскрипции элемента, с которым функционально связан промотор. Промотор может также сопровождаться «энхансером». Энхансеры усиливают активность промотора и стимулируют процесс транскрипции. Для получения большого количества белка в эукариотических клетках и, в частности, в клетках человека, целесообразно использовать сильные промоторы, активные в клетках-мишенях. Сильные конститутивные промоторы, способные инициировать экспрессию рекомбинантного гена в разных типах клеток, хорошо известны в данной области. В одном из вариантов осуществления изобретения в качестве промотора используют промотор цитомегаловируса (CMV), а в качестве энхансера - энхансер цитомегаловируса.
В некоторых вариантах осуществления изобретения плазмидный экспрессионный вектор включает следующие элементы в направлении от 5'-конца к 3'-концу:
- участок начала репликации ori;
- левый инвертированный концевой повтор ITR;
- CMV энхансер цитомегаловирусного промотора;
- цитомегаловирусный промотор CMV promotor;
- последовательность интрона гена b-глобина человека (интрон гена hBG1 - субъединицы гемоглобина гамма-1);
- последовательность по п. 1 Seq Id No.:2;
- последовательность сигнала полиаденилирования hGH poly(A) signal (hGH poly(A) signal, сигнал полиаденилирования гена гормона роста человека);
- правый инвертированный концевой повтор ITR;
- f1 ori;
- промотор гена устойчивости к ампициллину AmpR promotor;
- ген устойчивости к антибиотику ампициллину AmpR.
В одном из вариантов осуществления изобретения плазмидный экспрессионный вектор содержит консенсусную последовательность Козак (последовательность Козак, англ. Kozak consensus sequence). Консенсусная последовательность Козак - это последовательность нуклеотидов в составе молекулы мРНК эукариот, а также соответствующая последовательность в их генах, окружающая старт-кодон и важная для инициации трансляции.
В одном из вариантов осуществления изобретения плазмидный экспрессионный вектор содержит лидерную последовательность L21. L21 - элемент последовательности длиной 21 п.н. происходит из 5'-нетранслируемой лидерной последовательности кДНК тропомиозина омара L21. L21 содержит как последовательность Козак, так и А-богатую последовательность. В некоторых модельных системах был показан усиливающий эффект L21 на экспрессию гена и синтез белка [Sano K, Maeda K, Oki M,  Y. Enhancement of protein expression in insect cells by a lobster tropomyosin cDNA leader sequence. FEBS Lett. 2002 Dec 4;532(1-2):143-6].
Y. Enhancement of protein expression in insect cells by a lobster tropomyosin cDNA leader sequence. FEBS Lett. 2002 Dec 4;532(1-2):143-6].
Трансфекция клеток плазмидными экспрессионными векторами, содержащими ДНК с последовательностью нуклеотидов Seq Id No.:2, приводит к стабильной экспрессии гена AIPL1, при этом количество мРНК при трансфекции клеток плазмидным экспрессионным вектором, содержащим последовательность нуклеотидов Seq Id No.: 2 по настоящему изобретению, сохраняется на том же уровне, что и при введении гена дикого типа в аналогичном векторе, а количество в клетках гетерологичного белка aipl1 увеличивается на 29% по сравнению с клетками, трансфицированными аналогичным вектором, содержащим ДНК hAIPL1 дикого типа, различие статистически достоверно.
В одном из вариантов осуществления изобретения предлагается вирусный экспрессионный вектор, содержащий последовательность нуклеотидов Seq Id No.: 2. Вектор может быть вектором аденоассоциированного вируса (AAV), аденовирусным вектором, ретровирусом или лентивирусным вектором на основе вируса иммунодефицита человека и других вирусов. AAV и лентивирусы могут обеспечивать длительную экспрессию, в то время как аденовирус может обеспечивать временную экспрессию.
В одном из вариантов осуществления изобретения предлагается аденоассоциированный вирус, содержащий последовательность нуклеотидов Seq Id No.: 2, в качестве вирусного экспрессионного вектора. Примеры таких векторов на основе AAV можно найти в статье: Peters, С.W., Maguire, С.A., & Hanlon, K.S. (2021). Delivering AAV to the Central Nervous and Sensory Systems. Trends in Pharmacological Sciences, 42(6), 461-474. Векторы на AAV признаются эффективными для генной терапии производных нервной ткани, в том числе тканей сенсорных органов, таких как глаз. AAV представляет собой небольшой, неспособный к самостоятельной репликации, вирус, не имеющий оболочки размером около 20 нм. У человека и приматов описано множество различных серотипов AAV. Геном всех известных серотипов AAV организован сходно: он представляет собой линейную одноцепочечную молекулу ДНК размером менее чем примерно 5000 нуклеотидов (нт). Инвертированные концевые повторы (англ. inverted terminal repeats, ITR) ограничивают внутри себя уникальные нуклеотидные последовательности, кодирующие капсидные белки (Сар) и белки репликации (Rep). Ген Сар кодирует белки VP (VP1, VP2 и VP3), которые образуют капсид. При образовании рекомбинантного вектора AAV кассету экспрессии, не содержащую гены Rep и ограниченную ITR, помещают в капсид AAV. Рекомбинантный AAV не способен к репликации и в настоящее время признается одним из самых безопасных и широко используемых вирусных экспрессионных векторов для переноса генов in vivo. Векторы на основе AAV могут проникать в клетки различных тканей, обеспечивая стабильную экспрессию гетерологичного гена. Эти вирусы непатогенны и обладают низкой иммуногенностью [High KA, Aubourg P. rAAV human trial experience. Methods Mol Biol. 2011; 807:429-57].
В одном из вариантов осуществления изобретения предлагается аденоассоциированный вирус 2, 8 или 9 серотипа, содержащий последовательность нуклеотидов Seq Id No.:2, в качестве вирусного экспрессионного вектора. Все известные серотипы аденоассоциированных вирусов могут инфицировать клетки многих видов тканей. Тканевая специфичность определяется серотипом белков капсида, поэтому векторы на основе аденоассоциированого вируса конструируют, задавая необходимый серотип. Вирусные экспрессионные векторы на основе AAV 2, 8 и 9 серотипов, содержащие ДНК с последовательностью нуклеотидов по настоящему изобретению, приводят к стабильной экспрессии гетерологичной ДНК в трансдуцированных ими клетках, при этом уровень мРНК, синтезированной с гетерологичной ДНК с последовательностью нуклеотидов Seq Id No.:2, на 15% выше уровня мРНК в клетках, трансдуцированных аналогичным вектором, содержащим ген hAIPL1 дикого типа, различие статистически достоверно. Полученные данные могут позволить ожидать увеличенного количества гетерологичного белка aipl1 в клетках, трансдуцированных вирусными векторами, содержащими ДНК с последовательностью нуклеотидов по настоящему изобретению, даже по сравнению с клетками, трансфицированными плазмидными экспрессионными векторами, несущими ДНК с той же последовательностью нуклеотидов.
В одном из вариантов осуществления изобретения в качестве вирусного экспрессионного вектора предлагается аденоассоциированный вирус 2, 8 или 9 серотипа, содержащий последовательность нуклеотидов Seq Id No.:2, нарабатываемый в суспензионных клеточных культурах HEK293. Введение плазмидного экспрессионного вектора, содержащего ген с последовательностью нуклеотидов по настоящему изобретению, совместно с вектором pHelper и вектором, выбранным из векторов pRC2/2, pRC2/8, pRC2/9 в клетки суспензионной клеточной культуры HEK293 приводит к продукции вирусных экспрессионных векторов, представляющих собой аденоассоциированный вирус 2, 8 или 9 серотипа. Было показано, что при трансдукции клеток полученными AAV-векторами содержащими ген hAIPL1opt по настоящему изобретению, уровень мРНК AIPL1 увеличивается при использовании вируса в меньшей концентрации (multiplicity of infection), чем при использовании вектора с конструкцией дикого типа, что может позволить уменьшить терапевтические дозы вирусного вектора, содержащего ген с последовательностью нуклеотидов по настоящему изобретению, при дальнейшем использовании для терапии амавроза Лебера IV типа.
В одном из вариантов осуществления изобретения предлагается применение экспрессионного вектора, содержащего последовательность нуклеотидов Seq Id No.:2, для лечения амавроза Лебера 4 типа. Экспрессионные векторы по настоящему изобретению демонстрируют стабильную и высокую экспрессию гена AIPL1 в клетках. Это свидетельствует в пользу того, что введение любого из заявленных экспрессионных векторов по настоящему изобретению в ткани глаза может привести к стабильной экспрессии гена AIPL1 с последовательностью Seq Id No.:2 и восполнению недостатка белка aipl1 в клетках и тканях глаза, и, следовательно, восстановлению его функции и стабилизации зрения при амаврозе Лебера IV типа.
Сущность и промышленная применимость изобретения поясняются следующими примерами:
Пример 1. Создание плазмидных экспрессионных векторов.
Пример 1.1. Оптимизация кодонов последовательности нуклеотидов, кодирующих ген hAIPL1.
Аннотацию доменов pAIPL1 проводили с использованием сервиса NCBI/CCD. Для выравнивания нуклеотидных последовательностей применяли инструмент UniPro UGENE [Okonechnikov K, Golosova О, Fursov M, the UGENE team. Unipro UGENE: a unified bioinformatics toolkit. Bioinformatics, 2012, 28:1166-1167. doi:10.1093/bioinformatics/bts091]. Трансляцию нуклеотидной последовательности в аминокислотную проводили при помощи инструмента https://web.expasy.org/translate/ [дата обращения 26.11.2021]. Анализ стабильности доменов белка aipl1 выполняли в IUPred2A [https://iupred2a.elte.hu/, дата обращения 26.11.2021]. В результате проведенного анализа глобулярный домен aipl1 и неорганизованный участок белка были выявлены и каждый в отдельности был использован для оптимизации кодонов. Оптимизацию кодонов проводили с помощью биоинформатического программного обеспечения EMBOSS Backtranseq (EMBL-EBI, Великобритания). Дополнительно учитывали последовательность сайтов узнавания для рестриктаз, участвующих в клонировании. Для изучения стабильности транскрипта была использована программа RNA fold [http://rna.tbi.univie.ac.at/cgi-bin/RNAWebSuite/RNAfold.cgi, дата обращения 26.11.2021].
Пример 1.2. Синтез последовательностей нуклеотидов, кодирующих ген hAIPL1wt и hAIPL1opt и подготовка плазмидных экспрессионных векторов.
Нуклеиновую кислоту с последовательностью гена AIPL1 дикого типа (hAIPL1wt, Seq Id No: 1) и с оптимизированной последовательностью нуклеотидов по настоящему изобретению (hAIPL1opt, Seq Id No: 2) синтезировали на заказ при помощи сервиса TopGenetech (Канада). Для дальнейшего получения вирусных векторов использовали экспрессионные плазмиды, а также коммерчески доступные хелперную плазмиду (pHelper) и упаковочную плазмиду pRC2/8/9 для разных серотипов вируса: AAV2, AAV8, AAV9 соответственно (Cell Biolabs Inc, США).
Для получения вирусных векторов использовали экспрессионную плазмиду AAV-2 в которую методом клонирования по сайтам рестрикции BamHI и HindIII доставляли нуклеотидную последовательность гена hAIPL1wt или hAIPL1opt. Были созданы и наработаны, проверены рестрикционно и секвенированием, заложены в банк плазмидные экспрессионные векторы с экспрессионными кассетами AAV с генами AIPL дикого типа (Фиг. 1) и оптимизированными вариантами, включая hAIPL1opt (Фиг. 2), плазмиды с His-tag, необходимые для оценки уровня трансляции а также плазмидные экспрессионные векторы, дополнительно несущие консенсусную последовательность Kozak или лидерный пептид L21 (Фиг. 3А, 4А) и L21 (Фиг. 3Б, 4Б).
Пример 1.3. Выделение плазмидных экспрессионных векторов
Препаративное количество плазмидной ДНК для трансфекции получали с помощью наборов реагентов Qiagen Plasmid Mini Kit и Qiagen Plasmid Maxi Kit (Qiagen, Германия). Соответствие полученных плазмид картам проверяли с помощью рестрикционного анализа и последующего электрофореза в агарозном геле и методом секвенирования по Сэнгеру.
Пример 1.4. Трансфекция клеток HEK293T плазмидными экспрессионными векторами.
Для оценки уровня экспрессии после трансфекции использовали адгезионную клеточную линию HEK293T. Разморозка и культивирование клеточной линии осуществлялась согласно стандартным методикам. Трансфекцию клеток проводили с использованием полиэтиленэмина (PEI) в соотношении 5:1 к плазмидной ДНК (мкг/мкг) и 6-луночных планшетов.
Пример 1.5. Уровень экспрессии AIPL1 после трансфекции клеток полученными плазмидными транскрипционными векторами.
Клетки HEK293T, трансфицированные плазмидными экспрессионными векторами как описано в Примере 1.4., выращивали до конфлюэнтности по стандартным методикам культивирования клеток, после этого клетки собирали, из них выделяли мРНК с помощью набора RNeasy Kit (Qiagen, Германия) по рекомендациям изготовителя.
Для оценки уровня экспрессии после трансфекции в качестве генов домашнего хозяйства для относительной оценки уровня экспрессии были выбраны 3 гена (GAPDH, ТВР, PPIA), как наиболее стабильные гены для раковых и не раковых линий.
Прямой и обратный праймеры для ПЦР в реальном времени (RT-PCR) были подобраны таким образом, чтобы они были комплементарны как последовательности нуклеотидов AIPL1wt дикого типа, так и оптимизированной последовательности нуклеотидов AIPL1opt.
AIPL-common-for GTGGCTGAAGCTGGAGAAG
AIPL-common-rev CTCCAGCTCCAGCACTTTC
Ожидаемая длина фрагмента мРНК/ AIPL1-WT/ AIPL1-OPT 220 п.о.
>ENST00000570466.5_AIPL1:645+864 220 п.о.
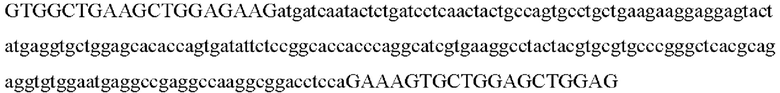
Ожидаемая длина фрагмента геномной ДНК=1004bp
>chr17:6425733-6426736 1004bp

Для AIPL1opt и AIPL1wt были подобраны специфические зонды.
Наложение последовательностей праймеров на последовательность гена AIPL1 отмечено двойным подчеркиванием, зондов волнистым подчеркиванием
AIPL1-WT-probe 56-ROXN/ AGTGCCTGCTGAAGAAGGAG /3BHQ_2/
AIPL1-OPT-probe /56-ROXN/ CAACACCCTGATCCTGAAC /3BHQ 2/
AIPL1opt 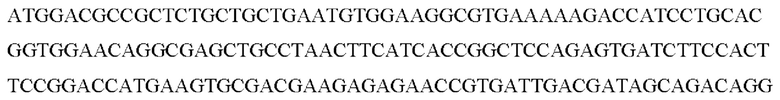

AIPL1wt

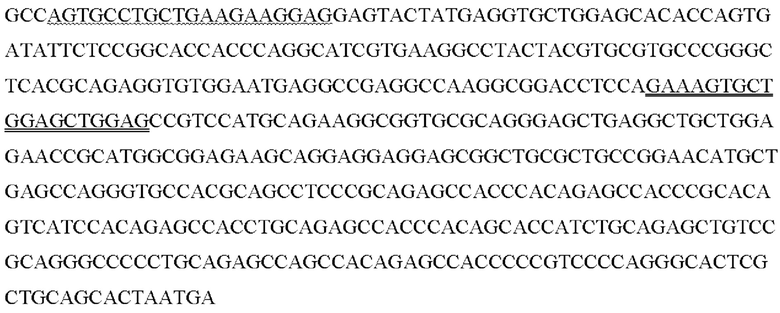
Последовательности праймеров для генов домашнего хозяйства были взяты из работы Лемма с соавторами [Lemma, S., Avnet, S., Meade, M.J., Chano, Т., & Baldini, N. (2018). Validation of suitable housekeeping genes for the normalization of mRNA expression for studying tumor acidosis. International journal of molecular sciences, 19(10), 2930]. В качестве генов домашнего хозяйства для относительной оценки уровня экспрессии были выбраны 3 гена: GAPDH, ТВР, PPIA, - как наиболее стабильные гены для раковых и не раковых клеточных линий. Последовательности зондов для генов домашнего хозяйства подобраны самостоятельно (выделены жирным подчеркиванием.
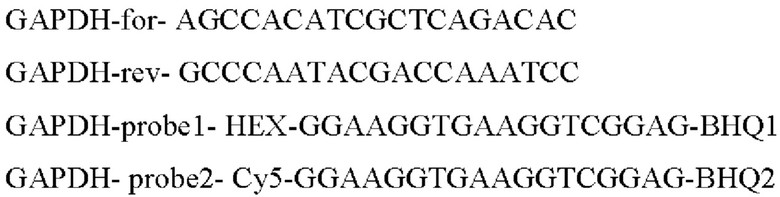
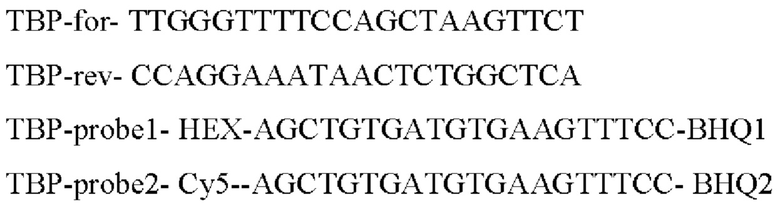
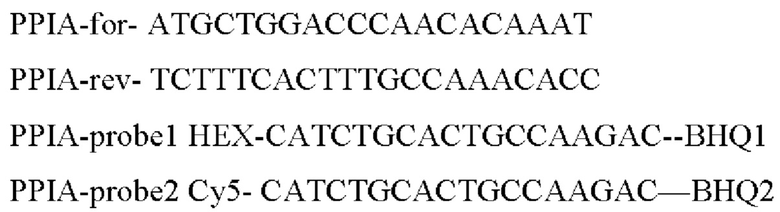
>ENST00000396856.5_GAPDH:42+107 66bp
>ENST00000636632.1_TBP:1098+1237 140bp

>ENST00000446829.1_TBP:53+153 101bp
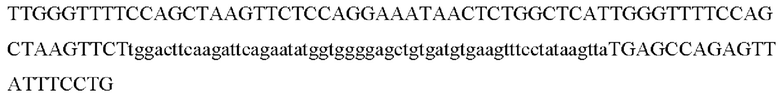
>ENST00000677107.1_PPIA:451+547 97bp

Олигонуклеотидные последовательности были проверены с помощью инструмента OligoAnalyzer™ Tool [https://www.idtdna.com/pages/tools/oligoanalyzer, дата обращения 29.11.2021]. Длину продукта оценивали посредством выравнивания на геномную ДНК GRch38/hg38 с помощью инструмента Genome Browser [https://genome.ucsc.edu/, дата обращения 29.11.2021].
Уровень гетерологичной мРНК, кодирующей aipl1, не различается в клетках, трансфицированных плазмидными экспрессионными векторами, содержащими ген hAIPL1 дикого типа и ДНК с последовательностью нуклеотидов по настоящему изобретению (Фиг. 6). Это свидетельствует о том, что произведенная оптимизация кодонов не приводит к ухудшению гетерологической экспрессии гена hAIPL1.
Пример 1.6. Оценка количества белка aipl1 после трансфекции клеток полученными плазмидными транскрипционными векторами.
Клетки HEK293T, трансфицированные плазмидными экспрессионными векторами как описано в Примере 1.4., выращивали до конфлюэнтности по стандартным методикам культивирования клеток, после этого клетки собирали, из них выделяли белок по стандартной методике, общее количество белка определяли по методу Лоури [Lowry О.Н., Rosebrough N.J., Farr A.L., Randall R.J. (1951) Protein measurement with the folin phenol reagent. J Biochem Sci, 193(1):265-275].
Электрофорез проводили в денатурирующих условиях по стандартной методике [U. K. Laemmli. Cleavage of Structural Proteins during the Assembly of the Head of Bacteriophage T4. Nature, 1970; V.227, P.680-685]. На ПААГ-гель наносили образец в количестве от 2,5 до 10 мкг белка. Перенос на нитроцеллюлозную мембрану осуществляли полусухим способом с использованием системы автоматического полусухого иммуноблоттинга Trans-blot turbo (BioRad, США). Для окрашивания мембраны использовали специфические мышиные моноклональные антитела против полноразмерного рекомбинантного белка aipl1 в разведении 1:1000 (2 В Scientific Ltd, Великобритания, кат. № Н00023746-М04) и кроличьи поликлональные антитела против His6-tag, конъюгированные с пероксидазой хрена, в разведении 1:5000 (HRP Anti-6x His tag antibody ab1187, Abcam, Великобритания). Изменение уровня экспрессии по концентрации белка после окрашивания мембраны антителами оценивали с использованием системы гель-документирования ChemiDoc с ПО ImageLab (BioRad, США).
Результаты электрофореза и иммуноблотинга показали, что уровень белка aipl1 на 29% выше после трансфекции клеток вектором, содержащим ДНК с последовательностью нуклеотидов по настоящему изобретению по сравнению с геном hAIPl1 дикого типа (Фиг. 8-10). Различия статистически достоверны.
Пример 2. Создание вирусных экспрессионных векторов.
Пример 2.1. Клеточные культуры и трансфекция
Для наработки векторов использовали линию HEK293, адаптированную к росту на суспензионной среде. Для оценки уровня экспрессии после трансфекции и эффективности транедукции использовали адгезионную клеточную линию HEK293T. Разморозка и культивирование клеточной линии осуществлялась согласно стандартным методикам. Трансфекцию клеток проводили с использованием полиэтиленэмина (PEI) в соотношении 5:1 к плазмидной ДНК (мкг/мкг) и 6-луночных планшетов. Для получения вирусных векторов использовали экспрессионную плазмиду AAV-2, получение которой описано в примере 1.2. Хелперная плазмида (pHelper) и упаковочная плазмида (pRC2/8/9) для разных серотипов вируса AAV-2, AAV-8, AAV-9 для сборки вирусных экспрессионных векторов использовались коммерчески доступные, например, производства Cell Biolabs, США.
Пример 2.2. Наработка вирусных экспрессионных векторов.
Разморозку и культивирование клеточной линии HEK293T осуществляли согласно стандартным операционным процедурам методикам. На момент получения расчетная плотность клеточной культуры 106 кл/мл, объем клеточной культуры 30 мл.
Трансфекцию проводили в колбах Эрленмейера (125 мл), рабочий объем 30 мл. Условия трансфекции: концентрация клеток при трансфекции 106 кл/мл, жизнеспособность 85-90%, масса ДНК 1,5 мкг/1 млн клеточной биомассы. Соотношение ДНК:PEI 1:5, объем трансфицирующей смеси 5% от объема клеточной культуры. Условия культивирования трансфицированной клеточной культуры: 37°С, 5% СО2, 70% влажность, 92 об/мин, диаметр платформы 50 мм. Время культивирования трансфицированной смеси 96-120 ч.
Приготовление трансфекционных смесей производили последовательным добавлением в 2 центрифужные пробирки объемом 1,5 мл pAAV-AIPL1wt или pAAV-AIPL1opt, pHelper, pRC2/8/9 суммарной массой 45 мкг, PEI 1 мкг/мл (225 мкл для соотношения 5:1, 135 мкл для соотношения 3:1) и бессывороточной среды для культивирования клеток BalanCD® HEK293 до 1000 мкл либо 1500 мкл. После добавления среды содержимое пробирок перемешивали вортексированием и выдерживали при комнатной температуре в течение 10 минут.
Для трансфекции к 30 мл клеточной культуры HEK293T добавляли приготовленную заранее трансфекционную смесь с концентрацией плазмидных ДНК (pDNA) 1,5 мкг/млн клеточной культуры и ниже указанными соотношениями pDNA:PEI. Готовые трансфекционные смеси вносили непосредственно в колбы одноканальным дозатором. После этого колбы переносили в инкубатор для культивирования и выдерживали при 37,0°С, влажности 70%, содержании СО2 5%, перемешивании 120 об/мин.
Через 96-120 часов после трансфекции переносили суспензию клеток в объеме 30 мл в стерильные 50 мл центрифужные пробирки, проводили химический лизис клеточной суспензии с помощью 10% Tween 20 в течение 2,5-3 часов при 37,0°С и 130-330 об/мин. После лизиса производили заморозку образцов при 20°С. Через 14 часов проводили разморозку лизатов и обработку бензоназой (ферментолиз, гидролиз ДНК). Для этого к лизату добавляли 35 мкл 1М раствора MgCl2, перемешивали в течение 30 минут при 37,0°С и 330 об/мин, затем добавляли бензоназу из расчета 30 ед/мл. и выдерживали в течение 90 минут при 37,0°С и 130 330 об/мин. После этого осветляли полученные лизаты внесением диатомитовой земли (0,01 г/мл) и выдерживанием в течение 5 мин при 37,0°С и 330 об/мин с последующей стерилизующей фильтрацией осветленных лизатов через фильтр с диаметром пор 0,22 мкм.
Далее проводили очистку вирусных частиц с использованием аффинной хроматографии на сорбенте CaptureSelect AAVX в условиях, рекомендованных фирмой производителем.
Хроматографическую колонку, упакованную 5 мл аффинного сорбента CaptureSelect AAVX, уравновешивали буфером для уравновешивания в объеме 5CV, затем наносили профильтрованный образец на сорбент в объеме ≈1400 мл (до момента загрязнения сорбента коагулирующими белками, образующимися в процессе отстаивания профильтрованного образца во время нанесения). Время контакта 2 мин, скорость нанесения 2,5 мл/мин. После этого
- промывали колонку буфером для уравновешивания, буфером для промывки в объеме 5CV каждый;
- элюировали первой части AAV-hAIPL буфером для элюции;
- титровали элюат до целевого значения рН 7,0-8,0 1 M Tris-OH;
- фильтровали полученный раствор через систему стерилизующей фильтрации (PES, 0,22 мкм);
Полученные в ходе хроматографической очистки элюаты концентрировали и диализовали с использованием центрифужных концентраторов Vivaspin 500 PES (Sartorius, Германия) с номинальным отсечением по молекулярной массе 100 кДа (MWCO 100 kDa) в условиях, рекомендованных фирмой производителем, и проводили стерилизующую фильтрацию с использованием центрифужных фильтров с диаметром пор 0,22 мкм. Стерильные препараты вирусных векторов использовали в дальнейшем для анализа концентрации вирусных частиц и трансдукции клеток.
В случае наработки AAV2 вместо аффинной хроматографии использовали метод ультрацентрифугирования с использованием прерывистого градиента йодиксанола по известной методике [Zolotukhin S, Byrne BJ, Mason E, Zolotukhin I, Potter M, Chesnut K, Summerford C, Samulski RJ, Muzyczka N. Recombinant adeno-associated virus purification using novel methods improves infectious titer and yield. Gene Ther. 1999 Jun; 6(6):973-85. doi: 10.1038/sj.gt.3300938. PMID: 10455399].
Пример 2.3. Визуализация образцов AAV с помощью трансмиссионной электронной микроскопии (ТЕМ)
Для фиксации образца брали 12-15 мкл изучаемого раствора с вирусными частицами, концентрация образцов для анализа - 1013 vg/мл, наносили на медные сеточки для электронной микроскопии, покрытые формваром, фиксировали 1% ФВК в MiliQ Н2О (рН 7,0-7,5). Образцы после фиксации промывали дистиллированной водой и высушивали. Полученные таким образом препараты анализировали на ультрамикроскопе Jeol 110 (Toshiba, Япония) при увеличении ×100000.
Количество полных капсидов ~50%, вирусные капсиды не агрегируют в заданных условиях, имеют правильную форму и размер (Фиг. 5).
Пример 2.4. Определение количества вирусных частиц
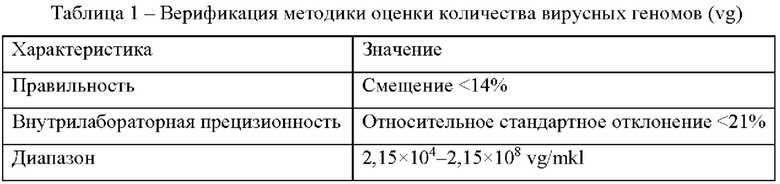
Определение количества вирусных геномов (vg) AAV векторов в культуральной жидкости и лизатах проводили методом RT-PCR с помощью набора реагентов OneTube RT-PCR TaqMan с использованием Hot Start Taq DNA Polymerase (NEB, New England Biolabs, США) cat# M0495L. Последовательности зондов были подобраны самостоятельно. Методика оценки была верифицирована (Таблица 1).
Была проведена оценка продуктивности клеток после трансфекции и общего выхода AAV трех разных серотипов (в vg на 1 л культуральной жидкости).
Результаты по продуктивности AAV-AIPL представлены в Таблице 2. 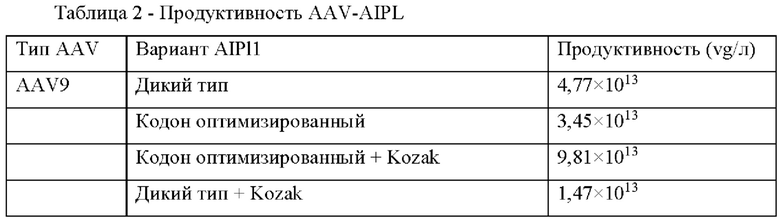
Модификация экспрессионной кассеты (оптимизация последовательностей) не влияет на эффективность сборки AAV, т.к. продуктивность находится в приемлемом для работы диапазоне (1012-1013 vg/л для последующей очистки, концентрирования и использования с учетом примерной дозы продукта для субретинальной инъекции пациенту - 1011 vg).
Для оценки уровня трансдукции и дальнейшего использования пригоден любой из наработанных серотипов.
Пример 3. Трансдукция клеток вирусными экспрессионными векторами, содержащими ген AIPL1.
Пример 3.1. Клеточные культуры и трансдукция
Для оценки уровня экспрессии после трансдукции использовали адгезионную клеточную линию HEK293T. Разморозка и культивирование клеточной линии осуществлялась согласно стандартным методикам. Трансдукцию клеток проводили по известным из уровня техники и стандартным методикам. Вирусный вектор суспендировали в среде для культивирования клеток и добавляли к клеткам в культуре, выращенным до примерно 80% конфлюэнтности. Инкубировали клетки с вируссодержащей средой в течение 6-12 часов.
Пример 3.2. Уровень экспрессии AIPL1 после трансдукции клеток полученными вирусными экспрессионными векторами.
Клетки HEK293T, трансдуцированные вирусными экспрессионными векторами, выращивали до конфлюэнтности по стандартным методикам, после этого клетки собирали, из них выделяли мРНК с помощью набора RNeasy Kit (Qiagen, Германия) по рекомендациям изготовителя.
Для оценки уровня экспрессии после трансдукции в качестве генов домашнего хозяйства для относительной оценки уровня экспрессии были выбраны 3 гена (GAPDH, ТВР, PPIA), как наиболее стабильные гены для раковых и не раковых линий.
Прямой и обратный праймеры для РТ ПЦР были подобраны таким образом, чтобы они были комплементарны как -WT, так и AIPL1-OPT. Олигонуклеотидные последовательности были проверены OligoAnalyzer™ Tool https://www.idtdna.com/pages/tools/oligoanalyzer. Длина продукта оценена с помощью выравнивания на геномную ДНК GRch38/hg38 с помощью Genome Browser https://genome.ucsc.edu/
Уровень гетерологичной мРНК, кодирующей aipl1, в клетках, трансдуцированных вирусным экспрессионным вектором, содержащим ДНК с последовательностью нуклеотидов по настоящему изобретению на 15% выше по сравнению с клетками, в которые был внесен ген hAIPL1 дикого типа (Фиг. 7). Различие статистически достоверно. Полученные данные позволяют ожидать увеличенного количества гетерологичного белка aipl1 в клетках, трансдуцированных вирусными векторами, содержащими ДНК с последовательностью нуклеотидов по настоящему изобретению, даже по сравнению с клетками, трансфицированными плазмидными экспрессионными векторами, несущими ДНК с той же последовательностью нуклеотидов. При анализе трансдукции клеток вирусным экспрессионным вектором по настоящему изобретению был обнаружен неожиданный эффект: было показано, что при трансдукции клеток AAV-векторами, содержащими ген hAIPL1opt по настоящему изобретению, уровень мРНК AIPL1 увеличивается при использовании вируса в меньшей концентрации (multiplicity of infection), чем при использовании вектора с геном hAIPL1 дикого типа, что позволит уменьшить терапевтические дозы вирусного вектора, содержащего ген с последовательностью нуклеотидов по настоящему изобретению, при дальнейшем использовании для терапии амавроза Лебера IV типа.
Все публикации, патенты и заявки на патенты включены в настоящий документ посредством ссылки. Хотя в вышеприведенном описании это изобретение было описано в отношении некоторых предпочтительных вариантов его осуществления, и многие детали были изложены в целях иллюстрации, для специалистов в данной области техники будет очевидно, что изобретение допускает дополнительные варианты осуществления и что некоторые детали, описанные в данном документе, могут значительно изменяться без отклонения от сущности изобретения.
Использование терминов в единственном числе в контексте описания изобретения должно толковаться как охватывающее как единственное, так и множественное число, если иное не указано в данном документе или явно не противоречит контексту. Термины «состоящий из», «имеющий», «включающий» и «содержащий» следует толковать как неограничивающие термины, т.е. означающие «включая, но не ограничиваясь», если не указано иное. Перечисление диапазонов значений в данном документе просто предназначено для использования в качестве сокращенного способа индивидуальной ссылки на каждое отдельное значение, попадающее в этот диапазон, если здесь не указано иное, и каждое отдельное значение включено в спецификацию, как если бы оно было отдельно изложено в данном документе. Все способы, описанные в данном документе, могут выполняться в любом подходящем порядке, если иное не указано в данном документе или иным образом явно не противоречит контексту. Использование любых и всех примеров или иллюстративного языка (например, «такой как»), представленных в данном документе, предназначено просто для лучшего описания изобретения и не налагает ограничения на объем изобретения, если иное не заявлено. Никакие формулировки в описании не следует истолковывать как указывающие на какой-либо не заявленный элемент как существенный для практического применения изобретения.
Здесь описаны варианты осуществления этого изобретения, включая лучший из известных изобретателям способа осуществления изобретения. Разновидности этих вариантов осуществления могут стать очевидными для специалистов в данной области техники после прочтения предшествующего описания. Авторы ожидают, что квалифицированные специалисты будут использовать такие варианты в зависимости от обстоятельств, и авторы предполагают, что изобретение будет реализовано на практике иначе, чем конкретно описано в данном документе. Соответственно, это изобретение включает в себя все модификации и эквиваленты признаков, изложенных в прилагаемой формуле изобретения, как это разрешено действующим законодательством. Более того, любая комбинация вышеописанных признаков во всех их возможных вариациях охватывается изобретением, если иное не указано в данном документе или иным образом явно не противоречит контексту.
Заявитель просит рассмотреть представленные материалы заявки «Кодон-оптимизированная последовательность нуклеотидов, кодирующая hAIPL1, и ее содержащий экспрессионный вектор» на предмет выдачи патента на изобретение.
--->
Перечень последовательностей
<110> Автономная некоммерческая образовательная организация
высшего образования «Научно-технологический университет «Сириус»
Sirius University of Science and Technology
<120> Кодон-оптимизированная последовательность нуклеотидов,
кодирующая hAIPL1, и её содержащий экспрессионный вектор
<130>
<160> 3
<210> 1
<211> 1158
<212> ДНК
<213> Homo sapiens
<220>
<222> (1)…(1158)
<223> Ген AIPL1 человека AIPL1wt
<400> 1
ATG GAT GCC GCT CTG CTC CTG AAC GTG GAA GGG GTC AAG AAA ACC ATT 48
1 5 10 15
CTG CAC GGG GGC ACG GGC GAG CTC CCA AAC TTC ATC ACC GGA TCC CGA 96
20 25 30
GTG ATC TTT CAT TTC CGC ACC ATG AAA TGT GAT GAG GAG CGG ACA GTC 144
35 40 45
ATT GAC GAC AGT CGG CAG GTG GGC CAG CCC ATG CAC ATC ATC ATC GGA 192
50 55 60
AAC ATG TTC AAG CTC GAG GTC TGG GAG ATC CTG CTT ACC TCC ATG CGG 240
65 70 75 80
GTG CAC GAG GTG GCC GAG TTC TGG TGC GAC ACC ATC CAC ACG GGG GTC 288
85 90 95
TAC CCC ATC CTA TCC CGG AGC CTG AGG CAG ATG GCC CAG GGC AAG GAC 336
100 105 110
CCC ACA GAG TGG CAC GTG CAC ACG TGC GGG CTG GCC AAC ATG TTC GCC 384
115 120 125
TAC CAC ACG CTG GGC TAC GAG GAC CTG GAC GAG CTG CAG AAG GAG CCT 432
130 135 140
CAG CCT CTG GTC TTT GTG ATC GAG CTG CTG CAG GTT GAT GCC CCG AGT 480
145 150 155 160
GAT TAC CAG AGG GAG ACC TGG AAC CTG AGC AAT CAT GAG AAG ATG AAG 528
165 170 175
GCG GTG CCC GTC CTC CAC GGA GAG GGA AAT CGG CTC TTC AAG CTG GGC 576
180 185 190
CGC TAC GAG GAG GCC TCT TCC AAG TAC CAG GAG GCC ATC ATC TGC CTA 624
195 200 205
AGG AAC CTG CAG ACC AAG GAG AAG CCA TGG GAG GTG CAG TGG CTG AAG 672
210 215 220
CTG GAG AAG ATG ATC AAT ACT CTG ATC CTC AAC TAC TGC CAG TGC CTG 720
225 230 235 240
CTG AAG AAG GAG GAG TAC TAT GAG GTG CTG GAG CAC ACC AGT GAT ATT 768
245 250 255
CTC CGG CAC CAC CCA GGC ATC GTG AAG GCC TAC TAC GTG CGT GCC CGG 816
260 265 270
GCT CAC GCA GAG GTG TGG AAT GAG GCC GAG GCC AAG GCG GAC CTC CAG 864
275 280 285
AAA GTG CTG GAG CTG GAG CCG TCC ATG CAG AAG GCG GTG CGC AGG GAG 912
290 295 300
CTG AGG CTG CTG GAG AAC CGC ATG GCG GAG AAG CAG GAG GAG GAG CGG 960
305 310 315 320
CTG CGC TGC CGG AAC ATG CTG AGC CAG GGT GCC ACG CAG CCT CCC GCA 1008
325 330 335
GAG CCA CCC ACA GAG CCA CCC GCA CAG TCA TCC ACA GAG CCA CCT GCA 1056
340 345 350
GAG CCA CCC ACA GCA CCA TCT GCA GAG CTG TCC GCA GGG CCC CCT GCA 1104
355 360 365
GAG CCA GCC ACA GAG CCA CCC CCG TCC CCA GGG CAC TCG CTG CAG CAC 1152
370 375 380
TAA TGA 1158
385 386
<210> 2
<211> 1158
<212> ДНК
<213> Искусственная последовательность
<220>
<222> (1)…(1158)
<223> Оптимизированная последовательность гена AIPL1opt
<400> 2
ATG GAC GCC GCT CTG CTG CTG AAT GTG GAA GGC GTG AAA AAG ACC ATC 48
Met Asp Ala Ala Leu Leu Leu Asn Val Glu Gly Val Lys Lys Thr Ile
1 5 10 15
CTG CAC GGT GGA ACA GGC GAG CTG CCT AAC TTC ATC ACC GGC TCC AGA 96
Leu His Gly Gly Thr Gly Glu Leu Pro Asn Phe Ile Thr Gly Ser Arg
20 25 30
GTG ATC TTC CAC TTC CGG ACC ATG AAG TGC GAC GAA GAG AGA ACC GTG 144
Val Ile Phe His Phe Arg Thr Met Lys Cys Asp Glu Glu Arg Thr Val
35 40 45
ATT GAC GAT AGC AGA CAG GTG GGC CAG CCT ATG CAC ATC ATC ATC GGC 192
Ile Asp Asp Ser Arg Gln Val Gly Gln Pro Met His Ile Ile Ile Gly
50 55 60
AAC ATG TTT AAG CTG GAG GTC TGG GAA ATC CTG CTG ACC AGC ATG AGA 240
Asn Met Phe Lys Leu Glu Val Trp Glu Ile Leu Leu Thr Ser Met Arg
65 70 75 80
GTG CAT GAA GTT GCC GAG TTC TGG TGC GAT ACA ATC CAC ACA GGA GTG 288
Val His Glu Val Ala Glu Phe Trp Cys Asp Thr Ile His Thr Gly Val
85 90 95
TAC CCT ATC CTG TCT AGA AGC CTG AGA CAG ATG GCC CAG GGA AAG GAC 336
Tyr Pro Ile Leu Ser Arg Ser Leu Arg Gln Met Ala Gln Gly Lys Asp
100 105 110
CCC ACA GAA TGG CAC GTG CAT ACC TGC GGC CTG GCC AAT ATG TTC GCT 384
Pro Thr Glu Trp His Val His Thr Cys Gly Leu Ala Asn Met Phe Ala
115 120 125
TAC CAC ACC CTG GGA TAC GAG GAC CTG GAT GAG CTT CAG AAG GAG CCA 432
Tyr His Thr Leu Gly Tyr Glu Asp Leu Asp Glu Leu Gln Lys Glu Pro
130 135 140
CAG CCT CTG GTC TTT GTG ATC GAG CTG CTT CAA GTG GAC GCC CCT AGC 480
Gln Pro Leu Val Phe Val Ile Glu Leu Leu Gln Val Asp Ala Pro Ser
145 150 155 160
GAC TAC CAG CGG GAA ACC TGG AAC CTG AGC AAC CAC GAA AAG ATG AAA 528
Asp Tyr Gln Arg Glu Thr Trp Asn Leu Ser Asn His Glu Lys Met Lys
165 170 175
GCT GTG CCT GTG CTG CAC GGC GAA GGC AAT CGG CTG TTC AAA CTG GGC 576
Ala Val Pro Val Leu His Gly Glu Gly Asn Arg Leu Phe Lys Leu Gly
180 185 190
AGA TAC GAG GAG GCC AGC AGC AAG TAC CAG GAG GCC ATC ATT TGT TTG 624
Arg Tyr Glu Glu Ala Ser Ser Lys Tyr Gln Glu Ala Ile Ile Cys Leu
195 200 205
CGC AAC CTG CAG ACC AAG GAA AAA CCT TGG GAG GTG CAG TGG CTG AAG 672
Arg Asn Leu Gln Thr Lys Glu Lys Pro Trp Glu Val Gln Trp Leu Lys
210 215 220
CTG GAG AAG ATG ATC AAC ACC CTG ATC CTG AAC TAC TGC CAG TGT CTG 720
Leu Glu Lys Met Ile Asn Thr Leu Ile Leu Asn Tyr Cys Gln Cys Leu
225 230 235 240
CTG AAG AAA GAG GAG TAC TAC GAG GTC CTG GAG CAC ACA TCT GAC ATC 768
Leu Lys Lys Glu Glu Tyr Tyr Glu Val Leu Glu His Thr Ser Asp Ile
245 250 255
CTG AGA CAC CAC CCC GGC ATC GTG AAG GCC TAT TAC GTG CGG GCC CGG 816
Leu Arg His His Pro Gly Ile Val Lys Ala Tyr Tyr Val Arg Ala Arg
260 265 270
GCC CAC GCC GAA GTG TGG AAC GAG GCC GAG GCC AAG GCG GAC CTC CAG 864
Ala His Ala Glu Val Trp Asn Glu Ala Glu Ala Lys Ala Asp Leu Gln
275 280 285
AAA GTG CTG GAG CTG GAG CCG TCC ATG CAG AAG GCG GTG CGC AGG GAG 912
Lys Val Leu Glu Leu Glu Pro Ser Met Gln Lys Ala Val Arg Arg Glu
290 295 300
CTG AGG CTG CTG GAG AAC CGC ATG GCG GAG AAG CAG GAG GAG GAG CGG 960
Leu Arg Leu Leu Glu Asn Arg Met Ala Glu Lys Gln Glu Glu Glu Arg
305 310 315 320
CTG CGC TGC CGG AAC ATG CTG AGC CAG GGT GCC ACG CAG CCT CCC GCA 1008
Leu Arg Cys Arg Asn Met Leu Ser Gln Gly Ala Thr Gln Pro Pro Ala
325 330 335
GAG CCA CCC ACA GAG CCA CCC GCA CAG TCA TCC ACA GAG CCA CCT GCA 1056
Glu Pro Pro Thr Glu Pro Pro Ala Gln Ser Ser Thr Glu Pro Pro Ala
340 345 350
GAG CCA CCC ACA GCA CCA TCT GCA GAG CTG TCC GCA GGG CCC CCT GCA 1104
Glu Pro Pro Thr Ala Pro Ser Ala Glu Leu Ser Ala Gly Pro Pro Ala
355 360 365
GAG CCA GCC ACA GAG CCA CCC CCG TCC CCA GGG CAC TCG CTG CAG CAC 1152
370 375 380
TAA TGA 1158
385 386
<210> 3
<211> 384
<212> белок
<213> Homo sapiens
<220>
<222> (1)…(384)
<223> Белок AIPL1
<400> 3
Met Asp Ala Ala Leu Leu Leu Asn Val Glu Gly Val Lys Lys Thr Ile
1 5 10 15
Leu His Gly Gly Thr Gly Glu Leu Pro Asn Phe Ile Thr Gly Ser Arg
20 25 30
Val Ile Phe His Phe Arg Thr Met Lys Cys Asp Glu Glu Arg Thr Val
35 40 45
Ile Asp Asp Ser Arg Gln Val Gly Gln Pro Met His Ile Ile Ile Gly
50 55 60
Asn Met Phe Lys Leu Glu Val Trp Glu Ile Leu Leu Thr Ser Met Arg
65 70 75 80
Val His Glu Val Ala Glu Phe Trp Cys Asp Thr Ile His Thr Gly Val
85 90 95
Tyr Pro Ile Leu Ser Arg Ser Leu Arg Gln Met Ala Gln Gly Lys Asp
100 105 110
Pro Thr Glu Trp His Val His Thr Cys Gly Leu Ala Asn Met Phe Ala
115 120 125
Tyr His Thr Leu Gly Tyr Glu Asp Leu Asp Glu Leu Gln Lys Glu Pro
130 135 140
Gln Pro Leu Val Phe Val Ile Glu Leu Leu Gln Val Asp Ala Pro Ser
145 150 155 160
Asp Tyr Gln Arg Glu Thr Trp Asn Leu Ser Asn His Glu Lys Met Lys
165 170 175
Ala Val Pro Val Leu His Gly Glu Gly Asn Arg Leu Phe Lys Leu Gly
180 185 190
Arg Tyr Glu Glu Ala Ser Ser Lys Tyr Gln Glu Ala Ile Ile Cys Leu
195 200 205
Arg Asn Leu Gln Thr Lys Glu Lys Pro Trp Glu Val Gln Trp Leu Lys
210 215 220
Leu Glu Lys Met Ile Asn Thr Leu Ile Leu Asn Tyr Cys Gln Cys Leu
225 230 235 240
Leu Lys Lys Glu Glu Tyr Tyr Glu Val Leu Glu His Thr Ser Asp Ile
245 250 255
Leu Arg His His Pro Gly Ile Val Lys Ala Tyr Tyr Val Arg Ala Arg
260 265 270
Ala His Ala Glu Val Trp Asn Glu Ala Glu Ala Lys Ala Asp Leu Gln
275 280 285
Lys Val Leu Glu Leu Glu Pro Ser Met Gln Lys Ala Val Arg Arg Glu
290 295 300
Leu Arg Leu Leu Glu Asn Arg Met Ala Glu Lys Gln Glu Glu Glu Arg
305 310 315 320
Leu Arg Cys Arg Asn Met Leu Ser Gln Gly Ala Thr Gln Pro Pro Ala
325 330 335
Glu Pro Pro Thr Glu Pro Pro Ala Gln Ser Ser Thr Glu Pro Pro Ala
340 345 350
Glu Pro Pro Thr Ala Pro Ser Ala Glu Leu Ser Ala Gly Pro Pro Ala
355 360 365
Glu Pro Ala Thr Glu Pro Pro Pro Ser Pro Gly His Ser Leu Gln His
370 375 380
*** ***
385 386
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНСТРУКЦИИ НУКЛЕИНОВОЙ КИСЛОТЫ И ВЕКТОРЫ ДЛЯ ГЕНОТЕРАПИИ ДЛЯ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ВИЛЬСОНА И ДРУГИХ СОСТОЯНИЙ | 2015 |
|
RU2745567C2 |
| Химерные белки на основе утрофина и дистрофина человека и их применение для лечения миодистрофии Дюшенна | 2021 |
|
RU2767335C1 |
| СПОСОБ УПРАВЛЕНИЯ РИТМОМ СЕРДЦА И СОКРАЩЕНИЕМ ОТДЕЛЬНЫХ КАРДИОМИОЦИТОВ ПРИ ПОМОЩИ ТЕРМОГЕНЕТИКИ | 2022 |
|
RU2802995C1 |
| Вакцина против герпеса | 2019 |
|
RU2731073C1 |
| ГЕННАЯ ТЕРАПИЯ ГИПОФОСФАТЕМИЧЕСКИХ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ФАКТОРОМ РОСТА ФИБРОБЛАСТОВ 23 | 2020 |
|
RU2815545C2 |
| Последовательность нуклеотидов, кодирующая β-N-ацетилгексозаминидазу Aggregatibacter actinomycetemcomitans, и генетические конструкции, её содержащие | 2021 |
|
RU2789544C1 |
| СПОСОБ ПОЛУЧЕНИЯ ХИМИЧЕСКИХ ПРОДУКТОВ ТОНКОГО СИНТЕЗА С ПОМОЩЬЮ CORYNEBACTERIUM, СЕКРЕТИРУЮЩЕЙ МОДИФИЦИРОВАННЫЕ α-1,6-ГЛЮКОЗИДАЗЫ | 2018 |
|
RU2763317C2 |
| Антитела против белка р17 ВИЧ-1 субтипа А | 2019 |
|
RU2727673C1 |
| Искусственные гены, кодирующие белки-иммуногены EV.CTL и EV.Th, рекомбинантные плазмидные ДНК pEV.CTL и pEV.Th, обеспечивающие экспрессию искусственных генов, и искусственные Т-клеточные полиэпитопные белки-иммуногены EV.CTL и EV.Th, содержащие эпитопы антигенов вируса Эбола, используемые для создания вакцины против вируса Эбола | 2018 |
|
RU2713723C1 |
| ИММУНОИНДУЦИРУЮЩЕЕ СРЕДСТВО | 2016 |
|
RU2744843C2 |



Изобретение относится к области биотехнологии и молекулярной биологии, к генной инженерии. Описана кодонно оптимизированная нуклеиновая кислота с последовательностью нуклеотидов Seq Id No.: 2, кодирующая aipl1 человека. Представлен экспрессионный вектор, содержащий указанную нуклеиновую кислоту. Изобретение позволяет увеличить уровень мРНК hAIPL1 по меньшей мере на 15%, а гетерологичного белкового продукта по меньшей мере на 29%. Изобретение может быть использовано для заместительной генной терапии амавроза Лебера 4 типа. 2 н. и 7 з.п. ф-лы, 10 ил., 2 табл., 5 пр.
1. Нуклеиновая кислота с последовательностью нуклеотидов Seq Id No.: 2, кодирующая aipl1 человека.
2. Экспрессионный вектор, содержащий нуклеиновую кислоту по п. 1.
3. Вектор по п. 2, представляющий собой плазмидный экспрессионный вектор, содержащий в соответствии с физической и генетической картой, представленной на Фиг. 2, следующие элементы:
— участок начала репликации ori;
— левый инвертированный концевой повтор ITR;
— CMV энхансер цитомегаловирусного промотора;
— цитомегаловирусный промотор CMV promotor;
— последовательность интрона гена b-глобина человека;
— последовательность по п. 1 Seq Id No.: 2;
— последовательность сигнала полиаденилирования hGH poly(A) signal;
— правый инвертированный концевой повтор ITR;
— f1 ori;
— промотор гена устойчивости к ампициллину AmpR promotor;
— ген устойчивости к антибиотику ампициллину AmpR.
4. Вектор по п. 2, представляющий собой плазмидный экспрессионный вектор, содержащий в соответствии с физической и генетической картой, представленной на Фиг. 4А, следующие элементы:
— участок начала репликации ori;
— левый инвертированный концевой повтор ITR;
— CMV энхансер цитомегаловирусного промотора;
— цитомегаловирусный промотор CMV promotor;
— последовательность интрона гена b-глобина человека;
— консенсусную последовательность Kozak;
— последовательность по п. 1 Seq Id No.: 2;
— последовательность сигнала полиаденилирования hGH poly(A) signal;
— правый инвертированный концевой повтор ITR;
— f1 ori;
— промотор гена устойчивости к ампициллину AmpR promotor;
— ген устойчивости к антибиотику ампициллину AmpR.
5. Вектор по п. 2, представляющий собой плазмидный экспрессионный вектор, содержащий в соответствии с физической и генетической картой, представленной на Фиг. 4Б, следующие элементы:
— участок начала репликации ori;
— левый инвертированный концевой повтор ITR;
— CMV энхансер цитомегаловирусного промотора;
— цитомегаловирусный промотор CMV promotor;
— последовательность интрона гена b-глобина человека;
— лидерную последовательность L21;
— последовательность по п. 1 Seq Id No.: 2;
— последовательность сигнала полиаденилирования hGH poly(A) signal;
— правый инвертированный концевой повтор ITR;
— f1 ori;
— промотор гена устойчивости к ампициллину AmpR promotor;
— ген устойчивости к антибиотику ампициллину AmpR.
6. Вектор по п. 2, представляющий собой вирусный экспрессионный вектор.
7. Вектор по п. 6, представляющий собой аденоассоциированный вирус.
8. Вектор по п. 7, представляющий собой аденоассоциированный вирус 2, или 8, или 9 серотипа.
9. Вектор по п. 8, нарабатываемый в суспензионных клеточных культурах HEK293.
| WO 2015082690 A1, 11.06.2015 | |||
| RU 2019105806 A, 04.09.2020 | |||
| RU 2017143997 A, 18.06.2019. |
Авторы
Даты
2022-12-09—Публикация
2021-12-21—Подача