Область техники, к которой относится изобретение
Настоящее изобретение относится к слитому белку, включающему белок IL-2 и белок CD80, и к его применению. В частности, настоящее изобретение относится к новому слитому белку, обладающему терапевтической и иммуностимулирующей эффективностью для лечения рака.
Предпосылки создания изобретения
Интерлейкин 2 (IL-2), также называемый фактором роста T-клеток (TCGF), представляет собой глобулярный гликопротеин, который играет центральную роль в продукции, выживании и гомеостазе лимфоцитов. IL-2 имеет размер белка 15,5 кДа - 16 кДа и состоит из 133 аминокислот. IL-2 опосредует различные иммунные действия путем связывания с IL-2 рецептором, состоящим из трех отдельных субъединиц.
Кроме того, IL-2 синтезируется преимущественно активированными T-клетками, в частности CD4+ хелперными T-клетками. IL-2 стимулирует пролиферацию и дифференциацию T-клеток и индуцирует продукцию цитотоксических T-лимфоцитов (CTL) и дифференциацию лимфоцитов периферической крови в цитотоксические клетки и лимфокин-активированные киллерные клетки (LAK клетки).
Кроме того, IL-2 вовлечен в пролиферацию и дифференциацию B-клеток, промотирует синтез иммуноглобулинов B-клетками и стимулирует продукцию, пролиферацию и активацию природных киллерных клеток (NK клеток). Поэтому IL-2 используют в качестве противоракового средства, поскольку он может увеличивать популяции лимфоцитов и усиливать функцию иммунных клеток в живом организме. В настоящее время терапия с использованием IL-2 одобрена и применяется для пациентов с метастатической почечно-клеточной карциномой и злокачественной меланомой.
Однако IL-2 выполняет двойную функцию в иммунных ответах, поскольку является важным не только для опосредования увеличения числа иммунных клеток и их активности, но также для поддержания иммунной толерантности. Кроме того, сообщалось, что IL-2 не может быть оптимальным для ингибирования роста опухоли. Причина заключается в том, что в присутствии IL-2 может происходить индуцированная активацией гибель клеток (AICD) в возникающих цитотоксических Т-лимфоцитах, а иммунные ответы могут ингибироваться IL-2-зависимыми регуляторными Т-клетками (Treg-клетками) (Imai et al., Cancer Sci 98, 416-423, 2007).
Кроме того, тяжелые сердечно-сосудистые, легочные, почечные, печеночные, желудочно-кишечные, нейрональные, кожные, гематологические и системные побочные эффекты возникают у пациентов, которые получали иммунотерапию IL-2. Поэтому различные мутации IL-2 были изучены для улучшения терапевтической эффективности IL-2 и минимизации его побочных эффектов (US 5229109 B). Однако еще предстоит решить много проблем, чтобы использовать IL-2 в фармакологических целях.
Между тем, CD80, также известный как B7-1, является членом семейства мембраносвязанных белков B7, которые участвуют в иммунной регуляции, связываясь со своим лигандом посредством передачи костимуляторных ответов и коингибирующих ответов. CD80 представляет собой трансмембранный белок, экспрессируемый на поверхности Т-клеток, В-клеток, дендритных клеток и моноцитов. Известно, что CD80 связывается с CD28, CTLA4 (CD152) и PD-L1. CD80, CD86, CTLA4 и CD28 вовлечены в костимуляторно-коингибиторную систему. Например, они регулируют активность Т-клеток и вовлечены в их пролиферацию, дифференцировку и выживание.
Например, когда CD80 и CD86 взаимодействуют с CD28, генерируются костимулирующие сигналы для активации Т-клеток. В результате, CD80 связывается с CTLA4 и стимулирует CTLA4 для его активации. Как результат, CD80 ингибирует ответы Т-клеток до активации иммунного ответа, вызываемого взаимодействием CD80/CD28. Эта петля обратной связи обеспечивает тонкую регуляцию иммунных ответов.
Кроме того, известно, что CD80 связывается с PD-L1, другим членом семейства B7, с аффинностью, подобной той, с которой CD28 связывается с PD-L1. PD-L1 известен как один из двух лигандов для белка запрограммированной смерти-1 (PD-1), а PD-L1, как известно, вовлечен в регуляцию Т-клеток. Связывание CD80 с PD-L1 является еще одним механизмом, который может блокировать взаимодействие PD-1/PD-L1, которое может предотвращать ингибирование Т-клеточных ответов в опухолях. В то же время, однако, увеличение уровней CD80 заставляет CD80 связываться с CD28, так что индуцируется CTLA4, тем самым индуцируя или ингибируя Т-клеточные ответы.
Раскрытие изобретения
Техническая задача
Авторами настоящего были осуществлены исследования для разработки IL-2, который является безопасным и эффективным. В результате, авторы настоящего изобретения обнаружили, что новый слитый белок, включающий, в одной молекуле, белок IL-2 и белок CD80, может активировать иммунные клетки и эффективно регулировать Treg клетки, создав, таким образом, настоящее изобретение.
Решение задачи
Для достижения указанной выше цели, в одном аспекте настоящего изобретения обеспечивается слитый белок, включающий белок IL-2 и белок CD80.
В другом аспекте настоящего изобретения обеспечивается димер слитого белка, полученный путем связывания двух слитых белков друг с другом.
Еще в одном аспекте настоящего изобретения обеспечивается полинуклеотид, кодирующий слитый белок.
Еще в одном аспекте настоящего изобретения обеспечивается вектор, включающий полинуклеотид.
Еще в одном аспекте настоящего изобретения обеспечивается трансформированная клетка, в которую введен вектор.
Еще в одном аспекте настоящего изобретения обеспечивается фармацевтическая композиция для профилактики или лечения рака или инфекционного заболевания, включающая, в качестве активного ингредиента, слитый белок или димер слитого белка.
Еще в одном аспекте настоящего изобретения обеспечивается применение слитого белка для лечения рака или инфекционного заболевания.
Еще в одном аспекте настоящего изобретения обеспечивается применение слитого белка для получения лекарственного средства для лечения рака или инфекционного заболевания.
Полезные эффекты изобретения
Слитый белок, включающий белок IL-2 и белок CD80, может не только активировать иммунные клетки благодаря IL-2, но также эффективно регулировать Treg клетки благодаря CD80. Поэтому слитый белок может атаковать раковые клетки эффективным образом, и, таким образом, может эффективно использоваться для лечения рака или инфекционного заболевания.
Краткое описание чертежей
Фиг. 1 схематически иллюстрирует вариант осуществления слитого белка.
Фиг. 2 иллюстрирует механизм, посредством которого слитый белок регулирует два разных типа иммунных клеток; однако, должно быть понятно, что механизм, посредством которого проявляется действие слитого белка, не ограничивается этим.
Фиг. 3 иллюстрирует механизм, посредством которого слитый белок проявляет противораковый эффект.
Фиг. 4 схематически иллюстрирует структуру слитого белка. В данном случае, каждый из GI101 и mGI101 представляет собой вариант осуществления слитого белка по изобретению, и GI101C1, GI101C2 и mGI101C1 являются сравнительными примерами для сравнения с активностью слитого белка.
Фиг. 5 иллюстрирует различные варианты осуществления слитого белка по изобретению. Белки человеческого и мышиного происхождения можно объединить для получения слитого белка. Белок CD80 и белок IL-2 могут быть связаны друг с другом через различные линкеры, отличные от Fc.
Фиг. 6 иллюстрирует результат, полученный путем идентификации полученного слитого белка (GI101) методом SDS-PAGE.
Фиг. 7 иллюстрирует количества слитого белка (GI101) на основании поглощения.
Фиг. 8 иллюстрирует результат, полученный путем анализа полученного слитого белка (GI101) методом эксклюзионной хроматографии (SEC).
Фиг. 9 иллюстрирует результат, полученный путем идентификации полученного слитого белка mGI101 методом SDS-PAGE.
Фиг. 10 иллюстрирует результаты, полученные путем идентификации полученного слитого белка GI101C1 методом SDS-PAGE.
Фиг. 11 иллюстрирует результаты, полученные путем идентификации полученного слитого белка GI101C2 методом SDS-PAGE.
Фиг. 12 иллюстрирует результат, полученный путем идентификации полученного слитого белка mGI101C1 методом SDS-PAGE.
Фиг. 13 иллюстрирует результаты, полученные путем идентификации полученного слитого белка GI102-M45 методом SDS-PAGE.
Фиг. 14 иллюстрирует результаты, полученные путем идентификации полученного слитого белка GI102-M61 методом SDS-PAGE.
Фиг. 15 иллюстрирует результаты, полученные путем идентификации полученного слитого белка GI102-M72 методом SDS-PAGE.
Фиг. 16 иллюстрирует аффинность связывания между hCTLA4 и GI101.
Фиг. 17 иллюстрирует аффинность связывания между hPD-L1 и GI101.
Фиг. 18 иллюстрирует аффинность связывания между hPD-L1 и hPD-1.
Фиг. 19 иллюстрирует аффинность связывания между mCTLA4 и mGI101.
Фиг. 20 иллюстрирует аффинность связывания между mPD-L1 и mGI101.
Фиг. 21 и 22 иллюстрируют результаты, полученные путем идентификации способности к связыванию между GI-101 (hCD80-Fc-hIL-2v) и CTLA-4, и между GI-101 (hCD80-Fc-hIL-2v) и PD-L1. Было определено, что GI-101 (hCD80-Fc-hIL-2v) обладает высокой способностью к связыванию в отношении CTLA-4 и PD-L1.
Фиг. 23 иллюстрирует эффект GI101 на PD-1/PD-L1 связывание. GI101 эффективно ингибировал PD-1/PD-L1 связывание.
Фиг. 24 иллюстрирует результаты, полученные путем определения аффинности связывания между GI101 и IL-2Rα или IL-2Rβ.
Фиг. 25 иллюстрирует результаты, полученные путем определения аффинности связывания между GI101 и IL-2Rα.
Фиг. 26 иллюстрирует результаты, полученные путем определения аффинности связывания между GI101 и IL-2Rβ.
Фиг. 27 иллюстрирует результаты, полученные путем определения аффинности связывания между IL-2Rα и GI102-M45.
Фиг. 28 иллюстрирует результаты, полученные путем определения аффинности связывания между IL-2Rα и GI102-M61.
Фиг. 29 иллюстрирует результаты, полученные путем определения аффинности связывания между IL-2Rα и GI102-M72.
Фиг. 30 иллюстрирует результаты, полученные путем определения аффинности связывания между IL-2Rβ и GI102-M45.
Фиг. 31 иллюстрирует результаты, полученные путем определения аффинности связывания между IL-2Rβ и GI102-M61.
Фиг. 32 иллюстрирует результаты, полученные путем определения аффинности связывания между IL-2Rβ и GI102-M72.
Фиг. 33 и 34 иллюстрируют результаты, полученные путем измерения количества IFN-γ, секретируемого из клеток, когда клетки подвергают обработке GI101, GI101C1, GI101C2 или IL-2 при соответствующих концентрациях и осуществляют инкубацию.
Фиг. 35 и 36 иллюстрируют результаты, полученные путем определения эффектов GI101, GI101C1, GI101C2 и IL-2 (Пролейкин) на пролиферацию CD8+ T-клеток.
Фиг. 37 иллюстрирует результаты, полученные путем определения эффектов GI101 и GI102 на пролиферацию CD8+ T-клеток и CD4+ T-клеток. Фиг. 37A иллюстрирует процент CD8+ T-клеток и CD4+ T-клеток, Фиг. 37B иллюстрирует способность к пролиферации CD8+ T-клеток, и Фиг. 37C иллюстрирует количественное отношение CD4+/FoxP3+ Treg клеток.
Фиг. 38 и 39 иллюстрируют результаты, полученные путем определения эффектов GI101 и GI101w на пролиферацию CD8+ T-клеток и NK клеток.
Фиг. 40 и 41 иллюстрируют результаты, полученные путем определения эффекта GI101 на эффекторные T-клетки.
Фиг. 42 иллюстрирует результаты, полученные путем определения эффектов mGI101 и mGI102-M61 на иммунные клетки мыши.
Фиг. 43 и 44 иллюстрируют результаты, полученные путем определения эффекта GI101 на раковые клетки, сверхэкспрессирующие PD-L1.
Фиг. 45 и 46 иллюстрируют результаты, полученные путем определения опухоль-ингибирующего эффекта GI101 у мышей с трансплантированными клетками колоректального рака, полученными от мыши.
Фиг. 47 иллюстрирует результаты, полученные путем определения опухоль-ингибирующего эффекта mGI101 у мышей с трансплантированными клетками меланомы, полученными от мыши.
Фиг. 48 иллюстрирует ингибирование опухоли, обеспечиваемое mGI101, у мышей с трансплантированными клетками меланомы, полученными от мыши.
Фиг. 49 иллюстрирует результаты, полученные путем определения опухоль-ингибирующего эффекта mGI101, в зависимости от его дозы, у мышей с трансплантированными клетками колоректального рака, полученными от мыши.
Фиг. 50 иллюстрирует результаты, полученные путем анализа выживаемости мышей с трансплантированными клетками колоректального рака, полученными от мыши, которым вводили mGI101.
Фиг. 51 иллюстрирует результаты, полученные путем определения опухоль-ингибирующего эффекта GI101 у мышей с трансплантированными клетками колоректального рака, полученными от мыши.
Фиг. 52 иллюстрирует результаты, полученные при обработке мышей с трансплантированными клетками колоректального рака, полученными от мыши, hIgG4, анти-PD-1 антителом или GI101, с последующим анализом, методом FACS, CD8+ T-клеток, IFN-γ T-клеток, CD4+ T-клеток и Treg клеток в раковых тканях.
Фиг. 53 графически иллюстрирует результаты, полученные при обработке мышей с трансплантированными клетками колоректального рака, полученными от мыши, hIgG4, анти-PD-1 антителом или GI101, с последующим анализом, методом FACS, CD8+ T-клеток, IFN-γ T-клеток, CD4+ T-клеток и Treg клеток в раковых тканях.
Фиг. 54 иллюстрирует результаты, полученные при обработке мышей с трансплантированными клетками колоректального рака, полученными от мыши, hIgG4, анти-PD-1 антителом или GI101, с последующим анализом, методом FACS, макрофагов в раковых тканях.
Фиг. 55 графически иллюстрирует результаты, полученные при обработке мышей с трансплантированными клетками колоректального рака, полученными от мыши, hIgG4, анти-PD-1 антителом или GI101, с последующим анализом, методом FACS, макрофагов в раковых тканях.
Фиг. 56 иллюстрирует результаты, полученные при обработке мышей с трансплантированными клетками колоректального рака, полученными от мыши, hIgG4, анти-PD-1 антителом или GI101, с последующим анализом, методом FACS, дендритных клеток в раковых тканях.
Фиг. 57 графически иллюстрирует результаты, полученные при обработке мышей с трансплантированными клетками колоректального рака, полученными от мыши, hIgG4, анти-PD-1 антителом или GI101, с последующим анализом, методом FACS, дендритных клеток в раковых тканях.
Фиг. 58 иллюстрирует результаты, полученные путем определения опухоль-ингибирующего эффекта GI101 у мышей с трансплантированными клетками рака легкого, полученными от мыши.
Фиг. 59 графически иллюстрирует результаты, полученные при обработке мышей с трансплантированными клетками рака легкого, полученными от мыши, hIgG4, анти-PD-1 антителом или GI101, с последующим анализом, методом FACS, CD8+ T-клеток, IFN-γ T-клеток, CD4+ T-клеток и Treg клеток в раковых тканях.
Фиг. 60 графически иллюстрирует результаты, полученные при обработке мышей с трансплантированными клетками рака легкого, полученными от мыши, hIgG4, анти-PD-1 антителом или GI101, с последующим анализом, методом FACS, макрофагов в раковых тканях.
Фиг. 61 графически иллюстрирует результаты, полученные при обработке мышей с трансплантированными клетками рака легкого, полученными от мыши, hIgG4, анти-PD-1 антителом или GI101, с последующим анализом, методом FACS, дендритных клеток в раковых тканях.
Фиг. 62 иллюстрирует результаты, полученные путем определения опухоль-ингибирующего эффекта mGI102-M61 у мышей с трансплантированными клетками колоректального рака, полученными от мыши.
Фиг. 63 иллюстрирует результаты, полученные путем анализа выживаемости мышей с трансплантированными клетками колоректального рака, полученными от мыши, которым вводили mGI102-M61.
Фиг. 64 иллюстрирует результаты, полученные путем определения опухоль-ингибирующего эффекта mGI101 у мышей с трансплантированными клетками колоректального рака, полученными от мыши.
Фиг. 65 иллюстрирует ингибирование опухоли при применении mGI101 у мышей с трансплантированными клетками колоректального рака, полученными от мыши.
Фиг. 66 иллюстрирует результаты, полученные при 15-дневных клинических наблюдениях за обезьянами, которым вводили PBS или GI101.
Фиг. 67 и 68 иллюстрируют результаты, полученные путем измерения в дни -1, 1, 8, и 15 массы тела обезьян, которым вводили PBS или GI101.
Фиг. 69 иллюстрирует 15-дневное потребление пищи обезьянами, которым вводили PBS или GI101.
Фиг. 70-72 иллюстрируют результаты, полученные путем анализа крови в дни -1, 1, 8, и 15 у обезьян, которым вводили PBS или GI101.
Фиг. 73-79 иллюстрируют результаты, полученные путем осуществления клинического и химического анализа в дни -1, 1, 8 и 15 у обезьян, которым вводили PBS или GI101.
Фиг. 80 и 81 иллюстрируют результаты, полученные путем анализа цитокинов в дни -1, 1, 8 и 15 у обезьян, которым вводили PBS или GI101.
Фиг. 82-87 иллюстрируют результаты, полученные путем анализа иммунных клеток в дни -1, 1, 8 и 15 у обезьян, которым вводили PBS или GI101.
Фиг. 88 иллюстрирует результаты, полученные путем умерщвления, в день 16, обезьян, которым вводили PBS или GI101, для получения тканей селезенки и патологического анализа тканей селезенки.
Фиг. 89 иллюстрирует слитые белки, в каждом из которых белок CD80 и белок IL-2 связаны с белком-носителем. В частности, Фиг. 89A иллюстрирует слитый белок, в котором белок CD80 и белок IL-2 связаны с N-концом и C-концом белка-носителя, соответственно. Кроме того, Фиг. 89B иллюстрирует слитый белок, в котором белок CD80 и белок IL-2 связаны с C-концом и N-концом белка-носителя, соответственно.
Лучший способ осуществления изобретения
Слитый белок, включающий белок IL-2 и белок CD80
В одном аспекте настоящего изобретения обеспечивается слитый белок, включающий белок IL-2 и белок CD80.
В контексте настоящей заявки термин "IL-2" или "интерлейкин-2", если не указано иное, относится к любому IL-2 дикого типа, полученному от любого позвоночного животного, включая млекопитающих, например, приматов (таких как человек) и грызунов (таких как мыши и крысы). IL-2 может быть получен из клеток животного, а также включает белок, полученный из рекомбинантных клеток, способных продуцировать IL-2. Кроме того, IL-2 может представлять собой IL-2 дикого типа или его вариант.
В настоящем описании IL-2 или его вариант могут быть представлены общим термином "белок IL-2" или "полипептид IL-2". IL-2, белок IL-2, полипептид IL-2 и вариант IL-2 специфически связываются с, например, рецептором IL-2. Это специфическое связывание можно определить способами, известными специалистам в данной области.
Вариант осуществления IL-2 может иметь аминокислотную последовательность SEQ ID NO: 35 или SEQ ID NO: 36. В данном случае, IL-2 также может быть в зрелой форме. В частности, зрелый IL-2 может не содержать сигнальную последовательность и может иметь аминокислотную последовательность SEQ ID NO: 10. В данном случае, IL-2 можно использовать в формате, охватывающем фрагмент IL-2 дикого типа, в котором часть N-конца или C-конца IL-2 дикого типа усечена.
Кроме того, фрагмент IL-2 может быть в форме, в которой 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 последовательных аминокислот отсечены с N-конца белка, имеющего аминокислотную последовательность SEQ ID NO: 35 или SEQ ID NO: 36. Кроме того, фрагмент IL-2 может быть в форме, в которой 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 последовательных аминокислот отсечены с C-конца белка, имеющего аминокислотную последовательность SEQ ID NO: 35 или SEQ ID NO: 36.
В контексте настоящей заявки термин “вариант IL-2” относится к форме, в которой часть аминокислот в полноразмерном IL-2 или вышеописанном фрагменте IL-2 заменена. То есть, вариант IL-2 может иметь аминокислотную последовательность, отличную от IL-2 дикого типа или его фрагмента. Однако вариант IL-2 может обладать активностью, эквивалентной или подобной активности IL-2 дикого типа. В данном случае, "активность IL-2" может, например, относиться к специфическому связыванию с рецептором IL-2, при этом специфическое связывание можно измерить способами, известными специалистам в данной области.
В частности, вариант IL-2 можно получить путем замены части аминокислот в IL-2 дикого типа. Вариант осуществления IL-2 варианта, полученного путем аминокислотной замены, можно получить путем замены по меньшей мере одной из 38-ой, 42-ой, 45-ой, 61-ой и 72-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10.
В частности, вариант IL-2 можно получить путем замены по меньшей мере одной из 38-ой, 42-ой, 45-ой, 61-ой или 72-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10 другой аминокислотой. Кроме того, когда IL-2 присутствует в форме, в которой часть N-конца в аминокислотной последовательности SEQ ID NO: 35 усечена, аминокислота в положении, комплементарно соответствующем положению в аминокислотной последовательности SEQ ID NO: 10, может быть заменена другой аминокислотой. Например, когда IL-2 имеет аминокислотную последовательность SEQ ID NO: 35, его IL-2 вариант можно получить путем замены по меньшей мере одной из 58-ой, 62-ой, 65-ой, 81-ой или 92-ой аминокислоты в аминокислотной последовательности SEQ ID NO: 35 другой аминокислотой. Эти аминокислотные остатки соответствуют 38-ому, 42-ому, 45-ому, 61-ому и 72-ому аминокислотным остаткам в аминокислотной последовательности SEQ ID NO: 10, соответственно. В соответствии с вариантом осуществления, одна, две, три, четыре, пять, шесть, семь, восемь, девять или десять аминокислот могут быть заменены при условии, что такой вариант IL-2 сохраняет активность IL-2. В соответствии с другим вариантом осуществления, могут быть заменены от одной до пяти аминокислот.
В одном варианте осуществления вариант IL-2 может быть в форме, в которой заменены две аминокислоты. В частности, вариант IL-2 можно получить путем замены 38-ой и 42-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10. Кроме того, в одном варианте осуществления вариант IL-2 можно получить путем замены 38-ой и 45-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10. Кроме того, в одном варианте осуществления вариант IL-2 можно получить путем замены 38-ой и 61-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10. Кроме того, в одном варианте осуществления вариант IL-2 можно получить путем замены 38-ой и 72-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10. Кроме того, в одном варианте осуществления вариант IL-2 можно получить путем замены 42-ой и 45-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10. Кроме того, в одном варианте осуществления вариант IL-2 можно получить путем замены 42-ой и 61-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10. Кроме того, в одном варианте осуществления вариант IL-2 можно получить путем замены 42-ой и 72-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10. Кроме того, в одном варианте осуществления вариант IL-2 можно получить путем замены 45-ой и 61-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10. Кроме того, в одном варианте осуществления вариант IL-2 можно получить путем замены 45-ой и 72-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10. Кроме того, в одном варианте осуществления вариант IL-2 можно получить путем замены 61-ой и 72-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10.
Кроме того, вариант IL-2 может быть в форме, в которой заменены три аминокислоты. В частности, вариант IL-2 можно получить путем замены 38-ой, 42-ой и 45-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10. Кроме того, в одном варианте осуществления вариант IL-2 можно получить путем замены 38-ой, 42-ой и 61-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10. Кроме того, в одном варианте осуществления вариант IL-2 можно получить путем замены 38-ой, 42-ой и 72-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10. Кроме того, в одном варианте осуществления вариант IL-2 можно получить путем замены 38-ой, 45-ой и 61-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10. Кроме того, в одном варианте осуществления вариант IL-2 можно получить путем замены 38-ой, 45-ой и 72-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10. Кроме того, в одном варианте осуществления вариант IL-2 можно получить путем замены 38-ой, 61-ой и 72-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10. Кроме того, в одном варианте осуществления вариант IL-2 можно получить путем замены 42-ой, 45-ой и 61-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10. Кроме того, в одном варианте осуществления вариант IL-2 можно получить путем замены 42-ой, 45-ой и 72-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10. Кроме того, в одном варианте осуществления вариант IL-2 можно получить путем замены 45-ой, 61-ой и 72-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10.
Кроме того, вариант IL-2 может быть в форме, в которой заменены четыре аминокислоты. В частности, вариант IL-2 можно получить путем замены 38-ой, 42-ой, 45-ой и 61-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10. Кроме того, в одном варианте осуществления вариант IL-2 можно получить путем замены 38-ой, 42-ой, 45-ой и 72-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10. Кроме того, в одном варианте осуществления вариант IL-2 можно получить путем замены 38-ой, 45-ой, 61-ой и 72-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10. Кроме того, в одном варианте осуществления вариант IL-2 можно получить путем замены 38-ой, 42-ой, 61-ой и 72-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10. Кроме того, в одном варианте осуществления вариант IL-2 можно получить путем замены 42-ой, 45-ой, 61-ой и 72-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10.
Кроме того, вариант IL-2 может быть в форме, в которой заменены пять аминокислот. В частности, вариант IL-2 можно получить путем замены каждой из 38-ой, 42-ой, 45-ой, 61-ой и 72-ой аминокислот в аминокислотной последовательности SEQ ID NO: 10 другой аминокислотой.
В данном случае, "другая аминокислота", введенная путем замены, может представлять собой любую, выбранную из группы, состоящей из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутаминовой кислоты, глутамина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, пролина, серина, треонина, триптофана, тирозина и валина. Однако, что касается аминокислотных замен для варианта IL-2, в аминокислотной последовательности SEQ ID NO: 10 38-ая аминокислота не может быть заменена аргинином, 42-ая аминокислота не может быть заменена фенилаланином, 45-ая аминокислота не может быть заменена тирозином, 61-ая аминокислота не может быть заменена глутаминовой кислотой и 72-ая аминокислота не может быть заменена лейцином.
Что касается аминокислотных замен для варианта IL-2, в аминокислотной последовательности SEQ ID NO: 10 38-ая аминокислота, аргинин, может быть заменена аминокислотой, отличной от аргинина. Предпочтительно, что касается аминокислотных замен для варианта IL-2, в аминокислотной последовательности SEQ ID NO: 10 38-ая аминокислота, аргинин, может быть заменена аланином (R38A).
Что касается аминокислотных замен для варианта IL-2, в аминокислотной последовательности SEQ ID NO: 10 42-ая аминокислота, фенилаланин, может быть заменена аминокислотой, отличной от фенилаланина. Предпочтительно, что касается аминокислотных замен для варианта IL-2, в аминокислотной последовательности SEQ ID NO: 10 42-ая аминокислота, фенилаланин, может быть заменена аланином (F42A).
Что касается аминокислотных замен для варианта IL-2, в аминокислотной последовательности SEQ ID NO: 10 45-ая аминокислота, тирозин, может быть заменена аминокислотой, отличной от тирозина. Предпочтительно, что касается аминокислотных замен для варианта IL-2, в аминокислотной последовательности SEQ ID NO: 10 45-ая аминокислота, тирозин, может быть заменена аланином (Y45A).
Что касается аминокислотных замен для варианта IL-2, в аминокислотной последовательности SEQ ID NO: 10 61-ая аминокислота, глутаминовая кислота, может быть заменена аминокислотой, отличной от глутаминовой кислоты. Предпочтительно, что касается аминокислотных замен для варианта IL-2, в аминокислотной последовательности SEQ ID NO: 10 61-ая аминокислота, глутаминовая кислота, может быть заменена аргинином (E61R).
Что касается аминокислотных замен для варианта IL-2, в аминокислотной последовательности SEQ ID NO: 10 72-ая аминокислота, лейцин, может быть заменена аминокислотой, отличной от лейцина. Предпочтительно, что касается аминокислотных замен для варианта IL-2, в аминокислотной последовательности SEQ ID NO: 10 72-ая аминокислота, лейцин, может быть заменена глицином (L72G).
В частности, вариант IL-2 можно получить с использованием по меньшей мере одной замены, выбранной из группы, состоящей из R38A, F42A, Y45A, E61R и L72G, в аминокислотной последовательности SEQ ID NO: 10.
В частности, вариант IL-2 можно получить с использованием аминокислотных замен в двух, трех, четырех или пяти положениях из положений, выбранных из группы, состоящей из R38A, F42A, Y45A, E61R и L72G.
Кроме того, вариант IL-2 может быть в форме, в которой заменены две аминокислоты. В частности, вариант IL-2 можно получить с использованием замен R38A и F42A. Кроме того, в одном варианте осуществления вариант IL-2 можно получить с использованием замен R38A и Y45A. Кроме того, в одном варианте осуществления вариант IL-2 можно получить с использованием замен R38A и E61R. Кроме того, в одном варианте осуществления вариант IL-2 можно получить с использованием замен R38A и L72G. Кроме того, в одном варианте осуществления вариант IL-2 можно получить с использованием замен F42A и Y45A. Кроме того, в одном варианте осуществления вариант IL-2 можно получить с использованием замен F42A и E61R. Кроме того, в одном варианте осуществления вариант IL-2 можно получить с использованием замен F42A и L72G. Кроме того, в одном варианте осуществления вариант IL-2 можно получить с использованием замен E61R и L72G.
Кроме того, вариант IL-2 может быть в форме, в которой заменены три аминокислоты. В частности, вариант IL-2 можно получить с использованием замен R38A, F42A и Y45A. Кроме того, в одном варианте осуществления вариант IL-2 можно получить с использованием замен R38A, F42A и E61R. Кроме того, в одном варианте осуществления вариант IL-2 можно получить с использованием замен R38A, F42A и L72G. Кроме того, в одном варианте осуществления вариант IL-2 можно получить с использованием замен R38A, Y45A и E61R. Кроме того, в одном варианте осуществления вариант IL-2 можно получить с использованием замен R38A, Y45A и L72G. Кроме того, в одном варианте осуществления вариант IL-2 можно получить с использованием замен F42A, Y45A и E61R. Кроме того, в одном варианте осуществления вариант IL-2 можно получить с использованием замен F42A, Y45A и L72G. Кроме того, в одном варианте осуществления вариант IL-2 можно получить с использованием замен F42A, E61R и L72G. Кроме того, в одном варианте осуществления вариант IL-2 можно получить с использованием замен Y45A, E61R и L72G.
Кроме того, вариант IL-2 может быть в форме, в которой заменены четыре аминокислоты. В частности, вариант IL-2 можно получить с использованием замен R38A, F42A, Y45A и E61R. Кроме того, в одном варианте осуществления вариант IL-2 можно получить с использованием замен R38A, F42A, Y45A и L72G. Кроме того, в одном варианте осуществления вариант IL-2 можно получить с использованием замен R38A, F42A, E61R и L72G. Кроме того, в одном варианте осуществления вариант IL-2 можно получить с использованием замен R38A, Y45A, E61R и L72G. Кроме того, в одном варианте осуществления вариант IL-2 можно получить с использованием замен F42A, Y45A, E61R и L72G.
Кроме того, вариант IL-2 можно получить с использованием замен R38A, F42A, Y45A, E61R и L72G.
Предпочтительно, вариант осуществления варианта IL-2 может содержать любую выбранную из следующих комбинаций замен (a) - (d) в аминокислотной последовательности SEQ ID NO: 10:
(a) R38A/F42A
(b) R38A/F42A/Y45A
(c) R38A/F42A/E61R
(d) R38A/F42A/L72G
В данном случае, когда IL-2 имеет аминокислотную последовательность SEQ ID NO: 35, аминокислотная замена может присутствовать в положении, комплементарно соответствующем положению в аминокислотной последовательности SEQ ID NO: 10. Кроме того, даже когда IL-2 представляет собой фрагмент аминокислотной последовательности SEQ ID NO: 35, аминокислотная замена может присутствовать в положении, комплементарно соответствующем положению в аминокислотной последовательности SEQ ID NO: 10.
В частности, вариант IL-2 может иметь аминокислотную последовательность SEQ ID NO: 6, 22, 23 или 24.
Кроме того, вариант IL-2 может характеризоваться низкой токсичностью in vivo. В данном случае, низкая токсичность in vivo может быть побочным эффектом, вызванным связыванием IL-2 с альфа-цепью рецептора IL-2 (IL-2Rα). Различные варианты IL-2 были разработаны для уменьшения побочного эффекта, вызываемого связыванием IL-2 с IL-2Rα, и такие варианты IL-2 могут быть такими, которые раскрыты в патенте США № 5229109 и корейском патенте № 1667096. В частности, варианты IL-2, описанные в настоящей заявке, имеют низкую способность к связыванию с альфа-цепью рецептора IL-2 (IL-2Rα) и, таким образом, обладают более низкой токсичностью in vivo, чем IL-2 дикого типа.
В контексте настоящей заявки "CD80", также называемый "B7-1", представляет собой мембранный белок, присутствующий в дендритных клетках, активированных В-клетках и моноцитах. CD80 обеспечивает костимулирующие сигналы, необходимые для активации и выживания Т-клеток. CD80 известен как лиганд для двух разных белков, CD28 и CTLA-4, присутствующих на поверхности Т-клеток. CD80 состоит из 288 аминокислот и может, в частности, иметь аминокислотную последовательность SEQ ID NO: 11. Кроме того, в контексте настоящей заявки термин "белок CD80" относится к полноразмерному CD80 или фрагменту CD80.
В контексте настоящей заявки термин "фрагмент CD80" относится к расщепленной форме CD80. Кроме того, фрагмент CD80 может представлять собой внеклеточный домен CD80. Вариант осуществления фрагмента CD80 можно получить элиминированием аминокислот с 1 по 34 с N-конца, которые представляют собой сигнальную последовательность CD80. В частности, вариант осуществления фрагмента CD80 может представлять собой белок, состоящий из аминокислот с 35 по 288 в SEQ ID NO: 11. Кроме того, вариант осуществления фрагмента CD80 может представлять собой белок, состоящий из аминокислот с 35 по 242 в SEQ ID NO: 11. Кроме того, вариант осуществления фрагмента CD80 может представлять собой белок, состоящий из аминокислот с 35 по 232 в SEQ ID NO: 11. Кроме того, вариант осуществления фрагмента CD80 может представлять собой белок, состоящий из аминокислот с 35 по 139 в SEQ ID NO: 11. Кроме того, вариант осуществления фрагмента CD80 может представлять собой белок, состоящий из аминокислот с 142 по 242 в SEQ ID NO: 11. В одном варианте осуществления фрагмент CD80 может иметь аминокислотную последовательность SEQ ID NO: 2.
Кроме того, белок IL-2 и белок CD80 могут быть связаны друг с другом через линкер или носитель. В частности, IL-2 или его вариант и CD80 (B7-1) или его фрагмент могут быть связаны друг с другом через линкер или носитель. В настоящем описании линкер и носитель могут использоваться взаимозаменяемо.
Линкер связывает два белка. Вариант осуществления линкера может включать 1-50 аминокислот, альбумин или его фрагмент, Fc домен иммуноглобулина или т.п. В данном случае, Fc домен иммуноглобулина относится к белку, который содержит константную область 2 тяжелой цепи (CH2) и константную область 3 тяжелой цепи (CH3) иммуноглобулина и не содержит вариабельные области тяжелой и легкой цепи и константную область 1 легкой цепи (CH1) иммуноглобулина. Иммуноглобулин может представлять собой IgG, IgA, IgE, IgD или IgM, и предпочтительно может представлять собой IgG4. В данном случае, Fc домен иммуноглобулина G4 дикого типа может иметь аминокислотную последовательность SEQ ID NO: 4.
Кроме того, Fc домен иммуноглобулина может представлять собой вариант Fc домена, а также Fc домен дикого типа. Кроме того, в контексте настоящей заявки термин "вариант Fc домена" может относиться к форме, которая отличается от Fc домена дикого типа паттерном гликозилирования, имеет высокое гликозилирование по сравнению с Fc доменом дикого типа, или имеет низкое гликозилирование по сравнению с Fc доменом дикого типа или дегликозилированную форму. Кроме того, он включает негликозилированный Fc домен. Fc домен или его вариант может быть адаптирован так, чтобы иметь отрегулированное количество сиаловых кислот, фукозилирования или гликозилирования, посредством условий культивирования или генетических манипуляций с хозяином.
Кроме того, гликозилирование Fc-домена иммуноглобулина можно модифицировать обычными методами, такими как химические методы, ферментативные методы и методы генной инженерии с использованием микроорганизмов. Кроме того, вариант домена Fc может быть в смешанной форме соответствующих областей Fc иммуноглобулинов, IgG, IgA, IgE, IgD и IgM. Кроме того, вариант Fc домена может быть в форме, в которой некоторые аминокислоты Fc домена заменены другими аминокислотами. Вариант осуществления варианта Fc домена может иметь аминокислотную последовательность SEQ ID NO: 12.
Слитый белок может иметь структуру, в которой, с использованием Fc домена в качестве линкера (или носителя), белок CD80 и белок IL-2 или белок IL-2 и белок CD80 связаны с N-концом и C-концом линкера или носителя, соответственно (Фиг. 89). Связывание между N-концом или C-концом Fc домена и CD-80 или IL-2, необязательно, может достигаться при помощи линкерного пептида.
В частности, слитый белок может состоять из следующей структурной формулы (I) или (II):
N'-X-[линкер (1)]n-Fc домен-[линкер (2)]m-Y-C' (I)
N'-Y-[линкер (1)]n-Fc домен-[линкер (2)]m-X-C' (II)
В представленных структурных формулах (I) и (II):
N′ представляет собой N-конец слитого белка,
C′ представляет собой C-конец слитого белка,
X представляет собой белок CD80,
Y представляет собой белок IL-2,
линкеры (1) и (2) представляют собой пептидные линкеры, и
n и m каждый независимо имеет значение 0 или 1.
Предпочтительно, слитый белок может состоять из структурной формулы (I). Белок IL-2 является таким, как описано выше. Кроме того, белок CD80 является таким, как описано выше. В соответствии с вариантом осуществления, белок IL-2 может представлять собой вариант IL-2, имеющий от одной до пяти аминокислотных замен по сравнению с IL-2 дикого типа. Белок CD80 может представлять собой фрагмент, полученный путем усечения на примерно до 34 последовательных аминокислотных остатков N-конца или C-конца CD80 дикого типа. Альтернативно, CD белок может представлять собой внеклеточный иммуноглобулин-подобный домен, обладающий активностью связывания с рецепторами CTLA-4 и CD28 на поверхности T-клеток.
В частности, слитый белок может иметь аминокислотную последовательность SEQ ID NO: 9, 26, 28 или 30. В соответствии с другим вариантом осуществления, слитый белок включает полипептид, имеющий идентичность последовательности 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% с аминокислотной последовательностью SEQ ID NO: 9, 26, 28 или 30. В данном случае, идентичность означает, например, процент гомологии и может быть определена с использованием программы сравнения гомологии, такой как BlastN программа National Center of Biotechnology Information (NCBI).
Пептидный линкер (1) может быть включен между белком CD80 и Fc доменом. Пептидный линкер (1) может состоять из 5-80 последовательных аминокислот, 20-60 последовательных аминокислот, 25-50 последовательных аминокислот или 30-40 последовательных аминокислот. В одном варианте осуществления пептидный линкер (1) может состоять из 30 аминокислот. Кроме того, пептидный линкер (1) может содержать по меньшей мере один цистеин. В частности, пептидный линкер (1) может содержать один, два или три цистеина. Кроме того, пептидный линкер (1) может происходить из шарнирной области иммуноглобулина. В одном варианте осуществления пептидный линкер (1) может представлять собой пептидный линкер, состоящий из аминокислотной последовательности SEQ ID NO: 3.
Пептидный линкер (2) может состоять из 1-50 последовательных аминокислот, 3-30 последовательных аминокислот или 5-15 последовательных аминокислот. В одном варианте осуществления пептидный линкер (2) может представлять собой (G4S)n (где n представляет собой целое число, имеющее значение 1-10). В данном случае, в (G4S)n, n может иметь значение 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10. В одном варианте осуществления пептидный линкер (2) может представлять собой пептидный линкер, состоящий из аминокислотной последовательности SEQ ID NO: 5.
В другом аспекте настоящего изобретения обеспечивается димер, полученный путем связывания двух слитых белков, каждый из которых включает белок IL-2 и белок CD80. Слитый белок, включающий IL-2 или его вариант и CD80 или его фрагмент, описан выше.
В данном случае, связывание между слитыми белками, образующими димер, может достигаться посредством, но не ограничивается этим, дисульфидной связи, образованной цистеинами, присутствующими в линкере. Слитые белки, образующие димер, могут представлять собой одинаковые или отличные друг от друга слитые белки. Предпочтительно, димер может представлять собой гомодимер. Вариант осуществления слитого белка, составляющего димер, может представлять собой белок, имеющий аминокислотную последовательность SEQ ID NO: 9.
Полинуклеотид, кодирующий слитый белок
Еще в одном аспекте настоящего изобретения обеспечивается полинуклеотид, кодирующий слитый белок, включающий белок IL-2 и белок CD80. В частности, полинуклеотид может содержать нуклеотидую последовательность SEQ ID NO: 8, 25, 27 или 29. Слитый белок, включающий белок IL-2 и белок CD80, описан выше. В полинуклеотиде один или несколько нуклеотидов могут быть изменены путем замены, делеции, вставки или их комбинации. Когда нуклеотидную последовательность получают путем химического синтеза, можно использовать синтетические способы, хорошо известные в данной области техники, такие как способы, описанные Engels и Uhlmann (Angew Chem IntEd Eng., 37: 73-127, 1988). Такие способы могут включать способы с использованием триэфира, фосфита, фосфорамидита и H-фосфата, ПЦР и другие аутопраймерные способы, способы синтеза олигонуклеотидов на твердых подложках и т.п.
В соответствии с вариантом осуществления, полипептид может содержать нуклеотидную последовательность, имеющую идентичность с SEQ ID NO: 8, 25, 27 или 29 по меньшей мере около 70%, по меньшей мере около 75%, по меньшей мере около 80%, по меньшей мере около 85%, по меньшей мере около 86%, по меньшей мере около 87%, по меньшей мере около 88%, по меньшей мере около 89%, по меньшей мере около 90%, по меньшей мере около 91%, по меньшей мере около 92%, по меньшей мере около 93%, по меньшей мере около 94%, по меньшей мере около 95%, по меньшей мере около 96%, по меньшей мере около 97%, по меньшей мере около 98%, по меньшей мере около 99% или по меньшей мере около 100%.
Полинуклеотид может дополнительно содержать нуклеиновую кислоту, кодирующую сигнальную последовательность или лидерную последовательность. В контексте настоящей заявки термин "сигнальная последовательность" относится к сигнальному пептиду, который направляет секрецию белка-мишени. Сигнальный пептид транслируется и затем расщепляется в клетке-хозяине. В частности, сигнальная последовательность представляет собой аминокислотную последовательность, которая инициирует миграцию белка через мембрану эндоплазматического ретикулума (ER). В варианте осуществления сигнальная последовательность может иметь аминокислотную последовательность SEQ ID NO: 1.
Сигнальные последовательности хорошо известны в данной области техники, что касается их характеристик. Такие сигнальные последовательности обычно содержат от 16 до 30 аминокислотных остатков и могут содержать больше или меньше аминокислотных остатков, чем указанное количество аминокислотных остатков. Типичный сигнальный пептид состоит из трех областей, т.е. основной N-концевой области, центральной гидрофобной области и более полярной C-концевой области. Центральная гидрофобная область содержит от 4 до 12 гидрофобных остатков, которые вызывают иммобилизацию сигнальной последовательности во время миграции незрелого полипептида через мембранный липидный бислой.
После инициации сигнальные последовательности расщепляются в просвете ER клеточными ферментами, обычно известными как сигнальные пептидазы. В данном случае, сигнальная последовательность может быть секреторной сигнальной последовательностью tPa (активатор тканевого плазминогена), HSV gDs (сигнальная последовательность гликопротеина D вируса простого герпеса) или гормона роста. Предпочтительно можно использовать секреторную сигнальную последовательность, используемую в высших эукариотических клетках, включая млекопитающих и т.п. Кроме того, можно использовать сигнальную последовательность, включенную в IL-2 и/или CD-80 дикого типа, или сигнальную последовательность, которая была замещена кодоном с высокой частотой экспрессии в клетке-хозяине.
Вектор с полинуклеотидом, кодирующим слитый белок
Еще в одном аспекте настоящего изобретения обеспечивается вектор, включающий полинуклеотид.
Вектор может быть введен в клетку-хозяина для рекомбинации и вставки в геном клетки-хозяина. Или вектор понимается как нуклеиновокислотное средство, содержащее полинуклеотидную последовательность, которая является автономно реплицируемой как эписома. Векторы включают линейные нуклеиновые кислоты, плазмиды, фагмиды, космиды, РНК-векторы, вирусные векторы и их аналоги. Примеры вирусного вектора включают, но не ограничиваются этим, ретровирусы, аденовирусы и аденоассоциированные вирусы.
В частности, вектор может включать плазмидную ДНК, фаговую ДНК и т.п.; и коммерчески разработанные плазмиды (pUC18, pBAD, pIDTSAMRT-AMP и т.п.), E. coli-происходящие плазмиды (pYG601BR322, pBR325, pUC118, pUC119 и т.п.), Bacillus subtilis-происходящие плазмиды (pUB110, pTP5 и т.п.), дрожжевые плазмиды (YEp13, YEp24, YCp50 и т.п.), фаговую ДНК (Charon4A, Charon21A, EMBL3, EMBL4, λ gt10, λ gt11, λ ZAP и т.п.), векторы на основе вирусов животных (ретровирусы, аденовирусы, вирусы коровьей оспы и т.п.), векторы на основе вирусов насекомых (бакуловирусы и т.п.). Поскольку вектор демонстрирует разные уровни экспрессии и модификации белка в зависимости от клетки-хозяина, предпочтительно выбирать и использовать клетку-хозяина, которая наиболее подходят для такой цели.
В контексте настоящей заявки термин "экспрессия гена" или "экспрессия" целевого белка понимается как означающий транскрипцию последовательностей ДНК, трансляцию транскриптов мРНК и секрецию слитых белковых продуктов или их фрагментов. Подходящим вектором экспрессии может быть RcCMV (Invitrogen, Carlsbad) или его вариант. Векторы экспрессии могут дополнительно содержать человеческий цитомегаловирусный (CMV) промотор для промотирования непрерывной транскрипции гена-мишени в клетках млекопитающих и сигнальную последовательность полиаденилирования бычьего гормона роста для повышения уровня стабильности РНК после транскрипции.
Трансформированная клетка, экспрессирующая слитый белок
Еще в одном аспекте настоящего изобретения обеспечивается трансформированная клетка, в которую введен вектор.
Клетки-хозяева для трансформированной клетки могут включать, но не ограничиваются этим, прокариотические клетки, эукариотические клетки и клетки млекопитающих, растений, насекомых, грибов или бактерий. В качестве примера прокариотических клеток можно использовать E.coli. Кроме того, в качестве примера эукариотических клеток можно использовать дрожжи. Кроме того, в качестве клеток млекопитающих можно использовать клетки CHO, клетки F2N, клетки CSO, клетки BHK, клетки меланомы Боуса, клетки HeLa, клетки 911, клетки AT1080, клетки A549, клетки HEK 293, клетки HEK293T или т.п. Однако клетки млекопитающих этим не ограничиваются, и могут использоваться любые клетки, которые известны специалистам в данной области техники в качестве клеток-хозяев.
Кроме того, для введения вектора экспрессии в клетку-хозяина можно использовать CaCl2 осаждение по методу Ханахана, эффективность которого была повышена за счет использования восстановителя, такого как диметилсульфоксид (DMSO), при CaCl2 осаждении, электропорацию, осаждение фосфатом кальция, слияние протопластов, перемешивание с использованием карбидокремниевого волокна, опосредованную агробактериями трансформацию, трансформацию с использованием ПЭГ, декстрансульфат-, липофектамин- или сухую/ингибирование-опосредованную трансформацию или т.п.
Как описано выше, для оптимизации свойств слитого белка в качестве терапевтического средства или для любой другой цели паттерн гликозилирования слитого белка (например, сиаловые кислоты, фукозилирования, гликозилирования) можно регулировать путем манипуляции, используя методы, известные специалистам в данной области, со связанными с гликозилированием генами, которыми обладают клетки-хозяева.
Способ продукции слитого белка
Еще в одном аспекте настоящего изобретения обеспечивается способ продукции слитого белка, включающкго белок IL-2 и белок CD80, при этом способ включает культивирование трансформированных клеток. В частности, способ получения может включать i) культивирование трансформированных клеток для получения культуры; и ii) сбор слитого белка из культуры.
Культивирование трансформированных клеток можно осуществить с использованием способов, хорошо известных в данной области техники. В частности, культивирование можно осуществить периодическим способом или можно осуществить непрерывно периодическим культивированием с подпиткой или повторяющимся периодическим культивированием с подпиткой.
Применение слитого белка или его димера
Еще в одном аспекте настоящего изобретения обеспечивается фармацевтическая композиция для лечения или профилактики рака или инфекционного заболевания, и/или для повышения эффективности лечения рака или инфекционного заболевания, при этом композиция включает, в качестве активного ингредиента, слитый белок, включающий белок IL-2 и белок CD80, или димер слитого белка, где два слитых белка связаны.
Слитый белок, включающий белок IL-2 и белок CD80, или димер слитого белка, где два слитых белка связаны, описаны выше.
Рак может быть выбран из группы, состоящей из рака желудка, рака печени, рака легких, колоректального рака, рака молочной железы, рака предстательной железы, рака яичника, рака поджелудочной железы, рака шейки матки, рака щитовидной железы, рака гортани, острого миелоидного лейкоза, опухоли головного мозга, нейробластомы, ретинобластомы, рака головы и шеи, рака слюнной железы и лимфомы. Кроме того, инфекционное заболевание может представлять собой любое заболевание, выбранное из группы, состоящей из гепатита B, гепатита C, инфекции, вызываемой вирусом папилломы человека (HPV), цитомегаловирусной инфекции, вирусного респираторного заболевания и гриппа.
Предпочтительная доза фармацевтической композиции варьируется в зависимости от состояния и массы тела пациента, тяжести заболевания, формы лекарственного средства, пути и продолжительности введения, и ее может соответствующим образом выбрать специалист в данной области. В фармацевтической композиции для лечения или профилактики рака или инфекционного заболевания по настоящему изобретению активный ингредиент может содержаться в любом количестве (эффективном количестве) в зависимости от применения, лекарственной формы, цели составления смеси и т.п., при условии, что активный ингредиент может проявлять противораковую активность или демонстрировать терапевтический эффект в отношении инфекционного заболевания. Его обычное эффективное количество будет определяться в диапазоне от 0,001% до 20,0% по массе в расчете на общую массу композиции. Термин "эффективное количество" относится к количеству активного ингредиента, способному индуцировать противораковый эффект или эффект лечения инфекционного заболевания. Такое эффективное количество может быть определено экспериментально специалистами в данной области на основании общих знаний.
В контексте настоящей заявки термин "лечение" может использоваться для обозначения как терапевтического, так и профилактического лечения. В данном случае, профилактика может использоваться для обозначения того, что патологическое состояние или заболевание индивидуума облегчается или ослабляется. В варианте осуществления термин "лечение" включает как применение, так и любую форму введения для лечения заболевания у млекопитающего, включая человека. Кроме того, термин включает ингибирование или замедление заболевания или прогрессирования заболевания; и включает значения восстановления или исправления нарушенной или утраченной функции, чтобы частично или полностью облегчить заболевание; стимулирование неэффективных процессов; или облегчение серьезного заболевания.
В контексте настоящей заявки термин "эффективность" относится к способности, которая может быть определена на основании одного или нескольких параметров, например, выживаемости или безрецидивной выживаемости в течение определенного периода времени, такого как один год, пять лет или десять лет. Кроме того, параметр может включать ингибирование размера по меньшей мере одной опухоли у индивидуума.
Фармакокинетические параметры, такие как биодоступность, и лежащие в основе этого параметры, такие как скорость клиренса, также могут влиять на эффективность. Таким образом, "повышенная эффективность" (например, повышение эффективности) может быть обусловлена улучшенными фармакокинетическими параметрами и улучшенной эффективностью, которые могут быть измерены путем сравнения скорости клиренса и роста опухоли у тестируемых животных или людей или путем сравнения таких параметров, как выживаемость, рецидив или безрецидивная выживаемость.
В контексте настоящей заявки термин "терапевтически эффективное количество" или "фармацевтически эффективное количество" относится к количеству соединения или композиции, эффективному для предотвращения или лечения рассматриваемого заболевания, которое является достаточным для лечения заболевания при разумном соотношении польза/риск в применении к медицинскому лечению и не вызывает побочных эффектов. Уровень эффективного количества может быть определен в зависимости от факторов, включающих состояние здоровья пациента, тип и тяжесть заболевания, активность лекарственного средства, чувствительность пациента к лекарственному средству, способ введения, время введения, путь введения и скорость экскреции, продолжительность лечения, композицию или одновременно используемые лекарственные средства, и других факторов, хорошо известных в области медицины. В одном варианте осуществления терапевтически эффективное количество означает количество лекарственного средства, эффективное для лечения рака.
В настоящем изобретении фармацевтическая композиция может дополнительно включать фармацевтически приемлемый носитель. Фармацевтически приемлемый носитель может представлять собой любой носитель при условии, что носитель является нетоксичным веществом, подходящим для доставки пациенту. В качестве носителя могут содержаться дистиллированная вода, спирт, жир, воск и инертное твердое вещество. Фармацевтически приемлемый адъювант (буфер, диспергатор) также может содержаться в фармацевтической композиции.
В частности, путем включения фармацевтически приемлемого носителя в дополнение к активному ингредиенту можно получить фармацевтическую композицию в виде композиции для парентерального введения, в зависимости от способа введения, с использованием обычных способов, известных в данной области. Термин "фармацевтически приемлемый" означает, что носитель не обладает большей токсичностью, чем может перенести субъект, для которого это должно применяться (которому назначено), не ингибируя при этом активность активного ингредиента.
Когда фармацевтическую композицию получают для парентерального введения, ее можно получить в виде препаратов для инъекций, трансдермальных пластырей, назальных ингалянтов или суппозиториев с подходящими носителями, в соответствии со способами, известными в данной области. В случае введения в виде инъекций в качестве подходящего носителя можно использовать стерильную воду, этанол, полиол, такой как глицерин или пропиленгликоль, или их смесь; и предпочтительно можно использовать изотонический раствор, такой как раствор Рингера, фосфатно-солевой буферный раствор (PBS), содержащий триэтаноламин или стерильную воду для инъекций, и 5% раствор декстрозы или т.п. Формулирование фармацевтических композиций известно в данной области, и, в частности, можно сослаться на Remington's Pharmaceutical Sciences (19-е изд., 1995) и т.п. Этот документ считается частью настоящего описания.
Предпочтительная доза фармацевтической композиции может составлять от 0,01 мг/кг до 10 г/кг или от 0,01 мг/кг до 1 г/кг в день в зависимости от состояния пациента, массы тела, пола, возраста, степени тяжести заболевания у пациента и пути введения. Дозу можно вводить один раз в день или можно разделить на несколько раз в день. Такая доза не должна рассматриваться как ограничивающая объем настоящего изобретения в любом аспекте.
Субъектами, для которых можно применять (которым прописана) фармацевтическую композицию, являются млекопитающие и люди, при этом люди являются особенно предпочтительными. В дополнение к активному ингредиенту, фармацевтическая композиция по настоящей заявке может дополнительно содержать любое соединение или природный экстракт, которые уже были оценены на безопасность и известны как обладающие противораковой активностью или терапевтическим эффектом при инфекционном заболевании, чтобы стимулировать или усилить противораковую активность.
Еще в одном аспекте настоящего изобретения предлагается применение слитого белка, содержащего белок IL-2 и белок CD80, для лечения рака или инфекционного заболевания.
Еще в одном аспекте настоящего изобретения предлагается применение слитого белка, содержащего белок IL-2 и белок CD80, для усиления терапевтического эффекта на рак или инфекционное заболевание.
Еще в одном аспекте настоящего изобретения предлагается применение слитого белка, содержащего белок IL-2 и белок CD80, для изготовления лекарственного средства для лечения рака или инфекционного заболевания.
Еще в одном аспекте настоящего изобретения предлагается способ лечения рака или инфекционного заболевания и/или способ усиления терапевтического эффекта на рак или инфекционное заболевание, включающий введение субъекту слитого белка, включающего белок IL-2 и белок CD80, или димера слитого белка, где связаны два слитых белка.
Субъектом может быть индивидуум, страдающий раком или инфекционным заболеванием. Кроме того, субъектом может быть млекопитающее, предпочтительно человек. Слитый белок, содержащий белок IL-2 и белок CD80, или димер слитого белка, где связаны два слитых белка, является таким, как описано выше.
Способ введения, доза и частота введения слитого белка или димера слитого белка могут варьироваться в зависимости от состояния пациента и наличия или отсутствия побочных эффектов, и, таким образом, слитый белок или димер слитого белка можно вводить субъекту различными способами и в различных количествах. Оптимальный способ введения, доза и частота введения могут быть выбраны в соответствующем диапазоне специалистами в данной области. Кроме того, слитый белок или димер слитого белка можно вводить в комбинации с другими лекарственными средствами или физиологически активными веществами, терапевтический эффект которых известен в отношении подлежащего лечению заболевания, или их можно сформулировать в виде комбинированных препаратов с другими лекарственными средствами.
Благодаря активности IL-2 слитый белок в варианте осуществления настоящего изобретения может активировать иммунные клетки, такие как природные киллерные клетки. Таким образом, слитый белок можно эффективно использовать при раке и инфекционных заболеваниях. В частности, было установлено, что по сравнению с диким типом вариант IL-2 с двумя-пятью аминокислотными заменами, в частности, вариант IL-2, который содержит аминокислотные замены в двух, трех, четырех или пяти положениях из положений, выбранных из группы, состоящей из R38A, F42A, Y45A, E61R и L72G, имеет низкую способность к связыванию с альфа-цепью рецептора IL-2 и, таким образом, демонстрирует улучшенные характеристики в отношении фармакологических побочных эффектов обычного IL-2. Таким образом, такой вариант IL-2, когда он используется отдельно или в форме слитого белка, может снизить частоту возникновения синдрома сосудистой (или капиллярной) проницаемости (VLS), общеизвестной проблемы с IL-2.
Вариант осуществления изобретения
Далее настоящее изобретение будет описано более подробно при помощи следующих примеров. Однако следующие примеры предназначены только для иллюстрации настоящего изобретения, и объем настоящего изобретения не ограничивается ими.
I. Получение слитого белка
Пример получения 1. Получение hCD80-Fc-IL-2 варианта (2M): GI101
Для получения слитого белка, включающего фрагмент CD80 человека, Fc домен и вариант IL-2, полинуклеотид синтезировали через сервиз Синтез Генов Invitrogen GeneArt компании ThermoFisher Scientific. В частности, полинуклеотид содержит нуклеотидную последовательность (SEQ ID NO: 8), которая кодирует слитый белок, который содержит сигнальный пептид (SEQ ID NO: 1), фрагмент CD80 (SEQ ID NO: 2), шарнирный участок Ig (SEQ ID NO: 3), Fc домен (SEQ ID NO: 4), линкер (SEQ ID NO: 5) и вариант IL-2 (2M) (R38A, F42A) (SEQ ID NO: 6), имеющий две аминокислотные замены, в указанном порядке от N-конца. Полинуклеотид встраивали в pcDNA3_4 вектор. Кроме того, вектор вводили в CHO клетки (Expi-CHOTM) для экспрессии слитого белка SEQ ID NO: 9. После введения вектора осуществляли культивирование в течение 7 дней в условиях 37°C, 125 об/мин и CO2 концентрации 8%. Затем культуру собирали и слитый белок очищали из культуры. Очищенный слитый белок был обозначен как "GI101".
Очистку осуществляли с использованием хроматографии, содержащей смолу с белком А MabSelect SuRe. Слитый белок связывали на ней в условиях 25 мМ Tris, 25 мМ NaCl, pH 7,4. Затем осуществляли элюирование с использованием 100 мМ NaCl, 100 мМ уксусной кислоты, pH 3. 20% 1 M Tris-HCl при pH 9 помещали в пробирку-сборник и затем собирали слитый белок. Для собранного слитого белка буфер заменяли путем диализа PBS буфером в течение 16 часов.
Затем измеряли поглощение при длине волны 280 нм, с течением времени, с использованием эксклюзионной хроматографии на TSKgel G3000SWXL колонке (TOSOH Bioscience) с получением высококонцентрированного слитого белка. Затем выделенный и очищенный слитый белок подвергали SDS-PAGE в восстанавливающих (R) или невосстанавливающих (NR) условиях и окрашивали кумасси синим для проверки его чистоты (Фиг. 6). Было определено, что слитый белок содержался при концентрации 2,78 мг/мл, как было показано методом NanoDrop (Фиг. 7). Кроме того, результаты, полученные в анализе с использованием эксклюзионной хроматографии, представлены на Фиг. 8.
Пример получения 2. Получение mCD80-Fc-IL-2 варианта (2M): mGI101
Для получения слитого белка, включающего мышиный CD80, Fc домен и вариант IL-2, полинуклеотид синтезировали через сервиз Синтез Генов Invitrogen GeneArt компании ThermoFisher Scientific. В частности, полинуклеотид содержит нуклеотидную последовательность (SEQ ID NO: 14), которая кодирует слитый белок, который содержит сигнальный пептид (SEQ ID NO: 1), mCD80 (SEQ ID NO: 13), шарнирный участок Ig (SEQ ID NO: 3), Fc домен (SEQ ID NO: 4), линкер (SEQ ID NO: 5) и вариант IL-2 (2M) (R38A, F42A) (SEQ ID NO: 6) с двумя аминокислотными заменами, в указанном порядке от N-конца. Полинуклеотид встраивали в pcDNA3_4 вектор. Кроме того, вектор вводили в CHO клетки (Expi-CHOTM) для экспрессии слитого белка SEQ ID NO: 15. После введения вектора осуществляли культивирование в течение 7 дней в условиях 37°C, 125 об/мин и CO2 концентрации 8%. Затем культуру собирали и слитый белок очищали из культуры. Очищенный слитый белок был обозначен как "mGI101".
Очистку и сбор слитого белка осуществляли таким же способом, как в Примере получения 1. Выделенный и очищенный слитый белок подвергали SDS-PAGE в восстанавливающих (R) или невосстанавливающих (NR) условиях и окрашивали кумасси синим для проверки его чистоты (Фиг. 9). Было обнаружено, что слитый белок содержался при концентрации 1,95 мг/мл, как было определено по поглощению при 280 нм с использованием NanoDrop.
Пример получения 3. Получение hCD80-Fc: GI101C1
Для получения слитого белка, включающего фрагмент CD80 человека и Fc домен, полинуклеотид синтезировали через сервиз Синтез Генов Invitrogen GeneArt компании ThermoFisher Scientific. В частности, полинуклеотид содержит нуклеотидную последовательность (SEQ ID NO: 16), которая кодирует слитый белок, который содержит сигнальный пептид (SEQ ID NO: 1), фрагмент CD80 (SEQ ID NO: 2), шарнирный участок Ig (SEQ ID NO: 3) и Fc домен (SEQ ID NO: 4). Полинуклеотид встраивали в pcDNA3_4 вектор. Кроме того, вектор вводили в CHO клетки (Expi-CHOTM) для экспрессии слитого белка SEQ ID NO: 17. После введения вектора осуществляли культивирование в течение 7 дней в условиях 37°C, 125 об/мин и CO2 концентрации 8%. Затем культуру собирали и слитый белок очищали из культуры. Очищенный слитый белок был обозначен как "GI101C1".
Очистку и сбор слитого белка осуществляли таким же способом, как в Примере получения 1. Выделенный и очищенный слитый белок подвергали SDS-PAGE в восстанавливающих (R) или невосстанавливающих (NR) условиях и окрашивали кумасси синим для проверки его чистоты (Фиг. 10). Было обнаружено, что слитый белок содержался при концентрации 3,61 мг/мл, как было определено по поглощению при 280 нм с использованием NanoDrop.
Пример получения 4. Получение Fc-IL-2 варианта (2M): GI101C2
Для получения слитого белка, включающего Fc домен и вариант IL-2, полинуклеотид синтезировали через сервиз Синтез Генов Invitrogen GeneArt компании ThermoFisher Scientific. В частности, полинуклеотид содержит нуклеотидную последовательность (SEQ ID NO: 18), которая кодирует слитый белок, который содержит сигнальный пептид (SEQ ID NO: 1), Fc домен (SEQ ID NO: 4), линкер (SEQ ID NO: 5) и вариант IL-2 (2M) (R38A, F42A) (SEQ ID NO: 6) с двумя аминокислотными заменами, в указанном порядке от N-конца. Полинуклеотид встраивали в pcDNA3_4 вектор. Кроме того, вектор вводили в CHO клетки (Expi-CHOTM) для экспрессии слитого белка SEQ ID NO: 19. После введения вектора осуществляли культивирование в течение 7 дней в условиях 37°C, 125 об/мин и CO2 концентрации 8%. Затем культуру собирали и слитый белок очищали из культуры. Очищенный слитый белок был обозначен как "GI101C2".
Очистку и сбор слитого белка осуществляли таким же способом, как в Примере получения 1. Выделенный и очищенный слитый белок подвергали SDS-PAGE в восстанавливающих (R) или невосстанавливающих (NR) условиях и окрашивали кумасси синим для проверки его чистоты (Фиг. 11). Было обнаружено, что слитый белок содержался при концентрации 4,79 мг/мл, как было определено по поглощению при 280 нм с использованием NanoDrop.
Пример получения 5. Получение mCD80-Fc: mGI101C1
Для получения слитого белка, включающего мышиный CD80 и Fc домен, полинуклеотид синтезировали через сервиз Синтез Генов Invitrogen GeneArt компании ThermoFisher Scientific. В частности, полинуклеотид содержит нуклеотидную последовательность (SEQ ID NO: 20), которая кодирует слитый белок, который содержит сигнальный пептид (SEQ ID NO: 1), mCD80 (SEQ ID NO: 13), шарнирный участок Ig (SEQ ID NO: 3) и Fc домен (SEQ ID NO: 4) в указанном порядке от N-конца. Полинуклеотид встраивали в pcDNA3_4 вектор. Кроме того, вектор вводили в CHO клетки (Expi-CHOTM) для экспрессии слитого белка SEQ ID NO: 21. После введения вектора осуществляли культивирование в течение 7 дней в условиях 37°C, 125 об/мин и CO2 концентрации 8%. Затем культуру собирали и слитый белок очищали из культуры. Очищенный слитый белок был обозначен как "mGI101C1".
Очистку и сбор слитого белка осуществляли таким же способом, как в Примере получения 1. Выделенный и очищенный слитый белок подвергали SDS-PAGE в восстанавливающих (R) или невосстанавливающих (NR) условиях и окрашивали кумасси синим для проверки его чистоты (Фиг. 12). Было обнаружено, что слитый белок содержался при концентрации 2,49 мг/мл, как было определено по поглощению при 280 нм с использованием NanoDrop.
Слитые белки, полученные в Примерах получения 1-5, представлены в Таблице 1 ниже.
Пример получения 6. Получение CD80-Fc-IL-2: GI101w
Для получения слитого белка, включающего фрагмент CD80 человека, Fc домен и человеческий IL-2, полинуклеотид синтезировали через сервиз Синтез Генов Invitrogen GeneArt компании ThermoFisher Scientific. В частности, полинуклеотид содержит нуклеотидную последовательность (SEQ ID NO: 31), которая кодирует слитый белок, который содержит сигнальный пептид (SEQ ID NO: 1), фрагмент CD80 (SEQ ID NO: 2), шарнирный участок Ig (SEQ ID NO: 3), Fc домен (SEQ ID NO: 4), линкер (SEQ ID NO: 5) и зрелый человеческий IL-2 (SEQ ID NO: 10) в указанном порядке от N-конца. Полинуклеотид встраивали в pcDNA3_4 вектор. Кроме того, вектор вводили в CHO клетки (Expi-CHOTM) для экспрессии слитого белка SEQ ID NO: 32. После введения вектора осуществляли культивирование в течение 7 дней в условиях 37°C, 125 об/мин и CO2 концентрации 8%. Затем культуру собирали и слитый белок очищали из культуры. Очищенный слитый белок был обозначен как "GI101w". Очистку и сбор слитого белка осуществляли таким же способом, как в Примере получения 1.
Пример получения 7. Получение hCD80-Fc-IL-2 варианта (3M): GI102-M45
Для получения слитого белка, включающего фрагмент CD80 человека, Fc домен и вариант IL-2 (3M) (R38A, F42A, Y45A) (GI102-M45) с тремя аминокислотными заменами, полинуклеотид синтезировали через сервиз Синтез Генов Invitrogen GeneArt компании ThermoFisher Scientific. В частности, полинуклеотид содержит нуклеотидную последовательность (SEQ ID NO: 25), которая кодирует слитый белок, который содержит сигнальный пептид (SEQ ID NO: 1), фрагмент CD80 (SEQ ID NO: 2), шарнирный участок Ig (SEQ ID NO: 3), Fc домен (SEQ ID NO: 4), линкер (SEQ ID NO: 5) и вариант IL-2 (SEQ ID NO: 22) в указанном порядке от N-конца. Полинуклеотид встраивали в pcDNA3_4 вектор. Кроме того, вектор вводили в CHO клетки (Expi-CHOTM) для экспрессии слитого белка SEQ ID NO: 26. После введения вектора осуществляли культивирование в течение 7 дней в условиях 37°C, 125 об/мин и CO2 концентрации 8%. Затем культуру собирали и слитый белок очищали из культуры. Очищенный слитый белок был обозначен как "GI102-M45".
Очистку и сбор слитого белка осуществляли таким же способом, как в Примере получения 1. Выделенный и очищенный слитый белок подвергали SDS-PAGE в восстанавливающих (R) или невосстанавливающих (NR) условиях и окрашивали кумасси синим для проверки его чистоты (Фиг. 13).
Пример получения 8. Получение hCD80-Fc-IL-2 варианта (3M): GI102-M61
Для получения слитого белка, включающего фрагмент CD80 человека, Fc домен и вариант IL-2 (3M) (R38A, F42A, E61R) (GI102-M61) с тремя аминокислотными заменами, полинуклеотид синтезировали через сервиз Синтез Генов Invitrogen GeneArt компании ThermoFisher Scientific. В частности, полинуклеотид содержит нуклеотидную последовательность (SEQ ID NO: 27), которая кодирует слитый белок, который содержит сигнальный пептид (SEQ ID NO: 1), фрагмент CD80 (SEQ ID NO: 2), шарнирный участок Ig (SEQ ID NO: 3), Fc домен (SEQ ID NO: 4), линкер (SEQ ID NO: 5) и вариант IL-2 (SEQ ID NO: 23) в указанном порядке от N-конца. Полинуклеотид встраивали в pcDNA3_4 вектор. Кроме того, вектор вводили в CHO клетки (Expi-CHOTM) для экспрессии слитого белка SEQ ID NO: 28. После введения вектора осуществляли культивирование в течение 7 дней в условиях 37°C, 125 об/мин и CO2 концентрации 8%. Затем культуру собирали и слитый белок очищали из культуры. Очищенный слитый белок был обозначен как "GI102-M61".
Очистку и сбор слитого белка осуществляли таким же способом, как в Примере получения 1. Выделенный и очищенный слитый белок подвергали SDS-PAGE в восстанавливающих (R) или невосстанавливающих (NR) условиях и окрашивали кумасси синим для проверки его чистоты (Фиг. 14).
Пример получения 9. Получение hCD80-Fc-IL-3M: GI102-M72
Для получения слитого белка, включающего фрагмент CD80 человека, Fc домен и вариант IL-2 (3M) (R38A, F42A, L72G) (GI102-M72) с тремя аминокислотными заменами, полинуклеотид синтезировали через сервиз Синтез Генов Invitrogen GeneArt компании ThermoFisher Scientific. В частности, полинуклеотид содержит нуклеотидную последовательность (SEQ ID NO: 29), которая кодирует слитый белок, который содержит сигнальный пептид (SEQ ID NO: 1), фрагмент CD80 (SEQ ID NO: 2), шарнирный участок Ig (SEQ ID NO: 3), Fc домен (SEQ ID NO: 4), линкер (SEQ ID NO: 5) и вариант IL-2 (SEQ ID NO: 24) в указанном порядке от N-конца. Полинуклеотид встраивали в pcDNA3_4 вектор. Кроме того, вектор вводили в CHO клетки (Expi-CHOTM) для экспрессии слитого белка SEQ ID NO: 30. После введения вектора осуществляли культивирование в течение 7 дней в условиях 37°C, 125 об/мин и CO2 концентрации 8%. Затем культуру собирали и слитый белок очищали из культуры. Очищенный слитый белок был обозначен как "GI102-M72".
Очистку и сбор слитого белка осуществляли таким же способом, как в Примере получения 1. Выделенный и очищенный слитый белок подвергали SDS-PAGE в восстанавливающих (R) или невосстанавливающих (NR) условиях и окрашивали кумасси синим для проверки его чистоты (Фиг. 15).
Пример получения 10. Получение mCD80-Fc-IL-3M: mGI102-M61
Для получения слитого белка, включающего фрагмент CD80 мыши, Fc домен и вариант IL-2 (3M) (R38A, F42A, E61R) (GI102-M61) с тремя аминокислотными заменами, полинуклеотид синтезировали через сервиз Синтез Генов Invitrogen GeneArt компании ThermoFisher Scientific. В частности, полинуклеотид содержит нуклеотидную последовательность (SEQ ID NO: 33), которая кодирует слитый белок, который содержит сигнальный пептид (SEQ ID NO: 1), фрагмент mCD80 (SEQ ID NO: 13), шарнирный участок Ig (SEQ ID NO: 3), Fc домен (SEQ ID NO: 4), линкер (SEQ ID NO: 5) и вариант IL-2 (SEQ ID NO: 23) в указанном порядке от N-конца. Полинуклеотид встраивали в pcDNA3_4 вектор. Кроме того, вектор вводили в CHO клетки (Expi-CHOTM) для экспрессии слитого белка SEQ ID NO: 34. После введения вектора осуществляли культивирование в течение 7 дней в условиях 37°C, 125 об/мин и CO2 концентрации 8%. Затем культуру собирали и слитый белок очищали из культуры. Очищенный слитый белок был обозначен как "mGI102-M61".
Очистку и сбор слитого белка осуществляли таким же способом, как в Примере получения 1.
II. Определение аффинности связывания между слитым белком и его лигандом
Для определения аффинности связывания между слитым белком и его лигандом аффинность связывания измеряли с использованием Octet RED 384.
Экспериментальный пример 1. Определение аффинности связывания между hCTLA-4 и GI101
AR2G биосенсор (Amine Reactive 2nd gen, ForteBio, Cat: 18-5092) предварительно гидратировали с использованием 200 мкл дистиллированной воды в 96-луночном микропланшете (GreinerBio-one, Cat: 655209). Лиганд (CTLA-4, Человеческий CTLA-4/CD152, His tag, Sino Biological, Cat: 11159-H08H), предназначенный для связывания с AR2G биосенсором, разбавляли с использованием 10 мМ ацетатного буфера (pH 5, AR2G reagent Kit, ForteBio, Cat: 18-5095) до концентрации 5 мкг/мл. При этом, GI101, предназначенный для связывания с лигандом, разбавляли 1X AR2G кинетическим буфером (AR2G reagent Kit, ForteBio, Cat: 18-5095) до концентрации 1000 нМ, 500 нМ, 250 нМ, 125 нМ или 62,5 нМ. Активационный буфер получали путем смешивания 20 мМ EDC и 10 мМ s-NHS (AR2G reagent Kit, ForteBio, Cat: 18-5095) в дистиллированной воде. 80 мкл каждого реагента вносили в 384-луночный микропланшет (Greiner Bio-one, Cat: 781209) и устанавливали программу.
Таким образом, аффинность связывания между hCTLA-4 и GI101 измеряли, как проиллюстрировано на Фиг. 16.
Экспериментальный пример 2. Определение аффинности связывания между hPD-L1/GI101 и hPD-L1/PD-1
Ni-NTA (Nickel charged Tris-NTA, Ni-NTA биосенсоры, ForteBio, 18-5101) предварительно гидратировали с использованием 200 мкл 1X Ni-NTA кинетического буфера (10X Kinetics buffer, ForteBio, 18-1042) в 96-луночном микропланшете (GreinerBio-one, Cat: 655209). Лиганд (Человеческий PD-L1/B7-H1 белок, His-tag, Sino biological, Cat: 10084-H08H), предназначенный для связывания с Ni-NTA биосенсорами, разбавляли 1X Ni-NTA кинетическим буфером до концентрации 5 мкг/мл. GI101, предназначенный для связывания с лигандом, разбавляли 1X Ni-NTA кинетическим буфером при 1000 нМ, 500 нМ, 250 нМ, 125 нМ или 62,5 нМ. При этом, человеческий PD-1/PDCD1 (Человеческий PD-1/PDCD1, Fc Tag, Sino Biological, Cat: 10377-H02H), предназначенный для связывания с лигандом, разбавляли 1X Ni-NTA кинетическим буфером до концентрации 2000 нМ, 1,000 нМ, 500 нМ, 250 нМ или 125 нМ. Затем 80 мкл каждого реагента вносили в 384-луночный микропланшет и устанавливали программу.
Таким образом, аффинность связывания между hPD-L1 и GI101 измеряли, как проиллюстрировано на Фиг. 17. При этом, аффинность связывания между hPD-L1 и hPD-1 измеряли, как проиллюстрировано на Фиг. 18.
Экспериментальный пример 3. Определение аффинности связывания между mCTLA-4 и mGI101
Аффинность связывания между mCTLA-4 и mGI101 исследовали таким же способом, как в Экспериментальном примере 1. В этом примере использовали следующее оборудование: Биосенсор: AR2G, Лиганд: mCTLA-4 (рекомбинантная мышиная CTLA-4 Fc химера, R&D Systems, Cat: 434-CT-200), Аналит: mGI101 (500 нМ, 250 нМ, 125 нМ, 62,5 нМ, 31,3 нМ).
Таким образом, аффинность связывания между mCTLA-4 и mGI101 измеряли, как проиллюстрировано на Фиг. 19.
Экспериментальный пример 4. Определение аффинности связывания между mPD-L1 и mGI101
Аффинность связывания между mPD-L1 и mGI101 определяли таким же способом, как в Экспериментальном примере 1. В этом примере использовали следующее оборудование. Биосенсор: AR2G, Лиганд: mPD-L1 (рекомбинантная мышиная B7-H1/PD-L1 Fc химера, R&D Systems, Cat: 434-CT-200), Аналит: mGI101 (500 нМ, 250 нМ, 125 нМ, 62,5 нМ, 31,3 нМ).
Таким образом, аффинность связывания между mPD-L1 и mGI101 измеряли, как проиллюстрировано на Фиг. 20.
Экспериментальный пример 5. Определение способности к связыванию GI-101 (hCD80-Fc-hIL-2v) с CTLA-4 и PD-L1
Определение кинетики связывания осуществляли с использованием устройства Octet RED 384 (ForteBio, Pall Life Science) при перемешивании при 30°C и 1000 об/мин. Способность к связыванию с CTLA-4 измеряли с использованием биосенсорного чипа Amine Reactive 2 generation (AR2G), а способность к связыванию с PD-L1 измеряли с использованием биосенсорного чипа Nickel charged Tris-NTA (Ni-NTA). AR2G биосенсорный чип активировали комбинацией 400 мМ EDC и 100 мМ сульфо-NHS. Затем человеческий CTLA-4-His Tag (Sino Biological, Cat: 11159-H08H) разбавляли 10 мМ ацетатного буфера (pH 5) до 5 мкг/мл и загружали на AR2G биосенсорный чип в течение 300 секунд и фиксировали.
Затем связывание CTLA-4 с GI-101 (hCD80-Fc-hIL-2v), GI-101C1 (hCD80-Fc), Ипилимумабом (Bristol-Myers Squibb) и GI-101C2 (Fc-hIL-2v) при различных концентрациях измеряли в течение 300 секунд и его диссоциацию также измеряли в течение 300 секунд. С другой стороны, Человеческий PD-L1-His Tag (Sino biological, Cat: 10084-H08H) разбавляли 1X Ni-NTA кинетическим буфером до концентрации 5 мг/мл и загружали на Ni-NTA биосенсорный чип в течение 600 секунд и фиксировали. Затем связывание PD-L1-GI-101, GI-101C1, hPD-1-Fc (Sino biological, Cat: 10377-H02H) и GI101C2 при различных концентрациях измеряли в течение 300 секунд и его диссоциацию также измеряли в течение 300 секунд. Анализ кинетики связывания осуществляли с использованием программы Octet Data Analysis HT ver. 10, предоставленной Pall Corporation. Результаты проиллюстрированы на Фиг. 21 и 22.
Экспериментальный пример 6. Определение эффекта GI-101 (hCD80-Fc-hIL-2v) на связывание PD-1/PD-L1
Эксперимент по блокированию осуществляли с использованием устройства Octet RED 384 (ForteBio, Pall Life Science) при перемешивании при 30°C и 1000 об/мин. Человеческий PD-L1-His Tag (Sino biological, Cat: 10084-H08H) разбавляли кинетическим буфером 1XNi-NTA до концентрации 5 мг/мл и загружали на Ni-NTA биосенсорный чип в течение 600 секунд и фиксировали. Для осуществления эксперимента по блокированию осуществляли возможность связывания hPD-L1, фиксированного на биосенсорном чипе, с GI-101 при различных концентрациях (300 нМ, 100 нМ, 50 нМ, 25 нМ, 12,5 нМ и 0 нМ) в течение 600 секунд и затем снова осуществляли возможность связывания с конкурентным человеческим PD-1 (100 нМ) в течение 600 секунд, чтобы измерить насколько больше hPD-1 может связаться с ним. С другой стороны, осуществляли возможность связывания hPD-L1 с hPD-1 при различных концентрациях (300 нМ, 100 нМ, 50 нМ, 25 нМ, 12,5 нМ и 0 нМ) в течение 600 секунд и затем снова осуществляли возможность связывания с конкурентным GI-101 (100 нМ) в течение 600 секунд, чтобы измерить насколько больше GI-101 может связаться с ним. Эксперимент по блокированию анализировали с использованием меню связывания с эпитопом программы Octet Data Analysis HT ver. 10, предоставленной Pall Corporation. Результаты проиллюстрированы на Фиг. 23.
Экспериментальный пример 7. Определение аффинности связывания между IL-2Rα или IL-2Rβ и GI101
Способность к связыванию для IL-2Rα измеряли с использованием биосенсора AR2G, а способность к связыванию для IL-2Rβ измеряли с использованием биосенсоров Ni-NTA (Nickel charged Tris-NTA, Ni-NTA Biosensors, ForteBio, 18-5101).
Лиганд (IL-2Rα-His Tag, Acro, Cat: ILA-H52H9), предназначенный для связывания с AR2G биосенсором, разбавляли с использованием 10 мМ ацетатного буфера (pH 5, AR2G reagent Kit, ForteBio, Cat: 18-5095) до концентрации 5 мкг/мл. AR2G биосенсор активировали буфером, полученным путем смешивания 400 мМ EDC и 100 мМ сульфо-NHS, и затем разбавленный лиганд загружали на AR2G биосенсор в течение 300 секунд и фиксировали.
Тем временем, лиганд (IL-2Rβ-His Tag, Acro, Cat: CD2-H5221), предназначенный для связывания с Ni-NTA биосенсором, разбавляли с использованием 1X Ni-NTA кинетического буфера до концентрации 5 мкг/мл. Разбавленный лиганд загружали на Ni-NTA биосенсор в течение 600 секунд и фиксировали.
Затем GI101, GI101w или Пролейкин (Novartis, hIL-2), при различных концентрациях, предназначенные для связывания с лигандом, загружали на него в течение 300 секунд. Затем измеряли их связывание, а также измеряли диссоциацию в течение 300 секунд. Анализ кинетики связывания осуществляли с использованием программы Octet Data Analysis HT ver. 10, предоставленной Pall Corporation. Результаты проиллюстрированы на Фиг. 24-26.
Как результат, было определено, что GI101 обладает низкой способностью к связыванию в отношении альфа цепи рецептора IL-2, IL-2Rα, и высокой способностью к связыванию в отношении IL-2Rβ, по сравнению с GI101w и Пролейкином.
Экспериментальный пример 8. Измерение аффинности связывания между слитым белком и лигандом
Для определения аффинности связывания между слитым белком и его лигандом, аффинность связывания измеряли с использованием Octet RED 384.
Экспериментальный пример 8.1. Определение аффинности связывания между рецептором IL2 альфа и GI101-M45, GI101-M61 или GI101-M72
AR2G биосенсор (Amine Reactive 2nd gen, ForteBio, Cat: 18-5092) предварительно гидратировали с использованием 200 мкл дистиллированной воды (DW) в 96-луночном микропланшете (GreinerBio-one, Cat: 655209). Лиганд (Человеческий IL-2 R альфа белок, His Tag, Acro, ILA-H52H9), предназначенный для связывания с биосенсором, разбавляли с использованием 10 мМ ацетатного буфера (pH 5) (AR2G reagent Kit, ForteBio, Cat: 18-5095) до концентрации 5 мкг/мл. Аналит (GI101-M45, GI101-M61, GI101-M72), предназначенный для связывания с лигандом, разбавляли 1X AR2G кинетическим буфером (AR2G reagent Kit, ForteBio, Cat: 18-5095) до 500 нМ, 250 нМ, 125 нМ и 62,5 нМ, соответственно. Активационный буфер получали путем смешивания 20 мМ EDC и 10 мМ s-NHS (AR2G reagent Kit, ForteBio, Cat: 18-5095) в DW. 80 мкл каждого реагента вносили в 384-луночный микропланшет (Greiner Bio-one, Cat: 781209) и устанавливали программу.
Как результат, аффинность связывания между IL2 альфа рецептором и GI101-M45 проиллюстрирована на Фиг. 27. При этом, аффинность связывания между IL2 альфа рецептором и GI101-M61 проиллюстрирована на Фиг. 28, а аффинность связывания между IL2 альфа рецептором и GI101-M72 проиллюстрирована на Фиг. 29.
Экспериментальный пример 8.2. Определение аффинности связывания GI102-M45, GI102-M61 и GI102-M72 с IL-2Rβ
Биосенсоры Ni-NTA предварительно гидратировали с использованием 200 мкл 1X Ni-NTA кинетического буфера (10X Kinetics buffer, ForteBio, 18-1042) в 96-луночном микропланшете. Лиганд (Человеческий IL-2 R бета белок, His-Tag, Acro, CD2-H5221), предназначенный для связывания с биосенсором, разбавляли 1X Ni-NTA кинетическим буфером до концентрации 2 мкг/мл. GI102-M45, GI102-M61 или GI102-M72, предназначенные для связывания с лигандом, разбавляли 1X Ni-NTA кинетическим буфером до концентрации 500 нМ, 250 нМ, 125 нМ или 62,5 нМ. 80 мкл каждого реагента вносили в 384-луночный микропланшет и устанавливали программу.
Таким образом, аффинность связывания между IL-2Rβ и GI102-M45 измеряли, как проиллюстрировано на Фиг. 30, а аффинность связывания между IL-2Rβ и GI102-M61 измеряли, как проиллюстрировано на Фиг. 31. При этом, аффинность связывания между IL-2Rβ и GI102-M72 измеряли, как проиллюстрировано на Фиг. 32.
III. Определение иммунной активности слитого белка
Экспериментальный пример 9. Определение продукции IFN-γ, вызываемой слитым белком
Экспериментальный пример 9.1. Культивирование CFSE-меченных PBMC
Мононуклеарные клетки периферической крови (PBMC), выделенные у человека, метили карбоксифлуоресцеин сукцинимидиловым эфиром (CFSE) путем их взаимодействия с 1 мкМ красителя CFSE CellTrace при 37°C в течение 20 минут. CFSE, не связанный с клетками, удаляли путем взаимодействия в течение 5 минут с культуральной средой, имеющей объем в 5 раз больше, чем объем раствора реакции окрашивания, а затем центрифугирования при 1300 об/мин в течение 5 минут. CFB-меченные PBMC ресуспендировали в культуральной среде (RPMI1640 среда, содержащая 10% FBS, 10 мМ HEPES, 100 Ед/мл пенициллина/стрептомицина, 1 мМ пирувата натрия, 55 мкМ 2-меркаптоэтанола, 1 мМ заменимых аминокислот и 2 мМ L-глутамина) и затем добавляли в 96-луночный планшет при 1×105 клеток на лунку. Осуществляли обработку с использованием 5 мкг/мл PHA (Лактин из Phaseolus Vulgaris, красной фасоли, Sigma-Aldrich, St. Louis, MO, USA, Cat. No. L1668-5MG) и GI101, GI101C1, GI101C2 или IL-2 (Альдеслейкин; человеческий рекомбинантный IL-2, Novartis) и осуществляли инкубацию в 5% CO2 инкубаторе при 37°C в течение 6 дней.
В данном случае, обработку с использованием GI101, GI101C1, GI101C2 и IL-2 осуществляли при концентрации 1 нМ, 10 нМ или 100 нМ. Клетки анализировали методом FACS и человеческий IFN-γ, присутствующий в культуральной среде, измеряли с использованием набора ELISA (Biolegend, San Diego, CA, USA, Cat. No. 430103).
Экспериментальный пример 9.2. FACS анализ
Клеточные осадки после центрифугирования, полученные путем удаления супернатанта, промывали FACS буфером (3% FBS, 10 мМ EDTA, 1M HEPES, 100 единиц/мл Пенициллина Стрептомицина, 10 мкг/мл, 1 мМ пирувата натрия) и затем подвергали взаимодействию с Fc блокатором (Biolegend, Cat. No. 422302) при 4°C в течение 5 минут. Затем осуществляли обработку с использованием APC анти-CD3 Ab (Biolegend, Cat. No. 300412) и PE анти-CD8a Ab (Biolegend, Cat. No. 300908) и реакции давали осуществиться при 4°С в течение 20 минут. Затем полученное вещество промывали FACS буфером. Клеточные осадки после центрифугирования ресуспендировали в FACS буфере и затем анализировали с использованием BD LSR Fortessa (BD Biosciences, San Diego, CA, USA) и программы FlowJo.
Экспериментальный пример 9.3. Анализ человеческого IFN-γ методом ELISA
Количество человеческого IFN-γ, секретированного в супернатант каждого образца, в котором осуществляли культивирование клеток, измеряли с использованием набора ELISA, содержащего человеческий IFN-γ (Biolegend, Cat. No. 430103). Вкратце, антитела против человеческого IFN-γ добавляли в ELISA планшет и реакции давали осуществиться в течение ночи при 4°C, чтобы осуществить покрытие планшета этими антителаи. Затем осуществляли блокирование при комнатной температуре в течение 1 часа с использованием раствора PBS, к которому был добавлен 1% BSA. Осуществляли промывку промывочным буфером (0,05% Tween-20 в PBS) и затем стандартный раствор и каждый образец подходящим образом разбавляли и добавляли в планшет. Затем реакции давали осуществиться при комнатной температуре в течение 2 часов.
После завершения реакции планшет промывали и добавляли вторичные антитела (детекторные антитела). Реакции давали осуществиться при комнатной температуре в течение 1 часа. Осуществляли промывку промывочным буфером и затем добавляли раствор Авидин-HRP. Реакции давали осуществиться при комнатной температуре в течение 30 минут. Добавляли раствор субстрата и индуцировали реакцию проявления цвета в темноте при комнатной температуре в течение 20 минут. В завершение, добавляли H2SO4 для остановки реакции проявления цвета и измеряли поглощение при 450 нм с использованием спектрофотометра для микропланшетов Epoch (BioTek Instruments, Inc., Winooski, VT, USA).
В результате, было обнаружено, что клетки, обработанные GI101, показали значительное повышение секреции IFN-γ по сравнению с клетками, обработанными GI101C1, GI101C2 или IL-2 (Фиг. 33 и 34).
Экспериментальный пример 10. Определение эффекта GI101 на пролиферацию CD8+ T-клеток
Мононуклеарные клетки периферической крови (PBMC), выделенные у человека, метили CFSE путем их взаимодействия с 1 мкМ красителя CFSE CellTrace при 37°C в течение 20 минут. CFSE, не связанный с клетками, удаляли путем взаимодействия в течение 5 минут с культуральной средой, имеющей объем в 5 раз больше, чем объем раствора реакции окрашивания, а затем центрифугирования при 1300 об/мин в течение 5 минут. CFB-меченные PBMC ресуспендировали в культуральной среде (RPMI1640 среда, содержащая 10% FBS, 10 мМ HEPES, 100 Ед/мл пенициллина/стрептомицина, 1 мМ пирувата натрия, 55 мкМ 2-меркаптоэтанола, 1 мМ заменимых аминокислот и 2 мМ L-глутамина) и затем добавляли в 96-луночный планшет при 1×105 клеток на лунку.
Затем осуществляли обработку с использованием 1 мкг/мл анти-CD3ε антитела (Biolegend Cat. No. L1668-5MG) и GI101, GI101C1, GI101C2 или Пролейкина (Novartis) и осуществляли инкубацию в 5% CO2 инкубаторе при 37°C в течение 6 дней. Клетки обрабатывали GI101, GI101C1, GI101C2 и IL-2 при концентрации 100 нМ. Инкубированные клетки исследовали на степень их пролиферации путем измерения, используя FACS анализ и APC-TCRαβ и PE-CD8α антитела, доли CD8+ T-клеток, которые не были CFSE-меченными.
В результате, было обнаружено, что GI101 активировал пролиферацию CD8+ T-клеток in vitro в такой же степени, как IL-2 Пролейкин дикого типа (Фиг. 35 и 36).
Экспериментальный пример 11. Определение эффекта GI101 и GI102 на пролиферацию CD8+ T-клеток
Человеческие PBMC закупали у Allcells (Lot # 3014928, USA). Использовали 1M красителя CFSE CellTrace, который подвергали взаимодействию с человеческими PBMC в светоблокирующих условиях при комнатной температуре в течение 20 минут. Клетки метили CFSE путем их взаимодействия с 1 мМ красителя CFSE CellTrace при 37°C в течение 20 минут. CFSE, не связанный с клетками, удаляли путем взаимодействия в течение 5 минут с культуральной средой, имеющей объем в 5 раз больше, чем объем раствора реакции окрашивания, а затем центрифугирования при 1300 об/мин в течение 5 минут. CFB-меченные PBMC ресуспендировали в культуральной среде (RPMI1640 среда, содержащая 10% FBS, 10 мМ HEPES, 100 Ед/мл пенициллина/стрептомицина, 1 мМ пирувата натрия, 55 мкМ 2-меркаптоэтанола, 1 мМ заменимых аминокислот и 2 мМ L-глутамина) и затем добавляли в 96-луночный планшет при 1×105 клеток на лунку.
Затем CFB-меченные PBMC обрабатывали при помощи 1 мкг/мл анти-CD3ε антитела (OKT3, eBioscience, USA) и GI101, GI101C1, GI101C2 или Пролейкина (Novartis) и осуществляли инкубацию в 5% CO2 инкубаторе при 37°C в течение 7 дней. Клетки подвергали обработке GI101, GI101C1, GI101C2 и IL-2 при концентрации 10 мМ.
Инкубированные клетки исследовали на степень их пролиферации путем измерения, используя FACS анализ и антитело против человеческого CD4-PE (Biolegend, USA), антитело против человеческого CD8-PE/Cy7 (Biolegend, USA) и антитело против человеческого FoxP3-APC (Biolegend, USA), доли CD8+ T-клеток, которые не были CFSE-меченными.
Как результат, группы обработки GI101, GI102_M61, GI101C2 и Пролейкином показали значительное повышение доли CD8+ T-клеток по сравнению с контрольной группой (без стимула), группой обработки только анти-CD3 антителом и группой обработки GI101C1. При этом, по сравнению с группой отрицательного контроля (без стимула) и группой обработки только анти-CD3, группы обработки GI101, GI101C2 и Пролейкином показали значительное повышение пролиферации CD4+/FoxP3+ Treg клеток, тогда как группы обработки GI102 и GI101C1 не показали значительного повышения пролиферации CD4+/FoxP3+ Treg клеток (Фиг. 37).
Экспериментальный пример 12. Определение эффекта GI101 или GI101w на пролиферацию CD8+ T-клеток и NK клеток
7-недельных C57BL/6 мышей закупали у Orient Bio (Busan, Korea) и разделяли на 3 группы, по 3 мыши в каждой группе, и мышам интраперитонеально вводили PBS, GI101 или GI101w. GI101 и GI101w соответственно получали при 40,5 мкг в 200 мкл PBS и вводили путем интраперитонеальной инъекции. Через пять дней после инъекции у мышей в каждой группе удаляли селезенки. Из них выделяли клетки и общее количество клеток измеряли с использованием гематоцитометра. Спленоциты исследовали на долю содержащихся в них CD8+ T-клеток и NK клеток методом FACS с использованием окрашивания APC-CD3ε антителом (Biolegend; 145-2C11), PE-NK1.1 антителом (Biolegend; PK136) и Pacific blue-CD8α антителом (BD; 53-6,7). Таким образом, рассчитывали количества CD8+ T-клеток и NK клеток, присутствующих в селезенке.
В результате, было определено, что GI101 активировал пролиферацию CD8+ T-клеток и NK клеток in vivo по сравнению с GI101w (Фиг. 38 и 39).
Экспериментальный пример 13. Определение эффекта GI101 на функцию T-клеток
Эксперимент осуществляли с использованием набора для биоанализа блокады CTLA-4 (Promega Cat. No. JA4005). Вкратце, эксперимент осуществляли следующим образом. CTLA-4 эффекторные клетки, которые хранили в жидком азоте, оттаивали на водяной бане при постоянной температуре 37°C в течение 3 минут и 0,8 мл CTLA-4 эффекторных клеток тщательно смешивали с 3,2 мл предварительно нагретого аналитического буфера (90% RPMI+10% FBS). Затем смесь добавляли в 96-луночный белый культуральный планшет (SPL, Cat. No. 30196) при 25 мкл на лунку. Затем добавляли 25 мкл GI101 при различных концентрациях. Для отрицательного контроля добавляли 25 мкл аналитического буфера. Затем белый культуральный планшет закрывали крышкой и выдерживали при комнатной температуре до подготовки aAPC/Raji клеток.
aAPC/Raji клетки, которые хранили в жидком азоте, оттаивали на водяной бане при постоянной температуре 37°C в течение 3 минут и 0,8 мл aAPC/Raji клеток тщательно смешивали с 3,2 мл предварительно нагретого аналитического буфера. Затем 25 мкл смеси добавляли в планшет и реакции давали осуществиться в 5% CO2 инкубаторе при 37°C в течение 16 часов. После завершения реакции полученное вещество оставляли выстаиваться при комнатной температуре в течение 15 минут и затем к нему добавляли Bio-Glo реагент, соблюдая осторожность, чтобы избежать образования пузырьков. Bio-Glo реагент также добавляли в три из самых крайних лунок и эти лунки использовали в качестве холостых лунок для коррекции фонового сигнала. Реакции давали осуществиться при комнатной температуре в течение 10 минут и затем измеряли люминесценцию с использованием Cytation 3 (BioTek Instruments, Inc., Winooski, VT, USA). Конечный анализ данных осуществляли путем расчета интенсивности сигнала люминесценции (RLU) (GI101-фон)/RLU (отсутствие обработки-фон).
В результате, было обнаружено, что GI101, связанный с CTLA-4, экспрессировался на эффекторных T-клетках и активировал функцию T-клеток, а не ингибировал ее (Фиг. 40 и 41).
Экспериментальный пример 14. Определение эффекта mGI101 и mGI102 на иммунные клетки
7-недельных C57BL/6 мышей закупали у Orient Bio (Korea) и разделяли на 3 группы, по 3 мыши в каждой группе, и мышам вводили внутривенно PBS, 3 мг/кг, 6 мг/кг или 12 мг/кг GI101 или 3 мг/кг, 6 мг/кг или 12 мг/кг mGI102 (mGI102-M61). В дни 1, 3, 5, 7 и 14 после инъекции селезенки мышей в каждой группе удаляли. Затем в тканях селезенки рассчитывали количества эффекторных CD8+ T-клеток, NK клеток и Treg клеток методом FACS с использованием соответствующих антител и соответственно рассчитывали количества эффекторных CD8+ T-клеток и NK клеток по отношению к количеству Treg клеток. Ниже представлена информация, касающаяся антител, используемых в каждом клеточном анализе:
Эффекторные CD8+ T-клетки: PB антитело против CD3ε мышиного (Biolegend, # 155612; KT3.1.1), FITC антитело против мышиного CD8α (BD, # 553031, 53-6.7), PE/Cy7 антитело против мышиного CD44 (Biolegend, # 103030; IM7), APC антитело против мышиного CD122 (Biolegend, # 123214; TM-β1)
NK клетки: PB антитело против мышиного CD3ε (Biolegend, # 155612; KT3,1,1), PE антитело против мышиного NK-1.1 (Biolegend, # 108708; PK136)
Treg клетки: FITC антитело против мышиного CD3 (Biolegend, # 100204; 17A2), PB антитело против мышиного CD4 (Biolegend, # 100531; RM4-5), PE антитело против мышиного CD25 (Biolegend, # 102008; PC61), APC антитело против мышиного Foxp3 (Invitrogen, # FJK-16s, 17-5773-82).
Как результат, группа, которой вводили mGI101 или mGI102 (mGI102-M61), показала значительное повышение количества CD8+ T-клеток и NK клеток во временных точках от 3 дней до 14 дней после введения, по сравнению с группой введения PBS. При этом было обнаружено, что группа, которой вводили mGI102, показала значительное повышение соотношений активированные CD8+ T-клетки/Treg клетки и NK клетки/Treg клетки во временных точках от 3 дней до 14 дней после введения по сравнению с группой введения PBS (Фиг. 42).
IV. Определение противоракового эффекта слитого белка
Экспериментальный пример 15. Определение эффекта GI101 на раковые клетки, сверхэкспрессирующие PD-L1
NCl-H292 раковую клеточную линию, сверхэкспрессирующую PD-L1, культивировали в течение 3 часов в культуральной среде, содержащей 10 мкг/мл Митомицина C (Sigma), и затем Митомицин C удаляли путем промывки культуральной средой. Затем 5×104 клеток Митомицин C-обработанной NCl-H292 раковой клеточной линии инкубировали с 1×105 PBMC клеток человека в 96-луночном планшете. Осуществляли обработку с использованием 5 мкг/мл PHA (Sigma) для T-клеточной активности. Кроме того, GI101C1 и GI101 при концентрации 50 нМ подвергали взаимодействию с IgG1-Fc (Biolegend) или абатецептом (= Orencia; Bristol-Myers Squibb) при концентрации 50 нМ в течение 30 минут при 4°C и затем полученное вещество использовали для обработки NCl-H292 раковых клеток. Через 3 дня собирали супернатант инкубированных клеток и количество IFN-γ определяли с использованием набора ELISA (Biolegend).
В качестве группы положительного контроля использовали человеческие PBMC, стимулированные PHA, в отсутствие Митомицин C-обработанной NCl-H292 раковой клеточной линии; а в качестве группы отрицательного контроля использовали человеческие PBMC, стимулированные PHA, в присутствии Митомицин C-обработанной NCl-H292 раковой клеточной линии. Экспериментальный способ с использованием набора IFN-γ ELISA осуществляли таким же способом, как в Экспериментальном примере 9.3.
Как результат, GI101 эффективно активировал иммунный ответ, который был ингибирован раковой клеточной линией сверхэкспрессирующей PD-L1. При этом, было обнаружено, что GI101 ингибировал передачу сигналов CTLA-4, экспрессируемого на эффекторных T-клетках (Фиг. 43 и 44).
Экспериментальный пример 16. Определение противоракового эффекта GI101 у мышей с трансплантированными клетками колоректального рака, полученными от мыши
5×106 клеток/0,05 мл мышиной CT-26 раковой клеточной линии смешивали с 0,05 мл матригелевой матрицы без фенолового красного (BD) и осуществляли трансплантацию 0,1 мл смеси путем подкожного введения в правую дорсальную область 6-недельным самкам мышей BALB/c (Orient Bio). Через определенный период времени после трансплантации раковых клеток измеряли объем опухоли и отбирали субъектов, у которых достигался объем около 80 мм3-120 мм3, затем субъектам внутривенно вводили 0,1 мл GI101. Всего осуществляли три введения один раз каждые три дня после первого введения, а группе отрицательного контроля вводили PBS. Размер опухоли измеряли ежедневно для определения противоракового эффекта.
В результате, было обнаружено, что мыши с трансплантированной раковой клеточной линией CT-26, получавшие GI101, показали существенное уменьшение размера опухоли по сравнению с группой отрицательного контроля (Фиг. 45 и 46).
Экспериментальный пример 17. Определение противоракового эффекта mGI101 у мышей с трансплантированными клетками меланомы, полученными от мыши
C57BL/6 мышей (самки, 7-недельные), приобретенных у Orient Bio, подвергали акклиматизации в течение 7 дней. Затем 5×106 клеток раковой клеточной линии B16F10 (ATCC, USA) смешивали с 0,05 мл матригелевой матрицы без фенолового красного (BD) и аллотрансплантацию смеси осуществляли путем подкожного введения при 0,1 мл в правую дорсальную область мыши. Через определенный период времени после трансплантации раковых клеток измеряли объем опухоли и отбирали субъектов, у которых достигался объем около 50 мм3-120 мм3, и затем отобранных мышей делили на равные группы на основании размера опухоли и массы тела, по 10 мышей в каждой группе.
Затем, используя разовый шприц (31G, 1 мл), hIgG4 при дозе 4 мг/кг вводили группе отрицательного контроля, а анти-PD-1 антитело при дозе 5 мг/кг вводили группе положительного контроля. Для экспериментальных групп осуществляли внутривенное введение mGI101 при дозе 1 мг/кг или 4 мг/кг. Кроме того, группы, которым вводили mGI101 при дозе 4 мг/кг и анти-PD-1 антитело при дозе 5 мг/кг, также были установлены как экспериментальные группы. Всего осуществляли три введения один раз каждые три дня после первого введения. Размер опухоли измеряли ежедневно.
Как результат, исходный объем опухоли во всех группах был 90 мм3, и стандартная ошибка (S.E.) для каждой группы составляла 5 мм3-6 мм3. В группе отрицательного контроля изменение объема опухоли наблюдали в течение экспериментального периода, когда объем опухоли увеличивался от 90 мм3 до 1434 мм3 вплоть до 15 дней после введения.
В группе, которой вводили mGI101 при дозе 1 мг/кг, наблюдали, что объем опухоли увеличивался от 90 мм3 до 885 мм3 в течение экспериментального периода, который является таким же периодом, как для группы отрицательного контроля, и статистически значимое ингибирование роста опухоли наблюдали в некоторых измеряемых временных точках (p-значение: 0,5 в день 11, p-значение < 0,01 в день 7, p-значение <0,001 в день 3). В группе, которой вводили mGI101 при дозе 4 мг/кг, наблюдали, что объем опухоли увеличивался от 90 мм3 до 748 мм3 в течение экспериментального периода, который является таким же периодом, как для группы отрицательного контроля, и статистически значимое ингибирование роста опухоли наблюдали в некоторых измеряемых временных точках (p-значение: 0,5 в день 9, p-значение <0,01 в дни 7 и 11).
Кроме того, анализировали процент ингибирования роста опухоли с использованием в качестве сравнения группу, которой вводили mIgG при дозе 4 мг/кг, и сравнивая эту группу с каждой из других групп. В группе, которой вводили mGI101 при дозе 1 мг/кг, наблюдали ингибирование роста 36,5% по сравнению с группой отрицательного контроля, и не наблюдали никакой статистически значимой разницы (p-значение: 0,5). В группе, которой вводили mGI101 при дозе 4 мг/кг, наблюдали статистически значимый (p-значение: 0,5) процент ингибирования роста опухоли по сравнению с группой отрицательного контроля. Всего осуществляли два введения один раз каждые три дня после первого введения. Размер опухоли измеряли ежедневно.
Таким образом, было обнаружено, что в испытании на эффективность ингибирования роста опухоли B16F10, аллотрансплантата меланомы, введенного мышам C57BL/6, mGI101 показал эффект ингибирования роста опухоли дозозависимым образом (Фиг. 47 и 48).
Экспериментальный пример 18. Определение противоракового эффекта mGI101 у мышей с трансплантированными клетками колоректального рака, полученными от мыши
BALB/c мышей (самки, 7-недельные), приобретенных у Orient Bio, подвергали акклиматизации в течение 7 дней. Затем 5×106 клеток CT-26 раковой клеточной линии (ATCC, USA) смешивали с 0,05 мл матригелевой матрицы без фенолового красного (BD) и осуществляли аллотрансплантацию смеси путем подкожного введения при 0,1 мл в правую дорсальную область мыши. Через определенный период времени после трансплантации раковых клеток измеряли объем опухоли и отбирали субъектов, у которых достигался объем около 28 мм3, и затем отобранных мышей делили на равные группы на основании размера опухоли и массы тела, по 10 мышей в каждой группе. Затем, используя разовый шприц (31G, 1 мл), hIgG4 при дозе 6 мг/кг вводили группе отрицательного контроля. Для экспериментальных групп осуществляли внутривенное введение mGI101 при дозе 3 мг/кг, 6 мг/кг или 12 мг/кг. Всего осуществляли три введения один раз каждые три дня после первого введения. Размер опухоли измеряли ежедневно.
В результате, было обнаружено, что экспериментальная группа, которой вводили mGI101 при дозе 6 мг/кг или 12 мг/кг, показала существенное ингибирование роста опухоли в некоторых измеряемых временных точках и в конце испытания по сравнению с группой отрицательного контроля (Фиг. 49). При этом, в результате измерения выживаемости, было обнаружено, что экспериментальная группа, которой вводили mGI101 при дозе 6 мг/кг, показала существенное улучшение в некоторых измеряемых временных точках и в конце испытания по сравнению с группой отрицательного контроля (Фиг. 50).
Экспериментальный пример 19. Определение противоракового эффекта GI101 у мышей с трансплантированными клетками колоректального рака, полученными от мыши
Экспериментальный пример 19.1. Определение опухоль-ингибирующего эффекта
BALB/c мышей (самки, 7-недельные), приобретенных у Orient Bio, подвергали акклиматизации в течение 7 дней. Затем 5×106 клеток раковой клеточной линии CT-26 (ATCC, USA) суспендировали в 0,1 мл PBS и осуществляли аллотрансплантацию суспензии путем подкожного введения при 0,1 мл в правую дорсальную область мыши. Через определенный период времени после трансплантации раковых клеток измеряли объем опухоли и отбирали субъектов, у которых достигался объем около 50 мм3-200 мм3, и затем отобранных мышей делили на равные группы на основании размера опухоли и массы тела, по 10 мышей в каждой группе. Затем, используя разовый шприц (31G, 1 мл), никакого лекарственного средства не вводили группе отрицательного контроля, а группам положительного контроля вводили внутривенно анти-PD-1 антитело при дозе 5 мг/кг, или анти-PD-1 антитело при дозе 5 мг/кг, и анти-CTLA-4 антитело при дозе 5 мг/кг. Для экспериментальных групп осуществляли внутривенное введение GI101 при дозе 0,1 мг/кг или 1 мг/кг. Всего осуществляли три введения один раз каждые три дня после первого введения. Размер опухоли измеряли ежедневно.
Как результат, все группы мышей с трансплантированной раковой клеточной линией CT-26, которым вводили анти-PD-1 антитело, анти-PD-1 антитело и анти-CTLA-4 антитело или GI101 при дозе 0,1 мг/кг или 1 мг/кг, показали существенное ингибирование роста опухоли по сравнению с группой отрицательного контроля. В частности, экспериментальная группа, которой вводили GI101 при дозе 0,1 мг/кг, показала существенный опухоль-ингибирующий эффект по сравнению с группой обработки анти-PD-1 антителом (* p < 0,05) (Фиг. 51).
Экспериментальный пример 19.2. Анализ иммунных клеток в раковой ткани
Мышей каждой группы в Экспериментальном примере 19.1 умерщвляли, когда объем опухоли достигал в среднем 200 мм3, и раковые ткани собирали. Затем раковые ткани разделяли до уровня отдельных клеток для анализа иммунных клеток в них и затем осуществляли FACS анализ на иммунные клетки в раковых тканях с использованием следующих антител: антитело против мышиного CD3 (Biolegend, Cat. No. 100320), антитело против мышиного CD4 (Biolegend, Cat. No. 100526), антитело против мышиного CD8 (Biolegend, Cat. No. 100750), антитело против мышиного FoxP3 (eBioscience, Cat. No. 12-5773-82), антитело против мышиного CD25 (Biolegend, Cat. No. 102049), антитело против мышиного CD44 (eBioscience, Cat. No. 61-0441-82), антитело против мышиного PD-1 (Biolegend, Cat. No. 135218), антитело против мышиного IFN-гамма (Biolegend, Cat. No. 505832), антитело против мышиного CD49b (Biolegend, Cat. No. 108906), антитело против мышиного H2 (Invitrogen, Cat. No. A15443), антитело против мышиного CD11c (Biolegend, Cat. No. 117343), антитело против мышиного CD80 (eBioscience, Cat. No. 47-4801-82), антитело против мышиного CD86 (Biolegend, Cat. No. 104729), антитело против мышиного F4/80 (eBioscience, Cat. No. 47-4801-82) и антитело против мышиного CD206 (eBioscience, Cat. No. 17-2061-80).
Как результат, экспериментальная группа, которой вводили GI101 при дозе 0,1 мг/кг, показала значительное увеличение CD8+ T-клеток по сравнению с группой положительного контроля, которой вводили только анти-PD-1 антитело при дозе 5 мг/кг (* p < 0,05, Фиг. 52 и 53). При этом все экспериментальные группы, которым вводили GI101, показали существенно повышенный уровень экспрессии IFN-γ в T-клетках по сравнению с группой отрицательного контроля (* p < 0,05, Фиг. 52 и 53). При этом, экспериментальная группа, которой вводили GI101 при дозе 0,1 мг/кг, показала увеличение количества M1 макрофагов по сравнению с группой отрицательного контроля и группой положительного контроля, которой вводили только анти-PD-1 антитело (Фиг. 54 и 55). При этом, все экспериментальные группы, которым вводили GI101, показали повышенный уровень экспрессии CD86 в макрофагах и дендритных клетках (* p < 0,05, Фиг. 54-57).
Экспериментальный пример 20. Определение противоракового эффекта GI101 у мышей с трансплантированными клетками рака легкого, полученными от мыши
Экспериментальный пример 20.1. Определение опухоль-ингибирующего эффекта
C57BL/6 мышей (самки, 7-недельные), приобретенных у Orient Bio, подвергали акклиматизации в течение 7 дней. Затем 5×106 клеток раковой клеточной линии LLC2 (ATCC, USA) суспендировали в 0,1 мл PBS и осуществляли аллотрансплантацию суспензии путем подкожного введения при 0,1 мл в правую дорсальную область мыши. Через определенный период времени после трансплантации раковых клеток измеряли объем опухоли и отбирали субъектов, у которых достигался объем около 50 мм3-200 мм3, и затем отобранных мышей делили на равные группы на основании размера опухоли и массы тела, по 10 мышей в каждой группе. Затем, используя разовый шприц (31G, 1 мл), никакого лекарственного средства не вводили группе отрицательного контроля, а группам положительного контроля вводили внутривенно анти-PD-1 антитело при дозе 5 мг/кг или анти-PD-1 антитело при дозе 5 мг/кг и анти-CTLA-4 антитело при дозе 5 мг/кг. Для экспериментальных групп осуществляли внутривенное введение GI101 при дозе 0,1 мг/кг или 1 мг/кг. Всего осуществляли три введения один раз каждые три дня после первого введения. Размер опухоли измеряли ежедневно.
Как результат, все экспериментальные группы показали существенный опухоль-ингибирующий эффект по сравнению с группой отрицательного контроля (* p < 0,05) (Фиг. 58).
Экспериментальный пример 20.2. Анализ иммунных клеток в раковой ткани
Мышей каждой группы в Экспериментальном примере 20.1 умерщвляли, когда объем опухоли достигал в среднем 200 мм3, и раковые ткани собирали. Затем осуществляли FACS анализ таким же способом, как Экспериментальном примере 19.2 для анализа иммунных клеток в раковых тканях.
Как результат, экспериментальная группа, которой вводили GI101 при дозе 0,1 мг/кг, показала значительное увеличение CD8+ T-клеток по сравнению с группой положительного контроля, которой вводили только анти-PD-1 антитело (* p < 0,05, Фиг. 59). При этом, все экспериментальные группы, которым вводили GI101, показали существенно повышенный уровень экспрессии IFN-γ по сравнению с группой отрицательного контроля (* p <0,05, Фиг. 59). При этом, все экспериментальные группы, которым вводили GI101, показали повышенный уровень экспрессии CD86 в макрофагах и дендритных клетках (* p < 0,05, Фиг. 59 to 61).
Экспериментальный пример 21. Определение противоракового эффекта mGI102-M61 у мышей с трансплантированными клетками колоректального рака, полученными от мыши
BALB/c мышей (самки, 7-недельные), приобретенных у Orient Bio, подвергали акклиматизации в течение 7 дней. Затем 5×106 клеток раковой клеточной линии CT-26 (ATCC, USA) смешивали с 0,05 мл матригелевой матрицы без фенолового красного (BD) и осуществляли аллотрансплантацию смеси путем подкожного введения при 0,1 мл в правую дорсальную область мыши. Через определенный период времени после трансплантации раковых клеток измеряли объем опухоли и отбирали субъектов, у которых достигался объем около 28 мм3, и затем отобранных мышей делили на равные группы на основании размера опухоли и массы тела, по 10 мышей в каждой группе. Затем, используя разовый шприц (31G, 1 мл), группе отрицательного контроля вводили hIgG4 при дозе 6 мг/кг. Для экспериментальных групп осуществляли внутривенное введение mGI102-M61 при дозе 3 мг/кг, 6 мг/кг или 12 мг/кг. Всего осуществляли три введения один раз каждые три дня после первого введения. Размер опухоли измеряли ежедневно.
В результате было определено, что экспериментальная группа, которой вводили mGI102-M61 при дозе 12 мг/кг, показала существенное ингибирование роста опухоли в некоторых измеряемых временных точках и в конце испытания, по сравнению с группой отрицательного контроля (Фиг. 62). При этом, в результате измерения выживаемости, было определено, что экспериментальная группа, которой вводили mGI102-M61 при дозе 12 мг/кг, показала существенное улучшение в некоторых измеряемых временных точках и в конце испытания, по сравнению с группой отрицательного контроля (Фиг. 63).
Экспериментальный пример 22. Определение противоракового эффекта mGI101 у мышей с трансплантированными клетками колоректального рака, полученными от мыши
BALB/c мышей (самки, 7-недельные), приобретенных у Orient Bio, подвергали акклиматизации в течение 7 дней. Затем 5×106 клеток CT-26 раковой клеточной линии (ATCC, USA) смешивали с 0,05 мл матригелевой матрицы без фенолового красного (BD) и осуществляли аллотрансплантацию смеси путем подкожного введения при 0,1 мл в правую дорсальную область мыши. Через определенный период времени после трансплантации раковых клеток измеряли объем опухоли и отбирали субъектов, у которых достигался объем около 200 мм3-250 мм3, и затем отобранных мышей делили на равные группы на основании размера опухоли и массы тела, по 10 мышей в каждой группе.
Затем, используя разовый шприц (31G, 1 мл), группе отрицательного контроля вводили hIgG4 при дозе 4 мг/кг. Для экспериментальных групп осуществляли внутривенное введение mGI101 при дозе 1 мг/кг, 4 мг/кг или 6 мг/кг. Кроме того, группы, которым вводили mCD80 при 4,9 мг/кг или Fc-IL-2v (GI101C2) при 2,8 мг/кг, были установлены как контрольные группы. При этом, группа, которой одновременно вводили mCD80 при 4,9 мг/кг и Fc-IL-2v (GI101C2) при 2,8 мг/кг, была установлена как контрольная группа.
При измерении объема опухоли было определено, что группа, которой вводили mGI101 при дозе 6 мг/кг, показала существенное ингибирование в некоторых измеряемых временных точках и в конце испытания, по сравнению с отрицательным контролем. Отличный процент ингибирования роста опухоли наблюдали по сравнению с группой, которой вводили комбинацию mCD80 и Fc-IL-2v (GI101C2) (Фиг. 64 и 65).
В заключение, в испытании эффективности ингибирования роста опухоли на BALB/c мышах с аллотрансплантатом CT-26, BALB/c мышиной клеточной линии колоректального рака, было продемонстрировано, что испытываемое вещество mGI101 обладало опухоль-ингибирующей эффективностью в условиях этого испытания по сравнению с отдельными препаратами mCD80 и IL-2v; и было определено, что mGI101 проявлял отличную противораковую эффективность по сравнению с группой, которой вводили комбинацию mCD80 и IL-2v (Фиг. 64 и 65). В частности, группа, которой вводили mGI101 при дозе 6 мг/кг, показала существенное ингибирование размера опухоли по сравнению с группой отрицательного контроля и группой, которой вводили комбинацию mCD80 и Fc-IL2v (GI101C2).
V. Оценка токсичности слитого белка
Экспериментальный пример 23. Оценка GI101 на токсичность с использованием обезьян
Экспериментальный пример 23.1. Содержание обезьян и введение лекарственного средства
В настоящем эксперименте использовали девять самцов Филиппинских обезьян (обезьяны Cynomolgus) возраста 2-3 лет. Эксперимент осуществляли в соответствии с "Act on Welfare and Management of Animals" в Японии и "Guidance for Animal Care and Use" компании Ina Research Inc. Протокол эксперимента был рассмотрен Комитетом по содержанию и использованию лабораторных животных (IACUC) Ina Research Inc и затем одобрен AAALAC International (Accredited Unit No. 001107).
Эксперимент осуществляли, начиная за один день до введения лекарственного средства и вплоть до 15 дней после введения лекарственного средства. Каждую обезьяну наблюдали вокруг клетки и дополнительно проверяли стул. Массу тела измеряли с использованием цифровой шкалы (LDS-150H, Shimadzu Corporation) за день до введения лекарственного средства и в дни 1, 8 и 15 после введения лекарственного средства. При этом, оставшееся количество пищи измеряли со дня перед введением лекарственного средства вплоть до умерщвления обезьян.
В этом эксперименте одноразовый шприц (24G) заполняли лекарственным средством GI101 и всего осуществляли два введения внутривенным путем, при этом каждое введение осуществляли при скорости 0,17 мл/сек. GI101 вводили два раза, с недельным интервалом, при дозе 5 мг/кг/день или 10 мг/кг/день. Контрольной группе вводили PBS (pH 7,4) таким же способом.
Экспериментальный пример 23.2. Клиническое обследование, определение изменений массы тела и потребления пищи
Клиническое обследование и измерение изменений массы тела и потребления пищи осуществляли с дня перед введением лекарственного средства вплоть до дней 1, 8 и 15 после введения лекарственного средства. Как результат, GI101 не вызывал никакой токсичности (Фиг. 66-69).
Экспериментальный пример 23.3. Анализ крови
Кровь собирали у обезьян в Экспериментальном примере 23.1 за день до введения лекарственного средства и в дни 1, 8 и 15 после введения лекарственного средства. Кровь собирали через бедренную вену с использованием одноразового шприца (22G). Собранную кровь подвергали анализу с использованием Automated Hematology System XN-2000 (Sysmex Corporation) и Automated Blood Coagulation Analyzer CA-510 (Sysmex Corporation) на показатели, перечисленные в Таблице 2 ниже.
RET #
109/л
Diff WBC #
103/мкл
Как результат, группа, которой вводили GI101 при дозе 5 мг/кг/день или 10 мг/кг/день, показала увеличение количества ретикулоцитов, лейкоцитов и лимфоцитов в день 15 (Фиг. 70-72).
Экспериментальный пример 23.4. Клинический и химический анализ
Кровь у обезьян в Экспериментальном примере 23.1 собирали за день до введения лекарственного средства и в дни 1, 8 и 15 после введения лекарственного средства. Кровь собирали таким же способом, как в Экспериментальном примере 23.3. Собранную кровь подвергали клиническому и химическому анализу с использованием клинического анализатора модели 7180 (Hitachi High-Technologies Corporation) на показатели, перечисленные в Таблице 3 ниже.
Как результат, в клиническом и химическом анализе не было обнаружено никакой токсичности, вызываемой GI101 (Фиг. 73-79).
Экспериментальный пример 21.5. Анализ цитокинов
Кровь у обезьян в Экспериментальном примере 23.1 собирали за день до введения лекарственного средства и в дни 1, 8 и 15 после введения лекарственного средства. Кровь собирали таким же способом, как в Экспериментальном примере 23.3. С использованием устройства Bio-Plex 200 (Bio-Rad Laboratories, Inc.) и набора для анализа Non-Human Primate Cytokine Magnetic Bead Panel (EMD Millipore) собранную кровь анализировали на TNF-α, IFN-γ IL-1β, IL-2, IL-4, IL-6, IL-8, IL-10 и IL-12. Как результат, не было обнаружено никакой токсичности, вызываемой GI101, что касается анализа цитокинов (Фиг. 80 и 81).
Экспериментальный пример 23.6. Анализ иммунных клеток
Кровь у обезьян в Экспериментальном примере собирали 23.1 за день до введения лекарственного средства и в дни 1, 8 и 15 после введения лекарственного средства. Кровь собирали таким же способом, как в Экспериментальном примере 23.3. С использованием проточного цитометра (LSRFortessa X-20, Becton, Dickinson and Company) собранную кровь анализировали на следующие показатели:
1) Ki67+CD4: CD45+/CD3+/CD4+/Ki67+
2) Ki67+CD8: CD45+/CD3+/CD8+/Ki67+
3) Ki67+Treg: CD45+/CD3+/FoxP3+/Ki67+
4) Ki67+ICOS+Treg: CD45+/CD3+/FoxP3+/Ki67+/CD278+
5) ICOS+Treg: CD45+/CD3+/FoxP3+/CD278+
6) Ki67+NK клетки: CD45+/CD16+ и CD56+/Ki67+.
Как результат, в анализе иммунных клеток все группы, которым вводили GI101, показали в день 15 увеличение количества T-клеток, CD4+ T-клеток, CD8+ T-клеток, регуляторных T-клеток, NK клеток и Ki67+ T-клеток, Ki67+ CD4+ T-клеток, Ki67+ CD8+ T-клеток, Ki67+ регуляторных T-клеток, Ki67+ ICOS+ регуляторных T-клеток, Ki67+ NK клеток, ICOS+ регуляторных T-клеток.
В частности, в лимфоцитах, доля T-клеток, CD4+ T-клеток, регуляторных T-клеток увеличивалась, а доля NK клеток уменьшалась, при этом доля CD8+ T-клеток не изменялась. Доля регуляторных T-клеток увеличивалась в день 3 и уменьшалась в дни 8 и 15. Однако при этом доля была больше, чем в контрольной группе.
Кроме того, что касается доли иммунных клеток, которые представляют собой Ki67+, в соответствующих иммунных клетках доля Ki67+ T-клеток, Ki67+ CD4+ T-клеток, Ki67+ CD8+ T-клеток, Ki67+ регуляторных T-клеток, Ki67+ ICOS+ регуляторных T-клеток, Ki67+ NK клеток и ICOS+ регуляторных T-клеток увеличивалась.
При этом, доля Ki67+ T-клеток, Ki67+ CD8+ T-клеток и Ki67+ NK клеток увеличивалась в дни 3, 8 и 15; доля Ki67+ CD4+ T-клеток и Ki67+ регуляторных T-клеток увеличивалась в дни 3 и 8; и доля Ki67+ ICOS+ регуляторных T-клеток и ICOS+ регуляторных T-клеток увеличивалась только в день 8 (Фиг. 82-87).
Экспериментальный пример 23.7. Патологический анализ
В день 16 обезьян в Экспериментальном примере 23.1 умерщвляли и все органы и ткани фиксировали с использованием 10% формалина. Однако яички фиксировали с использованием раствора формалина-сахарозы-уксусной кислоты (FSA), а глаза и зрительный нерв фиксировали с использованием 1% формальдегида-2,5% глутаральдегида в фосфатном буфере. Гематоксилиновое-эозиновое окрашивание осуществляли на органах и тканях, перечисленных в Таблице 4 ниже, и наблюдения осуществляли под оптическим микроскопом.
(с желчным пузырем, из которого удалена желчь)
R&L: осуществляли с обоими правым и левым органами/тканями;
L: осуществляли либо с правым, либо с левым (обычно с левым) органом/тканью;
R: осуществляли либо с правым, либо с левым (обычно с правым) органом/тканью.
Как результат, группа, получавшая GI101 при дозе 5 мг/кг/день или 10 мг/кг/день, показала увеличение массы селезенки (Фиг. 88). Никаких существенных изменений в других тканях не наблюдали. В заключение, в группах, которым вводили GI101, наблюдались некоторые изменения, но никакой токсичности не наблюдалось.
VI. Экспериментальный пример 24 для определения противоракового эффекта GI102. Определение противоракового эффекта GI102-M45
Экспериментальный пример 24.1. Определение противоракового эффекта GI102-M45 у мышей с трансплантированными клетками колоректального рака, полученными от мыши
5×106 клетки/0,05 мл мышиной CT-26 раковой клеточной линии смешивали с 0,05 мл матригелевой матрицы без фенолового красного (BD) и трансплантацию смеси осуществляли путем подкожного введения при 0,1 мл в правую дорсальную область 6-недельным самкам BALB/c мышей (Orient Bio). Через определенный период времени после трансплантации раковых клеток измеряли объем опухоли и отбирали субъектов, у которых достигался объем около 80 мм3-120 мм3. Затем субъектам внутривенно вводили 0,1 мл GI102-M45. Всего осуществляли три введения один раз каждые три дня после первого введения, а для отрицательного контроля вводили PBS. Размер опухоли измеряли ежедневно для определения противоракового эффекта. Активность GI102-M45 определяли таким же способом, как в Экспериментальном примере 16.
Экспериментальный пример 24.2. Определение противоракового эффекта GI102-M45 у мышей с трансплантированными клетками легкого, полученными от мыши
C57BL/6 мышей (самки, 7-недельные), приобретенных у Orient Bio, подвергали акклиматизации в течение 7 дней. Затем 5×106 клеток LLC2 раковой клеточной линии (ATCC, USA) суспендировали в 0,1 мл PBS и аллотрансплантацию суспензии осуществляли путем подкожного введения при 0,1 мл в правую дорсальную область мыши. Через определенный период времени после трансплантации раковых клеток измеряли объем опухоли и отбирали субъектов, у которых достигался объем около 50 мм3-200 мм3, и затем отобранных мышей делили на равные группы на основании размера опухоли и массы тела, по 10 мышей в каждой группе. Затем, используя разовый шприц (31G, 1 мл), группе отрицательного контроля не вводили никакого лекарственного средства, а группам положительного контроля вводили внутривенно анти-PD-1 антитело при дозе 5 мг/кг или анти-PD-1 антитело при дозе 5 мг/кг и анти-CTLA-4 антитело при дозе 5 мг/кг. Для экспериментальных групп осуществляли внутривенное введение GI102-M45 при дозе 0,1 мг/кг или 1 мг/кг. Всего осуществляли три введения один раз каждые три дня после первого введения. Размер опухоли измеряли ежедневно. Активность GI102-M45 определяли таким же способом, как в Экспериментальном примере 20.1.
Экспериментальный пример 25. Определение противоракового эффекта GI102-M61
Экспериментальный пример 25.1. Определение противоракового эффекта GI102-M61 у мышей с трансплантированными клетками колоректального рака, полученными от мыши
5×106 клеток/0,05 мл мышиной CT-26 раковой клеточной линии смешивали с 0,05 мл матригелевой матрицы без фенолового красного (BD) и трансплантацию смеси осуществляли путем подкожного введения при 0,1 мл в правую дорсальную область 6-недельным самкам BALB/c мышей (Orient Bio). Через определенный период времени после трансплантации раковых клеток измеряли объем опухоли и отбирали субъектов, у которых достигался объем около 80 мм3-120 мм3. Затем субъектам внутривенно вводили 0,1 мл GI102-M61. Всего осуществляли три введения один раз каждые три дня после первого введения, а группе отрицательного контроля вводили PBS. Размер опухоли измеряли ежедневно для определения противоракового эффекта. Активность GI102-M61 определяли таким же способом, как в Экспериментальном примере 16.
Экспериментальный пример 25.2. Определение противоопухолевого эффекта GI102-M61 у мышей с трансплантированными клетками рака легкого, полученными от мыши
C57BL/6 мышей (самки, 7-недельные), приобретенных у Orient Bio, подвергали акклиматизации в течение 7 дней. Затем 5×106 клеток LLC2 раковой клеточной линии (ATCC, USA) суспендировали в 0,1 мл PBS и аллотрансплантацию суспензии осуществляли путем подкожного введения при 0,1 мл в правую дорсальную область мыши. Через определенный период времени после трансплантации раковых клеток измеряли объем опухоли и отбирали субъектов, у которых достигался объем около 50 мм3-200 мм3, и затем отобранных мышей делили на равные группы на основании размера опухоли и массы тела, по 10 мышей в каждой группе. Затем, используя разовый шприц (31G, 1 мл), группе отрицательного контроля не вводили никакого лекарственного средства, а группам положительного контроля вводили внутривенно анти-PD-1 антитело при дозе 5 мг/кг или анти-PD-1 антитело при дозе 5 мг/кг и анти-CTLA-4 антитело при дозе 5 мг/кг. Для экспериментальных групп осуществляли внутривенное введение GI102-M61 при дозе 0,1 мг/кг или 1 мг/кг. Всего осуществляли три введения один раз каждые три дня после первого введения. Размер опухоли измеряли ежедневно. Активность GI102-M61 определяли таким же способом, как в Экспериментальном примере 20.1.
Экспериментальный пример 26. Определение противоракового эффекта GI102-M72
Экспериментальный пример 26.1. Определение противоопухолевого эффекта GI102-M72 у мышей с трансплантированными клетками колоректального рака, полученными от мыши
5×106 клеток/0,05 мл мышиной CT-26 раковой клеточной линии смешивали с 0,05 мл матригелевой матрицы без фенолового красного (BD) и трансплантацию смеси осуществляли путем подкожного введения при 0,1 мл в правую дорсальную область 6-недельным самкам BALB/c мышей (Orient Bio). Через определенный период времени после трансплантации раковых клеток измеряли объем опухоли и отбирали субъектов, у которых достигался объем около 80 мм3-120 мм3. Затем субъектам внутривенно вводили 0,1 мл GI102-M72. Всего осуществляли три введения один раз каждые три дня после первого введения, а группе отрицательного контроля вводили PBS. Размер опухоли измеряли ежедневно для определения противоракового эффекта. Активность GI102-M72 определяли таким же способом, как в Экспериментальном примере 16.
Экспериментальный пример 26.2. Определение противоракового эффекта GI102-M72 у мышей с трансплантированными клетками рака легкого, полученными от мыши
C57BL/6 мышей (самки, 7-недельные), приобретенных у Orient Bio, подвергали акклиматизации в течение 7 дней. Затем 5×106 клеток LLC2 раковой клеточной линии (ATCC, USA) суспендировали в 0,1 мл PBS и аллотрансплантацию суспензии осуществляли путем подкожного введения при 0,1 мл в правую дорсальную область мыши. Через определенный период времени после трансплантации раковых клеток измеряли объем опухоли и отбирали субъектов, у которых достигался объем около 50 мм3-200 мм3, и затем отобранных мышей делили на равные группы на основании размера опухоли и массы тела, по 10 мышей в каждой группе. Затем, используя разовый шприц (31G, 1 мл), группе отрицательного контроля не вводили никакого лекарственного средства, а группам положительного контроля вводили внутривенно анти-PD-1 антитело при дозе 5 мг/кг или анти-PD-1 антитело при дозе 5 мг/кг и анти-CTLA-4 антитело при дозе 5 мг/кг. Для экспериментальных групп осуществляли внутривенное введение GI102-M72 при дозе 0,1 мг/кг или 1 мг/кг. Всего осуществляли три введения один раз каждые три дня после первого введения. Размер опухоли измеряли ежедневно. Активность GI102-M72 определяли таким же способом, как в Экспериментальном примере 20.1.
--->
<110> GI Innovation, Inc.
<120> СЛИТЫЙ БЕЛОК, ВКЛЮЧАЮЩИЙ БЕЛОК IL-2 И БЕЛОК CD80,
И ЕГО ПРИМЕНЕНИЕ
<130> PCB907063GEE
<150> KR 10-2018-0110698
<151> 2018-09-17
<150> KR 10-2019-0001867
<151> 2019-01-07
<150> US 62/832013
<151> 2019-04-10
<150> KR 10-2019-0053436
<151> 2019-05-08
<160> 37
<170> KopatentIn 3.0
<210> 1
<211> 25
<212> Белок
<213> Искусственная последовательность
<220>
<223> сигнальный пептид (TPA)
<400> 1
Met Asp Ala Met Leu Arg Gly Leu Cys Cys Val Leu Leu Leu Cys Gly
1 5 10 15
Ala Val Phe Val Ser Pro Ser His Ala
20 25
<210> 2
<211> 208
<212> Белок
<213> Искусственная последовательность
<220>
<223> hB7-1:35-242
<400> 2
Val Ile His Val Thr Lys Glu Val Lys Glu Val Ala Thr Leu Ser Cys
1 5 10 15
Gly His Asn Val Ser Val Glu Glu Leu Ala Gln Thr Arg Ile Tyr Trp
20 25 30
Gln Lys Glu Lys Lys Met Val Leu Thr Met Met Ser Gly Asp Met Asn
35 40 45
Ile Trp Pro Glu Tyr Lys Asn Arg Thr Ile Phe Asp Ile Thr Asn Asn
50 55 60
Leu Ser Ile Val Ile Leu Ala Leu Arg Pro Ser Asp Glu Gly Thr Tyr
65 70 75 80
Glu Cys Val Val Leu Lys Tyr Glu Lys Asp Ala Phe Lys Arg Glu His
85 90 95
Leu Ala Glu Val Thr Leu Ser Val Lys Ala Asp Phe Pro Thr Pro Ser
100 105 110
Ile Ser Asp Phe Glu Ile Pro Thr Ser Asn Ile Arg Arg Ile Ile Cys
115 120 125
Ser Thr Ser Gly Gly Phe Pro Glu Pro His Leu Ser Trp Leu Glu Asn
130 135 140
Gly Glu Glu Leu Asn Ala Ile Asn Thr Thr Val Ser Gln Asp Pro Glu
145 150 155 160
Thr Glu Leu Tyr Ala Val Ser Ser Lys Leu Asp Phe Asn Met Thr Thr
165 170 175
Asn His Ser Phe Met Cys Leu Ile Lys Tyr Gly His Leu Arg Val Asn
180 185 190
Gln Thr Phe Asn Trp Asn Thr Thr Lys Gln Glu His Phe Pro Asp Asn
195 200 205
<210> 3
<211> 30
<212> Белок
<213> Искусственная последовательность
<220>
<223> шарнир
<400> 3
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
1 5 10 15
Ser Ala Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
20 25 30
<210> 4
<211> 216
<212> Белок
<213> Искусственная последовательность
<220>
<223> fc иммуноглобулина
<400> 4
Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Leu Gly
210 215
<210> 5
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> линкер
<400> 5
Gly Gly Gly Gly Ser
1 5
<210> 6
<211> 133
<212> Белок
<213> Искусственная последовательность
<220>
<223> hIL-2M
<400> 6
Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His
1 5 10 15
Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys
20 25 30
Asn Pro Lys Leu Thr Ala Met Leu Thr Ala Lys Phe Tyr Met Pro Lys
35 40 45
Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Glu Glu Leu Lys
50 55 60
Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu
65 70 75 80
Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu
85 90 95
Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala
100 105 110
Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser Ile
115 120 125
Ile Ser Thr Leu Thr
130
<210> 7
<211> 617
<212> Белок
<213> Искусственная последовательность
<220>
<223> слитый белок, включающий варианты IL-2 и фрагменты CD80
<400> 7
Met Asp Ala Met Leu Arg Gly Leu Cys Cys Val Leu Leu Leu Cys Gly
1 5 10 15
Ala Val Phe Val Ser Pro Ser His Ala Val Ile His Val Thr Lys Glu
20 25 30
Val Lys Glu Val Ala Thr Leu Ser Cys Gly His Asn Val Ser Val Glu
35 40 45
Glu Leu Ala Gln Thr Arg Ile Tyr Trp Gln Lys Glu Lys Lys Met Val
50 55 60
Leu Thr Met Met Ser Gly Asp Met Asn Ile Trp Pro Glu Tyr Lys Asn
65 70 75 80
Arg Thr Ile Phe Asp Ile Thr Asn Asn Leu Ser Ile Val Ile Leu Ala
85 90 95
Leu Arg Pro Ser Asp Glu Gly Thr Tyr Glu Cys Val Val Leu Lys Tyr
100 105 110
Glu Lys Asp Ala Phe Lys Arg Glu His Leu Ala Glu Val Thr Leu Ser
115 120 125
Val Lys Ala Asp Phe Pro Thr Pro Ser Ile Ser Asp Phe Glu Ile Pro
130 135 140
Thr Ser Asn Ile Arg Arg Ile Ile Cys Ser Thr Ser Gly Gly Phe Pro
145 150 155 160
Glu Pro His Leu Ser Trp Leu Glu Asn Gly Glu Glu Leu Asn Ala Ile
165 170 175
Asn Thr Thr Val Ser Gln Asp Pro Glu Thr Glu Leu Tyr Ala Val Ser
180 185 190
Ser Lys Leu Asp Phe Asn Met Thr Thr Asn His Ser Phe Met Cys Leu
195 200 205
Ile Lys Tyr Gly His Leu Arg Val Asn Gln Thr Phe Asn Trp Asn Thr
210 215 220
Thr Lys Gln Glu His Phe Pro Asp Asn Gly Ser Gly Gly Gly Gly Ser
225 230 235 240
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ala Glu Ser Lys Tyr Gly
245 250 255
Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser
260 265 270
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Gln Leu Met Ile Ser Arg
275 280 285
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
290 295 300
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
305 310 315 320
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
325 330 335
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
340 345 350
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
355 360 365
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
370 375 380
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
385 390 395 400
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
405 410 415
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
420 425 430
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
435 440 445
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Leu His Glu Ala
450 455 460
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Gly
465 470 475 480
Gly Gly Gly Ser Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu
485 490 495
Gln Leu Glu His Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile
500 505 510
Asn Asn Tyr Lys Asn Pro Lys Leu Thr Ala Met Leu Thr Ala Lys Phe
515 520 525
Tyr Met Pro Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu
530 535 540
Glu Glu Leu Lys Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys
545 550 555 560
Asn Phe His Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile
565 570 575
Val Leu Glu Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala
580 585 590
Asp Glu Thr Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe
595 600 605
Cys Gln Ser Ile Ile Ser Thr Leu Thr
610 615
<210> 8
<211> 1857
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотиды, кодирующие слитый белок (GI101)
<400> 8
atggatgcta tgctgagagg cctgtgttgc gtgctgctgc tgtgtggcgc tgtgttcgtg 60
tctccttctc acgctgtgat ccacgtgacc aaagaagtga aagaggtcgc cacactgtcc 120
tgcggccaca acgtttcagt ggaagaactg gcccagacca ggatctactg gcagaaagaa 180
aagaaaatgg tgctgaccat gatgtccggc gacatgaaca tctggcctga gtacaagaac 240
cggaccatct tcgacatcac caacaacctg tccatcgtga ttctggccct gaggccttct 300
gatgagggca cctatgagtg cgtggtgctg aagtacgaga aggacgcctt caagcgcgag 360
cacctggctg aagtgacact gtccgtgaag gccgactttc ccacaccttc catctccgac 420
ttcgagatcc ctacctccaa catccggcgg atcatctgtt ctacctctgg cggctttcct 480
gagcctcacc tgtcttggct ggaaaacggc gaggaactga acgccatcaa caccaccgtg 540
tctcaggacc ccgaaaccga gctgtacgct gtgtcctcca agctggactt caacatgacc 600
accaaccaca gcttcatgtg cctgattaag tacggccacc tgagagtgaa ccagaccttc 660
aactggaaca ccaccaagca agagcacttc cctgacaatg gatctggcgg cggaggttct 720
ggcggaggtg gaagcggagg cggaggatct gctgagtcta agtatggccc tccttgtcct 780
ccatgtcctg ctccagaagc tgctggcgga ccctctgtgt tcctgtttcc tccaaagcct 840
aaggaccagc tcatgatctc tcggacaccc gaagtgacct gcgtggtggt ggatgtgtct 900
caagaggacc ctgaggtgca gttcaattgg tacgtggacg gcgtggaagt gcacaacgcc 960
aagaccaagc ctagagagga acagttcaac tccacctaca gagtggtgtc cgtgctgacc 1020
gtgctgcacc aggattggct gaacggcaaa gagtacaagt gcaaggtgtc caacaagggc 1080
ctgccttcca gcatcgaaaa gaccatctcc aaggctaagg gccagcctag ggaaccccag 1140
gtttacaccc tgcctccaag ccaagaggaa atgaccaaga accaggtgtc cctgacctgc 1200
ctggtcaagg gcttctaccc ttccgacatt gccgtggaat gggagtccaa tggccagcct 1260
gagaacaact acaagaccac acctcctgtg ctggactccg acggctcctt ctttctgtac 1320
tctcgcctga ccgtggacaa gtctagatgg caagagggca acgtgttctc ctgctctgtg 1380
ctgcacgagg ccctgcacaa tcactacacc cagaagtccc tgtctctgtc tcttggaggt 1440
ggtggcggtt ctgcccctac cagctcctct accaagaaaa cccagctcca gttggagcat 1500
ctgctgctgg acctccagat gattctgaac gggatcaaca actataagaa ccccaagctg 1560
accgccatgc tgaccgctaa gttctacatg cccaagaagg ccaccgagct gaagcacctc 1620
cagtgcctgg aagaagaact gaagcccctg gaagaggtgc tgaatctggc ccagtccaag 1680
aacttccacc tgaggccacg ggacctgatc agcaacatca acgtgatcgt gctggaactg 1740
aagggctccg agacaacctt tatgtgcgag tacgccgacg agacagccac catcgtggaa 1800
tttctgaacc ggtggatcac cttctgccag agcatcatct ccacactgac ctgatga 1857
<210> 9
<211> 592
<212> Белок
<213> Искусственная последовательность
<220>
<223> слитый белок (GI101)
<400> 9
Val Ile His Val Thr Lys Glu Val Lys Glu Val Ala Thr Leu Ser Cys
1 5 10 15
Gly His Asn Val Ser Val Glu Glu Leu Ala Gln Thr Arg Ile Tyr Trp
20 25 30
Gln Lys Glu Lys Lys Met Val Leu Thr Met Met Ser Gly Asp Met Asn
35 40 45
Ile Trp Pro Glu Tyr Lys Asn Arg Thr Ile Phe Asp Ile Thr Asn Asn
50 55 60
Leu Ser Ile Val Ile Leu Ala Leu Arg Pro Ser Asp Glu Gly Thr Tyr
65 70 75 80
Glu Cys Val Val Leu Lys Tyr Glu Lys Asp Ala Phe Lys Arg Glu His
85 90 95
Leu Ala Glu Val Thr Leu Ser Val Lys Ala Asp Phe Pro Thr Pro Ser
100 105 110
Ile Ser Asp Phe Glu Ile Pro Thr Ser Asn Ile Arg Arg Ile Ile Cys
115 120 125
Ser Thr Ser Gly Gly Phe Pro Glu Pro His Leu Ser Trp Leu Glu Asn
130 135 140
Gly Glu Glu Leu Asn Ala Ile Asn Thr Thr Val Ser Gln Asp Pro Glu
145 150 155 160
Thr Glu Leu Tyr Ala Val Ser Ser Lys Leu Asp Phe Asn Met Thr Thr
165 170 175
Asn His Ser Phe Met Cys Leu Ile Lys Tyr Gly His Leu Arg Val Asn
180 185 190
Gln Thr Phe Asn Trp Asn Thr Thr Lys Gln Glu His Phe Pro Asp Asn
195 200 205
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
210 215 220
Ser Ala Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
290 295 300
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
325 330 335
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
355 360 365
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
385 390 395 400
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
405 410 415
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Leu Gly Gly Gly Gly Gly Ser Ala Pro Thr Ser Ser
450 455 460
Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His Leu Leu Leu Asp Leu
465 470 475 480
Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys Asn Pro Lys Leu Thr
485 490 495
Ala Met Leu Thr Ala Lys Phe Tyr Met Pro Lys Lys Ala Thr Glu Leu
500 505 510
Lys His Leu Gln Cys Leu Glu Glu Glu Leu Lys Pro Leu Glu Glu Val
515 520 525
Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu Arg Pro Arg Asp Leu
530 535 540
Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu Lys Gly Ser Glu Thr
545 550 555 560
Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala Thr Ile Val Glu Phe
565 570 575
Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser Ile Ile Ser Thr Leu Thr
580 585 590
<210> 10
<211> 133
<212> Белок
<213> Искусственная последовательность
<220>
<223> hIL-2
<400> 10
Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His
1 5 10 15
Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys
20 25 30
Asn Pro Lys Leu Thr Arg Met Leu Thr Phe Lys Phe Tyr Met Pro Lys
35 40 45
Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Glu Glu Leu Lys
50 55 60
Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu
65 70 75 80
Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu
85 90 95
Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala
100 105 110
Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser Ile
115 120 125
Ile Ser Thr Leu Thr
130
<210> 11
<211> 288
<212> Белок
<213> Искусственная последовательность
<220>
<223> CD80
<400> 11
Met Gly His Thr Arg Arg Gln Gly Thr Ser Pro Ser Lys Cys Pro Tyr
1 5 10 15
Leu Asn Phe Phe Gln Leu Leu Val Leu Ala Gly Leu Ser His Phe Cys
20 25 30
Ser Gly Val Ile His Val Thr Lys Glu Val Lys Glu Val Ala Thr Leu
35 40 45
Ser Cys Gly His Asn Val Ser Val Glu Glu Leu Ala Gln Thr Arg Ile
50 55 60
Tyr Trp Gln Lys Glu Lys Lys Met Val Leu Thr Met Met Ser Gly Asp
65 70 75 80
Met Asn Ile Trp Pro Glu Tyr Lys Asn Arg Thr Ile Phe Asp Ile Thr
85 90 95
Asn Asn Leu Ser Ile Val Ile Leu Ala Leu Arg Pro Ser Asp Glu Gly
100 105 110
Thr Tyr Glu Cys Val Val Leu Lys Tyr Glu Lys Asp Ala Phe Lys Arg
115 120 125
Glu His Leu Ala Glu Val Thr Leu Ser Val Lys Ala Asp Phe Pro Thr
130 135 140
Pro Ser Ile Ser Asp Phe Glu Ile Pro Thr Ser Asn Ile Arg Arg Ile
145 150 155 160
Ile Cys Ser Thr Ser Gly Gly Phe Pro Glu Pro His Leu Ser Trp Leu
165 170 175
Glu Asn Gly Glu Glu Leu Asn Ala Ile Asn Thr Thr Val Ser Gln Asp
180 185 190
Pro Glu Thr Glu Leu Tyr Ala Val Ser Ser Lys Leu Asp Phe Asn Met
195 200 205
Thr Thr Asn His Ser Phe Met Cys Leu Ile Lys Tyr Gly His Leu Arg
210 215 220
Val Asn Gln Thr Phe Asn Trp Asn Thr Thr Lys Gln Glu His Phe Pro
225 230 235 240
Asp Asn Leu Leu Pro Ser Trp Ala Ile Thr Leu Ile Ser Val Asn Gly
245 250 255
Ile Phe Val Ile Cys Cys Leu Thr Tyr Cys Phe Ala Pro Arg Cys Arg
260 265 270
Glu Arg Arg Arg Asn Glu Arg Leu Arg Arg Glu Ser Val Arg Pro Val
275 280 285
<210> 12
<211> 215
<212> Белок
<213> Искусственная последовательность
<220>
<223> модифицированный Fc
<400> 12
Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys
1 5 10 15
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
20 25 30
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
35 40 45
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
50 55 60
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
65 70 75 80
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
85 90 95
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
100 105 110
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
115 120 125
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
130 135 140
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
145 150 155 160
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
165 170 175
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
180 185 190
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
195 200 205
Leu Ser Leu Ser Leu Gly Lys
210 215
<210> 13
<211> 306
<212> Белок
<213> Искусственная последовательность
<220>
<223> mCD80
<400> 13
Met Ala Cys Asn Cys Gln Leu Met Gln Asp Thr Pro Leu Leu Lys Phe
1 5 10 15
Pro Cys Pro Arg Leu Ile Leu Leu Phe Val Leu Leu Ile Arg Leu Ser
20 25 30
Gln Val Ser Ser Asp Val Asp Glu Gln Leu Ser Lys Ser Val Lys Asp
35 40 45
Lys Val Leu Leu Pro Cys Arg Tyr Asn Ser Pro His Glu Asp Glu Ser
50 55 60
Glu Asp Arg Ile Tyr Trp Gln Lys His Asp Lys Val Val Leu Ser Val
65 70 75 80
Ile Ala Gly Lys Leu Lys Val Trp Pro Glu Tyr Lys Asn Arg Thr Leu
85 90 95
Tyr Asp Asn Thr Thr Tyr Ser Leu Ile Ile Leu Gly Leu Val Leu Ser
100 105 110
Asp Arg Gly Thr Tyr Ser Cys Val Val Gln Lys Lys Glu Arg Gly Thr
115 120 125
Tyr Glu Val Lys His Leu Ala Leu Val Lys Leu Ser Ile Lys Ala Asp
130 135 140
Phe Ser Thr Pro Asn Ile Thr Glu Ser Gly Asn Pro Ser Ala Asp Thr
145 150 155 160
Lys Arg Ile Thr Cys Phe Ala Ser Gly Gly Phe Pro Lys Pro Arg Phe
165 170 175
Ser Trp Leu Glu Asn Gly Arg Glu Leu Pro Gly Ile Asn Thr Thr Ile
180 185 190
Ser Gln Asp Pro Glu Ser Glu Leu Tyr Thr Ile Ser Ser Gln Leu Asp
195 200 205
Phe Asn Thr Thr Arg Asn His Thr Ile Lys Cys Leu Ile Lys Tyr Gly
210 215 220
Asp Ala His Val Ser Glu Asp Phe Thr Trp Glu Lys Pro Pro Glu Asp
225 230 235 240
Pro Pro Asp Ser Lys Asn Thr Leu Val Leu Phe Gly Ala Gly Phe Gly
245 250 255
Ala Val Ile Thr Val Val Val Ile Val Val Ile Ile Lys Cys Phe Cys
260 265 270
Lys His Arg Ser Cys Phe Arg Arg Asn Glu Ala Ser Arg Glu Thr Asn
275 280 285
Asn Ser Leu Thr Phe Gly Pro Glu Glu Ala Leu Ala Glu Gln Thr Val
290 295 300
Phe Leu
305
<210> 14
<211> 1848
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотиды, кодирующие слитый белок (mGI101)
<400> 14
atggatgcta tgctgagagg cctgtgttgc gtgctgctgc tgtgtggcgc tgtgttcgtg 60
tctccttctc acgctgtgga cgagcagctc tccaagtccg tgaaggataa ggtcctgctg 120
ccttgccggt acaactctcc tcacgaggac gagtctgagg accggatcta ctggcagaaa 180
cacgacaagg tggtgctgtc cgtgatcgcc ggaaagctga aagtgtggcc tgagtacaag 240
aacaggaccc tgtacgacaa caccacctac agcctgatca tcctgggcct cgtgctgagc 300
gatagaggca cctattcttg cgtggtgcag aagaaagagc ggggcaccta cgaagtgaag 360
cacctggctc tggtcaagct gtccatcaag gccgacttca gcacccctaa catcaccgag 420
tctggcaacc cttccgccga caccaagaga atcacctgtt tcgcctctgg cggcttccct 480
aagcctcggt tctcttggct ggaaaacggc agagagctgc ccggcatcaa taccaccatt 540
tctcaggacc cagagtccga gctgtacacc atctccagcc agctcgactt taacaccacc 600
agaaaccaca ccatcaagtg cctgattaag tacggcgacg cccacgtgtc cgaggacttt 660
acttgggaga aacctcctga ggaccctcct gactctggat ctggcggcgg aggttctggc 720
ggaggtggaa gcggaggcgg aggatctgct gagtctaagt atggccctcc ttgtcctcca 780
tgtcctgctc cagaagctgc tggcggaccc tctgtgttcc tgtttcctcc aaagcctaag 840
gaccagctca tgatctctcg gacccctgaa gtgacctgcg tggtggtgga tgtgtctcaa 900
gaggaccctg aggtgcagtt caattggtac gtggacggcg tggaagtgca caacgccaag 960
accaagccta gagaggaaca gttcaactcc acctatagag tggtgtccgt gctgaccgtg 1020
ctgcaccagg attggctgaa cggcaaagag tacaagtgca aggtgtccaa caagggcctg 1080
ccttccagca tcgaaaagac catcagcaag gctaagggcc agcctaggga accccaggtt 1140
tacaccctgc ctccaagcca agaggaaatg accaagaacc aggtgtccct gacctgcctg 1200
gtcaagggct tctacccttc cgacattgcc gtggaatggg agtccaatgg ccagcctgag 1260
aacaactaca agaccacacc tcctgtgctg gactccgacg gctccttctt tctgtactct 1320
cgcctgaccg tggacaagtc taggtggcaa gagggcaacg tgttctcctg ctctgtgctg 1380
cacgaggctc tgcacaacca ctacacccag aagtccctgt ctctgtctct tggaggtggt 1440
ggcggttctg cccctacctc cagctctacc aagaaaaccc agctccagtt ggagcatctg 1500
ctgctggacc tccagatgat cctgaatggc atcaacaatt acaagaaccc caagctgacc 1560
gccatgctga ccgctaagtt ctacatgccc aagaaggcca ccgagctgaa gcacttgcag 1620
tgcctggaag aggaactgaa gcccctggaa gaagtgctga atctggccca gtccaagaac 1680
ttccacctga ggcctaggga cctgatctcc aacatcaacg tgatcgtgct ggaactgaaa 1740
ggctccgaga caaccttcat gtgcgagtac gccgacgaga cagccaccat cgtggaattt 1800
ctgaaccggt ggatcacctt ctgccagagc atcatctcca cactgacc 1848
<210> 15
<211> 616
<212> Белок
<213> Искусственная последовательность
<220>
<223> слитый белок (mGI101)
<400> 15
Met Asp Ala Met Leu Arg Gly Leu Cys Cys Val Leu Leu Leu Cys Gly
1 5 10 15
Ala Val Phe Val Ser Pro Ser His Ala Val Asp Glu Gln Leu Ser Lys
20 25 30
Ser Val Lys Asp Lys Val Leu Leu Pro Cys Arg Tyr Asn Ser Pro His
35 40 45
Glu Asp Glu Ser Glu Asp Arg Ile Tyr Trp Gln Lys His Asp Lys Val
50 55 60
Val Leu Ser Val Ile Ala Gly Lys Leu Lys Val Trp Pro Glu Tyr Lys
65 70 75 80
Asn Arg Thr Leu Tyr Asp Asn Thr Thr Tyr Ser Leu Ile Ile Leu Gly
85 90 95
Leu Val Leu Ser Asp Arg Gly Thr Tyr Ser Cys Val Val Gln Lys Lys
100 105 110
Glu Arg Gly Thr Tyr Glu Val Lys His Leu Ala Leu Val Lys Leu Ser
115 120 125
Ile Lys Ala Asp Phe Ser Thr Pro Asn Ile Thr Glu Ser Gly Asn Pro
130 135 140
Ser Ala Asp Thr Lys Arg Ile Thr Cys Phe Ala Ser Gly Gly Phe Pro
145 150 155 160
Lys Pro Arg Phe Ser Trp Leu Glu Asn Gly Arg Glu Leu Pro Gly Ile
165 170 175
Asn Thr Thr Ile Ser Gln Asp Pro Glu Ser Glu Leu Tyr Thr Ile Ser
180 185 190
Ser Gln Leu Asp Phe Asn Thr Thr Arg Asn His Thr Ile Lys Cys Leu
195 200 205
Ile Lys Tyr Gly Asp Ala His Val Ser Glu Asp Phe Thr Trp Glu Lys
210 215 220
Pro Pro Glu Asp Pro Pro Asp Ser Gly Ser Gly Gly Gly Gly Ser Gly
225 230 235 240
Gly Gly Gly Ser Gly Gly Gly Gly Ser Ala Glu Ser Lys Tyr Gly Pro
245 250 255
Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Gln Leu Met Ile Ser Arg Thr
275 280 285
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
290 295 300
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
370 375 380
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
385 390 395 400
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
435 440 445
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Leu His Glu Ala Leu
450 455 460
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Gly Gly
465 470 475 480
Gly Gly Ser Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln
485 490 495
Leu Glu His Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn
500 505 510
Asn Tyr Lys Asn Pro Lys Leu Thr Ala Met Leu Thr Ala Lys Phe Tyr
515 520 525
Met Pro Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Glu
530 535 540
Glu Leu Lys Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn
545 550 555 560
Phe His Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val
565 570 575
Leu Glu Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp
580 585 590
Glu Thr Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys
595 600 605
Gln Ser Ile Ile Ser Thr Leu Thr
610 615
<210> 16
<211> 1437
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотиды, кодирующие слитый белок (GI101C1)
<400> 16
atggatgcta tgctgagagg cctgtgttgc gtgctgctgc tgtgtggcgc tgtgttcgtg 60
tctccttctc acgctgtgat ccacgtgacc aaagaagtga aagaggtcgc cacactgtcc 120
tgcggccaca acgtttcagt ggaagaactg gcccagacca ggatctactg gcagaaagaa 180
aagaaaatgg tgctgaccat gatgtccggc gacatgaaca tctggcctga gtacaagaac 240
cggaccatct tcgacatcac caacaacctg tccatcgtga ttctggccct gaggccttct 300
gatgagggca cctatgagtg cgtggtgctg aagtacgaga aggacgcctt caagcgcgag 360
cacctggctg aagtgacact gtccgtgaag gccgactttc ccacaccttc catctccgac 420
ttcgagatcc ctacctccaa catccggcgg atcatctgtt ctacctctgg cggctttcct 480
gagcctcacc tgtcttggct ggaaaacggc gaggaactga acgccatcaa caccaccgtg 540
tctcaggacc ccgaaaccga gctgtacgct gtgtcctcca agctggactt caacatgacc 600
accaaccaca gcttcatgtg cctgattaag tacggccacc tgagagtgaa ccagaccttc 660
aactggaaca ccaccaagca agagcacttc cctgacaatg gatctggcgg cggaggttct 720
ggcggaggtg gaagcggagg cggaggatct gctgagtcta agtatggccc tccttgtcct 780
ccatgtcctg ctccagaagc tgctggcgga ccctctgtgt tcctgtttcc tccaaagcct 840
aaggaccagc tcatgatctc tcggacaccc gaagtgacct gcgtggtggt ggatgtgtct 900
caagaggacc ctgaggtgca gttcaattgg tacgtggacg gcgtggaagt gcacaacgcc 960
aagaccaagc ctagagagga acagttcaac tccacctaca gagtggtgtc cgtgctgacc 1020
gtgctgcacc aggattggct gaacggcaaa gagtacaagt gcaaggtgtc caacaagggc 1080
ctgccttcca gcatcgaaaa gaccatctcc aaggctaagg gccagcctag ggaaccccag 1140
gtttacaccc tgcctccaag ccaagaggaa atgaccaaga accaggtgtc cctgacctgc 1200
ctggtcaagg gcttctaccc ttccgacatt gccgtggaat gggagtccaa tggccagcct 1260
gagaacaact acaagaccac acctcctgtg ctggactccg acggctcctt ctttctgtac 1320
tctcgcctga ccgtggacaa gtctaggtgg caagagggca acgtgttctc ctgctctgtg 1380
ctgcacgagg ccctgcacaa tcactacacc cagaagtccc tgtctctgtc cctgggc 1437
<210> 17
<211> 454
<212> Белок
<213> Искусственная последовательность
<220>
<223> слитый белок (GI101C1)
<400> 17
Val Ile His Val Thr Lys Glu Val Lys Glu Val Ala Thr Leu Ser Cys
1 5 10 15
Gly His Asn Val Ser Val Glu Glu Leu Ala Gln Thr Arg Ile Tyr Trp
20 25 30
Gln Lys Glu Lys Lys Met Val Leu Thr Met Met Ser Gly Asp Met Asn
35 40 45
Ile Trp Pro Glu Tyr Lys Asn Arg Thr Ile Phe Asp Ile Thr Asn Asn
50 55 60
Leu Ser Ile Val Ile Leu Ala Leu Arg Pro Ser Asp Glu Gly Thr Tyr
65 70 75 80
Glu Cys Val Val Leu Lys Tyr Glu Lys Asp Ala Phe Lys Arg Glu His
85 90 95
Leu Ala Glu Val Thr Leu Ser Val Lys Ala Asp Phe Pro Thr Pro Ser
100 105 110
Ile Ser Asp Phe Glu Ile Pro Thr Ser Asn Ile Arg Arg Ile Ile Cys
115 120 125
Ser Thr Ser Gly Gly Phe Pro Glu Pro His Leu Ser Trp Leu Glu Asn
130 135 140
Gly Glu Glu Leu Asn Ala Ile Asn Thr Thr Val Ser Gln Asp Pro Glu
145 150 155 160
Thr Glu Leu Tyr Ala Val Ser Ser Lys Leu Asp Phe Asn Met Thr Thr
165 170 175
Asn His Ser Phe Met Cys Leu Ile Lys Tyr Gly His Leu Arg Val Asn
180 185 190
Gln Thr Phe Asn Trp Asn Thr Thr Lys Gln Glu His Phe Pro Asp Asn
195 200 205
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
210 215 220
Ser Ala Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
290 295 300
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
325 330 335
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
355 360 365
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
385 390 395 400
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
405 410 415
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Leu Gly
450
<210> 18
<211> 1176
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотиды, кодирующие слитый белок (GI101C2)
<400> 18
atggatgcta tgctgagagg cctgtgttgc gtgctgctgc tgtgtggcgc tgtgttcgtg 60
tctccatctc acgccgctga gtctaagtac ggccctcctt gtcctccatg tcctgctcca 120
gaagctgctg gcggaccctc tgtgttcctg tttcctccaa agcctaagga ccagctcatg 180
atctctcgga cccctgaagt gacctgcgtg gtggtggatg tgtctcaaga ggaccctgag 240
gtgcagttca attggtacgt ggacggcgtg gaagtgcaca acgccaagac caagcctaga 300
gaggaacagt tcaactccac ctacagagtg gtgtccgtgc tgaccgtgct gcaccaggat 360
tggctgaacg gcaaagagta caagtgcaag gtgtccaaca agggcctgcc ttccagcatc 420
gaaaagacca tctccaaggc taagggccag cctagggaac cccaggttta caccctgcct 480
ccaagccaag aggaaatgac caagaaccag gtgtccctga cctgcctggt caagggcttc 540
tacccttccg acattgccgt ggaatgggag tccaatggcc agcctgagaa caactacaag 600
accacacctc ctgtgctgga ctccgacggc tccttctttc tgtactctcg cctgaccgtg 660
gacaagtcta ggtggcaaga gggcaacgtg ttctcctgct ctgtgctgca cgaggccctg 720
cacaatcact acacccagaa gtccctgtct ctgtctcttg gcggaggcgg aggatctgct 780
cctacctcca gctccaccaa gaaaacccag ctccagttgg agcatctgct gctggacctc 840
cagatgatcc tgaatggcat caacaattac aagaacccca agctgaccgc catgctgacc 900
gctaagttct acatgcccaa gaaggccacc gagctgaagc acctccagtg cctggaagag 960
gaactgaagc ccctggaaga agtgctgaat ctggcccagt ccaagaactt ccacctgagg 1020
cctagggacc tgatctccaa catcaacgtg atcgtgctgg aactgaaagg ctccgagaca 1080
accttcatgt gcgagtacgc cgacgagaca gccaccatcg tggaatttct gaaccggtgg 1140
atcaccttct gccagtccat catctccaca ctgacc 1176
<210> 19
<211> 367
<212> Белок
<213> Искусственная последовательность
<220>
<223> слитый белок (GI101C2)
<400> 19
Ala Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu
1 5 10 15
Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
20 25 30
Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
35 40 45
Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
50 55 60
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
65 70 75 80
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
85 90 95
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
100 105 110
Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
115 120 125
Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn
130 135 140
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
145 150 155 160
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
165 170 175
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg
180 185 190
Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys
195 200 205
Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
210 215 220
Ser Leu Ser Leu Gly Gly Gly Gly Gly Ser Ala Pro Thr Ser Ser Ser
225 230 235 240
Thr Lys Lys Thr Gln Leu Gln Leu Glu His Leu Leu Leu Asp Leu Gln
245 250 255
Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys Asn Pro Lys Leu Thr Ala
260 265 270
Met Leu Thr Ala Lys Phe Tyr Met Pro Lys Lys Ala Thr Glu Leu Lys
275 280 285
His Leu Gln Cys Leu Glu Glu Glu Leu Lys Pro Leu Glu Glu Val Leu
290 295 300
Asn Leu Ala Gln Ser Lys Asn Phe His Leu Arg Pro Arg Asp Leu Ile
305 310 315 320
Ser Asn Ile Asn Val Ile Val Leu Glu Leu Lys Gly Ser Glu Thr Thr
325 330 335
Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala Thr Ile Val Glu Phe Leu
340 345 350
Asn Arg Trp Ile Thr Phe Cys Gln Ser Ile Ile Ser Thr Leu Thr
355 360 365
<210> 20
<211> 1434
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотиды, кодирующие слитый белок (mGI101C1)
<400> 20
atggatgcta tgctgagagg cctgtgttgc gtgctgctgc tgtgtggcgc tgtgttcgtg 60
tctccttctc acgctgtgga cgagcagctc tccaagtccg tgaaggataa ggtcctgctg 120
ccttgccggt acaactctcc tcacgaggac gagtctgagg accggatcta ctggcagaaa 180
cacgacaagg tggtgctgtc cgtgatcgcc ggaaagctga aagtgtggcc tgagtacaag 240
aacaggaccc tgtacgacaa caccacctac agcctgatca tcctgggcct cgtgctgagc 300
gatagaggca cctattcttg cgtggtgcag aagaaagagc ggggcaccta cgaagtgaag 360
cacctggctc tggtcaagct gtccatcaag gccgacttca gcacccctaa catcaccgag 420
tctggcaacc cttccgccga caccaagaga atcacctgtt tcgcctctgg cggcttccct 480
aagcctcggt tctcttggct ggaaaacggc agagagctgc ccggcatcaa taccaccatt 540
tctcaggacc cagagtccga gctgtacacc atctccagcc agctcgactt taacaccacc 600
agaaaccaca ccatcaagtg cctgattaag tacggcgacg cccacgtgtc cgaggacttt 660
acttgggaga aacctcctga ggaccctcct gactctggat ctggcggcgg aggttctggc 720
ggaggtggaa gcggaggcgg aggatctgct gagtctaagt atggccctcc ttgtcctcca 780
tgtcctgctc cagaagctgc tggcggaccc tctgtgttcc tgtttcctcc aaagcctaag 840
gaccagctca tgatctctcg gacccctgaa gtgacctgcg tggtggtgga tgtgtctcaa 900
gaggaccctg aggtgcagtt caattggtac gtggacggcg tggaagtgca caacgccaag 960
accaagccta gagaggaaca gttcaactcc acctatagag tggtgtccgt gctgaccgtg 1020
ctgcaccagg attggctgaa cggcaaagag tacaagtgca aggtgtccaa caagggcctg 1080
ccttccagca tcgaaaagac catcagcaag gctaagggcc agcctaggga accccaggtt 1140
tacaccctgc ctccaagcca agaggaaatg accaagaacc aggtgtccct gacctgcctg 1200
gtcaagggct tctacccttc cgacattgcc gtggaatggg agtccaatgg ccagcctgag 1260
aacaactaca agaccacacc tcctgtgctg gactccgacg gctccttctt tctgtactct 1320
cgcctgaccg tggacaagtc taggtggcaa gagggcaacg tgttctcctg ctctgtgctg 1380
cacgaggctc tgcacaacca ctacacccag aagtccctgt ctctgtccct gggc 1434
<210> 21
<211> 478
<212> Белок
<213> Искусственная последовательность
<220>
<223> слитый белок (mGI101C1)
<400> 21
Met Asp Ala Met Leu Arg Gly Leu Cys Cys Val Leu Leu Leu Cys Gly
1 5 10 15
Ala Val Phe Val Ser Pro Ser His Ala Val Asp Glu Gln Leu Ser Lys
20 25 30
Ser Val Lys Asp Lys Val Leu Leu Pro Cys Arg Tyr Asn Ser Pro His
35 40 45
Glu Asp Glu Ser Glu Asp Arg Ile Tyr Trp Gln Lys His Asp Lys Val
50 55 60
Val Leu Ser Val Ile Ala Gly Lys Leu Lys Val Trp Pro Glu Tyr Lys
65 70 75 80
Asn Arg Thr Leu Tyr Asp Asn Thr Thr Tyr Ser Leu Ile Ile Leu Gly
85 90 95
Leu Val Leu Ser Asp Arg Gly Thr Tyr Ser Cys Val Val Gln Lys Lys
100 105 110
Glu Arg Gly Thr Tyr Glu Val Lys His Leu Ala Leu Val Lys Leu Ser
115 120 125
Ile Lys Ala Asp Phe Ser Thr Pro Asn Ile Thr Glu Ser Gly Asn Pro
130 135 140
Ser Ala Asp Thr Lys Arg Ile Thr Cys Phe Ala Ser Gly Gly Phe Pro
145 150 155 160
Lys Pro Arg Phe Ser Trp Leu Glu Asn Gly Arg Glu Leu Pro Gly Ile
165 170 175
Asn Thr Thr Ile Ser Gln Asp Pro Glu Ser Glu Leu Tyr Thr Ile Ser
180 185 190
Ser Gln Leu Asp Phe Asn Thr Thr Arg Asn His Thr Ile Lys Cys Leu
195 200 205
Ile Lys Tyr Gly Asp Ala His Val Ser Glu Asp Phe Thr Trp Glu Lys
210 215 220
Pro Pro Glu Asp Pro Pro Asp Ser Gly Ser Gly Gly Gly Gly Ser Gly
225 230 235 240
Gly Gly Gly Ser Gly Gly Gly Gly Ser Ala Glu Ser Lys Tyr Gly Pro
245 250 255
Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Gln Leu Met Ile Ser Arg Thr
275 280 285
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
290 295 300
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
370 375 380
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
385 390 395 400
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
435 440 445
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Leu His Glu Ala Leu
450 455 460
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
465 470 475
<210> 22
<211> 133
<212> Белок
<213> Искусственная последовательность
<220>
<223> варианты IL-2 (3M, M45)
<400> 22
Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His
1 5 10 15
Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys
20 25 30
Asn Pro Lys Leu Thr Ala Met Leu Thr Ala Lys Phe Ala Met Pro Lys
35 40 45
Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Glu Glu Leu Lys
50 55 60
Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu
65 70 75 80
Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu
85 90 95
Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala
100 105 110
Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser Ile
115 120 125
Ile Ser Thr Leu Thr
130
<210> 23
<211> 133
<212> Белок
<213> Искусственная последовательность
<220>
<223> варианты IL-2 (3M, M61)
<400> 23
Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His
1 5 10 15
Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys
20 25 30
Asn Pro Lys Leu Thr Ala Met Leu Thr Ala Lys Phe Tyr Met Pro Lys
35 40 45
Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg Glu Leu Lys
50 55 60
Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu
65 70 75 80
Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu
85 90 95
Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala
100 105 110
Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser Ile
115 120 125
Ile Ser Thr Leu Thr
130
<210> 24
<211> 133
<212> Белок
<213> Искусственная последовательность
<220>
<223> варианты IL-2 (3M, M72)
<400> 24
Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His
1 5 10 15
Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys
20 25 30
Asn Pro Lys Leu Thr Ala Met Leu Thr Ala Lys Phe Tyr Met Pro Lys
35 40 45
Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Glu Glu Leu Lys
50 55 60
Pro Leu Glu Glu Val Leu Asn Gly Ala Gln Ser Lys Asn Phe His Leu
65 70 75 80
Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu
85 90 95
Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala
100 105 110
Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser Ile
115 120 125
Ile Ser Thr Leu Thr
130
<210> 25
<211> 1851
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотиды, кодирующие слитый белок (GI102-M45)
<400> 25
atggatgcta tgctgagagg cctgtgttgc gtgctgctgc tgtgtggcgc tgtgttcgtg 60
tctccttctc acgctgtgat ccacgtgacc aaagaagtga aagaggtcgc cacactgtcc 120
tgcggccaca acgtttcagt ggaagaactg gcccagacca ggatctactg gcagaaagaa 180
aagaaaatgg tgctgaccat gatgtccggc gacatgaaca tctggcctga gtacaagaac 240
cggaccatct tcgacatcac caacaacctg tccatcgtga ttctggccct gaggccttct 300
gatgagggca cctatgagtg cgtggtgctg aagtacgaga aggacgcctt caagcgcgag 360
cacctggctg aagtgacact gtccgtgaag gccgactttc ccacaccttc catctccgac 420
ttcgagatcc ctacctccaa catccggcgg atcatctgtt ctacctctgg cggctttcct 480
gagcctcacc tgtcttggct ggaaaacggc gaggaactga acgccatcaa caccaccgtg 540
tctcaggacc ccgaaaccga gctgtacgct gtgtcctcca agctggactt caacatgacc 600
accaaccaca gcttcatgtg cctgattaag tacggccacc tgagagtgaa ccagaccttc 660
aactggaaca ccaccaagca agagcacttc cctgacaatg gatctggcgg cggaggttct 720
ggcggaggtg gaagcggagg cggaggatct gctgagtcta agtatggccc tccttgtcct 780
ccatgtcctg ctccagaagc tgctggcgga ccctctgtgt tcctgtttcc tccaaagcct 840
aaggaccagc tcatgatctc tcggacaccc gaagtgacct gcgtggtggt ggatgtgtct 900
caagaggacc ctgaggtgca gttcaattgg tacgtggacg gcgtggaagt gcacaacgcc 960
aagaccaagc ctagagagga acagttcaac tccacctaca gagtggtgtc cgtgctgacc 1020
gtgctgcacc aggattggct gaacggcaaa gagtacaagt gcaaggtgtc caacaagggc 1080
ctgccttcca gcatcgaaaa gaccatctcc aaggctaagg gccagcctag ggaaccccag 1140
gtttacaccc tgcctccaag ccaagaggaa atgaccaaga accaggtgtc cctgacctgc 1200
ctggtcaagg gcttctaccc ttccgacatt gccgtggaat gggagtccaa tggccagcct 1260
gagaacaact acaagaccac acctcctgtg ctggactccg acggctcctt ctttctgtac 1320
tctcgcctga ccgtggacaa gtctagatgg caagagggca acgtgttctc ctgctctgtg 1380
ctgcacgagg ccctgcacaa tcactacacc cagaagtccc tgtctctgtc tcttggaggt 1440
ggtggcggtt ctgcccctac cagctcctct accaagaaaa cccagctcca gttggagcat 1500
ctgctgctgg acctccagat gattctgaac gggatcaaca actataagaa ccccaagctg 1560
accgccatgc tgaccgctaa gttcgccatg cccaagaagg ccaccgagct gaagcacctc 1620
cagtgcctgg aagaagaact gaagcccctg gaagaggtgc tgaatctggc ccagtccaag 1680
aacttccacc tgaggccacg ggacctgatc agcaacatca acgtgatcgt gctggaactg 1740
aagggctccg agacaacctt tatgtgcgag tacgccgacg agacagccac catcgtggaa 1800
tttctgaacc ggtggatcac cttctgccag agcatcatct ccacactgac c 1851
<210> 26
<211> 592
<212> Белок
<213> Искусственная последовательность
<220>
<223> слитый белок (GI102-M45)
<400> 26
Val Ile His Val Thr Lys Glu Val Lys Glu Val Ala Thr Leu Ser Cys
1 5 10 15
Gly His Asn Val Ser Val Glu Glu Leu Ala Gln Thr Arg Ile Tyr Trp
20 25 30
Gln Lys Glu Lys Lys Met Val Leu Thr Met Met Ser Gly Asp Met Asn
35 40 45
Ile Trp Pro Glu Tyr Lys Asn Arg Thr Ile Phe Asp Ile Thr Asn Asn
50 55 60
Leu Ser Ile Val Ile Leu Ala Leu Arg Pro Ser Asp Glu Gly Thr Tyr
65 70 75 80
Glu Cys Val Val Leu Lys Tyr Glu Lys Asp Ala Phe Lys Arg Glu His
85 90 95
Leu Ala Glu Val Thr Leu Ser Val Lys Ala Asp Phe Pro Thr Pro Ser
100 105 110
Ile Ser Asp Phe Glu Ile Pro Thr Ser Asn Ile Arg Arg Ile Ile Cys
115 120 125
Ser Thr Ser Gly Gly Phe Pro Glu Pro His Leu Ser Trp Leu Glu Asn
130 135 140
Gly Glu Glu Leu Asn Ala Ile Asn Thr Thr Val Ser Gln Asp Pro Glu
145 150 155 160
Thr Glu Leu Tyr Ala Val Ser Ser Lys Leu Asp Phe Asn Met Thr Thr
165 170 175
Asn His Ser Phe Met Cys Leu Ile Lys Tyr Gly His Leu Arg Val Asn
180 185 190
Gln Thr Phe Asn Trp Asn Thr Thr Lys Gln Glu His Phe Pro Asp Asn
195 200 205
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
210 215 220
Ser Ala Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
290 295 300
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
325 330 335
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
355 360 365
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
385 390 395 400
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
405 410 415
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Leu Gly Gly Gly Gly Gly Ser Ala Pro Thr Ser Ser
450 455 460
Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His Leu Leu Leu Asp Leu
465 470 475 480
Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys Asn Pro Lys Leu Thr
485 490 495
Ala Met Leu Thr Ala Lys Phe Ala Met Pro Lys Lys Ala Thr Glu Leu
500 505 510
Lys His Leu Gln Cys Leu Glu Glu Glu Leu Lys Pro Leu Glu Glu Val
515 520 525
Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu Arg Pro Arg Asp Leu
530 535 540
Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu Lys Gly Ser Glu Thr
545 550 555 560
Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala Thr Ile Val Glu Phe
565 570 575
Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser Ile Ile Ser Thr Leu Thr
580 585 590
<210> 27
<211> 1851
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотиды, кодирующие слитый белок (GI102-M61)
<400> 27
atggatgcta tgctgagagg cctgtgttgc gtgctgctgc tgtgtggcgc tgtgttcgtg 60
tctccttctc acgctgtgat ccacgtgacc aaagaagtga aagaggtcgc cacactgtcc 120
tgcggccaca acgtttcagt ggaagaactg gcccagacca ggatctactg gcagaaagaa 180
aagaaaatgg tgctgaccat gatgtccggc gacatgaaca tctggcctga gtacaagaac 240
cggaccatct tcgacatcac caacaacctg tccatcgtga ttctggccct gaggccttct 300
gatgagggca cctatgagtg cgtggtgctg aagtacgaga aggacgcctt caagcgcgag 360
cacctggctg aagtgacact gtccgtgaag gccgactttc ccacaccttc catctccgac 420
ttcgagatcc ctacctccaa catccggcgg atcatctgtt ctacctctgg cggctttcct 480
gagcctcacc tgtcttggct ggaaaacggc gaggaactga acgccatcaa caccaccgtg 540
tctcaggacc ccgaaaccga gctgtacgct gtgtcctcca agctggactt caacatgacc 600
accaaccaca gcttcatgtg cctgattaag tacggccacc tgagagtgaa ccagaccttc 660
aactggaaca ccaccaagca agagcacttc cctgacaatg gatctggcgg cggaggttct 720
ggcggaggtg gaagcggagg cggaggatct gctgagtcta agtatggccc tccttgtcct 780
ccatgtcctg ctccagaagc tgctggcgga ccctctgtgt tcctgtttcc tccaaagcct 840
aaggaccagc tcatgatctc tcggacaccc gaagtgacct gcgtggtggt ggatgtgtct 900
caagaggacc ctgaggtgca gttcaattgg tacgtggacg gcgtggaagt gcacaacgcc 960
aagaccaagc ctagagagga acagttcaac tccacctaca gagtggtgtc cgtgctgacc 1020
gtgctgcacc aggattggct gaacggcaaa gagtacaagt gcaaggtgtc caacaagggc 1080
ctgccttcca gcatcgaaaa gaccatctcc aaggctaagg gccagcctag ggaaccccag 1140
gtttacaccc tgcctccaag ccaagaggaa atgaccaaga accaggtgtc cctgacctgc 1200
ctggtcaagg gcttctaccc ttccgacatt gccgtggaat gggagtccaa tggccagcct 1260
gagaacaact acaagaccac acctcctgtg ctggactccg acggctcctt ctttctgtac 1320
tctcgcctga ccgtggacaa gtctagatgg caagagggca acgtgttctc ctgctctgtg 1380
ctgcacgagg ccctgcacaa tcactacacc cagaagtccc tgtctctgtc tcttggaggt 1440
ggtggcggtt ctgcccctac cagctcctct accaagaaaa cccagctcca gttggagcat 1500
ctgctgctgg acctccagat gattctgaac gggatcaaca actataagaa ccccaagctg 1560
accgccatgc tgaccgctaa gttctacatg cccaagaagg ccaccgagct gaagcacctc 1620
cagtgcctgg aaagggaact gaagcccctg gaagaggtgc tgaatctggc ccagtccaag 1680
aacttccacc tgaggccacg ggacctgatc agcaacatca acgtgatcgt gctggaactg 1740
aagggctccg agacaacctt tatgtgcgag tacgccgacg agacagccac catcgtggaa 1800
tttctgaacc ggtggatcac cttctgccag agcatcatct ccacactgac c 1851
<210> 28
<211> 592
<212> Белок
<213> Искусственная последовательность
<220>
<223> слитый белок (GI102-M61)
<400> 28
Val Ile His Val Thr Lys Glu Val Lys Glu Val Ala Thr Leu Ser Cys
1 5 10 15
Gly His Asn Val Ser Val Glu Glu Leu Ala Gln Thr Arg Ile Tyr Trp
20 25 30
Gln Lys Glu Lys Lys Met Val Leu Thr Met Met Ser Gly Asp Met Asn
35 40 45
Ile Trp Pro Glu Tyr Lys Asn Arg Thr Ile Phe Asp Ile Thr Asn Asn
50 55 60
Leu Ser Ile Val Ile Leu Ala Leu Arg Pro Ser Asp Glu Gly Thr Tyr
65 70 75 80
Glu Cys Val Val Leu Lys Tyr Glu Lys Asp Ala Phe Lys Arg Glu His
85 90 95
Leu Ala Glu Val Thr Leu Ser Val Lys Ala Asp Phe Pro Thr Pro Ser
100 105 110
Ile Ser Asp Phe Glu Ile Pro Thr Ser Asn Ile Arg Arg Ile Ile Cys
115 120 125
Ser Thr Ser Gly Gly Phe Pro Glu Pro His Leu Ser Trp Leu Glu Asn
130 135 140
Gly Glu Glu Leu Asn Ala Ile Asn Thr Thr Val Ser Gln Asp Pro Glu
145 150 155 160
Thr Glu Leu Tyr Ala Val Ser Ser Lys Leu Asp Phe Asn Met Thr Thr
165 170 175
Asn His Ser Phe Met Cys Leu Ile Lys Tyr Gly His Leu Arg Val Asn
180 185 190
Gln Thr Phe Asn Trp Asn Thr Thr Lys Gln Glu His Phe Pro Asp Asn
195 200 205
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
210 215 220
Ser Ala Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
290 295 300
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
325 330 335
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
355 360 365
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
385 390 395 400
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
405 410 415
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Leu Gly Gly Gly Gly Gly Ser Ala Pro Thr Ser Ser
450 455 460
Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His Leu Leu Leu Asp Leu
465 470 475 480
Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys Asn Pro Lys Leu Thr
485 490 495
Ala Met Leu Thr Ala Lys Phe Tyr Met Pro Lys Lys Ala Thr Glu Leu
500 505 510
Lys His Leu Gln Cys Leu Glu Arg Glu Leu Lys Pro Leu Glu Glu Val
515 520 525
Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu Arg Pro Arg Asp Leu
530 535 540
Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu Lys Gly Ser Glu Thr
545 550 555 560
Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala Thr Ile Val Glu Phe
565 570 575
Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser Ile Ile Ser Thr Leu Thr
580 585 590
<210> 29
<211> 1857
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотиды, кодирующие слитый белок (GI102-M72)
<400> 29
atggatgcta tgctgagagg cctgtgttgc gtgctgctgc tgtgtggcgc tgtgttcgtg 60
tctccttctc acgctgtgat ccacgtgacc aaagaagtga aagaggtcgc cacactgtcc 120
tgcggccaca acgtttcagt ggaagaactg gcccagacca ggatctactg gcagaaagaa 180
aagaaaatgg tgctgaccat gatgtccggc gacatgaaca tctggcctga gtacaagaac 240
cggaccatct tcgacatcac caacaacctg tccatcgtga ttctggccct gaggccttct 300
gatgagggca cctatgagtg cgtggtgctg aagtacgaga aggacgcctt caagcgcgag 360
cacctggctg aagtgacact gtccgtgaag gccgactttc ccacaccttc catctccgac 420
ttcgagatcc ctacctccaa catccggcgg atcatctgtt ctacctctgg cggctttcct 480
gagcctcacc tgtcttggct ggaaaacggc gaggaactga acgccatcaa caccaccgtg 540
tctcaggacc ccgaaaccga gctgtacgct gtgtcctcca agctggactt caacatgacc 600
accaaccaca gcttcatgtg cctgattaag tacggccacc tgagagtgaa ccagaccttc 660
aactggaaca ccaccaagca agagcacttc cctgacaatg gatctggcgg cggaggttct 720
ggcggaggtg gaagcggagg cggaggatct gctgagtcta agtatggccc tccttgtcct 780
ccatgtcctg ctccagaagc tgctggcgga ccctctgtgt tcctgtttcc tccaaagcct 840
aaggaccagc tcatgatctc tcggacaccc gaagtgacct gcgtggtggt ggatgtgtct 900
caagaggacc ctgaggtgca gttcaattgg tacgtggacg gcgtggaagt gcacaacgcc 960
aagaccaagc ctagagagga acagttcaac tccacctaca gagtggtgtc cgtgctgacc 1020
gtgctgcacc aggattggct gaacggcaaa gagtacaagt gcaaggtgtc caacaagggc 1080
ctgccttcca gcatcgaaaa gaccatctcc aaggctaagg gccagcctag ggaaccccag 1140
gtttacaccc tgcctccaag ccaagaggaa atgaccaaga accaggtgtc cctgacctgc 1200
ctggtcaagg gcttctaccc ttccgacatt gccgtggaat gggagtccaa tggccagcct 1260
gagaacaact acaagaccac acctcctgtg ctggactccg acggctcctt ctttctgtac 1320
tctcgcctga ccgtggacaa gtctagatgg caagagggca acgtgttctc ctgctctgtg 1380
ctgcacgagg ccctgcacaa tcactacacc cagaagtccc tgtctctgtc tcttggaggt 1440
ggtggcggtt ctgcccctac cagctcctct accaagaaaa cccagctcca gttggagcat 1500
ctgctgctgg acctccagat gattctgaac gggatcaaca actataagaa ccccaagctg 1560
accgccatgc tgaccgctaa gttctacatg cccaagaagg ccaccgagct gaagcacctc 1620
cagtgcctgg aagaagaact gaagcccctg gaagaggtgc tgaatggggc ccagtccaag 1680
aacttccacc tgaggccacg ggacctgatc agcaacatca acgtgatcgt gctggaactg 1740
aagggctccg agacaacctt tatgtgcgag tacgccgacg agacagccac catcgtggaa 1800
tttctgaacc ggtggatcac cttctgccag agcatcatct ccacactgac ctgatga 1857
<210> 30
<211> 592
<212> Белок
<213> Искусственная последовательность
<220>
<223> слитый белок (GI102-M72)
<400> 30
Val Ile His Val Thr Lys Glu Val Lys Glu Val Ala Thr Leu Ser Cys
1 5 10 15
Gly His Asn Val Ser Val Glu Glu Leu Ala Gln Thr Arg Ile Tyr Trp
20 25 30
Gln Lys Glu Lys Lys Met Val Leu Thr Met Met Ser Gly Asp Met Asn
35 40 45
Ile Trp Pro Glu Tyr Lys Asn Arg Thr Ile Phe Asp Ile Thr Asn Asn
50 55 60
Leu Ser Ile Val Ile Leu Ala Leu Arg Pro Ser Asp Glu Gly Thr Tyr
65 70 75 80
Glu Cys Val Val Leu Lys Tyr Glu Lys Asp Ala Phe Lys Arg Glu His
85 90 95
Leu Ala Glu Val Thr Leu Ser Val Lys Ala Asp Phe Pro Thr Pro Ser
100 105 110
Ile Ser Asp Phe Glu Ile Pro Thr Ser Asn Ile Arg Arg Ile Ile Cys
115 120 125
Ser Thr Ser Gly Gly Phe Pro Glu Pro His Leu Ser Trp Leu Glu Asn
130 135 140
Gly Glu Glu Leu Asn Ala Ile Asn Thr Thr Val Ser Gln Asp Pro Glu
145 150 155 160
Thr Glu Leu Tyr Ala Val Ser Ser Lys Leu Asp Phe Asn Met Thr Thr
165 170 175
Asn His Ser Phe Met Cys Leu Ile Lys Tyr Gly His Leu Arg Val Asn
180 185 190
Gln Thr Phe Asn Trp Asn Thr Thr Lys Gln Glu His Phe Pro Asp Asn
195 200 205
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
210 215 220
Ser Ala Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
290 295 300
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
325 330 335
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
355 360 365
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
385 390 395 400
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
405 410 415
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Leu Gly Gly Gly Gly Gly Ser Ala Pro Thr Ser Ser
450 455 460
Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His Leu Leu Leu Asp Leu
465 470 475 480
Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys Asn Pro Lys Leu Thr
485 490 495
Ala Met Leu Thr Ala Lys Phe Tyr Met Pro Lys Lys Ala Thr Glu Leu
500 505 510
Lys His Leu Gln Cys Leu Glu Glu Glu Leu Lys Pro Leu Glu Glu Val
515 520 525
Leu Asn Gly Ala Gln Ser Lys Asn Phe His Leu Arg Pro Arg Asp Leu
530 535 540
Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu Lys Gly Ser Glu Thr
545 550 555 560
Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala Thr Ile Val Glu Phe
565 570 575
Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser Ile Ile Ser Thr Leu Thr
580 585 590
<210> 31
<211> 1851
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотиды, кодирующие слитый белок (GI101w)
<400> 31
atggatgcta tgctgagagg cctgtgttgc gtgctgctgc tgtgtggcgc tgtgttcgtg 60
tctccttctc acgctgtgat ccacgtgacc aaagaagtga aagaggtcgc cacactgtcc 120
tgcggccaca acgtttcagt ggaagaactg gcccagacca ggatctactg gcagaaagaa 180
aagaaaatgg tgctgaccat gatgtccggc gacatgaaca tctggcctga gtacaagaac 240
cggaccatct tcgacatcac caacaacctg tccatcgtga ttctggccct gaggccttct 300
gatgagggca cctatgagtg cgtggtgctg aagtacgaga aggacgcctt caagcgcgag 360
cacctggctg aagtgacact gtccgtgaag gccgactttc ccacaccttc catctccgac 420
ttcgagatcc ctacctccaa catccggcgg atcatctgtt ctacctctgg cggctttcct 480
gagcctcacc tgtcttggct ggaaaacggc gaggaactga acgccatcaa caccaccgtg 540
tctcaggacc ccgaaaccga gctgtacgct gtgtcctcca agctggactt caacatgacc 600
accaaccaca gcttcatgtg cctgattaag tacggccacc tgagagtgaa ccagaccttc 660
aactggaaca ccaccaagca agagcacttc cctgacaatg gatctggcgg cggaggttct 720
ggcggaggtg gaagcggagg cggaggatct gctgagtcta agtatggccc tccttgtcct 780
ccatgtcctg ctccagaagc tgctggcgga ccctctgtgt tcctgtttcc tccaaagcct 840
aaggaccagc tcatgatctc tcggacaccc gaagtgacct gcgtggtggt ggatgtgtct 900
caagaggacc ctgaggtgca gttcaattgg tacgtggacg gcgtggaagt gcacaacgcc 960
aagaccaagc ctagagagga acagttcaac tccacctaca gagtggtgtc cgtgctgacc 1020
gtgctgcacc aggattggct gaacggcaaa gagtacaagt gcaaggtgtc caacaagggc 1080
ctgccttcca gcatcgaaaa gaccatctcc aaggctaagg gccagcctag ggaaccccag 1140
gtttacaccc tgcctccaag ccaagaggaa atgaccaaga accaggtgtc cctgacctgc 1200
ctggtcaagg gcttctaccc ttccgacatt gccgtggaat gggagtccaa tggccagcct 1260
gagaacaact acaagaccac acctcctgtg ctggactccg acggctcctt ctttctgtac 1320
tctcgcctga ccgtggacaa gtctagatgg caagagggca acgtgttctc ctgctctgtg 1380
ctgcacgagg ccctgcacaa tcactacacc cagaagtccc tgtctctgtc tcttggaggt 1440
ggtggcggtt ctgcccctac cagctcctct accaagaaaa cccagctcca gttggagcat 1500
ctgctgctgg acctccagat gattctgaac gggatcaaca actataagaa ccccaagctg 1560
acccgcatgc tgacctttaa gttctacatg cccaagaagg ccaccgagct gaagcacctc 1620
cagtgcctgg aagaagaact gaagcccctg gaagaggtgc tgaatctggc ccagtccaag 1680
aacttccacc tgaggccacg ggacctgatc agcaacatca acgtgatcgt gctggaactg 1740
aagggctccg agacaacctt tatgtgcgag tacgccgacg agacagccac catcgtggaa 1800
tttctgaacc ggtggatcac cttctgccag agcatcatct ccacactgac c 1851
<210> 32
<211> 592
<212> Белок
<213> Искусственная последовательность
<220>
<223> слитый белок (GI101w)
<400> 32
Val Ile His Val Thr Lys Glu Val Lys Glu Val Ala Thr Leu Ser Cys
1 5 10 15
Gly His Asn Val Ser Val Glu Glu Leu Ala Gln Thr Arg Ile Tyr Trp
20 25 30
Gln Lys Glu Lys Lys Met Val Leu Thr Met Met Ser Gly Asp Met Asn
35 40 45
Ile Trp Pro Glu Tyr Lys Asn Arg Thr Ile Phe Asp Ile Thr Asn Asn
50 55 60
Leu Ser Ile Val Ile Leu Ala Leu Arg Pro Ser Asp Glu Gly Thr Tyr
65 70 75 80
Glu Cys Val Val Leu Lys Tyr Glu Lys Asp Ala Phe Lys Arg Glu His
85 90 95
Leu Ala Glu Val Thr Leu Ser Val Lys Ala Asp Phe Pro Thr Pro Ser
100 105 110
Ile Ser Asp Phe Glu Ile Pro Thr Ser Asn Ile Arg Arg Ile Ile Cys
115 120 125
Ser Thr Ser Gly Gly Phe Pro Glu Pro His Leu Ser Trp Leu Glu Asn
130 135 140
Gly Glu Glu Leu Asn Ala Ile Asn Thr Thr Val Ser Gln Asp Pro Glu
145 150 155 160
Thr Glu Leu Tyr Ala Val Ser Ser Lys Leu Asp Phe Asn Met Thr Thr
165 170 175
Asn His Ser Phe Met Cys Leu Ile Lys Tyr Gly His Leu Arg Val Asn
180 185 190
Gln Thr Phe Asn Trp Asn Thr Thr Lys Gln Glu His Phe Pro Asp Asn
195 200 205
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
210 215 220
Ser Ala Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
290 295 300
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
325 330 335
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
355 360 365
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
385 390 395 400
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
405 410 415
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Leu Gly Gly Gly Gly Gly Ser Ala Pro Thr Ser Ser
450 455 460
Ser Thr Lys Lys Thr Gln Leu Gln Leu Glu His Leu Leu Leu Asp Leu
465 470 475 480
Gln Met Ile Leu Asn Gly Ile Asn Asn Tyr Lys Asn Pro Lys Leu Thr
485 490 495
Arg Met Leu Thr Phe Lys Phe Tyr Met Pro Lys Lys Ala Thr Glu Leu
500 505 510
Lys His Leu Gln Cys Leu Glu Glu Glu Leu Lys Pro Leu Glu Glu Val
515 520 525
Leu Asn Leu Ala Gln Ser Lys Asn Phe His Leu Arg Pro Arg Asp Leu
530 535 540
Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu Lys Gly Ser Glu Thr
545 550 555 560
Thr Phe Met Cys Glu Tyr Ala Asp Glu Thr Ala Thr Ile Val Glu Phe
565 570 575
Leu Asn Arg Trp Ile Thr Phe Cys Gln Ser Ile Ile Ser Thr Leu Thr
580 585 590
<210> 33
<211> 1848
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотиды, кодирующие слитый белок (mGI102-M61)
<400> 33
atggatgcta tgctgagagg cctgtgttgc gtgctgctgc tgtgtggcgc tgtgttcgtg 60
tctccttctc acgctgtgga cgagcagctc tccaagtccg tgaaggataa ggtcctgctg 120
ccttgccggt acaactctcc tcacgaggac gagtctgagg accggatcta ctggcagaaa 180
cacgacaagg tggtgctgtc cgtgatcgcc ggaaagctga aagtgtggcc tgagtacaag 240
aacaggaccc tgtacgacaa caccacctac agcctgatca tcctgggcct cgtgctgagc 300
gatagaggca cctattcttg cgtggtgcag aagaaagagc ggggcaccta cgaagtgaag 360
cacctggctc tggtcaagct gtccatcaag gccgacttca gcacccctaa catcaccgag 420
tctggcaacc cttccgccga caccaagaga atcacctgtt tcgcctctgg cggcttccct 480
aagcctcggt tctcttggct ggaaaacggc agagagctgc ccggcatcaa taccaccatt 540
tctcaggacc cagagtccga gctgtacacc atctccagcc agctcgactt taacaccacc 600
agaaaccaca ccatcaagtg cctgattaag tacggcgacg cccacgtgtc cgaggacttt 660
acttgggaga aacctcctga ggaccctcct gactctggat ctggcggcgg aggttctggc 720
ggaggtggaa gcggaggcgg aggatctgct gagtctaagt atggccctcc ttgtcctcca 780
tgtcctgctc cagaagctgc tggcggaccc tctgtgttcc tgtttcctcc aaagcctaag 840
gaccagctca tgatctctcg gacccctgaa gtgacctgcg tggtggtgga tgtgtctcaa 900
gaggaccctg aggtgcagtt caattggtac gtggacggcg tggaagtgca caacgccaag 960
accaagccta gagaggaaca gttcaactcc acctatagag tggtgtccgt gctgaccgtg 1020
ctgcaccagg attggctgaa cggcaaagag tacaagtgca aggtgtccaa caagggcctg 1080
ccttccagca tcgaaaagac catcagcaag gctaagggcc agcctaggga accccaggtt 1140
tacaccctgc ctccaagcca agaggaaatg accaagaacc aggtgtccct gacctgcctg 1200
gtcaagggct tctacccttc cgacattgcc gtggaatggg agtccaatgg ccagcctgag 1260
aacaactaca agaccacacc tcctgtgctg gactccgacg gctccttctt tctgtactct 1320
cgcctgaccg tggacaagtc taggtggcaa gagggcaacg tgttctcctg ctctgtgctg 1380
cacgaggctc tgcacaacca ctacacccag aagtccctgt ctctgtctct tggaggtggt 1440
ggcggttctg cccctacctc cagctctacc aagaaaaccc agctccagtt ggagcatctg 1500
ctgctggacc tccagatgat cctgaatggc atcaacaatt acaagaaccc caagctgacc 1560
gccatgctga ccgctaagtt ctacatgccc aagaaggcca ccgagctgaa gcacttgcag 1620
tgcctggaaa gggaactgaa gcccctggaa gaagtgctga atctggccca gtccaagaac 1680
ttccacctga ggcctaggga cctgatctcc aacatcaacg tgatcgtgct ggaactgaaa 1740
ggctccgaga caaccttcat gtgcgagtac gccgacgaga cagccaccat cgtggaattt 1800
ctgaaccggt ggatcacctt ctgccagagc atcatctcca cactgacc 1848
<210> 34
<211> 616
<212> Белок
<213> Искусственная последовательность
<220>
<223> слитый белок (mGI102-M61)
<400> 34
Met Asp Ala Met Leu Arg Gly Leu Cys Cys Val Leu Leu Leu Cys Gly
1 5 10 15
Ala Val Phe Val Ser Pro Ser His Ala Val Asp Glu Gln Leu Ser Lys
20 25 30
Ser Val Lys Asp Lys Val Leu Leu Pro Cys Arg Tyr Asn Ser Pro His
35 40 45
Glu Asp Glu Ser Glu Asp Arg Ile Tyr Trp Gln Lys His Asp Lys Val
50 55 60
Val Leu Ser Val Ile Ala Gly Lys Leu Lys Val Trp Pro Glu Tyr Lys
65 70 75 80
Asn Arg Thr Leu Tyr Asp Asn Thr Thr Tyr Ser Leu Ile Ile Leu Gly
85 90 95
Leu Val Leu Ser Asp Arg Gly Thr Tyr Ser Cys Val Val Gln Lys Lys
100 105 110
Glu Arg Gly Thr Tyr Glu Val Lys His Leu Ala Leu Val Lys Leu Ser
115 120 125
Ile Lys Ala Asp Phe Ser Thr Pro Asn Ile Thr Glu Ser Gly Asn Pro
130 135 140
Ser Ala Asp Thr Lys Arg Ile Thr Cys Phe Ala Ser Gly Gly Phe Pro
145 150 155 160
Lys Pro Arg Phe Ser Trp Leu Glu Asn Gly Arg Glu Leu Pro Gly Ile
165 170 175
Asn Thr Thr Ile Ser Gln Asp Pro Glu Ser Glu Leu Tyr Thr Ile Ser
180 185 190
Ser Gln Leu Asp Phe Asn Thr Thr Arg Asn His Thr Ile Lys Cys Leu
195 200 205
Ile Lys Tyr Gly Asp Ala His Val Ser Glu Asp Phe Thr Trp Glu Lys
210 215 220
Pro Pro Glu Asp Pro Pro Asp Ser Gly Ser Gly Gly Gly Gly Ser Gly
225 230 235 240
Gly Gly Gly Ser Gly Gly Gly Gly Ser Ala Glu Ser Lys Tyr Gly Pro
245 250 255
Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Gln Leu Met Ile Ser Arg Thr
275 280 285
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
290 295 300
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
370 375 380
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
385 390 395 400
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
435 440 445
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Leu His Glu Ala Leu
450 455 460
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Gly Gly
465 470 475 480
Gly Gly Ser Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu Gln
485 490 495
Leu Glu His Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile Asn
500 505 510
Asn Tyr Lys Asn Pro Lys Leu Thr Ala Met Leu Thr Ala Lys Phe Tyr
515 520 525
Met Pro Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu Arg
530 535 540
Glu Leu Lys Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys Asn
545 550 555 560
Phe His Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile Val
565 570 575
Leu Glu Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala Asp
580 585 590
Glu Thr Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe Cys
595 600 605
Gln Ser Ile Ile Ser Thr Leu Thr
610 615
<210> 35
<211> 153
<212> Белок
<213> Искусственная последовательность
<220>
<223> hIL-2 дикого типа
<400> 35
Met Tyr Arg Met Gln Leu Leu Ser Cys Ile Ala Leu Ser Leu Ala Leu
1 5 10 15
Val Thr Asn Ser Ala Pro Thr Ser Ser Ser Thr Lys Lys Thr Gln Leu
20 25 30
Gln Leu Glu His Leu Leu Leu Asp Leu Gln Met Ile Leu Asn Gly Ile
35 40 45
Asn Asn Tyr Lys Asn Pro Lys Leu Thr Arg Met Leu Thr Phe Lys Phe
50 55 60
Tyr Met Pro Lys Lys Ala Thr Glu Leu Lys His Leu Gln Cys Leu Glu
65 70 75 80
Glu Glu Leu Lys Pro Leu Glu Glu Val Leu Asn Leu Ala Gln Ser Lys
85 90 95
Asn Phe His Leu Arg Pro Arg Asp Leu Ile Ser Asn Ile Asn Val Ile
100 105 110
Val Leu Glu Leu Lys Gly Ser Glu Thr Thr Phe Met Cys Glu Tyr Ala
115 120 125
Asp Glu Thr Ala Thr Ile Val Glu Phe Leu Asn Arg Trp Ile Thr Phe
130 135 140
Cys Gln Ser Ile Ile Ser Thr Leu Thr
145 150
<210> 36
<211> 158
<212> Белок
<213> Искусственная последовательность
<220>
<223> IL-2 с сигнальной последовательностью
<400> 36
Met Asp Ala Met Leu Arg Gly Leu Cys Cys Val Leu Leu Leu Cys Gly
1 5 10 15
Ala Val Phe Val Ser Pro Ser His Ala Ala Pro Thr Ser Ser Ser Thr
20 25 30
Lys Lys Thr Gln Leu Gln Leu Glu His Leu Leu Leu Asp Leu Gln Met
35 40 45
Ile Leu Asn Gly Ile Asn Asn Tyr Lys Asn Pro Lys Leu Thr Arg Met
50 55 60
Leu Thr Phe Lys Phe Tyr Met Pro Lys Lys Ala Thr Glu Leu Lys His
65 70 75 80
Leu Gln Cys Leu Glu Glu Glu Leu Lys Pro Leu Glu Glu Val Leu Asn
85 90 95
Leu Ala Gln Ser Lys Asn Phe His Leu Arg Pro Arg Asp Leu Ile Ser
100 105 110
Asn Ile Asn Val Ile Val Leu Glu Leu Lys Gly Ser Glu Thr Thr Phe
115 120 125
Met Cys Glu Tyr Ala Asp Glu Thr Ala Thr Ile Val Glu Phe Leu Asn
130 135 140
Arg Trp Ile Thr Phe Cys Gln Ser Ile Ile Ser Thr Leu Thr
145 150 155
<210> 37
<211> 474
<212> ДНК
<213> Искусственная последовательность
<220>
<223> нуклеотидная последовательность, кодирующая IL-2 с сигнальной
последовательностью
<400> 37
atggatgcta tgctgagagg cctgtgttgc gtgctgctgc tgtgtggcgc tgtgttcgtg 60
tctccttctc acgctgcccc taccagctcc tctaccaaga aaacccagct ccagttggag 120
catctgctgc tggacctcca gatgattctg aacgggatca acaactataa gaaccccaag 180
ctgacccgca tgctgacctt taagttctac atgcccaaga aggccaccga gctgaagcac 240
ctccagtgcc tggaagaaga actgaagccc ctggaagagg tgctgaatct ggcccagtcc 300
aagaacttcc acctgaggcc acgggacctg atcagcaaca tcaacgtgat cgtgctggaa 360
ctgaagggct ccgagacaac ctttatgtgc gagtacgccg acgagacagc caccatcgtg 420
gaatttctga accggtggat caccttctgc cagagcatca tctccacact gacc 474
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ, СОДЕРЖАЩАЯ СЛИТЫЙ БЕЛОК, СОДЕРЖАЩИЙ БЕЛОК IL-2 И БЕЛОК CD80, И ИНГИБИТОР ИММУННОЙ ТОЧКИ КОНТРОЛЯ | 2020 |
|
RU2828377C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ, СОДЕРЖАЩАЯ СЛИТЫЙ БЕЛОК, СОДЕРЖАЩИЙ БЕЛОК IL-2 И БЕЛОК CD80, И ПРОТИВОРАКОВОЕ СРЕДСТВО | 2021 |
|
RU2839599C1 |
| КОМПОЗИЦИЯ ДЛЯ ПРОТИВОРАКОВОГО ЛЕЧЕНИЯ, СОДЕРЖАЩАЯ NK-КЛЕТКИ И СЛИТЫЙ БЕЛОК, КОТОРЫЙ СОДЕРЖИТ БЕЛОК IL-2 И БЕЛОК CD80 | 2020 |
|
RU2832136C1 |
| СЛИТЫЙ БЕЛОК, ВКЛЮЧАЮЩИЙ IL-12 И АНТИТЕЛО ПРОТИВ FAP, И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2831612C1 |
| НОВЫЙ МОДИФИЦИРОВАННЫЙ СЛИТЫЙ БЕЛОК FC-ФРАГМЕНТА ИММУНОГЛОБУЛИНА И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2800919C2 |
| НОВЫЙ СЛИТЫЙ БЕЛОК, СПЕЦИФИЧНЫЙ ДЛЯ CD137 И PD-L1 | 2019 |
|
RU2818349C2 |
| IL-12 ГЕТЕРОДИМЕРНЫЕ СЛИТЫЕ БЕЛКИ FC | 2019 |
|
RU2819097C2 |
| БИСПЕЦИФИЧНЫЙ СЛИТЫЙ БЕЛОК И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2801528C2 |
| СЛИТЫЙ БЕЛОК ИЗ БЕЛКА DCTN1 С БЕЛКОМ RET | 2018 |
|
RU2813996C2 |
| СЛИТЫЙ БЕЛОК И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2800923C2 |
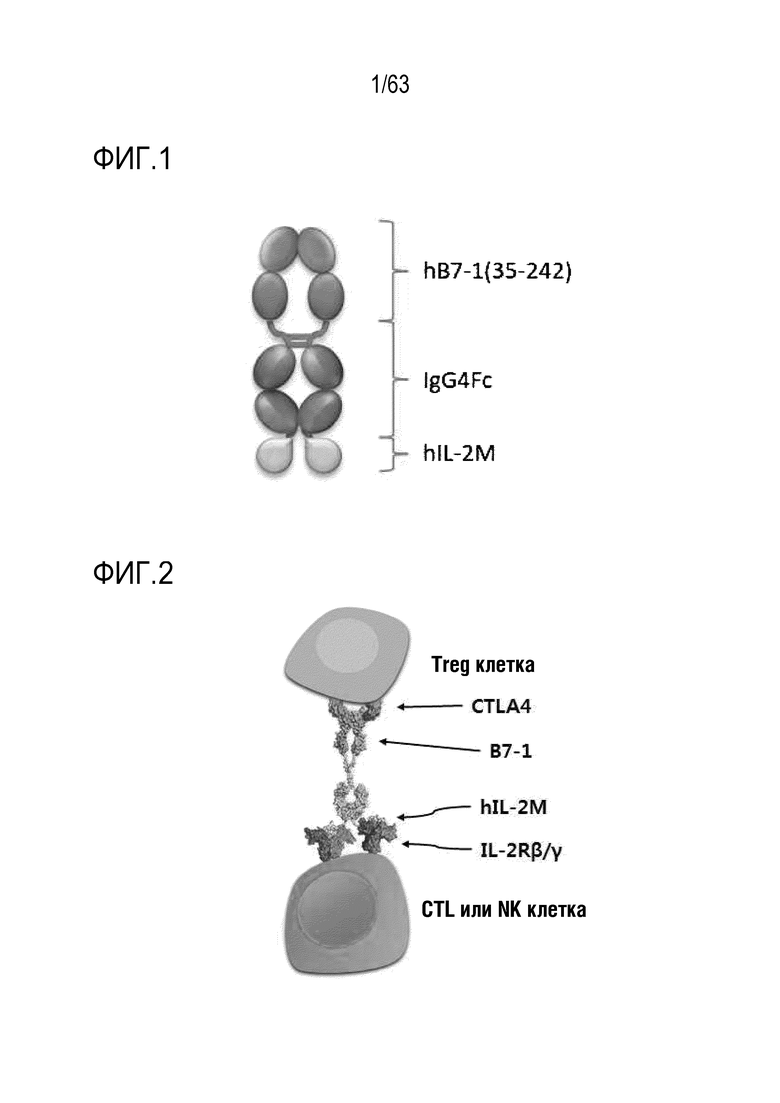
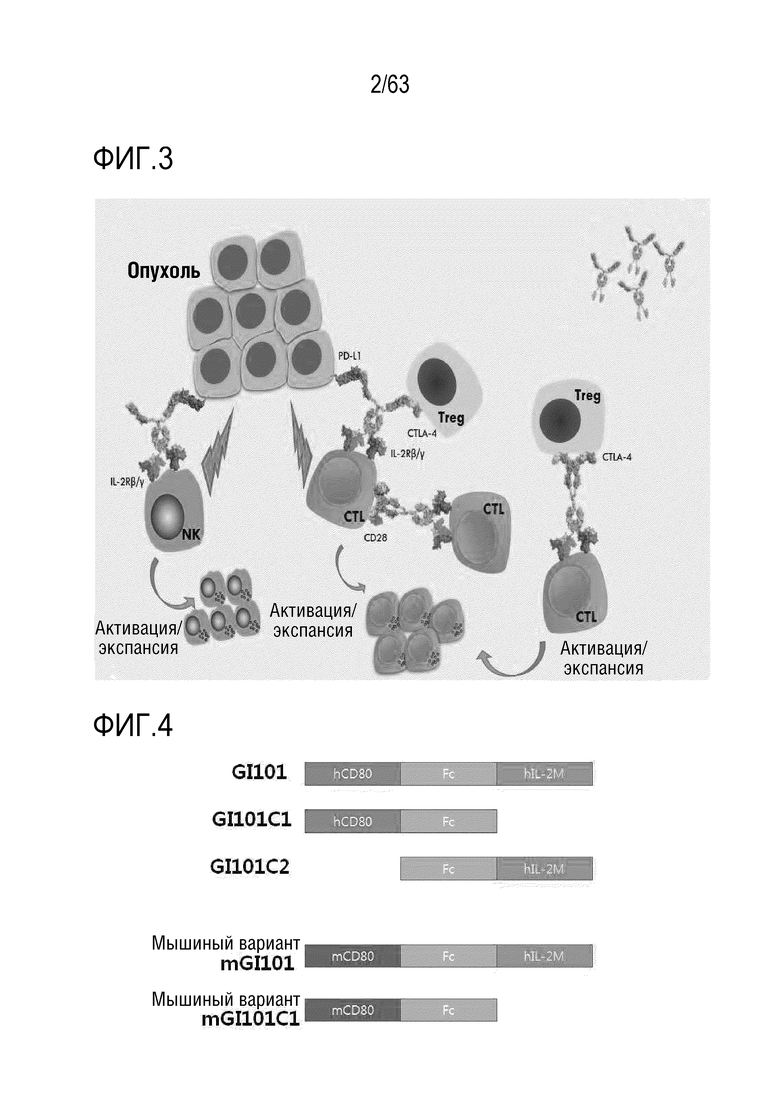
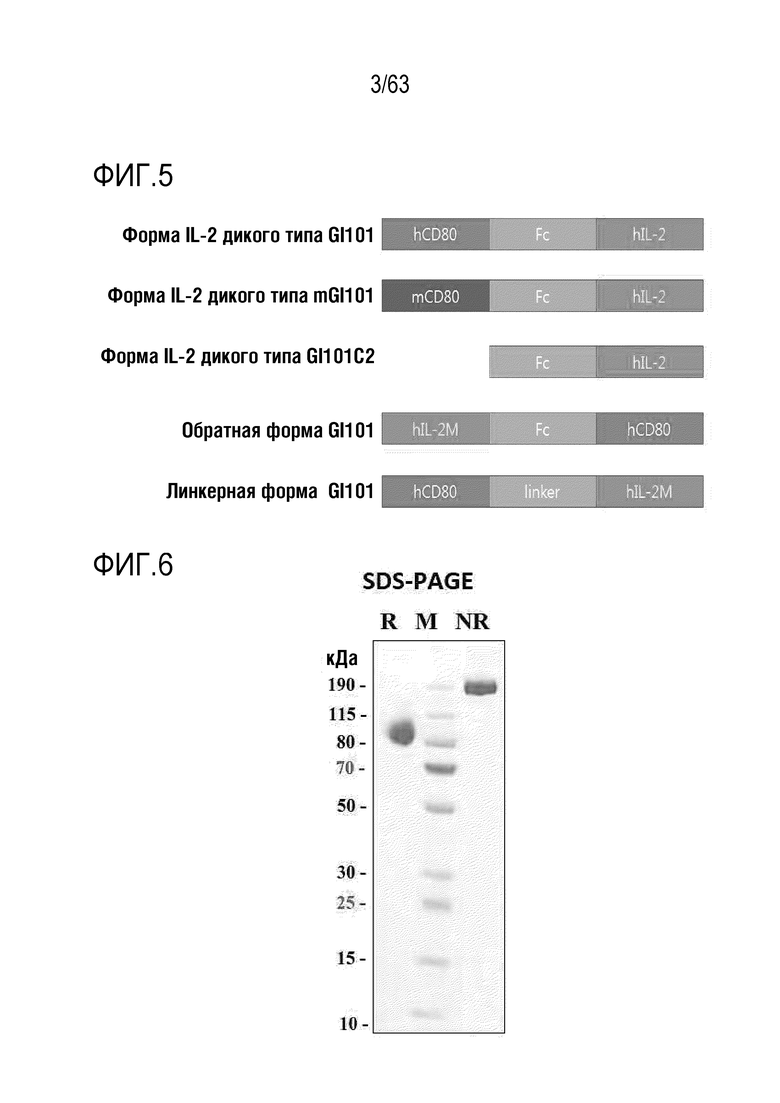
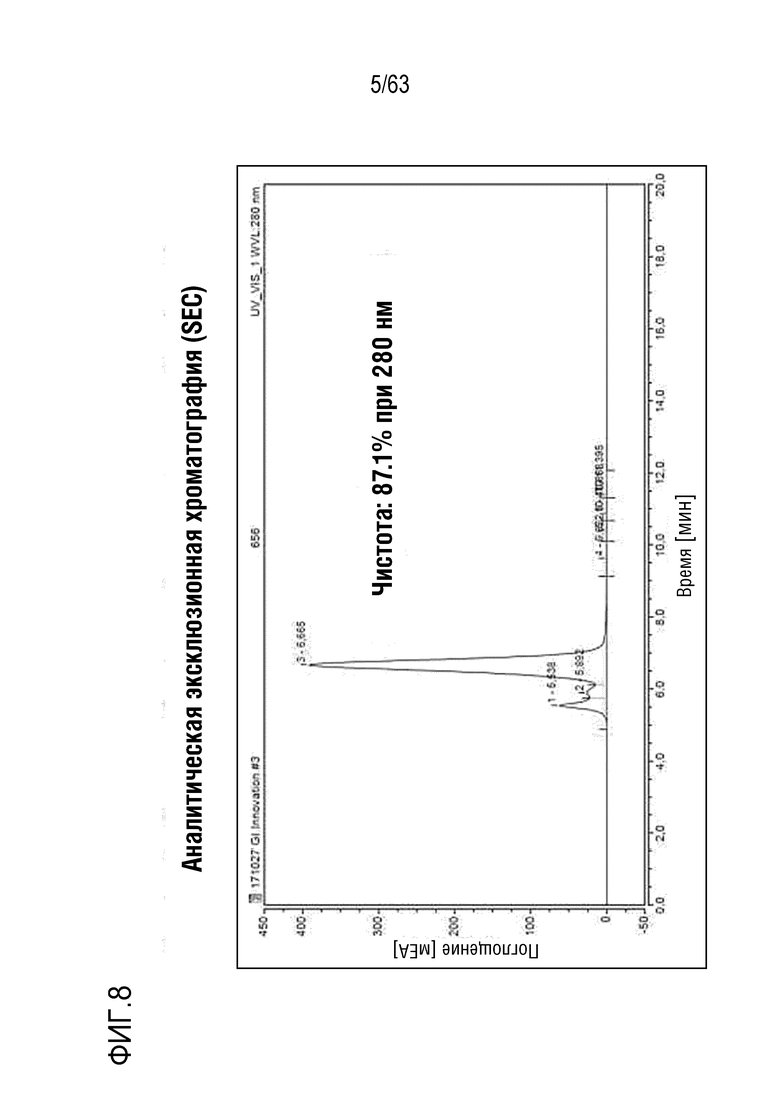
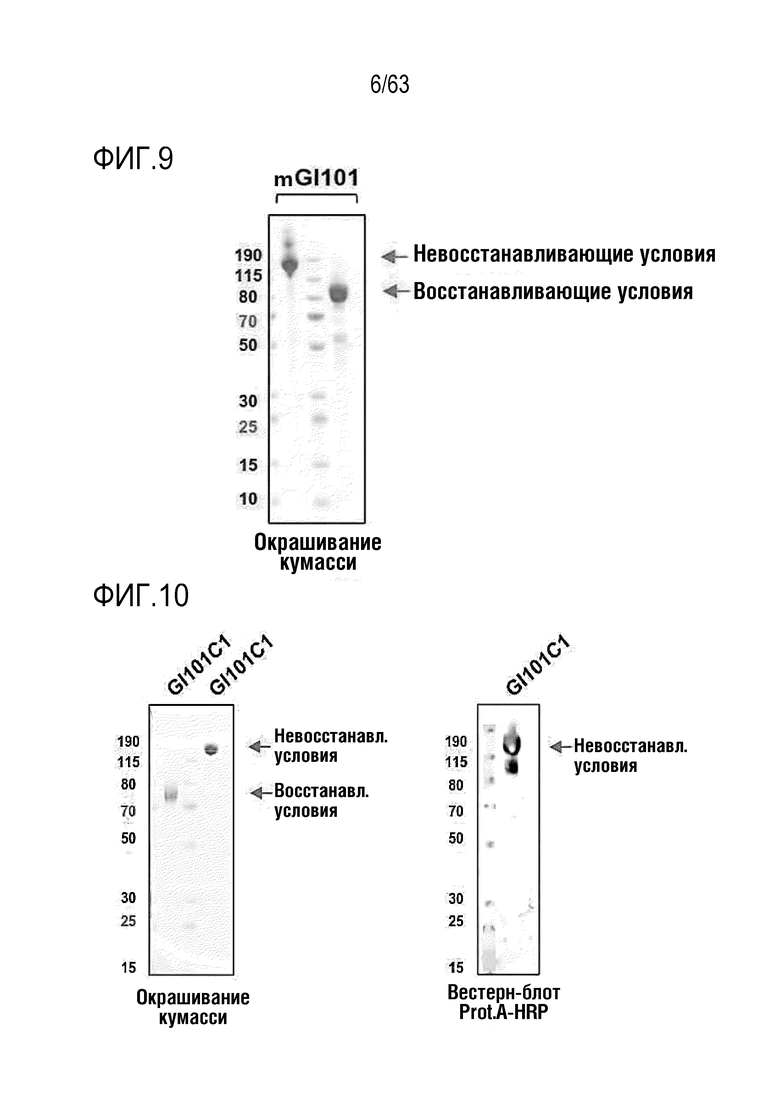
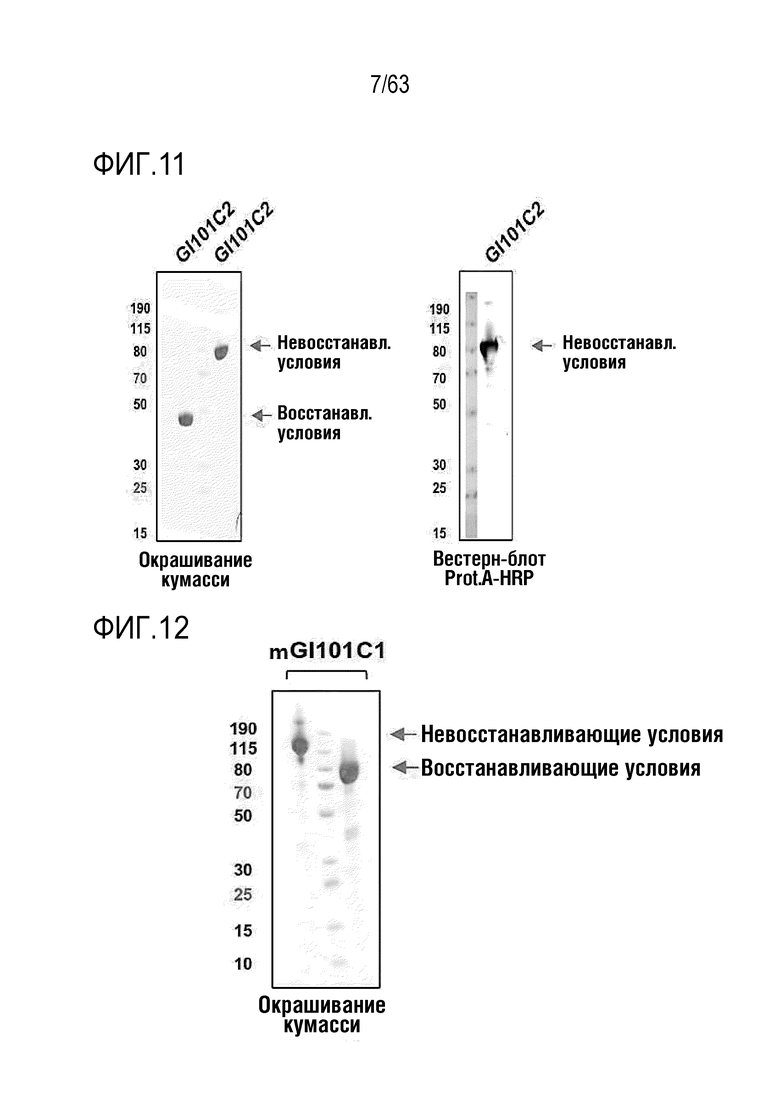

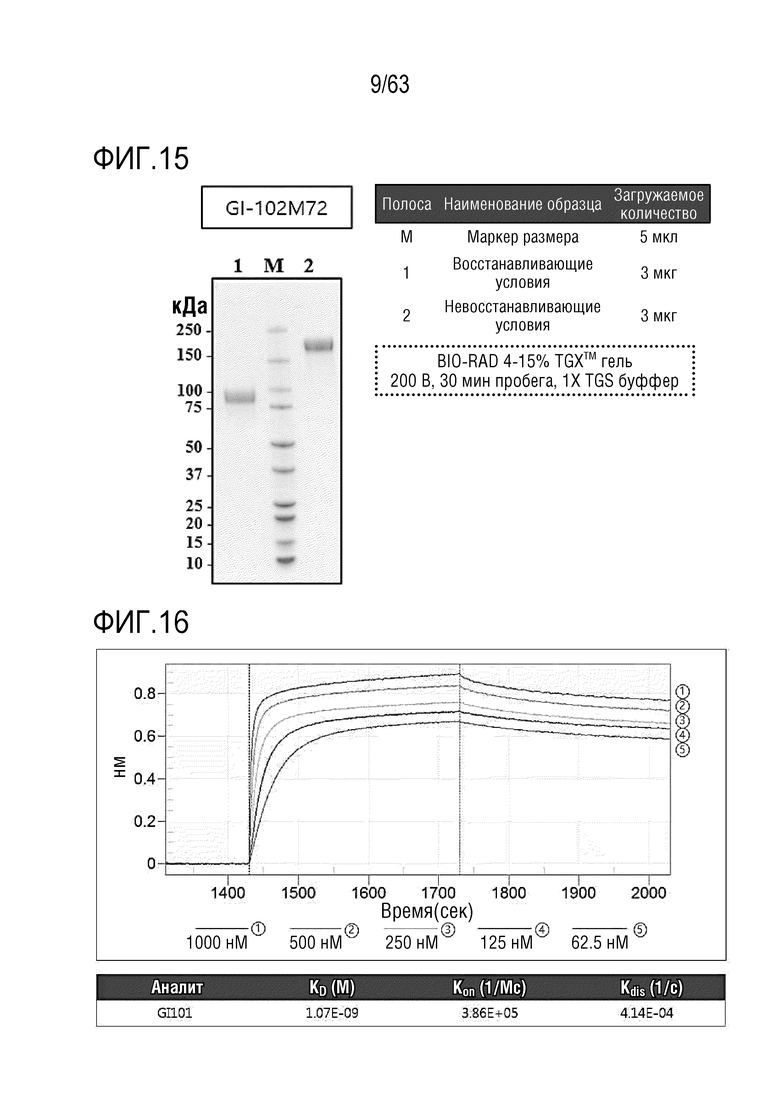
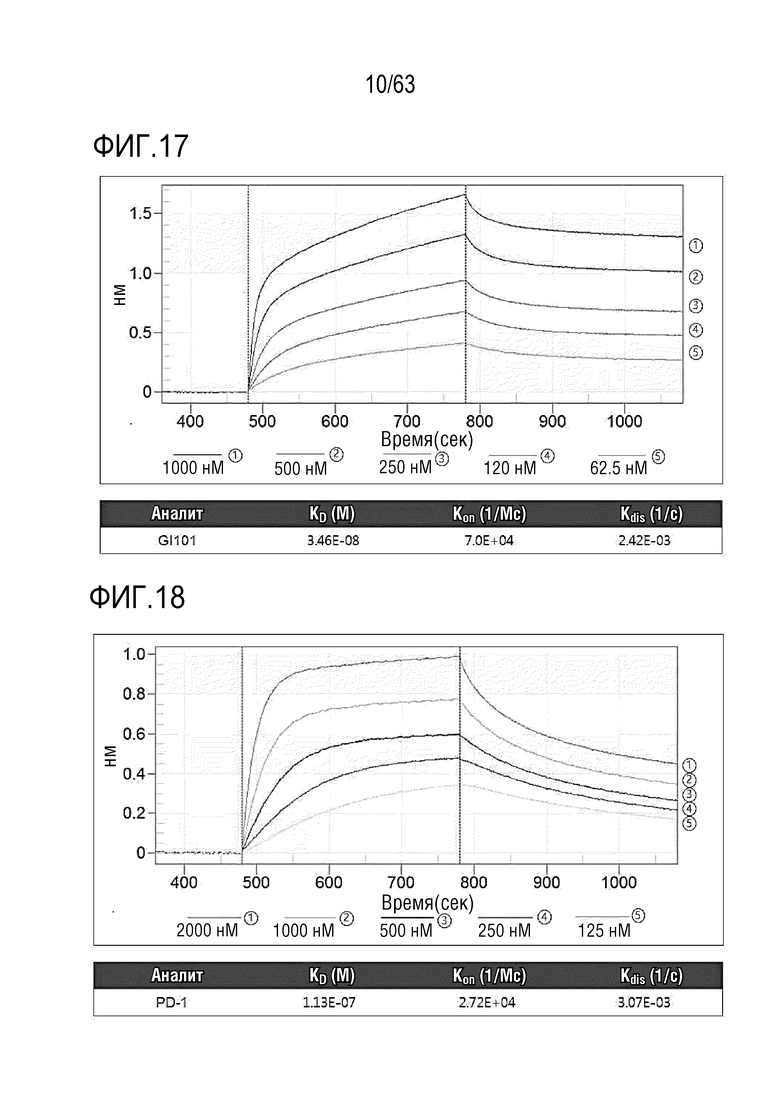
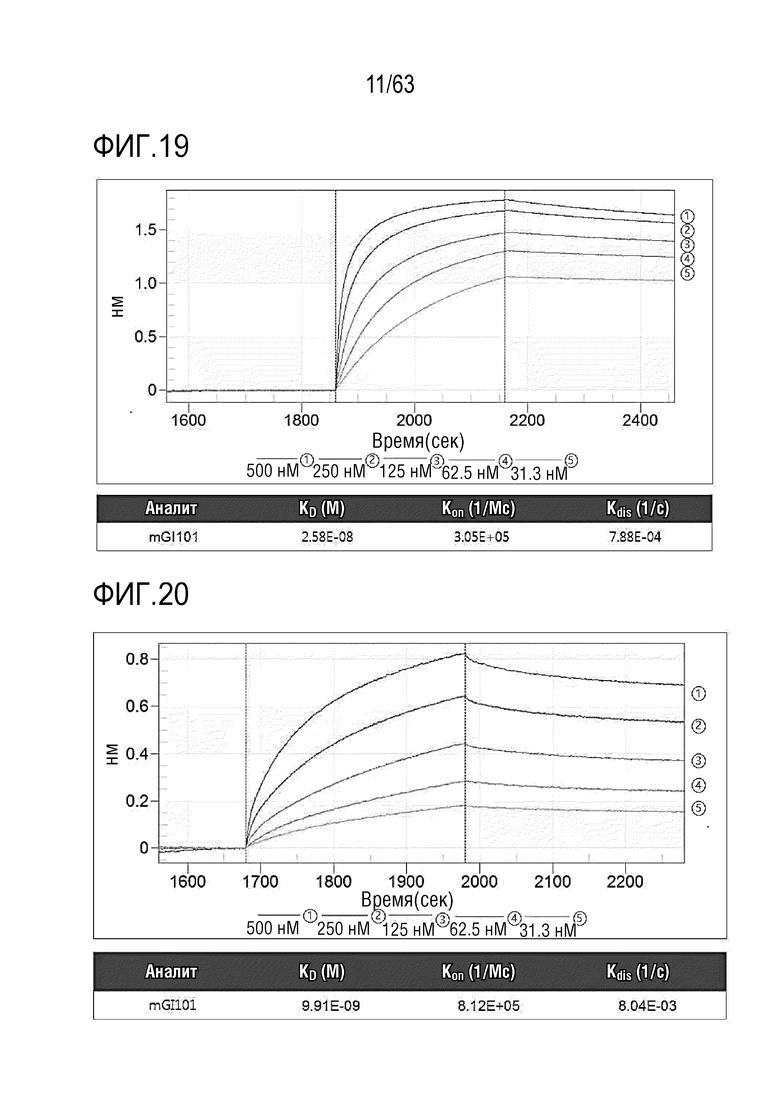
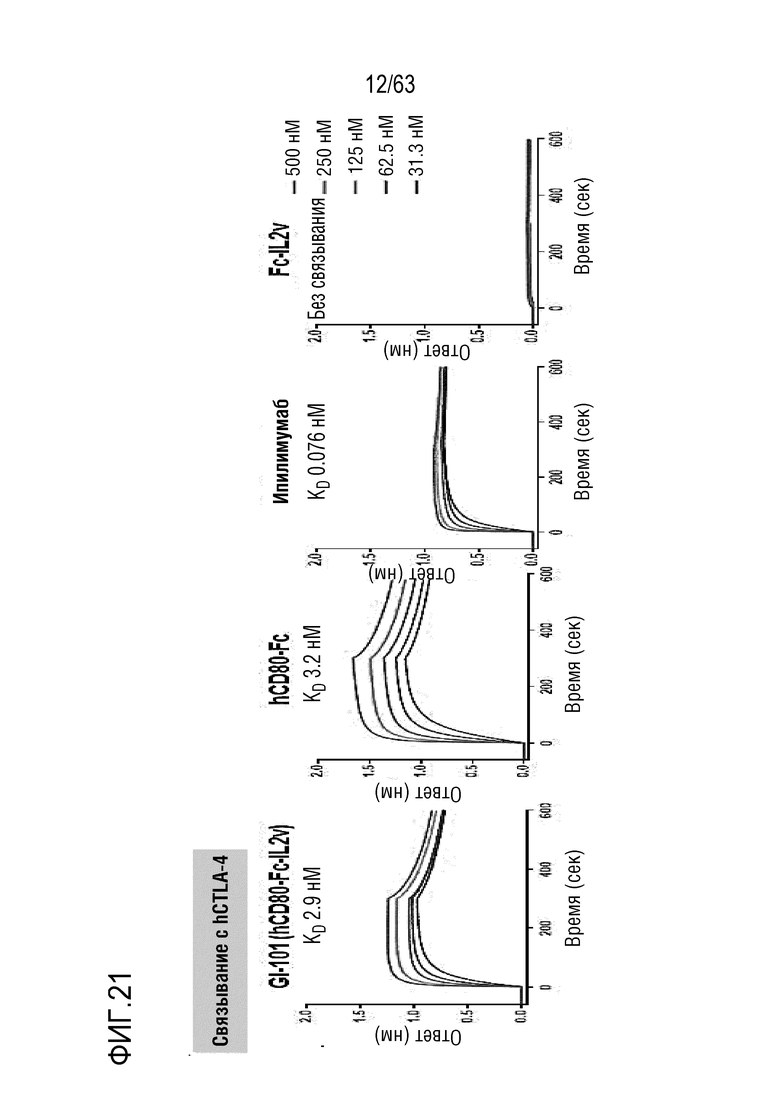
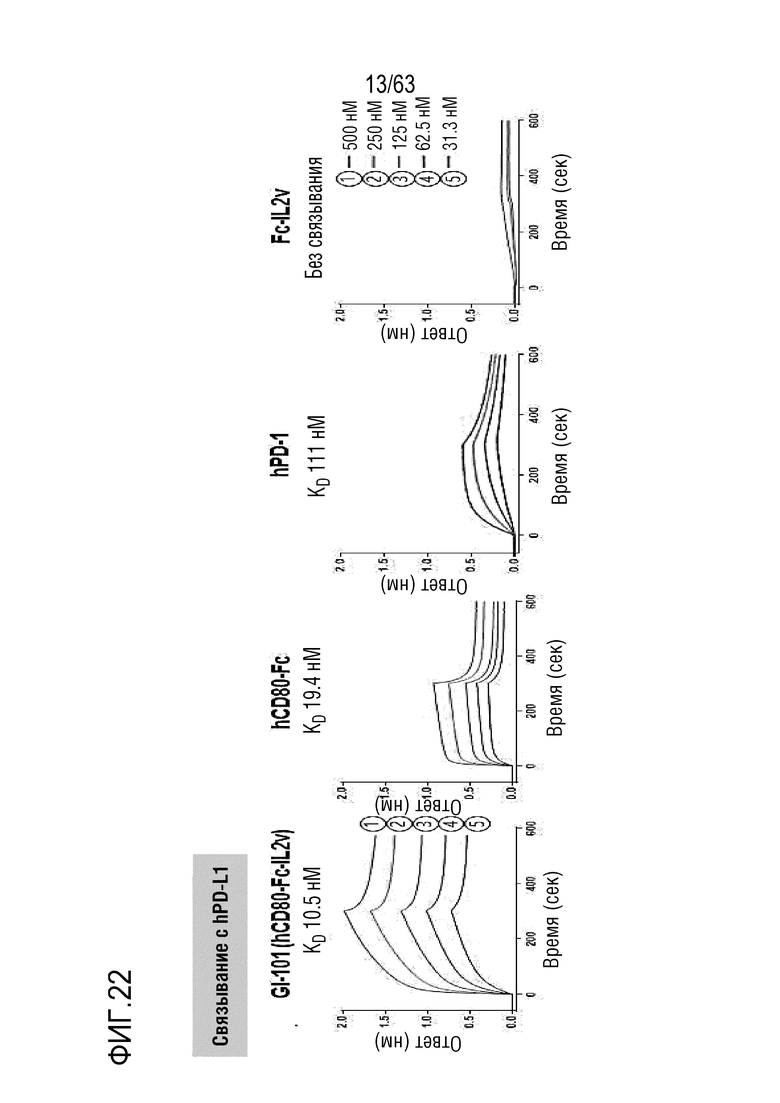
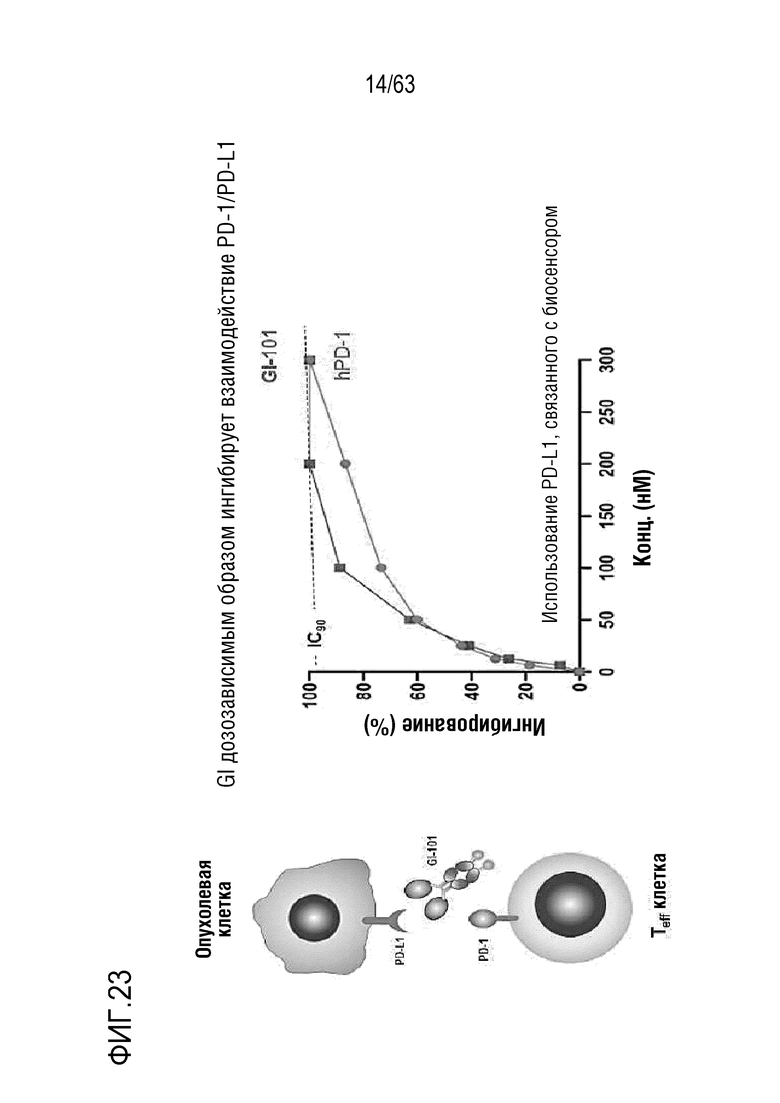
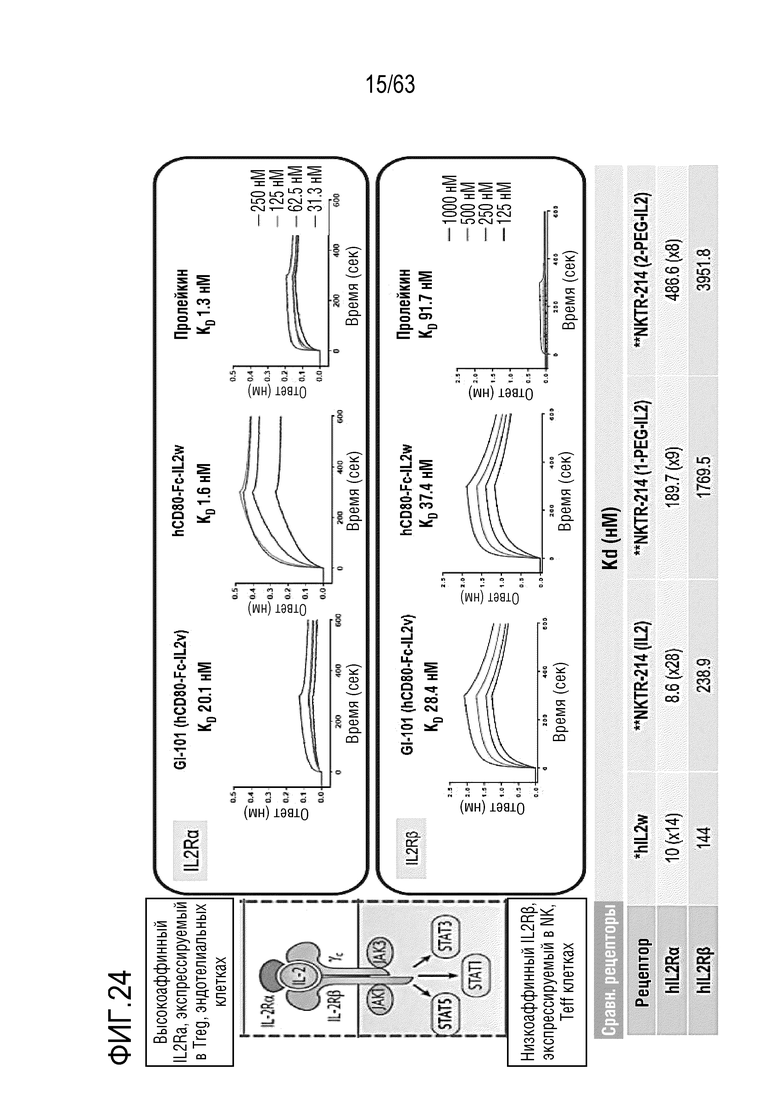
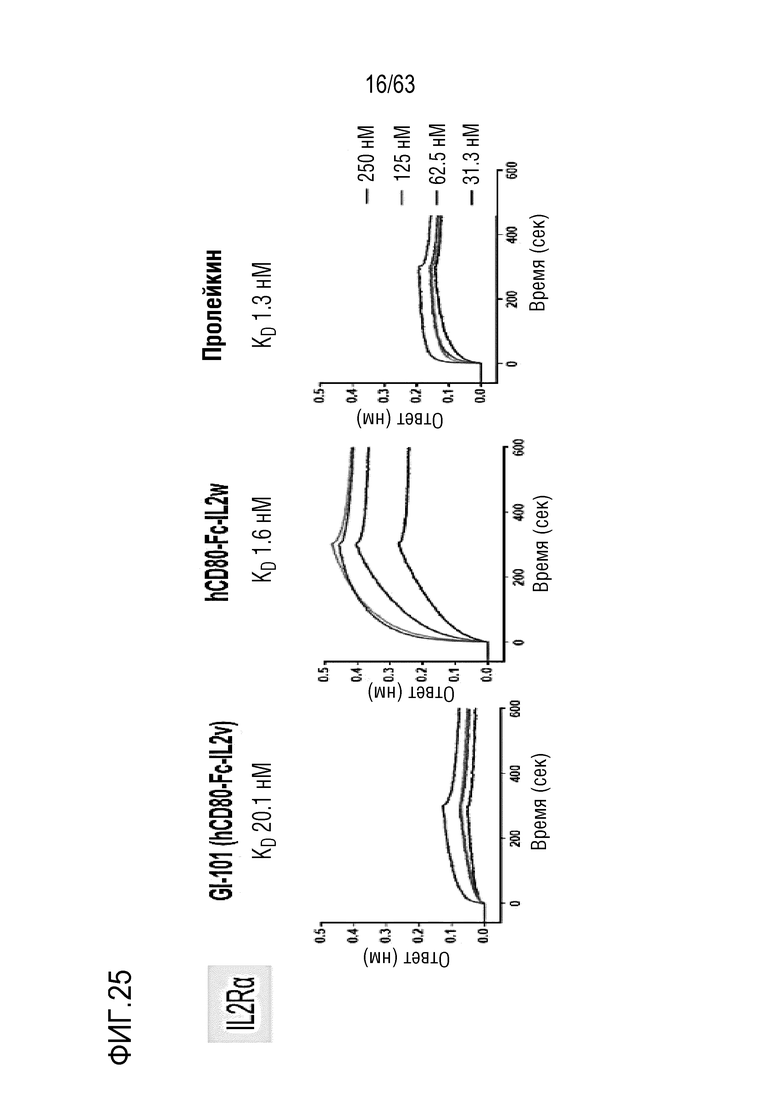
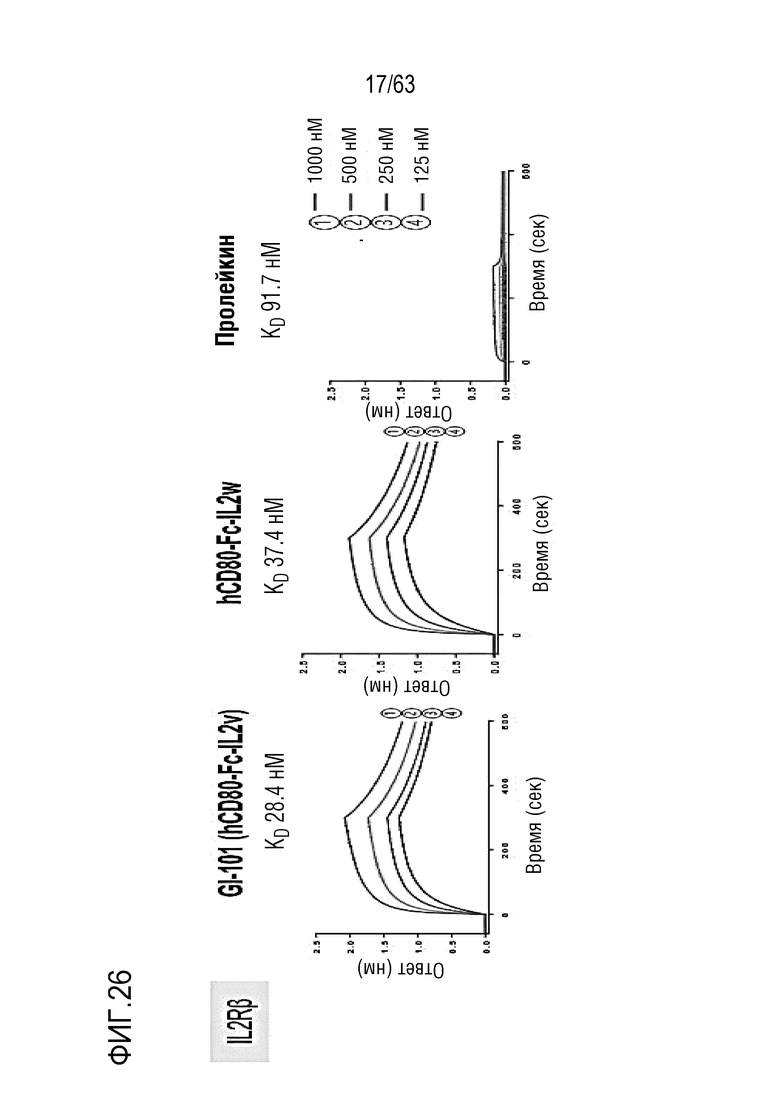
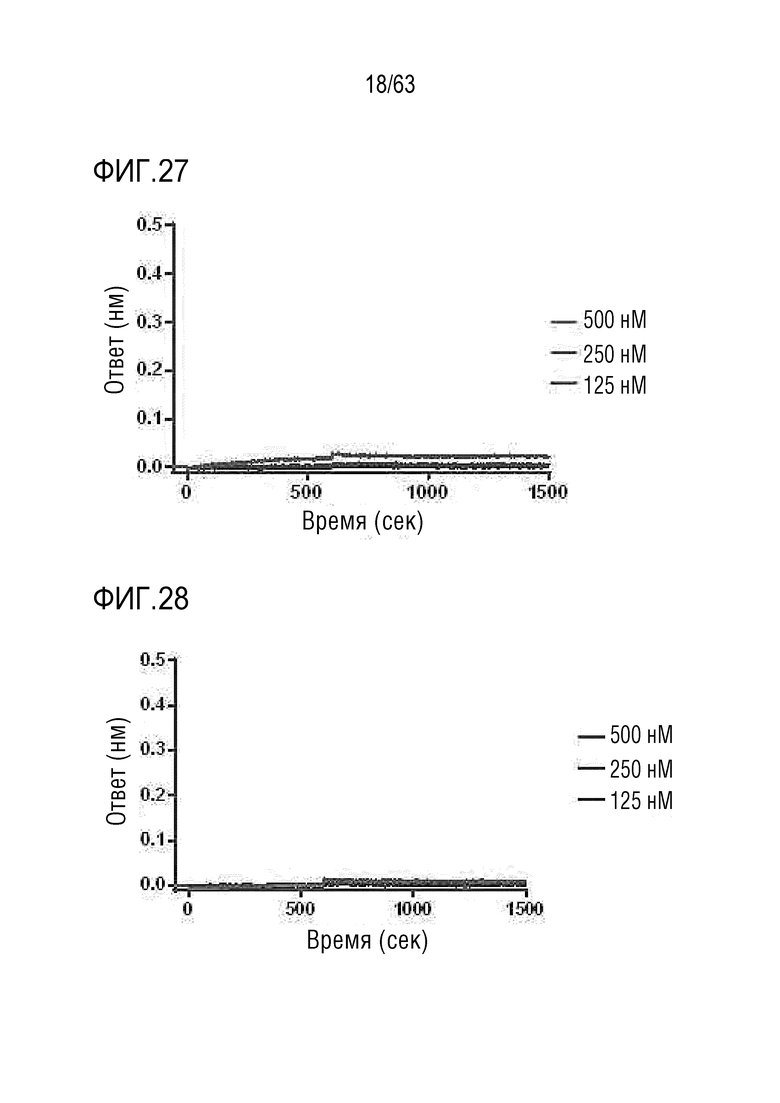
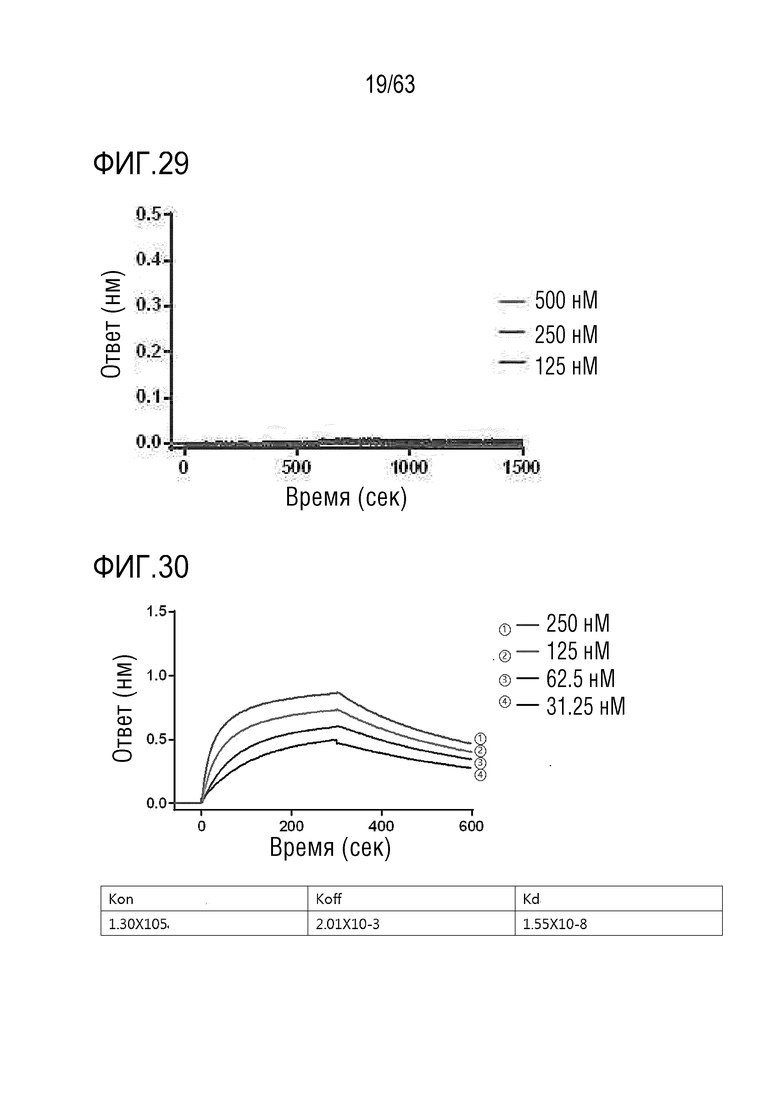
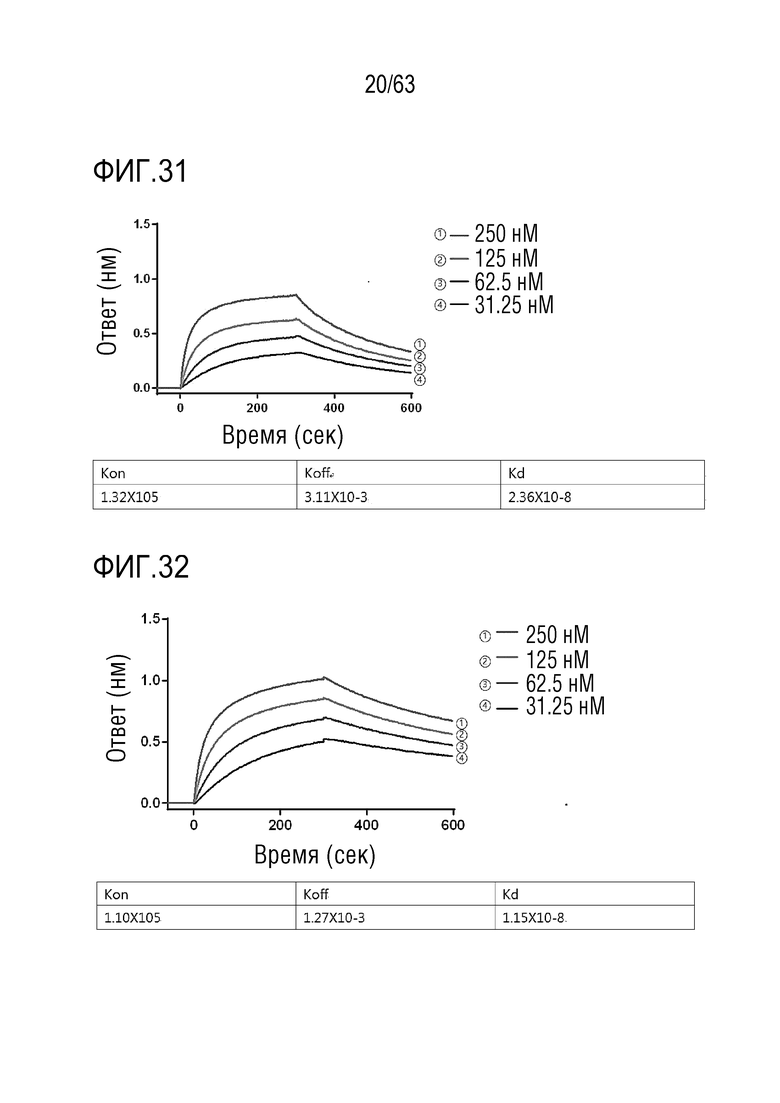
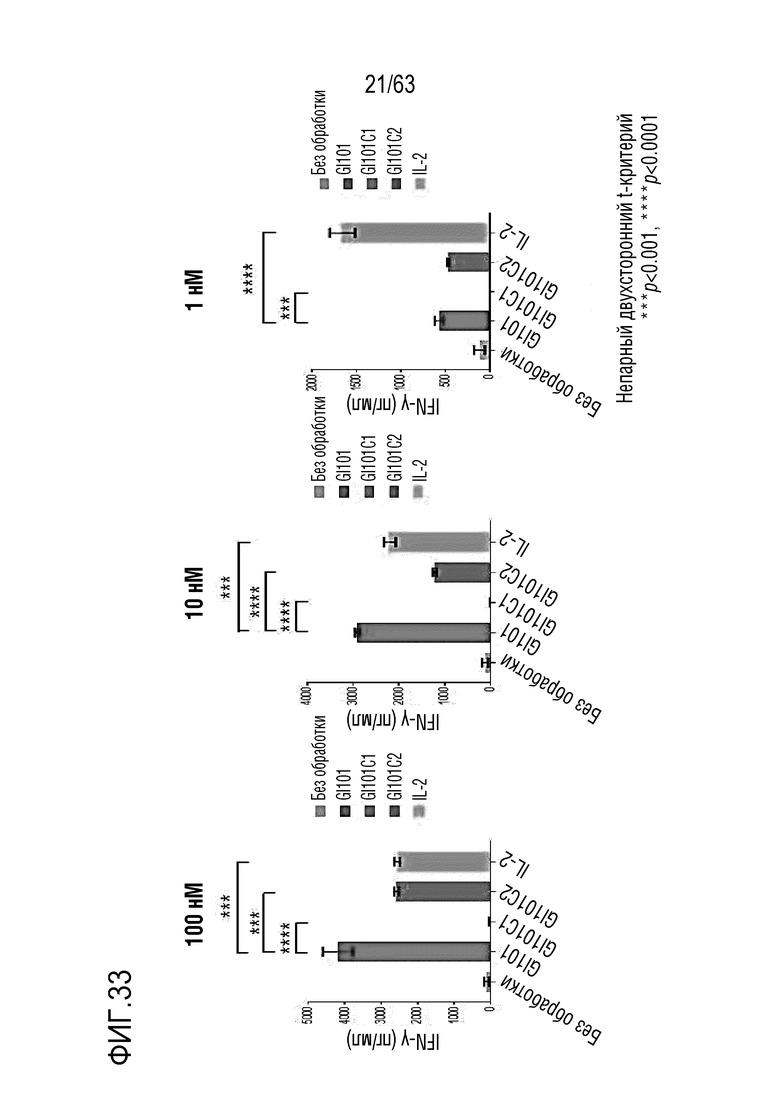
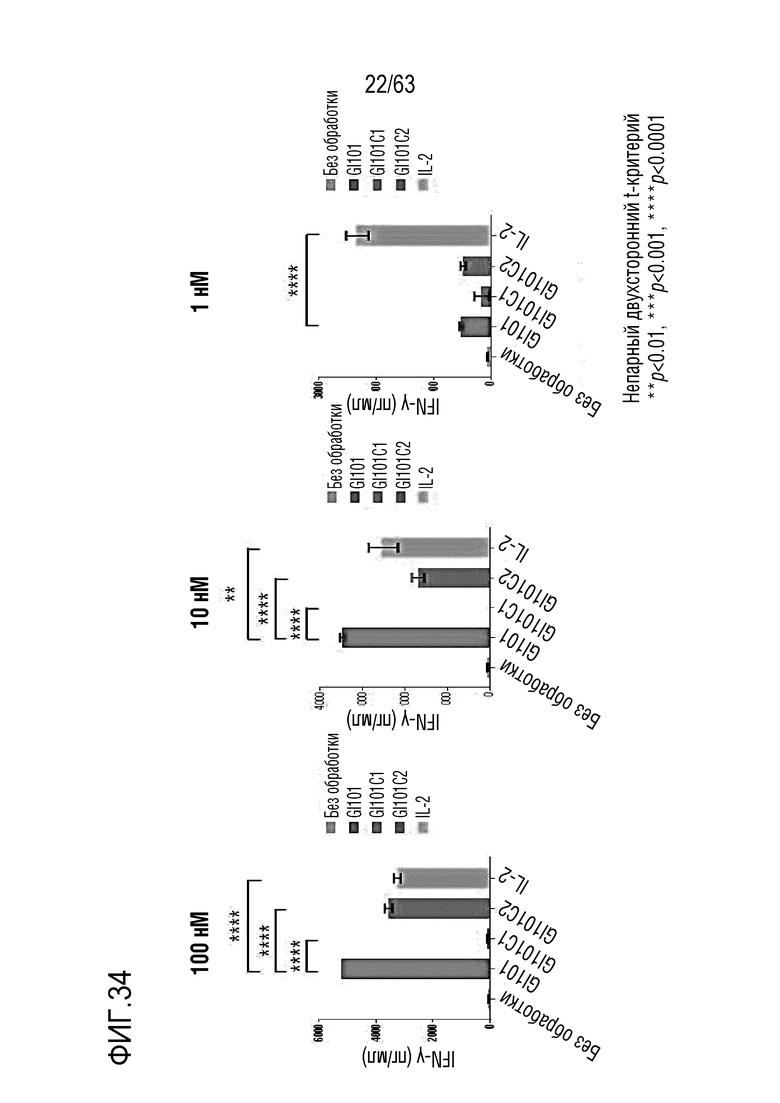
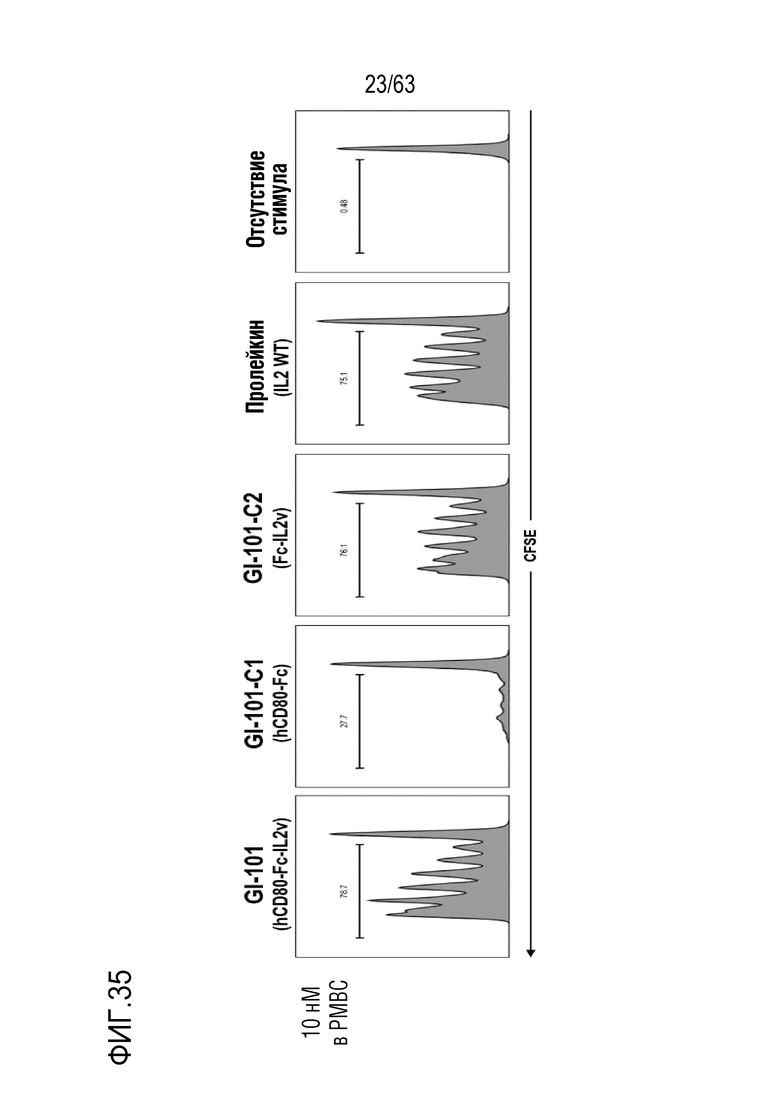

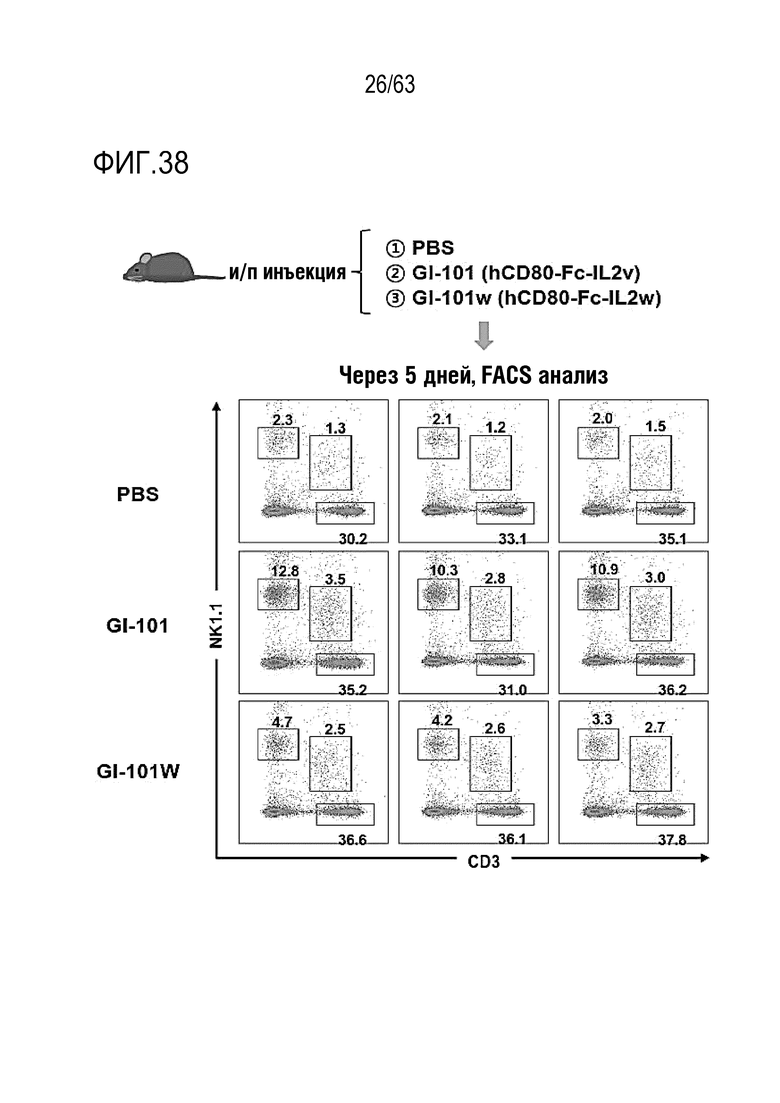
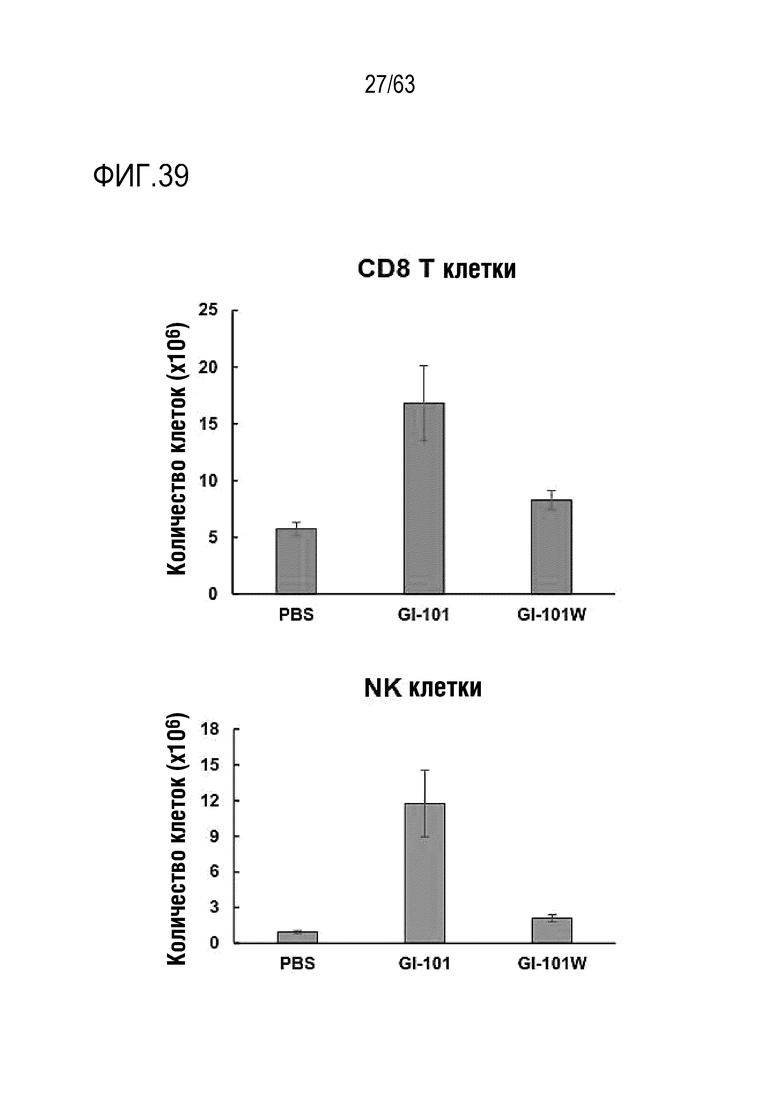
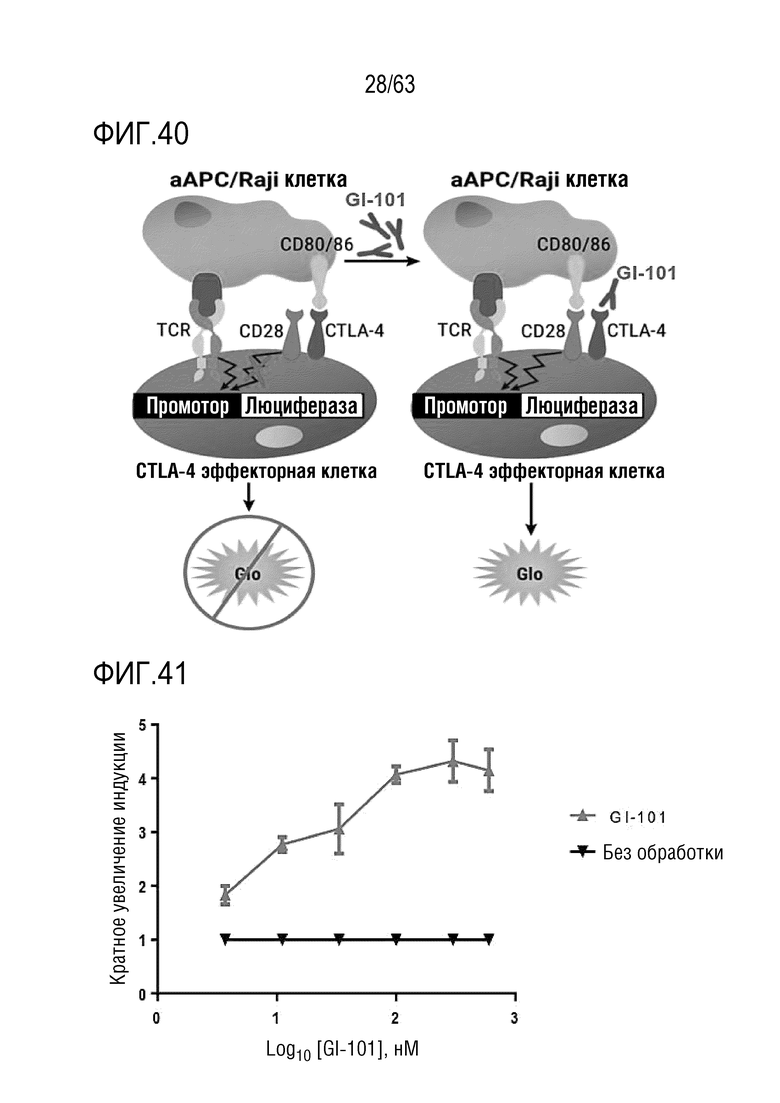
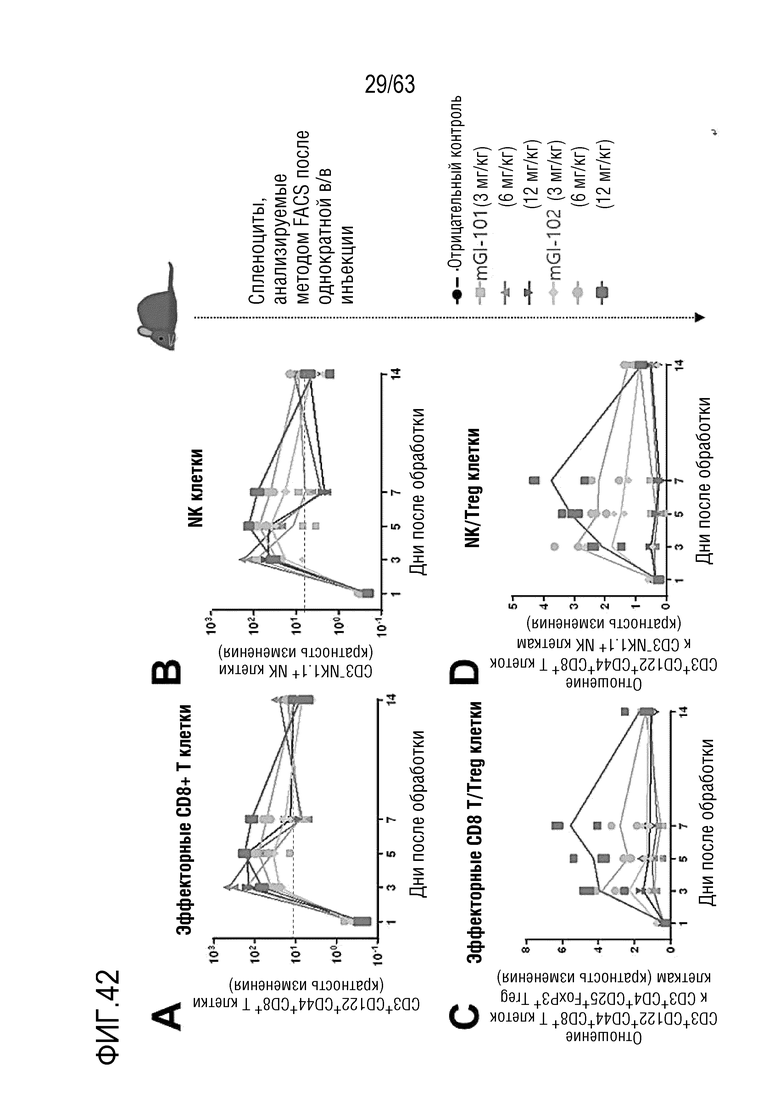
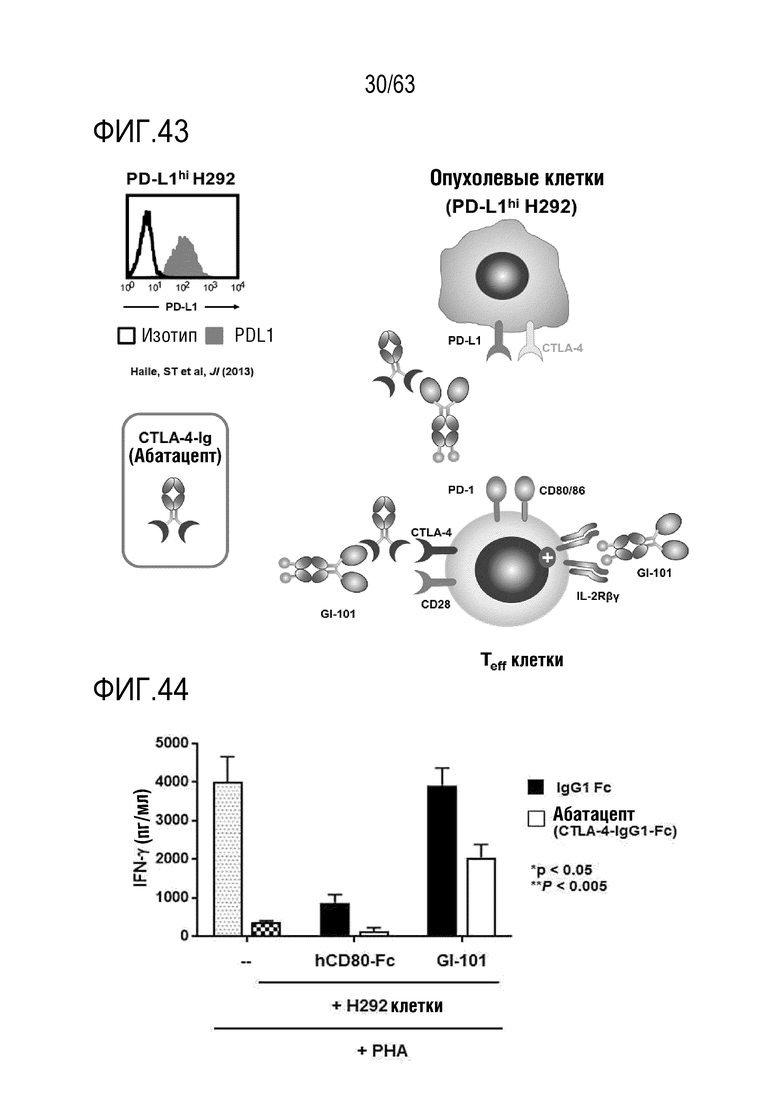
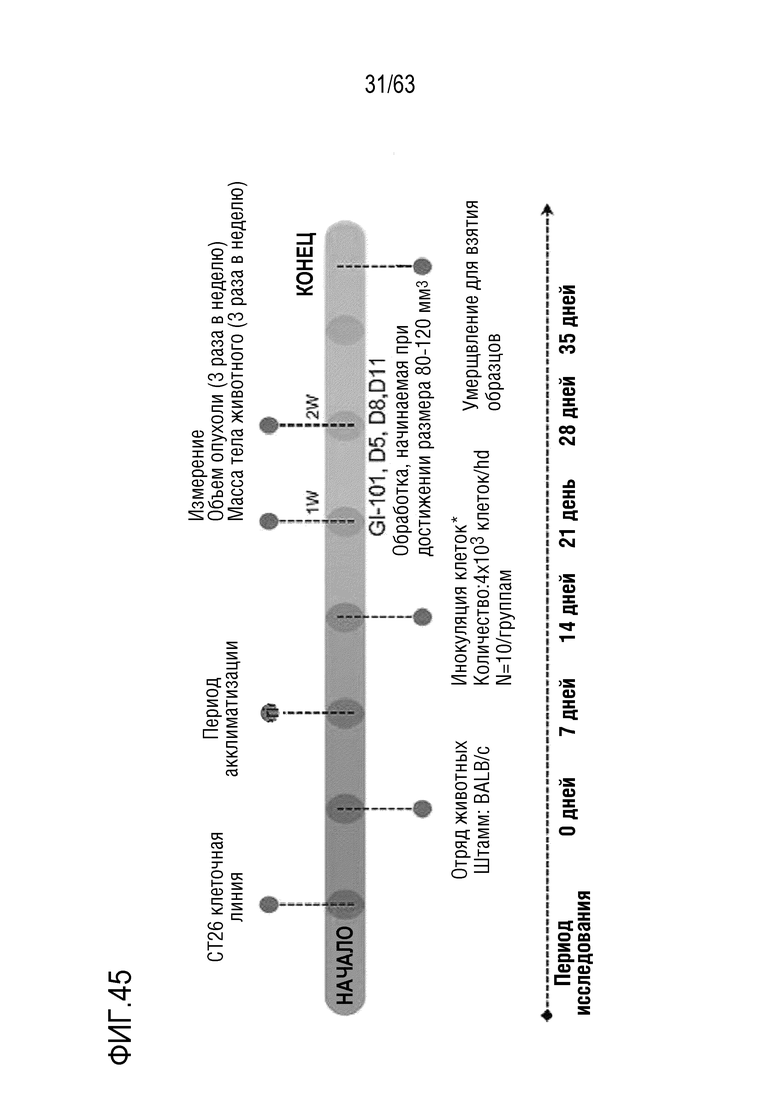
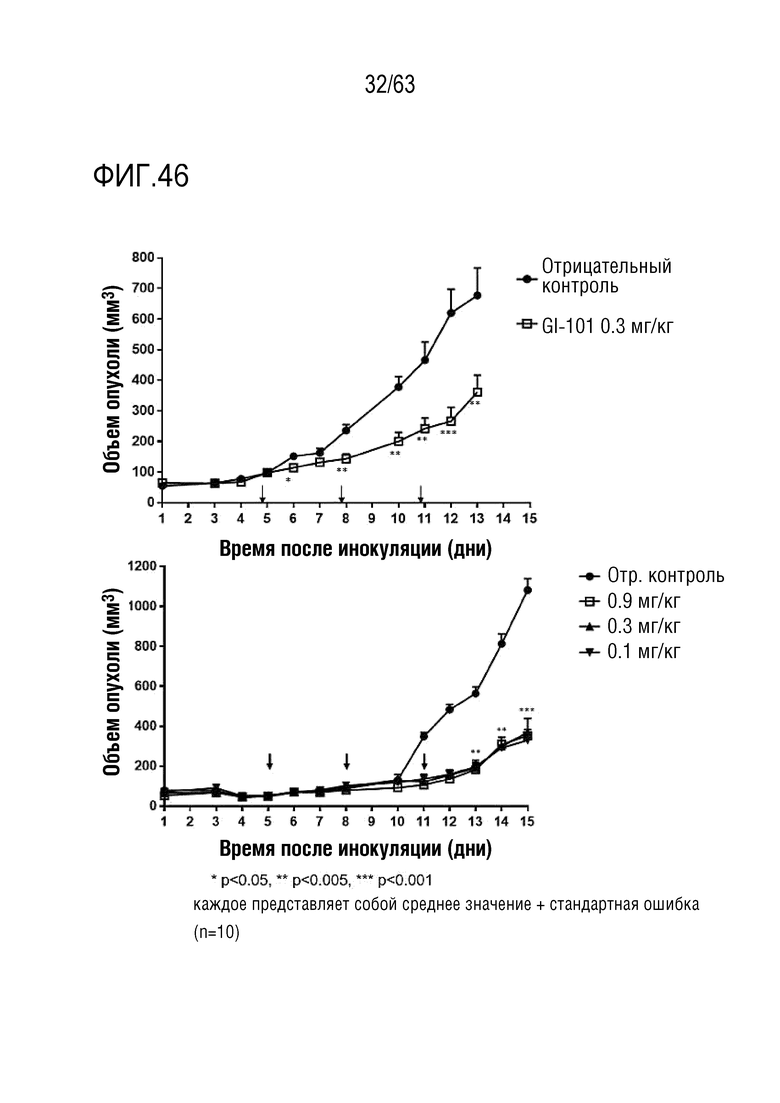
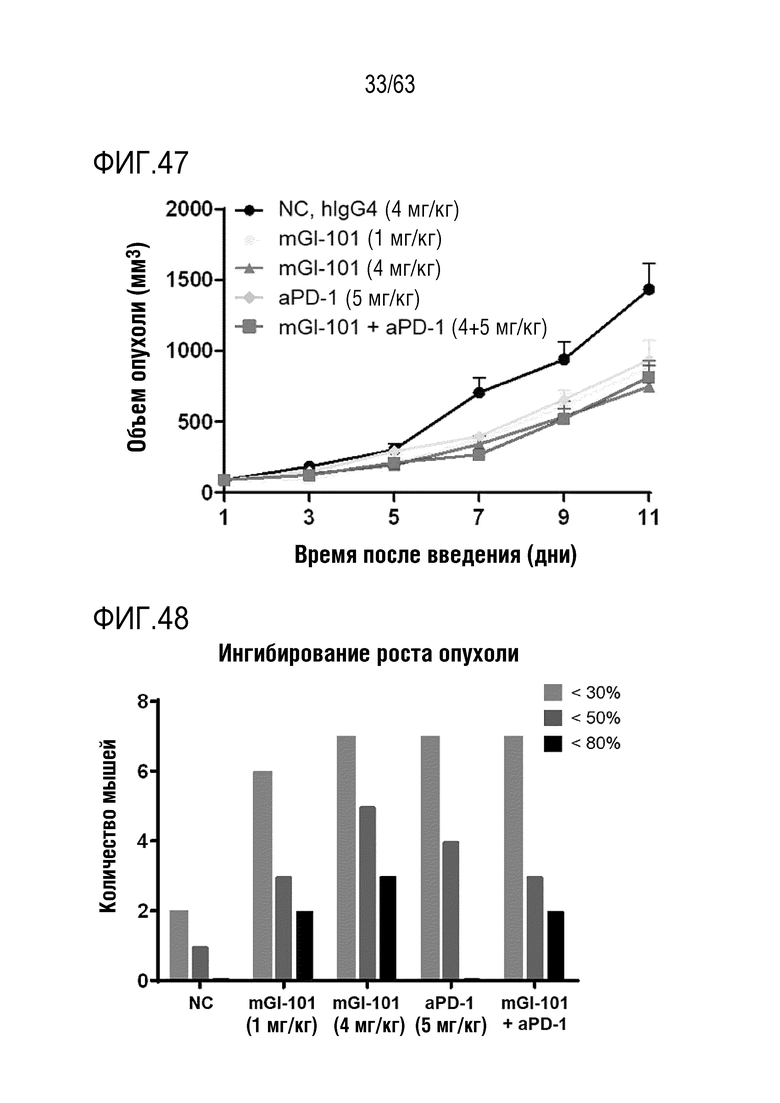
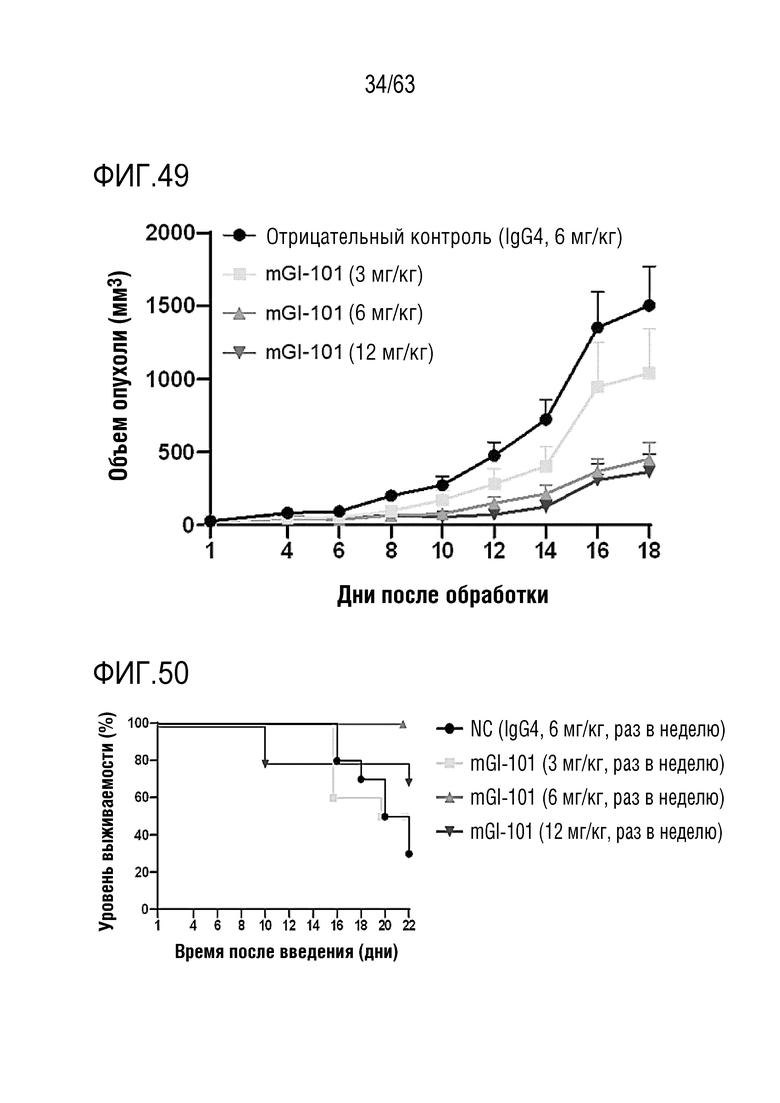
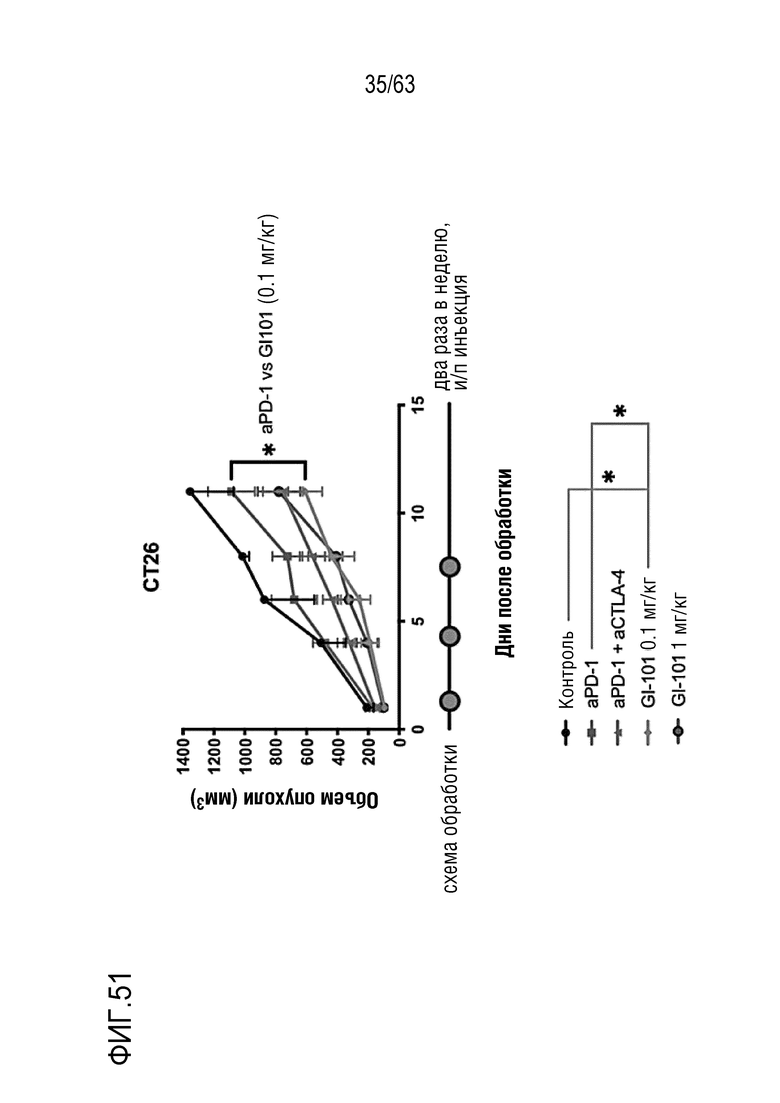
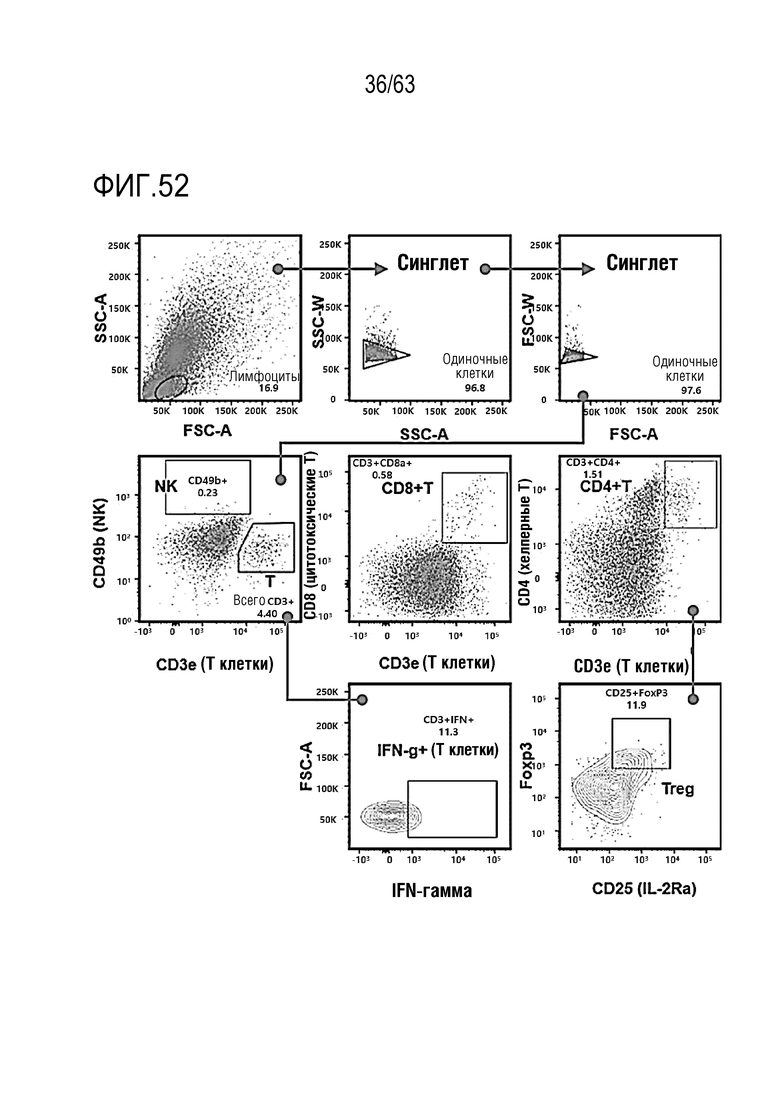
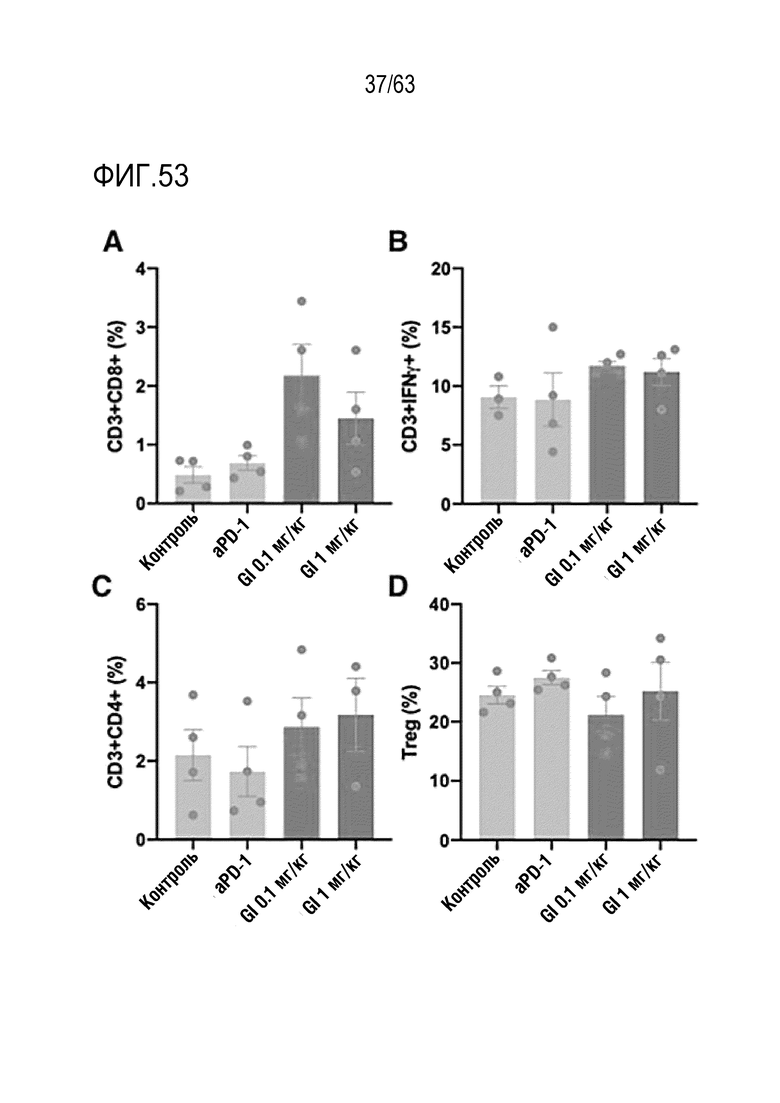
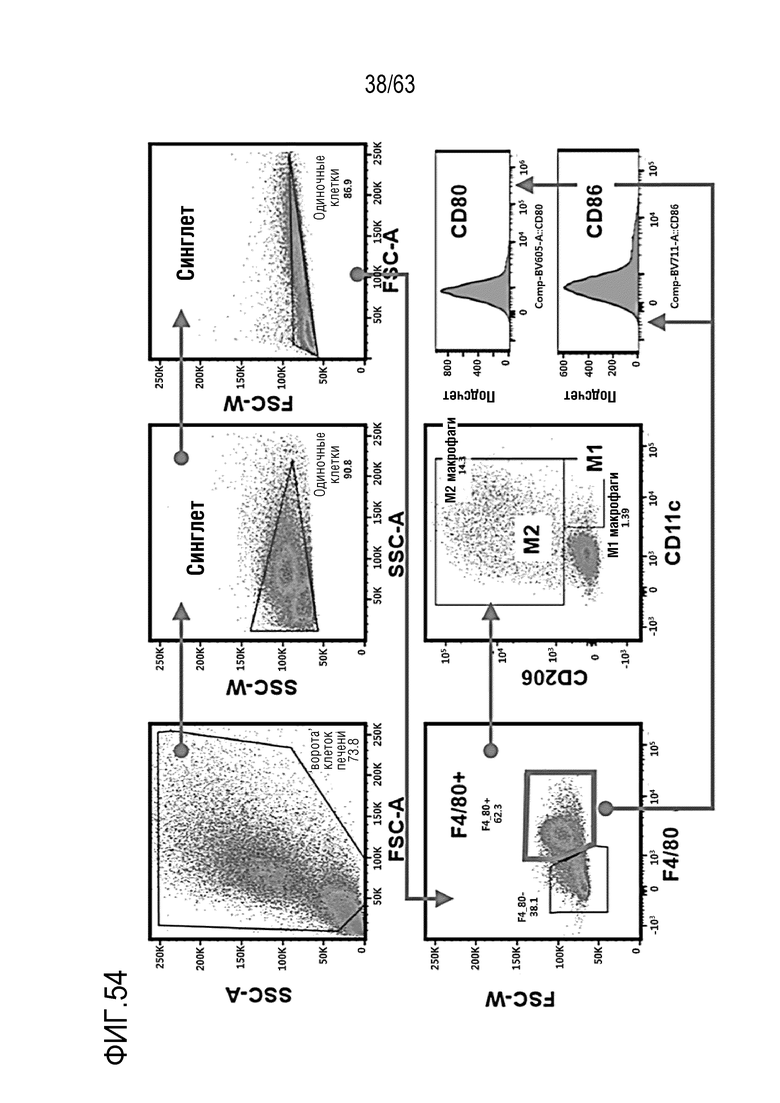
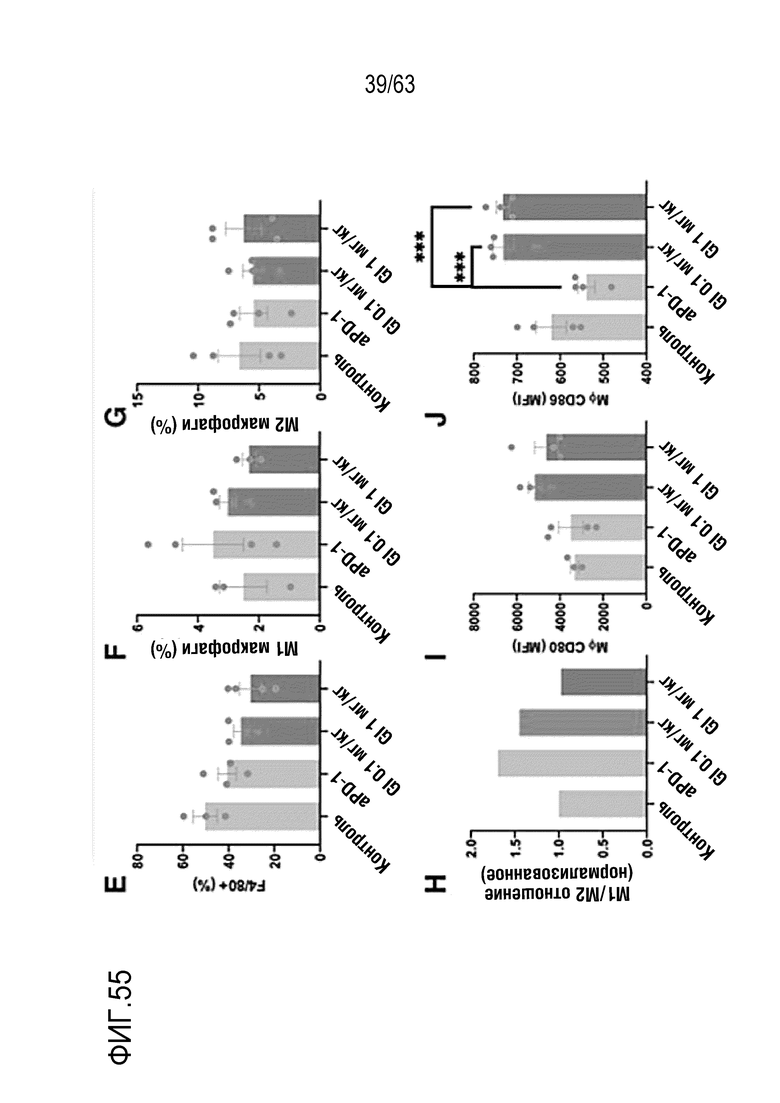
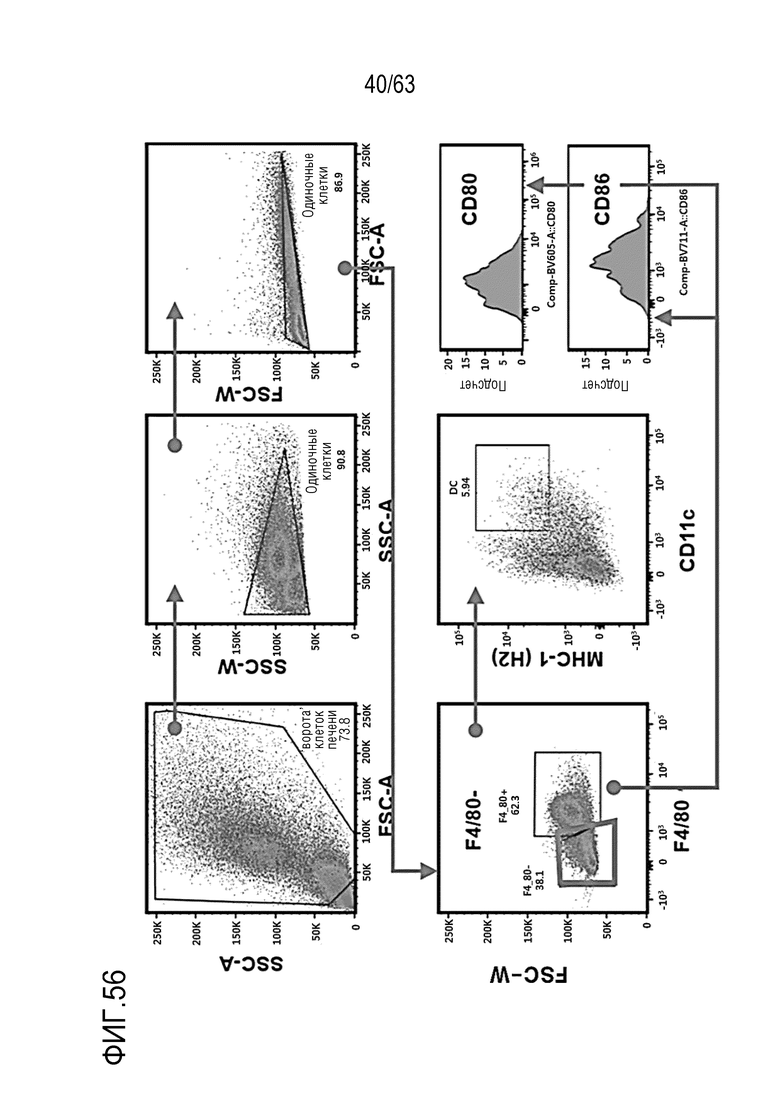
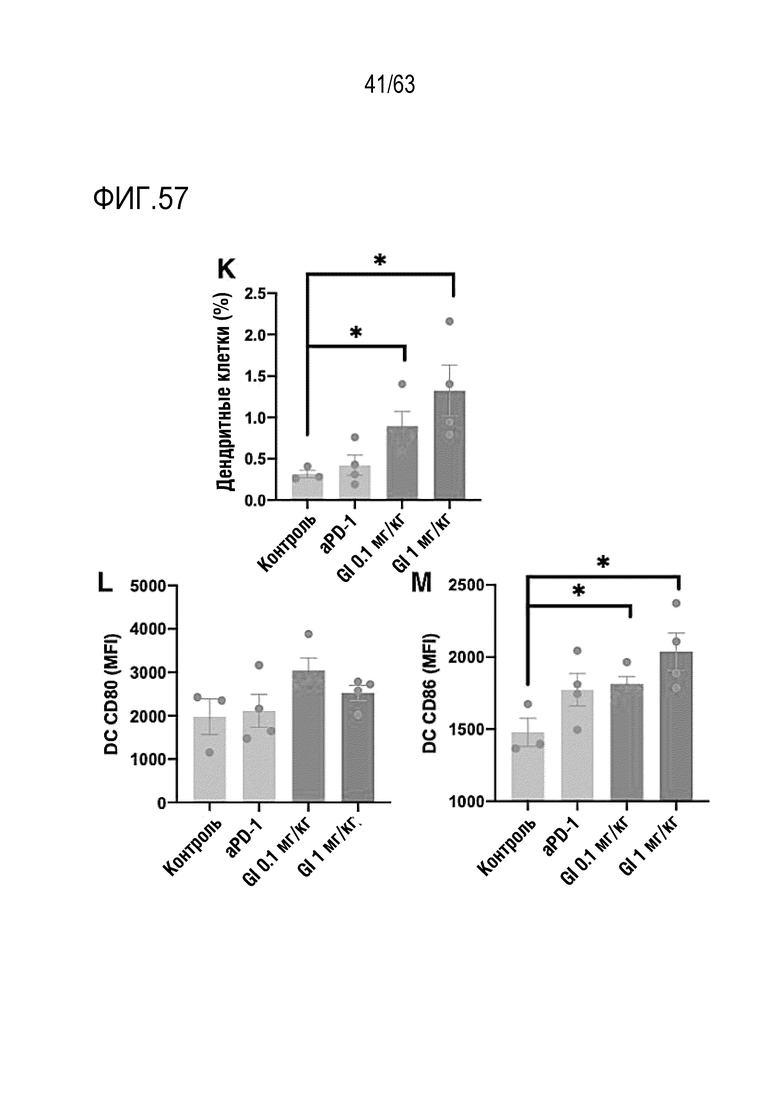
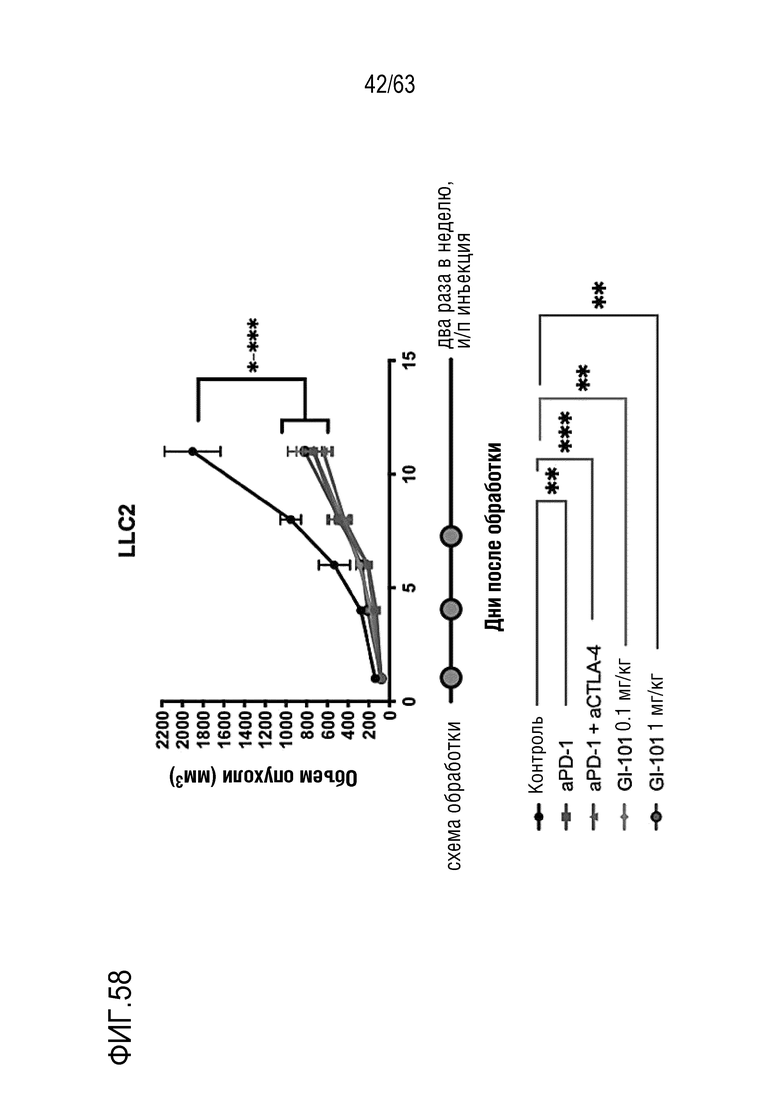
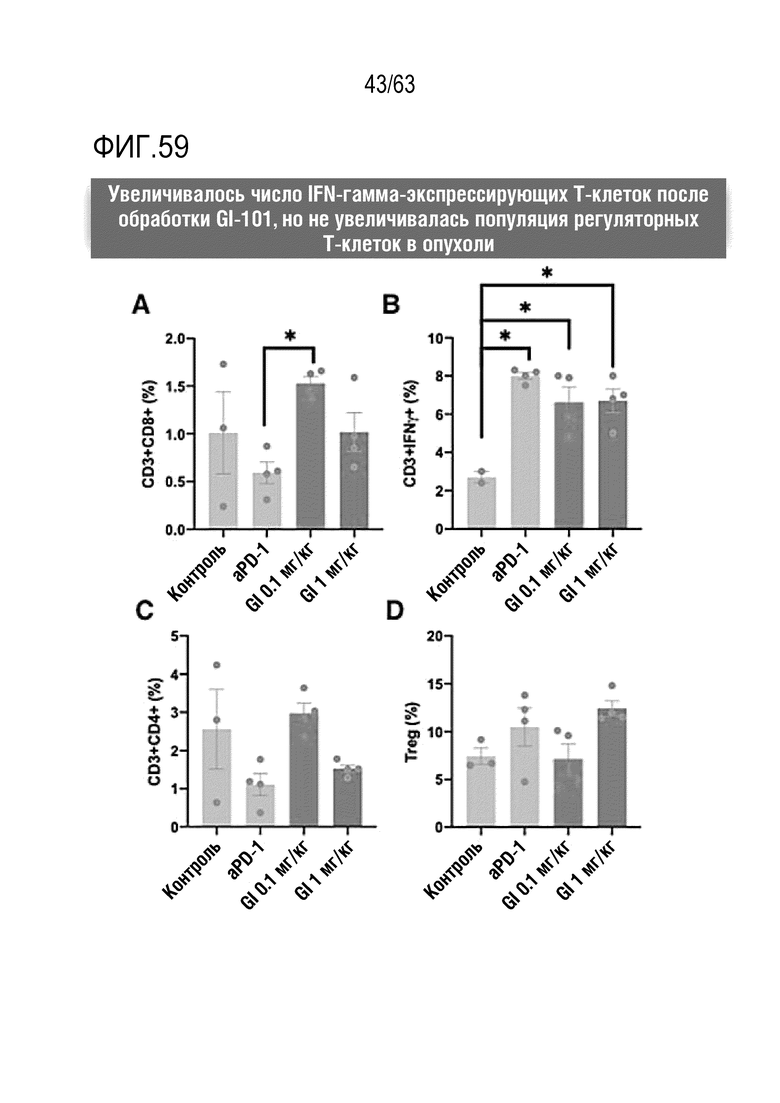
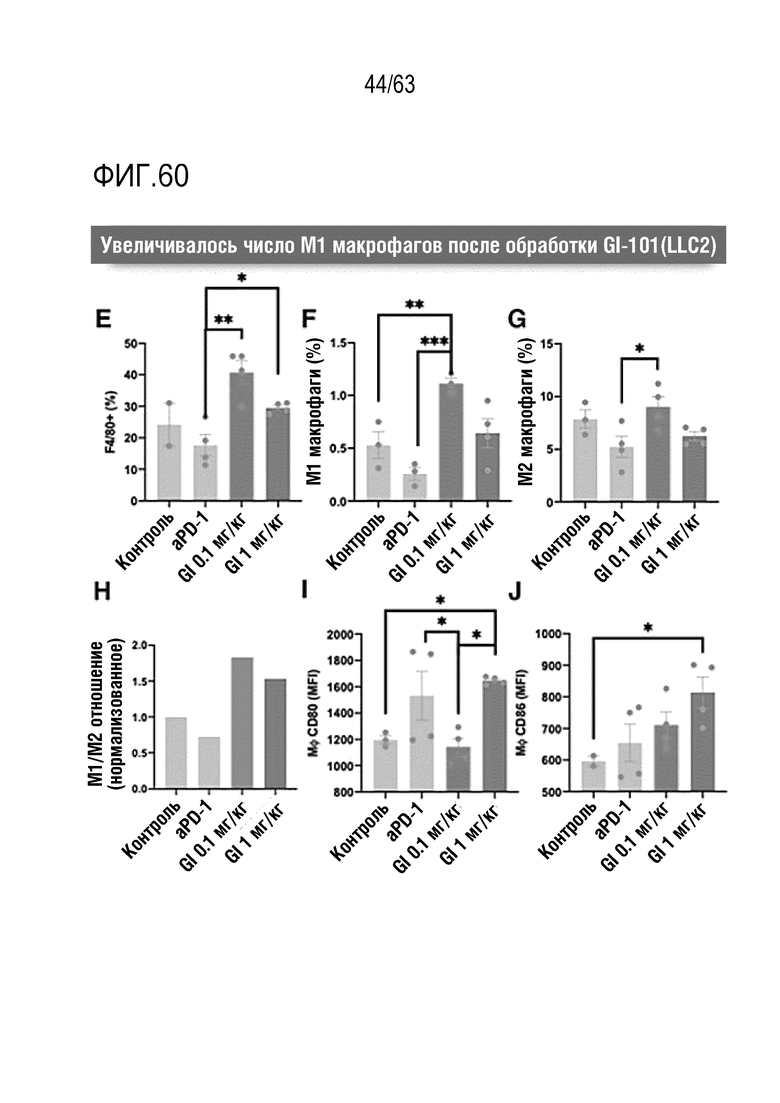
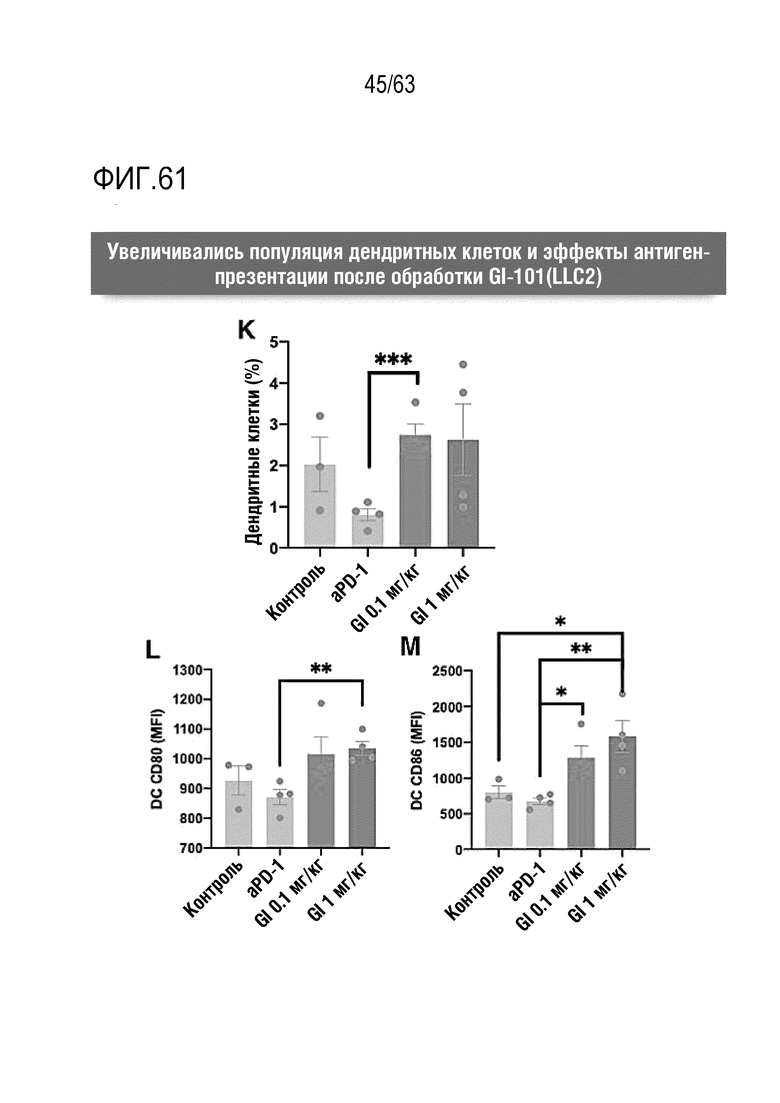
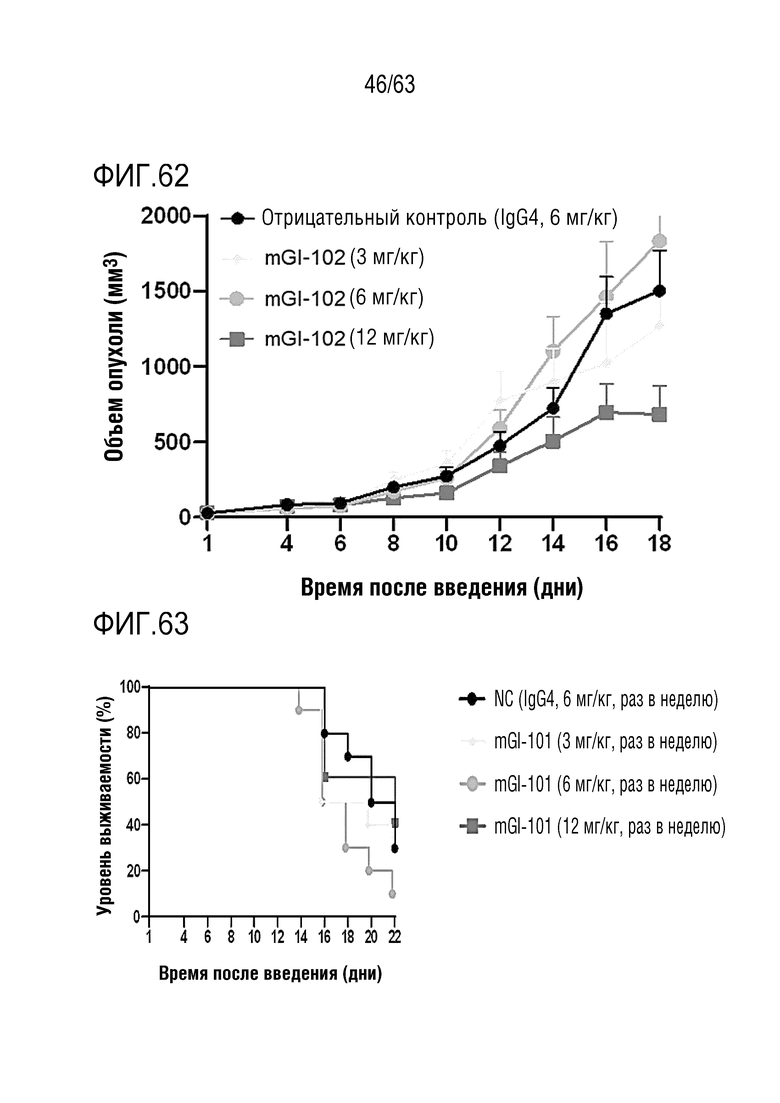
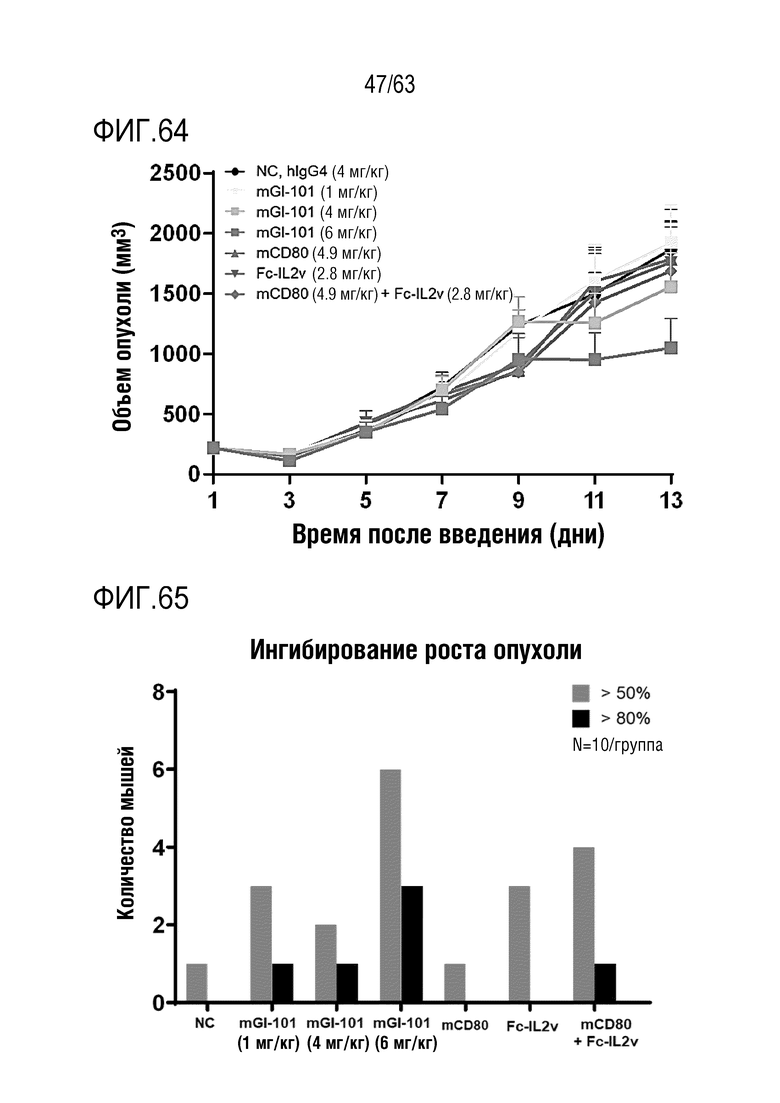
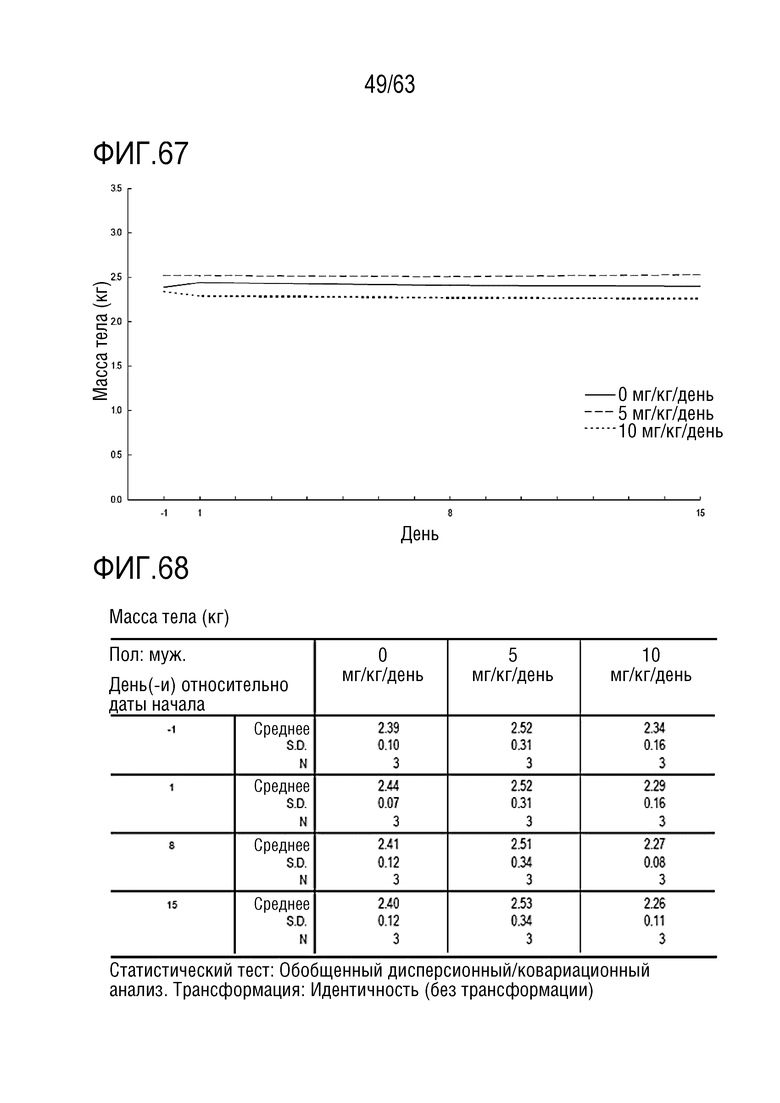

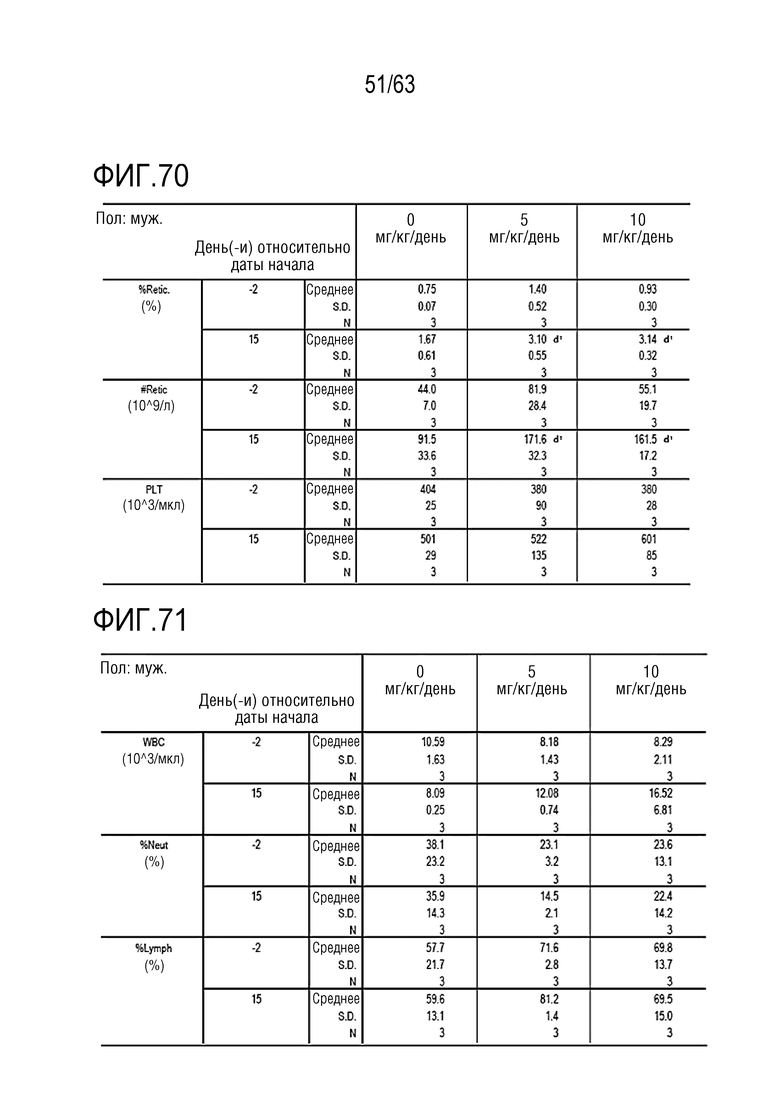
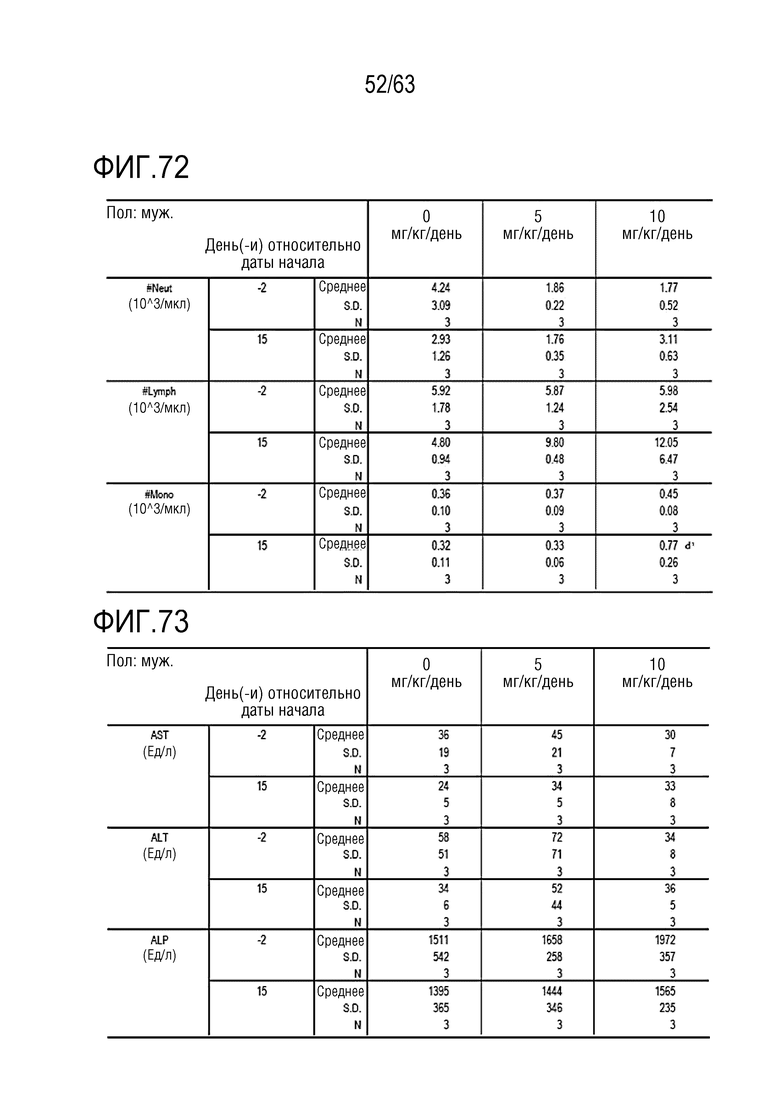
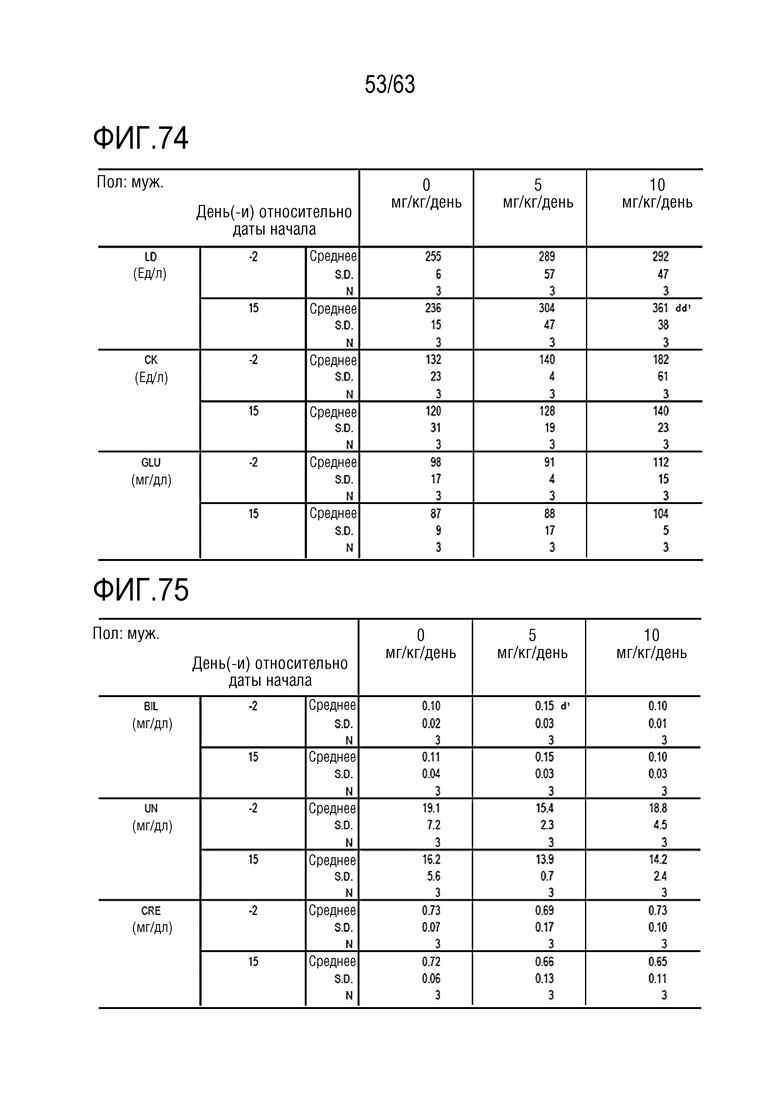
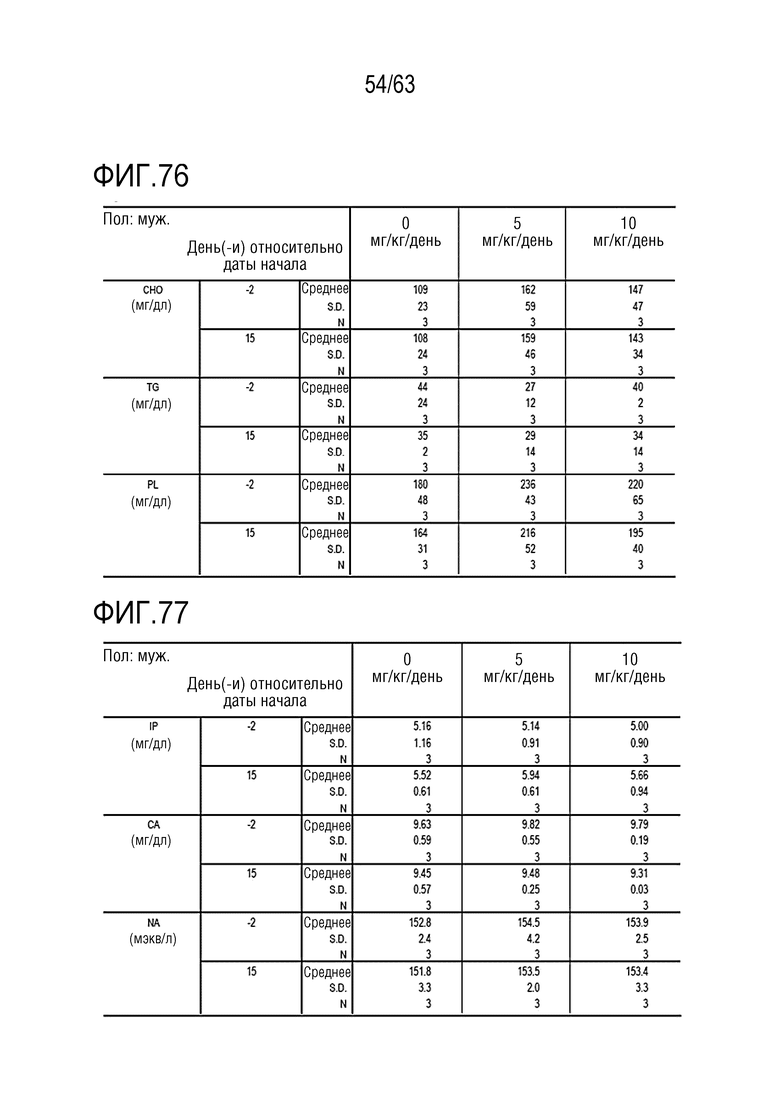
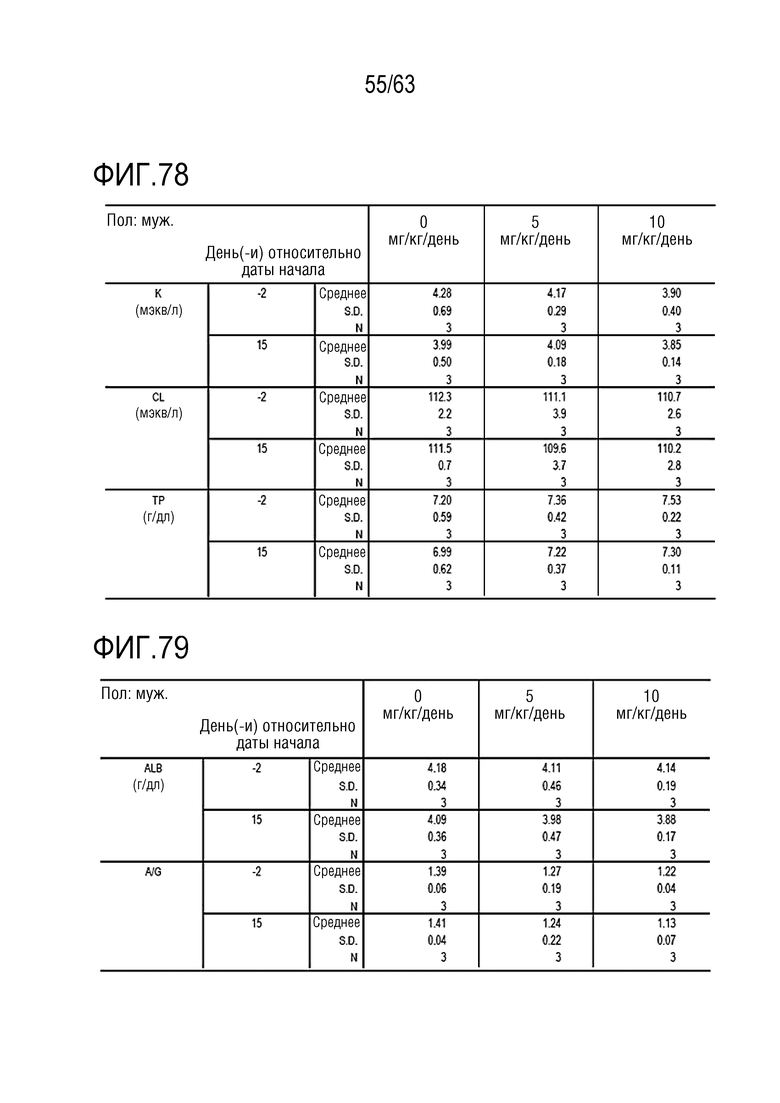
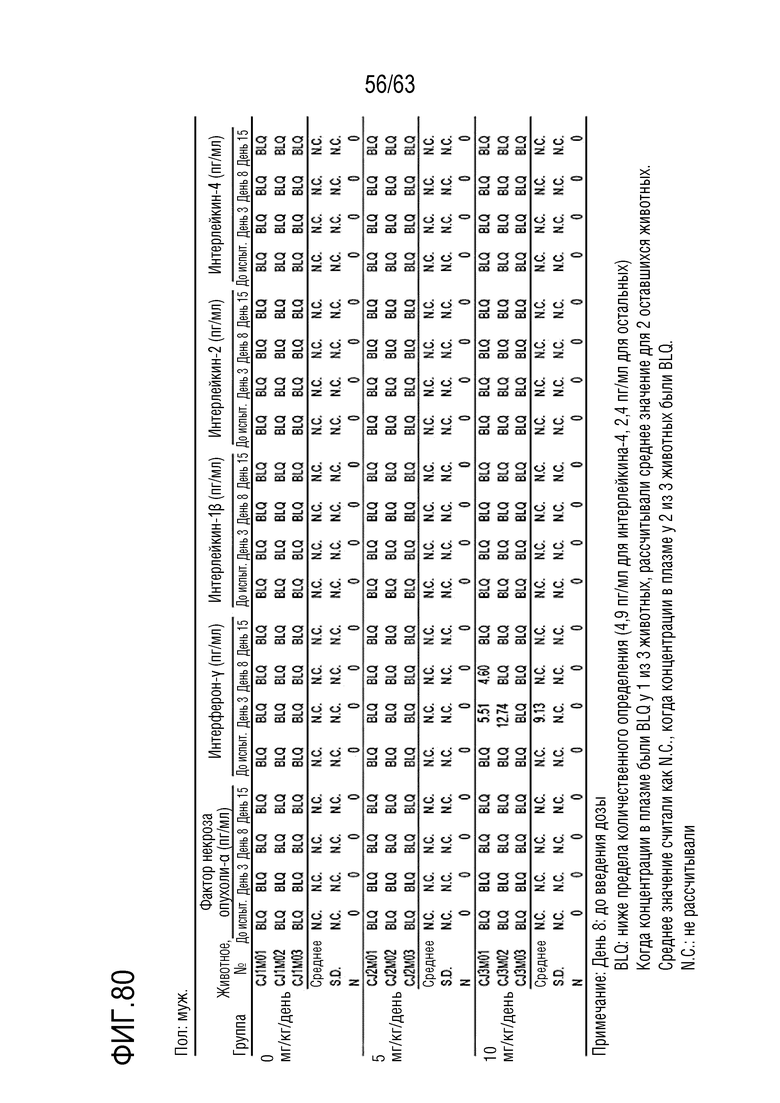
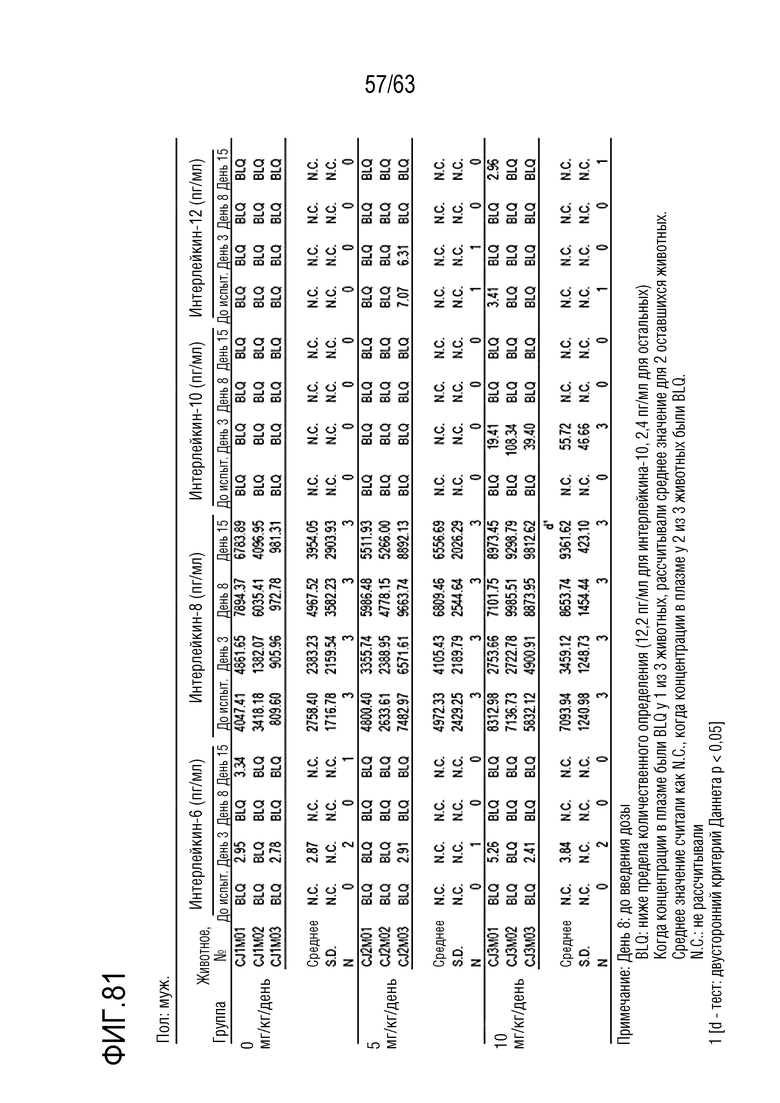
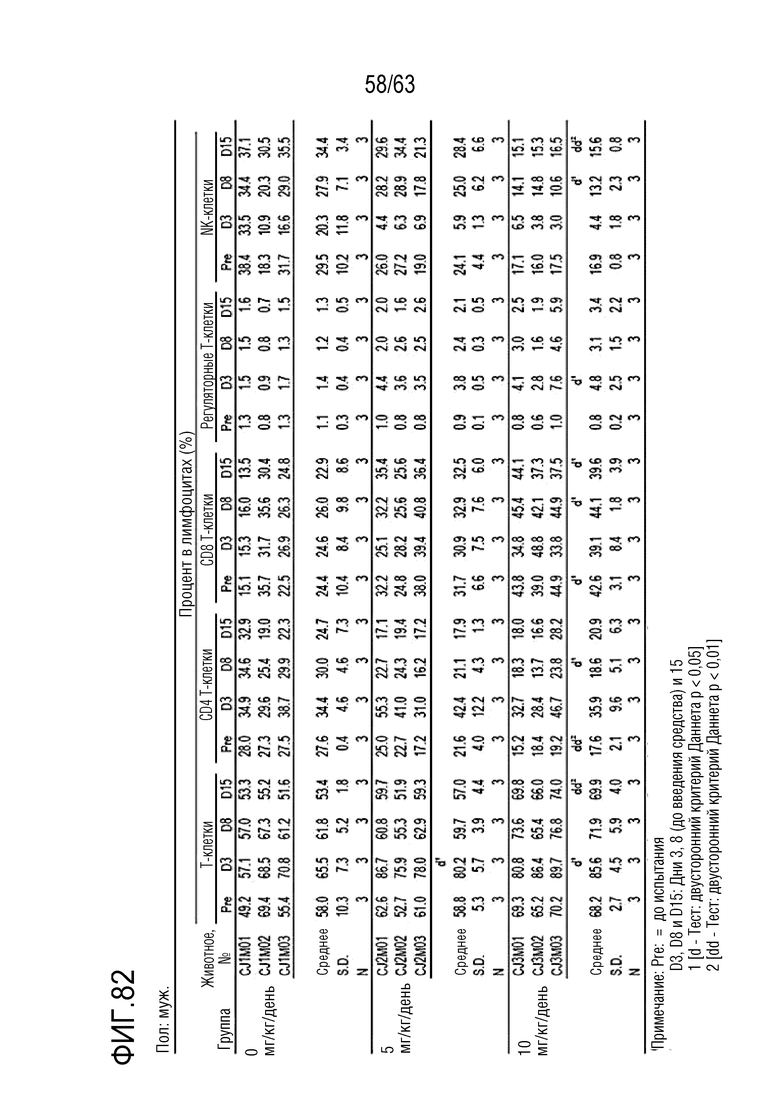
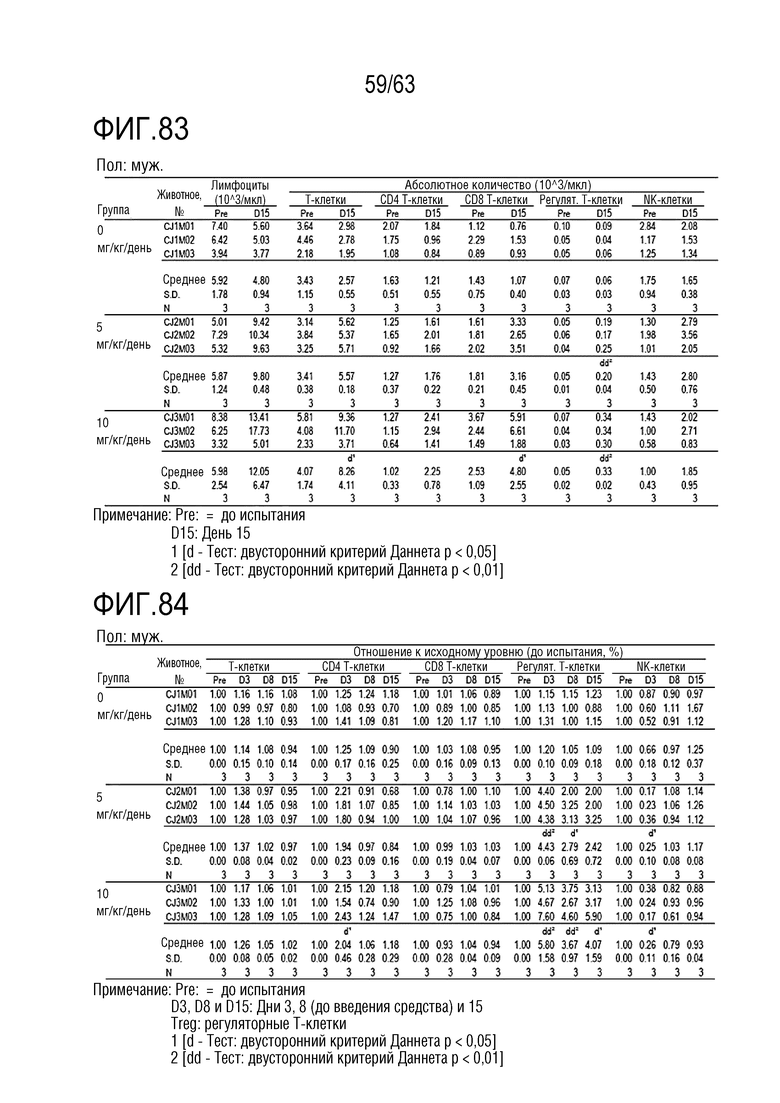



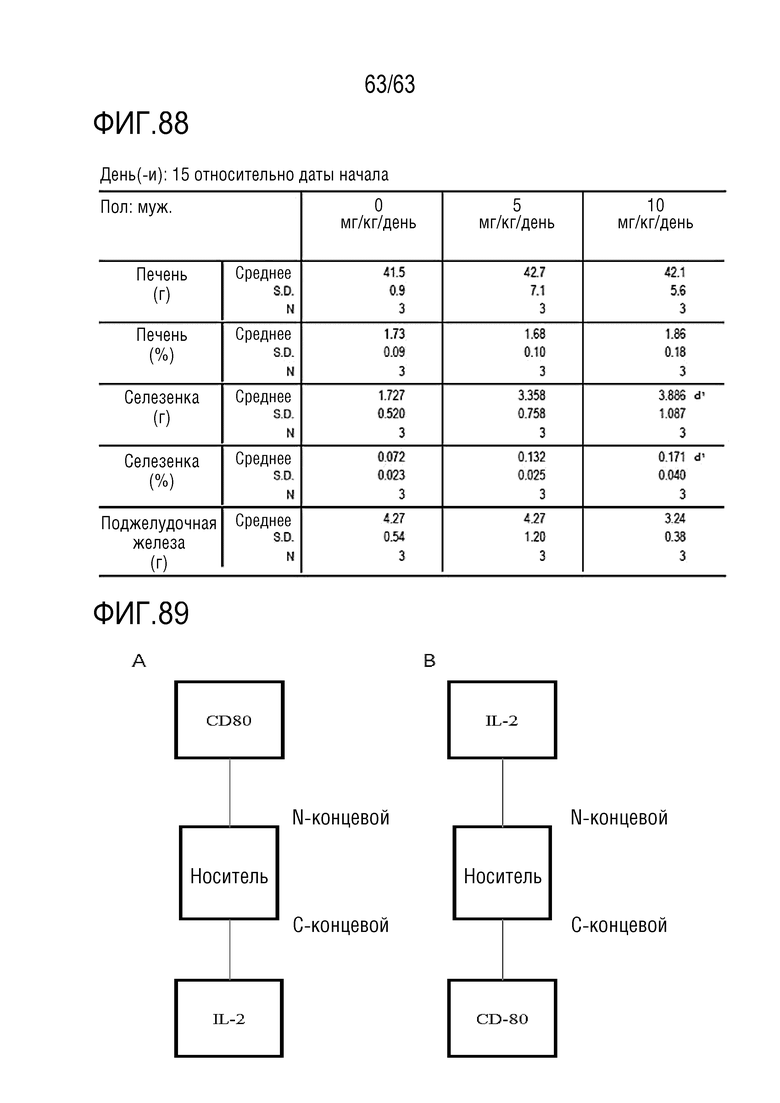
Изобретение относится к области биотехнологии, конкретно к рекомбинантным слитым белкам на основе IL-2 и CD80, и может быть использовано в медицине для лечения рака. Сконструирован слитый белок, включающий последовательно соединенные от N- к С-концу: (1) внеклеточный домен белка CD80, (2) линкер из 5-80 последовательных аминокислот, (3) Fc домен, (4) линкер из 1-50 последовательных аминокислот и (5) вариант белка IL-2 с заменами по меньшей мере двух выбранных из 38-й, 42-й, 45-й, 61-й и 72-й аминокислот в аминокислотной последовательности SEQ ID NO: 10. Изобретение обеспечивает получение слитого белка, который способен активировать природные киллерные клетки и контролировать активность регуляторных T-клеток (Treg). 7 н. и 14 з.п. ф-лы, 89 ил., 4 табл., 26 пр.
1. Слитый белок для активирования иммунных клеток и регулирования Treg клеток, который содержит вариант белка IL-2 и белок CD80, где слитый белок состоит из следующей структурной формулы (I) :
N'-X-[линкер (1)]n-Fc домен-[линкер (2)]m-Y-C', (I)
где
в структурной формуле (I)
N′ представляет собой N-конец слитого белка,
C′ представляет собой C-конец слитого белка,
X представляет собой внеклеточный домен белка CD80,
Y представляет собой белок IL-2,
где вариант белка IL-2 получают путем замены по меньшей мере двух выбранных из 38-й, 42-й, 45-й, 61-й и 72-й аминокислот в аминокислотной последовательности SEQ ID NO: 10;
линкеры (1) и (2) представляют собой пептидные линкеры, где линкер (1) состоит из 5-80 последовательных аминокислот, и линкер (2) состоит из 1-50 последовательных аминокислот, и
n и m каждый имеет значение 1.
2. Слитый белок по п. 1, где вариант белка IL-2 получают путем по меньшей мере двух замен, выбранных из группы, состоящей из R38A, F42A, Y45A, E61R и L72G, в аминокислотной последовательности SEQ ID NO: 10.
3. Слитый белок по п. 1, где вариант белка IL-2 содержит любую выбранную из следующих комбинаций замен (a)-(d) в аминокислотной последовательности SEQ ID NO: 10:
(a) R38A/F42A
(b) R38A/F42A/Y45A
(c) R38A/F42A/E61R
(d) R38A/F42A/L72G.
4. Слитый белок по п. 1, где вариант белка IL-2 имеет аминокислотную последовательность SEQ ID NO: 6, 22, 23 или 24.
5. Слитый белок по п. 1, где внеклеточный домен белка CD80 состоит из 35-й аминокислоты - 242-й аминокислоты в аминокислотной последовательности SEQ ID NO: 11.
6. Слитый белок по п. 1, где Fc домен является диким типом или вариантом.
7. Слитый белок по п. 1, где Fc домен имеет аминокислотную последовательность SEQ ID NO: 4.
8. Слитый белок по п. 6, где вариант Fc домена имеет аминокислотную последовательность SEQ ID NO: 12.
9. Слитый белок по п. 1, где линкер (1) представляет собой пептидный линкер, состоящий из аминокислотной последовательности SEQ ID NO: 3.
10. Слитый белок по п. 1, где линкер (2) представляет собой пептидный линкер, состоящий из аминокислотной последовательности SEQ ID NO: 5.
11. Слитый белок по п. 1, где слитый белок имеет идентичность последовательности 85% или больше с аминокислотной последовательностью SEQ ID NO: 9, 26, 28 или 30.
12. Димер слитого белка для активирования иммунных клеток и регулирования Treg клеток, где два слитых белка по любому из пп. 1-11 связаны друг с другом.
13. Димер слитого белка по п. 12, где димер слитого белка представляет собой гомодимер.
14. Полинуклеотид, кодирующий слитый белок по любому из пп. 1-11, где полинуклеотид имеет идентичность последовательности 85% или больше с нуклеотидной последовательностью SEQ ID NO: 8, 25, 27 или 29.
15. Вектор экспрессии млекопитающего для экспрессии слитого белка по п. 1, включающий полинуклеотид по п. 14.
16. Трансформированная клетка млекопитающего для экспрессии слитого белка по п. 1, в которую введен вектор экспрессии млекопитающего по п. 15, где клетка не является эмбриональной клеткой человека.
17. Фармацевтическая композиция для профилактики или лечения рака, включающая в качестве активного ингредиента:
слитый белок по любому из пп. 1-11 в эффективном количестве; или
димер слитого белка по п. 12 или 13 в эффективном количестве.
18. Фармацевтическая композиция по п. 17, дополнительно включающая фармацевтически приемлемый носитель.
19. Фармацевтическая композиция по п. 17, где рак представляет собой любой, выбранный из группы, состоящей из рака желудка, рака печени, рака легких, колоректального рака, рака молочной железы, рака предстательной железы, рака яичника, рака поджелудочной железы, рака шейки матки, рака щитовидной железы, рака гортани, острого миелоидного лейкоза, опухоли головного мозга, нейробластомы, ретинобластомы, рака головы и шеи, рака слюнной железы и лимфомы.
20. Применение слитого белка по п. 1 для получения лекарственного средства для лечения рака.
21. Применение по п. 20, где рак представляет собой любой, выбранный из группы, состоящей из рака желудка, рака печени, рака легких, колоректального рака, рака молочной железы, рака предстательной железы, рака яичника, рака поджелудочной железы, рака шейки матки, рака щитовидной железы, рака гортани, острого миелоидного лейкоза, опухоли головного мозга, нейробластомы, ретинобластомы, рака головы и шеи, рака слюнной железы и лимфомы.
| KONG LINGHONG et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Устройство для выпрямления опрокинувшихся на бок и затонувших у берега судов | 1922 |
|
SU85A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Катодный усилитель с питанием усилительной лампы переменным током | 1923 |
|
SU685A1 |
| CHAN et al | |||
| ПИШУЩАЯ МАШИНА ДЛЯ ПОЛУЧЕНИЯ РАВНОГЛУБОКИХ ОТТИСКОВ ЛИТЕР | 1923 |
|
SU1131A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
Авторы
Даты
2024-01-15—Публикация
2019-09-16—Подача