РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет согласно предварительной заявке на патент США No 62/934928, поданной 13 ноября 2019 г., и предварительной заявке на патент США No 62/804521, поданной 12 февраля 2019 г., каждая из которых полностью включена в данный документ посредством ссылки.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Данная заявка подается в электронном виде через EFS-Web и включает последовательность, представленную в электронном виде, в формате.txt. Файл.txt содержит список последовательностей под названием ROPA 013 02WO ST25.txt размером ~61 килобайт, созданный 11 февраля 2020 г. Перечень последовательностей, содержащийся в данном файле.txt, является частью описания и полностью включен в данный документ посредством ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение в целом относится к генной терапии заболеваний, ассоциированных с мутациями в мембранном белке 2, ассоциированном с лизосомами (LAMP-2, также известном как CD107b).
УРОВЕНЬ ТЕХНИКИ
Мембранный белок 2, ассоциированный с лизосомами (LAMP-2, также известный как CD107b), представляет собой ген, который кодирует мембранный гликопротеин, ассоциированный с лизосомами. Альтернативный сплайсинг гена продуцирует три изоформы: LAMP-2A, LAMP-2B и LAMP-2C. Мутации с потерей функции в LAMP-2 ассоциированы с заболеваниями человека, в том числе с болезнью Данона, семейной кардиомиопатией, ассоциированной с нарушением аутофагии. Болезнь Данона представляет собой редкую, но серьезную миопатию сердечной и скелетных мышц, приводящую к значительной заболеваемости и ранней смертности из-за аритмии и кардиомиопатии. Природа Х-сцепленного наследования объясняет регистрируемые различия в фенотипической тяжести данного заболевания у мужчин и женщин. Boucek et al. Genetics in Medicine 13:563-568 (2011). В настоящее время понятно, что причиной данного заболевания является первичный дефицит мембранного белка-2, ассоциированного с лизосомами (LAMP-2), который функционирует как лизосомный мембранный рецептор при аутофагии, опосредованной шапероном. Nishino et al. Nature 406:906-910 (2000).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложены такие векторы для генной терапии, имеющие отношение к LAMP2, способы их применения, фармацевтические композиции и многое другое. Хотя клиническое применение векторов на основе аденоассоциированного вируса (AAV) известно, селекция предпочтительного(-ых) серотипа(-ов) AAV для генной терапии остается сложным и непредсказуемым аспектом.
В настоящем изобретении предложены улучшенные векторы для генной терапии, содержащие полинуклеотидную последовательность, кодирующую полипептид LAMP-2, способы ее применения, фармацевтические композиции и многое другое. В частности, в настоящем изобретении предложены рекомбинантные векторы на основе AAV серотипа AAVrh74, экспрессирующие LАМР-2A LAMP-2B или LAMP-2C, для применения в качестве терапевтического средства при, например, болезни Данона.
Другие признаки и преимущества настоящего изобретения очевидны из следующего подробного описания и формулы изобретения и охватываются ими.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
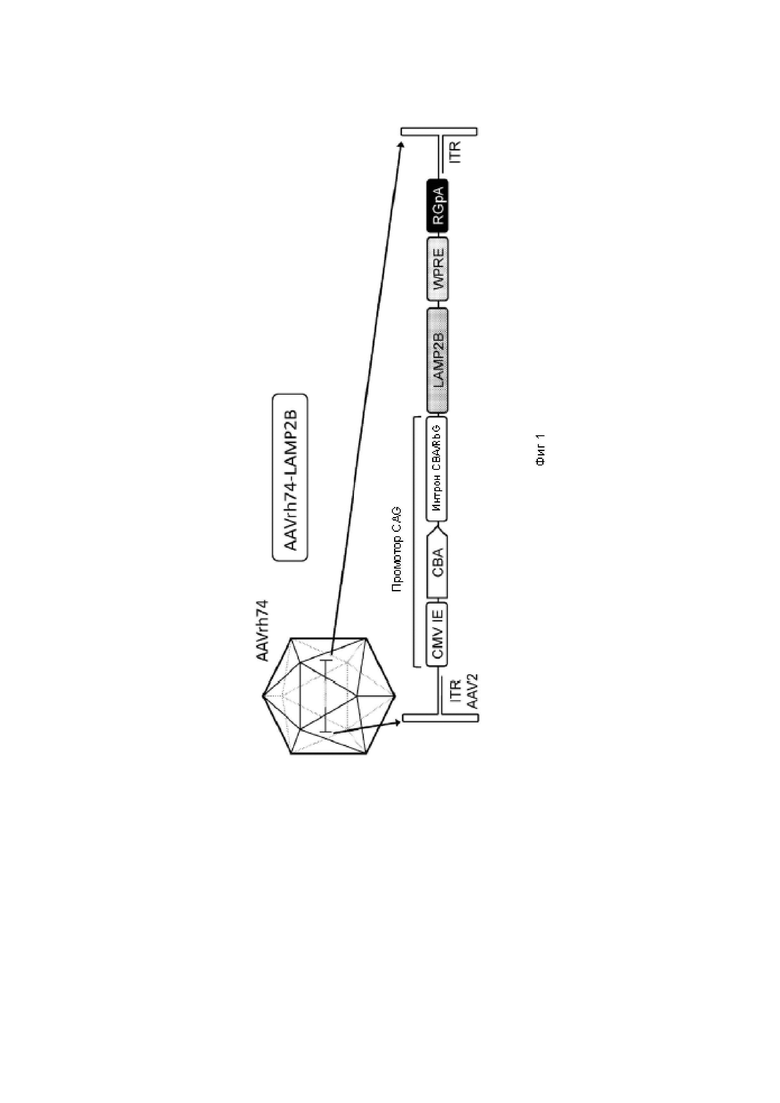
На фиг. 1 изображен вариант реализации вектора на основе AAV, характеризующегося серотипом AAVrh74.
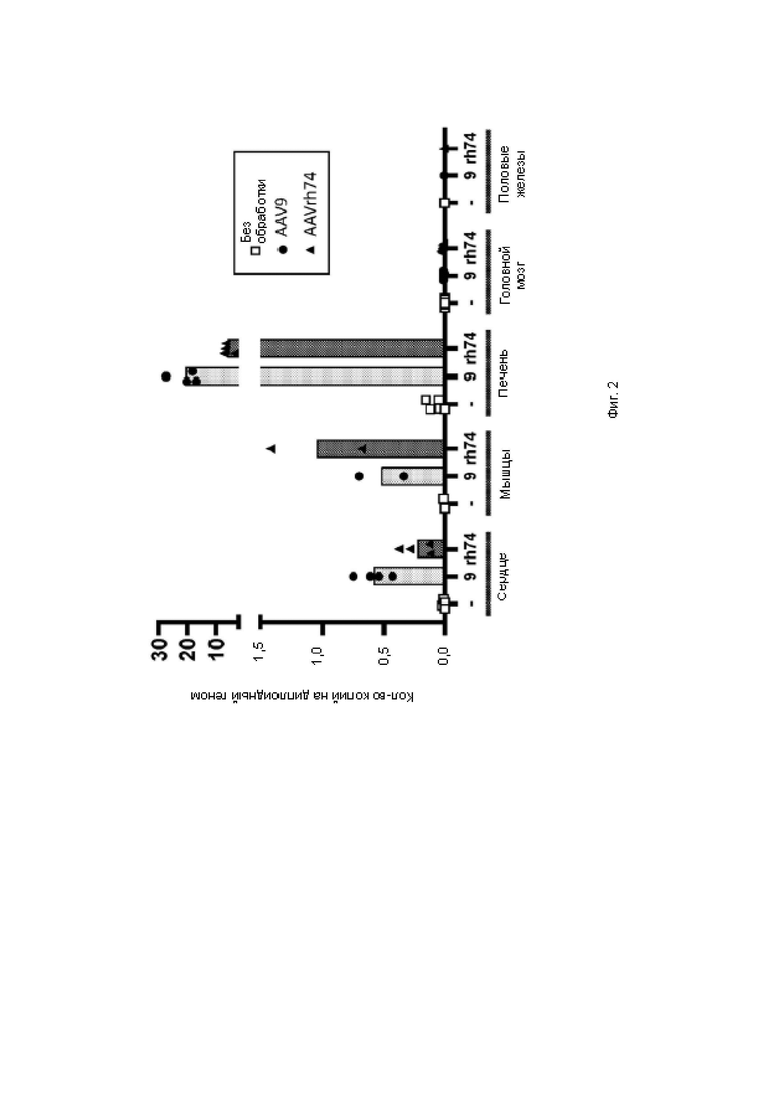
На фиг. 2 показана гистограмма количественного определения ДНК вектора в органах, в наибольшей степени поражаемых при болезни Данона, с помощью кПЦР.
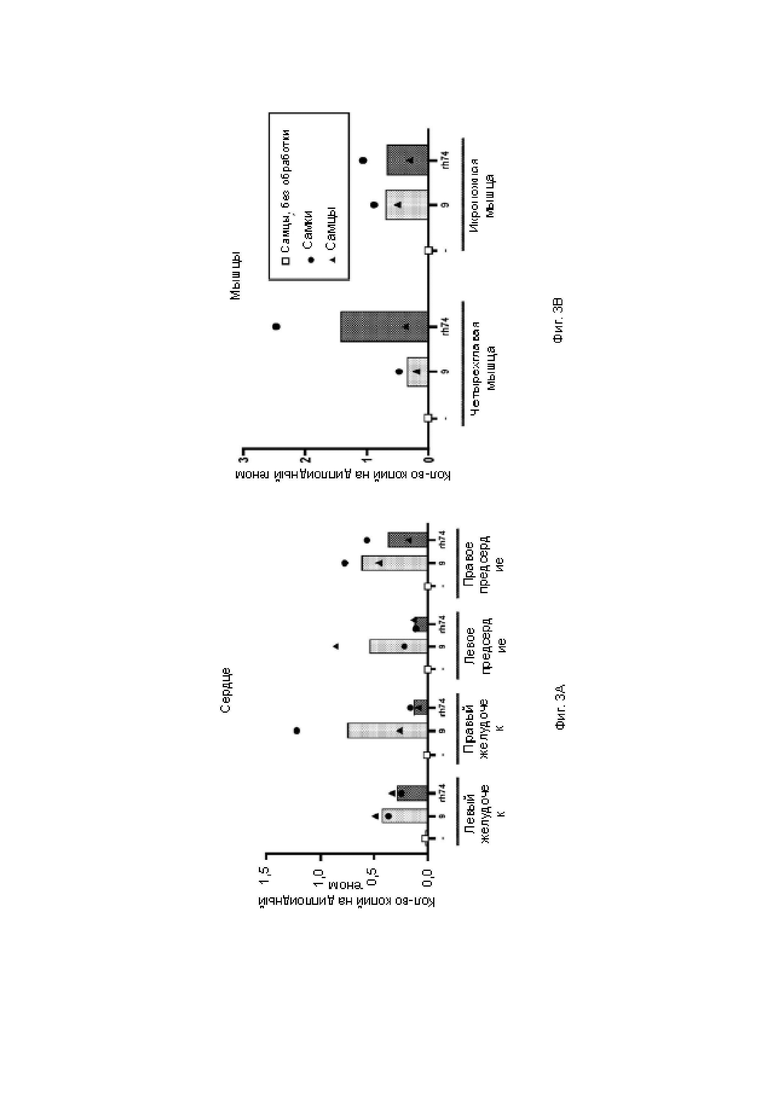
На фиг. 3А показана гистограмма количественного определения ДНК вектора в областях сердца с помощью кПЦР.
На фиг. 3В показана гистограмма количественного определения ДНК вектора в мышцах с помощью кПЦР.
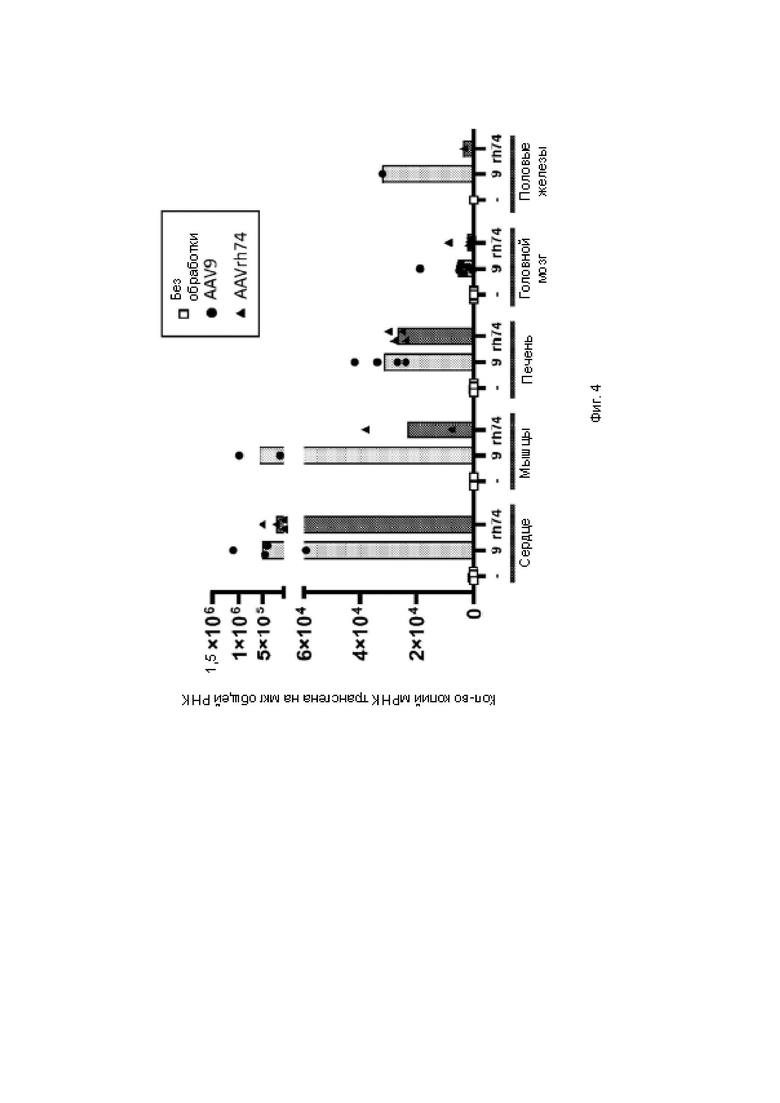
На фиг. 4 показана гистограмма количественного определения мРНК в органах, в наибольшей степени поражаемых при болезни Данона с помощью ОТ-кПЦР.
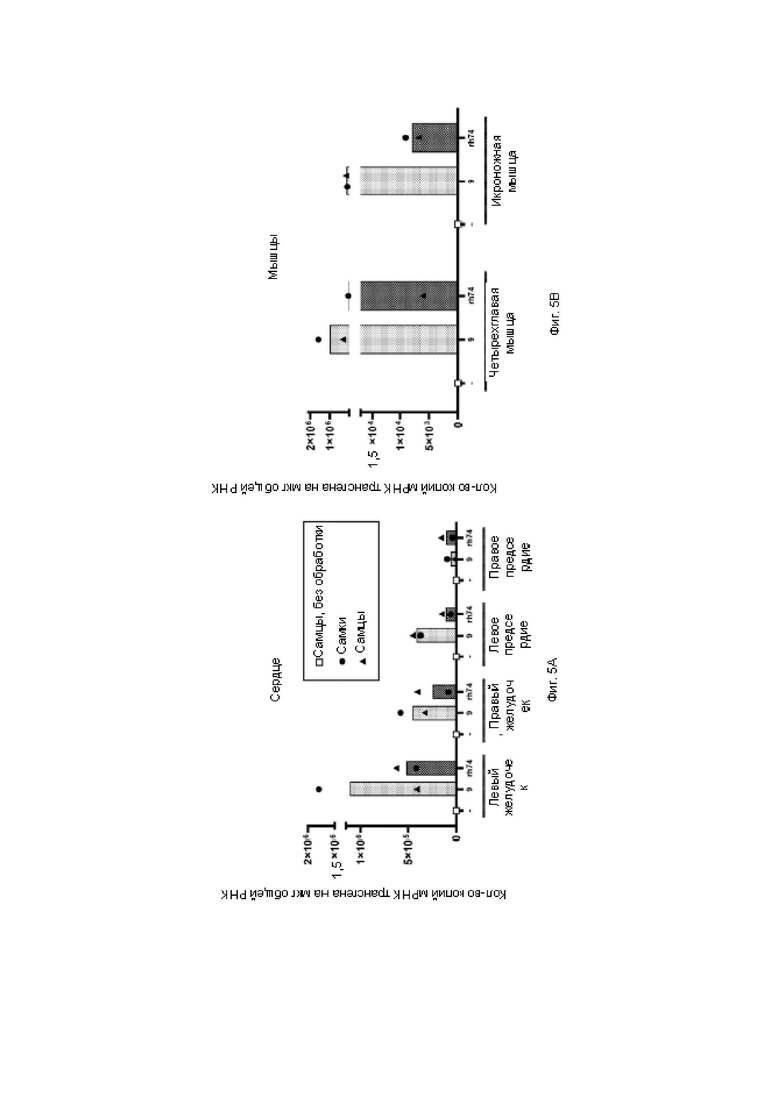
На фиг. 5А показана гистограмма количественного определения мРНК в областях сердца с помощью ОТ-кПЦР.
На фиг. 5В показана гистограмма количественного определения мРНК в мышцах с помощью ОТ-кПЦР.
На фиг. 6А показана микрофотография полуколичественного анализа мРНК с помощью RNAscope в необработанном левом желудочке.
На фиг. . 6 В показаны микрофотографии полуколичественного анализа мРНК с помощью RNAscope в обработанных левых желудочках.
На фиг. 7А показана микрофотография полуколичественного анализа мРНК с помощью RNAscope в необработанном квадрицепсе.
На фиг. 7В показаны микрофотографии полуколичественного анализа мРНК с помощью RNAscope в обработанных квадрицепсах.
На фиг. 8 показаны микрофотографии полуколичественного анализа мРНК с помощью RNAscope в обработанной икроножной мышце.
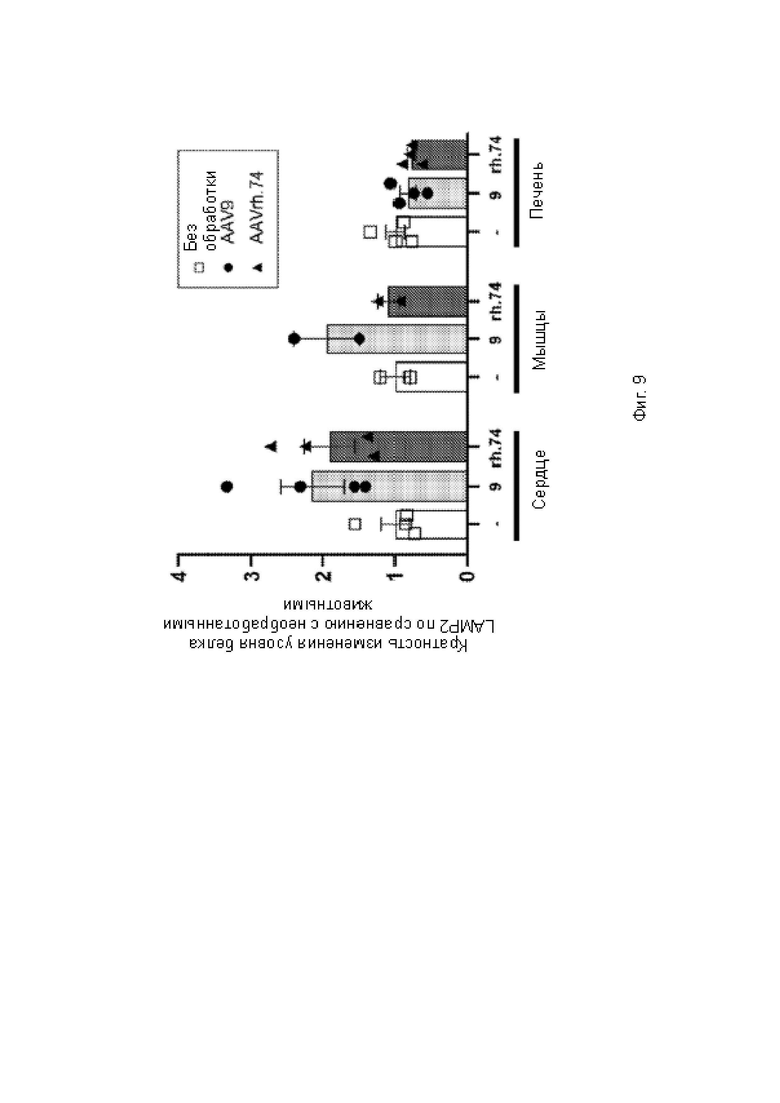
На фиг. 9 показана гистограмма количественного определения белка в тканях, в наибольшей степени поражаемых при болезни Данона, с помощью твердофазного ИФА
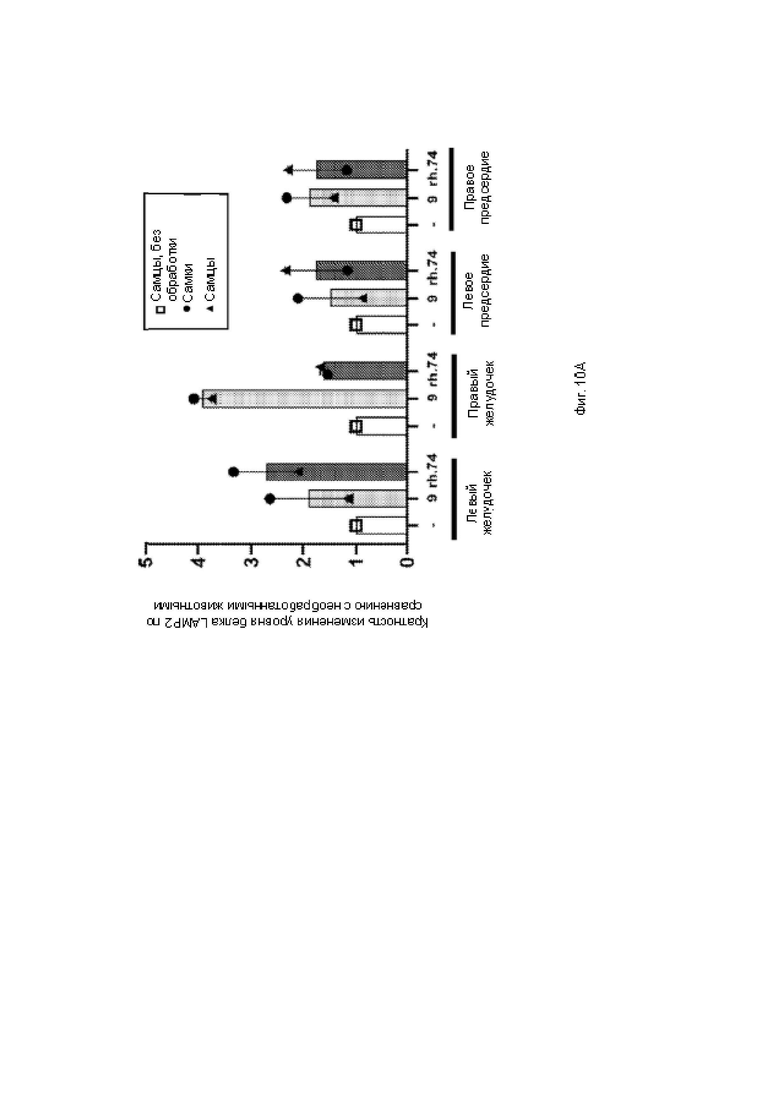
На фиг. . 10А показана гистограмма количественного определения белка в областях сердца с помощью твердофазного ИФА.
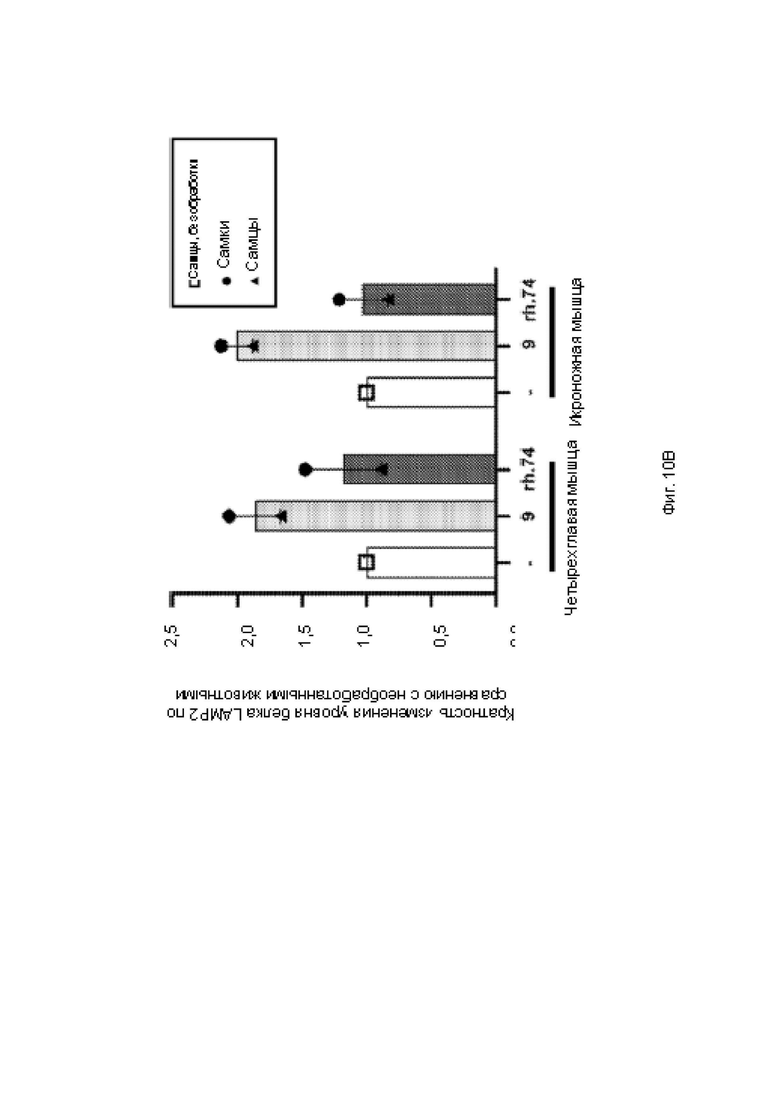
На фиг. . 10В показана гистограмма количественного определения белка в мышцах с помощью твердофазного ИФА.
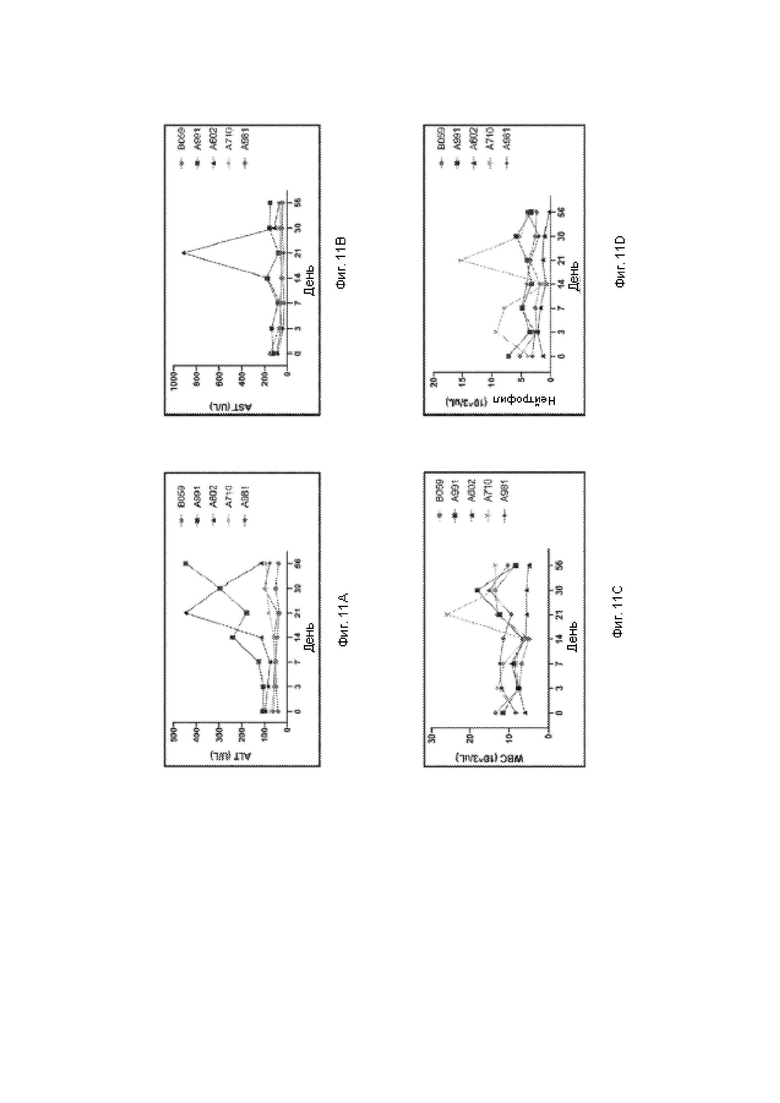
На фиг. 11A-11D показаны линейные графики измерения клинической патологии в сыворотке NHP в ходе исследования. Уровни клинической патологии оценивали как изменения уровня аланинаминотрансферазы, АЛТ (фиг. 11А); аспартатаминотрансферазы, ACT (фиг. 11В); лейкоцитов, WBC (фиг. 11С); и нейтрофилов (фиг. 11D) в течение всего исследования.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложены векторы для генной терапии на основе AAVrh74, в которых используются оптимизированные экспрессирующие кассеты для доставки полинуклеотида, кодирующего один из белков мембранного белка 2 (LAMP2), ассоциированного с лизосомами, также известного как CD107b. Как правило, LAMP2 представляет собой LAMP2 человека, хотя предусмотрена экспрессия LAMP-2 любого млекопитающего. Нативный ген LAMP2 за счет альтернативного сплайсинга кодирует три варианта белка: LAMP-2A, LAMP-2B и LAMP-2C. LAMP-2B ассоциирован с болезнью Данона. Хотя настоящее изобретение касается преимущественно болезни Данона, LAMP2 вовлечен в развитие различных других заболеваний, в том числе рака. Описанные векторы можно применять для лечения любого из этих заболеваний.
Настоящее изобретение дополнительно относится к капсидам AAVrh74 или капсидам, характеризующимся значительной гомологией по отношению к капе иду AAVrh74 и сохраняющим функцию капсида AAVrh74. В настоящем изобретении предложены последовательности, перечисленные в таблице 1. В таблице 1 дополнительно представлены полинуклеотидные последовательности, применяемые в различных вариантах реализации. Эти последовательности не предназначены для ограничения настоящего изобретения, поскольку предусмотрена замена или модификация этих последовательностей различными промоторами, энхансером или другими генетическими элементами.


В настоящем изобретении предложены рекомбинантные векторы для генной терапии на основе аденоассоциированного вируса (rAAV). В настоящем документе термин "вектор rAAV для генной терапии" относится к полному вирусу, содержащему нуклеотидные и белковые компоненты, в том числе капсидные белки. В некоторых вариантах реализации капсидный белок кодирует полинуклеотид, находящийся на плазмиде в транс-положении по отношению к плазмиде для переноса. Полинуклеотидная последовательность капсида AAVrh74 дикого типа выглядит следующим образом:
Кодирующая последовательность капсида AAVrh74 (SEQ ID NO: 1)


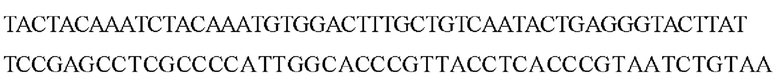
В настоящем изобретении дополнительно предложены последовательности белка VP3 AAVrh74, в том числе SEQ ID NO: 2-4, и его гомологи или функциональные варианты.
AAVrh74 VP3 (SEQ ID NO: 2)

AAVrh74 VP3 (SEQ ID NO: 3)

AAVrh74 VP3 (SEQ ID NO: 4)

В некоторых случаях капсид AAVrh74 содержит аминокислотную последовательность, представленную в SEQ ID NO: 2. В некоторых вариантах реализации вектор на основе rAAV содержит полипептид, который содержит или практически состоит из или дополнительно состоит из последовательности, например, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88% или 89%, в более типичном случае, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более, идентичной аминокислотной последовательности VP3 AAVrh74, представленной в SEQ ID NO: 2. В некоторых вариантах реализации вектор на основе rAAV содержит полипептид, который содержит или практически состоит из или дополнительно состоит из последовательности, например, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88% или 89%, в более типичном случае, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной SEQ ID NO: 3. В некоторых вариантах реализации вектор на основе rAAV содержит полипептид, который содержит, или практически состоит из, или дополнительно состоит из последовательности, например, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88% или 89%, в более типичном случае, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичной SEQ ID NO: 4.
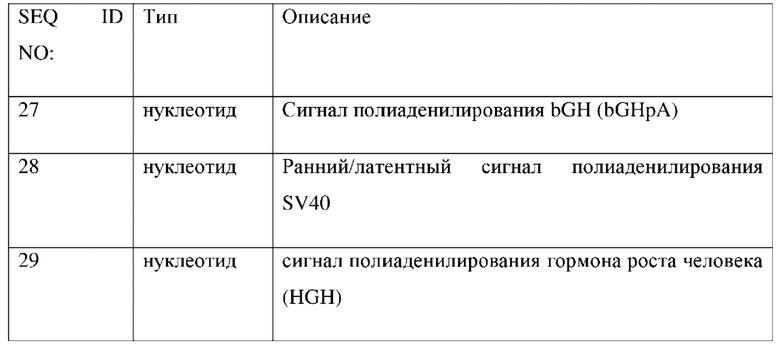
Полипепгидная последовательность дикого типа LAMP-2B (SEQ ID NO: 5) и полинуклеотидная последовательность дикого типа LAMP-2B (SEQ ID NO: 6) представляют собой соответственно:

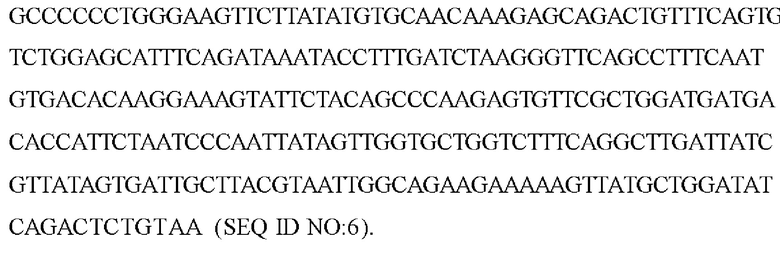
В одном варианте реализации транс ген характеризуется по меньшей мере 95% идентичностью полинуклеотидной последовательности SEQ ID NO: 5. В одном варианте реализации трансген характеризуется по меньшей мере 99% идентичностью полинуклеотидной последовательности SEQ ID NO: 5. В одном варианте реализации трансген содержит полинуклеотидную последовательность SEQ ID NO: 5. В одном варианте реализации трансген характеризуется по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или полной идентичностью SEQ ID NO: 5.
В одном варианте реализации трансген кодирует полипепгид, который характеризуется по меньшей мере 95% идентичностью с аминокислотной последовательностью SEQ ID NO: 6. В одном варианте реализации трансген кодирует полипепгид, характеризующийся по меньшей мере 99% идентичностью с аминокислотной последовательностью SEQ ID NO: 6. В одном варианте реализации полипептид, кодируемый трансгеном, содержит аминокислотную последовательность SEQ ID NO: 6. В одном варианте реализации полипептид, кодируемый трансгеном, обладает по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или полной идентичностью по отношению к SEQ ID NO:6.
В настоящем документе описаны модификации генной последовательности LAMP-2B, включающие кодонную оптимизацию, истощение CpG, удаление скрытых сайтов сплайсинга и уменьшение количества альтернативных открытых рамок считывания (ОРС). В вариантах реализации настоящего изобретении предложен трансген, кодирующий изоформу мембранного белка 2, ассоциированного с лизосомами, (LAMP-2) или ее функциональный вариант.В вариантах реализации трансген характеризуется по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или полной идентичностью последовательности, выбранной из SEQ ID NO: 7-9. В настоящем изобретении предложены по меньшей мере три варианта последовательностей гена LAMP-2B (SEQ ID NO: 7-9):



В одном варианте реализации трансген характеризуется по меньшей мере 95% идентичностью последовательности, выбранной из SEQ ID NO: 7-9. В одном варианте реализации трансген характеризуется по меньшей мере 99% идентичностью последовательности, выбранной из SEQ ID NO: 7-9. В одном варианте реализации трансген содержит последовательность, выбранную из SEQ ID NO: 7-9. В варианте реализации трансген характеризуется по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или полной идентичностью по отношению к SEQ ID NO: 7. В варианте реализации трансген характеризуется по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или полной идентичностью по отношению к SEQ ID NO: 8. В варианте реализации трансген характеризуется по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%,
93%, 94%, 95%, 96%, 97%, 98%, 99% или полной идентичностью по отношению k SEQ ID NO: 9.
В некоторых случаях трансген содержит полинуклеотидную последовательность, которая отличается от полинуклеотидной последовательности эталонной последовательности, например, "нативной" последовательности LAMP-2B или последовательности LAMP-2B "дикого" типа. В некоторых вариантах реализации трансген характеризуется не более чем 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94% или 95% идентичностью по отношению к эталонной последовательностью. В некоторых вариантах реализации эталонная последовательность представляет собой SEQ ID NO: 6. Например, SEQ ID NO: 7 характеризуется 78,5% идентичностью по отношению k SEQ ID NO: 6.
В некоторых вариантах реализации трансген подобен или идентичен подпоследовательности любой из SEQ ID NO: 5 или 7-9. В некоторых вариантах реализации трансген содержит подпоследовательность любой из SEQ ID NO: 5 или 7-9. В различных вариантах реализации подпоследовательность может содержать любую группу последовательных нуклеотидов (nt) в полной последовательности длиной по меньшей мере приблизительно 50 нуклеотидов, по меньшей мере приблизительно 100 нуклеотидов, по меньшей мере приблизительно 150 нуклеотидов, по меньшей мере приблизительно 250 нуклеотидов, по меньшей мере приблизительно 200 нуклеотидов, по меньшей мере приблизительно 350 нуклеотидов, по меньшей мере приблизительно 450 нуклеотидов, по меньшей мере приблизительно 400 нуклеотидов, по меньшей мере приблизительно 450 нуклеотидов, по меньшей мере приблизительно 550 нуклеотидов, по меньшей мере приблизительно 600 нуклеотидов, по меньшей мере приблизительно 650 нуклеотидов, по меньшей мере приблизительно 600 нуклеотидов, по меньшей мере приблизительно 650 нуклеотидов, по меньшей мере приблизительно 700 нуклеотидов, по меньшей мере приблизительно 750 нуклеотидов, по меньшей мере приблизительно 800 нуклеотидов, по меньшей мере приблизительно 850 нуклеотидов, по меньшей мере приблизительно 900 нуклеотидов, по меньшей мере приблизительно 950 нуклеотидов, по меньшей мере приблизительно 1000 нуклеотидов, по меньшей мере приблизительно 1050 нуклеотидов, по меньшей мере приблизительно 1100 нуклеотидов, по меньшей мере приблизительно 1150 нуклеотидов или по меньшей мере приблизительно 1200 нуклеотидов.
В некоторых вариантах реализации трансген кодирует полипептид, подобный или идентичный подпоследовательности любой из SEQ ID NO: 6 или 16-18. В некоторых вариантах реализации трансген кодирует полипепгид, содержащий подпоследовательность любой из SEQ ID NO: 6 или 16-18. В некоторых вариантах реализации подпоследовательность может содержать любую группу последовательных аминокислот (АК) в полной последовательности длиной по меньшей мере приблизительно 20 АК, по меньшей мере приблизительно 30 АК, по меньшей мере приблизительно 50 АК, по меньшей мере приблизительно 70 АК, по меньшей мере приблизительно 80 АК, по меньшей мере приблизительно 100 АК, по меньшей мере приблизительно 120 АК, по меньшей мере приблизительно 130 АК, по меньшей мере приблизительно 150 АК, по меньшей мере приблизительно 170 АК, по меньшей мере приблизительно 180 АК, по меньшей мере приблизительно 200 АК, по меньшей мере приблизительно 220 АК, по меньшей мере приблизительно 230 АК, по меньшей мере приблизительно 250 АК, по меньшей мере приблизительно 270 АК, по меньшей мере приблизительно 280 АК, по меньшей мере приблизительно 300 АК, по меньшей мере приблизительно 320 АК, по меньшей мере приблизительно 330 АК, по меньшей мере приблизительно 350 АК. по меньшей мере приблизительно 370 АК, по меньшей мере приблизительно 380 АК или по меньшей мере приблизительно 400 АК.
В некоторых вариантах реализации трансген кодирует полипептид LAMP-2, укороченный с N-конца на 1 - 10 аминокислот (АК), на 1-20 АК, на 1-30 АК, на 1-40 АК или на 1-50 АК, или укороченный с N-конца на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19,20,21,22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47,48,48, 50 или более АК; и/или укороченный с С-конца на 1 10 аминокислот (АК), на 1-20 АК, на 1-30 АК, на 1-40 АК или на 1-50 АК, или укороченный с С-конца на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19,20,21,22,23,24,25,26,27,28,29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 48, 50 или более АК.
В некоторых вариантах реализации подпоследовательность полипептида LAMP2 содержит функциональный вариант LAMP-2A, LAMP-2B или LAMP-2C. В настоящем документе термин "функциональный вариант" относится к полипептидной последовательности, характеризующейся сходством с эталонной последовательностью LAMP-2A, LAMP-2B или LAMP-2C и характеризующейся по меньшей мере одним биологическим свойством LAMP-2A LAMP-2B или LAMP-2C. Биологическое свойство может включать способность специфично взаимодействовать с одним или более партнерами по связыванию, способность связывать антитело против LAMP2 и/или способность восполнять дефект активности LAMP2 в клетке, ткани и/или организме.
В некоторых вариантах реализации подпоследовательность полипептида LAMP2 содержит функциональный фрагмент LAMP-2A LAMP-2B или LAMP-2C. В настоящем документе термин "функциональный фрагмент" относится к полипептиду, характеризующемуся сходством последовательности по отношению к подпоследовательности эталонного LAMP-2A, LAMP-2B или LAMP-2C и по меньшей мере одним биологическим свойством LAMP-2A, LAMP-2B или LAMP-2C. Биологическое свойство может включать способность специфично взаимодействовать с одним или более партнерами по связыванию, способность связывать антитело против LAMP2 и/или способность восполнять дефект активности LAMP2 в клетке, ткани и/или организме.
В одном варианте реализации трансген является кодон-опгимизированным для экспрессии в клетке-хозяине человека. В одном варианте реализации трансгенную кодирующую последовательность модифицируют или "подвергают оптимизации кодонов" для усиления экспрессии путем замены редко встречающихся кодонов более часто встречающимися кодонами. Кодирующая последовательность представляет собой фрагмент последовательности мРНК, который кодирует аминокислоты для трансляции. Во время трансляции каждый из 61 тринуклеотидного кодона транслируется в одну из 20 аминокислот, что приводит к вырожденности или избыточности генетического кода. Однако в различных типах клеток и у различных видов животных используются тРНК (каждая из которых несет антикодон), кодирующие одни и те же аминокислоты с разной частотой. Если последовательность гена содержит кодоны, редко представленные соответствующей тРНК, механизм трансляции рибосом может замедляться, препятствуя эффективной трансляции. Экспрессию можно улучшить посредством "оптимизации кодонов" для конкретного вида, где кодирующую последовательность изменяют, оеспечивая кодирование той же последовательности белка, но с использованием кодонов, которые хорошо представлены и/или используются в интенсивно экспрессируемых белках человека (Cid-Arregui et al, 2003; J. Virol. 77: 4928).
В некоторых вариантах реализации кодирующую последовательность трансгена модифицируют путем замены кодонов, редко экспрессирующихся у млекопитающих или у приматов, кодонами, часто экспрессирующимися у приматов. Например, в некоторых вариантах реализации трансген кодирует полипептид, характеризующийся по меньшей мере 85% идентичностью последовательности с эталонным полипептидом {например, LAMP-2B дикого типа; SEQ ID NO: 16) - например, по меньшей мере 90% идентичностью последовательности, по меньшей мере 95% идентичностью последовательности, по меньшей мере 98% идентичностью по меньшей мере 99% идентичности с эталонным полипепгидом, при этом по меньшей мере один кодон кодирующей последовательности характеризуется более высокой частотой тРНК у человека по сравнению с соответствующим кодоном в последовательности, описанной выше или в настоящем документе.
В одном варианте реализации трансген содержит меньшее количество альтернативных открытых рамок считывания, чем SEQ ID: 6. В одном варианте реализации трансген модифицируют для усиления экспрессии путем прекращения или удаления открытых рамок считывания (ОРС), которые не кодируют требуемый трансген. Открытая рамка считывания (ОРС) представляет собой нуклеотидную последовательность, которая следует за стартовым кодоном и не содержит стоп-кодона. ОРС могут находиться в прямой или обратной ориентации и могут бьпь "в рамке" или "вне рамки считывания" по сравнению с геном, представляющим интерес.Такие открытые рамки считывания потенциально могут экспрессироваться в экспрессирующей кассете наряду с геном, представляющим интерес, и могут приводить к нежелательным эффектам. В некоторых вариантах реализации трансген был модифицирован для удаления открытых рамок считывания путем дополнительного изменения использования кодонов. Это делается путем устранения одного или более из стартовых кодонов (ATG, TTG, СТО) и/или введения одного или более из стоп-кодонов (TAG, ТАА или TGA) в обратной ориентации или вне требуемой ОРС с сохранением кодируемой аминокислотной последовательности и, необязательно, сохранением интенсивно используемых кодонов в гене, представляющем интерес (т.е., избегая кодонов с частотой на уровне <20%).
В вариациях настоящего изобретения последовательность, кодирующую трансген, можно оптимизировать посредством оптимизации кодонов и удаления нетрансгенных ОРС или с применением обеих методик. В некоторых случаях нетрансгенные ОРС удаляют или минимизируют после оптимизации кодонов с целью удаления ОРС, введенных во время оптимизации кодонов.
В одном варианте реализации трансген содержит меньше сайтов CpG, чем SEQ ID: 6. Безотносительно к теоретическим представлениям, полагают, что наличие сайтов CpG в полинуклеотидной последовательности ассоциировано с нежелательными иммунологическими реакциями хозяина в отношении вирусного вектора, содержащего указанную полинуклеотидную последовательность. В некоторых вариантах реализации трансген предназначен для уменьшения количества сайтов CpG. Типичные способы представлены в публикации заявки на патент США №US 20020065236 A1.
В одном варианте реализации трансген содержит меньше скрытых сайтов сплайсинга, чем SEQ ID: 6. Для оптимизации можно использовать программное обеспечение GeneArt®, например, для повышения содержания GC и/или удаления скрытых сайтов сплайсинга с целью избежать транскрипционного сайленсинга и, следовательно, повышения экспрессии трансгенов. В качестве альтернативы, можно применять любой способ оптимизации, известный в данной области техники. Удаление скрытых сайтов сплайсинга описано, например, в публикации международной заявки на патент №WO 2004015106 A1.
Кроме того, в настоящем документе описаны экспрессирующие кассеты и векторы для генной терапии, кодирующие LAMP-2B, например, кодон-оптимизированную последовательность LAMP-2B, описанную в настоящем документе, содержащую консенсусную оптимальную последовательность Козака, полноразмерную последовательность полиаденилирования (полиА) (или замену полно раз мерно го полиА на укороченный полиА) и не содержащую или содержащую минимальное количество старт-кодонов (т.е. сайтов ATG) выше (т.е. в направлении 5').
В некоторых случаях экспрессирующая кассета содержит два или более элементов из первого инвертированного концевого повтора, энхансерно-промоторной области, консенсусной оптимальной последовательности Козака, трансгена (например, трансгена, кодирующего LAMP-2B, описанный в настоящем документе), 3'-нетранслируемой области, содержащей полноразмерную полиА-последовательность, и второго инвертированного концевого повтора.
В одном варианте реализации экспрессирующая кассета содержит последовательность Козака, функционально связанную с трансгеном. В одном варианте реализации последовательность Козака представляет собой консенсусную оптимальную последовательность Козака, содержащую SEQ ID NO: 20 или состоящую из нее.
GCCGCCАССATGG (SEQ ID NO: 20)
В различных вариантах реализации экспрессирующая кассета содержит альтернативную последовательность Козака, функционально связанную с трансгеном. В одном варианте реализации последовательность Козака представляет собой альтернативную последовательность Козака, содержащую или состоящую из любой из SEQ ID NO. 21-25.
(gcc)gccRccAUGG (SEQ ID NO: 21)
AGNNAUGN (SEQ ID NO: 22)
ANNAUGG (SEQ ID NO: 23)
ACCAUGG (SEQ ID NO: 24)
GACACCAUGG (SEQ ID NO: 25)
В SEQ ID NO: 21 строчная буква обозначает наиболее распространенное основание в положении, в котором основание, тем не менее, может варьировать; заглавная буква обозначает высококонсервативное основание; "R" указывает на аденин или гуанин. В SEQ ID NO: 21 последовательность в скобках (gcc) является необязательной. В SEQ ID NO: 22-23 "N" обозначает любое основание.
Вместо этой консенсусной оптимальной последовательности Козака в качестве сайта инициации трансляции можно применять ряд последовательностей, и специалист в данной области техники может идентифицировать и протестировать другие последовательности. See Kozak М. An analysis of vertebrate mRNA sequences: intimations of translational control. J. Cell Biol. 115 (4): 887 903 (1991).
В одном варианте реализации экспрессирующая кассета содержит полноразмерную полиА-последовательность, функционально связанную с транс геном. В одном варианте реализации полно раз мерная полиА-последовательность содержит SEQ ID NO: 26.

В экспрессирующих кассетах экспрессии согласно настоящему изобретению можно применять различные альтернативные полиА-последовательности, в том числе, без ограничений, сигнал полиаденилирования гормона роста КРС (bGHpA) (SEQ ID NO: 27), ранний/латентный сигнал полиаденилирования SV40 (SEQ ID NO: 28) и сигнал полиаденилирования гормона роста человека (HGH) (SEQ ID NO: 29).

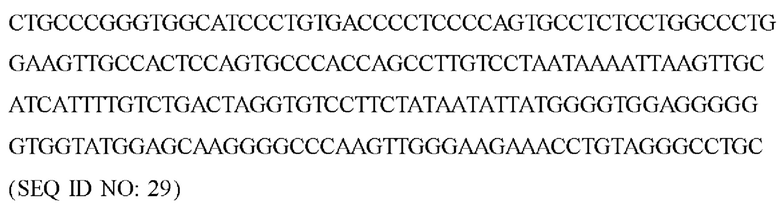
В некоторых вариантах реализации экспрессирующая кассета содержит активный фрагмент полиА-последовательности. В конкретных вариантах реализации активный фрагмент полиА-последовательности содержит или состоит из менее чем 20 пар оснований (п.о.), менее чем 50 п. о, менее чем 100 п. о. или менее чем 150 п. о, например, любой из полиА-последовательностей, описанных в настоящем документе.
В некоторых случаях экспрессию трансгена увеличивают путем обеспечения отсутствия конкурирующих ОРС в экспрессирующей кассете. В одном варианте реализации экспрессирующая кассета не содержит стартового кодона в пределах 20, 30, 40, 50, 60, 70, 80, 90, 100, 200 или 300 пар оснований в направлении к 5'-концу от стартового кодона трансгена. В одном варианте реализации экспрессирующая кассета не содержит стартового кодона в направлении к 5'-концу от стартового кодона трансгена. В некоторых вариантах реализации экспрессирующая кассета не содержит альтернативных транскриптов. В некоторых вариантах реализации экспрессирующая кассета не содержит альтернативных транскриптов, за исключением небольших транскриптов, например, размером 300 пар оснований или меньше.
В одном варианте реализации экспрессирующая кассета содержит следующие функционально связанные элементы в направлении от 5'-конна к 3'-концу: первый инвертированный концевой повтор, энхансерно-промоторную область, интроны, консенсусную оптимальную последовательность Козака, трансген, 3'-нетранслируемую область, содержащую полноразмерную полиА-последовательность, и второй инвертированный концевой повтор, причем экспрессирующая кассета не содержит стартового кодона в направлении к 5'-концу от стартового кодона трансгена.
В одном варианте реализации энхансерно-промоторная область содержит в направлении от 5'-конца к 3'-концу энхансер CMV IE и промотор бета-актина курицы. В одном варианте реализации энхансерно-промоторная область содержит промотор CAG. В настоящем документе термин "Промотор CAG" относится к полинуклеотидной последовательности, содержащей ранний энхансерный элемент CMV, промотор бета-актина курицы, первый экзон и первый интрон гена бета-актина курицы и акцептор сплайсинга из гена бета-глобина кролика.
В одном варианте реализации экспрессирующая кассета характеризуется по меньшей мере 95% идентичностью последовательности, выбранной из SEQ ID NO: 10-12. В одном варианте реализации экспрессирующая кассета характеризуется полной идентичностью последовательности, выбранной из SEQ ID NO: 10-12, или характеризуется по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности, выбранной из SEQ ID NO: 10-12. В определенных вариантах реализации экспрессирующая кассета содержит одну или более из модификаций по сравнению с последовательностью, выбранной из SEQ ID NO: 10-12. В конкретных вариантах реализации одна или более модификаций содержат одно или более из: удаления одной или более {например, всех) вышележащих последовательностей ATG, замены последовательности Козака оптимизированной консенсусной последовательностью Козака или другой последовательностью Козака, в том числе, без ограничений, любой из последовательностей, описанных в настоящем документе, и/или замены последовательности полиаденилирования полноразмерной последовательностью полиаденилирования, в том числе, любой из таких последовательностей, описанных в настоящем документе, но не ограничиваясь ими. Типичная конфигурация генетических элементов в этих типичных экспрессирующих кассетах изображена на фиг. 1.









В одном варианте реализации вектор представляет собой вектор на основе аденоассоциированного вируса (AAV). В одном варианте реализации экспрессирующая кассета содержит последовательности ИКП, выбранные из SEQ ID NO: 13 и 14.
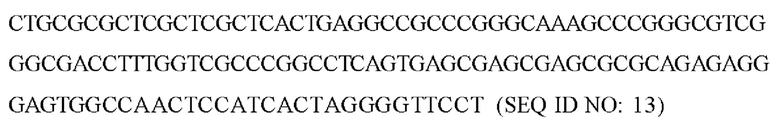
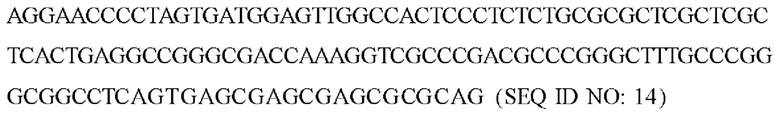
В связанных вариантах реализации настоящего изобретения предложены векторы для генной терапии, содержащие экспрессирующую кассету, описанную в настоящем документе. Как правило, векторы для генной терапии, описанные в настоящем документе, содержат экспрессирующую кассету, содержащую полинуклеотид, кодирующий одну или более изоформ мембранного белка 2, ассоциированного с лизосомами (LAMP-2), что обеспечивает возможность экспрессии LAMP-2 для частичного или полного восполнения уровней экспрессии белка LAMP-2 и/или аутофагического потока у субъекта, нуждающегося в этом {например, субъекта с болезнью Данона или другим расстройством, характеризующимся дефицитом аутофагического потока, по меньшей мере частично обусловленным дефицитом экспрессии LAMP-2).
Последовательность белка LAMP-2A

Последовательность белка LAMP-2 В


Последовательность белка LAMP-2С

В конкретных вариантах реализации экспрессирующая кассета содержит полинуклеотидную последовательность, кодирующую LAMP-2, описанный в настоящем документе, например, SEQ ID NO: 15-17, или последовательность, характеризующуюся по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью любой из SEQ ID NO: 15-17. Векторы для генной терапии могут представлять собой вирусные или невирусные векторы. Типичные невирусные векторы включают, например, несвязанную ДНК, катионные липосомные комплексы, катионные полимерные комплексы, катионные липосомные полимерные комплексы и экзосомы. Примеры вирусного вектора включают, без ограничений, аденовирусные, ретровирусные, лентивирусные, герпесыирусные векторы и векторы на основе аденоассоциированного вируса (AAV).
В некоторых вариантах реализации экспрессирующая кассета содержит полинуклеотидную последовательность, кодирующую одну или более, два или более или все три из SEQ ID NO: 15-17. В некоторых вариантах реализации полинуклеотидная последовательность, содержащая нативные интроны гена LAMP-2, обеспечивает возможность экспрессии более чем одной изоформы в одной и той же клетке с применением одного вектора. В некоторых вариантах реализации применяют искусственные интроны, акцепторы сплайсинга и/или доноры сплайсинга для оптимизации длины полинуклеотида и/или оптимизации соотношения изоформ, экспрессируемых полинуклеотидом, кодирующим два или более или все три из SEQ ID NO: 15-17.
В некоторых вариантах реализации экспрессирующую кассету, ген капсида AAV и/или гены-помощники доставляют в клетки с применением трансдукции, трансфекции, электропорации, липофекции и любых других способов, известных в данной области техники. В некоторых вариантах реализации экспрессирующую кассету, ген капсида AAV и/или гены-помощники доставляют в липосоме или липидной наночастице (LNP). Экспрессирующая кассета, ген капсида AAV и/или гены-помощники могут быть представлены в виде ДНК, например, на одной или более плазмидах, бакмидах или других молекулах ДНК. В некоторых вариантах реализации экспрессирующую кассету, ген капсида AAV и/или гены-помощники доставляют в виде молекул РНК. В некоторых вариантах реализации молекулы РНК содержат одну или более из молекул мРНК, например, одну или более из транскрибированных in vitro молекул мРНК. В некоторых вариантах реализации молекулы мРНК представляют собой модифицированные молекулы мРНК. Типичные модификации включают блокирующие нуклеиновые кислоты, тиофосфатные связи и модифицированные нуклеозиды (например, псевдоуридин, 5-метилцитозин или 5-метилцитидин). В некоторых вариантах реализации модифицированная мРНК содержит кэп, например, кэп ARCA. Экспрессирующую кассету, ген капсида AAV и/или гены-помощники можно доставлять in vitro или in vivo. В некоторых вариантах реализации ген капсида AAV содержит один или более из гена капсида AAV9 и гена капсида AAVrh74.
Вирусные векторы для доставки генов, применимые при практической реализации настоящего изобретения, можно конструировать с применением методик, хорошо известных в данной области молекулярной биологии. Как правило, вирусные векторы, несущие трансгены, собирают из полинуклеотидов, кодирующих трансген, подходящих регуляторных элементов и элементов, необходимых для получения вирусных белков, которые опосредуют клеточную трансдукцию. Такие рекомбинантные вирусы можно получать с помощью методик, известных в данной области техники, например, путем трансфекции упаковывающих клеток или временной трансфекции плазмидами или вирусами-помощниками. Типичные примеры клеток, упаковывающих вирус, включают, без ограничений, клетки HeLa, клетки SF9 (необязательно с бакуловирусным вектором-помощником), клетки 293 и т.д. Систему на основе герпесвируса можно использовать для получения векторов на основе AAV, как описано в US 20170218395 A1. Подробные протоколы получения таких рекомбинантных вирусов, дефектных по репликации, можно найти, например, в патенте США W095/14785, W096/22378, патенте США №5882877, патенте США №60135116, патенте США №4861719, патенте США №5278056 и W094/19478, полное содержание каждого из которых включено в данный документ посредством ссылки.
AAV представляет собой одноцепочечный ДНК- содержащий вирус размером 4,7 т.п.о. Рекомбинантные векторы на основе AAV ассоциированы с превосходной клинической безопасностью, поскольку AAV дикого типа является непатогенным и не характеризуется этиологической ассоциацией с любыми известными заболеваниями. Кроме того, AAV обеспечивает возможность высокоэффективной доставки генов и устойчивой экспрессии трансгенов во многих тканях. Под " AAV- вектором" подразумевается вектор, полученный из аденоассоциированного вируса определенного серотипа, в том числе, без ограничений, AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAVrh.10, AAVrh74 и т.д. AAV-векторы могут характеризоваться полной или частичной делецией одного или более генов AAV дикого типа, например, генов rep и/или cap, но сохранением функциональных фланкирующих последовательностей инвертированных концевых повторов (ИКП). Функциональные последовательности ИКП необходимы для спасения, репликации и упаковки вириона AAV. Таким образом, определение AAV-вектора в настоящем документе предусматривает включение по меньшей мере тех последовательности, которые должны присутствовать в цис-состоянии для репликации и упаковки (например, функциональные ИКП) вируса. ИКП не обязательно должны являться нуклеотидными последовательностями дикого типа, их можно изменять, например, путем инсерции, делеции или замены нуклеотидов, при условии, что указанные последовательности обеспечивают функциональное спасение, репликацию и упаковку. AAV-векторы могут содержать другие модификации, в том числе, без ограничений, один или более модифицированных капсидных белков (например, VP1. VP2 и/или VP3). Например, капсидный белок можно модифицировать для изменения тропизма и/или снижения иммуногенности. Экспрессирующие AAV-векторы конструируют с применением известных методик, по меньшей мере обеспечивающих наличие функционально связанных компонентов в направлении транскрипции, элементов контроля, включающих область инициации транскрипции, ДНК, представляющую интерес (т.е. ген LAMP-2), и область терминации транскрипции.
Аденоассоциированный вирус (AAV) представляет собой одноцепочечный ДНК-содержащий вирус. Геном AAV построен из (+или -) одноцепочечной дезоксирибонуклеиновой кислоты (оцДНК), длина которой составляет приблизительно 4,7 тысяч пар оснований. Геном содержит инвертированные концевые повторы (ИКП) на обоих концах цепи ДНК и две открытые рамки считывания (ОРС): rep и cap.Первая рамка считывания, rep, состоит из четырех перекрывающихся генов, кодирующих белки Rep, необходимые для жизненного цикла AAV, а вторая, cap, кодирует три капсидных белка: VP1, VP2 и VP3. Ген cap экспрессируется в виде матричной РНК (мРНК) с промотора р40 AAV. В качестве альтернативы, мРНК подвергается сплайсингу с образованием транскриптов длиной 2,3 т.п.о. и 2,6 т.п.о, при этом транс крипт длиной 2,3 т.п.о. является более распространенным. VP1 экспрессируется только с транскрипта 2,6 т.п.о, и молекулярная масса белка VP1 составляет 87 килодальтон (кДа). VP2 экспрессируется с открытой рамки считывания, которая начинается с кодона ACG, а не канонического кодона AUG, из-за наличия оптимальной последовательности Козака для инициации трансляции. Масса VP2 составляет 72 кДа. VP3, масса которого составляет лишь 62 кДа, экспрессируется с последовательности АТС, присутствующей в транскрипте длиной 2,3 т.п.о, а также транскрипте длиной 2,6 т.п.о. Относительные количества VP1:VP2:VP3 составляют 1:1:10. VP1, VP2 и VP3 взаимодействуют друг с другом с образованием капсида икосаэдрической симметрии.
Рекомбинантные векторы на основе AAV ассоциированы с превосходной клинической безопасностью, поскольку AAV дикого типа является непатогенным и не характеризуется этиологической ассоциацией с любыми известными заболеваниями. Кроме того, AAV обеспечивает возможность высокоэффективной доставки генов и устойчивой экспрессии трансгенов во многих тканях. Известны различные серотипы AAV, в том числе AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAV10, AAVrh.10, AAVrh74 и т.д. AAV-векторы могут характеризоваться полной или частичной деленией одного или более из генов AAV дикого типа, например, генов rep и/или cap, но сохранять функциональные фланкирующие последовательности
инвертированных концевых повторов (ИКП). Серотип рекомбинантного AAV-вектора определяется его капсидом. В международной публикации патента №WO2003042397A2 описаны различные последовательности капсидов, в том числе последовательности капсидов AAV1, AAV2, AAV3, AAV8, AAV9 и AAVrhlO. В международной публикации патента №WO 2013078316 А1 описана полипептидная последовательность VP1 AAVrh74. В данной области техники известно большое количество разнообразных природных или генетически модифицированных последовательностей капсидов AAV.
В настоящем изобретении также предложены фармацевтические композиции, содержащие экспрессирующую кассету или вектор (например, вектор для генной терапии), описанные в настоящем документе, и один или более из фармацевтически приемлемых носителей, разбавителей или вспомогательных веществ. В конкретных вариантах реализации фармацевтическая композиция содержит AAV-вектор, содержащий экспрессирующую кассету, описанную в настоящем документе, причем, например, указанная экспрессирующая кассета содержит кодон-оптимизированный трансген, кодирующий LAMP-2B, например, любую из SEQ ID NO: 7-9. Предложены фармацевтические композиции, например, для применения при профилактике или лечении расстройства, характеризующегося недостаточностью аутофагического потока (например, болезни Данона), которые содержат терапевтически эффективное количество вектора, содержащего нуклеотидную последовательность полинуклеотида, кодирующую одну или более изоформ LAMP-2.
Фармацевтические композиции, содержащие экспрессирующую кассету или вектор, могут находиться в любой форме, подходящей для выбранного способа введения, например, для внутрижелудочкового, внутримиокардиального, внутрикоронарного, внутривенного, внутриартериального, внутрипочечного, интрауретрального, эпидурального или внутримышечного введения. Вектор для генной терапии, содержащий полинуклеотид, кодирующий одну или более изоформ LAMP-2, можно вводить животным и людям в качестве единственного активного агента или в комбинации с другими активными агентами в стандартной форме для введения в виде смеси с традиционными фармацевтическими носителями. В некоторых вариантах реализации фармацевтическая композиция содержит клетки, трансдуцированные ex vivo любым из векторов для генной терапии согласно настоящему изобретению.
В различных вариантах реализации фармацевтические композиции содержат носители (например, носители, разбавители и вспомогательные вещества), фармацевтически приемлемые для состава, пригодного для инъекции. Они могут представлять собой, в частности, изотонические стерильные растворы солей (дигидрофосфата или гидрофосфата натрия, хлорида натрия, калия, кальция или магния и т.п.или смеси таких солей). Типичные фармацевтические формы, подходящие для инъекционного применения, включают, например, стерильные водные растворы или дисперсии; составы, содержащие кунжутное масло, арахисовое масло или водный пропиленгликоль; и стерильные порошки для приготовления стерильных инъекционных растворов или дисперсий для немедленного введения.
В еще одном аспекте настоящего изобретения предложены способы профилактики, смягчения, облегчения, снижения интенсивности, подавления, устранения и/или купирования одного или более из симптомов болезни Данона или другого расстройства аутофагии у субъекта, нуждающегося в этом, предусматривающие введение субъекту вектора для генной терапии согласно настоящему изобретению. Термин "болезнь Данона" относится к сцепленному с Х-хромосомой доминантному расстройству скелетной мускулатуры и сердечной мышцы с мультисистемными клиническими проявлениями. Мутации, вызывающие болезнь Данона, приводят к отсутствию экспрессии мембранного белка 2, ассоциированного с лизосомами (LAMP-2). Основные клинические признаки включают миопатию скелетных мышц и сердца, аномалии сердечной проводимости, когнитивные проблемы и заболевание сетчатки. Как правило, данное заболевание проявляется у мужчин раньше и тяжелее, чем у женщин.
В одном варианте реализации вектор вводят посредством пути, выбранного из группы, состоящей из парентерального, внутривенного, внутриартериального, внутрисердечного, внутрикоротарного, внутримиокардиального,
внутрипочечного, интрауретрального, эпидурального и внутримышечного путей. В одном варианте реализации вектор вводят несколько раз. В одном варианте реализации вектор вводят путем внутримышечной инъекции вектора. В одном варианте реализации вектор вводят путем инъекции вектора в скелетную мышцу. В одном варианте реализации экспрессирующая кассета содержит промотор, специфичный по отношению к мышцам, необязательно промотор мышечной креатинкиназы (МСК) или гибридный промотор MCK/SV40, описанный в работе Takeshirа et al. Muscle creatine kinase/SV40 hybrid promoter for muscle-targeted long-term transgene expression, hit J Mol Med. 2007 Feb;19(2):309-15. В одном варианте реализации вектор вводят путем внутрисердечной инъекции.
В одном варианте реализации настоящего изобретения предложен способ лечения заболевания или расстройства, необязательно болезни Данона, у субъекта, нуждающегося в этом, предусматривающий приведение клеток в контакт с вектором для генной терапии согласно настоящему изобретению и введение указанных клеток субъекту. В одном варианте реализации клетки представляют собой стволовые клетки, необязательно плюрипотенгные стволовые клетки. В одном варианте реализации стволовые клетки способны к дифференцировке в сердечную ткань. В одном варианте реализации стволовые клетки способны к дифференцировке в мышечные ткани, например, в ткани сердечной мышцы и/или в ткани скелетной мышцы. В одном варианте реализации стволовые клетки являются аутологичными. В одном варианте реализации стволовые клетки индуцируют плюрипотенгные стволовые клетки (iPSC).
В одном варианте реализации расстройство аутофагии выбрано из группы, состоящей из терминальной стадии сердечной недостаточности, инфаркта миокарда, токсических эффектов лекарственных средств, диабета, терминальной стадии почечной недостаточности и старения. В одном варианте реализации субъект представляет собой млекопитающее, например, человека. В одном варианте реализации у субъекта проявляются симптомы болезни Данона или другого расстройства аутофагии. В одном варианте реализации субъекта идентифицируют как характеризующегося пониженной или необнаружимой экспрессией LAMP-2. В одном варианте реализации субъекта идентифицируют по наличию мутантного гена LAMP-2.
Субъекты/пациенты, поддающиеся лечению с применением способов, описанных в настоящем документе, включают индивидов с риском заболевания или расстройства, характеризующегося недостаточным аутофагическим потоком (например, болезни Данона, а также других известных расстройств аутофагии, в том числе, без ограничений,, систолической и диастолической сердечной недостаточности, инфаркта миокарда, токсических эффектов лекарственных средств (например, антрациклинов, хлорохина и его производных), диабета, терминальной стадии почечной недостаточности и старения), у которых отсутствуют симптомы, а также субъектов, у которых в настоящее время наблюдаются симптомы. Такого субъекта можно идентифицировать по наличию мутантного гена LAMP-2 или пониженного или необнаружимого уровня экспрессии LAMP-2.
В некоторых вариантах реализации у субъекта проявляются симптомы заболевания или расстройства, характеризующегося недостаточным аутофагическим потоком (например, болезни Данона, а также других известных расстройств аутофагии, в том числе, без ограничений, систолической и диастолической сердечной недостаточности, инфаркта миокарда, токсических эффектов лекарственных средств, диабета, терминальной стадии почечной недостаточности и старения). Указанные симптомы могут быть активно проявляемыми, или могут быть подавлены или находиться под контролем (например, с помощью лекарственного средства) или в состоянии ремиссии. У субъекта может быть диагностировано или не диагностировано указанное расстройство, например, квалифицированным врачом.
Определения
Термины "мембранный белок 2, ассоциированный с лизосомами" и " LAMP-2 " взаимозаменяемо относятся к нуклеиновым кислотам и полиморфным вариантам, аллелям, мутантам и межвидовым гомологам полипепгидов, которые: (1) содержат аминокислотную последовательность, характеризующуюся более чем приблизительно 90% идентичностью аминокислотной последовательности, например, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% или большей идентичностью аминокислотной последовательности, предпочтительно в области, длина которой составляет по меньшей мере приблизительно 25, 50, 100, 200, 300, 400 или более аминокислот, или в полноразмерной области, по отношению к аминокислотной последовательности, кодируемой нуклеиновой кислотой LAMP-2 (см, например, учетные номера GenBank NM 002294.2 (изоформа A). NM 013995.2 (изоформа В), NM 001122606.1 (изоформа С)) или к аминокислотной последовательности полипептида LAMP-2 (см., например, учетные номера GenBank NP_002285.1 (изоформа A), NP_054701.1 (изоформа В), NP 001116078.1 (изоформа С)); (2) связываются с антителами, например, поликлональными антителами против иммуногена, содержащего аминокислотную последовательность полипептида LAMP-2 (например, полипептидов LAMP-2, описанных в настоящем документе); или аминокислотной последовательности, кодируемой нуклеиновой кислотой LAMP-2 (например, полинуклеотидами LAMP-2, описанными в настоящем документе), и их консервативно модифицированными вариантами; (3) специфически гибридизируются в жестких условиях гибридизации с антисмысловой цепью, соответствующей нуклеотидной последовательности, кодирующей белок LAMP-2, и ее консервативно модифицированными вариантами; (4) содержат нуклеотидную последовательность, характеризующуюся более чем приблизительно 90%, предпочтительно более чем приблизительно 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или большей идентичностью нуклеотидной последовательности, предпочтительно в области, длина которой составляет по меньшей мере приблизительно 25, 50, 100, 200, 500, 1000, 2000 или более нуклеотидов, или в полнорасмерной области, по отношению к нуклеиновой кислоте LAMP-2 LAMP-2 (например, полинуклеотиду LAMP-2, описанному в настоящем документе, и полинуклеотидам LAMP-2, кодирующим полипептиды LAMP-2, описанные в настоящем документе).
Термины "идентичность" или процентная "идентичность" в контексте двух или более нуклеотидных или полипептидных последовательностей относятся к двум или более последовательностям или подпоследовательностям, которые являются одинаковыми или характеризуются указанным процентом одинаковых аминокислотных остатков или нуклеотидов (т.е., обладающих по меньшей мере приблизительно 80% идентичностью, например, по меньшей мере приблизительно 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичностью в указанной области по отношению к эталонной последовательности, например, полинуклеотидной или полипептидной последовательности LAMP-2, описанной в настоящем документе, при сравнении и выравнивании с целью обеспечения максимального соответствия в пределах окна сравнения или обозначенной области, измеренной с применением одного из следующих алгоритмов сравнения последовательностей или с помощью ручного выравнивания и визуального контроля. Такие последовательности называются "по сути идентичными". Это определение также относится к последовательности, комплементарной тестируемой последовательности. Идентичность предпочтительно существует в области длиной по меньшей мере приблизительно 25 аминокислот или нуклеотидов, например, в области длиной 50, 100, 200, 300, 400 аминокислот или нуклеотидов, или на протяжении полноразмерной эталонной последовательности.
При сравнении последовательностей, как правило, одна последовательность действует как эталонная последовательность, с которой сравнивают тестируемые последовательности. При использовании алгоритма сравнения последовательностей тестируемые и эталонные последовательности вводят в компьютер, при необходимости обозначают координаты подпоследовательности и параметры программы алгоритма обработки последовательностей. Можно использовать параметры программы по умолчанию или назначить альтернативные параметры. Затем алгоритм сравнения последовательностей рассчитывает процентную идентичность тестируемых последовательностей относительно эталонной последовательности на основании параметров программы. Для сравнения последовательностей нуклеиновых кислот и белков с нуклеиновыми кислотами и белками LAMP-2 использовали алгоритмы BLAST и BLAST 2.0 и параметры по умолчанию.
В настоящем документе термин "окно сравнения" относится к сегменту любого из ряда смежных положений, выбранных из группы, состоящей из 20-600, обычно от приблизительно 50 до приблизительно 200, чаще от приблизительно 100 до приблизительно 150, в которых последовательность можно сравнивать с эталонной последовательностью, содержащей такое же количество смежных положений, после оптимального выравнивания двух последовательностей. Способы выравнивания последовательностей для сравнения хорошо известны в данной области техники. Оптимальное выравнивание последовательностей для сравнения можно выполнять, например, с помощью алгоритма локальной гомологии Smith & Waterman, Adv. Appl. Math. 2:482 (1981), с помощью алгоритма гомологичного выравнивания Needleman & Wunsch, J. Mol. Biol. 48:443 (1970), с использованием способа поиска сходства Pearson & Lipman, Proc. Nat'l. Acad. Sci. USA 85:2444 (1988), посредством компьютерных реализаций этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в пакете программного обеспечения Wisconsin Genetics, Genetics Computer Group, 575 Science Dr., Мэдисон, штат, Висконсин, США) или путем ручного выравнивания и визуального контроля (см, например, Ausubel et al, eds. Current Protocols in Molecular Biology (1995) supplement). Примерами алгоритмов, которые подходят для определения процента идентичности последовательностей и сходства последовательностей, являются алгоритмы BLAST и BLAST 2.0, описанные в Altschul et al, J. Mol. Biol. 215:403-410 (1990) и Altschul et al. Nucleic Acids Res. 25:3389-3402 (1977), соответственно. Программное обеспечение для выполнения анализов BLAST общедоступно в Национальном центре биотехнологической информации (по адресу ncbi.nlm.nih.gov/).
Указание на практическую идентичность двух нуклеотидных последовательностей или полипептидов заключается в том, что полипептид, кодируемый первой нуклеиновой кислотой, иммунологически перекрестно реагирует с антителами против полипептида, кодируемого второй нуклеиновой кислотой, как описано ниже. Таким образом, полипепгид, как правило, по сути идентичен второму полипепгиду, например, если два пептида отличаются только консервативными заменами. Другим указанием на практическую идентичность двух нуклеотидных последовательностей является то, что указанные две молекулы или комплементарные им последовательности гибридизируются друг с другом в жестких условиях. Еще одним указанием на практическую идентичность двух нуклеотидных последовательностей является то, что для амплификации этих последовательностей можно применять одинаковые праймеры.
В настоящем документе термин "введение" относится к местному и системному введению, например, в том числе, энтеральному, парентеральному, легочному и местному/трансдермальному введению. Пути введения соединений (например, полинуклеотида, кодирующего одну или более изоформ LAMP-2), которые находят применение в способах, описанных в настоящем документе, включают: например, пероральное введение (внутрь), назальное или ингаляционное введение, введение в виде суппозитория, наружное контактное введение, трансдермальную доставку (например, посредством трансдермального пластыря), интратекальное (IT) введение, внутривенное ("в/в") введение, внутрибрюшинное ("в/б") введение, внутримышечное ("в/м") введение, внутриочаговое введение, или подкожное ("п/к") введение, или имплантацию устройства, обеспечивающего медленное высвобождение, например, мини-осмотического насоса, депо-состава и т.д. субъекту. Введение можно осуществлять любым путем, включая парентеральный и трансмукозальный (например, пероральный, назальный, вагинальный, ректальный или трансдермальный пути). Парентеральное введение включает, например, внутривенное, внутримышечное, внутриартериальное, внутрипочечное, интрауретральное, ингракардиальное, ингракоронарное, инграмиокардиальное, интрадермальное, эпидуральное, подкожное, интраперитонеальное,
интравентрикулярное, ионофоретическое и внутричерепное. Другие способы доставки включают, без ограничений, применение липосомальных составов, внутривенное вливание, трансдермалыгые пластыри и т.д. В некоторых вариантах реализации вводимая доза rAAV-вектора для генной терапии составляет от приблизительно 1Е+11 геномов вектора (гв)/кг до приблизительно 1Е+12 в.г./кг, от приблизительно 1Е+12 в.г./кг до приблизительно 2Е+12 в.г./кг, от приблизительно 2Е+12 в.г./кг до приблизительно 3Е+12 в.г./кг, от приблизительно 3Е+12 в.г./кг до приблизительно 3Е+13 в.г./кг, от приблизительно 3Е+13 до приблизительно 3Е+14 в.г./кг. В некоторых вариантах реализации доза вводимого rAAV-вектора для генной терапии составляет от приблизительно 3Е+12 в.г./кг до приблизительно 3Е+14 в.г./кг.
Термины "системное введение" и "системно вводимый" относятся к способу введения соединения или композиции млекопитающим таким образом, что соединение или композицию доставляют в определенные области организма, в том числе в целевую область фармацевтической активности, через кровеносную систему. Системное введение включает, без ограничений, пероральное, интраназальное, ректальное и парентеральное (например, введение не через желудочно-кишечный тракт, например, внутримышечное, внутривенное, внутриартериальное, трансдермальное и подкожное) введение.
Термин "совместное введение" или "одновременное введение", например, в отношении соединений (например, полинуклеотидов LAMP-2) и/или их аналогов и другого активного агента относится к введению указанного соединения и/или его аналогов и указанного активного агента таким образом, что физиологическое действие указанных соединения и агента может достигаться одновременно. Однако указанные два агента не требуется вводить вместе. В определенных вариантах реализации введение одного агента может предшествовать введению другого. Одновременный физиологический эффект не обязательно требует одновременного присутствия обоих агентов в кровотоке. Однако в определенных вариантах реализации совместное введение обычно приводит к тому, что оба средства одновременно присутствуют в организме (например, в плазме крови) в значительной доле (например, 20% или более, например, 30% или 40% или более, например, 50% или 60% или более, например, 70% или 80% или 90% или более) от их максимальной концентрации в сыворотке для любой заданной дозы.
Термин "эффективное количество" или "фармацевтически эффективное количество" относится к количеству и/или дозировке и/или режиму введения одного или более из соединений (например, векторов для генной терапии), необходимых для достижения необходимого результата, например, повышенной экспрессии одной или более изоформ LAMP-2 в количестве, достаточном для снижения конечной степени тяжести заболевания, характеризующегося нарушением или недостаточностью аутофагии (например, болезни Данона). В некоторых вариантах реализации эффективное количество составляет от приблизительно 1Е+11 в.г./кг до приблизительно 1Е+12 в.г./кг, от приблизительно 1Е+12 в.г./кг до приблизительно 2Е+12 в.г./кг, от приблизительно 2Е+12 в.г./кг до приблизительно 3Е+12 в.г./кг, от приблизительно 3Е+12 в.г./кг до приблизительно 3Е+13 в.г./ кг или от приблизительно 3Е+13 в.г./кг до приблизительно 3Е+14 в.г./кг rAAV-вектора для генной терапии. В некоторых вариантах реализации эффективное количество составляет от приблизительно 3Е+12 в.г./кг до приблизительно 3Е+14 в.г./кг rAAV-вектора для генной терапии.
Фраза "повод для введения" относится к действиям, предпринятым медицинским работником (например, врачом) или лицом, контролирующим медицинское обслуживание субъекта, которые контролируют и/или разрешают введение агенга(ов)/соединения(й) в ткань субъекта. Получение повода для введения может включать диагностику и/или определение подходящей терапевтической или профилактической схемы и/или назначение конкретного агента (ов)/соединений субъекту. Такое назначение может включать, например, составление рецептурной формы, аннотирование медицинской записи и т.п.
В настоящем документе термины "лечение" и "обработка" относятся к задержке начала, замедлению или купированию хода, снижению тяжести или облегчению или профилактике заболевания или состояния, к которому применим данный термин, либо одного или более из симптомов такого заболевания или состояния. Термины "лечение" и "обработка" также включают профилактику, смягчение, облегчение, снижение интенсивности, ингибирование, устранение и/или купирование одного или более из симптомов заболевания или состояния.
Термин "смягчение" относится к снижению интенсивности или устранению одного или более симптомов указанной патологии или заболевания и/или снижению скорости или тяжести или задержке начала одного или более симптомов указанной патологии или заболевания и/или предупреждению указанной патологии или заболевания. В определенных вариантах реализации снижение интенсивности или устранение одного или более из симптомов патологии или заболевания может включать, например, измеримое и устойчивое повышение уровней экспрессии одной или более изоформ LAMP-2.
Используемая в настоящем документе фраза "состоящий главным образом из" относится к роду или виду активных фармацевтических агентов, перечисленных в способе или композиции, и может дополнительно включать другие агенты, сами по себе не обладающие существенной активностью для указанного показания или цели.
Термины "субъект", "индивид" и "пациент" взаимозаменяемо относятся к млекопитающим, предпочтительно к человеку или к примату, не являющемуся человеком, а также к домашним млекопитающим (например, собакам или кошкам), к лабораторным млекопитающим (например, мыши, крысе, кролику, хомяку, морской свинке) и сельскохозяйственным млекопитающим (например, лошадям, крупному рогатому скоту, свиньям, овцам). В различных вариантах реализации субъект может являться человеком (например, взрослым мужчиной, взрослой женщиной, подростком мужского пола, подростком женского пола, ребенком мужского пола, ребенком женского пола).
Термины "перенос гена" или "доставка гена" относятся к способам или системам для надежного введения чужеродной ДНК в клетки-хозяева. Такие способы могут приводить к временной экспрессии невстроенной перенесенной ДНК, внехромосомной репликации и экспрессии перенесенных репликонов (например, эписом) или встраиванию перенесенного генетического материала в геномную ДНК клеток-хозяев.
Термин "вектор" используется в настоящем документе для обозначения молекулы нуклеиновой кислоты, способной переносить или транспортировать другую молекулу нуклеиновой кислоты. Перенесенная нуклеиновая кислота обычно связана, например, с векторной молекулой нуклеиновой кислоты. Вектор может содержать последовательности, управляющие автономной репликацией или обратной транскрипцией в клетке, или включать последовательности, достаточные для обеспечения встраивания в ДНК клетки-хозяина, "векторы" включают векторы для генной терапии. В настоящем документе термин "вектор для генной терапии" относится к вектору, который можно применять при реализации генной терапии, например, доставке субъекту полинуклеотидной последовательности, кодирующей терапевтический полипептид. Векторы для генной терапии могут содержать молекулу нуклеиновой кислоты ("трансген"), кодирующую терапевтически активный полипептид, например, LAMP-2B или другой ген, пригодный для заместительной генной терапии при введении субъекту. Пригодные векторы включают, но не ограничиваются указанными, вирусные векторы.
В настоящем документе термин "экспрессирующая кассета" относится к сегменту ДНК, который в соответствующей ситуации способен управлять экспрессией полинуклеотида (трансгена), кодирующего терапевтически активный полипептид (например, LAMP-2B), включенный в указанную экспрессирующую кассету. При введении в клетку-хозяина экспрессирующая кассета, в числе прочего, способна использовать механизмы клетки для транскрибирования трансгена в РНК, которая затем обычно подвергается дополнительному процессингу и окончательно транслируется в терапевтически активный полипептид. Экспрессирующая кассета может находиться в векторе для генной терапии. Как правило, термин "экспрессирующая кассета" исключает полинуклеотидные последовательности, расположенные в 5'-направлении от 5'-ИКП и в 3'-направлении от 3'-ИКП.
Все патенты, патентные публикации и другие публикации, ссылки на которые и идентификаторы которых приведены в настоящем документе, полностью включены в настоящий документ посредством ссылки для всех целей.
ПРИМЕРЫ
ПРИМЕР 1: доклиническая и клиническая оценка AAVrh74-LAMP-2B
Плазмидный вектор, содержащий кассету для экспрессии генов, получали, как показано на фиг. 1. Трансген модифицировали так, чтобы он кодировал LAM2B-HA-FLAG таким образом, чтобы указанный белок можно было обнаружить с применением антител против НА или антител против FLAG. Вирусный вектор AAVrh74-LAMP2B получали с применением трехплазмидной системы, не содержащей вирусов-помощников, получая рекомбинантные частицы AAV, содержащие белки капсида серотипа rh74 и вирусные геномы, содержащие ИКП AAV2, фланкирующие экспрессирующую кассету LAMP-2B человека. Вирусный вектор тестировали на приматах, не являющихся человеком.
Фармакологические и токсикологические исследования выполняли на мышах LAMP-2B-/- и дикого типа. На основании доклинических данных по безопасности и эффективности, наблюдаемых в исследованиях на мышвх и приматах, не являющихся человеком, выполняли клинические исследования с участием пациентов с болезнью Данона.
ПРИМЕР 2. Экспрессия ДНК, РНК и белка у приматов, не являющихся человеком, после внутривенного введения 1×1013 в.г./кг AAV9.LAMP2B и ЛА Vrh 74. LAMP2B
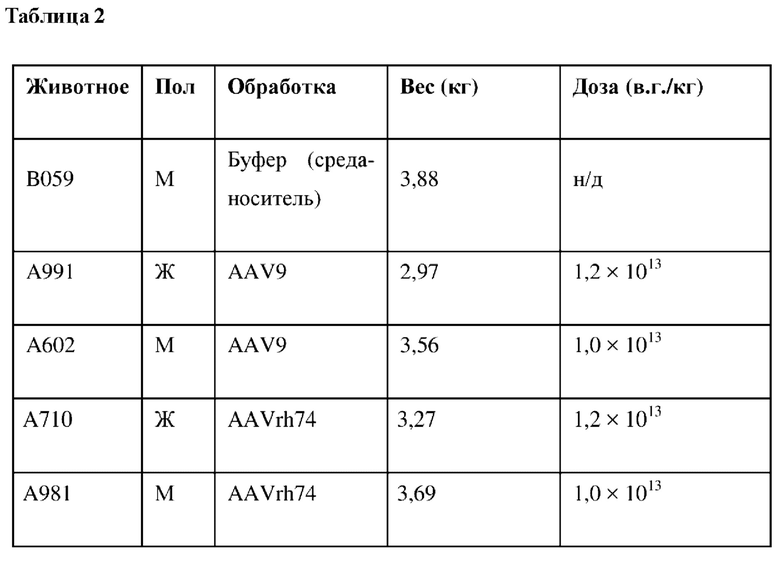
Исследования по сравнению векторов AAV9 и AAVrh74 на приматах, не являющихся человеком, выполняли на парах самцов и самок африканских зеленых мартышек(АGМ). Субъекты получали AAV9.LAMP2B-HA-Flag или AAVrh74.LAMP2B-HA-Flag. "AAV9.LAMP2B-HA-Flag" представлял собой вектор на основе аденоассоциированного вируса серотипа AAV9, кодирующий С-конец LAMP2B, соединенный с НА-фрагментом. "AAVrh74.LAMP2B-HA-Flag" представлял собой вектор на основе аденоассоциированного вируса серотипа AAVrh74, кодирующий С-конец LAMP2B, соединенный с HA-Flag-маркером. Одному субъекту давали контрольную среду-носитель. Векторы вводили путем внутривенной инъекции 2 мл 1,85 × 1013 геномов векторов (vg)/мл, что определяли с помощью количественной полимеразной цепной реакции (qPCR) с применением плазмиды, содержащей последовательность WPRE, для получения эталонной кривой. Эта инъекция позволяла достичь целевой дозы вектора, которая составляла приблизительно 1,0 × 1013 в.г./кг. Из-за более низкой массы тела субъекты женского пола получали приблизительно 1,2 × 1013 в.г./кг соответствующих векторов. Сводная информация об этом эксперименте приведена в таблице 2.
Через два месяца после инъекции субъектов гуманно умерщвляли и собирали ткани для анализа ДНК, РНК и белка. Исследовали следующие ткани: сердце (левое предсердие, правое предсердие, левый желудочек и правый желудочек); скелетные мышцы (четырехглавую и икроножную); печень (левую, правую, среднюю и квадратную доли); головной мозг (лобную долю, теменную долю, височную долю, затылочную долю, кору, гиппокамп, продолговатый мозг и мозжечок); и гонады.
ДНК вектора - количественная ПЦР
ДНК выделяли из замороженных тканей с применением набора Qiagen DNeasy®. Чистоту (А260/А280) и концентрацию ДНК оценивали на спектрофотометре NanoDrop OneTM (Thermo). Количественную ПЦР (кПЦР) выполняли с использованием 20 нг ДНК и универсального мастер-микса TaqMan Universal Master Mix II (Thermo, 4440038) в системе ПЦР в реальном времени (QuantStudio5, Thermo) с применением следующих праймеров/зондов:
WPRE (кассета):
Прямой праймер: 5`-ATCATGCTATTGCTTCCCGTA-3` (SEQ ID NO:30) Обратный праймер: 5`-GGGCCACAACTCCTCATAAA-3` (SEQ ID NO:31) Зонд: 5,-CCTCCTTGTATAAATCCTGGTTGCTGTCT-3, (SEQ ID NO:32) RNaseP (ген домашнего хозяйства Thermo)
Стандартную кривую получали с применением плазмидной ДНК, содержащей последовательность WPRE. На фиг. 2 показана гистограмма количественного определения ДНК вектора в органах, в наибольшей степени поражаемых при болезни Данона, с помощью кПЦР.
мРНК LAMP2B - количественная ОТ-ПНР
РНК выделяли из тканей сердца и мышц с применением набора RNeasy Fibrous Tissue (Qiagen), а из печени и головного мозга - с применением набора RNeasy Lipid Tissue (Qiagen). Чистоту (A260/A280) и концентрацию определяли на спектрофотометре NanoDrop One. РНК преобразовывали в кДНК с применением мастер-микса Superscript IV VILO (Thermo). кПЦР выполняли с использованием 10 нг РНК и универсального мастер-микса TaqMan Universal Master Mix II (Thermo) в системе ПЦР в реальном времени (QuantStudio5, Thermo) с применением следующих праймеров/зондов:
WPRE (кассета):
Прямой праймер: 5`-ATCATGCTATTGCTTCCCGTA-3` (SEQ ID NO:33) Обратный праймер: 5`GGGССАСААСТССТСАТААА-3` (SEQ ID NO:34) Зонд: 5,-CCTCCTTGTATAAATCCTGGTTGCTGTCT-3, (SEQIDN0:35) HPRT-1 (ген домашнего хозяйства, Thermo)
Стандартную кривую получали с применением плазмидной ДНК, содержащей последовательность WPRE. На фиг. 3А показана гистограмма количественного определения ДНК вектора в областях сердца с помощью кПЦР. На фиг. 3 В показана гистограмма количественного определения ДНК вектора в мышцах с помощью кПЦР. На фиг. 4 показана гистограмма количественного определения мРНК в органах, в наибольшей степени поражаемых при болезни Данона, с помощью ОТ-кПЦР. На фиг. 5А показана гистограмма количественного определения мРНК в областях сердца с помощью ОТ-кПЦР. На фиг. 5 В показана гистограмма количественного определения мРНК в мышцах с помощью ОТ-кПЦР.
мРНК LAMP2B - RNAscope
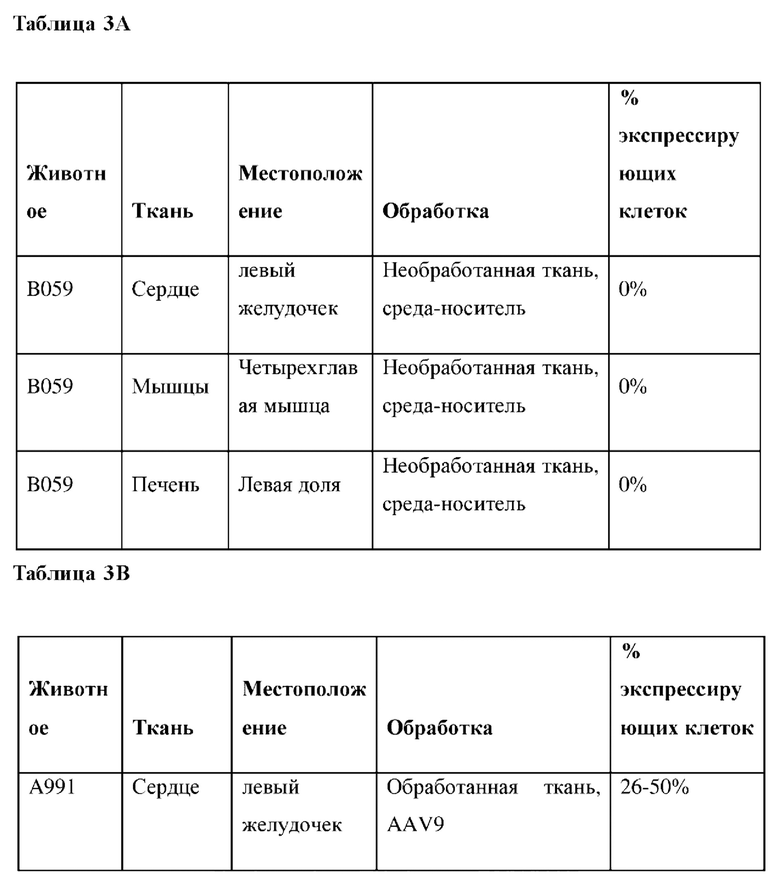
5-мм кубики тканей фиксировали в 10% нейтральном забуференном формалине, заливали в парафин и нарезали на срезы. мРНК трансгена обнаруживали с применением зонда WPRE-О3 ZZ (ACD) с помощью анализа RNAscope 2,5 LS RED. Выполняли полуколичественную визуальную оцежу одного среза каждой ткани, считая положительными клетки с ≥ 1 точкой на клетку. Процент клеток с положительным результатом распределяли на пять категорий: 0%, 1-25%, 26-50%, 51-75% или 100%.
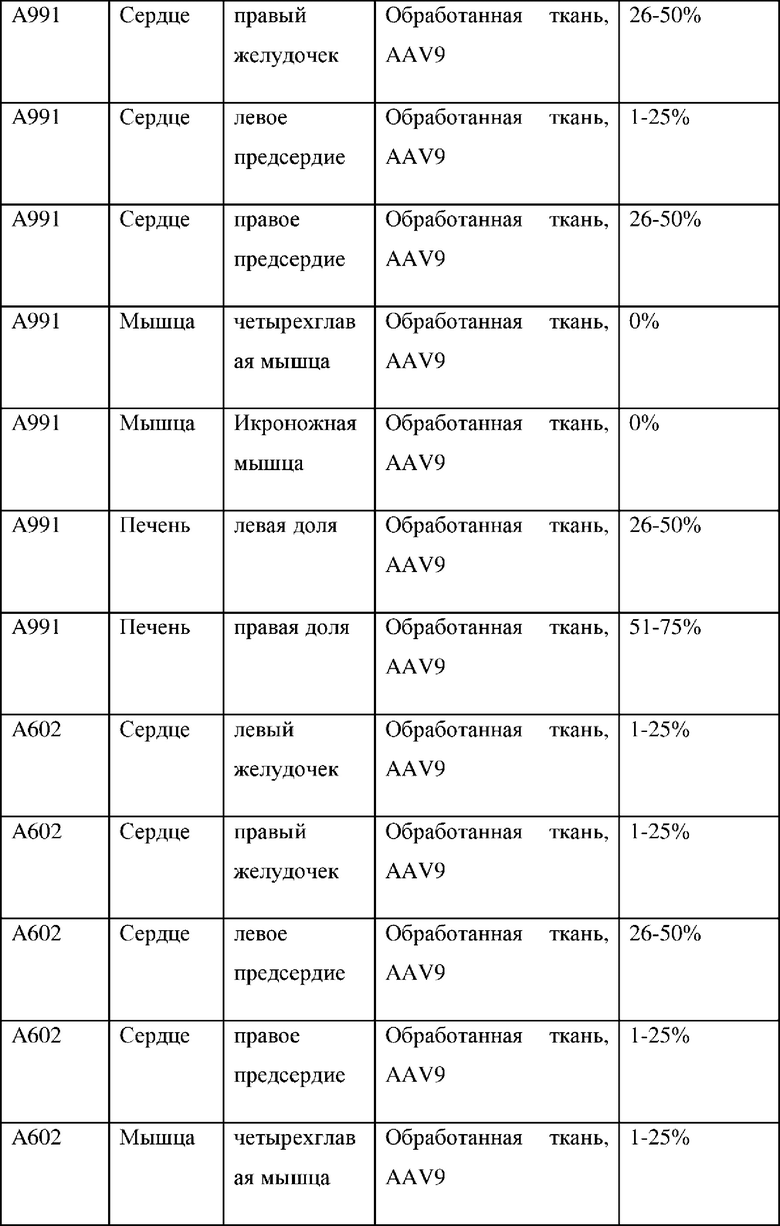
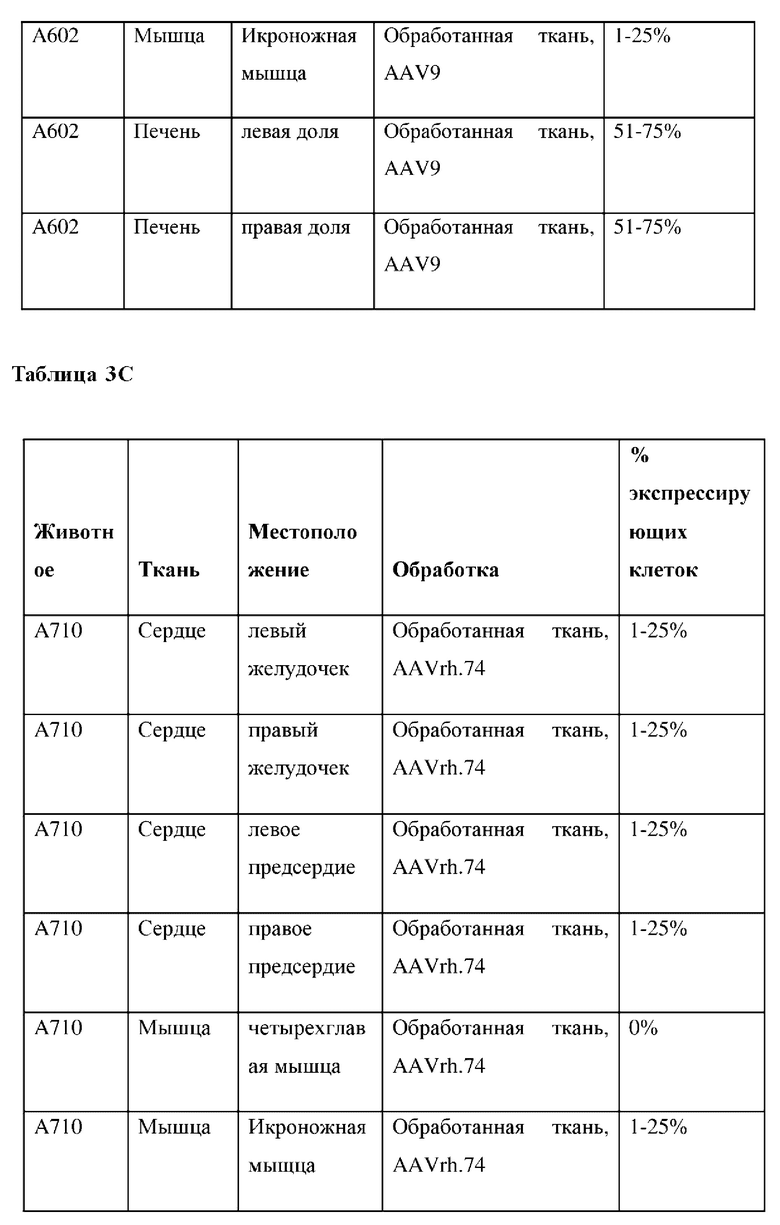
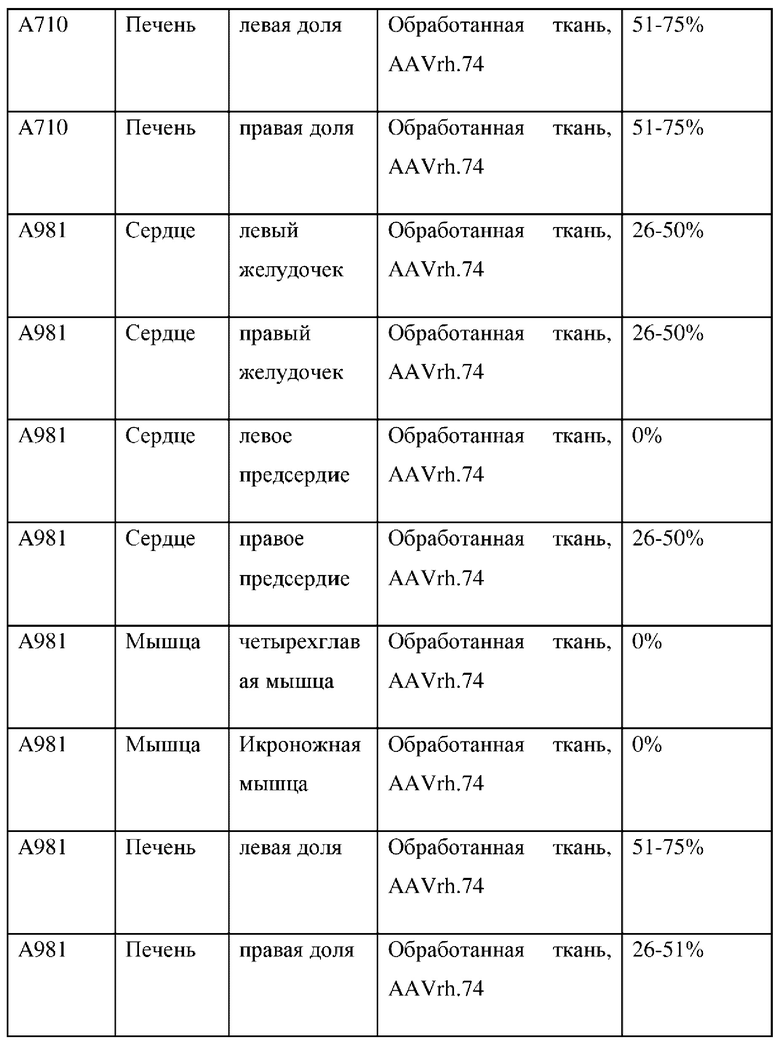
На фиг. 6А показана микрофотография полуколичественного анализа мРНК с помощью RNAscope в необработанном левом желудочке. На фиг. 6 В показаны микрофотографии полуколичественного анализа мРНК с помощью RNAscope в обработанных левых желудочках. На фиг. 7А показана микрофотография полуколичественного анализа мРНК с помощью RNAscope в необработанном квадрицепсе. На фиг. 7В показаны микрофотографии полуколичественного анализа мРНК с помощью RNAscope в обработанных квадрицепсах. На фиг. 8 показаны микрофотографии полуколичественного анализа мРНК с помощью RNAscope в обработанной икроножной мышце. Приведены сводные результаты для контрольной среды-носителя (таблица 3А), AAV9 (таблица 3А) и AAVrh74 (таблица 3С).
Белок LAMP2B - твердофазный ИФА
Приблизительно 125 мг ткани гомогенизировали в 500 ил лизирующего буфера с применением шариков из нержавеющей стали 0,9-2,00 мм (Next Advance) и блендера Next Advance Bullet Blender 24. Лизирующий буфер содержал 300 мМ NaCl, 20 мМ ЭДТД 100 мМ трис, рН 8,0, 2% NP-40 и 0,2% ДСН с ингибитором протеаз Complete™, не содержащим EDTA, и ингибитором фосфатазы PhosSTOPTM. Общий белок оценивали с помощью ВСА (Thermo). В каждую лунку загружали 100 мг общего белка. Стандартную кривую конструировали с применением очищенного белка LAMP2 человека (Origene). Твердофазный ИФА выполняли с использованием моноклонального антитела мыши (Н4 В4, Novus Biologicals) в качестве иммобилизованного антитела, поликлонального антитела козы (R&D Systems) в качестве детектирующего антитела, ПХ-связанного антитела осла против антител козы (Millipore) в качестве вторичного антитела. Планшеты проявляли с использованием ТМБ (Thermo) и количественно определяли на спектрофотометре (Spectramax М5 с).
На фиг. 9 показана гистограмма количественного определения белка в тканях, в наибольшей степени поражаемых при болезни Данона, с помощью твердофазного ИФА. На фиг. 10А показана гистограмма количественного определения белка в областях сердца с помощью твердофазного ИФА. На фиг. 10 В показана гистограмма количественного определения белка в мышцах с помощью твердофазного ИФА.
Клиническая патология
Оценивали патологические эффекты векторов. На фиг. 11A-11D показаны линейные графики измерения клинической патологии в сыворотке NHP в ходе исследования. Уровни клинической патологии оценивали как изменения уровня аланинаминотрансферазы, АЛТ (фиг. НА); аспартатаминотрансферазы, ACT (фиг. 11В); количества лейкоцитов, WBC (фиг. 11С); и количества нейтрофилов (фиг. 11D) в течение всего исследования. В059 представляет собой контрольную среду-носитель. А991 и А602 являются животными, обработанными AAV9. А710 и А981 являются животными, обработанными AAVrh74.
Выводы
Генная терапия на основе AAV с применением трансгена LAMP2B хорошо
переносилась у приматов, не являющихся человеком, при дозе вектора 1,0 × 1013 в.г./кг. Этот результат является важным и неожиданным результатом, поскольку эксперименты с генной терапией на основе AAV для некоторых других трансгенов демонстрировали патологические эффекты при дозах, равных 1,0 × 1013 в.г./кг или ниже. Кроме того, как AAV9, так и AAVrh74 хорошо переносились. Повышенные уровни определенных маркеров наблюдали у животных А602 и А710 в день 21, однако эти выпадающие значения могут быть обусловлены экспериментальной ошибкой или патологией, которая разрешилась сама по себе.
Оба вектора были локализованы в тканях-мишенях и трансдупировали их с целью лечения болезни Данона (сердце и мышцах), однако присутствовали в головном мозге или половых железах в меньшей степени. Экспрессия в половых железах была бы нежелательной по соображениям безопасности. Как и ожидалось, значительные количества вектора накапливались в печени, что является желательным, поскольку печень представляет собой ткань, поражаемую при болезни Данона. Вектор присутствовал в каждом квадранте сердца и как в четырехглавой, так и икроножной мышцах. Это является желательным результатом для лечения болезни Данона.
Локализация какого-либо серотипа AAV-вектора (например, AAV9) не является прогностическим фактором локализации других серотипов (например, AAVrh74). Данный эксперимент продемонстрировал, что AAVrh74 достигал требуемой локализации для лечения болезни Данона или других заболеваний с этиологией, связанной с сердечной и мышечной тканями. мРНК и белок трансгена LAMP2B экспрессировались в одинаковых тканях как в группах AAV9, так и в группах AAVrh74. Экспрессия векторов различных серотипов была сопоставимой. Количество животных в исследовании было слишком мало для выявления статистически значимых тенденций уровней экспрессии между AAV9 и AAVrh74. Анализ RNAscope позволяет предположить, что в группах AAV9 и AAVrh74 была инфицирована аналогичная доля клеток в тканях сердца, мышц и печени.
Эти данные демонстрируют, что AAVrh74 можно применять в качестве вектора для доставки LAMP2B в ткани, имеющие отношение к лечению болезни Данона. В этих экспериментах AAVrh74 не уступал по эффективности AAV9.



Изобретение относится к биотехнологии. Описан вектор для генной терапии на основе рекомбинантного аденоассоциированного вируса (rAAV). Вирус содержит полинуклеотид, содержащий 5’-ИКП, экспрессирующую кассету и 3’-ИКП, и капсидный белок. Причем экспрессирующая кассета содержит трансген, кодирующий мембранный белок 2, ассоциированный с лизосомами (LAMP-2), или его функциональный вариант. Экспрессирующая кассета фланкирована 5’-ИКП и 3’-ИКП. Капсидный белок включает капсидный белок AAVrh.74 или его функциональный вариантю. Капсидный белок или его функциональный вариант характеризуется по меньшей мере 95% идентичностью последовательности по отношению к аминокислотной последовательности SEQ ID NO: 2. Также описана фармацевтическая композиция, содержащая указанный rAAV-вектор для генной терапии. Представлен способ лечения или профилактики болезни Данона у субъекта, нуждающегося в этом, предусматривающий введение субъекту rAAV-вектора для генной терапии или фармацевтической композиции. Также представлен способ доставки полинуклеотида LAMP-2, кодирующего белок LAMP-2, субъекту и/или экспрессии белка LAMP-2 у субъекта, предусматривающий введение субъекту rAAV-вектора для генной терапии или фармацевтической композиции. Изобретение расширяет арсенал средств генной терапии. 4 н. и 23 з.п. ф-лы, 11 ил., 3 табл., 2 пр.
1. Вектор для генной терапии на основе рекомбинантного аденоассоциированного вируса (rAAV), содержащий полинуклеотид, содержащий 5’-ИКП, экспрессирующую кассету и 3’-ИКП; и капсидный белок,
причем экспрессирующая кассета содержит трансген, кодирующий мембранный белок 2, ассоциированный с лизосомами (LAMP-2), или его функциональный вариант,
причем экспрессирующая кассета фланкирована 5’-ИКП и 3’-ИКП, и
при этом капсидный белок включает капсидный белок AAVrh.74 или его функциональный вариант, при этом капсидный белок или его функциональный вариант характеризуется по меньшей мере 95% идентичностью последовательности по отношению к аминокислотной последовательности SEQ ID NO: 2.
2. rAAV-вектор для генной терапии по п. 1, где LAMP-2 выбран из LAMP-2A, LAMP-2B и LAMP-2C.
3. rAAV-вектор для генной терапии по п. 1, где указанный капсидный белок или его функциональный вариант характеризуется 100% идентичностью последовательности по отношению к аминокислотной последовательности SEQ ID NO: 2.
4. rAAV-вектор для генной терапии по любому из пп. 1-3, где каждый из 5’-ИКП и 3’-ИКП представляет собой 5’-ИКП AAV2 и 3’-ИКП AAV2 соответственно или их варианты.
5. rAAV-вектор для генной терапии по любому из пп. 1-4, где LAMP-2 или его функциональный вариант представляет собой LAMP-2B или его функциональный вариант, характеризующийся по меньшей мере 90% идентичностью по отношению к SEQ ID NO: 16.
6. rAAV-вектор для генной терапии по п. 5, где LAMP-2B или его функциональный вариант характеризуется 100% идентичностью по отношению к SEQ ID NO: 16.
7. rAAV-вектор для генной терапии по любому из пп. 1-6, где трансген характеризуется 90% идентичностью по отношению к SEQ ID NO: 6.
8. rAAV-вектор для генной терапии по п. 7, где трансген характеризуется 100% идентичностью по отношению к SEQ ID NO: 6.
9. rAAV-вектор для генной терапии по п. 1, где:
капсидный белок или его функциональный вариант характеризуется 100% идентичностью последовательности по отношению к аминокислотной последовательности SEQ ID NO: 2;
LAMP-2B или его функциональный вариант характеризуется 100% идентичностью по отношению к SEQ ID NO: 16; и
трансген характеризуется 100% идентичностью по отношению к SEQ ID NO: 6.
10. rAAV-вектор для генной терапии по любому из пп. 1-9, где экспрессирующая кассета содержит:
консенсусную оптимальную последовательность Козак, функционально связанную с трансгеном, причем указанная консенсусная оптимальная последовательность Козак содержит SEQ ID NO: 20;
полноразмерную полиA-последовательность, функционально связанную с трансгеном, причем указанная полноразмерная полиA-последовательность содержит SEQ ID NO: 26; и/или
не содержит стартового кодона в 5’-направлении от стартового кодона трансгена.
11. rAAV-вектор для генной терапии по любому из пп. 1-10, где экспрессирующая кассета содержит следующие функционально связанные элементы в направлении от 5’-конца к 3’-концу: первый инвертированный концевой повтор, энхансерную/промоторную область, интрон, консенсусную оптимальную последовательность Козак, трансген, 3’-нетранслируемую область, содержащую полноразмерную полиА-последовательность, и второй инвертированный концевой повтор, причем экспрессирующая кассета не содержит стартового кодона в 5’-направлении от стартового кодона трансгена.
12. rAAV-вектор для генной терапии по п. 11, где энхансерная/промоторная область содержит:
в направлении от 5’-конца к 3’-концу энхансер IE CMV и промотор бета-актина курицы, причем указанная энхансерная/промоторная область необязательно дополнительно содержит первый экзон и первый интрон гена бета-актина курицы и акцептор сплайсинга гена бета-глобина кролика; и/или
тканеспецифичный промотор, способный опосредовать повышенную экспрессию в ткани сердечной и/или скелетной мышцы по сравнению с тканью печени.
13. rAAV-вектор для генной терапии по п. 12, где:
капсидный белок или его функциональный вариант характеризуется 100% идентичностью последовательности по отношению к аминокислотной последовательности SEQ ID NO: 2;
LAMP-2B или его функциональный вариант характеризуется 100% идентичностью последовательности по отношению к SEQ ID NO: 16; и
трансген характеризуется 100% идентичностью по отношению к SEQ ID NO: 6.
14. Фармацевтическая композиция, содержащая rAAV-вектор для генной терапии по любому из пп. 1-13.
15. Способ лечения или профилактики болезни Данона у субъекта, нуждающегося в этом, предусматривающий введение субъекту rAAV-вектора для генной терапии по любому из пп. 1-13 или фармацевтической композиции по п. 14.
16. Способ по п. 15, отличающийся тем, что rAAV-вектор для генной терапии или фармацевтическую композицию вводят парентеральным путем, выбранным из внутривенного, внутриартериального, внутрисердечного, внутрикоронарного, внутримиокардиального, внутрипочечного, интрауретрального, эпидурального и внутримышечного введения.
17. Способ по п. 15 или 16, отличающийся тем, что субъект представляет собой человека.
18. Способ по любому из пп. 15-17, отличающийся тем, что у субъекта проявляются симптомы болезни Данона;
субъект идентифицирован как характеризующийся пониженной или необнаруживаемой экспрессией эндогенного LAMP-2B; и/или
субъект идентифицирован по наличию мутантного гена LAMP-2B.
19. Способ по любому из пп. 15-18, отличающийся тем, что rAAV-вектор для генной терапии вводят в дозе от приблизительно 3 × 1012 в.г./кг до приблизительно 3 × 1014 в.г./кг.
20. Способ по любому из пп. 15-19, отличающийся тем, что введение rAAV-вектора для генной терапии трансдуцирует одно или более из сердца, мышцы и печени;
введение rAAV-вектора для генной терапии вызывает экспрессию мРНК LAMP2B в одном или более из сердца, мышцы и печени;
введение rAAV-вектора для генной терапии вызывает экспрессию белка LAMP2B в одном или более из сердца, мышцы и печени;
введение rAAV-вектора для генной терапии вызывает инфекцию rAAV-вектором для генной терапии по меньшей мере приблизительно 10%, по меньшей мере приблизительно 20% или по меньшей мере приблизительно 30% клеток в одном или более из сердца, мышцы и печени;
введение rAAV-вектора для генной терапии вызывает трансдукцию rAAV-вектора для генной терапии в половых железах в количестве менее чем 0,1 генома вектора (в.г.) на диплоидный геном;
введение rAAV-вектора для генной терапии вызывает экспрессию мРНК LAMP2B в половых железах в количестве менее 2 × 104 копий мРНК на мкг общей РНК;
введение rAAV-вектора для генной терапии не вызывает экспрессии белка LAMP2B в головном мозге и/или половых железах; и/или
введение rAAV-вектора для генной терапии трансдуцирует и/или вызывает экспрессию трансгена на приблизительно том же уровне, что и введение вектора для генной терапии AAV9, содержащего такую же экспрессирующую кассету.
21. Способ доставки полинуклеотида LAMP-2, кодирующего белок LAMP-2, субъекту и/или экспрессии белка LAMP-2 у субъекта, предусматривающий введение субъекту rAAV-вектора для генной терапии по любому из пп. 1-13 или фармацевтической композиции по п. 14.
22. Способ по п. 21, отличающийся тем, что rAAV-вектор для генной терапии или фармацевтическую композицию вводят парентеральным путем, выбранным из внутривенного, внутриартериального, внутрисердечного, внутрикоронарного, внутримиокардиального, внутрипочечного, интрауретрального, эпидурального и внутримышечного введения.
23. Способ по п. 21 или 22, отличающийся тем, что субъект страдает или подвержен риску расстройства аутофагии, выбранного из группы, состоящей из болезни Данона, терминальной стадии сердечной недостаточности, инфаркта
миокарда, токсических эффектов лекарственных средств, диабета, терминальной стадии почечной недостаточности и старения.
24. Способ по любому из пп. 21-23, отличающийся тем, что субъект представляет собой человека.
25. Способ по любому из пп. 21-24, отличающийся тем, что субъект испытывает симптомы болезни Данона;
субъект идентифицирован как характеризующийся пониженной или необнаруживаемой экспрессией эндогенного LAMP-2В; и/или
субъект идентифицирован по наличию мутантного гена LAMP-2В.
26. Способ по любому из пп. 21-24, отличающийся тем, что rAAV-вектор для генной терапии вводят в дозе от приблизительно 3 × 1012 в.г./кг до приблизительно 3 × 1014 в.г./кг, необязательно в дозе, составляющей от приблизительно 3 × 1012 в.г./кг до приблизительно 1,2 × 1013 в.г./кг или приблизительно 1,0 × 1013 в.г./кг.
27. Способ по любому из пп. 21-26, отличающийся тем, что введение rAAV-вектора для генной терапии трансдуцирует одно или более из сердца, мышцы и печени;
введение rAAV-вектора для генной терапии вызывает экспрессию мРНК LAMP2B в одном или более из сердца, мышцы и печени;
введение rAAV-вектора для генной терапии вызывает экспрессию белка LAMP2B в одном или более из сердца, мышцы и печени;
введение rAAV-вектора для генной терапии вызывает инфекцию rAAV-вектором для генной терапии по меньшей мере приблизительно 10%, по меньшей мере приблизительно 20% или по меньшей мере приблизительно 30% клеток в одном или более из сердца, мышцы и печени;
введение rAAV-вектора для генной терапии вызывает трансдукцию rAAV-вектора для генной терапии в половых железах в количестве менее чем 0,1 генома вектора (в.г.) на диплоидный геном;
введение rAAV-вектора для генной терапии вызывает экспрессию мРНК LAMP2B в половых железах в количестве менее чем 2 × 104 копий мРНК на мкг общей РНК;
введение rAAV-вектора для генной терапии не вызывает экспрессии белка LAMP2B в головном мозге и/или половых железах; и/или
введение rAAV-вектора для генной терапии трансдуцирует и/или вызывает экспрессию трансгена на приблизительно том же уровне, что и введение вектора для генной терапии AAV9, содержащего ту же экспрессирующую кассету.
| RU 2016125883 A, 30.01.2018 | |||
| US 20150111955 A1, 23.04.2015 | |||
| WO 2017127565 A1, 27.07.2017. |
Авторы
Даты
2024-07-16—Публикация
2020-02-12—Подача