ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к белкам, обеспечивающим вкус и вкусо-ароматические свойства.
УРОВЕНЬ ТЕХНИКИ
Ссылки, которые считаются важными в качестве уровня техники для раскрытого в данном документе объекта изобретения, перечислены ниже:
GB2123672
WO8402450
Leone, S. et al. Sweeter and stronger: enhancing sweetness and stability of the single chain monellin MNEI through molecular design. Sci. Rep. 6, 34045; doi: 10.1038/srep34045 (2016);
Masuda, T. et al. A Hypersweet Protein: Removal of The Specific Negative Charge at Asp21 Enhances Thaumatin Sweetness. Sci. Rep. 6, 20255; doi: 10.1038/srep20255 (2016);
Samish I.,S, MacDermaid CM.,S, Perez-Aguilar JMP., Saven JG.PI, (2011). Theoretical and Computational Protein Design. Annu Rev Phys Chem 62:129-149;
Samish I., (Editor), Computational Protein Design (2017), Methods in Molecular Biology, Springer Protocols, Humana Press;
Zhao, Meng & Xu, Xiangqun & Liu, Bo. (2018) Structure basis of the improved sweetness and thermostability of a unique double-sites single-chain sweet-tasting protein monellin (MNEI) mutant. Biochimie. 154;
Zheng W., et al. (2018) Expression, purification and characterization of a novel double-sites mutant of the single-chain sweet-tasting protein monellin (MNEI) with both improved sweetness and stability. Protein Expr Purif, 143:52-56;
Pica Α., et al (2018) pH driven fibrillar aggregation of the super-sweet protein Y65R-MNEI: A step-by-step structural analysis. Biochim Biophys Acta Gen Subj., 1862:808-815.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
На рынке подсластителей преобладают сахар и сироп с высоким содержанием фруктозы, при этом менее 10% доли рынка приходится на другие подсластители, включая искусственные подсластители и подсластители, полученные из природных источников, например экстракт стевии и архата.
В GB2123672 описаны сладкие белки, такие как тауматин и монеллин, и слабокислотная полисахаридная камедь, которые включают в различные напитки, средства для полоскания рта или в фармацевтическую основу, необязательно вместе с пищевой кислотой или объемообразующим средством.
В WO8402450 описано нанесение тауматина или монеллина на поверхность композиции жевательной резинки, содержащей жевательную основу, подсластитель и вкусо-ароматическое вещество.
Leone, S. et al., Zhao et al., Zheng W., et al. и Pica Α., et al описывают мутанты MNEI.
Masuda, T. et al. описывают гиперсладкое производное тауматина.
Вычислительные средства для конструирования белков стали альтернативным надежным способом конструирования белков с улучшенными специфическими признаками, как описано в Samish I.,S., et al (2011) и (2017).
ОБЩЕЕ ОПИСАНИЕ
В соответствии с некоторыми аспектами настоящее изобретение предусматривает модифицированный белок, содержащий аминокислотную последовательность, которая содержит одно или несколько аминокислотных замещений по сравнению с эталонным белком, при этом модифицированный белок характеризуется по меньшей мере одним улучшенным пищевым свойством по сравнению с эталонным белком. В соответствии с некоторыми вариантами осуществления модифицированный белок содержит по меньшей мере два аминокислотных замещения по сравнению с эталонным белком.
В соответствии с некоторыми аспектами настоящее изобретение предусматривает модифицированный белок, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере три аминокислотные замены по остаткам Е2, Е23 и Y65 в SEQ ID NO:5, где модифицированный белок характеризуется по меньшей мере одним улучшенным пищевым свойством по сравнению с SEQ ID NO:5.
В соответствии с некоторыми аспектами настоящее изобретение предусматривает пищевой продукт, содержащий модифицированный белок, содержащий аминокислотную последовательность, которая содержит одно или несколько аминокислотных замещений по сравнению с эталонным белком, где модифицированный белок характеризуется по меньшей мере одним улучшенным пищевым свойством по сравнению с эталонным белком. В соответствии с некоторыми вариантами осуществления модифицированный белок содержит по меньшей мере два аминокислотных замещения по сравнению с эталонным белком.
В соответствии с некоторыми аспектами настоящее изобретение предусматривает пищевой продукт, содержащий модифицированный белок, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере три аминокислотные замены по остаткам Е2, Е23 и Y65 в SEQ ID NO:5, где модифицированный белок характеризуется по меньшей мере одним улучшенным пищевым свойством по сравнению с SEQ ID NO:5.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Для лучшего понимания объекта изобретения, который раскрыт в данном документе, и для иллюстрации того, как он может быть реализован на практике, ниже, исключительно в качестве неограничивающего примера, будут описаны варианты осуществления со ссылкой на прилагаемые графические материалы, описанные ниже.
На фиг.1 представлена гистограмма, показывающая среднюю оценку сладости MNEI и модифицированных белков на основе MNEI.
На фиг.2 представлена гистограмма, показывающая среднюю оценку сладости MNEI и модифицированных белков на основе MNEI.
На фиг.3 представлен акриламидный гель из экспериментов по экспрессии в штамме дрожжей Pichia.
На фиг.4А-4С представлен вид трех сайтов связывания рецептора тауматина при его стыковке с TAS1R2 и TAS1R3.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Искусственные низкокалорийные подсластители доступны на рынке, и известно, что некоторые из них обладают побочными эффектами. Например, сахарин широко использовался для подслащивания продуктов и напитков без калорий и углеводов, и его применение было связано с развитием рака мочевого пузыря. Таким образом, существует потребность в средствах, которыми можно будет заменить доступные в настоящее время искусственные низкокалорийные подсластители, которые обеспечат, с одной стороны, оптимальный органолептический профиль, а с другой стороны, будут подходящими для использования в пищевых продуктах и напитках.
Настоящее изобретение относится к новым сладким белкам и новым белкам, модифицирующим вкус, и основано на способах оптимизации, например вычислительных способах, приводящих к получению новых белков, которые проявляют улучшенные свойства по сравнению с известными подсластителями.
Неожиданно авторы настоящего изобретения обнаружили, что введение различных специфических замен в аминокислотную последовательность известного белка (обозначенного в данном документе как "эталонный белок") привело к образованию нового белка, характеризующегося по меньшей мере одним улучшенным свойством по сравнению с эталонным белком. Было высказано предположение, что по меньшей мере одно улучшенное свойство нового белка может быть очень важным в отношении пригодности и применения модифицированного белка в пищевых продуктах и напитках.
В частности, как показано в приведенных ниже примерах, новые белки (обозначенные в данном документе как "модифицированный белок" или "сконструированный белок") демонстрируют улучшенный органолептический профиль и/или термостабильность по сравнению с соответствующим эталонным белком. Органолептический профиль, описанный в данном документе, относится к вкусовому профилю (например, подслащивающая способность, послевкусие и стойкость вкуса).
Таким образом, настоящее изобретение в наиболее широком его аспекте относится к модифицированному белку, содержащему аминокислотную последовательность, которая характеризуется наличием по меньшей мере одного аминокислотного замещения (замены) в аминокислотной последовательности по сравнению с эталонным белком, где модифицированный белок характеризуется по меньшей мере одним улучшенным пищевым свойством по сравнению с эталонным белком.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, которая содержит по меньшей мере два аминокислотных замещения (замены), иногда три аминокислотных замещения (замены) по сравнению с аминокислотной последовательности эталонного белка.
По меньшей мере одно улучшенное пищевое свойство охватывает свойство, которое обеспечивает пригодность модифицированного протеина для применения в пищевых продуктах и напитках, такое как вкусо-ароматическое свойство, текстура, вкус, порог восприятия сладости, уровень сладости, профиль сладости, органолептический профиль, кинетика ощущения сладости, стабильность (структурная и функциональная), стойкость к нагреванию, соответствие пищевой матрице, срок хранения, маскировка и/или усиление другого вкусо-ароматического вещества, привкус, время появления вкуса, стойкость вкуса, округлость вкуса или вкус по сравнению с сахаром.
В некоторых вариантах осуществления по меньшей мере одно пищевое свойство является свойством, влияющим на органолептические ощущения. Используемый в данном документе термин "свойство, влияющее на органолептические ощущения" относится к изменению органолептического восприятия, которое определяется, например, чувством вкуса. Свойство, влияющее на органолептические ощущения, включает, например, профиль сладости, например подслащивающую способность (вкусо-ароматическое свойство по сравнению с сахаром), кинетику ощущения сладости (время до появления вкуса, время стойкости вкуса, продолжительность вкуса), отсутствие привкуса и маскировку или усиление других вкусов, привкуса (например, металлического привкуса). Например, улучшенное свойство относится к увеличению сладости, сокращению времени до появления вкуса или уменьшению стойкости вкуса.
В соответствии с некоторыми вариантами осуществления, где по меньшей мере одно свойство представляет собой свойство, влияющее на органолептические ощущения, модифицированный белок можно рассматривать в качестве заменителя сахара. В некоторых вариантах осуществления по меньшей мере одно пищевое свойство представляет собой по меньшей мере одно из подслащивающей способности, сокращения времени до появления вкуса или уменьшения стойкости вкуса.
В некоторых вариантах осуществления по меньшей мере одно пищевое свойство представляет собой стабильность. В некоторых вариантах осуществления стабильность представляет собой по меньшей мере одно из термостабильности, более длительного срока хранения, стабильности в условиях низкого рН, стабильности при определенных значениях концентрации соли, стабильности при определенных значениях ионной силы или стабильности в жиросодержащей или белоксодержащей матрице. В некоторых вариантах осуществления по меньшей мере одно пищевое свойство представляет собой термостабильность.
В некоторых вариантах осуществления по меньшей мере одно пищевое свойство представляет собой стабильность при хранении. Например, модифицированный белок может быть стабильным в течение по меньшей мере недели, двух недель, месяца и даже года.
Как подробно описано выше, модифицированный белок можно применять в комбинации с по меньшей мере одним дополнительным пищевым ингредиентом. В некоторых вариантах осуществления по меньшей мере одно пищевое свойство может относиться к синергическому эффекту модифицированного белка с по меньшей мере одним пищевым ингредиентом. Неограничивающие примеры пищевого ингредиента включают искусственное или натуральное вкусо-ароматическое вещество, пищевую добавку, пищевой краситель, консервант или добавку в виде дополнительного сахара. Пищевой ингредиент может обладать эффектом маскировки вкуса или эффектом усиления вкуса.
Как описано в данном документе, эталонный белок представляет собой белок, модифицирующий вкус, и/или белок-усилитель вкуса, и/или белок, обеспечивающий вкус, и, в частности, сладкий белок. Белок, модифицирующий вкус, вызывает ощущения сладкого вкуса от несладких веществ, например воды и кислых веществ. Известно, что белок, обеспечивающий вкус, как используется в данном документе, связывается со вкусовыми рецепторами и приводит к появлению вкусовых ощущений. Известно, что сладкий белок, как используется в данном документе, связывается с рецептором сладкого и приводит к появлению ощущения сладости. Неограничивающие примеры рецептора сладкого включают представитель 1 вкусовых рецепторов типа 1 (TAS1R1, Uniprot ID для гена человека: TS1R1_HUMAN), представитель 2 вкусовых рецепторов типа 1 (TAS1R2, T1R2, TR2, UniProt - Q8TE23), представитель 3 вкусовых рецепторов типа 1 (TAS1R3, T1R3, UniProt - Q7RTX0).
Эталонный белок может различаться по длине. В некоторых вариантах осуществления эталонный белок содержит по меньшей мере 45 аминокислот, по меньшей мере 80 аминокислот, по меньшей мере 100 аминокислот, по меньшей мере 258 аминокислот. В некоторых вариантах осуществления эталонный белок имеет длину 45 аминокислот, 50 аминокислот, 54 аминокислоты, 97 аминокислот, 100 аминокислот, 158 аминокислот, 220 аминокислот, 235 аминокислот, 258 аминокислот.
В некоторых вариантах осуществления эталонный белок представляет собой встречающийся в природе белок. В некоторых других вариантах осуществления эталонный белок содержится в растениях, таких как тропические растения. Неограничивающие примеры растений включают по меньшей мере одно из следующих: Capparis masaikai, Pentadiplandra brazzeana, Dioscoreophyllum volkensii, Thaumatococcus daniellii, ягоды Synsepalum dulcificum или Curculigo latifolia.
В некоторых вариантах осуществления эталонный сладкий белок выбран из группы, состоящей из тауматина, монеллина, миракулина, куркулина, браззеина и мабинлина.
В некоторых вариантах осуществления эталонный сладкий белок представляет собой тауматин.
В некоторых вариантах осуществления эталонный сладкий белок представляет собой монеллин.
В некоторых вариантах осуществления эталонный белок представляет собой тауматин-1 (регистрационный номер в GenBank Р02883; SEQ ID ΝΟ:1). В некоторых вариантах осуществления эталонный белок представляет собой тауматин-2 (регистрационный номер в GenBank Р02884; SEQ ID NO:2).
В некоторых вариантах осуществления эталонный белок представляет собой монеллин, состоящий из цепи А (регистрационный номер в GenBank Р02881; SEQ ID NO:3) и цепи В (регистрационный номер в GenBank Р02882; SEQ ID NO:4).
В некоторых вариантах осуществления эталонный белок представляет собой миракулин (регистрационный номер в GenBank Ρ13087; SEQ ID NO:6).
В некоторых вариантах осуществления эталонный белок представляет собой куркулин-1 (регистрационный номер в GenBank Р19667; SEQ ID NO:7) или куркулин-2 (регистрационный номер в GenBank Q6F495; SEQ ID NO:8).
В некоторых вариантах осуществления эталонный белок представляет собой браззеин (также известный как дефензин-подобный белок) (регистрационный номер в GenBank Р56552; SEQ ID NO:9).
В некоторых вариантах осуществления эталонный белок представляет собой мабинлин I/сладкий белок мабинлин-1 (регистрационный номер в GenBankP80351; SEQ ID NO:10), мабинлин II (также известный как сладкий белок мабинлин-2) (регистрационный номер в GenBankP30233; SEQ ID NO:11), мабинлин III (также известный как сладкий белок мабинлин-3) (регистрационный номер в GenBankP80352; SEQ ID NO:12), мабинлин IV (также известный как сладкий белок мабинлин-4) (регистрационный номер в GenBankP80353; SEQ ID NO:13) или цепь А мабинлина-1 (регистрационный номер в GenBank B9SA35; SEQ ID NO:14).
В некоторых вариантах осуществления эталонный белок представляет собой последовательность, которая не встречается в природе, и поэтому называется искусственным белком, или синтетическим белком, или сконструированным белком. Синтетический белок может содержать всю или часть аминокислотной последовательности встречающегося в природе белка (все или часть полипептидных цепей белка) или его части. Например, эталонный белок может предусматривать модификацию связи встречающегося в природе белка, приводящую к получению одной полипептидной цепи, которая соответствует встречающемуся в природе белку, так что по меньшей мере две полипептидные цепи белка дикого типа ковалентно присоединены другими аминокислотами.
В некоторых вариантах осуществления эталонный белок представляет собой модифицированный белок монеллин, известный как MNEI.
В некоторых вариантах осуществления эталонный белок представляет собой одноцепочечный белок монеллин (MNEI) (SEQ ID NO:5).
Новые модифицированные белки можно конструировать различными способами.
В некоторых вариантах осуществления конструирование белков выполняется с использованием вычислительных средств или с помощью способов экспертного конструирования белков и структурной биологии, например с помощью сайт-направленного мутагенеза, белковой инженерии или направленной эволюции, как дополнительно описано ниже. Авторы настоящего изобретения разработали вычислительные методики, основанные на данных о последовательностях эталонных белков, обеспечивающих вкусо-ароматические свойства, структурных данных эталонных белков, обеспечивающих вкусо-ароматические свойства, и/или данных по эволюции эталонных белков, обеспечивающих вкусо-ароматические свойства, и других белков, которые имеют локальное или глобальное сходство с эталонным белком, обеспечивающим вкусо-ароматические свойства, в отношении последовательности и/или структурных признаков. Возможности разработанных и примененных в данном документе вычислительных способов позволили авторам настоящего изобретения сконструировать белки со специфическими аминокислотными заменами, которые являются энергетически выгодными и, таким образом, предположительно обладают улучшенными признаками, представляющими собой термостабильность, стабильность в соленой среде, рН-стабильность, срок хранения, сворачивание и растворимость. В частности, вычислительное конструирование белка (CPD) применяли для фокусировки на конкретных сайтах в структуре и/или последовательности эталонного белка, которые не обязательно являются функциональными сайтами связывания с рецептором. Кроме того, использование CPD позволило авторам настоящего изобретения ограничить замены предварительно определенным набором аминокислот, который соответствует требуемым улучшенным признакам. Предварительно определенный набор аминокислот присутствует как для входных данных, т.е. областей белка, подвергнутых CPD, так и для выходных данных, т.е. для местоположения и типов аминокислот, которые могут присутствовать в полученном модифицированном белке.
Например, с помощью CPD можно заменить "неидеальные" аминокислоты (такие как гидрофильные аминокислоты в гидрофобной сердцевине или гидрофобные аминокислоты в области внешней поверхности) на "идеальные" аминокислоты (такие как гидрофильные аминокислоты в области внешней поверхности и гидрофобные аминокислоты внутри гидрофобной сердцевины).
Без ограничения какой-либо теорией, авторы настоящего изобретения предположили, что замена гидрофобных аминокислот в области внешней поверхности на гидрофильные аминокислоты в области внешней поверхности снизит уровень неспецифического связывания с полостью рта и уменьшит стойкое ощущение послевкусия.
Разработанные в данном документе методики включают поиск "стабилизирующих замен", например аминокислотных замен, которые обеспечат снижение общей энергии белковой структуры. Общая энергия может быть рассчитана с применением известных в данной области техники алгоритмов. Неограничивающие примеры таких алгоритмов включают Rosetta, OSPREY (Μ. Hallen, J. Martin, et al., Journal of Computational Chemistry 2018; 39(30): 2494-2507 или EnCoM (Frappier V, Chartier M, Najmanovich RJ. Nucleic Acids Res. 2015; 43(W1):W395-400). Эти способы CPD выполняют фокусировку и фильтрацию с помощью множества ортогональных способов, таких как эволюционная последовательность и структурный консенсус, обычная и высокотемпературная молекулярная динамика (MD), коррелированный мутационный анализ (СМА), визуальный осмотр, а также анализ полостей, гидрофобных участков, свободных водородных связей и т.п.
Аминокислотные замены основаны на следующих соображениях: (а) поверхностный электростатический потенциал и гидрофобные участки на поверхности (их отсутствие), (b) поддержание изоэлектрической точки (pI) белка в определенном диапазоне, (с) анализ внутрибелковых полостей (d), динамическая стабильность, включая корреляционный мутационный анализ, анализ нормальных колебаний и среднеквадратичные флуктуации (RMSF) в высокотемпературной динамике, (е) энтропийные и/или энтальпийные компоненты энергетики замены, (f) визуализация конкретной замены, (g) типы аминокислот, разрешенные в семействе родственных белков; как отражено в эволюционном анализе консервативности контролируемого множественного выравнивания последовательностей (MSA), (h) частота замены, как отражено в расчетах CPD с низкой псевдоэнергией.
Вычислительные методики включают один или несколько из следующих стадий.
(1) Множественное выравнивание последовательностей (MSA). На этой стадии в общедоступных базах данных осуществляют поиск последовательностей и/или белка, сходных с целевым эталонным белком. На основе этого поиска осуществляют построение множественного выравнивания последовательностей (MSA), рассчитывают степень консервативности. На основе последнего принимают решение относительно уровня проведения CPD. В неконсервативных положениях при CPD допускают все аминокислоты (с цистеином или без него), тогда как для более консервативных положений при CPD ограничиваются остатками со свойствами, аналогичными свойствам исходно присутствующих остатков (например, зарядом, размером и т.д.). Эта стадия включает установление ограничений в отношении замен в каждом положении, в котором происходит замена, на основе физических знаний и данных по консервативности.
(2) Анализ функции белка. На этой стадии создают базу данных замен с известным влиянием (на активность, структуру, связывание и т.д.) с использованием предшествующего уровня техники. В отношении замен, а также прилегающих положений (например, на расстоянии 0,5-1 нм от этих положений), которые, как известно на основе предшествующего уровня техники, нарушают стабильность и/или функцию, устанавливают ограничения при CPD и не осуществляют таких замен.
(3) CPD. Эту стадию выполняют с помощью специально предназначенного программного обеспечения, такого как ROSETTA, OSPREY, SCWRL и т.п.Перед проведением детерминированного CPD, минимизируют энергию трехмерной структуры/модели эталонного белка. Для каждого эталонного белка рассматривают несколько моделей.
(4) Отбор. Собирают модели белков с наименьшей энергией. На этих моделях осуществляют вычисления MSA и определяют консервативную последовательность. На основе накопленных знаний в области биохимии и биофизики выбирают подмножества замен. Эти подмножества предусматривают замещение в одном или нескольких положениях, которое появляется при CPD с высокой частотой. Затем каждое подмножество моделируют на трехмерной структуре белка и минимизируют его энергию. Затем выбирают подмножество с наименьшей энергией для дальнейшего вычислительного и экспериментального подтверждения.
Одним из факторов, которые надо учитывать при CPD, является сайт связывания рецептора и решение о том, заменять ли аминокислоты в области связывания и вблизи данной области. Определение в белке аминокислотных остатков, которые важны для связывания со вкусовым рецептором, обычно можно проводить путем одноточечной замены различных аминокислот. Как подробно описано в примерах, авторы настоящего изобретения применяли вычислительный анализ для характеристики предполагаемых сайтов связывания во вкусовых рецепторах. Авторы настоящего изобретения идентифицировали несколько новых сайтов связывания во вкусовом рецепторе, которые связываются с эталонными белками и модифицированными белками.
Модифицированный белок основан на эталонном белке (аминокислотной последовательности), и поэтому следует отметить, что любой признак/свойство/характеристика, описанные в данном документе в отношении модифицированного белка, представлены относительно соответствующего эталонного белка.
Как описано в данном документе, модифицированный белок содержит аминокислотную последовательность, содержащую по меньшей мере одну, по меньшей мере две, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть, по меньшей мере десять, по меньшей мере пятнадцать, в по меньшей мереосемнадцать аминокислотных замен по сравнению с эталонным белком (эталонной аминокислотной последовательностью).
В некоторых вариантах осуществления модифицированный белок содержит по меньшей мере две, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть, по меньшей мере десять, по меньшей мере пятнадцать, в по меньшей мереосемнадцать аминокислотных замен по сравнению с эталонным белком (эталонной аминокислотной последовательностью).
В некоторых вариантах осуществления модифицированный белок содержит по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть, по меньшей мере десять, по меньшей мере пятнадцать, по меньшей мере восемнадцать аминокислотных замен по сравнению с эталонным белком (эталонной аминокислотной последовательностью).
В некоторых вариантах осуществления модифицированный белок содержит от одной до двадцати аминокислотных замен по сравнению с эталонным белком (эталонной аминокислотной последовательностью), иногда от двух до десяти аминокислотных замен, иногда от трех до десяти аминокислотных замен, иногда от трех до шести аминокислотных замен.
В некоторых вариантах осуществления модифицированный белок содержит по меньшей мере одну, по меньшей мере две, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть, по меньшей мере десять, по меньшей мере пятнадцать, по меньшей мере восемнадцать аминокислотных замен по сравнению с эталонным белком (эталонной аминокислотной последовательностью), выбранным из группы, состоящей из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13 и SEQ ID NO:14.
В некоторых вариантах осуществления модифицированный белок содержит по меньшей мере одну, по меньшей мере две, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть, по меньшей мере десять, по меньшей мере пятнадцать, по меньшей мере восемнадцать аминокислотных замен по сравнению с эталонным белком, представленным под SEQ ID NO:5.
В некоторых вариантах осуществления модифицированный белок содержит по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть, по меньшей мере десять, по меньшей мере пятнадцать, по меньшей мере восемнадцать аминокислотных замен по сравнению с эталонным белком, представленным под SEQ ID NO:5.
В некоторых вариантах осуществления модифицированный белок содержит по меньшей мере одну, по меньшей мере две, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть, по меньшей мере десять, по меньшей мере пятнадцать, по меньшей мере восемнадцать аминокислотных замен по сравнению с эталонным белком, представленным под SEQ ID NO:1.
В некоторых вариантах осуществления модифицированный белок содержит по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере шесть, по меньшей мере десять, по меньшей мере пятнадцать, по меньшей мере восемнадцать аминокислотных замен по сравнению с эталонным белком, представленным под SEQ ID NO:1.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, которая на 40-99% идентична аминокислотной последовательности эталонного белка. В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, которая на 90-99% идентична эталонной аминокислотной последовательности.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, которая на 60-90% идентична эталонной аминокислотной последовательности. В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, которая на 70-90% идентична эталонной аминокислотной последовательности.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, характеризующуюся по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 99% идентичностью с аминокислотными последовательностями, выбранными из группы, состоящей из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13 и SEQ ID NO:14.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, характеризующуюся по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 99% идентичностью с аминокислотными последовательностями, представленными под SEQ ID NO:5.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, характеризующуюся по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 99% идентичностью с аминокислотными последовательностями, представленными под SEQ ID NO:1.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, характеризующуюся 60-99% идентичностью с аминокислотными последовательностями, выбранными из группы, состоящей из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13 и SEQ ID NO:14.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, характеризующуюся 90-99% идентичностью с аминокислотными последовательностями, выбранными из группы, состоящей из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13 и SEQ ID NO:14.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, характеризующуюся 90-99% идентичностью с аминокислотными последовательностями, представленными под SEQ ID NO:5.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, характеризующуюся 80-99% идентичностью с аминокислотными последовательностями, представленными под SEQ ID NO:1.
Значение % идентичности двух или более аминокислотных последовательностей определяют для двух или более последовательностей при сравнении и выравнивании до максимального соответствия. В контексте настоящего изобретения считается, что последовательности (аминокислотные), описанные в настоящем документе, характеризующиеся % идентичностью, имеют ту же функцию/активность, что и эталонная последовательность, по отношению к которой рассчитана идентичность.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, которая является на 40-99% сходной с аминокислотной последовательностью эталонного белка. В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, которая является на 90-99% сходной с эталонной аминокислотной последовательностью.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, которая является на 60-90% сходной с эталонной аминокислотной последовательностью. В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, которая является на 70-90% сходной с эталонной аминокислотной последовательностью.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, характеризующуюся по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 99% сходством с аминокислотными последовательностями, выбранными из группы, состоящей из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13 и SEQ ID NO:14.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, характеризующуюся по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 99% сходством с аминокислотными последовательностями, представленными под SEQ ID NO:5.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, характеризующуюся по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 99% сходством с аминокислотными последовательностями, представленными под SEQ ID ΝΟ:1.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, характеризующуюся 60-99% сходством с аминокислотными последовательностями, выбранными из группы, состоящей из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13 и SEQ ID NO:14.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, характеризующуюся 90-99% сходством с аминокислотными последовательностями, выбранными из группы, состоящей из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13 и SEQ ID NO:14.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, характеризующуюся 90-99% сходством с аминокислотными последовательностями, представленными под SEQ ID NO:5.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, характеризующуюся 80-99% сходством с аминокислотными последовательностями, представленными под SEQ ID ΝΟ:1.
Сходство последовательностей или гомология последовательностей, как используется в данном документе, относится к количеству (%) аминокислот, сохраняющих сходные физико-химические свойства, например лейцин и изолейцин.
При определении идентичности последовательностей гэпы не учитывают, и идентичность последовательностей определяют относительно более короткой последовательности из двух. В связи с этим следует отметить, что длина эталонного белка (аминокислотной последовательности) может быть такой же, как у модифицированного белка (аминокислотной последовательности), или может отличаться от длины модифицированного белка (аминокислотной последовательности).
Термины "аминокислотная последовательность" и/или "полипептидная цепь" используются для описания белка, содержащего аминокислотную последовательность или полипептидную цепь. Таким образом, термин "эталонный белок" эквивалентен термину "эталонная аминокислотная последовательность", а термин "модифицированный белок" эквивалентен термину "модифицированная аминокислотная последовательность". Следует отметить, что термины "аминокислотная последовательность" и/или "полипептидная цепь" охватывают последовательности, имеющие трехмерную структуру, а также последовательности без трехмерной структуры.
В рамках процесса вычислительной оптимизации модифицированные белки могут быть выбраны из большой выходной совокупности аминокислотных последовательностей после вычислительного, биоинформатического или структурного биологического анализа, на основе соображений, касающихся энергии, т.е. те последовательности, которые характеризуются низкой энергией.
Энергетические расчеты можно применять ко всей аминокислотной последовательности или, альтернативно, ограничиваясь различными областями или выбранными аминокислотами в пределах всей аминокислотной. В последнем случае (различные области или выбранные аминокислоты) информацию можно подвергнуть интегрированию с получением показателя для всего белка.
Расчет каждой из аминокислотных последовательностей (например, модифицированного белка) может быть выполнен путем комбинирования физических и статистических потенциалов, например с использованием единицы энергии проекта Rosetta (REU). Единица энергии проекта Rosetta (REU) представляет собой алгоритм программного обеспечения Rosetta, которое представляет собой пакет алгоритмов для вычислительного моделирования и анализа структур белков. Программное обеспечение Rosetta делает возможным осуществление заметных научных достижений в области вычислительной биологии, включая конструирование белков de novo, конструирование ферментов, стыковку лигандов и предсказание структуры биологических макромолекул и макромолекулярных комплексов. Энергетическая функция Rosetta представляет собой комбинацию физических и статистических потенциалов, которая не соответствует никаким реальным физическим единицам энергии. Значения энергии проекта Rosetta имеют произвольный масштаб и иногда называются REU ("единица энергии проекта Rosetta").
В некоторых вариантах осуществления REU можно рассчитать для всей белковой последовательности, содержащей по меньшей мере одну аминокислотную замену. В некоторых других вариантах осуществления REU можно рассчитать по меньшей мере для одной области, содержащей по меньшей мере одну аминокислотную замену, во всей белковой последовательности. В некоторых других вариантах осуществления REU можно рассчитать по меньшей мере для одной аминокислотной замены во всей белковой последовательности.
В некоторых вариантах осуществления модифицированный белок имеет энергию ниже -190, при представлении в REU. В некоторых вариантах осуществления модифицированный белок имеет энергию приблизительно -190, при представлении в REU. В некоторых вариантах осуществления модифицированный белок имеет энергию приблизительно -195, при представлении в REU. В некоторых вариантах осуществления модифицированный белок имеет энергию ниже -195, при представлении в REU. В некоторых вариантах осуществления модифицированный белок имеет энергию ниже -196, при представлении в REU. В некоторых вариантах осуществления модифицированный белок имеет энергию ниже -197, при представлении в REU. В некоторых вариантах осуществления модифицированный белок имеет энергию ниже -198, при представлении в REU. В некоторых вариантах осуществления модифицированный белок имеет энергию приблизительно -198, при представлении в REU. В некоторых вариантах осуществления модифицированный белок имеет энергию ниже -198,4, при представлении в REU. В некоторых вариантах осуществления модифицированный белок имеет энергию ниже -200, при представлении в REU. В некоторых вариантах осуществления модифицированный белок имеет энергию ниже -206,4, при представлении в REU. В некоторых вариантах осуществления модифицированный белок имеет энергию ниже -210, при представлении в REU. В некоторых вариантах осуществления модифицированный белок имеет энергию ниже -214,6, при представлении в REU.
В некоторых вариантах осуществления модифицированный белок имеет энергию ниже -270,11, при представлении в REU. В некоторых вариантах осуществления модифицированный белок имеет энергию ниже -300, при представлении в REU. В некоторых вариантах осуществления модифицированный белок имеет энергию ниже -350, при представлении в REU. В некоторых вариантах осуществления модифицированный белок имеет энергию ниже -400, при представлении в REU. В некоторых вариантах осуществления модифицированный белок имеет энергию ниже -410, при представлении в REU. В некоторых вариантах осуществления модифицированный белок имеет энергию ниже -418, при представлении в REU. В некоторых вариантах осуществления модифицированный белок имеет энергию ниже -420, при представлении в REU. В некоторых вариантах осуществления модифицированный белок имеет энергию ниже -430, при представлении в REU. В некоторых вариантах осуществления модифицированный белок имеет энергию ниже -433, с в REU.
В некоторых вариантах осуществления модифицированный белок имеет энергию от -190 в REU до приблизительно -214,6, при представлении в REU. В некоторых других вариантах осуществления модифицированный белок имеет энергию, составляющую от -195, при представлении в REU, до приблизительно -214,6, при представлении в REU. В некоторых других вариантах осуществления модифицированный белок имеет энергию, составляющую от -197, при представлении в REU, до приблизительно -214,6, при представлении в REU.
Как описано в данном документе, модифицированный белок может быть получен в результате аминокислотных замен в различных областях белка. "Области белка",, как используется в данном документе, относятся к аминокислотной последовательности или структурному мотиву, которые являются частью белковой последовательности (аминокислотной последовательности) или структуры белка. Неограничивающие примеры областей белка включают поверхность белка, сердцевину белка, петлевую область белка, область кэпирования вторичной структуры, дисульфидную область, область сайта связывания, линкерную область, область гидрофобного участка или гидрофобную область белка.
Аминокислотная замена в эталонном белке не ограничивается конкретной областью или последовательностью белка. Области эталонного белка, которые могут содержать аминокислотные замены, могут включать поверхность эталонного белка, гидрофобную сердцевину эталонного белка или области эталонного белка, называемые петлевыми областями, края вторичных структур (также называемые областями кэпирования вторичной структуры), дисульфидные области, области сайта связывания, линкерные области, области гидрофобного участка.
В некоторых вариантах осуществления замена в эталонном белке может быть осуществлена в ограниченной области в структуре и/или последовательности эталонного белка. В некоторых вариантах осуществления замена в эталонном белке может осуществляться в области поверхности. В некоторых вариантах осуществления замена в эталонном белке может осуществляться в области сердцевины. В некоторых вариантах осуществления замена в эталонном белке может осуществляться в области дисульфидных связей. В некоторых вариантах осуществления замена в эталонном белке может осуществляться в петлевых областях. В некоторых вариантах осуществления два или более аминокислотных замещений расположены на поверхности эталонного белка.
В некоторых вариантах осуществления замена в эталонном белке может быть осуществлена в ограниченной области, которая не находится в зоне, прилегающей к предсказанному или известному сайту связывания эталонного белка с рецептором. В данном контексте "прилегающий" может означать на расстоянии 4-7 А от поверхности связывания.
В некоторых вариантах осуществления замена в эталонном белке может быть осуществлена в различных областях в структуре и/или последовательности эталонного белка. В некоторых вариантах осуществления замена в эталонном белке быть осуществлена в по меньшей мере области поверхности, в области сердцевины, в области дисульфидных связей или в петлевых областях и в любой их комбинации.
Область поверхности белка, как используется в данном документе, представляет собой площадь с частичной или полной доступностью для растворителя (SASA - доступная для растворителя площадь поверхности). Область сердцевины белка, как используется в данном документе, представляет собой площадь, недоступную для растворителя, с относительной SASA (доступной для растворителя площадью поверхности) аминокислот, составляющей менее 50% или, для внутренней сердцевины, менее 20%.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, которая характеризуется 10-99%, иногда 20-99%, иногда 30-99%, иногда 40-99%, иногда 50-90%, иногда 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% идентичностью в области поверхности относительно области поверхности эталонной аминокислотной последовательности.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, которая характеризуется 10-99%, иногда 20-99%, иногда 30-99%, иногда 40-99%, иногда 50-90%, иногда 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% сходством в области поверхности относительно области поверхности эталонной аминокислотной последовательности.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, которая характеризуется 10-99%, иногда 20-99%, иногда 30-99%, иногда 40-99%, иногда 50-90%, иногда 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% идентичностью в области гидрофобной сердцевины (гидрофобного участка) относительно области гидрофобной сердцевины (гидрофобного участка) эталонной аминокислотной последовательности.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, которая характеризуется 10-99%, иногда 20-99%, иногда 30-99%, иногда 40-99%, иногда 50-90%, иногда 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% сходством в области гидрофобной сердцевины (гидрофобного участка) относительно области гидрофобной сердцевины (гидрофобного участка) эталонной аминокислотной последовательности.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, содержащую от трех (3) до сорока (40) аминокислотных замен, от 4 до 30, от 5 до 30 аминокислотных замен в области поверхности по сравнению с областью поверхности эталонной аминокислотной последовательности.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, содержащую по меньшей мере одну (1), две (2), три (3), по меньшей мере 4, по меньшей мере 5, по меньшей мере 6, по меньшей мере 10, по меньшей мере 15, по меньшей мере 18, по меньшей мере 20, по меньшей мере 25 или 30 аминокислотных замен в области поверхности по сравнению с областью поверхности эталонной аминокислотной последовательности.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, которая характеризуется 20%, 30%, 50%, 80%, 90%, 95%, 98% идентичностью в области сердцевины относительно области сердцевины эталонной аминокислотной последовательности.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, которая характеризуется 20%, 30%, 50%, 80%, 90%, 95%, 98% сходством в области сердцевины относительно области сердцевины эталонной аминокислотной последовательности.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, содержащую от одной до пяти аминокислотных замен в области сердцевины по сравнению с областью сердцевины эталонной аминокислотной последовательности.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, которая характеризуется 90%, 95%, 99% идентичностью в области, которая связывается с рецептором (сайт связывания рецептора), относительно области, которая связывается с рецептором, эталонной аминокислотной последовательности.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность, которая характеризуется 90%, 95%, 99% сходством в сайте связывания рецептора относительно сайта связывания рецептора эталонной аминокислотной последовательности.
В некоторых вариантах осуществления в модифицированном белке замену в сайте связывания рецептора эталонного белка не осуществляют.
В некоторых вариантах осуществления по меньшей мере одну из дисульфидных связей удаляют, и области вокруг них модифицируют посредством 8-20 замен вокруг каждой из удаленных дисульфидных связей.
Аминокислоты в данном документе могут быть обозначены с помощью их общеизвестных трехбуквенных символов или с помощью однобуквенных символов, рекомендованных Комиссией по биохимической номенклатуре IUPAC-IUB. Аминокислотная замена (замещение), как используется в данном документе, относится к изменению одной аминокислоты на другую аминокислоту. Обычно это происходит из-за точечной мутации в последовательности ДНК, вызванной несинонимичной миссенс-мутацией, которая изменяет последовательность кодона так, что он кодирует другую аминокислоту вместо эталонной. Аминокислотное замещение может оказывать эффект в отношении функции или структуры белка, и это обычно зависит от того, насколько сходными или несходными являются замещенные аминокислоты, а также от их положения в последовательности или структуре. Например, аминокислотные замены могут быть осуществлены на основе сходства по полярности, заряду, растворимости, гидрофобности, гидрофильности, объемности (или гибкости), бета-разветвлению, ароматичности, способности создавать специфические связывающие взаимодействия (водородные связи, солевые мостики, полярные и неполярные взаимодействия), рК, способности к связыванию Сахаров и к другим посттрансляционным модификациям и/или амфипатической природе вовлеченных остатков.
В некоторых вариантах осуществления аминокислотные замены могут представлять собой консервативное замещение. Такое замещение предусматривает изменение одной аминокислоты на другую, обладающую аналогичными свойствами. Консервативные аминокислотные замещения (также обозначенные как консервативные аминокислотные "замены" или консервативные аминокислотные мутации) представляют собой аминокислотные замещения в белке, которые меняют данную аминокислоту на другую аминокислоту с аналогичными биохимическими, структурными и/или химическими свойствами.
Например, аминокислоты можно разделить на шесть основных классов на основе их структуры и общих химических характеристик их боковых цепей (R-групп):
алифатические: изолейцин (I), лейцин (L), глицин (G), аланин (А), валин (V);
гидроксил- или серо-/селенсодержащие: серии (S), цистеин (С), треонин (Т), метионин (М);
циклические: пролин (Р);
ароматические: фенилаланин (F), тирозин (Y), триптофан (W);
основные: гистидин (Н), лизин (K), аргинин (R);
кислотные и их амиды: аспартат (D), глутамат (Е), аспарагин (N), глутамин (Q).
Кроме того, каждая из следующих групп включает другие иллюстративные аминокислоты, которые являются консервативными заменами друг для друга:
1) очень малого размера: аланин (А), глицин (G);
2) отрицательно заряженные: аспарагиновая кислота (D), глутаминовая кислота (Е);
3) полярные (амидированная карбоксильная боковая цепь): аспарагин (N), глутамин (Q);
4) положительно заряженные: аргинин (R), лизин (K);
6) ароматические: фенилаланин (F), тирозин (Y), триптофан (W) и иногда также гистидин (Н);
7) полярные малого размера: серии (S), треонин (Т);
8) серосодержащие: цистеин (С), метионин (М);
9) малого размера: аланин (А), глицин (G), серии (S);
10) бета-разветвленные: валин (V), изолейцин (I) и иногда также треонин (Т);
11) полярные: аспарагин (N), глутамин (Q), серии (S), треонин (Т).
Тем не менее, существует множество кластеров аминокислот, дающих многочисленные индексы аминокислот, каждый из которых выделяет различные аспекты характеристик аминокислот например, см. сотни таких индексов в базе данных индексов аминокислот https://www.genome.jp/aaindex/. Следовательно, некоторые из консервативных замещений могут фактически обеспечивать другие признаки, которые важны для пригодности белка для промышленного применения в пищевой промышленности, например неспецифическое связывание с языком или другие аспекты органолептического профиля.
Кроме того, дополнительный анализ консервативности основан на следующем:
- неполярные "гидрофобные" аминокислоты выбраны из группы, состоящей из валина (V), изолейцина (I), лейцина (L), метионина (М), фенилаланина (F), триптофана (W), цистеина (С), аланина. (А), тирозина (Y), гистидина (Н), треонина (Т), серина (S), пролина (Р), глицина (G), аргинина (R) и лизина (K);
- "полярные" аминокислоты выбраны из группы, состоящей из аргинина (R), лизина (K), аспарагиновой кислоты (D), глутаминовой кислоты (Е), аспарагина (N), глутамина (Q);
- "положительно заряженные" аминокислоты выбраны из группы, состоящей из аргинина (R), лизина (K) и гистидина (Н), и
- "кислотные" аминокислоты выбраны из группы, состоящей из аспарагиновой кислоты (D), аспарагина (N), глутаминовой кислоты (Е) и глутамина (Q).
В некоторых вариантах осуществления замещение представляет собой радикальное замещение. Радикальное замещение (замена) представляет собой обмен одной аминокислоты на другую с отличающимися свойствами.
Степень сходства последовательностей и/или идентичности последовательностей эталонного белка и модифицированного белка, как правило, может влиять на свойства модифицированных белков. Например, большое количество замен может влиять на кинетику связывания, кинетику сворачивания, растворимость, термостабильность, стабильность в соленой среде, рН-стабильность, срок хранения, связывание с неводными частицами (например, белком или жиром в пищевой матрице или гидрофобными областями в ротовой полости), на трехмерную структуру, а также на ее активность и связанные свойства. Вычислительные способы, разработанные и применяемые в данном документе, обеспечивают тщательную интерпретацию предполагаемых аминокислотных остатков для обеспечения замены, которая приведет к получению улучшенных модифицированных белков.
В соответствии с некоторыми аспектами эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5. Как показано в примере 1 ниже, CPD-анализ выявил несколько аминокислотных замен, которые были предположительно важны для замен.
Таким образом, в соответствии с некоторыми аспектами настоящее изобретение относится к модифицированному белку, содержащему аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну аминокислотную, где модифицированный белок характеризуется по меньшей мере одним улучшенным пищевым свойством по сравнению с SEQ ID NO:5.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, и аминокислота, подлежащая замене, представляет собой Е2. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, и аминокислота, подлежащая замене, представляет собой 18. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, и аминокислота, подлежащая замене, представляет собой F11. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, и аминокислота, подлежащая замене, представляет собой N14. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, и аминокислота, подлежащая замене, представляет собой G16. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, и аминокислота, подлежащая замене, представляет собой K17. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, и аминокислота, подлежащая замене, представляет собой F18. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, и аминокислота, подлежащая замене, представляет собой V20. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, и аминокислота, подлежащая замене, представляет собой D21. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, и аминокислота, подлежащая замене, представляет собой Е23. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, и аминокислота, подлежащая замене, представляет собой Q28. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, и аминокислота, подлежащая замене, представляет собой R31. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, и аминокислота, подлежащая замене, представляет собой Т33. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, и аминокислота, подлежащая замене, представляет собой N35. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, и аминокислота, подлежащая замене, представляет собой С41. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, и аминокислота, подлежащая замене, представляет собой L62. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, и аминокислота, подлежащая замене, представляет собой V64. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, и аминокислота, подлежащая замене, представляет собой Y65. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, и аминокислота, подлежащая замене, представляет собой S67. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, и аминокислота, подлежащая замене, представляет собой А73. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, и аминокислота, подлежащая замене, представляет собой R84. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, и аминокислота, подлежащая замене, представляет собой F89. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, и аминокислота, подлежащая замене, представляет собой по меньшей мере одну из следующих аминокислот: Е2, I8, F11, N14, G16, K17, F18, V20, D21, Е23, Q28, R31, Т33, N35, С41, L62, V64, S67, А73, R84 или F89.
В некоторых вариантах осуществления по меньшей мере одна аминокислотная замена представляет собой консервативную замену. В некоторых вариантах осуществления по меньшей мере одна аминокислотная замена представляет собой радикальную замену. В некоторых вариантах осуществления заменены две или более аминокислот.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену Е2 на полярную незаряженную аминокислоту. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену E2S, Е3Т, E2N или E2Q.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену 18 на полярную незаряженную аминокислоту или гидрофобную аминокислоту. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену I8T или I8V.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену F11 на заряженную аминокислоту. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену F11D или F11E.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену N14 на заряженную аминокислоту. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену N14K или N14E.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену G16 на гидрофобную аминокислоту. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену G16A.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену K17 на заряженную аминокислоту. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену K17E или K17R.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену F18 на заряженную аминокислоту или гидрофобную аминокислоту. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену F18D.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену V20 на гидрофобную аминокислоту. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену V20A.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену D21 на заряженную аминокислоту. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену D21K, D21R или D21E.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену Е23 на полярную незаряженную аминокислоту или гидрофобную аминокислоту. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену Е23Т или Е23А.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену Q28 на заряженную аминокислоту. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену Q28K.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену R31 на гидрофобную аминокислоту. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену R31V.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену Т33 на гидрофобную аминокислоту. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену T33V.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену N35 на гидрофобную аминокислоту. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену N35V.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену С41 на заряженную аминокислоту или полярную незаряженную аминокислоту. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену C41R или C41S.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену L62 на заряженную аминокислоту или полярную незаряженную аминокислоту. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену L62I.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену V64 L62 на заряженную аминокислоту или полярную незаряженную аминокислоту. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену V64F.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену Y65.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену S67 на полярную незаряженную аминокислоту. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену S67N.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену А73 на гидрофобную аминокислоту. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену A73G.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену R84 на гидрофобную аминокислоту. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену R84L.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену F89 на полярную незаряженную аминокислоту. В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере одну замену F89S.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, содержащий аминокислотную последовательность, представленную под SEQ ID NO:5, и аминокислота, подлежащая замене, представляет собой по меньшей мере одну из следующих аминокислот: Е2, I8, F11, N14, G16, K17, F18, V20, D21, Е23, Q28, R31, Т33, N35, С41, L62, V64, S67, А73, R84 или F89.
Ранее сообщалось о заменах аминокислот в MNEI, включая множественные мутации. Например, Zheng et al. сообщили о новых двойных мутантных белках на основе MNEI с повышенной сладостью и стабильностью. В частности, Zheng et al продемонстрировали, что одиночная замена E2N в MNEI приводит к 3-кратному повышению сладости и небольшому снижению стабильности. Zheng et al. также показали, что введение дополнительной замены, Е23А или Y65R, в дополнение к замене E2N (например, E2N/E23A, E2N/Y65R) не влияет на сладость.
Как описано выше, при CPD-анализе аминокислота Е23 была идентифицирована как важная для стабильности белка. Таким образом, заряженный глутамат в положении 23 (Е23) MNEI, который относительно скрыт, был замещен на гидрофобную аминокислоту.
Как также показано в данном документе в примерах ниже, для модифицированного белка, содержащего три замены в аминокислотах в положениях Е2, Е23 и Y65, неожиданно получили в результате в результате повышение сладости в 6-7 раз и, потенциально, другие улучшенные свойства, такие как органолептический профиль и синергизм с другими ингредиентами (включая другие подсластители, такие как стевия). Без ограничения какой-либо теорией, было высказано предположение, что тройная замена приводит к синергическому эффекту в отношении сладости модифицированного белка. Как также показано ниже, модифицированный белок, содержащий три замены по аминокислотам в положениях Е2, Е23 и Y65, имеет REU в том же диапазоне, что и MNEI, что позволяет предположить, что REU указывает на то, что замены не влияют на стабильность.
Таким образом, в соответствии с некоторыми аспектами настоящее изобретение относится к модифицированному белку, содержащему аминокислотную последовательность, представленную под SEQ ID NO:5, содержащую по меньшей мере три аминокислотные замены по остаткам Е2, Е23 и Y65 в SEQ ID NO:5, где модифицированный белок характеризуется по меньшей мере одним улучшенным пищевым свойством по сравнению с SEQ ID NO:5.
Следует понимать, что в соответствии с такими вариантами осуществления эталонный белок представляет собой MNEI, представленный под SEQ ID NO:5, и сконструированный белок содержит по меньшей мере три замены по аминокислотам Е2, Е23 и Y65 в SEQ ID NO:5.
Каждая из аминокислот Е2, Е23 и Y65 может быть заменена любой аминокислотой. В некоторых вариантах осуществления аминокислотная замена в положении аминокислоты (остатка) Е2 может представлять собой любую из E2R, Е2Н, E2K, E2D, E2S, Е2Т, E2N, E2Q, Е2С, E2G, Е2Р, Е2А, E2V, E2I, E2L, Е2М, E2F, E2Y, E2W. В некоторых вариантах осуществления аминокислотная замена в положении аминокислоты (остатка) Е23 может представлять собой любую из E23R, Е23Н, E23K, E23D, E23S, Е23Т, E23N, E23Q, Е23С, E23G, Е23Р, Е23А, E23V, E23I, E23L, Е23М, E23F, E23Y, E23W. В некоторых вариантах осуществления аминокислотная замена в положении аминокислоты (остатка) Y65 может представлять собой любую из Y65R, Y65H, Y65K, Y65D, Y65E, Y65S, Y65T, Y65N, Y65Q, Y65C, Y65G, Y65P, Y65A, Y65V, Y65I, Y65L, Y65M, Y65F и Y65W.
В некоторых вариантах осуществления по меньшей мере одна, по меньшей мере две или по меньшей мере три из по меньшей мере трех аминокислотных замен в эталонном белке, представляющем собой MNEI, являются консервативной заменой.
В некоторых вариантах осуществления по меньшей мере одна из по меньшей мере трех аминокислот, подлежащих замене, представляет собой аминокислоту Е2, и ее заменяют на заряженный остаток, необязательно на отрицательно заряженную аминокислоту. В некоторых вариантах осуществления по меньшей мере одна из по меньшей мере трех аминокислот, подлежащих замене, представляет собой аминокислоту Е2, и ее заменяют на кислотный остаток. В некоторых вариантах осуществления по меньшей мере одна из по меньшей мере трех аминокислот, подлежащих замене, представляет собой аминокислоту Е2, и ее заменяют на полярный остаток. В некоторых вариантах осуществления по меньшей мере одна из по меньшей мере трех аминокислот, подлежащих замене, представляет собой E2N, E2D, E2Q, E2R или E2K. В некоторых вариантах осуществления по меньшей мере одна из по меньшей мере трех аминокислот, подлежащих замене, представляет собой E2N, E2D или E2Q. В некоторых вариантах осуществления по меньшей мере одна из по меньшей мере трех аминокислот, подлежащих замене, представляет собой E2N.
В некоторых вариантах осуществления по меньшей мере одна из по меньшей мере трех аминокислот, подлежащих замене, представляет собой аминокислоту Е23, и ее заменяют на заряженный остаток, необязательно на отрицательно заряженную аминокислоту. В некоторых вариантах осуществления по меньшей мере одна из по меньшей мере трех аминокислот, подлежащих замене, представляет собой аминокислоту Е23, и ее заменяют на кислотный остаток. В некоторых вариантах осуществления по меньшей мере одна из по меньшей мере трех аминокислот, подлежащих замене, представляет собой аминокислоту Е23, и ее заменяют на полярный остаток. В некоторых вариантах осуществления по меньшей мере одна из по меньшей мере трех аминокислот, подлежащих замене, представляет собой E23N, E23D, E23Q, E23R или E23K. В некоторых вариантах осуществления по меньшей мере одна из по меньшей мере трех аминокислот, подлежащих замене, представляет собой E23N, E23D или E23Q.
В некоторых вариантах осуществления по меньшей мере одна из по меньшей мере трех аминокислот, подлежащих замене, представляет собой аминокислоту Y65, и ее заменяют на ароматический остаток. В некоторых вариантах осуществления по меньшей мере одна из по меньшей мере трех аминокислот, подлежащих замене, представляет собой аминокислоту Y65, и ее заменяют на неполярный гидрофобный остаток. В некоторых вариантах осуществления по меньшей мере одна из по меньшей мере трех аминокислот, подлежащих замене, представляет собой Y65F, Y65W, Y65H, Y65V, Y65I, Y65L, Y65M, Y65C, Y65A, Y65T, Y65S, Y65P, Y65G, Y65K и Y65R. В некоторых вариантах осуществления по меньшей мере одна из по меньшей мере трех аминокислот, подлежащих замене, представляет собой Y65K и Y65R.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, и по меньшей мере одна из по меньшей мере трех аминокислотных замен выбрана из группы, состоящей из E2N, E2D, E2Q, E2R, E2K, E23N, E23D, E23Q, E23R, E23K, Y65F, Y65W, Y65H, Y65V, Y65I, Y65L, Y65M, Y65C, Y65A, Y65T, Y65S, Y65P, Y65G, Y65K и Y65R.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, и по меньшей мере три замены выбраны из группы, состоящей из E2N, E23V, E23A, Y65K и Y65R.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, и по меньшей мере три замены представляют собой E2N, E23V и Y65K.
В некоторых вариантах осуществления эталонный белок представляет собой MNEI, и по меньшей мере три замены представляют собой E2N, Е23А и Y65R.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность:
GNWEIIDIGPFTQNLGKFAVDEVNKIGQYGRLTFNKVIRPCMKKTIYENEGFREIKGYEYQLYVKASDKLFRADISEDYKTRGRKLLRFNGPVPPP (SEQ ID NO:16). SEQ ID NO:16 обозначена в данном документе как DM08.
В некоторых вариантах осуществления модифицированный белок содержит аминокислотную последовательность:
GNWEIIDIGPFTQNLGKFAVDEANKIGQYGRLTFNKVIRPCMKKTIYENEGFREIKGYEYQLYVRASDKLFRADISEDYKTRGRKLLRFNGPVPPP (SEQ ID NO:17). SEQ ID NO:17 обозначена в данном документе как DM09.
В соответствии с некоторыми аспектами эталонный белок содержит аминокислотную последовательность, представленную под SEQ ID ΝΟ:1. Как показано в примере 2 ниже, CPD-анализ выявил несколько аминокислотных замен, которые были предположительно важны для замен.
Таким образом, в соответствии с некоторыми аспектами настоящее изобретение относится к модифицированному белку, содержащему аминокислотную последовательность, представленную под SEQ ID ΝΟ:1, содержащую по меньшей мере одну аминокислотную, где модифицированный белок характеризуется по меньшей мере одним улучшенным пищевым свойством по сравнению с SEQ ID NO:1.
В некоторых вариантах осуществления эталонный белок содержит аминокислотную последовательность, представленную под SEQ ID ΝΟ:1, и аминокислота, подлежащая замене, представляет собой по меньшей мере одну из следующих аминокислот: A1, Т2, F3, Е4, V, R8, S10, Q30, N32, S33, Е35, S36, W37, Т38, 139, N40, А52, А88, N93, I100, N104, М112, N113, F114, S115, Τ117, Τ118, R119, V124, R125, Α127, Α128, D129, V131, G132, Q133, Α136, Κ137, Κ139, Α140, G142, Α148, F152, Τ154, Υ157, G165, Ρ166, Ε168, Υ169, R171, L176, D179, V191, S196, S197, N198, R200, Τ202, Τ206 или Α207.
Как описано в данном документе, описанный в данном документе модифицированный белок обладает улучшенными пищевыми свойствами. Профиль сладости белка, например подслащивающая способность (вкусо-ароматические свойства по сравнению с сахаром), отсутствие привкуса, сокращение времени до появления вкуса и уменьшение стойкости вкуса, модифицированного белка может быть определен с помощью любого известного вкусового теста, известного в данной области техники. Например, сравнение сладости сахарозы или других подсластителей может быть выполнено дегустационной комиссией, и подслащивающая способность может быть оценена, как подробно описано в примерах ниже.
Сравнение может осуществляться путем определения порогового значения модифицированного белка по сравнению с известным подсластителем, таким как сахароза, например, путем определения минимальной концентрации, необходимой для появления ощущения сладости, или путем оценки профиля сладости, включая такие характеристики, как профиль сладости, время до появления ощущения сладости, стойкость вкуса, создаваемое во рту ощущение, послевкусие, привкус и маскировка нежелательных вкусов.
Используемый в данном документе термин "свойства, влияющие на подслащивание" охватывает ощущение сладости, определяемое по меньшей мере одним из порога восприятия сладости, составляющего приблизительно 0,28 мг/л или выше, продолжительности сладости, составляющей приблизительно от 1 до 20 секунд, иногда от 2 до 18 секунд, иногда от 2 до 4 секунд.
Модифицированный белок, сходный с эталонным белком, связывается с рецептором сладкого.
В некоторых вариантах осуществления модифицированный белок характеризуется порогом восприятия сладости, который в 300-16000 раз выше, чем у сахара в пересчете на вес.
Органолептический профиль включает кинетику ощущения вкуса, которая обычно характеризуется гауссовским распределением значений интенсивности вкуса с течением времени, т.е. продолжительность периода до появления вкуса (время до ощущения вкуса), продолжительность ощущения вкуса и время сохранения стойкости вкуса (соответствует "хвосту" гауссовского распределения). Дополнительные признаки включают привкус (например, из-за связывания с другими рецепторами), округлость вкуса, металлический и другие побочные вкусы, синергизм с другими ингредиентами (например, маскировка и усиление других вкусо-ароматических веществ или их нежелательных вкусов, таких как вкус стевии) и тому подобное.
В некоторых вариантах осуществления модифицированный белок характеризуется тем, что по меньшей мере одно из следующего является таким же или лучшим относительно такового у эталонного белка: (1) структурная термостабильность (2) функциональная термостабильность, (3) pH-стабильность (4) растворимость в воде или частично водной среде (например, пищевые продукты, содержащие жир) или (5) стабильность при хранении.
В некоторых вариантах осуществления модифицированный белок характеризуется структурной термостабильностью, являющейся такой же или лучшей относительно термостабильности эталонного белка.
Используемый в данном документе термин "структурная термостабильность" или "термостабильность" относится к способности модифицированного белка сохранять свою трехмерную структуру при температурах выше тех, что может переносить эталонный белок. Стабильность трехмерной структуры белка можно измерить любым способом, известным в данной области техники, таким как круговой дихроизм (CD), или анализы теплового сдвига, такие как дифференциальная сканирующая флуориметрия (DSF) или дифференциальная сканирующая калориметрия (DSC). Трехмерная структура белка может оказывать эффект в отношении функции белка. Примечательно, что срок хранения и термостабильность, необходимые для пищевых продуктов и напитков, могут быть связаны со структурной термостабильностью и состоят из различных измеримых показателей, например пастеризация может применяться в соответствии с разными протоколами и связана со стойкостью к нагреванию в виде сохранения структуры белка в течение очень короткого времени.
В некоторых вариантах осуществления модифицированный белок характеризуется функциональной термостабильностью, являющейся такой же или лучшей относительно таковой эталонного белка. Используемый в данном документе термин "функциональная термостабильность" относится к способности модифицированного белка сохранять свою функцию после воздействия высоких температур по сравнению с эталонным белком.
В некоторых вариантах осуществления модифицированный белок по настоящему изобретению может сохранять эффект сладости при более высокой температуре или после воздействия более высокой температуры в течение времени, которое может быть ограниченным. Другими словами, не происходит ощутимого изменения профиля сладости или органолептического профиля после воздействия на продукт температуры выше комнатной температуры, иногда до 50°С, иногда до 100°С или даже до 150°С. Функцию белка, например сладость, можно измерить с помощью тестов, основанных на ощущениях.
В некоторых вариантах осуществления модифицированный белок характеризуется рН-стабильностью, являющейся такой же или лучшей относительно таковой эталонного белка,. рН-стабильность относится к стабильности модифицированного белка в более широком диапазоне рН по сравнению с эталонным белком, а именно модифицированный белок сохраняет трехмерную структуру и/или функцию после воздействия на продукт любого значения рН от 3 до 8, иногда значения рН от 4 до 8. Например, такая содовая вода, как кола, характеризуется значением рН 2,3-2,5, при этом некоторые сладкие белки являются нестабильными и теряют функциональность сразу или по истечении времени, которое короче обычного срока хранения напитка.
В некоторых вариантах осуществления модифицированный белок характеризуется более высокой растворимостью, чем у эталонного белка. Растворимость может представлять собой растворимость в водной, частично водной или неводной среде, такой как пищевые продукты, содержащие жир.
В некоторых вариантах осуществления модифицированный белок характеризуется более продолжительным сроком хранения, чем у эталонного белка. Более продолжительный срок хранения означает отсутствие ощутимого изменения сладости (функции) или физической порчи продукта, содержащего композицию, (например, изменения цвета, разделения фаз и т.д.) после воздействия на продукт любой температуры до 150°С, иногда любой температуры от 4°С до 150°С или до 100°С.
В некоторых других вариантах осуществления модифицированный белок характеризуется тем, что по меньшей мере одно из следующего является таким же или лучшим относительно такового у эталонного белка: (1) кинетика сворачивания; (2) профиль посттрансляционной модификации (например, гликозилирования) белка отличается от такового у эталонного белка; (3) количество дисульфидных связей является меньшим относительно такового у эталонного белка.
В некоторых вариантах осуществления модифицированный белок характеризуется кинетикой сворачивания, являющейся такой же или лучшей относительно таковой у эталонного белка. А именно, скорость сворачивания белка из развернутой или частично свернутой структуры является более высокой (по оценке in silico, например с помощью молекулярной динамики, или с помощью экспериментальных способов in vitro или in vivo). Альтернативно, более быстрая кинетика сворачивания также относится к более медленной кинетике разворачивания в экспериментах по денатурации, например с помощью титрования денатурирующим средством (например, гуанидиния хлоридом и/или мочевиной с высокой концентрацией) или других способов.
В некоторых вариантах осуществления в оцениваемом организме-хозяине модифицированный белок характеризуется экспрессией с выходом, являющимся таким же или более высоким относительно такового в случае эталонного белка.
В некоторых вариантах осуществления модифицированный белок имеет показатель PI от 7,8 до 8,4.
Описанный в данном документе модифицированный белок, характеризующийся сладким вкусом, а также потенциально другими вкусовыми эффектами (маскировка нежелательных вкусов, меньшее послевкусие, менее стойкий вкус, меньший привкус, менее продолжительное время до появления вкуса, вкус умами), можно применять в качестве подсластителя в получении продукта для перорального приема.
Модифицированный белок можно использовать в качестве средства для модификации вкусо-ароматических свойств или средства, усиливающего вкусо-ароматические свойства.
Описанный в данном документе белок предназначен для применения в качестве перорального продукта. В некоторых вариантах осуществления продукт представляет собой пищевой продукт, продукт на основе пищевой добавки или лекарственный препарат. Для получения продукта описанные в данном документе белки могут быть объединены с любой пищевой добавкой. Пищевой продукт может быть предусмотрен и применяться в любой твердой сухой форме, включая без ограничения мелкодисперсный порошок, лиофилизат, гранулят, таблетки и т.д. В некоторых вариантах осуществления композиция предусмотрена в жидкой форме, например в виде растворенного в воде вещества (водного раствора).
Продукт, содержащий белки, может иметь различные применения. Это включает без ограничения (каждое из следующего представляет собой отдельный вариант осуществления настоящего изобретения) применение в качестве подсластителя, вкусо-ароматического вещества, усилителя или маскирующего средства в промышленности пищи и напитков (безалкогольные напитки, готовые к употреблению напитки, сиропы, функциональные напитки, спортивные напитки и т.д.), в молочной промышленности, т.е. в молочных продуктах, йогуртах ипудингах, в фармацевтической промышленности, в натуропатической промышленности, в нутрицевтической промышленности и в других продуктах медицинского назначения (например, зубной пасте, средстве для полоскания рта); в промышленности конфет и жевательных резинок или любое другое применение, которое требует применения композиции для модификации вкусо-ароматических свойств в качестве вспомогательного вещества или добавки.
Продукт может содержать дополнительные пищевые ингредиенты. В некоторых вариантах осуществления пищевой ингредиент представляет собой подсластитель, например стевию. Как показано в примерах ниже, комбинация описанного в данном документе модифицированного белка и стевии дает синергический эффект. Таким образом, в некоторых вариантах осуществления продукт содержит по меньшей мере один модифицированный белок, представленный под SEQ ID NO:16 или SEQ ID NO:17, и стевию.
Следует отметить, что модифицированные белки согласно настоящему изобретению могут быть получены любым способом, известным в данной области техники, например белок может быть получен синтетическим путем, с помощью технологии рекомбинантной ДНК или путем продуцирования белка в микроорганизмах с помощью ферментеров, в растениях или в растительном каллюсе или в других биореакторах. В некоторых вариантах осуществления модифицированные белки могут продуцироваться бактериями, такими как Е. coli. В некоторых других вариантах осуществления модифицированные белки могут продуцироваться дрожжами, такими как Saccharomyces cerevisiae или Pichia pastoris. В некоторых вариантах осуществления последовательность ДНК выбранной аминокислотной последовательности оптимизирована на уровнях РНК и ДНК. На уровне РНК это включает минимизацию вторичных структур РНК для обеспечения быстрого встраивания в рибосому. На уровне ДНК это включает оптимизацию кодонов для организма-хозяина (с учетом оптимизации на уровне РНК). Оптимизация частоты использования кодонов обеспечивает предпочтительное использование тРНК, преобладающей в организме-хозяине, для каждой экспрессируемой аминокислоты.
Что касается вышеизложенного, следует понимать, что процентные значения, если они предусмотрены, такие как, например, 10%, 50%, 120%, 500% и т.д., являются взаимозаменяемыми со значениями "кратного изменения", т.е. 0,1, 0,5, 1,2, 5 и т.д. соответственно.
Все используемые в данном документе научные и технические термины имеют значения, обычно используемые в данной области техники, если не указано иное. Приведенные в данном документе определения предназначены для облегчения понимания некоторых выражений, часто применяемых в данном документе, и не предназначены для ограничения объема настоящего изобретения.
Используемый в данном документе термин "приблизительно" относится к ±10%. Термины "содержит", "содержащий", "включает", "включающий", "имеющий" и родственные им слова означают "включая без ограничения". Термин "состоящий по существу из" означает, что композиция, способ или структура могут включать дополнительные ингредиенты, стадии и/или части, но только в том случае, если дополнительные ингредиенты, стадии и/или части не обеспечивают существенного изменения основных и новых характеристик заявленных состава, способа или структуры. Используемый в данном документе термин "приблизительно" описывает значения, которые могут отклоняться выше или ниже от указанного значения на значение, составляющее не более 1%, более конкретно 5%, более конкретно 10%, более конкретно 15%, а в некоторых случаях до 20%, при этом диапазон отклонения включает целые числа, а также, если применимо, нецелые числа, составляющие непрерывный диапазон.
Следует отметить, что используемые в настоящем описании и прилагаемой формуле изобретения формы единственного числа включают определяемые объекты во множественном числе, если из контекста явно не следует иное.
НЕОГРАНИЧИВАЮЩИЕ ПРИМЕРЫ
Пример 1. Конструирование и определение характеристик белков на основе MNEI.
Пример 1А. Конструирование белков на основе MNEI
Конструирование белков на основе MNEI выполняли следующим образом. Одноцепочечный монеллин, MNEI, представляет собой полипептид, состоящий из 96 аминокислот, с молекулярной массой ~11 кДа и pI ~8,7. MNEI представлен под SEQ ID NO:5.
Вычислительные способы
Как описано выше, вычислительный анализ и анализ людьми-экспертами обеспечивает сокращение пространства вариантов последовательностей, которые могут быть дополнительно проанализированы с помощью вычислительных методик, или экспертом, или экспериментально, или с помощью комбинации этих способов. Такой анализ могут применять в отношении отдельных аминокислот, кластеров аминокислот или других комбинаций.
Во ходе процесса CPD допускались аминокислотные замещения в определенных областях, которые менее склонны быть частью сайта связывания с рецептором, например вокруг спирали и недоступной стороны бета-листа, который формирует сердцевину белка. Цикл ROSETTA обеспечил 160 тысяч моделей. После получения значений энергии всех моделей получили график, имеющий форму логит-функции. Логит-функция (также известная как логарифм отношения шансов) представляет собой логарифм шансов p/(1-p), где p представляет собой вероятность. Это обратная сигмоидальная "логистическая" функция.
Для дальнейшего анализа отобрали 5 тысяч моделей с наименьшей энергией. В результате построения графика зависимости количества замещений (по сравнению с MNEI) от REU получили гауссовское распределение, показывающее, что популяции являются нормальными и пригодны для дальнейшего анализа.
Таблица 1 показывает, что в результате CPD, выполненного на конкретных остатках, которые охватывают всю последовательность эталонного белка, были предложены замещения в альфа-спирали, бета-листах и петлях, охватывающих все элементы вторичной структуры MNEI.
Важно отметить, что были выявлены нетривиальные замещения. Например, замещение V64F обусловило введение в бета-лист аминокислоты большого размера, не являющейся аминокислотой бета-листа. Большинство замещений в областях бета-листов приходится на аминокислоты бета-листа для защиты его третичной структуры.
Из таблицы 1 также можно увидеть, что для большинства скрытых положений CPD предлагает замещение на гидрофобные остатки, такие как Leu, Ala или Val. Такие замещения вероятно стабилизируют сердцевину белка и, следовательно, увеличивают стабильность и срок хранения. Тем не менее, в результате CPD действительно получено несколько случаев, где замещения представляют собой замещения на полярные или заряженные остатки (например, N14K). Маловероятно, что такие замещения стабилизируют ядро MNEI. При внимательном рассмотрении кажется, что такие неожиданные замещения могут образовывать водородные связи с другими остатками или с молекулами воды.
В расположенном на поверхности полностью или частично доступном положении чаще всего осуществляется замена на полярные или заряженные остатки, которые могут взаимодействовать с водой и стабилизировать MNEI. Однако бывают непредвиденные случаи, когда CPD предлагает замещение на гидрофобный остаток, например R84L. Такие случаи являются неожиданными и уникальными, и вряд ли их можно объяснить при рассмотрении трехмерной структуры MNEI.
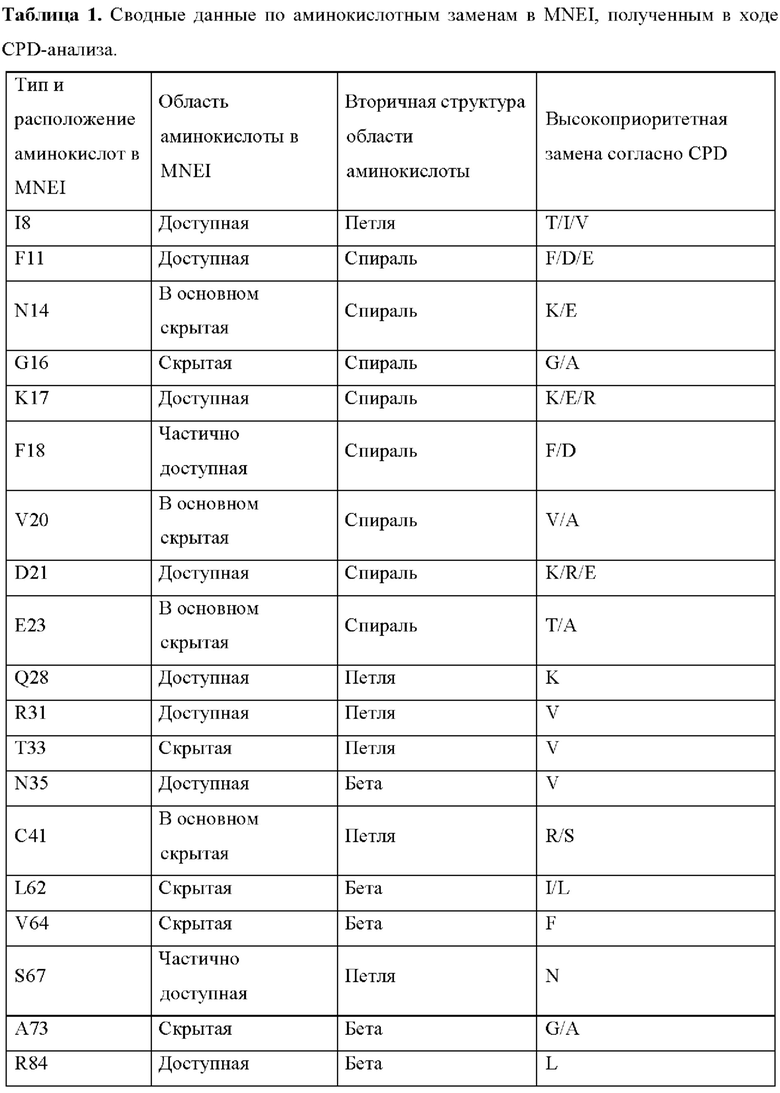

Кроме того, в ходе процесса CPD после анализа белков отбирали определенные аминокислоты, аминокислота Е23 была идентифицирована как остаток, важный для стабильности. Вклад этой аминокислоты отдельно или в комбинации тестировали с помощью CPD. В таблице 2 показаны значения REU этого анализа.
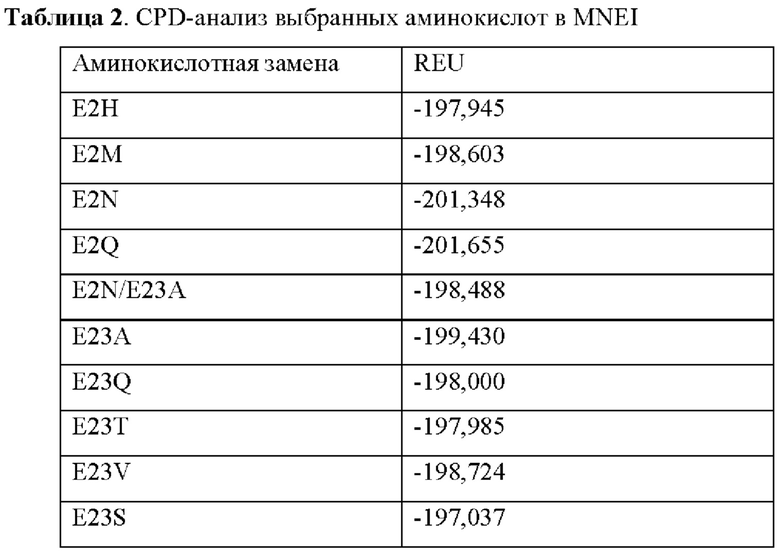
В таблице 3 показана последовательность модифицированных белков на основе MNEI (сконструированные белки), которые конструировали, как подробно описано выше.

Экспрессию белков осуществляли в ферментационной культуре с высокой плотностью объемом 1 л и очищали до уровня>90% с помощью ионообменной хроматографии с последующей эксклюзионной хроматографией.
В таблице 4 показана структурная характеристика новых сконструированных белков.
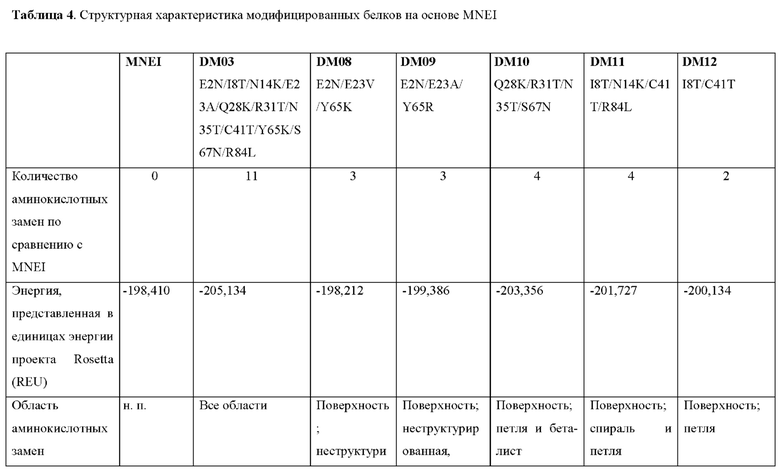
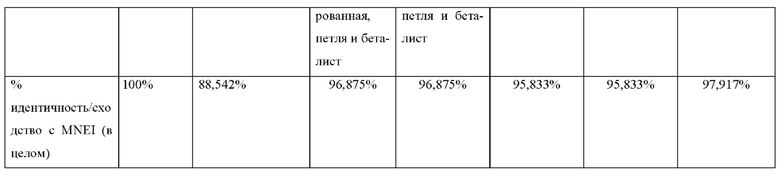
Пример 1В. Органолептическая оценка порога восприятия сладкого вкуса для сконструированных белков на основе MNEI в модельном растворе безалкогольного напитка
Целью данного исследования являлась оценка порога восприятия сладкого вкуса MNEI и новых белков на основе MNEI и расчет порога восприятия вкуса новых белков DM08 и DM10.
Способы
Подслащивающая способность описанных в данном документе белков на основе MNEI по сравнению с сахарозой как правило находится в диапазоне от 1:700 до 1:16000. Таким образом, для целей сравнения растворы MNEI (в качестве эталонного белка) и белков на основе MNEI сначала разбавляли 1:1000 и при необходимости разбавляли дополнительно. В целом порог восприятия сладости сахара в безалкогольных напитках для большинства людей составляет 0,32% - 1,0%. Расчеты концентраций белков на основе MNEI и MNEI (в качестве эталонного белка) выполняли соответственно.
Растворы, которые использовали в данном исследовании, подробно описаны в таблице 5. Растворы получали следующим образом: применимо к каждому раствору, добавляли определенное количество подсластителя (сахарозы/MNEI/сконструированного (модифицированного) белка; более подробно см. в таблице 1), как указано в таблице 3, и доводили раствор до 100 г водой (чтобы получить подсластитель, эквивалентный 1% сахара). В дегустационный стакан наливали 20 мл каждого раствора и каждый образец маркировали для слепого тестирования в соответствии с таблицей 5.
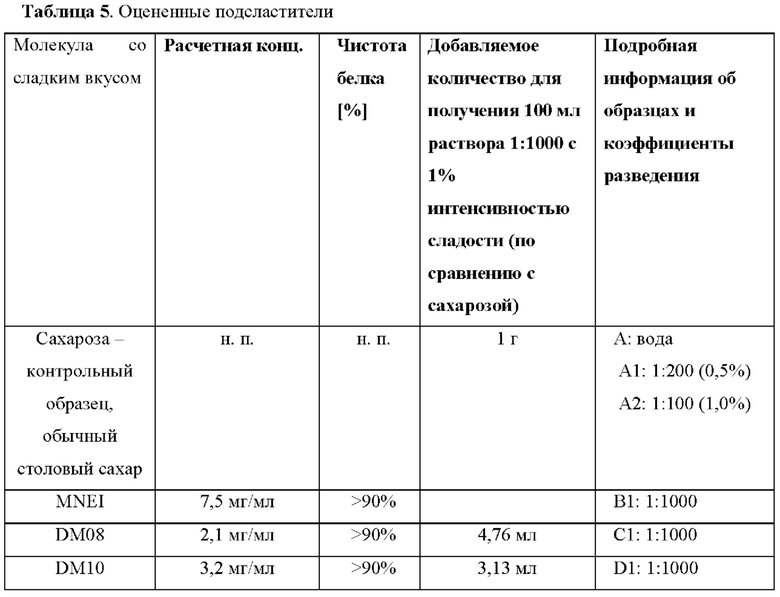
Процедура тестирования
Чтобы оценить порог восприятия сладости для каждого из растворов с заклеенным названием, проводили двойное слепое исследование вкуса. Испытанные образцы включали MNEI, два сконструированных белка на основе MNEI (DM08 и DM10), сахарозу и минеральную воду. Ряд концентраций получили путем разбавления исходного раствора белков минеральной водой (рН 6,9) незадолго до исследования вкуса (таблица 3). В этой сессии приняли участие пять здоровых оценщиков, 2 мужчины и 3 женщины в возрасте 30-50 лет, из которых 3 были обученными дегустаторами.
Образцы объемом двадцать мл тестировали случайным образом, в сравнении с раствором сахара. Перед каждым анализом оценщиков просили прополоскать рот водой и съесть крекер нейтрального вкуса, до исчезновения остаточного вкуса. Испытуемый раствор держали во рту не менее 10 секунд. Затем оценщики оценили образец в соответствии со своей реакцией от 0 до 10:0 - нет восприятия сладкого, 10 - очень сладко.
Порог обнаружения сладости определили как наиболее низкую концентрацию, при которой дегустатор распознавал образец как сладкий. Выраженность сладости сообщают в сравнении с сахарозой.
Результаты и обсуждение
Большинство участников признали 0,5% раствор сахарозы сладким со средней оценкой 0,63±0,6. Средняя оценка для 1% раствора сахарозы составила 1,25±0,9, демонстрируя линейную зависимость доза-ответ (данные не показаны).
Аналогичную картину наблюдали и для MNEI: 0,68±0,2, 0,98±0,4 и 2,2±1,0 для коэффициентов разбавления 1:4000, 1:2000 и 1:1000 соответственно. Эти результаты показали, что порог восприятия сладости MNEI близок к 1:2000, при этом подслащивающая способность составляет приблизительно 2000, что имитирует восприятие 1 0Вх.
Что касается DM08, представляющего собой сконструированный белок на основе MNEI, линейная кривая доза-ответ была также продемонстрирована для диапазона разбавления от 1:12000 до 1:1000, при этом порог восприятия сладости составлял приблизительно 1:12000, при этом подслащивающая способность составляла приблизительно 10000, что имитирует восприятие 1 0Вх.
Для DM10, представляющего собой сконструированный белок на основе MNEI, также была показана линейная кривая с порогом восприятия сладости, близким к 1:1000, и подслащивающей способностью, составляющей приблизительно 1000, что имитирует восприятие 1 0Вх.
На фиг.1 показаны сводные данные по средней оценке сладости растворов, описанных выше.
Пример 1С. Органолептическая оценка порога восприятия сладкого вкуса для MNEI в растворе
Целью данного исследования являлась характеристика сладких сконструированных белков на основе MNEI и оценка порога восприятия сладкого вкуса, который определяли как наиболее низкую концентрацию сладкого вещества, которую можно обнаружить или распознать как сладкую. В данном исследовании протестировали порог восприятия вкуса новых сконструированных белков на основе MNEI: DM09, DM11 и DM 12.
Способы
Как отмечалось выше, подслащивающая способность сладких белков по сравнению с сахаром зависит от состава пищи и обычно находится в диапазоне от 1:700 до 1:3000. Следовательно, растворы сладкого белка сначала разбавляли 1:1000 и при необходимости разбавляли дополнительно.
Порог восприятия сладости сахара в безалкогольных напитках для большинства людей составляет 0,32% - 1,0%. Расчет концентраций MNEI и белков на основе MNEI проводили соответственно.
Растворы, которые использовали в данном исследовании, подробно описаны в таблице 4. Растворы получали следующим образом: в случае каждого раствора добавляли определенное количество подсластителя (сахарозы/MNEI/сконструированного белка; более подробно см. в таблице 1), как указано в таблице 6, и доводили раствор до 100 г водой (чтобы получить подсластитель, эквивалентный 1% сахара). В дегустационный стакан наливали 20 мл каждого раствора и каждый образец маркировали для слепого тестирования в соответствии с таблицей 6.
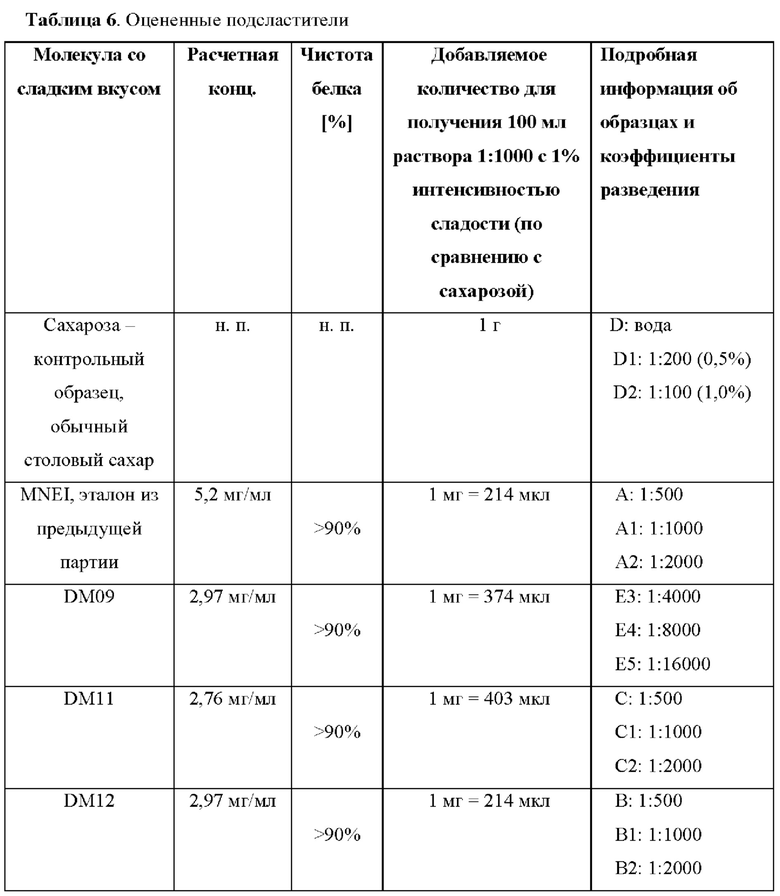
Процедура тестирования
Чтобы оценить порог восприятия сладости для каждого из растворов с заклеенным названием, проводили двойное слепое исследование вкуса. Испытанные образцы включали MNEI, два сконструированных белка на основе MNEI (DM09, DM11 и DM12), сахарозу и минеральную воду. Ряд концентраций получили путем разбавления исходного раствора белков минеральной водой (рН 6,9) незадолго до исследования вкуса (таблица 6). В этой сессии приняли участие шесть здоровых оценщиков, 5 мужчин и 1 женщина в возрасте 30-75 лет, из которых половина являлись обученными дегустаторами.
Порог обнаружения сладости определили как наиболее низкую концентрацию, при которой дегустатор распознавал образец как сладкий. Выраженность сладости сообщают в сравнении с сахарозой.
Образцы объемом двадцать мл тестировали случайным образом, в сравнении с раствором сахара. Перед каждым анализом оценщиков просили прополоскать рот водой и съесть крекер нейтрального вкуса, до исчезновения остаточного вкуса. Испытуемый раствор держали во рту не менее 10 секунд. Затем оценщики оценили образец в соответствии со своей реакцией от 0 до 10: 0 - нет восприятия сладкого, 10 - очень сладко.
Порог обнаружения сладости определили как наиболее низкую концентрацию, при которой дегустатор распознавал образец как сладкий. Выраженность сладости сообщают в сравнении с сахарозой.
Результаты и обсуждение
Сладость воды (контроль) ощущали со средним значением 0,5±0,8. Ненулевое значение может быть связано со эффектами стойкости предыдущих образцов. Все участников признали 0,5% раствор сахарозы сладким со средней оценкой 1,9±0,9. Средняя оценка для 1% раствора сахарозы составила 3,8±1,9, демонстрируя линейную зависимость доза-ответ (фиг.1).
Аналогичную картину наблюдали и для MNEI: 1,0±0,7, 2,5±1,4 и 4,7±3,2 для коэффициентов разбавления 1:2000, 1:1000 и 1:500 соответственно. Эти результаты показывают, что порог восприятия сладости MNEI составляет от 1:1000 до 1:2000, при этом подслащивающая способность, составляющая приблизительно 1000, соответствует раствору сахара 1 0Вх.
Что касается DM11, представляющего собой сконструированный белок на основе монеллина, оказалось, что его подслащивающая способность составляет менее 500, как установлено на основе оценок образцов: 0,0±0,0, 0,3±0,8 и 0,4±0,9 для коэффициентов разбавления 1:500, 1:1000 и 1:2000 соответственно. Для DM12, представляющего собой сконструированный белок на основе монеллина, показали аналогичные значения 1,0 для всех коэффициентов разведения без заметного эффекта доза-ответ.
Для DM09, представляющего собой сконструированный белок на основе монеллина, продемонстрировали линейную кривую доза-ответ, показывающую, что порог восприятия сладости составляет примерно 1:16000 с подслащивающей способностью от 16000 до 8000, что имитирует раствор сахара 1 0Вх.
Результаты показаны на фиг.2.
Пример 1D. Подслащивающая способность MNEI и сконструированных белков на основе MNEI
На основе вышеописанной оптимизации, подслащивающую способность, послевкусие и эффект стойкости DM08 и DM09 тестировали по сравнению с MNEI и дополнительными подсластителями, как показано в таблице 7. Способ тестирования включал слепое тестирование каждого из белков по сравнению с раствором сахара с участием 6 обученных участников.
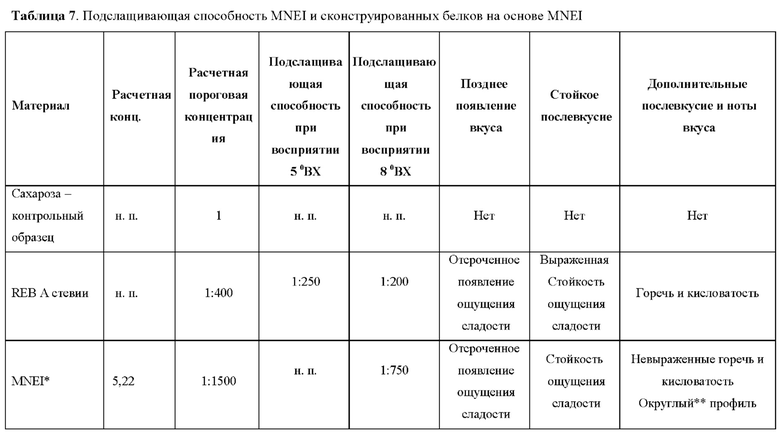
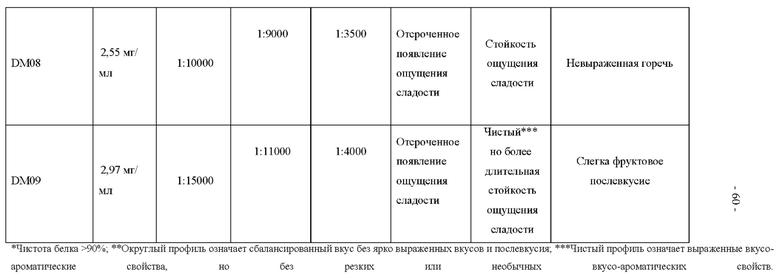
Как можно видеть, сконструированные белки на основе MNEI характеризуются более высокой подслащивающей способностью по сравнению с MNEI. Следует отметить, что порог восприятия сладости MNEI и модифицированных белков на основе MNEI, DM08 в тестируемых экспериментах в 10000 раз больше, чем у сахара по весу, а у DM09 в 15000 больше, чем у сахара. Был продемонстрирован нелинейный эффект доза-ответ, показывающий, что подслащивающая способность при восприятии 8 0ВХ для DM08 в 3500 больше, чем у сахара, а для DM09 в 4000 больше, чем у сахара.
Кроме того, проводили слепое тестирование синергических эффектов различных комбинаций у 6 участников по сравнению с раствором сахара (таблица 8).
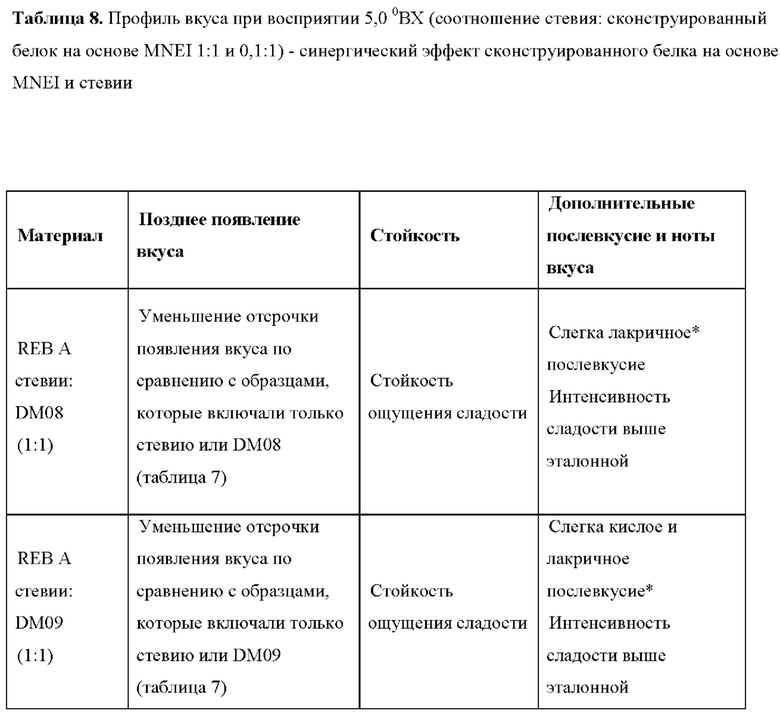
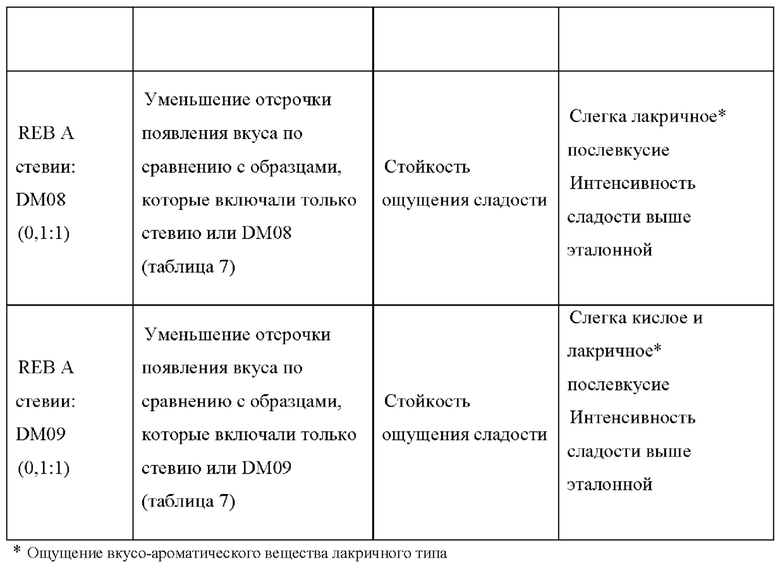
Синергический эффект сконструированного белка на основе MNEI (DM08 / DM09) и стевии (REB А) был продемонстрирован для соотношения стевия/MNEI в диапазоне 1,0:1,0 - 0,1:1,0 соответственно:
- Подслащивающая способность стевии + DM08 и DM09, представляющих собой сконструированные белки на основе MNEI, была выше, чем аддитивные значения.
- Комбинация сконструированных белков на основе MNEI со стевией обеспечила уменьшение отсрочки появления вкуса, общей стойкости вкуса и другого послевкусия.
Кроме того, тестировали комбинации путем слепого сравнения различных комбинаций с раствором сахара у 6 участников.
В таблице 9 показан профиль вкуса при восприятии 8,0 0ВХ (добавление 3,0 0ВХ сахара) (отношение стевия: сконструированный белок на основе MNEI 0,1:1,0) - синергический эффект сконструированного белка MNEI и стевии в присутствии сахара
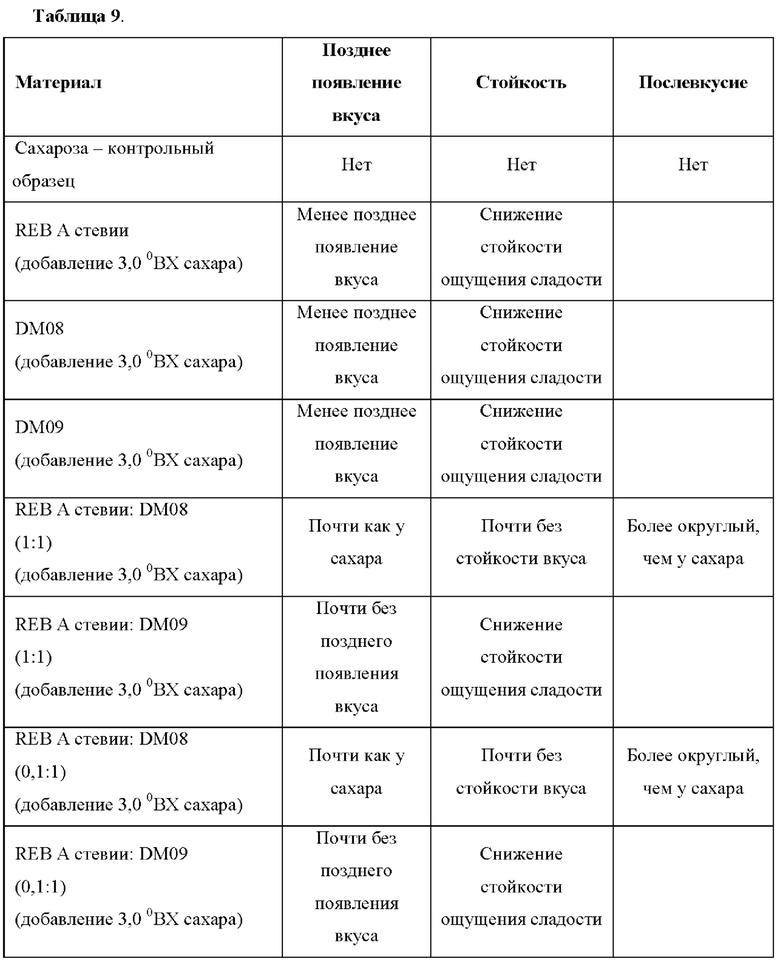
Все испытанные образцы продемонстрировали лучшие вкусовые качества в присутствии сахара (3 0Вх): менее позднее появление вкуса и сниженную стойкость вкуса и другие послевкусия.
Для смесей стевии/DM08 (E&G) отметили их сахароподобный вкусовой профиль.
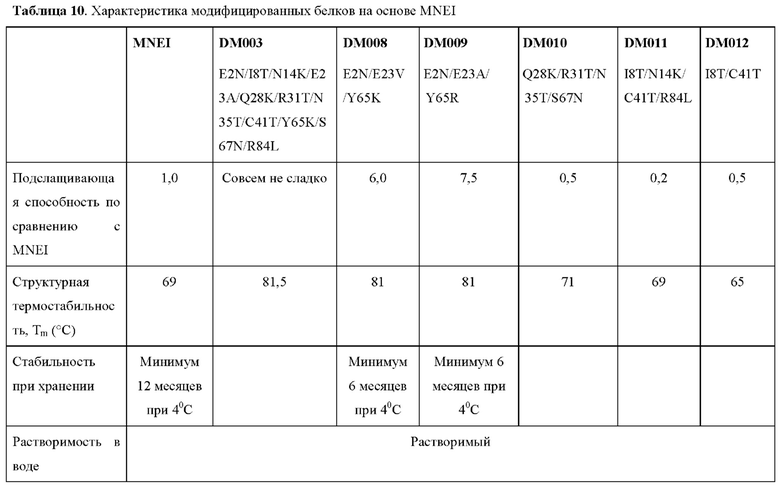
Как показано, было обнаружено, что все испытанные модифицированные белки демонстрируют равную или повышенную сладость, а также DM12 вызывает сладкий вкус на уровне, аналогичном MNEI, DM09 демонстрирует по меньшей мере равную температуру плавления или улучшенную температуру плавления.
Пример 2. Конструирование белков на основе тауматина
Пример 2А. Конструирование белков на основе тауматина
Конструирование белков на основе тауматина выполняли на основе SEQ ID ΝΟ:1 в качестве эталонного белка.
Вычислительные способы
В ходе процесса CPD допускались только замещения вокруг спирали и недоступной стороны бета-листа, который формирует сердцевину белка. Цикл ROSETTA обеспечил более 71 тысячи моделей. После получения значений энергии всех моделей получили график, имеющий форму логит-функции. Логит-функция (также известная как логарифм шансов) представляет собой логарифм шансов р/(1-р), где p представляет собой вероятность. Это обратная сигмоидальная "логистическая" функция.
Для дальнейшего анализа отобрали 5 тысяч моделей с наименьшей энергией. В результате построения графика зависимости количества замещений от REU получили гауссовское распределение, показывающее, что популяции являются нормальными и пригодны для дальнейшего анализа. Результат CPD можно увидеть в Error! Reference source not found, (см. Таблицу 11).
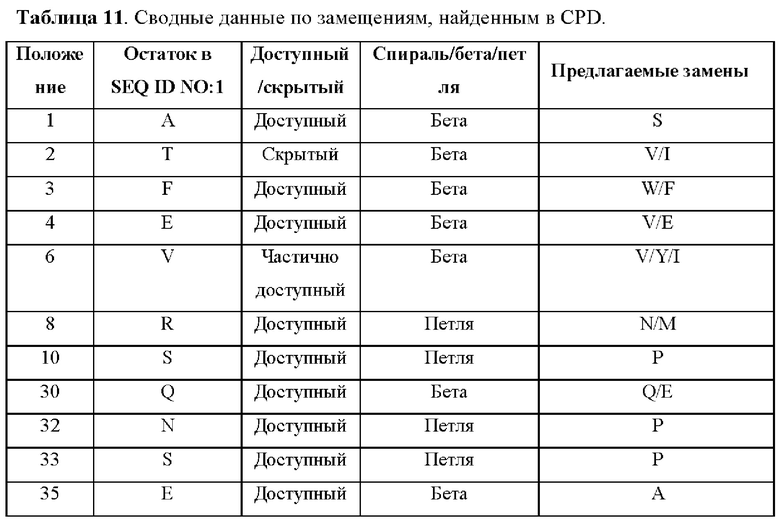
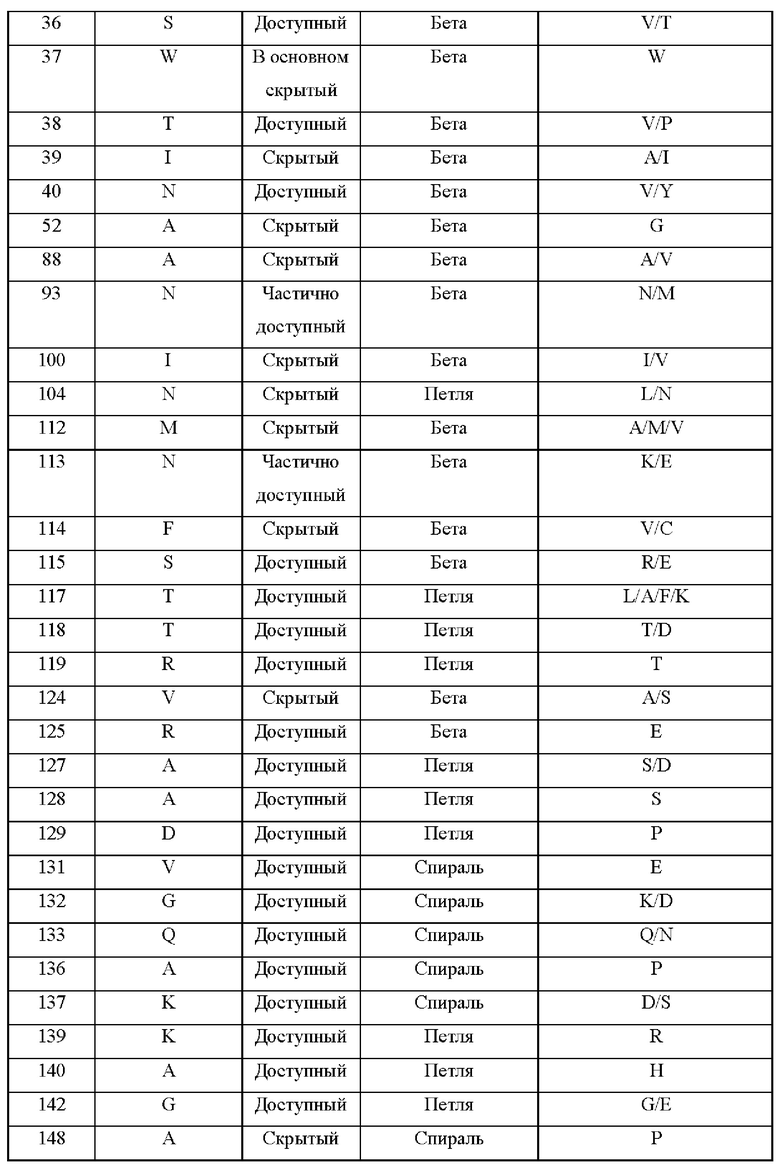
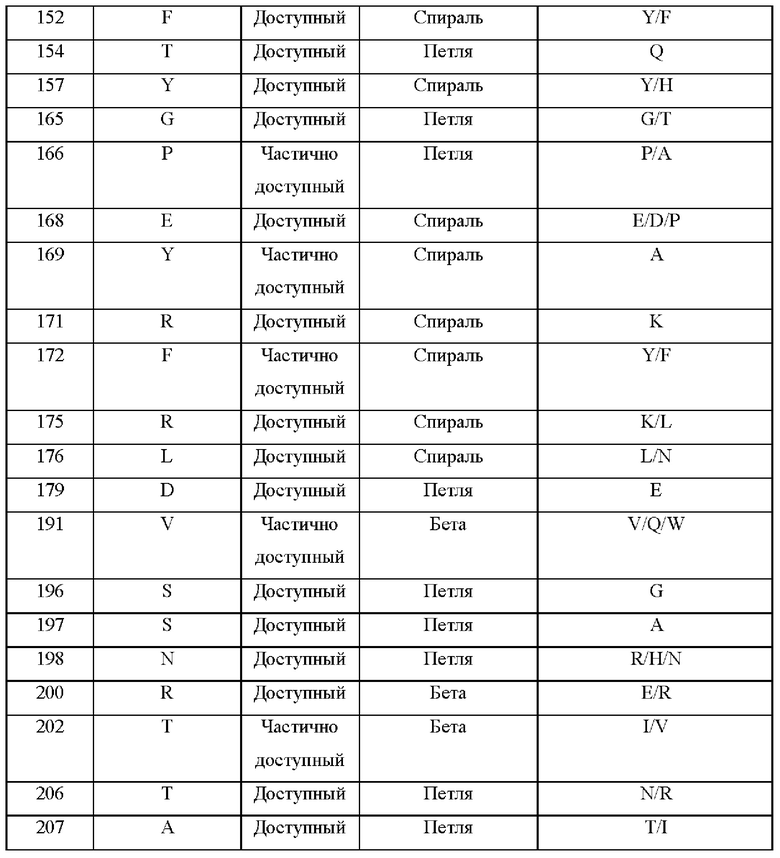
Пример 2В. Экспрессия модифицированных белков на основе тауматина в Pichia pastoris (в настоящее время называется Komagataella phaffi)
Шесть вариантов тауматина протестировали на экспрессию и секрецию дрожжами Р. pasoris с применением двух различных систем индукции, а именно экспрессии, управляемой метанолом и управляемой глюкозой. Последовательности и системы экспрессии показаны в таблице 12 ниже.
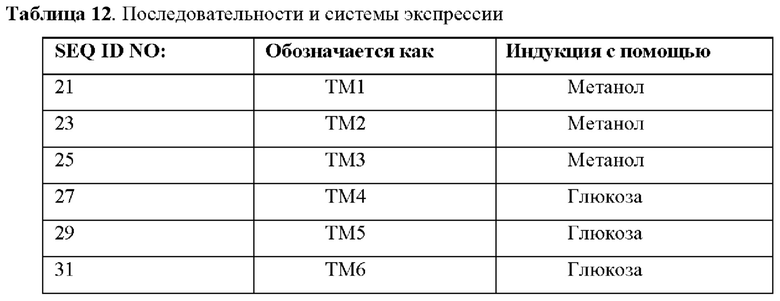
Экспрессию тестировали в штаммах Х33 или LP1 Pichia pastoris после электропорации и отбора с помощью зеоцина (500-1000 мкг/мл). Пример результата можно увидеть на фиг.3, где представленакондиционированная культуральная среда, разделенная с помощью электрофореза в акриламидном геле. Кондиционированную среду от выбранных колоний разделяли с помощью электрофореза в акриламидном геле и обнаружение осуществляли путем окрашивания серебром. Косматин (дорожки 2-7) обнаруживали при правильной молекулярной массе 22 кДа (стрелка). Секреция управляется сигнальными последовательностями амилазы (Т8-1) или фактора спаривания альфа (2). Дорожка 1 - экспрессия тауматина в тех же условиях, секреция, управляемая "пре"-сигнальной последовательностью тауматина (MAATTCFFFLFPFLLLLTLSRA).
Эксперименты проводили с тремя различными штаммами организмов-хозяев, включая X-33, GS115 и LP1. Системы экспрессии включали как индукцию метанолом (с промотором АОХ1, испытанную в штаммах Х33, GS115 и LP1), так и индукцию глюкозой (с промотором G1-3, испытанную в штаммах LP1 и GS115).
Скринингу подвергали различные сигнальные пептиды. Для АОХ1 такие пептиды включают альфа-амилазу, альфаK, альфаТ, глюкоамил, инулиназу, инвертазу, киллерпро, лизоцим, альбумин и претауматин. Для G1-3 они включают пре-таматин, LSP1, LSP2 и альфаМF.
В случае тауматина наиболее низкая оценка псевдоэнергии, полученная программой CPD, предусматривала 54 замены. Однако после перекрестной валидации с помощью многочисленных ортогональных способов некоторые модифицированные белки, экспрессируемые в лаборатории, содержали 3 и 22 замены. Ортогональные способы предусматривают консервативность последовательностей и структуры в компьютерных моделях, а также в рамках эволюционного семейства белков, анализ гидрофобных участков, полостей, динамическую высоко- и низкотемпературную динамику (оцениваемую, например, с помощью молекулярной динамики), визуализацию, соответствие известным мутациям и т.п. ~72000 моделей и распределение псевдоэнергии (функция оценки). Каждая модель представляет собой отдельную последовательность, и все значения псевдоэнергии ниже, чем у входящего белка (дикого типа). Фокус на 5000 моделей с наименьшей псевдоэнергией: значение псевдоэнергии в зависимости от количества замен (компьютерный вывод перед оценкой и валидацией с помощью ортогональных способов).
Пример 3. Определение характеристик сайта связывания рецептора
Определение характеристик сайта связывания рецептора, содержащего по меньшей мере следующие аминокислоты, где А соответствует TAS1R2 (от человека), а В соответствует TAS1R3 (от человека), где нумерация соответствует соответствующему остатку (аминокислоте) в соответствующей последовательности.
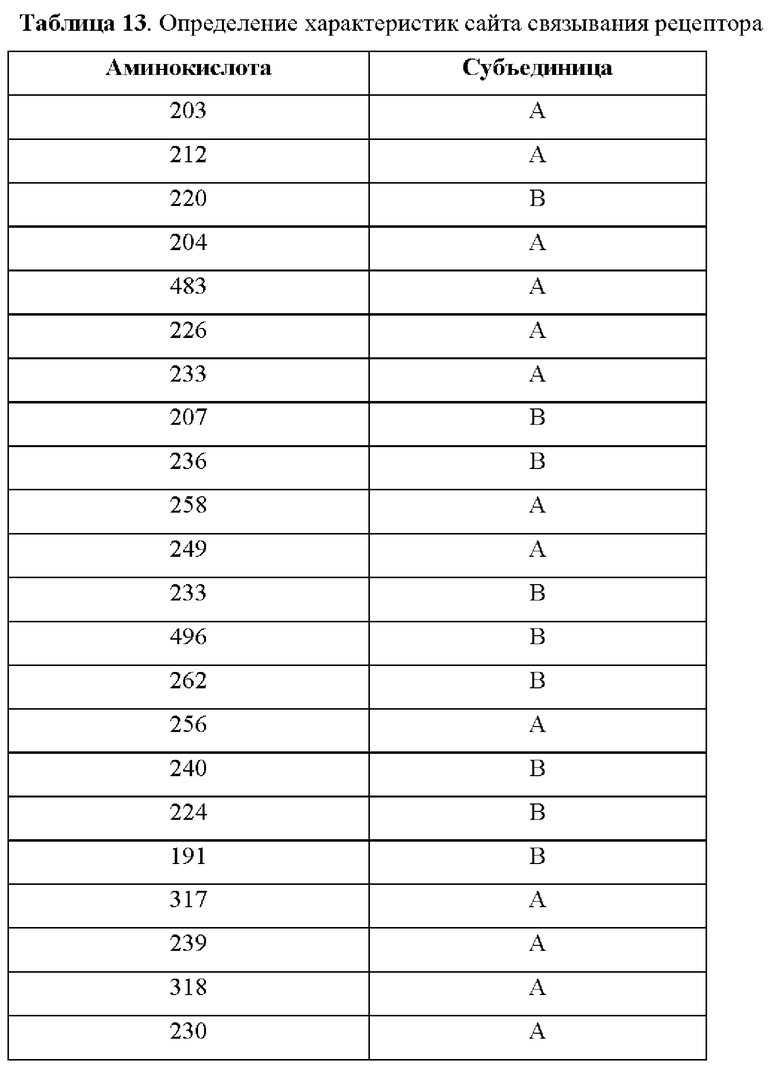
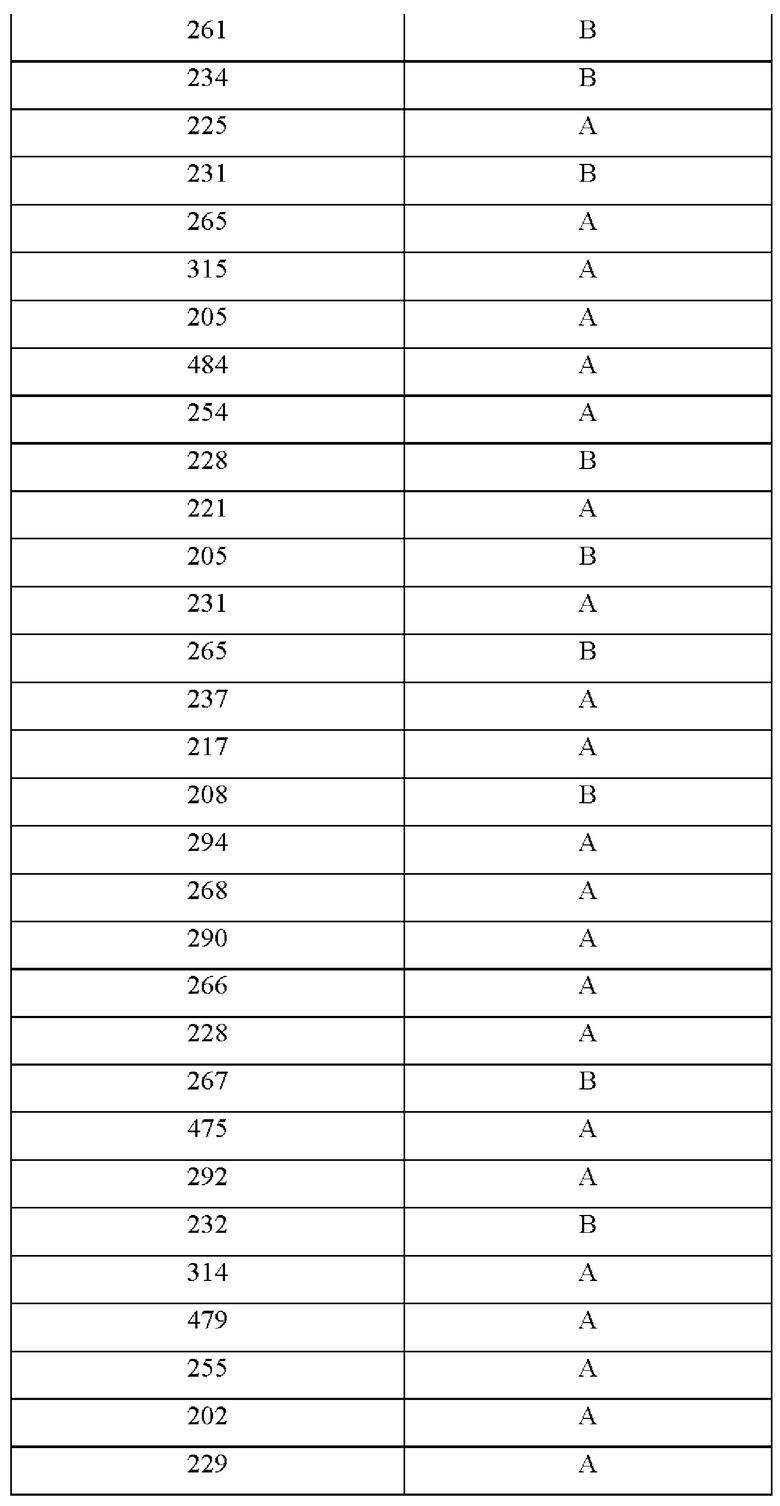

Кроме того, сайт связывания рецептора содержит по меньшей мере следующие аминокислоты, где А соответствует TAS1R2 (от человека), а В соответствует TAS1R3 (от человека), где нумерация соответствует соответствующему остатку (аминокислоте) в соответствующей последовательности (таблица 14).
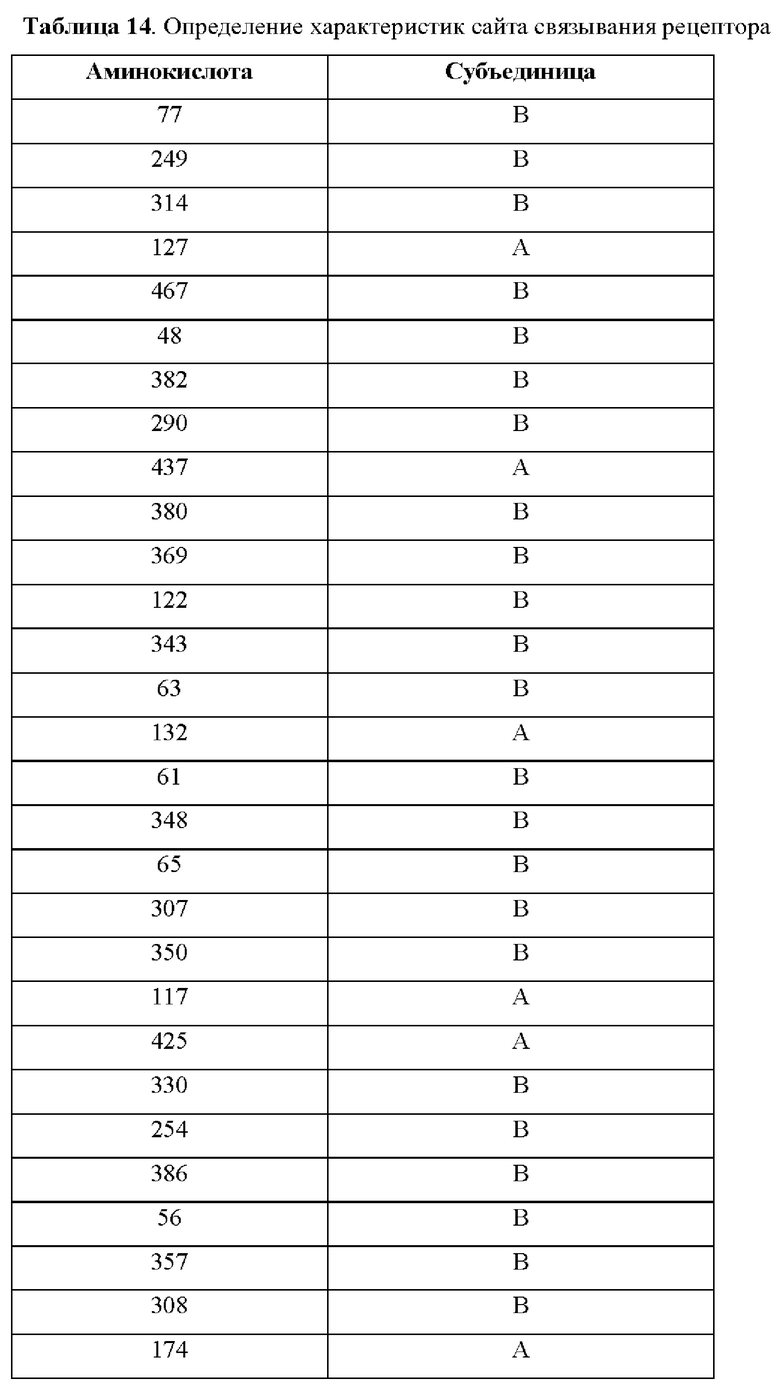
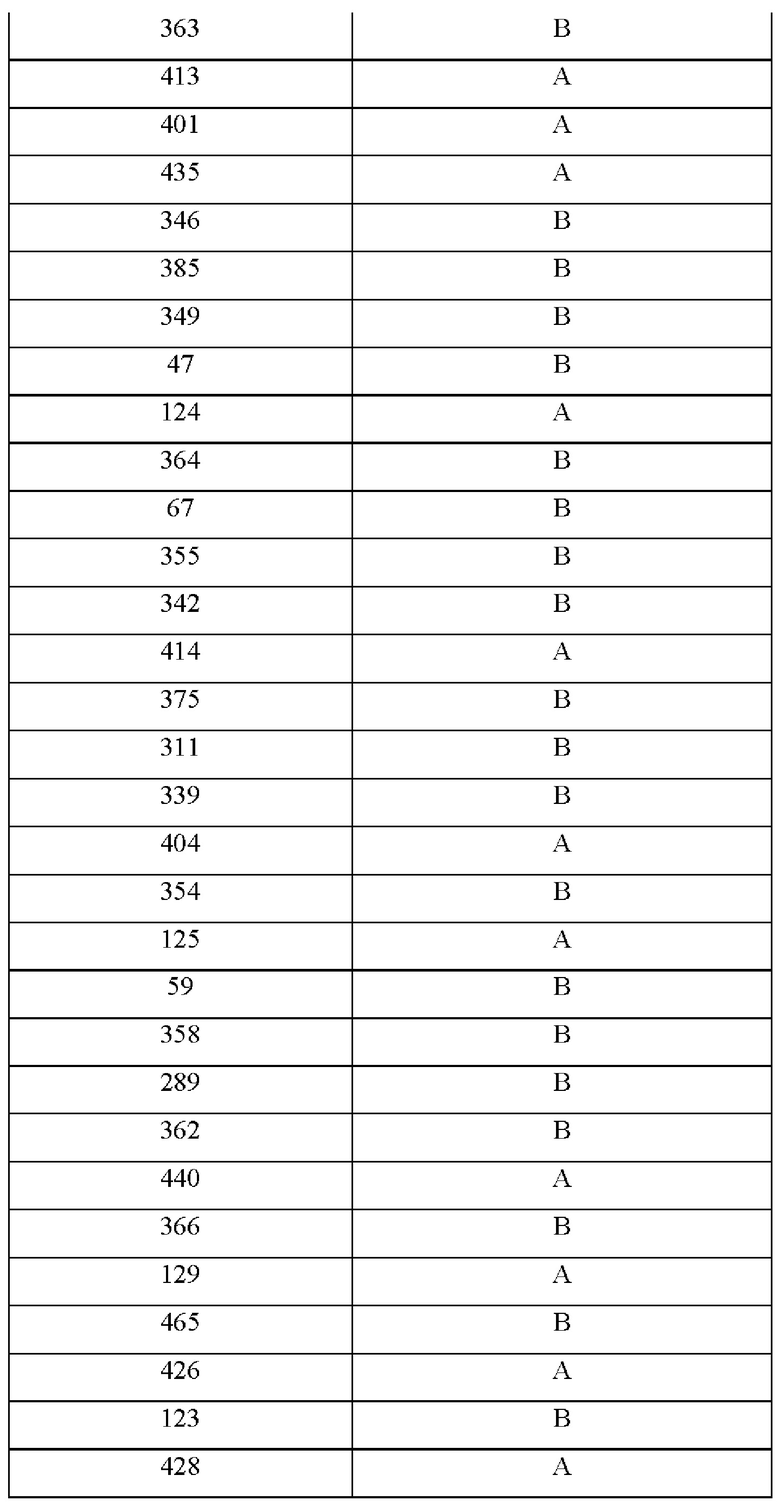
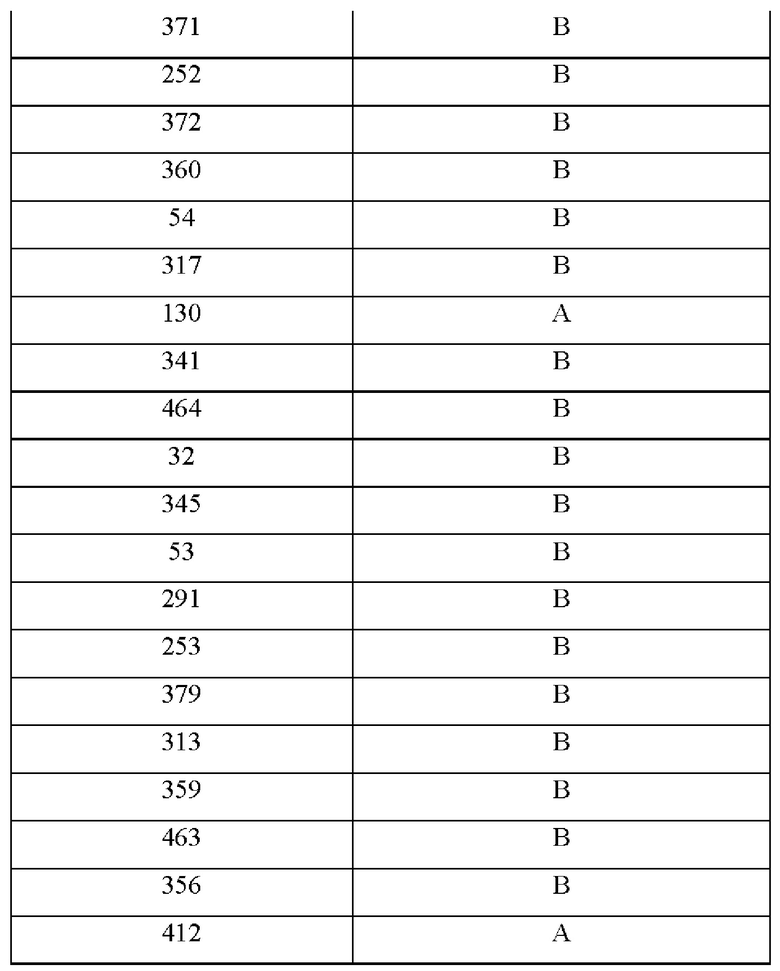
Сайт связывания рецептора содержит по меньшей мере следующие аминокислоты, где А соответствует TAS1R2 (от человека), а В соответствует TAS1R3 (от человека), где нумерация соответствует соответствующему остатку (аминокислоте) в соответствующей последовательности (таблица 15).
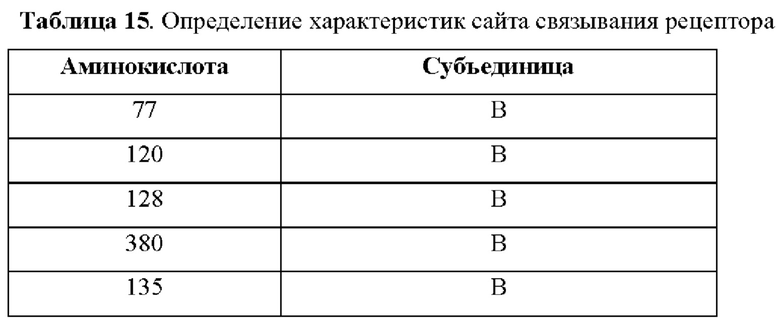
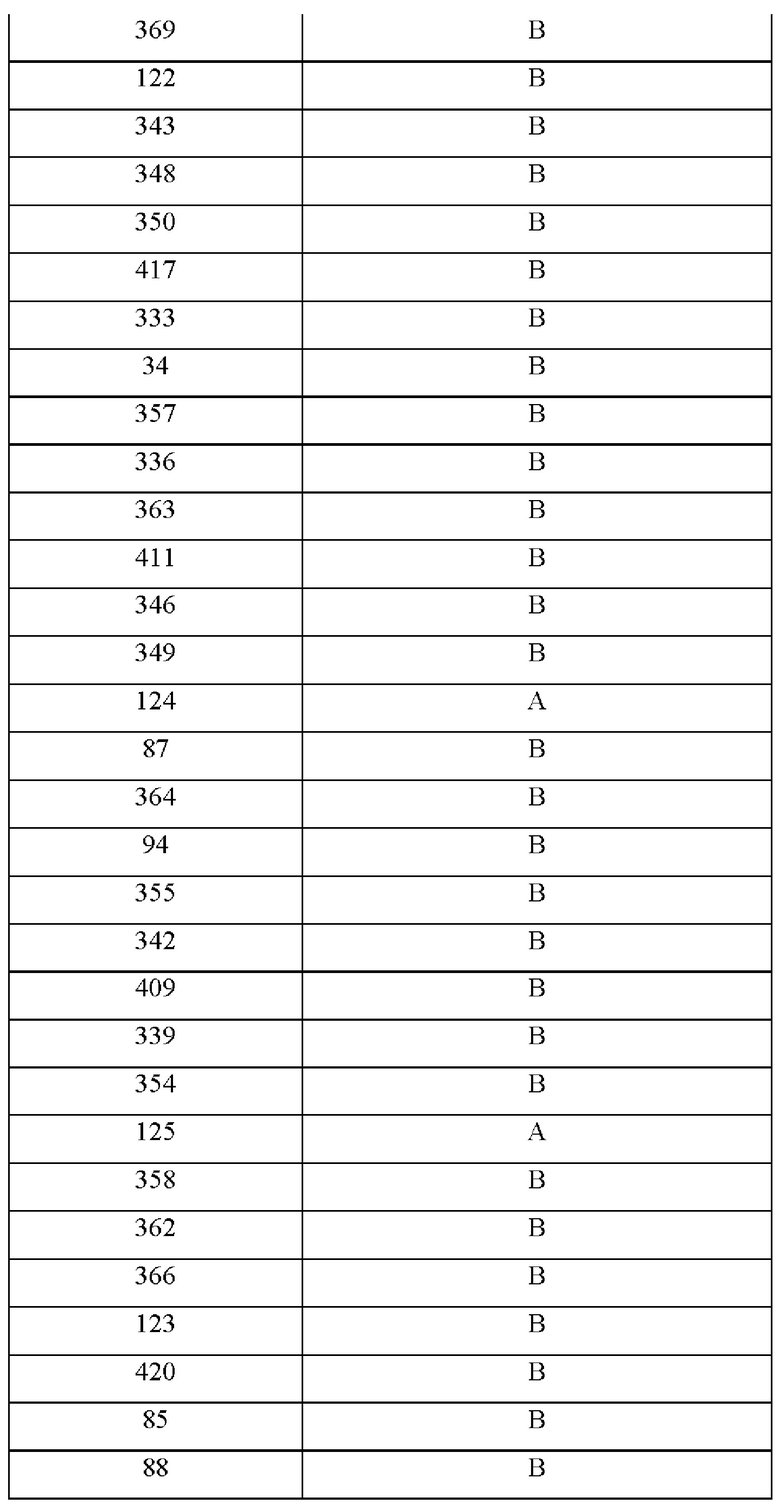
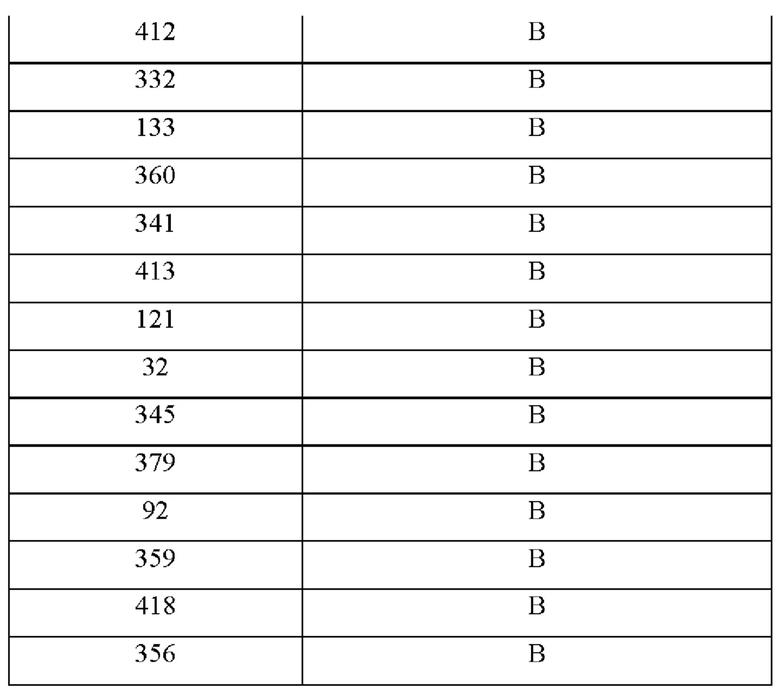
На фиг.4А-4С показаны предлагаемые сайты связывания. После моделирования стыковки тауматина с рецептором на рецепторе обнаружили три сайта с высокой вероятностью связывания. В ходе моделирования проводят многочисленные эксперименты по предсказанию стыковки и группируют результаты с низкой энергией. На фиг.4А-4С показаны три сайта и кластеризацию тауматина на этих сайтах.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Amai Proteins Ltd.
<120> БЕЛКИ, ЯВЛЯЮЩИЕСЯ МОДИФИКАТОРАМИ ВКУСА И ВКУСО-АРОМАТИЧЕСКИХ СВОЙСТВ
<130> 2647289
<150> US 62/667,532
<151> 2018-05-06
<160> 32
<170> PatentIn версия 3.5
<210> 1
<211> 207
<212> БЕЛОК
<213> Thaumatococcus daniellii
<220>
<221> MISC_FEATURE
<223> Тауматин I, номер доступа в GenBank P02883
<400> 1
Ala Thr Phe Glu Ile Val Asn Arg Cys Ser Tyr Thr Val Trp Ala Ala
1 5 10 15
Ala Ser Lys Gly Asp Ala Ala Leu Asp Ala Gly Gly Arg Gln Leu Asn
20 25 30
Ser Gly Glu Ser Trp Thr Ile Asn Val Glu Pro Gly Thr Asn Gly Gly
35 40 45
Lys Ile Trp Ala Arg Thr Asp Cys Tyr Phe Asp Asp Ser Gly Ser Gly
50 55 60
Ile Cys Lys Thr Gly Asp Cys Gly Gly Leu Leu Arg Cys Lys Arg Phe
65 70 75 80
Gly Arg Pro Pro Thr Thr Leu Ala Glu Phe Ser Leu Asn Gln Tyr Gly
85 90 95
Lys Asp Tyr Ile Asp Ile Ser Asn Ile Lys Gly Phe Asn Val Pro Met
100 105 110
Asn Phe Ser Pro Thr Thr Arg Gly Cys Arg Gly Val Arg Cys Ala Ala
115 120 125
Asp Ile Val Gly Gln Cys Pro Ala Lys Leu Lys Ala Pro Gly Gly Gly
130 135 140
Cys Asn Asp Ala Cys Thr Val Phe Gln Thr Ser Glu Tyr Cys Cys Thr
145 150 155 160
Thr Gly Lys Cys Gly Pro Thr Glu Tyr Ser Arg Phe Phe Lys Arg Leu
165 170 175
Cys Pro Asp Ala Phe Ser Tyr Val Leu Asp Lys Pro Thr Thr Val Thr
180 185 190
Cys Pro Gly Ser Ser Asn Tyr Arg Val Thr Phe Cys Pro Thr Ala
195 200 205
<210> 2
<211> 234
<212> БЕЛОК
<213> Thaumatococcus daniellii
<220>
<221> MISC_FEATURE
<223> Тауматин-2, номер доступа в GenBank P02884
<400> 2
Met Ala Ala Thr Thr Cys Phe Phe Phe Leu Phe Pro Phe Leu Leu Leu
1 5 10 15
Leu Thr Leu Ser Arg Ala Ala Thr Phe Glu Ile Val Asn Arg Cys Ser
20 25 30
Tyr Thr Val Trp Ala Ala Ala Ser Lys Gly Asp Ala Ala Leu Asp Ala
35 40 45
Gly Gly Arg Gln Leu Asn Ser Gly Glu Ser Trp Thr Asn Val Glu Pro
50 55 60
Gly Thr Lys Gly Gly Lys Ile Trp Ala Arg Thr Asp Cys Tyr Phe Asp
65 70 75 80
Asp Ser Gly Arg Gly Ile Cys Arg Thr Gly Asp Cys Gly Gly Leu Leu
85 90 95
Gln Cys Lys Arg Phe Gly Arg Pro Pro Thr Thr Leu Ala Glu Phe Ser
100 105 110
Leu Asn Gln Tyr Gly Lys Asp Tyr Ile Asp Ile Ser Asn Ile Lys Gly
115 120 125
Phe Asn Val Pro Met Asp Phe Ser Pro Thr Thr Arg Gly Cys Arg Gly
130 135 140
Val Arg Cys Ala Ala Asp Ile Val Gly Gln Cys Pro Ala Lys Leu Lys
145 150 155 160
Ala Pro Gly Gly Gly Cys Asn Asp Ala Cys Thr Val Phe Gln Thr Ser
165 170 175
Glu Tyr Cys Cys Thr Thr Gly Lys Cys Gly Pro Thr Glu Tyr Ser Arg
180 185 190
Phe Phe Lys Arg Leu Cys Pro Asp Ala Phe Ser Tyr Val Leu Asp Lys
195 200 205
Pro Thr Thr Val Thr Cys Pro Gly Ser Ser Asn Tyr Arg Val Thr Phe
210 215 220
Cys Pro Thr Ala Leu Glu Leu Glu Asp Glu
225 230
<210> 3
<211> 45
<212> БЕЛОК
<213> Dioscoreophyllum cumminsii
<220>
<221> MISC_FEATURE
<223> Цепь А монеллина, номер доступа в GenBank P02881
<400> 3
Phe Arg Glu Ile Lys Gly Tyr Glu Tyr Gln Leu Tyr Val Tyr Ala Ser
1 5 10 15
Asp Lys Leu Phe Arg Ala Asp Ile Ser Glu Asp Tyr Lys Thr Arg Gly
20 25 30
Arg Lys Leu Leu Arg Phe Asn Gly Pro Val Pro Pro Pro
35 40 45
<210> 4
<211> 50
<212> БЕЛОК
<213> Dioscoreophyllum cumminsii
<220>
<221> MISC_FEATURE
<223> Цепь B монеллина, номер доступа в GenBank P02882
<400> 4
Gly Glu Trp Glu Ile Ile Asp Ile Gly Pro Phe Thr Gln Asn Leu Gly
1 5 10 15
Lys Phe Ala Val Asp Glu Glu Asn Lys Ile Gly Gln Tyr Gly Arg Leu
20 25 30
Thr Phe Asn Lys Val Ile Arg Pro Cys Met Lys Lys Thr Ile Tyr Glu
35 40 45
Glu Asn
50
<210> 5
<211> 96
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> MNEI-монеллин
<400> 5
Gly Glu Trp Glu Ile Ile Asp Ile Gly Pro Phe Thr Gln Asn Leu Gly
1 5 10 15
Lys Phe Ala Val Asp Glu Glu Asn Lys Ile Gly Gln Tyr Gly Arg Leu
20 25 30
Thr Phe Asn Lys Val Ile Arg Pro Cys Met Lys Lys Thr Ile Tyr Glu
35 40 45
Asn Glu Gly Phe Arg Glu Ile Lys Gly Tyr Glu Tyr Gln Leu Tyr Val
50 55 60
Tyr Ala Ser Asp Lys Leu Phe Arg Ala Asp Ile Ser Glu Asp Tyr Lys
65 70 75 80
Thr Arg Gly Arg Lys Leu Leu Arg Phe Asn Gly Pro Val Pro Pro Pro
85 90 95
<210> 6
<211> 220
<212> БЕЛОК
<213> Synsepalum dulcificum
<220>
<221> MISC_FEATURE
<223> Миракулин, номер доступа в GenBank P13087
<400> 6
Met Lys Glu Leu Thr Met Leu Ser Leu Ser Phe Phe Phe Val Ser Ala
1 5 10 15
Leu Leu Ala Ala Ala Ala Asn Pro Leu Leu Ser Ala Ala Asp Ser Ala
20 25 30
Pro Asn Pro Val Leu Asp Ile Asp Gly Glu Lys Leu Arg Thr Gly Thr
35 40 45
Asn Tyr Tyr Ile Val Pro Val Leu Arg Asp His Gly Gly Gly Leu Thr
50 55 60
Val Ser Ala Thr Thr Pro Asn Gly Thr Phe Val Cys Pro Pro Arg Val
65 70 75 80
Val Gln Thr Arg Lys Glu Val Asp His Asp Arg Pro Leu Ala Phe Phe
85 90 95
Pro Glu Asn Pro Lys Glu Asp Val Val Arg Val Ser Thr Asp Leu Asn
100 105 110
Ile Asn Phe Ser Ala Phe Met Pro Cys Arg Trp Thr Ser Ser Thr Val
115 120 125
Trp Arg Leu Asp Lys Tyr Asp Glu Ser Thr Gly Gln Tyr Phe Val Thr
130 135 140
Ile Gly Gly Val Lys Gly Asn Pro Gly Pro Glu Thr Ile Ser Ser Trp
145 150 155 160
Phe Lys Ile Glu Glu Phe Cys Gly Ser Gly Phe Tyr Lys Leu Val Phe
165 170 175
Cys Pro Thr Val Cys Gly Ser Cys Lys Val Lys Cys Gly Asp Val Gly
180 185 190
Ile Tyr Ile Asp Gln Lys Gly Arg Arg Arg Leu Ala Leu Ser Asp Lys
195 200 205
Pro Phe Ala Phe Glu Phe Asn Lys Thr Val Tyr Phe
210 215 220
<210> 7
<211> 158
<212> БЕЛОК
<213> Molineria latifolia
<220>
<221> MISC_FEATURE
<223> Куркулин-1, номер доступа в GenBank P19667
<400> 7
Met Ala Ala Lys Phe Leu Leu Thr Ile Leu Val Thr Phe Ala Ala Val
1 5 10 15
Ala Ser Leu Gly Met Ala Asp Asn Val Leu Leu Ser Gly Gln Thr Leu
20 25 30
His Ala Asp His Ser Leu Gln Ala Gly Ala Tyr Thr Leu Thr Ile Gln
35 40 45
Asn Lys Cys Asn Leu Val Lys Tyr Gln Asn Gly Arg Gln Ile Trp Ala
50 55 60
Ser Asn Thr Asp Arg Arg Gly Ser Gly Cys Arg Leu Thr Leu Leu Ser
65 70 75 80
Asp Gly Asn Leu Val Ile Tyr Asp His Asn Asn Asn Asp Val Trp Gly
85 90 95
Ser Ala Cys Trp Gly Asp Asn Gly Lys Tyr Ala Leu Val Leu Gln Lys
100 105 110
Asp Gly Arg Phe Val Ile Tyr Gly Pro Val Leu Trp Ser Leu Gly Pro
115 120 125
Asn Gly Cys Arg Arg Val Asn Gly Gly Ile Thr Val Ala Lys Asp Ser
130 135 140
Thr Glu Pro Gln His Glu Asp Ile Lys Met Val Ile Asn Asn
145 150 155
<210> 8
<211> 158
<212> БЕЛОК
<213> Molineria latifolia
<220>
<221> MISC_FEATURE
<223> Куркулин-2, номер доступа в GenBank Q6F495
<400> 8
Met Ala Ala Lys Phe Leu Leu Thr Ile Leu Val Thr Phe Ala Ala Val
1 5 10 15
Ala Ser Leu Gly Met Ala Asp Ser Val Leu Leu Ser Gly Gln Thr Leu
20 25 30
Tyr Ala Gly His Ser Leu Thr Ser Gly Ser Tyr Thr Leu Thr Ile Gln
35 40 45
Asn Asn Cys Asn Leu Val Lys Tyr Gln His Gly Arg Gln Ile Trp Ala
50 55 60
Ser Asp Thr Asp Gly Gln Gly Ser Gln Cys Arg Leu Thr Leu Arg Ser
65 70 75 80
Asp Gly Asn Leu Ile Ile Tyr Asp Asp Asn Asn Met Val Val Trp Gly
85 90 95
Ser Asp Cys Trp Gly Asn Asn Gly Thr Tyr Ala Leu Val Leu Gln Gln
100 105 110
Asp Gly Leu Phe Val Ile Tyr Gly Pro Val Leu Trp Pro Leu Gly Leu
115 120 125
Asn Gly Cys Arg Ser Leu Asn Gly Glu Ile Thr Val Ala Lys Asp Ser
130 135 140
Thr Glu Pro Gln His Glu Asp Ile Lys Met Val Ile Asn Asn
145 150 155
<210> 9
<211> 54
<212> БЕЛОК
<213> Pentadiplandra brazzeana
<220>
<221> MISC_FEATURE
<223> Браззеин или дефензин-подобный белок, номер доступа в GenBank P56552
<400> 9
Gln Asp Lys Cys Lys Lys Val Tyr Glu Asn Tyr Pro Val Ser Lys Cys
1 5 10 15
Gln Leu Ala Asn Gln Cys Asn Tyr Asp Cys Lys Leu Asp Lys His Ala
20 25 30
Arg Ser Gly Glu Cys Phe Tyr Asp Glu Lys Arg Asn Leu Gln Cys Ile
35 40 45
Cys Asp Tyr Cys Glu Tyr
50
<210> 10
<211> 104
<212> БЕЛОК
<213> Capparis masaikai
<220>
<221> MISC_FEATURE
<223> Сладкий белок мабинлин-1, номер доступа в GenBank P80351
<400> 10
Glu Pro Leu Cys Arg Arg Gln Phe Gln Gln His Gln His Leu Arg Ala
1 5 10 15
Cys Gln Arg Tyr Ile Arg Arg Arg Ala Gln Arg Gly Gly Leu Val Asp
20 25 30
Glu Gln Arg Gly Pro Ala Leu Arg Leu Cys Cys Asn Gln Leu Arg Gln
35 40 45
Val Asn Lys Pro Cys Val Cys Pro Val Leu Arg Gln Ala Ala His Gln
50 55 60
Gln Leu Tyr Gln Gly Gln Ile Glu Gly Pro Arg Gln Val Arg Gln Leu
65 70 75 80
Phe Arg Ala Ala Arg Asn Leu Pro Asn Ile Cys Lys Ile Pro Ala Val
85 90 95
Gly Arg Cys Gln Phe Thr Arg Trp
100
<210> 11
<211> 155
<212> БЕЛОК
<213> Capparis masaikai
<220>
<221> MISC_FEATURE
<223> Сладкий белок мабинлин-2, номер доступа в GenBank P30233
<400> 11
Met Ala Lys Leu Ile Phe Leu Phe Ala Thr Leu Ala Leu Phe Val Leu
1 5 10 15
Leu Ala Asn Ala Ser Ile Gln Thr Thr Val Ile Glu Val Asp Glu Glu
20 25 30
Glu Asp Asn Gln Leu Trp Arg Cys Gln Arg Gln Phe Leu Gln His Gln
35 40 45
Arg Leu Arg Ala Cys Gln Arg Phe Ile His Arg Arg Ala Gln Phe Gly
50 55 60
Gly Gln Pro Asp Glu Leu Glu Asp Glu Val Glu Asp Asp Asn Asp Asp
65 70 75 80
Glu Asn Gln Pro Arg Arg Pro Ala Leu Arg Gln Cys Cys Asn Gln Leu
85 90 95
Arg Gln Val Asp Arg Pro Cys Val Cys Pro Val Leu Arg Gln Ala Ala
100 105 110
Gln Gln Val Leu Gln Arg Gln Ile Ile Gln Gly Pro Gln Gln Leu Arg
115 120 125
Arg Leu Phe Asp Ala Ala Arg Asn Leu Pro Asn Ile Cys Asn Ile Pro
130 135 140
Asn Ile Gly Ala Cys Pro Phe Arg Ala Trp Pro
145 150 155
<210> 12
<211> 104
<212> БЕЛОК
<213> Capparis masaikai
<220>
<221> MISC_FEATURE
<223> Сладкий белок мабинлин-3, номер доступа в GenBank P80352
<400> 12
Glu Pro Leu Cys Arg Arg Gln Phe Gln Gln His Gln His Leu Arg Ala
1 5 10 15
Cys Gln Arg Tyr Leu Arg Arg Arg Ala Gln Arg Gly Gly Leu Ala Asp
20 25 30
Glu Gln Arg Gly Pro Ala Leu Arg Leu Cys Cys Asn Gln Leu Arg Gln
35 40 45
Val Asn Lys Pro Cys Val Cys Pro Val Leu Arg Gln Ala Ala His Gln
50 55 60
Gln Leu Tyr Gln Gly Gln Ile Glu Gly Pro Arg Gln Val Arg Arg Leu
65 70 75 80
Phe Arg Ala Ala Arg Asn Leu Pro Asn Ile Cys Lys Ile Pro Ala Val
85 90 95
Gly Arg Cys Gln Phe Thr Arg Trp
100
<210> 13
<211> 100
<212> БЕЛОК
<213> Capparis masaikai
<220>
<221> MISC_FEATURE
<223> Сладкий белок мабинлин-4, номер доступа в GenBank P80353
<400> 13
Glu Pro Leu Cys Arg Arg Gln Phe Gln Gln His Gln His Leu Arg Ala
1 5 10 15
Cys Gln Arg Tyr Leu Arg Arg Arg Ala Gln Arg Gly Glu Gln Arg Gly
20 25 30
Pro Ala Leu Arg Leu Cys Cys Asn Gln Leu Arg Gln Val Asn Lys Pro
35 40 45
Cys Val Cys Pro Val Leu Arg Gln Ala Ala His Gln Gln Leu Tyr Gln
50 55 60
Gly Gln Ile Glu Gly Pro Arg Gln Val Arg Arg Leu Phe Arg Ala Ala
65 70 75 80
Arg Asn Leu Pro Asn Ile Cys Lys Ile Pro Ala Val Gly Arg Cys Gln
85 90 95
Phe Thr Arg Trp
100
<210> 14
<211> 258
<212> БЕЛОК
<213> Ricinus communis
<220>
<221> MISC_FEATURE
<223> Цепь А сладкого белка мабинлина-1, номер доступа в GenBank B9SA35
<400> 14
Met Ala Lys Leu Ile Pro Thr Ile Ala Leu Val Ser Val Leu Leu Phe
1 5 10 15
Ile Ile Ala Asn Ala Ser Phe Ala Tyr Arg Thr Thr Ile Thr Thr Ile
20 25 30
Glu Ile Asp Glu Ser Lys Gly Glu Arg Glu Gly Ser Ser Ser Gln Gln
35 40 45
Cys Arg Gln Glu Val Gln Arg Lys Asp Leu Ser Ser Cys Glu Arg Tyr
50 55 60
Leu Arg Gln Ser Ser Ser Arg Arg Ser Pro Gly Glu Glu Val Leu Arg
65 70 75 80
Met Pro Gly Asp Glu Asn Gln Gln Gln Glu Ser Gln Gln Leu Gln Gln
85 90 95
Cys Cys Asn Gln Val Lys Gln Val Arg Asp Glu Cys Gln Cys Glu Ala
100 105 110
Ile Lys Tyr Ile Ala Glu Asp Gln Ile Gln Gln Gly Gln Leu His Gly
115 120 125
Glu Glu Ser Glu Arg Val Ala Gln Arg Ala Gly Glu Ile Val Ser Ser
130 135 140
Cys Gly Val Arg Cys Met Arg Gln Thr Arg Thr Asn Pro Ser Gln Gln
145 150 155 160
Gly Cys Arg Gly Gln Ile Gln Glu Gln Gln Asn Leu Arg Gln Cys Gln
165 170 175
Glu Tyr Ile Lys Gln Gln Val Ser Gly Gln Gly Pro Arg Arg Ser Asp
180 185 190
Asn Gln Glu Arg Ser Leu Arg Gly Cys Cys Asp His Leu Lys Gln Met
195 200 205
Gln Ser Gln Cys Arg Cys Glu Gly Leu Arg Gln Ala Ile Glu Gln Gln
210 215 220
Gln Ser Gln Gly Gln Leu Gln Gly Gln Asp Val Phe Glu Ala Phe Arg
225 230 235 240
Thr Ala Ala Asn Leu Pro Ser Met Cys Gly Val Ser Pro Thr Glu Cys
245 250 255
Arg Phe
<210> 15
<211> 96
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> DM3
<400> 15
Gly Asn Trp Glu Ile Ile Asp Thr Gly Pro Phe Thr Gln Lys Leu Gly
1 5 10 15
Lys Phe Ala Val Asp Glu Ala Asn Lys Ile Gly Lys Tyr Gly Thr Leu
20 25 30
Thr Phe Thr Lys Val Ile Arg Pro Thr Met Lys Lys Thr Ile Tyr Glu
35 40 45
Asn Glu Gly Phe Arg Glu Ile Lys Gly Tyr Glu Tyr Gln Leu Tyr Val
50 55 60
Lys Ala Asn Asp Lys Leu Phe Arg Ala Asp Ile Ser Glu Asp Tyr Lys
65 70 75 80
Thr Arg Gly Leu Lys Leu Leu Arg Phe Asn Gly Pro Val Pro Pro Pro
85 90 95
<210> 16
<211> 96
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> DM8
<400> 16
Gly Asn Trp Glu Ile Ile Asp Ile Gly Pro Phe Thr Gln Asn Leu Gly
1 5 10 15
Lys Phe Ala Val Asp Glu Val Asn Lys Ile Gly Gln Tyr Gly Arg Leu
20 25 30
Thr Phe Asn Lys Val Ile Arg Pro Cys Met Lys Lys Thr Ile Tyr Glu
35 40 45
Asn Glu Gly Phe Arg Glu Ile Lys Gly Tyr Glu Tyr Gln Leu Tyr Val
50 55 60
Lys Ala Ser Asp Lys Leu Phe Arg Ala Asp Ile Ser Glu Asp Tyr Lys
65 70 75 80
Thr Arg Gly Arg Lys Leu Leu Arg Phe Asn Gly Pro Val Pro Pro Pro
85 90 95
<210> 17
<211> 96
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> DM9
<400> 17
Gly Asn Trp Glu Ile Ile Asp Ile Gly Pro Phe Thr Gln Asn Leu Gly
1 5 10 15
Lys Phe Ala Val Asp Glu Ala Asn Lys Ile Gly Gln Tyr Gly Arg Leu
20 25 30
Thr Phe Asn Lys Val Ile Arg Pro Cys Met Lys Lys Thr Ile Tyr Glu
35 40 45
Asn Glu Gly Phe Arg Glu Ile Lys Gly Tyr Glu Tyr Gln Leu Tyr Val
50 55 60
Arg Ala Ser Asp Lys Leu Phe Arg Ala Asp Ile Ser Glu Asp Tyr Lys
65 70 75 80
Thr Arg Gly Arg Lys Leu Leu Arg Phe Asn Gly Pro Val Pro Pro Pro
85 90 95
<210> 18
<211> 96
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> DM10
<400> 18
Gly Glu Trp Glu Ile Ile Asp Ile Gly Pro Phe Thr Gln Asn Leu Gly
1 5 10 15
Lys Phe Ala Val Asp Glu Glu Asn Lys Ile Gly Lys Tyr Gly Thr Leu
20 25 30
Thr Phe Thr Lys Val Ile Arg Pro Cys Met Lys Lys Thr Ile Tyr Glu
35 40 45
Asn Glu Gly Phe Arg Glu Ile Lys Gly Tyr Glu Tyr Gln Leu Tyr Val
50 55 60
Tyr Ala Asn Asp Lys Leu Phe Arg Ala Asp Ile Ser Glu Asp Tyr Lys
65 70 75 80
Thr Arg Gly Arg Lys Leu Leu Arg Phe Asn Gly Pro Val Pro Pro Pro
85 90 95
<210> 19
<211> 96
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> DM11
<400> 19
Gly Glu Trp Glu Ile Ile Asp Thr Gly Pro Phe Thr Gln Lys Leu Gly
1 5 10 15
Lys Phe Ala Val Asp Glu Glu Asn Lys Ile Gly Gln Tyr Gly Arg Leu
20 25 30
Thr Phe Asn Lys Val Ile Arg Pro Thr Met Lys Lys Thr Ile Tyr Glu
35 40 45
Asn Glu Gly Phe Arg Glu Ile Lys Gly Tyr Glu Tyr Gln Leu Tyr Val
50 55 60
Tyr Ala Ser Asp Lys Leu Phe Arg Ala Asp Ile Ser Glu Asp Tyr Lys
65 70 75 80
Thr Arg Gly Leu Lys Leu Leu Arg Phe Asn Gly Pro Val Pro Pro Pro
85 90 95
<210> 20
<211> 96
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> DM12
<400> 20
Gly Glu Trp Glu Ile Ile Asp Thr Gly Pro Phe Thr Gln Asn Leu Gly
1 5 10 15
Lys Phe Ala Val Asp Glu Glu Asn Lys Ile Gly Gln Tyr Gly Arg Leu
20 25 30
Thr Phe Asn Lys Val Ile Arg Pro Thr Met Lys Lys Thr Ile Tyr Glu
35 40 45
Asn Glu Gly Phe Arg Glu Ile Lys Gly Tyr Glu Tyr Gln Leu Tyr Val
50 55 60
Tyr Ala Ser Asp Lys Leu Phe Arg Ala Asp Ile Ser Glu Asp Tyr Lys
65 70 75 80
Thr Arg Gly Leu Lys Leu Leu Arg Phe Asn Gly Pro Val Pro Pro Pro
85 90 95
<210> 21
<211> 207
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> TM1
<400> 21
Ala Thr Phe Asp Ile Arg Asn Asn Cys Pro Tyr Thr Val Trp Ala Ala
1 5 10 15
Ala Ser Lys Gly Asp Ala Ala Leu Asp Ala Gly Gly Arg Arg Leu Asp
20 25 30
Arg Gly Gln Ser Trp Thr Ile Asn Val Glu Pro Gly Thr Asn Gly Gly
35 40 45
Lys Ile Trp Ala Arg Thr Asn Cys Tyr Phe Asp Asp Ser Gly Ser Gly
50 55 60
Ile Cys Lys Thr Gly Asp Cys Gly Gly Leu Leu Arg Cys Lys Arg Phe
65 70 75 80
Gly Arg Pro Pro Thr Thr Leu Ala Glu Phe Ser Leu Asn Gln Tyr Gly
85 90 95
Lys Asp Tyr Phe Asp Ile Ser Leu Ile Lys Gly Phe Asn Val Pro Met
100 105 110
Glu Phe Ser Pro Thr Ser Arg Gly Cys Arg Gly Ile Arg Cys Thr Ala
115 120 125
Asp Ile Asn Gly Gln Cys Pro Asn Glu Leu Arg Ala Pro Gly Gly Gly
130 135 140
Cys Asn Asp Ala Cys Thr Val Phe Gln Thr Ser Glu Tyr Cys Cys Thr
145 150 155 160
Thr Gly Lys Cys Gly Pro Thr Glu Tyr Ser Arg Phe Phe Lys Asp Arg
165 170 175
Cys Pro Asp Ala Phe Ser Tyr Val Leu Asp Asp Pro Thr Thr Val Thr
180 185 190
Cys Pro Gly Ser Ser Asn Tyr Arg Val Thr Phe Cys Pro Thr Ala
195 200 205
<210> 22
<211> 627
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TD1
<400> 22
gcaacctttg atatcagaaa taactgtccc tacacagtat gggctgctgc atctaaaggt 60
gatgctgcac ttgacgccgg tggcagacgt ctagatcgtg gacagtcctg gaccatcaat 120
gttgagcctg gtacaaatgg tggaaagatt tgggctagga ctaattgcta ctttgatgac 180
tctggatccg gtatatgtaa gactggtgac tgtggcggat tgttgagatg taagagattc 240
ggtaggcccc caactacact ggctgaattc tcgttgaatc aatatggtaa agattacttt 300
gacattagtc tgattaaggg attcaacgtt cctatggaat tctccccaac ctcacgtggg 360
tgcagaggaa tcagatgtac ggctgacatc aacggtcaat gtccgaatga attgcgagcc 420
cctggtggtg gatgtaacga tgcatgcaca gtgttccaaa cttctgagta ttgttgtact 480
actggtaagt gcggaccaac tgagtactcc agatttttca aagatcgttg tccagatgca 540
ttcagctatg tgttagacga cccaactaca gttacgtgcc caggttcaag caattacaga 600
gtcaccttct gtcctacagc ttaatag 627
<210> 23
<211> 207
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> TM2
<400> 23
Ala Thr Phe Asp Ile Arg Asn Asn Cys Pro Tyr Thr Val Trp Ala Ala
1 5 10 15
Ala Ser Lys Gly Asp Ala Ala Leu Asp Ala Gly Gly Arg Arg Leu Asp
20 25 30
Arg Gly Gln Ser Trp Thr Ile Asn Val Glu Pro Gly Thr Asn Gly Gly
35 40 45
Lys Ile Trp Ala Arg Thr Asn Cys Tyr Phe Asp Asp Ser Gly Ser Gly
50 55 60
Ile Cys Lys Thr Gly Asp Cys Gly Gly Leu Leu Arg Cys Lys Arg Phe
65 70 75 80
Gly Arg Pro Pro Thr Thr Leu Ala Glu Phe Ser Leu Asn Gln Tyr Gly
85 90 95
Lys Asp Tyr Ile Asp Ile Ser Asn Ile Lys Gly Phe Asn Val Pro Met
100 105 110
Glu Phe Ser Pro Thr Ser Arg Gly Cys Arg Gly Val Arg Cys Thr Ala
115 120 125
Asp Ile Asn Gly Gln Cys Pro Asn Glu Leu Arg Ala Pro Gly Gly Gly
130 135 140
Cys Asn Asp Ala Cys Thr Val Phe Gln Thr Ser Glu Tyr Cys Cys Thr
145 150 155 160
Thr Gly Lys Cys Gly Pro Thr Glu Tyr Ser Arg Phe Phe Lys Asp Arg
165 170 175
Cys Pro Asp Ala Phe Ser Tyr Val Leu Asp Asp Pro Thr Thr Val Thr
180 185 190
Cys Pro Gly Ser Ser Asn Tyr Arg Val Thr Phe Cys Pro Thr Ala
195 200 205
<210> 24
<211> 627
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TD2
<400> 24
gcaacctttg atatcagaaa taactgtccc tacacagtat gggctgctgc atctaaaggt 60
gatgctgcac ttgacgccgg tggcagacgt ctagatcgtg gacagtcctg gaccatcaat 120
gttgagcctg gtacaaatgg tggaaagatt tgggctagga ctaattgcta ctttgatgac 180
tctggatccg gtatatgtaa gactggtgac tgtggcggat tgttgagatg taagagattc 240
ggtaggcccc caactacact ggctgaattc tcgttgaatc aatatggtaa agattacatc 300
gacattagta acattaaggg attcaacgtt cctatggaat tctccccaac ctcacgtggg 360
tgcagaggag tcagatgtac ggctgacatc aacggtcaat gtccgaatga attgcgagcc 420
cctggtggtg gatgtaacga tgcatgcaca gtgttccaaa cttctgagta ttgttgtact 480
actggtaagt gcggaccaac tgagtactcc agatttttca aagatcgttg tccagatgca 540
ttcagctatg tgttagacga cccaactaca gttacgtgcc caggttcaag caattacaga 600
gtcaccttct gtcctacagc ttaatag 627
<210> 25
<211> 207
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> TM3
<400> 25
Ala Thr Phe Glu Ile Val Asn Arg Cys Ser Tyr Thr Val Trp Ala Ala
1 5 10 15
Ala Ser Lys Gly Asp Ala Ala Leu Asp Ala Gly Gly Arg Gln Leu Asn
20 25 30
Ser Gly Glu Ser Trp Thr Ile Asn Val Glu Pro Gly Thr Asn Gly Gly
35 40 45
Lys Ile Trp Ala Arg Thr Asp Cys Tyr Phe Asp Asp Ser Gly Ser Gly
50 55 60
Ile Cys Lys Thr Gly Asp Cys Gly Gly Leu Leu Arg Cys Lys Arg Phe
65 70 75 80
Gly Arg Pro Pro Thr Thr Leu Ala Glu Phe Ser Leu Asn Gln Tyr Gly
85 90 95
Lys Asp Tyr Phe Asp Ile Ser Leu Ile Lys Gly Phe Asn Val Pro Met
100 105 110
Asn Phe Ser Pro Thr Thr Arg Gly Cys Arg Gly Ile Arg Cys Ala Ala
115 120 125
Asp Ile Val Gly Gln Cys Pro Ala Lys Leu Lys Ala Pro Gly Gly Gly
130 135 140
Cys Asn Asp Ala Cys Thr Val Phe Gln Thr Ser Glu Tyr Cys Cys Thr
145 150 155 160
Thr Gly Lys Cys Gly Pro Thr Glu Tyr Ser Arg Phe Phe Lys Arg Leu
165 170 175
Cys Pro Asp Ala Phe Ser Tyr Val Leu Asp Lys Pro Thr Thr Val Thr
180 185 190
Cys Pro Gly Ser Ser Asn Tyr Arg Val Thr Phe Cys Pro Thr Ala
195 200 205
<210> 26
<211> 627
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TD3
<400> 26
gccacatttg aaatagtcaa tcgttgttcc tatactgttt gggctgctgc atcaaagggt 60
gatgcagctc tagatgccgg tggcagacaa cttaatagcg gtgagtcctg gacaatcaat 120
gttgagcccg gaactaacgg tggaaaaatc tgggctagga ctgactgtta ctttgacgac 180
tctggttccg gaatctgcaa aacgggtgat tgtggtggac tgttacgttg taaaagattc 240
ggtaggccac caactacctt ggcagaattt tccctgaatc agtacggtaa agattatttc 300
gatatttcgt tgattaaggg tttcaatgtg cctatgaact tttctcctac taccagaggt 360
tgcagaggaa tcagatgtgc tgctgatatt gtgggacaat gtccggcaaa gttgaaagct 420
cctggtggcg ggtgtaacga cgcttgcaca gtctttcaaa caagcgagta ctgttgtaca 480
actggtaagt gcggtccaac agaatatagt cgtttcttta agagactttg tcctgacgca 540
ttctcttatg tattggacaa accaactaca gttacgtgcc caggatcatc aaactacaga 600
gttactttct gtccaaccgc ctaatag 627
<210> 27
<211> 207
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> TM4
<400> 27
Ser Thr Trp Glu Ile Val Asn Asn Cys Pro Tyr Thr Val Trp Ala Ala
1 5 10 15
Ala Ser Lys Gly Asp Ala Ala Leu Asp Ala Gly Gly Arg Gln Leu Pro
20 25 30
Pro Gly Glu Ser Trp Thr Ile Asn Val Glu Pro Gly Thr Asn Gly Gly
35 40 45
Lys Ile Trp Ala Arg Thr Asp Cys Tyr Phe Asp Asp Ser Gly Ser Gly
50 55 60
Ile Cys Lys Thr Gly Asp Cys Gly Gly Leu Leu Arg Cys Lys Arg Phe
65 70 75 80
Gly Arg Pro Pro Thr Thr Leu Ala Glu Phe Ser Leu Asn Gln Tyr Gly
85 90 95
Lys Asp Tyr Ile Asp Ile Ser Leu Ile Lys Gly Phe Asn Val Pro Ile
100 105 110
Glu Val Gln Pro Thr Thr Thr Gly Cys Arg Gly Val Arg Cys Ser Ser
115 120 125
Pro Ile Gln Thr Gln Cys Pro Ala Lys Leu Arg His Pro Gly Gly Gly
130 135 140
Cys Asn Asp Pro Cys Thr Val Tyr Gln Thr Ser Glu Tyr Cys Cys Thr
145 150 155 160
Thr Gly Lys Cys Gly Pro Thr Glu Tyr Ser Arg Tyr Phe Lys Arg Leu
165 170 175
Cys Pro Glu Ala Phe Ser Tyr Val Leu Asp Lys Pro Thr Thr Val Thr
180 185 190
Cys Pro Gly Ser Ser Arg Tyr Arg Val Thr Phe Cys Pro Thr Thr
195 200 205
<210> 28
<211> 627
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TD4
<400> 28
tctacttggg aaattgttaa caactgtcca tacaccgtgt gggctgctgc tagtaagggt 60
gatgctgctt tggacgccgg tggtcgtcaa ctaccacctg gcgagtcctg gactatcaat 120
gttgaaccgg gaacaaatgg tggtaaaatc tgggccagaa cagactgtta tttcgatgat 180
tctggatccg gtatttgtaa gactggtgac tgtggtggat tgctgaggtg taaaagattt 240
ggtcgtcctc caactacgtt agcagagttt tcattgaatc aatacggtaa agactacatt 300
gatatttcat tgataaaggg atttaacgtc cctatcgaag tacagccaac tacgacaggt 360
tgcagaggag ttagatgttc cagcccaatc cagactcaat gtccagcaaa gcttagacat 420
cccggtggtg ggtgtaatga cccatgcact gtgtaccaaa catctgagta ctgttgtacc 480
accggaaagt gcggccctac tgaatattcc aggtatttca aaagattgtg ccccgaggca 540
ttcagttacg tcctggataa acctacaaca gttacttgtc ctggatcgtc aagatatcgt 600
gtgacattct gtccaactac ataatag 627
<210> 29
<211> 207
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> TM5
<400> 29
Ala Thr Trp Glu Ile Val Asn Arg Cys Ser Tyr Thr Val Trp Ala Ala
1 5 10 15
Ala Ser Lys Gly Asp Ala Ala Leu Asp Ala Gly Gly Arg Gln Leu Asn
20 25 30
Ser Gly Glu Ser Trp Thr Ile Asn Val Glu Pro Gly Thr Asn Gly Gly
35 40 45
Lys Ile Trp Ala Arg Thr Asp Cys Tyr Phe Asp Asp Ser Gly Ser Gly
50 55 60
Ile Cys Lys Thr Gly Asp Cys Gly Gly Leu Leu Arg Cys Lys Arg Phe
65 70 75 80
Gly Arg Pro Pro Thr Thr Leu Ala Glu Phe Ser Leu Asn Gln Tyr Gly
85 90 95
Lys Asp Tyr Ile Asp Ile Ser Leu Ile Lys Gly Phe Asn Val Pro Ile
100 105 110
Asn Val Ser Pro Thr Thr Arg Gly Cys Arg Gly Val Arg Cys Ala Ala
115 120 125
Asp Ile Val Gly Gln Cys Pro Ala Lys Leu Lys Ala Pro Gly Gly Gly
130 135 140
Cys Asn Asp Pro Cys Thr Val Phe Gln Thr Ser Glu Tyr Cys Cys Thr
145 150 155 160
Thr Gly Lys Cys Gly Pro Thr Glu Tyr Ser Arg Phe Phe Lys Arg Leu
165 170 175
Cys Pro Asp Ala Phe Ser Tyr Val Leu Asp Lys Pro Thr Thr Val Thr
180 185 190
Cys Pro Gly Ser Ser Asn Tyr Arg Val Thr Phe Cys Pro Thr Ala
195 200 205
<210> 30
<211> 627
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TD5
<400> 30
gctacgtggg aaattgtgaa tagatgttct tatacagtgt gggcagccgc aagtaaaggt 60
gacgctgctc tggatgccgg tggtagacaa ctgaactccg gcgaatcttg gactataaat 120
gtcgagccag gaaccaatgg tgggaaaatc tgggctagaa cagattgtta tttcgacgac 180
tccggttccg gtatttgtaa gactggtgac tgcggtggat tattgcgttg caaaagattt 240
ggaaggcctc caactacact agcagagttt agcttgaatc agtacggaaa agattatatc 300
gatatttcac tcatcaaggg tttcaacgtt cctatcaatg tttcaccaac cacccgtggt 360
tgtaggggtg ttagatgtgc agccgatatt gtaggacaat gtccagctaa gcttaaggca 420
ccgggtggtg gatgtaacga tccttgcaca gtgtttcaaa catctgagta ctgttgcact 480
actggaaagt gtggtcccac tgaatattca cgtttcttca aaagattgtg tccagacgct 540
ttctcgtacg ttttggacaa accaacgact gttacatgtc ccggcagttc caactacaga 600
gtcacttttt gccctacagc ttaatag 627
<210> 31
<211> 207
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> TM6
<400> 31
Ser Thr Phe Glu Ile Val Asn Asn Cys Pro Tyr Thr Val Trp Ala Ala
1 5 10 15
Ala Ser Lys Gly Asp Ala Ala Leu Asp Ala Gly Gly Arg Gln Leu Pro
20 25 30
Pro Gly Glu Ser Trp Thr Ile Asn Val Glu Pro Gly Thr Asn Gly Gly
35 40 45
Lys Ile Trp Ala Arg Thr Asp Cys Tyr Phe Asp Asp Ser Gly Ser Gly
50 55 60
Ile Cys Lys Thr Gly Asp Cys Gly Gly Leu Leu Arg Cys Lys Arg Phe
65 70 75 80
Gly Arg Pro Pro Thr Thr Leu Ala Glu Phe Ser Leu Asn Gln Tyr Gly
85 90 95
Lys Asp Tyr Ile Asp Ile Ser Asn Ile Lys Gly Phe Asn Val Pro Met
100 105 110
Glu Phe Gln Pro Thr Thr Thr Gly Cys Arg Gly Val Arg Cys Ser Ser
115 120 125
Pro Ile Gln Thr Gln Cys Pro Ala Lys Leu Arg His Pro Gly Gly Gly
130 135 140
Cys Asn Asp Ala Cys Thr Val Tyr Gln Thr Ser Glu Tyr Cys Cys Thr
145 150 155 160
Thr Gly Lys Cys Gly Pro Thr Glu Tyr Ser Arg Tyr Phe Lys Arg Leu
165 170 175
Cys Pro Glu Ala Phe Ser Tyr Val Leu Asp Lys Pro Thr Thr Val Thr
180 185 190
Cys Pro Gly Ser Ser Arg Tyr Arg Val Thr Phe Cys Pro Thr Thr
195 200 205
<210> 32
<211> 627
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TD6
<400> 32
tctacttttg aaattgttaa caactgtcca tacaccgtat gggctgctgc tagtaagggt 60
gatgctgctt tggacgccgg tggtcgtcaa ctaccacctg gcgagtcctg gactatcaat 120
gttgaaccgg gaacaaatgg tggtaaaatc tgggccagaa cagactgtta tttcgatgat 180
tctggatccg gtatttgtaa gactggtgac tgtggtggat tgctgaggtg taaaagattt 240
ggtcgtcctc ccactacgtt agcagagttt tcattgaatc aatacggtaa agactacatt 300
gatatttcaa atataaaggg atttaacgtc cctatggaat ttcagccaac tacgacaggt 360
tgcagaggag ttagatgttc cagcccaatc cagactcaat gtccagcaaa gcttagacat 420
cccggtggtg ggtgtaatga cgcatgcact gtgtaccaaa catctgagta ctgttgtacc 480
accggaaagt gcggccctac tgaatattcc aggtatttca aaagattgtg ccccgaggca 540
ttcagttacg tcctggataa acctacaaca gttacttgtc ctggatcgtc aagatatcgt 600
gtgacattct gtccaactac ataatag 627
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ СЛИТЫЕ БЕЛКИ, СПЕЦИФИЧЕСКИЕ В ОТНОШЕНИИ CD137 И GPC3 | 2020 |
|
RU2814653C2 |
| ВАРИАНТЫ IgG-FC ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2018 |
|
RU2814952C2 |
| СЛИТЫЙ БЕЛОК И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2800923C2 |
| НОВЫЕ ПОЛИПЕПТИДЫ СО СПЕЦИФИЧЕСКИМ СВЯЗЫВАНИЕМ И ПУТИ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2723034C2 |
| МУТАНТНЫЙ БЕЛОК F RSV И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2807742C1 |
| ПОЛИВАЛЕТНЫЕ И ПОЛИСПЕЦИФИЧНЫЕ GITR-СВЯЗЫВАЮЩИЕ СЛИТЫЕ БЕЛКИ | 2016 |
|
RU2753439C2 |
| ГЛИКОЗИЛИРОВАННЫЕ СЛИТЫЕ БЕЛКИ VWF С УЛУЧШЕННОЙ ФАРМАКОКИНЕТИКОЙ | 2017 |
|
RU2782212C2 |
| МУТАНТЫ ГЕМАГГЛЮТИНИНА ВИРУСА ГРИППА | 2019 |
|
RU2809237C2 |
| ПОЛИВАЛЕНТНЫЕ И ПОЛИСПЕЦИФИЧЕСКИЕ ОХ40-СВЯЗЫВАЮЩИЕ СЛИТЫЕ БЕЛКИ | 2017 |
|
RU2773052C2 |
| СЛИТЫЙ БЕЛОК GDF15 ДЛИТЕЛЬНОГО ДЕЙСТВИЯ И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2020 |
|
RU2836280C1 |
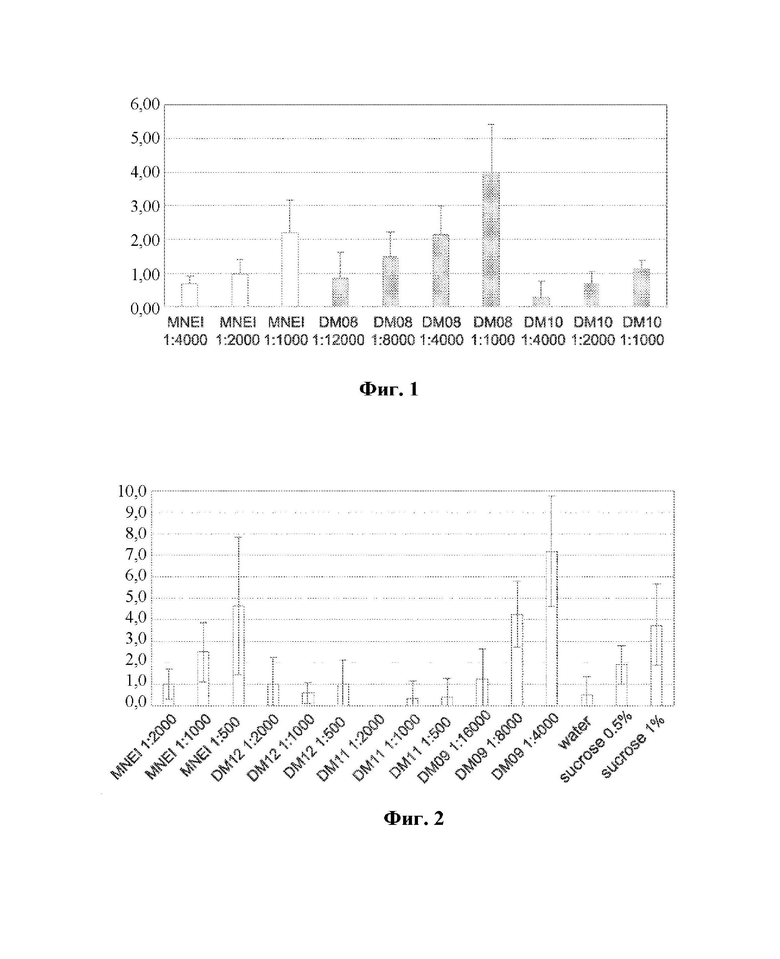
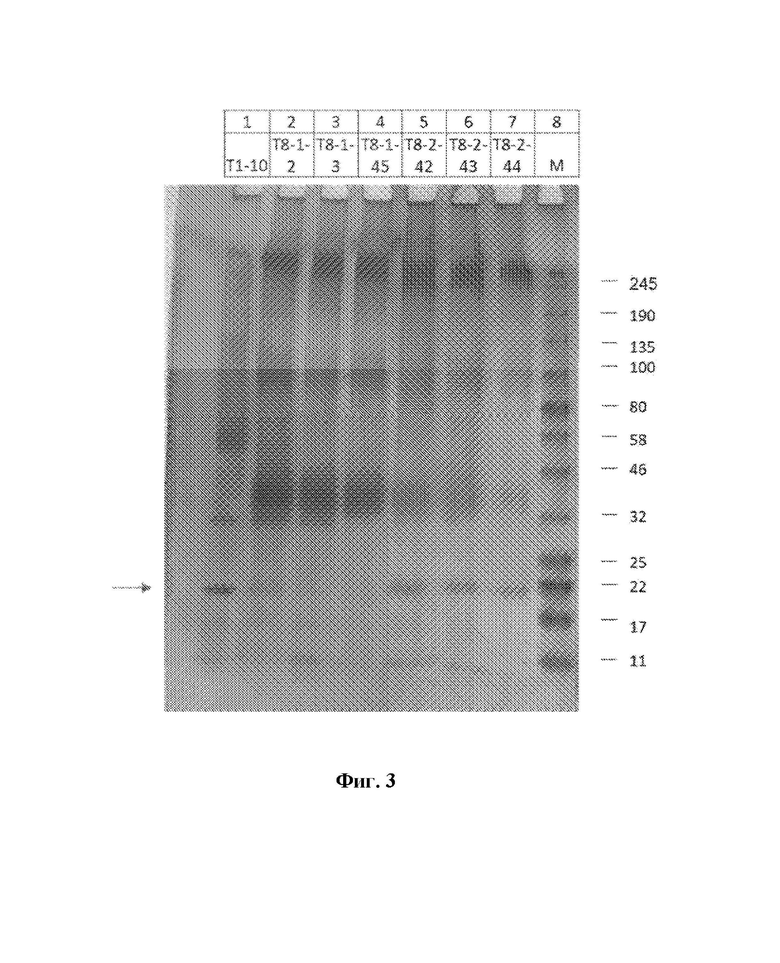

Группа изобретений относится к биотехнологии. Представлены: модифицированный белок, который содержит аминокислотную последовательность, содержащую одно или несколько аминокислотных замещений по сравнению с эталонным белком, при этом модифицированный белок характеризуется по меньшей мере одним улучшенным пищевым свойством по сравнению с эталонным белком, а также раскрыт пищевой продукт, содержащий модифицированный белок. Изобретение применяется в пищевой промышленности, в частности в качестве средства для модификации вкусо-ароматических свойств или средства, усиливающего вкусо-ароматические свойства. 2 н. и 15 з.п. ф-лы, 4 ил., 15 табл., 3 пр.
1. Модифицированный белок для использования в качестве средства для модификации или усиления вкусо-ароматических свойств, содержащий аминокислотную последовательность, содержащую 3-15 аминокислотных замещений относительно эталонного белка, где указанные 3-15 аминокислотных замещений содержат аминокислотное замещение по положениям, соответствующим остаткам E2, E23 и Y65 эталонного белка, где остаток E2 заменен аминокислотой N, Q, S или T, остаток 23 заменен аминокислотой V, I или T, и остаток Y65 заменен аминокислотой R, K или H; при этом модифицированный белок характеризуется улучшенной функциональной термостабильностью относительно эталонного белка и относительно эталонного белка, модифицированного только по двум из остатков E2, E23 и Y65, и где эталонный белок содержит последовательность, представленную в SEQ ID No:5.
2. Модифицированный белок по п. 1, характеризующийся 90-99% идентичностью с эталонным белком.
3. Модифицированный белок по п. 1, имеющий REU (оценку в единицах энергии проекта Rosetta), которая ниже, чем таковая для эталонного белка.
4. Модифицированный белок п. 1, где модифицированный белок дополнительно характеризуется улучшенной подслащивающей способностью по сравнению с эталонным белком.
5. Модифицированный белок п. 1, где модифицированный белок дополнительно характеризуется улучшенными кинетикой ощущения сладости, маскирующим эффектом, усилением вкуса и/или уменьшением привкуса.
6. Модифицированный белок по п. 1, характеризующийся порогом восприятия сладости, являющимся повышенным в по меньшей мере 1,5 раза по сравнению с эталонным белком.
7. Модифицированный белок по п. 1, характеризующийся порогом восприятия сладости, являющимся повышенным в по меньшей мере шесть раз по сравнению с эталонным белком.
8. Модифицированный белок по п. 1, дополнительно характеризующийся по меньшей мере одним из следующего по сравнению с эталонным белком: (1) повышенной термостабильностью, как определено посредством дифференциальной сканирующей флуориметрии (DSF) (2) повышенной pH-стабильностью, (3) повышенной растворимостью и (4) повышенной стабильностью при хранении.
9. Модифицированный белок по п. 1, содержащий аминокислотную последовательность, представленную в SEQ ID NO:16 или SEQ ID NO:17.
10. Модифицированный белок по любому из пп. 1-9 для применения в получении продукта для пероральной доставки.
11. Модифицированный белок по п. 10, где продукт представляет собой пищевой продукт, продукт на основе пищевой добавки или лекарственный препарат.
12. Модифицированный белок по любому из пп. 1-11 для применения в качестве средства для модификации вкусо-ароматических свойств или средства, усиливающего вкусо-ароматические свойства.
13. Модифицированный белок по любому из пп. 1-11 для применения в качестве подсластителя.
14. Пищевой продукт, содержащий модифицированный белок по любому из пп. 1-11.
15. Пищевой продукт по п. 14, содержащий по меньшей мере один пищевой ингредиент.
16. Пищевой продукт по п. 15, где пищевой ингредиент представляет собой по меньшей мере одно из искусственной вкусо-ароматической добавки, пищевой добавки, пищевого красителя, консерванта или сахаросодержащей добавки.
17. Пищевой продукт по п. 14, дополнительно содержащий стевию.
| ZHENG WEIWEI ET AL: "Expression purification and characterization of a novel double-sites mutant of the single-chain sweet-tasting protein monellin (MNEI) with both improved weetness and stability", PROTEIN EXPRESSION AND PURIFICATION,vol | |||
| Крутильная машина для веревок и проч. | 1922 |
|
SU143A1 |
| SERENA LEONE ET AL: "Sweeter and stronger: enhancing sweetness and stability of | |||
Авторы
Даты
2024-07-24—Публикация
2019-05-06—Подача