Область техники, к которой относится изобретение
Настоящая заявка относится к области биомедицины, в частности к мультиспецифичному слитому белку, а также к его применению для лечения опухоли и/или аутоиммунного заболевания.
Уровень техники изобретения
В настоящее время в области терапии опухолей существуют два основных подхода: введение препаратов направленного действия и иммунотерапия. Эти две терапии могут взаимодействовать друг с другом, вызывая более сильный цитотоксический эффект, что приводит к устойчивому и долговременному уменьшению опухолей. Однако взаимодействие между препаратами направленного действия и иммунотерапией очень сложно, и на общий противоопухолевый эффект и профиль токсичности комбинированной терапии могут влиять различные факторы, такие как вид, дозировки, порядок, лекарственные формы и тому подобное.
Белок CD47 представляет собой разновидность трансмембранного гликопротеина, который принадлежит к суперсемейству иммуноглобулинов. Помимо того что CD47 экспрессируется нормальными тканевыми клетками, он чрезмерно экспрессируется многими опухолевыми клетками. Белок CD47 на поверхности опухолевых клеток связывается с белком SIRPα на поверхности макрофагов, что предотвращает фагоцитоз опухолевых клеток макрофагами, это считается одним из механизмов, с помощью которого опухоли избегают распознавания иммунной системой. Блокирование взаимодействия между белком CD47 и SIRPα может подавлять рост опухоли.
Однако современные реагенты, используемые для блокирования взаимодействия между белком CD47 и SIRPα, обладают ограниченной активностью распознавания, их сродство с белком CD47 всегда недостаточно, поэтому они обладают ограниченной способностью ингибировать опухоли. Кроме того, современные препараты-антитела, нацеленные на CD47, могут вызывать побочные эффекты, такие как реакции анемии или тромбоцитопения. Поэтому крайне необходимо получить эффективную терапию, которая специфично направлена как на белок CD47, так и на связанные с ним опухолевые антигены.
Сущность изобретения
Настоящее изобретение относится к слитому белку, включающему в себя первый связывающий домен, который специфично связывает опухоль-ассоциированный антиген, и второй связывающий домен, который специфично связывает белок CD47. Настоящее изобретение также относится к иммуноконъюгату, включающему в себя слитый белок; молекуле нуклеиновой кислоты, кодирующей слитый белок; вектору, композиции и клетке, способной включать в себя и/или экспрессировать слитый белок; и способу получения слитого белка. Слитый белок, иммуноконъюгат, молекула нуклеиновой кислоты, вектор, композиция и клетка настоящего изобретения обладают одним или несколькими из следующих свойств: 1) способны специфично связывать как белок CD47, так и опухоль-ассоциированный антиген; 2) способны специфично блокировать взаимодействие между белком CD47 и SIRPα; 3) способны эффективно ингибировать рост и/или пролиферацию опухолей или опухолевых клеток.
В одном аспекте настоящее изобретение относится к слитому белку, включающему в себя: первый связывающий домен, который специфично связывает опухоль-ассоциированный антиген; и второй связывающий домен, который специфично связывает белок CD47; где второй связывающий домен содержит мутант варианта 1 человеческого SIRPα, этот мутант содержит замену, делецию или добавление аминокислотного остатка в одном или нескольких положениях от сайта 33 до сайта 149 по сравнению с последовательностью, приведенной в SEQ ID NO: 50.
В некоторых вариантах осуществления изобретения мутант содержит аминокислотные замены одного или нескольких аминокислотных остатков, выбранных из группы, состоящей из: R22, I29, I61, V63, E77, Q82, K83, E84, V93, D95, D96, K98, N100, R107, G109 и V132.
В некоторых вариантах осуществления изобретения мутант содержит аминокислотные замены аминокислотных остатков, выбранных из группы, состоящей из: (1) I61, V63, E77, E84, V93, L96, K98, N100 и V132; (2) I61, E77, Q82, K83 и E84; (3) I61, V63, K83, E84 и V132; (4) I61, E77, E84, R107 и V132; (5) I61, V63, E77, K83, E84 и N100; (6) I61, E77, Q82, K83, E84 и R107; (7) I61, E77, Q82, E84, V93, L96, N100, R107, G109 и V132; (8) I61, E77, Q82, K83, E84 и V132; (9) I61; (10) I61, D95, L96, G109 и V132; (11) I61, D95, L96, K98, G109 и V132; (12) I61, E77, E84, V93, R107 и V132; (13) E77, L96, N100, G109 и V132; (14) I61, V63, Q82, E84, D95, L96, N100 и V132; (15) I61, E77, Q82, K83, E84, V93, D95, L96, K98, N100 и V132; (16) I61, E77, Q82, K83, E84 и V93; (17) I61, V63, E77, K83, E84, D95, L96, K98 и N100; (18) I61, V63, E77, K83, D95, L96, K98, N100 и G109; (19) I61, E77, Q82, E84, V93, D95, L96, K98 и N100; и (20) I61, V63, E77, Q82 и E84.
В некоторых вариантах осуществления изобретения мутант содержит одну или несколько аминокислотных замен, выбранных из группы, состоящей из: R22C, I29L, I61L/V/F, V63I, E77I/N/Q/K/H/M/R/N/V/L, Q82S/R/G/N, K83R, E84K/H/D/R/G, V93L/A, D95H/R/E, D96S/T, K98R, N100G/K/D/E, R107N/S, G109R/H и V132L/R/I/S.
В некоторых вариантах осуществления изобретения мутант содержит аминокислотные замены, выбранные из группы, состоящей из: (1) I61L, V63I, E77I, E84K, V93L, L96S, K98R, N100G и V132L; (2) I61V, E77N, Q82S, K83R и E84H; (3) I61F, V63I, K83R, E84K и V132I; (4) I61L, E77Q, E84D, R107N и V132I; (5) I61L, V63I, E77K, K83R, E84D и N100G; (6) I61V, E77H, Q82R, K83R, E84H и R107S; (7) I61L, E77I, Q82G, E84R, V93L, L96T, N100G, R107S, G109R и V132R; (8) I61L, E77M, Q82G, K83R, E84D и V132L; (9) I61L; (10) I61F, D95H, L96S, G109H и V132S; (11) I61F, D95H, L96S, K98R, G109H и V132S; (12) I61L, E77Q, E84D, V93A, R107N и V132I; (13) E77K, L96S, N100K, G109H и V132L; (14) I61L, V63I, Q82G, E84G, D95R, L96S, N100D и V132I; (15) I61L, E77R, Q82N, K83R, E84G, V93L, D95E, L96T, K98R, N100D и V132L; (16) I61V, E77N, Q82S, K83R, E84H и V93A; (17) I61V, V63I, E77V, K83R, E84D, D95E, L96T, K98R и N100E; (18) I61L, V63I, E77V, K83R, D95E, L96S, K98R, N100D и G109R; (19) I61V, E77L, Q82G, E84G, V93L, D95E, L96T, K98R и N100G; и (20) I61L, V63I, E77N, Q82G и E84G.
В некоторых вариантах осуществления изобретения мутант аминокислотную последовательность, показанную в любой из SEQ ID NO: 51-70.
В некоторых вариантах осуществления изобретения первый связывающий домен содержит антитело или его антигенсвязывающий фрагмент или вариант. В некоторых вариантах осуществления изобретения антитело выбрано из группы, состоящей из моноклонального антитела, одноцепочечного антитела, химерного антитела, гуманизированного антитела и полностью человеческого антитела. В некоторых вариантах осуществления изобретения антигенсвязывающий фрагмент выбран из группы, состоящей из Fab, Fab’, F(ab')2, F(ab)2, dAb, выделенных определяющих комплементарность областей CDR, Fv и scFv.
В некоторых вариантах осуществления изобретения вариант антитела или его антигенсвязывающий фрагмент выбран из группы, состоящей из:
a) белка или полипептида с заменой, делецией или добавлением одной или нескольких аминокислот в антителе или его антигенсвязывающем фрагменте; и
b) белка или полипептида с гомологией по последовательности, по меньшей мере, 90% с антителом или его антигенсвязывающим фрагментом.
В некоторых вариантах осуществления изобретения опухоль-ассоциированный антиген включает в себя опухоль-ассоциированный антиген, связанный с несолидной опухолью и/или солидной опухолью. В некоторых вариантах осуществления изобретения опухоль-ассоциированный антиген выбран из группы, состоящей из CD38, AXL и Trop2.
В некоторых вариантах осуществления изобретения первый связывающий домен содержит антитело к CD38 или его антигенсвязывающий фрагмент или вариант. В некоторых вариантах осуществления изобретения CD38 представляет собой CD38 человека.
В некоторых вариантах осуществления изобретения антитело содержит тяжелую цепь антитела или его фрагмента, тяжелая цепь антитела или его фрагмента содержит HCDR1-3, аминокислотные последовательности HCDR1-3 представляют собой SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6, последовательно. В некоторых вариантах осуществления изобретения тяжелая цепь антитела или его фрагмента содержит вариабельную область тяжелой цепи VH, а вариабельная область тяжелой цепи VH содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 8. В некоторых вариантах осуществления изобретения тяжелая цепь антитела или его фрагмента содержит константную область тяжелой цепи, а константная область тяжелой цепи включает в себя IgG. В некоторых вариантах осуществления изобретения IgG выбран из группы, состоящей из IgG1 и IgG4. В некоторых вариантах осуществления изобретения тяжелая цепь антитела содержит любую одну из аминокислотных последовательностей, выбранную из группы, состоящей из: SEQ ID NO: 13, SEQ ID NO: 17, SEQ ID NO: 19 и SEQ ID NO: 21.
В некоторых вариантах осуществления изобретения антитело содержит легкую цепь антитела или его фрагмента, легкая цепь антитела или его фрагмента содержит LCDR1-3, аминокислотные последовательности LCDR1-3 представляют собой SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3, последовательно. В некоторых вариантах осуществления изобретения легкая цепь антитела или его фрагмента содержит вариабельную область легкой цепи VL, а вариабельная область легкой цепи VL содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 7. В некоторых вариантах осуществления изобретения легкая цепь антитела или его фрагмента содержит константную область легкой цепи, а константная область легкой цепи включает в себя Igκ. В некоторых вариантах осуществления изобретения легкая цепь антитела содержит любую одну из аминокислотных последовательностей, выбранную группы, состоящей из: SEQ ID NO: 11, SEQ ID NO: 16, SEQ ID NO: 18 и SEQ ID NO: 20.
В некоторых вариантах осуществления изобретения первый связывающий домен содержит антитело AXL или его антигенсвязывающий фрагмент или вариант. В некоторых вариантах осуществления изобретения AXL представляет собой AXL человека.
В некоторых вариантах осуществления изобретения антитело содержит тяжелую цепь антитела или его фрагмента, тяжелая цепь антитела или его фрагмента содержит HCDR1-3, аминокислотные последовательности HCDR1-3 представляют собой SEQ ID NO: 25, SEQ ID NO: 26 и SEQ ID NO: 27, последовательно. В некоторых вариантах осуществления изобретения тяжелая цепь антитела или его фрагмента содержит вариабельную область тяжелой цепи VH, а вариабельная область тяжелой цепи VH содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 29. В некоторых вариантах осуществления изобретения тяжелая цепь антитела или его фрагмента содержит константную область тяжелой цепи, а константная область тяжелой цепи включает в себя IgG. В некоторых вариантах осуществления изобретения IgG выбран из группы, состоящей из IgG1 и IgG4. В некоторых вариантах осуществления изобретения тяжелая цепь антитела содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 34.
В некоторых вариантах осуществления изобретения антитело содержит легкую цепь антитела или его фрагмента, легкая цепь антитела или его фрагмента содержит LCDR1-3, аминокислотные последовательности LCDR1-3 представляют собой SEQ ID NO: 22, SEQ ID NO: 23 и SEQ ID NO: 24, последовательно. В некоторых вариантах осуществления изобретения легкая цепь антитела или его фрагмента содержит вариабельную область легкой цепи VL, а вариабельная область легкой цепи VL содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 28. В некоторых вариантах осуществления изобретения легкая цепь антитела или его фрагмента содержит константную область легкой цепи, а константная область легкой цепи включает в себя Igκ. В некоторых вариантах осуществления изобретения легкая цепь антитела содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 32.
В некоторых вариантах осуществления изобретения первый связывающий домен содержит антитело Trop2 или его антигенсвязывающий фрагмент или вариант. В некоторых вариантах осуществления изобретения Trop2 представляет собой Trop2 человека.
В некоторых вариантах осуществления изобретения антитело содержит тяжелую цепь антитела или его фрагмента, тяжелая цепь антитела или его фрагмента содержит HCDR1-3, аминокислотные последовательности HCDR1-3 представляют собой SEQ ID NO: 39, SEQ ID NO: 40 и SEQ ID NO: 41, последовательно. В некоторых вариантах осуществления изобретения тяжелая цепь антитела или его фрагмента содержит вариабельную область тяжелой цепи VH, а вариабельная область тяжелой цепи VH содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 43. В некоторых вариантах осуществления изобретения тяжелая цепь антитела или его фрагмента содержит константную область тяжелой цепи, а константная область тяжелой цепи включает в себя IgG. В некоторых вариантах осуществления изобретения IgG выбран из группы, состоящей из IgG1 и IgG4. В некоторых вариантах осуществления изобретения тяжелая цепь антитела содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 48. В некоторых вариантах осуществления изобретения антитело содержит легкую цепь антитела или его фрагмента, легкая цепь антитела или его фрагмента содержит LCDR1-3, аминокислотные последовательности LCDR1-3 представляют собой SEQ ID NO: 36, SEQ ID NO: 37 и SEQ ID NO: 38, последовательно. В некоторых вариантах осуществления изобретения легкая цепь антитела или его фрагмента содержит вариабельную область легкой цепи VL, а вариабельная область легкой цепи VL содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 42. В некоторых вариантах осуществления изобретения легкая цепь антитела или его фрагмента содержит константную область легкой цепи, а константная область легкой цепи включает в себя Igκ. В некоторых вариантах осуществления изобретения легкая цепь антитела содержит аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 46.
В некоторых вариантах осуществления изобретения первый связывающий домен расположен на N-конце второго связывающего домена. В некоторых вариантах осуществления изобретения слитый белок дополнительно содержит линкер, причем линкер расположен на С-конце первого связывающего домена и расположен на N-конце второго связывающего домена. В некоторых вариантах осуществления изобретения линкер содержит аминокислотную последовательность, приведенную в любой из SEQ ID NO: 73-74.
В некоторых вариантах осуществления изобретения слитый белок содержит, по меньшей мере, два из вторых связывающих доменов. В некоторых вариантах осуществления изобретения каждый из вторых связывающих доменов расположен на С-конце первого связывающего домена соответственно.
В другом аспекте настоящее изобретение относится к иммуноконъюгату, который содержит слитый белок.
В другом аспекте настоящее изобретение относится к одной или нескольким выделенным молекулам нуклеиновых кислот, которые кодируют слитый белок или иммуноконъюгат.
В другом аспекте настоящее изобретение относится к одному или нескольким векторам, которые содержат молекулы нуклеиновых кислот.
В другом аспекте настоящее изобретение относится к композиции, которая содержит слитый белок, иммуноконъюгат или молекулы нуклеиновых кислот и, необязательно, фармацевтически приемлемые вспомогательные вещества.
В другом аспекте настоящее изобретение относится к клетке, которая содержит слитый белок, иммуноконъюгат, молекулы нуклеиновых кислот или векторы.
В другом аспекте настоящее изобретение относится к способу получения слитого белка, который включает в себя культивирование клетки в условиях, обеспечивающих экспрессию слитого белка.
В другом аспекте настоящее изобретение относится к применению слитого белка, иммуноконъюгата, молекул нуклеиновых кислот, векторов, композиции или клетки в получении лекарственного средства, при этом лекарственное средство используется для лечения опухоли или аутоиммунного заболевания.
В некоторых вариантах осуществления изобретения опухоль включает в себя несолидную опухоль и солидную опухоль.
В некоторых вариантах осуществления изобретения опухоль включает в себя множественную миелому, лейкоз, неходжкинскую лимфому, лимфому Ходжкина, нейроглиому, герминому, саркому, мезотелиому, плацентому, рак головного мозга, рак кости, рак кожи, рак носоглотки, рак легких, рак полости рта, рак пищевода, рак желудка, рак печени, рак поджелудочной железы, рак предстательной железы, рак кишечника, рак молочной железы, рак шейки матки, рак яичника и рак яичка.
В некоторых вариантах осуществления изобретения аутоиммунное заболевание включает в себя хронический лимфоцитарный тиреоидит, гипертиреоз, инсулинозависимый сахарный диабет, миастению, хронический язвенный колит, пернициозную анемию с хроническим атрофическим гастритом, синдром Гудпасчера, вульгарную пузырчатку, пемфигоид, первичный билиарный цирроз, множественный склероз, идиопатический полиневрит, системную красную волчанку, ревматоидный артрит, склеродермию и узелковый полиартериит.
В другом аспекте настоящее изобретение относится к слитому белку, иммуноконъюгату, молекуле нуклеиновой кислоты, векторам, композиции или клетке, которые применяются для лечения опухолей или аутоиммунных заболеваний.
В другом аспекте настоящее изобретение относится к способу блокирования взаимодействия между белком CD47 и SIRPα, включающему в себя введение нуждающемуся в этом субъекту эффективного количества слитого белка, иммуноконъюгата, молекул нуклеиновых кислот, векторов, композиции или клетки.
В другом аспекте настоящее изобретение относится к способу ингибирования роста и/или пролиферации опухолей или опухолевых клеток, включающему в себя введение нуждающемуся в этом субъекту эффективного количества слитого белка, иммуноконъюгата, молекул нуклеиновых кислот, векторов, композиции или клетки.
Другие аспекты и преимущества настоящего изобретения могут быть легко поняты специалистами в данной области техники из следующего подробного описания. В следующем подробном описании приведены только примеры вариантов осуществления настоящего изобретения. Как будет понятно специалистам в данной области техники, содержание настоящей заявки позволяет специалистам в данной области техники вносить изменения в раскрытые конкретные варианты осуществления изобретения, не выходя за рамки сущности и объема изобретения, к которому относится настоящая заявка. Соответственно, прилагаемые чертежи настоящей заявки и описание настоящей заявки являются только примерными, но не ограничительными.
Краткое описание чертежей
Конкретные отличительные признаки настоящего изобретения, приведены в прилагаемой формуле изобретения. Характеристики и преимущества настоящего изобретения будут лучше поняты со ссылкой на примеры вариантов осуществления изобретения и прилагаемые чертежи, подробно описанные ниже. Прилагаемые чертежи кратко описаны ниже:
На Фигуре 1 показана примерная структура слитого белка настоящего изобретения.
На Фигурах 2 и 3 показана биологическая активность слитого белка настоящего изобретения.
На Фигурах 4A и 4B показана биологическая активность слитого белка настоящего изобретения.
На Фигуре 5 показана схема, иллюстрирующая принцип способа обнаружения взаимодействия между слитым белком настоящего изобретения и CD38 и CD47.
На Фигуре 6 показана биологическая активность слитого белка настоящего изобретения.
На Фигуре 7 показана диаграмма, иллюстрирующая принцип способа обнаружения взаимодействия между слитым белком настоящего изобретения и CD38 и CD47.
На Фигурах 8 и 9 показана биологическая активность слитого белка настоящего изобретения.
На Фигуре 10 показано, что слитый белок настоящего изобретения блокирует взаимодействие между белком CD47 и SIRPα.
На Фигурах 11A-11B, Фигурах 12A-12B и Фигурах 13A-13B показана активность связывания между слитым белком настоящего изобретения и соответствующими антигенами.
На Фигуре 14 показаны результаты визуализации опухоли мышей в различных группах лечения.
На Фигуре 15 показана средняя интенсивность флуоресценции опухоли мышей в различных группах лечения.
На Фигуре 16 показана выживаемость мышей в различных группах лечения.
Подробное описание изобретения
Реализация настоящего изобретения будет проиллюстрирована в следующих конкретных вариантах осуществления изобретения, и другие преимущества и эффекты настоящего изобретения будут легко понятны специалистам, знакомым с технологией, раскрытой в описании.
В настоящем изобретении термин «слитый белок» как правило, относится к белку, полученному слиянием двух или более белков или полипептидов. Слитый белок можно получить искусственно с помощью технологии рекомбинантных ДНК. Например, гены или молекулы нуклеиновых кислот, кодирующие два или более белков или полипептидов, могут быть соединены друг с другом с образованием слитых генов или слитых молекул нуклеиновых кислот, которые могут кодировать слитый белок. Трансляция слитых генов может давать единственный полипептид, который может обладать свойствами, по меньшей мере, одного или даже каждого из двух или более белков или полипептидов до слияния.
В настоящем изобретении термин «специфично связывается» как правило, относится к реакции неслучайного связывания между двумя молекулами, такой как реакция между антителом и антигеном, продуцирующим антитело. Одно антитело, специфичное к определенному антигену, означает связывание с антигеном с аффинностью (KD)≤10-5 M (например, 10-6 M, 10-7 M, 10-8 M, 10-9 M, 10-10 M и т.д.), где обозначение KD относится к отношению скорости диссоциации к скорости связывания (koff/kon), которое может быть определено методом, известным специалистам в данной области техники.
В настоящем изобретении термин «связывающий домен» как правило, означает домен, который может специфично связывать и/или распознавать конкретный эпитоп на мишени (например, антигене). В настоящем изобретении термин «домен», как правило, относится к структурной области по форме близкой к сферической, которая четко выделяется в структуре субъединиц белка. Например, полипептидная цепь сначала может быть обычной вторичной структурой, образованной из соседних аминокислотных остатков в некоторых областях, затем может также быть супервторичной структурой, образованной путем сборки смежных вторичных структурных фрагментов вместе, на такой основе полипептидная цепь может быть свернутым в третичную структуру, которая имеет почти сферическую форму. Для более крупных белковых молекул или субъединиц полипептидная цепь часто может быть третичной структурой, которая образована ассоциацией двух или более относительно независимых региональных структур, которые можно четко различить в пространстве, и такая относительно независимая региональная структура может быть названа доменом.
В настоящем изобретении термины «первый», «второй», используемые в терминах «первый связывающий домен» и «второй связывающий домен», используются только для различия в описании.
В настоящем изобретении термин «белок CD47» как правило, относится к интегрин-ассоциированному белку (IAP), который представляет собой множественный трансмембранный рецептор, принадлежащий суперсемейству иммуноглобулинов. Например, белок CD47 может связываться с интегринами мембран, а также связываться с их лигандами тромбоспондином-1 (TSP-1) и сигнальным регуляторным белком альфа (SIRPα). Белок CD47 в значительной степени экспрессируется на поверхности клеточной мембраны. В настоящем изобретении белок CD47 может включать в себя любые варианты, изотипы и видовые гомологи человеческого CD47. Аминокислотная последовательность человеческого белка CD47 указана как CEJ95640.1 в базе данных GenBank. Белок CD47 может экспрессироваться в естественных условиях клетками или экспрессироваться на клетках, трансфицированных генами CD47.
В настоящем изобретении термин «SIRPα» как правило, относится к регуляторному мембранному гликопротеину из семейства SIRP, который может быть использован в качестве лиганда белка CD47. В настоящем изобретении SIRPα может включать человеческий SIRPα, например, вариант 1 SIRPα и вариант 2 SIRPα. Вариант 2 SIRPα отличается от варианта 1 SIRPα 13 аминокислотами, а его аминокислотная последовательность указана как CAA71403.1 в базе данных GenBank. В настоящем изобретении термин «вариант 1 SIRPα» как правило, относится к белку SIRPα, аминокислотная последовательность которого указана как NCBI RefSeq NP_542970.1 (остатки 31-504 составляют зрелый тип), также аминокислотная последовательность Варианта 1 SIRPα представлен в SEQ ID NO: 50.
В настоящем изобретении термин «вариант» как правило, относится к белковой молекуле, которая имеет гомологию по последовательности с белком без каких-либо мутаций/модификаций, которая сохраняет, по меньшей мере, часть терапевтической и/или биологической активности биоактивного белка. Например, вариант белка может иметь, по меньшей мере, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичности аминокислотной последовательности по сравнению с эталонным биоактивным белком. В некоторых вариантах осуществления изобретения термин «вариант» может включать в себя белки, которые были намеренно модифицированы (например, посредством сайт-направленного мутагенеза, синтеза, вставки или иногда мутации кодирующих генов).
Термин «антитело» как правило, относится к белку, включающему в себя один или несколько полипептидов, преимущественно кодируемых генами иммуноглобулинов или фрагментами генов иммуноглобулинов. Например, гены иммуноглобулина могут включать гены константной области κ, λ, α, γ, δ, ε и μ, а также многочисленные гены вариабельной области иммуноглобулина. Например, легкая цепь может быть классифицирована на κ или λ, которые могут определять типы иммуноглобулина соответственно: Igκ и Igλ. Тяжелая цепь может быть классифицирована на γ, μ, α, δ или ε, которые, в свою очередь, определяют типы иммуноглобулинов соответственно: IgG, IgM, IgA, IgD и IgE. Например, антитело может иметь структурные единицы, включающие в себя тетрамеры, каждый из тетрамеров может состоять из двух пар одинаковых полипептидных цепей, и каждая пара имеет «легкую цепь» (примерно 25 кДа) и «тяжелую цепь» (примерно 50-70 кДа), N-конец каждого члена может определять вариабельную область из примерно 100-110 или более аминокислот, которая в основном отвечает за распознавание антигенов. Например, термины «вариабельная область легкой цепи (VL)» и «вариабельная область тяжелой цепи (VH)» как правило, относятся к вариабельной области легкой цепи и тяжелой цепи соответственно. Антитело может существовать в виде полного иммуноглобулина или множества полностью охарактеризованных фрагментов, полученных путем расщепления различными пептидазами или экспрессии de novo.
В настоящем изобретении термин «антигенсвязывающий фрагмент» как правило, относится к одной или нескольким частям полноразмерного антитела, у которых части в значительной степени сохраняют способность связывать тот же антиген (например, CD38), с которым связывается антитело, и они могут конкурировать с полноразмерным антителом за специфичное связывание с антигеном. Общую теоретическую информацию можно найти в книге Fundamental Immunology, Ch. 7 (Paul, W., ed., Edition 2, Raven Press, N.Y. (1989), полное содержание которой включено в настоящее изобретение путем ссылки. Антигенсвязывающие фрагменты могут быть получены с помощью технологии рекомбинантных ДНК или ферментативного или химического расщепление полного антитела. В некоторых случаях антигенсвязывающий фрагмент содержит Fab, Fab', F(ab')2, (Fab)2, Fd, Fv, dAb и фрагменты определяющих комплементарность областей (CDR), одноцепочечные антитела (например, scFv), химерные антитела, диантитела и полипептид, который содержит, по меньшей мере, часть антитела, достаточную для придания полипептиду способности специфичного связывания с антигеном. Обычные технологии, известные специалистам в данной области техники (например, технология рекомбинантных ДНК или процесс ферментативного или химического расщепления) могут быть использованы для получения антигенсвязывающих фрагментов антитела из данного антитела и скрининга антигенсвязывающих фрагментов антитела на наличие у них такой же специфичности связывания, что и у полноразмерных антител. Например, пепсин может расщеплять антитела в шарнирной области ниже дисульфидной связи с образованием F(ab')2.
В настоящем изобретении термин «Fab» как правило, относится к фрагментам антител, состоящим из доменов VL, VH, CL и CH1.
В настоящем изобретении термин «Fab'» как правило, относится к фрагментам антител с несколькими дополнительными остатками на карбоксильном конце домена CH1 по сравнению с фрагментами Fab. Например, Fab' может содержать один или несколько цистеинов, происходящих из шарнирной области антитела.
В настоящем изобретении термин «F(ab)2» как правило, относится к антигенсвязывающим фрагментам, полученным из спаренных фрагментов Fab, связанных цистеином.
В настоящем изобретении термин «фрагменты dAb» как правило, относится к фрагментам антител, состоящим из доменов VH (Ward et al., Nature 341: 544-546 (1989)).
В настоящем изобретении термин «определяющие комплементарность области CDR» как правило, относится к 3 гипервариабельным областям (HVR) вариабельной области легкой цепи (VL) и вариабельной области тяжелой цепи (VH), а гипервариабельные области также известны как определяющие комплементарность области, поскольку эти области могут формировать точную пространственную комплементарность с антигенными детерминантами.
В настоящем изобретении термин «фрагменты Fv» как правило, относится к фрагментам антитела, состоящим из одноцепочечных доменов VL и VH антитела.
В настоящем изобретении термин «scFv» как правило, относится к молекулам, состоящим из вариабельной области тяжелой цепи и вариабельной области легкой цепи антитела, связанных коротким пептидным линкером, который также известен как одноцепочечное антитело.
В настоящем изобретении термин «моноклональное антитело» как правило, относится к группе антител, которые в значительной степени являются однородными, и различные антитела, содержащиеся в этой группе, могут быть идентичными, за исключением возможного присутствия в следовых количествах встречающихся в природе мутаций. Моноклональные антитела высокоспецифичны непосредственно по отношению к одному антигенному сайту. Кроме того, в отличие от препарата поликлональных антител, которые содержат разные антитела по отношению к разным детерминантам (эпитопам), модификатор «моноклональный» каждого моноклонального антитела в отношении единственной антигенной детерминанте не интерпретируется как требующий получения антител любыми конкретными методами. Например, моноклональные антитела могут быть получены гибридомным методом или моноклональные антитела могут быть получены в бактериальных, эукариотических клетках животных или растений с помощью технологии рекомбинантных ДНК, а также могут быть получены из библиотеки фаговых антител, например, с использованием технологии, описанной в Clackson et al., Nature, 352: 624-628 (1991) и Marks et al., Mol.Biol., 222: 581-597 (1991).
В настоящем изобретении термин «химерное антитело» как правило, относится к такому антителу, где часть каждой аминокислотной последовательности тяжелой или легкой цепи гомологична соответствующей аминокислотной последовательности в антителе из определенного вида или принадлежит к определенной категории, а остальные сегменты цепи гомологичны соответствующим последовательностям другого вида. Например, вариабельные области легкой цепи и тяжелой цепи получены из вариабельных областей антитела у одного вида животных (например, мышей, крыс и т.д.), в то время как константная часть гомологична последовательности антитела, полученного от другого вида (например, человека). Например, для получения химерных антител можно использовать нечеловеческие В-клетки или гибридомные клетки для получения вариабельных областей, а константные области, объединенные с ними, получены от человека. Преимущество вариабельных областей заключается в простоте получения, и на их специфичность не влияет источник объединенных с ними константных областей. Между тем, поскольку константные области химерных антител могут быть получены от человека, химерные антитела с меньшей вероятностью вызывают иммунный ответ во время инъекции, по сравнению с применением антител с константными областями, полученными не от человека.
В настоящем изобретении термин «гуманизированное антитело» как правило, относится к модифицированному антителу, которое снижает иммуногенность антитела, связывающего иммуноглобулин белка и полипептида, полученных от видов, не являющихся человеком (например, мышей или крыс), по отношению к человеку, но при этом сохраняет антигенсвязывающие свойства исходного антитела. Например, гуманизированное антитело можно получить с помощью технологии генной инженерии, и нечеловеческие связывающие домены можно гуманизировать с использованием метода переноса CDR (Jones et al., Nature 321:522 (1986)) и его варианта с помощью технических средств, включающих в себя реконструирование (Verhoeyen, et al., 1988 Science 239:1534-1536; Riechmann, et al., 1988 Nature 332:323-337; Tempest, et al., Bio/Technol 1991 9:266-271), гиперхимеризацию (Queen, et al., 1989 Proc Natl Acad Sci USA 86:10029-10033; Co, et al., 1991 Proc Natl Acad Sci USA 88:2869-2873; Co, et al., 1992 J Immunol 148:1149-1154) и маскировку поверхностных остатков (Mark, et al., «Derivation of therapeutically active humanized and veneered anti-CD18 antibodies.» In: Metcalf B W, Dalton B J, eds. Cellular adhesion: molecular definition to therapeutic potential. New York: Plenum Press, 1994: 291-312). Если другие области, например, шарнирная область и домены константной области, также происходят из нечеловеческих источников, то эти области также могут быть гуманизированы.
В настоящем изобретении термин «полностью человеческое антитело» как правило, относится к антителу, полученному путем экспрессии генов, кодирующих человеческое антитело, у генно-инженерного животного с делецией гена антитела. Например, с помощью трансгенной или трансхромосомной технологии все гены, кодирующие человеческое антитело, могут быть перенесены в генно-инженерное животное с делецией гена антитела, чтобы животное могло экспрессировать человеческое антитело.
Используемый в настоящем изобретении термин «гомология по последовательности» как правило, относится к сходству последовательностей или возможности взаимозаменяемости между двумя или более полинуклеотидными последовательностями или между двумя или более полипептидными последовательностями. Когда для определения идентичности последовательностей, сходства или гомологии между двумя различными аминокислотными последовательностями используется компьютерная программа (например, Emboss Needle или BestFit), можно использовать настройки по умолчанию или можно выбрать подходящую матрицу оценок (например, blosum 45 или blosum 80) для оптимизации показателей идентичности, сходства или гомологии. В некоторых вариантах осуществления изобретения гомологичные полинуклеотиды представляют собой те последовательности, которые гибридизируются в строгих условиях, и они имеют идентичность по последовательности, составляющую, по меньшей мере, 60%, по меньшей мере, 65%, по меньшей мере, 70%, по меньшей мере, 80%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 97%, по меньшей мере, 98%, по меньшей мере, 99% или даже 100% между этими последовательностями. При выравнивании последовательностей эквивалентной длины гомологичные полипептиды имеют идентичность по последовательности, по меньшей мере, 80%, или, по меньшей мере, 90%, или, по меньшей мере, 95%, или, по меньшей мере, 97%, или, по меньшей мере. 98%, или могут иметь идентичность по последовательности, по меньшей мере, 99%.
В настоящем изобретении термины «CD38», «белок CD38» и «антиген CD38» могут использоваться взаимозаменяемо в настоящей заявке и включают в себя любые варианты, изотипы и видовые гомологи человеческого CD38, которые могут экспрессироваться в естественных условиях клетками или экспрессируется на клетках, трансфицированных генами CD38. Синонимы CD38, хорошо известные в данной области техники, включают в себя ADP-рибозилциклазу 1, cADPr-гидролазу 1, Cd38-rs1, циклическую ADP-рибозогидролазу 1, I-19 и антиген NIM-R5. CD38 может в высокой степени экспрессироваться на поверхности миеломных клеток.
В настоящем изобретении термины «AXL», «белок AXL» и «антиген AXL» могут использоваться взаимозаменяемо в настоящей заявке и, как правило, относятся к типу белка, принадлежащего к семейству тирозинкиназ, который имеет общий лиганд Gas6. В настоящем изобретении высокая экспрессия AXL может быть сильно связана с образованием опухоли, и AXL можно использовать в качестве маркера прогрессирования рака. В настоящем изобретении AXL может быть AXL человека, аминокислотная последовательность которого находится в базе данных GenBank под регистрационным номером AAH32229.
В настоящем изобретении термин «Trop2» как правило, относится к опухоль-ассоциированному преобразователю кальциевого сигнала 2, который может быть известен как TACSTD2, EGP-1, GA733-1 или GP50 и т.д. Trop2 в клетках может быть локализован в клеточной мембране, и его положительно окрашиваемые участки могут быть в основном на клеточной мембране. В нормальных тканях Trop2 минимально экспрессируется, но сверхэкспрессируется в опухолевых клетках, поэтому его можно использовать в качестве мишени для терапии опухолей. В настоящем изобретении Trop2 может представлять собой Trop2 человека, аминокислотная последовательность которого находится в базе данных GenBank под регистрационным номером NP_002344.
Как правило, в полипептидной цепи аминогруппа связана с другой карбоксильной группой в полипептидной цепи так, чтобы стать одной цепью, но на двух концах белка остаются аминокислотные остатки, которые не образуют пептидных связей соответственно, которые представляют собой конец полипептидной цепи, несущий свободные аминогруппы, и конец полипептидной цепи, несущий карбоксильные группы, соответственно. В настоящем изобретении термин «N-конец» как правило, относится к концу полипептидной цепи с аминокислотным остатком, несущим свободные аминогруппы. В настоящем изобретении термин «С-конец» как правило, относится к концу полипептидной цепи с аминокислотным остатком, несущим свободные карбоксильные группы.
В настоящем изобретении термин «молекулы нуклеиновых кислот» как правило, относится к нуклеотидам, дезоксирибонуклеотидам или рибонуклеотидам или их аналогам в изолированных формах любой длины, которые выделены из естественной среды или синтезированы искусственно.
В настоящем изобретении термин «иммуноконъюгат», как правило, относится к молекуле полипептида с иммунной функцией, в которой конъюгированы одна или несколько гетерогенных молекул (включая без ограничений цитотоксин). В настоящем изобретении термины «конъюгат» и «связь», «слияние» могут использоваться взаимозаменяемо в настоящей заявке и, как правило, относятся к тому, что два или более химических элемента, последовательностей или компонентов связаны вместе, например, путем химической конъюгации или рекомбинации. Гетерогенная молекула может быть цитотоксином, химиотерапевтическим агентом и т.д. Например, слитый белок настоящего изобретения может быть конъюгирован с одной или несколькими гетерогенными молекулами (например, цитотоксином) для получения иммуноконъюгата.
В настоящем изобретении термин «вектор» относится к носителю для доставки нуклеиновой кислоты, в который может быть вставлен полинуклеотид, кодирующий определенный белок, так чтобы белок мог быть экспрессирован. Вектор заставляет элемент генетического материала, который он несет, экспрессироваться в клетке-хозяине посредством трансформации, трансдукции или трансфекции клетки-хозяина. Например, векторы включают в себя плазмиду; фагмид; космиду; искусственные хромосомы, такие как искусственная хромосома дрожжей (YAC), бактериальная искусственная хромосома (BAC) или искусственная хромосома на основе P1 (PAC); фаги, такие как фаг λ или фаг M13; и вирусы животных и тому подобное. Разновидности вирусов животных, используемых в качестве векторов, включают в себя ретровирус (включая лентивирус), аденовирус, аденоассоциированный вирус, вирус герпеса (например, вирус простого герпеса), поксвирус, бакуловирус, вирус папилломы, паповавирус (например, SV40). Вектор может содержать различные элементы для контроля экспрессии, включая последовательность промотора, последовательность инициации транскрипции, последовательность энхансера, элемент отбора и репортерный ген. Кроме того, вектор может также содержать ориджин репликации. Вектор также может содержать компонент, который помогает ему проникнуть в клетку, такой как вирион, липосома или белковая оболочка, но не только эти компоненты.
В настоящем изобретении термин «опухоль» как правило, относится к новообразованиям, возникшим в результате пролиферации локальных гистоцитов в организмах млекопитающих (например, клеток или их частей) под действием различных онкогенных факторов. В настоящем изобретении опухоль может включать в себя солидную опухоль и несолидную опухоль. Солидная опухоль может включать в себя нейроглиому, герминому, саркому, мезотелиому, плацентому, рак головного мозга, рак костей, рак кожи, рак носоглотки, рак легких, рак полости рта, рак пищевода, рак желудка, рак печени, рак поджелудочной железы, рак предстательной железы, рак кишечника, рак молочной железы, рак шейки матки, рак яичника и рак яичка. В настоящем изобретении несолидная опухоль может включать в себя множественную миелому, лейкоз, неходжкинскую лимфому, лимфому Ходжкина.
В настоящем изобретении термин «лимфома» как правило, относится к злокачественной опухоли лимфатической системы. Возникновение лимфомы может быть связано с тем, что клетки или лимфоциты лимфатических узлов начинают бесконтрольно воспроизводиться и вырабатывают раковые клетки с аномальными способностями, которые могут проникать в другие ткани по всему организму. Признаки и симптомы у пациентов могут включать в себя лимфаденэктазию, лихорадку, ночное потоотделение, истощение или зуд, а также постоянное чувство усталости. Существуют различные подтипы лимфомы, двумя основными из которых являются лимфома Ходжкина и неходжкинская лимфома. В настоящем изобретении термин «лимфома Ходжкина (ЛХ)» как правило, относится к лимфоме, продуцируемой лимфоцитарными лейкоцитами. Около половины случаев лимфомы Ходжкина вызываются вирусами Эпштейна-Барр. В настоящем изобретении термин «неходжкинская лимфома (НХЛ)» как правило, относится к другим типам лимфомы, за исключением лимфомы Ходжкина.
В настоящем изобретении термин «лейкоз» как правило, относится к злокачественному пролиферативному заболеванию кроветворной системы и обычно относится к типу заболевания, вызванному массивной пролиферацией или накоплением лейкозных клеток. Клетки клонального лейкоза размножаются и накапливаются в костном мозге и других кроветворных тканях в значительной степени из-за таких механизмов, как неконтролируемая пролиферация, дисдифференцировка и блокирование апоптоза, и инфильтрируют другие негематопоэтические ткани и органы, и в то же время подавляют нормальную кроветворную функцию. Клиническими проявлениями являются анемия разной степени, кровотечение, инфекционная лихорадка, а также опухоль печени, селезенки, лимфатических узлов и скелетная боль.
В настоящем изобретении термин «множественная миелома» как правило, относится к злокачественной опухоли, поражающей костный мозг, вызванной аномальной пролиферацией плазмоцитов. Множественная миелома вызывает накопление раковых клеток в костном мозге, в результате чего здоровые гемоциты удаляются. Раковые клетки вырабатывают аномальные белки, которые могут вызывать осложнения, а не нормальные антитела. Заболеваемость множественной миеломой может увеличиваться у пожилых людей. При лечении множественной миеломы при помощи химиотерапии имеет место низкая скорость пролиферации клеток и сильная лекарственная устойчивость, что ограничивает химиотерапевтическую эффективность. Более 90% пациентов с множественной миеломой обладают химиотерапевтической резистентностью.
В настоящем изобретении термин «клетка Раджи», как правило, относится к непрерывным линиям клеток человека, которые могут продуцировать штаммы вируса Эпштейна-Барр. Вирусами трансформируют лимфоциты пуповины и индуцируют ранние антигены в клетках Раджи. Клетки Раджи могут широко использоваться в качестве хозяев для трансфекции, а также могут использоваться для определения гемопоэтических клеток и других злокачественных клеточных новообразований. Кроме того, клетки Раджи имеют и экспрессируют несколько рецепторов некоторых компонентов комплемента и Fc-рецепторы иммуноглобулина G, поэтому их также можно использовать для обнаружения иммунных комплексов.
В настоящем изобретении термин «аутоиммунное заболевание» как правило, относится к заболеванию, вызванному иммунным ответом организма на аутоантигены, приводящим к повреждению его собственных тканей. Аутоиммунные заболевания можно разделить на два основных класса: органоспецифичные аутоиммунные заболевания и системные аутоиммунные заболевания. Органоспецифичные аутоиммунные заболевания могут относиться к патологическим повреждениям и дисфункциям тканей и органов, но их локализация ограничена только определенным органом, на который нацелены антитела или сенсибилизированные лимфоциты, и эти заболевания могут включать в себя хронический лимфоцитарный тиреоидит, гипертиреоз, инсулинозависимый сахарный диабет, миастению, хронический язвенный колит, пернициозную анемию с хроническим атрофическим гастритом, синдром Гудпасчера, вульгарную пузырчатку, пемфигоид, первичный билиарный цирроз, множественный склероз и острый идиопатический полиневрит. Системные аутоиммунные заболевания могут представлять собой множественные поражения органов по всему организму из-за обширного отложения комплексов антиген-антитело в сосудистой стенке или могут быть вызваны целлюлозоподобным некротическим воспалением сосудистой стенки и интерстиция и последующей пролиферацией коллагеновых волокон во множестве органы, вызванной иммунным поражением; и системные аутоиммунные заболевания могут включать в себя системную красную волчанку, ревматоидный артрит, склеродермию и узелковый полиартериит.
В настоящем изобретении термин «АЗКЦ» означает «антителозависимая клеточноопосредованная цитотоксичность» (АЗКЦ) и, как правило, относится к тому, что клетки с цитолитической активностью при помощи экспрессируемых на их поверхности Fc-рецепторов (FcR) распознают Fc-сегменты, находящиеся на антигене-мишени, благодаря чему эффекторные клетки иммунной системы активно лизируют клетки-мишени, в которых поверхностный антиген мембраны связался со специфичным антителом.
В настоящем изобретении термин «содержать» как правило, означает включение четко определенных признаков, но не исключение других факторов.
В настоящем изобретении термин «примерно» как правило, относится к вариациям в диапазоне 0,5-10% выше или ниже указанного значения, например, вариациям в диапазоне 0,5%, 1%, 1,5%, 2%, 2,5%, 3%, 3,5%, 4%, 4,5%, 5%, 5,5%, 6%, 6,5%, 7%, 7,5%, 8%, 8,5%, 9%, 9,5% или 10% выше или ниже указанного значения.
Слитый белок
В одном аспекте настоящее изобретение относится к слитому белку, слитый белок может содержать первый связывающий домен и второй связывающий домен. Первый связывающий домен может специфично связываться с опухоль-ассоциированным антигеном; второй связывающий домен может специфично связываться с белком CD47, второй связывающий домен может содержать мутант варианта 1 человеческого SIRPα, и этот мутант содержит замену, делецию или добавление аминокислотных остатков в одном или нескольких (например, 1-2, 1-3, 1-4, 1-5, 1-6, 1-7, 1-8, 1-9, 1-10 или более) положениях от сайта 33 до сайта 149 по сравнению с последовательностью, приведенной в SEQ ID NO: 50. Слитый белок настоящего изобретения может специфично связывать как опухоль-ассоциированный антиген, так и белок CD47, тем самым играя роль в лечении опухолей и/или аутоиммунных заболеваний.
В настоящем изобретении термин «первый связывающий домен» как правило, относится к домену, который может специфично связывать опухоль-ассоциированный антиген. Термин «второй связывающий домен» как правило, относится к домену, который может специфично связывать белок CD47.
В настоящем изобретении опухоль-ассоциированный антиген может включать в себя опухоль-ассоциированный антиген, связанный с несолидной опухолью и/или солидной опухолью. Например, опухоль-ассоциированный антиген может быть выбран из группы, состоящей из CD38, AXL и Trop2.
Второй связывающий домен, специфично связывающий CD47
В настоящем изобретении мутант (например, мутант варианта 1 человеческого SIRPα, который специфично связывает белок CD47) содержит аминокислотные замены в одном или нескольких (например, 1-2, 1-3, 1-4, 1- 5, 1-6, 1-7, 1-8, 1-9, 1-10 или более) положениях аминокислотных остатков, выбранных из группы, состоящей из: R22, I29, I61, V63, E77, Q82, K83, E84, V93, D95, D96, K98, N100, R107, G109 и V132.
В настоящем изобретении положения аминокислотных остатков в аминокислотных заменах означают количество остатков, определенных на основе аминокислотной последовательности, приведенной SEQ ID NO: 50.
В настоящем изобретении «аминокислотная замена Xn» означает, что аминокислотная замена происходит в остатке X положения n в соответствующей аминокислотной последовательности, как показано в SEQ ID NO: 50, где n представляет собой положительное целое число, X представляет собой сокращенное обозначение любого аминокислотного остатка. Например, «аминокислотная замена I61» указывает на то, что аминокислотная замена происходит в остатке I положения 61 в соответствующей аминокислотной последовательности, как показано в SEQ ID NO: 50.
В настоящем изобретении аминокислотные замены могут быть неконсервативными заменами. Неконсервативные замены могут включать в себя изменение аминокислотных остатков в целевых белках или полипептидах в неконсервативной форме, например, изменение аминокислотного остатка с определенным размером боковой цепи или определенным свойством (например, гидрофильным) на другой аминокислотный остаток с другой размером боковой цепи или другим свойством (например, гидрофобным).
В настоящем изобретении аминокислотные замены также могут быть консервативными заменами. Консервативные замены могут включать в себя изменение аминокислотных остатков в целевых белках или полипептидах в консервативной форме, например, замену аминокислотного остатка с определенным размером боковой цепи или определенным свойством (например, гидрофильным) на другой аминокислотный остаток с таким же или подобный размер боковой цепи или таким же или подобным свойством (например, все еще гидрофильным). Такие консервативные замены обычно не сильно влияют на структуру или функцию полученного белка. В настоящем изобретении вариант аминокислотной последовательности слитого белка или его фрагмента может содержать консервативные аминокислотные замены, которые существенно не изменяют структуру или функцию белка (например, мутант варианта 1 человеческого SIRPα, который блокирует CD47 и специфично связывает белок CD47).
В качестве примера, взаимные замены различных аминокислот в каждой группе следующих групп могут рассматриваться как консервативные замены в настоящем изобретении: группа аминокислот с неполярными боковыми цепями: аланин, валин, лейцин, изолейцин, пролин, фенилаланин, триптофан и метионин; группа незаряженных аминокислот с полярными боковыми цепями: глицин, серин, треонин, цистеин, тирозин, аспарагин и глутамин; группа отрицательно заряженных аминокислот с полярными боковыми цепями: аспарагиновая кислота и глутаминовая кислота; положительно заряженные основные аминокислоты: лизин, аргинин и гистидин; и аминокислоты, несущие фенильные группы: фенилаланин, триптофан и тирозин.
В настоящем изобретении мутант может содержать аминокислотные замены аминокислотных остатков, выбранных из группы, состоящей из: (1) I61, V63, E77, E84, V93, L96, K98, N100 и V132; (2) I61, E77, Q82, K83 и E84; (3) I61, V63, K83, E84 и V132; (4) I61, E77, E84, R107 и V132; (5) I61, V63, E77, K83, E84 и N100; (6) I61, E77, Q82, K83, E84 и R107; (7) I61, E77, Q82, E84, V93, L96, N100, R107, G109 и V132; (8) I61, E77, Q82, K83, E84 и V132; (9) I61; (10) I61, D95, L96, G109 и V132; (11) I61, D95, L96, K98, G109 и V132; (12) I61, E77, E84, V93, R107 и V132; (13) E77, L96, N100, G109 и V132; (14) I61, V63, Q82, E84, D95, L96, N100 и V132; (15) I61, E77, Q82, K83, E84, V93, D95, L96, K98, N100 и V132; (16) I61, E77, Q82, K83, E84 и V93; (17) I61, V63, E77, K83, E84, D95, L96, K98 и N100; (18) I61, V63, E77, K83, D95, L96, K98, N100 и G109; (19) I61, E77, Q82, E84, V93, D95, L96, K98 и N100; и (20) I61, V63, E77, Q82 и E84.
В настоящем изобретении мутант может содержать одну или несколько (например, 1-2, 1-3, 1-4, 1-5, 1-6, 1-7, 1-8, 1-9, 1-10 или более) аминокислотных замен, выбранных из группы, состоящей из: R22C, I29L, I61L/V/F, V63I, E77I/N/Q/K/H/M/R/N/V/L, Q82S/R/G/N, K83R, E84K/H/D/R/G, V93L/A, D95H/R/E, D96S/T, K98R, N100G/K/D/E, R107N/S, G109R/H и V132L/R/I/S.
В настоящем изобретении аминокислотная замена «XnY/Z» означает, что остаток X в положении n в соответствующей аминокислотной последовательности, как показано в SEQ ID NO: 50, заменен аминокислотным остатком Y или аминокислотным остатком Z, где n представляет собой положительное целое число, X, Y и Z представляют собой сокращенное обозначение любых аминокислотных остатков независимо, а X отличается от Y или Z. Например, аминокислотная замена «I61L/V/F» означает, что остаток I в положении 61 в соответствующей аминокислотной последовательности, как показано в SEQ ID NO: 50, заменен аминокислотным остатком L, V или F.
В настоящем изобретении мутант может содержать аминокислотные замены, выбранные из группы, состоящей из: (1) I61L, V63I, E77I, E84K, V93L, L96S, K98R, N100G и V132L; (2) I61V, E77N, Q82S, K83R и E84H; (3) I61F, V63I, K83R, E84K и V132I; (4) I61L, E77Q, E84D, R107N и V132I; (5) I61L, V63I, E77K, K83R, E84D и N100G; (6) I61V, E77H, Q82R, K83R, E84H и R107S; (7) I61L, E77I, Q82G, E84R, V93L, L96T, N100G, R107S, G109R и V132R; (8) I61L, E77M, Q82G, K83R, E84D и V132L; (9) I61L; (10) I61F, D95H, L96S, G109H и V132S; (11) I61F, D95H, L96S, K98R, G109H и V132S; (12) I61L, E77Q, E84D, V93A, R107N и V132I; (13) E77K, L96S, N100K, G109H и V132L; (14) I61L, V63I, Q82G, E84G, D95R, L96S, N100D и V132I; (15) I61L, E77R, Q82N, K83R, E84G, V93L, D95E, L96T, K98R, N100D и V132L; (16) I61V, E77N, Q82S, K83R, E84H и V93A; (17) I61V, V63I, E77V, K83R, E84D, D95E, L96T, K98R и N100E; (18) I61L, V63I, E77V, K83R, D95E, L96S, K98R, N100D и G109R; (19) I61V, E77L, Q82G, E84G, V93L, D95E, L96T, K98R и N100G; и (20) I61L, V63I, E77N, Q82G и E84G.
В настоящем изобретении, основанные на варианте 1 человеческого SIRPα (аминокислотная последовательность, приведенная в SEQ ID NO: 50, т.е. остатки в положениях с 33 по 149 в аминокислотной последовательности человеческого SIRPα), мутанты варианта 1 SIRPα, содержащие аминокислотные замены вышеуказанных групп (1) - (20), соответственно, обозначены как M1, M5, M12, M35, M37, M41, M57, M67, M81, M82, M84, M91, M99, M102, M111, M122, M126, M130, M135 и M145 последовательно. Мутанты варианта 1 SIRPα могут последовательно содержать аминокислотные последовательности, приведенные в SEQ ID NO: 51 - SEQ ID NO: 70.
В некоторых вариантах осуществления изобретения мутант варианта 1 SIRPα представляет собой M91, и мутант варианта 1 SIRPα содержит аминокислотную последовательность, приведенную в SEQ ID NO: 62.
Первый связывающий домен, специфично связывающий опухоль-ассоциированный антиген
В настоящем изобретении первый связывающий домен может содержать антитело или его антигенсвязывающий фрагмент или вариант. Например, антитело может быть выбрано из группы, состоящей из моноклональных антител, одноцепочечных антител, химерных антител, гуманизированных антител и полностью человеческих антител. Например, антигенсвязывающий фрагмент выбран из группы, состоящей из: Fab, Fab', (Fab')2, F(ab)2, dAb, выделенных определяющих комплементарность областей CDR, Fv и scFv.
В настоящем изобретении вариант антитела или его антигенсвязывающий фрагмент может представлять собой белок или полипептид с заменой, делецией или добавлением одного или нескольких (например, 1-2, 1-3, 1-4, 1- 5, 1-6, 1-7, 1-8, 1-9, 1-10 или более) аминокислот в антителе или его антигенсвязывающем фрагменте. Альтернативно вариант антитела или его антигенсвязывающий фрагмент может представлять собой белок или полипептид с гомологией по последовательности, по меньшей мере, 90% (например, по меньшей мере, 90%, по меньшей мере, 91%, по меньшей мере, 92%, по меньшей мере, 93%, по меньшей мере, 94%, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98%, по меньшей мере, 99% или, по меньшей мере, 100%) с антителом или его антигенсвязывающим фрагментом.
Первый связывающий домен, специфично связывающий CD38
Антитело, или его антигенсвязывающий фрагмент или вариант в соответствии с настоящим изобретением могут уничтожать опухолевые клетки и/или ингибировать рост опухоли путем специфичного связывания белка CD38. Например, опухоль может включать CD38-положительную опухоль. Например, CD38-положительная опухоль может быть выбрана из группы, состоящей из миеломы, лимфомы и лейкоза. Кроме того, например, опухоль выбрана из группы, состоящей из неходжкинской лимфомы и лимфомы Ходжкина. Опухолевые клетки могут быть выбраны из группы, состоящей из клеток Раджи, клеток Дауди, клеток Рамос и клеток RPMI8226. В настоящем изобретении антитело, его антигенсвязывающий фрагмент или вариант могут уничтожать клетки множественной миеломы, лимфомы, лейкоза, неходжкинской лимфомы и лимфомы Ходжкина или подавлять рост множественной миеломы, лимфомы, лейкоза, неходжкинской лимфомы и лимфомы Ходжкина.
Белок CD38 настоящего изобретения может быть белком CD38 человека или его функциональным фрагментом. Например, белок CD38 может не быть белком CD38 мыши или может не быть белком CD38 крысы. В некоторых вариантах осуществления изобретения антитело, его антигенсвязывающий фрагмент или вариант настоящего изобретения практически не связывается с белком CD38 мыши или белком CD38 крысы.
Антитело, его антигенсвязывающий фрагмент или вариант в соответствии с настоящим изобретением могут конкурировать с эталонным антителом за связывание с белком CD38. Эталонное антитело может содержать вариабельную область легкой цепи и вариабельную область тяжелой цепи. Например, вариабельная область легкой цепи эталонного антитела может содержать LCDR1-3, аминокислотные последовательности LCDR1-3 представляют собой SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3, последовательно. Вариабельная область тяжелой цепи эталонного антитела может содержать HCDR1-3, аминокислотные последовательности HCDR1-3 представляют собой SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6, последовательно.
Например, аминокислотная последовательность вариабельной области легкой цепи эталонного антитела может быть SEQ ID NO: 7, а аминокислотная последовательность вариабельной области тяжелой цепи эталонного антитела может быть SEQ ID NO: 8. Кроме того, например, легкая цепь эталонного антитела может содержать любую одну из аминокислотных последовательностей, выбранных из группы, состоящей из: SEQ ID NO: 11, SEQ ID NO: 16, SEQ ID NO: 18 и SEQ ID NO: 20; и тяжелая цепь эталонного антитела может содержать любую одну из аминокислотных последовательностей, выбранных из группы, состоящей из: SEQ ID NO: 13, SEQ ID NO: 17, SEQ ID NO: 19 и SEQ ID NO: 21. Например, легкая цепь эталонного антитела может содержать аминокислотную последовательность, приведенную в SEQ ID NO: 11, а тяжелая цепь эталонного антитела может содержать аминокислотную последовательность, приведенную в SEQ ID NO: 13. Например, легкая цепь эталонного антитела может содержать аминокислотную последовательность, приведенную в SEQ ID NO: 16, а тяжелая цепь эталонного антитела может содержать аминокислотную последовательность, приведенную в SEQ ID NO: 17. Например, легкая цепь эталонного антитела может содержать аминокислотную последовательность, приведенную в SEQ ID NO: 18, а тяжелая цепь эталонного антитела может содержать аминокислотную последовательность, приведенную в SEQ ID NO: 19. Например, легкая цепь эталонного антитела может содержать аминокислотную последовательность, приведенную в SEQ ID NO: 20, а тяжелая цепь эталонного антитела может содержать аминокислотную последовательность, приведенную в SEQ ID NO: 21.
Антитело, его антигенсвязывающий фрагмент или вариант настоящего изобретения могут содержать легкую цепь антитела или его фрагмента. Например, легкая цепь антитела или его фрагмента может содержать константную область Igκ, например, может содержать константную область Igκ человека.
Например, легкая цепь антитела или его фрагмента может содержать LCDR1, и LCDR1 может содержать аминокислотную последовательность, как показано ниже в SEQ ID NO: 1. Легкая цепь антитела или его фрагмента может содержать LCDR2, и LCDR2 может содержать аминокислотную последовательность, как показано ниже в SEQ ID NO: 2. Легкая цепь антитела или его фрагмента может содержать LCDR3, и LCDR3 может содержать аминокислотную последовательность, как показано ниже в SEQ ID NO: 3.
Легкая цепь антитела или его фрагмента настоящего изобретения может содержать вариабельную область легкой цепи VL, и аминокислотная последовательность вариабельной области легкой цепи VL может представлять собой SEQ ID NO: 7. В некоторых вариантах осуществления изобретения легкая цепь антитела или его фрагмента может содержать любую одну из аминокислотных последовательностей, выбранных из группы, состоящей из: SEQ ID NO: 11, SEQ ID NO: 16, SEQ ID NO: 18 и SEQ ID NO: 20.
Антитело или его антигенсвязывающий фрагмент настоящего изобретения может содержать тяжелую цепь антитела или его фрагмента. Например, тяжелая цепь антитела или его фрагмента дополнительно содержит человеческую константную область. Где человеческая константная область может включать в себя константную область человеческого IgG. Где константная область IgG может включать в себя константную область человеческого IgG1 или IgG4.
Например, тяжелая цепь антитела или его фрагмента может содержать HCDR1, и HCDR1 может содержать аминокислотную последовательность, как показано ниже в SEQ ID NO: 4. Тяжелая цепь антитела или его фрагмента может содержать HCDR2, и HCDR2 может содержать аминокислотную последовательность, как показано ниже в SEQ ID NO: 5. Кроме того, например, тяжелая цепь антитела или его фрагмента может содержать HCDR3, и HCDR3 может содержать аминокислотную последовательность, как показано ниже в SEQ ID NO: 6.
Тяжелая цепь антитела или его фрагмента может содержать вариабельную область тяжелой цепи VH, и вариабельная область тяжелой цепи VH может содержать аминокислотную последовательность, как показано ниже в SEQ ID NO: 8. В некоторых вариантах осуществления изобретения тяжелая цепь антитела может содержать любую одну из аминокислотных последовательностей, выбранных из группы, состоящей из: SEQ ID NO: 13, SEQ ID NO: 17, SEQ ID NO: 19 и SEQ ID NO: 21.
В некоторых вариантах осуществления изобретения в антителе или его антигенсвязывающем фрагменте настоящего изобретения аминокислотная последовательность LCDR1 может содержать SEQ ID NO: 1; аминокислотная последовательность LCDR2 может содержать SEQ ID NO: 2; аминокислотная последовательность LCDR3 может содержать SEQ ID NO: 3; и аминокислотная последовательность HCDR1 может содержать SEQ ID NO: 4; или аминокислотная последовательность HCDR2 может содержать SEQ ID NO: 5; аминокислотная последовательность HCDR3 может содержать SEQ ID NO: 6. Например, антитело или его антигенсвязывающий фрагмент может содержать антитело SG003 или антитело, имеющее такие же LCDR1-3 и HCDR1-3, что и антитело SG003. В некоторых вариантах осуществления изобретения легкая цепь антитела или его антигенсвязывающий фрагмент настоящего изобретения может содержать вариабельную область легкой цепи, аминокислотная последовательность которой может включать SEQ ID NO: 7; и его тяжелая цепь может содержать вариабельную область тяжелой цепи, аминокислотная последовательность которой может содержать SEQ ID NO: 8. Например, антитело или его антигенсвязывающий фрагмент может содержать антитело SG003 или антитело, имеющее такую же вариабельную область легкой цепи и вариабельную область тяжелой цепи, что и антитело SG003. В некоторых вариантах осуществления изобретения антитело или его антигенсвязывающий фрагмент настоящего изобретения может содержать легкую цепь и тяжелую цепь, аминокислотная последовательность легкой цепи приведена в SEQ ID NO: 11, а аминокислотная последовательность тяжелая цепь приведена в SEQ ID NO: 13. Например, антитело или его антигенсвязывающий фрагмент может содержать антитело SG003 или иметь такие же аминокислотные последовательности легкой цепи и тяжелой цепи, что и антитело SG003.
В некоторых вариантах осуществления изобретения антитело настоящего изобретения может представлять собой SG003. Аминокислотные последовательности LCDR1-3 в антителе SG003 приведены в SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3 соответственно; аминокислотная последовательность VL приведена в SEQ ID NO: 7; аминокислотные последовательности HCDR1-3 приведены в SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6 соответственно; аминокислотная последовательность VH приведена в SEQ ID NO: 8; аминокислотная последовательность легкой цепи приведена в SEQ ID NO: 11; а аминокислотная последовательность тяжелой цепи приведена в SEQ ID NO: 13.
Антитело или его антигенсвязывающий фрагмент или вариант настоящего изобретения может также содержать одну или несколько случайных мутаций (например, одну или несколько, например, одну или несколько замен аминокислот) в аминокислотной последовательности легкой цепи и/или тяжелой цепи антитела SG003. Например, антитело, его антигенсвязывающий фрагмент или вариант может содержать одну или несколько случайных мутаций (например, одну или несколько, например, одну или несколько замен аминокислот) в одном или нескольких сайтах каркасных областей L-FR1-4 в вариабельной области легкой цепи SG003, и/или содержать одну или несколько случайных мутаций (например, одну или несколько, например, одну или несколько замен аминокислот) в одном или нескольких сайтах каркасных областей H-FR1-4 в вариабельной области тяжелой цепи SG003. Например, после случайных мутаций легкая цепь антитела или его антигенсвязывающего фрагмента или варианта может содержать любую одну из аминокислотных последовательностей, выбранных из группы, состоящей из: SEQ ID NO: 16, SEQ ID NO: 18 и SEQ ID NO: 20; и/или тяжелая цепь антитела, или его антигенсвязывающего фрагмент, или вариант может содержать любую одну из аминокислотных последовательностей, выбранных из группы, состоящей из: SEQ ID NO: 17, SEQ ID NO: 19. и SEQ ID NO: 21. Антитело к CD38 или его антигенсвязывающий фрагмент или вариант после случайных мутаций все еще обладают способностью специфично связывать человеческий белок CD38.
В некоторых вариантах осуществления изобретения аминокислотная последовательность легкой цепи антитела или его антигенсвязывающего фрагмента настоящего изобретения содержит SEQ ID NO: 11, а аминокислотная последовательность тяжелой цепи содержит SEQ ID NO: 13; альтернативно, в антителе или его антигенсвязывающем фрагменте настоящего изобретения аминокислотная последовательность легкой цепи содержит SEQ ID NO: 16, а аминокислотная последовательность тяжелой цепи содержит SEQ ID NO: 17; альтернативно, аминокислотная последовательность легкой цепи антитела или его антигенсвязывающего фрагмента настоящего изобретения содержит SEQ ID NO: 18, а аминокислотная последовательность тяжелой цепи содержит SEQ ID NO: 19; альтернативно, в антителе или его антигенсвязывающем фрагменте настоящего изобретения аминокислотная последовательность легкой цепи содержит SEQ ID NO: 20, а аминокислотная последовательность тяжелой цепи содержит SEQ ID NO: 21.
Первый связывающий домен, специфично связывающий AXL
Антитело или его антигенсвязывающий фрагмент или вариант настоящего изобретения может уничтожать опухолевые клетки и/или ингибировать рост опухоли путем специфичного связывания AXL. Например, AXL может представлять собой AXL человека.
Антитело, его антигенсвязывающий фрагмент или вариант настоящего изобретения могут конкурировать с эталонным антителом за связывание с белком AXL. Эталонное антитело может содержать вариабельную область легкой цепи и вариабельную область тяжелой цепи. Например, вариабельная область легкой цепи эталонного антитела может содержать LCDR1-3, аминокислотные последовательности LCDR1-3 представляют собой SEQ ID NO: 22, SEQ ID NO: 23 и SEQ ID NO: 24, последовательно. Вариабельная область тяжелой цепи эталонного антитела может содержать HCDR1-3, аминокислотные последовательности HCDR1-3 представляют собой SEQ ID NO: 25, SEQ ID NO: 26 и SEQ ID NO: 27, последовательно.
Например, аминокислотная последовательность вариабельной области легкой цепи эталонного антитела может представлять собой SEQ ID NO: 28, а аминокислотная последовательность вариабельной области тяжелой цепи эталонного антитела может представлять собой SEQ ID NO: 29. Кроме того, например, аминокислотная последовательность легкой цепи эталонного антитела может представлять собой SEQ ID NO: 32; и аминокислотная последовательность тяжелой цепи эталонного антитела может представлять собой SEQ ID NO: 34.
Антитело, его антигенсвязывающий фрагмент или вариант настоящего изобретения может содержать легкую цепь антитела или его фрагмента. Например, легкая цепь антитела или его фрагмента может содержать константную область Igκ, например, может содержать константную область Igκ человека.
Например, легкая цепь антитела или его фрагмента может содержать LCDR1, и LCDR1 может содержать аминокислотную последовательность, как показано ниже в SEQ ID NO: 22. Легкая цепь антитела или его фрагмента может содержать LCDR2, и LCDR2 может содержать аминокислотную последовательность, как показано ниже в SEQ ID NO: 23. Легкая цепь антитела или его фрагмента может содержать LCDR3, и LCDR3 может содержать аминокислотную последовательность, как показано ниже в SEQ ID NO: 24.
Легкая цепь антитела настоящего изобретения или его фрагмента может содержать вариабельную область легкой цепи VL, а аминокислотная последовательность вариабельной области легкой цепи VL может представлять собой SEQ ID NO: 28. В некоторых вариантах осуществления изобретения аминокислотная последовательность легкой цепи антитела или его фрагмента может представлять собой SEQ ID NO: 32.
Антитело или его антигенсвязывающий фрагмент настоящего изобретения может содержать тяжелую цепь антитела или его фрагмента. Например, тяжелая цепь антитела или его фрагмента дополнительно содержит человеческую константную область. Где человеческая константная область может содержать константную область человеческого IgG. Где константная область IgG может содержать константную область человеческого IgG1 или IgG4.
Например, тяжелая цепь антитела или его фрагмента может содержать HCDR1, и HCDR1 может содержать аминокислотную последовательность, как показано ниже в SEQ ID NO: 25. Тяжелая цепь антитела или его фрагмента может содержать HCDR2, и HCDR2 может содержать аминокислотную последовательность, как показано ниже в SEQ ID NO: 26. Кроме того, например, тяжелая цепь антитела или его фрагмента может содержать HCDR3, и HCDR3 может содержать аминокислотную последовательность, как показано ниже в SEQ ID NO: 27.
Тяжелая цепь антитела или его фрагмента может содержать вариабельную область тяжелой цепи VH, и аминокислотная последовательность вариабельной области тяжелой цепи VH может представлять собой SEQ ID NO: 29. В некоторых вариантах осуществления изобретения аминокислотная последовательность тяжелой цепь антитела или его фрагмента может представлять собой SEQ ID NO: 34.
В некоторых вариантах осуществления изобретения аминокислотная последовательность LCDR1 антитела или его антигенсвязывающего фрагмента настоящего изобретения может содержать SEQ ID NO: 22 или ее вариант; аминокислотная последовательность LCDR2 может содержать SEQ ID NO: 23 или ее вариант; аминокислотная последовательность LCDR3 может содержать SEQ ID NO: 24 или ее вариант; и аминокислотная последовательность HCDR1 может содержать SEQ ID NO: 25 или ее вариант; аминокислотная последовательность HCDR2 может содержать SEQ ID NO: 26 или ее вариант; аминокислотная последовательность HCDR3 может содержать SEQ ID NO: 27 или ее вариант. Например, антитело или его антигенсвязывающий фрагмент может содержать антитело C6G12 или антитело, имеющее такие же LCDR1-3 и HCDR1-3, что и антитело C6G12. В некоторых вариантах осуществления изобретения легкая цепь антитела или его антигенсвязывающего фрагмента настоящего изобретения может содержать вариабельную область легкой цепи, и аминокислотная последовательность вариабельной области легкой цепи может содержать SEQ ID NO: 28 или ее вариант; и его тяжелая цепь может содержать вариабельную область тяжелой цепи, и аминокислотная последовательность вариабельной области тяжелой цепи может содержать SEQ ID NO: 29 или ее вариант. Например, антитело или его антигенсвязывающий фрагмент может содержать антитело C6G12 или антитело, имеющее такую же вариабельную область легкой цепи и вариабельную область тяжелой цепи, что и антитело C6G12. В некоторых вариантах осуществления изобретения антитело или его антигенсвязывающий фрагмент настоящего изобретения может содержать легкую цепь и тяжелую цепь, аминокислотная последовательность легкой цепи приведена в SEQ ID NO: 32, а аминокислотная последовательность тяжелой цепи приведена в SEQ ID NO: 34. Например, антитело или его антигенсвязывающий фрагмент может содержать антитело C6G12 или иметь такие же аминокислотные последовательности легкой цепи и тяжелой цепи, что и антитело C6G12.
В некоторых вариантах осуществления изобретения антитело настоящего изобретения может представлять собой антитело C6G12. аминокислотные последовательности LCDR1-3 антитела C6G12 приведены в SEQ ID NO: 22, SEQ ID NO: 23 и SEQ ID NO: 24 соответственно; аминокислотная последовательность VL приведена в SEQ ID NO: 28; аминокислотные последовательности HCDR1-3 приведена в SEQ ID NO: 25, SEQ ID NO: 26 и SEQ ID NO: 27 соответственно; аминокислотная последовательность VH приведена в SEQ ID NO: 29; аминокислотная последовательность легкой цепи приведена в SEQ ID NO: 32; и аминокислотная последовательность тяжелой цепи приведена в SEQ ID NO: 34.
Первый связывающий домен, специфично связывающий Trop2
Антитело или его антигенсвязывающий фрагмент или вариант настоящего изобретения могут уничтожать опухолевые клетки и/или ингибировать рост опухоли путем специфичного связывания Trop2. Например, Trop2 может представлять собой Trop2 человека.
Антитело, его антигенсвязывающий фрагмент или вариант настоящего изобретения могут конкурировать с эталонным антителом за связывание с белком Trop2. Эталонное антитело может содержать вариабельную область легкой цепи и вариабельную область тяжелой цепи. Например, вариабельная область легкой цепи эталонного антитела может содержать LCDR1-3, аминокислотные последовательности LCDR1-3 представляют собой SEQ ID NO: 36, SEQ ID NO: 37 и SEQ ID NO: 38, последовательно. Вариабельная область тяжелой цепи эталонного антитела может содержать HCDR1-3, аминокислотные последовательности HCDR1-3 представляют собой SEQ ID NO: 39, SEQ ID NO: 40 и SEQ ID NO: 41, последовательно.
Например, аминокислотная последовательность вариабельной области легкой цепи эталонного антитела может представлять собой SEQ ID NO: 42, и аминокислотная последовательность вариабельной области тяжелой цепи эталонного антитела может представлять собой SEQ ID NO: 43. Кроме того, например, аминокислотная последовательность легкой цепи эталонного антитела может представлять собой SEQ ID NO: 46; и аминокислотная последовательность тяжелой цепи эталонного антитела может представлять собой SEQ ID NO: 48. Например, легкая цепь эталонного антитела может содержать аминокислотную последовательность, приведенную в SEQ ID NO: 46, а тяжелая цепь эталонного антитела может содержать аминокислотную последовательность, приведенную в SEQ ID NO: 48.
Антитело, его антигенсвязывающий фрагмент или вариант настоящего изобретения может содержать легкую цепь антитела или его фрагмента. Например, легкая цепь антитела или его фрагмента может содержать константную область Igκ, например, может содержать константную область Igκ человека.
Например, легкая цепь антитела или его фрагмента может содержать LCDR1, и LCDR1 может содержать аминокислотную последовательность, как показано ниже в SEQ ID NO: 36. Легкая цепь антитела или его фрагмента может содержать LCDR2, и LCDR2 может содержать аминокислотную последовательность, как показано ниже в SEQ ID NO: 37. Легкая цепь антитела или его фрагмента может содержать LCDR3, и LCDR3 может содержать аминокислотную последовательность, как показано ниже в SEQ ID NO: 38.
Легкая цепь антитела или его фрагмента настоящего изобретения может содержать вариабельную область легкой цепи VL, и вариабельная область легкой цепи VL может содержать аминокислотную последовательность, как показано ниже в SEQ ID NO: 42. В некоторых вариантах осуществления изобретения аминокислотная последовательность легкой цепи антитела или его фрагмента может представлять собой SEQ ID NO: 46.
Антитело или его антигенсвязывающий фрагмент настоящего изобретения может содержать тяжелую цепь антитела или его фрагмента. Например, тяжелая цепь антитела или его фрагмента дополнительно содержит человеческую константную область. Где человеческая константная область может содержать константную область человеческого IgG. Где константная область IgG может содержать константную область человеческого IgG1 или IgG4.
Например, тяжелая цепь антитела или его фрагмента может содержать HCDR1, и HCDR1 может содержать аминокислотную последовательность, как показано ниже в SEQ ID NO: 39. Тяжелая цепь антитела или его фрагмента может содержать HCDR2, и HCDR2 может содержать аминокислотную последовательность, как показано ниже в SEQ ID NO: 40. Кроме того, например, тяжелая цепь антитела или его фрагмента может содержать HCDR3, и HCDR3 может содержать аминокислотную последовательность, как показано ниже в SEQ ID NO: 41.
Тяжелая цепь антитела или его фрагмента может содержать вариабельную область тяжелой цепи VH, и вариабельная область тяжелой цепи VH может содержать аминокислотную последовательность, как показано ниже в SEQ ID NO: 43. В некоторых вариантах осуществления изобретения аминокислотная последовательность тяжелой цепи антитела или его фрагмента может представлять собой SEQ ID NO: 48.
В некоторых вариантах осуществления изобретения в антителе или его антигенсвязывающем фрагменте настоящего изобретения аминокислотная последовательность LCDR1 может содержать SEQ ID NO: 36 или ее вариант; аминокислотная последовательность LCDR2 может содержать SEQ ID NO: 37 или ее вариант; аминокислотная последовательность LCDR3 может содержать SEQ ID NO: 38 или ее вариант; и аминокислотная последовательность HCDR1 может содержать SEQ ID NO: 39 или ее вариант; аминокислотная последовательность HCDR2 может содержать SEQ ID NO: 40 или ее вариант; аминокислотная последовательность HCDR3 может содержать SEQ ID NO: 41 или ее вариант. Например, антитело или его антигенсвязывающий фрагмент может содержать антитело SG701 или антитело, имеющее такие же LCDR1-3 и HCDR1-3, что и антитело SG701. В некоторых вариантах осуществления изобретения легкая цепь антитела или его антигенсвязывающего фрагмента настоящего изобретения может содержать вариабельную область легкой цепи, аминокислотная последовательность вариабельной области легкой цепи может содержать SEQ ID NO: 42 или ее вариант; и его тяжелая цепь может содержать вариабельную область тяжелой цепи, аминокислотная последовательность вариабельной области тяжелой цепи может содержать SEQ ID NO: 43 или ее вариант. Например, антитело или его антигенсвязывающий фрагмент может содержать антитело SG701 или антитело, имеющее такую же вариабельную область легкой цепи и вариабельную область тяжелой цепи, что и антитело SG701. В некоторых вариантах осуществления изобретения антитело или его антигенсвязывающий фрагмент настоящего изобретения может содержать легкую цепь и тяжелую цепь, аминокислотная последовательность легкой цепи приведена в SEQ ID NO: 46, и аминокислотная последовательность тяжелой цепи приведена в SEQ ID NO: 48. Например, антитело или его антигенсвязывающий фрагмент может содержать антитело SG701 или иметь такие же аминокислотные последовательности легкой цепи и тяжелой цепи, что и антитело SG701.
В некоторых вариантах осуществления изобретения антитело настоящего изобретения может представлять собой антитело SG701. Аминокислотные последовательности LCDR1-3 антитела SG701 приведены в SEQ ID NO: 36, SEQ ID NO: 37 и SEQ ID NO: 38 соответственно; аминокислотная последовательность VL приведена в SEQ ID NO: 42; аминокислотные последовательности HCDR1-3 приведены в SEQ ID NO: 39, SEQ ID NO: 40 и SEQ ID NO: 41 соответственно; аминокислотная последовательность VH приведена в SEQ ID NO: 43; аминокислотная последовательность легкой цепи приведена в SEQ ID NO: 46; и аминокислотная последовательность тяжелой цепи приведена в SEQ ID NO: 48.
Связь между первым связывающим доменом и вторым связывающим доменом
В настоящем изобретении первый связывающий домен может быть расположен на N-конце второго связывающего домена. Например, C-конец первого связывающего домена может быть связан с N-концом второго связывающего домена посредством линкера. В некоторых случаях C-конец первого связывающего домена также может быть напрямую связан с N-концом второго связывающего домена (например, находиться в рамке считывания).
В настоящем изобретении слитый белок может также содержать линкер, который может быть расположен на С-конце первого связывающего домена и расположен на N-конце второго связывающего домена. Например, в слитом белке C-конец первого связывающего домена может быть связан с N-концом линкера, а C-конец линкера может быть связан с N-концом второго связывающего домена. Например, первый связывающий домен, линкер и второй связывающий домен могут включаться в слитый белок последовательно от N-конца к C-концу.
В настоящем изобретении линкер может содержать аминокислотную последовательность, приведенную в любой из SEQ ID NO: 73-74.
В некоторых случаях слитый белок может содержать, по меньшей мере, 2 (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5, по меньшей мере, 6, по меньшей мере, 7, по меньшей мере, 8, по меньшей мере, 9, по меньшей мере, 10, или более) вторых связывающих доменов. В настоящем изобретении каждый из вторых связывающих доменов может быть расположен на С-конце первого связывающего домена соответственно. В настоящей заявке более двух вторых связывающих доменов могут быть прямо или опосредованно связаны с С-концом первого связывающего домена.
В настоящем изобретении слитый белок может содержать первый связывающий домен, который специфично связывает антиген CD38, и второй связывающий домен, который специфично связывает белок CD47, где первый связывающий домен может содержать антитело, которое специфично связывает антиген CD38 или его антигенсвязывающий фрагмент или вариант, второй связывающий домен может содержать мутант варианта 1 человеческого SIRPα, С-конец антитела, которое специфично связывает антиген CD38, или его антигенсвязывающий фрагмент или вариант, может быть прямо или опосредованно связан с N-концом мутанта варианта 1 человеческого SIRPα. Например, второй связывающий домен может содержать, по меньшей мере, два мутанта варианта 1 человеческого SIRPα и N-концы двух мутантов вариант 1 человеческого SIRPα связаны с С-концами антитела, которое специфично связывает антиген CD38, или его антигенсвязывающего фрагмента или варианта, соответственно.
Например, как показано на Фигуре 1, первый связывающий домен слитого белка (SG3847L1) может содержать SG003, а его второй связывающий домен может содержать два мутанта M91 варианта 1 SIRPα, последовательность использованного линкера 1 приведена в SEQ ID NO: 73, N-концы двух M91 связаны с C-концами двух тяжелых цепей SG003 через линкер 1, соответственно. В слитом белке M91 связан с С-концом тяжелой цепи SG003, чтобы получить вторую полипептидную цепь, а легкая цепь SG003 может быть названа первой полипептидной цепью. Аминокислотные последовательности второй полипептидной цепи и первой полипептидной цепи SG3847L1 приведены в SEQ ID NO: 75 и SEQ ID NO: 11, соответственно.
Например, как показано на Фигуре 1, первый связывающий домен слитого белка (SG3847L2) может содержать SG003, его второй связывающий домен может содержать два мутанта M91 варианта 1 SIRPα, последовательность использованного линкера 2 показана в SEQ ID NO: 74, N-концы двух M91 связаны с C-концами двух тяжелых цепей SG003 через линкер 2, соответственно. В слитом белке M91 связан с С-концом тяжелой цепи SG003, чтобы получить вторую полипептидную цепь, а легкая цепь SG003 может быть названа первой полипептидной цепью. Аминокислотные последовательности второй полипептидной цепи и первой полипептидной цепи SG3847L2 приведены в SEQ ID NO: 76 и SEQ ID NO: 11, соответственно.
В настоящем изобретении слитый белок может содержать первый связывающий домен, который специфично связывает антиген Trop2, и второй связывающий домен, который специфично связывает белок CD47, где первый связывающий домен может содержать антитело, которое специфично связывает антиген Trop2, или его антигенсвязывающий фрагмент или вариант, второй связывающий домен может содержать мутант варианта 1 человеческого SIRPα, и С-конец антитела, которое специфично связывает антиген Trop2, или его антигенсвязывающего фрагмента или варианта, может быть прямо или опосредованно связано с N-концом мутанта варианта 1 человеческого SIRPα. В настоящем изобретении второй связывающий домен может содержать, по меньшей мере, два мутанта варианта 1 человеческого SIRPα и N-концы двух мутантов варианта 1 человеческого SIRPα связаны с С-концами антитела, которое специфично связывает антиген AXL, или его антигенсвязывающего фрагмента или варианта, соответственно.
Например, как показано на Фигуре 1, первый связывающий домен слитого белка (SGTrop247) может содержать антитело SG701, его второй связывающий домен может содержать два мутанта M91 варианта 1 SIRPα, последовательность использованного линкера приведена в SEQ ID NO: 74, N-концы двух M91 связаны с C-концами двух тяжелых цепей SG701 через линкер, соответственно. В слитом белке M91 связан с С-концом тяжелой цепи SG701, чтобы получить вторую полипептидную цепь, а легкая цепь SG701 может быть названа первой полипептидной цепью. Аминокислотные последовательности второй полипептидной цепи и первой полипептидной цепи SGTrop247 приведены в SEQ ID NO: 78 и SEQ ID NO: 46 соответственно.
В настоящем изобретении слитый белок может содержать первый связывающий домен, который специфично связывает антиген AXL, и второй связывающий домен, который специфично связывает белок CD47, где первый связывающий домен может содержать антитело, которое специфично связывает антиген AXL, или его антигенсвязывающий фрагмент или вариант, второй связывающий домен может содержать мутант варианта 1 человеческого SIRPα, С-конец антитела, которое специфично связывает антиген AXL, или его антигенсвязывающего фрагмента или варианта может быть прямо или опосредованно связан с N-концом мутанта варианта 1 человеческого SIRPα. В настоящем изобретении второй связывающий домен может содержать, по меньшей мере, два мутанта варианта 1 человеческого SIRPα, и N-концы двух мутантов вариант 1 человеческого SIRPα связаны с С-концами антитела, которое специфично связывает антиген AXL, или его антигенсвязывающего фрагмента или варианта, соответственно.
Например, как показано на Фигуре 1, первый связывающий домен слитого белка (SGAXL47) может содержать антитело C6G12, его второй связывающий домен может содержать два мутанта M91 варианта 1 SIRPα, последовательность использованного линкера приведена в SEQ ID NO: 74, N-концы двух M91 связаны с C-концами двух тяжелых цепей C6G12 через линкер, соответственно. В слитом белке M91 связан с C-концом тяжелой цепи C6G12, чтобы получить вторую полипептидную цепь, а легкая цепь C6G12 может быть названа первой полипептидной цепью. Аминокислотные последовательности второй полипептидной цепи и первой полипептидной цепи SGAXL47 приведены в SEQ ID NO: 77 и SEQ ID NO: 32, соответственно.
Молекулы нуклеиновых кислот, векторы и клетки и способы их получения
В другом аспекте настоящее изобретение относится к одной или нескольким выделенным молекулам нуклеиновых кислот, которые кодируют слитый белок или иммуноконъюгат. Например, каждая молекула нуклеиновой кислоты из одной или нескольких молекул нуклеиновых кислот может кодировать целое антитело или его антигенсвязывающий фрагмент, а также может кодировать его часть (например, один или несколько из HCDR1-3, LCDR1-3, VL, VH, легкие цепи или тяжелые цепи).
Молекулы нуклеиновых кислот настоящего изобретения могут быть выделены. Например, они могут быть получены или синтезированы следующими способами: (i) путем амплификации in vitro, например, получение амплификацией посредством полимеразной цепной реакции (ПЦР), (ii) путем клонирования и рекомбинации, (iii) путем очистка, например, фракционированы ферментативным расщеплением и гель-электрофорезом, или (iv) путем синтеза, например, путем химического синтеза. В некоторых вариантах осуществления изобретения выделенные нуклеиновые кислоты представляют собой молекулы нуклеиновых кислот, полученные с помощью технологии рекомбинантных ДНК.
Технология рекомбинантных ДНК и методы молекулярного клонирования включают в себя методы, описанные в Sambrook, J., Fritsch, E. F. and Maniatis, T. Molecular Cloning: A Laboratory Manual; Cold Spring Harbor Laboratory Press: Cold Spring Harbor, (1989) (Maniatis) и в T. J. Silhavy, M. L. Bennan and L. W. Enquist, Experiments with Gene Fusions, Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y. (1984), а также в Ausubel, F. M. et al., Current Protocols in Molecular Biology, pub. by Greene Publishing Assoc. and Wiley-Interscience (1987). В кратком изложении, нуклеиновые кислоты могут быть получены из фрагментов геномной ДНК, кДНК и РНК, и все эти нуклеиновые кислоты могут быть извлечены из клеток напрямую или получены путем рекомбинации с помощью различных методов амплификации (включая без ограничений, ПЦР и ОТ-ПЦР).
Прямой химический синтез нуклеиновых кислот обычно включает в себя последовательное добавление 3'-кэпированных и 5'-кэпированных нуклеотидных мономеров к концевому 5'-гидроксилу растущей нуклеотидной полимерной цепи, в котором каждое добавление осуществляется путем нуклеофильной атаки концевого 5'-гидроксила растущей цепи в 3'-положении добавленных мономеров, и мономеры обычно представляют собой производные фосфора, такие как фосфотриэфир, фосфорамидит и т.д. См., например, Matteuci et al, Tet. Lett. 521: 719 (1980); Патент США No. 4500707, Caruthers et al; и патенты США Nos. 5436327 и 5700637 авторов Southern et al. В другом аспекте настоящее изобретение относится к векторам, включающим в себя выделенный полинуклеотид настоящего изобретения. Векторы могут быть любыми линейными нуклеиновыми кислотами, плазмидами, фагмидами, космидами, векторами РНК, вирусными векторами и т.д. Неограничивающие примеры вирусных векторов могут включать в себя ретровирусы, аденовирусы и аденоассоциированные вирусы. В некоторых вариантах осуществления изобретения векторы представляют собой экспрессионные векторы, например, векторы фагового дисплея.
В другом аспекте настоящее изобретение относится к одному или нескольким векторам, включающим в себя молекулы нуклеиновых кислот. Например, вектор может содержать одну или несколько молекул нуклеиновых кислот настоящего изобретения. Каждый вектор может содержать одну или несколько молекул нуклеиновых кислот. Кроме того, вектор может дополнительно содержать другие гены, такие как маркерные гены, которые позволяют отбирать вектор в подходящих клетках-хозяевах и в соответствующих условиях. Кроме того, вектор может дополнительно содержать элементы контроля экспрессии, обеспечивающие корректную экспрессию кодирующих областей в соответствующем хозяине. Такие элементы контроля хорошо известны специалистам в данной области техники. Например, они могут включать в себя промоторы, сайты связывания рибосом, энхансеры и другие элементы контроля для регуляции транскрипции генов или трансляции мРНК и т.п. В некоторых вариантах осуществления изобретения последовательности контроля экспрессии являются регулируемыми элементами. Конкретные структуры последовательностей контроля экспрессии могут изменяться в зависимости от вида или функций типов клеток, но обычно включают 5'-нетранскрибируемые последовательности и 5'- и 3'-нетранслируемые последовательности, которые участвуют в инициации транскрипции и трансляция соответственно, например кассеты ТАТА, кэпированные последовательности, последовательности СААТ и т.д. Например, 5'-нетранскрибируемая последовательность контроля экспрессии может содержать промоторную область, которая может содержать промоторную последовательность для транскрипции и контроля функционально связанных нуклеиновых кислот. Последовательность контроля экспрессии может дополнительно содержать энхансерную последовательность или предшествующую активаторную последовательность. В настоящем изобретении подходящие промоторы могут включать в себя, например, промоторы для полимераз SP6, T3 и T7, промотор U6RNA человека, промотор CMV и искусственные гибридные промоторы (например, CMV), в которых определенная часть промотора может быть слита с определенная часть промотора гена других клеточных белков (например, человеческой ГАФДГ, глицеральдегид-3-фосфатдегидрогеназы), и она может содержать или не содержать дополнительные интроны. Одна или несколько молекул нуклеиновых кислот настоящего изобретения могут быть функционально связаны с элементами контроля экспрессии.
Векторы могут включать в себя, например, плазмиды, космиды, вирусы, фаги или другие векторы, обычно используемые, например, в генной инженерии. В некоторых вариантах осуществления изобретения векторы могут представлять собой экспрессионные векторы.
Векторы также могут содержать один или несколько селективных маркерных генов, которые после экспрессии могут придавать один или несколько фенотипических признаков, которые можно использовать для отбора или идентификации клеток-хозяев, несущих векторы, другими способами. Неограничивающие примеры подходящих селективных маркеров для эукариоцитов включают в себя устойчивость к дигидрофолатредуктазе и неомицину.
В другом аспекте настоящее изобретение относится к клетке, которая содержит слитый белок, иммуноконъюгат, молекулы нуклеиновых кислот или векторы. Клетка может быть клеткой-хозяином. Например, клетка может включать в себя различные типы клеток, как указано ниже: прокариотические клетки, такие как Escherichia coli или Bacillus subtilis, клетки грибов, такие как дрожжевые клетки или Aspergillus, клетки насекомых, такие как клетки S2 Drosophila или Sf9, или клетки животных, такие как фибробласты, CHO клетки, клетки COS, клетки NSO, клетки HeLa, клетки BHK, клетки HEK 293 или клетки человека.
Например, векторы можно вводить в клетки-хозяева стабильно или временно с помощью множества хорошо известных технологий. Например, один способ включает в себя обработку хлоридом кальция, при которой векторы вводят путем осаждения кальция. В аналогичных способах можно также использовать другие соли, например, фосфат кальция. Кроме того, можно использовать электропорацию (то есть применение электрического тока для увеличения проницаемости клеток для нуклеиновых кислот). Другие примеры способов трансформации включают в себя микроинъекцию, трансформацию, опосредованную DEAE декстраном, и тепловой шок в присутствии ацетата лития. Липидные комплексы, липосомы и дендримеры также можно использовать для трансфекции клеток-хозяев.
Когда в клетки-хозяева вводят гетерогенные последовательности, для идентификации клеток-хозяев, в которые были введены векторы, можно применять различные способы. Один пример способа отбора включает в себя субкультивирование одной клетки с образованием единой колонии, а затем тестирование экспрессии желаемого белкового продукта. Другой способ предусматривает отбор клеток-хозяев, содержащих гетерогенные последовательности, на основе фенотипических признаков, обусловленных экспрессией селективных маркерных генов, включенных в векторы.
Например, введение различных гетерогенных последовательностей настоящего изобретения в клетки-хозяева может быть подтверждено следующими методами, такими как ПЦР, Саузерн-блоттинг или Нозерн-блоттинг. Например, нуклеиновые кислоты можно выделить из полученных клеток-хозяев, а конкретные целевые последовательности можно амплифицировать с помощью ПЦР с использованием праймеров, специфичных для целевых последовательностей. Амплифицированные продукты подвергают электрофорезу в агарозном геле, электрофорезу в полиакриламидном геле или капиллярному электрофорезу, затем окрашивают бромистым этидием, раствором SYBR Green или подобным или обнаруживают ДНК с помощью УФ-детекции. В качестве альтернативы в реакциях гибридизации можно использовать зонды нуклеиновых кислот, специфичные для целевых последовательностей. Экспрессию конкретных генных последовательностей можно определить гибридизацией с помощью ПЦР или Нозерн-блоттинга или путем обнаружения обратной транскрипции соответствующей мРНК с использованием иммуноанализа антител, которые реагируют с кодируемыми генными продуктами. Примеры иммуноанализов включают в себя без ограничений твердофазный ИФА, радиоиммуноанализ и сэндвич-иммуноанализ.
Кроме того, введение различных гетерогенных последовательностей настоящего изобретения в клетки-хозяева может быть подтверждено ферментативной активностью ферментов (например, ферментных маркеров), которые кодируются гетерогенными последовательностями. Ферменты можно определять различными методами, известными в данной области техники. Обычно ферментативную активность можно определять по образованию продуктов или по трансформации субстрата исследуемой ферментативной реакции. Реакцию можно проводить in vitro или in vivo.
В другом аспекте настоящее изобретение относится к способу получения слитого белка, который может включать в себя культивирование клетки в условиях, обеспечивающих экспрессию слитого белка. Например, можно использовать подходящие культуральные среды, подходящую температуру и время культивирования, все эти методы известны специалистам в данной области техники.
В некоторых случаях способ может дополнительно включать в себя этапы разделения и/или очистки слитого белка. Например, слитый белок настоящего изобретения можно очистить и разделить с помощью аффинной хроматографии с использованием протеин G-агарозы или протеин A-агарозы, или при помощи гель-электрофореза и/или высокоэффективной жидкостной хроматографии.
Иммуноконъюгат, композиция и применение
В другом аспекте настоящее изобретение относится к иммуноконъюгату, включающему в себя слитый белок. Например, иммуноконъюгат может быть конъюгатом слитый белок-лекарственное средство (ADC), в котором слитый белок настоящего изобретения конъюгирован с одним или несколькими терапевтическими агентами, и терапевтические агенты включают в себя без ограничений цитотоксические агенты, радиотоксические агенты (например, радиоизотопы) и/или иммунные ингибиторы (например, любые агенты, которые уничтожают клетки посредством ингибирования иммунных ответов) и тому подобное. В некоторых вариантах осуществления изобретения терапевтические агенты могут представлять собой агент, способные лечить опухоль-ассоциированные заболевания или расстройства.
Конъюгация может осуществляться пептидными линкерами (например, расщепляемыми линкерами) или другими способами. Например, линкеры могут быть кислотолабильными линкерами, чувствительными к пептидазе линкерами, фотолабильным линкером и тому подобное.
В другом аспекте настоящее изобретение относится к композиции, включающей в себя слитый белок, иммуноконъюгат или молекулы нуклеиновых кислот и, необязательно, фармацевтически приемлемые вспомогательные вещества.
Например, фармацевтически приемлемые вспомогательные вещества могут включать в себя буферные агенты, антиоксиданты, консерванты, полипептиды с низкой молекулярной массой, белки, гидрофильные полимеры, аминокислоты, сахар, хелатирующие агенты, противоионы, комплексы металлов и/или неионные поверхностно-активные вещества и тому подобное.
В настоящем изобретении композиция может быть составлена с фармацевтически приемлемым носителем или разбавителем и любыми другими известными вспомогательными агентами и вспомогательными веществами при помощи обычных технических средств, известных в данной области техники, например, по технологии, описанной в Remington: The Science and Practice of Pharmacy, Edition 19, Gennaro ed., Mack Publishing Co., Easton, PA, 1995.
В настоящем изобретении композиция может быть составлена для перорального введения, внутривенного введения, внутримышечного введения, введения in situ в участки опухоли, введения путем ингаляции, ректального введения, вагинального введения, трансдермального введения или введения с использованием подкожного резервуара.
Например, композиция может применяться для подавления роста опухоли. Например, композиция настоящего изобретения может подавлять или задерживать развитие или прогрессирование заболеваний, уменьшать размеры опухолей (даже практически устраняя опухоли) и/или облегчать и/или стабилизировать состояние заболеваний.
Например, композиция настоящего изобретения может представлять собой подходящие формы для перорального введения, такие как таблетки, капсулы, пилюли, порошки, препараты с замедленным высвобождением, растворы, суспензии; или для парентеральной инъекции, такие как стерильные растворы, суспензии или эмульсии; или для местного применения в виде мази или крема; или для ректального введения в виде суппозиториев. Композиция может представлять собой стандартные лекарственные формы, подходящие для разового введения в точных дозах. Композиция может дополнительно содержать обычные носители лекарственных средств или вспомогательные вещества. Кроме того, композиция может содержать другие лекарственные средства или агенты, носители, адъюванты и т.д.
Композиция настоящего изобретения может содержать терапевтически эффективное количество слитого белка. Терапевтически эффективное количество представляет собой дозу, необходимую для предотвращения и/или лечения (по меньшей мере, частичного лечения) заболеваний или нарушений (например, опухолей) и/или любых их осложнений у субъектов, страдающих от этих заболеваний или нарушений или находящихся в группе риска. Конкретное количество/концентрация дозы может изменяться в зависимости от способа введения и потребностей пациентов и может определяться, например, на основании размеров пациентов, вязкости и/или веса тела. Например, подходящая доза может составлять от примерно 0,1 мг или от 1 мг/кг/сутки до примерно 50 мг/кг/сутки; иногда доза может быть выше. Следует понимать, что эти конкретные дозировки могут быть легко скорректированы специалистами в данной области техники (например, врачами или фармацевтами) в зависимости от конкретных пациентов, препаратов и/или статуса заболевания.
В настоящем изобретении термины «лечение», или «излечение», или «облегчение», или «улучшение» могут использоваться взаимозаменяемо в настоящей заявке и относятся к тем способам, которые позволяют получить полезные или желаемые результаты (включая без ограничений терапевтическую и/или профилактическую пользу). В настоящем изобретении термин «терапевтическая польза» как правило, относится к устранению или уменьшению тяжести основных состояний, которые подлежат лечению. Кроме того, терапевтическая польза реализуются путем устранения или уменьшения тяжести первопричинных состояний или снижения частоты одного или нескольких физических симптомов, связанных с первопричинными состояниями, чтобы наблюдать улучшения у субъектов (хотя субъекты могут по-прежнему страдать от первопричинных состояний). Что касается профилактической пользы, то композицию можно вводить субъектам с риском развития конкретного заболевания или субъектам с одним или несколькими физическими симптомами известного заболевания, даже если заболевание могло не быть диагностировано.
В другом аспекте настоящее изобретение относится к применению слитого белка, иммуноконъюгата, молекул нуклеиновых кислот, векторов, композиции или клетки для получения лекарственного средства, где лекарственное средство можно применять для лечения опухоли или аутоиммунного заболевания.
В другом аспекте слитый белок, иммуноконъюгат, молекулы нуклеиновых кислот, векторы, композиция или клетка настоящего изобретения могут применяться для лечения опухоли или аутоиммунного заболевания.
В другом аспекте настоящее изобретение относится к способу лечения опухоли или аутоиммунного заболевания, включающему в себя введение субъекту слитого белка, иммуноконъюгата, молекул нуклеиновых кислот, векторов, композиции или клетки настоящего изобретения.
В другом аспекте настоящее изобретение относится к способу блокирования взаимодействия между белком CD47 и SIRPα, включающему в себя введение (например, введение нуждающемуся в этом субъекту или клеткам или биологическим образцам) слитого белка или композиции настоящего изобретения.
В другом аспекте настоящее изобретение относится к способу ингибирования опухоли или роста и/или пролиферации опухолевых клеток, включающему в себя приведение слитого белка или композиции настоящего изобретения в контакт с опухолью или опухолевыми клетками. Например, контакт может быть in vitro.
В некоторых вариантах осуществления изобретения опухоль может включать в себя несолидную опухоль и солидную опухоль.
В некоторых вариантах осуществления изобретения опухоль может включать в себя множественную миелому, лейкоз, неходжкинскую лимфому, лимфому Ходжкина, нейроглиому, герминому, саркому, мезотелиому, плацентому, рак головного мозга, рак костей, рак кожи, рак носоглотки, рак легких, рак полости рта, рак пищевода, рак желудка, рак печени, рак поджелудочной железы, рак предстательной железы, рак кишечника, рак молочной железы, рак шейки матки, рак яичника и рак яичка.
В некоторых вариантах осуществления изобретения аутоиммунное заболевание может включать в себя хронический лимфоцитарный тиреоидит, гипертиреоз, инсулинозависимый сахарный диабет, миастению, хронический язвенный колит, пернициозную анемию с хроническим атрофическим гастритом, синдром Гудпасчера, вульгарную пузырчатку, пемфигоид, первичный билиарный цирроз, множественный склероз, идиопатический полиневрит, системную красную волчанку, ревматоидный артрит, склеродермию и узелковый полиартериит.
В другом аспекте настоящее изобретение относится к слитому белку, иммуноконъюгату, молекулам нуклеиновых кислот, векторам, композиции или клетке, которые можно применять для лечения опухоли или аутоиммунного заболевания.
В другом аспекте настоящее изобретение относится к способу блокирования взаимодействия между белком CD47 и SIRPα, включающему в себя введение нуждающемуся в этом субъекту эффективного количества слитого белка, иммуноконъюгата, молекул нуклеиновых кислот, векторов, композиции или клетки.
В настоящем изобретении термин «субъект» как правило, относится к человеку или не являющимся человеком животным, включая без ограничений кошку, собаку, лошадь, свинью, корову, овцу, козу, кролика, мышь, крысу или обезьяну.
В другом аспекте настоящее изобретение относится к способу, способному ингибировать опухоли или рост и/или пролиферацию опухолевых клеток, который может включать в себя введение нуждающемуся в этом субъекту эффективного количества слитого белка, иммуноконъюгата, молекул нуклеиновых кислот, векторов, композиции или клетки.
Не ограничиваясь какой-либо теорией, приведенные ниже варианты осуществления изобретения предназначены только для иллюстрации слитого белка, способа получения и применения настоящего изобретения, а не для ограничения объема настоящего изобретения.
Варианты осуществления изобретения
Вариант осуществления 1. Влияние выбора различных линкеров на активность
1.1 Получение слитого белка с использованием различных линкеров
В соответствии со структурой слитого белка, показанной на Фигуре 1, взяв, например, гуманизированное антитело SG003 против CD38 и мутант M91 (SEQ ID: NO 62) варианта 1 SIRPα, использовали разные линкеры от N-конца к C-концу для последовательного связывания SG003, линкера и двух M91, где N-концы двух M91 связаны с C-концом тяжелой цепи SG003 соответственно, чтобы исследовать влияние различных линкеров на биологическую активность слитого белка.
Аминокислотные последовательности LCDR1-3 антитела SG003 приведены в SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3, соответственно; аминокислотная последовательность VL приведена в SEQ ID NO: 7; нуклеотидная последовательность, кодирующая VL, приведена в SEQ ID NO: 9; аминокислотные последовательности HCDR1-3 антитела SG003 приведены в SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6, соответственно; аминокислотная последовательность VH приведена в SEQ ID NO: 8; нуклеотидная последовательность, кодирующая VH, приведена в SEQ ID NO: 10. Аминокислотная последовательность легкой цепи антитела SG003 приведена в SEQ ID NO: 11; и кодирующая ее нуклеотидная последовательность приведена в SEQ ID NO: 12. Аминокислотная последовательность тяжелой цепи антитела SG003 приведена в SEQ ID NO: 13; и кодирующая ее нуклеотидная последовательность приведена в SEQ ID NO: 14.
Был выбран линкер 1 (SEQ ID: NO 73), и сконструированный слитый белок получил название SG3847L1. SG3847L1 состоит из первой полипептидной цепи и второй полипептидной цепи. Первая полипептидная цепь представляет собой легкую цепь SG003, аминокислотная последовательность которой приведена в SEQ ID NO: 11; вторая полипептидная цепь представляет собой полипептидную цепь, образованную связью между тяжелой цепью SG003 и M91 через линкер 1, аминокислотная последовательность которого приведена в SEQ ID NO: 75.
Был выбран линкер 2 (SEQ ID: NO 74), и сконструированный слитый белок получил название SG3847L2. SG3847L2 состоит из первой полипептидной цепи и второй полипептидной цепи. Первая полипептидная цепь представляет собой легкую цепь SG003, аминокислотная последовательность которой приведена в SEQ ID NO: 11; вторая полипептидная цепь представляет собой полипептидную цепь, образованную связью между тяжелой цепью SG003 и M91 через линкер 2, аминокислотная последовательность которого приведена в SEQ ID NO: 76.
1.2 Анализ активности связывания двух антигенов, соответственно
(1) Используя SG003 в качестве контроля, активность связывания между слитым белком и CD38 оценивали с помощью твердофазного ИФА.
Целевой антиген CD38-His (1 мкг/мл) наносили на ИФА-планшеты, инкубировали в течение ночи при температуре 4°C; после промывания ФСБТ добавляли 10% эмбриональной телячьей сыворотки и блокировали при температуре 37°C в течение 1 часа; добавляли различные концентрации антитела SG003, слитого белка SG3847L1 или SG3847L2 и проводили реакцию при температуре 37°C в течение 1 часа; после промывки ФСБТ добавляли меченные пероксидазой хрена вторичные козьи антитела против человеческого IgG (Goat Anti human IgG HRP, Thermo Fisher Scientific), проводили реакцию при температуре 37°C в течение 30 минут и промывали ФСБТ 5 раз; в каждую лунку добавляли 100 мкл ТМБ (eBioscience), помещали в темноту при комнатной температуре (20±5°C) на 1-2 минуты; затем в каждую лунку добавляли 100 мкл 2Н останавливающего раствора H2SO4 для прекращения реакции субстрата, значения OD считывали при длине волны 450 нм на считывающем устройстве для микропланшетов и анализировали способность слитого белка связывать целевой антиген CD38.
Как показано на Фигуре 2, по сравнению с антителом SG003, способность SG3847L1, SG3847L2 связываться с целевым антигеном CD38 была аналогичной, значения EC50 для SG3847L1, SG3847L2 и SG003 составляли 0,175 нМ, 0,149 нМ и 0,133 нМ, соответственно.
(2) Используя SS002M91 в качестве контроля, активность связывания между слитым белком и CD47 оценивали с помощью твердофазного ИФА.
M91 сливали с IgG1-FC (последовательность приведена в SEQ ID NO: 71), чтобы получить SS002M91, аминокислотная последовательность которого приведена в SEQ ID NO: 72.
Целевой антиген CD47-His (1 мкг/мл) наносили на ИФА-планшеты, инкубировали в течение ночи при температуре 4°C; после промывания ФСБТ добавляли 10% эмбриональной телячьей сыворотки и блокировали при температуре 37°C в течение 1 часа; добавляли различные концентрации SS002M91, SG3847L1 или SG3847L2 и проводили реакцию при температуре 37 °C в течение 1 часа; после промывки ФСБТ добавляли меченные пероксидазой хрена вторичные козьи антитела против человеческого IgG (Goat Anti human IgG HRP, Thermo Fisher Scientific), проводили реакцию при температуре 37°C в течение 30 минут и промывали ФСБТ 5 раз; в каждую лунку добавляли 100 мкл ТМБ (eBioscience), помещали в темноту при комнатной температуре (20±5°C) на 1-2 минуты; затем в каждую лунку добавляли 100 мкл 2Н останавливающего раствора H2SO4 для прекращения реакции субстрата, значения OD считывали при длине волны 450 нм на считывающем устройстве для микропланшетов и анализировали способность слитого белка связывать целевой антиген CD47.
Как показано на Фигуре 3, по сравнению с SS002M91, способность SG3847L1, SG3847L2 связываться с целевым антигеном CD47 была аналогичной, значения EC50 для SG3847L1, SG3847L2 и SS002M91 составляли 0,114 нМ, 0,091 нМ и 0,072 нМ, соответственно.
(3) Используя SG003 и SS002M91, соответственно, в качестве контроля, активность связывания между слитым белком и антигенами CD38 и CD47 оценивали с помощью твердофазного ИФА, соответственно.
Линии клеток CHO-S, которые были сконструированы для экспрессии человеческого CD38 или человеческого CD47, использовали для оценки способности слитого белка связывать антигены на поверхности клетки. Клетки в период логарифмического роста собирали, доводили до плотности клеток 5 × 106 клеток/мл и предварительно охлаждали на льду. SG003, SS002M91, антитело отрицательного контроля (IgG1), SG3847L1 или SG3847L2 разводили до различных концентраций предварительно охлажденным физиологическим раствором, содержащим 2% ФБС.
Брали 100 мкл клеток и добавляли к равному объему вышеуказанного разбавленного антитела или слитого белка и проводили реакцию в темноте при температуре 4°C в течение 30 мин. По окончании реакции клетки дважды промывали. Клетки ресуспендировали в 100 мкл разведенных меченных фикоэритрином вторичных козьих антител против человеческого IgG Fc (eBioscience) и проводили реакцию в темноте при температуре 4°C в течение 30 мин. По окончании реакции клетки дважды промывали. Клетки ресуспендировали в 400 мкл 1% параформальдегида. Связывающую способность между слитым белком и CD38 или CD47 на поверхности клетки анализировали на проточном цитометре (BD Calibur).
Как показано на Фигурах 4A и 4B, обозначения «1», «2», «3», «4», «5», «6», «7», «8» и «9» относятся к 20 мкг мл-1 IgG1, 20 мкг мл-1 SG003, 20 мкг мл-1 SS002M91, 20 мкг мл-1 SG3847L1, 10 мкг мл-1 SG3847L1, 5 мкг мл-1 SG3847L1, 20 мкг мл-1 SG3847L2, 10 мкг мл-1 SG3847L2 и 5 мкг мл-1 SG3847L2, соответственно. Результаты показали, что слитые белки SG3847L1 и SG3847L2 могут специфично распознавать антиген CD38 или CD47, экспрессируемый на поверхности клетки.
1.3 Анализ активности одновременного связывания двух антигенов
(1) В соответствии с принципом, показанным на Фигуре 5, используя гуманизированное антитело SG003 против CD38 в качестве контроля, биологическую активность слитых белков SG3847L1 и SG3847L2 по одновременному связыванию двух антигенов CD38 и CD47 анализировали с помощью твердофазного ИФА.
Целевой антиген CD38-His (1 мкг/мл) наносили на ИФА-планшеты, инкубировали в течение ночи при температуре 4°C; после промывания ФСБТ добавляли 10% эмбриональной телячьей сыворотки и блокировали при температуре 37°C в течение 1 часа; добавляли различные концентрации антитела SG003, слитого белка SG3847L1 или SG3847L2 и проводили реакцию при 37°C в течение 1 часа; и проводили реакцию при температуре 37 °C в течение 1 часа; после промывки ФСБТ добавляли меченный биотином CD47 (Biotin-Fc-CD47), проводили реакцию при температуре 37°C в течение 30 минут и промывали ФСБТ 5 раз; добавляли меченный пероксидазой хрена авидин (Streptavidin-HRP, Jiaxuan Bio.), проводили реакцию при температуре 37°C в течение 30 минут и промывали ФСБТ 5 раз; в каждую лунку добавляли 100 мкл ТМБ (eBioscience), помещали в темноту при комнатной температуре (20±5°C) на 1-2 минуты; затем в каждую лунку добавляли 100 мкл 2Н останавливающего раствора H2SO4 для прекращения реакции субстрата, значения OD считывали при длине волны 450 нм на считывающем устройстве для микропланшетов и анализировали способность слитых белков одновременно связывать целевые антигены CD38 и CD47.
Как показано на Фигуре 6, по сравнению с антителом SG003 слитые белки SG3847L1, SG3847L2 могли одновременно связывать целевые антигены CD38 и CD47, а значения EC50 для SG3847L1 и SG3847L2 составляли 0,020 нМ и 0,024 нМ, соответственно.
(2) В соответствии с принципом, показанным на Фигуре 7, используя SG003 и SS002M91 в качестве контроля, оценивали биологическую активность слитых белков SG3847L1 и SG3847L2 по одновременному связыванию двух антигенов CD38 и CD47 на поверхности клетки.
Линии клеток CHO-S, которые были сконструированы для экспрессии человеческого CD38, использовали для оценки способности слитых белков одновременно связывать два антигена на поверхности клетки. Клетки в период логарифмического роста собирали, доводили до плотности клеток 5 × 106 клеток/мл и предварительно охлаждали на льду. Антитело SG003, слитый белок SS002M91, антитело отрицательного контроля (IgG1), SG3847L1 или SG3847L2 разбавляли предварительно охлажденным физиологическим раствором, содержащим 2% ФБС. Брали 100 мкл клеток и добавляли к равному объему вышеуказанных разведенных антител или слитых белков и CD47-FITC (Jiaxuan Bio.) и проводили реакцию в темноте при температуре 4°C в течение 30 мин. По окончании реакции клетки дважды промывали. Клетки ресуспендировали в 100 мкл разведенных меченных фикоэритрином (PE) вторичных козьих антител против человеческого IgG Fc (eBioscience), то есть Fc-PE, и проводили реакцию в темноте при температуре 4°C в течение 30 мин. По окончании реакции клетки дважды промывали. Клетки ресуспендировали в 400 мкл 1% параформальдегида. Способность слитых белков одновременно связывать CD38 и CD47 на поверхности клетки анализировали на проточном цитометре (BD Calibur).
Как показано на Фигуре 8, слитые белки SG3847L1 и SG3847L2 могли одновременно распознавать антигены CD38 и CD47 на поверхности клетки, а SG3847L2 обладал более высокой способностью одновременного распознавания двух антигенов.
1.4 Анализ активности АЗКЦ по уничтожению CD38-положительных клеток
Сначала клетки-мишени (клетки Раджи), необходимые для эксперимента, доводили до плотности 2 × 105 клеток/мл, ресуспендировали в буферном растворе АЗКЦ (культуральный раствор MEM без фенолового красного+1% ФБС) и добавляли в 96-луночный планшет (50 мкл на лунку). Затем в каждую лунку добавляли 100 мкл различных концентраций SG003, SG3847L1 и SG3847L2, перемешивали до однородного состояния и затем инкубировали в инкубаторе при температуре 37°C и 5% CO2 в течение 30 минут. Затем эффекторные клетки NK92MI-CD16a (Huabo Bio.), необходимые для эксперимента, доводили до плотности 1,2 × 106 клеток/мл и добавляли в лунки, содержащие клетки-мишени, так чтобы соотношение клеток-мишеней к эффекторным клеткам было равно 1:6. После перемешивания до однородного состояния их инкубировали в инкубаторе при температуре 37°C и 5% CO2 в течение 6 часов. Затем из 96-луночного планшета удаляли 100 мкл на лунку исходного раствора и добавляли 100 мкл на лунку реакционной смеси ЛДГ из набора реагентов для обнаружения ЛДГ (Cytotoxicity Detection Kit, Roche) и проводили реакцию при температуре 37°C в течение 10 минут. Дополнительно добавляли 50 мкл на лунку останавливающего раствора и осторожно перемешивали. OD при длине волны 492 нм определяли на считывающем устройстве для микропланшетов, и OD при длине волны 650 нм также определяли как фоновое значение. Следующие контрольные группы были сформированы одновременно в начале эксперимента, где контроль 1 представлял собой буферный раствор АЗКЦ, контроль 2 представлял собой клетки-мишени+буферный раствор АЗКЦ, контроль 3 представлял собой клетки-мишени+лизат+буферный раствор АЗКЦ, контроль 4 представлял собой клетки-мишени+эффекторные клетки+буферный раствор АЗКЦ. Удельная скорость уничтожения% = ((опытная группа - контроль 4) / (контроль 3 - контроль 2)) × 100%. Анализ данных выполняли на кривой доза-эффект с использованием программы GraphPad Prism версия 5.
Как показано на Фигуре 9, когда для обнаружения использовали клетки-мишени Раджи и эффекторные клетки NK92MI-CD16a, слитые белки SG3847L1 и SG3847L2 показали лучший эффект АЗКЦ. Значения ЕС50 для SG003, SG3847L1 и SG3847L2 составляли 0,067 нМ, 0,014 нМ и 0,013 нМ, соответственно.
1.5 Анализ активности блокирования взаимодействия между белком CD47 и SIRPα
Используя SS002M91 в качестве контроля, оценивали биологическую активность слитых белков SG3847L1 и SG3847L2 по блокированию взаимодействия между белком CD47 и SIRPα.
SIRPα-His наносили на аналитический планшет в концентрации 1 мкг/мл и инкубировали в течение ночи при температуре 4°C; после промывания ФСБТ добавляли 10% эмбриональной телячьей сыворотки и блокировали при температуре 37°C в течение 1 часа; SS002M91, SG3847L1 или SG3847L2 градиентно разбавляли соответственно 10% фетальной телячьей крови, и в качестве первичного антитела в образцы добавляли биотин-Fc-CD47 до конечной концентрации 2 мкг/мл, предварительно инкубировали при температуре 37°C в течение 30 минут; после промывания аналитического планшета ФСБТ добавляли первичное антитело и инкубировали при температуре 37°C в течение 1 часа; после 5-кратной промывки ФСБТ добавляли меченный пероксидазой хрена авидин (Streptavidin-HRP, Jiaxuan Bio.) и инкубировали при температуре 37°C в течение 30 минут; после 5-кратной промывки ФСБТ в каждую лунку добавляли 100 мкл ТМБ (eBioscience), помещали в темноту при комнатной температуре (20±5°C) на 1-5 мин; затем в каждую лунку добавляли 100 мкл 2Н останавливающего раствора H2SO4 для прекращения реакции субстрата, значения OD считывали при длине волны 450 нм на считывающем устройстве для микропланшетов и анализировали блокирующее действие SS002M91, SG3847L1, SG3847L2 на CD47/SIRPα.
Как видно на Фигуре 10, аналогично SS002M91, SG3847L1 и SG3847L2 могут конкурентно блокировать связывание между CD47 и его лигандом SIRPα. Значение IC50 для SG3847L1 составляет 46,8 нМ, значение IC50 для SG3847L2 составляет 78,8 нМ и значение IC50 для SS002M91 составляет 45,7 нМ.
Вариант осуществления 2. Использование комбинаций различных целевых антител и мутанта варианта 1 человеческого SIRPα
В соответствии со структурой слитого белка, показанной на Фигуре 1 и результатами Варианта осуществления 1, взяв, например, антитело против AXL (C6G12) и антитело против Trop2 (SG701), исследовали влияние различных целевых антител на биологическую активность слитого белка, в котором в качестве линкера использовали линкер 2.
Аминокислотные последовательности LCDR1-3 антитела C6G12 приведены в SEQ ID NO: 22, SEQ ID NO: 23 и SEQ ID NO: 24, соответственно; аминокислотная последовательность VL приведена в SEQ ID NO: 28; аминокислотные последовательности HCDR1-3 приведены в SEQ ID NO: 25, SEQ ID NO: 26 и SEQ ID NO: 27, соответственно; аминокислотная последовательность VH приведена в SEQ ID NO: 29; аминокислотная последовательность легкой цепи приведена в SEQ ID NO: 32; и аминокислотная последовательность тяжелой цепи приведена в SEQ ID NO: 34.
Аминокислотные последовательности LCDR1-3 антитела SG701 приведены в SEQ ID NO: 37, SEQ ID NO: 38 и SEQ ID NO: 39, соответственно; аминокислотная последовательность VL приведена в SEQ ID NO: 42; аминокислотные последовательности HCDR1-3 приведены в SEQ ID NO: 39, SEQ ID NO: 40 и SEQ ID NO: 41, соответственно; аминокислотная последовательность VH приведена в SEQ ID NO: 43; аминокислотная последовательность легкой цепи приведена в SEQ ID NO: 46; аминокислотная последовательность тяжелой цепи приведена в SEQ ID NO: 48.
Слитый белок получали из антитела против AXL (C6G12), мутанта M91 варианта 1 SIRPα и линкера 2 (SEQ ID: NO 74). C6G12, линкер и два M91 были последовательно связаны от N-конца к C-концу, при этом N-концы двух M91 были связаны с C-концом тяжелой цепи C6G12, соответственно, и полученный слитый белок получил название SGAXL47. Аминокислотные последовательности второй полипептидной цепи и первой полипептидной цепи SGAXL47 приведены в SEQ ID NO: 77 и SEQ ID NO: 32, соответственно.
Слитый белок получали из антитела против Trop (SG701), мутанта M91 варианта 1 SIRPα и линкера 2 (SEQ ID: NO 74). SG701, линкер и два M91 были последовательно связаны от N-конца к C-концу, при этом N-концы двух M91 были связаны с C-концом тяжелой цепи SG701, соответственно, и полученный слитый белок получил название SGTrop247. Аминокислотные последовательности второй полипептидной цепи и первой полипептидной цепи SGTrop247 приведены в SEQ ID NO: 78 и SEQ ID NO: 46, соответственно.
При помощи стандартных молекулярно-биологических методов, гены экспрессии слитых белков SGAXL47 и SGTrop247 встраивали в эукариотические экспрессионные векторы. После трансфекции клеток CHO-S супернатант собирали, а затем проводили аффинную очистку через белок А для получения целевого белка, биологическую активность которого оценивали соответствующим образом.
2.1 Анализ активности связывания двух антигенов
(1) Используя гуманизированные антитела против различных антигенов в качестве контроля, активность связывания между слитым белком и родственными антигенами оценивали с помощью твердофазного ИФА.
Целевые антигены наносили на ИФА-планшеты, инкубировали в течение ночи при температуре 4°C; после промывания ФСБТ добавляли 10% эмбриональной телячьей сыворотки и блокировали при температуре 37°C в течение 1 часа; добавляли различные концентрации антител или слитых белков и проводили реакцию при температуре 37°C в течение 1 часа; после промывки ФСБТ добавляли меченные пероксидазой хрена вторичные козьи антитела против человеческого IgG (Goat Anti human IgG HRP, Thermo Fisher Scientific), проводили реакцию при температуре 37°C в течение 30 минут и промывали ФСБТ 5 раз; в каждую лунку добавляли 100 мкл ТМБ (eBioscience), помещали в темноту при комнатной температуре (20±5°C) на 1-2 минуты; затем в каждую лунку добавляли 100 мкл 2Н останавливающего раствора H2SO4 для прекращения реакции субстрата, значения OD считывали при длине волны 450 нм на считывающем устройстве для микропланшетов и анализировали способность слитого белка связывать соответствующие целевые антигены.
Как показано на Фигуре 11A, способность SGAXL47 связываться с антигеном AXL близка к способности C6G12. Как показано на Фигуре 11B, способность SGTrop247 связываться с антигеном Trop2 близка к способности SG701. Это продемонстрировало, что антитела с разными сайтами-мишенями, используемые в слитом белке, не влияли на способность антитела связываться с антигеном Trop2.
(2) Используя SS002M91 в качестве контроля, активность связывания между слитым белком и CD47 оценивали с помощью твердофазного ИФА.
Целевой антиген CD47 наносили на ИФА-планшеты, инкубировали в течение ночи при температуре 4°C; после промывания ФСБТ добавляли 10% эмбриональной телячьей сыворотки и блокировали при температуре 37°C в течение 1 часа; добавляли различные концентрации слитого белка SS002M91 или слитого белка и проводили реакцию при температуре 37°C в течение 1 часа; после промывки ФСБТ добавляли меченные пероксидазой хрена вторичные козьи антитела против человеческого IgG (Goat Anti human IgG HRP, Thermo Fisher Scientific), проводили реакцию при температуре 37°C в течение 30 минут и промывали ФСБТ 5 раз; в каждую лунку добавляли 100 мкл ТМБ (eBioscience), помещали в темноту при комнатной температуре (20±5°C) на 1-2 минуты; затем в каждую лунку добавляли 100 мкл 2Н останавливающего раствора H2SO4 для прекращения реакции субстрата, значения OD считывали при длине волны 450 нм на считывающем устройстве для микропланшетов и анализировали способность слитого белка связывать CD47.
Как показано на Фигуре 12A, способность SGAXL47 связываться с антигеном CD47 близка к способности SS002M91. Как показано на Фигуре 12B, способность SGTrop247 связываться с антигеном CD47 близка к способности SS002M91. Это продемонстрировало, что антитела с разными сайтами-мишенями, используемые в слитом белке, не влияли на способность антитела связывать антиген CD47.
2.2. Анализ активности одновременного связывания двух антигенов
Используя гуманизированные антитела против различных антигенов в качестве контроля, биологическую активность слитого белка по одновременному связыванию двух антигенов проанализировали с помощью твердофазного ИФА.
наносили на ИФА-планшеты, инкубировали в течение ночи при температуре 4°C; после промывания ФСБТ добавляли 10% эмбриональной телячьей сыворотки и блокировали при температуре 37°C в течение 1 часа; добавляли различные концентрации антител или слитых белков и проводили реакцию при температуре 37°C в течение 1 часа; после промывки ФСБТ добавляли меченный биотином CD47 (Biotin-Fc-CD47), проводили реакцию при температуре 37°C в течение 30 минут и промывали ФСБТ 5 раз; добавляли авидин, меченный пероксидазой хрена (Streptavidin-HRP, Jiaxuan Bio.), проводили реакцию при температуре 37°C в течение 30 минут и промывали ФСБТ 5 раз; в каждую лунку добавляли 100 мкл ТМБ (eBioscience), помещали в темноту при комнатной температуре (20±5°C) на 1-2 минуты; затем в каждую лунку добавляли 100 мкл 2Н останавливающего раствора H2SO4 для прекращения реакции субстрата, значения OD считывали при длине волны 450 нм на считывающем устройстве для микропланшетов и анализировали способность слитых белков одновременно связывать соответствующий антиген и CD47.
На Фигуре 13А показаны профили связывания SGAXL47 и C6G12 с двойными антигенами AXL и CD47, соответственно; На Фигуре 13B показаны профили связывания SGTrop247 и SS002M91 с двойными антигенами Trop2 и CD47, соответственно. Результаты, приведенные н Фигуре 13, показали, что разные антитела, замененные в слитом белке, не влияют на его одновременное связывание с двойными антигенами.
Вариант осуществления 3. Слитый белок ингибирует активность опухоли in vivo
Мышам CB17 с синдромом ТКИД инокулировали клетки Раджи, экспрессирующие люциферазу, путем внутривенной инъекции в хвост для создания опухолевых моделей, и оценивали ингибирующее действие слитого белка SG3847L1 на опухолевую активность.
Для эксперимента были выбраны самки мышей CB17 с ТКИД в возрасте 5-8 недель (приобретенные у Beijing Biocytogen Co., Ltd). Клетки Раджи, экспрессирующие люциферазу, представляли собой стабильные клеточные линии на основе клеток Раджи, полученные путем введения репортерного гена люциферазы, эти клетки были приобретены у компании Beijing Biocytogen Co., Ltd. Клетки Раджи, экспрессирующие люциферазу, восстанавливали и культивировали до желаемого количества, затем собирали клетки в период фазы логарифмического роста и суспендировали до концентрации 2,5 × 107 на мл. Эту суспензию внутривенно вводили Мышам CB17 с ТКИД путем инъекции в хвост в дозе 0,2 мл на мышь. В дни 0 и 7 после введения использовали тепловизор для мелких животных для наблюдения за профилем роста и массой опухоли. На 7 день отбирали 30 мышей с умеренными сигналами визуализации опухоли, и этих мышей случайным образом распределили на 5 групп, по 6 мышей в группе. Затем животным однократно вводили препараты, которые разделяли на контрольную группу физиологического раствора, опытную группу (SG003, 100 мкг/кг), опытную группу (SS002M91, 50 мкг/кг), группу комбинированной дозы (SG003+SS002M91, 100 мкг/кг+50 мкг/кг), опытную группу (SG3847L1, 120 мкг/кг). Одновременно наблюдали за массой мышей и профилями роста опухоли.
Результаты показали, что антитело SG003, слитый белок SS002M91 и слитый белок SG3847L1 переносились экспериментальными животными. По сравнению с контрольной группой, получавшей физиологический раствор, наблюдалось очевидное ингибирующие действие на рост опухоли в различных группах животных, которым вводили дозу (см. Фигуру 14). На Фигуре 15 видно, что на 7 день после введения средняя интенсивность флуоресценции группы лечения антителом SG003, группы лечения слитым белком SS002M91, группы лечения комбинацией антитела SG003 и слитого белка SS002M91 и группы лечения слитым белком SG3847L1 составляла 1,60E+07 (стандартная ошибка: 1,02E+07), 2,42E+07 (стандартная ошибка: 6,70E+06), 4,61E+06 (стандартная ошибка: 7,57E+05), 5,97E+05 (стандартная ошибка: 1,10E+05), соответственно, все из этих значений были значительно ниже, чем средняя интенсивность флуоресценции контрольной группы, то есть 8,04E+08 (стандартная ошибка: 1,15E+08). Кроме того, ингибирующее действие на рост опухоли в группе лечения слитым белком SG3847L1 значительно превосходит действие в группе, получавшей комбинацию антитела SG003 и слитого белка SS002M91.
Кроме того, на Фигуре 16 «физиологический раствор G1», «G2 SG003», «G3 SS002M91», «G4 SG003+SS002M91» и «G5 SG3847L1» обозначают «группу физиологического раствора», «группу лечения антителом SG003», «группу лечения слитым белком SS002M91», «группу лечения комбинацией SG003 и SS002M91» и «группу лечения слитым белком SG3847L1» соответственно; Среднее время выживания в группе, получавшей физиологический раствор, составляло 11 дней, среднее время выживания в группе лечения антителом SG003 и группе лечения слитым белком SS002M91 составляло 22 дня и 21 день, соответственно, что указывает на то, что SG003 и SS002M91 значительно продлили время выживания мышей. До 23 дней после распределения по группам не было случаев смерти в группе комбинированного лечения SG003 и SS002M91 и в группе лечения слитым белком SG3847L1, что указывает на то, что по сравнению с лечением только SG003 или SS002M91, время выживания мышей в группе комбинированного лечения SG003 и SS002M91 и в группе лечения только SG3847L1 было продлено.
Вышеприведенное подробное описание предоставлено посредством объяснений и примеров, но не с целью ограничения объема прилагаемой формулы изобретения. Различные варианты вариантов осуществления изобретения, приведенные выше в настоящей заявке, очевидны для средних специалистов в данной области техники и находятся в пределах объема прилагаемой формулы изобретения и ее эквивалентов.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Hangzhou Sumgen Biotech Co., Ltd.
Sumgen Mab (Beijing) Biotech Co., Ltd.
<120> СЛИТЫЙ БЕЛОК И ЕГО ПРИМЕНЕНИЕ
<130> 0070-PA-014
<160> 78
<170> Патентная версия 3.5
<210> 1
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> LCDR1 SG003
<400> 1
Arg Ala Ser Ser Ser Val Ser Ser Ser Ala Phe Ser Tyr Val His
1 5 10 15
<210> 2
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> LCDR2 SG003
<400> 2
Leu Ala Ser Asn Leu Glu Ser
1 5
<210> 3
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> LCDR3 SG003
<400> 3
His His Ser Arg Glu Leu Pro Phe Thr
1 5
<210> 4
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> HCDR1 SG003
<400> 4
Leu Tyr Trp Met Asn
1 5
<210> 5
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> HCDR2 SG003
<400> 5
Lys Ile Asn Pro Asp Ser Ser Thr Ile Asn Tyr Thr Pro Ser Leu Lys
1 5 10 15
Asp
<210> 6
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> HCDR3 SG003
<400> 6
Leu Trp Ile Ala Thr Gly Gly Phe Asp Tyr
1 5 10
<210> 7
<211> 111
<212> Белок
<213> Искусственная последовательность
<220>
<223> VL SG003
<400> 7
Glu Ile Val Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Ser Ser Val Ser Ser Ser
20 25 30
Ala Phe Ser Tyr Val His Trp Tyr Gln Gln Lys Ser Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile His
65 70 75 80
Pro Val Glu Ser Glu Asp Val Ala Thr Tyr Tyr Cys His His Ser Arg
85 90 95
Glu Leu Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 8
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> VH SG003
<400> 8
Gln Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Val Ala Ser Gly Phe Asp Phe Ser Leu Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Lys Ile Asn Pro Asp Ser Ser Thr Ile Asn Tyr Thr Pro Ser Leu
50 55 60
Lys Asp Lys Phe Phe Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Lys Val Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Leu Trp Ile Ala Thr Gly Gly Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 9
<211> 333
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеиновая кислота, кодирующая VL SG003
<400> 9
gagatcgtga tgacccagag ccctgccagc ctgagcgcca gcctgggcca gagggccacc 60
atcagctgca gggccagcag cagcgtgagc agcagcgcct tcagctacgt gcactggtac 120
cagcagaaga gcggccagcc tcctaagctg ctgatctacc tggccagcaa cctggagagc 180
ggcgtgcctg ccaggttcag cggcagcggc agcggcaccg acttcaccct gaccatccac 240
cctgtggaga gcgaggacgt ggccacctac tactgccacc acagcaggga gctgcctttc 300
accttcggca gcggcaccaa gctggagatc aag 333
<210> 10
<211> 357
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеиновая кислота, кодирующая VH SG003
<400> 10
caggtgcagc tgctggagag cggcggcggc ctggtgcagc ctggcggcag cctgaagctg 60
agctgcgtgg ccagcggctt cgacttcagc ctgtactgga tgaactgggt gaggcaggcc 120
cctggcaagg gcctggagtg gatcggcaag atcaaccctg acagcagcac catcaactac 180
acccctagcc tgaaggacaa gttcttcatc agcagggaca acgccaagaa caccctgtac 240
ctgcagatga ccaaggtgag gagcgaggac accgccctgt actactgcgc caggctgtgg 300
atcgccaccg gcggcttcga ctactggggc cagggcacca ccctgaccgt gagcagc 357
<210> 11
<211> 218
<212> Белок
<213> Искусственная последовательность
<220>
<223> Легкая цепь SG003
<400> 11
Glu Ile Val Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Ser Ser Val Ser Ser Ser
20 25 30
Ala Phe Ser Tyr Val His Trp Tyr Gln Gln Lys Ser Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile His
65 70 75 80
Pro Val Glu Ser Glu Asp Val Ala Thr Tyr Tyr Cys His His Ser Arg
85 90 95
Glu Leu Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 12
<211> 657
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеиновая кислота, кодирующая легкую цепь SG003
<400> 12
gagatcgtga tgacccagag ccctgccagc ctgagcgcca gcctgggcca gagggccacc 60
atcagctgca gggccagcag cagcgtgagc agcagcgcct tcagctacgt gcactggtac 120
cagcagaaga gcggccagcc tcctaagctg ctgatctacc tggccagcaa cctggagagc 180
ggcgtgcctg ccaggttcag cggcagcggc agcggcaccg acttcaccct gaccatccac 240
cctgtggaga gcgaggacgt ggccacctac tactgccacc acagcaggga gctgcctttc 300
accttcggca gcggcaccaa gctggagatc aagcgtacgg tggctgcacc atctgtcttc 360
atcttcccgc catctgatga gcagttgaaa tctggaactg cctctgttgt gtgcctgctg 420
aataacttct atcccagaga ggccaaagta cagtggaagg tggataacgc cctccaatcg 480
ggtaactccc aggagagtgt cacagagcag gacagcaagg acagcaccta cagcctcagc 540
agcaccctga cgctgagcaa agcagactac gagaaacaca aagtctacgc ctgcgaagtc 600
acccatcagg gcctgagctc gcccgtcaca aagagcttca acaggggaga gtgttag 657
<210> 13
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь SG003
<400> 13
Gln Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Val Ala Ser Gly Phe Asp Phe Ser Leu Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Lys Ile Asn Pro Asp Ser Ser Thr Ile Asn Tyr Thr Pro Ser Leu
50 55 60
Lys Asp Lys Phe Phe Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Lys Val Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Leu Trp Ile Ala Thr Gly Gly Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 14
<211> 1350
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеиновая кислота, кодирующая тяжелую цепь SG003
<400> 14
caggtgcagc tgctggagag cggcggcggc ctggtgcagc ctggcggcag cctgaagctg 60
agctgcgtgg ccagcggctt cgacttcagc ctgtactgga tgaactgggt gaggcaggcc 120
cctggcaagg gcctggagtg gatcggcaag atcaaccctg acagcagcac catcaactac 180
acccctagcc tgaaggacaa gttcttcatc agcagggaca acgccaagaa caccctgtac 240
ctgcagatga ccaaggtgag gagcgaggac accgccctgt actactgcgc caggctgtgg 300
atcgccaccg gcggcttcga ctactggggc cagggcacca ccctgaccgt gagcagcgct 360
agcaccaagg gcccatcggt cttccccctg gcaccctcct ccaagagcac ctctgggggc 420
acagcggccc tgggctgcct ggtcaaggac tacttccccg aaccggtgac ggtgtcgtgg 480
aactcaggcg ccctgaccag cggcgtgcac accttcccgg ctgtcctaca gtcctcagga 540
ctctactccc tcagcagcgt ggtgaccgtg ccctccagca gcttgggcac ccagacctac 600
atctgcaacg tgaatcacaa gcccagcaac accaaggtgg acaagaaagt tgagcccaaa 660
tcttgtgaca aaactcacac atgcccaccg tgcccagcac ctgaactcct ggggggaccg 720
tcagtcttcc tcttcccccc aaaacccaag gacaccctca tgatctcccg gacccctgag 780
gtcacgtgcg tggtggtgga cgtgagccac gaagaccccg aggtcaagtt caactggtac 840
gtggacggcg tggaggtgca taatgccaag acaaagccgc gggaggagca gtacaacagc 900
acgtaccgtg tggtcagcgt cctcaccgtc ctgcaccagg actggctgaa tggcaaggag 960
tacaagtgca aggtctccaa caaagccctc ccagccccca tcgagaaaac catctccaaa 1020
gccaaagggc agccccgaga accacaggtg tacaccctgc ccccatcccg ggatgagctg 1080
accaagaacc aggtcagcct gacctgcctg gtcaaaggct tctatcccag cgacatcgcc 1140
gtggagtggg agagcaatgg gcagccggag aacaactaca agaccacgcc tcccgtgctg 1200
gactccgacg gctccttctt cctctacagc aagctcaccg tggacaagag caggtggcag 1260
caggggaacg tcttctcatg ctccgtgatg catgaggctc tgcacaacca ctacacgcag 1320
aagagcctct ccctgtctcc gggtaaatga 1350
<210> 15
<211> 22
<212> Белок
<213> Искусственная последовательность
<220>
<223> Связывающий эпитоп белка CD38
<400> 15
Ser Thr Phe Gly Ser Val Glu Val His Asn Leu Gln Pro Glu Lys Val
1 5 10 15
Gln Thr Leu Glu Ala Trp
20
<210> 16
<211> 218
<212> Белок
<213> Искусственная последовательность
<220>
<223> Мутантная легкая цепь 1 SG003
<400> 16
Glu Ile Val Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Gln Arg Ala Ser Ile Ser Cys Arg Ala Ser Asn Ser Val Ser Ser Ser
20 25 30
Ala Tyr Ser Tyr Val His Trp Tyr Gln Gln Lys Ser Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Ile Gln Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile His
65 70 75 80
Pro Val Glu Ser Glu Asp Val Ala Thr Tyr Tyr Cys His His Ser Arg
85 90 95
Gln Leu Pro Ser Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 17
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> Мутантная тяжелая цепь 1 SG003
<400> 17
Gln Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Val Ala Ser Gly Tyr Asn Phe Ser Leu Tyr
20 25 30
Tyr Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Lys Ile Gln Pro Glu Ser Ser Thr Ile Gln Tyr Thr Pro Ser Leu
50 55 60
Lys Asp Lys Phe Phe Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Lys Val Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Leu Trp Ile Gly Ser Gly Gly Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 18
<211> 218
<212> Белок
<213> Искусственная последовательность
<220>
<223> Мутантная легкая цепь 2 SG003
<400> 18
Glu Ile Val Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Ser Ser Val Ser Ser Ser
20 25 30
Ala Tyr Ser Tyr Val His Trp Tyr Gln Gln Lys Ser Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asp Leu Gln Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile His
65 70 75 80
Pro Val Glu Ser Glu Asp Val Ala Thr Tyr Tyr Cys His His Ser Arg
85 90 95
Glu Leu Pro Tyr Ser Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 19
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> Мутантная тяжелая цепь 2 SG003
<400> 19
Gln Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Val Ala Ser Gly Phe Asp Phe Ser Leu Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Lys Ile Ser Pro Asn Ser Ser Thr Ile Asn Tyr Ser Pro Ser Leu
50 55 60
Lys Asp Lys Phe Phe Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Lys Val Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Leu Tyr Ile Ala Ser Gly Gly Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 20
<211> 218
<212> Белок
<213> Искусственная последовательность
<220>
<223> Мутантная легкая цепь 3 SG003
<400> 20
Glu Ile Val Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Asn Ser Val Ser Thr Ser
20 25 30
Ala Phe Ser Tyr Val His Trp Tyr Gln Gln Lys Ser Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile His
65 70 75 80
Pro Val Glu Ser Glu Asp Val Ala Thr Tyr Tyr Cys His His Ser Arg
85 90 95
Glu Val Pro Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 21
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> Мутантная тяжелая цепь 3 SG003
<400> 21
Gln Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Val Ala Ser Gly Phe Asp Phe Ser Leu Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Lys Ile Ser Pro Asp Ser Ser Ser Leu Asn Tyr Thr Pro Ser Val
50 55 60
Lys Asp Lys Phe Phe Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Lys Val Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Leu Trp Ile Ala Thr Gly Gly Tyr Asn Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 22
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> LCDR1 C6G12
<400> 22
Arg Ser Ser Arg Ser Leu Leu His Ser Asn Gly Phe Thr Tyr Leu Tyr
1 5 10 15
<210> 23
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> LCDR2 C6G12
<400> 23
Gln Met Ser Asn Leu Ala Ser
1 5
<210> 24
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> LCDR3 C6G12
<400> 24
Gly Gln Asn Leu Glu Leu Pro Leu Thr
1 5
<210> 25
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> HCDR1 C6G12
<400> 25
Ser Gly Tyr Tyr Trp Asn
1 5
<210> 26
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> HCDR2 C6G12
<400> 26
Tyr Arg Ser Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu Lys Asn
1 5 10 15
<210> 27
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> HCDR3 C6G12
<400> 27
Gly Trp Leu Leu His Tyr Thr Met Asp Tyr
1 5 10
<210> 28
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> VL C6G12
<400> 28
Glu Leu Val Met Thr Gln Ser Pro Phe Ser Asn Ala Val Thr Leu Gly
1 5 10 15
Thr Ser Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Leu Leu His Ser
20 25 30
Asn Gly Phe Thr Tyr Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Gln Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Ser Ser Gly Ser Gly Thr Asp Phe Thr Leu Arg Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gly Gln Asn
85 90 95
Leu Glu Leu Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 29
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<223> VH C6G12
<400> 29
Gln Val Gln Leu Lys Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Ser Val Thr Gly Phe Ser Ile Ser Ser Gly
20 25 30
Tyr Tyr Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Met Gly Tyr Arg Ser Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Asn Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Phe
65 70 75 80
Leu Lys Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Gly Trp Leu Leu His Tyr Thr Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser
115
<210> 30
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеиновая кислота, кодирующая VL C6G12
<400> 30
gagctcgtga tgacacagtc tccattctcc aatgcagtca ctcttggaac atcagcttcc 60
atctcctgca ggtctagtag gagtctccta catagtaatg gcttcactta tttgtattgg 120
tatctgcaga agccaggcca gtctcctcag ctcctgattt atcagatgtc caaccttgcc 180
tcaggagtcc cagacaggtt cagtagcagt gggtcaggaa ctgatttcac actgagaatc 240
agcagagtgg aggctgagga tgtgggtgtt tattactgtg gtcaaaatct agagcttccg 300
ctcacgttcg gtgctgggac caagctggag ctgaaa 336
<210> 31
<211> 357
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеиновая кислота, кодирующая VH C6G12
<400> 31
caggtgcagc tgaagcagtc aggacctggc ctcgtgaaac cttctcagtc tctgtctctc 60
acctgttctg tcactggctt ctccatcagc agtggttatt actggaactg gatccggcag 120
tttccaggaa acaaactgga atggatgggc tacagaagct acgacggttc caataactac 180
aacccatctc tcaaaaatcg aatctccatc actcgtgaca catctaagaa ccagtttttc 240
ctgaagttga attctgtgac aactgaggac acagctacat attactgtgc aagaggatgg 300
ttactgcatt atactatgga ctactggggt caaggaacct cagtcaccgt ctcctca 357
<210> 32
<211> 219
<212> Белок
<213> Искусственная последовательность
<220>
<223> Легкая цепь C6G12
<400> 32
Glu Leu Val Met Thr Gln Ser Pro Phe Ser Asn Ala Val Thr Leu Gly
1 5 10 15
Thr Ser Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Leu Leu His Ser
20 25 30
Asn Gly Phe Thr Tyr Leu Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Gln Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Ser Ser Gly Ser Gly Thr Asp Phe Thr Leu Arg Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gly Gln Asn
85 90 95
Leu Glu Leu Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 33
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеиновая кислота, кодирующая легкую цепь C6G12
<400> 33
gagctcgtga tgacacagtc tccattctcc aatgcagtca ctcttggaac atcagcttcc 60
atctcctgca ggtctagtag gagtctccta catagtaatg gcttcactta tttgtattgg 120
tatctgcaga agccaggcca gtctcctcag ctcctgattt atcagatgtc caaccttgcc 180
tcaggagtcc cagacaggtt cagtagcagt gggtcaggaa ctgatttcac actgagaatc 240
agcagagtgg aggctgagga tgtgggtgtt tattactgtg gtcaaaatct agagcttccg 300
ctcacgttcg gtgctgggac caagctggag ctgaaacgta cggtggctgc accatctgtc 360
ttcatcttcc cgccatctga tgagcagttg aaatctggaa ctgcctctgt tgtgtgcctg 420
ctgaataact tctatcccag agaggccaaa gtacagtgga aggtggataa cgccctccaa 480
tcgggtaact cccaggagag tgtcacagag caggacagca aggacagcac ctacagcctc 540
agcagcaccc tgacgctgag caaagcagac tacgagaaac acaaagtcta cgcctgcgaa 600
gtcacccatc agggcctgag ctcgcccgtc acaaagagct tcaacagggg agagtgttag 660
<210> 34
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь C6G12
<400> 34
Gln Val Gln Leu Lys Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Ser Val Thr Gly Phe Ser Ile Ser Ser Gly
20 25 30
Tyr Tyr Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Met Gly Tyr Arg Ser Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Asn Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Phe
65 70 75 80
Leu Lys Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Gly Trp Leu Leu His Tyr Thr Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 35
<211> 1350
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеиновая кислота, кодирующая тяжелую цепь C6G12
<400> 35
caggtgcagc tgaagcagtc aggacctggc ctcgtgaaac cttctcagtc tctgtctctc 60
acctgttctg tcactggctt ctccatcagc agtggttatt actggaactg gatccggcag 120
tttccaggaa acaaactgga atggatgggc tacagaagct acgacggttc caataactac 180
aacccatctc tcaaaaatcg aatctccatc actcgtgaca catctaagaa ccagtttttc 240
ctgaagttga attctgtgac aactgaggac acagctacat attactgtgc aagaggatgg 300
ttactgcatt atactatgga ctactggggt caaggaacct cagtcaccgt ctcctcagct 360
agcaccaagg gcccatcggt cttccccctg gcaccctcct ccaagagcac ctctgggggc 420
acagcggccc tgggctgcct ggtcaaggac tacttccccg aaccggtgac ggtgtcgtgg 480
aactcaggcg ccctgaccag cggcgtgcac accttcccgg ctgtcctaca gtcctcagga 540
ctctactccc tcagcagcgt ggtgaccgtg ccctccagca gcttgggcac ccagacctac 600
atctgcaacg tgaatcacaa gcccagcaac accaaggtgg acaagaaagt tgagcccaaa 660
tcttgtgaca aaactcacac atgcccaccg tgcccagcac ctgaactcct ggggggaccg 720
tcagtcttcc tcttcccccc aaaacccaag gacaccctca tgatctcccg gacccctgag 780
gtcacgtgcg tggtggtgga cgtgagccac gaagaccccg aggtcaagtt caactggtac 840
gtggacggcg tggaggtgca taatgccaag acaaagccgc gggaggagca gtacaacagc 900
acgtaccgtg tggtcagcgt cctcaccgtc ctgcaccagg actggctgaa tggcaaggag 960
tacaagtgca aggtctccaa caaagccctc ccagccccca tcgagaaaac catctccaaa 1020
gccaaagggc agccccgaga accacaggtg tacaccctgc ccccatcccg ggatgagctg 1080
accaagaacc aggtcagcct gacctgcctg gtcaaaggct tctatcccag cgacatcgcc 1140
gtggagtggg agagcaatgg gcagccggag aacaactaca agaccacgcc tcccgtgctg 1200
gactccgacg gctccttctt cctctacagc aagctcaccg tggacaagag caggtggcag 1260
caggggaacg tcttctcatg ctccgtgatg catgaggctc tgcacaacca ctacacgcag 1320
aagagcctct ccctgtctcc gggtaaatga 1350
<210> 36
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> LCDR1 SG701
<400> 36
Arg Ala Ser Gln Gly Ile Ser Ser Trp Leu Ala
1 5 10
<210> 37
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> LCDR2 SG701
<400> 37
Asp Ala Ser Asn Leu Glu Ala
1 5
<210> 38
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> LCDR3 SG701
<400> 38
Gln Gln Tyr Gly Asp Phe Pro Leu Thr
1 5
<210> 39
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> HCDR1 SG701
<400> 39
Asn Asn Tyr Ile His
1 5
<210> 40
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> HCDR2 SG701
<400> 40
Met Ile Asn Pro Ser Gly Gly Ser Thr Thr Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 41
<211> 18
<212> Белок
<213> Искусственная последовательность
<220>
<223> HCDR3 SG701
<400> 41
Ala Ala Leu Ser Tyr Tyr Ser Ile Val Thr Ala Lys Asp Tyr Gly Met
1 5 10 15
Asp Val
<210> 42
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> VL SG701
<400> 42
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Asn Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Leu Glu Ala Gly Val Pro Ser Arg Phe Arg Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Thr Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Tyr Gly Asp Phe Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 43
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> VH SG701
<400> 43
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Asn
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asn Pro Ser Gly Gly Ser Thr Thr Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Leu Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Asp Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Ala Leu Ser Tyr Tyr Ser Ile Val Thr Ala Lys Asp Tyr
100 105 110
Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 44
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеиновая кислота, кодирующая VL SG701
<400> 44
gacatccagc tgacccagag ccctagcagc gtgagcgcca gcgtgggcga cagggtgaac 60
atcacctgca gggccagcca gggcatcagc agctggctgg cctggtacca gcagaagcct 120
ggcaaggccc ctaagctgct gatctacgac gccagcaacc tggaggccgg cgtgcctagc 180
aggttcaggg gcagcggcag cggcaccgac ttcaccttca ccatcaccag cctgcagcct 240
gaggacatcg ccacctactt ctgccagcag tacggcgact tccctctgac cttcggccag 300
ggcaccaagc tggagatcaa g 321
<210> 45
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеиновая кислота, кодирующая VH SG701
<400> 45
caggtgcagc tggtgcagag cggcgccgag gtgaagaagc ctggcgccag cgtgaaggtg 60
agctgcaagg ccagcggcta caccttcacc aacaactaca tccactgggt gaggcaggcc 120
cctggccagg gcctggagtg gatgggcatg atcaacccta gcggcggcag caccacctac 180
gcccagaagt tccagggcag gctgaccatg accagggaca ccagcaccag caccgtgtac 240
atggacctga gcagcctgag gagcgaggac accgccgtgt actactgcgc cagggccgcc 300
ctgagctact acagcatcgt gaccgccaag gactacggca tggacgtgtg gggccagggc 360
accaccgtga ccgtgagcag c 381
<210> 46
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Легкая цепь SG701
<400> 46
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Asn Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Leu Glu Ala Gly Val Pro Ser Arg Phe Arg Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Thr Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Tyr Gly Asp Phe Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 47
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеиновая кислота, кодирующая легкую цепь SG701
<400> 47
gacatccagc tgacccagag ccctagcagc gtgagcgcca gcgtgggcga cagggtgaac 60
atcacctgca gggccagcca gggcatcagc agctggctgg cctggtacca gcagaagcct 120
ggcaaggccc ctaagctgct gatctacgac gccagcaacc tggaggccgg cgtgcctagc 180
aggttcaggg gcagcggcag cggcaccgac ttcaccttca ccatcaccag cctgcagcct 240
gaggacatcg ccacctactt ctgccagcag tacggcgact tccctctgac cttcggccag 300
ggcaccaagc tggagatcaa gcgtacggtg gctgcaccat ctgtcttcat cttcccgcca 360
tctgatgagc agttgaaatc tggaactgcc tctgttgtgt gcctgctgaa taacttctat 420
cccagagagg ccaaagtaca gtggaaggtg gataacgccc tccaatcggg taactcccag 480
gagagtgtca cagagcagga cagcaaggac agcacctaca gcctcagcag caccctgacg 540
ctgagcaaag cagactacga gaaacacaaa gtctacgcct gcgaagtcac ccatcagggc 600
ctgagctcgc ccgtcacaaa gagcttcaac aggggagagt gttag 645
<210> 48
<211> 457
<212> Белок
<213> Искусственная последовательность
<220>
<223> Тяжелая цепь SG701
<400> 48
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Asn
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asn Pro Ser Gly Gly Ser Thr Thr Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Leu Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Asp Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Ala Leu Ser Tyr Tyr Ser Ile Val Thr Ala Lys Asp Tyr
100 105 110
Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala
115 120 125
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser
130 135 140
Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
145 150 155 160
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
165 170 175
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
180 185 190
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr
195 200 205
Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys
210 215 220
Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
225 230 235 240
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
245 250 255
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
260 265 270
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
275 280 285
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
290 295 300
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
305 310 315 320
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
325 330 335
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
340 345 350
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu
355 360 365
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
370 375 380
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
385 390 395 400
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
405 410 415
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
420 425 430
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
435 440 445
Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455
<210> 49
<211> 1374
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеиновая кислота, кодирующая тяжелую цепь SG701
<400> 49
caggtgcagc tggtgcagag cggcgccgag gtgaagaagc ctggcgccag cgtgaaggtg 60
agctgcaagg ccagcggcta caccttcacc aacaactaca tccactgggt gaggcaggcc 120
cctggccagg gcctggagtg gatgggcatg atcaacccta gcggcggcag caccacctac 180
gcccagaagt tccagggcag gctgaccatg accagggaca ccagcaccag caccgtgtac 240
atggacctga gcagcctgag gagcgaggac accgccgtgt actactgcgc cagggccgcc 300
ctgagctact acagcatcgt gaccgccaag gactacggca tggacgtgtg gggccagggc 360
accaccgtga ccgtgagcag cgctagcacc aagggcccat cggtcttccc cctggcaccc 420
tcctccaaga gcacctctgg gggcacagcg gccctgggct gcctggtcaa ggactacttc 480
cccgaaccgg tgacggtgtc gtggaactca ggcgccctga ccagcggcgt gcacaccttc 540
ccggctgtcc tacagtcctc aggactctac tccctcagca gcgtggtgac cgtgccctcc 600
agcagcttgg gcacccagac ctacatctgc aacgtgaatc acaagcccag caacaccaag 660
gtggacaaga aagttgagcc caaatcttgt gacaaaactc acacatgccc accgtgccca 720
gcacctgaac tcctgggggg accgtcagtc ttcctcttcc ccccaaaacc caaggacacc 780
ctcatgatct cccggacccc tgaggtcacg tgcgtggtgg tggacgtgag ccacgaagac 840
cccgaggtca agttcaactg gtacgtggac ggcgtggagg tgcataatgc caagacaaag 900
ccgcgggagg agcagtacaa cagcacgtac cgtgtggtca gcgtcctcac cgtcctgcac 960
caggactggc tgaatggcaa ggagtacaag tgcaaggtct ccaacaaagc cctcccagcc 1020
cccatcgaga aaaccatctc caaagccaaa gggcagcccc gagaaccaca ggtgtacacc 1080
ctgcccccat cccgggatga gctgaccaag aaccaggtca gcctgacctg cctggtcaaa 1140
ggcttctatc ccagcgacat cgccgtggag tgggagagca atgggcagcc ggagaacaac 1200
tacaagacca cgcctcccgt gctggactcc gacggctcct tcttcctcta cagcaagctc 1260
accgtggaca agagcaggtg gcagcagggg aacgtcttct catgctccgt gatgcatgag 1320
gctctgcaca accactacac gcagaagagc ctctccctgt ctccgggtaa atga 1374
<210> 50
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Усеченный домен варианта 1 человеческого SIRPa
<400> 50
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
1 5 10 15
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Ile Pro Val Gly
20 25 30
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu Ile Tyr
35 40 45
Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser Asp Leu
50 55 60
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Asn Ile Thr
65 70 75 80
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
85 90 95
Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
100 105 110
Arg Ala Lys Pro Ser
115
<210> 51
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> M1
<400> 51
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
1 5 10 15
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Leu Pro Ile Gly
20 25 30
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Ile Leu Ile Tyr
35 40 45
Asn Gln Lys Lys Gly His Phe Pro Arg Val Thr Thr Leu Ser Asp Ser
50 55 60
Thr Arg Arg Gly Asn Met Asp Phe Ser Ile Arg Ile Gly Asn Ile Thr
65 70 75 80
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
85 90 95
Pro Asp Asp Leu Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
100 105 110
Arg Ala Lys Pro Ser
115
<210> 52
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> M5
<400> 52
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
1 5 10 15
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Val Pro Val Gly
20 25 30
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Asn Leu Ile Tyr
35 40 45
Asn Ser Arg His Gly His Phe Pro Arg Val Thr Thr Val Ser Asp Leu
50 55 60
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Asn Ile Thr
65 70 75 80
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
85 90 95
Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
100 105 110
Arg Ala Lys Pro Ser
115
<210> 53
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> M12
<400> 53
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
1 5 10 15
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Phe Pro Ile Gly
20 25 30
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu Ile Tyr
35 40 45
Asn Gln Arg Lys Gly His Phe Pro Arg Val Thr Thr Val Ser Asp Leu
50 55 60
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Asn Ile Thr
65 70 75 80
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
85 90 95
Pro Asp Asp Ile Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
100 105 110
Arg Ala Lys Pro Ser
115
<210> 54
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> M35
<400> 54
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
1 5 10 15
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Leu Pro Val Gly
20 25 30
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Gln Leu Ile Tyr
35 40 45
Asn Gln Lys Asp Gly His Phe Pro Arg Val Thr Thr Val Ser Asp Leu
50 55 60
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Asn Ile Gly Asn Ile Thr
65 70 75 80
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
85 90 95
Pro Asp Asp Ile Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
100 105 110
Arg Ala Lys Pro Ser
115
<210> 55
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> M37
<400> 55
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
1 5 10 15
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Leu Pro Ile Gly
20 25 30
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Lys Leu Ile Tyr
35 40 45
Asn Gln Arg Asp Gly His Phe Pro Arg Val Thr Thr Val Ser Asp Leu
50 55 60
Thr Lys Arg Gly Asn Met Asp Phe Ser Ile Arg Ile Gly Asn Ile Thr
65 70 75 80
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
85 90 95
Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
100 105 110
Arg Ala Lys Pro Ser
115
<210> 56
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> M41
<400> 56
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
1 5 10 15
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Val Pro Val Gly
20 25 30
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg His Leu Ile Tyr
35 40 45
Asn Arg Arg His Gly His Phe Pro Arg Val Thr Thr Val Ser Asp Leu
50 55 60
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Ser Ile Gly Asn Ile Thr
65 70 75 80
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
85 90 95
Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
100 105 110
Arg Ala Lys Pro Ser
115
<210> 57
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> M57
<400> 57
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
1 5 10 15
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Leu Pro Val Gly
20 25 30
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Ile Leu Ile Tyr
35 40 45
Asn Gly Lys Arg Gly His Phe Pro Arg Val Thr Thr Leu Ser Asp Thr
50 55 60
Thr Lys Arg Gly Asn Met Asp Phe Ser Ile Ser Ile Arg Asn Ile Thr
65 70 75 80
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
85 90 95
Pro Asp Asp Arg Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
100 105 110
Arg Ala Lys Pro Ser
115
<210> 58
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> M67
<400> 58
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
1 5 10 15
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Leu Pro Val Gly
20 25 30
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Met Leu Ile Tyr
35 40 45
Asn Gly Arg Asp Gly His Phe Pro Arg Val Thr Thr Val Ser Asp Leu
50 55 60
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Asn Ile Thr
65 70 75 80
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
85 90 95
Pro Asp Asp Leu Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
100 105 110
Arg Ala Lys Pro Ser
115
<210> 59
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> M81
<400> 59
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
1 5 10 15
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Leu Pro Val Gly
20 25 30
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu Ile Tyr
35 40 45
Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser Asp Leu
50 55 60
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Asn Ile Thr
65 70 75 80
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
85 90 95
Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
100 105 110
Arg Ala Lys Pro Ser
115
<210> 60
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> M82
<400> 60
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
1 5 10 15
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Phe Pro Val Gly
20 25 30
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu Ile Tyr
35 40 45
Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser His Ser
50 55 60
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile His Asn Ile Thr
65 70 75 80
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
85 90 95
Pro Asp Asp Ser Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
100 105 110
Arg Ala Lys Pro Ser
115
<210> 61
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> M84
<400> 61
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
1 5 10 15
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Phe Pro Val Gly
20 25 30
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu Ile Tyr
35 40 45
Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser His Ser
50 55 60
Thr Arg Arg Asn Asn Met Asp Phe Ser Ile Arg Ile His Asn Ile Thr
65 70 75 80
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
85 90 95
Pro Asp Asp Ser Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
100 105 110
Arg Ala Lys Pro Ser
115
<210> 62
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> M91
<400> 62
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
1 5 10 15
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Leu Pro Val Gly
20 25 30
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Gln Leu Ile Tyr
35 40 45
Asn Gln Lys Asp Gly His Phe Pro Arg Val Thr Thr Ala Ser Asp Leu
50 55 60
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Asn Ile Gly Asn Ile Thr
65 70 75 80
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
85 90 95
Pro Asp Asp Ile Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
100 105 110
Arg Ala Lys Pro Ser
115
<210> 63
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> M99
<400> 63
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
1 5 10 15
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Ile Pro Val Gly
20 25 30
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Lys Leu Ile Tyr
35 40 45
Asn Gln Lys Glu Gly His Phe Pro Arg Val Thr Thr Val Ser Asp Ser
50 55 60
Thr Lys Arg Lys Asn Met Asp Phe Ser Ile Arg Ile His Asn Ile Thr
65 70 75 80
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
85 90 95
Pro Asp Asp Leu Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
100 105 110
Arg Ala Lys Pro Ser
115
<210> 64
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> M102
<400> 64
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
1 5 10 15
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Leu Pro Ile Gly
20 25 30
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Glu Leu Ile Tyr
35 40 45
Asn Gly Lys Gly Gly His Phe Pro Arg Val Thr Thr Val Ser Arg Ser
50 55 60
Thr Lys Arg Asp Asn Met Asp Phe Ser Ile Arg Ile Gly Asn Ile Thr
65 70 75 80
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
85 90 95
Pro Asp Asp Ile Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
100 105 110
Arg Ala Lys Pro Ser
115
<210> 65
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> M111
<400> 65
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
1 5 10 15
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Leu Pro Val Gly
20 25 30
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Arg Leu Ile Tyr
35 40 45
Asn Asn Arg Gly Gly His Phe Pro Arg Val Thr Thr Leu Ser Glu Thr
50 55 60
Thr Arg Arg Asp Asn Met Asp Phe Ser Ile Arg Ile Gly Asn Ile Thr
65 70 75 80
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
85 90 95
Pro Asp Asp Leu Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
100 105 110
Arg Ala Lys Pro Ser
115
<210> 66
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> M122
<400> 66
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
1 5 10 15
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Val Pro Val Gly
20 25 30
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Asn Leu Ile Tyr
35 40 45
Asn Ser Arg His Gly His Phe Pro Arg Val Thr Thr Ala Ser Asp Leu
50 55 60
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Asn Ile Thr
65 70 75 80
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
85 90 95
Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
100 105 110
Arg Ala Lys Pro Ser
115
<210> 67
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> M126
<400> 67
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
1 5 10 15
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Val Pro Ile Gly
20 25 30
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Val Leu Ile Tyr
35 40 45
Asn Gln Arg Asp Gly His Phe Pro Arg Val Thr Thr Val Ser Glu Thr
50 55 60
Thr Arg Arg Glu Asn Met Asp Phe Ser Ile Arg Ile Gly Asn Ile Thr
65 70 75 80
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
85 90 95
Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
100 105 110
Arg Ala Lys Pro Ser
115
<210> 68
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> M130
<400> 68
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
1 5 10 15
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Leu Pro Ile Gly
20 25 30
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Val Leu Ile Tyr
35 40 45
Asn Gln Arg Glu Gly His Phe Pro Arg Val Thr Thr Val Ser Glu Ser
50 55 60
Thr Arg Arg Asp Asn Met Asp Phe Ser Ile Arg Ile Arg Asn Ile Thr
65 70 75 80
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
85 90 95
Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
100 105 110
Arg Ala Lys Pro Ser
115
<210> 69
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> M135
<400> 69
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
1 5 10 15
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Val Pro Val Gly
20 25 30
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Leu Leu Ile Tyr
35 40 45
Asn Gly Lys Gly Gly His Phe Pro Arg Val Thr Thr Leu Ser Glu Thr
50 55 60
Thr Arg Arg Gly Asn Met Asp Phe Ser Ile Arg Ile Gly Asn Ile Thr
65 70 75 80
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
85 90 95
Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
100 105 110
Arg Ala Lys Pro Ser
115
<210> 70
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> M145
<400> 70
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
1 5 10 15
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Leu Pro Ile Gly
20 25 30
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Asn Leu Ile Tyr
35 40 45
Asn Gly Lys Gly Gly His Phe Pro Arg Val Thr Thr Val Ser Asp Leu
50 55 60
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Arg Ile Gly Asn Ile Thr
65 70 75 80
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
85 90 95
Pro Asp Asp Val Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
100 105 110
Arg Ala Lys Pro Ser
115
<210> 71
<211> 233
<212> Белок
<213> Искусственная последовательность
<220>
<223> IgG1-FC
<400> 71
Leu Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10 15
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
20 25 30
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
35 40 45
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
50 55 60
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
65 70 75 80
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
85 90 95
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
100 105 110
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
115 120 125
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu
130 135 140
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
145 150 155 160
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
165 170 175
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
180 185 190
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
195 200 205
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
210 215 220
Lys Ser Leu Ser Leu Ser Pro Gly Lys
225 230
<210> 72
<211> 350
<212> Белок
<213> Искусственная последовательность
<220>
<223> SS002M91
<400> 72
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
1 5 10 15
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Leu Pro Val Gly
20 25 30
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Gln Leu Ile Tyr
35 40 45
Asn Gln Lys Asp Gly His Phe Pro Arg Val Thr Thr Ala Ser Asp Leu
50 55 60
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Asn Ile Gly Asn Ile Thr
65 70 75 80
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
85 90 95
Pro Asp Asp Ile Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
100 105 110
Arg Ala Lys Pro Ser Leu Glu Pro Lys Ser Cys Asp Lys Thr His Thr
115 120 125
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
130 135 140
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
145 150 155 160
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
165 170 175
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
180 185 190
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
195 200 205
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
210 215 220
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
225 230 235 240
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
245 250 255
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
260 265 270
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
275 280 285
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
290 295 300
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
305 310 315 320
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
325 330 335
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
340 345 350
<210> 73
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Линкер 1
<400> 73
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 74
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Линкер 2
<400> 74
Gly Gly Gly Ser Ala Ala Ala
1 5
<210> 75
<211> 576
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вторая полипептидная цепь SG3847L1
<400> 75
Gln Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Val Ala Ser Gly Phe Asp Phe Ser Leu Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Lys Ile Asn Pro Asp Ser Ser Thr Ile Asn Tyr Thr Pro Ser Leu
50 55 60
Lys Asp Lys Phe Phe Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Lys Val Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Leu Trp Ile Ala Thr Gly Gly Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Leu Gln Val Ile
450 455 460
Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly Glu Thr Ala Thr Leu
465 470 475 480
Arg Cys Thr Ala Thr Ser Leu Leu Pro Val Gly Pro Ile Gln Trp Phe
485 490 495
Arg Gly Ala Gly Pro Gly Arg Gln Leu Ile Tyr Asn Gln Lys Asp Gly
500 505 510
His Phe Pro Arg Val Thr Thr Ala Ser Asp Leu Thr Lys Arg Asn Asn
515 520 525
Met Asp Phe Ser Ile Asn Ile Gly Asn Ile Thr Pro Ala Asp Ala Gly
530 535 540
Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser Pro Asp Asp Ile Glu
545 550 555 560
Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val Arg Ala Lys Pro Ser
565 570 575
<210> 76
<211> 573
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вторая полипептидная цепь SG3847L2
<400> 76
Gln Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Val Ala Ser Gly Phe Asp Phe Ser Leu Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Lys Ile Asn Pro Asp Ser Ser Thr Ile Asn Tyr Thr Pro Ser Leu
50 55 60
Lys Asp Lys Phe Phe Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Thr Lys Val Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Leu Trp Ile Ala Thr Gly Gly Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys Gly Gly Gly Ser Ala Ala Ala Glu Leu Gln Val Ile Gln Pro Asp
450 455 460
Lys Ser Val Leu Val Ala Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr
465 470 475 480
Ala Thr Ser Leu Leu Pro Val Gly Pro Ile Gln Trp Phe Arg Gly Ala
485 490 495
Gly Pro Gly Arg Gln Leu Ile Tyr Asn Gln Lys Asp Gly His Phe Pro
500 505 510
Arg Val Thr Thr Ala Ser Asp Leu Thr Lys Arg Asn Asn Met Asp Phe
515 520 525
Ser Ile Asn Ile Gly Asn Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr
530 535 540
Cys Val Lys Phe Arg Lys Gly Ser Pro Asp Asp Ile Glu Phe Lys Ser
545 550 555 560
Gly Ala Gly Thr Glu Leu Ser Val Arg Ala Lys Pro Ser
565 570
<210> 77
<211> 573
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вторая полипептидная цепь SGAXL47
<400> 77
Gln Val Gln Leu Lys Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Ser Val Thr Gly Phe Ser Ile Ser Ser Gly
20 25 30
Tyr Tyr Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Met Gly Tyr Arg Ser Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Asn Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Phe
65 70 75 80
Leu Lys Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Gly Trp Leu Leu His Tyr Thr Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys Gly Gly Gly Ser Ala Ala Ala Glu Leu Gln Val Ile Gln Pro Asp
450 455 460
Lys Ser Val Leu Val Ala Ala Gly Glu Thr Ala Thr Leu Arg Cys Thr
465 470 475 480
Ala Thr Ser Leu Leu Pro Val Gly Pro Ile Gln Trp Phe Arg Gly Ala
485 490 495
Gly Pro Gly Arg Gln Leu Ile Tyr Asn Gln Lys Asp Gly His Phe Pro
500 505 510
Arg Val Thr Thr Ala Ser Asp Leu Thr Lys Arg Asn Asn Met Asp Phe
515 520 525
Ser Ile Asn Ile Gly Asn Ile Thr Pro Ala Asp Ala Gly Thr Tyr Tyr
530 535 540
Cys Val Lys Phe Arg Lys Gly Ser Pro Asp Asp Ile Glu Phe Lys Ser
545 550 555 560
Gly Ala Gly Thr Glu Leu Ser Val Arg Ala Lys Pro Ser
565 570
<210> 78
<211> 581
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вторая полипептидная цепь SGTrop247
<400> 78
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Asn
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asn Pro Ser Gly Gly Ser Thr Thr Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Leu Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Asp Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Ala Leu Ser Tyr Tyr Ser Ile Val Thr Ala Lys Asp Tyr
100 105 110
Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala
115 120 125
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser
130 135 140
Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
145 150 155 160
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
165 170 175
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
180 185 190
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr
195 200 205
Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys
210 215 220
Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
225 230 235 240
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
245 250 255
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
260 265 270
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
275 280 285
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
290 295 300
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
305 310 315 320
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
325 330 335
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
340 345 350
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu
355 360 365
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
370 375 380
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
385 390 395 400
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
405 410 415
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
420 425 430
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
435 440 445
Lys Ser Leu Ser Leu Ser Pro Gly Lys Gly Gly Gly Ser Ala Ala Ala
450 455 460
Glu Leu Gln Val Ile Gln Pro Asp Lys Ser Val Leu Val Ala Ala Gly
465 470 475 480
Glu Thr Ala Thr Leu Arg Cys Thr Ala Thr Ser Leu Leu Pro Val Gly
485 490 495
Pro Ile Gln Trp Phe Arg Gly Ala Gly Pro Gly Arg Gln Leu Ile Tyr
500 505 510
Asn Gln Lys Asp Gly His Phe Pro Arg Val Thr Thr Ala Ser Asp Leu
515 520 525
Thr Lys Arg Asn Asn Met Asp Phe Ser Ile Asn Ile Gly Asn Ile Thr
530 535 540
Pro Ala Asp Ala Gly Thr Tyr Tyr Cys Val Lys Phe Arg Lys Gly Ser
545 550 555 560
Pro Asp Asp Ile Glu Phe Lys Ser Gly Ala Gly Thr Glu Leu Ser Val
565 570 575
Arg Ala Lys Pro Ser
580
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СВЯЗЫВАНИЕ СЛИТОГО БЕЛКА С БЕЛКОМ CD47 И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2787521C2 |
| СЛИТЫЙ БЕЛОК И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2811120C2 |
| АНТИТЕЛА К БЕЛКУ CD38 И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2776795C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО ПРОТИВ ВИРУСА БЕШЕНСТВА И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2764740C1 |
| БИСПЕЦИФИЧНЫЙ СЛИТЫЙ БЕЛОК И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2801528C2 |
| АНТИТЕЛО ПРОТИВ ПРОТЕИНТИРОЗИНФОСФАТАЗЫ σ РЕЦЕПТОРНОГО ТИПА ЧЕЛОВЕКА | 2012 |
|
RU2715642C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2839153C2 |
| АНТИТЕЛО ПРОТИВ CD79B, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2817143C2 |
| АНТИТЕЛО ПРОТИВ СТОЛБНЯЧНОГО ТОКСИНА И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2815280C1 |
| СЛИТЫЙ БЕЛОК ИЗ БЕЛКА DCTN1 С БЕЛКОМ RET | 2018 |
|
RU2813996C2 |
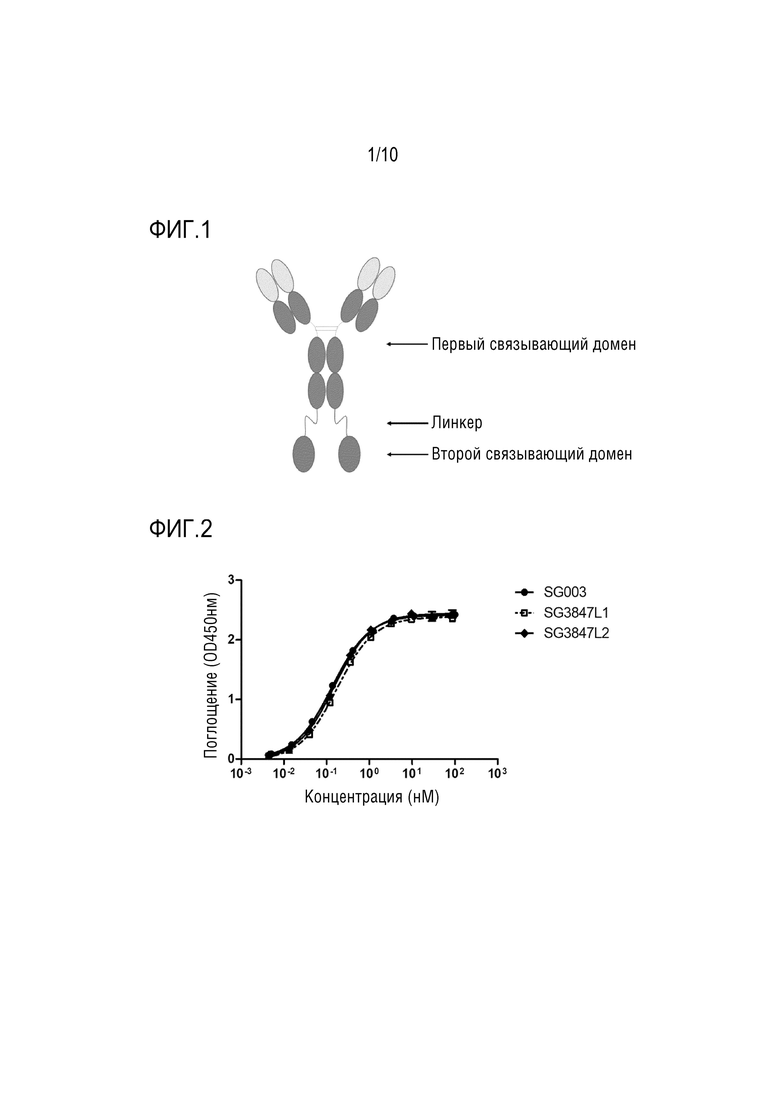
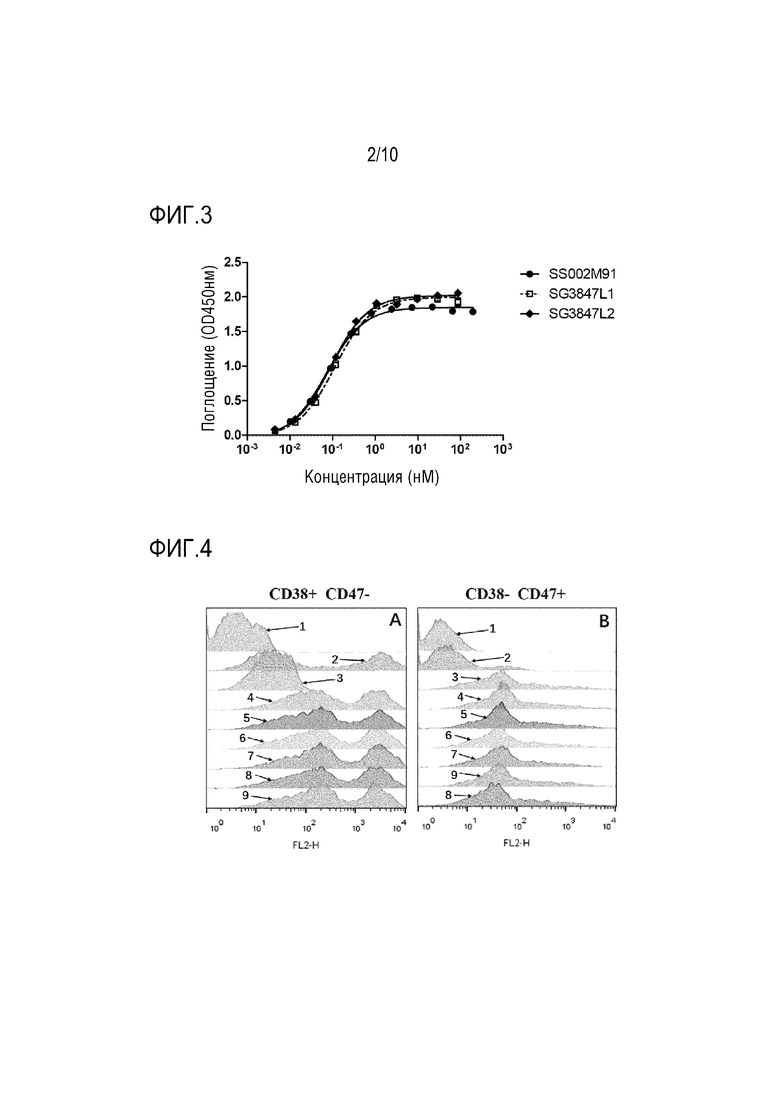
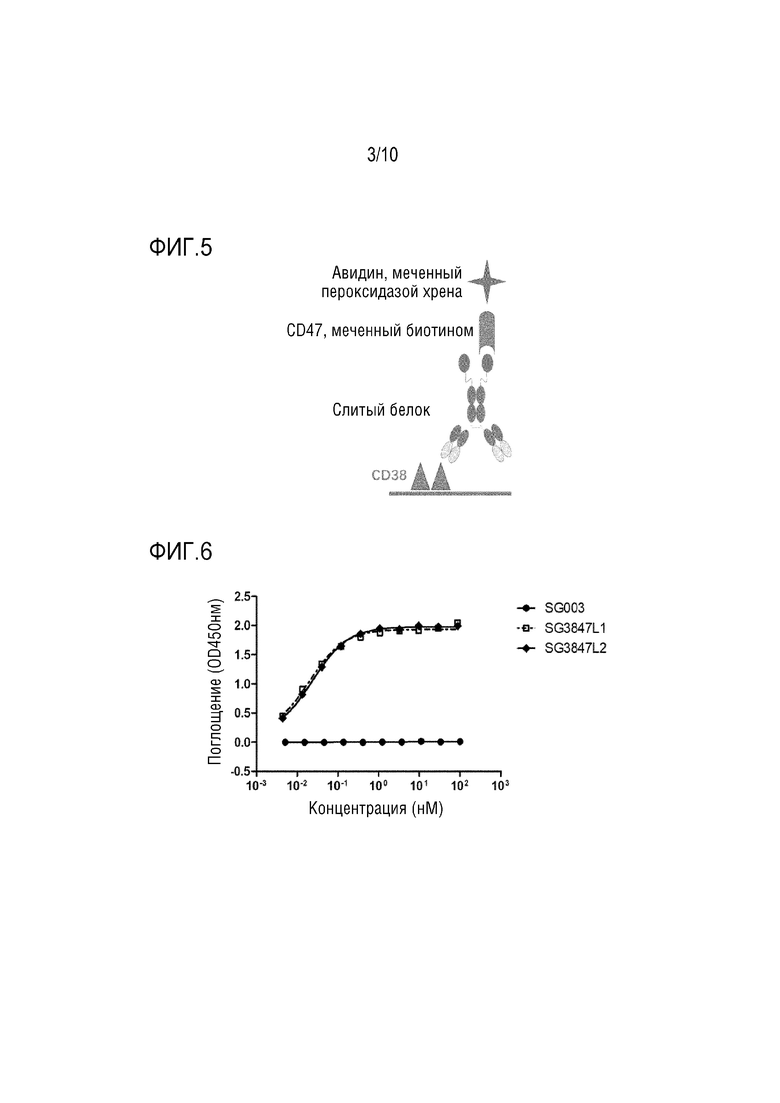
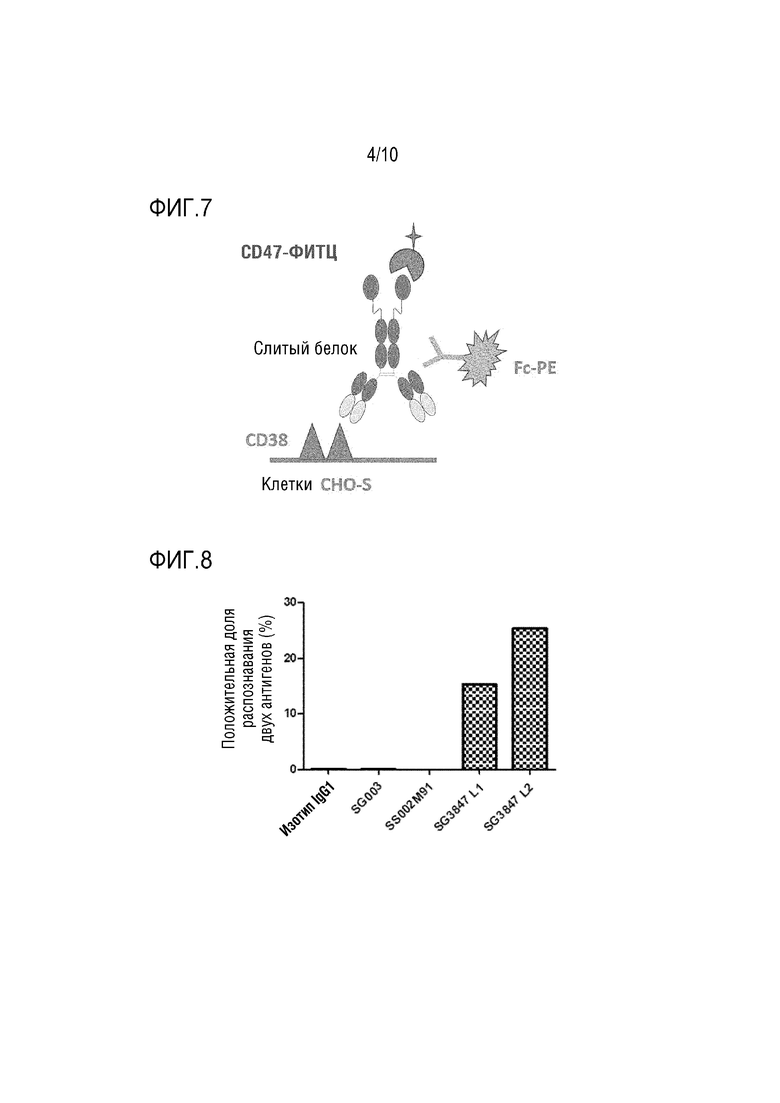

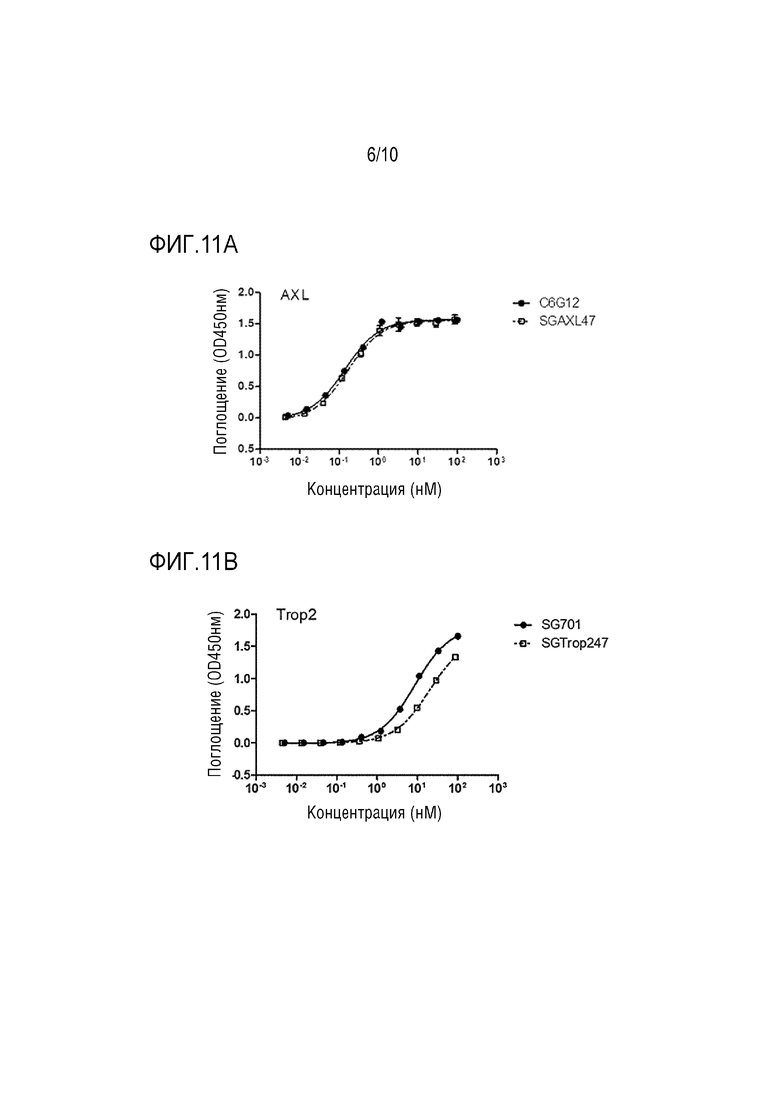
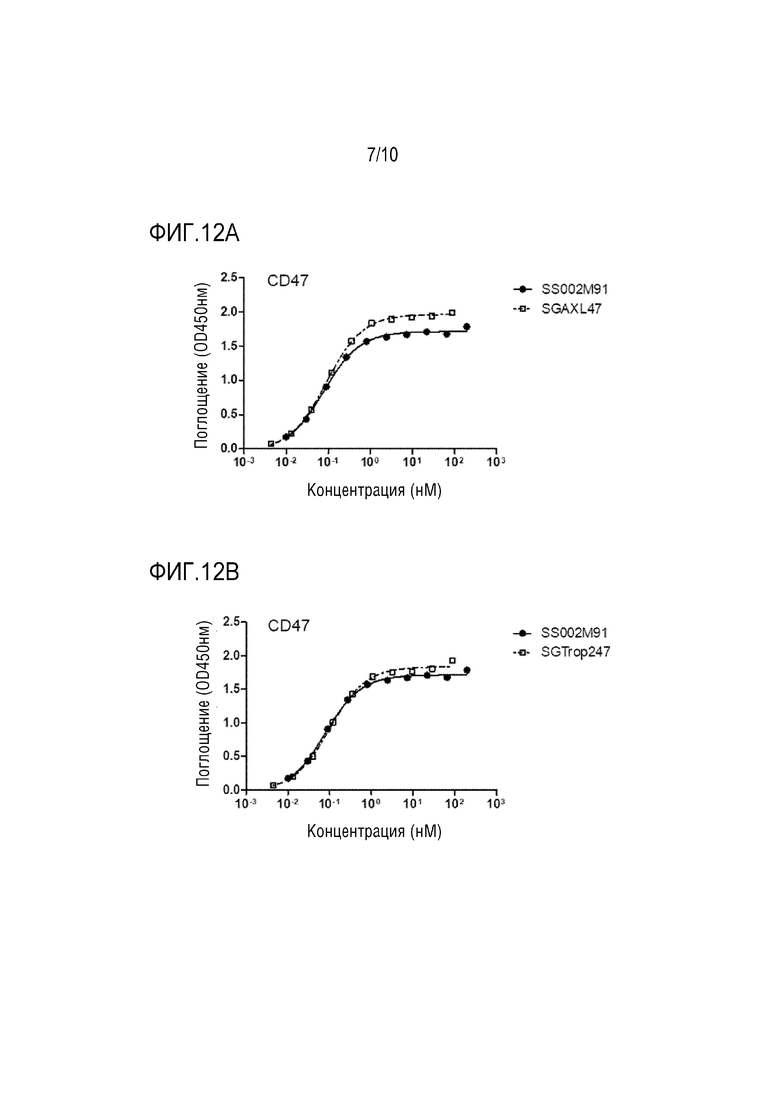

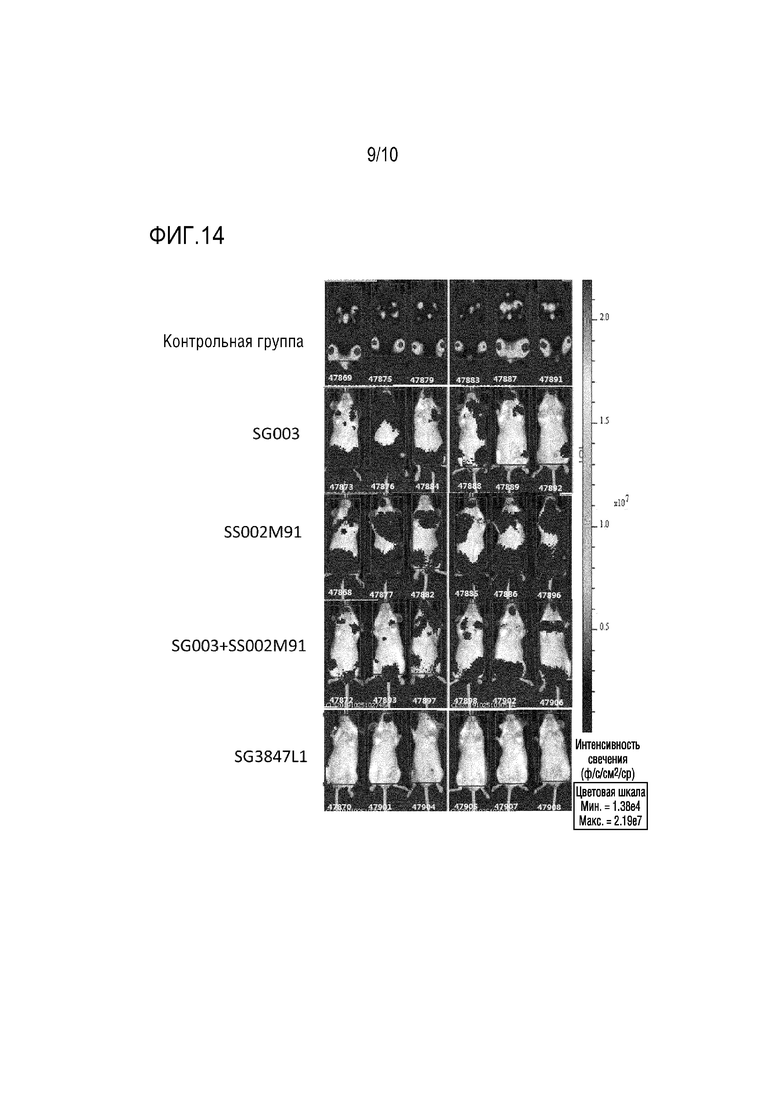
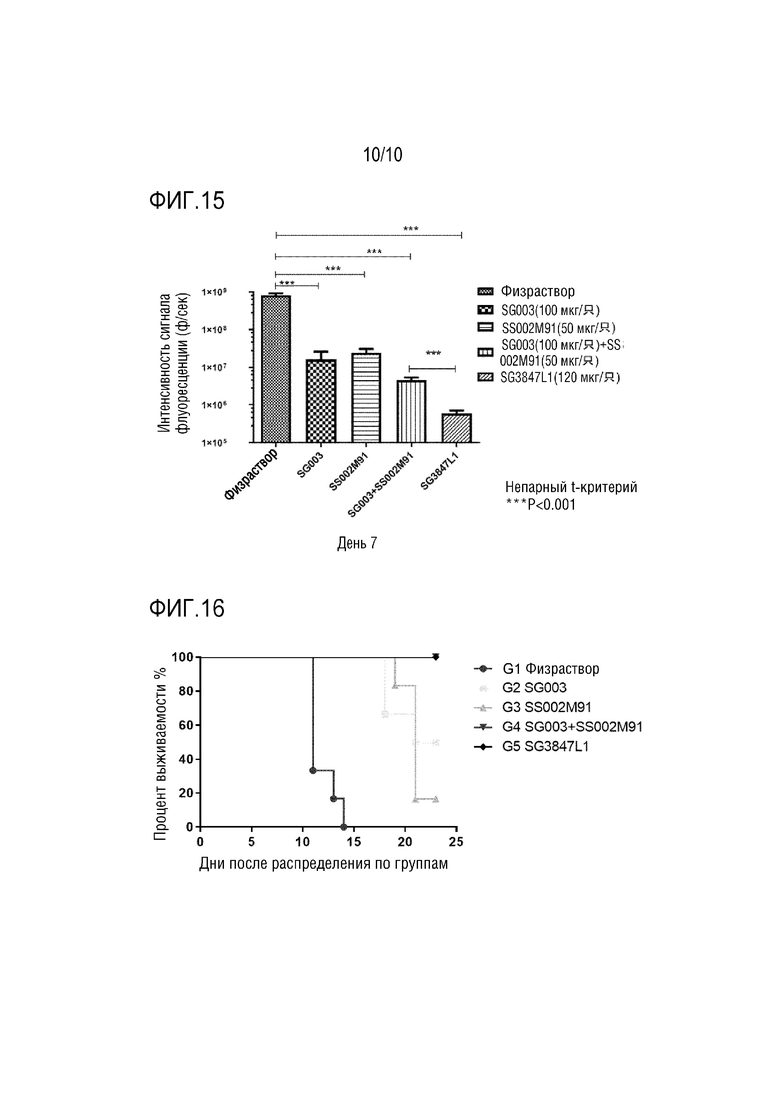
Настоящее изобретение относится к области биотехнологии, конкретно к слитым белкам на основе человеческого SIRPα, и может быть использовано в медицине для противоопухолевой терапии или в лечении аутоиммунных заболеваний. Сконструирован слитый белок для связывания с белком CD47 и опухоль-ассоциированным антигеном, включающий в себя: первый связывающий домен, который специфично связывает опухоль-ассоциированный антиген; и второй связывающий домен, содержащий мутант домена человеческого SIRPα, который специфично связывает белок CD47. Изобретение позволяет получить слитый белок, который способен специфично связывать как белок CD47, так и опухоль-ассоциированный антиген; и/или способен специфично блокировать взаимодействие между белком CD47 и SIRPα; и/или способен эффективно ингибировать рост и/или пролиферацию опухолей или опухолевых клеток. 4 н. и 16 з.п. ф-лы, 16 ил., 3 пр.
1. Слитый белок для связывания с белком CD47 и опухоль-ассоциированным антигеном, включающий в себя: первый связывающий домен, который специфично связывает опухоль-ассоциированный антиген; и второй связывающий домен, который специфично связывает белок CD47; где указанный второй связывающий домен содержит мутант домена человеческого SIRPα, где указанный домен человеческого SIRPα содержит аминокислотные остатки в положениях 33-149 варианта 1 человеческого SIRPα, где указанные аминокислотные остатки в положениях 33-149 варианта 1 человеческого SIRPα приведены в SEQ ID NO: 50, и указанный мутант содержит аминокислотные замены, выбранные из группы, состоящей из:
(1) I61L, V63I, E77I, E84K, V93L, L96S, K98R, N100G и V132L;
(2) I61V, E77N, Q82S, K83R и E84H;
(3) I61F, V63I, K83R, E84K и V132I;
(4) I61L, E77Q, E84D, R107N и V132I;
(5) I61L, V63I, E77K, K83R, E84D и N100G;
(6) I61V, E77H, Q82R, K83R, E84H и R107S;
(7) I61L, E77I, Q82G, E84R, V93L, L96T, N100G, R107S, G109R и V132R;
(8) I61L, E77M, Q82G, K83R, E84D и V132L;
(9) I61L;
(10) I61F, D95H, L96S, G109H и V132S;
(11) I61F, D95H, L96S, K98R, G109H и V132S;
(12) I61L, E77Q, E84D, V93A, R107N и V132I;
(13) E77K, L96S, N100K, G109H и V132L;
(14) I61L, V63I, Q82G, E84G, D95R, L96S, N100D и V132I;
(15) I61L, E77R, Q82N, K83R, E84G, V93L, D95E, L96T, K98R, N100D и V132L;
(16) I61V, E77N, Q82S, K83R, E84H и V93A;
(17) I61V, V63I, E77V, K83R, E84D, D95E, L96T, K98R и N100E;
(18) I61L, V63I, E77V, K83R, D95E, L96S, K98R, N100D и G109R;
(19) I61V, E77L, Q82G, E84G, V93L, D95E, L96T, K98R и N100G; и
(20) I61L, V63I, E77N, Q82G и E84G.
2. Слитый белок по п. 1, где указанный мутант содержит аминокислотную последовательность, приведенную в любой из SEQ ID NO: 51-70.
3. Слитый белок по п. 1, где указанный первый связывающий домен содержит антитело или его антигенсвязывающий фрагмент или вариант.
4. Слитый белок по п. 1, где указанный опухоль-ассоциированный антиген выбран из группы, состоящей из CD38, AXL и Trop2.
5. Слитый белок по п.1, где первый связывающий домен содержит анти-CD38 антитело или его антигенсвязывающий фрагмент или вариант.
6. Слитый белок по п.5, где указанное антитело содержит тяжелую цепь антитела или его фрагмента, где тяжелая цепь антитела или его фрагмента содержит HCDR1-3, аминокислотные последовательности HCDR1-3 представляют собой SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6, последовательно.
7. Слитый белок по пп.5, 6, где антитело содержит легкую цепь антитела или его фрагмента, где легкая цепь антитела или его фрагмента содержит LCDR1-3, аминокислотные последовательности LCDR1-3 представляют собой SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3, последовательно.
8. Слитый белок по п.4, где первый связывающий домен содержит антитело против AXL или его антигенсвязывающий фрагмент или вариант.
9. Слитый белок по п.8, где антитело содержит тяжелую цепь антитела или его фрагмента, где тяжелая цепь антитела или его фрагмента содержит HCDR1-3, аминокислотные последовательности HCDR1-3 представляют собой SEQ ID NO: 25, SEQ ID NO: 26 и SEQ ID NO: 27, последовательно.
10. Слитый белок по любому из пп.8, 9, где антитело содержит легкую цепь антитела или его фрагмента, где легкая цепь антитела или его фрагмента содержит LCDR1-3, аминокислотные последовательности LCDR1-3 представляют собой SEQ ID NO: 22, SEQ ID NO: 23 и SEQ ID NO: 24, последовательно.
11. Слитый белок по п.4, где первый связывающий домен содержит анти-Trop2 антитело или его антигенсвязывающий фрагмент или вариант.
12. Слитый белок по п.11, где антитело содержит тяжелую цепь антитела или его фрагмента, где тяжелая цепь антитела или его фрагмента содержит HCDR1-3, аминокислотные последовательности HCDR1-3 представляют собой SEQ ID NO: 39, SEQ ID NO: 40 и SEQ ID NO: 41, последовательно.
13. Слитый белок по любому из пп. 11, 12, где антитело содержит легкую цепь антитела или его фрагмента, где легкая цепь антитела или его фрагмента содержит LCDR1-3, аминокислотные последовательности LCDR1-3 представляют собой SEQ ID NO: 36, SEQ ID NO: 37 и SEQ ID NO: 38, последовательно.
14. Слитый белок по п.1, где первый связывающий домен расположен на N-конце второго связывающего домена.
15. Слитый белок по п.1, где слитый белок дополнительно содержит линкер, причем линкер расположен на С-конце первого связывающего домена и расположен на N-конце второго связывающего домена.
16. Слитый белок по п. 1, содержащий, по меньшей мере, два из вторых связывающих доменов, и каждый из вторых связывающих доменов расположен на С-конце первого связывающего домена, соответственно.
17. Слитый белок по п. 1, содержащий первую полипептидную цепь и вторую полипептидную цепь, где
первая полипептидная цепь содержит аминокислотные последовательности, приведенные в SEQ ID NO: 11, и вторая полипептидная цепь содержит аминокислотные последовательности, приведенные в SEQ ID NO: 75,
первая полипептидная цепь содержит аминокислотные последовательности, приведенные в SEQ ID NO: 11, и вторая полипептидная цепь содержит аминокислотные последовательности, приведенные в SEQ ID NO: 76,
первая полипептидная цепь содержит аминокислотные последовательности, приведенные в SEQ ID NO: 46, и вторая полипептидная цепь содержит аминокислотные последовательности, приведенные в SEQ ID NO: 78, или
первая полипептидная цепь содержит аминокислотные последовательности, приведенные в SEQ ID NO: 32, и вторая полипептидная цепь содержит аминокислотные последовательности, приведенные в SEQ ID NO: 77.
18. Композиция для связывания с белком CD47 и/или опухоль-ассоциированным антигеном, содержащая эффективное количество слитого белка по любому из пп. 1-17 и, необязательно, фармацевтически приемлемое вспомогательное вещество.
19. Применение слитого белка по любому из пп. 1-17 или композиции по п.18 для получения лекарственного средства, при этом лекарственное средство используется для лечения опухоли, где указанная опухоль включает в себя множественную миелому, лейкоз, неходжкинскую лимфому, лимфому Ходжкина, нейроглиому, герминому, саркому, мезотелиому, плацентому, рак головного мозга, рак кости, рак кожи, рак носоглотки, рак легких, рак полости рта, рак пищевода, рак желудка, рак печени, рак поджелудочной железы, рак предстательной железы, рак кишечника, рак молочной железы, рак шейки матки, рак яичника и рак яичка.
20. Применение слитого белка по любому из пп. 1-17 или композиции по п.18 для получения лекарственного средства, при этом лекарственное средство используется для лечения аутоиммунного заболевания, где указанное аутоиммунное заболевание включает в себя хронический лимфоцитарный тиреоидит, гипертиреоз, инсулинозависимый сахарный диабет, миастению гравис, хронический язвенный колит, пернициозную анемию с хроническим атрофическим гастритом, синдром Гудпасчера, вульгарную пузырчатку, пемфигоид, первичный билиарный цирроз, множественный склероз, идиопатический полиневрит, системную красную волчанку, ревматоидный артрит, склеродермию и узелковый полиартериит.
| WO 2016024021 A1, 18.02.2016, WO 2013109752 A1, 25.07.2013, WO 2016022971 A1, 11.02.2016, WO 2017027422 A1, 16.02.2017, WO 2018014067 A1, 25.01.2018, EA 201100947 A1, 28.02.2012, KONTERMANN R | |||
| E | |||
| et al., Bispecific antibodies, Drug Discovery Today, 2015, v | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Прибор для промывания газов | 1922 |
|
SU20A1 |
| et al., Single variable domain-IgG fusion: a novel | |||
Авторы
Даты
2023-08-01—Публикация
2019-11-13—Подача