Изобретение относится к медицине, а именно к хирургии, и может быть использовано для дифференциальной диагностики доброкачественных и злокачественных узловых образований щитовидной железы (УОЩЖ), в частности, фолликулярных неоплазий с целью уменьшения количества необоснованных оперативных вмешательств и выбора их рационального объема.
Диагностика УОЩЖ остается одной из сложных проблем эндокринной хирургии, что связано с трудностями их дооперационной морфологической верификации. Особенно актуальным становится вопрос в случае выявления фолликулярных неоплазий – образований с неопределенным потенциалом злокачественности, которые требуют хирургического лечения ввиду онкологической настороженности, что приводит к выполнению необоснованных оперативных вмешательств. В связи с этим необходима оптимизация алгоритма дооперационной диагностики с использованием комплексного подхода к оценке всех данных, позволяющего обеспечить выбор наиболее рационального персонифицированного варианта лечения [1–3].
Первичное выявление УОЩЖ требует проведения дальнейших диагностических мероприятий с целью своевременного исключения и раннего выявления рака. Этому способствует комплексное использование современного арсенала скрининговых методов обследования с внедрением новых диагностических технологий. Анализ литературных данных показал высокую эффективность ультразвукового исследования (УЗИ) ЩЖ с применением классификационной системы TIRADS, как самого распространенного и общедоступного скринингового метода, чувствительность которого в диагностике рака (РЩЖ) достигает 83-99% [4, 5]. Не уступает данному методу пункционная тонкоигольная аспирационная биопсия (ПТАБ) УОЩЖ под УЗ-контролем с цитологическим исследованием полученного материала и последующей его оценкой в рамках международной цитологической классификации BSRTC, диагностическая значимость которой в выявлении РЩЖ составляет более 90% [6, 7]. Однако другие показатели информативности данных методик (специфичность и точность) резко снижаются с учетом выявления образований с неопределённым потенциалом злокачественности [8–10].
На сегодняшний день высокие показатели диагностической значимости достигнуты при использовании новых высокотехнологичных методов исследования. Так, применение динамической двухиндикаторной сцинтиграфии с препаратами технеция (99mTc-пертехнетатом, 99mTc-технетрилом) с качественной и полуколичественной оценкой поглощения и вымывания радиофармпрепарата (РФП), позволило установить высокие показатели чувствительности и отрицательной прогностической ценности (90-100%) в отношении папиллярного РЩЖ (ПРЩЖ). При этом, данный метод исследования показал низкую специфичность (67-79%) и точность (71-75%) в диагностике фолликулярных аденом и карцином ЩЖ [1, 11].
В настоящее время во всем мире продолжается разработка и исследование новых молекулярно-генетических панелей, позволяющих повысить эффективность дооперационной диагностики УОЩЖ, более точно оценивать риски и прогноз заболевания на основании изучения экспрессии различных онкогенов и идентификации соматических мутаций. Указанные исследования подтверждают высокую эффективность молекулярно-генетических классификаторов в верификации злокачественного процесса ЩЖ [12–14]. Одним из перспективных биомаркеров онкологического процесса является лектиновый белок Galectin-3, который обеспечивает трансформацию опухолевых клеток, повышение их пролиферации и адгезии к нормальным клеткам, ускоряя метастазирование опухоли. По данным многочисленных исследований отмечено преобладание данного маркера в высокодифференцированных опухолевых клетках ЩЖ по сравнению с доброкачественными образованиями и нормальной тиреоидной тканью [15,16]. Соматическая мутация V600E гена BRAF является сильнейшим индуктором митоген-активирующего MAP-киназного сигнального пути, что приводит к повышению митотической активности клеток и бесконтрольной пролиферации тиреоцитов. Данный механизм позволил прочно закрепиться BRAF-мутации в лечебно-диагностическом алгоритме ВДРЩЖ, что отображено в российских и зарубежных клинических рекомендациях и протоколах [17, 18]. Проведены исследования, указывающие на ведущую роль данной мутации в канцерогенезе ПРЩЖ [19, 20]. Несмотря на постоянное совершенствование методов диагностики, применение новых молекулярно-генетических технологий показало их высокую эффективность в дооперационной диагностике и выборе оптимальной тактики лечения больных УОЩЖ. Так, Galectin-3 является высокочувствительным маркером ВДРЩЖ (более 90%), а мутация V600E гена BRAF – высокоспецифичным маркером ПКЩЖ (100%), что позволяет обосновать наиболее рациональный вариант хирургического лечения [2, 13–15].
Очевидно, используемые в настоящее время методы обследования больных УОЩЖ обладают разными показателями информативности и не могут иметь самостоятельного решающего значения в их диагностике. При этом вопросы, касающиеся системного подхода к дооперационной диагностике УОЩЖ, часто обсуждаются в мировой литературе и на научных мероприятиях. Известны единичные разработки комплексных диагностических алгоритмов, основанных на ультразвуковых, цитологических и генетических характеристиках образований, позволяющих стратифицировать риск их злокачественности [12–14].
Развитие и совершенствование цифровых технологий с разработкой и внедрением оценочных шкал, путем «балльного» подхода, давно нашло применение в различных областях медицины. Учитывая отсутствие в эндокринологии и хирургии щитовидной железы интегрального учета результатов обследования, нами предлагается способ комплексной лабораторно-инструментальной оценки риска злокачественности узловых образований щитовидной железы на основании интегральной диагностической шкалы. Применение указанного метода позволяет стратифицировать УОЩЖ и обосновать рациональную тактику лечения больных.
Решение поставленной задачи обеспечивается тем, что в способе комплексной лабораторно-инструментальной оценки риска злокачественности узловых образований щитовидной железы на основании интегральной диагностической шкалы, включающей пятибалльную систему (от 0 до 4, где «0» – отсутствие, а «4» – высокий риск злокачественности) интерпретации результатов современных лабораторно-инструментальных исследований: УЗИ ЩЖ со стратификацией риска малигнизации УО в зависимости от наличия «злокачественных» эхографических характеристик согласно международной классификационной системы TIRADS, цитологического исследования материала, полученного при ПТАБ, с описанием заключений в рамках категорий системы Bethesda, оригинальной методики динамической двухиндикаторной сцинтиграфии щитовидной железы с 99mTc-пертехнетатом и 99mТс-технетрилом и расчетом индекса вымывания, а также молекулярно-генетических исследований пункционного материала с оценкой уровня Galectin-3 и мутации V600E гена BRAF; по результатам проведенного УЗИ ЩЖ 0 баллов присваивают категории TIRADS 2; 1 балл – TIRADS 3; 2 балла – TIRADS 4a; 3 балла – TIRADS 4b и 4с; 4 балла – TIRADS 5; при оценке результатов цитологического исследования 0 баллов присваивают диагностической категории Bethesda I; 1 – Bethesda II; 2 – Bethesda IV; 3 – Bethesda V; 4 – Bethesda VI; с учетом полуколичественной оценки данных двухиндикаторной сцинтиграфии с 99mТс-пертехнетатом и 99mТс-технетрилом с расчетом индекса вымывания 0 баллов присваивают при его значении >60%, 1 – 40-60%, 2 – 20-39,9%; 4 – <20%; по результатам оценки уровня экспрессии Galectin-3 и наличия мутации V600E гена BRAF в пункционном материале 0 баллов присваивают УО со значением Galectin-3 <20%, 1 – 20-39,9%, 2 – 40-59,9%, 3 – 60-80%, 4 – >80%; выявление BRAF-мутации оценивают в 4 балла, ее отсутствие – 1 балл (табл. 1); после комплексной оценки УОЩЖ осуществляют подсчет суммы баллов указанных методов: от 0 до 5 баллов риск злокачественности считают низким (3-6,9%), от 6 до 10 баллов – средним (7-34,9%), от 11 до 15 баллов – повышенным (35-79,9%), от 16 до 20 баллов – высоким (80-96%) (табл. 2); используя полученные данные о риске злокачественности УОЩЖ обосновывают выбор лечебной тактики: в случаях низкого риска злокачественности при отсутствии признаков компрессии органов шеи рекомендуют динамическое наблюдение, а при их наличии – резекцию ЩЖ различного объема в зависимости от вовлечения долей в патологический процесс; среднего риска – выполнение органосберегающих операций в объеме гемитиреоидэктомии; повышенного риска – выполнение тиреоидэктомии с индивидуальным решением вопроса о ее дополнении профилактической центральной лимфаденэктомией с учетом BRAF-статуса; высокого риска – радикальный объем хирургического вмешательства в объеме тиреоидэктомии с обязательной центральной лимфаденэктомией.
Таблица 1. Интегральная диагностическая шкала комплексной оценки риска злокачественности УОЩЖ
экспрессии Galectin-3 (%)
Таблица 2. Расчет риска злокачественности согласно интегральной диагностической шкалы
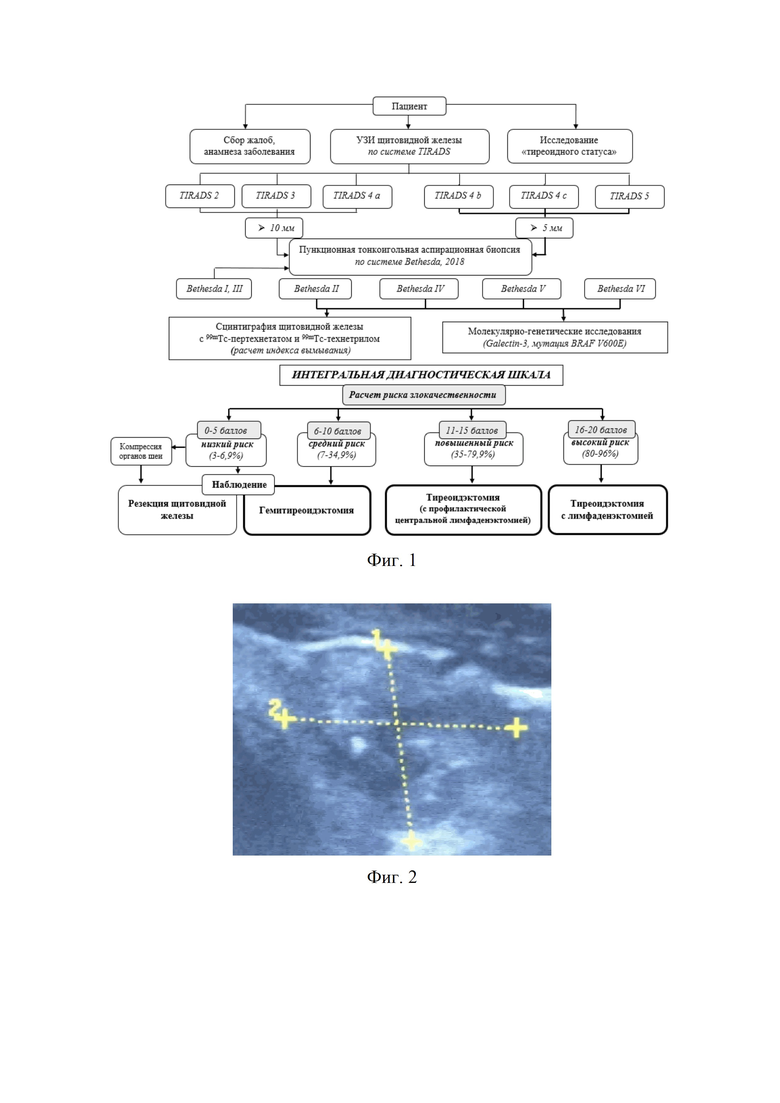
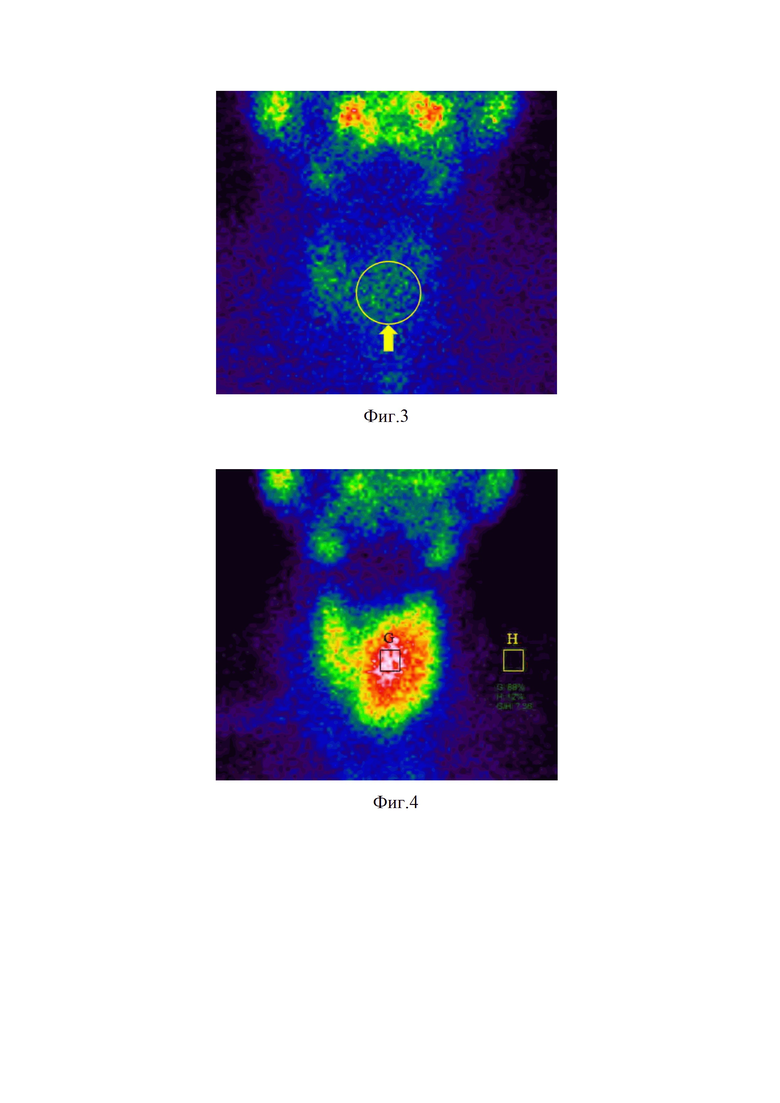
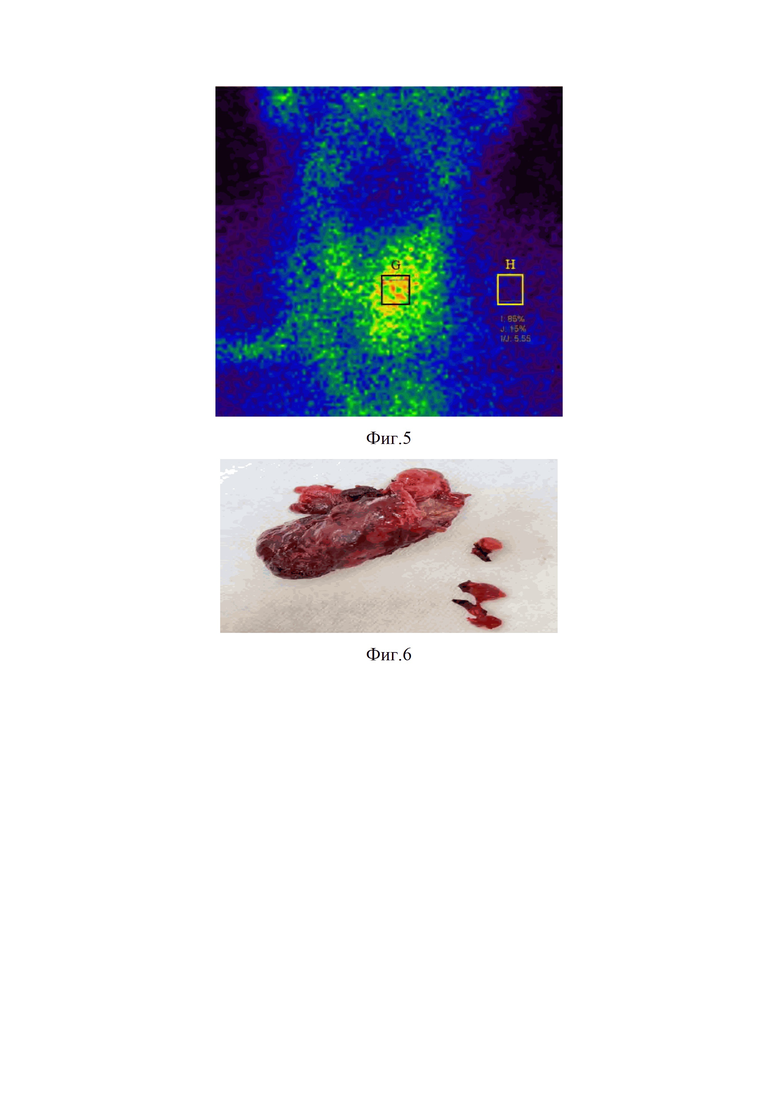
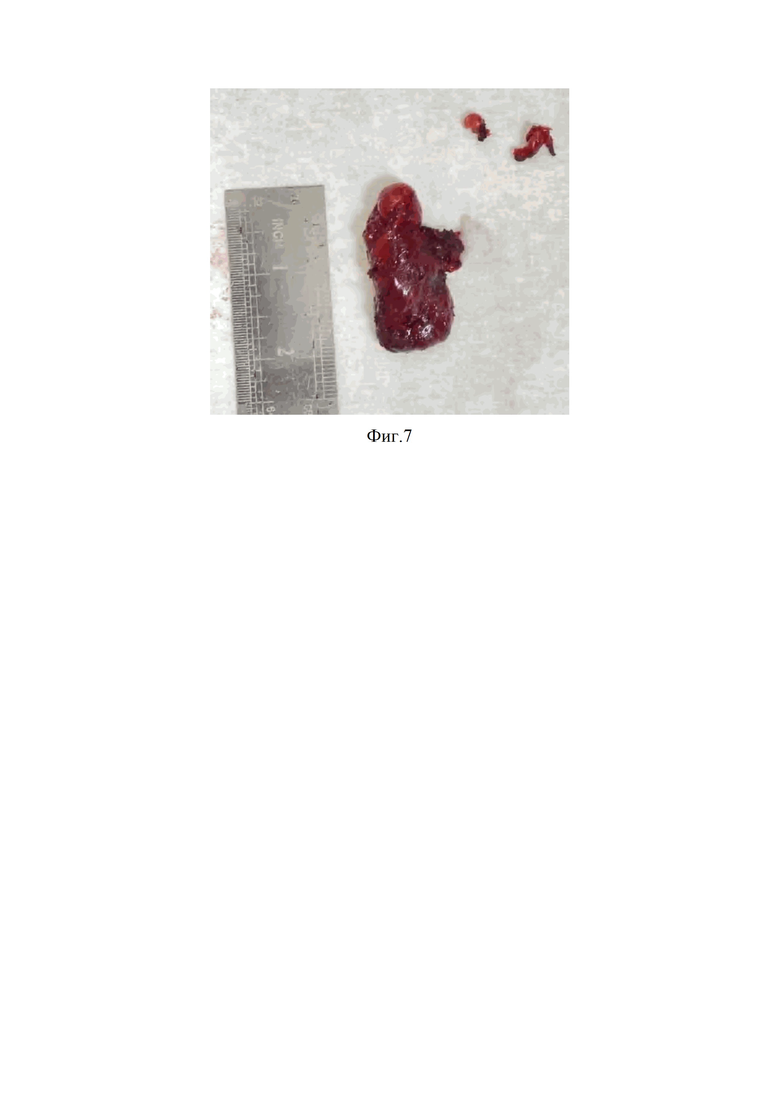
Изобретение поясняется фиг.1, на которой представлен модифицированный алгоритм диагностики и выбора варианта лечения больных УОЩЖ с применением интегральной шкалы; фиг.2, где изображена сонограмма больного А. с УО левой доли ЩЖ, характеризующееся наличием 5-ти признаков злокачественности – TIRADS 5; фиг.3 – показана сцинтиграмма ЩЖ больного А. с нефункционирующим («холодным») узлом левой доли (указан стрелкой с кругом) при сканировании с 99mTc-пертехнетатом; фиг.4, где на сцинтиграмме ЩЖ больного А. указано среднее поглощение 99mТс-технетрила в области интересов (88%) и среднее поглощение 99mТс-технетрила в области фонового поглощения (12%) в раннюю фазу сканирования (через 10 минут после введения РФП); фиг.5, на которой представлена сцинтиграмма ЩЖ больного А. с указанием среднего поглощения 99mТс-технетрила в области интересов (85%) и среднее поглощение 99mТс-технетрила в области фонового поглощения (15%) в позднюю фазу сканирования (через 60 минут после введения РФП); фиг.6 – показан макропрепарат удаленной левой доли ЩЖ больного А., где стрелками опухоль с признаками инвазии в капсулу железы и центральная клетчатка с лимфатическими узлами; фиг.7 с изображением макропрепарата удаленной правой доли ЩЖ больного А. с центральной клетчаткой с лимфатическими узлами (указаны стрелками).
Изобретение осуществляется следующим образом. В рамках комплексного обследования больных УОЩЖ проводится их интегральная оценка путем подсчета суммы баллов лабораторно-инструментальных методов исследования. По результатам проведенного УЗИ ЩЖ с интерпретацией результатов в рамках международной классификационной системы TIRADS в оригинальной шкале 0 баллов присваивается категории TIRADS 2; 1 балл – TIRADS 3; 2 балла – TIRADS 4a; 3 балла – TIRADS 4b и 4с; 4 балла – TIRADS 5. При оценке результатов цитологического исследования материала, полученного при ПТАБ, с описанием заключений в рамках категорий системы Bethesda 0 баллов соответствует диагностической категории Bethesda I; 1 – Bethesda II; 2 – Bethesda IV; 3 – Bethesda V; 4 – Bethesda VI. С учетом полуколичественной оценки данных двухиндикаторной сцинтиграфии с 99mТс-пертехнетатом и 99mТс-технетрилом с расчетом индекса вымывания 0 баллов присваивается при его значении >60%, 1 – 40-60%, 2 – 20-39,9%; 4 – <20%. По результатам оценки уровня экспрессии Galectin-3 и наличия мутации V600E гена BRAF в пункционном материале в рамках оригинальной шкалы 0 баллов имеют УОЩЖ при уровне Galectin-3 <20%, 1 – 20-39,9%, 2 – 40-59,9%, 3 – 60-80%, 4 – >80%; выявление BRAF-мутации соответствует 4 баллам, ее отсутствие – 1 баллу (табл. 1). Полученные результаты с присвоением баллов интегральной диагностической шкалы позволяют уточнить предоперационный риск злокачественности УОЩЖ: низкий (3-6,9%) при количестве баллов от 0 до 5; средний (7-34,9%) – от 6 до 10 баллов; повышенный (35-79,9%) – от 11 до 15 баллов; высокий (80-96%) – от 16 до 20 баллов (табл. 2). Определение объема операции у пациентов основывается на оценке риска злокачественности УОЩЖ предложенной интегральной диагностической шкалы: при низком риске с наличием компрессионного синдрома выполняется резекция ЩЖ различного объема в зависимости от вовлечения долей в патологический процесс; среднем риске – гемитиреоидэктомия; повышенном риске – тиреоидэктомия с индивидуальным решением вопроса о необходимости профилактической центральной лимфаденэктомии, учитывая BRAF-статус больного; высоком – радикальный объем хирургического вмешательства в объеме тиреоидэктомии с центральной лимфаденэктомией. На фиг.1 представлен модифицированный алгоритм диагностики и выбора варианта лечения больных УОЩЖ с применением интегральной шкалы.
С целью подтверждения эффективности предлагаемого нами способа комплексной лабораторно-инструментальной оценки риска злокачественности узловых образований щитовидной железы на основании интегральной диагностической шкалы представляем клиническое наблюдение.
Пациент А., 38 лет, поступил в клинику с жалобами на дискомфорт в области передней поверхности шеи, преимущественно в проекции левой доли ЩЖ. Из анамнеза установлено, что узловое образование левой доли размером около 1,5 см впервые выявлено при плановом УЗИ около 5 лет назад. Была выполнена его ПТАБ, получена цитологическая картина коллоидного узла. За последующее время размер узла увеличился до 22 мм. Оценен гормональный фон ЩЖ – эутиреоз без признаков АИТ: уровень ТТГ составил 0,78 мкМЕд/мл, св. Т4 – 15,5 пмоль/л, АТ-ТПО – 5,2 МЕд/мл, Кальцитонина – 2 пг/мл. При УЗИ: в левой доле визуализируется гипоэхогенное с неровными нечеткими, местами изъеденными контурами, кальцификатами, усиленным интранодулярным кровотоком размером 22х20 мм – TIRADS 5. Местами изъеденный контур образования достигает капсулы железы, в связи с чем нельзя исключить инвазию папиллярных структур в окружающие ткани (фиг.2). В правой доле анэхогенное округлое образование размером 0,2х0,2 см (киста). Регионарные лимфатические узлы не изменены.
Выполнена повторная ПТАБ узла левой доли с цитологическим исследованием полученного материала, соответствующего фолликулярной опухоли (Bethesda IV). С учетом сонографической картины, указывающей на наличие рака, одновременно выполнен забор пункционного материала для молекулярно-генетического исследования с оценкой уровня экспрессии Galectin-3 и мутации V600E гена BRAF. Получены следующие результаты: экспрессия Galectin-3 – 48,4%; мутация V600E гена BRAF: обнаружено. С целью более детального изучения распространенности опухолевого процесса выполнена МСКТ шеи и груди, по данным которой структура левой доли ЩЖ неоднородная за счет образования размером 20х22х21 мм, деформирующего контур железы (нельзя исключить инвазию в грудино-щитовидную мышцу). Для уточнения потенциала злокачественности образования выполнена динамическая двухиндикаторная сцинтиграфия ЩЖ по модифицированной методике. При сканировании с 99mTc-пертехнетатом в левой доле выявлен «холодный» (афункционирующий) узел, активно накапливающий 99mТс-технетрил в раннюю фазу сканирования и частично вымывающий его в позднюю фазу сканирования. По результатам применения полуколичественной оценки данных сцинтиграфии индекс вымывания РФП из образования составил 8% (фиг.3, фиг.4, фиг.5).
Комплексная оценка с использованием интегральной диагностической шкалы свидетельствует, что образование левой доли ЩЖ относится к высокому риску злокачественности – сумма баллов составила 16. При этом учитывая результаты лабораторно-инструментального обследования, пациенту установлен предварительный диагноз: Фолликулярная опухоль левой доли щитовидной железы. Однако интерпретация данных комплексного обследования согласно оригинальной шкале, учитывающей указанные эхографические характеристики, высокую экспрессию Galectin-3, наличие BRAF-мутации и низкое вымывание РФП при сцинтиграфии, позволила установить диагноз папиллярной карциномы сT3NхM0.
Таким образом, с учетом высокого риска злокачественности образования принято однозначное решение о выполнении радикального хирургического вмешательства в объеме тиреоидэктомии с профилактической ЦЛАЭ. Интраоперационно выявлена опухоль плотноэластической консистенции, интимно спаянная с капсулой железы и прилежащими мышцами, при отсутствии признаков лимфаденопатии. Выполнена операция – тиреоидэктомия, профилактическая центральная лимфаденэктомия (фиг.6, фиг.7).
Получено гистологическое заключение: узел левой доли щитовидной железы представлен папиллярной карциномой диаметром 2 см, фолликулярный вариант с инвазией ткани и капсулы щитовидной железы и признаками минимального распространения в окружающую жировую клетчатку (рТ3b). В исследуемом материале центральной клетчатки выявлено два лимфатических узла с признаками роста папиллярного рака (рN1a). Фон: диффузный коллоидный зоб. Установлен окончательный диагноз: рак (папиллярная карцинома) левой доли щитовидной железы рT3bN1аM0, I стадия.
Послеоперационный период протекал без особенностей и осложнений. Учитывая результаты гистологического исследования, объем выполненного оперативного вмешательства является достаточным. В связи с наличием папиллярной карциномы с признаками экстратиреоидного распространения, метастазирования в регионарные лимфатические узлы, BRAF-мутацией пациент согласно международной системе стратификации рисков для больных высокодифференцированным раком щитовидной железы отнесен к группе промежуточного риска рецидивирования и отправлен на следующий этап лечения – РЙТ. В настоящее время срок наблюдения за больным составляет 8 месяцев – признаков рецидива или персистенции заболевания нет, что что позволяет говорить об успешно проведенном комбинированном лечении с выполнением профилактической ЦЛАЭ.
Представленное клиническое наблюдение демонстрирует возможности интегральной диагностической шкалы, позволившей с высокой точностью стратифицировать риск злокачественности УОЩЖ, дифференцировать их характер и обосновать выбор рациональной тактики лечения, избежав повторных (завершающих) хирургических вмешательств и развития специфических осложнений.
СПИСОК ЛИТЕРАТУРЫ
1. Тимофеева Л.А., Тухбатуллин М.Г., Сенча А.Н. Ультразвуковая эластография в дифференциальной диагностике узловой патологии щитовидной железы. Кубанский научный медицинский вестник. 2019;26(4):45-55.
2. Сергийко С.В., Лукьянов С.А., Титов С.Е. и др. Современные тенденции, парадигмы и заблуждения в диагностике и лечении узловых образований щитовидной железы. Таврический медико-биологический вестник. 2021;24(2):150-155.
3. Arabi M., Zamani Н., Soltanabadi М. 99mTc-MIBI scintigraphy in a patient with thyroid follicular neoplasm: a case report and review of literature. Nucl Med Rev Cent East Eur. 2021;24(2):118-119.
4. Horvath E., Silva C.F., Majlis S. et al. Prospective validation of the ultrasound based TIRADS (Thyroid Imaging Reporting And Data System) classification: results in surgically resected thyroid nodules. Eur. Radiol. 2017;27(6):2619-2628.
5. Tugendsam C., Petz V., Buchinger W. et al. Ultrasound criteria for risk stratification of thyroid nodules in the previously iodine deficient area of Austria – a single centre, retrospective analysis. Thyroid. Res. 2018;11:3.
6. Щеголев A.A., Пантелеев И.В., Ларин А.А. Пункционная тонкоигольная аспирационная биопсия узлов щитовидной железы: сравнительная оценка цитологического и гистологического заключений. Лечебное дело. 2021;3:120-124.
7. Avior G., Dagan O., Shochat I. et al. Outcomes of the Bethesda system for reporting thyroid cytopathology: Real-life experience. Clin Endocrinol (Oxf). 2021;94(3):521-527.
8. Габаидзе Д.И., Ипполитов Л.И. Спорные вопросы в диагностике и хирургическом лечении пациентов с «фолликулярной неоплазией» щитовидной железы. Голова и шея. 2019;2:70-74.
9. Решетова О.Н., Иванцова А.А., Мокеев А.Г. Тонкоигольная аспирационная биопсия узлового зоба с применением метода жидкостной цитологии: диагностическая значимость, анализ полученных результатов. Вестник медицинского института «РЕАВИЗ». 2019;3:131-136.
10. Anand B., Ramdas A., Ambroise M.M., Kumar N.P. The Bethesda System for Reporting Thyroid Cytopathology: A Cytohistological Study. J Thyroid Res. 2020;2020:1-8.
11. Arabi M., Zamani H., Soltanabadi M., Kalhor L. 99mTc-MIBI scintigraphy in a patient with thyroid follicular neoplasm: a case report and review of literature. Nucl Med Rev Cent East Eur. 2021;24(2):118-119.
12. Krane J.F., Cibas E.S., Endo M. et al. The Afirma Xpression Atlas for thyroid nodules and thyroid cancer metastases: Insights to inform clinical decision-making from a fine-needle aspiration sample. Cancer Cytopathol. 2020;128(7):452-459.
13. Endo M., Nabhan K., Porter K. et al. Afirma gene sequencing classifier compared with gene expression classifier in indeterminate thyroid nodules. Thyroid. 2019;29(8):1115-1124.
14. Lupo M.A., Walts A.E., Sistrunk J.W. et al. Multiplatform molecular test performance in indeterminate thyroid nodules. Diagnostic Cytopathology. 2020;48(12):1254-1264.
15. Bartolazzi A., Sciacchitano S., D’Alessandria C. Galectin-3: the impact on the clinical management of patients with thyroid nodules and future perspectives. Int J Mol Sci. 2018;19(2):445.
16. Kafri N.A., Hafizi S. Galectin-3 Stimulates Tyro3 Receptor Tyrosine Kinase and Erk Signalling, Cell Survival and Migration in Human Cancer Cells. Biomolecules. 2020;10(7).:1035.
17. Бельцевич Д.Г., Мудунов А.М., Ванушко В.Э. и др. Дифференцированный рак щитовидной железы: клинические рекомендации. Министерство Здравоохранения Российской Федерации. 2020;46.
18. Haugen B.R., Alexander E.K., Bible K.C. et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016;26(1): 1–133.
19. Румянцев П.О., Никифорович, П.А. Полозников А.А. и др. Мутация BRAFV600E при папиллярном раке щитовидной железы. Клинические и методологические аспекты. Вопросы онкологии. 2019;65(1):16-26.
20. Scheffel R.S., Dora J.M., Maia A.L. BRAF mutations in thyroid cancer. Curr Opin Oncol. 2022;34(1):9-18.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ диагностики хирургических заболеваний щитовидной железы с использованием динамической двухиндикаторной сцинтиграфии | 2019 |
|
RU2726601C1 |
| Способ дифференциальной диагностики новообразований щитовидной железы | 2019 |
|
RU2705110C1 |
| Способ комплексной дооперационной дифференциальной диагностики доброкачественных и злокачественных узловых образований щитовидной железы | 2022 |
|
RU2805941C1 |
| Способ дифференциальной диагностики узловых образований щитовидной железы человека | 2021 |
|
RU2757347C1 |
| СПОСОБ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ ЩИТОВИДНОЙ ЖЕЛЕЗЫ | 2023 |
|
RU2820815C1 |
| Способ определения тактики ведения пациентов с узловыми образованиями щитовидной железы | 2022 |
|
RU2817505C2 |
| Способ дооперационной дифференциальной диагностики доброкачественных и злокачественных узловых образований щитовидной железы | 2021 |
|
RU2783304C1 |
| Способ дооперационной диагностики медуллярного рака щитовидной железы | 2023 |
|
RU2819521C1 |
| Способ оценки риска наличия рака щитовидной железы у пациентов с синдромом узлового зоба | 2023 |
|
RU2814933C1 |
| СПОСОБ ОЦЕНКИ РИСКА НАЛИЧИЯ РАКА ЩИТОВИДНОЙ ЖЕЛЕЗЫ У ПАЦИЕНТА С УЗЛОВЫМИ ОБРАЗОВАНИЯМИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ | 2019 |
|
RU2725749C1 |
Изобретение относится к медицине, а именно к хирургии. Проводят комплексную лабораторно-инструментальную оценку риска злокачественности узловых образований щитовидной железы (УОЩЖ) на основании интегральной диагностической шкалы по пятибалльной системе от 0 до 4, где 0 – отсутствие, а 4 – высокий риск злокачественности. Проводят интегральную оценку результатов современных методов исследования УОЩЖ путем подсчета суммы баллов разработанной шкалы. По результатам УЗИ ЩЖ со стратификацией риска малигнизации образований в зависимости от эхографических характеристик согласно международной классификационной системе TIRADS: 0 баллов присваивают категории TIRADS 2; 1 балл – TIRADS 3; 2 балла – TIRADS 4a; 3 балла – TIRADS 4b и 4с; 4 балла – TIRADS 5. При оценке результатов цитологического исследования материала, полученного при пункционной тонкоигольной аспирационной биопсии, с описанием заключений в рамках категорий системы Bethesda: 0 баллов присваивают диагностической категории Bethesda I; 1 – Bethesda II; 2 – Bethesda IV; 3 – Bethesda V; 4 – Bethesda VI. С учетом методики полуколичественной оценки данных двухиндикаторной сцинтиграфии с 99mТс-пертехнетатом и 99mТс-технетрилом с расчетом индекса вымывания: 0 баллов присваивают при его значении >60%, 1 – 40-59,9%, 2 – 20-39,9%; 4 – <20%. По результатам оценки уровня экспрессии Galectin-3 и наличия мутации V600E гена BRAF в пункционном материале: 0 баллов имеют УО при значении Galectin-3 <20%, 1 – 20-39,9%, 2 – 40-59,9%, 3 – 60-80%, 4 – >80%; выявление BRAF-мутации оценивают в 4 балла, ее отсутствие – 1 балл. Осуществляют подсчет суммы баллов указанных лабораторно-инструментальных методов: от 0 до 5 баллов риск злокачественности считают низким и составляющим 3-6,9%, от 6 до 10 баллов – средним и составляющим 7-34,9%, от 11 до 15 баллов – повышенным и составляющим 35-79,9%, от 16 до 20 баллов – высоким и составляющим 80-96%. По полученным данным о риске злокачественности УОЩЖ обосновывают выбор лечебной тактики. В случаях низкого риска злокачественности образований при отсутствии признаков компрессии органов шеи рекомендуют динамическое наблюдение, при наличии признаков компрессии органов шеи – резекцию щитовидной железы различного объема, в зависимости от вовлечения долей в патологический процесс. В случаях среднего риска злокачественности образований – выполнение органосберегающих операций в объеме гемитиреоидэктомии. В случаях повышенного риска злокачественности образований – выполнение тиреоидэктомии с индивидуальным решением вопроса о ее дополнении профилактической центральной лимфаденэктомией с учетом BRAF-статуса. В случаях высокого риска злокачественности образований – радикальный объем хирургического вмешательства в объеме тиреоидэктомии с обязательной центральной лимфаденэктомией. Способ позволяет с высокой точностью стратифицировать риск злокачественности узловых образований щитовидной железы, дифференцировать их характер и обосновать выбор рациональной тактики лечения, избежав повторных хирургических вмешательств и развития осложнений. 7 ил., 2 табл., 1 пр.
Способ выбора тактики лечения узловых образований щитовидной железы, включающий проведение комплексной лабораторно-инструментальной оценки риска злокачественности узловых образований щитовидной железы на основании интегральной диагностической шкалы по пятибалльной системе от 0 до 4, где 0 – отсутствие, а 4 – высокий риск злокачественности, интерпретации результатов современных методов исследования, отличающийся тем, что в рамках применяемого обследования больных с узловыми образованиями щитовидной железы проводят их интегральную оценку путем подсчета суммы баллов разработанной шкалы; по результатам УЗИ щитовидной железы со стратификацией риска малигнизации образований в зависимости от эхографических характеристик согласно международной классификационной системы TIRADS 0 баллов присваивают категории TIRADS 2; 1 балл – TIRADS 3; 2 балла – TIRADS 4a; 3 балла – TIRADS 4b и 4с; 4 балла – TIRADS 5; при оценке результатов цитологического исследования материала, полученного при ПТАБ, с описанием заключений в рамках категорий системы Bethesda 0 баллов присваивают диагностической категории Bethesda I; 1 – Bethesda II; 2 – Bethesda IV; 3 – Bethesda V; 4 – Bethesda VI; с учетом методики полуколичественной оценки данных двухиндикаторной сцинтиграфии с 99mТс-пертехнетатом и 99mТс-технетрилом с расчетом индекса вымывания 0 баллов присваивают при его значении >60%, 1 – 40-59,9%, 2 – 20-39,9%; 4 – <20%; по результатам оценки уровня экспрессии Galectin-3 и наличия мутации V600E гена BRAF в пункционном материале 0 баллов имеют УО при значении Galectin-3 <20%, 1 – 20-39,9%, 2 – 40-59,9%, 3 – 60-80%, 4 – >80%; выявление BRAF-мутации оценивают в 4 балла, ее отсутствие – 1 балл; затем осуществляют подсчет суммы баллов указанных лабораторно-инструментальных методов: от 0 до 5 баллов риск злокачественности считают низким и составляющим 3-6,9%, от 6 до 10 баллов – средним и составляющим 7-34,9%, от 11 до 15 баллов – повышенным и составляющим 35-79,9%, от 16 до 20 баллов – высоким и составляющим 80-96%; используя полученные данные о риске злокачественности узловых образований щитовидной железы, обосновывают выбор лечебной тактики: в случаях низкого риска злокачественности образований при отсутствии признаков компрессии органов шеи рекомендуют динамическое наблюдение, а при их наличии – резекцию ЩЖ различного объема в зависимости от вовлечения долей в патологический процесс; среднего риска – выполнение органосберегающих операций в объеме гемитиреоидэктомии; повышенного риска – выполнение тиреоидэктомии с индивидуальным решением вопроса о ее дополнении профилактической центральной лимфаденэктомией с учетом BRAF-статуса; высокого риска – радикальный объем хирургического вмешательства в объеме тиреоидэктомии с обязательной центральной лимфаденэктомией.
| Способ дифференциальной диагностики новообразований щитовидной железы | 2019 |
|
RU2705110C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ВЕРОЯТНОСТИ ЗЛОКАЧЕСТВЕННОСТИ УЗЛА ЩИТОВИДНОЙ ЖЕЛЕЗЫ | 2018 |
|
RU2706948C1 |
| Фонарь для кинопроекционного аппарата | 1930 |
|
SU23086A1 |
| Беляев А.М | |||
| и др | |||
| "Петровский" диагностический балльный показатель риска злокачественности узла в щитовидной железе (Petrov Thyroid Cancer Score, PTCS): оценка практической значимости при сопоставлении с результатами морфологического анализа операционного материала | |||
Авторы
Даты
2024-07-29—Публикация
2023-04-19—Подача