Группа изобретений относится к области органического синтеза мероцианиновых красителей, касается ранее неизвестных 2,6-бис(аминовинил)-4-метилен-1,4-дигидропиридинов, обладающих люминесцентными свойствами, и может быть применена для получения новых хромофоров и флуоресцентных материалов для визуализации биологических процессов.
Известные люминофоры на основе трициано-4-метилен-1,4-пиридина обладают люминесценцией, вызванной агрегацией, в ближней ИК-области спектра, хорошей биосовместимостью и низкой цитотоксичностью, что позволяет широко применять их для биологических исследований in vivo. Данные люминофоры находят свое применение в фотодинамической терапии с визуальным контролем для лечения раковых заболеваний, позволяют определять расположение β-амилоидов, которые являются основным компонентом амилоидных бляшек, обнаруживаемых при болезни Альцгеймера, а также могут использоваться для отслеживания доставки лекарственных соединений в организме [Веб-ресурс: https://onlinelibrary.wiley.com/doi/full/10.1002/anie.201913249, дата публикации: 14.11.2019].
Природными красителями 4-метилен-1,4-дигидропиридиного ряда являются широко распространенные беталаины, которые обладают желто-оранжевой или красной окраской и находят применение в качестве пищевых красителей. Также эти соединения проявляют антиоксидантную и противораковую активность [Веб-ресурс: https://web.archive.org/web/20231121061643/https://www.sciencedirect.com/science/article/pii/S1674205217303076, дата публикации: 08.02.2018 г.].
В качестве прототипа выбраны люминофоры на основе диметиламиновинил-замещенных пиранов, получаемый из соответствующих 4-метилен-4Н-пиранов и диметилацеталя N,N-диметилформамида [Веб-ресурс: https://web.archive.org/web/20221219093752/https://pubs.rsc.org/en/content/articlelanding/2023/OB/D2OB01862D, дата публикации: 14.12.2022 г.].
Недостатком прототипа и известного технического решения является малая номенклатура существующих на данный момент синтетических люминофоров, а также способов получения люминофоров на основе коммерчески доступных реагентов.
Техническая проблема, на решение которой направлена группа изобретений, заключается в расширении арсенала существующих люминофоров и способов их получения.
Технический результат, на достижение которого направлена группа изобретений, заключается в синтезе новых групп соединений на основе 1,4-дигидропиридинов, обладающих люминесцентными свойствами с использованием коммерчески доступных реагентов.
Дополнительный технический результат, на достижение которого направлена группа изобретений, заключается в исключении необходимости применения методов колоночной хроматографии для очистки целевых продуктов синтеза.
Сущность первого изобретения из группы изобретений заключается в следующем.
Люминофоры на основе 2,6-Бис(аминовинил)-4-метилен-1,4-дигидропиридина формулы I:
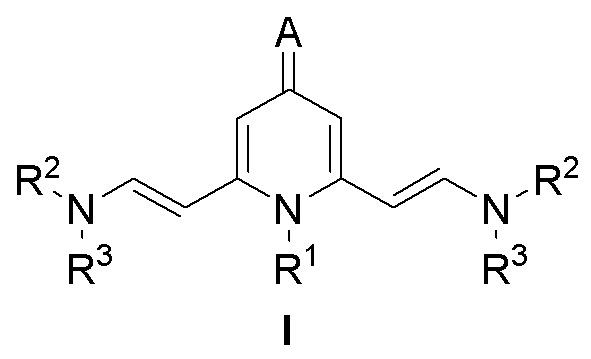
где:
- R1 представляет собой Bn, Ph, n-Bu, Oct, CH2CH2NMe2, CH2CH(OMe)2, CH2CH2OH, 2-MeOC6H4, 4-MeOC6H4;
- R2 представляет собой Me;
- R3 представляет собой Me;
- A представляет собой дицианометилиден, 1,3-диоксо-1,3-дигидро-2H-инден-2-илиден, 1-(дицианометилен)-3-оксо-1,3-дигидро-2H-инден-2-илиден, 1,3-диметил-2,4,6-триоксотетрагидропиримидин-5(2H)-илиден, 1,3-диэтил-4,6-диоксо-2-тиоксотетрагидропиримидин-5(2H)-илиден.
Me представляет собой метильную группу.
Сущность второго изобретения из группы изобретений заключается в следующем.
Способ получения люминофоров на основе 2,6-бис(аминовинил)-4-метилен-1,4-дигидропиридина общей формулы I реализуют рядом следующих этапов:
- смешивают 2,6-диметил-1,4-дигидропиридина (1 эквивалент), диметилформамид диметилацеталь (5 эквивалентов) и N-метилимидазола (1 эквивалент);
- полученную смесь нагревают при 130° С в течение 15 часов;
- после нагрева смесь отфильтровывают и промывают.
Нагрев смеси могут осуществлять в герметичном автоклаве.
Фильтрацию и промывку смеси могут осуществлять посредством фильтров Шотта с использованием этанола.
Группа изобретений может быть выполнена из известных материалов с помощью известных средств, что свидетельствует о ее соответствии критерию патентоспособности «промышленная применимость».
Группа изобретений характеризуется ранее неизвестной из уровня техники совокупностью существенных признаков, позволяющих синтезировать люминофор на основе 2,6-бис(аминовинил)-4-метилен-1,4-дигидропиридина.
Благодаря этому обеспечивается достижение технического результата, заключающегося в синтезе новых групп соединений на основе 1,4-дигидропиридинов, обладающих люминесцентными свойствами с использованием коммерчески доступных реагентов, тем самым расширяется арсенал существующих люминофоров и способов их получения.
Группа изобретений обладает ранее неизвестной из уровня техники совокупностью существенных признаков, что свидетельствует о ее соответствии критерию патентоспособности «новизна».
Из уровня техники известны природный люминофор на основе бетацианина и бетаксантина и диметиламиновинил-замещенных пиранов. Однако из уровня техники не известны предложенные люминофор на основе 2,6-бис(аминовинил)-4-метилен-1,4-дигидропиридина и способ его получения. Ввиду этого группа изобретений соответствует критерию патентоспособности «изобретательский уровень».
Изобретения из группы изобретений связаны между собой и образуют единый изобретательский замысел, что свидетельствует о соответствии группы изобретений критерию патентоспособности «единство изобретения».
Группа изобретений поясняется следующими фигурами.
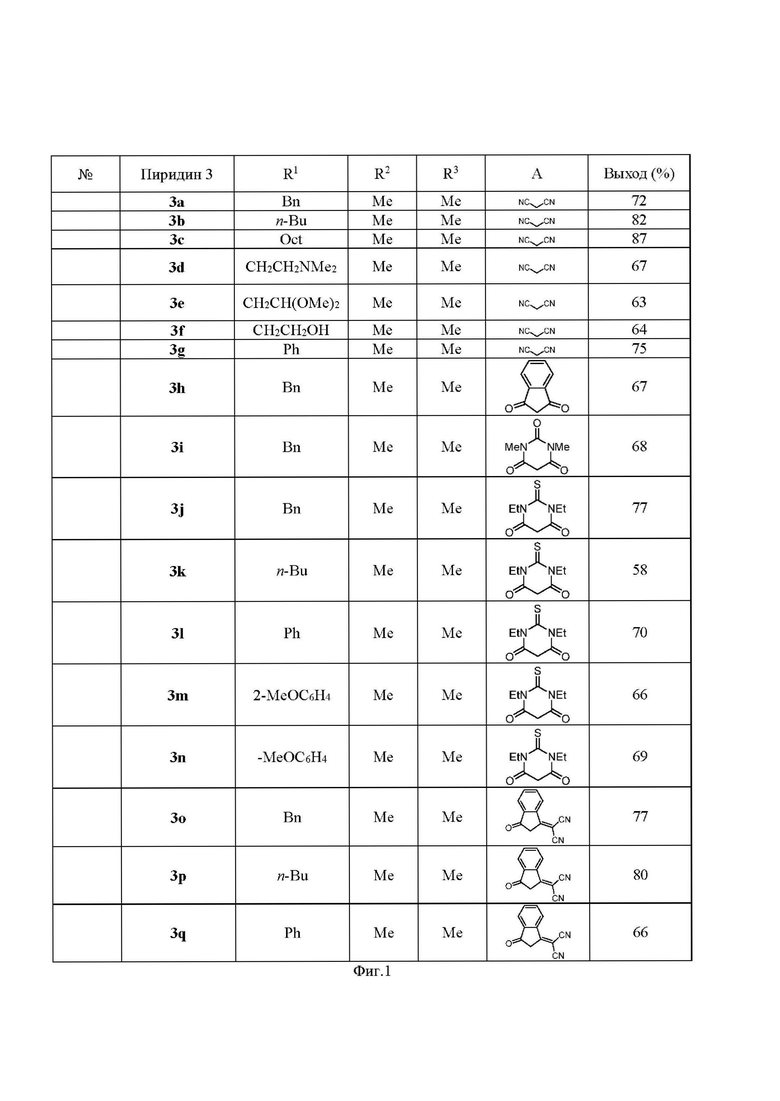
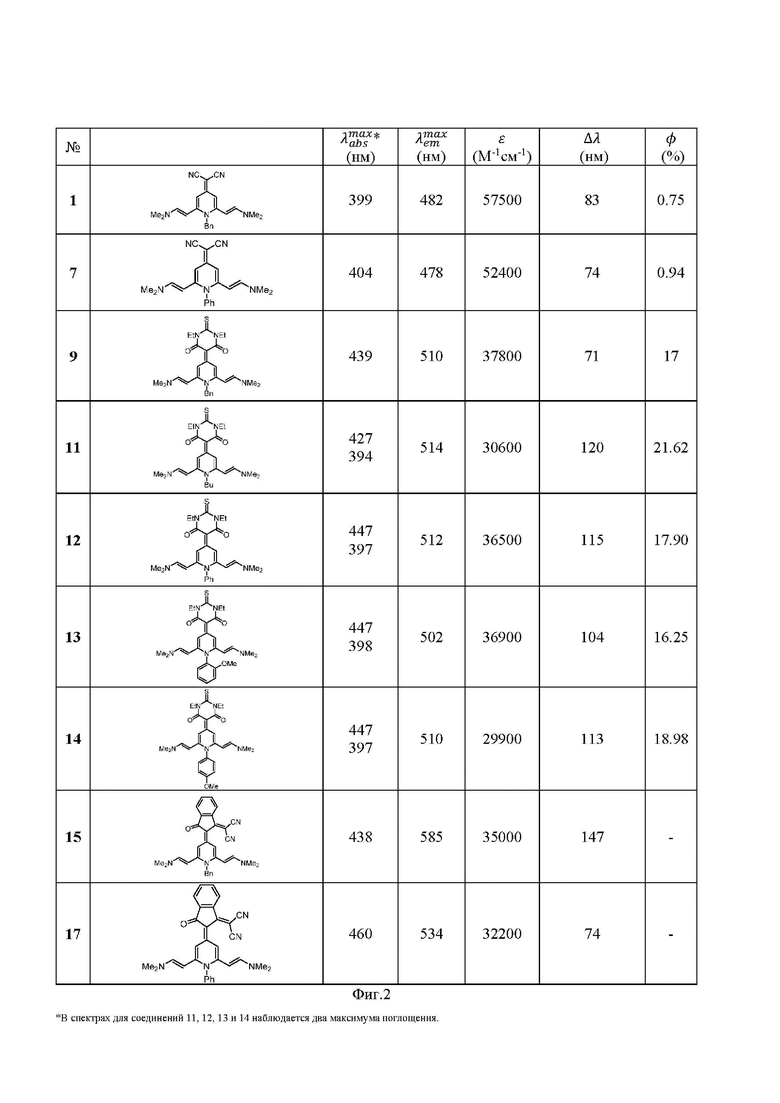
Фиг. 1 - Синтез соединений общей формулы I (примеры 1-17).
Фиг. 2 - Фотофизические свойства соединений общей формулы I.
Для иллюстрации возможности реализации и более полного понимания сути группы изобретений ниже представлен вариант ее осуществления, который может быть любым образом изменен или дополнен, при этом настоящая группа изобретений ни в коем случае не ограничивается представленным вариантом.
Способ получения люминофоров на основе 2,6-бис(аминовинил)-4-метилен-1,4-дигидропиридина осуществляют следующим образом.
Пример 1
Получение 2-(1-бензил-2,6-бис((E)-2-(диметиламино)винил)пиридин-4(1H)-илиден)малононитрила
Смесь 100 мг 2-(1-бензил-2,6-диметилпиридин-4(1H)-илиден)малононитрила (3a) (0.38 ммоль), 0.252 мл диметилацеталь-N,N-диметилформамида (ДМА-ДМФА) (1.9 ммоль) и 0.030 мл N-метилимидазола (0.38 ммоль) нагревают в автоклаве при 130°С в течение 15 часов. Затем образовавшийся продукт отфильтровывают и промывают 95% этанолом. Получают 2-(1-бензил-2,6-бис((E)-2-(диметиламино)винил)пиридин-4(1H)-илиден)малононитрил в виде коричневых кристаллов. Выход приведен на фиг. 1.
Т. пл. 291-292°C.
Спектр ЯМР1H (500 MГц, DMSO-d6) Sδ (м.д.): 7.39 (т, J=7.6 Гц, 2H), 7.30 (т, J=7.4 Гц, 1Н), 7.23 (д, J=12.7 Гц, 2Н), 7.15 (д, J=7.5 Гц, 2Н), 6.40 (с, 2H), 5.34 (с, 2H), 4.73 (д, J=12.7 Гц, 2H), 2.80 (уш.с, 12H).
Спектр ЯМР13C (151 MГц, DMSO-d6) δ (м.д.): 152.8, 151.7, 148.1, 136.9, 129.5, 127.9, 126.2, 121.5, 102.4, 86.8, 52.6, 37.9.
Элементный анализ для C23H25N5 (371.488):
Вычислено (%): C, 74.36; H, 6.78; N, 18.85.
Найдено (%): C, 74.17; H, 6.74; N, 18.88.
Пример 2
Получение 2-(1-бутил-2,6-бис((E)-2-(диметиламино)винил)пиридин-4(1H)-yилиден)малононитрила
Данное соединение получают из 2-(1-бутил-2,6-диметилпиридин-4(1H)-илиден)малононитрила (3b), ДМА-ДМФА и N-метилимидазола по способу, аналогичному способу примера 1. Выход приведен на фиг. 1.
Т. пл. 265-268 °C, бежевый порошок.
Спектр ЯМР1H (400 MГц, DMSO-d6) δ (м.д.): 7.20 (д, J=12.7 Гц, 2Н), 6.34 (с, 2H), 4.89 (д, J=12.7 Гц, 2H), 3.96-4.05 (с, 2H), 2.80 (уш.с, 12H), 1.60-1.71 (с, 2H), 1.40 (секстет, J=7.2 Гц, 2H), 0.96 (т, J=7.0 Гц, 3H).
Спектр ЯМР13C (151 MГц, DMSO-d6) δ (м.д.): 152.5, 151.1, 148.0, 121.6, 102.9, 86.6, 48.5, 37.4, 30.3, 19.7, 13.9.
Элементный анализ для C20H27N5 (337.471):
Вычислено (%): C, 71.18; H, 8.06; N, 20.75.
Найдено (%): C, 71.23; H, 8.02; N, 20.71.
Пример 3
Получение 2-(2,6-бис((E)-2-(диметиламино)винил)-1-октилпиридин-4(1H)-илиден)малононитрила
Данное соединение получают из 2-(2,6-диметил-1-октилпиридин-4(1H)-илиден)малононитрила (3c), ДМА-ДМФА и N-метилимидазола по способу, аналогичному способу примера 1. Выход приведен на фиг. 1.
Т. пл. 140-143°C, коричневый порошок.
Спектр ЯМР1H (400 MГц, DMSO-d6) δ (м.д.): 7.19 (д, J=12.7 Гц, 2H), 6.34 (с, 2H,), 4.88 (д, J=12.7 Гц), 3.95-4.03 (с, 2H), 2.93 (уш.с, 12H), 1.60-1.71 (м, 2H), 1.2-1.41 (м, 10H), 0.83-0.90 (м, 3H).
Спектр ЯМР13C (151 MГц, DMSO-d6) δ (м.д.): 152.6, 151.1, 148.0, 121.5, 102.9, 86.7, 37.5, 31.6, 29.0, 28.8, 28.2, 26.3, 22.5, 14.4.
HRMS (ESI) m/z вычислено для C24H35N5+ (M+H)+ 394.2971, найдено 394.2984.
Пример 4
Получение 2-(1-(2-(диметиламино)этил)-2,6-бис((E)-2-(диметиламино)винил)пиридин-4(1H)-илиден)малононитрила
Данное соединение получают из 2-(1-(2-(диметиламино)этил)-2,6-диметилпиридин-4(1H)-илиден)малононитрила (3d), ДМА-ДМФА и N-метилимидазола по способу, аналогичному способу примера 1. Выход приведен на фиг. 1.
Т. пл. 246-249°C, фиолетовые кристаллы.
Спектр ЯМР 1H (400 MГц, DMSO-d6) δ (м.д.): 7.20 (д, J=12.7 Гц, 2Н), 6.34 (с, 2H,), 4.98 (д, J=12.7 Гц, 2H), 4.11 (д, J=7.2 Гц, 2H), 2.93 (уш.с, 12H), 2.57 (д, J=7.2 Гц, 2H), 2.25 (с, 6H).
Спектр ЯМР 13C (151 MГц, DMSO-d6) δ (м.д.): 152.7, 151.4, 148.0, 121.5, 102.8, 86.9, 57.3, 47.5, 45.9, 37.6, 21.0.
Элементный анализ для C20H28N6 (352.486):
Вычислено (%): C, 68.15; H, 8.01; N, 23.84.
Найдено (%): C, 71.23; H, 8.02; N, 20.71.
Пример 5
Получение 2-(1-(3,3-диметоксиэтил)-2,6-бис((E)-2-(диметиламино)винил)пиридин-4(1H)-илиден)малононитрила
Данное соединение получают из 2-(1-(3,3-диметоксиэтил)-2,6-диметилпиридин-4(1H)-илиден)малононитрила (3e), ДМА-ДМФА и N-метилимидазола по способу, аналогичному способу примера 1. Выход приведен на фиг. 1.
Т. пл. 230-231°C, красные кристаллы.
Спектр ЯМР1H (400 MГц, DMSO-d6) δ (м.д.): 7.17 (д, J=12.8 Гц, 2H), 6.34 (с, 2H), 5.05 (д, J=12.8 Гц, 2H), 4.72 (т, J=4.9 Гц, 1H), 4.19 (д, J=4.9 Гц, 2H), 3.36 (с, 6H), 2.92 (уш.с, 12H).
Спектр ЯМР13C (126 MГц, DMSO-d6) δ (м.д.): 152.4, 151.5, 147.4, 120.8, 102.7, 102.4, 87.0, 54.8, 51.2, 37.5, 21.1.
Элементный анализ для C20H27N5О2 (369.469):
Вычислено (%): C, 65.02; H, 7.37; N, 18.96.
Найдено (%): C, 65.21; H, 7.68; N, 19.05.
Пример 6
Получение 2-(2,6-бис((E)-2-(диметиламино)винил)-1-(2-гидроксиэтил)пиридин-4(1H)-илиден)малононитрила
Данное соединение получают из 2-(1-(2-гидроксиэтил)-2,6-диметилпиридин-4(1H)-илиден)малононитрила (3f), ДМА-ДМФА и N-метилимидазола по способу, аналогичному способу примера 1. Выход приведен на фиг. 1.
Т. пл. 291-292°C, темно-фиолетовый порошок.
Спектр ЯМР 1H (400 МГц, DMSO-d6) δ (м.д.): 7.14 (д, J=12.7 Гц, 2Н), 6.34 (с, 2H), 5.16 (т, J=5.5 Гц, 1H), 5.05 (д, J=12.8 Гц, 2H), 4.13 (т, J=6.1 Гц, 2H), 3.70 (квартет, J=5.7 Гц, 2H), 2.92 (уш.с, 12H).
HRMS (ESI) m/z вычислено для C18H23N5О+ (M+H)+ 326.1981, найдено 326.1974.
Пример 7
Получение 2-(2,6-бис((E)-2-(диметиламино)винил)-1-фенилпиридин-4(1H)-илиден)малононитрила
Данное соединение получают из 2-(2,6-диметил -1-фенилпиридин -4(1H)-илиден)малононитрила (3g), ДМА-ДМФА и N-метилимидазола по способу, аналогичному способу примера 1. Выход приведен на фиг. 1.
Т. пл. 323-324 °C, коричневые кристаллы.
Спектр ЯМР 1H (400 MГц, DMSO-d6) δ (м.д.): 7.55-7.65 (м, 3H), 7.26-7.29 (м, 2H), 7.24 (д, J=13.0 Гц, 2H), 6.45 (с, 2H), 3.89 (д, J=12.9 Гц, 2H), 2.65 (уш.с, 12H).
HRMS (ESI) m/z вычислено для C22H23N5+ (M+H)+ 358.2032, найдено 358.2035.
Пример 8
Получение 2-(1-бензил-2,6-бис((E)-2-(диметиламино)винил)пиридин-4(1H)-илиден)-1H-инден -1,3(2H)-диона
Данное соединение получают из 2-(1-бензил-2,6-диметилпиридин-4(1H)-илиден)-1H-инден-1,3(2H)-диона (3h), ДМА-ДМФА и N-метилимидазола по способу, аналогичному способу примера 1. Выход приведен на фиг. 1.
Т. пл. 240-250 °C, черные кристаллы.
Спектр ЯМР 1H (400 MГц, DMSO-d6) δ (м.д.): 7.11-7.52(м, 11H), 8.43 (с, 2H), 5.45 (с, 2H), 4.88 (д, J=12.7 Гц, 2H), 2.85 (уш.с, 12H).
HRMS (ESI) m/z вычислено для C29H29N3О2+ (M+H)+ 452.2338, найдено 452.2331.
Пример 9
Получение 5-(1-бензил-2,6-бис((E)-2-(диметиламино)винил)пиридин-4(1H)-илиден)-1,3-диметилпиримидин -2,4,6(1H,3H,5H)-триона
Данное соединение получают из 5-(1-бензил-2,6-диметилпиридин-4(1H)-илиден)-1,3-диметилпиримидин-2,4,6(1H,3H,5H)-триона (3i), ДМА-ДМФА и N-метилимидазола по способу, аналогичному способу примера 1. Выход приведен на фиг. 1.
Т. пл. 315-31 7°C, коричневый порошок.
Спектр ЯМР 1H (400 MГц, DMSO-d6) δ (м.д.): 8.44 (с, 2H), 7.40 (т, J=7,6 Гц, 2H), 7.32 (т, J=7.6 Гц, 1H), 7.16 (м, 4H), 5.47 (с, 2H), 4.88 (д, J=12.6 Гц, 2H), 3.16 (с, 6H), 2.83 (уш.с, 12H).
Элементный анализ для C26H31N5О3 (461.566):
Вычислено (%): C, 67.66; H, 6.77; N, 15.17.
Найдено (%): C, 67.47; H, 6.76; N, 15.24.
Пример 10
Получение 5-(1-бензил-2,6-бис((E)-2-(диметиламино)винил)пиридин-4(1H)-илиден)-1,3-диэтил-2-тиоксодигидропиримидин-4,6(1H,5H)-диона
Данное соединение получают из 5-(1-бензил-2,6-диметилпиридин-4(1H)-илиден)-1,3-диэтил-2-тиоксодигидропиримидин-4,6(1H,5H)-диона (3j), ДМА-ДМФА и N-метилимидазола по способу, аналогичному способу примера 1. Выход приведен на фиг. 1.
Т. пл. 305-308 °C, коричневые кристаллы.
Спектр ЯМР 1H (400 MГц, DMSO-d6) δ (м.д.): 8.25 (c, 2H), 7.40 (дд, J=7.1 Гц, J=7.7 Гц, 2H), 7.32 (т, J=7.1 Гц, 1H), 7.22 (д, J=12.5 Гц, 2H), 7.18 (д, J=7.1 Гц, 2H), 5.5 (с, 2H), 4.91 (д, J=12,5 Гц, 2H), 4.48 (к, J=6.9 Гц, 4H), 2.85 (уш.с, 12H), 1.18 (т, J=6.9 Гц, 6H).
Элементный анализ для C28H35N5О2S (505.681):
Вычислено (%): C, 66.51; H, 6.98; N, 13.85.
Найдено (%): C, 66.51; H, 6.98; N, 13.86.
Пример 11
Получение 5-(1-бутил-2,6-бис((E)-2-(диметиламино)винил)пиридин -4(1H)-илиден)-1,3-диэтил -2-тиоксодигидропиримидин-4,6(1H,5H)-диона
Данное соединение получают из 5-(1-бутил-2,6-диметилпиридин-4(1H)-илиден)-1,3-диэтил-2-тиоксодигидропиримидин-4,6(1H,5H)-диона (3k), ДМА-ДМФА и N-метилимидазола по способу, аналогичному способу примера 1. Выход приведен на фиг. 1.
Т. пл. 305-306 °C, желтые кристаллы.
Спектр ЯМР 1H (400 MГц, DMSO-d6) δ (м.д.): 8.17 (с, 2H), 7.20 (д, J=12.7 Гц, 2H), 5.05 (д, J=12.6 Гц, 2H), 4.46 (квартет, J=6.7 Гц, 4H), 2.97 (уш.с, 12H), 1.73 (м, 2H), 1.45 (квартет, J=7.3 Гц, 2H), 1.27 (с, 4H), 1.17 (т, J=6.9 Гц, 7H), 0.99 (т, J=7.3 Гц, 4H).
Спектр ЯМР 13C (126 MГц, DMSO-d6) δ (м.д.): 175.2, 160.1, 150.3, 149.9, 147.9, 112.9, 89.7, 86.8, 48.6, 41.7, 29.3, 19.2, 13.4, 12.6.
Элементный анализ для C25H37N5О2S (471.664):
Вычислено (%): C, 63.66; H, 7.91; N, 14.85.
Найдено (%): C, 63.64; H, 7.96; N, 14.78.
Пример 12
Получение 5-(2,6-бис((E)-2-(диметиламино)винил)-1-фенилпиридин-4(1H)-илиден)-1,3-диэтил-2-тиоксодигидропиримидин-4,6(1H,5H)-диона
Данное соединение получают из 5-(2,6-диметил-1-фенилпиридин-4(1H)-илиден)-1,3-диэтил-2-тиоксодигидропиримидин-4,6(1H,5H)-диона (3l), ДМА-ДМФА и N-метилимидазола по способу, аналогичному способу примера 1. Выход приведен на фиг. 1.
Т. пл. 310-311 °C, коричневый порошок.
Спектр ЯМР 1H (400 MГц, DMSO-d6) δ (м.д.): 8.22 (с, 2H), 7.69-7.62 (м, 3H), 7.34 (д, J=7.0 Гц, 2H), 7.23 (д, J=12.9 Гц, 2H), 4.49 (квартет, J=6.8 Гц, 4H), 4.03 (д, J=12.9 Гц, 2H), 2.69 (уш.с, 12H), 1.19 (т, J=6.9 Гц, 6H).
Спектр ЯМР 13C (126 MГц, DMSO-d6) δ (м.д.): 175.3, 160.1, 150.8, 150.4, 146.7, 139.3, 130.4, 129.7, 127.7, 110.0, 93.8, 90.0, 88.2, 41.7, 12.6.
Элементный анализ для C27H33N5О2S (491.654):
Вычислено (%): C, 65.96; H, 6.77; N, 14.24.
Найдено (%): C, 66.15; H, 6.78; N, 14.33.
Пример 13
Получение 5-(2,6-бис((E)-2-(диметиламино)винил)-1-(2-метоксифенил)пиридин-4(1H)-илиден)-1,3-диэтил-2-тиоксодигидропиримидин-4,6(1H,5H)-диона
Данное соединение получают из 1,3-диэтил-5-(1-(2-метоксифенил)-2,6-диметилпиридин-4(1H)-илиден)-2-тиоксодигидропиримидин-4,6(1H,5H)-диона (3m), ДМА-ДМФА и N-метилимидазола по способу, аналогичному способу примера 1. Выход приведен на фиг. 1.
Т. пл. 295-296 °C, коричневый порошок.
Спектр ЯМР 1H (400 MГц, DMSO-d6) δ (м.д.): 8.17 (с, 2H), 7.62 (м, 1H), 7.35 (д, J=8.4 Гц, 1H), 7.24 (м, 2H), 7.20 (м, 2H), 4.49 (с, J=13.7, 6.8 Гц, 4H), 4.10 (д, J=12.9 Гц, 2H), 3.78 (с, 3H), 2.69 (уш.с, 12H), 1.19 (т, J=6.9 Гц, 6H).
13C NMR (151 MГц, DMSO-d6) δ (м.д.) 175.7, 160.5, 154.3, 151.3, 151.1, 147.5, 132.1, 129.2, 127.7, 122.3, 113.8, 110.7, 90.6, 87.8, 56.6, 42.3, 13.2.
HRMS (ESI) m/z вычислено для C28H35N5O3S+ (M+H)+ 522.2539, найдено 522.2529.
Пример 14
Получение 5-(2,6-бис((E)-2-(диметиламино)винил)-1-(4-метоксифенил)пиридин-4(1H)-илиден)-1,3-диэтил-2-тиоксодигидропиримидин-4,6(1H,5H)-диона
Данное соединение получают из 1,3-диэтил-5-(1-(4-метоксифенил)-2,6-диметилпиридин-4(1H)-илиден)-2-тиоксодигидропиримидин-4,6(1H,5H)-диона (3n), ДМА-ДМФА и N-метилимидазола по способу, аналогичному способу примера 1. Выход приведен на фиг. 1.
Т. пл. 305-306 °C, желтые кристаллы.
Спектр ЯМР 1H (400 MГц, DMSO-d6) δ (м.д.): 8.19 (с, 2H), 7.25-7.17 (м, 4Н), 4.49 (к, J=6.8 Гц, 4H), 3.85 (с, 3H), 2.72 (уш.с, 12H), 1.19 (т, J=6.8 Гц, 6H).
HRMS (ESI) m/z вычислено для C28H35N5O3S+ (M+H)+ 522.2539, найдено 522.2519.
Пример 15
Получение 2-(2-(1-бензил-2,6-бис((E)-2-(диметиламино)винил)пиридин-4(1H)-илиден)-3-оксо-2,3-дигидро-1H-инден-1-илиден)малононитрила
Данное соединение получают из 2-(2-(1-бензил-2,6-диметилпиридин-4(1H)-илиден)-3-оксо-2,3-дигидро-1H-инден-1-илиден)малононитрила (3o), диметилформамид диметилацеталь (ДМА-ДМФА) и N-метилимидазола по способу, аналогичному способу примера 1. Выход приведен на фиг. 1.
Т. пл. 292-293°C, коричневый порошок.
Спектр ЯМР 1H (400 MГц, DMSO-d6) δ (м.д.): 8.14 (д, J=7.5 Гц, 1H), 7.62 (д, J=12.7 Гц, 2H), 7.49 (тд, J=7.4, 1.7 Гц, 1H), 7.43-7.38 (м, 4H), 7.33 (т, J=7.3 Гц, 1H), 7.21 (с, 2H), 5.54 (с, 2H), 4.94 (д, J=12.6 Гц, 2H), 2.88 (уш.с, 12H).
Спектр ЯМР 13C (126 MГц, DMSO-d6) δ (м.д.): 186.7, 156.7, 151.8,149.4, 144.5, 140.2, 135.3, 135.0, 131.4, 130.0, 128.9, 127.5, 125.8, 121.0, 120.7, 119.3, 118.8, 113.4, 108.8, 86.4, 52.9, 45.9
Элементный анализ для C32H29N5О (499.618):
Вычислено (%): C, 76.93; H, 5.85; N, 14.02.
Найдено (%): C, 76.66; H, 5.66; N, 13.90.
Пример 16
Получение 2-(2-(1-бутил-2,6-бис((E)-2-(диметиламино)винил)пиридин-4(1H)-илиден)-3-оксо-2,3-дигидро-1H-инден-1-илиден)малононитрила
Данное соединение получают из 2-(2-(1-бутил-2,6-диметилпиридин-4(1H)-илиден)-3-оксо-2,3-дигидро-1H-инден-1-илиден)малононитрила (3p), ДМА-ДМФА и N-метилимидазола по способу, аналогичному способу примера 1. Выход приведен на фиг. 1.
Т. пл. 232-233°C, красный порошок.
Спектр ЯМР1H (400 MГц, DMSO-d6) δ (м.д.): 8.13 (д, J=7.5 Гц, 1H), 7.58 (д, J=12.6 Гц, 2H), 7.48 (тд, J=7.6, 1.4 Гц, 1H), 7.42-7.37 (м, 2H), 7.14 (с, 2H), 5.06 (д, J=12.6 Гц, 2H), 4.20 (т, J=7.8 Гц, 2H), 3.00 (уш.с, 12H), 1.76 (квинтет, J=7.5 Гц, 2H), 1.48 (секстет, J=7.5 Гц, 2H), 1.23 (с, 1H), 1.00 (т, J=7.3 Гц, 3H).
Спектр ЯМР13C (126 MГц, DMSO-d6) δ (м.д.): 186.8, 156.5, 150.9, 149.3, 144.0, 140.2, 134.9, 131.4, 129.9, 121.0, 120.7, 119.9, 118.8, 113.8, 108.6, 86.0, 48.8, 45.7, 29.0, 19.2, 13.4.
HRMS (ESI) m/z вычислено для C29H31N5O+ (M+H)+ 466.2607, найдено 466.2610.
Пример 17
Получение 2-(2-(2,6-бис((E)-2-(диметиламино)винил)-1-фенилпиридин-4(1H)-илиден)-3-оксо-2,3-дигидро-1H-инден-1-илиден)малононитрила
Данное соединение получают из 2-(2-(2,6-диметил-1-фенилпиридин-4(1H)-илиден)-3-оксо-2,3-дигидро-1H-инден-1-илиден)малононитрила (3q), ДМА-ДМФА и N-метилимидазола по способу, аналогичному способу примера 1. Выход приведен на фиг. 1.
Т. пл. 288-289°C, коричневые кристаллы.
Спектр ЯМР1H (400 MГц, DMSO-d6) δ (м.д.): 8.16 (д, J=7.5 Гц, 1H), 7.72-7.65 (м, 3H), 7.63 (д, J=12.9 Гц, 2H), 7.49 (т.д, J=7.2,1.8 Гц, 1H), 7.44-7.40 (м, 2H), 7.31 (д, J=7.3 Гц, 2H), 7.23 (с, 2H), 4.04 (д, J=12.9 Гц, 2H), 2.72 (уш.с, 12H).
Спектр ЯМР13C (126 MГц, DMSO-d6) δ (м.д.): 186.6, 156.7, 151.3, 148.3, 145.1, 140.2, 139.1, 135.0, 131.4, 130.7, 130.0, 129.8, 127.5, 121.0, 120.7, 119.9, 118.7, 111.2, 108.9, 87.5, 46.0.
Элементный анализ для C31H27N5О (485.591):
Вычислено (%): C, 76.68; H, 5.60; N, 14.42.
Найдено (%): C, 75.44; H, 5.51; N, 14.38.
Сведения, подтверждающие возможность осуществления изобретения.
Список условных сокращений:
А - величина поглощения
ε - коэффициент экстинкции
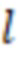 - ширина кюветы
- ширина кюветы
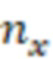 - коэффициент преломления растворителя для раствора исследуемого образца
- коэффициент преломления растворителя для раствора исследуемого образца
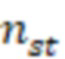 - коэффициент преломления растворителя для раствора стандартного образца
- коэффициент преломления растворителя для раствора стандартного образца
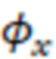 - квантовый выход исследуемого образца
- квантовый выход исследуемого образца
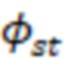 - квантовый выход стандартного образца.
- квантовый выход стандартного образца.
Изучение спектральных свойств заявляемых соединений общей формулы I проведено c помощью спектрофотометра Shimadzu UV-1900 и спектрофлуориметра Shimadzu RF-6000.
Исследуемые вещества растворяют в диметилсульфоксиде и готовят серию растворов с концентрациями 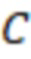 (моль/л):
(моль/л): 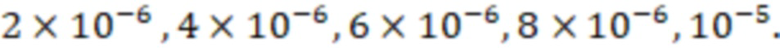 Для каждого раствора записывают спектры поглощения и определяют длины волн максимумов абсорбции
Для каждого раствора записывают спектры поглощения и определяют длины волн максимумов абсорбции 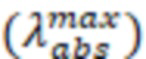 и поглощение
и поглощение 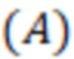 . На основании полученных данных определялся коэффициент экстинкции
. На основании полученных данных определялся коэффициент экстинкции 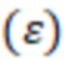 для концентрации
для концентрации 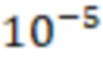 моль/л исследуемых веществ. Коэффициент экстинкции рассчитывают по формуле:
моль/л исследуемых веществ. Коэффициент экстинкции рассчитывают по формуле:
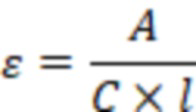
Затем регистрируют спектры испускания серий растворов с аналогичными концентрациями. Выбор длины волны возбуждения производят в соответствии с длиной волны максимума абсорбции, определенной из спектра поглощения. Из полученных спектров определяют длины волн максимума испускания 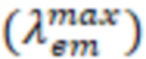 . На основании полученных данных вычисляют Стоксов сдвиг
. На основании полученных данных вычисляют Стоксов сдвиг 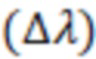 по формуле:
по формуле:
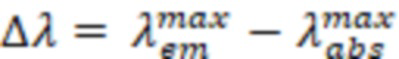
Для расчета относительного квантового выхода 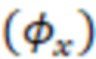 используют формулу:
используют формулу:
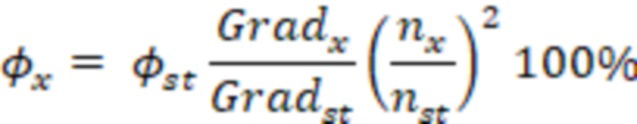
Градиенты для исследуемого образца и стандарта рассчитывают исходя из графиков зависимости абсорбции от интегрированной интенсивности флуоресценции. Для проведения расчетов использовались программы Microsoft Excel и LabSolutions RF. В качестве стандартного образца был использован Родамин 6G в этаноле (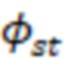 = 95%).
= 95%).
Результаты исследований представлены на фиг 2.
Таким образом, впервые получены 2,6-бис(аминовинил)-4-метилен-1,4-дигидропиридины, которые проявляют флуоресцентные свойства, и предложен эффективный способ их получения.
Преимуществами данного способа синтеза являются:
1. Доступность исходных реагентов.
2. Не требуется дополнительная очистка целевых продуктов с помощью колоночной хроматографии.
Для всех исследованных соединений общей формулы I максимумы поглощения и испускания располагаются в длинноволновом диапазоне спектра. Соединения 9, 11, 12, 13 и 14 проявляют наиболее сильные люминесцентные свойства.
Таким образом, изученные соединения представляют собой потенциальные новые хромофоры для использования их в биологических исследованиях, тем самым обеспечивается достижение технического результата, заключающегося в синтезе новых групп соединений на основе 1,4-дигидропиридинов, обладающих люминесцентными свойствами с использованием коммерчески доступных реагентов и исключении необходимости применения методов колоночной хроматографии для очистки целевых продуктов синтеза, тем самым расширяется арсенал существующих люминофоров и способов их получения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИ[(2,7-БИС(1',4'-ФЕНИЛЕН)ДИБЕНЗО[A,C]ФЕНАЗИН-4',4'-ДИИЛ)1,4-ФЕНИЛЕНДИМЕТАНИМИН-N,N'-ДИИЛ] | 2023 |
|
RU2817296C1 |
| ЗАМЕЩЕННЫЕ БЕНЗОЛЬНЫЕ СОЕДИНЕНИЯ | 2012 |
|
RU2629118C2 |
| ИНГИБИТОРЫ ПРОТЕИНКИНАЗ ДЛЯ УСИЛЕНИЯ РЕГЕНЕРАЦИИ ПЕЧЕНИ ИЛИ СНИЖЕНИЯ ИЛИ ПРЕДОТВРАЩЕНИЯ ГИБЕЛИ ГЕПАТОЦИТОВ | 2019 |
|
RU2822216C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДИСПИРОИНДОЛИНОНОВ НА ОСНОВЕ 5-ИНДОЛИДЕН-2-ТИОГИДАНТОИНОВ | 2020 |
|
RU2756463C1 |
| ПРОИЗВОДНЫЕ ФЕНОТИАЗИНСОДЕРЖАЩИХ 1,2,3,4-ТЕТРАГИДРОПИРИДО[4,3-b]ИНДОЛОВ В КАЧЕСТВЕ СРЕДСТВА ДЛЯ СНИЖЕНИЯ НЕКОНТРОЛИРУЕМОЙ АГРЕГАЦИИ БЕЛКОВ В НЕРВНОЙ СИСТЕМЕ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАКОЛОГИЧЕСКОЕ СРЕДСТВО НА ИХ ОСНОВЕ И СПОСОБ СНИЖЕНИЯ НЕКОНТРОЛИРУЕМОЙ АГРЕГАЦИИ БЕЛКОВ В НЕРВНОЙ СИСТЕМЕ | 2013 |
|
RU2529899C1 |
| СПОСОБ ЛЕЧЕНИЯ | 2012 |
|
RU2621148C2 |
| НОВОЕ КОНДЕНСИРОВАННОЕ ПИРИМИДИНОВОЕ СОЕДИНЕНИЕ ИЛИ ЕГО СОЛЬ | 2014 |
|
RU2666349C2 |
| ПИРАЗИНОВЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2809631C2 |
| ПРОИЗВОДНЫЕ ПИРИДИНОНА И ПИРИДАЗИНОНА | 2012 |
|
RU2632915C2 |
| 6-Трифтор(трихлор)метилзамещенные спиро[хромено[3,4-a]пирролизидин-11,3'-индолин]-2'-оны, проявляющие противоопухолевую активность, и способ их получения | 2020 |
|
RU2775605C2 |
Группа изобретений относится к области органического синтеза, а именно к производным 2,6-бис(аминовинил)-4-метилен-1,4-дигидропиридина формулы I и способу их получения. В формуле I R1 представляет собой Bn, Ph, n-Bu, Oct, CH2CH2NMe2, CH2CH(OMe)2, CH2CH2OH, 2-MeOC6H4, 4-MeOC6H4; R2 и R3 представляют собой Me; А представляет собой дицианометилиден, 1,3-диоксо-1,3-дигидро-2H-инден-2-илиден, 1-(дицианометилен)-3-оксо-1,3-дигидро-2H-инден-2-илиден, 1,3-диметил-2,4,6-триоксотетрагидропиримидин-5(2H)-илиден, 1,3-диэтил-4,6-диоксо-2-тиоксотетрагидропиримидин-5(2H)-илиден. Технический результат – синтез соединений формулы I на основе 1,4-дигидропиридинов, обладающих люминесцентными свойствами, с использованием коммерчески доступных реагентов без применения методов колоночной хроматографии для очистки целевых продуктов. 2 н.п. ф-лы, 2 ил., 17 пр.
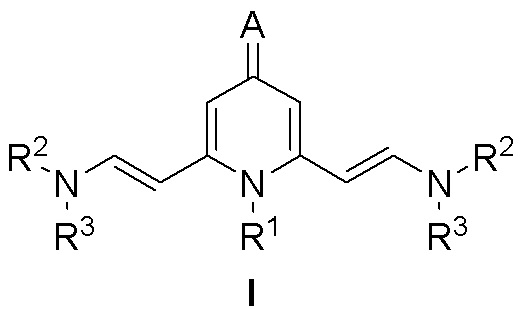
1. Люминофоры на основе 2,6-бис(аминовинил)-4-метилен-1,4-дигидропиридина формулы I:
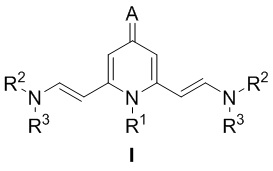
где:
R1 представляет собой Bn, Ph, n-Bu, Oct, CH2CH2NMe2, CH2CH(OMe)2, CH2CH2OH, 2-MeOC6H4, 4-MeOC6H4;
R2 представляет собой Me;
R3 представляет собой Me;
А представляет собой дицианометилиден, 1,3-диоксо-1,3-дигидро-2H-инден-2-илиден, 1-(дицианометилен)-3-оксо-1,3-дигидро-2H-инден-2-илиден, 1,3-диметил-2,4,6-триоксотетрагидропиримидин-5(2H)-илиден, 1,3-диэтил-4,6-диоксо-2-тиоксотетрагидропиримидин-5(2H)-илиден,
при этом Me представляет собой метильную группу.
2. Способ получения люминофоров на основе 2,6-бис(аминовинил)-4-метилен-1,4-дигидропиридина общей формулы I по п.1, заключающийся в том, что соответствующий исходный пиридин (1 эквивалент) смешивают с N,N-диметилформамид диметилацеталем (5 эквивалентов) и N-метилимидазолом (1 эквивалент) и нагревают при 130°С в течение 15 часов, затем охлаждают до комнатной температуры, а образовавшийся осадок отфильтровывают и промывают.
| Рожина И.В | |||
| и др | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Проблемы теоретической и экспериментальной химии | |||
| Тезисы докладов XXXII Российской молодежной научной конференции с международным участием, посвященной 110-летию со дня рождения профессора А | |||
| А | |||
| Тагер | |||
| Екатеринбург, 19-22 апреля 2022 г., | |||
Авторы
Даты
2024-08-07—Публикация
2023-12-13—Подача