Область техники, к которой относится изобретение
Настоящее раскрытие относится к области биомедицины, и, в частности, относится к комбинации генных маркеров и их применению.
Уровень техники
Рак легких представляет собой злокачественную опухоль легкого, происходящую из слизистой оболочки бронхов, гландов или альвеолярного эпителия. В соответствии с патологическими закономерностями рак легких может подразделяться на: 1) мелкоклеточный рак легких (МРЛ): МРЛ представляет собой рак легких специального паталогического типа и обладает явной предрасположенностью к отдаленным метастазам и неблагоприятному прогнозу, но большинство пациентов чувствительны к химиолучевой терапии; 2) немелкоклеточный рак легких (НМРЛ): НМРЛ представляет собой рак легких других патологических типов, за исключением МРЛ, и включает в себя плоскоклеточную карциному, аденоматозную карциному и крупноклеточный рак. Рак легких имеет определенные отличия с точки зрения биологических характеристик и течения болезни. По месту возникновения рак легких также может подразделяться на: 1) центральный рак легких: рак легких, растущий в месте отверстия бронхов третьего порядка и выше; и 2) периферический рак легких: рак легких, прорастающий за пределы отверстия бронхов третьего порядка.
За последние годы, вследствие влияния таких факторов, как старение населения, загрязнение атмосферы и курение, заболеваемость и смертность от рака легких в Китае прогрессивно возрастает из года в год. В Ежегодном Отчете Канцер-регистра Китая (2017) показано, что каждую минуту онкологические заболевания диагностируются примерно у 7 человек по всему Китаю, причем заболеваемость и смертность от рака легких занимает первое место. Китай стал страной с самым большим количеством людей в мире, страдающих от рака легких. Эксперты предсказывают, что в 2025 году количество людей, страдающих от рака легких, достигнет 1 миллиона. Кроме того, согласно эпидемиологическим исследованиям, важным фактором, вызывающим рак легких, является курение. Примерно 80-90% случаев рака легких в мире можно связать с курением. По сопоставлению с некурящими, люди в возрасте 45-64 лет, которые выкуривают 1-19 сигарет и 20 или более сигарет в день, имеют соответствующий относительный риск (4,27 и 8,61) заболеть раком легких; и по сравнению с никогда не курившими людьми, люди, которые выкуривают 1-19 и 20 или более сигарет в день в течение долгого времени, имеют относительный риск (6,14 и 10,73) смерти от рака легких. Хотя технология лечения рака легких быстро изменяется, пятилетняя выживаемость повысилась с 4% лишь примерно до 12%. Существующие противоопухолевые средства пока могут лишь облегчать болезнь, а выживаемость пациентов без прогрессирования заболевания в среднем продлевается лишь на 3-5 месяцев. Однако послеоперационные пациенты с раком легких I стадии имеют пятилетнюю выживаемость примерно до 60-70%. Поэтому ранняя диагностика и раннее оперативное вмешательство являются наиболее эффективными способами для повышения пятилетней выживаемости при раке легких и снижения смертности.
В настоящее время существует несколько основных клинических вспомогательных методов диагностики рака легких, но при этом не удается в полной мере осуществить раннее обнаружение и раннюю диагностику рака легких.
(1) Биохимическое исследование крови: в настоящее время нет никаких специальных биохимических исследований крови для первичного рака легких. Повышение уровня щелочной фосфатазы или кальция в крови у пациентов с раком легких должно учитывать возможность костного метастаза, тогда как повышение уровня щелочной фосфатазы, глутамат-оксалоацетат-трансаминазы, лактатдегидрогеназы или билирубина в крови должно учитывать возможность метастазов рака в печень.
(2) Исследование онкомаркеров: 1) РЭА (раково-эмбриональный антиген): аномально высокий уровень РЭА присутствует в сыворотке у 30-70% пациентов с раком легких, но в основном у пациентов с запущенным раком легких. В настоящее время, исследование РЭА в сыворотке в основном используют для оценки прогноза рака легких и мониторинга процесса лечения. 2) НСЭ (нейронспецифическая энолаза): НСЭ является предпочтительным маркером для мелкоклеточного рака легких, используется для диагностирования мелкоклеточного рака легких и мониторинга терапевтического ответа и имеет различные эталонные значения в соответствии с различиями в методах испытаний и используемых реагентах. 3) CYFRA21-1 (фрагмент цитокератина 19): CYFRA21-1 является предпочтительным маркером для немелкоклеточного рака легких, может достигать чувствительности 60% к диагнозу карциномы чешуйчатых клеток легких и имеет различные эталонные значения в соответствии с различиями в методах испытаний и используемых реагентах.
(3) Визуализационное исследование: 1) рентгеновское исследование грудной клетки: рентгеновское исследование грудной клетки должно включать в себя передне-заднюю и боковую проекцию грудной клетки. В стационаре первичного звена передне-задняя и боковая проекция грудной клетки по-прежнему является наиболее важным и предпочтительным способом визуализации в ходе предварительной диагностики рака легких. При диагностировании или подозрении на рак легких проводят КТ-исследование грудной клетки. 2) КТ-исследование: КТ грудной клетки является наиболее распространенным и важным способом исследования для рака легких и используется для диагностики и дифференциальной диагностики рака легких, а также для определения стадии и планового обследования после лечения. Трансторакальная пункционная биопсия под управлением КТ после лечения является важной техникой диагностики для рака легких. В больницах с хорошими условиями, трансторакальную пункционную биопсию под управлением КТ после лечения можно использовать для диагностики сложных качественных поражений легких, а клинический диагноз рака легких требует цитологического и гистологического подтверждения, когда материалы трудно получить другими способами. В последние годы мультисрезовая спиральная КТ и низкодозная КТ (НДКТ) являются эффективными инструментами скрининга для обнаружения рака легких на ранних стадиях и снижения смертности. Американский национальный скрининговый тест на рак легких (NLST) показал, что по сравнению с рентгеновским скринингом грудной клетки, НДКТ может позволить снизить смертность от рака легких на 20%. Низкодозная спиральная КТ рекомендована как важное средство скрининга рака легких на ранних стадиях. Однако поскольку в этом виде диагностики большую роль играет человеческий фактор, уровень ложноположительных сигналов крайне высок. 3) Ультразвуковое тестирование: ультразвуковое тестирование в основном используют для обнаружения метастазов в жизненно важных органах брюшной полости, а также в абдоминальных и забрюшинных лимфатических узлах; также его можно использовать для исследования цервикальных лимфатических узлов. Могут быть идентифицированы солидно-кистозные характеристики поражений легких, прилегающих к стенкам грудной клетки, или поражений стенок грудной клетки, и тогда проводят чрескожную биопсию, контролируемую с помощью ультразвука. Ультразвуковое тестирование часто дополнительно используют для извлечения и локализации гидроторакса. 4) Сканирование костей: сканирование костей обладает более высокой чувствительностью к обнаружению метастазов рака легких в костях, но имеет определенный уровень ложноположительных сигналов. Сканирование костей можно использовать для следующих условий: предоперационное исследование рака легких; пациенты с местными симптомами.
(4) Другие исследования: 1) исследование цитологии мокроты: исследование цитологии мокроты в настоящее время является простым и удобным неинвазивным способом диагностики рака легких, может повысить число положительных результатов примерно на 60% за счет непрерывного исследования мазка, и представляет собой рутинный способ диагностики в случаях подозрения на рак легких. 2) оптоволоконная бронхоскопия: оптоволоконная бронхоскопия является одним из наиболее важных средств диагностики рака легких, играет важную роль в качественной диагностике локализации рака легких и выборе плана операции, а также является необходимым элементом обычного обследования пациентов, подлежащих оперативному лечению. Однако, хотя трансбронхиальная игольная аспирация (TBNA) благоприятна для определения стадии перед лечением, из-за более высокой технической сложности и риска пациенты, нуждающиеся в этом, могут быть переведены в больницу более высокого уровня для дополнительного обследования. 3) Другие: другие исследования включают в себя чрескожную биопсию легких, видеоассистированную торакальную хирургию, медиастинальную биопсию, цитологическое исследование гидроторакса и могут быть соответственно использованы для дополнительной диагностики в соответствии с существующими условиями при наличии показаний.
Мультисрезовая спиральная КТ и низкодозная КТ (НДКТ) в визуализационных исследованиях являются эффективными инструментами скрининга для обнаружения рака легких на ранних стадиях и снижения смертности. Американский национальный скрининговый тест на рак легких (NLST) показал, что по сравнению с рентгеновским скринингом грудной клетки, НДКТ может снизить смертность от рака легких на 20%. В клинической практике было доказано, что успех или неудача любого элемента скрининга рака легких зависит от идентификации группы высокого риска. Модель предсказания риска, объединенная с множеством факторов высокого риска, признана в мире как один из способов идентификации группы высокого риска рака легких. Содействуя врачам-клиницистам в усовершенствовании мер вмешательства или средств лечения, модель риска дополнительно улучшает лечебные воздействия на пациентов с раком легких. Хотя в мире признано, что скрининг, направленный на группу высокого риска, в настоящее время может снизить повышенную смертность от рака легких, определение группы высокого риска все еще является сложной проблемой. Для максимизации соотношения пользы и вреда скрининга рака легких, первая ключевая проблема состоит в том, как определить группу высокого риска заболевания; а вторая ключевая проблема состоит в определении способа скрининга для группы, включая определение факторов высокого риска, количественное суммирование общего риска и выбор предела полезности скрининга.
С быстрым развитием технологии обнаружение онкомаркеров становится новой областью диагностики и лечения опухолей после визуализации и диагностики патологий и может оказывать значительное влияние на диагностику, обнаружение и лечение опухолей. Онкомаркер может быть выявлен в жидкостях организма или ткани и может отражать наличие опухолей, дифференцированные степени, оценку прогноза, персонализированное лечение, терапевтические эффекты, и т.п. У пациентов с раком легких на ранней стадии нет очевидных симптомов; рак легких на ранних стадиях трудно распознается врачами и пациентами; и поскольку в крови или в биохимических образцах нет очевидных конкретных маркеров, раннее обнаружение и раннюю диагностику сложно проводить с помощью обычного способа диагностики. Поэтому ранняя диагностика рака легких, в частности, крупномасштабное применение скрининга среди населения, относительно сложна.
Все больше исследований показывают, что в процесс образования опухоли включены две основные категории механизмов. Один механизм образует мутацию за счет изменения нуклеотидной последовательности ДНК и называется генетическим механизмом. То, что опухоль является генетическим заболеванием, было доказано в области молекулярной биологии. Другой механизм представляет собой эпигенетический механизм и может изменять уровень экспрессии гена независимо от изменения последовательности ДНК, а эффекты эпигенетического механизма в процессе образования опухоли привлекают все больше и больше внимания. Генетический механизм и эпигенетический механизм пересекаются и вместе способствуют образованию опухолей. Аберрантное метилирование генов может возникать на ранней стадии возникновения опухоли; а в процессе постепенного развития опухолей степень аберрантного метилирования генов повышается. Путем анализа генома 98 обычных первичных опухолей человека было выявлено, что каждая опухоль включает в себя по меньшей мере 600 аберрантно метилированных CpG-островков.
Многие исследования показали, что аберрантное метилирование промотора представляет собой частое раннее событие в процессе возникновения многих опухолей. Поэтому статус метилирования генов, связанных с опухолью, представляет собой ранний чувствительный индикатор онкогенеза и идентифицируется как предполагаемый биомаркер молекулы опухоли. Что еще более важно, клетки, отвечающие за канцеризацию, могут высвобождать ДНК в периферическую кровь. Свободная ДНК на уровне нанограмма присутствует в периферической крови у обычного человека. С помощью исследования было обнаружено, что аберрантное метилирование промотора генов, связанных с опухолью, присутствующих в опухолевых тканях, также может быть выявлено в плазме/сыворотке периферической крови, опухолевых поражениях, а также жидкостях организма, связанных с органом (таких как слюна и мокрота). Эти биологические образцы легко доступны и могут быть чувствительно выявлены путем амплификации большого количества ДНК в образцах с помощью технологии ПЦР. Поэтому выявление статуса метилирования промоторной области некоторых генов, связанных с опухолью, может обеспечить очень ценную информацию для ранней диагностики опухолей. По сравнению с маркерами молекул опухоли других типов, биомаркер имеет больше преимуществ при обнаружении аберрантного метилирования промотора. Определенный ген имеет одну и ту же область аберрантного метилирования промотора в различных типах опухолей, тогда детектирование становится относительно удобным. В дополнение, по сравнению с маркером делеции аллели, аберрантное метилирование представляет собой положительный сигнал, легко отличимый от отрицательного фона в нормальных тканях. Esteller et al. выявили аберрантный статус метилирования промоторной области генов, таких как p16, DAPK, GSTP1 и MGM T в опухолевых тканях и в сыворотке в 22 случаях НМРЛ, и выявили, что метилирование промотора по меньшей мере одного гена происходит в 68% (15/22) опухолевых тканей. Однако в 15 случаях положительных тканей, наличие аберрантного метилирования промотора также выявляется в сыворотке в 11 случаях. Дополнительно, многие исследователи выявляют метилирование промотора некоторых генов, связанных с опухолью, из опухолевых тканей и сыворотки пациентов соответственно с раком печени, карциномой шейного отдела, раком пищевода и раком толстой кишки.
Существующая технология обнаружения рака легких в основном обладает низкой чувствительностью, высоким уровнем ложноположительных сигналов и инвазивна; а рак легких на ранних стадиях сложно выявлять с помощью существующих обычных технологий обнаружения.
Кроме того, неинвазивное обнаружение, такое как обнаружение рака легких в мокроте, имеет более высокую сложность. Хотя онкомаркер в мокроте пациентов с раком легких исследуется специалистами, по сравнению с обнаружением и оценкой онкомаркера в образцах крови других пациентов с опухолью, показатель успешности для образцов мокроты крайне низок. Основные причины состоят в следующем: (1) состав мокроты сложен, и различные группы имеют большие различия в компонентах и в вязкости мокроты при различных заболеваниях или в различных средах; (2) мокрота содержит компоненты многих бронхиальных эпителиальных клеток и бактерий, клетки слизистой оболочки полости рта и другие клетки, не относящиеся к раку легких; и достаточное количество ДНК, полученной из рака легких, не может быть эффективно обогащено обычным способом обработки образца; (3) у многих курящих пациентов нет отхаркивания. Исследования A. J. Hubers et al. в работе «Молекулярный анализ мокроты для диагностики рака легких» для 10 предыдущих статей показывают, что степень метилирования медианного маркера в тканях с раком легких составляет 48%, тогда как степень метилирования в медианной мокроте составляет 38%. Результаты показывают, что частота обнаружения маркера метилирования в тканях значительно выше, чем в мокроте. Между тем, в работе Rosalia Cirincione «Профиль метилирования в опухоли и в образцах мокроты пациентов с раком легких, выявленным путем спиральной компьютерной томографии: когортное исследование случай-контроль» сообщается, что частота обнаружения RARbeta2, P16 и RASSF1A в тканях с раком легких составляет соответственно до 65,5%, 41,4% и 51,7%, тогда как частота обнаружения только в одной мокроте составляет соответственно до 44,4%, 5% и 5%.
Раскрытие изобретения
Одной из задач настоящего раскрытия является обеспечение комбинации генных маркеров, а также детектирующий/диагностический реагент для выявления комбинации генных маркеров и применение комбинации генных маркеров.
В одном аспекте настоящее раскрытие обеспечивает комбинацию генных маркеров. Комбинация генных маркеров включает в себя HOXB4 и SRCIN1.
Комбинация генных маркеров в настоящем раскрытии дополнительно включает в себя фрагмент любой длины в каждом генном маркере. Иными словами, комбинация любого фрагмента из HOXB4 и любого фрагмента из SRCIN1 (фрагмент может быть любой длины) подпадает под объем охраны настоящего раскрытия.
Ген HOXB4 является членом семейства гомеобоксных генов Antp и принадлежит к гомеобоксному кластеру генов B на хромосоме 17. Нуклеопротеин с гомеобоксным ДНК-связывающим доменом кодируется, и закодированный белок служит в качестве фактора транскрипции специфической последовательности, участвующего в развитии. Внутриклеточная или эктопическая экспрессия белка может амплифицировать гематопоэтические стволовые клетки и клетки-предшественники в естественных и лабораторных условиях, так что белок становится потенциальным кандидатом для терапевтической амплификации стволовых клеток.
SRCIN1 имеет полное наименование - ингибитор 1 передачи сигналов SRC-киназы. Ген и белок SRCIN1, играющего роль отрицательного регулирующего фактора SRC, ингибируют активность SRC и нисходящую передачу сигнала путем активации CSK, вызывая, таким образом, нарушение диффузии и миграции клеток. SRCIN1 регулирует морфологию дендритных шипиков и участвует в кальций-зависимом экзоцитозе.
Настоящее раскрытие дополнительно обеспечивает применение мультигенного комбинированного реагента для обнаружения метилирования при приготовлении реагента или набора для обнаружения рака легких. Гены включают в себя HOXB4 и SRCIN1.
В настоящее время уровень недодиагностики рака легких является более высоким. В частности, неинвазивное обнаружение в мокроте для типа аденоматозной карциномы крайне осложнено, а частота обнаружения крайне низка. Причина этого состоит в следующем: большая часть аденоматозной карциномы происходит из мелких бронхов и представляет собой периферический рак легких, а слущенные клетки, находящиеся глубоко в легких, трудно отхаркиваются с мокротой. Поэтому в настоящее время почти отсутствуют средства обнаружения мокроты для аденоматозной карциномы.
Снижение недодиагностики важно, в частности, при раннем скрининге опухолей. Если ранний скрининг не может обеспечить обследование всех или подавляющего большинства пациентов, пациенты, которые не были подвергнуты обследованию, не получат достаточных предупреждений о риске, и возможность лечения будет отсрочена, что является огромной потерей для пациентов.
Хотя некоторые онкомаркеры, связанные с раком легких, были раскрыты в работах из уровня техники, они ограничены реагентами для детектирования или средствами обнаружения этих онкомаркеров, и требования по чувствительности и специфичности для этих онкомаркеров не могут быть удовлетворены. Поэтому в настоящее время средства скрининга, которые могут быть особо применены для рака легких, все еще нуждаются в дополнительном исследовании в данной области. Однако, хотя неинвазивный скрининг имеет уникальные преимущества в отборе проб, неинвазивный скрининг также имеет некоторые ограничения в других аспектах. Например, для типа аденоматозной карциномы в раке легких, поскольку слущенные клетки, погруженные в легкое, сложно отхаркивать с мокротой, как правило, специалисты в данной области считают, что рак легких этого типа не пригоден для неинвазивного скрининга. Кроме того, даже при раке легких любого другого типа способ неинвазивного скрининга, о котором сообщалось до сих пор, сложно привести в соответствие с требованиями клинического применения. Хотя соответствующие исследования проводились в течение многих лет, до сих пор не существует неинвазивного способа скрининга для рака легких, который можно было бы применять в клинической практике.
Настоящее раскрытие дополнительно обеспечивает мультигенный комбинированный реагент или набор для обнаружения метилирования, включающий в себя реагент для обнаружения метилирования для генов HOXB4 и SRCIN1.
Термин «реагент для обнаружения метилирования» включает в себя следующее содержание: реагент для обнаружения, специфичный для любой меньшей/более короткой последовательности гена или содержимого гена. Иными словами, обнаружение, проведенное в любом указанном местоположении в гене (например, меньший фрагмент), и реагент для такого обнаружения попадает в объем охраны настоящего раскрытия.
Генные маркеры HOXB4 и SRCIN1 в настоящем раскрытии выявляют комбинированным образом. Иными словами, в настоящем раскрытии несколько генных маркеров выявляют одновременно.
Термин «обнаружение» («выявление», «детектирование») в настоящем раскрытии означает диагностику, включает в себя средне- и позднестадийный диагноз рака легких, в дополнение к ранней диагностике рака легких, и дополнительно включает в себя скрининг рака легких, оценку риска, прогноз, идентификацию заболевания, диагностику стадий заболевания и выбор терапевтических мишеней.
Благодаря применению комбинации маркеров HOXB4 и SRCIN1 рака легких становится возможной ранняя диагностика рака легких. Если определено, что метилированные гены в раковых клетках метилированы в клетках с клинически или морфологически нормальным внешним видом, это указывает на то, что клетки с нормальным внешним видом перерождаются в рак. Таким образом, рак легких может быть диагностирован путем метилирования комбинации генов HOXB4 и SRCIN1, специфичных для рака легких, в клетках с нормальным внешним видом на ранней стадии.
Ранняя диагностика включает в себя раскрытие возможности возникновения рака до появления метастазов, предпочтительно, до наблюдения морфологических изменений в тканях или клетках.
В дополнение к ранней диагностике рака легких, ожидается, что реагент/набор в настоящем раскрытии будет использоваться для скрининга рака легких, оценки риска, прогноза, идентификации заболевания, диагностики стадий заболевания и выбора терапевтических мишеней.
В качестве необязательного варианта стадий заболевания, рак легких может быть диагностирован путем измерения метилирования комбинации генов HOXB4 и SRCIN1, полученной из образцов с помощью прогрессирования рака легких на различных стадиях или фазах. Путем сопоставления степени метилирования комбинации генов HOXB4 и SRCIN1 нуклеиновых кислот, выделенных из образцов на каждой стадии рака легких, со степенью метилирования комбинации генов HOXB4 и SRCIN1 одной или более нуклеиновых кислот, выделенных из образцов в ткани без аномалии пролиферации клеток, можно выявить конкретную стадию рака легких в образцах.
Как правило, CpG-островки относятся к некоторым областям, обогащенным динуклеотидами CpG и, как правило, расположенным на промоторе и в близлежащей области. CpG-островок в настоящем раскрытии относится не только к динуклеотиду CpG, обогащенному промотором и близлежащей областью, но также включает в себя локус CpG с гетерозиготным метилированием или выделенный локус CpG.
Комбинированный реагент для обнаружения метилирования в комбинации генов HOXB4 и SRCIN1 может представлять собой реагент для обнаружения метилирования, описанный в работах согласно уровню техники. В работах из уровня техники метилирование генов-мишеней может быть выявлено несколькими существующими способами, такими как ПЦР, специфичная к метилированию (МСП), количественная ПЦР, специфичная к метилированию (кМСП), ПЦР, специфичная для метилирования ДНК, связывающей белок, количественная ПЦР и ДНК-чип, рестрикционные эндонуклеазы, чувствительные к метилированию, бисульфитное секвенирование или пиросеквенирование. В дополнение, могут быть задействованы другие способы обнаружения метилирования, описанные в предварительной патентной заявке США 62/007,687. Каждый способ обнаружения включает в себя соответствующий реагент. Все эти реагенты могут быть использованы для выявления метилирования комбинации генов HOXB4 и SRCIN1 в настоящем раскрытии.
Настоящее раскрытие дополнительно обеспечивает комбинированный реагент для обнаружения метилирования для комбинации генов HOXB4 и SRCIN1. Комбинированный реагент для обнаружения метилирования включает в себя праймер и/или зонд, специфичный для каждого гена в комбинации генов HOXB4 и SRCIN1.
В некоторых конкретных вариантах осуществления настоящего раскрытия реагент для обнаружения включает в себя праймер и/или зонд, полученный из CpG-островков каждого гена, в комбинации генов HOXB4 и SRCIN1.
В некоторых конкретных вариантах осуществления настоящего раскрытия праймер и/или зонд выявляет метилирование каждого гена в комбинации генов HOXB4 и SRCIN1 посредством количественной ПЦР, специфичной для метилирования (кМСП).
В некоторых конкретных вариантах осуществления настоящего раскрытия реагент для обнаружения метилирования, обеспеченный настоящим раскрытием, выявляет уровни метилирования геносомы, межгенной области, или промоторной области и области вблизи промоторной области каждого гена в комбинации генов HOXB4 и SRCIN1.
В некоторых вариантах осуществления реагент для обнаружения метилирования, обеспеченный настоящим раскрытием, содержит праймер и/или зонд, полученный из CpG-островков промоторной области или области вблизи промоторной области каждого гена в комбинации генов HOXB4 и SRCIN1.
В некоторых вариантах осуществления в реагенте для обнаружения метилирования, обеспеченном настоящим раскрытием, прямой праймер в праймерах для обнаружения метилирования гена HOXB4 включает в себя любую из нуклеотидных последовательностей, показанных следующим образом:
I. Нуклеотидная последовательность, имеющая идентичность по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 91%, или по меньшей мере 92%, или по меньшей мере 93%, или по меньшей мере 94%, или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99%, или 100% с нуклеотидными последовательностями, показанными как SEQ ID №1, SEQ ID №16 и SEQ ID №19; и
II. Комплементарная последовательность к последовательности, показанной в I; и/или
обратный праймер в праймерах для обнаружения метилирования гена HOXB4 включает в себя любую из нуклеотидных последовательностей, показанных следующим образом:
III. Нуклеотидная последовательность, имеющая идентичность по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 91%, или по меньшей мере 92%, или по меньшей мере 93%, или по меньшей мере 94%, или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99%, или 100% с нуклеотидными последовательностями, показанными как SEQ ID №2, SEQ ID №17 и SEQ ID №20;
IV. Комплементарная последовательность к последовательности, показанной в III; и/или
прямой праймер в праймерах для обнаружения метилирования гена SRCIN1 включает в себя любую из нуклеотидных последовательностей, показанных следующим образом:
V. Нуклеотидная последовательность, имеющая идентичность по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 91%, или по меньшей мере 92%, или по меньшей мере 93%, или по меньшей мере 94%, или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99%, или 100% с нуклеотидными последовательностями, показанными как SEQ ID №4 и SEQ ID №22; и
VI. Комплементарная последовательность к последовательности, показанной в V; и/или
обратный праймер в праймерах для обнаружения метилирования гена SRCIN1 включает в себя любую из нуклеотидных последовательностей, показанных следующим образом:
VII. Нуклеотидная последовательность, имеющая идентичность по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 91%, или по меньшей мере 92%, или по меньшей мере 93%, или по меньшей мере 94%, или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99%, или 100% с нуклеотидной последовательностью, показанной как SEQ ID №5; и
VIII. Комплементарная последовательность к последовательности, показанной в VII.
В некоторых вариантах осуществления пара праймеров для обнаружения метилирования гена HOXB4 показана как SEQ ID №1 и SEQ ID №2.
В некоторых вариантах осуществления пара праймеров для обнаружения метилирования гена HOXB4 показана как SEQ ID №16 и SEQ ID №17.
Пара праймеров для обнаружения метилирования гена HOXB4 показана как SEQ ID №19 и SEQ ID №20.
В некоторых вариантах осуществления пара праймеров для обнаружения метилирования гена SRCIN1 показана как SEQ ID №4 и SEQ ID №5.
В некоторых вариантах осуществления пара праймеров для обнаружения метилирования гена SRCIN1 показана как SEQ ID №22 и SEQ ID №5.
В некоторых вариантах осуществления зонд для обнаружения метилирования гена HOXB4 имеет любую из нуклеотидных последовательностей, показанных следующим образом:
IX. Нуклеотидная последовательность, имеющая идентичность по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 91%, или по меньшей мере 92%, или по меньшей мере 93%, или по меньшей мере 94%, или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99%, или 100% с нуклеотидными последовательностями, показанными как SEQ ID №3, SEQ ID №18 и SEQ ID №21; и
X. Комплементарная последовательность к последовательности, показанной в IX; и/или
зонд для обнаружения метилирования гена SRCIN1 имеет любую из нуклеотидных последовательностей, показанных следующим образом:
XI. Нуклеотидная последовательность, имеющая идентичность по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 91%, или по меньшей мере 92%, или по меньшей мере 93%, или по меньшей мере 94%, или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99%, или 100% с нуклеотидной последовательностью, показанной как SEQ ID №6; и
XII. Комплементарная последовательность к последовательности, показанной в XI.
В некоторых вариантах осуществления рак легких выбран из мелкоклеточного рака легких и немелкоклеточного рака легких.
В некоторых вариантах осуществления немелкоклеточный рак легких выбран из плоскоклеточной карциномы или аденоматозной карциномы.
Настоящее раскрытие дополнительно обеспечивает набор для выявления рака легких. Набор включает в себя комбинированный реагент для обнаружения метилирования.
В некоторых вариантах осуществления набор, обеспеченный настоящим раскрытием, дополнительно включает в себя общие реагенты в наборе. Например, общий трансформирующий агент в кМСП используют для преобразования неметилированного цитозинового основания в урацил, тогда как метилированное цитозиновое основание остается тем же. Трансформирующий агент специально не ограничен. Доступны все реагенты, которые могут трансформировать цитозин в урацил, представленные в работах согласно уровню техники, включая один или несколько из: соли гидразиния, бисульфита и гидросульфита (метабисульфит натрия, бисульфит калия, бисульфит цезия и бисульфит аммония). Другие примеры - полимераза ДНК, дНТФ, ионы Mg2+, буферный раствор, и т.д., которые являются общими в амплификации гена.
В некоторых вариантах осуществления реагент или набор дополнительно включает в себя реагент для обнаружения референсного гена.
В некоторых вариантах осуществления референсный ген представляет собой β-актин.
В некоторых вариантах осуществления реагент для обнаружения референсного гена относится к праймеру и зонду, специфичному для референсного гена.
В некоторых вариантах осуществления реагент для обнаружения референсного гена представляет собой пару праймеров, показанную как SEQ ID №13 и SEQ ID №14, а зонд показан как SEQ ID №15.
Настоящее раскрытие обеспечивает применение комбинированного реагента для обнаружения метилирования генов HOXB4 и SRCIN1 при приготовлении реагента или набора для обнаружения рака легких.
Настоящее раскрытие обеспечивает праймер. Праймер выбран из нуклеотидной последовательности, имеющей идентичность по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 91%, или по меньшей мере 92%, или по меньшей мере 93%, или по меньшей мере 94%, или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99%, или 100% с нуклеотидными последовательностями, показанными как SEQ ID №1, SEQ ID №2, SEQ ID №4, SEQ ID №5, SEQ ID №16, SEQ ID №17, SEQ ID №19, SEQ ID №20 или SEQ ID №22, или по меньшей мере любой из последовательностей, комплементарных данным последовательностям.
Настоящее раскрытие обеспечивает праймер. Праймер выбран из нуклеотидной последовательности, имеющей идентичность по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 91%, или по меньшей мере 92%, или по меньшей мере 93%, или по меньшей мере 94%, или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99%, или 100% с нуклеотидными последовательностями, показанными как SEQ ID №1, SEQ ID №2, SEQ ID №4 или SEQ ID №5, или по меньшей мере любой из последовательностей, комплементарных данным последовательностям.
В некоторых вариантах осуществления праймер выбран по меньшей мере из одной пары праймеров, показанной как SEQ ID №1 и SEQ ID №2, или SEQ ID №4 и SEQ ID №5.
В некоторых вариантах осуществления праймер выбран из пар праймеров, показанных как SEQ ID №1 и SEQ ID №2, или SEQ ID №4 и SEQ ID №5.
Праймер используют для амплификации фрагментов нуклеиновой кислоты. В данной области техники хорошо известно, что успешный дизайн праймера имеет особую важность для ПЦР. Что касается общей ПЦР, то влияние дизайна праймера является более важным при обнаружении метилирования. Причина этого состоит в следующем: «C» в цепи ДНК преобразуется в «U» вследствие реакции метилсульфурирования, и тогда содержание GC снижается. Таким образом, после ПЦР в последовательности возникает длинная непрерывная «T»; разрыв цепи ДНК легко вызвать, и сложно подобрать стабильный праймер, имеющий подходящее значение Tm. Кроме того, чтобы отличить сульфидированный ДНК и ДНК, который не является сульфидированным или полностью обработанным, праймер должен иметь достаточную «C». Таким образом, сложность подбора стабильного праймера повышается. Поэтому при обнаружении метилирования ДНК выбор указанной амплификации фрагментов праймера, таких как длины и местоположения фрагментов амплификации, а также выбор праймера оказывает влияние на чувствительность и специфичность обнаружения. С помощью экспериментов автор изобретения обнаружил, что различные целевые фрагменты амплификации и праймеры имеют различные эффекты обнаружения. Несколько раз было раскрыто, что некоторые гены или фрагменты нуклеиновой кислоты имеют различия в экспрессии в опухолевых и неопухолевых тканях. Однако предстоит еще очень много сделать для преобразования генов или фрагментов нуклеиновой кислоты в онкомаркер для клинического применения. Наиболее важная причина этого состоит в следующем: из-за ограничения реагента для обнаружения сложно обеспечить, чтобы чувствительность и специфичность обнаружения потенциального онкомаркера удовлетворяли требованиям по обнаружению, или способ обнаружения сложен в эксплуатации и имеет высокую стоимость, и его сложно клинически применять в крупном масштабе.
В другом аспекте настоящее раскрытие дополнительно обеспечивает зонд нуклеиновой кислоты. Зонд нуклеиновой кислоты выбран из нуклеотидной последовательности, имеющей идентичность по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 91%, или по меньшей мере 92%, или по меньшей мере 93%, или по меньшей мере 94%, или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99%, или 100% с последовательностями, показанными как SEQ ID №3, SEQ ID №6, SEQ ID №18 и SEQ ID №21, или по меньшей мере любой из последовательностей, комплементарных данным последовательностям.
В качестве предпочтительного варианта осуществления настоящего раскрытия зонд нуклеиновой кислоты выбран из последовательностей, показанных как SEQ ID №3 и SEQ ID №6.
В некоторых вариантах осуществления набор, обеспеченный настоящим раскрытием, включает в себя первый контейнер, включающий в себя пару праймеров, используемых для амплификации, и второй контейнер, включающий в себя зонд.
В некоторых вариантах осуществления набор дополнительно включает в себя инструкцию.
В некоторых вариантах осуществления набор дополнительно включает в себя реагент для извлечения нуклеиновой кислоты.
В некоторых вариантах осуществления набор дополнительно включает в себя устройство для отбора проб.
Настоящее раскрытие дополнительно обеспечивает применение вышеуказанного реагента и набора для обнаружения метилирования, праймера и зонда при приготовлении реагента или набора для обнаружения метилирования, или при приготовлении реагента или набора для обнаружения рака легких.
Настоящее раскрытие дополнительно обеспечивает применение вышеуказанного реагента, набора для обнаружения метилирования, праймера и зонда при обнаружении метилирования, или их применение для обнаружения рака легких.
Настоящее раскрытие дополнительно обеспечивает систему обнаружения рака легких. Система включает в себя следующие компоненты:
(1) комбинированный компонент обнаружения метилирования генов HOXB4 и SRCIN1;
(2) компонент обработки данных; и
(3) компонент вывода результата.
В некоторых вариантах осуществления компонент обнаружения метилирования включает в себя прибор для обнаружения метилирования.
В некоторых вариантах осуществления компонент обнаружения метилирования дополнительно включает в себя прибор для обнаружения метилирования, набор, праймер и зонд.
В некоторых вариантах осуществления прибор для обнаружения метилирования включает в себя один или более из следующих приборов: прибор для количественной флуоресцентной ПЦР, прибор для ПЦР и секвенатор.
В некоторых вариантах осуществления компонент обработки данных включает в себя вычислительную машину для обработки данных.
Вычислительная машина для обработки данных включает в себя любое устройство или прибор или аппарат, который могут использовать специалисты в данной области и который позволяет проводить обработку данных.
В некоторых вариантах осуществления вычислительная машина для обработки данных включает в себя один или более калькуляторов и компьютеров.
На компьютеры загружают любое программное обеспечение или программу, которую могут использовать специалисты в данной области, и с помощью которой можно проводить обработку данных или статистический анализ.
В некоторых вариантах осуществления компьютеры включают в себя компьютер, на который загружен один или более элементов программного обеспечения из SPSS, SAS и Excel.
В некоторых вариантах осуществления компонент вывода результата включает в себя блок вывода результата.
Блок вывода результата включает в себя любое устройство или прибор или устройство, которое может отображать результаты обработки данных в виде считываемого содержимого.
В некоторых вариантах осуществления компонент обнаружения метилирования дополнительно включает в себя мультигенный комбинированный реагент для обнаружения метилирования.
В некоторых вариантах осуществления блок вывода результата включает в себя один или более экранов и бумажных отчетов.
В некоторых вариантах осуществления процессор для обработки данных сконфигурирован для: a) приема данных испытаний детектируемого образца и нормального контрольного образца; b) хранения данных испытаний детектируемого образца и нормального контрольного образца; c) сопоставления данных испытаний детектируемого образца и нормального контрольного образца того же типа; d) реагирования на вероятность или возможность того, что пациент страдает раком легких согласно результатам сопоставления.
В некоторых вариантах осуществления компонент вывода результата используют для вывода данных о вероятности или возможности того, что пациент страдает раком легких.
В некоторых вариантах осуществления критерием компонента обработки данных является следующее: пробы рака легких и нормальные пробы определяют по граничным значениям.
В некоторых вариантах осуществления комбинированное обнаружение HOXB4 и SRCIN1 в настоящем раскрытии может быть выполнено в режиме нескольких ПЦР.
В некоторых вариантах осуществления уровень метилирования проб определяют по значению Cp и/или по значению ΔCp генов-мишеней, т.е., HOXB4 и SRCIN1 (значение ΔCp = Cpген-мишень - Cp референсный ген).
В некоторых вариантах осуществления пробы ткани определяют как пробы рака легких, если значение ΔCp одного гена в пробах ткани меньше граничного значения величины ΔCp; а пробы ткани определяют как нормальные пробы, только когда значения ΔCp одновременно двух генов в пробах ткани больше или равны граничному значению величины ΔCp.
В некоторых вариантах осуществления граничное значение величины Cp в пробах ткани находится в диапазоне 35-39; а граничное значение величины ΔCp находится в диапазоне 4-12.
В некоторых вариантах осуществления в ходе комбинированного обнаружения HOXB4 и SRCIN1 в пробах ткани граничное значение величины ΔCp HOXB4 равно 5,4, а граничное значение величины ΔCp SRCIN1 равно 6,5.
В некоторых вариантах осуществления в ходе комбинированного обнаружения HOXB4 и SRCIN1 в пробах мокроты пороговые значения Cp HOXB4 и SRCIN1 составляют соответственно 36,9 и 37,0. Когда один из отдельных результатов обнаружения гена меньше вышеуказанного порога, пробы можно идентифицировать как положительные (т.е., как пробы рака легких); а если 2 пункта результатов обнаружения больше или равны соответствующим пороговым значениям, пробы можно идентифицировать как отрицательные (т.е., как нормальные пробы).
В некоторых вариантах осуществления в ходе нескольких ПЦР-обнаружений HOXB4 и SRCIN1 граничное значение величины Cp в пробах мокроты составляет 36,7, тогда как в пробах смывной жидкости граничное значение величины Cp равно 37,2, а граничное значение величины ΔCp равно 9.
В некоторых вариантах осуществления в ходе нескольких ПЦР-обнаружений HOXB4 и SRCIN1 пробы определяют как пробы рака легких, когда значение Cp в пробах мокроты меньше граничного значения величины Cp; и пробы определяют как нормальные пробы, когда значение Cp в пробах мокроты больше или равно граничному значению величины Cp.
В некоторых вариантах осуществления в ходе нескольких ПЦР-обнаружений HOXB4 и SRCIN1 пробы определяют как пробы рака легких, когда любое численное значение величины Cp и значение ΔCp проб смывной жидкости соответственно меньше граничного значения величины Cp и значения ΔCp; и пробы определяют как нормальные пробы, когда значение Cp и значение ΔCp проб смывной жидкости больше или равны граничному значению соответственно величины Cp и величины ΔCp.
В некоторых вариантах осуществления опухоль представляет собой рак легких.
В некоторых вариантах осуществления опухоли представляют собой мелкоклеточный рак легких и немелкоклеточный рак легких.
В некоторых вариантах осуществления немелкоклеточный рак легких выбран из плоскоклеточной карциномы или аденоматозной карциномы.
В некоторых вариантах осуществления типы указанного детектируемого образца или пробы выбраны по меньшей мере из одного из следующего: смывной жидкости альвеол легких, тканей, гидроторакса, мокроты, крови, сыворотки, плазмы, мочи, сока предстательной железы или экскрементов.
В некоторых вариантах осуществления образцы в настоящем раскрытии выбраны по меньшей мере из одного из следующего: смывной жидкости альвеол легких, ткани или мокроты.
В некоторых вариантах осуществления образцы в настоящем раскрытии выбраны по меньшей мере из одного из следующего: смывной жидкости альвеол легких или мокроты.
Настоящее раскрытие дополнительно обеспечивает способ диагностики рака легких. Способ включает в себя следующие этапы:
(1) выявление уровней метилирования генов HOXB4 и SRCIN1 в детектируемом образце, полученном у пациента;
(2) сопоставление уровней метилирования генов HOXB4 и SRCIN1 детектируемого образца и нормального контрольного образца; и
(3) диагностирование рака легких, исходя из отклонения уровней метилирования детектируемого образца от нормального контрольного образца.
В некоторых вариантах осуществления настоящее раскрытие обеспечивает способ диагностики рака легких. Способ включает в себя следующие этапы: (1) выявление уровней метилирования генов HOXB4 и SRCIN1 в детектируемом образце, полученном у пациента, в котором обнаружение включает в себя создание контакта между детектируемым образцом, взятым у пациента, и реагентом для обнаружения, для выявления уровней метилирования генов HOXB4 и SRCIN1; (2) сопоставление уровней метилирования генов HOXB4 и SRCIN1 детектируемого образца и нормального контрольного образца; и (3) диагностирование рака легких, исходя из отклонения уровней метилирования детектируемого образца от нормального контрольного образца.
В некоторых вариантах осуществления настоящее раскрытие обеспечивает способ диагностики рака легких. Способ включает в себя следующие этапы: добавление реагента для обнаружения метилирования генов в детектируемый образец, полученный у пациента, и выявление уровней метилирования генов HOXB4 и SRCIN1 в детектируемом образце; сопоставление уровней метилирования генов HOXB4 и SRCIN1 детектируемого образца и нормального контрольного образца; и диагностирование рака легких, исходя из отклонения уровней метилирования детектируемого образца от нормального контрольного образца.
В некоторых вариантах осуществления отклонение на этапе (3) относится к отклонению уровня метилирования любого из 2 генов, т.е., HOXB4 и SRCIN1.
В некоторых вариантах осуществления на этапе (1) обнаружение включает в себя создание контакта между детектируемым образцом, взятым у пациента, и реагентом для обнаружения, для выявления уровней метилирования генов HOXB4 и SRCIN1.
В некоторых вариантах осуществления уровни метилирования генов HOXB4 и SRCIN1 выявляют путем использования количественной ПЦР, специфичной для метилирования (кМСП).
В некоторых вариантах осуществления результаты метилирования детектируемого образца и нормального образца сопоставляют по результатам; и когда результаты детектируемого образца и нормального образца имеют существенные различия или крайне существенные различия, из этих результатов определяют, что детектируемый образец свидетельствует о высоком риске заболевания.
Способ диагностики в настоящем раскрытии можно использовать перед лечением рака легких или после него или комбинировать его с лечением рака легких. При использовании после лечения способ диагностики включает в себя: оценку успеха лечения, или мониторинг облегчения, рецидива и/или прогрессирования (включая метастазирование) рака легких после лечения.
В одном аспекте дополнительно предложен способ лечения рака легких. Способ включает в себя следующие этапы:
(1) выявление уровней метилирования генов HOXB4 и SRCIN1 в детектируемом образце, полученном у пациента;
(2) сопоставление уровней метилирования генов HOXB4 и SRCIN1 детектируемого образца и нормального контрольного образца;
(3) диагностирование рака легких, исходя из отклонения уровней метилирования детектируемого образца от нормального контрольного образца; и
(4) введение препарата против рака легких пациенту, у которого диагностирован рак легких.
Другой аспект настоящего раскрытия предлагает способ лечения рака легких. Способ включает в себя: применение операций, химиотерапии, радиотерапии, химиолучевой терапии, иммунотерапии, онколитической вирусной терапии или любого другого способа лечения для других типов рака легких, доступного в данной области, и комбинации этих способов лечения для пациентов с диагностированным раком легких с помощью вышеуказанного способа диагностики.
В настоящем раскрытии с помощью исследования было обнаружено, что в некоторых конкретных вариантах осуществления образцы рака легких можно хорошо отличить от контрольных образцов путем выявления комбинации генов HOXB4 и SRCIN1. Чувствительность и специфичность обнаружения для рака легких крайне высока.
краткое описание чертежей
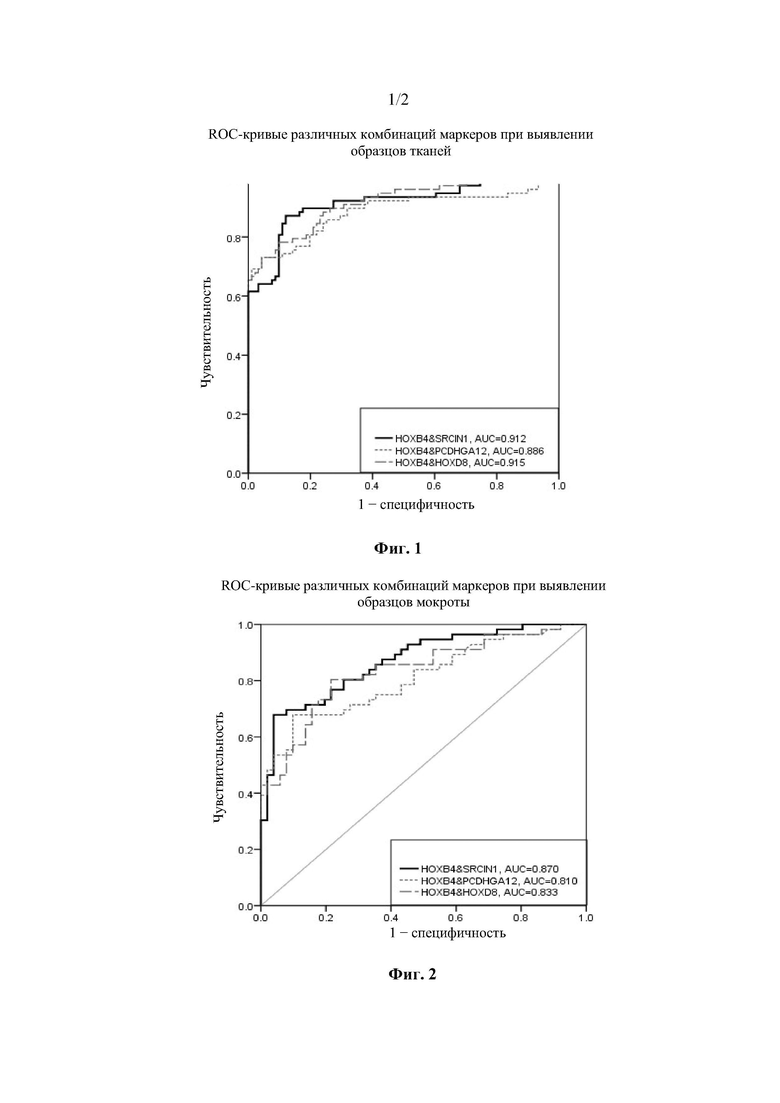
Фиг. 1 представляет собой ROC-кривые (зависимость количества верно классифицированных положительных объектов от количества неверно классифицированных отрицательных объектов) для различных комбинаций маркеров для исследования образцов ткани;
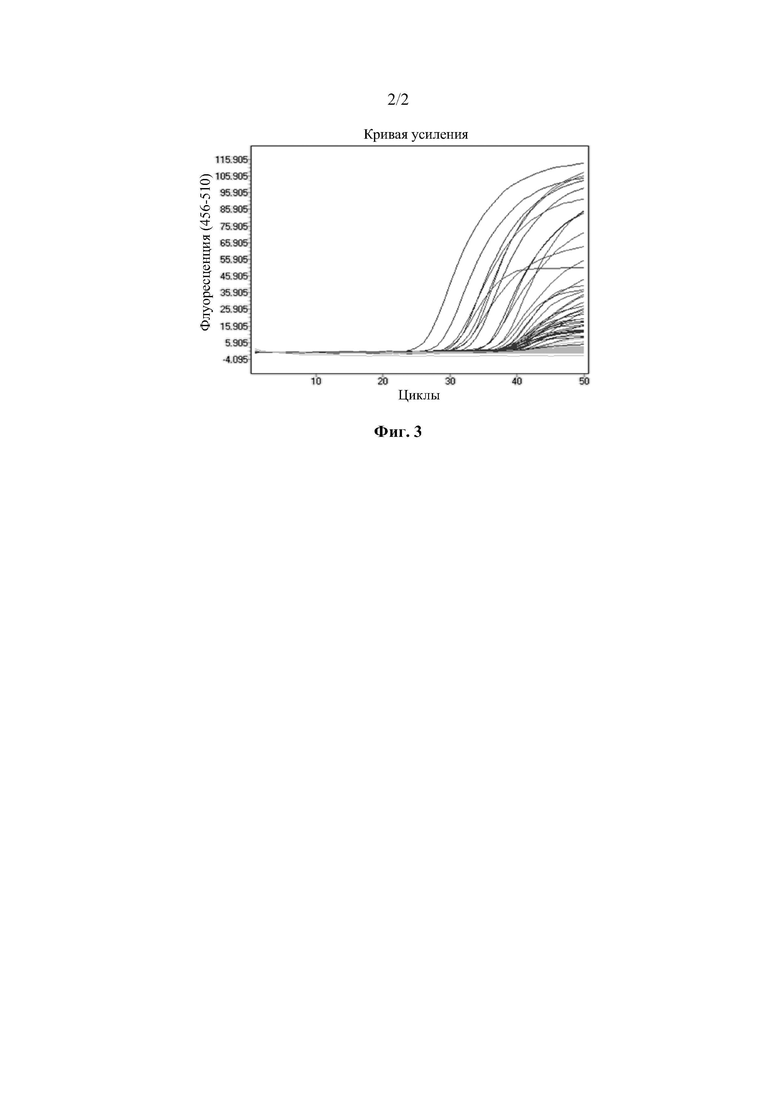
Фиг. 2 представляет собой ROC-кривые для различных комбинаций маркеров для исследования образцов мокроты; и
Фиг. 3 представляет собой кривую амплификации комбинированного обнаружения HOXB4 и SRCIN1 для исследования образцов смывной жидкости.
Осуществление изобретения
Технические решения в настоящем раскрытии будут дополнительно описаны ниже с помощью конкретных примеров. Конкретные примеры не являются ограничениями объема охраны настоящего раскрытия. Некоторые несущественные модификации и правки, сделанные другими лицами согласно концепции настоящего раскрытия, по-прежнему входят в объем охраны настоящего раскрытия.
Термины «праймер» или «зонд» в настоящем раскрытии относятся к олигонуклеотиду, включая область, комплементарную к последовательности по меньшей мере 6 непрерывных нуклеотидов молекулы-мишени (такой как фрагмент нуклеиновой кислоты - мишень). В некоторых вариантах осуществления по меньшей мере одна часть последовательности праймера или зонда не комплементарна к амплифицированной последовательности. В некоторых вариантах осуществления праймер или зонд включает в себя область, комплементарную к последовательности из по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или по меньшей мере 20 непрерывных нуклеотидов молекулы-мишени. Когда праймер или зонд включает в себя область, «комплементарную по меньшей мере к x непрерывных нуклеотидов молекулы-мишени», праймер или зонд, по меньшей мерее, на 95% комплементарен по меньшей мере к x непрерывных или прерывистых блок-нуклеотидов молекулы-мишени. В некоторых вариантах осуществления праймер или зонд по меньшей мере на 80%, по меньшей мере на 81%, по меньшей мере на 82%, по меньшей мере на 83%, по меньшей мере на 84%, по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, или на 100% комплементарен к молекуле-мишени.
В настоящем раскрытии «нормальные» образцы относятся к образцам того же типа, выделенным у известных индивидов, не имеющих рака или опухолей.
Образцы для обнаружения метилирования в настоящем раскрытии включают в себя, без ограничения перечисленным, ДНК, или РНК, или мРНК-содержащую ДНК, и РНК-образцы, или гибриды ДНК-РНК, в которых ДНК или РНК может быть одноцепочечной или двухцепочечной.
В настоящем раскрытии «пациентами» являются млекопитающие, такие как люди.
В настоящем раскрытии термин «уровень метилирования» имеет то же значение, что и термин «степень метилирования», и может быть, как правило, представлен в виде процентного содержания метилированного цитозина, причем процентное содержание метилированного цитозина получают путем деления количества метилированного цитозина на сумму количества метилированного цитозина и количества не метилированного цитозина. Кроме того, в настоящее время уровень метилирования обычно представляют с использованием способа для деления количества метилированных генов-мишеней на количество референсных генов. Более того, в работах согласно уровню техники уровень метилирования представлен другими способами представления уровня метилирования.
«Пробы» в настоящем раскрытии имеют то же значение, что и «образцы».
Термин «и/или», используемый в настоящем раскрытии, относится и показывает любой из одного или более связанных перечисленных объектов и любую возможную комбинацию. При использовании в перечне двух или более объектов термин «и/или» представляет, что любой из перечисленных объектов можно использовать по отдельности, или можно использовать любую комбинацию двух или более перечисленных объектов. Например, если состав, комбинация, или структура описана так, что она содержит (или включает в себя) компоненты A, B, C, и/или D, состав может отдельно включать в себя A, отдельно включать в себя B, отдельно включать в себя C и отдельно включать в себя D; и может включать в себя комбинацию A и B, комбинацию A и C, комбинацию A и D, комбинацию B и C, комбинацию B и D, комбинацию C и D, комбинацию A, B и C, комбинацию A, B и D, комбинацию A, C и D, комбинацию B, C и D, или комбинацию A, B, C и D.
Пример 1
Автор изобретения провел скрининг сотен генов. Скрининг генов проводили из образцов ткани, где референсным геном служит ген β-актин, сопоставляли комбинированные результаты обнаружения каждых двух генов, таких как HOXB4, SRCIN1, PCDHGA12 и HOXD8, а обнаружение праймеров и зондов каждого гена производили следующим образом:
обнаружение праймеров и зонда HOXB4:
SEQ ID №1 праймер HOXB4-F1 F: TTCGTCGTTTTCGTTATCATTC
SEQ ID №2 праймер HOXB4-R1 R: TACTAACCGCCTCGCTAC
SEQ ID №3 зонд HOXB4-P1 P: FAM-CGGGTTTTTGCGTCGTTATTCGTC-BQ1
обнаружение праймеров и зонда SRCIN1:
SEQ ID №4 праймер SRCIN1 F: TCGTGTGTCGTCGTTCAGAC
SEQ ID №5 праймер SRCIN1 R: GAAATACCCGCGAAAATACTG
SEQ ID №6 зонд SRCIN1 P: FAM-AGTTTTACGTTGGAGAAGCGTCGG-BQ1
обнаружение праймеров и зонда PCDHGA12:
SEQ ID №7 праймер PCDHGA12 F: TTGGTTTTTACGGTTTTCGAC
SEQ ID №8 праймер PCDHGA12 R: AAATTCTCCGAAACGCTCG
SEQ ID №9 зонд PCDHGA12 P: FAM-ATTCGGTGCGTATAGGTATCGCGC-BQ1
обнаружение праймеров и зонда HOXD8:
SEQ ID №10 праймер HOXD8 F: TTAGTTTCGGCGCGTAGC
SEQ ID №11 праймер HOXD8 R: CCTAAAACCGACGCGATCTA
SEQ ID №12 зонд HOXD8 P: FAM-AAAACTTACGATCGTCTACCCTCCG-BQ1
обнаружение праймеров и зонда β-актин:
SEQ ID №13 праймер β-актин F: GGAGGTTTAGTAAGTTTTTTGGATT
SEQ ID №14 праймер β-актин R: CAATAAAACCTACTCCTCCCTTA
SEQ ID №15 зонд β-актин P: FAM-TTGTGTGTTGGGTGGTGGTT-BQ1
Методики эксперимента:
1. Извлечение ДНК
Собирали пробы пациентов с диагностированным раком легких и пробы пациентов, не страдающих раком легких, и эти пробы соответственно включали в себя пробы ткани, заполненные парафином, пробы мокроты и пробы смывной жидкости. После предварительной обработки образца и выделения клеток, извлечение ДНК проводили согласно инструкции к набору ДНК HiPure FFPE (D3126-03) в компании Magen.
2. Модифицирование ДНК
Бисульфитное модифицирование проводили согласно инструкции к набору для метилирования EZ ДНК (D5002) в биотехнологической компании ZYMO RESEARCH.
3. Амплификация и обнаружение
(100 мкМ)
(25 мМ)
(5 единиц/мкл)
Система амплификации: системы амплификации различных генов обнаружения показаны в Таблице 2 и в Таблице 3.
4. Результаты обнаружения
Информация об образце: всего имеется 169 образцов легочной ткани, включая 91 образцов нормальной ткани и 78 образцов раковой ткани; 78 образцов раковой ткани включают в себя 27 образцов плоскоклеточной карциномы, 38 образцов аденоматозной карциномы, 3 образцов мелкоклеточного рака, 4 образцов крупноклеточного рака, 1 образец сложного рака и 5 образцов рака легких, которые четко не классифицированы. Имеются 77 пар раковых и смежные с раком контрольные образцы.
В качестве референсного гена служит ACTB (β-актин); уровни метилирования проб определяли согласно значению ΔCp генов-мишеней, т.е., HOXB4 и SRCIN1 (значение ΔCp = Cpген-мишень - CpACTB); а пороговые величины HOXB4 и SRCIN1 соответственно являются следующими: значение ΔCp = 5,4, а значение ΔCp = 6,5. Когда результаты по одному объекту при обнаружении меньше вышеуказанного порогового значения, пробы можно идентифицировать как положительные; а если результаты по двум объектам при обнаружении больше или равны соответствующим пороговым величинам, пробы можно идентифицировать как отрицательные.
Порог для PCDHGA12 представляет собой значение Cp = 25,9, а порог для HOXD8 представляет собой значение Cp = 27,4. Когда результат обнаружения для каждого маркера больше или равен соответствующему порогу, пробы можно идентифицировать как отрицательные; а когда результат обнаружения для каждого маркера меньше, чем соответствующий порог, пробы можно идентифицировать как положительные.
ROC-кривые для комбинации HOXB4 и SRCIN1, комбинации HOXB4 и PCDHGA12 и комбинации HOXB4 и HOXD8 для тестирования всех образцов ткани показаны на Фиг. 1. Статистические результаты каждого гена, протестированного в ткани, показаны в Таблице 3.
Из вышеприведенных результатов видно, что при сопоставлении нормальных групп и всех раковых групп, обнаружение комбинации HOXB4 и SRCIN1 в образцах ткани имеет специфичность 97,8% и чувствительность 89,7%; а по сравнению с обнаружением двух других комбинаций, обнаружение комбинации HOXB4 и SRCIN1 имеет более высокую чувствительность в случае постоянной специфичности. В дополнение, по сравнению с раздельным обнаружением HOXB4 и SRCIN1, не очевидно, что обнаружение комбинации HOXB4 и SRCIN1 значительно повышает чувствительность.
Согласно вышеприведенным результатам, HOXB4 и SRCIN1 по-прежнему обладают более высокой чувствительностью в образцах ткани при высокой специфичности. В частности, при комбинированном обнаружении чувствительность сильно повышается при условии, что специфичность в основном не затрагивается. Мокрота, служащая в качестве неинвазивного образца для обнаружения, имеет важное значение в диагностике рака легких. Поэтому автор изобретения выявил в мокроте 2 маркера, а именно, HOXB4 и SRCIN1.
Пример 2: Обнаружение генов HOXB4 и SRCIN1 в мокроте
Информация об образце: всего имеется 107 протестированных образцов мокроты, включая 51 образец нормальной контрольной группы и 56 образцов раковой группы. 56 образцов раковой группы включают в себя 20 образцов плоскоклеточной карциномы, 8 образцов мелкоклеточного рака, 20 образцов аденоматозной карциномы, 1 образец крупноклеточного рака, 1 образец гигантоклеточного рака и 6 образцов рака легких, которые четко не классифицированы.
Методики исследования:
a) собирали пробы мокроты пациентов с диагностированным раком легких и пациентов, не страдающих раком легких; пробы разбавляли NaOH и центробежно осаждали для выделения клеток; пробы дважды промывали в ПБС; а затем ДНК извлекали с использованием набора для извлечения ДНК (Набор D3126-03 для ДНК от HiPure FFPE) компании Magen.
b) ДНК подвергали бисульфитному модифицированию с использованием набора для трансформации ДНК (Набор EZ для метилирования ДНК, D5002) биотехнологической компании ZYMO RESEARCH.
c) Праймер и зонд последовательности, система приготовления раствора и система амплификации для каждого генного маркера такие же, как и в Примере 1.
d) уровни метилирования проб определяли по значениям Cp генов-мишеней, а именно, HOXB4 и SRCIN1; а пороговые значения Cp HOXB4 и SRCIN1 составляют соответственно 36,9 и 37,0. Когда результаты для одного объекта при обнаружении одного гена меньше вышеуказанного порога, пробы можно идентифицировать как положительные; а если результаты для двух объектов при обнаружении больше или равны соответствующим пороговым величинам, пробы можно идентифицировать как отрицательные.
PCDHGA12 и HOXD8: порог для PCDHGA12 представляет собой значение Cp = 23,48; порог для HOXD8 представляет собой значение Cp = 26,4; когда результат обнаружения для каждого маркера больше или равен соответствующему порогу, пробы можно идентифицировать как отрицательные; и когда результат обнаружения для каждого маркера меньше, чем соответствующий порог, пробы можно идентифицировать как положительные.
e) результаты обнаружения получали следующим образом:
ROC-кривые HOXB4 и SRCIN1 для тестирования пробы мокроты показаны на Фиг. 2, а статистические результаты показаны в Таблице 4. Из вышеприведенных результатов видно, что при сопоставлении нормальных групп и всех раковых групп, в ходе обнаружения комбинации HOXB4 и SRCIN1 в образцах мокроты, чувствительность к раку легких повышается до 76,8%; а при сопоставлении нормальных групп и всех групп с мелкоклеточным раком чувствительность может составлять до 100%. Что касается одиночного генного маркера, частота обнаружения HOXB4 составляет 64,3%, а частота обнаружения SRCIN1 составляет 48,2%. В ходе комбинированного обнаружения двух генов чувствительность к раку легких повышается до 76,8%; а два гена обладают синергическим эффектом.
Пример 3: Оптимизация систем мультиплексной ПЦР для генов HOXB4 и SRCIN1
Вышеприведенные результаты показывают, что комбинированное обнаружение генов HOXB4 и SRCIN1 может существенно повысить частоту обнаружения рака легких. Система ПЦР оптимизирована автором изобретения в режиме нескольких ПЦР, с упрощением, таким образом, процедур обнаружения и проведением проверки данных, исходя из образцов, представленных в Примере 2. Обнаружение праймеров и зондов различных генов происходит следующим образом:
Последовательности обнаружения праймеров и зондов HOXB4, SRCIN1 и β-актина такие же, как и в Примере 1.
a) обработка образца мокроты такая же, как и в Примере 2.
b) система приготовления раствора представлена следующим образом:
c) система амплификации такая же, как и система амплификации, представленная в Таблице 2 для Примера 1.
d) уровни метилирования проб определяли по значениям Cp нескольких ПЦР для генов-мишеней, а именно, HOXB4 и SRCIN1; а пороговое значение Cp нескольких ПЦР-обнаружений для HOXB4 и SRCIN1 составляет 36,7. Когда результаты для одного объекта при обнаружении одного гена меньше вышеуказанного порога, пробы можно идентифицировать как положительные; а если результаты обнаружения больше или равны порогу, пробы можно идентифицировать как отрицательные.
e) результаты обнаружения показаны в Таблице 6:
Результаты показывают, что результаты обнаружения для системы из нескольких ПЦР для HOXB4 и SRCIN1 в основном согласуются с результатами обнаружения, представленными в Примере 2. Таким образом, это указывает на то, что результаты обнаружения для системы из нескольких ПЦР могут служить в качестве определенных результатов комбинации генов HOXB4 и SRCIN1 для выявления рака легких.
Пример 4: Обнаружение генов HOXB4 и SRCIN1 в смывной жидкости
Информация об образце: всего было протестировано 387 образцов смывной жидкости альвеол легких, причем образцы включают в себя 303 образцов нормальной контрольной группы и 84 образцов раковой группы. 84 образца раковой группы включают в себя 21 образец плоскоклеточной карциномы, 40 образцов аденоматозной карциномы, 10 образцов мелкоклеточного рака и 13 образцов рака легких, которые четко не классифицированы.
Последовательности обнаружения праймеров и зондов HOXB4, SRCIN1 и β-актина такие же, как и в Примере 1.
Методики исследований:
a) собирали смывную жидкость альвеол легких пробы пациентов с диагностированным раком легких и пациентов, не страдающих раком легких; пробы подвергали центрифугированию для выделения клеток, а затем ДНК извлекали с использованием набора для извлечения ДНК (набор D3126-03 для ДНК от HiPure FFPE) компании Magen.
b) ДНК подвергали бисульфитному модифицированию с использованием набора для трансформации ДНК (набор EZ для метилирования ДНК, D5002) биотехнологической компании ZYMO RESEARCH.
c) система приготовления раствора и система амплификации такие же, как и в Примере 3.
d) Результаты обнаружения следующие:
В качестве референсного гена служит ACTB; уровни метилирования проб определяют по значению Cp и значению ΔCp генов-мишеней, т.е., HOXB4 и SRCIN1 (значение ΔCp = Cpген-мишень - CpACTB); а пороговые величины HOXB4 и SRCIN1 следующие: значение Cp = 37,2, а значение ΔCp = 9. Когда результаты для одного объекта при обнаружении меньше вышеуказанного порога, пробы можно идентифицировать как положительные; а если результаты для двух объектов при обнаружении больше или равны пороговым величинам, пробы можно идентифицировать как отрицательные. Результаты обнаружения для 387 образцов смывной жидкости альвеол легких следующие:
Кривая амплификации комбинации HOXB4 и SRCIN1 для тестирования всех проб смывной жидкости показана на Фиг. 3, а статистические результаты показаны в Таблице 7. Из вышеприведенных результатов видно, что обнаружение комбинации HOXB4 и SRCIN1 достигает чувствительности 77,4% при высокой специфичности 96,0%; и при сравнительном анализе по подтипам рака легких в группе плоскоклеточной карциномы частота обнаружения комбинации HOXB4 и SRCIN1 составляет до 71,4%. В частности, для эффекта обнаружения аденоматозной карциномы, чувствительность обнаружения комбинации HOXB4 и SRCIN1 составляет до 75,0%. Этот прорыв имеет значение при обнаружении аденоматозной карциномы. Поскольку аденоматозная карцинома, как правило, является периферической, из-за древовидной физиологической структуры бронхов, смывную жидкость альвеол легких сложно привести в контакт с альвеолами легких или с раковыми тканями глубоко в легком.
Пример 5: Результаты обнаружения различных комбинаций маркеров в образцах мокроты
Автор изобретения одновременно сопоставляет условия обнаружения различных комбинаций маркеров в образцах мокроты. Сопоставляемые группы следующие:
Группа 1: HOXB4+SRCIN1
Группа 2: HOXB4+PCDHGA12
Группа 3: SRCIN1+PCDHGA12
Группа 4: HOXB4+HOXD8
Группа 5: SRCIN1+HOXD8
Группа 6: SRCIN1+PCDHGA12+HOXD8
Группа 7: SRCIN1+HOXB4+HOXD8
Конкретные экспериментальные условия и операции такие же, как и в Примере 2.
Различные комбинации маркеров выявляли в 107 образцах мокроты. Образцы мокроты включают в себя 51 образец нормальной контрольной группы и 56 образцов раковой группы. Результаты обнаружения каждой группы показаны в Таблице 8.
Результаты, представленные в Таблице 8, показывают, что различные комбинации маркеров оказывают значительные влияния на частоту обнаружения рака легких образцов мокроты. Аналитические результаты Комбинации 1, Комбинации 2, Комбинации 3, Комбинации 4 и Комбинации 5 показывают, что результаты обнаружения комбинаций каждых двух различных маркеров имеют большие различия; в Комбинации 1, обнаружение комбинации HOXB4 и SRCIN1 имеет специфичность 92,2% и чувствительность 76,8%; а всеобъемлющая эффективность обнаружения комбинации 1 намного более высокая, чем эффективность любой из четырех остальных комбинаций. При анализе Комбинации 3, Комбинации 5, и Комбинации 6, или Комбинации 1 и Комбинации 7, результаты показывают, что при дополнительном повышении количества маркера, частота обнаружения необязательно повышается, а напротив, специфичность, возможно, снижается. Результаты показывают, что не любая генная комбинация маркеров может достигать всеобъемлюще превосходных эффектов по трем показателям, таким как чувствительность, специфичность и AUC, точно так же, как и Комбинация 1 в настоящем раскрытии. Не является очевидным, что специфичность и чувствительность не повышаются соответствующим образом при повышении количества маркеров генов-мишеней для проведения комбинированного обнаружения (например, Комбинации 6 и Комбинации 7).
Пример 6: Выбор комбинаций праймера и зонда
Праймеры и зонды оказывают значительные влияния на эффекты обнаружения онкомаркеров. Автор изобретения сконструировал несколько пар праймеров и их соответствующих зондов в ходе исследования по поиску праймеров и зондов, которые могут, насколько возможно, повышать чувствительность и специфичность обнаружения. Таким образом, реагент для обнаружения в настоящем изобретении может быть в настоящее время применен для клинического обнаружения.
Различные комбинации праймеров и зондов выявлены в 40 образцах мокроты. Образцы мокроты включают в себя 15 образцов нормальной контрольной группы и 25 контрольных образцов раковой группы.
Различные системы приготовления раствора согласуются между собой; согласованы между собой также системы приготовления раствора и различные процедуры амплификации, причем процедуры амплификации такие же, как и в Примере 2.
Результаты обнаружения показаны в Таблице 10 и Таблице 11.
Результаты показывают, что различные пары праймеров в одной и той же области будут влиять на результаты обнаружения. В случае постоянной специфичности комбинации праймеров и зондов для HOXB-F1, HOXB-R1, HOXB-P1, SRCIN1-F1, SRCIN1-R1 и SRCIN1-P1 обладают более высокой чувствительностью.
Изобретение относится к области молекулярной биологии. Описан набор для обнаружения метилирования генов, содержащий реагент для обнаружения метилирования генов HOXB4 и реагент для обнаружения метилирования генов SRCIN1. Указанные реагенты содержат разработанные праймеры и зонды. Также описано применение указанного набора для обнаружения рака легких у пациента. Технический результат заключается в обеспечении возможности ранней диагностики рака легких за счёт применения комбинации маркеров HOXB4 и SRCIN1. 2 н. и 10 з.п. ф-лы, 3 ил., 11 табл., 6 пр.
1. Набор для обнаружения метилирования генов, содержащий:
реагент для обнаружения метилирования генов HOXB4 и реагент для обнаружения метилирования генов SRCIN1, где
реагент для обнаружения метилирования генов HOXB4 содержит:
первую пару праймеров, содержащую:
первый прямой праймер, содержащий нуклеотидную последовательность, имеющую идентичность 100% с любыми из нуклеотидных последовательностей, показанных в SEQ ID NO:1, SEQ ID NO:16 или SEQ ID NO:19; и
первый обратный праймер, содержащий нуклеотидную последовательность, имеющую идентичность 100% с любыми из нуклеотидных последовательностей, показанных в SEQ ID NO:2, SEQ ID NO:17 или SEQ ID NO:20; и
первый зонд, содержащий нуклеотидную последовательность, имеющую идентичность 100% с любыми из нуклеотидных последовательностей, показанных в SEQ ID NO:3, SEQ ID NO:18 или SEQ ID NO:21, или с последовательностями, комплементарными им; а
реагент для обнаружения метилирования генов SRCIN1 содержит:
вторую пару праймеров, содержащую:
второй прямой праймер, содержащий нуклеотидную последовательность, имеющую идентичность 100% с любыми из нуклеотидных последовательностей, показанных в SEQ ID NO:4 или SEQ ID NO:22; и
второй обратный праймер, содержащий нуклеотидную последовательность, имеющую идентичность 100% с нуклеотидной последовательностью, показанной в SEQ ID NO:5;
и
второй зонд для обнаружения метилирования гена SRCIN1,
содержащий нуклеотидную последовательность, имеющую идентичность 100% с нуклеотидной последовательностью, показанной как SEQ ID №6, или с последовательностью, комплементарной ей.
2. Набор по п. 1, в котором:
нуклеотидная последовательность первого прямого праймера показана в SEQ ID NO: 1, а нуклеотидная последовательность первого обратного праймера показана в SEQ ID NO: 2; или
нуклеотидная последовательность первого прямого праймера показана в SEQ ID NO: 16, а нуклеотидная последовательность первого обратного праймера показана в SEQ ID NO: 17; или
нуклеотидная последовательность первого прямого праймера показана в SEQ ID NO: 19, а нуклеотидная последовательность первого обратного праймера показана в SEQ ID NO: 20.
3. Набор по п. 1, в котором нуклеотидная последовательность первого зонда показана в SEQ ID NO: 3, SEQ ID NO: 18, SEQ ID NO: 21, или последовательности комплементарной им.
4. Набор по п. 1, в котором:
нуклеотидная последовательность второго прямого праймера показана в SEQ ID NO: 4, а нуклеотидная последовательность второго обратного праймера показана в SEQ ID NO: 5; или
нуклеотидная последовательность второго прямого праймера показана в SEQ ID NO: 22, а нуклеотидная последовательность второго обратного праймера показана в SEQ ID NO: 5.
5. Набор по п. 1, в котором нуклеотидная последовательность второго зонда показана в SEQ ID NO: 6 или последовательности комплементарной ей.
6. Применение набора по любому из пп. 1-5 для обнаружения рака легких у пациента.
7. Применение по п. 6, в котором рак легких представляет собой мелкоклеточный рак легких или немелкоклеточный рак легких.
8. Применение по п. 6, в котором рак легких представляет собой плоскоклеточную карциному или аденоматозную карциному.
9. Применение по п. 6, в котором обнаружение включает в себя:
выявление уровней метилирования генов HOXB4 и SRCIN1 в образце, полученном у пациента;
сопоставление уровней метилирования генов HOXB4 и SRCIN1 образца и нормального контрольного образца; и
обнаружение рака легких на основании отклонения уровней метилирования образца от нормального контрольного образца.
10. Применение по п. 9, в котором уровни метилирования генов HOXB4 и SRCIN1 выявляют путем использования количественной ПЦР, специфичной для метилирования (кМСП).
11. Применение по п. 9, в котором образец представляет по меньшей мере один образец, выбранный из смывной жидкости альвеол легких, тканей, мокроты.
12. Применение по п. 9, в котором образец представляет собой смывную жидкость альвеол легких или мокроту.
| Li L | |||
| et al | |||
| Diagnosis of pulmonary nodules by DNA methylation analysis in bronchoalveolar lavage fluids //Clinical Epigenetics | |||
| Способ регенерирования сульфо-кислот, употребленных при гидролизе жиров | 1924 |
|
SU2021A1 |
| - Т | |||
| Насос | 1917 |
|
SU13A1 |
| - No | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| - С | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Новикова С | |||
| Е | |||
| и др | |||
| Омиксные технологии для диагностики аденокарциномы лёгкого //Биомедицинская химия | |||
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| - Т | |||
| Способ приготовления сернистого красителя защитного цвета | 1915 |
|
SU63A1 |
| - No | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| - С | |||
| Водяные лыжи | 1919 |
|
SU181A1 |
| RU 2733754 C2, 06.10.2020. | |||
Авторы
Даты
2024-08-07—Публикация
2020-09-29—Подача