УРОВЕНЬ ТЕХНИКИ
Область техники
Настоящее изобретение относится к технической области моноклональных антител и относится к моноклональному антителу к активированному белку C (aPC) человека и его применению.
Описание уровня техники
Метаболические пути белка C (PC) играют решающую роль в регуляции свертывания крови и воспаления. Тромбин образует комплекс с тромбомодулином (ТМ) на сосудистых эндотелиальных клетках, тем самым активируя белок C. Активированный белок C (aPC) расщепляет активированный фактор V и фактор VIII, тем самым отрицательно регулируя образование тромбина и поддерживая баланс между тромбозом и гемостазом in vivo. aPC защищает животных от воздействия эндотоксина (LPS) или Escherichia coli. Рекомбинантные человеческие продукты aPC были одобрены FDA (Управление по контролю за качеством пищевых продуктов и медикаментов) в качестве первого препарата для лечения тяжелого сепсиса. В настоящее время молекулярные механизмы aPC, касающиеся противовоспалительного и цитопротекторного эффектов еще недостаточно изучены. Исследования мутаций показали, что антикоагулянтная активность aPC, очевидно, не является необходимой для антиапоптотического действия aPC на эндотелиальные клетки. Сосудистые эндотелиальные рецепторы белка C (EPCR) в основном экспрессируются на эндотелии крупных сосудов и способствуют активации белка C через комплекс тромбин-TM. Недавно было продемонстрировано, что aPC, связанный с EPCR, может расщеплять PAR-1 на эндотелиальных клетках. Кроме того, это исследование показывает, что все противовоспалительные и антиапоптотические эффекты передачи сигналов aPC опосредуются PAR-1 в эндотелиальных клетках. Однако при воздействии летальной дозы LPS (липосахарид) фенотип мышей с дефицитом PAR-1 был аналогичен фенотипу контрольных мышей дикого типа, что указывало на то, что PAR-1 может быть не единственным участником регуляции воспаления и апоптоза посредством передачи сигналов aPC.
Ввиду ключевой роли aPC в регуляции патофизиологических функций in vivo было получено моноклональное антитело HAPC1573. Это антитело специфически распознает активированную форму человеческого белка C (aPC), а не белка C (Xu, US8153766B2, US9127072B2). Это антитело изменяет амидолитическую активность aPC на хромогенных пептидных субстратах и блокирует антикоагулянтную активность aPC в плазме. Что еще более важно, это антитело не влияет на расщепление внеклеточных гистонов H3 и H4 aPC, а также на цитопротекторную активность aPC на индуцированной тромбином проницаемости эндотелиальных клеток. MAPC1591 представляет собой моноклональное антитело к aPC мыши, обладающее функциями, аналогичными HAPC1573. MAPC1591 может блокировать антикоагулянтную активность aPC у мышей и поддерживать цитопротекторную активность aPC, и, таким образом, защищать людей с гемофилией A от травматического кровоизлияния. Это указывает на то, что антитело к aPC можно применять при клинических состояниях, таких как гемофилия, травма и сепсис.
Zhao et al. сообщили о последовательностях CDR HAPC1573 и гуманизированного HAPC1573 только в отношении антикоагулянтной активности, но не других активностей aPC. Эти последовательности CDR продемонстрировали in vivo защитный эффект против кровотечения в модели острой приобретенной гемофилии A у обезьян (Zhao, US9657111B2, WO2017/087391A1, Nat. Communications 2020). Рентгеновская кристаллическая структура комплекса aPC и гуманизированного HAPC1573 Fab указывает на то, что HAPC1573 может не связываться с активным сайтом aPC, но связываться с петлей автолиза aPC, содержащей известный сайт связывания aPC-FVa. Следовательно, гуманизированный HAPC1573 может ингибировать антикоагулянтное действие aPC, препятствуя взаимодействию между aPC и FVa. Ингибирующее действие гуманизированного HAPC1573 ограничивается только антикоагулянтной активностью aPC, и не влияет на его цитопротекторные, противовоспалительные и клеточные сигнальные функции. Сообщается, что концентрация aPC в плазме крови человека составляет около 40 пМ, и согласно анализу на основе поверхностного плазмонного резонанса аффинность гуманизированного HAPC1573 к aPC составляет 10 нМ. Зависимое от концентрации действие HAPC1573 на укорочение пролонгированного АЧТВ (активированное частичное тромбопластиновое время) в плазме с дефицитом FVIII человека и в плазме с дефицитом FIX человека было продемонстрировано в анализе коагулирующей активности АЧТВ, зависящей от Protac. Даже при концентрации 50 мкг/мл HAPC1573 все еще не мог достичь максимального ингибирующего эффекта на антикоагулянтную активность aPC в этом эксперименте in vitro. Это наблюдение согласуется с наблюдением in vivo гуманизированного HAPC1573 на обезьяньей модели острой приобретенной гемофилии. В исследованиях на животных было обнаружено, что только HAPC1573 в высоких дозах 10 мг/кг и 30 мг/кг может обеспечить значимый защитный эффект. Однако такие высокие дозы не подходят для клинического применения, поэтому гуманизированный HAPC 1573 с более высокой аффинностью является предпосылкой и гарантией потенциального использования aPC в лечении в будущем.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном аспекте настоящего изобретения предлагается моноклональное антитело к aPC. Моноклональное антитело к aPC включает исходное антитело и мутантное антитело, полученное путем мутации одного или более из следующих 6 сайтов мутации в исходном антителе.
Исходное антитело включает:
(a) CDR (область, определяющую комплементарность) тяжелой цепи, представленную любой одной или более из SEQ ID NO: 27, 28 и 29; и/или
(b) CDR легкой цепи, представленную любой одной или более из SEQ ID NO: 30, 31 и 32.
6 мутантных сайтов представляют собой:
1) N57R/W, расположенный в VL CDR2;
2) E59G/P, расположенный в VL CDR2;
3) Q93V, расположенный в VL CDR3;
4) N31F, расположенный в VH CDR1;
5) S55K, расположенный в VH CDR2; и
6) Y104T, расположенный в VH CDR3.
В настоящем описании константная область моноклонального антитела к aPC включает одну или более последовательностей IgG1, IgG2, IgG3 и IgG4 человека.
Предпочтительно, в настоящем описании сайты мутаций моноклонального антитела к aPC, где исходное антитело является мутированным, включают по меньшей мере: N31F, расположенный в VH CDR1; S55K, расположенный в VH CDR2; N57R, расположенный в VL CDR2; и E59G, расположенный в VL CDR2.
Предпочтительно, в настоящем описании сайты мутации моноклонального антитела к aPC, где исходное антитело является мутированным, включают по меньшей мере: N57R, расположенный в VL CDR2; E59G, расположенный в VL CDR2; Q93V, расположенный в VL CDR3; N31F, расположенный в VH CDR1; и S55K, расположенный в VH CDR2.
Другой аспект настоящего изобретения относится к биологическому материалу, относящемуся к моноклональному антителу к aPC, который представляет собой любое одно или более из 1) - 10):
1) молекулу нуклеиновой кислоты, кодирующую моноклональное антитело к aPC, как описано выше;
2) экспрессионную кассету, содержащую молекулу нуклеиновой кислоты, как описано в 1);
3) конструкцию, содержащую молекулу нуклеиновой кислоты, как описано в 1);
4) конструкцию, содержащую экспрессионную кассету, как описано в 2);
5) систему экспрессии, содержащую молекулу нуклеиновой кислоты, как описано в 1);
6) систему экспрессии, содержащую кассету экспрессии, как описано в 2);
7) систему экспрессии, содержащую конструкцию, как описано в 3);
8) систему экспрессии, содержащую рекомбинантный вектор, как описано в 4);
9) пару праймеров для амплификации молекулы нуклеиновой кислоты, кодирующей аминокислотную последовательность моноклонального антитела к aPC, как описано выше; и
10) слитое антитело, содержащее моноклональное антитело к aPC, как описано выше.
Другой аспект настоящего изобретения относится к препарату. Препарат представляет собой фармацевтическую композицию или набор для детектирования. Препарат включает моноклональное антитело к aPC, как описано выше, или любой один или более родственных биологических материалов. В случае фармацевтической композиции продукт приготовления дополнительно включает фармацевтически приемлемый носитель.
Другой аспект настоящего изобретения относится к способу лечения расстройств, связанных со свертыванием, который включает введение индивидууму, нуждающемуся в лечении, эффективного количества моноклонального антитела к aPC или связанного с ним биологического материала, как описано выше. Индивид страдает от расстройств, связанных с нарушением или дефектом свертывания, или индивид нуждается в лечении свертывания крови, или индивид страдает от сепсиса или гемофилии, или индивид нуждается в регуляции гемостаза.
Другой аспект настоящего изобретения относится к применению моноклонального антитела к aPC или связанного с ним биологического материала при получении лекарственного средства для предотвращения и/или лечения расстройств, связанных с недостаточностью или дефектом свертывания. Расстройства, связанные с недостаточностью или дефектом свертывания включают нарушения, вызывающие коагулопатию из-за дефицита факторов свертывания крови и, таким образом, приводящие к кровотечению, и нарушения свертывания крови, вызванные травмой или хирургическим вмешательством. Кроме того, расстройства, связанные с недостаточностью или дефектом свертывания включают гемофилию, сепсис, травматическое кровотечение и тому подобное.
Другой аспект настоящего изобретения относится к применению моноклонального антитела к aPC или связанного с ним биологического материала для получения промотора для содействия способности aPC расщеплять гистоны H3 и H4, или для получения лекарственного средства для ингибирования антикоагулянтной активности активированного белка C у индивидуума, или для получения лекарственного средства для предупреждения и/или лечения у индивидуума, нуждающегося в свертывании крови, или для получения лекарственного средства для предупреждения и/или лечения у индивидуума, страдающего сепсисом, или для получения лекарственного средства для предупреждения и/или лечения у индивидуума, страдающего гемофилией, или для получения лекарственного средства для регулирования гемостаза у индивидуума, или для иммунологических анализов в целях диагностики и лечения заболеваний или не связанных с заболеванием, или для получения реагента или набора для детектирования aPC, или в комбинации с другими реагентами или лекарственными средствами.
Другой аспект настоящего изобретения относится к способу получения моноклонального антитела к aPC, как описано выше. Способ включает культивирование системы экспрессии моноклонального антитела к aPC в условиях, подходящих для экспрессии моноклонального антитела к aPC, для экспрессии моноклонального антитела к aPC.
Настоящее изобретение имеет следующие полезные эффекты: моноклональное антитело к aPC, представленное в настоящем изобретении, представляет собой гуманизированное антитело, полученное путем гуманизации HAPC 1573 или путем выполнения скрининга мутаций на одном сайте и комбинации сайтов одновременно. Моноклональное антитело к aPC селективно связывается и ингибирует активированный белок C, но не связывается и не ингибирует неактивированный белок C. Моноклональное антитело к aPC селективно связывается с активированным белком C человека, но не связывается с активированным белком C других видов или неактивированным белком C. Аффинность антитела значительно увеличена, и аффинность некоторых антител в 100 раз выше, по сравнению с HAPC 1573. В анализе Protac-зависимой коагуляции АЧТВ очень небольшое количество антитела, например 1 мкг/мл, используется в настоящем описании и может достичь максимального ингибирующего эффекта в отношении антикоагулянтной активности aPC. Антитело потенциально может блокировать антикоагулянтную активность aPC и имеет широкие перспективы применения при лечении расстройств, связанных с недостаточностью или дефектом свертывания.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фиг. 1A-1D показана способность связывания гуманизированных моноклональных антител к aPC (Humab001-1 - Humab001-28 или HAPC-1 - HAPC-28) с aPC человека.
На фиг. 2A-2B показана способность связывания гуманизированных моноклональных антител к aPC (Humab001-13 - Humab001-20 или HAPC-13 - HAPC-20) с PC человека; на фиг 2C показана способность связывания 30120-mAb001 с aPC человека.
На фиг. 3A-3D показана способность связывания мутантных антител HAPC-14 (HAPC14-1 - HAPC14-10 или HAPC-14-1 - HAPC-14-10) с hAPC/hPC; где абсциссы на фиг. 3A-3D представляют собой соответственно 10-6 нМ, 10-4 нМ, 10-2 нМ, 100 нМ, 102 нМ и 104 нМ.
На фиг. 4A-4K показаны анализы аффинности HAPC-14 и его мутантных антител (HAPC14-1 - HAPC14-10 или HAPC-14-1 - HAPC-14-10).
На фиг. 5 показано влияние мутантного антитела HAPC-14-6 на способность aPC расщеплять гистоны.
На фиг. 6 показаны фармакодинамические эксперименты in vitro. Влияние мутантных антител HAPC-14, HAPC-14-3 и HAPC-14-6, на ингибирование антикоагулянтной активности aPC в плазме с дефицитом фактора свертывания: A: для плазмы с дефицитом фактора свертывания FVIII, B: для плазмы с дефицитом фактора свертывания FIX, C: для плазмы с дефицитом фактора свертывания FXI, D: для плазмы с дефицитом фактора свертывания FVII, E: для плазмы с дефицитом фактора свертывания FXII, F: для плазмы с дефицитом фактора свертывания FV, G: для плазмы с дефицитом фактора свертывания FX, H: для плазмы с дефицитом VWF.
На фиг. 7 показаны фармакодинамические эксперименты in vivo. A: эффекты инъекции фактора свертывания крови FVIII, HAPC1573 и HAPC-14-6 мышам с дефицитом фактора свертывания крови FVIII на функцию свертывания крови у указанных мышей с недостаточностью свертывания; B: эффекты инъекции различных доз HAPC-14-6 мышам с дефицитом фактора свертывания крови FVIII на функцию свертывания крови у указанных мышей с недостаточностью свертывания; C: эффекты инъекции HAPC1573 и различных доз HAPC-14-6 мышам с дефицитом фактора свертывания крови FIX на функцию свертывания крови у указанных мышей с недостаточностью свертывания.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В настоящем описании HAPC 1573 гуманизируют, а затем оптимизируют в отношении аффинности, и оптимизированные сайты мутаций подвергают скринингу на основе Fab для окончательного получения 6 оптимальных сайтов. Кроме того, за счет комбинации мутаций аффинность полученных оптимизированных мутантов в 100 раз выше, чем у HAPC 1573, и в анализе Protac-зависимой коагуляции АЧТВ мутантное антитело в количестве 1 мкг/мл может достичь максимального ингибирующего эффекта на антикоагулянтную активность aPC и, таким образом, иметь возможность дальнейшего клинического применения.
В настоящем описании предложено антитело к aPC, а именно моноклональное антитело 14 (HAPC-14) к aPC. Антитело включает:
(a) тяжелую цепь, содержащую CDR тяжелой цепи, представленную любой одной или более из SEQ ID NO: 27, 28 и 29; и/или
(b) легкую цепь, содержащую CDR легкой цепи, представленную любой одной или более из SEQ ID NO: 30, 31 и 32.
Моноклональное антитело 14 к aPC (HAPC-14), представленное в настоящем описании, имеет последовательность тяжелой цепи, показанную в SEQ ID NO: 5, и последовательность легкой цепи, показанную в SEQ ID NO: 6.
Настоящее изобретение дополнительно относится к мутантному антителу моноклонального антитела (моноклональное антитело 14 к aPC) к активированному белку C (aPC) человека. После конструирования, скрининга и статистической оценки мутантного антитела на основе последовательности моноклонального антитела 14 к aPC было обнаружено, что мутации в одном или более из следующих шести сайтов значительно влияют на способность связывания фрагмента Fab моноклонального антитела с иммобилизованным антителом, и мутантное антитело обладает высокой аффинностью, высокой функциональной активностью и небольшими отличиями от последовательности зародышевой линии. Шесть сайтов представляют собой:
а) N57R/W, расположенный в VL CDR2 (N57R предпочтительнее N57W);
b) E59G/P, расположенный в VL CDR2 (E59G предпочтительнее E59P);
c) Q93V, расположенный в VL CDR3;
d) N31F, расположенный в VH CDR1;
e) S55K, расположенный в VH CDR2; и
f) Y104T, расположенный в VH CDR3.
Наиболее важными мутантными сайтами являются N57R в легкой цепи и N31F в тяжелой цепи. В некоторых вариантах реализации изобретения концентрация моноклонального антитела к aPC, необходимая для полного ингибирования антикоагулянтной активности aPC и восстановления нормальной функции свертывания крови в мышиной модели гемофилии гуманизированного белка C (haPC), составляет всего 1 мкг/мл.
Для удобства описания комбинации мутаций будут описаны в коротких формах. N57R относится к N57R, расположенному в VL CDR2, N57W относится к N57W, расположенному в VL CDR2, E59G относится к E59G, расположенному в VL CDR2, E59P относится к E59P, расположенному в VL CDR2, Q93V относится к Q93V, расположенному в VL CDR3, N31F относится к N31F, расположенному в VH CDR1, S55K относится к S55K, расположенному в VH CDR2, и Y104T относится к Y104T, расположенному в VH CDR3.
В настоящем описании комбинация мутаций в шести сайтах включает, но не ограничивается ими, (1) только одну мутацию в любом из следующих сайтов: N57R, N57W, E59G, E59P, Q93V, N31F или S55K; или (2) мутации в обоих из следующих сайтов: N57R и N57W; E59G и E59P; Q93V и N31F; N31F и S55K; N57R и E59G; N57R и E59P; N57R и Q93V; N57R и N31F; N57R и S55K; N57W и E59P; N57W и Q93V; N57W и N31F; N57W и S55K; E59G и Q93V; E59G и N31F; E59G и S55K; E59P и N31F; E59P и S55K; или Q93V и S55K; или (3) мутации во всех следующих трех сайтах: N57R, N57W и E59G; N57R, N57W и E59P; N57R, N57W и Q93V; N57R, N57W и N31F; N57R, N57W и S55K; N57R, E59G и E59P; N57R, E59G и Q93V; N57R, E59G и N31F; N57R, E59G и S55K; N57R, E59P и Q93V; N57R, E59P и N31F; N57R, E59P и S55K; N57R, Q93V и N31F; N57R, Q93V и S55K; N57R, N31F и S55K; N57W, E59G и E59P; N57W, E59G и Q93V; N57W, E59G и N31F; N57W, E59G и S55K; N57W, E59P и Q93V; N57W, E59P и N31F; N57W, E59P и S55K; N57W, Q93V и N31F; N57W, Q93V и S55K; N57W, N31F и S55K; E59G, E59P и Q93V; E59G, E59P и N31F; E59G, E59P и S55K; E59G, Q93V и N31F; E59G, Q93V и S55K; E59G, N31F и S55K; E59P, Q93V и N31F; E59P, Q93V и S55K; E59P, N31F и S55K; или Q93V, N31F и S55K; или (4) мутации во всех следующих четырех сайтах: N57R, N57W, E59G и E59P; N57R, N57W, E59G и Q93V; N57R, N57W, E59G и N31F; N57R, N57W, E59G и S55K; N57R, E59G, E59P и Q93V; N57R, E59G, E59P и N31F; N57R, E59G, E59P и S55K; N57R, E59G, Q93V и N31F; N57R, E59G, Q93V и S55K; N57R, E59P, Q93V и N31F; N57R, E59P, Q93V и S55K; N57R, E59P, N31F и S55K; N57R, Q93V, N31F и S55K; N57W, E59G, E59P и Q93V; N57W, E59G, E59P и N31F; N57W, E59G, E59P и S55K; N57W, E59P, Q93V и N31F; N57W, E59P, Q93V и S55K; N57W, E59P, N31F и S55K; N57W, Q93V, N31F и S55K; E59G, E59P, Q93V и N31F; E59G, E59P, Q93V и S55K; E59G, Q93V, N31F и S55K; или E59P, Q93V, N31F и S55K; или (5) мутации во всех следующих пяти сайтах: N57R, N57W, E59G, E59P и Q93V; N57R, N57W, E59G, E59P и N31F; N57R, N57W, E59G, Q93V и N31F; N57R, N57W, E59P, Q93V и N31F; N57R, E59G, E59P, Q93V и N31F; N57W, E59G, E59P, Q93V и N31F; N57R, N57W, E59G, E59P и S55K; N57R, N57W, E59G, Q93V и S55K; N57R, N57W, E59P, Q93V и S55K; N57R, E59G, E59P, Q93V и S55K; N57W, E59G, E59P, Q93V и S55K; N57R, N57W, E59G, N31F и S55K; N57R, N57W, E59P, N31F и S55K; N57R, E59G, E59P, N31F и S55K; N57W, E59G, E59P, N31F и S55K; N57R, N57W, Q93V, N31F и S55K; N57R, E59G, Q93V, N31F и S55K; N57W, E59G, Q93V, N31F и S55K; N57R, E59P, Q93V, N31F и S55K; N57W, E59P, Q93V, N31F и S55K; или E59G, E59P, Q93V, N31F и S55K; или (6) мутации во всех следующих шести сайтах: N57R, N57W, E59G, E59P, Q93V и N31F; N57R, N57W, E59G, E59P, Q93V и S55K; N57R, N57W, E59G, E59P, N31F и S55K; N57R, N57W, E59G, Q93V, N31F и S55K; N57R, N57W, E59P, Q93V, N31F и S55K; N57R, E59G, E59P, Q93V, N31F и S55K; или N57W, E59G, E59P, Q93V, N31F и S55K; или (7) мутации во всех следующих семи сайтах: N57R, N57W, E59G, E59P, Q93V, N31F и S55K.
В конкретном варианте реализации настоящего изобретения предлагается моноклональное антитело к aPC, которое включает:
одну, или две, или три из CDR1 тяжелой цепи, представленной SEQ ID NO: 27 или 33, CDR2 тяжелой цепи, представленной SEQ ID NO: 28 или 40, и CDR3 тяжелой цепи, представленной SEQ ID NO: 29 или 77; и/или
одну, или две, или три из CDR1 легкой цепи, представленной SEQ ID NO: 30, CDR2 легкой цепи, представленной любой из SEQ ID NO: 31, 37, 43, 49 и 73, и CDR3 легкой цепи, представленной SEQ ID NO: 32 или 44.
В конкретном варианте реализации антитело выбрано из следующего:
антитело, содержащее (а) CDR тяжелой цепи, представленные SEQ ID NO: 27, 28 и 29; и/или
(b) CDR легкой цепи, представленные SEQ ID NO: 30, 31 и 32;
антитело, содержащее (c) CDR тяжелой цепи, представленные SEQ ID NO: 33, 34 и 35; и/или
(d) CDR легкой цепи, представленные SEQ ID NO: 36, 37 и 38;
антитело, содержащее (e) CDR тяжелой цепи, представленные SEQ ID NO: 39, 40 и 41; и/или
(f) CDR легкой цепи, представленные SEQ ID NO: 42, 43 и 44;
антитело, содержащее (g) CDR тяжелой цепи, представленные SEQ ID NO: 45, 46 и 47; и/или
(h) CDR легкой цепи, представленные SEQ ID NO: 48, 49 и 50;
антитело, содержащее (i) CDR тяжелой цепи, представленные SEQ ID NO: 51, 52 и 53; и/или
(j) CDR легкой цепи, представленные SEQ ID NO: 54, 55 и 56;
антитело, содержащее (k) CDR тяжелой цепи, представленные SEQ ID NO: 57, 58 и 59; и/или
(l) CDR легкой цепи, представленные SEQ ID NO: 60, 61 и 62;
антитело, содержащее (m) CDR тяжелой цепи, представленные SEQ ID NO: 63, 64 и 65; и/или
(n) CDR легкой цепи, представленные SEQ ID NO: 66, 67 и 68;
антитело, содержащее (o) CDR тяжелой цепи, представленные SEQ ID NO: 69, 70 и 71; и/или
(p) CDR легкой цепи, представленные SEQ ID NO: 72, 73 и 74;
антитело, содержащее (q) CDR тяжелой цепи, представленные SEQ ID NO: 75, 76 и 77; и/или
(r) CDR легкой цепи, представленные SEQ ID NO: 78, 79 и 80;
антитело, содержащее (s) CDR тяжелой цепи, представленные SEQ ID NO: 81, 82 и 83; и/или
(t) CDR легкой цепи, представленные SEQ ID NO: 84, 85 и 86; и
антитело, содержащее (u) CDR тяжелой цепи, представленные SEQ ID NO: 87, 88 и 89; и/или
(v) CDR легкой цепи, представленные SEQ ID NO: 90, 91 и 92.
В настоящем изобретении каркасная область тяжелой цепи моноклонального антитела к aPC может представлять собой любую существующую каркасную область, подходящую для осуществления функций моноклонального антитела к aPC по настоящему изобретению, и может быть человеческого происхождения или мышиного происхождения.
В настоящем изобретении каркасная область легкой цепи моноклонального антитела к aPC может представлять собой любую существующую каркасную область, подходящую для осуществления функций моноклонального антитела к aPC по настоящему изобретению, и может быть человеческого происхождения или мышиного происхождения.
В конкретном варианте реализации изобретения моноклональное антитело к aPC включает:
последовательность тяжелой цепи, как показано в любой из SEQ ID NO: 5, 7, 9, 11, 13, 15, 17, 19, 21, 23 и 25; и/или
последовательность легкой цепи, как показано в любой из SEQ ID NO: 6, 8, 10, 12, 14, 16, 18, 20, 22, 24 и 26.
В конкретном варианте реализации моноклональное антитело к aPC выбрано из следующего:
антитело HaPC14, содержащее последовательность тяжелой цепи, как показано в SEQ ID NO: 5, и последовательность легкой цепи, как показано в SEQ ID NO: 6;
антитело HaPC14-1, содержащее последовательность тяжелой цепи, как показано в SEQ ID NO: 7, и последовательность легкой цепи, как показано в SEQ ID NO: 8;
антитело HaPC14-2, содержащее последовательность тяжелой цепи, как показано в SEQ ID NO: 9, и последовательность легкой цепи, как показано в SEQ ID NO: 10;
антитело HaPC14-3, содержащее последовательность тяжелой цепи, как показано в SEQ ID NO: 11, и последовательность легкой цепи, как показано в SEQ ID NO: 12;
антитело HaPC14-4, содержащее последовательность тяжелой цепи, как показано в SEQ ID NO: 13, и последовательность легкой цепи, как показано в SEQ ID NO: 14;
антитело HaPC14-5, содержащее последовательность тяжелой цепи, как показано в SEQ ID NO: 15, и последовательность легкой цепи, как показано в SEQ ID NO: 16;
антитело HaPC14-6, содержащее последовательность тяжелой цепи, как показано в SEQ ID NO: 17, и последовательность легкой цепи, как показано в SEQ ID NO: 18;
антитело HaPC14-7, содержащее последовательность тяжелой цепи, как показано в SEQ ID NO: 19, и последовательность легкой цепи, как показано в SEQ ID NO: 20;
антитело HaPC14-8, содержащее последовательность тяжелой цепи, как показано в SEQ ID NO: 21, и последовательность легкой цепи, как показано в SEQ ID NO: 22;
антитело HaPC14-9, содержащее последовательность тяжелой цепи, как показано в SEQ ID NO: 23, и последовательность легкой цепи, как показано в SEQ ID NO: 24; и
антитело HaPC14-10, содержащее последовательность тяжелой цепи, как показано в SEQ ID NO: 25, и последовательность легкой цепи, как показано в SEQ ID NO: 26.
В настоящем описании некоторые последовательности имеют одинаковый состав, но разные номера (для подробностей см. конкретные аминокислотные последовательности в перечне последовательностей).
Например, среди последовательностей, представляющих CDR1 тяжелой цепи антитела, последовательности 27 и 87 являются одинаковыми, и последовательности 33, 39, 45, 51, 57, 63, 69, 75 и 81 являются одинаковыми.
Среди последовательностей, представляющих CDR2 тяжелой цепи антитела, последовательности 28, 34, 52 и 70 являются одинаковыми, и последовательности 40, 46, 58, 64, 76, 82 и 88 являются одинаковыми.
Среди последовательностей, представляющих CDR3 тяжелой цепи антитела, последовательности 29, 35, 41, 47, 53, 59, 65 и 71 являются одинаковыми, и последовательности 77, 83 и 89 являются одинаковыми.
Среди последовательностей, представляющих CDR1 легкой цепи антитела, последовательности 30, 36, 42, 48, 54, 60, 66, 72, 78, 84 и 90 являются одинаковыми.
Среди последовательностей, представляющих CDR2 легкой цепи антитела, последовательности 37 и 61 являются одинаковыми, и последовательности 49, 55, 67, 79, 85 и 91 являются одинаковыми.
Среди последовательностей, представляющих CDR3 легкой цепи антитела, последовательности 32, 38, 68, 74 и 86 являются одинаковыми, и последовательности 44, 50, 56, 62, 80 и 92 являются одинаковыми.
В конкретном варианте реализации настоящее изобретение относится к биологическому материалу, относящемуся к моноклональному антителу к aPC, которое представляет собой любое одно или более из 1) - 10) из следующего:
1) молекулу нуклеиновой кислоты, кодирующую моноклональное антитело к aPC, как описано выше;
2) экспрессионную кассету, содержащую молекулу нуклеиновой кислоты, как описано в 1);
3) конструкцию, содержащую молекулу нуклеиновой кислоты, как описано в 1);
4) конструкцию, содержащую экспрессионную кассету, как описано в 2);
5) систему экспрессии, содержащую молекулу нуклеиновой кислоты, как описано в 1);
6) систему экспрессии, содержащую кассету экспрессии, как описано в 2);
7) систему экспрессии, содержащую конструкцию, как описано в 3);
8) систему экспрессии, содержащую рекомбинантный вектор, как описано в 4);
9) пару праймеров для амплификации молекулы нуклеиновой кислоты, кодирующей аминокислотную последовательность моноклонального антитела к aPC, как описано выше; и
10) слитое антитело, содержащее моноклональное антитело к aPC, как описано выше. Система экспрессии может представлять собой клетку или клеточную линию, и клетка или клеточная линия кодирует моноклональное антитело к aPC.
В конкретном варианте реализации настоящего изобретения предлагается препарат. Препарат представляет собой фармацевтическую композицию или реагент для детектирования или набор для детектирования.
В конкретном варианте реализации изобретения фармацевтическая композиция, предложенная в настоящем описании, включает моноклональное антитело к aPC, как описано выше, или любой один или более биологический материал, как описано выше, и фармацевтически приемлемый носитель. Носитель может включать различные вспомогательные вещества и разбавители, которые не являются существенными активными ингредиентами как таковыми и не имеют чрезмерной токсичности после введения. Подходящие носители хорошо известны специалистам в данной области техники. Например, соответствующее содержание фармацевтически приемлемых носителей описано в Remington's Pharmaceutical Sciences (Mack Pub.Co., N.J., 1991).
В конкретном варианте реализации изобретения детектирующий реагент или набор для детектирования, предложенный в настоящем изобретении, включает моноклональное антитело к aPC, как описано выше, или любой один или более биологический материал, как описано выше. Антитело является меченным.
Мечение может быть осуществлено любым существующим способом, таким как мечение хемилюминесценцией, флуорофор, радиоактивное мечение, хромофор или тому подобное.
Реагент или набор для детектирования может дополнительно содержать буферы, разбавители, инструкции по эксплуатации и тому подобное.
Антитело может присутствовать в любой форме, подходящей для его функционирования или активности, например, в форме водной суспензии.
В некоторых вариантах реализации изобретения моноклональное антитело к aPC согласно настоящему изобретению повышает способность aPC расщеплять гистоны H3 и H4, что указывает на то, что моноклональное антитело к aPC может оказывать цитопротекторное действие в отношении цитотоксичности гистонов H3 и H4.
В конкретном варианте реализации настоящее изобретение относится к способу лечения расстройств, связанных с недостаточностью или дефектом свертывания, как определено выше, и, в частности, к способу лечения наследственного и приобретенного недостаточностью свертывания крови или таких нарушений, как гемофилия A и гемофилия B или сепсис. Настоящее изобретение также относится к способу сокращения времени кровотечения путем введения моноклонального антитела к aPC нуждающемуся пациенту (например, травмированному пациенту или пациенту, нуждающемуся в свертывании крови). Настоящее изобретение дополнительно относится к способу ингибирования антикоагулянтной активности активированного белка С у субъекта. Настоящее изобретение дополнительно относится к способу регулирования тромбоза у субъекта. В соответствии со способом согласно настоящему изобретению эффективное количество моноклонального антитела к aPC, описанного выше в настоящем изобретении, вводят индивидууму, нуждающемуся в лечении. Настоящее изобретение также относится к способу получения моноклонального антитела к aPC человека.
В конкретном варианте реализации настоящее изобретение относится к способу лечения расстройств, связанных с недостаточностью или дефектом свертывания, который включает введение эффективного количества моноклонального антитела к aPC или связанного с ним биологического материала, как описано выше, индивидууму, нуждающемуся в лечении.
В конкретном варианте реализации настоящее изобретение относится к способу лечения расстройств, связанных со свертыванием, который включает введение эффективного количества моноклонального антитела к aPC, как описано выше, или любого одного или более биологических материалов, как описано выше, индивидууму, нуждающемуся в лечении. Индивид страдает от расстройств, связанных с недостаточностью или дефектом свертывания, или индивид нуждается в лечении свертывания крови, или индивид страдает от сепсиса или гемофилии, или индивид нуждается в регуляции гемостаза.
Расстройства, связанные с недостаточностью или дефектом свертывания могут быть наследственными или приобретенными, включая нарушения, вызывающие коагулопатию из-за дефицита одного или нескольких факторов свертывания в плазме и, таким образом, вызывающие кровотечение, и, в частности, включающие: гемофилию A, гемофилию B и гемофилию C, которые вызваны дефицитом факторов свертывания VIII, IX и XI соответственно; и редкие дефициты факторов свертывания, которые представляют собой геморрагические заболевания, вызванные отсутствием или аномальной работой одного или нескольких других факторов свертывания (т.е. факторов свертывания I, II, V, V+VIII, VII, X или XIII), например, нарушения свертывания, вызванные травмой, и чрезмерное кровотечение, вызванное лечением сепсиса, трансплантацией, кардиохирургией и косметической хирургией.
В конкретном варианте реализации изобретения, в соответствии со способом стимулирования способности aPC расщеплять гистоны H3 и H4 согласно настоящему изобретению, после введения моноклонального антитела к aPC или связанного с ним биологического материала или фармацевтической композиции, способность aPC расщеплять гистоны H3 и H4 может быть повышена, так что может быть обеспечен цитопротекторный эффект в отношении цитотоксичности гистонов H3 и H4.
В конкретном варианте реализации изобретения, в соответствии со способом ингибирования антикоагулянтной активности активированного белка С у индивидуума согласно настоящему изобретению, введение моноклонального антитела к aPC, или связанного с ним биологического материала, или фармацевтической композиции может ингибировать антикоагулянтную активность активированного белка С у индивидуума, так что функция свертывания индивидуума может регулироваться.
В конкретном варианте реализации настоящего изобретения предлагается применение моноклонального антитела к aPC или связанного с ним биологического материала:
i) при приготовлении лекарственного средства для предотвращения и/или лечения расстройств, связанных с недостаточностью или дефектом свертывания;
ii) при получении промотора для повышения способности aPC расщеплять гистоны H3 и H4;
iii) при получении лекарственного средства для ингибирования антикоагулянтной активности активированного белка С у индивидуума;
iv) при приготовлении лекарственного средства для лечения индивидуума, нуждающегося в свертывании крови;
vi) при приготовлении лекарственного средства для регулирования гемостаза у индивидуума;
vii) в иммунологических анализах для диагностики и лечения заболеваний или диагностики, не связанной с заболеванием, или при приготовлении реагента или набора для детектирования aPC; и
viii) в комбинации с другими реагентами или лекарственными средствами.
В конкретном варианте реализации настоящего изобретения дополнительно предложен способ получения моноклонального антитела к aPC, как описано выше. Способ включает культивирование системы экспрессии моноклонального антитела к aPC в условиях, подходящих для экспрессии моноклонального антитела к aPC, для экспрессии моноклонального антитела к aPC.
В настоящем изобретении полипептид, имеющий определенную идентичность с аминокислотной последовательностью моноклонального антитела к aPC, также находится в пределах объема защиты настоящего изобретения, например, антитело или фрагмент антитела (имеющий 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичности последовательности), на 70%, 75%, 80%, 85%, 90%, 95%, 99% или более идентичные последовательности моноклонального антитела к aPC, и имеющие функции моноклонального антитела к aPC, и, в частности, полипептидный фрагмент, полученный путем замены, делеции или добавления одной или более (в частности, 1-50, 1-30, 1-20, 1-10, 1-5, 1-3, 1, 2 или 3) аминокислот в моноклональном антителе к aPC, или путем добавления одной или более (в частности, 1-50, 1-30, 1-20, 1-10, 1-5, 1-5, 2 или 3 аминокислоты, 3 или 3) аминокислоты к N-концу и/или С-концу моноклонального антитела к aPC, и обладающие функциями моноклонального антитела к aPC.
Термин "белок С" или "PC" относится к любому варианту, изоформе и/или видовому гомологу белка С в форме зимогена, который естественным образом экспрессируется клетками и присутствует в плазме, и отличается от активированной формы белка С.
Термин "активированный белок C" или "aPC" относится к активированной форме белка C.
Термин "моноклональное антитело к aPC" относится к антителу, которое специфически связывается с эпитопом aPC и представляет собой моноклональное антитело к aPC человека. Моноклональное антитело к aPC может находиться в различных формах антител, включая, но не ограничиваясь ими, полное антитело, фрагмент антитела, человеческое антитело, гуманизированное антитело и генетически сконструированное антитело, такое как моноклональное антитело, химерное антитело или рекомбинантное антитело, а также фрагменты этих антител, при условии, что они сохраняют свои свойства в соответствии с настоящим изобретением.
Фрагмент антитела дополнительно определен как Fab', Fab, F(ab')2, однодоменное антитело, Fv или scFv. Моноклональное антитело к aPC, используемое в настоящем документе, относится к препарату молекулы антитела с одним молекулярным компонентом. Компонент моноклонального антитела проявляет единую специфичность связывания и аффинность к конкретному эпитопу и может иметь вариабельные и константные области, полученные из последовательностей иммуноглобулина зародышевой линии человека. Например, фрагмент Fab относится к моновалентному фрагменту, состоящему из доменов VL, VH, CL и CH1; фрагмент F(ab')2 относится к двухвалентному фрагменту, содержащему два фрагмента Fab, связанных дисульфидными мостиками в шарнирной области; и фрагмент Fv относится к фрагменту Fv, состоящему из доменов VL и VH одного плеча антитела.
"Идентичность" может быть оценена невооруженным глазом или с помощью компьютерного программного обеспечения. Используя компьютерное программное обеспечение, идентичность между двумя или более последовательностями может быть выражена в процентах (%), которые могут быть использованы для оценки идентичности между родственными последовательностями.
Термин "индивидуум" обычно включает людей и приматов, не являющихся людьми, таких как млекопитающие, собаки, кошки, лошади, козы, свиньи и крупный рогатый скот, которые могут извлечь выгоду из лечения с использованием антитела, лекарственного средства, композиции, родственного препарата, набора или комбинированного препарата, описанного выше.
Термин "терапевтически эффективное количество" обычно относится к количеству, которое может достичь эффекта лечения заболеваний, перечисленных выше, после соответствующего периода введения.
Термин "моноклональное антитело" относится к получению молекулы антитела одной аминокислотного состава, которое может иметь вариабельные и константные области, полученные из последовательностей иммуноглобулина зародышевой линии человека. В одном варианте реализации изобретения моноклональное антитело получают из гибридомы, включающей В-клетки, которая получена от трансгенного животного, не являющегося человеком, такого как трансгенная мышь, имеющая геном, включающий трансгены тяжелой цепи человека и трансгены легкой цепи человека, слитые с иммортализованными клетками.
Термин "гибридное антитело" относится к продукту, полученному путем слияния фрагмента антитела с другими биологически активными белками с использованием технологии генной инженерии. Это рекомбинантный белок с двумя вышеуказанными доменами, в котором целевой ген связан с генами фрагмента Ig на генном уровне и экспрессируется в эукариотических или прокариотических клетках. Гибридные антитела можно разделить на две категории в соответствии с различными фрагментами Ig, связанными с целевым белком: слитые белки Fab(Fv); и слитые белки Fc. Два разных белка связаны вместе в одну макромолекулу. Линейность может быть реализована химическим способом или путем слияния генов. Способ получения гибридного антитела включает традиционные методы рекомбинантной ДНК и трансфекции генов, хорошо известные в данной области техники. Из-за различных слитых белков этот слитый белок антитела имеет много биологических функций, и экспрессируемый рекомбинантный белок не влияет ни на антигенсвязывающую способность одноцепочечного антитела, ни на биологические характеристики белка, слитого с ним.
Термин "гуманизированное антитело" относится к антителу, в котором каркасная область или "участок, определяющий комплементарность" (CDR) были модифицированы в CDR иммуноглобулина, имеющего другую специфичность по сравнению с исходным иммуноглобулином.
При ссылке на ингибирование и/или блокирование связывания субстрата aPC с aPC термин "ингибирование" и "блокирование" также включает измеримое снижение аффинности связывания aPC с физиологическим субстратом, когда aPC находится в контакте с антителом к aPC, по сравнению с ситуацией, когда aPC не находится в контакте с антителом к aPC, например, блокирование взаимодействия aPC с его субстратами, включая фактор Va или фактор VIIIa, по меньшей мере на около 10%, около 20%, около 30%, около 40%, около 50%, около 60%, около 70%, около 80%, около 90%, около 91%, около 92%, около 93%, около 94%, около 95%, около 96%, около 97%, около 98%, около 99% или около 100%.
"Участок, определяющий комплементарность" или "CDR" относится к одной из трех гипервариабельных областей в вариабельной области тяжелой цепи или вариабельной области легкой цепи молекулы антитела, которая образует N-концевую антигенсвязывающую поверхность, комплементарную трехмерной структуре связанного антигена. Начиная с N-конца тяжелой цепи или легкой цепи, эти определяющие комплементарность области обозначаются как "CDR1", "CDR2" и "CDR3" соответственно. CDR включают связывание антигена с антителом, а CDR3 включает уникальную область, специфичную для связывания антигена с антителом. Следовательно, антигенсвязывающий сайт может включать шесть CDR, которые включают CDR из каждой из вариабельных областей тяжелой цепи и легкой цепи.
Термин "эпитоп" означает диапазон или область антигена, с которым антитело специфически связывается или взаимодействует, и в некоторых вариантах реализации изобретения "эпитоп" указывает, где антиген физически контактирует с антителом.
Термин "консервативная замена" означает полипептидную модификацию, которая включает замену одной или более аминокислот аминокислотами, которые имеют сходные биохимические характеристики, но не вызывают потери биологических или биохимических функций полипептида. "Консервативная аминокислотная замена" означает замену аминокислотного остатка аминокислотным остатком, имеющим аналогичные боковые цепи. Семейства аминокислотных остатков, имеющих схожие боковые цепи, были определены в данной области техники. Общие консервативные замены представляют собой, например, взаимные замены между ароматическими аминокислотами Phe, Trp и Tyr, взаимные замены между гидрофобными аминокислотами Leu, Ile и Val, взаимные замены между полярными аминокислотами Gln и Asn, взаимные замены между основными аминокислотами Lys, Arg и His, взаимные замены между кислотными аминокислотами Asp и Glu и взаимные замены между гидроксильными аминокислотами Ser и Thr.
Термин "идентичность" относится к доле нуклеотидов, являющихся идентичными, когда сравниваются две нуклеиновые кислоты или два полипептида, например, по меньшей мере около 80% нуклеотидов или аминокислот, обычно по меньшей мере около 85%, в некоторых вариантах реализации изобретения около 90%, 91%, 92%, 93%, 94% или 95%, по меньшей мере в одном варианте реализации изобретения по меньшей мере около 96%, 97%, 98%, 99%, 99,1%, 99,2%, 99,3%, 99,4% или 99,5% нуклеотидов или аминокислот являются идентичными.
Указанные нуклеиновые кислоты могут присутствовать в целой клетке, в клеточном лизате, или в частично очищенной или в значительно чистой форме. Нуклеиновые кислоты "выделены" или "сделаны по существу чистыми" при очистке от других клеточных компонентов, которые обычно связаны с нуклеиновыми кислотами в естественной среде. Нуклеиновые кислоты могут быть выделены с использованием методов, хорошо известных в данной области техники, таких как обработка щелочью/SDS (додецилсульфат натрия), связывание CsCl, колоночная хроматография, электрофорез в агарозном геле и тому подобное.
Соответствующие термины, используемые в настоящем описании, объясняются следующим образом:
Дополнительные описания настоящего изобретения приведены ниже со ссылкой на варианты реализации изобретения. Следующие варианты осуществления используются для описания настоящего изобретения, но не предназначены для ограничения объема настоящего изобретения. За исключением содержания, конкретно упомянутого ниже, способ, условия, экспериментальные способы и т.п. для осуществления настоящего изобретения являются общими знаниями и хорошо известными знаниями в данной области, и настоящее изобретение не является конкретно ограниченным.
Пример 1. Гуманизация мышиного моноклонального антитела к aPC
Последовательности вариабельных областей мышиных гибридомных антител были гуманизированы. Аминокислотные последовательности VH/VL нумеруют с использованием системы Kabat. Затем последовательности VH/VL анализировали на наличие сайтов горячих точек, включая непарные остатки цистеина, сайты N-связанного гликозилирования и сайты дезаминирования внутри CDR. N-связанные сайты гликозилирования, близкие к CDR, также будут рассматриваться как сайты высокого риска. Если такие сайты распознаются, их необходимо удалить. Основываясь на выравнивании последовательностей VH/VL, были выбраны лучшие каркасные последовательности генов зародышевой линии человека, а последовательности J-области были выбраны и сплайсированы на основе лучшей гомологии. Моделирование гомологии проводилось на мышиных последовательностях VH/VL для формирования 3D-структур. Остатки FR в пределах 5Å от CDR, остатки на VH/VL связывающей поверхности, которые влияют на связывание антигена после изменения, и тому подобное будут рассматриваться как потенциальные сайты, нуждающиеся в обратных мутациях. Важность обратных мутаций была определена с помощью анализа с использованием компьютера, и были разработаны различные комбинации, содержащие одну или несколько обратных мутаций.
ДНК целевого сегмента амплифицировали с помощью ПЦР и конструировали плазмиды, кодирующие гуманизированные последовательности антител. Антитела подвергали временной трансфекции и экспрессии и очищали с помощью колонки аффинной хроматографии с белком А. Гуманизированные антитела анализировали с помощью SEC-HPLC и SDS-PAGE-электрофореза и получали 28 клонов гуманизированных моноклональных антител к aPC.
1.1 Анализы аффинности моноклональных антител к aPC к aPC человека (haPC) медотом ELISA
Аффинность химерных антител и вышеуказанных 28 гуманизированных антител к haPC анализировали с помощью анализов ELISA и FACS.
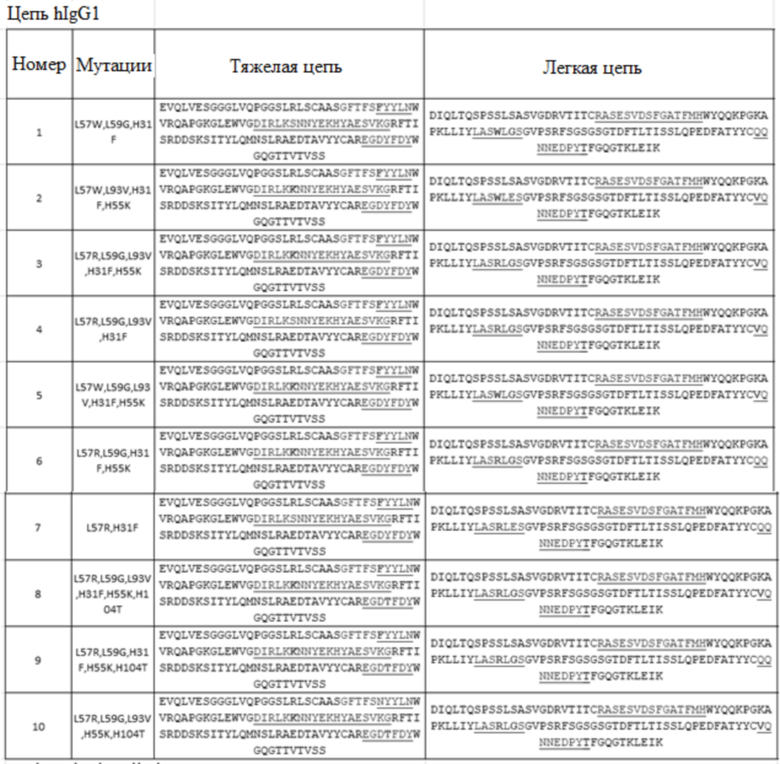
Результаты анализа показаны на фиг. 1. №№ 1-28 (от Humab001-1 до Humab001-28 или от HAPC-1 до HAPC28) гуманизированные антитела, 3657 положительное контрольное антитело (3657 PC mAb) и химерное антитело (30120-mAb001×hIgG) имели хорошее связывание с haPC. Антитела №№ 13-20 имели низкие значения EC50, что указывало на то, что эти антитела обладали более высокой способностью связывания с haPC.
1.2 Анализ связывания моноклональных антител к aPC с человеческим PC (hPC) методом ELISA
Отбирали №№ 13-20 гуманизированных моноклональных антител к aPC (от Humab001-13 до Humab001-20 или от HAPC-13 до HAPC-20) и анализировали их способность связываться с hPC.
Результаты показаны на Фиг. 2. Результаты показали, что №№ 13-20 гуманизированных моноклональных антител к aPC вообще не связываются с hPC.
Антитело № 13 (HAPC-13), антитело № 14 (HAPC-14) и антитело № 16 (HAPC-16) были тремя родительскими антителами, выбранными для оптимизации аффинности. Эти три антитела имели одинаковые каркасные области тяжелой цепи и разные каркасные области легкой цепи. HAPC-13 было оригинальным, HAPC-14 имело 1 обратную мутацию на основе HAPC-13, а HAPC-16 имело 5 обратных мутаций на основе HAPC-13. В следующих вариантах реализации изобретения антитело HAPC-14 было выбрано для последующей оптимизации аффинности.
Пример 2. Оптимизация аффинности моноклонального антитела к aPC HAPC-14
На основе антитела № 14 (Humab001-14 или HAPC14 или HAPC-14), описанного выше, оптимизировали аффинность этого антитела и сконструировали мутантов.
2.1 Сайт-направленная мутация
Каждая аминокислота из шести определяющих комплементарность областей (CDR) родительского клона HAPC-14 Fab была соответственно мутирована в 19 других аминокислот с использованием сайт-специфической мутации. Праймеры ДНК, содержащие кодоны NNS, кодирующие 20 аминокислот, использовали для введения мутаций в каждую целевую позицию CDR. Фосфорилированные вырожденные праймеры использовали в сайт-направленных мутационных реакциях.
2.2 ПЦР
ПЦР проводили при 94°C в течение 2 минут (94°C в течение 30 секунд, 55°C в течение 30 секунд, 72°C в течение 5 минут) в течение 16 циклов, а затем при 72°C в течение 10 минут.
Продукт ПЦР очищали, а затем вводили в Escherichia coli TG1 путем электропорации для образования колоний и получения Fab-фрагмента.
2.3 Предварительный скрининг библиотеки мутантов Fab
Предварительный скрининг включал одноточечный анализ ELISA (SPE), проведенный с помощью ELISA захвата.
Каждая лунка 96-луночных планшетов была покрыта анти-Fab антителом в покрывающем буфере PBS с pH 7,4 при 4°C. На следующий день планшеты блокировали казеином в PBS с pH 7,4 при 25°C в течение 1 часа. Затем в планшеты добавляли Fab PE и инкубировали при 25°С в течение 1 часа. После промывки планшетов в лунки добавляли биотинилированный антиген и инкубировали при 25°C в течение 1 часа. Затем биотинилированный антиген инкубировали с конъюгатом пероксидазы SA-хрена (HRP) при 25°С в течение 1 часа. Активность HRP обнаруживали с помощью субстрата тетраметилбензидина (TMB), и реакцию гасили с помощью 2M HCl. Планшеты считывали при 450 нМ. Клоны, демонстрирующие сигнал оптической плотности (OD) при 450 нм, который был в 3 раза больше, чем у родительского клона, отбирали и секвенировали. Улучшенные связыванием мутанты с уникальными последовательностями HAPC-14 были продемонстрированы с помощью ELISA захвата при рН 7,4. Улучшенные связыванием мутанты с уникальными последовательностями HAPC-14 ранжировались на основе прямого антигенного покрытия ELISA. Результаты приведены ниже в таблице 1.
OD450
Как показано в Таблице 1, мутации с улучшенной аффинностью у девяти индивидуумов (HAPC-14-R1-1H1-F2, HAPC-14-R1-2H6-C2, HAPC-14-R1-3H4-C6, HAPC-14-R1-2L4-B2, HAPC-14-R1-2L4-D4, HAPC-14-R1-2L6-G1, HAPC-14-R1-2L6-G11, HAPC-14-R1-3L1-D11 и HAPC-14-R1-3L1-G8), идентифицированные при предварительном скрининге HAPC-14, дополнительно использовали для дизайна и конструирования комбинаторной библиотеки мутантов.
2.4 Верификация основной библиотеки мутантов Fab путем прямого ранжирования KD ELISA
Ранжирование KD улучшенного связывания Fab каждого мутанта определяли с помощью KD ELISA прямого антигенного покрытия ELISA.
Каждая лунка 96-луночных планшетов была покрыта hPro1. биотином в буфере 1xPBS с pH 7,4, и инкубацию проводили в течение ночи при 4°C. На следующий день планшеты блокировали казеином в буфере 1xPBS с pH 7,4 при 25°C в течение 1 часа. Fab PE каждого мутанта, разведенного в соответствии с одной концентрацией, добавляли к планшетам и инкубировали при 25°С в течение 1 часа. Затем Fab PE инкубировали с козьим HRP к c-myc, конъюгированным при 25°C в течение 1 часа. Активность HRP обнаруживали с помощью субстрата тетраметилбензидина (TMB), и реакцию гасили с помощью 2M HCl. Значения OD каждого планшета считывали при 450 нМ.
2.5 Комбинаторный скрининг библиотеки HAPC-14 Fab
Точечные мутации в VH и VL, определенные как полезные для связывания антигена, дополнительно объединяли для дополнительной синергии связывания. Вкратце, каждый вырожденный праймер фосфорилировали, а затем использовали с урацилированной одноцепочечной ДНК в соотношении 10:1. Смесь нагревали до 85°C в течение 5 минут, а затем охлаждали до 55°C в течение более 1 часа. Затем добавляли лигазу T4 и ДНК-полимеразу T4 и смесь инкубировали при 37°С в течение 1,5 часов. 100 нг комбинаторной библиотечной ДНК вводили в TG1 путем электропорации с образованием колоний и получением Fab-фрагментов.
Комбинаторные мутанты экспрессировали как Fab и скринировали с использованием захвата ELISA. Клоны, демонстрирующие сигнал оптической плотности (OD) при 450 нм, который был в 3 раза больше, чем у клона-предшественника первого раунда, отбирали и секвенировали. Мутанты с улучшенным связыванием с уникальными последовательностями дополнительно демонстрировали с помощью ELISA захвата и секвенировали с помощью ELISA с прямым антигенным покрытием.
Множество комбинаторных мутантов HAPC-14 были подвергнуты скринингу, и 16 лучших комбинаторных мутантов со значительно улучшенной аффинностью были подтверждены с помощью KD ELISA (как показано в № 1-16 в таблице 2).
После скрининга и статистического анализа было обнаружено, что мутации в следующих 6 сайтах значительно влияют на способность связывания Fab-фрагмента с иммобилизованным антителом. Этими шестью сайтами были:
а) N57R/W, расположенный в VL CDR2 (N57R предпочтительнее N57W);
b) E59G/P, расположенный в VL CDR2 (E59G предпочтительнее E59P);
c) Q93V, расположенный в VL CDR3;
d) N31F, расположенный в VH CDR1;
e) S55K, расположенный в VH CDR2; и
f) Y104T, расположенный в VH CDR3.
Наиболее важными мутантными сайтами были N57R в легкой цепи и N31F в тяжелой цепи.
Пример 3. Моноклональные антитела к aPC на основе сайтов комбинаторной мутации HAPC-14 (конструирование целого IgG1)
3.1 Конструирование моноклональных антител к aPC (HAPC14-1 - HAPC14-10) на основе комбинирования сайтов мутации HAPC14
Основываясь на 6 сайтах мутаций из примера 2, проводили комбинаторное конструирование для получения 10 мутантов (14-1 - 14-10 в таблице 3 ниже) (HAPC14-1 - HAPC14-10), а затем последовательности конструировали в целую форму IgG для экспрессии и очистки. Исследовали уровень экспрессии, аффинность и другие биологические активности антител.
Аминокислотные последовательности HAPC-14 и 10 мутантов показаны в SEQ ID NO: 5-26.
Гуманизированное антитело 13 (HAPC-13)
Тяжелая цепь (SEQ ID NO: 1)
EVQLVESGGGLVQPGGSLRLSCAASGFTFSNYYLNWVRQAPGK
GLEWVGDIRL
KSNNYEKHYAESVKGRFTISRDDSKSITYLQMNSLRAEDTAVYYCAREGDYFDYWGQGTTVTVSS
Легкая цепь (SEQ ID NO: 2)
DIQMTQSPSSLSASVGDRVTITCRASESVDSFGATFMHWYQQKPGKAPKLLIYLASNLESGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQNNEDPYTFGQGTKLEIK
Гуманизированное антитело 16 (HAPC-16)
Тяжелая цепь (SEQ ID NO: 3)
EVQLVESGGGLVQPGGSLRLSCAASGFTFSNYYLNWVRQAP
GKGLEWVGDIRLK
SNNYEKHYAESVKGRFTISRDDSKSITYLQMNSLRAEDTAVYYCA
REGDYFDYWGQGTTVTVSS
Легкая цепь (SEQ ID NO: 4)

Гуманизированное антитело 14 (HAPC-14)
Тяжелая цепь (SEQ ID NO: 5)
EVQLVESGGGLVQPGGSLRLSCAASGFTFSNYYLNWVRQAPGKGL
EWVGDIRLKS
NNYEKHYAESVKGRFTISRDDSKSITYLQMNSLRAEDTAVYYCAR
EGDYFDYWGQGTTVTVSS
Легкая цепь (SEQ ID NO: 6)
DIQLTQSPSSLSASVGDRVTITCRASESVDSFGATFMHWYQQKPGKAPKLLIYLASNLESGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQNNEDPYTFGQGTKLEIK
HAPC-14-1
Тяжелая цепь (SEQ ID NO: 7)
EVQLVESGGGLVQPGGSLRLSCAASGFTFSFYYLNWVRQAPGKGLEWVGDIRLKSNNYEKHYAESVKGRFTISRDDSKSITYLQMNSLRAEDTAVYYCAREGDYFDYWGQGTTVTVSS
Легкая цепь (SEQ ID NO: 8)
DIQLTQSPSSLSASVGDRVTITCRASESVDSFGATFMHWYQQKPGKAPKLLIYLASWLGSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQNNEDPYTFGQGTKLEIK
HAPC-14-2
Тяжелая цепь (SEQ ID NO: 9)
EVQLVESGGGLVQPGGSLRLSCAASGFTFSFYYLNWVRQAPGKGLEWVGDIRLKKNNYEKHYAESVKGRFTISRDDSKSITYLQMNSLRAEDTAVYYCAREGDYFDYWGQGTTVTVSS
Легкая цепь (SEQ ID NO: 10)
DIQLTQSPSSLSASVGDRVTITCRASESVDSFGATFMHWYQQKPGKAPKLLIYLASWLESGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVQNNEDPYTFGQGTKLEIK
HAPC-14-3
Тяжелая цепь (SEQ ID NO: 11)
EVQLVESGGGLVQPGGSLRLSCAASGFTFSFYYLNWVRQAPGKGLEWVGDIRLKKNNYEKHYAESVKGRFTISRDDSKSITYLQMNSLRAEDTAVYYCAREGDYFDYWGQGTTVTVSS
Легкая цепь (SEQ ID NO: 12)
DIQLTQSPSSLSASVGDRVTITCRASESVDSFGATFMHWYQQKPGKAPKLLIYLASRLGSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVQNNEDPYTFGQGTKLEIK
HAPC-14-4
Тяжелая цепь (SEQ ID NO: 13)
EVQLVESGGGLVQPGGSLRLSCAASGFTFSFYYLNWVRQAPGKGLEWVGDIRLKSNNYEKHYAESVKGRFTISRDDSKSITYLQMNSLRAEDTAVYYCAREGDYFDYWGQGTTVTVSS
Легкая цепь (SEQ ID NO: 14)
DIQLTQSPSSLSASVGDRVTITCRASESVDSFGATFMHWYQQKPGKAPKLLIYLASRLGSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVQNNEDPYTFGQGTKLEIK
HAPC-14-5
Тяжелая цепь (SEQ ID NO: 15)
EVQLVESGGGLVQPGGSLRLSCAASGFTFSFYYLNWVRQAPGKGLEWVGDIRLKKNNYEKHYAESVKGRFTISRDDSKSITYLQMNSLRAEDTAVYYCAREGDYFDYWGQGTTVTVSS
Легкая цепь (SEQ ID NO: 16)
DIQLTQSPSSLSASVGDRVTITCRASESVDSFGATFMHWYQQKPGKAPKLLIYLASWLGSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVQNNEDPYTFGQGTKLEIK
HAPC-14-6
Тяжелая цепь (SEQ ID NO: 17)
EVQLVESGGGLVQPGGSLRLSCAASGFTFSFYYLNWVRQAPGKGLEWVGDIRLKKNNYEKHYAESVKGRFTISRDDSKSITYLQMNSLRAEDTAVYYCAREGDYFDYWGQGTTVTVSS
Легкая цепь (SEQ ID NO: 18)
DIQLTQSPSSLSASVGDRVTITCRASESVDSFGATFMHWYQQKPGKAPKLLIYLASRLGSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQNNEDPYTFGQGTKLEIK
HAPC-14-7
Тяжелая цепь (SEQ ID NO: 19)
EVQLVESGGGLVQPGGSLRLSCAASGFTFSFYYLNWVRQAPGKGLEWVGDIRLKSNNYEKHYAESVKGRFTISRDDSKSITYLQMNSLRAEDTAVYYCAREGDYFDYWGQGTTVTVSS
Легкая цепь (SEQ ID NO: 20)
DIQLTQSPSSLSASVGDRVTITCRASESVDSFGATFMHWYQQKPGKAPKLLIYLASRLESGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQNNEDPYTFGQGTKLEIK
HAPC-14-8
Тяжелая цепь (SEQ ID NO: 21)
EVQLVESGGGLVQPGGSLRLSCAASGFTFSFYYLNWVRQAPGKGLEWVGDIRLKKNNYEKHYAESVKGRFTISRDDSKSITYLQMNSLRAEDTAVYYCAREGDTFDYWGQGTTVTVSS
Легкая цепь (SEQ ID NO: 22)
DIQLTQSPSSLSASVGDRVTITCRASESVDSFGATFMHWYQQKPGKAPKLLIYLASRLGSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVQNNEDPYTFGQGTKLEIK
HAPC-14-9
Тяжелая цепь (SEQ ID NO: 23)
EVQLVESGGGLVQPGGSLRLSCAASGFTFSFYYLNWVRQAPGKGLEWVGDIRLKKNNYEKHYAESVKGRFTISRDDSKSITYLQMNSLRAEDTAVYYCAREGDTFDYWGQGTTVTVSS
Легкая цепь (SEQ ID NO: 24)
DIQLTQSPSSLSASVGDRVTITCRASESVDSFGATFMHWYQQKPGKAPKLLIYLASRLGSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQNNEDPYTFGQGTKLEIK
HAPC-14-10
Тяжелая цепь (SEQ ID NO: 25)
EVQLVESGGGLVQPGGSLRLSCAASGFTFSNYYLNWVRQAPGKGLEWVGDIRLKKNNYEKHYAESVKGRFTISRDDSKSITYLQMNSLRAEDTAVYYCAREGDTFDYWGQGTTVTVSS
Легкая цепь (SEQ ID NO: 26)
DIQLTQSPSSLSASVGDRVTITCRASESVDSFGATFMHWYQQKPGKAPKLLIYLASRLGSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVQNNEDPYTFGQGTKLEIK
HAPC-14
CDR1 тяжелой цепи (SEQ ID NO: 27)
NYYLN
HAPC-14
CDR2 тяжелой цепи (SEQ ID NO: 28)
DIRLKSNNYEKHYAESVKG
HAPC-14
CDR3 тяжелой цепи (SEQ ID NO: 29)
EGDYFDY
HAPC-14
CDR1 легкой цепи (SEQ ID NO: 30)
RASESVDSFGATFMH
HAPC-14
CDR2 легкой цепи (SEQ ID NO: 31)
LASNLES
HAPC-14
CDR3 легкой цепи (SEQ ID NO: 32)
QQNNEDPYT
HAPC-14-1
CDR1 тяжелой цепи (SEQ ID NO: 33)
FYYLN
HAPC-14-1
CDR2 тяжелой цепи (SEQ ID NO: 34)
DIRLKSNNYEKHYAESVKG
HAPC-14-1
CDR3 тяжелой цепи (SEQ ID NO: 35)
EGDYFDY
HAPC-14-1
CDR1 легкой цепи (SEQ ID NO: 36)
RASESVDSFGATFMH
HAPC-14-1
CDR2 легкой цепи (SEQ ID NO: 37)
LASWLGS
HAPC-14-1
CDR3 легкой цепи (SEQ ID NO: 38)
QQNNEDPYT
HAPC-14-2
CDR1 тяжелой цепи (SEQ ID NO: 39)
FYYLN
HAPC-14-2 (SEQ ID NO: 40)
CDR2 тяжелой цепи
DIRLKKNNYEKHYAESVKG
HAPC-14-2
CDR3 тяжелой цепи (SEQ ID NO: 41)
EGDYFDY
HAPC-14-2
CDR1 легкой цепи (SEQ ID NO: 42)
RASESVDSFGATFMH
HAPC-14-2
CDR2 легкой цепи (SEQ ID NO: 43)
LASWLES
HAPC-14-2
CDR3 легкой цепи (SEQ ID NO: 44)
VQNNEDPYT
HAPC-14-3
CDR1 тяжелой цепи (SEQ ID NO: 45)
FYYLN
HAPC-14-3
CDR2 тяжелой цепи (SEQ ID NO: 46)
DIRLKKNNYEKHYAESVKG
HAPC-14-3
CDR3 тяжелой цепи (SEQ ID NO: 47)
EGDYFDY
HAPC-14-3
CDR1 легкой цепи (SEQ ID NO: 48)
RASESVDSFGATFMH
HAPC-14-3
CDR2 легкой цепи (SEQ ID NO: 49)
LASRLGS
HAPC-14-3
CDR3 легкой цепи (SEQ ID NO: 50)
VQNNEDPYT
HAPC-14-4
CDR1 тяжелой цепи (SEQ ID NO: 51)
FYYLN
HAPC-14-4
CDR2 тяжелой цепи (SEQ ID NO: 52)
DIRLKSNNYEKHYAESVKG
HAPC-14-4
CDR3 тяжелой цепи (SEQ ID NO: 53)
EGDYFDY
HAPC-14-4
CDR1 легкой цепи (SEQ ID NO: 54)
RASESVDSFGATFMH
HAPC-14-4
CDR2 легкой цепи (SEQ ID NO: 55)
LASRLGS
HAPC-14-4
CDR3 легкой цепи (SEQ ID NO: 56)
VQNNEDPYT
HAPC-14-5
CDR1 тяжелой цепи (SEQ ID NO: 57)
FYYLN
HAPC-14-5
CDR2 тяжелой цепи (SEQ ID NO: 58)
DIRLKKNNYEKHYAESVKG
HAPC-14-5
CDR3 тяжелой цепи (SEQ ID NO: 59)
EGDYFDY
HAPC-14-5
CDR1 легкой цепи (SEQ ID NO: 60)
RASESVDSFGATFMH
HAPC-14-5
CDR2 легкой цепи (SEQ ID NO: 61)
LASWLGS
HAPC-14-5
CDR3 легкой цепи (SEQ ID NO: 62)
VQNNEDPYT
HAPC-14-6
CDR1 тяжелой цепи (SEQ ID NO: 63)
FYYLN
HAPC-14-6
CDR2 тяжелой цепи (SEQ ID NO: 64)
DIRLKKNNYEKHYAESVKG
HAPC-14-6
CDR3 тяжелой цепи (SEQ ID NO: 65)
EGDYFDY
HAPC-14-6
CDR1 легкой цепи (SEQ ID NO: 66)
RASESVDSFGATFMH
HAPC-14-6
CDR2 легкой цепи (SEQ ID NO: 67)
LASRLGS
HAPC-14-6
CDR3 легкой цепи (SEQ ID NO: 68)
QQNNEDPYT
HAPC-14-7
CDR1 тяжелой цепи (SEQ ID NO: 69)
FYYLN
HAPC-14-7
CDR2 тяжелой цепи (SEQ ID NO: 70)
DIRLKSNNYEKHYAESVKG
HAPC-14-7
CDR3 тяжелой цепи (SEQ ID NO: 71)
EGDYFDY
HAPC-14-7
CDR1 легкой цепи (SEQ ID NO: 72)
RASESVDSFGATFMH
HAPC-14-7
CDR2 легкой цепи (SEQ ID NO: 73)
LASRLES
HAPC-14-7
CDR3 легкой цепи (SEQ ID NO: 74)
QQNNEDPYT
HAPC-14-8
CDR1 тяжелой цепи (SEQ ID NO: 75)
FYYLN
HAPC-14-8
CDR2 тяжелой цепи (SEQ ID NO: 76)
DIRLKKNNYEKHYAESVKG
HAPC-14-8
CDR3 тяжелой цепи (SEQ ID NO: 77)
EGDTFDY
HAPC-14-8
CDR1 легкой цепи (SEQ ID NO: 78)
RASESVDSFGATFMH
HAPC-14-8
CDR2 легкой цепи (SEQ ID NO: 79)
LASRLGS
HAPC-14-8
CDR3 легкой цепи (SEQ ID NO: 80)
VQNNEDPYT
HAPC-14-9
CDR1 тяжелой цепи (SEQ ID NO: 81)
FYYLN
HAPC-14-9
CDR2 тяжелой цепи (SEQ ID NO: 82)
DIRLKKNNYEKHYAESVKG
HAPC-14-9
CDR3 тяжелой цепи (SEQ ID NO: 83)
EGDTFDY
HAPC-14-9
CDR1 легкой цепи (SEQ ID NO: 84)
RASESVDSFGATFMH
HAPC-14-9
CDR2 легкой цепи (SEQ ID NO: 85)
LASRLGS
HAPC-14-9
CDR3 легкой цепи (SEQ ID NO: 86)
QQNNEDPYT
HAPC-14-10
CDR1 тяжелой цепи (SEQ ID NO: 87)
NYYLN
HAPC-14-10
CDR2 тяжелой цепи (SEQ ID NO: 88)
DIRLKKNNYEKHYAESVKG
HAPC-14-10
CDR3 тяжелой цепи (SEQ ID NO: 89)
EGDTFDY
HAPC-14-10
CDR1 легкой цепи (SEQ ID NO: 90)
RASESVDSFGATFMH
HAPC-14-10
CDR2 легкой цепи (SEQ ID NO: 91)
LASRLGS
HAPC-14-10
CDR3 легкой цепи (SEQ ID NO: 92)
VQNNEDPYT
Подробная информация приведена в таблице 3.
Таблица 3
Подчеркнутые части являются CDR, а другие части являются каркасными областями.
Гуманизированное антитело 14 (моноклональное антитело 14 к aPC)
Тяжелая цепь

Легкая цепь
Подчеркнутые части представляют собой CDR, другие части представляют собой каркасные области, а белый шрифт указывает на гуманизированные сайты.
3.2 Анализы связывающей способности моноклональных антител к aPC, сконструированных на основе сайтов комбинаторных мутаций HAPC14 к haPC/hPC (HAPC14-1 - HAPC14-10)
Метод анализа:
Способность связывания моноклональных антител к aPC с haPC/hPC анализировали с помощью Elisa.
1. Планшеты для ELISA покрывали haPC/hPC (1 мкг/мл в PBS), 100 мкл/лунку, при 4°C в течение ночи.
2. Планшеты промывали 3 раза PBST (фосфатно-солевой буфер с твином) (0,1% Tween 20), 200 мкл/лунку.
3. Планшеты блокировали 2% BSA (раствор PBS), 200 мкл/лунку, при комнатной температуре в течение 1 часа.
4. Планшеты промывали 3 раза PBST (0,1% Tween 20), 200 мкл/лунку.
5. Планшеты инкубировали с моноклональным антителом к aPC в качестве первичного антитела (разбавленного от 10 мкг/мл в 2% BSA), 100 мкл/лунку, при комнатной температуре в течение 1 часа.
6. Планшеты промывали 3 раза PBST (0,1% Tween 20), 200 мкл/лунку.
7. Планшеты инкубировали с антителом HRP к hIgG-Fc (разведенным в 5000 раз в 2% буфере BSA) при комнатной температуре в течение 1 часа.
8. Планшеты промывали 6 раз PBST (0,1% Tween 20), 200 мкл/лунку.
9. Планшеты инкубировали с субстратом TMB (приготовленным из растворов A и B в соотношении 1:1 (об./об.)), 100 мкл/лунку, не на свету в течение 10 минут.
10. Реакцию гасили HCl (1 M), 100 мкл/лунку и считывали OD450.
Результаты анализа показаны на Фиг. 3, Таблице 4 и Таблице 5. Как можно видеть, моноклональные антитела к aPC связываются с hAPC и не связываются с hPC.
3.3 Анализы аффинности моноклональных антител к aPC, сконструированных на основе сайтов комбинаторных мутаций HAPC-14 с использованием системы Octet для биомолекулярных взаимодействий (HAPC-14-1 - HAPC-14-10)
Метод анализа: анализ Octet проводили при 25°C с использованием биосенсора протеина A Octet в 1× кинетическом буфере. Во время кинетического анализа исходный этап анализа проводили в 1× кинетическом буфере в течение 120 секунд, а затем в течение 240 секунд после загрузки антитела в биосенсор. Затем исходный двухэтапный анализ проводили в 1× кинетическом буфере в течение 120 секунд. Затем биосенсор с иммобилизованным антителом погружали в лунки, содержащие антиген (huAPC) в 5 концентрациях (3,13 нМ, 6,25 нМ, 12,5 нМ, 25 нМ и 50 нМ) в течение 180 сек, и затем проводили диссоциацию в 1× кинетическом буфере в течение 400 сек. 1× кинетический буфер использовали в качестве холостого контроля для демонстрации естественной диссоциации антитела в буфере. Для стадии регенерации использовали 10 мМ глицина при рН 1,5. Программное обеспечение для анализа данных Octet использовалось для расчета кинетики связывания, а модель связывания 1:1 использовалась для подгонки кривой.
Аффинность мутантных антител анализировали при pH 7,4. Результаты представлены на Фиг. 4 и в таблице 6.
Как видно из результатов на фиг. 4 и в таблице 6, мутантные антитела все еще могут связываться с haPC, но не могут связываться с hPC, и их аффинность была увеличена по сравнению с немутированным антителом № 14 HAPC-14. Особенно № 6 (HAPC14-6) и № 3 (HAPC14-3) показали почти 100-кратное увеличение.
Пример 4. Расщепление гистонов моноклональным антителом к aPC HAPC14-6 и aPC
Метод анализа:
После ДСН-ПААГ-электрофореза проводили окрашивание Кумасси синим и наблюдали, способствовало ли или ингибировало моноклональное антитело HAPC расщеплению гистонов aPC.
Результаты анализа показаны на фиг. 5 (слева направо на фиг. 5: только гистоны; гистоны и aPC; гистоны, APC и HAPC1573; гистоны, APC и HAPC14-6). Как можно видеть, HAPC1573 и HAPC14-6 повышали способность aPC расщеплять гистоны, что указывает на то, что моноклональное антитело HAPC14-6 по настоящему изобретению может оказывать цитопротекторное действие в отношении цитотоксичности гистонов H3 и H4.
В соответствии с HAPC1573, HAPC-14-6 не ингибирует, а фактически способствует расщеплению гистонов H3 и H4 посредством aPC. В отличие от HAPC1573, HAPC-14-6 слегка ингибировал расщепление гистона H1 посредством aPC. Это указывает на то, что HAPC-14-6 может оказывать цитопротекторное действие в отношении цитотоксичности гистонов H3 и H4.
Пример 5. Фармакодинамические исследования in vitro моноклональных антител к aPC HAPC-14-3 и HAPC-14-6
В этом примере было проанализировано влияние различных антител в различных концентрациях на плазму с дефицитом фактора свертывания крови.
Для измерения минимальной дозы моноклонального антитела для ингибирования антикоагулянтной активности aPC в плазме человека, с дефицитом нескольких факторов свертывания, проводили эксперименты с АЧТВ, индуцированные Protc. Было обнаружено, что концентрация не более 1 мкг/мг может ингибировать 95% или более антикоагулянтной активности aPC, в то время как для HAPC1573 требуется концентрация 100 мкг/мл или выше.
5.1 Экспериментальный метод и принцип
Принцип анализа активированного частичного тромбопластинового времени (АЧТВ): При 37°C факторы XII и XI активировали каолином, тромбоцитарный фактор 3 заменяли цефалином (частичным тромбопластином), а в присутствии Ca2+ наблюдали время, необходимое для свертывания плазмы, которое было активированным частичным тромбопластиновым временем. Анализ АЧТВ является чувствительным и наиболее часто используемым скрининговым тестом для врожденной системы свертывания.
Недавно разработанное моноклональное антитело к aPC HAPC-14-6 в концентрации не более 1 мкг/мл может ингибировать антикоагулянтную активность aPC в плазме человека с дефицитом различных факторов свертывания крови, включая дефицит в плазме крови человека фактора свертывания крови V, фактора свертывания крови VII, фактора свертывания крови VIII, фактора свертывания крови IX, фактора свертывания крови X, фактора свертывания крови XI, фактора свертывания крови XII, VWF и т.п.
5.2 Анализ влияния антител на плазму с дефицитом фактора свертывания крови
(1) Экспериментальные результаты влияния различных антител в различных концентрациях на фактор свертывания VIII и плазму с дефицитом VIX
Экспериментальный метод: антитела разбавляли до соответствующих концентраций буфером OWREN-KOLLER.
Плазма с дефицитом фактора свертывания FVIII плюс антитела в различных разведениях в таблице 7 (конечная концентрация), плюс 0,05 ед./мл Protac (конечная концентрация), плюс буфер OWREN-KOLLER, при комнатной температуре в течение 15 мин.
150 мкл всего 150 мкл
Контроль: плазма с дефицитом фактора свертывания FVIII 150 мкл плюс буфер OWREN-KOLLER 150 мкл.
Метод анализа: STAGO Compact Max APTT-процедура.
Плазма с дефицитом фактора свертывания FIX плюс антитела в различных разведениях в таблице 7 (конечная концентрация), плюс 0,01 ед./мл Protac (конечная концентрация), плюс буфер OWREN-KOLLER, при комнатной температуре в течение 15 мин.
150 мкл всего 150 мкл
Контроль: плазма с дефицитом фактора свертывания FIX 150 мкл плюс буфер OWREN-KOLLER 150 мкл.
Метод анализа: STAGO Compact Max APTT-процедура.
Результат анализа: Как показано в таблице 7, в плазме с дефицитом факторов свертывания VIII и VIX моноклональные антитела к aPC HAPC14-1 - HAPC14-10 могут в разной степени ингибировать антикоагулянтную активность aPC. При той же концентрации моноклональные антитела к aPC HAPC14-1 - HAPC14-10 все имели лучшие эффекты в ингибировании антикоагулянтной активности aPC, чем мышиные антитела 1573, HAPC13 и HAPC14.
(2) Экспериментальные результаты влияния различных антител в различных концентрациях на фактор свертывания FVIII
Экспериментальный метод: антитела разбавляли до соответствующих концентраций буфером OWREN-KOLLER.
Плазма с дефицитом фактора свертывания FVIII плюс антитела в различных разведениях на фиг. 6А (конечная концентрация), плюс 0,05 ед./мл Protac (конечная концентрация), плюс буфер OWREN-KOLLER, при комнатной температуре в течение 15 мин.
150 мкл всего 150 мкл
Контроль: плазма с дефицитом фактора свертывания FVIII 150 мкл плюс буфер OWREN-KOLLER 150 мкл.
Метод анализа: STAGO Compact Max APTT-процедура.
Экспериментальный результат: Как показано на фиг. 6А, в плазме с дефицитом фактора свертывания FVIII моноклональные антитела к aPC полностью ингибировали антикоагулянтную активность aPC.
(3) Экспериментальные результаты влияния различных антител в различных концентрациях на фактор свертывания FIX
Экспериментальный метод: антитела разбавляли до соответствующих концентраций буфером OWREN-KOLLER.
Плазма с дефицитом фактора свертывания FIX плюс антитела в различных разведениях на фиг. 6В (конечная концентрация), плюс 0,01 ед./мл Protac (конечная концентрация), плюс буфер OWREN-KOLLER, при комнатной температуре в течение 15 мин.
150 мкл всего 150 мкл
Контроль: плазма с дефицитом фактора свертывания FIX 150 мкл плюс буфер OWREN-KOLLER 150 мкл.
Метод анализа: STAGO Compact Max APTT-процедура.
Экспериментальный результат: Как показано на фиг. 6В, в плазме с дефицитом фактора свертывания FIX моноклональные антитела к aPC полностью ингибировали антикоагулянтную активность aPC.
(4) Экспериментальные результаты влияния различных антител в различных концентрациях на фактор свертывания FXI
Экспериментальный метод: антитела разбавляли до соответствующих концентраций буфером OWREN-KOLLER.
Плазма с дефицитом фактора свертывания FIX плюс антитела в различных разведениях на фиг. 6C (конечная концентрация), плюс 0,06 ед./мл Protac (конечная концентрация), плюс буфер OWREN-KOLLER, при комнатной температуре в течение 15 мин.
150 мкл всего 150 мкл
Контроль: плазма с дефицитом фактора свертывания FXI 150 мкл плюс буфер OWREN-KOLLER 150 мкл.
Метод анализа: STAGO Compact Max APTT-процедура.
Экспериментальный результат: Как показано на фиг. 6C, в плазме с дефицитом фактора свертывания FXI моноклональные антитела к aPC полностью ингибировали антикоагулянтную активность aPC.
(5) Экспериментальные результаты влияния различных антител в различных концентрациях на фактор свертывания FVII
Экспериментальный метод: антитела разбавляли до соответствующих концентраций буфером OWREN-KOLLER.
Плазма с дефицитом фактора свертывания FVII плюс антитела в различных разведениях на фиг. 6D (конечная концентрация), плюс 0,1 ед./мл Protac (конечная концентрация), плюс буфер OWREN-KOLLER, при комнатной температуре в течение 15 мин.
150 мкл всего 150 мкл
Контроль: плазма с дефицитом фактора свертывания FVII 150 мкл плюс буфер OWREN-KOLLER 150 мкл.
Метод анализа: STAGO Compact Max APTT-процедура.
Экспериментальный результат: Как показано на фиг. 6D, в плазме с дефицитом фактора свертывания FVII моноклональные антитела к aPC полностью ингибировали антикоагулянтную активность aPC.
(6) Экспериментальные результаты влияния различных антител в различных концентрациях на фактор свертывания FXII
Экспериментальный метод: антитела разбавляли до соответствующих концентраций буфером OWREN-KOLLER.
Плазма с дефицитом фактора свертывания FXII плюс антитела в различных разведениях на фиг. 6E (конечная концентрация), плюс 0,025 ед./мл Protac (конечная концентрация), плюс буфер OWREN-KOLLER, при комнатной температуре в течение 15 мин.
150 мкл всего 150 мкл
Контроль: плазма с дефицитом фактора свертывания FXII 150 мкл плюс буфер OWREN-KOLLER 150 мкл.
Метод анализа: STAGO Compact Max APTT-процедура.
Экспериментальный результат: Как показано на фиг. 6E, в плазме с дефицитом фактора свертывания FXII моноклональные антитела к aPC полностью ингибировали антикоагулянтную активность aPC.
(7) Экспериментальные результаты влияния различных антител в различных концентрациях на фактор свертывания FV
Экспериментальный метод: антитела разбавляли до соответствующих концентраций буфером OWREN-KOLLER.
Плазма с дефицитом фактора свертывания FV (содержащая 5% стандартной плазмы) плюс антитела в различных разведениях на фиг. 6F (конечная концентрация), плюс 0,05 ед./мл Protac (конечная концентрация), плюс буфер OWREN-KOLLER, при комнатной температуре в течение 15 мин.
150 мкл всего 150 мкл
Контроль: плазма с дефицитом фактора коагуляции FV (содержащая 5% стандартной плазмы) 150 мкл + буфер OWREN-KOLLER 150 мкл.
Метод анализа: STAGO Compact Max APTT-процедура.
Экспериментальный результат: Как показано на фиг. 6F, в плазме с дефицитом фактора свертывания FV моноклональные антитела к aPC полностью ингибировали антикоагулянтную активность aPC.
(8) Экспериментальные результаты влияния различных антител в различных концентрациях на фактор свертывания FX
Экспериментальный метод: антитела разбавляли до соответствующих концентраций буфером OWREN-KOLLER.
Плазма с дефицитом фактора свертывания FX (содержащая 1% стандартной плазмы) плюс антитела в различных разведениях на фиг. 6G (конечная концентрация), плюс 0,05 ед./мл Protac (конечная концентрация), плюс буфер OWREN-KOLLER, при комнатной температуре в течение 15 мин.
150 мкл всего 150 мкл
Контроль: плазма с дефицитом фактора коагуляции FX (содержащая 1% стандартной плазмы) 150 мкл + буфер OWREN-KOLLER 150 мкл.
Метод анализа: STAGO Compact Max APTT-процедура.
Экспериментальный результат: Как показано на фиг. 6G, в плазме с дефицитом фактора свертывания FX моноклональные антитела к aPC полностью ингибировали антикоагулянтную активность aPC.
(9) Экспериментальные результаты влияния различных антител в различных концентрациях на фактор свертывания VWF
Экспериментальный метод: антитела разбавляли до соответствующих концентраций буфером OWREN-KOLLER.
Плазма с дефицитом фактора свертывания VWF плюс антитела в различных разведениях на фиг. 6H (конечная концентрация), плюс 0,01 ед./мл Protac (конечная концентрация), плюс буфер OWREN-KOLLER, при комнатной температуре в течение 15 мин.
150 мкл всего 150 мкл
Контроль: плазма с дефицитом фактора свертывания VWF 150 мкл плюс буфер OWREN-KOLLER 150 мкл.
Метод анализа: STAGO Compact Max APTT-процедура.
Экспериментальный результат: Как показано на фиг. 6H, в плазме с дефицитом фактора свертывания VWF моноклональные антитела к aPC полностью ингибировали антикоагулянтную активность aPC.
Пример 6. Фармакодинамический эксперимент in vivo
В мышиной модели гемофилии на основе гуманизированного белка С (со ссылкой на абз. [0230] - [0238] в китайской патентной заявке № CN201911027061,6), после введения мышам определенной дозы моноклонального антитела к aPC измеряли объем кровотечения после ампутации кончика хвоста для определения эффекта свертывания моноклонального антитела к aPC путем ингибирования антикоагулянтной функции aPC.
6.1 Экспериментальный метод
Введение осуществляли путем внутривенной инъекции через кант мыши. Через 1 час после введения мышей анестезировали внутрибрюшинной инъекцией пентобарбитала натрия. Хвост анестезированной мыши отрезали на 2 мм от кончика хвоста мыши, а рану хвоста погружали в 15 мл физиологического раствора при 37°С для сбора крови. Через 20 минут сбор был остановлен. После лизирования эритроцитов в собранном растворе супернатант собирали центрифугированием. Надосадочную жидкость испытывали с помощью ультрафиолетового спектрофотометра при длине волны 600 нм. Для представления объема кровотечения у мыши использовали измеренное значение OD, которое использовали для измерения функции свертывания крови у мыши. Группа WT (дикий тип) представляет собой нормальных мышей, и группа "без лечения" представляет собой мышей с гемофилией A или гемофилией B, которым не вводили гуманизированный белок С.
6.2 Результат эксперимента
Как показано на фиг. 7A, мышам с гемофилией A с гуманизированным белком C вводили 1 ед. фактора свертывания FVIII, 20 мкг мышиного антитела 1573 и 1 мкг HAPC-14-6 соответственно. Коагуляционная функция у мышей, которым вводили новое моноклональное антитело к aPC HAPC-14-6, была восстановлена до уровня нормальных мышей, что совпало с эффектом лечения мышей фактором свертывания FVIII.
Как показано на фиг. 7B, у мышей с гемофилией A с гуманизированным белком С после введения различных доз HAPC-14-6, соответственно, функция свертывания крови дефицитных мышей могла быть восстановлена до нормального уровня не более чем 1 мкг HAPC-14-6.
Как показано на фиг. 7C, у мышей с гемофилией В с гуманизированным белком С после введения различных доз HAPC-14-6, соответственно, функция свертывания крови дефицитных мышей могла быть восстановлена до нормального уровня не более чем 1 мкг HAPC-14-6.
Раскрытый в настоящем описании результат экспериментов с АЧТВ, индуцированным (protac) активирующим белок C ферментом, которые использовали для тестирования минимальной дозы моноклональных антител к aPC для ингибирования антикоагулянтной активности aPC в плазме крови человека с дефицитом нескольких факторов свертывания, показал, что концентрация не более 1 мкг/мг моноклональных антител к aPC может полностью ингибировать антикоагулянтную активность aPC, в то время как для мышиного антитела HAPC1573 требуется концентрация 100 мкг/мл или выше.
Вышеуказанные варианты осуществления предназначены только для описания технических решений настоящего изобретения, но не для ограничения настоящего изобретения. Хотя настоящее раскрытие подробно описано со ссылкой на предшествующие варианты осуществления, специалисты в данной области техники должны понимать, что они все еще могут вносить изменения в конкретные варианты осуществления, описанные в предшествующих вариантах осуществления, или делать эквивалентные замены некоторых технических признаков. Изменения и преимущества, которые могут быть поняты специалистами в данной области техники без отклонения от сущности и объема концепции изобретения, должны подпадать под объем технических решений, заявленных в настоящем описании.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Оклахома Медикал Рисерч Фаундейшн
<120> МОНОКЛОНАЛЬНОЕ АНТИТЕЛО К АКТИВИРОВАННОМУ БЕЛКУ С ЧЕЛОВЕКА
И ЕГО ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ
<130> 210411
<160> 92
<170> PatentIn версии 3.5
<210> 1
<211> 118
<212> Белок
<213> Искусственная последовательность
<400> 1
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Tyr Leu Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Asp Ile Arg Leu Lys Ser Asn Asn Tyr Glu Lys His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Thr Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Glu Gly Asp Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 2
<211> 111
<212> Белок
<213> Искусственная последовательность
<400> 2
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Asp Ser Phe
20 25 30
Gly Ala Thr Phe Met His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Asn Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 3
<211> 118
<212> Белок
<213> Искусственная последовательность
<400> 3
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Tyr Leu Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Asp Ile Arg Leu Lys Ser Asn Asn Tyr Glu Lys His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Thr Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Glu Gly Asp Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 4
<211> 111
<212> Белок
<213> Искусственная последовательность
<400> 4
Asn Ile Val Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Asp Ser Phe
20 25 30
Gly Ala Thr Phe Met His Trp Tyr Gln Gln Lys Pro Gly Lys Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Asn Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 5
<211> 118
<212> Белок
<213> Искусственная последовательность
<400> 5
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Tyr Leu Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Asp Ile Arg Leu Lys Ser Asn Asn Tyr Glu Lys His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Thr Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Glu Gly Asp Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 6
<211> 111
<212> Белок
<213> Искусственная последовательность
<400> 6
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Asp Ser Phe
20 25 30
Gly Ala Thr Phe Met His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Asn Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 7
<211> 118
<212> Белок
<213> Искусственная последовательность
<400> 7
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Phe Tyr
20 25 30
Tyr Leu Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Asp Ile Arg Leu Lys Ser Asn Asn Tyr Glu Lys His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Thr Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Glu Gly Asp Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 8
<211> 111
<212> Белок
<213> Искусственная последовательность
<400> 8
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Asp Ser Phe
20 25 30
Gly Ala Thr Phe Met His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Trp Leu Gly Ser Gly Val Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Asn Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 9
<211> 118
<212> Белок
<213> Искусственная последовательность
<400> 9
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Phe Tyr
20 25 30
Tyr Leu Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Asp Ile Arg Leu Lys Lys Asn Asn Tyr Glu Lys His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Thr Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Glu Gly Asp Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 10
<211> 111
<212> Белок
<213> Искусственная последовательность
<400> 10
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Asp Ser Phe
20 25 30
Gly Ala Thr Phe Met His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Trp Leu Glu Ser Gly Val Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Val Gln Asn Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 11
<211> 118
<212> Белок
<213> Искусственная последовательность
<400> 11
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Phe Tyr
20 25 30
Tyr Leu Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Asp Ile Arg Leu Lys Lys Asn Asn Tyr Glu Lys His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Thr Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Glu Gly Asp Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 12
<211> 111
<212> Белок
<213> Искусственная последовательность
<400> 12
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Asp Ser Phe
20 25 30
Gly Ala Thr Phe Met His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Arg Leu Gly Ser Gly Val Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Val Gln Asn Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 13
<211> 118
<212> Белок
<213> Искусственная последовательность
<400> 13
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Phe Tyr
20 25 30
Tyr Leu Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Asp Ile Arg Leu Lys Ser Asn Asn Tyr Glu Lys His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Thr Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Glu Gly Asp Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 14
<211> 111
<212> Белок
<213> Искусственная последовательность
<400> 14
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Asp Ser Phe
20 25 30
Gly Ala Thr Phe Met His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Arg Leu Gly Ser Gly Val Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Val Gln Asn Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 15
<211> 118
<212> Белок
<213> Искусственная последовательность
<400> 15
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Phe Tyr
20 25 30
Tyr Leu Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Asp Ile Arg Leu Lys Lys Asn Asn Tyr Glu Lys His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Thr Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Glu Gly Asp Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 16
<211> 111
<212> Белок
<213> Искусственная последовательность
<400> 16
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Asp Ser Phe
20 25 30
Gly Ala Thr Phe Met His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Trp Leu Gly Ser Gly Val Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Val Gln Asn Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 17
<211> 118
<212> Белок
<213> Искусственная последовательность
<400> 17
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Phe Tyr
20 25 30
Tyr Leu Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Asp Ile Arg Leu Lys Lys Asn Asn Tyr Glu Lys His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Thr Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Glu Gly Asp Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 18
<211> 111
<212> Белок
<213> Искусственная последовательность
<400> 18
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Asp Ser Phe
20 25 30
Gly Ala Thr Phe Met His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Arg Leu Gly Ser Gly Val Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Asn Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 19
<211> 118
<212> Белок
<213> Искусственная последовательность
<400> 19
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Phe Tyr
20 25 30
Tyr Leu Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Asp Ile Arg Leu Lys Ser Asn Asn Tyr Glu Lys His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Thr Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Glu Gly Asp Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 20
<211> 111
<212> Белок
<213> Искусственная последовательность
<400> 20
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Asp Ser Phe
20 25 30
Gly Ala Thr Phe Met His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Arg Leu Glu Ser Gly Val Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Asn Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 21
<211> 118
<212> Белок
<213> Искусственная последовательность
<400> 21
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Phe Tyr
20 25 30
Tyr Leu Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Asp Ile Arg Leu Lys Lys Asn Asn Tyr Glu Lys His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Thr Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Glu Gly Asp Thr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 22
<211> 111
<212> Белок
<213> Искусственная последовательность
<400> 22
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Asp Ser Phe
20 25 30
Gly Ala Thr Phe Met His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Arg Leu Gly Ser Gly Val Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Val Gln Asn Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 23
<211> 118
<212> Белок
<213> Искусственная последовательность
<400> 23
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Phe Tyr
20 25 30
Tyr Leu Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Asp Ile Arg Leu Lys Lys Asn Asn Tyr Glu Lys His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Thr Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Glu Gly Asp Thr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 24
<211> 111
<212> Белок
<213> Искусственная последовательность
<400> 24
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Asp Ser Phe
20 25 30
Gly Ala Thr Phe Met His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Arg Leu Gly Ser Gly Val Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Asn Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 25
<211> 118
<212> Белок
<213> Искусственная последовательность
<400> 25
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Tyr Leu Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Asp Ile Arg Leu Lys Lys Asn Asn Tyr Glu Lys His Tyr Ala Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Thr Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Glu Gly Asp Thr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 26
<211> 111
<212> Белок
<213> Искусственная последовательность
<400> 26
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Asp Ser Phe
20 25 30
Gly Ala Thr Phe Met His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Arg Leu Gly Ser Gly Val Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Val Gln Asn Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 27
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 27
Asn Tyr Tyr Leu Asn
1 5
<210> 28
<211> 19
<212> Белок
<213> Искусственная последовательность
<400> 28
Asp Ile Arg Leu Lys Ser Asn Asn Tyr Glu Lys His Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 29
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 29
Glu Gly Asp Tyr Phe Asp Tyr
1 5
<210> 30
<211> 15
<212> Белок
<213> Искусственная последовательность
<400> 30
Arg Ala Ser Glu Ser Val Asp Ser Phe Gly Ala Thr Phe Met His
1 5 10 15
<210> 31
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 31
Leu Ala Ser Asn Leu Glu Ser
1 5
<210> 32
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 32
Gln Gln Asn Asn Glu Asp Pro Tyr Thr
1 5
<210> 33
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 33
Phe Tyr Tyr Leu Asn
1 5
<210> 34
<211> 19
<212> Белок
<213> Искусственная последовательность
<400> 34
Asp Ile Arg Leu Lys Ser Asn Asn Tyr Glu Lys His Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 35
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 35
Glu Gly Asp Tyr Phe Asp Tyr
1 5
<210> 36
<211> 15
<212> Белок
<213> Искусственная последовательность
<400> 36
Arg Ala Ser Glu Ser Val Asp Ser Phe Gly Ala Thr Phe Met His
1 5 10 15
<210> 37
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 37
Leu Ala Ser Trp Leu Gly Ser
1 5
<210> 38
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 38
Gln Gln Asn Asn Glu Asp Pro Tyr Thr
1 5
<210> 39
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 39
Phe Tyr Tyr Leu Asn
1 5
<210> 40
<211> 19
<212> Белок
<213> Искусственная последовательность
<400> 40
Asp Ile Arg Leu Lys Lys Asn Asn Tyr Glu Lys His Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 41
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 41
Glu Gly Asp Tyr Phe Asp Tyr
1 5
<210> 42
<211> 15
<212> Белок
<213> Искусственная последовательность
<400> 42
Arg Ala Ser Glu Ser Val Asp Ser Phe Gly Ala Thr Phe Met His
1 5 10 15
<210> 43
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 43
Leu Ala Ser Trp Leu Glu Ser
1 5
<210> 44
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 44
Val Gln Asn Asn Glu Asp Pro Tyr Thr
1 5
<210> 45
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 45
Phe Tyr Tyr Leu Asn
1 5
<210> 46
<211> 19
<212> Белок
<213> Искусственная последовательность
<400> 46
Asp Ile Arg Leu Lys Lys Asn Asn Tyr Glu Lys His Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 47
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 47
Glu Gly Asp Tyr Phe Asp Tyr
1 5
<210> 48
<211> 15
<212> Белок
<213> Искусственная последовательность
<400> 48
Arg Ala Ser Glu Ser Val Asp Ser Phe Gly Ala Thr Phe Met His
1 5 10 15
<210> 49
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 49
Leu Ala Ser Arg Leu Gly Ser
1 5
<210> 50
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 50
Val Gln Asn Asn Glu Asp Pro Tyr Thr
1 5
<210> 51
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 51
Phe Tyr Tyr Leu Asn
1 5
<210> 52
<211> 19
<212> Белок
<213> Искусственная последовательность
<400> 52
Asp Ile Arg Leu Lys Ser Asn Asn Tyr Glu Lys His Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 53
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 53
Glu Gly Asp Tyr Phe Asp Tyr
1 5
<210> 54
<211> 15
<212> Белок
<213> Искусственная последовательность
<400> 54
Arg Ala Ser Glu Ser Val Asp Ser Phe Gly Ala Thr Phe Met His
1 5 10 15
<210> 55
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 55
Leu Ala Ser Arg Leu Gly Ser
1 5
<210> 56
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 56
Val Gln Asn Asn Glu Asp Pro Tyr Thr
1 5
<210> 57
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 57
Phe Tyr Tyr Leu Asn
1 5
<210> 58
<211> 19
<212> Белок
<213> Искусственная последовательность
<400> 58
Asp Ile Arg Leu Lys Lys Asn Asn Tyr Glu Lys His Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 59
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 59
Glu Gly Asp Tyr Phe Asp Tyr
1 5
<210> 60
<211> 15
<212> Белок
<213> Искусственная последовательность
<400> 60
Arg Ala Ser Glu Ser Val Asp Ser Phe Gly Ala Thr Phe Met His
1 5 10 15
<210> 61
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 61
Leu Ala Ser Trp Leu Gly Ser
1 5
<210> 62
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 62
Val Gln Asn Asn Glu Asp Pro Tyr Thr
1 5
<210> 63
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 63
Phe Tyr Tyr Leu Asn
1 5
<210> 64
<211> 19
<212> Белок
<213> Искусственная последовательность
<400> 64
Asp Ile Arg Leu Lys Lys Asn Asn Tyr Glu Lys His Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 65
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 65
Glu Gly Asp Tyr Phe Asp Tyr
1 5
<210> 66
<211> 15
<212> Белок
<213> Искусственная последовательность
<400> 66
Arg Ala Ser Glu Ser Val Asp Ser Phe Gly Ala Thr Phe Met His
1 5 10 15
<210> 67
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 67
Leu Ala Ser Arg Leu Gly Ser
1 5
<210> 68
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 68
Gln Gln Asn Asn Glu Asp Pro Tyr Thr
1 5
<210> 69
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 69
Phe Tyr Tyr Leu Asn
1 5
<210> 70
<211> 19
<212> Белок
<213> Искусственная последовательность
<400> 70
Asp Ile Arg Leu Lys Ser Asn Asn Tyr Glu Lys His Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 71
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 71
Glu Gly Asp Tyr Phe Asp Tyr
1 5
<210> 72
<211> 15
<212> Белок
<213> Искусственная последовательность
<400> 72
Arg Ala Ser Glu Ser Val Asp Ser Phe Gly Ala Thr Phe Met His
1 5 10 15
<210> 73
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 73
Leu Ala Ser Arg Leu Glu Ser
1 5
<210> 74
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 74
Gln Gln Asn Asn Glu Asp Pro Tyr Thr
1 5
<210> 75
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 75
Phe Tyr Tyr Leu Asn
1 5
<210> 76
<211> 19
<212> Белок
<213> Искусственная последовательность
<400> 76
Asp Ile Arg Leu Lys Lys Asn Asn Tyr Glu Lys His Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 77
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 77
Glu Gly Asp Thr Phe Asp Tyr
1 5
<210> 78
<211> 15
<212> Белок
<213> Искусственная последовательность
<400> 78
Arg Ala Ser Glu Ser Val Asp Ser Phe Gly Ala Thr Phe Met His
1 5 10 15
<210> 79
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 79
Leu Ala Ser Arg Leu Gly Ser
1 5
<210> 80
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 80
Val Gln Asn Asn Glu Asp Pro Tyr Thr
1 5
<210> 81
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 81
Phe Tyr Tyr Leu Asn
1 5
<210> 82
<211> 19
<212> Белок
<213> Искусственная последовательность
<400> 82
Asp Ile Arg Leu Lys Lys Asn Asn Tyr Glu Lys His Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 83
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 83
Glu Gly Asp Thr Phe Asp Tyr
1 5
<210> 84
<211> 15
<212> Белок
<213> Искусственная последовательность
<400> 84
Arg Ala Ser Glu Ser Val Asp Ser Phe Gly Ala Thr Phe Met His
1 5 10 15
<210> 85
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 85
Leu Ala Ser Arg Leu Gly Ser
1 5
<210> 86
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 86
Gln Gln Asn Asn Glu Asp Pro Tyr Thr
1 5
<210> 87
<211> 5
<212> Белок
<213> Искусственная последовательность
<400> 87
Asn Tyr Tyr Leu Asn
1 5
<210> 88
<211> 19
<212> Белок
<213> Искусственная последовательность
<400> 88
Asp Ile Arg Leu Lys Lys Asn Asn Tyr Glu Lys His Tyr Ala Glu Ser
1 5 10 15
Val Lys Gly
<210> 89
<211> 7
<212> Белок
<213> Искусственная последовательность
<400> 89
Glu Gly Asp Thr Phe Asp Tyr
1 5
<210> 90
<211> 15
<212> Белок
<213> Искусственная последовательность
<400> 90
Arg Ala Ser Glu Ser Val Asp Ser Phe Gly Ala Thr Phe Met His
1 5 10 15
<210> 91
<211> 15
<212> Белок
<213> Искусственная последовательность
<400> 91
Arg Ala Ser Glu Ser Val Asp Ser Phe Gly Ala Thr Phe Met His
1 5 10 15
<210> 92
<211> 9
<212> Белок
<213> Искусственная последовательность
<400> 92
Val Gln Asn Asn Glu Asp Pro Tyr Thr
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Композиции и способы лечения и предупреждения инфекций, вызванных Staphylococcus aureus | 2015 |
|
RU2764981C1 |
| АНТИТЕЛА ПРОТИВ ФАКТОРА СВЕРТЫВАНИЯ XI | 2017 |
|
RU2757314C2 |
| Антитело против FXI/FXIA, его антигенсвязывающий фрагмент и фармацевтическое применение | 2021 |
|
RU2838408C1 |
| АНТИТЕЛО ПРОТИВ СТОЛБНЯЧНОГО ТОКСИНА И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2815280C1 |
| Терапевтический биопрепарат для лечения гепатоцеллюлярной карциномы | 2014 |
|
RU2739218C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО ПРОТИВ ВИРУСА БЕШЕНСТВА И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2764740C1 |
| МОЛЕКУЛЫ АНТИ-SIGLEC-9 АНТИТЕЛА | 2020 |
|
RU2833330C1 |
| Композиции и способы активации интегринов | 2020 |
|
RU2836262C1 |
| НОВЫЕ АНТИТЕЛА ПРОТИВ ФАКТОРА XI И ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2758160C2 |
| БИСПЕЦИФИЧЕСКИЙ БЕЛОК | 2019 |
|
RU2784486C1 |
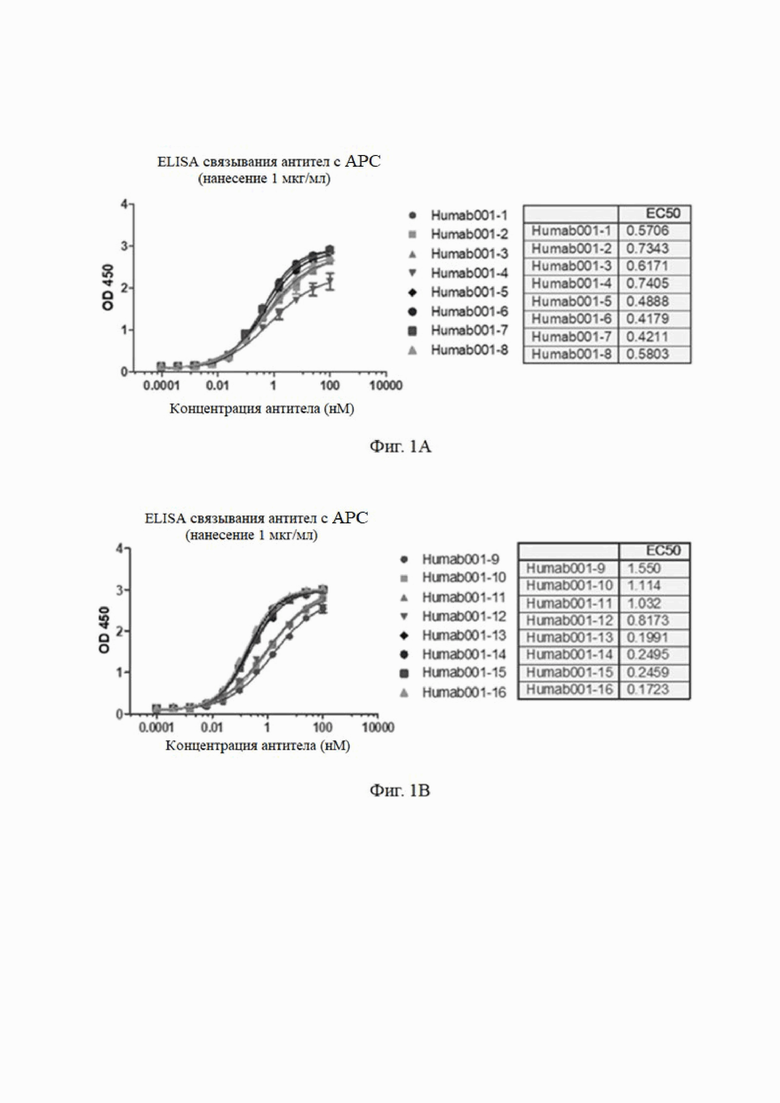
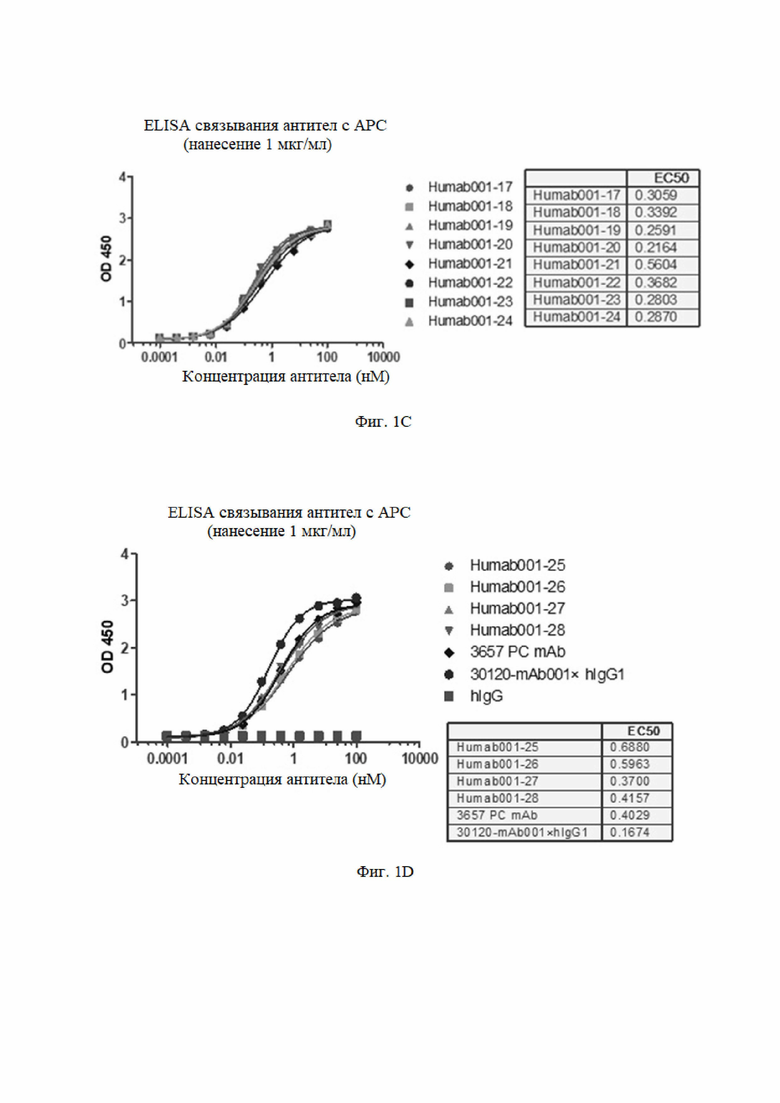
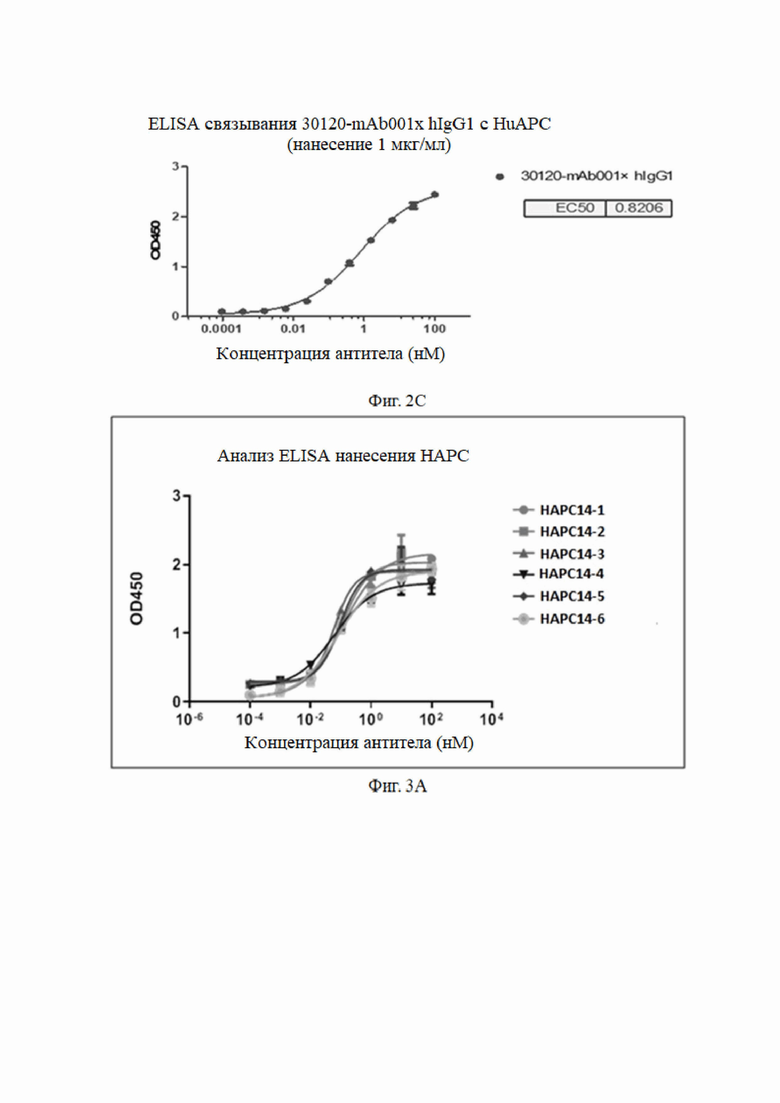
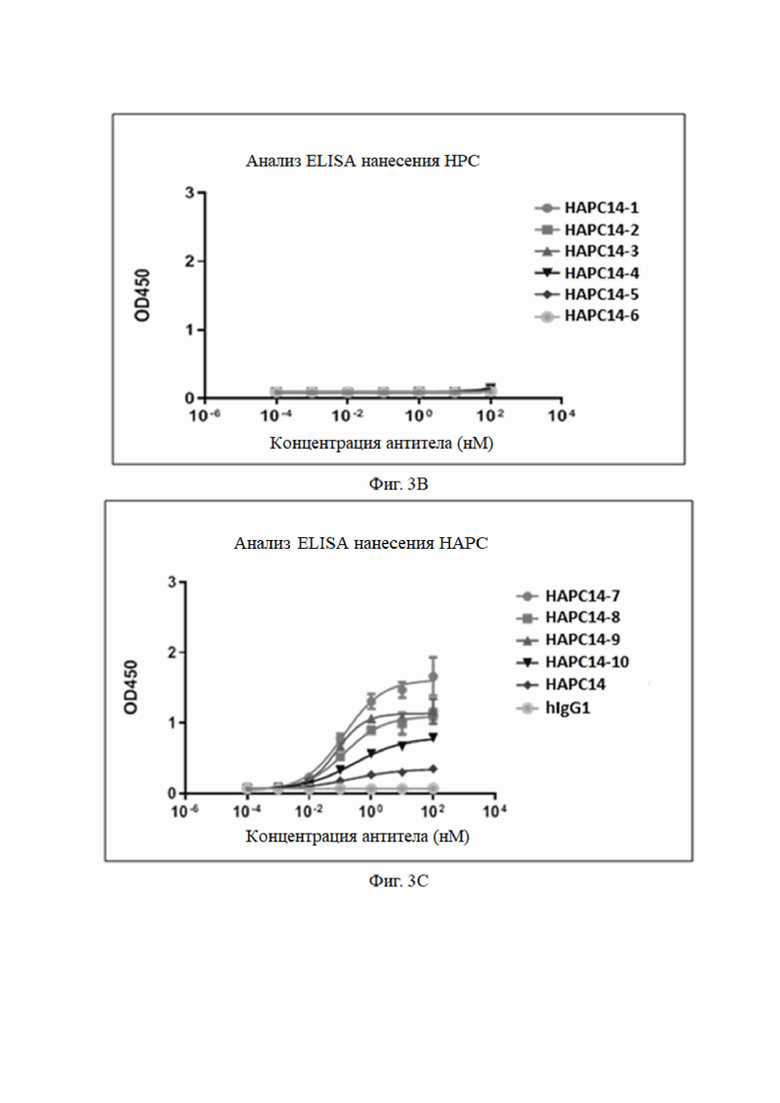
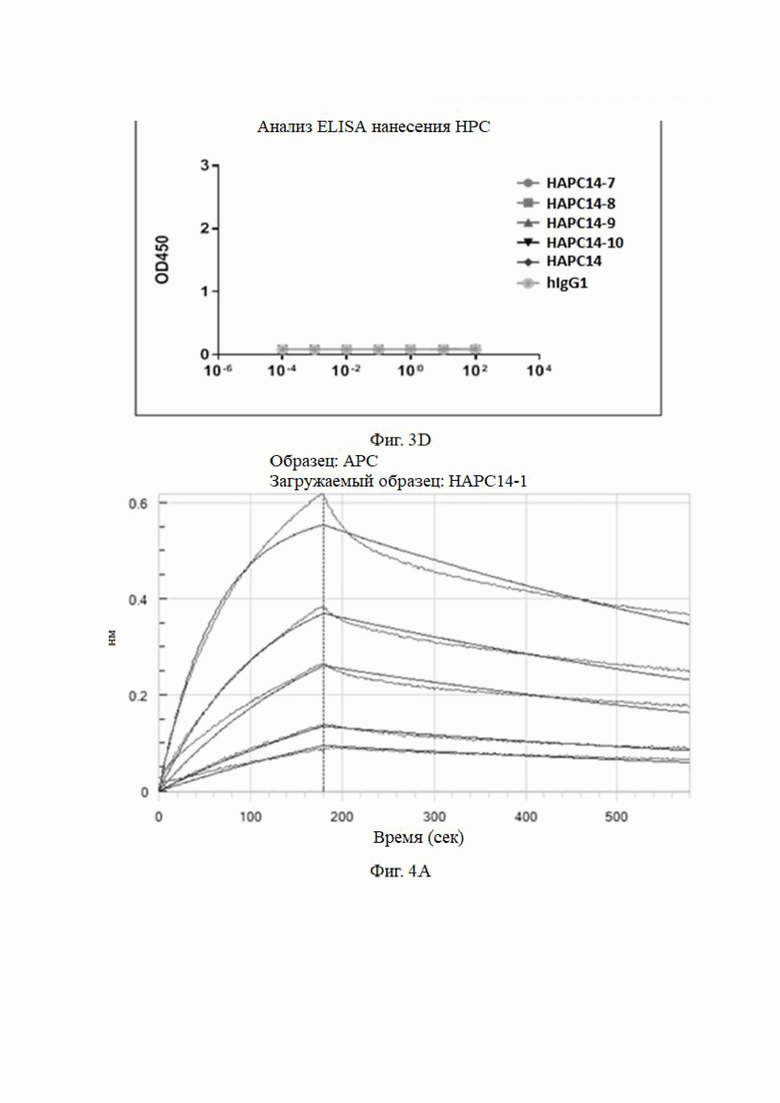
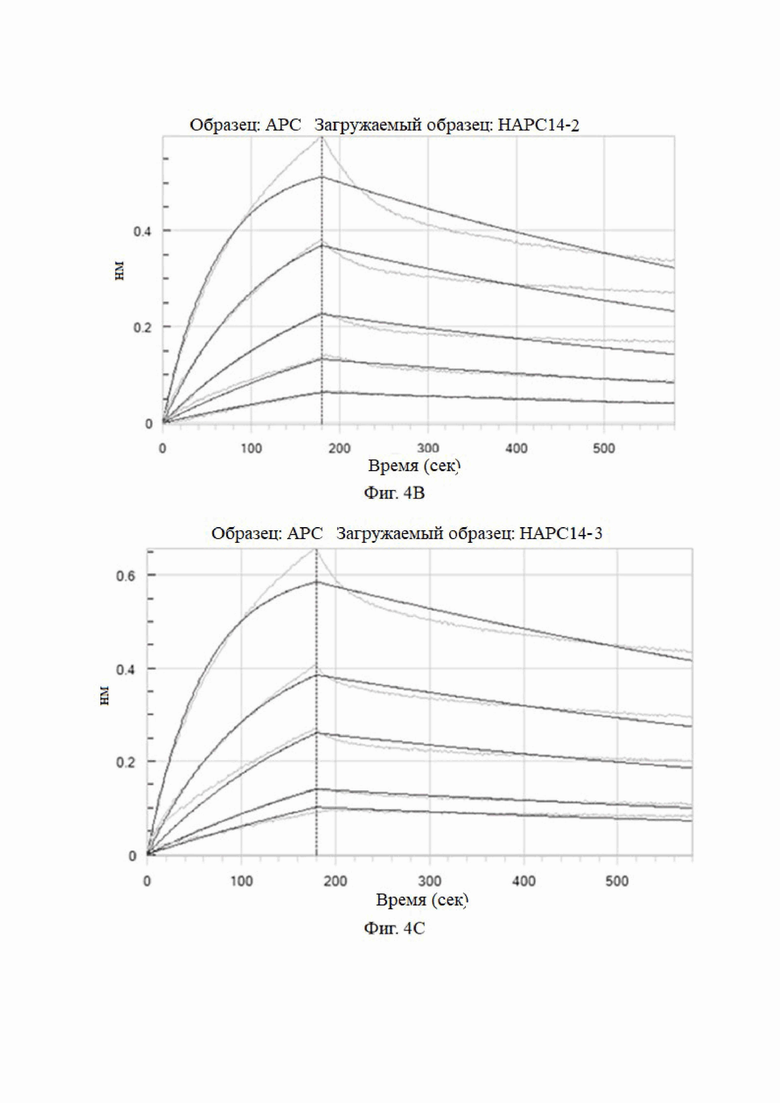
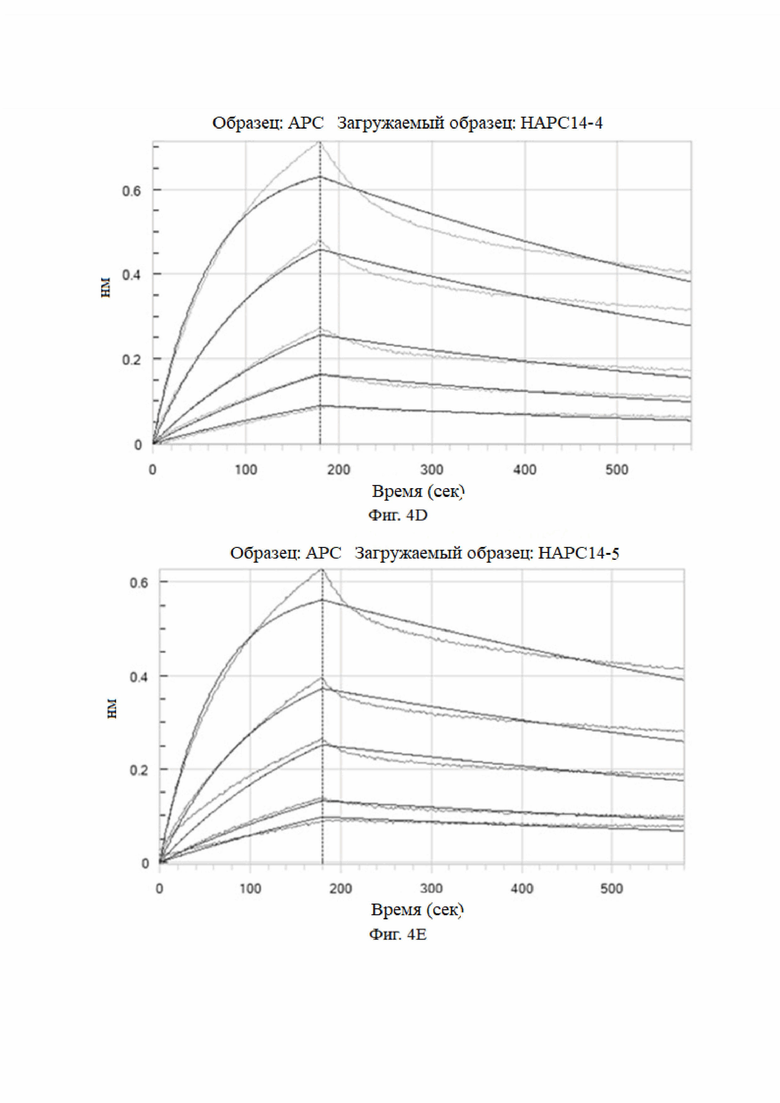
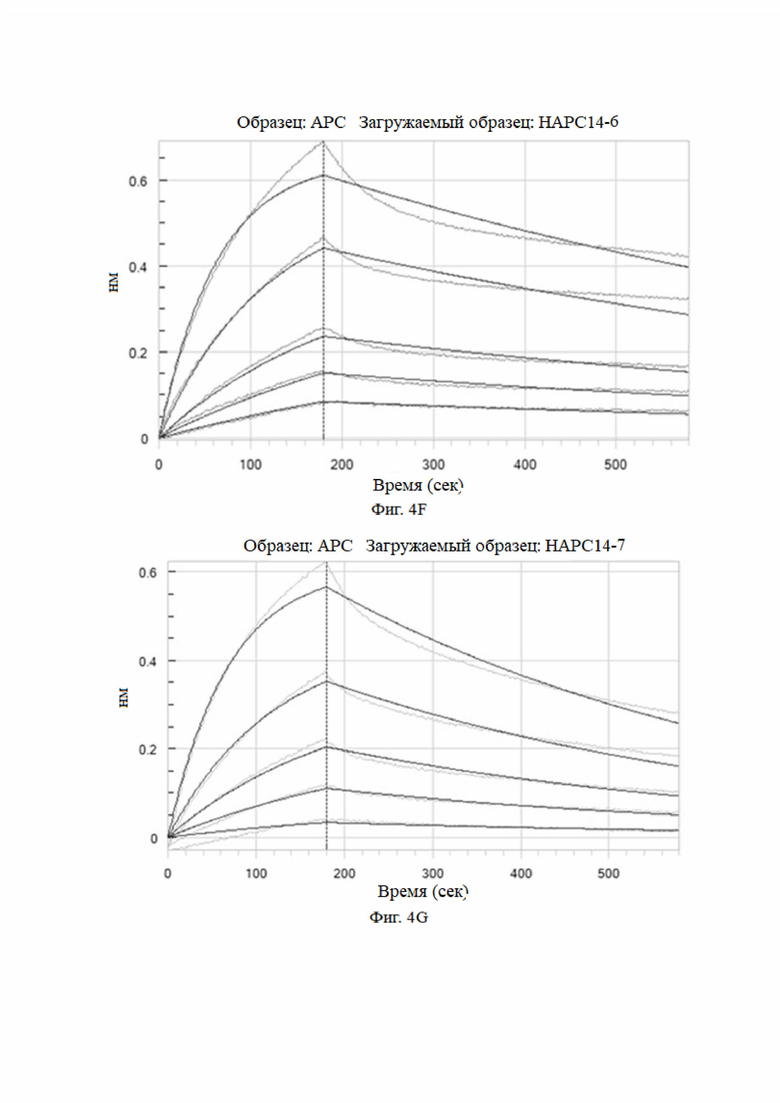
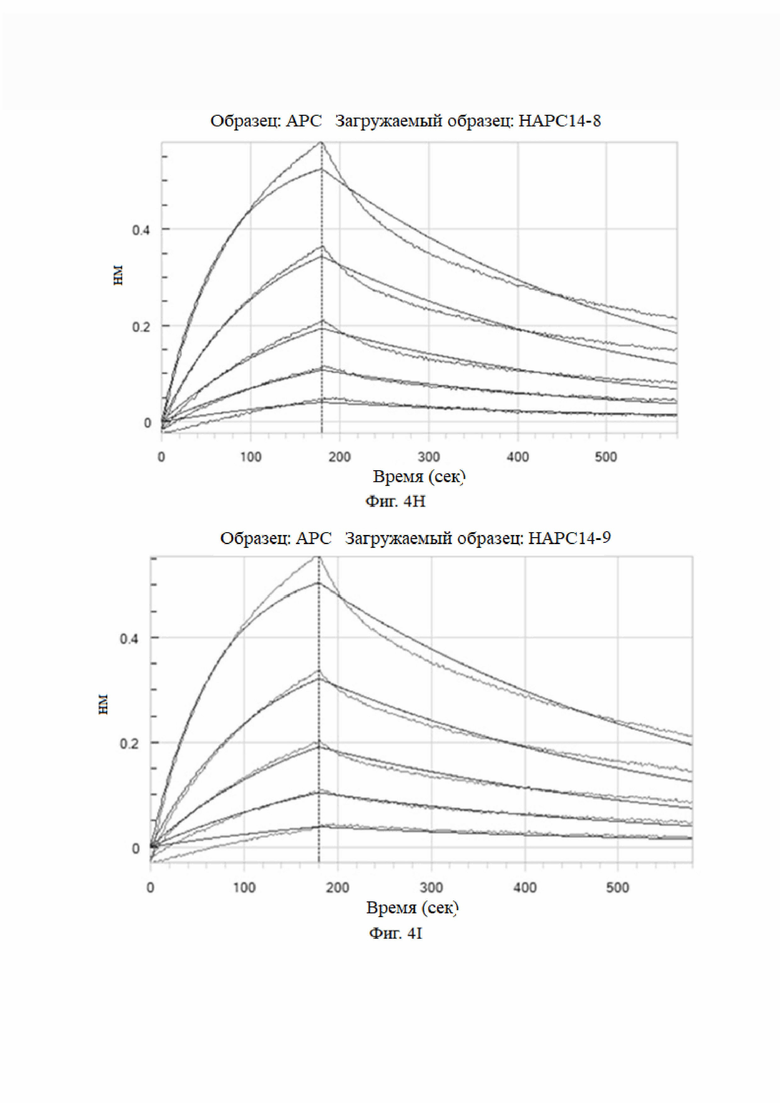
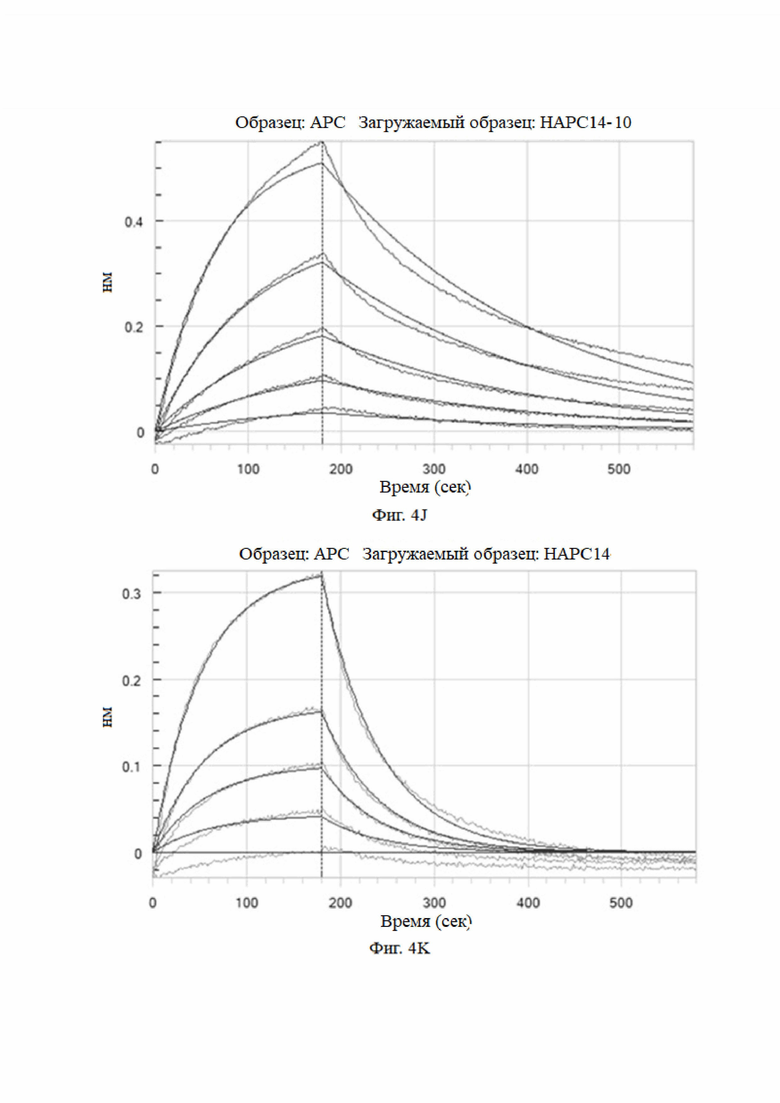
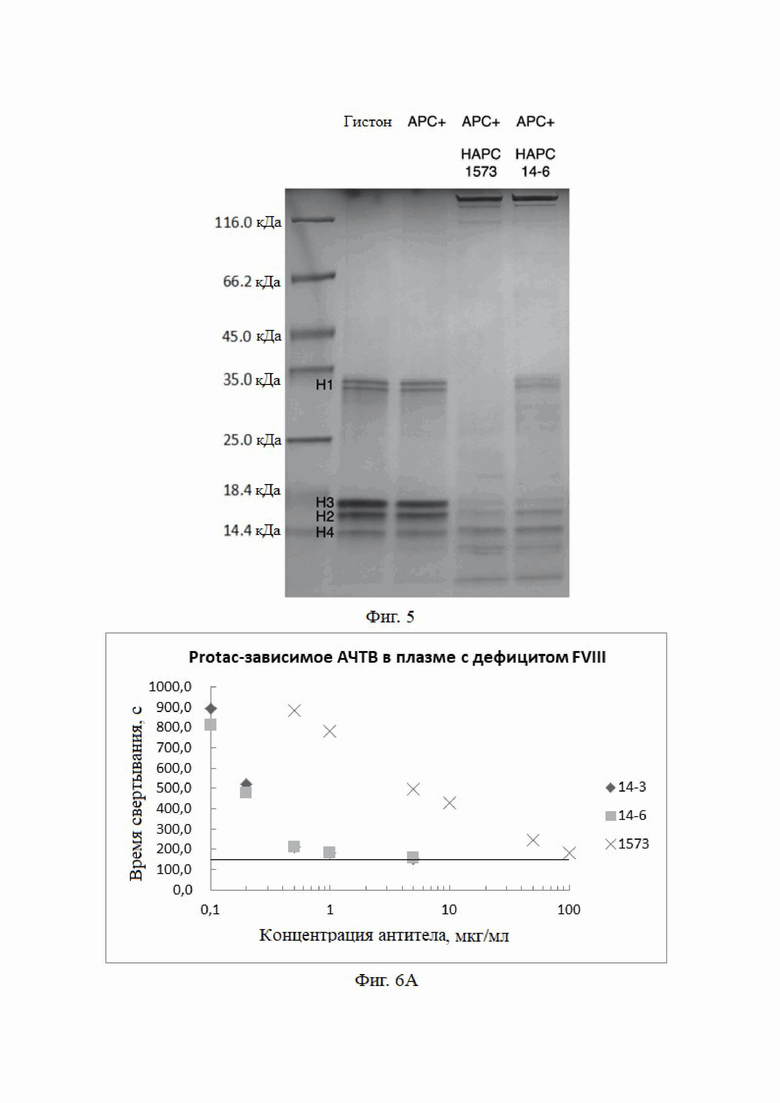
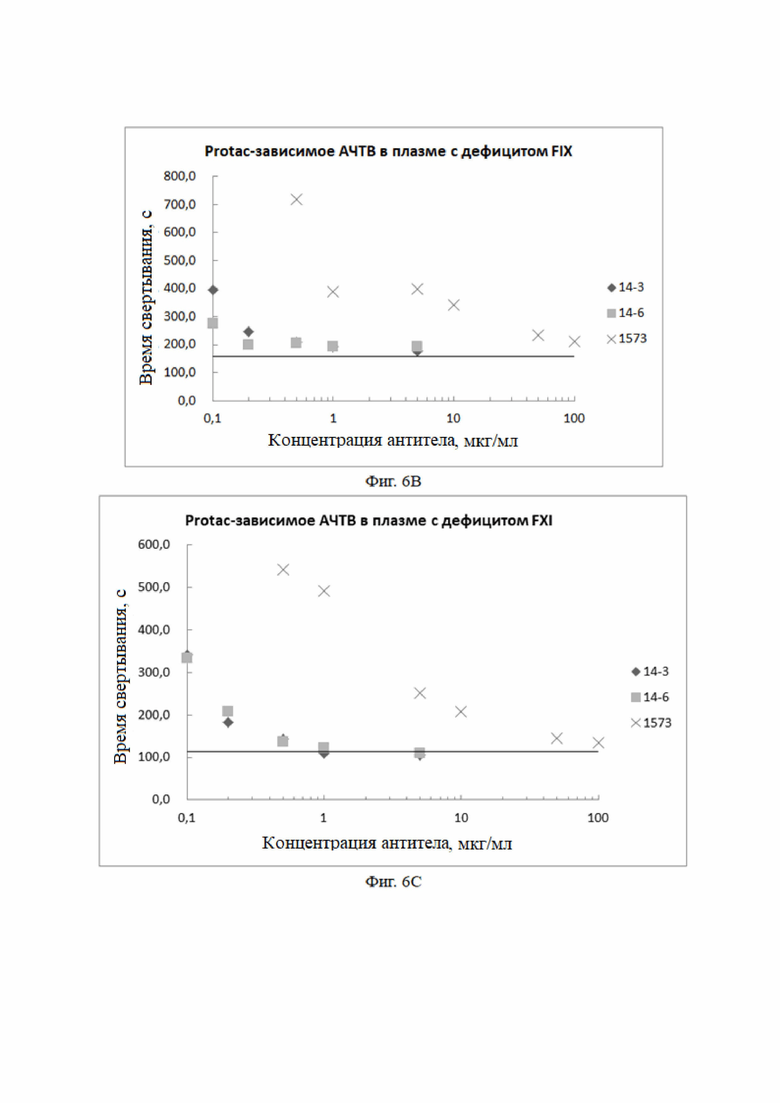
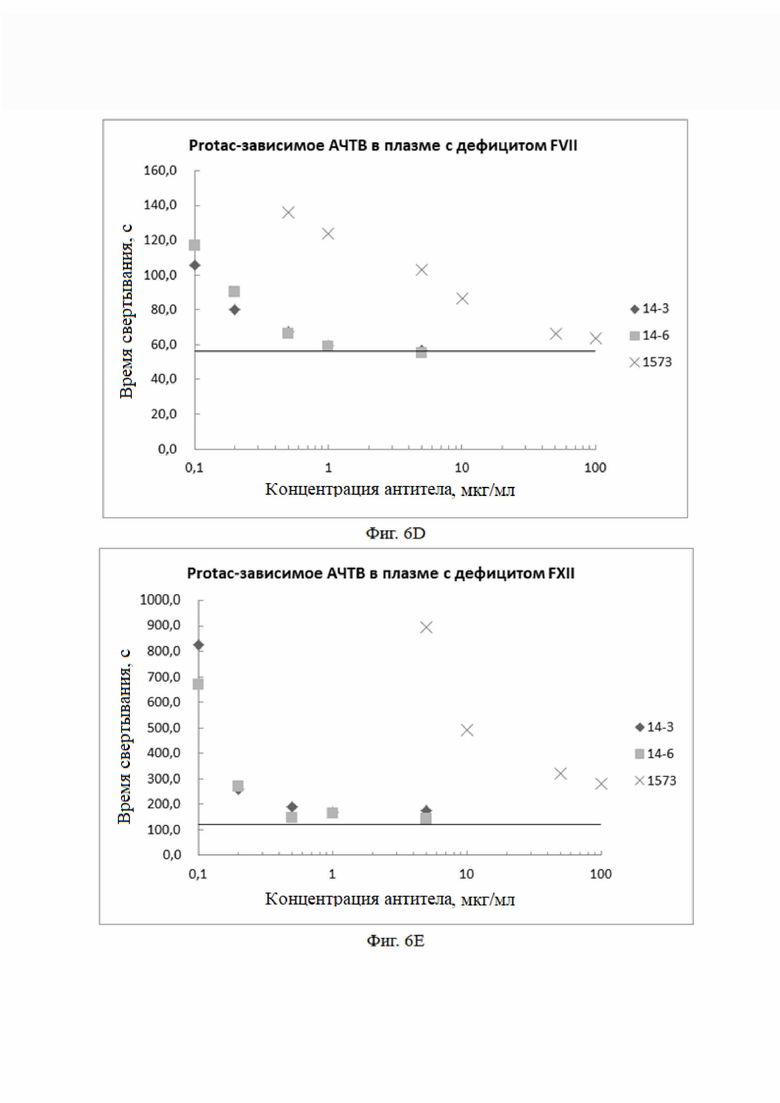
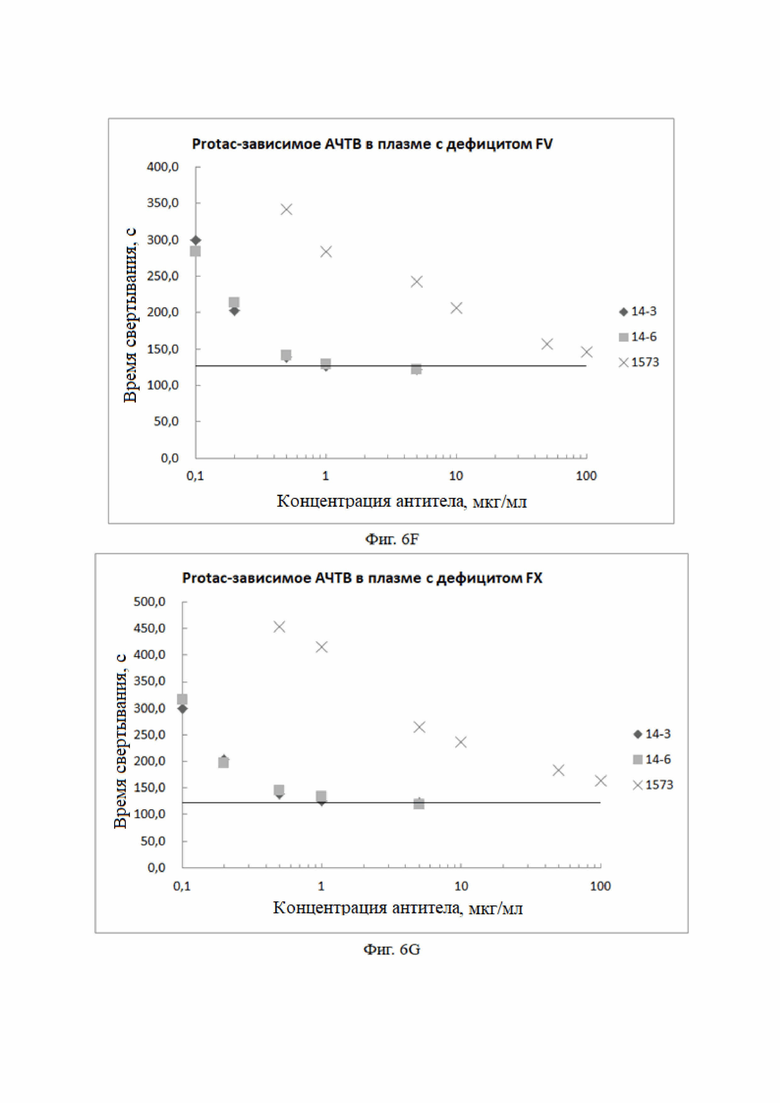
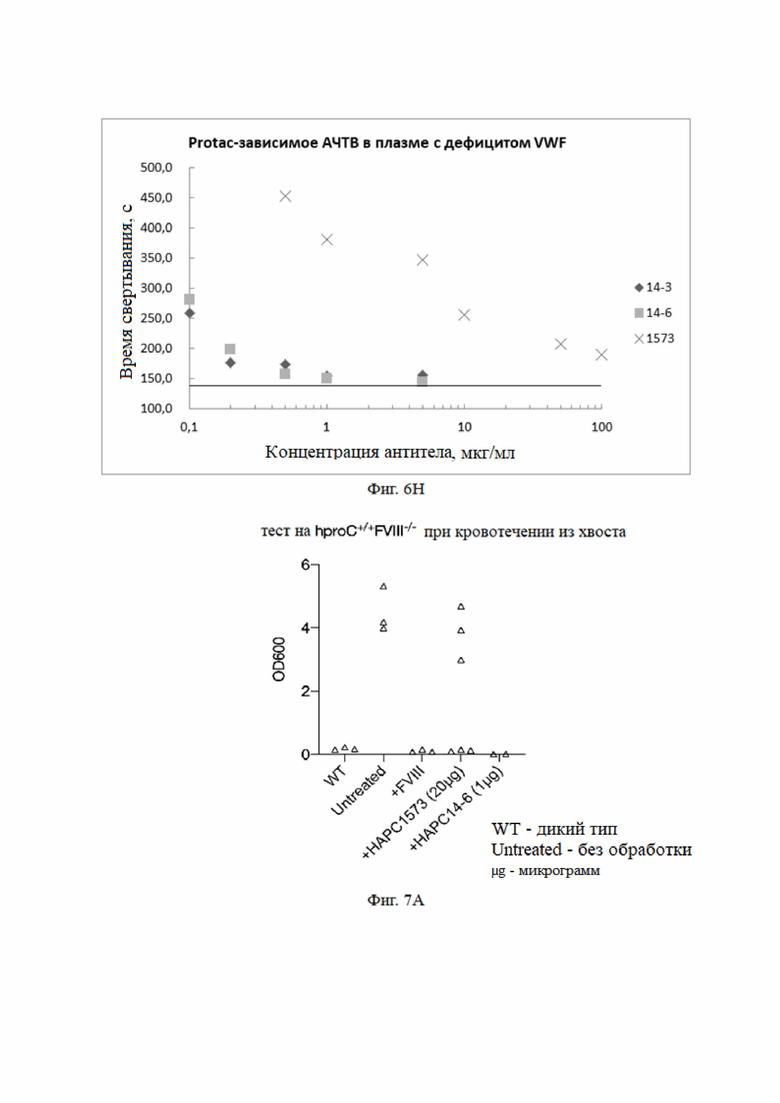
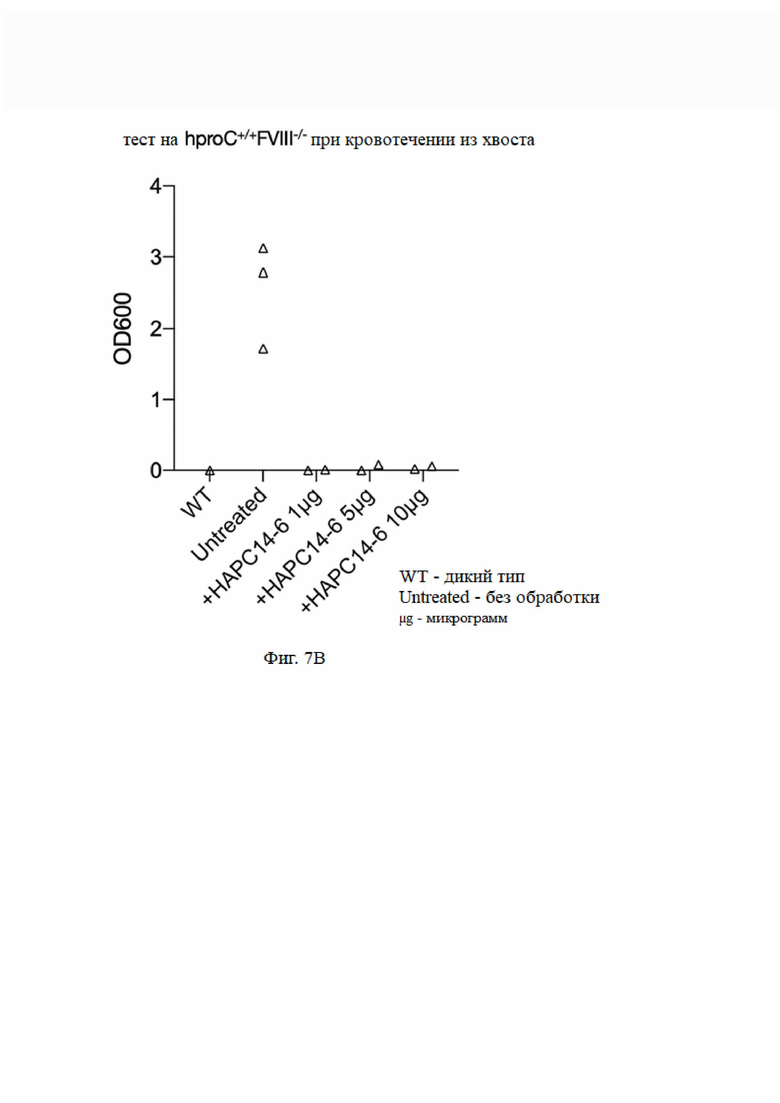
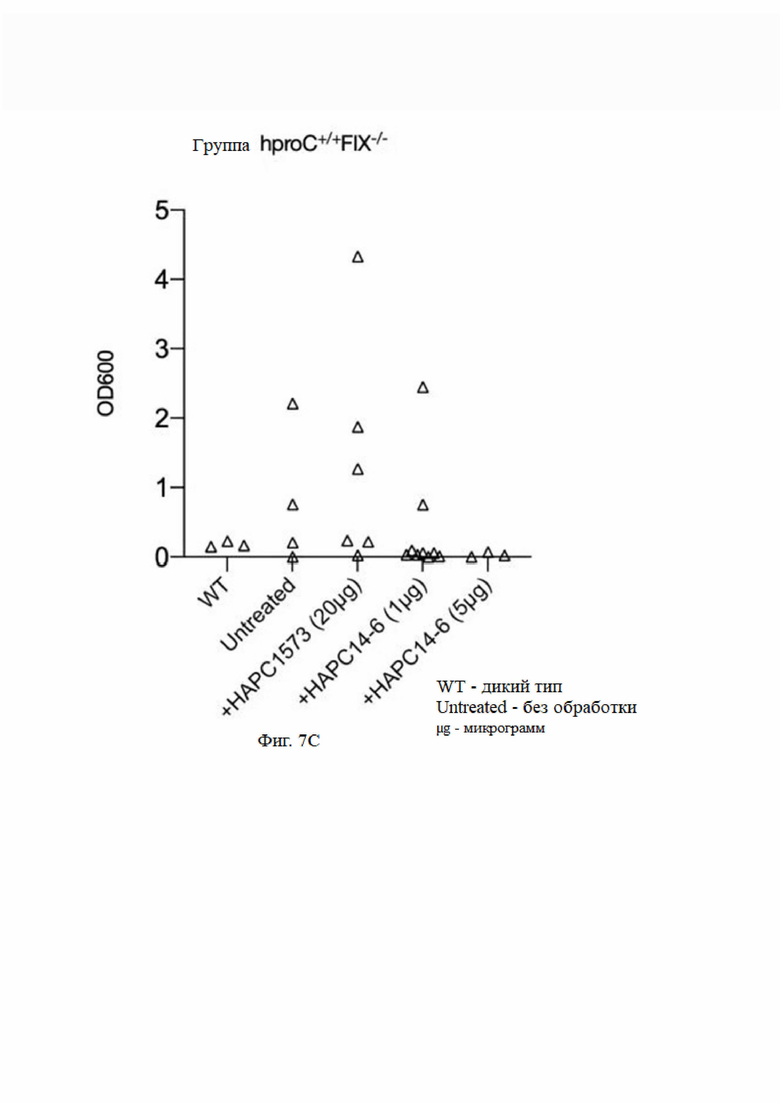
Изобретение относится к биотехнологии и медицине, в частности к моноклональным антителам к активированному белку С (аРС). Аминокислотные последовательности тяжелой цепи и легкой цепи моноклонального антитела показаны в SEQ ID NO: 5-26, а последовательности CDR показаны в SEQ ID NO: 27-92. В настоящем изобретении дополнительно предлагается биологический материал, связанный с моноклональным антителом, и моноклональное антитело, способное селективно связываться с аРС, а не с неактивированным белком С, а также применение моноклонального антитела и связанного с ним биологического материала при приготовлении лекарственного средства для лечения расстройств, связанных с недостаточностью или дефектом свертывания, и связанного с ним способа лечения. Антитела по настоящему изобретению могут блокировать антикоагулянтную активность aPC и имеют широкие перспективы применения при лечении расстройств, связанных с недостаточностью или дефектом свертывания. 12 н. и 8 з.п. ф-лы, 7 ил., 7 табл., 6 пр.
1. Моноклональное антитело для связывания с aPC (активированный белок C) или его фрагмент, где антитело содержит одно из следующего:
антитела, содержащего (c) CDR тяжелой цепи, представленные SEQ ID NO: 33, 34 и 35; и
(d) CDR легкой цепи, представленные SEQ ID NO: 36, 37 и 38;
антитела, содержащего (e) CDR тяжелой цепи, представленные SEQ ID NO: 39, 40 и 41; и
(f) CDR легкой цепи, представленные SEQ ID NO: 42, 43 и 44;
антитела, содержащего (g) CDR тяжелой цепи, представленные SEQ ID NO: 45, 46 и 47; и
(h) CDR легкой цепи, представленные SEQ ID NO: 48, 49 и 50;
антитела, содержащего (i) CDR тяжелой цепи, представленные SEQ ID NO: 51, 52 и 53; и
(j) CDR легкой цепи, представленные SEQ ID NO: 54, 55 и 56;
антитела, содержащего (k) CDR тяжелой цепи, представленные SEQ ID NO: 57, 58 и 59; и
(l) CDR легкой цепи, представленные SEQ ID NO: 60, 61 и 62;
антитела, содержащего (m) CDR тяжелой цепи, представленные SEQ ID NO: 63, 64 и 65; и
(n) CDR легкой цепи, представленные SEQ ID NO: 66, 67 и 68;
антитела, содержащего (o) CDR тяжелой цепи, представленные SEQ ID NO: 69, 70 и 71; и
(p) CDR легкой цепи, представленные SEQ ID NO: 72, 73 и 74;
антитела, содержащего (q) CDR тяжелой цепи, представленные SEQ ID NO: 75, 76 и 77; и
(r) CDR легкой цепи, представленные SEQ ID NO: 78, 79 и 80;
антитела, содержащего (s) CDR тяжелой цепи, представленные SEQ ID NO: 81, 82 и 83; и
(t) CDR легкой цепи, представленные SEQ ID NO: 84, 85 и 86; и
антитела, содержащего (u) CDR тяжелой цепи, представленные SEQ ID NO: 87, 88 и 89; и
(v) CDR легкой цепи, представленные SEQ ID NO: 90, 91 и 92.
2. Моноклональное антитело по п. 1, которое выбрано из одного из следующего: антитела, содержащего тяжелую цепь, как показано в SEQ ID NO: 7, и легкую цепь, как показано в SEQ ID NO: 8;
антитела, содержащего тяжелую цепь, как показано в SEQ ID NO: 9, и легкую цепь, как показано в SEQ ID NO: 10;
антитела, содержащего тяжелую цепь, как показано в SEQ ID NO: 11, и легкую цепь, как показано в SEQ ID NO: 12;
антитела, содержащего тяжелую цепь, как показано в SEQ ID NO: 13, и легкую цепь, как показано в SEQ ID NO: 14;
антитела, содержащего тяжелую цепь, как показано в SEQ ID NO: 15, и легкую цепь, как показано в SEQ ID NO: 16;
антитела, содержащего тяжелую цепь, как показано в SEQ ID NO: 17, и легкую цепь, как показано в SEQ ID NO: 18;
антитела, содержащего тяжелую цепь, как показано в SEQ ID NO: 19, и легкую цепь, как показано в SEQ ID NO: 20;
антитела, содержащего тяжелую цепь, как показано в SEQ ID NO: 21, и легкую цепь, как показано в SEQ ID NO: 22;
антитела, содержащего тяжелую цепь, как показано в SEQ ID NO: 23, и легкую цепь, как показано в SEQ ID NO: 24; и
антитела, содержащего тяжелую цепь, как показано в SEQ ID NO: 25, и легкую цепь, как показано в SEQ ID NO: 26.
3. Моноклональное антитело по п. 1, где фрагмент антитела представляет собой Fab', Fab, F(ab')2, однодоменное антитело, Fv или scFv.
4. Молекула нуклеиновой кислоты, кодирующая моноклональное антитело по любому из пп. 1-3.
5. Конструкция для экспрессии моноклонального антитела по любому из пп. 1-3, содержащая молекулу нуклеиновой кислоты по п. 4.
6. Система экспрессии, содержащая молекулу нуклеиновой кислоты по п. 4.
7. Фармацевтическая композиция, ингибирующая антикоагулянтную активность aPC, содержая моноклональное антитело по любому из пп. 1-3 и фармацевтически приемлемый носитель.
8. Набор для детектирования aPC, содержащий моноклональное антитело по любому из пп. 1-3 и буфер, разбавитель, инструкции по эксплуатации.
9. Способ лечения расстройств, связанных со свертыванием, включающий введение индивидууму, нуждающемуся в лечении, эффективного количества моноклонального антитела по любому из пп. 1-3; причем индивидуум страдает от расстройств, связанных с недостаточностью или дефектом свертывания, или индивидууму необходимо лечение свертывания крови, или индивидуум страдает сепсисом или гемофилией, или индивидууму необходимо регулирование гемостаза.
10. Применение моноклонального антитела по любому из пп. 1-3 при приготовлении лекарственного средства, ингибирующего антикоагулянтную активность aPC.
11. Применение по п. 10, где лекарственное средство предназначено для предотвращения и/или лечения расстройств, связанных с недостаточностью или дефектом свертывания.
12. Применение по п. 11, где расстройства, связанные с недостаточностью или дефектом свертывания, включают расстройства, вызывающие коагулопатию из-за дефицита факторов свертывания и, таким образом, вызывающие кровотечение, и нарушения свертывания, вызванные травмой или хирургическим вмешательством.
13. Применение по п. 11, где расстройства, связанные с недостаточностью или дефектом свертывания, включают гемофилию, сепсис и травматическое кровоизлияние.
14. Применение по п. 10, где лекарственное средство предназначено для ингибирования антикоагулянтной активности активированного белка С у индивидуума.
15. Применение по п. 10, где лекарственное средство предназначено для лечения индивидуума, нуждающегося в свертывании крови.
16. Применение по п. 10, где лекарственное средство предназначено для регулирования гемостаза у индивидуума.
17. Применение моноклонального антитела по любому из пп. 1-3 при получении промотора для повышения способности aPC расщеплять гистоны H3 и H4.
18. Применение моноклонального антитела по любому из пп. 1-3 в иммунологических анализах для диагностики и лечения заболеваний или не связанных с заболеванием.
19. Применение моноклонального антитела по любому из пп. 1-3 при приготовлении реагента для детектирования aPC.
20. Применение моноклонального антитела по любому из пп. 1-3 при приготовлении набора для детектирования aPC.
| WO 2014085527 A1, 05.06.2014 | |||
| YAN S.B | |||
| et al., Evaluation of anti-activated protein C antibody development in patients with severe sepsis from four clinical studies with drotrecogin alpha (activated), J Thromb Haemost, 2009, vol | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| Вентиль для нефтепроводов | 1924 |
|
SU1787A1 |
| ZHAO X | |||
| Y | |||
| et al., Targeted inhibition of activated protein C by a non-active-site inhibitory | |||
Авторы
Даты
2024-08-08—Публикация
2021-07-28—Подача