ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области средств на основе антител. В частности, настоящее изобретение относится к средствам на основе антител к TSLP (тимический стромальный лимфопоэтин) и их применению.
УРОВЕНЬ ТЕХНИКИ
Утверждения в данном разделе относятся только к общей информации, связанной с настоящим изобретением, и не обязательно составляют уровень техники.
Астма представляет собой серьезное хроническое воспалительное заболевание дыхательных путей. В мире насчитывается около 334 миллионов пациентов с астмой и около 30 миллионов пациентов с астмой в Китае, где уровень смертности намного выше, чем в развитых странах. По мере ухудшения состояния окружающей среды и увеличения уровня загрязнения воздуха все больше людей могут страдать от этого заболевания, которое серьезно угрожает жизни и здоровью людей.
Тимический стромальный лимфопоэтин (TSLP) представляет собой цитокин эпителиальных клеток, продуцируемый в ответ на провоспалительные стимулы. Он в основном способствует аллергическому воспалению за счет своей активности на дендритных клетках и тучных клетках. TSLP представляет собой вид интерлейкин 7 (IL-7)-подобного цитокина, который был впервые обнаружен в кондиционированной среде стромальных клеток тимуса мыши. TSLP в основном экспрессируется в эпителиальных клетках легких, кожи и кишечника. TSLP состоит из 4 α-спиралей и двух петель AB и CD. В его молекуле содержится три пары дисульфидных связей, состоящих из шести цистеинов, два сайта N-гликозилирования, и молекулярная масса составляет около 15-20 кДа. Рецептор TSLP представляет собой комплекс, состоящий из двух частей, одна из которых представляет собой TSLPR, а другая - IL7Rα. TSLP сначала связывается с TSLPR с относительно низкой аффинностью, затем рекрутирует связывание IL7Rα с высокой аффинностью и, наконец, активирует сигнальные пути stat5 и т.д., что приводит к созреванию ДК и дифференцировке T-клеток.
Миелоидные дендритные клетки (мДК) являются основными эффекторными клетками для TSLP. TSLP действует на незрелые мДК, секретирующие цитокины IL-8, эотаксин-2, TARC и MDC, при этом на высоком уровне экспрессируя OX40L. В отсутствие IL-12 OX40L связывается с нативными CD4+ Т-клетками, что приводит к их дифференцировке в Th2-клетки. Затем Th2-клетки секретируют Th2-цитокины, такие как IL-5, IL-4, IL-9, IL-9 и TNF, вызывая воспалительный ответ Th2-типа в организме. Кроме того, TSLP также может индуцировать продукцию ДК-клетками цитокина IL-8, который, в свою очередь, рекрутирует нейтрофилы, что приводит к нейтрофильному воспалительному ответу врожденного иммунитета. TSLP также может индуцировать продукцию ДК-клетками эотаксина-2, который рекрутирует эозинофилы и действует совместно с IL5, заставляя организм быстро запустить воспалительный процесс эозинофильной инфильтрации. TSLP также воздействует на тучные клетки и естественные клетки-киллеры и опосредует воспалительный ответ врожденного иммунитета, индуцируя продукцию IL-4, IL-6, IgE и т.д. Таким образом, TSLP может вызывать воспалительный ответ врожденного иммунитета и воспаление Th2-типа одновременно, что, в свою очередь, увеличивает слизеобразование в тканях, ремоделирует дыхательные пути, что приводит к стенозу трахеи, и приводит к тяжелой форме клеточного фиброза. Воспаление постепенно развивается в три основных аллергических заболевания: астму, аллергический дерматит и аллергический ринит. Следовательно, блокирование TSLP является потенциально эффективной стратегией лечения таких заболеваний, как астма, аллергический дерматит и т.д.
Известные на настоящий момент антитела к TSLP раскрыты в WO 2008155365, WO 2009035577, WO 2011056772, WO 2016142426 и WO 2017004149. Однако соответствующие антитела недоступны на рынке. Следовательно, необходимо продолжить разработку эффективных препаратов для лечения заболеваний, связанных с TSLP.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к антителу к TSLP.
В некоторых вариантах осуществления антитело к TSLP, как описано выше, содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи антитела, где:
i) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 14, SEQ ID NO: 15 и SEQ ID NO: 47, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2, представленные в SEQ ID NO: 17, SEQ ID NO: 18, соответственно, и LCDR3, представленную в SEQ ID NO: 48 или 55;
где последовательность SEQ ID NO: 47 представляет собой EDYDYDGYAMDX1, последовательность SEQ ID NO: 48 представляет собой QQWSSX2RT, последовательность SEQ ID NO: 55 представляет собой QQSDX3X4RX5, где X1 представляет собой H или Y, X2 представляет собой N или D, X3 представляет собой N или S, X4 представляет собой V или G, X5 представляет собой G или E; или
ii) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 20, SEQ ID NO: 21 и SEQ ID NO: 22, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 76, SEQ ID NO: 24 и SEQ ID NO: 25, соответственно;
где последовательность SEQ ID NO: 76 представляет собой RASESVDX6SGLSFMH, где X6 выбран из N, S или Q; или
iii) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 26, SEQ ID NO: 96 и SEQ ID NO: 28, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 29, SEQ ID NO: 118 и SEQ ID NO: 31, соответственно;
где последовательность SEQ ID NO: 96 представляет собой VIDPGX7X8DTNYNE, последовательность SEQ ID NO: 118 представляет собой X9VX10X11X12X13T, где X7 выбран из N, Q и V, X8 представляет собой G или V; X9 представляет собой Y или E, X10 выбран из S, D и E, X11 выбран из N, Q, D и E, X12 выбран из H, Y, D и E, X13 представляет собой E или Y; или
iv) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 32, SEQ ID NO: 33 и SEQ ID NO: 34, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 35, SEQ ID NO: 36 и SEQ ID NO: 37, соответственно.
В некоторых вариантах осуществления антитело к TSLP, как описано выше, содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, где:
i) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 14, SEQ ID NO: 15 и SEQ ID NO: 16, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 19, соответственно; или
ii) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 14, SEQ ID NO: 15 и SEQ ID NO: 45, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 46, соответственно; или
iii) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 14, SEQ ID NO: 15 и SEQ ID NO: 45, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 53, соответственно; или
iv) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 14, SEQ ID NO: 15 и SEQ ID NO: 45, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 54, соответственно; или
v) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 20, SEQ ID NO: 21 и SEQ ID NO: 22, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 23, SEQ ID NO: 24 и SEQ ID NO: 25, соответственно; или
vi) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 20, SEQ ID NO: 21 и SEQ ID NO: 22, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 70, SEQ ID NO: 24 и SEQ ID NO: 25, соответственно; или
vii) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 20, SEQ ID NO: 21 и SEQ ID NO: 22, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 71, SEQ ID NO: 24 и SEQ ID NO: 25, соответственно; или
viii) вариабельная область тяжелой цепи содержит HCDR1 и HCDR3, представленные в SEQ ID NO: 26, SEQ ID NO: 28, соответственно, и HCDR2, представленную в SEQ ID NO: 27, 93, 94 или 95, и вариабельная область легкой цепи содержит LCDR1 и LCDR3, представленные в SEQ ID NO: 29, SEQ ID NO: 31, соответственно, и LCDR2, представленную в SEQ ID NO: 30, 108, 109, 110, 111, 112, 113, 114, 115, 116 или 117.
В некоторых вариантах осуществления антитело к TSLP, как описано выше, содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, где:
a) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 29, SEQ ID NO: 30 и SEQ ID NO: 31, соответственно; или
b) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 26, SEQ ID NO: 93 и SEQ ID NO: 28, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 29, SEQ ID NO: 30 и SEQ ID NO: 31, соответственно; или
c) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 26, SEQ ID NO: 94 и SEQ ID NO: 28, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 29, SEQ ID NO: 30 и SEQ ID NO: 31, соответственно; или
d) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 26, SEQ ID NO: 95 и SEQ ID NO: 28, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 29, SEQ ID NO: 30 и SEQ ID NO: 31, соответственно; или
e) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 29, SEQ ID NO: 108 и SEQ ID NO: 31, соответственно; или
f) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 29, SEQ ID NO: 109 и SEQ ID NO: 31, соответственно; или
g) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 29, SEQ ID NO: 110 и SEQ ID NO: 31, соответственно; или
h) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 29, SEQ ID NO: 111 и SEQ ID NO: 31, соответственно; или
i) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 29, SEQ ID NO: 112 и SEQ ID NO: 31, соответственно; или
j) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 29, SEQ ID NO: 113 и SEQ ID NO: 31, соответственно; или
k) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 29, SEQ ID NO: 114 и SEQ ID NO: 31, соответственно; или
l) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 29, SEQ ID NO: 115 и SEQ ID NO: 31, соответственно; или
m) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 29, SEQ ID NO: 116 и SEQ ID NO: 31, соответственно; или
n) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 29, SEQ ID NO: 117 и SEQ ID NO: 31, соответственно.
В некоторых вариантах осуществления антитела к TSLP, как описано выше, антитело к TSLP представляет собой мышиное антитело, химерное антитело или гуманизированное антитело.
В некоторых вариантах осуществления антитела к TSLP, как описано выше, антитело к TSLP содержит каркасную область (области), полученную из человеческого антитела, или антитело к TSLP содержит вариабельную область легкой цепи и/или вариабельную область тяжелой цепи, выбранные из описанных в (a), (b), (c) или (d) ниже:
a) вариабельная область тяжелой цепи содержит HCDR1 и HCDR2, представленные в SEQ ID NO: 14, SEQ ID NO: 15, соответственно, и HCDR3, представленную в SEQ ID NO: 16 или 45, и ее каркасная область (области) содержит не более 10 обратных мутаций, предпочтительно обратная мутация выбрана из одной или более из 38K, 48I, 67A, 69L, 71V и 73K; и/или вариабельная область легкой цепи содержит LCDR1 и LCDR2, представленные в SEQ ID NO: 17, SEQ ID NO: 18, соответственно, и LCDR3, представленную в SEQ ID NO: 19, 46, 53 или 54, и ее каркасная область (области) содержит не более 10 обратных аминокислотных мутаций, предпочтительно обратная мутация выбрана из одной или более из 46P, 47W, 58V, 70S и 71Y;
b) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 20, SEQ ID NO: 21 и SEQ ID NO: 22, соответственно, и ее каркасная область (области) содержит не более 10 обратных мутаций, предпочтительно обратная мутация выбрана из одной или более из 2A, 27F, 38K, 39H, 48I, 67A, 69L, 71V и 76R; и/или вариабельная область легкой цепи содержит LCDR2 и LCDR3, представленные в SEQ ID NO: 24, SEQ ID NO: 25, соответственно, и LCDR1, представленную в SEQ ID NO: 23, 70 или 71, и ее каркасная область (области) содержит не более 10 обратных аминокислотных мутаций, предпочтительно обратная мутация представляет собой одну или более из 1D, 4L, 43P, 48L и 58I;
c) вариабельная область тяжелой цепи содержит HCDR1 и HCDR3, представленные в SEQ ID NO: 26, SEQ ID NO: 28, соответственно, и HCDR2, представленную в SEQ ID NO: 27, 93, 94 или 95, и ее каркасная область (области) содержит не более 10 обратных мутаций, предпочтительно обратная мутация выбрана из одной или более из 27Y, 28A, 38K, 48I, 66K, 67A, 69L, 80I и 82b R; и/или вариабельная область легкой цепи содержит LCDR1 и LCDR3, представленные в SEQ ID NO: 29, SEQ ID NO: 31, соответственно, и LCDR2, представленную в SEQ ID NO: 30, 108, 109, 110, 111, 112, 113, 114, 115, 116 или 117, и ее каркасная область (области) содержит не более 10 обратных мутаций, предпочтительно обратная мутация выбрана из одной или более из 1S, 43S, 67Y и 73F; или
d) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 32, SEQ ID NO: 33 и SEQ ID NO: 34, соответственно, и ее каркасная область (области) содержит не более 10 обратных мутаций, предпочтительно обратная мутация выбрана из одной или более из 38K, 48I, 66K, 67A, 69L, 71V, 73K и 78A; и/или вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 35, SEQ ID NO: 36 и SEQ ID NO: 37, соответственно, и ее каркасная область (области) содержит не более 10 обратных мутаций, предпочтительно обратная мутация выбрана из одной или более из 43S, 45Q, 48V, 66V и 70Q.
В некоторых вариантах осуществления антитело к TSLP, как описано выше, содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, где:
i) вариабельная область тяжелой цепи обладает по меньшей мере 90%, 92%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с вариабельной областью тяжелой цепи, представленной в аминокислотной последовательности SEQ ID NO: 6, 42, 43, 44 или 50, и вариабельная область легкой цепи обладает по меньшей мере 90%, 92%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с вариабельной областью легкой цепи, представленной в аминокислотной последовательности SEQ ID NO: 7, 38, 39, 40, 41, 49, 51 или 52; или
ii) вариабельная область тяжелой цепи обладает по меньшей мере 90%, 92%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с вариабельной областью тяжелой цепи, представленной в аминокислотной последовательности SEQ ID NO: 8, 62, 63, 64, 65, 66, 67, 68 или 69, и вариабельная область легкой цепи обладает по меньшей мере 90%, 92%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с вариабельной областью легкой цепи, представленной в аминокислотной последовательности SEQ ID NO: 9, 56, 57, 58, 59, 60, 61, 72, 73, 74 или 75; или
iii) вариабельная область тяжелой цепи обладает по меньшей мере 90%, 92%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с вариабельной областью тяжелой цепи, представленной в аминокислотной последовательности SEQ ID NO: 10, 85, 86, 87, 88, 89, 90, 91, 92 или 97, и вариабельная область легкой цепи обладает по меньшей мере 90%, 92%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с вариабельной областью легкой цепи, представленной в аминокислотной последовательности SEQ ID NO: 11, 77, 78, 79, 80, 81, 82, 83, 84, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107 или 119; или
iv) вариабельная область тяжелой цепи обладает по меньшей мере 90%, 92%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с вариабельной областью тяжелой цепи, представленной в аминокислотной последовательности SEQ ID NO: 12, 126, 127, 128, 129, 130, 131 или 132, и вариабельная область легкой цепи обладает по меньшей мере 90%, 92%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью последовательности с вариабельной областью легкой цепи, представленной в аминокислотной последовательности SEQ ID NO: 13, 120, 121, 122, 123, 124 или 125.
В некоторых вариантах осуществления антитела к TSLP, как описано выше, антитело к TSLP представляет собой гуманизированное антитело, содержащее каркасную область (области), полученную из человеческого антитела, или вариант его каркасной области, где указанный вариант каркасной области имеет не более 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 обратных аминокислотных мутаций в каркасной области (областях) легкой цепи и/или каркасной области (областях) тяжелой цепи человеческого антитела, соответственно.
В некоторых вариантах осуществления антитела к TSLP, как описано выше, вариант каркасной области содержит обратные мутации, выбранные из описанных в (a), (b), (c) или (d) ниже:
a) одна или более обратных аминокислотных мутаций, выбранных из группы, состоящей из 46P, 47W, 58V, 70S и 71Y, содержащиеся в каркасной области (областях) вариабельной области легкой цепи, представленной в SEQ ID NO: 38, 49, 51 или 52, и/или одна или более обратных аминокислотных мутаций, выбранных из группы, состоящей из 38K, 48I, 67A, 69L, 71V и 73K, содержащиеся в каркасной области (областях) вариабельной области тяжелой цепи, представленной в SEQ ID NO: 42 или 50;
b) одна или более обратных аминокислотных мутаций, выбранных из группы, состоящей из 1D, 4L, 43P, 48L и 58I, содержащиеся в каркасной области (областях) вариабельной области легкой цепи, представленной в SEQ ID NO: 56, 59, 72, 73, 74 или 75, и/или одна или более обратных аминокислотных мутаций, выбранных из группы, состоящей из 2A, 27F, 38K, 39H, 48I, 67A, 69L, 71V и 76R, содержащиеся в каркасной области (областях) вариабельной области тяжелой цепи, представленной в SEQ ID NO: 62;
c) одна или более обратных аминокислотных мутаций, выбранных из группы, состоящей из 1S, 43S, 67Y и 73F, содержащиеся в каркасной области (областях) вариабельной области легкой цепи, представленной в SEQ ID NO: 77, 81, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107 или 119, и/или одна или более обратных аминокислотных мутаций, выбранных из группы, состоящей из 27Y, 28A, 38K, 48I, 66K, 67A, 69L, 80I и 82b R, содержащиеся в каркасной области (областях) вариабельной области тяжелой цепи, представленной в SEQ ID NO: 85, 90, 91, 92 или 97;
d) одна или более обратных аминокислотных мутаций, выбранных из группы, состоящей из 43S, 45Q, 48V, 66V и 70Q, содержащиеся в каркасной области (областях) вариабельной области легкой цепи, представленной в SEQ ID NO: 120, и/или одна или более обратных аминокислотных мутаций, выбранных из группы, состоящей из 38K, 48I, 66K, 67A, 69L, 71V, 73K и 78A, содержащиеся в каркасной области вариабельной области тяжелой цепи, представленной в SEQ ID NO: 126.
В некоторых вариантах осуществления антитело к TSLP, как описано выше, содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, где:
i) аминокислотная последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 6, 42, 43, 44 или 50, и аминокислотная последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 7, 38, 39, 40, 41, 49, 51 или 52; или
ii) аминокислотная последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 8, 62, 63, 64, 65, 66, 67, 68 или 69, и аминокислотная последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 9, 56, 57, 58, 59, 60, 61, 72, 73, 74 или 75; или
iii) аминокислотная последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 10, 85, 86, 87, 88, 89, 90, 91, 92 или 97, и аминокислотная последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 11, 77, 78, 79, 80, 81, 82, 83, 84, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107 или 119; или
iv) аминокислотная последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 12, 126, 127, 128, 129, 130, 131 или 132, и аминокислотная последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 13, 120, 121, 122, 123, 124 или 125.
В некоторых вариантах осуществления антитело к TSLP, как описано выше, содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, представленные ниже:
(a) последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 6, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 7;
(b) последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 42, 43 или 44, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 39, 40 или 41;
(c) последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 43, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 38;
(d) последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 50, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 49, 51 или 52;
(e) последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 8, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 9;
(f) последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 62, 63, 64 или 65, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 56, 57 или 58;
(g) последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 64, 66, 67, 68 или 69, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 59, 60 или 61;
(h) последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 64, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 72 или 73;
(i) последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 69, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 74;
(j) последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 10, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 11;
(k) последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 85, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 77, 78, 102 или 104;
(l) последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 86 или 88, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 77 или 78;
(m) последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 87, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 77, 78, 79, 81, 82, 83, 84, 98, 99, 100, 101, 103, 105, 106 или 107;
(n) последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 89, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 79, 81, 82, 83 или 84;
(o) последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 90, 91 или 92, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 78;
(p) последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 97, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 119;
(q) последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 12, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 13;
(r) последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 127, 128, 129, 130, 131 или 132, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 120, 121, 123, 124 или 125; или
(s) последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 132, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 125.
В некоторых вариантах осуществления антитела к TSLP, как описано выше, комбинации вариабельной области легкой цепи и вариабельной области тяжелой цепи антител представлены следующим образом:
Таблица 1. Комбинации вариабельных областей легкой и тяжелой цепи гуманизированных антител mAb3
Таблица 2. Комбинации вариабельных областей легкой и тяжелой цепи гуманизированных антител mAb119
Таблица 3. Комбинации вариабельных областей легкой и тяжелой цепи гуманизированных антител mAb179
Таблица 4. Комбинации вариабельных областей легкой и тяжелой цепи гуманизированных антител mAb199
В некоторых вариантах осуществления антитела к TSLP, как описано выше, указанное антитело дополнительно содержит константную область (области) антитела; предпочтительно константная область тяжелой цепи константных областей антитела выбрана из группы, состоящей из константных областей человеческого IgG1, IgG2, IgG3 и IgG4 и их традиционных вариантов, константная область легкой цепи константных областей антитела выбрана из группы, состоящей из константных областей κ- и λ-цепи человеческого антитела и их традиционных вариантов; более предпочтительно антитело содержит константную область тяжелой цепи, представленную в последовательности SEQ ID NO: 133, и константную область легкой цепи, представленную в последовательности SEQ ID NO: 134.
В некоторых вариантах осуществления антитело к TSLP, как описано выше, содержит тяжелую цепь и легкую цепь, представленные ниже:
(a) аминокислотная последовательность тяжелой цепи соответствует представленной в SEQ ID NO: 135 или обладает по меньшей мере 90%, 92%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью указанной последовательности, и аминокислотная последовательность легкой цепи соответствует представленной в SEQ ID NO: 136 или обладает по меньшей мере 90%, 92%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью указанной последовательности;
(b) аминокислотная последовательность тяжелой цепи соответствует представленной в SEQ ID NO: 137 или обладает по меньшей мере 90%, 92%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью указанной последовательности, и аминокислотная последовательность легкой цепи соответствует представленной в SEQ ID NO: 138 или обладает по меньшей мере 90%, 92%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью указанной последовательности;
(c) аминокислотная последовательность тяжелой цепи соответствует представленной в SEQ ID NO: 139 или обладает по меньшей мере 90%, 92%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью указанной последовательности, и аминокислотная последовательность легкой цепи соответствует представленной в SEQ ID NO: 140 или обладает по меньшей мере 90% идентичностью указанной последовательности; или
(d) аминокислотная последовательность тяжелой цепи соответствует представленной в SEQ ID NO: 141 или обладает по меньшей мере 90%, 92%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью указанной последовательности, и аминокислотная последовательность легкой цепи соответствует представленной в SEQ ID NO: 142 или обладает по меньшей мере 90%, 92%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью указанной последовательности.
В некоторых вариантах осуществления антитело к TSLP, как описано выше, содержит тяжелую цепь и легкую цепь, представленные ниже:
(a) аминокислотная последовательность тяжелой цепи соответствует представленной в SEQ ID NO: 135, и аминокислотная последовательность легкой цепи соответствует представленной в SEQ ID NO: 136;
(b) аминокислотная последовательность тяжелой цепи соответствует представленной в SEQ ID NO: 137, и аминокислотная последовательность легкой цепи соответствует представленной в SEQ ID NO: 138;
(c) аминокислотная последовательность тяжелой цепи соответствует представленной в SEQ ID NO: 139, и аминокислотная последовательность легкой цепи соответствует представленной в SEQ ID NO: 140; или
(d) аминокислотная последовательность тяжелой цепи соответствует представленной в SEQ ID NO: 141, и аминокислотная последовательность легкой цепи соответствует представленной в SEQ ID NO: 142.
В некоторых вариантах осуществления указанное антитело конкурирует с антителом к TSLP, как описано выше, или его антигенсвязывающим фрагментом за связывание с человеческим TSLP.
В еще одном аспекте настоящее изобретение также относится к молекуле нуклеиновой кислоты, кодирующей антитело к TSLP, как описано выше.
В еще одном аспекте настоящее изобретение также относится к вектору экспрессии, содержащему молекулу нуклеиновой кислоты, как описано выше.
В еще одном аспекте настоящее изобретение также относится к клетке-хозяину, содержащей молекулу нуклеиновой кислоты, как описано выше, или вектор экспрессии, как описано выше, предпочтительно указанная клетка представляет собой бактериальную клетку, клетку гриба, клетку насекомого или клетку млекопитающего.
В некоторых вариантах осуществления настоящего изобретения предложен способ получения антитела к TSLP, как описано выше.
В некоторых вариантах осуществления настоящего изобретения предложена фармацевтическая композиция, содержащая терапевтически эффективное количество антитела к TSLP, как описано выше, или молекулы нуклеиновой кислоты, как описано выше, или клетки-хозяина, как описано выше, а также один или более фармацевтически приемлемых носителей, разбавителей, буферов или эксципиентов. Предпочтительно терапевтически эффективное количество означает 0,1-3000 мг или 1-1000 мг антитела к TSLP, как описано выше, содержащегося в разовой дозе композиции.
В некоторых вариантах осуществления настоящего изобретения предложен способ иммунодетекции или определения TSLP in vitro или ex vivo, включающий стадию применения антитела к TSLP, как описано выше.
В некоторых вариантах осуществления настоящего изобретения предложено применение антитела к TSLP, как описано выше, для получения реагентов для иммунодетекции человеческого TSLP.
В некоторых вариантах осуществления настоящего изобретения предложено антитело к TSLP, как описано выше, для применения для иммунодетекции или определения TSLP.
В некоторых вариантах осуществления настоящего изобретения предложен набор, содержащий антитело к TSLP, как описано выше.
В некоторых вариантах осуществления настоящего изобретения предложено применение антитела к TSLP, как описано выше, или молекулы нуклеиновой кислоты, как описано выше, или клетки-хозяина, как описано выше, или фармацевтической композиции, как описано выше, для получения лекарственного средства для лечения связанных с TSLP заболеваний, где связанное с TSLP заболевание включает, не ограничиваясь перечисленным: астму, идиопатический легочный фиброз, атопический дерматит, аллергический конъюнктивит, аллергический ринит, аллергический синусит, крапивницу, синдром Нетертона, эозинофильный эзофагит, пищевую аллергию, аллергическую диарею, эозинофильный гастроэнтерит, аллергический бронхолегочный аспергиллез, аллергический грибковый синусит, хронический зуд, рак, рак молочной железы, рак ободочной кишки, рак легкого, рак яичника, рак предстательной железы, ревматоидный артрит, хроническую обструктивную болезнь легких, системный склероз, рассеянный склероз, келоидоз, язвенный колит, назальный полипоз, хроническую эозинофильную пневмонию, эозинофильный бронхит, целиакию, синдром Черджа-Стросс, синдром эозинофилии-миалгии, гиперэозинофильный синдром, эозинофильный гранулематоз с полиангиитом, воспалительное заболевание кишечника, склеродермию, интерстициальное заболевание легких, фиброз, вызванный хроническим гепатитом B или C, фиброз, вызванный облучением, и фиброз, вызванный заживлением раны.
В некоторых вариантах осуществления настоящего изобретения предложен способ лечения связанных с TSLP заболеваний, включающий введение субъекту терапевтически эффективного количества антитела к TSLP, как описано выше, или молекулы нуклеиновой кислоты, как описано выше, или клетки-хозяина, как описано выше, или фармацевтической композиции, как описано выше, астмы, идиопатического легочного фиброза, атопического дерматита, аллергического конъюнктивита, аллергического ринита, аллергического синусита, крапивницы, синдрома Нетертона, эозинофильного эзофагита, пищевой аллергии, аллергической диареи, эозинофильного гастроэнтерита, аллергического бронхолегочного аспергиллеза, аллергического грибкового синусита, хронического зуда, рака, рака молочной железы, рака ободочной кишки, рака легкого, рака яичника, рака предстательной железы, ревматоидного артрита, хронической обструктивной болезни легких, системного склероза, рассеянного склероза, келоидоза, язвенного колита, назального полипоза, хронической эозинофильной пневмонии, эозинофильного бронхита, целиакии, синдрома Черджа-Стросс, синдрома эозинофилии-миалгии, гиперэозинофильного синдрома, эозинофильного гранулематоза с полиангиитом, воспалительного заболевания кишечника, склеродермии, интерстициального заболевания легких, фиброза, вызванного хроническим гепатитом B или C, фиброза, вызванного облучением, и фиброза, вызванного заживлением раны.
В некоторых вариантах осуществления настоящего изобретения предложено антитело к TSLP для применения в качестве лекарственного средства, где антитело к TSLP предназначено для применения для лечения связанных с TSLP заболеваний, где связанное с TSLP заболевание включает, не ограничиваясь перечисленным: астму, идиопатический легочный фиброз, атопический дерматит, аллергический конъюнктивит, аллергический ринит, аллергический синусит, крапивницу, синдром Нетертона, эозинофильный эзофагит, пищевую аллергию, аллергическую диарею, эозинофильный гастроэнтерит, аллергический бронхолегочный аспергиллез, аллергический грибковый синусит, хронический зуд, рак, рак молочной железы, рак ободочной кишки, рак легкого, рак яичника, рак предстательной железы, ревматоидный артрит, хроническую обструктивную болезнь легких, системный склероз, рассеянный склероз, келоидоз, язвенный колит, назальный полипоз, хроническую эозинофильную пневмонию, эозинофильный бронхит, целиакию, синдром Черджа-Стросс, синдром эозинофилии-миалгии, гиперэозинофильный синдром, эозинофильный гранулематоз с полиангиитом, воспалительное заболевание кишечника, склеродермию, интерстициальное заболевание легких, фиброз, вызванный хроническим гепатитом B или C, фиброз, вызванный облучением, и фиброз, вызванный заживлением раны.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1: Результат в отношении блокирования антителом активности связывания TSLP с рецептором TSLP.
Фиг. 2: Результат в отношении блокирования антителом активности связывания TSLP с рецептором TSLP на клеточной поверхности.
Фиг. 3: Антитело ингибирует индуцированную TSLP пролиферативную активность клеток BaF3.
На фиг. 4A показана активность антитела в отношении ингибирования индуцированной TSLP продукции хемокина TARC; на фиг. 4B показана активность антитела в отношении ингибирования индуцированной TSLP продукции хемокина OPG.
На фиг. 5A показана активность антитела в отношении ингибирования продукции Th2-цитокина IL-13; на фиг. 5B показана активность антител в отношении ингибирования продукции Th2-цитокина IL-4; на фиг. 5C показана активность антитела в отношении ингибирования продукции Th2-цитокина TNF-α; на фиг. 5D показана активность антитела в отношении ингибирования продукции Th2-цитокина IL-5.
ПОДРОБНОЕ ОПИСАНИЕ РАСКРЫТИЯ
Подробное описание изобретения
Терминология
Для облегчения понимания настоящего изобретения определения некоторых технических и научных терминов специально приведены ниже. Если иное не определено явным образом в настоящем документе, все технические и научные термины, используемые в настоящем документе, имеют значения, обычно понимаемые специалистами в области техники, к которой относится настоящее изобретение.
Трехбуквенные коды и однобуквенные коды для аминокислот, используемые в настоящем описании, соответствуют описанным в J. biol. chem, 243, p 3558 (1968).
Термин "тимический стромальный лимфопоэтин (TSLP)" представляет собой цитокин I типа, содержащий пучок из четырех α-спиралей, также известный как цитокин эпителиальных клеток, продуцируемый в ответ на провоспалительные стимулы. Он тесно связан с интерлейкином-7 (IL-7), запускает аллергические реакции, стимулируя дендритные клетки (ДК), и является важным фактором регуляции иммунного ответа в организме человека. Термин "TSLP" включает варианты, изоформы, гомологи, ортологи и паралоги TSLP.
"Антитело", описанное в настоящем описании, относится к иммуноглобулину, как правило, интактное антитело имеет структуру тетрапептидной цепи, состоящей из двух идентичных тяжелых цепей и двух идентичных легких цепей, связанных межцепочечными дисульфидными связями. Константные области тяжелой цепи иммуноглобулина имеют разный аминокислотный состав и ранжирование, следовательно, обладают разной антигенностью. Соответственно, иммуноглобулины могут быть разделены на пять типов, иначе называемых изотипами иммуноглобулинов, а именно, IgM, IgD, IgG, IgA и IgE, и соответствующие тяжелые цепи представляют собой μ-цепь, δ-цепь, γ-цепь, α-цепь и ε-цепь, соответственно. Один и тот же тип Ig может быть дополнительно подразделен на разные подклассы в соответствии с различием в аминокислотном составе шарнирной области и количеством и положением дисульфидных связей тяжелой цепи. Например, IgG может быть подразделен на IgG1, IgG2, IgG3 и IgG4. Легкая цепь подразделяется на κ-цепь или λ-цепь в соответствии с различием константной области. Каждый из пяти типов Ig может иметь κ-цепь или λ-цепь.
Последовательность из приблизительно 110 аминокислот около N-конца тяжелой и легкой цепей антитела сильно различается и известна как вариабельная область (Fv-область); оставшаяся аминокислотная последовательность около С-конца относительно стабильна и представляет собой константную область. Вариабельная область включает 3 гипервариабельных области (HVR) и 4 каркасных области (FR) с относительно консервативными последовательностями. 3 гипервариабельные области определяют специфичность антитела и также известны как определяющие комплементарность области (CDR). Каждая вариабельная область легкой цепи (VL) и вариабельная область тяжелой цепи (VH) состоит из 3 областей CDR и 4 областей FR. Порядок от аминоконца к карбоксиконцу представляет собой следующий: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. 3 области CDR легкой цепи относятся к LCDR1, LCDR2 и LCDR3; 3 области CDR тяжелой цепи относятся к HCDR1, HCDR2 и HCDR3.
Антитела согласно настоящему изобретению включают мышиные антитела, химерные антитела и гуманизированные антитела.
Термин "мышиное антитело" в настоящем изобретении относится к моноклональному антителу к человеческому TSLP, полученному в соответствии со знаниями и навыками в данной области техники. При получении испытуемому вводят антиген TSLP, а затем выделяют гибридомы, экспрессирующие антитела с желаемой последовательностью или функциональными свойствами. В предпочтительном варианте осуществления настоящего изобретения мышиное антитело к TSLP или его антигенсвязывающий фрагмент может дополнительно содержать константную область легкой цепи мышиной κ-, λ-цепи или ее варианты, или дополнительно содержать константную область тяжелой цепи мышиного IgG1, IgG2, IgG3 или ее варианты.
Термин "химерное антитело" означает антитело, образованное путем слияния вариабельной области мышиного антитела с константной областью человеческого антитела, что может ослабить иммунный ответ, индуцируемый мышиным антителом. Создание химерного антитела требует сначала создания гибридомы, секретирующей мышиные специфические моноклональные антитела, затем клонирования гена вариабельной области из клеток мышиной гибридомы, а затем клонирования гена константной области человеческого антитела, если необходимо, связывания гена мышиной вариабельной области с геном человеческой константной области с образованием химерного гена, вставляемого в вектор экспрессии и, наконец, экспрессии молекулы химерного антитела в эукариотической системе или прокариотической системе. В предпочтительном варианте осуществления настоящего изобретения легкая цепь антитела химерного антитела к TSLP дополнительно содержит константную область легкой цепи человеческой κ-, λ-цепи или ее вариант. Тяжелая цепь антитела химерного антитела к TSLP дополнительно содержит константную область тяжелой цепи человеческого IgG1, IgG2, IgG3, IgG4 или ее вариант, предпочтительно содержит константную область тяжелой цепи человеческого IgG1, IgG2 или IgG4, или варианты IgG1, IgG2 или IgG4 с аминокислотными мутациями (например, мутациями L234A и/или L235A, и/или мутациями S228P).
Термин "гуманизированное антитело", также известное как антитело с привитыми CDR, относится к антителу, полученному путем привития мышиных последовательностей CDR на каркас вариабельных областей человеческого антитела, то есть к антителу, получаемому из различных типов каркасных последовательностей антитела зародышевой линии человека. Оно может преодолеть гетерогенную реакцию, индуцируемую химерным антителом, поскольку оно несет большое количество компонентов мышиного белка. Такие каркасные последовательности могут быть получены из общедоступных баз данных ДНК или опубликованных источников, которые включают последовательности генов антител зародышевой линии. Например, последовательности ДНК зародышевой линии генов вариабельной области человеческой тяжелой и легкой цепи можно найти в базе данных последовательностей зародышевой линии человека "VBase" (доступной по ссылке www.mrccpe.com.ac.uk/vbase), а также в Kabat, E.A., et al., 1991, Sequences of Proteins of Immunological Interest, 5th edition. Чтобы избежать снижения активности, одновременно вызываемого в результате снижения иммуногенности, каркасная последовательность вариабельной области человеческого антитела может быть подвергнута минимальным реверсивным мутациям или обратным мутациям для поддержания активности. Гуманизированное антитело согласно настоящему изобретению также включает гуманизированные антитела, в которых созревание аффинности CDR осуществляется с помощью дрожжевого дисплея.
Привитие CDR может приводить к снижению аффинности полученного антитела или его антигенсвязывающего фрагмента к этому антигену из-за изменения каркасных остатков, находящихся в контакте с антигеном. Такие взаимодействия могут быть результатом гипермутации соматических клеток. Поэтому все же может быть необходимо прививать такие донорские каркасные аминокислоты на каркас гуманизированного антитела. Аминокислотные остатки, участвующие в связывании антигена и полученные из отличных от человеческих антител или их антигенсвязывающих фрагментов, могут быть идентифицированы путем исследования последовательности и структуры вариабельной области моноклонального антитела животного. Остатки в донорском каркасе CDR, которые отличаются от зародышевой линии, можно считать родственными. Если ближайшую зародышевую линию определить невозможно, последовательность можно сравнить с консенсусной последовательностью подкласса или последовательностью антитела животного с высоким процентом сходства. Считается, что редкие каркасные остатки являются результатом гипермутации в соматических клетках и поэтому играют важную роль в связывании.
В одном из вариантов осуществления настоящего изобретения антитело или его антигенсвязывающий фрагмент может дополнительно содержать константную область легкой цепи человеческой или мышиной κ-, λ-цепи или ее вариант, или дополнительно содержит константную область тяжелой цепи человеческого или мышиного IgG1, IgG2, IgG3, IgG4 или ее вариант; предпочтительно содержит константную область тяжелой цепи человеческого IgG1, IgG2 или IgG4, или вариантов IgG1, IgG2 или IgG4 с аминокислотными мутациями (например, мутацией L234A/L235A, мутацией S228P, мутацией YTE).
"Традиционный вариант" константной области тяжелой цепи человеческого антитела и константной области легкой цепи человеческого антитела, описанный в настоящем документе, относится к варианту константной области тяжелой цепи или константной области легкой цепи, раскрытому в уровне техники, который не изменяет структуру и функцию вариабельной области антитела. Примеры вариантов включают варианты константной области тяжелой цепи IgG1, IgG2, IgG3 или IgG4 с сайт-направленными модификациями и аминокислотными заменами в константной области тяжелой цепи. Конкретные замены представляют собой такие, как мутации YTE, мутации L234A и/или L235A, мутации S228P и/или мутации для получения структуры "выступ-во-впадину" (что превращает тяжелую цепь антитела в комбинацию "выступ"-Fc и "впадина"-Fc), известные в данной области техники. Было доказано, что эти мутации наделяют антитело новыми свойствами без изменения функции вариабельной области антитела.
Термины "человеческое антитело HuMAb", "антитело человеческого происхождения", "полностью человеческое антитело" и "целиком человеческое антитело" могут использоваться взаимозаменяемо и могут относиться к антителам, полученным от человека, или антитела, полученные от генетически модифицированного организма, который был "сконструирован" для получения определенных человеческих антител в ответ на стимуляцию антигеном, и могут быть получены любым способом, известным в данной области техники. В некоторых технологиях элементы локусов генов человеческой тяжелой цепи и легкой цепи вводят в клеточные линии организмов, происходящих из линий эмбриональных стволовых клеток, в которых эндогенные генетические локусы тяжелой цепи и легкой цепи были целевым образом нарушены. Трансгенные организмы могут синтезировать человеческие антитела, специфичные к человеческим антигенам, и эти организмы можно использовать для получения гибридом, секретирующих человеческие антитела. Человеческое антитело также может представлять собой антитело, в котором тяжелая и легкая цепи кодируются нуклеотидными последовательностями, полученными из одного или нескольких источников человеческой ДНК. Полностью человеческое антитело также может быть сконструировано методами трансфекции генов или хромосом и технологией фагового дисплея, или сконструированы B-клетками, активированными in vitro, при этом все из перечисленного известно в данной области техники.
Термины "полноразмерное антитело", "интактное антитело", "целое антитело" и "полное антитело" используются в настоящем документе взаимозаменяемо и относятся к антителу в по существу интактной форме, в отличие от антигенсвязывающих фрагментов, определенных ниже. Эти термины относятся исключительно к антителу, в котором легкая цепь и тяжелая цепь содержит константную область. "Антитело" согласно настоящему изобретению включает "полноразмерное антитело" и его антигенсвязывающие фрагменты.
В некоторых вариантах осуществления полноразмерное антитело согласно настоящему изобретению включает антитела, образованные путем связывания вариабельной области легкой цепи с константной областью легкой цепи и связывания вариабельной области тяжелой цепи с константной областью тяжелой цепи, как показано в комбинациях легкой и тяжелой цепи в таблицах с 1 по 4 ниже. Специалисты в данной области могут выбрать различные константные области легкой цепи и константные области тяжелой цепи, полученные из антитела, в соответствии с фактическими потребностями, например, константные области легкой цепи и константные области тяжелой цепи, полученные из человеческого антитела.
Термин "антигенсвязывающий фрагмент" или "функциональный фрагмент" антитела относится к одному или более фрагментам антитела, которые сохраняют способность специфически связываться с антигеном (например, TSLP). Было показано, что фрагменты полноразмерных антител могут быть использованы для осуществления антигенсвязывающей функции антител. Примеры связывающего фрагмента, охватываемого термином "антигенсвязывающий фрагмент" антитела, включают (i) Fab-фрагмент - одновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) F(ab')2-фрагмент - двухвалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из доменов VH и CH1; (iv) Fv-фрагмент, состоящий из доменов VH и VL одного плеча антитела; (v) dsFv - стабильный антигенсвязывающий фрагмент, образованный межцепочечными дисульфидными связями между VH и VL; (vi) диатело - биспецифическое антитело и мультиспецифическое антитело, содержащие такие фрагменты, как scFv, dsFv, Fab и т.д. Кроме того, хотя два домена VL и VH Fv-фрагмента кодируются отдельными генами, могут использоваться методы рекомбинации для их связывания с помощью синтетических линкеров, так что он может быть получен в виде единой белковой цепи, в которой области VL и VH соединяются в пары с образованием одновалентной молекулы (называемой одноцепочечным Fv (scFv); см., например, Bird et al. (1988) Science 242:423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci USA 85: 5879-5883). Такие одноцепочечные антитела также охватываются термином "антигенсвязывающий фрагмент" антитела. Такие фрагменты антител получают с использованием обычных методов, известных специалистам в данной области техники, и подвергают скринингу таким же образом, как и интактные антитела. Антигенсвязывающий фрагмент может быть получен с помощью технологии рекомбинантных ДНК или ферментативной или химической фрагментации интактного иммуноглобулина. Антитела могут представлять собой антитела разных изотипов, например, антитела IgG (например, подтипы IgG1, IgG2, IgG3 или IgG4), IgA1, IgA2, IgD, IgE или IgM.
Fab представляет собой фрагмент антитела, имеющий молекулярную массу приблизительно 50000 и обладающий антигенсвязывающей активностью, и относится к фрагментам, получаемым обработкой молекул антитела IgG папаином (который расщепляет аминокислотный остаток в положении 224 H-цепи), в котором примерно половина N-концевой стороны H-цепи и вся L-цепь соединены вместе дисульфидными связями.
F(ab')2 представляет собой фрагмент антитела, который имеет молекулярную массу около 100000, обладает антигенсвязывающей активностью и содержит две области Fab, связанные в положении шарнира, и относится к фрагментам, получаемым путем расщепления нижней части двух дисульфидных связей в шарнирной области IgG ферментом пепсином.
Fab' представляет собой фрагмент антитела, имеющий молекулярную массу около 50000 и обладающий антигенсвязывающей активностью, получаемый путем расщепления дисульфидной связи в шарнирной области F(ab')2. Fab' согласно настоящему изобретению может быть получен с использованием восстанавливающих агентов, например, дитиотреитола, для обработки F(ab')2 согласно настоящему изобретению, который специфически распознает TSLP и связывается с аминокислотной последовательностью внеклеточного домена или ее трехмерной структурой.
Кроме того, Fab' может быть получен путем вставки ДНК, кодирующей Fab'-фрагмент антитела, в прокариотический вектор экспрессии или эукариотический вектор экспрессии, и введения вектора в прокариотический организм или эукариотический организм для экспрессии Fab'.
Термин "одноцепочечное антитело", "одноцепочечный Fv" или "scFv" относится к молекулам, содержащим вариабельный домен тяжелой цепи антитела (или область, VH) и вариабельный домен легкой цепи антитела (или область, VL), связанные линкером. Такие молекулы scFv могут иметь общую структуру: NH2-VL-линкер-VH-COOH или NH2-VH-линкер-VL-COOH. Подходящие линкеры, известные из уровня техники, состоят из повторяющихся аминокислотных последовательностей GGGGS или их вариантов, например, вариантов с 1-4 повторами (Holliger et al. (1993), Proc. Natl. Acad. Sci. USA 90: 6444-6448). Другие линкеры, которые могут быть использованы в настоящем изобретении, описаны в Alfthan et al. (1995), Protein Eng. 8:725-731, Choi et al. (2001), Eur. J. Immunol. 31:94-106, Hu et al. (1996), Cancer Res. 56:3055-3061, Kipriyanov et al. (1999), J. Mol. Biol. 293:41-56 и Roovers et al. (2001), Cancer Immunol.
Диатело представляет собой фрагмент антитела, в котором scFv или Fab димеризован, и представляет собой фрагмент антитела с двухвалентной антигенсвязывающей активностью. При двухвалентной антигенсвязывающей активности два антигена могут быть одинаковыми или разными.
Биспецифическое антитело и мультиспецифическое антитело относятся к антителу, которое может одновременно связываться с двумя или более антигенами или антигенными детерминантами, включая scFv- или Fab-фрагменты, которые могут связываться с TSLP.
Диатело согласно настоящему изобретению может быть получено посредством следующих стадий: получение кодирующей кДНК VH и VL моноклонального антитела согласно настоящему изобретению, которое специфически распознает человеческий TSLP и связывается с аминокислотной последовательностью внеклеточного домена или ее трехмерной структурой, конструирование ДНК, кодирующей scFv, так что длина аминокислотной последовательности пептидного линкера составляет 8 остатков или менее, вставка ДНК в прокариотический вектор экспрессии или эукариотический вектор экспрессии, и затем введение вектора экспрессии в прокариотический организм или эукариотический организм для экспрессии диатела.
dsFv получают путем связывания полипептидов VH и VL, в которых один аминокислотный остаток в каждом из них заменен остатком цистеина, посредством дисульфидных связей между указанными остатками цистеина. Аминокислотные остатки, замещенные остатками цистеина, могут быть выбраны согласно известным методам (Protein Engineering, 7, 697 (1994)), основанным на предсказании трехмерной структуры антитела.
Полноразмерное антитело или его антигенсвязывающий фрагмент согласно настоящему изобретению может быть получено посредством следующих стадий: получение кодирующей кДНК VH и VL моноклонального антитела согласно настоящему изобретению, которое специфически распознает человеческий TSLP и связывается с аминокислотной последовательностью внеклеточного домена или ее трехмерной структурой, конструирование ДНК, кодирующей полноразмерное антитело или его антигенсвязывающий фрагмент, вставка ДНК в прокариотический вектор экспрессии или эукариотический вектор экспрессии, и затем введение вектора экспрессии в прокариотический организм или эукариотический организм для экспрессии.
Термин "аминокислотная разница" или "аминокислотная мутация" относится к наличию аминокислотных изменений или мутаций в варианте белка или полипептида по сравнению с исходным белком или полипептидом, включая наличие 1, 2, 3 или более инсерций, делеций или замен аминокислот относительно исходного белка или полипептида.
Термин "каркас антитела" или "область FR" относится к фрагменту вариабельного домена VL или VH, который служит каркасом для антигенсвязывающей петли (CDR) вариабельного домена. Фактически она представляет собой вариабельный домен без CDR.
Термин "определяющая комплементарность область", "CDR" или "гипервариабельная область" относится к одной из шести гипервариабельных областей в вариабельном домене антитела, которые в основном вносят вклад в связывание антигена. Обычно имеется три CDR (HCDR1, HCDR2, HCDR3) в каждой вариабельной области тяжелой цепи и три CDR (LCDR1, LCDR2, LCDR3) в каждой вариабельной области легкой цепи. Для определения границ аминокислотных последовательностей CDR может быть использована любая из хорошо известных схем, включая систему нумерации "Kabat" (см. Kabat et al. (1991), "Sequences of Proteins of Immunological Interest", 5th edition, Public Health Service, National Institutes of Health, Bethesda, MD), систему нумерации "Chothia" (см. Al-Lazikani et al., (1997) JMB 273: 927-948) и систему нумерации ImmunoGenTics (IMGT) (Lefranc M.P., Immunologist, 7, 132-136 (1999); Lefranc, M.P., et al., Dev. Comp. Immunol., 27, 55-77 (2003)), и т.д. Например, для классического формата в соответствии с системой Kabat номера аминокислотных остатков CDR в вариабельном домене тяжелой цепи (VH) представляют собой 31-35 (HCDR1), 50-65 (HCDR2) и 95-102 (HCDR3); и номера аминокислотных остатков CDR в вариабельном домене легкой цепи (VL) представляют собой 24-34 (LCDR1), 50-56 (LCDR2) и 89-97 (LCDR3). В соответствии с системой Chothia номера аминокислотных остатков CDR в VH представляют собой 26-32 (HCDR1), 52-56 (HCDR2) и 95-102 (HCDR3); и номера аминокислотных остатков в VL представляют собой 26-32 (LCDR1), 50-52 (LCDR2) и 91-96 (LCDR3). При комбинировании определений CDR согласно Kabat и Chothia, CDR состоят из аминокислотных остатков 26-35 (HCDR1), 50-65 (HCDR2) и 95-102 (HCDR3) в человеческой VH и аминокислотных остатков 24-34 (LCDR1), 50-56 (LCDR2) и 89-97 (LCDR3) в человеческой VL. В соответствии с системой IMGT номера аминокислотных остатков CDR в VH примерно представляют собой 26-35 (CDR1), 51-57 (CDR2) и 93-102 (CDR3), и номера аминокислотных остатков CDR в VL примерно представляют собой 27-32 (CDR1), 50-52 (CDR2) и 89-97 (CDR3). В соответствии с системой IMGT области CDR антитела могут быть определены с использованием программы IMGT/DomainGap Align.
Термин "эпитоп" или "антигенная детерминанта" относится к сайту на антигене, с которым специфически связывается иммуноглобулин или антитело (например, определенному сайту на молекулах TSLP). Эпитопы обычно включают по меньшей мере 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 последовательных или непоследовательных аминокислот в уникальной пространственной конформации. См., например, Epitope Mapping Protocols in Methods in Molecular Biology, Vol. 66, G.E.Morris, Ed. (1996).
Термины "специфически связывает", "селективно связывает", "связывается селективно" и "связывается специфически" относятся к связыванию антитела с эпитопом на выбранном антигене. Обычно антитело связывается с аффинностью (KD) приблизительно менее 10-8 М, например, приблизительно менее 10-9 M, 10-10 M, 10-11 M, 10-12 M или менее.
Термин "KD" относится к равновесной константе диссоциации для конкретного взаимодействия антитело-антиген. Обычно антитело согласно настоящему изобретению связывается с TSLP с аффинностью (KD) приблизительно менее 10-7 М, например приблизительно менее 10-8 М или 10-9 М, например, в настоящем изобретении аффинность антитела к антигену клеточной поверхности определяют методом FACS или Biacore для определения значения KD.
Когда термин "конкуренция" используется в контексте антигенсвязывающих белков (например, нейтрализующего антигенсвязывающего белка или нейтрализующего антитела), которые конкурируют за один и тот же эпитоп, он относится к конкуренции между антигенсвязывающими белками, которую определяют с помощью следующего анализа: антигенсвязывающие белки, подлежащие тестированию (например, антитела или их иммунологические функциональные фрагменты), предотвращают или ингибируют (например, снижают) специфическое связывание референсного антигенсвязывающего белка (например, лиганда или референсного антитела) с общим антигеном (например, антигеном TSLP или его фрагментом). Для определения того, конкурирует ли один антигенсвязывающий белок с другим, может быть использовано множество типов анализов конкурентного связывания, например: твердофазный прямой или непрямой радиоиммуноанализ (РИА), твердофазный прямой или непрямой иммуноферментный анализ (EIA), конкурентный сэндвич-анализ (см., например, Stahli et al., 1983, Methods in Enzymology 9: 242-253); твердофазный прямой биотин-авидиновый EIA (см., например, Kirkland et al., 1986, J. Immunol. 137: 3614-3619), твердофазный анализ с прямым мечением, твердофазный сэндвич-анализ с прямым мечением (см., например, Harlow and Lane, 1988, Antibodies, A Laboratory Manual, Cold Spring Harbor Press); твердофазный РИА с прямым мечением метками I-125 (см., например, Morel et al., 1988, Molec. Immunol. 25: 7-15); твердофазный прямой биотин-авидиновый EIA (см., например, Cheung, et al., 1990, Virology 176: 546-552); и РИА с прямым мечением (Moldenhauer et al., 1990, Scand. J. Immunol. 32: 77-82). Обычно анализы включают использование любого из немеченых тестируемых антигенсвязывающих белков и меченых референсных антигенсвязывающих белков для связывания очищенных антигенов, связанных с твердой поверхностью или клетками. Конкурентное ингибирование измеряют путем измерения количества метки, связанной с твердой поверхностью или с клетками, в присутствии тестируемого антигенсвязывающего белка. Обычно тестируемый антигенсвязывающий белок присутствует в избытке. Антигенсвязывающие белки, идентифицируемые с помощью конкурентного анализа (конкурирующие антигенсвязывающие белки), включают: антигенсвязывающие белки, которые связываются с тем же эпитопом, что и референсный антигенсвязывающий белок; и антигенсвязывающие белки, которые связываются с соседними эпитопами, расположенными достаточно близко к эпитопу, с которым связывается референсный антигенсвязывающий белок, где указанные два эпитопа пространственно затрудняют связывание друг друга. Обычно, когда конкурирующий антигенсвязывающий белок присутствует в избытке, он будет ингибировать (например, снижать) специфическое связывание референсного антигенсвязывающего белка с общим антигеном по меньшей мере на 40-45%, 45-50%, 50-55%, 55-60%, 60-65%, 65-70%, 70%-75% или 75%, или более. В некоторых случаях связывание ингибируется по меньшей мере на 80-85%, 85-90%, 90-95%, 95-97% или 97%, или более.
Термин "молекула нуклеиновой кислоты" в контексте настоящего документа относится к молекуле ДНК и молекуле РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной и предпочтительно представляет собой двухцепочечную ДНК или одноцепочечную мРНК или модифицированную мРНК. Когда нуклеиновая кислота находится в функциональной связи с другой последовательностью нуклеиновой кислоты, нуклеиновая кислота является "функционально связанной". Например, если промотор или энхансер влияет на транскрипцию кодирующей последовательности, то промотор или энхансер функционально связан с кодирующей последовательностью.
"Идентичность" аминокислотной последовательности относится к процентному содержанию аминокислотных остатков, которые идентичны между первой и второй последовательностями, когда аминокислотные последовательности выровнены (при необходимости с введением гэпов) для достижения максимального процента идентичности последовательностей, и никакие консервативные замены не рассматриваются как часть идентичности последовательности. Для определения процента идентичности аминокислотных последовательностей выравнивание может быть достигнуто различными способами в пределах технических возможностей данной области техники, например, с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN, ALIGN-2 или Megalign (DNASTAR). Специалисты в данной области техники способны определить параметры, подходящие для измерения выравнивания, включая любой алгоритм, необходимый для достижения максимального выравнивания по всей длине сравниваемых последовательностей.
Термин "вектор экспрессии" относится к молекуле нуклеиновой кислоты, способной переносить другую нуклеиновую кислоту, с которой она была связана. В одном из вариантов осуществления вектор представляет собой "плазмиду", которая относится к кольцевой двухцепочечной петле ДНК, с которой могут быть связаны дополнительные сегменты ДНК. В еще одном варианте осуществления вектор представляет собой вирусный вектор, в котором дополнительные сегменты ДНК могут быть связаны с вирусным геномом. Раскрытые в настоящем документе векторы могут автономно реплицироваться в клетке-хозяине, в которую они были введены (например, бактериальные векторы с бактериальной точкой начала репликации и эписомальные векторы млекопитающих), или могут быть интегрированы в геном клетки-хозяина после введения в клетку-хозяина, чтобы реплицироваться вместе с геномом хозяина (например, неэписомальные векторы млекопитающих).
Способы получения и очистки антител и антигенсвязывающих фрагментов хорошо известны в уровне техники, см., например, Antibody Experiment Technical Guide, Cold Spring Harbor, главы 5-8 и 15. Например, мыши могут быть иммунизированы человеческим TSLP или его фрагментом, и полученные антитела могут быть ренатурированы и очищены, и может быть проведено аминокислотное секвенирование с использованием обычных методов. Антигенсвязывающие фрагменты также могут быть получены с использованием обычных методов. Антитело или антигенсвязывающий фрагмент согласно настоящему изобретению генетически сконструированы для добавления одной или более человеческих областей FR к областям CDR, отличным от человеческих. Последовательности FR зародышевой линии человека могут быть получены с веб-сайта ImmunoGeneTics (IMGT) http://imgt.cines.fr путем сравнения базы данных IMGT генов зародышевой линии вариабельной области человеческого антитела и программного обеспечения MOE, или быть получены из The Immunoglobulin FactsBook, 2001ISBN012441351.
Термин "клетка-хозяин" относится к клетке, в которую был введен вектор экспрессии. Клетки-хозяева могут включать бактерии, микроорганизмы, клетки растений или животных. Бактерии, которые могут быть легко трансформированы, включают представителей Enterobacteriaceae, например, штаммы Escherichia coli или Salmonella; Bacillaceae, например, Bacillus subtilis; Pneumococcus; Streptococcus и Haemophilus influenzae. Подходящие микроорганизмы включают Saccharomyces cerevisiae и Pichia pastoris. Подходящие линии клеток-хозяев животных включают клетки СНО (линия клеток яичника китайского хомячка), клетки 293 и клетки NS0.
Генетически модифицированные антитела или антигенсвязывающие фрагменты согласно настоящему изобретению могут быть получены и очищены обычными методами. Например, последовательности кДНК, кодирующие тяжелую цепь и легкую цепь, могут быть клонированы и рекомбинированы в вектор экспрессии GS. Векторы экспрессии рекомбинантного иммуноглобулина могут стабильно трансфицировать клетки СНО. В качестве более рекомендуемого уровня техники системы экспрессии млекопитающих могут приводить к гликозилированию антител, особенно в высококонсервативных N-концевых сайтах Fc-области. Стабильные клоны получают путем экспрессии антител, которые специфически связываются с человеческим TSLP. Положительные клоны размножают в бессывороточной среде биореакторов для получения антител. Среда, в которую секретируются антитела, может быть очищена обычными методами. Например, с использованием для очистки колонки Sepharose FF A или G с отрегулированным буфером. Неспецифически связанные компоненты вымываются. Затем связанные антитела элюируют методом градиента pH, и фрагменты антител детектируют с помощью SDS-PAGE и собирают. Антитела могут быть отфильтрованы и концентрированы обычными методами. Растворимые смеси и полимеры также могут быть удалены обычными методами, например, с помощью молекулярных сит и ионного обмена. Полученный продукт необходимо немедленно заморозить, например, при -70°C, или лиофилизировать.
"Введение", "дача", "лечение" и "обработка" применительно к животным, людям, экспериментальным субъектам, клеткам, тканям, органам или биологическим жидкостям относятся к контакту экзогенного лекарственного средства, терапевтического агента, диагностического агента или композиции с животными, людьми, субъектами, клетками, тканями, органами или биологическими жидкостями. "Введение", "дача", "лечение" и "обработка" могут относиться, например, к лечению, фармакокинетике, диагностике, исследованиям и экспериментальным методам. Обработка клеток включает приведение реагентов в контакт с клетками и приведение реагентов в контакт с жидкостями, где жидкости контактируют с клетками. "Введение", "дача", "лечение" и "обработка" также относятся к обработке, например, клеток реагентами, диагностическими, связывающими композициями или другой клеткой in vitro и ex vivo. "Лечение", применительно к человеку, субъектам ветеринарного лечения или субъектам исследования, относится к терапевтическому лечению, профилактическим или превентивным мерам, исследовательским и диагностическим применениям.
"Лечение" относится к введению внутреннего или наружного терапевтического агента, например, композиции, содержащей любое из связывающих соединений согласно настоящему изобретению, пациенту с одним или более симптомами заболевания, при котором терапевтическое средство, как известно, оказывает терапевтический эффект. Обычно терапевтический агент вводят в количестве, эффективном для облегчения одного или более симптомов заболевания у получающего лечение пациента или популяции, чтобы вызвать регресс таких симптомов или подавить развитие таких симптомов в любой клинически измеримой степени. Количество терапевтического агента, эффективное для облегчения какого-либо конкретного симптома заболевания (также называемое "терапевтически эффективным количеством"), может варьироваться в зависимости от различных факторов, таких как патологическое состояние, возраст и масса тела пациента, а также способность лекарственного средства оказывать желаемый терапевтический эффект у пациента. Были ли облегчены симптомы заболевания, можно оценить с помощью любых методов клинического тестирования, обычно используемых врачами или другими специалистами в области здравоохранения для оценки степени тяжести или прогрессирования симптомов. Хотя варианты осуществления настоящего изобретения (например, способы лечения или продукты) могут быть неэффективны для облегчения симптома(ов) целевого заболевания у каждого пациента, они должны ослаблять симптом(ы) целевого заболевания у статистически значимого количества пациентов, как определено с помощью любого статистического критерия, известного в данной области техники, такого как t-критерий Стьюдента, критерий хи-квадрат, U-критерий Манна-Уитни, критерий Краскела-Уоллиса (H-критерий), критерий Джонкхира-Терпстры и критерий Уилкоксона.
"Консервативная модификация" или "консервативное замещение или замена" относится к такой замене аминокислот в белке другими аминокислотами, имеющими схожие характеристики (например, заряд, размер боковой цепи, гидрофобность/гидрофильность, конформацию и жесткость основной цепи и т.д.), которая позволяет часто вносить изменения без изменения биологической активности белка. Специалистам в данной области техники известно, что в общем случае замена одной аминокислоты в несущественных областях полипептида по существу не изменяет биологическую активность (см., например, Watson et al. (1987) Molecular Biology of the Gene, The Benjamin/Cummings Pub. Co., стр. 224, (4th edition)). Кроме того, маловероятно, что замена аминокислотами со схожей структурой или функцией повлияет на биологическую активность. Иллюстративные консервативные аминокислотные замены приведены в таблице "Иллюстративные консервативные аминокислотные замены" ниже.
Таблица 5. Иллюстративные консервативные аминокислотные замены
"Эффективное количество" или "эффективная доза" относится к количеству лекарственного средства, соединения или фармацевтической композиции, необходимому для получения любого одного или более полезных или желаемых терапевтических результатов. Для профилактических целей полезные или желаемые результаты включают устранение или снижение риска, снижение степени тяжести или отсрочку начала заболевания, включая биохимические, гистологические и/или поведенческие проявления заболевания, его осложнения и промежуточные патологические фенотипы, которые имеют место в процессе развития заболевания. Для терапевтических целей полезные или желаемые результаты включают клинические результаты, такие как снижение частоты различных расстройств, связанных с антигеном-мишенью согласно настоящему изобретению, или улучшение одного или более симптомов расстройства, снижение дозы других агентов, необходимых для лечения расстройства, повышение терапевтической эффективности другого агента и/или задержка прогрессирования расстройств у пациента, связанных с антигеном-мишенью согласно настоящему изобретению.
"Экзогенный" относится к веществам, продуцируемым вне организмов, клеток или человеческих тел, в зависимости от обстоятельств. "Эндогенный" относится к веществам, продуцируемым внутри клеток, организмов или человеческих тел, в зависимости от обстоятельств.
"Гомология" относится к сходству последовательностей между двумя полинуклеотидными последовательностями или между двумя полипептидами. Когда положения в двух сравниваемых последовательностях заняты одним и тем же основанием или субъединицей мономера аминокислоты, например, если положение в каждой из двух молекул ДНК занято аденином, то молекулы гомологичны в этом положении. Процент гомологии между двумя последовательностями является функцией количества совпадающих или гомологичных положений, общих для двух последовательностей, деленного на количество сравниваемых положений, а затем умноженного на 100. Например, при оптимальном выравнивании последовательностей, если 6 из 10 положений в двух последовательностях совпадают или гомологичны, то две последовательности гомологичны на 60%; если 95 из 100 положений в двух последовательностях совпадают или гомологичны, то две последовательности гомологичны на 95%. Обычно при выравнивании двух последовательностей сравнения проводят для получения максимального процента гомологии. Например, сравнение может проводиться алгоритмом BLAST, где параметры алгоритма выбирают так, чтобы обеспечить максимальное совпадение для каждой последовательности по всей длине каждой референсной последовательности. Следующие ссылки относятся к алгоритму BLAST, часто используемому для анализа последовательностей: АЛГОРИТМЫ BLAST: Altschul, S.F. et al., (1990) J. Mol. Biol. 215:403-410; Gish, W. et al., (1993) Nature Genet. 3:266-272; Madden, T.L. et al., (1996) Meth. Enzymol. 266:131-141; Altschul, S.F. et al., (1997) Nucleic Acids Res. 25:3389-3402; Zhang, J. et al., (1997) Genome Res. 7:649-656. Другие традиционные алгоритмы BLAST, такие как доступные от NCBI BLAST, также хорошо известны специалистам в данной области техники.
Выражения "клетка", "линия клеток" и "культура клеток", используемые в настоящем документе, могут использоваться взаимозаменяемо, и все такие названия включают потомство. Следовательно, слова "трансформант" и "трансформированная клетка" включают первичные тестируемые клетки и полученные из них культуры, независимо от количества пассажей. Также следует иметь в виду, что из-за преднамеренных или случайных мутаций все потомство не может быть абсолютно одинаковым с точки зрения содержания ДНК. Включено мутантное потомство с той же функцией или биологической активностью, что и обнаруженная при скрининге исходных трансформированных клеток. Когда имеется в виду другое понятие, это будет ясно из контекста.
"Полимеразная цепная реакция" или "ПЦР" в контексте настоящего документа относится к процедуре или методике, согласно которой амплифицируют следовое количество определенного фрагмента нуклеиновой кислоты, РНК и/или ДНК, как описано, например, в патенте США №4683195. В общем случае необходимо получить информацию о последовательности на конце или вне целевой области для того, чтобы можно было конструировать олигонуклеотидные праймеры; эти праймеры являются такими же или подобными с точки зрения последовательности соответствующей цепи матрицы, подлежащей амплификации. 5'-концевые нуклеотиды двух праймеров могут быть идентичны концам вещества, подлежащего амплификации. ПЦР может быть использована для амплификации конкретных последовательностей РНК, конкретных последовательностей ДНК из тотальной геномной ДНК, а также последовательностей кДНК, транскрибированных из тотальной клеточной РНК, последовательностей фагов или плазмид, и т.д. См. в общем Mullis et al. (1987) Cold Spring Harbor, Symp. Ouant. Biol. 51:263; Erlich ed., (1989) PCR TECHNOLOGY (Stockton Press, N.Y.). Используемая в настоящем документе ПЦР рассматривается как пример, но не единственный пример метода полимеразной реакции нуклеиновых кислот для амплификации тестируемого образца нуклеиновой кислоты, и этот метод включает использование известных нуклеиновых кислот в качестве праймеров и полимераз нуклеиновых кислот для амплификации или получения определенного фрагмента нуклеиновой кислоты.
"Выделенный " относится к очищенному состоянию и в этом случае означает, что обозначенная молекула по существу не содержит других биомолекул, например, нуклеиновых кислот, белков, липидов, углеводов или других веществ, например, клеточного детрита и питательной среды. В целом, термин "выделенный" не подразумевает полного отсутствия этих веществ или отсутствия воды, буфера или соли, если только они не присутствуют в количестве, которое существенно мешает экспериментальному или терапевтическому применению соединения, как описано в настоящем документе.
"Необязательный" или "необязательно" означает, что событие или обстоятельство, описанные далее, могут, но не обязательно должны иметь место, и описание включает случаи, когда событие или обстоятельство имеют или не имеют места.
"Фармацевтическая композиция" означает смесь, содержащую одно или более соединений, описанных в настоящем документе, или их физиологически/фармацевтически приемлемые соли или пролекарства, и другие химические компоненты, например, физиологические/фармацевтически приемлемые носители и эксципиенты. Назначение фармацевтической композиции состоит в том, чтобы облегчить введение соединения в организмы, что способствует абсорбции активного ингредиента, в результате чего он проявляет биологическую активность.
Термин "фармацевтически приемлемый носитель" относится к любому неактивному веществу, подходящему для использования в составе для доставки антител или антигенсвязывающих фрагментов. Носитель может представлять собой антиадгезивный агент, связующее, оболочку, разрыхлитель, наполнитель или разбавитель, консервант (такой как антиоксидант, антибактериальный или противогрибковый агент), подсластитель, агент, замедляющий абсорбцию, смачивающий агент, эмульгатор, буфер и т.д. Примеры подходящих фармацевтически приемлемых носителей включают воду, этанол, многоатомный спирт (например, глицерин, пропиленгликоль, полиэтиленгликоль и т.д.), декстрозу, растительное масло (например, оливковое масло), физиологический раствор, буфер, забуференный физиологический раствор и изотонический агент, например, сахар, многоатомный спирт, сорбит и хлорид натрия.
Кроме того, настоящее изобретение включает агенты для лечения связанных с TSLP заболеваний, содержащие антитело к TSLP согласно настоящему изобретению или его антигенсвязывающий фрагмент в качестве активного ингредиента.
Связанное с TSLP заболевание не ограничено в настоящем изобретении при условии, что оно представляет собой заболевание, связанное с TSLP. Например, терапевтический ответ, индуцированный молекулой согласно настоящему изобретению, может быть достигнут путем связывания с человеческим TSLP, а затем блокирования связывания TSLP с его рецепторами, или уничтожения клеток, сверхэкспрессирующих TSLP.
Кроме того, настоящее изобретение относится к способам иммунодетекции или определения антигена-мишени (например, TSLP), реагентам для иммунодетекции или определения антигена-мишени (например, TSLP), способам иммунодетекции или определения клеток, экспрессирующих антиген-мишень (например, TSLP), и диагностическим агентам для диагностики заболеваний, связанных с клетками, положительными на антиген-мишень (например, TSLP), которые включают антитело или фрагмент антитела согласно настоящему изобретению в качестве активного ингредиента, который специфически распознает антиген-мишень (например, человеческий TSLP) и связывается с аминокислотной последовательностью внеклеточного домена или ее трехмерной структурой.
В настоящем изобретении способ, используемый для обнаружения или измерения количества антигена-мишени (например, TSLP) может представлять собой любой известный способ. Например, он включает методы иммунодетекции или измерения.
Методы иммунодетекции или измерения представляют собой методы обнаружения или измерения количества антитела или антигена с использованием меченых антигенов или антител. Примеры методов иммунодетекции или измерения включают радиоиммуноанализ (РИА), иммуноферментный анализ (EIA или ELISA), флуоресцентный иммуноанализ (FIA), люминесцентный иммуноанализ, вестерн-блоттинг, физико-химические методы и т.д.
Вышеупомянутые связанные с TSLP заболевания могут быть диагностированы путем обнаружения или измерения клеток, экспрессирующих TSLP, с использованием антитела или фрагмента антитела согласно настоящему изобретению.
Для обнаружения клеток, экспрессирующих указанный полипептид, могут быть использованы известные методы иммунодетекции, предпочтительно с использованием иммунопреципитации, флуоресцентного окрашивания клеток, иммуногистохимического окрашивания и т.д. Кроме того, может быть использован метод флуоресцентного окрашивания антителами с помощью системы FMAT8100HTS (Applied Biosystem).
В настоящем изобретении для образца in vivo, используемого для обнаружения или измерения антигена-мишени (например, TSLP), нет конкретных ограничений при условии, что он может содержать клетки, экспрессирующие антиген-мишень (например, TSLP), например, гистоциты, кровь, плазму, сыворотку, панкреатический сок, мочу, кал, интерстициальную жидкость или культуральную жидкость.
В зависимости от требуемого метода диагностики диагностический агент, содержащий моноклональное антитело или его фрагмент согласно настоящему изобретению, может также содержать реагенты для проведения реакции антиген-антитело или реагенты для обнаружения такой реакции. Реагенты, используемые для проведения реакции антиген-антитело, включают буферы, соли и т.д. Реагенты, используемые для обнаружения, включают агенты, обычно используемые в методах иммунодетекции или измерения, например, меченые вторичные антитела, распознающие моноклональное антитело, фрагмент антитела или его конъюгат, и субстраты, соответствующие метке, и т.д.
В приведенном выше описании представлены подробности одного или более вариантов осуществления настоящего изобретения. Хотя любые методы и материалы, подобные или идентичные описанным в настоящем документе, могут быть использованы для реализации или тестирования настоящего изобретения, предпочтительные методы и материалы описаны ниже. Другие признаки, цели и преимущества настоящего изобретения будут очевидны из описания и формулы изобретения. В описании и формуле изобретения, если иное явным образом не следует из контекста, форма единственного числа включает множественное число упомянутого термина. Если явным образом не определено иное, все технические и научные термины, используемые в настоящем документе, имеют значения, обычно понимаемые специалистами в области техники, к которой относится настоящее изобретение. Все патенты и публикации, цитируемые в описании, включены посредством ссылки. Следующие ниже примеры представлены для более полной иллюстрации предпочтительных вариантов осуществления настоящего изобретения. Эти примеры не следует истолковывать как ограничивающие объем настоящего изобретения каким-либо образом, и объем настоящего изобретения определяется формулой изобретения.
Примеры
Приведенные ниже примеры включены для дополнительного описания настоящего изобретения, но эти примеры не ограничивают объем настоящего изобретения.
Экспериментальные методы, условия для которых конкретно не указаны в примерах или тестовых примерах настоящего изобретения, обычно соответствуют обычным условиям или соответствуют условиям, рекомендованным производителем сырья или продукта. См. Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor; Current Protocols Molecular Biology, Ausubel et al., Greene Publishing Associates, Wiley Interscience, NY. Реагенты без конкретно указанных источников представляют собой обычные реагенты, приобретенные на рынке.
Пример 1. Экспрессия TSLP и рецептора TSLP
Последовательности, кодирующие меченный His человеческий TSLP и TSLP яванского макака, меченный человеческим IgG1-Fc человеческий TSLP и TSLP яванского макака и последовательности внеклеточного домена рецептора TSLP, нагружали на вектор phr для конструирования плазмид экспрессии, которые затем трансфицировали в HEK293. Конкретные стадии трансфекции были следующими: накануне клетки HEK293E высевали в экспрессионную среду Freestyle (содержащую 1% FBS) с плотностью 0,8×106/мл, помещали на шейкер с постоянной температурой 37°C (120 об/мин) и проводили культивирование в течение 24 часов. Через 24 часа трансфекционную плазмиду и реагент для трансфекции PEI стерилизовали через фильтры на 0,22 мкм. Затем трансфекционную плазмиду доводили до концентрации 100 мкг/100 мл клеток, и массовое соотношение PEI (1 мг/мл) и плазмиды составляло 3:1. Взяв в качестве примера трансфекцию 200 мл клеток HEK293E, брали 10 мл Opti-MEM и 200 мкг плазмиды, хорошо перемешивали и оставляли на 5 мин; брали еще 10 мл Opti-MEM и 600 мкг PEI, хорошо перемешивали и оставляли на 5 мин. Плазмиду и PEI хорошо перемешивали и оставляли на 15 мин, предпочтительно не более 20 мин. Смесь плазмиды и PEI медленно добавляли к 200 мл клеток HEK293E и помещали на шейкер при 8% CO2, 120 об/мин и 37°C для культивирования. На 3 день трансфекции в культуру добавляли 10% объема дополнительной среды. До 6 дня трансфекции отбирали образцы и центрифугировали при 4500 об/мин в течение 10 мин для сбора клеточного супернатанта. Супернатант фильтровали и очищали с получением рекомбинантных белков TSLP и рецептора TSLP согласно примеру 2. Очищенные белки можно использовать в экспериментах каждого из приведенных ниже примеров. Соответствующие последовательности представляют собой следующие.
1. Аминокислотная последовательность меченного his человеческого антигена TSLP (huTSLP-his)

Примечание: Подчеркивание представляет собой последовательность сигнального пептида; выделенная курсивом часть представляет собой Flag-His6-метку.
SEQ ID NO: 1
2. Аминокислотная последовательность меченного Fc человеческого антигена TSLP (huTSLP-Fc)

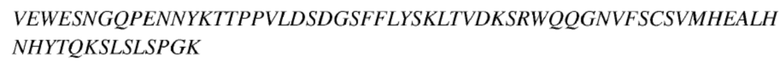
Примечание: Подчеркивание представляет собой последовательность сигнального пептида; выделенная курсивом часть представляет собой линкер-человеческую Fc-метку.
SEQ ID NO: 2
3. Аминокислотная последовательность меченного his антигена TSLP яванского макака (cynoTSLP-his)
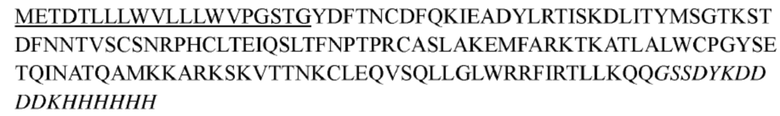
Примечание: Подчеркивание представляет собой последовательность сигнального пептида; выделенная курсивом часть представляет собой flag-His6-метку.
SEQ ID NO: 3
4. Аминокислотная последовательность меченного Fc антигена TSLP яванского макака (cynoTSLP-Fc)

Примечание: Подчеркивание представляет собой последовательность сигнального пептида; выделенная курсивом часть представляет собой линкер-человеческую Fc-метку.
SEQ ID NO: 4
5. Аминокислотная последовательность внеклеточного домена меченного Fc человеческого рецептора TSLP (human-TSLPR-Fc-ECD):

Примечание: Подчеркнутая часть представляет собой внеклеточный домен человеческого TSLPR, а выделенная курсивом часть представляет собой линкер-человеческий Fc-метку.
SEQ ID NO: 5
Пример 2. Очистка рекомбинантных белков TSLP и рецептора TSLP (TSLPR)
2.1 Очистка меченных His рекомбинантных белков TSLP каждого из видов
Образцы супернатанта с продуктами клеточной экспрессии центрифугировали на высокой скорости для удаления примесей и фильтровали. Колонки с никелевым сорбентом уравновешивали раствором PBS и промывали 10-кратным колоночным объемом. Отфильтрованные образцы супернатанта вводили в колонки. Колонки промывали раствором PBS, содержащим 30 мМ имидазола, до тех пор, пока показания при А280 не падали до исходного уровня. Затем целевые белки элюировали раствором PBS, содержащим 300 мМ имидазола, и собирали пики элюирования. Белки концентрировали, среду заменяли на PBS, и из них отбирали аликвоты для использования после того, как они были идентифицированы как правильные с помощью ЖХ-МС. Были получены меченные his человеческий TSLP и TSLP яванского макака.
2.1 Очистка рекомбинантных белков меченого человеческим Fc TSLP каждого из видов и внеклеточного домена человеческого рецептора TSLP
Образцы супернатанта с продуктами клеточной экспрессии центрифугировали на высокой скорости для удаления примесей. Супернатант с продуктом экспрессии рекомбинантного антитела очищали на колонках с белком А. Колонки промывали PBS до тех пор, пока показание поглощение при 280 нм не упало до исходного уровня. Целевые белки элюировали 100 М ацетатным буфером, pH 3,5, и нейтрализовали 1 М трис-HCl, pH 8,0. Полученные белки концентрировали, среду заменяли новым раствором, и из них отбирали аликвоты для использования после того, как они были идентифицированы как правильные с помощью электрофореза и ЖХ-МС.
Пример 3. Конструирование и идентификация линий клеток, экспрессирующих рекомбинантный рецептор TSLP и рецептор IL7Rα
Для скрининга антител, способных блокировать связывание TSLP с рецептором TSLP, были сконструированы клеточные линии CHO-K1 и BaF3, одновременно экспрессирующие как человеческий рецептор TSLP, так и человеческий IL7Rα (TSLPR/IL7Rα). Для упаковки целевого гена TSLPR/IL7 Rα использовали лентивирус и клонировали в линии клеток-мишеней с образованием стабильных линий клеток с высокой экспрессией. Сначала гены человеческого TSLPR и человеческого IL7Rα клонировали в плазмиды pCDH-CMV-MCS-EF1-puro и pCDH-CMV-MCS-EF1-Neo (SBI, CD500B-1), соответственно. Затем использовали метод инфицирования лентивирусом для вставки человеческого TSLPR в линии клеток CHO-K1 и BaF3, которые культивировали под давлением отбора, представлявшего собой 10 мкг/мл пуромицина (Gibco, США), в течение трех недель. Затем проводили второй раунд инфицирования. Ген человеческого IL7Rα вставляли в линии клеток и подвергали скринингу с использованием 1 мг/мл G418 (Gibco, США) и 10 мкг/мл пуромицина в течение двух-трех недель. Наконец, моноклональные линии клеток CHO-K1 и BaF3 с одновременной высокой экспрессией TSLPR и IL7Rα подвергали скринингу методом сортинга по принципу проточной цитометрии.
Пример 4. Получение и скрининг антител к человеческому TSLP
Моноклональные антитела к человеческому TSLP получали путем иммунизации лабораторных белых мышей SJL, самок в возрасте 6-8 недель (Beijing Charles River Laboratory Animal Technology Co., Ltd., номер лицензии на животноводство: SCXK (Beijing) 2012-0001). Условия содержания: свободный от патогенной микрофлоры. После приобретения мышей содержали в лабораторных условиях в течение 1 недели, с циклом свет/темнота 12/12 часов при температуре 20-25°C; влажность 40-60%. Мышей, которые адаптировались к окружающей среде, иммунизировали рекомбинантными белками huTSLP-Fc (25 мкг), huTSLP-his (12,5 мкг) и cyno TSLP-his (12,5 мкг) и адъювантом TiterMax, Alum или CpG. После 4-5 иммунизаций отбирали мышей с высокими титрами антител в сыворотке и титрами, имеющими тенденцию к достижению плато, и умерщвляли. Клетки селезенки собирали и сливали с клетками миеломы. Лимфоциты селезенки были слиты с клетками миеломы Sp2/0 (ATCC® CRL-8287™) с получением гибридомных клеток с применением оптимизированной процедуры слияния, опосредованной ПЭГ.
Для первоначального скрининга были проведены анализы связывания с помощью ELISA в отношении TSLP человека и яванского макака, анализы блокирования связывания человеческого TSLP с его рецептором TSLPR и эксперименты по ингибированию TSLP-индуцированной пролиферации клеток BaF3. После переноса клеток гибридомы в 24-луночные планшеты супернатант подвергали повторному скринингу. Клоны гибридомы получали после двух раундов субклонирования выбранных положительных клонов и использовали для продукции антител, а очистку проводили методами, основанными на аффинности.
После скрининга были получены линии моноклональных клеток гибридомы №3, №119, №179 и №199 с хорошей активностью, и собирали клетки гибридомы в логарифмической фазе роста. Выделяли РНК с помощью NucleoZol (MN) и проводили обратную транскрипцию (PrimeScript™ Reverse Transcriptase, Takara, кат. №2680A). кДНК, полученную в результате обратной транскрипции, амплифицировали с помощью ПЦР с использованием набора мышиного Ig-праймера (Novagen, TB326 Rev.B 0503) и отправляли в компанию, оказывающую услуги по секвенированию, для проведения секвенирования. После секвенирования были получены мышиные антитела к TSLP: последовательности mab3, mab119, mab179 и mab199, аминокислотные последовательности их вариабельных областей представляют собой следующие:
>мышиная последовательность вариабельной области тяжелой цепи mab3:
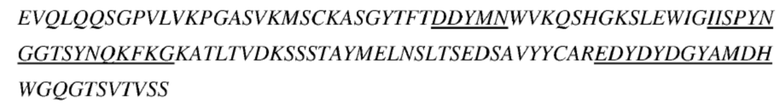
SEQ ID NO: 6
>мышиная последовательность вариабельной области легкой цепи mab3:

SEQ ID NO: 7
>мышиная последовательность вариабельной области тяжелой цепи mab119:
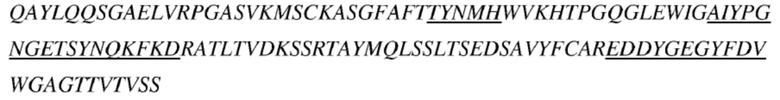
SEQ ID NO: 8
>мышиная последовательность вариабельной области легкой цепи mab119:
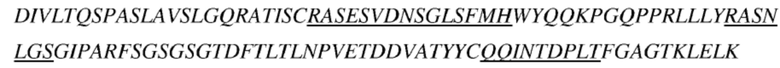
SEQ ID NO: 9
>мышиная последовательность вариабельной области тяжелой цепи mab179:
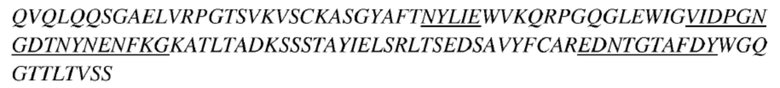
SEQ ID NO: 10
>мышиная последовательность вариабельной области легкой цепи mab179:
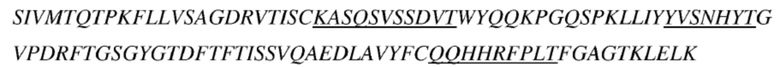
SEQ ID NO: 11
>мышиная последовательность вариабельной области тяжелой цепи mab199:
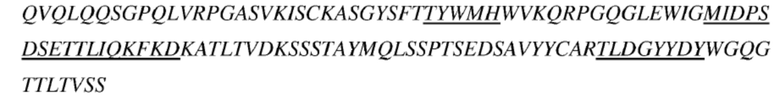
SEQ ID NO: 12
>мышиная последовательность вариабельной области легкой цепи mab199:
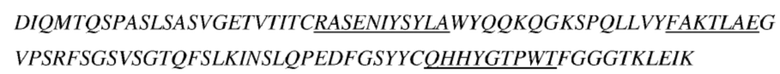
SEQ ID NO: 13
Аминокислотные последовательности областей CDR, полученные в соответствии с системой нумерации Kabat, представлены в следующей таблице:
Таблица 6. Последовательности областей CDR тяжелой цепи и легкой цепи антител из клонов гибридомы
SEQ ID NO: 14
SEQ ID NO: 17
SEQ ID NO: 15
SEQ ID NO: 18
SEQ ID NO: 16
SEQ ID NO: 19
SEQ ID NO: 20
SEQ ID NO: 23
SEQ ID NO: 21
SEQ ID NO: 24
SEQ ID NO: 22
SEQ ID NO: 25
SEQ ID NO: 26
SEQ ID NO: 29
SEQ ID NO: 27
SEQ ID NO: 30
SEQ ID NO: 28
SEQ ID NO: 31
SEQ ID NO: 32
SEQ ID NO: 35
SEQ ID NO: 33
SEQ ID NO: 36
SEQ ID NO: 34
SEQ ID NO: 37
Химерные антитела были образованы путем связывания вариабельных областей легкой и тяжелой цепей вышеупомянутого мышиного антитела с константными областями легкой и тяжелой цепей человеческого антитела (такими как константная область каппа, представленная в SEQ ID NO: 134, и константная область IgG1-YTE, представленная в SEQ ID NO: 133). Химерное антитело, соответствующее клону mab3, было названо Ch3 и так далее для других антител.
Пример 5. Дизайн гуманизации моноклональных антител к человеческому TSLP
Чтобы снизить иммуногенность мышиных антител, отобранные антитела mab3, mab119, mab179 и mab199 с превосходной активностью in vivo и in vitro гуманизировали. Гуманизацию мышиных моноклональных антител осуществляли в соответствии с методами, опубликованными во многих документах в данной области техники. Вкратце, константные домены человеческого антитела использовали для замены родительских константных доменов (мышиного антитела), последовательности человеческих антител зародышевой линии выбирали в соответствии с гомологией между мышиными и человеческими антителами, и проводили привитие CDR. Затем, основываясь на трехмерной структуре мышиного антитела, аминокислотные остатки VL и VH были подвергнуты обратной мутации, и константные области мышиного антитела были заменены человеческими константными областями с получением конечной гуманизированной молекулы.
5.1 Отбор и обратные мутации человеческих областей FR для mab3
(1) Отбор и обратные мутации человеческих областей FR
Для mab3 гуманизированная матрица VH представляла собой IGHV1-3*01+IGHJ6*01, и гуманизированная матрица VL представляла собой IGKV3-20+IGKJ4*01. CDR mab3 прививали к человеческой матрице, и последовательности вариабельной области, полученные после привития, представляют собой следующие:
VL hu3 с привитыми CDR:
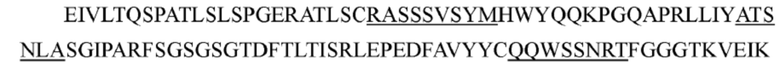
SEQ ID NO: 38
VH hu3 с привитыми CDR:
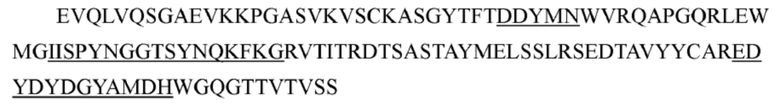
SEQ ID NO: 42
Дизайн обратных мутаций гуманизированного антитела mab3 представлен в следующей таблице:
Таблица 7. Обратные мутации гуманизированного антитела mab3
Примечание: "привитое" означает привитие CDR мышиного антитела в последовательности области FR зародышевой линии человека. L46P означает, что согласно системе нумерации Kabat L в положении 46 подвергнут обратной мутации в P.
Последовательности вариабельных областей гуманизированного антитела mab3 представляют собой следующие:
> hu3VL1 (VL hu3 с привитыми CDR)

SEQ ID NO: 38


Примечание: Одинарное подчеркивание обозначает области CDR, а двойное подчеркивание - сайты обратных мутаций.
Вышеупомянутые вариабельные области легкой и тяжелой цепи объединяли с последовательностями константных областей легкой и тяжелой цепи зародышевой линии человека с образованием конечных полных последовательностей легкой и тяжелой цепей, с получением таким образом антитела с полной последовательностью. Например, для гуманизированного антитела mab3 в настоящем изобретении константная область тяжелой цепи представляет собой константную область IgG1-YTE, представленную в SEQ ID NO: 133, а константная область легкой цепи представляет собой константную область каппа-цепи, представленную в SEQ ID NO: 134, но они также могут быть заменены другими константными областями, известными в данной области техники.
Последовательности вариабельных областей тяжелой и легкой цепи полученных гуманизированных антител mab3 представлены в следующей таблице:
Таблица 8. Последовательности вариабельной области тяжелой и легкой цепи гуманизированного антитела mab3
Связывающая активность гуманизированного антитела mab3 в отношении человеческого TSLP была определена методом ELISA, и результаты показали, что гуманизированные антитела mab3 обладают очень хорошей способностью связываться с человеческим TSLP.
(2) Точечная мутация антитела hu3
Путем определения было обнаружено наличие горячих точек на последовательности MDH HCDR3 и последовательности NTR LCDR3 гуманизированного антитела mab3. Следовательно, соответствующие горячие точки были мутированы. Последовательности областей CDR гуманизированных антител mab3, полученные после введения мутаций, представляют собой следующие:
Таблица 9. Последовательности HCDR3 и LCDR3 после введения мутаций
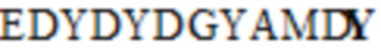
SEQ ID NO: 45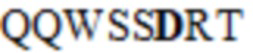
SEQ ID NO: 46
Примечание: Положения сайтов мутаций в таблице 9 пронумерованы в соответствии с естественным порядком последовательностей вариабельных областей.
Можно сделать вывод, что последовательности CDR гуманизированного антитела mab3 представляют собой следующие:
Таблица 10. CDR после введения мутаций в гуманизированное антитело mab3
SEQ ID NO: 14
SEQ ID NO: 17
SEQ ID NO: 15
SEQ ID NO: 18
SEQ ID NO: 47
SEQ ID NO: 48
Где X1 выбран из H или Y, X2 выбран из N или D.
В качестве примера, CDR и вариабельные области тяжелой и легкой цепей гуманизированного антитела hu3-11, полученные после введения мутаций, представляют собой следующие:
Таблица 11. Области CDR hu3-11
SEQ ID NO: 14
SEQ ID NO: 17
SEQ ID NO: 15
SEQ ID NO: 18
SEQ ID NO: 45
SEQ ID NO: 46
>Вариабельная область легкой цепи hu3-11 (hu3VL4-N93D)

SEQ ID NO: 49
>Вариабельная область тяжелой цепи hu3-11 (hu3VH2-H110Y)
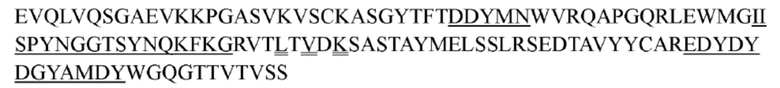
SEQ ID NO: 50
Вариабельные области легкой и тяжелой цепи после введения мутаций в горячие точки рекомбинировали с последовательностями константных областей легкой и тяжелой цепи зародышевой линии человека с образованием конечных полных последовательностей легкой и тяжелой цепей, с получением таким образом антитела с полной последовательностью.
Связывающую активность антитела, полученного после введения мутаций, в отношении человеческого TSLP определяли методом ELISA. Результаты показали, что аффинная активность hu3-11 к человеческому TSLP осталась высокой, что указывает на то, что мутации в горячих точках HCDR3 и LCDR3 гуманизированного антитела mab3 не влияют на активность антитела.
(3) Созревание аффинности антитела hu3-11
Молекулу hu3-11 подвергали созреванию аффинности. Процесс созревания аффинности представлял собой следующий:
Конструирование дрожжевой библиотеки: были сконструированы вырожденные праймеры, и сконструированные мутантные аминокислоты были введены в мутантные библиотеки антител hu3-11 scFv методом ПЦР, где размер каждой библиотеки составлял около 109. Сконструированные дрожжевые библиотеки проверяли на их разнообразие методом секвенирования.
В первом раунде скрининга инкубировали приблизительно 5×1010 клеток из мутантных библиотек hu3-11-scFv и биотинилированный белок TSLP-Fc (1-10 мкг/мл) в 50 мл натрий-фосфатного буфера с 0,1% бычьего сывороточного альбумина (BSA) (PBSA) в течение 1 ч при комнатной температуре. Затем смесь промывали 0,1% PBSA для удаления несвязавшихся фрагментов антител. Затем к мутантным библиотекам антител hu3-11-scFv, связанным с биотинилированным TSLP-Fc, добавляли 100 мкл гранул со стрептомицином (Milenyi Biotec, Оберн, Калифорния) и загружали в систему AutoMACS для сортировки. Клетки с высокой аффинностью к TSLP-Fc собирали из библиотеки антител и индуцировали при 250 об/мин и 20°C в течение 18 часов. Полученную обогащенную библиотеку подвергали второму раунду скрининга против биотинилированного рекомбинантного белка TSLP-Fc.
Для третьего и четвертого раундов скрининга клетки библиотеки из предыдущего раунда инкубировали с биотинилированным рекомбинантным белком TSLP-Fc (0,1-1 мкг/мл) и 10 мкг/мл мышиного антитела к cMyc (9E10, sigma) в 0,1% PBSA при комнатной температуре в течение 1 ч. Смесь промывали 0,1% PBSA для удаления несвязавшихся фрагментов антител. Добавляли козье антимышиное антитело, конъюгированное с Alexa488 (A-11001, life technologies) и стрептавидин-PE (S-866, Life technologies) и инкубировали при 4°C в течение 1 ч. Смесь промывали 0,1% PBSA для удаления несвязавшихся фрагментов антител. Наконец, антитела с высокой аффинностью подвергали скринингу с помощью FACS-скрининга (BD FACSAriaTM FUSION).
Библиотеки мутантов hu3-11-scFv прошли 2 раунда скрининга методом MACS и 2 раунда скрининга методом FACS с использованием биотинилированного антигена TSLP-Fc. Затем было отобрано приблизительно 400 отдельных клонов дрожжей для культивирования и индукции экспрессии. Определяли связывание отдельных клонов дрожжей с антигеном TSLP-Fc с помощью FACS, отбирали отдельные клоны дрожжей с высокой аффинностью и подвергали проверке секвенированием. Секвенированные клоны сравнивали и анализировали. После удаления дублированных последовательностей недублированные последовательности были преобразованы в полноразмерные антитела для экспрессии в клетках млекопитающих.
Последовательности вариабельных областей легкой цепи, полученные в результате созревания аффинности, представляют собой следующие:

Полученные вариабельные области легкой цепи рекомбинировали с вариабельными областями тяжелой цепи гуманизированного антитела mab3 для получения нового гуманизированного антитела mab3. Например, huVL5 и huVL6 комбинировали соответственно с hu3VH2-H110Y с получением новых молекул антител hu3-12 и hu3-13, как подробно представлено ниже:
Таблица 12. Антитела, полученные в результате созревания аффинности
Последовательности CDR гуманизированного антитела mab, полученного в результате созревания аффинности, представляют собой следующие:
Таблица 13. CDR антитела гуманизированного антитела mab3, полученного в результате созревания аффинности
SEQ ID NO: 14
SEQ ID NO: 17
SEQ ID NO: 15
SEQ ID NO: 18
SEQ ID NO: 45
SEQ ID NO: 53
SEQ ID NO: 14
SEQ ID NO: 17
SEQ ID NO: 15
SEQ ID NO: 18
SEQ ID NO: 45
SEQ ID NO: 54
Полученное новое гуманизированное антитело mab3 подвергали ELISA для определения его связывающей активности в отношении человеческого TSLP. Результаты показали, что hu3-12 и hu3-13 сохраняют высокую способность к связыванию с человеческим TSLP. Они показали, что изменения LCDR3 не влияют на активность антител серии hu3.
Таким образом, CDR гуманизированного антитела mab3 имеют следующие последовательности:
Таблица 14. Общая формула последовательностей областей CDR гуманизированного антитела mab3
SEQ ID NO: 14
SEQ ID NO: 17
SEQ ID NO: 15
SEQ ID NO: 18
SEQ ID NO: 47
SEQ ID NO: 55
Где X1 представляет собой H или Y, X3 представляет собой N или S, X4 представляет собой V или G, X5 представляет собой G или E.
Комбинации вариабельных областей тяжелой и легкой цепи гуманизированного антитела mab3 после введения мутаций в горячие точки мутагезена и созревания аффинности представлены в следующей таблице:
Таблица 15. Последовательности антител после созревания аффинности
5.2 Отбор и обратные мутации человеческих областей FR для mab119
Для mab119 IGHV1-69*02 и HJ6*01 были выбраны в качестве матриц для VH, а IGKV4-1*01 и IGKJ2*01, а также IGKV3-11*01 и IGKJ2*01 были выбраны в качестве матриц для VL. Области CDR мышиного антитела прививали к выбранным гуманизированным матрицам, и в области FR вводили обратные мутации для получения различных вариабельных областей легкой и тяжелой цепи. Последовательности вариабельной области, полученные в результате привития CDR, представляют собой следующие:

Обратные мутации гуманизированного антитела mab119 представлены в следующей таблице:
Таблица 16. Обратные мутации mab119
+A43P, I48L
Примечание: Например, M4L обозначает, что согласно системе нумерации Kabat M в положении 4 подвергнут обратной мутации в L. "Привитое" означает, что CDR мышиного антитела имплантирована в последовательность области FR зародышевой линии человека.
Конкретные последовательности вариабельных областей гуманизированного антитела mab119 представляют собой следующие:
>hu119VL1 (привитое (IGKV4-1*01))

>hu119VL2

SEQ ID NO: 57
>hu119VL3

SEQ ID NO: 58
>hu119VL4 (привитое, IGKV3-11*01)

SEQ ID NO: 59
>hu119VL5 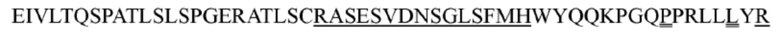
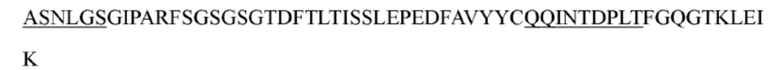
SEQ ID NO: 60
>hu119VL6

SEQ ID NO: 61




Примечание: Одинарное подчеркивание обозначает вариабельные области, а двойное подчеркивание - обратные мутации.
Вышеупомянутые вариабельные области легкой и тяжелой цепи объединяли с последовательностями константных областей легкой и тяжелой цепи зародышевой линии человека с образованием конечных полных последовательностей легкой и тяжелой цепей, с получением таким образом антитела с полной последовательностью. Например, для гуманизированного антитела mab119 в настоящем изобретении константная область тяжелой цепи представляет собой константную область IgG1-YTE, представленную в SEQ ID NO: 133, а константная область легкой цепи представляет собой константную область каппа-цепи, представленную в SEQ ID NO: 134, но они также могут быть заменены другими константными областями, известными в данной области техники.
Вариабельные области тяжелой и легкой цепи гуманизированного антитела mab119 представлены в таблице 17.
Таблица 17. Вариабельные области тяжелой и легкой цепи гуманизированного антитела mab119
Связывающая активность указанного гуманизированного антитела в отношении человеческого TSLP была определена методом ELISA, и результаты показали, что гуманизированные антитела mab119 способны специфично связываться с человеческим TSLP.
(2) Мутации hu119
С помощью определения было обнаружено наличие горячей точки в последовательности DNS LCDR1 гуманизированного антитела mab119, таким образом, соответствующий сайт был мутирован в N31S или N31Q. Последовательности LCDR1, полученные после введения мутаций, представляют собой следующие:
Таблица 18. LCDR1 после введения мутаций в сайт гуманизированного антитела mab119
SEQ ID NO: 70
SEQ ID NO: 71
Примечание: Положения сайтов мутаций в таблице 19 пронумерованы в соответствии с естественным порядком.
В качестве примера, мутантные последовательности hu119VL2, hu119VL6, полученные после введения мутаций, представляют собой следующие:


Примечание: Одинарное подчеркивание обозначает вариабельные области, а двойное подчеркивание - обратные мутации.
Полученные мутанты hu119VL2, hu119VL6 объединяли с hu119VH с получением новых гуманизированных антител hu119. Например, hu119VL2-N31S, hu119VL2-N31Q соответственно объединяли с hu119VH3 с получением антител hu119-28 и hu119-29; hu119VL3-N31S объединяли с hu119VH8 с получением антитела hu119-30. Примеры комбинаций вариабельных областей мутированных антител представляют собой следующие:
Таблица 19. Комбинации вариабельных областей гуманизированного антитела после введения мутаций в горячие точки мутагезена
Аффинность антитела, полученного после введения мутаций, к человеческому TSLP определяли методом ELISA. Результаты показали, что антитела hu119-28 и hu119-29 сохранили относительно высокую аффинность к человеческому TSLP, что свидетельствует о том, что мутации N31S и N31Q в LCDR2 не повлияют на активность антитела к TSLP.
Таким образом, CDR гуманизированного антитела mab119 имеют следующие последовательности:
Таблица 20. CDR гуманизированного антитела mab119
SEQ ID NO: 20
общая формула
SEQ ID NO: 76
SEQ ID NO: 21
SEQ ID NO: 24
SEQ ID NO: 22
SEQ ID NO: 25
Где X6 выбран из N, S и Q.
5.3. Гуманизация mab179
(1) Выбор матрицы и обратных мутаций для гуманизации мышиного антитела mab179
Для mab179 IGHV1-69*02 и IGHJ6*01 были выбраны в качестве матриц для VH, а IGKV4-1*01 и IGKJ2*01 или IGKV2-29*02 и IGKJ2*01 были выбраны в качестве матриц для VL. Области CDR мышиного антитела прививали к выбранным гуманизированным матрицам, а в области FR вводили обратные мутации для получения вариабельных областей легкой и тяжелой цепи с различными последовательностями. Последовательности гуманизированных вариабельных областей и обратные мутации представляют собой следующие:

Таблица 21. Матрицы и обратные мутации для гуманизации mab179
P43S
Примечание: Например, P43S обозначает, что согласно системе нумерации Kabat P в положении 43 подвергнут обратной мутации в S. "Привитое" означает, что CDR мышиного антитела имплантирована в последовательность области FR зародышевой линии человека.
Вариабельные области гуманизированного антитела mab179 представляют собой следующие:
>hu179VL1 (Привитое (IGKV4-1*01))
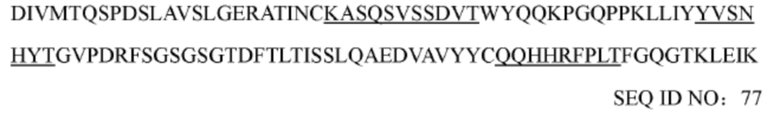





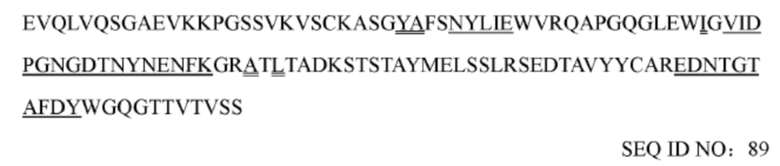
Примечание: Одинарное подчеркивание обозначает области CDR, а двойное подчеркивание - сайты обратных мутаций.
Вышеупомянутые вариабельные области легкой и тяжелой цепи объединяли с последовательностями константных областей легкой и тяжелой цепи зародышевой линии человека с образованием конечных полных последовательностей легкой и тяжелой цепей, с получением таким образом антитела с полной последовательностью. Например, для гуманизированного антитела mab199 в настоящем изобретении константная область тяжелой цепи представляет собой константную область IgG1-YTE, представленную в SEQ ID NO: 133, а константная область легкой цепи представляет собой константную область каппа-цепи, представленную в SEQ ID NO: 134, но они также могут быть заменены другими константными областями, известными в данной области техники.
Таблица 22. Комбинации вариабельных областей тяжелой и легкой цепи гуманизированного антитела mab179
Аффинность гуманизированного антитела mab179 к человеческому TSLP была определена методом ELISA, и результаты показали, что гуманизированные антитела mab179 обладают очень хорошей аффинностью в отношении человеческого TSLP.
(2) Мутации антитела hu179
Путем определения было обнаружено наличие горячих точек на последовательностях HCDR2 и LCDR2 гуманизированного антитела mab179. Следовательно, соответствующие горячие точки были мутированы для устранения риска модифицирования молекулы.
В одном из вариантов осуществления GNG HCDR2 hu179VH1 был подвергнут аминокислотной мутации, и последовательности hu179VH1 после введения мутаций представляют собой следующие:
hu179VH1- N55Q
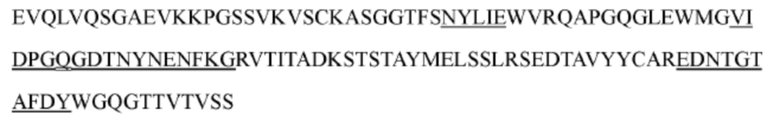
SEQ ID NO: 90
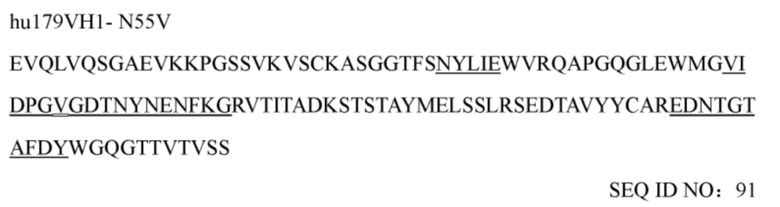

Примечание: Одинарное подчеркивание обозначает области CDR, а двойное подчеркивание - сайты обратных мутаций.
Последовательности областей HCDR2 гуманизированного антитела mab179, полученные после введения мутаций, представляют собой следующие:
Таблица 23. Мутанты HCDR2 гуманизированного антитела mab179
SEQ ID NO: 93
SEQ ID NO: 94
SEQ ID NO: 95
Примечание: Положения сайтов мутаций в таблице 24 пронумерованы в соответствии с естественным порядком.
Области CDR гуманизированного антитела mab179 могут быть получены из приведенных выше и представляют собой следующие:
Таблица 24. CDR гуманизированного антитела mab179 после введения мутаций
SEQ ID NO: 26
SEQ ID NO: 29
SEQ ID NO: 96
SEQ ID NO: 30
SEQ ID NO: 28
SEQ ID NO: 31
Где X7 выбран из N, Q или V, X8 выбран из G или V.
Мутанты hu179VH1, полученные после введения мутаций, комбинировали с гуманизированным hu179VL с получением новых гуманизированных антител mab179. Примеры антител, полученных из комбинации мутанта hu179VH1 и hu179VL2, представляют собой следующие:
Таблица 25. Комбинации вариабельных областей антитела после введения мутаций
Аффинность антитела, полученного после введения мутаций, к человеческому TSLP определяли методом ELISA. Результаты показали, что антитела после введения мутаций в HCDR2 сохраняют относительно высокую аффинность к человеческому TSLP. Они показали, что точечные мутации N55Q, N55V и G56V в HCDR2 гуманизированного антитела mab179 в основном не повлияют на аффинность антитела к TSLP.
Тем же способом были сделаны точечные мутации N55Q, N55V и G56V (пронумерованные в естественном порядке) в hu179VH2, hu179VH3, hu179VH4 и hu179VH5, соответственно, и вариабельные области тяжелой и легкой цепи, полученные путем введения указанных мутаций, рекомбинировали с получением новых гуманизированных антител mab179. В качестве примера, мутированная последовательность hu179VH3 представляет собой следующую:

Примечание: Одинарное подчеркивание обозначает области CDR, а двойное подчеркивание - сайты обратных мутаций.
В некоторых других примерах LCDR2 гуманизированного антитела mab179 подвергали введению аминокислотных мутаций. В качестве примера, последовательности hu179VL2, полученные после введения мутаций, представляют собой следующие:




Примечание: Одинарное подчеркивание обозначает области CDR, а двойное подчеркивание - сайты обратных мутаций.
Последовательности LCDR2 гуманизированного антитела mab179, полученные после введения мутаций, представляют собой следующие:
Таблица 26. Мутанты LCDR2 гуманизированного антитела mab179
SEQ ID NO: 108
SEQ ID NO: 109
SEQ ID NO: 110
SEQ ID NO: 111
SEQ ID NO: 112
SEQ ID NO: 113
SEQ ID NO: 114
SEQ ID NO: 115
SEQ ID NO: 116
SEQ ID NO: 117
Из приведенного выше видно, что общая формула LCDR2 гуманизированного антитела mab179 представляет собой: X9VX10X11X12X13T (SEQ ID NO: 118), где X9 выбран из Y или E, X10 выбран из S, D или E, X11 выбран из N, Q, D или E; X12 выбран из H, Y, D или E; X13 выбран из E или Y. Области CDR гуманизированного антитела mab179 представлены в следующей таблице:
Таблица 27. CDR гуманизированного антитела mab179
SEQ ID NO: 26
SEQ ID NO: 29
SEQ ID NO: 96
SEQ ID NO: 118
SEQ ID NO: 28
SEQ ID NO: 31
Где X7 выбран из N, Q или V, X8 выбран из G или V; X9 выбран из Y или E; X10 выбран из S, D или E; X11 выбран из N, Q, D или E; X12 выбран из H, Y, D или E; X13 выбран из E или Y.
Мутанты hu179VL2, полученные после введения мутаций, комбинировали с вариабельными областями тяжелой цепи гуманизированного hu179 с получением новых гуманизированных антител mab179. В качестве примера, мутанты hu179VL2 комбинировали с hu179VH1, hu179VH3 и CDR, и комбинации вариабельных областей тяжелой и легкой цепи полученных гуманизированных антител mab179 представляют собой следующие:
Таблица 28. Последовательности областей CDR гуманизированного антитела mab179 после введения мутаций в LCDR2
SEQ ID NO: 26
SEQ ID NO: 29
SEQ ID NO: 27
SEQ ID NO: 118
SEQ ID NO: 28
SEQ ID NO: 31
Где X5 выбран из Y или E; X6 выбран из S, D или E; X7 выбран из N, Q, D или E; X8 выбран из H, Y, D или E; X9 выбран из E или Y.
Таблица 29. Комбинации вариабельных областей тяжелой и легкой цепи гуманизированного антитела mab179, полученных после введения мутаций в LCDR2
Аффинность гуманизированных антител mab179, полученных после введения мутаций в LCDR2, к человеческому TSLP определяли методом ELISA. Результаты показали, что антитела, полученные после введения мутаций в горячие точки мутагезена в LCDR2, сохраняют относительно хорошую аффинность к человеческому TSLP. Они показали, что мутации в горячих точках в LCDR2 не повлияют на связывающую активность гуманизированных антител mab179.
Тем же способом были сделаны мутации N53Q, N53D, N53S, H54Y, Y50E, S52D, S52E, N53E, H54D, H54E, Y55E в LCDR2 hu179VL3, hu179VL4, hu179VL5, hu179VL6, hu179VL7 и hu179VL8. Вариабельные области легкой цепи и вариабельные области тяжелой цепи после введения мутаций комбинировали с образованием новых гуманизированных антител mab. В одном из вариантов осуществления последовательность hu179VL8 после введения мутаций представляет собой следующую:

hu179VL8-N53E и hu179VH3-N55V, полученные путем введения мутаций, комбинировали с получением новой молекулы антитела hu179-33, последовательности CDR которого представляет собой следующие:
Таблица 30. Области CDR антитела hu179-33
SEQ ID NO: 26
SEQ ID NO: 29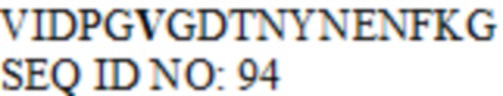

SEQ ID NO: 28
SEQ ID NO: 31
Связывающую активность антител, полученных после введения мутаций, в отношении человеческого TSLP определяли с помощью Biacore. Иллюстративная связывающая активность антител представляет собой следующую:
Таблица 31. Аффинность hu179-33 к человеческому TSLP
Результаты показали, что антитело hu179-33 обладает относительно высокой специфичной активностью связывания с человеческим TSLP. Это указывает на то, что точечные мутации горячих точек как в HCDR2, так и в LCDR2 не повлияют на аффинность гуманизированного антитела mab179 к человеческому TSLP. Можно видеть, что в молекуле гуманизированного антитела mab179 мутации N55Q, N55V, G56V, сделанные в HCDR2, и мутации N53Q, N53D, N53S, H54Y, Y50E, S52D, S52E, N53E, H54D, H54E, Y55E, сделанные в LCDR2, не повлияют на связывание антитела с человеческим TSLP, т. е. не повлияет на активность антител к TSLP.
5.4 Отбор и обратные мутации человеческих областей FR для антитела mab199
Для mab199 IGHV1-46*01 и HJ6*01 были выбраны в качестве матриц для VH, а IGKV1-39*01 и IGKJ4*01 были выбраны в качестве матриц для VL. Области CDR мышиного антитела прививали к выбранным гуманизированным матрицам, а в области FR вводили обратные мутации для получения вариабельных областей легкой и тяжелой цепи с различными последовательностями. Обратные мутации представлены в таблице 32.
Таблица 32. Дизайн обратных мутаций для mab199
Примечание: Например, I48V обозначает, что согласно системе нумерации Kabat I в положении 48 подвергнут обратной мутации в V. "Привитое" означает, что CDR мышиного антитела имплантирована в последовательность области FR зародышевой линии человека.
Вариабельные области гуманизированного антитела mab199 представляют собой следующие:





Примечание: Одинарное подчеркивание обозначает области CDR, а двойное подчеркивание - сайты обратных мутаций.
Вышеупомянутые вариабельные области легкой и тяжелой цепи объединяли с последовательностями константных областей легкой и тяжелой цепи зародышевой линии человека с образованием конечных полных последовательностей легкой и тяжелой цепей, с получением таким образом антитела с полной последовательностью. Для гуманизированных антител mab199, если в настоящем документе нет четкого описания, константная область легкой цепи представляет собой константную область, представленную в последовательности SEQ ID NO: 134, а константная область тяжелой цепи представляет собой константную область, представленную в последовательности SEQ ID NO: 133.
Полученные гуманизированные антитела mab199 представляют собой следующие:
Таблица 33. Последовательности вариабельных областей тяжелой и легкой цепи гуманизированных антител mab199
Активность гуманизированных антител mab199, блокирующих связывание TSLP с рецептором TSLP, была определена методом ELSA, и результаты определения представляют собой следующие:
Таблица 34. Активность гуманизированного антитела mab199 в отношении блокирования связывания TSLP с рецептором TSLP
Результаты показали, что гуманизированные антитела mab199 сохраняют относительно высокую активность блокирования связывания TSLP с рецептором TSLP.
5.5 Константные области антител
Константная область тяжелой цепи гуманизированного антитела и химерного антитела могут быть выбраны из группы, состоящей из константных областей IgG1, IgG2, IgG4 и их вариантов. Например, в настоящем изобретении использовали константную область IgG1-YTE, и ее последовательность представлена в SEQ ID NO: 133. Константная область легкой цепи может быть выбрана из константных областей человеческой легкой κ-, λ-цепи или их вариантов. Например, в настоящем изобретении использовали константную область человеческой κ-цепи, и ее последовательность представлена в SEQ ID NO: 134.
>константная область тяжелой цепи IgG1-YTE:

Примечание: Подчеркивание относится к разработанным мутациям M252Y, S254T, T256E
> константная область легкой κ-цепи:

Гуманизированные вариабельные области тяжелой и легкой цепи в настоящем изобретении рекомбинировали с вышеуказанными константными областями с получением полноразмерных последовательностей тяжелых и легких цепей. Примеры последовательностей антител представляют собой следующие:
тяжелая цепь антитела hu3-13:

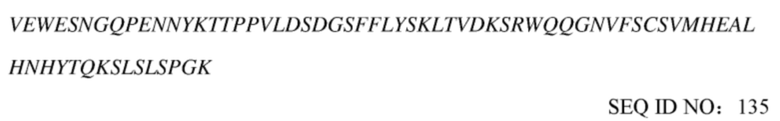
легкая цепь антитела hu3-13:

тяжелая цепь антитела hu119-30

легкая цепь антитела hu119-30

тяжелая цепь антитела hu179-33


легкая цепь антитела hu179-33

тяжелая цепь антитела hu199-36

легкая цепь антитела hu199-36

Примечание: Подчеркнутая часть представляет собой CDR, а выделенная курсивом часть представляет собой константную область.
AMG157 использовали в качестве положительного контроля для настоящего изобретения, и его последовательность соответствует представленной в SEQ ID NO: 143 и SEQ ID NO: 144.
Последовательность тяжелой цепи AMG157

Последовательность легкой цепи AMG157

Кроме того, при тестировании активности антител в настоящем изобретении также использовались человеческий рецептор TSLP и человеческий IL7Rα для конструирования линий клеток, и их последовательности представляют собой следующие:
Полноразмерная аминокислотная последовательность человеческого рецептора TSLP:

Примечание: Подчеркнутая часть относится к сигнальному пептиду
SEQ ID NO: 145
Полноразмерная аминокислотная последовательность человеческого IL7Rα (Uniprot ID: P16871)


Примечание: Подчеркнутая часть относится к сигнальному пептиду
SEQ ID NO: 146
Антитела согласно настоящему изобретению могут быть клонированы, экспрессированы и очищены с использованием обычных способов клонирования генов и методов рекомбинантной экспрессии.
Тестовые примеры:
Биологическая оценка активности in vitro
Тестовый пример 1: Определение связывания антител к TSLP с человеческим TSLP с помощью ELSA
Человеческий TSLP-his (SEQ ID NO: 1) разбавляли до 1 мкг/мл буфером PBS с pH 7,4 (Shanghai BasalMedia, B320), добавляли в количестве 100 мкг/лунку в 96-луночные планшеты для микротитрования (Corning, CLS3590-100EA) и инкубировали в течение ночи при 4°C. После удаления жидкости добавляли 200 мкл/лунку блокирующего раствора с 5% обезжиренного молока (сухое обезжиренное молоко Bright Dairy), разведенного в PBS, и инкубировали в инкубаторе при 37°C в течение 2 часов для блокирования. После завершения блокирования блокирующий раствор удаляли и 3 раза промывали планшеты буфером PBST (PBS, содержащий 0,1% твин-20, pH 7,4). Тестируемые антитела и антитело положительного контроля AMG157 в различных концентрациях, разбавленные разбавителем для образцов, добавляли в количестве 100 мкл/лунку и инкубировали в инкубаторе при 37°C в течение 1 часа. По окончании инкубации планшеты 3 раза промывали PBST. Добавляли меченное HRP (пероксидаза хрена) вторичное козье антимышиное антитело (Jackson Immuno Research, 115-035-003), разбавленное разбавителем для образцов, в количестве 100 мкл/лунку и инкубировали при 37°C в течение 1 часа. После 6-кратной промывки планшета PBST добавляли 50 мкл/лунку хромогенного субстрата TMB (KPL, 52-00-03) и инкубировали при комнатной температуре в течение 10-15 минут, после чего добавляли 50 мкл/лунку 1 M H2SO4 для остановки реакции. Величину поглощения считывали с помощью считывающего устройства для микропланшетов NOVOStar при 450 нм. Рассчитывали значение EC50 связывания антител к TSLP с TSLP, и результаты представлены в следующей таблице.
Таблица 35. Результаты в отношении связывающей активности антител к человеческому TSLP
Результаты показали, что антитела согласно настоящему изобретению обладают очень хорошей активностью связывания с человеческим TSLP.
Тестовый пример 2: Определение аффинности гуманизированных антител к TSLP к TSLP от различных видов по технологии Biacore
Аффинность гуманизированных антител к TSLP, подлежащих тестированию с TSLP человека и яванского макака, определяли с помощью прибора Biacore T200 (GE).
Тестируемые молекулы были аффинно захвачены биосенсорными чипами с белком А (кат. №29127556, GE). Затем антигенам (huTSLP-his, cynoTSLP-his, полученным в примере 1) позволяли протекать по поверхности чипа и определяли сигнал реакции в реальном времени с помощью прибора Biacore T200 для получения кривых связывания и диссоциации. После завершения диссоциации в каждом экспериментальном цикле биосенсорные чипы промывали и регенерировали раствором для регенерации глицин-соляная кислота (рН 1,5, кат. № BR-1003-54, GE). Данные аппроксимировали с помощью модели Ленгмюра (1:1) с использованием программного обеспечения BIAevaluation version 4.1, GE для получения значения аффинности, представленного в следующих таблицах.
Таблица 36. Аффинность антител к TSLP в отношении TSLP от различных видов
к huTSLP
(M)
к TSLP яванского макака
(M)
Результаты показали, что антитела к TSLP согласно настоящему изобретению обладают относительно высокой аффинностью к человеческому TSLP, и могут также связываться с TSLP яванского макака.
Тестовый пример 3: Основанный на ELISA эксперимент по исследованию блокирования антителами к TSLP связывания TSLP с рецептором TSLP
Рецептор TSLP имеет две субъединицы, TSLPR и IL7R, из которых TSLPR является специфическим рецептором для TSLP, а IL7R является общим рецептором для TSLP и IL7. TSLP сначала связывается с TSLPR, а затем с IL7R. Этот тестовый пример использовали для определения того, могут ли антитела к TSLP блокировать связывание TSLP с внеклеточным доменом рекомбинантно экспрессированного рецепторного белка TSLPR.
Планшеты для ELISA покрывали человеческим TSLPR-Fc-ECD (2 мкг/мл, SEQ ID NO: 5) и инкубировали в течение ночи при 4°C. После удаления жидкости добавляли 200 мкл/лунку блокирующего раствора с 5% обезжиренного молока, разведенного в PBS, и инкубировали в инкубаторе при 37°C в течение 2 часов для блокирования. После завершения блокирования блокирующий раствор удаляли и 3 раза промывали планшеты буфером PBST (PBS, содержащий 0,05% твин-20, pH 7,4). Готовили меченный биотином антиген huTSLP-Fc в концентрации 3 нМ и последовательные разведения тестируемых антител, начиная с 200 нМ. Антиген и антитело смешивали 1:1, затем помещали при 37°C на 15 мин, добавляли по 100 мкл на лунку в планшеты для микротитрования и помещали при 37°C на 1 час. Планшеты 3 раза промывали PBST. Добавляли полимер стрептавидин-пероксидазы, разбавленный до 1:4000 разбавителем для образцов, в количестве 100 мкл/лунку и инкубировали при 37°C в течение 1 часа. После 5-кратной промывки планшетов PBST добавляли 100 мкл/лунку хромогенного субстрата TMB (KPL, 52-00-03) и инкубировали при комнатной температуре в течение 3-10 минут, после чего добавляли 100 мкл/лунку 1 M H2SO4 для остановки реакции. Величину поглощения считывали с помощью считывающего устройства для микропланшетов NOVOStar при 450 нм. Рассчитывали значение IC50 блокирования антителами к TSLP связывания TSLP с TSLPR, и результаты представлены в таблице 37 и на фиг. 1.
Таблица 37. Результаты в отношении блокирующей активности антител
Результаты показали, что все антитела согласно настоящему изобретению способны на высоком уровне ингибировать связывание TSLP с его рецептором TSLPR.
Тестовый пример 5: Основанный на FACS эксперимент по исследованию блокирования антителом к TSLP связывания TSLP с рецептором TSLP
Этот тестовый пример использовали для определения того, могут ли антитела к TSLP соответственно блокировать связывание TSLP с рецепторами TSLPR/IL7R на поверхности линии клеток CHOK1.
А именно, метод представлял собой следующий: CHOK1-TSLPR/IL7R культивировали с DME/F12, содержащей 10% FBS, 1 мг/мл G418 и 10 мкг/мл пуромицина. Клетки CHOK1-TSLPR/IL7R в хорошем состоянии центрифугировали (1000 об/мин, 5 мин), однократно промывали 2% FBS в PBS. Клетки подсчитывали и доводили до концентрации клеток 1×106/мл. 50 мкл клеток добавляли в 96-луночные планшеты с круглым дном. Тестируемые антитела разбавляли раствором PBS, содержащим 2% BSA, с начальной концентрацией 20 нМ и 8 градиентами в соотношении 1:4. Готовили меченный биотином антиген TSLP-Fc в концентрации 2 нМ. Антиген и антитело смешивали в соотношении 1:1 и помещали при 37°C на 15 мин. Смесь добавляли по 50 мкл на лунку в 96-луночные планшеты, в которые были высеяны клетки, и инкубировали при 4°C в течение 1 часа. По окончании инкубации планшеты центрифугировали при 4°C (800 g, 5 мин) и удаляли супернатант. Планшеты дважды промывали 200 мкл предварительно охлажденного PBS центрифугированием. Добавляли вторичное антитело PE-SA, разбавленное 1:1000, и инкубировали при 4°C в темноте в течение 40 минут. Затем планшеты центрифугировали при 4°C (800 g, 5 мин) и удаляли супернатант. Добавляли 200 мкл предварительно охлажденного PBS, чтобы увеличить клетки в размерах, и трижды промывали их центрифугированием при 4°C. Добавляли 100 мкл PBS и загружали планшет в устройство для считывания с планшета. Значение IC50 блокирования связывания TSLP с TSLPR/IL7R антителами к TSLP рассчитывали в соответствии со значением сигналов флуоресценции. Результаты представлены в таблице 38.
Таблица 38. Результаты блокирования антителами TSLPR на клеточной поверхности
Результаты показали, что все антитела согласно настоящему изобретению способны на относительно высоком уровне ингибировать связывание TSLP с TSLPR/IL7R на клеточной поверхности.
Тестовый пример 6: Антитела к TSLP ингибировали продукцию хемокинов, индуцированную TSLP
TSLP может индуцировать созревание наивных миелоидных дендритных клеток (мДК) и секрецию тимус-ассоциированного регуляторного хемокина (TARC) и остеопротегерина (OPG), тем самым дополнительно опосредуя врожденный и адаптивный иммунный воспалительный ответ. Этот тестовый пример использовали для проверки того, что полученные антитела способны блокировать индуцированную TSLP продукцию хемокинов мДК, тем самым блокируя возникновение врожденного и адаптивного воспалительного ответа.
Наивные миелоидные мДК отделяли и очищали от мононуклеарных клеток периферической крови (МНПК) человека с использованием метода сортировки с помощью магнитных гранул (CD1c (BDCA-1) + Dendritic Cell Isolation Kit, Miltenyi Biotec). Полученные мДК высевали в 96-луночные планшеты для культивирования клеток. Последовательно разведенные образцы антител и человеческого TSLP (huTSLP-his, конечная концентрация 50 нг/мл) предварительно инкубировали в течение приблизительно 45 минут (37°C), а затем соответственно добавляли в каждую лунку с культурой клеток, содержащую мДК, для стимуляции мДК in vitro. Планшеты помещали в инкубатор для культивирования на 48 часов. Супернатант клеточной культуры собирали и разводили надлежащим образом, а затем содержание в нем хемокинов определяли методом ELISA. TARC определяли с использованием набора для ELISA-анализа человеческого CCL17/TARC Quantikine от R&D Company; содержание OPG определяли с использованием набора для ELISA-анализа человеческого CCL22/MDC Quantikine (R&D), и результаты показаны на фиг. 4A-фиг. 4B.
Результаты показали, что все антитела согласно настоящему изобретению способны значительно ингибировать индуцированную TSLP продукцию хемокинов TARC и OPG, что указывает на то, что антитела согласно настоящему изобретению способны блокировать возникновение врожденного и адаптивного воспалительного ответа.
Тестовый пример 7. Антитела к TSLP блокировали пролиферацию клеток BaF3-TLSPR/IL7R, индуцированную нативным TSLP
Клетки BaF3-hTSLPR/hIL7R могут пролиферировать при стимуляции нативным TSLP. Связывание антител с нативным TSLP снижает стимулирующее действие TSLP на клетки BaF3-hTSLPR/hIL7R.
Клетки NHLF (коллекция культур BeNa, BNCC340764) и клетки HLF1 (коллекция культур BeNa, BNCC337730) культивировали до тех пор, пока клетки не вырастали до 80%, и удаляли супернатант. Фибробласты легких человека, NHLF (коллекция культур BeNa, BNCC340764) и HLF1 (коллекция культур BeNa, BNCC337730) стимулировали 10 нг/мл человеческого IL1-β (Sino Biological GMP-10139-HNAE), 20 нг/мл IL13 (R&D 213-ILB-005), 20 нг/мл TNF-α (PEPROTECH 300-01A) в течение 72 часов, чтобы индуцировать продукцию нативного TSLP. После окончания стимуляции клеточный супернатант собирали и центрифугировали при 4500 об/мин в течение 5 минут для удаления клеточного детрита. Супернатант собирали, концентрировали примерно в 10 раз на концентрационных колонках и фильтровали для дальнейшего использования.
Клетки BaF3-hTSLPR/hIL17R культивировали в RPMI1640 с 10% FBS (10 нг/мл mIL3, R&D 213-ILB-005), доводили до плотности 1×104 клеток/мл и культивировали в инкубаторе при 37°C, 5% CO2 до логарифмической фазы роста. Клетки собирали, центрифугировали при 800 об/мин в течение 5 минут и удаляли супернатант; клетки трижды промывали PBS для удаления цитокинов, которые стимулируют их пролиферацию, из культуральной среды. Клетки ресуспендировали в среде RPMI1640 с 4% FBS, высевали в 96-луночные планшеты в количестве 4000 клеток/50 мкл/лунку и культивировали в инкубаторе в течение 2 часов. Тестируемые антитела последовательно разводили с использованием нативного TSLP в 10 раз с начальной концентрацией антител 100 нМ, что дало 3 градиента разведения: 100 нМ, 10 нМ и 1 нМ. К клеткам добавляли 50 мкл/лунку разбавленной смеси антитело/антиген с конечной концентрацией антител 50 нМ, 5 нМ, 0,5 нМ. Планшеты инкубировали в инкубаторе с 5% CO2 при 37°C в течение 72 ч. Затем в каждую лунку добавляли 30 мкл CellTiter-Glo (Promega) и инкубировали в темноте при комнатной температуре в течение 10 мин, и проводили обнаружение с использованием программы люминесценции на визуализаторе клеток Cytation5. Результаты представлены в следующей таблице.
Таблица 39. Результаты ингибирования антителами к TSLP пролиферации клеток BaF3-TLSPR/IL7R
Результаты показали, что все антитела, полученные в настоящем изобретении, способны значительно ингибировать активность нативного TSLP в отношении стимуляции пролиферации BaF3, особенно hu179-33, активность которого более чем в 100 раз превышала активность AMG157.
Тестовый пример 8: Эксперимент по ингибированию антителами к TSLP индуцированную TSLP пролиферацию клеток BaF3, сверхэкспрессирующих TSLPR/IL7R
TSLP может связываться с TSLPR/IL7R на поверхности BaF3, тем самым способствуя пролиферации BaF3. Этот тестовый пример использовали для определения того, могут ли антитела согласно настоящему изобретению блокировать активность TSLP в отношении индукции пролиферации BaF3.
В частности, клетки BaF3, сверхэкспрессирующие TSLPR/IL7R, культивировали в RPMI1640 с 10% FBS и 2 нг/мл rhIL3 (MultiSciences, кат. №96-AF-300-03-20), культивировали в инкубаторе при 37°C, 5% CO2 при плотности клеток не более 1×106 клеток/мл. При обнаружении антител клетки в фазе логарифмического роста трижды промывали PBS и центрифугировали при 800 об/мин в течение 5 мин. Плотность клеток доводили до 8000 клеток/лунку/90 мкл с помощью RPMI1640 (2% FBS, рекомбинантный человеческий TSLP-Fc: 40 нг/мл). 10 мкл последовательно разведенных антител для тестирования добавляли в 96-луночные планшеты и культивировали в течение 2 дней. Добавляли 30 мкл титра клеток и перемешивали для обнаружения. IC50 рассчитывали согласно показаниям. Результаты показаны в таблице 40 и на фиг. 3.
Таблица 40. Ингибирование пролиферативной активности клеток BaF3 антителами
Результаты показали, что все антитела согласно настоящему изобретению обладают относительно сильной способностью ингибировать опосредованную TSLP пролиферацию клеток BaF3.
Тестовый пример 9: Гуманизированные антитела к TSLP блокировали индуцированную TSLP дифференцировку нативных CD4+ T-клеток в Th2-клетки
TSLP может индуцировать созревание первичных миелоидных клеток мДК. Зрелые мДК-клетки на высоком уровне экспрессируют лиганд OX40, который может связываться с OX40 на поверхности нативных CD4+ T-клеток, тем самым дифференцируя нативные CD4+ T в Th2-клетки, которые продуцируют факторы, связанные с иммунным ответом, такие как IL4/IL5/IL13 и т.д., что приводит к воспалительному ответу Th2-типа в организме. Этот тестовый пример использовали для определения, могут ли антитела, полученные в настоящем изобретении, блокировать индуцированную TSLP дифференцировку Th2-клеток.
Наивные миелоидные мДК отделяли и очищали от мононуклеарных клеток периферической крови (МНПК) человека с использованием метода сортировки с помощью магнитных гранул (CD1c (BDCA-1) + Dendritic Cell Isolation Kit, Miltenyi Biotec). Полученные мДК высевали в 96-луночные планшеты для культивирования клеток. Последовательно разведенные образцы антител и рекомбинатно экспрессированного человеческого TSLP (huTSLP-his, конечная концентрация 50 нг/мл) предварительно инкубировали (37°C) в течение приблизительно 45 минут, а затем соответственно добавляли в каждую лунку с культурой клеток, содержащую мДК, и культивировали при 37°C в течение 24 часов. Зрелые мДК после стимуляции собирали и дважды промывали PBS. CD4+ CD45RA+ нативные Т-клетки экстрагировали из МНПК методом разделения на магнитных гранулах (Myltenyi, Biotec). Нативные Т-клетки, полученные путем разделения, и зрелые мДК смешивали и высевали в 96-луночные планшеты для культивирования клеток в соотношении 5:1, и совместно культивировали в течение 6 дней. Клетки собирали и высевали в 96-луночные планшеты, предварительно покрытые антителом к CD3 (10 мкг/мл), и добавляли антитело к CD28 (1 мкг/мл) для повторной стимуляции дифференцированных Т-клеток. Клетки культивировали в течение 24 часов и, наконец, собирали супернатант клеточной культуры. Связанные с Th2 цитокины, секретированные клетками, в супернатанте были обнаружены с помощью ELISA. Цитокины IL-4 и IL-5 были обнаружены с помощью наборов ELISA от R&D, а TNF-α и IL-13 были обнаружены с помощью наборов ELISA от NeoBioscience. Результаты представлены на фиг. 5A-фиг. 5D.
Результаты показали, что антитела согласно настоящему изобретению способны значительно ингибировать продукцию Th2-цитокинов IL4, IL5, IL13 и TNF-α, что свидетельствует о том, что антитела согласно настоящему изобретению способны блокировать дифференцировку Th2-клеток, индуцированную TSLP.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ЦЗЯНСУ ХЭНЖУЙ МЕДСИН КО., ЛТД.
ШАНХАЙ ХЭНЖУЙ ФАРМАСЬЮТИКАЛ КО., ЛТД.
<120> АНТИТЕЛО, СПОСОБНОЕ СВЯЗЫВАТЬСЯ С ТИМИЧЕСКИМ СТРОМАЛЬНЫМ
ЛИМФОПОЭТИНОМ, И ЕГО ПРИМЕНЕНИЕ
<130> 702048CPCT
<160> 146
<170> SIPOSequenceListing 1.0
<210> 1
<211> 176
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ПЕПТИД
<223> Аминокислотная последовательность меченного his
человеческого антигена TSLP (huTSLP-his)
<400> 1
Met Phe Pro Phe Ala Leu Leu Tyr Val Leu Ser Val Ser Phe Arg Lys
1 5 10 15
Ile Phe Ile Leu Gln Leu Val Gly Leu Val Leu Thr Tyr Asp Phe Thr
20 25 30
Asn Cys Asp Phe Glu Lys Ile Lys Ala Ala Tyr Leu Ser Thr Ile Ser
35 40 45
Lys Asp Leu Ile Thr Tyr Met Ser Gly Thr Lys Ser Thr Glu Phe Asn
50 55 60
Asn Thr Val Ser Cys Ser Asn Arg Pro His Cys Leu Thr Glu Ile Gln
65 70 75 80
Ser Leu Thr Phe Asn Pro Thr Ala Gly Cys Ala Ser Leu Ala Lys Glu
85 90 95
Met Phe Ala Met Lys Thr Lys Ala Ala Leu Ala Ile Trp Cys Pro Gly
100 105 110
Tyr Ser Glu Thr Gln Ile Asn Ala Thr Gln Ala Met Lys Lys Ala Arg
115 120 125
Lys Ser Lys Val Thr Thr Asn Lys Cys Leu Glu Gln Val Ser Gln Leu
130 135 140
Gln Gly Leu Trp Arg Arg Phe Asn Arg Pro Leu Leu Lys Gln Gln Gly
145 150 155 160
Ser Ser Asp Tyr Lys Asp Asp Asp Asp Lys His His His His His His
165 170 175
<210> 2
<211> 398
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ПЕПТИД
<223> Аминокислотная последовательность меченного Fc
человеческого антигена TSLP (huTSLP-Fc)
<400> 2
Met Phe Pro Phe Ala Leu Leu Tyr Val Leu Ser Val Ser Phe Arg Lys
1 5 10 15
Ile Phe Ile Leu Gln Leu Val Gly Leu Val Leu Thr Tyr Asp Phe Thr
20 25 30
Asn Cys Asp Phe Glu Lys Ile Lys Ala Ala Tyr Leu Ser Thr Ile Ser
35 40 45
Lys Asp Leu Ile Thr Tyr Met Ser Gly Thr Lys Ser Thr Glu Phe Asn
50 55 60
Asn Thr Val Ser Cys Ser Asn Arg Pro His Cys Leu Thr Glu Ile Gln
65 70 75 80
Ser Leu Thr Phe Asn Pro Thr Ala Gly Cys Ala Ser Leu Ala Lys Glu
85 90 95
Met Phe Ala Met Lys Thr Lys Ala Ala Leu Ala Ile Trp Cys Pro Gly
100 105 110
Tyr Ser Glu Thr Gln Ile Asn Ala Thr Gln Ala Met Lys Lys Ala Arg
115 120 125
Lys Ser Lys Val Thr Thr Asn Lys Cys Leu Glu Gln Val Ser Gln Leu
130 135 140
Gln Gly Leu Trp Arg Arg Phe Asn Arg Pro Leu Leu Lys Gln Gln Asp
145 150 155 160
Ile Glu Gly Arg Met Asp Glu Pro Lys Ser Ser Asp Lys Thr His Thr
165 170 175
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
180 185 190
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
195 200 205
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
210 215 220
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
225 230 235 240
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
245 250 255
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
260 265 270
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
275 280 285
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
290 295 300
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
305 310 315 320
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
325 330 335
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
340 345 350
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
355 360 365
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
370 375 380
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
385 390 395
<210> 3
<211> 168
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ПЕПТИД
<223> Аминокислотная последовательность меченного his TSLP
яванского макака (cynoTSLP-his)
<400> 3
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Tyr Asp Phe Thr Asn Cys Asp Phe Gln Lys Ile Glu
20 25 30
Ala Asp Tyr Leu Arg Thr Ile Ser Lys Asp Leu Ile Thr Tyr Met Ser
35 40 45
Gly Thr Lys Ser Thr Asp Phe Asn Asn Thr Val Ser Cys Ser Asn Arg
50 55 60
Pro His Cys Leu Thr Glu Ile Gln Ser Leu Thr Phe Asn Pro Thr Pro
65 70 75 80
Arg Cys Ala Ser Leu Ala Lys Glu Met Phe Ala Arg Lys Thr Lys Ala
85 90 95
Thr Leu Ala Leu Trp Cys Pro Gly Tyr Ser Glu Thr Gln Ile Asn Ala
100 105 110
Thr Gln Ala Met Lys Lys Ala Arg Lys Ser Lys Val Thr Thr Asn Lys
115 120 125
Cys Leu Glu Gln Val Ser Gln Leu Leu Gly Leu Trp Arg Arg Phe Ile
130 135 140
Arg Thr Leu Leu Lys Gln Gln Gly Ser Ser Asp Tyr Lys Asp Asp Asp
145 150 155 160
Asp Lys His His His His His His
165
<210> 4
<211> 390
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ПЕПТИД
<223> Аминокислотная последовательность меченного Fc TSLP
яванского макака (cyno TSLP-Fc)
<400> 4
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Tyr Asp Phe Thr Asn Cys Asp Phe Gln Lys Ile Glu
20 25 30
Ala Asp Tyr Leu Arg Thr Ile Ser Lys Asp Leu Ile Thr Tyr Met Ser
35 40 45
Gly Thr Lys Ser Thr Asp Phe Asn Asn Thr Val Ser Cys Ser Asn Arg
50 55 60
Pro His Cys Leu Thr Glu Ile Gln Ser Leu Thr Phe Asn Pro Thr Pro
65 70 75 80
Arg Cys Ala Ser Leu Ala Lys Glu Met Phe Ala Arg Lys Thr Lys Ala
85 90 95
Thr Leu Ala Leu Trp Cys Pro Gly Tyr Ser Glu Thr Gln Ile Asn Ala
100 105 110
Thr Gln Ala Met Lys Lys Ala Arg Lys Ser Lys Val Thr Thr Asn Lys
115 120 125
Cys Leu Glu Gln Val Ser Gln Leu Leu Gly Leu Trp Arg Arg Phe Ile
130 135 140
Arg Thr Leu Leu Lys Gln Gln Asp Ile Glu Gly Arg Met Asp Glu Pro
145 150 155 160
Lys Ser Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
165 170 175
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
180 185 190
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
195 200 205
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
210 215 220
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
225 230 235 240
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
245 250 255
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
260 265 270
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
275 280 285
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn
290 295 300
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
305 310 315 320
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
325 330 335
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
340 345 350
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
355 360 365
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
370 375 380
Ser Leu Ser Pro Gly Lys
385 390
<210> 5
<211> 446
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ПЕПТИД
<223> Аминокислотная последовательность внеклеточного домена
меченного Fc человеческого рецептора TSLP (human-TSLPR-Fc-ECD)
<400> 5
Gly Ala Ala Glu Gly Val Gln Ile Gln Ile Ile Tyr Phe Asn Leu Glu
1 5 10 15
Thr Val Gln Val Thr Trp Asn Ala Ser Lys Tyr Ser Arg Thr Asn Leu
20 25 30
Thr Phe His Tyr Arg Phe Asn Gly Asp Glu Ala Tyr Asp Gln Cys Thr
35 40 45
Asn Tyr Leu Leu Gln Glu Gly His Thr Ser Gly Cys Leu Leu Asp Ala
50 55 60
Glu Gln Arg Asp Asp Ile Leu Tyr Phe Ser Ile Arg Asn Gly Thr His
65 70 75 80
Pro Val Phe Thr Ala Ser Arg Trp Met Val Tyr Tyr Leu Lys Pro Ser
85 90 95
Ser Pro Lys His Val Arg Phe Ser Trp His Gln Asp Ala Val Thr Val
100 105 110
Thr Cys Ser Asp Leu Ser Tyr Gly Asp Leu Leu Tyr Glu Val Gln Tyr
115 120 125
Arg Ser Pro Phe Asp Thr Glu Trp Gln Ser Lys Gln Glu Asn Thr Cys
130 135 140
Asn Val Thr Ile Glu Gly Leu Asp Ala Glu Lys Cys Tyr Ser Phe Trp
145 150 155 160
Val Arg Val Lys Ala Met Glu Asp Val Tyr Gly Pro Asp Thr Tyr Pro
165 170 175
Ser Asp Trp Ser Glu Val Thr Cys Trp Gln Arg Gly Glu Ile Arg Asp
180 185 190
Ala Cys Ala Glu Thr Pro Thr Pro Pro Lys Pro Lys Leu Ser Lys Asp
195 200 205
Ile Glu Gly Arg Met Asp Glu Pro Lys Ser Ser Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 6
<211> 121
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕПТИД
<223> Мышиная последовательность вариабельной области тяжелой
цепи mab3
<400> 6
Glu Val Gln Leu Gln Gln Ser Gly Pro Val Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Asp
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Ile Ile Ser Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Tyr Asp Tyr Asp Gly Tyr Ala Met Asp His Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 7
<211> 105
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕПТИД
<223> Мышиная mab3 последовательность вариабельной области
легкой цепи
<400> 7
Gln Ile Val Leu Ser Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Arg Thr Phe
85 90 95
Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 8
<211> 120
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕПТИД
<223> Мышиная последовательность вариабельной области тяжелой цепи mab119
<400> 8
Gln Ala Tyr Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Phe Ala Phe Thr Thr Tyr
20 25 30
Asn Met His Trp Val Lys His Thr Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Gly Glu Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Ala Thr Leu Thr Val Asp Lys Ser Ser Arg Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Asp Asp Tyr Gly Glu Gly Tyr Phe Asp Val Trp Gly Ala
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 9
<211> 111
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕПТИД
<223> Мышиная последовательность вариабельной области легкой цепи mab119
<400> 9
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Asn Ser
20 25 30
Gly Leu Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Arg Leu Leu Leu Tyr Arg Ala Ser Asn Leu Gly Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Leu Asn
65 70 75 80
Pro Val Glu Thr Asp Asp Val Ala Thr Tyr Tyr Cys Gln Gln Ile Asn
85 90 95
Thr Asp Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 10
<211> 119
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕПТИД
<223> Мышиная последовательность вариабельной области тяжелой цепи mab179
<400> 10
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Thr
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asp Pro Gly Asn Gly Asp Thr Asn Tyr Asn Glu Asn Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Ile Glu Leu Ser Arg Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Asp Asn Thr Gly Thr Ala Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 11
<211> 107
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕПТИД
<223> Мышиная последовательность вариабельной области легкой цепи mab179
<400> 11
Ser Ile Val Met Thr Gln Thr Pro Lys Phe Leu Leu Val Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Lys Ala Ser Gln Ser Val Ser Ser Asp
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Val Ser Asn His Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Phe Cys Gln Gln His His Arg Phe Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 12
<211> 117
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕПТИД
<223> Мышиная последовательность вариабельной области тяжелой цепи mab199
<400> 12
Gln Val Gln Leu Gln Gln Ser Gly Pro Gln Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Glu Thr Thr Leu Ile Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Leu Asp Gly Tyr Tyr Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 13
<211> 107
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕПТИД
<223> Мышиная последовательность вариабельной области легкой цепи mab199
<400> 13
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Glu Thr Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Phe Ala Lys Thr Leu Ala Glu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Val Ser Gly Thr Gln Phe Ser Leu Lys Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Gly Ser Tyr Tyr Cys Gln His His Tyr Gly Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 14
<211> 5
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ДОМЕН
<223> HCDR1 mab3
<400> 14
Asp Asp Tyr Met Asn
1 5
<210> 15
<211> 17
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕПТИД
<223> HCDR2 mab3
<400> 15
Ile Ile Ser Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 16
<211> 12
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕПТИД
<223> HCDR3 mab
<400> 16
Glu Asp Tyr Asp Tyr Asp Gly Tyr Ala Met Asp His
1 5 10
<210> 17
<211> 10
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ДОМЕН
<223> LCDR1 mab3
<400> 17
Arg Ala Ser Ser Ser Val Ser Tyr Met His
1 5 10
<210> 18
<211> 7
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ДОМЕН
<223> LCDR2 mab
<400> 18
Ala Thr Ser Asn Leu Ala Ser
1 5
<210> 19
<211> 8
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ДОМЕН
<223> LCDR3 mab3
<400> 19
Gln Gln Trp Ser Ser Asn Arg Thr
1 5
<210> 20
<211> 5
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ДОМЕН
<223> HCDR1 mab119
<400> 20
Thr Tyr Asn Met His
1 5
<210> 21
<211> 17
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ДОМЕН
<223> HCDR2 mab119
<400> 21
Ala Ile Tyr Pro Gly Asn Gly Glu Thr Ser Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 22
<211> 11
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ДОМЕН
<223> HCDR3 mab119
<400> 22
Glu Asp Asp Tyr Gly Glu Gly Tyr Phe Asp Val
1 5 10
<210> 23
<211> 15
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ДОМЕН
<223> LCDR1 mab119
<400> 23
Arg Ala Ser Glu Ser Val Asp Asn Ser Gly Leu Ser Phe Met His
1 5 10 15
<210> 24
<211> 7
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ДОМЕН
<223> LCDR2 mab119
<400> 24
Arg Ala Ser Asn Leu Gly Ser
1 5
<210> 25
<211> 9
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ДОМЕН
<223> LCDR3 mab119
<400> 25
Gln Gln Ile Asn Thr Asp Pro Leu Thr
1 5
<210> 26
<211> 5
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ДОМЕН
<223> HCDR1 mab179
<400> 26
Asn Tyr Leu Ile Glu
1 5
<210> 27
<211> 17
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ДОМЕН
<223> HCDR2 mab179
<400> 27
Val Ile Asp Pro Gly Asn Gly Asp Thr Asn Tyr Asn Glu Asn Phe Lys
1 5 10 15
Gly
<210> 28
<211> 10
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ДОМЕН
<223> HCDR3 mab179
<400> 28
Glu Asp Asn Thr Gly Thr Ala Phe Asp Tyr
1 5 10
<210> 29
<211> 11
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ДОМЕН
<223> LCDR1 mab179
<400> 29
Lys Ala Ser Gln Ser Val Ser Ser Asp Val Thr
1 5 10
<210> 30
<211> 7
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ДОМЕН
<223> LCDR2 mab179
<400> 30
Tyr Val Ser Asn His Tyr Thr
1 5
<210> 31
<211> 9
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ДОМЕН
<223> LCDR3 mab179
<400> 31
Gln Gln His His Arg Phe Pro Leu Thr
1 5
<210> 32
<211> 5
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ДОМЕН
<223> HCDR1 mab199
<400> 32
Thr Tyr Trp Met His
1 5
<210> 33
<211> 17
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ДОМЕН
<223> HCDR2 mab199
<400> 33
Met Ile Asp Pro Ser Asp Ser Glu Thr Thr Leu Ile Gln Lys Phe Lys
1 5 10 15
Asp
<210> 34
<211> 8
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ДОМЕН
<223> HCDR3 mab199
<400> 34
Thr Leu Asp Gly Tyr Tyr Asp Tyr
1 5
<210> 35
<211> 11
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ДОМЕН
<223> LCDR1 mab199
<400> 35
Arg Ala Ser Glu Asn Ile Tyr Ser Tyr Leu Ala
1 5 10
<210> 36
<211> 7
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ДОМЕН
<223> LCDR2 mab199
<400> 36
Phe Ala Lys Thr Leu Ala Glu
1 5
<210> 37
<211> 9
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ДОМЕН
<223> LCDR3 mab199
<400> 37
Gln His His Tyr Gly Thr Pro Trp Thr
1 5
<210> 38
<211> 105
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> VL hu3 с привитыми CDR
<400> 38
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu
65 70 75 80
Asp Phe Ala Val Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Arg Thr Phe
85 90 95
Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 39
<211> 105
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu3VL2
<400> 39
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Pro Leu Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu
65 70 75 80
Asp Phe Ala Val Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Arg Thr Phe
85 90 95
Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 40
<211> 105
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu3VL3
<400> 40
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu
65 70 75 80
Asp Phe Ala Val Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Arg Thr Phe
85 90 95
Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 41
<211> 105
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu3VL4
<400> 41
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu
65 70 75 80
Asp Phe Ala Val Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Arg Thr Phe
85 90 95
Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 42
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu3VH1
<400> 42
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Asp
20 25 30
Tyr Met Asn Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Ile Ile Ser Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Tyr Asp Tyr Asp Gly Tyr Ala Met Asp His Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 43
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu3VH2
<400> 43
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Asp
20 25 30
Tyr Met Asn Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Ile Ile Ser Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Val Asp Lys Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Tyr Asp Tyr Asp Gly Tyr Ala Met Asp His Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 44
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu3VH3
<400> 44
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Asp
20 25 30
Tyr Met Asn Trp Val Lys Gln Ala Pro Gly Gln Arg Leu Glu Trp Ile
35 40 45
Gly Ile Ile Ser Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Val Asp Lys Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Tyr Asp Tyr Asp Gly Tyr Ala Met Asp His Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 45
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu3 HCDR3-H110Y
<400> 45
Glu Asp Tyr Asp Tyr Asp Gly Tyr Ala Met Asp Tyr
1 5 10
<210> 46
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu3LCDR3-N93D
<400> 46
Gln Gln Trp Ser Ser Asp Arg Thr
1 5
<210> 47
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> HCDR3 hu3 (общая формула)
<220>
<221> ДОМЕН
<222> (12)..(12)
<223> Xaa выбрана из His или Tyr.
<400> 47
Glu Asp Tyr Asp Tyr Asp Gly Tyr Ala Met Asp Xaa
1 5 10
<210> 48
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> LCDR hu3 (общая формула 1)
<220>
<221> ДОМЕН
<222> (6)..(6)
<223> Xaa выбрана из Asn или Asp.
<400> 48
Gln Gln Trp Ser Ser Xaa Arg Thr
1 5
<210> 49
<211> 105
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> Последовательность варибальной области легкой цепи hu3-11
<400> 49
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu
65 70 75 80
Asp Phe Ala Val Tyr Tyr Cys Gln Gln Trp Ser Ser Asp Arg Thr Phe
85 90 95
Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 50
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> Последовательность варибальной области тяжелой цепи hu3-11
<400> 50
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Asp
20 25 30
Tyr Met Asn Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Ile Ile Ser Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Val Asp Lys Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Tyr Asp Tyr Asp Gly Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 51
<211> 105
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu3VL5
<400> 51
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu
65 70 75 80
Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Asp Asn Val Arg Gly Phe
85 90 95
Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 52
<211> 105
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu3VL6
<400> 52
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu
65 70 75 80
Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Asp Ser Gly Arg Glu Phe
85 90 95
Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 53
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> LCDR3-V1 hu3
<400> 53
Gln Gln Ser Asp Asn Val Arg Gly
1 5
<210> 54
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> LCDR3-V2 hu3
<400> 54
Gln Gln Ser Asp Ser Gly Arg Glu
1 5
<210> 55
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> LCDR3 hu3 (общая формула 2)
<220>
<221> ДОМЕН
<222> (5)..(5)
<223> Xaa выбрана из Asn или Ser.
<220>
<221> ДОМЕН
<222> (6)..(6)
<223> Xaa выбрана из Val или Gly.
<220>
<221> ДОМЕН
<222> (8)..(8)
<223> Xaa выбрана из Gly или Glu.
<400> 55
Gln Gln Ser Asp Xaa Xaa Arg Xaa
1 5
<210> 56
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> VL hu119 с привитыми CDR(IGKV4-1*01)
<400> 56
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Glu Ser Val Asp Asn Ser
20 25 30
Gly Leu Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Gly Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ile Asn
85 90 95
Thr Asp Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 57
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu119VL2
<400> 57
Asp Ile Val Leu Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Glu Ser Val Asp Asn Ser
20 25 30
Gly Leu Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Gly Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ile Asn
85 90 95
Thr Asp Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 58
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu119VL3
<400> 58
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Glu Ser Val Asp Asn Ser
20 25 30
Gly Leu Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Leu Tyr Arg Ala Ser Asn Leu Gly Ser Gly Ile Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ile Asn
85 90 95
Thr Asp Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 59
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu119VL4 (Привитое, IGKV3-11*01)
<400> 59
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Asn Ser
20 25 30
Gly Leu Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Arg Ala Ser Asn Leu Gly Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ile Asn
85 90 95
Thr Asp Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 60
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu119VL5
<400> 60
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Asn Ser
20 25 30
Gly Leu Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Arg Leu Leu Leu Tyr Arg Ala Ser Asn Leu Gly Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ile Asn
85 90 95
Thr Asp Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 61
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu119VL6
<400> 61
Asp Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Asn Ser
20 25 30
Gly Leu Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Arg Leu Leu Leu Tyr Arg Ala Ser Asn Leu Gly Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ile Asn
85 90 95
Thr Asp Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 62
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu119VH1 (Привитое)
<400> 62
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Asn Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Gly Glu Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Asp Tyr Gly Glu Gly Tyr Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 63
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu119VH2
<400> 63
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Asn Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Gly Glu Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Asp Tyr Gly Glu Gly Tyr Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 64
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu119VH3
<400> 64
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Asn Met His Trp Val Lys His Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Gly Glu Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Ala Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Asp Tyr Gly Glu Gly Tyr Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 65
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu119VH4
<400> 65
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Asn Met His Trp Val Lys His Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Gly Glu Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Ala Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Asp Tyr Gly Glu Gly Tyr Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 66
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu119VH5
<400> 66
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Asn Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Gly Glu Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Ala Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Asp Tyr Gly Glu Gly Tyr Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 67
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu119VH6
<400> 67
Glu Ala Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Asn Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Gly Glu Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Ala Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Asp Tyr Gly Glu Gly Tyr Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 68
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu119VH7
<400> 68
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Asn Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Gly Glu Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Ala Thr Leu Thr Val Asp Lys Ser Thr Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Asp Tyr Gly Glu Gly Tyr Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 69
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu119VH8
<400> 69
Glu Ala Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Asn Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Gly Glu Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Ala Thr Leu Thr Val Asp Lys Ser Thr Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Asp Tyr Gly Glu Gly Tyr Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 70
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu119 LCDR1-N31S
<400> 70
Arg Ala Ser Glu Ser Val Asp Ser Ser Gly Leu Ser Phe Met His
1 5 10 15
<210> 71
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu119 LCDR1-N31Q
<400> 71
Arg Ala Ser Glu Ser Val Asp Gln Ser Gly Leu Ser Phe Met His
1 5 10 15
<210> 72
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu119VL2-N31S
<400> 72
Asp Ile Val Leu Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Glu Ser Val Asp Ser Ser
20 25 30
Gly Leu Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Gly Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ile Asn
85 90 95
Thr Asp Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 73
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu119VL2-N31Q
<400> 73
Asp Ile Val Leu Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Glu Ser Val Asp Gln Ser
20 25 30
Gly Leu Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Gly Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ile Asn
85 90 95
Thr Asp Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 74
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu119VL6-N31S
<400> 74
Asp Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Ser Ser
20 25 30
Gly Leu Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Arg Leu Leu Leu Tyr Arg Ala Ser Asn Leu Gly Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ile Asn
85 90 95
Thr Asp Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 75
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu119VL6-N31Q
<400> 75
Asp Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Gln Ser
20 25 30
Gly Leu Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Arg Leu Leu Leu Tyr Arg Ala Ser Asn Leu Gly Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ile Asn
85 90 95
Thr Asp Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 76
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu119 LCDR1-общая формула
<220>
<221> ДОМЕН
<222> (9)..(9)
<223> Xaa выбрана из Asn, Ser или Gln.
<400> 76
Arg Ala Ser Glu Ser Val Asp Xaa Ser Gly Leu Ser Phe Met His
1 5 10 15
<210> 77
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VL1 (Привитое (IGKV4-1*01))
<400> 77
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Gln Ser Val Ser Ser Asp
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Val Ser Asn His Tyr Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His His Arg Phe Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 78
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VL2
<400> 78
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Gln Ser Val Ser Ser Asp
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Val Ser Asn His Tyr Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His His Arg Phe Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 79
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> VL3 hu179
<400> 79
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Gln Ser Val Ser Ser Asp
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Val Ser Asn His Tyr Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His His Arg Phe Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 80
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> VL4 hu179
<400> 80
Ser Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Gln Ser Val Ser Ser Asp
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Val Ser Asn His Tyr Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His His Arg Phe Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 81
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VL5 (Привитое(IGKV2-29*02))
<400> 81
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ala Ser Gln Ser Val Ser Ser Asp
20 25 30
Val Thr Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile
35 40 45
Tyr Tyr Val Ser Asn His Tyr Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
65 70 75 80
Glu Asp Val Gly Val Tyr Tyr Cys Gln Gln His His Arg Phe Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 82
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VL6
<400> 82
Ser Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ala Ser Gln Ser Val Ser Ser Asp
20 25 30
Val Thr Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile
35 40 45
Tyr Tyr Val Ser Asn His Tyr Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
65 70 75 80
Glu Asp Val Gly Val Tyr Tyr Cys Gln Gln His His Arg Phe Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 83
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VL7
<400> 83
Ser Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ala Ser Gln Ser Val Ser Ser Asp
20 25 30
Val Thr Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile
35 40 45
Tyr Tyr Val Ser Asn His Tyr Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Lys Ile Ser Arg Val Glu Ala
65 70 75 80
Glu Asp Val Gly Val Tyr Tyr Cys Gln Gln His His Arg Phe Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 84
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VL8
<400> 84
Ser Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ala Ser Gln Ser Val Ser Ser Asp
20 25 30
Val Thr Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile
35 40 45
Tyr Tyr Val Ser Asn His Tyr Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
65 70 75 80
Glu Asp Val Gly Val Tyr Tyr Cys Gln Gln His His Arg Phe Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 85
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VH1 (Привитое)
<400> 85
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asp Pro Gly Asn Gly Asp Thr Asn Tyr Asn Glu Asn Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Asn Thr Gly Thr Ala Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 86
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VH2
<400> 86
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asp Pro Gly Asn Gly Asp Thr Asn Tyr Asn Glu Asn Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Asn Thr Gly Thr Ala Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 87
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VH3
<400> 87
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asp Pro Gly Asn Gly Asp Thr Asn Tyr Asn Glu Asn Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Ile Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Asn Thr Gly Thr Ala Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 88
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VH4
<400> 88
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Asn Tyr
20 25 30
Leu Ile Glu Trp Val Lys Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asp Pro Gly Asn Gly Asp Thr Asn Tyr Asn Glu Asn Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Ile Glu Leu Ser Arg Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Asn Thr Gly Thr Ala Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 89
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VH5
<400> 89
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asp Pro Gly Asn Gly Asp Thr Asn Tyr Asn Glu Asn Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Asn Thr Gly Thr Ala Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 90
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VH1- N55Q
<400> 90
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asp Pro Gly Gln Gly Asp Thr Asn Tyr Asn Glu Asn Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Asn Thr Gly Thr Ala Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 91
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VH1- N55V
<400> 91
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asp Pro Gly Val Gly Asp Thr Asn Tyr Asn Glu Asn Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Asn Thr Gly Thr Ala Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 92
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VH1- G56V
<400> 92
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asp Pro Gly Asn Val Asp Thr Asn Tyr Asn Glu Asn Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Asn Thr Gly Thr Ala Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 93
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> HCDR2-N55Q hu179
<400> 93
Val Ile Asp Pro Gly Gln Gly Asp Thr Asn Tyr Asn Glu Asn Phe Lys
1 5 10 15
Gly
<210> 94
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> HCDR2-N55V hu179
<400> 94
Val Ile Asp Pro Gly Val Gly Asp Thr Asn Tyr Asn Glu Asn Phe Lys
1 5 10 15
Gly
<210> 95
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> HCDR2-G56V hu179
<400> 95
Val Ile Asp Pro Gly Asn Val Asp Thr Asn Tyr Asn Glu Asn Phe Lys
1 5 10 15
Gly
<210> 96
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> HCDR2 hu179 (общая формула)
<220>
<221> ДОМЕН
<222> (6)..(6)
<223> Xaa выбрана из Asn, Gln или Val.
<220>
<221> ДОМЕН
<222> (7)..(7)
<223> Xaa выбрана из Gly или Val.
<400> 96
Val Ile Asp Pro Gly Xaa Xaa Asp Thr Asn Tyr Asn Glu Asn Phe Lys
1 5 10 15
Gly
<210> 97
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VH3-N55V
<400> 97
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asp Pro Gly Val Gly Asp Thr Asn Tyr Asn Glu Asn Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Ile Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Asn Thr Gly Thr Ala Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 98
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VL2-Y50E
<400> 98
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Gln Ser Val Ser Ser Asp
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Glu Val Ser Asn His Tyr Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His His Arg Phe Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 99
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VL2-S52D
<400> 99
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Gln Ser Val Ser Ser Asp
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Val Asp Asn His Tyr Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His His Arg Phe Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 100
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VL2-S52E
<400> 100
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Gln Ser Val Ser Ser Asp
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Val Glu Asn His Tyr Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His His Arg Phe Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 101
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VL2-N53Q
<400> 101
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Gln Ser Val Ser Ser Asp
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Val Ser Gln His Tyr Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His His Arg Phe Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 102
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VL2-N53D
<400> 102
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Gln Ser Val Ser Ser Asp
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Val Ser Asp His Tyr Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His His Arg Phe Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 103
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VL2-N53E
<400> 103
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Gln Ser Val Ser Ser Asp
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Val Ser Glu His Tyr Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His His Arg Phe Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 104
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VL2-H54Y
<400> 104
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Gln Ser Val Ser Ser Asp
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Val Ser Asn Tyr Tyr Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His His Arg Phe Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 105
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VL2-H54D
<400> 105
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Gln Ser Val Ser Ser Asp
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Val Ser Asn Asp Tyr Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His His Arg Phe Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 106
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VL2-H54E
<400> 106
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Gln Ser Val Ser Ser Asp
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Val Ser Asn Glu Tyr Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His His Arg Phe Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 107
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VL2-Y55E
<400> 107
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ala Ser Gln Ser Val Ser Ser Asp
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Val Ser Asn His Glu Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His His Arg Phe Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 108
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179 LCDR2-Y50E
<400> 108
Glu Val Ser Asn His Tyr Thr
1 5
<210> 109
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179 LCDR2-S52D
<400> 109
Tyr Val Asp Asn His Tyr Thr
1 5
<210> 110
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179 LCDR2-S52E
<400> 110
Tyr Val Glu Asn His Tyr Thr
1 5
<210> 111
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179 LCDR2-N53Q
<400> 111
Tyr Val Ser Gln His Tyr Thr
1 5
<210> 112
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179 LCDR2-N53D
<400> 112
Tyr Val Ser Asp His Tyr Thr
1 5
<210> 113
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179 LCDR2-N53E
<400> 113
Tyr Val Ser Glu His Tyr Thr
1 5
<210> 114
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179 LCDR2-H54Y
<400> 114
Tyr Val Ser Asn Tyr Tyr Thr
1 5
<210> 115
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179 LCDR2-H54D
<400> 115
Tyr Val Ser Asn Asp Tyr Thr
1 5
<210> 116
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179 LCDR2-H54E
<400> 116
Tyr Val Ser Asn Glu Tyr Thr
1 5
<210> 117
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179 LCDR2-Y55E
<400> 117
Tyr Val Ser Asn His Glu Thr
1 5
<210> 118
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> LCDR2 гуманизированного антитела mab179 общая формула
<220>
<221> ДОМЕН
<222> (1)..(1)
<223> Xaa выбрана из Try или Glu.
<220>
<221> ДОМЕН
<222> (3)..(3)
<223> Xaa выбрана из Ser, Asp или Glu.
<220>
<221> ДОМЕН
<222> (4)..(4)
<223> Xaa выбрана из Asn, Gln, Asp или Glu.
<220>
<221> ДОМЕН
<222> (5)..(5)
<223> Xaa выбрана из His, Tyr, Asp или Glu.
<220>
<221> ДОМЕН
<222> (6)..(6)
<223> Xaa выбрана из Glu или Tyr.
<220>
<221> ДОМЕН
<223> hu179VL8-N53E
<400> 118
Xaa Val Xaa Xaa Xaa Xaa Thr
1 5
<210> 119
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu179VL8-N53E
<400> 119
Ser Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ala Ser Gln Ser Val Ser Ser Asp
20 25 30
Val Thr Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile
35 40 45
Tyr Tyr Val Ser Glu His Tyr Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
65 70 75 80
Glu Asp Val Gly Val Tyr Tyr Cys Gln Gln His His Arg Phe Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 120
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu199VL1 (Привитое)
<400> 120
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Phe Ala Lys Thr Leu Ala Glu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln His His Tyr Gly Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 121
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu199VL2
<400> 121
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Val
35 40 45
Tyr Phe Ala Lys Thr Leu Ala Glu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln His His Tyr Gly Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 122
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu199VL3
<400> 122
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Phe Ala Lys Thr Leu Ala Glu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln His His Tyr Gly Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 123
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu199VL4
<400> 123
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Phe Ala Lys Thr Leu Ala Glu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Val Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln His His Tyr Gly Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 124
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu199VL5
<400> 124
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Val
35 40 45
Tyr Phe Ala Lys Thr Leu Ala Glu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Val Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln His His Tyr Gly Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 125
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu199VL6
<400> 125
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Phe Ala Lys Thr Leu Ala Glu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Val Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln His His Tyr Gly Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 126
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu199VH1 (Привитое)
<400> 126
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Glu Thr Thr Leu Ile Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Leu Asp Gly Tyr Tyr Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 127
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu199VH2
<400> 127
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Glu Thr Thr Leu Ile Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Leu Asp Gly Tyr Tyr Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 128
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu199VH3
<400> 128
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Glu Thr Thr Leu Ile Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Leu Asp Gly Tyr Tyr Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 129
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu199VH4
<400> 129
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Glu Thr Thr Leu Ile Gln Lys Phe
50 55 60
Lys Asp Arg Ala Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Leu Asp Gly Tyr Tyr Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 130
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu199VH5
<400> 130
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Lys Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Glu Thr Thr Leu Ile Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Leu Asp Gly Tyr Tyr Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 131
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu199VH6
<400> 131
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Lys Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Glu Thr Thr Leu Ile Gln Lys Phe
50 55 60
Lys Asp Lys Val Thr Met Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Leu Asp Gly Tyr Tyr Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 132
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> hu199VH7
<400> 132
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Lys Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Glu Thr Thr Leu Ile Gln Lys Phe
50 55 60
Lys Asp Lys Val Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Leu Asp Gly Tyr Tyr Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 133
<211> 330
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> Константная область тяжелой цепи IgG1-YTE
<400> 133
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Tyr Ile Thr Arg Glu Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 134
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> Константная область легкой цепи kappa
<400> 134
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 135
<211> 451
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> Тяжелая цепь антитела hu3-13
<400> 135
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Asp
20 25 30
Tyr Met Asn Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Ile Ile Ser Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Val Asp Lys Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Tyr Asp Tyr Asp Gly Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Tyr
245 250 255
Ile Thr Arg Glu Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 136
<211> 212
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> Легкая цепь антитела hu3-13
<400> 136
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu
65 70 75 80
Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Asp Ser Gly Arg Glu Phe
85 90 95
Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro Ser
100 105 110
Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala
115 120 125
Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val
130 135 140
Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser
145 150 155 160
Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr
165 170 175
Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys
180 185 190
Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn
195 200 205
Arg Gly Glu Cys
210
<210> 137
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> Тяжелая цепь антитела hu119-30
<400> 137
Glu Ala Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Asn Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asn Gly Glu Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Ala Thr Leu Thr Val Asp Lys Ser Thr Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Asp Tyr Gly Glu Gly Tyr Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Tyr Ile
245 250 255
Thr Arg Glu Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 138
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> Легкая цепь антитела hu119-30
<400> 138
Asp Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Ser Ser
20 25 30
Gly Leu Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Arg Leu Leu Leu Tyr Arg Ala Ser Asn Leu Gly Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ile Asn
85 90 95
Thr Asp Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 139
<211> 449
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> Тяжелая цепь антитела hu179-33
<400> 139
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asp Pro Gly Val Gly Asp Thr Asn Tyr Asn Glu Asn Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Ile Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asp Asn Thr Gly Thr Ala Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Tyr Ile Thr
245 250 255
Arg Glu Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 140
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> Легкая цепь антитела hu179-33
<400> 140
Ser Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ala Ser Gln Ser Val Ser Ser Asp
20 25 30
Val Thr Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile
35 40 45
Tyr Tyr Val Ser Glu His Tyr Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
65 70 75 80
Glu Asp Val Gly Val Tyr Tyr Cys Gln Gln His His Arg Phe Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 141
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> Тяжелая цепь антитела hu199-36
<400> 141
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Lys Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Met Ile Asp Pro Ser Asp Ser Glu Thr Thr Leu Ile Gln Lys Phe
50 55 60
Lys Asp Lys Val Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Leu Asp Gly Tyr Tyr Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Tyr Ile Thr Arg Glu
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 142
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ДОМЕН
<223> Легкая цепь антитела hu199-36
<400> 142
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Phe Ala Lys Thr Leu Ala Glu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Val Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln His His Tyr Gly Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 143
<211> 448
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> Последовательность тяжелой цепи AMG157
<400> 143
Gln Met Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Arg Thr Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Asn Lys His Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Thr Arg Asp Asn Ser Lys Asn Thr Leu Asn
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Pro Gln Trp Glu Leu Val His Glu Ala Phe Asp Ile Trp
100 105 110
Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys
210 215 220
Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val
290 295 300
Ser Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 144
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ЦЕПЬ
<223> Последовательность легкой цепи AMG157
<400> 144
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Leu Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Trp Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Gly Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser
210
<210> 145
<211> 371
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ПЕПТИД
<223> Аминокислотная последовательность полноразмерной
последовательности рецептора TSLP человека
<400> 145
Met Gly Arg Leu Val Leu Leu Trp Gly Ala Ala Val Phe Leu Leu Gly
1 5 10 15
Gly Trp Met Ala Leu Gly Gln Gly Gly Ala Ala Glu Gly Val Gln Ile
20 25 30
Gln Ile Ile Tyr Phe Asn Leu Glu Thr Val Gln Val Thr Trp Asn Ala
35 40 45
Ser Lys Tyr Ser Arg Thr Asn Leu Thr Phe His Tyr Arg Phe Asn Gly
50 55 60
Asp Glu Ala Tyr Asp Gln Cys Thr Asn Tyr Leu Leu Gln Glu Gly His
65 70 75 80
Thr Ser Gly Cys Leu Leu Asp Ala Glu Gln Arg Asp Asp Ile Leu Tyr
85 90 95
Phe Ser Ile Arg Asn Gly Thr His Pro Val Phe Thr Ala Ser Arg Trp
100 105 110
Met Val Tyr Tyr Leu Lys Pro Ser Ser Pro Lys His Val Arg Phe Ser
115 120 125
Trp His Gln Asp Ala Val Thr Val Thr Cys Ser Asp Leu Ser Tyr Gly
130 135 140
Asp Leu Leu Tyr Glu Val Gln Tyr Arg Ser Pro Phe Asp Thr Glu Trp
145 150 155 160
Gln Ser Lys Gln Glu Asn Thr Cys Asn Val Thr Ile Glu Gly Leu Asp
165 170 175
Ala Glu Lys Cys Tyr Ser Phe Trp Val Arg Val Lys Ala Met Glu Asp
180 185 190
Val Tyr Gly Pro Asp Thr Tyr Pro Ser Asp Trp Ser Glu Val Thr Cys
195 200 205
Trp Gln Arg Gly Glu Ile Arg Asp Ala Cys Ala Glu Thr Pro Thr Pro
210 215 220
Pro Lys Pro Lys Leu Ser Lys Phe Ile Leu Ile Ser Ser Leu Ala Ile
225 230 235 240
Leu Leu Met Val Ser Leu Leu Leu Leu Ser Leu Trp Lys Leu Trp Arg
245 250 255
Val Lys Lys Phe Leu Ile Pro Ser Val Pro Asp Pro Lys Ser Ile Phe
260 265 270
Pro Gly Leu Phe Glu Ile His Gln Gly Asn Phe Gln Glu Trp Ile Thr
275 280 285
Asp Thr Gln Asn Val Ala His Leu His Lys Met Ala Gly Ala Glu Gln
290 295 300
Glu Ser Gly Pro Glu Glu Pro Leu Val Val Gln Leu Ala Lys Thr Glu
305 310 315 320
Ala Glu Ser Pro Arg Met Leu Asp Pro Gln Thr Glu Glu Lys Glu Ala
325 330 335
Ser Gly Gly Ser Leu Gln Leu Pro His Gln Pro Leu Gln Gly Gly Asp
340 345 350
Val Val Thr Ile Gly Gly Phe Thr Phe Val Met Asn Asp Arg Ser Tyr
355 360 365
Val Ala Leu
370
<210> 146
<211> 459
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> ПЕПТИД
<223> Аминокислотная последовательность полноразмерной
последовательности рецептора IL7R альфа человека
<400> 146
Met Thr Ile Leu Gly Thr Thr Phe Gly Met Val Phe Ser Leu Leu Gln
1 5 10 15
Val Val Ser Gly Glu Ser Gly Tyr Ala Gln Asn Gly Asp Leu Glu Asp
20 25 30
Ala Glu Leu Asp Asp Tyr Ser Phe Ser Cys Tyr Ser Gln Leu Glu Val
35 40 45
Asn Gly Ser Gln His Ser Leu Thr Cys Ala Phe Glu Asp Pro Asp Val
50 55 60
Asn Thr Thr Asn Leu Glu Phe Glu Ile Cys Gly Ala Leu Val Glu Val
65 70 75 80
Lys Cys Leu Asn Phe Arg Lys Leu Gln Glu Ile Tyr Phe Ile Glu Thr
85 90 95
Lys Lys Phe Leu Leu Ile Gly Lys Ser Asn Ile Cys Val Lys Val Gly
100 105 110
Glu Lys Ser Leu Thr Cys Lys Lys Ile Asp Leu Thr Thr Ile Val Lys
115 120 125
Pro Glu Ala Pro Phe Asp Leu Ser Val Ile Tyr Arg Glu Gly Ala Asn
130 135 140
Asp Phe Val Val Thr Phe Asn Thr Ser His Leu Gln Lys Lys Tyr Val
145 150 155 160
Lys Val Leu Met His Asp Val Ala Tyr Arg Gln Glu Lys Asp Glu Asn
165 170 175
Lys Trp Thr His Val Asn Leu Ser Ser Thr Lys Leu Thr Leu Leu Gln
180 185 190
Arg Lys Leu Gln Pro Ala Ala Met Tyr Glu Ile Lys Val Arg Ser Ile
195 200 205
Pro Asp His Tyr Phe Lys Gly Phe Trp Ser Glu Trp Ser Pro Ser Tyr
210 215 220
Tyr Phe Arg Thr Pro Glu Ile Asn Asn Ser Ser Gly Glu Met Asp Pro
225 230 235 240
Ile Leu Leu Thr Ile Ser Ile Leu Ser Phe Phe Ser Val Ala Leu Leu
245 250 255
Val Ile Leu Ala Cys Val Leu Trp Lys Lys Arg Ile Lys Pro Ile Val
260 265 270
Trp Pro Ser Leu Pro Asp His Lys Lys Thr Leu Glu His Leu Cys Lys
275 280 285
Lys Pro Arg Lys Asn Leu Asn Val Ser Phe Asn Pro Glu Ser Phe Leu
290 295 300
Asp Cys Gln Ile His Arg Val Asp Asp Ile Gln Ala Arg Asp Glu Val
305 310 315 320
Glu Gly Phe Leu Gln Asp Thr Phe Pro Gln Gln Leu Glu Glu Ser Glu
325 330 335
Lys Gln Arg Leu Gly Gly Asp Val Gln Ser Pro Asn Cys Pro Ser Glu
340 345 350
Asp Val Val Ile Thr Pro Glu Ser Phe Gly Arg Asp Ser Ser Leu Thr
355 360 365
Cys Leu Ala Gly Asn Val Ser Ala Cys Asp Ala Pro Ile Leu Ser Ser
370 375 380
Ser Arg Ser Leu Asp Cys Arg Glu Ser Gly Lys Asn Gly Pro His Val
385 390 395 400
Tyr Gln Asp Leu Leu Leu Ser Leu Gly Thr Thr Asn Ser Thr Leu Pro
405 410 415
Pro Pro Phe Ser Leu Gln Ser Gly Ile Leu Thr Leu Asn Pro Val Ala
420 425 430
Gln Gly Gln Pro Ile Leu Thr Ser Leu Gly Ser Asn Gln Glu Glu Ala
435 440 445
Tyr Val Thr Met Ser Ser Phe Tyr Gln Asn Gln
450 455
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛО К СКЛЕРОСТИНУ, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2016 |
|
RU2716101C2 |
| Антитела к TSLP человека и их применение | 2021 |
|
RU2825460C1 |
| АНТИТЕЛО ПРОТИВ ФАКТОРА РОСТА СОЕДИНИТЕЛЬНОЙ ТКАНИ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2819228C2 |
| АНТИТЕЛО ПРОТИВ КЛАУДИНА 18.2 И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2822550C2 |
| КОНЪЮГАТ АНТИТЕЛА ПРОТИВ CEA И АНАЛОГА ЭКСАТЕКАНА И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2833323C1 |
| АНТИТЕЛО К PD-1, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2807484C2 |
| БИСПЕЦИФИЧЕСКИЙ БЕЛОК | 2019 |
|
RU2784486C1 |
| БЕЛКОВЫЙ КОМПЛЕКС ИНТЕРЛЕЙКИНА 15 И ЕГО ПРИМЕНЕНИЕ | 2015 |
|
RU2711979C2 |
| АНТИТЕЛО К CD3 И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2802272C2 |
| КОНЬЮГАТ АНТИТЕЛА К КЛАУДИНУ И ЛЕКАРСТВЕННОГО СРЕДСТВА И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2826119C1 |
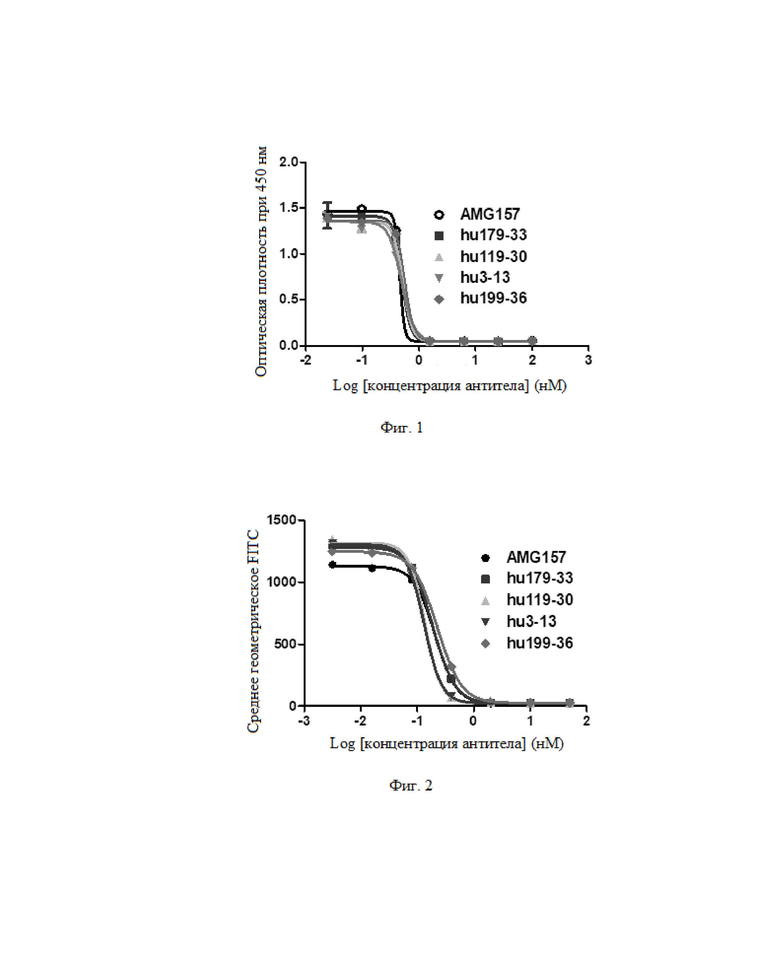
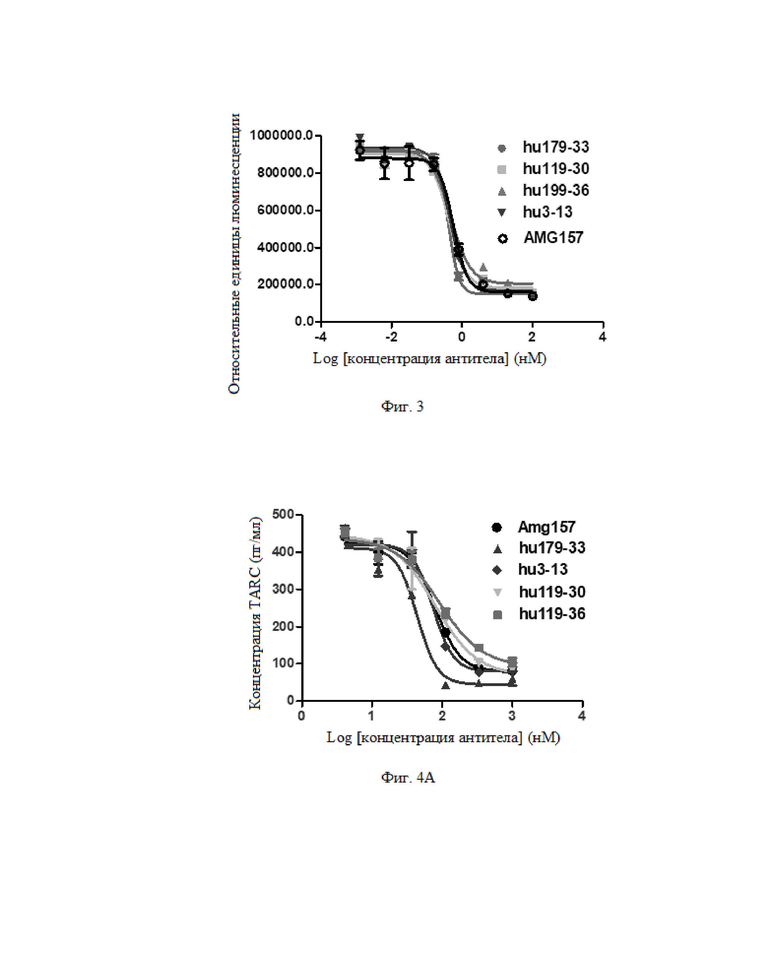
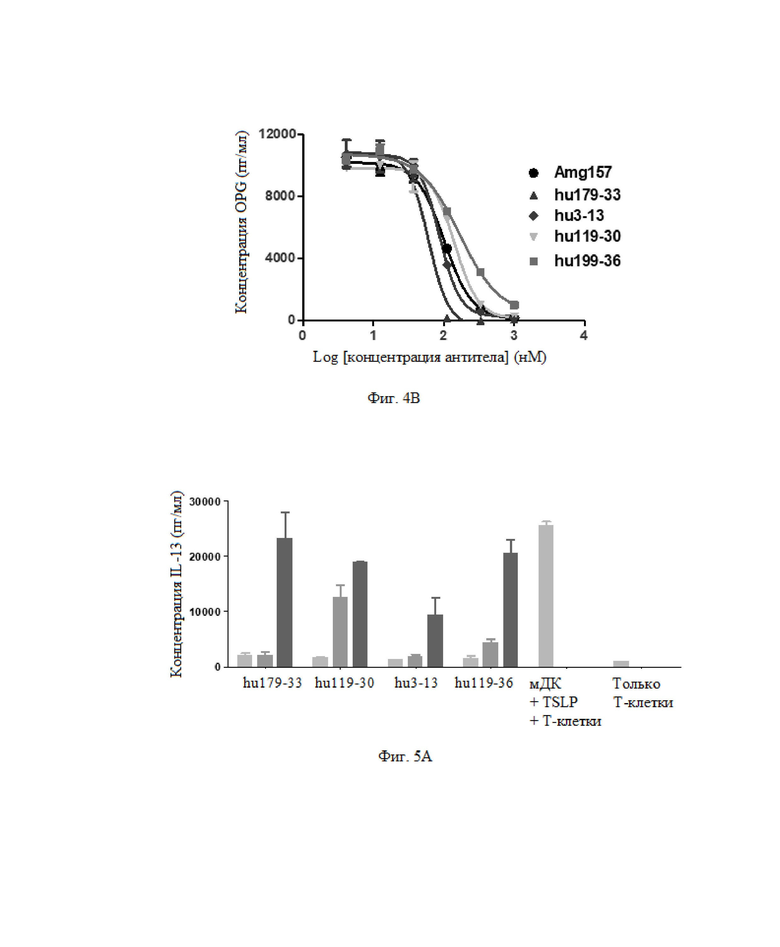
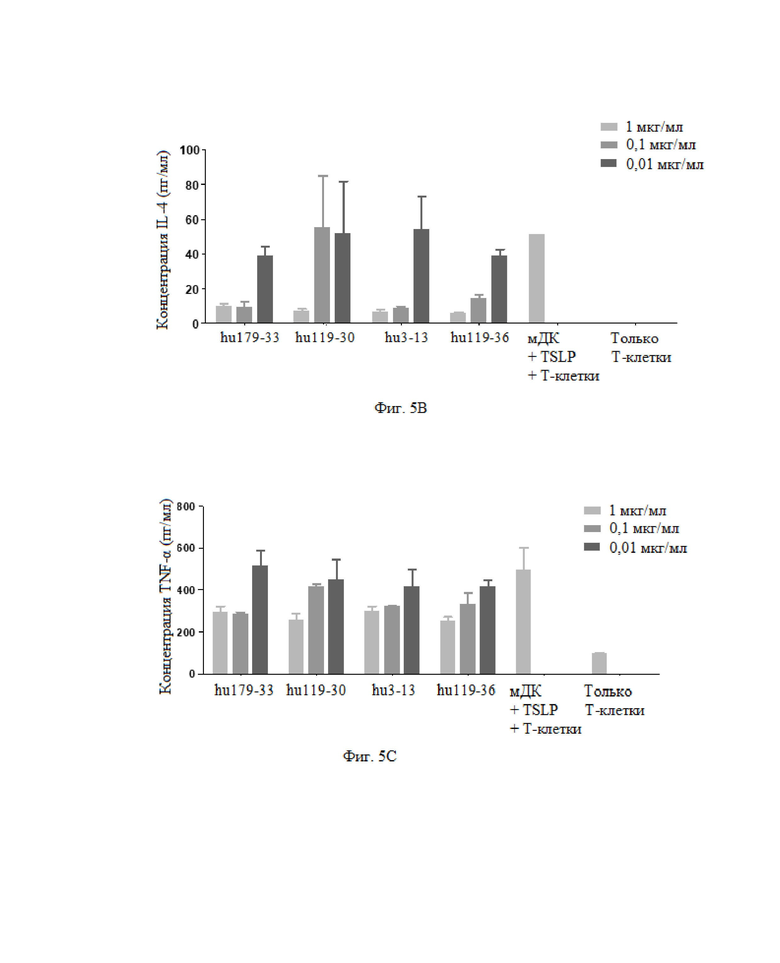
Изобретение относится к области биотехнологии, в частности к антителу к TSLP (тимический стромальный лимфопоэтин), а также к композиции, его содержащей. Также раскрыты молекула нуклеиновой кислоты, кодирующая вышеуказанное антитело, а также клетка, ее содержащая. Изобретение эффективно для лечения заболеваний, связанных с TSLP. 5 н. и 14 з.п. ф-лы, 5 ил., 40 табл., 9 пр.
1. Антитело к TSLP (тимический стромальный лимфопоэтин), содержащее вариабельную область тяжелой цепи и вариабельную область легкой цепи, где:
i) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 14, SEQ ID NO: 15 и SEQ ID NO: 45, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 54, соответственно; или
ii) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 14, SEQ ID NO: 15 и SEQ ID NO: 45, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 53, соответственно; или
iii) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 20, SEQ ID NO: 21 и SEQ ID NO: 22, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 70, SEQ ID NO: 24 и SEQ ID NO: 25, соответственно; или
iv) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 20, SEQ ID NO: 21 и SEQ ID NO: 22, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 71, SEQ ID NO: 24 и SEQ ID NO: 25, соответственно; или
v) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 26, SEQ ID NO: 94 и SEQ ID NO: 28, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 29, SEQ ID NO: 113 и SEQ ID NO: 31, соответственно; или
vi) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 26, SEQ ID NO: 94 и SEQ ID NO: 28, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 29, SEQ ID NO: 30 и SEQ ID NO: 31, соответственно; или
vii) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 14, SEQ ID NO: 15 и SEQ ID NO: 16, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 19, соответственно; или
viii) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 14, SEQ ID NO: 15 и SEQ ID NO: 45, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 17, SEQ ID NO: 18 и SEQ ID NO: 46, соответственно; или
ix) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 20, SEQ ID NO: 21 и SEQ ID NO: 22, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 23, SEQ ID NO: 24 и SEQ ID NO: 25, соответственно; или
x) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 29, SEQ ID NO: 30 и SEQ ID NO: 31, соответственно; или
xi) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 26, SEQ ID NO: 93 и SEQ ID NO: 28, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 29, SEQ ID NO: 30 и SEQ ID NO: 31, соответственно; или
xii) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 26, SEQ ID NO: 95 и SEQ ID NO: 28, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 29, SEQ ID NO: 30 и SEQ ID NO: 31, соответственно; или
xiii) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR3, представленные в SEQ ID NO: 29, SEQ ID NO: 31, соответственно, и LCDR2, представленную в SEQ ID NO: 108, 109, 110, 111, 112, 113, 114, 115, 116 или 117.
2. Антитело к TSLP по п. 1, где вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 26, SEQ ID NO: 94 и SEQ ID NO: 28, соответственно, и вариабельная область легкой цепи содержит LCDR1, LCDR2 и LCDR3, представленные в SEQ ID NO: 29, SEQ ID NO: 113 и SEQ ID NO: 31, соответственно.
3. Антитело к TSLP по п. 1 или 2, представляющее собой мышиное антитело, химерное антитело или гуманизированное антитело.
4. Антитело к TSLP по п. 3, где антитело к TSLP содержит каркасную область (области), полученную из человеческого антитела, где антитело к TSLP содержит вариабельную область легкой цепи и/или вариабельную область тяжелой цепи, выбранные из описанных в (а), (b), (с) или (d) ниже:
a) вариабельная область тяжелой цепи содержит HCDR1 и HCDR2, представленные в SEQ ID NO: 14 и SEQ ID NO: 15, соответственно, и HCDR3, представленную в SEQ ID NO: 16 или 45, и ее каркасная область (области) содержит(ат) не более 10 обратных мутаций; и/или вариабельная область легкой цепи содержит LCDR1 и LCDR2, представленные в SEQ ID NO: 17 и SEQ ID NO: 18, соответственно, и LCDR3, представленную в SEQ ID NO: 19, 46, 53 или 54, и ее каркасная область (области) содержит(ат) не более 10 обратных аминокислотных мутаций;
b) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 20, SEQ ID NO: 21 и SEQ ID NO: 22, соответственно, и ее каркасная область (области) содержит(ат) не более 10 обратных мутаций; и/или вариабельная область легкой цепи содержит LCDR2 и LCDR3, представленные в SEQ ID NO: 24 и SEQ ID NO: 25, соответственно, и LCDR1, представленную в SEQ ID NO: 23, 70 или 71, и ее каркасная область (области) содержит(ат) не более 10 обратных аминокислотных мутаций;
c) вариабельная область тяжелой цепи содержит HCDR1 и HCDR3, представленные в последовательности SEQ ID NO: 26 и SEQ ID NO: 28, соответственно, и HCDR2, представленную в SEQ ID NO: 27, 93, 94 или 95, и ее каркасная область (области) содержит(ат) не более 10 обратных мутаций; и/или вариабельная область легкой цепи содержит LCDR1 и LCDR3, представленные в последовательности SEQ ID NO: 29 и SEQ ID NO: 31, соответственно, и LCDR2, представленную в SEQ ID NO: 30, 108, 109, 110, 111, 112, 113, 114, 115, 116 или 117, и ее каркасная область (области) содержит(ат) не более 10 обратных мутаций.
5. Антитело к TSLP по п. 3, где антитело к TSLP содержит каркасную область (области), полученную из человеческого антитела, где антитело к TSLP содержит вариабельную область легкой цепи и/или вариабельную область тяжелой цепи, выбранные из описанных в (а), (b), (с) или (d) ниже:
а) вариабельная область тяжелой цепи содержит HCDR1 и HCDR2, представленные в SEQ ID NO: 14 и SEQ ID NO: 15, соответственно, и HCDR3, представленную в SEQ ID NO: 16 или 45, и ее каркасная область (области) содержит(ат) не более 10 обратных мутаций, причем обратная мутация выбрана из одной или более из 38K, 48I, 67A, 69L, 71V и 73K; и/или вариабельная область легкой цепи содержит LCDR1 и LCDR2, представленные в SEQ ID NO: 17 и SEQ ID NO: 18, соответственно, и LCDR3, представленную в SEQ ID NO: 19, 46, 53 или 54, и ее каркасная область (области) содержит(ат) не более 10 обратных аминокислотных мутаций, причем обратная мутация выбрана из одной или более из 46Р, 47W, 58V, 70S и 71Y;
b) вариабельная область тяжелой цепи содержит HCDR1, HCDR2 и HCDR3, представленные в SEQ ID NO: 20, SEQ ID NO: 21 и SEQ ID NO: 22, соответственно, и ее каркасная область (области) содержит(ат) не более 10 обратных мутаций, причем обратная мутация выбрана из одной или более из 2A, 27F, 38K, 39Н, 48I, 67А, 69L, 71V и 76R; и/или вариабельная область легкой цепи содержит LCDR2 и LCDR3, представленные в SEQ ID NO: 24 и SEQ ID NO: 25, соответственно, и LCDR1, представленную в SEQ ID NO: 23, 70 или 71, и ее каркасная область (области) содержит(ат) не более 10 обратных аминокислотных мутаций, причем обратная мутация выбрана из одной или более из 1D, 4L, 43Р, 48L и 58I;
c) вариабельная область тяжелой цепи содержит HCDR1 и HCDR3, представленные в последовательности SEQ ID NO: 26 и SEQ ID NO: 28, соответственно, и HCDR2, представленную в SEQ ID NO: 27, 93, 94 или 95, и ее каркасная область (области) содержит(ат) не более 10 обратных мутаций, причем обратная мутация выбрана из одной или более из 27Y, 28А, 38K, 48I, 66K, 67A, 69L, 80I и 82b R; и/или вариабельная область легкой цепи содержит LCDR1 и LCDR3, представленные в последовательности SEQ ID NO: 29 и SEQ ID NO: 31, соответственно, и LCDR2, представленную в SEQ ID NO: 30, 108, 109, 110, 111, 112, 113, 114, 115, 116 или 117, и ее каркасная область (области) содержит(ат) не более 10 обратных мутаций, причем обратная мутация выбрана из одной или более из 1S, 43S, 67Y и 73F.
6. Антитело к TSLP по п. 3, содержащее вариабельную область тяжелой цепи и вариабельную область легкой цепи, где:
i) вариабельная область тяжелой цепи обладает по меньшей мере 90% идентичностью последовательности с вариабельной областью тяжелой цепи, представленной в аминокислотной последовательности SEQ ID NO: 6, 42, 43, 44 или 50, и вариабельная область легкой цепи обладает по меньшей мере 90% идентичностью последовательности с вариабельной областью легкой цепи, представленной в аминокислотной последовательности SEQ ID NO: 7, 38, 39, 40, 41, 49, 51 или 52; или
ii) вариабельная область тяжелой цепи обладает по меньшей мере 90% идентичностью последовательности с вариабельной областью тяжелой цепи, представленной в аминокислотной последовательности SEQ ID NO: 8, 62, 63, 64, 65, 66, 67, 68 или 69, и вариабельная область легкой цепи обладает по меньшей мере 90% идентичностью последовательности с вариабельной областью легкой цепи, представленной в аминокислотной последовательности SEQ ID NO: 9, 56, 57, 58, 59, 60, 61, 72, 73, 74 или 75; или
iii) вариабельная область тяжелой цепи обладает по меньшей мере 90% идентичностью последовательности с вариабельной областью тяжелой цепи, представленной в аминокислотной последовательности SEQ ID NO: 10, 85, 86, 87, 88, 89, 90, 91, 92 или 97, и вариабельная область легкой цепи обладает по меньшей мере 90% идентичностью последовательности с вариабельной областью легкой цепи, представленной в аминокислотной последовательности SEQ ID NO: 11, 77, 78, 79, 80, 81, 82, 83, 84, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107 или 119.
7. Антитело к TSLP по п. 6, содержащее вариабельную область тяжелой цепи и вариабельную область легкой цепи, где:
i) аминокислотная последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 6, 42, 43, 44 или 50, и аминокислотная последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 7, 38, 39, 40, 41, 49, 51 или 52; или
ii) аминокислотная последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 8, 62, 63, 64, 65, 66, 67, 68 или 69, и аминокислотная последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 9, 56, 57, 58, 59, 60, 61, 72, 73, 74 или 75; или
iii) аминокислотная последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 10, 85, 86, 87, 88, 89, 90, 91, 92 или 97, и аминокислотная последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 11, 77, 78, 79, 80, 81, 82, 83, 84, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107 или 119.
8. Антитело к TSLP по п. 7, содержащее вариабельную область тяжелой цепи и вариабельную область легкой цепи, представленные ниже:
a) последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 50, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 52; или
b) последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 50, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 51; или
c) последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 69, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 74; или
d) последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 64, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 73; или
e) последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 97, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 119; или
f) последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 91, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 78.
9. Антитело к TSLP по п. 8, содержащее вариабельную область тяжелой цепи и вариабельную область легкой цепи, при этом последовательность вариабельной области тяжелой цепи соответствует представленной в SEQ ID NO: 97, и последовательность вариабельной области легкой цепи соответствует представленной в SEQ ID NO: 119.
10. Антитело к TSLP или его антигенсвязывающий фрагмент по любому из пп. 1-9, где антитело содержит константную область тяжелой цепи и константную область легкой цепи антитела.
11. Антитело к TSLP или его антигенсвязывающий фрагмент по любому из пп. 1-10, где константная область тяжелой цепи выбрана из группы, состоящей из константных областей человеческого IgG1, IgG2, IgG3 и IgG4 и их традиционных вариантов, константная область легкой цепи выбрана из группы, состоящей из константных областей κ- и λ-цепи человеческого антитела и их традиционных вариантов.
12. Антитело к TSLP или его антигенсвязывающий фрагмент по любому из пп. 1-11, где антитело содержит константную область тяжелой цепи, представленную в последовательности SEQ ID NO: 133, и константную область легкой цепи, представленную в последовательности SEQ ID NO: 134.
13. Антитело к TSLP по п. 12, содержащее тяжелую цепь и легкую цепь, представленные ниже:
а) аминокислотная последовательность тяжелой цепи соответствует представленной в SEQ ID NO: 135 или обладает по меньшей мере 90% идентичностью указанной последовательности, и аминокислотная последовательность легкой цепи соответствует представленной в SEQ ID NO: 136 или обладает по меньшей мере 90% идентичностью указанной последовательности; или
b) аминокислотная последовательность тяжелой цепи соответствует представленной в SEQ ID NO: 137 или обладает по меньшей мере 90% идентичностью указанной последовательности, и аминокислотная последовательность легкой цепи соответствует представленной в SEQ ID NO: 138 или обладает по меньшей мере 90% идентичностью указанной последовательности; или
c) аминокислотная последовательность тяжелой цепи соответствует представленной в SEQ ID NO: 139 или обладает по меньшей мере 90% идентичностью указанной последовательности, и аминокислотная последовательность легкой цепи соответствует представленной в SEQ ID NO: 140 или обладает по меньшей мере 90% идентичностью указанной последовательности.
14. Антитело к TSLP по п. 13, содержащее тяжелую цепь и легкую цепь, при этом аминокислотная последовательность тяжелой цепи соответствует представленной в SEQ ID NO: 139, и аминокислотная последовательность легкой цепи соответствует представленной в SEQ ID NO: 140.
15. Молекула нуклеиновой кислоты, кодирующая антитело к TSLP по любому из пп. 1-14.
16. Клетка-хозяин для репликации молекул нуклеиновых кислот, содержащая молекулу нуклеиновой кислоты по п. 15.
17. Фармацевтическая композиция для лечения заболеваний, связанных с TSLP, содержащая терапевтически эффективное количество антитела к TSLP по любому из пп. 1-14, или молекулы нуклеиновой кислоты по п. 15, или клетки-хозяина по п. 16, а также один или более фармацевтически приемлемых носителей, разбавителей, буферов или эксципиентов.
18. Способ лечения заболеваний, связанных с TSLP, включающий введение субъекту терапевтически эффективного количества антитела к TSLP по любому из пп. 1-14, или молекулы нуклеиновой кислоты по п. 15, или клетки-хозяина по п. 16, или фармацевтической композиции по п. 17.
19. Способ по п. 18, где заболевание, связанное с TSLP, выбрано из группы, состоящей из: астмы, идиопатического легочного фиброза, атопического дерматита, аллергического конъюнктивита, аллергического ринита, аллергического синусита, крапивницы, синдрома Нетертона, эозинофильного эзофагита, пищевой аллергии, аллергической диареи, эозинофильного гастроэнтерита, аллергического бронхолегочного аспергиллеза, аллергического грибкового синусита, хронического зуда, рака, рака молочной железы, рака ободочной кишки, рака легкого, рака яичника, рака предстательной железы, ревматоидного артрита, хронической обструктивной болезни легких, системного склероза, рассеянного склероза, келоидоза, язвенного колита, назального полипоза, хронической эозинофильной пневмонии, эозинофильного бронхита, целиакии, синдрома Черджа-Стросс, синдрома эозинофилии-миалгии, гиперэозинофильного синдрома, эозинофильного гранулематоза с полиангиитом, воспалительного заболевания кишечника, склеродермии, интерстициального заболевания легких, фиброза, вызванного хроническим гепатитом В или С, фиброза, вызванного облучением, и фиброза, вызванного заживлением раны.
| WO 2008155365 A1, 24.12.2008 | |||
| СКОНСТРУИРОВАННОЕ АНТИТЕЛО ПРОТИВ TSLP | 2010 |
|
RU2575039C2 |
| CN 101389657 A, 18.03.2009 | |||
| GAIL M GAUVREAU et al., Effects of an anti-TSLP antibody on allergen-induced asthmatic responses, N Engl J Med, 2014, 370(22), pp.2102-2110. | |||
Авторы
Даты
2024-08-23—Публикация
2020-06-03—Подача