ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Настоящая заявка испрашивает приоритет на основании заявки на патент Китая №202110147687.1, поданной 3 февраля 2021 года, содержание которой полностью включено в настоящий документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящая заявка в целом относится к области генной инженерии и лечению на основе антител. В частности, настоящая заявка относится к биспецифическому антителу и к моноклональному антителу к TSLP человека и применению указанных антител.
УРОВЕНЬ ТЕХНИКИ
Тимусный стромальный лимфопоэтин человека (TSLP), также известный как IL-7-подобный цитокин[1] является представителем семейства цитокинов JL-2. TSLP секретируется преимущественно эпителиальными клетками тимуса, легкого, кишечника и кожи [2,3] и в меньшей степени некоторыми фибробластами, эндотелиальными клетками гладких мышц дыхательных путей, тучными клетками, моноцитами, гранулоцитами и дендритными клетками (DC)[4-14]. Экспрессия TSLP регулируется некоторыми факторами, такими как аллергены, провоспалительные факторы (IL-1β, TNF-α, TGF-β, IL-4 и IL-13), цитокин Th2, травма, механическое повреждение и бактерии и так далее [15-18].
Клетки-мишени TSLP характеризуются совместной экспрессией рецептора TSLP (рецептор тимусного стромального лимфопоэтина, TSLPR) и α-цепи рецептора IL-7 (TL-7Rα) [19] TSLPR с высокой аффинностью связывается с TSLP, тем самым аллостерически активируя TSLP, который, в свою очередь, рекрутирует IL-7Rα с образованием тройного комплекса TSLP-TSLPR-IL-7Rα, который может передавать сигналы. IL-7Rα с высокой аффинностью связывается с TSLP-TSLPR, но очень слабо связывается с TSLP [20]
Астма представляет собой хроническое заболевание, характеризующееся воспалением дыхательных путей, и клинически характеризуется рецидивирующими симптомами, такими как свистящее дыхание, одышка, ощущение стеснения в груди и кашель [21] Во всем мире астмой болеют примерно 300 миллионов человек [22] В течение последних двух десятилетий число случаев астмы в мире увеличивалось со скоростью примерно 1% в год. Существующие терапевтические лекарственные средства, включаябронхолитики, глюкокортикоиды, комбинированные препараты бронхолитиков и глюкокортикоидов (такие как серетид и симбикорт), модуляторы лейкотриенов, антагонисты холинергических рецепторов длительного действия (такие как тиотропия бромид) и антитела IgE, не могут обеспечить контроль состояния всех астматиков.
Многочисленные исследования показали, что примерно 2/3 случаев тяжелой астмы характеризуются сверхэкспрессией цитокинов Th2, и TSLP является важным фактором, вызывающим сверхэкспрессию цитокинов Th2. Действие TSLP-TSLPR в основном опосредуется сигнальным путем JAK-STAT [2]. Исследования показывают, что при положительной регуляции TSLP связывается с TSLPR на клетках DC (дендритные клетки) так, чтобы активировать JAK, рекрутировать транскрипционный фактор STAT5 и вызывать нисходящую передачу сигналов, что в итоге приводит к активации клеток DC. При активации клеток DC наблюдается положительная регуляция экспрессии костимулирующих молекул (таких как CD80, CD40 и CD86) и секреция хемокинов (таких как TARC/CCL17, MDC/CCL22 и I-309/CCL1), что обеспечивает благоприятное микроокружение для дифференцировки клеток Th0 в Th2, определяющей направление воспалительного ответа с преобладанием клеток Th2, сопровождающегося высвобождением факторов (IL-4, IL-13 и IL-5)[11,12 23 24] Трансгенные TSLP мыши восприимчивы к конкретным антигенам, вследствие чего у них развивается астма, тогда как у нокаутных по рецептору TSLP мышей симптомы существенно снижены [24] Как следует из анализа механизмов астмы и воспаления, нацеленные на цитокины (IL-4, IL-13, IL-5) лекарственные средства нацеливаются только на конкретные воспалительные молекулы, способствующие развитию астмы и воспаления, и подходят только для пациентов с определенными типами тяжелой астмы, то есть для подгруппы пациентов, такой как пациенты с эозинофильной астмой. TSLP существенно отличается от таких мишеней, как IL-4 и IL-5. TSLP активен на ранних стадиях каскада воспалительных реакций, и может подойти широкому кругу пациентов с тяжелой неконтролируемой астмой.
Исследователями были проведены масштабные исследования и поиски лекарственных средств, нацеленных на TSLP. Моноклональные антитела к TSLP могут эффективно блокировать действие TSLP/TSLPR, обращать воспаление дыхательных путей, предупреждать структурные изменения тканей, а также снижать гиперреактивность дыхательных путей (AHR) и уровень TGF-β в индуцированной пылевым клещом модели астмы у мышей [25] В индуцированной сывороточными белками модели астмы у мышей моноклональные антитела к TSLP эффективно снижаютэкспрессию факторов Th2 (таких как JL-4 и IL-5) [26] Безопасность моноклональных антител к TSLP также была хорошо изучена у обезьян. Более того, единственное в мире клинически исследованное моноклональное антитело к TSLP демонстрирует хорошую частоту объективных ответов на ранней клинической фазе, эффективно обеспечивая облегчение симптомов у субъектов [27]
Биспецифическое антитело (BsAb) представляет собой класс искусственных антител и содержит два разных антигенсвязывающих сайта, может служить мостиком между клетками-мишенями и функциональными молекулами (клетками) и стимулировать направленный иммунный ответ.В настоящее время оно является центром исследований в области инжиниринга антител и имеет перспективу широкого применения в иммунотерапии заболеваний.
В этой области имеется потребность в разработке и применении новых антител к TSLP. Следовательно, ввиду широкой применимости антител к TSLP и с учетом клинических потребностей, изучение и разработка новых антител к TSLP имеет большое биологическое и медицинское значение.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В первом аспекте настоящей заявки предложено биспецифическое антитело, содержащее первый связывающий фрагмент и второй связывающий фрагмент, которые связываются с неперекрывающимися эпитопами тимусного стромального лимфопоэтина человека (TSLP).
В некоторых воплощениях первого аспекта указанное биспецифическое антитело способно блокировать связывание TSLP человека с рецептором TSLP (TSLPR) человека, а также указанное биспецифическое антитело способно блокировать связывание альфа-цепи рецептора IL-7 (IL-7Rα) человека с комплексом TSLP:TSLPR человека.
В некоторых воплощениях первого аспекта эпитоп TSLP человека, связанный с одним из первого связывающего фрагмента и второго связывающего фрагмента, частично перекрывается с эпитопом TSLP человека, связанного с IL-7Rα.
В некоторых воплощениях первого аспекта первый связывающий фрагмент содержит HCDR1, представленную в SEQ ID NO:29, HCDR2, представленную в SEQ ID NO:30, HCDR3, представленную в SEQ ID NO:31, LCDR1, представленную в SEQ ID NO:32, LCDR2, представленную в SEQ ID NO:33, и LCDR3, представленную в SEQ ID NO:34; где аминокислотные последовательности HCDR и LCDR определены согласно нумерации Kabat.
В некоторых воплощениях первого аспекта второй связывающий фрагментсодержит HCDR1, представленную в SEQ ID NO:35, HCDR2, представленную в SEQ ID NO:36, HCDR3, представленную в SEQ ID NO:37, LCDR1, представленную в SEQ ID NO:32, LCDR2, представленную в SEQ ID NO:33, и LCDR3, представленную в SEQ ID NO:34; где аминокислотные последовательности HCDR и LCDR определены согласно нумерации Kabat.
В некоторых воплощениях первого аспекта аминокислотная последовательность вариабельной области тяжелой цепи первого связывающего фрагмента представлена в SEQ ID NO: 24, и аминокислотная последовательность вариабельной области легкой цепи первого связывающего фрагмента представлена в SEQ ID NO: 21; или
аминокислотная последовательность вариабельной области тяжелой цепи первого связывающего фрагмента представлена в SEQ ID NO: 24, и аминокислотная последовательность вариабельной области легкой цепи первого связывающего фрагмента представлена в SEQ ID NO: 28.
В некоторых воплощениях первого аспекта аминокислотная последовательность вариабельной области тяжелой цепи второго связывающего фрагмента представлена в SEQ ID NO: 20, и аминокислотная последовательность вариабельной области легкой цепи второго связывающего фрагмента представлена в SEQ ID NO: 21; или
аминокислотная последовательность вариабельной области тяжелой цепи второго связывающего фрагмента представлена в SEQ ID NO: 20, и аминокислотная последовательность вариабельной области легкой цепи второго связывающего фрагмента представлена в SEQ ID NO: 28.
В некоторых воплощениях первого аспекта биспецифическое антитело представляет собой антитело IgGl, содержащее первую константную область тяжелой цепи и вторую константную область тяжелой цепи, где аминокислоты в положениях 354 и 366 первой константной области тяжелой цепи представляют собой С и W соответственно, и аминокислоты в положениях 349, 366, 368 и 407 второй константной области тяжелой цепи представляют собой С, S, А и V соответственно; и положения аминокислот константных областей антитела определены согласно нумерации в соответствии с индексом EU.
В некоторых воплощениях первого аспекта биспецифическое антитело представляет собой антитело IgGl, содержащее первую константную область тяжелой цепи и вторую константную область тяжелой цепи, где аминокислоты в положениях 234, 235 и 331 первой константной области тяжелой цепи и второй константной области тяжелой цепи представляют собой F, Е и S соответственно; и положения аминокислотконстантных областей антитела определены согласно нумерации в соответствии с индексом EU.
В некоторых воплощениях первого аспекта формы первого связывающего фрагмента и второго связывающего фрагмента независимо выбраны из одноцепочечного вариабельного фрагмента (scFv) или Fab-фрагмента.
В некоторых воплощениях первого аспекта первый связывающий фрагмент и второй связывающий фрагмент имеют одинаковую вариабельную область легкой цепи.
В некоторых воплощениях первого аспекта указанное биспецифическое антитело содержит тяжелую цепь, представленную в SEQ ID NO:38, и легкую цепь, представленную в одной из SEQ ID NO: 39 и 40.
В некоторых воплощениях первого аспекта указанное биспецифическое антитело содержит тяжелую цепь, представленную в SEQ ID NO:41, и легкую цепь, представленную в одной из SEQ ID NO: 39 и 40.
Во втором аспекте настоящей заявки предложено моноклональное антитело, которое связывается с TSLP человека, содержащее HCDR1, представленную в SEQ ID NO:29, HCDR2, представленную в SEQ ID NO:30, HCDR3, представленную в SEQ ID NO:31, LCDR1, представленную в SEQ ID NO:32, LCDR2, представленную в SEQ ID NO:33, и LCDR3, представленную в SEQ ID NO:34; где аминокислотные последовательности HCDR и LCDR определены согласно нумерации Kabat.
В третьем аспекте настоящей заявки предложена фармацевтическая композиция, содержащая биспецифическое антитело согласно первому аспекту или моноклональное антитело согласно второму аспекту и фармацевтически приемлемый эксципиент, разбавитель или носитель.
В четвертом аспекте настоящей заявки предложено применение биспецифического антитела согласно первому аспекту, моноклонального антитела согласно второму аспекту или фармацевтической композиции согласно третьему аспекту в изготовлении лекарственного средства для предупреждения или лечения опосредованных TSLP заболеваний.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 показаны результаты анализа методом ELISA, направленного на оценку ингибирующего действия моноклонального антитела S17C7+L3E8-M1 к TSLP человека на связывание TSLP с TSLPR.
На Фиг. 2 показаны результаты анализа методом ELISA, направленного на оценку способности моноклонального антитела S17C7+L3E8-M1 к TSLP человека ингибироватьсвязывание тезепелумаба-mIgG2a с TSLP.
На Фиг. 3 показаны результаты хемилюминесцентного анализа жизнеспособности клеток, направленного на оценку способности моноклонального антитела S17C7+L3E8-М1 к TSLP человека ингибировать стимулирующее пролиферацию действие TSLP на клетки BAF3-TSLPR/IL-7Rα.
На Фиг. 4 показаны результаты анализа методом ELISA, направленного на оценку способности моноклонального антитела S17C7+L3E8-M1 к TSLP человека ингибировать секрецию TARC (хемокин, регулируемый тимусом и активацией) клетками РВМС, стимулированными TSLP.
На Фиг. 5 показано ингибирующее действие гуманизированного моноклонального антитела H3B10-M1+L3E8-M1 к TSLP человека на связывание TSLP с TSLPR.
На Фиг. 6 показаны результаты хемилюминесцентного анализа жизнеспособности клеток, направленного на оценку способности моноклональных антител к TSLP человека и двух моноклональных антител в комбинации ингибировать стимулирующее пролиферацию действие TSLP на клетки BAF3-TSLPR/IL-7Rα.
На Фиг. 7 показаны результаты анализа методом ELISA, направленного на оценку способности моноклональных антител к TSLP человека и двух моноклональных антител в комбинации ингибировать секрецию TARC клетками РВМС, стимулированными TSLP.
На Фиг. 8 показаны результаты анализа методом ELISA, направленного на оценку ингибирующего действия биспецифических антител к TSLP человека на связывание TSLP с TSLPR.
На Фиг. 9 показаны результаты хемилюминесцентного анализа жизнеспособности клеток, направленного на оценку способности биспецифических антител к TSLP человека ингибировать стимулирующее пролиферацию действие TSLP на клетки BAF3-TSLPR/IL-7Rα.
На Фиг. 10 показаны результаты анализа методом ELISA, направленного на оценку способности биспецифического антитела к TSLP человека ингибировать секрецию TARC клетками РВМС, стимулированными TSLP.
На Фиг. 11 показаны результаты анализа связывания эпитопов антителами к TSLP человека, выполненного с помощью Biacore Т200, где на панелях A-D соответственно показаны результаты анализа с использованием H3B10-M1+L3E8-M7, HI A10+L3E8-M7, биспецифического антитела H1A10×H3B10-M1+L3E8-M7 и тезепелумаба в качестве первых антител.
На Фиг. 12 показана структура комплекса антитело-антиген, в котором антиген TSLP показан слева, a Fab H1A10+L3E8-M1 показан справа.
На Фиг. 13 показаны результаты оценки способности антител к TSLP человека блокировать связывание TSLPR человека с TSLP человека, выполненной с помощью Biacore Т200.
На Фиг. 14 показаны результаты оценки способности антител к TSLP человека блокировать связывание IL-7Rα человека с комплексом TSLP:TSLPR человека, выполненной с помощью Biacore Т200.
ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO: 1 представляет аминокислотную последовательность длинного варианта внеклеточного домена TSLP человека {homo sapiens) (hTSLP1-ECD).
SEQ ID NO: 2 представляет аминокислотную последовательность короткого варианта внеклеточного домена TSLP человека {homo sapiens) (hTSLP2-ECD).
SEQ ID NO: 3 представляет аминокислотную последовательность внеклеточного домена TSLP мыши {mus musculus) (mTSLP-ECD).
SEQ ID NO: 4 представляет аминокислотную последовательность внеклеточного домена TSLP яванского макака {Масаса fascicularis) (mfTSLP1-ECD).
SEQ ID NO: 5 представляет аминокислотную последовательность мутанта hTSLP1 (hTSLPl-m) с делецией в сайте распознавания фурином.
SEQ ID NO: 6 представляет аминокислотную последовательность мутанта hTSLP2 (hTSLP2-m) с делецией в сайте распознавания фурином.
SEQ ID NO: 7 представляет аминокислотную последовательность мутанта mfTSLP (mfTSLPl-m) с делецией в сайте распознавания фурином.
SEQ ID NO: 8 представляет аминокислотную последовательность His-метки.
SEQ ID NO:9 представляет аминокислотную последовательность Fc-фрагмента (hFc) антитела IgG1 человека {homo sapiens).
SEQ ID NO:10 представляет аминокислотную последовательность Fc-фрагмента (mFc) антитела IgG2a мыши {mus musculus).
SEQ ID NO:11 представляет аминокислотную последовательность константной области тяжелой цепи подтипа IgG1 человека {homo sapiens).
SEQ ID NO:12 представляет аминокислотную последовательность константной области тяжелой цепи подтипа IgG2 человека {homo sapiens).
SEQ ID NO:13 представляет аминокислотную последовательность константной области тяжелой цепи подтипа IgG4 человека {homo sapiens).
SEQ ID NO:14 представляет аминокислотную последовательность константнойобласти тяжелой цепи подтипа IgG1 мыши (mus musculus).
SEQ ID NO:15 представляет аминокислотную последовательность константной области тяжелой цепи подтипа IgG2a мыши (mus musculus).
SEQ ID NO:16 представляет аминокислотную последовательность константной области легкой цепи подтипа каппа человека (homo sapiens).
SEQ ID NO:17 представляет аминокислотную последовательность константной области легкой цепи подтипа лямбда человека (homo sapiens).
SEQ ID NO:18 представляет аминокислотную последовательность константной области легкой цепи подтипа каппа мыши (mus musculus).
SEQ ID NO:19 представляет аминокислотную последовательность константной области легкой цепи подтипа лямбда мыши (mus musculus).
SEQ ID NO:20 представляет аминокислотную последовательность вариабельной области тяжелой цепи гуманизированного антитела H1A10+L3E8-M1 с аминокислотными последовательностями HCDR1-HCDR3, представленными в SEQ ID NO:35, SEQ ID NO:36 и SEQ ID NO:37 соответственно.
SEQ ID NO:21 представляет аминокислотную последовательность вариабельной области легкой цепи L3E8-M1 гуманизированного антитела H1A10+L3E8-M1 с аминокислотными последовательностями LCDR1-LCDR3, представленными в SEQ ID NO:32, SEQ ID NO:33 and SEQ ID NO:34 соответственно.
SEQ ID NO:22 представляет аминокислотную последовательность вариабельной области тяжелой цепи контрольного антитела к TSLP человека тезепелумаба.
SEQ ID NO:23 представляет аминокислотную последовательность вариабельной области легкой цепи контрольного антитела к TSLP человека тезепелумаба.
SEQ ID NO:24 представляет аминокислотную последовательность гуманизированного мутанта тяжелой цепи Н3В10-М1 с аминокислотными последовательностями HCDR1-HCDR3, представленными в SEQ ID NO:29, SEQ ID NO:30 и SEQ ID NO:31 соответственно.
SEQ ID NO:25 представляет аминокислотную последовательность L3E8-M2.
SEQ ID NO:26 представляет аминокислотную последовательность L3E8-M3.
SEQ ID NO:27 представляет аминокислотную последовательность L3E8-M4.
SEQ ID NO:28 представляет аминокислотную последовательность мутанта L3E8-М7 с аминокислотными последовательностями LCDR1-LCDR3, представленными в SEQ ID NO:32, SEQ ID NO:33 и SEQ ID NO:34 соответственно.
SEQ ID NO:38 представляет аминокислотную последовательность Н3В10-М1-IgGlm3-H.
SEQ ID NO:39 представляет аминокислотную последовательность легкой цепи, содержащей вариабельную область легкой цепи L3E8-M1.
SEQ ID NO:40 представляет аминокислотную последовательность легкой цепи, содержащей вариабельную область легкой цепи L3E8-M7.
SEQ ID NO:41 представляет аминокислотную последовательность Н1А10-IgGlm3-K.
SEQ ID NO:42 представляет аминокислотную последовательность внеклеточного домена рецептора TSLP человека (homo sapiens) (hTSLPR-ECD).
SEQ ID NO:43 представляет аминокислотную последовательность внеклеточного домена альфа-цепи рецептора IL-7 человека (homo sapiens) (hIL-7Rα-ECD).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения осуществили широкомасштабные исследования и разработку лекарственных средств на основе антител, которые связываются с TSLP человека, и получили новые биспецифические антитела и моноклональные антитела, которые связываются с TSLP человека, с помощью методов инжиниринга антител. В различных аспектах настоящей заявки предложены новые биспецифические и моноклональные антитела, которые связываются с TSLP человека, полинуклеотиды, кодирующие указанные биспецифические или моноклональные антитела, векторы, содержащие указанные полинуклеотиды, клетки-хозяева, содержащие указанные полинуклеотиды или векторы, способы получения и очистки биспецифических или моноклональных антител, а также медицинское и биологическое применение указанных биспецифических или моноклональных антител. На основе последовательностей вариабельных областей биспецифических или моноклональных антител, предложенных в настоящем документе, могут быть сконструированы полноразмерные молекулы биспецифических или моноклональных антител для применения в клинической практике в качестве лекарственных средств для предупреждения или лечения опосредованных TSLP заболеваний.
Если не указано иное, изобретения согласно настоящей заявке могут быть реализованы с использованием методик молекулярной биологии, микробиологии, клеточной биологии, биохимии и иммунологии, общепринятых в данной области техники.
Если не указано иное, термины, используемые в настоящей заявке, имеют значения, обычно подразумеваемые специалистами в данной области техники.
ОПРЕДЕЛЕНИЯ
В настоящем документе термин «антитело» относится к молекуле иммуноглобулина, которая способна специфично связываться с мишенью посредством по меньшей мере одного сайта распознавания антигена, расположенного в вариабельной области молекулы иммуноглобулина. Мишени включают, без ограничения ими, углеводы, полинуклеотиды, липиды и полипептиды и так далее. В настоящем документе «антитело» включает не только интактное (то есть полноразмерное) антитело, но и его связывающий фрагмент (например Fab, Fab', F(ab')2, Fv), его вариант, слитый белок, содержащий части антитела, гуманизированное антитело, химерное антитело, диатело, линейное антитело, одноцепочечный вариабельный фрагмент, VHH-антитело, полиспецифическое антитело (например биспецифическое антитело) и любые другие модифицированные конфигурации молекулы иммуноглобулина, содержащие нужный сайт распознавания специфичного антигена, включая гликозилированный вариант антитела, вариант аминокислотной последовательности антитела и ковалентно модифицированное антитело.
Как правило, интактное или полноразмерное антитело содержит две тяжелых цепи и две легких цепи. Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (VH), а также первую, вторую и третью константные области (CH1, СН2 и СН3). Каждая легкая цепь содержит вариабельную область легкой цепи (VL) и константную область (CL). Полноразмерное антитело может представлять собой антитело любого типа, такое как антитело IgD, IgE, IgG, IgA или IgM (или их подтипам), но не обязательно принадлежит к какому-либо конкретному типу. Иммуноглобулины могут быть отнесены к разным типам в зависимости от аминокислотных последовательностей константных областей их тяжелых цепей. В общем случае иммуноглобулины имеют пять основных типов, а именно IgA, IgD, IgE, IgG и IgM, и некоторые из этих типов могут быть дополнительно разделены на подтипы (изотипы), такие как IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные области тяжелой цепи, соответствующие отдельным типам иммуноглобулинов, обозначаются α, β, ε, γ, и μ соответственно. Структуры субъединиц и трехмерные структуры разных типов иммуноглобулинов хорошо известны.
В настоящем документе термин «биспецифическое антитело» относится к антителу, которое может одновременно связываться с двумя эпитопами антигена. Два эпитопа антигена могут находиться на разных антигенах или на одном и том же антигене. Биспецифическое антитело может иметь различные структурные конфигурации. Например, биспецифическое антитело может состоять из двух фрагментов Fc и двухслитых с ними связывающих частей соответственно (подобно природному антителу, за исключением того, что два плеча связываются с разными антигенными мишенями или эпитопами). Антигенсвязывающие части могут представлять собой одноцепочечный вариабельный фрагмент (scFv) или Fab-фрагменты. Когда имеются два неперекрывающихся эпитопа одного и того же антигена, каждая из двух разных связывающих частей биспецифического антитела связывается с N-концом одного Fc-фрагмента. Конфигурация антигенсвязывающих частей двух плеч может иметь четыре комбинации, а именно scFv+Fab-фрагмент, Fab-фрагмент+scFv, scFv+scFv и Fab-фрагмент+Fab-фрагмент.Fc-фрагменты могут содержать мутации, которые могут обеспечивать гетеромеризацию тяжелых цепей. Методика KIH (knob-in-hole, выступ-во-впадину) является одной из стратегий решения проблемы гетеромеризации тяжелых цепей. В целом, методика KIH относится к образованию структуры, которая облегчает спаривание гетерогенных гемител, путем конструирования аминокислотной последовательности области СН3. Это позволяет в максимально возможной степени сохранять структуру нормального антитела при получении биспецифического антитела. Рекомендации по методике KIH см., например, в ”An efficient route to human bispecific IgG”, A. Margaret Merchant et al., Nature Biotechnology, Volume 16, 1998, который включен в настоящий документ посредством ссылки во сей свое полноте. Кроме того, биспецифическое антитело может быть сконфигурировано таким образом, что антитело, которое связывается с первым эпитопом антигена (например в форме природного антитела), имеет антигенсвязывающую часть, которая может связываться со вторым эпитопом антигена, присоединенную к С-концу области СН3 (например посредством гибкого линкера).
В настоящем документе термины «связывающая часть» или «связывающий фрагмент» могут использоваться взаимозаменяемо и относятся к части или области интактной молекулы антитела, отвечающей за связывание с антигеном. Антигенсвязывающий домен может содержать вариабельную область тяжелой цепи (VH), вариабельную область легкой цепи (VL) или обе из них. Каждая из VH и VL обычно содержит три определяющие комплементарность области, а именно CDR1, CDR2 и CDR3.
Специалистам в данной области техники хорошо известно, что определяющие комплементарность области (CDR, обычно включающие CDR1, CDR2 и CDR3) представляют собой участки вариабельной области, которые оказывают наибольшее влияние на аффинность и специфичность антитела. Последовательности CDR VH или VL имеют два общепринятых определения, а именно определение согласно нумерации Kabat и определение согласно нумерации Chothia (см., Kabat, ”Sequences of Proteins of Immunological Interest”, National Institutes of Health, Bethesda, Md. (1991); Al-Lazikani et al, J. Mol. Biol. 273: 927-948 (1997); и Martin et al, Proc. Natl. Acad. Sci. USA 86: 9268-9272 (1989)). В случае последовательностей вариабельной области конкретного антитела последовательности областей CDR в VH и VL могут быть определены в соответствии с определением согласно нумерации Kabat или с определением согласно нумерации Chothia. В одном из воплощений настоящей заявки последовательности CDR определены согласно нумерации Kabat.
В случае последовательностей вариабельной области конкретного антитела последовательности областей CDR в последовательностях вариабельной области могут быть определены различными способами, например с помощью онлайнового программного обеспечения Abysis (http://www.abysis.org/).
В случае стандартных антител примеры антигенсвязывающего фрагмента включают, без ограничения ими, (1) Fab-фрагмент, который может представлять собой моновалентный фрагмент, содержащий цепь VL-CL и цепь VH-CH1; (2) F(ab’)2-фрагмент, который может представлять собой бивалентный фрагмент, содержащий два Fab'-фрагмента, соединенных дисульфидным мостиком шарнирной области (то есть димер Fab'); (3) Fv-фрагмент, содержащий домены VL и VH в единственном плече антитела; (4) одноцепочечный Fv (scFv), который может представлять собой единственную полипептидную цепь, состоящую из домена VH и домена VL, соединенных полипептидным линкером; (5) (scFv)2, который может содержать два домена VH, соединенных пептидным линкером, и два домена VL, которые соединены с двумя доменами VH дисульфидным мостиком; и (6) VHH-антитело.
В конструкции биспецифического антитела «связывающая часть» включает, без ограничения ими, Fab-фрагмент или одноцепочечный вариабельный фрагмент (scFv).
В настоящем документе термин «одноцепочечный вариабельный фрагмент (scFv)» относится к антителу с одноцепочечной структурой, обычно сконструированному методами генетической инженерии, содержащему полипептидную цепь, которая содержит вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL). Гибкий линкер, как правило, конструируют между вариабельной областью тяжелой цепи и вариабельной областью легкой цепи так, чтобы вариабельная область тяжелой цепи и вариабельная область легкой цепи могли сворачиваться с получением правильной конформации для связывания с антигеном.
В настоящем документе термин «Fab-фрагмент (антигенсвязывающий фрагмент)», «Fab-часть» или тому подобное относится к фрагменту антитела, который образуется после обработки интактного антитела папаином и способен связываться с антигеном, содержащему интактную легкую цепь (VL-CL), вариабельную область тяжелой цепи и фрагмент CH1 (VH-CH1).
В настоящем документе оба термина «первая константная область тяжелой цепи» и «вторая константная область тяжелой цепи» относятся к терминам «Fc-фрагмент», «Fc-домен» и «Fc-часть » или подобным терминам и обозначают часть константной области тяжелой цепи антитела, содержащей шарнирную область, фрагмент СН2 и фрагмент СН3 константной области тяжелой цепи, они определены согласно нумерации в соответствии с индексом EU антитела IgG1 человека.
В настоящем документе термин «моноклональное антитело» относится к антителу из по существу гомогенной популяции антител, что означает, что антитела, составляющие указанную популяцию, являются одинаковыми, за исключением встречающихся в природе мутаций, которые могут присутствовать в небольшом количестве отдельных антител. Моноклональные антитела, описанные в настоящем документе, в частности, включают «химерные» антитела, в которых часть тяжелой цепи и/или легкой цепи идентична или гомологична соответствующей последовательности в антителе, полученном от конкретного вида или принадлежащем к конкретному типу или подтипу антител, при этом оставшаяся часть тяжелой цепи и/или легкой цепи идентична или гомологична соответствующей последовательности в антителе, полученном от другого вида или принадлежащем к другому типу или подтипу антител; а также включают фрагменты таких антител при условии, что они способны проявлять нужную биологическую активность (см. патент США №4816567 и Morrison et al., Proc. Natl. Acad. Sci. USA 81: 6851-6855 (1984)).
В настоящем документе термин «специфичное связывание» относится к реакции неслучайного связывания между двумя молекулами, например к связыванию антитела с эпитопом антигена.
В первом аспекте настоящей заявки предложено биспецифическое антитело, содержащее первый связывающий фрагмент и второй связывающий фрагмент, которые связываются с неперекрывающимися эпитопами тимусного стромального лимфопоэтина человека (TSLP).
В некоторых воплощениях первого аспекта указанное биспецифическое антитело способно блокировать связывание TSLP человека с рецептором TSLP (TSLPR) человека, а также указанное биспецифическое антитело способно блокировать связывание альфа-цепи рецептора IL-7 (IL-7Rα) человека с комплексом TSLP: TSLPR человека.
В некоторых воплощениях первого аспекта эпитоп TSLP человека, связанный с одним из первого связывающего фрагмента и второго связывающего фрагмента, частично перекрывается с эпитопом TSLP человека, связанного с IL-7Rα.
В некоторых воплощениях первого аспекта первый связывающий фрагмент содержит HCDR1, представленную в SEQ ID NO:29, HCDR2, представленную в SEQ ID NO:30, HCDR3, представленную в SEQ ID NO:31, LCDR1, представленную в SEQ ID NO:32, LCDR2, представленную в SEQ ID NO:33, и LCDR3, представленную в SEQ ID NO:34; где аминокислотные последовательности HCDR и LCDR определены согласно нумерации Kabat.
В некоторых воплощениях первого аспекта второй связывающий фрагмент содержит HCDR1, представленную в SEQ ID NO:35, HCDR2, представленную в SEQ ID NO:36, HCDR3, представленную в SEQ ID NO:37, LCDR1, представленную в SEQ ID NO:32, LCDR2, представленную в SEQ ID NO:33, и LCDR3, представленную в SEQ ID NO:34; где аминокислотные последовательности HCDR и LCDR определены согласно нумерации Kabat.
В некоторых воплощениях первого аспекта аминокислотная последовательность вариабельной области тяжелой цепи первого связывающего фрагмента представлена в SEQ ID NO: 24, и аминокислотная последовательность вариабельной области легкой цепи первого связывающего фрагмента представлена в SEQ ID NO: 21; или
аминокислотная последовательность вариабельной области тяжелой цепи первого связывающего фрагмента представлена в SEQ ID NO: 24, и аминокислотная последовательность вариабельной области легкой цепи первого связывающего фрагмента представлена в SEQ ID NO: 28.
В некоторых воплощениях первого аспекта аминокислотная последовательность вариабельной области тяжелой цепи второго связывающего фрагмента представлена в SEQ ID NO: 20, и аминокислотная последовательность вариабельной области легкой цепи второго связывающего фрагмента представлена в SEQ ID NO: 21; или
аминокислотная последовательность вариабельной области тяжелой цепи второго связывающего фрагмента представлена в SEQ ID NO: 20, и аминокислотная последовательность вариабельной области легкой цепи второго связывающего фрагмента представлена в SEQ ID NO: 28.
В некоторых воплощениях первого аспекта биспецифическое антителопредставляет собой антитело IgG1, содержащее первую константную область тяжелой цепи и вторую константную область тяжелой цепи, где аминокислоты в положениях 354 и 366 первой константной области тяжелой цепи представляют собой С и W соответственно, и аминокислоты в положениях 349, 366, 368 и 407 второй константной области тяжелой цепи представляют собой С, S, А и V соответственно; и положения аминокислот константных областей антитела определены согласно нумерации в соответствии с индексом EU.
В некоторых воплощениях первого аспекта биспецифическое антитело представляет собой антитело IgG1, содержащее первую константную область тяжелой цепи и вторую константную область тяжелой цепи, где аминокислоты в положениях 234, 235 и 331 первой константной области тяжелой цепи и второй константной области тяжелой цепи представляют собой F, Е и S; и положения аминокислот константных областей антитела определены согласно нумерации в соответствии с индексом EU.
В некоторых воплощениях первого аспекта формы первого связывающего фрагмента и второго связывающего фрагмента независимо выбраны из одноцепочечного вариабельного фрагмента (scFv) или Fab-фрагмента.
В некоторых воплощениях первого аспекта и связывающий фрагмент, и второй связывающий фрагмент представляют собой Fab-фрагменты.
В некоторых воплощениях первого аспекта первый связывающий фрагмент и второй связывающий фрагмент имеют одинаковую вариабельную область легкой цепи.
В некоторых воплощениях первого аспекта первый связывающий фрагмент и второй связывающий фрагмент имеют одинаковуюы легкую цепь.
В некоторых воплощениях первого аспекта указанное биспецифическое антитело содержит тяжелую цепь, представленную в SEQ ID NO:38, и легкую цепь, представленную в одной из SEQ ID NO: 39 и 40.
В некоторых воплощениях первого аспекта указанное биспецифическое антитело содержит тяжелую цепь, представленную в SEQ ID NO:41, и легкую цепь, представленную в одной из SEQ ID NO: 39 и 40.
В некоторых воплощениях первого аспекта аминокислотная последовательность вариабельной области тяжелой цепи первого связывающего фрагмента отличается от аминокислотной последовательности, представленной в SEQ ID NO:24, примерно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотными заменами, делециями и/или вставками.
В некоторых воплощениях первого аспекта аминокислотная последовательность вариабельной области легкой цепи первого связывающего фрагмента отличается отаминокислотной последовательности, представленной в SEQ ID NO:21 или 28, примерно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотными заменами, делециями и/или вставками.
В некоторых воплощениях первого аспекта аминокислотная последовательность вариабельной области тяжелой цепи первого связывающего фрагмента имеет по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более гомологии с SEQ ID NO:24.
В некоторых воплощениях первого аспекта аминокислотная последовательность вариабельной области легкой цепи первого связывающего фрагмента имеет по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более гомологии с SEQ ID NO:21 или 28.
В некоторых воплощениях первого аспекта С-концевая или N-концевая область аминокислотной последовательности, представленной в SEQ ID NO:24, также может быть укорочена примерно на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25 или более аминокислот, сохраняя при этом функцию, аналогичную функции вариабельной области тяжелой цепи первого связывающего фрагмента.
В некоторых воплощениях первого аспекта к С-концевой или N-концевой области аминокислотной последовательности, представленной в SEQ ID NO:24, также могут быть добавлены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25 или более аминокислот, и полученные аминокислотные последовательности сохраняют функцию, аналогичную функции вариабельной области тяжелой цепи первого связывающего фрагмента.
В некоторых воплощениях первого аспекта в области, отличной от С-конца или N-конца аминокислотной последовательности, представленной в SEQ ID NO:24, также могут быть добавлены или удалены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25 или более аминокислот при условии, что измененные аминокислотные последовательности по существу сохраняют функцию, аналогичную функции вариабельной области тяжелой цепи первого связывающего фрагмента.
В некоторых воплощениях первого аспекта С-концевая или N-концевая область аминокислотной последовательности, представленной в SEQ ID NO:21 или 28, также может быть укорочена примерно на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25 или более аминокислот, сохраняя при этом функцию, аналогичную функции вариабельной области легкой цепи первого связывающего фрагмента.
В некоторых воплощениях первого аспекта к С-концевой или N-концевой области аминокислотной последовательности, представленной в SEQ ID NO:21 или 28, также могут быть добавлены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25 или болееаминокислот, и при этом полученные аминокислотные последовательности сохраняют функцию, аналогичную функции вариабельной области легкой цепи первого связывающего фрагмента.
В некоторых воплощениях первого аспекта в области, отличной от С-конца или N-конца аминокислотной последовательности, представленной в SEQ ID NO:21 или 28, также могут быть добавлены или удалены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25 или более аминокислот при условии, что измененные аминокислотные последовательности по существу сохраняют функцию, аналогичную функции вариабельной области легкой цепи первого связывающего фрагмента.
В некоторых воплощениях первого аспекта аминокислотная последовательность вариабельной области тяжелой цепи второго связывающего фрагмента отличается от аминокислотной последовательности, представленной в SEQ ID NO:20, примерно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотными заменами, делециями и/или вставками.
В некоторых воплощениях первого аспекта аминокислотная последовательность вариабельной области легкой цепи второго связывающего фрагмента отличается от аминокислотной последовательности, представленной в SEQ ID NO:21 или 28, примерно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотными заменами, делециями и/или вставками.
В некоторых воплощениях первого аспекта аминокислотная последовательность вариабельной области тяжелой цепи второго связывающего фрагмента имеет по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более гомологии с SEQ ID NO:20.
В некоторых воплощениях первого аспекта аминокислотная последовательность вариабельной области легкой цепи второго связывающего фрагмента имеет по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более гомологии с SEQ ID NO:21 или 28.
В некоторых воплощениях первого аспекта С-концевая или N-концевая область аминокислотной последовательности, представленной в SEQ ID NO:20, также может быть укорочена примерно на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25 или более аминокислот, сохраняя при этом функцию, аналогичную функции вариабельной области тяжелой цепи второго связывающего фрагмента.
В некоторых воплощениях первого аспекта к С-концевой или N-концевой области аминокислотной последовательности, представленной в SEQ ID NO:20, также могут быть добавлены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25 или более аминокислот, и при этом полученные аминокислотные последовательности сохраняют функцию, аналогичную функции вариабельной области тяжелой цепи второго связывающего фрагмента.
В некоторых воплощениях первого аспекта в области, отличной от С-конца или N-конца аминокислотной последовательности, представленной в SEQ ID NO:20, также могут быть добавлены или удалены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25 или более аминокислот при условии, что измененные аминокислотные последовательности по существу сохраняют функцию, аналогичную функции вариабельной области тяжелой цепи второго связывающего фрагмента.
В некоторых воплощениях первого аспекта С-концевая или N-концевая область аминокислотной последовательности, представленной в SEQ ID NO: 21 или 28, также может быть укорочена примерно на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25 или более аминокислот, сохраняя при этом функцию, аналогичную функции вариабельной области легкой цепи второго связывающего фрагмента.
В некоторых воплощениях первого аспекта к С-концевой или N-концевой области аминокислотной последовательности, представленной в SEQ ID NO:21 или 28, также могут быть добавлены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25 или более аминокислот, и при этом полученные аминокислотные последовательности сохраняют функцию, аналогичную функции вариабельной области легкой цепи второго связывающего фрагмента.
В некоторых воплощениях первого аспекта в области, отличной от С-конца или N-конца аминокислотной последовательности, представленной в SEQ ID NO:21 или 28, также могут быть добавлены или удалены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25 или более аминокислот при условии, что измененные аминокислотные последовательности по существу сохраняют функцию вариабельной области легкой цепи второго связывающего фрагмента.
Во втором аспекте настоящей заявки предложено моноклональное антитело, которое связывается с TSLP человека, содержащее HCDR1, представленную в SEQ ID NO:29, HCDR2, представленную в SEQ ID NO:30, HCDR3, представленную в SEQ ID NO:31, LCDR1, представленную в SEQ ID NO:32, LCDR2, представленную в SEQ ID NO:33, и LCDR3, представленную в SEQ ID NO:34; где аминокислотные последовательности HCDR и LCDR определены согласно нумерации Kabat.
В некоторых воплощениях второго аспекта аминокислотная последовательность вариабельной области тяжелой цепи моноклонального антитела представлена в SEQ ID NO:24, и аминокислотная последовательность вариабельной области легкой цепипредставлена в SEQ ID NO: 21; или аминокислотная последовательность вариабельной области тяжелой цепи моноклонального антитела представлена в SEQ ID NO:24, и аминокислотная последовательность вариабельной области легкой цепи представлена в SEQ ID NO:28.
В некоторых воплощениях второго аспекта аминокислотная последовательность вариабельной области тяжелой цепи моноклонального антитела отличается от аминокислотной последовательности, представленной в SEQ ID NO:24, примерно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотными заменами, делециями и/или вставками.
В некоторых воплощениях второго аспекта аминокислотная последовательность вариабельной области легкой цепи моноклонального антитела отличается от аминокислотной последовательности, представленной в SEQ ID NO:21 или 28, примерно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотными заменами, делециями и/или вставками.
В некоторых воплощениях второго аминокислотная последовательность вариабельной области тяжелой цепи моноклонального антитела имеет по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более гомологии с SEQ ID NO:24.
В некоторых воплощениях второго аминокислотная последовательность вариабельной области легкой цепи моноклонального антитела имеет по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более гомологии с SEQ ID NO:21 или 28.
В некоторых воплощениях второго аспекта С-концевая или N-концевая область аминокислотной последовательности, представленной в SEQ ID NO:24, также может быть укорочена примерно на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25 или более аминокислот, сохраняя при этом функцию, аналогичную функции вариабельной области тяжелой цепи моноклонального антитела.
В некоторых воплощениях второго аспекта к С-концевой или N-концевой области аминокислотной последовательности, представленной в SEQ ID NO:24, также могут быть добавлены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25 или более аминокислот, и при этом полученные аминокислотные последовательности сохраняют функцию, аналогичную функции вариабельной области тяжелой цепи моноклонального антитела.
В некоторых воплощениях второго аспекта в области, отличной от С-конца или N-конца аминокислотной последовательности, представленной в SEQ ID NO:24, также могут быть добавлены или удалены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25 или более аминокислот при условии, что измененные аминокислотные последовательностипо существу сохраняют функцию, аналогичную функции вариабельной области тяжелой цепи моноклонального антитела.
В некоторых воплощениях второго аспекта С-концевая или N-концевая область аминокислотной последовательности, представленной в SEQ ID NO:21 или 28, также может быть укорочена примерно на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25 или более аминокислот, сохраняя при этом функцию, аналогичную функции вариабельной области легкой цепи моноклонального антитела.
В некоторых воплощениях второго аспекта к С-концевой или N-концевой области аминокислотной последовательности, представленной в SEQ ID NO:21 или 28, также могут быть добавлены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25 или более аминокислот, и при этом полученные аминокислотные последовательности сохраняют функцию, аналогичную функции вариабельной области легкой цепи моноклонального антитела.
В некоторых воплощениях второго аспекта в области, отличной от С-конца или N-конца аминокислотной последовательности, представленной в SEQ ID NO:21 или 28, также могут быть добавлены или удалены 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25 или более аминокислот при условии, что измененные аминокислотные последовательности по существу сохраняют функцию, аналогичную функции вариабельной области легкой цепи моноклонального антитела.
В третьем аспекте настоящей заявки предложена фармацевтическая композиция, содержащая биспецифическое антитело согласно первому аспекту или моноклональное антитело согласно второму аспекту и фармацевтически приемлемый эксципиент, разбавитель или носитель.
В некоторых воплощениях третьего аспекта фармацевтическую композицию применяют для предупреждения или лечения опосредованного TSLP заболевания.
В некоторых воплощениях третьего аспекта опосредованное TSLP заболевание выбрано из группы, состоящей из астмы, склеродермии, системной красной волчанки, ревматоидного артрита, синдрома Черджа-Стросса, гранулематоза Вегенера, аллергической пневмонии, атопического дерматита, ринита, болезни Крона, псориатического артрита, хронического нефрита, синдрома Шегрена и рассеянного склероза.
В некоторых воплощениях третьего аспекта фармацевтическая композиция может дополнительно содержать одно или более из скользящего агента, такого как тальк, стеарат магния и минеральное масло; увлажняющего агента; эмульгирующего агента; суспендирующего агента; консерванта, такого как бензойная кислота, сорбиновая кислота и пропионат кальция; подсластителя и/или вкусоароматического агента.
В некоторых воплощениях третьего аспекта фармацевтическая композиция, предложенная в настоящем документе, может быть приготовлена в форме таблетки, пилюли, порошка, пастилки, эликсира, суспензии, эмульсии, раствора, сиропа, суппозитория или капсулы.
В некоторых воплощениях третьего аспекта фармацевтическая композиция согласно настоящей заявке может быть доставлена с применением любого физиологически приемлемого пути введения, включая, без ограничения ими, пероральное введение, парентеральное введение, назальное введение, ректальное введение, внутрибрюшинное введение, внутрисосудистую инъекцию, подкожное введение, трансдермальное введение или ингаляционное введение.
В некоторых воплощениях третьего аспекта фармацевтическая композиция для терапевтического применения может быть приготовлена для хранения в форме лиофилизированной композиции или водного раствора путем смешивания агента желаемой чистоты с фармацевтически приемлемым носителем или эксципиентом, если это необходимо.
В четвертом аспекте настоящей заявки предложено применение биспецифического антитела согласно первому аспекту, моноклонального антитела согласно второму аспекту или фармацевтической композиции согласно третьему аспекту в изготовлении лекарственного средства для предупреждения или лечения опосредованного TSLP заболевания.
В некоторых воплощениях четвертого аспекта опосредованное TSLP заболевание выбрано из группы, состоящей из астмы, склеродермии, системной красной волчанки, ревматоидного артрита, синдрома Черджа-Стросса, гранулематоза Вегенера, аллергической пневмонии, атопического дерматита, ринита, болезни Крона, псориатического артрита, хронического нефрита, синдрома Шегрена и рассеянного склероза.
В пятом аспекте настоящей заявки предложен способ предупреждения или лечения опосредованного TSLP заболевания, включающий введение нуждающемуся в этом субъекту биспецифического антитела согласно первому аспекту, моноклонального антитела согласно второму аспекту или фармацевтической композиции согласно третьему аспекту.
В некоторых воплощениях пятого аспекта опосредованное TSLP заболеваниевыбрано из группы, состоящей из астмы, склеродермии, системной красной волчанки, ревматоидного артрита, синдрома Черджа-Стросса, гранулематоза Вегенера, аллергической пневмонии, атопического дерматита, ринита, болезни Крона, псориатического артрита, хронического нефрита, синдрома Шегрена и рассеянного склероза.
В других аспектах настоящей заявки предложена молекула нуклеиновой кислоты, кодирующая биспецифическое антитело согласно первому аспекту или моноклональное антитело согласно второму аспекту. В некоторых воплощениях молекула нуклеиновой кислоты функционально связана с регуляторной последовательностью, которая может распознаваться клеткой-хозяином, трансформированной вектором.
В настоящей заявке также предложен вектор, содержащий выделенную молекулу нуклеиновой кислоты, кодирующую биспецифическое антитело согласно первому аспекту или моноклональное антитело согласно второму аспекту, а также клетка-хозяин, содержащая указанную молекулу нуклеиновой кислоты или указанный вектор. В других аспектах настоящей заявки предложен способ получения биспецифического антитела согласно первому аспекту или моноклонального антитела согласно второму аспекту. В некоторых воплощениях способ получения биспецифического антитела согласно первому аспекту или моноклонального антитела согласно второму аспекту включает культивирование клетки-хозяина для облегчения экспрессии молекулы нуклеиновой кислоты. В некоторых воплощениях способ получения биспецифического антитела согласно первому аспекту или моноклонального антитела согласно второму аспекту дополнительно включает выделение биспецифического антитела или моноклонального антитела из среды культивирования клеток-хозяев.
Следует понимать, что приведенное выше подробное описание предназначено только для обеспечения возможности лучшего понимания настоящей заявки специалистами в данной области техники и не предназначено для какого-либо ограничения. Специалистами в данной области техники могут быть осуществлены различные модификации и вариации описанных воплощений.
Следующие примеры представлены только для иллюстративных целей и не предназначены для ограничения объема настоящей заявки.
Примеры
Пример 1: Получение рекомбинантных белков
Для получения антител к TSLP необходим ряд разных рекомбинантных белков, включая длинный вариант внеклеточного домена TSLP человека (hTSLP1-ECD, SEQ IDNO:1), короткий вариант внеклеточного домена TSLP человека (hTSLP2-ECD, SEQ ID NO:2), внеклеточный домен TSLP мыши (mTSLP-ECD, SEQ ID NO:3) и внеклеточный домен TSLP яванского макака (mfTSLP1-ECD, SEQ ID NO:4). Эти белки имеют большое количество посттрансляционных модификаций (например гликозилирование или дисульфидные связи и так далее), вследствие чего применение системы экспрессии клеток млекопитающих является более предпочтительным для сохранения структуры и функции указанных рекомбинантных белков. Кроме того, во избежание влияния сайтов распознавания фурином в hTSLP1, hTSLP2 и mfTSLP1 на активность белка TSLP были сконструированы мутант hTSLP1(hTSLP1-m, SEQ ID NO:5), мутант hTSLP2 (hTSLP2-m, SEQ ID NO:6) и мутант mfTSLP1 (mfTSLP1-m, SEQ ID NO:7) соответственно, с делецией сайтов распознавания фурином. При этом добавление His-метки (His, SEQ ID NO:8), или Fc-фрагмента антитела IgG1 человека (hFc, SEQ ID NO:9), или Fc-фрагмента антитела IgG2a мыши (mFc, SEQ ID NO:10) к С-концу этих рекомбинантных белков является более предпочтительным для очистки рекомбинантных белков и идентификации функций моноклональных антител. Константная область тяжелой цепи антитела может иметь подтип IgG1 человека (SEQ ID NO:11), подтип IgG2 человека (SEQ ID NO:12), подтип IgG4 человека (SEQ ID NO:13), или подтип IgGl мыши (SEQ ID NO:14), или подтип IgG2a мыши (SEQ ID NO:15), а константная область легкой цепи может иметь подтип каппа человека (SEQ ID NO:16), подтип лямбда человека (SEQ ID NO:17), подтип каппа мыши (SEQ ID NO:18) или подтип лямбда мыши (SEQ ID NO:19).
В соответствии с аминокислотными последовательностями различных интересующих рекомбинантных белков в базе данных Uniprot, конструировали и синтезировали гены (включая гены, кодирующие His-метки, или hFc, или mFc), кодирующие указанные выше различные рекомбинантные белки. Различные синтезированные гены, кодирующие указанные рекомбинантные белки, клонировали в подходящие эукариотические экспрессионные векторы (такие как pcDNA3.1, Invitrogen Inc., и так далее), используя стандартные методики молекулярной биологии, и полученные плазмиды для экспрессии рекомбинантных антител затем трансфицировали в клетки НЕК293 (такие как HEK293F, Invitrogen, Inc.) с использованием липосом (таких как 293fectin, Invitrogen, Inc., и так далее) или других катионных реагентов для трансфекции (таких как PEI (полиэтиленимин) и так далее). Клетки культивировали в суспензии в бессывороточной среде в течение 3-4 суток. Затем собирали культуральный супернатант путем центрифугирования.
Рекомбинантный белок, экспрессируемый путем слияния с His-меткой, подвергали одностадийной очистке рекомбинантного белка из культурального супернатанта, используя колонку для металл-хелатной аффинной хроматографии (такую как HisTrap FF, GE, Inc., и так далее). Рекомбинантный белок, экспрессируемый посредством слияния с hFc и mFc, подвергали дополнительной очистке на колонке для аффинной хроматографии с белком A/G (такой как Mabselect SURE, GE, Inc., и так далее). Затем буфер для сохранения рекомбинантного белка заменяли на PBS (фосфатно-солевой буфер) (рН 7,0) или другие подходящие буферы, используя колонку для обессоливания (такую как Hitrap desaulting, GE, Inc., и так далее). При необходимости, образец антитела можно стерилизовать посредством фильтрации и затем хранить в аликвотах при -20°С.
Пример 2: Конструирование и скрининг мышиной иммунной библиотеки к TSLP на основе фиксированной легкой цепи
Для конструирования биспецифического антитела к TSLP на основе общей легкой цепи выбирали вариабельную область легкой цепи моноклонального анти-TSLP антитела к конкретному эпитопу в сочетании с вариабельной областью тяжелой цепи мыши, которая созревала в присутствии антигена TSLP in vivo, и конструировали библиотеку одноцепочечных вариабельных фрагментов (scFv) с применением стандартных средств молекулярной биологии для скрининга моноклональных анти-TSLP антител к разным эпитопам.
Собирали спленоциты мышей BALB/c в возрасте 6-8 недель после иммунизации с применением рекомбинантного белка hTSLP1-m-His в качестве иммуногена. Лимфоциты селезенки мыши выделяли, используя раствор для выделения лимфоцитов мыши (Dakewe Biotech Co., Ltd., номер по каталогу DKW33-R0100). Из выделенных лимфоцитов экстрагировали суммарную РНК, используя набор для экстракции суммарной клеточной РНК (Tiangen Biotech (Beijing) Co., Ltd., номер по каталогу DP430). Используя экстрагированную суммарную РНК в качестве матрицы, синтезировали вариабельную область тяжелой цепи антитела с помощью набора для синтеза первой цепи кДНК (Thermo scientific, номер по каталогу К1621). Вариабельную область легкой цепи моноклонального антитела H1A10+L3E8-M1, распознающую конкретный эпитоп hTSLP1, получали путем амплификации методом ПЦР с применением стандартных средств молекулярной биологии (см. гуманизированное антитело H1A10+L3E8-M1 в заявке на патент Китая №202010080450.1, где аминокислотная последовательность вариабельной области тяжелой цепи представлена в SEQ ID NO:20, и аминокислотная последовательность вариабельной области легкой цепи представлена в SEQ ID NO:21), и вариабельную область тяжелой цепи мыши получали путем иммунизации мышейрекомбинантным антигеном hTSLPl-m-His. Затем конструировали одноцепочечный вариабельный фрагмент (scFv) с помощью технологии ПЦР с перекрывающимися праймерами (overlapping extension PCR). Гены, кодирующие полученные одноцепочечные вариабельные фрагменты мыши, клонировали в вектор pADSCFV-S (подробные протоколы экспериментов см. в примере 1 заявки на патент Китая №201510097117.0) для конструирования библиотеки scFv. Библиотека антител имеет емкость 8,3Е+07 и точность 65%.
В соответствии с источником (заявкой на патент Китая №201510097117.0) сконструированную иммунную библиотеку мыши с заданной легкой цепью исследовали с помощью стратегии твердофазного скрининга (протокол эксперимента см. в источнике Phage Display: APractical Approach, Tim Clackson (USA) and Henry B. Lowman (USA) (ed.), перевод Lan Ma et al, Chemical Industry Press, May 2008) с применением в качестве антигена рекомбинантного hTSLPl-m-his, полученного в примере 1. Проводили три цикла скрининга посредством связывания, элюирования, нейтрализации, инфицирования и амплификации. В итоге получали один одноцепочечный вариабельный фрагмент S17C7+L3E8-M1, специфично связывающийся с TSLP человека.
Пример 3: Идентификация моноклонального мышиного анти-hTSLP антитела
Молекулы нуклеиновых кислот, кодирующие вариабельную область легкой цепи и вариабельную область тяжелой цепи S17C7+L3E8-M1 соответственно клонировали в эукариотические экспрессионные векторы с применением обычных методов молекулярной биологии с целью получения и экспрессии целого антитела. В то же время получали гуманизированное моноклональное анти-TSLP антитело тезепелумаб согласно патенту US 9284372 В2 в качестве положительного контроля (аминокислотная последовательность вариабельной области тяжелой цепи представлена в SEQ ID NO:22; и аминокислотная последовательность вариабельной области легкой цепи представлена в SEQ ID NO:23).
3.1 Анализ аффинности рекомбинантного моноклонального анти-TSLP антитела S17C7+L3E8-M1
Аффинность указанного анти-TSLP антитела определяли методом поверхностного плазмонного резонанса, используя Biacore XI00. Реагенты и расходные материалы, такие как набор для иммобилизации соединений, содержащих аминогруппы (amino-coupling kit, BR-1000-50), набор для иммобилизации антител человека (human antibody capture kit, BR-1008-39), СМ5-чип (BR100012) и 10×HBS-EP (pH 7,4, BR100669), были приобретены у GE Healthcare. Поверхность карбоксилированного СМ5-чипа активировали с помощью 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорида (EDC) и N-гидроксисукцинимида (NHS) согласно инструкциям к набору. Антитело к IgG (Fc) человека (захватывающее антитело) разбавляли до 25 мкг/мл с помощью 10 мМ ацетата натрия (рН 5,0), и затем вводили со скоростью потока 10 мкл/мин до достижения значения связывания примерно 10000 единиц ответа (RU). После введения захватывающего антитела вводили 1 М этаноламин для блокирования непрореагировавших групп.Для определения кинетики анти-TSLP антитело разбавляли до 0,5-1 мкг/мл и вводили со скоростью 10 мкл/мин для обеспечения захвата примерно 100RU указанного антитела антителом к Fc человека. Затем обеспечивали серию градиентов концентрации hTSLPl-m-his (например 0,625 нМ, 1,25 нМ, 2,5 нМ, 5 нМ и 10 нМ) и осуществляли введение при 25°С, переходя от более низких концентраций к более высоким, со скоростью 30 мкл/мин, при этом время ассоциации составляло 120 с, а время диссоциации составляло 3600 с. Для регенерации поверхности чипа вводили 3М раствор MgCh со скоростью 10 мкл/мин в течение 30 с. Скорость ассоциации (Ка) и скорость диссоциации (Kd) рассчитывали путем аппроксимации сенсограмм связывания и диссоциации к модели связывания 1:1 с помощью программного обеспечения для анализа Biacore Х100 версии 2.0.1. Константу равновесия диссоциации (KD) рассчитывали как отношение Kd/Ka. Результаты аппроксимации представлены в таблице 1.
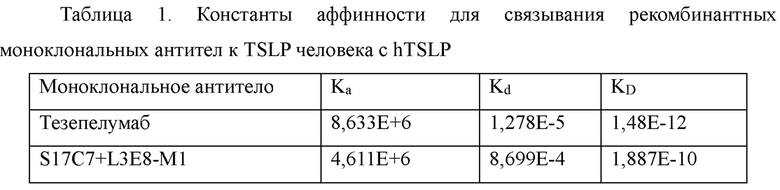
3.2 Ингибирование рекомбинантным моноклональным антителом к TSLP S17C7+L3E8-M1 связывания TSLP с TSLPR
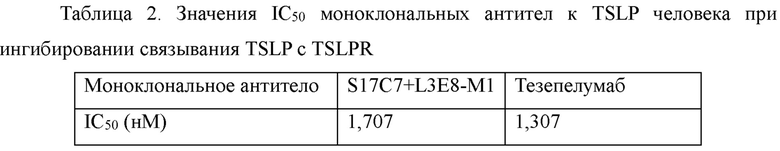
Поверхность 96-луночных планшетов покрывали рекомбинантным антигеном TSLPR-Fc (3 мкг/мл, 100 мкл/лунку) в течение ночи при 4°С и затем блокировали с помощью блокирующего раствора (PBS-0,1% Tween 20-3% молоко) при 37°С в течение 1 часа. Градиентные разведения моноклональных антител S17C7+L3E8-M1 и тезепелумаба выполняли с использованием hTSLPl -m-his в фиксированной концентрации (0,2 мкг/мл). Начальная концентрация антител составляла 100 мкг/мл, ивыполняли разведение в 3 раза с получением в общей сложности 10 градиентов концентрации. В 96-луночные планшеты для ELISA после блокирования добавляли указанные разведения антител в количестве 100 мкл/лунку, и планшеты инкубировали при 37°С в течение 1 часа. Затем планшеты для ELISA промывали PBS-0,1% Tween 20 с последующим добавлением разбавленного 1:5000 конъюгированного с HRP мышиного моноклонального антитела к His-метке (Beijing Kangwei Century Biotechnology Co., Ltd., CW0285M) в количестве 100 мкл/лунку, и планшеты инкубировали при 37°С в течение 1 часа. Планшеты для ELISA промывали PBS-0,1% Tween 20 и добавляли раствор хромогенного субстрата OPD. После инкубирования в течение 5-10 минут развитие окрашивания останавливали с помощью 1М H2SO4. Значения оптической плотности измеряли, используя микропланшетный анализатора при двух длинах волн 492 нм/630 нм. Результаты анализа методом ELISA (ФИГ. 1) показали, что S17C7+L3E8-M1 может полностью ингибировать связывание TSLP с TSLPR, и ингибирующая способность S17C7+L3E8-M1 была сопоставима с ингибирующей способностью тезепелумаба. Значения IC50 представлены в таблице 2.
3.3. Сравнение эпитопов TSLP, связываемых рекомбинантными моноклональными антителами к TSLP S17C7+L3E8-M1 и тезепелумабом.
Поверхность 96-луночных планшетов покрывали рекомбинантным белком hTSLPl-m-his (1 мкг/мл, 100 мкл/лунку) в течение ночи при 4°С, и затем блокировали с помощью блокирующего раствора (PBS-0,1% Tween 20-3% молоко) при 37°С в течение 1 часа. Градиентные разведения тезепелумаба-IgG4 и S17C7+L3E8-Ml-IgG1m3 выполняли с применением PBS-2% молока, содержащего рекомбинантное антитело тезепелумаб-mIgG2a в концентрации 0,05 мкг/мл. Начальная концентрация антител составляла 200 мкг/мл, выполняли разведение в 3 раза с получением в общей сложности 10 градиентов концентрации. В 96-луночные планшеты для ELISA после блокирования добавляли полученные разведения антител в количестве 100 мкл/лунку, и планшеты инкубировали при 37°С в течение 1 часа. Затем планшеты для ELISA промывали PBS-0,1% Tween 20 с последующим добавлением разбавленного 1:5000 конъюгированного с HRP антитела козы к IgG мыши (Beijing Zhongshan Jinqiao Biotechnology Co., Ltd., ZB2305) в количестве 100 мкл/лунку, и планшеты инкубировали при 37°С в течение 1 часа. Планшеты для ELISA промывали PBS-0,1% Tween 20 и добавляли раствор хромогенного субстрата OPD (О-фенилендиамин). После инкубирования в течение 5-10 минут развитие окрашивания останавливали с помощью 1М H2SO4. Значения оптической плотности определяли с помощью микропланшетного анализатора при двух длинах волн 492 нм/630 нм. Анализ и графическое представление данных выполняли с помощью GraphPad Prism 6. Результаты анализа методом ELISA (ФИГ. 2) показали, что S17C7+L3E8-M1-IgG1m3 может полностью ингибировать связывание тезепелумаба-mIgG2a с TSLP. Значения IC50 представлены в таблице 3. Значение IC50 S17C7+L3E8-M1-IgG1m3 для ингибирования связывания тезепелумаба-MIgG2a с TSLP было в 2,2 раза выше, чем значение 1С50 отезепелумаба-IgG4 для ингибировании связывания тезепелумаба-IgG2a с TSLP, что может быть связано с более низкой аффинностью связывания S17C7+L3E8-M1-IgG1m3 с TSLP по сравнению с аффинностью связывания тезепелумаба-IgG4 с TSLP (см. таблицу 1).

3.4 Ингибирование рекомбинантным моноклональным антителом к TSLP человека S17C7+L3E8-M1 стимулирующего пролиферацию влияния TSLP на клетки BAF3-TSLPR/IL-7Rα
BAF3-TSLPR/IL-7Rα представлял собой стабильный штамм трансгенных клеток с высокой экспрессией рецептора TSLP, и его пролиферация зависела от mIL-3. В отсутствие mIL-3 TSLP может эффективно стимулировать пролиферацию клеток BA/F3-TSLPR/IL-7Rα. Этот способ можно применять для оценки способности моноклонального антитела к TSLP человека ингибировать стимулирующее пролиферацию влияние TSLP на клетки BAF3-TSLPR/IL-7Rα. В указанном эксперименте клетки BAF3-TSLPR/IL-7Rα предварительно культивировали в течение двух суток, используя полную среду без mIL-3. В день эксперимента клетки центрифугировали и ресуспендировали до плотности 1×106 клеток/мл и добавляли в 96-луночные планшеты с плоским дном для культивирования клеток в количестве 50 мкл/лунку. Разведения рекомбинантного моноклонального антитела к TSLP человека S17C7+L3E8-M1 и антителаположительного контроля (то есть тезепелумаба) начинали с конечной концентрации 60 мкг/мл, вторая концентрация составляла 30 мкг/мл с последующим 5-кратным градиентом каждого из 8 градиентов концентрации. Развбавленное моноклональное антитело к TSLP человека предварительно смешивали с равным объемом hTSLP-m-his в конечной концентрации 0,4 нг/мл в течение 30 минут, и затем полученную смесь смешивали с клетками BAF3-TSLPR/IL-7Ra и инкубировали в общем объеме 150 мкл/лунку. Через 48 часов определяли пролиферацию клеток с помощью многофункционального микропланшетного анализатора (SpectraMax®I3X) с применением набора для люминесцентного анализа жизнеспособности клеток Cell Titer-Glo® (Promega, номер по каталогу G7570). Проводили аппроксимацию и анализ результатов регистрации хемилюминесценции. Результаты (ФИГ. 3) показали, что и моноклональное антитело к TSLP человека S17C7+L3E8-M1, и антитело положительного контроля (то есть тезепелумаб) эффективно ингибировали стимулирующее пролиферацию влияние TSLP на клетки BAF3-TSLPR/IL-7Rα.
3.5 Влияние рекомбинантного моноклонального антитела к TSLP человека S17C7+L3E8-M1 на ингибирование секреции TARC клетками РВМС, стимулированными TSLP.
Собирали кровь здоровых добровольцев (по 50 мл от каждого), при этом собранная кровь была предоставлена авторами настоящего изобретения и их коллегами в качестве добровольцев, и все они подписали информированное согласие. Критериями включения для добровольцев являлись:
1. возраст более 18 лет;
2. отсутствие инфекций HIV и HBV;
3. нормальные стандартные анализы крови;
4. отсутствие беременных или кормящих женщин.
Мононуклеарные клетки периферической крови человека (РВМС) выделяли из периферической крови здорового человека путем центрифугирования в градиенте плотности фиколла.
Связывание TSLP с TSLPR на дендритных клетках может вызывать активацию дендритных клеток, что приводит к секреции хемокинов (например TARC (хемокин, регулируемый активацией тимуса), также известного как CCL17). Ингибирующее влияние рекомбинантных антител к TSLP на TSLP может быть эффективно оценено путем обнаружения TARC. РВМС ресуспендировали в среде R1640, содержащей 10% (инактивированной) сыворотки, с плотностью 2×107 клеток/мл и добавляли в 96-луночные планшеты с плоским дном для культивирования клеток (50 мкл/лунку). Разведения рекомбинантного моноклонального антитела к TSLP человека S17C7+L3E8-М1 и антитела положительного контроля (то есть тезепелумаба) начинали с конечной концентрации 0,5 нМ с 2-кратным градиентом для всех 3 рабочих концентраций. Разведенное таким образом рекомбинантное моноклональное антитело к TSLP человека предварительно смешивали с равным объемом hTSLP-m-his в конечной концентрации 1 нг/мл в течение 30 минут, и затем полученную смесь добавляли к клеткам для смешивания с общим объемом 150 мкл/лунку. Был выполнен контроль без TSLP (клетки), контроль без антитела (клетки+TSLP) и изотипический контроль с антителом IgGlm3 (клетки+TSLP+IgGlm3). Смесь инкубировали при 37°С, 5% СО2 в течение 24 часов. Затем отбирали супернатант и проводили обнаружение TARC с использованием набора гуманизированных антител TARC matched ELISA antibody pair set (Sino Biological Inc., номер по каталогу SEK10233) на основе анализа ELISA. Хромогенный раствор представлял собой раствор высокочувствительного субстрата ТМВ (Biolegend, номер по каталогу 421501). Значение оптической плотности OD450 определяли с помощью микропланшетного анализатора (Biotek, номер по каталогу ELX800). Проводили анализ полученных данных. Результаты (ФИГ. 4) показали, что и рекомбинантное моноклональное антитело к TSLP человека S17C7+L3E8-M1, и контрольное антитело тезепелумаб могут ингибировать секрецию TARC клетками РВМС, стимулированными TSLP.
Пример 4: Конструирование с целью гуманизации и функциональная идентификация мышиного моноклонального антитела к TSLP человека
Для гуманизации тяжелой цепи мышиного моноклонального антитела к TSLP человека S17C7+L3E8-M1 применяли классическую стратегию пересадки каркасных участков {J Immunol. 169, 1119-1125, 2002). Вариабельную область тяжелой цепи S17C7+L3E8-M1 сравнивали с генетической последовательностью зародышевой линии антитела человека по базе данных FMGT. Для обеспечения каркасных областей 1-3 антитела (FR1+FR2+FR3) была выбрана подходящая генетическая последовательность зародышевой линии, а для обеспечения каркасной области 4 (FR4) была выбрана подходящая генетическая последовательность J-области. Эта матрица могла быть выбрана с учетом различных факторов, таких как относительная общая длина антитела, размер CDR, аминокислотные остатки, расположенные в месте соединения каркасной области (FR) и гипервариабельной области (CDR) антитела, и гомологияполноразмерных последовательностей в целом. Выбранная матрица может представлять собой смесь нескольких последовательностей или может представлять собой консенсусную матрицу в целях сохранения соответствующей конформации исходных определяющих комплементарность областей (CDR) в максимально возможной степени. В результате был получен гуманизированный мутант тяжелой цепи Н3В10-М1 (SEQ ID NO:24). Ген вариабельной области антитела конструировали и синтезировали на основе аминокислотной последовательности гуманизированного антитела, клонировали в эукариотический экспрессионный вектор и экспрессировали совместно с легкой цепью L3E8-M1 в виде целого антитела H3B10-M1+L3E8-M1.
Анализ аффинности проводили с гуманизированным моноклональным антителом H3B10-M1+L3E8-M1 и S17C7+L3E8-M1, используя Biacore Х100 и в соответствии с примером 3.1, и полученные результаты представлены в таблице 4.
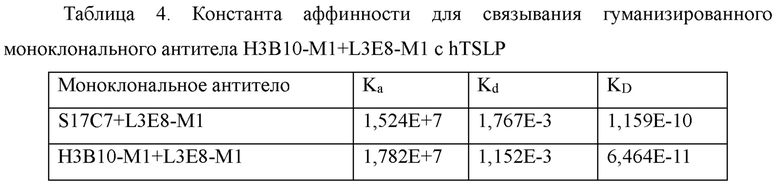
Способность гуманизированного моноклонального антитела H3B10-M1+L3E8-М1 ингибировать связывание TSLP с TSLPR анализировали посредством анализа ELISA в соответствии с примером 3.2. Результаты анализа ELISA (ФИГ. 5) показали, что гуманизированное моноклональное антитело H3B10-M1+L3E8-M1 может полностью ингибировать связывание TSLP с TSLPR. Значения IC50 представлены в таблице 5.

Пример 5: Оптимизация и идентификация общей легкой цепи L3E8-M1
5.1 Конструирование общей легкой цепи L3E8-M1
В процессе гуманизации мышиных антител изменения аминокислот каркасной области могут привести к конформационным изменениям антитела, что влияет на нормальный фолдинг и секрецию антител, нарушает стабильность антител и тем самым влияет на экспрессию антител. Общую легкую цепь L3E8-M1 объединяли с тяжелой цепью Н1А10 и Н3В10-М1 для экспрессии моноклональных антител соответственно. Уровни экспрессии были существенно снижены по сравнению с уровнем экспрессии исходной последовательности L3E8. По сравнению с уровнями экспрессии других мутантов L3E8 (см. L3E8-M1 с аминокислотной последовательностью, представленной в SEQ ID NO:21; L3E8-M2 с аминокислотной последовательностью, представленной в SEQ ID NO:25; L3E8-M3 с аминокислотной последовательностью, представленной в SEQ ID NO:26; и L3E8-M4 с аминокислотной последовательностью, представленной в SEQ ID NO:27, раскрытые в заявке на патент Китая №202010080450.1), новый мутант L3E8-M7 (SEQ ID NO:28) был сконструирован путем введения мутаций L78V и S80A в вариабельную область L3E8-M1. Ген вариабельной области антитела конструировали и синтезировали на основе аминокислотной последовательности L3E8-M7, клонировали в эукариотический экспрессионный вектор и экспрессировали совместно с тяжелыми цепями Н1А10 и Н3В10-М1 соответственно в виде целых антител. Уровни экспрессии целых антител с разными легкими цепями L3E8, L3E8-M1 и L3E8-M7 сравнивали в соответствии с примером 1. Уровень экспрессии L3E8-M7 был восстановлен до уровня исходной L3E8 и значительно превосходил уровень экспрессии L3E8-M1.
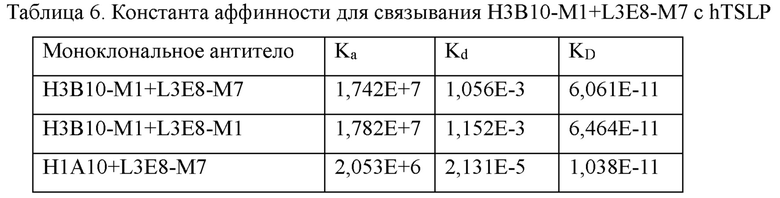
5.2 Анализ аффинности гуманизированного антитела H3B10-M1+L3E8-M7 Анализ аффинности H3B10-M1+L3E8-M7 проводили, используя Biacore Х100 и в соответствии с примером 3.1, и полученные результаты представлены в таблице 6.
5.3 Ингибирование гуманизированным антителом H3B10-M1+L3E8-M7 стимулирующего пролиферацию влияния TSLP на клетки BAF3-TSLPR/IL-7Rα
Клетки BAF3-TSLPR/IL-7Rα обрабатывали в соответствии с примером 3.4. В день эксперимента клетки центрифугировали и ресуспендировали с плотностью 1×106 клеток/мл и добавляли в 96-луночные планшеты с плоским дном для культивирования клеток в количестве 50 мкл/лунку. Все разведения рекомбинантных моноклональных антител к TSLP человека (H1A10+L3E8-M1, H1A10+L3E8-M7, H3B10-M1+L3E8-M1 и H3B10-M1+L3E8-M7) и антитела положительного контроля (то есть тезепелумаба) начинали с конечной концентрации 60 мкг/мл, вторая концентрация составляла 30 мкг/мл с последующим 6-кратным градиентом каждого из 8 градиентов концентрации. Дозы вэкспериментальных группах для комбинаций (H1A10+L3E8-M1 и H3B10-M1+L3E8-M1, H1A10+L3E8-M7 и H3B10-M1+L3E8-M7) составляли половинные дозы каждого из моноклональных антител. Разведенное таким образом моноклональное антитело к TSLP человека предварительно смешивали с равным объемом hTSLP-m-his в конечной концентрации 0,4 нг/мл в течение 30 минут, и затем полученную смесь смешивали с клетками BAF3-TSLPR/IL-7Rα и инкубировали в общем объеме 150 мкл/лунку. Через 48 часов определяли пролиферацию клеток с помощью многофункционального микропланшетного анализатора (SpectraMax®I3X) с применением набора для люминесцентного анализа жизнеспособности клеток Cell Titer-Glo® (Promega, номер по каталогу G7570). Проводили аппроксимацию и анализ результатов регистрации хемилюминесценции. Результаты (ФИГ. 6) показали, что оба моноклональных антитела H1A10+L3E8-M7 и H3B10-M1+L3E8-M7 с легкой цепью L3E8-M7 эффективно ингибировали стимулирующее пролиферацию влияние TSLP на клетки BAF3-TSLPR/IL-7Rα, и что их активности были сопоставимы с активностями моноклональных антител H1A10+L3E8-M1 и H3B10-M1+L3E8-M1 с легкой цепью L3E8-M1. По сравнению с моноклональным антителом и антителом положительного контроля (то есть тезепелумабом), экспериментальные группы для комбинаций демонстрировали более значительное ингибирование стимулирующего пролиферацию влияния TSLP на клетки BAF3-TSLPR/IL-7Rα.
5.4 Влияние гуманизированного антитела H3B10-M1+L3E8-M7 на ингибирование секреции TARC клетками РВМС, стимулированными TSLP.
Клетки РВМС получали в соответствии с примером 3.5. В день эксперимента РВМС ресуспендировали в среде R1640, содержащей 10% (инактивированной) сыворотки, с плотностью 2×107 клеток/мл и добавляли в 96-луночные планшеты с плоским дном для культивирования клеток (50 мкл/лунку). Все разведения моноклональных антител к TSLP человека (H1A10+L3E8-M1, H1A10+L3E8-M7, Н3В10-M1+L3E8-M1 и H3B10-M1+L3E8-M7) и антитела положительного контроля (то есть тезепелумаба) начинали с конечной концентрации 0,25 нМ с 2-кратным градиентом для всех 3 рабочих концентраций. Дозы в экспериментальных группах для комбинаций (H1A10+L3E8-M1 и H3B10-M1+L3E8-M1 и H1A10+L3E8-M7 и H3B10-M1+L3E8-M7) составляли половинные дозы каждого из моноклональных антител. Был выполнен контроль без TSLP (клетки), контроль без антитела (клетки+1 нг/мл TSLP) и изотипический контроль с антителом IgG1m3 (клетки+1 нг/мл TSLP+IgG1m3). Разведенное рекомбинантное моноклональное антитело к TSLP человекапредварительно смешивали с равным объемом hTSLP-m-his в конечной концентрации 1 нг/мл в течение 30 минут, и затем смесь добавляли к клеткам для смешивания в общим объемом 150 мкл/лунку. Полученную смесь инкубировали при 37°С, 5% СО2 в течение 24 часов. Затем отбирали супернатант и проводили обнаружение TARC с применением набора гуманизированных антител для TARC ELISA (Sino Biological Inc., номер по каталогу SEK10233) на основе анализа ELISA. Хромогенный раствор представлял собой раствор высокочувствительного субстрата ТМВ (3, 3', 5, 5'-тетраметилбензидин) (Biolegend, номер по каталогу 421501). Значение оптической плотности OD450 определяли с помощью микропланшетного анализатора (Biotek, номер по каталогу ELX800). Проводили анализ полученных данных. Результаты (ФИГ. 7) показали, что оба моноклональных антитела H1A10+L3E8-M7 и H3B10-M1+L3E8-M7 с легкой цепью L3E8-M7 эффективно ингибировали секрецию TARC клетками РВМС, стимулированными TSLP, и что их активности были сопоставимы с активностями моноклональных антител H1A10+L3E8-M1 и H3B10-M1+L3E8-M1 с легкой цепью L3E8-М1. По сравнению с моноклональными антителами и антителом положительного контроля (то есть тезепелумабом) экспериментальные группы для комбинаций демонстрировали более значительное ингибирование секреции TARC клетками РВМС, стимулированными TSLP.
Пример 6: Получение и идентификация биспецифических антител к TSLP человека
6.1 Получение биспецифических антител к TSLP человека
Нуклеотидные последовательности, кодирующие вариабельные области тяжелых цепей Н1А10 и Н3В10-М1 моноклональных антител к двум разным эпитопам TSLP человека, клонировали соответственно в подходящие эукариотические экспрессионные векторы для конструирования гетеродимеров на основе общей легкой цепи L3E8-M7. То есть нуклеотидную последовательность, кодирующую вариабельную область тяжелой цепи Н1А10, клонировали в эукариотический экспрессионный вектор, слитый с нуклеотидной последовательностью, кодирующей константную область IgG1 IgG1m3-K с мутацией Knob (выступ); нуклеотидную последовательность, кодирующую вариабельную область тяжелой цепи Н3В10-М1, клонировали в эукариотический экспрессионный вектор, содержащий нуклеотидную последовательность, кодирующую константную область IgG1 IgG1m3-H с мутацией Hole (впадина); и нуклеотидную последовательность, кодирующую вариабельную область общей легкой цепи L3E8-M7, клонировали в эукариотический экспрессионный вектор, слитый с нуклеотиднойпоследовательностью, кодирующей константную область легкой цепи человека СК.
Указанные три сконструированных эукариотических экспрессионных вектора, экспрессирующих H1A10-IgG1m3-K, Н3В10-М 1-IgG1m3-H и L3E8-M7-CK, совместно трансфицировали в клетки HEK293F, используя липосомы, и указанные клетки культивировали в суспензии в бессывороточной среде в течение 3-5 суток. Собирали культуральный супернатант путем центрифугирования. Биспецифические антитела, присутствующие в культуральном супернатанте очищали, используя колонку для аффинной хроматографии с белком A/G (например Mabselect SURE, GE Inc., и так далее). Затем буфер для сохранения рекомбинантного белка заменяли на буфер BS (рН 7,0) или другие подходящие буферы, используя колонку для обессоливания (например Hitrap desaulting, GE Inc., и так далее). Обессоленный раствор белка очищали методом эксклюзионной хроматографии (SEC), используя Superdex 200 (GE), с получением интересующего белка. При необходимости образцы антител можно стерилизовать посредством фильтрации и затем хранить в аликвотах при - 20°С для дальнейшего применения.
6.2 Анализ аффинности биспецифических антител к TSLP человека Аффинность молекул биспецифических антител (BsAb) к TSLP человека и молекул моноклональных антител, связывающихся с TSLP человека (hTSLP) и TSLP яванского макака (mfTSLP), анализировали, используя Biacore X 100, в соответствии с примером 3.1. Результаты представлены в таблицах 7 и 8.
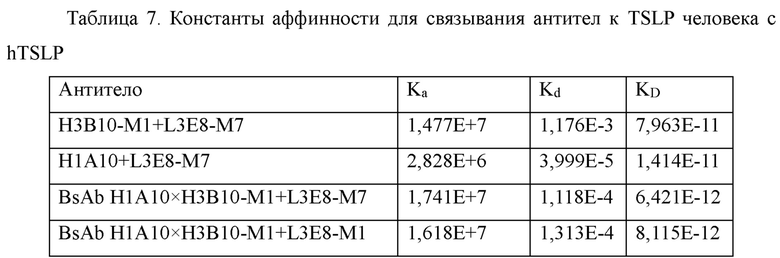

6.3 Ингибирование связывания TSLP с TSLPR биспецифическими антителами к TSLP человека
Способность биспецифических антител к TSLP ингибировать связывание TSLP с TSLPR анализировали методом ELISA в соответствии с примером 3.2. Результаты анализа ELISA (ФИГ. 8) показали, что способности биспецифических антител к TSLP человека, H1A10×H3B10-M1+L3E8-M1 BsAb и H1A10×H3B10-M1+L3E8-M7 BsAb, ингибировать связывание TSLP с TSLPR были сопоставимы с ингибирующей способностью тезепелумаба. Значения IC50 представлены в таблице 9.
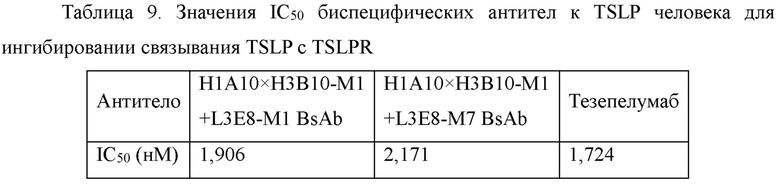
6.4 Ингибирование биспецифическими антителами к TSLP человека стимулирующего пролиферацию влияния TSLP на клетки BAF3-TSLPR/IL-7Rα
Пролиферацию клеток определяли с применением набора для люминесцентного анализа жизнеспособности клеток Cell Titer-Glo® (Promega, номер по каталогу G7570) в соответствии с примером 5.3, и значения регистрировали с помощью многофункционального микропланшетного анализатора (SpectraMax®I3X). Результаты (ФИГ. 9) показали, что по сравнению с экспериментальными группами для комбинаций (H1A10+L3E8-M1 и H3B10-M1+L3E8-M1, и H1A10+L3E8-M7 и H3B10-M1+L3E8-M7) и антителом положительного контроля (то есть тезепелумабом) биспецифические антитела к TSLP человека (BsAb H1A10×H3B10-M1+L3E8-M1 и BsAb H1A10×H3B10-M1+L3E8-М7) демонстрировали более значительное ингибирование стимулирующего пролиферацию влияния TSLP на клетки BAF3-TSLPR/IL-7Rα.
6.5 Влияние биспецифического антитела к TSLP человека на ингибирование секреции TARC клетками РВМС, стимулированными TSLP.
Клетки РВМС получали в соответствии с примером 3.5. В день эксперимента РВМС ресуспендировали в среде R1640, содержащей 10% (инактивированной) сыворотки, с плотностью 2×107 клеток/мл и добавляли в 96-луночные планшеты с плоским дном для культивирования клеток (50 мкл/лунку). Все разведения моноклональных антител к TSLP человека H1A10+L3E8-M7 и H3B10-M1+L3E8-M7, биспецифического антитела к TSLP человека BsAb H1A10×H3B10-Ml+L3E8-M7 иантитела положительного контроля (то есть тезепелумаба) начинали с конечной концентрации 0,25 мкг/мл с 4-кратным разведением для первых 3 точек, 3-кратным разведением для средних 4-6-й точек и 5-кратным разведением для 7-9-й точек. Доза в экспериментальной группе для комбинации (H1A10+L3E8-M7 и H3B10-M1+L3E8-M7) составляла половинную дозу каждого из моноклональных антител. В качестве антитела изотипического контроля применяли IgG1m3. Разведенное антитело к TSLP человека предварительно смешивали с равным объемом hTSLP-m-his в конечной концентрации 1 нг/мл в течение 30 минут, и затем смесь добавляли к клеткам для смешивания с общим объемом 150 мкл/лунку. Смесь инкубировали при 37°С, 5% CO2 в течение 24 часов. Затем отбирали супернатант и проводили обнаружение TARC, используя набор гуманизированных антител TARC matched ELISA antibody pair set (Sino Biological Inc., номер по каталогу SEK10233) на основе анализа ELISA. Хромогенный раствор представлял собой раствор высокочувствительного субстрата ТМВ (Biolegend, номер по каталогу 421501). Значение оптической плотности OD450 определяли с помощью микропланшетного анализатора (Biotek, номер по каталогу ELX800). Проводили аппроксимацию и анализ полученных значений. Результаты показали (ФИГ. 10), что по сравнению с экспериментальными группами моноклональных антител и антитела положительного контроля (то есть тезепелумабом) биспецифическое антитело и экспериментальная группа для комбинации демонстрировали более значительное ингибирование секреции TARC клетками РВМС, стимулированными TSLP.
Пример 7: Двойной эпитопный анализ биспецифического антитела к TSLP человека
7.1 Идентификация двух эпитопов биспецифического антитела к TSLP человека Эпитопы связывания антитела к TSLP анализировали методом поверхностного плазмонного резонанса, используя Biacore Т200.
Реагенты и расходные материалы
Набор для иммобилизации соединений, содержащих аминогруппы (amino-coupling kit, BR-1000-50), набор для захвата His (His kit, 28995056), СМ5-чип S-серии (BR100530) и 10×HBS-EP (рН 7,4, BR100669) и так далее были доступны от GE Healthcare.
Иммобилизация на чипе
Поверхность карбоксилированного СМ5-чипа активировали с помощью гидрохлорида 1-этил-3-(3-диметиламинопропил)-карбодиимида (EDC) и N-гидроксисукцинимида (NHS) согласно инструкциям к набору для иммобилизациисоединений, содержащих аминогруппы. Антитело к His (захватывающее антитело) разбавляли до 25 мкг/мл 10 мМ ацетатом натрия (рН 5,0), и затем вводили со скоростью потока 10 мкл/мин до достижения значения связывания примерно 12000 единиц ответа (RU). После введения захватывающего антитела вводили 1 М этаноламин для блокирования непрореагировавших групп.
Эпитопный анализ
Рекомбинантный белок hTSLP1-m-His разбавляли 1×HBS-EP до 2 мкг/мл и вводили со скоростью 10 мкл/мин в течение 12 секунд с обеспечением захвата примерно 25RU hTSLP1-m-His антителом к His. Моноклональные антитела к TSLP человека H3B10-M1+L3E8-M7, H1A10+L3E8-M7 и тезепелумаб, а также биспецифическое антитело к TSLP человека H1A10×H3B10-Ml+L3E8-M7 (BsAb Н1А10×Н3В10-M1+L3E8-M7) разбавляли 1×HBS-EP до 45 мкг/мл соответственно. Разные антитела последовательно вводили с использованием режима двойного введения Biacore Т200. То есть первое антитело пропускали через поверхность чипа с иммобилизованным антигеном hTSLP-m-His со скоростью потока 30 мкл/мин, после чего вводили второе антитело. Каждое из антител вводили в течение 120 с. По окончании введения осуществляли регенерацию поверхности чипа путем введения 1,7 мМ глицин-HCl со скоростью 10 мкл/мин в течение 30 с. Контрольная точка уровня захвата для hTSLP1-m-His была приведена к нулю с использованием программного обеспечения для анализа Biacore Т200 версии 3.0, а затем были построены графики зависимости значений RU от времени с помощью программного обеспечения GraphPad (соединительные линии).
Были представлены следующие результаты эпитопного анализа: 1) Не было обнаружено сигнала связывания тезепелумаба при введении сначала H3B10-M1+L3E8-М7, а затем тезепелумаба (ФИГ. ПА, таблица 10); аналогично, не было обнаружено сигнала связывания H3B10-M1+L3E8-M7 при введении сначала тезепелумаба, а затем H3B10-M1+L3E8-M7 (ФИГ. 11D, таблица 10), что указывает на то, что эпитоп TSLP, связываемый H3B10-M1+L3E8-M7, перекрывался с эпитопом TSLP, связываемым тезепелумабом. 2) Сигналы связывания значительно перекрывались при введении сначала H3B10-M1+L3E8-M7, а затем HI A10+L3E8-M7 (ФИГ. ПА, таблица 10); сигналы связывания значительно перекрывались при введении сначала HI A10+L3E8-M7, а затем H3B10-M1+L3E8-M7 (ФИГ. 11 В, таблица 10), что указывает на то, что H3B10-M1+L3E8-М7 и H1A10+L3E8-M7 распознавали разные эпитопы TSLP. 3) После связывания биспецифического антитела H1A10×H3B10-M1+L3E8-M7 (BsAb Н1А10×Н3В10-M1+L3E8-M7) с TSLP, ни H3B10-M1+L3E8-M7, ни H1A10+L3E8-M7 не могутпродолжать связываться с TSLP (ФИГ. ПС, таблица 10), что указывает на то, что биспецифическое антитело Н1А10×Н3В10-М1 распознавало дваэпитопа TSLP.
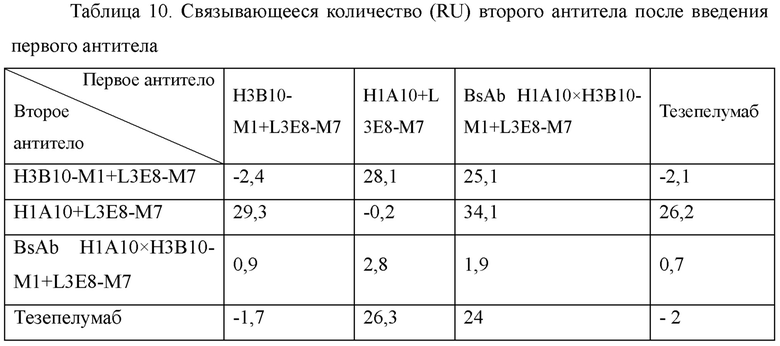
7.2 Анализ связывания эпитопа антителом к TSLP человека
Анализировали связывание эпитопа TSLP моноклональным антителом к TSLP человека H1A10+L3E8-M1. Для исследования связывания эпитопа гуманизированным моноклональным антителом HI A10+L3E8-M1 к TSLP человека из клеток СНО получали рекомбинантный Fab H1A10+L3E8-M1 и рекомбинантный TSLP человека с образованием комплекса Fab H1A10+L3E8-M1-TSLP. Получали кристалл комплекса в условиях 0,2 М формиат натрия и 20% PEG3350. Проводили анализ кристалла комплекса методом рентгеновской дифракции и собирали данные с разрешением 2,23 А. Кристаллическую структуру комплекса антиген TSLP-антитело анализировали методом молекулярного замещения. Плотности легкой и тяжелой цепей и электронная плотность антигена в модели структуры комплекса H1A10+L3E8-M1 Fab -TSLP были четкими, а значения R-work и R-free составляли 0,198 и 0,260 соответственно.
Площадь взаимодействия TSLP с Fab H1A10+L3E8-M1 составляла примерно 895,1 Å2, при этом площадь взаимодействия TSLP с тяжелой цепью составляла примерно 612,5 Å2, а площадь взаимодействия TSLP с легкой цепью составляла примерно 282,6 Å2. Во взаимодействиях в основном участвуют две спирали аминокислот в положениях 41-53 и аминокислот в положениях 95-114 TSLP, тогда как HCDR1, HCDR2 и HCDR3 вариабельной области тяжелой цепи антитела, а также LCDR1 и LCDR3 вариабельной области легкой цепи антитела участвовали в распознавании TSLP (ФИГ. 12). Ключевыми аминокислотными сайтами тяжелой цепи, участвовавшими в связывании TSLP, были N31, Q50, D57, Y101, G104, D55 и D57. Ключевыми аминокислотными сайтами легкойцепи, участвовавшими в связывании TSLP, были N33, Y92 и Y95. Тип взаимодействия Fab H1A10+L3E8-M1 с TSLP включал водородные связи, солевые связи, ван-дер-ваальсовы силы и гидрофобные взаимодействия (см. таблицу 11).
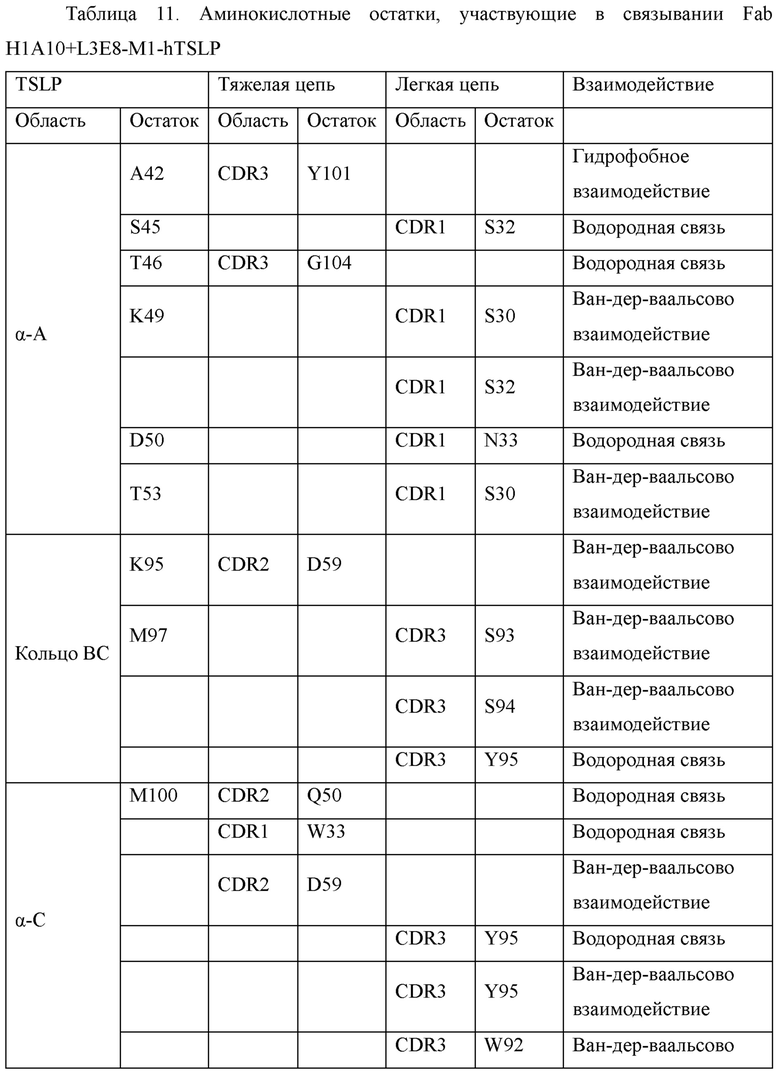
Во взаимодействии IL-7R с TSLP в основном участвуют две спирали аминокислот в положениях 41-49 и аминокислот в положениях 97-109 TSLP[28]. Эпитопы TSLP, связываемые H1A10+L3E8-M1, в основном включают аминокислоты в положениях 41-53 и аминокислоты в положениях 95-114 TSLP. Эпитоп TSLP, связываемый H1A10+L3E8-M1, перекрывался с эпитопом TSLP, связываемым IL-7R. H1A10-L3E8-M1 ингибировало связывание TSLP с IL-7R. L3E8-M1 подвергалось двухточечной мутации с получением L3E8-M7 с сайтами мутаций L79V и S81A. Эти два сайта являлись частью структурной укладки и были пространственно удалены от CDR. Аминокислоты в этих положениях мутаций не участвовали в связывании с TSLP и не влияли на связывание ключевых аминокислот с TSLP. Теоретически можно сделать вывод, что L3E8-M7 взаимодействует с TSLP так же, как L3E8-M1 взаимодействует с TSLP, то есть H1A10+L3E8-M7 и H1A10+L3E8-M1 взаимодействуют с TSLP одинаково.
Во взаимодействии тезепелумаба с TSLP в основном участвуют аминокислоты в положениях 65-78 и аминокислоты в положениях 150-153 TSLP. Во взаимодействии TSLPR с TSLP в основном участвуют аминокислоты в положениях 60-69, аминокислоты в положениях 142-152 и аминокислоты в положениях 153-158 TSLP[28] То есть эпитоп TSLP, связываемый тезепелумабом, перекрывался с эпитопом TSLP, связываемым TSLPR. Данные эпитопного анализа различных моноклональных и биспецифических антител, представленные в разделе 7.1, показали, что эпитоп TSLP, связываемый Н3В10-M1+L3E8-M7, перекрывался с эпитопом TSLP, связываемым тезепелумабом. Можно сделать вывод, что эпитоп TSLP, связываемый H3B10-M1+L3E8-M7, перекрывался с эпитопом TSLP, связываемым TSLPR.
Пример 8: Блокирование образования комплекса TSLP: TSLPR:IL-7Rα человека антителами к TSLP человека
Сначала TSLP связывается с TSLPR на поверхности клетки с образованием двойного комплекса, а затем рекрутирует IL-7Ra с образованием тройного комплекса TSLP: TSLPR:IL-7Rα, после чего происходит трансдукция нисходящих сигнальных путей. TSLP может связываться с TSLPR с высокой аффинностью (KD=32 нМ). Взаимодействие TSLP с IL-7Rα было слабым. Однако IL-7Rα может связываться с комплексом TSLP: TSLPR с высокой аффинностью (KD=29 нМ)[28] Функциональные антитела к TSLP действуют в первую посредством блокирования образования тройного комплекса TSLP: TSLPR: IL-7Rα двумя путями: 1) путем блокирования связывания TSLPR с TSLP и 2) путем блокирования связывания IL-7Rα с двойным комплексом TSLP: TSLPR.
Реагенты и расходные материалы
Все реагенты и расходные материалы, такие как набор для иммобилизации соединений, содержащих аминогруппы (amino-coupling kit, BR-1000-50), набор для иммобилизации антител мыши (mouse antibody capture kit, BR100838), СМ5-чип S-серии (BR100530) и 10×HBS-EP с рН 7,4 (BR100669), были доступны от GE Healthcare.
Иммобилизация на чипе
Поверхность карбоксилированного СМ5-чипа активировали с помощью гидрохлорида 1-этил-3-(3-диметиламинопропил)-карбодиимида (EDC) и N-гидроксисукцинимида (NHS) согласно инструкциям к набору для иммобилизации соединений, содержащих аминогруппы. Антитело к Fc мыши (захватывающее антитело) разбавляли до 25 мкг/мл 10 мМ ацетатом натрия (рН 5,0), и затем вводили со скоростьюпотока 10 мкл/мин до достижения значения связывания примерно 10000 единиц ответа (RU). После введения захватывающего антитела вводили 1 М этаноламин для блокирования непрореагировавших групп.
8.1 Блокирование связывания TSLPR человека с TSLP человека антителами к TSLP человека
Экспрессию внеклеточного домена рецептора TSLP человека (hTSLPR-ECD, SEQ ID NO:42) осуществляли в соответствии с примером 1. Рекомбинантный белок hTSLP 1-m-mFc разбавляли до 2 мкг/мл буфером 1×HBS-EP и вводили со скоростью 10 мкл/мин в течение 12 с. Примерно 80RU hTSLPl-m-mFc было захвачено антителом к mFc. Антитела к hTSLP (H3B10-M1+L3E8-M7, H1A10+L3E8-M7 и BsAb H1A10×H3B10-M1+L3E8-M7) разбавляли до 50 мкг/мл буфером 1×HBS-EP, и hTSLPR разбавляли до 100 мкг/мл. Две молекулы вводили последовательно с использованием режима двойного введения Biacore Т200. То есть антитело к TSLP (первый аналит) пропускали через поверхность чипа с иммобилизованным антигеном - рекомбинантным белком hTSLP 1-m-mFc со скоростью потока 30 мкл/мин, после чего вводили то же антитело или hTSLPR-ECD (второй аналит). Каждую из молекул вводили в течение 90 с. По окончании введения осуществляли регенерацию поверхности чипа путем введения 10 мМ глицин-HCl (рН 1,7) со скоростью 10 мкл/мин в течение 30 с. Контрольные точки по оси Y для двух исходных уровней были приведены к нулю с помощью программного обеспечения для анализа Biacore Т200 версии 3.0, а затем были построены графики зависимости значений RU от времени с помощью программного обеспечения GraphPad.
На ФИГ. 13А показан основной принцип анализа блокирования белком с помощью Biacore Т200. Были представлены следующие результаты: 1) При введении hTSLPR-ECD отдельно, связывающееся количество hTSLPR-ECD составляло 68,1 RU (ФИГ. 13 В и таблица 12). 2) Не было обнаружено сигнала связывания hTSLPR-ECD при введении сначала H3B10-M1+L3E8-M7, а затем hTSLPR-ECD (ФИГ. 13С и таблица 12), что указывает на то, что H3B10-M1+L3E8-M7 блокировало связывание hTSLPR-ECD с рекомбинантным белком hTSLP1-m-mFc. 3) При введении сначала H1A10+L3E8-M7, а затем hTSLPR-ECD сигнал связывания hTSLPR-ECD был аналогичен сигналу связывания hTSLPR-ECD отдельно (ФИГ. 13D и таблица 12), что указывает на то, что H1A10+L3E8-M7 не блокировало связывание hTSLPR-ECD с рекомбинантным белком hTSLP 1-m-mFc. 4) hTSLPR-ECD больше не может продолжать связываться с рекомбинантным белком hTSLP1-m-mFc после связывания BsAb Н1А10×Н3В10-M1+L3E8-M7 с рекомбинантным белком hTSLPl-m-mFc (ФИГ. 13Е и таблица 12), что указывает на то, что BsAb H1A10×H3B10-M1+L3E8-M7 может блокировать связывание hTSLPR-ECD с рекомбинантным белком hTSLP 1-m-mFc.
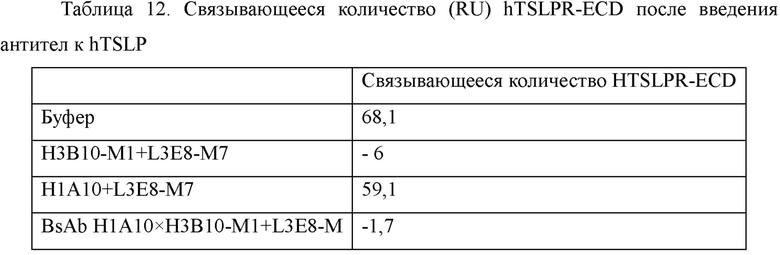
8.2 Блокирование антителами к TSLP человека связывания IL-7Rα человека с комплексом TSLP: TSLPR человека
Экспрессию внеклеточного домена IL-7Rα человека (hIL-7Ra-ECD, SEQ ID NO:43) осуществляли в соответствии с примером 1. Рекомбинантные белки hTSLP 1-m-mFc и hTSLPR-ECD разбавляли буфером 1×HBS-EP до 2 мкг/мл и 100 мкг/мл соответственно. hTSLP1-m-mFc и hTSLPR-ECD последовательно вводили в течение 12 с и 60 с обеспечением возможности образования комплекса hTSLP:hTSLPR на поверхности СМ5-чипа. Антитела к hTSLP (H3B10-M1+L3E8-M7, HIA10+L3E8-M7 и BsAb H1A10×H3B10-Ml+L3E8-M7) разбавляли до 50 мкг/мл буфером 1×HBS-EP, и hIL-7Rα-ECD разбавляли до 200 мкг/мл. Две молекулы вводили последовательно с использованием режима двойного введения Biacore Т200. То есть антитело к TSLP пропускали через поверхность чипа с иммобилизованным комплексом hTSLP:hTSLPR со скоростью потока 30 мкл/мин, после чего вводили hIL-7Rα-ECD. Каждую из молекул вводили в течение 60 с. По окончании введения осуществляли регенерацию поверхности чипа путем введения 10 мМ глицин-HCl (рН 1,7) со скоростью 10 мкл/мин в течение 30 с. Контрольные точки по оси Y для двух исходных уровней были приведены к нулю с помощью программного обеспечения для анализа Biacore Т200 версии 3.0, а затем были построены графики зависимости значений RU от времени с помощью программного обеспечения GraphPad.
Были представлены следующие результаты: 1) При введении hIL-7Rα-ECD отдельно значение ответа связывания hIL-7Rα-ECD с комплексом hTSLP:hTSLPR составляло 36,2RU (ФИГ. 14А и таблица 13). 2) При введении сначала H3B10-M1+L3E8-М7, а затем hIL-7Rα-ECD, сигнал связывания hIL-7Rα-ECD был аналогичен сигналу связывания hIL-7Rα-ECD отдельно (ФИГ. 14 В и таблица 13), что указывает на то, что H3B10-M1+L3E8-M7 не блокировал связывание hIL-7Rα-ECD с комплексом hTSLP:hTSLPR. 3) Не было обнаружено сигнала связывания hIL-7Ra-ECD при введении сначала HI A10+L3E8-M7, а затем hIL-7Rα-ECD (ФИГ. 14С и таблица 13), что указывает на то, что H1A10+L3E8-M7 может блокировать связывание hIL-7Rα-ECD с комплексом hTSLP:hTSLPR. 4) hIL-7Rα-ECD не может связываться с комплексом hTSLP:hTSLPR после связывания BsAb H1A10×H3B10-M1+L3E8-M7 с hTSLP (ФИГ. 14D и таблица 13), что указывает на то, что BsAb H1A10×H3B10-M1+L3E8-M7 может блокировать связывание hIL-7Rα-ECD с комплексом hTSLP:hTSLPR.

Иллюстративные воплощения настоящего изобретения были описаны выше. Однако специалисты в данной области техники могут модифицировать или улучшить описанные в настоящем документе иллюстративные воплощения без отступления от сущности и объема настоящей заявки, и полученные на их основе вариации или эквиваленты также входят в объем настоящей заявки.
Список литературы
1. Leonard, W.J. (2002) TSLP is now revealed to be an important regulator of DC-mediated control of TH2-based human allergic responses, identifying a potentially new species-specific function for this cytokine. Nat Immunol 3, 605-607.
2. Liu, Y.J., Soumelis, V, Watanabe, N., et al. (2007) TSLP: an epithelial cell cytokine that regulates T cell differentiation by conditioning dendritic cell maturation. Annual Review of Immunology 25, 93-219.
3. Ziegler, S.R, Artis, D. (2010) Sensing the outside world: TSLP regulates barrier immunity. Nat Immunol 11, 289-293.
4. Allakhverdi, Z., Comeau, M.R., Jessup, H.K., et al. (2009) Thymic stromal lymphopoietin as a mediator of crosstalk between bronchial smooth muscle and mast cells. Journal of Allergy and Clinical Immunology 123,958-960.
5. Allakhverdi, Z., Comeau, M.R., Jessup, H.K., et al. (2007) Thymic stromal lymphopoietin is released by human epithelial cells in response to microbes, trauma, or inflammation and potently activates mast cells. J Exp Med 204, 253-258.
6. Lee, H.C., Ziegler, S.E (2007) Inducible expression of the proallergic cytokine thymic stromal lymphopoietin in airway epithelial cells is controlled by NFkB. Proceedings of the National Academy of Sciences 104, 914-919.
7. Ying, S., O''Connor, В., Ratoff, J., et al. (2005) Expression and cellular provenance of thymic stromal lymphopoietin and chemokines in patients with severe asthma and chronic obstructive pulmonary disease. Journal of Allergy and Clinical Immunology 115, S9.
8. Gounni, A.S. (2007) Constitutive and inducible thymic stromal lymphopoietin expression in human airway smooth muscle cells: role in chronic obstructive pulmonary disease. American Journal of Physiology Lung Cellular & Molecular Physiology 293,375-382.
9. Ying, S., O''Connor, В., Ratoff, J., et al. (2005). Thymic stromal lymphopoietin expression is increased in asthmatic airways and correlates with expression of th2-attracting chemokines and disease severity. The Journal of Immunology 174, 8183-8190.
10. Kashyap, M., Rochman, Y, Spolski, R., Samsel, L., et al. (2011) Thymic stromal lymphopoietin is produced by dendritic cells. The Journal of Immunology 187(3), 13-24.
11. Soumelis, V, Reche, P.A., Kanzler, H., et al. (2002) Human epithelial cells trigger dendritic cell mediator allergic inflammation by producing TSLP. Nat Immunol 3, 673-680.
12. Watanabe, N., Hanabuchi, S., Soumelis, V, et al. (2004) Human thymic stromal lymphopoietin promotes dendritic cell-mediated CD4+T cell homeostatic expansion. Nat Immunol 5,426-434.
13. Moon, P.D., Choi, I.H., Kim, H.M. (2011) Naringenin suppresses the production of thymic stromal lymphopoietin through the blockade of RIP2 and caspase-1 signal cascade in mast cells. European Journal of Pharmacology 671,128-132.
14. Barton, G.M., Farr, A.G., et al. (2008) A mechanism for the initiation of allergen-induced T helper type 2 responses. Nature Immunology 9(3), 310-318.
15. He R, Geha, R.S. (2010) Thymic stromal lymphopoietin. Ann NY Acad Sci 1183, 13-24.
16. Oyoshi, M.K., Larson, R.P, Ziegler, S.E, et al. (2010) Mechanical injury polarizes skin dendritic cells to elicit a T (H) 2 response by inducing cutaneous thymic stromal
lymphopoietin expression. Journal of Allergy & Clinical Immunology 126, 976-984; e975.
17. Hai yan Tu, Xin Chen, Jing Li. (2007) Signal transduction in respiratory syncytial virus infection-induced thymic stromal lymphopoietin expression in human epithelial cells. Journal of Southern Medical University 27(10), 1581-1583.
18. Medoff, B.D., Landry, A. L., Wittbold, K.A., et al. (2009) CARMA3 mediates lysophoshatidic acid-stimulated cytokine secretion by bronchial epithelial cells. American Journal of Respiratory Cell and Molecular Biology 2009(40), 286-294.
19. Park, L.S., Martin, U., Garka, K., et al. (2000) Cloning of the murine thymic stromal lymphopoietin (TSLP) receptor: formation of a functional heteromeric complex requires interleukin 7 receptor. The Journal of Experimental Medicine 192, 659-670.
20. Kenneth Verstraete, Frank Peelman, Harald Braun,et al.(2017) Structure and antagonism of the receptor complex mediated by human TSLP in allergy and asthma. Nature Communications 8, 14937.
21. GJNA Report, Global Strategy for Asthma Management and Prevention. Available from:http://www.ginasthma.com.
22. von Biilow, Anna, Kriegbaum, M., Backer, V, et al. (2014) The prevalence of severe asthma and low asthma control among Danish adults. The Journal of Allergy and Clinical Immunology: In Practice 2(6), 759-673.
23. Reche, PA., Soumelis, V.M., Gorman. D.M., et al. (2001) Human thyroid stromal lymphopoietin preferentially stimulates myeloid cells. The Journal of Immunology 167, 336-343.
24. Zhou, В., Comeau, M.R., De, S.T., et al. (2005) Thymic stromal lymphopoietin as a key initiator of allergic airway inflammation in mice. Nat Immunol 6, 1047-1053.
25. Zhuang gui Chen, Tian tuo Zhang, Hong tao Li, et al. (2013) Neutralization of TSLP inhibits airway remodeling in a murine model of allergic asthma induced by chronic exposure to house dust mite. PLoS One 8, e51268.
26. He, R., Oyoshi, M.K., Garibyan, L., et al. (2008). TSLP acts on infiltrating effector T cells to drive allergic skin inflammation. Proc Natl Acad Sci USA 105(33), 11875-11880.
27. Corren, J., Parnes, J. R., Wang, L., et al. (2017) Tezepelumab in Adults with Uncontrolled Asthma. New England Journal of Medicine 377(10), 936-946.
28. Verstraete K, Peelman F, Braun H, et al. 2017. Structure and antagonism of the receptor complex mediated by human TSLP in allergy and asthma. Nat Commun [J], 8: 14937.
--->
Перечень последовательностей
<110> Beijing Wisdomab Biotechnology Co., Ltd
GENRIX (Shanghai) Biopharmaceutical Co., Ltd.
Chongqing Genrix Biopharmaceutical Co., Ltd.
<120> АНТИТЕЛА К TSLP ЧЕЛОВЕКА И ИХ ПРИМЕНЕНИЕ
<150> CN 202110147687.1
<151> 2021-02-03
<160> 43
<170> SIPOSequenceListing 1.0
<210> 1
<211> 131
<212> PRT
<213> Homo sapiens
<400> 1
Tyr Asp Phe Thr Asn Cys Asp Phe Glu Lys Ile Lys Ala Ala Tyr Leu
1 5 10 15
Ser Thr Ile Ser Lys Asp Leu Ile Thr Tyr Met Ser Gly Thr Lys Ser
20 25 30
Thr Glu Phe Asn Asn Thr Val Ser Cys Ser Asn Arg Pro His Cys Leu
35 40 45
Thr Glu Ile Gln Ser Leu Thr Phe Asn Pro Thr Ala Gly Cys Ala Ser
50 55 60
Leu Ala Lys Glu Met Phe Ala Met Lys Thr Lys Ala Ala Leu Ala Ile
65 70 75 80
Trp Cys Pro Gly Tyr Ser Glu Thr Gln Ile Asn Ala Thr Gln Ala Met
85 90 95
Lys Lys Arg Arg Lys Arg Lys Val Thr Thr Asn Lys Cys Leu Glu Gln
100 105 110
Val Ser Gln Leu Gln Gly Leu Trp Arg Arg Phe Asn Arg Pro Leu Leu
115 120 125
Lys Gln Gln
130
<210> 2
<211> 63
<212> PRT
<213> Homo sapiens
<400> 2
Met Phe Ala Met Lys Thr Lys Ala Ala Leu Ala Ile Trp Cys Pro Gly
1 5 10 15
Tyr Ser Glu Thr Gln Ile Asn Ala Thr Gln Ala Met Lys Lys Arg Arg
20 25 30
Lys Arg Lys Val Thr Thr Asn Lys Cys Leu Glu Gln Val Ser Gln Leu
35 40 45
Gln Gly Leu Trp Arg Arg Phe Asn Arg Pro Leu Leu Lys Gln Gln
50 55 60
<210> 3
<211> 121
<212> PRT
<213> Mus musculus
<400> 3
Tyr Asn Phe Ser Asn Cys Asn Phe Thr Ser Ile Thr Lys Ile Tyr Cys
1 5 10 15
Asn Ile Ile Phe His Asp Leu Thr Gly Asp Leu Lys Gly Ala Lys Phe
20 25 30
Glu Gln Ile Glu Asp Cys Glu Ser Lys Pro Ala Cys Leu Leu Lys Ile
35 40 45
Glu Tyr Tyr Thr Leu Asn Pro Ile Pro Gly Cys Pro Ser Leu Pro Asp
50 55 60
Lys Thr Phe Ala Arg Arg Thr Arg Glu Ala Leu Asn Asp His Cys Pro
65 70 75 80
Gly Tyr Pro Glu Thr Glu Arg Asn Asp Gly Thr Gln Glu Met Ala Gln
85 90 95
Glu Val Gln Asn Ile Cys Leu Asn Gln Thr Ser Gln Ile Leu Arg Leu
100 105 110
Trp Tyr Ser Phe Met Gln Ser Pro Glu
115 120
<210> 4
<211> 131
<212> PRT
<213> Macaca fascicularis
<400> 4
Tyr Asp Phe Thr Asn Cys Asp Phe Gln Lys Ile Glu Ala Asp Tyr Leu
1 5 10 15
Arg Thr Ile Ser Lys Asp Leu Ile Thr Tyr Met Ser Gly Thr Lys Ser
20 25 30
Thr Asp Phe Asn Asn Thr Val Ser Cys Ser Asn Arg Pro His Cys Leu
35 40 45
Thr Glu Ile Gln Ser Leu Thr Phe Asn Pro Thr Pro Arg Cys Ala Ser
50 55 60
Leu Ala Lys Glu Met Phe Ala Arg Lys Thr Lys Ala Thr Leu Ala Leu
65 70 75 80
Trp Cys Pro Gly Tyr Ser Glu Thr Gln Ile Asn Ala Thr Gln Ala Met
85 90 95
Lys Lys Arg Arg Lys Arg Lys Val Thr Thr Asn Lys Cys Leu Glu Gln
100 105 110
Val Ser Gln Leu Leu Gly Leu Trp Arg Arg Phe Ile Arg Thr Leu Leu
115 120 125
Lys Lys Gln
130
<210> 5
<211> 126
<212> PRT
<213> Artificial Sequence
<220>
<223> мутант hTSLP1 (hTSLP1-m) с делецией в сайте распознавания
фурином
<400> 5
Tyr Asp Phe Thr Asn Cys Asp Phe Glu Lys Ile Lys Ala Ala Tyr Leu
1 5 10 15
Ser Thr Ile Ser Lys Asp Leu Ile Thr Tyr Met Ser Gly Thr Lys Ser
20 25 30
Thr Glu Phe Asn Asn Thr Val Ser Cys Ser Asn Arg Pro His Cys Leu
35 40 45
Thr Glu Ile Gln Ser Leu Thr Phe Asn Pro Thr Ala Gly Cys Ala Ser
50 55 60
Leu Ala Lys Glu Met Phe Ala Met Lys Thr Lys Ala Ala Leu Ala Ile
65 70 75 80
Trp Cys Pro Gly Tyr Ser Glu Thr Gln Ile Asn Ala Thr Gln Ala Met
85 90 95
Lys Lys Val Thr Thr Asn Lys Cys Leu Glu Gln Val Ser Gln Leu Gln
100 105 110
Gly Leu Trp Arg Arg Phe Asn Arg Pro Leu Leu Lys Gln Gln
115 120 125
<210> 6
<211> 58
<212> PRT
<213> Artificial Sequence
<220>
<223> мутант hTSLP1 (hTSLP2-m) с делецией в сайте распознавания
фурином
<400> 6
Met Phe Ala Met Lys Thr Lys Ala Ala Leu Ala Ile Trp Cys Pro Gly
1 5 10 15
Tyr Ser Glu Thr Gln Ile Asn Ala Thr Gln Ala Met Lys Lys Val Thr
20 25 30
Thr Asn Lys Cys Leu Glu Gln Val Ser Gln Leu Gln Gly Leu Trp Arg
35 40 45
Arg Phe Asn Arg Pro Leu Leu Lys Gln Gln
50 55
<210> 7
<211> 126
<212> PRT
<213> Artificial Sequence
<220>
<223> мутант mfTSLP (mfTSLP1-m) с делецией в сайте распознавания
фурином
<400> 7
Tyr Asp Phe Thr Asn Cys Asp Phe Gln Lys Ile Glu Ala Asp Tyr Leu
1 5 10 15
Arg Thr Ile Ser Lys Asp Leu Ile Thr Tyr Met Ser Gly Thr Lys Ser
20 25 30
Thr Asp Phe Asn Asn Thr Val Ser Cys Ser Asn Arg Pro His Cys Leu
35 40 45
Thr Glu Ile Gln Ser Leu Thr Phe Asn Pro Thr Pro Arg Cys Ala Ser
50 55 60
Leu Ala Lys Glu Met Phe Ala Arg Lys Thr Lys Ala Thr Leu Ala Leu
65 70 75 80
Trp Cys Pro Gly Tyr Ser Glu Thr Gln Ile Asn Ala Thr Gln Ala Met
85 90 95
Lys Lys Val Thr Thr Asn Lys Cys Leu Glu Gln Val Ser Gln Leu Leu
100 105 110
Gly Leu Trp Arg Arg Phe Ile Arg Thr Leu Leu Lys Lys Gln
115 120 125
<210> 8
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> His-метка
<400> 8
His His His His His His
1 5
<210> 9
<211> 232
<212> PRT
<213> Homo sapiens
<400> 9
Glu Pro Lys Ser Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
1 5 10 15
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
20 25 30
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
35 40 45
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
50 55 60
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
65 70 75 80
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
85 90 95
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
100 105 110
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
115 120 125
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
130 135 140
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
145 150 155 160
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
165 170 175
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
180 185 190
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
195 200 205
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
210 215 220
Ser Leu Ser Leu Ser Pro Gly Lys
225 230
<210> 10
<211> 232
<212> PRT
<213> Mus musculus
<400> 10
Pro Arg Gly Pro Thr Ile Lys Pro Cys Pro Pro Cys Lys Cys Pro Ala
1 5 10 15
Pro Asn Leu Leu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Lys Ile
20 25 30
Lys Asp Val Leu Met Ile Ser Leu Ser Pro Ile Val Thr Cys Val Val
35 40 45
Val Asp Val Ser Glu Asp Asp Pro Asp Val Gln Ile Ser Trp Phe Val
50 55 60
Asn Asn Val Glu Val His Thr Ala Gln Thr Gln Thr His Arg Glu Asp
65 70 75 80
Tyr Asn Ser Thr Leu Arg Val Val Ser Ala Leu Pro Ile Gln His Gln
85 90 95
Asp Trp Met Ser Gly Lys Glu Phe Lys Cys Lys Val Asn Asn Lys Asp
100 105 110
Leu Pro Ala Pro Ile Glu Arg Thr Ile Ser Lys Pro Lys Gly Ser Val
115 120 125
Arg Ala Pro Gln Val Tyr Val Leu Pro Pro Pro Glu Glu Glu Met Thr
130 135 140
Lys Lys Gln Val Thr Leu Thr Cys Met Val Thr Asp Phe Met Pro Glu
145 150 155 160
Asp Ile Tyr Val Glu Trp Thr Asn Asn Gly Lys Thr Glu Leu Asn Tyr
165 170 175
Lys Asn Thr Glu Pro Val Leu Asp Ser Asp Gly Ser Tyr Phe Met Tyr
180 185 190
Ser Lys Leu Arg Val Glu Lys Lys Asn Trp Val Glu Arg Asn Ser Tyr
195 200 205
Ser Cys Ser Val Val His Glu Gly Leu His Asn His His Thr Thr Lys
210 215 220
Ser Phe Ser Arg Thr Pro Gly Lys
225 230
<210> 11
<211> 330
<212> PRT
<213> Homo sapiens
<400> 11
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 12
<211> 326
<212> PRT
<213> Homo sapiens
<400> 12
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro
100 105 110
Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
115 120 125
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
130 135 140
Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
145 150 155 160
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
165 170 175
Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp
180 185 190
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
195 200 205
Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu
210 215 220
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
225 230 235 240
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
245 250 255
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
260 265 270
Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
275 280 285
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
290 295 300
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
305 310 315 320
Ser Leu Ser Pro Gly Lys
325
<210> 13
<211> 327
<212> PRT
<213> Homo sapiens
<400> 13
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Lys
325
<210> 14
<211> 324
<212> PRT
<213> Mus musculus
<400> 14
Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu Ala Pro Gly Ser Ala
1 5 10 15
Ala Gln Thr Asn Ser Met Val Thr Leu Gly Cys Leu Val Lys Gly Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Thr Trp Asn Ser Gly Ser Leu Ser Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Glu Ser Asp Leu Tyr Thr Leu
50 55 60
Ser Ser Ser Val Thr Val Pro Ser Ser Pro Arg Pro Ser Glu Thr Val
65 70 75 80
Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys
85 90 95
Ile Val Pro Arg Asp Cys Gly Cys Lys Pro Cys Ile Cys Thr Val Pro
100 105 110
Glu Val Ser Ser Val Phe Ile Phe Pro Pro Lys Pro Lys Asp Val Leu
115 120 125
Thr Ile Thr Leu Thr Pro Lys Val Thr Cys Val Val Val Asp Ile Ser
130 135 140
Lys Asp Asp Pro Glu Val Gln Phe Ser Trp Phe Val Asp Asp Val Glu
145 150 155 160
Val His Thr Ala Gln Thr Gln Pro Arg Glu Glu Gln Phe Asn Ser Thr
165 170 175
Phe Arg Ser Val Ser Glu Leu Pro Ile Met His Gln Asp Trp Leu Asn
180 185 190
Gly Lys Glu Phe Lys Cys Arg Val Asn Ser Ala Ala Phe Pro Ala Pro
195 200 205
Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Arg Pro Lys Ala Pro Gln
210 215 220
Val Tyr Thr Ile Pro Pro Pro Lys Glu Gln Met Ala Lys Asp Lys Val
225 230 235 240
Ser Leu Thr Cys Met Ile Thr Asp Phe Phe Pro Glu Asp Ile Thr Val
245 250 255
Glu Trp Gln Trp Asn Gly Gln Pro Ala Glu Asn Tyr Lys Asn Thr Gln
260 265 270
Pro Ile Met Asn Thr Asn Gly Ser Tyr Phe Val Tyr Ser Lys Leu Asn
275 280 285
Val Gln Lys Ser Asn Trp Glu Ala Gly Asn Thr Phe Thr Cys Ser Val
290 295 300
Leu His Glu Gly Leu His Asn His His Thr Glu Lys Ser Leu Ser His
305 310 315 320
Ser Pro Gly Lys
<210> 15
<211> 330
<212> PRT
<213> Mus musculus
<400> 15
Ala Lys Thr Thr Ala Pro Ser Val Tyr Pro Leu Ala Pro Val Cys Gly
1 5 10 15
Asp Thr Thr Gly Ser Ser Val Thr Leu Gly Cys Leu Val Lys Gly Tyr
20 25 30
Phe Pro Glu Pro Val Thr Leu Thr Trp Asn Ser Gly Ser Leu Ser Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu
50 55 60
Ser Ser Ser Val Thr Val Thr Ser Ser Thr Trp Pro Ser Gln Ser Ile
65 70 75 80
Thr Cys Asn Val Ala His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys
85 90 95
Ile Glu Pro Arg Gly Pro Thr Ile Lys Pro Cys Pro Pro Cys Lys Cys
100 105 110
Pro Ala Pro Asn Leu Leu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro
115 120 125
Lys Ile Lys Asp Val Leu Met Ile Ser Leu Ser Pro Ile Val Thr Cys
130 135 140
Val Val Val Asp Val Ser Glu Asp Asp Pro Asp Val Gln Ile Ser Trp
145 150 155 160
Phe Val Asn Asn Val Glu Val His Thr Ala Gln Thr Gln Thr His Arg
165 170 175
Glu Asp Tyr Asn Ser Thr Leu Arg Val Val Ser Ala Leu Pro Ile Gln
180 185 190
His Gln Asp Trp Met Ser Gly Lys Glu Phe Lys Cys Lys Val Asn Asn
195 200 205
Lys Asp Leu Pro Ala Pro Ile Glu Arg Thr Ile Ser Lys Pro Lys Gly
210 215 220
Ser Val Arg Ala Pro Gln Val Tyr Val Leu Pro Pro Pro Glu Glu Glu
225 230 235 240
Met Thr Lys Lys Gln Val Thr Leu Thr Cys Met Val Thr Asp Phe Met
245 250 255
Pro Glu Asp Ile Tyr Val Glu Trp Thr Asn Asn Gly Lys Thr Glu Leu
260 265 270
Asn Tyr Lys Asn Thr Glu Pro Val Leu Asp Ser Asp Gly Ser Tyr Phe
275 280 285
Met Tyr Ser Lys Leu Arg Val Glu Lys Lys Asn Trp Val Glu Arg Asn
290 295 300
Ser Tyr Ser Cys Ser Val Val His Glu Gly Leu His Asn His His Thr
305 310 315 320
Thr Lys Ser Phe Ser Arg Thr Pro Gly Lys
325 330
<210> 16
<211> 107
<212> PRT
<213> Homo sapiens
<400> 16
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 17
<211> 106
<212> PRT
<213> Homo sapiens
<400> 17
Gly Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser
1 5 10 15
Glu Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp
20 25 30
Phe Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro
35 40 45
Val Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn
50 55 60
Lys Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys
65 70 75 80
Ser His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val
85 90 95
Glu Lys Thr Val Ala Pro Thr Glu Cys Ser
100 105
<210> 18
<211> 107
<212> PRT
<213> Mus musculus
<400> 18
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu
1 5 10 15
Gln Leu Thr Ser Gly Gly Ala Ser Val Val Cys Phe Leu Asn Asn Phe
20 25 30
Tyr Pro Lys Asp Ile Asn Val Lys Trp Lys Ile Asp Gly Ser Glu Arg
35 40 45
Gln Asn Gly Val Leu Asn Ser Trp Thr Asp Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Met Ser Ser Thr Leu Thr Leu Thr Lys Asp Glu Tyr Glu
65 70 75 80
Arg His Asn Ser Tyr Thr Cys Glu Ala Thr His Lys Thr Ser Thr Ser
85 90 95
Pro Ile Val Lys Ser Phe Asn Arg Asn Glu Cys
100 105
<210> 19
<211> 106
<212> PRT
<213> Mus musculus
<400> 19
Gly Gln Pro Lys Ser Ser Pro Ser Val Thr Leu Phe Pro Pro Ser Ser
1 5 10 15
Glu Glu Leu Glu Thr Asn Lys Ala Thr Leu Val Cys Thr Ile Thr Asp
20 25 30
Phe Tyr Pro Gly Val Val Thr Val Asp Trp Lys Val Asp Gly Thr Pro
35 40 45
Val Thr Gln Gly Met Glu Thr Thr Gln Pro Ser Lys Gln Ser Asn Asn
50 55 60
Lys Tyr Met Ala Ser Ser Tyr Leu Thr Leu Thr Ala Arg Ala Trp Glu
65 70 75 80
Arg His Ser Ser Tyr Ser Cys Gln Val Thr His Glu Gly His Thr Val
85 90 95
Glu Lys Ser Leu Ser Arg Ala Asp Cys Ser
100 105
<210> 20
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> вариабельная область тяжелой цепи гуманизированного антитела
H1A10+L3E8-M1
<400> 20
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gln Ile Phe Pro Gly Asp Ser Asp Thr Asp Tyr Asp Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Gly Tyr Tyr Arg Gly Tyr Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 21
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> вариабельная область легкой цепи L3E8-M1 гуманизированного
антитела H1A10+L3E8-M1
<400> 21
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Ser Val Ser Ser Ser Ile Ser Ser Ser
20 25 30
Asn Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Pro Trp
35 40 45
Ile Tyr Gly Thr Ser Asn Leu Ala Ser Gly Ile Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln
65 70 75 80
Ser Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Trp Ser Ser Tyr Pro
85 90 95
Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 22
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<223> вариабельная область тяжелой цепи контрольного антитела к TSLP
человека тезепелумаба
<400> 22
Gln Met Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Arg Thr Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Asn Lys His Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Thr Arg Asp Asn Ser Lys Asn Thr Leu Asn
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Pro Gln Trp Glu Leu Val His Glu Ala Phe Asp Ile Trp
100 105 110
Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 23
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> вариабельная область легкой цепи контрольного антитела к TSLP
человека тезепелумаба
<400> 23
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Leu Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Trp Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Gly Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 24
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> гуманизированный мутант тяжелой цепи H3B10-M1
<400> 24
Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu Val Lys Pro Thr Glu
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ser Tyr
20 25 30
Asp Ile Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Ser Glu Gly Gly Thr Ser Tyr Ser Thr Ser Leu Lys
50 55 60
Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Ser Gln Val Val Leu
65 70 75 80
Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Asp Ser Asp Asp Gly Tyr Leu Asn Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 25
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> L3E8-M2
<400> 25
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Ser Val Ser Ser Ser Ile Ser Ser Ser
20 25 30
Asn Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Lys Pro Trp
35 40 45
Ile Tyr Gly Thr Ser Asn Leu Ala Ser Gly Ile Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln
65 70 75 80
Ser Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Trp Ser Ser Tyr Pro
85 90 95
Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 26
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> L3E8-M3
<400> 26
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Ile Thr Cys Ser Val Ser Ser Ser Ile Ser Ser Ser
20 25 30
Asn Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Pro Trp
35 40 45
Ile Tyr Gly Thr Ser Asn Leu Ala Ser Gly Ile Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln
65 70 75 80
Ser Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Trp Ser Ser Tyr Pro
85 90 95
Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 27
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> L3E8-M4
<400> 27
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Ser Val Ser Ser Ser Ile Ser Ser Ser
20 25 30
Asn Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Pro Trp
35 40 45
Ile Tyr Gly Thr Ser Asn Leu Ala Ser Gly Ile Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Met Glu
65 70 75 80
Ala Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Trp Ser Ser Tyr Pro
85 90 95
Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 28
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> мутант L3E8-M7
<400> 28
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Ser Val Ser Ser Ser Ile Ser Ser Ser
20 25 30
Asn Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Pro Trp
35 40 45
Ile Tyr Gly Thr Ser Asn Leu Ala Ser Gly Ile Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Val Gln
65 70 75 80
Ala Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Trp Ser Ser Tyr Pro
85 90 95
Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 29
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> HCDR1 гуманизированного мутанта тяжелой цепи H3B10-M1
<400> 29
Ser Tyr Asp Ile Ser
1 5
<210> 30
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> HCDR2 гуманизированного мутанта тяжелой цепи H3B10-M1
<400> 30
Val Ile Trp Ser Glu Gly Gly Thr Ser Tyr Ser Thr Ser Leu Lys Ser
1 5 10 15
<210> 31
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> HCDR3 гуманизированного мутанта тяжелой цепи H3B10-M1
<400> 31
Asp Ser Asp Asp Gly Tyr Leu Asn
1 5
<210> 32
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> LCDR1 вариабельной области легкой цепи L3E8-M1
<400> 32
Ser Val Ser Ser Ser Ile Ser Ser Ser Asn Leu His
1 5 10
<210> 33
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> LCDR2 вариабельной области легкой цепи L3E8-M1
<400> 33
Gly Thr Ser Asn Leu Ala Ser
1 5
<210> 34
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> LCDR3 вариабельной области легкой цепи L3E8-M1
<400> 34
Gln Gln Trp Ser Ser Tyr Pro Leu Thr
1 5
<210> 35
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> HCDR1 вариабельной области тяжелой цепи гуманизированного
антитела H1A10+L3E8-M1
<400> 35
Asn Tyr Trp Met Asn
1 5
<210> 36
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> HCDR2 вариабельной области тяжелой цепи гуманизированного
антитела H1A10+L3E8-M1
<400> 36
Gln Ile Phe Pro Gly Asp Ser Asp Thr Asp Tyr Asp Gln Lys Phe Gln
1 5 10 15
Gly
<210> 37
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> HCDR3 вариабельной области тяжелой цепи гуманизированного
антитела H1A10+L3E8-M1
<400> 37
Ala Gly Tyr Tyr Arg Gly Tyr Tyr Ala Met Asp Tyr
1 5 10
<210> 38
<211> 446
<212> PRT
<213> Artificial Sequence
<220>
<223> H3B10-M1-IgG1m3-H
<400> 38
Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu Val Lys Pro Thr Glu
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Ser Tyr
20 25 30
Asp Ile Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Ser Glu Gly Gly Thr Ser Tyr Ser Thr Ser Leu Lys
50 55 60
Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Ser Gln Val Val Leu
65 70 75 80
Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Asp Ser Asp Asp Gly Tyr Leu Asn Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Glu Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asp His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Thr Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Phe Glu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val
260 265 270
Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Ser Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys Thr Leu Pro Pro
340 345 350
Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Ser Cys Ala Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Val Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 39
<211> 215
<212> PRT
<213> Artificial Sequence
<220>
<223> легкая цепь, содержащая вариабельную область легкой цепи L3E8-M1
<400> 39
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Ser Val Ser Ser Ser Ile Ser Ser Ser
20 25 30
Asn Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Pro Trp
35 40 45
Ile Tyr Gly Thr Ser Asn Leu Ala Ser Gly Ile Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln
65 70 75 80
Ser Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Trp Ser Ser Tyr Pro
85 90 95
Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 40
<211> 215
<212> PRT
<213> Artificial Sequence
<220>
<223> легкая цепь, содержащая вариабельную область легкой цепи L3E8-M7
<400> 40
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Ser Val Ser Ser Ser Ile Ser Ser Ser
20 25 30
Asn Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Pro Trp
35 40 45
Ile Tyr Gly Thr Ser Asn Leu Ala Ser Gly Ile Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Val Gln
65 70 75 80
Ala Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Trp Ser Ser Tyr Pro
85 90 95
Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 41
<211> 451
<212> PRT
<213> Artificial Sequence
<220>
<223> H1A10-IgG1m3-K
<400> 41
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gln Ile Phe Pro Gly Asp Ser Asp Thr Asp Tyr Asp Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Gly Tyr Tyr Arg Gly Tyr Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Phe Glu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Ser Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Cys Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 42
<211> 209
<212> PRT
<213> Homo sapiens
<400> 42
Gln Gly Gly Ala Ala Glu Gly Val Gln Ile Gln Ile Ile Tyr Phe Asn
1 5 10 15
Leu Glu Thr Val Gln Val Thr Trp Asn Ala Ser Lys Tyr Ser Arg Thr
20 25 30
Asn Leu Thr Phe His Tyr Arg Phe Asn Gly Asp Glu Ala Tyr Asp Gln
35 40 45
Cys Thr Asn Tyr Leu Leu Gln Glu Gly His Thr Ser Gly Cys Leu Leu
50 55 60
Asp Ala Glu Gln Arg Asp Asp Ile Leu Tyr Phe Ser Ile Arg Asn Gly
65 70 75 80
Thr His Pro Val Phe Thr Ala Ser Arg Trp Met Val Tyr Tyr Leu Lys
85 90 95
Pro Ser Ser Pro Lys His Val Arg Phe Ser Trp His Gln Asp Ala Val
100 105 110
Thr Val Thr Cys Ser Asp Leu Ser Tyr Gly Asp Leu Leu Tyr Glu Val
115 120 125
Gln Tyr Arg Ser Pro Phe Asp Thr Glu Trp Gln Ser Lys Gln Glu Asn
130 135 140
Thr Cys Asn Val Thr Ile Glu Gly Leu Asp Ala Glu Lys Cys Tyr Ser
145 150 155 160
Phe Trp Val Arg Val Lys Ala Met Glu Asp Val Tyr Gly Pro Asp Thr
165 170 175
Tyr Pro Ser Asp Trp Ser Glu Val Thr Cys Trp Gln Arg Gly Glu Ile
180 185 190
Arg Asp Ala Cys Ala Glu Thr Pro Thr Pro Pro Lys Pro Lys Leu Ser
195 200 205
Lys
<210> 43
<211> 219
<212> PRT
<213> Homo sapiens
<400> 43
Glu Ser Gly Tyr Ala Gln Asn Gly Asp Leu Glu Asp Ala Glu Leu Asp
1 5 10 15
Asp Tyr Ser Phe Ser Cys Tyr Ser Gln Leu Glu Val Asn Gly Ser Gln
20 25 30
His Ser Leu Thr Cys Ala Phe Glu Asp Pro Asp Val Asn Thr Thr Asn
35 40 45
Leu Glu Phe Glu Ile Cys Gly Ala Leu Val Glu Val Lys Cys Leu Asn
50 55 60
Phe Arg Lys Leu Gln Glu Ile Tyr Phe Ile Glu Thr Lys Lys Phe Leu
65 70 75 80
Leu Ile Gly Lys Ser Asn Ile Cys Val Lys Val Gly Glu Lys Ser Leu
85 90 95
Thr Cys Lys Lys Ile Asp Leu Thr Thr Ile Val Lys Pro Glu Ala Pro
100 105 110
Phe Asp Leu Ser Val Ile Tyr Arg Glu Gly Ala Asn Asp Phe Val Val
115 120 125
Thr Phe Asn Thr Ser His Leu Gln Lys Lys Tyr Val Lys Val Leu Met
130 135 140
His Asp Val Ala Tyr Arg Gln Glu Lys Asp Glu Asn Lys Trp Thr His
145 150 155 160
Val Asn Leu Ser Ser Thr Lys Leu Thr Leu Leu Gln Arg Lys Leu Gln
165 170 175
Pro Ala Ala Met Tyr Glu Ile Lys Val Arg Ser Ile Pro Asp His Tyr
180 185 190
Phe Lys Gly Phe Trp Ser Glu Trp Ser Pro Ser Tyr Tyr Phe Arg Thr
195 200 205
Pro Glu Ile Asn Asn Ser Ser Gly Glu Met Asp
210 215
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО ПРОТИВ ВИРУСА БЕШЕНСТВА И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2764740C1 |
| АНТИТЕЛО ПРОТИВ СТОЛБНЯЧНОГО ТОКСИНА И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2815280C1 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО ПРОТИВ CD3E/BCMA И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2800164C2 |
| АНТИ-TSLP АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2834227C1 |
| АНТИТЕЛО К CLDN-18.2 И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2829997C1 |
| АНТИТЕЛО К B7-H4, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2792748C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛА К PCSK-9, И ЕЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2782792C2 |
| АНТИТЕЛО, СПОСОБНОЕ СВЯЗЫВАТЬСЯ С ТИМИЧЕСКИМ СТРОМАЛЬНЫМ ЛИМФОПОЭТИНОМ, И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2825304C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛО К LAG-3, И ЕЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2771384C2 |
| Антитело против FXI/FXIA, его антигенсвязывающий фрагмент и фармацевтическое применение | 2021 |
|
RU2838408C1 |
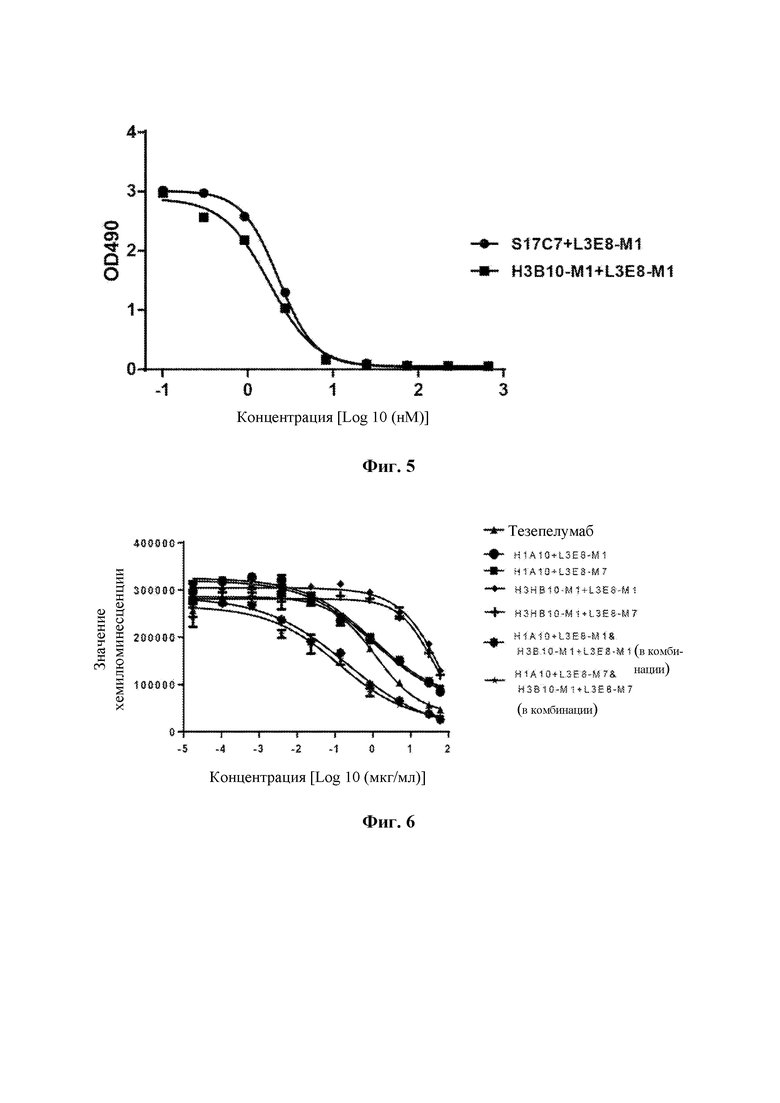
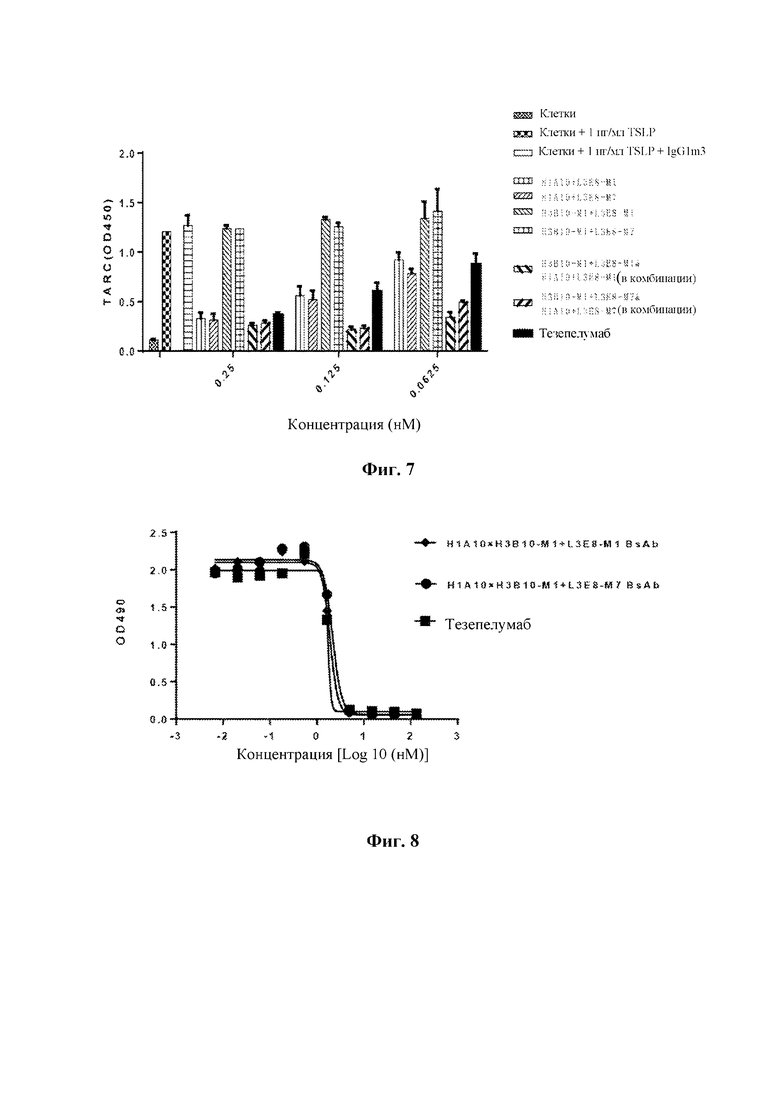
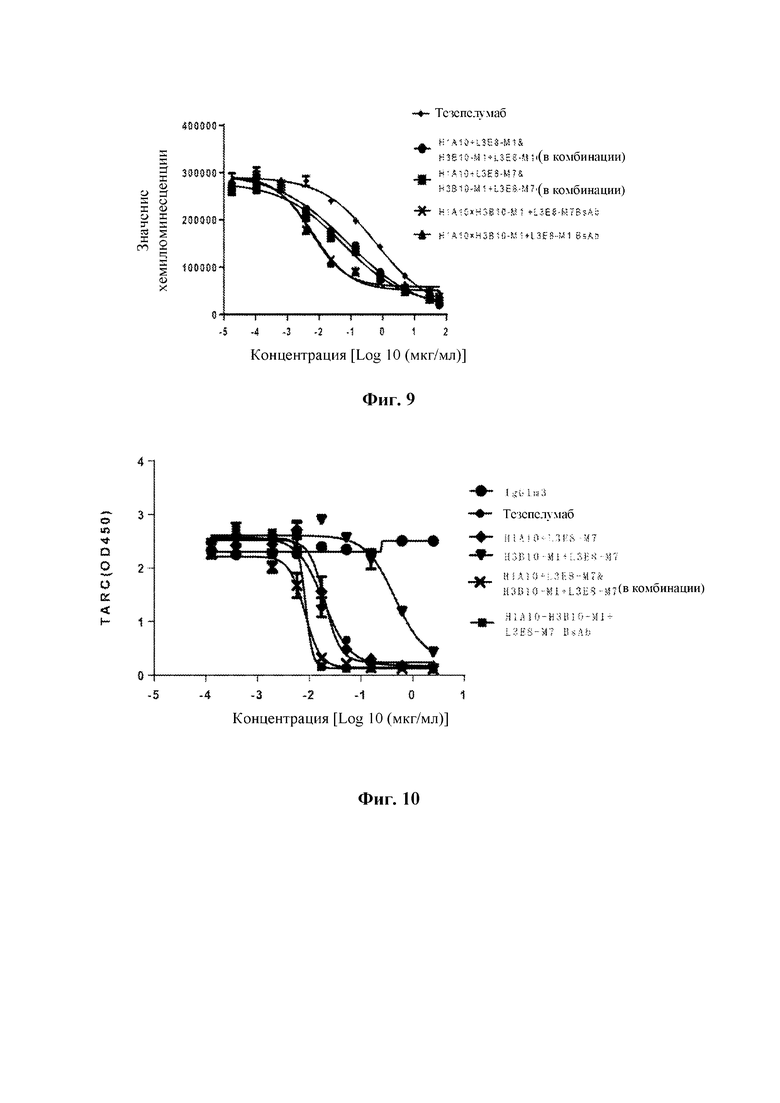
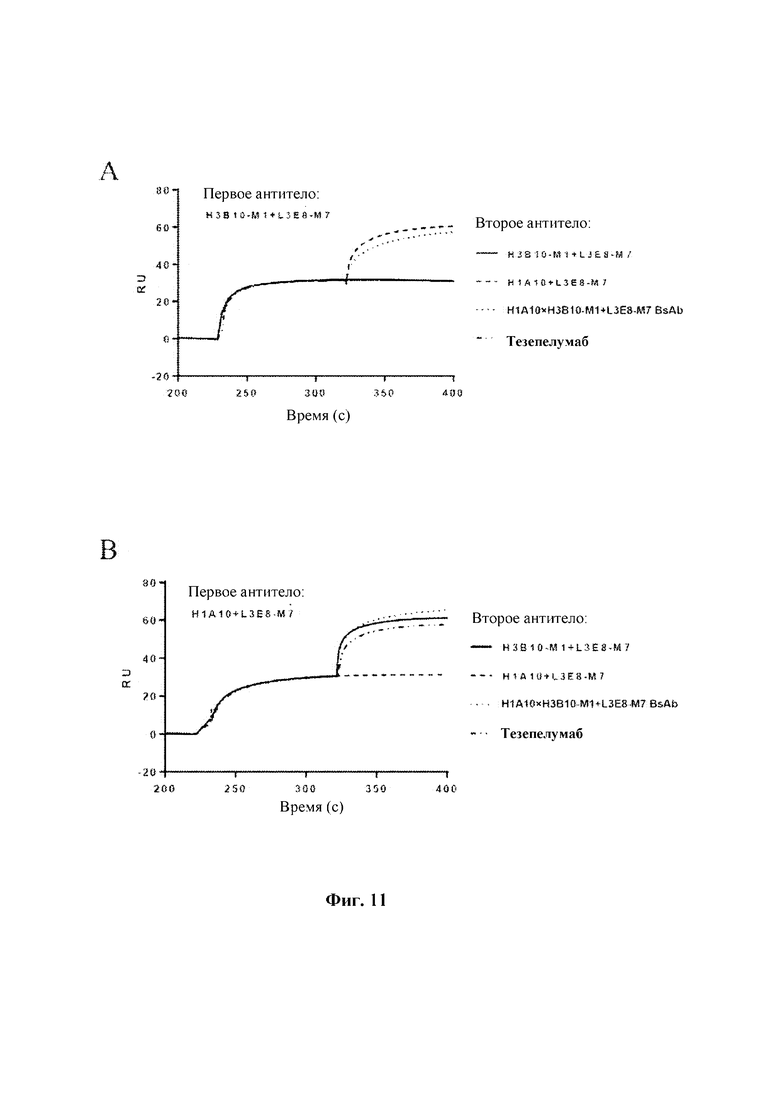
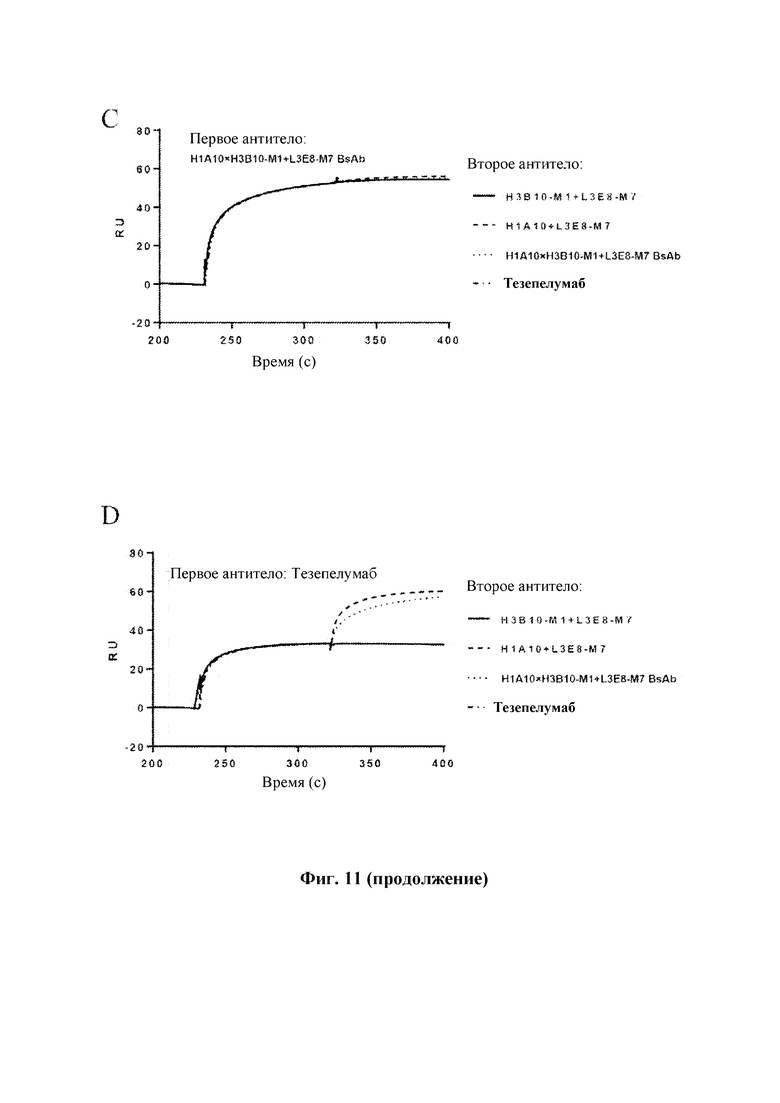
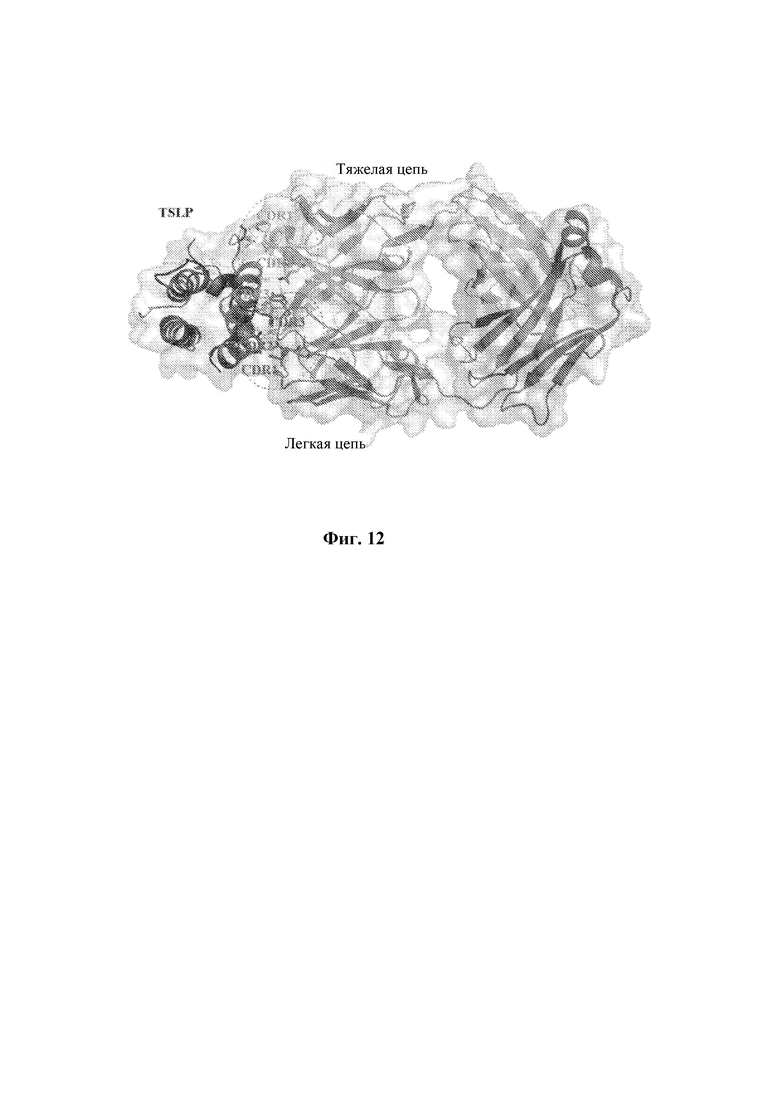
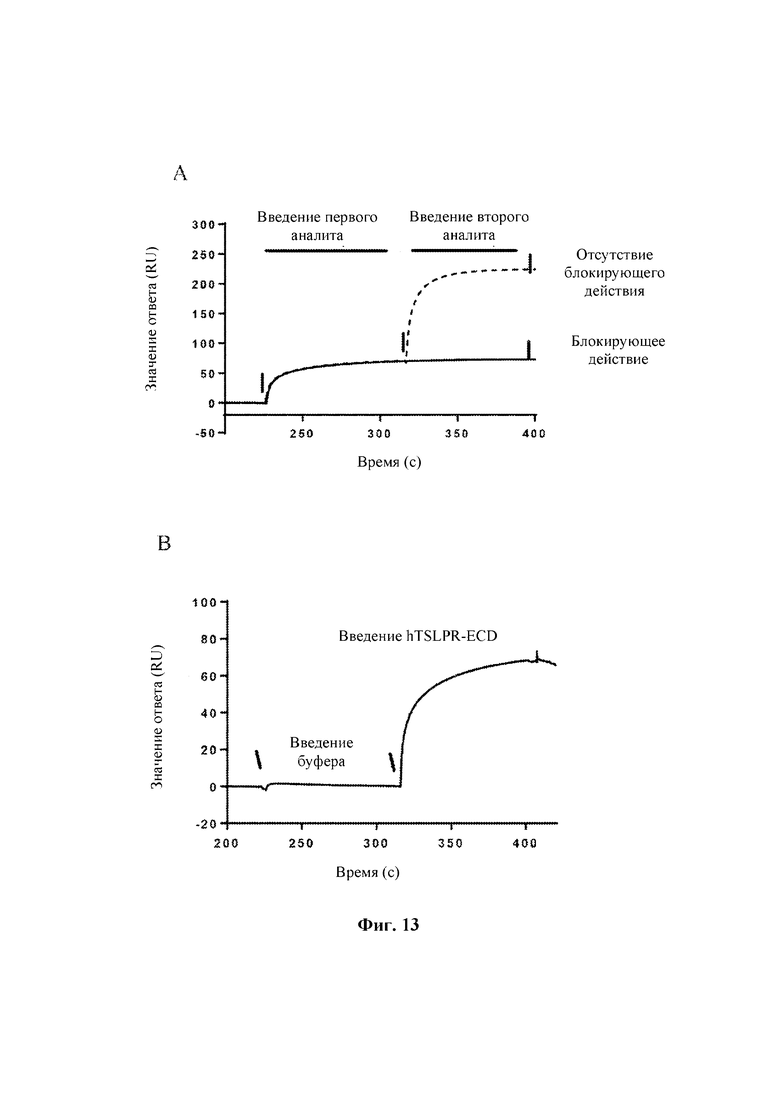
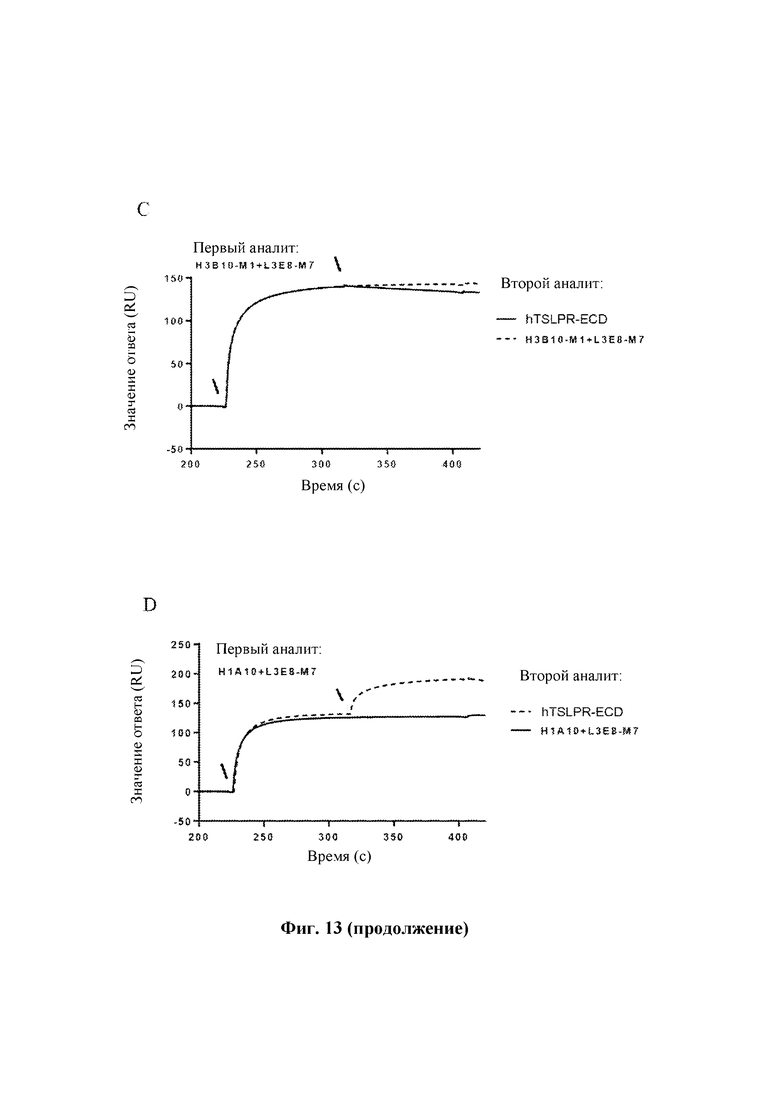
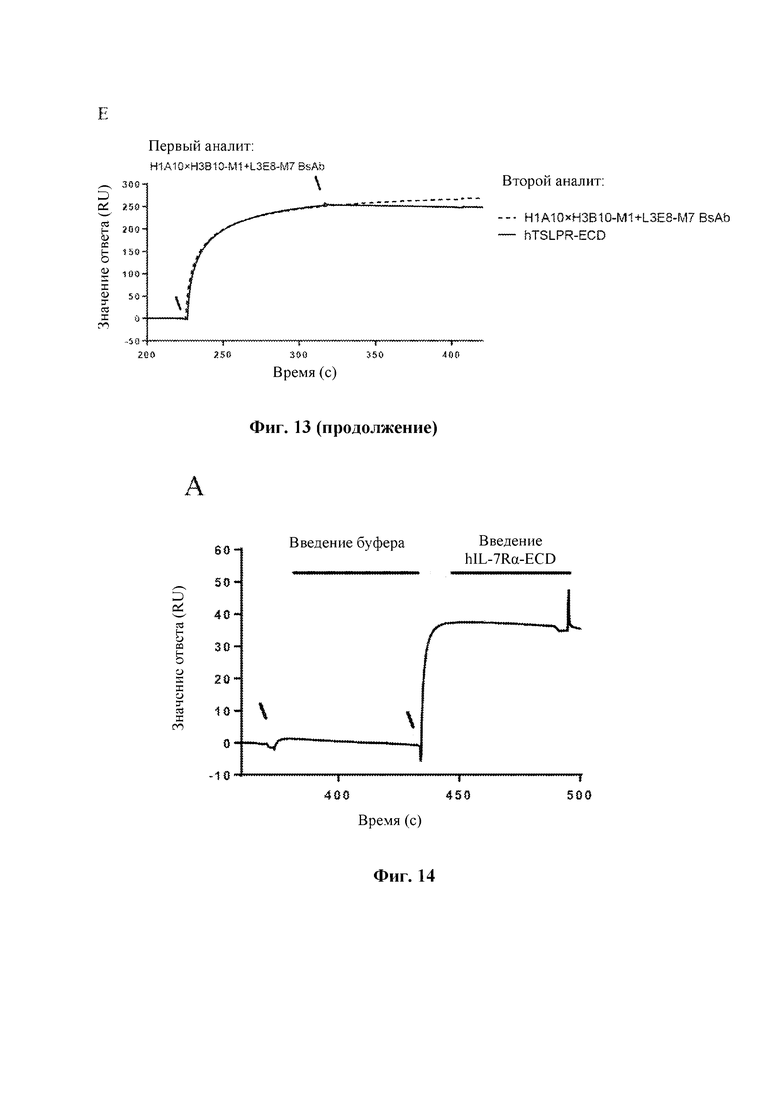
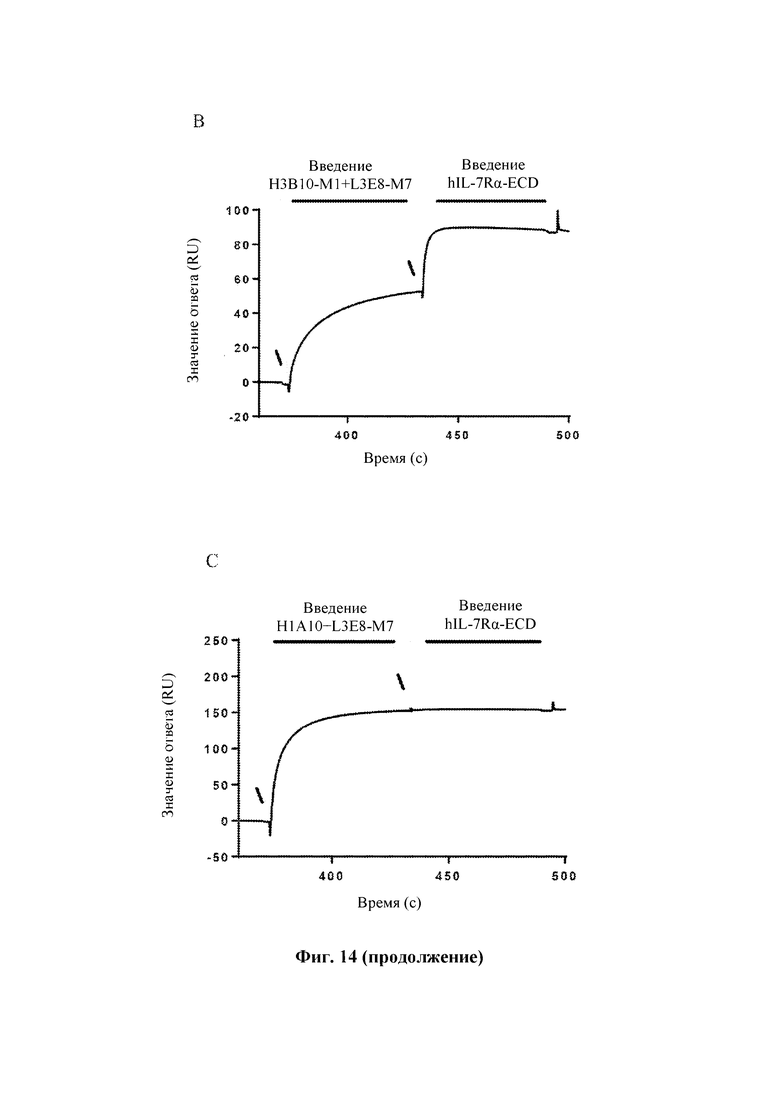
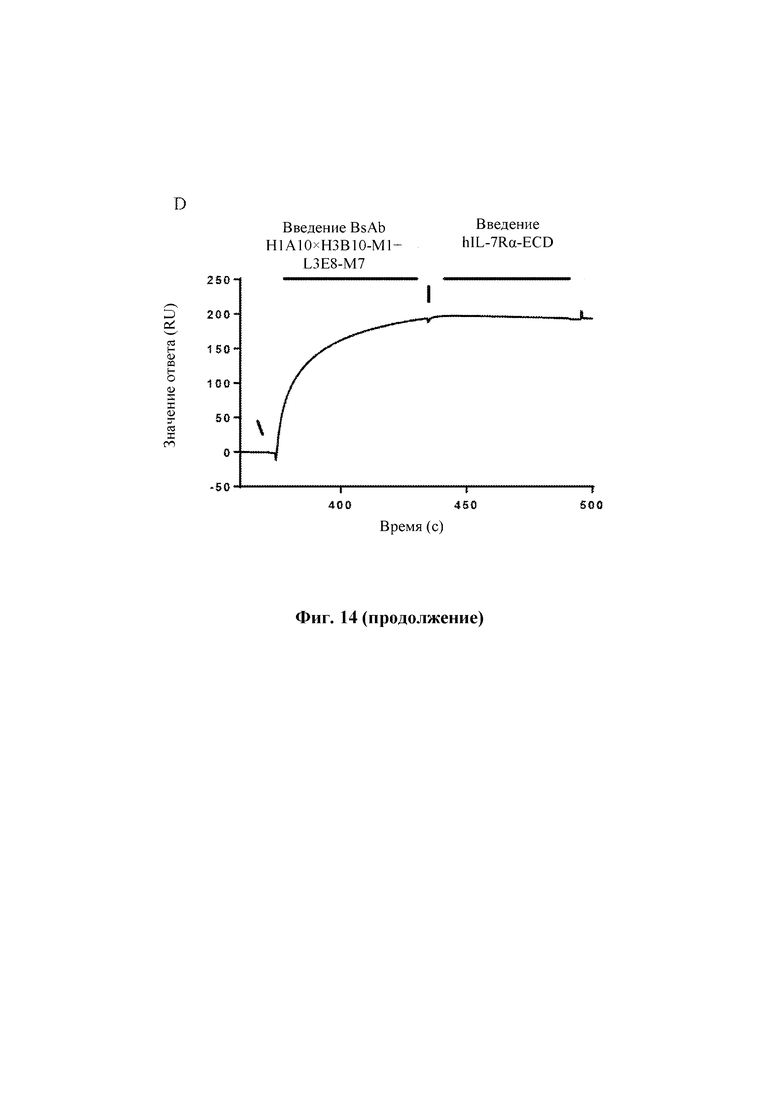
Изобретение относится к области биотехнологии, в частности к биспецифическому антителу, которое связывается с TSLP человека, а также к моноклональному антителу, которое связывается с TSLP человека. Изобретение эффективно для предупреждения или лечения опосредованного TSLP заболевания. 4 н. и 11 з.п. ф-лы, 14 ил., 13 табл., 8 пр.
1. Биспецифическое антитело, которое связывается с TSLP человека, содержащее первый связывающий фрагмент и второй связывающий фрагмент, которые связываются с неперекрывающимися эпитопами тимусного стромального лимфопоэтина человека (TSLP),
где первый связывающий фрагмент содержит HCDR1, представленную в SEQ ID NO: 29, HCDR2, представленную в SEQ ID NO: 30, HCDR3, представленную в SEQ ID NO: 31, LCDR1, представленную в SEQ ID NO: 32, LCDR2, представленную в SEQ ID NO: 33, и LCDR3, представленную в SEQ ID NO: 34; и
второй связывающий фрагмент содержит HCDR1, представленную в SEQ ID NO: 35, HCDR2, представленную в SEQ ID NO: 36, HCDR3, представленную в SEQ ID NO: 37, LCDR1, представленную в SEQ ID NO: 32, LCDR2, представленную в SEQ ID NO: 33, и LCDR3, представленную в SEQ ID NO: 34;
где аминокислотные последовательности HCDR и LCDR определены согласно нумерации Kabat.
2. Биспецифическое антитело по п. 1, которое способно блокировать связывание TSLP человека с рецептором TSLP (TSLPR) человека и которое способно блокировать связывание альфа-цепи рецептора IL-7 (IL-7Rα) человека с комплексом TSLP:TSLPR человека.
3. Биспецифическое антитело по п. 1 или 2, где эпитоп TSLP человека, связанный с одним из первого связывающего фрагмента и второго связывающего фрагмента, частично перекрывается эпитопом TSLP человека, связанного с IL-7Rα.
4. Биспецифическое антитело по п. 1, где
аминокислотная последовательность вариабельной области тяжелой цепи первого связывающего фрагмента представлена в SEQ ID NO: 24 и аминокислотная последовательность вариабельной области легкой цепи первого связывающего фрагмента представлена в SEQ ID NO: 21 или
аминокислотная последовательность вариабельной области тяжелой цепи первого связывающего фрагмента представлена в SEQ ID NO: 24 и аминокислотная последовательность вариабельной области легкой цепи первого связывающего фрагмента представлена в SEQ ID NO: 28.
5. Биспецифическое антитело по п. 1, где
аминокислотная последовательность вариабельной области тяжелой цепи второго связывающего фрагмента представлена в SEQ ID NO: 20 и аминокислотная последовательность вариабельной области легкой цепи второго связывающего фрагмента представлена в SEQ ID NO: 21 или
аминокислотная последовательность вариабельной области тяжелой цепи второго связывающего фрагмента представлена в SEQ ID NO: 20 и аминокислотная последовательность вариабельной области легкой цепи второго связывающего фрагмента представлена в SEQ ID NO: 28.
6. Биспецифическое антитело по любому из пп. 1-5, где
указанное биспецифическое антитело представляет собой антитело IgG1, содержащее первую константную область тяжелой цепи и вторую константную область тяжелой цепи, где
аминокислоты в положениях 354 и 366 первой константной области тяжелой цепи представляют собой С и W соответственно и аминокислоты в положениях 349, 366, 368 и 407 второй константной области тяжелой цепи представляют собой С, S, А и V соответственно;
и положения аминокислот константных областей антитела определены согласно нумерации в соответствии с индексом EU.
7. Биспецифическое антитело по любому из пп. 1-5, где
указанное биспецифическое антитело представляет собой антитело IgG1, содержащее первую константную область тяжелой цепи и вторую константную область тяжелой цепи, где
аминокислоты в положениях 234, 235 и 331 первой константной области тяжелой цепи и второй константной области тяжелой цепи представляют собой F, Е и S соответственно;
и положения аминокислот константных областей антитела определены согласно нумерации в соответствии с индексом EU.
8. Биспецифическое антитело по любому из пп. 1-7, где
формы первого связывающего фрагмента и второго связывающего фрагмента независимо выбраны из одноцепочечного вариабельного фрагмента (scFv) или Fab-фрагмента; предпочтительно и первый связывающий фрагмент, и второй связывающий фрагмент представляют собой Fab-фрагменты.
9. Биспецифическое антитело по любому из пп. 1-7, где
первый связывающий фрагмент и второй связывающий фрагмент имеют одинаковую вариабельную область легкой цепи; предпочтительно первый связывающий фрагмент и второй связывающий фрагмент содержат одинаковую легкую цепь.
10. Биспецифическое антитело по любому из пп. 1-7, которое содержит тяжелую цепь, представленную в SEQ ID NO: 38, и легкую цепь, представленную в одной из SEQ ID NO: 39 и 40.
11. Биспецифическое антитело по любому из пп. 1-7, которое содержит тяжелую цепь, представленную в SEQ ID NO: 41, и легкую цепь, представленную в одной из SEQ ID NO: 39 и 40.
12. Моноклональное антитело, которое связывается с TSLP человека, содержащее HCDR1, представленную в SEQ ID NO: 29, HCDR2, представленную в SEQ ID NO: 30, HCDR3, представленную в SEQ ID NO: 31, LCDR1, представленную в SEQ ID NO: 32, LCDR2, представленную в SEQ ID NO: 33, и LCDR3, представленную в SEQ ID NO: 34;
где аминокислотные последовательности HCDR и LCDR определены согласно нумерации Kabat.
13. Моноклональное антитело по п. 12, аминокислотная последовательность вариабельной области тяжелой цепи которого представлена в SEQ ID NO: 24 и аминокислотная последовательность вариабельной области легкой цепи которого представлена в SEQ ID NO: 21 или
аминокислотная последовательность вариабельной области тяжелой цепи которого представлена в SEQ ID NO: 24 и аминокислотная последовательность вариабельной области легкой цепи которого представлена в SEQ ID NO: 28.
14. Применение биспецифического антитела по любому из пп. 1-11 или моноклонального антитела по п. 12 или 13 в изготовлении лекарственного средства для предупреждения или лечения опосредованного TSLP заболевания; предпочтительно опосредованное TSLP заболевание выбрано из группы, состоящей из астмы, склеродермии, системной красной волчанки, ревматоидного артрита, синдрома Черджа-Стросса, гранулематоза Вегенера, аллергической пневмонии, атопического дерматита, ринита, болезни Крона, псориатического артрита, хронического нефрита, синдрома Шегрена и рассеянного склероза.
15. Способ предупреждения или лечения опосредованного TSLP заболевания, включающий введение нуждающемуся в этом субъекту биспецифического антитела по любому из пп. 1-11 или моноклонального антитела по п. 12 или 13; предпочтительно опосредованное TSLP заболевание выбрано из группы, состоящей из астмы, склеродермии, системной красной волчанки, ревматоидного артрита, синдрома Черджа-Стросса, гранулематоза Вегенера, аллергической пневмонии, атопического дерматита, ринита, болезни Крона, псориатического артрита, хронического нефрита, синдрома Шегрена и рассеянного склероза.
| МОЛЕКУЛЫ, СВЯЗЫВАЮЩИЕСЯ С ТИМУСНЫМ СТРОМАЛЬНЫМ ЛИМФОПОЭТИНОМ (TSLP), И СПОСОБЫ ПРИМЕНЕНИЯ ТАКИХ МОЛЕКУЛ | 2016 |
|
RU2731644C2 |
| CN 111171150 A, 19.05.2020 | |||
| WO 2020252907 A1, 24.12.2020 | |||
| WO 2007096149 A1, 30.08.2007 | |||
| GAIL M | |||
| GAUVREAU, PH.D | |||
| et al | |||
| Effects of an Anti-TSLP Antibody on Allergen-Induced Asthmatic Responses, New England Journal of Medicine, 2014, 370(22), 2102-2110, doi:10.1056/nejmoa1402895. | |||
Авторы
Даты
2024-08-26—Публикация
2021-06-17—Подача