Предлагаемое изобретение относится к области медицинской микробиологии и является элективно-дифференциальной питательной средой, которая может быть использована в лабораторной практике при выделении штаммов Klebsiella spp. (Klebsiella pneumonia, Klebsiella oxytoca) из клинического материала, пищевых продуктов и объектов окружающей среды. Питательная среда содержит в качестве азотистой питательной основы пептон ферментативный сухой (для бактериологических целей); L-Арабинозу - в качестве источника углерода; мочевину для выявления уреазной активности; железо (II) сернокислое семиводное - в качестве ингибитора роста посторонней микрофлоры; крезоловый красный водорастворимый - в качестве индикатора изменения pН среды; агар-агар микробиологический, воду дистиллированную. Изобретение позволяет повысить эффективность выделения Klebsiella spp., сократить срок их идентификации по принципу биохимической активности и специфической окраски колоний. Таким образом, изобретение сокращает время лабораторной диагностики микроорганизмов рода Klebsiella.
Экологическими резервуарами бактерий рода Klebsiella (в том числе, вирулентных) служат воды поверхностных водоемов, сточные воды, растения, промышленные стоки (Пай Г.В. с соавт., 2020) [10]. Они являются представителями нормальной транзиторной микрофлоры человека, но, в то же время, возбудителями различных инфекционных заболеваний потому, что обладают выработанной устойчивостью ко многим факторам внешней среды, в частности, к большинству антибактериальных препаратов (Меджидов М.М., 2008; Рахманин Ю.А. с соавт., 2016) [5, И]. Это приводит к возникновению острых кишечных инфекций, сепсисов, конъюнктивитов, поражениям легких, печени у людей с ослабленной иммунной системой (Анганова Е.В. с соавт., 2010; Choby J.E. et al., 2020) [1, 14]. Последние обстоятельства указывают на то, что клебсиеллы из окружающей среды могут представлять угрозу для здоровья человека (Lightfoot N., 2003) [15].
Бактериологические исследования, направленные на обнаружение клебсиелл и других энтеробактерий, проводят по одной схеме. При этом используются селективно-дифференциальные среды типа Эндо, Левина, Плоскирева, Мак-Конки. Принцип их работы основан на утилизации бактериями кишечной группы лактозы. Это не позволяет отличить Klebsiella spp. от других представителей Enterobacteriaceae.
Такого же рода обстоятельства возникают при использовании элективно-дифференциальных сред с рамнозой или инозитом, в состав которых наряду с вышеуказанными соединениями входят ингибиторы роста посторонней микрофлоры (желчь, желчные соли, кристаллвиолет, бриллиантовый зеленый, антибиотики), когда, например, дифференциация К. pneumoniae от Serratia spp. очень затруднительна. К тому же эти среды (модифицированный агар Мак-Конки, М-Агар FC для клебсиелл, дифференциально-элективная питательная среда для выделения клебсиелл и др.) являются слабоселективными. В связи с этим требуется постановка дополнительных тестов и манипуляций для выделения чистых культур клебсиелл.
Изобретение относится к области медицинской микробиологии и может быть использовано для выделения Klebsiella spp. из клинического материала, пищевых продуктов и объектов окружающей среды.
В основе предлагаемого способа лежит применение питательной среды, которая содержит в %:
1. Пептон сухой ферментативный для бактериологических целей - 0,9-1,4;
2. L-Арабиноза - 0,2-1,0;
3. Железо (II) сернокислое семиводное - 0,01-0,06;
4. Мочевина - 0,2-1,0;
5. Крезоловый красный водорастворимый - 0,00005-0,004;
6. Агар-агар микробиологический - 1,0-1,5;
7. Вода дистиллированная - до 100%,
pН готовой среды 7,2±0,2.
Бактерии рода Klebsiella - грамотрицательные микроорганизмы, принадлежащие к семейству Enterobacteriaceae порядка Enterobacterial. Род Klebsiella представлен более чем 12 видами, из которых чаще встречаются К. pneumoniae и К. oxytoca (Бардашева А.В. с соавт., 2021) [2].
Известна питательная среда «Хромогенная питательная среда для выделения и идентификации клебсиелл», предложенная М.М. Меджидовым с соавт. [6]. Данная среда имеет следующий состав (г/л):
1. Питательный агар сухой - 35,0-40,0;
2. Глюкоза - 5,0-6,0;
3. 5-аминосалициловая кислота - 2,0-3,0;
4. Экстракт кормовых дрожжей - 3,0-5,0;
5. Парааминобензойная кислота - 0,01-0,02;
6. Бромтимоловый синий - 0,08-0,09;
7. Трис-буфер - 1,0-1,5;
8. Натрий углекислый - 0,6-0,7;
9. Бриллиантовый зеленый - 0,0001-0,0002;
10. Агар микробиологический - 2,5-3,0;
11. Вода дистиллированная - до 1 литра.
pН 7,4±0,2. Данную питательную среду получают следующим образом. В 1 литр дистиллированной воды вносят навески сухого питательного агара, экстракта кормовых дрожжей, парааминобензойной кислоты, трис-буфера, натрия углекислого, бриллиантового зеленого. Смесь тщательно перемешивают, троекратно кипятят 1-2 мин при помешивании, не допуская пригорания агара, до появления крупнопузырчатой пены. Среду охлаждают до 45-50°С и разливают в стерильные чашки Петри. После застывания и подсушивания чашек со средой на нее наносят исследуемый материал, затем инкубируют при 37°С в течение 24 ч. Через 24 ч от начала культивирования K. pneumoniae, K. oxytoca, K. mobilis образуют типичные колонии коричневого цвета, диаметром 1,5-2,0 мм в S-форме с коричневым преципитатом вокруг них из-за воздействия на 5-аминосалициловую кислоту фермента 5-аминосалицилатдекарбоксилазы, наличие которого характерно только для Klebsiella spp. Остальные энтеробактерии вырастают в виде типичных для каждого вида колоний желтого цвета на фоне бутылочно-зеленого цвета питательной среды. Коричневый преципитат вокруг этих колоний отсутствует. Рост грамположительных микроорганизмов подавляется благодаря внесению в эту среду бриллиантового зеленого. Данная питательная среда является хромогенной и не может позволить выделить только лишь представителей рода Klebsiella, а также имеет довольно сложный с дорогостоящими ингредиентами состав, в который необходимо вводить стимуляторы роста - экстракт кормовых дрожжей и парааминобензойную кислоту. Таким образом, назначение указанной среды не совпадает с назначением (решением задач) предлагаемой нами.
Разработанная нами среда является хромогенной, содержит селективную добавку ввиде соли железа валентностью 2, позволяющую задерживать, блокировать рост посторонней микрофлоры и других энтеробактерий кроме представителей рода Klebsiella, а также являющуюся стимулятором гиперкапсулообразования у K. pneumoniae, что позволяет разделять гипермукоидные и классические варианты клинических штаммов K. pneumoniae, что невозможно на других селективных средах.
Кроме того, в состав среды не входят ионы натрия и калия (в отличии большинства сред), что также является селективным фактором для роста посторонней микрофлоры и других энтеробактерий, нуждающихся в этих ионах, за исключением представителей рода Klebsiella. В качестве индикатора и селективного фактора нами использован крезоловый красный блокирующий рост других энтеробактерий, но не активный в отношении представителей рода Klebsiella.
Известен способ выделения и идентификации бактерий рода Klebsiella с помощью среды, предложенной Сиволодским Е.П. [12]. Данная среда имеет следующий состав (г/л):
1. L-пролин - 2,0-2,5;
2. L-глутамат натрия - 5,0-6,0;
3. L-арабиноза - 10,0;
4. 5-аминосалициловая кислота - 3,0-5,0;
5. Na2CO3⋅10H2O - 2,0-3,3;
6. NaCl - 5,0;
7. КН2РО4 - 0,5;
8. MgSO4 - 0,l;
9. Агар микробиологический - 12,0;
10. Вода дистиллированная - до 1 литра;
pН 7,2±0,2.
Эту питательную среду приготовляют путем внесения порошка смеси ингредиентов кроме суплементов 5-аминосалициловой кислоты и углекислого натрия в дистиллированную воду, растворяют при нагревании, добавляют суплементы, кипятят в течение 5 минут, разливают в стерильные чашки Петри. Посевы инкубируют при 35°С в аэробных условиях 24-48 ч, после чего определяют принадлежность выросших колоний микроорганизмов к роду Klebsiella по образованию вокруг последних зоны темно-коричневой окраски питательной среды. Хотя, по заявлению автора, данная среда позволяет выделять клебсиеллы с высокой долей вероятности и на ней подавляется рост грамположительных бактерий (например, рода Bacillus); она является хромогенной и синтетической. Применение этой питательной среды не дает возможности выявлять исключительно Klebsiella spp. из-за штаммовых различий по питательным потребностям последних. Некоторые ингредиенты, входящие в ее состав (L-пролин, L-глутамат натрия, 5-аминосалициловая кислота) дороги. Таким образом, назначение указанной среды не совпадает с назначением (решением задач) предлагаемой нами.
Наиболее близкой к предлагаемой питательной среде является питательная среда К-2 (Калина Г.П., 1980) [4]. В состав этой среды входят натрий хлористый, магний сернокислый, двузамещенный фосфат калия, однозамещенный фосфат калия, сульфат калия, раффиноза, мочевина, бромтимоловый синий, кристаллический фиолетовый, агар микробиологический, дистиллированную воду. На этой среде Klebsiella spp. образуют округлые, блестящие слизистые, желтые, зеленые с желтым центром или голубые колонии.
Недостатком прототипа является слабая селективность в отношении бактерий родов Enterobacter, Citrobacter и других представителей семейства Enterobacteriaceae; отсутствие четкого отличия колоний клебсиелл по цвету.
Технической задачей предлагаемого изобретения является создание новой питательной среды для выделения чистых культур Klebsiella spp. из клинического материала, пищевых продуктов и объектов окружающей среды путем применения элективно-дифференциальной питательной среды, позволяющей сократить сроки дифференциации клебсиелл.
Поставленная задача достигается путем применения элективно-дифференциальной питательной среды, позволяющей дифференцировать клебсиеллы по наличию ферментации L-арабинозы и уреазной активности.
Цель изобретения достигается при использовании питательной среды, содержащей (в %):
1. Пептон ферментативный для бактериологических целей - 0,9-1,4;
2. L-Арабиноза ЧДА или ХЧ - 0,2-1,0;
3. Мочевина ЧДА или ХЧ - 0,2-1,0;
4. Железо (II) сернокислое семиводное - 0,01-0,06;
5. Крезоловый красный водорастворимый ЧДА или ХЧ - 0,0005-0,004;
6. Агар-агар микробиологический - 1-1,5;
7. Вода дистиллированная - до 1 литра.
РН 7,2±0,2.
Колонии округлые, полупрозрачные, выпуклые, с ровным краем, слизистые, малиновые. Цвет среды в области роста колоний становится малиновым.
Способ приготовления питательной среды осуществляется по следующей технологии.
В стеклянную термостойкую вносят навески пептона сухого ферментативного для бактериологических целей, мочевины, крезолового красного водорастворимого, агар-агара. Добавляют дистиллированную воду до 1000 мл. Устанавливают pН 7,2±0,2 при помощи 20% водного раствора гидроокиси натрия и 12% водного раствора соляной кислоты. Нагревают в паровом стерилизаторе текучим паром в течение 45-65 минут или кипятят на электроплитке при постоянном помешивании, не допуская пригорания агаровых частиц, в течение 2-3 минут после полного растворения агара. Вносят навески L-арабинозы и железа (II) сернокислого семиводного с последующим перемешиванием до их полного растворения. Питательную среду стерилизуют кипячением в течение 2-3 минут.
Питательную среду асептично разливают в стерильные чашки Петри по 20-30 мл и оставляют застывать на ровной поверхности. Цвет питательной среды - желтый. Готовая питательная среда, разлитая в чашки Петри может храниться не более 15 дней при температуре от 2 до 8°С.
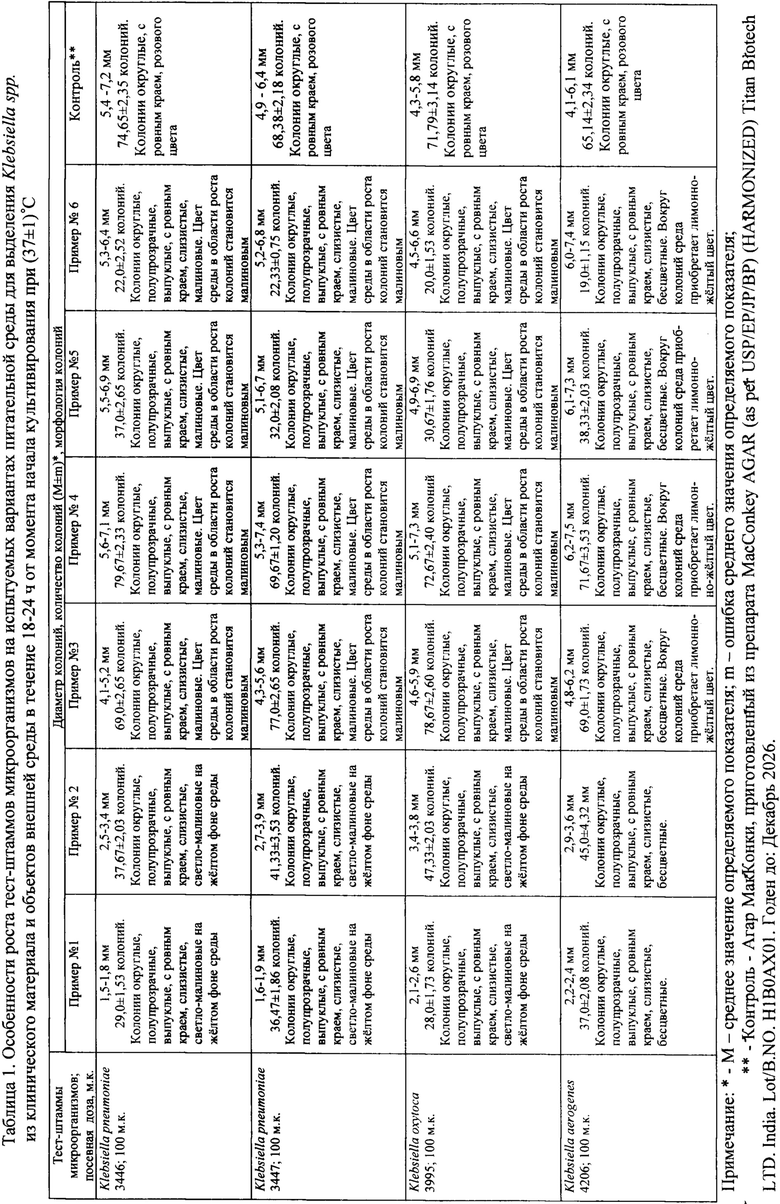
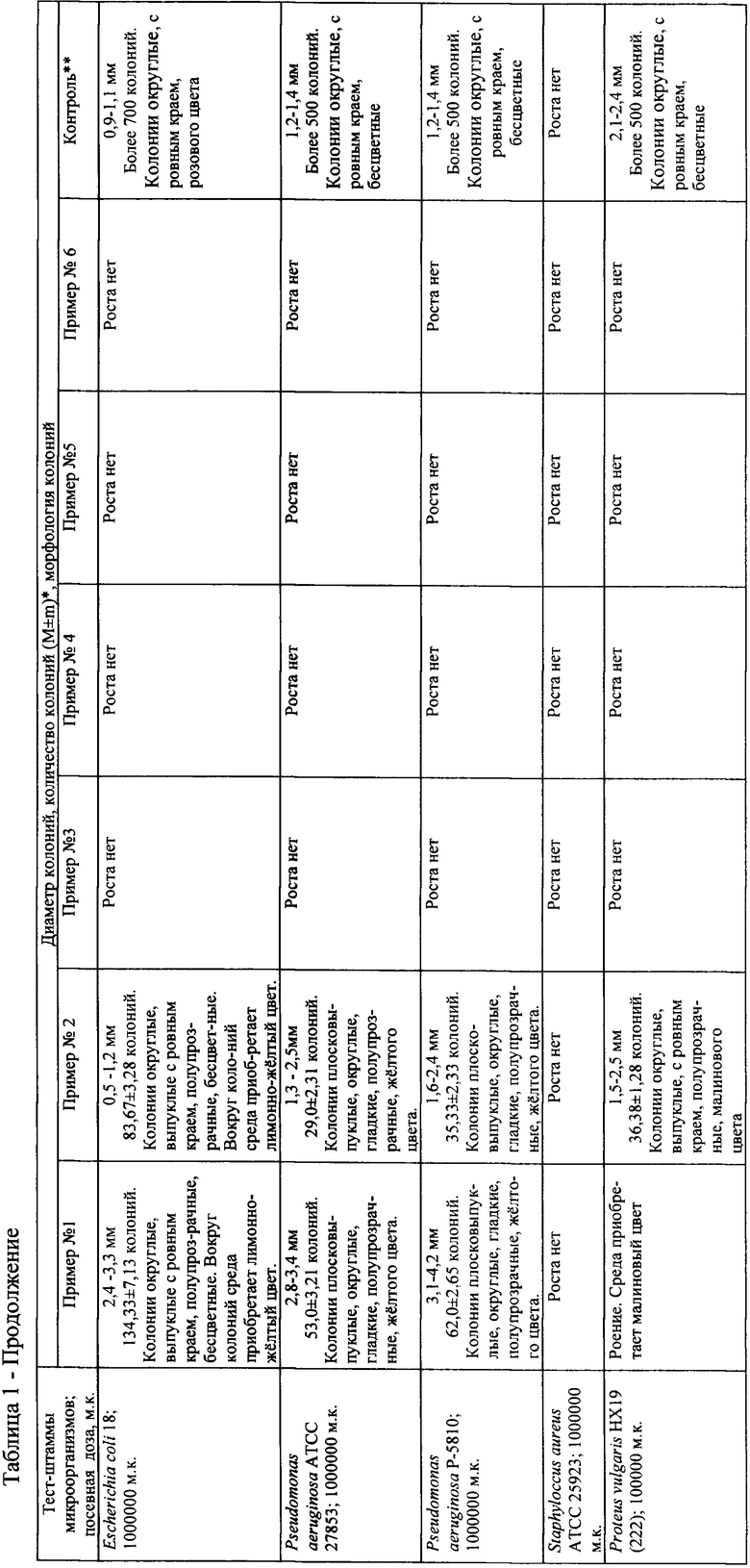
Качество предлагаемого способа выделения Klebsiella spp. из объектов окружающей среды и биологического материала проверяют следующим образом.
Перед проверкой качества предлагаемого способа тест-штаммы К. pneumoniae 3446, К. pneumoniae 3347, К. oxytoca 3955, К. aerogenes 4206, Е. coli 18, P. aeruginosa АТСС 27853, P. aeruginosa Р-5810, S. aureus АТСС 25925, P. vulgaris НХ19 (222) подготавливают к контролю в соответствии с требованиями МУК 4.2.2316-08 [].
Пример 1
Готовят питательную среду следующего состава: в чистую 2-литровую колбу вносят:
1. Пептон ферментативный для бактериологических целей - 0,9%;
2. L-Арабиноза ЧДА или ХЧ - 0,2%;
3. Мочевина ЧДА или ХЧ - 0,2%;
4. Железо (II) сернокислое семиводное - 0,01%;
5. Крезоловый красный водорастворимый ЧДА или ХЧ - 0,0005%;
6. Агар-агар микробиологический - 1,0%;
7. Вода дистиллированная - до 1 литра.
Устанавливают pН 7,2±0,2 при помощи 20% водного раствора гидроокиси натрия и 12% водного раствора соляной кислоты. Смесь кипятят на электроплитке при постоянном помешивании, не допуская пригорания агаровых частиц, в течение 2-3 минут после полного растворения агара или в паровом стерилизаторе (в режиме текучего пара) в течение 45 - 65 мин. Затем добавляют навески L-арабинозы - 0,2% и железа (II) сернокислого семиводного - 0,01% с последующим перемешиванием до полного растворения ингредиентов. Питательную среду асептично разливают в стерильные чашки Петри по 20-30 мл и оставляют застывать на ровной поверхности. Цвет полученной питательной среды - желтый.
Для контроля качества полученной элективной питательной среды используют тест-штаммы К. pneumoniae 3446, К. pneumoniae 3347, К. oxytoca 3955, К. aerogenes 4206, Е. coli 18, P. aeruginosa АТСС 27853, P. aeruginosa Р-5810, S. aureus АТСС 25925, P. vulgaris НХ19 (222), хранящиеся и подготовленные к посеву согласно МУК 4.2.2316-08 [7]. Суточную культуру каждого из них суспендируют в стерильном 0,9% растворе хлорида натрия, забуференного 1/150 М калий-натрий фосфатным буфером pН (7,1±0,1) до концентрации 1 × 109 м.к./мл по стандартному образцу мутности ОСО-42-28-85П (ФГБУ «НЦЭСМП» Минздрава России). Приготовленные взвеси тест-штаммов К. pneumoniae 3446, К. pneumoniae 3347, К. oxytoca 3955, К. aerogenes 4206 последовательно разводят в стерильном 0,9% растворе хлорида натрия, забуференного 1/150 М калий-натрий фосфатным буфером pН (7,1±0,1) с десятикратным интервалом до разведения 10-6 (1000 м.к./мл). Взвеси тест-штаммов, используемые в качестве микробов-ассоциантов: Е. coli 18, P. aeruginosa АТСС 27853, P. aeruginosa Р-5810, S. aureus АТСС 25925, P. vulgaris НХ19 (222) также разводят с десятикратным интервалом последовательно до разведений 10-2 (1000000 м.к./мл) и до 10-3 (1000000 м.к./мл) - P. vulgaris НХ19 (222).
Посев тест-штаммов осуществляют по 0,1 мл из каждого разведения с последующей инкубацией при (37±1)°С в течение 18-24 ч, затем проводят учет результатов.
Как видно из таблицы 1, осуществление предлагаемого способа при применении среды указанного состава не соответствует требованиям Методических указаний по микробиологической диагностике заболеваний, вызываемых энтеробактериями МУ 04-723/3 [9], МУК 4.2.3115-13 «Лабораторная диагностика внебольничных пневмоний» [8], т.к. присутствует рост микробов-ассоциантов. Искомые микроорганизмы выявить практически невозможно.
Пример 2
Готовят питательную среду следующего состава: в чистую 2-литровую колбу вносят:
1. Пептон ферментативный для бактериологических целей - 1,0%;
2. L-Арабиноза ЧДА или ХЧ - 0,3%;
3. Мочевина ЧДА или ХЧ - 0,3%;
4. Железо (II) сернокислое семиводное - 0,015%;
5. Крезоловый красный водорастворимый ЧДА или ХЧ - 0,001%;
6. Агар-агар микробиологический - 1,1%;
7. Вода дистиллированная - до 1 литра.
Устанавливают pН 7,2±0,2 при помощи 20% водного раствора гидроокиси натрия и 12% водного раствора соляной кислоты.
В ходе приготовления и испытания среды использованы методические приемы, как в примере 1.
Как видно из таблицы 1, осуществление предлагаемого способа при применении среды указанного состава не соответствует требованиям Методических указаний по микробиологической диагностике заболеваний, вызываемых энтеробактериями МУ 04-723/3 [9], МУК 4.2.3115-13 «Лабораторная диагностика внебольничных пневмоний» [8], т.к. присутствует рост микробов-ассоциантов. Искомые микроорганизмы выявить было практически невозможно.
Пример 3
Готовят питательную среду следующего состава: в чистую 2-литровую колбу вносят:
1. Пептон ферментативный для бактериологических целей - 1,1%;
2. L-Арабиноза ЧДА или ХЧ - 0,4%;
3. Мочевина ЧДА или ХЧ - 0,4%;
4. Железо (II) сернокислое семиводное - 0,025%;
5. Крезоловый красный водорастворимый ЧДА или ХЧ - 0,0015%;
6. Агар-агар микробиологический - 1,2%;
7. Вода дистиллированная - до 1 литра.
Устанавливают pН 7,2±0,2 при помощи 20% водного раствора гидроокиси натрия и 12% водного раствора соляной кислоты.
В ходе приготовления и испытания среды используют методические приемы, как в примере 1.
Как видно из таблицы 1, осуществление предлагаемого способа при применении среды указанного состава соответствует требованиям Методических указаний по микробиологической диагностике заболеваний, вызываемых энтеробактериями МУ 04-723/3 [9], МУК 4.2.3115-13 «Лабораторная диагностика внебольничных пневмоний [8]» и позволяет выявлять Klebsiella spp.
Пример 4
Готовят питательную среду следующего состава: в чистую 2-литровую колбу вносят:
1. Пептон ферментативный для бактериологических целей - 1,2%;
2. L-Арабиноза ЧДА или ХЧ - 0,5%;
3. Мочевина ЧДА или ХЧ - 0,5%;
4. Железо (II) сернокислое семиводное - 0,03%;
5. Крезоловый красный водорастворимый ЧДА или ХЧ - 0,002%;
6. Агар-агар микробиологический - 1,3%;
7. Вода дистиллированная - до 1 литра.
Устанавливают pН 7,2±0,2 при помощи 20% водного раствора гидроокиси натрия и 12% водного раствора соляной кислоты.
В ходе приготовления и испытания среды используют методические приемы, как в примере 1.
Как видно из таблицы 1, осуществление предлагаемого способа при применении среды указанного состава соответствует требованиям Методических указаний по микробиологической диагностике заболеваний, вызываемых энтеробактериями МУ 04-723/3 [9], МУК 4.2.3115-13 «Лабораторная диагностика внебольничных пневмоний [8]» и позволяет выявлять Klebsiella spp.
Пример 5
Готовят питательную среду следующего состава: в чистую 2-литровую колбу вносят:
1. Пептон ферментативный для бактериологических целей - 1,3%;
2. L-Арабиноза ЧДА или ХЧ - 0,7%;
3. Мочевина ЧДА или ХЧ - 0,7%;
4. Железо (II) сернокислое семиводное - 0,05%;
5. Крезоловый красный водорастворимый ЧДА или ХЧ - 0,003%;
6. Агар-агар микробиологический - 1,4%;
7. Вода дистиллированная - до 1 литра.
Устанавливают рН 7,2±0,2 при помощи 20% водного раствора гидроокиси натрия и 12% водного раствора соляной кислоты.
В ходе приготовления и испытания среды используют методические приемы, как в примере 1.
Как видно из таблицы 1, осуществление предлагаемого способа при применении среды указанного состава не соответствует требованиям Методических указаний по микробиологической диагностике заболеваний, вызываемых энтеробактериями МУ 04-723/3 [9], МУК 4.2.3115-13 «Лабораторная диагностика внебольничных пневмоний» [8]. Происходит снижение значений диаметра колоний и показателя прорастания (из посевной дозы 100 м.к.) элективно-дифференциальной питательной среды в отношении использованных для контроля штаммов К. pneumoniae, К. oxytoca, К. aerogenes.
Пример 6
Готовят питательную среду следующего состава: в чистую 2-литровую колбу вносят:
1. Пептон ферментативный для бактериологических целей - 1,3%;
2. L-Арабиноза ЧДА или ХЧ - 0,7%;
3. Мочевина ЧДА или ХЧ - 0,7%;
4. Железо (II) сернокислое семиводное - 0,05%;
5. Крезоловый красный водорастворимый ЧДА или ХЧ - 0,003%;
6. Агар-агар микробиологический - 1,4%;
7. Вода дистиллированная - до 1 литра.
Устанавливают рН 7,2±0,2 при помощи 20% водного раствора гидроокиси натрия и 12% водного раствора соляной кислоты.
В ходе приготовления и испытания среды используют методические приемы, как в примере 1.
Как видно из таблицы 1, осуществление предлагаемого способа при применении среды указанного состава не соответствует требованиям Методических указаний по микробиологической диагностике заболеваний, вызываемых энтеробактериями МУ 04-723/3 [9], МУК 4.2.3115-13 «Лабораторная диагностика внебольничных пневмоний» [8]. Происходит снижение значений диаметра колоний и показателя прорастания (из посевной дозы 100 м.к.) элективно-дифференциальной питательной среды в отношении использованных для контроля штаммов К. pneumoniae, К. oxytoca, К. aerogenes за счет возрастания содержания ингибитора - железа (II) сернокислого семиводного и повышения плотности агарового геля.
Таким образом, приведенные данные позволяют сделать вывод, что осуществление предлагаемого способа выделения Klebsiella spp. с применением сред, составленных по примерам №1, №2, №5 и №6 не удовлетворяет требованиям
Осуществление указанного выше способа удовлетворяет требованиям МУ 04-723/3, МУК 4.2.3115-13 с применением сред, состав которых приведен в примерах №3 и №4. Использование среды, указанной в примере №3, является экономически более выгодным.
Источники информации
1. Анганова, Н.В. Характеристика условно-патогенных возбудителей острых кишечных инфекций / Е.В. Анганова, Н.Н. Чемезова, Н.В. Ермолаева, Л.А. Распопина // Журнал инфекционной патологии. 2010. - №19. - С. 12-23.
2. Бардашева, А.В. Генетическая характеристика клинических изолятов клебсиелл, циркулирующих в Новосибирске / А.В. Бардашева, Н.В. Фоменко, Т.В. Калимбетова, И.В. Бабкин, С.О. Кретьен, Е.В. Жираковская, Н.В. Тикунова, В.В. Морозова // Вавиловский журнал генетики и селекции. 2021. Т.25. - №2. - С. 234-245.
3. Ибрагимов Ф.Х., Журавлева Л.А., Бочановский В.А., Резаев А.А. Селективная питательная среда для выделения клебсиелл. Патент РФ № RU 2265056. Опубл. 27.11.2005. Бюл. №33.
4. Калина, Г.П. Среды узконаправленного действия для обнаружения клебсиелл / Г.П. Калина // ЖМЭИ. 1980. - №6. - С. 28-32.
5. Меджидов, М.М. Региональные проблемы антибиотикорезистентности микроорганизмов // Антибиотикорезистентность и антимикробная химиотерапия: Материалы 2-ой Всероссийской практической конференции. - Махачкала, 2008. С. 5-7.
6. Меджидов М.М., Степанова Э.Д., Юнусова Р.Ю. Хромогенная питательная среда для выделения и идентификации клебсиелл. Патент РФ № RU 2416635. Опубл. 20.04.2011. Бюл. №11.
7. Методические указания: Методы контроля бактериологических питательных сред: МУК 4.2.2316 - 08 (утверждены Главным санитарным врачом Российской Федерации 18.01.2008) М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2008. - 52 с.
8. Методические указания: 4.2. Методы контроля. Биологические и микробиологические факторы. Лабораторная диагностика внебольничных пневмоний: МУК 4.2.3115-13 (утверждены Главным санитарным врачом Российской федерации 21.10.2013). М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2014. - 39 с.
9. Методические указания по микробиологической диагностике заболеваний, вызываемых энтеробактериями: МУ 04-723/3 (утверждены зам. министра здравоохранения СССР 17.12.1984). М.: МЗ СССР, 1985. - 32 с.
10. Пай, Г.В. сравнение патогенного потенциала изолятов Klebsiella pneumonia, выделенных из кишечной микробиоты человека, из поверхностных сточных вод //Г.В. Пай, Д.В. Ракитина, Н.Н. Пенькова, СМ. Юдин, А.В. Загайнова // Гигиена и санитария. 2020. Т. 99. - №19. - С. 1360-1364.
11. Рахманин, Ю.А. Распространение бактерий рода Klebsiella в водных объектах и их значение в возникновении водообусловленных острых кишечных инфекций / Ю.А. Рахманин, Л.В. Иванова, Т.З. Артемова, Е.К. Гипп, А.В. Загайнова, Т.Н. Максимкина, А.В. Красняк, П.В. Журавлев, В.В. Алешня, О.В. Панасовец // Гигиена и санитария. 2016. Т.95.- №4.- С. 397-406.
12. Сиволодский Е.П. Способ выделения и идентификации бактерий рода Klebsiella. Патент РФ № RU 2535881. Опубл. 20.12.2014. Бюл. №35.
13. Шепелин А.П., Марчихина И.И., Полосенко О.В., Шолохова Л.П. Дифференциально-элективная питательная среда для выделения клебсиелл. Патент РФ № RU 2704854. Опубл. 31.10.2019. Бюл. №31.
14. Choby, J.E. Hypervirulent Klebsiella pneumoniae - clinical and molecular perspectives (Review) / J.E. Choby, J. Howard-Anderson, D.S. Weiss // J. Intern. Med. - 2020, № 287. - P. 283-300.
15. Lightfoot, N. Bacteria of potential health concern. In: World Health Organization (WHO). Heterotrophic Plate Counts and Drinking Water Safety. London; 2003:61-79.
| название | год | авторы | номер документа |
|---|---|---|---|
| Элективная питательная среда для выделения Pseudomonas aeruginosa | 2024 |
|
RU2827845C1 |
| Дифференциально-элективная питательная среда для выделения клебсиелл | 2019 |
|
RU2704854C1 |
| СПОСОБ ОПТИМАЛЬНОЙ ИДЕНТИФИКАЦИИ НАИБОЛЕЕ ЧАСТО ВСТРЕЧАЮЩИХСЯ ЦИТРАТ-АССИМИЛИРУЮЩИХ ЭНТЕРОБАКТЕРИЙ, ИМЕЮЩИХ МЕДИЦИНСКОЕ ЗНАЧЕНИЕ | 2016 |
|
RU2646101C2 |
| ХРОМОГЕННАЯ ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫЯВЛЕНИЯ И ИДЕНТИФИКАЦИИ КЛЕБСИЕЛЛ | 2008 |
|
RU2416635C2 |
| СПОСОБ ВЫДЕЛЕНИЯ И ИДЕНТИФИКАЦИИ БАКТЕРИЙ PSEUDOMONAS AERUGINOSA | 2017 |
|
RU2658435C1 |
| СПОСОБ ВЫДЕЛЕНИЯ И ИДЕНТИФИКАЦИИ БАКТЕРИЙ РОДА KLEBSIELLA | 2013 |
|
RU2535881C1 |
| СПОСОБ ВИДОВОЙ МИКРОБИОЛОГИЧЕСКОЙ ДИАГНОСТИКИ УСЛОВНО-ПАТОГЕННЫХ ЭНТЕРОБАКТЕРИЙ | 2006 |
|
RU2327160C2 |
| СРЕДА ДЛЯ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ЭНТЕРОБАКТЕРИЙ | 2008 |
|
RU2376384C2 |
| СПОСОБ ВЫДЕЛЕНИЯ И ИДЕНТИФИКАЦИИ БАКТЕРИЙ КОМПЛЕКСА ACINETOBACTER CALCOACETICUS - ACINETOBACTER BAUMANNII | 2017 |
|
RU2660567C1 |
| Питательная среда для селективного выделения Pseudomonas aeruginosa - модифицированная Среда Блеск | 2024 |
|
RU2834480C1 |
Изобретение относится к области биотехнологии и является элективно-дифференциальной питательной средой. Питательная среда содержит в качестве азотистой питательной основы пептон ферментативный сухой (для бактериологических целей); L-Арабинозу - в качестве источника углерода; мочевину для выявления уреазной активности; железо (II) сернокислое семиводное - в качестве ингибитора роста посторонней микрофлоры; крезоловый красный водорастворимый - в качестве индикатора изменения pН среды; агар-агар микробиологический, воду дистиллированную. Изобретение позволяет повысить эффективность выделения Klebsiella spp., сократить срок их идентификации по принципу биохимической активности и специфической окраски колоний. Таким образом, изобретение сокращает время лабораторной диагностики микроорганизмов рода Klebsiella. 1 табл., 6 пр.
Элективно-дифференциальная питательная среда для выделения Klebsiella spp., содержащая в качестве азотистой питательной основы пептон сухой ферментативный для бактериологических целей, мочевину, агар-агар микробиологический, воду дистиллированную, отличающаяся тем, что в качестве источника углерода она дополнительно содержит L-Арабинозу, железо (II) сернокислое семиводное - в качестве ингибитора роста посторонней микрофлоры, крезоловый красный водорастворимый - в качестве индикатора изменения рН среды при следующем содержании компонентов:
Пептон сухой ферментативный для бактериологических целей - 0,9-1,4%;
L-Арабиноза - 0,2-1,0%;
Железо (II) сернокислое семиводное - 0,01-0,06%;
Мочевина - 0,2-1,0%;
Крезоловый красный водорастворимый - 0,00005-0,004%;
Агар-агар микробиологический - 1,0-1,5%;
Вода дистиллированная - до 100%,
pН готовой среды 7,2±0,2.
| КАЛИНА, Г.П | |||
| Среды узконаправленного действия для обнаружения клебсиелл, ЖМЭИ | |||
| Способ получения фтористых солей | 1914 |
|
SU1980A1 |
| Видоизменение прибора с двумя приемами для рассматривания проекционные увеличенных и удаленных от зрителя стереограмм | 1919 |
|
SU28A1 |
| СЕЛЕКТИВНАЯ ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ КЛЕБСИЕЛЛ | 2003 |
|
RU2265056C2 |
| CHOBY, J.E | |||
| Hypervirulent Klebsiella pneumoniae - clinical and molecular perspectives (Review), J | |||
| Intern | |||
| Med, 2020, N 287, p | |||
| ПРИБОР ДЛЯ ОПРЕДЕЛЕНИЯ ОСАДКИ ВАЛОВ ПАРОВЫХ ТУРБИН | 1917 |
|
SU283A1 |
Авторы
Даты
2024-10-02—Публикация
2024-03-26—Подача