Изобретение относится к клинической и санитарной микробиологии и может быть использовано для обнаружения и количественного учета бактерий рода Klebsiellа при исследовании различного биологического материала, а также объектов окружающей среды при подозрении на клебсиеллез.
Представители рода Klebsiellа достаточно широко распространены в природе и могут вызывать инфекционные заболевания, характеризующиеся тяжелым течением, а нередко и летальным исходом.
Алгоритм бактериологического исследования клебсиеллезов соответствует той же схеме, что и при заболеваниях, вызванных другими видами энтеробактерий. Посев материала производят в МПБ, на МПА и на селективные дифференциально-диагностические питательные среды - Эндо, Плоски-рева, Левина, МакКонки, К-2 (МПА с мочевиной, раффинозой и бромтимо-ловым синим). Однако отличить лактозоположительныеклебсиеллы на этих средах от других бактерий группы кишечной палочки (БГКП) весьма затруднительно.
Известны питательные среды для выделения клебсиелл, принцип действия которых основан на утилизации преимущественно клебсиеллами инозита или рамнозы с одновременным добавлением антибиотиков или других ингибиторов сопутствующей микрофлоры (желчные соли, кристаллический фиолетовый и др.).Среды для выделения клебсиелл по признаку расщепления инозита поддерживают рост не только K. pneumoniae, но и Serratiaspp. Дифференциация клебсиелл от серраций по морфологии колоний на этих средах весьма затруднительна.
Использование большинства питательных сред в бактериологической практике диагностики клебсиеллезовмалоинформативно ввиду слабой дифференциации клебсиелл от энтеробактерий (по цвету и морфологии) и слабой селективности, так как не обеспечивается значительное подавление роста всех сопутствующих БГКП.
Выделение на питательной среде чистых культур микроорганизмов с характерными для клебсиеллкультуральными, морфологическими и тинкто-риальными свойствами требует постановки целого ряда подтверждающих тестов, а, следовательно, значительного времени и материальных затрат.
Быстрота получения результатов при микробиологических исследованиях в значительной степени влияет на диагностику, проведение терапевтических и противоэпидемических мероприятий.
В отечественной практике для выделения клебсиелл рекомендована дифференциально-элективная среда К-2 (с мочевиной, раффинозой и бром-тимоловым синим)лабораторного приготовления, кроме того выпускается коммерческий набор питательной среды "Клебсиелла 5-АСК 20"предназначенный для одноэтапного выделения и одновременной идентификации бактерий рода Klebsiella (виды К. pneumoniae, К. oxytoca, К. mobilis). Метод основан на выявлении 5-аминосалицилатдекарбоксилазы -уникального фермента бактерий рода Klebsiella. Этот фермент расщепляет 5-аминосалициловую кислоту (5-АСК) с образованием пара-аминофенола, который под действием кислорода воздуха образует полимер черно-коричневого цвета. В результате хромогенной реакции вокруг колоний патогенных клебсиелл образуется широкая зона черно-коричневой окраски среды, непатогенные виды клебсиелл не дают хромогенную реакцию.
Наиболее близким прототипом предлагаемой питательной среды является АгарМакКонки (модифицированный) по ААЗ MacConkeyAgar, Modified (asperAPHA) фирмы HIMEDIAHa основе пептона,протеазного пептона, и инозита. Селективность среды обусловлена наличием желчных солей, кристаллического фиолетового и карбенициллина, а дифференцирующие свойства наличием индикатора - нейтрального красного.
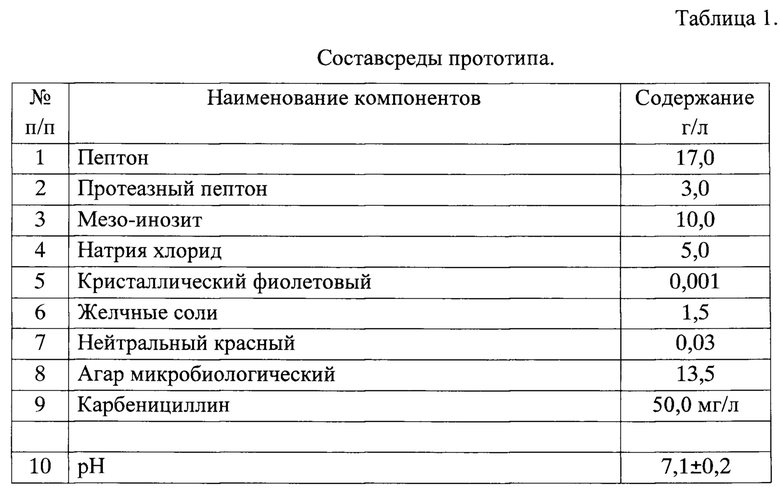
Пептоны являются белковой основой среды и источниками азотистых питательных веществ для роста микроорганизмов, мезоинозит в присутствии индикатора нейтрального красного - дифференцирующим агентом, а кристаллический фиолетовый, желчные соли и карбенициллин ингибируют рост сопутствующих бактерий.
Среда стерилизуется кипячением до полного расплавления агара. Затем, после охлаждения до температуры 50°С, добавляют 50,0 мг/лкарбенициллина и тщательно перемешивают.
Биохимические характеристики коммерческой сухой питательной среды MacConkeyAgar, Мо(Modified представлен в таблице 2.
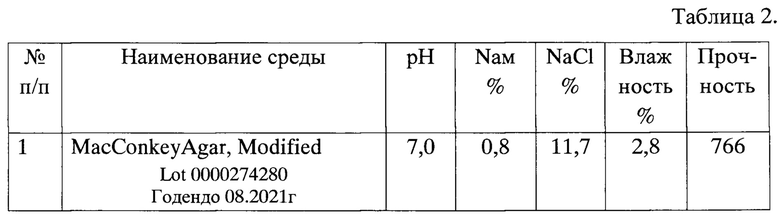
По результатам определения аминного азота (Nам) методом формольного титрования в соответствии с МУК 4.2.2316-08 «Методы контроля бактериологических питательных сред» экспериментально установлено, что содержание в среде составляет 0,8%. Исходя из данных о содержании Nам пептонах производства HIMEDIA, используемых в качестве белковой основы составляющих по 3,5% соответственно, расчетный Nам среды должен быть порядка 1,5%.
Недостатками MacConkeyAgar, Modified фирмы НIМЕDIA являются:
 высокая стоимость;
высокая стоимость;
 несоответствие расчетного содержания Nамистинному в готовой среде;
несоответствие расчетного содержания Nамистинному в готовой среде;
 низкая чувствительность при элективном росте некоторых представителей рода Klebsiella;
низкая чувствительность при элективном росте некоторых представителей рода Klebsiella;
 слабые дифференцирующие свойства среды клебсиелл от эшерихий (в случае большой посевной дозы);
слабые дифференцирующие свойства среды клебсиелл от эшерихий (в случае большой посевной дозы);

Техническим результатом предлагаемого изобретения является создание отечественной сухой дифференциально-элективной питательной среды для выделения клебсиелл, обладающей стабильностью результатов по ростовым, дифференцирующим и ингибирующим свойствам с целью обеспечения доступности и получения объективных результатов бактериологического контроля в возможно более короткие сроки.
Технический результат достигается тем, что предложена питательная среда, содержащая в качестве источника азотистого питания пептон мясной, натрий хлористый, мезо-инозит, соли желчных кислот (СЖК), кристаллический фиолетовый, нейтральный красный и агар микробиологический, причем в качестве белковой основы она дополнительно содержит панкреатический гидролизат рыбной муки, дрожжевой экстракт - источник витаминов и натрий углекислый в качестве стабилизатора рН среды при следующем содержании компонентов г/л:
Состав СД, г/л:
Отличием предлагаемой среды от прототипа является использование сырья отечественного производства - панкреатического гидролизата рыбной муки в качестве белковой основы и отечественных сухих солей желчных кислот (СЖК), полученных из нативной желчи крупного рогатого скота. СЖК получают путем адсорбции примесей активированным углем, с последующей фильтрацией. Затем проводят щелочной гидролиз осветленной желчи 50%-ным раствором натрия гидроокиси с последующим освобождением от непрогидролизованных белков и высокомолекулярных пептидов методом фильтрации, обработку гидролизата 20%-ным хлористым барием, и отстаивание осажденных примесей с последующей фильтрацией. Осаждение желчных кислот в изоэлектрической точке с рН 6,4-6,6 растворение осадка после удаления надосадочной жидкости раствором натрия гидроокиси при рН 7,2-7,4. Заключительный этап подготовки состоит из адсорбции в растворе СЖК примесей активированным углем, фильтрации и высушивания на сушильной установке в виброкипящем слое А1-ФМУ.
Технический результат достигается также сбалансированностью компонентного состава среды в экспериментально установленных концентрациях с использованием СЖК, полученных из отечественного сырья по разработанной промышленной технологии.
Доказана возможность использования панкреатического гидролизата рыбной муки (ПГРМ), в качестве белковой питательной основы в комбинации с пептоном для селективного роста клебсиелл.
Панкреатический гидролизат рыбной муки и пептон мясной обеспечивают ростовые потребности клебсиелл в азотистом питании. СЖК, кристаллический фиолетовый и карбенициллин обеспечивают ингибирующие свойства в отношении нежелательной сопутствующей бактериальной флоры, а мезо-инозит в присутствии нейтрального красного - дифференциацию клебсиелл.
Количественное соотношение компонентов питательной среды, рН, обеспечивают сохранение хороших ростовых и дифференцирующих свойств, ингибирующий эффект в отношении сопутствующей микрофлоры. Готовая среда сохраняет стерильность не менее 10 суток
Пример 1. Способ получения питательной среды предусматривает смешивание сухих компонентов. Для приготовления среды берут навески следующих ингредиентов, г/л:
Состав СД, г/л:
Навески размешивают в 1 л дистиллированной воды, стерилизуют кипячением в течение не более 2 мин. до полного расплавления агара. В стерильную, охлажденную до температуры 50-55°С питательную среду для выделения клебсиелл вносят содержимое флакона с селективной добавкой, растворенного в 5 мл дистиллированной воды, из расчета 5 мл на 1 л среды.
Используемые для контроля среды тест-штаммы микроорганизмов получены из Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ-Оболенск» ФБУН ГНЦ ПМБ.
Готовили стандартную взвесь культуры каждого тест-штамма, соответствующую 10 единицам по стандартному образцу мутностиОСО 42-28-85 П, с использованием стерильного 0,9% раствора натрия хлористого. Полученные взвеси культур десятикратными разведениями (4,5 мл 0,9% раствора натрия хлорида с 0,5 мл микробной взвеси) доводили до необходимых разведений: 10-6,10-4 и 10-1 использовали для контроля среды.
Посевы инкубировали при температуре (37±1)°С в течение 20-24 ч.
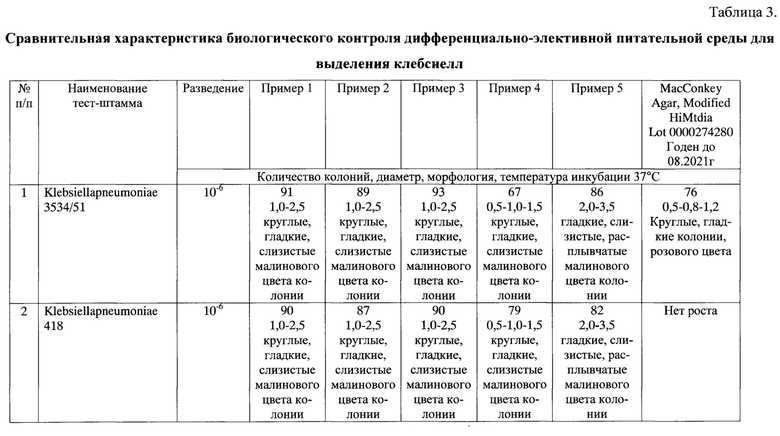
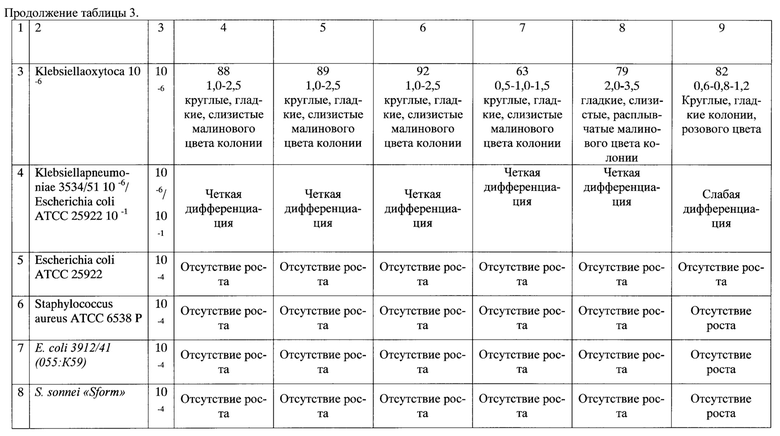
Предлагаемая среда, обеспечивает рост следующих тест-штаммов при посеве по 0,1 мл микробной взвеси из разведения 10-6 Klebsiellapneumoniae 3534/51, Klebsiellapneumoniae 418, Klebsiellaoxytoca, ингибициюпри посеве по 0,1 мл микробной взвеси каждого из тест-штаммов: EscherichiacoliATCC 25922 и StaphylococcusaureusATCC 6538 Риз разведения 10-4 через 48 часов инкубации посевов при температуре (37±1)°С и дифференциацию при посеве 0,1 мл микробной смеси тест-штамшов Klebsiellapneumoniae 3534/51 изразведения 10-6 с EscherichiacoliATCC 25922 изразведения 10-1.
Результаты биологического контроля представлены в табл. 3.
Пример 2. Среду готовят в соответствии с примером 1.
Состав СД, г/л:
Результаты биологического контроля представлены в таблице 3 и аналогичны результатам проверки по примеру 1.
Пример 3. Среду готовят в соответствии с примером 1.
Состав СД, г/л:
Результаты биологического контроля представлены в таблице 3 и аналогичны результатам проверки по примеру 1.
Пример 4. Среду готовят в соответствии с примером 1.
Состав СД, г/л:
Нарушение количественного соотношения ингредиентов среды ведет к ухудшению ростовых свойств в отношении клебсиелл и ингибирующих свойств к микробам ассоциантам.
Результаты биологического контроля представлены в таблице 3.
Пример 5. Среду готовят в соответствии с примером 1.
Состав СД, г/л:
Результаты биологического контроля представлены в таблице 3 и показывают ухудшение ростовых дифференциально-элективной среды для выделения клебсиелл.
Из таблиц видно, что предлагаемая питательная среда в соответствии с примерами 1, 2, 3 обладает высокой чувствительностью, стабильностью ростовых свойств в отношении клебсиелл, подавляет рост сопутствующих микроорганизмов и обеспечивает четкую дифференциацию клебсиелл от эшерихий.
Изменение количественного соотношения компонентов среды ведет к нарушению биологических показателей качества предлагаемой дифференциально-элективной среды для выделения клебсиелл Так, в случае приготовления среды в соответствии с примером 4 наблюдается снижение чувствительности и изменение диаметра колоний контрольных тест-штаммов клебсиелл, а в случае приготовления среды в соответствии с примером 5 - изменение диаметра колоний и морфологии контрольных тест-штаммов клебсиелл.
Таким образом, по сравнению со средой прототипом предлагаемая питательная среда является сухой отечественной, конкурентоспособной средой для селективного выделения клебсиелл, обладает большей чувствительностью в отношении клебсиелл, обеспечивает четкую дифференциацию клебсиелл от эшерихий, в случае высокой концентрации последних.
| название | год | авторы | номер документа |
|---|---|---|---|
| СУХАЯ ХРОМОГЕННАЯ ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ОБНАРУЖЕНИЯ КОЛИФОРМНЫХ БАКТЕРИЙ И E.coli (ВАРИАНТЫ) | 2012 |
|
RU2508400C1 |
| Питательная среда для селективного выделения Pseudomonas aeruginosa - модифицированная Среда Блеск | 2024 |
|
RU2834480C1 |
| Селективная питательная среда с маннитом, желчью и полимиксином для выявления бактерий родов Proteus, Morganella, Providencia сухая | 2022 |
|
RU2792438C1 |
| Питательная среда для селективного выявления патогенных маннитположительных стафилококков | 2015 |
|
RU2620965C2 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ БАКТЕРИЙ YERSINIA ENTEROCOLITICA | 2016 |
|
RU2648160C2 |
| Питательная среда для выделения Pseudomonas aeruginosa | 2019 |
|
RU2709136C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ СЕЛЕКТИВНОГО НАКОПЛЕНИЯ ЭНТЕРОБАКТЕРИЙ, СУХАЯ (БУЛЬОН МОССЕЛЯ), ВАРИАНТЫ | 2013 |
|
RU2553224C2 |
| Питательная среда для выделения чистой культуры Porphyromonas gingivalis | 2023 |
|
RU2802078C1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ПИТАТЕЛЬНОЙ СРЕДЫ ДЛЯ ВЫЯВЛЕНИЯ КИШЕЧНОЙ ПАЛОЧКИ СЕРОТИПА 0157 | 2004 |
|
RU2273661C2 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ ДИФТЕРИЙНЫХ МИКРОБОВ | 2011 |
|
RU2455351C1 |
Изобретение относится к клинической и санитарной микробиологии. Питательная среда для выделения клебсиелл содержит панкреатический гидролизат рыбной муки, пептон мясной, дрожжевой экстракт, мезо-инозит, натрий хлористый, соли желчных кислот, кристаллический фиолетовый, нейтральный красный, натрий углекислый, карбенициллин, агар микробиологический и дистиллированную воду при заданном соотношении компонентов. Изобретение позволяет сократить сроки дифференциации клебсиелл. 3 табл., 5 пр.
Дифференциально-элективная питательная среда для выделения клебсиелл, содержащая в качестве источника азотистого питания пептон мясной, натрий хлористый, мезо-инозит, соли желчных кислот, кристаллический фиолетовый, нейтральный красный и агар микробиологический, отличающаяся тем, что в качестве белковой основы она дополнительно содержит панкреатический гидролизат рыбной муки, дрожжевой экстракт - источник витаминов и натрий углекислый в качестве стабилизатора рН среды при следующем содержании компонентов:
| Методические рекомендации | |||
| Микробиологическая диагностика дисбактериоза кишечника, Москва, 2007, с.26 | |||
| ШЕПЕЛИН А.П., ДЯТЛОВ И.А | |||
| Питательные среды для энтеробактерий, Оболенск, 2017, с | |||
| Раздвижной паровозный золотник с подвижными по его скалке поршнями между упорными шайбами | 1922 |
|
SU148A1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ КЛЕБСИЕЛЛ | 2002 |
|
RU2218396C1 |
| СЕЛЕКТИВНАЯ ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ КЛЕБСИЕЛЛ | 2003 |
|
RU2265056C2 |
| ХРОМОГЕННАЯ ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫЯВЛЕНИЯ И ИДЕНТИФИКАЦИИ КЛЕБСИЕЛЛ | 2008 |
|
RU2416635C2 |
Авторы
Даты
2019-10-31—Публикация
2019-03-18—Подача