Изобретение относится к области органической химии, конкретно к способу получения фторангидридов ароматических карбоновых кислот общей формулы I, где Ar - ароматическая или гетероароматическая группа, например, фенил, пиридил, в том числе в которой один или несколько атомов водорода замещены атомами галогенов, алкильными, перфторалкильными или алкокси-группами, в котором целевые продукты получают взаимодействием соответствующих ароматических альдегидов с солью 1-фтор-4-хлорметил-1,4-диазониабицикло[2.2.2]октана с перфторированным анионом в органическом растворителе в течение 10-60 минут под действием ультрафиолетового излучения (365 нм). Технический результат: одностадийный способ получения ароматических фторангидридов с высоким выходом без использования катализаторов, характеризующийся сокращенным временем реакции и уменьшение количества используемого растворителя.
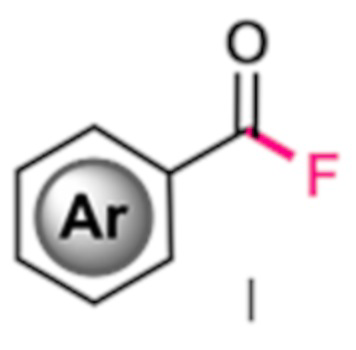
Фторангидриды карбоновых кислот находят применение в органическом синтезе. Ацилфториды имеют ряд преимуществ перед ацилхлоридами, включая меньшую склонность к гидролизу, сольволизу, более высокую селективность за счет пониженной реакционной способности [Ogiwara Y., Sakai N. Acyl Fluorides in Late Transition-Metal Catalysis //Angewandte Chemie International Edition. - 2020. - Vol. 59. - №. 2. - P. 574-594]. Фторангидриды используются для синтеза кетонов, арилфторидов, замещенных ароматических соединений, эфиров и тиоэфиров [Fu L., Chen Q., Nishihara Y. Decarboxylative Cross-Coupling of Acyl Fluorides with Potassium Perfluorobenzoates //Organic Letters. - 2020. - Vol. 22. - №. 16. - P. 6388-6393], [Ogiwara Y., Sakai N. Acyl Fluorides in Late Transition-Metal Catalysis //Angewandte Chemie International Edition. - 2020. - Vol. 59. - №. 2. - P. 574-594], [Karbakhshzadeh A. et al. Aroyl fluorides: Novel and promising arylating agents //Journal of Fluorine Chemistry. - 2021. - Vol. 248. - P. 109806], [Garth B. H., Gumprecht W. H. Decarbonylation of fluorinated acyl fluorides: pat. 3555100 USA. - 1971], [Beardmore L. N. D., Cobb S. L., Brittain W. D. G. One-pot ester and thioester formation mediated by pentafluoropyridine (PFP) //Organic & Biomolecular Chemistry. - 2022. - Vol. 20. - №. 41. - P. 8059-8064]. Фторангидриды карбоновых кислот являются эффективными биоконъюгирующими агентами белков по лизиновым остаткам [Dovgan I. et al. Acyl fluorides: fast, efficient, and versatile lysine-based protein conjugation via plug-and-play strategy //Bioconjugate Chemistry. - 2017. - Vol. 28. - №. 5. - P. 1452-1457]. В методах синтеза фторангидридов, основанных на прямом фторировании C-H связей, используются доступные и безопасные реагенты, такие как тетрафторборат 1-фтор-4-хлорметил-1,4-диазониабицикло[2.2.2]октана (SelectFluor) и N-фторбензолсульфонимид (NFSI) [Meanwell M. et al. Synthesis of acyl fluorides via photocatalytic fluorination of aldehydic C-H bonds //Chemical Communications. - 2018. - Vol. 54. - №. 71. - P. 9985-9988], [Yoshii T. et al. N-Hydroxybenzimidazole as a structurally modifiable platform for N-oxyl radicals for direct C-H functionalization reactions //Chemical Science. - 2020. - Vol. 11. - №. 22. - P. 5772-5778]. Однако данные способы имеют множество технологических недостатков: длительное время проведения реакции, низкая растворимость фторирующих реагентов в апротонных растворителях (в случае SelectFluor), а также необходимость в использовании катализаторов.
Известен способ получения фторангидридов ароматических кислот взаимодействием карбоновых кислот с 1,1′-(3,3-дифтор-1-циклопропен-1,2-диил)бис[бензол]ом [Патент КНР №102285849 от 25.12.2013].
Недостатком данного способа является труднодоступность деоксофторирующего реагента и его нестабильность в отношении гидролиза во влажной атмосфере.
Так же известен способ получения фторангидридов ароматических карбоновых кислот путем деоксофторирования ароматических карбоновых кислот, в котором в качестве деоксофторирующего реагента используется коммерчески доступный реагент XtalFluor-E [Патент США №8680332 от 25.03.2014].
Недостатком данного способа является необходимость использования гидролитически нестабильных деоксофторирующих реагентов.
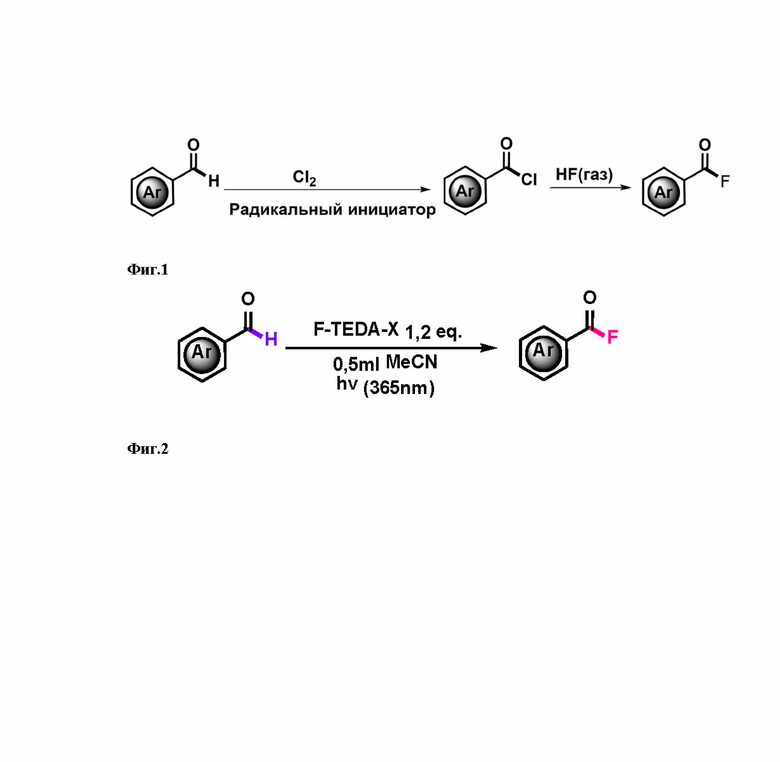
Наиболее близким к предлагаемому техническому решению является способ получения ароматического ацилфторида, включающий радикальное хлорирование альдегида под действием газообразного хлора в присутствии свободно-радикального инициатора при повышенной температуре с последующей заменой атома хлора в получающемся ацилхлориде на атом фтора действием фтороводорода. Данный способ получения ароматических ацилфторидов предполагает использование агрессивных и токсичных газообразных реагентов (хлор, фтороводород), повышенных температур, дополнительных реагентов (Патент КНР №104693164 от 10.06.2015). Данный способ изображен на Фиг. 1.
Недостатками данного способа являются:
- многостадийность процесса;
- необходимость выделения и очистки промежуточного продукта;
- использование опасных и коррозионно-активных реагентов.
Технический результат предлагаемого изобретения заключается в повышении эффективности получения фторангидридов ароматических карбоновых кислот путем уменьшения числа стадий, отказ от использования токсичных и коррозионно активных реагентов, сокращения времени реакции, уменьшения количества используемого растворителя, использования коммерчески доступных и безопасных исходных соединений, упрощения процедуры препаративного выделения продуктов.
Технический результат достигается путем приготовления смеси ароматического альдегида, соли 1-фтор-4-хлорметил-1,4-диазониабицикло[2.2.2]октана с перфторированным анионом и диполярного апротонного растворителя в оптически прозрачном реакционном сосуде в атмосфере аргона, облучении реакционной смеси при комнатной температуре ультрафиолетовым излучением, упариванием растворителя, экстракцией продукта неполярным углеводородным или эфирным растворителем, упариванием экстракта.
Новым является то, что замещение атома водорода в альдегидной группе на атом фтора достигается в одну стадию при комнатной температуре под действием ультрафиолетового излучения без добавления катализатора.
Также новым является то, что реакцию проводят с использованием в качестве фторирующего реагента - трифторметансульфонимида или тетрафторбората 1-фтор-4-хлорметил-1,4-диазониабицикло[2.2.2]октана (F-TEDA-TFSI или F-TEDA-BF4), обладающих высокой растворимостью в органических растворителях.
Также новым является то, что фторангидриды ароматических карбоновых кислот получают с использованием концентрированных растворов реагентов в ацетонитриле, что приводит к увеличению удельного выхода продукта на единицу объема реакционной смеси.
Предлагаемый способ иллюстрируется на Фиг. 2.
Способ осуществляют следующей последовательностью операций и режимов.
В качестве исходных соединений для фторирования целесообразно использовать ароматические альдегиды, которые могут содержать в ароматическом фрагменте алкильные или гетероатомные заместители.
В качестве растворителя целесообразно применять диполярные апротонные растворители, не имеющие поглощения ультрафиолетового излучения на длине волны 365 нм, такие как алифатические нитрилы, в частности, ацетонитрил.
Процесс целесообразно вести при температуре 0-40°С, предпочтительно 20-25°С.
Для достижения высоких выходов продуктов фторирования процесс целесообразно вести в инертной среде, предпочтительно в атмосфере аргона.
В инертной атмосфере аргона в полипропиленовых виалах объемом 2 мл подготавливают смесь ароматического альдегида, соли 1-фтор-4-хлорметил-1,4-диазониабицикло[2.2.2]октана (F-TEDA-X) и ацетонитрила в соотношении 1 ммоль альдегида : 1.2 ммоль F-TEDA-X : 1.2 мл ацетонитрила. Полученную смесь облучают ультрафиолетовым излучением флуоресцентных ламп с длиной волны максимума спектра излучения 365 нм и общей мощностью 36 Вт в течение 10-60 мин. Далее растворитель упаривают, твердый остаток промывают на фильтре диэтиловым эфиром, чтобы отделить продукт от непрореагировавшего фторирующего реагента и побочных продуктов его превращений. Диэтиловый эфир упаривают, получают продукт.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение бензоилфторида.
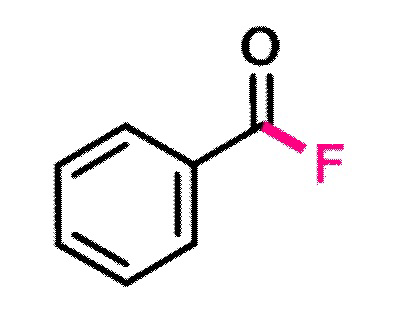
В виалу 10 мл в атмосфере аргона добавляют 7 ммоль (5.19 грамм) F-TEDA-TFSI, 7 мл ацетонитрила, 5.83 ммоль (0.617 грамм) бензальдегида. Реакционную смесь облучают ультрафиолетовым излучением 4 флуоресцентных ламп общей мощностью 36 Вт с длиной волны максимума спектра излучения 365 нм в течение 20 минут. Выход, определенный по ЯМР 19F с использованием трифторметансульфонимид-аниона в качестве внутреннего стандарта, составил 99%.
19F NMR (283.36 MHz, (CD3)2CO) δ 16.0 (s, 1F).
Характеристики продукта соответствуют литературным данным.
[Liang Y., Zhao Z., Shibata N. Pd-catalyzed fluoro-carbonylation of aryl, vinyl, and heteroaryl iodides using 2-(difluoromethoxy)-5-nitropyridine //Communications Chemistry. - 2020. - Vol. 3. - №. 1. - P. 59]
Пример 2. Получение п-хлорбензоилфторида
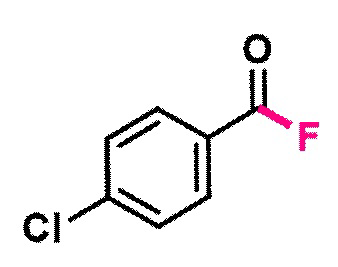
В виалу 10 мл под атмосферой аргона добавляют 7 ммоль (5.19 грамм) F-TEDA-TFSI, 7 мл ацетонитрила, 5.83 ммоль (0.815 грамм) п-хлорбензальдегида. Реакционную смесь облучают ультрафиолетовым излучением 4 флуоресцентных ламп общей мощностью 36 Вт с длиной волны максимума спектра излучения 365 нм в течение 20 минут. Выход определяют по ЯМР 19F с использованием трифторметансульфонимид-аниона в качестве внутреннего стандарта (99%). Ацетонитрил упаривают, полученную смесь промывают 4 мл диэтиловым эфиром на фильтре три раза, полученный фильтрат упаривают, получая светло-коричневые кристаллы. Продукт разбавляют 3 мл диэтилового эфира и снова фильтруют, чтобы удалить примеси фторирующего реагента. Эфир упаривают, получают 0.690г, 4.9 ммоль соответствующего продукта с препаративным выходом 75%.
1H NMR (300 MHz, (CD3)2CO) δ 7.95 (d, J = 8.2 Hz, 2H), 7.53 (d, J = 8.2 Hz, 2H).
19F NMR (283.36 MHz, (CD3)2CO) δ 16.5 (s, 1F).
Характеристики продукта соответствуют литературным данным.
[Liang Y., Zhao Z., Shibata N. Pd-catalyzed fluoro-carbonylation of aryl, vinyl, and heteroaryl iodides using 2-(difluoromethoxy)-5-nitropyridine //Communications Chemistry. - 2020. - Vol. 3. - №. 1. - P. 59]
Пример 3. Получение 2,4-дихлорбензоилфторида.
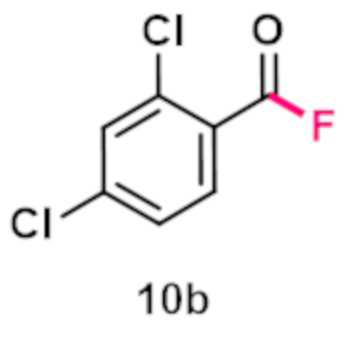
В виалу 10 мл в атмосфере аргона добавляют 5.83 ммоль (1.021 грамм) 2,4-дихлорбензальдегида, 7 ммоль (5.19 грамм) бис(трифторметансульфонимида) 1-фтор-4-хлорметил-1,4-диазониабицикло[2.2.2]октана (F-TEDA-TFSI), 7 мл ацетонитрила. Реакционную смесь облучают ультрафиолетовым излучением 4 флуоресцентных ламп общей мощностью 36 Вт с длиной волны максимума спектра излучения 365 нм в течение 20 минут. Выход по ЯМР 19F с использованием трифторметансульфонимид-аниона в качестве внутреннего стандарта составил 96%. Ацетонитрил упаривают, остаток промывают 4 мл диэтиловым эфиром на фильтре три раза, нерастворимый осадок отделяют фильтрованием, полученный раствор упаривают в вакууме, получая светло-коричневые кристаллы. Продукт разбавляют 3 мл диэтилового эфира и снова фильтруют. Эфирный фильтрат упаривают, получают 0.946 г, 4.9 ммоль соответствующего продукта с препаративным выходом 84%.
1H NMR (500 MHz, CDCl3) δ 8.11 (d, J = 8.11 Hz, 1H), 7.77 (t, J = 1.6 Hz, 1H), 7.63 (dd, J1 = 8.6 Hz, J2 = 2.0 Hz, 1H).
13C NMR (75.5 MHz, CDCl3) δ 154.4 (d, J = 343.1), 142.0, 137.9 (d, J = 4.4 Hz), 135.8 (d, J = 2.1 Hz), 132.5 (d, J = 3.5 Hz), 128.9, 123.4, 122.9.
19F NMR (283.36 MHz, CDCl3) δ 30.0 (s, 1F).
Характеристики продукта соответствуют литературным данным.
[Boreux A. et al. Acyl fluorides as efficient electrophiles for the copper-catalyzed boroacylation of allenes //ACS Catalysis. - 2017. - Т. 7. - №. 12. - С. 8200-8204]
Пример 4. Получение п-бромбензоилфторида
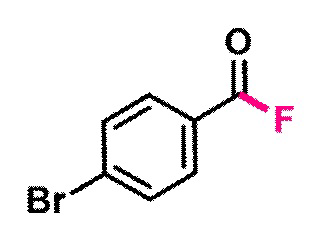
В виалу 10 мл под атмосферой аргона добавляют 7 ммоль (5.19 грамм) F-TEDA-TFSI, 7 мл ацетонитрила, 5.83 ммоль (1.08 грамм) п-бромбензальдегида. Реакционную смесь облучают ультрафиолетовым излучением 4 флуоресцентных ламп общей мощностью 36 Вт с длиной волны максимума спектра излучения 365 нм в течение 20 минут. Выход, определенный по ЯМР 19F с использованием трифторметансульфонимид-аниона в качестве внутреннего стандарта, составил 95% c примесью исходного альдегида.
1H NMR (300 MHz, (CD3)2CO) δ 7.87 (d, J = 8.2 Hz, 2H), 7.70 (d, J = 8.3 Hz, 2H).
19F NMR (283.36 MHz, (CD3)2CO) δ 16.5 (s, 1F).
Характеристики продукта соответствуют литературным данным.
[Liang, Y.; Zhao, Z.; Taya, A.; Shibata, N. Acyl Fluorides from Carboxylic Acids, Aldehydes, or Alcohols under Oxidative Fluorination. Org. Lett. 2021, 23 (3), 847-852.]
Пример 5. Получение перфторбензоилфторида
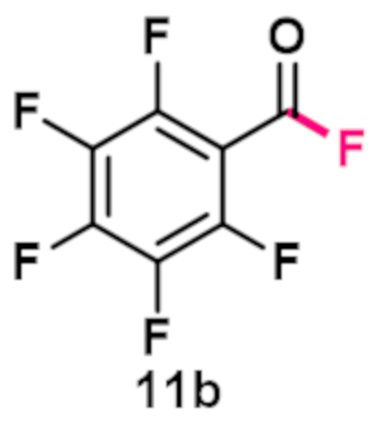
В виалу 10 мл под атмосферой аргона добавляют 7 ммоль (5.19 грамм) F-TEDA-TFSI, 7 мл ацетонитрила, 5.83 ммоль (1.14 грамм) пентафторбензальдегида. Реакционную смесь облучают ультрафиолетовым излучением 4 флуоресцентных ламп общей мощностью 36 Вт с длиной волны максимума спектра излучения 365 нм в течение 60 минут. Выход, определенный по ЯМР 19F с использованием трифторметансульфонимид-аниона в качестве внутреннего стандарта, составил 94% c примесью исходного альдегида.
19F NMR (283.36 MHz, (CD3)2CO) δ 46.35 (t, J = 44.3 Hz, 1F) -133.7 - -134.1 (m, 2F), -142.1 - -142.3 (m, 1F), -159.8 - -160.0 (m, 2F).
Характеристики продукта соответствуют литературным данным.
[Шипилов А.И., Колпащикова Л.А., Игумнов С.М. Селективный гидролиз перфторбензотрихлорида. Журнал органической химии, Т. 39, №. 7, 2003, С. 1036-1039]
Пример 6. Получение п-метилбензоилфторида
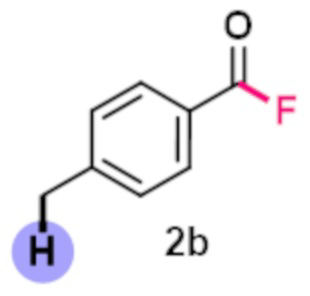
В виалу 10 мл под атмосферой аргона добавляют 7 ммоль (5.19 грамм) F-TEDA-TFSI, 7 мл ацетонитрила, 5.83 ммоль (0.7 грамм) п-метилбензальдегида. Реакционную смесь облучают ультрафиолетовым излучением 4 флуоресцентных ламп общей мощностью 36 Вт с длиной волны максимума спектра излучения 365 нм в течение 20 минут. Выход, определенный по ЯМР 19F с использованием трифторметансульфонимид-аниона в качестве внутреннего стандарта, составил 81% c примесью 4-фторметилбензоилфторида.
1H NMR (300 MHz, (CD3)2CO) δ 7.85 (d, J = 8.0 Hz, 2H), 7.33 (d, J = 8.0 Hz, 2H), 2.37 (s, 3H).
19F NMR (283.36 MHz, (CD3)2CO) δ 15.4 (s, 1F).
Характеристики продукта соответствуют литературным данным.
[Liang Y., Zhao Z., Shibata N. Pd-catalyzed fluoro-carbonylation of aryl, vinyl, and heteroaryl iodides using 2-(difluoromethoxy)-5-nitropyridine //Communications Chemistry. - 2020. - Vol. 3. - №. 1. - P. 59]
Пример 7. Получение 3,5-бис(трифторметил)бензоилфторида
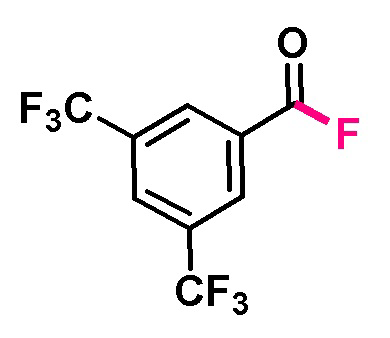
В виалу 10 мл под атмосферой аргона добавляют 7 ммоль (5.19 грамм) F-TEDA-TFSI, 7 мл ацетонитрила, 5.83 ммоль (1.41 грамм) 3,5-бис(трифторметил)бензальдегида. Реакционную смесь облучают ультрафиолетовым излучением 4 флуоресцентных ламп общей мощностью 36 Вт с длиной волны максимума спектра излучения 365 нм в течение 30 минут. Выход, определенный по ЯМР 19F с использованием трифторметансульфонимид-аниона в качестве внутреннего стандарта, составил 95% c примесью исходного альдегида.
1H NMR (300 MHz, (CD3)2CO) δ 8.49 (s, 2H), 8.33 (s, 1H).
19F NMR (283.36 MHz, (CD3)2CO) δ 17.9 (s, 1F), -64.5 (s, 6F).
Характеристики продукта соответствуют литературным данным.
[Gonay, M.; Batisse, C.; Paquin, J.-F. Synthesis of Acyl Fluorides from Carboxylic Acids Using NaF-Assisted Deoxofluorination with XtalFluor-E. J. Org. Chem. 2020, 85 (15), 10253-10260.]
Пример 8. Получение п-метоксибензоилфторида
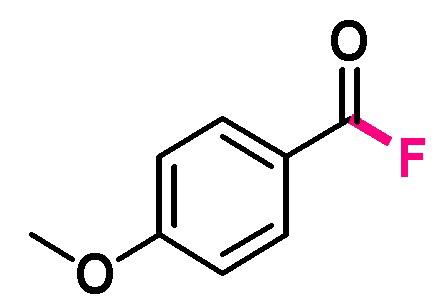
В виалу 10 мл под атмосферой аргона добавляют 0.7 ммоль (0.248 грамм) тетрафторбората 1-фтор-4-хлорметил-1,4-диазониабицикло[2.2.2]октана (F-TEDA-BF4), 7 мл ацетонитрила, 0.58 ммоль (0.088 грамм) п-метоксибензальдегида. Реакционную смесь облучают ультрафиолетовым излучением 4 флуоресцентных ламп общей мощностью 36 Вт с длиной волны максимума спектра излучения 365 нм в течение 1 часа. Выход, определенный по ЯМР 19F с использованием тетрафторборат-аниона в качестве внутреннего стандарта, составил 43% с примесями продуктов электрофильного фторирования.
19F NMR (283.36 MHz, (CD3)2CO) δ 13.7 (s, 1F).
[Liang Y. et al. Acyl fluorides from carboxylic acids, aldehydes, or alcohols under oxidative fluorination //Organic Letters. - 2021. - V. 23. - №. 3. - P. 847-852]
Пример 9. Получение изоникотиноилфторида
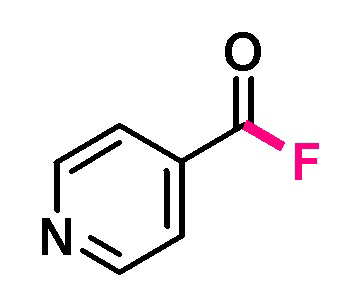
В виалу 10 мл под атмосферой аргона добавляют 7 ммоль (5.19 грамм) F-TEDA-TFSI, 7 мл ацетонитрила, 5.83 ммоль (0.62 грамм) 4-пиридинкарбальдегида. Реакционную смесь облучают ультрафиолетовым излучением 4 флуоресцентных ламп общей мощностью 36 Вт с длиной волны максимума спектра излучения 365 нм в течение 30 минут. Выход, определенный по ЯМР 19F с использованием трифторметансульфонимид-аниона в качестве внутреннего стандарта, составил 76% c примесью исходного альдегида и изоникотиновой кислоты.
19F NMR (283.36 MHz, (CD3)2CO) δ 19.7 (s, 1F).
Характеристики продукта соответствуют литературным данным.
[Meanwell, M.; Lehmann, J.; Eichenberger, M.; Martin, R. E.; Britton, R. Synthesis of Acyl Fluorides via Photocatalytic Fluorination of Aldehydic C-H Bonds. Chem. Commun. 2018, 54 (71), 9985-9988].
| название | год | авторы | номер документа |
|---|---|---|---|
| МОЛЕКУЛЫ С ПЕСТИЦИДНОЙ ФУНКЦИЕЙ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, КОМПОЗИЦИИ И СПОСОБЫ, СВЯЗАННЫЕ С НИМИ | 2016 |
|
RU2735602C2 |
| Борированные производные фторированных бактериохлоринов и их металлокомплексов, обладающие противоопухолевой активностью | 2015 |
|
RU2615770C1 |
| Ковалентный конъюгат ацикловира с фотолабильной защитной группой | 2021 |
|
RU2777189C1 |
| Способ синтеза 3-арилиндан-1-онов реакцией суперэлектрофильного ароматического замещения коричных нитрилов | 2020 |
|
RU2768714C2 |
| ПОВЕРХНОСТНО-АКТИВНЫЙ ФОТОСЕНСИБИЛИЗАТОР, ПРЕДСТАВЛЯЮЩИЙ СОБОЙ БРОМИД 2-{ 4-[(Е)-2-(4-ЭТОКСИФЕНИЛ)ВИНИЛ]ФЕНОКСИ} -N, N, N-ТРИМЕТИЛЭТАМАНАМИНА (С-ТАБ) | 2012 |
|
RU2515502C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3,4-ДИАРИЛ(ГЕТАРИЛ)МАЛЕИМИДОВ | 2005 |
|
RU2278855C1 |
| ПРОИЗВОДНЫЕ НЕЙРАМИНОВОЙ КИСЛОТЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ГРИППА | 1997 |
|
RU2169145C2 |
| ИНГИБИТОРЫ GCN2 И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2811408C2 |
| АНАЛОГИ ВИТАМИНА D, СОЕДИНЕНИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2153491C2 |
| Соединение-антагонист PD-L1 | 2020 |
|
RU2823231C1 |
Изобретение относится к области органической химии, конкретно к способу получения фторангидридов ароматических карбоновых кислот формулы I, где Ar представляет фенил или пиридил, в том числе в которой один или несколько атомов водорода замещены атомами галогенов, алкильными, перфторалкильными или алкокси-группами, и характеризуется тем, что целевой продукт получают путем прямого замещения альдегидного атома водорода на атом фтора взаимодействием соответствующих ароматических альдегидов с солью 1-фтор-4-хлорметил-1,4-диазониабицикло[2.2.2]октана с перфторированным анионом. Синтез проводят в среде диполярного апротонного растворителя под действием ультрафиолетового излучения с длиной волны 330-420 нм при температуре от 0 до 40°С в течение 20-60 мин в инертной газовой среде. Техническими результатами изобретения является уменьшение числа стадий синтеза, отказ от использования токсичных и коррозионно-активных реагентов, сокращение времени реакции, уменьшение количества используемого растворителя и упрощение выделения целевых продуктов. 6 з.п. ф-лы, 2 ил., 9 пр.
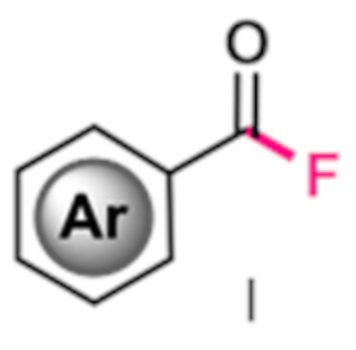
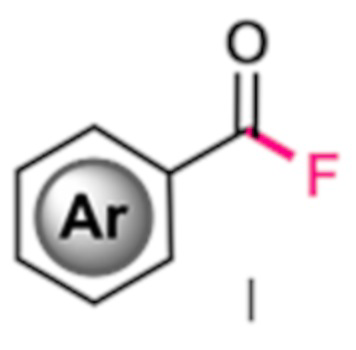
1. Способ получения фторангидридов ароматических карбоновых кислот общей формулы I, где Ar - ароматическая или гетероароматическая группа, такая как фенил или пиридил, в том числе в которой один или несколько атомов водорода замещены атомами галогенов, алкильными, перфторалкильными или алкокси-группами, отличающийся тем, что продукт получают путем прямого замещения альдегидного атома водорода на атом фтора взаимодействием соответствующих ароматических альдегидов с солью 1-фтор-4-хлорметил-1,4-диазониабицикло[2.2.2]октана с перфторированным анионом в среде диполярного апротонного растворителя под действием ультрафиолетового излучения с длиной волны максимума излучения 330-420 нм при температуре от 0 до 40°С в течение 20-60 мин в инертной газовой среде
 .
.
2. Способ по п. 1, отличающийся тем, что в качестве перфторированного аниона используется тетрафторборат.
3. Способ по п. 1, отличающийся тем, что в качестве перфторированного аниона используется трифторметансульфонимид.
4. Способ по п. 1, отличающийся тем, что процесс ведут при облучении излучением с максимумом длины волны 365 нм.
5. Способ по п. 1, отличающийся тем, что в качестве растворителя используется ацетонитрил.
6. Способ по п. 1, отличающийся тем, что предпочтительная температура процесса от 20 до 40°С.
7. Способ по п. 1, отличающийся тем, что в качестве инертной газовой среды используется аргон.
| Meanwell M | |||
| et al | |||
| Synthesis of acyl fluorides via photocatalytic fluorination of aldehydic C-H bonds | |||
| Chemical Communications, 2018, 54 (71), p | |||
| Способ получения едкого барита из силикатов бария | 1927 |
|
SU9985A1 |
| Yoshii T | |||
| et al | |||
| N-Hydroxybenzimidazole as a structurally modifiable platform for N-oxyl radicals for direct C-H functionalization reactions | |||
| Chemical Science, 2020, 11 (22), p | |||
| Обратный клапан | 1926 |
|
SU5772A1 |
| CN | |||
Авторы
Даты
2024-11-18—Публикация
2023-12-25—Подача