Область техники, к которой относится изобретение
Настоящее изобретение касается 5-метил-замещенного фуранового соединения общей формулы (I) и способа его получения:

где
R1 выбран из группы, включающей: атом водорода, гидроксиметил, метил, алкил, гидрокси-группу, альдегидную группу, атом галогена, сложноэфирную группу, карбоксильную группу, амид, амин, замещенный амин, алкокси/простоэфирные мостики, производные серы, производные фосфора и любую арильную и гетероарильную функциональную группу; и R2 и R3 могут выбраны из группы, включающей: атом водорода, алкил и арил.
Более конкретно, настоящее изобретение касается нового способа в рамках “Способов без применения металлов для селективного восстановления альдегидной группы до метильной группы в различных замещенных фуранах”. Авторами настоящего изобретения был разработан атомно-экономичный, высоко селективный и экономически выгодный способ для получения метил-замещенных фурановых соединений из различных альдегид-замещенных фурановых соединений без применения металлического катализатора и газообразного водорода. Все стадии данного способа легко масштабируются, и для достижения высокой чистоты не нужны сложные стадии очистки.
Настоящее изобретение в частности касается способа получения 5-метилфурфурилового спирта (5-МФС), 2,5-диметилфурана (ДМФ), 5-метилфурана из соответствующих альдегидных соединений, перечисленные соединения имеют огромный потенциал применения в качестве биотоплива и в других областях.
Настоящее изобретение также касается метил-замещенных фурановых соединений общей формулы (I), которые могут применяться в качестве промежуточных/конечных продуктов при производстве биотоплива, ароматизаторов, пищевых добавок, лекарственных препаратов, полимеров и в синтезе биополимеров.
Настоящее изобретение также касается удобного, дешевого, эффективного и масштабируемого способа синтеза метил-замещенных фурановых соединений общей формулы (I).
Предшествующий уровень техники
Производство биотоплива из биомассы стало важным вопросом за последние несколько десятков лет. С каждым днем истощение запасов полезных ископаемых и выделение газов, вызывающих парниковый эффект, подталкивает научный мир к использованию возобновляемых ресурсов в качестве сырья для производства биотоплива. Источники биомассы (лигноцеллюлоза, целлюлоза, крахмал, фруктоза, глюкоза, сахароза и т.д.) являются возобновляемыми ресурсами для производства энергии и широкого ряда химических соединений, поскольку их запасы в природе очень велики. 5-Гидроксиметилфурфураль (ГМФ) в этом контексте считается молекулой-платформой; его получают из биомассы и используют как ключевой интермедиат для производства различных химических соединений и биотоплива (Mika, L. T., Cséfalvay, E. and Németh, A., Chem. Rev., 2018, 118, (2),505–613).
Восстановление 5-ГМФ дает 2,5-диметилфуран (ДМФ), который представляет собой перспективное биотопливо, получаемое как из 5-ГМФ, так и напрямую из биомассы. Промышленное производство биотоплива все еще требует больших научных изысканий из-за высокой стоимости производства и проблем с масштабированием. В этой связи, 5-метилфурфуриловый спирт (5-МФС) рассматривается как важный интермедиат, который поддается гидрогенолизу с образованием диметилфурана (биотопливо) (Thananatthanachon, T. and Rauchfuss, B. T., Angew. Chem., 2010, 49, 6616–6618). В работе Nishimura et al. сообщалось о гидрировании 5-ГМФ до 2,5-ДМФ через промежуточный 5-МФС под действием катализатора Pd-Au/C. Выход 5-МФС при производстве в этих условиях очень низкий (Nishimura, S.; Ikeda, N. and Ebitani, K., Catalysis Today, 2014, 232,89–98). Также сообщалось о 5-хлорфуран-2-карбальдегиде как о прекурсоре для синтеза 5-МФС (количественный выход 98% по данным ГХ) с применением Zr-бензилфосфоната (Li, H.; Fang, Z.; He, J. and Yang, S., ChemSusChem, 2017, 10, 681 – 686). Кроме того, 5-МФС играет также важную роль для синтеза 2,5-ДМФ с применением Cu/g-Al2O3 и молекулярного водорода как источника водорода. Было выяснено влияние воды на Cu/g-Al2O3 и обнаружено, что в отсутствие воды главным продуктом гидрогенолиза 5-ГМФ является 5-МФС и 2,5-ДМФ (Liu, Y.; Mellmer, A. M.; Alonso, M. D. and Dumesic, A. J., ChemSusChem, 2015, 8, 3983–3986). В продолжение этой работы применялись также различные гетерогенные катализаторы, такие как рутениевый катализатор на циркониевой подложке (Ru(OH)x/ZrO2), для высокоселективного гидрирования 5-ГМФ до 2,5-ДГМФ в различных спиртовых растворителях, и было установлено, что в случае 2-пропанола и трет-бутилового спирта в качестве побочного продукта образовывался 5-МФС (Han, J.; Kim, H. Y.; Jnag, S. H.; Hwang, Y. S.; Jegal, J.; Kim, W. J. and Lee, S. Y., RSC Adv., 2016, 6, 93394–93397). Позднее был разработан также нанокомпозит Cu(50)–SiO2 для синтеза ДГМФ из 5-ГМФ. Сообщалось об образовании 5-МФС (2%) вместе с ДГМФ (Upare, P. P.; Hwang, K. Y. and Hwang, W. D., Green Chem., 2018, 20, 879–885). Максимальный выход 5-МФС (19%) был получен с применением Ru–Sn/ZnO (Upare, P. P.; Hwang, W. D.; Hwang, K. Y.; Lee, H. U.; Hong, Y. D. and Chang, S. J., Green Chem., 2015, 17, 3310–3313). Также никель на подложке из оксида типа перовскита был протестирован в работе Fu et al., и было обнаружено, что 5-МФС (38.5%) образовался вместе с другим продуктом гидрогенолиза 5-ГМФ (Chen, Y. M.; Chen, B. C.; Zada, B. and Fu, Y., Green Chem., 2016, 18, 3858–3866). Другой подход к синтезу ДГМФ из 5-ГМФ был опробован Chatterjee et al. посредством гидрирования в мягких условиях; давление водорода 0.8 МПа в водной среде с применением катализатора Pt/MCM-41 без добавок. Было обнаружено, что 5-МФС (выход 90% по данным ГХ) образовывался только когда субстрат представлял собой метилфурфураль и ДГМФ, а увеличение времени реакции относительно стандартных условий (с 2 часов до 6 часов) способствовал формированию 5-МФС (Chatterjee, M.; Ishizaka, T. and Kawanami, H., Green Chem., 2014, 16, 4734–4739). Недавно Hu et al. провели каталитическое трансферное гидрирование 5-метилфурфураля до 5-метилфурфурилового спирта с применением наногибрида цирконий N-алкилтрифосфата (ZrPN) при 140°C, выход по данным ГХ составил до 99%. (Li, H.; He, J.; Riisager, A.; Saravanamurugan, S.; Song, B. and Yang, S. ACS Catal. 2016, 6, 7722−7727). Проводили также другое каталитическое трансферное гидрирование с наночастицами NiO и получили 93%-ный выход 5-МФС из 5-метилфурфураля при высокой температуре 180°C. (He, J.; Schill, L.; Yang, S. and Riisager, A., ACS Sustainable Chem. Eng., 2018, 6, 17220−17229). Синтез 2-метилфурана (МФ) также был недавно описан в работе Zhao et al путем селективного деоксигенирования водного фурфураля над Cu0/Cu2O·SiO2 ситами через медь-филлосиликатный прекурсор без применения постороннего газа (Li, B.; Li. L.; Sun, H. and Zhao, C. ACS Sustainable Chem. Eng., 2018, 6, 12096-12103). В работе Zhu et al сообщалось, что Cu-содержащий катализатор на подложке SiO2 селективно превращал фурфураль в 2-МФ с высоким выходом 89% (Dong, F.; Zhu, Y. L.; Zheng, H. Y.; Zhu, Y. F.; Li, X. Q. and Li, Y. W. J. Mol. Catal. A: Chem. 2015, 398, 140−148). Также применялся гибридный каталитический подход для синтеза 2-МФ из фурфураля с применением Cu−Zn−Al катализатора и циклогексанола в качестве донора водорода, с селективностью 87% при 250°C (Zheng, H. Y.; Zhu, Y. L.; Bai, Z. Q.; Huang, L.; Xiang, H. W. and Li, Y. W. Green Chem. 2006, 8 (1), 107−109).
В продолжение работ из предшествующего уровня техники, настоящее изобретение нацелено на разработку удобного способа получения метил-замещенных фурановых соединений из различных альдегид-замещенных фурановых соединений. Настоящее изобретение в частности касается способа получения 5-метилфурфурилового спирта (5-МФС), 2,5-диметилфурана (ДМФ), 2-метилфурана из соответствующих альдегидных соединений, перечисленные соединения имеют огромный потенциал применения в качестве биотоплива и в других областях.
Цель изобретения
Главной целью настоящего изобретения является получение 5-метил-замещенных фурановых соединений общей формулы (I).

Другой целью настоящего изобретения является разработка не требующего использования металлов и газообразного водорода, высоко селективного и экономически выгодного способа синтеза 5-МФС и ДМФ из 5-ГМФ и 2,5-диформилфурана (ДФФ) или 5-метилфуран-2-карбальдегида, имеющих широкое применение в области биотоплива, пищевых добавок, лекарственных препаратов, согласно удобному подходу, который не имеет указанных недостатков.
Другой целью настоящего изобретения является разработка атомно-экономичного способа, характеризующегося высоким выходом, намного меньшим образованием побочных продуктов и не требующего тщательной очистки.
Другой целью настоящего изобретения является разработка более мягкого и эффективного способа, который можно применять в масштабируемых превращениях.
Другой целью настоящего изобретения является разработка масштабируемого способа получения биотоплива или кандидата для биотоплива с использованием дешевых углеводных биоотходов, согласно поэтапному методу из 5-ГМФ или его альдегид-замещенных производных.
Другой целью настоящего изобретения является применение этой же стратегии для восстановления альдегидной группы, присоединенной к молекулам похожих типов.
Другой целью настоящего изобретения является утилизация несъедобных и дешевых целлюлозы/углеводов в производстве ценных биохимикатов (5-МФС, ДМФ и т.д.) как сырья для биотоплива, пищевых добавок, ароматизаторов и применения в фармацевтике.
Другой целью настоящего изобретения является утилизация 5-МФС для производства 2-(этоксиметил)-5-метилфурана (ЭММФ) как биотопива/биодизеля и для других коммерческих применений.
Другой целью настоящего изобретения является разработка способа дешевого производства 2,5-диметилфурана (ДМФ) в качестве биотоплива и для синтеза коммерчески ценных молекул/продуктов.
Краткое описание изобретения
В одном варианте осуществления, в настоящем изобретении описан способ получения 5-метил-замещенных фуранов общей формулы (I):

где
R1 выбран из группы, включающей: атом водорода, гидроксиметил, метил, алкил, гидрокси-группу, альдегидную группу, атом галогена, сложноэфирную группу, карбоксильную группу, амид, амин, замещенный амин, алкокси/простоэфирные мостики, производные серы, производные фосфора, и арильную и гетероарильную функциональную группу; и R2 и R3 могут выбраны из группы, включающей: атом водорода, алкил и арил.
В другом варианте осуществления, в настоящем изобретении описан экономически выгодный, атомно-экономичный, высокоселективный и характеризующийся высоким выходом способ получения 5-метил-замещенных фурановых соединений общей формулы (I) из дешевых углеводов (таких как жом сахарного тростника, рисовая солома, стержни початков кукурузы, другие источники целлюлозы, целлюлоза, крахмал, полисахарид, глюкоза и фруктоза) через 5-ГМФ и его соответствующие продукты, и минимизация образования побочных продуктов для избежания дорогостоящего процесса очистки.
В другом варианте осуществления, в настоящем изобретении описан однореакторный способ получения 5-метил-замещенных фуранов общей формулы (I)
В другом варианте осуществления, в настоящем изобретении описан не требующий использования металлов и газообразного водорода, высоко селективный и экономически выгодный способ получения 5-метил-замещенных фуранов общей формулы (I).
В другом варианте осуществления, в настоящем изобретении описан способ получения 5-метил-замещенных фуранов общей формулы (I), включающий:
i) реакцию аминного соединения и неорганического основания с замещенным фурфуралем формулы (II) в подходящем растворителе с получением in situ соответствующего имина

ii) восстановление in situ сгенерированного имина со стадии (i) в основных условиях в подходящем растворителе до метил-замещенных фуранов общей формулы (I);
iii) выделение метил-замещенных фуранов общей формулы (I); и
iv) необязательно, очистку выделенных метил-замещенных фуранов общей формулы (I).
В другом варианте осуществления, в настоящем изобретении описан способ получения 5-метилфурфурилового спирта (5-МФС) формулы (1),
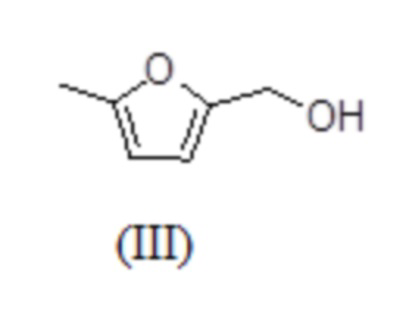
включающий:
i) реакцию аминного соединения и неорганического основания с 5-гидроксиметилфурфуралем (ГМФ) в подходящем растворителе с получением in situ соответствующего имина;
ii) восстановление in situ сгенерированного имина со стадии (i) в основных условиях в подходящем растворителе до 5-МФС формулы (1);
iii) выделение 5-МФС формулы (1); и
iv) необязательно, очистку выделенного 5-МФС.
В другом варианте осуществления, в настоящем изобретении описан способ получения 2,5-диметилфурана формулы (IV),

включающий следующие стадии:
i) реакцию аминного соединения и неорганического основания с 2,5-диформилфураном в растворителе с получением in situ соответствующего диимина;
ii) восстановление in situ сгенерированного диимина со стадии (i) в основных условиях в растворителе с получением 2,5-диметилфурана формулы (IV);
iii) выделение 2,5-диметилфурана формулы (IV); и
iv) необязательно, очистку выделенного 2,5-диметилфурана формулы (IV).
В другом варианте осуществления, в настоящем изобретении описан способ получения 2-(этоксиметил)-5-метилфурана (ЭММФ) формулы (V) из 5-метилфурфурилового спирта (5-МФС) формулы (III).

Соответственно, способ по настоящему изобретению включает применение комбинации неорганических оснований в мягких условиях в растворителе без использования металлов, чтобы избежать нежелательной реакции и обеспечить нужные условия для успешной конверсии.
Подробное описание изобретения
В настоящем изобретении описан “Способ без применения металлов для селективного восстановления альдегидной группы до метильной группы в различных замещенных фуранах”, который включает in situ стадии образования гидразона карбонильного соединения и дальнейшего разложения в присутствии сильного основания с получением 5-метил-замещенных фурановых соединений общей формулы (I):

где
R1 выбран из группы, включающей: атом водорода, гидроксиметил, метил, алкил, гидрокси-группу, формил, атом галогена, сложноэфирную группу, карбоксил, нитро-группу, амид, амино-группу, замещенную амино-группу, алкокси-группу, простоэфирную группу, производные серы, производные фосфора, и арильную и гетероарильную функциональную группу; и R2 и R3 могут выбраны из группы, включающей: атом водорода, алкил и арил.
В отличие от ранее известных в данной области способов, в настоящем изобретении описан способ восстановления, не требующий использования металлов и газообразного водорода, для прямой конверсии 5-ГМФ и ди/моноформил фурана в соответствующий 5-МФС и ДМФ, с хорошими выходами.
Проблематичный и ранее неопробованный подход через восстановление по Вольфу-Кижнеру был осуществлен в настоящем исследовании при сравнительно низкой температуре для селективной конверсии 5-альдегид замещенных фурановых соединений в 5-метил-замещенное фурановое соединение общей формулы (I) с хорошим выходом и очень небольшим образованием побочных продуктов.
Данный способ был осуществлен в условиях обычного кипячения без необходимости использования автоклавов с высоким давлением.
Данный модифицированный способ синтеза оказался высоко селективным, характеризующимся высоким выходом и применимым для крупномасштабного получения 5-МФС с очень хорошим выходом.
Вся модифицированная система в целом также ограничивает формирование нежелательных побочных продуктов в ходе процессов восстановления и полимеризации.
В одном варианте осуществления, в настоящем изобретении описан способ получения 5-метил-замещенных фуранов общей формулы (I):

где
R1 выбран из группы, включающей: атом водорода, гидроксиметил, метил, алкил, гидрокси-группу, альдегидную группу, атом галогена, сложноэфирную группу, карбоксильную группу, амид, амино-группу, замещенную амино-группу, алкокси/простоэфирные мостики, производные серы, производные фосфора, и арильную и гетероарильную функциональную группу; R2 и R3 могут выбраны из группы, включающей: атом водорода, алкил и арил; данный способ включает следующие стадии:
i) реакция аминного соединения и неорганического основания с замещенным фурфуралем формулы (II) в растворителе с получением in situ соответствующего иминного соединения;

ii) восстановление in situ сгенерированного имина со стадии (i) в основных условиях в растворителе с получением 5-метил-замещенных фуранов общей формулы (I);
iii) выделение метил-замещенных фуранов общей формулы (I); и
iv) необязательно, очистка выделенных метил-замещенных фуранов общей формулы (I).
В другом варианте осуществления, алкил представляет собой метил.
В другом варианте осуществления, в настоящем изобретении описан экономически выгодный, атомно-экономичный, высокоселективный и характеризующийся высоким выходом способ получения 5-метил-замещенных фурановых соединений общей формулы (I) из дешевых углеводов (таких как жом сахарного тростника, рисовая солома, стержни початков кукурузы, другие источники целлюлозы, целлюлоза, крахмал, полисахарид, глюкоза и фруктоза) через 5-ГМФ и его соответствующие продукты, и минимизация образования побочных продуктов для избежания дорогостоящего процесса очистки.
В другом варианте осуществления, в настоящем изобретении описан однореакторный способ получения 5-метил-замещенных фуранов общей формулы (I)
В другом варианте осуществления, в настоящем изобретении описан не требующий использования металлов и газообразного водорода, высоко селективный и экономически выгодный способ получения 5-метил-замещенных фуранов общей формулы (I).
В другом варианте осуществления, в настоящем изобретении описан способ получения 5-метилфурфурилового спирта (5-МФС) формулы (1),

включающий:
i) реакцию аминного соединения и неорганического основания с 5-гидроксиметилфурфуралем (ГМФ) в подходящем растворителе с получением in situ соответствующего имина;
ii) восстановление in situ сгенерированного имина со стадии (i) в основных условиях в подходящем растворителе до 5-МФС формулы (1);
iii) выделение 5-МФС формулы (III); и
iv) необязательно, очистку выделенного 5-МФС формулы (III).
5-ГМФ был использован как основной строительный блок, полученный из углеводов, для построения 5-МФС.
Спиртовая группа 5-ГМФ оказалась нереакционноспособной, и был получен основной продукт 5-МФС и 2,5-диформилфуран или моноформилфуран, которые оба успешно были превращены по этому способу в ДМФ как основной продукт.
В другом варианте осуществления, финальный продукт формулы (I) или формулы (III) или формулы (IV) выделяли методом экстракции с использованием подходящего растворителя для экстракции.
Подходящие растворители для экстракции включают (но не ограничиваются только ими) алкилкетоны, этилацетат, дихлорметан, хлороформ, ТГФ и диэтиловый эфир и т.п., и их смеси.
Для достижения высокого выхода и чистоты финального продукта формулы (I) или формулы (III) или формулы (IV), проводили перегонку при различном давлении и температуре.
Способ по настоящему изобретению следует традиционному подходу восстановления по Вольфу-Кижнеру, который ранее не применялся к альдегид-замещенным фурановым соединениям общей формулы (II).
Указанное аминное соединение включает (но не ограничивается только им) гидразин гидрат, гидразин гидрохлорид, арил-замещенный гидразин/алкил-замещенный гидразин/гидроксил-замещенный гидразин, а также любую группу диаминных соединений, обладающих способностью формировать имины и далее вступать в аналогичную реакцию восстановления по Вольфу-Кижнеру, и т.п. Предпочтительно, неорганическое основание представляет собой сильное неорганическое основание.
Неорганическое основание включает (но не ограничивается только ими) неорганические основания, представляющие собой алкоксилаты щелочных металлов, гидроксиды щелочных металлов и гидриды щелочных металлов. Наиболее предпочтительно, щелочные металлы представляют собой K, Na и Cs. Алкоксилаты щелочных металлов выбраны из группы, состоящей из KOtBu, NaOtBu, KOEt, NaOEt, KOMe и NaOMe. Гидроксиды щелочных металлов выбраны из группы, состоящей из NaOH и KOH; и гидрид щелочного металла представляет собой NaH.
Наиболее предпочтительно, неорганическое основание выбрано из группы, состоящей из KOtBu, NaOtBu, KOEt, NaOEt, KOMe, NaOMe, NaOH, KOH и NaH.
Предпочтительно, подходящим растворителем является спиртовой органический растворитель.
Спиртовой органический растворитель представляет собой любой протонный спирт с различными температурами кипения, имеющий способность к переносу протона в сильно щелочных условиях для восстановления имина, сформированного in situ из карбонильных соединений, до алкила.
Спиртовой органический растворитель включает (но не ограничивается только ими) алкиловый спирт, циклоалкиловый спирт и т.п.
Предпочтительно, алкиловый или циклоалкиловый спирт как растворитель выбран из группы, состоящей из метанола, этанола, изопропанола, н-бутанола, 2-бутанола, трет-бутанола или их смесей. Наиболее предпочтительно, спиртовой растворитель представляет собой 2-бутанол и этанол.
Стадию выделения iii) в описанных выше способах проводят методом экстракции с использованием растворителя, выбранного из группы, состоящей из алкилкетонов, этилацетата, дихлорметана, хлороформа, ТГФ, диэтилового эфира или их смеси.
В другом варианте осуществления настоящего изобретения, метилфурфуриловый спирт (5-МФС) формулы (III) далее вводят в реакцию в присутствии трихлорида алюминия и этанола, получая 2-(этоксиметил)-5-метилфуран (ЭММФ) формулы (V).

Подходящая температура для данной реакции может варьироваться от 80 до 180°C в зависимости от основания и растворителя, применяющихся для этого превращения. Предпочтительно, реакцию проводят при температуре в диапазоне от 120 до 140°C для получения наивысшего выхода с низким формированием побочных продуктов.
Время реакции может составлять от 2 до 6 часов, или до полного завершения реакции.
Для расширения области применения способа по настоящему изобретению, различные 5-альдегид-замещенные фурановые соединения были успешно использованы для получения 5-метил-замещенных фуранов в рамках общей формулы (I).
При разработке способа по настоящему изобретению, различные аналоги гидразина, неорганические основания и спиртовые растворители были использованы для селективного образования соединений в рамках общей формулы (I).
Описанный в настоящей заявке способ получения целевых 5-метил-замещенных фуранов формулы (I) высоко селективным образом включает применение аминового соединения для селективного образования имина с альдегидной группой замещенных фурановых соединений формулы (II). Основание в спиртовом растворителе специфично восстанавливает карбонильную группу по механизму переноса протона, давая газообразный азот как единственный побочный продукт.
Предпочтительно, мольное соотношение реагентов следующее: альдегид-замещенный фуран (1 экв.), аминное соединение (1-3 экв.), неорганическое основание (0.5-4 экв.).
Метод очистки выбирают из любых подходящих методов, известных в данной области, которые включают (но не ограничиваются только ими) хроматографические методы, перегонку, кристаллизацию и т.п.
Предпочтительно, очистку проводят посредством экстракции растворителем, дробной перегонки, за которыми могут следовать другие методы очистки.
В другом варианте осуществления, в настоящем изобретении описан способ получения 2-(этоксиметил)-5-метилфурана (ЭММФ) формулы (V) из 5-метилфурфурилового спирта (5-МФС) формулы (III).

В этом способе по настоящему изобретению, оптимизация реагентов, субстратов, растворителей и условий реакции все вместе имеют важное значение для получения целевых соединений общей формулы (I) с минимальным формированием побочных продуктов.
Кроме того, способ по настоящему изобретению можно применять для крупномасштабного производства 5-метил-замещенных фурановых соединений общей формулы (I) из различных альдегид-замещенных фурановых соединений; они могут применяться как сырье для биотоплива и других коммерчески ценных продуктов.
Масштабируемый способ получения 5-МФС как сырьевого компонента может также применяться к производству прекурсоров биотоплива, таких как 2,5-диметилфуран (2,5-ДМФ), и других важных биохимикатов (Схема 1).

Схема 1. Получение 5-МФС из 5-ГМФ как соединения-платформы для производства биотоплива и других важных биохимикатов
Список аббревиатур
ГМФ: 5-гидроксиметилфурфураль
ДМФ: 2,5-диметилфуран
5-МФС: 5-метилфурфуриловый спирт
МФ: 2-метилфуран
ЭММФ: 2-(этоксиметил)-5-метилфуран
ТГФ: Тетрагидрофуран
GC-MS: Газовая хроматография/Масс-спектрометрия
ЯМР: Ядерный магнитный резонанс
ТСХ: Тонкослойная хроматография
Вещества и методы, применяющиеся в экспериментах
Все использовавшиеся исходные вещества и растворители были куплены у коммерческих поставщиков: гидразин гидрат и его аналоги – у Thomas Baker и Sigma, основания – у Avra, растворители – у CDH, SD Fine, 5-ГМФ был получен по собственному запатентованному способу авторов настоящего изобретения (Номер заявки: 201811023331), а остальные исходные соединения – от Sigma и TCI.
Примеры
Общая экспериментальная методика:
В высушенную в термошкафу круглодонную колбу (500 мл) помещали основание (0.5-2.0 экв.) и спиртовой растворитель. Реакционную смесь нагревали до температуры в диапазоне от 120°C до 140°C до полного растворения основания. В другую круглодонную колбу помещали 5-ГМФ (1.0 экв.) вместе с 2-бутанолом, затем по каплям добавляли гидразин гидрат (1-3 экв.) при аккуратном перемешивании. Смесь с 5-ГМФ постепенно добавляли в приготовленный раствор основания и кипятили при 120-130°C в течение 2-6 часов. Протекание реакции отслеживали методом ТСХ, и после окончания реакции реакционную смесь экстрагировали смесью этилацетат/диэтиловый эфир и сушили над Na2SO4, затем отгоняли растворитель при 100-110°C в вакууме и получали сырой продукт 5-МФС, который далее очищали вакуумной перегонкой, получая 5-МФС с выходом 50-70% и селективностью >90%. Полученный продукт дополнительно анализировали методом GC-MS и ЯМР (1H и 13C).

Схема 2. Синтез 5-метилзамещенных фуранов из 5-альдегид-замещенных фуранов
1. Экспериментальная методика синтеза 5-МФС из 5-ГМФ:
В высушенный реактор (15 л) помещали KOtBu (106.8 г, 0.95 моль) и 2-бутанол (1 L). Реакционную смесь нагревали, перемешивали и кипятили при 130°C до полного растворения основания. В другую круглодонную колбу помещали 5-ГМФ (100.0 г, 0.79 моль) вместе с 2-бутанолом (300 мл), затем по каплям добавляли гидразин гидрат (78.0 мл, 1.58 моль) при аккуратном перемешивании. Смесь с 5-ГМФ постепенно добавляли в приготовленный раствор основания и кипятили при 120-130°C в течение 3-6 часов. Протекание реакции отслеживали методом ТСХ, после окончания реакции реакционную смесь экстрагировали смесью этилацетат/диэтиловый эфир и сушили над Na2SO4, затем отгоняли растворитель при 100-110°C, получая 5-МФС, 45.15 г, выход 51%. Полученный сырой продукт анализировали методом GC-MS и ЯМР. 1H ЯМР (300 МГц, CDCl3) δ 6.15 (д, 1H, J = 3 Гц), 5.91 (д, 1H, J = 3 Гц), 4.52 (с, 2H), 2.29 (с, 3H); 13C ЯМР (300 МГц, CDCl3) δ 152.31, 152.30, 108.67, 106.19, 57.35, 13.48; GC-MS [M]+ = 112.

Схема 3. Синтез 5-МФС из 5-ГМФ
2. Экспериментальная методика синтеза 5-МФС из 5-ГМФ:
В высушенную в термошкафу круглодонную колбу (500 мл) помещали трет-бутоксид натрия NaOtBu (18.2 г, 0.19 моль) и 2-бутанол (25 мл). Реакционную смесь нагревали, перемешивали и кипятили при 130°C до полного растворения основания. В другую круглодонную колбу помещали ГМФ (20 г, 0.15 ммоль) вместе с 2-бутанолом (15 мл), затем по каплям добавляли гидразин гидрат (11.6 мл, 0.23 моль) при аккуратном перемешивании. Смесь с 5-ГМФ постепенно добавляли в приготовленный раствор основания и кипятили при 120-130°C в течение 3-6 часов. Протекание реакции отслеживали методом ТСХ, и после окончания реакции реакционную смесь экстрагировали смесью этилацетат/диэтиловый эфир и сушили над Na2SO4, после чего удаляли растворитель отгонкой при 100-110°C, получая сырой продукт 5-МФС, который затем очищали методом вакуумной перегонки с получением 5-МФС, 9.0 г, выход 50.5%. Перегнанный продукт анализировали методом GC-MS и ЯМР. Спектральные данные были такие же, как в Схеме 2 для соединения III.

Схема 4. Синтез 5-МФС из 5-ГМФ
3. Экспериментальная методика синтеза 5-МФС из 5-ГМФ:
В высушенную в термошкафу круглодонную колбу (250 мл) помещали KOH (3.3 г, 0.05 моль) и 2-бутанол (10 мл). Реакционную смесь нагревали, перемешивали и кипятили при 130°C до полного растворения основания. В другую круглодонную колбу помещали ГМФ (5.0 г, 0.03 моль) вместе с 2-бутанолом (10 мл), затем по каплям добавляли гидразин гидрат (2.9 мл, 0.05 моль) при аккуратном перемешивании. Смесь с 5-ГМФ постепенно добавляли в приготовленный раствор основания и кипятили при 120-130°C в течение 3-6 часов. Протекание реакции отслеживали методом ТСХ, и после окончания реакции реакционную смесь экстрагировали смесью этилацетат/диэтиловый эфир и сушили над Na2SO4, после чего удаляли растворитель отгонкой при 100-110°C, получая сырой продукт 5-МФС, который затем очищали методом вакуумной перегонки с получением 5-МФС, 1.1 г, выход 25%. Перегнанный продукт анализировали методом GC-MS и ЯМР. Спектральные данные были такие же, как в Схеме 2 для соединения III.

Схема 5. Синтез 5-МФС из 5-ГМФ
4. Экспериментальная методика синтеза 2-метилфурана из 2-фурфуральдегида:
В высушенную в термошкафу круглодонную колбу (100 мл) помещали KOtBu (1.1 г, 0.010 моль) и 2-бутанол (3 мл). Реакционную смесь нагревали, перемешивали и кипятили при 130°C до полного растворения основания. В другую круглодонную колбу помещали 2-фурфуральдегид (1.0 г, 0.01 моль) вместе с 2-бутанолом (3 мл), затем по каплям добавляли гидразин гидрат (1.02 мл, 0.020 моль) при аккуратном перемешивании. Смесь с 2-фурфуральдегидом постепенно добавляли в приготовленный раствор основания и кипятили при 120-130°C в течение 3-6 часов. Протекание реакции отслеживали методом ТСХ, и после окончания реакции реакционную смесь анализировали методом GC-MS. Полученный продукт дополнительно анализировали методом GC-MS и сравнивали со стандартом.

Схема 6. Синтез 2-метилфурана из 2-фурфуральдегида
5. Экспериментальная методика синтеза 2,5-диметилфурана (ДМФ) из 2,5-диформилфурана:
В высушенную в термошкафу круглодонную колбу (100 мл) помещали KOtBu (45.0 мг, 0.403 ммоль) и 2-бутанол (1.5 мл). Реакционную смесь нагревали, перемешивали и кипятили при 130°C до полного растворения основания. В другую круглодонную колбу помещали 2,5-диформилфуран (100 мг, 0.806 ммоль) вместе с 2-бутанолом (3 мл), затем по каплям добавляли гидразин гидрат (79 мкл, 1.612 ммоль) при аккуратном перемешивании. Смесь с 2,5-диформилфураном постепенно добавляли в приготовленный раствор основания и кипятили при 130°C в течение 3-5 часов. Протекание реакции отслеживали методом ТСХ, и после окончания реакции реакционную смесь анализировали методом GC-MS. Полученный продукт дополнительно анализировали методом GC-MS и сравнивали со стандартом.

Схема 7. Синтез 2,5-диметилфурана из 2,5-диформилфурана
6. Экспериментальная методика синтеза 2-этил-5-метилфурана из 5-этилфуран-2-карбальдегида:
В высушенную в термошкафу круглодонную колбу (100 мл) помещали KOtBu (45.0 мг, 0.403 ммоль) и 2-бутанол (1.5 мл). Реакционную смесь нагревали, перемешивали и кипятили при 130°C до полного растворения основания. В другую круглодонную колбу помещали 5-этилфуран-2-карбальдегид (100 мг, 0.805 ммоль) вместе с 2-бутанолом (3 мл), затем по каплям добавляли гидразин гидрат (79 мкл, 1.611 ммоль) при аккуратном перемешивании. Смесь с 5-этилфуран-2-карбальдегидом постепенно добавляли в приготовленный раствор основания и кипятили при 120-130°C в течение 3-5 часов. Протекание реакции отслеживали методом ТСХ, после окончания реакции реакционную смесь анализировали методом GC-MS и сравнивали со стандартом.

Схема 8. Синтез 2-этил-5-метилфурана из 5-этилфуран-2-карбальдегида.
7. Экспериментальная методика синтеза 4,5-диметилфуран-2-карбальдегида:
В высушенную в термошкафу круглодонную колбу (100 мл) помещали KOtBu (45.0 мг, 0.403 ммоль) и 2-бутанол (1.5 мл). Реакционную смесь нагревали, перемешивали и кипятили при 130°C до полного растворения основания. В другую круглодонную колбу помещали 4,5-диметилфуран-2-карбальдегид (100 мг, 0.806 ммоль) вместе с 2-бутанолом (3 мл), затем по каплям добавляли гидразин гидрат (79 мкл, 1.612 ммоль) при аккуратном перемешивании. Смесь с 4,5-диметилфуран-2-карбальдегидом постепенно добавляли в приготовленный раствор основания и кипятили при 120-130°C в течение 3-5 часов. Протекание реакции отслеживали методом ТСХ, после окончания реакции реакционную смесь анализировали методом GC-MS и сравнивали со стандартом.

Схема 9. Синтез 2,3,5-триметилфурана из 4,5-диметилфуран-2-карбальдегида
8. Экспериментальная методика синтеза 2-(этоксиметил)-5-метилфурана (ЭММФ) из 5-МФС:
В высушенную в термошкафу круглодонную колбу (100 мл) помещали 5-МФС (100 мг, 0.8919 ммоль) и этанол (2 мл), затем добавляли трихлорид алюминия (3.56 мг, 0.0267 ммоль). Нагревали и перемешивали реакционную смесь при кипячении при 90°C в течение 4-12 часов. Протекание реакции отслеживали методом ТСХ, после окончания реакции реакционную смесь нейтрализовывали бикарбонатом натрия, после чего экстрагировали смесью диэтилового эфира и этилацетата. Полученный экстракт сушили над сульфатом натрия и упаривали в вакууме, получая целевой продукт соединение V с практически количественной конверсией. Полученный продукт дополнительно анализировали методом GC-MS и сравнивали со стандартом.

Схема 10. Синтез ЭММФ из 5-МФС
Главными преимуществами настоящего изобретения являются следующие:
1. Был разработан простой, атомно-экономичный и экономически выгодный способ получения 5-метил-замещенных фуранов из 5-альдегид замещенных фуранов.
2. В разработанном способе не используются газообразный водород и металлы, он легко масштабируется и не требует тщательной очистки для достижения высокого выхода.
3. В разработанном способе не наблюдается перевосстановления, и выделение продукта осуществляется простой экстракцией растворителем и упариванием.
4. Нет необходимости применять автоклавные системы, и проведение реакции в условиях кипячения снижает риски.
5. Разработанный способ можно применять для дешевого получения высоко востребованного соединения-платформы 5-МФС, 2,5-ДМФ и других 5-метил-замещенных фурановых соединений для применения в качестве биотоплива и в других целях.
6. 5-МФС является очень хорошим выбором для производства 2,5-ДМФ энергоэффективным образом.
7. Образование простых эфиров 5-МФС можно осуществлять в мягких кислых условиях с различными алкиловыми спиртами, и они имеют широкое применение в качестве биотоплива и биодизеля.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения 5-метилфурфурилового спирта | 1985 |
|
SU1298212A1 |
| Способ получения 2-гидрокси-2-((5-метилфуран-2-ил)метил)-3,3,3-трифторпропановой кислоты | 2023 |
|
RU2813205C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТЕТРАГИДРОФУРО[3,2-c]ПИРИДИНОВ | 2023 |
|
RU2810212C1 |
| БИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ИМИДАЗО-3-ИЛАМИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 2000 |
|
RU2264402C2 |
| Способ получения 5-метилфурфурилового спирта | 1981 |
|
SU1004377A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-(БЕНЗИЛ)ФУРАНА | 2014 |
|
RU2570420C1 |
| КАТАЛИЗАТОРЫ НА ОСНОВЕ ПЕРЕХОДНОГО МЕТАЛЛА 8 ГРУППЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И СПОСОБ ИХ ПРИМЕНЕНИЯ В РЕАКЦИИ МЕТАТЕЗИСА | 2014 |
|
RU2674471C2 |
| СПОСОБ СИНТЕЗА 5-ГИДРОКСИМЕТИЛФУРФУРАЛЯ (5-HMF) ИЗ УГЛЕВОДОВ | 2019 |
|
RU2797180C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2,5-ДИАЛКОКСИ-2,5-ДИГИДРОФУРАНОВ | 1997 |
|
RU2124508C1 |
| ОКСИАЛКИЛФУРАНОВЫЕ ПРОИЗВОДНЫЕ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ ПРИСОЕДИНЕНИЯ КИСЛОТ, ИЛИ ИХ СТЕРЕОХИМИЧЕСКИЕ ИЗОМЕРНЫЕ ФОРМЫ, ОБЛАДАЮЩИЕ АНТИАЛЛЕРГИЧЕСКОЙ АКТИВНОСТЬЮ И АНТИАЛЛЕРГИЧЕСКАЯ КОМПОЗИЦИЯ | 1990 |
|
RU2030415C1 |
Изобретение относится к способу селективного восстановления альдегидной группы до метильной группы в замещенных фуранах с получением 5-метил-замещенных фуранов общей формулы (I), где R1 выбран из группы, состоящей из следующих: атом водорода, гидроксиметил, алкил, гидрокси-группа, альдегидная группа, атом галогена, сложноэфирная группа, карбоксил, нитро-группа, амино-группа, амид, замещенная амино-группа, алкокси/простоэфирные мостики, производные серы, производные фосфора, и арильная и гетероарильная функциональная группа; и R2 и R3 выбраны из группы, состоящей из следующих: атом водорода, алкил и арил, где указанный способ включает стадии: i) реакция аминного соединения и неорганического основания с замещенным фурфуралем формулы (II) в растворителе, с получением in situ соответствующего иминного соединения; ii) восстановление in situ сгенерированного имина со стадии (i) в основных условиях в растворителе, с получением 5-метил-замещенных фуранов общей формулы (I); iii) выделение метил-замещенных фуранов общей формулы (I). Предложенный способ является удобным, эффективным и масштабируемым. 12 з.п. ф-лы, 9 пр.

1. Способ селективного восстановления альдегидной группы до метильной группы в замещенных фуранах с получением 5-метил-замещенных фуранов общей формулы (I)
 ,
,
где
R1 выбран из группы, состоящей из следующих: атом водорода, гидроксиметил, алкил, гидрокси-группа, альдегидная группа, атом галогена, сложноэфирная группа, карбоксил, нитро-группа, амино-группа, амид, замещенная амино-группа, алкокси/простоэфирные мостики, производные серы, производные фосфора, и арильная и гетероарильная функциональная группа; и
R2 и R3 выбраны из группы, состоящей из следующих: атом водорода, алкил и арил,
где указанный способ включает стадии:
i) реакция аминного соединения и неорганического основания с замещенным фурфуралем формулы (II) в растворителе, с получением in situ соответствующего иминного соединения
 ;
;
ii) восстановление in situ сгенерированного имина со стадии (i) в основных условиях в растворителе, с получением 5-метил-замещенных фуранов общей формулы (I);
iii) выделение метил-замещенных фуранов общей формулы (I); и
iv) необязательно, очистка выделенных метил-замещенных фуранов общей формулы (I).
2. Способ по п. 1, в котором 5-метил-замещенный фуран общей формулы (I) представляет собой 5-метилфурфуриловый спирт (5-МФС) формулы (III),
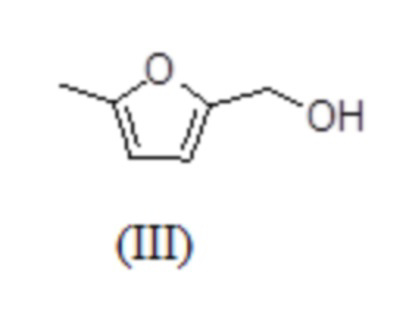
включающий следующие стадии:
i) реакция аминного соединения и неорганического основания с 5-гидроксиметилфурфуралем (ГМФ) в растворителе, с получением in situ соответствующего имина;
ii) восстановление in situ сгенерированного имина со стадии (i) в основных условиях в растворителе, с получением 5-МФС формулы (III);
iii) выделение 5-МФС формулы (III); и
iv) необязательно, очистка выделенного 5-МФС формулы (III).
3. Способ по п. 1, в котором 5-метил-замещенный фуран общей формулы (I) представляет собой 2,5-диметилфуран формулы (IV),

включающий стадии:
i) реакция аминного соединения и неорганического основания с 2,5-диформилфураном в растворителе, с получением in situ соответствующего диимина;
ii) восстановление in situ сгенерированного диимина со стадии (i) в основных условиях в растворителе, с получением 2,5-диметилфурана формулы (IV);
iii) выделение 2,5-диметилфурана формулы (IV); и
iv) необязательно, очистка выделенного 2,5-диметилфурана формулы (IV).
4. Способ по пп. 1-3, в котором аминное соединение выбрано из группы, состоящей из гидразина гидрата, гидразина гидрохлорида, арил-замещенного гидразина или алкил-замещенного гидразина или гидроксил-замещенного гидразина, или их смеси.
5. Способ по пп. 1-3, в котором неорганическое основание представляет собой алкоксилаты щелочных металлов, гидроксиды щелочных металлов и гидриды щелочных металлов.
6. Способ по п. 5, в котором неорганическое основание выбрано из группы, состоящей из KOtBu, NaOtBu, KOEt, NaOEt, KOMe, NaOMe, NaOH, KOH и NaH, или их смеси.
7. Способ по пп. 1-3, в котором алкиловый или циклоалкиловый спиртовой органический растворитель способен осуществлять перенос протона в сильно основных условиях, восстанавливая сформированный in situ имин.
8. Способ по п. 1 или 7, в котором алкиловый или циклоалкиловый спиртовой органический растворитель выбран из группы, состоящей из метанола, этанола, изопропанола, н-бутанола, 2-бутанола, трет-бутанола или их смеси.
9. Способ по пп. 1-3, в котором стадию выделения iii) осуществляют методом экстракции, применяя растворитель, выбранный из группы, состоящей из алкилкетонов, этилацетата, дихлорметана, хлороформа, ТГФ, диэтилового эфира или их смеси.
10. Способ по п. 2, в котором метилфурфуриловый спирт (5-МФС) формулы (III) далее вводят в реакцию в присутствии трихлорида алюминия и этанола, получая 2-(этоксиметил)-5-метилфуран (ЭММФ) формулы (V)
 .
.
11. Способ по п. 1, в котором соотношение аминное соединение : неорганическое основание : замещенный фурфураль формулы (II) находится в диапазоне 1-3:0,5-4:1.
12. Способ по п. 2, в котором соотношение аминное соединение : неорганическое основание : 5-гидроксиметилфурфураль (ГМФ) находится в диапазоне 1-3:0,5-2:1.
13. Способ по п. 3, в котором мольное соотношение аминное соединение : неорганическое основание : 2,5-диформилфуран составляет 2:0,5:1.
| REICHSTEIN T | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| XIA HAIAN ETAL | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,4-ДИЗАМЕЩЕННЫХ ФУРАНОВ | 2023 |
|
RU2810211C1 |
Авторы
Даты
2024-12-02—Публикация
2021-02-19—Подача