Изобретение относится к гибридным антибактериальным покрытиям на металлах для биосовместимых имплантатов с адресной доставкой лекарства, и может найти применение в имплантационной хирургии.
Металлические имплантаты являются основным материалом в костной хирургии. Титан широко используется для производства зубных и ортопедических имплантатов благодаря своей высокой прочности, коррозионной стойкости и биоинертности, а сплавы магния обладают биосовместимостью, биоразлагаемостью и механическими свойствами наиболее близкими к человеческой кости. Однако эти металлы не лишены недостатков и поверхность имплантата требует дополнительной обработки для улучшения остеоинтеграции и повышения адгезии клеток костной ткани. Формирование покрытий является одним из методов модификации, приводящих к устранению недостатков металлической поверхности. Плазменное электролитическое оксидирование (ПЭО) является одним из наиболее перспективных методов защиты металлов от электрохимического растворения и улучшения механических характеристик и используется для формирования биоактивных покрытий на имплантатах.
На поверхности имплантата необходимо сформировать биологически активный слой (ускоряющий остеогенез и остеоинтеграцию кости), с одной стороны, и антикоррозионный защитный (снижающий скорость растворения магниевого имплантата в физиологической среде) – с другой. Наибольший интерес в данном отношении представляют биоактивные кальций-фосфатные слои, содержащие в своем составе «родные» для костных тканей соединения фосфатов кальция. Исходя из этого целесообразен синтез на поверхности металлов кальций-фосфатных соединений, в том числе гидроксиапатита, в составе антикоррозионных покрытий с развитой морфологической структурой. Это позволит обеспечить оптимальную биосовместимость имплантата с костной тканью. Изделия из гидроксиапатита применяют в травматологии, стоматологии, ортопедии и косметологии как биоактивный материал, используемый для регенерации костной ткани и идентичный ее минеральной части по химическому составу. Физические и химические свойства гидроксиапатита обеспечивают идеальную биосовместимость, активно стимулируя остеогенез и восстановление костной ткани.
Другой проблемой использования имплантатов являются имплантат-ассоциированные инфекции. Основным этиологическим агентом инфекции костной ткани является S. aureus, в том числе метициллинрезистентный S. aureus. При наличии секвестрации антибиотики и иммунные клетки не достигают зараженного участка, что приводит к неэффективности лечения. Одним из основных методов решения данной проблемы является адресная доставка лекарств. Эффективным её решением является модификация поверхности имплантата так называемыми активными покрытиями, содержащими бактерицидный агент. Одним из вариантов такой модификации является нанесение кальций-фосфатных покрытий, содержащих антибиотик.
Так, например, известно композитное антибактериальное кальций-фосфатное покрытие, содержащее в своем составе лекарственное средство хлорамфеникол и биоразлагаемый полимер – поликапролактон [Ковтунов М.А. и др. Исследование физико-механических характеристик композитных антибактериальных кальций-фосфатных покрытий, полученных методом МДО /материалы XVI международной конференции студентов, аспирантов и молодых учёных «Перспективы развития фундаментальных наук». 2019. Т.2 Химия. С.111-113]. Покрытие получали методом микродугового оксидирования титановых дисков в насыщенном растворе СаО в H3PO4, дополненном дисперсионной фазой гидроксиапатита, с дальнейшей пропиткой образцов в растворе поликапролактона в гесксафторизопропаноле с добавлением порошка хлорамфеникола при постоянном ультразвуковом воздействии. Данные покрытия показали повышенную адгезионную прочность и эластичность по сравнению с кальций-фосфатными покрытиями без добавки полимера.
Основным недостатком данного аналога является то, что хлорамфеникол является чрезвычайно токсичным веществом, вызывающим тяжелые побочные эффекты. Применение данного вещества возможно только при полном отсутствии альтернатив. В связи с этим использование его в качестве антибактериального компонента для композиционных слоев на имплантатах невозможно.
Одним из широко используемых антибиотиков первой линии при лечении широко распространенных грамположительных бактериальных инфекций, в частности, метициллинрезистентного золотистого стафилококка является ванкомицин. Он способен разрушать биопленки и обладает низкой токсичностью в отношении эукариотических клеток, в следствии чего он интересен для создания покрытий на имплантатах.
Одним из таких известных покрытий является кальций фосфатное керамическое покрытие с ванкомицином [Radin S. et al. Calcium phosphate ceramic coatings as carries of vancomycin / Biomaterials. 1998. V. 18. P. 777-782], для его получения на образцах из титанового сплава электрофоретическим осаждением кальций-дефицитного гидроксиапатита из 2-пропанола с последующим спеканием получали тонкие кальций-фосфатные покрытия, которые далее погружали в TRIS-буферный раствор, содержащий ванкомицин, на 6, 24 и 72 ч при 37°С, некоторые образцы также были после погружены в метанол, содержащий ванкомицин и яичный фосфатидилхолин, на 24 ч.
Покрытия, полученные однократным нанесением ванкомицина проявили «взрывное» высвобождение его в моделируемом физиологическом растворе, композитное покрытие, содержащее липид, отличалось более длительным высвобождением антибиотика, но все еще слишком быстрым для терапевтической эффективности.
Еще одним известным покрытием являются композитные кальций-фосфатные покрытия, пропитанные полимерным раствором из поли-ϵ-капролактона и поливинилпирролидона с добавлением ванкомицина [Солдатова Е.А. и др. Композитные кальций фосфатные покрытия с иерархической структурой и антибактериальными свойствами для челюстно-лицевой хирургии / Тезисы докладов международной конференции «Физическая мезомеханика. Материалы с многоуровневой иерархически организованной структурой и интеллектуальные производственные технологии». 2020. Секция 6. С. 388-389]. Для получения которых на титановых подложках методом микродугового оксидирования формировали кальций-фосфатные покрытия в электролите (пересыщенный раствор оксида кальция в водном растворе ортофосфорной кислоты с добавлением порошка гидроксиапатита) Далее образцы помещали в раствор полимерной композиции, содержащей поли-ϵ-капролактон и поливинилпирролидон, растворенные в гексафторизопропаноле, и ванкомицин, в ультразвуковой ванне. Пропитка кальфий-фосфатного покрытия биорезорбируемым полимерным материалом привела к увеличению эластичности, а также данные покрытия продемонстрировали репаративный и противовоспалительный эффект.
Однако в описываемой работе не приводятся какие-либо данные об антибактериальной активности материалов, что не позволяет судить о возможности применения полученных покрытий в качестве поверхностей, препятствующих возникновению имплантат-ассоциированных инфекций.
В качестве наиболее близкого по техническому решению к заявляемому изобретению выбрано антибиктериальное кальций-фосфатное покрытие, сформированное на магниевом сплаве МА8 методом ПЭО и импрегнацией антибиотика – ванкомицина [Mashtalyar D.V. et al. Antibacterial Ca/P-coatings formed on Mg alloy using plasma electrolytic oxidation and antibiotic impregnation / Matter. Lett. 2022. V. 317. P. 1-5]. В данном прототипе на пластинах из магниевого сплава МА8 формировали ПЭО-покрытия в электролите, состоящем из глицерофосфата кальция, фторида натрия и метасиликата, в 2 стадии, далее для получения антибактериальных покрытий раствор Рингера, с растворенным в нем ванкомицином, импрегнировали в ПЭО-покрытие под вакуумом. Полученные покрытия показали более высокую коррозионную стойкость по сравнению с чистым сплавом, а антибактериальные тесты подтвердили их высокую ингибирующую активность. Однако существенным недостатком прототипа является пониженная адгезионная прочность фосфата кальция, нанесённого методом ПЭО, приводящая к быстрому износу покрытия, в результате чего степень остеоинтеграции со временем сокращается, а высвобождение лекарственного средства происходит неравномерно. В качестве решения этой проблемы предлагается добавление к фосфату кальция полимерного соединения, улучшающего механические свойства покрытия.
Задачей изобретения является создание простого в получении эффективного гибридного кальций-фосфатного ПЭО-покрытия на металлах и сплавах, содержащего антибиотик, с улучшенными механическими свойствами покрытия, позволяющими усилить адгезионную прочность фосфата кальция.
Технический результат заявляемого изобретения заключается в повышении адгезионной прочности гидроксиапатитного покрытия, повышение его осаждения, что приводит к увеличению равномерности высвобождения лекарственного средства из покрытия.
Заявленный технический результат достигается кальций-фосфатными покрытиями на металле, импрегнированными ванкомицином и дофамином, получаемыми методом ПЭО в электролите, содержащем глицерофосфат кальция, фторид натрия и метасиликат натрия, в биполярном режиме, с последующей промывкой под вакуумом этиловым спиртом и водой, высушиванием при комнатной температуре, и дальнейшей импрегнацией ванкомицина и дофамина путем перемешивания в растворе для полимеризации, состоящем из дофамина и ванкомицина в буфере ТРИС-HCl, в течение 2 часов при комнатной температуре.
Полидофамин был выбран в качестве полимерной компоненты для формирования гибридных покрытий, содержащих в своем составе ванкомицин. Известно, что полимеризованный дофамин способствует осаждению гидроксиапатита, а также он обладает отличной биосовместимостью, простому процессу полимеризации, противовоспалительной активностью и способностью удалять активные формы кислорода. Оптимальная степень равномерности и шероховатости покрытия в данной работе достигается при концентрации дофамина 2 мг/мл при выдержке в щелочной среде.
Способ получения гибридного кальций-фосфатного ПЭО-покрытия, импрегнированного ванкомицином и дофамином осуществляется следующим образом.
Формирование ПЭО-покрытий проводят в электролите, содержащем 25 г/л глицерофосфата кальция (C3H7CaO6P), 5 г/л фторида натрия (NaF) и 7 г/л метасиликата натрия (Na2SiO3) в биполярном режиме. На первом этапе плазменно-электролитическое оксидирование проводят в потенциометрическом режиме при напряжении тока 380 В в ходе анодной поляризации, на втором - в гальванодинамическом режиме при силе тока, изменяющейся от 5 А до 3 А в ходе катодной поляризации.
Образцы с кальций-фосфатным ПЭО-покрытием подвешивают на леску, промывают под вакуумом 2 раза 70% этиловым спиртом и 2 раза дистиллированной водой для удаления остатков спирта, высушивают при комнатной температуре.
Дофамин и ванкомицин растворяют в буфере ТРИС-HCl (pH 8,5) в необходимых концентрациях – 2 мг/мл и 5 мг/мл соответственно. Раствор переливают в емкость необходимого объема с якорем для магнитной мешалки.
Образец помещают в емкость так, чтобы он не касался якоря и был полностью погружен в раствор для полимеризации, и ставят на магнитную мешалку (200 об/мин) при комнатной температуре. Через 2 часа образец аккуратно вынимают и высушивают на воздухе в течение 4-6 часов.
Пример конкретного осуществления способа
Для приготовления образца использовали прямоугольные пластины из титанового сплава ВТ6 размером 8×8×2 мм, перед формированием покрытия образец обработали шлифовальной бумагой, промыли дистиллированной водой и обезжирили спиртом. Пластину поместили в электролит, содержащий 25 г/л глицерофосфата кальция (C3H7CaO6P), 5 г/л фторида натрия (NaF) и 7 г/л метасиликата натрия (Na2SiO3). На первом этапе увеличивали напряжение до 380 В, на втором — ток изменяли с 5 А до 3 А. Образец промыли дистиллированной водой, обезжирили спиртом и сушили теплым воздухом.
Образец с полученным кальций-фосфатным ПЭО-покрытием подвесили на леску, промыли под вакуумом 2 раза 70% этиловым спиртом и 2 раза дистиллированной водой для удаления остатков спирта, высушили при комнатной температуре.
10 мг дофамина и 25 мг ванкомицина растворили в 5 мл буфера TRIS-HCl (pH 8,5). Образец поместили в раствор в емкость с магнитной мешалкой, чтоб он не касался якоря и был полностью погружен в раствор для полимеризации, и перемешивали раствор со скоростью магнитной мешалки 200 об/мин при комнатной температуре в течение 2 часов. Далее образец аккуратно вынули и высушили на воздухе в течение 4-6 часов.
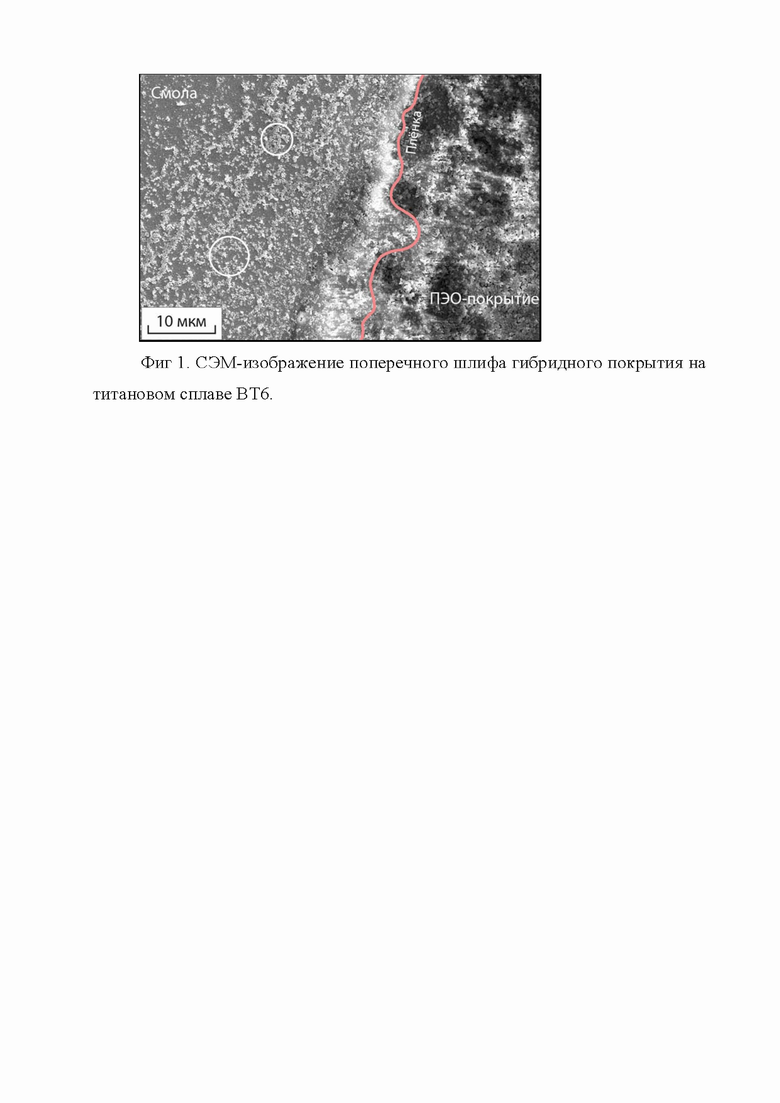
Анализ микрофотографии поперечного шлифа образцов с данным покрытием показал, что на поверхности металла имеются поры, образованные в ходе резкого охлаждения зоны пробоя до температуры электролита после затухания плазменного разряда, а также испарения газа при ПЭО. Такая развитая поверхность положительно влияет на пролиферацию клеток и увеличивает площадь контакта кости с имплантатом. На микрофотографии видно внедрение компонентов в пористую часть ПЭО-слоя и равномерное распределение компонентов по толщине исследуемого образца. При этом стоит отметить, что процесс получения поперечного шлифа покрытия сопровождался вымыванием водорастворимых веществ, что обусловлено применением воды в процессе шлифовки.
На Фиг. 1 представлено СЭМ-изображение поперечного шлифа гибридного покрытия на титановом сплаве ВТ6. Белыми кругами отмечены следы водорастворимых веществ.
Данные потенциодинамической поляризации показали, что различий между плотностью токов коррозии для ПЭО-покрытия и композицинного покрытия с ванкомицином. Таким образом, импрегнация антибиотика с полимерной составляющей в ПЭО-покрытие не оказывает отрицательного влияния на коррозионные свойства, а значит, что они будут снижать скорость коррозии имплантата в среде, аналогичной жидкостям человеческого организма, тем самым регулируя его биорезорбцию.
Для оценки интенсивности формирования бактериальной биопленки на образцах использовался St. aureus, штамм, полученный и идентифицированный в бактериологической лаборатории г. Владивосток.
Бактериальные биопленки на исследуемых образцах получали путем погружения их в жидкую питательную среду (Тиогликолевая среда, Оболенск, Россия) с St. Aureus (0,5 стандарт McFarland) на 10 минут, после этого образцы размещали на чашках Петри на поверхности 5% кровяного агара и агара Мюллера - Хинтона, засеянного этим же микроорганизмом. Культивирование проводили при 37°C 24 часа.
Диффузия антибиотика в агар привела к формированию зоны подавления роста St. Aureus вокруг образцов и составила 20 мм, что свидетельствует наличии у покрытий существенных антибактериальных свойств.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения на сплавах магния гибридных защитных покрытий с антибактериальными свойствами | 2022 |
|
RU2785579C1 |
| Способ получения защитного коррозионно-износостойкого биосовместимого гибридного покрытия на сплаве магния | 2023 |
|
RU2815770C1 |
| Способ получения композиционного материала для биорезорбируемого магниевого имплантата | 2019 |
|
RU2710597C1 |
| Способ получения коррозионностойких гибридных покрытий на магнии и его сплавах | 2023 |
|
RU2809685C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИКОРРОЗИОННЫХ КАЛЬЦИЙСОДЕРЖАЩИХ ПОКРЫТИЙ НА СПЛАВАХ МАГНИЯ | 2011 |
|
RU2445409C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОСОВМЕСТИМОГО ПОКРЫТИЯ НА СТОМАТОЛОГИЧЕСКИХ ИМПЛАНТАТАХ | 2012 |
|
RU2507315C1 |
| Способ получения борсодержащего покрытия на магниевом сплаве | 2023 |
|
RU2829372C1 |
| Способ получения биорезорбируемого материала на основе магния и гидроксиапатита с защитным многокомпонентным покрытием | 2021 |
|
RU2763138C1 |
| Модифицированное кальций-фосфатное покрытие на титановом имплантате с внедренным в него фармакологическим препаратом и способ его получения | 2024 |
|
RU2833928C1 |
| Способ получения модифицированного биопокрытия с микрочастицами трикальцийфосфата и/или волластонита на имплантате из магниевого сплава | 2021 |
|
RU2763091C1 |
Изобретение относится к гибридным антибактериальным покрытиям на сплавах для биосовместимых имплантатов с адресной доставкой лекарства и может найти применение в имплантационной хирургии. Предложен способ получения гибридного антибактериального кальций-фосфатного ПЭО-покрытия на сплаве из электролита методом плазменно-электролитического оксидирования в комбинированном биполярном режиме: в потенциометрическом режиме при напряжении тока 380 В в ходе анодной поляризации и в гальванодинамическом режиме при силе тока, изменяющейся от 5 до 3 А в ходе катодной поляризации. Электролит содержит 25 г/л глицерофосфата кальция (C3H7CaO6P), 5 г/л фторида натрия (NaF) и 7 г/л метасиликата натрия (Na2SiO3). Полученный образец с кальций-фосфатным ПЭО-покрытием промывают под вакуумом 2 раза 70% этиловым спиртом и 2 раза дистиллированной водой, сушат при комнатной температуре и погружают в раствор для полимеризации, состоящий из буфера ТРИС-HCl с pH 8,5, с растворенными в нем 2 мг/мл дофамином и 5 мг/мл ванкомицином, который перемешивают при комнатной температуре в течение 2 ч, с дальнейшим высушиванием на воздухе в течение 4-6 ч. Способ обеспечивает повышение адгезионной прочности гидроксиапатитного покрытия, повышение его осаждения, причем полученное покрытие обладает отличной биосовместимостью, противовоспалительной активностью и антибактериальными свойствами. 1 ил., 1 пр.
Способ получения гибридного антибактериального кальций-фосфатного ПЭО-покрытия на сплаве, импрегнированного антибиотиком – ванкомицином и полимерной компонентой – полидофамином, из электролита, содержащего 25 г/л глицерофосфата кальция (C3H7CaO6P), 5 г/л фторида натрия (NaF) и 7 г/л метасиликата натрия (Na2SiO3) методом плазменно-электролитического оксидирования в комбинированном биполярном режиме: в потенциометрическом режиме при напряжении тока 380 В в ходе анодной поляризации и в гальванодинамическом режиме при силе тока, изменяющейся от 5 до 3 А в ходе катодной поляризации, промывкой под вакуумом 2 раза 70% этиловым спиртом и 2 раза дистиллированной водой, сушкой при комнатной температуре и последующим погружением образца в раствор для полимеризации, состоящий из буфера ТРИС-HCl с pH 8,5, с растворенными в нем 2 мг/мл дофамином и 5 мг/мл ванкомицином, перемешиванием его при комнатной температуре в течение 2 ч, с дальнейшим высушиванием на воздухе в течение 4-6 ч.
| Способ получения биорезорбируемого материала на основе магния и гидроксиапатита с защитным многокомпонентным покрытием | 2021 |
|
RU2763138C1 |
| Способ получения композиционного материала для биорезорбируемого магниевого имплантата | 2019 |
|
RU2710597C1 |
| CN 107648674 A, 02.02.2018 | |||
| D.V | |||
| MASHTALYAR et al | |||
| Antibacterial Ca/P-coatings formed on Mg alloy using plasma electrolytic oxidation and antibiotic impregnation | |||
| Materials Letters, 2022, vol.317, 132099 | |||
| YIGUO SHEN et al | |||
| A strontium/vancomycin composite coating on titanium implants for | |||
Авторы
Даты
2024-12-23—Публикация
2024-01-12—Подача