Изобретение относится к химической промышленности, к области производства гетерогенных катализаторов процессов жидкофазного окисления органических соединений, а именно глюкозы, и может быть применено на предприятиях химической и фармацевтической промышленности для получения биологически активных веществ -компонентов пищевых продуктов и биологически активных добавок (в том числе - глюконовой кислоты и глюконата кальция).
Известен магнитоотделяемый гетерогенный катализатор жидкофазного окисления глюкозы (Сульман A.M. Гетерогенные биокатализаторы на основе глюкозооксидазы, иммобилизованной на магнитоотделяемые мезопористые оксиды. Диссертация к.х.н. Тверь. 2020. 144 с), содержащий носитель, модифицированный 3-аминопропилтриэтоксисиланом, глутаровый диальдегид в качестве сшивающего агента и глюкозооксидазу из Aspergillus niger в качестве активного компонента, в котором носителем являются магнитные наночастицы Fe3O4, модифицированные неорганическими оксидами (SiO2, Al2O3 или ZrO2), при следующем соотношении компонентов в % масс: Fe3O4 - 2,8÷3,0; неорганический оксид (SiO2, Al2O3 или ZrO2)-19,5÷19,7; 3-аминопропилтриэтоксисилан - 59,5÷59,7; глутаровый диальдегид - 16,3÷16,5; глюкозооксидаза - 1,4÷1,6.
Однако катализатор имеет недостаточно высокую степень сшивки активного компонента (глюкозооксидазы) с поверхностью носителя из-за высокого содержания в составе катализатора глутарового диальдегида и 3-аминопропилтриэтоксисилана по отношению к массе носителя, что приводит к существенному снижению активности и операционной стабильности катализатора в реакциях окисления органических соединений.
Также известен магнитоотделяемый катализатор окисления органических соединений (RU, п. №2807591, МПК B01J 23/745, B01J 21/06, B01J 21/04, B01J 21/08, B01J 37/04, 16.11.2023.), содержащий в качестве носителя магнитные наночастицы Fe3O4, модифицированные 3-аминопропилтриэтоксисиланом, неорганическим оксидом, выбранным из SiO2, Al2O3 или ZrO2, и хитозаном, глутаровый диальдегид в качестве сшивающего агента и глюкозооксидазу из Aspergillus niger в качестве активного компонента, при соотношении компонентов в % масс: Fe3O4-9,58÷9,88; неорганический оксид, выбранный из SiO2, Al2O3 или ZrO2-63,72÷64,32; хитозан - 3,0-3,4; 3-аминопропилтриэтоксисилан - 6,2÷6,6; глутаровый диальдегид - 15,71÷16,31; глюкозооксидаза - 0,61÷0,67.
Однако данный катализатор содержит в качестве компонентов 3-аминопропилтриэтоксисилан и глутаровый диальдегид, являющиеся токсичными компонентами для человека, поэтому катализатор не может быть применен для получения биологически активных веществ для пищевой промышленности и фармацевтики. Кроме того, магнитные свойства носителя существенно снижаются при добавлении неорганических оксидов в количестве более 60%, что существенно снижает операционную стабильность катализатора.
Наиболее близким к предлагаемому катализатору является магнитоотделяемый катализатор жидкофазного окисления глюкозы (Тихонов Б.Б., Лисичкин Д.Р., Матвеева В.Г., Сульман М.Г., Desai A.Sh., Dos Santos J.C. Иммобилизация оксидоредуктаз на магнитных наночастицах, стабилизированных хитозаном и триполифосфатом натрия // Актуальная биотехнология. 2023. №4. С. 37-38), содержащий в качестве носителя магнитные наночастицы Fe3O4, модифицированные хитозаном и триполифосфатом натрия, и глюкозооксидазу из Aspergillus niger в качестве активного компонента, при соотношении компонентов в % масс: Fe3O4 - 76,3÷90,5; хитозан - 1,0÷16,5; триполифосфат натрия - 4,1÷4,9; глюкозооксидаза -3,1÷3,6.
Однако катализатор имеет недостаточное содержание активного компонента (глюкозооксидазы), а также недостаточную прочность сшивки хитозана с поверхностью носителя, что приводит к существенному снижению активности и операционной стабильности катализатора в реакции окисления глюкозы.
Известен способ получения иммобилизованных ферментов (SU, п. №644760, 1979.01.30.) путем ковалентного связывания ферментов (в том числе - глюкозооксидазы) с неорганическим носителем, активированным органосиланом, при чем с целью упрощения процесса иммобилизации и повышения активности иммобилизованных ферментов, в качестве органосилана используют глицедоксипропилтриэтоксисилан.
Однако для этого способа характерна недостаточная стабилизация активного компонента на поверхности носителя из-за отсутствия химического взаимодействия между носителем и ферментом, что существенно ухудшает каталитическую активность и стабильность катализатора. Кроме того, использование силановых компонентов делает процесс синтеза токсичным для человека.
Также известен способ получения магнитоотделяемого катализатора окисления органических соединений (RU, п. №2807591, 16.11.2023, МПК B01J 23/745, B01J 21/06, B01J 21/04, B01J 21/08, B01J 37/04, 14.02.2023.), включающий взаимодействие ферментсодержащего раствора с магнитоотделяемым носителем, модифицированным для получения альдегидных групп на его поверхности.
Однако в данном способе имеет место недостаточная стабилизация активного компонента на поверхности носителя, что существенно ухудшает каталитическую активность и стабильность катализатора. Кроме того, использование силановых и альдегидных компонентов делает процесс получения катализатора токсичным для человека.
Наиболее близким к предлагаемому способу является способ получения магнитоотделяемого катализатора жидкофазного окисления глюкозы (Тихонов Б.Б., Лисичкин Д.Р., Матвеева В.Г., Сульман М.Г., Desai A.Sh., Dos Santos J.C. Иммобилизация оксидоредуктаз на магнитных наночастицах, стабилизированных хитозаном и триполифосфатом натрия // Актуальная биотехнология. 2023. №4. С. 37-38), включающий смешивание растворов FeCl3 FeCl2, перемешивание в течение 15 минут со скоростью 400 мин-1 при температуре 25°С, перемешивание в течение 15 минут со скоростью 400 мин-1 при температуре 65°С, добавление по каплям со скоростью 2 мл/мин 10 мл раствора аммиака водного, перемешивание в течение 15 минут со скоростью 400 мин-1 при температуре 65°С, добавление раствора хитозана в уксусной кислоте, перемешивание в течение 15 минут со скоростью 400 мин-1 при температуре 25°С, добавление раствора триполифосфата натрия, перемешивание в течение 60 минут со скоростью 400 мин-1 при температуре 25°С, добавление смеси содержащей карбодиимид, N-гидроксисукцинимид и глюкозооксидазу, перемешивание в течение 24 часов со скоростью 400 мин-1 при температуре 25°С, промывку дистиллированной водой, извлечение с использованием постоянного магнита и высушивание на воздухе.
Однако в данном способе при синтезе наночастиц и смешивании их с хитозаном и триполифосфатом образуются конгломераты частиц магнетита, которые имеют несферическую форму и неравномерную структуру и образуют «мертвый объем» носителя, который не заполняется ферментом вследствие усложнения диффузии фермента в поры носителя. Кроме того, из-за недостаточной степени очистки хитозана его нерастворимые остатки (не менее 1%) закупоривают поры носителя и существенно снижают активность и операционную стабильность катализатора в реакции окисления глюкозы.
Технической проблемой, решаемой при создании изобретения, является получение высокоактивного, стабильного, селективного магнитоотделяемого катализатора для многократного использования в реакции жидкофазного окисления глюкозы и способ получения данного катализатора.
Техническим результатом изобретения является повышение активности, селективности, операционной стабильности гетерогенного катализатора в реакции жидкофазного окисления глюкозы и его способности к отделению от реакционной среды за счет использования твердого носителя с большой площадью поверхности, большим количеством реакционно-способных групп на поверхности и магнитными свойствами, дополнительной очистки хитозана от нерастворимых примесей, применения ультразвуковой обработки для предотвращения слипания наночастиц.
Решение поставленной проблемы и заявленный технический результат достигаются за счет того, что магнитоотделяемый катализатор окисления глюкозы содержит в качестве носителя магнитные наночастицы Fe3O4, модифицированные хитозаном и триполифосфатом натрия, и глюкозооксидазу из Aspergillus niger, при этом носитель дополнительно включает ацетилцистеин, при следующем соотношении компонентов в % масс:
-Fe3O4 - 82,65÷83,22;
- хитозан - 8,25÷8,35;
- триполифосфат натрия - 1,61÷1,71;
- ацетилцистеин - 0,80÷0,86;
- глюкозооксидаза - 6,12÷6,32.
Способ получения магнитоотделяемого катализатора окисления глюкозы, содержащего в качестве носителя магнитные наночастицы Fe3O4, модифицированные хитозаном и триполифосфатом натрия, глюкозооксидазу из Aspergillus niger, ацетилцистеин, при следующем соотношении компонентов в % масс.:
-Fe3O4 - 82,65÷83,22;
- хитозан - 8,25÷8,35;
- триполифосфат натрия - 1,61÷1,71;
- ацетилцистеин - 0,80÷0,86;
- глюкозооксидаза - 6,12÷6,32,
причем для получения катализатора смешивают раствор FeCl3, полученный растворением 2,34±0,02 г FeCl3⋅6Н2О в 25 мл дистиллированной воды и раствор FeCl2, полученный растворением 0,86±0,02 г FeCl2⋅H2O в 25 мл дистиллированной воды, в термостатируемом реакторе с рубашкой, смесь перемешивают в течение 10 минут при температуре 25°С со скоростью 300 мин-1, перемешивают смесь еще 10 минут при температуре 65±2°С со скоростью 300 мин-1, после чего добавляют по каплям 10 мл раствора аммиака водного со скоростью 5 мл/мин, перемешивают смесь еще 10 минут при температуре 65±2°С со скоростью 300 мин-1, переносят смесь в химический стакан, проводят обработку ультразвуком мощностью 5±0,1 Вт/см2 в течение 5 минут, после чего в смесь добавляют раствор, полученный растворением 0,1±0,01 г хитозана в 25±0,1 мл 2Н уксусной кислоты, перемешивают ее 10 минут со скоростью 300 мин-1, добавляют в смесь раствор триполифосфата натрия, приготовленный растворением навески 0,02 г в 10 мл дистиллированной воды, и раствор ацетилцистеина, приготовленный растворением навески 0,01 г в 10 мл дистиллированной воды, перемешивают смесь 10 минут со скоростью 300 мин-1, 5 раз промывают дистиллированной водой, отделяют частицы с помощью постоянного магнита, добавляют к частицам раствор глюкозооксидазы, приготовленный растворением 75±0,5 мг глюкозооксидазы в 50 мл фосфатного буферного раствора с рН=6,0, смешанный с 0,4 г 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорида и 0,15 г N-гидроксисукцинимида и выдержанный при перемешивании со скоростью 300 мин-1 в течение 2 часов, перемешивают смесь в течение 4 часов, 2 раза промывают катализатор эмульгатором Span 80, 5 раз промывают катализатор дистиллированной водой, отделяют с помощью постоянного магнита, замораживают до температуры 18±0,5°С в течение 30 минут, высушивают лиофильно до постоянной массы, при этом хитозан перед приготовлением раствора предварительно смешивают с 1 М раствором NaOH в соотношении 1±0,01 г хитозана на 10 мл 1 М раствора NaOH, смесь нагревают и перемешивают в течение 2 часов при 70°С, фильтруют через воронку Бюхнера, хитозан промывают дистиллированной водой, высушивают при температуре 40°С в течение 12 часов, растворяют в 0,1 М растворе уксусной кислоты, раствор фильтруют через бумажный фильтр, рН раствора доводят до 8,0±0,01 с помощью 1 М раствора NaOH, выпавший осадок хитозана отделяют фильтрованием, замораживают до температуры 18±0,5°С в течение 30 минут, высушивают лиофильно до постоянной массы.
Предлагаемый катализатор обладает следующими преимуществами:
- малой полидисперсностью размеров частиц (0,03÷0,05 мкм);
- формой частиц, близкой к сферической;
- более высокой активностью в реакции окисления органических субстратов по сравнению с прототипом;
- более высокой операционной стабильностью при многократном использовании по сравнению с прототипом;
- удобством полного отделения от реакционной среды практически без потерь с помощью постоянного магнита;
- рабочий диапазон рН 3÷10; рабочий диапазон температур 10÷60°С. Включение в катализатор каждого из компонентов является
обязательным и ни один из них нельзя исключить из состава катализатора, а также изменить их количественное соотношение, так как это приведет к существенному снижению активности и стабильности катализатора в реакции окисления органических соединений.
Магнитные наночастицы Fe3O4 необходимы для создания твердой основы для катализатора и придания ему магнитных свойств, что способствует легкому отделению катализатора от реакционной среды с помощью постоянного магнита.
Хитозан необходим для увеличения количества аминогрупп на поверхности катализатора, способных к взаимодействию с другими функциональными группами, и увеличения площади поверхности носителя, что увеличивает количество присоединенных к поверхности носителя молекул фермента, и, соответственно, повышает удельную активность и операционную стабильность катализатора.
Триполифосфат натрия необходим для увеличения прочности закрепления хитозана на поверхности носителя за счет ионной связи аминогрупп хитозана с фосфат-ионами триполифосфата, что повышает удельную активность и операционную стабильность катализатора и снижает потери активного компонента в ходе процесса.
Ацетилцистеин необходим для увеличения прочности закрепления хитозана на поверхности носителя за счет ковалентного взаимодействия карбоксильных групп ацетилцистеина с аминогруппами хитозана с образованием амидной связи, что повышает удельную активность и операционную стабильность катализатора и снижает потери активного компонента в ходе процесса.
Активный компонент - фермент глюкозооксидаза из Aspergillus niger-катализирует реакцию окисления органических соединений в присутствии растворенного в жидкой фазе кислорода.
Катализатор содержит 82,65÷83,22% масс. Fe3O4 Уменьшение содержания Fe3O4 меньше представленного значения существенно снижает магнитные свойства катализатора и его отделяемость от реакционной смеси. Увеличение содержания Fe3O4 больше указанного значения приводит к чрезмерному увеличению поверхности катализатора, что приводит к диффузионным ограничениям и существенно снижает активность катализатора из-за затруднения удаления субстрата из реакционной среды и отравления фермента.
Катализатор содержит 8,25÷8,35% масс, хитозана, 1,61÷1,71% масс, триполифосфата натрия и 0,80÷0,86% масс, ацетилцистеина. Уменьшение содержания хитозана, триполифосфата натрия и ацетилцистеина меньше представленных значений существенно снижает активность катализатора, так как значительно снижается количество глюкозооксидазы, ковалентно и ионно связанной с поверхностью носителя и фермент легко смывается с нее в процессе промывки. Увеличение содержания хитозана, триполифосфата натрия и ацетилцистеина выше указанных значений нецелесообразно, так как это не приводит к существенному увеличению активности и операционной стабильности катализатора.
Содержание активного компонента (фермента глюкозооксидазы) в катализаторе - 6,12÷6,32% масс. Уменьшение содержания активного компонента ниже указанного значения значительно снижает активность катализатора в реакции окисления органических субстратов, а увеличение его содержания нецелесообразно, так как, по результатам экспериментов, не приводит к существенному увеличению активности катализатора в реакции окисления органических субстратов.
Добавление аммиака к смеси FeCl3 и FeCl2 в количестве 10±0,1 мл необходимо для восстановления ионов железа и образования магнетита Fe3O4 (FeO⋅Fe2O3), который обладает магнитными свойствами. Уменьшение количества аммиака ниже указанных значений приводит к недовосстановлению ионов железа и существенному снижению магнитных свойств продукта, что существенно увеличивает потери катализатора в ходе реакции, а дальнейшее увеличение количества аммиака выше указанных значений не приводит к улучшению магнитных свойств и нецелесообразно.
Аммиак добавляется в смесь со скоростью 5±0,1 мл/мин. Увеличение скорости добавления аммиака выше указанных значений существенно снижает равномерность формирования наночастиц магнетита, а снижение ее ниже указанных значений приводит к слипанию наночастиц магнетита и формированию крупных агломератов с ухудшенными магнитными свойствами, что существенно увеличивает потери катализатора в ходе реакции.
Восстановление проводят при температуре 65±2°С в течение 10±0,5 минут для наиболее полного восстановления ионов железа.
Уменьшение времени ниже указанных значений приводит к недовосстановлению ионов железа и существенному снижению магнитных свойств продукта, что существенно увеличивает потери катализатора в ходе реакции, а дальнейшее увеличение времени выше указанных значений не приводит к улучшению магнитных свойств и нецелесообразно из-за увеличения энергозатрат. Снижение температуры ниже указанных значений приводит к недовосстановлению ионов железа и существенному снижению магнитных свойств продукта, что существенно увеличивает потери катализатора в ходе реакции, а дальнейшее увеличение температуры выше указанных значений не приводит к улучшению магнитных свойств и нецелесообразно из-за увеличения энергозатрат.
Обработка смеси ультразвуком мощностью 5±0,1 Вт/см2 в течение 5±0,1 минут необходима для предотвращения слипания наночастиц магнетита. Уменьшение мощности и времени обработки ультразвуком ниже указанных значений приводит к слипанию наночастиц магнетита, чрезмерному увеличению поверхности катализатора и диффузионным ограничениям и существенно снижает активность катализатора из-за затруднения удаления субстрата из реакционной среды. Увеличение мощности и времени обработки ультразвуком выше указанных значений нецелесообразно, так как, по результатам экспериментов, не приводит к улучшению свойств наночастиц, при этом увеличивает энергозатраты и приводит к чрезмерному перегреву реакционной смеси.
Выдерживание носителя в растворе хитозана в течение 10±0,5 минут необходимо для обеспечения наличия на поверхности носителя большого количества реакционноспособных аминогрупп для взаимодействия с модификаторами и активными компонентами. Уменьшение времени выдерживания носителя в растворе хитозана приводит к неполному взаимодействию хитозана с носителем, что существенно снижает количество свободных аминогрупп на поверхности носителя, и, соответственно, снижает активность и стабильность получаемого катализатора. Дальнейшее увеличение времени выдерживания выше указанных значений нецелесообразно, так как оно не приводит к существенному улучшению активности и стабильности катализатора, при этом требует дополнительных энергозатрат.
Добавление триполифосфата натрия и ацетилцистеина и выдерживание носителя в растворе в течение 10±0,5 минут необходимо для повышения удельной активности и стабильности фермента и увеличения прочности закрепления хитозана на поверхности носителя за счет взаимодействия аминогрупп хитозана с карбоксильными группами цистеина и фосфат-ионами триполифосфата. Уменьшение времени выдерживания носителя в растворах триполифосфата натрия и ацетилцистеина приводит к неполному взаимодействию триполифосфата натрия и ацетилцистеина с носителем, что существенно снижает прочность закрепления хитозана на поверхности носителя, и, соответственно, снижает активность и операционную стабильность получаемого катализатора. Дальнейшее увеличение времени выдерживания выше указанных значений нецелесообразно, так как оно не приводит существенному улучшению активности и стабильности катализатора, при этом требует дополнительных энергозатрат.
Смешивание активного компонента катализатора - глюкозооксидазы -с раствором, содержащим 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид и N-гидроксисукцинимид, и выдерживание его в растворе в течение 2±0,1 часов необходимо для активации карбоксильных групп глюкозооксидазы за счет образования устойчивого N-гидроксисукцинимидного эфира, способного к дальнейшему взаимодействию с аминогруппами носителя с образованием прочной ковалентной связи. Уменьшение времени выдерживания глюкозооксидазы в растворе, содержащем 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид и N-гидроксисукцинимид, приводит к неполному взаимодействию карбоксильных групп фермента с N-гидроксисукцинимидом, что существенно снижает количество активированных карбоксильных групп глюкозооксидазы, способных к образованию ковалентной связи с аминогруппами носителя, что существенно снижает активность и операционную стабильность получаемого катализатора. Дальнейшее увеличение времени выдерживания выше указанных значений нецелесообразно, так как оно не приводит существенному улучшению активности и стабильности катализатора, при этом требует дополнительных энергозатрат.
Выдерживание носителя в растворе глюкозооксидазы в течение 4±0,1 часов необходимо для равномерного нанесения глюкозокосидазы и образования амидной связи между аминогруппами носителя и активированными карбоксильными группами глюкозооксидазы. Уменьшение времени выдерживания носителя в растворе глюкозооксидазы, приводит к неполному взаимодействию активированных карбоксильных групп глюкозооксидазы с аминогруппами носителя, что существенно снижает прочность закрепления глюкозооксидазы на поверхности носителя, что, соответственно, приводит к снижению активности и операционной стабильности катализатора. Дальнейшее увеличение времени выдерживания выше указанных значений нецелесообразно, так как оно не приводит существенному улучшению активности и стабильности катализатора, при этом требует дополнительных энергозатрат.
Промывка катализатора эмульгатором Span80 необходима для предотвращения слипания частиц катализатора между собой и облегчения процесса его отделения от реакционной смеси.
Лиофильное высушивание катализатора необходимо для эффективного удаления влаги из катализатора и предотвращения слипания частиц катализатора между собой в процессе высушивания.
Предварительная обработка хитозана перед использованием раствором NaOH при нагревании с последующим растворением его в уксусной кислоте, удалением осадка, переосаждением раствором NaOH, фильтрованием и лиофильным высушиванием необходима для удаления из хитозана нерастворимых, белковых и пигментных примесей, которые существенно ухудшают его свойства, способность к полному растворению и образованию тонкодисперсной пленки на поверхности носителя.
Постоянное перемешивание реакционной смеси со скоростью 300±5 мин-1 необходимо для увеличения равномерности распределения компонентов в реакционной смеси, увеличения скорости взаимодействия компонентов катализатора и исключения диффузионных ограничений.
Промежуточные промывки носителя между стадиями в количестве 5 раз необходимы для удаления из его пор и с его поверхности неспецифически связанных реагентов. Уменьшение количества промывок приводит к недостаточному удалению из пор и с поверхности носителя неспецифически связанных реагентов, что существенно загрязняет реакционную среду, может быть причиной побочных реакций в порах и на поверхности носителя, и, соответственно, снижает активность и операционную стабильность получаемого катализатора. Увеличение количества промывок нецелесообразно, так как оно не приводит существенному улучшению активности и стабильности катализатора, при этом требует дополнительных энергозатрат.
Основными свойствами гетерогенных катализаторов процессов жидкофазного окисления органических соединений являются активность катализатора (А, ед/мг), коэффициент иммобилизации (%) и сохранение начальной активности после 10 циклов использования в реакции окисления органического соединения.
Активность катализатора (А, ед. (ммоль/л субстрата в минуту) на мг глюкозооксидазы) рассчитывают по формуле (1):

где Спероксида - концентрация пероксида водорода в реакционной смеси через время t после начала реакции, ммоль/л; t - время с начала реакции, мин; m -масса глюкозооксидазы в образце катализатора, г.
Относительную активность катализатора определяют по формуле (2):
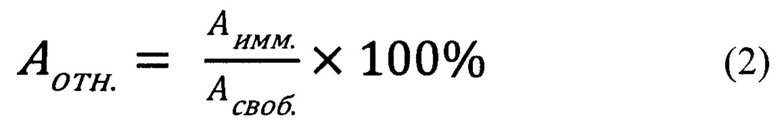
где Асвоб. и Аимм. - активности свободной и иммобилизованной форм глюкозооксидазы, соответственно.
Сохранение катализатором начальной активности после 10 циклов использования определяют по формуле (3):
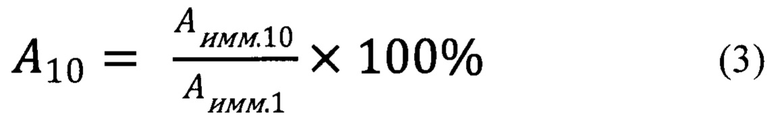
где Аимм.1 и Аимм.10 - активность иммобилизованной глюкозооксидазы в 1-м и 10-м цикле использования, соответственно.
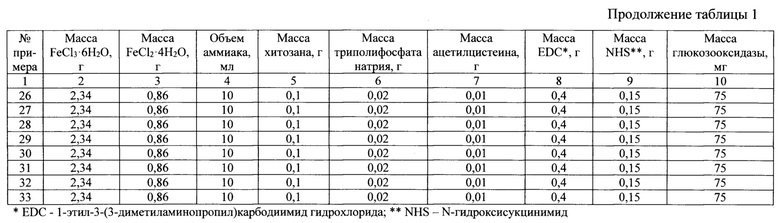
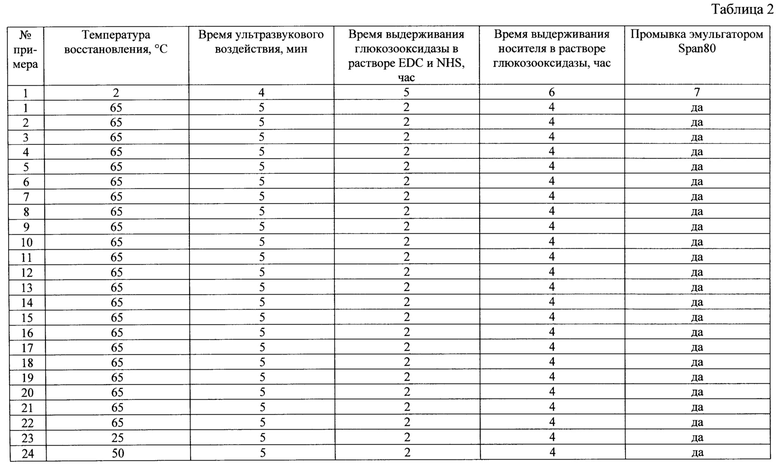
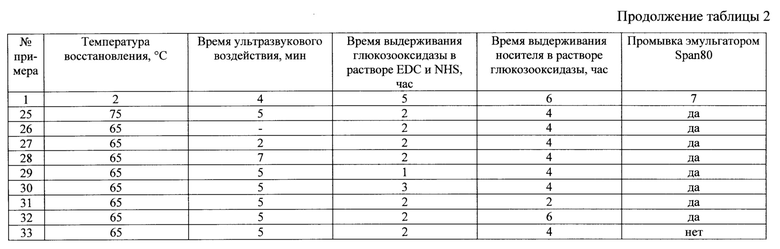
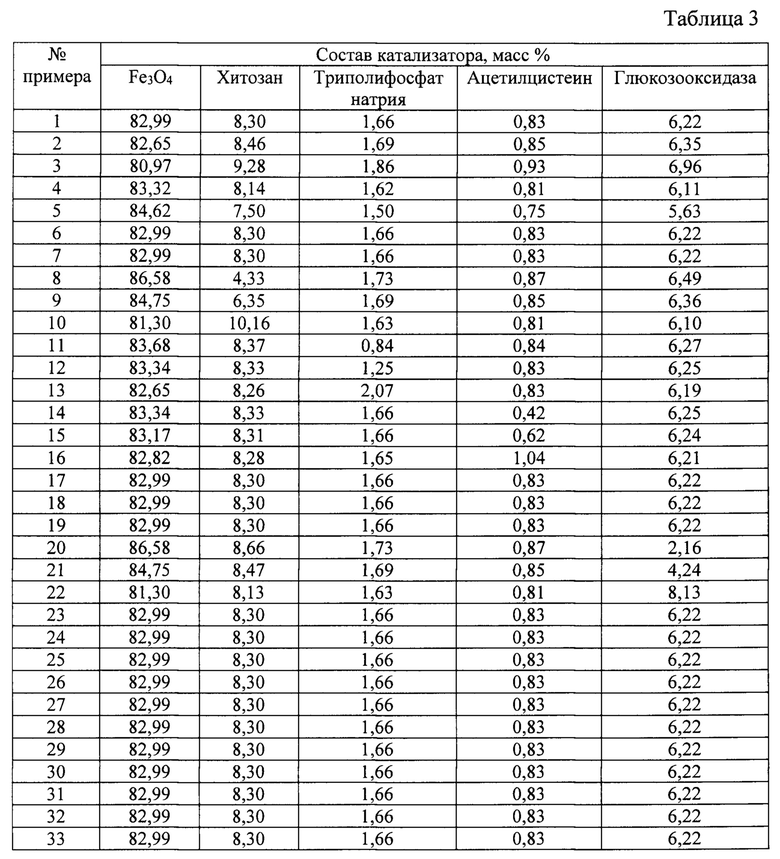
Сущность изобретения иллюстрируется следующими примерами и таблицами. Способ получения магнитоотделяемого катализатора описывается примерами 1-33, таблицами 1, 2 и 3. В таблице 3 представлен состав магнитоотделяемых катализаторов окисления органических соединений, получаемых в результате примеров 1-33.
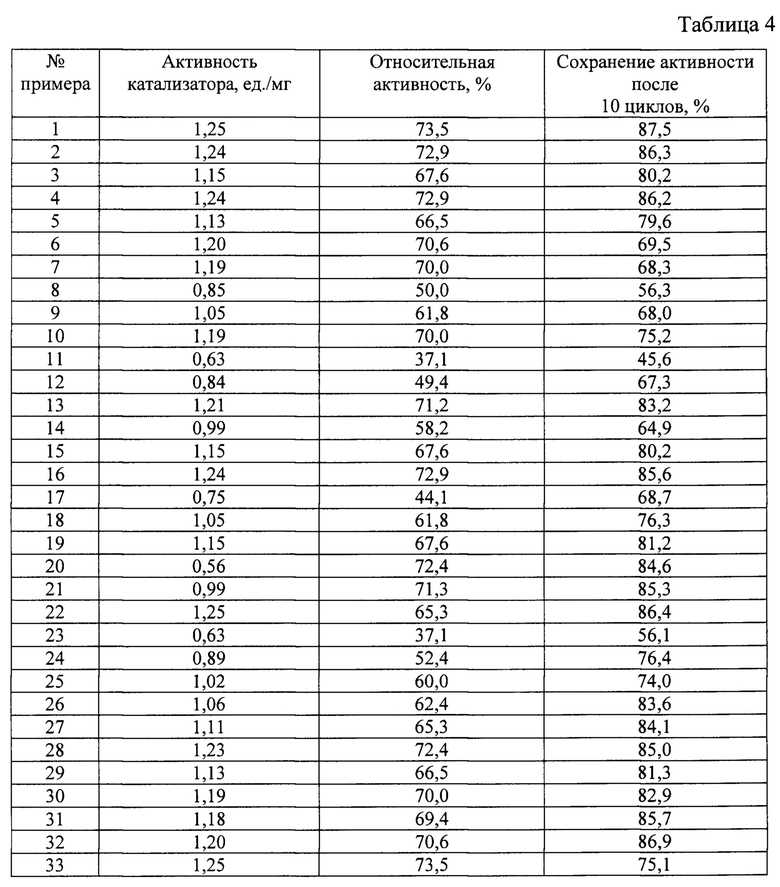
Свойства получаемых магнитоотделяемых катализаторов окисления органических соединений согласно примерам 1-33 представлены в таблице 4.
Пример 1
25 мл раствора FeCl3⋅6H2O (2,34 г в 25 мл дистиллированной воды) и 25 мл раствора FeCl2⋅Н2О (0,86 г в 25 мл дистиллированной воды) смешивают в термостатируемом реакторе с рубашкой, смесь перемешивают в течение 10 минут при температуре 25°С со скоростью 300 мин-1, перемешивают смесь еще 10 минут при температуре 65°С со скоростью 300 мин-1, после чего добавляют по каплям со скоростью 5 мл/мин 10 мл раствора аммиака водного, перемешивают смесь еще 10 минут при температуре 65°С со скоростью 300 мин-1, переносят смесь в химический стакан, проводят обработку ультразвуком мощностью 5 Вт/см2 в течение 5 минут, после чего в смесь добавляют раствор 25 мл раствора хитозана (0,1 г хитозана в 2Н уксусной кислоты), перемешивают ее 10 минут со скоростью 300 мин-1, добавляют в смесь 10 мл раствора триполифосфата натрия (0,02 г в 10 мл дистиллированной воды) и 10 мл раствора ацетилцистеина (0,01 г в 10 мл дистиллированной воды), перемешивают смесь 10 минут со скоростью 300 мин-1, 5 раз промывают дистиллированной водой, отделяют частицы с помощью постоянного магнита, добавляют к частицам раствор глюкозооксидазы (75 мг глюкозооксидазы в фосфатном буферном растворе с рН=6,0, смешанные с 0,4 г 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорида и 0,15 г N-гидроксисукцинимида, выдержанные при перемешивании со скоростью 300 мин-1 в течение 2 часов), перемешивают смесь в течение 4 часов, 2 раза промывают катализатор эмульгатором Span80, 5 раз промывают катализатор дистиллированной водой, отделяют с помощью постоянного магнита, замораживают до температуры 18°С в течение 30 минут, высушивают лиофильно до постоянной массы, при этом хитозан перед приготовлением раствора предварительно смешивают с 1 М раствором NaOH в соотношении 1 г хитозана на 10 мл 1 М раствора NaOH, смесь нагревают и перемешивают в течение 2 часов при 70°С, фильтруют через воронку Бюхнера, хитозан тщательно промывают дистиллированной водой, высушивают при температуре 40°С в течение 12 часов, растворяют в 0,1 М растворе уксусной кислоты, раствор фильтруют через бумажный фильтр, рН раствора доводят до 8,0 с помощью 1 М раствора NaOH, выпавший осадок хитозана отделяют фильтрованием, замораживают до температуры 18°С в течение 30 минут, высушивают лиофильно до постоянной массы.
Полученный катализатор имеет следующее соотношение компонентов, % масс.:
- Fe3O4 - 82,99;
- хитозан - 8,3;
- триполифосфат натрия - 1,66;
- ацетилцистеин - 0,83;
- глюкозооксидаза - 6,22.
Активность катализатора определяют в реакции окисления D-глюкозы. Для исследования активности катализатора в термостатируемую стеклянную ячейку с возвратно-поступательным качанием вносят 0,25 г катализатора, 40 мл раствора D-глюкозы (2,2 ммоль/л D-глюкозы в фосфатном буферном растворе с рН=6,0), перемешивают со скоростью 300 мин-1 в течение 1 часа. Через 5, 10, 20, 30, 45 и 60 минут после начала реакции, отбирают по 10 мкл реакционной смеси микропипеткой и смешивают их в кювете спектрофотометра размером 1*1 см с 2,0 мл 0,05 Н раствора НС1, 0,2 мл 16,6% масс, раствора KI, 0,2 мл раствора молибдата аммония (0,12% масс.(NH4)6Mo7O24; 2,8% об. H2SO4 (конц.) в дистиллированной воде) и 0,2 мл 5% масс раствора растворимого крахмала. Через 180 секунд после смешивания определяют оптическую плотность смеси при длине волны 570 нм с помощью спектрофотометра. Оптическую плотность пересчитывают в концентрацию пероксида водорода в реакционной смеси по формуле (4) (Тихонов Б.Б., Стадольникова П.Ю., Сидоров А.И., Сульман М.Г. Определение активности глюкозооксидазы спектрофотометрическим методом // Вестник Тверского государственного университета. Серия: Химия. 2021. №2 (44). С. 18-25):
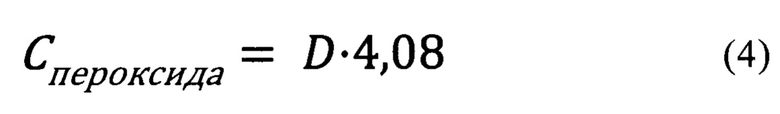
Где D-оптическая плотность реакционной смеси.
Реакцию проводят при атмосферном давлении. После завершения реакции катализатор отделяют от реакционной смеси с помощью постоянного магнита и промывают 5 раз дистиллированной водой.
Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Пример 2
Аналогичен примеру 1, однако использовали 2,28 г FeCl3⋅6H2O и 0,84 г FeCl2⋅4H2O.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношение компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Пример 3
Аналогичен примеру 1, однако использовали 2,04 г FeCl3⋅6H2O и 0,75 г FeCl2⋅4H2O.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношение компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Пример 4
Аналогичен примеру 1, однако использовали 2,39 г FeCl3⋅6H2O и 0,88 г FeCl2⋅4H2O.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношение компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Пример 5
Аналогичен примеру 1, однако использовали 2,64 г FeCl3⋅6H2O и 0,97 г FeCl2⋅4H2O.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношение компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Из результатов, сведенных в таблице 3 и таблице 4 по примерам 1-5 видно, что оптимальной активностью и стабильностью обладает катализатор, полученный при использовании 2,34±0,02 г FeCl3⋅6H2O и 0,86±0,02 г FeCl2⋅4H2O.
Пример 6
Аналогичен примеру 1, однако использовали 5 мл аммиака.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Пример 7
Аналогичен примеру 1, однако использовали 15 мл аммиака.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Из результатов, сведенных в таблице 3 и таблице 4 по примерам 1, 6-7 видно, что оптимальной активностью и стабильностью обладает катализатор, полученный при использовании 10 мл аммиака.
Пример 8
Аналогичен примеру 1, однако использовали 0,05 г хитозана.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Пример 9
Аналогичен примеру 1, однако использовали 0,075 г хитозана.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Пример 10
Аналогичен примеру 1, однако использовали 0,125 г хитозана.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Из результатов, сведенных в таблице 3 и таблице 4 по примерам 1, 8-10 видно, что оптимальной активностью и стабильностью обладает катализатор, полученный при использовании 0,1 г хитозана.
Пример 11
Аналогичен примеру 1, однако использовали 0,01 г триполифосфата натрия.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Пример 12
Аналогичен примеру 1, однако использовали 0,015 г триполифосфата натрия.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Пример 13
Аналогичен примеру 1, однако использовали 0,025 г триполифосфата натрия.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Из результатов, сведенных в таблице 3 и таблице 4 по примерам 1,11-13 видно, что оптимальной активностью и стабильностью обладает катализатор, полученный при использовании 0,02 г триполифосфата натрия.
Пример 14
Аналогичен примеру 1, однако использовали 0,005 г ацетилцистеина.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Пример 15
Аналогичен примеру 1, однако использовали 0,0075 г ацетилцистеина.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Пример 16
Аналогичен примеру 1, однако использовали 0,0125 г ацетилцистеина.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Из результатов, сведенных в таблице 3 и таблице 4 по примерам 1, 14-16 видно, что оптимальной активностью и стабильностью обладает катализатор, полученный при использовании 0,01 г ацетилцистеина.
Пример 17
Аналогичен примеру 1, однако использовали 0,2 г 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорида и 0,075 г N-гидроксисукцинимида.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Пример 18
Аналогичен примеру 1, однако использовали 0,3 г 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорида и 0,1125 г N-гидроксисукцинимида.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Пример 19
Аналогичен примеру 1, однако использовали 0,5 г 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорида и 0,1875 г N-гидроксисукцинимида.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Из результатов, сведенных в таблице 3 и таблице 4 по примерам 1,17-19 видно, что оптимальной активностью и стабильностью обладает катализатор, полученный при использовании 0,4 г 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорида и 0,15 г N-гидроксисукцинимида.
Пример 20
Аналогичен примеру 1, однако использовали 25 мг глюкозооксидазы.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Пример 21
Аналогичен примеру 1, однако использовали 50 мг глюкозооксидазы.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Пример 22
Аналогичен примеру 1, однако использовали 100 мг глюкозооксидазы.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Из результатов, сведенных в таблице 3 и таблице 4 по примерам 1, 20-22 видно, что оптимальной активностью и стабильностью обладает катализатор, полученный при использовании 75 мг глюкозооксидазы.
Пример 23
Аналогичен примеру 1, однако реакцию восстановления аммиаком проводили при температуре 25°С.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Пример 24
Аналогичен примеру 1, однако реакцию восстановления аммиаком проводили при температуре 50°С.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Пример 25
Аналогичен примеру 1, однако реакцию восстановления аммиаком проводили при температуре 75°С.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Из результатов, сведенных в таблице 3 и таблице 4 по примерам 1, 23-25 видно, что оптимальной активностью и стабильностью обладает катализатор, полученный при проведении реакции восстановления аммиаком при температуре 65°С.
Пример 26
Аналогичен примеру 1, однако не проводили обработку носителя ультразвуком.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Пример 27
Аналогичен примеру 1, однако обработку носителя ультразвуком проводили в течение 2 минут.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Пример 28
Аналогичен примеру 1, однако обработку носителя ультразвуком проводили в течение 7 минут.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Из результатов, сведенных в таблице 3 и таблице 4 по примерам 1, 26-28 видно, что оптимальной активностью и стабильностью обладает катализатор, полученный при обработке ультразвуком в течение 5 минут.
Пример 29
Аналогичен примеру 1, однако выдерживание глюкозооксидазы в растворе 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорида и N-гидроксисукцинимида проводили в течение 1 часа.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Пример 30
Аналогичен примеру 1, однако выдерживание глюкозооксидазы в растворе 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорида и N-гидроксисукцинимида проводили в течение 3 часов.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Из результатов, сведенных в таблице 3 и таблице 4 по примерам 1, 29-30 видно, что оптимальной активностью и стабильностью обладает катализатор, полученный при выдерживании глюкозооксидазы в растворе 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорида и N-гидроксисукцинимида в течение 2 часов.
Пример 31
Аналогичен примеру 1, однако выдерживание носителя в растворе активированной глюкозооксидазы проводили в течение 2 часов.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Пример 32
Аналогичен примеру 1, однако выдерживание носителя в растворе активированной глюкозооксидазы проводили в течение 6 часов.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Из результатов, сведенных в таблице 3 и таблице 4 по примерам 1,31-32 видно, что оптимальной активностью и стабильностью обладает катализатор, полученный при выдерживании носителя в растворе активированной глюкозооксидазы в течение 4 часов.
Пример 33
Аналогичен примеру 1, однако промывка катализатора эмульгатором Span80 не проводилась.
Основные параметры способа получения представлены в таблицах 1 и 2. Соотношения компонентов в катализаторе представлены в таблице 3. Свойства полученного катализатора представлены в таблице 4.
Из результатов, сведенных в таблице 3 и таблице 4 по примерам 1 и 33 видно, что оптимальной активностью и стабильностью обладает катализатор, полученный при промывке катализатора эмульгатором Span80.
Таким образом, оптимальное соотношение компонентов магнитоотделяемого катализатора окисления органических соединений составляет, % масс:
- Fe3O4 - 82,65÷83,22;
- хитозан - 8,25÷8,35;
- триполифосфат натрия - 1,61÷1,71;
- ацетилцистеин - 0,80÷0,86;
- глюкозооксидаза - 6,12÷6,32.
Предложенный способ позволяет получить магнитоотделяемый катализатор окисления глюкозы с повышенной активностью, селективностью, операционной стабильностью, который обладает способностью к отделению от реакционной среды за счет использования твердого носителя с большой площадью поверхности, высоко реакционно-способными аминогруппами на поверхности и магнитными свойствами, а также дополнительной стабилизации носителя триполифосфатом натрия и ацетилцистеина, использования ультразвукового воздействия и промывки катализатора эмульгатором Span80 с целью предотвращения слипания частиц катализатора.
| название | год | авторы | номер документа |
|---|---|---|---|
| Магнитоотделяемый катализатор окисления органических соединений и способ его получения | 2023 |
|
RU2807591C1 |
| Гетерогенный катализатор жидкофазного окисления органических соединений и способ его получения | 2020 |
|
RU2741010C1 |
| Гетерогенный катализатор жидкофазного окисления органических соединений | 2016 |
|
RU2626964C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОГЕННОГО КАТАЛИЗАТОРА СИНТЕЗА УГЛЕВОДОРОДОВ ИЗ МЕТАНОЛА | 2015 |
|
RU2597269C1 |
| КАТАЛИЗАТОР СИНТЕЗА ФИШЕРА-ТРОПША И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2020 |
|
RU2745214C1 |
| Катализатор синтеза Фишера-Тропша и способ его получения | 2024 |
|
RU2839626C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОГЕННОГО МЕТАЛЛ-ПОЛИМЕРНОГО КАТАЛИЗАТОРА ДЛЯ ОЧИСТКИ СТОЧНЫХ ВОД ОТ ФЕНОЛЬНЫХ СОЕДИНЕНИЙ | 2006 |
|
RU2314155C1 |
| Способ получения полимерсодержащего катализатора реакции Сузуки | 2016 |
|
RU2627265C1 |
| ГЕТЕРОГЕННЫЙ КАТАЛИЗАТОР ОКИСЛЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ | 2005 |
|
RU2288033C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИТНОГО КАТАЛИТИЧЕСКОГО МАТЕРИАЛА В ВИДЕ СЛОИСТЫХ ПОЛЫХ СФЕР | 2015 |
|
RU2608125C1 |
Настоящее изобретение относится к гетерогенному катализатору жидкофазного окисления глюкозы и технологии его получения и может применяться на предприятиях химической и фармацевтической промышленности для получения компонентов пищевых продуктов и биологически активных добавок, таких как глюконовая кислота и глюконат кальция. Магнитоотделяемый катализатор окисления глюкозы, содержащий в качестве носителя магнитные наночастицы Fe3O4, модифицированные хитозаном и триполифосфатом натрия, и глюкозооксидазу из Aspergillus niger, характеризуется тем, что носитель дополнительно включает ацетилцистеин. Соотношение компонентов катализатора в % по массе составляет: Fe3O4 - 82,65÷83,22, хитозан - 8,25÷8,35, триполифосфат натрия - 1,61÷1,71, ацетилцистеин - 0,80÷0,86, глюкозооксидаза - 6,12÷6,32. Технический результат изобретения заключается в повышении активности, селективности и стабильности катализатора в реакции окисления глюкозы, а также его способности к отделению от реакционной среды. 2 н.п. ф-лы, 4 табл., 33 пр.
1. Магнитоотделяемый катализатор окисления глюкозы, содержащий в качестве носителя магнитные наночастицы Fe3O4, модифицированные хитозаном и триполифосфатом натрия, и глюкозооксидазу из Aspergillus niger, отличающийся тем, что носитель дополнительно включает ацетилцистеин при следующем соотношении компонентов в % масс.:
2. Способ получения магнитоотделяемого катализатора окисления глюкозы, содержащего в качестве носителя магнитные наночастицы Fe3O4, модифицированные хитозаном и триполифосфатом натрия, глюкозооксидазу из Aspergillus niger, ацетилцистеин при следующем соотношении компонентов в % масс.:
заключающийся в том, что смешивают раствор FeCl3, полученный растворением 2,34±0,02 г FeCl3⋅6H2O в 25 мл дистиллированной воды, и раствор FeCl2, полученный растворением 0,86±0,02 г FeCl2⋅4H2O в 25 мл дистиллированной воды, в термостатируемом реакторе с рубашкой, смесь перемешивают в течение 10 минут при температуре 25°С со скоростью 300 мин-1, перемешивают смесь еще 10 минут при температуре 65±2°С со скоростью 300 мин-1, после чего добавляют по каплям 10 мл раствора аммиака водного со скоростью 5 мл/мин, перемешивают смесь еще 10 минут при температуре 65±2°С со скоростью 300 мин-1, переносят смесь в химический стакан, проводят обработку ультразвуком мощностью 5±0,1 Вт/см2 в течение 5 минут, после чего в смесь добавляют раствор, полученный растворением 0,1±0,01 г хитозана в 25±0,1 мл 2Н уксусной кислоты, перемешивают ее 10 минут со скоростью 300 мин-1, добавляют в смесь раствор триполифосфата натрия, приготовленный растворением навески 0,02 г в 10 мл дистиллированной воды, и раствор ацетилцистеина, приготовленный растворением навески 0,01 г в 10 мл дистиллированной воды, перемешивают смесь 10 минут со скоростью 300 мин-1, 5 раз промывают дистиллированной водой, отделяют частицы с помощью постоянного магнита, добавляют к частицам раствор глюкозооксидазы, приготовленный растворением 75±0,5 мг глюкозооксидазы в 50 мл фосфатного буферного раствора с рН=6,0, смешанный с 0,4 г 1-этил-3-(3-диметиламинопропил) карбодиимид гидрохлорида и 0,15 г N-гидроксисукцинимида и выдержанный при перемешивании со скоростью 300 мин-1 в течение 2 часов, перемешивают смесь в течение 4 часов, 2 раза промывают катализатор эмульгатором Span80, 5 раз промывают катализатор дистиллированной водой, отделяют с помощью постоянного магнита, замораживают до температуры 18±0,5°С в течение 30 минут, высушивают лиофильно до постоянной массы, при этом хитозан перед приготовлением раствора предварительно смешивают с 1 М раствором NaOH в соотношении 1±0,01 г хитозана на 10 мл 1 М раствора NaOH, смесь нагревают и перемешивают в течение 2 часов при 70°С, фильтруют через воронку Бюхнера, хитозан промывают дистиллированной водой, высушивают при температуре 40°С в течение 12 часов, растворяют в 0,1 М растворе уксусной кислоты, раствор фильтруют через бумажный фильтр, рН раствора доводят до 8,0±0,01 с помощью 1 М раствора NaOH, выпавший осадок хитозана отделяют фильтрованием, замораживают до температуры 18±0,5°С в течение 30 минут, высушивают лиофильно до постоянной массы.
| Тихонов Б | |||
| Б | |||
| и др | |||
| ИММОБИЛИЗАЦИЯ ОКСИДОРЕДУКТАЗ НА МАГНИТНЫХ НАНОЧАСТИЦАХ, СТАБИЛИЗИРОВАННЫХ ХИТОЗАНОМ И ТРИПОЛИФОСФАТОМ НАТРИЯ | |||
| Актуальная биотехнология, (4), 2023, с | |||
| Пишущая машина | 1922 |
|
SU37A1 |
| EP 3442341 A1, 20.02.2019 | |||
| Магнитоотделяемый катализатор окисления органических соединений и способ его получения | 2023 |
|
RU2807591C1 |
| EP 2903734 A1, 12.08.2015 | |||
| СПОСОБ ПОЛУЧЕНИЯ НАНОЧАСТИЦ МАГНЕТИТА, СТАБИЛИЗИРОВАННЫХ БИОСОВМЕСТИМЫМ ПОЛИМЕРОМ, ИМЕЮЩИМ ФУНКЦИОНАЛЬНЫЕ ФОРМИЛЬНЫЕ ГРУППЫ | 2009 |
|
RU2431472C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОВЕРХНОСТНО-МОДИФИЦИРОВАННЫХ НАНОЧАСТИЦ ДЛЯ ИММОБИЛИЗАЦИИ БИОЛОГИЧЕСКИХ ВЕЩЕСТВ | 2010 |
|
RU2425879C1 |
| Гетерогенный катализатор жидкофазного окисления органических соединений и способ его получения | 2020 |
|
RU2741010C1 |
Авторы
Даты
2024-12-23—Публикация
2024-03-06—Подача